ISSN 1977-0650
Euroopa Liidu
Teataja
L 426

Eestikeelne väljaanne
Õigusaktid
64. aastakäik
29. november 2021
|
ISSN 1977-0650 |
||
|
Euroopa Liidu Teataja |
L 426 |
|

|
||
|
Eestikeelne väljaanne |
Õigusaktid |
64. aastakäik |
|
|
|
|
|
(1) EMPs kohaldatav tekst |
|
ET |
Aktid, mille peakiri on trükitud harilikus trükikirjas, käsitlevad põllumajandusküsimuste igapäevast korraldust ning nende kehtivusaeg on üldjuhul piiratud. Kõigi ülejäänud aktide pealkirjad on trükitud poolpaksus kirjas ja nende ette on märgitud tärn. |
II Muud kui seadusandlikud aktid
MÄÄRUSED
|
29.11.2021 |
ET |
Euroopa Liidu Teataja |
L 426/1 |
KOMISJONI RAKENDUSMÄÄRUS (EL) 2021/2076,
26. november 2021,
milles käsitletakse loa andmist Escherichia coli KCCM 80210 abil toodetud L-trüptofaani kasutamiseks kõigi loomaliikide söödalisandina
(EMPs kohaldatav tekst)
EUROOPA KOMISJON,
võttes arvesse Euroopa Liidu toimimise lepingut,
võttes arvesse Euroopa Parlamendi ja nõukogu 22. septembri 2003. aasta määrust (EÜ) nr 1831/2003 loomasöötades kasutatavate söödalisandite kohta, (1) eriti selle artikli 9 lõiget 2,
ning arvestades järgmist:
|
(1) |
Määruses (EÜ) nr 1831/2003 on sätestatud loomasöödas kasutatava söödalisandi loa taotlemise nõue ning sellise loa andmise alused ja kord. |
|
(2) |
Kooskõlas määruse (EÜ) nr 1831/2003 artikliga 7 on esitatud taotlus Escherichia coli KCCM 80210 abil toodetud L-trüptofaani lubamiseks. Taotlusele olid lisatud kõnealuse määruse artikli 7 lõikes 3 nõutud üksikasjad ja dokumendid. |
|
(3) |
Taotluses käsitletakse Escherichia coli KCCM 80210 abil toodetud L-trüptofaani kasutamise lubamist söödalisandina kõigi loomaliikide puhul ning selle liigitamist söödalisandite kategooriasse „toitainelised lisandid“ ja funktsionaalrühma „aminohapped, nende soolad ja analoogid“. |
|
(4) |
Euroopa Toiduohutusamet (edaspidi „toiduohutusamet“) jõudis oma 27. jaanuari 2021. aasta arvamuses (2) järeldusele, et kavandatud kasutustingimuste korral ei avalda Escherichia coli KCCM 80210 abil toodetud L-trüptofaan kahjulikku mõju mittemäletsejaliste tervisele, tarbijateohutusele ega keskkonnale. Mäletsejaliste puhul tuleks ohutuse tagamiseks kaitsta L-trüptofaani lagunemise eest vatsas. Toiduohutusamet märkis, et hinnatavat söödalisandit peetakse silmadele kergelt ärritavaks. Söödalisandi endotoksiini aktiivsus ja võimalik tolmuna õhku eraldumine viitavad riskile sissehingamisel. Seepärast leiab komisjon, et tuleks võtta asjakohased kaitsemeetmed, mis võimaldavad ennetada kahjulikku mõju inimeste, eelkõige kõnealuse söödalisandi kasutajate tervisele. |
|
(5) |
Toiduohutusamet leidis, et Escherichia coli KCCM 80210 abil toodetud L-trüptofaan on mittemäletsejaliste jaoks asendamatu aminohappe trüptofaani tõhus allikas; selleks et söödalisandina kasutatav, Escherichia coli KCCM 80210 abil toodetud L-trüptofaan oleks mäletsejaliste puhul sama tõhus kui mittemäletsejaliste puhul, tuleks seda kaitsta lagunemise eest vatsas. Toiduohutusameti hinnangul ei ole vaja kehtestada turustamisjärgse järelevalve erinõudeid. Toiduohutusamet kinnitas ka määruse (EÜ) nr 1831/2003 kohaselt asutatud referentlabori aruande söödas sisalduva kõnealuse söödalisandi analüüsimise meetodi kohta. |
|
(6) |
Escherichia coli KCCM 80210 abil toodetud L-trüptofaani hindamisest nähtub, et määruse (EÜ) nr 1831/2003 artiklis 5 sätestatud tingimused kasutamise lubamiseks on täidetud. Seepärast tuleks anda luba kõnealuse aine kasutamiseks vastavalt käesoleva määruse lisas esitatud tingimustele. |
|
(7) |
Käesoleva määrusega ettenähtud meetmed on kooskõlas alalise taime-, looma-, toidu- ja söödakomitee arvamusega, |
ON VASTU VÕTNUD KÄESOLEVA MÄÄRUSE:
Artikkel 1
Lisas kirjeldatud ainet, mis kuulub söödalisandite kategooriasse „toitainelised lisandid“ ja funktsionaalrühma „aminohapped, nende soolad ja analoogid“, lubatakse kasutada söödalisandina loomasöödas vastavalt lisas esitatud tingimustele.
Artikkel 2
Käesolev määrus jõustub kahekümnendal päeval pärast selle avaldamist Euroopa Liidu Teatajas.
Käesolev määrus on tervikuna siduv ja vahetult kohaldatav kõikides liikmesriikides.
Brüssel, 26. november 2021
Komisjoni nimel
president
Ursula VON DER LEYEN
(1) ELT L 268, 18.10.2003, lk 29.
(2) EFSA Journal 2021;19(3): 6425.
LISA
|
Söödalisandi identifitseerimisnumber |
Loa hoidja |
Söödalisand |
Koostis, keemiline valem, kirjeldus, analüüsimeetod |
Loomaliik või -kategooria |
Vanuse ülempiir |
Miinimumsisaldus |
Maksimumsisaldus |
Muud sätted |
Loa kehtivusaja lõpp |
||||||||
|
mg/kg täissöödas, mille niiskusesisaldus on 12 % |
|||||||||||||||||
|
Kategooria: toitainelised lisandid Funktsionaalrühm: aminohapped, nende soolad ja analoogid |
|||||||||||||||||
|
3c440i |
- |
L-trüptofaan |
Söödalisandi koostis Pulber, milles L-trüptofaani sisaldus on vähemalt 98 % (kuivaine põhjal) ning suurim niiskusesisaldus on 1 % 1,1′-etülideen-bis-L-trüptofaani (EBT) maksimumsisaldus: 10 mg/kg |
Kõik loomaliigid |
- |
- |
- |
|
19. detsember 2031 |
||||||||
|
Toimeaine kirjeldus L-trüptofaan, mis on toodetud Escherichia coli KCCM 80210 abil kääritamise teel Keemiline valem: C11H12N2O2 CASi number: 73–22-3 |
|||||||||||||||||
|
Analüüsimeetodid (1) L-trüptofaani sisalduse määramiseks söödalisandis:
|
|||||||||||||||||
(1) Analüüsimeetodite üksikasjad on kättesaadavad referentlabori veebisaidil aadressil: https://ec.europa.eu/jrc/en/eurl/feed-additives/evaluation-reports
(2) Kokkupuute määr on arvutatud söödalisandi endotoksiinisisaldusest ja võimalikust tolmuna õhku eraldumisest lähtuvalt kooskõlas Euroopa Toiduohutusameti kasutatava meetodiga (EFSA Journal 2015; 13(2): 4015); analüüsimeetod: Euroopa farmakopöa 2.6.14 (bakteriaalsed endotoksiinid).
(3) Komisjoni 27. jaanuari 2009. aasta määrus (EÜ) nr 152/2009, milles sätestatakse proovivõtu- ja analüüsimeetodid sööda ametlikuks kontrolliks (ELT L 54, 26.2.2009, lk 1).
|
29.11.2021 |
ET |
Euroopa Liidu Teataja |
L 426/5 |
KOMISJONI RAKENDUSMÄÄRUS (EL) 2021/2077,
26. november 2021,
milles käsitletakse loa andmist Corynebacterium glutamicum CGMCC 7.366 abil toodetud L-valiini kasutamiseks kõigi loomaliikide söödalisandina
(EMPs kohaldatav tekst)
EUROOPA KOMISJON,
võttes arvesse Euroopa Liidu toimimise lepingut,
võttes arvesse Euroopa Parlamendi ja nõukogu 22. septembri 2003. aasta määrust (EÜ) nr 1831/2003 loomasöötades kasutatavate söödalisandite kohta, (1) eriti selle artikli 9 lõiget 2,
ning arvestades järgmist:
|
(1) |
Määruses (EÜ) nr 1831/2003 on sätestatud loomasöödas kasutatava söödalisandi loa taotlemise nõue ning sellise loa andmise alused ja kord. |
|
(2) |
Kooskõlas määruse (EÜ) nr 1831/2003 artikliga 7 on esitatud taotlus lubada kasutada L-valiini. Taotlusele olid lisatud kõnealuse määruse artikli 7 lõikes 3 nõutud üksikasjad ja dokumendid. |
|
(3) |
Taotluses käsitletakse luba kasutada Corynebacterium glutamicum CGMCC 7.366 abil toodetud L-valiini kõigi loomaliikide söödalisandina ning selle klassifitseerimist söödalisandite kategooriasse „toitainelised lisandid“ ja funktsionaalrühma „aminohapped, nende soolad ja analoogid“. |
|
(4) |
Euroopa Toiduohutusamet (edaspidi „toiduohutusamet“) jõudis oma 17. märtsi 2021. aasta arvamuses (2) järeldusele, et kavandatud kasutustingimustel ja söödale asjakohases koguses lisatuna ei avalda Corynebacterium glutamicum CGMCC 7.366 abil toodetud L-valiin kahjulikku mõju loomade tervisele, tarbijate ohutusele ega keskkonnale. Kõnealuse söödalisandi kasutaja ohutuse seisukohast ei saanud toiduohutusamet välistada, et võib esineda sissehingamisega seotud ohtu ja seda, et L-valiin võib ärritada nahka või silmi või olla naha sensibilisaator. Seepärast leiab komisjon, et tuleks võtta asjakohased kaitsemeetmed, mis võimaldavad ennetada kahjulikku mõju inimeste, eelkõige kõnealuse söödalisandi kasutajate tervisele. Toiduohutusamet jõudis järeldusele, et kõnealust söödalisandit peetakse loomade söötmisel asendamatu aminohappe L-valiini tõhusaks allikaks, kuid selleks, et söödalisand oleks mäletsejaliste puhul tõhus, tuleks seda kaitsta lagunemise eest vatsas. Toiduohutusameti hinnangul ei ole vaja kehtestada turustamisjärgse järelevalve erinõudeid. Toiduohutusamet kinnitas ka määruse (EÜ) nr 1831/2003 kohaselt asutatud referentlabori aruanded söödas sisalduva kõnealuse söödalisandi analüüsimise meetodi kohta. |
|
(5) |
Corynebacterium glutamicum CGMCC 7.366 abil toodetud L-valiini hindamine näitab, et määruse (EÜ) nr 1831/2003 artiklis 5 sätestatud tingimused kasutamise lubamiseks on täidetud. Seepärast tuleks anda luba söödalisandi kasutamiseks käesoleva määruse lisas esitatud viisil. |
|
(6) |
Käesoleva määrusega ettenähtud meetmed on kooskõlas alalise taime-, looma-, toidu- ja söödakomitee arvamusega, |
ON VASTU VÕTNUD KÄESOLEVA MÄÄRUSE:
Artikkel 1
Lisas kirjeldatud ainet, mis kuulub söödalisandite kategooriasse „toitainelised lisandid“ ja funktsionaalrühma „aminohapped, nende soolad ja analoogid“, lubatakse kasutada söödalisandina loomasöödas vastavalt lisas esitatud tingimustele.
Artikkel 2
Käesolev määrus jõustub kahekümnendal päeval pärast selle avaldamist Euroopa Liidu Teatajas.
Käesolev määrus on tervikuna siduv ja vahetult kohaldatav kõikides liikmesriikides.
Brüssel, 26. november 2021
Komisjoni nimel
president
Ursula VON DER LEYEN
(1) ELT L 268, 18.10.2003, lk 29.
(2) EFSA Journal 2021;19(4): 6521.
LISA
|
Söödalisandi identifitseerimisnumber |
Loa hoidja |
Söödalisand |
Koostis, keemiline valem, kirjeldus, analüüsimeetod |
Loomaliik või -kategooria |
Vanuse ülempiir |
Miinimumsisaldus |
Maksimumsisaldus |
Muud sätted |
Loa kehtivusaja lõpp |
||||||||
|
Sisaldus milligrammides 12 % niiskusesisaldusega täissööda kilogrammi kohta |
|||||||||||||||||
|
Kategooria: toitainelised lisandid Funktsionaalrühm: aminohapped, nende soolad ja analoogid |
|||||||||||||||||
|
3c371i |
- |
L-valiin |
Söödalisandi koostis pulber, milles on vähemalt 98 % L-valiini (kuivainena) ja kuni 1,5 % vett |
Kõik loomaliigid |
- |
|
|
|
19. detsember 2031 |
||||||||
|
Toimeaine kirjeldus L-valiin ((2S)-2-amino-3-metüülbutaanhape), mis on toodetud Corynebacterium glutamicum CGMCC 7.366 abil Keemiline valem: C5H11NO2 CASi number: 72–18-4 |
|||||||||||||||||
|
Analüüsimeetod (1) L-valiini sisalduse määramiseks söödalisandis:
Valiini sisalduse määramiseks eelsegus, söödamaterjalis ja segasöödas:
Valiini sisalduse määramiseks vees:
|
|||||||||||||||||
(1) Analüüsimeetodite üksikasjad on kättesaadavad referentlabori veebisaidil aadressil: https://ec.europa.eu/jrc/en/eurl/feed-additives/evaluation-reports
|
29.11.2021 |
ET |
Euroopa Liidu Teataja |
L 426/9 |
KOMISJONI RAKENDUSMÄÄRUS (EL) 2021/2078,
26. november 2021,
millega kehtestatakse Euroopa Parlamendi ja nõukogu määruse (EL) 2017/745 rakenduseeskirjad Euroopa meditsiiniseadmete andmebaasi (Eudamed) osas
EUROOPA KOMISJON,
võttes arvesse Euroopa Liidu toimimise lepingut,
võttes arvesse Euroopa Parlamendi ja nõukogu 5. aprilli 2017. aasta määrust (EL) 2017/745, milles käsitletakse meditsiiniseadmeid, millega muudetakse direktiivi 2001/83/EÜ, määrust (EÜ) nr 178/2002 ja määrust (EÜ) nr 1223/2009 ning millega tunnistatakse kehtetuks nõukogu direktiivid 90/385/EMÜ ja 93/42/EMÜ, (1) eriti selle artikli 33 lõiget 8,
ning arvestades järgmist:
|
(1) |
Määruse (EL) 2017/745 kohaselt peab komisjon sätestama Euroopa meditsiiniseadmete andmebaasi (Eudamed) loomiseks ja haldamiseks vajaliku üksikasjaliku korra. |
|
(2) |
Euroopa Parlamendi ja nõukogu määruse (EL) 2017/746 (2) kohaselt loob komisjon Eudamedi ja haldab seda kooskõlas määruses (EL) 2017/745 sätestatud tingimuste ja üksikasjaliku korraga. |
|
(3) |
Määruste (EL) 2017/745 ja (EL) 2017/746 kohaselt peaks komisjonil, pädevatel asutustel, teavitatud asutuste eest vastutavatel asutustel, teavitatud asutustel, tootjatel, volitatud esindajatel, importijatel, määruse (EL) 2017/745 artikli 22 lõikes 1 osutatud füüsilistel või juriidilistel isikutel (süsteemi või protseduuripaketi koostajatel) ning kliiniliste uuringute ja toimivusuuringute sponsoritel olema juurdepääs Eudamedile ja nad peaksid seda kasutama, et täita oma kohustusi ja ülesandeid vastavalt nimetatud määrustele. Seetõttu on vaja tagada piiratud juurdepääsuga veebisaidi kaudu juurdepääs Eudamedile. Lisaks peaks Eudamediga andma üldsusele piisavat teavet turule lastud seadmete, teavitatud asutuste väljastatud vastavate sertifikaatide, asjaomaste ettevõtjate ja kliiniliste uuringute kohta. Seetõttu on vaja teha Eudamed kättesaadavaks ka avaliku veebisaidi kaudu. Lisaks on Eudamedi ja riiklike andmebaaside vahelise andmevahetuse võimaldamiseks vaja muuta Eudamed kättesaadavaks masinatevahelise andmevahetuse teenuste kaudu. |
|
(4) |
Seoses füüsiliste ja juriidiliste isikutega, kellel peab olema juurdepääs Eudamedile piiratud juurdepääsuga veebisaidi kaudu, on vaja täpsustada sellise juurdepääsu andmise tingimused ja kord. |
|
(5) |
Komisjon on koostanud Euroopa meditsiiniseadmete nomenklatuuri (EMDN), nagu sätestatud määrustes (EL) 2017/745 ja (EL) 2017/746. Seetõttu peaks EMDN olema Eudamedis tasuta kättesaadav ja seda tuleks kasutada Eudamedis meditsiiniseadmeid käsitleva teabe esitamiseks. |
|
(6) |
Tagamaks, et Eudamedi kasutajad saavad selle andmebaasi kasutamisel vajalikku tuge, peaks komisjon pakkuma neile Eudamedi osas õigeaegset tehnilist ja haldusabi. |
|
(7) |
Kui Eudamed on tehnilistel põhjustel juurdepääsmatu või ei tööta tehnilise rikke tõttu, peaks volitatud kasutajatel olema siiski võimalik oma kohustusi täita. Seepärast on vaja kindlaks määrata alternatiivsed andmevahetusmehhanismid, mida sellisel juhul kasutada, ning kehtestada selliste mehhanismide jaoks eriolukorra eeskirjad. |
|
(8) |
Eudamedi suhtes kohaldatakse komisjoni otsuses (EL, Euratom) 2017/46 (3) sätestatud IT turbe eeskirju. Selleks, et Eudamed toimiks turvaliselt ja oleks kaitstud ohtude eest funktsioonide ja andmete kättesaadavusele, terviklusele ja konfidentsiaalsusele, tuleks kehtestada täiendavad turbe-eeskirjad. |
|
(9) |
Selleks, et vähendada riske ja takistada Eudamedi võimalikku petturlikku kasutamist, tuleks kehtestada erisätted kasutaja petturliku tegevuse kohta Eudamedis. |
|
(10) |
Vastavalt Euroopa Parlamendi ja nõukogu määruse (EL) 2018/1725 (4) artikli 42 lõikele 1 konsulteeriti Euroopa Andmekaitseinspektoriga, kes esitas oma arvamuse 9. juulil 2021. |
|
(11) |
Käesolevas määruses sätestatud meetmed on kooskõlas meditsiiniseadmete komitee arvamusega, |
ON VASTU VÕTNUD KÄESOLEVA MÄÄRUSE:
Artikkel 1
Mõisted
Käesolevas määruses kasutatakse järgmisi mõisteid:
|
1) |
„subjekt“ – komisjon, pädev asutus, teavitatud asutuste eest vastutav asutus, teavitatud asutus, tootja, volitatud esindaja, importija, süsteemi või protseduuripaketi koostaja või sponsor, kes on registreeritud Eudamedis kooskõlas käesoleva määruse artikliga 3, et täita määrustes (EL) 2017/745 ja (EL) 2017/746 sätestatud kohustusi; |
|
2) |
„volitatud kasutaja“ – füüsiline isik, kellele on antud piiratud juurdepääsuga veebisaidi kaudu juurdepääs Eudamedile, et tegutseda subjekti nimel; |
|
3) |
„subjekti kohalik administraator“ – volitatud kasutaja, kellel on õigus hallata teatavat teavet subjekti andmete kohta ja anda piiratud juurdepääsuga veebisaidi kaudu teistele füüsilistele isikutele juurdepääs Eudamedile, et nad tegutseksid selle subjekti nimel; |
|
4) |
„kasutaja kohalik administraator“ – volitatud kasutaja, kellel on õigus anda piiratud juurdepääsuga veebisaidi kaudu teistele füüsilistele isikutele juurdepääs Eudamedile, et nad tegutseksid subjekti nimel; |
|
5) |
„rike“ – Eudamedi toimimise oluline tõrge, sealhulgas ettenägematust olukorrast või vääramatust jõust põhjustatud tõrge, mis võib kahjustada IT-turvalisust või takistada mõne määruse (EL) 2017/745 artikli 33 lõikes 2 osutatud Eudamedi elektrooniliste süsteemide funktsiooni kättesaadavust. |
Artikkel 2
Juurdepääsuviisid
1. Eudamed on volitatud kasutajatele kättesaadav piiratud juurdepääsuga veebisaidi kaudu ja tuvastamata kasutajatele avaliku veebisaidi kaudu.
2. Eudamed peab olema määruse (EL) 2017/745 artiklis 101 ja määruse (EL) 2017/746 artiklis 96 osutatud pädevatele asutustele (edaspidi „pädevad asutused“) ja käesoleva määruse artikli 3 kohaselt Eudamedis registreeritud teavitatud asutustele kättesaadav masinatevahelise andmevahetuse teenuste kaudu. Komisjon annab igale liikmesriigile ja teavitatud asutusele nende taotlusel andmevahetuspunktid, mis võimaldavad neil selliseid andmevahetusteenuseid kasutada.
Eudamed peab olema kättesaadav masinatevahelise andmevahetuse teenuste kaudu muudele subjektidele kui pädevad asutused ja teavitatud asutused, tingimusel et asjaomase subjekti kohalik administraator esitab sellise juurdepääsu taotluse, nagu on osutatud artikli 3 lõike 8 esimeses lõigus. Komisjon kiidab kõnealuse taotluse heaks kiita artikli 3 lõike 8 teises lõigus sätestatud tingimustel.
Artikkel 3
Registreerimine Eudamedis ja juurdepääs Eudamedile piiratud juurdepääsuga veebisaidi kaudu
1. Selleks et saada juurdepääs Eudamedile piiratud juurdepääsuga veebisaidi kaudu, loob füüsiline isik konto komisjoni autentimisteenuse veebisaidil.
2. Komisjon registreerib pädevad asutused ja teavitatud asutuste eest vastutavad asutused ning võimaldab juurdepääsu piiratud juurdepääsuga veebisaidile esimesele füüsilisele isikule, kes tegutseb nende nimel. Selleks esitavad liikmesriigid komisjonile teabe oma pädevate asutuste, teavitatud asutuste eest vastutavate asutuste ja füüsiliste isikute kohta, kellest saavad nende asutuste esimesed volitatud kasutajad.
3. Komisjon registreerib teavitatud asutused Eudamedis komisjoni loodud ja hallatavas teavitatud asutuste andmebaasis (NANDO) sisalduva teabe alusel.
Selleks et saada Eudamedile juurdepääs piiratud juurdepääsuga veebisaidi kaudu, esitab teavitatud asutuse kui subjekti nimel tegutsev esimene füüsiline isik piiratud juurdepääsuga veebisaidi kaudu juurdepääsutaotluse. Teavitatud asutuse eest vastutav asutus kiidab taotluse heaks.
4. Selleks et Eudamedis registreeritaks muud kui lõigetes 2 ja 3 nimetatud üksused, esitab tulevase subjekti nimel tegutsev füüsiline isik piiratud juurdepääsuga veebisaidi kaudu subjekti registreerimise taotluse. Subjekti registreerimise taotlus peab sisaldama allkirjastatud deklaratsiooni artikli 10 lõikes 1 osutatud infoturbe kohustuste kohta. Subjekti registreerimise taotlusele on vaja riikliku pädeva asutuse heakskiitu, välja arvatud juhul, kui taotletakse kliinilise uuringu või toimivusuuringu sponsori registreerimist.
Subjekti registreerimise taotluse heakskiitmisel või sponsori puhul siis, kui subjekti registreerimise taotlus on esitatud, antakse esimeses lõigus osutatud taotluse esitanud füüsilisele isikule automaatselt juurdepääs piiratud juurdepääsuga veebisaidile ja temast saab esimene volitatud kasutaja, tingimusel et lõikes 6 sätestatud tingimused on täidetud.
Käesoleva lõike kohaldamisel on riiklikuks pädevaks asutuseks tulevase subjekti asukohajärgne asutus. Väljaspool liitu asutatud tootjate puhul on riiklikuks pädevaks asutuseks subjekti registreerimistaotluses nimetatud volitatud esindaja eest vastutav asutus. Süsteemi või protseduuripaketi koostaja puhul, kes on asutatud väljaspool liitu, on riigi pädevaks asutuseks selle liikmesriigi asutus, kus viiakse turule kõnealuse koostaja esimene süsteem või protseduuripakett.
5. Selleks et füüsilisele isikule antaks juurdepääs piiratud juurdepääsuga veebisaidile, et ta saaks tegutseda subjekti nimel, esitab ta juurdepääsutaotluse piiratud juurdepääsuga veebisaidi kaudu. Subjekti kohalik administraator või selle subjekti kasutaja kohalik administraator kiidab juurdepääsutaotluse heaks.
6. Volitatud kasutajateks saamiseks aktsepteerivad füüsilised isikud artikli 10 lõike 1 punktis a osutatud dokumendis sätestatud kasutajaõigusi ja -kohustusi ning tutvuvad kõnealuse artikli punktis c osutatud isikuandmete kaitse põhimõtetega.
7. Subjekti esimene volitatud kasutaja on automaatselt esimene subjekti kohalik administraator.
8. Subjekti kohalik administraator võib piiratud juurdepääsuga veebisaidi kaudu esitada komisjonile taotluse masinatevahelise ühenduse saamiseks, et vahetada andmeid subjekti andmebaasi ja Eudamedi vahel.
Komisjon võib esimeses lõigus osutatud taotluse heaks kiita, kui subjekti kohalik administraator on kinnitanud, et subjekt täidab artikli 10 lõikes 1 osutatud teabevahetuse infoturbenõudeid.
Artikkel 4
Nomenklatuur
Volitatud kasutajad kasutavad Eudamedis meditsiiniseadmeid käsitleva teabe esitamisel Euroopa meditsiiniseadmete nomenklatuuri (EMDN) avatud juurdepääsuga koode.
Komisjon teeb EMDNi Eudamedis tasuta kättesaadavaks.
Artikkel 5
Tehniline abi ja haldusabi
1. Komisjon loob rakenduse tugirühma, et pakkuda Eudamedi kasutajatele õigeaegset abi, mis on kättesaadav selleks ettenähtud e-posti aadressi kaudu.
2. Komisjon teeb Eudamedi kasutajatele kättesaadavaks asjakohased tehnilised dokumendid ja korduma kippuvad küsimused Eudamedi kohta ning masinatevahelise andmevahetuse teenuseid toetavad dokumendid.
Artikkel 6
Isikuandmete omandiõigus ja töötlemine
1. Komisjon on Eudamedi omanik ja tal on täielikud haldusõigused.
2. Eudamedis töödeldakse isikuandmeid, et täita määrustes (EL) 2017/745 ja (EL) 2017/746 sätestatud kohustusi.
3. Töödeldakse järgmistesse kategooriatesse kuuluvaid isikuandmeid:
|
a) |
subjektide ja volitatud kasutajate nimed; |
|
b) |
subjektide ja volitatud kasutajate kontaktandmed; |
|
c) |
muude füüsiliste või juriidiliste isikute identifitseerimisandmed ja kontaktandmed ning andmed nende kutsekvalifikatsioonide kohta, mis esitatakse Eudamedis eesmärgiga täita määrustes (EL) 2017/745 ja (EL) 2017/746 sätestatud kohustusi. |
Artikkel 7
Toimimiseeskirjad
1. Andmete esitamine Eudamedis loetakse toimunuks kuupäeval ja kellaajal, mil andmed Eudamedis edukalt registreeriti. Esitamise kuupäev ja kellaaeg määratakse Kesk-Euroopa aja (CET) või Kesk-Euroopa suveaja (CEST) alusel.
2. Eudamed on juurdepääsetav igal ajal, välja arvatud hooldustöödest, sealhulgas versiooniuuendustest, tingitud vajalike ja varem teatatud seisakute ajal. Komisjon avaldab eelnevalt sellekohase teate piiratud juurdepääsuga veebisaidil või asjakohasel juhul avalikul veebisaidil.
Artikkel 8
Rikked
1. Komisjon võtab kõik vajalikud meetmed, et rikkeid ennetada ja rikke esinemise korral see põhjendamatu viivituseta kindlaks teha.
2. Kui subjekt või volitatud kasutaja kahtlustab riket, teatab ta sellest viivitamata komisjonile.
3. Kui komisjon tuvastab rikke, võtab ta järgmised meetmed:
|
a) |
esitab viivitamata vastavasisulise teate („rikketeade“) piiratud juurdepääsuga veebisaidil või asjakohasel juhul avalikul veebisaidil, välja arvatud juhul, kui rikke laad takistab komisjoni seda tegemast; sel juhul avaldab komisjon teate võimaluse korral meditsiiniseadmeid käsitleval komisjoni veebisaidil; |
|
b) |
peatab määrustes (EL) 2017/745 ja (EL) 2017/746 sätestatud tähtajad andmete esitamiseks Eudamedi, kui rike takistab asjakohaste andmete sisestamist. |
Kui komisjon peatab esimese lõigu punktis b sätestatud tähtaja andmete esitamiseks Eudamedi, täpsustatakse rikketeates teate esitamise aeg ja peatamise tõenäoline kestus.
4. Lisaks käesoleva artikli lõike 3 esimese lõigu punktis b osutatud tähtaegade peatamisele kohaldatakse juhul, kui rike takistab mõne sellise kohustuse täitmist, mis on osutatud määruse (EL) 2017/745 artiklis 80, artikli 87 lõikes 1, artikli 89 lõigetes 5, 7, 8 ja 9, artikli 95 lõigetes 2, 4 ja 6 või artikli 98 lõikes 2 või määruse (EL) 2017/746 artiklis 76, artikli 82 lõikes 1, artikli 84 lõigetes 5, 7, 8 ja 9, artikli 90 lõigetes 2, 4 ja 6 või artikli 93 lõikes 2, üht kahest järgmisest menetlusest:
|
a) |
kui rike kestab rohkem kui 12 tundi pärast rikketeate kuvamist, esitab subjekt viivitamata komisjonile, asjaomastele riiklikele pädevatele asutustele ja vajaduse korral määruse (EL) 2017/745 artiklis 56 või määruse (EL) 2017/746 artiklis 51 osutatud vastavussertifikaadi väljastanud teavitatud asutusele üldteabe asjakohaste andmete kohta ja märke selle kohta, et rikke tõttu on andmete esitamine ootel; |
|
b) |
kui rike kestab rohkem kui 24 tundi pärast rikketeate kuvamist või kui rike kestab vähem kui 24 tundi ja asjaomased riiklikud pädevad asutused nõuavad seda pärast käesoleva lõike punktis a osutatud teabe saamist, esitab subjekt viivitamata kõnealustele asutustele asjakohased andmed nende asutuste ette nähtud viisil. |
5. Lisaks käesoleva artikli lõike 3 esimese lõigu punktis b osutatud tähtaegade peatamisele kohaldatakse rikke korral, mis takistab mõne määruses (EL) 2017/745 või määruses (EL) 2017/746 sätestatud kohustuse täitmist, välja arvatud käesoleva artikli lõikes 4 osutatud kohustused, järgmist menetlust:
|
a) |
kui rike kestab rohkem kui 36 tundi pärast rikketeate kuvamist, esitab subjekt viivitamata komisjonile, asjaomastele riiklikele pädevatele asutustele ja määruse (EL) 2017/745 artiklis 56 või määruse (EL) 2017/746 artiklis 51 osutatud vastavussertifikaadi väljastanud teavitatud asutusele üldteabe nende andmete kohta ja märke selle kohta, et rikke tõttu on andmete esitamine ootel; |
|
b) |
kui rike kestab rohkem kui viis päeva pärast rikketeate kuvamist, teatab subjekt sellest asjaomastele riiklikele pädevatele asutustele ning esitab viimaste nõudmisel neile asjakohased andmed nende ette nähtud viisil. |
6. Kui komisjon on kindlaks teinud, et rike on lõppenud, teavitab ta sellest pädevaid asutusi. Lisaks avaldab komisjon vastavasisulise teate vastavalt vajadusele piiratud juurdepääsuga veebisaidil ja/või avalikul veebisaidil. Nii teavituses kui ka teates märgitakse rikke kestus ja lõike 3 punktis b osutatud tähtaegade peatamise kestus.
7. Kui komisjon on avaldanud lõikes 6 osutatud teate, sisestavad subjektid viivitamata andmed, mille esitamine oli Eudamedi rikke ajal takistatud.
Artikkel 9
Proovimiseks ja koolituseks ettenähtud veebisaidid
1. Komisjon teeb subjektidele kättesaadavaks veebisaidid, millel saab proovida Eudamedi kasutamist ja teha sellekohaseid koolitusi (edaspidi „proovimiseks ja koolituseks ettenähtud veebisaidid“).
Proovimiseks ja koolituseks ettenähtud veebisaitidele sisestatud andmeid käsitletakse fiktiivsetena ega tehta neid üldsusele kättesaadavaks.
2. Enne esimest korda masinatevahelise andmevahetuse teenuste kasutamist teeb subjekt vähemalt ühe eduka katse andmete esitamiseks masinatevahelise andmevahetuse kaudu, kasutades proovimiseks ja koolituseks ettenähtud veebisaiti.
3. Kõik muudatused, mida komisjon kavatseb teha Eudamedi masinatevahelise andmevahetuse teenustes, teeb ta kõigepealt kättesaadavaks proovimiseks ja koolituseks ettenähtud veebisaitidel ajavahemikuks, mille komisjon määrab eelnevalt kindlaks koostöös määruse (EL) 2017/745 artikli 103 alusel loodud meditsiiniseadmete koordineerimisrühmaga.
Eelnevalt teavitab komisjon Eudamedi kaudu asjaomaseid subjekte kavandatavatest muudatustest ning ajavahemikust, mille jooksul need on proovimiseks ja koolituseks ettenähtud veebisaitidel kättesaadavad.
Artikkel 10
Infoturve
1. Komisjon teeb piiratud juurdepääsuga veebisaidil kättesaadavaks järgmised dokumendid:
|
a) |
dokument kasutaja õiguste ja kohustuste kohta; |
|
b) |
deklaratsioon infoturbealaste kohustuste kohta; |
|
c) |
isikuandmete kaitse põhimõtted; |
|
d) |
teabevahetuse infoturbenõuded. |
2. Subjektid järgivad tingimusi, mis on sätestatud lõike 1 punktis b ja vajaduse korral kõnealuse lõike punktis d osutatud dokumentides.
3. Kui komisjon kahtlustab, et on ilmnenud või esineb otsuse (EL, Euratom) 2017/46 artikli 2 punktides 15, 22 ja 25 määratletud IT turbe intsident, IT turbe risk või IT turbe oht, mis tema arvates võib Eudamedile, selles sisalduvatele andmetele või nende konfidentsiaalsusele kahjulik olla (edaspidi „IT turbe intsident“, „IT turbe oht“ või „IT turbe risk“), võib komisjon peatada kogu juurdepääsu Eudamedile.
4. Kui komisjon tuvastab IT turbe intsidendi, IT turbe ohu või IT turbe riski, võib ta peatada kõik Eudamedi elektrooniliste süsteemide funktsioonid või osa neist.
Kui esimeses lõigus osutatud peatamine takistab andmete sisestamist Eudamedi, kohaldatakse vajalike muudatustega artikli 8 lõikeid 3, 4 ja 5.
5. Iga subjekt või volitatud kasutaja, kes saab teada IT turbe intsidendist, IT turbe ohust või IT turbe riskist või kahtlustab seda, teatab sellest viivitamata komisjonile ja asjaomastele liikmesriikidele.
Artikkel 11
Kasutaja petturlik tegevus Eudamedis
1. Kui pädev asutus, subjekti kohalik administraator või kasutaja kohalik administraator kahtlustab petturlikku juurdepääsutaotlust Eudamedile, keeldub ta taotlust rahuldamast ja teavitab sellest keeldumisest viivitamata komisjoni artikli 5 lõikes 1 osutatud rakenduse tugirühma kaudu, täpsustades, et see puudutab petturluse kahtlusega juurdepääsutaotlust.
2. Kui komisjonil on põhjendatud kahtlus, et volitatud kasutaja tegeleb pettusega, mis mõjutab Eudamedi IT-turvalisust, peatab ta ajutiselt selle volitatud kasutaja juurdepääsu Eudamedile. Sellisel juhul teavitab komisjon juurdepääsu peatamisest ja selle põhjendusest viivitamata kõiki liikmesriike ja asjaomaseid subjekte.
3. Iga subjekt või volitatud kasutaja, kes kahtlustab volitatud kasutajat pettuses, teavitab komisjoni ja liikmesriike viivitamata pettuse kahtlusest rakenduse tugirühma kaudu, millele on osutatud artikli 5 lõikes 1.
4. Kui komisjon tuvastab Eudamedis pettuse, lõpetab ta viivitamata asjaomaste volitatud kasutajate juurdepääsu Eudamedile ja võtab vajalikud meetmed, sealhulgas takistab vajaduse korral komisjoni autentimisteenuse veebisaidil loodud seotud kontode edasist juurdepääsu Eudamedile. Komisjon teavitab viivitamata asjaomaseid riiklikke pädevaid asutusi ja asjaomaseid subjekte kõigist käesoleva lõike kohaselt võetud meetmetest.
Artikkel 12
Jõustumine
Käesolev määrus jõustub kahekümnendal päeval pärast selle avaldamist Euroopa Liidu Teatajas.
Käesolev määrus on tervikuna siduv ja vahetult kohaldatav kõikides liikmesriikides.
Brüssel, 26. november 2021
Komisjoni nimel
president
Ursula VON DER LEYEN
(1) ELT L 117, 5.5.2017, lk 1.
(2) Euroopa Parlamendi ja nõukogu 5. aprilli 2017. aasta määrus (EL) 2017/746 in vitro diagnostikameditsiiniseadmete kohta ning millega tunnistatakse kehtetuks direktiiv 98/79/EÜ ja komisjoni otsus 2010/227/EL (ELT L 117, 5.5.2017, lk 176).
(3) Komisjoni 10. jaanuari 2017. aasta otsus (EL, Euratom) 2017/46 Euroopa Komisjoni side- ja infosüsteemide turvalisuse kohta (ELT L 6, 11.1.2017, lk 40).
(4) Euroopa Parlamendi ja nõukogu 23. oktoobri 2018. aasta määrus (EL) 2018/1725, mis käsitleb füüsiliste isikute kaitset isikuandmete töötlemisel liidu institutsioonides, organites ja asutustes ning isikuandmete vaba liikumist, ning millega tunnistatakse kehtetuks määrus (EÜ) nr 45/2001 ja otsus nr 1247/2002/EÜ (ELT L 295, 21.11.2018, lk 39).
|
29.11.2021 |
ET |
Euroopa Liidu Teataja |
L 426/16 |
KOMISJONI RAKENDUSMÄÄRUS (EL) 2021/2079,
26. november 2021,
millega lubatakse vastavalt Euroopa Parlamendi ja nõukogu määrusele (EL) 2015/2283 lasta uuendtoiduna turule D2-vitamiini sisaldav seenepulber ning muudetakse komisjoni rakendusmäärust (EL) 2017/2470
(EMPs kohaldatav tekst)
EUROOPA KOMISJON,
võttes arvesse Euroopa Liidu toimimise lepingut,
võttes arvesse Euroopa Parlamendi ja nõukogu 25. novembri 2015. aasta määrust (EL) 2015/2283, mis käsitleb uuendtoitu, millega muudetakse Euroopa Parlamendi ja nõukogu määrust (EL) nr 1169/2011 ning tunnistatakse kehtetuks Euroopa Parlamendi ja nõukogu määrus (EÜ) nr 258/97 ja komisjoni määrus (EÜ) nr 1852/2001, (1) eriti selle artiklit 12,
ning arvestades järgmist:
|
(1) |
Määruses (EL) 2015/2283 on sätestatud, et liidus võib turule lasta ainult loa saanud ja liidu loetellu kantud uuendtoitu. |
|
(2) |
Vastavalt määruse (EL) 2015/2283 artiklile 8 võeti vastu komisjoni rakendusmäärus (EL) 2017/2470, (2) millega on kehtestatud liidus lubatud uuendtoitude loetelu. |
|
(3) |
29. juulil 2019 esitas äriühing MBio, Monaghan Mushrooms (edaspidi „taotleja“) komisjonile määruse (EL) nr 2015/2283 artikli 10 lõike 1 kohase taotluse lasta liidu turule uuendtoiduna D2-vitamiini sisaldav seenepulber. Taotleja soovis saada luba kasutada D2-vitamiini sisaldavat seenepulbrit mitmes üldelanikkonnale ettenähtud toiduaines. Taotleja taotles ka luba kasutada uuendtoitu toidulisandites, mis on määratletud Euroopa Parlamendi ja nõukogu direktiivis 2002/46/EÜ (3), välja arvatud imikutele ettenähtud toidulisandid, ning meditsiinilisel näidustusel kasutamiseks ettenähtud toidus, mis on määratletud Euroopa Parlamendi ja nõukogu määruses (EL) nr 609/2013, (4) välja arvatud imikutele meditsiinilisel näidustusel kasutamiseks ettenähtud toit. Taotluse menetlemise ajal nõustus taotleja jätma uuendtoidu toidulisandites kasutamise loa taotlusest välja alla 3aastased lapsed. |
|
(4) |
Taotleja soovis ka komisjonilt oma taotluse toetuseks esitatud algsete konfidentsiaalsete andmete kaitsmist. Need andmed on järgmised: tootmisprotsessi käsitlevad andmed; (5) koostise andmed: osakeste suurus, (6) füüsikalis-keemilised omadused, (7) D-vitamiini analüüs, (8) toitainete analüüs, (9) D2-vitamiini analüüs, (10) D-vitamiini analüüsi kontrollimine, (11) stabiilsusuuringud, (12) toksikoloogiline analüüs, (13) tahhüsterooli ja lumisterooli käsitlevad andmed, (14) ergosteroolisuhte analüüs, (15) D-vitamiini suhte analüüs, (16) ergosterooli käsitlevad andmed; (17) värskete seente spetsifikatsioonid; (18) allergeensust käsitlevad andmed (19). |
|
(5) |
Vastavalt määruse (EL) 2015/2283 artikli 10 lõikele 3 konsulteeris komisjon 24. jaanuaril 2020 Euroopa Toiduohutusametiga (edaspidi „toiduohutusamet“) ja palus esitada teadusliku arvamuse D2-vitamiini sisaldava seenepulbri kui uuendtoidu ohutushindamise põhjal. |
|
(6) |
Toiduohutusamet võttis 24. veebruaril 2021 vastu teadusliku arvamuse „Safety of vitamin D2 mushroom (Agaricus bisporus) powder as a novel food pursuant to Regulation (EU) 2015/2283“ (20) (D2-vitamiini sisaldava, perekonna Agaricus bisporus seentest saadud pulbri ohutus uuendtoiduna määruse (EL) 2015/2283 kohaselt). Arvamus on kooskõlas määruse (EL) 2015/2283 artikli 11 nõuetega. |
|
(7) |
Oma arvamuses jõudis toiduohutusamet järeldusele, et D2-vitamiini sisaldav seenepulber on kavandatud kasutusviiside ja -koguste juures ohutu. Toiduohutusameti arvamus annab piisavalt alust arvata, et D2-vitamiini sisaldav seenepulber on konkreetsete kasutustingimuste korral kooskõlas määruse (EL) 2015/2283 artikli 12 lõikega 1. |
|
(8) |
Tuleks ette näha märgistamisnõue, et teavitada tarbijaid nõuetekohaselt sellest, et imikud ja alla 3aastased lapsed ei tohiks tarbida toidulisandeid, milles on D2-vitamiini sisaldavat seenepulbrit. |
|
(9) |
Toiduohutusamet leidis oma arvamuses, et uuendtoidu ohutuse kindlakstegemisel võeti aluseks tootmisprotsessi ja koostisega seotud andmed. Komisjon on sellele tuginedes seisukohal, et ilma kõnealuste andmeteta ei oleks olnud võimalik teha järeldust D2-vitamiini sisaldava seenepulbri ohutuse kohta. |
|
(10) |
Komisjon palus taotlejal täiendavalt selgitada põhjendust, mis on esitatud seoses nende andmete konfidentsiaalsuse kaitsmisega ning selgitada nende andmete kasutamise ainuõiguse taotlemist, nagu on nõutud määruse (EL) 2015/2283 artikli 26 lõike 2 punktis b. |
|
(11) |
Taotleja deklareeris taotluse esitamise ajal kõnealused andmed konfidentsiaalsena ja kinnitas, et liikmesriigi õiguse alusel oli tal taotluse esitamise ajal ainuõigus nende kasutamisele, mistõttu ei ole need andmed kolmandate isikute jaoks seaduslikult kättesaadavad ega kasutatavad ning kolmandad isikud ei või kõnealuseid andmeid kasutada. |
|
(12) |
Komisjon hindas kogu teavet, mille taotleja oli esitanud, ning leidis, et taotleja on piisavalt tõendanud vastavust määruse (EL) 2015/2283 artikli 26 lõike 2 nõuetele. Seepärast ei tohiks toiduohutusamet viie järgneva aasta jooksul alates käesoleva määruse jõustumisest kasutada ühegi järgneva taotleja hüvanguks järgmisi taotleja toimikus sisalduvaid andmeid, mis olid aluseks toiduohutusameti otsusele, millega kinnitati kõnealuse uuendtoidu ohutust, ja ilma milleta ei oleks toiduohutusamet saanud uuendtoitu hinnata: tootmisprotsessi käsitlevad andmed; koostise andmed: osakeste suurus, füüsikalis-keemilised omadused, D-vitamiini analüüs, toitainete analüüs, D2-vitamiini analüüs, D-vitamiini analüüsi kontrollimine, stabiilsusuuringud, toksikoloogiline analüüs, tahhüsterooli ja lumisterooli käsitlevad andmed, ergosteroolisuhte analüüs, D-vitamiini suhte analüüs ja ergosterooli käsitlevad andmed. Seega tuleks lubada sel ajavahemikul liidu turule D2-vitamiini sisaldavat seenepulbrit lasta ainult taotlejal. |
|
(13) |
D2-vitamiini sisaldava seenepulbri jaoks antud loa ja taotleja toimikus sisalduvate andmete kasutamise ainuõiguse andmisega üksnes taotlejale ei takistata siiski teisi taotlejaid esitamast sama uuendtoidu turulelaskmiseks loataotlust, kui see põhineb määruse (EL) 2015/2283 kohaselt loa andmist toetaval seaduslikult hangitud teabel. |
|
(14) |
Seepärast tuleks rakendusmäärust (EL) 2017/2470 vastavalt muuta. |
|
(15) |
Käesoleva määrusega ettenähtud meetmed on kooskõlas alalise taime-, looma-, toidu- ja söödakomitee arvamusega, |
ON VASTU VÕTNUD KÄESOLEVA MÄÄRUSE:
Artikkel 1
1. Lisas kirjeldatud, D2-vitamiini sisaldav seenepulber lisatakse liidus lubatud uuendtoitude loetellu, mis on kehtestatud rakendusmäärusega (EL) 2017/2470.
2. Viie aasta jooksul alates 19. detsembrist 2021 võib üksnes esmane taotleja,
|
|
Äriühing: MBio, Monaghan Mushrooms, |
|
|
Aadress: Tullygony, Tyholland, Co. Monaghan, Iirimaa, |
|
|
lasta lõikes 1 osutatud uuendtoitu liidus turule, välja arvatud juhul, kui mõni hilisem taotleja saab kõnealuse uuendtoidu jaoks loa artikli 2 kohaselt kaitstud andmeid kasutamata või äriühingu MBio, Monaghan Mushrooms nõusolekul. |
3. Lõikes 1 osutatud kanne liidu loetelus hõlmab lisas esitatud kasutustingimusi ja märgistusnõudeid.
Artikkel 2
Taotlustoimikus esitatud andmeid, mille alusel amet hindas artiklis 1 osutatud uuendtoitu ja mis taotleja väitel on konfidentsiaalsed ning milleta ei oleks selle uuendtoidu jaoks luba antud, ei kasutata viie aasta jooksul alates 19. detsembrist 2021 äriühingu MBio, Monaghan Mushrooms nõusolekuta ühegi järgneva taotleja hüvanguks.
Artikkel 3
Rakendusmääruse (EL) 2017/2470 lisa muudetakse vastavalt käesoleva määruse lisale.
Artikkel 4
Käesolev määrus jõustub kahekümnendal päeval pärast selle avaldamist Euroopa Liidu Teatajas.
Käesolev määrus on tervikuna siduv ja vahetult kohaldatav kõikides liikmesriikides.
Brüssel, 26. november 2021
Komisjoni nimel
president
Ursula VON DER LEYEN
(1) ELT L 327, 11.12.2015, lk 1.
(2) Komisjoni 20. detsembri 2017. aasta rakendusmäärus (EL) 2017/2470, millega vastavalt Euroopa Parlamendi ja nõukogu määrusele (EL) 2015/2283 uuendtoidu kohta kehtestatakse liidu uuendtoitude loetelu (ELT L 351, 30.12.2017, lk 72).
(3) Euroopa Parlamendi ja nõukogu 10. juuni 2002. aasta direktiiv 2002/46/EÜ toidulisandeid käsitlevate liikmesriikide õigusaktide ühtlustamise kohta (EÜT L 183, 12.7.2002, lk 51).
(4) Euroopa Parlamendi ja nõukogu 12. juuni 2013. aasta määrus (EL) nr 609/2013 imikute ja väikelaste toidu, meditsiinilisel näidustusel kasutamiseks ettenähtud toidu ning kehakaalu alandamiseks ettenähtud päevase toidu asendajate kohta, millega tunnistatakse kehtetuks nõukogu direktiiv 92/52/EMÜ, komisjoni direktiivid 96/8/EÜ, 1999/21/EÜ, 2006/125/EÜ ja 2006/141/EÜ, Euroopa Parlamendi ja nõukogu direktiiv 2009/39/EÜ ning komisjoni määrused (EÜ) nr 41/2009 ja (EÜ) nr 953/2009 (ELT L 181, 29.6.2013, lk 35).
(5) 2.3.1 Production Process Confidential_Final.
(6) Annex 1 Particle Size Report.
(7) Annex 3 NIZO Report physico-chemical properties.
(8) Annex 4 COA vitamin D analysis.
(9) Annex 5 COA nutritional analysis.
(10) Annex 7 MBio SOP Vitamin D2 analysis.
(11) Annex 8 MBio Vit D analysis validation report.
(12) Annex 9 Stability Study Report UCC; Annex 14 COA Vit D stability study; Annex 24 Stability study Report CampdenBRI; Annex 25 Stability study report meat free product; Annex 29 COAs Stability Meat free.
(13) Annex 16 COA Toxicological analysis.
(14) Annex 17 Report Tachysterol and lumisterol.
(15) Annex 20 COA Ergosterol ratio analysis.
(16) Annex 21 COA Vitamin D ratio analysis.
(17) Annex 22 MBio Ergosterol.
(18) Annex 13 COA fresh mushrooms analysis.
(19) Annex 12 MBio Allergen Policy.
(20) EFSA Journal 2021; 19(4): 6516.
LISA
Rakendusmääruse (EL) 2017/2470 lisa muudetakse järgmiselt.
|
1) |
Tabelisse 1 („Lubatud uuendtoidud“) lisatakse järgmine kanne:
|
||||||||||||||||||||||||||||||||||||||||||
|
2) |
Tabelisse 2 („Spetsifikatsioonid“) lisatakse järgmine kanne:
|
(1) CFU: kolooniat moodustav ühik.
|
29.11.2021 |
ET |
Euroopa Liidu Teataja |
L 426/23 |
KOMISJONI RAKENDUSMÄÄRUS (EL) 2021/2080,
26. november 2021,
milles käsitletakse loa andmist Escherichia coli NITE SD 00268 abil kääritamise teel saadud L-histidiinmonovesinikkloriidmonohüdraadi kasutamiseks kõigi loomaliikide (v.a kalad) söödalisandina
(EMPs kohaldatav tekst)
EUROOPA KOMISJON,
võttes arvesse Euroopa Liidu toimimise lepingut,
võttes arvesse Euroopa Parlamendi ja nõukogu 22. septembri 2003. aasta määrust (EÜ) nr 1831/2003 loomasöötades kasutatavate söödalisandite kohta, (1) eriti selle artikli 9 lõiget 2,
ning arvestades järgmist:
|
(1) |
Määruses (EÜ) nr 1831/2003 on sätestatud loomasöödas kasutatava söödalisandi loa taotlemise nõue ning sellise loa andmise alused ja kord. |
|
(2) |
Kooskõlas määruse (EÜ) nr 1831/2003 artikliga 7 on esitatud taotlus saada luba kalade söödalisandina kasutatava, Escherichia coli NITE SD 00268 abil kääritamise teel saadud L-histidiinmonovesinikkloriidmonohüdraadi kasutusala laiendamiseks kõigi loomaliikide söödalisandina. Taotlusele olid lisatud määruse (EÜ) nr 1831/2003 artikli 7 lõikes 3 nõutud üksikasjad ja dokumendid. |
|
(3) |
Taotluses käsitletakse kalade söödalisandina kasutatava, Escherichia coli NITE SD 00268 abil kääritamise teel saadud L-histidiinmonovesinikkloriidmonohüdraadi kasutusala laiendamist kõigile loomaliikidele, ning selle klassifitseerimist söödalisandite kategooriasse „toitainelised lisandid“, funktsionaalrühma „aminohapped, nende soolad ja analoogid“ ning söödalisandite kategooriasse „organoleptilised lisandid“, funktsionaalrühma „lõhna- ja maitseained“. |
|
(4) |
Euroopa Toiduohutusamet (edaspidi „toiduohutusamet“) jõudis oma 5. mai 2021. aasta arvamuses (2) järeldusele, et kavandatud kasutustingimuste juures ei avalda Escherichia coli NITE SD 00268 abil kääritamise teel saadud L-histidiinmonovesinikkloriidmonohüdraat kahjulikku mõju loomade tervisele, tarbijate ohutusele ega keskkonnale. Toiduohutusamet leidis ka, et kõnealuse söödalisandi puhul ei olnud võimalik järeldada, kas see võib sissehingamisel olla mürgine, silmi ärritav või nahka sensibiliseeriv. Seepärast leiab komisjon, et tuleks võtta asjakohased kaitsemeetmed, mis võimaldavad ennetada kahjulikku mõju inimeste, eelkõige kõnealuse söödalisandi kasutajate tervisele. Toiduohutusamet tegi ka järelduse, et kõnealune söödalisand on asendamatu aminohappe histidiini tõhus allikas ning mõjus lõhna- ja maitseaine. |
|
(5) |
Toiduohutusameti hinnangul ei ole vaja kehtestada turustamisjärgse järelevalve erinõudeid. Toiduohutusamet kinnitas ka määruse (EÜ) nr 1831/2003 kohaselt asutatud referentlabori aruanded söödas sisalduva kõnealuse söödalisandi analüüsimise meetodi kohta. |
|
(6) |
Escherichia coli NITE SD 00268 abil kääritamise teel saadud L-histidiinmonovesinikkloriidmonohüdraadi hindamisest nähtub, et määruse (EÜ) nr 1831/2003 artiklis 5 sätestatud tingimused kasutamise lubamiseks on täidetud. Seepärast tuleks anda luba kõnealuse söödalisandi kasutamiseks vastavalt käesoleva määruse lisas esitatud tingimustele. |
|
(7) |
Käesoleva määrusega ettenähtud meetmed on kooskõlas alalise taime-, looma-, toidu- ja söödakomitee arvamusega, |
ON VASTU VÕTNUD KÄESOLEVA MÄÄRUSE:
Artikkel 1
1. Escherichia coli NITE SD 00268 abil kääritamise teel saadud ainet L-histidiinmonovesinikkloriidmonohüdraati, mida on kirjeldatud lisas ning mis kuulub söödalisandite kategooriasse „toitainelised lisandid“ ja funktsionaalrühma „aminohapped, nende soolad ja analoogid“, lubatakse kasutada söödalisandina loomasöödas vastavalt kõnealuses lisas esitatud tingimustele.
2. Escherichia coli NITE SD 00268 abil kääritamise teel saadud ainet L-histidiinmonovesinikkloriidmonohüdraati, mida on kirjeldatud lisas ning mis kuulub söödalisandite kategooriasse „organoleptilised lisandid“ ja funktsionaalrühma „lõhna- ja maitseained“, lubatakse kasutada söödalisandina loomasöödas kõnealuses lisas esitatud tingimustel.
Artikkel 2
Käesolev määrus jõustub kahekümnendal päeval pärast selle avaldamist Euroopa Liidu Teatajas.
Käesolev määrus on tervikuna siduv ja vahetult kohaldatav kõikides liikmesriikides.
Brüssel, 26. november 2021
Komisjoni nimel
president
Ursula VON DER LEYEN
(1) ELT L 268, 18.10.2003, lk 29.
(2) EFSA Journal (2021); 19(5):6622.
LISA
|
Söödalisandi identifitseerimisnumber |
Loa hoidja |
Söödalisand |
Koostis, keemiline valem, kirjeldus, analüüsimeetod |
Loomaliik või -kategooria |
Vanuse ülempiir |
Miinimumsisaldus |
Maksimumsisaldus |
Muud sätted |
Loa kehtivusaja lõpp |
||||||||||
|
Sisaldus milligrammides 12 % niiskusesisaldusega täissööda kilogrammi kohta |
|||||||||||||||||||
|
Kategooria: toitainelised lisandid Funktsionaalrühm: aminohapped, nende soolad ja analoogid |
|||||||||||||||||||
|
3c351i |
- |
L-histidiinmonovesinikkloriidmonohüdraat |
Söödalisandi koostis Pulber, mis sisaldab vähemalt 98 % L-histidiinmonovesinikkloriidmonohüdraati ja 72 % histidiini ja mille maksimaalne histamiinisisaldus on 100 ppm |
Kõik loomaliigid, välja arvatud kalad |
- |
- |
- |
|
19. detsember 2031 |
||||||||||
|
Toimeaine kirjeldus L-histidiinmonovesinikkloriidmonohüdraat, mis on saadud Escherichia coli NITE SD 00268 abil kääritamise teel Keemiline valem: C3H3N2-CH2-CH(NH2)-COΟΗ·ΗCl·Η2O CASi number: 5934-29–2 EINECSi nr: 211–438-9 |
|||||||||||||||||||
|
Analüüsimeetod: (1) Histidiinisisalduse määramiseks söödalisandis:
Histidiinisisalduse määramiseks eelsegus, söödamaterjalis ja segasöödas:
Histamiinisisalduse määramiseks söödalisandis:
|
|||||||||||||||||||
|
Kategooria: organoleptilised lisandid Funktsionaalrühm: lõhna- ja maitseained |
|||||||||||||||||||
|
3c351i |
- |
L-histidiinmonovesinikkloriidmonohüdraat |
Söödalisandi koostis Pulber, mis sisaldab vähemalt 98 % L-histidiinmonovesinikkloriidmonohüdraati ja 72 % histidiini ja mille maksimaalne histamiinisisaldus on 100 ppm |
Kõik loomaliigid |
- |
- |
- |
|
19. detsember 2031 |
||||||||||
|
Toimeaine kirjeldus L-histidiinmonovesinikkloriidmonohüdraat, mis on saadud Escherichia coli NITE SD 00268 abil kääritamise teel Keemiline valem: C3H3N2-CH2-CH(NH2)-COΟΗ·ΗCl·Η2O CASi number: 5934-29–2 EINECSi nr: 211–438-9 |
|||||||||||||||||||
|
Analüüsimeetod: (1) Histidiinisisalduse määramiseks söödalisandis:
Histidiinisisalduse määramiseks eelsegudes:
Histamiinisisalduse määramiseks söödalisandis:
|
|||||||||||||||||||
(1) Analüüsimeetodite üksikasjad on kättesaadavad referentlabori veebisaidil aadressil: https://ec.europa.eu/jrc/en/eurl/feed-additives/evaluation-reports
|
29.11.2021 |
ET |
Euroopa Liidu Teataja |
L 426/28 |
KOMISJONI RAKENDUSMÄÄRUS (EL) 2021/2081,
26. november 2021,
milles käsitletakse toimeaine indoksakarbi heakskiidu pikendamata jätmist vastavalt Euroopa Parlamendi ja nõukogu määrusele (EÜ) nr 1107/2009 taimekaitsevahendite turulelaskmise kohta ning millega muudetakse komisjoni rakendusmäärust (EL) nr 540/2011
(EMPs kohaldatav tekst)
EUROOPA KOMISJON,
võttes arvesse Euroopa Liidu toimimise lepingut,
võttes arvesse Euroopa Parlamendi ja nõukogu 21. oktoobri 2009. aasta määrust (EÜ) nr 1107/2009 taimekaitsevahendite turulelaskmise ja nõukogu direktiivide 79/117/EMÜ ja 91/414/EMÜ kehtetuks tunnistamise kohta, (1) eriti selle artikli 20 lõike 1 punkti b ja artikli 78 lõiget 2,
ning arvestades järgmist:
|
(1) |
Komisjoni direktiiviga 2006/10/EÜ (2) kanti toimeaine indoksakarb nõukogu direktiivi 91/414/EMÜ (3) I lisasse. |
|
(2) |
Direktiivi 91/414/EMÜ I lisasse kantud toimeained loetakse määruse (EÜ) nr 1107/2009 alusel heaks kiidetuks ja need on loetletud komisjoni rakendusmääruse (EL) nr 540/2011 lisa A osas (4). |
|
(3) |
Toimeaine indoksakarbi heakskiit, nagu on sätestatud rakendusmääruse (EL) nr 540/2011 lisa A osas, aegub 31. oktoobril 2022. |
|
(4) |
Kooskõlas komisjoni rakendusmääruse (EL) nr 844/2012 (5) artikliga 1 on kõnealuses artiklis sätestatud ajavahemikus esitatud taotlus indoksakarbi heakskiidu pikendamiseks. |
|
(5) |
Taotleja esitas täiendavad toimikud, mis on nõutud vastavalt rakendusmääruse (EL) nr 844/2012 artiklile 6. Referentliikmesriik leidis, et taotlus on täielik. |
|
(6) |
Referentliikmesriik koostas kaasreferentliikmesriigiga konsulteerides pikendamise hindamisaruande kavandi ning esitas selle 28. novembril 2016 Euroopa Toiduohutusametile (edaspidi „toiduohutusamet“) ja komisjonile. |
|
(7) |
Toiduohutusamet tegi täiendava kokkuvõtliku toimiku üldsusele kättesaadavaks. Samuti edastas toiduohutusamet pikendamise hindamisaruande taotlejale ja liikmesriikidele märkuste esitamiseks ning algatas selle kohta avaliku arutelu. Toiduohutusamet edastas saadud märkused komisjonile. |
|
(8) |
15. detsembril 2017 esitas toiduohutusamet komisjonile oma järelduse (6) selle kohta, kas indoksakarb võib eeldatavalt vastata määruse (EÜ) nr 1107/2009 artiklis 4 sätestatud heakskiitmise kriteeriumidele. Selle järelduse ökotoksikoloogiat käsitlevat osa muudeti 2018. aastal, et selgitada riskihindamist mesilaste puhul vastavalt asjakohastele Euroopa Komisjoni suunistele (SANCO/10329/2002-rev.2). 15. mail 2019 palus komisjon toiduohutusametil koostada ajakohastatud vastastikuse eksperdihinnangu indoksakarbist imetajatele ja mesilastele tuleneva riski kohta. 28. oktoobril 2019 kiitis toiduohutusamet heaks seisukoha toimeainest indoksakarbist imetajatele ja mesilastele tulenevat riski käsitleva ajakohastatud vastastikuse eksperdihinnangu kohta; (7) seda seisukohta kajastati toiduohutusameti järelduse teises ajakohastatud versioonis, milles käsitleti seda, kas indoksakarb võib eeldatavalt vastata määruse (EÜ) nr 1107/2009 artiklis 4 sätestatud heakskiitmise kriteeriumidele. |
|
(9) |
Toiduohutusamet tegi kindlaks tõsist muret tekitava küsimuse seoses suure pikaajalise riskiga looduslikele imetajatele, eelkõige väikestele taimtoidulistele imetajatele. |
|
(10) |
Lisaks tehti kindlaks tarbijatele ja töötajatele avalduv suur risk seoses iseloomuliku kasutusviisiga aedsalati puhul ning mesilastele avalduv suur risk seoses iseloomuliku kasutusviisiga maisi, suhkrumaisi ja seemnete tootmiseks kasvatatava aedsalati puhul. |
|
(11) |
Lisaks ei olnud mitmes valdkonnas võimalik riskihindamist lõpule viia, sest toimikus leiduv teave ei olnud piisav. Täpsemalt ei olnud võimalik lõpule viia tarbijale avalduva riski hindamist, sest puudusid andmed külvikorrakultuuride metabolismi kohta, andmed metabolismi kohta kodulindudel, jääkide koguse kohta põhikultuurides ja külvikorrakultuurides ning andmed veetöötlemisprotsesside mõju kohta jääkidele joogivees. Lisaks ei olnud võimalik lõpule viia hindamist pinnases leiduva metaboliidi IN-U8E24 kokkupuute kohta põhjaveega, kuna puuduvad andmed mulla degradeerumise ja adsorptsiooni kohta. Samuti ei olnud võimalik lõpule viia mitme metaboliidiga seotud ökotoksikoloogilise riski hindamist. |
|
(12) |
14. novembril 2018 teatas taotleja komisjonile oma otsusest eemaldada pikendamistaotlusest iseloomulikud kasutusviisid aedsalati puhul. |
|
(13) |
Komisjon palus taotlejal esitada oma märkused toiduohutusameti järelduste, läbivaadatud järelduste ja seisukoha kohta. Lisaks palus komisjon rakendusmääruse (EL) nr 844/2012 artikli 14 lõike 1 kolmanda lõigu kohaselt, et taotleja esitaks oma märkused pikendamisaruande kavandi kohta. Taotleja esitas oma märkused ja need on põhjalikult läbi vaadatud. |
|
(14) |
Vaatamata taotleja esitatud väidetele ei olnud võimalik kõnealuse toimeainega seotud probleeme lahendatuks lugeda. |
|
(15) |
Seega ei ole vähemalt ühe taimekaitsevahendi ühe või mitme iseloomuliku kasutusviisiga seoses leidnud kinnitust, et määruse (EÜ) nr 1107/2009 artiklis 4 sätestatud heakskiitmise kriteeriumid on täidetud. Seetõttu on asjakohane jätta toimeaine indoksakarbi heakskiit vastavalt kõnealuse määruse artikli 20 lõike 1 punktile b pikendamata. |
|
(16) |
Rakendusmäärust (EL) nr 540/2011 tuleks seega vastavalt muuta. |
|
(17) |
Liikmesriikidele tuleks anda piisavalt aega indoksakarbi sisaldavate taimekaitsevahendite lubade tagasivõtmiseks. |
|
(18) |
Kui liikmesriigid annavad indoksakarbi sisaldavate taimekaitsevahendite puhul ajapikendust kooskõlas määruse (EÜ) nr 1107/2009 artikliga 46, peab see olema võimalikult lühike. |
|
(19) |
Komisjoni rakendusmäärusega (EL) 2021/1449 (8) pikendati indoksakarbi heakskiidu kehtivusaega 31. oktoobrini 2022, et pikendamismenetluse saaks lõpule viia enne kõnealuse aine heakskiidu aegumist. Kuna aga heakskiidu pikendamata jätmise kohta on otsus tehtud enne pikendatud kehtivusaja lõppkuupäeva, tuleks hakata käesolevat määrust kohaldama niipea kui võimalik. |
|
(20) |
Käesoleva määrusega ei piirata õigust esitada määruse (EÜ) nr 1107/2009 artikli 7 kohaselt uut taotlust indoksakarbi heakskiitmiseks. |
|
(21) |
Käesoleva määrusega ettenähtud meetmed on kooskõlas alalise taime-, looma-, toidu- ja söödakomitee arvamusega, |
ON VASTU VÕTNUD KÄESOLEVA MÄÄRUSE:
Artikkel 1
Toimeaine heakskiidu pikendamata jätmine
Toimeaine indoksakarbi heakskiitu ei pikendata.
Artikkel 2
Rakendusmääruse (EL) nr 540/2011 muutmine
Rakendusmääruse (EL) nr 540/2011 lisa A osast jäetakse välja 119. rida, milles käsitletakse indoksakarbi.
Artikkel 3
Üleminekumeetmed
Liikmesriigid võtavad toimeainet indoksakarbi sisaldavate taimekaitsevahendite load tagasi hiljemalt 19. märtsiks 2022.
Artikkel 4
Ajapikendus
Ajapikendus, mille liikmesriigid annavad kooskõlas määruse (EÜ) nr 1107/2009 artikliga 46, lõpeb 19. septembriks 2022.
Artikkel 5
Jõustumine
Käesolev määrus jõustub kahekümnendal päeval pärast selle avaldamist Euroopa Liidu Teatajas.
Käesolev määrus on tervikuna siduv ja vahetult kohaldatav kõikides liikmesriikides.
Brüssel, 26. november 2021
Komisjoni nimel
president
Ursula VON DER LEYEN
(1) ELT L 309, 24.11.2009, lk 1.
(2) Komisjoni 27. jaanuari 2006. aasta direktiiv 2006/10/EÜ, millega muudetakse nõukogu direktiivi 91/414/EMÜ, et lisada toimeainete hulka forkloorfenuroon ja indoksakarb (ELT L 25, 28.1.2006, lk 24).
(3) Nõukogu 15. juuli 1991. aasta direktiiv 91/414/EMÜ taimekaitsevahendite turuleviimise kohta (EÜT L 230, 19.8.1991, lk 1).
(4) Komisjoni 25. mai 2011. aasta rakendusmäärus (EL) nr 540/2011, millega rakendatakse Euroopa Parlamendi ja nõukogu määrust (EÜ) nr 1107/2009 seoses heakskiidetud toimeainete loeteluga (ELT L 153, 11.6.2011, lk 1).
(5) Komisjoni 18. septembri 2012. aasta rakendusmäärus (EL) nr 844/2012, millega kehtestatakse Euroopa Parlamendi ja nõukogu määruses (EÜ) nr 1107/2009 (taimekaitsevahendite turulelaskmise kohta) ette nähtud toimeainete heakskiidu pikendamise menetluse rakendamiseks vajalikud sätted (ELT L 252, 19.9.2012, lk 26).
(6) EFSA Journal 2018;16(1):5140, 36 lk doi:10.2903/j.efsa.2018.5140. Kättesaadav internetis: www.efsa.europa.eu.
(7) EFSA (Euroopa Toiduohutusamet), 2019. „Statement on the updated peer review concerning the risk to mammals and bees for the active substance indoxacarb“ („Seisukoht ajakohastatud vastastikuse eksperdihinnangu kohta, milles käsitletakse toimeaine indoksakarbiga seotud riski imetajatele ja mesilastele“), EFSA Journal 2019;17(10):5866, 10 lk
(8) Komisjoni 3. septembri 2021. aasta rakendusmäärus (EL) 2021/1449, millega muudetakse rakendusmäärust (EL) nr 540/2011 seoses toimeainete 2-fenüülfenooli (sealhulgas selle soolad, näiteks naatriumsool), 8-hüdroksükinoliini, amidosulfurooni, bifenoksi, kloormekvaadi, klorotolurooni, klofentesiini, klomasooni, tsüpermetriini, daminosiidi, deltametriini, dikamba, difenokonasooli, diflufenikaani, dimetakloori, etofeenproksi, fenoksaprop-P, fenpropidiini, fludioksoniili, flufenatseedi, fostiasaadi, indoksakarbi, lenatsiili, MCPA, MCPB, nikosulfurooni, parafiinõlide, parafiinõli, penkonasooli, pikloraami, propakvisafopi, prosulfokarbi, kvisalofop-P-etüüli, kvisalofop-P-tefurüüli, väävli, tetrakonasooli, triallaadi, triflusulfurooni ja tritosulfurooni heakskiidu kehtivusaja pikendamisega (ELT L 313, 6.9.2021, lk 20).
|
29.11.2021 |
ET |
Euroopa Liidu Teataja |
L 426/32 |
KOMISJONI RAKENDUSMÄÄRUS (EL) 2021/2082,
26. november 2021,
millega kehtestatakse Euroopa Parlamendi ja nõukogu määruse (EL) nr 376/2014 rakendamise kord seoses Euroopa ühise riskiklassifitseerimissüsteemiga
(EMPs kohaldatav tekst)
EUROOPA KOMISJON,
võttes arvesse Euroopa Liidu toimimise lepingut,
võttes arvesse Euroopa Parlamendi ja nõukogu 3. aprilli 2014. aasta määrust (EL) nr 376/2014, mis käsitleb tsiviillennunduses toimunud juhtumitest teatamist ning juhtumite analüüsi ja järelmeid, millega muudetakse Euroopa Parlamendi ja nõukogu määrust (EL) nr 996/2010 ning tunnistatakse kehtetuks Euroopa Parlamendi ja nõukogu direktiiv 2003/42/EÜ ja komisjoni määrused (EÜ) nr 1321/2007 ja (EÜ) nr 1330/2007, (1) eriti selle artikli 7 lõiget 7,
ning arvestades järgmist:
|
(1) |
Määruse (EL) nr 376/2014 kohaselt peavad nii liikmesriigid kui ka Euroopa Liidu Lennundusohutusamet (edaspidi „amet“) looma süsteemi lennuohutust mõjutavate juhtumite üksikasjade sõltumatuks kogumiseks, hindamiseks, töötlemiseks, analüüsimiseks ja salvestamiseks. Liikmesriikide pädevad asutused peavad lennuohutust mõjutavate juhtumitega seotud üksikasjade põhjal koostama lennuohutust mõjutavate juhtumite ettekanded ning säilitama need riiklikus andmebaasis. Ametil on samasugune kohustus koostada lennuohutust mõjutavate juhtumite üksikasjade põhjal neid käsitlevad ettekanded ning säilitada need andmebaasis. |
|
(2) |
Vastavalt määruse (EL) nr 376/2014 artikli 9 lõikele 1 osalevad liikmesriigid ja amet teabevahetuses ning teevad Euroopa keskse andmekogu kaudu kättesaadavaks kogu ohutusalase teabe, mis nad on talletanud oma andmebaasides lennuohutust mõjutavate juhtumite kohta. |
|
(3) |
Määruse (EL) nr 376/2014 kohaselt peavad lennuohutust mõjutavate juhtumite ettekanded sisaldama ohutusriskide klassifikatsiooni, mille vaatavad läbi liikmesriikide pädevad asutused või amet ning mis tuleb edastada Euroopa kesksesse andmekogusse. Selleks et kõik Euroopa keskses andmekogus sisalduvad lennuohutust mõjutavate juhtumite ettekanded klassifitseeritaks ühtlustatud viisil, peaksid liikmesriikide pädevad asutused ja amet tagama, et nendes aruannetes sisalduv klassifikatsioon määratakse kindlaks vastavalt komisjoni delegeeritud määruses (EL) 2020/2034 (2) sätestatud Euroopa ühisele riskiklassifitseerimissüsteemile (ERCS). |
|
(4) |
Nüüd on vaja sätestada kord ERCSi ühtlustatud ja järjepidevaks rakendamiseks ameti ning liikmesriikide poolt. |
|
(5) |
Kui lennuohutust mõjutavate juhtumite ettekanded sisaldavad riskiklassifikatsiooni, mille koostamiseks on kasutatud muid meetodeid kui ERCS, peaksid liikmesriikide pädevad asutused või amet klassifitseerima asjaomase juhtumi ohutusriski vastavalt ERCSile, nagu on kindlaks määratud komisjoni delegeeritud määruses (EL) 2020/2034. |
|
(6) |
Kui liikmesriikide pädevad asutused või amet otsustavad kasutada teisendamismenetlust põhjenduses 5 osutatud riskiklasside teisendamiseks ERCSi riskiklassifitseerimissüsteemi ja tegemist on selliste meetoditega nagu ARMS-ERC 4x4 või RAT „ATM-üld“, peaksid liikmesriikide pädevad asutused või amet kasutama käesolevas määruses sätestatud automaatse teisendamise menetlust. |
|
(7) |
Kui lisas esitatud automaatse teisendamise menetlust ei kohaldata, peaks liikmesriikide pädevatel asutustel ja ametil olema lubatud kasutada muid teisendamismenetlusi, tingimusel et tulemuseks on samaväärne ERCSi liigitus. |
|
(8) |
Selleks et tagada ERCSi tõhus kohaldamine, on seda vaja pidevalt jälgida ja täiustada. On vaja kehtestada sellise jälgimise ja täiustamise üksikasjalikud eeskirjad ning amet peaks komisjoni sellisel läbivaatamisel ja jälgimisel abistama. Selleks peaksid liikmesriigid andma ettenähtud tähtaja jooksul ametile ja komisjonile korrapäraselt aru ERCSi kasutamisest ning selle hindamisest. |
|
(9) |
Liikmesriikide pädevad asutused ja amet peavad ERCSi kohaldamiseks ette valmistuma, eelkõige kohandama oma sisemenetlusi ning eraldama võimaluse korral täiendavaid vahendeid. Määruse (EL) nr 376/2014 artikli 24 lõikes 3 on siiski sätestatud, et kõnealuse määruse artikli 7 lõiget 2, millega on ette nähtud, et liikmesriigid ja amet kasutavad ERCSi, hakatakse kohaldama siis, kui jõustuvad delegeeritud õigusaktid ja rakendusaktid, millega ERCSi täpsustatakse ja arendatakse. Komisjoni delegeeritud määrus (EL) 2020/2034, millega loodi ERCS, jõustus juba 31. detsembril 2020. Seetõttu ei ole võimalik ERCSi kasutuselevõtu kohustuse kohaldamist pärast käesoleva määruse jõustumise kuupäeva enam edasi lükata. Euroopa Parlamendi ja nõukogu määruse (EL) 2018/1139 (3) artikli 72 lõike 7 kohaselt ameti poolt avaldatava iga-aastase ohutusülevaate seisukohast on eelkõige oluline, et ühe aasta jooksul Euroopa kesksesse andmekogusse üles laaditud lennuohutust mõjutavate juhtumite aruandeid hinnataks ühtlustatud viisil. Kohustust klassifitseerida lennuohutust mõjutavad juhtumid vastavalt ERCSile tuleks hakata kohaldama alates käesoleva määruse jõustumise kuupäevast. Seega peaks käesolev määrus jõustuma 1. jaanuaril 2023. |
|
(10) |
Käesoleva määrusega ettenähtud meetmed on kooskõlas määruse (EL) 2018/1139 artikli 127 kohaselt asutatud komitee arvamusega, |
ON VASTU VÕTNUD KÄESOLEVA MÄÄRUSE:
Artikkel 1
Reguleerimisese
Käesoleva määrusega nähakse ette delegeeritud määruses (EL) 2020/2034 sätestatud Euroopa ühise riskiklassifitseerimissüsteemi (edaspidi „ERCS“) rakendamise kord.
Artikkel 2
Mõisted
Käesolevas määruses kasutatakse delegeeritud määruse (EL) 2020/2034 artiklis 2 sätestatud mõisteid.
Kasutatakse ka järgmisi mõisteid:
|
1) |
„ARMS-ERC meetod“ – meetod, mille töötas välja lennundussektori töörühm ARMS (Airline Risk Management Solutions) õhusõidukite käitamisega seotud riskide hindamiseks; |
|
2) |
„lennuliikluse korraldamine“ – Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 549/2004 (4) artikli 2 lõikes 10 määratletud lennuliikluse korraldamine; |
|
3) |
„raskusastet „ATM-õhk“ väljendav punktisumma“– RAT-meetodi osa, mille abil hinnatakse lennuohutust mõjutava juhtumi mõju õhusõiduki käitamisele; |
|
4) |
„raskusastet „ATM-maa“ väljendav punktisumma“ – RAT-meetodi osa, mille abil hinnatakse ATM-süsteemi toimimist (protseduurid, seadmed ja inimfaktor); |
|
5) |
„raskusastet „ATM-üld“ väljendav punktisumma“ – raskusastet „ATM-õhk“ ja raskusastet „ATM-maa“ väljendavad punktisummad kombineerituna üheks punktisummaks; |
|
6) |
„RAT-meetod“ – Eurocontroli väljatöötatud riskianalüüsivahendi meetod, mida kasutatakse lennuliikluse korraldamise valdkonnas ohutusega seotud juhtumite liigitamiseks; |
|
7) |
„Eurocontrol“ – Euroopa Lennuliikluse Ohutuse Organisatsioon, loodud lennuliikluse ohutuse alast koostööd käsitleva 13. detsembri 1960. aasta rahvusvahelise konventsiooniga (5). |
Artikkel 3
Ohutusriskide klassifikatsiooni läbivaatamine, muutmine ja kinnitamine
1. Liikmesriigi pädev asutus või amet vaatab asjaomase lennuohutust mõjutava juhtumi ettekandes sisalduva ohutusriski klassifikatsiooni läbi ning vajaduse korral muudab seda ja kinnitab selle vastavalt ERCSile, nagu on sätestatud komisjoni delegeeritud määruses (EL) 2020/2034.
2. Ilma et see piiraks lõike 1 kohaldamist, kasutab liikmesriigi pädev asutus või amet meetodite ARMS-ERC 4x4 või RAT „ATM-üld“ abil kindlaks määratud ohutusriski klassifikatsiooni teisendamiseks käesoleva määruses lisas esitatud automaatse teisendamise menetlust. Muude meetoditega kindlaks määratud ohutusriskide klassifitseerimiseks võib liikmesriigi pädev asutus või amet kasutada lisa punktis 2 kirjeldatud käsitsi teisendamise menetlust või muid teisendamismenetlusi, kui need on asjakohased, tingimusel et tulemuseks on samaväärne ERCSi liigitus.
Artikkel 4
ERCSi jälgimine ja täiustamine
1. Iga liikmesriik esitab 31. märtsil 2026 ning seejärel iga viie aasta tagant komisjonile ja ametile aruande ERCSi kasutamise kohta.
2. Amet vaatab käesoleva artikli lõike 1 kohaselt läbi liikmesriikidelt saadud teabe ning muu teabe, mille amet võib olla ERCSi rakendamise kohta saanud. Amet võib läbivaatamisel arvesse võtta määruse (EL) nr 376/2014 artikli 14 lõikes 2 osutatud lennundusohutusanalüütikute võrgustiku ja ameti loodud asjaomaste eksperdirühmade eksperditeadmisi.
Artikkel 5
Muude riskiklassifitseerimissüsteemidega ühilduvuse jälgimine
1. Selleks et käesoleva määruse lisas esitatud teisendamismenetlused oleksid jätkuvalt asjakohased, vaatab amet need korrapäraselt läbi. Läbivaatamisel võib arvesse võtta lennundusohutusanalüütikute võrgustiku ja ameti loodud asjaomaste eksperdirühmade eksperditeadmisi.
2. Vajaduse korral teavitavad liikmesriigid komisjoni ja ametit lisa punktis 2 esitatud käsitsi teisendamise menetluse kasutamisest ning muudest käesoleva määruse artikli 3 lõikes 2 osutatud teisendamismenetlustest.
Artikkel 6
Jõustumine
Käesolev määrus jõustub 1. jaanuaril 2023.
Käesolev määrus on tervikuna siduv ja vahetult kohaldatav kõikides liikmesriikides.
Brüssel, 26. november 2021
Komisjoni nimel
president
Ursula VON DER LEYEN
(1) ELT L 122, 24.4.2014, lk 18.
(2) Komisjoni 6. oktoobri 2020. aasta delegeeritud määrus (EL) 2020/2034, millega täiendatakse Euroopa Parlamendi ja nõukogu määrust (EL) nr 376/2014 seoses Euroopa ühise riskiklassifitseerimissüsteemiga (ELT L 416, 11.12.2020, lk 1).
(3) Euroopa Parlamendi ja nõukogu 4. juuli 2018. aasta määrus (EL) 2018/1139, mis käsitleb tsiviillennunduse valdkonna ühisnorme ja millega luuakse Euroopa Liidu Lennundusohutusamet ning millega muudetakse Euroopa Parlamendi ja nõukogu määrusi (EÜ) nr 2111/2005, (EÜ) nr 1008/2008, (EL) nr 996/2010, (EL) nr 376/2014 ja Euroopa Parlamendi ja nõukogu direktiive 2014/30/EL ning 2014/53/EL ning tunnistatakse kehtetuks Euroopa Parlamendi ja nõukogu määrused (EÜ) nr 552/2004 ja (EÜ) nr 216/2008 ning nõukogu määrus (EMÜ) nr 3922/91 (ELT L 212, 22.8.2018, lk 1).
(4) Euroopa Parlamendi ja nõukogu 10. märtsi 2004. aasta määrus (EÜ) nr 549/2004, millega sätestatakse raamistik ühtse Euroopa taeva loomiseks (raammäärus) (ELT L 96, 31.3.2004, lk 1).
(5) 12. veebruari 1981. aasta protokolliga muudetud ning 27. juuni 1997. aasta protokolliga üle vaadatud konventsioon.
LISA
Riskianalüüsivahendi (RAT) ja lennundussektori töörühma Aviation Risk Management Solutions juhtumiriski klassifitseerimisvahendi (ARMS-ERC) punktisummade Euroopa riskiklassifitseerimissüsteemi (ERCS) punktisummadeks teisendamise menetlused
Käesolevas lisas määratakse kindlaks komisjoni delegeeritud määruse (EL) 2020/2034 lisa 2. etapis määratletud RATi ja ARMS-ERC punktisummade ERCSi punktisummaks (1) teisendamise menetlused.
Allpool kirjeldatud teisendamismenetluste abil saab RATi ja/või ARMS-ERC punktisummad kas automaatselt või käsitsi teisendada ERCSi klassifikatsioonile vastavaks punktisummaks kooskõlas käesoleva määruse artikliga 3.
1. Automaatne teisendamine
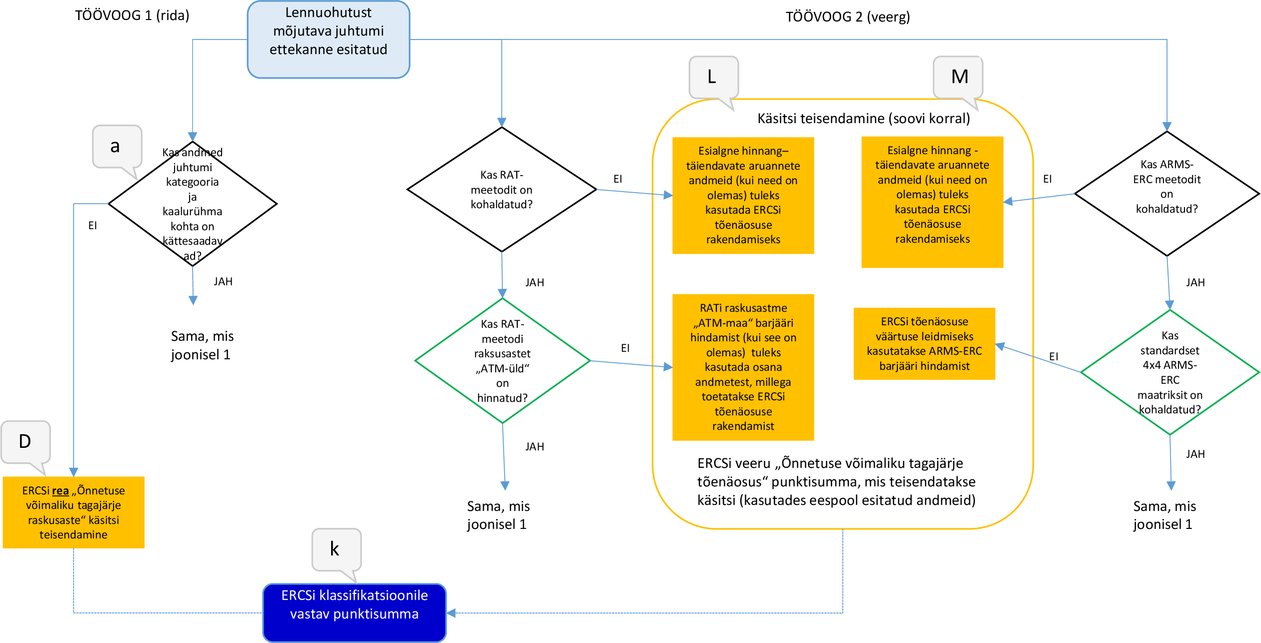
Kohustusliku teisendamismenetluse puhul järgitakse kaht töövoogu:
|
— |
töövoog 1 – võimaldab automaatset teisendamist, et saada ERCSi raskusastet väljendav punktisumma; |
|
— |
töövoog 2 – võimaldab automaatset teisendamist, et saada ERCSi tõenäosust väljendav punktisumma. |
Joonisel 1 on esitatud ülevaade menetlustest. Protsessi alguspunktiks on lahter „Lennuohutust mõjutava juhtumi ettekanne esitatud“ ja tulemuseks lahter „ERCSi klassifikatsioonile vastav punktisumma“. Joonisel 1 kujutatud punktiirjooned näitavad, et iga protsessitulemuse jaoks on vaja vaid üht allikat.

1.1. TÖÖVOOG 1 – ERCSi raskusastet väljendav punktisumma
a. Teave lennuohutust mõjutava juhtumi kategooria ja kaalurühma kohta
|
— |
Kui lennuohutust mõjutava juhtumi ettekanne sisaldab teavet juhtumi kategooria ja kaalurühma kohta, saab need teisendada ERCSi punktisummaks, mis väljendab õnnetuse võimaliku tagajärje raskusastet. Järgmist etappi tähistab joonisel 1 kujutatud kast b. |
|
— |
Kui lennuohutust mõjutava juhtumi ettekanne ei sisalda teavet juhtumi kategooria ega kaalurühma ega mitte kummagi kohta, siis automaatset teisendamist kasutada ei saa. Kui kasutatakse käesoleva lisa punktis 2 kirjeldatud käsitsi teisendamist, tähistab järgmist etappi joonistel 1 ja 5 kujutatud kast D. |
b. Lennuohutust mõjutava juhtumi kategooria teisendamine ERCSi põhiliseks riskivaldkonnaks (KRA)
|
— |
Kui lennuohutust mõjutava juhtumi ettekandes märgitud juhtumi kategooria vastab otseselt mõnele ERCSi põhilisele riskivaldkonnale, mis on kindlaks määratud delegeeritud määruse (EL) 2020/2034 lisa punktis 1.2, tähistab järgmist etappi joonisel 1 kujutatud kast c. |
|
— |
Ettekannete puhul, milles lennuohutust mõjutava juhtumi kategooria erineb ERCSi põhilistest riskivaldkondadest, automaatset teisendamist kasutada ei saa. Kui kasutatakse käesoleva lisa punktis 2 kirjeldatud käsitsi teisendamist, tähistab järgmist etappi joonistel 1 ja 5 kujutatud kast D. |
c. ERCSi punktisumma, mis väljendab õnnetuse võimaliku tagajärje raskusastet – automaatne teisendamine
|
— |
Kui lennuohutust mõjutava juhtumi ettekanne sisaldab teavet juhtumi kategooria ja kaalurühma kohta, teisendatakse raskusaste automaatselt ERCSi punktisummaks, mis väljendab õnnetuse võimaliku tagajärje raskusastet. Tulemus esitatakse kastis k, mis sisaldab esimest väärtust, milleks on juhtumi raskusastme kindlaksmääramisel saadud täht (raskusastmed A–X). |
1.2. TÖÖVOOG 2 – ERCSi tõenäosuse punktisumma
e. Lennuohutust mõjutava juhtumi ettekanne, mida on hinnatud RAT-meetodi alusel
Kui lennuohutust mõjutava juhtumi ettekannet on hinnatud RAT-meetodi (2) alusel:
|
— |
Lennuohutust mõjutava juhtumi ettekande, millel on RAT-meetodi alusel arvutatud raskusastme klassifikatsioon „ATM-üld“, saab kaardistada otse ERCSi tõenäosuse veergudes, nagu on selgitatud joonisel 2 kujutatud kastis g. |
|
— |
Kui lennuohutust mõjutava juhtumi ettekandes on esitatud ainult RAT-meetodi alusel arvutatud raskusastet „ATM-maa“ väljendav punktisumma, (3) tuleb see ERCSi tõenäosuse punktisumma saamiseks teisendada käsitsi. Kui kasutatakse käesoleva lisa punktis 2 kirjeldatud käsitsi teisendamist, tähistab järgmist etappi joonisel 5 kujutatud kast L. |
|
— |
Sellise lennuohutust mõjutava juhtumi ettekande puhul, mis on kodeeritud kui „ATM-spetsiifiline juhtum“, ei ole RATi punktisummasid võimalik ERCSi punktisummadeks teisendada. |
f. RAT-meetodi alusel arvutatud raskusastme „ATM-üld“ punktisumma
|
— |
Kui lennuohutust mõjutava juhtumi ettekanne sisaldab raskusastme „ATM-üld“ punktisummat, tähistab järgmist etappi joonisel 1 kujutatud kast g. |
g. ERCSi veerg „Õnnetuse võimaliku tagajärje tõenäosus“, mis on teisendatud RATi väärtusest „ATM-üld“ (ainult väärtuste A, B, C, E puhul)
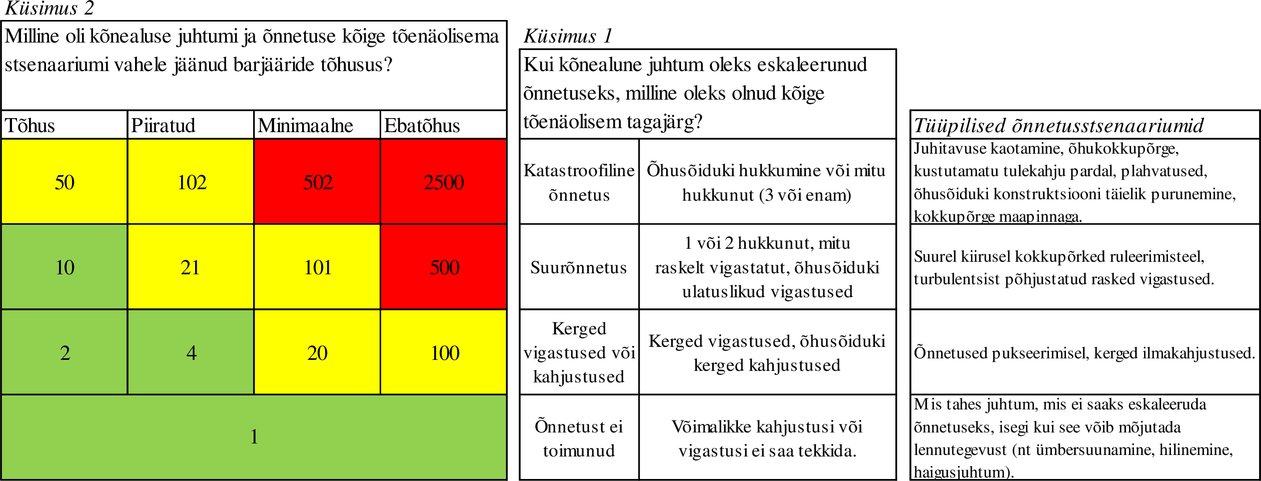
Sellise lennuohutust mõjutava juhtumi ettekande puhul, millel on raskusastme „ATM-üld“ (A, B, C, E) klassifikatsioon, kohaldatakse järgmist automaatset teisendamist ERCSi tõenäosuse kategooriateks:

h. Lennuohutust mõjutavate juhtumite ettekanded, mis on klassifitseeritud ARMS-ERC meetodi alusel
|
— |
ARMS-ERC meetodi järgi hinnatud lennuohutust mõjutavate juhtumite ettekannete puhul tähistab järgmist etappi joonisel 1 kujutatud kast i. |
|
— |
Sellise lennuohutust mõjutava juhtumi ettekande puhul, mida ei ole hinnatud ARMS-ERC meetodi alusel, tähistab järgmist etappi joonisel 5 kujutatud kast M. |
i. Standardne 4x4 ARMS-ERC maatriks
Kui lennuohutust mõjutava juhtumi ettekande hindamiseks kasutatakse joonisel 3 kujutatud 4x4 ARMS-ERC maatriksit, tähistab järgmist etappi joonisel 1 kujutatud kast j.
j. ERCSi punktisumma, mis väljendab õnnetuse võimaliku tagajärje tõenäosust – automaatne teisendamine
Kui lennuohutust mõjutava juhtumi ettekanne sisaldab ARMSi hinnangut „Barjääri tõhusus“, siis kasutatakse õnnetuse võimaliku tagajärje tõenäosust väljendava ERCSi punktisumma kindlaksmääramiseks järgmist automaatset teisendamist ERCSi maatriksisse.

k. ERCSi klassifikatsioonile vastav punktisumma
ERCSi klassifikatsioonile vastava punktisumma saamiseks kombineeritakse ERCSi maatriksis omavahel õnnetuse võimaliku tagajärje raskusastet väljendav ERCSi punktisumma ja õnnetuse võimaliku tagajärje tõenäosust väljendav ERCSi punktisumma, nagu on kindlaks määratud delegeeritud määruse (EL) 2020/2034 lisa 2. etapis.
2. KÄSITSI TEISENDAMINE
Käsitsi teisendamise puhul järgitakse kaht järgmist töövoogu:
|
— |
töövoog 1 – võimaldab käsitsi teisendamist, et saada ERCSi raskusastet väljendav punktisumma; |
|
— |
töövoog 2 – võimaldab käsitsi teisendamist, et saada ERCSi tõenäosuse punktisumma. |
2.1. TÖÖVOOG 1
D. ERCSi punktisumma, mis väljendab õnnetuse võimaliku tagajärje raskusastet – käsitsi teisendamine
|
— |
Kui lennuohutust mõjutava juhtumi ettekanne ei sisalda teavet juhtumi kategooria ega kaalurühma ega mitte kummagi kohta, kohaldatakse õnnetuse võimaliku tagajärje või põhilise riskivaldkonna kindlaksmääramisel delegeeritud määruse (EL) 2020/2034 lisas määratletud ERCSi meetodit. Lõpptulemus esitatakse kastis k, mis sisaldab esimest väärtust, milleks on juhtumi raskusastme kindlaksmääramisel saadud täht (raskusastmed A–X). |
2.2. TÖÖVOOG 2
L. ERCSi veerg „Õnnetuse võimaliku tagajärje tõenäosus“ – käsitsi teisendamine
|
— |
Kui lennuohutust mõjutava juhtumi ettekanne ei sisalda raskusastet „ATM-üld“, siis õnnetuse võimaliku tagajärje tõenäosust väljendava ERCSi punktisumma kindlaksmääramisel automaatset teisendamist ei kohaldata. |
Raskusastme „ATM-maa“ abil on siiski võimalik osaline teisendamine, kaardistades raskusastme „ATM-maa“ barjääri hindamise ja ERCSi barjääri hindamise protsessi, mis on kindlaks määratud delegeeritud määruse (EL) 2020/2034 lisa punktis 2.1.3.
M. ERCSi punktisumma, mis väljendab õnnetuse võimaliku tagajärje tõenäosust – käsitsi teisendamine
Kui lennuohutust mõjutavate juhtumite ettekannetes ei kasutata juhtumite hindamiseks 4x4 ARMS-ERC maatriksit, teisendatakse õnnetuse võimaliku tagajärje tõenäosust väljendava ERCSi punktisumma saamiseks ARMS-ERC barjääri hinde väärtus ERCSi barjääri hindeks, nagu on kindlaks määratud delegeeritud määruse (EL) 2020/2034 lisa punktis 2.1.3.
k. ERCSi klassifikatsioonile vastav punktisumma
ERCSi klassifikatsioonile vastava punktisumma saamiseks kombineeritakse ERCSi maatriksis omavahel õnnetuse võimaliku tagajärje raskusastet väljendav ERCSi punktisumma ja õnnetuse võimaliku tagajärje tõenäosust väljendav ERCSi punktisumma, nagu on kindlaks määratud delegeeritud määruse (EL) 2020/2034 lisa 2. etapis.
(1) ERCSi punktisumma on kahe väärtuse kombinatsioon, milles esimesel kohal on juhtumi raskusastme kindlaksmääramisel saadud täht (raskusastmed A–X) ja teisel kohal juhtumile vastava punktisumma arvutamisel saadud arvväärtus (tõenäosus).
(2) RAT-meetodi alusel klassifitseeritakse lennuliikluse korraldamisega seotud juhtumeid. RAT-meetodi alusel ei anta juhtumitele hinnet, vaid mõõdetakse seda, kui lähedal oli lennuliikluse korraldamisega seotud juhtum õnnetuseks eskaleerumisele. RAT-meetod on jagatud mitmeks põhielemendiks (st „ATM-maa“, „ATM-õhk“), millest igaüks annab osa RAT-meetodi alusel arvutatud raskusastet „ATM-üld“ väljendavasse lõplikku punktisummasse. Selleks et teha kindlaks raskusastet „ATM-üld“ väljendav punktisumma, peavad kättesaadavad olema raskusastmeid „ATM-maa“ ja „ATM-õhk“ väljendavad punktisummad.
(3) RAT-meetodi alusel arvutatud raskusaste näitab, kui raske oli asjaomane juhtum muude juhtumitega võrreldes. RAT-meetodi puhul tehakse raskusaste kindlaks kaitsete/barjääride hindamise teel.
|
29.11.2021 |
ET |
Euroopa Liidu Teataja |
L 426/41 |
KOMISJONI RAKENDUSMÄÄRUS (EL) 2021/2083,
26. november 2021,
millega peatatakse rakendusmäärustega (EL) 2018/886 ja (EL) 2020/502 kehtestatud kaubanduspoliitika meetmed, mida kohaldatakse teatavate Ameerika Ühendriikidest pärit toodete suhtes
EUROOPA KOMISJON,
võttes arvesse Euroopa Liidu toimimise lepingut,
võttes arvesse Euroopa Parlamendi ja nõukogu 15. mai 2014. aasta määrust (EL) nr 654/2014, milles käsitletakse liidu õiguste rakendamist rahvusvaheliste kaubanduseeskirjade kohaldamisel ja jõustamisel ning millega muudetakse nõukogu määrust (EÜ) nr 3286/94, millega kehtestatakse ühenduse meetmed ühise kaubanduspoliitika vallas, et tagada rahvusvahelistest kaubanduseeskirjadest, eeskätt Maailma Kaubandusorganisatsiooni egiidi all kehtestatud eeskirjadest tulenevate ühenduse õiguste kasutamine, (1) eriti selle artikli 7 lõiget 3,
ning arvestades järgmist:
|
(1) |
Komisjon võttis 20. juunil 2018 vastu rakendusmääruse (EL) 2018/886, (2) milles käsitletakse teatavaid kaubanduspoliitika meetmeid, mida kohaldatakse Ameerika Ühendriikidest pärit teatavate toodete suhtes ja millega nähakse ette täiendavate tollimaksude kehtestamine mitmesuguste USAst pärit toodete liitu importimisele. Need tooted on järgmised:
|
|
(2) |
Komisjon võttis 7. aprillil 2020 vastu rakendusmääruse (EL) 2020/502, (3) millega nähakse ette täiendav tollimaks teatavatele liitu imporditavatele Ameerika Ühendriikidest pärit toodetele. Need tooted on järgmised:
|
|
(3) |
31. mail 2021, pärast 17. mai 2021 ELi ja Ameerika Ühendriikide ühisavaldust, võttis komisjon vastu rakendusmääruse (EL) 2021/866 (4) teatavaid Ameerika Ühendriikidest pärit tooteid käsitlevate kaubanduspoliitika meetmete kohta, millega peatati täiendava väärtuselise tollimaksu kohaldamine rakendusmääruse (EL) 2018/886 II lisas loetletud toodetele kuni 30. novembrini 2021. |
|
(4) |
Kui Ameerika Ühendriigid teevad oma kaitsemeetmetes muudatusi, võib komisjon rakendusmäärusi (EL) 2018/886 (5) ja (EL) 2020/502 (6) oma äranägemisel liidu nimel muuta. |
|
(5) |
31. oktoobril 2021 teatasid Ameerika Ühendriigid, et teevad oma kaitsemeetmetes järgmised muudatused, mis jõustuvad 1. jaanuaril 2022:
|
|
(6) |
Seetõttu peaks liit peatama rakendusmäärustega (EL) 2018/886 ja (EL) 2020/502 kehtestatud täiendava väärtuselise tollimaksu kohaldamise kuni 31. detsembrini 2023. Peatamine peaks toimuma järgmiselt:
|
|
(7) |
Selline peatamine aitaks märkimisväärselt kaasa liidu ja Ameerika Ühendriikide praegusele koostööle, sealhulgas vastavate tollimaksude kaotamisele. Tuleb siiski märkida, et USA meetmetest tehtavad erandid kehtivad ainult 31. detsembrini 2023. Liidu toodete importimisel Ameerika Ühendriikide importijatele võimaldatud erandid vähendavad oluliselt Ameerika Ühendriikide kaitsemeetmete negatiivset mõju. Seepärast käsitatakse peatamist kuni 31. detsembrini 2023 piisava ja mõistliku ajavahemikuna, mis lähtub Ameerika Ühendriikide 31. oktoobri 2021. aasta teadaandest. |
|
(8) |
Määruse (EL) nr 654/2014 artikli 4 lõike 2 punkti c kohaselt peavad liidu meetmed olema sisuliselt samaväärsed nende kontsessioonide ja muude kohustuste suhtes kohaldatud kolmanda riigi kaitsemeetmete kahjustava tasemega. |
|
(9) |
Komisjon peaks jälgima peatamist ja asjaomaseid arenguid, näiteks selliste toodete liidust eksportimise raskendamist, mille suhtes Ameerika Ühendriikide kaitsemeetmed jäävad kehtima, ning liidu ekspordi takistamist. Komisjon võib käesolevat määrust muuta vastavalt Ameerika Ühendriikide kaitsemeetmete arengutele, parandustele ja muudatustele. |
|
(10) |
Peatamine ei piira liidu seisukohta, et Ameerika Ühendriikide kaitsemeetmed ei ole kooskõlas WTO lepinguga. |
|
(11) |
Käesoleva määrusega ettenähtud meetmed on kooskõlas Euroopa Parlamendi ja nõukogu määruse (EL) 2015/1843 kohaselt moodustatud kaubandustõkete komitee arvamusega (7), |
ON VASTU VÕTNUD KÄESOLEVA MÄÄRUSE:
Artikkel 1
Rakendusmääruse (EL) 2018/886 I lisas loetletud toodete impordi suhtes 10 % ja 25 % suuruse täiendava väärtuselise tollimaksu kohaldamine peatatakse alates 1. jaanuarist 2022 kuni 31. detsembrini 2023.
Rakendusmääruse (EL) 2018/886 II lisas loetletud toodete impordi suhtes 10 %, 25 %, 35 % ja 50 % suuruse täiendava väärtuselise tollimaksu kohaldamine peatatakse 1. detsembrist 2021 kuni 31. detsembrini 2023.
Rakendusmäärusega (EL) 2018/886 ette nähtud tollimakse hakatakse kohaldama alates 1. jaanuarist 2024, ilma et see mõjutaks kohaldamise täiendavat peatamist või muutmist, sealhulgas varasemat taastamist.
Artikkel 2
Rakendusmääruse (EL) 2020/502 kohaldamine peatatakse kuni 31. detsembrini 2023 järgmiselt:
|
a) |
rakendusmääruse (EL) 2020/502 artikli 1 lõike 2 punktis a nimetatud toodete impordile kohaldatav 20 % ja 7 % suurune täiendav väärtuseline tollimaks peatatakse alates 1. jaanuarist 2022; |
|
b) |
rakendusmääruse (EL) 2020/502 artikli 1 lõike 2 punktis b nimetatud toote impordile kohaldatav 4,4 % suurune täiendav väärtuseline tollimaks peatatakse alates 8. veebruarist 2023. |
Rakendusmäärusega (EL) 2020/502 ette nähtud tollimakse hakatakse kohaldama alates 1. jaanuarist 2024, ilma et see mõjutaks kohaldamise täiendavat peatamist või muutmist, sealhulgas varasemat taastamist.
Artikkel 3
Käesolev määrus jõustub 30. novembril 2021.
Käesolev määrus on tervikuna siduv ja vahetult kohaldatav kõikides liikmesriikides.
Brüssel, 26. november 2021
Komisjoni nimel
president
Ursula VON DER LEYEN
(1) ELT L 189, 27.6.2014, lk 50, muudetud Euroopa Parlamendi ja nõukogu 6. oktoobri 2015. aasta määrusega (EL) 2015/1843 (ELT L 272, 16.10.2015, lk 1) ning Euroopa Parlamendi ja nõukogu 10. veebruari 2021. aasta määrusega (EL) 2021/167 (ELT L 49, 12.2.2021, lk 1).
(2) Komisjoni 20. juuni 2018. aasta rakendusmäärus (EL) 2018/886, milles käsitletakse teatavaid kaubanduspoliitika meetmeid, mida kohaldatakse Ameerika Ühendriikidest pärit teatavate toodete suhtes, ning millega muudetakse rakendusmäärust (EL) 2018/724 (ELT L 158, 21.6.2018, lk 5).
(3) Komisjoni 6. aprilli 2020. aasta rakendusmäärus (EL) 2020/502, milles käsitletakse teatavaid kaubanduspoliitika meetmeid, mida kohaldatakse Ameerika Ühendriikidest pärit teatavate toodete suhtes (ELT L 109, 7.4.2020, lk 10).
(4) Komisjoni 28. mai 2021. aasta rakendusmäärus (EL) 2021/866, millega peatatakse rakendusmäärusega (EL) 2018/886 kehtestatud kaubanduspoliitika meetmed, mida kohaldatakse teatavate Ameerika Ühendriikidest pärit toodete suhtes (ELT L 190, 31.5.2021, lk 94).
(5) Rakendusmääruse (EL) 2018/886 põhjendus 7.
(6) Rakendusmääruse (EL) 2020/502 põhjendus 19.
(7) Euroopa Parlamendi ja nõukogu 6. oktoobri 2015. aasta määrus (EL) 2015/1843, millega kehtestatakse liidu meetmed ühise kaubanduspoliitika vallas, et tagada rahvusvahelistest kaubandusreeglitest, eeskätt Maailma Kaubandusorganisatsiooni egiidi all kehtestatud reeglitest tulenevate liidu õiguste kasutamine (ELT L 272, 16.10.2015, lk 1).