II LISA
Määruse (EÜ) nr 142/2011 XV lisa muudetakse järgmiselt.
|
1) |
1. peatükk kuni 3. peatüki F osa asendatakse järgmisega: „1. PEATÜKK Tervisesertifikaat muuks otstarbeks kui inimtoiduks ettenähtud töödeldud loomse valgu (v.a tehistingimustes kasvatatud putukatest saadud valk), sh kõnealust valku sisaldavate segude ja toodete kohta (v.a lemmikloomatoit), mis on ette nähtud lähetamiseks Euroopa Liitu või transiidiks Euroopa Liidu kaudu (2) 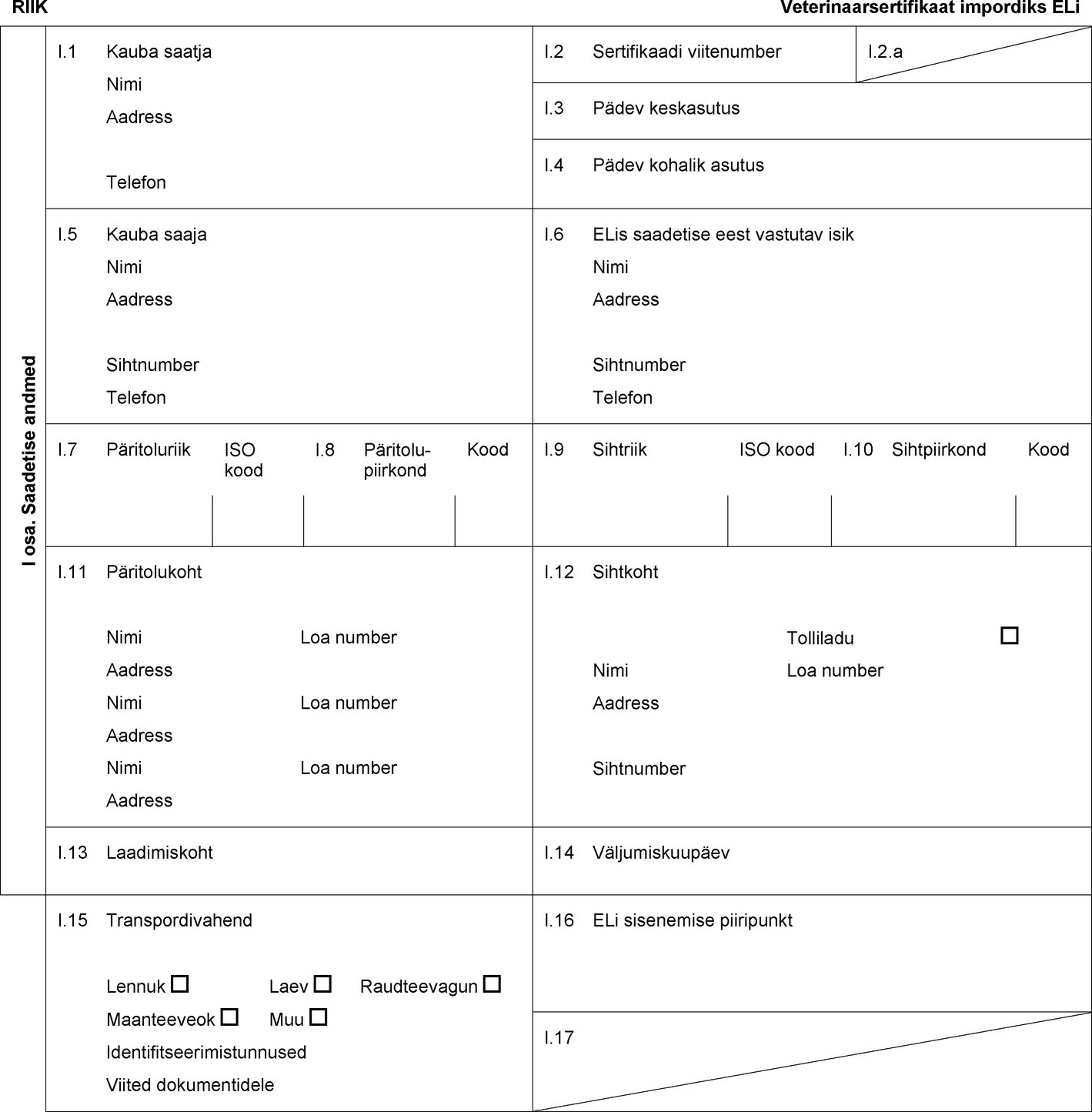 Tekst pildi
Tekst pildi
RIIK Veterinaarsertifikaat impordiks ELi I osa. Saadetise andmed I.1 Kauba saatja Nimi Aadress Telefon I.2 Sertifikaadi viitenumber I.2.a I.3 Pädev keskasutus I.4 Pädev kohalik asutus I.5 Kauba saaja Nimi Aadress Sihtnumber Telefon I.6 ELis saadetise eest vastutav isik Nimi Aadress Sihtnumber Telefon I.7 Päritoluriik ISO kood I.8 Päritolu-piirkond Kood I.9 Sihtriik ISO kood I.10 Sihtpiirkond Kood I.11 Päritolukoht Nimi Loa number Aadress Nimi Loa number Aadress Nimi Loa number Aadress I.12 Sihtkoht Tolliladu Nimi Loa number Aadress Sihtnumber I.13 Laadimiskoht I.14 Väljumiskuupäev I.15 Transpordivahend Lennuk Laev Raudteevagun Maanteeveok Muu Identifitseerimistunnused Viited dokumentidele I.16 ELi sisenemise piiripunkt I.17 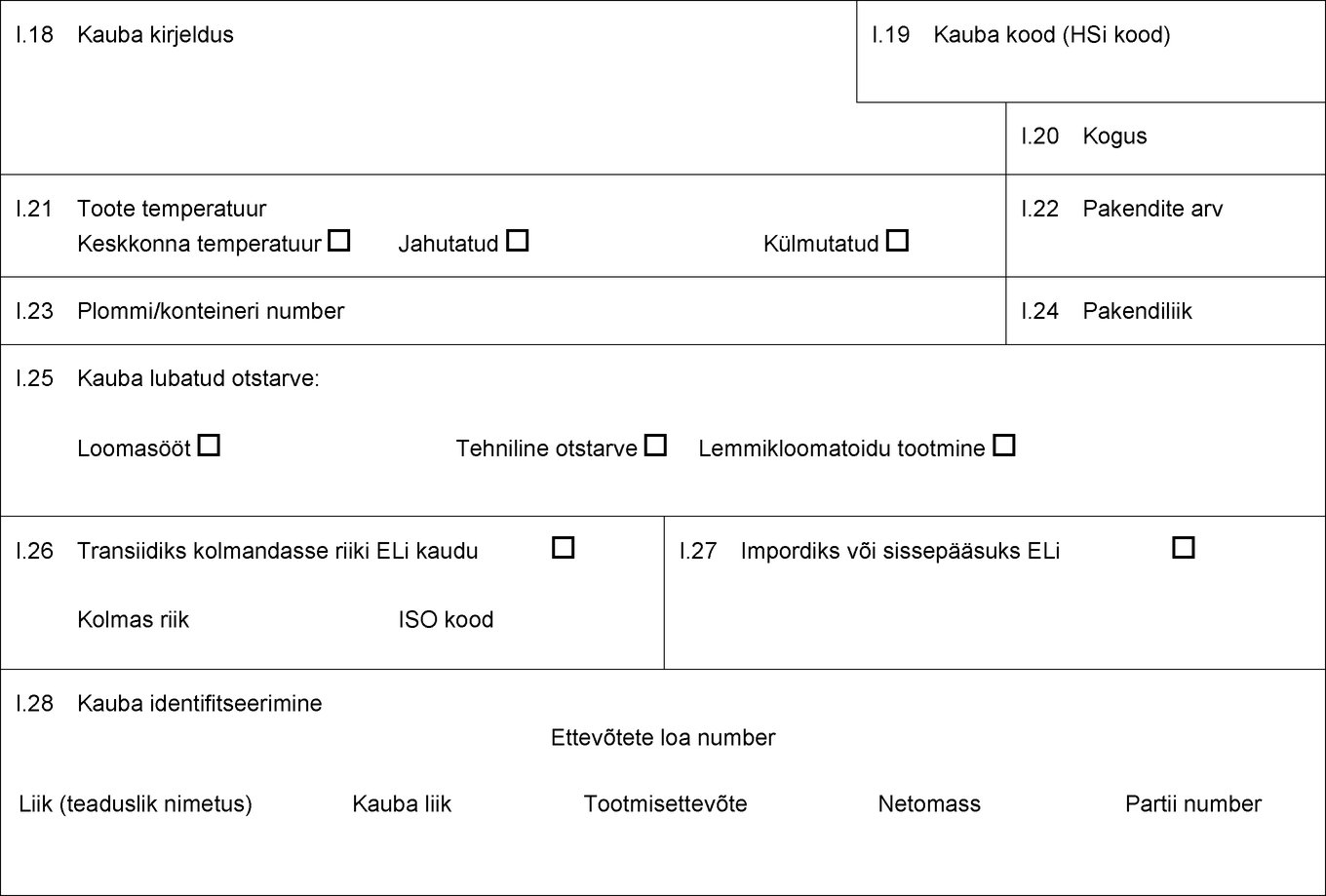 Tekst pildi
Tekst pildi
I.18 Kauba kirjeldus I.19 Kauba kood (HSi kood) I.20 Kogus I.21 Toote temperatuur Keskkonna temperatuur Jahutatud Külmutatud I.22 Pakendite arv I.23 Plommi/konteineri number I.24 Pakendiliik I.25 Kauba lubatud otstarve: Loomasööt Tehniline otstarve Lemmikloomatoidu tootmine I.26 Transiidiks kolmandasse riiki ELi kaudu Kolmas riik ISO kood I.27 Impordiks või sissepääsuks ELi I.28 Kauba identifitseerimine Ettevõtete loa number Liik (teaduslik nimetus) Kauba liik Tootmisettevõte Netomass Partii number  Tekst pildi
Tekst pildi
RIIK Muuks otstarbeks kui inimtoiduks ettenähtud, muudest kui tehistingimustes kasvatatud putukatest saadud töödeldud loomne valk, sh kõnealust valku sisaldavad segud ja tooted, v.a lemmikloomatoit II. Terviseteave II.a. Sertifikaadi viitenumber II.b. Mina, allakirjutanud veterinaarjärelevalve ametnik, teatan, et olen lugenud ja mõistan Euroopa Parlamendi ja nõukogu määrust (EÜ) nr 1069/2009 (1a), eelkõige selle artiklit 10, ning komisjoni määrust (EL) nr 142/2011 (1b), eelkõige selle X lisa II peatüki 1. jagu ja XIV lisa I peatükki, ning kinnitan järgmist: II.1 eelkirjeldatud töödeldud loomne valk või toode sisaldab üksnes muuks otstarbeks kui inimtoiduks ettenähtud töödeldud loomset valku, a) mis on valmistatud ja ladustatud ettevõttes, mida pädev asutus on määruse (EÜ) nr 1069/2009 artikli 24 kohaselt tunnustanud ja valideerinud ning mis on pädeva asutuse järelevalve all, ning b) mille valmistamisel on kasutatud üksnes järgmisi loomseid kõrvalsaadusi: (2) kas [- tapetud loomade rümbad ja loomade kehaosad või tapetud ulukite kehad või kehaosad, mis on kõlblikud inimtoiduks vastavalt Euroopa Liidu õigusaktidele, kuid mis ei ole ärilistel kaalutlustel inimtoiduks ette nähtud;] (2) ja/või [- rümbad ja järgmised kehaosad tapamajas tapetud loomadelt, kes tunnistati tapaeelse kontrolli põhjal inimtoiduks tapmiseks kõlblikuks, või kehad ja järgmised kehaosad ulukitelt, kes tapeti inimtoiduna kasutamiseks vastavalt Euroopa Liidu õigusaktidele: i) loomade rümbad või kehad ja kehaosad, mis on tunnistatud inimtoiduks kõlbmatuks vastavalt Euroopa Liidu õigusaktidele, kuid millel ei ilmne mingeid inimestele või loomadele nakkavate haiguste nähte; ii) kodulindude pead; iii) loomade toornahad ja nahad, kaasa arvatud nahalõiked ja -jäägid, sarved ja jalad, kaasa arvatud randme- ja kämblaluud, pöiad, pöiapärad ja varbalülid; iv) seaharjased; v) suled;] (2) ja/või [- veri tapamajas tapetud loomadelt, kellel ei ilmnenud mingeid vere kaudu inimestele või loomadele nakkavate haiguste nähte ja kes tunnistati tapaeelsel ülevaatusel inimtoiduks kõlblikuks vastavalt Euroopa Liidu õigusaktidele;] (2) ja/või [- loomsed kõrvalsaadused, mis on tekkinud inimtoiduks ette nähtud toodete valmistamisel, sealhulgas rasvatustatud kondid, kõrned ning piima töötlemisel tekkinud tsentrifuugimis- või separeerimissete;] (2) ja/või [- loomsed saadused või loomseid saadusi sisaldav toit, mis ei ole enam ette nähtud inimtoiduks kas ärilistel kaalutlustel, tootmis- või pakendamisdefektide või muude puuduste tõttu, mis ei ohusta inimeste ega loomade tervist;] (2 )ja/või [- veri, platsenta, vill, suled, karvad, sarved, kabja- ja sõralõikmed ning toorpiim elusloomadelt, kellel ei ole ilmnenud mingite asjaomase toote kaudu inimestele või loomadele nakkavate haiguste nähte;] (2) ja/või [- veeloomad (v.a mereimetajad) ja nende kehaosad, millel ei ole ilmnenud mingeid inimestele või loomadele nakkavate haiguste nähte;] (2) ja/või [- kõrvalsaadused veeloomadest, mis on saadud ettevõtetest, kus valmistatakse inimtoiduks ettenähtud tooteid;] II osa. Sertifitseerimine  Tekst pildi
Tekst pildi
RIIK Muuks otstarbeks kui inimtoiduks ettenähtud, muudest kui tehistingimustes kasvatatud putukatest saadud töödeldud loomne valk, sh kõnealust valku sisaldavad segud ja tooted, v.a lemmikloomatoit II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (2) ja/või [- järgmine materjal loomadelt, kel ei ole ilmnenud sellise materjali kaudu inimestele või loomadele nakkavate haiguste nähte: i) pehme koe või lihaga karpide või koorikloomade kojad või koorikud; ii) järgmine maismaaloomadelt pärinev materjal: — kõrvalsaadused haudejaamadest; — munad; — munade kõrvalsaadused, sh munakoored; iii) ärilisel eesmärgil tapetud ööpäevased tibud;] (2) ja/või [- selgrootud vee- ja maismaaloomad, v.a inimestele või loomadele patogeensed liigid ja putukad;] (2) ja/või [- näriliste ja jäneseliste hulka kuuluvad loomad ja nende kehaosad, välja arvatud 1. kategooria materjal, millele viidatakse määruse (EÜ) nr 1069/2009 artikli 8 punkti a alapunktides iii, iv ja v, ning 2. kategooria materjal, millele viidatakse määruse (EÜ) nr 1069/2009 artikli 9 punktides a–g;] ja c) mida on töödeldud alljärgneva standardi alusel: (2) kas [katkematu läbikuumutamine vähemalt 20 minuti jooksul sisetemperatuuril üle 133 °C ja küllastatud auru tekitatud vähemalt 3baarise (absoluut)rõhu all, kusjuures osakeste suurus on enne töötlemist kuni 50 millimeetrit;] (2) või [muudelt loomadelt kui imetajatelt pärit valgu puhul (v.a kalajahu) … töötlemismeetod (märkida 1., 2., 3., 4., 5. või 7. töötlemismeetod), mis on esitatud määruse (EL) nr 142/2011 IV lisa III peatükis;] (2) või [kalajahu puhul … töötlemismeetod (märkida 1., 2., 3., 4., 5., 6. või 7. töötlemismeetod), mis on esitatud määruse (EL) nr 142/2011 IV lisa III peatükis;] (2) või [seavere puhul … töötlemismeetod (märkida 1., 2., 3., 4., 5. või 7. töötlemismeetod), mis on esitatud määruse (EL) nr 142/2011 IV lisa III peatükis, kusjuures 7. meetodi korral on see läbi kuumutatud vähemalt temperatuuril 80 °C;] II.2 pädev asutus on analüüsinud pistelist proovi vahetult enne saatmist ja leidnud, et see vastab järgmistele standarditele (3): salmonella: puudub 25 grammis: n = 5, c = 0, m = 0, M = 0 enterobakterid: n = 5, c = 2, m = 10, M = 300 1 grammis; II.3 toote puhul on võetud kõik ettevaatusabinõud, et vältida haigusetekitajatega taassaastumist töötlemise järel; II.4 lõpptoode: (2) kas [pakendati kasutamata või steriliseeritud kottidesse,]  Tekst pildi
Tekst pildi
RIIK Muuks otstarbeks kui inimtoiduks ettenähtud, muudest kui tehistingimustes kasvatatud putukatest saadud töödeldud loomne valk, sh kõnealust valku sisaldavad segud ja tooted, v.a lemmikloomatoit II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (2) või [transporditi puistlastikonteinerites või muudes transpordivahendites, mida puhastati ja desinfitseeriti enne kasutamist põhjalikult,] millel on sildid kirjaga „MITTE INIMTOIDUKS“; II.5 lõpptoodet ladustati suletud ruumides; (2) [II.6. töödeldud loomne valk või eelkirjeldatud toode sisaldab mäletsejalistelt pärit loomseid kõrvalsaadusi või on nendest saadud ning: (2) kas [on pärit riigist või piirkonnast, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE riskiga riikide või piirkondade hulka ning kus ei ole esinenud algupäraseid BSE juhtumeid, ning]] (2) või [on pärit riigist või piirkonnast, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE riskiga riikide või piirkondade hulka ning kus on esinenud algupäraseid BSE juhtumeid, ning loomne kõrvalsaadus või sellest saadud toode on saadud loomadelt, kes on sündinud pärast mäletsejalistelt saadud liha-kondijahu ja kõrnete (nagu need on määratletud OIE maismaaloomade tervise koodeksis) mäletsejalistele söötmise keelu jõustumise tegelikku kuupäeva asjaomases riigis või piirkonnas, ning] (2) kas [on saadud muudelt mäletsejalistelt kui veised, lambad ja kitsed.] (2) või [on saadud veistelt, lammastelt ja kitsedelt ning ei sisalda järgmist materjali ega ole sellest saadud: (2) kas [veistelt, lammastelt või kitsedelt saadud materjal, v.a materjal, mis on saadud loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka.]] (2) või [a) Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 999/2001 (4) V lisa punktis 1 nimetatud määratletud riskiteguriga materjal; b) veiste, lammaste või kitsede kontidelt mehhaaniliselt eraldatud lihamass, välja arvatud sellistelt loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt komisjoni otsusele 2007/453/EÜ (5) liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka, kus ei ole esinenud algupäraseid BSE-juhtumeid; c) loomne kõrvalsaadus või toode on saadud veistelt, lammastelt või kitsedelt, kes on pärast uimastamist surmatud kesknärvisüsteemikudede vigastamise teel koljuõõnde viidava pika vardakujulise instrumendiga või koljuõõnde süstitud gaasiga, v.a juhul, kui kõnealused loomad on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE riskiga riikide või piirkondade hulka.]]] II.7 töödeldud loomne valk või eespool kirjeldatud toode: (2) kas [ei sisalda lammastelt või kitsedelt saadud piima ega piimatooteid ega ole ette nähtud põllumajandusloomade (v.a karusloomad) söödaks.] (2) või [sisaldavad lammastelt või kitsedelt saadud piima ja piimatooteid ning on ette nähtud põllumajandusloomade (v.a karusloomad) söödaks ning piim ja piimatooted: a) on saadud lammastelt ja kitsedelt, keda on sünnist saadik pidevalt kasvatatud riigis, kus on täidetud järgmised tingimused: i) klassikalise skreipi juhtumitest teatamine on kohustuslik;  Tekst pildi
Tekst pildi
RIIK Muuks otstarbeks kui inimtoiduks ettenähtud, muudest kui tehistingimustes kasvatatud putukatest saadud töödeldud loomne valk, sh kõnealust valku sisaldavad segud ja tooted, v.a lemmikloomatoit II. Terviseteave II.a. Sertifikaadi viitenumber II.b. ii) riigis on olemas teadlikustamis-, seire- ja järelevalvesüsteem; iii) põllumajandusettevõtete suhtes, kus on lambad või kitsed, kohaldatakse TSE kahtluse või klassikalise skreipi kinnitamise korral ametlikke piiranguid; iv) klassikalisse skreipisse haigestunud lambad ja kitsed tapetakse ja hävitatakse; v) lammaste ja kitsede söötmine mäletsejalistelt saadud liha-kondijahu või kõrnetega, nagu on määratletud OIE maismaaloomade tervise koodeksis, on olnud keelatud ja seda keeldu on tegelikult rakendatud kogu riigis vähemalt eelneva seitsmeaastase ajavahemiku jooksul; b) on pärit ettevõtetest, kus puuduvad TSE kahtluse tõttu kehtestatud ametlikud piirangud; c) lamba- või kitsepiim ja piimatooted on pärit põllumajandusettevõtetest, kus vähemalt eelneva seitsmeaastase ajavahemiku jooksul ei ole diagnoositud klassikalise skreipi juhtumit või kus pärast klassikalise skreipi juhtumi kinnitamist: (2) kas [on põllumajandusettevõttes surmatud ja hävitatud või tapetud kõik lambad ja kitsed, v.a ARR/ARR-genotüübiga tõujäärad, vähemalt ühe ARR-alleeliga ja ilma VRQ-alleelita aretusuted ning teised vähemalt ühe ARR-alleeliga lambad;] (2) või on tapetud ja hävitatud kõik loomad, kelle puhul leidis kinnitust nakatumine klassikalisse skreipisse, ning põllumajandusettevõttes on toimunud viimasest klassikalise skreipi juhtumi kinnitamise kuupäevast alates vähemalt kahe aasta jooksul tõhustatud TSE seire, mis hõlmab muu hulgas määruse (EÜ) nr 999/2001 X lisa C peatüki punktis 3.2 sätestatud laboratoorsete meetodite kohaselt tehtud ja negatiivseid tulemusi andnud kontrolle TSE esinemise suhtes kõikide järgmiste üle 18 kuu vanuste loomade, välja arvatud ARR/ARR-genotüübiga lammaste puhul: — inimtoiduks tapetud loomad ja — loomad, kes on põllumajandusettevõttes surnud või tapetud, ent keda ei hukatud haiguste likvideerimise programmi raames.]] II.8 töödeldud loomne valk või eelkirjeldatud toode sisaldab muudelt loomadelt kui mäletsejalistelt saadud loomseid kõrvalsaadusi või on nendest saadud ning lahtris I.1 osutatud kauba saatja avalduse kohaselt: (2) kas [ei ole ette nähtud põllumajandusloomade (v. a karusloomad) sööda tootmiseks.] (2) (6) või [on ette nähtud muude põllumajandusloomade kui mäletsejaliste (v.a karusloomad) sööda tootmiseks, ning kauba saatja tagab, et sisenemise piiripunktile esitatakse selliste analüüside tulemused, mis on tehtud vastavalt komisjoni määruse (EÜ) nr152/2009 VI lisas esitatud meetoditele (7).] Märkused I osa. — Lahter I.6.: Euroopa Liidus saadetise eest vastutav isik: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist sertifikaadiga Euroopa Liidu kaudu transporditava transiitkauba kohta; Euroopa Liitu imporditava kauba kohta antava sertifikaadi puhul võib selle samuti täita. — Lahter I.12.: Sihtkoht: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist transiitkauba kohta antava sertifikaadiga. Transiitkaupu võib ladustada üksnes vabatsoonis, vabalaos ja tollilaos. — Lahter I.15.: registreerimisnumber (raudteevagunid või -konteinerid ja veoautod), lennu number (lennuk) või nimi (laev); teave tuleb esitada maha- ja ümberlaadimise korral.  Tekst pildi
Tekst pildi
RIIK Muuks otstarbeks kui inimtoiduks ettenähtud, muudest kui tehistingimustes kasvatatud putukatest saadud töödeldud loomne valk, sh kõnealust valku sisaldavad segud ja tooted, v.a lemmikloomatoit II. Terviseteave II.a. Sertifikaadi viitenumber II.b. — Lahter I.19.: kasutada asjakohast HSi koodi: 05.05; 05.06; 05.07; 05.11; 23.01 või 23.09. — Lahter I.25.: Tehniline otstarve: muuks kui põllumajandusloomade (v.a karusloomad) söödaks, ning lemmikloomatoidu tootmiseks või valmistamiseks. — Lahtrid I.26 ja I.27: täita vastavalt sellele, kas tegemist on transiidiks või impordiks antava sertifikaadiga. — Lahter I.28.: Liik: valida üks järgmistest: Aves, Ruminantia, Suidae, Mammalia, v.a Ruminantia või Suidae, Pesca, Mollusca, Crustacea, selgrootud, v.a Mollusca ja Crustacea. Kasvanduskala puhul täpsustada kala teaduslik nimetus. II osa. (1a) ELT L 300, 14.11.2009, lk 1. (1b) ELT L 54, 26.2.2011, lk 1. (2) Mittevajalik läbi kriipsutada. (3) Kus: n = analüüsitavate proovide arv; m = bakterite arvu väärtuslävi; tulemus on rahuldav, kui bakterite arv kogu valimis ei ületa näitajat m; M = bakterite arvu maksimumväärtus; tulemus on ebarahuldav, kui bakterite arv ühes või mitmes proovis on võrdne näitajaga M või sellest suurem; ja c = nende proovide arv, milles bakterite arv võib jääda näitajate m ja M vahele; proov on siiski rahuldav, kui teiste proovide bakterite arv on võrdne näitajaga m või sellest väiksem. (4) EÜT L 147, 31.5.2001, lk 1. (5) ELT L 172, 30.6.2007, lk 84. (6) Lahtris I.6 osutatud lasti eest vastutav isik peab tagama, et kui töödeldud loomne valk või käesolevas sertifikaadis kirjeldatud toode on ette nähtud kasutamiseks muude põllumajandusloomade kui mäletsejaliste (v.a karusloomad) sööda tootmisel, tuleb saadetist analüüsida vastavalt määruse (EÜ) nr 152/2009 VI lisas esitatud meetoditele, et teha kindlaks, et selles ei esine keelatud loomseid komponente. Selliste analüüside tulemusi käsitlev teave peab olema lisatud käesolevale sertifikaadile saadetise esitamisel ELi piiripunktis. (7) ELT L 54, 26.2.2009, lk 1. — Allkirja ja templi värv peavad erinema teksti värvist. — Märkus Euroopa Liidus saadetise eest vastutavale isikule: käesolev sertifikaat on ette nähtud üksnes veterinaarotstarbeks ning peab partiiga kaasas olema kuni kõnealuse partii jõudmiseni piiripunkti. Veterinaarjärelevalve ametnik/inspektor Nimi (trükitähtedega): Kvalifikatsioon ja ametinimetus: Kuupäev: Allkiri: Tempel: 1a PEATÜKK Tervisesertifikaat muuks otstarbeks kui inimtoiduks ettenähtud, tehistingimustes kasvatatud putukatest saadud töödeldud loomse valgu, sh kõnealust valku sisaldavate segude ja toodete kohta (v.a lemmikloomatoit), mis on ette nähtud lähetamiseks Euroopa Liitu või transiidiks (2) Euroopa Liidu kaudu  Tekst pildi
Tekst pildi
RIIK Veterinaarsertifikaat impordiks ELi I osa. Saadetise andmed I.1 Kauba saatja Nimi Aadress Telefon I.2 Sertifikaadi viitenumber I.2.a I.3 Pädev keskasutus I.4 Pädev kohalik asutus I.5 Kauba saaja Nimi Aadress Sihtnumber Telefon I.6 ELis saadetise eest vastutav isik Nimi Aadress Sihtnumber Telefon I.7 Päritoluriik ISO kood I.8 Päritolu-piirkond Kood I.9 Sihtriik ISO kood I.10 Sihtpiirkond Kood I.11 Päritolukoht Nimi Loa number Aadress Nimi Loa number Aadress Nimi Loa number Aadress I.12 Sihtkoht Tolliladu Nimi Loa number Aadress Sihtnumber I.13 Laadimiskoht I.14 Väljumiskuupäev I.15 Transpordivahend Lennuk Laev Raudteevagun Maanteeveok Muu Identifitseerimistunnused Viited dokumentidele I.16 ELi sisenemise piiripunkt I.17 I.18 Kauba kirjeldus I.19 Kauba kood (HSi kood) I.20 Kogus I.21 Toote temperatuur Keskkonna temperatuur Jahutatud Külmutatud I.22 Pakendite arv I.23 Plommi/konteineri number I.24 Pakendiliik  Tekst pildi
Tekst pildi
I.25 Kauba lubatud otstarve: Loomasööt Tehniline otstarve Lemmikloomatoidu tootmine I.26 Transiidiks kolmandasse riiki ELi kaudu Kolmas riik ISO kood I.27 Impordiks või sissepääsuks ELi I.28 Kauba identifitseerimine Ettevõtete loa number Liik (teaduslik nimetus) Kauba liik Tootmisettevõte Netomass Partii number  Tekst pildi
Tekst pildi
RIIK Muuks otstarbeks kui inimtoiduks ettenähtud, tehistingimustes kasvatatud putukatest saadud töödeldud loomne valk, sh kõnealust valku sisaldavad segud ja tooted, v.a lemmikloomatoit II. Terviseteave II.a. Sertifikaadi viitenumber II.b. Mina, allakirjutanud veterinaarjärelevalve ametnik, teatan, et olen lugenud ja mõistan Euroopa Parlamendi ja nõukogu määrust (EÜ) nr 1069/2009 (1a), eelkõige selle artiklit 10, ning komisjoni määrust (EL) nr 142/2011 (1b), eelkõige selle X lisa II peatüki 1. jagu ja XIV lisa I peatükki, ning kinnitan järgmist: II.1 tehistingimustes kasvatatud putukatest saadud töödeldud loomne valk või eelkirjeldatud toode sisaldab üksnes muuks otstarbeks kui inimtoiduks ettenähtud töödeldud loomset valku: a) mis on valmistatud ja ladustatud ettevõttes, mida pädev asutus on määruse (EÜ) nr 1069/2009 artikli 24 kohaselt tunnustanud ning mis on pädeva asutuse järelevalve all, ning b) on valmistatud üksnes järgmistest tehistingimustes kasvatatud putukaliikidest: (2) kas [- kärbes liigist Hermetia illucens;] (2) ja/või [- harilik toakärbes (Musca domestica);] (2)j a/või [- harilik jahumardikas (Tenebrio molitor);] (2) ja/või [- mardikas liigist Alphitobius diaperinus;] (2) ja/või [- toakilk (Acheta domesticus);] (2) ja/või [- sihktiivaline liigist Gryllodes sigillatus;] (2) ja/või [- sihktiivaline liigist Gryllus assimilis.] ja c) on töödeldud määruse (EL) nr 142/2011 IV lisa III peatükis esitatud töötlemismeetodi [1]-[2]-[3]-[4]-[5]-[7] (2) alusel ja d) tehistingimustes kasvatatud putukate toitesubstraat võib sisaldada ainult mitteloomseid tooteid või järgmisi 3. kategooria materjali alla kuuluvaid loomseid tooteid: — kalajahu; — muudelt loomadelt kui mäletsejalistelt saadud veretooted; — loomne kaltsiumvesinikfosfaat ja trikaltsiumfosfaat; — muudelt loomadelt kui mäletsejalistelt saadud hüdrolüüsitud valgud; — mäletsejaliste toornahkadest saadud hüdrolüüsitud valgud; — muudelt loomadelt kui mäletsejalistelt saadud želatiin ja kollageen; — munad ja munatooted; — piim, piimapõhised tooted, piimasaadused ja ternespiim; — mesi; — sulatatud rasvad, II osa. Sertifitseerimine  Tekst pildi
Tekst pildi
RIIK Muuks otstarbeks kui inimtoiduks ettenähtud, tehistingimustes kasvatatud putukatest saadud töödeldud loomne valk, sh kõnealust valku sisaldavad segud ja tooted, v.a lemmikloomatoit II. Terviseteave II.a. Sertifikaadi viitenumber II.b. ja e) putukate toitesubstraat ning putukad või nende vastsed ei ole kokku puutunud muude kui punktis d osutatud loomsete materjalidega ning substraat ei sisaldanud sõnnikut, toidujäätmeid ega muid jäätmeid. II.2 pädev asutus on analüüsinud pistelist proovi vahetult enne saatmist ja leidnud, et see vastab järgmistele standarditele (3): salmonella: puudub 25 grammis: n = 5, c = 0, m = 0, M = 0 enterobakterid: n = 5, c = 2, m = 10, M = 300 1 grammis; II.3 toote puhul on võetud kõik ettevaatusabinõud, et vältida haigusetekitajatega taassaastumist töötlemise järel; II.4 lõpptoode: (2) kas [pakendati kasutamata või steriliseeritud kottidesse,] (2) või [transporditi puistlastina konteinerites või muudes transpordivahendites, mida puhastati ja desinfitseeriti enne kasutamist põhjalikult,] mis kannavad märgistust kirjaga „MITTE INIMTOIDUKS / TÖÖDELDUD PUTUKAVALGUD – MITTE KASUTADA PÕLLUMAJANDUSLOOMADE SÖÖDAS, VÄLJA ARVATUD VESIVILJELUS- JA KARUSLOOMAD“; II.5 lõpptoodet ladustati suletud ruumides; (2) [II.6. töödeldud loomne valk või eelkirjeldatud toode sisaldab mäletsejalistelt pärit loomseid kõrvalsaadusi või on nendest saadud ning: (2) kas [on pärit riigist või piirkonnast, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE riskiga riikide või piirkondade hulka ning kus ei ole esinenud algupäraseid BSE juhtumeid, ning]] (2) või [on pärit riigist või piirkonnast, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE riskiga riikide või piirkondade hulka ning kus on esinenud algupäraseid BSE juhtumeid, ning loomne kõrvalsaadus või sellest saadud toode on saadud loomadelt, kes on sündinud pärast mäletsejalistelt saadud liha-kondijahu ja kõrnete (nagu need on määratletud OIE maismaaloomade tervise koodeksis) mäletsejalistele söötmise keelu jõustumise tegelikku kuupäeva asjaomases riigis või piirkonnas, ning]] (2) kas [on saadud muudelt mäletsejalistelt kui veised, lambad ja kitsed.]] (2) või [on saadud veistelt, lammastelt ja kitsedelt ning ei sisalda järgmist materjali ega ole sellest saadud: (2) kas [veistelt, lammastelt või kitsedelt saadud materjal, v.a materjal, mis on saadud loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka.]] (2) või [a) Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 999/2001 (4) V lisa punktis 1 nimetatud määratletud riskiteguriga materjal; b) veiste, lammaste või kitsede kontidelt mehhaaniliselt eraldatud lihamass, välja arvatud sellistelt loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt komisjoni otsusele 2007/453/EÜ (5) liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka, kus ei ole esinenud algupäraseid BSE-juhtumeid;  Tekst pildi
Tekst pildi
RIIK Muuks otstarbeks kui inimtoiduks ettenähtud, tehistingimustes kasvatatud putukatest saadud töödeldud loomne valk, sh kõnealust valku sisaldavad segud ja tooted, v.a lemmikloomatoit II. Terviseteave II.a. Sertifikaadi viitenumber II.b. c) loomne kõrvalsaadus või toode on saadud veistelt, lammastelt või kitsedelt, kes on pärast uimastamist surmatud kesknärvisüsteemikudede vigastamise teel koljuõõnde viidava pika vardakujulise instrumendiga või koljuõõnde süstitud gaasiga, v.a juhul, kui kõnealused loomad on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE riskiga riikide või piirkondade hulka.]]] II.7 töödeldud loomne valk või eespool kirjeldatud toode: (2) kas [ei sisalda lammastelt või kitsedelt saadud piima ega piimatooteid ega ole ette nähtud põllumajandusloomade (v.a karusloomad) söödaks.] (2) või [sisaldavad lammastelt või kitsedelt saadud piima ja piimatooteid ning on ette nähtud põllumajandusloomade (v.a karusloomad) söödaks ning piim ja piimatooted: a) on saadud lammastelt ja kitsedelt, keda on sünnist saadik pidevalt kasvatatud riigis, kus on täidetud järgmised tingimused: i) klassikalise skreipi juhtumitest teatamine on kohustuslik; ii) riigis on olemas teadlikustamis-, seire- ja järelevalvesüsteem; iii) põllumajandusettevõtete suhtes, kus on lambad või kitsed, kohaldatakse TSE kahtluse või klassikalise skreipi kinnitamise korral ametlikke piiranguid; iv) klassikalisse skreipisse haigestunud lambad ja kitsed tapetakse ja hävitatakse; v) lammaste ja kitsede söötmine mäletsejalistelt saadud liha-kondijahu või kõrnetega, nagu on määratletud OIE maismaaloomade tervise koodeksis, on olnud keelatud ja seda keeldu on tegelikult rakendatud kogu riigis vähemalt eelneva seitsmeaastase ajavahemiku jooksul; b) on pärit ettevõtetest, kus puuduvad TSE kahtluse tõttu kehtestatud ametlikud piirangud; c) lamba- või kitsepiim ja piimatooted on pärit põllumajandusettevõtetest, kus vähemalt eelneva seitsmeaastase ajavahemiku jooksul ei ole diagnoositud klassikalise skreipi juhtumit või kus pärast klassikalise skreipi juhtumi kinnitamist: (2) kas onpõllumajandusettevõttes surmatud ja hävitatud või tapetud kõik lambad ja kitsed, v.a ARR/ARR-genotüübiga tõujäärad, vähemalt ühe ARR-alleeliga ja ilma VRQ-alleelita aretusuted ning teised vähemalt ühe ARR-alleeliga lambad; (2) või on tapetud ja hävitatud kõik loomad, kelle puhul leidis kinnitust nakatumine klassikalisse skreipisse, ning ettevõttes on toimunud viimasest klassikalise skreipi juhtumi kinnitamise kuupäevast alates vähemalt kahe aasta jooksul tõhustatud TSE seire, mis hõlmab muu hulgas määruse (EÜ) nr 999/2001 X lisa C peatüki punktis 3.2 sätestatud laboratoorsete meetodite kohaselt tehtud ja negatiivseid tulemusi andnud kontrolle TSE esinemise suhtes kõikide järgmiste üle 18 kuu vanuste loomade, välja arvatud ARR/ARR-genotüübiga lammaste puhul: — inimtoiduks tapetud loomad ja — loomad, kes on põllumajandusettevõttes surnud või tapetud, ent keda ei hukatud haiguste likvideerimise programmi raames.]] II.8 [töödeldud loomne valk või eelkirjeldatud toode sisaldab muudelt loomadelt kui mäletsejalistelt saadud loomseid kõrvalsaadusi või on nendest saadud ning lahtris I.1 osutatud kauba saatja avalduse kohaselt:  Tekst pildi
Tekst pildi
RIIK Muuks otstarbeks kui inimtoiduks ettenähtud, tehistingimustes kasvatatud putukatest saadud töödeldud loomne valk, sh kõnealust valku sisaldavad segud ja tooted, v.a lemmikloomatoit II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (2) kas [ei ole ette nähtud põllumajandusloomade (v. a karusloomad) sööda tootmiseks.] (2) (6) või [on ette nähtud muude põllumajandusloomade kui mäletsejaliste (v.a karusloomad) sööda tootmiseks, ning kauba saatja tagab, et Euroopa Liitu sisenemise piiripunktis esitatakse selliste analüüside tulemused, mis on tehtud vastavalt komisjoni määruse (EÜ) nr 152/2009 (7) VI lisas esitatud meetoditele.] Märkused I osa. — Lahter I.6.: Euroopa Liidus saadetise eest vastutav isik: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist sertifikaadiga Euroopa Liidu kaudu transporditava transiitkauba kohta; Euroopa Liitu imporditava kauba kohta antava sertifikaadi puhul võib selle samuti täita. — Lahter I.12.: Sihtkoht: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist transiitkauba sertifikaadiga. Transiitkaupu võib ladustada üksnes vabatsoonis, vabalaos ja tollilaos. — Lahter I.15.: registreerimisnumber (raudteevagunid või -konteinerid ja veoautod), lennu number (lennuk) või nimi (laev); teave tuleb esitada maha- ja ümberlaadimise korral. — Lahter I.19.: kasutada asjakohast HS-koodi: 05.11, 23.01 või 23.09. — Lahter I.25.: Tehniline otstarve: muuks kui põllumajandusloomade (v.a karusloomad) söödaks, ning lemmikloomatoidu tootmiseks või valmistamiseks. — Lahtrid I.26 ja I.27: täita vastavalt sellele, kas tegemist on transiidiks või impordiks antava sertifikaadiga. — Lahter I.28.: Liik: putukad, täpsustada nende teaduslik nimetus. II osa. (1a) ELT L 300, 14.11.2009, lk 1. (1b) ELT L 54, 26.2.2011, lk 1. (2) Mittevajalik läbi kriipsutada. (3) Kus: n = analüüsitavate proovide arv; m = bakterite arvu väärtuslävi; tulemus on rahuldav, kui bakterite arv kogu valimis ei ületa näitajat m; M = bakterite arvu maksimumväärtus; tulemus on ebarahuldav, kui bakterite arv ühes või mitmes proovis on võrdne näitajaga M või sellest suurem; ja c = nende proovide arv, milles bakterite arv võib jääda näitajate m ja M vahele; proov on siiski rahuldav, kui teiste proovide bakterite arv on võrdne näitajaga m või sellest väiksem. (4) EÜT L 147, 31.5.2001, lk 1. (5) ELT L 172, 30.6.2007, lk 84.  Tekst pildi
Tekst pildi
RIIK Muuks otstarbeks kui inimtoiduks ettenähtud, tehistingimustes kasvatatud putukatest saadud töödeldud loomne valk, sh kõnealust valku sisaldavad segud ja tooted, v.a lemmikloomatoit II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (6) Lahtris I.6 osutatud lasti eest vastutav isik peab tagama, et kui töödeldud loomne valk või käesolevas sertifikaadis kirjeldatud toode on ette nähtud kasutamiseks muude põllumajandusloomade kui mäletsejaliste (v.a karusloomad) sööda tootmisel, tuleb saadetist analüüsida vastavalt määruse (EÜ) nr 152/2009 VI lisas esitatud meetoditele, et teha kindlaks, et selles ei esine keelatud loomseid komponente. Selliste analüüside tulemusi käsitlev teave peab olema lisatud käesolevale sertifikaadile saadetise esitamisel ELi piiripunktis. (7) ELT L 54, 26.2.2009, lk 1. — Allkirja ja templi värv peavad erinema teksti värvist. — Märkus Euroopa Liidus saadetise eest vastutavale isikule: käesolev sertifikaat on ette nähtud üksnes veterinaarotstarbeks ning peab partiiga kaasas olema kuni kõnealuse partii jõudmiseni piiripunkti. Veterinaarjärelevalve ametnik/inspektor Nimi (trükitähtedega): Kvalifikatsioon ja ametinimetus: Kuupäev: Allkiri: Tempel: 2. PEATÜKK, A OSA Tervisesertifikaat muuks otstarbeks kui inimtoiduks ettenähtud piima, piimapõhiste toodete ja piimasaaduste kohta, mis on ette nähtud lähetamiseks Euroopa Liitu või transiidiks (2) Euroopa Liidu kaudu  Tekst pildi
Tekst pildi
RIIK Veterinaarsertifikaat impordiks ELi I osa. Saadetise andmed I.1 Kauba saatja Nimi Aadress Telefon I.2 Sertifikaadi viitenumber I.2.a I.3 Pädev keskasutus I.4 Pädev kohalik asutus I.5 Kauba saaja Nimi Aadress Sihtnumber Telefon I.6 ELis saadetise eest vastutav isik Nimi Aadress Sihtnumber Telefon I.7 Pärit-oluriik ISO kood I.8 Päritolu-piirkond Kood I.9 Sihtriik ISO kood I.10 Sihtpiirkond Kood I.11 Päritolukoht Nimi Loa number Aadress Nimi Loa number Aadress Nimi Loa number Aadress I.12 Sihtkoht Tolliladu Nimi Loa number Aadress Sihtnumber I.13 Laadimiskoht I.14 Väljumiskuupäev I.15 Transpordivahend Lennuk Laev Raudteevagun Maanteeveok Muu Identifitseerimistunnused Viited dokumentidele I.16 ELi sisenemise piiripunkt I.17 CITESi number/numbrid I.18 Kauba kirjeldus I.19 Kauba kood (HSi kood) I.20 Kogus I.21 Toote temperatuur Keskkonna temperatuur Jahutatud Külmutatud I.22 Pakendite arv I.23 Plommi/konteineri number I.24 Pakendiliik  Tekst pildi
Tekst pildi
I.25 Kauba lubatud otstarve: Loomasööt Edasine töötlemine Lemmikloomatoidu tootmine Tehniline otstarve I.26 Transiidiks kolmandasse riiki ELi kaudu Kolmas riik ISO kood I.27 Impordiks või sissepääsuks ELi I.28 Kauba identifitseerimine Ettevõtete loa number Liik (teaduslik nimetus) Tootmisettevõte Netomass Partii number  Tekst pildi
Tekst pildi
RIIK Muuks otstarbeks kui inimtoiduks ettenähtud piim, piimapõhised tooted ja piimasaadused II. Terviseteave II.a. Sertifikaadi viitenumber II.b. Mina, allakirjutanud veterinaarjärelevalve ametnik, teatan, et olen lugenud ja mõistan Euroopa Parlamendi ja nõukogu määrust (EÜ) nr 1069/2009 (1a), eelkõige selle artiklit 10, ning komisjoni määrust (EL) nr 142/2011 (1b), eelkõige selle X lisa II peatüki 4. jagu ja XIV lisa I peatükki, ning kinnitan, et lahtris I.28 osutatud piim (2), piimapõhised tooted (2) ja piimasaadused (2) vastavad järgmistele tingimustele: II.1 need on toodetud ja saadud (märkida eksportiva riiginimi) (3), (märkida piirkonna nimi) (3), mis on loetletud komisjoni määruse (EL) nr 605/2010 (4) II lisa I osas ning kus ei ole 12kuulise ajavahemiku jooksul vahetult enne eksportimist esinenud suu- ja sõrataudi ega veiste katku ning kus samal ajavahemikul ei ole toimunud veiste katku vastu vaktsineerimist; II.2 need on toodetud toorpiimast, mis on saadud loomadelt, kellel lüpsmise ajal ei avaldunud piima kaudu inimestele või loomadele leviva ühegi haiguse kliinilisi tunnuseid ning keda oli vähemalt 30-päevase ajavahemiku jooksul enne tootmist hoitud ettevõtetes, kus ei ole kehtestatud ametlikke piiranguid suu- ja sõrataudi või veiste katku tõttu; II.3 tegemist on piima või piimatootega, mis (2) kas [on läbinud ühe või mitu punktis II.4 kirjeldatud töötlusviisidest] (2) või [sisaldab vadakut, mis on ette nähtud söötmiseks suu- ja sõrataudi suhtes vastuvõtlikele loomadele ning see vadak on kogutud piimast, mis on läbinud ühe punktis II.4 kirjeldatud töötlusviisidest, ja (2) kas [vadak on kogutud vähemalt 16 tundi pärast piima kalgendumist ning selle pH väärtus on alla 6;] (2) (5) või [vadak on toodetud vähemalt 21 päeva enne lähetamist ning sel ajavahemikul ei ole eksportivas riigis tuvastatud ühtegi suu- ja sõrataudi juhtumit;] (2) (5) või [vadak on toodetud (pp.kk.aaaa); see kuupäev on vedamise eeldatavat kestust arvestades vähemalt 21 päeva enne saadetise esitamist Euroopa Liidu piiripunktis;]] II.4 need on läbinud ühe järgmistest töötlusviisidest: (2) kas [lühiajaline kõrgpastöriseerimine 72 °C juures vähemalt 15 sekundit või samaväärse mõjuga pastöriseerimine, mis tagab fosfataastesti negatiivse tulemuse veisepiimas, ning: (2) kas [järgnev teine lühiajaline kõrgpastöriseerimine 72 °C juures vähemalt 15 sekundit või samaväärse mõjuga pastöriseerimine, mis tagab fosfataastesti negatiivse tulemuse veisepiimas;] (2) või [järgnev kuivatusprotsess ja täiendav kuumutamine vähemalt kuni temperatuurini 72 °C, kui piim on ette nähtud söödaks;] (2) või [järgnev töötlus, millega pH väärtust alandatakse ja hoitakse vähemalt 1 tunni vältel alla 6;] (2) (5) või [piim/piimatoode on toodetud vähemalt 21 päeva enne lähetamise kuupäeva ning sellel ajavahemikul ei ole eksportivas riigis tuvastatud ühtegi suu- ja sõrataudi juhtumit;] (2) (5) või [vadak on toodetud (pp.kk.aaaa); see kuupäev on vedamise eeldatavat kestust arvestades vähemalt 21 päeva enne saadetise esitamise kuupäeva Euroopa Liidu piiripunktis;] (2) või [steriliseerimine vähemalt väärtusel F03;]] II osa. Sertifitseerimine  Tekst pildi
Tekst pildi
RIIK Muuks otstarbeks kui inimtoiduks ettenähtud piim, piimapõhised tooted ja piimasaadused II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (2) või [kõrgkuumutamine 132 °C juures vähemalt ühe sekundi jooksul ning: (2) kas [järgnev kuivatusprotsess ja täiendav kuumutamine vähemalt kuni temperatuurini 72 °C, kui piim on ette nähtud söödaks;] (2) või [järgnev töötlus, millega pH väärtust alandatakse ja hoitakse vähemalt 1 tunni vältel alla 6;] (2) (5) või [piim/piimatoode on toodetud vähemalt 21 päeva enne lähetamise kuupäeva ning sel ajavahemikul ei ole eksportivas riigis tuvastatud ühtegi suu- ja sõrataudi juhtumit;] (2) (5) või [piim/piimatoode on toodetud (pp.kk.aaaa); see kuupäev on vedamise eeldatavat kestust arvestades vähemalt 21 päeva enne saadetise esitamise kuupäeva Euroopa Liidu piiripunktis;]] II.5 võetud on kõik ettevaatusabinõud, et vältida piima / piimapõhise toote / piimasaaduse saastumist töötlemise järel; II.6 piim / piimapõhine toode / piimasaadus on pakendatud: (2) kas [kasutamata mahutitesse;] (2) või [veokitesse või puistlastikonteineritesse, mida on enne laadimist desinfitseeritud tootega, mille pädev asutus on heaks kiitnud;] ja mahutitele on märgitud piima / piimapõhise toote / piimasaaduse andmed ja neil on sildid kirjaga selle kohta, et toode on 3. kategooria materjal ja see ei ole ette nähtud inimtoiduks; II.7 eelkirjeldatud piim, piimapõhised tooted ja piimasaadused: (2) kas [ei sisalda lammastelt või kitsedelt saadud piima ega piimatooteid ega ole ette nähtud põllumajandusloomade (v.a karusloomad) söödaks.] (2) või [sisaldavad lammastelt või kitsedelt saadud piima ja piimatooteid ning on ette nähtud põllumajandusloomade (v.a karusloomad) söödaks ning piim ja piimatooted: a) on saadud lammastelt ja kitsedelt, keda on sünnist saadik pidevalt kasvatatud riigis, kus on täidetud järgmised tingimused: i) klassikalise skreipi juhtumitest teatamine on kohustuslik; ii) riigis on olemas teadlikustamis-, seire- ja järelevalvesüsteem; iii) põllumajandusettevõtete suhtes, kus on lambad või kitsed, kohaldatakse TSE kahtluse või klassikalise skreipi kinnitamise korral ametlikke piiranguid; iv) klassikalisse skreipisse haigestunud lambad ja kitsed tapetakse ja hävitatakse; v) lammaste ja kitsede söötmine mäletsejalistelt saadud liha-kondijahu või kõrnetega, nagu on määratletud OIE maismaaloomade tervise koodeksis, on olnud keelatud ja seda keeldu on tegelikult rakendatud kogu riigis vähemalt eelneva seitsmeaastase ajavahemiku jooksul; b) on pärit ettevõtetest, kus puuduvad TSE kahtluse tõttu kehtestatud ametlikud piirangud;  Tekst pildi
Tekst pildi
RIIK Muuks otstarbeks kui inimtoiduks ettenähtud piim, piimapõhised tooted ja piimasaadused II. Terviseteave II.a. Sertifikaadi viitenumber II.b. c) lamba- või kitsepiim ja piimatooted on pärit põllumajandusettevõtetest, kus vähemalt eelneva seitsmeaastase ajavahemiku jooksul ei ole diagnoositud klassikalise skreipi juhtumit või kus pärast klassikalise skreipi juhtumi kinnitamist: (2) kas on põllumajandusettevõttes surmatud ja hävitatud või tapetud kõik lambad ja kitsed, v.a ARR/ARR-genotüübiga tõujäärad, vähemalt ühe ARR-alleeliga ja ilma VRQ-alleelita aretusuted ning teised vähemalt ühe ARR-alleeliga lambad; (2) või [on tapetud ja hävitatud kõik loomad, kelle puhul leidis kinnitust nakatumine klassikalisse skreipisse, ning ettevõttes on toimunud viimasest klassikalise skreipi juhtumi kinnitamise kuupäevast alates vähemalt kaheaastase ajavahemiku jooksul tõhustatud TSE seire, mis hõlmab muu hulgas määruse (EÜ) nr 999/2001 (6) X lisa C peatüki punktis 3.2 sätestatud laboratoorsete meetodite kohaselt tehtud ja negatiivseid tulemusi andnud kontrolle TSE esinemise suhtes kõikide järgmiste üle 18 kuu vanuste loomade, välja arvatud ARR/ARR-genotüübiga lammaste puhul: — inimtoiduks tapetud loomad ja — loomad, kes on põllumajandusettevõttes surnud või tapetud, ent keda ei hukatud haiguste likvideerimise programmi raames.]] Märkused I osa — Lahter I.6.: Euroopa Liidus saadetise eest vastutav isik: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist sertifikaadiga Euroopa Liidu kaudu transporditava transiitkauba kohta; Euroopa Liitu imporditava kauba kohta antava sertifikaadi puhul võib selle samuti täita. — Lahter I.12.: Sihtkoht: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist transiitkauba kohta antava sertifikaadiga. — Lahter I.15.: tuleb esitada registreerimisnumber (raudteevagunid või -konteinerid ja veoautod), lennu number (lennuk) või nimi (laev). Maha- ja ümberlaadimise korral peab kauba saatja teavitama Euroopa Liidu piiripunkti. — Lahter I.19.: kasutada Maailma Tolliorganisatsiooni asjakohast kaupade kirjeldamise ja kodeerimise harmoneeritud süsteemi (HS) koodi: 04.01; 04.02; 04.03; 04.04; 23.09.10, 23.09.90, 35.01, 35.02 või 35.04. — Lahter I.23.: puistlastikonteinerite puhul tuleb lisada konteineri number ja plommi number (kui on). — Lahter I.25.: Tehniline otstarve: muuks kui põllumajandusloomade (v.a karusloomad) söödaks, ning lemmikloomatoidu tootmiseks või valmistamiseks. — Lahtrid I.26 ja I.27: täita vastavalt sellele, kas tegemist on transiidiks või impordiks antava sertifikaadiga. — Lahter I.28.: Tootmisettevõte: märkida töötlemisettevõtte registrinumber. II osa. (1a) ELT L 300, 14.11.2009, lk 1. (1b) ELT L 54, 26.2.2011, lk 1.  Tekst pildi
Tekst pildi
RIIK Muuks otstarbeks kui inimtoiduks ettenähtud piim, piimapõhised tooted ja piimasaadused II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (2) Mittevajalik läbi kriipsutada. (3) Täidetakse juhul, kui luba importida Euroopa Liitu või transiidiks Euroopa Liidu kaudu on kitsendatud asjaomase kolmanda riigi teatavate piirkondadega. (4) ELT L 175, 10.7.2010, lk 1. (5) Seda tingimust kohaldatakse üksnes määruse (EL) nr 605/2010 I lisa veerus A loetletud kolmandate riikide suhtes. (6) EÜT L 147, 31.5.2001, lk 1. — Allkirja ja templi värv peavad erinema teksti värvist. — Märkus Euroopa Liidus saadetise eest vastutavale isikule: käesolev sertifikaat on ette nähtud üksnes veterinaarotstarbeks ning peab partiiga kaasas olema kuni kõnealuse partii jõudmiseni piiripunkti. Veterinaarjärelevalve ametnik/inspektor Nimi (trükitähtedega): Kvalifikatsioon ja ametinimetus: Kuupäev: Allkiri: Tempel: 2. PEATÜKK, B OSA Tervisesertifikaat muuks otstarbeks kui inimtoiduks ettenähtud ternespiima ja ternespiimatoodete kohta, mis on pärit veistelt ja ette nähtud lähetamiseks Euroopa Liitu või transiidiks (2) Euroopa Liidu kaudu  Tekst pildi
Tekst pildi
RIIK Veterinaarsertifikaat impordiks ELi I osa. Saadetise andmed I.1 Kauba saatja Nimi Aadress Telefon I.2 Sertifikaadi viitenumber I.2.a I.3 Pädev keskasutus I.4 Pädev kohalik asutus I.5 Kauba saaja Nimi Aadress Sihtnumber Telefon I.6 ELis saadetise eest vastutav isik Nimi Aadress Sihtnumber Telefon I.7 Päri-toluriik ISO kood I.8 Päritolu-piirkond Kood I.9 Sihtriik ISO kood I.10 Sihtpiirkond Kood I.11 Päritolukoht Nimi Loa number Aadress Nimi Loa number Aadress Nimi Loa number Aadress I.12 Sihtkoht Tolliladu Nimi Loa number Aadress Sihtnumber I.13 Laadimiskoht I.14 Väljumiskuupäev I.15 Transpordivahend Lennuk Laev Raudteevagun Maanteeveok Muu Identifitseerimistunnused Viited dokumentidele I.16 ELi sisenemise piiripunkt I.17 CITESi number/numbrid I.18 Kauba kirjeldus I.19 Kauba kood (HSi kood) I.20 Kogus I.21 Toote temperatuur Keskkonna temperatuur Jahutatud Külmutatud I.22 Pakendite arv I.23 Plommi/konteineri number I.24 Pakendiliik 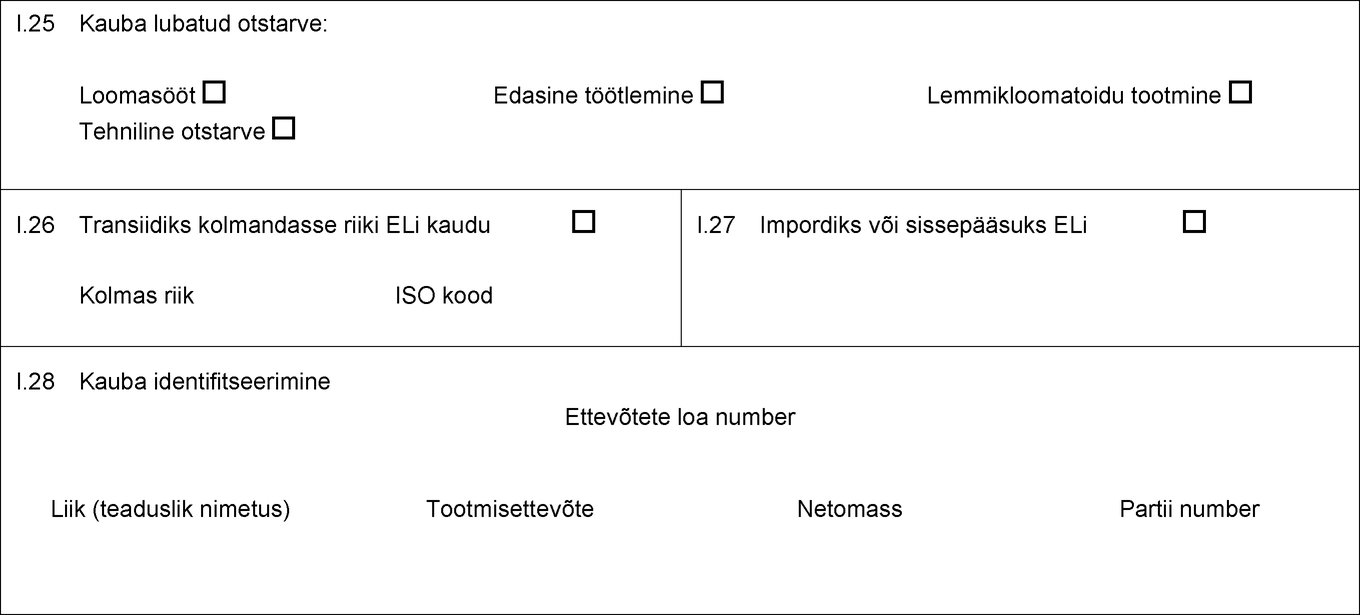 Tekst pildi
Tekst pildi
I.25 Kauba lubatud otstarve: Loomasööt Edasine töötlemine Lemmikloomatoidu tootmine Tehniline otstarve I.26 Transiidiks kolmandasse riiki ELi kaudu Kolmas riik ISO kood I.27 Impordiks või sissepääsuks ELi I.28 Kauba identifitseerimine Ettevõtete loa number Liik (teaduslik nimetus) Tootmisettevõte Netomass Partii number  Tekst pildi
Tekst pildi
RIIK Muuks otstarbeks kui inimtoiduks ettenähtud ternespiim ja ternespiimatooted, mis on pärit veistelt II. Terviseteave II.a. Sertifikaadi viitenumber II.b. Mina, allakirjutanud veterinaarjärelevalve ametnik, teatan, et olen lugenud ja mõistan Euroopa Parlamendi ja nõukogu määrust (EÜ) nr 1069/2009 (1a), eelkõige selle artiklit 10, ning komisjoni määrust (EL) nr 142/2011 (1b), eelkõige selle X lisa II peatüki 4. jagu ja XIV lisa I peatükki, ning kinnitan, et lahtris I.28 osutatud ternespiim (2) või ternespiimatooted (2) vastab/vastavad järgmistele tingimustele: II.1 need on toodetud ja saadud (märkida eksportiva riiginimi) (3), (märkida piirkonna nimi) (3), mis on loetletud komisjoni määruse (EL) nr 605/2010 (4) I lisas ning kus ei ole 12kuulise ajavahemiku jooksul vahetult enne eksportimist esinenud suu- ja sõrataudi ega veiste katku ning kus samal ajavahemikul ei ole toimunud veiste katku vastu vaktsineerimist; II.2 need on valmistatud ternespiimast, mis on saadud loomadelt, kellel lüpsmise ajal ei avaldunud ternespiima kaudu inimestele või loomadele leviva ühegi haiguse kliinilisi tunnuseid ning keda oli vähemalt 30-päevase ajavahemiku jooksul enne tootmist hoitud ettevõtetes, kus ei ole kehtestatud ametlikke piiranguid suu- ja sõrataudi või veiste katku tõttu; II.3 tegemist on veiste ternespiima või ternespiimatoodetega, mida on lühikest aega kõrgpastöriseeritud 72 °C juures vähemalt 15 sekundit või mis on läbinud samaväärse mõjuga pastöriseerimise, mis tagab fosfataastesti negatiivse tulemuse veise ternespiimas, ning: (2) (5) kas [ternespiim/ternespiimatoode on toodetud vähemalt 21 päeva enne lähetamise kuupäeva ning sellel ajavahemikul ei ole eksportivas riigis tuvastatud ühtegi suu- ja sõrataudi juhtumit,] (2) (5) või [ternespiim/ternespiimatooted on toodetud (pp.kk.aaaa); see kuupäev on vedamise eeldatavat kestust arvestades vähemalt 21 päeva enne saadetise esitamist Euroopa Liidu piiripunktis,] ja need on pärit loomadelt, kelle puhul tehakse korrapärast veterinaarkontrolli, tagamaks, et nad on pärit põllumajandusettevõttest, (2) (5) kas [mille kõik veisekarjad on tunnistatud ametlikult tuberkuloosi- ja brutselloosivabaks (6),] (2) (5) või [mille ühegi veisekarja suhtes ei ole kehtestatud piiranguid tuberkuloosi ja brutselloosi likvideerimist käsitlevate kolmandast riigist päritoluriigi riiklike õigusaktide alusel,] ja (2) (5) kas [mille kõik veisekarjad on tunnistatud ametlikult veiste enzootilise leukoosi vabaks (6),] (2) (5) või [mille kõik veisekarjad on kaasatud veiste enzootilise leukoosi tõrje ametlikku süsteemi ja neis ei ole eelneva kaheaastase ajavahemiku jooksul kliiniliste ega laboriuuringute tulemusel saadud tõendeid kõnealuse haiguse esinemise kohta,]] II.4 võetud on kõik ettevaatusabinõud, et vältida ternespiima/ternespiimatoodete saastumist töötlemise järel; II.5 ternespiim või ternespiimatooted on pakendatud: (2) kas [kasutamata mahutitesse,] (2) või [veokitesse või puistlastikonteineritesse, mida on enne laadimist desinfitseeritud tootega, mille pädev asutus on heaks kiitnud,] ja mahutitele on märgitud ternespiima/ternespiimatoote andmed ja neil on sildid kirjaga selle kohta, et toode on 3. kategooria materjal ja see ei ole ette nähtud inimtoiduks; II.6 ternespiim või ternespiimatoode ei sisalda lammastelt või kitsedelt saadud piima ega piimatooteid. Märkused I osa — Lahter I.6.: Euroopa Liidus saadetise eest vastutav isik: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist sertifikaadiga Euroopa Liidu kaudu transporditava transiitkauba kohta; Euroopa Liitu imporditava kauba kohta antava sertifikaadi puhul võib selle samuti täita. II osa. Sertifitseerimine  Tekst pildi
Tekst pildi
RIIK Muuks otstarbeks kui inimtoiduks ettenähtud ternespiim ja ternespiimatooted, mis on pärit veistelt II. Terviseteave II.a. Sertifikaadi viitenumber II.b. — Lahter I.12.: Sihtkoht: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist transiitkauba kohta antava sertifikaadiga. — Lahter I.15.: tuleb esitada registreerimisnumber (raudteevagunid või -konteinerid ja veoautod), lennu number (lennuk) või nimi (laev). Euroopa Liidus maha- ja ümberlaadimise korral peab kauba saatja teavitama Euroopa Liidu piiripunkti. — Lahter I.19.: kasutada Maailma Tolliorganisatsiooni asjakohast kaupade kirjeldamise ja kodeerimise harmoneeritud süsteemi (HS) koodi: 04.04.90; 23.09.10, 23.09.90, 35.01, 35.02 või 35.04. — Lahter I.23.: puistlastikonteinerite puhul tuleb lisada konteineri number ja plommi number (kui on). — Lahter I.25.: Tehniline otstarve: muuks kui põllumajandusloomade (v.a karusloomad) söödaks, ning lemmikloomatoidu tootmiseks või valmistamiseks. — Lahtrid I.26 ja I.27: täita vastavalt sellele, kas tegemist on transiidiks või impordiks antava sertifikaadiga. — Lahter I.28.: Tootmisettevõte: märkida töötlemisettevõtte registrinumber. II osa. (1a) ELT L 300, 14.11.2009, lk 1. (1b) ELT L 54, 26.2.2011, lk 1. (2) Mittevajalik läbi kriipsutada. (3) Täidetakse juhul, kui luba sisse tuua Euroopa Liitu on kitsendatud asjaomase kolmanda riigi teatavate piirkondadega. (4) ELT L 175, 10.7.2010, lk 1. (5) Seda tingimust kohaldatakse üksnes komisjoni määruse (EL) nr 605/2010 I lisa veerus A loetletud kolmandate riikide suhtes (ELT L 175, 10.7.2010, lk 1). (6) Ametlikult tuberkuloosi-/brutselloosivaba kari, nagu on sätestatud nõukogu direktiivi 64/432/EMÜ (EÜT 121, 29.7.1964, lk1977/64) A lisas, ning ametlikult veiste enzootilise leukoosi vaba kari, nagu on sätestatud kõnealuse direktiivi D lisa I peatükis. — Allkirja ja templi värv peavad erinema teksti värvist. — Märkus importijale: käesolev sertifikaat on ette nähtud üksnes veterinaarotstarbeks ning peab partiiga kaasas olema kuni kõnealuse partii jõudmiseni Euroopa Liidu piiripunkti. Veterinaarjärelevalve ametnik/inspektor Nimi (trükitähtedega): Kvalifikatsioon ja ametinimetus: Kuupäev: Allkiri: Tempel: 3. PEATÜKK, A OSA Tervisesertifikaat lemmikloomatoidu konservide kohta, mis on ette nähtud lähetamiseks Euroopa Liitu või transiidiks (2) Euroopa Liidu kaudu 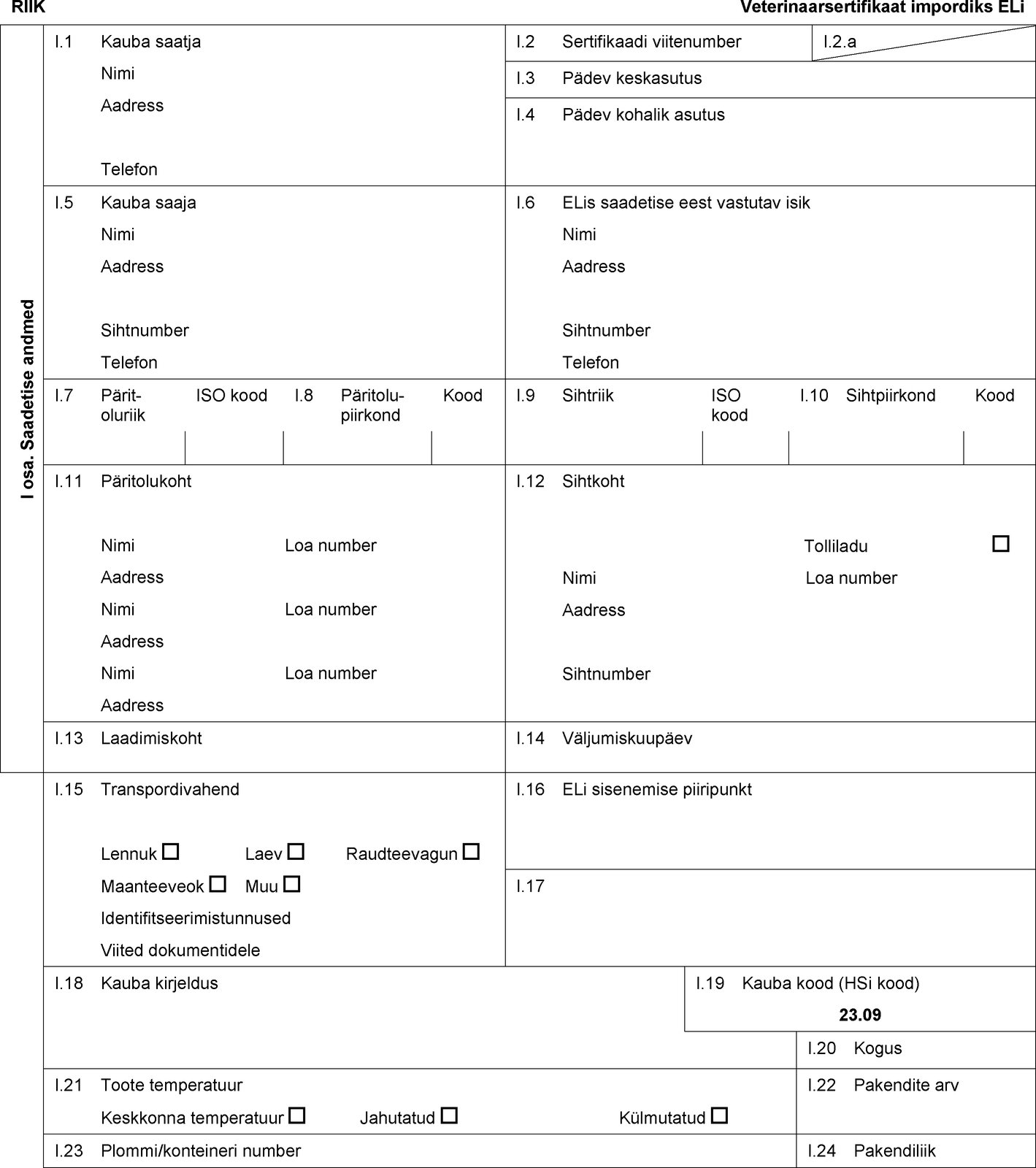 Tekst pildi
Tekst pildi
RIIK Veterinaarsertifikaat impordiks ELi I osa. Saadetise andmed I.1 Kauba saatja Nimi Aadress Telefon I.2 Sertifikaadi viitenumber I.2.a I.3 Pädev keskasutus I.4 Pädev kohalik asutus I.5 Kauba saaja Nimi Aadress Sihtnumber Telefon I.6 ELis saadetise eest vastutav isik Nimi Aadress Sihtnumber Telefon I.7 Pärit-oluriik ISO kood I.8 Päritolu-piirkond Kood I.9 Sihtriik ISO kood I.10 Sihtpiirkond Kood I.11 Päritolukoht Nimi Loa number Aadress Nimi Loa number Aadress Nimi Loa number Aadress I.12 Sihtkoht Tolliladu Nimi Loa number Aadress Sihtnumber I.13 Laadimiskoht I.14 Väljumiskuupäev I.15 Transpordivahend Lennuk Laev Raudteevagun Maanteeveok Muu Identifitseerimistunnused Viited dokumentidele I.16 ELi sisenemise piiripunkt I.17 I.18 Kauba kirjeldus I.19 Kauba kood (HSi kood) 23.09 I.20 Kogus I.21 Toote temperatuur Keskkonna temperatuur Jahutatud Külmutatud I.22 Pakendite arv I.23 Plommi/konteineri number I.24 Pakendiliik  Tekst pildi
Tekst pildi
I.25 Kauba lubatud otstarve: Lemmikloomatoit Tehniline otstarve I.26 Transiidiks kolmandasse riiki ELi kaudu Kolmas riik ISO kood I.27 Impordiks või sissepääsuks ELi I.28 Kauba identifitseerimine Ettevõtete loa number Liik (teaduslik nimetus) Tootmisettevõte Netomass Partii number  Tekst pildi
Tekst pildi
RIIK Lemmikloomatoidu konservid II. Terviseteave II.a. Sertifikaadi viitenumber II.b. Mina, allakirjutanud veterinaarjärelevalve ametnik, teatan, et olen lugenud ja mõistan Euroopa Parlamendi ja nõukogu määrust (EÜ) nr 1069/2009 (1a), eelkõige selle artikleid 8 ja 10, ning komisjoni määrust (EL) nr 142/2011 (1b), eelkõige selle XIII lisa II peatükki ja XIV lisa II peatükki, ning kinnitan seoses eelkirjeldatud lemmikloomatoiduga järgmist: II.1 see on valmistatud ja ladustatud ettevõttes, mida pädev asutus on määruse (EÜ) nr 1069/2009 artikli 24 kohaselt tunnustanud ja mis on pädeva asutuse järelevalve all; II.2 selle valmistamisel on kasutatud üksnes järgmisi loomseid kõrvalsaadusi: (2) kas [- tapetud loomade rümbad ja loomade kehaosad või tapetud ulukite kehad või kehaosad, mis on kõlblikud inimtoiduks vastavalt Euroopa Liidu õigusaktidele, kuid mis ei ole ärilistel kaalutlustel inimtoiduks ette nähtud;] (2) ja/või [- rümbad ja järgmised kehaosad tapamajas tapetud loomadelt, kes tunnistati tapaeelse kontrolli põhjal inimtoiduks tapmiseks kõlblikuks, või kehad ja järgmised kehaosad ulukitelt, kes tapeti inimtoiduna kasutamiseks vastavalt Euroopa Liidu õigusaktidele: i) loomade rümbad või kehad ja kehaosad, mis on tunnistatud inimtoiduks kõlbmatuks vastavalt Euroopa Liidu õigusaktidele, kuid millel ei ole ilmnenud mingeid inimestele või loomadele nakkava haiguse nähte; ii) kodulindude pead; iii) loomade toornahad ja nahad, kaasa arvatud nahalõiked ja -jäägid, sarved ja jalad, kaasa arvatud randme- ja kämblaluud, pöiad, pöiapärad ja varbalülid; iv) seaharjased; v) suled;] (2) ja/või [- loomsed kõrvalsaadused kodulindudest ja jäneselistest, kes on tapetud põllumajandusettevõttes vastavalt Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 853/2004 artikli 1 lõike 3 punktile d ja millel ei ole ilmnenud inimestele või loomadele nakkava haiguse nähte] (2) ja/või [- veri tapamajas tapetud loomadelt, kellel ei ilmnenud mingeid vere kaudu inimestele või loomadele nakkava haiguse nähte ja kes tunnistati tapaeelsel ülevaatusel inimtoiduks kõlblikuks vastavalt Euroopa Liidu õigusaktidele;] (2) ja/või [- loomsed kõrvalsaadused, mis on tekkinud inimtoiduks ette nähtud toodete valmistamisel, sealhulgas rasvatustatud kondid, kõrned ning piima töötlemisel tekkinud tsentrifuugimis- või separeerimissete;] (2) ja/või [- loomsed tooted või loomseid tooteid sisaldav toit, mis ei ole enam ette nähtud inimtoiduks kas ärilistel kaalutlustel, tootmis- või pakendamisdefektide või muude puuduste tõttu, mis ei ohusta inimeste ega loomade tervist;] (2) ja/või [- loomne lemmikloomatoit ja sööt või loomseid kõrvalsaadusi või nendest saadud tooteid sisaldav sööt, mis ei ole enam ette nähtud söödana kasutamiseks kas ärilistel kaalutlustel, tootmis- või pakendamisdefektide või muude puuduste tõttu, mis ei ohusta inimeste ega loomade tervist;] (2) ja/või [- veri, platsenta, vill, suled, karvad, sarved, kabja- ja sõralõikmed ning toorpiim elusloomadelt, kellel ei ole ilmnenud mingite asjaomase toote kaudu inimestele või loomadele nakkava haiguse nähte;] (2) ja/või [- veeloomad (v.a mereimetajad) ja nende kehaosad, millel ei ole ilmnenud mingeid inimestele või loomadele nakkavate haiguste nähte;] (2) ja/või [- kõrvalsaadused veeloomadest, mis on saadud ettevõtetest, kus valmistatakse inimtoiduks ettenähtud tooteid;] II osa. Sertifitseerimine  Tekst pildi
Tekst pildi
RIIK Lemmikloomatoidu konservid II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (2) ja/või [- järgmine materjal loomadelt, kel ei ole ilmnenud sellise materjali kaudu inimestele või loomadele nakkava haiguse nähte: i) pehme koe või lihaga karpide või koorikloomade kojad või koorikud; ii) järgmine maismaaloomadelt pärinev materjal: — kõrvalsaadused haudejaamadest; — munad; — munade kõrvalsaadused, sh munakoored; iii) ärilisel eesmärgil tapetud ööpäevased tibud;] (2) ja/või [- kõrvalsaadused selgrootutest vee- või maismaaloomadest, kes ei kuulu inimestele või loomadele patogeensete liikide hulka;] (2) ja/või [- näriliste ja jäneseliste hulka kuuluvad loomad ja nende kehaosad, välja arvatud 1. kategooria materjal, millele on osutatud määruse (EÜ) nr 1069/2009 artikli 8 punkti a alapunktides iii, iv ja v, ning 2. kategooria materjal, millele on osutatud kõnealuse määruse artikli 9 punktides a–g;] (2) ja/või [- sellistest loomadest saadud materjal, kelle puhul on kasutatud teatavaid direktiiviga 96/22/EÜ (2b) keelatud aineid, kusjuures kõnealuse materjali import on määruse (EÜ) nr 1069/2009 artikli 35 punkti a alapunkti ii kohaselt lubatud;] II.3 seda on kuumtöödeldud hermeetiliselt suletud mahutites vähemalt Fc väärtuseni 3; II.4 seda on analüüsitud laboratoorse diagnoosimeetodiga, mille puhul on iga töödeldud partii kohta võetud vähemalt viis pistelist proovi, et veenduda kogu saadetise piisavas kuumtöötluses, mis on ette nähtud punktiga II.3; II.5 selle puhul on võetud kõik ettevaatusabinõud, et vältida haigusetekitajatega saastumist töötlemise järel. (2) [II.6. eelkirjeldatud lemmikloomatoit (2) kas [on saadud muudelt mäletsejalistelt kui veised, lambad ja kitsed.] (2) või [on saadud veistelt, lammastelt ja kitsedelt ning ei sisalda järgmist materjali ega ole sellest saadud: (2) kas [veistelt, lammastelt või kitsedelt saadud materjal, v.a materjal, mis on saadud loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka.]] (2) või [a) Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 999/2001 (3) V lisa punktis 1 nimetatud määratletud riskiteguriga materjal; b) veiste, lammaste või kitsede kontidelt mehhaaniliselt eraldatud lihamass, välja arvatud sellistelt loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt komisjoni otsusele 2007/453/EÜ (4) liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka, kus ei ole esinenud algupäraseid BSE-juhtumeid; c) loomne kõrvalsaadus või toode on saadud veistelt, lammastelt või kitsedelt, kes on pärast uimastamist surmatud kesknärvisüsteemikudede vigastamise teel koljuõõnde viidava pika vardakujulise instrumendiga või koljuõõnde süstitud gaasiga, v.a juhul, kui kõnealused loomad on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE riskiga riikide või piirkondade hulka.]]]  Tekst pildi
Tekst pildi
RIIK Lemmikloomatoidu konservid II. Terviseteave II.a. Sertifikaadi viitenumber II.b. Märkused I osa — Lahter I.6.: Euroopa Liidus saadetise eest vastutav isik: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist sertifikaadiga Euroopa Liidu kaudu transporditava transiitkauba kohta; Euroopa Liitu imporditava kauba kohta antava sertifikaadi puhul võib selle samuti täita. — Lahter I.12.: Sihtkoht: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist transiitkauba kohta antava sertifikaadiga. Transiitkaupu võib ladustada üksnes vabatsoonis, vabalaos ja tollilaos. — Lahter I.15.: registreerimisnumber (raudteevagunid või -konteinerid ja veoautod), lennu number (lennuk) või nimi (laev); teave tuleb esitada Euroopa Liidus maha- ja ümberlaadimise korral. — Lahter I.23.: puistlastikonteinerite puhul tuleb lisada konteineri number ja plommi number (kui on). — Lahter I.25.: Tehniline otstarve: muuks kui põllumajandusloomade (v.a karusloomad) söödaks, ning lemmikloomatoidu tootmiseks või valmistamiseks. — Lahtrid I.26 ja I.27: täita vastavalt sellele, kas tegemist on transiidiks või impordiks antava sertifikaadiga. — Lahter I.28.: Liik: valida üks järgmistest: Aves, Ruminantia, Suidae, Mammalia, v.a Ruminantia või Suidae, Pesca, Mollusca, Crustacea, selgrootud, v.a Mollusca ja Crustacea. II osa. (1a) ELT L 300, 14.11.2009, lk 1. (1b) ELT L 54, 26.2.2011, lk 1. (2) Mittevajalik läbi kriipsutada. (2a) ELT L 139, 30.4.2004, lk 55. (2b) EÜT L 125, 23.5.1996, lk 3. (3) EÜT L 147, 31.5.2001, lk 1. (4) ELT L 172, 30.6.2007, lk 84. — Allkirja ja templi värv peavad erinema teksti värvist. — Märkus Euroopa Liidus saadetise eest vastutavale isikule: käesolev sertifikaat on ette nähtud üksnes veterinaarotstarbeks ning peab partiiga kaasas olema kuni kõnealuse partii jõudmiseni piiripunkti. Veterinaarjärelevalve ametnik/inspektor Nimi (trükitähtedega): Kvalifikatsioon ja ametinimetus: Kuupäev: Allkiri: Tempel: 3. PEATÜKK, B OSA Tervisesertifikaat töödeldud lemmikloomatoidu (v.a konservid) kohta, mis on ette nähtud lähetamiseks Euroopa Liitu või transiidiks (2) Euroopa Liidu kaudu 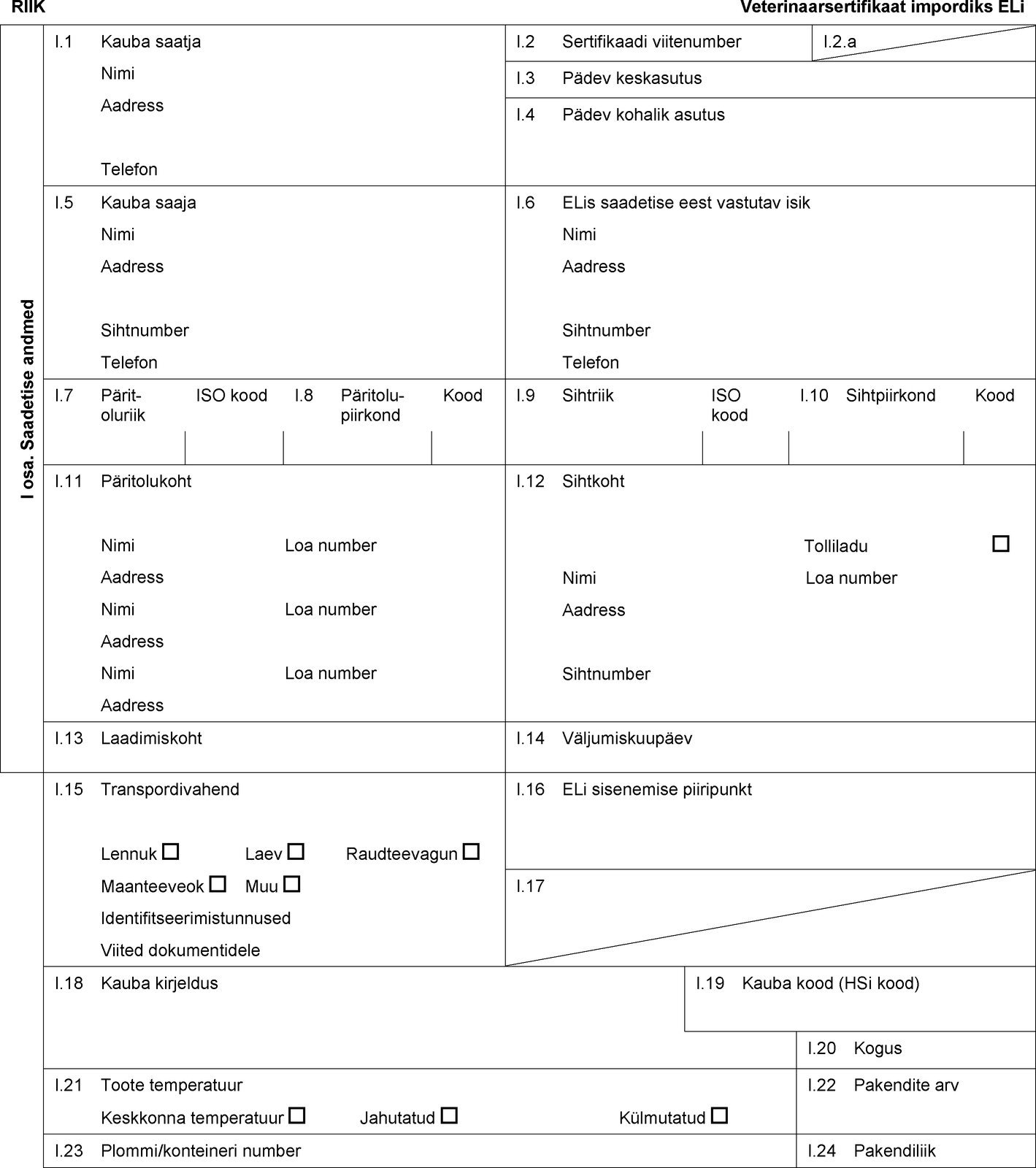 Tekst pildi
Tekst pildi
RIIK Veterinaarsertifikaat impordiks ELi I osa. Saadetise andmed I.1 Kauba saatja Nimi Aadress Telefon I.2 Sertifikaadi viitenumber I.2.a I.3 Pädev keskasutus I.4 Pädev kohalik asutus I.5 Kauba saaja Nimi Aadress Sihtnumber Telefon I.6 ELis saadetise eest vastutav isik Nimi Aadress Sihtnumber Telefon I.7 Pärit-oluriik ISO kood I.8 Päritolu-piirkond Kood I.9 Sihtriik ISO kood I.10 Sihtpiirkond Kood I.11 Päritolukoht Nimi Loa number Aadress Nimi Loa number Aadress Nimi Loa number Aadress I.12 Sihtkoht Tolliladu Nimi Loa number Aadress Sihtnumber I.13 Laadimiskoht I.14 Väljumiskuupäev I.15 Transpordivahend Lennuk Laev Raudteevagun Maanteeveok Muu Identifitseerimistunnused Viited dokumentidele I.16 ELi sisenemise piiripunkt I.17 I.18 Kauba kirjeldus I.19 Kauba kood (HSi kood) I.20 Kogus I.21 Toote temperatuur Keskkonna temperatuur Jahutatud Külmutatud I.22 Pakendite arv I.23 Plommi/konteineri number I.24 Pakendiliik  Tekst pildi
Tekst pildi
I.25 Kauba lubatud otstarve: Lemmikloomatoit Tehniline otstarve I.26 Transiidiks kolmandasse riiki ELi kaudu Kolmas riik ISO kood I.27 Impordiks või sissepääsuks ELi I.28 Kauba identifitseerimine Ettevõtete loa number Liik (teaduslik nimetus) Tootmisettevõte Netomass Partii number 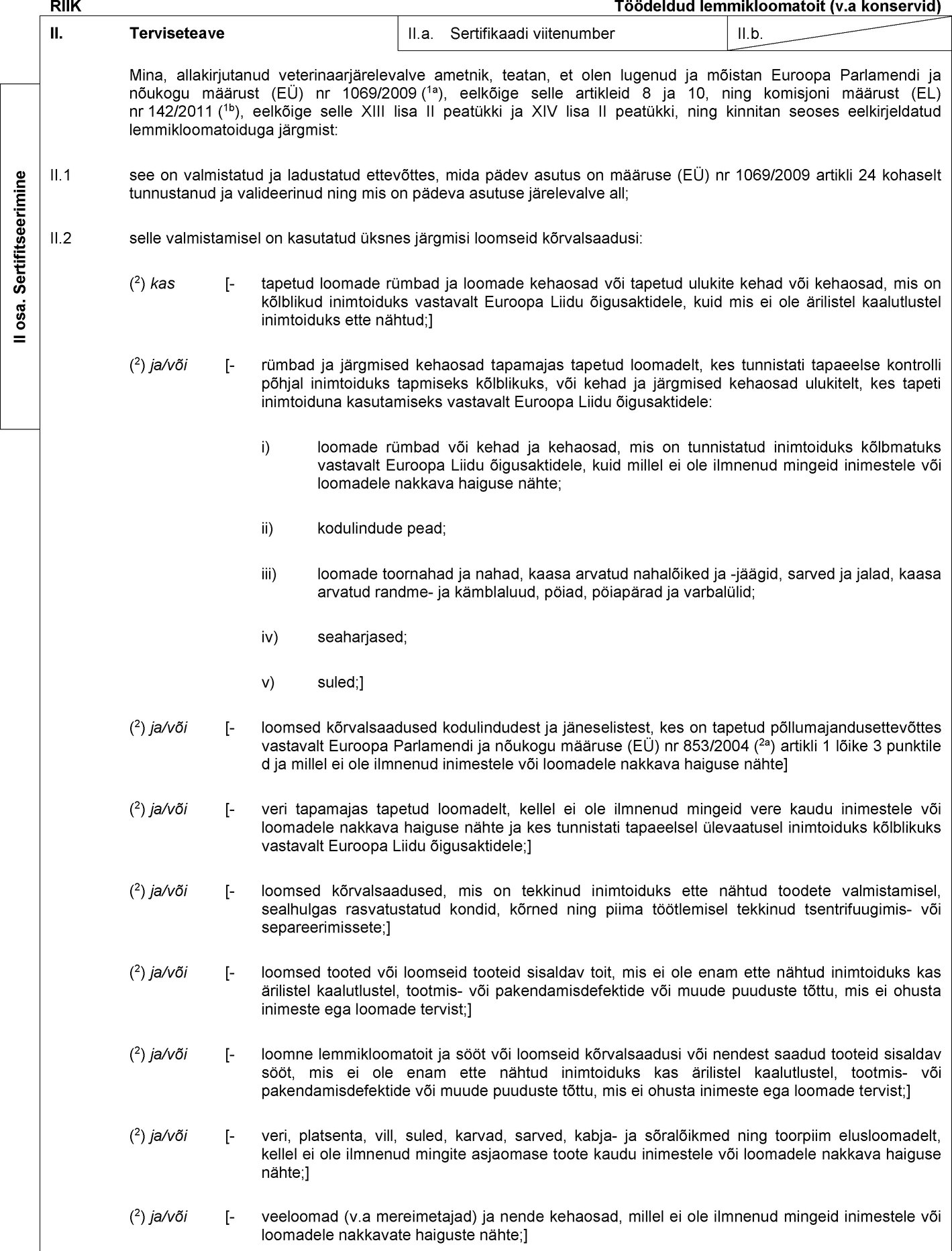 Tekst pildi
Tekst pildi
RIIK Töödeldud lemmikloomatoit (v.a konservid) II. Terviseteave II.a. Sertifikaadi viitenumber II.b. Mina, allakirjutanud veterinaarjärelevalve ametnik, teatan, et olen lugenud ja mõistan Euroopa Parlamendi ja nõukogu määrust (EÜ) nr 1069/2009 (1a), eelkõige selle artikleid 8 ja 10, ning komisjoni määrust (EL) nr 142/2011 (1b), eelkõige selle XIII lisa II peatükki ja XIV lisa II peatükki, ning kinnitan seoses eelkirjeldatud lemmikloomatoiduga järgmist: II.1 see on valmistatud ja ladustatud ettevõttes, mida pädev asutus on määruse (EÜ) nr 1069/2009 artikli 24 kohaselt tunnustanud ja valideerinud ning mis on pädeva asutuse järelevalve all; II.2 selle valmistamisel on kasutatud üksnes järgmisi loomseid kõrvalsaadusi: (2) kas [- tapetud loomade rümbad ja loomade kehaosad või tapetud ulukite kehad või kehaosad, mis on kõlblikud inimtoiduks vastavalt Euroopa Liidu õigusaktidele, kuid mis ei ole ärilistel kaalutlustel inimtoiduks ette nähtud;] (2) ja/või [- rümbad ja järgmised kehaosad tapamajas tapetud loomadelt, kes tunnistati tapaeelse kontrolli põhjal inimtoiduks tapmiseks kõlblikuks, või kehad ja järgmised kehaosad ulukitelt, kes tapeti inimtoiduna kasutamiseks vastavalt Euroopa Liidu õigusaktidele: i) loomade rümbad või kehad ja kehaosad, mis on tunnistatud inimtoiduks kõlbmatuks vastavalt Euroopa Liidu õigusaktidele, kuid millel ei ole ilmnenud mingeid inimestele või loomadele nakkava haiguse nähte; ii) kodulindude pead; iii) loomade toornahad ja nahad, kaasa arvatud nahalõiked ja -jäägid, sarved ja jalad, kaasa arvatud randme- ja kämblaluud, pöiad, pöiapärad ja varbalülid; iv) seaharjased; v) suled;] (2) ja/või [- loomsed kõrvalsaadused kodulindudest ja jäneselistest, kes on tapetud põllumajandusettevõttes vastavalt Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 853/2004 (2a) artikli 1 lõike 3 punktile d ja millel ei ole ilmnenud inimestele või loomadele nakkava haiguse nähte] (2) ja/või [- veri tapamajas tapetud loomadelt, kellel ei ole ilmnenud mingeid vere kaudu inimestele või loomadele nakkava haiguse nähte ja kes tunnistati tapaeelsel ülevaatusel inimtoiduks kõlblikuks vastavalt Euroopa Liidu õigusaktidele;] (2) ja/või [- loomsed kõrvalsaadused, mis on tekkinud inimtoiduks ette nähtud toodete valmistamisel, sealhulgas rasvatustatud kondid, kõrned ning piima töötlemisel tekkinud tsentrifuugimis- või separeerimissete;] (2) ja/või [- loomsed tooted või loomseid tooteid sisaldav toit, mis ei ole enam ette nähtud inimtoiduks kas ärilistel kaalutlustel, tootmis- või pakendamisdefektide või muude puuduste tõttu, mis ei ohusta inimeste ega loomade tervist;] (2) ja/või [- loomne lemmikloomatoit ja sööt või loomseid kõrvalsaadusi või nendest saadud tooteid sisaldav sööt, mis ei ole enam ette nähtud inimtoiduks kas ärilistel kaalutlustel, tootmis- või pakendamisdefektide või muude puuduste tõttu, mis ei ohusta inimeste ega loomade tervist;] (2) ja/või [- veri, platsenta, vill, suled, karvad, sarved, kabja- ja sõralõikmed ning toorpiim elusloomadelt, kellel ei ole ilmnenud mingite asjaomase toote kaudu inimestele või loomadele nakkava haiguse nähte;] (2) ja/või [- veeloomad (v.a mereimetajad) ja nende kehaosad, millel ei ole ilmnenud mingeid inimestele või loomadele nakkavate haiguste nähte;] II osa. Sertifitseerimine  Tekst pildi
Tekst pildi
RIIK Töödeldud lemmikloomatoit (v.a konservid) II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (2) ja/või [- kõrvalsaadused veeloomadest, mis on saadud ettevõtetest, kus valmistatakse inimtoiduks ettenähtud tooteid;] (2) ja/või [- järgmine materjal loomadelt, kel ei ole ilmnenud sellise materjali kaudu inimestele või loomadele nakkava haiguse nähte: i) pehme koe või lihaga karpide või koorikloomade kojad või koorikud; ii) järgmine maismaaloomadelt pärinev materjal: — kõrvalsaadused haudejaamadest, — munad, — munade kõrvalsaadused, sh munakoored, iii) ärilisel eesmärgil tapetud ööpäevased tibud;] (2) ja/või [- kõrvalsaadused selgrootutest vee- või maismaaloomadest, kes ei kuulu inimestele või loomadele patogeensete liikide hulka;] (2) ja/või [- näriliste ja jäneseliste hulka kuuluvad loomad ja nende kehaosad, välja arvatud 1. kategooria materjal, millele on osutatud määruse (EÜ) nr 1069/2009 artikli 8 punkti a alapunktides iii, iv ja v, ning 2. kategooria materjal, millele on osutatud määruse (EÜ) nr 1069/2009 artikli 9punktides a–g;] (2) ja/või [- sellistest loomadest saadud materjal, kelle puhul on kasutatud teatavaid nõukogu direktiiviga 96/22/EÜ (2b) keelatud aineid, kusjuures kõnealuse materjali import on määruse (EÜ) nr 1069/2009 artikli 35 punkti a alapunkti ii kohaselt lubatud;] II.3 (2) kas [see on läbi kuumutatud vähemalt temperatuuril 90 °C;] (2) või [selle loomsete koostisosade valmistamiseks on kasutatud üksnes tooteid a) mis on loomsete kõrvalsaaduste, lihasaaduste või lihatoodete puhul läbi kuumutatud vähemalt temperatuuril 90 °C; b) mis piima või piimapõhiste toodete puhul, i) kui need on pärit komisjoni määruse (EL) nr 605/2010 (3) I lisa veerus B loetletud kolmandatest riikidest või kolmandate riikide osadest, on läbinud pastöriseerimise, millest piisab, et fosfataastesti tulemus oleks negatiivne; ii) mille pH väärtus on vähendatud alla 6 ja mis on pärit määruse (EL) nr 605/2010 I lisa veerus C loetletud kolmandatest riikidest või kolmandate riikide osadest, on läbinud kõigepealt pastöriseerimise, millest piisab, et fosfataastesti tulemus oleks negatiivne; iii) kui need on pärit määruse (EL) nr 605/2010 I lisa veerus C loetletud kolmandatest riikidest või kolmandate riikide osadest, on läbinud steriliseerimise või kahekordse kuumtöötlemise, sealjuures piisab vaid ühest nimetatud töötlusviisist, et fosfataastesti tulemus oleks negatiivne; iv) kui need on pärit määruse (EL) nr 605/2010 I lisa veerus C loetletud kolmandatest riikidest või kolmandate riikide osadest, kus on viimase 12 kuu jooksul olnud suu- ja sõrataudi puhang või kus viimase 12 kuu jooksul on loomi suu- ja sõrataudi vastu vaktsineeritud, on läbinud kas — steriliseerimisprotsessi, kuni Fc väärtus on vähemalt 3, või — esialgse kuumtöötlemise temperatuuril, mille mõju on vähemalt samaväärne pastöriseerimisega vähemalt temperatuuril 72 °C vähemalt 15 sekundi jooksul ja millest piisab, et fosfataastesti tulemus oleks negatiivne, ning millele järgneb  Tekst pildi
Tekst pildi
RIIK Töödeldud lemmikloomatoit (v.a konservid) II. Terviseteave II.a. Sertifikaadi viitenumber II.b. kas — teine kuumtöötlemine, mille mõju on vähemalt samaväärne esimese kuumtöötlemise mõjuga ja millest piisab, et fosfataastesti tulemus oleks negatiivne, ning millele piimapulbri või piimapulbripõhise toote puhul järgneb kuivatusprotsess, või — hapestamisprotsess, mille jooksul pH väärtust hoitakse vähemalt ühe tunni jooksul alla 6; c) mis želatiini puhul on toodetud protsessi käigus, millega tagatakse, et töötlemata 3. kategooria materjal läbib töötluse happe või leelisega, millele järgneb üks või mitu loputust ja seejärel pH korrigeerimine ning želatiini eraldamine ühe või vajaduse korral mitme kuumutamisega, millele järgneb puhastamine filtreerimise teel ja steriliseerimine; d) mis hüdrolüüsitud valgu puhul on toodetud protsessi käigus, milles sobivate meetmete abil viiakse toore 3. kategooria materjali saastumisvõimalus miinimumini, ning täielikult või osaliselt mäletsejaliste toornahkadest saadud hüdrolüüsitud valgu puhul on toodetud töötlemisettevõttes, kes tegeleb ainult hüdrolüüsitud valgu tootmisega, kasutades üksnes materjali molekulmassiga alla 10 000 aatommassiühiku ja protsessi, mis hõlmab toore 3. kategooria materjali ettevalmistamist soolvee ja lubjaga töötlemise ning ohtra pesemise teel, misjärel: i) materjali hoitakse pH > 11 ja üle 80 °C juures üle 3 tunni ning sellele järgneb 30minutiline kuumtöötlus temperatuuril üle 140 °C ja rõhul üle 3,6 baari; või ii) materjali hoitakse pH 1–2 juures ja seejärel pH > 11 juures ning sellele järgneb 30minutiline kuumtöötlus temperatuuril 140 °C ja rõhul 3 baari; e) mida munatoodete puhul on töödeldud määruse (EL) nr 142/2011 IV lisa III peatükis kirjeldatud 1.–5. või 7. töötlemismeetodi alusel; või vastavalt määruse (EÜ) nr 853/2004 III lisa X jao II peatükile; f) mis kollageeni puhul on toodetud protsessi käigus, millega tagatakse, et töötlemata 3. kategooria materjal läbib töötlemise, mis hõlmab pesemist, pH korrigeerimist happe või leelise abil ning sellele järgnevat ühte või mitut loputuskorda, filtreerimist ja väljapressimist, kusjuures keelatud on kasutada säilitusaineid, mis ei ole Euroopa Liidu õigusaktidega lubatud; g) mida veretoodete puhul on töödeldud määruse (EL) nr 142/2011 IV lisa III peatükis kirjeldatud 1.–5. või 7. töötlemismeetodi alusel; h) mida imetajatelt pärit loomsete valkude puhul on töödeldud 1.–5. või 7. töötlemismeetodi alusel ja seavere puhul on töödeldud 1.–5. või 7. töötlemismeetodi alusel tingimusel, et 7. meetodi puhul on kasutatud läbikuumutamist vähemalt temperatuuril 80 °C; i) mida muu kui imetajatelt pärit valgu puhul on töödeldud määruse (EL) nr 142/2011 IV lisa III peatükis kirjeldatud 1.–5. või 7. töötlemismeetodi alusel; j) mida kalajahu puhul on töödeldud määruse (EL) nr 142/2011 IV lisa III peatükis kirjeldatud 1.–7. töötlemismeetodi alusel või sellise meetodi alusel ja selliste parameetrite juures, mis tagavad, et toode vastab määruse (EL) nr 142/2011 X lisa I peatükis esitatud töödeldud toodete mikrobioloogilistele standarditele; k) mida sulatatud rasvade, sealhulgas kalaõli puhul on töödeldud määruse (EL) nr 142/2011. IV lisa III peatükis kirjeldatud 1.–5. või 7. töötlemismeetodi alusel (ja kalaõli puhul 6. töötlemismeetodi alusel) või on toodetud vastavalt määruse (EÜ) nr 853/2004 III lisa XII jao II peatükile; mäletsejalistelt saadud sulatatud rasvad peavad olema puhastatud nii, et allesjäävad lahustumatud lisaained ei ületa 0,15 massiprotsenti;  Tekst pildi
Tekst pildi
RIIK Töödeldud lemmikloomatoit (v.a konservid) II. Terviseteave II.a. Sertifikaadi viitenumber II.b. l) mis kaltsiumvesinikfosfaadi puhul on toodetud sellise protsessi käigus, i) millega tagatakse, et 3. kategooria materjali kondid purustatakse peeneks, rasvatustatakse kuuma veega ja töödeldakse lahjendatud soolhappega (mille miinimum-kontsentratsioon on 4 % ja pH alla 1,5) vähemalt kahe päeva jooksul; ii) kus pärast alapunktis i osutatud menetlust töödeldakse saadud fosforit sisaldavat vedelikku lubjaga, mille tulemusena tekib pH väärtuse 4–7 juures kaltsiumdivesinikfosfaadi sade; ja iii) mis lõpeb kaltsiumdivesinikfosfaadi sademe õhkkuivatamisega nii, et siseneva õhu temperatuur on 65–325 °C ja lõpptemperatuur on 30–65 °C; m) mis kaltsiumdivesinikfosfaadi puhul on toodetud sellise protsessi käigus, i) kus kogu 3. kategooria kondimaterjal purustatakse peeneks ja rasvatustatakse vastuvoolumeetodil kuuma veega (kondikillud on väiksemad kui 14 mm); ii) toimub aurus keetmine 145 °C juures rõhul 4 baari 30 minuti jooksul; iii) valguleem eraldatakse hüdroksüapatiidist (trikaltsiumfosfaadist) tsentrifuugimise teel; ja iv) trikaltsiumfosfaat granuleeritakse pärast õhuga kuivatamist keevkihis 200 °C juures; n) mis lõhna- ja maitsetugevdajate puhul on toodetud sellise töötlemismeetodi alusel ja niisuguseid parameetreid kasutades, mis tagavad, et toode vastab punktis II.4 osutatud mikrobioloogilistele standarditele.] (2) või [seda on töödeldud kuivatamise või kääritamise teel meetodi alusel, mille pädev asutus on heaks kiitnud;] (2) või [selgrootute vee- ja maismaaloomade puhul, kes ei kuulu inimestele või loomadele patogeensete liikide hulka, on toodet töödeldud meetodi alusel, mille pädev asutus on heaks kiitnud ja millega tagatakse, et lemmikloomatoit ei kujuta endast lubamatud terviseriski inimestele ega loomadele;] II.4 on analüüsitud juhusliku valimi meetodil, kusjuures igast töödeldud partiist võeti töötlemisettevõttes ladustamise ajal või pärast seda vähemalt viis proovi, ning vastab järgmistele standarditele (4): salmonella: puudub 25 grammis: n = 5, c = 0, m = 0, M = 0, enterobakterid: n = 5, c = 2, m = 10, M = 300 1 grammis; II.5 selle puhul on võetud kõik ettevaatusabinõud, et vältida haigusetekitajatega saastumist töötlemise järel. II.6 see on pakendatud kasutamata pakenditesse, millel on sildid kirjaga „MITTE INIMTOIDUKS“, v.a juhul, kui lemmikloomatoit saadetakse müügipakendites, millele on selgelt märgitud, et nende sisu on mõeldud üksnes lemmikloomatoiduks; (2) [II.7. eelkirjeldatud lemmikloomatoit (2) kas [on saadud muudelt mäletsejalistelt kui veised, lambad ja kitsed.] (2) või [on saadud veistelt, lammastelt ja kitsedelt ning ei sisalda järgmist materjali ega ole sellest saadud: (2) kas [veistelt, lammastelt või kitsedelt saadud materjal, v.a materjal, mis on saadud loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka.]] (2) või [a) Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 999/2001 (5) V lisa punktis 1 nimetatud määratletud riskiteguriga materjal;  Tekst pildi
Tekst pildi
RIIK Töödeldud lemmikloomatoit (v.a konservid) II. Terviseteave II.a. Sertifikaadi viitenumber II.b. b) veiste, lammaste või kitsede kontidelt mehhaaniliselt eraldatud lihamass, välja arvatud sellistelt loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt komisjoni otsusele 2007/453/EÜ (6) liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka, kus ei ole esinenud algupäraseid BSE-juhtumeid; c) loomne kõrvalsaadus või toode on saadud veistelt, lammastelt või kitsedelt, kes on pärast uimastamist surmatud kesknärvisüsteemikudede vigastamise teel koljuõõnde viidava pika vardakujulise instrumendiga või koljuõõnde süstitud gaasiga, v.a juhul, kui kõnealused loomad on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE riskiga riikide või piirkondade hulka.]]] Märkused I osa — Lahter I.6.: Euroopa Liidus saadetise eest vastutav isik: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist sertifikaadiga Euroopa Liidu kaudu transporditava transiitkauba kohta; Euroopa Liitu imporditava kauba kohta antava sertifikaadi puhul võib selle samuti täita. — Lahter I.12.: Sihtkoht: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist transiitkauba sertifikaadiga. Transiitkaupu võib ladustada üksnes vabatsoonis, vabalaos ja tollilaos. — Lahter I.15.: tuleb esitada registreerimisnumber (raudteevagunid või -konteinerid ja veoautod), lennu number (lennuk) või nimi (laev). Maha- ja ümberlaadimise korral peab kauba saatja teavitama Euroopa Liidu piiripunkti. — Lahter I.19.: kasutada vajalikku harmoneeritud süsteemi (HS) koodi järgmistes rubriikides: 04.01; 04.02; 04.03; 04.04; 04.08, 05.04, 05.05, 05.06; 05.11, 15.01, 15.02, 15.03, 15.04, 23.01, 23.09; 28.35.25; 28.35.26; 35.01; 35.02; 35.03 või 35.04. — Lahter I.23.: puistlastikonteinerite puhul tuleb lisada konteineri number ja plommi number (kui on). — Lahter I.25.: Tehniline otstarve: muuks kui põllumajandusloomade (v.a karusloomad) söödaks, ning lemmikloomatoidu tootmiseks või valmistamiseks. — Lahtrid I.26 ja I.27: täita vastavalt sellele, kas tegemist on transiidiks või impordiks antava sertifikaadiga. — Lahter I.28.: Liik: valida üks järgmistest: Aves, Ruminantia, Suidae, Mammalia, v.a Ruminantia või Suidae, Pesca, Mollusca, Crustacea, selgrootud, v.a Mollusca ja Crustacea. II osa. (1a) ELT L 300, 14.11.2009, lk 1. (1b) ELT L 54, 26.2.2011, lk 1. (2) Mittevajalik läbi kriipsutada. (2a) ELT L 139, 30.4.2004, lk 55. (2b) EÜT L 125, 23.5.1996, lk 3. (3) ELT L 175, 10.7.2010, lk 1.  Tekst pildi
Tekst pildi
RIIK Töödeldud lemmikloomatoit (v.a konservid) II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (4) Kus: n = analüüsitavate proovide arv; m = bakterite arvu väärtuslävi; tulemus on rahuldav, kui bakterite arv kogu valimis ei ületa näitajat m; M = bakterite arvu maksimumväärtus; tulemus on ebarahuldav, kui bakterite arv ühes või mitmes proovis on võrdne näitajaga M või sellest suurem; ja c = nende proovide arv, milles bakterite arv võib jääda näitajate m ja M vahele; proov on siiski rahuldav, kui teiste proovide bakterite arv on võrdne näitajaga m või sellest väiksem. (5) EÜT L 147, 31.5.2001, lk 1. (6) ELT L 172, 30.6.2007, lk 84. — Allkirja ja templi värv peavad erinema teksti värvist. — Märkus Euroopa Liidus saadetise eest vastutavale isikule: käesolev sertifikaat on ette nähtud üksnes veterinaarotstarbeks ning peab partiiga kaasas olema kuni kõnealuse partii jõudmiseni Euroopa Liitu sisenemise piiripunkti. Veterinaarjärelevalve ametnik/inspektor Nimi (trükitähtedega): Kvalifikatsioon ja ametinimetus: Kuupäev: Allkiri: Tempel: 3. PEATÜKK, C OSA Tervisesertifikaat koerte närimiskontide kohta, mis on ette nähtud lähetamiseks Euroopa Liitu või transiidiks (2) Euroopa Liidu kaudu  Tekst pildi
Tekst pildi
RIIK Veterinaarsertifikaat impordiks ELi I osa. Saadetise andmed I.1 Kauba saatja Nimi Aadress Telefon I.2 Sertifikaadi viitenumber I.2.a I.3 Pädev keskasutus I.4 Pädev kohalik asutus I.5 Kauba saaja Nimi Aadress Sihtnumber Telefon I.6 ELis saadetise eest vastutav isik Nimi Aadress Sihtnumber Telefon I.7 Pärit-oluriik ISO kood I.8 Päritolu-piirkond Kood I.9 Sihtriik ISO kood I.10 Sihtpiirkond Kood I.11 Päritolukoht Nimi Loa number Aadress Nimi Loa number Aadress Nimi Loa number Aadress I.12 Sihtkoht Tolliladu Nimi Loa number Aadress Sihtnumber I.13 Laadimiskoht I.14 Väljumiskuupäev I.15 Transpordivahend Lennuk Laev Raudteevagun Maanteeveok Muu Identifitseerimistunnused Viited dokumentidele I.16 ELi sisenemise piiripunkt I.17 I.18 Kauba kirjeldus I.19 Kauba kood (HSi kood) I.20 Kogus I.21 Toote temperatuur Keskkonna temperatuur Jahutatud Külmutatud I.22 Pakendite arv I.23 Plommi/konteineri number I.24 Pakendiliik  Tekst pildi
Tekst pildi
I.25 Kauba lubatud otstarve: Lemmikloomatoit Tehniline otstarve I.26 Transiidiks kolmandasse riiki ELi kaudu Kolmas riik ISO kood I.27 Impordiks või sissepääsuks ELi I.28 Kauba identifitseerimine Ettevõtete loa number Liik (teaduslik nimetus) Tootmisettevõte Netomass Partii number  Tekst pildi
Tekst pildi
RIIK Koerte närimiskondid II. Terviseteave II.a. Sertifikaadi viitenumber II.b. Mina, allakirjutanud veterinaarjärelevalve ametnik, teatan, et olen lugenud ja mõistan Euroopa Parlamendi ja nõukogu määrust (EÜ) nr 1069/2009 (1a), eelkõige selle artiklit 10, ning komisjoni määrust (EL) nr 142/2011 (1b), eelkõige selle XIII lisa II peatükki ja XIV lisa II peatükki, ning kinnitan seoses eelkirjeldatud koerte närimiskontidega järgmist: II.1 nende valmistamisel on kasutatud üksnes järgmisi loomseid kõrvalsaadusi: (2) kas [- tapetud loomade rümbad ja loomade kehaosad või tapetud ulukite kehad või kehaosad, mis on kõlblikud inimtoiduks vastavalt Euroopa Liidu õigusaktidele, kuid mis ei ole ärilistel kaalutlustel inimtoiduks ette nähtud;] (2) ja/või [- rümbad ja järgmised kehaosad tapamajas tapetud loomadelt, kes tunnistati tapaeelse kontrolli põhjal inimtoiduks tapmiseks kõlblikuks, või kehad ja järgmised kehaosad ulukitelt, kes tapeti inimtoiduna kasutamiseks vastavalt Euroopa Liidu õigusaktidele: i) loomade rümbad või kehad ja kehaosad, mis on tunnistatud inimtoiduks kõlbmatuks vastavalt Euroopa Liidu õigusaktidele, kuid millel ei ole ilmnenud mingeid inimestele või loomadele nakkava haiguse nähte; ii) kodulindude pead; iii) loomade toornahad ja nahad, kaasa arvatud nahalõiked ja -jäägid, sarved ja jalad, kaasa arvatud randme- ja kämblaluud, pöiad, pöiapärad ja varbalülid; iv) seaharjased; v) suled;] (2) ja/või [- veri tapamajas tapetud loomadelt, kellel ei ole ilmnenud mingeid vere kaudu inimestele või loomadele nakkava haiguse nähte ja kes tunnistati tapaeelsel ülevaatusel inimtoiduks kõlblikuks vastavalt Euroopa Liidu õigusaktidele;] (2) ja/või [- loomsed kõrvalsaadused, mis on tekkinud inimtoiduks ette nähtud toodete valmistamisel, sealhulgas rasvatustatud kondid, kõrned ning piima töötlemisel tekkinud tsentrifuugimis- või separeerimissete;] (2) ja/või [- veeloomad (v.a mereimetajad) ja nende kehaosad, millel ei ole ilmnenud mingeid inimestele või loomadele nakkava haiguse nähte;] (2) ja/või [- kõrvalsaadused veeloomadest, mis on saadud ettevõtetest, kus valmistatakse inimtoiduks ettenähtud tooteid;] (2) ja/või [- sellistest loomadest saadud materjal, kelle puhul on kasutatud teatavaid nõukogu direktiiviga 96/22/EÜ (2a) keelatud aineid, kusjuures kõnealuse materjali import on määruse (EÜ) nr 1069/2009 artikli 35 punkti a alapunkti ii kohaselt lubatud;] II.2 neid on (2) kas [kabiloomade toornahkadest või kalast toodetud närimiskontide puhul töödeldud viisil, mis on piisav patogeensete mikroobide (sh salmonella) hävitamiseks; ning närimiskondid on kuivad;] (2) ja/või [muudest loomsetest kõrvalsaadustest kui kabiloomade toornahkadest või kalast toodetud närimiskontide puhul läbi kuumutatud vähemalt temperatuuril 90 °C;] II.3 on analüüsitud juhusliku valimi meetodil, kusjuures igast töödeldud partiist võeti töötlemisettevõttes ladustamise ajal või pärast seda vähemalt viis proovi, ning vastab järgmistele standarditele (3): salmonella: puudub 25 grammis: n = 5, c = 0, m = 0, M = 0, enterobakterid: n = 5, c = 2, m = 10, M = 300 1 grammis; II osa. Sertifitseerimine  Tekst pildi
Tekst pildi
RIIK Koerte närimiskondid II. Terviseteave II.a. Sertifikaadi viitenumber II.b. II.4 nende puhul on võetud kõik ettevaatusabinõud, et vältida haigusetekitajatega saastumist töötlemise järel; II.5 need on pakendatud kasutamata pakenditesse; (2) [II.6. eelkirjeldatud koerte närimiskondid (2) kas [on saadud muudelt mäletsejalistelt kui veised, lambad ja kitsed.]] (2) või [on saadud veistelt, lammastelt ja kitsedelt ning ei sisalda järgmist materjali ega ole sellest saadud: (2) kas [veistelt, lammastelt või kitsedelt saadud materjal, v.a materjal, mis on saadud loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka.]] (2) või [a) Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 999/2001 (4) V lisa punktis 1 nimetatud määratletud riskiteguriga materjal; b) veiste, lammaste või kitsede kontidelt mehhaaniliselt eraldatud lihamass, välja arvatud sellistelt loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt komisjoni otsusele 2007/453/EÜ (5) liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka, kus ei ole esinenud algupäraseid BSE-juhtumeid; c) loomne kõrvalsaadus või toode on saadud veistelt, lammastelt või kitsedelt, kes on pärast uimastamist surmatud kesknärvisüsteemikudede vigastamise teel koljuõõnde viidava pika vardakujulise instrumendiga või koljuõõnde süstitud gaasiga, v.a juhul, kui kõnealused loomad on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE riskiga riikide või piirkondade hulka.]]] Märkused I osa — Lahter I.6.: Euroopa Liidus saadetise eest vastutav isik: selle lahtri täitmine on kohustuslik ainult juhul, kui tegemist on transiitkauba kohta antava sertifikaadiga; Euroopa Liitu imporditava kauba kohta antava sertifikaadi puhul võib selle samuti täita. — Lahter I.12: Sihtkoht: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist transiitkauba sertifikaadiga. Transiitkaupu võib ladustada üksnes vabatsoonis, vabalaos ja tollilaos. — Lahter I.15: registreerimisnumber (raudteevagunid või -konteinerid ja veoautod), lennu number (lennuk) või nimi (laev); teave tuleb esitada Euroopa Liidus maha- ja ümberlaadimise korral. — Lahter I.19: 05.11, 23.09, 41.01 või 42.05. — Lahter I.23: puistlastikonteinerite puhul tuleb lisada konteineri number ja plommi number (kui on). — Lahter I.25: Tehniline otstarve: muuks kui põllumajandusloomade (v.a karusloomad) söödaks, ning lemmikloomatoidu tootmiseks või valmistamiseks. — Lahtrid I.26 ja I.27: täita vastavalt sellele, kas tegemist on transiidiks või impordiks antava sertifikaadiga. — Lahter I.28: Liik: valida üks järgmistest: Aves, Ruminantia, Suidae, Mammalia, v.a Ruminantia või Suidae, Pesca, Mollusca, Crustacea, selgrootud, v.a Mollusca ja Crustacea. II osa. (1a) ELT L 300, 14.11.2009, lk 1. (1b) ELT L 54, 26.2.2011, lk 1.  Tekst pildi
Tekst pildi
RIIK Koerte närimiskondid II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (2) Mittevajalik läbi kriipsutada. (2a) EÜT L 125, 23.5.1996, lk 3. (3) Kus: — n = analüüsitavate proovide arv; — m = bakterite arvu väärtuslävi; tulemus on rahuldav, kui bakterite arv kogu valimis ei ületa näitajat m; — M = bakterite arvu maksimumväärtus; tulemus on ebarahuldav, kui bakterite arv ühes või mitmes proovis on võrdne näitajaga M või sellest suurem; ja — c = nende proovide arv, milles bakterite arv võib jääda näitajate m ja M vahele; proov on siiski rahuldav, kui teiste proovide bakterite arv on võrdne näitajaga m või sellest väiksem. (4) EÜT L 147, 31.5.2001, lk 1. (5) ELT L 172, 30.6.2007, lk 84. — Allkirja ja templi värv peavad erinema teksti värvist. — Märkus Euroopa Liidus saadetise eest vastutavale isikule: käesolev sertifikaat on ette nähtud üksnes veterinaarotstarbeks ning peab partiiga kaasas olema kuni kõnealuse partii jõudmiseni Euroopa Liitu sisenemise piiripunkti. Veterinaarjärelevalve ametnik/inspektor Nimi (trükitähtedega): Kvalifikatsioon ja ametinimetus: Kuupäev: Allkiri: Tempel: 3. PEATÜKK, D OSA Tervisesertifikaat otsemüügiks ettenähtud töötlemata lemmikloomatoidu või karusloomade söödana kasutatavate loomsete kõrvalsaaduste kohta, mis on ette nähtud lähetamiseks Euroopa Liitu või transiidiks (2) Euroopa Liidu kaudu  Tekst pildi
Tekst pildi
RIIK Veterinaarsertifikaat impordiks ELi I osa. Saadetise andmed I.1 Kauba saatja Nimi Aadress Telefon I.2 Sertifikaadi viitenumber I.2.a I.3 Pädev keskasutus I.4 Pädev kohalik asutus I.5 Kauba saaja Nimi Aadress Sihtnumber Telefon I.6 ELis saadetise eest vastutav isik Nimi Aadress Sihtnumber Telefon I.7 Pärit-oluriik ISO kood I.8 Päritolu-piirkond Kood I.9 Sihtriik ISO kood I.10 Sihtpiirkond Kood I.11 Päritolukoht Nimi Loa number Aadress Nimi Loa number Aadress Nimi Loa number Aadress I.12 Sihtkoht Tolliladu Nimi Loa number Aadress Sihtnumber I.13 Laadimiskoht I.14 Väljumiskuupäev I.15 Transpordivahend Lennuk Laev Raudteevagun Maanteeveok Muu Identifitseerimistunnused Viited dokumentidele I.16 ELi sisenemise piiripunkt I.17 I.18 Kauba kirjeldus I.19 Kauba kood (HSi kood) I.20 Kogus I.21 Toote temperatuur Keskkonna temperatuur Jahutatud Külmutatud I.22 Pakendite arv I.23 Plommi/konteineri number I.24 Pakendiliik  Tekst pildi
Tekst pildi
I.25 Kauba lubatud otstarve: Lemmikloomatoit Tehniline otstarve I.26 Transiidiks kolmandasse riiki ELi kaudu Kolmas riik ISO kood I.27 Impordiks või sissepääsuks ELi I.28 Kauba identifitseerimine Ettevõtete loa number Liik (teaduslik nimetus) Kauba liik Tootmisettevõte Netomass Partii number  Tekst pildi
Tekst pildi
RIIK Otsemüügiks ettenähtud töötlemata lemmikloomatoit või karusloomade söödana kasutatavad loomsed kõrvalsaadused II. Terviseteave II.a. Sertifikaadi viitenumber II.b. Mina, allakirjutanud veterinaarjärelevalve ametnik, teatan, et olen lugenud ja mõistan Euroopa Parlamendi ja nõukogu määrust (EÜ) nr 1069/2009 (1a), eelkõige selle artiklit 10, ning komisjoni määrust (EL) nr 142/2011 (1b), eelkõige selle XIII lisa II peatükki ja XIV lisa II peatükki, ning seoses eelkirjeldatud töötlemata lemmikloomatoidu või karusloomade söödana kasutatavate loomsete kõrvalsaadustega kinnitan järgmist: II.1 tegemist on loomsete kõrvalsaadustega, mis vastavad alljärgnevatele tervishoiunõuetele; II.2 tegemist on loomsete kõrvalsaadustega, mis a) on saadud järgmistes õigusaktides sätestatud loomade ja inimeste tervishoiunõuetele vastavast lihast: — komisjoni määrus (EL) nr 206/2010 (3), sealjuures kehtib tingimus, et loomad, kellelt liha on saadud, on pärit kolmandatest riikidest, nende territooriumilt või territooriumi osast … (märkida ISO kood, kui tegemist on riigiga, või selle territooriumi või osa kood); — ja/või komisjoni määrus (EÜ) nr 798/2008 (4), sealjuures kehtib tingimus, et loomad, kellelt liha on saadud, on pärit kõnealuses määruses loetletud kolmandatest riikidest, nende territooriumilt või territooriumi osast … (märkida ISO kood, kui tegemist on riigiga, või selle territooriumi või osa kood), kus viimase 12 kuu jooksul ei ole esinenud Newcastle’i haigust ega linnugrippi; — ja/või komisjoni määrus (EÜ) nr 119/2009 (5), sealjuures kehtib tingimus, et loomad, kellelt liha on saadud, on pärit kõnealuses määruses loetletud kolmandatest riikidest, nende territooriumilt või territooriumi osast … (märkida ISO kood, kui tegemist on riigiga, või selle territooriumi või osa koodid), kus eelneva 12 kuu jooksul ei ole esinenud suu- ja sõrataudi, veiste katku, sigade katku, sigade Aafrika katku, sigade vesikulaarhaigust, Newcastle’i haigust ega linnugrippi ning kus sel ajal ei ole ei toimunud nende haiguste vastu vaktsineerimist (tingimust kohaldatakse asjaomaste vastuvõtlike liikide suhtes); b) on saadud loomadelt, kes läbisid tapamajas 24 tunni pikkuse ajavahemiku jooksul enne tapmist tapaeelse veterinaarkontrolli ja kellel ei ilmnenud selliste haiguste tunnuseid, millele on osutatud punktis a nimetatud määrustes ja millele loomad on vastuvõtlikud; ning c) on saadud loomadelt, keda on tapamajas enne tapmist või surmamist ja selle ajal koheldud kooskõlas liidu õigusaktidega ning nad vastasid vähemalt nõukogu määruse (EÜ) nr 1099/2009 (6) II ja III peatükis sätestatud nõuetele; või d) kui tegemist on veeloomadest saadud karusloomade söödaga, mis vastab komisjoni otsuses 2006/766/EÜ (7) kehtestatud looma- ja rahvatervist käsitlevatele tingimustele, on need pärit kõnealuse otsuse II lisas loetletud riikidest või nende territooriumitelt …(märkida ISO kood); II.3.1 need koosnevad ainult järgmistest loomsetest kõrvalsaadustest: a) tapetud loomade rümbad ja loomade kehaosad või tapetud ulukite kehad või kehaosad, mida peetakse inimtoiduks kõlblikuks vastavalt Euroopa Liidu õigusaktidele, kuid mis on ärilistel kaalutustel sellele vastupidiselt deklareeritud loomsete kõrvalsaadustena; b) tapetud loomade kehaosad, mis on tunnistatud inimtoiduks kõlbmatuks, kuid millel pole inimestele või loomadele nakkavate haiguste tunnuseid ja mis on saadud Euroopa Liidu õigusaktide kohaselt inimtoiduks kõlblikest rümpadest; II.3.2 kui tegemist on karusloomade söödaga, siis koosnevad need peale punktis II.3.1. nimetatu järgmistest loomsetest kõrvalsaadustest: (2) kas [- loomsed kõrvalsaadused kodulindudest ja jäneselistest, kes on tapetud põllumajandusettevõttes vastavalt Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 853/2004 (2a) artikli 1 lõike 3 punktile d ja millel ei ole ilmnenud inimestele või loomadele nakkava haiguse nähte;] (2) ja/või [- veri tapamajas tapetud loomadelt, kellel ei ole ilmnenud mingeid vere kaudu inimestele või loomadele nakkava haiguse nähte ja kes tunnistati tapaeelsel ülevaatusel inimtoiduks kõlblikuks vastavalt Euroopa Liidu õigusaktidele;] (2) ja/või [- loomsed kõrvalsaadused, mis on tekkinud inimtoiduks ette nähtud toodete valmistamisel, sealhulgas rasvatustatud kondid, kõrned ning piima töötlemisel tekkinud tsentrifuugimis- või separeerimissete;] II osa. Sertifitseerimine  Tekst pildi
Tekst pildi
RIIK Otsemüügiks ettenähtud töötlemata lemmikloomatoit või karusloomade söödana kasutatavad loomsed kõrvalsaadused II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (2) ja/või [- loomsed tooted või loomseid tooteid sisaldav toit, mis ei ole enam ette nähtud inimtoiduks kas ärilistel kaalutlustel, tootmis- või pakendamisdefektide või muude puuduste tõttu, mis ei ohusta inimeste ega loomade tervist;] (2) ja/või [- loomne lemmikloomatoit ja sööt või loomseid kõrvalsaadusi või nendest saadud tooteid sisaldav sööt, mis ei ole enam ette nähtud söödana kasutamiseks kas ärilistel kaalutlustel, tootmis- või pakendamisdefektide või muude puuduste tõttu, mis ei ohusta inimeste ega loomade tervist;] (2) ja/või [- veri, platsenta, vill, suled, karvad, sarved, kabja- ja sõralõikmed ning toorpiim elusloomadelt, kellel ei ole ilmnenud mingite asjaomase toote kaudu inimestele või loomadele nakkava haiguse nähte;] (2) ja/või [- veeloomad (v.a mereimetajad) ja nende kehaosad, millel ei ole ilmnenud mingeid inimestele või loomadele nakkavate haiguste nähte;] (2) ja/või [- kõrvalsaadused veeloomadest, mis on saadud ettevõtetest, kus valmistatakse inimtoiduks ettenähtud tooteid;] (2) ja/või [- järgmine materjal loomadelt, kel ei ole ilmnenud sellise materjali kaudu inimestele või loomadele nakkava haiguse nähte: i) pehme koe või lihaga karpide või koorikloomade kojad või koorikud; ii) järgmine maismaaloomadelt pärinev materjal: — kõrvalsaadused haudejaamadest, — munad, — munade kõrvalsaadused, sh munakoored, iii) ärilisel eesmärgil tapetud ööpäevased tibud;] (2) ja/või [- kõrvalsaadused selgrootutest vee- või maismaaloomadest, kes ei kuulu inimestele või loomadele patogeensete liikide hulka;] (2) ja/või [- näriliste ja jäneseliste hulka kuuluvad loomad ja nende kehaosad, välja arvatud 1. kategooria materjal, millele on osutatud määruse (EÜ) nr 1069/2009 artikli 8 punkti a alapunktides iii, iv ja v, ning 2. kategooria materjal, millele on osutatud kõnealuse määruse artikli 9 punktides a–g;] II.4 need on saadud ja valmistatud nii, et need ei ole kokku puutunud muu, määruse (EÜ) nr 1069/2009 nõuetele mittevastava materjaliga, ning käideldud viisil, mis hoiab ära saastumise haigusetekitajatega; II.5 need on pakendatud lõpp-pakendisse, millel on sildid kirjaga „TÖÖTLEMATA LEMMIKLOOMATOIT – MITTE INIMTOIDUKS“ või „LOOMSED KÕRVALSAADUSED KARUSLOOMADE SÖÖDAKS – MITTE INIMTOIDUKS“, ja seejärel pandud lekkekindlatesse ametliku plommiga kastidesse/mahutitesse või kasutamata lekkekindlatesse pakenditesse ja ametliku plommiga kastidesse/mahutitesse, millel on sildid kirjaga „TÖÖTLEMATA LEMMIKLOOMATOIT – MITTE INIMTOIDUKS“ või „LOOMSED KÕRVALSAADUSED KARUSLOOMADE SÖÖDAKS – MITTE INIMTOIDUKS“, sihtettevõtte nimi ja aadress; II.6 töötlemata lemmikloomatoidu puhul: a) on toode valmistatud ja ladustatud ettevõttes, mida pädev asutus on määruse (EÜ) nr 1069/2009 artikli 24 kohaselt tunnustanud ja mis on pädeva asutuse järelevalve all, ning b) on toode analüüsitud juhusliku valimi meetodil, kusjuures igast partiist võeti ladustamise ajal (enne lähetamist) vähemalt viis proovi, ning see vastab järgmistele standarditele (8):  Tekst pildi
Tekst pildi
RIIK Otsemüügiks ettenähtud töötlemata lemmikloomatoit või karusloomade söödana kasutatavad loomsed kõrvalsaadused II. Terviseteave II.a. Sertifikaadi viitenumber II.b. salmonella: puudub 25 grammis: n = 5, c = 0, m = 0, M = 0, enterobakterid: n = 5, c = 2, m = 10, M = 5000 1 grammis; (2) [II.7. lemmikloomatoit või eelkirjeldatud karusloomade söödana kasutatavad loomsed kõrvalsaadused sisaldavad mäletsejalistelt pärit loomseid kõrvalsaadusi või on nendest saadud ning: (2) kas [on pärit riigist või piirkonnast, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE riskiga riikide või piirkondade hulka ning kus ei ole esinenud algupäraseid BSE juhtumeid, ning]] (2) või [on pärit riigist või piirkonnast, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE riskiga riikide või piirkondade hulka, ning kus on esinenud algupäraseid BSE juhtumeid, ning loomne kõrvalsaadus või sellest saadud toode on saadud loomadelt, kes on sündinud pärast mäletsejalistelt saadud liha-kondijahu ja kõrnete (nagu need on määratletud OIE maismaaloomade tervise koodeksis) mäletsejalistele söötmise keelu jõustumise tegelikku kuupäeva asjaomases riigis või piirkonnas, ning]] (2) kas [on saadud muudelt mäletsejalistelt kui veised, lambad ja kitsed.] (2) või [on saadud veistelt, lammastelt ja kitsedelt ning ei sisalda järgmist materjali ega ole sellest saadud: (2) kas [veistelt, lammastelt või kitsedelt saadud materjal, v.a materjal, mis on saadud loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka.]] (2) või [a) Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 999/2001 (9) V lisa punktis 1 nimetatud määratletud riskiteguriga materjal; b) veiste, lammaste või kitsede kontidelt mehhaaniliselt eraldatud lihamass, välja arvatud sellistelt loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt komisjoni otsusele 2007/453/EÜ (10) liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka, kus ei ole esinenud algupäraseid BSE-juhtumeid; c) loomne kõrvalsaadus või toode on saadud veistelt, lammastelt või kitsedelt, kes on pärast uimastamist surmatud kesknärvisüsteemikudede vigastamise teel koljuõõnde viidava pika vardakujulise instrumendiga või koljuõõnde süstitud gaasiga, v.a juhul, kui kõnealused loomad on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE riskiga riikide või piirkondade hulka.]]] Märkused I osa — Lahter I.6: Euroopa Liidus saadetise eest vastutav isik: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist sertifikaadiga Euroopa Liidu kaudu transporditava transiitkauba kohta; Euroopa Liitu imporditava kauba kohta antava sertifikaadi puhul võib selle samuti täita. — Lahter I.12: Sihtkoht: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist transiitkauba kohta antava sertifikaadiga. Transiitkaupu võib ladustada üksnes vabatsoonis, vabalaos ja tollilaos. — Lahter I.15: tuleb esitada registreerimisnumber (raudteevagunid või -konteinerid ja veoautod), lennu number (lennuk) või nimi (laev). Maha- ja ümberlaadimise korral peab kauba saatja teavitama Euroopa Liidu piiripunkti. — Lahter I.19: kasutada vajalikku harmoneeritud süsteemi (HS) koodi järgmistes rubriikides: 04.08; 05.06; 05.08; 05.11, 23.01 või 23.09. — Lahter I.23: puistlastikonteinerite puhul tuleb lisada konteineri number ja plommi number (kui on). — Lahter I.25: Tehniline otstarve: muuks kui põllumajandusloomade (v.a karusloomad) söödaks, ning lemmikloomatoidu tootmiseks või valmistamiseks. — Lahtrid I.26 ja I.27: täita vastavalt sellele, kas tegemist on transiidiks või impordiks antava sertifikaadiga.  Tekst pildi
Tekst pildi
RIIK Otsemüügiks ettenähtud töötlemata lemmikloomatoit või karusloomade söödana kasutatavad loomsed kõrvalsaadused II. Terviseteave II.a. Sertifikaadi viitenumber II.b. — Lahter I.28: kauba liik: valida töötlemata lemmikloomatoit või loomne kõrvalsaadus. Kui tegemist on töötlemata lemmikloomatoidu valmistamiseks kasutatava toorainega, märkige liigi teaduslik nimetus. Kui tegemist on karusloomade sööda valmistamiseks kasutatava toorainega, valige üks järgmistest: Aves, Ruminantia, Suidae, Mammalia, v.a Ruminantia või Suidae, Pesca, Mollusca, Crustacea, selgrootud, v.a Mollusca ja Crustacea. II osa. (1a) ELT L 300, 14.11.2009, lk 1. (1b) ELT L 54, 26.2.2011, lk 1. (2) Mittevajalik läbi kriipsutada. (2a) ELT L 139, 30.4.2004, lk 55. (3) ELT L 73, 20.3.2010, lk 1. (4) ELT L 226, 23.8.2008, lk 1. (5) ELT L 39, 10.2.2009, lk 12. (6) ELT L 303, 18.11.2009, lk 1. (7) ELT L 320, 18.11.2006, lk 53. (8) Kus: n = analüüsitavate proovide arv; m = bakterite arvu väärtuslävi; tulemus on rahuldav, kui bakterite arv kogu valimis ei ületa näitajat m; M = bakterite arvu maksimumväärtus; tulemus on ebarahuldav, kui bakterite arv ühes või mitmes proovis on võrdne näitajaga M või sellest suurem; ning c = nende proovide arv, milles bakterite arv võib jääda näitajate m ja M vahele; proov on siiski rahuldav, kui teiste proovide bakterite arv on võrdne näitajaga m või sellest väiksem. (9) EÜT L 147, 31.5.2001, lk 1. (10) ELT L 172, 30.6.2007, lk 84. — Allkirja ja templi värv peavad erinema teksti värvist. — Märkus Euroopa Liidus saadetise eest vastutavale isikule: käesolev sertifikaat on ette nähtud üksnes veterinaarotstarbeks ning peab partiiga kaasas olema kuni kõnealuse partii jõudmiseni Euroopa Liidu piiripunkti. Veterinaarjärelevalve ametnik/inspektor Nimi (trükitähtedega): Kvalifikatsioon ja ametinimetus: Kuupäev: Allkiri: Tempel: 3. PEATÜKK, E OSA Tervisesertifikaat lemmikloomatoidu valmistamisel kasutatavate lõhna- ja maitsetugevdajate kohta, mis on ette nähtud lähetamiseks Euroopa Liitu või transiidiks (2) Euroopa Liidu kaudu 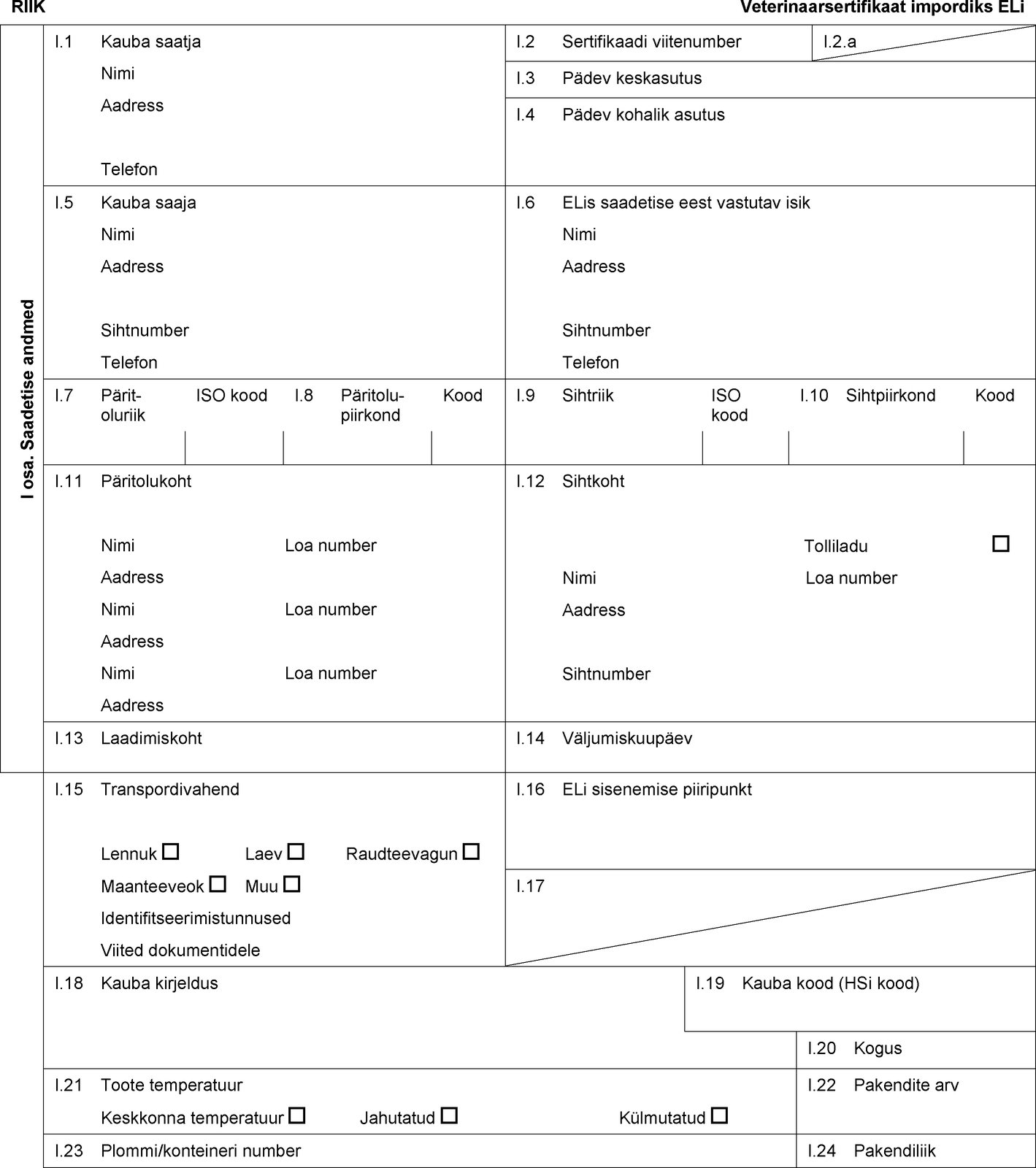 Tekst pildi
Tekst pildi
RIIK Veterinaarsertifikaat impordiks ELi I osa. Saadetise andmed I.1 Kauba saatja Nimi Aadress Telefon I.2 Sertifikaadi viitenumber I.2.a I.3 Pädev keskasutus I.4 Pädev kohalik asutus I.5 Kauba saaja Nimi Aadress Sihtnumber Telefon I.6 ELis saadetise eest vastutav isik Nimi Aadress Sihtnumber Telefon I.7 Pärit-oluriik ISO kood I.8 Päritolu-piirkond Kood I.9 Sihtriik ISO kood I.10 Sihtpiirkond Kood I.11 Päritolukoht Nimi Loa number Aadress Nimi Loa number Aadress Nimi Loa number Aadress I.12 Sihtkoht Tolliladu Nimi Loa number Aadress Sihtnumber I.13 Laadimiskoht I.14 Väljumiskuupäev I.15 Transpordivahend Lennuk Laev Raudteevagun Maanteeveok Muu Identifitseerimistunnused Viited dokumentidele I.16 ELi sisenemise piiripunkt I.17 I.18 Kauba kirjeldus I.19 Kauba kood (HSi kood) I.20 Kogus I.21 Toote temperatuur Keskkonna temperatuur Jahutatud Külmutatud I.22 Pakendite arv I.23 Plommi/konteineri number I.24 Pakendiliik 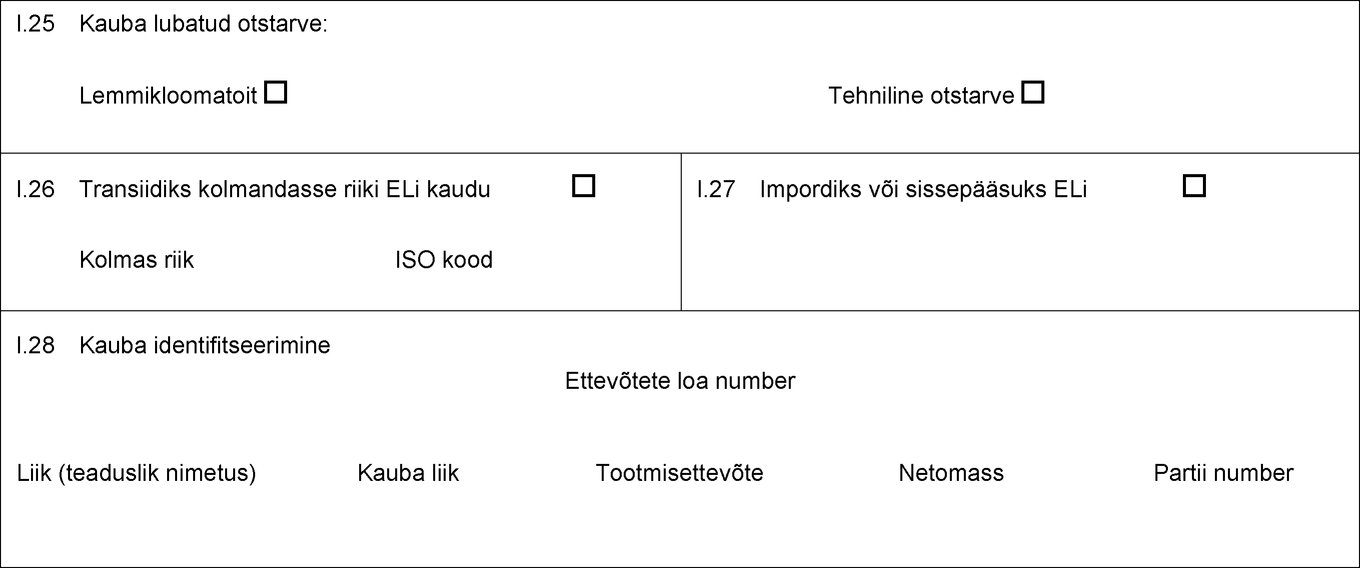 Tekst pildi
Tekst pildi
I.25 Kauba lubatud otstarve: Lemmikloomatoit Tehniline otstarve I.26 Transiidiks kolmandasse riiki ELi kaudu Kolmas riik ISO kood I.27 Impordiks või sissepääsuks ELi I.28 Kauba identifitseerimine Ettevõtete loa number Liik (teaduslik nimetus) Kauba liik Tootmisettevõte Netomass Partii number  Tekst pildi
Tekst pildi
RIIK Lemmikloomatoidu valmistamisel kasutatavad lõhna- ja maitsetugevdajad II. Terviseteave II.a. Sertifikaadi viitenumber II.b. Mina, allakirjutanud veterinaarjärelevalve ametnik, teatan, et olen lugenud ja mõistan Euroopa Parlamendi ja nõukogu määrust (EÜ) nr 1069/2009 (1a), eelkõige selle artikleid 8 ja 10, ning komisjoni määrust (EL) nr 142/2011 (1b), eelkõige selle XIII lisa III peatükki ja XIV lisa II peatükki, ning seoses eelkirjeldatud lõhna- ja maitsetugevdajatega kinnitan järgmist: II.1 tegemist on loomsete kõrvalsaadustega, mis vastavad alljärgnevatele loomatervisenõuetele; II.2 nende valmistamisel on kasutatud üksnes järgmisi loomseid kõrvalsaadusi: (2) kas [- tapetud loomade rümbad ja loomade kehaosad või tapetud ulukite kehad või kehaosad, mis on kõlblikud inimtoiduks vastavalt Euroopa Liidu õigusaktidele, kuid mis ei ole ärilistel kaalutlustel inimtoiduks ette nähtud;] (2) ja/või [- rümbad ja järgmised kehaosad tapamajas tapetud loomadelt, kes tunnistati tapaeelse kontrolli põhjal inimtoiduks tapmiseks kõlblikuks, või kehad ja järgmised kehaosad ulukitelt, kes tapeti inimtoiduna kasutamiseks vastavalt Euroopa Liidu õigusaktidele: i) loomade rümbad või kehad ja kehaosad, mis on tunnistatud inimtoiduks kõlbmatuks vastavalt Euroopa Liidu õigusaktidele, kuid millel ei ole ilmnenud mingeid inimestele või loomadele nakkava haiguse nähte; ii) kodulindude pead; iii) loomade toornahad ja nahad, kaasa arvatud nahalõiked ja -jäägid, sarved ja jalad, kaasa arvatud randme- ja kämblaluud, pöiad, pöiapärad ja varbalülid; iv) seaharjased; v) suled;] (2) ja/või [- veri tapamajas tapetud loomadelt, kellel ei ole ilmnenud mingeid vere kaudu inimestele või loomadele nakkava haiguse nähte ja kes tunnistati tapaeelsel ülevaatusel inimtoiduks kõlblikuks vastavalt Euroopa Liidu õigusaktidele;] (2) ja/või [- loomsed kõrvalsaadused, mis on tekkinud inimtoiduks ette nähtud toodete valmistamisel, sealhulgas rasvatustatud kondid, kõrned ning piima töötlemisel tekkinud tsentrifuugimis- või separeerimissete; ] (2) ja/või [- loomsed tooted või loomseid tooteid sisaldav toit, mis ei ole enam ette nähtud inimtoiduks kas ärilistel kaalutlustel, tootmis- või pakendamisdefektide või muude puuduste tõttu, mis ei ohusta inimeste ega loomade tervist;] (2) ja/või [- loomne lemmikloomatoit ja sööt või loomseid kõrvalsaadusi või nendest saadud tooteid sisaldav sööt, mis ei ole enam ette nähtud söödana kasutamiseks kas ärilistel kaalutlustel, tootmis- või pakendamisdefektide või muude puuduste tõttu, mis ei ohusta inimeste ega loomade tervist;] (2) ja/või [- veri, platsenta, vill, suled, karvad, sarved, kabja- ja sõralõikmed ning toorpiim elusloomadelt, kellel ei ole ilmnenud mingite asjaomase toote kaudu inimestele või loomadele nakkava haiguse nähte;] (2) ja/või [- veeloomad (v.a mereimetajad) ja nende kehaosad, millel ei ole ilmnenud mingeid inimestele või loomadele nakkavate haiguste nähte;] (2) ja/või [- kõrvalsaadused veeloomadest, mis on saadud ettevõtetest, kus valmistatakse inimtoiduks ettenähtud tooteid;] (2) ja/või [- järgmine materjal loomadelt, kel ei ole ilmnenud sellise materjali kaudu inimestele või loomadele nakkava haiguse nähte: i) pehme koe või lihaga karpide või koorikloomade kojad või koorikud; II osa. Sertifitseerimine  Tekst pildi
Tekst pildi
RIIK Lemmikloomatoidu valmistamisel kasutatavad lõhna- ja maitsetugevdajad II. Terviseteave II.a. Sertifikaadi viitenumber II.b. ii) järgmine maismaaloomadelt pärinev materjal: – kõrvalsaadused haudejaamadest, – munad, – munade kõrvalsaadused, sh munakoored; iii) ärilisel eesmärgil tapetud ööpäevased tibud;] (2) ja/või [- kõrvalsaadused selgrootutest vee- või maismaaloomadest, kes ei kuulu inimestele või loomadele patogeensete liikide hulka;] (2) ja/või [- näriliste ja jäneseliste hulka kuuluvad loomad ja nende kehaosad, välja arvatud 1. kategooria materjal, millele on osutatud määruse (EÜ) nr 1069/2009 artikli 8 punkti a alapunktides iii, iv ja v, ning 2. kategooria materjal, millele on osutatud kõnealuse määruse artikli 9 punktides a–g;] (2) ja/või [- sellistest loomadest saadud materjal, kelle puhul on kasutatud teatavaid nõukogu direktiiviga 96/22/EÜ (2a) keelatud aineid, kusjuures kõnealuse materjali import on määruse (EÜ) nr 1069/2009 artikli 35 punkti a alapunkti ii kohaselt lubatud;] II.3 neid on haigusetekitajate hävitamiseks töödeldud vastavalt määruse (EL) nr 142/2011 XIII lisa III peatükile; II.4 on analüüsitud juhusliku valimi meetodil, kusjuures igast töödeldud partiist võeti töötlemisettevõttes ladustamise ajal või pärast seda vähemalt viis proovi, ning vastab järgmistele standarditele (3): salmonella: puudub 25 grammis: n = 5, c = 0, m = 0, M = 0, enterobakterid: n = 5, c = 2, m = 10, M = 300 1 grammis; II.5 lõpptoode: (2) kas [pakendati kasutamata või steriliseeritud kottidesse,] (2) või [transporditi puistlastina mahutites või muudes transpordivahendites, mida puhastati ja desinfitseeriti enne kasutamist põhjalikult pädeva asutuse heaks kiidetud desinfektsioonivahendiga,] millel on sildid kirjaga „MITTE INIMTOIDUKS“; II.6 lõpptoodet ladustati suletud ruumides; II.7 toote puhul on võetud kõik ettevaatusabinõud, et vältida haigusetekitajatega saastumist töötlemise järel; (2) [II.8. eelkirjeldatud lõhna- ja maitsetugevdajad (2) kas [on saadud muudelt mäletsejalistelt kui veised, lambad ja kitsed.]] (2) või [on saadud veistelt, lammastelt ja kitsedelt ning ei sisalda järgmist materjali ega ole sellest saadud: (2) kas [veistelt, lammastelt või kitsedelt saadud materjal, v.a materjal, mis on saadud loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka.]] (2) või [a) Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 999/2001 (4) V lisa punktis 1 nimetatud määratletud riskiteguriga materjal; b) veiste, lammaste või kitsede kontidelt mehhaaniliselt eraldatud lihamass, välja arvatud sellistelt loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt komisjoni otsusele 2007/453/EÜ (5) liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka, kus ei ole esinenud algupäraseid BSE-juhtumeid; c) loomne kõrvalsaadus või toode on saadud veistelt, lammastelt või kitsedelt, kes on pärast uimastamist surmatud kesknärvisüsteemikudede vigastamise teel koljuõõnde viidava pika vardakujulise instrumendiga või koljuõõnde süstitud gaasiga, v.a juhul, kui kõnealused loomad on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE riskiga riikide või piirkondade hulka.]]]  Tekst pildi
Tekst pildi
RIIK Lemmikloomatoidu valmistamisel kasutatavad lõhna- ja maitsetugevdajad II. Terviseteave II.a. Sertifikaadi viitenumber II.b. Märkused I osa — Lahter I.6: Euroopa Liidus saadetise eest vastutav isik: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist sertifikaadiga Euroopa Liidu kaudu transporditava transiitkauba kohta; Euroopa Liitu imporditava kauba kohta antava sertifikaadi puhul võib selle samuti täita. — Lahter I.12: Sihtkoht: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist transiitkauba kohta antava sertifikaadiga. Transiitkaupu võib ladustada üksnes vabatsoonis, vabalaos ja tollilaos. — Lahter I.15: registreerimisnumber (raudteevagunid või -konteinerid ja veoautod), lennu number (lennuk) või nimi (laev); teave tuleb esitada Euroopa Liidus maha- ja ümberlaadimise korral. — Lahter I.19: kasutada asjakohast HSi koodi: 05.04; 05.06, 05.11 või 23.09. — Lahter I.23: puistlastikonteinerite puhul tuleb lisada konteineri number ja plommi number (kui on). — Lahter I.25: Tehniline otstarve: muuks kui põllumajandusloomade (v.a karusloomad) söödaks, ning lemmikloomatoidu tootmiseks või valmistamiseks. — Lahtrid I.26 ja I.27: täita vastavalt sellele, kas tegemist on transiidiks või impordiks antava sertifikaadiga. — Lahter I.28: — Liik: valida üks järgmistest: Aves, Ruminantia, Suidae, Mammalia, v.a Ruminantia või Suidae, Pesca, Mollusca, Crustacea, selgrootud, v.a Mollusca ja Crustacea — määratleda lõhna-/maitsetugevdustoode. II osa. (1a) ELT L 300, 14.11.2009, lk 1. (1b) ELT L 54, 26.2.2011, lk 1. (2) Mittevajalik läbi kriipsutada. (2a) EÜT L 125, 23.5.1996, lk 3. (3) Kus: n = analüüsitavate proovide arv; m = bakterite arvu väärtuslävi; tulemus on rahuldav, kui bakterite arv kogu valimis ei ületa näitajat m; M = bakterite arvu maksimumväärtus; tulemus on ebarahuldav, kui bakterite arv ühes või mitmes proovis on võrdne näitajaga M või sellest suurem; ning c = nende proovide arv, milles bakterite arv võib jääda näitajate m ja M vahele; proov on siiski rahuldav, kui teiste proovide bakterite arv on võrdne näitajaga m või sellest väiksem. (4) EÜT L 147, 31.5.2001, lk 1. (5) ELT L 172, 30.6.2007, lk 84. — Allkirja ja templi värv peavad erinema teksti värvist. — Märkus Euroopa Liidus saadetise eest vastutavale isikule: käesolev sertifikaat on ette nähtud üksnes veterinaarotstarbeks ning peab partiiga kaasas olema kuni kõnealuse partii jõudmiseni piiripunkti. Veterinaarjärelevalve ametnik/inspektor Nimi (trükitähtedega): Kvalifikatsioon ja ametinimetus: Kuupäev: Allkiri: Tempel: 3. PEATÜKK, F OSA Tervisesertifikaat lemmikloomatoidu valmistamisel kasutatavate loomsete kõrvalsaaduste (3) kohta, mis on ette nähtud lähetamiseks Euroopa Liitu või transiidiks (2) Euroopa Liidu kaudu  Tekst pildi
Tekst pildi
RIIK Veterinaarsertifikaat impordiks ELi I osa. Saadetise andmed I.1 Kauba saatja Nimi Aadress Telefon I.2 Sertifikaadi viitenumber I.2.a I.3 Pädev keskasutus I.4 Pädev kohalik asutus I.5 Kauba saaja Nimi Aadress Sihtnumber Telefon I.6 ELis saadetise eest vastutav isik Nimi Aadress Sihtnumber Telefon I.7 Pärit-oluriik ISO kood I.8 Päritolu-piirkond Kood I.9 Sihtriik ISO kood I.10 Sihtpiirkond Kood I.11 Päritolukoht Nimi Loa number Aadress Nimi Loa number Aadress Nimi Loa number Aadress I.12 Sihtkoht Tolliladu Nimi Loa number Aadress Sihtnumber I.13 Laadimiskoht I.14 Väljumiskuupäev I.15 Transpordivahend Lennuk Laev Raudteevagun Maanteeveok Muu Identifitseerimistunnused Viited dokumentidele I.16 ELi sisenemise piiripunkt I.17 I.18 Kauba kirjeldus I.19 Kauba kood (HSi kood) I.20 Kogus I.21 Toote temperatuur Keskkonna temperatuur Jahutatud Külmutatud I.22 Pakendite arv I.23 Plommi/konteineri number I.24 Pakendiliik 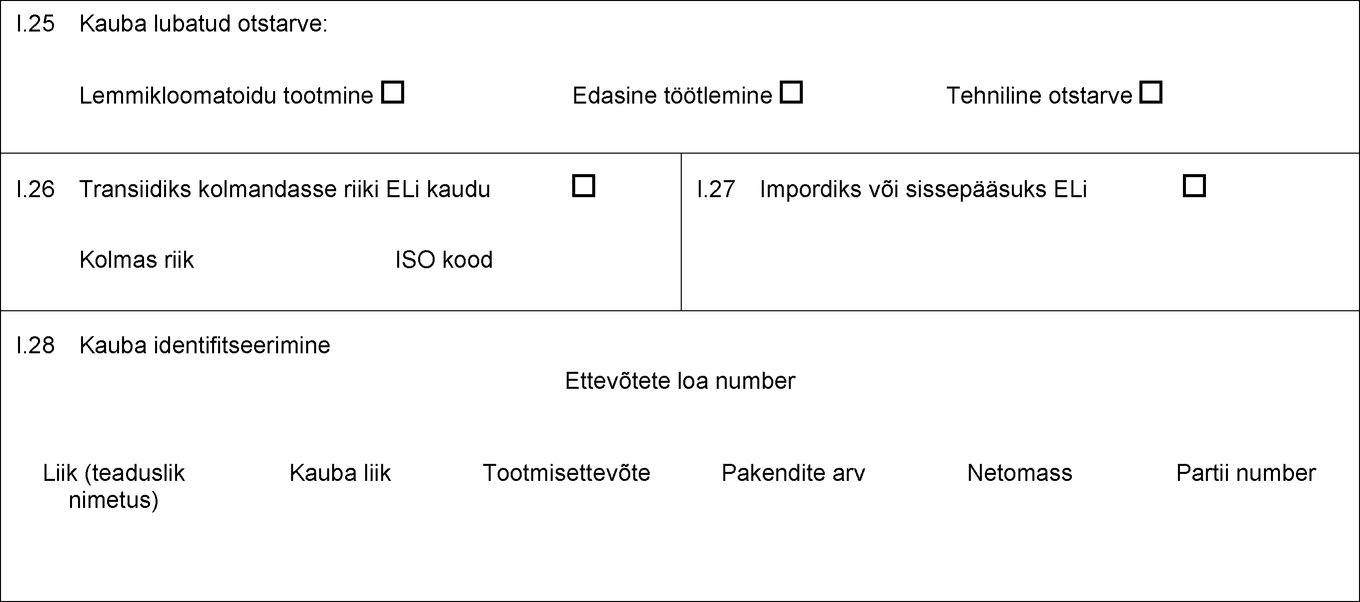 Tekst pildi
Tekst pildi
I.25 Kauba lubatud otstarve: Lemmikloomatoidu tootmine Edasine töötlemine Tehniline otstarve I.26 Transiidiks kolmandasse riiki ELi kaudu Kolmas riik ISO kood I.27 Impordiks või sissepääsuks ELi I.28 Kauba identifitseerimine Ettevõtete loa number Liik (teaduslik nimetus) Kauba liik Tootmisettevõte Pakendite arv Netomass Partii number  Tekst pildi
Tekst pildi
RIIK Lemmikloomatoidu valmistamisel kasutatavad loomsed kõrvalsaadused II. Terviseteave II.a. Sertifikaadi viitenumber II.b. Mina, allakirjutanud veterinaarjärelevalve ametnik, teatan, et olen lugenud ja mõistan Euroopa Parlamendi ja nõukogu määrust (EÜ) nr 1069/2009 (1a) ning komisjoni määrust (EL) nr 142/2011 (1b), eelkõige selle XIV lisa II peatükki, ning kinnitan seoses eelkirjeldatud loomsete kõrvalsaadustega järgmist: II.1.1 tegemist on loomsete kõrvalsaadustega, mis vastavad alljärgnevatele loomatervisenõuetele; II.1.2 need on saadud: (1c) territooriumil loomadelt, kes (2) kas [a) on olnud sellel territooriumil sünnist saadik või vähemalt kolm kuud enne tapa- või tootmiskuupäeva;] (2) või [b) on tapetud sellel territooriumil vabas looduses (1d);] (2) või [c) on saadud närilistest, jäneselistest, veeloomadest või maismaa- või veeselgrootutest;] II.1.3 need on saadud või toodetud loomadest: (2) kas [a) kes on pärit põllumajandusettevõttest: i) kus ei ole olnud järgmiste haiguste juhtumeid/puhanguid, millele asjaomased loomad on vastuvõtlikud: veiste katku, sigade vesikulaarhaigust, Newcastle’i haigust ega kõrge patogeensusega linnugrippi eelneva 30-päevase ajavahemiku jooksul ning sigade katku ega sigade Aafrika katku eelneva 40-päevase ajavahemiku jooksul; samuti ei ole neid haigusi eelneva 30-päevase ajavahemiku jooksul esinenud 10 km raadiuses asuvates põllumajandusettevõtetes, ning ii) kus ei ole olnud suu- ja sõrataudi juhtumeid/puhanguid eelneva 60-päevase ajavahemiku jooksul; samuti ei ole seda haigust esinenud 25 km raadiuses asuvates põllumajandusettevõtetes eelneva 30-päevase ajavahemiku jooksul, ning b) kes: i) ei ole hukatud mõne epizootilise haiguse likvideerimiseks; ii) olid päritoluettevõttes vähemalt 40-päevase ajavahemiku jooksul enne lähetamise kuupäeva ja transporditi otse tapamajja, ilma et nad oleksid kokku puutunud muude loomadega, kes ei vasta samadele tervishoiunõuetele; iii) läbisid tapamajas 24 tunni pikkuse ajavahemiku jooksul enne tapmist tapaeelse veterinaarkontrolli ning neil ei ilmnenud selliste eelnimetatud haiguste tunnuseid, millele loomad on vastuvõtlikud; ning iv) on saadud loomadelt, keda on tapamajas enne tapmist või surmamist ja selle ajal koheldud kooskõlas liidu õigusaktidega ning nad vastasid vähemalt nõukogu määruse (EÜ) nr 1099/2009 (4) II ja III peatükis sätestatud nõuetele] (2) või [a) kes püüti kinni ja tapeti vabas looduses piirkonnas, i) mille ümber 25 km raadiuses ei ole esinenud ühegi alljärgneva haiguse juhtumit/puhangut, millele asjaomased loomad on vastuvõtlikud: suu- ja sõrataudi, veiste katku, Newcastle’i haigust ega kõrge patogeensusega linnugrippi eelneva 30-päevase ajavahemiku jooksul ning sigade katku ega sigade Aafrika katku eelneva 40-päevase ajavahemiku jooksul; ning ii) mis asub enam kui 20 km kaugusel sellise riigi või riigi osa territooriumi piirist, kust ei ole lubatud Euroopa Liitu eksportida kodulindudest saadud materjali eelneva 30-päevase ajavahemiku jooksul või sigadest saadud materjali eelneva 40-päevase ajavahemiku jooksul; ning b) kes pärast tapmist transporditi 12 tunnise ajavahemiku jooksul jahutamisele kas kõigepealt kogumiskeskusesse ja vahetult pärast seda ulukiliha töötlevasse ettevõttesse või otse ulukiliha töötlevasse ettevõttesse;] II osa. Sertifitseerimine  Tekst pildi
Tekst pildi
RIIK Lemmikloomatoidu valmistamisel kasutatavad loomsed kõrvalsaadused II. Terviseteave II.a. Sertifikaadi viitenumber II.b. II.1.4 need on saadud ettevõttest, mille ümber 10 km raadiuses ei ole eelneva 30-päevase ajavahemiku jooksul olnud punktis II.1.3 osutatud selliste haiguste juhtumeid/puhanguid, millele asjaomased loomad on vastuvõtlikud, või kui haigusjuhtum on esinenud, siis on luba töödelda toormaterjali Euroopa Liitu eksportimiseks antud alles pärast seda, kui kogu liha on ettevõttest kõrvaldatud ja ettevõte on veterinaarjärelevalve ametniku järelevalve all täielikult puhastatud ja desinfitseeritud; II.1.5 need on saadud ja valmistatud nii, et need ei ole kokku puutunud muu, eelnimetatud nõuetele mittevastava materjaliga, ning käideldud viisil, mis hoiab ära saastumise haigusetekitajatega; II.1.6 need on pakendatud kasutamata lekkekindlatesse pakenditesse ja ametliku plommiga mahutitesse, millel on silt kirjaga „TOORAINE – ÜKSNES LEMMIKLOOMATOIDU VALMISTAMISEKS“, ELis asuva sihtettevõtte nimi ja aadress; II.1.7 need koosnevad ainult järgmistest loomsetest kõrvalsaadustest: (2) kas [- tapetud loomade rümbad ja loomade kehaosad või tapetud ulukite kehad või kehaosad, mida peetakse inimtoiduks kõlblikuks vastavalt Euroopa Liidu õigusaktidele, kuid mis on ärilistel kaalutustel sellele vastupidiselt deklareeritud loomsete kõrvalsaadustena;] (2) ja/või [- rümbad ja järgmised kehaosad tapamajas tapetud loomadelt, kes tunnistati tapaeelse kontrolli põhjal inimtoiduks tapmiseks kõlblikuks, või kehad ja järgmised kehaosad ulukitelt, kes tapeti inimtoiduna kasutamiseks vastavalt Euroopa Liidu õigusaktidele: i) loomade rümbad või kehad ja kehaosad, mis on tunnistatud inimtoiduks kõlbmatuks vastavalt Euroopa Liidu õigusaktidele, kuid millel ei ole ilmnenud mingeid inimestele või loomadele nakkava haiguse nähte; ii) kodulindude pead; iii) loomade toornahad ja nahad, kaasa arvatud nahalõiked ja -jäägid, sarved ja jalad, kaasa arvatud randme- ja kämblaluud, pöiad, pöiapärad ja varbalülid; iv) seaharjased; v) suled;] (2) ja/või [- loomsed kõrvalsaadused, mis on tekkinud inimtoiduks ette nähtud toodete valmistamisel, sealhulgas rasvatustatud kondid, kõrned ning piima töötlemisel tekkinud tsentrifuugimis- või separeerimissete;] (2) ja/või [- loomsed tooted või loomseid tooteid sisaldav toit, mis ei ole enam ette nähtud inimtoiduks kas ärilistel kaalutlustel, tootmis- või pakendamisdefektide või muude puuduste tõttu, mis ei ohusta inimeste ega loomade tervist;] (2) ja/või [- veeloomad (v.a mereimetajad) ja nende kehaosad, millel ei ole ilmnenud mingeid inimestele või loomadele nakkavate haiguste nähte;] (2) ja/või [- kõrvalsaadused veeloomadest, mis on saadud ettevõtetest, kus valmistatakse inimtoiduks ettenähtud tooteid;] (2) ja/või [- järgmine materjal loomadelt, kel ei ole ilmnenud sellise materjali kaudu inimestele või loomadele nakkava haiguse nähte: i) pehme koe või lihaga karpide või koorikloomade kojad või koorikud; ii) järgmine maismaaloomadelt pärinev materjal: — kõrvalsaadused haudejaamadest, — munad, — munade kõrvalsaadused, sh munakoored;  Tekst pildi
Tekst pildi
RIIK Lemmikloomatoidu valmistamisel kasutatavad loomsed kõrvalsaadused II. Terviseteave II.a. Sertifikaadi viitenumber II.b. iii) ärilisel eesmärgil tapetud ööpäevased tibud;] (2) ja/või [- kõrvalsaadused selgrootutest vee- või maismaaloomadest, kes ei kuulu inimestele või loomadele patogeensete liikide hulka;] (2) ja/või [- näriliste ja jäneseliste hulka kuuluvad loomad ja nende kehaosad, välja arvatud 1. kategooria materjal, millele on osutatud määruse (EÜ) nr 1069/2009 artikli 8 punkti a alapunktides iii, iv ja v, ning 2. kategooria materjal, millele on osutatud kõnealuse määruse artikli 9 punktides a–g;] (2) ja/või [- sellistest loomadest saadud materjal, kelle puhul on kasutatud teatavaid nõukogu direktiiviga 96/22/EÜ (4a) keelatud aineid, kusjuures kõnealuse materjali import on määruse (EÜ) nr 1069/2009 artikli 35 punkti a alapunkti ii kohaselt lubatud;] II.1.8 neid on päritoluettevõttes kooskõlas Euroopa Liidu õigusaktidega sügavkülmutatud või säilitatud viisil, mis hoiab ära riknemise Euroopa Liidus asuvasse sihtettevõttesse lähetamise ja tarnimise vahelisel ajal või transiidiks Euroopa Liidu kaudu; II.1.9 lemmikloomatoidu valmistamiseks kasutatava tooraine puhul, mis on saadud loomadest, kelle puhul on kasutatud teatavaid direktiiviga 96/22/EÜ keelatud aineid, on kõnealuse materjali import määruse (EÜ) nr 1069/2009 artikli 35 punkti a alapunkti ii kohaselt lubatud, a) on tooraine kolmandas riigis enne Euroopa Liidu territooriumile sisenemist märgistatud selliselt, et iga külmutatud ploki igale välisküljele või – kui toorainet transporditakse kaubaalustel, mis ei ole Euroopa Liidus asuvasse lemmikloomatoitu valmistavasse sihtettevõttesse transportimisel või transiidiks Euroopa Liidu kaudu eraldi saadetistesse jagatud – iga kaubaaluse igale välisküljele on aktiivsöesuspensiooniga või aktiivsöega tehtud rist, mis katab vähemalt 70 % külmutatud ploki diagonaali pikkusest ja on vähemalt 10 cm lai; b) on külmutamata materjal kolmandas riigis enne Euroopa Liidu territooriumile sisenemist märgistatud pihustatava aktiivsöesuspensiooniga või söepulbriga selliselt, et süsi on materjalil selgelt näha; ning c) kui loomsed kõrvalsaadused koosnevad eespool osutatud viisil töödeldud toorainest ja muust töötlemata toorainest, on kogu tooraine märgistatud vastavalt punktides a ja b osutatule. (2) (5) [II.2. Erinõuded (2) (6) [II.2.1. käesolevas saadetises sisalduvad kõrvalsaadused on pärit loomadelt, keda on peetud punktis II.1.2. osutatud territooriumil, kus korraldatakse ametliku järelevalve all korrapäraseid koduveiste suu- ja sõrataudi vastaseid vaktsineerimisprogramme.] (2) (7) [II.2.2. käesolevas saadetises sisalduvad kõrvalsaadused koosnevad üksnes kodumäletsejaliste trimmitud rupsist saadud loomsetest kõrvalsaadustest, mis on laagerdunud keskkonna temperatuuril üle +2 °C vähemalt kolmetunnise ajavahemiku jooksul, või veiste mälumislihaste ja koduloomade konditustatud liha puhul vähemalt 24-tunnise ajavahemiku jooksul.]] (2) [II.3. lemmikloomatoidu valmistamiseks kasutatavad loomsed kõrvalsaadused sisaldavad mäletsejalistelt pärit loomseid kõrvalsaadusi või on nendest saadud ning: (2) kas [on pärit riigist või piirkonnast, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE riskiga riikide või piirkondade hulka ning kus ei ole esinenud algupäraseid BSE juhtumeid, ning]] (2) või [on pärit riigist või piirkonnast, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE riskiga riikide või piirkondade hulka, ning kus on esinenud algupäraseid BSE juhtumeid, ning loomne kõrvalsaadus või sellest saadud toode on saadud loomadelt, kes on sündinud pärast mäletsejalistelt saadud liha-kondijahu ja kõrnete (nagu need on määratletud OIE maismaaloomade tervise koodeksis) mäletsejalistele söötmise keelu jõustumise tegelikku kuupäeva asjaomases riigis või piirkonnas, ning]] (2) kas [on saadud muudelt mäletsejalistelt kui veised, lambad ja kitsed.]  Tekst pildi
Tekst pildi
RIIK Lemmikloomatoidu valmistamisel kasutatavad loomsed kõrvalsaadused II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (2) või [on saadud veistelt, lammastelt ja kitsedelt ning ei sisalda järgmist materjali ega ole sellest saadud: (2) kas [veistelt, lammastelt või kitsedelt saadud materjal, v.a materjal, mis on saadud loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka.]]] (2) või [a) Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 999/2001 (8) V lisa punktis 1 nimetatud määratletud riskiteguriga materjal; b) veiste, lammaste või kitsede kontidelt mehhaaniliselt eraldatud lihamass, välja arvatud sellistelt loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt komisjoni otsusele 2007/453/EÜ (9) liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka, kus ei ole esinenud algupäraseid BSE-juhtumeid; c) loomne kõrvalsaadus või toode on saadud veistelt, lammastelt või kitsedelt, kes on pärast uimastamist surmatud kesknärvisüsteemikudede vigastamise teel koljuõõnde viidava pika vardakujulise instrumendiga või koljuõõnde süstitud gaasiga, v.a juhul, kui kõnealused loomad on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE riskiga riikide või piirkondade hulka.]]] Märkused I osa — Lahter I.6: Euroopa Liidus saadetise eest vastutav isik: selle lahtri täitmine on kohustuslik ainult juhul, kui tegemist on transiitkauba kohta antava sertifikaadiga; Euroopa Liitu imporditava kauba kohta antava sertifikaadi puhul võib selle samuti täita. — Lahter I.12: Sihtkoht: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist transiitkauba sertifikaadiga. Transiitkaupu võib ladustada üksnes vabatsoonis, vabalaos ja tollilaos. — Lahter I.15: registreerimisnumber (raudteevagunid või -konteinerid ja veoautod), lennu number (lennuk) või nimi (laev); teave tuleb esitada Euroopa Liidus maha- ja ümberlaadimise korral. — Lahter I.19: kasutada asjakohast HSi koodi: 05.04; 05.06; 05.07; 05.11.91 või 05.11.99; 23.01; 41.01. — Lahter I.23: puistlastikonteinerite puhul tuleb lisada konteineri number ja plommi number (kui on). — Lahter I.25: Tehniline otstarve: muuks kui põllumajandusloomade (v.a karusloomad) söödaks, ning lemmikloomatoidu tootmiseks või valmistamiseks. — Lahtrid I.26 ja I.27: täita vastavalt sellele, kas tegemist on transiidiks või impordiks antava sertifikaadiga. — Lahter I.28: — Liik: valida üks järgmistest: Aves, Ruminantia, Suidae, Mammalia, v.a Ruminantia või Suidae, Pesca, Mollusca, Crustacea, selgrootud, v.a Mollusca ja Crustacea; — Tootmisettevõte: märkida tunnustatud ettevõtte veterinaarloa number. II osa (1a) ELT L 300, 14.11.2009, lk 1. (1b) ELT L 54, 26.2.2011, lk 1.  Tekst pildi
Tekst pildi
RIIK Lemmikloomatoidu valmistamisel kasutatavad loomsed kõrvalsaadused II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (1c) Eksportiva riigi nimi ja ISO kood, mis on sätestatud — määruse (EL) nr 206/2010 II lisa 1. osas; — määruse (EL) nr 798/2008 I lisa 1. osas ja — määruse (EL) nr 119/2009 I lisa 1. osas. Peale selle tuleb märkida ISO kood eespool nimetatud lisades viidatud piirkondadeks jaotamise alusel (kui see on asjaomaste vastuvõtlike loomaliikide puhul kohaldatav). (1d) Ainult selliste riikide puhul, millest on lubatud Euroopa Liitu importida inimtoiduks ettenähtud samade ulukiliikide liha. (2) Mittevajalik läbi kriipsutada. (3) Välja arvatud töötlemata veri, toorpiim, toornahad, kabjad, sõrad ja sarved, seaharjased ja suled (vt kõnealuses lisas asjakohaseid erisertifikaate nende toodete importimiseks). (4) ELT L 303, 18.11.2009, lk 1. (4a) EÜT L 125, 23.5.1996, lk 3. (5) Lisakinnitused tuleb anda, kui kodumäletsejalistest saadud materjal on pärit Lõuna-Ameerika või Lõuna-Aafrika riikidest või nende osadest, kust on Euroopa Liitu lubatud eksportida üksnes kodumäletsejaliste laagerdunud ja konditustatud värsket liha, mis on ette nähtud inimtoiduks. Lubatud on ka veiste terviklikud mälumislihased, millesse on tehtud sisselõiked vastavalt Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 854/2004 I lisa IV jao I peatüki osale B.1 (ELT L 139, 30.4.2004, lk 206). (6) Ainult teatavate Lõuna-Ameerika riikide puhul. (7) Ainult teatavate Lõuna-Ameerika ja Lõuna-Aafrika riikide puhul. (8) EÜT L 147, 31.5.2001, lk 1. (9) ELT L 172, 30.6.2007, lk 84. — Allkirja ja templi värv peavad erinema teksti värvist. — Märkus Euroopa Liidus saadetise eest vastutavale isikule: käesolev sertifikaat on ette nähtud üksnes veterinaarotstarbeks ning peab partiiga kaasas olema kuni kõnealuse partii jõudmiseni Euroopa Liidu piiripunkti. Veterinaarjärelevalve ametnik/inspektor Nimi (trükitähtedega): Kvalifikatsioon ja ametinimetus: Kuupäev: Allkiri: Tempel: |
|
2) |
4. peatüki B osa kuni 4. peatüki F osa asendatakse järgmisega: „4. PEATÜKK, B OSA Tervisesertifikaat muuks otstarbeks kui inimtoiduks ettenähtud veretoodete kohta, mida võidakse kasutada söödamaterjalina ja mis on ette nähtud lähetamiseks Euroopa Liitu või transiidiks (2) Euroopa Liidu kaudu 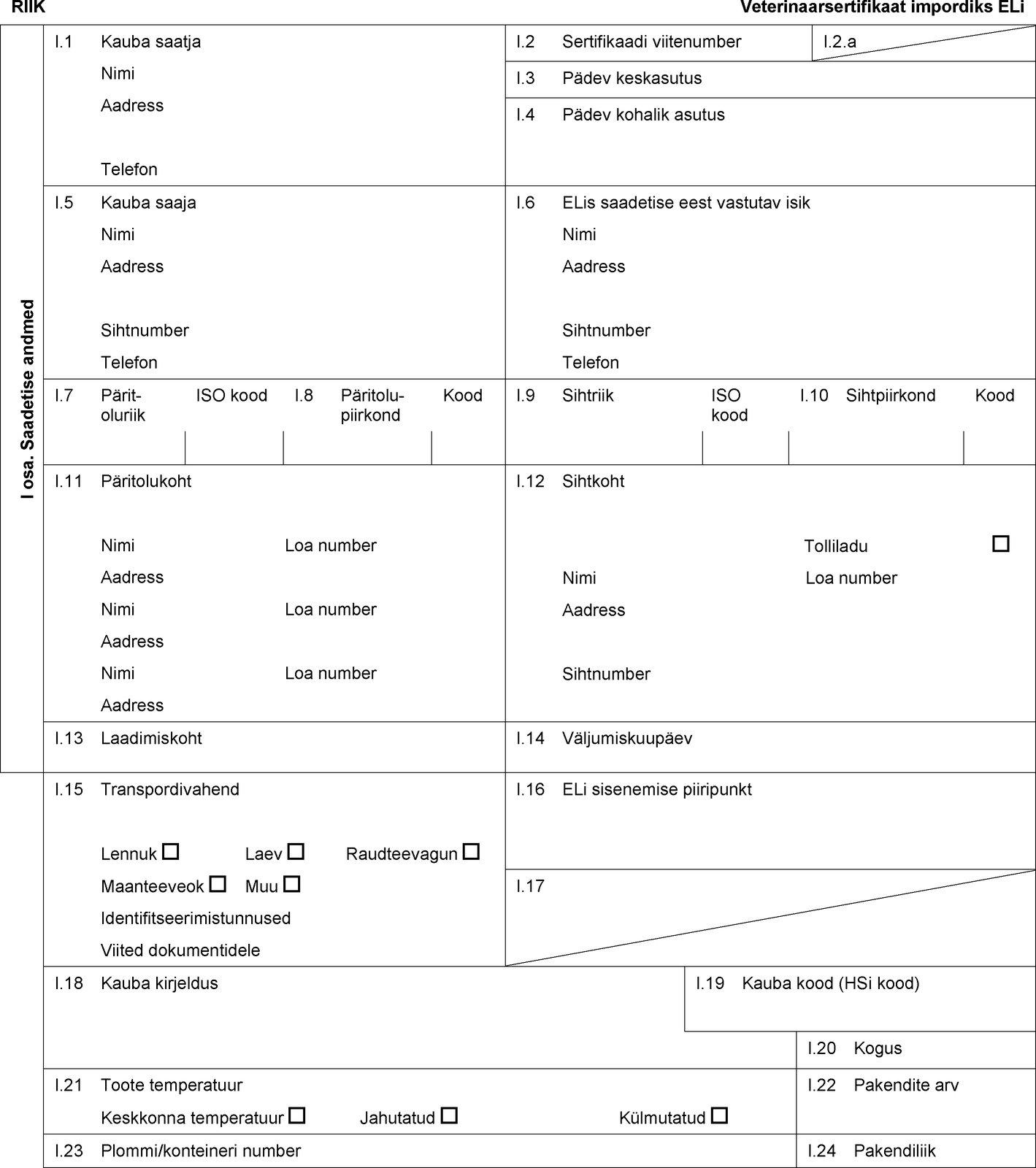 Tekst pildi
Tekst pildi
RIIK Veterinaarsertifikaat impordiks ELi I osa. Saadetise andmed I.1 Kauba saatja Nimi Aadress Telefon I.2 Sertifikaadi viitenumber I.2.a I.3 Pädev keskasutus I.4 Pädev kohalik asutus I.5 Kauba saaja Nimi Aadress Sihtnumber Telefon I.6 ELis saadetise eest vastutav isik Nimi Aadress Sihtnumber Telefon I.7 Pärit-oluriik ISO kood I.8 Päritolu-piirkond Kood I.9 Sihtriik ISO kood I.10 Sihtpiirkond Kood I.11 Päritolukoht Nimi Loa number Aadress Nimi Loa number Aadress Nimi Loa number Aadress I.12 Sihtkoht Tolliladu Nimi Loa number Aadress Sihtnumber I.13 Laadimiskoht I.14 Väljumiskuupäev I.15 Transpordivahend Lennuk Laev Raudteevagun Maanteeveok Muu Identifitseerimistunnused Viited dokumentidele I.16 ELi sisenemise piiripunkt I.17 I.18 Kauba kirjeldus I.19 Kauba kood (HSi kood) I.20 Kogus I.21 Toote temperatuur Keskkonna temperatuur Jahutatud Külmutatud I.22 Pakendite arv I.23 Plommi/konteineri number I.24 Pakendiliik  Tekst pildi
Tekst pildi
I.25 Kauba lubatud otstarve: Loomasööt Lemmikloomatoidu tootmine Tehniline otstarve I.26 Transiidiks kolmandasse riiki ELi kaudu Kolmas riik ISO kood I.27 Impordiks või sissepääsuks ELi I.28 Kauba identifitseerimine Ettevõtete loa number Liik (teaduslik nimetus) Kauba liik Tootmisettevõte Partii number  Tekst pildi
Tekst pildi
RIIK Muuks otstarbeks kui inimtoiduks ettenähtud veretooted, mida võidakse kasutada söödamaterjalina II. Terviseteave II.a. Sertifikaadi viitenumber II.b. Mina, allakirjutanud veterinaarjärelevalve ametnik, teatan, et olen lugenud ja mõistan Euroopa Parlamendi ja nõukogu määrust (EÜ) nr 1069/2009 (1a) ning komisjoni määrust (EL) nr 142/2011 (1b) ning seoses eelkirjeldatud veretoodetega kinnitan järgmist: II.1 tegemist on veretoodetega, mis vastavad alljärgnevatele tervishoiunõuetele; II.2 sisaldavad üksnes muuks kui inimtoiduks ettenähtud veretooteid; II.3 on valmistatud ja ladustatud ettevõttes, mida pädev asutus on määruse (EÜ) nr 1069/2009 artikli 24 kohaselt tunnustanud ja mis on pädeva asutuse järelevalve all; II.4 selle valmistamisel on kasutatud üksnes järgmisi loomseid kõrvalsaadusi: (2) kas [tapetud loomade veri, mis on inimtoiduks kõlblik vastavalt Euroopa Liidu õigusaktidele, kuid mis ei ole ärilistel kaalutlustel inimtoiduks ette nähtud;] (2) ja/või [tapetud loomade veri, mis on tunnistatud inimtoiduks kõlbmatuks vastavalt Euroopa Liidu õigusaktidele, kuid millel ei ilmnenud mingeid inimestele või loomadele nakkavate haiguste nähte ja mis on saadud selliste tapamajas tapetud loomade rümpadest, kes tunnistati tapaeelsel ülevaatusel inimtoiduks kõlblikuks vastavalt Euroopa Liidu õigusaktidele;] II.5 on haigusetekitajate inaktiveerimiseks läbinud töötluse (2) kas [määruse (EL) nr 142/2011 IV lisa III peatükis esitatud … töötlemismeetodi (3) alusel;] (2) või [sellise meetodi alusel ja selliste parameetrite juures, millega tagatakse, et toode vastab määruse (EL) nr 142/2011 X lisa I peatükis sätestatud mikrobioloogilistele normidele;] (2) või [veretoodete, sealhulgas sigade söötmiseks ette nähtud pihustuskuivatatud seaveri ja seavereplasma puhul sellise kuumtöötluse alusel, kus temperatuur on kogu materjali ulatuses vähemalt 80 °C ning kuivatatud vere ja vereplasma niiskus on kuni 8 massiprotsenti ja vee aktiivsus (Aw) alla 0,60.] II.6 lõpptoode: (2) kas [pakendati kasutamata või steriliseeritud kottidesse,] (2) või [transporditi puistlastina mahutites või muudes transpordivahendites, mida puhastati ja desinfitseeriti enne kasutamist põhjalikult pädeva asutuse heaks kiidetud desinfektsioonivahendiga,] millel on sildid kirjaga „MITTE INIMTOIDUKS“; II.7 lõpptoodet ladustati suletud ruumides; II.8 toote puhul on võetud kõik ettevaatusabinõud, et vältida haigusetekitajatega saastumist töötlemise järel; (2) ja [veretoodete puhul, sealhulgas pihustuskuivatatud seaveri ja seavereplasma, mis on ette nähtud sigade söötmiseks, hoiti kuivas laos toatemperatuuril vähemalt 6-nädalase ajavahemiku jooksul]. II.9 neid on enne lähetamist analüüsinud vastutav pädev asutus, kes on võtnud neist pistelise proovi ja leidnud, et need vastavad järgmistele standarditele (4): salmonella: puudub 25 grammis: n = 5, c = 0, m = 0, M = 0, enterobakterid: n = 5, c = 2, m = 10, M = 300 1 grammis; II osa. Sertifitseerimine  Tekst pildi
Tekst pildi
RIIK Muuks otstarbeks kui inimtoiduks ettenähtud veretooted, mida võidakse kasutada söödamaterjalina II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (2) [II.10. eespool kirjeldatud veretooted (2) kas [on saadud muudelt mäletsejalistelt kui veised, lambad ja kitsed.]] (2) või [on saadud veistelt, lammastelt ja kitsedelt ning ei sisalda järgmist materjali ega ole sellest saadud: (2) kas [veistelt, lammastelt või kitsedelt saadud materjal, v.a materjal, mis on saadud loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka.]] (2) või [a) Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 999/2001 (5) V lisa punktis 1 nimetatud määratletud riskiteguriga materjal; b) veiste, lammaste või kitsede kontidelt mehhaaniliselt eraldatud lihamass, välja arvatud sellistelt loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt komisjoni otsusele 2007/453/EÜ (6) liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka, kus ei ole esinenud algupäraseid BSE-juhtumeid; c) loomne kõrvalsaadus või toode on saadud veistelt, lammastelt või kitsedelt, kes on pärast uimastamist surmatud kesknärvisüsteemikudede vigastamise teel koljuõõnde viidava pika vardakujulise instrumendiga või koljuõõnde süstitud gaasiga, v.a juhul, kui kõnealused loomad on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE riskiga riikide või piirkondade hulka.]]] II.11 eespool kirjeldatud veretooted (2) kas [ei sisalda lammastelt või kitsedelt saadud piima ega piimatooteid ega ole ette nähtud põllumajandusloomade (v.a karusloomad) söödaks.] (2) või [sisaldavad lammastelt või kitsedelt saadud piima ja piimatooteid ning on ette nähtud põllumajandusloomade (v.a karusloomad) söödaks, mis: a) on saadud lammastelt ja kitsedelt, keda on sünnist saadik pidevalt kasvatatud riigis, kus on täidetud järgmised tingimused: i) klassikalise skreipi juhtumitest teatamine on kohustuslik; ii) riigis on olemas teadlikustamis-, seire- ja järelevalvesüsteem; iii) põllumajandusettevõtete suhtes, kus on lambad või kitsed, kohaldatakse TSE kahtluse või klassikalise skreipi kinnitamise korral ametlikke piiranguid; iv) klassikalisse skreipisse haigestunud lambad ja kitsed tapetakse ja hävitatakse; v) lammaste ja kitsede söötmine mäletsejalistelt saadud liha-kondijahu või kõrnetega, nagu on määratletud OIE maismaaloomade tervise koodeksis, on olnud keelatud ja seda keeldu on tegelikult rakendatud kogu riigis vähemalt eelneva seitsmeaastase ajavahemiku jooksul; b) on pärit ettevõtetest, kus puuduvad TSE kahtluse tõttu kehtestatud ametlikud piirangud; c) on pärit põllumajandusettevõtetest, kus vähemalt eelneva seitsmeaastase ajavahemiku jooksul ei ole diagnoositud klassikalise skreipi juhtumit või kus pärast klassikalise skreipi juhtumi kinnitamist:  Tekst pildi
Tekst pildi
RIIK Muuks otstarbeks kui inimtoiduks ettenähtud veretooted, mida võidakse kasutada söödamaterjalina II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (2) kas [on põllumajandusettevõttes surmatud ja hävitatud või tapetud kõik lambad ja kitsed, v.a ARR/ARR-genotüübiga tõujäärad, vähemalt ühe ARR-alleeliga ja ilma VRQ-alleelita aretusuted ning teised vähemalt ühe ARR-alleeliga lambad;] (2) või [on tapetud ja hävitatud kõik loomad, kelle puhul leidis kinnitust nakatumine klassikalisse skreipisse, ning ettevõttes on toimunud viimasest klassikalise skreipi juhtumi kinnitamise kuupäevast alates vähemalt kahe aasta jooksul tõhustatud TSE seire, mis hõlmab muu hulgas määruse (EÜ) nr 999/2001 X lisa C peatüki punktis 3.2 sätestatud laboratoorsete meetodite kohaselt tehtud ja negatiivseid tulemusi andnud kontrolle TSE esinemise suhtes kõikide järgmiste üle 18 kuu vanuste loomade, välja arvatud ARR/ARR-genotüübiga lammaste puhul: — inimtoiduks tapetud loomad ning — loomad, kes on põllumajandusettevõttes surnud või tapetud, ent keda ei hukatud haiguste likvideerimise programmi raames.]] II.12 töödeldud loomne valk või eespool kirjeldatud toode sisaldab muudelt loomadelt kui mäletsejalistelt saadud loomseid kõrvalsaadusi või on nendest saadud ning lahtris I.1 osutatud kauba saatja avalduse kohaselt: (2) kas [ei ole ette nähtud põllumajandusloomade (v. a karusloomad) sööda tootmiseks.] (2) (7) või [on ette nähtud muude põllumajandusloomade kui mäletsejaliste (v.a karusloomad) sööda tootmiseks, ning kauba saatja tagab, et sisenemise piiripunktis esitatakse selliste analüüside tulemused, mis on tehtud vastavalt komisjoni määruse (EÜ) nr152/2009 VI lisas esitatud meetoditele (8).] Märkused I osa — Lahter I.6: Euroopa Liidus saadetise eest vastutav isik: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist sertifikaadiga Euroopa Liidu kaudu transporditava transiitkauba kohta; Euroopa Liitu imporditava kauba kohta antava sertifikaadi puhul võib selle samuti täita. — Lahter I.12: Sihtkoht: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist transiitkauba sertifikaadiga. Transiitkaupu võib ladustada üksnes vabatsoonis, vabalaos ja tollilaos. — Lahter I.15: registreerimisnumber (raudteevagunid või -konteinerid ja veoautod), lennu number (lennuk) või nimi (laev); teave tuleb esitada Euroopa Liidus maha- ja ümberlaadimise korral. — Lahter I.19: kasutada asjakohast HSi koodi: 05.11.91, 05.11.99, 35.02 või 35.04. — Lahter I.23: puistlastikonteinerite puhul tuleb lisada konteineri number ja plommi number (kui on). — Lahter I.25: Tehniline otstarve: muuks kui põllumajandusloomade (v.a karusloomad) söödaks, ning lemmikloomatoidu tootmiseks või valmistamiseks. — Lahtrid I.26 ja I.27: täita vastavalt sellele, kas tegemist on transiidiks või impordiks antava sertifikaadiga. — Lahter I.28: Liik: valida üks järgmistest: Aves, Ruminantia, Suidae, Mammalia, v.a Ruminantia või Suidae , Pesca, Reptilia.  Tekst pildi
Tekst pildi
RIIK Muuks otstarbeks kui inimtoiduks ettenähtud veretooted, mida võidakse kasutada söödamaterjalina II. Terviseteave II.a. Sertifikaadi viitenumber II.b. II osa. (1a) ELT L 300, 14.11.2009, lk 1. (1b) ELT L 54, 26.2.2011, lk 1. (2) Mittevajalik läbi kriipsutada. (3) Vajaduse korral märkida meetod 1–5 või 7. (4) Kus: n = analüüsitavate proovide arv; m = bakterite arvu väärtuslävi; tulemus on rahuldav, kui bakterite arv kogu valimis ei ületa näitajat m; M = bakterite arvu maksimumväärtus; tulemus on ebarahuldav, kui bakterite arv ühes või mitmes proovis on võrdne näitajaga M või sellest suurem; ning c = nende proovide arv, milles bakterite arv võib jääda näitajate m ja M vahele; proov on siiski rahuldav, kui teiste proovide bakterite arv on võrdne näitajaga m või sellest väiksem. (5) EÜT L 147, 31.5.2001, lk 1. (6) ELT L 172, 30.6.2007, lk 84. (7) Lahtris I.6 osutatud lasti eest vastutav isik peab tagama, et kui käesolevas tervisesertifikaadis kirjeldatud veretooted on ette nähtud kasutamiseks muude põllumajandusloomade kui mäletsejaliste (v.a karusloomad) sööda tootmisel, tuleb saadetist analüüsida vastavalt määruse (EÜ) nr 152/2009 VI lisas esitatud meetoditele, et teha kindlaks, et selles ei esine keelatud loomseid komponente. Selliste analüüside tulemusi käsitlev teave peab olema lisatud käesolevale tervisohutuse tõendile saadetise esitamisel ELi piiripunktis. (8) ELT L 54, 26.2.2009, lk 1. — Allkirja ja templi värv peavad erinema teksti värvist. — Märkus Euroopa Liidus saadetise eest vastutavale isikule: käesolev sertifikaat on koostatud üksnes veterinaariaalastel eesmärkidel ja see peab saadetisega kaasas olema kuni Euroopa Liitu sisenemise piiripunkti jõudmiseni. Veterinaarjärelevalve ametnik/inspektor Nimi (trükitähtedega): Kvalifikatsioon ja ametinimetus: Kuupäev: Allkiri: Tempel: 4. PEATÜKK, C OSA Tervisesertifikaat väljaspool põllumajandusloomade söödaahelat kasutatavate toodete valmistamiseks ettenähtud töötlemata veretoodete (v.a tooted hobuslaste verest) kohta, mis on ette nähtud lähetamiseks Euroopa Liitu või transiidiks (2) Euroopa Liidu kaudu  Tekst pildi
Tekst pildi
RIIK Veterinaarsertifikaat impordiks ELi I osa. Saadetise andmed I.1 Kauba saatja Nimi Aadress Telefon I.2 Sertifikaadi viitenumber I.2.a I.3 Pädev keskasutus I.4 Pädev kohalik asutus I.5 Kauba saaja Nimi Aadress Sihtnumber Telefon I.6 ELis saadetise eest vastutav isik Nimi Aadress Sihtnumber Telefon I.7 Pärit-oluriik ISO kood I.8 Päritolu-piirkond Kood I.9 Sihtriik ISO kood I.10 Sihtpiirkond Kood I.11 Päritolukoht Nimi Loa number Aadress Nimi Loa number Aadress Nimi Loa number Aadress I.12 Sihtkoht Tolliladu Nimi Loa number Aadress Sihtnumber I.13 Laadimiskoht I.14 Väljumiskuupäev I.15 Transpordivahend Lennuk Laev Raudteevagun Maanteeveok Muu Identifitseerimistunnused Viited dokumentidele I.16 ELi sisenemise piiripunkt I.17 I.18 Kauba kirjeldus I.19 Kauba kood (HSi kood) I.20 Kogus I.21 Toote temperatuur Keskkonna temperatuur Jahutatud Külmutatud I.22 Pakendite arv I.23 Plommi/konteineri number I.24 Pakendiliik  Tekst pildi
Tekst pildi
I.25 Kauba lubatud otstarve: Tehniline otstarve I.26 Transiidiks kolmandasse riiki ELi kaudu Kolmas riik ISO kood I.27 Impordiks või sissepääsuks ELi I.28 Kauba identifitseerimine Ettevõtete loa number Liik (teaduslik nimetus) Tootmisettevõte Partii number  Tekst pildi
Tekst pildi
RIIK Töötlemata veretooted (v.a tooted hobuslaste verest), mis on ette nähtud väljaspool põllumajandusloomade söödaahelat kasutatavate toodete valmistamiseks II. Terviseteave II.a. Sertifikaadi viitenumber II.b. Mina, allakirjutanud veterinaarjärelevalve ametnik, teatan, et olen lugenud ja mõistan Euroopa Parlamendi ja nõukogu määrust (EÜ) nr 1069/2009 (1a), eelkõige selle artikli 8 punkte c ja d ja artiklit 10, ning komisjoni määrust (EL) nr 142/2011 (1b), eelkõige selle XIV lisa II peatükki, ning kinnitan järgmist: II.1 eelkirjeldatud veretooted koosnevad veretoodetest, mis vastavad alljärgnevatele tervishoiunõuetele; II.2 tegemist on üksnes muuks otstarbeks kui inim- või loomatoiduks ettenähtud veretoodetega; II.3 need on valmistatud ja ladustatud kas pädeva asutuse järelevalve all olevas ettevõttes või kogumisettevõttes ning nende valmistamisel on kasutatud üksnes alljärgnevaid loomseid kõrvalsaadusi: (2) kas [- tapetud loomade veri, mis on inimtoiduks kõlblik vastavalt Euroopa Liidu õigusaktidele, kuid mis ei ole ärilistel kaalutlustel inimtoiduks ette nähtud;] (2) ja/või [- tapetud loomade veri, mis on tunnistatud inimtoiduks kõlbmatuks vastavalt Euroopa Liidu õigusaktidele, kuid millel ei ilmnenud mingeid inimestele või loomadele nakkavate haiguste nähte ja mis on saadud selliste tapamajas tapetud loomade rümpadest, kes tunnistati tapaeelsel ülevaatusel inimtoiduks kõlblikuks vastavalt Euroopa Liidu õigusaktidele;] (2) ja/või [- veri tapetud loomadelt, kellel ei ilmnenud mingeid vere kaudu inimestele või loomadele nakkavate haiguste nähte, mis saadi tapamajas tapetud loomadest, kes tunnistati tapaeelsel ülevaatusel inimtoiduks kõlblikuks vastavalt Euroopa Liidu õigusaktidele;] (2) ja/või [- veri ja veretooted, mis on saadud inimtoiduks ettenähtud toodete tootmisel;] (2) ja/või [- veri ja veretooted elusloomadest, kellel ei ilmnenud mingeid asjaomase toote kaudu inimestele või loomadele nakkavate haiguste tunnuseid;] (2) ja/või [- loomsed kõrvalsaadused loomadest, kelle suhtes on kasutatud ebaseaduslikku ravi vastavalt nõukogu direktiivi 96/22/EÜ (2a) artikli 1 lõike 2 punktis d või nõukogu direktiivi 96/23/EÜ (2b) artikli 2 punktis b esitatud määratlusele;] (2) ja/või [- loomsed kõrvalsaadused, mis sisaldavad direktiivi 96/23/EÜ I lisa rühma B punktis 3 loetletud muude ainete ja keskkonna saasteainete jääke, kui sellised jäägid ületavad liidu õigusaktides või nende puudumisel siseriiklikes õigusaktides sätestatud lubatud taset;] II.4 veri, millest sellised tooted on valmistatud, on kogutud vastavalt Euroopa Liidu õigusaktidele tunnustatud tapamajades, kogujariigi pädeva asutuse poolt tunnustatud ja selle asutuse järelevalve all olevatest tapamajades või elusloomadelt kogujariigi pädeva asutuse tunnustatud ja tema järelevalve all olevates rajatistes; (2) [II.5. kui tegemist on veretoodetega, mis on saadud sõraliste, kabjaliste ja londiliste taksonitesse kuuluvatest loomadest, sealhulgas nende ristanditest, on veri kogutud riigis või piirkonnas, kus vähemalt eelneva 12-kuulise ajavahemiku jooksul ei ole registreeritud veiste katku, väikemäletsejaliste katku ega Rift Valley palaviku juhtumeid ning kus vähemalt 12-kuulise ajavahemiku jooksul ei ole toimunud nende haiguste vastu vaktsineerimist; ning (2) kas [kolmandas riigis, territooriumil või selle osas (märkida ISO kood, kui tegemist on riigiga, või selle territooriumi või osa koodid) (3), kus vähemalt eelneva 12-kuulise ajavahemiku jooksul ei ole registreeritud suu- ja sõrataudi juhtumeid ja kus vähemalt 12-kuulise ajavahemiku jooksul ei ole toimunud selle haiguse vastu vaktsineerimist, ning] (2) või [kolmandas riigis, territooriumil või selle osas (märkida ISO kood, kui tegemist on riigiga, või selle territooriumi või osa koodid) (3), kus vähemalt eelneva 12-kuulise ajavahemiku jooksul ei ole registreeritud suu- ja sõrataudi juhtumeid ning kus mäletsejalistest koduloomade suu- ja sõrataudi vastaseid vaktsineerimisprogramme on ametlikult tehtud ja kontrollitud vähemalt eelneva 12-kuulise ajavahemiku jooksul (4), ning]] II osa. Sertifitseerimine  Tekst pildi
Tekst pildi
RIIK Töötlemata veretooted (v.a tooted hobuslaste verest), mis on ette nähtud väljaspool põllumajandusloomade söödaahelat kasutatavate toodete valmistamiseks II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (2) [II.5.1. muude loomade kui sigalaste ja pekaariliste puhul kolmandas riigis või piirkonnas, kus: (2) kas [vähemalt eelneva 12-kuulise ajavahemiku jooksul ei ole registreeritud vesikulaarse stomatiidi ja lammaste katarraalse palaviku juhtumeid (2) (sealhulgas seropositiivsete loomade esinemine) ning kus nende haiguste vastu vaktsineerimist ei ole tehtud vähemalt eelneva 12-kuulise ajavahemiku jooksul;] (2) või [esineb vesikulaarse stomatiidi ja lammaste katarraalse palavikuga (2) seropositiivseid loomi (4);]] (2) [II.5.2. sigalaste ja pekaariliste puhul riigis või -piirkonnas, kus vähemalt eelneva 12-kuulise ajavahemiku jooksul ei ole esinenud sigade vesikulaarhaiguse, sigade katku ja sigade Aafrika katku juhtumeid ning kus vastuvõtlikke liike ei ole vähemalt eelneva 12-kuulise ajavahemiku jooksul nende haiguste vastu vaktsineeritud ja (2) kas [vähemalt eelneva 12-kuulise ajavahemiku jooksul ei ole registreeritud vesikulaarse stomatiidi ja lammaste katarraalse palaviku juhtumeid (sealhulgas seropositiivsete loomade esinemine) ning kus nende haiguste vastu vaktsineerimist ei ole tehtud vähemalt eelneva 12-kuulise ajavahemiku jooksul;]] (2) või [esineb vesikulaarse stomatiidi seropositiivseid loomi (4);]]] (2) [II.6. kodulindudest ja muudest linnuliikidest saadud veretoodete puhul on linnuliigid ja tooted pärit riigi või piirkonna territooriumilt, mille kood on … (5) kus ei esine Newcastle’i haigust ega kõrge patogeensusega linnugrippi, nagu on määratletud OIE maismaaloomade tervise koodeksis; kus vähemalt eelneva 12-kuulise ajavahemiku jooksul ei ole toimunud vaktsineerimist lindude gripi vastu; loomad, kellest tooted on saadud, ei ole vaktsineeritud Newcastle’i haiguse vastu vaktsiiniga, mis on valmistatud Newcastle’i haiguse põhitüvest, mille patogeensus on kõrgem kui lentogeensetel viirusetüvedel;] II.7 tooted on: (2) kas [on pakendatud kasutamata või steriliseeritud kottidesse või pudelitesse;] (2) või [transporditi puistlastina mahutites või muudes transpordivahendites, mida puhastati ja desinfitseeriti enne kasutamist põhjalikult pädeva asutuse heaks kiidetud desinfektsioonivahendiga,] välispakendil või mahutitel on sildid kirjaga „MITTE INIM- EGA LOOMATOIDUKS”; II.8 lõpptoodet ladustati suletud ruumides; II.9 toodete puhul võeti kõik ettevaatusabinõud, et vältida haigusetekitajatega saastumist transportimise ajal; (2) [II.10. eespool kirjeldatud töötlemata veretooted (2) kas [on saadud muudelt mäletsejalistelt kui veised, lambad ja kitsed.]] (2) või [on saadud veistelt, lammastelt ja kitsedelt ning ei sisalda järgmist materjali ega ole sellest saadud: (2) kas [veistelt, lammastelt või kitsedelt saadud materjal, v.a materjal, mis on saadud loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka.]] (2) või [a) Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 999/2001 (6) V lisa punktis 1 nimetatud määratletud riskiteguriga materjal; b) veiste, lammaste või kitsede kontidelt mehhaaniliselt eraldatud lihamass, välja arvatud sellistelt loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt komisjoni otsusele 2007/453/EÜ (7) liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka, kus ei ole esinenud algupäraseid BSE-juhtumeid;  Tekst pildi
Tekst pildi
RIIK Töötlemata veretooted (v.a tooted hobuslaste verest), mis on ette nähtud väljaspool põllumajandusloomade söödaahelat kasutatavate toodete valmistamiseks II. Terviseteave II.a. Sertifikaadi viitenumber II.b. c) loomne kõrvalsaadus või toode on saadud veistelt, lammastelt või kitsedelt, kes on pärast uimastamist surmatud kesknärvisüsteemikudede vigastamise teel koljuõõnde viidava pika vardakujulise instrumendiga või koljuõõnde süstitud gaasiga, v.a juhul, kui kõnealused loomad on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE riskiga riikide või piirkondade hulka.]]] Märkused I osa — Lahter I.6: Euroopa Liidus saadetise eest vastutav isik: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist sertifikaadiga Euroopa Liidu kaudu transporditava transiitkauba kohta; Euroopa Liitu imporditava kauba kohta antava sertifikaadi puhul võib selle samuti täita. — Lahtrid I.11 ja I.12: Loa number ettevõtte registreerimisnumber, mille on andnud pädev asutus. — Lahter I.12: Sihtkoht: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist transiitkauba sertifikaadiga. Transiitkaupu võib ladustada üksnes vabatsoonis, vabalaos ja tollilaos. — Lahter I.15: tuleb esitada registreerimisnumber (raudteevagunid või -konteinerid ja veoautod), lennu number (lennuk) või nimi (laev). Euroopa Liidus maha- ja ümberlaadimise korral peab kauba saatja teavitama Euroopa Liidu piiripunkti. — Lahter I.19: kasutada vajalikku harmoneeritud süsteemi (HS) koodi järgmistes rubriikides: 05.11; 30.02 või 35.02. — Lahter I.23: puistlastikonteinerite puhul tuleb lisada konteineri number ja plommi number (kui on). — Lahter I.25: Tehniline otstarve: muuks kui põllumajandusloomade (v.a karusloomad) söödaks, ning lemmikloomatoidu tootmiseks või valmistamiseks. — Lahtrid I.26 ja I.27: täita vastavalt sellele, kas tegemist on transiidiks või impordiks antava sertifikaadiga. — Lahter I.28.: valida üks järgmistest: Aves, Ruminantia, Suidae, Mammalia, v.a. Ruminantia või Suidae, Pesca, Reptilian. II osa. (1a) ELT L 300, 14.11.2009, lk 1. (1b) ELT L 54, 26.2.2011, lk 1. (2) Mittevajalik läbi kriipsutada. (2a) EÜT L 125, 23.5.1996, lk 3. (2b) EÜT L 125, 23.5.1996, lk 10. (3) Territooriumi kood, mis on esitatud määruse (EL) nr 206/2010 II lisa 1. osas (ELT L 73, 20.3.2010, lk 1). (4) Sellisel juhul tuleb tooted pärast direktiiviga 97/78/EÜ (EÜT L 24, 30.1.1998, lk 9) ette nähtud veterinaarkontrolli vastavalt kõnealuse direktiivi artikli 8 lõikes 4 sätestatud tingimustele transportida otse sihtettevõttesse.  Tekst pildi
Tekst pildi
RIIK Töötlemata veretooted (v.a tooted hobuslaste verest), mis on ette nähtud väljaspool põllumajandusloomade söödaahelat kasutatavate toodete valmistamiseks II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (5) Territooriumi kood, mis on esitatud määruse (EL) nr 798/2008 II lisa 1. osas (ELT L 226, 23.8.2008, lk1). (6) EÜT L 147, 31.5.2001, lk 1. (7) ELT L 172, 30.6.2007, lk 84. — Allkirja ja templi värv peavad erinema teksti värvist. — Märkus Euroopa Liidus saadetise eest vastutavale isikule: käesolev sertifikaat on koostatud üksnes veterinaariaalastel eesmärkidel ja see peab saadetisega kaasas olema kuni Euroopa Liitu sisenemise piiripunkti jõudmiseni. Veterinaarjärelevalve ametnik/inspektor Nimi (trükitähtedega): Kvalifikatsioon ja ametinimetus: Kuupäev: Allkiri: Tempel: 4. PEATÜKK, D OSA Tervisesertifikaat väljaspool põllumajandusloomade söödaahelat kasutatavate toodete valmistamiseks ettenähtud töödeldud veretoodete (v.a tooted hobuslaste verest) kohta, mis on ette nähtud lähetamiseks Euroopa Liitu või transiidiks (2) Euroopa Liidu kaudu  Tekst pildi
Tekst pildi
RIIK Veterinaarsertifikaat impordiks ELi I osa. Saadetise andmed I.1 Kauba saatja Nimi Aadress Telefon I.2 Sertifikaadi viitenumber I.2.a I.3 Pädev keskasutus I.4 Pädev kohalik asutus I.5 Kauba saaja Nimi Aadress Sihtnumber Telefon I.6 ELis saadetise eest vastutav isik Nimi Aadress Sihtnumber Telefon I.7 Pärit-oluriik ISO kood I.8 Päritolu-piirkond Kood I.9 Sihtriik ISO kood I.10 Sihtpiirkond Kood I.11 Päritolukoht Nimi Loa number Aadress Nimi Loa number Aadress Nimi Loa number Aadress I.12 Sihtkoht Tolliladu Nimi Loa number Aadress Sihtnumber I.13 Laadimiskoht I.14 Väljumiskuupäev I.15 Transpordivahend Lennuk Laev Raudteevagun Maanteeveok Muu Identifitseerimistunnused Viited dokumentidele I.16 ELi sisenemise piiripunkt I.17 I.18 Kauba kirjeldus I.19 Kauba kood (HSi kood) I.20 Kogus I.21 Toote temperatuur Keskkonna temperatuur Jahutatud Külmutatud I.22 Pakendite arv I.23 Plommi/konteineri number I.24 Pakendiliik 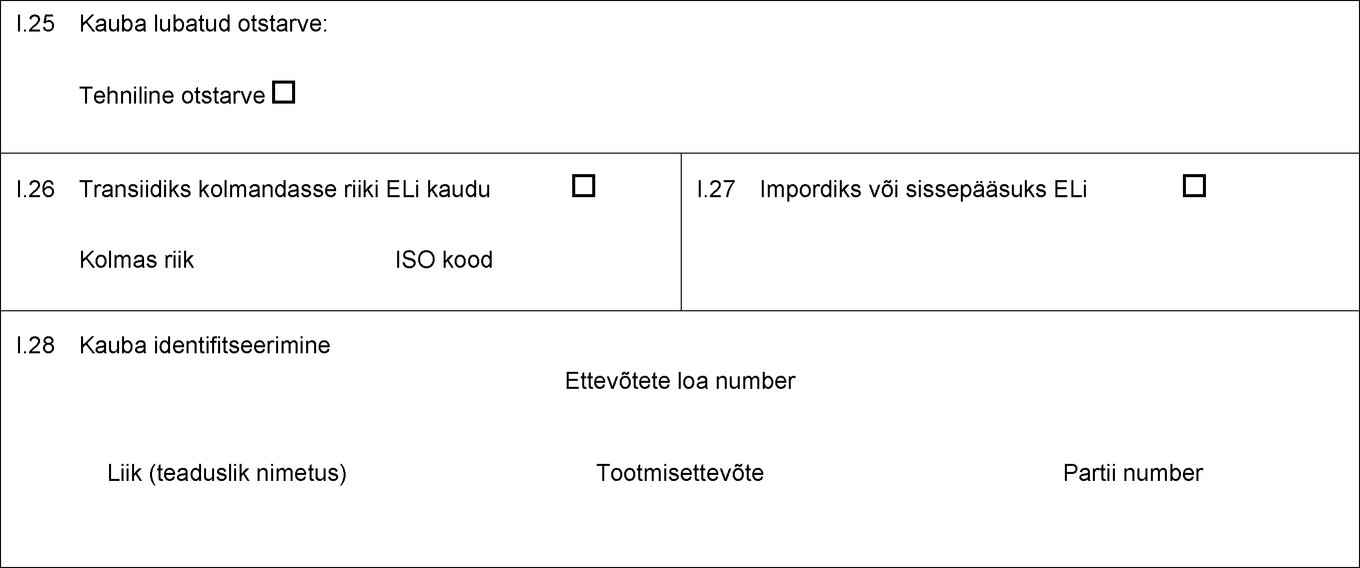 Tekst pildi
Tekst pildi
I.25 Kauba lubatud otstarve: Tehniline otstarve I.26 Transiidiks kolmandasse riiki ELi kaudu Kolmas riik ISO kood I.27 Impordiks või sissepääsuks ELi I.28 Kauba identifitseerimine Ettevõtete loa number Liik (teaduslik nimetus) Tootmisettevõte Partii number  Tekst pildi
Tekst pildi
RIIK Töödeldud veretooted (v.a tooted hobuslaste verest), mis on ette nähtud väljaspool põllumajandusloomade söödaahelat kasutatavate toodete valmistamiseks II. Terviseteave II.a. Sertifikaadi viitenumber II.b. Mina, allakirjutanud veterinaarjärelevalve ametnik, teatan, et olen lugenud ja mõistan Euroopa Parlamendi ja nõukogu määrust (EÜ) nr 1069/2009 (1a), eelkõige selle artikli 8 punkte c ja d, artiklit 10, ning komisjoni määrust (EL) nr 142/2011 (1b), eelkõige selle XIV lisa II peatükki, ning kinnitan järgmist: II.1 eelkirjeldatud veretooted koosnevad veretoodetest, mis vastavad alljärgnevatele tervishoiunõuetele; II.2 tegemist on üksnes muuks otstarbeks kui inim- või loomatoiduks ettenähtud veretoodetega; II.3 need on valmistatud ja ladustatud pädeva asutuse järelevalve all olevas ettevõttes ning nende valmistamisel on kasutatud üksnes alljärgnevaid loomseid kõrvalsaadusi: (2) kas [- tapetud loomade veri, mis on inimtoiduks kõlblik vastavalt Euroopa Liidu õigusaktidele, kuid mis ei ole ärilistel kaalutlustel inimtoiduks ette nähtud;] (2) ja/või [- tapetud loomade veri, mis on tunnistatud inimtoiduks kõlbmatuks vastavalt Euroopa Liidu õigusaktidele, kuid millel ei ilmnenud mingeid inimestele või loomadele nakkavate haiguste nähte ja mis on saadud selliste tapamajas tapetud loomade rümpadest, kes tunnistati tapaeelsel ülevaatusel inimtoiduks kõlblikuks vastavalt Euroopa Liidu õigusaktidele;] (2) ja/või [- veri tapetud loomadelt, kellel ei ilmnenud mingeid vere kaudu inimestele või loomadele nakkavate haiguste nähte, mis saadi tapamajas tapetud loomadest, kes tunnistati tapaeelsel ülevaatusel inimtoiduks kõlblikuks vastavalt Euroopa Liidu õigusaktidele;] (2) ja/või [- veri ja veretooted elusloomadest, kellel ei ilmnenud mingeid asjaomaste toodete kaudu inimestele või loomadele nakkavate haiguste kliinilisi tunnuseid;] (2) ja/või [- veri ja veretooted, mis on saadud inimtoiduks ettenähtud toodete tootmisel;] (2) ja/või [- loomsed kõrvalsaadused, mis on saadud loomadest, kelle suhtes on kasutatud ebaseaduslikku ravi vastavalt nõukogu direktiivi 96/22/EÜ (2a) artikli 1 lõike 2 punktis d või nõukogu direktiivi 96/23/EÜ (2b) artikli 2 punktis b esitatud määratlusele;] (2) ja/või [- loomsed kõrvalsaadused, mis sisaldavad direktiivi 96/23/EÜ I lisa rühma B punktis 3 loetletud muude ainete ja keskkonna saasteainete jääke, kui sellised jäägid ületavad liidu õigusaktides või nende puudumisel siseriiklikes õigusaktides sätestatud lubatud taset; II.4 [veri, millest sellised tooted valmistatakse, on kogutud vastavalt Euroopa Liidu õigusaktidele tunnustatud tapamajades, kogujariigi pädeva asutuse poolt tunnustatud ja selle asutuse järelevalve all olevatest tapamajades või elusloomadelt kogujariigi pädeva asutuse tunnustatud ja tema järelevalve all olevates rajatistes. (2) [II.5. sõraliste, kabjaliste ja londiliste taksonitesse kuuluvatest loomadest, sealhulgas nende ristanditest (v.a sigalased ja pekaarilised) saadud veretooted on läbinud ühe järgmistest töötlusviisidest, mis tagab suu- ja sõrataudi, vesikulaarse stomatiidi, veiste katku, väikemäletsejaliste katku, Rift Valley palaviku ja lammaste katarraalse palaviku tekitajate puudumise: (2) kas [kuumtöötlus temperatuuril 65 °C vähemalt kolme tunni jooksul, millele järgneb tõhususe kontroll;] (2) ja/või [kiiritamine 25 kGy gammakiirtega, millele järgneb tõhususe kontroll;] (2) ja/või [pH muutmine kuni väärtuseni 5 kahe tunni jooksul, millele järgneb tõhususe kontroll;] (2) ja/või [läbikuumutamine vähemalt temperatuuril 80 °C, millele järgneb tõhususe kontroll.]] II osa. Sertifitseerimine  Tekst pildi
Tekst pildi
RIIK Töödeldud veretooted (v.a tooted hobuslaste verest), mis on ette nähtud väljaspool põllumajandusloomade söödaahelat kasutatavate toodete valmistamiseks II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (2) [II.6. sigalastelt, pekaarilistelt, kodulindudelt ja muudelt linnuliikidelt pärit veretooted on läbinud ühe järgmistest töötlusviisidest, mis tagab järgmiste haiguste tekitajate puudumise: suu- ja sõrataud, vesikulaarne stomatiit, sigade vesikulaarhaigus, klassikaline sigade katk, sigade Aafrika katk, Newcastle’i haigus ning kõrge patogeensusega linnugripp (kohaldatav vastavalt liigile): (2) kas [kuumtöötlus temperatuuril 65 °C vähemalt kolme tunni jooksul, millele järgneb tõhususe kontroll;] (2) ja/või [kiiritamine 25 kGy gammakiirtega, millele järgneb tõhususe kontroll;] (2) ja/või [sigalaste/pekaariliste (2) puhul läbikuumutamine vähemalt temperatuuril 80 °C ning kodulindude ja muude linnuliikide (2) puhul kogu toote materjali läbikuumutamine vähemalt temperatuuril 70 °C, millele järgneb tõhususe kontroll]]. (2) [II.7. muudest kui punktides II.5 või II.6 loetletud liikidest saadud veretooted on läbinud järgmise töötlusviisi(täpsustada): ] II.8 tooted: (2) kas [on pakendatud kasutamata või steriliseeritud kottidesse või pudelitesse,] (2) või [transporditi puistlastina mahutites või muudes transpordivahendites, mida puhastati ja desinfitseeriti enne kasutamist põhjalikult pädeva asutuse heaks kiidetud desinfektsioonivahendiga;] ja välispakendil või mahutitel on sildid kirjaga „MITTE INIM- EGA LOOMATOIDUKS”; II.9 tooteid ladustati suletud ruumides; II.10 toodete puhul on võetud kõik ettevaatusabinõud, et vältida haigusetekitajatega saastumist töötlemise järel; (2) [II.11. eelkirjeldatud töötlemata veretooted (2) kas [on saadud muudelt mäletsejalistelt kui veised, lambad ja kitsed.]] (2) või [on saadud veistelt, lammastelt ja kitsedelt ning ei sisalda järgmist materjali ega ole sellest saadud: (2) kas [veistelt, lammastelt või kitsedelt saadud materjal, v.a materjal, mis on saadud loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka.]] (2) või [a) Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 999/2001 (3) V lisa punktis 1 nimetatud määratletud riskiteguriga materjal; b) veiste, lammaste või kitsede kontidelt mehhaaniliselt eraldatud lihamass, välja arvatud sellistelt loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt komisjoni otsusele 2007/453/EÜ (4) liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka, kus ei ole esinenud algupäraseid BSE-juhtumeid; c) loomne kõrvalsaadus või toode on saadud veistelt, lammastelt või kitsedelt, kes on pärast uimastamist surmatud kesknärvisüsteemikudede vigastamise teel koljuõõnde viidava pika vardakujulise instrumendiga või koljuõõnde süstitud gaasiga, v.a juhul, kui kõnealused loomad on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE riskiga riikide või piirkondade hulka.]]]  Tekst pildi
Tekst pildi
RIIK Töödeldud veretooted (v.a tooted hobuslaste verest), mis on ette nähtud väljaspool põllumajandusloomade söödaahelat kasutatavate toodete valmistamiseks II. Terviseteave II.a. Sertifikaadi viitenumber II.b. Märkused I osa — Lahter I.6: Euroopa Liidus saadetise eest vastutav isik: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist sertifikaadiga Euroopa Liidu kaudu transporditava transiitkauba kohta; Euroopa Liitu imporditava kauba kohta antava sertifikaadi puhul võib selle samuti täita. — Lahtrid I.11 ja I.12: Loa number ettevõtte registreerimisnumber, mille on andnud pädev asutus. — Lahter I.12: Sihtkoht: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist transiitkauba sertifikaadiga. Transiitkaupu võib ladustada üksnes vabatsoonis, vabalaos ja tollilaos. — Lahter I.15: tuleb esitada registreerimisnumber (raudteevagunid või -konteinerid ja veoautod), lennu number (lennuk) või nimi (laev). Euroopa Liidus maha- ja ümberlaadimise korral peab kauba saatja teavitama Euroopa Liitu sisenemise piiripunkti. — Lahter I.19: kasutada vajalikku harmoneeritud süsteemi (HS) koodi järgmistes rubriikides: 05.11, 30.02, 35.02 või 35.04. — Lahter I.23: puistlastikonteinerite puhul tuleb lisada konteineri number ja plommi number (kui on). — Lahter I.25: Tehniline otstarve: muuks kui põllumajandusloomade (v.a karusloomad) söödaks, ning lemmikloomatoidu tootmiseks või valmistamiseks. — Lahtrid I.26 ja I.27: täita vastavalt sellele, kas tegemist on transiidiks või impordiks antava sertifikaadiga. — Lahter I.28, kui tegemist on liigiga: valida üks järgmistest: Aves, Ruminantia, Suidae, Mammalia, v.a Ruminantia või Suidae, Pesca, Reptilian. II osa. (1a) ELT L 300, 14.11.2009, lk 1. (1b) ELT L 54, 26.2.2011, lk 1. (2) Mittevajalik läbi kriipsutada. (2a) EÜT L 125, 23.5.1996, lk 3. (2b) EÜT L 125, 23.5.1996, lk 10. (3) EÜT L 147, 31.5.2001, lk 1. (4) ELT L 172, 30.6.2007, lk 84. — Allkirja ja templi värv peavad erinema teksti värvist. — Märkus Euroopa Liidus saadetise eest vastutavale isikule: käesolev sertifikaat on ette nähtud üksnes veterinaarotstarbeks ning peab partiiga kaasas olema kuni kõnealuse partii jõudmiseni Euroopa Liidu piiripunkti. Veterinaarjärelevalve ametnik/inspektor Nimi (trükitähtedega): Kvalifikatsioon ja ametinimetus: Kuupäev: Allkiri: Tempel: |
|
3) |
6. peatüki B osa asendatakse järgmisega: „6. PEATÜKK, B OSA Tervisesertifikaat jahitrofeede või muude esemete kohta, mis koosnevad lindude ja kabiloomade töötlemata tervikosadest ning on ette nähtud lähetamiseks Euroopa Liitu või transiidiks (2) Euroopa Liidu kaudu  Tekst pildi
Tekst pildi
RIIK Veterinaarsertifikaat impordiks ELi I osa. Saadetise andmed I.1 Kauba saatja Nimi Aadress Telefon I.2 Sertifikaadi viitenumber I.2.a I.3 Pädev keskasutus I.4 Pädev kohalik asutus I.5 Kauba saaja Nimi Aadress Sihtnumber Telefon I.6 ELis saadetise eest vastutav isik Nimi Aadress Sihtnumber Telefon I.7 Pärit-oluriik ISO kood I.8 Päritolu-piirkond Kood I.9 Sihtriik ISO kood I.10 Sihtpiirkond Kood I.11 Päritolukoht Nimi Loa number Aadress Nimi Loa number Aadress Nimi Loa number Aadress I.12 Sihtkoht Tolliladu Nimi Loa number Aadress Sihtnumber I.13 Laadimiskoht I.14 Väljumiskuupäev I.15 Transpordivahend Lennuk Laev Raudteevagun Maanteeveok Muu Identifitseerimistunnused Viited dokumentidele I.16 ELi sisenemise piiripunkt I.17 CITESi number/numbrid I.18 Kauba kirjeldus I.19 Kauba kood (HSi kood) I.20 Kogus I.21 I.22 Pakendite arv I.23 Plommi/konteineri number I.24 Pakendiliik  Tekst pildi
Tekst pildi
I.25 Kauba lubatud otstarve: Tehniline otstarve I.26 Transiidiks kolmandasse riiki ELi kaudu Kolmas riik ISO kood I.27 Impordiks või sissepääsuks ELi I.28 Kauba identifitseerimine Liik (teaduslik nimetus) Pakendite arv  Tekst pildi
Tekst pildi
RIIK Lindude ja kabiloomade kõigist tervikosadest koosnevad töötlemata jahitrofeed või muud nendest pärit esemed II. Terviseteave II.a. Sertifikaadi viitenumber II.b. Mina, allakirjutanud veterinaarjärelevalve ametnik, teatan, et olen lugenud ja mõistan Euroopa Parlamendi ja nõukogu määrust (EÜ) nr 1069/2009 (1a) ning komisjoni määrust (EL) nr 142/2011 (1b), eelkõige selle XIV lisa II peatükki, ning seoses eelkirjeldatud jahitrofeedega kinnitan järgmist: (2) kas [II.1 sõraliste, v.a sigade jahitrofeede ja muude nendest pärit esemete puhul: a) ei ole eelneva 12-kuulise ajavahemiku jooksul esinenud (piirkond) suu- ja sõrataudi ega veiste katku ning kõnealuse ajavahemiku jooksul ei ole toimunud nende haiguste vastu vaktsineerimist; ning b) eelkirjeldatud jahitrofeed või muud nendest saadud esemed i) on saadud loomadelt, kes on surmatud kõnealuse piirkonna territooriumil, kust on lubatud eksportida Euroopa Liitu vastavate nakkushaigustele vastuvõtlike koduloomade värsket liha ja kus eelneva 60-päevase ajavahemiku jooksul ei ole kohaldatud jahiloomadele nakkavate haiguste puhangutest tingitud veterinaarpiiranguid; ning ii) on pärit loomadelt, kes on tapetud vähemalt 20 km kaugusel sellise kolmanda riigi või selle osa piiridest, kust ei ole lubatud eksportida Euroopa Liitu sõraliste, v.a sigade töötlemata jahitrofeesid;] (2) või [II.1 metssigade jahitrofeede või muude nendelt pärit esemete puhul: a) ei ole eelneva 12-kuulise ajavahemiku jooksul esinenud (piirkond) sigade katku, sigade Aafrika katku, sigade vesikulaarhaigust, suu- ja sõrataudi ega enteroviirus-entsefalomüeliiti (Tescheni haigus) ning eelneva 12-kuulise ajavahemiku jooksul ei ole toimunud ühegi nimetatud haiguse vastu vaktsineerimist; ning b) eelkirjeldatud jahitrofeed või muud nendelt pärit esemed i) on saadud loomadest, kes on surmatud kõnealusel territooriumil, kust on lubatud eksportida Euroopa Liitu vastavate nakkushaigustele vastuvõtlike koduloomade värsket liha ja kus eelneva 60-päevase ajavahemiku jooksul ei ole kohaldatud sigadele nakkavate haiguste puhangutest tingitud veterinaarpiiranguid; ning ii) on pärit loomadest, kes on surmatud vähemalt 20 km kaugusel sellise kolmanda riigi või selle osa piiridest, kust ei ole lubatud eksportida Euroopa Liitu metssigade töötlemata jahitrofeesid;] (2) või [II.1 kabjaliste jahitrofeede või muude nendest pärit esemete puhul on eelkirjeldatud jahitrofeed või muud esemed saadud kabjalistest metsloomadest, kes on surmatud eespool osutatud eksportiva riigi territooriumil;] (2) või [II.1 uluklindude jahitrofeede või muude nendest pärit esemete puhul: a) ei esine (piirkond) kõrge patogeensusega linnugrippi ega Newcastle’i haigust; ning b) eelkirjeldatud jahitrofeed on pärit looduses elavatest jahilindudest, kes on surmatud kõnealuses piirkonnas, kus eelneva 30-päevase ajavahemiku jooksul ei ole kohaldatud metslindudele nakkavate haiguste puhangutest tingitud veterinaarpiiranguid;] II.2 eelkirjeldatud jahitrofeed või muud eelkirjeldatud esemed on võimaliku hilisema saastamise vältimiseks pärast töötlemist viivitamata pakendatud läbipaistvatesse ja suletud üksikpakenditesse, ilma et need oleksid puutunud kokku muude loomsete saadustega, mis võiksid neid saastada; II osa. Sertifitseerimine  Tekst pildi
Tekst pildi
RIIK Lindude ja kabiloomade kõigist tervikosadest koosnevad töötlemata jahitrofeed või muud nendest pärit esemed II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (2) [II.3. eelkirjeldatud jahitrofeed või muud nendest saadud esemed (2) kas [on saadud muudelt mäletsejalistelt kui veised, lambad ja kitsed.]] (2) või [on saadud veistelt, lammastelt ja kitsedelt ning ei sisalda ega ole saadud järgmisest materjalist: (2) kas [veistelt, lammastelt või kitsedelt saadud materjal, v.a materjal, mis on saadud loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka.]] (2) või [a) Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 999/2001 (3) V lisa punktis 1 nimetatud määratletud riskiteguriga materjal; b) veiste, lammaste või kitsede kontidelt mehhaaniliselt eraldatud lihamass, välja arvatud sellistelt loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt komisjoni otsusele 2007/453/EÜ (4) liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka, kus ei ole esinenud algupäraseid BSE-juhtumeid; c) loomne kõrvalsaadus või toode on saadud veistelt, lammastelt või kitsedelt, kes on pärast uimastamist surmatud kesknärvisüsteemikudede vigastamise teel koljuõõnde viidava pika vardakujulise instrumendiga või koljuõõnde süstitud gaasiga, v.a juhul, kui kõnealused loomad on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE riskiga riikide või piirkondade hulka.]]] Märkused I osa — Lahter I.6: Euroopa Liidus saadetise eest vastutav isik: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist sertifikaadiga Euroopa Liidu kaudu transporditava transiitkauba kohta; Euroopa Liitu imporditava kauba kohta antava sertifikaadi puhul võib selle samuti täita. — Lahtrid I.11 ja I.12: Loa number ettevõtte registreerimisnumber, mille on andnud pädev asutus. — Lahter I.12: Sihtkoht: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist transiitkauba kohta antava sertifikaadiga. Transiitkaupu võib ladustada üksnes vabatsoonis, vabalaos ja tollilaos. — Lahter I.15: registreerimisnumber (raudteevagunid või -konteinerid ja veoautod), lennu number (lennuk) või nimi (laev); teave tuleb esitada Euroopa Liidus maha- ja ümberlaadimise korral. — Lahter I.19: kasutada asjakohast HSi koodi: 05.05; 05.06, 05.07, 05.11; 96.01 või 97.05. — Lahter I.23: puistlastikonteinerite puhul tuleb lisada konteineri number ja plommi number (kui on). — Lahter I.25: Tehniline otstarve: muuks kui loomatoiduks. — Lahtrid I.26 ja I.27: täita vastavalt sellele, kas tegemist on transiidiks või impordiks antava sertifikaadiga. — Lahter I.28: Liik: valida üks järgmistest: Aves, Equidae, Tapiridae, Rhinoceritidae, Antilocaparidae, Bovidae, Camelidae, Cervidae, Giraffidae, Hippopotamindae, Moschidae Suidae, Tayassuidae, Tragulidae ja Elephantidae.  Tekst pildi
Tekst pildi
RIIK Lindude ja kabiloomade kõigist tervikosadest koosnevad töötlemata jahitrofeed või muud nendest pärit esemed II. Terviseteave II.a. Sertifikaadi viitenumber II.b. II osa. (1a) ELT L 300, 14.11.2009, lk 1. (1b) ELT L 54, 26.2.2011, lk 1. (2) Mittevajalik läbi kriipsutada. (3) EÜT L 147, 31.5.2001, lk 1. (4) ELT L 172, 30.6.2007, lk 84. — Allkirja ja templi värv peavad erinema teksti värvist. — Märkus Euroopa Liidus saadetise eest vastutavale isikule: käesolev sertifikaat on koostatud üksnes veterinaariaalastel eesmärkidel ja see peab saadetisega kaasas olema kuni Euroopa Liitu sisenemise piiripunkti jõudmiseni. Veterinaarjärelevalve ametnik/inspektor Nimi (trükitähtedega): Kvalifikatsioon ja ametinimetus: Kuupäev: Allkiri: Tempel: |
|
4) |
8. peatükk asendatakse järgmisega: „8. PEATÜKK Tervisesertifikaat väljaspool söödaahelat kasutatavate loomsete kõrvalsaaduste või kaubanäidiste (2) kohta, mis on ette nähtud lähetamiseks Euroopa Liitu või transiidiks (2) Euroopa Liidu kaudu  Tekst pildi
Tekst pildi
RIIK Veterinaarsertifikaat impordiks ELi I osa. Saadetise andmed I.1 Kauba saatja Nimi Aadress Telefon I.2 Sertifikaadi viitenumber I.2.a I.3 Pädev keskasutus I.4 Pädev kohalik asutus I.5 Kauba saaja Nimi Aadress Sihtnumber Telefon I.6 ELis saadetise eest vastutav isik Nimi Aadress Sihtnumber Telefon I.7 Pärit-oluriik ISO kood I.8 Päritolu-piirkond Kood I.9 Sihtriik ISO kood I.10 Sihtpiirkond Kood I.11 Päritolukoht Nimi Loa number Aadress Nimi Loa number Aadress Nimi Loa number Aadress I.12 Sihtkoht Tolliladu Nimi Loa number Aadress Sihtnumber I.13 Laadimiskoht I.14 Väljumiskuupäev I.15 Transpordivahend Lennuk Laev Raudteevagun Maanteeveok Muu Identifitseerimistunnused Viited dokumentidele I.16 ELi sisenemise piiripunkt I.17 I.18 Kauba kirjeldus I.19 Kauba kood (HSi kood) I.20 Kogus I.21 Toote temperatuur Keskkonna temperatuur Jahutatud Külmutatud I.22 Pakendite arv I.23 Plommi/konteineri number I.24 Pakendiliik  Tekst pildi
Tekst pildi
I.25 Kauba lubatud otstarve: Tehniline otstarve I.26 Transiidiks kolmandasse riiki ELi kaudu Kolmas riik ISO kood I.27 Impordiks või sissepääsuks ELi I.28 Kauba identifitseerimine Ettevõtete loa number Liik (teaduslik nimetus) Kauba liik Tootmisettevõte Pakendite arv Netomass Partii number  Tekst pildi
Tekst pildi
RIIK Väljaspool söödaahelat kasutamiseks ettenähtud või kaubanäidistena lähetatavad loomsed kõrvalsaadused (2) II. Terviseteave II.a. Sertifikaadi viitenumber II.b. Mina, allakirjutanud veterinaarjärelevalve ametnik, teatan, et olen lugenud ja mõistan Euroopa Parlamendi ja nõukogu määrust (EÜ) nr 1069/2009 (1a) ning komisjoni määrust (EL) nr 142/2011 (1b), eelkõige selle XIV lisa II peatükki, ning kinnitan seoses eelkirjeldatud loomsete kõrvalsaadustega järgmist: (2) kas [tegemist on kaubanäidistega, mis koosnevad loomsetest saadustest, mida kavatsetakse kasutada komisjoni määruse (EL) nr 142/2011 I lisa määratluses nr 39 osutatud konkreetseteks sihtuuringuteks või -analüüsideks, ning millel on silt kirjaga „KAUBANÄIDIS – MITTE INIMTOIDUKS“.] (2) või [need vastavad punktis II.1 kehtestatud loomatervisenõuetele]; II.1 eelkirjeldatud loomsed kõrvalsaadused II.1.1 on (2) kas [a) saadud materjalist, mis on imporditud järgmisest kolmandast riigist, selle territooriumilt või osast: (3), kust on lubatud Euroopa Liitu eksportida värsket liha;] (2) ja/või [b) saadud eksportivas kolmandas riigis, selle territooriumil või selle osas (3) loomadest, kes kas: i) on olnud sünnist saadik või vähemalt eelnevad kolm kuud enne tapmise kuupäev sellise kolmanda riigi, selle territooriumil või selle osas, kust on lubatud Euroopa Liitu eksportida värsket liha; ja/või ii) on surmatud kõnealuses kolmandas riigis, selle territooriumil või selle osas vabas looduses (4);] (2) ja/või [c) on saadud munadest, piimast, närilistest, jäneselistest, või veeloomadest või maismaa- või veeselgrootutest;] (2) [II.1.2. muude kui munadest, piimast, närilistest, jäneselistest, villarasvast, veeloomadest, maismaa- või veeselgrootutelt ja töötlemata karusnahkadest saadud materjalide puhul on need saadud loomadelt, kes: (2) kas [a) kes on pärit põllumajandusettevõttest: i) kus ei ole olnud järgmiste haiguste juhtumeid/puhanguid, millele asjaomased loomad on vastuvõtlikud: veiste katku, sigade vesikulaarhaigust, Newcastle’i haigust ega kõrge patogeensusega linnugrippi eelneva 30-päevase ajavahemiku jooksul ning sigade katku ega sigade Aafrika katku eelneva 40-päevase ajavahemiku jooksul; samuti ei ole neid haigusi eelneva 30-päevase ajavahemiku jooksul esinenud 10 km raadiuses asuvates põllumajandusettevõtetes; ning ii) kus ei ole olnud suu- ja sõrataudi juhtumeid/puhanguid eelneva 60-päevase ajavahemiku jooksul; samuti ei ole seda haigust esinenud 25 km raadiuses asuvates põllumajandusettevõtetes eelneva 30-päevase ajavahemiku jooksul; ning b) kes: i) ei ole hukatud mõne epizootilise haiguse likvideerimiseks; ii) kes olid päritoluettevõttes vähemalt 40-päevase ajavahemiku jooksul enne lähetamise kuupäeva ja transporditi otse tapamajja, ilma et nad oleksid kokku puutunud muude loomadega, kes ei vasta samadele tervishoiunõuetele; iii) kes läbisid tapamajas 24-tunnise ajavahemiku jooksul enne tapmist tapaeelse veterinaarkontrolli ja neil ei ilmnenud selliste eelnimetatud haiguste tunnuseid, millele asjaomased loomad on vastuvõtlikud; ning iv) on saadud loomadelt, keda on tapamajas enne tapmist või surmamist ja selle ajal koheldud kooskõlas liidu õigusaktidega ning nad vastasid vähemalt nõukogu määruse (EÜ) nr 1099/2009 (5) II ja III peatükis sätestatud nõuetele] II osa. Sertifitseerimine  Tekst pildi
Tekst pildi
RIIK Väljaspool söödaahelat kasutamiseks ettenähtud või kaubanäidistena lähetatavad loomsed kõrvalsaadused (2) II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (2) või [a) kes püüti kinni ja surmati vabas looduses piirkonnas, i) mille ümber 25 km raadiuses ei ole esinenud ühegi alljärgneva haiguse juhtumit/puhangut, millele asjaomased loomad on vastuvõtlikud: suu- ja sõrataudi, veiste katku, Newcastle’i haigust ega kõrge patogeensusega linnugrippi eelneva 30-päevase ajavahemiku jooksul ning sigade katku ega sigade Aafrika katku eelneva 40-päevase ajavahemiku jooksul; ning ii) mis asub enam kui 20 km kaugusel sellise kolmanda riigi või riigi osa territooriumi piirist, kust kõnealusel ajal ei ole lubatud asjaomast materjali Euroopa Liitu eksportida; ning b) kes pärast surmamist transporditi 12 tunnise ajavahemiku jooksul jahutamisele kas kõigepealt kogumiskeskusesse ja vahetult pärast seda ulukiliha töötlevasse ettevõttesse või otse ulukiliha töötlevasse ettevõttesse;]] (2) [II.1.3. muude kui püütud looduslikest kaladest või selgrootutest saadud materjalide puhul on need saadud ettevõttest, mille ümber 10 km raadiuses ei ole eelneva 30-päevase ajavahemiku jooksul olnud punktis II.1.2 osutatud selliste haiguste juhtumeid/puhanguid, millele asjaomased loomad on vastuvõtlikud, või kui üks sellise haiguse juhtum/puhang on esinenud, siis on luba töödelda toormaterjali Euroopa Liitu eksportimiseks antud alles pärast seda, kui kogu liha on ettevõttest kõrvaldatud ja ettevõte on veterinaarjärelevalve ametniku järelevalve all täielikult puhastatud ja desinfitseeritud;] II.1.4 need on saadud ja valmistatud nii, et need ei ole kokku puutunud eespool kirjeldatud, nõuetele mittevastava materjaliga, ning käideldud viisil, mis hoiab ära saastumise haigusetekitajatega; II.1.5 need on pakendatud kasutamata lekkekindlatesse või enne kasutamist puhastatud ja desinfitseeritud pakenditesse, ja kui tegemist on muude kui postipakiga lähetatavate kaubasaadetistega, pädeva asutuse vastutusel plommiga varustatud mahutitesse, millel on silt kirjaga „LOOMSED KÕRVALSAADUSED – ÜKSNES VÄLJASPOOL SÖÖDAAHELAT KASUTATAVATE TOODETE VALMISTAMISEKS“ ning Euroopa Liidus asuva sihtettevõtte nimi ja aadress; II.1.6 need koosnevad ainult järgmistest loomsetest kõrvalsaadustest: (2) kas [- tapetud loomade rümbad ja loomade kehaosad või tapetud ulukite kehad või kehaosad, mida peetakse inimtoiduks kõlblikuks vastavalt Euroopa Liidu õigusaktidele, kuid on vastupidiselt deklareeritud loomsete kõrvalsaadustena ärilistel kaalutustel;] (2) ja/või [- rümbad ja järgmised kehaosad tapamajas tapetud loomadelt, kes tunnistati tapaeelse kontrolli põhjal inimtoiduks tapmiseks kõlblikuks, või kehad ja järgmised kehaosad ulukitelt, kes tapeti kasutamiseks inimtoiduks vastavalt Euroopa Liidu õigusaktidele: i) loomade rümbad või kehad ja kehaosad, mis on tunnistatud inimtoiduks kõlbmatuks vastavalt Euroopa Liidu õigusaktidele, kuid millel ei ilmne mingeid inimestele või loomadele nakkavate haiguste nähte; ii) kodulindude pead; iii) loomade toornahad ja nahad, kaasa arvatud nahalõiked ja -jäägid, sarved ja jalad, kaasa arvatud randme- ja kämblaluud, pöiad, pöiapärad ja varbalülid; iv) seaharjased; v) suled;] (2) ja/või [- loomsed kõrvalsaadused kodulindudest ja jäneselistest, kes on tapetud põllumajandusettevõttes vastavalt Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 853/2004 (2a) artikli 1 lõike 3 punktile d ja millel ei ole ilmnenud inimestele või loomadele nakkava haiguse nähte;] (2) ja/või [- veri tapamajas tapetud loomadelt, kellel ei ole ilmnenud mingeid vere kaudu inimestele või loomadele nakkava haiguse nähte ja kes tunnistati tapaeelsel ülevaatusel inimtoiduks kõlblikuks vastavalt Euroopa Liidu õigusaktidele;]  Tekst pildi
Tekst pildi
RIIK Väljaspool söödaahelat kasutamiseks ettenähtud või kaubanäidistena lähetatavad loomsed kõrvalsaadused (2) II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (2) ja/või [- loomsed kõrvalsaadused, mis on tekkinud inimtoiduks ette nähtud toodete valmistamisel, sealhulgas rasvatustatud kondid, kõrned ning piima töötlemisel tekkinud tsentrifuugimis- või separeerimissete;] (2) ja/või [- loomsed tooted või loomseid tooteid sisaldav toit, mis ei ole enam ette nähtud inimtoiduks kas ärilistel kaalutlustel, tootmis- või pakendamisdefektide või muude puuduste tõttu, mis ei ohusta inimeste ega loomade tervist;] (2) ja/või [- loomne lemmikloomatoit ja sööt või loomseid kõrvalsaadusi või nendest saadud tooteid sisaldav sööt, mis ei ole enam ette nähtud söödana kasutamiseks kas ärilistel kaalutlustel, tootmis- või pakendamisdefektide või muude puuduste tõttu, mis ei ohusta inimeste ega loomade tervist;] (2) ja/või [- veri, platsenta, vill, suled, karvad, sarved, kabja- ja sõralõikmed ning toorpiim elusloomadelt, kellel ei ole ilmnenud mingite asjaomase toote kaudu inimestele või loomadele nakkava haiguse nähte;] (2) ja/või [- veeloomad (v.a mereimetajad) ja nende kehaosad, millel ei ole ilmnenud mingeid inimestele või loomadele nakkavate haiguste nähte;] (2) ja/või [- kõrvalsaadused veeloomadest, mis on saadud ettevõtetest, kus valmistatakse inimtoiduks ettenähtud tooteid;] (2) ja/või [- järgmine materjal loomadelt, kel ei ole ilmnenud sellise materjali kaudu inimestele või loomadele nakkava haiguse nähte: i) pehme koe või lihaga karpide või koorikloomade kojad või koorikud; ii) järgmine maismaaloomadelt pärinev materjal: — kõrvalsaadused haudejaamadest, — munad, — munade kõrvalsaadused, sh munakoored; iii) ärilisel eesmärgil tapetud ööpäevased tibud;] (2) ja/või [- kõrvalsaadused selgrootutest vee- või maismaaloomadest, kes ei kuulu inimestele või loomadele patogeensete liikide hulka;] (2) ja/või [- näriliste ja jäneseliste hulka kuuluvad loomad ja nende kehaosad, välja arvatud 1. kategooria materjal, millele on osutatud määruse (EÜ) nr 1069/2009 artikli 8 punkti a alapunktides iii, iv ja v, ning 2. kategooria materjal, millele on osutatud kõnealuse määruse artikli 9 punktides a–g;] (2) ja/või [- sellistelt surnud loomadelt saadud karusnahk, kellel ei ilmnenud mingeid asjaomaste toodete kaudu inimestele või loomadele nakkavate haiguste kliinilisi tunnuseid;] II.1.7 neid on päritoluettevõttes kooskõlas Euroopa Liidu õigusaktidega sügavkülmutatud või säilitatud viisil, mis hoiab ära riknemise sihtettevõttesse lähetamise ja tarnimise vahelisel ajal. (2) (6) [II.1.8. (2) (7) kas [II.1.8.1 käesolevas saadetises sisalduvad loomsed kõrvalsaadused on pärit loomadest, keda on peetud punktis II.1.1. osutatud sellises riigis, selle territooriumil või selle osas, kus korraldatakse ametliku järelevalve all korrapäraseid koduveiste suu- ja sõrataudi vastaseid vaktsineerimisprogramme.]]  Tekst pildi
Tekst pildi
RIIK Väljaspool söödaahelat kasutamiseks ettenähtud või kaubanäidistena lähetatavad loomsed kõrvalsaadused (2) II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (2) (8) ja/või [II.1.8.2 käesolevas saadetises sisalduvad loomsed kõrvalsaadused koosnevad rupsist või konditustatud lihast saadud loomsetest kõrvalsaadustest.]] (2) [II.1.9. eelkirjeldatud loomsed kõrvalsaadused (2) kas [on saadud muudelt mäletsejalistelt kui veised, lambad ja kitsed.]] (2) või [on saadud veistelt, lammastelt ja kitsedelt ning ei sisalda ega ole saadud järgmisest materjalist: (2) kas [veistelt, lammastelt või kitsedelt saadud materjal, v.a materjal, mis on saadud loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka.]] (2) või [a) Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 999/2001 (9) V lisa punktis 1 nimetatud määratletud riskiteguriga materjal; b) veiste, lammaste või kitsede kontidelt mehhaaniliselt eraldatud lihamass, välja arvatud sellistelt loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt komisjoni otsusele 2007/453/EÜ (10) liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka, kus ei ole esinenud algupäraseid BSE-juhtumeid; c) loomne kõrvalsaadus või toode on saadud veistelt, lammastelt või kitsedelt, kes on pärast uimastamist surmatud kesknärvisüsteemikudede vigastamise teel koljuõõnde viidava pika vardakujulise instrumendiga või koljuõõnde süstitud gaasiga, v.a juhul, kui kõnealused loomad on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE riskiga riikide või piirkondade hulka.]]] II.1.10 eelkirjeldatud loomsed kõrvalsaadused (2) kas [ei sisalda lammastelt või kitsedelt saadud piima ega piimatooteid ega ole ette nähtud põllumajandusloomade (v.a karusloomad) söödaks.] (2) või [sisaldavad lammastelt või kitsedelt saadud piima ja piimatooteid ning on ette nähtud põllumajandusloomade (v.a karusloomad) söödaks ning piim ja piimatooted: a) on saadud lammastelt ja kitsedelt, keda on sünnist saadik pidevalt kasvatatud riigis, kus on täidetud järgmised tingimused: i) klassikalise skreipi juhtumitest teatamine on kohustuslik; ii) riigis on olemas teadlikustamis-, seire- ja järelevalvesüsteem; iii) põllumajandusettevõtete suhtes, kus on lambad või kitsed, kohaldatakse TSE kahtluse või klassikalise skreipi kinnitamise korral ametlikke piiranguid; iv) klassikalisse skreipisse haigestunud lambad ja kitsed tapetakse ja hävitatakse; v) lammaste ja kitsede söötmine mäletsejalistelt saadud liha-kondijahu või kõrnetega, nagu on määratletud OIE maismaaloomade tervise koodeksis, on olnud keelatud ja seda keeldu on tegelikult rakendatud kogu riigis vähemalt eelneva seitsmeaastase ajavahemiku jooksul; b) on pärit ettevõtetest, kus puuduvad TSE kahtluse tõttu kehtestatud ametlikud piirangud; c) lamba- või kitsepiim ja piimatooted on pärit põllumajandusettevõtetest, kus eelneva seitsmeaastase ajavahemiku jooksul ei ole diagnoositud klassikalise skreipi juhtumit või kus pärast klassikalise skreipi juhtumi kinnitamist:  Tekst pildi
Tekst pildi
RIIK Väljaspool söödaahelat kasutamiseks ettenähtud või kaubanäidistena lähetatavad loomsed kõrvalsaadused (2) II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (2) kas [on põllumajandusettevõttes surmatud ja hävitatud või tapetud kõik lambad ja kitsed, v.a ARR/ARR-genotüübiga tõujäärad, vähemalt ühe ARR-alleeliga ja ilma VRQ-alleelita aretusuted ning teised vähemalt ühe ARR-alleeliga lambad;] (2) või [on tapetud ja hävitatud kõik loomad, kelle puhul leidis kinnitust nakatumine klassikalisse skreipisse, ning ettevõttes on toimunud viimasest klassikalise skreipi juhtumi kinnitamise kuupäevast alates vähemalt kahe aasta jooksul tõhustatud TSE seire, mis hõlmab muu hulgas määruse (EÜ) nr 999/2001 X lisa C peatüki punktis 3.2 sätestatud laboratoorsete meetodite kohaselt tehtud ja negatiivseid tulemusi andnud kontrolle TSE esinemise suhtes kõikide järgmiste üle 18 kuu vanuste loomade, välja arvatud ARR/ARR-genotüübiga lammaste puhul: — inimtoiduks tapetud loomad ning — loomad, kes on põllumajandusettevõttes surnud või tapetud, ent keda ei hukatud haiguste likvideerimise programmi raames.]] Märkused I osa — Lahter I.6: Euroopa Liidus saadetise eest vastutav isik: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist sertifikaadiga Euroopa Liidu kaudu transporditava transiitkauba kohta; Euroopa Liitu imporditava kauba kohta antava sertifikaadi puhul võib selle samuti täita. — Lahter I.11: Kaubanäidisteks või analüüsideks ettenähtud saadetiste puhul: märkida üksnes ettevõtte nimi ja aadress. — Lahtrid I.11 ja I.12: Loa number: ettevõtte registreerimisnumber, mille on andnud pädev asutus. — Lahter I.12: Sihtkoht: see lahter tuleb täita järgmiselt: — väljaspool söödaahelat kasutatavate toodete valmistamiseks ettenähtud toodete puhul: ainult siis, kui sertifikaat antakse transiitkauba kohta. Transiitkaupu võib ladustada üksnes vabatsoonis, vabalaos ja tollilaos. — kaubanäidisteks ja analüüsideks ettenähtud tooted: vajaduse korral pädeva asutuse antud loas esitatud ettevõte Euroopa Liidus. — Lahter I.15: tuleb esitada registreerimisnumber (raudteevagunid või -konteinerid ja veoautod), lennu number (lennuk) või nimi (laev). Euroopa Liidus maha- ja ümberlaadimise korral peab kauba saatja teavitama Euroopa Liitu sisenemise piiripunkti. — Lahter I.19: kasutada vajalikku harmoneeritud süsteemi (HS) koodi järgmistes rubriikides: 04.01; 04.02; 04.03; 04.04; 04.08; 05.05; 05.06, 05.07; 05.11.91; 05.11.99, 23.01 või 30.01. — Lahter I.23: puistlastikonteinerite puhul tuleb lisada konteineri number ja plommi number (kui on). — Lahter I.25: Tehniline otstarve: muuks kui põllumajandusloomade (v.a karusloomad) söödaks, ning lemmikloomatoidu tootmiseks või valmistamiseks. — Lahter I.25: selle sertifikaadi puhul hõlmab „tehniline otstarve“ kaubanäidisena kasutamist. — Lahtrid I.26 ja I.27: välja arvatud kaubanäidised, mida ei saadeta transiidi korras; täita vastavalt sellele, kas tegemist on transiidiks või impordiks antava sertifikaadiga. — Lahter I.28: — väljaspool söödaahelat kasutatavate toodete valmistamiseks ettenähtud toodete puhul: Tootmisettevõte: märkida tunnustatud ettevõtte veterinaarloa number. — konkreetseteks tehnoloogilisteks sihtuuringuteks või -analüüsideks ettenähtud toodete puhul: vajaduse korral pädeva asutuse antud loas esitatud ettevõte Euroopa Liidus. — Liik: valida üks järgmistest: Aves, Ruminantia, Suidae, Mammalia, v.a Ruminantia või Suidae, Pesca, Mollusca, Crustacea, selgrootud, v.a Mollusca ja Crustacea.  Tekst pildi
Tekst pildi
RIIK Väljaspool söödaahelat kasutamiseks ettenähtud või kaubanäidistena lähetatavad loomsed kõrvalsaadused (2) II. Terviseteave II.a. Sertifikaadi viitenumber II.b. II osa. (1a) ELT L 300, 14.11.2009, lk 1. (1b) ELT L 54, 26.2.2011, lk 1. (2) Mittevajalik läbi kriipsutada. (2a) ELT L 139, 30.4.2004, lk 55. (3) Eksportiva riigi nimi ja ISO kood, mis on sätestatud — komisjoni määruse (EL) nr 206/2010 (ELT L 73, 20.3.2010, lk 1) II lisa 1. osas; — komisjoni määruse (EL) nr 798/2008 (ELT L 226, 23.8.2008, lk 1) I lisas; — komisjoni määruse (EL) nr 119/2009 (ELT L 39, 10.2.2009, lk 12) I lisas. Vajaduse korral tuleb lisada käesolevas allmärkuses osutatud määrustes (EL) nr 206/2010, (EÜ) nr 798/2008 ja (EÜ) nr 119/2009 viidatud territooriumide ja nende osade ISO-kood (kui seda kohaldatakse asjaomaste vastuvõtlike liikide suhtes). (4) Ainult selliste riikide puhul, millest on lubatud Euroopa Liitu importida inimtoiduks ettenähtud samade ulukiliikide liha. (5) ELT L 303, 18.11.2009, lk 1. (6) Lisakinnitused tuleb anda, kui kodumäletsejalistest saadud materjal on pärit Lõuna-Ameerika või Lõuna-Aafrika riikidest või nende osadest, kust on Euroopa Liitu lubatud eksportida üksnes kodumäletsejaliste laagerdunud ja konditustatud värsket liha, mis on ette nähtud inimtoiduks. Lubatud on ka veiste terviklikud mälumislihased, millesse on tehtud sisselõiked vastavalt Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 854/2004 I lisa IV jao I peatüki osale B.1 (ELT L 139, 30.4.2004, lk 206). (7) Ainult teatavate Lõuna-Ameerika riikide puhul. (8) Ainult teatavate Lõuna-Ameerika ja Lõuna-Aafrika riikide puhul. (9) EÜT L 147, 31.5.2001, lk 1. (10) ELT L 172, 30.6.2007, lk 84. — Allkirja ja templi värv peavad erinema teksti värvist. — Märkus Euroopa Liidus saadetise eest vastutavale isikule: käesolev sertifikaat on koostatud üksnes veterinaariaalastel eesmärkidel ja see peab saadetisega kaasas olema kuni Euroopa Liitu sisenemise piiripunkti jõudmiseni. Veterinaarjärelevalve ametnik/inspektor Nimi (trükitähtedega): Kvalifikatsioon ja ametinimetus: Kuupäev: Allkiri: Tempel: |
|
(5) |
10. peatüki A osa, 10. peatüki B osa, 11. ja 12. peatükk asendatakse järgmistega: „10. PEATÜKK, A OSA Tervisesertifikaat muuks otstarbeks kui inimtoiduks ettenähtud sulatatud rasvade kohta, mida kasutatakse söödamaterjalina ja mis on ette nähtud lähetamiseks Euroopa Liitu või transiidiks (2) Euroopa Liidu kaudu  Tekst pildi
Tekst pildi
RIIK Veterinaarsertifikaat impordiks ELi I osa. Saadetise andmed I.1 Kauba saatja Nimi Aadress Telefon I.2 Sertifikaadi viitenumber I.2.a I.3 Pädev keskasutus I.4 Pädev kohalik asutus I.5 Kauba saaja Nimi Aadress Sihtnumber Telefon I.6 ELis saadetise eest vastutav isik Nimi Aadress Sihtnumber Telefon I.7 Pärit-oluriik ISO kood I.8 Päritolu-piirkond Kood I.9 Sihtriik ISO kood I.10 Sihtpiirkond Kood I.11 Päritolukoht Nimi Loa number Aadress Nimi Loa number Aadress Nimi Loa number Aadress I.12 Sihtkoht Tolliladu Nimi Loa number Aadress Sihtnumber I.13 Laadimiskoht I.14 Väljumiskuupäev I.15 Transpordivahend Lennuk Laev Raudteevagun Maanteeveok Muu Identifitseerimistunnused Viited dokumentidele I.16 ELi sisenemise piiripunkt I.17 I.18 Kauba kirjeldus I.19 Kauba kood (HSi kood) I.20 Kogus I.21 Toote temperatuur Keskkonna temperatuur Jahutatud Külmutatud I.22 Pakendite arv I.23 Plommi/konteineri number I.24 Pakendiliik  Tekst pildi
Tekst pildi
I.25 Kauba lubatud otstarve: Loomasööt Lemmikloomatoidu tootmine Tehniline otstarve I.26 Transiidiks kolmandasse riiki ELi kaudu Kolmas riik ISO kood I.27 Impordiks või sissepääsuks ELi I.28 Kauba identifitseerimine Ettevõtete loa number Liik (teaduslik nimetus) Kauba liik Tootmisettevõte Pakendite arv Netomass Partii number  Tekst pildi
Tekst pildi
RIIK Muuks otstarbeks kui inimtoiduks ettenähtud sulatatud rasvad, mida kasutatakse söödamaterjalina II. Terviseteave II.a. Sertifikaadi viitenumber II.b. Mina, allakirjutanud veterinaarjärelevalve ametnik, teatan, et olen lugenud ja mõistan Euroopa Parlamendi ja nõukogu määrust (EÜ) nr 1069/2009 (1a), eriti selle artiklit 10 ning komisjoni määrust (EL) nr 142/2011 (1b), eriti selle XIV lisa II peatükki, ning kinnitan seoses eelkirjeldatud sulatatud rasvadega järgmist: II.1 tegemist on sulatatud rasvadega, mis vastavad alljärgnevatele tervishoiunõuetele; II.2 tegemist on sulatatud rasvadega, mis ei ole ette nähtud inimtoiduks; II.3 need on valmistatud ja ladustatud ettevõttes, mida pädev asutus on määruse (EÜ) nr 1069/2009 artikli 24 kohaselt tunnustanud ning mis on pädeva asutuse järelevalve all või mida pädev asutus on haigusetekitajate hävitamise suhtes Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 853/2004 (3), artikli 4 lõike 2 kohaselt kontrollinud; II.4 nende valmistamisel on kasutatud üksnes järgmisi loomseid kõrvalsaadusi: (2) kas [- tapetud loomade rümbad ja loomade kehaosad või tapetud ulukite kehad või kehaosad, mis on kõlblikud inimtoiduks vastavalt Euroopa Liidu õigusaktidele, kuid mis ei ole ärilistel kaalutlustel inimtoiduks ette nähtud;] (2) ja/või [- rümbad ja järgmised kehaosad tapamajas tapetud loomadelt, kes tunnistati tapaeelse kontrolli põhjal inimtoiduks tapmiseks kõlblikuks, või kehad ja järgmised kehaosad ulukitelt, kes tapeti kasutamiseks inimtoiduks vastavalt Euroopa Liidu õigusaktidele: i) loomade rümbad või kehad ja kehaosad, mis on tunnistatud inimtoiduks kõlbmatuks vastavalt Euroopa Liidu õigusaktidele, kuid millel ei ole ilmnenud mingeid inimestele või loomadele nakkava haiguse nähte; ii) kodulindude pead; iii) loomade toornahad ja nahad, kaasa arvatud nahalõiked ja -jäägid, sarved ja jalad, kaasa arvatud randme- ja kämblaluud, pöiad, pöiapärad ja varbalülid; iv) seaharjased; v) suled;] (2) ja/või [- veri tapamajas tapetud loomadelt, kellel ei ole ilmnenud mingeid vere kaudu inimestele või loomadele nakkava haiguse nähte ja kes tunnistati tapaeelsel ülevaatusel inimtoiduks kõlblikuks vastavalt Euroopa Liidu õigusaktidele;] (2) ja/või [- loomsed kõrvalsaadused, mis on tekkinud inimtoiduks ette nähtud toodete valmistamisel, sealhulgas rasvatustatud kondid, kõrned ning piima töötlemisel tekkinud tsentrifuugimis- või separeerimissete;] (2) ja/või [- loomsed tooted või loomseid tooteid sisaldav toit, mis ei ole enam ette nähtud inimtoiduks kas ärilistel kaalutlustel, tootmis- või pakendamisdefektide või muude puuduste tõttu, mis ei ohusta inimeste ega loomade tervist;] (2) ja/või [- loomne lemmikloomatoit ja sööt või loomseid kõrvalsaadusi või nendest saadud tooteid sisaldav sööt, mis ei ole enam ette nähtud söödana kasutamiseks kas ärilistel kaalutlustel, tootmis- või pakendamisdefektide või muude puuduste tõttu, mis ei ohusta inimeste ega loomade tervist;] (2) ja/või [- veri, platsenta, vill, suled, karvad, sarved, kabja- ja sõralõikmed ning toorpiim elusloomadelt, kellel ei ole ilmnenud mingite asjaomase toote kaudu inimestele või loomadele nakkava haiguse nähte;] II osa. Sertifitseerimine  Tekst pildi
Tekst pildi
RIIK Muuks otstarbeks kui inimtoiduks ettenähtud sulatatud rasvad, mida kasutatakse söödamaterjalina II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (2) ja/või [- veeloomad (v.a mereimetajad) ja nende kehaosad, millel ei ole ilmnenud mingeid inimestele või loomadele nakkavate haiguste nähte;] (2) ja/või [- kõrvalsaadused veeloomadest, mis on saadud ettevõtetest, kus valmistatakse inimtoiduks ettenähtud tooteid;] (2) ja/või [- järgmine materjal loomadelt, kel ei ole ilmnenud sellise materjali kaudu inimestele või loomadele nakkava haiguse nähte: i) pehme koe või lihaga karpide või koorikloomade kojad või koorikud; ii) järgmine maismaaloomadelt pärinev materjal: — kõrvalsaadused haudejaamadest, — munad, — munade kõrvalsaadused, sh munakoored; iii) ärilisel eesmärgil tapetud ööpäevased tibud;] II.5 (2) kas [- sigadelt pärit materjal on pärit riigist või selle territooriumi osast, kus eelneva 24-kuulise ajavahemiku jooksul ei ole esinenud suu- ja sõrataudi ning eelneva 12-kuulise ajavahemiku jooksul sigade katku ega sigade Aafrika katku;] (2) ja/või [- kodulindudelt pärit materjal on pärit riigist või selle territooriumi osast, kus eelneva6-kuulise ajavahemiku jooksul ei ole esinenud Newcastle’i haigust ega linnugrippi;] (2) ja/või [- mäletsejalistelt pärit materjal on pärit riigist või selle territooriumi osast, kus eelneva24-kuulise ajavahemiku jooksul ei ole esinenud suu- ja sõrataudi ning eelneva 12-kuulise ajavahemiku jooksul veiste katku;] (2) ja/või [- kui punktis II.5 osutatud asjakohase ajavahemiku jooksul on esinenud mõne punktis II.5 osutatud haiguse puhang ja sulatatud rasvad on saadud vastuvõtlikult liigilt, on need läbinud kuumtöötluse vähemalt temperatuuril 70 °C 30 minuti jooksul või vähemalt temperatuuril 90 °C vähemalt 15 minuti jooksul; ja kriitiliste kontrollpunktide andmed registreeritakse ja säilitatakse, et omanik, ettevõtja või nende esindaja ning vajaduse korral pädev asutus saaksid jälgida ettevõtte tööd; need andmed peavad hõlmama järgmist: osakese suurus, kriitiline temperatuur ning vajaduse korral töötlemise absoluutne aeg, rõhk, tooraine etteandmise kiirus ja rasva tsirkuleerimise kiirus.] II.6 mäletsejalistest saadud sulatatud rasvad peavad olema puhastatud nii, et allesjäävad lahustumatud lisaained ei ületa 0,15 massiprotsenti; II.7 sulatatud rasvad: a) neid on haigusetekitajate hävitamiseks töödeldud määruse (EL) nr 142/2011 X lisa II peatüki 3. jao nõuete kohaselt või määruse (EÜ) nr 853/2004 III lisa XII jao kohaselt; ning (2) kas [b) need on pakendatud kasutamata mahutitesse või puhastatud mahutitesse, mida on saastumise vältimiseks vajaduse korral desinfitseeritud, ning mahutite saastumise vältimiseks on võetud kõik vajalikud ettevaatusabinõud;] (2) või [b) lahtiselt transportimise korral on toru, pumbad ja tsisternid ning kõik muud mahutid või paakautod, mida kasutatakse toote transportimisel tootmisettevõttest otse laevale või sadamatsisternidesse või otse ettevõtetesse, enne kasutamist pädeva asutuse vastutusel üle kontrollitud ja puhtaks tunnistatud;] millel on sildid kirjaga „MITTE INIMTOIDUKS“;  Tekst pildi
Tekst pildi
RIIK Muuks otstarbeks kui inimtoiduks ettenähtud sulatatud rasvad, mida kasutatakse söödamaterjalina II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (2) [II.8. eelkirjeldatud sulatatud rasvad (2) kas [on saadud muudelt mäletsejalistelt kui veised, lambad ja kitsed.]] (2) või [on saadud veistelt, lammastelt ja kitsedelt ning ei sisalda järgmist materjali ega ole sellest saadud: (2) kas [veistelt, lammastelt või kitsedelt saadud materjal, v.a materjal, mis on saadud loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka.]] (2) või [a) Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 999/2001 (4) V lisa punktis 1 nimetatud määratletud riskiteguriga materjal; b) veiste, lammaste või kitsede kontidelt mehhaaniliselt eraldatud lihamass, välja arvatud sellistelt loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt komisjoni otsusele 2007/453/EÜ (5) liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka, kus ei ole esinenud algupäraseid BSE-juhtumeid; c) loomne kõrvalsaadus või toode on saadud veistelt, lammastelt või kitsedelt, kes on pärast uimastamist surmatud kesknärvisüsteemikudede vigastamise teel koljuõõnde viidava pika vardakujulise instrumendiga või koljuõõnde süstitud gaasiga, v.a juhul, kui kõnealused loomad on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE riskiga riikide või piirkondade hulka.]]] II.9 eelkirjeldatud sulatatud rasvad (2) kas [ei sisalda lammastelt või kitsedelt saadud piima ega piimatooteid ega ole ette nähtud põllumajandusloomade (v.a karusloomad) söödaks.] (2) või [sisaldavad lammastelt või kitsedelt saadud piima ja piimatooteid ning on ette nähtud põllumajandusloomade (v.a karusloomad) söödaks ning piim ja piimatooted: a) on saadud lammastelt ja kitsedelt, keda on sünnist saadik pidevalt kasvatatud riigis, kus on täidetud järgmised tingimused: i) klassikalise skreipi juhtumitest teatamine on kohustuslik; ii) riigis on olemas teadlikustamis-, seire- ja järelevalvesüsteem; iii) põllumajandusettevõtete suhtes, kus on lambad või kitsed, kohaldatakse TSE kahtluse või klassikalise skreipi kinnitamise korral ametlikke piiranguid; iv) klassikalisse skreipisse haigestunud lambad ja kitsed tapetakse ja hävitatakse; v) lammaste ja kitsede söötmine mäletsejalistelt saadud liha-kondijahu või kõrnetega, nagu on määratletud OIE maismaaloomade tervise koodeksis, on olnud keelatud ja seda keeldu on tegelikult rakendatud kogu riigis vähemalt eelneva seitsmeaastase ajavahemiku jooksul; b) on pärit ettevõtetest, kus puuduvad TSE kahtluse tõttu kehtestatud ametlikud piirangud; c) on pärit põllumajandusettevõtetest, kus vähemalt viimase seitsme aasta jooksul ei ole diagnoositud klassikalise skreipi juhtumit või kus pärast klassikalise skreipi juhtumi kinnitamist:  Tekst pildi
Tekst pildi
RIIK Muuks otstarbeks kui inimtoiduks ettenähtud sulatatud rasvad, mida kasutatakse söödamaterjalina II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (2) kas [on põllumajandusettevõttes surmatud ja hävitatud või tapetud kõik lambad ja kitsed, v.a ARR/ARR-genotüübiga tõujäärad, vähemalt ühe ARR-alleeliga ja ilma VRQ-alleelita aretusuted ning teised vähemalt ühe ARR-alleeliga lambad;] (2) või [on tapetud ja hävitatud kõik loomad, kelle puhul leidis kinnitust nakatumine klassikalisse skreipisse, ning ettevõttes on toimunud viimasest klassikalise skreipi juhtumi kinnitamise kuupäevast alates vähemalt kaheaastase ajavahemiku jooksul tõhustatud TSE seire, mis hõlmab muu hulgas määruse (EÜ) nr 999/2001 X lisa C peatüki punktis 3.2 sätestatud laboratoorsete meetodite kohaselt tehtud ja negatiivseid tulemusi andnud kontrolle TSE esinemise suhtes kõikide järgmiste üle 18 kuu vanuste loomade, välja arvatud ARR/ARR-genotüübiga lammaste puhul: — inimtoiduks tapetud loomad ning — loomad, kes on põllumajandusettevõttes surnud või tapetud, ent keda ei hukatud haiguste likvideerimise programmi raames.]] Märkused I osa — Lahter I.6: Euroopa Liidus saadetise eest vastutav isik: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist sertifikaadiga Euroopa Liidu kaudu transporditava transiitkauba kohta; Euroopa Liitu imporditava kauba kohta antava sertifikaadi puhul võib selle samuti täita. — Lahter I.12: Sihtkoht: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist transiitkauba sertifikaadiga. Transiitkaupu võib ladustada üksnes vabatsoonis, vabalaos ja tollilaos. — Lahter I.15: registreerimisnumber (raudteevagunid või -konteinerid ja veoautod), lennu number (lennuk) või nimi (laev); teave tuleb esitada Euroopa Liidus maha- ja ümberlaadimise korral. — Lahter I.19: kasutada asjakohast HSi koodi: 04.05; 15.01; 15.02; 15.03; 15.04; 15.05; 15.06; 15.16.10 või 15.18. — Lahter I.23: puistlastikonteinerite puhul tuleb lisada konteineri number ja plommi number (kui on). — Lahter I.25: Tehniline otstarve: muuks kui põllumajandusloomade (v.a karusloomad või lemmikloomad) söödaks, ning lemmikloomatoidu tootmiseks või valmistamiseks. — Lahtrid I.26 ja I.27: täita vastavalt sellele, kas tegemist on transiidiks või impordiks antava sertifikaadiga. — Lahter I.28: — Liik: valida üks järgmistest: mäletsejalised, muud kui mäletsejalised — Tootmisettevõte: märkida töötlemisettevõtte registrinumber. II osa. (1a) ELT L 300, 14.11.2009, lk 1. (1b) ELT L 54, 26.2.2011, lk 1. (2) Mittevajalik läbi kriipsutada. (3) ELT L 139, 30.4.2004, lk 55.  Tekst pildi
Tekst pildi
RIIK Muuks otstarbeks kui inimtoiduks ettenähtud sulatatud rasvad, mida kasutatakse söödamaterjalina II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (4) EÜT L 147, 31.5.2001, lk 1. (5) ELT L 172, 30.6.2007, lk 84. — Allkirja ja templi värv peavad erinema teksti värvist. — Märkus Euroopa Liidus saadetise eest vastutavale isikule: käesolev sertifikaat on ette nähtud üksnes veterinaarotstarbeks ning peab partiiga kaasas olema kuni kõnealuse partii jõudmiseni Euroopa Liidu piiripunkti. Veterinaarjärelevalve ametnik/inspektor Nimi (trükitähtedega): Kvalifikatsioon ja ametinimetus: Kuupäev: Allkiri: Tempel: 10. PEATÜKK, B OSA Tervisesertifikaat muuks otstarbeks kui inimtoiduks ettenähtud ja väljaspool söödaahelat kasutatavate sulatatud rasvade kohta, mis on ette nähtud lähetamiseks Euroopa Liitu või transiidiks (2) Euroopa Liidu kaudu 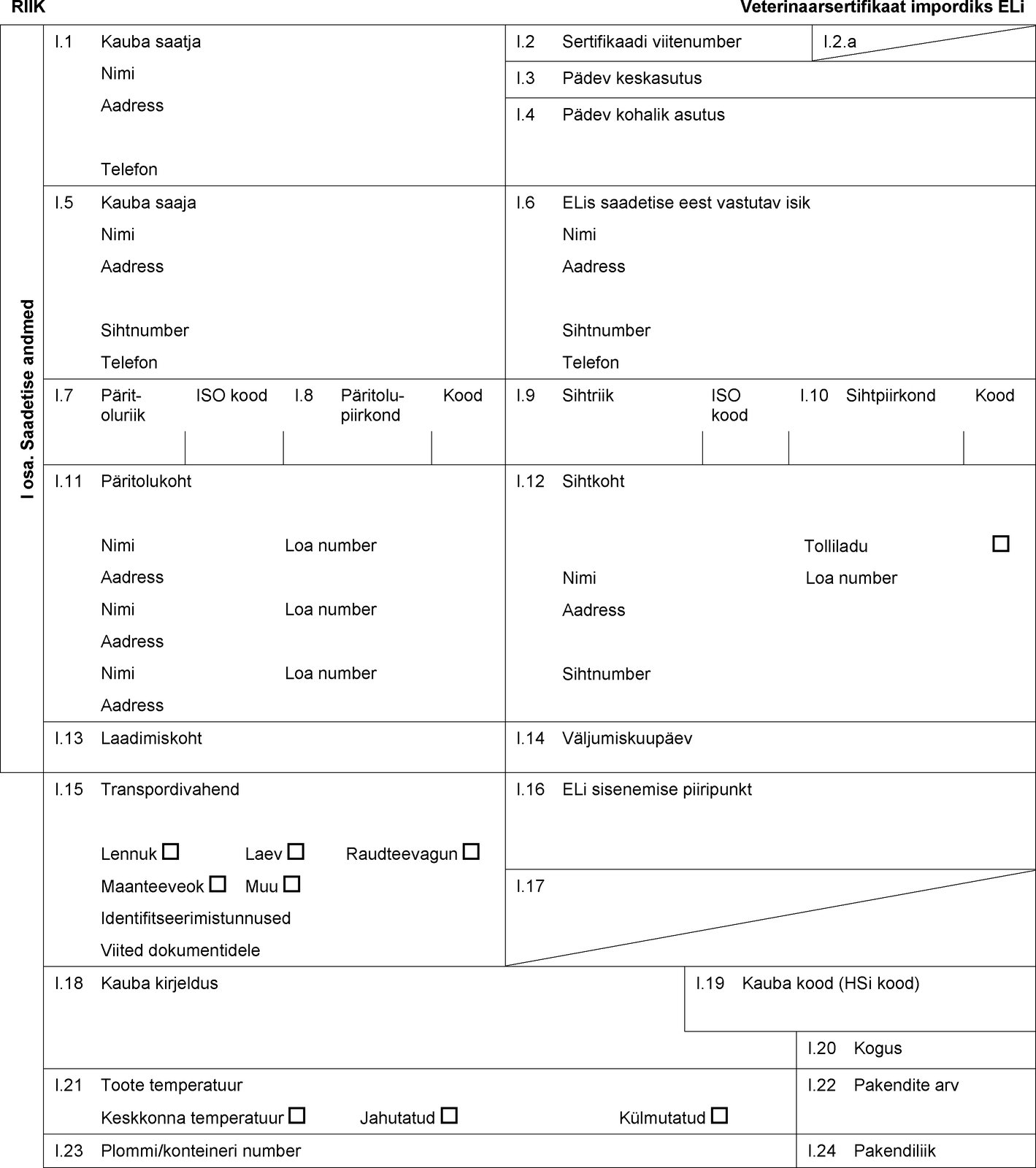 Tekst pildi
Tekst pildi
RIIK Veterinaarsertifikaat impordiks ELi I osa. Saadetise andmed I.1 Kauba saatja Nimi Aadress Telefon I.2 Sertifikaadi viitenumber I.2.a I.3 Pädev keskasutus I.4 Pädev kohalik asutus I.5 Kauba saaja Nimi Aadress Sihtnumber Telefon I.6 ELis saadetise eest vastutav isik Nimi Aadress Sihtnumber Telefon I.7 Pärit-oluriik ISO kood I.8 Päritolu-piirkond Kood I.9 Sihtriik ISO kood I.10 Sihtpiirkond Kood I.11 Päritolukoht Nimi Loa number Aadress Nimi Loa number Aadress Nimi Loa number Aadress I.12 Sihtkoht Tolliladu Nimi Loa number Aadress Sihtnumber I.13 Laadimiskoht I.14 Väljumiskuupäev I.15 Transpordivahend Lennuk Laev Raudteevagun Maanteeveok Muu Identifitseerimistunnused Viited dokumentidele I.16 ELi sisenemise piiripunkt I.17 I.18 Kauba kirjeldus I.19 Kauba kood (HSi kood) I.20 Kogus I.21 Toote temperatuur Keskkonna temperatuur Jahutatud Külmutatud I.22 Pakendite arv I.23 Plommi/konteineri number I.24 Pakendiliik  Tekst pildi
Tekst pildi
I.25 Kauba lubatud otstarve: Tehniline otstarve I.26 Transiidiks kolmandasse riiki ELi kaudu Kolmas riik ISO kood I.27 Impordiks või sissepääsuks ELi I.28 Kauba identifitseerimine Ettevõtete loa number Liik:(teaduslik nimetus) Tootmisettevõte Pakendite arv Netomass Partii number  Tekst pildi
Tekst pildi
RIIK Muuks otstarbeks kui inimtoiduks ettenähtud ja väljaspool söödaahelat kasutatavad sulatatud rasvad II. Terviseteave II.a. Sertifikaadi viitenumber II.b. Mina, allakirjutanud veterinaarjärelevalve ametnik, teatan, et olen lugenud ja mõistan Euroopa Parlamendi ja nõukogu määrust (EÜ) nr 1069/2009 (1a), eriti selle artikleid 8, 9 ja 10 ning komisjoni määrust (EL) nr 142/2011 (1b), eriti selle XIV lisa II peatükki, ning kinnitan seoses eelkirjeldatud sulatatud rasvadega järgmist: II.1 tegemist on sulatatud rasvadega, mis ei ole ette nähtud inimtoiduks ja mis vastavad alljärgnevatele tervishoiunõuetele; II.2 nende valmistamisel on kasutatud üksnes järgmisi loomseid kõrvalsaadusi: (2) [II.2.1. määruse (EL) nr 142/2011 IV lisa IV peatüki 2. jao punktis L osutatud taastuvkütuste tootmiseks ettenähtud materjalide, biodiislikütuse või õlikeemiliste toodete puhul määruse (EÜ) nr 1069/2009 artiklites 8, 9 ja 10 osutatud loomsed kõrvalsaadused;] (2) [II.2.2. määruse (EL) nr 142/2011 IV lisa IV peatüki 2. jao punktis J osutatud taastuvkütuste tootmiseks ettenähtud materjalide puhul on materjalid valmistatud üksnes määruse (EÜ) nr 1069/2009 artiklites 9 ja 10 osutatud loomsetest kõrvalsaadustest;] (2) [II.2.3. muuks otstarbeks kui kosmeetikatoodetes, ravimites ja meditsiiniseadmetes kasutatavate materjalide puhul on nende valmistamisel kasutatud üksnes: (2) kas [- loomsed kõrvalsaadused, mis sisaldavad lubatud ainete või saasteainete jääke nõukogu direktiivi 96/23/EÜ (2a) artikli 15 lõikes 3 osutatud lubatud tasemetest rohkem;] (2) ja/või [- loomsed saadused, mis on neis esinevate võõrkehade tõttu tunnistatud inimtoiduks kõlbmatuks;] (2) ja/või [- muud loomad ja loomade kehaosad kui need, millele on osutatud määruse (EÜ) nr 1069/2009 artiklites 8 ja 10, kui need loomad surid muul viisil kui inimtoiduks tapmise või surmamise tõttu, sh haiguste tõrjeks hukatud loomad;] (2) ja/või [- tapetud loomade rümbad ja loomade kehaosad või tapetud ulukite kehad või kehaosad, mis on kõlblikud inimtoiduks vastavalt Euroopa Liidu õigusaktidele, kuid mis ei ole ärilistel kaalutlustel inimtoiduks ette nähtud;] (2) ja/või [- rümbad ja järgmised kehaosad tapamajas tapetud loomadest, kes tunnistati tapaeelse kontrolli põhjal inimtoiduks tapmiseks kõlblikuks, või kehad ja järgmised kehaosad ulukitelt, kes tapeti kasutamiseks inimtoiduks vastavalt Euroopa Liidu õigusaktidele: i) loomade rümbad või kehad ja kehaosad, mis on tunnistatud inimtoiduks kõlbmatuks vastavalt Euroopa Liidu õigusaktidele, kuid millel ei ilmne mingeid inimestele või loomadele nakkavate haiguste nähte; ii) kodulindude pead; iii) loomade toornahad ja nahad, kaasa arvatud nahalõiked ja -jäägid, sarved ja jalad, kaasa arvatud randme- ja kämblaluud, pöiad, pöiapärad ja varbalülid; iv) seaharjased; v) suled;] (2) ja/või [- veri tapamajas tapetud loomadelt, kellel ei ilmnenud mingeid vere kaudu inimestele või loomadele nakkavate haiguste nähte ja kes tunnistati tapaeelsel ülevaatusel inimtoiduks kõlblikuks vastavalt Euroopa Liidu õigusaktidele;] (2) ja/või [- loomsed kõrvalsaadused, mis on tekkinud inimtoiduks ette nähtud toodete valmistamisel, sealhulgas rasvatustatud kondid, kõrned ning piima töötlemisel tekkinud tsentrifuugimis- või separeerimissete;] II osa. Sertifitseerimine  Tekst pildi
Tekst pildi
RIIK Muuks otstarbeks kui inimtoiduks ettenähtud ja väljaspool söödaahelat kasutatavad sulatatud rasvad II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (2) ja/või [- loomsed saadused või loomseid saadusi sisaldav toit, mis ei ole enam ette nähtud inimtoiduks kas ärilistel kaalutlustel, tootmis- või pakendamisdefektide või muude puuduste tõttu, mis ei ohusta inimeste ega loomade tervist;] (2) ja/või [- loomne lemmikloomatoit ja sööt või loomseid kõrvalsaadusi või nendest saadud tooteid sisaldav sööt, mis ei ole enam ette nähtud söödana kasutamiseks kas ärilistel kaalutlustel, tootmis- või pakendamisdefektide või muude puuduste tõttu, mis ei ohusta inimeste ega loomade tervist;] (2) ja/või [- veri, platsenta, vill, suled, karvad, sarved, kabja- ja sõralõikmed ning toorpiim elusloomadelt, kellel ei ole ilmnenud mingite asjaomase toote kaudu inimestele või loomadele nakkava haiguse nähte;] (2) ja/või [- veeloomad (v.a mereimetajad) ja nende kehaosad, millel ei ole ilmnenud mingeid inimestele või loomadele nakkavate haiguste nähte;] (2) ja/või [- kõrvalsaadused veeloomadest, mis on saadud ettevõtetest, kus valmistatakse inimtoiduks ettenähtud tooteid;] (2) ja/või [- järgmist materjali loomadelt, kel ei ole ilmnenud sellise materjali kaudu inimestele või loomadele nakkava haiguse nähte: i) pehme koe või lihaga karpide või koorikloomade kojad või koorikud; ii) järgmine maismaaloomadelt pärinev materjal: — kõrvalsaadused haudejaamadest, — munad, — munade kõrvalsaadused, sh munakoored, iii) ärilisel eesmärgil tapetud ööpäevased tibud;] (2) ja/või [- selgrootutud vee- ja maismaaloomad, kes ei kuulu inimestele või loomadele patogeensete liikide hulka;] (2) ja/või [- näriliste ja jäneseliste hulka kuuluvaid loomad ja nende kehaosad, välja arvatud 1. kategooria materjal, millele on osutatud määruse (EÜ) nr 1069/2009 artikli 8 punkti a alapunktides iii, iv ja v, ning 2. kategooria materjal, millele on osutatud kõnealuse määruse artikli 9 punktides a–g;] (2) ja/või [- toornahad, kabjad, sulged, vill, sarved, karvad ja karusnahk surnud loomadelt, kellel ei ilmnenud mingeid asjaomase toote kaudu inimestele või loomadele nakkavate haiguste tunnuseid;] (2) ja/või [- selliste tapamajas tapetud loomade rasvkude, kellel ei ilmnenud mingeid selle materjali kaudu inimestele või loomadele nakkavate haiguste nähte ja kes tunnistati tapaeelse kontrolli põhjal inimtoiduks tapmiseks kõlblikuks vastavalt Euroopa Liidu õigusaktidele;]] (2) [II.2.4. materjalide puhul, mis on ette nähtud kasutamiseks muuks otstarbeks kui orgaaniliste väetiste või mullaparandusainete, kosmeetikatoodete, ravimite ja meditsiiniseadmete tootmiseks: (2) kas [- Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 999/2001 (2b) artikli 3 lõike 1 punktis g nimetatud määratletud riskiteguriga materjal;] (2) ja/või [- surnud loomade terved kehad või kehaosad, mis sisaldasid kõrvaldamise ajal määruse (EÜ) nr 999/2001 artikli 3 lõike 1 punktis g nimetatud määratletud riskiteguriga materjali;] (2) ja/või [- loomsed kõrvalsaadused loomadest, kelle suhtes on kasutatud ebaseaduslikku ravi vastavalt nõukogu direktiivi 96/22/EÜ (2c) artikli 1 lõike 2 punktis d või nõukogu direktiivi 96/23/EÜ artikli 2 punktis b esitatud määratlusele;]  Tekst pildi
Tekst pildi
RIIK Muuks otstarbeks kui inimtoiduks ettenähtud ja väljaspool söödaahelat kasutatavad sulatatud rasvad II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (2) ja/või [- loomsed kõrvalsaadused, mis sisaldavad direktiivi 96/23/EÜ I lisa rühma B punktis 3 loetletud muude ainete ja keskkonna saasteainete jääke, kui sellised jäägid ületavad liidu õigusaktides või nende puudumisel siseriiklikes õigusaktides sätestatud lubatud taset;]] II.3 sulatatud rasvad: a) neid on haigusetekitajate hävitamiseks töödeldud vastavalt meetodile (märkida töötlemismeetod), mis on esitatud määruse (EL) nr 142/2011 IV lisa III peatükis, b) need on enne Euroopa Liitu saatmist märgistatud glütserooltriheptanaadiga nii, et need sisaldavad homogeenselt vähemalt 250 mg glütserooltriheptanaati ühe kilogrammi rasva kohta; c) mäletsejalistelt pärit sulatatud rasvade puhul on eemaldatud lahustumatud lisaained, mis ületavad 0,15 massiprotsenti; d) neid on transporditud tingimustel, mis välistavad nende saastumise, ja e) nende pakendil või mahutil on silt kirjaga „MITTE INIM- EGA LOOMATOIDUKS“; (2) [II.4. materjalide puhul, mis on ette nähtud kasutamiseks orgaaniliste väetiste, kosmeetikatoodete, farmaatsiatoodete, meditsiiniseadmete või mullaparandusainete jaoks, on eelkirjeldatud sulatatud rasvad (2) kas [saadud muudelt mäletsejalistelt kui veised, lambad ja kitsed.] (2) või [on saadud veistelt, lammastelt ja kitsedelt ning ei sisalda ega ole saadud järgmisest materjalist: (2) kas [veistelt, lammastelt või kitsedelt saadud materjal, v.a materjal, mis on saadud loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka.] (2) või [a) Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 999/2001 (3) V lisa punktis 1 nimetatud määratletud riskiteguriga materjal; b) veiste, lammaste või kitsede kontidelt mehhaaniliselt eraldatud lihamass, välja arvatud sellistelt loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt komisjoni otsusele 2007/453/EÜ (4) liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka, kus ei ole esinenud algupäraseidBSE-juhtumeid; c) loomne kõrvalsaadus või toode on saadud veistelt, lammastelt või kitsedelt, kes on pärast uimastamist surmatud kesknärvisüsteemikudede vigastamise teel koljuõõnde viidava pika vardakujulise instrumendiga või koljuõõnde süstitud gaasiga, v.a juhul, kui kõnealused loomad on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE riskiga riikide või piirkondade hulka.]]] Märkused I osa — Lahter I.6: Euroopa Liidus saadetise eest vastutav isik: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist sertifikaadiga Euroopa Liidu kaudu transporditava transiitkauba kohta; Euroopa Liitu imporditava kauba kohta antava sertifikaadi puhul võib selle samuti täita. — Lahtrid I.11 ja I.12: Loa number: ettevõtte registreerimisnumber, mille on andnud pädev asutus.  Tekst pildi
Tekst pildi
RIIK Muuks otstarbeks kui inimtoiduks ettenähtud ja väljaspool söödaahelat kasutatavad sulatatud rasvad II. Terviseteave II.a. Sertifikaadi viitenumber II.b. — Lahter I.12: Sihtkoht: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist transiitkauba sertifikaadiga. Transiitkaupu võib ladustada üksnes vabatsoonis, vabalaos ja tollilaos. — Lahter I.15: tuleb esitada registreerimisnumber (raudteevagunid või -konteinerid ja veoautod), lennu number (lennuk) või nimi (laev). Euroopa Liidus maha- ja ümberlaadimise korral peab kauba saatja teavitama Euroopa Liidu piiripunkti. — Lahter I.19: kasutada vajalikku harmoneeritud süsteemi (HS) koodi järgmistes rubriikides: 04.05; 15.01, 15.02; 15.03; 15.04; 15.05; 15.06; 15.16 või 15.18. — Lahter I.23: puistlastikonteinerite puhul tuleb lisada konteineri number ja plommi number (kui on). — Lahter I.25: Tehniline otstarve: muuks kui põllumajandusloomade (v.a karusloomad või lemmikloomad) söödaks, ning lemmikloomatoidu tootmiseks või valmistamiseks. — Lahtrid I.26 ja I.27: täita vastavalt sellele, kas tegemist on transiidiks või impordiks antava sertifikaadiga. — Lahter I.28: Liik: valida üks järgmistest: mäletsejalised, muud kui mäletsejalised Tootmisettevõte: märkida töötlemisettevõtte registrinumber. II osa. (1a) ELT L 300, 14.11.2009, lk 1. (1b) ELT L 54, 26.2.2011, lk 1. (2) Mittevajalik läbi kriipsutada. (2a) EÜT L 125, 23.5.1996, lk 10. (2b) EÜT L 147, 31.5.2001, lk 1. (2c) EÜT L 125, 23.5.1996, lk 3. (3) EÜT L 147, 31.5.2001, lk 1. (4) ELT L 172, 30.6.2007, lk 84. — Allkirja ja templi värv peavad erinema teksti värvist. — Märkus Euroopa Liidus saadetise eest vastutavale isikule: käesolev sertifikaat on koostatud üksnes veterinaariaalastel eesmärkidel ja see peab saadetisega kaasas olema kuni Euroopa Liitu sisenemise piiripunkti jõudmiseni. Veterinaarjärelevalve ametnik/inspektor Nimi (trükitähtedega): Kvalifikatsioon ja ametinimetus: Kuupäev: Allkiri: Tempel: 11. PEATÜKK Tervisesertifikaat muuks otstarbeks kui inimtoiduks ettenähtud, söödamaterjalina või väljaspool söödaahelat kasutatava želatiini ja kollageeni kohta, mis on ette nähtud lähetamiseks Euroopa Liitu või transiidiks (2) Euroopa Liidu kaudu 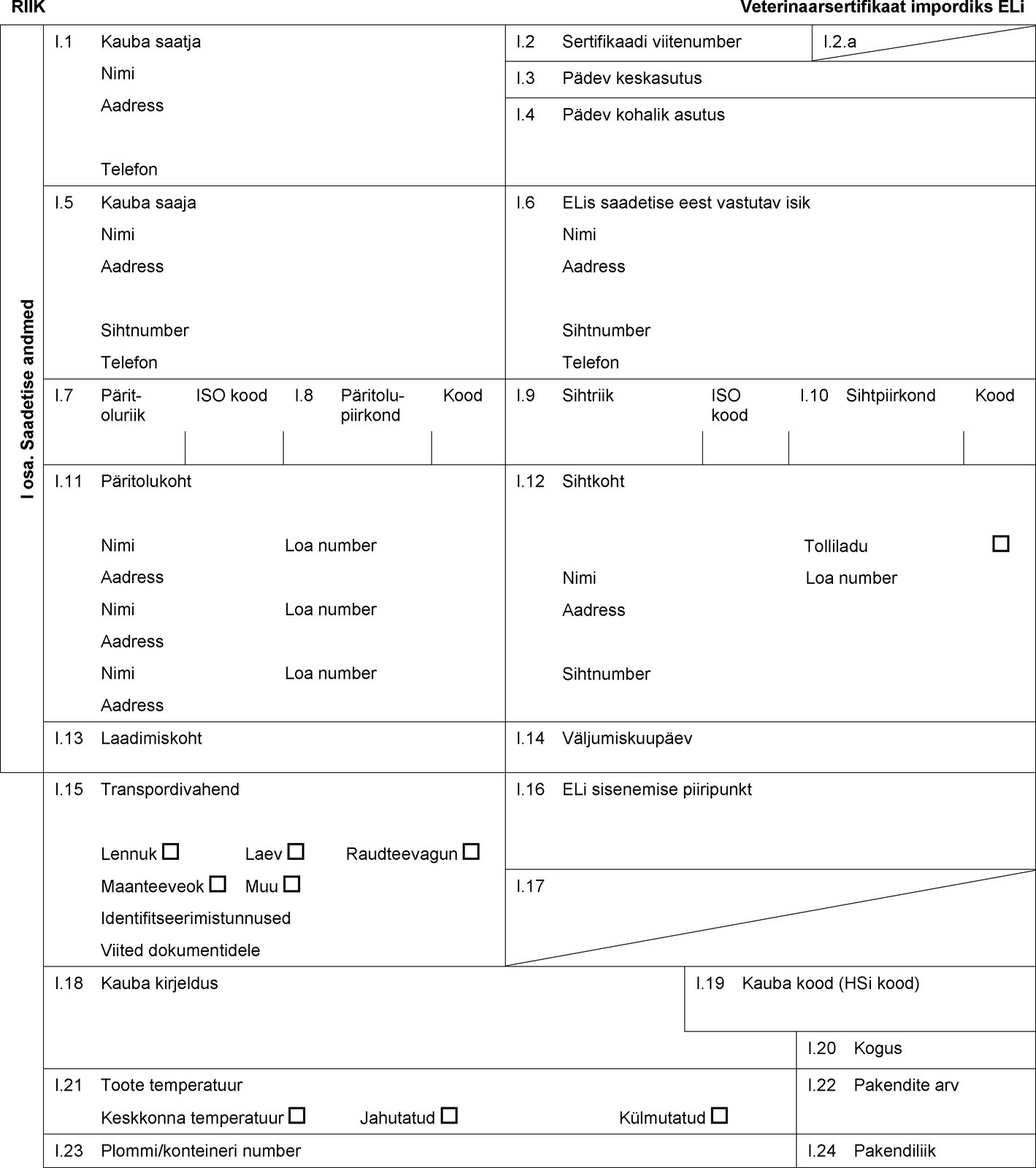 Tekst pildi
Tekst pildi
RIIK Veterinaarsertifikaat impordiks ELi I osa. Saadetise andmed I.1 Kauba saatja Nimi Aadress Telefon I.2 Sertifikaadi viitenumber I.2.a I.3 Pädev keskasutus I.4 Pädev kohalik asutus I.5 Kauba saaja Nimi Aadress Sihtnumber Telefon I.6 ELis saadetise eest vastutav isik Nimi Aadress Sihtnumber Telefon I.7 Pärit-oluriik ISO kood I.8 Päritolu-piirkond Kood I.9 Sihtriik ISO kood I.10 Sihtpiirkond Kood I.11 Päritolukoht Nimi Loa number Aadress Nimi Loa number Aadress Nimi Loa number Aadress I.12 Sihtkoht Tolliladu Nimi Loa number Aadress Sihtnumber I.13 Laadimiskoht I.14 Väljumiskuupäev I.15 Transpordivahend Lennuk Laev Raudteevagun Maanteeveok Muu Identifitseerimistunnused Viited dokumentidele I.16 ELi sisenemise piiripunkt I.17 I.18 Kauba kirjeldus I.19 Kauba kood (HSi kood) I.20 Kogus I.21 Toote temperatuur Keskkonna temperatuur Jahutatud Külmutatud I.22 Pakendite arv I.23 Plommi/konteineri number I.24 Pakendiliik  Tekst pildi
Tekst pildi
I.25 Kauba lubatud otstarve: Loomasööt Lemmikloomatoidu tootmine Tehniline otstarve I.26 Transiidiks kolmandasse riiki ELi kaudu Kolmas riik ISO kood I.27 Impordiks või sissepääsuks ELi I.28 Kauba identifitseerimine Ettevõtete loa number Liik (teaduslik nimetus) Tootmisettevõte Pakendite arv Netomass Partii number  Tekst pildi
Tekst pildi
RIIK Muuks kui inimtoiduks ettenähtud, söödamaterjalina või väljaspool söödaahelat kasutatav želatiin ja kollageen II. Terviseteave II.a. Sertifikaadi viitenumber II.b. Mina, allakirjutanud veterinaarjärelevalve ametnik, teatan, et olen lugenud ja mõistan Euroopa Parlamendi ja nõukogu määrust (EÜ) nr 1069/2009 (1a), eriti selle artiklit 10 ning komisjoni määrust (EL) nr 142/2011 (1b), eriti selle XIV lisa I peatükki, ning kinnitan seoses eelkirjeldatud želatiini ja kollageeniga järgmist: II.1 tegemist on želatiini/kollageeniga (2), mis vastab alljärgnevatele tervishoiunõuetele; II.2 tegemist on üksnes muuks otstarbeks kui inimtoiduks ettenähtud želatiini/kollageeniga (2); II.3 see on valmistatud ja ladustatud ettevõttes, mida pädev asutus on määruse (EÜ) nr 1069/2009 artikli 24 kohaselt tunnustanud ning kus ta teostab haigusetekitajate hävitamise suhtes järelevalvet; II.4 selle valmistamisel on kasutatud üksnes järgmisi loomseid kõrvalsaadusi: (2) kas [- tapetud loomade rümbad ja loomade kehaosad või tapetud ulukite kehad või kehaosad, mis on kõlblikud inimtoiduks vastavalt Euroopa Liidu õigusaktidele, kuid mis ei ole ärilistel kaalutlustel inimtoiduks ette nähtud;] (2) ja/või [- rümbad ja järgmised kehaosad tapamajas tapetud loomadelt, kes tunnistati tapaeelse kontrolli põhjal inimtoiduks tapmiseks kõlblikuks, või kehad ja järgmised kehaosad ulukitelt, kes tapeti kasutamiseks inimtoiduks vastavalt Euroopa Liidu õigusaktidele: i) loomade rümbad või kehad ja kehaosad, mis on tunnistatud inimtoiduks kõlbmatuks vastavalt Euroopa Liidu õigusaktidele, kuid millel ei ole ilmnenud mingeid inimestele või loomadele nakkava haiguse nähte; ii) kodulindude pead; iii) loomade toornahad ja nahad, kaasa arvatud nahalõiked ja -jäägid, sarved ja jalad, kaasa arvatud randme- ja kämblaluud, pöiad, pöiapärad ja varbalülid; iv) seaharjased; v) suled;] (2) ja/või [- loomsed kõrvalsaadused, mis on tekkinud inimtoiduks ette nähtud toodete valmistamisel, sealhulgas rasvatustatud kondid, kõrned ning piima töötlemisel tekkinud tsentrifuugimis- või separeerimissete;] (2) ja/või [- loomsed tooted või loomseid tooteid sisaldav toit, mis ei ole enam ette nähtud inimtoiduks kas ärilistel kaalutlustel, tootmis- või pakendamisdefektide või muude puuduste tõttu, mis ei ohusta inimeste ega loomade tervist;] (2) ja/või [- loomne lemmikloomatoit ja sööt või loomseid kõrvalsaadusi või nendest saadud tooteid sisaldav sööt, mis ei ole enam ette nähtud söödana kasutamiseks kas ärilistel kaalutlustel, tootmis- või pakendamisdefektide või muude puuduste tõttu, mis ei ohusta inimeste ega loomade tervist;] (2) ja/või [- veeloomad (v.a mereimetajad) ja nende kehaosad, millel ei ole ilmnenud mingeid inimestele või loomadele nakkavate haiguste nähte;] (2) ja/või [- kõrvalsaadused veeloomadest, mis on saadud ettevõtetest, kus valmistatakse inimtoiduks ettenähtud tooteid;] II.5 želatiin/kollageen (2): a) pakendati, ladustati ja transporditi rahuldavates hügieenitingimustes, kusjuures pakendamine toimus selleks ettenähtud ruumis ja kasutati üksnes Euroopa Liidu õigusaktidega lubatud säilitusaineid. II osa. Sertifitseerimine  Tekst pildi
Tekst pildi
RIIK Muuks kui inimtoiduks ettenähtud, söödamaterjalina või väljaspool söödaahelat kasutatav želatiin ja kollageen II. Terviseteave II.a. Sertifikaadi viitenumber II.b. Želatiini/kollageeni (2) pakenditel on tekst „LOOMATOIDUKS KÕLBLIK ŽELATIIN/KOL-LAGEEN (2)“; ning (2) kas [b) želatiin on toodetud protsessi käigus, millega tagatakse, et töötlemata 3. kategooria materjal läbib haigusetekitajate hävitamiseks töötluse happe või leelisega, millele järgneb üks või mitu loputust, pH korrigeerimine ning želatiini eraldamine ühe või mitme järjestikuse kuumutamisega ning seejärel puhastamine filtreerimise teel ja steriliseerimine;] (2) või [b) kollageen on toodetud protsessi käigus, millega tagatakse, et töötlemata 3. kategooria materjal läbib haigusetekitajate hävitamiseks töötluse, mis hõlmab materjali pesemist, pH korrigeerimist happe või leelisega ning sellele järgnevat ühte või mitut loputust, filtreerimist ja väljapressimist;] (2) [II.6. muust materjalist kui toornahkadest saadud želatiini/kollageeni (2) puhul: (2) kas [on saadud muudelt mäletsejalistelt kui veised, lambad ja kitsed.]] (2) või [on saadud veistelt, lammastelt ja kitsedelt ning ei sisalda järgmist materjali ega ole sellest saadud: (2) kas [veistelt, lammastelt või kitsedelt saadud materjal, v.a materjal, mis on saadud loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka.]] (2) või [a) Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 999/2001 (3) V lisa punktis 1 nimetatud määratletud riskiteguriga materjal; b) veiste, lammaste või kitsede kontidelt mehhaaniliselt eraldatud lihamass, välja arvatud sellistelt loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt komisjoni otsusele 2007/453/EÜ (4) liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka, kus ei ole esinenud algupäraseid BSE-juhtumeid; c) loomne kõrvalsaadus või toode on saadud veistelt, lammastelt või kitsedelt, kes on pärast uimastamist surmatud kesknärvisüsteemikudede vigastamise teel koljuõõnde viidava pika vardakujulise instrumendiga või koljuõõnde süstitud gaasiga, v.a juhul, kui kõnealused loomad on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE riskiga riikide või piirkondade hulka.]]] II.7 muust materjalist kui toornahkadest saadud želatiini/kollageeni (2) puhul: (2) kas [ei sisalda lammastelt või kitsedelt saadud piima ega piimatooteid ega ole ette nähtud põllumajandusloomade (v.a karusloomad) söödaks.] (2) või [sisaldavad lammastelt või kitsedelt saadud piima ja piimatooteid ning on ette nähtud põllumajandusloomade (v.a karusloomad) söödaks ning piim ja piimatooted: a) on saadud lammastelt ja kitsedelt, keda on sünnist saadik pidevalt kasvatatud riigis, kus on täidetud järgmised tingimused: i) klassikalise skreipi juhtumitest teatamine on kohustuslik; ii) riigis on olemas teadlikustamis-, seire- ja järelevalvesüsteem; iii) põllumajandusettevõtete suhtes, kus on lambad või kitsed, kohaldatakse TSE kahtluse või klassikalise skreipi kinnitamise korral ametlikke piiranguid;  Tekst pildi
Tekst pildi
RIIK Muuks kui inimtoiduks ettenähtud, söödamaterjalina või väljaspool söödaahelat kasutatav želatiin ja kollageen II. Terviseteave II.a. Sertifikaadi viitenumber II.b. iv) klassikalisse skreipisse haigestunud lambad ja kitsed tapetakse ja hävitatakse; v) lammaste ja kitsede söötmine mäletsejalistelt saadud liha-kondijahu või kõrnetega, nagu on määratletud OIE maismaaloomade tervise koodeksis, on olnud keelatud ja seda keeldu on tegelikult rakendatud kogu riigis vähemalt eelneva seitsmeaastase ajavahemiku jooksul; b) on pärit ettevõtetest, kus puuduvad TSE kahtluse tõttu kehtestatud ametlikud piirangud; c) lamba- või kitsepiim ja piimatooted on pärit põllumajandusettevõtetest, kus vähemalt eelneva seitsmeaastase ajavahemiku jooksul ei ole diagnoositud klassikalise skreipi juhtumit või kus pärast klassikalise skreipi juhtumi kinnitamist: (2) kas [on põllumajandusettevõttes surmatud ja hävitatud või tapetud kõik lambad ja kitsed, v.a ARR/ARR-genotüübiga tõujäärad, vähemalt ühe ARR-alleeliga ja ilma VRQ-alleelita aretusuted ning teised vähemalt ühe ARR-alleeliga lambad;] (2) või [on tapetud ja hävitatud kõik loomad, kelle puhul leidis kinnitust nakatumine klassikalisse skreipisse, ning ettevõttes on toimunud viimasest klassikalise skreipi juhtumi kinnitamise kuupäevast alates vähemalt kahe aasta jooksul tõhustatud TSE seire, mis hõlmab muu hulgas määruse (EÜ) nr 999/2001 X lisa C peatüki punktis 3.2 sätestatud laboratoorsete meetodite kohaselt tehtud ja negatiivseid tulemusi andnud kontrolle TSE esinemise suhtes kõikide järgmiste üle 18 kuu vanuste loomade, välja arvatud ARR/ARR-genotüübiga lammaste puhul: — inimtoiduks tapetud loomad ning — loomad, kes on põllumajandusettevõttes surnud või tapetud, ent keda ei hukatud haiguste likvideerimise programmi raames.]] Märkused I osa — Lahter I.6: Euroopa Liidus saadetise eest vastutav isik: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist sertifikaadiga Euroopa Liidu kaudu transporditava transiitkauba kohta; Euroopa Liitu imporditava kauba kohta antava sertifikaadi puhul võib selle samuti täita. — Lahter I.12: Sihtkoht: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist transiitkauba kohta antava sertifikaadiga. Transiitkaupu võib ladustada üksnes vabatsoonis, vabalaos ja tollilaos. — Lahter I.15: tuleb esitada registreerimisnumber (raudteevagunid või -konteinerid ja veoautod), lennu number (lennuk) või nimi (laev). Euroopa Liidus maha- ja ümberlaadimise korral peab kauba saatja teavitama Euroopa Liidu piiripunkti. — Lahter I.19: kasutada vajalikku harmoneeritud süsteemi (HS) koodi järgmistes rubriikides: 35.03 või 35.04. — Lahter I.23: puistlastikonteinerite puhul tuleb lisada konteineri number ja plommi number (kui on). — Lahter I.25: Tehniline otstarve: muuks kui põllumajandusloomade (v.a karusloomad) söödaks, ning lemmikloomatoidu tootmiseks või valmistamiseks. — Lahtrid I.26 ja I.27: täita vastavalt sellele, kas tegemist on transiidiks või impordiks antava sertifikaadiga. — Lahter I.28: Liik: valida üks järgmistest: Aves, Ruminantia, Suidae, Mammalia, v.a Ruminantia või Suidae, Pesca.  Tekst pildi
Tekst pildi
RIIK Muuks kui inimtoiduks ettenähtud, söödamaterjalina või väljaspool söödaahelat kasutatav želatiin ja kollageen II. Terviseteave II.a. Sertifikaadi viitenumber II.b. II osa. (1a) ELT L 300, 14.11.2009, lk 1. (1b) ELT L 54, 26.2.2011, lk 1. (2) Mittevajalik läbi kriipsutada. (3) EÜT L 147, 31.5.2001, lk 1. (4) ELT L 172, 30.6.2007, lk 84. — Allkirja ja templi värv peavad erinema teksti värvist. — Märkus Euroopa Liidus saadetise eest vastutavale isikule: käesolev sertifikaat on ette nähtud üksnes veterinaarotstarbeks ning peab partiiga kaasas olema kuni kõnealuse partii jõudmiseni piiripunkti. Veterinaarjärelevalve ametnik/inspektor Nimi (trükitähtedega): Kvalifikatsioon ja ametinimetus: Kuupäev: Allkiri: Tempel: 12. PEATÜKK Tervisesertifikaat muuks otstarbeks kui inimtoiduks ettenähtud, söödamaterjalina või väljaspool söödaahelat kasutatava hüdrolüüsitud valgu, kaltsiumvesinikfosfaadi ja trikaltsiumfosfaadi kohta, mis on ette nähtud lähetamiseks Euroopa Liitu või transiidiks (2) Euroopa Liidu kaudu  Tekst pildi
Tekst pildi
RIIK Veterinaarsertifikaat impordiks ELi I osa. Saadetise andmed I.1 Kauba saatja Nimi Aadress Telefon I.2 Sertifikaadi viitenumber I.2.a I.3 Pädev keskasutus I.4 Pädev kohalik asutus I.5 Kauba saaja Nimi Aadress Sihtnumber Telefon I.6 ELis saadetise eest vastutav isik Nimi Aadress Sihtnumber Telefon I.7 Pärit-oluriik ISO kood I.8 Päritolu-piirkond Kood I.9 Sihtriik ISO kood I.10 Sihtpiirkond Kood I.11 Päritolukoht Nimi Loa number Aadress Nimi Loa number Aadress Nimi Loa number Aadress I.12 Sihtkoht Tolliladu Nimi Loa number Aadress Sihtnumber I.13 Laadimiskoht I.14 Väljumiskuupäev I.15 Transpordivahend Lennuk Laev Raudteevagun Maanteeveok Muu Identifitseerimistunnused Viited dokumentidele I.16 ELi sisenemise piiripunkt I.17 I.18 Kauba kirjeldus I.19 Kauba kood (HSi kood) I.20 Kogus I.21 Toote temperatuur Keskkonna temperatuur Jahutatud Külmutatud I.22 Pakendite arv I.23 Plommi/konteineri number I.24 Pakendiliik 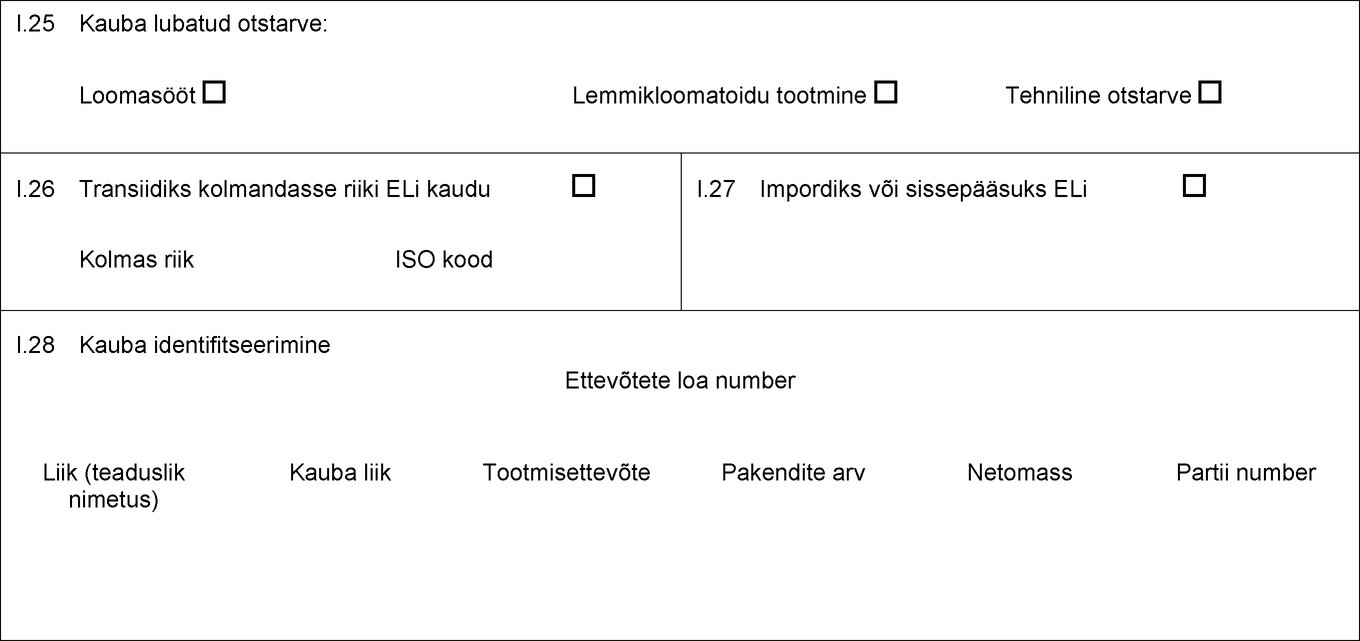 Tekst pildi
Tekst pildi
I.25 Kauba lubatud otstarve: Loomasööt Lemmikloomatoidu tootmine Tehniline otstarve I.26 Transiidiks kolmandasse riiki ELi kaudu Kolmas riik ISO kood I.27 Impordiks või sissepääsuks ELi I.28 Kauba identifitseerimine Ettevõtete loa number Liik (teaduslik nimetus) Kauba liik Tootmisettevõte Pakendite arv Netomass Partii number  Tekst pildi
Tekst pildi
RIIK Söödamaterjalina või väljaspool söödaahelat kasutatav muuks kui inimtoiduks ettenähtud hüdrolüüsitud valk, kaltsiumvesinikfosfaat ja trikaltsiumfosfaat II. Terviseteave II.a. Sertifikaadi viitenumber II.b. Mina, allakirjutanud veterinaarjärelevalve ametnik, teatan, et olen lugenud ja mõistan Euroopa Parlamendi ja nõukogu määrust (EÜ) nr 1069/2009 (1a), eriti selle artiklit 10 ning komisjoni määrust (EL) nr 142/2011 (1b), eriti selle XIV lisa I peatükki, ning kinnitan seoses eelkirjeldatud hüdrolüüsitud valguga / kaltsiumvesinikfosfaadiga / trikaltsiumfosfaadiga (2) järgmist: II.1 tegemist on hüdrolüüsitud valguga / kaltsiumvesinikfosfaadiga / trikaltsiumfosfaadiga (2), mis vastab alljärgnevatele tervishoiunõuetele; II.2 tegemist on üksnes muuks otstarbeks kui inimtoiduks ettenähtud hüdrolüüsitud valguga / kaltsiumdivesinikfosfaadiga / trikaltsiumfosfaadiga (2); II.3 see on haigusetekitajate hävitamiseks valmistatud ja ladustatud ettevõttes, mida pädev asutus on määruse (EÜ) nr 1069/2009 artikli 24 kohaselt tunnustanud ja mis on pädeva asutuse järelevalve all; II.4 selle valmistamisel on kasutatud üksnes järgmisi loomseid kõrvalsaadusi: (2) kas [kaltsiumvesinikfosfaadi puhul, mis on saadud rasvatustatud kontidest, tapetud loomade rümbad ja loomade kehaosad või tapetud ulukite kehad või kehaosad, mis on kõlblikud inimtoiduks vastavalt Euroopa Liidu õigusaktidele, kuid mis ei ole ärilistel kaalutlustel inimtoiduks ette nähtud;] (2) või [muude materjalide puhul: (2) kas [- tapetud loomade rümbad ja loomade kehaosad või tapetud ulukite kehad või kehaosad, mis on kõlblikud inimtoiduks vastavalt Euroopa Liidu õigusaktidele, kuid mis ei ole ärilistel kaalutlustel inimtoiduks ette nähtud;] (2) ja/või [- rümbad ja järgmised kehaosad tapamajas tapetud loomadelt, kes tunnistati tapaeelse kontrolli põhjal inimtoiduks tapmiseks kõlblikuks, või kehad ja järgmised kehaosad ulukitelt, kes tapeti kasutamiseks inimtoiduks vastavalt Euroopa Liidu õigusaktidele: i) loomade rümbad või kehad ja kehaosad, mis on tunnistatud inimtoiduks kõlbmatuks vastavalt Euroopa Liidu õigusaktidele, kuid millel ei ole ilmnenud mingeid inimestele või loomadele nakkava haiguse nähte; ii) kodulindude pead; iii) loomade toornahad ja nahad, kaasa arvatud nahalõiked ja -jäägid, sarved ja jalad, kaasa arvatud randme- ja kämblaluud, pöiad, pöiapärad ja varbalülid; iv) seaharjased; v) suled;]] (2) ja/või [- veri sellistelt tapamajas tapetud loomadelt, kellel ei ilmnenud mingeid vere kaudu inimestele või loomadele nakkavate haiguste nähte ja kes tunnistati tapaeelsel ülevaatusel inimtoiduks kõlblikuks vastavalt Euroopa Liidu õigusaktidele;] (2) ja/või [- loomsed kõrvalsaadused, mis on tekkinud inimtoiduks ette nähtud toodete valmistamisel, sealhulgas rasvatustatud kondid, kõrned ning piima töötlemisel tekkinud tsentrifuugimis- või separeerimissete;]] (2) ja/või [- loomsed saadused või loomseid saadusi sisaldav toit, mis ei ole enam ette nähtud inimtoiduks kas ärilistel kaalutlustel, tootmis- või pakendamisdefektide või muude puuduste tõttu, mis ei ohusta inimeste ega loomade tervist;]] II osa. Sertifitseerimine  Tekst pildi
Tekst pildi
RIIK Söödamaterjalina või väljaspool söödaahelat kasutatav muuks kui inimtoiduks ettenähtud hüdrolüüsitud valk, kaltsiumvesinikfosfaat ja trikaltsiumfosfaat II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (2) ja/või [- loomne lemmikloomatoit ja sööt või loomseid kõrvalsaadusi või nendest saadud tooteid sisaldav sööt, mis ei ole enam ette nähtud söödana kasutamiseks kas ärilistel kaalutlustel, tootmis- või pakendamisdefektide või muude puuduste tõttu, mis ei ohusta inimeste ega loomade tervist;]] (2) ja/või [- veri, platsenta, vill, suled, karvad, sarved, kabja- ja sõralõikmed ning toorpiim elusloomadelt, kellel ei ole ilmnenud mingite asjaomase toote kaudu inimestele või loomadele nakkavate haiguste nähte;]] (2) ja/või [- veeloomad (v.a mereimetajad) ja nende kehaosad, millel ei ole ilmnenud mingeid inimestele või loomadele nakkavate haiguste nähte;]] (2) ja/või [- kõrvalsaadused veeloomadest, mis on saadud ettevõtetest, kus valmistatakse inimtoiduks ettenähtud tooteid;]] (2) ja/või [- järgmine materjal loomadelt, kel ei ole ilmnenud sellise materjali kaudu inimestele või loomadele nakkava haiguse nähte: i) pehme koe või lihaga karpide või koorikloomade kojad või koorikud; ii) järgmine maismaaloomadelt pärinev materjal: — kõrvalsaadused haudejaamadest, — munad, — munade kõrvalsaadused, sh munakoored; iii) ärilisel eesmärgil tapetud ööpäevased tibud;]] II.5 hüdrolüüsitud valk / kaltsiumvesinikfosfaat / trikaltsiumfosfaat (2) vastab järgmistele nõuetele: a) see on pakendatud pakenditesse, millel on sildid kirjaga „MITTE INIMTOIDUKS“ ning seda ladustati ja transporditi rahuldavates hügieenitingimustes, kusjuures pakendamine toimus selleks ettenähtud ruumis ja kasutati üksnes Euroopa Liidu õigusaktidega lubatud säilitusaineid; ning (2) kas [b) hüdrolüüsitud valk on toodetud protsessi käigus, milles sobivate meetmete abil viiakse toore 3. kategooria materjali saastumisvõimalus miinimumini. Täielikult või osaliselt mäletsejaliste toornahkadest saadud hüdrolüüsitud valk on toodetud töötlemisettevõttes, mis tegeleb ainult hüdrolüüsitud valgu tootmisega, kasutades protsessi, mis hõlmab 3. kategooria toormaterjali ettevalmistamist soolvee ja lubjaga töötlemise ning ohtra pesemise teel, misjärel: i) materjali hoitakse pH > 11 ja üle 80 °C juures üle 3 tunni ning sellele järgneb 30minutiline kuumtöötlus temperatuuril üle 140 °C ja rõhul üle 3,6 baari; või ii) materjali hoitakse pH 1–2 juures ja seejärel pH > 11 juures ning sellele järgneb 30minutiline kuumtöötlus temperatuuril 140 °C ja rõhul 3 baari.] (2) või [b) mis kaltsiumvesinikfosfaadi puhul on toodetud sellise protsessi käigus, i) millega tagatakse, et 3. kategooria materjali kondid purustatakse peeneks, rasvatustatakse kuuma veega ja töödeldakse lahjendatud soolhappega (mille miinimum-kontsentratsioon on 4 % ja pH alla 1,5) vähemalt kahe päeva jooksul; ii) kus pärast menetlust töödeldakse saadud fosforit sisaldavat vedelikku lubjaga, mille tulemusena tekib pH väärtuse 4–7 juures kaltsiumvesinikfosfaadi sade;  Tekst pildi
Tekst pildi
RIIK Söödamaterjalina või väljaspool söödaahelat kasutatav muuks kui inimtoiduks ettenähtud hüdrolüüsitud valk, kaltsiumvesinikfosfaat ja trikaltsiumfosfaat II. Terviseteave II.a. Sertifikaadi viitenumber II.b. iii) mis lõpeb kaltsiumvesinikfosfaadi sademe õhkkuivatamisega nii, et siseneva õhu temperatuur on 65–325 °C ja lõpptemperatuur on 30–65 °C.] (2) või [b) mis trikaltsiumfosfaadi puhul on toodetud sellise protsessi käigus, millega tagatakse, et i) kogu 3. kategooria kondimaterjal purustatakse peeneks ja rasvatustatakse vastuvoolumeetodil kuuma veega (kondikillud on väiksemad kui 14 mm); ii) toimub aurus keetmine 145 °C juures rõhul 4 baari 30 minuti jooksul; iii) valguleem eraldatakse hüdroksüapatiidist (trikaltsiumfosfaadist) tsentrifuugimise teel; iv) trikaltsiumfosfaat granuleeritakse pärast õhuga kuivatamist keevkihis 200 °C juures; (2) [II.6. eelkirjeldatud hüdrolüüsitud valk / kaltsiumvesinikfosfaat / trikaltsiumfosfaat (2) (2) kas [on saadud muudelt mäletsejalistelt kui veised, lambad ja kitsed.]] (2) või [on saadud veistelt, lammastelt ja kitsedelt ning ei sisalda järgmist materjali ega ole sellest saadud: (2) kas [veistelt, lammastelt või kitsedelt saadud materjal, v.a materjal, mis on saadud loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka.]] (2) või [a) Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 999/2001 (3) V lisa punktis 1 nimetatud määratletud riskiteguriga materjal; b) veiste, lammaste või kitsede kontidelt mehhaaniliselt eraldatud lihamass, välja arvatud sellistelt loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt komisjoni otsusele 2007/453/EÜ (4) liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka, kus ei ole esinenud algupäraseid BSE-juhtumeid; c) loomne kõrvalsaadus või toode on saadud veistelt, lammastelt või kitsedelt, kes on pärast uimastamist surmatud kesknärvisüsteemikudede vigastamise teel koljuõõnde viidava pika vardakujulise instrumendiga või koljuõõnde süstitud gaasiga, v.a juhul, kui kõnealused loomad on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE riskiga riikide või piirkondade hulka.]]] II.7 eelkirjeldatud hüdrolüüsitud valk / kaltsiumvesinikfosfaat / trikaltsiumfosfaat (2) (2) kas [ei sisalda lammastelt või kitsedelt saadud piima ega piimatooteid ega ole ette nähtud põllumajandusloomade (v.a karusloomad) söödaks.] (2) või [sisaldavad lammastelt või kitsedelt saadud piima ja piimatooteid ning on ette nähtud põllumajandusloomade (v.a karusloomad) söödaks ning piim ja piimatooted: a) on saadud lammastelt ja kitsedelt, keda on sünnist saadik pidevalt kasvatatud riigis, kus on täidetud järgmised tingimused: i) klassikalise skreipi juhtumitest teatamine on kohustuslik; ii) riigis on olemas teadlikustamis-, seire- ja järelevalvesüsteem; iii) põllumajandusettevõtete suhtes, kus on lambad või kitsed, kohaldatakse TSE kahtluse või klassikalise skreipi kinnitamise korral ametlikke piiranguid;  Tekst pildi
Tekst pildi
RIIK Söödamaterjalina või väljaspool söödaahelat kasutatav muuks kui inimtoiduks ettenähtud hüdrolüüsitud valk, kaltsiumvesinikfosfaat ja trikaltsiumfosfaat II. Terviseteave II.a. Sertifikaadi viitenumber II.b. iv) klassikalisse skreipisse haigestunud lambad ja kitsed tapetakse ja hävitatakse; v) lammaste ja kitsede söötmine mäletsejalistelt saadud liha-kondijahu või kõrnetega, nagu on määratletud OIE maismaaloomade tervise koodeksis, on olnud keelatud ja seda keeldu on tegelikult rakendatud kogu riigis vähemalt eelneva seitsmeaastase ajavahemiku jooksul; b) on pärit ettevõtetest, kus puuduvad TSE kahtluse tõttu kehtestatud ametlikud piirangud; c) lamba- või kitsepiim ja piimatooted on pärit põllumajandusettevõtetest, kus vähemalt eelneva seitsmeaastase ajavahemiku jooksul ei ole diagnoositud klassikalise skreipi juhtumit või kus pärast klassikalise skreipi juhtumi kinnitamist: (2) kas [on põllumajandusettevõttes surmatud ja hävitatud või tapetud kõik lambad ja kitsed, v.a ARR/ARR-genotüübiga tõujäärad, vähemalt ühe ARR-alleeliga ja ilma VRQ-alleelita aretusuted ning teised vähemalt ühe ARR-alleeliga lambad;] (2) või [on tapetud ja hävitatud kõik loomad, kelle puhul leidis kinnitust nakatumine klassikalisse skreipisse, ning ettevõttes on toimunud viimasest klassikalise skreipi juhtumi kinnitamise kuupäevast alates vähemalt kahe aasta jooksul tõhustatud TSE seire, mis hõlmab muu hulgas määruse (EÜ) nr 999/2001 X lisa C peatüki punktis 3.2 sätestatud laboratoorsete meetodite kohaselt tehtud ja negatiivseid tulemusi andnud kontrolle TSE esinemise suhtes kõikide järgmiste üle 18 kuu vanuste loomade, välja arvatud ARR/ARR-genotüübiga lammaste puhul: — inimtoiduks tapetud loomad ning — loomad, kes on põllumajandusettevõttes surnud või tapetud, ent keda ei hukatud haiguste likvideerimise programmi raames.]] Märkused I osa — Lahter I.6: Euroopa Liidus saadetise eest vastutav isik: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist sertifikaadiga Euroopa Liidu kaudu transporditava transiitkauba kohta; Euroopa Liitu imporditava kauba kohta antava sertifikaadi puhul võib selle samuti täita. — Lahter I.12: Sihtkoht: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist transiitkauba sertifikaadiga. Transiitkaupu võib ladustada üksnes vabatsoonis, vabalaos ja tollilaos. — Lahter I.15: registreerimisnumber (raudteevagunid või -konteinerid ja veoautod), lennu number (lennuk) või nimi (laev); teave tuleb esitada maha- ja ümberlaadimise korral. — Lahter I.19: kasutada asjakohast HS-koodi: 05.08, 28.35.25; 28.35.26, 29.22; 35.02; 35.03 või 35.04. — Lahter I.23: puistlastikonteinerite puhul tuleb lisada konteineri number ja plommi number (kui on). — Lahter I.25: Tehniline otstarve: muuks kui põllumajandusloomade (v.a karusloomad) söödaks, ning lemmikloomatoidu tootmiseks või valmistamiseks. — Lahtrid I.26 ja I.27: täita vastavalt sellele, kas tegemist on transiidiks või impordiks antava sertifikaadiga. — Lahter I.28: — Liik: valida üks järgmistest: Aves, Ruminantia, Suidae, Mammalia, v.a Ruminantia või Suidae, Pesca, Mollusca, Crustacea, selgrootud, v.a Mollusca ja Crustacea.  Tekst pildi
Tekst pildi
RIIK Söödamaterjalina või väljaspool söödaahelat kasutatav muuks kui inimtoiduks ettenähtud hüdrolüüsitud valk, kaltsiumvesinikfosfaat ja trikaltsiumfosfaat II. Terviseteave II.a. Sertifikaadi viitenumber II.b. — kauba liik: täpsustada, kas tegemist on hüdrolüüsitud valgu, kaltsiumvesinikfosfaadi või trikaltsiumfosfaadiga. — Tootmisettevõte: märkida töötlemisettevõtte registrinumber. II osa. (1a) ELT L 300, 14.11.2009, lk 1. (1b) ELT L 54, 26.2.2011, lk 1. (2) Mittevajalik läbi kriipsutada. (3) EÜT L 147, 31.5.2001, lk 1. (4) ELT L 94, 1.4.2006, lk 28. — Allkirja ja templi värv peavad erinema teksti värvist. — Märkus Euroopa Liidus saadetise eest vastutavale isikule: käesolev sertifikaat on koostatud üksnes veterinaariaalastel eesmärkidel ja see peab saadetisega kaasas olema kuni Euroopa Liitu sisenemise piiripunkti jõudmiseni. Veterinaarjärelevalve ametnik/inspektor Nimi (trükitähtedega): Kvalifikatsioon ja ametinimetus: Kuupäev: Allkiri: Tempel: |
|
6) |
18. peatükk asendatakse järgmisega: „18. PEATÜKK Tervisesertifikaat sarvede ja sarvedest valmistatud toodete (v.a sarvejahu), kapjade ja sõrgade ning neist valmistatud toodete (v.a kabja- ja sõrajahu) kohta, mis on ette nähtud orgaaniliste väetiste või mullaparandusainete tootmiseks ning ette nähtud lähetamiseks Euroopa Liitu või transiidiks (2) Euroopa Liidu kaudu  Tekst pildi
Tekst pildi
RIIK Veterinaarsertifikaat impordiks ELi I osa. Saadetise andmed I.1 Kauba saatja Nimi Aadress Telefon I.2 Sertifikaadi viitenumber I.2.a I.3 Pädev keskasutus I.4 Pädev kohalik asutus I.5 Kauba saaja Nimi Aadress Sihtnumber Telefon I.6 ELis saadetise eest vastutav isik Nimi Aadress Sihtnumber Telefon I.7 Pärit-oluriik ISO kood I.8 Päritolu-piirkond Kood I.9 Sihtriik ISO kood I.10 Sihtpiirkond Kood I.11 Päritolukoht Nimi Loa number Aadress Nimi Loa number Aadress Nimi Loa number Aadress I.12 Sihtkoht Tolliladu Nimi Loa number Aadress Sihtnumber I.13 Laadimiskoht I.14 Väljumiskuupäev I.15 Transpordivahend Lennuk Laev Raudteevagun Maanteeveok Muu Identifitseerimistunnused Viited dokumentidele I.16 ELi sisenemise piiripunkt I.17 CITESi number/numbrid I.18 Kauba kirjeldus I.19 Kauba kood (HSi kood) 05.07 I.20 Kogus I.21 Toote temperatuur Keskkonna temperatuur Jahutatud Külmutatud I.22 Pakendite arv I.23 Plommi/konteineri number I.24 Pakendiliik 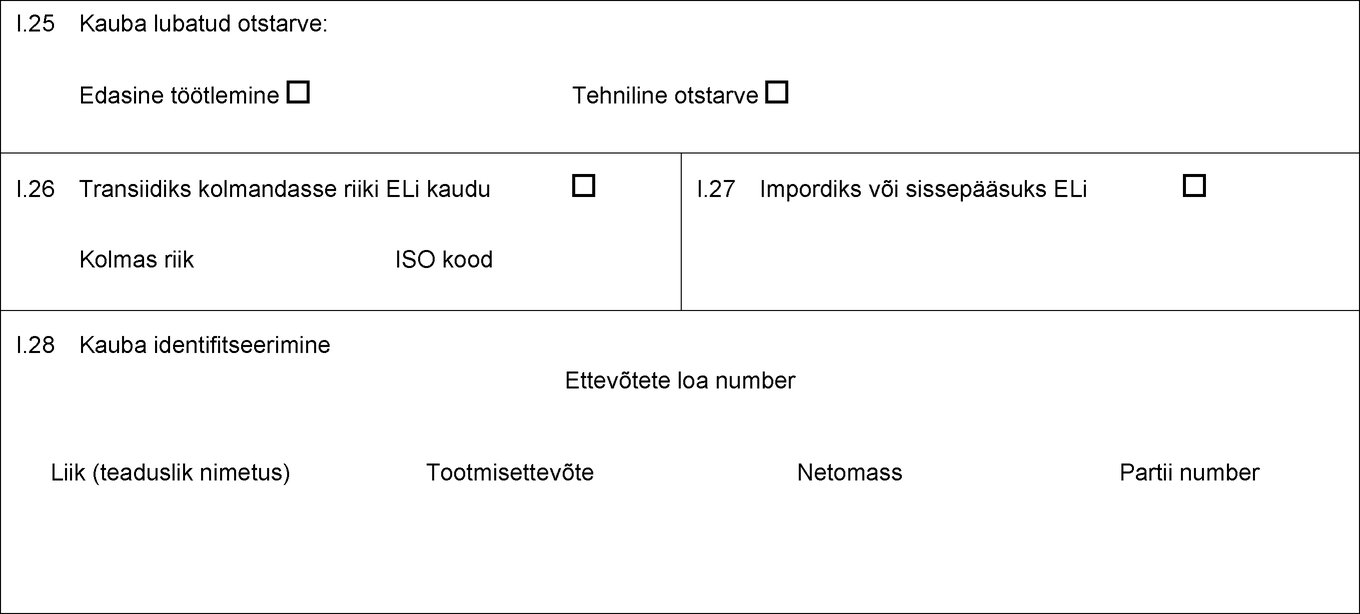 Tekst pildi
Tekst pildi
I.25 Kauba lubatud otstarve: Edasine töötlemine Tehniline otstarve I.26 Transiidiks kolmandasse riiki ELi kaudu Kolmas riik ISO kood I.27 Impordiks või sissepääsuks ELi I.28 Kauba identifitseerimine Ettevõtete loa number Liik (teaduslik nimetus) Tootmisettevõte Netomass Partii number  Tekst pildi
Tekst pildi
RIIK Sarved ja sarvedest valmistatud tooted (v.a sarvejahu), kabjad ja sõrad ning neist valmistatud tooted, (v.a kabja- ja sõrajahu), mis on ette nähtud orgaaniliste väetiste või mullaparandusainete tootmiseks II. Terviseteave II.a. Sertifikaadi viitenumber II.b. Mina, allakirjutanud veterinaarjärelevalve ametnik, teatan, et olen lugenud ja mõistan Euroopa Parlamendi ja nõukogu määrust (EÜ) nr 1069/2009 (1a) ja komisjoni määrust (EL) nr 142/2011 (1b), eelkõige selle XIV lisa II peatükki, ning kinnitan seoses eelkirjeldatud sarvedega, sarvedest valmistatud toodetega (v.a sarvejahu), kapjade ja sõrgadega ning neist valmistatud toodetega (v.a kabja- ja sõrajahu) (2) , et II.1. need on pärit loomadelt: (2) kas [kes on tapetud tapamajas pärast tapaeelset kontrolli ja tunnistatud selle kontrolli põhjal inimtoiduks tapmiseks kõlblikuks;] (2) või [kellel ei avaldunud mingite asjaomase toote kaudu inimestele või loomadele nakkavate haiguste kliinilisi tunnuseid;] II.2. sarved ja sarvedest valmistatud tooted, kabjad ja sõrad ning neist valmistatud tooted on ühe tunni vältel vähemalt sisetemperatuuril 80 °C läbi kuumutatud; II.3 sarved on eemaldatud koljuõõnt avamata; II.4 igal töötlemise etapil, ladustamisel või transpordil peavad olema võetud kõik ettevaatusabinõud ristsaastumise vältimiseks; II.5 sarved ja sarvedest valmistatud tooted (v.a sarvejahu), kabjad ja sõrad ning neist valmistatud tooted (v.a kabja- ja sõrajahu) on pakendatud: (2) kas [kasutamata pakenditesse või mahutitesse] (2) või [veokitesse või puistlastikonteineritesse, mida on enne laadimist desinfitseeritud tootega, mille pädev asutus on heaks kiitnud;] ja pakendid või mahutid on märgistatud vastavalt loomse kõrvaltoote liigile (3) ja neil on sildid kirjaga „MITTE INIM- EGA LOOMATOIDUKS” ning sihtasutuse nimi ja aadress. (2) [II.6. sarved ja sarvedest valmistatud tooted (v.a sarvejahu), ning eelkirjeldatud kabjad ja sõrad ning neist valmistatud tooted (v.a kabja- ja sõrajahu) (2) kas [on saadud muudelt mäletsejalistelt kui veised, lambad ja kitsed.]] (2) või [on saadud veistelt, lammastelt ja kitsedelt ning ei sisalda järgmist materjali ega ole sellest saadud: (2) kas [veistelt, lammastelt või kitsedelt saadud materjal, v.a materjal, mis on saadud loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka.] (2) või [a) Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 999/2001 (4) V lisa punktis 1 nimetatud määratletud riskiteguriga materjal; b) veiste, lammaste või kitsede kontidelt mehhaaniliselt eraldatud lihamass, välja arvatud sellistelt loomadelt, kes on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt komisjoni otsusele 2007/453/EÜ (5) liigitatud väheolulise BSE-ohuga riikide või piirkondade hulka, kus ei ole esinenud algupäraseid BSE-juhtumeid; c) loomne kõrvalsaadus või toode on saadud veistelt, lammastelt või kitsedelt, kes on pärast uimastamist surmatud kesknärvisüsteemikudede vigastamise teel koljuõõnde viidava pika vardakujulise instrumendiga või koljuõõnde süstitud gaasiga, v.a juhul, kui kõnealused loomad on sündinud, pidevalt kasvatatud ja tapetud riigis või piirkonnas, mis on vastavalt otsusele 2007/453/EÜ liigitatud väheolulise BSE riskiga riikide või piirkondade hulka.]]] II osa. Sertifitseerimine  Tekst pildi
Tekst pildi
RIIK Sarved ja sarvedest valmistatud tooted (v.a sarvejahu), kabjad ja sõrad ning neist valmistatud tooted, (v.a kabja- ja sõrajahu), mis on ette nähtud orgaaniliste väetiste või mullaparandusainete tootmiseks II. Terviseteave II.a. Sertifikaadi viitenumber II.b. Märkused I osa — Lahter I.6: Euroopa Liidus saadetise eest vastutav isik: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist sertifikaadiga Euroopa Liidu kaudu transporditava transiitkauba kohta; Euroopa Liitu imporditava kauba kohta antava sertifikaadi puhul võib selle samuti täita. — Lahtrid I.11 ja I.12: Loa number: ettevõtte registreerimisnumber, mille on andnud pädev asutus. — Lahter I.12: Sihtkoht: selle lahtri täitmine on kohustuslik ainult juhul, kui on tegemist transiitkauba sertifikaadiga. Transiitkaupu peab ladustama üksnes vabatsoonis, vabalaos ja tollilaos. — Lahter I.15: registreerimisnumber (raudteevagunid või -konteinerid ja veoautod), lennu number (lennuk) või nimi (laev); teave tuleb esitada Euroopa Liidus maha- ja ümberlaadimise korral. — Lahter I.23: puistlastikonteinerite puhul tuleb lisada konteineri number ja plommi number (kui on). — Lahter I.25: Tehniline otstarve: muuks kui loomatoiduks. — Lahtrid I.26 ja I.27: täita vastavalt sellele, kas tegemist on transiidiks või impordiks antava sertifikaadiga. — Lahter I.28: kauba liik. II osa. (1a) ELT L 300, 14.11.2009, lk 1. (1b) ELT L 54, 26.2.2011, lk 1. (2) Mittevajalik läbi kriipsutada. (3) Toote liik: sarved ja nendest valmistatud tooted ning kabjad ja sõrad ja nendest valmistatud tooted. (4) EÜT L 147, 31.5.2001, lk 1. (5) ELT L 172, 30.6.2007, lk 84. — Allkirja ja templi värv peavad erinema teksti värvist. — Märkus Euroopa Liidus saadetise eest vastutavale isikule: käesolev sertifikaat on koostatud üksnes veterinaariaalastel eesmärkidel ja see peab saadetisega kaasas olema kuni Euroopa Liitu sisenemise piiripunkti jõudmiseni. Veterinaarjärelevalve ametnik/inspektor Nimi (trükitähtedega): Kvalifikatsioon ja ametinimetus: Kuupäev: Allkiri: Tempel: |
|
7) |
20. peatükk asendatakse järgmisega: „20. PEATÜKK Näidisdeklaratsioon Deklaratsioon ravimite, veterinaarravimite, meditsiiniseadmete, meditsiinis või veterinaarias kasutatavate meditsiiniseadmete, aktiivsete siiratavate meditsiiniseadmete, meditsiinis või veterinaarias kasutatavate in vitro diagnostikavahendite, laborireaktiivide ja kosmeetikatoodete tootmiseks kasutatavate vahesaaduste kolmandatest riikidest importimise ja Euroopa Liidu kaudu toimuva transiidi (2) kohta 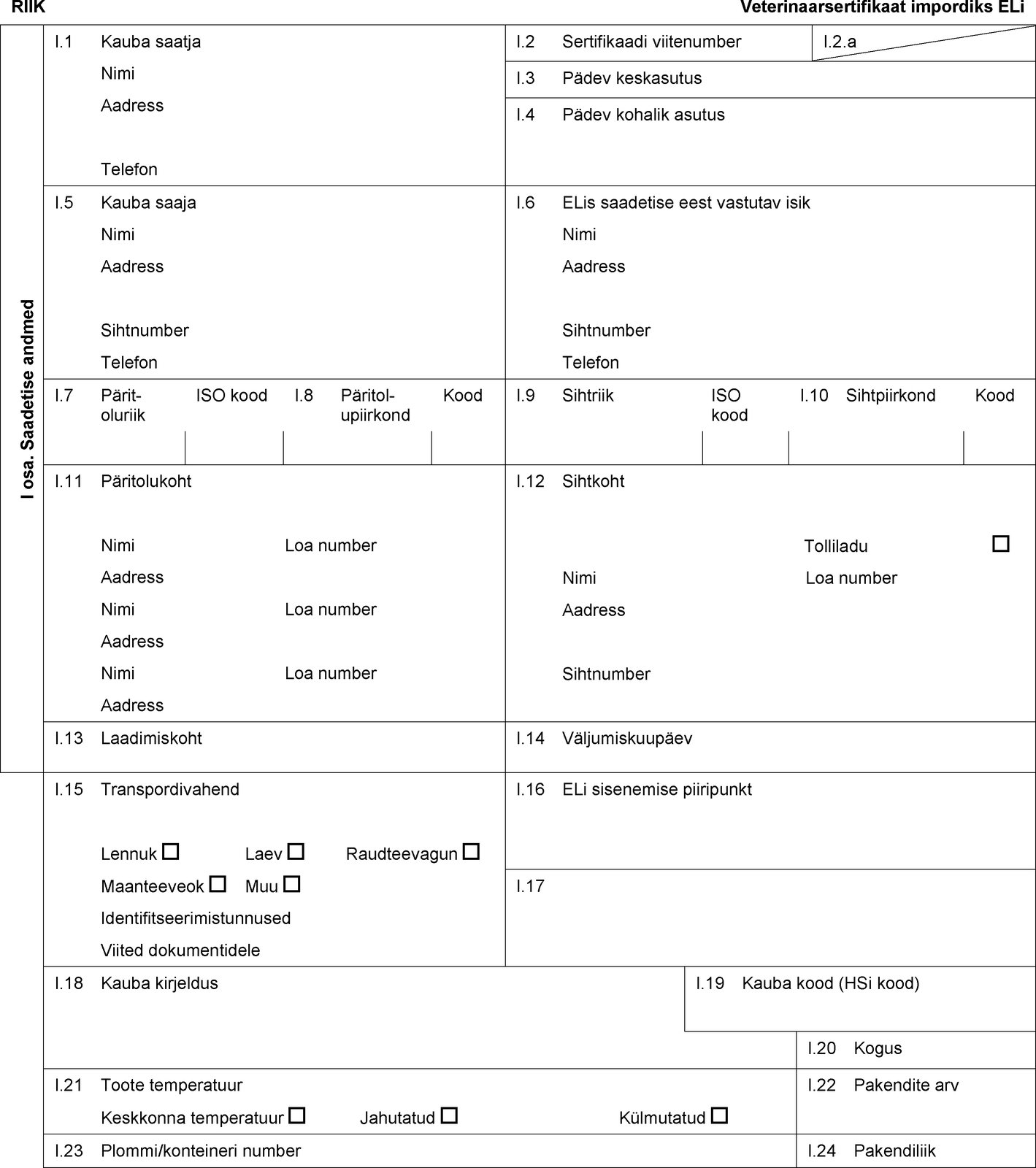 Tekst pildi
Tekst pildi
RIIK Veterinaarsertifikaat impordiks ELi I osa. Saadetise andmed I.1 Kauba saatja Nimi Aadress Telefon I.2 Sertifikaadi viitenumber I.2.a I.3 Pädev keskasutus I.4 Pädev kohalik asutus I.5 Kauba saaja Nimi Aadress Sihtnumber Telefon I.6 ELis saadetise eest vastutav isik Nimi Aadress Sihtnumber Telefon I.7 Pärit-oluriik ISO kood I.8 Päritol-upiirkond Kood I.9 Sihtriik ISO kood I.10 Sihtpiirkond Kood I.11 Päritolukoht Nimi Loa number Aadress Nimi Loa number Aadress Nimi Loa number Aadress I.12 Sihtkoht Tolliladu Nimi Loa number Aadress Sihtnumber I.13 Laadimiskoht I.14 Väljumiskuupäev I.15 Transpordivahend Lennuk Laev Raudteevagun Maanteeveok Muu Identifitseerimistunnused Viited dokumentidele I.16 ELi sisenemise piiripunkt I.17 I.18 Kauba kirjeldus I.19 Kauba kood (HSi kood) I.20 Kogus I.21 Toote temperatuur Keskkonna temperatuur Jahutatud Külmutatud I.22 Pakendite arv I.23 Plommi/konteineri number I.24 Pakendiliik  Tekst pildi
Tekst pildi
I.25 Kauba lubatud otstarve: Tehniline otstarve I.26 Transiidiks kolmandasse riiki ELi kaudu Kolmas riik ISO kood I.27 Impordiks või sissepääsuks ELi I.28 Kauba identifitseerimine Ettevõtete loa number Liik (teaduslik nimetus) Tootmisettevõte Netomass Partii number  Tekst pildi
Tekst pildi
RIIK Vahesaadused, mis on ette nähtud ravimite, veterinaarravimite, meditsiinis või veterinaarias kasutatavate meditsiiniseadmete, aktiivsete siiratavate meditsiiniseadmete, meditsiinis või veterinaarias kasutatavate in vitro diagnostikavahendite, laborireaktiivide, ning kosmeetikatoodete tootmiseks II. Terviseteave II.a. Sertifikaadi viitenumber II.b. DEKLARATSIOON Mina, allakirjutanu, teatan, et kavatsen importida Euroopa Liitu või transportida Euroopa Liidu kaudu eespool osutatud transiitvahesaaduse, mis vastab komisjoni määruse (EL) nr 142/2011 (1a), I lisa punktis 35 esitatud määratlusele ning 1) see on ette nähtud selleks, et toota: (2) kas [- ravimeid,] (2) ja/või [- veterinaarravimeid,] (2) ja/või [- [meditsiinis või veterinaarias kasutatavaid meditsiiniseadmeid,] (2) ja/või [- aktiivseid siiratavaid meditsiiniseadmeid,] (2) ja/või [- meditsiinis või veterinaarias kasutatavaid in vitro diagnostikavahendeid,] (2) ja/või [- laborireaktiive,] (2) ja/või [- kosmeetikatooted;] 2) selle kavandamis-, töötlemis- ja valmistamisetapid on olnud piisavalt põhjalikud, et seda võiks käsitada kõnealusele otstarbele vastava toote materjalina või selle osana, kuigi seda on vaja siiski veel käidelda või töödelda, näiteks segada, pealistada, monteerida või pakendada, et seda oleks võimalik turule lasta või kasutusele võtta ravimina, veterinaarravimina, meditsiinis ja veterinaarias kasutatava meditsiiniseadmena, aktiivse siirdatava meditsiiniseadmena, meditsiinis või veterinaarias kasutatava in vitro diagnostikavahendina või kosmeetikatootena vastavalt Euroopa Liidu õigusaktidele, mida selliste toodete või laborireaktiivi suhtes kohaldatakse(1b); 3) see on saadud (2) kas [- materjalist, mis võib olla pärit loomadest, kelle suhtes on kasutatud ebaseaduslikku ravi vastavalt nõukogu direktiivi 96/22/EÜ (2a) artikli 1 lõike 2 punktis d või nõukogu direktiivi 96/23/EÜ (2b) artikli 2 punktis b esitatud määratlusele;] (2) ja/või [- tapetud loomade rümbad ja loomade kehaosad või tapetud ulukite kehad või kehaosad, mis on kõlblikud inimtoiduks vastavalt Euroopa Liidu õigusaktidele, kuid mis ei ole ärilistel kaalutlustel inimtoiduks ette nähtud;] (2) ja/või [- rümbad ja järgmised kehaosad tapamajas tapetud loomadelt, kes tunnistati tapaeelse kontrolli põhjal inimtoiduks tapmiseks kõlblikuks, või kehad ja järgmised kehaosad ulukitelt, kes tapeti kasutamiseks inimtoiduks vastavalt Euroopa Liidu õigusaktidele: i) loomade rümbad või kehad ja kehaosad, mis on tunnistatud inimtoiduks kõlbmatuks vastavalt Euroopa Liidu õigusaktidele, kuid millel ei ole ilmnenud mingeid inimestele või loomadele nakkava haiguse nähte; ii) kodulindude pead; iii) loomade (v.a mäletsejalised) toornahad, kaasa arvatud nahalõiked ja -jäägid, sarved ja jalad, kaasa arvatud randme- ja kämblaluud, pöiad, pöiapärad ja varbalülid; iv) seaharjased; v) suled;] II osa. Sertifitseerimine  Tekst pildi
Tekst pildi
RIIK Vahesaadused, mis on ette nähtud ravimite, veterinaarravimite, meditsiinis või veterinaarias kasutatavate meditsiiniseadmete, aktiivsete siiratavate meditsiiniseadmete, meditsiinis või veterinaarias kasutatavate in vitro diagnostikavahendite, laborireaktiivide, ning kosmeetikatoodete tootmiseks II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (2) ja/või [- veri tapamajas tapetud muudelt loomadelt kui mäletsejalistelt, kellel ei ilmnenud mingeid vere kaudu inimestele või loomadele nakkavate haiguste nähte ja kes tunnistati tapaeelsel ülevaatusel inimtoiduks kõlblikuks vastavalt Euroopa Liidu õigusaktidele;] (2) ja/või [- loomsed kõrvalsaadused, mis on tekkinud inimtoiduks ette nähtud toodete valmistamisel, sealhulgas rasvatustatud kondid, kõrned ning piima töötlemisel tekkinud tsentrifuugimis- või separeerimissete;] (2) ja/või [- loomsed saadused või loomseid saadusi sisaldav toit, mis ei ole enam ette nähtud inimtoiduks kas ärilistel kaalutlustel, tootmis- või pakendamisdefektide või muude puuduste tõttu, mis ei ohusta inimeste ega loomade tervist;] (2) ja/või [- loomne lemmikloomatoit ja sööt või loomseid kõrvalsaadusi või nendest saadud tooteid sisaldav sööt, mis ei ole enam ette nähtud söödana kasutamiseks kas ärilistel kaalutlustel, tootmis- või pakendamisdefektide või muude puuduste tõttu, mis ei ohusta inimeste ega loomade tervist;] (2) ja/või [- veri, platsenta, vill, suled, karvad, sarved, kabja- ja sõralõikmed ning toorpiim elusloomadelt, kellel ei ole ilmnenud mingite asjaomase toote kaudu inimestele või loomadele nakkavate haiguste nähte;] (2) ja/või [- veeloomad (v.a mereimetajad) ja nende kehaosad, millel ei ole ilmnenud mingeid inimestele või loomadele nakkavate haiguste nähte;] (2) ja/või [- kõrvalsaadused veeloomadest, mis on saadud ettevõtetest, kus valmistatakse inimtoiduks ettenähtud tooteid;] (2) ja/või [- järgmine materjal loomadest, kellel ei ole ilmnenud sellise materjali kaudu inimestele või loomadele nakkavate haiguste nähte: i) pehme koe või lihaga karpide või koorikloomade kojad või koorikud; ii) järgmine maismaaloomadelt pärinev materjal: — kõrvalsaadused haudejaamadest, — munad, — munade kõrvalsaadused, sh munakoored; iii) ärilisel eesmärgil tapetud ööpäevased tibud;] (2) ja/või [- kõrvalsaadused selgrootutest vee- või maismaaloomadest, kes ei kuulu inimestele või loomadele patogeensete liikide hulka;] (2) ja/või [- näriliste ja jäneseliste hulka kuuluvad loomad ja nende kehaosad, välja arvatud 1. kategooria materjal, millele viidatakse määruse (EÜ) nr 1069/2009 artikli 8 punkti a alapunktides iii, iv ja v, ning 2. kategooria materjal, millele viidatakse määruse (EÜ) nr 1069/2009 artikli 9 punktides a–g;] (2) ja/või [- alljärgnevatest saadud tooted: — veeloomad (v.a mereimetajad) ja nende kehaosad, millel ei ole ilmnenud mingeid inimestele või loomadele nakkavate haiguste nähte, — selgrootud vee- ja maismaaloomad, kes ei kuulu inimestele või loomadele patogeensete liikide hulka, — näriliste ja jäneseliste hulka kuuluvad loomad ja nende kehaosad, välja arvatud 1.kategooria materjal, millele on osutatud määruse (EÜ) nr 1069/2009 artikli 8 punkti a alapunktides iii, iv ja v, ning 2. kategooria materjal, millele on osutatud määruse (EÜ) nr 1069/2009 artikli 9 punktides a–g;]  Tekst pildi
Tekst pildi
RIIK Vahesaadused, mis on ette nähtud ravimite, veterinaarravimite, meditsiinis või veterinaarias kasutatavate meditsiiniseadmete, aktiivsete siiratavate meditsiiniseadmete, meditsiinis või veterinaarias kasutatavate in vitro diagnostikavahendite, laborireaktiivide, ning kosmeetikatoodete tootmiseks II. Terviseteave II.a. Sertifikaadi viitenumber II.b. (2) ja/või [- loomad, kellele ei ole osutatud määruse (EÜ) nr 1069/2009 artiklites 8 või 10, ja nende kehaosad; i) kes on surnud muul viisil kui inimtoiduks tapmise või surmamise läbi, kaasa arvatud tauditõrje eesmärgil hukatud loomad; ii) looted; iii) munarakud, embrüod ja sperma, mis ei ole ettenähtud tõuaretuseks; ning iv) koorumata jäänud linnud;] (2) ja/või [- loomsed kõrvalsaadused, mida ei liigitata 1. kategooria või 3. kategooria materjaliks;] 4) selle välispakendil on kiri „AINULT RAVIMITE, VETERINAARRAVIMITE, MEDITSIINIS VÕI VETERINAARIAS KASUTATAVATE MEDITSIINISEADMETE, AKTIIVSETE SIIRATAVATE MEDITSIINISEADMETE, MEDITSIINIS VÕI VETERINAARIAS KASUTATAVATE IN VITRO DIAGNOSTIKAVAHENDITE, LABORIREAKTIIVIDE VÕI KOSMEETIKA-TOODETE TARBEKS“ ning seda ei kasutata Euroopa Liidus üheski etapis ühelgi muul otstarbel; 5) saadetis transporditakse otse käesoleva deklaratsiooni punktis I.12 nimetatud sihtkohta, mis on (2) kas [ravimeid, veterinaarravimeid, meditsiiniseadmeid, meditsiinis või veterinaarias kasutatavaid meditsiini-seadmeid, aktiivseid siiratavaid meditsiiniseadmeid, meditsiinis või veterinaarias kasutatavaid in vitro diagnostikavahendeid, laborireaktiive või kosmeetikatooteid tootev ettevõte, mis on registreeritud määruse (EÜ) nr 1069/2009 artikli 23 kohaselt], (2) või määruse (EÜ) nr 1069/2009 artikli 24 punkti 1 alapunkti i kohaselt tunnustatud ettevõte, kust neid võib saata üksnes käesoleva punkti eelmises taandes osutatud ettevõttesse.] Märkused — Lahter I.19: kasutada HSi asjakohast koodi vastavalt komisjoni 17. aprilli 2007. aasta otsusele 2007/275/EÜ, milles käsitletakse nõukogu direktiivide 91/496/EMÜ ja 97/78/EÜ alusel piiripunktides kontrollitavate loomade ja toodete loetelusid (ELT L 116, 4.5.2007, lk 9). — Lahter I.25: Tehniline otstarve: muuks kui loomatoiduks. (1a) ELT L 54, 26.2.2011, lk 1. (1b) Vastavalt kas Euroopa Parlamendi ja nõukogu 6. novembri 2001. aasta direktiiv 2001/82/EÜ veterinaarravimeid käsitlevate ühenduse eeskirjade kohta (EÜT L 311, 28.11.2001, lk 1), Euroopa Parlamendi ja nõukogu 6. novembri 2001. aasta direktiiv 2001/83/EÜ inimtervishoius kasutatavaid ravimeid käsitlevate ühenduse eeskirjade kohta (EÜT L 311, 28.11.2001, lk 67), nõukogu 14. juuni 1993. aasta direktiiv 93/42/EMÜ meditsiiniseadmete kohta (EÜT L 169, 12.7.1993, lk 1), Euroopa Parlamendi ja nõukogu 27. oktoobri 1998. aasta direktiiv 98/79/EÜ meditsiiniliste in vitro diagnostikavahendite kohta (EÜT L 331, 7.12.1998, lk 1) või Euroopa Parlamendi ja nõukogu 30. novembri 2009. aasta määrus (EÜ) nr 1223/2009 kosmeetikatoodete kohta (ELT L 342, 22.12.2009, lk 59). (2) Mittevajalik läbi kriipsutada. (2a) EÜT L 125, 23.5.1996, lk 3. (2b) EÜT L 125, 23.5.1996, lk 10. Importija Nimi (trükitähtedega): Aadress: Kuupäev: Allkiri: |