II LISA
GENEETILISELT MUUNDATUD TOIDU JA SÖÖDA RISKI HINDAMISE TEADUSLIKUD NÕUDED
I. SISSEJUHATUS
1. MÕISTED
Käesolevas lisas kasutatakse järgmisi mõisteid:
1. „ohu kindlakstegemine”– selliste bioloogiliste, keemiliste või füüsikaliste mõjurite kindlakstegemine, mis võivad avaldada kahjulikku mõju tervisele ja mis võivad esineda teatavas toidus või söödas või teatavates toidu- ja söödarühmades;
2. „ohu kirjeldamine”– selliste tervisele avalduvate kahjulike mõjude kvalitatiivne ja/või kvantitatiivne hindamine, mis on seotud bioloogilise, keemilise või füüsikalise mõjuriga, mis võib esineda toidus või söödas;
3. „riski kirjeldamine”– teadaolevate või võimalike kahjulike tervisemõjude esinemise tõenäosuse ja raskuse, sealhulgas kaasnevate ebakindluste kvalitatiivne ja/või kvantitatiivne hindamine teatavas elanikkonnarühmas, võttes aluseks ohu kindlakstegemise, ohu kirjeldamise ja ohuga kokkupuute hindamise.
2. ERIKAALUTLUSED
2.1. Selliste markergeenide ja muude nukleiinhappe/-hapete järjestuste sisestamine, mis ei ole soovitud tunnuse saavutamiseks olulised
Riski hindamise hõlbustamiseks püüab taotleja minimeerida soovitud tunnuse saavutamiseks mittevajaliku sisestatud nukleiinhappe/-hapete järjestuste esinemist.
Taimede ja muude organismide geneetilise muundamise protsessi käigus kasutatakse sageli markergeene, et hõlbustada muundamata rakkude valdava enamuse hulgas selliste geneetiliselt muundatud rakkude valimist ja kindlakstegemist, mis sisaldavad peremeesorganismi genoomi sisestatud soovitavat geeni. Taotleja valib sellised markergeenid hoolikalt välja ning järgib direktiivi 2001/18/EÜ artikli 4 lõiget 2. Seepärast on taotleja eesmärk luua GMOsid antibiootikumiresistentseid markergeene kasutamata.
2.2. Mitmekordselt transformeeritud geneetiliselt muundatud toidu ja sööda riski hindamine
Kui on tegemist ühe- või mitmekordselt transformeeritud geneetiliselt muundatud taimede traditsioonilise ristamise teel saadud mitmekordselt transformeeritud geneetiliselt muundatud toidu ja sööda riski hindamisega, esitab taotleja iga transformatsiooni kohta riskihinnangu või osutab kooskõlas käesoleva määruse artikli 3 lõikega 6 juba esitatud avaldustele. Mitmekordselt transformeeritud geneetiliselt muundatud toidu ja sööda riski hindamine sisaldab ka järgmiste aspektide hindamist:
|
a) |
transformatsioonide stabiilsus; |
|
b) |
transformatsioonide ekspressioon; |
|
c) |
võimalikke sünergilisi või antagonistlikke mõjusid, mis tulenevad transformatsioonide kombineerimisest, tuleb hinnata punktide 1.4 (toksikoloogia), 1.5 (allergeensus) ja 1.6 (toitaineline hindamine) kohaselt. |
Geneetiliselt muundatud taimi, mille kasvatamine on seotud erinevaid transformatsioonide alakombinatsioone sisaldava geneetiliselt muundatud materjali tootmisega (segregeeruvad põllukultuurid), sisaldava, neist koosneva või nendest toodetud geneetiliselt muundatud toidu ja sööda puhul hõlmab taotlus sõltumata nende päritolust kõiki alakombinatsioone, mida ei ole veel lubatud. Sellisel juhul esitab taotleja teadusliku põhjenduse, milles näidatakse, et asjaomaste alakombinatsioonide kohta ei ole katseandmeid vaja, või esitab sellise teadusliku põhjenduse puudumise korral katseandmed.
Geneetiliselt muundatud taimi, mille kasvatamine ei vii erinevaid transformatsioonide kombinatsioone sisaldava geneetiliselt muundatud materjali tootmiseni (mitte-segregeeruvad põllukultuurid), sisaldava, neist koosneva või nendest toodetud geneetiliselt muundatud toidu ja sööda puhul hõlmab taotlus ainult turule viidavaid kombinatsioone.
Käesolevas jaos esitatud eeskirju kohaldatakse mutatis mutandis transformatsioonide suhtes, mis on kombineeritud muude vahendite abil, nagu ko- ja retransformatsioon.
II. TEADUSLIKUD NÕUDED
1. Ohu kindlakstegemine ja kirjeldamine
1.1. Retsipient- või (vajaduse korral) vanemtaimedega seotud teave
|
1.1.1. |
Taotleja esitab retsipient- või (vajaduse korral) vanemtaimede kohta igakülgse teabe, et:
|
|
1.1.2. |
Punktis 1.1.1 osutatud eesmärkidel esitab taotleja järgmise teabe:
|
1.2. Molekulaarne iseloomustus
1.2.1. Geneetilise muundamisega seotud teave
Taotleja esitab geneetilise muundamise kohta piisava teabe, et:
|
a) |
teha kindlaks transformatsiooniks kavandatud nukleiinhape ja sellega seotud vektorijärjestused, mis võidakse anda retsipienttaimele; |
|
b) |
iseloomustada taimesse tegelikult sisestatud nukleiinhapet. |
1.2.1.1. Geneetilisel muundamisel kasutatud meetodite kirjeldus
Taotleja esitab teabe järgmiste punktide kohta:
|
a) |
geneetilise transformatsiooni meetod, sealhulgas olulised viited; |
|
b) |
retsipienttaime materjal; |
|
c) |
Agrobacterium’i ning muude mikroobide liik ja tüvi, kui neid kasutatakse geneetilise transformatsiooni protsessis; |
|
d) |
abiplasmiidid, kui neid kasutatakse geneetilise transformatsiooni protsessis; |
|
e) |
kandja-nukleiinhappe allikas, kui seda kasutatakse geneetilise transformatsiooni protsessis. |
1.2.1.2. Kasutatud vektori laad ja päritolu
Taotleja esitab järgmise teabe:
|
a) |
funktsionaalsete elementide ja muude plasmiidi/vektori koostisosade füüsiline kaart koos asjaomase teabega, mis on vajalik molekulaarse analüüsi tõlgendamiseks (nagu restriktsioonikohad, polümeraasi ahelreaktsioonis kasutatud praimerid, Southern-analüüsis kasutatud proovide asukoht). Sisseviimiseks kavandatud piirkond näidatakse selgelt; |
|
b) |
tabel, milles identifitseeritakse plasmiidi/vektori iga komponent (kaasa arvatud sisseviimiseks kavandatud piirkond), selle suurus, selle päritolu ja selle kavandatud funktsioon. |
1.2.1.3. Transformatsiooniks kasutatud doonornukleiinhappe päritolu, sisseviimiseks mõeldud piirkonna iga koostisesse kuuluva fragmendi suurus ja kavandatud otstarve
Taotleja esitab teabe doonororganismide kohta ja sisseviimiseks kavandatud nukleiinhappe/-hapete järjestuste kohta, et teha kindlaks, kas doonororganismide või nukleotiidide järjestuste laad võib põhjustada ohutusprobleeme.
Sisseviimiseks kavandatud nukleiinhappe piirkondade funktsiooni käsitlev teave sisaldab järgmisi elemente:
|
a) |
sisseviimiseks kavandatud nukleiinhappe/-hapete täielik järjestus, sealhulgas teave vastavate järjestuste kõikide tahtlike muutmiste kohta doonororganismis; |
|
b) |
sisseviimiseks kavandatud piirkondadest pärinevate geeniproduktide varasem ohutu kasutamine; |
|
c) |
geeniproduktide võimalik seos teadaolevate toksiinide, toitainete omastatavust takistavate ainete ja allergeenidega. |
Iga doonororganismi käsitlev teave hõlmab järgmist:
|
— |
taksonoomiline liigitus; |
|
— |
varasem kasutus toidu ja sööda ohutuse seisukohast. |
1.2.2. Teave geneetiliselt muundatud taime kohta
1.2.2.1. Lisatud või muudetud tunnus(t)e ja omaduste üldkirjeldus
Käesoleva punkti alusel esitatud teave võib piirduda sisseviidud tunnus(t)e ja neist tulenevate muutustega taime fenotüübis ja ainevahetuses.
Näiteks kui sisseviidud tunnus on herbitsiidikindlus, esitab taotleja teabe toimeaine toimeviisi ja selle ainevahetuse kohta taimes.
1.2.2.2. Teave tegelikult sisseviidud/eemaldatud järjestuste kohta
Taotleja esitab järgmise teabe:
|
a) |
kõikide avastatavate, nii täielike kui ka osaliste insertide suurus ja koopiate arv; tavaliselt tehakse see kindlaks Southern-analüüsiga. Sel eesmärgil kasutatud proovi/restriktsioonensüümi kombinatsioonid katavad täielikult kõik järjestused, mida saab sisestada geneetiliselt muundatud taimesse, nagu plasmiidi/vektori mis tahes osad või kandjad või võõrnukleiinhape, mis jääb geneetiliselt muundatud taime sisse. Southern-analüüs hõlmab transgeenset lookust (transgeenseid lookusi) kogu ulatuses, samuti külgnevaid järjestusi, ning hõlmab kõiki asjakohaseid kontrolle. Inserdi koopiate arvu kindlakstegemiseks võib kasutada täiendavaid meetodeid (näiteks reaalajaline PCR-meetod); |
|
b) |
sisestatud geneetilise materjali korraldatus ja järjestus igas sisestamiskohas standardsel elektroonilisel kujul, et teha kindlaks muutused sisestamiskohas võrreldes sisestamiseks ette nähtud järjestusega; |
|
c) |
eemaldamis(t)e korral eemaldatud piirkonna (piirkondade) suurus ja funktsioon, kui võimalik; |
|
d) |
inserdi rakusisene asukoht (tuum, kloroplastid, mitokondrid või esinemine mitteintegreeritud püsivormina) ja selle/nende kindlaksmääramise meetodid; |
|
e) |
järjestuse andmed standardsel elektroonilisel kujul 5’- ja 3’- külgneva ala kohta igas sisestamiskohas, et teha kindlaks tuntud geenide katkestamised. Tehakse bioinformaatiline analüüs, kasutades ajakohaseid andmebaase, et teha nii liikidesiseste kui ka liikidevaheliste sarnasuste otsingud. Mitmekordselt transformeeritud geneetiliselt muundatud taimede puhul hinnatakse iga sisestamiskoha mis tahes tahtmatute modifikatsioonide võimalikke vastasmõjusid; |
|
f) |
avatud lugemisraam (mis tahes nukleotiidijärjestus, mis sisaldab koodonite järjestust, mida ei katkesta stoppkoodoni esinemine samas lugemisraamis), mis luuakse geneetilise muundamise tulemusel kas genoomse DNAga ühenduse kohal või insertide sisemiste ümberkorralduste tõttu. Avatud lugemisraami analüüsitakse stoppkoodonite vahel nende pikkust piiramata. Bioinformaatiline analüüs tehakse, et uurida võimalikke sarnasusi teadaolevate toksiinide või allergeenidega, kasutades ajakohaseid andmebaase. Esitatakse teave andmebaaside omaduste ja versioonide kohta. Sõltuvalt kogutud teabest võivad riskihindamise lõpule viimiseks osutuda vajalikuks edasised analüüsid (näiteks transkriptsiooni analüüs). |
1.2.2.3. Teave inserdi ekspressiooni kohta
Taotleja esitab teabe, et
|
— |
et näidata, kas sisestatud/muundatud järjestuse tulemuseks on tahtlikud muutused valgu, RNA ja/või metaboliidi tasandil; |
|
— |
et iseloomustada uute avatud lugemisraamide võimalikku tahtmatut ekspressiooni, mille ohutuse suhtes on punkti 1.2.2.2 alapunkti f kohaselt kahtlus. |
Selleks esitab taotleja järgmise teabe.
|
a) |
ekspressiooni analüüsiks kasutatud meetod koos selle tulemuslikkuse kriteeriumidega; |
|
b) |
teave inserdi arengu ekspressiooni kohta taime elutsükli kestel. Nõuet esitada teave inserdi arengu ekspressiooni kohta kaalutakse iga üksikjuhtumi puhul eraldi, võttes arvesse kasutatud promootorit, muundamise soovitud mõju ja taotluse kohaldamisala; |
|
c) |
taimeosad, milles insert/muundatud järjestus ekspresseerub; |
|
d) |
uute avatud lugemisraamide võimalik tahtmatu ekspressioon, mille ohutuse suhtes on punkti 1.2.2.2 alapunkti f kohaselt kahtlus; |
|
e) |
valgu ekspressiooni andmed, sh algandmed, mis on saadud väliuuringutel ja on seotud tingimustega, milles põllukultuuri kasvatatakse. Kõikidel juhtudel tuleb esitada ekspressioonitasemeid käsitlevad andmed taime nende osade kohta, mida kasutatakse toiduks ja söödaks. Lisaks esitatakse ka andmed sihtmärkgeenide ekspressiooni kohta muudes taimeosades, kui on kasutatud koespetsiifilisi promootoreid ja kui see on oluline riski hindamise seisukohast. Miinimumnõue on, et valgu ekspressiooni kohta tuleb esitada andmed kolmest kasvatuskohast või ühest kohast kolme perioodi kohta. Kohtade ja perioodide permutatsioon on vastuvõetav tingimusel, et miinimumnõue on täidetud. Kui see on inserdi laadi tõttu põhjendatud (näiteks geeni vaigistamise meetodid või kui biokeemilisi radu on tahtlikult muudetud), analüüsitakse teatavaid RNA-sid või metaboliite. Geeni vaigistamise korral RNAi ekspressiooniga tuleks võimalikke muid kui sihtgeene otsida in silico analüüsiga, et hinnata, kas geneetiline muundamine võiks mõjutada muude geenide ekspressiooni, mis võiks tekitada ohutuse suhtes kahtlust; |
|
f) |
traditsioonilise ristamise teel saadud mitmekordse transformatsiooni puhul esitatakse andmed ekspressiooni kohta, et hinnata transformatsioonide võimalikku vastastikmõju, mis võib võrreldes ühekordse transformatsiooniga tekitada ohutuse suhtes täiendavat kahtlust seoses valgu ja tunnuste ekspressiooniga. Võrdluseks kasutakse andmeid, mis on saadud samade väliuuringute raames kasvatatud taimedest. Kui juhtumipõhiselt tekib kahtlusi, võib olla vaja esitada lisateavet. |
1.2.2.4. Inserdi geneetiline stabiilsus ja geneetiliselt muundatud taime fenotüüpiline püsivus
Taotleja esitab teabe, et
|
a) |
näidata transgeense lookuse (transgeensete lookuste) geneetilist stabiilsust ning sisestatud tunnuste fenotüüpilist püsivust ja pärandumismustreid; |
|
b) |
kinnitada mitmekordse transformeerimise puhul, et igal mitmekordse transformatsiooni osal taimes on samasugused molekulaarsed omadused ja sama molekulaarne iseloomustus nagu ühekordse transformatsiooniga taimedes. |
Selle teabe puhul esitab taotleja stabiilsusandmed mitme (tavaliselt viie) põlvkonna kohta või vegetatiivsete tsüklite kohta ühekordsete transformatsioonidega taimede puhul. Piisab, kui esitatakse andmed vegetatiivsete tsüklite esimese ja viimase põlvkonna kohta. Kasutatud materjali allikat tuleb täpselt kirjeldada. Andmeid analüüsitakse sobivate statistiliste meetodite abil.
Mitmekordsete transformatsioonide puhul tuleb teha nende võrdlus esialgsete transformatsioonidega, kasutades tööstuslikuks kasutamiseks kavandatud taimset materjali. Taotleja esitab kasutatud taimsete materjalide kohta piisava põhjenduse. Võrdluste käigus võrreldakse ka ühekordselt transformeeritud taimedest ja mitmekordselt transformeeritud taimedest saadud insertide ja külgnevate piirkondade järjestusi.
Transformatsioonide geneetilise stabiilsuse hindamiseks kasutavad taotlejad punktis 1.2.2.2 osutatud sobivaid molekulaarseid meetodeid.
1.2.2.5. Horisontaalse geeniülekandega seotud võimalik risk
Taotleja hindab, kui tõenäoline on horisontaalne geeniülekanne tootelt inimestele, loomadele ja mikroorganismidele ning mis tahes võimalikke seotud riske, kui intaktne ja toimiv nukleiinhape jääb geneetiliselt muundatud toitu ja sööta.
1.2.3. Molekulaarse iseloomustuse järeldused
Molekulaarses iseloomustuses esitatakse andmed insertide struktuuri ja ekspressiooni kohta ning kavandatud tunnuste stabiilsuse kohta. See kehtib ka olukordades, kus transformatsioonid on liidetud traditsioonilise aretustehnika abil.
Konkreetselt tuleb märkida, kas geneetilise muundamise molerkulaarne iseloomustus tekitab kahtlust ohutuse pärast, pidades silmas endogeensete geenide või regulatiivsete järjestuste katkestamist.
Molekulaarse iseloomustuse eesmärk on ka teha kindlaks, kas geneneetiline muundamine tekitab küsimusi seoses võimalusega, et toodetakse muid valke/aineid kui neid, mida kavatseti, ja eelkõige uusi toksiine või allergeene.
Käesolevas punktis esile toodud võimalikke tahtmatuid muudatusi käsitletakse ohutushinnangule lisatud vastavates osades.
1.3. Võrdlev analüüs
Koostise ning põllumajanduslike ja fenotüüpiliste omaduste võrdlev analüüs moodustab koos molekulaarse iseloomustusega uue geneetiliselt muundatud toidu ja sööda riski hindamise struktureerimise ja teostamise lähtepunkti.
Selle eesmärk on teha kindlaks sarnasused ja erinevused:
|
a) |
koostises, põllumajanduslikes tulemustes ja fenotüüpilistes omadustes (tahtlikud ja tahtmatud muudatused) geneetiliselt muundatud taime ja tavapärase vaste vahel; |
|
b) |
koostises geneetiliselt muundatud toidu ja sööda ning vastava tavapärase toote vahel. |
Kui ei ole võimalik teha kindlaks tavapärast vastet, ei saa võrdlevat ohutushindamist teha ja seepärast tehakse geneetiliselt muundatud toidu või sööda ohutuse ja toitaineline hindamine nagu uuendtoitude puhul, mis kuuluvad nõukogu ja Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 258/97 (1) kohaldamisalasse ja millel puuduvad tavapärased vasted (näiteks kui geneetiliselt muundatud toit või sööt ei ole lähedalt seotud toidu võis söödaga, mille puhul on olemas ohutu kasutamise kogemus või kui konkreetne tunnus või konkreetsed tunnused lisatakse kavatsusega tekitada geneetiliselt muundatud toidu või sööda koostises keerukad muudatused).
1.3.1. Vastava tavapärase toote ja muude võrdlusmaterjalide valik
Vegetatiivselt paljundatavate põllukultuuride puhul on põhimõtteliselt tavapäraseks vasteks lähi-isogeenne sort, mida kasutatakse transgeense liini loomiseks.
Suguliselt paljunevate kultuurtaimede puhul on tavapärasel vastel geneetiline taust, mis on võrreldav geneetiliselt muundatud taime omaga. Juhul kui geneetiliselt muundatud taime saamiseks on kasutatud tagasiristamist, valitakse konventsionaalne vaste, mille geneetiline taust on võimalikult lähedane geneetiliselt muundatud taimele.
Lisaks võib taotleja lisada võrdlusmaterjali, millel on geneetiliselt muundatud taimele lähedasem geneetiline taust kui tavapärasel vastel (näiteks negatiivne segregant).
Herbitsiidikindlate geneetiliselt muundatud taimede puhul ning selleks, et hinnata, kas eeldatavad põllumajandustavad mõjutavad uuritud lõpp-produktide ekspresseerumist, võrreldakse kolme katsematerjali: ettenähtud herbitsiidiga kokkupuutunud geneetiliselt muundatud taim; herbitsiidi tavapärase kasutusmeetodiga töödeldud tavapärane vaste ja geneetiliselt muundatud taim, mida on töödeldud sama herbitsiidi tavapärase kasutusmeetodiga.
Mitmekordsete transformatsioonide puhul ei ole alati võimalik leida tavapärast vastet, millel oleks geneetiline taust, mis on sama lähedane kui tavapärane vaste, mida tavaliselt kasutatakse ühekordsete transformatsioonide jaoks. Sellises olukorras esitab taotleja tavapärase vaste valiku kohta piisava põhjenduse ning hindab selle piiratust riskihindamise seisukohast. Täiendavate võrdlusmaterjalidena võib lisada ka geneetiliselt muundatud üksikud vanemliinid või geneetiliselt muundatud liinid, mis sisaldavad mitmekordsete transformatsioonide alakombinatsiooni, mille kohta taotlus on esitatud, või nendest geneetiliselt muundatud liinidest saadud negatiivsed segregandid. Taotleja esitab üksikasjaliku teabe, millega põhjendatakse täiendavate võrdlusmaterjalide lisamist.
Kõikidel juhtudel esitab taotleja teabe, mis käsitleb aretusskeemi (sugupuu) seoses geneetiliselt muundatud taime, tavapärase vaste ja vajaduse korral täiendava võrdlusmaterjaliga, koos piisava põhjendusega nende valiku kohta. Teavet tavapärase vaste varasema ohutu kasutamise kohta tuleb asjakohaselt tõendada nii kvalitatiivsete kui ka kvantitatiivsete andmetega.
Käesolevas punktis sätestatud nõuete kohaldamise kohta sisaldab üksikasjalikumat teavet EFSA teaduslik arvamus „Guidance on selection of comparators for the risk assessment of genetically modified plants and derived food and feed” (2).
1.3.2. Katsekava ja väliuuringutel saadud andmete statistiline analüüs võrdleva analüüsi jaoks
1.3.2.1. Katsekava protokollide kirjeldus
a) Katsekava põhimõtted
Võrdleva analüüsi materjali tootmiseks kasutatavad väliuuringud tehakse, et teha kindlaks, kas geneetiliselt muundatud taim ja/või geneetiliselt muundatud toit või sööt erineb oma tavapärasest vastest ja/või on varasema ohutu kasutusega geneetiliselt muundamata võrdlussortidega samaväärne.
Iga lõpp-produkti kohta kastutatakse võrdlevas analüüsis kaht järgmist lähenemisviisi:
|
i) |
erinevuse katsetamine, et kontrollida, kas geneetiliselt muundatud taim erineb oma tavapärasest vastest ja kas seda võib pidada seepärast ohtlikuks sõltuvalt kindlakstehtud erinevuse tüübist ning kokkupuute ulatusest ja tüübist; |
|
ii) |
samaväärsuse katsetamine, et kontrollida, kas geneetiliselt muundatud taim, kui sisestatud tunnus(ed) välja arvata, on geneetiliselt muundamata võrdlussortidega samaväärne või mitte. |
Erinevuse katsetamises on nullhüpotees, et GMO ja selle tavapärase vaste vahel erinevus puudub, ja alternatiivne hüpotees on, et erinevus on olemas.
Kui riskihindamisel kasutatakse täiendavat võrdlusmaterjali, katsetakse erinevust geneetiliselt muundatud taime ja iga täiendava võrdlusmaterjali vahel, järgides punktis 1.3.2.2 esitatud nõudeid, mis käsitlevad geneetiliselt muundatud taime ja selle tavapärase vaste erinevuse katsetamist.
Samaväärsuse katsetamises on nullhüpotees, et GMO ja võrdlussortide vahel on erinevus vähemalt nii suur kui kindlaksmääratud minimaalsuurus (vt punkt 1.3.2.2), ja alternatiivne hüpotees on, et erinevust ei ole või erinevus on väiksem kui kindlaksmääratud miinimum GMO ja võrdlussortide vahel.
Nullhüpoteesi tagasilükkamine on vajalik, järeldamaks, et GMO ja võrdlussordid on asjaomase lõpp-produkti puhul üheselt samaväärsed. Samaväärsuse katseks kasutatavad samaväärsuse piirid esindavad asjakohaselt loodusliku kõikumise ulatust, mida eeldatakse varasema ohutu kasutusega võrdlussortide puhul.
b) Katsekava eriprotokollid
Looduslikul kõikumisel võib olla palju põhjusi: sordi piires tekib kõikumine keskkonnategurite mõjul ja sortide vaheline kõikumine tekib geneetiliste ja keskkondlike tegurite tõttu. Ainult genotüüpidele omistatavate erinevuste kindlakstegemiseks ja hindamiseks on oluline kontrollida keskkondlikku varieeruvust. Seepärast lisatakse väliuuringute katsekavasse piisaval arvul geneetiliselt muundamata võrdlussorte, et tagada samaväärsuse piiride kehtestamiseks vajalik varieeruvuse asjakohane hinnang. Geneetiliselt muundatud taimedest, tavapärasest vastest, võrdlussortidest ja vajaduse korral täiendavast võrdlusmaterjalist koosnev katsematerjal jagatakse igal katsealal ühe välja piires juhuslikele proovitükkidele tavaliselt täielikult randomiseeritud süsteemi või randomiseeritud plokksüsteemi järgi. Väliuuringuteks valitud eri katsealad esindavad erinevaid ilmastikuolusid ja põllumajanduslikke tingimusi, milles põllukultuuri kasvatatakse; valikut põhjendatakse selgelt. Geneetiliselt muundamata võrdlussortide valik sobib valitud katsealadele ja seda põhjendatakse selgelt. Kui katsealade kasvutingimused on piiratud, kordab taotleja väliuuringuid kauem kui ühe aasta jooksul.
Iga katseala piires on katsematerjalid, mis koosnevad geneetiliselt muundatud taimedest, tavapärasest vastest ja vajaduse korral täiendavast võrdlusmaterjalist, kõikide dubleerivate analüüside puhul identsed. Lisaks on igal katsealal vähemalt kolm sobivat sellise põllukultuuri geneetiliselt muundamata võrdlussorti, mille puhul on teada varasem ohutu kasutus, mis on ka dubleerivate analüüside puhul identne, v.a juhul, kui selle nõude täitmata jätmiseks on selge põhjendus. Iga katseala dubleerivate analüüside arv vastab iga katsematerjali kohta saadud tulemuste arvule; dubleerivaid analüüse peab alati olema neli. Kui teatud katsealal on olemas üksnes kaks sobivat võrdlussorti, tehakse katseala kohta kuus dubleerivat analüüsi; kui on olemas üksnes üks sobiv võrdlussort, siis tehakse kaheksa dubleerivat analüüsi.
Iga väliuuringut korratakse vähemalt kaheksal katsealal, mis on valitud esindama tõenäolisi vastuvõtvaid keskkondi, kus hakatakse taime kasvatama. Väliuuringuid võib teha ühe aasta jooksul või jaotada need mitmele aastale. Geneetiliselt muundamata võrdlussordid võivad olla katsealati erinevad ning kogu väliuuringute sarja ajal kasutatakse vähemalt kuut eri võrdlussorti.
Kui geneetiliselt muundatud taime katsetatakse koos sama põllukultuuriliigi (näiteks Zea mays) muude geneetiliselt muundatud taimedega, võib nende erinevate geneetiliselt muundatud taimede võrdlevaks analüüsiks toota materjali ühel ajal samal katsealal ja sama väliuuringu raames, pannes erinevad geneetiliselt muundatud taimed ja nendega sobiva võrdlusmaterjali samasse randomiseeritud plokki. Selle suhtes kehtib kaks ranget tingimust:
|
i) |
tavapärane vaste ja vajaduse korral täiendav võrdlusmaterjal esinevad alati koos geneetiliselt muundatud taimega samas plokis; |
|
ii) |
kõik erinevad geneetiliselt muundatud taimed ja nende võrdlusmaterjal ja kõik geneetiliselt muundamata võrdlussordid, mida kasutatakse, et kontrollida samaväärsust kõnealuste geneetiliselt muundatud taimedega, randomiseeritakse täielikult iga ploki piires. |
Kui iga ploki kohta on nõutud väljade arv suurem kui 16, võib kasutada osaliselt tasakaalustatud mittetäielikku plokksüsteemi, et vähendada igas plokis väljade arvu, jättes igast plokist välja mõne geneetiliselt muundatud taime ja nende asjakohase võrdlusmaterjali. Selle suhtes kehtib kaks ranget tingimust:
|
i) |
tavapärane vaste esineb alati koos selle juurde kuuluva vastava geneetiliselt muundatud taimega samas plokis; |
|
ii) |
kõik geneetiliselt muundamata võrdlussordid esinevad igas mittetäielikus plokis ja on täielikult randomiseeritud koos taimede ja nende võrdlusmaterjaliga. |
Väliuuringuid kirjeldatakse asjakohaselt, esitades teabe oluliste parameetrite kohta, nagu katsevälja harimine enne külvi, külvikuupäev, pinnase tüüp, herbitsiidide kasutamine, klimaatilised ja muud kasvatamis- või keskkonnatingimused kasvu- ja koristusajal, samuti koristatud materjali ladustamise aegsed tingimused.
Üksikasjalikumad juhised käesoleva punkti nõuete kohaldamise kohta on esitatud EFSA arvamuses: „Statistical considerations for the safety evaluation of GMOs” (3).
1.3.2.2. Statistiline analüüs
Andmete analüüs esitatakse selges vormis, kasutades standarditud teaduslikke ühikuid. Statistilises analüüsis kasutatud algandmed ja programmikoodid esitatakse töödeldaval kujul.
Andmete muutmine võib olla vajalik, et tagada normaalsus ja esitada sobiv skaala, millel statistilised mõjud on aditiivsed. Lõpp-produktide paljude sõltuvate muutujate puhul on logaritmteisendus eeldatavasti asjakohane. Sellistel juhtudel tõlgendatakse mis tahes erinevust geneetiliselt muundatud materjali ja mis tahes muu katsematerjali vahel suhtena loomulikul skaalal. Ent kui logaritmteisendus ei anna asjakohaseid tulemusi, kaalutakse loomuliku skaala või muu skaala kasutamist.
Väliuuringutel vaadeldud iga lõpp-produkti koguvarieeruvust hinnatakse ja liigendatakse, kasutades sobivaid statistilisi mudeleid, et tuletada kaks usalduspiiride kogumit ja seada alumine ja ülemine samaväärsuspiir võrdlussortide seas vaadeldud varieeruvuse põhjal. Üht usalduspiiride kogumit kasutatakse erinevuse katses, teist kogumit ja samaväärsuspiire kasutatakse samaväärsuskatses.
Lineaarset statistilist segamudelit kasutatakse usalduspiiride arvutamiseks mõlema katse puhul (st erinevus- ja samaväärsuskatsed); veidi teistsugust mudelit kasutatakse, et hinnata samaväärsuskatses kasutatavaid samaväärsuspiire.
Sõltumatut muutujat tähistatakse tähega l (segamudelis ei ole keskel), kusjuures l = 1, kui proovitükkidel on mis tahes geneetiliselt muundamata võrdlussordid, muul juhul l = 0. Mudeli 1 juhuslikud tegurid peaksid olema sellised, mis näitavad erinevust (kuid ei piirdu nendega) i) katsematerjalide vahel (kogum, kuhu kuuluvad geneetiliselt muundatud taim, selle tavapärane vaste, iga geneetiliselt muundamata võrdlussort ja mis tahes täiendav võrdlusmaterjal); ii) katsematerjalide ja muutuja l vastastikmõju vahel; iii) katsealade vahel; ja iv) katseala plokkide vahel. Mudel 2 peaks olema mudeliga 1 identne, kuid katsematerjalide ja muutuja l vastastikmõju kujutav juhuslik tegur jäetakse välja.
Mõlemate mudelite puhul peaks kindlaksmääratud teguril olema sama palju tasandeid kui on katsematerjale ning kujutama katsematerjalide keskmiste erinevust. Katsematerjalid on vastavalt eespool esitatud määratlusele järgmised: geneetiliselt muundatud taim; selle tavapärane vaste; geneetiliselt muundamata võrdlussortide kogum; ning mis tahes täiendav katsematerjal. Geneetiliselt muundamata võrdlussortide kogumit käsitatakse kindlakstehtud teguri üheainsa tasandina. Seoses erinevuskatsetega pakub kindlaksmääratud teguri puhul huvi geneetiliselt muundatud taime ja selle tavapärase vaste vaheline vabadusaste. Seoses samaväärsuskatsega pakub kindlaksmääratud teguri puhul huvi geneetiliselt muundatud taime ja geneetiliselt muundamata võrdlussortide kogumi vaheline vabadusaste.
Nii erinevuskatse kui ka samaväärsuskatse tegemisel kasutatakse hüpoteesikontrolli ja usalduspiiride struktuuri vahelist vastavust. Samaväärsuskatse puhul kasutatakse lähenemisviisi, milles järgitakse kahe ühekülgse katse (TOST) metoodikat, lükates tagasi mittesamaväärsuse nullhüpoteesi, kui mõlemad usalduspiirid jäävad samaväärsuspiiride vahele. 90 % usalduspiiride valik vastab tavalisele 95 % tasemele samaväärsuse statistilise katsetamise puhul.
Erinevus- ja samaväärsuskatsete tulemused esitatakse visuaalselt kõikide lõpp-produktide kohta korraga ühe või mitme diagrammiga.
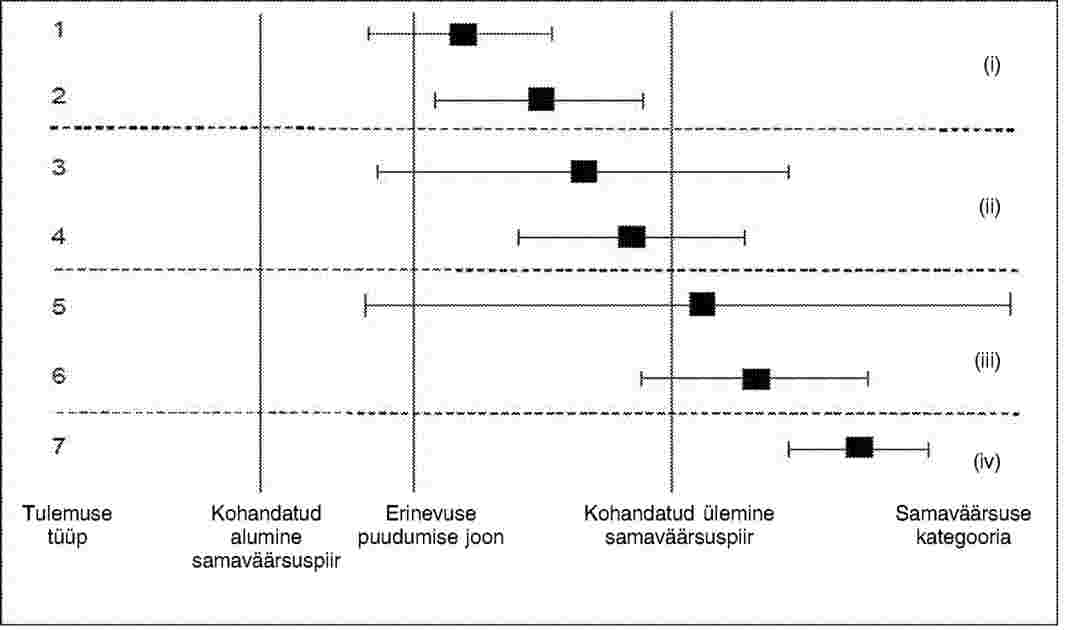
Diagramm(id) näitab (näitavad) null-erinevuse joont geneetiliselt muundatud materjali ja selle tavapärase vaste vahel ning iga lõpp-produkti kohta: alumine ja ülemine kohandatud samaväärsuspiir, keskmine erinevus geneetiliselt muundatud materjali ja selle tavapärase vaste vahel ja selle erinevuse usalduspiirid (vt joonisel 1 olevas diagrammis võimalikke tulemusi ühe lõpp-produkti kohta).
Kui tavapärasele vastele lisaks kasutatakse võrdlusmaterjalina muud katsematerjali, näidatakse diagrammi(de)s geneetiliselt muundatud materjali ja kõnealuse võrdlusmaterjali keskmine erinevus, selle usalduspiirid ja selle kohandatud samaväärsuspiirid kõikide selliste täiendavate võrdlusmaterjalide puhul, osutades samale null-alusjoonele, mis on määratud kindlaks tavapärase vastega. Null-erinevusjoon logaritmilisel skaalal vastab multiplikatiivsele ühtsustegurile loomulikul skaalal. Horisontaalteljele märgitakse väärtused, mis näitavad muutust loomulikul skaalal. Logaritmteisenduse puhul näidatakse muutused 2x ja ½x ühesuguse vahemikuga mõlemal pool null-erinevusjoont.
Märkimisväärselt valede erinevuste eeldatavast osatähtsusest olenemata teatab taotleja kõigist vaadeldud märkimisväärsetest erinevustest geneetiliselt muundatud põllukultuuri, selle tavapärase vaste ja vajaduse korral muu katsematerjali vahel, ja käsitleb neid keskendudes nende bioloogilisele tähtsusele (vt riski kirjeldust käsitlev punkt 3).
Teatamisel esitatakse iga analüüsitud lõpp-produkti kohta täpsed andmed, esitades järgmise teabe:
|
a) |
oletused, millel analüüs põhineb; |
|
b) |
valitud segamudelite täielik kirjeldus, sealhulgas määratud ja juhuslikud mõjud; |
|
c) |
katsematerjali ja katsealade vastastikmõju kõikide katsete tulemused; |
|
d) |
kindlad mõjud, koos asjakohase hinnangulise jääkhälbega, millega neid võrreldakse, ja dispersioonikomponendid juhuslike tegurite puhul; |
|
e) |
hinnangulised vabadusastmed; |
|
f) |
muu asjakohane statistika. |
Käsitleda tuleb muude selliste kasvutingimuste tõenäolist mõju, mida ei ole veel katsetatud väliuuringutes.
Joonis 1. Võrdleva hindamise diagrammi lihtsustatud versioon, mis näitab iga lõpp-produkti kohta seitset võimalikku tulemuse tüüpi. Pärast samaväärsuspiiride kohandamist aitab üks usalduspiir (erinevuse jaoks) visuaalselt hinnata mõlema katse (erinevus ja samaväärsus) tulemusi. Siin võetakse arvesse vaid ülemist samaväärsuspiiri. Näidatud on: geneetiliselt muundatud põllukultuuri keskmine asjakohasel skaalal (ruut), usalduspiirid (joonte otspunktid) erinevuste kohta geneetiliselt muundatud põllukultuuri ja selle tavapärase vaste vahel (joon näitab usaldusvahemikku), üks vertikaalne joon näitab erinevuse puudumist (erinevuskatse jaoks) ja vertikaalsed jooned näitavad kohandatud samaväärsuspiire (samaväärsuskatse). Tulemuse tüüpide 1, 3 ja 5 puhul ei saa erinevuse puudumise nullhüpoteesi tagasi lükata: tulemuste 2, 4, 6 ja 7 puhul erineb geneetiliselt muundatud põllukultuur oma tavapärasest vastest. Samaväärsuse tõlgendamisel määratakse kindlaks neli kategooriat i–iv: kategoorias i lükatakse mittesamaväärsuse nullhüpotees samaväärsuse kasuks tagasi; kategooriates ii, iii ja iv ei saa mittesamaväärsust tagasi lükata.
|
A. |
Erinevuskatse osas liigitatakse diagrammi iga tulemus järgmiselt ja tehakse vastav asjakohane järeldus.
|
|
B. |
Samaväärsuskatse osas liigitatakse diagrammi iga tulemus järgmiselt ja tehakse vastav asjakohane järeldus.
Kui on tegemist märkimisväärse erinevuse ja/või samaväärsuse puudumisega mis tahes lõpp-produkti puhul, tehakse statistiline lisaanalüüs, et hinnata, kas mõne katsematerjali ja katseala vahel esineb vastastikmõju, seejuures võidakse kasutada lihtsat standardmeetodit ANOVA. Meetodist olenemata esitatakse iga analüüsitud lõpp-produkti kohta üksikasjalikud andmed, kaasa arvatud: a) oletused, millel analüüs põhineb, ja vajaduse korral: b) vabadusastmed, c) hinnanguline jääkhälve iga hälbeallika kohta ja dispersioonikomponendid, d) muu oluline statistika. Kõnealuste lisaanalüüside eesmärk on aidata tõlgendada leitud olulisi erinevusi ning uurida katsematerjalide ja muude tegurite vahelist võimalikku vastastikmõju. Üksikasjalikumad juhised käesoleva punkti nõuete kohaldamise kohta on esitatud EFSA arvamuses: „Statistical considerations for the safety evaluation of GMOs” (4). |
1.3.3. Materjali ja koostisosade valimine analüüsi jaoks
Kui võrreldakse geneetiliselt muundatud toitu ja sööta tavapärase vastega, on taimse materjali koostise analüüs otsustava tähtsusega. Võrdlevaks hindamiseks kasutatava materjali valimisel võetakse arvesse geneetiliselt muundatud taime kasutusotstarvet ja geneetilise muundamise laadi. Herbitsiidikindlate geneetiliselt muundatud taimede puhul kasutatakse kolme katsematerjali: ettenähtud herbitsiidiga kokkupuutunud geneetiliselt muundatud taim; herbitsiidi tavapärase kasutusmeetodiga töödeldud tavapärane vaste ja geneetiliselt muundatud taim, mida on töödeldud sama herbitsiidi tavapärase kasutusmeetodiga. Analüüs tehakse töötlemata põllumajandussaadusega (välja arvatud nõuetekohase põhjenduse olemasolu korral), sest see on tavaliselt peamine lähtekoht, mille kaudu materjal siseneb toidu ja sööda tootmis- ja töötlemisahelasse. Vajaduse korral ja juhtumipõhiselt (vt ka punkt 1.3.6) tehakse töödeldud toodete (näiteks toit ja sööt, toidu koostisosad, söödamaterjal, toidu- ja söödalisandid, lõhna- ja maitseained) lisaanalüüs. Proovivõtt, analüüs ja katsetatava materjali ettevalmistamine tehakse asjakohaste kvaliteedistandardite kohaselt.
1.3.4. Koostise võrdlev analüüs
Lisaks analüüsile uute ekspresseeritud valkude tasandil (vt punkt 1.2.2.3) tehakse asjakohase segu koostise analüüs. Igal juhul esitab taotleja vähemalt analüüsi põhikoostise (sealhulgas niiskus ja tuhasus), peamiste makro- ja mikrotoitainete, toitaine omastatavust takistavate koostisosade, looduslike toksiinide ja juba kindlakstehtud allergeenide kohta, samuti muude teiseste metaboliitide kohta, mis on konkreetsetele põllukultuuriliikidele iseloomulikud (vt Majanduskoostöö ja Arengu Organisatsiooni (OECD) konsensusdokumendid, mis käsitlevad arvamusi uute taimesortide koostise kohta) (5). Analüüsiks valitakse vitamiinid ja mineraalained, mille sisalduse määr on toitumise seisukohast oluline ja/või millel on toitumise seisukohast oluline tähendus toiduvalikus koguste puhul, milles taime tarbitakse. Nõutavad spetsiaalsed analüüsid sõltuvad uuritavast taimeliigist, kuid sisaldavad üksikasjalikku hinnangut, mis on asjakohane geneetilise muundamise kavandatud mõju, taime uuritud toiteväärtuse ja kasutuse puhul. Taotleja pöörab erilist tähelepanu peamistele toitainetele, nagu valgud, süsivesikud, lipiidid/rasvad, kiudained, vitamiinid ja mineraalained. Näiteks lisatakse suure õlisisaldusega taimede puhul rasvhappeline profiil (peamised individuaalselt küllastatud, monoküllastumata ja polüküllastumata rasvhapped) ja tähtsa valguallikana kasutatavate taimede puhul aminohappeline profiil (üksikud valgu aminohapped ja peamised mittevalgulised aminohapped). Nõutakse ka taime rakuseina koostisosade analüüsi söödaks kasutatavate taime vegetatiivsete osade kohta.
Taotleja esitab ka analüüsi peamiste toksiinide kohta, mis esinevad retsipienttaimes looduslikult ja mis võivad mõjuda kahjulikult inimeste/loomade tervisele sõltuvalt nende toksilisuse tugevusest ja tasemetest. Selliste koostisosade sisaldust hinnatakse vastavalt taimeliigile ja toidu- või söödatoote kavandatud kasutusele. Uuritakse sarnasust, toitaine omastatavust takistavaid koostisosi, nagu seedeensüümi inhibiitorid, ja juba kindlaks tehtud allergeene.
Sisestatud tunnuse omadused võivad teha vajalikuks konkreetsete koostisosade edasise analüüsi, sealhulgas nende ainevahetusradade metaboliitide analüüsi, mis võivad olla muundatud. Taotleja kaalub vajaduse korral muude koostisosade kui OECD konsensusdokumentides kindlaks määratud peamiste toitainete, peamiste toksiinide, toitaine omastatavust takistavate koostisosade ja allergeenide lisamist analüüsi.
1.3.5. Põllumajanduslike ja fenotüüpiliste omaduste võrdlev analüüs
Taotleja esitab geneetiliselt muundatud taime ja selle tavapärase vaste vahel tehtud võrdluse. See võrdlus võimaldab taotlejal kindlaks teha geneetilisest muundamisest tulenevad tahtmatud mõjud ja selles käsitletakse ka taime bioloogiat ja põllumajanduslikke tunnuseid, sealhulgas üldised aretusparameetrid (näiteks saak, taime morfoloogia, õitsemisaeg, päevakraadid täisküpsuseni, õietolmu elujõulisuse kestus, reageerimine taimpatogeenidele ja putukkahjuritele, tundlikkus abiootiliste stressitegurite suhtes). Kõnealuste väliuuringute protokollid vastavad punktis 1.3.2. sätestatud nõuetele.
Kui transformatsioonid liidetakse traditsioonilise ristamise teel, võib toimuda muutusi ka põllumajanduslikes ja fenotüüpilistes omadustes. Mitmekordsete transformatsioonide fenotüüpiliste ja põllumajanduslike omaduste võimalikke erinevusi hinnatakse väliuuringutel. Vajaduse korral esitab taotleja lisateavet mitmekordsete transformatsioonide põllumajanduslike tunnuste kohta, mis saadakse täiendavatelt väliuuringutelt.
1.3.6. Töötlemise mõjud
Taotleja hindab, kas on tõenäoline, et kohaldatud töötlemis- või säilitamistehnoloogiad võivad muuta geneetiliselt muundatud lõpptoodete omadusi võrreldes asjaomase tavapärase vastega. Taotleja esitab piisavalt üksikasjaliku kirjelduse erinevate töötlemistehnoloogiate kohta, pöörates erilist tähelepanu sammudele, mis võivad põhjustada märkimisväärseid muutusi toote koostises, kvaliteedis või puhtuses.
Geneetiline muundamine võib mõjutada ainevahetusradu, mille tulemuseks on muutused mittevalguliste ainete sisalduses või uutes metaboliitides (näiteks toitaineliselt täiustatud toitudes). Töödeldud toodet võib hinnata koos geneetiliselt muundatud taimega geneetilise muundamise ohutuse osas või töödeldud toodet võib hinnata eraldi. Taotleja esitab kõnealuste toodete riski hindamiseks teaduslikud põhjendused. Taotleja kaalub lisakatseandmete esitamist iga juhtumi puhul eraldi.
Vajaduse korral on sõltuvalt tootest tarvis teavet koostise, soovimatute ainete taseme, toiteväärtuse ja ainevahetuse, samuti kavandatud kasutuse kohta.
Vajaduse korral tuleb uute ekspresseeritud valkude laadist sõltuvalt hinnata, millisel määral viivad töötlemisetapid lõpptootes kõnealuste valkude kontsentreerumiseni või kõrvaldamiseni, denaturatsioonini ja/või lagunemiseni.
1.3.7. Järeldus
Võrdleva analüüsi järelduses märgitakse selgelt järgmised seigad:
|
a) |
kas geneetiliselt muundatud taime põllumajanduslikud ja fenotüüpilised omadused, välja arvatud sisestatud tunnus(ed), on erinevad selle tavapärasest vastest ja/või on samaväärsed võrdlussortidega, võttes arvesse looduslikku kõikumist; |
|
b) |
kas geneetiliselt muundatud toidu ja sööda koostise omadused on looduslikku kõikumist arvesse võttes erinevad selle tavapärase vaste omadustest ja/või on samaväärsed võrdlussortidega, kui arvata välja sisestatud tunnus(ed); |
|
c) |
omadused, mille poolest geneetiliselt muundatud taim või geneetiliselt muundatud toit ja sööt erinevad oma tavapärasest vastest ja/või mille poolest need ei ole samaväärsed võrdlussortidega, võttes arvesse looduslikku kõikumist, ja mis vajavad edasist uurimist; |
|
d) |
kas traditsioonilise ristamisega tehtud mitmekordsete transformatsioonide puhul on märke kombineeritud transformatsioonide vastastikmõjude kohta. |
1.4. Toksikoloogia
Hinnatakse sellise geneetilise muundamise nagu sisestatud uute geenide, geeni vaigistamisest või endogeense geeni üleekspressioonist tulenevate muutuste toksikoloogilist mõju terviklikule geneetiliselt muundatud toidule ja söödale.
Toksikoloogiline hindamine tehakse selleks, et:
|
a) |
näidata, et geneetilise muundamise kavandatud mõju(de)l ei ole inimeste ja loomade tervisele kahjulikku mõju; |
|
b) |
näidata, et geneetilise muundamise tahtmatu(d) mõju(d), mis on kindlaks tehtud varasemate võrdlevate molekulaarsete, koostise ja fenotüüpiliste analüüside põhjal või mis on eeldatavalt avaldunud, ei ole kahjulikud inimeste ja loomade tervisele; |
|
c) |
teha kindlaks uute koostisosade võimalikud kahjulikud mõjud ja määrata kindlaks suurimad annused, mis ei tekita kahjulikke mõjusid. Asjakohasest loomkatsest saadud andmete põhjal võib tuletada üksiku koostisosa aktsepteeritava päevadoosi inimese jaoks, kasutades määramatuse ja ohutuse tegureid, millega võetakse arvesse erinevusi katseloomaliikide ja inimeste vahel ning individuaalseid erinevusi inimeste seas; |
|
d) |
teha kindlaks võimalikud kahjulikud mõjud terviklikule geneetiliselt muundatud toidule ja söödale või kõrvaldada allesjäänud ebakindlus 90-päevaste söötmise uuringute abil. |
Taotleja otsustab, milline toksikoloogiline uuring uute koostisosade ja tervikliku geneetiliselt muundatud toidu/sööda suhtes teha, punktis 1.2 ja 1.3 osutatud molekulaarse ja võrdleva analüüsi tulemuste ehk geneetiliselt muundatud toote ja selle tavapärase vaste vahel kindlaks tehtud erinevuste põhjal, kaasa arvatud tahtlikud ja tahtmatud muutused. Taotleja hindab ka tehtud toksikoloogiliste uuringute tulemusi, et kaaluda, kas uute koostisosade ja tervikliku geneetiliselt muundatud toidu/sööda suhtes on vaja teha täiendavaid uuringuid, nagu on ette nähtud punktides 1.4.4.2. ja 1.4.4.3.
Taotleja võtab arvesse uute ekspresseeritud valkude esinemist, muude uute koostisosade võimalikku esinemist ja/või võimalikke muutusi loomulike koostisosade tasemes, mis ületavad tavalisi kõikumisi. Konkreetsed teabenõuded ja katsestrateegiad on sätestatud punktides 1.4.1–1.4.4.
Selliste taotluste puhul, mille kohaldamisala hõlmab geneetiliselt muundatud taimedest toodetud geneetiliselt muundatud toitu ja sööta või piirdub sellega, esitatakse töödeldud toodetega tehtud toksikoloogilised uuringud, välja arvatud juhul, kui taotleja esitab geneetiliselt muundatud taime (või selle asjakohaste osade) riskihinnangu, mis tõendab selle ohutust, ning tingimusel, et puuduvad märgid selle kohta, et töödeldud geneetiliselt muundatud toit ja sööt ei erine asjaomasest tavapärasest vastest. Taotleja esitab selle kohta piisava põhjenduse.
Inimeste ja/või loomade tervisele avalduvate riskide hindamiseks ettenähtud toksikoloogilised uuringud täiendavad üksteist. Enamik geneetiliselt muundatud toidu ohutuse hindamiseks nõutud uuringuid on kehtivad ka geneetiliselt muundatud sööda hindamise puhul.
Lisaks tarbijate ja loomade kokkupuutele toidu ja sööda tarbimise kaudu peab taotleja teatama kõikidest kahjulikest mõjudest inimestele, mille põhjuseks võib olla nende kokkupuutumine geneetiliselt muundatud toidu- ja söödamaterjaliga ametialase tegevuse raames, näiteks põllumajanduses või seemnete töötlemises. Võimalike kahjulike mõjude kõnealuste märkide täpsemaks kirjeldamiseks tehakse sobivad uuringud.
Taotleja kasutab toksikoloogiliste katsete jaoks rahvusvaheliselt kokkulepitud protokolle ja katsemeetodeid (vt punkti 1.7 tabel 1 ja 2). Kõnealuste protokollide kohandamist või meetodite kasutamist, mis erinevad sellistest protokollidest, tuleb taotluses põhjendada.
1.4.1. Uute ekspresseeritud valkude katsetamine
Taotleja esitab hinnangu kõigi uute ekspresseeritud valkude kohta. Uuringud, mida nõutakse uue ekspresseeritud valgu võimaliku toksilisuse uurimiseks, valitakse iga juhtumi puhul eraldi sõltuvalt olemasolevatest teadmistest valgu allika, funktsiooni või toime kohta ja varasemast tarbimise kogemusest inimeste ja loomade seas. Geneetiliselt muundatud taimedes ekspresseeritud valkude puhul ei nõuta käesolevas punktis sätestatud spetsiaalseid toksilisuse uuringuid, kui nii taime kui ka uute ekspresseeritud valkude varasem ohutu tarbimine toiduna ja/või söödana on nõuetekohaselt dokumenteeritud. Sel juhul esitab taotleja valkude varasemat ohutut kasutamist tõendava vajaliku teabe.
Kui nõutakse spetsiaalseid katseid, on uuritav valk samaväärne uue ekspresseeritud valguga, nagu see ekspresseerub geneetiliselt muundatud taimes. Kui piisava hulga katsematerjali puudumise tõttu kasutatakse mikroorganismide toodetud valku, tõendatakse, et see mikroobne analoog on struktuuriliselt, biokeemiliselt ja funktsiooniliselt uue ekspresseeritud valguga samaväärne. Samaväärsuse tõendamiseks on eelkõige vaja võrrelda molekulmassi, aminohappe järjestust, translatsioonijärgset muutust, immunoloogilist reageerimisvõimet ja ensüümide puhul ensümaatilist aktiivsust. Kui taimes ekspresseerunud valgu ja selle mikroobse analoogi vahel on erinevused, hinnatakse kõnealuste erinevuste tähtsust ohutusuuringute jaoks.
Uute ekspresseeritud valkude ohutuse tõendamiseks esitab taotleja:
|
a) |
uue ekspresseeritud valgu molekulaarse ja biokeemilise iseloomustuse, sealhulgas primaarstruktuuri ja molekulmassi (näiteks kasutades massispektromeetriat) kindlaksmääramine, uuringud translatsioonijärgsete muutuste kohta ja selle ülesande kohta. Uute ekspresseeritud ensüümide puhul esitatakse teave ensüümiaktiivsuse kohta, sealhulgas optimaalse aktiivsuse temperatuuri ja pH vahemik, substraadi spetsiifika ja võimalikud reaktsioonisaadused. Hinnatakse ka võimalikku vastastikmõju muude taime koostisosadega; |
|
b) |
selliste homoloogiliste valkude ajakohase otsingu, mille puhul on teada, et neil on kahjulikud mõjud, näiteks toksilised valgud. Ka võib anda väärtusliku teavet selliste homoloogiliste valkude otsing, mis toovad esile normaalse ainevahetusliku või struktuurilise funktsiooni. Otsingu tegemiseks kasutatud andmebaase ja metoodikat kirjeldatakse täpselt; |
|
c) |
kirjelduse valgu stabiilsuse kohta asjakohastes töötlemis- ja ladustamistingimustes ning toidu ja sööda eeldatava töötlemise kohta. Uuritakse temperatuuri- ja pH muutuste mõju ja iseloomustatakse selliste töötlemisviiside kaudu tekkinud võimalikke valkude muutusi (näiteks denaturatsioon) ja/või püsivate valgufragmentide tootmist; |
|
d) |
andmed, mis käsitlevad uute ekspresseeritud valkude resistentsust proteolüütiliste ensüümide (näiteks pepsiin) suhtes, näiteks in vitro uuringute abil, kasutades sobivaid ja standarditud katseid. Iseloomustatakse ja hinnatakse stabiilseid lagunemisprodukte, pidades silmas võimalust, et neil on tervisele kahjulik mõju, mis on seotud nende bioloogilise aktiivsusega. |
|
e) |
uute ekspresseeritud valkudega suukaudse kordusdoosi toksilisuse 28-päevane uuring närilistel. Toksilisuse 28-päevase uuringu tulemustest sõltuvalt esitatakse vajaduse korral muud sihipärased uuringud, sealhulgas immuuntoksilisuse analüüs. |
Geneetiliselt muundatud taimede uute ekspresseeritud valkude ägeda toksilisuse katsetel on geneetiliselt muundatud toidu ja sööda korduva tarbimise riski hindamise seisukohast vähe lisaväärtust ning neid ei esitata selle punkti kohaselt tehtud uuringute osana.
Taotleja teeb uuringud valkude kombineeritud manustamise kohta, kui geneetilise muundamise tulemuseks on kahe või enama valgu ekspresseerumine geneetiliselt muundatud taimes ja kui teaduslike andmete põhjal on tehtud kindlaks sünergiliste või antagonistlike vastastikmõjude võimalus, mis tekitab ohutuse suhtes kahtlust.
1.4.2. Uute koostisosade (välja arvatud valgud) katsetamine
Taotleja esitab muude kindlaks tehtud uute koostisosade kui valkude riskihinnangu. See hõlmab vastavalt juhtumile nende toksilisuse tugevuse ja toksikoloogiliste uuringute vajalikkuse hindamist, samuti nende sisalduse kindlaksmääramist geneetiliselt muundatud toidus ja söödas. Selliste uute koostisosade ohutuse kindlaksmääramiseks, millel puudub toidu ja söödana varasema ohutu kasutamise kogemus, esitab taotleja samasuguse teabe, nagu on kirjeldatud 16. augustil 2012 avaldatud dokumendis „Guidance for submissions for food additive evaluations by the EFSA Panel on Food Additives and Nutrient Sources added to Food” (6) ning komisjoni 25. aprilli 2008. aasta määruses (EÜ) nr 429/2008 Euroopa Parlamendi ja nõukogu määruse (EÜ) nr 1831/2003 rakendamise üksikasjalike eeskirjade kohta seoses taotluste koostamise ja esitamise ning söödalisandite hindamise ja lubamisega (7). See hõlmab teabe esitamist alusuuringute kohta, mis käsitlevad näiteks ainevahetuse/toksikokineetika, subkroonilise toksilisuse, genotoksilisuse, kroonilise toksilisuse, kantserogeensuse, paljunemisvõimet kahjustava ja arengut mõjutava toksilisuse kohta, samuti lisatakse muud asjakohased uuringud. Loomkatseid käsitlevate erisuuniste kohta vt käesoleva lisa punktis 1.7 esitatud tabel 1. Genotoksilisuse katse protokollid on esitatud käesoleva lisa punkti 1.7 tabelis 2.
1.4.3. Teave toidu ja sööda koostisosade sisalduse muutumise kohta
Käesolevat punkti kohaldatakse vaid juhul, kui geneetilise muundamise tahtliku või tahtmatu mõju tulemusel muutub toidu ja sööda selliste looduslike koostisosade sisaldus rohkem kui looduslike kõikumiste puhul.
Selleks, et tõendada toidu ja sööda selliste looduslike koostisosade muutunud sisalduse ohutust, nagu makro- ja mikrotoitained, toitaine omastatavust takistavad ained ja looduslikud toksiinid, samuti muud teisesed taime metaboliidid, esitab taotleja üksikasjaliku riskihinnangu, mis põhineb kõnealuste koostisosade füsioloogilise funktsiooni ja/või toksiliste omaduste andmetel.
Selle riskihinnangu tulemuse põhjal otsustatakse, kas ja millises ulatuses esitab taotleja lisaks närilistele tehtavale 90-päevase tervikliku toidu või söödaga söötmise uuringule toidu ja sööda valitud koostisosade täiendavad toksikoloogilised uuringud.
1.4.4. Tervikliku geneetiliselt muundatud toidu ja sööda katsetamine
Taotleja võtab geneetiliselt muundatud toidu ja sööda riskihinnangu aluseks eeskätt molekulaarse iseloomustuse, põllumajanduslikud ja fenotüüpilised omadused ning täieliku koostist käsitleva võrdleva analüüsi ning kindlaks tehtud tahtlike ja tahtmatute mõjude toksikoloogilise hindamise, sh närilistele tehtava 90-päevase tervikliku toidu või söödaga söötmise uuringu, nagu on esitatud punktis 1.4.4.1. Käesoleva jao punktides 1.4.4.2 ja 1.4.4.3 nimetatud olukordades tehakse tervikliku geneetiliselt muundatud toidu ja söödaga täiendavad toksikoloogilised eriuuringud.
1.4.4.1. 90-päevane tervikliku geneetiliselt muundatud toidu või söödaga söötmise uuring närilistel
Taotleja lisab 90-päevase tervikliku toidu või söödaga söötmise uuringu närilistel sellise toidu ja sööda hindamiseks, mis sisaldab geneetiliselt muundatud taimi, koosneb neist taimedest või on nendest taimedest toodetud, mis on ühe- või mitmekordse transformatsiooniga, mida ei ole saadud ühekordselt transformeeritud geneetiliselt muundatud taimede traditsioonilise ristamisega.
Selliste mitmekordsete transformatsioonide puhul, mis on saadud ühekordselt või mitmekordselt transformeeritud geneetiliselt muundatud taimede traditsioonilise ristamisega, lisatakse 90-päevane tervikliku toidu või söödaga söötmise uuring närilistel iga ühekordse transformatsiooniga geneetiliselt muundatud taime puhul, mida on kasutatud. Peale selle esitatakse 90-päevane närilistega tehtav mitmekordselt transformeeritud geneetiliselt muundatud taime sisaldava tervikliku toidu või söödaga söötmise lisauuring, kui i) insertide stabiilsuse, ii) insertide ekspresseerumise ja iii) transformatsioonide kombineerimisest tulenevate võimalike sünergiliste või antagonistlike mõjude hindamise käigus osutavad märgid võimalikele kahjulikele mõjudele.
Geneetiliselt muundatud toidu ja sööda toksikoloogiline uuring tuleks teha vastavalt katsele „Subkroonilise suukaudse toksilisuse katse – suukaudse kordusdoosi toksilisuse 90päevane uuring närilistel” (vt tabel 1), järgides vastu võetud protokolli. Põhimõtteliselt kasutatakse vähemalt kahte katsedoosi ja negatiivset kontrollproovi. Kõige suurem doos on maksimaalne võimalik doos, mis ei riku toitumuslikku tasakaalu; kõige väiksem doos sisaldab katsetatud toitu ja sööta koguses, mis on alati inimeste/loomade eeldatavast tarbimisannusest suurem. Analüüsitav geneetiliselt muundatud toit ja sööt peaks olema seotud tarbitava tootega. Herbitsiidikindlate geneetiliselt muundatud taimede puhul peaks katsetatav materjal tulema ettenähtud herbitsiidiga kokkupuutunud geneetiliselt muundatud taimest. Selle asemel et lisada katsesse võrdlussorte, tuletatakse võimaluse korral katseparameetrite looduslik kõikumine pigem varasematest taustaandmetest, mis on saadud müügil olevast toidust ja söödast, mis on saadud geneetiliselt muundamata taimedest, mille kohta on olemas ohutu kasutamise kogemus. Statistiline analüüs keskendub katsetatava materjali ja selle kontrollmaterjali vaheliste võimalike erinevuste kindlakstegemisele. Tuleks kasutada võimsusanalüüsi, et kindlaks teha sellise valimi suuruse, millega on võimalik avastada eelnevalt kindlaksmääratud bioloogiliselt olulise mõju suurus teataval võimsus- ja olulisustasemel. Kõnealuse uuringu tegemiseks on antud üksikasjalikud juhtnöörid dokumendis „EFSA Guidance on conducting repeated-dose 90-day oral toxicity study in rodents on whole food/feed” (8).
1.4.4.2. Paljunemisvõimet kahjustava ja arengut mõjutava toksilisusega seotud loomkatsed
Kui punktides 1.4.1, 1.4.2 ja 1.4.3 nõutud teave geneetiliselt muundatud toidu ja sööda kohta viitab võimalikule paljunemisvõimet kahjustavale, arengut mõjutavale ja kroonilisele toksilisusele või kui 90-päevase söötmise uuringus närilistel ilmnevad märgid viitavad kahjulikele mõjudele (näiteks närvi-, endokriinsete, paljunemis- või immuun- kudede/organite funktsioonilised ja/või histoloogilised muutused), tuleb teha asjakohased katsed. Paljunemisvõimet kahjustava ja arengut mõjutava ja kroonilise toksilisusega seotud katsete protokolle (vt punktis 1.7 esitatud tabel 1) võib kohandada tervikliku geneetiliselt muundatud toidu ja sööda katsetamise eesmärgil.
Arvestades, et 90-päevane söötmise uuring närilistel on ette nähtud täiskasvanud looma paljunemisorgani kaalus ja histopatoloogias avalduvate mõjude avastamiseks ja et sellega ei avastata muid paljunemisvõimele või arengule avalduvaid mõjusid, tehakse lisaks 90-päevane söötmise uuringule närilistel tervikliku geneetiliselt muundatud toidu ja sööda katse, kui sellega seoses on täheldatud ohte.
1.4.4.3. Muud loomkatsed geneetiliselt muundatud toidu ja sööda ohutuse uurimiseks (vt ka punktid 1.6.1 ja 1.6.2)
Esitatakse söötmise uuringud sihtloomaliikidega, kui märgid kahjulike mõjude kohta põhinevad punktides 1.4.1, 1.4.2 ja 1.4.3 nõutud teabel geneetiliselt muundatud toidu ja sööda kohta või närilistel tehtud 90-päevase söötmise uuringu tulemustel. Neis keskendutakse uute koostisosade (uute ekspresseeritud valkude ja muude uute koostisosade) ohutusele, tahtmatute mõjude kindlakstegemisele ja iseloomustamisele ja geneetiliselt muundatud taime kõikide tahtlike, oluliste ja koostise muutuste toitainelisele mõjule (vt ka punkt 1.6).
Seda liiki uuringutes piirdutakse taimsete materjalidega, mis sobivad nende toiduvalikuga ja mida saab kõrvutada toitainete poolest sobiva võrdlustoiduvalikuga.
1.4.4.4. Loomkatsete olulisuse tõlgendamine
Loomkatsetes täheldatud olulisi mõjusid hinnatakse, et teha kindlaks võimalikud tagajärjed inimeste ja loomade tervisele ja hinnata nende olulisust geneetiliselt muundatud toidu ja sööda ohutuse seisukohalt. Selle hinnangu toetamiseks võib esitada lisateavet ja muid märkusi. Tuleks pöörata tähelepanu asjaolule, et tulenevalt liikidevahelistest erinevustest võivad teatavad mõjud olla iseloomulikud katseloomale, mitte inimestele.
Taotleja võtab eelkõige arvesse doosi ja toime suhteid parameetrites, mida on muudetud (st vastavaid suuremaid muutusi suurendatud dooside korral), sest need annavad selge viite katsetatud koostisosa mõju kohta. Kui erinevust märgatakse vaid suurima kasutatud doosi puhul, kaalutakse muid tegureid, et määrata kindlaks, kas sellel on töötlemisega seos. Teavet taustavarieeruvuse kohta asjaomases parameetris võib taotleja saada andmetest, mis käsitlevad muid sama liiki/tüvikonna loomi, keda on uuritud samade või muude katsete käigus, või rahvusvaheliselt ühtlustatud andmebaasidest.
Katsed, milles kasutatakse mõlemast soost loomi, võivad muutused, mis esinevad vaid ühest soost loomadel, olla ikkagi olulised näitajad mõju kohta, sõltuvalt muudetavast parameetrist ja mehhanismist, millega see muutus võib olla põhjustatud. Näiteks võivad ühest soost loomad olla rohkem või isegi eriti altid vastava koostisosa põhjustatud muutustele kui vastassoost loomad, näiteks endokriinsete mõjude puhul.
Taotleja teeb kindlaks ka võimalikud vastastikused seosed täheldatud muutuste vahel üksikutes parameetrites, mis võivad tugevdada märki mõju avaldumise kohta. Näiteks maksakahjustus, mida võib täheldada maksas endas muutusena histopatoloogias, üldpatoloogias ja organi kaalus, võib ilmneda ka teatavate maksa toodetavate ainete muutunud tasemetes, näiteks ensüümide või bilirubiini sisalduses seerumis.
Täheldatud mõju võimalikku põhjust silmas pidades arvestatakse põhjusliku seose tõenäosust nii katsetatava koostisosa kui ka muude tegurite puhul, mis on samuti võinud tulemusi mõjutada (näiteks kehakaalulangus tingituna vähem maitsvama toidu väiksemas koguses söömisest). Katsetatava koostisosa ja katseloomadele avalduva mõju vahelise põhjusliku seose toetuseks esitatavad andmed võivad sisaldada näiteks ennustavaid andmeid tõenäoliste mõjude kohta in vitro ja in silico katsete põhjal ning doosi ja toime seoseid, mida on täheldatud loomkatsetes.
1.4.5. Toksikoloogilise hindamise järeldused
Toksikoloogilise hindamise järeldused osutavad sellele, kas
|
a) |
ohutushinnangu muudes osades kindlaks tehtud võimalikud kahjulikud mõjud on saanud kinnituse või kõrvale jäetud; |
|
b) |
geneetilise muundamise tulemusel uute ekspresseeritud valkude ja muude uute koostisosade kohta kättesaadav teave osutab võimalikele kahjulikele mõjudele eelkõige selles osas, kas ja milliste annuste puhul on konkreetsetes uuringutes kahjulikud mõjud kindlaks tehtud; |
|
c) |
teave nende looduslike koostisosade kohta, mille sisalduse tase erineb tavapärase vaste omast, osutab võimalikele kahjulikele mõjudele, eelkõige selles osas, kas ja milliste annuste puhul on konkreetsetes uuringutes kahjulikud mõjud kindlaks tehtud; |
|
d) |
tervikliku geneetiliselt muundatud toidu ja söödaga tehtud uuringutes on tehtud kindlaks kahjulikud mõjud ja milliste annuste puhul need esinevad. |
Taotleja hindab toksikoloogilise hindamise tulemust muundatud toidu ja sööda eeldatava tarbimisannuse põhjal (vt 2. jagu).
1.5. Allergeensus
Toiduallergia on toidu kõrvaltoime ning suur tervishoiuprobleem. Toiduallergia erineb toksilistest reaktsioonidest ja talumatusest. Allergia on teatava aine suhtes tekkiva immuunvastuse patoloogiline kõrvalekalle, mis mõjutab vaid teatavaid isikuid, kui keskkonna muutuste ja geneetilise soodumuse kombinatsiooni tagajärjel tekib allergiline sensibiliseerumine.
Allergilistel isikutel võib mõnikord üliväike kogus toitu, mida elanikkonna valdav enamik hästi talub, põhjustada raskeid sümptomeid ja surma. Kahjulikku mõju tervisele ei põhjusta allergeen ise, vaid allergilise isiku anormaalne reaktsioon allergeeni suhtes.
Toiduallergiat võivad põhjustada mitmesugused immuunmehhanismid. IgE vahendatud toiduallergia on toiduallergia peamine vorm, mis põhjustab kõige raskemaid reaktsioone ja on ainuke eluohtlikke reaktsioone põhjustav vorm. IgE vahendatud toiduallergia on olnud GMOde allergeensust käsitleva riskihindamise keskmes. Toiduallergia koosneb kahest faasist: esimene on sensibilisatsioon, mille puhul sümptomeid ei esine, samas kui immuunsüsteemi reageerimisvõime suureneb tugevasti ning hiljem toimub esilekutsumine (ärritus) koos kliiniliste nähtudega.
Allergeenide ehk ülitundlikkust põhjustava toidu või toidu koostisosade suukaudsel tarbimisel vähendavad neid teataval määral seedeensüümid, seejärel imenduvad need soole limaskesta kaudu (väikesed kogused isegi suu limaskesta kaudu), neid töödeldakse immuunsüsteemi spetsiaalsetes rakkudes ja seejärel toimub nende kokkupuude reaktiivsete immuunrakkudega, mis kutsuvad esile immuunvastuse. Sensibiliseerimine võib toimuda ka siis, kui allergeen puutub kokku nahaga või seda hingatakse sisse.
Peamised koostisosad, mis põhjustavad toidu, samuti õietolmu allergeensust, on valgud. Teatavad valgu lagunemisproduktid ehk peptiidifragmendid võivad säilitada osa algupärase valgu allergeensusest ja seega võib ka neid pidada allergeenideks.
GMOde konkreetne allergiaoht on seotud järgmisega: i) kokkupuutumine uute ekspresseeritud valkudega, mis võivad esineda taimede söödavates osades või õietolmus; see on seotud transgeeni bioloogilise allikaga; ja ii) tervikliku taime ja selle toodete allergeensuse muutumised, näiteks loodusliku endogeense allergeeni üleekspressiooni tõttu, mis on geneetilise muundamise tahtmatu mõju; see on seotud retsipienttaime enda bioloogiaga.
Käesolevas punktis sätestatud nõuete kohaldamise kohta sisaldab üksikasjalikumat teavet 30. juunil 2010. vastu võetud EFSA teaduslik arvamus, mis käsitleb geneetiliselt muundatud taimede ja mikroorganismide ning nendest saadud toidu ja sööda allergeensuse hindamist (9).
1.5.1. Uute ekspresseeritud valkude allergeensuse hindamine
Allergeensus ei ole teatava valgu loomulik, täielikult ennustatav omadus, vaid bioloogiline aktiivsus, mille eelduseks on vastastikmõju geneetilise eelsoodumusega isikutega. Seepärast sõltub allergeensus atoopiliste isikute geneetilisest mitmekesisusest ja varieeruvusest. Allergiliste reaktsioonide sagedus, raskusaste ja spetsiifilisus sõltuvad ka geograafilistest ja keskkondlikest teguritest. Kuna täielik prognoosimine ei ole võimalik, on vaja allergeensuse hindamises arvestada mitmeid aspekte, et saada kumulatiivsed tõendid, mis minimeerivad ebakindlust asjaomaste valkude suhtes.
Uue ekspresseeritud valgu struktuuriliste, bioloogiliste ja füüsikalis-keemiliste omaduste uurimisel on oluline, et katsealune valk on struktuuri ja aktiivsuse poolest samaväärne uue ekspresseeritud valguga geneetiliselt muundatud taimes. Uuringud, mille tegemisel on kasutatud puhastatud sihtvalke, mis on valmistatud ette Escherichia coli laadi organismides, on vastuvõetavad tingimusel, et mikroobse asendusvalgu omadused on identsed taimes ekspresseeritud valguga, võttes arvesse kõiki taimes toimuvaid translatsioonijärgseid muutusi.
Taotleja kontrollib, kas transgeeni allikas on allergeenne. Kui sisestatud geneetiline materjal on saadud nisust, rukkist, kaerast või nendega sarnastest teraviljadest, hindab taotleja ka uusi ekspresseeritud valke nende võimaliku rolli seisukohast gluteenitundliku enteropaatia või muude enteropaatiate (mis ei ole IgE vahendatud) esilekutsumisel. Mitmekordsete transformatsioonide puhul esitab taotleja juhtumipõhiselt hinnangu inimeste ja loomade puhul allergeensuse võimaliku suurenemise kohta. Kõnealused võimalikud mõjud võivad tekkida geenitoodete aditiivsel, sünergilisel või antagonistlikul mõjul.
Taotleja järgib uute ekspresseeritud valkude võimaliku allergeensuse hindamisel integreeritud juhtumipõhist lähenemisviisi ehk tõendite kaalukuse lähenemisviisi kasutades. See lähenemisviis hõlmab järgmist:
|
a) |
aminohappe järjestuse homoloogia võrdlemine uute ekspresseeritud valkude ja tuntud allergeenide vahel. Iga kord tehakse ekspresseeritud valgu ja tuntud allergeenide vaheliste homoloogiate järjestuse ja/või struktuuriliste sarnasuste otsing, et teha kindlaks IgE võimalik risttoime uue ekspresseeritud valgu ja tuntud allergeenide vahel. Taotleja tagab, et andmebaasid on alati võimalikult kvaliteetsed ja terviklikud. Miinimumnõudeks peetakse joondamispõhist kriteeriumi, mis tähendab järjestuse 35 % identsust tuntud allergeeniga vähemalt 80 aminohappega aknas. Esitatakse kõik analüüsis kasutatud järjestuste joondamise parameetrid, kaasa arvatud protsendi identsuse (PID) arvutus. PID arvutus tehakse 80 aminohappega aknas, milles on lüngad, nii et sisestatud lünki käsitatakse kokkusobimatutena. Teatavatel juhtudel, kui hinnatakse lühikesi peptiidifragmente nagu avatud lugemisraamid, võib teha külgnevate identsete või keemiliselt sarnaste aminohappejääkide otsingu. Kuid seda otsingut ei tohi rutiinselt teha lineaarsete IgE-d siduvate epitoopide kindlakstegemiseks selle nõrga tundlikkuse ja spetsiifilisuse tõttu. |
|
b) |
Spetsiifiline seerumiuuring Kui on märke järjestuse homoloogia või struktuuriliste sarnasuste kohta, põhineb oluline meetod, mis käsitleb võimalust, et uute ekspresseeritud valkudega kokkupuutumine võib kutsuda esile allergilise reaktsiooni isikutel, kes on juba tundlikud risttoimega valkude suhtes, in vitro katsetel, millega mõõdetakse allergiliste patsientide teatava IgE suutlikkust siduda katsealuseid valke. Inimeste IgE reaktsioon on isikuti varieeruv nii spetsiifilisuse kui afiinsuse poolest. Eelkõige IgE antikehade spetsiifilisus erinevate allergeenide osas, mis esinevad teatavas toidus/allikas, ja/või erinevate epitoopide osas, mis esinevad asjaomases valgus, võib allergiliste inimeste seas varieeruda. Katse tundlikkuse optimeerimiseks kasutatakse nende allergiliste isikute individuaalseid seerumeid, kelle kohta on hea kirjeldus. Taotleja teeb spetsiaalse seerumiuuringu järgmistel juhtudel:
Spetsiifiline seerumiuuring tehakse nende isikute individuaalsete seerumitega, kelle puhul on kindlaks tehtud allergia, mida on allika või võimaliku risttoimega allergeeni osas hästi kirjeldatud, kasutades asjakohaseid immunokeemilisi katseid. Sobivad meetodid on IgE-d siduvad katsed (nagu Radio- või ensüümne allergosorbenttest (RAST või EAST), ensüümne immunosorbenttest (ELISA) ja elektroforees, millele järgneb immunoblotanalüüs spetsiaalsete IgE-d sisaldavate seerumitega). |
|
c) |
Pepsiiniresistentsus ja in vitro seeduvuskatsed Allergeensetele valkudele on kaua peetud iseloomulikuks seda, et proteolüütilised ensüümid ei suuda neid seedida. Kuigi on kindlaks tehtud, et absoluutset korrelatsiooni ei ole, on valkude resistentsus pepsiini suhtes veel üks kriteerium, mida tuleb arvestada allergeensuse hindamisel tõendite kaalukuse lähenemisviisi kasutades. Pepsiini resistentsuse katse tehakse üldjuhul standardsetes tingimustes, madalatel pH-tasemetel ning pepsiini ja proteiini kõrge suhtega. On teada, et pepsiini resistentsuse katse ei kajasta seedimise füsioloogilisi tingimusi. Uute ekspresseeritud valkude seeduvust võib teatavates elanikkonnarühmades, nagu väikelapsed ja seedetegevuse häiretega isikud, hinnata, kasutades in vitro seeduvuskatseid erinevates tingimustes. Kuna uute sisestatud geenidega kodeeritud valk esineb tootes keeruka maatriksina, võetakse valgu ja muude maatriksi koostisosade võimalikku vastastikmõju, samuti töötlemise mõjusid arvesse täiendavates in vitro seeduvuskatsetes. Sõltuvalt in vitro seeduvuskatse tulemusest võrreldakse terveid, kuum-denatureeritud ja pepsiiniga seedunud valke IgE sidumise osas, sest muutunud seeduvus võib mõjutada uue ekspresseeritud valgu allergeensust. |
|
d) |
Lisakatsed Kuigi lisakatsed, sealhulgas loomadel tehtavad in vitro rakupõhised katsed või in vivo katsed ei ole praeguseks veel õigusliku reguleerimise eesmärgil valideeritud, võivad need anda kasulikku lisateavet näiteks uue ekspresseeritud valgu uue de novo sensibiliseerimise võimalikkuse kohta. |
1.5.2. Geneetiliselt muundatud toidu või sööda allergeensuse hindamine
Kui sisestatud geeni retsipienttaime puhul on teada selle allergeensus, hindab taotleja allergeensuse võimalikku muutumist geneetiliselt muundatud toidus või söödas, võrreldes allergeenide komplekti tavapärase vaste omaga. Eelkõige uuritakse looduslike endogeensete allergeenide võimalikku üleekspressiooni geneetiliselt muundatud taimes.
Taotleja järgib juhtumipõhist lähenemisviisi sõltuvalt kättesaadavast teabest retsipienttaime allergiaohu kohta. Üldjuhul kasutatakse selliseid analüüsimeetodeid nagu proteoomika, mille puhul kasutatakse proovidena allergikute seerumeid. Kliiniliselt hästi kirjeldatud allergiliste isikute individuaalsed seerumid, mida kasutatakse IgE sidumise uuringutes referentmaterjalina, võivad olla kättesaadavad piiratud arvul ja koguses. Inimseerumite kasutamise minimeerimiseks on võimalik saada olulist eelteavet geneetiliselt muundatud taime üldise allergeensuse tahtmatu muutuse tõenäosuse kohta, kasutades selliste loomade seerumeid, keda on täpselt määratletud tingimustes katseliselt sensibiliseeritud, ja lisades asjaomased kindlaks tehtud endogeensed allergeenid koostise võrdlevasse analüüsi.
Lisaks esitab taotleja võimaluse korral teabe allergia levimuse kohta isikute seas, kelle töö on seotud geneetiliselt muundatud taime kasvatamisega või kes puutuvad sellega kokku või kes viibivad selle läheduses.
1.5.3. Adjuvantsus
Adjuvandid on ained, mis võimendavad antigeeniga üheaegsel manustamisel immuunvastust antigeenile ja võivad seega võimendada ka allergilist reaktsiooni. Juhtudel, kus uue ekspresseeritud valgu tuntud funktsionaalsed aspektid või struktuurilised sarnasused tuntud tugevate adjuvantidega võivad viidata võimalikule adjuvantsele aktiivsusele, hindab taotleja kõnealuste valkude võimalikku rolli adjuvantidena. Allergeenide puhul võivad vastastikmõjud toidumaatriksi muude koostisosadega ja/või töötlemine muuta adjuvandi struktuuri ja biosaadavust ning seega muuta selle bioloogilist aktiivsust.
1.5.4. Allergeensuse hindamise järeldused
Allergeensuse hindamise järeldused osutavad sellele,
|
a) |
kas uudne valk on tõenäoliselt allergeenne; |
|
b) |
kas geneetiliselt muundatud toit või sööt on tõenäoliselt allergeensem kui selle tavapärane vaste. |
Kui on tõenäoline, et geneetilise muundamise tõttu allergeensus suureneb, kirjeldatakse geneetiliselt muundatud toitu või sööta selle eeldatava tarbimisannuse põhjal (vt punkt 2). Taotleja teeb ettepaneku turuleviimise asjakohaste tingimuste kohta (nagu turustamisjärgne järelevalve ja märgistamine).
1.6. Toitaineline hindamine
1.6.1. Toitainelise hindamise eesmärgid
Taotleja esitab toitainelise hinnangu, näitamaks, et:
|
a) |
geneetiliselt muundatud toidu ja sööda turuleviimine ei põhjusta inimestel ja loomadel toitainevaegust. Hindamine hõlmab geneetiliselt muundatud toidus ja söödas uute ekspresseeritud valkude, muude uute koostisosade ja toidu ja sööda koostisosade sisalduse muutuste olulisust toitumises, samuti võimalikke muutusi tarbijate või looma üldises toitumises; |
|
b) |
geneetilise muundamise tahtmatud mõjud, mis on kindlaks tehtud või mis võivad punktide 1.2 ja 1.3 kohaselt oletatavasti olla esinenud varasemate molekulaarsete, koostise ja fenotüüpiliste analüüside põhjal, ei ole kahjustanud geneetiliselt muundatud toidu ja sööda toiteväärtust. |
Tavapärase ristamise abil kombineeritud mitmekordsete transformatsioonide puhul esitab taotleja hindamise toiteväärtuse nende võimalike muutuste, sealhulgas koostise muutuste kohta, mis võivad tuleneda geenitoodete sünergilistest või antagonistlikest mõjudest. See võib olla eriti oluline juhtudel, kui uute sisestatud geenide kombineeritud ekspresseerumisel on ettenägematu mõju biokeemilistele radadele.
1.6.2. Geneetiliselt muundatud toidu ja sööda toitainelise hindamise puhul arvessevõetavad seigad
Geneetiliselt muundatud toidu ja sööda toitainelisel hindamisel võetakse arvesse:
|
a) |
geneetiliselt muundatud toidu ja sööda koostist, pidades silmas toitainete ja toitainete omastatavust takistavate ainete sisaldust (vt punktis 1.3 kirjeldatud koostise uuringud); |
|
b) |
toidus ja söödas sisalduvate toitainete biosaadavust ja bioloogilist toimet, võttes arvesse transportimise, ladustamise ning toidu ja sööda eeldatava töötlemise võimalikke mõjusid; |
|
c) |
toidu ja sööda eeldatavat tarbimisannust (vt punkt 2) ja sellest tulenevat toitainelist mõju. |
Kui võrdleva analüüsiga on kindlaks tehtud geneetiliselt muundatud toidu ja sööda omadused, mis erinevad tavapärase vaste omadustest ja/või ei ole võrdlussortide omadustega samaväärsed, hinnatakse nende toitainelist olulisust praeguste teaduslike andmete põhjal. Kui selle hindamise põhjal järeldatakse, et geneetiliselt muundatud toit ja sööt ning selle tavapärane vaste on toitainete poolest samaväärsed, ei tehta lisauuringuid. Kui vastupidiselt sellele ei ole võrdlevast analüüsist saadud andmete põhjal võimalik järeldada toitainelist samaväärsust, tehakse toitainelised lisauuringud. Võrdlevad kasvu-uuringud tehakse noorte kiiresti kasvavate loomaliikidega (näiteks broilertibu mittemäletsejaliste loomamudelina, talled mäletsejate loomamudelina või muud kiiresti kasvavad liigid).
1.6.3. Geneetiliselt muundatud sööda toitainelised uuringud
Taotleja hindab toitaineliste uuringute vajadust ja kava sisestatud tunnus(t)e, võrdleva analüüsi ja 90-päevase söötmise uuringu tulemuste põhjal, kui need on kättesaadavad. Lisateavet toiteväärtuse kohta võib saada muude loomaliikidega, näiteks broileritega tehtud võrdlevatest kasvu-uuringutest, mis käsitlevad geneetiliselt muundatud sööda toitainelist hindamist. Toitaineliste uuringute tegemisel kuulub kontrolldieeti tavapärane vaste ja vajaduse korral täiendav võrdlusmaterjal. Herbitsiidikindlate geneetiliselt muundatud taimede puhul peaks katsetatav materjal tulema ettenähtud herbitsiidiga kokkupuutunud geneetiliselt muundatud taimest.
Kui võrrelda tavapärase toiduga, võivad tarbija tervisele täiendava kasuliku toimega geneetiliselt muundatud toidud olla kasulikud teatavatele elanikkonna rühmadele või alarühmadele, kuid teistele võib sama toit põhjustada ohtu. Juhtudel, kui on vaja teha kindlaks muutunud biosaadavus ja võib tekkida mure elanikkonna alarühmade pärast, määratakse kindlaks toidu toitainesisaldus, võttes arvesse koostisosa kõiki erinevaid vorme. Biosaadavuse katsemeetodid valitakse juhtumipõhiselt sõltuvalt toitainest või muust koostisosast, neid koostisosi sisaldavast toidust, samuti seda toitu eeldatavalt tarbiva asjaomase elanikkonnarühma tervislikust ja toitumisseisundist ning toitumisharjumustest.
1.6.4. Geneetiliselt muundatud sööda toitainelised uuringud
Taotleja hindab toitaineliste lisauuringute vajadust ja kava sisestatud tunnus(t)e, võrdleva analüüsi ja 90-päevase söötmise uuringu tulemuste põhjal, kui need on kättesaadavad. Lisateavet toiteväärtuse kohta võib saada muude loomaliikidega, näiteks broileritega tehtud võrdlevatest kasvu-uuringutest, mis käsitlevad geneetiliselt muundatud sööda toitainelist hindamist. Toitaineliste uuringute tegemisel kuulub kontrolldieeti tavapärane vaste ja vajaduse korral täiendav võrdlusmaterjal.
Parandatud toitaineliste omadustega geneetiliselt muundatud sööda puhul tehakse söötmise uuringud sihttoiduloomaliikidega, et hinnata söödale avalduvat mõju. Geneetiliselt muundatud taimede puhul, mida on muundatud toitainete sisalduse ja biosaadavuse parandamiseks, tehakse uuringud sihttoiduloomaliikidega, et määrata kindlaks üksikute toitainete biosaadavus geneetiliselt muundatud taimes võrreldes selle tavapärase vastega. Geneetiliselt muundatud taimede puhul, mida on spetsiaalselt muundatud, et parandada loomade omadusi suurema toitainete hulga (näiteks suurem õlisisaldus) või teatava toitaine (näiteks asendamatu aminohappe või vitamiini) suurema sisalduse kaudu, tuleb koostada sobiv kontrolldieet, millesse lisatakse asjaomane toitaine sellises mahus, nagu geneetiliselt muundatud taimes muudatuste tulemusel. Kõrvaltooteid (näiteks õlikook), millest geneetiliselt muundatud koostisosa on ekstraheeritud, võib võrrelda kõrvaltoodetega, mis on toodetud tavapärasest vastest.
Sihtloomade söötmise uuringud hõlmavad kasvuperioodi ja/või lõppetappi kuni tapmiseni kanade, sigade ja nuumveiste puhul või laktatsioonitsüklit lüpsilehmade puhul või munemistsüklit munakanade ja vuttide puhul. Üksnes akvakultuuriks ettenähtud söötade puhul valitakse veeskasvatatavate liikide, nagu karpkalade, merihuntide, lõhelaste või tüüpiliste taimetoiduliste kasvu-uuringud.
Vajaduse korral esitatakse mitmesuguste katsekavadega uuringud, näitamaks, et parandatud toiteomadustega geneetiliselt muundatud taim on oodatava toiteväärtusega. Täpne katsekava ja statistiline lähenemisviis toiduloomadega tehtavate söötmiskatsete puhul selleks, et katsetada geneetiliselt muundatud sööda toiteväärtust, mida on muundatud toiteaineliste omaduste parandamiseks, sõltuvad sihtloomaliigist, uuritud taimetunnus(t)e tüübist ja oodatud mõju ulatusest. Katsedieedid koostatakse nii, et peamised mõõdetavad parameetrid reageerivad asjaomase toitaine koguse ja/või saadavuse erinevustele. Parameetrite mõõtmised varieeruvad vastavalt uuringus kasutatavale sihtliigile, kuid hõlmavad sööda tarbimisannust, kehakaalu, loomade omadusi ja toitainete biosaadavust.
Üksikasjalikumad juhised käesoleva punkti nõuete kohaldamise kohta on esitatud EFSA aruandes: „GMO Panel Working Group on Animal Feeding Trials” (10).
1.6.5. Toitainelise hindamise järeldused
Geneetiliselt muundatud toidu ja sööda toitaineline hindamine näitab, kas geneetiliselt muundatud toit ja sööt on tavapärase vastega toitaineliselt samaväärsed, võttes arvesse looduslikke kõikumisi.
Taotleja hindab toitainelise hindamise tulemust muundatud toidu ja sööda eeldatava tarbimisannuse põhjal (vt punkt 2).
1.7. Toksilisuskatse standarditud juhised
Taotleja kasutab toksilisuskatseks rahvusvaheliselt kokkulepitud juhiseid ja katsemeetodeid, mida on kirjeldatud komisjoni 30. mai 2008. aasta määruses (EÜ) nr 440/2008, millega kehtestatakse katsemeetodid vastavalt Euroopa Parlamendi ja nõukogu määrusele (EÜ) nr 1907/2006, mis käsitleb kemikaalide registreerimist, hindamist, autoriseerimist ja piiramist (REACH) (11) (vt tabelid 1 ja 2). Tabelites 1 ja 2 on esitatud mittetäielik nimekiri valideeritud katsemeetoditest, mida kasutatakse GMOde toksikoloogiliseks katsetamiseks vajaduse korral kohandatud kujul.
Katsemeetodite tõhusus sõltub geneetiliselt muundatud toidu ja sööda liigist, geneetilise muundamise liigist ja selle tulemusel tekkinud tahtlikest või tahtmatutest muutustest, kavandatud kasutusest ja kokkupuutest/tarbimisannusest ning olemasolevatest teadmistest. Mõni kõnealune katse on töötatud välja riskide hindamiseks töökohal (vt punktid 1.4 ja 1.5).
Tabel 1
Määruses (EÜ) nr 440/2008 sätestatud mittetäielik nimekiri valideeritud katsemeetoditest kemikaalide jaoks, mida võib kasutada GMOde toksikoloogiliseks katsetamiseks vajaduse korral kohandatud kujul
|
Pealkiri |
Meetodi viide määruse (EÜ) nr 440/2008 lisa B osas |
|
ÄGE MÜRGISUS (NAHAKAUDNE) |
B.3. |
|
NAHA SENSIBILISEERIMINE |
B.6. |
|
TOKSILINE TOIME KORDUSDOOSI TÕTTU (28 PÄEVA) (SUUKAUDNE) |
B.7. |
|
KORDUSDOOSI MÜRGISUS (28 PÄEVA, NAHAKAUDNE) |
B.9. |
|
SUBKROONILISE SUUKAUDSE TOKSILISUSE KATSE – SUUKAUDSE KORDUSDOOSI TOKSILISUSE 90PÄEVANE UURING NÄRILISTEL |
B.26. |
|
KROONILISE TOKSILISUSE KATSE |
B.30. |
|
KARTSINOGEENSUSE UURING |
B32. |
|
KOMBINEERITUD KROONILISE TOKSILISUSE/KARTSINOGEENSUSE UURING |
B.33. |
|
ÜHE PÕLVKONNA REPRODUKTSIOONITOKSILISUSE UURING |
B.34. |
|
KAHE PÕLVKONNA REPRODUKTSIOONI TOKSILISUSE UURING |
B.35. |
|
TOKSIKOKINEETIKA |
B.36. |
|
NEUROTOKSILISUSE UURING NÄRILISTEL |
B.43. |
Tabel 2
Määruses (EÜ) nr 440/2008 sätestatud genotoksilisuse katsed
|
Pealkiri |
Meetodi viide määruse (EÜ) nr 440/2008 lisa B osas |
|
MUTAGEENSUS - KROMOSOOMABERRATSIOONKATSE IMETAJATE LUUÜDIS IN VIVO |
B.11. |
|
MUTAGEENSUS – PISITUUMA KATSE IMETAJATE ERÜTROTSÜÜTIDES IN VIVO |
B.12. |
|
MUTAGEENSUS: BAKTERITE PÖÖRDMUTATSIOONKATSE |
B.13/14. |
|
MUTAGEENSUSE JA KARTSINOGEENSUSE UURING, GEENMUTATSIOON – SACCHAROMYCES CEREVISIAE |
B.15. |
|
MITOOTILINE REKOMBINATSIOON – SACCHAROMYCES CEREVISIAE |
B.16. |
|
DNA KAHJUSTAMINE JA PARANDAMINE – PLAANIVÄLINE DNA SÜNTEES – IMETAJATE RAKKUDEL IN VITRO |
B.18. |
|
MUTAGEENSUS – IN VITRO IMETAJATE RAKKUDE GEENIMUTATSIOONKATSE |
B.17. |
|
ÕDEKROMATIIDI VAHETUSE IN VITRO ANALÜÜS |
B.19. |
|
IMETAJARAKU TRANSFORMATSIOONITESTID IN VITRO |
B.21. |
|
IMETAJATE SPERMATOGOONIDE KROMOSOOMABERRATSIOONKATSE |
B.23. |
2. KOKKUPUUTE HINDAMINE – EELDATAV TARBIMISANNUS VÕI KASUTUSE ULATUS
Eeldatava tarbimisannuse hindamine on geneetiliselt muundatud toidu ja sööda riskihindamise oluline element ning seda nõutakse ka toitaineliseks hindamiseks. Taotleja esitab teabe geneetiliselt muundatud toidu ja sööda kavandatava funktsiooni kohta, selle rolli kohta toitumises ja selle eeldatava kasutusulatuse kohta ELis. Lisaks esitatakse toodetud uute valkude või tahtlikult muundatud olemasolevate taimsete valkude oodatud kontsentratsioonivahemik turule viidavas geneetiliselt muundatud toidus ja söödas.
Tavapärastest taimedest saadud toodete representatiivsete tarbimisandmete põhjal hindab taotleja geneetiliselt muundatud toidu ja sööda eeldatavat keskmist ja maksimaalset tarbimisannust. Prognoosivaid meetodeid võib kasutada pigem tõenäoliste väärtuste vahemike kui üksikväärtuste või punkthinnangute määramiseks. Taotleja teeb kindlaks konkreetsed ELi elanikkonnarühmad, kelle puhul eeldatakse suuremat kokkupuudet, ja arvestab seda suuremat kokkupuudet riskihindamises. Kokkupuute hindamises tehtud võimalikke oletusi kirjeldatakse. Kasutatakse uusimaid meetodeid ja asjakohaseid tarbimisandmeid. Tarbimisannuse hindamisel võivad anda impordi ja tootmiskoguste andmed lisateavet.
Taotleja teeb asjakohaste meetoditega kindlaks uute ekspresseeritud valkude, muude uute koostisosade ning endogeensete toidu ja sööda koostisosade kontsentratsiooni, mille sisaldus on muutunud geneetilise modifikatsiooni tõttu (nt tulenevalt muutustest ainevahetusradades), geneetiliselt muundatud taime nendes osades, mis on ette nähtud kasutamiseks toidus või söödas. Nende koostisosade eeldatavat tarbimisannust hinnatakse, võttes arvesse töötlemise, ladustamise ning asjaomase toidu ja sööda eeldatava töötlemise mõjusid (näiteks võimalik kuhjumine või vähenemine). Juhtudel, kui geneetilise muundamise tagajärjel on muutunud loodusliku koostisosa sisaldus või kui uus koostisosa esineb looduslikult muudes toidu- ja söödatoodetes, hinnatakse selle koostisosa tarbimise koguannust, võttes arvesse halvimaid võimalikke tarbimisstsenaariume.
Taotleja esitab teabe, mis käsitleb samasuguse geneetiliselt muundatud toidu ja sööda teadaolevat või eeldatavat tarbimisannust inimeste/loomade puhul ning vastavate uute ja looduslike koostisosadega kokkupuute muid teid, sealhulgas määra, sagedust ja kokkupuudet mõjutavaid muid tegureid.
3. RISKI KIRJELDAMINE
3.1. Sissejuhatus
Taotleja võtab geneetiliselt muundatud taimede ning toitude ja sööda riski kirjeldamisel aluseks ohu kindlakstegemise ja ohu kirjeldamise andmed ning kokkupuute/tarbimise andmed. Taotleja tagab, et riski kirjeldus on laiahaardeline, võttes arvesse kõiki kättesaadavaid tõendeid, mis pärinevad erinevatest analüüsidest, sealhulgas molekulaaranalüüsist, fenotüüpilisest, põllumajanduslikust ja koostise analüüsist ning toksilisuse ja allergeensuse uuringutest. Taotleja pöörab tähelepanu riski kirjeldamise käigus ilmnenud märkidele, mille puhul on võib olla vajalik võtta geneetiliselt muundatud toidu ja sööda turustamise järgse järelevalve meetmeid.
Riski kirjeldamisel tõendab taotleja, et ohu kindlakstegemine ja ohu kirjeldamine on täielikult sooritatud. Taotleja käsitleb olemasolevate andmete ja teabe kvaliteeti. Selles käsitluses näidatakse selgelt, kuidas kõnealust teabekogumit on riski lõpliku kirjelduse kindlaksmääramisel arvesse võetud.
Taotleja esitab hinnangud iga uuringu ja riski hindamise eri etappidega seotud ebakindluste kohta. Taotleja esitab need arvuliselt nii suures ulatuses kui võimalik. Eristatakse ebakindlusi, mis kajastavad looduslikke kõikumisi bioloogilistes parameetrites (sealhulgas vastuvõtlikkuse varieerumine eri rühmades) ja tulemuste varieerumist eri liigiti.
Sõltuvalt käsitletavast küsimusest ja kättesaadavatest andmetest koostab taotleja kvalitatiivse ja võimaluse korral kvantitatiivse riskikirjelduse. Hinnangulise riski ja sellega seotud ebakindluste tingimused peavad olema võimalikult täpsed.
3.2. Riski kirjeldamisel arvestatavad küsimused
Taotleja teostab vajaduse korral ja sõltuvalt geneetilise muundamise liigist geneetiliselt muundatud taimede riski hindamise integreeritud viisil punkti 3.1 kohaselt. Riski hindamine tehakse juhtumipõhiselt sõltuvalt muundatud taimest ja geneetilise muundamise liigist, geneetiliselt muundatud taime kasvatamise tavadest ning geneetiliselt muundatud toidu ja sööda kasutusest. Taotleja võtab arvesse erinevaid küsimusi, mida on käsitletud ohu kindlakstegemise ja ohu kirjeldamise ning kokkupuutega seoses. Nende küsimuste käsitlemise tulemusi võtab taotleja koos arvesse riski kirjeldamise etapis. Käesolevas punktis esitatud küsimuste puhul ei ole tegemist ammendava loeteluga.
3.2.1. Molekulaarne iseloomustus
Doonor- ja retsipienttaime iseloomustuse ja varasema kasutuse hindamine on peamine element, et teha kindlaks selliste spetsiaalsete analüüside vajalikkus nagu konkreetsete toksiinide või allergeenide esinemine muundamata retsipienttaimes, mille esinemine võib tahtmatult suureneda geneetilise muundamise tagajärjel.
Transformeerimise protokollid, molekulaarse iseloomustuse strateegiad ning kasutatud meetodite spetsiifilisust ja tundlikkust käsitleb taotleja seoses geenijärjestuse tahtliku ja võimaliku tahtmatu sisestamise ja ekspressiooniga.
Kui järjestuste analüüsimisel on kindlaks tehtud võimalik oht, näitab taotleja, kuidas aitavad ohutushindamisel sellised meetodid nagu bioinformaatiline analüüs, koostise analüüs / põllumajanduslik analüüs ning võimalikud loomade söötmiskatsed tervikliku geneetiliselt muundatud toidu ja söödaga. Saadud tulemuste väärtust hinnatakse teadmiste põhjal, mis on olemas asjaomaste põllukultuuriliikide või sugulasliikide genoomiandmepankade struktuuri ja funktsiooni kohta.
Mitmekordselt transformeeritud geneetiliselt muundatud taimede puhul hinnatakse mitmekordselt transformeeritud geenidest tuleneva võimaliku koondmõjuga seotud täiendavaid riske.
3.2.2. Võrdlev analüüs
Võrdleva analüüsi esimene eesmärk on kindlaks teha võimalikud erinevused geneetiliselt muundatud taime ja selle tavapärase vaste ning vajaduse korral täiendava võrdlusmaterjali vahel. Võrdleva analüüsi teine eesmärk on kindlaks teha geneetiliselt muundatud taime ja selle võrdlussortide samaväärsuse puudumine. Kõnealuseid erinevusi ja/või samaväärsuse puudumist tuleks hinnata lähtuvalt nende võimalikust mõjust toidu ja sööda ohutusele ning toiteainelistele omadustele, võttes arvesse looduslikku kõikumist. Hinnangulisi riske ja seotud ebakindlusi tuleks hinnata võimalikult täpselt ja vastavalt arvesse võtta.
Taotleja tõendab, et geneetiliselt muundatud taime ja selle tavapärase vaste vahel on tehtud käesoleva määruse nõuete kohaselt võrdlev analüüs, milles võrreldakse põllumajanduslikke, morfoloogilisi ja koostise omadusi. Tavapärase vaste ja vajaduse korral täiendava võrdlusmaterjali valikut tuleb põhjendada.
3.2.3. Toidu ja sööda ohutus tarbimisannusega seoses
Taotleja hindab kogutud andmeid, et hinnata lühi- ja pikaajalisi riske inimeste ja loomade tervisele, mida seostatakse geneetiliselt muundatud toidu ja sööda tarbimisega, kui geneetiliselt muundatud toit/sööt sisaldab uusi valke/metaboliite, samuti algseid taime valke/metaboliite oluliselt muutunud tasemetel. See hindamine hõlmab iga katse olulisuse ja piirangute, samuti kogu teabe põhjalikku analüüsi.
Taotleja uurib vaadeldud koostisosade tasemete vahemikke, mis teadaolevalt esinevad tavapärases vastes ja võrdlussortides. Kõnealust varieeruvust võivad põhjustada erinevused, mis sõltuvad genotüübist või keskkonnast, või seda võivad põhjustada genotüübi ja keskkonna vastastikmõjud. Lisaks võib võtta arvesse tasemete vahemikke, mida on vaadeldud mitmesuguses toidus ja söödas, mis on tüüpilised inimeste ja loomade toiduvalikule, tingimusel et see peegeldab konkreetse koostisosa tasemeid, millega tarbijad võivad kokku puutuda.
Kui üksiku koostisosa ja/või tervikliku geneetiliselt muundatud toidu ja sööda puhul leitakse, et teatavates uuringutes avaldab see kahjulikku mõju, esitatakse doosi ja toime seosed, lävitasemed, kahjulike mõjude viivitusega ilmnemine, risk teatavatele elanikkonnarühmadele, ebakindlustegurid loomade andmete ekstrapoleerimisel inimestele.
Taotleja uurib andmeid, mis käsitlevad geneetiliselt muundatud taimes esinevate uute koostisosade omadusi, sealhulgas võimalikud bioloogilised mõjud inimestele ja loomadele. Kui koostisosade puhul on teada kahjulik mõju tervisele ja spetsiaalsete õigusaktidega on kehtestatud nende koostisosade esinemise piirnormid taimes või selle toodetes, võetakse neid piirnorme arvesse. Muudel juhtudel tuleb uurida eeldatava tarbimisannusega seoses lubatud päevast tarbitavat kogust või maksimaalset lubatud doosi. Juhul kui koostisosa on ohutult toiduna tarbitud, peetakse tavapärase toitumise raames inimeste tarbitavaid koguseid ohutuks.
Taotleja hindab teavet uute koostisosade töötlemise mõjude kohta. Uuritakse võimalikku kuhjumist/vähenemist toidu- ja söödatoodetes, mida sisaldab inimeste ja loomade toiduvalik. Taotleja hindab ka, kui olulised on erinevused, mis tekivad töötlemistingimustes teadaolevalt esinevate keemiliste reaktsioonide tagajärjel.
Juhtudel, kui võetakse ette keerukamaid geneetilisi muundamisi, näiteks mitme geeni ülekandmine ühte konstruktsiooni, olemasolevate geneetiliselt muundatud liinide retransformeerimine ja mitmekordne transformeerimine geneetiliselt muundatud vanemtaimede tavapärase aretuse kaudu, kirjeldab taotleja strateegiaid, millega hinnatakse kõiki riske, mis on seotud uute ekspresseeritud valkude, uute metaboliitide ja taime esialgsete koostisosade võimalike vastastikmõjudega. Hindamisel võetakse arvesse kogu kättesaadavat teavet, sh geneetiliselt muundatud taime uute ekspresseeritud valkude toimeviisi, molekulaarseid ning koostisega seotud/põllumajanduslikke omadusi ning loomadele tehtavate toksikoloogiliste uuringute ja söötmise katsete tulemusi
Taotleja hindab andmeid, mis on saadud geneetiliselt muundatud taimes uute ekspresseeritud valkude allergiaohu hindamiseks, keskendudes sellele, et uued allergeensed valgud sisestatakse toidu- ja söödataimedesse, mis võib tundlikel isikutel kutsuda esile allergilised reaktsioonid; samuti hindab ta andmeid, millega tõendatakse, et geneetiline muundamine ei põhjusta tahtmatuid muutusi geneetiliselt muundatud toidus sisalduvate endogeensete allergeensete valkude omadustes ja/või ekspressioonitasemetes. Eelkõige põhjendatakse katsemudelite valikut spetsiifilisuse, prognoosimise ja valideerimisstaatuse seisukohast.
Geneetiliselt muundatud toitude tarbimise hinnangutega seoses hindab taotleja kohaldatud metoodikaid, võttes arvesse pikaajalise tarbimisannuse ennustamisega seotud ebakindlusi. Erilist tähelepanu pööratakse nendele geneetiliselt muundatud taimedele, mille otstarve on toidu ja sööda toiteomaduste muutmine. Nende geneetiliselt muundatud toidete puhul arutatakse turustamisjärgse järelevalve nõuet, millega saab teha kindlaks, kuidas muutuvad geneetiliselt muundatud toidu üldised tarbimisharjumused tegelikult, millises ulatuses see muutus on toimunud ja kas toode põhjustab tuntud (kõrval)mõjusid või ootamatuid kõrvalmõjusid. Kui turustamisjärgset järelvalvet peetakse vajalikuks, esitatakse soovitatud meetodite tundlikkus ja spetsiifilisus.
3.3. Riski kirjeldamise tulemus
Määruse (EÜ) nr 1829/2003 artiklit 4 ja 16 nõuete kohaselt tagab taotleja, et lõpliku riskikirjeldus näitab selgelt järgmist:
|
a) |
geneetiliselt muundatud toit ja sööt ei tohi avaldada kahjulikku mõju inimeste ja loomade tervisele; |
|
b) |
geneetiliselt muundatud toit ei erine asendatavast toidust sellisel määral, et selle tavapärane tarbimine võib põhjustada tarbijale toitainevaegust; |
|
c) |
geneetiliselt muundatud toit ei eksita tarbijat; |
|
d) |
geneetiliselt muundatud sööt ei kahjusta ega eksita tarbijat loomsete toodete iseloomulike omaduste muutmise teel; |
|
e) |
geneetiliselt muundatud sööt ei erine asendatavast söödast sellisel määral, et selle tavapärane tarbimine võib põhjustada inimestele või loomadele toitainevaegust; |
Taotleja osutab selgelt, milliseid oletusi on riski hindamise käigus tehtud, et ennustada kahjulike mõjude esinemise tõenäosust ja raskust teatavates elanikkonnarühmades, ning nende riskidega seotud ebakindluste laadile ja ulatusele.
Taotleja lisab ka üksikasjaliku teabe, millega põhjendatakse taotlusele määruse (EÜ) nr 1829/2003 artikli 13 lõike 2 punkti a ja artikli 25 lõike 2 punkti c ja lõike 3 kohase märgistuse ettepaneku lisamist või lisamata jätmist.
(1) EÜT L 43, 14.2.1997, lk 1.
(2) EFSA Journal 2011; 9(5):2149.
(3) EFSA Journal 2010; 8(1):1250.
(4) EFSA Journal 2010; 8(1):1250.
(5) http://www.oecd.org/document/15/0,3746,en_2649_34385_46726799_1_1_1_1,00.html.
(6) http://www.efsa.europa.eu/en/efsajournal/pub/2760.htm
(7) ELT L 133, 22.5.2008, lk 1.
(8) EFSA Journal 2011; 9(12):2438.
(9) EFSA Journal 2010; 8(7):1700.
(10) EFSA, 2008 Report of the EFSA GMO Panel Working Group on Animal Feeding Trials, 2008. Safety and nutritional assessment of GM plants and derived food and feed. The role of animal feeding trials. Food and Chemical Toxicology 46 (2008) S2–S70.