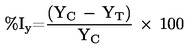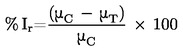|
24.8.2009
|
ET
|
Euroopa Liidu Teataja
|
L 220/1
|
KOMISJONI MÄÄRUS (EÜ) nr 761/2009,
23. juuli 2009,
millega muudetakse tehnika arenguga kohandamise eesmärgil määrust (EÜ) nr 440/2008, millega kehtestatakse katsemeetodid vastavalt Euroopa Parlamendi ja nõukogu määrusele (EÜ) nr 1907/2006, mis käsitleb kemikaalide registreerimist, hindamist, autoriseerimist ja piiramist (REACH)
(EMPs kohaldatav tekst)
EUROOPA ÜHENDUSTE KOMISJON,
võttes arvesse Euroopa Ühenduse asutamislepingut,
võttes arvesse Euroopa Parlamendi ja nõukogu 18. detsembri 2006. aasta määrust (EÜ) nr 1907/2006, mis käsitleb kemikaalide registreerimist, hindamist, autoriseerimist ja piiramist (REACH) ja millega asutatakse Euroopa Kemikaalide Agentuur ning muudetakse direktiivi 1999/45/EÜ ja tunnistatakse kehtetuks nõukogu määrus (EMÜ) nr 793/93, komisjoni määrus (EÜ) nr 1488/94 ning samuti nõukogu direktiiv 76/769/EMÜ ja komisjoni direktiivid 91/155/EMÜ, 93/67/EMÜ, 93/105/EÜ ja 2000/21/EÜ, (1) eriti selle artikli 13 lõiget 3,
ning arvestades järgmist:
|
(1)
|
Komisjoni määruses (EÜ) nr 440/2008 (2) on esitatud katsemeetodid määruse (EÜ) nr 1907/2006 kohaldamisel kasutatavate ainete füüsikalis-keemiliste omaduste, toksilisuse ja ökotoksilisuse määramiseks.
|
|
(2)
|
Määrust (EÜ) nr 440/2008 on vaja ajakohastada, et teha muudatusi teatavates katsemeetodites ja lisada sellesse uued katsemeetodid, mille OECD on heaks kiitnud. Käesoleva ettepanekuga seoses on konsulteeritud sidusrühmadega. Muudatustega kohandatakse meetodid teaduse ja tehnika arenguga.
|
|
(3)
|
Sätted aururõhu kohta tuleb läbi vaadata, arvestades uue efusioonmeetodi lisamist.
|
|
(4)
|
On vaja lisada uus meetod kiudude läbimõõdu kaalutud keskmise mõõtmiseks, milles kaalude väärtustena kasutatakse pikkust.
|
|
(5)
|
On asjakohane ajakohastada määrust (EÜ) nr 440/2008, et lisada eelistatud meetodina uus in vitro katsemeetod nahaärrituse määramiseks, et vähendada katsetes kasutatavate loomade arvu miinimumini vastavalt nõukogu 24. novembri 1986. aasta direktiivile 86/609/EMÜ katseteks ja muudel teaduslikel eesmärkidel kasutatavate loomade kaitsega seotud liikmesriikide õigus- ja haldusnormide ühtlustamise kohta (3). Kuigi arutelu OECDga kavandatava in vitro katsemeetodi üle nahaärituse määramiseks veel kestab, on kohane võtta meetod B 46 erandkorras käesolevasse määrusesse. Meetod B 46 tuleks ajakohastada võimalikult kiiresti pärast kokkuleppe saavutamist OECDga või siis, kui sellist läbivaatamist õigustab täiendav teave.
|
|
(6)
|
Vetikate kasvu pidurdamise katset käsitlevad sätted vajavad läbivaatamist, et lisada täiendavaid liike ning järgida kemikaalide ohu hindamise ja klassifitseerimise nõudeid.
|
|
(7)
|
On vaja lisada pinnavee aeroobse mineralisatsiooni mõõtmise uus meetod e biolagundavuse mudelkatse ning perekonda Lemna kuuluvaid organisme mõjutava toksilisuse hindamise uus meetod organismide kasvu pidurdamise järgi.
|
|
(8)
|
Seepärast tuleks määrust (EÜ) nr 440/2008 vastavalt muuta.
|
|
(9)
|
Käesoleva määrusega ette nähtud meetmed on kooskõlas määruse (EÜ) nr 1907/2006 artikli 133 kohaselt asutatud komitee arvamusega,
|
ON VASTU VÕTNUD KÄESOLEVA MÄÄRUSE:
Artikkel 1
Määruse (EÜ) nr 440/2008 lisa muudetakse järgmiselt.
|
1)
|
A osa muudetakse järgmiselt:
|
a)
|
peatükk A.4 asendatakse käesoleva määruse I lisa peatükiga A.4;
|
|
b)
|
lisatakse peatükk A.22, mis on esitatud käesoleva määruse II lisas.
|
|
|
2)
|
B osa muudetakse järgmiselt:
lisatakse käesoleva määruse III lisa peatükk B.46.
|
|
3)
|
C osa muudetakse järgmiselt:
|
a)
|
peatükk C.3 asendatakse käesoleva määruse IV lisa peatükiga C.3;
|
|
b)
|
lisatakse käesoleva määruse V ja VI lisas esitatud peatükid C.25 ja C.26.
|
|
Artikkel 2
Käesolev määrus jõustub kolmandal päeval pärast selle avaldamist Euroopa Liidu Teatajas.
Käesolev määrus on tervikuna siduv ja vahetult kohaldatav kõikides liikmesriikides.
Brüssel, 23. juuli 2009
Komisjoni nimel
komisjoni liige
Stavros DIMAS
(1) ELT L 396, 30.12.2006, lk 1.
(2) ELT L 142, 31.5.2008, lk 1.
(3) EÜT L 358, 18.12.1986, lk 1.
I LISA
1. METOODIKA
Käesolev metoodika on samaväärne standardiga OECD TG 104 (2004).
1.1. SISSEJUHATUS
Käesolevas metoodika A.4(1) uuesti läbi vaadatud versioonis on esitatud üks täiendav mõõtemeetod, „Efusioonmeetod: isotermiline termogravimeetria”; see on välja töötatud väga madala aururõhuga (kuni 10–10 Pa) ainete jaoks. Arvestades vajadust meetodite järele, mis võimaldavad mõõta eeskätt madala aururõhuga ainete aururõhku, on ümber hinnatud ka käesoleva metoodika muude mõõtemeetodite rakenduspiirid.
Termodünaamilise tasakaalu tingimustes sõltub puhta aine aururõhk ainult temperatuurist. Asjaomased põhimõtted on esitatud mujal (2, 3).
Ükski mõõtmismeetod ei ole rakendatav kogu aururõhkude vahemikus – vähem kui 10–10 Pa kuni 105 Pa. Sellepärast esitatakse käesolevas kirjelduses kaheksa aururõhu mõõtmise meetodit, mis on rakendatavad erinevates aururõhu vahemikes. Tabelis 1 on võrreldud nende meetodite rakendatavust ja mõõtevahemikke. Neid meetodeid saab kasutada üksnes ainete puhul, mis mõõtmistingimustes ei lagune. Juhul kui tehnilistel põhjustel eksperimentaalseid meetodeid ei saa kasutada, võib aururõhku ka hinnata; soovitatav hindamismeetod on esitatud liites.
1.2. MÕISTED JA ÜHIKUD
Aine aururõhk on tema küllastatud auru rõhk vedelas või tahkes faasis oleva aine kohal.
Tuleb kasutada rahvusvahelise mõõtühikute süsteemi (SI) rõhuühikut, milleks on paskal (Pa). Varem kasutusel olnud rõhuühikud ja nende teisendustegurid on järgmised:
|
1 torr
|
=
|
1 mm Hg
|
=
|
1,333 × 102 Pa
|
|
1 atmosfäär
|
=
|
1,013 × 105 Pa
|
|
|
|
1 baar
|
=
|
105 Pa
|
|
|
SI temperatuuriühik on kelvin (K). Celsiuse kraadid teisendatakse kelviniteks järgmise valemi abil:
T = t + 273,15
kus T on kelvinites väljendatud termodünaamiline temperatuur ja t on temperatuur Celsiuse kraadides.
Tabel 1
|
Mõõtmismeetod
|
Aine
|
Hinnanguline korratavus
|
Hinnanguline reprodutseeritavus
|
Soovitatav mõõtevahemik
|
|
Tahke
|
Vedelik
|
|
Dünaamiline meetod
|
Kergsulav
|
Jah
|
kuni 25 %
1–5 %
|
kuni 25 %
1–5 %
|
103 Pa kuni 2 × 103 Pa,
2 × 103 Pa kuni 105 Pa
|
|
Staatiline meetod
|
Jah
|
Jah
|
5–10 %
|
5–10 %
|
10 Pa kuni 105 Pa,
10–2 Pa kuni 105 Pa (1)
|
|
Isoteniskoopiline meetod
|
Jah
|
Jah
|
5–10 %
|
5–10 %
|
102 Pa kuni105 Pa
|
|
Efusioonmeetod: aururõhukaalud
|
Jah
|
Jah
|
5–20 %
|
kuni 50 %
|
10–3 kuni 1 Pa
|
|
Efusioonmeetod: Knudseni rakk
|
Jah
|
Jah
|
10–30 %
|
—
|
10–10 kuni 1 Pa
|
|
Efusioonmeetod: isotermiline termogravimeetria
|
Jah
|
Jah
|
5–30 %
|
kuni 50 %
|
10–10 kuni 1 Pa
|
|
Gaasiküllastusmeetod
|
Jah
|
Jah
|
10–30 %
|
kuni 50 %
|
10–10 kuni 103 Pa
|
|
Pöörleva kuuli meetod
|
Jah
|
Jah
|
10–20 %
|
—
|
10–4 kuni 0,5 Pa
|
1.3. MÕÕTMISE PÕHIMÕTE
Üldiselt määratakse aururõhku erinevatel temperatuuridel. Kitsas temperatuurivahemikus sõltub puhta aine aururõhu logaritm lineaarselt termodünaamilisest temperatuurist vastavalt lihtsustatud Clapeyron-Clausiuse võrrandile:

kus:
|
p
|
=
|
aururõhk, Pa,
|
|
ΔHv
|
=
|
aurustumissoojus, Jmol–1,
|
|
R
|
=
|
universaalne gaasikonstant, 8,314 Jmol–1K–1,
|
|
T
|
=
|
temperatuur, K.
|
1.4. STANDARDAINED
Standardaineid ei ole tingimata vaja kasutada. Neid on vaja eeskätt selleks, et aeg-ajalt kontrollida meetodi suutlikkust ja võrrelda eri meetodite abil saadud tulemusi.
1.5. MEETODITE KIRJELDUS
1.5.1. Dünaamiline meetod (Cottrelli meetod)
1.5.1.1. Põhimõte
Aururõhu määramiseks mõõdetakse aine keemistemperatuur erinevatel teadaolevatel rõhkudel ligikaudu 103–105 Pa vahemikus. Seda meetodit soovitatakse ka keemistemperatuuri määramiseks. Selleks saab kõnesolevat meetodit kasutada kuni temperatuurini 600 K. Vedelikusamba hüdrostaatilise rõhu tõttu on vedeliku keemistemperatuur 3–4 cm sügavusel ligikaudu 0,1 °C kõrgem kui vedeliku pinnal. Cottrelli meetodi (4) puhul asetatakse termomeeter aurudesse vedeliku pinna kohal ja keeval vedelikul lastakse pidevalt voolata üle termomeetri reservuaari. Termomeetri reservuaar on pidevalt kaetud õhukese vedelikukihiga, mis on tasakaalus atmosfäärirõhul oleva auruga. Seega vastab termomeetri näit tõelisele keemistemperatuurile, kusjuures mõõtmistulemus ei sisalda ülekuumenemisest või hüdrostaatilisest rõhust tingitud viga. Cottrelli poolt algselt kasutatud pump on kujutatud joonisel 1. Katseklaasis A on keev vedelik. Põhja külge joodetud plaatinatraat soodustab ühtlast keemist. Külgtoru C on ühendatud püstjahutiga; pritsmekaitse D ei lase termomeetril E puutuda kokku külma kondensaadiga. Kui vedelik katseklaasis A keeb, tõusevad lehtrisse sattunud mullid ja vedelik üles ning suunatakse pumba F kahte haru pidi termomeetri reservuaarile.
|
Joonis 1

|
Joonis 2

|
Cottrelli pump (4)
|
B:
|
anum vaakumi stabiliseerimiseks
|
|
F:
|
kütteelement, ligikaudu 150 W
|
1.5.1.2. Mõõteseade
Joonisel 2 on kujutatud suurt täpsust võimaldav mõõteseade, milles on kasutatud Cottrelli põhimõtet. See kujutab endast toru, mille alumises osas keeb vedelik, keskmine osa kujutab endast jahutit ning ülemises osas on väljumisava ja äärik. Cottrelli pump asub keemissektsioonis, mida kütab elektriline padrunkuumuti. Temperatuuri mõõdetakse kaetud termopaari või takistustermomeetri abil, mis on viidud torusse ülevalt läbi äärikliite. Väljumisava on ühendatud rõhu reguleerimise süsteemiga. See hõlmab vaakumpumpa, anumat vaakumi stabiliseerimiseks, manostaati, millest lastakse seadmesse rõhu reguleerimiseks vajalikku lämmastikku, ja manomeetrit.
1.5.1.3. Mõõtmise käik
Aine viiakse keemissektsiooni. Kui tahke aine ei ole pulbri kujul, võib seejuures esineda raskusi, mille puhul mõnikord aitab jahutussärgi kuumutamine. Seade suletakse äärikliitega ja ainest eemaldatakse gaasid. Vahutavate ainete aururõhku ei saa selle meetodiga mõõta.
Seade reguleeritakse kõige madalamale vajalikule rõhule ja lülitatakse sisse küte. Samal ajal ühendatakse temperatuuriandur registreerimisseadmega.
Kui püsival rõhul registreeritakse püsiv keemistemperatuur, on saavutatud tasakaal. Eriti tuleb jälgida, et keemine ei oleks tõukeline. Lisaks sellele peab jälgima, et kondenseerumine jahutis oleks täielik. Kui määratakse kergsulava tahke aine aururõhku, tuleb jälgida, et jahuti ei ummistuks.
Pärast tasakaalupunkti registreerimist reguleeritakse seade kõrgemale rõhule. Mõõtmisi jätkatakse samal viisil, kuni saavutatakse rõhk 105 Pa (aururõhk mõõdetakse kokku ligikaudu 5–10 tasakaalupunktis). Kontrolliks korratakse mõõtmist tasakaalupunktides alaneva rõhu järjekorras.
1.5.2. Staatiline meetod
1.5.2.1. Põhimõte
Staatilise meetodi (5) puhul määratakse termodünaamilisele tasakaalule vastav aururõhk kindlaksmääratud temperatuuril. See meetod sobib individuaalsete ainete ning mitmekomponendiliste vedelike ja tahkete ainete segude puhul rõhuvahemikus 10–1 kuni 105 Pa ja, kui rakendatakse ettevaatusabinõusid, ka rõhuvahemikus 1–10 Pa.
1.5.2.2. Mõõteseade
Mõõteseade koosneb termostateeritud vannist (täpsus ±0,2 K), vaakumsüsteemiga ühendatud proovinõust, manomeetrist ja rõhu reguleerimise süsteemist. Proovinõu (joonis 3a) ühendatakse kraani ja nullindikaatorina kasutatava diferentsiaalmanomeetri (sobiva manomeetrivedelikuga U-toru) kaudu vaakumsüsteemiga. Olenevalt rõhuvahemikust ja uuritava aine keemilistest omadustest võib diferentsiaalmanomeetris kasutada elavhõbedat, silikoonõlisid või ftalaate. Keskkonnakaitse kaalutlustel tuleks elavhõbeda kasutamisest võimaluse korral hoiduda. Uuritav aine ei tohi U-torus olevas vedelikus märgatavalt lahustuda või sellega reageerida. U-toru asemel võib kasutada ka mõnda muud rõhumõõturit (joonis 3b). Normaalrõhust kuni rõhuni 102 Pa võib manomeetrivedelikuna kasutada elavhõbedat; kui rõhk on vahemikus 10–102 Pa, võib kasutada silikoonõlisid ja ftalaate. Rõhul alla 102 Pa võib kasutada ka muid rõhumõõtureid; kuumutatava membraaniga mahtuvusmanomeetrit võib kasutada isegi rõhul alla 10–1 Pa. Temperatuuri mõõdetakse kas proovinõu seina välisküljel või proovinõus.
1.5.2.3. Mõõtmise käik
Kui kasutatakse joonisel 3a kujutatud mõõteseadet, täidetakse U-toru selleks valitud vedelikuga, mis tuleb enne näidu registreerimist gaasidest kõrgendatud temperatuuri abil vabastada. Uuritav aine viiakse mõõteseadmesse ja vabastatakse gaasidest madalal temperatuuril. Kui tegemist on mitmekomponendilise prooviga, peab temperatuur olema piisavalt madal, et seejuures ei muutuks materjali koostis. Tasakaalu kiiremaks saavutamiseks võib proovi segada. Proovi võib jahutada vedela lämmastiku või kuiva jääga, kuid seejuures tuleb jälgida, et õhk ja väljapumbatav gaas ei kondenseeruks. Proovinõu kohal oleva kraani avamisega ühendatakse nõu mõneks minutiks vaakuumsüsteemiga, et eemaldada õhk. Vajaduse puhul korratakse gaaside eemaldamist mitu korda.
|
Joonis 3a

|
Joonis 3b

|
Kui proovi kuumutamise ajal on kraan suletud, siis aururõhk tõuseb. See muudab U-torus oleva vedeliku tasakaaluasendit. Selle kompenseerimiseks lastakse seadmesse lämmastikku või õhku, kuni diferentsiaalrõhu indikaator on uuesti nullasendis. Selleks vajalik rõhk loetakse manomeetrilt või suurema täpsusega mõõteriistalt. See rõhk vastab aine aururõhule mõõtmistemperatuuril. Kui kasutatakse joonisel 3b kujutatud mõõteseadet, võib aururõhu näidu lugeda otse seadmelt.
Aururõhk määratakse piisavalt väikeste temperatuurivahemike tagant kuni vajaliku kõrgeima temperatuurini (aururõhk mõõdetakse kokku umbes 5–10 tasakaalupunktis).
Kontrolliks korratakse näitude registreerimist madalal temperatuuril. Kui kordamisel saadud väärtused ei lange kokku temperatuuri tõstmisel saadud kõveraga, võib põhjuseks olla üks järgmistest asjaoludest:
|
i)
|
proov sisaldab ikka veel õhku (nt suure viskoossusega materjalide puhul) või kuumutamisel eraldunud madala keemistemperatuuriga aineid;
|
|
ii)
|
uuritavas temperatuurivahemikus toimub ainega keemiline reaktsioon (nt lagunemine või polümerisatsioon).
|
1.5.3. Isoteniskoopiline meetod
1.5.3.1. Põhimõte
Isoteniskoop (6) töötab staatilise meetodi põhimõttel. Proov viiakse termostateeritud kolbi, mis on ühendatud manomeetri ja vaakumpumbaga. Uuritavast ainest kergemini lenduvad lisandid eemaldatakse degaseerimisega alarõhul. Proovi aururõhk valitud temperatuuril tasakaalustatakse inertse gaasi rõhuga, mille väärtus on teada. Isoteniskoop töötati välja teatavate vedelate süsivesinike aururõhu määramiseks, kuid ta sobib ka tahkete ainete uurimiseks. Harilikult ei sobi kõnesolev meetod mitmekomponendiliste süsteemide puhul kasutamiseks. Mittelenduvaid lisandeid sisaldavate proovide korral on mõõtmistulemuste viga väike. Soovitatav määramisvahemik on 102–105 Pa.
1.5.3.2. Mõõteseade
Mõõteseadme näidis on esitatud joonisel 4. Seadme täielik kirjeldus on standardis ASTM D 2879–86 (6).
1.5.3.3. Mõõtmise käik
Vedelate ainete puhul on diferentsiaalmanomeetri vedelikuks uuritav aine ise. Isoteniskoopi viiakse vedelikukogus, mis on küllaldane reservuaari ja manomeetri lühikese haru täitmiseks. Isoteniskoop ühendatakse vaakumsüsteemiga, sellest eemaldatakse õhk ning see täidetakse seejärel lämmastikuga. Süsteemist gaasi väljapumpamist ja süsteemi täitmist lämmastikuga korratakse kaks korda, et eemaldada kogu hapnik. Täidetud isoteniskoop asetatakse horisontaalselt, nii et proov valgub õhukese kihina reservuaaris ja manomeetris laiali. Rõhk süsteemis langetatakse 133 paskalini ja proovi kuumutatakse ettevaatlikult, kuni see hakkab keema (seda tehakse lahustunud gaaside kõrvaldamiseks). Isoteniskoop asetatakse seejärel nii, et proov voolab tagasi reservuaari ja täidab manomeetri lühikese haru. Rõhku hoitakse 133 Pa juures. Proovireservuaari väljavenitatud tippu kuumutatakse väikesel leegil, kuni proovi aurud küllaldaselt paisuvad ning suruvad osa proovist reservuaari ülaosast ja manomeetri lühikesest harust manomeetri ülejäänud ossa, nii et tekib auruga täidetud lämmastikuvaba ruum. Isoteniskoop paigutatakse seejärel termostateeritud vanni ja lämmastiku rõhk võrdsustatakse proovipoolse ruumi rõhuga. Tasakaaluolekus on lämmastiku rõhk võrdne aine aururõhuga.
Joonis 4

Tahkete ainete puhul kasutatakse rõhust ja temperatuurivahemikust olenevalt selliseid manomeetrivedelikke, nagu silikoonõlid ja ftalaadid. Gaasidest vabastatud manomeetrivedelik viiakse isoteniskoobi pikal harul olevasse laiemasse ossa. Uuritav tahke aine pannakse proovikolbi ja vabastatakse gaasidest kõrgendatud temperatuuril. Seejärel kallutatakse isoteniskoopi nii, et manomeetrivedelik voolab U-torusse.
1.5.4. Efusioonmeetod: aururõhukaalud (7)
1.5.4.1. Põhimõte
Uuritava aine proovi kuumutatakse väikeses ahjus ja asetatakse vakumeeritud klaaskupli alla. Ahi on kaetud kaanega, milles on väikesed teadaoleva läbimõõduga avad. Ühest avast väljuv aine aur juhitakse sama vakumeeritud klaaskupli all asuva kõrgtundliku kaalu kausile. Mõne seadmetüübi puhul asub kaalukauss külmkambris, mis tagab soojuse hajumise väljapoole soojusjuhtivuse teel; kaalukauss jahtub soojuskiirguse arvel ja avast väljuv aur kondenseerub kaalukausil. Aurujoa impulss toimib kaalukausile mõjuva jõuna. Aururõhu võib arvutada kahel viisil: kas otse kaalukausile mõjuva jõu põhjal või aurustumiskiiruse alusel, kasutades Hertz-Knudseni valemit (2):

kus:
|
G
|
=
|
aurustumiskiirus (kgs–1m–2),
|
|
M
|
=
|
molaarmass (gmol–1),
|
|
T
|
=
|
temperatuur (K),
|
|
R
|
=
|
universaalne gaasikonstant (Jmol–1K–1),
|
|
p
|
=
|
aururõhk (Pa).
|
Soovitatav määramisvahemik on 10–3 kuni 1 Pa.
1.5.4.2. Mõõteseade
Seadme üldpõhimõte on esitatud joonisel 5.
Joonis 5

|
A:
|
alusplaat
|
F:
|
külmkamber ja jahutuslatt
|
|
B:
|
magnetelektriline seade
|
G
|
aurustusahi
|
|
C:
|
klaaskuppel
|
H:
|
Dewari anum vedela lämmastikuga
|
|
D:
|
kaalud ja kaalukauss
|
I:
|
proovi temperatuuri mõõtur
|
|
E:
|
vaakumimõõtur
|
J:
|
uuritav proov
|
1.5.5. Efusioonmeetod: Knudseni rakk
1.5.5.1. Põhimõte
Meetodi aluseks on kõrgvaakumi tingimustes Knudseni raku (8) mikroavast ajaühikus auruna väljuva uuritava aine massi määramine. Väljavoolanud auru massi võib leida kas raku massi vähenemise määramise kaudu või auru madalal temperatuuril kondenseerimise ja lendunud ainekoguse kromatograafilise määramisega. Aururõhk arvutatakse Hertz-Knudseni võrrandi abil (vt punkt 1.5.4.1), kasutades seadme parameetritest sõltuvat parandustegurit (9). Soovitatav aururõhu vahemik on 10–10 kuni 1 Pa (10, 11, 12, 13, 14).
1.5.5.2. Mõõteseade
Seadme üldpõhimõte on esitatud joonisel 6.
Joonis 6
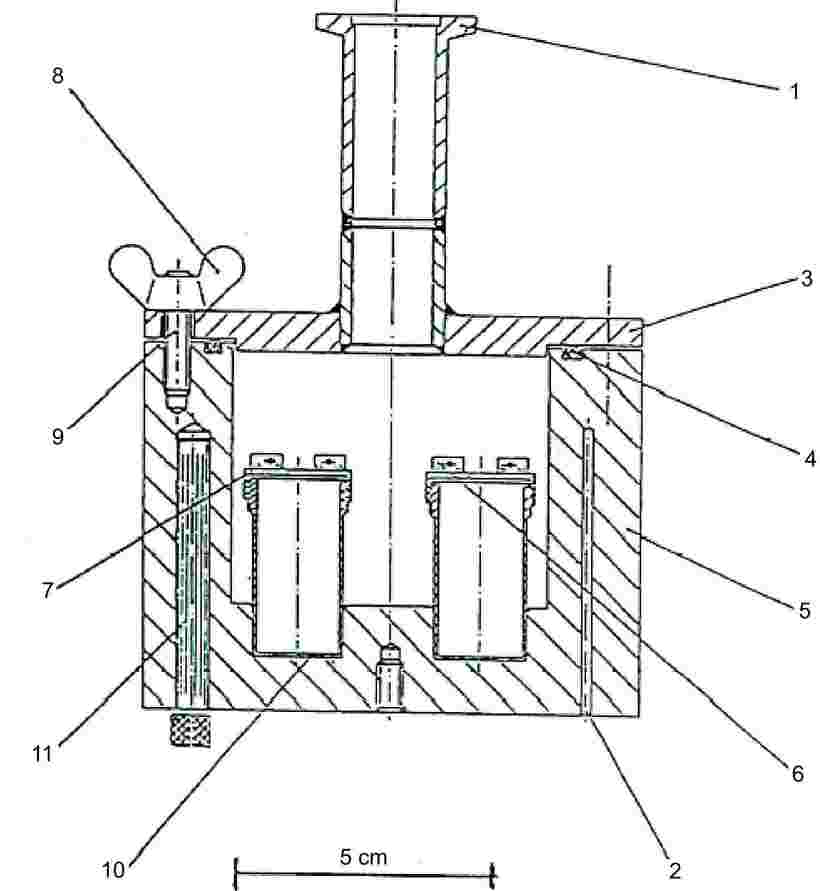
|
1:
|
ühendus vaakumsüsteemiga
|
7:
|
keermega kaas
|
|
2:
|
pesad plaatina-takistustermomeetri või temperatuuri mõõtmise ja reguleerimise seadme jaoks
|
8:
|
liblikmutrid
|
|
3:
|
vaakummahuti kaas
|
9:
|
poldid
|
|
4:
|
O-rõngas
|
10:
|
roostevabast terasest efusioonirakud
|
|
5:
|
alumiiniumist vaakummahuti
|
11:
|
padrunkuumuti
|
|
6:
|
efusioonirakkude paigaldamise ja eemaldamise seade
|
|
|
1.5.6. Efusioonmeetod: isotermiline termogravimeetria
1.5.6.1. Põhimõte
Meetod põhineb uuritava aine kiirenenud aurustumise määramisel kõrgendatud temperatuuril ja normaalrõhul termogravimeetria abil (10, 15, 16, 17, 18, 19, (20). Aurustumiskiiruse vT määramiseks hoitakse uuritavat ainet aeglaselt voolava inertgaasi atmosfääris kindlaksmääratud isotermilisel temperatuuril T (kelvinites) ja jälgitakse vajaliku ajavahemiku jooksul, kuidas väheneb ainekoguse mass. Aururõhud pT arvutatakse vT väärtuste põhjal, kasutades aururõhu logaritmi ja aurustumiskiiruse logaritmi lineaarset seost. Vajaduse korral võib tulemused ekstrapoleerida temperatuuridele 20 ja 25 °C, rakendades regressioonanalüüsi koordinaatides log pT
vs. 1/T. See meetod sobib ainete puhul, mille aururõhk on 10–10 Pa (10–12 mbar) ja puhtusaste on võimalikult lähedane 100 protsendile, et vältida mõõdetava massi vähenemise ekslikku tõlgendamist.
1.5.6.2. Mõõteseade
Mõõteseadme üldpõhimõte on esitatud joonisel 7.
Joonis 7

Proov kandeplaadil, mis ripub mikrokaalul reguleeritava temperatuuriga kambris, asub kuiva lämmastiku voolus, mis kannab uuritava aine aurustunud molekulid ära. Kambrist väljuv gaas puhastatakse sorptsiooniseadmes.
1.5.6.3. Mõõtmise käik
Uuritav aine kantakse ühtlase kihina karestatud klaasplaadi pinnale. Tahke aine puhul niisutatakse plaat ühtlaselt aine lahusega sobivas lahustis ja kuivatatakse inertgaasi atmosfääris. Ainekihiga klaasplaat riputatakse mõõtmiste tegemiseks termogravimeetrilisse analüsaatorisse ja mõõdetakse pidevalt klaasplaadi massi vähenemist ajas.
Aurustumiskiirus vT kindlaksmääratud temperatuuril arvutatakse proovi massi vähenemise Δm alusel järgmise valemi abil:

kus F on klaasplaati katva aine pindala (tavaliselt võrdne klaasplaadi pindalaga) ja t on aeg, mille jooksul mass vähenes.
Aururõhk pT arvutatakse aurustumiskiirust vT väljendava funktsiooni alusel:
log pT = C + D log vT
kus C ja D on katseseadet iseloomustavad konstandid, mis olenevad mõõtekambri läbimõõdust ja gaasivoo kiirusest. Need konstandid määratakse üks kord, mõõtes teadaoleva aururõhuga ainete seeria aurustumiskiirused ja kasutades regressioonanalüüsi log pT
vs. log vT (11, 21, 22).
Aururõhu pT ja kelvinites väljendatud temperatuuri T vahelist seost kajastab võrrand
log pT = A + B 1/T
kus A ja B on regressioonseosest log pT
vs. 1/T saadud konstandid. Selle võrrandi alusel saab arvutada aururõhu mis tahes muu temperatuuri juures ekstrapoleerimise teel.
1.5.7. Gaasiküllastusmeetod (23)
1.5.7.1. Põhimõte
Üle või läbi uuritava aine proovi voolutatakse toatemperatuuril inertgaasi teadaoleva piisavalt väikese kiirusega, mis tagab gaasi küllastumise. Gaasifaasi küllastamine on väga tähtis. Kaasa kandunud aine kogutakse, kasutades püüdurina enamasti sorbenti, ja määratakse selle kogus. Auru püüdmise ja edasise analüüsi alternatiivina võib kaasa kandunud materjali koguse määramiseks kasutada ka järjestikku ühendatud analüüsiseadet, näiteks gaasikromatograafi. Aururõhu arvutamisel eeldatakse, et süsteem järgib ideaalse gaasi olekuvõrrandit ja gaasisegu üldrõhk on võrdne komponentgaaside rõhkude summaga. Uuritava aine partsiaalrõhu ehk aururõhu arvutamisel lähtutakse teadaolevast gaasi ruumalast ja kaasa kantud materjali massist.
Gaasiküllastusmeetod on rakendatav nii tahkete kui ka vedelate ainete korral. Seda võib kasutada ka madalal rõhul kuni 10–10 Pa (10, 11, 12, 13, 14). Kõnesolev meetod on kõige usaldusväärsem aururõhul alla 103 Pa. Aururõhul üle 103 Pa saadakse tavaliselt õigetest suuremad väärtused, mis on tõenäoliselt tingitud aerosooli tekkimisest. Kuna aururõhu mõõtmised tehakse toatemperatuuril, ei ole vaja ekstrapoleerida kõrgetel temperatuuridel saadud andmeid; sellega välditakse sageli tõsiseid vigu põhjustavat ekstrapoleerimist kõrgetelt temperatuuridelt.
1.5.7.2. Mõõteseade
Mõõtmiseks on vaja konstantse temperatuuriga kambrit. Joonisel 8 oleval skeemil on kamber, milles on kolm hoidlit tahketele proovidele ja kolm hoidlit vedelatele proovidele; see võimaldab teha tahke või vedela prooviga kolm analüüsi. Temperatuuri reguleeritakse ±0,5 °C või suurema täpsusega.
Joonis 8
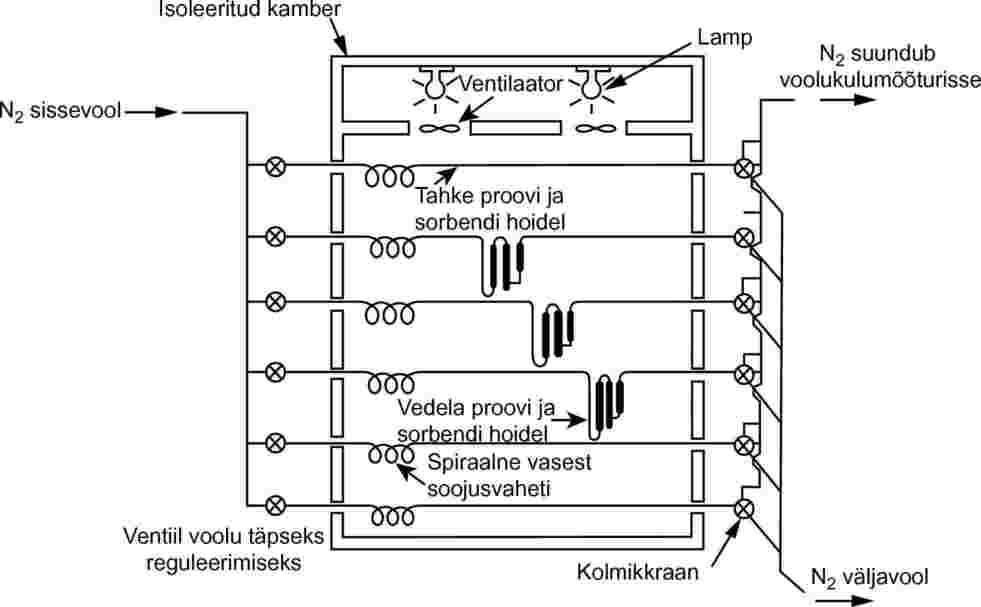
Üldiselt kasutatakse inertse kandegaasina lämmastikku, kuid mõnikord on vaja kasutada ka muid gaase (24). Kandegaas peab olema kuiv. Gaasivoog jaotatakse kuueks vooks, mida reguleeritakse nõelventiilide abil (ava läbimõõt ligikaudu 0,79 mm); need vood juhitakse 3,8 mm siseläbimõõduga vasktorude kaudu kambrisse. Pärast temperatuuri tasakaalustumist läbib gaas proovi ja sorbentpüünise ning väljub kambrist.
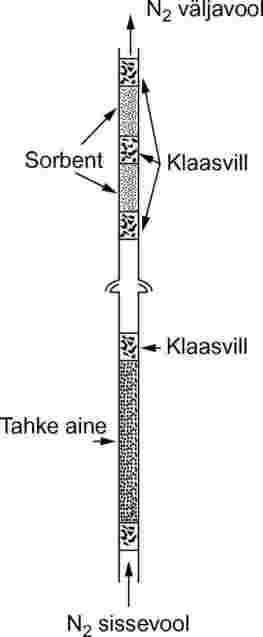
Tahke proov asetatakse 5-millimeetrise siseläbimõõduga klaastorusse klaasvillast korkide vahele (vt joonis 9). Joonisel 10 on näidatud vedela proovi hoidel ja sorptsioonisõlm. Vedeliku aururõhu mõõtmised on kõige paremini reprodutseeritavad, kui vedelik kantakse klaashelmestele või mõnele muule inertsele sorbendile, nagu ränidioksiid, ning hoidel täidetakse selliselt kaetud helmestega. Alternatiivina võib kandegaasi voolutada läbi jämeda friti või barboteerida uuritava vedelikuga täidetud kolonni kandegaasiga.
|
Joonis 9
|
Joonis 10

|
Sorptsioonisõlmes on eel- ja järeladsorptsiooni sektsioon. Väga madala aururõhu puhul võib olla tõsiseks probleemiks adsorptsioon proovi ning adsorbendi vahel oleval klaasvillal ja klaastorudel, kusjuures sorbendile jääb ainult väike kogus uuritavat ainet.
Tõhus viis aurustunud materjali kogumiseks on kasutada süsihappelumega jahutatavat püüdurit. Selline püüdur ei avalda vasturõhku küllastuskolonnile ja sellest on kerge püütud materjali kvantitatiivselt eemaldada.
1.5.7.3. Mõõtmise käik
Kandegaasi voolukiirust mõõdetakse toatemperatuuril. Voolukiirust kontrollitakse katse ajal sageli, et tagada kandegaasi üldmahu õige määramine. Parem on seda massivoolumõõturi abil pidevalt mõõta. Gaasifaasi küllastumiseks peab kokkupuuteaeg olema küllalt pikk ja gaasivoolu kiirus väike (25).
Katse lõpus analüüsitakse eel- ja järeladsorptsiooni sektsiooni eraldi. Kummastki sektsioonist desorbeeritakse uuritav aine lahusti abil. Saadud lahuseid analüüsitakse kvantitatiivselt kummastki sektsioonist desorbeeritud massi määramiseks. Analüüsimeetodi (ja ka sorbendi ja desorbeeriva lahusti) valik oleneb uuritavast ainest. Desorptsiooni täielikkuse määramiseks kantakse teadaolev kogus uuritavat proovi sorbendile, desorbeeritakse, ja määratakse aine saagis. Desorptsiooni tõhusust on vaja kontrollida samal või ligikaudu samal uuritava proovi kontsentratsioonil, mis esineb mõõtmise puhul.
Tagamaks, et kandegaas on uuritava ainega küllastunud, kasutatakse kolme erinevat gaasivoolu kiirust. Kui arvutatud aururõhk ei olene voolukiirusest, peetakse kandegaasi küllastunuks.
Aururõhk arvutatakse järgmise valemi abil:
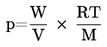
kus:
|
p
|
=
|
aururõhk (Pa),
|
|
W
|
=
|
aurustunud uuritava aine mass (g),
|
|
V
|
=
|
küllastunud kandegaasi maht (m3),
|
|
R
|
=
|
universaalne gaasikonstant, 8,314 (Jmol–1K–1),
|
|
T
|
=
|
temperatuur (K),
|
|
M
|
=
|
uuritava aine molaarmass (gmol–1).
|
Mõõdetud mahu väärtusi on vaja parandada, et arvestada rõhu ja temperatuuri erinevusi voolumõõturis ja küllastuskolonnis.
1.5.8. Pöörleva kuuli meetod
1.5.8.1. Põhimõte
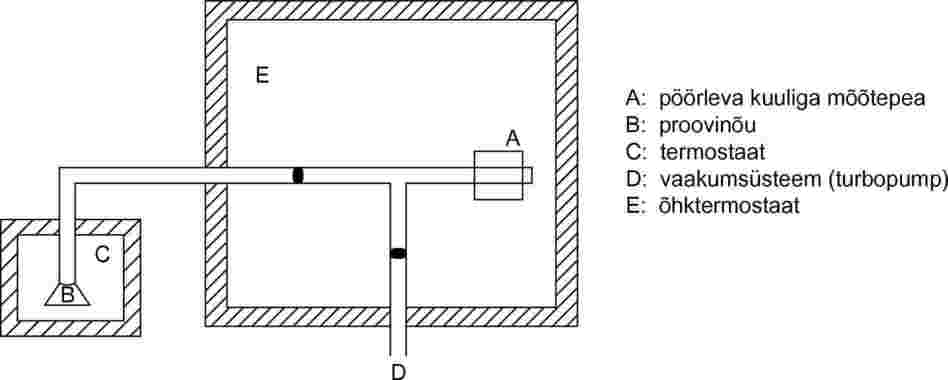
Selle meetodi puhul kasutatakse pöörleva kuuli põhimõttel töötavat viskoossusmõõturit, mille mõõteelement on magnetväljas hõljuv väike teraskuul, mis pannakse pöörlevate magnetväljade abil pöörlema (26, 27, 28). Kuuli pöörlemiskiirust saab mõõta andurmähiste abil. Kui kuul on jõudnud ettenähtud pöörlemiskiiruseni (tavaliselt umbes 400 pööret sekundis), lõpetatakse edasine kiirendamine ja kuuli pöörlemine hakkab hõõrdumise tõttu gaasikeskkonnas aeglustuma. Mõõdetakse pöörlemiskiiruse vähenemise sõltuvust ajast. Aururõhk tuletatakse teraskuulikese pöörlemiskiiruse vähenemisest, mis oleneb rõhust. Soovitatav määramisvahemik on 10–4 kuni 0,5 Pa.
1.5.8.2. Mõõteseade
Katseseadme skeem on esitatud joonisel 11. Mõõtepea asetatakse 0,1 °C täpsusega termostateeritavasse kambrisse. Proovinõu paigutatakse 0,1 °C täpsusega termostateeritud eraldi kambrisse ning seadme kõiki ülejäänud osi hoitakse kondensatsiooni vältimiseks kõrgemal temperatuuril. Kogu seade on ühendatud kõrgvaakumsüsteemiga.
Joonis 11
2. MÕÕTMISANDMED JA MÕÕTMISPROTOKOLLI KOOSTAMINE
2.1. MÕÕTMISANDMED
Mis tahes eespool kirjeldatud meetodi kasutamise puhul määratakse aururõhk vähemalt kahel temperatuuril. Aururõhu sõltuvuse lineaarsuse kontrollimiseks tuleks eelistada aururõhu määramist kolmel või enamal temperatuuril vahemikus 0–50 °C. Efusioonmeetodite (Knudseni rakk ja isotermiline termogravimeetria) ning gaasiküllastusmeetodi korral on temperatuurivahemiku 0–50 °C asemel soovitatav mõõta aururõhud vahemikus 120–150 °C.
2.2. MÕÕTMISPROTOKOLL
Mõõtmisprotokollis esitatakse järgmine teave:
|
—
|
aine täpne iseloomustus (identifitseerimiseks vajalikud andmed, lisandid) ja eelneva puhastusetapi kirjeldus (kui ainet puhastati);
|
|
—
|
vähemalt kaks, parem aga kolm või enam aururõhu ja temperatuuri väärtust vahemikus 0–50 °C (või 120–150 °C);
|
|
—
|
kui see valitud meetodi puhul on tehniliselt võimalik, peaks vähemalt üks temperatuur olema 25 °C või madalam;
|
|
—
|
kõver log p versus 1/T;
|
|
—
|
hinnanguline aururõhu väärtus 20 või 25 °C juures.
|
Kui esineb aine oleku muutusi (agregaatoleku muutumine, lagunemine), märgitakse järgmine teave:
|
—
|
atmosfäärirõhule vastav temperatuur, mille juures muutus toimub;
|
|
—
|
aururõhk 10 ja 20 °C allpool olekumuutuse temperatuuri ning 10 ja 20 °C ülalpool seda temperatuuri (välja arvatud juhtum, kui agregaatolek muutub tahkest gaasiliseks).
|
Registreerida tuleb kõik tulemuste tõlgendamist mõjutavad andmed ja tähelepanekud, eriti sellised, mis käsitlevad lisandeid ja aine füüsikalist olekut.
3. KIRJANDUS
|
1)
|
Official Journal of the European Communities L 383 A, 26–47 (1992).
|
|
2)
|
Ambrose, D. (1975). Experimental Thermodynamics, Vol. II, Le Neindre, B., and Vodar, B., Eds., Butterworths, London.
|
|
3)
|
Weissberger R., ed. (1959). Technique of Organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed., Vol. I, Part I. Chapter IX, Interscience Publ., New York.
|
|
4)
|
Glasstone, S. (1946). Textbook of Physical Chemistry, 2nd ed., Van Nostrand Company, New York.
|
|
5)
|
NF T 20–048 AFNOR (September 1985). Chemical products for industrial use – Determination of vapour pressure of solids and liquids within a range from 10–1 to 105 Pa – Static method.
|
|
6)
|
ASTM D 2879–86, Standard test method for vapour pressure – temperature relationship and initial decomposition temperature of liquids by isoteniscope.
|
|
7)
|
NF T 20–047 AFNOR (September 1985). Chemical products for industrial use –Determination of vapour pressure of solids and liquids within range from 10–3 to 1 Pa – Vapour pressure balance method.
|
|
8)
|
Knudsen, M. (1909). Ann. Phys. Lpz., 29, 1979; (1911), 34, 593.
|
|
9)
|
Ambrose, D., Lawrenson, I.J., Sprake, C.H.S. (1975). J. Chem. Thermodynamics 7, 1173.
|
|
10)
|
Schmuckler, M.E., Barefoot, A.C., Kleier, D.A., Cobranchi, D.P. (2000), Vapor pressures of sulfonylurea herbicides; Pest Management Science 56, 521–532.
|
|
11)
|
Tomlin, C.D.S. (ed.), The Pesticide Manual, Twelfth Edition (2000).
|
|
12)
|
Friedrich, K., Stammbach, K., Gas chromatographic determination of small vapour pressures determination of the vapour pressures of some triazine herbicides. J. Chromatog. 16 (1964), 22–28.
|
|
13)
|
Grayson, B.T., Fosbraey, L.A., Pesticide Science 16 (1982), 269–278.
|
|
14)
|
Rordorf, B.F., Prediction of vapor pressures, boiling points and enthalpies of fusion for twenty-nine halogenated dibenzo-p-dioxins, Thermochimia Acta 112 Issue 1 (1987), 117–122.
|
|
15)
|
Gückel, W., Synnatschke, G., Ritttig, R., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection; Pesticide Science 4 (1973) 137–147.
|
|
16)
|
Gückel, W., Synnatschke, G., Ritttig, R., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection II. Application to Formulated Products; Pesticide Science 5 (1974) 393–400.
|
|
17)
|
Gückel, W., Kaestel, R., Lewerenz, J., Synnatschke, G., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection. Part III: The Temperature Relationship between Vapour Pressure and Evaporation Rate; Pesticide Science 13 (1982) 161–168.
|
|
18)
|
Gückel, W., Kaestel, R., Kroehl, T., Parg, A., Methods for Determining the Vapour Pressure of Active Ingredients Used in Crop Protection. Part IV: An Improved Thermogravimetric Determination Based on Evaporation Rate; Pesticide Science 45 (1995) 27–31.
|
|
19)
|
Kroehl, T., Kaestel, R., Koenig, W., Ziegler, H., Koehle, H., Parg, A., Methods for Determining the Vapour Pressure of Active Ingredients Used in Crop Protection. Part V: Thermogravimetry Combined with Solid Phase MicroExtraction (SPME); Pesticide Science, 53 (1998) 300–310.
|
|
20)
|
Tesconi, M., Yalkowsky, S.H., A Novel Thermogravimetric Method for Estimating the Saturated Vapor Pressure of Low-Volatility Compounds; Journal of Pharmaceutical Science 87(12) (1998) 1512–20.
|
|
21)
|
Lide, D.R. (ed.), CRC Handbook of Chemistry and Physics, 81th ed.(2000), Vapour Pressure in the Range –25 °C to 150 °C.
|
|
22)
|
Meister, R.T. (ed.), Farm Chemicals Handbook, Vol. 88 (2002).
|
|
23)
|
40 CFR, 796. (1993). pp 148–153, Office of the Federal Register, Washington DC
|
|
24)
|
Rordorf B.F. (1985). Thermochimica Acta 85, 435.
|
|
25)
|
Westcott et al. (1981). Environ. Sci. Technol. 15, 1375.
|
|
26)
|
Messer G., Röhl, P., Grosse G., and Jitschin W. (1987). J. Vac. Sci. Technol. (A), 5(4), 2440.
|
|
27)
|
Comsa G., Fremerey J.K., and Lindenau, B. (1980). J. Vac. Sci. Technol. 17(2), 642.
|
|
28)
|
Fremerey, J.K. (1985). J. Vac. Sci. Technol. (A), 3(3), 1715.
|
(1) Mahtuvusmanomeetri kasutamise korral.
Liide
Hindamismeetod
SISSEJUHATUS
Hinnangulisi aururõhu väärtusi võib kasutada järgmistel juhtudel:
|
—
|
sobiva katsemeetodi valimiseks;
|
|
—
|
hinnangu või piirväärtuse andmiseks juhtudel, kui tehnilistel põhjustel ei saa mõõtmismeetodeid rakendada.
|
HINDAMISMEETOD
Vedelike ja tahkete ainete aururõhu hindamiseks võib kasutada teisendatud Watsoni korrelatsiooni (a). Ainus selleks vajalik eksperimentaalselt määratav väärtus on keemistemperatuur normaalrõhul. Meetod on rakendatav rõhuvahemikus 105 kuni 10–5 Pa.
Meetodi üksikasjalik kirjeldus on esitatud väljaandes „Handbook of Chemical Property Estimation Methods” (b). Vt ka OECD Environmental Monograph No. 67 (c).
ARVUTUSKÄIK
Aururõhk arvutatakse järgmise valemi abil:

kus:
|
T
|
=
|
aururõhu hindamise temperatuur,
|
|
Tb
|
=
|
keemistemperatuur normaalrõhul,
|
|
Pvp
|
=
|
aururõhk temperatuuril T,
|
|
ΔHvb
|
=
|
aurustumissoojus,
|
|
ΔZb
|
=
|
kokkusurutavustegur (hinnanguliselt 0,97),
|
|
m
|
=
|
empiiriline konstant, mis oleneb aine füüsikalisest olekust aururõhu hindamise temperatuuril.
|
Kasutatakse ka valemit

kus KF on aine polaarsust arvestav empiiriline tegur. Rea ühendiklasside KF-tegurid on esitatud publikatsioonis (b).
Sageli on olemas andmed keemistemperatuuri kohta madalamal rõhul. Sellisel juhul arvutatakse aururõhk järgmiselt:

kus T1 on keemistemperatuur madalamal rõhul P1.
PROTOKOLLI KOOSTAMINE
Kui kasutatakse hindamismeetodit, tuleb protokollis esitada täielik arvutuskäik.
KIRJANDUS
|
a)
|
Watson, K.M. (1943). Ind. Eng. Chem, 35, 398.
|
|
b)
|
Lyman, W.J., Reehl, W.F., Rosenblatt, D.H. (1982). Handbook of Chemical Property Estimation Methods, McGraw-Hill.
|
|
c)
|
OECD Environmental Monograph No.67. Application of Structure-Activity Relationships to the Estimation of Properties Important in Exposure Assessment (1993).
|
II LISA
|
A.22.
|
KIUDUDE PIKKUSE JÄRGI KAALUTUD GEOMEETRILINE KESKMINE DIAMEETER
|
1. MEETOD
1.1. SISSEJUHATUS
See meetod kirjeldab protseduuri lahtiste keemiliste mineraalkiudude (MMMF, Man Made Mineral Fibres) pikkuse järgi kaalutud geomeetrilise keskmise diameetri (LWGMD, Length Weighted Geometric Mean Diameter) mõõtmiseks. Kuna kogumi LWGMD on 95 % tõenäosusega proovi 95 % usalduspiiride vahel (LWGMD ± kaks standardviga), asub esitatud väärtus (testväärtus) proovi madalamal 95 % usalduspiiril (st LWGMD – kaks standardviga). Meetod põhineb 1994. aasta juunis uuendatud HSE tööstusprotseduuri kavandil, mis kooskõlastati ECFIA ja HSE kohtumisel Chesteris 26. septembril 1993 ja mida arendati edasi teise laboritevahelise katse jaoks ja selle põhjal (1, 2). Seda mõõtmismeetodit saab kasutada selliste lahtiste ainete või toodete kiudiameetri iseloomustamiseks, mis sisaldavad MMMFisid, kaasa arvatud tulekindlad keraamilised kiud (RCF, refractory ceramic fibres), keemilised klaaskiud (MMVF, man-made vitreous fibres), kristallilised ja polükristallilised kiud.
Pikkuse järgi kaalumine on viis kompenseerida diameetri jaotumist, mida põhjustab pikkade kiudude murdumine materjalist proovi võtmisel või materjali käsitsemisel. Geomeetrilist statistikat (geomeetrilist keskmist) kasutatakse MMMFide diameetri suuruse järgi jaotumise mõõtmiseks, kuna nende diameetrite jaotus suuruse järgi on tavaliselt lähedane logaritmilisele normaaljaotusele.
Nii pikkuse kui diameetri mõõtmine on tüütu ja aeganõudev, aga kui mõõdetakse vaid neid kiudusid, mis puudutavad lõpmatult peenikest riba skaneeriva elektronmikroskoobi (SEM) vaateväljas, siis on antud kiu valimise tõenäosus võrdeline selle pikkusega. Kuna sellega võetakse arvesse pikkust pikkuse järgi kaalumise arvutustes, on ainus nõutav mõõtmine diameetri mõõtmine ja „LWGMD – kaks standardviga” võib arvutada kirjeldatud viisil.
1.2. MÕISTED
Partikkel – objekt, mille pikkuse-laiuse suhe on vähem kui 3:1.
Kiud – objekt, mille pikkuse-laiuse suhe (formaadisuhe) on vähemalt 3:1.
1.3. RAKENDUSALA JA PIIRANGUD
Meetod on mõeldud vaatlemaks diameetri jaotumisi, keskmise diameetriga alates 0,5 μm kuni 6 μm. Suuremaid diameetreid võib mõõta, kasutades väiksemaid SEMi suurendusi, kuid meetodi täpsus väheneb peenemate kiudude jaotuste puhul ja kui keskmine diameeter on alla 0,5 μm, soovitatakse mõõtmist TEMiga (transmissiooni elektronmikroskoop).
1.4. Katsemeetodi põhimõte
Kiu kihist või lahtisest kiumassist võetakse mitu representatiivset südamikuproovi. Lahtiste kiudude pikkust vähendatakse purustava protseduuri abil ja representatiivne osaproov hajutatakse vees. Eraldatakse alikvoodid ja filtreeritakse need läbi 0,2 μm poorisuurusega polükarbonaadifiltri ja valmistatakse ette uurimiseks SEMi tehnikate abil. Kiu diameeter mõõdetakse 10 000-kordse või suurema ekraanisuurendusega, (1) kasutades erapooletu keskmise diameetri hinnangu andmiseks liini katkestamise meetodit. Arvutatakse madalam 95 % usaldusvahemik (mis põhineb ühepoolsel testil), et anda hinnang materjali kiudiameetri geomeetrilise keskmise väikseima väärtuse kohta.
1.5. Katsemeetodi kirjeldus
1.5.1. Turvalisus/ettevaatusabinõud
Isiklikku kokkupuudet õhus sisalduvate kiududega tuleks minimeerida ja kuivkiudude käsitsemisel tuleks kasutada tõmbekappi või laminaarboksi. Kontrollmeetodite tõhususe kindlaksmääramiseks tuleks läbi viia korrapärast isikliku kokkupuute seiret. MMMFide käsitsemisel tuleb nahaärrituse vähendamiseks ja ristsaastumise ärahoidmiseks kanda ühekordselt kasutatavaid kindaid.
1.5.2. Seadmed/vahendid
|
—
|
Press ja pressvormid (võimelised tekitama 10 MPa).
|
|
—
|
0,2 μm poorisuurusega polükarbonaat-kapillaarfiltrid (25 mm diameetriga).
|
|
—
|
5 μm poorisuurusega tselluloos-ester membraanifilter tugifiltrina kasutamiseks.
|
|
—
|
Klaasist filtreermisseadmed (või ühekordselt kasutatavad filtreerimissüsteemid) 25 mm diameetriga filtritele (nt Millipore’i klaasist mikroanalüüsikomplekt, tüüp nr XX10 025 00).
|
|
—
|
Värskelt destilleeritud vesi, mis on mikroorganismide eemaldamiseks lastud läbi 0,2 μm poorisuurusega filtri.
|
|
—
|
Pihusti kuld- või kuld/pallaadiumotsaga.
|
|
—
|
Skaneeriv elektronmikroskoop lahutamisvõimega kuni 10 nm ja 10 000-kordse suurendusega.
|
|
—
|
Muu: spaatlid, tüüp 24, skalpellitera, pintsetid, SEMi torud, süsinikliim või süsinikteip, kolloidhõbe.
|
|
—
|
Ultrahelisond või lauale asetatav ultrahelivann.
|
|
—
|
Südamiku proovivõtuvahend või korgipuur südamikuproovide võtmiseks MMMFide kihist.
|
1.5.3. Katsemenetlus
1.5.3.1. Proovivõtmine
Mineraalvilla ja villaku puhul kasutatakse ristlõikest proovide võtmisel 25 mm südamikuproovide võtmise vahendit või korgipuuri. Proovid peaksid olema võrdselt jaotatud kihi laiuse ulatuses või võetud suvalistest kohtadest, kui käepärast on pikki kihte. Samade vahendite abil on võimalik eraldada juhuslikke proove lahtisest kiust. Võimaluse korral tuleks ruumiliste variatsioonide peegeldamiseks lahtises materjalis võtta kuus proovi.
Kuus südamikuproovi purustatakse 50 mm läbimõõduga vormis 10 MPa juures. Materjal segatakse spaatliga ja pressitakse uuesti 10 MPa juures. Seejärel võetakse materjal vormist välja ja säilitatakse seda suletud klaaspudelis.
1.5.3.2. Proovi ettevalmistamine
Orgaanilist sideainet saab vajaduse korral eemaldada, asetades kiu umbes tunniks 450 °C sulatusahju.
Proovi jaotamiseks vormitakse see koonuseks ja lõigatakse see neljaks (seda tuleks teha tolmukapis).
Spaatli abil lisatakse väike hulk (< 0,5 g) proovist 100 ml värskelt destilleeritud veele, mis on lastud läbi 0,2 μm membraaniga filtri (alternatiivina võib kasutada ultrapuhast vett muudest allikatest, kui need vastavad nõuetele). Proov hajutatakse põhjalikult ultrahelisondi abil 100 W võimsuse juures ja seda pööratakse nii, et tekiks kavitatsioon. (Kui sondi pole käepärast, kasutada järgmist meetodit: proovi raputatakse ja pööratakse korduvalt ümber 30 sekundi jooksul; hoitakse viis minutit lauale asetatavas ultrahelivannis; seejärel raputatakse ja pööratakse korduvalt veel 30 sekundi jooksul).
Kohe pärast kiu hajutamist eemaldatakse teatud arv alikvoote (näit kolm 3, 6 ja 10 ml alikvooti), kasutades laiasuulist pipetti (2–5 ml mahutavusega).
Iga alikvoot vaakumfiltreeritakse läbi 0,2 μm polükarbonaatfiltri, mida toetab 5 µm poorisuurusega MEC-tugifilter, kasutades 25 mm klaasist filterlehtrit silindrilise mahutiga. Umbkaudu 5 ml filtreeritud destilleeritud veest tuleks asetada lehtrisse ja alikvoot aeglaselt vette pipettida, hoides pipetiotsa allpool meniskit. Peale pipettimist tuleb pipett ja veemahuti põhjalikult läbi loputada, kuna peenikesed kiud kipuvad jääma pinnale.
Filter eemaldatakse hoolikalt ja eraldatakse see tugifiltrist enne mahutisse kuivama asetamist.
Filtreeritud osast lõigatakse veerand või pool tüüp 24 skalpelliga edasi-tagasi liigutuste abil. Lõigatud osa kinnitatakse ettevaatlikult SEMi esemelaua külge süsinikteibi või süsinikliimi abil. Kolloidhõbedat tuleks lisada vähemalt kolme kohta, et parandada elektrilist kontakti filtri ja esemelaua äärtel. Kui liim/kolloidhõbe on kuiv, pihustada proovi pinnale umbes 50 nm kulla või kulla/pallaadiumi kiht.
1.5.3.3. SEMi kalibreerimine ja kasutamine
1.5.3.3.1. Kalibreerimine
SEMi kalibreerimist tuleks kontrollida vähemalt kord nädalas (ideaaljuhul kord päevas), kasutades sertifitseeritud kalibreerimisvõret. Kalibreerimist tuleks kontrollida sertifitseeritud standardi alusel ja kui mõõdetud väärtus (SEM) ei jää ±2 % sisse sertifitseeritud väärtusest, siis tuleb SEM-kalibreerimist kohandada ja uuesti kontrollida.
SEM peaks olema võimeline lahendama vähemalt minimaalselt nähtava diameetri 0,2 µm, kasutades tegelikku proovimaatriksit, 2 000-kordse suurendusega.
1.5.3.3.2. Kasutamine
SEM peaks töötama 10 000-kordse suurenduse (2) juures tingimustel, mis annavad hea lahutusvõime lubatava kujutise aeglasel skaneerimiskiirusel, näiteks 5 sekundit kaadri kohta. Kuigi erinevate SEMide kasutamisnõuded võivad varieeruda, tuleks suhteliselt väikese aatommassiga materjalide korral üldiselt parima nähtavuse ja resolutsiooni saavutamiseks kasutada kiirendavat pinget 5–10 keV, väikest laotuspunkti seadistust ja lühikest töökaugust. Lineaarse skaneerimise puhul tuleb kasutada 0o kallet, et minimeerida refokuseerimine, või kui SEMil on võimalik kohaldada kõrgust, tuleks kasutada kohaldatud kõrgusega töökaugust. Võib kasutada väiksemat suurendust, kui materjal ei sisalda väikseid (väikese diameetriga) kiude ja kiudude diameeter on suur (> 5 μm).
1.5.3.4. Suuruse järgi sorteerimine
1.5.3.4.1. Väikese suurendusega uurimine proovi hindamiseks
Algselt tuleks proovi uurida väikese suurendusega, et otsida tõendust suurte kiudude pundarde kohta ning hinnata kiutihedust. Juhul kui moodustub liiga palju puntraid, on soovitatav ette valmistada uus proov.
Statistilise täpsuse jaoks on vaja mõõta miinimumarv kiude ja suur kiutihedus võib tunduda soovitav, kuna tühjade väljade uurimine on aeganõudev ega oma analüüsi jaoks väärtust. Kui aga filter on üle koormatud, muutub kõigi mõõdetavate kiudude mõõtmine siiski raskeks, ja kuna väikesed kiud võivad jääda suuremate varju, võivad need jääda kahe silma vahele.
Kalduvus LWGMD ülehindamisele võib tuleneda kiutihedustest enam kui 150 kiudu millimeetri kohta lineaarse sammu puhul. Teisest küljest pikendab väike kiukontsentratsioon analüüsi aega ja sageli on mõistlikum valmistada ette proov, mille kiutihendus on lähedasem optimaalsele, kui jätkata madala kontsentratsiooniga filtrite loendamist. Optimaalne kiutihedus peaks andma keskmiselt üks või kaks loendatavat kiudu vaatevälja kohta 5 000-kordse suurendusega. Siiski sõltub optimaalne tihedus kiudude suurusest (diameetrist), nii et on vajalik, et operaator kasutaks teatavat eksperdihinnangut otsustamaks, kas kiu tihedus on optimaalse lähedane või mitte.
1.5.3.4.2. Kiu diameetri kaalumine pikkuse järgi
Loendatakse vaid kiude, mis puudutavad (lõpmatult) peenikest SEMi ekraanile tõmmatud joont (või lõikuvad sellega). Selleks on ekraani keskele tõmmatud horisontaalne (või vertikaalne) joon.
Alternatiivina võib ekraani keskele asetada üksiku punkti ja alustada pidevat skaneeringut ühes suunas üle filtri. Mõõdetakse ja salvestatakse iga sellise kiu diameeter, mille formaadisuhe on suurem kui 3:1 ja mis puudutab või ületab seda punkti.
1.5.3.4.3. Kiudude sorteerimine suuruse järgi
Soovitav on mõõta minimaalselt 300 kiudu. Iga kiudu mõõdetakse ainult korra ja selles punktis, kus ta lõikub kujutisele paigutatud joone või punktiga (või lõikumiskoha lähedal, kui kiu servad on hägused). Kui leidub ebaühtlase põiklõikega kiude, tuleks kasutada mõõtmist, mis vastab kiu keskmisele diameetrile. Hoolikas tuleb olla kiuservade määratlemisel ja nendevahelise lühima kauguse mõõtmisel. Sorteerimist võib läbi viia on-line või off-line salvestatud kujutistel või fotodel. Soovitatav on kasutada poolautomatiseeritud kujutise mõõtmise süsteeme, mis laadivad andmed otse arvutustabelisse, kuna need säästavad aega ja välistavad ümberkirjutusvead ning arvutusi on võimalik automatiseerida.
Pikkade kiudude otsi tuleks kontrollida väikese suurendusega, et välistada nende tagasikeerdumine mõõtmise vaatevälja ja tagada, et neid mõõdetakse ainult üks kord.
2. ANDMED
2.1. TULEMUSTE TÖÖTLEMINE
Kiudiameetritel ei esine tavaliselt normaaljaotust. Siiski on logaritmteisenduse abil võimalik saavutada normaaljaotusele lähenev jaotus.
Arvutatakse n kiudiameetri (D) naturaallogaritmide (lnD) aritmeetiline keskmine (keskmine lnD) ja standardhälve (SDlnD).
|

|
(1)
|
|

|
(2)
|
Standardhälve jagatakse mõõtmiste arvu (n) ruutjuurega, et saada standardviga (SElnD).
|
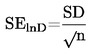
|
(3)
|
Keskmisest lahutatakse kahekordne standardviga ja arvutatakse selle väärtuse eksponent (keskmine miinus kaks standardviga), et saada geomeetriline keskmine miinus kaks geomeetrilist standardviga.
|
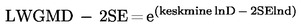
|
(4)
|
3. ARUANDMINE
KATSEARUANNE
Katsearuanne peaks sisaldama vähemalt järgmist teavet:
|
—
|
avaldise LWGMD – 2SE väärtus;
|
|
—
|
mis tahes hälbed ja eriti need, mis võivad avaldada mõju tulemuste täpsusele, koos piisavate põhjendustega.
|
4. VIITED
|
1)
|
B. Tylee SOP MF 240. Health and Safety Executive. Veebruar 1999.
|
|
2)
|
G. Burdett ja G. Revell. Development of a standard method to measure the length-weigthed geometric mean fibre diameter: Results of the Second inter-laboratory exchange. IR/L/MF/94/07. Project R42.75 HPD. Health and Safety Executive. Research and Laboratory Services Division. 1994.
|
(1) See suurendusväärtus kehtib 3 µm kiu puhul, 6 µm kiu puhul võib 5 000-kordne suurendus olla sobivam.
(2) 3 μm kiudude korral vt eelmist märkust.
III LISA
|
B.46.
|
IN VITRO NAHAÄRRITUSKATSE: KATSE REKONSTRUEERITUD INIMEPIDERMISE MUDELIGA
|
1. MEETOD
1.1. SISSEJUHATUS
Nahaärritus / nahka ärritav toime tähendab pöörduva nahakahjustuse tekitamist kuni neljatunnisel kokkupuutel uuritava ainega (nagu on määratletud ÜRO ühtses ülemaailmses kemikaalide klassifitseerimise ja märgistamise süsteemis (GHS)) (1). Käesolevas katsemeetodis on esitatud in vitro meetod, millega saab, olenevalt vajatavast teabest, määrata ainete põhjustatavat nahaärritust katsestrateegiale vastava iseseisva asendustestina, kasutades tõendusmaterjali kaalukuse hindamise lähenemisviisi (2).
Nahka ärritava toime hindamisel on tavaliselt kasutatud laboriloomi (vt meetod B.4) (3). Loomade heaolu tagamise vajadust arvestades saab meetodiga B.4 määrata nahka söövitavat või ärritavat toimet, kohaldades järjestikuste katsete strateegiat, milleks kasutatakse valideeritud in vitro ja ex vivo meetodeid, et vältida loomadele valu ja kannatuste põhjustamist. Meetodi B.4 järjestikuste katsete strateegia rakendamisel saab söövitamise uurimiseks kasutada kolme valideeritud in vitro katsemeetodit või -eeskirja: B.40, B.40bis ja TG 435 (4, 5, 6).
Käesolevas katsemeetodis on kasutatud rekonstrueeritud inimepidermise mudeleid, mis oma üldise ülesehituse poolest (rakkude allikana on nendes kasutatud inimepidermisest saadud keratinotsüüte, mudelil on epidermisesarnane kude ja rakuarhitektuur) jäljendavad nii oma biokeemiliste kui ka füsioloogiliste omaduste poolest inimnaha ülemisi kihte, s.t epidermist. Käesolevas katsemeetodis kirjeldatud menetlusega on võimalik kindlaks määrata ÜRO GHS-süsteemi 2. kategooriale vastavate ärritavate ainetega seotud ohud. Käesolevas katsemeetodis on esitatud ka rida tulemuslikkuse nõudeid rekonstrueeritud inimepidermisel põhinevate sarnaste ja modifitseeritud katsemeetodite hindamiseks (7).
Rekonstrueeritud inimepidermise mudelite kasutamisel põhinevatest in vitro katsemeetoditest (8, 9, 10, 11, 12, 13, 14, 15, 16, 17) on kahe meetodi eelvalideerimise, optimeerimise ja valideerimise uuringud lõpetatud ning need kaks meetodit, EpiSkin™ ja EpiDerm™, on müügil. Nimetatud standardmeetodid põhinesid R 38-l. GHS-süsteemi kasutamiseks vajalike ümberarvutuste teatavaid aspekte on käsitletud viites 25. Meetodeid, mille tulemused on samaväärsed meetodi EpiSkin™ tulemustega (valideeritud standardmeetod 1), soovitatakse iseseisva asendusmeetodina küüliku in vivo katsele, mille alusel klassifitseeritakse GHS-süsteemi 2. kategooria ärritavaid aineid. Meetodeid, mille tulemused on samaväärsed EpiDerm™ (valideeritud standardmeetod 2) tulemustega, soovitatakse GHS-süsteemi 2. kategooria ärritavate ainete klassifitseerimisel ainult sõeluuringumeetodina või tõendusmaterjali kaalukuse hindamise lähenemisviisi järjestikuste katsete strateegia osana. Enne kui nahaärrituse mudelkatseks kavandatud in vitro katset rekonstrueeritud inimepidermise mudeliga võib kasutada seadusega ette nähtud katsena, tuleb kindlaks määrata selle usaldusväärsus, asjakohasus (tulemuste täpsus) ja piirangud selle tagamiseks, et meetod on vastavalt käesolevas katsemeetodis esitatud tulemuslikkuse nõuetele (vt liide) võrreldav valideeritud standardmeetodiga 1.
Käesolevas katsemeetodis esitatud nõuete kohaselt on valideeritud veel kaks katsemeetodit, milles kasutatakse in vitro rekonstrueeritud inimepidermise mudelit; osutatud meetodid annavad valideeritud standardmeetodiga 1 sarnaseid tulemusi (18). Need on modifitseeritud katsemeetod EpiDerm™ (modifitseeritud standardmeetod 2) ja katsemeetod SkinEthic RHE™ (sarnane meetod 1).
1.2. MÕISTED
Käesolevas katsemeetodis on kasutatud järgmisi mõisteid.
Täpsus – katsemeetodi tulemuste ja kinnitatud võrdlusväärtuste kooskõla määr. Täpsus näitab katsemeetodi tulemuslikkust ja on üks asjakohastest aspektidest. Seda terminit kasutatakse ka vastavuse tähenduses ja see näitab, kui sageli annab katsemeetod õige tulemuse.
Partii kontrollaine – võrdlusaine, mille mõju koerakkude eluvõimelisusele jääb mõõdetava vahemiku keskele.
Rakkude eluvõimelisus – rakupopulatsiooni üldist aktiivust, näiteks raku mitokondrite dehüdrogenaaside võimet taandada vitaalvärvainet MTT ([3–(4,5-dimetüültiasool-2-üül)-2,5-difenüültetrasooliumbromiid, tiasolüülsinine), väljendav parameeter, mis olenevalt mõõdetavast lõpp-punktist ja katseplaanist korreleerub elusrakkude koguarvu ja/või elujõulisusega.
ET50
– kokkupuuteaeg, pärast mida markeraine teatava kindla kontsentratsiooni rakendamisel rakkude eluvõimelisus väheneb 50 %; vt ka IC50.
Valenegatiivsete vastuste määr – kõikide selliste positiivsete ainete osakaal, mis katsemeetodi alusel on tunnistatud negatiivseteks. See on üks katsemeetodi tulemuslikkuse näitaja.
Valepositiivsete vastuste määr – kõikide selliste negatiivsete (mitteaktiivsete) ainete osakaal, mis katsemeetodi alusel on ekslikult tunnistatud positiivseks. See on üks katsemeetodi tulemuslikkuse näitaja.
Lõpmatu annus – nahale kantud uuritava aine kogus, mis on suurem nahapinna täielikuks ja ühtlaseks katmiseks vajalikust kogusest.
GHS (Globally Harmonized System of Classification and Labelling of Chemicals – kemikaalide ühtne ülemaailmne klassifitseerimis- ja märgistamissüsteem) – süsteem, millega nähakse ette ainete ja segude klassifitseerimine vastavalt nende füüsilise ohtlikkuse ning kahjuliku tervise- ja keskkonnamõju standarditud tüübile ja -tasemele ning mis hõlmab asjaomaseid teavitustähiseid, nagu piktogrammid, märksõnad, ohulaused, hoiatuslaused ja ohutuskaardid, et anda edasi inimeste (sealhulgas tööandjate, töötajate, vedajate, tarbijate ja päästetöötajate) ja keskkonna kaitsmiseks vajalikku teavet kõnealuste ainete kahjuliku mõju kohta (1), ja mis on ELis rakendatud määrusega (EÜ) nr 1272/2008.
IC50
– kontsentratsioon, mille puhul markeraine vähendab pärast kindlaksmääratud kokkupuuteaega kudede eluvõimelisust 50 %; vt ka ET50.
Tulemuslikkuse nõuded – valideeritud standardmeetodil põhinevad nõuded, mille alusel hinnatakse, kuivõrd saab kavandatud katsemeetodit võrrelda mehaaniliselt ja tööpõhimõttelt sarnase meetodiga. See hõlmab järgmist: I) olulisemad katsemeetodi osad; II) valideeritud standardmeetodi usaldusväärsuse tõendamiseks kasutatud ainete hulgast valitud etalonainete miinimumloend ja III) võrreldavad täpsuse ja usaldusväärsuse tasemed, mis põhinevad valideeritud standardmeetodiga saadud tulemustel ja mis tuleks kavandatud katsemeetodi hindamisel saavutada etalonainete miinimumloendi kasutamisel.
Usaldusväärsus – sellega mõõdetakse katsemeetodi tulemuste reprodutseeritavust, kui meetodit rakendatakse ühe ja sama katseprotokolli alusel ühes laboris ja eri laborites pikema aja jooksul. Usaldusväärsuse hindamisel arvutatakse laborisisene ja laboritevaheline reprodutseeritavus.
Tundlikkus – kõikide positiivsete ainete / toimeainete osakaal, mis katsemeetodi alusel klassifitseeritakse õigesti. Tundlikkus näitab selgeid tulemusi andva katsemeetodi täpsust ja on oluline katsemeetodi asjakohasuse hindamisel.
Spetsiifilisus – kõikide negatiivsete/toimeta ainete osakaal, mis katsemeetodi alusel klassifitseeritakse õigesti. Tundlikkus näitab selgeid tulemusi andva katsemeetodi täpsust ja on oluline katsemeetodi asjakohasuse hindamisel.
Nahaärritus – pöörduva nahakahjustuse tekkimine uuritava ainega kuni neljatunnise kokkupuute tagajärjel. Nahaärritus on kohalik mitteimmunogeenne reaktsioon, mis tekib lühikese aja jooksul pärast kokkupuudet (24). Seda iseloomustab peamiselt pöörduv protsess, mis hõlmab põletikureaktsiooni ja põletikuga seotud iseloomulikke kliinilisi ärrituse tunnuseid (punetus, turse, sügelus ja valu).
1.3. KASUTUSALA JA PIIRANGUD
Käesolevas katsemeetodis esitatud rekonstrueeritud inimepidermise mudeliga tehtavaid katseid piirab see, et nendega saab aineid klassifitseerida ainult nahka ärritavateks aineteks, mis vastavad ÜRO GHS-süsteemi 2. kategooriale. Kuna meetod ei võimalda klassifitseerida aineid ÜRO GHS-süsteemi 3. valikkategooriasse kuuluvateks aineteks, jäävad kõik ülejäänud ained klassifitseerimata (ilma kategooriata). Olenevalt reguleerimisvajadustest ja uute lõpp-punktide võimalikust hõlmamisest tulevikus, samuti võimalikest täiustustest või samalaadsete katsemeetodite väljatöötamisest, tuleb käesolevat katsemeetodit võib-olla hakata läbi vaatama.
Käesolev katsemeetod võimaldab kindlaks määrata ühest koostisosast koosnevate ärritavate ainete ohtlikkuse (19), kuid ei anna tõepärast teavet nahka söövitava toime kohta. Gaaside ja aerosoolide toimet ei ole võimalik määrata, valideerimisuuringuga ei ole veel hinnatud segusid.
1.4. KATSE PÕHIMÕTE
Uuritav aine kantakse kolmemõõtmelisele rekonstrueeritud inimepidermise mudelile, mis koosneb tavalistest inimepidermisest saadud keratinotsüütidest, mida on kasvatatud nii, et need moodustavad mitmekihilise tugevalt diferentseerunud inimepidermise mudeli. See koosneb korrastatud basaalkihist, ogakihist ja sõmerkihist ning mitmekihilisest sarvkihist, mis sisaldab rakkudevahelisi õhiklipiidkihte, mille paigutus sarnaneb paigutusega in vivo.
Rekonstrueeritud inimepidermise mudeli katse põhineb hüpoteesil, et ärritavad ained suudavad difusiooni teel tungida läbi sarvkihi ja on tsütotoksilised allpool asuvatele rakukihtidele. Rakkude eluvõimelisust mõõdetakse selle põhjal, kuidas dehüdrogenaas muundab vitaalvärvainet MTT [3–(4,5-dimetüültiasool-2-üül)-2,5-difenüültetrasooliumbromiid, tiasolüülsinine; EINECSi number 206–069–5, CASi number 298–93–1)] siniseks formasaansoolaks, mis pärast koest ekstraheerimist määratakse kvantitatiivselt (20). Ärritavad ained tehakse kindlaks nende võime järgi vähendada rakkude eluvõimelisust allapoole kindlaksmääratud läviväärtusi (see tähendab ≤ 50 % ÜRO GHS-süsteemi 2. kategooria ärritavate ainete puhul). Ained, mille puhul rakkude eluvõimelisus jääb ülespoole kindlaksmääratud läviväärtust, jäetakse klassifitseerimata (see tähendab > 50 %, ilma kategooriata).
Rekonstrueeritud inimepidermise mudelsüsteeme saab kasutada tahkete ainete, vedelike, pooltahkete ainete ja vahataoliste ainete määramiseks. Vedelikud võivad olla vesilahused või muud vedelikud; tahked ained võivad olla vees lahustuvad või lahustumatud. Võimaluse korral tuleks tahkeid aineid alati katsetada peene pulbri kujul. Kuna rekonstrueeritud inimepidermise mudeli valideerimiseks kasutati katsesüsteemidena 58 hoolikalt valitud ainet, mis esindavad paljusid keemiliste ühendite klasse, peetakse kõnealuseid meetodeid üldiselt rakendatavaks paljude aineklasside puhul (16). Valideerimine hõlmab 13 GHS-süsteemi 2. kategooria ärritavat ainet. Tuleb märkida, et valideerimisel ei kasutatud mittesöövitavaid happeid, aluseid, sooli ja muid anorgaanilisi aineid, samuti ei kasutatud või kasutati üksnes piiratud ulatuses aineid, mis kuuluvad mõnesse teadaolevalt ärritavate orgaaniliste ainete klassi, nagu vesinikperoksiidid, fenoolid ja pindaktiivsed ained.
1.5. PÄDEVUSE TÕENDAMINE
Enne käesoleval katsemeetodil põhineva valideeritud meetodi igapäevast kasutuselevõttu võivad laborid tõendada oma tehnilist pädevust, kasutades tabelis 1 soovitatud kümmet ainet. Käesoleva katsemeetodi kohaselt käsitatakse ÜRO GHS-süsteemi 3. valikkategooriat kategooria puudumisena. Käesoleva katsemeetodi alusel väljatöötatavate uute samalaadsete katsemeetodite puhul, mis oma struktuuri ja tööpõhimõtte poolest sarnanevad valideeritud standardmeetoditega, samuti valideeritud meetodite modifikatsioonide puhul, tuleks kasutada käesoleva katsemeetodi liites kirjeldatud tulemuslikkuse nõudeid, et tõendada uue katsemeetodi võrreldavat usaldusväärsust ja täpsust, enne kui uus meetod võetakse kasutusele õigusnormides ette nähtud meetodina.
Tabel 1
Liites esitatud etalonainete hulgast valitud ained pädevuse kontrollimiseks
|
Aine
|
CASi number
|
Tulemus in vivo
|
Füüsikaline olek
|
GHS-kategooria
|
|
naftüüläädikhape
|
86–87–3
|
0
|
tahke
|
kat-ta
|
|
isopropanool
|
67–63–0
|
0,3
|
vedelik
|
kat-ta
|
|
metüülstearaat
|
112–61–8
|
1
|
tahke
|
kat-ta
|
|
heptüülbutüraat
|
5870–93–9
|
1,7
|
vedelik
|
3. valikkat.
|
|
heksüülsalitsülaat
|
6259–76–3
|
2
|
vedelik
|
3. valikkat.
|
|
3-p-kumenüül-2-metüülpropioonaldehüüd
|
103–95–7
|
2,3
|
vedelik
|
2. kat.
|
|
1-bromoheksaan
|
111–25–1
|
2,7
|
vedelik
|
2. kat.
|
|
butüülmetakrülaat
|
97–88–1
|
3
|
vedelik
|
2. kat.
|
|
1-metüül-3-fenüül-1-piperasiin
|
5271–27–2
|
3,3
|
tahke
|
2. kat.
|
|
heptanaal
|
111–71–7
|
4
|
vedelik
|
2. kat.
|
1.6. MEETODI KIRJELDUS
Järgnevas osas kirjeldatakse nahaärrituse hindamiseks kasutatava rekonstrueeritud inimepidermise mudeliga tehtava katse koostisosi ja menetlusi. Rekonstrueeritud inimepidermise mudeli võib koostada, valmistada ise või osta (näiteks EpiSkin™, EpiDerm™ ja SkinEthic RHE™). Standardsete katsemeetodite EpiSkin™, EpiDerm™ ja SkinEthic RHE™ läbiviimise eeskirjad võib saada aadressilt http://ecvam.jrc.ec.europa.eu (21, 22, 23). Katse tuleks läbi viia järgmiselt.
1.6.1. Rekonstrueeritud inimepidermise mudeli koostisosad
1.6.1.1. Mudeli üldised tingimused
Epiteelkoe ehitamiseks tuleb kasutada tavalisi inimese keratinotsüüte. Talitleva sarvkihi all peab olema mitu kihti (basaalkiht, ogakiht ja sõmerkiht) eluvõimelisi epiteelrakke. Sarvkiht peaks olema mitmekihiline ja vajaliku lipiidse koostisega, et tekiks sellise tugevusega funktsionaalne kaitsekiht, mis suudab takistada tsütotoksiliste markerainete, nagu naatriumdodetsüülsulfaat (SDS) või Triton X-100, kiiret läbitungimist. Nimetatud kaitsekihina toimimist saab hinnata kas sellise kontsentratsiooni määramisega, mille juures markeraine vähendab koe eluvõimelisust 50 % võrra (IC50) pärast kindlaksmääratud kokkupuuteaega, või sellise kokkupuuteaja määramisega, mille puhul markeraine vähendab koe eluvõimelisust 50 % võrra (ET50) teatava kindla kontsentratsiooni juures. Mudel peab olema selline, et aine ei saaks tungida eluskudedesse sarvkihist mööda minnes, vastasel korral ei oleks tegemist naha ja keemilise aine kokkupuute õige mudeliga. Nahamudel ei tohi olla saastunud bakterite, viiruste, mükoplasma ega seentega.
1.6.1.2. Mudeli funktsionaalsed tingimused
1.6.1.2.1. Eluvõimelisus
Eluvõimelisuse määramiseks kasutatakse eelistatult värvainet MTT (20). Negatiivse kontrolli võrdlusainega töödeldud koest ekstraheeritud (lahustatud) värvaine optiline tihedus (OD) peab olema vähemalt 20 korda suurem kui ekstraheerimislahusti optiline tihedus. Peaks olema tõendatud, et negatiivse võrdlusainega töödeldud kude on kultuuris stabiilne (võimaldab saada sarnaseid eluvõimelisuse mõõtmistulemusi) katses kasutatava kokkupuuteaja jooksul.
1.6.1.2.2. Toimimine kaitsekihina
Sarvkiht ja selle lipiidne koostis peavad olema piisavad, et takistada tsütotoksiliste markerainete, nagu SDSi või Triton X-100 kiiret läbitungimist; seda hinnatakse IC50 või ET50 abil.
1.6.1.2.3. Morfoloogia
Vajaliku ettevalmistusega töötajad peavad tegema rekonstrueeritud naha/epidermise histoloogilise uuringu, mis peaks näitama, et on saadud inimnaha/epidermisega sarnane struktuur (kaasa arvatud mitmekihiline sarvkiht).
1.6.1.2.4. Reprodutseeritavus
Konkreetse mudeli kasutamise korral peaks meetod andma ajas reprodutseeritavaid tulemusi, kusjuures partii kontrollimiseks kasutatakse eelistatavalt mingit sobivat (kontroll)ainet (vt liide).
1.6.1.2.5. Mudeli kvaliteedikontroll
Epidermisemudeli iga partii peaks vastama teatavatele kindlatele toote kvaliteedikontrolli kriteeriumidele, millest kõige tähtsamad on eluvõimelisus (punkt 1.6.1.2.1) ja toimimine kaitsekihina (punkt 1.6.1.2.2). Nahamudeli tootja (või katse läbiviija, kui ta kasutab omatehtud mudelit) peaks kindlaks määrama IC50 või ET50 lubatava vahemiku (ülem- ja alampiiri). Kudede kaitsekihiomadusi tuleks laboris pärast kudede saamist kontrollida. Nahaärrituse põhjustamise usaldusväärseks ennustamiseks saab kasutada ainult sobivate omadustega kudedega saadud tulemusi. Järgmises tabelis on näitena esitatud valideeritud standardmeetodite puhul lubatavad vahemikud.
Tabel 2
Partii kvaliteedi kontrollimise kriteeriumide näited
|
|
Lubatav alampiir
|
Lubatava vahemiku keskväärtus
|
Lubatav ülempiir
|
|
Valideeritud standardmeetod 1 (18-tunnine töötlus SDS-ga)
|
IC50 = 1,0 mg/ml
|
IC50 = 2,32 mg/ml
|
IC50 = 3,0 mg/ml
|
|
Valideeritud standardmeetod 2 (1 % Triton X-100)
|
ET50 = 4,8 h
|
ET50 = 6,7 h
|
ET50 = 8,7 h
|
1.6.1.3. Uuritavate ja kontrollainete pealekandmine
Igaks määramiseks ja kontrollkatseteks tuleb kasutada piisavat arvu koemudeleid (vähemalt kolm korduskatset iga määramise kohta). Nii vedelate kui ka tahkete ainete korral tuleb kasutada piisavat uuritava aine kogust, nii et see kataks ühtlaselt naha pinna, kuid vältida tuleb lõpmatut annust (vt punkt 1.2 „Mõisted”); see tähendab, et ainet tuleb peale kanda vähemalt 25 μl/cm2 või 25 mg/cm2. Tahkete ainete puhul tuleks epidermist niisutada enne aine pealekandmist deioniseeritud või destilleeritud veega, et tagada aine hea kontakt nahaga. Võimaluse korral tuleks tahkeid aineid alati katsetada peene pulbri kujul. Kokkupuuteaja lõpus tuleks uuritav aine nahapinnalt hoolikalt maha pesta vesipuhverlahusega või 0,9 % NaCl lahusega. Olenevalt kasutatavast rekonstrueeritud inimepidermise mudelist võib kokkupuuteaeg olla 15–60 minutit ja inkubatsioonitemperatuur 20–37 °C. Üksikasjad on esitatud kolme meetodi standardses töökorras (21, 22, 23).
Iga uuringu puhul tuleb teha paralleelkatsed negatiivse kontrolli võrdlusaine ja positiivse kontrolli võrdlusainega, millega tõendatakse, et kudede eluvõimelisus (negatiivse kontrolli võrdlusaine), kaitsekihi toime ja sellega määratud kudede tundlikkus (positiivse kontrolli võrdlusaine) on kindlaksmääratud varasemates lubatud piirides. Soovitatav positiivse kontrolli võrdlusaine on SDSi 5 % vesilahus. Soovitatavad negatiivse kontrolli võrdlusained on vesi või fosfaatpuhvrit sisaldav keedusoolalahus.
1.6.1.4. Raku eluvõimelisuse mõõtmine
Kõige olulisem katse läbiviimisel on see, et eluvõimelisuse mõõtmisi ei tehtaks vahetult pärast kokkupuudet uuritava ainega, vaid pärast töötlemisele järgnevat puhtaks loputatud kudede piisavalt pikka inkubeerimist värskes keskkonnas. Inkubeerimine võimaldab toibuda nõrgalt ärritavast mõjust ja ilmneda selgel tsütotoksilisel mõjul. Katse optimeerimise etapil (9, 10, 11, 12, 13) tehti kindlaks, et 42-tunnine inkubeerimine pärast töötlemist on optimaalne, ja seepärast kasutatigi seda inkubatsiooniaega määramise standardmeetodite valideerimisel.
MTT muundamise katse on kvantitatiivne valideeritud meetod, mida tuleks kasutada rakkude eluvõimelisuse mõõtmiseks. Meetodit saab kasutada kolmemõõtmelises koekonstruktsioonis. Nahaproov asetatakse kolmeks tunniks sobiva kontsentratsiooniga (nt 0,3–1 mg/ml) MTT lahusesse sobival inkubatsioonitemperatuuril. Sadestunud sinine formasaan ekstraheeritakse seejärel lahustiga (näiteks isopropanool, hapestatud isopropanool) ja formasaani kontsentratsioon määratakse optilise tiheduse mõõtmisega lainepikkusel 570 nm, kasutades spektririba laiust kuni ±30 nm.
Uuritava aine enda optilised omadused või selle keemiline mõju MTT-le võib segada määramist, põhjustades eluvõimelisuse hindamisel vea (kuna uuritav aine võib segada värvuse ilmumist, nõrgendada värvust või põhjustada seda). See võib juhtuda, kui uuritavat ainet ei ole nahalt täielikult maha loputatud või kui aine on tunginud epidermisesse. Kui uuritav aine reageerib otse MTTga, on ise värviline või muutub värviliseks koega kokkupuutumisel, tuleb kasutada täiendavaid kontrollkatseid, et teha kindlaks, kuivõrd segab uuritav aine eluvõimelisuse määramist, ning viia sisse asjakohane parandus. Üksikasjalik kirjeldus, kuidas kontrollida MTT otsest taandamist, on esitatud valideeritud standardmeetodite eeskirjades (21, 22, 23). Nendest segavatest mõjudest tingitud mittespetsiifiline värvus ei tohiks ületada 30 % negatiivse kontrolli värvusest (paranduste tegemiseks). Kui mittespetsiifilist värvust on üle 30 %, tehakse järeldus, et uuritavat ainet ei saa käesoleva meetodiga mõõta.
1.6.1.5. Katse kehtivuse kriteeriumid
Igas katses, milles kasutatakse kõlblikku partiid (vt punkt 1.6.1.2.5), peaks negatiivse kontrolli võrdlusainega töödeldud kudede korral leitama optilise tiheduse väärtused, mis näitavad, et koed on pärast transpordi ja vastuvõtmise etappe ja ärritava toime määramist säilitanud oma kvaliteedi. Kontrollkatsete optilise tiheduse väärtused ei peaks olema allpool varem määratud alampiire. Ka positiivse kontrolli võrdlusainega, s.t 5 % SDSi lahusega töödeldud kudedel peaks olema säilinud tundlikkus ja võime reageerida ärritavale ainele iga individuaalse määramise tingimustes (näiteks peaks eluvõimelisus olema valideeritud standardmeetodi 1 puhul ≤ 40 % ja valideeritud standardmeetodi 2 puhul ≤ 20 %). Peavad olema määratletud koeproovide varieeruvusega seotud sobivad näitajad (kui kasutatakse näiteks standardhälbeid, peaksid need olema < 18 %).
2. ANDMED
2.1. ANDMED
Iga töötlemise kohta tuleks tabelina esitada üksikute paralleelproovide tulemused (näiteks optilise tiheduse väärtused ja rakkude eluvõimelisuse arvutatud protsendimäära andmed iga uuritud aine kohta, kaasa arvatud klassifikatsioon); samuti tuleb vajaduse korral esitada kordusmääramiste andmed. Lisaks keskväärtusele esitatakse iga katse jaoks ka ± standardhälbe väärtused. Iga uuritava aine puhul registreeritakse tähelepanekud selle mõjude kohta MTT-reagendile, samuti märgitakse ära värvilised uuritavad ained.
2.2. TULEMUSTE TÕLGENDAMINE
Iga uuritava proovi kohta saadud optilise tiheduse väärtusi saab kasutada selleks, et arvutada rakkude eluvõimelisuse protsent võrreldes negatiivse kontrollprooviga, mille eluvõimelisuseks määratakse 100 %. Rakkude eluvõimelisuse protsendimäära piirväärtus, mis eraldab ärritavaid aineid klassifitseerimata uuritavatest ainetest, ning statistiline meetod (statistilised meetodid), mida kasutati tulemuste hindamiseks ja ärritavate ainete kindlakstegemiseks, peavad olema selgelt määratletud ja dokumenteeritud ning nende sobivus peab olema tõendatud. Valideeritud standardmeetoditega seotud piirväärtused, mida kasutatakse ärritava toime kindlakstegemiseks, on järgmised.
Uuritav aine loetakse ÜRO GHS-süsteemi 2. kategooriale vastavaks nahka ärritavaks aineks:
|
i)
|
kui koe eluvõimelisus pärast kokkupuudet ainega ja kokkupuutele järgnenud inkubeerimist on väiksem kui 50 % või sellega võrdne (≤).
|
Uuritav aine loetakse aineks, millele ei ole omistatud kategooriat:
|
ii)
|
kui koe eluvõimelisus pärast kokkupuudet ainega ja kokkupuutele järgnenud inkubeerimist on suurem kui 50 % (>).
|
3. ARUANNETE ESITAMINE
3.1. KATSEARUANNE
Katsearuanne peab sisaldama järgmist teavet:
Uuritavad ained ja kontrollained:
|
—
|
keemiline nimetus või nimetused, nagu IUPACi või CASi nimetus ja CASi number, kui see on teada;
|
|
—
|
aine puhtus või koostis (massiprotsendina);
|
|
—
|
määramise läbiviimise seisukohast olulised füüsikalis-keemilised omadused (näiteks füüsiline olek, stabiilsus ja lenduvus, pH, lahustuvus vees, kui see on teada);
|
|
—
|
uuritava aine / kontrollaine töötlemine enne katset, kui see on asjakohane (nt soojendamine, peenestamine);
|
Kasutatud nahamudeli ja katse tegemise käigu põhjendus.
Katsetingimused:
|
—
|
rakkude eluvõimelisuse mõõtmiseks kasutatud mõõteriista (nt spektrofotomeetri) kaliibrimist käsitlev teave ja spektririba laius;
|
|
—
|
kogu täiendav teave kasutatud konkreetse nahamudeli ja selle tulemuslikkuse kohta. See hõlmab vähemalt järgmist:
|
ii)
|
toimimine kaitsekihina;
|
|
iv)
|
reprodutseeritavus ja ennustamisväärtus;
|
|
v)
|
mudeli kvaliteedi kontroll;
|
|
|
—
|
katsemetoodika üksikasjad;
|
|
—
|
määramisel kasutatud annused, kokkupuute kestus ja kokkupuutele järgnenud inkubatsiooniaeg;
|
|
—
|
kõikide katsemetoodikas tehtud muudatuste kirjeldus;
|
|
—
|
viide varasematele andmetele mudeli kohta. See hõlmab vähemalt järgmist:
|
i)
|
kvaliteedikontrolli andmete kehtivus, arvestades varasemaid partii andmeid;
|
|
ii)
|
positiivse ja negatiivse kontrolli väärtuste kehtivus, arvestades positiivse ja negatiivse kontrolli keskväärtusi ja vahemikke;
|
|
|
—
|
kasutatud hindamiskriteeriumide kirjeldus, sealhulgas ennustamismudelis kasutamiseks valitud piirväärtus(t)e valiku põhjendus.
|
Tulemused:
|
—
|
andmetabelid individuaalsete uuritud proovide kohta;
|
|
—
|
muude täheldatud toimete kirjeldus.
|
Tulemuste arutelu.
Järeldused.
4. KIRJANDUSVIITED
|
1)
|
United Nations (UN) (2007). Globally Harmonized System of Classification and Labelling of Chemicals (GHS), Second revised edition, UN New York and Geneva, 2007. Vaata: http://www.unece.org/trans/danger/publi/ghs/ghs_rev02/02files_e.html.
|
|
2)
|
REACH: Guidance on Information Requirements and Chemical Safety Assessment. Vaata: http://guidance.echa.europa.eu/docs/guidance_document/information_requirements_en.htm?time=1232447649.
|
|
3)
|
Katsemeetod B.4. ÄGE MÜRGISUS; NAHAÄRRITUS/-SÖÖVITUS.
|
|
4)
|
Katsemeetod B.40. NAHASÖÖVITUS IN VITRO: TRANSKUTAANSE ELEKTRITAKISTUSE (TER) MÕÕTMINE.
|
|
5)
|
Katsemeetod B.40 BIS. NAHASÖÖVITUS IN VITRO: KATSE INIMNAHA MUDELIGA.
|
|
6)
|
OECD (2006). Test Guideline 435. OECD Guideline for the Testing of Chemicals. In Vitro Membrane Barrier Test Method. Vastu võetud 19.7.2006. Vaata: http://www.oecd.org/document/22/0,2340,en_2649_34377_1916054_1_1_1_1,00.html.
|
|
7)
|
ECVAM (2009) Performance Standards for applying human skin models to in vitro skin irritation. Allalaaditav dokument, vaata: http://ecvam.jrc.ec.europa.eu.
|
|
8)
|
Fentem, J.H., Briggs, D., Chesné, C., Elliot, G.R., Harbell, J.W., Heylings, J.R., Portes, P., Roguet, R., van de Sandt, J.J.M. & Botham, P. (2001). A prevalidation study on in vitro tests for acute skin irritation. Results and evaluation by the Management Team. Toxicology in Vitro 15, 57–93.
|
|
9)
|
Portes, P., Grandidier, M.H., Cohen, C. & Roguet, R.(2002). Refinement of the EPISKIN protocol for the assessment of acute skin irritation of chemicals: follow-up to the ECVAM prevalidation study. Toxicology in Vitro 16, 765–770.
|
|
10)
|
Kandárová, H., Liebsch, M., Genschow, E., Gerner, I., Traue, D., Slawik, B. & Spielmann, H. (2004). Optimisation of the EpiDerm test protocol for the upcoming ECVAM validation study on in vitro skin irritation tests. ALTEX 21, 107–114.
|
|
11)
|
Kandárová, H., Liebsch, M., Gerner, I., Schmidt, E., Genschow, E., Traue, D. & Spielmann H. (2005) The EpiDerm Test Protocol fort the Upcoming ECVAM Validation Study on In Vitro Skin Irritation Tests – An Assessment of the Performance of the Optimised Test. ATLA 33, 351–367.
|
|
12)
|
Cotovio, J., Grandidier, M.–H., Portes, P., Roguet, R. & G. Rubinsteen. (2005). The In Vitro Acute Skin Irritation of Chemicals: Optimisation of the EPISKIN Prediction Model within the Framework of the ECVAM Validation Process. ATLA 33, 329–249.
|
|
13)
|
Zuang, V., Balls, M., Botham, P.A., Coquette, A., Corsini, E., Curren, R.D., Elliot, G.R., Fentem, J.H., Heylings, J.R., Liebsch, M., Medina, J., Roguet, R., van De Sandt, J.J.M., Wiemann, C. & Worth, A.(2002). Follow-up to the ECVAM prevalidation study on in vitro tests for acute skin irritation. ECVAM Skin Irritation Task Force Report 2. ATLA 30, 109–129.
|
|
14)
|
Spielmann, H., Hoffmann, S., Liebsch, M., Botham, P., Fentem, J., Eskes, C., Roguet, R., Cotovió, J., Cole, T., Worth, A., Heylings, J., Jones, P., Robles, C., Kandárová, H., Gamer, A., Remmele, M., Curren, R., Raabe, H., Cockshott, A., Gerner, I. and Zuang, V. (2007) The ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Report on the Validity of the EPISKIN and EpiDerm Assays and on the Skin Integrity Function Test. ATLA 35, 559–601.
|
|
15)
|
Hoffmann, S. (2006). ECVAM Skin Irritation Validation Study Phase II: Analysis of the Primary Endpoint MTT and the Secondary Endpoint IL1-α. 135 pp. + annexes. Allalaaditav dokument, vaata: http://ecvam.jrc.ec.europa.eu.
|
|
16)
|
Eskes, C., Cole, T., Hoffmann, S., Worth, A., Cockshott, A., Gerner, I. & Zuang. V (2007) ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Selection of Test Chemicals. ATLA 35, 603–619.
|
|
17)
|
J. Cotovio, M.–H. Grandidier, D. Lelièvre, R. Roguet, E. Tinois-Tessonneaud, J. Leclaire (2007). In vitro acute skin irritancy of chemicals using the validated EPISKIN model in a tiered strategy – Results and performances with 184 cosmetic ingredients, AATEX, Special Issue-proceedings from WC6. Vol.14, 351–358.
|
|
18)
|
ESAC statement on updated EpiDerm and similar SkinEthic assays. 5 November 2008.
|
|
19)
|
EÜ (2006). Euroopa Parlamendi ja nõukogu määrus (EÜ) nr 1907/2006, 18. detsember 2006, mis käsitleb kemikaalide registreerimist, hindamist, autoriseerimist ja piiramist (REACH) ja millega asutatakse Euroopa Kemikaaliamet ning muudetakse direktiivi 1999/45/EÜ ja tunnistatakse kehtetuks nõukogu määrus (EMÜ) nr 793/93, komisjoni määrus (EÜ) nr 1488/94 ning samuti nõukogu direktiiv 76/769/EMÜ ja komisjoni direktiivid 91/155/EMÜ, 93/67/EMÜ, 93/105/EÜ ja 2000/21/EÜ.
Euroopa Liidu Teataja L 396/1, 30.12.2006. OPOCE, Luxembourg.
|
|
20)
|
Mosman, T. (1983) Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods 65, 55–63.
|
|
21)
|
EpiSkin™ SOP, Version 1.6 (January 2005). Validation of the EpiSkin Skin Irritation Test – 42 Hours Assay For The Prediction of Acute Skin Irritation of Chemicals. Allalaaditav dokument, vaata: http://ecvam.jrc.ec.europa.eu.
|
|
22)
|
EpiDerm™ SOP, Version 5.0 (October 2004). Draft Standard Operating Procedure. In Vitro Skin Irritation Test: Human Skin Model. Model: EpiDerm™- 200. Allalaaditav dokument, vaata: http://ecvam.jrc.ec.europa.eu.
|
|
23)
|
SkinEthic RHE™ SOP. Avaldatakse allalaaditava dokumendina, vaata: http://ecvam.jrc.ec.europa.eu.
|
|
24)
|
Harvell, J.D., Lammintausta, K. Maibach H.I. (1995) Irritant contact dermatitis IN: Guin J.D. Practical Contact Dermatitis Mc Graw-Hill New York, pp 7–18.
|
|
25)
|
Griesinger C, Barroso J & Zuang V: ECVAM background document on the recent adaptations of the ECVAM performance standards for in vitro skin irritation testing in the context of the drafting process of an EU test method and an OECD draft test guideline. Ispra, November 13, 2008.
|
Liide
Nahaärrituse mudelkatseks kavandatud in vitro katse rekonstrueeritud inimepidermise mudeliga: tulemuslikkuse näitajate hindamine
SISSEJUHATUS
Käesoleva katsemeetodi alusel kasutamiseks kavandatud menetlusi tuleks hinnata, et määrata kindlaks nende usaldusväärsus ja täpsus kõikide ainete puhul, mis esindavad kogu Draize ärritavusskaalat. Kavandatud katsemenetlusel peaksid kõigi 20 soovitatud etalonainega (tabel 2) hindamisel olema usaldusväärsuse ja täpsuse näitajad, mis oleksid võrreldavad valideeritud standardmeetodi 1 näitajatega (tabel 3) (1). Punktides II ja III on esitatud usaldusväärsuse ja täpsuse normid, mis tuleks saavutada. Tabelis on klassifitseerimata ja klassifitseeritud (ÜRO GHS-süsteemi 2. kategooria) ained, mis esindavad asjaomaste keemiliste ühendite klasse, et kavandatud katsemeetodi usaldusväärsust ja tulemuslikkuse näitajaid (tundlikkus, spetsiifilisus, valenegatiivsete vastuste määr, valepositiivsete vastuste määr ja täpsus) saaks võrrelda valideeritud katsemeetodi 1 asjaomaste väärtustega. Katsemeetodi usaldusväärsust ja võimet õigesti kindlaks määrata ÜRO GHS-süsteemi 2. kategooria ärritavaid aineid tuleks kontrollida enne seda, kui meetodit kasutatakse uute ainete katsetamiseks.
TULEMUSLIKKUSE NÕUDED
Tulemuslikkuse nõuded hõlmavad kolme järgmist elementi: I) katsemeetodi olulised koostisosad, II) etalonained ja III) kindlaksmääratud täpsuse ja usaldusväärsuse väärtused (2). Kõnealused tulemuslikkuse nõuded põhinevad, pärast ECVAMi nahaärritavuse valideerimise uuringut kindlaksmääratud tulemuslikkuse nõuetel (3).
I. Katsemeetodi olulised koostisosad
Mudeli üldtingimused
Epiteelkoe ehitamiseks tuleb kasutada tavalisi inimese keratinotsüüte. Talitleva sarvkihi all peab olema mitu kihti (basaalkiht, ogakiht ja sõmerkiht) eluvõimelisi epiteelrakke. Sarvkiht peaks olema mitmekihiline ja vajaliku lipiidse koostisega, et tekiks sellise tugevusega funktsionaalne kaitsekiht, mis suudab takistada tsütotoksiliste markerainete, nagu SDSi või Triton X-100 kiiret läbitungimist. Nimetatud kaitsekihina toimimist saab hinnata kas sellise kontsentratsiooni määramisega, mille juures markeraine vähendab koe eluvõimelisust 50 % võrra (IC50) pärast kindlaksmääratud kokkupuuteaega, või sellise kokkupuuteaja määramisega, mille juures markeraine vähendab koe eluvõimelisust 50 % võrra (ET50) teatava kindla kontsentratsiooni juures. Mudel peab olema selline, et aine ei saaks tungida eluskudedesse sarvkihist mööda minnes, vastasel korral ei oleks tegemist naha ja keemilise aine kokkupuute õige mudeliga. Nahamudel ei tohi olla saastunud bakterite, viiruste, mükoplasma ega seentega.
Mudeli funktsionaalsed tingimused
Eluvõimelisus
Eluvõimelisuse määramiseks kasutatakse eelistatult värvainet MTT (4). Negatiivse kontrolliga töödeldud koest ekstraheeritud (lahustatud) värvaine optiline tihedus peab olema vähemalt 20 korda suurem kui ekstraheerimislahusti optiline tihedus. Peaks olema tõendatud, et negatiivse kontrolliga töödeldud kude on kultuuris stabiilne (võimaldab saada sarnaseid elujõulisuse mõõtmistulemusi) katses kasutatava kokkupuuteaja jooksul.
Toimimine kaitsekihina
Sarvkiht ja selle lipiidne koostis peavad olema piisavad, et takistada tsütotoksiliste markerainete, nagu SDSi või Triton X-100 kiiret läbitungimist; seda hinnatakse IC50 või ET50 abil.
Morfoloogia
Vajaliku ettevalmistusega töötajad peavad tegema rekonstrueeritud naha/epidermise histoloogilise uuringu, mis peaks näitama, et on saadud inimnaha/epidermisega sarnane struktuur (kaasa arvatud mitmekihiline sarvkiht).
Reprodutseeritavus
Konkreetse mudeli kasutamise korral peaks meetod andma ajas reprodutseeritavaid tulemusi, kusjuures partii kontrollimiseks kasutatakse eelistatavalt mingit sobivat (võrdlus)ainet (vt mõisted punktis 1.2).
Mudeli kvaliteedi kontroll
Epidermisemudeli iga partii peaks vastama teatavatele kindlatele toote kvaliteedi kontrolli kriteeriumidele; kõige tähtsamad nendest on eluvõimelisus ja toimimine kaitsekihina. Nahamudeli tootja (või katse läbiviija, kui ta kasutab omatehtud mudelit) peaks kindlaks määrama IC50 või ET50 lubatava vahemiku (ülem- ja alampiiri). Kudede kaitsekihiomadusi tuleks laboris pärast kudede saamist kontrollida. Nahaärrituse põhjustamise usaldusväärseks ennustamiseks saab kasutada ainult sobivate omadustega kudede abil saadud tulemusi. Järgmises tabelis on näitena esitatud valideeritud standardmeetodite puhul lubatavad vahemikud.
Tabel 1
Partii kvaliteedi kontrollimise kriteeriumide näited
|
|
Lubatav alampiir
|
Lubatava vahemiku keskväärtus
|
Lubatav ülempiir
|
|
Valideeritud standardmeetod 1 (18-tunnine töötlus SDSga)
|
IC50 = 1,0 mg/ml
|
IC50 = 2,32 mg/ml
|
IC50 = 3,0 mg/ml
|
|
Valideeritud standardmeetod 2 (1 % Triton X-100)
|
ET50 = 4,8 h
|
ET50 = 6,7 h
|
ET50 = 8,7 h
|
II. Etalonained
Etalonaineid kasutatakse selleks, et teha kindlaks, kas rekonstrueeritud inimepidermisel põhinev uus kavandatud in vitro katsemeetod, mis on nii oma ülesehituse kui põhimõtte poolest üsna sarnane valideeritud standardmeetodiga või kujutab endast üksnes viimase väikest modifikatsiooni, annab sama usaldusväärseid ja täpseid tulemusi ja on samade tulemuslikkuse näitajatega kui valideeritud standardmeetod 1 (1). Tabelis 2 loetletud 20 etalonainet esindavad erinevaid huvipakkuvaid aineklasse ja ÜRO GHS-süsteemi 2. kategooria aineid. Loetelus olevatest ainetest kümme kuuluvad ÜRO GHS-süsteemi 2. kategooria ainete hulka, kolm ainet on sama süsteemi 3. valikkategooria ained ja seitse on klassifitseerimata ained. Käesoleva katsemeetodi kohaselt käsitatakse 3. valikkategooriat kategooria puudumisena. Etalonained on vähimalt nõutav arv aineid, mida tuleks kasutada selleks, et hinnata, kuivõrd usaldusväärseid ja täpseid tulemusi annab nahaärrituse määramiseks kavandatud uus in vitro katsemeetod, milles kasutatakse rekonstrueeritud inimepidermist. Kui mõnda loetletud ainet ei ole saada, võib kasutada muid aineid, mille kohta in vivo katsega on määratud piisavad võrdlusandmed. Soovi korral võib etalonainetele miinimumloendisse lisada kavandatud katsemeetodi täpsuse hindamiseks muid aineid, mis esindavad teisi aineklasse ja mille kohta on in vivo katsega määratud piisavad võrdlusandmed.
Tabel 2
Etalonained rekonstrueeritud inimepidermise mudelitega saadud tulemuste täpsuse ja usaldusväärsuse näitajate määramiseks
|
Aine (1)
|
CASi nr
|
EINECSi nr
|
Füüsikaline olek
|
Tulemus in vivo
|
GHS in vitro kat.
|
GHS in vivo kat.
|
|
1-bromo-4-klorobutaan
|
6940–78–9
|
230–089–3
|
vedelik
|
0
|
2. kat.
|
kat-ta
|
|
dietüülftalaat
|
84–66–2
|
201–550–6
|
vedelik
|
0
|
kat-ta
|
kat-ta
|
|
naftüüläädikhape
|
86–87–3
|
201–705–8
|
tahke
|
0
|
kat-ta
|
kat-ta
|
|
allüülfenoksüatsetaat
|
7493–74–5
|
231–335–2
|
vedelik
|
0,3
|
kat-ta
|
kat-ta
|
|
isopropanool
|
67–63–0
|
200–661–7
|
vedelik
|
0,3
|
kat-ta
|
kat-ta
|
|
4-metüültiobensaldehüüd
|
3446–89–7
|
222–365–7
|
vedelik
|
1
|
2. kat.
|
kat-ta
|
|
metüülstearaat
|
112–61–8
|
203–990–4
|
tahke
|
1
|
kat-ta
|
kat-ta
|
|
heptüülbutüraat
|
5870–93–9
|
227–526–5
|
vedelik
|
1,7
|
kat-ta
|
3. valikkat.
|
|
heksüülsalitsülaat
|
6259–76–3
|
228–408–6
|
vedelik
|
2
|
kat-ta
|
3. valikkat.
|
|
tri-isobutüülfosfaat
|
126–71–6
|
204–798–3
|
vedelik
|
2
|
2. kat.
|
3. valikkat.
|
|
1-dekanool
|
112–30–1
|
203–956–9
|
vedelik
|
2,3
|
2. kat.
|
2. kat.
|
|
3-p-kumenüül-2-metüülpropioonaldehüüd
|
103–95–7
|
203–161–7
|
vedelik
|
2,3
|
2. kat.
|
2. kat.
|
|
1-bromoheksaan
|
111–25–1
|
203–850–2
|
vedelik
|
2,7
|
2. kat.
|
2. kat.
|
|
2-klorometüül-3,5-dimetüül-4-metoksüpüridiinvesinikkloriid
|
86604–75–3
|
434–680–9
|
tahke
|
2,7
|
2. kat.
|
2. kat.
|
|
a-terpineool
|
98–55–5
|
202–680–6
|
vedelik
|
2,7
|
2. kat.
|
2. kat.
|
|
di-n-propüüldisulfiid
|
629–19–6
|
211–079–8
|
vedelik
|
3
|
kat-ta
|
2. kat.
|
|
butüülmetakrülaat
|
97–88–1
|
202–615–1
|
vedelik
|
3
|
2. kat.
|
2. kat.
|
|
5–(1,1-dimetüületüül)-2-metüülbenseentiool
|
7340–90–1
|
438–520–9
|
vedelik
|
3,3
|
2. kat.
|
2. kat.
|
|
1-metüül-3-fenüül-1-piperasiin
|
5271–27–2
|
431–180–2
|
tahke
|
3,3
|
2. kat.
|
2. kat.
|
|
heptanaal
|
111–71–7
|
203–898–4
|
vedelik
|
4
|
2. kat.
|
2. kat.
|
Tabelis 2 loetletud ainete jaotus ECVAMi nahaärritavuse valideerimise rahvusvahelises uuringus (1) kasutatud 58 aine hulgas on esindav. Nende valimine põhineb järgmistel kriteeriumidel:
|
—
|
ained esindavad kogu Draize ärritavusskaalat (mitteärritavatest ainetest kuni tugevat ärritust põhjustavate aineteni);
|
|
—
|
nende kõigi keemiline ehitus on hästi teada;
|
|
—
|
nad esindavad valideeritud meetodi reprodutseeritavust ja ennustusvõimet, mis määrati kindlaks ECVAMi valideerimisuuringuga;
|
|
—
|
nad esindavad samu keemiliste ainete klasse, mida kasutati valideerimisel;
|
|
—
|
nad ei ole äärmiselt mürgised (näiteks kantserogeensed või viljakust kahjustavad) ja nende kõrvaldamine ei ole seotud ülemääraste kuludega.
|
III. Täpsuse ja usaldusväärsuse kindlaksmääratud väärtused
Kavandatud katsemeetodi tulemuslikkuse näitajad (tundlikkus, spetsiifilisus, valenegatiivsete vastuste määr, valepositiivsete vastuste määr ja täpsus) peaksid olema võrreldavad valideeritud standardmeetodi 1 asjaomaste väärtustega (tabel 3), st tundlikkus peaks olema vähemalt (≥) 80 %, spetsiifilisus peaks olema vähemalt (≥) 70 % ja täpsus peaks olema vähemalt (≥) 75 %. Tulemuslikkuse näitajate arvutamisel tuleks kasutada kõiki klassifitseerimistulemusi, mis saadakse nimetatud 20 ainega kõikides osalevates laborites. Iga aine klassifitseerimine igas laboris peaks põhinema eri katsetes (vähemalt kolm kehtivat paralleelkatset) määratud eluvõimelisuse keskväärtusel.
Tabel 3
Valideeritud standardmeetodi 1 (2) tulemusnäitajad
|
Katsemeetod
|
Ainete arv
|
Tundlikkus
|
Spetsiifilisus
|
Valenegatiivsete vastuste määr
|
Valepositiivsete vastuste määr
|
Täpsus
|
|
Valideeritud standardmeetod 1 (3)
|
58
|
87,2 % (4)
|
71,1 % (5)
|
12,8 %
|
29,9 %
|
74,7 %
|
|
Valideeritud standardmeetod 1 (3)
|
20
|
90 %
|
73,3 %
|
10 %
|
26,7 %
|
81,7 %
|
Kavandatud katsemeetodi usaldusväärsus peaks olema võrreldav valideeritud katsemeetodite usaldusväärsusega.
Laborisisene reprodutseeritavus
Laborisisese varieeruvuse hinnang peaks näitama, et klassifitseerimistulemused (2. kategooria või ilma kategooriata), mis on saadud eraldi sõltumatutel määramistel 20 etalonainega ühes laboris, on omavahel kooskõlas vähemalt (≥) 90 % juhtudest.
Laboritevaheline reprodutseeritavus
Laboritevahelise reprodutseeritavuse hindamine ei ole oluline, kui kavandatud katsemeetodit kavatsetakse kasutada ainult ühes laboris. Kui meetodit tahetakse anda edasi teistesse laboritesse, peaks laboritevahelise varieeruvuse hinnang näitama, et klassifitseerimistulemused (2. kategooria või ilma kategooriata), mis on saadud eraldi sõltumatutel määramistel 20 etalonainega eelistatavalt vähemalt kolmes laboris, on omavahel kooskõlas vähemalt (≥) 80 % juhtudest.
KIRJANDUSVIITED
|
1)
|
Spielmann, H., Hoffmann, S., Liebsch, M., Botham, P., Fentem, J., Eskes, C., Roguet, R., Cotovió, J., Cole, T., Worth, A., Heylings, J., Jones, P., Robles, C., Kandárová, H., Gamer, A., Remmele, M., Curren, R., Raabe, H., Cockshott, A., Gerner, I. and Zuang, V. (2007) The ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Report on the Validity of the EPISKIN and EpiDerm Assays and on the Skin Integrity Function Test. ATLA 35, 559–601.
|
|
2)
|
OECD (2005) Guidance Document No. 34 on the validation and international acceptance of new or updated test methods for hazard assessment. OECD, Paris.
|
|
3)
|
ECVAM (2007) Performance Standards for applying human skin models to in vitro skin irritation. Allalaaditav dokument, vt http://ecvam.jrc.ec.europa.eu. Kasutatud: 27.10.2008.
|
|
4)
|
Mosman, T. (1983) Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods 65, 55–63.
|
|
5)
|
Eskes, C., Cole, T., Hoffmann, S., Worth, A., Cockshott, A., Gerner, I. & Zuang. V (2007) ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Selection of Test Chemicals. ATLA 35, 603–619.
|
(1) Esitatud 20 etalonaine puhul on tegemist esindava valikuga nende 58 aine hulgast, mida kasutati standardmeetodi 1 (EpiSkin™) algseks valideerimiseks. Uuritavate ainete täielik loetelu ja nende valimise kriteeriumid on esitatud kirjandusviites 5.
(2) Tabelis 3 on esitatud valideeritud standardmeetodi 1 tulemusnäitajad, mis kirjeldavad meetodi võimet korrektselt kindlaks määrata ärritavaid aineid (ÜRO GHS-süsteemi 2. kategooria) ja klassifitseerimata aineid (millele ei ole omistatud kategooriat; klassifitseerimata ainete hulka arvestatakse ka 3. valikkategooria ained) vastavalt 58 ja 20 etalonaine puhul (tabel 2).
(3) EpiSkin™
(4) Põhinevad 13 GHS-süsteemi 2. kategooria ärritaval ainel.
(5) Põhinevad 45 ainel, mis kuuluvad kas GHS-süsteemi 3. kategooria ärritavate ainete või GHS-süsteemi kategooriata ainete hulka.
IV LISA
|
C.3.
|
MAGEVEEVETIKATE JA TSÜANOBAKTERITE KASVU PIDURDAMISE KATSE
|
1. METOODIKA
Käesolev metoodika on samaväärne standardiga OECD TG 201 (2006) (1).
1.1. SISSEJUHATUS
Metoodikaid on vaja teaduse arengut arvestades korrapäraselt läbi vaadata ja ajakohastada. Metoodika C.3 vajas läbivaatamist, et lisada täiendavaid liike ja viia see vastavusse ohu hindamise nõuetega ning kemikaalide klassifikatsiooniga. Läbivaatamisel võeti aluseks laialdased praktilised kogemused, teaduse edusammud vetikatele toksiliste ainete uurimisel ja asjaomaste õigusaktide laialdane rakendamine pärast esialgse metoodika kasutuselevõttu.
1.2. MÕISTED
Käesoleva metoodikaga seoses kasutatakse järgmisi mõisteid ja lühendeid.
Biomass on populatsiooni elusaine kuivmass teatava mahuühiku kohta, nt vetikate kuivmass milligrammides ühe liitri katselahuse kohta. Tavaliselt tähendab „biomass” lihtsalt massi, kuid käesoleva metoodika tähenduses on see mass mahuühiku kohta. Käesoleva meetodi kasutamisel mõõdetakse harilikult biomassi asendavaid näitajaid, nagu rakkude arv, fluorestsents jne; sellisel juhul mõistetakse termini „biomass” all ka kõnesolevaid asendusnäitajaid.
Variatsioonikordaja on suhteline (mõõtühikuta) näitaja, mis iseloomustab parameetri varieeruvust ja võrdub standardhälbe ja keskväärtuse suhtega. Seda võib väljendada ka protsentides. Paralleelsete kontrollkultuuride kasvu keskmise erikiiruse keskmine variatsioonikordaja arvutatakse järgmiselt:
|
1.
|
ööpäevade ja/või lõikude kaupa leitud kasvukiiruste põhjal arvutatakse asjaomase paralleelkultuuri kasvu keskmise erikiiruse variatsioonikordaja protsentides;
|
|
2.
|
paralleelsete kontrollkultuuride ööpäevade/lõikude kaupa mõõdetud kasvu keskmise erikiiruse keskmise variatsioonikordaja leidmiseks arvutatakse 1. punkti kohaselt leitud väärtuste keskmine.
|
ECx
on katsekeskkonnas lahustatud uuritava aine kontsentratsioon, mille puhul katseorganismi kasv pidurdub x % (nt 50 %) võrra, kui see organism puutub ainega kokku kindlaksmääratud ajavahemiku jooksul (kui kokkupuuteaeg erineb täielikust ehk tavaliselt katsetes kasutatavast kokkupuuteajast, tuleb selle pikkus täpselt märkida). Kasvukiiruse järgi ja saagise järgi leitavate EC väärtuste eristamiseks kasutatakse vastavalt tähiseid ErC ja EyC.
Sööde on täielik sünteetiline keskkond, milles katsevetikaid kasvatatakse uuritava ainega kokkupuutumise ajal. Tavaliselt lahustatakse uuritav aine katsekeskkonnas.
Kasvukiirus (keskmine kasvu erikiirus) on biomassi logaritmiline suurenemine kokkupuute ajal.
Madalaim avastatava mõjuga kontsentratsioon on madalaim uuritud kontsentratsioon, mille puhul on näidatud, et teatava kokkupuuteaja jooksul pidurdab uuritav aine kontrolliga võrreldes statistiliselt oluliselt (p < 0,05) katseorganismi kasvu. Kõik madalaimast avastatava mõjuga kontsentratsioonist kõrgemad kontsentratsioonid peavad avaldama sama tugevat või tugevamat kahjulikku mõju kui madalaim avastatava mõjuga kontsentratsioon. Kui neid kahte tingimust ei ole võimalik täita, tuleb anda täielik selgitus, kuidas valiti madalaim avastatava mõjuga kontsentratsioon (ja avastatava mõjuta kontsentratsioon).
Avastatava mõjuta kontsentratsioon on madalaimast avastatava mõjuga kontsentratsioonist allapoole järgmine uuritud kontsentratsioon.
Kostemuutuja on toksilisuse hindamiseks kasutatav muutuja, mis tuletatakse biomassi kajastavast mõõtemuutujast mitmesuguste arvutuste abil. Käesoleva metoodika tähenduses on kostemuutujateks kasvukiirus ja saagis, mis tuletatakse biomassi otsese mõõtmise andmetest või eespool mainitud asendusnäitajate mõõtmisest.
Kasvu erikiirus on kostemuutuja, mis määratletakse jagatisena, mille lugejaks on uuritava parameetri (käesoleva metoodika puhul biomassi) väärtuste naturaallogaritmide vahe ja nimetajaks asjaomane ajavahemik.
Saagis on kokkupuuteaja lõpus ja alguses leitud mõõdetava muutuja väärtuste vahe, mis väljendab katse jooksul toimunud biomassi kasvu.
1.3. MEETODI RAKENDATAVUS
Käesolevat meetodit on kõige lihtsam rakendada vees lahustuvate ainete puhul, mis katsetingimustes tõenäoliselt püsivad vesilahuses. Kui uuritav aine on lenduv, seostub tugevasti pindadega, on värviline või vees vähelahustuv või võib mõjutada söötme toit- või mineraalainete kättesaadavust, siis võib kirjeldatud määramismeetodis olla vaja teha teatavaid muudatusi (nt kasutada suletud süsteemi, valmistada katsenõusid eelnevalt spetsiaalselt ette). Juhendid teatavate vajalike muudatuste tegemiseks on esitatud standardites (2, 3, 4).
1.4. KATSE PÕHIMÕTE
Katse eesmärk on määrata uuritava aine mõju magevee-mikrovetikate ja/või tsüanobakterite kasvule. Portskultuuris lastakse eksponentsiaalse kasvu faasis olevatel katseorganismidel uuritava ainega kokku puutuda tavaliselt 72 tunni jooksul. Vaatamata suhteliselt lühikesele katseajale võimaldab see hinnata, millist mõju avaldab uuritava ainega kokkupuutumine mitme põlvkonna vältel.
Katsesüsteemi koste on vetikakultuuri seeriate (katseüksused) kasvu pidurdumine kokkupuutumisel uuritava aine mitmesuguste kontsentratsioonidega. Katsesüsteemi koste hindamiseks uuritakse kasvu sõltuvust aine kontsentratsioonist ja võrreldakse seda keskmise kasvuga paralleelsetes kontrollkultuurides, kuhu uuritavat ainet ei ole lisatud. Et süsteemi koste toksilisele mõjule täielikult avalduks (optimaalne tundlikkus), lastakse kultuuridel küllaldase aja jooksul piiramatult eksponentsiaalselt kasvada piisava toitainete sisalduse ja pideva valguse tingimustes, et mõõta kasvu erikiiruse vähenemist.
Kasvu ja kasvu pidurdamise kvantitatiivseks iseloomustamiseks mõõdetakse vetikate biomassi sõltuvust ajast. Vetikate biomass on määratletud kuivmassina ruumala kohta, nt milligrammides ühe liitri katselahuse kohta. Kuna kuivmassi on raske mõõta, kasutatakse asendusparameetreid. Asendusparameetritest kasutatakse kõige rohkem rakkude arvu. Asendusparameetriteks võivad olla veel rakkude maht, fluorestsents, optiline tihedus jne. On vaja teada kordajat, mille abil saab mõõdetava asendusparameetri arvutada ümber biomassiks.
Katsetulem on kasvu pidurdumine, kusjuures kasvu väljendatakse biomassi logaritmi suurenemisena kokkupuuteaja jooksul (keskmine kasvu erikiirus). Katselahuste seerias määratud keskmistest kasvu erikiirustest leitakse kontsentratsioon, mis vähendab kasvukiirust teatava protsendimäära x võrra (näiteks 50 %); selle kontsentratsiooni tähis on ErCx (nt ErC50).
Kui käesolevat meetodit rakendatakse ELi õigusraamistikus, peaksid tulemuste arvutused punktis 2.2 kirjeldatud põhjusi arvestades põhinema kasvu keskmisel erikiirusel. Lisaks kasutatakse käesoleva meetodi korral kostemuutujana veel saagist, mida võib vaja olla teatavates riikides kehtestatud erieeskirjade täitmiseks. Saagis on määratletud kokkupuuteaja lõpus ja alguses olevate biomasside vahena. Katselahuste seerias määratud saagiste põhjal leitakse kontsentratsioon, mis vähendab saagist teatava protsendimäära x võrra (näiteks 50 %); selle tähis on EyCx (nt EyC50).
Lisaks sellele võib statistiliselt määrata madalaima avastatava mõjuga kontsentratsiooni ja ka avastatava mõjuta kontsentratsiooni.
1.5. ANDMED UURITAVA AINE KOHTA
Katsetingimuste kindlaksmääramiseks võib uuritava aine kohta olla vaja teada järgmisi andmeid: struktuurivalem, puhtusaste, püsivus valguse käes, püsivus katsetingimustes, valguse neeldumisega seotud omadused, pKa ja andmed aine muundumiste kohta, sealhulgas biolagunduvus vees.
On vaja teada uuritava aine lahustuvust vees, jaotuskoefitsienti oktanooli-vee süsteemis (Pow) ja aururõhku; katselahuses oleva aine kontsentratsiooni mõõtmiseks peaks olema valideeritud meetod, mille kohta oleksid teada tulemuslikkus ja määramispiir.
1.6. STANDARDAINE
Katse teostuse kontrollimiseks võib kasutada rahvusvahelistes võrdluskatsetes (4) kasutatavaid standardaineid, näiteks 3,5-diklorofenooli. Rohevetikate puhul võib standardainena kasutada ka kaaliumdikromaati. Kontrolli standardainega soovitatakse teha vähemalt kaks korda aastas.
1.7. KATSE VASTAVUS NÕUETELE
Katse on läbi viidud nõuetekohaselt, kui on täidetud järgmised kriteeriumid.
|
—
|
Kontrollkultuuri biomass peab 72-tunnise katseaja jooksul olema eksponentsiaalselt suurenenud vähemalt 16 korda. See vastab kasvu erikiirusele 0,92 ööpäev–1. Kõige sagedamini kasutatavate liikide puhul on kasvukiirus tavaliselt palju suurem (vt 1. liide). See kriteerium ei pea olema täidetud, kui kasutatakse 1. liites loetletud liikidest aeglasemalt kasvavaid liike. Sellisel juhul tuleb katseaega pikendada, nii et kontrollkultuuri biomass kasvaks vähemalt 16-kordseks, kusjuures kasv peab kogu katse ajal olema eksponentsiaalne. Kui piiramatu eksponentsiaalse kasvu tingimustes saavutatakse biomassi nõutav 16-kordne kasv lühema ajaga, võib katseaega lühendada 48 tunnini.
|
|
—
|
Lõikude kaupa (72-tunnise katse puhul katsepäevad 0–1, 1–2 ja 2–3) leitud kontrollkultuuride kasvu erikiiruste keskmine variatsioonikordaja (vt punkt 1.2, variatsioonikordaja) ei tohi ületada 35 %. Kontrollkultuuride kasvu erikiiruste lõikude kaupa arvutamise kohta vt punkt 2.2.1, teine lõik. Seda kriteeriumi rakendatakse paralleelsete kontrollkultuuride puhul arvutatud variatsioonikordaja keskmise väärtuse suhtes.
|
|
—
|
Katsetes Pseudokirchneriella subcapitata ja Desmodesmus subspicatus’ega ei tohi paralleelsete kontrollkultuuride keskmiste kasvu erikiiruste variatsioonikordaja kogu katseaja jooksul ületada 7 %. Harvemini kasutatavate liikide korral ei tohi see väärtus ületada 10 %.
|
1.8. MEETODI KIRJELDUS
1.8.1. Seadmed
Katselahusega kokku puutuvad katsenõud ja muud seadmed peavad olema tervenisti klaasist või muust keemiliselt inertsest materjalist. Seadmed peavad olema hoolikalt pestud, et orgaanilised või anorgaanilised lisandid ei mõjutaks vetikate kasvu või katselahuse koostist.
Katse viiakse tavaliselt läbi klaaskolvis, mis on piisavalt suur, et katse ajal saaks mõõtmisteks võtta küllaldases mahus kultuuri, ja oleks tagatud piisav CO2 massiülekanne atmosfäärist (vt punkt 1.8.9, teine lõik). Tuleb silmas pidada, et vedeliku maht oleks küllaldane analüüside tegemiseks (vt punkt 1.8.11, viies lõik).
Lisaks sellele võib vaja minna järgmisi seadmeid.
|
—
|
Kultiveerimisseade: soovitatav on kasutada kappi või kambrit, milles inkubatsioonitemperatuuri hoitakse täpsusega ±2 °C.
|
|
—
|
Fotomeetrid: on oluline silmas pidada, et valgustatuse mõõtmise meetod ja eriti vastuvõtja (kollektori) tüüp mõjutavad mõõdetavat väärtust. Mõõtmiseks kasutatakse eelistatavalt sfäärilist (4π) vastuvõtjat (reageerib igast suunast, nii ülalt- kui ka altpoolt mõõtetasapinda saabuvale otsesele ja peegeldunud valgusele) või poolsfäärilist (2π) vastuvõtjat (reageerib igast suunast ülaltpoolt mõõtetasapinda saabuvale valgusele).
|
|
—
|
Seade vetikate biomassi määramiseks. Rakkude arvu, mis on kõige sagedamini kasutatav vetikate biomassi asendusparameeter, võib määrata elektroonilise osakesteloenduri, loenduskambriga varustatud mikroskoobi või läbivoolutsütomeetri abil. Muid biomassi asendusparameetreid võib mõõta läbivoolutsütomeetri, fluorimeetri, spektrofotomeetri või kolorimeetri abil. On kasulik arvutada ümberarvutustegur üleminekuks rakkude arvult kuivmassile. Kui madalatel biomassi kontsentratsioonidel kasutatakse spektrofotomeetrit, võib kasutuskõlblike mõõtmistulemuste saamiseks olla vaja küvette, mille optilise tee pikkus on vähemalt 4 cm.
|
1.8.2. Katseorganismid
Võib kasutada mitmeid vabalt ujuvate mikrovetikate ja tsüanobakterite liike. On näidatud, et käesolevas metoodikas esitatud määramismeetodi korral sobivad kasutamiseks 1. liites loetletud tüved.
Kui kasutatakse muid liike, tuleb märkida kasutatud tüvi ja/või selle päritolu. Tuleb tõendada, et valitud katsevetikate kasv on kasutatavates tingimustes kogu katseaja kestel eksponentsiaalne.
1.8.3. Sööde
Soovitatakse kasutada kas OECD või AAP söödet. Nende söötmete koostis on esitatud 2. liites. Tuleb silmas pidada, et nende söötmete pH algväärtused ja puhvermahtuvused (viimane kompenseerib pH tõusu) on erinevad. Seetõttu võivad katse tulemused sõltuda kasutatud söötmest, eriti kui uuritakse ioniseeruva aine mõju.
Teatavatel juhtudel, näiteks metallide ja kelaaditekitajate uurimise korral või katsetel erineva pH väärtuse juures, võib olla vaja söödet muuta. Muudetud söötme kasutamist tuleb üksikasjalikult kirjeldada ja põhjendada (3, 4).
1.8.4. Biomassi algkontsentratsioon
Biomassi algkontsentratsioon peab kõigis uuritava ainega kultuurides olema sama ja piisavalt madal, et kasv püsiks kogu inkubatsiooniaja kestel eksponentsiaalne ja ei tekiks toitainete ammendumise ohtu. Biomassi kuivaine algkontsentratsioon ei tohi olla kõrgem kui 0,5 mg/l. Soovitatakse kasutada järgmisi rakkude algkontsentratsioone:
|
Pseudokirchneriella subcapitata
|
5 × 103–104
|
rakku/ml
|
|
Desmodesmus subspicatus
|
2–5 × 103
|
rakku/ml
|
|
Navicula pelliculosa
|
104
|
rakku/ml
|
|
Anabaena flos-aquae
|
104
|
rakku/ml
|
|
Synechococcus leopoliensis
|
5 × 104–105
|
rakku/ml
|
1.8.5. Uuritava aine kontsentratsioon
Kontsentratsioonivahemiku, milles mõju tõenäoliselt avaldub, võib määrata mõjuvahemiku hindamise katsete tulemuste alusel. Lõpliku katse tegemisel kasutatakse vähemalt viit geomeetrilise jadana järjestatud kontsentratsiooni, kus jadategur ei ole suurem kui 3,2. Laugema kontsentratsiooni-mõju kõvera korral võib olla õigustatud suurema jadateguri kasutamine. Eelistatavalt peaks kontsentratsioonide jada hõlmama vahemiku, milles vetikate kasvukiirus pidurdub 5–75 % võrra.
1.8.6. Paralleel- ja kontrollkultuurid
Katseplaanis tuleb ette näha kolm paralleelkultuuri iga uuritava kontsentratsiooni kohta. Kui avastatava mõjuta kontsentratsiooni määramist ei nõuta, võib katseplaani muuta selliselt, et suurendatakse uuritavate kontsentratsioonide arvu ja vähendatakse paralleelkultuuride arvu ühe kontsentratsiooni kohta. Paralleelseid kontrollkultuure peab olema vähemalt kolm ja parimal juhul võiks neid olla kaks korda rohkem kui iga uuritava kontsentratsiooni puhul kasutatavaid paralleelkultuure.
Uuritava aine kontsentratsioonide määramiseks võib valmistada eraldi katselahuste seeria (vt punkt 1.8.11, neljas ja kuues lõik).
Kui uuritava aine lahustamiseks kasutatakse lahustit, tuleb katseplaanis ette näha täiendavad kontrollkultuurid, millele on lisatud lahustit samas kontsentratsioonis kui uuritava ainega kultuuridele.
1.8.7. Inokulum-kultuuri valmistamine
Harjutamaks katsevetikaid katsetingimustega ja tagamaks, et katselahuse inokuleerimisel on vetikad eksponentsiaalse kasvu faasis, valmistatakse katsekeskkonnas 2–4 päeva enne katse algust inokulum-kultuur. Vetikate biomass reguleeritakse nii, et inokulum-kultuuris oleks enne katse algust ülekaalus eksponentsiaalne kasv. Inokulum-kultuuri inkubeeritakse samades tingimustes kui uuritava ainega kultuure. Veendumaks, et katsetüvi kasvab kultiveerimistingimustes normaalselt, mõõdetakse inokulum-kultuuris biomassi juurdekasvu. 3. liites on esitatud ühe vetikate kultiveerimise katse näide. Rakkude sünkroonse pooldumise vältimiseks katse ajal võib olla vajalik inokulum-kultuuri teistkordne ülekandmise etapp.
1.8.8. Katselahuste valmistamine
Kõigis katselahustes peab söötme kontsentratsioon ja katsevetikate biomassi algkontsentratsioon olema ühesugune. Valitud kontsentratsiooniga katselahuste valmistamiseks segatakse tavaliselt uuritava aine põhilahus söötme ja inokulum-kultuuriga. Põhilahuse saamiseks lahustatakse uuritav aine tavaliselt söötmes.
Vees raskesti lahustuvate ainete lisamiseks söötmele võib kasutada lahusteid, näiteks atsetooni, t-butüülalkoholi või dimetüülformamiidi (2, 3). Lahusti kontsentratsioon ei tohi olla kõrgem kui 100 µl/l ja peab olema sama kõigis katseseeria kultuurides, kaasa arvatud kontrollkultuurid.
1.8.9. Inkubeerimine
Katsenõud suletakse õhku läbi laskvate korkidega. Nõusid loksutatakse ja need asetatakse kultiveerimisseadmesse. Katse ajal on vetikaid vaja hoida suspensioonis ja soodustada CO2 transporti. Selleks loksutatakse või segatakse kultuure pidevalt. Kultuure termostateeritakse temperatuurivahemikus 21–24 °C täpsusega ±2 °C. Kui kasutatakse 1. liites loetlemata liike (nt troopilised liigid), võib olla vaja valida kõrgem temperatuur, kuid nõuetele vastavuse kriteeriumid peavad olema täidetud. On soovitav paigutada kolvid inkubaatoris juhuslikult ja muuta iga päev nende paigutust.
Katse ajal ei tohi kontrollkeskkonna pH tõusta enam kui 1,5 ühiku võrra. Kui uuritakse metalle või ühendeid, mis katsekeskkonna pH väärtustel on osaliselt ioniseeritud, võib reprodutseeritavate ja selgete tulemuste saamiseks olla vaja piirata pH muutumist. Tehniliselt on võimalik saavutada, et pH muutuks vähem kui 0,5 ühikut, kui tagada, näiteks loksutamiskiiruse suurendamisega, piisavalt kiire CO2 ülekanne atmosfääriõhust katselahusesse. Teine võimalus on vähendada CO2 tarvet, vähendades algset biomassi või katse kestust.
Pinnale, millel inkubeeritakse kultuure, suunatakse pidev ühtlane külmvalge või päevavalgusspektriga fluorestsentsvalgus. Vetikate ja tsüanobakterite tüvede valgusetarve on erinev. Valguse intensiivsus valitakse vastavalt kasutatava katseorganismi vajadusele. Soovitatud rohevetikaliikide puhul valitakse valguse intensiivsuseks katselahuste tasapinnal 60–120 µEm–2s–1, mõõdetuna sobiva anduri abil fotosünteesiks sobivas lainepikkuse vahemikus 400–700 nm. Mõni liik, eriti Anabaena flos-aquae, kasvab hästi nõrgema valguse juures ja liigne valgus võib teda kahjustada. Sellise liigi puhul valitakse keskmiseks valguse intensiivsuseks 40–60 µEm–2s–1. (Luksides kalibreeritud fotomeetri puhul vastab külmvalge valguse soovitatud valgustatuse vahemikule 60–120 µEm–2s–1 vahemik 4 440 – 8 880 luksi). Valguse intensiivsus inkubatsiooniala eri osades ei tohi keskmisest väärtusest erineda üle 15 %.
1.8.10. Katse kestus
Katse kestab harilikult 72 tundi. Võib siiski kasutada ka lühema või pikema kestusega katseid tingimusel, et kõiki nõuetele vastavuse kriteeriume (vt punkt 1.7) on võimalik täita.
1.8.11. Mõõtmised ja analüütilised määramised
Katse ajal määratakse vetikate biomassi igas kolvis vähemalt üks kord ööpäevas. Kui mõõtmiseks kasutatakse katselahusest pipetiga võetud väikesi proove, ei panda neid enam katselahusesse tagasi.
Biomassi mõõdetakse kas mikroskoobi abil rakkude silmaga loendamisega või elektroonilise osakeste loenduriga (määratakse rakkude arv ja/või biomaht). Võib kasutada ka alternatiivmeetodeid, nt läbivoolutsütomeetriat, klorofülli fluorestsentsi in vitro või in vivo (6, 7) või optilist tihedust, kui saab näidata, et katses esinevas biomassi vahemikus on asjaomaste parameetrite ja biomassi vahel rahuldav korrelatsioon.
Lahuste pH mõõdetakse katse alguses ja lõpus.
Kui uuritavat ainet on kasutatavas kontsentratsioonivahemikus võimalik määrata, siis kontrollitakse aine algkontsentratsiooni katselahuses ja kontsentratsiooni püsivust katse ajal.
Kui kontsentratsiooni muutus katse ajal on tõenäoliselt alla 20 % nominaalväärtusest, siis piisab uuritava aine kontsentratsiooni määramisest katse alguses ja lõpus ühel madalal ja ühel kõrgel väärtusel ja eeldatava EC50 läheduses. Kui kontsentratsioon tõenäoliselt ei püsi vahemikus 80–120 % nominaalväärtusest, siis soovitatakse kõigi uuritavate kontsentratsioonide määramist katse alguses ja lõpus. Kui uuritav aine on lenduv, ebapüsiv või adsorbeerub pindadele, soovitatakse katse ajal võtta iga 24 tunni tagant määramiseks lisaproove, et paremini jälgida uuritava aine kadu. Selliste ainete puhul on vaja täiendavaid paralleelkultuure. Igal juhul on uuritava aine kontsentratsioone igal uuritaval väärtusel vaja määrata ainult ühes paralleelkultuuri nõus (või ühes paralleelkultuuridest kokku segatud proovis).
Söötmeid, mis valmistatakse spetsiaalselt kokkupuutekontsentratsiooni määramiseks, käideldakse täpselt samuti kui katses kasutatavaid söötmeid, st need inokuleeritakse vetikatega ja neid inkubeeritakse samades tingimustes. Uuritava aine kontsentratsiooni määramiseks lahuses võib olla vaja vetikate eraldamist kasvukeskkonnast. Eraldamiseks kasutatakse eelistatavalt tsentrifuugimist madalal, kuid vetikate sadestamiseks piisaval kiirendusel.
Kui saab tõendada, et uuritava aine kontsentratsioon püsib katse ajal nominaalse või mõõdetud algväärtuse läheduses täpsusega ±20 %, võib tulemuste analüüsil kasutada nominaalset või mõõdetud algväärtust. Kui kõrvalekalle nominaalsest või mõõdetud algväärtusest on suurem kui ±20 %, kasutatakse tulemuste analüüsil katse geomeetrilist keskmist kontsentratsiooni või uuritava aine kontsentratsiooni muutumist kajastavaid mudeleid (3, 8).
Vetikate kasvu pidurdamise katse on dünaamilisem kui enamik muid veeorganismidele mürgise toime määramise kiirkatseid. Sellepärast võib olla raske kindlaks teha tegelikku kokkupuutekontsentratsiooni, eriti kui uuritakse adsorbeeruvat ainet madalal kontsentratsioonil. Uuritava aine kadumine lahusest adsorbeerumise tõttu kasvavale vetikate biomassile ei tähenda sel juhul, et aine on katsesüsteemist kadunud. Katsetulemuste analüüsimisel tuleb kontrollida, kas uuritava aine kontsentratsiooni vähenemisega katse ajal kaasneb kasvu pidurdumise vähenemine. Kui kasvu pidurdumine väheneb, võib kaaluda uuritava aine kontsentratsiooni vähenemist kajastava sobiva mudeli rakendamist (8). Kui kasvu pidurdamine ei vähene, võib olla sobiv kasutada tulemuste analüüsil nominaalset või mõõdetud algkontsentratsiooni.
1.8.12. Muud tähelepanekud
Inokulum-kultuuri vaadeldakse mikroskoobiga veendumaks, et kultuur on normaalse ja terve välimusega, ning katse lõpus uuritakse kultuuri mikroskoobiga, et avastada vetikate morfoloogilisi muutusi (mis võivad olla põhjustatud kokkupuutumisest uuritava ainega).
1.8.13. Piirsisalduskatse
Teatavatel asjaoludel, näiteks kui eelkatse näitab, et kontsentratsioonil kuni 100 mg·l–1 või katsekeskkonnas lahustuvuse piirkontsentratsioonil (olenevalt sellest, kumb on madalam), ei avalda uuritav aine toksilist mõju, võib teha piirsisalduskatse, milles võrreldakse kontrollrühmas ja ühes katserühmas (kontsentratsioonil 100 mg·l–1 või lahustuvuse piirkontsentratsioonil) avalduvat mõju. Piirsisalduskatse tegemisel soovitatakse kindlasti määrata ka kokkupuutekontsentratsioon. Kõik eespool kirjeldatud katsetingimused ja nõuetele vastavuse kriteeriumid on rakendatavad ka piirsisalduskatse puhul, ent uuritava ainega tuleb teha vähemalt kuus paralleelkatset. Kontroll- ja katserühma kostemuutujate analüüsil võib keskväärtusi võrrelda statistilise kriteeriumi (nt Studenti t-kriteerium) abil. Kui kahe rühma dispersioonid erinevad, kasutatakse mittevõrdsete dispersioonide juhtumile kohandatud t-kriteeriumi.
1.8.14. Muudatus intensiivse värvusega ainete määramise puhul
Valgustatus (valguse intensiivsus) peaks olema käesolevas katsemeetodis ette nähtud vahemiku ülemises otsas: 120 µEm–2s–1 või suurem.
Optilise tee pikkust tuleks lühendada katselahuste ruumala vähendamisega (vahemikus 5–25 ml).
Tuleks tagada piisav segamine (näiteks mõõduka loksutamisega), et vetikad võimalikult sageli satuksid hea valgustatuse tingimustesse kasvukeskkonna pinnal.
2. KATSEANDMED
2.1. KASVUKÕVERATE EHITAMINE
Katsenõus olevat biomassi võib väljendada mõõtmisel kasutatud asendusparameetri (nt rakkude arvu, fluorestsentsi) ühikutes.
Katse- ja kontrollkultuurides määratud biomassi ning uuritava materjali kontsentratsioonid, mis registreeritakse vähemalt iga täistunni möödumisel, ja mõõtmise ajad kantakse tabelisse ja nende andmete põhjal ehitatakse graafik. Sel esimesel etapil võib olla vaja nii logaritmilist kui ka lineaarset skaalat, kuid logaritmiline skaala on kohustuslik ja üldiselt saab katse ajal esinevaid kasvulaadi muutusi selles paremini esitada. Logaritmilises skaalas saadakse eksponentsiaalse kasvu puhul sirge, mille tõus näitab kasvu erikiirust.
Kasvugraafikute abil kontrollitakse, kas kontrollkultuuride kasv on kogu katse jooksul eksponentsiaalne ja toimub eeldatud kiirusega. Iga andmepunkti ja graafikute kuju hinnatakse kriitiliselt veendumaks, et originaalandmetes ei ole vigu ja katse on läbi viidud korrektselt. Eriti kontrollitakse andmepunkte, mille kõrvalekaldumises võib kahtlustada süstemaatilist viga. Kui katse läbiviimises saab tuvastada vea või selle olemasolu võib pidada väga tõenäoliseks, siis tähistatakse asjaomane punkt võõrväärtusena ja seda punkti ei arvestata hiljem statistilisel analüüsil. (Näiteks võib vetikate nullkontsentratsioon ühes kahest või kolmest paralleelnõust osutada sellele, et nõu ei inokuleeritud õigesti või see oli halvasti puhastatud.) Põhjused, miks teatavat andmepunkti käsitleti võõrväärtusena ja ei arvestatud, tuleb katseprotokollis selgesti esitada. Lubatavaks põhjuseks peetakse ainult (harva esinevaid) vigu katse läbiviimises, mitte aga vähest täpsust. Kõnesoleva küsimuse puhul saab statistilisi meetodeid võõrväärtuste kindlakstegemiseks kasutada üksnes piiratult ja need ei asenda eksperdihinnangut. Edasisel katseandmete esitamisel graafiku või tabelina on soovitav esitada koos muude punktidega ka võõrväärtustele vastavad (ja sellisena tähistatud) punktid.
2.2. KOSTEMUUTUJAD
Kõnesoleva katse eesmärk on määrata uuritava aine mõju vetikate kasvule. Kuna liikmesriikide eelistused ja reguleerimisvajadused on erinevad, käsitletakse käesolevas metoodikas kahte kostemuutujat. Et katsetulemused oleksid vastuvõetavad kõikides liikmesriikides, tuleb uuritava mõju hindamisel kasutada mõlemat järgnevalt kirjeldatud kostemuutujat (a ja b).
|
a)
|
Keskmine kasvu erikiirus: see kostemuutuja arvutatakse katse ajal toimunud biomassi juurdekasvu logaritmi alusel ja väljendatakse ühe ööpäeva kohta.
|
|
b)
|
Saagis: see kostemuutuja on biomasside vahe katse lõpus ja alguses.
|
Kui käesolevat meetodit rakendatakse ELi õigusraamistikus, peaksid tulemuste arvutused tagapool kirjeldatud põhjusi arvestades põhinema kasvu keskmisel erikiirusel. Tuleb märkida, et nende kahe kostemuutuja abil arvutatud toksilisuse väärtused ei ole võrreldavad ning seda erinevust tuleb katsetulemuste kasutamisel arvestada. Kui järgitakse käesoleva metoodika tingimusi, on asjaomaste lähenemisviiside matemaatilise aluse eripära tõttu keskmisel kasvu erikiirusel põhinevad ECx väärtused (ErCx) üldiselt suuremad kui saagise alusel saadud tulemused (EyCx). See erinevus ei ole tõlgendatav kahe kostemuutuja tundlikkuse erinevusena; asjaomased väärtused on lihtsalt matemaatiliselt erinevad. Keskmise kasvu erikiiruse mõiste põhineb vetikate üldisel eksponentsiaalsel kasvul piiramata kultuuris, kusjuures toksilisus määratakse kasvukiirusele avaldatava mõju alusel; see ei sõltu kontrollkultuuri kasvu erikiiruse tegelikust väärtusest, kontsentratsiooni-mõju sõltuvuse suurenemisest või katse kestusest. Kui kostemuutujaks on saagis, siis sõltuvad tulemused aga kõikidest mainitud kõrvalmuutujatest. EyCx sõltub igas katses kasutatud vetikaliigi kasvu erikiirusest ja maksimaalsest kasvu erikiirusest, mis võib eri vetikaliikidel ja isegi ühe liigi eri tüvedel olla erinev. Seda kostemuutujat ei tohi kasutada, kui võrreldakse vetikaliikide või -tüvede tundlikkust toksiliste ainete suhtes. Kuigi kasvu erikiiruse kasutamine toksilisuse määramiseks on teaduslikult paremini põhjendatud, vaadeldakse käesolevas metoodikas toksilisuse määramist ka saagise põhjal, et võtta arvesse teatavate liikmesriikide praegusi nõudeid.
2.2.1. Keskmine kasvukiirus
Nii kontrollkultuuride kui uuritava ainega kultuuride puhul arvutatakse teatava ajavahemiku keskmine kasvu erikiirus nõus biomassi suurenemise logaritmist järgmise valemi abil:
 (ööpäev–1)
(ööpäev–1)
kus:
|
µ
i–j
|
on keskmine kasvu erikiirus ajavahemikul i–j;
|
|
X
i
|
on biomass ajahetkel i;
|
|
X
j
|
on biomass ajahetkel j.
|
Iga katse- ja kontrollrühma puhul arvutatakse kasvukiiruse keskmine väärtus ja selle dispersiooni hinnang.
Arvutatakse kogu katse (tavaliselt päevad 0–3) keskmine kasvu erikiirus, võttes aluseks inokuleerimiseks kasutatud nominaalse biomassi väärtuse, mitte biomassi mõõdetud algväärtuse, sest harilikult saadakse nii täpsem tulemus. Kui biomassi mõõtmise seade (nt läbivoolutsütomeeter) võimaldab määrata inokulumi biomassi piisavalt täpselt, võib lähtuda siiski biomassi mõõdetud algkontsentratsioonist. Kasvukiirusi hinnatakse ka lõikude kaupa, need väärtused arvutatakse iga ööpäeva kohta (katsepäevad 0–1, 1–2 ja 2–3) ja kontrollitakse, kas kontrollkultuuri kasvukiirus püsib muutumatuna (vt punkt 1.7, nõuetele vastavuse kriteerium). Kui esimesel katsepäeval leitakse üldisest keskmisest väärtusest oluliselt väiksem kasvu erikiirus, võib see osutada ootefaasi esinemisele. Kontrollkultuuri ootefaasi võib minimeerida või praktiliselt kõrvaldada eelkultuuri õige paljundamisega; uuritava ainega kultuuri puhul võib ootefaasi olemasolu osutada taastumisele esialgsest toksilise aine põhjustatud stressist või uuritava aine sisalduse vähenemisele seoses aine kaoga pärast kokkupuudet (ka sorptsiooni tõttu vetikate biomassil). Sellepärast võib kasvukiiruse lõikude kaupa hindamist kasutada ka selleks, et määrata uuritava aine mõju kokkupuuteaja jooksul. Lõikude kaupa leitud kasvukiiruste ja keskmise kasvukiiruse olulised erinevused osutavad kõrvalekaldumisele pidevast eksponentsiaalsest kasvust; sel juhul on kasvukõveraid vaja üksikasjalikult uurida.
Iga uuritavat ainet sisaldava paralleelkultuuri puhul arvutatakse kasvukiiruse pidurdumise protsent järgmise valemi abil:

kus:
|
%Ir
|
on keskmise kasvu erikiiruse pidurdumise määr protsentides;
|
|
µC
|
on keskmise kasvu erikiiruse (µ) keskväärtus kontrollrühmas;
|
|
µT
|
on asjaomase uuritava ainega kultuuri keskmine kasvu erikiirus.
|
Kui katselahuste valmistamiseks kasutatakse lahusteid, tuleb pidurdumise määra arvutamisel kasutada lahustit sisaldavaid kontrollkultuure, mitte lahustivabasid kontrollkultuure.
2.2.2. Saagis
Iga kontrollkultuuri või uuritava ainega kultuuri puhul arvutatakse saagis, lahutades biomassist katse lõpus biomassi katse alguses. Iga uuritava kontsentratsiooni ja kontrollkultuuri jaoks arvutatakse keskmine saagis ning selle dispersiooni hinnang. Saagise vähenemine protsentides (%Iy) arvutatakse iga uuritava ainega paralleelkultuuri puhul järgmiselt:
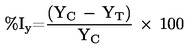
kus:
|
%Iy
|
on saagise vähenemine protsentides;
|
|
YC
|
on kontrollrühma keskmine saagis;
|
|
YT
|
on asjaomase uuritava ainega kultuuri saagis.
|
2.3. KONTSENTRATSIOONI-MÕJU KÕVERA EHITAMINE
Andmed kantakse graafikule koordinaadistikus, mis näitab protsentides väljendatud pidurdumismäära sõltuvust uuritava aine kontsentratsiooni logaritmist; graafikut uuritakse üksikasjalikult, jättes kõrvale kõik esimesel etapil kõrvale jäetud punktid. Läbi punktide ehitatakse käsitsi või arvutiinterpolatsiooni abil sujuv kõver, mis annab esmapildi kontsentratsiooni-mõju seosest; seejärel rakendatakse üksikasjalikumat lähenemisviisi, eelistatavalt mõnda arvutistatistilist meetodit. Olenevalt andmete edasisest kasutamisest, kvaliteedist (täpsusest) ja hulgast ning andmete analüüsivahendite kättesaadavusest, võidakse andmete analüüsimine sellega lõpetada (teatavatel juhtudel on see õigustatud) ning lihtsalt lugeda peamised väärtused EC50 ja EC10 (ja/või EC20) silma järgi ehitatud kõveralt (vt ka stimuleerivat mõju käsitlev punkt allpool). Mõjuvad põhjused statistiliste meetodite kasutamisest loobumiseks võivad olla näiteks järgmised:
|
—
|
andmed ei võimalda saada arvutimeetoditega usaldusväärsemaid tulemusi kui eksperdihinnanguga – sellisel juhul võivad mõned arvutiprogrammid üldse mitte anda usaldusväärseid lahendeid (iteratsioonisammud võivad mitte koonduda jne);
|
|
—
|
olemasolevad arvutiprogrammid ei võimalda adekvaatselt hinnata kasvu stimuleerivat mõju (vt allpool).
|
2.4. STATISTILISED MEETODID
Eesmärk on leida regressioonanalüüsi abil kvantitatiivne seos kontsentratsiooni ja mõju vahel. Võib kasutada kaalutud lineaarset regressiooni pärast kosteandmete lineariseerivat teisendamist näiteks probit-, logit- või Weibulli ühikute kujule (9), kuid eelistada tuleb siiski mittelineaarse regressiooni meetodeid, mis sobivad paremini vältimatute andmevigade ja sujuvast jaotusest kõrvalekallete puhul. Kui andmevead lähenevad null-pidurdusele või täielikule pidurdusele, võivad need teisendustel võimendada ja segada analüüsi (9). Tuleb silmas pidada, et probit-, logit- või Weibulli teisendusega standardsed analüüsimeetodid on ette nähtud kõik-või-mitte-midagi-andmete (nt suremus või elulemus) analüüsiks ja kasvu või biomassi andmete analüüsimiseks tuleb neid kohandada. Konkreetsed meetodid ECx väärtuste määramiseks pidevate andmete alusel on esitatud publikatsioonides (10, 11, 12). Mittelineaarse regressiooni kasutamist on üksikasjalikult käsitletud 4. liites.
Kummagi kostemuutuja puhul arvutatakse kontsentratsiooni-mõju kõverast punkti ECx hinnangud. Võimaluse korral määratakse iga hinnangu usaldusvahemik 95 % usaldusnivoo jaoks. Kosteandmete sobivust regressioonimudeliga hinnatakse graafiliselt või statistiliselt. Regressioonanalüüsiks ei kasutata katserühma keskväärtusi, vaid individuaalsete paralleelkultuuride koste väärtusi. Kui andmete suure hajuvuse tõttu on kõvera mittelineaarne lähendamine raske või võimatu, võib probleemi ületamiseks kasutada rühmade keskväärtuste regressioonanalüüsi – see on praktiline lähenemisviis, mis võimaldab vähendada oletatavate võõrväärtuste mõju. Selle võimaluse kasutamise korral tuleb katseprotokolli teha märkus, et kalduti kõrvale tavalisest toimimisviisist, kuna kõvera lähendamine individuaalsete paralleelkultuuride andmetega ei andnud head tulemust.
Kui tavalised regressioonimudelid ja -meetodid katseandmete puhul ei sobi, võib EC50 hinnangute ja usaldusvahemike leidmiseks kasutada ka lineaarset interpolatsiooni koos andmete usaldusväärsuse iteratiivse kontrollimisega (bootstrapping) (13).
Selleks et määrata madalaim avastatava mõjuga kontsentratsioon, selle kaudu ka avastatava mõjuta kontsentratsioon ja kirjeldada uuritava aine mõju kasvukiirusele, on vaja võrrelda uuritava ainega kultuuride keskväärtusi dispersioonanalüüsi (ANOVA) abil. Iga kontsentratsiooni puhul leitud keskväärtust võrreldakse seejärel kontrollkultuuride keskväärtusega, kasutades sobivat mitmekordse võrdluse või trendikatse meetodit. Dunnetti või Williamsi test võib osutuda sobivaks (14, 15, 16, 17, 18). Tuleb hinnata, kas kehtib dispersioonanalüüsi eeldus, et dispersioon on homogeenne. Selle hinnangu võib saada graafiliselt või formaaltesti abil (18). Sobivad Levene’i või Bartletti testid. Kui dispersioonide homogeensuse eeldus ei kehti, võib mõnikord olla abi andmete logaritmilisest teisendamisest. Kui dispersiooni heterogeensus on väga suur ja seda ei saa korrigeerida teisendamisega, tuleb kaaluda Jonkheere alanevate astmetega trenditesti kasutamist. Täiendavad juhised avastatava mõjuta kontsentratsiooni määramiseks on esitatud publikatsioonis (12).
Teaduse viimaste saavutuste põhjal on soovitatud loobuda avastatava mõjuta kontsentratsiooni mõistest ja asendada see regressioonist leitud punkti ECx hinnangutega. Kõnesoleva katse jaoks vetikatel ei ole sobivat x väärtust veel kindlaks määratud. Nähtavasti on see väärtus 10–20 % vahemikus (olenevalt valitud kosteparameetrist); parem oleks esitada nii EC10 kui ka EC20.
2.5. KASVU STIMULEERIMINE
Mõnikord täheldatakse madalatel kontsentratsioonidel kasvu stimuleerimist (negatiivne pidurdumine). Selle põhjuseks võib olla hormees (mürgise aine stimuleeriv toime) või kasutatud minimaalsöötmele stimuleeriva kasvufaktori lisamine katsematerjaliga. Tuleb arvestada, et anorgaaniliste toitainete lisamine ei peaks avaldama otsest mõju, sest katsekeskkonnas on kogu katse vältel toitaineid liiaga. Tavaliselt võib EC50 arvutamisel väikeste dooside stimuleerivat mõju mitte arvestada, kui see mõju ei ole liiga suur. Kui stimuleeriv mõju on väga suur või on vaja leida ECx väärtus väikese x puhul, võib vaja minna erimeetmeid. Võimaluse korral tuleb vältida stimuleerimist kajastavate tulemuste väljajätmist andmeanalüüsist; kui olemasolev kõveraga lähendamise tarkvara ei võimalda nõrka stimuleerimist töödelda, võib kasutada lineaarset interpolatsiooni koos andmete usaldusväärsuse iteratiivse kontrollimisega. Kui stimuleerimine on väga tugev, võib kaaluda hormeesimudeli kasutamist (19).
2.6. KASVU PIDURDAMINE MITTETOKSILISTE AINETEGA
Valgust neelavad uuritavad materjalid võivad vähendada kasvukiirust, kuna varjestamine vähendab kättesaadavat valgust. Sedalaadi füüsikalised mõjud tuleb toksilisest mõjust katsetingimuste muutmisega lahku viia, ja füüsikalisi mõjusid tuleb kirjeldada eraldi. Asjaomased juhtnöörid on esitatud publikatsioonides (2, 3).
3. TULEMUSTE ESITAMINE
3.1. KATSEPROTOKOLL
Katseprotokollis esitatakse järgmine teave.
Uuritav aine:
|
—
|
füüsikaline iseloomustus ja asjakohased füüsikalis-keemilised omadused, kaasa arvatud lahustuvus vees;
|
|
—
|
keemiline iseloomustus, kaasa arvatud puhtusaste.
|
Katseorganismi liik:
|
—
|
tüvi, päritolukollektsioon või eraldamise koht, kasutatud kultiveerimistingimused.
|
Katsetingimused:
|
—
|
katse alustamise kuupäev ja katse kestus;
|
|
—
|
katseplaani kirjeldus: katsenõud, kultuuri mahud, biomassi tihedus katse alguses;
|
|
—
|
uuritud kontsentratsioonid ja paralleelkultuurid (paralleelkultuuride arv, uuritud kontsentratsioonide arv, kasutatud geomeetriline progressioon);
|
|
—
|
katselahuste valmistamise kirjeldus, sh lahustite kasutamine jne;
|
|
—
|
valguse intensiivsus ja kvaliteet (valgusallikas, valguse ühtlus);
|
|
—
|
uuritud kontsentratsioonid: nominaalsed uuritud kontsentratsioonid ja katsenõudes oleva uuritava aine kontsentratsiooni määramiste tulemused. Märgitakse meetodi tulemuslikkus ja uuritavas süsteemis määratav minimaalne kontsentratsioon;
|
|
—
|
kõik kõrvalekaldumised käesolevast metoodikast;
|
|
—
|
biomassi määramise meetod ning mõõdetava parameetri ja kuivmassi korrelatsiooni tõendid.
|
Katsetulemused:
|
—
|
pH väärtused kõikide katsete alguses ja lõpus;
|
|
—
|
biomass igas kolvis igas mõõtmispunktis ning biomassi mõõtmise meetod;
|
|
—
|
kasvukõverad (graafikud, kuidas biomass muutus aja muutudes);
|
|
—
|
iga uuritava ainega paralleelkultuuri puhul arvutatud kostemuutujate väärtused, keskväärtused ja paralleelkultuuride variatsioonikordaja;
|
|
—
|
graafik, kuidas mõju sõltub kontsentratsioonist;
|
|
—
|
kostemuutujate (nt EC50, EC10, EC20) abil väljendatud toksilisuse hinnangud ja nende usaldusvahemikud. Madalaim avastatava mõjuga kontsentratsioon ja ka avastatava mõjuta kontsentratsioon (kui need arvutati) ning nende määramiseks kasutatud statistilised meetodid;
|
|
—
|
kui kasutati dispersioonanalüüsi (ANOVA), siis avastatava efekti suurus (nt väikseim oluline erinevus);
|
|
—
|
uuritava ainega kultuuris jälgitud kasvu stimuleerimine;
|
|
—
|
muu täheldatud mõju, nt vetikate morfoloogilised muutused;
|
|
—
|
tulemuste arutelu, kaasa arvatud käesolevast metoodikast kõrvalekaldumise võimalik mõju katsetulemustele.
|
4. KIRJANDUS
|
1)
|
OECD TG 201 (2006) Freshwater Alga and Cyanobacteria, Growth Inhibition Test.
|
|
2)
|
ISO 1998: Water quality – Guidance for algal growth inhibition tests with poorly soluble materials, volatile compounds, metals and waster water. ISO/DIS 14442.
|
|
3)
|
OECD 2000: Guidance Document on Aquatic Toxicity Testing of Difficult Substances and mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment, no. 23.
|
|
4)
|
ISO 1998: Water quality – Sampling – Part 16: General Guidance for Biotesting. ISO 5667–16.
|
|
5)
|
ISO 1993: Water quality – Algal growth inhibition test. ISO 8692.
|
|
6)
|
Mayer, P., Cuhel, R. and Nyholm, N. (1997). A simple in vitro fluorescence method for biomass measurements in algal growth inhibition tests. Water Research 31: 2525–2531.
|
|
7)
|
Slovacey, R.E. and Hanna, P.J. In vivo fluorescence determinations of phytoplancton chlorophyll, Limnology & Oceanography 22,5 (1977), pp. 919–925
|
|
8)
|
Simpson, S.L., Roland, M.G.E., Stauber, J.L. and Batley, G.E. (2003) Effect of declining toxicant concentrations on algal bioassay endpoints. Environ. Toxicol. Chem 22, 2073–2079.
|
|
9)
|
Christensen, E.R., Nyholm, N. (1984): Ecotoxicological Assays with Algae: Weibull Dose-Response Curves. Env. Sci. Technol. 19, 713–718.
|
|
10)
|
Nyholm, N. Sørensen, P.S., Kusk, K.O. and Christensen, E.R. (1992): Statistical treatment of data from microbial toxicity tests. Environ. Toxicol. Chem. 11, 157–167.
|
|
11)
|
Bruce, R.D., and Versteeg, D.J. (1992). A statistical procedure for modelling continuous toxicity data. Env. Toxicol. Chem. 11:1485–1494.
|
|
12)
|
OECD. (2004). Guidance Document on Statistical Analysis of Ecotoxicity Data.
|
|
13)
|
Norberg-King T.J. (1988) An interpolation estimate for chronic toxicity: The ICp approach. National Effluent Toxicity Assessment Center Technical Report 05–88. USEPA, Duluth, MN.
|
|
14)
|
Dunnett, C.W. (1955) A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc. 50: 1096–1121
|
|
15)
|
Dunnett, C.W. (1964) New tables for multiple comparisons with a control. Biometrics 20: 482–491.
|
|
16)
|
Williams, D.A. (1971) A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27: 103–117.
|
|
17)
|
Williams, D.A. (1972) The comparison of several dose levels with a zero dose control. Biometrics 28: 510–531.
|
|
18)
|
Draper, N.R. and Smith, H. (1981). Applied Regression Analysis, second edition. Wiley, New York.
|
|
19)
|
Brain P. and Cousens R. (1989). An equation to describe dose-responses where there is stimulation of growth at low doses. Weed Research, 29, 93–96.
|
1. liide
Tüved, mille sobivus katseks on tõendatud
Rohevetikad
|
—
|
Pseudokirchneriella subcapitata (varasem liiginimi Selenastrum capricornutum), ATCC 22662, CCAP 278/4, 61.81 SAG
|
|
—
|
Desmodesmus subspicatus (varasem liiginimi Scenedesmus subspicatus), 86.81 SAG
|
Ränivetikad
|
—
|
Navicula pelliculosa, UTEX 664
|
Tsüanobakterid
|
—
|
Anabaena flos-aquae, UTEX 1444, ATCC 29413, CCAP 1403/13A
|
|
—
|
Synechococcus leopoliensis, UTEX 625, CCAP 1405/1
|
Tüvede kollektsioonid
Soovitatud tüved on kättesaadavad vetikate monokultuuridena järgmistest kollektsioonidest (tähestikulises järjestuses):
|
|
|
ATCC: American Type Culture Collection
|
|
10801 University Boulevard
|
|
Manassas, Virginia 20110–2209
|
|
USA
|
|
|
|
|
CCAP, Culture Collection of Algae and Protozoa
|
|
Institute of Freshwater Ecology,
|
|
Windermere Laboratory
|
|
Far Sawrey, Amblerside
|
|
Cumbria
|
|
LA22 0LP
|
|
UK
|
|
|
|
|
SAG: Sammlung von Algenkulturen
|
|
Albrecht-von-Haller-Institut
|
|
Universität Göttingen
|
|
Nikolausberger Weg 18
|
|
D-3400 Göttingen
|
|
GERMANY
|
|
|
|
|
UTEX Culture Collection of Algae
|
|
Section of Molecular, Cellular and Developmental Biology
|
|
School of Biological Sciences
|
|
the University of Texas at Austin
|
|
Austin, Texas 78712
|
|
USA
|
|
Soovitatavate liikide väline iseloomustus ja omadused
|
|
P. subcapitata
|
D. subspicatus
|
N. pelliculosa
|
A. flos-aquae
|
S. leopoliensis
|
|
Väline iseloomustus
|
Kõverdunud kruvijad eraldi rakud
|
Ovaalsed enamasti eraldi rakud
|
Kepikesed
|
Ovaalsete rakkude ahelad
|
Kepikesed
|
|
Mõõtmed (pikkus × läbimõõt) µm
|
8–14 × 2–3
|
7–15 × 3–12
|
7,1 × 3,7
|
4,5 × 3
|
6 × 1
|
|
Rakumaht (µm3/rakk)
|
40–60 (1)
|
60–80 (1)
|
40–50 (1)
|
30–40 (1)
|
2,5 (2)
|
|
Raku kuivmass (mg/rakk)
|
2–3 × 10–8
|
3–4 × 10–8
|
3–4 × 10–8
|
1–2 × 10–8
|
2–3 × 10–9
|
|
Kasvukiirus (3) (ööpäev–1)
|
1,5–1,7
|
1,2–1,5
|
1,4
|
1,1–1,4
|
2,0–2,4
|
Konkreetsed soovitused soovitatavate katseliikide kultiveerimiseks ja käitlemiseks
Pseudokirchneriella subcapitata ja Desmodesmus subspicatus
Neid rohevetikaid on üldiselt kerge säilitada erinevatel söötmetel. Teavet sobivate söötmete kohta võib saada vetikakultuuri kollektsioonidest. Tavaliselt on rakud eraldi ja rakkude kontsentratsiooni on kerge määrata elektroonilise osakesteloenduri või mikroskoobi abil.
Anabaena flos-aquae
Tüvikultuuri säilitamiseks võib kasutada erinevaid söötmeid. Portskultuuri uuendamisel on eriti tähtis vältida kasvu väljumist logaritmilisest faasist, sest logaritmilise kasvu taastamine on raske.
Anabaena flos-aquae areneb kokkukeerdunud rakuahelate kogumitena. Olenevalt kultiveerimistingimustest võib nende rakukogumite suurus olla erinev. Kui biomassi määramiseks kasutatakse loendamist mikroskoobi abil või elektroonilist osakesteloendurit, võib olla vaja neid rakukogumeid lõhkuda.
Kõikumiste vähendamiseks rakkude loendamisel võib rakuahelad lõhkuda, töödeldes osaproove ultraheliga. Kui osaproove töödeldakse ultraheliga kauem, kui on vaja rakuahelate lõhkumiseks, siis võivad rakud puruneda. Ultraheliga töötlemise intensiivsus ja kestus peab olema kõigis katsetes ühesugune.
Tulemuste kõikumise kompenseerimiseks peab hemotsütomeetri abil loendatud väljade arv olema küllaldane (vähemalt 400 rakku). See muudab rakkude kontsentratsiooni mikroskoobiga määramise usaldusväärsemaks.
Pärast rakuahelate lõhkumist hoolika ultrahelitöötluse abil võib Anabaena rakkude üldmahu määramiseks kasutada elektroonilist osakesteloendurit. Ultraheli energia tuleb nii reguleerida, et rakud jääksid terveks.
Katsenõude inokuleerimiseks kasutatava vetikasuspensiooni hea läbisegatuse ja homogeensuse tagamiseks kasutatakse pöörissegajat.
Katsenõud asetatakse orbitaal- või võnkloksuti lauale töörežiimil ligikaudu 150 pööret minutis. Anabaena rakukogumite moodustumist võib takistada ka perioodilise loksutamisega. Kui rakukogumid siiski tekivad, tuleb jälgida, et biomassi mõõtmiseks võetavad proovid oleksid representatiivsed. Võib olla vajalik kultuuri tugev segamine, et lõhkuda vetikakogumid enne proovi võtmist.
Synechococcus leopoliensis
Tüvikultuuri säilitamiseks võib kasutada erinevaid söötmeid. Teavet sobivate söötmete kohta võib saada vetikakultuuri kollektsioonidest.
Synechococcus leopoliensis kasvab eraldi kepikesekujuliste rakkudena. Rakud on väga väikesed, mis raskendab biomassi mõõtmist rakkude loendamisega mikroskoobi abil. Võib kasutada elektroonilist osakesteloendurit, mis võimaldab loendada osakesi läbimõõduga alates 1 µm. Võib kasutada ka fluorimeetrilisi mõõtmisi in vitro.
Navicula pelliculosa
Tüvikultuuri säilitamiseks võib kasutada erinevaid söötmeid. Teavet sobivate söötmete kohta võib saada vetikakultuuri kollektsioonidest. Tuleb silmas pidada, et sööde peab sisaldama silikaati.
Navicula pelliculosa võib teatavates kasvutingimustes moodustada rakukogumeid. Lipiidide moodustumise tõttu võivad vetikarakud mõnikord koguneda õhukesse pinnakihti. Sel juhul tuleb biomassi määramiseks vajalike osaproovide võtmisel rakendada erimeetmeid selleks, et proovid oleksid representatiivsed. Näiteks võib vaja minna intensiivset segamist pöörissegajaga.
(1) Määratud elektroonilise osakesteloenduri abil.
(2) Arvutatud mõõtmete alusel.
(3) Kõige sagedamini täheldatav kasvukiirus OECD söötmel, kui valgustatus on 70 µEm–2 s–1 ja temperatuur 21 °C.
2. liide
Söötmed
Võib kasutada ühte järgmistest söötmetest.
OECD sööde: originaalsööde OECD TG 201, vastab ka standardile ISO 8692.
US EPA sööde AAP, vastab ka standardile ASTM.
Nende söötmete valmistamisel kasutatakse keemiliselt või analüütiliselt puhtaid kemikaale ja deioniseeritud vett.
USA Keskkonnakaitseagentuuri (U.S. EPA) AAP-söötme ja OECD eeskirjas 201 ette nähtud söötme koostis
|
Koostisaine
|
EPA
|
OECD
|
|
|
mg/l
|
mM
|
mg/l
|
mM
|
|
NaHCO3
|
15,0
|
0,179
|
50,0
|
0,595
|
|
NaNO3
|
25,5
|
0,300
|
|
|
|
NH4Cl
|
|
|
15,0
|
0,280
|
|
MgCl2·6(H2O)
|
12,16
|
0,0598
|
12,0
|
0,0590
|
|
CaCl2·2(H2O)
|
4,41
|
0,0300
|
18,0
|
0,122
|
|
MgSO4·7(H2O)
|
14,6
|
0,0592
|
15,0
|
0,0609
|
|
K2HPO4
|
1,044
|
0,00599
|
|
|
|
KH2PO4
|
|
|
1,60
|
0,00919
|
|
FeCl3·6(H2O)
|
0,160
|
0,000591
|
0,0640
|
0,000237
|
|
Na2EDTA·2(H2O)
|
0,300
|
0,000806
|
0,100
|
0,000269 (1)
|
|
H3BO3
|
0,186
|
0,00300
|
0,185
|
0,00299
|
|
MnCl2·4(H2O)
|
0,415
|
0,00201
|
0,415
|
0,00210
|
|
ZnCl2
|
0,00327
|
0,000024
|
0,00300
|
0,0000220
|
|
CoCl2·6(H2O)
|
0,00143
|
0,000006
|
0,00150
|
0,00000630
|
|
Na2MoO4·2(H2O)
|
0,00726
|
0,000030
|
0,00700
|
0,0000289
|
|
CuCl2·2(H2O)
|
0,000012
|
0,00000007
|
0,00001
|
0,00000006
|
|
pH
|
7,5
|
8,1
|
Kui katses kasutatakse ränivetikat Navicula pelliculosa, lisatakse kummalegi söötmele Na2SiO3·9H2O kontsentratsioonini 1,4 mg Si/l.
Nõutav söötme pH saavutatakse, kui söötme karbonaatsüsteem on tasakaalus CO2 partsiaalrõhuga atmosfääriõhus. pH väärtus ja vesinikkarbonaadi molaarne kontsentratsioon 25 °C juures on omavahel seotud järgmise ligikaudse võrrandiga:
pHeq = 11,30 + log [HCO3]
Kui NaHCO3 sisaldus on 15 mg/l, siis pHeq = 7,5 (U.S. EPA sööde); kui NaHCO3 sisaldus on 50 mg/l, siis pHeq = 8,1 (OECD sööde).
Elementide sisaldus katsesöötmes
|
Element
|
EPA
|
OECD
|
|
|
mg/l
|
mg/l
|
|
C
|
2,144
|
7,148
|
|
N
|
4,202
|
3,927
|
|
P
|
0,186
|
0,285
|
|
K
|
0,469
|
0,459
|
|
Na
|
11,044
|
13,704
|
|
Ca
|
1,202
|
4,905
|
|
Mg
|
2,909
|
2,913
|
|
Fe
|
0,033
|
0,017
|
|
Mn
|
0,115
|
0,115
|
OECD söötme valmistamine
|
Toitaine
|
Sisaldus põhilahuses
|
|
Põhilahus 1: makrotoitained
|
|
NH4Cl
MgCl2·6H2O
CaCl2·2H2O
MgSO4·7H2O
KH2PO4
|
1,5 g·l–1
1,2 g·l–1
1,8 g·l–1
1,5 g·l–1
0,16 g·l–1
|
|
Põhilahus 2: raud
|
|
FeCl3·6H2O
Na2EDTA·2H2O
|
64 mg·l–1
100 mg·l–1
|
|
Põhilahus 3: mikroelemendid
|
|
H3BO3
MnCl2·4H2O
ZnCl2
CoCl2·6H2O
CuCl2·2H2O
Na2MoO4·2H2O
|
185 mg·l–1
415 mg·l–1
3 mg·l–1
1,5 mg·l–1
0,01 mg·l–1
7 mg·l–1
|
|
Põhilahus 4: vesinikkarbonaat
|
|
NaHCO3
|
50 g·l–1
|
|
Na2SiO3·9H20
|
|
Põhilahused steriliseeritakse membraanfiltrimise (keskmine poori läbimõõt 0,2 µm) või autoklaavimise (120 °C, 15 min) abil. Lahuseid hoitakse valguse juurdepääsuta 4 °C juures.
Põhilahuseid 2 ja 4 ei autoklaavita, vaid steriliseeritakse membraanfiltrimise abil.
Söötme valmistamiseks lisatakse veele vajalikud mahud põhilahuseid 1–4.
500 ml steriliseeritud veele lisatakse:
Lahuse ruumala viiakse steriliseeritud veega 1 000 milliliitrini.
Lahusel lastakse piisavalt kaua seista, et sööde saavutaks tasakaalu atmosfääris oleva süsihappegaasiga; vajaduse korral barboteeritakse mõne tunni jooksul läbi lahuse filtritud steriilset õhku.
AAP-söötme valmistamine
|
A1.1.
|
Ligikaudu 900 ml deioniseeritud või destilleeritud veele lisatakse à 1 ml põhilahuseid A1.2.1–A1.2.7 ja saadud lahuse ruumala viiakse 1 liitrini.
|
|
A1.2.
|
Makrotoitainete põhilahuse valmistamiseks lahustatakse 500 ml deioniseeritud või destilleeritud vees järgmised kogused aineid. Reaktiivikogustest A1.2.1, A1.2.2, A1.2.3 ja A1.2.4 võib valmistada ühe kombineeritud põhilahuse.
|
|
A1.2.2.
|
MgCl2·6H2O –6,082 g.
|
|
A1.2.3.
|
CaCl2·2H2O –2,205 g.
|
|
A1.2.4.
|
Mikrotoitainete põhilahus – (vt A1.3).
|
|
A1.2.5.
|
MgSO4·7H2O –7,350 g.
|
|
A1.2.8.
|
Na2SiO3·9H2O – vt märkus A1.1.
Märkus A1.1. Kasutatakse ainult ränivetikatel tehtavates katsetes. Võib lisada otse (202,4 mg) või põhilahuse koostises, nii et räni lõppkontsentratsioon söötmes oleks 20 mg/l.
|
|
A1.3.
|
Mikroelementide põhilahuse saamiseks lahustatakse 500 ml deioniseeritud või destilleeritud vees järgmised kogused aineid.
|
|
A1.3.2.
|
MnCl2·4H2O – 207,690 mg.
|
|
A1.3.4.
|
FeCl3·6H2O –79,880 mg.
|
|
A1.3.5.
|
CoCl2·6H2O –0,714 mg.
|
|
A1.3.6.
|
Na2MoO4·2H2O –3,630 mg.
|
|
A1.3.7.
|
CuCl2·2H2O –0,006 mg.
|
|
A1.3.8.
|
Na2EDTA·2H2O – 150,000 mg
[dinaatrium(etüleendinitrilo)tetraatsetaat].
|
|
A1.3.9.
|
Na2SeO4·5H2O –0,005 mg, vt märkus A1.2.
Märkus A1.2. Kasutatakse ainult ränivetikaliikide tüvikultuuride jaoks ette nähtud söötmetes.
|
|
A1.4.
|
pH reguleeritakse väärtusele 7,5 ± 0,1, kasutades 0,1 N või 1,0 N NaOH või HCl lahust.
|
|
A1.5.
|
Sööde filtritakse steriilsesse nõusse läbi 0,22 μm membraanfiltri (kui kasutatakse osakeste loendurit) või 0,45 μm membraanfiltri (kui osakeste loendurit ei kasutata).
|
|
A1.6.
|
Kuni kasutamiseni hoitakse söödet valguse juurdepääsuta 4 °C juures.
|
(1) EDTA ja raua moolsuhe on veidi suurem kui 1. See hoiab ära raua sadestumise, samas kui kelaatide moodustumine raskmetallide ioonidega on minimaalne.
3. liide
Vetikate kultiveerimiskatse näide
Üldised märkused
Allpool on kirjeldatud vetikakultuuride saamist mürgisuse määramise katsete jaoks.
Tuleb rakendada kohaseid meetmeid, et hoida ära vetikakultuuride nakatumine bakteritega. Puhaskultuuri kasutamine võib olla eelistatav, kuid on vaja saada selline kultuur, mis sisaldaks ainult ühte vetikat, ja kasutada seda.
Bakterite või teiste vetikatüvedega saastumise vältimiseks töötatakse steriilsetes tingimustes.
Seadmed ja materjalid
Vt „Meetodi kirjeldus: seadmed”.
Vetikakultuuride saamine
Toitainelahuste (söötmete) valmistamine
Kõikidest söötmeks vajalikest toitesooladest valmistatakse kontsentreeritud põhilahused, mida hoitakse valguse juurdepääsuta ja jahedas kohas. Need lahused steriliseeritakse filtrimise või autoklaavimisega.
Söötme valmistamiseks lisatakse steriilsele destilleeritud veele vajalik kogus põhilahust, jälgides, et lahusesse ei viidaks infektsiooni. Tahke söötme saamiseks lisatakse 0,8 % agarit.
Tüvikultuur
Tüvikultuur on väikesemahuline vetikakultuur, mida kantakse korrapäraselt üle värskesse söötmesse ja kasutatakse katse algmaterjalina. Kui tüvikultuuri pidevalt ei kasutata, külvatakse see viirgudena kaldagariga katseklaasi. Kaldagarilt kantakse tüvikultuur ümber värskele söötmele vähemalt üks kord kahe kuu jooksul.
Tüvikultuure kasvatatakse sobiva söötmega koonilistes kolbides (maht ligikaudu 100 ml). Vetikate inkubeerimisel pideva valguse käes 20 °C juures tuleb neid iga nädal üle kanda.
Teatav kogus vana kultuuri kantakse steriilse pipetiga üle värske söötmega kolbi nii, et kiirelt kasvava liigi puhul oleks algkontsentratsioon ligikaudu 100 korda väiksem kui vanas kultuuris.
Liigi kasvukiiruse võib määrata kasvukõveralt. Kui see on teada, on võimalik hinnanguliselt määrata kultuuri uude söötmesse ülekandmiseks vajalik kontsentratsioon. Seda on vaja teha enne, kui kultuur jõuab suremisfaasi.
Eelkultuur
Eelkultuur on mõeldud vetikakoguse saamiseks, mis sobib uuritava ainega kultuuride inokuleerimiseks. Eelkultuuri inkubeeritakse katse tingimustes ja kasutatakse siis, kui see on veel eksponentsiaalse kasvu faasis, harilikult pärast 2–4 päeva kestnud inkubeerimist. Kui vetikakultuur sisaldab moondunud või ebanormaalseid rakke, praagitakse kultuur välja.
4. liide
Andmete töötlemine mittelineaarse regressiooni abil
Üldised märkused
Vetikate ja muude mikroorganismide kasvu katsetes on kostemuutujaks protsessi kiirus, kui kasutatakse kasvukiirust, või selle integraal aja järgi, kui kasutatakse biomassi (biomassi kasv on pidev ehk mõõdetav muutuja). Kumbagi muutujat võrreldakse vastava keskmise kostemuutuja väärtusega paralleelsetes kontrollkultuurides, mis ei sisalda uuritavat ainet, kusjuures tingimused (vetikakatse puhul on peamised määravad tegurid valgus ja temperatuur) on valitud nii, et koste oleks maksimaalne. Tegemist on hajus- ehk homogeense süsteemiga, mille biomassi võib vaadelda kontiinumina, arvestamata individuaalseid rakke. Sellise süsteemi koste dispersiooni jaotus sõltub üksnes katsetingimustest (harilikult on vea jaotus lognormaalne või normaalne). Olukord on teistsugune kui tavaliste biotestide puhul, millest saadakse kõik-või-mitte-midagi-andmeid, mille korral sageli eeldatakse, et dispersiooni põhikomponent on – tavaliselt binomiaaljaotusega – individuaalsete organismide taluvus. Antud juhul on null- ehk tausttasemeks kontrollkultuuridega saadud koste.
Lihtsal juhul väheneb normeeritud ehk suhteline koste r monotoonselt alates väärtusest 1 (nullpidurdus) kuni väärtuseni 0 (täielik pidurdus). Tuleb silmas pidada, et koste mõõtmine on seotud veaga ja näilist negatiivset pidurdust võib töödelda üksnes kui juhuvea tulemust.
Regressioonanalüüs
Mudelid
Regressioonanalüüsi eesmärk on esitada kontsentratsiooni-mõju kõver kvantitatiivselt kas matemaatilise regressioonifunktsiooni Y = f(C) kujul või sagedamini funktsioonina F(Z), kus Z = log C. Pöördfunktsioon C = f–1 (Y) võimaldab arvutada ECx väärtused EC50, EC10 ja EC20 ning nende usaldusvahemikud usaldusnivool 95 %. Vetikate kasvu pidurdamise katsetes on kontsentratsiooni mõju kirjeldamisel edukalt kasutatud mitut lihtsat matemaatilist funktsiooni. Sellisteks funktsioonideks on näiteks logistiline võrrand, mittesümmeetriline Weibulli võrrand ja lognormaalne jaotusfunktsioon, mis kõik kujutavad endast sigmoidkõveraid ning lähenevad 1-le, kui C → 0, ja 0-le, kui C → ∞.
Viimasel ajal on asümptootiliste mudelite alternatiiviks pakutud pideva lävifunktsiooni mudeleid (nt Kooijmani mudel populatsiooni kasvu pidurdamise kirjeldamiseks, Kooijman et al. 1996). Kooijmani mudeli puhul eeldatakse, et teatavast kontsentratsiooni läviväärtusest EC0+ allpool uuritav aine ei mõju; see läviväärtus määratakse, ekstrapoleerides kontsentratsiooni-mõju kõverat lõikumiseni kontsentratsiooniteljega, kasutades selleks lihtsat pidevat funktsiooni, mis algpunktis ei ole diferentseeritav.
Analüüs võib seisneda lihtsalt hälvete ruutude summa minimeerimises (oletades, et dispersioon on konstantne) või kaalutud hälvete ruutude summa minimeerimises (kui dispersiooni heterogeensus on kompenseeritud).
Analüüsi käik
Analüüsi käiku võib kirjeldada järgmiselt. Valitakse sobiv funktsioon Y = f(C) ja lähendatakse see katseandmetega mittelineaarse regressiooni abil. Et saada katseandmetest võimalikult palju teavet, on parem mitte kasutada paralleelkultuuridest leitud keskmisi väärtusi, vaid iga üksiku kolvi puhul saadud mõõteväärtusi. Teisest küljest näitavad kogemused, et kui dispersioon on suur, võib paralleelkultuuride keskmise väärtuse kasutamine anda usaldusväärsema, katseandmete juhuslikest vigadest vähem mõjutatud matemaatilise hinnangu kui iga individuaalse andmepunkti kasutamine.
Lähendatud kõver ja mõõdetud andmed kantakse graafikule ning kontrollitakse kõvera ja andmete sobivust. Selleks võib olla eriti kasulik rakendada hälvete analüüsi. Kui kontsentratsiooni-mõju kirjeldamiseks valitud funktsionaalseos ei kajasta hästi kogu kõverat või mõnda selle olulist osa, nt madalate kontsentratsioonide mõju, valitakse lähendamiseks muu kõver – näiteks võib sümmeetrilise kõvera asemel valida Weibulli funktsioonile vastava mittesümmeetrilise kõvera. Negatiivne pidurdus võib olla probleemiks näiteks lognormaalse jaotusfunktsiooni korral ja vajada samuti alternatiivset regressioonifunktsiooni. Sellistele negatiivsetele väärtustele ei soovitata omistada nullväärtust või väikesi positiivseid väärtusi, kuna see moonutab vigade jaotust. Võib olla vaja lähendada teatavaid kõvera osi eraldi, nt lähendada eraldi nõrga pidurduse osa ECmadal x väärtuste hindamiseks. Lähendatud võrrandi ja pöördfunktsiooni C = f–1 (Y) abil arvutatakse iseloomulike punktide ECx hinnangud, kusjuures katseprotokolli kantakse vähemalt EC50 hinnang ning üks või kaks ECmadal x hinnangut. Kogemused on näidanud, et vetikakatsete täpsus võimaldab mõistliku täpsusega hindamist tavaliselt 10-protsendilise pidurdustaseme juures, kui andmepunkte on küllaldaselt ja madalatel kontsentratsioonidel ei esine segavat kasvu stimuleerimist. EC20 hinnang on sageli oluliselt täpsem kui EC10 hinnang, kuna EC20 asub harilikult kontsentratsiooni-mõju kõvera keskmises, ligikaudu lineaarses osas. Kasvu stimuleerimise tõttu on EC10 väärtusi mõnikord raske tõlgendada. Sellepärast soovitatakse, et kuigi EC10 on piisava täpsusega määratav, oleks katseprotokollis alati esitatud ka EC20.
Kaalutegurid
Dispersioon katses ei ole üldiselt konstantne ja sisaldab harilikult võrdelist komponenti, sellepärast on tavaliselt parem kasutada kaalutud regressiooni. Tavaliselt eeldatakse sellise analüüsi puhul, et kaalutegur on pöördvõrdeline dispersiooniga:
Wi = 1/Var(ri)
Paljud regressiooniprogrammid võimaldavad valida kaalutud regressioonanalüüsi tabelites esitatud kaalutegurite kasutamisega. Sobiv on kaalutegurid normeerida; selleks korrutatakse need teguriga n/Σ wi (n on andmepunktide arv), nii et kõikide kaalutegurite summa on 1.
Koste normeerimine
Normeerimine kontrollkatse keskmise koste abil tekitab teatavaid põhimõttelisi raskusi ja muudab dispersiooni struktuuri üsna keeruliseks. Kui pidurdusprotsendi saamiseks jagatakse koste väärtus kontrollkatse koste keskväärtusega, siis tuuakse sisse lisaviga, kuna kontrollkatse koste keskväärtus ise on määratud veaga. Kui see viga ei ole tühiselt väike, tuleb regressiooni kaalutegureid ja usaldusintervalle parandada, arvestades kontrolli kovariatsiooni (17). Tuleb silmas pidada, et kontrolli koste keskväärtuse täpne määramine on oluline suhtelise koste ülddispersiooni vähendamiseks. Seda dispersiooni kirjeldab järgmine valem,
milles alaindeks i märgib kontsentratsiooni i ja alaindeks 0 – kontrollkultuuri:
Yi = suhteline koste = ri/r0 = 1 – I = f (Ci)
mille dispersioon on järgmine:
Var (Yi) = Var (ri/r0) ≅ (∂Yi / ∂ ri)2·Var(ri) + (∂ Yi/ ∂ r0)2·Var (r0)
ja kuna
(∂ Yi/ ∂ ri) = 1/r0 ja (∂ Yi / ∂ r0) = ri/r0
2
andmete dispersiooni normaaljaotuse ja paralleelkultuuride arvu mi ja m0 puhul:
Var(ri) = σ2/mi
siis suhtelise koste summaarne dispersioon Yi võrdub:
Var(Yi) = σ2/(r0
2 mi) + ri
2·σ2/r0
4 m0
Kontrollkultuuride koste keskväärtuse viga on pöördvõrdeline ruutjuurega keskmistatud kontrollkultuuride arvust; sellepärast on vea oluliseks vähendamiseks mõnikord õigustatud varasemate andmete arvestamine. Teine võimalus on loobuda andmete normeerimisest ja kasutada lähendamisel absoluutseid koste väärtusi, kaasa arvatud kontrollkultuuride koste väärtused, kusjuures kontrollkultuuri koste väärtust käsitletakse mittelineaarse regressiooni abil lähendatava täiendava parameetrina. Tavalise kaheparameetrilise regressioonivõrrandi puhul nõuab see meetod lähendamist kolme parameetri järgi, järelikult on meetodi kasutamiseks vaja rohkem andmepunkte kui mittelineaarse regressiooni läbiviimiseks andmetega, mida on normeeritud eelnevalt kindlaks määratud kontrollkultuuri koste väärtuse abil.
Usaldusvahemike pöördhinnangud
Mittelineaarse regressiooni usaldusvahemike arvutamine pöördhinnangu abil on üsna keeruline ega kuulu tavaliste statistilise tarkvara pakettide standardvariantides ette nähtud võimaluste hulka. Ligikaudsed usaldusvahemikud võib leida standardse mittelineaarse regressiooni programmide abil, kasutades ümberparametriseerimist (Bruce and Versteeg, 1992), mille puhul matemaatiline võrrand kirjutatakse ümber nii, et määratavateks parameetriteks on otsitavad punktide hinnangud, (nt EC10 ja EC50). Kui funktsioon on I = f(α, β, kontsentratsioon), kasutatakse määratlusi f(α, β, EC10) = 0,1 ja f(α, β, EC50) = 0,5 selleks, et asendada funktsioon f(α, β, kontsentratsioon) ekvivalentse funktsiooniga g(EC10, EC50, kontsentratsioon).
Otsesema arvutusviisi kasutamisel (Andersen et al, 1998) säilitatakse võrrand originaalkujul ja arendatakse funktsioon Taylori ritta ri ja r0 keskväärtuste ümbruses.
Viimasel ajal on saanud populaarseks andmete usaldusväärsuse iteratiivsel kontrollil põhinevad (boot strap) meetodid. Nende meetodite puhul kasutatakse empiirilise dispersioonijaotuse saamiseks katseandmeid ja sagedast korduvat valimi moodustamist, mida suunatakse juhuslike arvude generaatori abil.
KIRJANDUS
Kooijman, S.A.L.M.; Hanstveit, A.O.; Nyholm, N. (1996): No-effect concentrations in algal growth inhibition tests. Water Research, 30, 1625–1632.
Bruce, R.D. and Versteeg, D.J.(1992) A Statistical Procedure for Modelling Continuous Ecotoxicity Data. Env. Toxicol. Chem.11, 1485–1494.
Andersen, J.S., Holst, H., Spliid, H., Andersen, H., Baun, A. & Nyholm, N. (1998): Continuous ecotoxicological data evaluated relative to a control response. Journal of Agricultural, Biological and Environmental Statistics, 3, 405–420.
V LISA
|
C.25.
|
AEROOBNE MINERALISEERUMINE PINNAVEES – BIOLAGUNEMISE MUDELKATSE
|
1. METOODIKA
Käesolev metoodika on samaväärne standardiga OECD TG 309 (2004) (1).
1.1. SISSEJUHATUS
Käesoleva katse eesmärk on mõõta uuritava aine biolagunemise sõltuvust ajast aeroobses looduslikus vees madalatel kontsentratsioonidel ja väljendada mõõtmistulemused kineetiliste seoste vormis. Kõnesolev mudelkatse on laboratoorne loksutatavas kolvis läbiviidav portskatse, millega saab määrata orgaanilise aine aeroobse biolagunemise kiiruse loodusliku pinnavee (mage-, riim- või merevee) proovides. Metoodika põhineb standardil ISO/DIS 14592–1 (2), kuid sisaldab ka metoodikate C.23 ja C.24 elemente (3, 4). Uuritava mikrokosmi seisundi halvenemise vältimiseks võib pika katseaja korral asendada portsrežiimi poolpideva režiimiga, kuid see ei ole kohustuslik. Mudelkatse peamine eesmärk on määrata uuritava aine mineraliseerumine pinnavees ja esitada selle alusel lagunemise kineetika. Katse teine (mittekohustuslik) eesmärk võib olla teabe saamine esmase lagunemise ja oluliste muundumissaaduste kohta. Muundumissaaduste kindlakstegemine ja võimaluse korral nende sisalduse määramine on eriti oluline väga aeglaselt mineraliseeruvate ainete puhul (ained, mille 14C-märgisega jäägi üldine poolestusaeg on üle 60 ööpäeva). Oluliste muundumissaaduste kindlakstegemiseks ja mõõtmiseks tuleb analüüsimeetodite piiratud võimaluste tõttu kasutada tavaliselt kõrgemaid uuritava aine kontsentratsioone (> 100 μg/l).
Kõnesoleva katse puhul tähendab madal kontsentratsioon uuritava aine sisaldust (1–100 μg/l), mis on nii madal, et katses saadud biolagunemise kineetika võiks kajastada eeldatavat kineetikat keskkonnas. Looduslikus katsevees leiduvate biolagundatavate süsiniksubstraatide üldmassiga võrreldes on madala kontsentratsiooniga uuritav aine sekundaarne substraat. Sellest järeldub, et biolagunemise kineetika on eeldatavalt esimest järku („ilma kasvuta kineetika”) ja uuritav aine laguneb „kometabolismi” teel. Esimest järku kineetika tähendab, et lagunemise kiirus (mg/l/ööpäev) on aja jooksul väheneva substraadi kontsentratsiooniga võrdeline. Tõelise esimest järku kineetika puhul on konkreetse aine lagunemise kiiruskonstant k sõltumatu ajast ja kontsentratsioonist. See tähendab, et k ei muutu märkimisväärselt katse jooksul ja on samasugune ka kõrgematel kontsentratsioonidel läbiviidud eri katsete puhul. Definitsiooni järgi on lagunemise kiiruskonstant k võrdne kontsentratsiooni suhtelise muutusega ajaühiku kohta: k = (1/C) · (dC/dt). Kuigi ettenähtud tingimustes on eeldatav kineetika tavaliselt esimest järku, võib esineda teatavaid olukordi, kus andmeid kirjeldab paremini muud tüüpi kineetika. Kõrvalekalle esimest järku kineetikast võib ilmneda näiteks siis, kui biomuundumist ei limiteeri bioloogilise reaktsiooni kiirus, vaid mingi massiülekande nähtus, nagu difusiooni kiirus. Siiski võib katseandmeid peaaegu alati kirjeldada pseudo-esimest järku kineetika abil, kui eeldada, et kiiruskonstant sõltub kontsentratsioonist.
Katseplaani koostamise ja tulemuste tõlgendamise hõlbustamiseks peavad enne katset olemas olema (nt standardsetest sõelkatsetest saadud) andmed uuritava aine biolagundatavuse kohta kõrgematel kontsentratsioonidel, abiootilise lagundatavuse, muundumissaaduste ja oluliste füüsikalis-keemiliste omaduste kohta. Täieliku biolagundatavuse määramiseks kasutatakse 14C-märgisega uuritavat ainet ja määratakse 14C jaotumine faaside vahel katse lõpus. Märgiseta uuritava aine puhul saab täielikku biolagundatavust määrata ainult kõrgete kontsentratsioonide kasutamisel ja tingimusel, et kõik olulised muundumissaadused on teada.
1.2. MÕISTED
Esmane biolagunemine on keemilise aine struktuuri muutumine (muundumine) mikroorganismide toimel, mille tulemusel aine kaotab oma keemilise identiteedi.
Funktsionaalne biolagunemine on keemilise aine struktuuri muutumine (muundumine) mikroorganismide toimel, mille tulemusena aine kaotab teatava omaduse.
Täielik aeroobne biolagunemine on hapniku juuresolekul mikroorganismide abil toimuv keemilise aine lagunemine (mineraliseerumine) süsinikdioksiidiks, veeks ja muude aines esinevate elementide anorgaanilisteks sooladeks ning uute mikrobioloogilise sünteesi produktide ja biomassi teke.
Mineraliseerumine on keemilise aine või orgaanilise materjali lagunemine süsinikdioksiidiks, veeks ja muude aines esinevate elementide anorgaanilisteks sooladeks mikroorganismide toimel.
Ootefaas on aeg katse algusest kuni hetkeni, millal lagundava toimega mikroorganismid on kohanenud ja keemilise aine või orgaanilise materjali biolagunemine on jõudnud avastatava tasemeni (10 protsendini maksimaalsest teoreetilisest lagunemisest või vähem, olenevalt mõõtemeetodi täpsusest).
Maksimaalne biolagunemise tase on keemilise aine või orgaanilise materjali katses registreeritud biolagunemise määr protsentides, millest edasi biolagunemine katses enam ei lähe.
Primaarne substraat on looduslike süsiniku- ja energiaallikate kogum, mis tagab mikroorganismide biomassi kasvu ja elutegevuse.
Sekundaarne substraat on nii madala kontsentratsiooniga substraadikomponent, et selle lagundamisest saavad asjaomased mikroorganismid üksnes tähtsusetu koguse süsinikku ja energiat, võrreldes süsiniku- ja energiakogusega, mille nad saavad substraadi peamiste komponentide (primaarsete substraatide) lagundamisest.
Lagunemise kiiruskonstant on esimest või pseudo-esimest järku kiiruskonstant k (ööpäev–1), mis näitab lagunemise kiirust. Portskatses määratakse k pärast ootefaasi saadud lagunemiskõvera esimese osa alusel.
Poolestusaeg t1/2 (ööpäev) on mõiste, mida kasutatakse esimest järku reaktsiooni kiiruse iseloomustamiseks. See on aeg, mille jooksul aine kontsentratsioon väheneb kaks korda. Poolestusaeg ja lagunemise kiiruskonstant on seotud valemiga t1/2 = ln2/k.
Poollagunemisaeg, DT50 (ööpäev) on mõiste, mida kasutatakse biolagunemiskatse tulemuse väljendamiseks. See on 50-protsendiliseks biolagunemiseks vajalik aeg (koos ootefaasiga).
Avastamislävi ja mõõtmislävi. Avastamislävi on aine kontsentratsioon, millest madalamal väärtusel ei saa aine identsust tõendavat signaali eristada analüüsi artefaktidest. Mõõtmislävi on aine kontsentratsioon, millest madalamal väärtusel ei saa kontsentratsiooni määrata nõutava täpsusega.
Lahustunud orgaaniline süsinik on veeproovis leiduva orgaanilise süsiniku osa, mida ei saa eemaldada teatava faaside eraldamisviisi abil, näiteks tsentrifuugimisega 40 000 ms–2 juures 15 minuti jooksul või filtrimisega läbi membraani, mille poori läbimõõt on 0,2–0,45 μm.
Orgaanilise 14C üldaktiivsus on orgaanilise süsinikuga seotud 14C üldaktiivsus.
Lahustunud orgaanilise 14C aktiivsus on lahustunud orgaanilise süsinikuga seotud 14C üldaktiivsus.
Tahkete osakestega seotud orgaanilise 14C aktiivsus on tahkete osakestega seotud orgaanilise 14C üldaktiivsus.
1.3. KATSE RAKENDATAVUS
Kõnesolev mudelkatse on rakendatav lendumatu või vähelenduva orgaanilise aine madalate kontsentratsioonide puhul. Atmosfääriõhule avatud kolvi (nt puuvillvatikorgiga kolvi) puhul võib praktiliselt lendumatuks pidada ainet, mille Henry konstant on väiksem kui umbes 1 Pa·m3/mol (umbes 10–5 atm·m3/mol). Kui kasutatakse suletud kolbi vaba ruumiga ülaosas, on võimalik uurida ka vähelenduvaid aineid (Henry konstant < 100 Pa·m3/mol või < 10–3 atm·m3/mol), ilma et süsteemist läheks ainet kaduma. Kui CO2 eemaldamisel ei kasutata vajalikke ettevaatusabinõusid, võib 14C-märgisega ainet siiski kaotsi minna. Sel juhul võib olla vaja püüda CO2 leelist sisaldavasse siseabsorberisse või kasutada välist CO2 absorberit (otsene 14CO2 määramine, vt 3. liide). Biolagunemise kineetika määramiseks peab uuritava aine kontsentratsioon olema madalam selle aine lahustuvusest vees. Tuleb siiski märkida, et kirjanduses esitatud vesilahustuvus võib olla oluliselt suurem uuritava aine lahustuvusest looduslikus vees. Väga halvasti lahustuva uuritava aine puhul võib lahustuvuse määramiseks kasutada sama vett, mida kasutatakse katses, kuid see ei ole kohustuslik.
Käesolevat metoodikat võib kasutada biolagunemise modelleerimiseks suuremaid osakesi mittesisaldavas pinnavees („pelaagiline katse”) või häguses pinnavees, mis võib esineda vee ja sette piirpinna läheduses (hõljumikatse).
1.4. KATSE PÕHIMÕTE
Portskatses inkubeeritakse uuritavat ainet kas ainult pinnavees (pelaagiline katse) või pinnavees, millele on lisatud hõljuvainet (hõljumit) ja/või setet, nii et selle kuivmassi sisaldus on 0,01–1 g/l (hõljumikatse); viimasel juhul modelleeritakse veekogu, milles on hõljumit või taassuspendeeritud setet. Enamasti on pinnavee hõljumi ja/või hõljuvsette sisaldus eespool märgitud vahemiku madalamas osas. Katsekolbe inkubeeritakse valguse juurdepääsuta keskkonnatemperatuuril aeroobsetes tingimustes, segamisega. Lagunemise kineetika määratakse vähemalt kahel uuritava aine kontsentratsioonil. Kontsentratsioonid peavad teineteisest erinema 5–10 korda ja vastama uuritava aine eeldatavale kontsentratsioonivahemikule keskkonnas. Uuritava aine maksimaalne kontsentratsioon ei tohi ületada 100 µg/l ja on parem, kui see on alla 10 µg/l, kuna sel puhul vastab biolagunemine esimest järku kineetikale. Minimaalne kontsentratsioon ei tohi ületada 10 µg/l ja on parem, kui see on 1–2 μg/l või isegi madalam kui 1 μg/l. Müügilolevate 14C-märgisega ainete kasutamisel saab nii madalaid kontsentratsioone tavaliselt hästi määrata. Muude analüüsimeetodite piiratud võimaluste tõttu on sageli võimatu mõõta uuritava aine kontsentratsiooni vajaliku täpsusega, kui selle algkontsentratsioon on ≤ 100 µg/l (vt punkt 1.7.2, teine lõik). Kui ei ole piisavalt madala avastamislävega analüüsimeetodit, siis võib oluliste muundumissaaduste identifitseerimiseks ja sisalduse mõõtmiseks kasutada uuritava aine kõrgemaid kontsentratsioone (> 100 µg/l, mõnikord > 1 mg/l). Kui kasutatakse uuritava aine kõrget kontsentratsiooni, siis ei saa katsetulemustest võib-olla hinnata lagunemise esimest järku kiiruskonstanti ja poolestusaega, kuna lagunemine tõenäoliselt ei vasta esimest järku kineetikale.
Lagunemist registreeritakse sobiva aja tagant, mõõtes kas 14C jääkaktiivsust või (kui kasutatakse spetsiifilist keemilist analüüsi) uuritava aine jääkkontsentratsiooni. Kõige stabiilsema molekuliosa märgistamine 14C-ga võimaldab mõõta täielikku mineraliseerumist, samas kui vähem stabiilse molekuliosa märgistamine 14C-ga või spetsiifilise analüüsimeetodi kasutamine võimaldab hinnata esmast biolagunemist. Kõige stabiilsem molekuliosa ei pruugi siiski sisaldada olulist funktsionaalosa, mida võib seostada aine teatava eriomadusega, nagu toksilisus, bioakumulatsioon jne. Selle eriomaduse kao jälgimiseks võib niisugusel juhul olla vaja kasutada 14C-märgistatud funktsionaalosaga uuritavat ainet.
1.5. ANDMED UURITAVA AINE KOHTA
Käesolevas katses võib kasutada nii radioaktiivse märgisega kui ka märgiseta aineid. Soovitatakse kasutada märgistamist 14C-ga, kusjuures märgis peab tavaliselt asuma kõige stabiilsemas (stabiilsemates) molekuli osas (osades) (vt ka punkt 1.4). Rohkem kui ühe aromaatse tsükliga molekulis on soovitatav märgistada 14C-ga üks või mitu süsinikku igas tsüklis. Lisaks on soovitatav märgistada 14C-ga üks või mitu süsinikku mõlemal pool kergesti lõhustatavat sidet. Uuritava aine keemiline ja radiokeemiline puhtusaste peab olema > 95 %. Et hõlbustada 14C mõõtmist madala algkontsentratsiooniga katsetes, kasutatakse radiomärgisega aineid, mille eriaktiivsus on eelistatavalt umbes 50 μCi/mg (1,85 MBq) või kõrgem. Uuritava aine kohta on vaja teada järgmist:
|
—
|
lahustuvus vees [metoodika A.6];
|
|
—
|
lahustuvus orgaanilises (orgaanilistes) lahustis (lahustites) (aine puhul, mida lisatakse lahustis või mis lahustub vees halvasti);
|
|
—
|
dissotsiatsioonikonstant (pKa), kui aine seob või loovutab kergesti prootoneid [OECD TG 112] (5);
|
|
—
|
aururõhk [metoodika A.4] ja Henry konstant;
|
|
—
|
keemiline püsivus vees valguse juurdepääsuta (hüdrolüüs) [metoodika C.7].
|
Kui uuritakse vees vähelahustuva aine lagunemist merevees, võib olla kasulik teada ka soolamiskonstanti (Setšenovi konstant) Ks, mis on määratud valemiga log(S/S') = Ks Cm, kus S ja S' on aine lahustuvus vastavalt magedas vees ja merevees ja Cm on soola molaarne kontsentratsioon.
Hõljumikatse puhul on vaja teada ka järgmist:
|
—
|
jaotuskoefitsient süsteemis n-oktanool-vesi [metoodika A.8];
|
|
—
|
adsorptsioonikoefitsient [metoodika C.18].
|
Kasulik on teada veel järgmist:
|
—
|
uuritava aine kontsentratsioon keskkonnas, kui see on teada või seda on hinnatud;
|
|
—
|
uuritava aine toksilisus mikroorganismidele [metoodika C.11];
|
|
—
|
kergbiolagundatavus ja/või loomulik biolagundatavus [metoodikad C.4 A–F, C.12, C.9, OECD TG 302 (5)];
|
|
—
|
aeroobne või anaeroobne biolagundatavus mullas ja muundumiskatsed süsteemis setted-vesi [metoodikad C.23, C.24].
|
1.6. STANDARDAINE
Tavaliselt kasutatakse standardainena aeroobsetes tingimustes kergesti biolagundatavat ainet (nt aniliin või naatriumbensoaat). Aniliini ja naatriumbensoaadi eeldatav biolagunemise aeg on tavaliselt alla kahe nädala. Standardainega kontrollitakse, et katses kasutatava vee mikroorganismide aktiivsus oleks teatavates piirides, st et vees oleks aktiivne mikroorganismide populatsioon.
1.7. KVALITEEDIKRITEERIUMID
1.7.1. Saagis
Pärast uuritava aine lisamist kontrollitakse iga katsetatavat algkontsentratsiooni kohe 14C aktiivsuse mõõtmisega või, märgistamata aine puhul, keemilise analüüsiga vähemalt kahes paralleelproovis. Nii saadakse andmeid asjaomase analüüsimeetodi rakendatavuse ja korratavuse ning uuritava aine jaotuse ühtluse kohta. Edasisel andmete analüüsil ei kasutata tavaliselt nominaalset kontsentratsiooni, vaid mõõdetud 14C algaktiivsust või uuritava aine algkontsentratsiooni, kuna sellega kompenseeritakse sorptsioonist tingitud ainekaod ja doseerimisvead. 14C-märgisega uuritava aine korral võib aine saagise katse lõpus leida massibilansi koostamisega (vt punkt 1.8.9.4, viimane lõik). Paremal juhul on radiomärgisega aine massibilansist leitud saagis 90–110 %, samas kui radiomärgiseta aine saagis on olenevalt analüüsimeetodi täpsusest 70–110 %. Neid vahemikke ei tule pidada katse nõuetele vastavuse kriteeriumideks; neid tuleb tõlgendada sihtvahemikena. Analüüsi täpsuse võib määrata ka algkontsentratsioonist madalamal uuritava aine kontsentratsioonil ning oluliste muundumissaaduste puhul, kuid see ei ole kohustuslik.
1.7.2. Analüüsimeetodi korratavus ja tundlikkus
Et kontrollida analüüsimeetodi korratavust uuritava aine ja, vajaduse korral, muundumissaaduste sisalduse mõõtmisel (kaasa arvatud esmase ekstraheerimise tõhusus), tehakse viis pinnavee üksikekstraktide paralleelanalüüsi.
Võimaluse korral ei tohiks uuritava aine ja muundumissaaduste puhul analüüsimeetodi avastamislävi olla kõrgem kui 1 % katsesüsteemi lisatud aine algkontsentratsioonist. Mõõtmislävi ei tohiks ületada 10 % algkontsentratsioonist. Paljude orgaaniliste ainete ja nende muundumissaaduste keemiliseks analüüsiks on sageli vaja, et lisatud uuritava aine algkontsentratsioon oleks suhteliselt kõrge (> 100 μg/l).
1.8. KATSEMEETODI KIRJELDUS
1.8.1. Seadmed
Katse tehakse vajaliku mahuga (nt 0,5- või 1,0-liitristes) silikoon- või kummikorgiga suletud koonilistes kolbides, silindrikujulistes pudelites või CO2-kindlalt (nt butüülkummist septumiga) suletud seerumipudelites. Üks võimalus on teha katse suure arvu nõudega ja võtta igal proovivõtuajal prooviks vähemalt kahe paralleelnõu kogu sisu (vt punkt 1.8.9.1, viimane lõik). Radiomärgiseta lendumatu uuritava aine korral ei ole gaasikindel kork või septum vajalik, selle asemel sobib mittetihe puuvillvatikork, mille abil välditakse saastumist õhu kaudu (vt punkt 1.8.9.1, teine lõik). Vähelenduvaid aineid katsetatakse biomeetrilaadses seadmes, milles veepinda nõrgalt segatakse. Baktersaaste vältimiseks võib katsenõu enne kasutamist steriliseerida kuumutamise või autoklaavimisega, kuid see ei ole kohustuslik. Lisaks sellele kasutatakse järgmisi tavalisi laboriseadmeid:
|
—
|
plaatloksuti või magnetsegajad katsenõude pidevaks segamiseks;
|
|
—
|
turbidimeeter hägususe nefelomeetriliseks määramiseks;
|
|
—
|
ahi või mikrolaineahi kuivmassi määramiseks;
|
|
—
|
membraanfiltrimise seade;
|
|
—
|
autoklaav või ahi klaasnõude kuumsteriliseerimiseks;
|
|
—
|
vahendid 14C-märgisega aine käitlemiseks;
|
|
—
|
seade 14C aktiivsuse mõõtmiseks süsinikdioksiidi neelavast lahusest võetud proovis ja vajaduse korral setteproovis;
|
|
—
|
analüüsiseade uuritava ja standardaine määramiseks, kui kasutatakse spetsiifilist keemilist analüüsi (nt gaasikromatograaf, kõrgefektiivne vedelikkromatograaf).
|
1.8.2. Uuritava aine põhilahus
Uuritava ja standardaine põhilahuste valmistamiseks kasutatakse deioniseeritud vett (vt punkt 1.8.7, esimene lõik). Deioniseeritud vesi ei tohi sisaldada mikroorganismidele mürgiseid aineid ning üle 1 mg/l lahustunud orgaanilist süsinikku (6).
1.8.3. Pinnavee võtmine ja vedu
Pinnavee võtmise koht valitakse igal konkreetsel juhtumil vastavalt katse eesmärgile. Veevõtukoha valikul tuleb arvestada võimalikke varasemaid põllumajanduse, tööstuse või olmemõjusid. Kui on teada, et eelneva nelja aasta jooksul saastati veekogu uuritava ainega või selle struktuurianaloogidega, ei tohi sellest veekogust katsevett võtta, välja arvatud juhul, kui uurija eesmärk ongi lagunemiskiiruse kindlakstegemine eelnevalt saasteainega kokku puutunud keskkonnas. Veevõtukohas mõõdetakse vee pH ja temperatuur. Registreeritakse proovivõtu sügavus ja antakse veeproovi väline iseloomustus (nt värvus ja hägusus) (vt punkt 3). Aeroobsete tingimuste olemasolu tõendamiseks mõõdetakse hapnikusisaldus ja/või redokspotentsiaal vees ja setete pinnakihis, kui aeroobsete tingimuste olemasolu ei ole ilmne juba eelnevast kogemusest ning veevõtukoha laadist. Pinnavett veetakse täiesti puhtas nõus. Transpordi ajal ei tohi proovi temperatuur oluliselt ületada katsetemperatuuri. Kui vedu kestab üle 2–3 tunni, soovitatakse proov jahutada temperatuurini 4 °C. Veeproovi ei tohi külmutada.
1.8.4. Pinnavee hoidmine ja ettevalmistamine
Katset on parem alustada üks ööpäev pärast proovivõttu. Kui vett on vaja säilitada, peab säilitusaeg olema võimalikult lühike ja ei tohi ületada nelja nädalat. Säilitamisel aereeritakse veeproovi 4 °C juures kuni kasutamiseni. Enne kasutamist kõrvaldatakse veeproovist suuremad tahked osakesed näiteks filtrimisega läbi nailonfiltri, mille ava läbimõõt on umbes 100 μm, läbi suurepoorilise paberfiltri või sadestamisega.
1.8.5. Sette lisamine veele (mittekohustuslik)
Hõljumikatseks vajaliku suspensiooni saamiseks lisatakse looduslikku vett sisaldavasse nõusse pindmist setet (mis on filtritud suuremate tahkete osakeste eemaldamiseks vastavalt punktile 1.8.4); suspendeeritud tahke aine sisaldus peab olema vahemikus 0,01–1 g/l. Pindmine sete peab pärinema veeprooviga samast kohast. Olenevalt konkreetsest veekeskkonnast võib pindmine sete olla suure orgaanilise süsiniku sisalduse (2,5–7,5 %) ja peeneteralise lõimisega või väikese orgaanilise süsiniku sisalduse (0,5–2,5 %) ja jämeteralise lõimisega (3). Pindmine sete valmistatakse ette järgmiselt: läbipaistva plasttoru abil võetakse mitu settesüdamikku; kohe pärast proovi võtmist lõigatakse ära iga südamiku ülemine aeroobne osa (kuni 5 mm paksune pindmine kiht) ja segatakse need osad kokku. Saadud setteproovi transporditakse nõus, mille ülaosas on palju õhuga täidetud ruumi, mis tagab settele aeroobsed tingimused (kui vedu kestab üle 2–3 tunni, jahutatakse nõu temperatuurini 4 °C). Setteproov suspendeeritakse uuritavas vees, nii et proovi ja vee suhe oleks 1:10, ja hõljumit aereeritakse 4 °C juures kuni kasutamiseni. Kui setet on vaja säilitada, peab säilitusaeg olema võimalikult lühike ega tohi ületada nelja nädalat.
1.8.6. Poolpidev menetlus (mittekohustuslik)
Kui uuritava aine olulist lagunemist on võimalik mõõta alles pärast pika ootefaasi möödumist, võib olla vajalik pikk inkubatsiooniperiood (mitu kuud). Kui see on teada uuritava ainega tehtud eelkatsetest, võib katse alguses kasutada poolpidevat režiimi, milles osa katsevett või hõljumit perioodiliselt uuendatakse (vt 2. liide). Teine võimalus on muuta tavaline portskatse poolpidevaks pärast seda, kui umbes 60 katsepäevaga ei ole portsrežiimis saavutatud uuritava aine lagunemist (vt punkt 1.8.8.3, teine lõik).
1.8.7. Uuritava aine (või standardaine) lisamine
Kui uuritav aine lahustub vees hästi (> 1 mg/l) ja on vähelenduv (Henry konstant < 1 Pa·m3/mol või < 10–5 atm·m3/mol), võib põhilahuse valmistada deioniseeritud vees (vt punkt 1.8.2); vajaliku kontsentratsiooni saamiseks lisatakse katsenõusse vajalik maht põhilahust. Lisatava põhilahuse maht peab olema võimalikult väike (< 10 % vedeliku lõppmahust, kui võimalik). Teine võimalus on lahustada uuritav aine suuremas mahus katsevees, seda võib käsitleda alternatiivina orgaanilise lahusti kasutamisele.
Äärmisel juhul võib lendumatu vähelahustuva aine põhilahuse valmistada lenduvas orgaanilises lahustis, kuid katsesüsteemi lisatava lahusti kogus ei tohi ületada 1 mahuprotsenti ja pärssida mikroorganismide aktiivsust. Lahusti ei tohi mõjutada uuritava aine stabiilsust vees. Lahusti eemaldatakse, kuni lahusesse jääv väga väike lahustikogus enam oluliselt ei suurenda lahustunud orgaanilise süsiniku sisaldust katsevees või -hõljumis. Selle kontrollimiseks tehakse ainespetsiifiline analüüs või, võimaluse korral, lahustunud orgaanilise süsiniku analüüs (6). Lisatava lahusti kogus peab olema võimalikult väike ja uuritav aine peab olema täielikult lahustunud katsevee lõppmahus. Uuritava aine lisamiseks katsenõusse võib kasutada ka teisi publikatsioonides (7, 8) kirjeldatud võtteid. Kui uuritava aine lisamiseks kasutatakse orgaanilist lahustit, tuleb lahusti mõju kontrolliks ette nähtud katseveega nõu (mis ei sisalda lisatud aineid) ja katseveega nõu, mis sisaldab lisatud standardainet, käidelda samal viisil kui tegelikku katsenõu, millesse on lisatud kandelahustis lahustatud uuritav aine. Lahusti mõju kontrollimise eesmärk on standardaine lagunemiskiiruse jälgimisega näidata, et lahusti ei pärsi mikroorganismide populatsiooni.
1.8.8. Katsetingimused
1.8.8.1. Katsetemperatuur
Inkubeerimine toimub (eelistatavalt) valguse juurdepääsuta või hajuvalguses püsival temperatuuril (± 2 °C), milleks võib olla välistemperatuur või standardtemperatuur (20–25 °C). Välistemperatuur võib olla kas tegelik proovi temperatuur proovi võtmisel või proovivõtukoha keskmine temperatuur.
1.8.8.2. Loksutamine või segamine
Et tahked osakesed ja mikroorganismid püsiksid hõljumis, tuleb katsenõu pidevalt loksutada või segada. Loksutamine või segamine soodustab ka hapniku transporti nõus olevast õhust vedelikku, mis tagab nõutavate aeroobsete tingimuste püsimise. Katsenõud asetatakse plaatloksutile (ligikaudu 100 võnget minutis) või magnetsegajale. Loksutamine või segamine peab olema pidev. Loksutamine või segamine peab olema võimalikult nõrk, kuid tagama homogeense suspensiooni püsimise.
1.8.8.3. Katse kestus
Katse kestab tavaliselt kuni 60 ööpäeva, välja arvatud juhul, kui kasutatakse poolpidevat režiimi, milles katsehõljumit perioodiliselt uuendatakse (vt punkt 1.8.6 ja 2. liide). Kui uuritava aine lagunemine algab 60 esimese katsepäeva jooksul, võib portskatset siiski pikendada kuni 90 ööpäevani. Lagunemist kontrollitakse vajaliku aja tagant lahuses oleva 14C jääkaktiivsuse või eraldunud 14CO2 aktiivsuse määramisega (punkt 1.8.9.4) ja/või keemilise analüüsiga (punkt 1.8.9.5). Inkubatsiooniaeg peab olema piisav lagunemisprotsessi hindamiseks. Oleks hea, kui katses laguneks üle 50 % ainest; aeglaselt laguneva aine korral peab lagunema piisavalt palju (tavaliselt üle 20 %) ainet selleks, et hinnata lagunemise kiiruskonstanti.
Katsesüsteemis mõõdetakse korduvalt pH-d ja hapnikusisaldust, kui eelnevad samalaadsed katsed samast kohast võetud vee- ja setteproovidega ei ole näidanud, et sellist kontrollimist ei ole vaja. Mõnikord võib vees või settes palju kõrgemas kontsentratsioonis olevate primaarsete substraatide tarbimine põhjustada nii rohket CO2 eraldumist ja hapnikukulu, et katse jooksul muutuvad oluliselt katsetingimused.
1.8.9. Katse läbiviimine
1.8.9.1. Nõude ettevalmistamine pelaagiliseks katseks
Katsenõudesse pannakse sobiv kogus katsevett, nii et ligikaudu üks kolmandik nõu mahust oleks täidetud ja igas nõus oleks vähemalt 100 ml vett. Kui katse tehakse suure arvu nõudega (ja igal proovivõtuajal võetakse prooviks teatavate katsenõude kogu sisu), on katsevee vajalik maht samuti umbes 100 ml, sest liiga väike proovi maht võib mõjutada ootefaasi pikkust. Uuritav aine lisatakse põhilahusena, nagu on kirjeldatud punktides 1.8.2 ja 1.8.7. Lagunemise kineetika määramiseks ja lagunemise kiiruskonstandi arvutamiseks kasutatakse vähemalt kahte uuritava aine kontsentratsiooni, mille väärtused erinevad 5–10 korda. Mõlemad kontsentratsioonid peavad olema alla 100 µg/l ja eelistatavalt vahemikus 1–10 µg/l.
Katsenõud suletakse õhu- ja CO2-kindla korgi või kaanega. 14C-märgiseta lendumatu uuritava aine korral sobib mittetihe puuvillvatikork, mis hoiab ära saastumise õhu kaudu (vt punkt 1.8.1); seejuures peavad võimalikud peamised lagunemisproduktid olema teadaolevalt lendumatud ning CO2 määratakse kaudselt (vt 3. liide).
Katsenõusid inkubeeritakse valitud temperatuuril (vt punkt 1.8.8.1). Keemiliseks analüüsiks või 14C mõõtmisteks võetakse proovid katse alguses (enne biolagunemise algust; vt punkt 1.7.1) ja seejärel katse jooksul sobiva aja tagant. Proovivõtt seisneb kas igast paralleelnõust osaproovide võtmises (5 ml alikvoodid) või igal proovivõtuajal kogu katsenõu sisu ärakasutamises. Uuritava aine mineraliseerumist võib määrata kas kaudselt või otse (vt 3. liide). Kiiruskonstandi usaldusväärse hinnangu saamiseks on tavaliselt vaja lagunemisfaasi jooksul (pärast ootefaasi lõppu) võtta proovid vähemalt viie andmepunkti jaoks; kiiresti laguneva aine korral võib piirduda kolme punktiga, kui saab tõendada, et neist piisab. Kui uuritav aine ei lagune kiiresti, on lagunemisfaasi ajal kerge teha ka rohkem mõõtmisi, sellepärast tuleks kineetilise konstandi hindamiseks kasutada rohkem andmepunkte. Kuna biolagunemise kiirused on erinevad, ei saa kindlat proovivõtu ajagraafikut ette anda; aeglase lagunemise korral soovitatakse siiski võtta proove üks kord nädalas. Kui uuritav aine on kiiresti biolagundatav, tuleb kolmel esimesel katsepäeval võtta proov iga päev ja seejärel igal teisel või kolmandal päeval. Mõnikord, näiteks kui aine hüdrolüüsub väga kiiresti, võib olla vaja võtta proove iga tunni tagant. Enne katset soovitatakse teha eeluuring sobivate proovivõtuaegade kindlaksmääramiseks. Kui proove on vaja ka edasisteks keemilisteks analüüsideks, on soovitatav võtta rohkem proove ja seejärel valida katse lõpus analüüsitavad proovid tagurpidises järjekorras, st viimaseid proove analüüsitakse esimestena (proovide stabiilsuse tagamise kohta säilitamise ajal vt punkt 1.8.9.5, teine lõik).
1.8.9.2. Katsenõude ja proovide arv
Valmistatakse ette piisav arv katsenõusid, et oleksid:
|
—
|
katsenõud: vähemalt kaks (parem kolm) paralleelnõu igal uuritava aine kontsentratsioonil või (kui prooviks võetakse teatavate katsenõude kogu sisu) suur arv katsenõusid igal kontsentratsioonil (nõu tähis on FT);
|
|
—
|
katsenõud massibilansi arvutamiseks: vähemalt kaks paralleelnõu igal uuritava aine kontsentratsioonil (nõu tähis on FM);
|
|
—
|
ilma uuritava aineta pimekatsenõu: vähemalt üks ainult katsevett sisaldav pimekatsenõu (nõu tähis on FB);
|
|
—
|
standardainega kontrollnõud: kaks paralleelnõu standardainega (nt aniliin või naatriumbensoaat, 10 µg/l) (nõu tähis on FC). Standardainega kontrollnõusid on vaja minimaalse mikroorganismide aktiivsuse olemasolu kinnitamiseks. Kui see on otstarbekohane, võib radiomärgisega standardainet kasutada ka siis, kui uuritava aine lagunemist jälgitakse keemilise analüüsiga;
|
|
—
|
steriilsed kontrollnõud: üks või kaks steriliseeritud katseveega nõu, et kontrollida uuritava aine võimalikku abiootilist lagunemist või muud mittebioloogilist kadu (nõu tähis on FS). Bioloogilise aktiivsuse võib kõrvaldada katsevee autoklaavimise (121 °C, 20 minutit), mürgi lisamise (nt naatriumasiid (NaN3), 10–20 g/l, elavhõbe(II)kloriid, HgCl2, 100 mg/l, või formaliin, 100 mg/l) või gammakiirituse abil. Kui kasutatakse HgCl2, tuleb katsete jäätmed kõrvaldada mürgiste jäätmete eeskirjade kohaselt. Kui veele on lisatud rohkesti setet, on steriilsust raske saavutada; sellisel juhul soovitatakse näiteks kolmekordset autoklaavimist. Tuleb arvestada, et autoklaavimine võib mõjutada sette sorptsiooniomadusi.
|
|
—
|
lahusti kontrollnõud, milles on katsevesi ja katsevesi standardainega: kaks paralleelnõu, mille sisule on lisatud lahustit samas koguses ja samal viisil kui uuritava aine lisamisel. Neid nõusid on vaja, et standardaine lagunemise määramisega kontrollida lahusti võimalikku kahjulikku mõju.
|
Katse planeerimisel peab uurija arvestama, et parem on teha rohkem paralleelkatseid kui suurendada proovivõtukordade arvu. Vajalike nõude täpne arv oleneb lagunemise mõõtmise meetodist (vt punkt 1.8.9.1, kolmas lõik; punkt 1.8.9.4 ja 3. liide).
Igal proovivõtuajal võetakse igast katsenõust kaks osaproovi (nt 5 ml alikvoodid). Kui kasutatakse suurt arvu nõusid ja prooviks võetakse katsenõu kogu sisu, moodustatakse iga proov vähemalt kahe nõu sisust (vt punkt 1.8.9.1, esimene lõige).
1.8.9.3. Nõude ettevalmistamine hõljumikatseks (mittekohustuslik)
Katsenõudesse lisatakse nõutav maht katsevett ja vajaduse korral setet (vt punkt 1.8.5). Hõljumikatse nõud valmistatakse ette samal viisil kui pelaagilise katse nõud (vt punktid 1.8.9.1 ja 1.8.9.2). Parem on kasutada seerumipudeleid või samalaadse kujuga nõusid. Suletud nõud asetatakse loksutile horisontaalselt. 14C-märgiseta lendumatu uuritava ainega avatud nõud pannakse muidugi püstasendisse; sel juhul soovitatakse kasutada magnetsegajat ja klaasiga kaetud magnetilisi segamispulkasid. Vajaduse korral aereeritakse pudeleid nõuetekohase õhustatuse tagamiseks.
1.8.9.4. Radiokeemiline määramine
Eraldunud 14CO2 mõõdetakse kaudselt ja otse (vt 3. liide). 14CO2 kaudseks määramiseks kasutatakse järgmist vahet: katsevees või -hõljumis leiduva 14C algaktiivsusest lahutatakse summaarne jääkaktiivsus proovivõtuhetkel, mis mõõdetakse pärast proovi pH viimist väärtuseni 2–3 ja CO2 eemaldamist. Kuna anorgaaniline süsinik eemaldatakse, pärineb mõõdetav jääkaktiivsus üksnes orgaanilisest materjalist. Kaudset 14CO2 määramist ei kasutata, kui uuritava aine olulised muundumissaadused on lenduvad (vt 3. liide). Võimaluse korral tuleb igal proovivõtul mõõta otse vähemalt ühest katsenõust eralduv 14CO2 (vt 3. liide); see meetod võimaldab kontrollida nii massibilanssi kui ka biolagunemist, kuid seda saab rakendada ainult suletud nõus tehtava katse korral.
Katse jooksul eraldunud 14CO2 otseseks mõõtmiseks valmistatakse katseks ette rohkem nõusid. Otsest 14CO2 määramist soovitatakse siis, kui uuritava aine olulised muundumissaadused on lenduvad. Iga andmepunkti saamiseks viiakse katsenõu sisu pH väärtuseni 2–3 ja 14CO2 kogutakse sise- või välisabsorberisse (vt 3. liide).
14C-märgisega uuritava aine ja oluliste muundumissaaduste kontsentratsioonid võib määrata kas radiokromatograafiliselt (õhukese kihi kromatograafia, radioloogiline õhukese kihi kromatograafia) või radiokeemilise detektsiooniga kõrgefektiivse vedelikkromatograafia abil.
Soovi korral võib määrata ka, kuidas on faaside vahel jaotunud jääkradioaktiivsus (vt 1. liide), lagunemata uuritav aine ja muundumissaadused.
Massibilansi kontrollimiseks mõõdetakse katse lõpus otseselt 14CO2, kasutades selleks eraldi katsenõu, millest ei ole katse käigus proove võetud (vt 3. liide).
1.8.9.5. Keemiline analüüs
Tundliku analüüsimeetodi olemasolu korral võib esmase biolagunemise hindamiseks kasutada radioaktiivse märgistamise asemel uuritava aine jääkkontsentratsiooni mõõtmist. Kui mineraliseerumise ulatuse mõõtmiseks kasutatakse radiomärgisega ainet, võib paralleelselt teha ka keemilise analüüsi, mis võimaldab saada lisateavet ja kontrollida meetodit. Keemilist analüüsi võib kasutada ka uuritava aine lagunemise käigus tekkinud muundumissaaduste mõõtmiseks, seda soovitatakse ainete puhul, mille mineraliseerumise poolestusaeg on üle 60 ööpäeva. Igal proovivõtukorral mõõdetakse ning registreeritakse (absoluutsetes ühikutes ja protsendina algsisaldusest) uuritava aine ja muundumissaaduste kontsentratsioonid. Üldiselt tuleb identifitseerida iga muundumissaadus, mille sisaldus teataval proovivõtukorral on ≥ 10 % uuritava aine algkontsentratsioonist; identifitseerimata jätmine peab olema mõistlikult põhjendatud. Kui teatava muundumissaaduse kontsentratsioon katse jooksul pidevalt kasvab, võib see osutada selle saaduse püsivusele; sellepärast tuleb kaaluda sellise saaduse identifitseerimist ka siis, kui selle kontsentratsioon ei ületa eespool märgitud piirmäära. Kui uuritav aine võib kiiresti abiootiliselt muunduda (nt hüdrolüüsuda), tuleb kaaluda muundumissaaduste analüüsimist steriilsete kontrollkatsete abil. Muundumissaaduste identifitseerimise ja sisalduse mõõtmise vajadust kaalutakse iga juhtumi puhul eraldi ja põhjendatakse katseprotokollis. Orgaanilise lahustiga ekstraheerimist rakendatakse asjaomase analüüsimeetodi juhiste kohaselt.
Kui analüüs toimub hiljemalt 24 tundi pärast proovi võtmist, hoitakse proovi õhukindlas nõus 2–4 °C juures (eelistatav). Pikemaks säilitamiseks külmutatakse proov temperatuurini alla –18 °C või konserveeritakse keemiliselt. Proovi konserveerimiseks ei soovitata hapestamist, sest hapestatud proov võib olla ebapüsiv. Kui proovi ei analüüsita 24 tunni jooksul ja seda on vaja kauem säilitada, tuleb teha säilivusuuring ja tõendada, et uuritavad keemilised ained on temperatuuril alla –18 °C või konserveeritult säilitamisel stabiilsed. Kui asjaomane analüüsimeetod hõlmab ekstraheerimist lahustiga või tahkefaas-ekstraheerimist, tuleb aine ekstraheerida kohe pärast proovi võtmist või pärast proovi säilitamist külmutatult kuni 24 tundi.
Analüüsimeetodi tundlikkusest olenevalt võib olla vaja võtta suuremaid proove, kui on märgitud punktis 1.8.1. Katset on kerge teha 2–3-liitristes nõudes: igasse nõusse pannakse 1 liiter katsevett ja võetakse umbes 100-milliliitriseid proove.
2. KATSEANDMED JA NENDE ESITAMINE
2.1. ANDMETE TÖÖTLEMINE
2.1.1. Andmete graafiline esitamine
Proovivõtuajad ümardatakse täistundideks (välja arvatud juhul, kui aine laguneb oluliselt minutite või tundide jooksul), mitte täisööpäevadeks. Uuritava aine jääkaktiivsuse (14C-märgisega aine) või jääkkontsentratsiooni (märgistamata aine) hinnatud väärtused esitatakse sõltuvalt ajast graafiliselt nii lineaarses kui ka poollogaritmilises skaalas (vt joonised 1a ja 1b). Kui on toimunud lagunemine, võrreldakse nõudega FT saadud tulemusi nendega, mis on saadud nõudega FS. Kui uuritava ainega nõude (FT) puhul saadud tulemuste keskväärtus erineb steriilsete nõudega (FS) saadud keskväärtusest vähem kui 10 %, võib oletada, et täheldatud lagunemine on valdavalt abiootiline. Kui lagunemise määr nõudes FS on väiksem, siis võib neid andmeid kasutada nõudes FT toimunud biolagunemise määra hindamisel parandina (vastav arv lahutatakse). Kui tehakse mittekohustuslik oluliste muundumissaaduste analüüs, esitatakse lisaks uuritava aine vähenemise graafikule ka muundumissaaduste tekkimist ja kadumist kajastavad graafikud.
Ootefaasi kestuse tL hindamiseks ekstrapoleeritakse lagunemiskõvera (poollogaritmilise graafiku) lineaarne osa null-lagunemise tasemeni või määratakse ligikaudu 10 % lagunemise aeg (vt joonised 1a ja 1b). Poollogaritmiliselt graafikult leitakse esimest järku kiiruskonstandi k ja selle standardhälbe hinnang, kasutades lineaarset regressiooni ln (14C jääkaktiivsus või uuritava aine jääkkontsentratsioon) vs. aeg. Eriti 14C mõõtmise puhul tuleb kasutada ainult neid andmeid, mis kuuluvad ootefaasile järgnevasse lagunemiskõvera esimesse lineaarsesse osasse; paljude suure määramatusega andmete asemel on parem koguda väiksem arv representatiivseid andmeid. Antud juhul hõlmab määramatus vigu, mis on seotud mõõdetud 14C jääkaktiivsuse soovitatud otsese kasutamisega (vt edaspidi). Kui lagunemine on kahefaasiline, on mõnikord vaja arvutada kaks kiiruskonstanti. Selleks määratakse kindlaks lagunemiskõvera kaks faasi. Kui ühest ja samast nõust võetakse osaproove, arvutatakse kiiruskonstant k ja poolestusaeg t½ = ln 2/k iga paralleelnõu jaoks eraldi; kui igal proovivõtukorral võetakse prooviks katsenõu kogu sisu, arvutatakse need parameetrid keskväärtuste alusel (vt punkt 1.8.9.2, viimane lõik). Esimese meetodi korral esitatakse iga paralleelnõu jaoks leitud kiiruskonstant ja poolestusaeg ning nende keskväärtused koos standardhälvetega. Uuritava aine kõrge kontsentratsiooni puhul võib lagunemiskõver (poollogaritmiline graafik) sirgjoonest märkimisväärselt kõrvale kalduda ja esimest järku kineetika ei kehti. Sel juhul ei ole poolestusaja määramisel mõtet. Piiratud andmevahemikus saab siiski rakendada pseudo-esimest järku kineetikat ja määrata poollagunemisaeg DT50 (aeg, mille jooksul laguneb 50 % ainest). Ent tuleb silmas pidada, et DT50 abil ei saa ennustada lagunemise ajalist kulgu väljaspool valitud andmevahemikku, sest DT50 iseloomustab ainult valitud andmekogumit. Kuna statistilisi arvutusi ja kõverate lähendamist hõlbustavad analüüsiprogrammid on kergesti kättesaadavad, on soovitatav kasutada asjaomast tarkvara.
Kui kasutatakse keemilist analüüsi, määratakse esmase lagunemise kiiruskonstant ja poolestusaeg samal viisil, nagu kirjeldati eespool mineraliseerumise üldmäära mõõtmise puhul. Kui esmane lagunemine on limiteeriv protsess, võib mõnikord kasutada ka lagunemise üldmäära iseloomustavaid andmepunkte. Seda võib teha, kuna 14C aktiivsuse mõõtmisest erinevalt on antud juhul otsene mõõtmine.
Kui kasutatakse 14C-märgisega ainet, koostatakse vähemalt katse lõpus massibilanss, mis väljendatakse lisatud aine algkontsentratsiooni protsentides.
2.1.2. Jääkaktiivsus
Orgaanilise aine 14C-märgisega osa lagunemisel läheb suurem osa isotoobist 14C üle 14CO2-ks; muu osa kasutatakse biomassi kasvatamiseks ja/või rakuväliste ainevahetussaaduste sünteesimiseks. Järelikult ei muundu aine täielikul „lõplikul” biolagunemisel kogu tema süsinik 14CO2-ks. Biosünteesi produktidesse seotud 14C vabaneb aeglaselt 14CO2-na hiljem toimuval teisesel mineraliseerumisel. Graafikutel, mis kajastavad orgaanilise 14C jääkaktiivsuse (mõõdetakse pärast CO2 eemaldamist) või eraldunud 14CO2 aktiivsuse sõltuvust ajast, esineb sellepärast pärast lagunemise lõppu järelfaas. See raskendab andmete kineetilist tõlgendamist ja sellepärast kasutatakse lagunemise kiiruskonstandi määramiseks tavaliselt ainult kõvera esimest osa, mis järgneb ootefaasile ja lõpeb enne, kui on lagunenud umbes 50 % ainest. Kui uuritav aine laguneb, on orgaanilise 14C üldine jääkaktiivsus alati suurem kui lagunemata uuritava ainega seotud 14C aktiivsus. Kui uuritava aine lagunemine on esimest järku reaktsioon ja CO2-ni mineraliseerub konstantne osa α, on 14C kadumise kõvera (summaarne orgaaniline 14C vs. aeg) algtõus võrdne α ja uuritava aine (täpsemalt, uuritava aine 14C-märgisega osa) kontsentratsiooni kajastava kõvera tõusu korrutisega. Järelikult, kui kasutatakse orgaanilise 14C summaarse aktiivsuse mõõtmise tulemusi ilma parandusteta, on arvutatud lagunemise kiiruskonstant tegelikust väiksem. Mitmesugustel lihtsustavatel eeldustel põhinevaid meetodeid, kuidas mõõdetud radiokeemilise aktiivsuse järgi hinnata uuritava aine kontsentratsiooni, on kirjeldatud reas publikatsioonides (2, 9, 10, 11). Neid meetodeid on kõige lihtsam kasutada kiiresti lagundatavate ainete puhul.
2.2. TULEMUSTE TÕLGENDAMINE
Kui selgub, et k ei olene lisatud aine kontsentratsioonist (st uuritava aine eri kontsentratsioonidel arvutatakse enam-vähem ühesugused k väärtused), siis võib järeldada, et see esimest järku kiiruskonstant tõesti kirjeldab seda reaktsiooni kasutatud katsetingimustes (uuritav aine, veeproov, katsetemperatuur). Kuivõrd saadud tulemust võib üldistada või ekstrapoleerida muudele süsteemidele, tuleb selgitada eksperdihinnanguga. Kui kasutatakse uuritava aine kõrget kontsentratsiooni ja lagunemine ei järgi esimest järku kineetikat, ei saa katseandmeid kasutada esimest järku kiiruskonstandi või vastava poolestusaja otseseks määramiseks. Uuritava aine kõrgel kontsentratsioonil saadud katseandmeid võib siiski kasutada mineraliseerumise üldmäära hindamiseks ja/või muundumissaaduste identifitseerimiseks ja kvantitatiivseks kirjeldamiseks.
Kui on teada, millise kiirusega toimuvad teised aine kadu põhjustavad protsessid peale biolagunemise (nt hüdrolüüs või lendumine), võib biolagunemise ligikaudse kiiruse hindamisel lahutada need kiirused katses mõõdetud üldkiirusest. Andmeid hüdrolüüsi kohta võib saada näiteks steriilsest kontrollkatsest või kõrgemal uuritava aine kontsentratsioonil tehtud paralleelkatsest.
14CO2 kaudset ja otsest määramist (punkt 1.8.9.4 ja 3. liide) võib kasutada ainult selleks, et mõõta uuritava aine mineraliseerumist CO2-ni. 14C-märgisega uuritava aine kontsentratsiooni ja oluliste muundumissaaduste tekke analüütiliseks määramiseks võib kasutada radiokromatograafiat (radioloogilist õhukese kihi kromatograafiat) või kõrgefektiivset vedelikkromatograafiat (punkt 1.8.9.4, kolmas lõik). Poolestusaega saab otse määrata juhul, kui lagunemisel ei teki olulisi muundumissaadusi (definitsiooni kohaselt loetakse oluliseks muundumissaaduseks ainet, mille kontsentratsioon on vähemalt 10 % uuritava aine algkontsentratsioonist). Kui sellised olulised muundumissaadused siiski tekivad, tuleb andmeid üksikasjalikult hinnata. Selleks võib olla vaja muundumissaadusi korduvalt määrata ja/või identifitseerida (vt punkt 1.8.9.5, esimene lõik), välja arvatud juhul, kui muundumissaaduste edasist käitumist saab kogemuste (nt lagunemisteed käsitlevate andmete) alusel põhjendatult hinnata. Kuna see, millises ulatuses uuritava aine süsinik muundub CO2-ks, sõltub oluliselt uuritava aine ja muude substraatide kontsentratsioonist, katsetingimustest ja mikroobikooslusest, ei saa kõnesoleva katsega, erinevalt lahustunud orgaanilise süsiniku kao mõõtmisest, otse määrata lõplikku biolagunemist, kuid tulemus on respiromeetrilise katse tulemusega sarnane. Mineraliseerumise määr on järelikult lõpliku biolagunemise minimaalsest tasemest väiksem või sellega võrdne. Täielikuma pildi saamiseks lõplikust biolagunemisest (mineraliseerumine ja sidumine biomassi) tehakse katse lõpus 14C faasijaotuse analüüs (vt 1. liide). Tahkete osakeste puuli seotud 14C jaguneb baktermassi seotud 14C-ks ja orgaanilistele tahketele osakestele sorbeerunud 14C-ks.
2.3. KATSE VASTAVUS NÕUETELE
Kui standardaine ei lagune eeldatud aja jooksul (aniliini ja naatriumbensoaadi eeldatav lagunemisaeg on tavaliselt alla kahe nädala), on katse nõuetelevastavus kaheldav ja vajab tõendamist; teine võimalus on korrata katset uue veeprooviga. Käesoleva meetodi kontrollimisel seitsme Euroopa labori vahelises ISO võrdluskatses oli aniliini lagunemise kiiruskonstandi väärtus 20 °C juures pärast kohanemisfaasi vahemikus 0,3–1,7 ööpäev–1, keskväärtus 0,8 ööpäev–1 ja standardhälve ±0,4 ööpäev–1 (t½ = 0,9 ööpäeva). Ootefaas oli tavaliselt 1–7 ööpäeva. Kontrollitud veeproovides registreeriti bakterbiomassi sisalduseks 103–104 kolooniaid moodustavat üksust ühes milliliitris. Toitainerikastes Kesk-Euroopa veeproovides oli lagunemiskiirus suurem kui Põhja-Euroopa oligotroofsetes veeproovides; see võib olla tingitud kas erinevast troofsusest või erinevustest varasemas kokkupuutumises keemiliste ainetega.
Radiomärgisega ainete korral peaks kogu määramissaagis (massibilanss) katse lõpus olema 90–110 %; märgiseta ainete korral peaks algfaasi määramissaagis katse alguses olema 70–110 %. Need saagisevahemikud on esitatud siiski üksnes sihtvahemikena ja neid ei tule kasutada katse nõuetele vastavuse kriteeriumina.
3. KATSEPROTOKOLL
Katseprotokollis märgitakse selgesti, kas tegemist on pelaagilise või hõljumikatsega; lisaks sellele esitatakse vähemalt järgmine teave.
Uuritav aine ja standardaine (standardained):
|
—
|
uuritava aine ja standardaine tavanimetused, keemilised nimetused (soovitatavalt IUPACi ja/või CASi nimetused), CASi numbrid, struktuurivalemid (radiomärgisega aine puhul näidatakse 14C asukoht) ning olulised füüsikalis-keemilised omadused (vt punktid 1.5 ja 1.6);
|
|
—
|
muundumissaaduste identifitseerimise ja mõõtmise standarditena kasutatud ainete keemilised nimetused, CASi numbrid, struktuurivalemid (radiomärgisega aine puhul näidatakse 14C asukoht) ning olulised füüsikalis-keemilised omadused;
|
|
—
|
uuritava aine ja standardaine puhtusaste (lisandid);
|
|
—
|
märgisega kemikaalide radiokeemiline puhtusaste ja eriaktiivsus (vajaduse korral).
|
Pinnavesi:
Võetud veeproovi kohta esitatakse vähemalt järgmised andmed:
|
—
|
proovivõtukoha asukoht ja kirjeldus, kaasa arvatud saastelugu (võimaluse korral);
|
|
—
|
proovivõtu kuupäev ja aeg;
|
|
—
|
toitainesisaldus (üldlämmastik, ammoonium, nitritid, nitraadid, üldfosfor, lahustunud ortofosfaat);
|
|
—
|
proovi väline iseloomustus (nt värvus ja hägusus);
|
|
—
|
lahustunud ja summaarne orgaaniline süsinik;
|
|
—
|
biokeemiline hapnikutarve;
|
|
—
|
proovi võtmisel kohapeal määratud temperatuur ja pH;
|
|
—
|
hapnikusisaldus või redokspotentsiaal (nõutav, kui ei ole ilmne, et tegemist on aeroobsete tingimustega);
|
|
—
|
soolsus või juhtivus (mere- või riimvee puhul);
|
|
—
|
hõljumisisaldus (häguse proovi puhul);
|
|
—
|
proovivõtu asukohta käsitlev muu asjakohane teave, mis oli teada proovivõtu ajal (nt andmed jõe voolu- või merehoovuse kiiruse kohta proovi võtmise ajal või varem, naabruses esinenud suured heited ja nende laad, proovivõtule eelnenud ilmastikutingimused);
|
ning järgmised mittekohustuslikud andmed:
|
—
|
mikroorganismide biomass (nt otse loendatud akridiinoranžiga värvunud rakkude arv või kolooniaid moodustavate üksuste arv);
|
|
—
|
klorofüll a kontsentratsioon, mis on vetikate biomassi kajastav spetsiifiline näitaja.
|
Hõljumikatse korral esitatakse lisaks veel järgmised andmed sette kohta:
|
—
|
setteproovi võtmise sügavus;
|
|
—
|
sette väline iseloomustus (värvunud, muda-, aleuriit- või liivsete);
|
|
—
|
lõimis (jämeteralise liiva, peeneteralise liiva, aleuriidi ja savi protsent);
|
|
—
|
hõljuvaine kuivmassi sisaldus, g/l; orgaanilise süsiniku üldsisaldus või põletuskadu, mis on orgaanilise aine sisalduse näitaja;
|
|
—
|
hapnikusisaldus või redokspotentsiaal (nõutav, kui ei ole ilmne, et tegemist on aeroobsete tingimustega).
|
Katsetingimused:
|
—
|
proovivõtust katseni möödunud ajavahemik, proovi hoidmine ja ettevalmistamine, katsekuupäevad;
|
|
—
|
lisatud uuritava aine kogus, kontsentratsioon katses ja standardaine;
|
|
—
|
uuritava aine lisamise viis, kaasa arvatud lahusti kasutamine;
|
|
—
|
kasutatud pinnavee ja sademe maht ning iga proovivõtukorra puhul analüüsitud osaproovi maht;
|
|
—
|
kasutatud katsesüsteemi kirjeldus.
|
Kui katse ei toimunud valguse juurdepääsuta, märgitakse hajuvalgustuse tingimused;
|
—
|
teave steriilsete kontrollkatsete ettevalmistamise kohta (autoklaavimise temperatuur, aeg ja kordade arv);
|
|
—
|
inkubatsioonitemperatuur;
|
|
—
|
analüüsimeetodid ja radiokeemilise mõõtmise meetodid, massibilansi kontrollimiseks ja faasijaotuse mõõtmiseks (kui mõõdeti) kasutatud meetodid.
|
Tulemused:
|
—
|
saagis protsentides (vt punkt 1.7.1);
|
|
—
|
kasutatud analüüsimeetodite korratavus ja tundlikkus, kaasa arvatud avastamislävi ja mõõtmislävi (vt punkt 1.7.2);
|
|
—
|
kõik mõõtmistulemused (koos proovivõtuaegadega) ja arvutatud väärtused esitatakse tabelina ja lagunemiskõverad graafiliselt; iga uuritava kontsentratsiooni ja iga paralleelnõu jaoks esitatakse logaritmilise graafiku tõusu iseloomustav lineaarse korrelatsiooni koefitsient, hinnanguline ootefaasi kestus ning (võimaluse korral) esimest järku või pseudo-esimest järku kiiruskonstant ja vastav poollagunemisaeg (või poolestusaeg, t50);
|
|
—
|
asjaomased väärtused (ootefaasi kestus, lagunemise kiiruskonstant, poollagunemisaeg või poolestusaeg, t50) esitatakse üksikute paralleelkatsete tulemuste keskmisena;
|
|
—
|
lagunemiskõvera laadi ja uuritava aine kontsentratsiooni võimaliku mõju alusel liigitatakse katsesüsteem kohanenud või kohanemata süsteemiks;
|
|
—
|
lõpliku massibilansi kontrolli ja faasijaotuse mõõtmiste tulemused;
|
|
—
|
mineraliseerunud 14C osa ja esmase lagunemise lõpptase (kui see määrati analüüsiga);
|
|
—
|
(vajaduse korral) lisatud ainete ja oluliste muundumissaaduste identifitseerimisandmed, molaarne kontsentratsioon ja protsent (vt punkt 1.8.9.5, esimene lõik);
|
|
—
|
oletatav muundumistee (vajaduse korral);
|
4. KIRJANDUS
|
1)
|
OECD TG 309 (2004) Aerobic Mineralisation in surface water – Simulation Biodegradation Test.
|
|
2)
|
ISO/DIS 14592–1 (1999) Water quality – Evaluation of the aerobic biodegradability of organic compounds at low concentrations – Part 1: Shake flask batch test with surface water or surface water/sediment suspensions.
|
|
3)
|
Testing Method C.23. Aerobic and anaerobic transformation in soil.
|
|
4)
|
Testing Method C.24. Aerobic and anaerobic transformation in aquatic sediments.
|
|
5)
|
OECD (1993). Guidelines for the Testing of Chemicals. OECD, Paris.
|
|
6)
|
ISO 8245 (1999). Water quality – Guidelines on the determination of total organic carbon (TOC) and dissolved organic carbon (DOC).
|
|
7)
|
ISO 10634 (1995). Water quality – Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium.
|
|
8)
|
OECD draft (2000). Guidance Document on aquatic toxicity testing of difficult substances and mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No 22 (to be published summer 2000).
|
|
9)
|
Simkins, S. and Alexander, M. (1984). Models for mineralization kinetics with the variables of substrate concentration and population density. Appl. Environ. Microbiol.47, 394–401.
|
|
10)
|
Ingerslev, F. and N. Nyholm. (2000). Shake-flask test for determination of biodegradation rates of 14C-labeled chemicals at low concentrations in surface water systems. Ecotoxicol. Environ. Saf. 45, 274–283.
|
|
11)
|
ISO/CD 14592–1 (1999). Ring test report: Water Quality – Evaluation of the aerobic biodegradability of organic compounds at low concentrations part 1 – report of 1998/1999 ring-test. Shake flask batch test with surface water or surface water/sediment suspensions.
|
1. liide
14C jaotus faaside vahel
Lisaks tavalistele orgaanilise 14C jääkaktiivsuse mõõtmistele määratakse meetodi kontrollimiseks ka massibilanss, mille puhul mõõdetakse eraldunud 14CO2 otse pärast selle püüdmist absorberisse (vt 3. liide). 14CO2 eraldumine on biolagunemise otsene tõend, kuna abiootilisel lagunemisel või muude kaomehhanismide, nagu lendumise või sorptsiooni korral seda ei esine. Kasulikku lisateavet biolagunemise kohta annab mõõtmine, kuidas summaarne orgaaniline süsinik on jaotunud lahusefaasi (lahustunud orgaanilise 14C aktiivsus) ja osakestefaasi (tahkete osakestega seotud orgaanilise 14C aktiivsus) vahel; tahked osakesed eraldatakse membraanfiltrimise või tsentrifuugimisega. Tahkete osakestega seotud orgaanilise 14C aktiivsusesse annavad panuse mikroobide biomassile ja muudele tahketele osakestele sorbeerunud uuritav aine ja uuritavast ainest pärinev süsinik, mida on kasutatud uue rakumaterjali sünteesiks ja seotud tahkete osakestena esineva biomassi fraktsiooni. Lahustunud orgaaniline 14C määratakse biolagunemise lõpus (kõveral lagunemine vs. aeg esineva platoo järgi).
Et valitud proovis määrata 14C jääkaktiivsuse jaotus faaside vahel, filtritakse proov läbi membraanfiltri poori suurusega 0,22 või 0,45 μm, mis on valmistatud uuritavat ainet praktiliselt mitteadsorbeerivast materjalist (võib sobida polükarbonaatfilter). Kui uuritava aine sorptsioon filtrile (kontrollitakse enne katset) on nii tugev, et seda ei saa jätta arvestamata, võib filtrimise asemel kasutada suure kiirendusega tsentrifuugimist (2 000 g; 10 min).
Filtraati või tsentrifugaati käideldakse 3. liites filtrimata proovi puhul kirjeldatud viisil. Membraanfilter lahustatakse sobivas stsintillatsioonivedelikus ja aktiivsus loendatakse tavalisel viisil, kusjuures kasutatakse kas ainult välisstandardi suhte meetodil saadud kustumisparandit või proovi oksüdeerijat. Tsentrifuugimise korral resuspendeeritakse tahkete osakeste sade 1–2 ml destilleeritud vees ja asetatakse stsintillatsioonipudelisse. Tsentrifuugitopsi pestakse kaks korda 1 ml destilleeritud veega ja pesuveed lisatakse stsintillatsioonipudelisse. Vajaduse korral võib hõljumi fikseerida vedelikstsintillatsioonloendamiseks ettenähtud geeli.
2. liide
Poolpidev meetod
Raskesti lagunevate ainete piisavaks lagundamiseks võib olla vajalik kuudepikkune inkubeerimine. Kui esmase veeproovi omaduste säilitamiseks katsehõljumit ei uuendata, ei peaks katse kestus ületama tavaliselt 60 ööpäeva. Kui uuritava aine lagunemine algab esimese 60 ööpäeva jooksul, võib katset siiski pikendada kuni 90 ööpäevani katsehõljumit uuendamata.
Mitmesuguste kaomehhanismide ning veeproovis leiduvate asendamatute toitainete ja esmaste süsiniksubstraatide ammendumise tõttu võib pika inkubatsiooniaja jooksul väheneda mikroobikoosluse mitmekesisus. Sellepärast soovitatakse aeglaselt lagunevate ainete lagunemiskiiruse nõuetekohaseks määramiseks kasutada poolpidevat katset. Kui kogemuste põhjal võib eeldada, et 20 % aine lagunemiseks on proovi vaja inkubeerida kolm kuud, tuleb katset alustada poolpidevas režiimis. Kui katset on alustatud portsrežiimis ja umbes 60 ööpäevaga ei ole nõutavat lagunemise määra saavutatud, võib hariliku portsrežiimi asendada poolpideva režiimiga. Kui on registreeritud oluline lagunemine (> 20 %), võib poolpideva režiimi peatada ja jätkata katset portsrežiimis.
Poolpideva katse puhul vahetatakse iga kahe nädala tagant umbes üks kolmandik katsehõljumi mahust värskelt võetud veega, millele on lisatud uuritavat ainet algkontsentratsioonini. Ka mittekohustusliku hõljumikatse korral lisatakse vahetusveele setet algkontsentratsioonini (0,01–1 g/l). Hõljumikatse puhul on oluline, et ka veevahetuse jooksul säiliks täielikult suspendeeritud süsteem ning tahke aine ja vee viibeajad oleksid samad, vastasel juhul läheks kaduma taotletud sarnasus homogeense, fikseeritud faasideta veesüsteemiga. Sellepärast tuleks poolpideva režiimi kasutamisel valida suspendeeritud sette kontsentratsioon pigem selle vahemiku madalamas osas.
Uuritava aine lisamine ettenähtud viisil tähendab, et katsesuspensiooni osalisel uuendamisel ei ületata uuritava aine algkontsentratsiooni ja järelikult välditakse kõrge uuritava aine kontsentratsiooni puhul sageli esinevat kohanemisfaasi. Kuna katse käigus toimub nii reinokuleerimine kui ka ammendatud toitainete ja esmaste substraadivarude täiendamine, taastatakse algne mikroobikoosluse mitmekesisus ja katset võib põhimõtteliselt pikendada lõpmatult. Poolpideva režiimi kasutamisel on oluline silmas pidada, et uuritava aine jääkkontsentratsioonis tuleb teha parandid, mis arvestavad iga veevahetusega lisatud ja eemaldatud uuritava aine koguseid. Vähesorbeeruva aine puhul ei ole vaja teha vahet lahustunud uuritava aine kontsentratsiooni ja uuritava aine üldkontsentratsiooni vahel. Ainete puhul, mille log Kow < 3 (ja tegemist on neutraalse lipofiilse ühendiga), on ettenähtud tingimustes (tahke aine sisaldus 0,1–1 g/l) sorptsioon tähtsusetu (< 5 %). Seda selgitab järgmine arvutusnäide. Tahke aine sisaldus 0,1 g/l vastab süsiniku sisaldusele ligikaudu 10 mg/l (süsiniku osa, fC = 0,01). Eeldame, et
uuritava aine log Kow = 3,
Koc = 0,42 × Kow,
jaotuskoefitsient Kd = fC × Koc,
järelikult avaldub üldkontsentratsiooni lahustunud fraktsioon (C-vesi (Cw)/C-üld (Ct)) järgmiselt:
Cw/Ct = 1/(1 + Kd × SS) = 1(1 + Koc × fC × SS) = 1/(1 + 0,42 × 103 × 0,01 × 0,1 × 10–3) = 0,999.
3. liide
14CO2 määramine
14CO2 kaudne määramine
Kui uuritav aine ei ole lenduv ega muundu lenduvateks muundumissaadusteks, on standardsete mõõtmiste korral kaudne meetod tavaliselt kõige väiksemat ajakulu nõudev ja kõige täpsem. Filtrimata 5-milliliitrised proovid pannakse lihtsalt stsintillatsioonipudelitesse. Sobiv proovi algaktiivsus on 5 000 – 10 000 lagunemist minutis (80–170 Bq) ja minimaalne algaktiivsus umbes 1 000 lagunemist minutis. Pärast 1–2 tilga kontsentreeritud H3PO4 või HCl lisamist keskkonna hapestamiseks pH-ni 2–3 eraldatakse CO2. CO2 eraldamiseks võib barboteerida õhku läbi proovi ligikaudu ½–1 tunni jooksul. Teine võimalus CO2 eraldamiseks on loksutada proovi tugevasti 1–2 tundi (mikroplaatloksutil) või loksutada mõõdukalt hommikuni. CO2 eraldumise täielikkust on vaja kontrollida (selleks pikendatakse barboteerimise või loksutamise aega). Seejärel lisatakse veeproovide puhul loendamiseks sobiv stsintillatsioonivedelik, proov homogeniseeritakse keerissegistil ja määratakse radioaktiivsus vedelikstsintillatsiooniloenduse abil, millest lahutatakse pimekatses leitud taustaktiivsus (FB). Kui katsevesi ei ole väga tugevasti värvunud ja tahkete osakeste sisaldus ei ole ülemäära suur, on kustumine kõigi proovide puhul tavaliselt ühetaoline ja piisab välisstandardi abil leitud kustumisparandist. Kui katsevesi on tugevasti värvunud, võib kustumisparandi leidmiseks olla vajalik sisestandardi lisamine. Suure tahkete osakeste sisalduse korral võib homogeense lahuse või geeli saamine olla võimatu või kustumine võib erinevates proovides olla väga erinev. Sellisel juhul võib kasutada järgmist suspensioonide uurimiseks mõeldud loendusmeetodit. 14CO2 kaudseks mõõtmiseks hõljumikatses eraldatakse faasid, tsentrifuugides 10 ml katsevee/katsehõljumi homogeenset proovi sobival kiirendusel (40 000 m/s2, 15 minutit). Veefaasi käideldakse eespool kirjeldatud viisil. 14C aktiivsuse määramiseks tahkete osakeste faasis (tahkete osakestega seotud orgaanilise 14CO2 aktiivsus) resuspendeeritakse sade väikeses koguses destilleeritud vees, kantakse suspensioon üle stsintillatsioonipudelitesse ja lisatakse geeli moodustav stsintillatsioonivedelik (selleks on müügil spetsiaalsed stsintillatsioonivedelikud). Olenevalt tahkete osakeste laadist (nt orgaanilise aine sisaldusest) võib proovi digereerida koesolubilisaatoriga hommikuni, homogeniseerida keerissegistil ja lisada seejärel stsintillatsioonivedelik. Tahkete osakestega seotud orgaanilise 14CO2 aktiivsuse määramiseks võib sademe ka põletada hapniku liias proovi oksüdeerija juuresolekul. Sellisel juhul tuleb alati kasutada sisestandardit, kusjuures kustumisparandite arvestamiseks võib olla vaja lisada sisestandard igale proovile eraldi.
14CO2 otsemääramine
Kui eraldunud 14CO2 määratakse otse, tuleb katseks ette valmistada rohkem nõusid ja võtta iga mõõtepunkti puhul prooviks ühe katsenõu kogu sisu, hapestada see pH-ni 2–3 ja koguda 14CO2 siseabsorberisse (pannakse igasse katsenõusse katse alguses) või välisabsorberisse. Absorbeeriva keskkonnana võib kasutada leelist (1 N NaOH lahus või NaOH graanulid), etanoolamiini või mõnda etanoolamiini baasil valmistatud müügil olevat absorbenti. 14CO2 otsemõõtmise korral peavad katsenõud olema suletud butüülkummist septumitega.
Joonis 1a
Naturaalses teljestikus (jääkaktiivsus vs. aeg) esitatud katseandmete näide
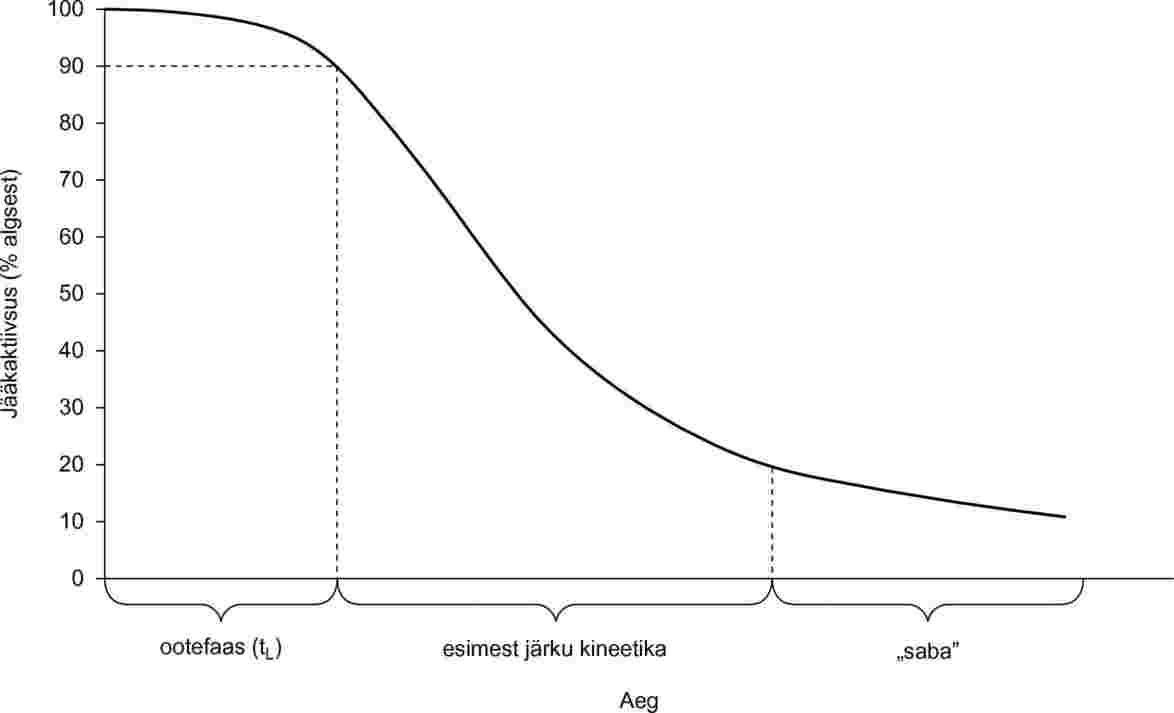
Joonis 1b
Poollogaritmilises teljestikus (naturaallogaritm jääkaktiivsusest vs. aeg) esitatud katseandmete näide

VI LISA
|
C.26.
|
LEMLE LEMNA SP. KASVU PIDURDAMISE KATSE
|
1. METOODIKA
Käesolev metoodika on samaväärne standardiga OECD TG 221 (2006) (1). ELi asutuste hulgas on jõutud laialdasele kokkuleppele, et intensiivse värvusega ühendite puhul on lemle kasvu pidurdamise katse sobiv asendusmeetod vetikal põhinevale katsele (2, 3).
1.1. SISSEJUHATUS
Käesolev metoodika on ette nähtud ainete mürgise mõju hindamiseks lemmeldel, perekonda Lemna kuuluvatel mageveetaimedel. See põhineb senistel juhenditel (4, 5, 6, 7, 8, 9), kuid neisse on tehtud muudatusi, mis kajastavad viimaste uuringute ja rea põhiküsimuste üle peetud nõupidamiste tulemusi. Soovitatav meetod on valideeritud rahvusvahelise laboratooriumidevahelise võrdluskatse abil (10).
Käesolevas metoodikas kirjeldatakse mürgisuse kontrollimist küürlemlel (Lemna gibba) ja väiksel lemlel (Lemna minor), mida on ulatuslikult uuritud ja mis on eespool viidatud standardite kohased katseobjektid. Suure fenotüübilise varieeruvuse tõttu on lemle liikide (Lemna spp.) taksonoomia keeruline. Kuigi lemle tundlikkuses mürgiste ainete suhtes võib esineda geneetilist varieeruvust, on andmeid selle varieeruvusallika kohta praegu liiga vähe selleks, et soovitada käesolevas metoodikas kasutamiseks mõnda konkreetset klooni. Tuleb märkida, et katset ei tehta puhaskultuuriga, kuid teatavatel katseetappidel rakendatakse meetmeid, et saastumine muude organismidega oleks minimaalne.
Kirjeldatakse katse üksikasju uuendatava katselahuse (poolstaatilise ja läbivoolukatse) ning mitteuuendatava katselahuse (staatilise katse) korral. Olenevalt katsete eesmärgist ja eeskirjadest soovitatakse kaaluda poolstaatilise või läbivoolumeetodi kasutamist neil juhtudel, kui tegemist on näiteks ainetega, mis kaovad lahusest kiiresti lendumise, fotolagunemise, sadestumise või biolagunemise tõttu. Edasised juhendid on esitatud publikatsioonis (11).
1.2. MÕISTED
Käesolevas metoodikas kasutatakse järgmisi mõisteid ja lühendeid.
Biomass on populatsiooni elusaine kuivmass. Käesoleva meetodi puhul mõõdetakse tavaliselt biomassi asendavaid näitajaid, nagu tallusjate võsude arv või pindala, seega osutatakse mõiste „biomass” kasutamisel ka nendele asendusnäitajatele.
Kloroos on tallusja võsu koe kolletumine.
Kloon on organism või rakk, mis on tekkinud individuaalsest organismist mittesugulise paljunemise tulemusena. Samast kloonist pärinevad isendid on geneetiliselt identsed.
Koloonia on üksteisega liitunud tallusjate ema- ja tütarvõsude kogum (tavaliselt 2–4 tallusjat võsu). Mõnikord nimetatakse kolooniat ka taimeks.
ECx
on katsekeskkonnas lahustatud uuritava aine kontsentratsioon, mille puhul lemle kasv pidurdub x % (nt 50 %) võrra, kui see taim puutub ainega kokku teatava ajavahemiku jooksul (kui kokkupuuteaeg erineb täielikust ehk tavaliselt katsetes kasutatavast kokkupuuteajast, tuleb selle pikkus täpselt märkida). Kasvukiirusega seotud EC väärtuse ja saagisega seotud EC väärtuse üheseks tähistamiseks kasutatakse vastavalt sümboleid ErC ja EyC, mille järel märgitakse kasutatud mõõtemuutuja, nt ErC (tallusjate võsude arv).
Läbivoolukatse on katse, mille käigus katselahus pidevalt vahetub.
Tallusjas võsu on individuaalne lehetaoline lemlestruktuur. See on väikseim paljunemisvõimeline üksus, st isend.
Puhetumus osutab kõverdunud või puhetunud tallusjale võsule.
Kasv on mõõdetava suuruse (nt tallusjate võsude arv, kuivmass, märgmass, tallusjate võsude pindala) suurenemine katse ajal.
Kasvukiirus (keskmine kasvu erikiirus) on biomassi logaritmiline suurenemine uuritava ainega kokkupuute ajal.
Madalaim avastatava mõjuga kontsentratsioon on madalaim uuritud kontsentratsioon, mille puhul on näidatud, et teatava kokkupuuteaja jooksul pidurdab uuritav aine kontrolliga võrreldes statistiliselt oluliselt (p < 0,05) katseorganismi kasvu. Kõik madalaimast avastatava mõjuga kontsentratsioonist kõrgemad kontsentratsioonid peavad avaldama sama tugevat või tugevamat kahjulikku mõju kui madalaim avastatava mõjuga kontsentratsioon. Kui neid kahte tingimust ei ole võimalik täita, tuleb anda täielik selgitus, kuidas valiti madalaim avastatava mõjuga kontsentratsioon (ja ka avastatava mõjuta kontsentratsioon).
Mõõtemuutuja on mis tahes liiki muutuja, mida mõõdetakse, et ühe või mitme eri kostemuutuja kasutamisega väljendada katsetulem. Käesoleva meetodi puhul on mõõtemuutujad tallusjate võsude arv, tallusjate võsude pindala, elusmass ja kuivmass.
Monokultuur on ühte liiki taimede kultuur.
Nekroos on surnud (nt valge või hügrofaanne) tallusja võsu kude.
Avastatava mõjuta kontsentratsioon on madalaimast avastatava mõjuga kontsentratsioonist allapoole järgmine uuritud kontsentratsioon.
Fenotüüp on organismi vaadeldavate tunnuste kogum, mille määrab tema geenide ja keskkonna vastastikune mõju.
Kostemuutujad on toksilisuse hindamiseks kasutatavad muutujad, mis tuletatakse biomassi kajastavatest mõõtemuutujatest mitmesuguste arvutuste abil. Käesoleva meetodi puhul on kasvukiirus ja saagis kostemuutujad, mis tuletatakse sellistest mõõtemuutujatest nagu tallusjate võsude arv, nende pindala, elusmass või kuivmass.
Poolstaatiline (uuendatava lahusega) katse on katse, mille käigus lahust perioodiliselt, kindla ajavahemiku järel vahetatakse.
Staatiline katse on katse, mille käigus lahust ei uuendata.
Katsetulem on katse eesmärgile vastav üldise teguri muutus uuritava kemikaali mõjul võrreldes kontrollkultuuriga. Käesoleva meetodi puhul on katsetulem kasvu pidurdumine, mida võib väljendada erinevate ühel või mitmel mõõtemuutujal põhinevate kostemuutujate abil.
Katsekeskkond on täissünteetiline toitelahus, millel kasvatatakse katsetaimi uuritava ainega kokkupuutumise ajal. Tavaliselt lahustatakse uuritav aine katsekeskkonnas.
Saagis on kokkupuuteaja lõpus ja alguses leitud mõõtemuutuja väärtuste vahe, mis väljendab katse kestel toimunud biomassi suurenemist.
1.3. KATSE PÕHIMÕTE
Eksponentsiaalselt kasvavatel lemmelde perekonda (Lemna) kuuluvate taimede monokultuuridel lastakse kokku puutuda uuritava ainega erinevates kontsentratsioonides seitsme ööpäeva jooksul. Katse eesmärk on kvantitatiivselt kirjeldada uuritava aine mõju vegetatiivsele kasvule katseaja jooksul, võttes aluseks valitud mõõtemuutuja hinnangud. Peamine mõõtemuutuja on tallusjate võsude arv. Kuna mõni aine võib mõjutada muid mõõtemuutujaid rohkem kui tallusjate võsude arvu, mõõdetakse ka vähemalt ühte täiendavat mõõtemuutujat (tallusjate võsude üldpindala, kuivmass või elusmass). Uuritava aine mõju kvantitatiivseks iseloomustamiseks võrreldakse kasvu uuritavas lahuses kasvuga kontroll-lahuses ja määratakse kontsentratsioon, mis põhjustab kasvukiiruse pidurdumise teatava x % (nt 50 %) võrra; selle kontsentratsiooni tähis on ECx (nt EC50).
Katsetulem on kasvu pidurdumine, kusjuures kasvu väljendatakse mõõtemuutuja väärtuse logaritmi suurenemisena kokkupuuteaja jooksul (keskmine kasvu erikiirus). Katselahuste seerias määratud keskmistest kasvu erikiirustest leitakse kontsentratsioon, mis vähendab kasvukiirust teatava protsendimäära x võrra (näiteks 50 %); selle kontsentratsiooni tähis on ErCx (nt ErC50).
Lisaks kasutatakse käesoleva meetodi korral kostemuutujana veel saagist, mida võib vaja olla teatavates riikides kehtestatud erieeskirjade täitmiseks. Saagis on kokkupuuteaja lõpus ja alguses määratud mõõtemuutujate väärtuste vahe. Lähtudes katselahuse seeriate puhul registreeritud saagistest, arvutatakse kontsentratsioon, mis põhjustab saagise vähenemise teatava x % (nt 50 %) võrra; selle kontsentratsiooni tähis on EyCx (nt EyC50).
Lisaks sellele võib statistiliselt määrata madalaima avastatava mõjuga kontsentratsiooni ja ka avastatava mõjuta kontsentratsiooni.
1.4. ANDMED UURITAVA AINE KOHTA
Uuritava aine sisalduse määramiseks katsekeskkonnas peab olema piisavalt tundlik analüüsimeetod.
Katsetingimuste valimisel võib olla kasulik teada järgmisi uuritavat ainet iseloomustavaid näitajaid: struktuurivalem, puhtusaste, lahustuvus vees, püsivus vees, valguskindlus, pKa, Kow, aururõhk ja biolagundatavus. Lahustuvust vees ja aururõhku võib kasutada Henry konstandi arvutamiseks, mis näitab, kas katse ajal on tõenäoline märkimisväärne uuritava aine kadu. See aitab selgitada, kas aine kao ärahoidmiseks on vaja erimeetmeid. Kui andmeid aine lahustuvuse ja püsivuse kohta on vähe, soovitatakse hinnata neid omadusi katsetingimustes, s.o sama toitelahuse, temperatuuri ja valgusrežiimi puhul nagu katseski.
Kui katsekeskkonna pH reguleerimine on eriti tähtis, nt hüdrolüütiliselt ebapüsivate metallide või muude ainete mõju uurimisel, soovitatakse katselahusele lisada puhvrit (vt punkt 1.7.4, esimene lõik). Täiendavad juhised selliste ainete mõju uurimiseks, mille füüsikalis-keemilised omadused raskendavad seda uurimist, on esitatud publikatsioonis (11).
1.5. STANDARDAINE
Katse korrektse läbiviimise kontrollimiseks võib kasutada rahvusvahelistes võrdluskatsetes (10) kasutatavaid standardaineid, näiteks 3,5-diklorofenooli. Kontrolli standardainega soovitatakse teha vähemalt kaks korda aastas või, kui katseid tehakse harvemini, siis paralleelselt uuritava aine toksilisuse määramisega.
1.6. KATSE VASTAVUS NÕUETELE
Et katse vastaks nõuetele, peab tallusjate võsude arvu kahekordistumise aeg kontrollkultuuride puhul olema alla 2,5 ööpäeva (alla 60 tunni), mis vastab ligikaudu seitsmekordsele kasvule seitsme ööpäeva jooksul ja keskmisele kasvu erikiirusele 0,275 ööpäev–1. Käesolevas metoodikas kirjeldatud toitelahuste ja katsetingimuste puhul võib seda kriteeriumi täita staatilise katse tingimustes (8). Oletatavalt saab seda kriteeriumi täita ka poolstaatilise ja läbivoolukatse tingimustes. Kahekordistumisaja arvutamist on selgitatud punktis 2.1.
1.7. MEETODI KIRJELDUS
1.7.1. Seadmed
Kõik katsekeskkonnaga kokku puutuvad seadmed peavad olema valmistatud klaasist või muust keemiliselt inertsest materjalist. Kultuuride kasvatamiseks ja katseteks kasutatavad klaasnõud peavad olema steriilsed ja puhastatud keemilistest saasteainetest, mis võiksid leostuda katsekeskkonda. Katsenõud peavad olema piisavalt laiad, et kontrollnõudes kasvavad eri kolooniate tallusjad võsud katse lõpus ei hakkaks üksteist katma. Ei ole tähtis, kas juured puudutavad katsenõu põhja, kuid on soovitatav, et nõu sügavus oleks vähemalt 20 mm ja maht vähemalt 100 ml. Kui need tingimused on täidetud, ei ole nõu tüübi valik tähtis. Sobivad nii nõuetekohaste mõõtmetega keeduklaasid, kristallisaatorid kui ka klaasist Petri tassid. Katsenõud peavad olema kaetud, et vähendada keskkonna aurumist ja juhuslikku saastumist, kuid samal ajal peab olema tagatud vajalik õhuvahetus. Nõuetekohased katsenõud ja eriti nende kaaned ei tohi varjata valgust või muuta selle spektrit.
Kultuure ja katsenõusid ei hoita koos. Sellepärast on kõige parem kasutada eraldi fütotrone, inkubaatoreid või kasvukambreid. Valguse intensiivsus ja temperatuur peavad olema reguleeritavad ja need hoitakse konstantsed (vt punkt 1.7.8).
1.7.2. Katseorganismid
Käesolevas katses kasutatakse katseorganismina küürlemmelt (Lemna gibba) või väikest lemmelt (Lemna
minor). Mürgisuse katsetes kasutatavate lemleliikide lühikirjeldus on esitatud 1. liites. Taimmaterjali võib saada kultuuride kollektsioonist, teisest laborist või loodusest. Loodusest kogutud materjali kasvatatakse enne kasutamist vähemalt kaheksa nädalat kultuuris samas toitelahuses, mida kasutatakse katsetes. Loodusliku lähtekultuuri kogumiskohta ei tohi mõjutada ilmsed saasteallikad. Teisest laborist või kultuuride kollektsioonist saadud taimmaterjali kasvatatakse enne kasutamist samal viisil vähemalt kolm nädalat. Taimmaterjali allikas ning kasutatud liik ja kloon (kui see on teada) märgitakse katseprotokolli.
Tuleb kasutada monokultuure, mis ei ole nähtavalt saastatud muude organismidega, nagu vetikad või algloomad. Väikese lemle, L. minor’i terve taim moodustab 2–5 tallusjast võsust koosneva koloonia; küürlemle, L. gibba terve koloonia võib koosneda kuni seitsmest tallusjast võsust.
Katses kasutatavate taimede kvaliteet ja ühetaolisus mõjutavad märkimisväärselt katsetulemust, sellepärast tuleb need valida hoolikalt. Kasutatakse noori kiirekasvulisi taimi, millel pole nähtavaid kahjustusi või värvidefekte (kloroos). Hea kvaliteediga kultuuris on rohkesti vähemalt kahest tallusjast võsust koosnevaid kolooniaid. Üksikute tallusjate võsude rohkus osutab keskkonnastressile (nt toitainete vaegus); sellisest kultuurist saadud taimmaterjali ei tohi katses kasutada.
1.7.3. Kasvatamine
Kultuuri hooldamissageduse vähendamiseks (nt kui teatava aja jooksul ei kavandata katseid Lemna’ga) võib kultuure hoida vähendatud valgustatuse ja madala temperatuuri (4–10 °C) juures. Kasvatamise üksikasjad on esitatud 2. liites. Vetikate või muude organismidega saastumise tunnuste ilmnemisel tuleb lemle tallusjate võsude osaproov pindmiselt steriliseerida ja seejärel üle kanda värskesse toitelahusesse (vt 2. liide). Ülejäänud saastunud kultuur visatakse sel juhul ära.
Vähemalt seitse päeva enne katset kantakse piisav arv kolooniaid aseptiliselt värskesse steriilsesse toitelahusesse ja neid kasvatatakse katsetingimustes 7–10 ööpäeva jooksul.
1.7.4. Katsekeskkond
Väikese lemle ja küürlemle puhul soovitatakse kasutada allpool kirjeldatud toitelahuseid. pH-d reguleeriva puhvri lisamist toitelahusesse tuleb hoolikalt kaaluda, kui oletatakse, et puhver võib reageerida uuritava ainega ja mõjutada toksilisuse avaldumist (väikese lemle toitelahusesse lisatakse 4-morfoliinpropaansulfoonhapet, CASi nr 1132–61–2; EINECSi nr 214–478–5, küürlemle toitelahusesse lisatakse NaHCO3). Võib kasutada ka Steinbergi toitelahust (12), kui nõuetele vastavuse kriteeriumid on täidetud.
Väikese lemle kasvatamiseks ja sellega katsete tegemiseks soovitatakse kasutada Rootsi standardiga (SIS) lemle kasvatamiseks ette nähtud toitelahuse modifikatsiooni. Selle toitelahuse koostis on esitatud 3. liites.
Küürlemle kasvatamiseks ja sellega katsete tegemiseks soovitatakse kasutada 3. liites kirjeldatud toitelahust 20X-AAP.
Väikese lemle ja küürlemle puhul võib kasutada ka 3. liites kirjeldatud Steinbergi toitelahust, kui nõuetele vastavuse kriteeriumid on täidetud.
1.7.5. Katselahused
Katselahused valmistatakse tavaliselt põhilahuse lahjendamise teel. Uuritava aine põhilahus valmistatakse tavaliselt aine lahustamisega toitelahuses.
Tavaliselt ei tohi uuritava aine kõrgeim kontsentratsioon ületada aine lahustuvust vees katsetingimustes. Tuleb veel silmas pidada, et lemle liigid ujuvad pinnal ja võivad kokku puutuda vee ja õhu piirpinnale koguneva ainega (nt vees vähelahustuvad, hüdrofoobsed või pindaktiivsed ained). Sel juhul puutub lemle kokku mitte lahuses oleva materjali kontsentratsiooniga, vaid see võib – olenevalt uuritava aine omadustest – olla kõrgem selle aine lahustuvusest vees. Vees vähelahustuva aine puhul võib olla vaja valmistada selle aine kontsentreeritud põhilahus või dispersioon, kasutades orgaanilist lahustit või dispergeerivat ainet, et hõlbustada täpsete uuritava aine koguste lisamist katsekeskkonda ja soodustada aine lahustumist või pihustumist. Tuleb teha kõik sellise materjali kasutamise vältimiseks. Abilahusti või dispergeeriv aine ise ei tohi olla fütotoksiline. Tavaliselt kasutatavad lahustid, mis kuni kontsentratsioonini 100 μl·l–1 ei ole fütotoksilised, on näiteks atsetoon ja dimetüülformamiid. Kui kasutatakse lahustit või dispergeerivat ainet, peab selle lõppkontsentratsioon, mis märgitakse katseprotokolli, olema võimalikult madal (≤ 100 μl·l–1) ning kõigi katse- ja kontrollkultuuride puhul tuleb kasutada lahusti või dispergeeriva aine ühesugust kontsentratsiooni. Täiendavad juhised dispergeeriva aine kasutamise kohta on esitatud publikatsioonis (11).
1.7.6. Katse- ja kontrollrühmad
Uuritava aine sobivate kontsentratsioonide valimiseks peaks eelnevalt näiteks mõjuvahemiku hindamise katsega välja selgitama, kui mürgine see aine on lemlele. Lõpliku katse tegemisel kasutatakse tavaliselt vähemalt viit geomeetrilise jadana järjestatud kontsentratsiooni. Uuritavate kontsentratsioonide jada kordaja ei peaks üldiselt olema suurem kui 3,2, kuid lameda kontsentratsiooni-mõju kõvera korral võib kordaja siiski olla suurem. Kui kasutatakse vähem kui viit kontsentratsiooni, tuleb seda põhjendada. Iga uuritava kontsentratsiooni puhul kasutatakse vähemalt kolme paralleelkultuuri.
Uuritavate kontsentratsioonide vahemiku valimisel (mõjuvahemiku hindamise katse ja lõpliku toksilisuskatse puhul) tuleb arvestada järgmist.
|
—
|
ECx määramisel peaks ECx väärtus olema uuritavate kontsentratsioonide vahemikus, et tagada sobiv usaldusnivoo. Näiteks EC50 määramisel peab kõrgeim uuritav kontsentratsioon olema kõrgem kui EC50 väärtus. Kui EC50 väärtus jääb väljapoole uuritavate kontsentratsioonide vahemikku, on asjaomased usaldusvahemikud laiad ja lähendatud mudeli sobivust katseandmetega on raske statistiliselt hinnata.
|
|
—
|
Kui eesmärk on madalaima avastatava mõjuga kontsentratsiooni ja ka avastatava mõjuta kontsentratsiooni määramine, peab madalaim uuritav kontsentratsioon olema nii madal, et kasv ei oleks oluliselt aeglasem kui kontrollkultuuris. Peale selle peab kõrgeim uuritav kontsentratsioon olema nii kõrge, et kasv oleks oluliselt aeglasem kui kontrollkultuuris. Kui see nii ei ole, tuleb katset korrata teise kontsentratsioonivahemikuga (kui kõrgeim uuritav kontsentratsioon ei ole juba võrdne lahustuvuse või kõrgeima nõutava piirkontsentratsiooniga, näiteks 100 mgl–1).
|
Igas katses tehakse ka kontrollkultuurid, mille toitelahus, tallusjate võsude ja kolooniate arv, keskkonnatingimused ning määramiskatsed on samad kui katsenõude puhul, kuid millele ei ole lisatud uuritavat ainet. Kui kasutatakse abilahustit või dispergeerivat ainet, tuleb lisaks teha kontrollkultuur, milles lahusti või dispergeeriva aine kontsentratsioon on sama kui uuritavat ainet sisaldavates nõudes. Paralleelsete kontrollnõude (ja vajaduse korral lahustit sisaldavate kontrollnõude) arv peab olema vähemalt võrdne iga kontsentratsiooni korral kasutatavate nõude arvuga või paremal juhul sellest kaks korda suurem.
Kui avastatava mõjuta kontsentratsiooni määrata ei ole vaja, võib katseplaani muuta nii, et suurendatakse uuritavate kontsentratsioonide arvu ja vähendatakse paralleelkultuuride arvu ühe kontsentratsiooni kohta. Kontrollkultuure peab siiski olema vähemalt kolm.
1.7.7. Kokkupuude uuritava ainega
Aseptilistes tingimustes kantakse inokulum-kultuurist juhuvaliku alusel paigutatud katsenõudesse üle 2–4 nähtavast tallusjast võsust koosnevad kolooniad. Iga katsenõu peaks sisaldama kokku 9–12 tallusjat võsu. Tallusjate võsude ja kolooniate arv peab kõikides katsenõudes olema sama. Käesoleva meetodiga saadud kogemused ja laboratooriumidevahelised võrdluskatsed näitavad, et kasvukiiruse 4–7-protsendilise või saagise 10–15-protsendilise erinevuse määramiseks uuritava aine eri kontsentratsioonidel piisab, kui uuritava aine ühe kontsentratsiooniga tehakse paralleelkatsed kolmes nõus, kui katse alguses sisaldab iga paralleelkultuuri nõu 9–12 tallusjat võsu (10).
Katsenõud paigutatakse inkubaatorisse juhuslikult, et vähendada paigutusest tingitud valgustatuse ja temperatuuri erinevuste mõju. Igal katseandmete registreerimisel või veelgi sagedamini on katsenõud vaja ka kas rühmiti või juhuvaliku alusel vastastikku ümber paigutada.
Kui eelkatse näitab, et uuritava aine kontsentratsioon ei püsi 7-päevase katse jooksul samal tasemel (katse lõpus mõõdetud kontsentratsioon on alla 80 % mõõdetud algtasemest), soovitatakse kasutada poolstaatilist katserežiimi. Sel juhul lastakse kolooniatel katse jooksul vähemalt kahel korral (nt kolmandal ja viiendal katsepäeval) kokku puutuda värskelt valmistatud katselahusega ja kontroll-lahusega. Kui sageli lastakse kultuuril puutuda kokku värske katsekeskkonnaga, see oleneb uuritava aine püsivusest; kui aine on väga ebastabiilne või lenduv, siis ligikaudu püsiva kontsentratsiooni hoidmiseks peab see sagedus olema suurem. Mõnel juhul võib olla vaja kasutada läbivoolumeetodit (11, 13).
Käesolevas metoodikas ei käsitleta kokkupuutekatset, milles uuritav aine pritsitakse taimelehtedele (vt 14).
1.7.8. Inkubeerimistingimused
Kasutatakse päevavalgus- või külmvalge spektriga pidevat fluorestsentsvalgust, mille intensiivsus valitakse vahemikus 85–135 μE·m–2s–1 (vastab 6 500 – 10 000 luksile); valgustatust mõõdetakse fotosünteesiks sobivas lainepikkuse vahemikus 400–700 nm punktides, mis on valgusallikast sama kaugel kui lemle tallusjad võsud. Katseala ulatuses ei tohi valgustatus erineda valitud väärtusest üle 15 %. Valgustatuse mõõdetav väärtus sõltub mõõtmismeetodist ja eriti sensori tüübist. Ühest suunast langevat valgust mõõtvale sensorile eelistatakse sfäärilist sensorit (reageerib nii ülalt- kui altpoolt mõõtetasapinda igast suunast langevale valgusele) või koosinussensorit (reageerib ülaltpoolt mõõtetasapinda igast suunast langevale valgusele); käesoleva meetodi kohase mitmepunktilise valgustuse puhul annavad need sensorid suuremaid väärtusi.
Katsenõude temperatuur peab olema 24 ± 2 °C. Katse ajal ei tohi kontrollkeskkonna pH tõusta enam kui 1,5 ühiku võrra. Kui pH tõuseb üle 1,5 ühiku, siis loetakse siiski, et katse vastab nõuetele, kui saab näidata, et nõuetele vastavuse kriteeriumid on täidetud. Erijuhtudel, nt ebapüsivate ainete või metallide mõju uurimisel tuleb pH nihkumisele pöörata erilist tähelepanu. Täiendavad juhised on esitatud publikatsioonis (11).
1.7.9. Katse kestus
Katse lõpetatakse 7 ööpäeva möödumisel taimede ülekandmisest katsenõudesse.
1.7.10. Mõõtmised ja analüütilised määramised
Katse alguses loendatakse ja registreeritakse tallusjate võsude arv katsenõudes, jälgides, et kõik väljaulatuvad selgesti nähtavad tallusjad võsud oleksid arvesse võetud. Normaalse või ebanormaalse välimusega tallusjate võsude arv määratakse katse alguses, vähemalt üks kord kolme ööpäeva kohta (st vähemalt kaks korda 7-päevase katse jooksul) ja katse lõpus. Registreeritakse muutused taimede arengus, nt tallusjate võsude suurus, välimus, nekroosi, kloroosi või puhetumise ilmingud, kolooniate lagunemine, kolooniate ujuvuse halvenemine, juurte pikkuse ja välimuse muutused. Registreerida tuleb ka olulised tähelepanekud katsekeskkonna kohta (nt mittelahustunud materjali olemasolu, vetikate kasv katsenõudes).
Lisaks tallusjate võsude arvu määramisele katse jooksul hinnatakse ka uuritava aine mõju ühele või mitmele järgmisele mõõtemuutujale:
|
i)
|
tallusjate võsude üldpindala;
|
Tallusjate võsude üldpindala eelis on, et seda saab määrata igas katse- ja kontrollnõus katse alguses, katse käigus ja lõpus. Kuiv- või elusmass määratakse katse alguses inokulum-kultuuri representatiivses proovis ning katse lõpus igast katse- ja kontrollnõust saadud taimmaterjali alusel. Kui tallusjate võsude üldpindala ei määrata, eelistatakse elusmassi määramisele kuivmassi määramist.
Tallusjate võsude üldpindala, kuivmass ja elusmass määratakse järgmiselt.
|
i)
|
Tallusjate võsude üldpindala. Kõigi kolooniate tallusjate võsude üldpindala võib määrata pildianalüüsi abil. Katsenõu ja taimede siluett jäädvustatakse videokaameraga (nt asetades katsenõu valguskastile) ja saadud kujutis digitaliseeritakse. Kasutades kalibreerimiseks teadaoleva pindalaga tasapinnalisi kujundeid, võib seejärel määrata katsenõus olevate tallusjate võsude üldpindala. Tuleb jälgida, et katsenõu serv ei segaks määramist. Teine, töömahukam meetod on teha katsenõu ja taimede fotokoopia, lõigata välja saadud kolooniate siluett ja määrata nende pindala lehepinnaanalüsaatori või millimeetripaberi abil. Võib kasutada ka muid määramismeetodeid (nt kolooniate siluetile ja ühikpindalale vastava paberi masside suhte määramine).
|
|
ii)
|
Kuivmass. Igast katsenõust kogutakse kõik kolooniad ja neid loputatakse destilleeritud või deioniseeritud veega. Kolooniatest eemaldatakse filterpaberi abil ülemäärane vesi ja neid kuivatatakse 60 °C juures püsiva kaaluni. Kõik juuretükid võetakse määramisel arvesse. Kuivmass väljendatakse täpsusega vähemalt 0,1 mg.
|
|
iii)
|
Elusmass. Kõik kolooniad kantakse üle eelnevalt kaalutud polüstüreenist (või muust inertsest materjalist) katseklaasidesse, mille ümarates põhjades on väikesed (1 mm) avad. Katseklaase tsentrifuugitakse toatemperatuuril kiirusel 3 000 pööret minutis 10 minuti jooksul. Katseklaasid niimoodi kuivatatud kolooniatega kaalutakse ja elusmassi leidmiseks lahutatakse saadud tulemusest tühja katseklaasi mass.
|
1.7.10.1. Mõõtmiste ja analüütiliste määramiste sagedus
Staatilise katse puhul mõõdetakse pH igas katsenõus katse alguses ja lõpus. Poolstaatilistes katsetes mõõdetakse värske katselahuse pH enne iga lahusevahetust ja määratakse ka iga „kasutatud” lahuse pH.
Valgustatus mõõdetakse fütotroni, inkubaatori või kasvukambri punktides, mis on valgusallikast samal kaugusel kui lemle tallusjad võsud. Valgustatust mõõdetakse katse jooksul vähemalt üks kord. Katsekeskkonna temperatuur fütotronis, inkubaatoris või kasvukambris samades tingimustes hoitavas asendusnõus registreeritakse vähemalt üks kord päevas.
Uuritava aine kontsentratsioon määratakse katse ajal sobiva vaheaja tagant. Staatilise katse puhul tuleb uuritava aine kontsentratsioon määrata vähemalt katse alguses ja lõpus.
Poolstaatilise katse puhul, kus oletatakse uuritava aine kontsentratsiooni muutumist üle 20 % nominaalväärtusest, tuleb see kontsentratsioon määrata kõigis värskelt valmistatud katselahustes ja samades lahustes pärast nende asendamist (vt punkt 1.7.7, kolmas lõik). Kui uuritava aine mõõdetud algkontsentratsioon erineb nominaalsest enam kui 20 % võrra, kuid on piisavad tõendid, et algkontsentratsiooni väärtus on korratav ja püsiv (st 80–120 % algkontsentratsioonist), võib keemilised määramised teha ainult kõrgeima ja madalaima uuritava kontsentratsiooni puhul. Kõigil juhtudel on aine kontsentratsioon igal uuritaval väärtusel vaja määrata enne katselahuse vahetamist ainult ühes paralleelkultuuri nõus (või paralleelkultuuridest kokku segatud proovis).
Läbivoolukatse puhul kasutatakse sama proovivõturežiimi kui poolstaatilises katses, kaasa arvatud analüüs katse alguses, katse käigus ja lõpus, selle erinevusega, et „kasutatud” lahust ei ole vaja analüüsida. Nendes katsetes kontrollitakse igal katsepäeval lahjenduslahuse ja uuritava aine või uuritava aine põhilahuse voolukiirust.
Kui on tõendatud, et uuritava aine kontsentratsioon püsib kogu katse ajal rahuldavalt nominaalse või mõõdetud algväärtuse läheduses täpsusega ± 20 %, võib katsetulemusi analüüsida nominaalse või mõõdetud algväärtuse põhjal. Kui kõrvalekalle nominaalsest või mõõdetud algväärtusest on suurem kui ± 20 %, analüüsitakse katsetulemusi katse geomeetrilise keskmise kontsentratsiooni alusel või kasutatakse uuritava aine kontsentratsiooni kõrvalekaldeid kajastavaid mudeleid (11).
1.7.11. Piirsisalduskatse
Teatavatel asjaoludel, näiteks kui eelkatse näitab, et kontsentratsioonil kuni 100 mg·l–1 või katsekeskkonnas lahustuvuse piirkontsentratsioonil (olenevalt sellest, kumb on madalam) ei avalda uuritav aine toksilist mõju, võib teha piirsisalduskatse, milles võrreldakse kontrollrühmas ja ühes katserühmas (kontsentratsioonil 100 mg·l–1 või lahustuvuse piirkontsentratsioonil) avalduvat mõju. Piirsisalduskatse tegemisel soovitatakse kindlasti määrata ka kokkupuutekontsentratsioon. Kõik eespool kirjeldatud katsetingimused ja nõuetele vastavuse kriteeriumid kehtivad ka piirsisalduskatse puhul, kuid uuritava ainega tuleb teha vähemalt kahekordne arv paralleelkatseid. Kasvu analüüsimiseks kontroll- ja katseseerias võib keskmisi väärtusi võrrelda statistilise kriteeriumi (nt Studenti t-kriteerium) abil.
2. KATSEANDMED JA NENDE ESITAMINE
2.1. KAHEKORDISTUMISAEG
Tallusjate võsude arvu kahekordistumise aja (Td) määramiseks ja katse nõuetele vastavuse sellekohase kriteeriumi täitmise kindlakstegemiseks (punkt 1.6) kasutatakse kontrollkultuuridega saadud andmeid ja järgmist valemit:
Td = ln 2/μ
kus μ on punkti 2.2.1 esimeses ja teises lõigus kirjeldatud viisil määratud keskmine kasvu erikiirus.
2.2. KOSTEMUUTUJAD
Kõnesoleva katse eesmärk on määrata uuritava aine mõju lemle vegetatiivsele kasvule. Kuna liikmesriikide eelistused ja reguleerimisvajadused on erinevad, käsitletakse käesolevas metoodikas kahte kostemuutujat. Et katsetulemused oleksid vastuvõetavad kõikides liikmesriikides, tuleb uuritava mõju hindamisel kasutada mõlemat järgnevalt kirjeldatud kostemuutujat (a ja b).
|
a)
|
Keskmine kasvu erikiirus. See kostemuutuja arvutatakse katse ajal toimuva tallusjate võsude arvu logaritmi muutuse ja veel ühe mõõtemuutuja (tallusjate võsude üldpindala, kuivmassi või elusmassi) logaritmi muutuse ning selleks kulunud aja (ööpäevades) alusel kontrollkultuurides ja igas uuritava ainega kultuuris. Seda nimetatakse mõnikord ka suhteliseks kasvukiiruseks (15).
|
|
b)
|
Saagis. See kostemuutuja arvutatakse katse lõpuks toimunud tallusjate võsude arvu muutuse ja lisaks veel ühe mõõtemuutuja (tallusjate võsude üldpindala, kuivmass või elusmass) muutuse alusel kontrollkultuurides ning igas uuritava ainega kultuuris.
|
Tuleb märkida, et nende kahe kostemuutuja abil arvutatud toksilisuse väärtused ei ole võrreldavad ning seda erinevust tuleb katsetulemuste kasutamisel arvestada. Kui järgitakse käesoleva metoodika tingimusi, on asjaomaste lähenemisviiside matemaatilise aluse eripära tõttu keskmisel kasvu erikiirusel põhinevad ECx väärtused (ErCx) üldiselt suuremad kui saagise alusel saadud tulemused (EyCx). Seda erinevust ei tuleks tõlgendada kahe kostemuutuja tundlikkuse erinevusena; asjaomased väärtused on lihtsalt matemaatiliselt erinevad. Keskmise kasvu erikiiruse mõiste põhineb lemmelde üldisel eksponentsiaalsel kasvul piiramata kultuuris, kusjuures toksilisus määratakse kasvukiiruses avalduva mõju alusel ja see ei olene kontrollkultuuri kasvu erikiiruse absoluutsest tasemest, kontsentratsiooni-mõju kõvera tõusust või katse kestusest. Kui kostemuutujaks on saagis, siis sõltuvad tulemused aga kõikidest mainitud kõrvalmuutujatest. EyCx oleneb igas katses kasutatud lemleliigi kasvu erikiirusest ja maksimaalsest kasvu erikiirusest, mis võib olla eri lemleliikide ja isegi eri kloonide puhul erinev. Seda kostemuutujat ei tohi kasutada, kui võrreldakse lemleliikide või -kloonide tundlikkust toksiliste ainete suhtes. Kuigi teaduslikust aspektist on toksilisuse määramiseks parem kasutada kasvu erikiirust, esitatakse käesolevas metoodikas teatavate liikmesriikide eeskirjade järgimiseks ka saagisel põhinev toksilisuse määramise käik.
Toksilisuse hinnang peab põhinema tallusjate võsude arvul ja ühel täiendaval mõõtemuutujal (tallusjate võsude üldpindala, kuivmass või elusmass), sest mõned ained võivad mõjutada muid mõõtemuutujaid palju enam kui tallusjate võsude arvu. See mõju jääks avastamata, kui toksilisuse määramiseks kasutataks ainult tallusjate võsude arvu.
Tallusjate võsude arv ja muud registreeritud mõõtemuutujad (tallusjate võsude üldpindala, kuivmass, elusmass) kantakse iga mõõtmise puhul koos uuritava aine kontsentratsiooni väärtustega tabelisse. Avastatava mõjuta kontsentratsiooni, madalaima avastatava mõjuga kontsentratsiooni ja ECx määramiseks ei kasutata andmetöötluses mitte katseseeria jaoks arvutatud keskmisi väärtusi, vaid individuaalsete paralleelkultuuridega saadud väärtusi.
2.2.1. Keskmine kasvu erikiirus
Kontrollkultuuride ja uuritava ainega kultuuride puhul arvutatakse teatava ajavahemiku keskmine kasvu erikiirus igas nõus kasvu iseloomustavate muutujate – tallusjate võsude arvu ja ühe täiendava mõõtemuutuja (tallusjate võsude üldpindala, kuivmassi või elusmassi) – logaritmi suurenemise alusel järgmise valemi abil:

kus:
|
—
|
μi–j
|
on keskmine kasvu erikiirus ajavahemikul i–j,
|
|
—
|
Ni
|
on mõõtemuutuja väärtus katse- või kontrollkultuuri sisaldavas nõus ajahetkel i,
|
|
—
|
Nj
|
on mõõtemuutuja väärtus katse- või kontrollkultuuri sisaldavas nõus ajahetkel j,
|
|
—
|
t
|
on ajavahemik i–j.
|
Iga katse- ja kontrollseeria puhul arvutatakse kasvukiiruse keskväärtus ja dispersiooni hinnang.
Keskmine kasvu erikiirus arvutatakse kogu katseaja kohta (eespool esitatud valemis vastab katse algusele ajahetk i ja katse lõpule ajahetk j). Iga uuritava kontsentratsiooni ja kontrolli puhul arvutatakse keskmise kasvu erikiiruse keskväärtus ja dispersiooni hinnang. Lisaks sellele hinnatakse kasvukiirust ka lõikude kaupa, et näiteks logaritmitud kasvukõverate uurimise abil hinnata uuritava aine mõju katse vältel. Lõikude kaupa leitud kasvukiiruste ja keskmise kasvukiiruse olulised erinevused osutavad kõrvalekaldumisele pidevast eksponentsiaalsest kasvust; sel juhul on kasvukõveraid vaja üksikasjalikult uurida. Konservatiivse lähenemisviisi kohaselt tuleb sel juhul võrrelda uuritava ainega kultuurides maksimaalse pidurdumise ajavahemikul määratud kasvu erikiirusi kontrollkultuurides samal ajavahemikul määratud kasvu erikiirustega.
Iga uuritava kontsentratsiooni (katseseeria) puhul arvutatakse järgmise valemi abil kasvukiiruse pidurdumise protsent Ir:
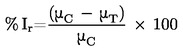
kus:
|
—
|
% Ir
|
on keskmine kasvu erikiiruse pidurdumise määr protsentides,
|
|
—
|
μC
|
on keskmise kasvu erikiiruse (µ) keskväärtus kontrollseerias,
|
|
—
|
μT
|
on keskmise kasvu erikiiruse (µ) keskväärtus katseseerias.
|
2.2.2. Saagis
Uuritava aine mõju saagisele määratakse kahe mõõtemuutuja – tallusjate võsude arvu ja ühe täiendava mõõtemuutuja (tallusjate võsude üldpindala, kuivmass või elusmass) – alusel, mille väärtused mõõdetakse igas uuritavas kultuuris katse alguses ja lõpus. Kuivmassi või elusmassi esialgne väärtus määratakse tallusjate võsude proovist, mis võetakse katsenõu inokuleerimiseks kasutatud kultuurist (vt punkt 1.7.3, teine lõik). Iga uuritava kontsentratsiooni ja kontrollkultuuri jaoks arvutatakse keskmine saagis ning dispersiooni hinnang. Iga katseseeria puhul arvutatakse saagise keskmine vähenemine protsentides %Iy:
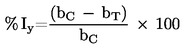
kus:
|
—
|
%Iy
|
on saagise vähenemine protsentides,
|
|
—
|
bC
|
on lõppbiomassi ja algbiomassi vahe kontrollseeria puhul,
|
|
—
|
bT
|
on lõppbiomassi ja algbiomassi vahe katseseeria puhul.
|
2.2.3. Kontsentratsiooni-mõju kõvera ehitamine
Ehitatakse kontsentratsiooni-mõju kõver, mis kajastab kostemuutuja protsentides väljendatud keskmise vähenemise määra (punkti 2.2.1 või 2.2.2 viimase lõigu kohaselt arvutatud Ir või Iy) sõltuvust uuritava aine kontsentratsiooni logaritmist.
2.2.4. ECx hindamine
ECx (nt EC50) hinnangud tuleb leida nii keskmise kasvu erikiiruse kui ka saagise põhjal (vastavalt ErCx ja EyCx), mis omakorda leitakse tallusjate võsude arvu ja ühe täiendava mõõtemuutuja (tallusjate võsude üldpindala, kuivmassi või elusmassi) põhjal. Selle põhjuseks on asjaolu, et teatavad uuritavad ained mõjutavad tallusjate võsude arvu ja muid mõõtemuutujaid erinevalt. Otsitavad toksilisusparameetrid, mis tuleb arvutada iga pidurdustaseme x puhul, on järelikult neli ECx väärtust: ErCx (leitakse tallusjate võsude arvu alusel), ErCx (leitakse tallusjate võsude üldpindala, kuivmassi või elusmassi alusel), EyCx (leitakse tallusjate võsude arvu alusel), EyCx (leitakse tallusjate võsude üldpindala, kuivmassi või elusmassi alusel).
2.3. STATISTILISED MEETODID
Eesmärk on leida regressioonanalüüsi abil kvantitatiivne seos kontsentratsiooni ja mõju vahel. Võib kasutada kaalutud lineaarset regressiooni pärast kosteandmete lineariseerivat teisendamist näiteks probit-, logit- või Weibulli ühikute kujule (16), kuid eelistada tuleb siiski mittelineaarse regressiooni meetodeid, mis sobivad paremini vältimatute andmevigade ja sujuvast jaotusest kõrvalekallete puhul. Kui andmevead lähenevad null-pidurdusele või täielikule pidurdusele, võivad need teisendustel võimendada ja segada analüüsi (16). Tuleb silmas pidada, et probit-, logit- või Weibulli teisendusega standardsed analüüsimeetodid on ette nähtud kõik-või-mitte-midagi-andmete (nt suremus või elulemus) analüüsiks ja kasvukiiruse või biomassi andmete analüüsimiseks tuleb neid kohandada. Konkreetsed meetodid ECx väärtuste määramiseks pidevate andmete alusel on esitatud publikatsioonides (17, 18, 19).
Kummagi kostemuutuja puhul arvutatakse kontsentratsiooni-mõju kõverast punkti ECx hinnangud. Võimaluse korral määratakse iga hinnangu usaldusvahemik 95-protsendilise usaldusnivoo jaoks. Kosteandmete sobivust regressioonimudeliga hinnatakse graafiliselt või statistiliselt. Regressioonanalüüsiks ei kasutata katserühma keskväärtusi, vaid individuaalsete paralleelkultuuride koste väärtusi.
Kui tavalised regressioonimudelid ja -meetodid katseandmete puhul ei sobi, võib EC50 hinnangute ja usaldusvahemike leidmiseks kasutada ka lineaarset interpolatsiooni koos andmete usaldusväärsuse iteratiivse kontrollimisega (bootstrapping) (20).
Selleks et määrata madalaim avastatava mõjuga kontsentratsioon ja sellest ka avastatava mõjuta kontsentratsioon, on uuritava ainega kultuuride keskväärtusi vaja võrrelda dispersioonanalüüsi (ANOVA) abil. Iga kontsentratsiooni puhul leitud keskväärtust võrreldakse seejärel kontrollkultuuride keskväärtusega, kasutades sobivat mitmekordse võrdluse või trendikatse meetodit. Dunnetti või Williamsi test võib osutuda sobivaks (21, 22, 23, 24). Tuleb hinnata, kas kehtib dispersioonanalüüsi eeldus, et dispersioon on homogeenne. Selle hinnangu võib saada graafiliselt või formaaltesti abil (25). Sobivad Levene’i või Bartletti testid. Kui dispersioonide homogeensuse eeldus ei kehti, võib mõnikord olla abi andmete logaritmilisest teisendamisest. Kui dispersiooni heterogeensus on väga suur ja seda ei saa korrigeerida teisendamisega, tuleb kaaluda Jonkheere alanevate astmetega trenditesti kasutamist. Täiendavad juhised avastatava mõjuta kontsentratsiooni määramiseks on esitatud publikatsioonis (19).
Teaduse viimaste saavutuste põhjal on soovitatud loobuda avastatava mõjuta kontsentratsiooni mõistest ja asendada see regressioonist leitud punkti ECx hinnangutega. Kõnesoleva katse jaoks lemmeldel ei ole sobivat x väärtust veel kindlaks määratud. Nähtavasti on see väärtus 10–20 % vahemikus (olenevalt valitud kosteparameetrist); parem oleks esitada nii EC10 kui ka EC20.
3. TULEMUSTE ESITAMINE
3.1. KATSEPROTOKOLL
Katseprotokollis esitatakse järgmine teave.
Uuritav aine:
|
—
|
füüsikaline iseloomustus ja füüsikalis-keemilised omadused, kaasa arvatud lahustuvus vees;
|
|
—
|
kemikaali identifitseerimiseks vajalikud andmed (nt CASi number), kaasa arvatud puhtusaste.
|
Katseorganismi liik:
|
—
|
teaduslik nimi, kloon (kui see on teada) ja päritolu.
|
Katsetingimused:
|
—
|
kasutatud katsemeetod (staatiline, poolstaatiline või läbivoolukatse);
|
|
—
|
katse alustamise kuupäev ja kestus;
|
|
—
|
katseplaani kirjeldus: katsenõud ja nõukatted, lahuste mahud, kolooniate ja tallusjate võsude arv ühe katsenõu kohta katse alguses;
|
|
—
|
uuritavad kontsentratsioonid (nominaalsed või mõõdetavad, olenevalt sellest, mis sobib) ja paralleelkultuuride arv ühe kontsentratsiooni kohta;
|
|
—
|
põhi- ja katselahuste valmistusviisid, sh lahusti või dispergeeriva aine kasutamine;
|
|
—
|
valgusallikas, valguse intensiivsus ja ühtlus;
|
|
—
|
katsekeskkonna ja kontrollkultuuri keskkonna pH väärtused;
|
|
—
|
uuritava aine kontsentratsioonid, analüüsimeetod ja asjakohased kvaliteedihinnangu andmed (valideerimisuuringud, analüüsiandmete standardhälbed ja usaldusvahemikud);
|
|
—
|
tallusjate võsude arvu ja muude mõõtemuutujate (kuivmass, elusmass, tallusjate võsude pindala) määramise meetodid;
|
|
—
|
kõik kõrvalekaldumised käesolevast metoodikast.
|
Katsetulemused:
|
—
|
originaalandmed: tallusjate võsude arv ja muude mõõtemuutujate väärtused igas uuritava ainega kultuuris ja kontrollkultuuris iga vaatluse ja analüüsi korral;
|
|
—
|
iga mõõtemuutuja keskväärtus ja standardhälve;
|
|
—
|
igale kontsentratsioonile vastav kasvukõver (soovitatakse esitada kasvukõver logaritmitud mõõtemuutuja järgi, vt punkt 2.2.1, teine lõik);
|
|
—
|
kontrollkultuuri kahekordistumise aeg või kasvukiirus, mis määratakse tallusjate võsude arvu järgi;
|
|
—
|
iga uuritava ainega paralleelkultuuri puhul arvutatud kostemuutujate väärtused, keskväärtused ja paralleelkultuuride variatsioonikordaja;
|
|
—
|
kontsentratsiooni-mõju sõltuvuse graafik;
|
|
—
|
kostemuutujate (nt EC50, EC10, EC20) abil väljendatud toksilisuse hinnangud ja nende usaldusvahemikud. Madalaim avastatava mõjuga kontsentratsioon ja ka avastatava mõjuta kontsentratsioon (kui need arvutati) ning nende määramiseks kasutatud statistilised meetodid;
|
|
—
|
kui kasutati dispersioonanalüüsi (ANOVA), siis avastatava efekti suurus (nt väikseim oluline erinevus);
|
|
—
|
uuritava ainega kultuuris jälgitud kasvu stimuleerimine;
|
|
—
|
visuaalsed fütotoksilisuse tunnused ja tähelepanekud katselahuste kohta;
|
|
—
|
tulemuste arutelu, kaasa arvatud käesolevast metoodikast kõrvalekaldumise võimalik mõju katsetulemustele.
|
4. KIRJANDUS
|
1)
|
OECD TG 221 (2006) Lemna Sp. Growth Inhibition Test.
|
|
2)
|
The use of Lemna studies for coloured substances is detailed in Section 13.5.3 of the EU Manual of Decisions dated July 2006, at http://ecb.jrc.ec.europa.eu/new-chemicals.
|
|
3)
|
Guidance on information requirements and chemical safety assessment – Chapter R.7b: Endpoint specific guidance; Table 7.8.3 Summary of difficult substance testing issues, available at
http://guidance.echa.europa.eu/docs/guidance_document/information_requirements_en.htm?time=1234958685#A.
|
|
4)
|
ASTM International. (2003). Standard Guide for Conducting Static Toxicity Test With Lemna gibba G3. E 1415–91 (Reapproved 1998). pp. 733–742. In, Annual Book of ASTM Standards, Vol. 11.05 Biological Effects and Environmental Fate; Biotechnology; Pesticides, ASTM, West Conshohocken, PA.
|
|
5)
|
USEPA – United States Environmental Protection Agency. (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., „Public draft”. EPA 712-C-96–156. 8pp.
|
|
6)
|
AFNOR – Association Française de Normalisation. (1996). XP T 90–337: Détermination de l’inhibition de la croissance de Lemna minor. 10pp.
|
|
7)
|
SSI – Swedish Standards Institute. (1995). Water quality – Determination of growth inhibition (7-d) Lemna minor, duckweed. SS 02 82 13. 15pp. (Rootsi keeles.)
|
|
8)
|
Environment Canada. (1999). Biological Test Method: Test for Measuring the Inhibition of Growth Using the Freshwater Macrophyte, Lemna minor. EPS 1/RM/37–120 pp.
|
|
9)
|
Environment Canada. (1993) Proposed Guidelines for Registration of Chemical Pesticides: Non-Target Plant Testing and Evaluation. Canadian Wildlife Service, Technical Report Series No. 145.
|
|
10)
|
Sims I., Whitehouse P., and Lacey R. (1999) The OECD Lemna Growth Inhibition Test. Development and Ring-testing of draft OECD Test Guideline. R&D Technical Report EMA 003. WRc plc – Environment Agency.
|
|
11)
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environmental Health and Safety Publications, Series on Testing and Assessment No.23.
|
|
12)
|
ISO DIS 20079. Water Quality – Determination of the Toxic Effect of Water Constituents and Waste Water to Duckweed (Lemna minor) – Duckweed Growth Inhibition Test.
|
|
13)
|
Walbridge C. T. (1977). A flow-through testing procedure with duckweed (Lemna minor L.). Environmental Research Laboratory – Duluth, Minnesota 55804. US EPA Report No. EPA-600/3–77 108. September 1977.
|
|
14)
|
Lockhart W. L., Billeck B. N. and Baron C. L. (1989). Bioassays with a floating plant (Lemna minor) for effects of sprayed and dissolved glyphosate. Hydrobiologia, 118/119, 353–359.
|
|
15)
|
Huebert, D.B. and Shay J.M. (1993) Considerations in the assessment of toxicity using duckweeds. Environmental Toxicology and Chemistry, 12, 481–483.
|
|
16)
|
Christensen, E.R., Nyholm, N. (1984): Ecotoxicological Assays with Algae: Weibull Dose-Response Curves. Env. Sci. Technol. 19, 713–718.
|
|
17)
|
Nyholm, N. Sørensen, P.S., Kusk, K.O. and Christensen, E.R. (1992): Statistical treatment of data from microbial toxicity tests. Environ. Toxicol. Chem. 11, 157–167.
|
|
18)
|
Bruce R.D. and Versteeg D.J. (1992) A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry, 11, 1485–1494.
|
|
19)
|
OECD. (2004). Guidance Document on Statistical Analysis of Ecotoxicity Data.
|
|
20)
|
Norberg-King T.J. (1988) An interpolation estimate for chronic toxicity: The ICp approach. National Effluent Toxicity Assessment Center Technical Report 05–88. USEPA, Duluth, MN.
|
|
21)
|
Dunnett, C.W. (1955) A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc., 50, 1096–1121.
|
|
22)
|
Dunnett, C.W. (1964) New tables for multiple comparisons with a control. Biometrics, 20, 482–491.
|
|
23)
|
Williams, D.A. (1971) A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27: 103–117.
|
|
24)
|
Williams, D.A. (1972) The comparison of several dose levels with a zero dose control. Biometrics, 28: 510–531.
|
|
25)
|
Brain P. and Cousens R. (1989). An equation to describe dose-responses where there is stimulation of growth at low doses. Weed Research, 29, 93–96.
|
1. liide
Lemmelde liikide kirjeldus
Üldnime lemled (Lemna spp.) all tuntud veetaimed kuuluvad lemleliste (Lemnaceae) sugukonda, mis hõlmab paljusid ülemaailmse levikuga liike, mis kuuluvad nelja perekonda. Nende morfoloogilisi erinevusi ja taksonoomiat on kirjeldatud ammendavalt (1, 2). Toksilisuskatsetes kasutatakse üldiselt parasvöötmele iseloomulikku küürlemmelt (Lemna gibba) ja väikest lemmelt (Lemna minor). Mõlemal liigil on vee pinnal või vee sees ujuv litrikesetaoline vars (tallusjas võsu) ja iga tallusja võsu alakülje keskkoha külge kinnitunud väga peenike juur. Lemled õitsevad harva ja paljunevad peamiselt vegetatiivselt uute tallusjate võsude moodustamise abil (3). Vanemate taimedega võrreldes on noored taimed heledamad, lühemate juurtega ja koosnevad kahest või kolmest erineva suurusega tallusjast võsust. Tänu lemle väiksusele, lihtsale ehitusele, mittesugulisele paljunemisele ja lühikesele generatsiooniajale sobivad selle perekonna taimed väga hästi laboratoorseteks katseteks (4, 5).
Kuna tundlikkus uuritava aine suhtes on tõenäoliselt liigiti erinev, saab aineid võrrelda ainult ühe liigiga tehtud katsete alusel.
Näiteid lemle liikide kasutamise kohta katsetes: viited
Lemna aequinoctialis: Eklund, B. (1996). The use of the red alga Ceramium strictum and the duckweed Lemna aequinoctialis in aquatic ecotoxicological bioassays. Licentiate in Philosophy Thesis 1996:2. Dep. of Systems Ecology, Stockholm University.
Lemna major: Clark, N. A. (1925). The rate of reproduction of Lemna major as a function of intensity and duration of light. J. phys. Chem., 29: 935–941.
Lemna minor: United States Environmental Protection Agency (USEPA). (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., „Public draft”. EPA 712-C-96–156. 8pp.
Association Française de Normalisation (AFNOR). (1996). XP T 90–337: Détermination de l’inhibition de la croissance de Lemna minor. 10pp.
Swedish Standards Institute (SIS). (1995). Water quality – Determination of growth inhibition (7-d) Lemna minor, duckweed. SS 02 82 13. 15pp. (in Swedish).
Lemna gibba: ASTM International. (2003). Standard Guide for Conducting Static Toxicity Test With Lemna gibba G3. E 1415–91 (Reapproved 1998). pp. 733–742.
United States Environmental Protection Agency (USEPA). (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., „Public draft”. EPA 712-C-96–156. 8pp.
Lemna paucicostata: Nasu, Y., Kugimoto, M. (1981). Lemna (duckweed) as an indicator of water pollution. I. The sensitivity of Lemna paucicostata to heavy metals. Arch. Environ. Contam. Toxicol., 10:1959–1969.
Lemna perpusilla: Clark, J. R. et al. (1981). Accumulation and depuration of metals by duckweed (Lemna perpusilla). Ecotoxicol. Environ. Saf., 5:87–96.
Lemna trisulca: Huebert, D. B., Shay, J. M. (1993). Considerations in the assessment of toxicity using duckweeds. Environ. Toxicol. and Chem., 12:481–483.
Lemna valdiviana: Hutchinson, T.C., Czyrska, H. (1975). Heavy metal toxicity and synergism to floating aquatic weeds. Verh.-Int. Ver. Limnol., 19:2102–2111.
Lemna liikide kollektsioonid
|
University of Toronto Culture Collection of Algae and Cyanobacteria
|
|
Department of Botany, University of Toronto
|
|
Toronto, Ontario, Canada, M5S 3 B2
|
|
Tel: +1 4169783641
|
|
Faks:+1 4169785878
|
|
e-post: jacreman@botany.utoronto.ca
|
|
http://www.botany.utoronto.ca/utcc
|
|
North Carolina State University
|
|
Forestry Dept
|
|
Duckweed Culture Collection
|
|
Campus Box 8002
|
|
Raleigh, NC 27695–8002
|
|
United States
|
|
Tel: +1 9195157572
|
|
astomp@unity.ncsu.edu
|
|
Institute of Applied Environmental Research (ITM) Stockholm University
|
|
SE-106 91 STOCKHOLM
|
|
SWEDEN
|
|
Tel: +46 86747240
|
|
Faks +46 86747636
|
|
Federal Environmental Agency (UBA)
|
|
FG III 3.4
|
|
Schichauweg 58
|
|
12307 Berlin
|
|
Germany
|
|
e-post: lemna@uba.de
|
|
http://www.umweltbundesamt.de/contact.htm
|
KIRJANDUS
|
1)
|
Hillman, W.S. (1961). The Lemnaceae or duckweeds: A review of the descriptive and experimental literature. The Botanical Review, 27:221–287.
|
|
2)
|
Landolt, E. (1986). Biosystematic investigations in the family of duckweed (Lemnaceae). Vol. 2. Geobotanischen Inst. ETH, Stiftung Rubel, Zürich, Switzerland.
|
|
3)
|
Björndahl, G. (1982). Growth performance, nutrient uptake and human utilization of duckweeds (Lemnaceae family). ISBN 82–991150–0–0. The Agricultural Research Council of Norway, University of Oslo.
|
|
4)
|
Wang, W. (1986). Toxicity tests of aquatic pollutants by using common duckweed. Environmental Pollution, Ser B, 11:1–14.
|
|
5)
|
Wang, W. (1990). Literature review on duckweed toxicity testing. Environmental Research, 52:7–22.
|
2. liide
Tüvikultuuri säilitamine
Tüvikultuure võib pikemat aega säilitada madalal temperatuuril (4–10 °C), ilma et oleks vaja alustada uut kultiveerimist. Lemle toitelahus võib olla sama, mida kasutatakse katsetes, kuid tüvikultuuride puhul võib kasutada ka muid toitainerikkaid lahuseid.
Teatav arv noori helerohelisi taimi kantakse kindlate ajavahemike tagant aseptiliselt üle värsket toitelahust sisaldavasse nõusse. Käesolevas lisas soovitatud madala temperatuuri korral võib subkultuuride inokuleerimise vaheaeg olla kuni kolm kuud.
Kasutatakse keemiliselt puhtaid (happega pestud) steriilseid klaasist kultiveerimisnõusid ja aseptilist käitlustehnikat. Kui tüvikultuur saastub näiteks vetikate või seentega, tuleb võtta meetmeid saasteorganismide kõrvaldamiseks. Vetikate ja enamiku muude saastavate organismide korral võib seda saavutada pindmise steriliseerimise abil. Saastatud taimmaterjalist võetakse proov ja lõigatakse ära taimede juured. Materjali loksutatakse tugevasti puhtas vees ja see asetatakse 30 sekundiks kuni 5 minutiks 0,5-mahuprotsendilisse naatriumhüpokloriti lahusesse. Seejärel loputatakse taimmaterjali steriilse veega ja kantakse siis mitme portsjonina värsket toitelahust sisaldavatesse kultiveerimisnõudesse. Sellise töötlemise tagajärjel surevad paljud tallusjad võsud, eriti kui töötlemisaeg on pikem, kuid üksikud ellujäänud tallusjad võsud on tavaliselt saasteorganismidest vabad. Neid tallusjaid võsusid võib kasutada uute kultuuride inokuleerimiseks.
3. liide
Toitelahused
Väikese lemle ja küürlemle jaoks soovitatakse erinevaid toitelahuseid. Väikese lemle puhul soovitatakse kasutada Rootsi standardi (SIS) kohase toitelahuse modifikatsiooni, samas kui küürlemle puhul soovitatakse kasutada toitelahust 20X-AAP. Järgnevalt on esitatud mõlema toitelahuse koostised. Nende toitelahuste valmistamiseks kasutatakse analüütiliselt puhtaid reaktiive ja deioniseeritud vett.
Rootsi standardi (SIS) kohane lemle toitelahus
|
—
|
I–V põhilahus steriliseeritakse autoklaavimise (120 °C, 15 minutit) või membraanfiltrimise (pooride läbimõõt ligikaudu 0,2 μm) abil.
|
|
—
|
VI põhilahus (ja mittekohustuslik VII põhilahus) steriliseeritakse membraanfiltrimise abil, neid lahuseid ei autoklaavita.
|
|
—
|
Steriilseid põhilahuseid hoitakse jahedas kohas valguse juurdepääsuta. I–V põhilahus visatakse ära kuus kuud pärast valmistamist; VI põhilahuse (ja mittekohustusliku VII põhilahuse) säilimisaeg on üks kuu.
|
Põhilahus nr
|
Koostisaine
|
Sisaldus põhilahuses (g·l–1)
|
Sisaldus toitelahuses (mg·l–1)
|
Toitelahus
|
|
Element
|
Sisaldus (mg·l–1)
|
|
I
|
NaNO3
KH2PO4
|
8,50
1,34
|
85
13,4
|
Na; N
K; P
|
32; 14
6,0; 2,4
|
|
II
|
MgSO4 · 7H2O
|
15
|
75
|
Mg; S
|
7,4; 9,8
|
|
III
|
CaCl2 · 2H2O
|
7,2
|
36
|
Ca; Cl
|
9,8; 17,5
|
|
IV
|
Na2CO3
|
4,0
|
20
|
C
|
2,3
|
|
V
|
H3BO3
MnCl2 · 4H2O
Na2MoO4 · 2H2O
ZnSO4 · 7H2O
CuSO4 · 5H2O
Co(NO3)2 · 6H2O
|
1,0
0,20
0,010
0,050
0,0050
0,010
|
1,00
0,20
0,010
0,050
0,0050
0,010
|
B
Mn
Mo
Zn
Cu
Co
|
0,17
0,056
0,0040
0,011
0,0013
0,0020
|
|
VI
|
FeCl3 · 6H2O
Na2-EDTA·2H2O
|
0,17
0,28
|
0,84
1,4
|
Fe
—
|
0,17
—
|
|
VII
|
MOPS (puhver)
|
490
|
490
|
—
|
—
|
|
|
—
|
Ühe liitri SIS toitelahuse saamiseks lisatakse 900 ml deioniseeritud veele järgmised komponendid:
|
—
|
1 ml VII põhilahust (mittekohustuslik).
|
Märkus. Täiendav VII põhilahus (MOPS puhver) võib olla vajalik teatavate uuritavate ainete puhul (vt punkt 1.4, viimane lõik).
|
|
—
|
0,1 või 1 M HCl või NaOH lisamisega reguleeritakse pH väärtusele 6,5 ± 0,2 ja lahuse maht viiakse deioniseeritud veega ühe liitrini.
|
Toitelahus 20X-AAP
Põhilahuste valmistamiseks kasutatakse steriilset destilleeritud või deioniseeritud vett.
Steriilseid põhilahuseid hoitakse jahedas kohas valguse juurdepääsuta. Nendes tingimustes on põhilahuste säilimisaeg vähemalt 6–8 nädalat.
Toitelahuse 20X – AAP viie põhilahuse (A1, A2, A3, B, C) valmistamiseks kasutatakse keemiliselt puhtaid kemikaale. Toitelahuse saamiseks lisatakse ligikaudu 850 ml deioniseeritud veele 20 ml iga põhilahust. 0,1 või 1 M HCl või NaOH lisamisega reguleeritakse pH väärtusele 7,5 ± 0,1 ja lahuse maht viiakse deioniseeritud veega 1 liitrini. Seejärel filtritakse toitelahus läbi ligikaudu 0,2 μm pooridega membraanfiltri steriilsesse nõusse.
Katses kasutamiseks ette nähtud toitelahus tehakse valmis 1–2 päeva enne kasutamist, et pH saaks stabiliseeruda. Enne kasutamist kontrollitakse toitelahuse pH ja reguleeritakse seda vajaduse korral uuesti 0,1 või 1 M NaOH või HCl lisamisega eespool kirjeldatud viisil.
|
Põhilahus nr
|
Koostisaine
|
Sisaldus põhilahuses (g·l–1) (1)
|
Sisaldus toitelahuses (mg·l–1) (1)
|
Toitelahus
|
|
Element
|
Sisaldus (1)(mg·l–1)
|
|
A1
|
NaNO3
MgCl2·6H2O
CaCl2·2H2O
|
26
12
4,4
|
510
240
90
|
Na; N
Mg
Ca
|
190; 84
58,08
24,04
|
|
A2
|
MgSO4·7H2O
|
15
|
290
|
S
|
38,22
|
|
A3
|
K2HPO4·3H2O
|
1,4
|
30
|
K; P
|
9,4; 3,7
|
|
B
|
H3BO3
MnCl2·4H2O
FeCl3·6H2O
Na2EDTA·2H2O
ZnCl2
CoCl2·6H2O
Na2MoO4·2H2O
CuCl2·2H2O
|
0,19
0,42
0,16
0,30
3,3 mg·l–1
1,4 mg·l–1
7,3 mg·l–1
0,012 mg·l–1
|
3,7
8,3
3,2
6,0
66 μg·l–1
29 μg·l–1
145 μg·l–1
0,24 μg·l–1
|
B
Mn
Fe
—
Zn
Co
Mo
Cu
|
0,65
2,3
0,66
—
31 μg·l–1
7,1 μg·l–1
58 μg·l–1
0,080 μg·l–1
|
|
C
|
NaHCO3
|
15
|
300
|
Na; C
|
220; 43
|
Märkus. Teoreetiliselt vajalik vesinikkarbonaadi lõppsisaldus (mille puhul ei ole vaja märkimisväärselt reguleerida pH-d) ei ole 300 mg/l, vaid 15 mg/l. Varem, kaasa arvatud laboratooriumidevahelistes võrdluskatsetes, on siiski kasutatud toitelahust 20X-AAP, mille vesinikkarbonaadisisaldus on 300 mg/l (I. Sims, P. Whitehouse and R. Lacey. (1999) The OECD Lemna Growth Inhibition Test. Development and Ring-testing of draft OECD Test Guideline. R&D
Technical Report EMA 003. WRc plc – Environment Agency.
Steinbergi toitelahus (vastab standardile ISO 20079)
Koostisainete sisaldus ja põhilahused
|
—
|
Standardis ISO 20079 nähakse modifitseeritud Steinbergi toitelahuse kasutamine ette ainult väikese lemle, Lemna minor’i puhul (kuna üksnes väikest lemmelt seal lubataksegi kasutada), kuid katsed näitavad, et selle toitelahusega võib saada häid tulemusi ka küürlemle, Lemna gibba puhul.
|
|
—
|
Toitelahuse valmistamiseks kasutatakse keemiliselt või analüütiliselt puhtaid kemikaale ja deioniseeritud vett.
|
|
—
|
Toitelahuse valmistamiseks kasutatakse põhilahuseid või 10 korda kontsentreeritumat toitelahust (see on kõrgeim kontsentratsioon, mille puhul koostisained veel ei sadestu).
|
Tabel 1
Stabiliseeritud pH-ga Steinbergi toitelahus (Altenburgeri modifikatsioon)
|
Koostisaine
|
Toitelahus
|
|
Makroelemendid
|
molekulmass
|
mg/l
|
mmol/l
|
|
KNO3
|
101,12
|
350,00
|
3,46
|
|
Ca(NO3)2 · 4H2O
|
236,15
|
295,00
|
1,25
|
|
KH2PO4
|
136,09
|
90,00
|
0,66
|
|
K2HPO4
|
174,18
|
12,60
|
0,072
|
|
MgSO4 · 7H2O
|
246,37
|
100,00
|
0,41
|
|
Mikroelemendid
|
molekulmass
|
µg/l
|
µmol/l
|
|
H3BO3
|
61,83
|
120,00
|
1,94
|
|
ZnSO4 · 7H2O
|
287,43
|
180,00
|
0,63
|
|
Na2MoO4 · 2H2O
|
241,92
|
44,00
|
0,18
|
|
MnCl2 · 4H2O
|
197,84
|
180,00
|
0,91
|
|
FeCl3 · 6H2O
|
270,21
|
760,00
|
2,81
|
|
EDTA-dinaatriumdihüdraat
|
372,24
|
1 500,00
|
4,03
|
Tabel 2
Põhilahused (makroelemendid)
|
1.
|
Makroelemendid (50-kordselt kontsentreeritud)
|
|
g/l
|
|
Põhilahus 1:
|
|
KNO3
|
17,50
|
|
KH2PO4
|
4,5
|
|
K2HPO4
|
0,63
|
|
Põhilahus 2:
|
|
MgSO4 · 7H2O
|
5,00
|
|
Põhilahus 3:
|
|
Ca(NO3)2 · 4H2O
|
14,75
|
Tabel 3
Põhilahused (mikroelemendid)
|
2.
|
Mikroelemendid (1 000-kordselt kontsentreeritud)
|
|
mg/l
|
|
Põhilahus 4:
|
|
H3BO3
|
120,0
|
|
Põhilahus 5:
|
|
ZnSO4 · 7H2O
|
180,0
|
|
Põhilahus 6:
|
|
Na2MoO4 · 2H2O
|
44,0
|
|
Põhilahus 7:
|
|
MnCl2 · 4H2O
|
180,0
|
|
Põhilahus 8:
|
|
FeCl3 · 6H2O
|
760,00
|
|
EDTA-dinaatriumdihüdraat
|
1 500,00
|
|
—
|
Põhilahused 2 ja 3 võib kokku valada, samuti võib kokku valada ka põhilahused 4–7 (arvestades vajalikke kontsentratsioone).
|
|
—
|
Säilimisaja pikendamiseks autoklaavitakse põhilahused 121 °C juures 20 minuti jooksul või steriliseeritakse membraanfiltrimisega (0,2 µm). Põhilahus 8 soovitatakse kindlasti steriliseerida membraanfiltrimisega (0,2 µm).
|
Vajaliku lõppkontsentratsiooniga modifitseeritud Steinbergi toitelahuse valmistamine
|
—
|
Ligikaudu 900 ml deioniseeritud veele (et vältida sadestumist) lisatakse à 20 ml põhilahuseid 1, 2 ja 3 (vt tabel 2).
|
|
—
|
Lisatakse à 1,0 ml põhilahuseid 4, 5, 6, 7 ja 8 (vt tabel 3).
|
|
—
|
Toitelahuse pH peab olema 5,5 ± 0,2 (pH reguleerimiseks lisatakse väikseim vajalik kogus NaOH või HCl lahust).
|
|
—
|
Toitelahuse maht viiakse veega 1 000 milliliitrini.
|
|
—
|
Kui põhilahused on steriilsed ja kasutatakse nõuetekohast vett, ei ole lahust vaja täiendavalt steriliseerida. Kui valmis lahust steriliseeritakse, siis lisatakse põhilahus 8 pärast autoklaavimist (121 °C, 20 minutit).
|
Pikemaks säilitamiseks mõeldud 10-kordse kontsentratsiooniga modifitseeritud Steinbergi toitelahuse valmistamine
|
—
|
Ligikaudu 30 ml deioniseeritud veele (et vältida sadestumist) lisatakse à 20 ml põhilahuseid 1, 2 ja 3 (vt tabel 2).
|
|
—
|
Lisatakse à 1,0 ml põhilahuseid 4, 5, 6, 7 ja 8 (vt tabel 3). Lahuse maht viiakse veega 100 milliliitrini.
|
|
—
|
Kui põhilahused on steriilsed ja kasutatakse nõuetekohast vett, ei ole lahust vaja täiendavalt steriliseerida. Kui valmis lahust steriliseeritakse, siis lisatakse põhilahus 8 pärast autoklaavimist (121 °C, 20 minutit).
|
|
—
|
Lõppkontsentratsiooniga lahuse pH peab olema 5,5 ± 0,2.
|
(1) Kui ei ole märgitud teisiti.








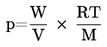











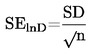
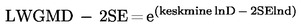
 (ööpäev
(ööpäev