EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 32006D0437
2006/437/EC: Commission Decision of 4 August 2006 approving a Diagnostic Manual for avian influenza as provided for in Council Directive 2005/94/EC (notified under document number C(2006) 3477) (Text with EEA relevance)
2006/437/EÜ: Komisjoni otsus, 4. august 2006 , millega kiidetakse heaks nõukogu direktiiviga 2005/94/EÜ ette nähtud diagnostikakäsiraamat seoses lindude gripiga (teatavaks tehtud numbri K(2006) 3477 all) (EMPs kohaldatav tekst)
2006/437/EÜ: Komisjoni otsus, 4. august 2006 , millega kiidetakse heaks nõukogu direktiiviga 2005/94/EÜ ette nähtud diagnostikakäsiraamat seoses lindude gripiga (teatavaks tehtud numbri K(2006) 3477 all) (EMPs kohaldatav tekst)
OJ L 118M, 8.5.2007, p. 1285–1311
(MT)
OJ L 237, 31.8.2006, p. 1–27
(ES, CS, DA, DE, ET, EL, EN, FR, IT, LV, LT, HU, NL, PL, PT, SK, SL, FI, SV)
Special edition in Bulgarian: Chapter 03 Volume 075 P. 56 - 82
Special edition in Romanian: Chapter 03 Volume 075 P. 56 - 82
Special edition in Croatian: Chapter 03 Volume 015 P. 117 - 143
 No longer in force, Date of end of validity: 20/04/2021; kehtetuks tunnistatud 32020R0689
No longer in force, Date of end of validity: 20/04/2021; kehtetuks tunnistatud 32020R0689
|
31.8.2006 |
ET |
Euroopa Liidu Teataja |
L 237/1 |
KOMISJONI OTSUS,
4. august 2006,
millega kiidetakse heaks nõukogu direktiiviga 2005/94/EÜ ette nähtud diagnostikakäsiraamat seoses lindude gripiga
(teatavaks tehtud numbri K(2006) 3477 all)
(EMPs kohaldatav tekst)
(2006/437/EÜ)
EUROOPA ÜHENDUSTE KOMISJON,
võttes arvesse nõukogu 20. detsembri 2005. aasta direktiivi 2005/94/EÜ linnugripi tõrjet käsitlevate ühenduse meetmete ning määruse 92/40/EMÜ kehtetuks tunnistamise kohta, (1) ning eelkõige selle artikli 50 lõike 1 teist lõiku,
ning arvestades järgmist:
|
(1) |
Direktiivis 2005/94/EÜ on sätestatud linnugripi tõrjumise ja varajase avastamisega seotud teatud ennetavad meetmed, ning samuti minimaalsed kontrollimeetmed, mida tuleb kohaldada selle haiguse puhangu korral kodulindude ja muude vangistuses peetavate lindude seas. |
|
(2) |
Ühenduse tasandil on vajalik diagnostiliste menetluste, proovivõtumeetodite ning linnugripi puhangu kindlakstegemiseks tehtavate laboriuuringute tulemuste hindamiskriteeriumide paikaseadmine. |
|
(3) |
Direktiivi 2005/94/EÜ VII lisa sätestab ühenduse referentlabori funktsioonid ja ülesanded lindude gripi korral, et komisjoniga konsulteerides kooskõlastada liikmesriikides kasutatavaid selle haiguse diagnoosimise meetmeid. Need funktsioonid ja ülesanded hõlmavad regulaarsete võrdluskatsete korraldamist ning standardreaktiivide tarnimist ühenduse tasandil. |
|
(4) |
Hiljuti arendati välja laborikatsed lindude gripi kiire diagnoosimise tagamiseks. |
|
(5) |
Viimastel aastatel lindude gripi tõrjumisest saadud kogemuste põhjal on selgunud sobivaimad proovide võtmise viisid ning kriteeriumid selle haiguse õigeks diagnoosimiseks eri olukordades tehtavate laborikatsete tulemuste hindamiseks. |
|
(6) |
Käesoleva otsusega sätestatud meetmed on kooskõlas toiduahela ja loomatervishoiu alalise komitee arvamusega, |
ON VASTU VÕTNUD JÄRGMISE OTSUSE:
Artikkel 1
Direktiiviga 2005/94/EÜ ette nähtud ning käesoleva otsuse lisas sätestatud diagnostikakäsiraamat on heaks kiidetud.
Artikkel 2
Liikmesriigid kohaldavad diagnostikakäsiraamatut alates direktiivi 2005/94/EÜ ülevõtmisest või alates 1. juulist 2007, sõltuvalt sellest, kumb kuupäev on varasem.
Artikkel 3
Käesolev otsus on adresseeritud liikmesriikidele.
Brüssel, 4. august 2006
Komisjoni nimel
komisjoni liige
Markos KYPRIANOU
(1) ELT L 10, 14.1.2006, lk 16.
LISA
LINDUDE GRIPI DIAGNOSTIKA KÄSIRAAMAT
I PEATÜKK
Sissejuhatus, eesmärgid ja mõisted
|
1. |
Ühtsete menetluste tagamiseks lindude gripi (edaspidi “AI”) diagnoosimisel ühenduses nähakse käesoleva diagnostikakäsiraamatuga ette:
|
|
2. |
Käesolev diagnostikakäsiraamat on suunatud ametiasutustele, kes vastutavad AI tõrje eest. Seepärast puudutab see peaasjalikult laborikatsete põhimõtteid ja kohaldamist ning nende tulemuste hindamist, aga samuti laboritehnikaid. |
|
3. |
Käesolevas diagnostikakäsiraamatus kasutatakse lisaks direktiivi 2005/94/EÜ artiklis 2 osutatud mõistetele järgmist mõistet:
|
|
4. |
AIsse nakatumise kinnitamine kodulindudel ja muudel vangistuses peetavatel lindudel peab toimuma vastavalt käesoleva diagnostikakäsiraamatuga ette nähtud menetlustele, proovivõtumeetoditele ning laborikatsete tulemuste hindamise kriteeriumidele, võttes aluseks üht või enamat punktides a, b ja c esitatud kriteeriumi:
|
|
5. |
Imetajate nakatumise kinnitamine lindudelt pärit A-tüüpi gripiviiruse kõrge või madala patogeensusega alatüüpidega H5 või H7 peab põhinema ühel või enamal punktis a või b esitatud kriteeriumil:
|
|
6. |
Menetlused, proovivõtumeetodid ja laborikatsete tulemuste hindamise kriteeriumid peavad olema:
|
II PEATÜKK
AI kirjeldus erilise rõhuasetusega eristusdiagnoosil
1. Haiguse põhjused ja virulentsus
AI on eriti nakkav viirusnakkus, mida põhjustavad Orthomyxoviridae perekonna A-tüüpi gripiviiruste hulka kuuluvad viirused. Need viirused on ainsad teadaolevad lindudele nakkavad ortomüksoviirused. Mitmete linnuliikide puhul on avaldunud vastuvõtlikkus A-tüüpi gripiviiruse nakkuse suhtes; veelinnud moodustavad selliste viiruste suurima reservuaari, kuid isolaatide ülekaalukas enamik on olnud madala patogeensusega kanadel ja kalkunitel, kes on peamised haigusesse nakatunud majanduslikult olulised linnud.
A-tüüpi gripiviirustel on antigeenselt seotud nukleoproteiinid ja antigeenselt seotud maatriksvalgud, kuid alatüüpidesse on need klassifitseeritud pinna glükoproteiinide hemaglutiniini (HA) ja neuraminidaasi (NA) antigeense seotuse põhjal. Hetkel teatakse 16 HA alatüüpi (H1–H16) ja 9 NA alatüüpi (N1–N9). Igal A-tüüpi gripiviirusel on üks HA- ja üks NA-antigeen, ilmselt mis tahes kombinatsioonis.
A-tüüpi gripiviirused jagunevad kahte rühma nende võime alusel põhjustada vastuvõtlike kodulindude haigestumist:
|
a) |
kõrge patogeensusega linnugripi (KPLG) viirused, mis põhjustavad väga raske haiguse, mida iseloomustab nakatunud kodulindude generaliseerunud nakatumine, mis võib kaasa tuua linnukarja väga suure suremuse (kuni 100%); ning |
|
b) |
madala patogeensusega linnugripi (MPLG) viirused, mis põhjustavad kodulindudel üksnes kergekujulisi hingamisteede haigusi, kui puuduvad kaasnevate nakkuste või tegurite põhjustatud muud raskendavad asjaolud. |
Metslindudel, eriti rändavatel veelindudel, on A-tüüpi viiruse kandjatena väga oluline osa, nagu seda on näidanud HA- ja NA-alatüüpide pea kõikvõimalike kombinatsioonide isoleerimine metslindudel. Üldiselt, kui välja arvata juhud, kus KPLG on üle kandunud nakatunud kodulindudelt, on metslindudel avastatud ainult MPLG-viiruseid.
Põhilised AI-viiruste sissetoomised kodulinnukasvandustesse on kõige tõenäolisemalt põhjustatud kas otsestest või kaudsetest kokkupuudetest metslindudega.
Kodulindude puhul eksisteerib võimalus, et sellised metslindude poolt sisse toodud MPLG-viirused võivad edasi kanduda märkamatult, kuna kliinilised tunnused on tihtipeale kergekujulised või puuduvad.
Kodulindudele üle kandunud MPLG viirusetüvede H5- ja H7-alatüübid võivad muteeruda KPLG tüvedeks. Siiani on tõendeid ainult H5- ja H7-alatüüpi viiruste poolt põhjustatud KPLGst.
Ehkki näib, et MPLG muteerumise taga KPLG-viiruseks võib olla mitmeid mehhanisme, ei ole mutatsiooni esile kutsuvad tegurid teada. Mõnel juhul näib mutatsioon olevat leidnud kiiresti aset metslindude poolt algselt sisse toodud kohas, teistel juhtudel on MPLG-viirus kodulindude hulgas enne muteerumist ringluses olnud mitu kuud. Seega on võimatu ennustada, kas ja millal selline mutatsioon toimub. Siiski on põhjust oletada, et mida laiem on MPLG levik kodulindude seas, seda suurem on selle tõenäosus muteeruda KPLGks.
Peiteaega on raske hinnata ning tõenäoliselt on see viirusetüvede ja peremeesorganismide kaupa erinev, tavaliselt on räägitud viiest kuni kuuest päevast, kuid üksikute lindude puhul võib see ulatuda mõnest tunnist umbes seitsme päevani.
2. KPLG-viirusega nakatunud lindude kliinilised tunnused
Kliinilised tunnused on väga varieeruvad ning neid mõjutavad sellised tegurid nagu nakkava viiruse virulentsus, mõjutatud liigid, vanus, sugu, kaasnevad haigused ning keskkond.
Varajaste haigustunnuste hulka kuuluvad isutus, veejoomise vähenemine ning suhteliselt väike suremus. Siiski võib haigus teise võimalusena linnukarjas avalduda äkitselt ning suur hulk linde võib surra kas hoiatavate tunnusteta või minimaalsete tunnustega, nagu depressioon, isutus, turris suled või palavik. Üldiselt nähtub, et mida kauem lind elab, seda selgemini kliinilised tunnused avalduvad. Haigustunnuste väljakujunemise aeg sõltub viirusest, peremeesorganismist, esmasest nakkusdoosist ning linnukasvatussüsteemist. Viirus levib aeglasemini puurides peetavate munakanade ning välistingimustes peetavate lindude seas, võrreldes broilerikasvandustega.
KPLG-viirusega nakatunud emaslinnud võivad esialgu muneda pehme koorega mune, kuid lõpetavad peagi munemise. Haigestunud linnud istuvad või seisavad tihtipeale poolenisti komatoosses olekus, pead vastu maad. Harjad ja lotid on tsüanootilised ja tursunud ning nende servades võivad olla petehhiaalsed või sinakad verevalumid. Sageli esineb rohke vesine diarröa ning linnud on ülemäära janused. Hingamine võib olla raskendatud ning täheldada võib liigset pisaratevoolu. Naha sulgedeta piirkondades võib näha verevalumeid. Linnukarja suremuse määr on 50 kuni 100 %.
Broileritel on KPLG tunnused sageli raskemini märgatavad kui muudel kodulindudel ja tavaliselt hõlmavad need raskekujulist depressiooni ning isutust, esimeseks täheldatud hälbeks võib olla väga järsk suremuse kasv. Samuti võib täheldada näo ja kaela turseid ning neuroloogilisi tunnuseid nagu kõverkaelsus ning ataksia.
KPLG avaldumine kalkunitel sarnaneb selle avaldumisega muudel kodulindudel, kuid osa KPLG-viirustest tundub kalkunite puhul olevat enam, osa aga vähem virulentne.
KPLG-viirusesse nakatunud hanedel sarnanevad depressiooni, isutuse ja diarröa tunnused munakanade omadega, ehkki tihtipeale kaasneb nendega ninaõõne paistetus. Noorematel lindudel võivad avalduda neuroloogilised tunnused.
KPLG-viirusega nakatunud partidel ei pruugi kliinilisi tunnuseid avalduda, kuid mõne viirusetüve puhul on koos mõningase suremusega täheldatud samalaadseid tunnuseid mis hanedelgi.
Kliinilised tunnused võivad puududa KPLGsse ja MPLGsse nakatunud jaanalindudel. KPLG-puhangute puhul, nagu Itaalias aastatel 1999–2000, täheldati pärlkanade ja jaapani põldvuttide vastuvõtlikkust nakkustele, mille tunnused ja suremus sarnanesid kanade ja kalkunite haigustunnustega. Siiski on mõned eksperimentaaluuringud näidanud põldvuttide resistentsust KPLG teatud tüvede suhtes. Kõigi lindude puhul võib sama H-alatüübi antikehade olemasolu kas vaktsineerimise või loomuliku nakatumise kaudu tähendada seda, et nakatumine KPLG-viirusega ei avaldu selgete kliiniliste tunnustena.
3. Surmajärgsed kahjustused KPLG-viirusega nakatunud lindudel
Ägeda haiguse tagajärjel surnud lindudel võib täheldada minimaalseid kahjustusi, mis avalduvad vedelikukaotuse ning sisikonna ja lihaste kongestiooni näol.
Lindudel, kes surevad pikaajalise haiguse tagajärjel, tekivad petehhiaalsed ja sinakad verevalumid, eriti neelus, hingetorus, eesmao ja epikardi rasvkoes ning rinnakuga külgnevatel seroossetel kelmetel. Täheldatakse ulatuslikku nahaalust ödeemi, eriti pea ja kannavaheliigese ümbruses. Rümp võib olla dehüdreerunud. Põrnas, maksas, neerudes ning kopsudes võivad esineda kollakad või hallikad kärbunud kolded. Õhukottides võib sisalduda eritist. Põrn võib olla suurenenud ning verevalumites.
Histoloogiliselt iseloomustavad AId vaskulaarsed häiritused, mis viivad ödeemi, verevalumite ning perivaskulaarsete turseteni, eriti müokardis, põrnas, kopsudes, ajus, pankreases ja lotis. Kärbunud koldeid leidub kopsudes, maksas ja neerudes. Ajus võib esineda glioosi, vaskulaarset vohamist ja neuronite degenereerumist.
4. Diferentsiaaldiagnostika
KPLG diferentsiaaldiagnostikas tuleb arvesse võtta eelkõige järgmisi haigusi:
|
a) |
muud äkilist kõrget suremust põhjustavad haigused, nagu
|
|
b) |
muud harjade ja lottide paistetust põhjustavad haigused, nagu
|
5. MPLG-viirusega nakatunud lindude kliinilised tunnused
MPLG-viiruste poolt tekitatud haiguse raskusastet mõjutab olulisel määral:
|
a) |
viiruse tüvi; |
|
b) |
peremeesorganismi liik ja vanus; |
|
c) |
peremeesorganismi immuunstaatus viiruse suhtes ning eriti olemasolevad muud nakkusallikad, nagu
|
|
d) |
immuunpuudulikkuse tingimused; |
|
e) |
keskkonnategurid (nagu ülemäärane ammoniaak, tolm, kõrged ja madalad temperatuurid). |
Ühtedel juhtudel võivad haiguse kliinilised tunnused olla märkamatud või kerged, tekitades ainult kergekujulisi hingamisprobleeme, või munalindude puhul munatootmisprobleeme. Teistel juhtudel võib KPLG-viirusnakkust, eriti kalkunite puhul, seostada selle haiguse raskete kliiniliste tunnustega, millega kaasneb korin, köha, silmaalune paistetus ning palavikuline olek koos isukaotuse ning suure suremusega.
KPLGd võidakse segi ajada või seda võivad raskendada mitmed muud hingamisteede või seedetrakti vaevustena avalduvad haigused. AId tuleb kahtlustada igasuguse taudipuhangu korral, mis ei vaibu vaatamata teiste haiguste ennetus- ja ravimeetmete kohaldamisele.
6. Kliinilised tunnused vangistuses peetavatel lindudel
Kliiniliste tunnuste spekter võib olla väga lai ning nagu kodulindudegi puhul võib see ulatuda märkamatutest raskete haigustunnusteni, mille tagajärjeks on suur suremus.
Üldiselt levib nakkus vangistuses peetavate lindude kogumis aeglasemalt seoses eri liikide mitmekesisuse, erisuguse vastuvõtlikkuse, viiruse leviku erinevate tasemete ning tihtipeale ka suhteliselt aeglase edasikandumisega, mis tuleneb madalast kokkupuuteastmest ning suhteliselt väikesest asustustihedusest.
III PEATÜKK
Suunised, mida tuleb arvesse võtta AI-kahtluse korral linnukasvatusettevõttes
Nii KPLG kui MPLG kliiniliste tunnuste varieeruvus tähendab, et üheste suuniste andmine puhangukahtluse juhuks ei ole võimalik. Äkilist suurt kodulindude suremust koos või ilma II peatükis kirjeldatud kliiniliste tunnusteta, mida seostatakse haigusega, tuleb uurida, esitades proovid laboratoorsete uuringute tegemiseks, kuid suure suremuse puudumisel on AI esinemise kahtlustamine või välistamine raskem.
Kuna H5- ja H7-alatüüpide põhjustatud KPLG või MPLG kiire diagnoosimine on nende varase kontrolli alla saamise ja likvideerimise seisukohast ülimalt tähtis, tuleb hingamisraskuste, munemisprobleemide ning kodulindude suurenenud suremuse eristusdiagnoosis alati arvestada AI võimalusega ning vastavad proovid saata laboriuuringutele.
Joonis
Skemaatiline ülevaade diagnostilistest sammudest AI kinnitamisel
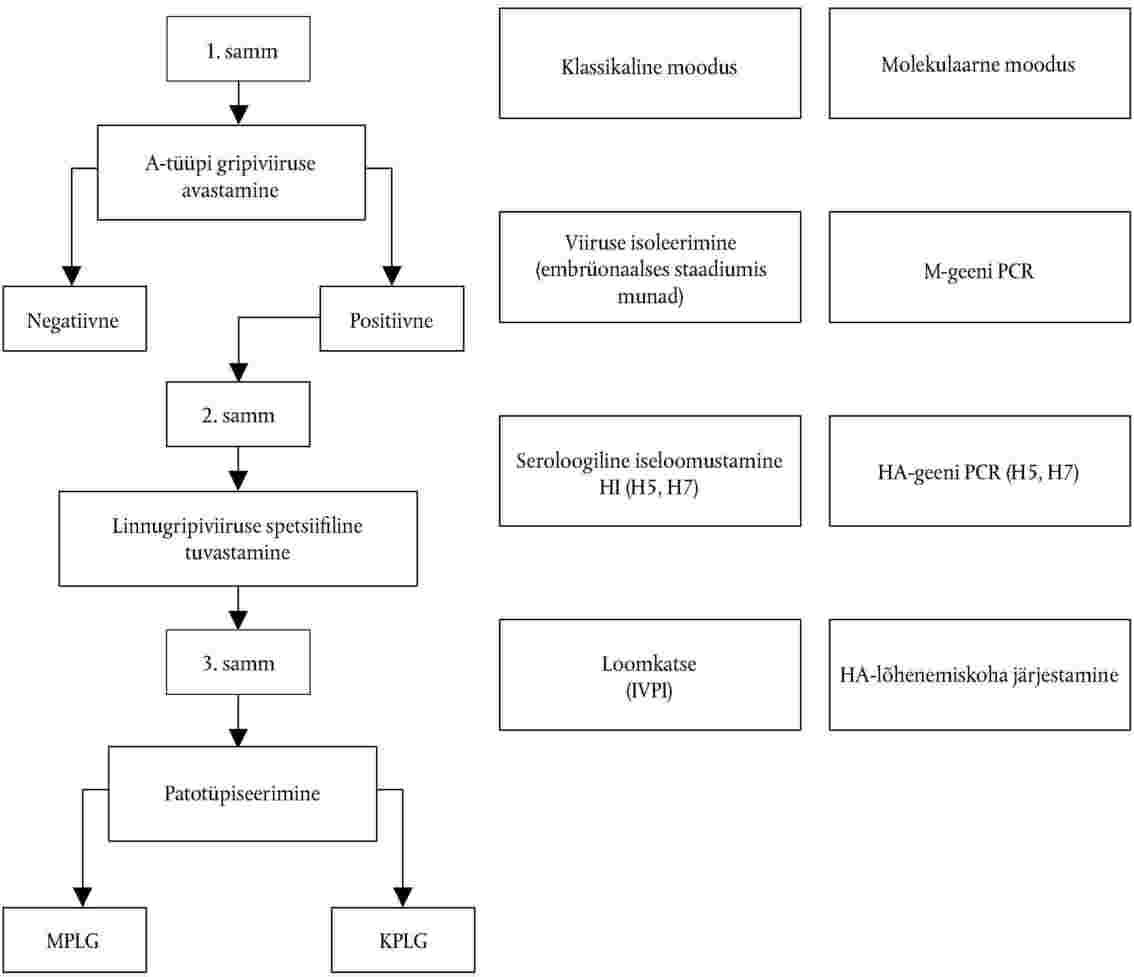
IV PEATÜKK
Proovide võtmise ja proovide vedamise üldised meetodid
1. Direktiiv 2005/94/EÜ ja diagnostikakäsiraamat
Juhtudel, kus direktiivis 2005/94/EÜ osutatakse diagnostikakäsiraamatule, tuleb läbi viia diagnostikakäsiraamatu käesolevas peatükis sätestatud uuringud, proovivõtu- ja jälgimisprotseduurid.
2. Menetlused, mida tuleb järgida AI-puhangu kahtluse korral
Juhtudel, kui ametlikul veterinaararstil on AI-puhangu kliiniline kahtlus või kui mis tahes laborikatsete tulemused selle taudi kindlakstegemisel ei ole negatiivsed, peab pädev asutus tagama, et kooskõlas direktiivi 2005/94/EÜ artikliga 7 tehakse diagnostikakäsiraamatu käesolevas peatükis kirjeldatud uuring, mis on rahuldavalt lõpule viidud alles haiguse esinemise välistamisel.
3. Viroloogiliste katsete tõlgendamine
Pädev asutus võib AI-viiruse esinemise lugeda välistatuks, kui kooskõlas käesoleva peatükiga on kõnealuse viiruse või selle genoomi avastamiseks esitatud kohane arv haigeid või surnud linde ja hingetoru/kitsa suuneelu või kloaagi tampooniproove, ning need on andnud negatiivsed tulemused, kui neid on testitud, kasutades üht V või VI peatükis osutatud või pädeva asutuse poolt kooskõlas I peatüki punkti 6 alapunktiga b heaks kiidetud spetsifitseeritud viiruse avastamise meetodit.
4. Proovide standardkogum viroloogilisteks või seroloogilisteks laborikatseteks
AI-viiruse nakkuskahtlusega ettevõtte uurimiseks tuleb võtta ning viivitamata viroloogiliste ja seroloogiliste laborikatsete läbiviimiseks esitada punktides a ja b osutatud proovide standardkogum viroloogilisteks või seroloogilisteks katseteks (edaspidi “standardproovid”).
|
a) |
Viroloogiliste uuringute proovide standardkogumiks on:
Rümbad tuleb võtta lindude hulgast, kes on surnud hiljuti või kes on raskelt haiged või kes olid suremas ja on surmatud humaansel moel. Tampooniproovid tuleb võtta punktis a osutatud arvult lindudelt või nakkuskahtlusega ettevõtte kõigilt lindudelt, kui lindude arv on väike. Kliiniliste tunnustega linnud tuleb suunata proovivõtmisele. Kloaagi-tampooniproovid peavad olema kaetud fekaalidega (optimaalne 1 g). Kui mingil põhjusel ei peaks kloaagi-tampooniproovide ettevaatlik kogumine lindudelt olema teostatav, võivad alternatiivina toimida värskete fekaalide proovid. Sageli on hingetoru/kitsa suuneelu tampooniproove kõige praktilisem koguda suuõõnest. Niipea kui viiruse kasvuomadused on teada, võib pädev asutus otsustada kas ainult hingetoru/kitsa suuneelu või ainult kloaagi tampooniproovide, mitte nende mõlema kogumise kasuks, sõltuvalt sellest, kas viirus paljuneb paremini hingamisteedes või seedetraktis, ning võttes arvesse ka asjaomaseid liike. |
|
b) |
Seroloogiliste uuringute proovide standardkogum koosneb vähemalt 20 vereproovist. Proovid tuleb võtta punktis b osutatud arvult lindudelt või nakkuskahtlusega ettevõtte kõigilt lindudelt, kui lindude arv on väike. Haiged või näiliselt paranenud linnud tuleb saata proovivõtmisele. Pädev asutus võib otsustada, et standardproovide võtmine täismahus ei ole vajalik, kuid nende asemel võib võtta standardproovide osarühma. |
5. Proovide vedu
Proovide ladustamine ja laborisse transportimine uurimise eesmärgil nõuab erilist hoolt.
Tampooniproovid tuleb viivitamata jahutada jääl või külmutatud geelikottide abil ning esitada laborile nii kiiresti kui võimalik. Proove ei tohi külmutada, kui see ei ole just hädavajalik. Kui proovide kiiret vedu laborisse 24 tunni jooksul ei ole võimalik tagada, tuleb proovid viivitamata külmutada, ladustada ja transportida kuival jääl.
Lisaks, kuid mitte jahutamise asemel, tuleb tampooniproovid asetada antibiootilisse või mõnesse muusse spetsiifilisse viiruste transportimise keskkonda 4 oC juures, nii et need on täielikult sellega kaetud. Sellise keskkonna puudumisel tuleb tampooniproovid asetada tagasi nende ümbristesse ning esitada need laborile testimiseks kuivalt.
Proovide ladustamist ja vedu võivad mõjutada eri tegurid, seega peab vedamiseks valitud meetod olema selleks otstarbeks sobiv.
6. Antibiootiline keskkond
Punktis 5 osutatud antibiootiline keskkond peab põhinema fosfaatpuhvri lisandiga keedusoolalahusel pH-tasemega 7,0–7,4 (kontrollitakse pärast antibiootikumi lisamist).
Valgupõhised keskkonnad, nagu aju-südame- või Tris-puhverdatud trüptoosi puljong võivad lisada viirusele stabiilsust, eriti transportimise ajal. Kasutatavaid antibiootikume ja nende kontsentratsioone võib kohalikest tingimustest ja kättesaadavusest lähtuvalt varieerida.
Fekaaliproovide puhul võivad vajalikud olla antibiootikumide väga suured kogused, ning kohasteks kogusteks on 10 000 RÜ/ml penitsilliini, 10 mg/ml streptomütsiini, 0,25 mg/ml gentamütsiini ning 5 000 RÜ/ml nüstatiini. Kudede ja hingetoru-tampooniproovide puhul võivad need kogused olla kuni viis korda väiksemad.
Kui soovitakse Chlamydophila kontrolli all hoidmist, tuleb lisada 0,05–0,1 mg/ml oksütetratsükliini.
7. Aju-südamepuljongi keskkond
Lahus tuleb teha vees, ning see peab enne steriliseerimist (autoklaaviga 121 oC/15 minutit) sisaldama 15 mahuprotsenti aju-südame-puljongipulbrit.
Pärast steriliseerimist tuleb lisada järgmistes kogustes antibiootikume: 10 000 RÜ/ml penitsilliin G-d, 20 ug amfoteritsiin B-d ja 1 000 ug/ml gentamütsiini. Lahust võib 4 oC juures säilitada kuni kaks kuud.
8. Direktiivi 2005/94/EÜ asjaomaste sätete osas tuleb läbi viia järgmised menetlused.
8.A. Taudikahtlus
8.1. Artikli 7 lõige 1 – taudipuhangu kahtluse korral ettevõtete suhtes kohaldatavad meetmed
Ametliku veterinaararsti kontrollkäigul taudikahtlusega ettevõttesse tuleb kohaldada järgmisi meetmeid.
|
a) |
Ettevõtte tootmise ja tervisega seotud andmete kontroll, kui sellised andmed on olemas. Ametliku veterinaararsti koostatavas inspekteerimisaruandes peavad olema esitatud päevase suremuse, munatootmise ning toidu ja/või vedelikutarbimise andmed ajavahemikust üks nädal enne AI kliiniliste tunnuste ilmnemist kuni ettevõtte inspekteerimiseni ametliku veterinaararsti poolt. |
|
b) |
Iga tootmisüksuse kliiniline kontroll, sealhulgas selle kliiniliste andmete hindamine ning kodulindude või muude vangistuses peetavate lindude, eriti haigestunud lindude kliiniline läbivaatus. |
|
c) |
Välja arvatud juhul, kui pädev asutus on veendunud, et taudipuhangu võib välistada vastavalt punktidele a ja b teostatud kliinilise uurimise põhjal, tuleb igast tootmisüksusest võtta standardproovid. |
|
d) |
Sõltumata standardproovide kontrollimise negatiivsetest tulemustest ning lähtuvalt kohalikest teguritest tuleb igas tootmisüksuses teha kodulindude kliiniline läbivaatus, enne kui ametlik järelevalve lõpetatakse. |
8.2. Artikli 10 lõige 3 – epidemioloogilise uurimise põhjal kohaldatavad täiendavad meetmed
Igas tootmisüksuses tuleb surmatud kodulindudelt või muudelt vangistuses peetavatelt lindudelt võtta standardproovid.
8.B. Kõrge patogeensusega linnugripp (KPLG)
8.3. Artikli 11 lõige 4 – kinnitatud taudipuhanguga ettevõtetest korjatud munadest koorunud kodulindude puhul kohaldatavad meetmed
Ametliku veterinaararsti kontrollkäigul ettevõttesse, kus esineb kodulinde, kes on juba koorunud KPLG-kinnitusega ettevõttest peiteaja jooksul korjatud munadest, tuleb kohaldada järgmisi meetmeid.
|
a) |
Ettevõtte tootmise ja tervisega seotud andmete kontroll, kui sellised andmed on olemas. Ametliku veterinaararsti koostatavas inspekteerimisaruandes peavad olema esitatud päevase suremuse ning toidu ja/või vedelikutarbimise andmed ajavahemikust üks nädal enne KPLG kliiniliste tunnuste ilmnemist kuni ettevõtte inspekteerimiseni ametliku veterinaararsti poolt. |
|
b) |
Iga tootmisüksuse kliiniline kontroll ning kodulindude, eriti haigestunud ning oodatust aeglasemalt kasvavate lindude kliiniline läbivaatus. |
|
c) |
Kahe- kuni kolmenädalastelt kodulindudelt tuleb võtta standardproovid. |
|
d) |
Ettevõtte ametlikku järelevalvet ei lõpetata enne, kui on tehtud üle 21 päeva vanuste kodulindude kliiniline läbivaatus ning standardproovide kontrollimine on andnud negatiivsed tulemused. |
8.4. Artikli 13 lõike 2 punkt b – teatavaid ettevõtteid käsitlevad erandid
Ametliku veterinaararsti kontrollkäigul ettevõttesse, mille suhtes on kehtestatud direktiivi 2005/94/EÜ artikli 11 lõike 2 esimeses lõigus sätestatud erand, tuleb kohaldada järgmisi meetmeid.
|
a) |
Ettevõtte tootmise ja tervisega seotud andmete kontroll, kui sellised andmed on olemas. |
|
b) |
Iga tootmisüksuse kliiniline kontroll, sealhulgas selle kliiniliste andmete hindamine ning kodulindude või muude vangistuses peetavate lindude, eriti haigestunud lindude kliiniline läbivaatus. |
|
c) |
Standardproovide asemel tuleb 21 päeva möödudes viimasest positiivsest KPLG leiust igast tootmisüksusest ning iga 21 päeva tagant laborikatseteks võtta järgmised proovid:
Siiski võib pädev asutus riskide hindamise tulemuste põhjal lubada kõrvalekaldumisi alapunktides i ja ii osutatud proovide arvust. |
|
d) |
Punktis c osutatud proovide võtmine ning nende laboratoorsed uuringud peavad jätkuma, kuni saadakse kaks järjestikust negatiivset laboritulemust, mille vahele peab jääma vähemalt 21 päeva. |
8.5. Artikli 15 lõiked 1 ja 3 – kontaktettevõtetes kohaldatavad meetmed
Ametliku veterinaararsti kontrollkäigul kontaktettevõttesse tuleb kohaldada järgmisi meetmeid.
|
a) |
Ettevõtte tootmise ja tervisega seotud andmete kontroll, kui sellised andmed on olemas. Ametliku veterinaararsti koostatavas farmi inspekteerimise aruandes peavad olema esitatud päevase suremuse ning toidu- ja/või vedelikutarbimise andmed, kui sellised andmed on olemas ajavahemikust üks nädal enne AI-nakkuskahtlusega linnukarjaga kokkupuutumist kuni ettevõtte inspekteerimiseni ametliku veterinaararsti poolt. |
|
b) |
Iga tootmisüksuse kliiniline kontroll, sealhulgas selle kliiniliste andmete hindamine ning kodulindude või muude vangistuses peetavate lindude, eriti haigestunud lindude kliiniline läbivaatus. |
|
c) |
Kui kodulindudel või muudel vangistuses peetavatel lindudel ilmnevad kliinilised tunnused või märgid päevase suremuse suurenemisest (linnukarja enam kui kolmekordistunud tavasuremus) või päevase munatootmise langusest (> 5 %) või päevase toidu- ja/või vedelikutarbimise vähenemisest (> 5 %), tuleb igast tootmisüksusest viivitamata võtta standardproovid. |
|
d) |
Kui punktides b ja c osutatud tunnused puuduvad, tuleb standardproovid võtta 21 päeva möödumisel viimasest võimalikust kokkupuutest nakatunud ettevõttega või kui kodulinnud või muud vangistuses peetavad linnud surmatakse. |
8.6. Artikli 18 punktid b ja c – loendus ja ametliku veterinaararsti kontrollvisiidid ning järelevalve ohustatud tsooni ettevõtetes
Ametliku veterinaararsti kontrollkäigul kaubandusettevõtetesse tuleb kohaldada järgmisi meetmeid.
|
a) |
Ettevõtte tootmise ja tervisega seotud andmete kontroll. Kui ilmnevad märgid päevase suremuse suurenemisest (linnukarja enam kui kolmekordistunud tavasuremus) või päevase munatootmise langusest (> 5 %) või päevase toidu- ja/või vedelikutarbimise vähenemisest (> 5 %), tuleb igast tootmisüksusest võtta standardproovid. |
|
b) |
Iga tootmisüksuse kliiniline kontroll, sealhulgas selle kliiniliste andmete hindamine ning kodulindude või muude vangistuses peetavate lindude, eriti haigestunud lindude kliiniline läbivaatus. |
|
c) |
Kui kodulinnuliikidele või muudele vangistuses peetavatele linnuliikidele ei ole omane taudi kliiniliste tunnuste selge avaldumine, või kui tegemist on vaktsineeritud lindudega, võib pädev asutus riskianalüüsi tulemuste põhjal otsustada, et standardproovid tuleb võtta igast tootmisüksusest. |
|
d) |
Pädev asutus peab riskianalüüsi tulemuste põhjal otsustama täiendava ametliku järelevalve üle kliiniliste läbivaatuste ja laboratoorseteks uuringuteks proovide võtmise näol jälgimise all olevates ettevõtetes, kasvatusaladel või tootmistüüpide puhul. |
8.7. Artikli 19 punkt f – ohustatud tsooni ettevõtetele kohaldatavad meetmed
Ametliku veterinaararsti kontrollkäigul ettevõttesse, kus on täheldatud haigestumise või suremuse suurenemist või tootmisnäitajate olulist langust, tuleb kohaldada järgmisi meetmeid.
|
a) |
Ettevõtte tootmise ja tervisega seotud andmete kontroll. Kui ilmnevad märgid päevase suremuse suurenemisest (linnukarja enam kui kolmekordistunud tavasuremus) või päevase munatootmise langusest (> 5 %) või päevase toidu- ja/või vedelikutarbimise vähenemisest (> 5 %), tuleb igast tootmisüksusest võtta standardproovid. |
|
b) |
Iga tootmisüksuse kliiniline kontroll, sealhulgas selle kliiniliste andmete hindamine ning kodulindude või muude vangistuses peetavate lindude, eriti haigestunud lindude kliiniline läbivaatus. |
8.8. Artikli 23 punkt b – kohe tapale viidavate kodulindude otseveo korral tehtavad erandid
Ametliku veterinaararsti kontrollkäigul ettevõttesse, mille suhtes on kehtestatud direktiivi 2005/94/EÜ artikliga 22 sätestatud erand, tuleb kohaldada järgmisi meetmeid.
|
a) |
Ettevõtte tootmise ja tervisega seotud andmete kontroll. |
|
b) |
Iga tootmisüksuse kliiniline kontroll, sealhulgas selle kliiniliste andmete hindamine ning igasuguste kodulindude, eriti 24 tundi enne väljasaatmist haigestunud lindude kliiniline läbivaatus. |
|
c) |
Pädeva asutuse poolt läbiviidud riskianalüüsi tulemuste põhjal ning standardproovide asemel tuleb iga tootmisüksuse tapale saadetavatelt kodulindudelt vähem kui 48 tundi enne kodulindude väljasaatmist võtta vähemalt 60 hingetoru/kitsa suuneelu ja/või 60 kloaagi tampooniproovi. |
8.9. Artikli 25 punkt b – munema hakkavate kodulindude otseveo korral tehtavad erandid
Ametliku veterinaararsti kontrollkäigul ettevõttesse, mille suhtes on kehtestatud artikliga 22 sätestatud erand, tuleb enne munema hakkavate kodulindude otsetransporti kohaldada järgmisi meetmeid.
|
a) |
Ettevõtte tootmise ja tervisega seotud andmete kontroll. |
|
b) |
Iga tootmisüksuse kliiniline kontroll, sealhulgas selle kliiniliste andmete hindamine ning kodulindude, eriti 24 tundi enne väljasaatmist haigestunud lindude kliiniline läbivaatus. |
|
c) |
Pädeva asutuse tehtud riskianalüüsi tulemuste põhjal ning standardproovide asemel tuleb iga tootmisüksuse väljaveetavatelt kodulindudelt vähem kui 48 tundi enne kodulindude väljasaatmist võtta vähemalt 60 hingetoru/kitsa suuneelu ja/või 60 kloaagi tampooniproovi. |
8.10. Artikli 26 lõike 1 punkt a – haude- ja toidumunade otseveo korral tehtavad erandid
Ametliku veterinaararsti kontrollkäigul päritolukarja ettevõttesse, mille suhtes on kehtestatud artikliga 22 sätestatud erand, tuleb enne haudemunade otsevedu kohaldada järgmisi meetmeid.
|
a) |
Ettevõtte tootmise ja tervisega seotud andmete kontroll. |
|
b) |
Iga tootmisüksuse kliiniline läbivaatus iga 15 päeva tagant. |
|
c) |
Igast tootmisüksusest tuleb võtta standardproovid. |
8.11. Artikli 29 lõige 1 – meetmete kestus
Ohustatud tsoonis kooskõlas direktiivi 2005/94/EÜ IV peatüki 3. jaoga kohaldatavad meetmed võib tühistada alles 21 päeva pärast nakatunud ettevõtte esialgset puhastamist ja desinfitseerimist järgmistel eeldustel.
|
a) |
Ametlik veterinaararst on kontrollinud kõiki ohustatud tsooni kaubanduslikke ettevõtteid ning kõik artikli 8 lõike 6 punktides a, b ja c ja artikli 8 lõikes 7 sätestatud kliinilised kontrollid ja läbivaatused ning laborikatsed on andnud negatiivsed tulemused. |
|
b) |
Ametlik veterinaararst on kontrollinud kõiki ohustatud tsooni tuvastatud mittekaubanduslikke ettevõtteid ning ei kliiniline läbivaatus ega ühegi teostatud laborikatse tulemused ole tekitanud AI-nakatumiskahtlust. |
|
c) |
Igasugune artikli 8 lõike 6 punkti d kohaselt teostatud täiendav ametlik järelevalve on andnud negatiivsed tulemused. |
8.12. Artikli 30 punkt g – järelevalvetsoonides kohaldatavad meetmed
Ametliku veterinaararsti kontrollkäigul ettevõttesse, kus on täheldatud haigestumise või suremuse suurenemist või tootmisnäitajate olulist langust, tuleb kohaldada järgmisi meetmeid.
|
a) |
Ettevõtte tootmise ja tervisega seotud andmete kontroll. |
|
b) |
Iga tootmisüksuse kliiniline kontroll, sealhulgas selle kliiniliste andmete hindamine ning kodulindude või muude vangistuses peetavate lindude, eriti haigestunud lindude kliiniline läbivaatus. |
|
c) |
Igast tootmisüksusest tuleb võtta standardproovid. |
8.13. Artikkel 35 – tapamajades ja veovahendites KPLG esinemise kahtluse korral läbiviidav uurimine
Ametliku veterinaararsti kontrollkäigul tapamajades või veovahendites olevate kodulindude päritoluettevõttesse tuleb kohaldada järgmisi meetmeid.
|
a) |
Ettevõtte tootmise ja tervisega seotud andmete kontroll, kui need andmed on olemas. |
|
b) |
Iga tootmisüksuse kliiniline kontroll, sealhulgas selle kliiniliste andmete hindamine ning kodulindude või muude vangistuses peetavate lindude kliiniline läbivaatus, võttes arvesse konsulteerimist ametliku veterinaararstiga tapamajast, kes peab esitama igasuguste varasemate kontrollide andmete üksikasjad ning surmaeelsete ja -järgsete läbivaatuste tulemused. |
|
c) |
Välja arvatud juhul, kui pädev asutus on veendunud, et KPLG esinemise kahtluse võib välistada vastavalt punktidele a ja b teostatud veterinaarse uurimise põhjal, tuleb igast tootmisüksusest võtta standardproovid. |
|
d) |
Lisaks standardproovidele tuleb laboratoorsetele uuringutele saata proovid vähemalt viielt patoloogiliste leidudega tapamaja haigestunud, surnud või tapetud linnult. |
8.14. Artikli 36 lõige 1 – tapamajades kohaldatavad meetmed
Pärast punktis 8.13 osutatud uuringute läbiviimist ning eeldusel, et laborikatsete tulemused on negatiivsed ja KPLG esinemise kohta päritoluettevõttes ja tapamajas puudub kliiniline kahtlus, võib ametliku järelevalve lõpetada.
8.15. Artikli 37 lõiked 1 ja 2 – piiripunktides või veovahendites kohaldatavad meetmed
|
8.15.1. |
Kui ametlik veterinaararst teeb läbivaatuse kodulindudele või muudele vangistuses peetavatele lindudele, kes on piiripunktist või veovahendist KPLG-kahtluse või selle kinnitamise tõttu teisaldatud, tuleb kohaldada järgmisi meetmeid.
|
|
8.15.2. |
Ametliku veterinaararsti kontrollkäigul päritoluettevõttesse tuvastatud kodulindude või muude vangistuses peetavate lindude tapmise korral tuleb kohaldada järgmisi meetmeid.
|
8.C. Madala patogeensusega linnugripp (MPLG)
8.16. Artikli 39 lõike 6 punktid b ja h – kinnitust leidnud MPLG-puhangu korral ettevõtetes kohaldatavad meetmed
Ametliku veterinaararsti kontrollkäigul ettevõttesse enne kodulindude vedu tapamajja või ettevõttesse, kus juba esineb peiteajal kogutud munadest välja koorunud kodulinde, tuleb kohaldada järgmisi meetmeid.
|
a) |
Ettevõtte tootmise ja tervisega seotud andmete kontroll. |
|
b) |
Iga tootmisüksuse kliiniline kontroll, sealhulgas selle kliiniliste andmete hindamine ning kodulindude või muude vangistuses peetavate lindude läbivaatus. |
|
c) |
Iga tootmisüksuse tapamajja saadetavatelt lindudelt tuleb vähem kui 48 tundi enne väljasaatmist võtta standardproovid. |
|
d) |
Iga tootmisüksuse kodulindudelt, kes on juba koorunud peiteajal kogutud munadest, tuleb võtta standardproovid. |
8.17. Artikli 40 lõike 2 punkt b – kinnitatud puhangu korral teatavate ettevõtete suhtes kohaldatavate meetmete osas tehtavad erandid
Ametliku veterinaararsti kontrollkäigul ettevõttesse, mille suhtes on kehtestatud direktiivi 2005/94/EÜ artikli 39 lõikega 2 ning lõike 5 punktiga b sätestatud erand, kohaldatakse järgmisi meetmeid.
|
a) |
Ettevõtte tootmise ja tervisega seotud andmete kontroll, kui sellised andmed on olemas. |
|
b) |
Iga tootmisüksuse kliiniline kontroll korrapäraste ajavahemike tagant, sealhulgas selle kliiniliste andmete hindamine ning kodulindude või muude vangistuses peetavate lindude, eriti haigestunud lindude kliiniline läbivaatus. |
|
c) |
Standardproovide asemel tuleb 21 päeva möödumisel viimasest positiivsest MPLG-leiust igast tootmisüksusest ning iga 21 päeva tagant laboratoorseteks uuringuteks võtta järgmised proovid:
Siiski võib pädev asutus riskide hindamise tulemuste põhjal lubada kõrvalekaldumisi alapunktides i ja ii osutatud proovide arvust. |
|
d) |
Punktis c osutatud proovide võtmine ning nende laboratoorsed uuringud peavad jätkuma, kuni saadakse kaks järjestikust negatiivset laboritulemust, mille vahele peab jääma vähemalt 21 päeva. |
8.18. Artikli 42 lõiked 1 ja 3 – kontaktettevõtetes kohaldatavad meetmed
Ametliku veterinaararsti kontrollkäigul kontaktettevõttesse tuleb kohaldada järgmisi meetmeid.
|
a) |
Ettevõtte tootmise ja tervisega seotud andmete kontroll, kui sellised andmed on olemas. |
|
b) |
Iga tootmisüksuse kliiniline kontroll, sealhulgas selle kliiniliste andmete hindamine ning kodulindude või muude vangistuses peetavate lindude, eriti haigestunud lindude kliiniline läbivaatus. |
|
c) |
Standardproovid tuleb võtta igast tootmisüksusest või kui kodulinde või muid vangistuses peetavaid linde surmatakse. |
8.19. Artikli 44 lõike 1 punkt b – piirangutsoonis kohaldatavad meetmed
Ametliku veterinaararsti kontrollkäigul piirangutsoonis asuvasse kaubanduslikku ettevõttesse tuleb kohaldada järgmisi meetmeid.
|
a) |
Ettevõtte tootmise ja tervisega seotud andmete kontroll. |
|
b) |
Iga tootmisüksuse kliiniline kontroll, sealhulgas selle kliiniliste andmete hindamine ning kodulindude või muude vangistuses peetavate lindude, eriti haigestunud lindude kliiniline läbivaatus. |
|
c) |
Igast tootmisüksusest tuleb võtta standardproovid. |
|
d) |
Pädev asutus peab riskide hindamise tulemuste põhjal otsustama täiendava ametliku järelevalve üle kliiniliste läbivaatuste ja laborikatseteks proovide võtmise näol jälgimise all olevates ettevõtetes, kasvatusaladel või tootmistüüpide puhul. |
8.20. Artikli 45 punktid a ja b – meetmete kestus
Piirangutsoonis kooskõlas direktiiv 2005/94/EÜ V peatüki 3. jaoga kohaldatavad meetmed võib tühistada alles 21 päeva pärast nakatunud ettevõtetes läbi viidud lindudest tühjendamise järgset esialgset puhastamist ja desinfitseerimist või alles 42 päeva pärast MPLG kinnitamise kuupäeva järgmistel eeldustel:
|
a) |
ametlik veterinaararst on kontrollinud kõiki piirangutsooni kaubanduslikke ettevõtteid ning kõik punkti 8.13 alapunktides c ja d osutatud proovide laboratoorsed katsed on teostatud ning kättesaadavad; |
|
b) |
igasuguste täiendavate kliiniliste läbivaatuste ja laboratoorsete katsete tulemused, mis võivad MPLG levimise ohu kindlaksmääramiseks hõlmata mittekaubanduslikke ettevõtteid, on kättesaadavad; |
|
c) |
pädev asutus on riskide hindamise tulemuste põhjal ning epidemioloogilist olukorda ja punktides a ja b osutatud laboratoorsete uuringute tulemusi arvesse võttes veendunud, et MPLG levimise oht on kaduvväike; sellise hindamise tulemusel võidakse positiivsete seroloogiliste leidude ja negatiivsete viroloogiliste leidude korral piirangud tühistada. |
8.D. Meetmed, mille eesmärgiks on vältida lindudelt pärinevate gripiviiruste levimist teistele liikidele
8.21. Artikli 47 lõiked 1 ja 6 – sigade ja muude liikidega tehtavad laboratoorsed katsed ning muud nende suhtes võetavad meetmed
Ametliku veterinaararsti kontrollkäigul ettevõttesse, milles peetakse sigu, tuleb pärast AI-kinnituse saamist kohaldada järgmisi meetmeid.
|
a) |
Ettevõtte tootmise ja tervisega seotud andmete kontroll, kui sellised andmed on olemas. |
|
b) |
Iga tootmisüksuse kliiniline kontroll, sealhulgas selle kliiniliste andmete hindamine ning sigade, eriti haigestunud sigade kliiniline läbivaatus. |
|
c) |
Iga tootmisüksuse 60 sealt, või kui tootmisüksuses on vähem kui 60 siga, siis kõigilt sigadelt tuleb päev enne või samal päeval, kui tapetakse nakatunud kodulinnud või muud vangistuses peetavad linnud, võtta nina/kitsa suuneelu tampooniproovid. Kaks kuni neli nädalat pärast tapmist tuleb sigadelt võtta vähemalt 60 vereproovi. Proovid tuleb võtta selliselt, et vähemalt üks proov oleks saadud omavahel otseses kokkupuutes olevatelt sigade rühmadelt. |
|
d) |
Sigade vedu teistesse ettevõtetesse võidakse lubada juhul, kui vähemalt 60 iga tootmisüksuse sigadelt võetud nina/kitsa suuneelu tampooniproovi ning 60 vereproovi annavad 14 päeva pärast AI-positiivseid leide negatiivsed tulemused. Sigade vedu tapamajja võidakse lubada juhul, kui vähemalt 60 iga tootmisüksuse sigadelt võetud nina/kitsa suuneelu tampooniproovi annavad 14 päeva möödumisel AI esinemise positiivsetest leidudest negatiivsed tulemused. Segaste või positiivsete laboritulemuste korral on AI nakkuse või ülekandumise välistamiseks sigade seas vajalikud mis tahes täiendavad uuringud. |
|
e) |
Kui ametlikul veterinaararstil on kahtlus, et muud ettevõtetes koduloomadena peetavad imetajad, eelkõige need, kelle puhul on tuvastatud vastuvõtlikkus H5- ja H7-alatüüpi AI-viirusega nakatumisele, on võinud kokku puutuda nakatunud kodulindudega või muude vangistuses peetavate lindudega, tuleb laboratoorseteks uuringuteks võtta proovid. |
8.E. Taasasustamine
8.22. Artikli 49 lõike 3 punktid b ja c – ettevõtete taasasustamine
Ametliku veterinaararsti kontrollkäigul taasasustatud ettevõttesse tuleb kohaldada järgmisi meetmeid.
|
a) |
Ettevõtte tootmise ja tervisega seotud andmete kontroll. |
|
b) |
Iga tootmisüksuse kliiniline kontroll, sealhulgas selle kliiniliste andmete hindamine ning kodulindude või muude vangistuses peetavate lindude, eriti haigestunud lindude kliiniline läbivaatus. |
|
c) |
Standardproovide asemel tuleb igast tootmisüksusest võtta järgmised proovid:
|
|
d) |
Kui ettevõte on varem olnud nakatunud KPLGsse, tuleb taasasustamisjärgse 21päevase ajavahemiku viimase nädala jooksul vajaduse korral võtta 20 hingetoru/kitsa suuneelu ja 20 kloaagi tampooniproovi ka iga tootmisüksuse veelindudelt (pardid/haned). |
|
e) |
Kui ettevõte on varem olnud nakatunud MPLGsse, tuleb igast tootmisüksusest võtta 20 hingetoru/kitsa suuneelu ja 20 kloaagi tampooniproovi ning 20 vereproovi. |
8.F. Vaktsineerimine
8.23. Artikli 56 lõike 2 punkt i – kodulindude või muude vangistuses peetavate lindude profülaktiline vaktsineerimine
Direktiivi 2005/94/EÜ IX peatükis sätestatud laboratoorsed uuringud tuleb vaktsineeritud kodulindudel või muudel vangistuses peetavatel lindudel läbi viia, kasutades tunnustatud DIVA strateegiat, mille puhul väliviirus on teada.
Testlindude kasutamise korral peavad nad olema esindatud igas vaktsineeritud linnukarjas, nad peavad olema kliiniliselt läbi vaadatud ning kontrollitud, kasutades hemaglutinatsiooni inhibitsiooni testi (HI). Selleks tuleb vähemalt iga 60 päeva tagant iga vaktsineeritud ettevõtte vaktsineerimata testlindudelt võtta 20 vereproovi.
8.24. IX lisa – erakorralise vaktsineerimise korral kodulindude, muude vangistuses peetavate lindude ja linnukasvatussaaduste liikumise suhtes kehtivad nõuded
Elusate kodulindude ja muude vangistuses peetavate lindude ning nende munade liikumisele tuleb kohaldada rangeid jälgimismeetmeid, et viia AI nakkuse edasise leviku oht miinimumini.
Selleks tuleb erakorralise vaktsineerimise kampaania alguses samu jälgimismeetmeid rakendada elusate kodulindude ja muude vangistuses peetavate lindude ning nende munade liikumisele, et viia AI nakkuse edasise leviku oht nii vaktsineerimispiirkonna sees kui sellest väljaspool miinimumini.
|
a) |
Enne haude- ja toidumunade esimest liikumist vaktsineerimispiirkonna sees ja sellest väljapoole ning selle järgselt vähemalt iga 30 päeva tagant tuleb ametlikul veterinaararstil kohaldada järgmisi meetmeid:
|
|
b) |
Elusate vaktsineeritud kodulindude või muude vangistuses peetavate lindude liikumiseks teistesse ettevõtetesse või elusate vaktsineeritud lindude liikumiseks vaktsineerimispiirkonna sees ja sellest välja tuleb ametlikul veterinaararstil kohaldada järgmisi meetmeid:
|
V PEATÜKK
Diagnostilised viroloogilised uuringud ning tulemuste hindamine
|
1. |
Molekulipõhiste uuringute loomise ja väljaarendamiseni peeti viiruse isoleerimist embrüonaalses staadiumis kanamunade nakatamise abil kõige tundlikumaks AI diagnoosimise uuringuks üldse ning nakkusliku viiruse hilisemal tuvastamisel ja kirjeldamisel hädavajalikuks. Olulisemad sammud on esitatud käesolevas peatükis. |
2. Proovide töötlemine
Kui tampooniproovid esitatakse “kuivalt”, tuleb need asetada piisavasse kogusesse antibiootilisse keskkonda, et tagada nende täielikku sukeldamist. Eeldusel, et proovid pärinevad ühelt ja samalt liigilt, samast ajast ja epidemioloogilisest üksusest, võib need paigutada ühte partiisse, viis proovi partii kohta.
Laborile esitatud rümpadele tuleb teha surmajärgne läbivaatus ning võtta proovid järgmistelt elunditelt: fekaalid või soolesisaldised, ajukude, hingetoru, kopsud, põrn ja muud ilmselt kahjustunud elundid. Need elundid ja koed võib panna liitproovi, kuid fekaale tuleb töödelda eraldi.
Fekaaliproovid ja elundid tuleb homogeenida (kinnises segistis või kasutades uhmrinuia, uhmrit ja steriilset liiva) antibiootilises keskkonnas ning teha keskkonnas 10–20 % suspensioonid (mass/maht).
Sukeldatud tampoonid ja suspensioonid tuleb jätta umbes kaheks tunniks ümbritseva õhu temperatuurile (või pikemaks ajaks 4 oC juurde) ning seejärel selitada tsentrifuugimise teel (nt 800–1 000 × g juures 10 minutit).
3. Viirusisolatsioon embrüonaalses staadiumis kanamunades
Selitatud supernatant tuleb panna 0,1–0,2 ml kogustes allantoisi õõntesse, milles on igaühes vähemalt neli embrüonaalses staadiumis kanamuna, mida on inkubeeritud 9–11 päeva. Ideaaljuhul tuleks need munad võtta patogeenivabalt karjalt, aga kui see on võimatu, võib kasutada mune, mis on saadud karjalt, millel pole linnugripi antikehi.
Nakatunud mune tuleb hoida 37 oC juures ning iga päev läbi valgustada. Surnud või surevate embrüotega munad ning kõik ülejäänud munad tuleb kuus päeva pärast nakatamist jahutada temperatuurini 4 oC ning kontrollida allantoisi-amnionivedelikus hemaglutinatsiooni aktiivsust. Kui hemaglutinatsiooni ei avastata, tuleb eespool nimetatud toimingut korrata, kasutades inokulaadina lahjendamata allantoisi-amnionivedelikku. Kui avastatakse hemaglutinatsioon, tuleks kultuuriga välistada bakterite esinemine. Kui esineb baktereid, võib vedelikku valada läbi 450 nm membraanfiltri, lisada veel antibiootikume ning nakatada sellega embrüonaalses staadiumis munad eespool kirjeldatud viisil.
Diagnoosi kiirendamiseks on mõned laborid kasutanud kaht 3-päevast passaaži või 2-päevast ja 4-päevast passaaži ning on saanud kahe 6-päevase passaažiga võrreldavaid tulemusi, kuid seda ei ole veel lähemalt uuritud.
Positiivseid vedelikke tuleb testida bakterite sisalduse osas. Kui esineb baktereid, võib vedeliku bakterite eemaldamiseks lasta läbi 450 nm membraanfiltri või seda tsentrifuugida, ning süstida see pärast täiendavate antibiootikumide lisamist jälle munadesse.
4. Eristusdiagnoos
|
a) |
Esialgne eristus Kuna on oluline niipea kui võimalik rakendada tõrjemeetmed, mille eesmärk on piirata AI-viiruse levikut, peaks iga siseriiklik referentlabor, mis on hemaglutineeriva viiruse isoleerinud, olema võimeline tuvastama, kas tegemist on A-tüüpi gripiviiruse H5- või H7-alatüübi või Newcastle'i haigusega. Hemaglutineerivaid vedelikke tuleb kasutada hemaglutinatsiooni inhibitsiooni testis vastavalt IX peatükile. Positiivne inhibitsiooni väärtus, nagu seda on positiivne tiiter 2–3 log2 A-tüüpi gripiviiruse alatüüpidele H5 või H7 omaste polüklonaalsete antiseerumitega, on sobiv esialgseks kindlaksmääramiseks, mis võimaldab kehtestada ajutisi tõrjemeetmeid. |
|
b) |
Tulemuse kinnitamine Kuna on 16 hemaglutiniini alatüüpi ning 9 gripiviiruste neuraminidaasi alatüüpi ning igal tüübil on ka variatsioonid, ei ole otstarbekas ega majanduslikult efektiivne hoida igas riiklikus laboris antiseerumeid, mis võimaldaksid gripi isolaatide alatüüpide täielikku tuvastamist. Siiski peab iga riiklik referentlabor vähemalt:
Lisaks on asjakohase varustusega laboritel soovitatav:
Riiklikud referentlaborid peavad kaaluma teadmiste ja seadmete kasutamist, mis võimaldavad nukleotiidide järjestuse määramist hemaglutiniini geenis, et määrata mitmealuseliste aminohapete olemasolu hemaglutiniini prekursorvalgu lõhestamispiirkonnas mis tahes KPLG H5- või H7-viiruse jaoks. Ehkki ühenduse referentlabor teeb osana direktiivi 2005/94/EÜ VII lisa punkti 2 alapunktis b osutatud ülesannetest patogeensuse kindlaksmääramist eelisjärjekorras, vähendab viiruse selline iseloomustamine riiklikul tasandil oluliselt aega, mis kulub diagnoosimiseks, ning juhul kui diagnoos on positiivne, siis KPLG tõrjemeetmete täielikuks rakendamiseks. |
|
c) |
Isolaatide edasine liigitamine ja kirjeldus Ühenduse referentlabor peab direktiivi 2005/94/EÜ VII lisas sätestatud funktsioonide ja ülesannete kohaselt saama riiklikelt laboritelt kõik hemaglutineerivad viirused edasiseks antigeeni- ja geeniuuringuteks, et paremini mõista haigus(t)e episotoloogiat Euroopa Ühenduses. Lisaks nimetatud ülesannetele teeb ühenduse referentlabor kõikide saadud gripiviiruste täieliku antigeeniuuringu. Viiruste alatüüpide H5 ja H7 korral, mille intravenoosse patogeensuse indeksid on alla 1,2, tuleb viivitamata teha ka nukleotiidide järjestusmääramine hemaglutiniini geenis, et määrata mitmealuseliste aminohapete olemasolu hemaglutiniini prekursorvalgu lõhestamispiirkonnas, ning riiklikku referentlaborit ja päritolumaad tuleb teavitada niipea, kui on teada tulemused, et KPLG tõrjemeetmed saaks täiel määral kohaldatud. |
|
d) |
Võttes arvesse KPLGga/MPLGga seotud epidemioloogilist olukorda, võib kokkuleppel nii komisjoni kui ühenduse referentlaboriga olla võimalik erandi kehtestamine laboritele, millel on kõik võimalused viiruse kiireks iseloomustamiseks, et need esitaksid andmete kontrollimise järel nende viiruste osahulga ning et ühenduse referentlabor teeks vastava valiku. Sellist erandit võib lubada ainult juhul, kus riiklik referentlabor on võimeline andmeid kiiresti tootma ning neid ühenduse referentlaboriga jagama. |
VI PEATÜKK
Molekulaarsed uuringud ja tulemuste hindamine
KPLG olemasolev definitsioon võimaldab virulentsuse tegurite molekulaarset tuvastamist ning kinnitab molekulaarsete tehnikate kasutamist AI diagnoosimisel. Hiljuti on toimunud arengud nende rakendamisel AI-viiruse avastamiseks ja iseloomustamiseks otse nakatunud lindude kliinilistes proovides. Tavaliste RT-PCR-meetodi tehnikate kasutamine kliiniliste proovidega võimaldaks õigesti määratletud praimerite korral kiiret avastamist ja alatüübi (vähemalt H5 või H7) kirjeldamist, lisaks võib nukleotiidide järjestusmääramiseks kasutada PCR-meetodil põhinevat toodet, millel on oluline rakendusala järgmiste puhangute tuvastamisel pärast seda, kui esmane nakatunud valdus on tuvastatud ning viirus on iseloomustatud. Reaalajas toimivad, üheetapilised RT-PCR-meetodit kasutavad praimer-/fluorogeensed indikaatorsüsteemid (rRT-PCR) võimaldavad veelgi kiiremat ja tundlikumat diagnoosi koos AI-viiruste avastamise ning alatüüpide H5 ja H7 määratlemisega kliinilistes proovides.
Oluliseks probleemiks RT-PCR- ja rRT-PCR-süsteemide puhul on see, et praeguseks on eri laborid välja arendanud eri süsteemid, mis ei ole vaatamata sellele, et nad on täiesti legitiimsed, valideeritud ega läbinud testimist suure arvu proovidega eri laborites. Ühenduse referentlabor ja määratud riiklikud referentlaborid on selle probleemiga tegelenud ühenduse rahastatava projekti raames (EU AVIFLU), et koostada ratifitseeritud protokoll kokkuleppelise RT-PCR ja rRT-PCR kohta, mille võiksid omaks võtta teised riiklikud referentlaborid. Kui testimisparameetrid nagu tsükli- ja rambiaeg erinevad täpsustatud protokollides soovitatutest, tuleb näidata nende sobivust selleks otstarbeks enne, kui neid kasutatakse vastavalt käesoleva diagnostikakäsiraamatu I peatüki lõikele 6.
Ühenduse referentlabori poolt nendele molekulaarsetele testidele ja nende hindamisele kohaldatavad standardprotokollid võib leida järgmiselt veebilehelt:
http://www.defra.gov.uk/corporate/vla/science/science-viral-ai-reflab.htm.
VII PEATÜKK
In vivo patogeensustest ning tulemuste hindamine
Lindudelt isoleeritud A-tüüpi gripiviiruste virulentsust kanadele tuleb hinnata, kasutades intravenoosse patogeensuse indeksi (IVPI) testi, mis tuleb teha järgmiselt.
|
a) |
Väikseima passaažide arvuga, soovitatavalt esialgsest isolatsioonist ja valimata saadud värske nakkuslik allantoisi vedelik HA tiitriga >1/16 (>24 või vastavalt >log2 4) lahjendatakse 1:10 steriilses isotoonilises soolalahuses. |
|
b) |
0,1 ml lahjendatud viirust süstitakse intravenoosselt kümnele kuuenädalasele patogeenivabale või viiruse antikehadeta kanale. |
|
c) |
Linde uuritakse iga 24 tunni järel kümne päeva jooksul. Iga linnu puhul registreeritakse iga uurimise käigus, kas lind on terve (0), haige (1), raskesti haige (2) või surnud (3). Otsus, kas lind on haige või raskesti haige, põhineb subjektiivsel kliinilisel hinnangul. Tavaliselt väljendub “haigetel” lindudel üks, “raskesti haigetel” lindudel enam kui üks järgmistest tunnustest: hingamisteede haigused, depressioon, diarröa, naha või loti tsüanoos, näo- ja/või peapiirkonna ödeem, ärritusnähud. Surnud linnu kohta tuleb surmajärgsetel allesjäänud igapäevastel uurimistel märkida “3”. Heaolu kaalutlustel tuleb linnud, kes on liiga haiged, et süüa või juua, humaanselt surmata, ning märkida järgmisel uurimisel surnuks, kuna sekkumiseta sureksid nad 24 tunni jooksul. See lähenemine on akrediteerimisorganite jaoks vastuvõetav. |
|
d) |
Intravenoosse patogeensuse indeks (IVPI) on keskmine tulemus ühe linnu ühe jälgimise kohta kümnepäevase ajavahemiku jooksul. Indeks 3,00 tähendab, et kõik linnud surid 24 tunni jooksul, ning indeks 0,00 tähendab, et ühelgi linnul ei avaldunud kümnepäevase jälgimisperioodi jooksul ühtegi kliinilist tunnust. |
Lihtne meetod tulemuste registreerimiseks ning indeksite arvutamiseks on esitatud alltoodud näites.
|
Kliinilised tunnused |
Nakatumisest möödunud päevad |
Kokku punkte |
|||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
||
|
Terve |
10 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
12 x 0 = 0 |
|
Haige |
0 |
4 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
6 x 1 = 6 |
|
Raskesti haige |
0 |
2 |
2 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
6 x 2 = 12 |
|
Surnud |
0 |
2 |
6 |
8 |
10 |
10 |
10 |
10 |
10 |
10 |
76 x 3 = 228 |
|
|
|
|
|
|
|
|
|
|
|
|
Kokku = 246 |
Notes:
10 lindu jälgitakse 10 päeva jooksul = 100 jälgimist
Indeks = keskmiselt punkte linnu kohta ühe vaatluse käigus = 246/100 = 2,46
KPLG-viirusena käsitletakse alatüübist sõltumata mis tahes A-tüüpi gripiviirust, mille tulemus IVPI-testis on suurem kui 1,2.
VIII PEATÜKK
Seroloogilised uuringud ning tulemuste hindamine
A-tüüpi gripiviiruse olemasolu kindlakstegemiseks on eelistatud meetod, millega näidatakse nukleoproteiini või maatriksi antigeenide olemasolu, mis on samad kõikide gripi A-tüüpi viiruste korral.
Seda võib teha kahekordse immunodifusioontestiga, kasutades kas kontsentreeritud viiruspreparaate või nakatunud koorionallantoismembraanide ekstrakte.
AI-viiruse antikehade seroloogilisel testimisel on eelistatud meetodiks hemaglutinatsiooni (HA) ja hemaglutinatsiooni inhibitsiooni (HI) testid.
Maailma loomatervishoiu organisatsiooni (OIE) maismaaloomade diagnostiliste testide käsiraamatu peatükis 2.7.12 sisaldub üksikasjalik teave laboritehnikate ning tulemuste hindamise kohta.
Ühenduse referentlabori poolt nendele seroloogilistele testidele ja nende hindamisele kohaldatavad standardprotokollid võib leida järgmiselt veebilehelt:
http://www.defra.gov.uk/corporate/vla/science/science-viral-ai-reflab.htm.
IX PEATÜKK
Vaktsineerimisega seotud jälgimissüsteemid
1. Direktiiv 2005/94/EÜ ning diagnostikakäsiraamat
Direktiivi 2005/94/EÜ IX peatüki 2. ja 3. jaos on lubatud erakorralise ja profülaktilise vaktsineerimise kasutamine teatavatel tingimustel. Üheks tingimuseks on see, et kasutatakse DIVA (nakatunud ja vaktsineeritud lindude eristamise) strateegiat.
Vaktsineerimise eesmärgiks peab olema ennetada nakatumist ning sellele järgnevat viiruse levimist linnukarjalt linnukarjale. Vaieldamatud tõendid näitavad, et vaktsineerimine suurendab lindude nakatumiseks vajalikku viiruse hulka ning vähendab väljutatava viiruse hulka. Siiski võivad vaktsineeritud linnud, ehkki neil ei avaldu enam kliinilisi tunnuseid, viirust edasi kanda. Seetõttu võivad KPLG-viiruse H5- ja H7-alatüübid optimaalsest madalama immuunsustasemega linnukarjas märkamatult ringelda mõnda aega, samuti nagu MPLG-viirused võivad seda teha vaktsineerimata linnukarjas. Seega eksisteerib vajadus olla võimeline tuvastama väliviirusega nakatunud viiruspositiivseid vaktsineeritud linnukarju, selleks et võiks rakendada teisi tõrjemeetmeid, näiteks hukkamist.
2. Testlindude kasutamine nakkuse jälgimiseks
Linnukarja tasandil on lihtsaks meetodiks vaktsineeritud linnukarjas vaktsineerimata jäetud testlindude korrapärane jälgimine, kuid selle lähenemisviisiga kaasnevad mõned probleemid, eelkõige seoses testlindude tuvastamisega, eriti mis puutub suurtesse linnukarjadesse. Kokkupuude testlindude ja vaktsineeritud lindude vahel peab olema tagatud.
3. DIVA laboratoorne kontroll nakkuse jälgimiseks
Lisaks või alternatiivina võib kokkupuuteuuringuid teha ka vaktsineeritud lindudel endil, kasutades DIVA laboratoorset kontrolli. Viimastel aastatel on välja arendatud mitmeid kontrollisüsteeme, mis võimaldavad ka vaktsineeritud lindude nakatumise avastamist. Üks meetod, mis on tõestanud oma toimivust, on vaktsiini kasutamine, mis sisaldab valdava väliviirusega sama hemaglutiniini (H) alatüüpi, kuid sellest erinevat neuraminidaasi (N). Väliviiruse N-i antikehad toimivad nakkuse loomulike markeritena.
Seda süsteemi kasutati Itaalias pärast MPLG H7N1 viiruse taasilmnemist 2000. aastal. Otseste tõrjemeetmete täiendamiseks rakendati DIVA-strateegiat, kasutades H7N1 välinakkuse vastu võitlemiseks vaktsiini, milles sisaldus H7N3. Vaktsineeritud ja viirusega nakatunud lindude eristamiseks kasutati seroloogilist kontrolli, et avastada spetsiifilisi antiN1-antikehasid. Sama strateegiat kasutati H7N3 poolt põhjustatud MPLG tõrjeks Itaalias aastatel 2002–2003, sel korral H7N1 vaktsiini ning seroloogilise kontrolli abil, mis oli ette nähtud konkreetselt N3 antikehade avastamiseks. Kummalgi juhul kasutati vaktsineerimist koos hukkamisega, millega saavutati väliviiruse hävitamine selle DIVA-strateegia kasutamisel.
Selle süsteemiga tekivad probleemid juhul, kui ilmnenud viirusel on sama N-antigeen mis olemasoleval väliviirusel, kuid mille H-alatüüp ei ole ei H5 ega H7, või kui alatüübid samade N-antigeenidega on juba ringluses. Eriti pardid on teatavasti enam kui ühe alatüübi kandjateks. Lisaks oli olemas vajadus sobiva testi väljaarendamiseks, mis võimaldaks anti-neuraminidaasi antikehade esinemise rutiinset jälgimist linnukarjadel. Itaalias arendati välja ning kasutati selleks seroloogilist testi, mis põhines immunofluorestsentskatsel viiruse antikehade määramiseks, ning milles kasutati antigeenina baculovirus'e rekombinantseid N-valke. E LISA testi väljaarendamisel võib selle rakendamine muutuda laiemaks ning lihtsamaks.
Ainult HAd sisaldavate vaktsiinide, nagu rekombinantse vektori vaktsiinide kasutamine võimaldab nakkuse avastamiseks vaktsineeritud lindudel nukleoproteiinil, mittestruktuurvalgul või maatriksproteiinidel põhinevate klassikaliste AGID testide või E LISA testide kasutamist.
Inaktiveeritud vaktsiinide jaoks on kirjeldatud testi, mis avastab mittestruktuurilise viirusvalgu antikehi, mida toodetakse ainult loomuliku nakatumise korral. Seda süsteemi tuleb veel välitöödel valideerida, ent sellel on see piirang, et linnukarja loomulikul nakatumisel ükskõik millisesse gripiviirusesse, sõltumata selle alatüübist, hakatakse tootma mittestruktuurvalgu-vastaseid antikehi.
Kiirete ja tundlike viiruse avastamise meetodite, eriti selliste, mida on võimalik automatiseerida, nagu näiteks reaalajas toimiv RT-PCR, arendamine tähendab, et neid võiks kasutada väliviiruse esinemise laialdaseks ja regulaarseks kindlakstegemiseks vaktsineeritud lindudel. Nakkusetekitaja avastamine oleks aga siiski piiratud lühikese ajavahemikuga nakkuse akuutses faasis, ning seda ei saa kasutada, et teha kindlaks, kas linnukari on viirusega varem kokku puutunud. See lähenemine sobib kõige paremini vaktsineeritud lindude kontrollimiseks enne nende vedu, et tõestada neil aktiivse nakkuse puudumist.
Valitud süsteemide abil kontrollitavate proovide arv peab võimaldama AI-viirusnakkuse esinemise välistamist enam kui 15 protsendil linnukarjast usaldusnivool 95 %.
X PEATÜKK
AI diagnoosimise strateegiad
Nagu on sätestatud direktiivi 2005/94/EÜ IV lisas, võivad ohu suurusest sõltuvalt oluliselt varieeruda otsused meetmete kohaldamise kohta spetsiifilistes piirkondades või kontaktettevõttes ning nende meetmete ranguse kohta. Taudi nõutavat diagnostilist kinnitamist võib mõjutada ka valitsev olukord, ohu suurus ning riskiaste. Veterinaarasutused peavad tegema otsuseid diagnostilise tõendusmaterjali põhjal, mis hoiab tasakaalus taudi kiire tõrjumise ja hävitamise ning vale diagnoosi võimaliku mõju. Sellised otsused tuleb teha mitmeid tegureid arvestades, kuid teatud olukorrad on ennustatavad.
|
Haiguse olukord |
Võimalik probleem |
Diagnostilised kriteeriumid |
|
Spetsiifilised tunnused ning ametlik kahtlus puudub |
Isoleeritud ettevõte |
Teha kiire M-geeni RT-PCRil põhinev kontroll. Vastavalt sätestatule eristusdiagnoos. |
|
Esmane puhangukahtlus |
Isoleeritud ettevõte |
Teha täielik diagnostiline testimine, viiruse isoleerimine ja iseloomustamine |
|
Esmane puhangukahtlus |
Ettevõte tihedalt asustatud kodulinnukasvatuspiirkonnas |
Teha täielik diagnostiline testimine, viiruse isoleerimine ja iseloomustamine, kuid keskenduda kiire avastamise ja iseloomustamise meetoditele, eriti nendele, mille aluseks on RT-PCR ja sekveneerimine (1) |
|
Teisene ja järgnevad puhangukahtlused |
Isoleeritud ettevõtted, epidemioloogiliselt seotud esmase puhangukahtlusega |
Keskenduda kiire avastamise ja iseloomustamise meetoditele, eriti nendele, mille aluseks on RT-PCR ja sekveneerimine (1) |
|
Teisene ja järgnevad puhangukahtlused |
Ettevõtted tihedalt asustatud kodulinnukasvatuspiirkonnas või ettevõtted, millel on mitmeid epidemioloogilisi sidemeid |
Tugineda kiire avastamise meetoditele, mis annavad AI-viiruse esinemisest kõige kiiremini märku (1) |
|
Mitmed puhangukahtlused või haiguse kiire levik, sealhulgas järelevalve |
Kiire sekkumiseta väljub levik kontrolli alt |
Tugineda kiire avastamise meetoditele, mis annavad AI-viiruse esinemisest kõige kiiremini märku, või kliinilistele tunnustele (1) |
XI PEATÜKK
AI-viirustega nakatumise diagnoosimine sigadel ja muudel imetajatel
1. AI sigadel
AI-viirused nakatavad sigu kergesti, ning ehkki paljunemine on enamikul juhtudest suhteliselt piiratud, eksisteerib võimalus, et nakatunud sead võivad haigust edasi anda kodulindudele ning muudele vastuvõtlikele loomadele. Tänaseks ei ole tegelikkusest ühtegi tõendit selle kohta, et nakatunud sead kannavad edasi H5- ja H7- alatüüpi AI-viiruseid.
Madalmaades 2003. aastal aset leidnud taudipuhangust saadud kogemus näitas, et H7N7-ga nakatunud sigadel H7N7-nakkusele omistatavaid kliinilisi tunnuseid ei avaldunud. Lisaks ei ole ilmselgelt H5N1 puhanguga seoses Aasias ja mujal tänaseni teatatud ühestki haigestunud seast.
Seetõttu ei saa kliinilistele tunnustele tuginedes näidata, kas sead on nakatunud, ehkki kliinilised tunnused sigade nakatumisest teistesse lindudelt pärit gripiviirustesse võivad ilmneda niipea, kui viirus on peremeesorganismiga kohanenud. AI-viirusnakkuste diagnoosimine sigadel on põhijoontes sama, mis linnuliikidel, tuginedes viiruse isoleerimisele, molekulaarsetele tehnikatele ning spetsiifiliste antikehade avastamisele, kasutades hemaglutinatsiooni inhibitsiooni teste. Siiski on teatud erinevusi, ning ükski nendest testidest ei ole täielikult valideeritud, et kasutada neid AI-viirusnakkuse olemasolu kindlakstegemiseks sigadel.
2. Proovid viiruse isoleerimiseks
AI-viirusnakkused sigadel piirduvad tavaliselt hingamisteedega ning võtta tuleb hingamisteede kudede proovid ja vajaduse korral suuneelu või nina tampooniproovid, eelistatult sigadelt, kellel avalduvad selle haiguse tunnused. Neid proove ja tampooniproove võib töödelda viiruse isoleerimiseks või molekulaarseks avastamiseks, kasutades samu tehnikaid, mida on ülalpool kirjeldatud lindudelt võetud proovide jaoks. Siiski tuleb PCR-tehnikate kohaldamisel kasutada nõuetekohaseid kontrollimeetmeid tagamaks, et võimendamist ei takistaks sigadelt võetud proovides esinevad ained.
3. Munade nakatamine ja inkubeerimine
Imetajate gripiviiruste isoleerimisel 9–11 päeva vanustesse embrüonaalses staadiumis kanamunadesse on tavaliseks praktikaks iga muna nakatamine allantoisi kaudu ning amnioniõõnde. Siiski, kui sigu kontrollitakse seoses AI-viirustega, kui viirusel on olnud vähe võimalusi kohanemiseks, piisab tõenäoliselt allantoisi nakatamisest.
Sarnaselt on 35 oC soovitatav inkubeerimistemperatuur imetajate A-tüüpi gripiviiruste isoleerimiseks, kuid samas viiruste puhul, mis ei ole sigadega hästi kohanenud, ei tohiks 37 oC olla viiruse isoleerimist takistav.
4. Spetsiifiliste antikehade kontroll HI-testides
Viiruse isoleerimine ja molekulaarne avastamine on AI-viirusnakkuste kindlakstegemisel sigadel tõenäoliselt kõige tundlikum moodus. Siiski on sigadel seroloogilisi vastuseid avastatud viiruse isoleerimise ja avastamiseta. HI-testid nõuavad seaseerumite kasutamiseks mõningaid muudatusi võrreldes VIII peatükis osutatud linnuseerumi puhul kasutatava testiga.
Seaseerumid on tuntud oma mittespetsiifilise inhibitsiooni tõttu HI-testides, mistõttu igat seerumiproovi tuleb selle vältimiseks töödelda retseptoreid lõhustava ensüümiga (RDE). Kasutada tuleb järgmist meetodit.
|
a) |
100 μl sea antiseerumile lisatakse 400 μl retseptoreid lõhustavat ensüümi (kindlaksmääratud töölahjendus), ning segatakse korralikult. |
|
b) |
Inkubeeritakse 37 oC juures üks tund. |
|
c) |
Seejärel inkubeeritakse 56 oC juures 30 minutit. |
|
d) |
Proove jahutatakse 4 oC juures vähemalt 15 minutit. |
|
e) |
Lisatakse 10 μl 30 % (hematokritarv) kana punaseid vererakke ning segatakse jõuliselt. |
|
f) |
Inkubeeritakse 4 oC juures üle öö. Vastasel korral, kui vajalik on proovide kasutamine samal päeval, inkubeeritakse 37 oC juures üks tund ning tsentrifuugitakse 300 x g juures viis minutit. |
Seejärel kasutatakse töödeldud seerumit HI-testis peatükis [..] linnuseerumite puhul kirjeldatud viisil, esialgseks lahjendusvahekorraks on 1:10. Seaseerumite komplekti, mille puhul on teada nende AIsse puutuv seronegatiivne staatus, tuleb kasutada HI-testide spetsiifilisuse hindamiseks kasutatava viirusetüve suhtes (vt puhangust saadud viirusetüve kasutamine seroloogilises testis; VIII peatükk). Madalmaades 2003. aastal aset leidnud puhangu vältel avastati HI-testides, kasutades puhangust sõltumatult kogutud seaseerumeid, mittespetsiifilisi reaktsioone kuni 2,6 %.
5. Proovide võtmine sigadelt
Eelkõige farmides, kus peetakse korraga nii sigu kui kodulinde, kas ühes hoones või eraldi, on sigadel oht AIsse nakatumiseks kas otseselt või kaudselt kokkupuute kaudu kodulindude või linnukasvatussaadustega. Sellise nakatumise välistamiseks tuleb vastavalt IV peatüki punktis 8.21 kirjeldatud menetlusele koguda suuneelu või nina tampooniproove ja vereproove. Proovid tuleb võtta sigadelt, kellel avalduvad haiguse kliinilised tunnused. Kui neil aga kliinilisi tunnuseid ei avaldu, võib proovid võtta pisteliselt hoone igast osast. Kui need on laboris saadaval, tuleb neid kontrollida kiirete molekulaarsete testidega ja/või viiruse isoleerimisega. RT-PCR peab olema nõuetekohaselt valideeritud ning omama tundlikkust, mis on vähemalt võrdne viiruse isoleerimisega munas A-tüüpi gripiviiruste puhul.
Kaks kuni neli nädalat pärast AIsse nakatunud kodulindude hukkamist tuleb sigadelt koguda vähemalt 60 vereproovi selliselt, et vähemalt osa proovidest oleksid saadud sigade rühmadelt, kellel on olnud omavaheline otsene kokkupuude. Proove tuleb kontrollida HI-testis, kasutades kodulindude seas esinenud puhangust saadud viirust. Samas testis tuleb kontrollida nii ägeda kui paranemisfaasi proove. Positiivsete proovide kinnitamiseks võib kasutada viiruse neutraliseerimist ja/või immunoblotanalüüsi.
Kui milline tahes nendest proovidest annab testis positiivse tulemuse, tuleb epidemioloogiline kontroll läbi viia kõigis ohustatud tsoonis asuvates seafarmides, sõltumata sellest, kas nad on segatüüpi või mitte.
6. AI-viirused muudel imetajatel peale sigade
Muudele AI suhtes vastuvõtlikele imetajatele peale sigade, sealhulgas kassidele, tuleb teha läbivaatus. Eriviitega KPLG H5N1-le tuleb kasside kontrollimisel toimida järgmiselt.
Viiruse paljunemisega seostatavad suured patoloogilised kahjustused koonduvad kopsudesse ja maksa, mistõttu proovid viroloogilisteks uuringuteks tuleb eelistatult võtta surnud loomade nendelt elunditelt. Elusloomadelt tuleb viiruse avastamiseks eelistatult võtta hingetoru/suuneelu tampooniproovid. Lisaks võib eraldi võtta fekaalide tampooniproovid.
HI-testides uuritavad vereproovid nõuavad kuumtöötlust 56 oC juures 30 minutit, ning RDE töötluse võib ära jätta.
XII PEATÜKK
Proovide veole esitatavad minimaalsed ohutusnõuded
|
1. |
Selliste proovide veole, mille puhul on teada patogeenide esinemine või on olemas nende esinemise kahtlus, kehtivad ranged siseriiklikud ning rahvusvahelised määrused, millest tuleb alati kinni pidada. Viiruse isolaate ei klassifitseerita diagnostiliste proovidena, vaid need tuleb pakendada vastavalt rahvusvahelistele standarditele. Käesolevas peatükis esitatud juhised kehtivad õhutranspordi puhul, kuid samasugust pakendamist tuleb kasutada ka proovide maismaa- või meretranspordil. |
2. Diagnostiliste näidiste pakendamine veoks
Rahvusvahelise Lennutranspordi Assotsiatsiooni (IATA) määruste alusel tuleb veetavad diagnostilised näidised tähistada ÜRO identifitseerimisnumbriga vastavalt 2814, 2900 või 3373.
Kuni saadetise jõudmiseni vastuvõtjani vastutab veo eest saatja, mitte transpordiettevõte.
3. Esmane pakend
|
a) |
Esmane anum (või -anumad) peab olema veekindel, näiteks peavad keeratavad korgid olema tihendatud parafilmi või kleeplindi abil, või tuleb rakendada muud samalaadset kaitset. |
|
b) |
Kui esmaseid anumaid on mitu, tuleb need purunemise vältimiseks pakkida eraldi. |
|
c) |
Veetavate diagnostiliste näidiste mahu kindlaksmääramisel tuleb arvesse võtta viiruste transportimise keskkondi. |
|
d) |
Esmane anum (või -anumad) ei või sisaldada enam kui 500 ml või 500 g. |
Kogu esmase anuma sisu on diagnostiline näidis.
4. Teisene pakend
|
a) |
Teiseses mahutis tuleb kasutada piisavas koguses imavat materjali, et see oleks lekke või kahjustumise korral võimeline endasse imema kõigi esmaste anumate kogu sisu. |
|
b) |
Teisene pakend peab vastama IATA pakendamisnõuetele diagnostiliste näidiste kohta, sealhulgas 1,2 meetri (3,9 jala) kõrguselt kukkumise menetlusele. Kuna nakkusohtlike ainete pakend ületab IATA pakkimisjuhendis 602 diagnostiliste näidiste pakendile esitatavaid nõudeid, võib seda kasutada. |
|
c) |
Nakkusohtliku aine pakendil peavad olema nõutavad spetsifikatsioonitähised (“UN” on ringi sees), näiteks “UN 4G/CLASS 6.2/99/GB/2450” |
|
d) |
Teisene pakend peab olema veekindel. Järgida tuleb pakendi valmistaja või volitatud osapoole pakkimisjuhendit, mis on teisese pakendiga kaasas. |
|
e) |
Teisese pakendi kõige väiksemaks välismõõduks peab olema vähemalt 100 mm (neli tolli). |
|
f) |
Teisene pakend peab olema piisavalt suur dokumentide, näiteks saatekirja lisamiseks. |
5. Välispakend
|
a) |
Välispakend ei või sisaldada enam kui 4 l või 4 kg. |
|
b) |
Nõudmise korral tuleb väljapoole teisest pakendit paigutada kuiv või märg jää. Kuiva jää kasutamise korral peab pakend võimaldama süsihappegaasi väljumist ning mitte lubama surve tekkimist, mis võiks pakendi rebestada. Märja jää kasutamise korral peab pakend olema lekkimiskindel. Iga pakend ning saatekiri peab kandma täpselt järgmise sõnastusega tähistust: “UN 3373 DIAGNOSTIC SPECIMEN PACKED IN COMPLIANCE WITH IATA PACKING INSTRUCTION 650” |
|
c) |
Teisese ja välispakendi vahel peab olema kaasa pandud sisu üksikasjalik loend. |
|
d) |
Välispakend tuleb kaitseks niiskuse eest panna suletud plastkotti. |
|
e) |
Saatja deklaratsioon ohtlike kaupade kohta ei ole nõutav. |
XIII PEATÜKK
Viiruste ja proovide lähetamine ühenduse referentlaborisse
|
1. |
Ühenduse referentlaborile saadetavad proovid peavad vastama soovitustele ohtlike patogeenide veo kohta ühenduse piires, aga samuti Ühendkuningriigis kehtivatele määrustele ja õigusaktidele. Järgida tuleb käesolevas peatükis esitatud juhiseid. |
2. Viiruste ja muude materjalide lähetamine ühenduse referentlaborile
|
a) |
Kõik materjalid tuleb pakendada vastavalt käesolevas peatükis esitatud juhistele. |
|
b) |
Välispakend tuleb tähistada järgmiselt: “ANIMAL PATHOGEN – PACKAGE ONLY TO BE OPENED AT THE AVIAN VIROLOGY SECTION, VLA, WEYBRIDGE. IMPORTATION AUTHORISED BY LICENCE NUMBER....*......ISSUED UNDER THE IMPORTATION OF ANIMAL PATHOGENS ORDER.” |
|
c) |
Sisestada tuleb üks järgmistest litsentsinumbritest:
Kuna neid litsentsinumbreid aeg-ajalt muudetakse, peavad proove saatvad laborid enne pakendite saatmist veenduma, et nad kasutavad parajasti kehtivaid litsentsinumbreid. |
|
d) |
Pakk tuleb saata järgmisel aadressil:
|
|
e) |
Pakiga tuleb kaasa panna kiri võimalikult üksikasjalike andmetega isolaatide kohta, nagu liik ja vanus, isoleerimise piirkond/riik, igasugused kliinilised andmed. |
|
f) |
Pakid tuleb saata lennuposti või lennutranspordiga. Kui pakid saadetakse lennutranspordiga, tuleb ühenduse referentlaborile enne materjalide saabumist faksi, telefoni või elektronposti teel edastada saatekirja number. Et tagada kiiret töötlust lennujaamas, tuleb lennutranspordiga saadetavad pakid selgelt tähistada järgmiselt: “CARE OF TRANSGLOBAL”, . Ühenduse referentlabori kontaktandmed:
|
XIV PEATÜKK
Minimaalsed ohutusnõuded AI-diagnostikalaborile
|
1. |
AI-viiruseid käitlevate diagnostikalaborite ohutusnõuded peavad hõlmama nii viiruse kui loomade tervise ohustaja ohjeldamist ja laboris (ning sellest väljaspool) töötavate inimeste kaitset igasuguse zoonootilise ohu eest. Ühenduses on sätestatud laborite minimaalseid ohutusnõudeid mitmes direktiivis. Lisaks on tegevuslikud aspektid kirjeldatud ning sätestatud aluseks olevates Euroopa standardites (EN). Labori käitamist diagnostilisel otstarbel käsitlevad täiendavad määrused (EN), nagu näiteks hea laboritava. |
2. Ühenduse direktiivid laborite kohta
12. juuni 1989. aasta nõukogu direktiiv 89/391/EMÜ töötajate töötervishoiu ja tööohutuse parandamist soodustavate meetmete kehtestamise kohta (EÜT L 183, 29.6.1989, lk 1).
26. novembri 1990. aasta nõukogu direktiiv 90/679/EMÜ töötajate kaitse kohta bioloogiliste mõjuritega kokkupuutest tulenevate ohtude eest tööl (seitsmes üksikdirektiiv direktiivi 89/391/EMÜ artikli 16 lõike 1 tähenduses) (EÜT L 374, 31.12.1990, lk 1).
Juhul kui diagnoosimisel kasutatakse polümeraasi ahelreaktsiooni (PCR) ning PCR-toodete kloonimist bakteriaalsesse plasmiidi nende paljundamiseks, näiteks DNA järjestuse määramise eesmärgil, kohaldatakse lisaks nendele kahele direktiivile järgmist direktiivi ning Euroopa standardeid (EN):
23. aprilli 1990. aasta nõukogu direktiiv 90/219/EMÜ geneetiliselt muundatud mikroorganismide isoleeritud kasutamise kohta (EÜT L 117, 8.5.1990, lk 1).
|
3. |
Lisaks ühenduse direktiividele tuleb tunnustada Euroopa standardeid (EN):
Labori kasutamisele/juhtimisele kohaldatakse järgmisi tingimusi. |
4. Nõuded laboritele (ohutustasemed 1–4)
Kooskõlas Euroopa Parlamendi ja nõukogu 18. septembri 2000. aasta direktiiviga 2000/54/EÜ töötajate kaitse kohta bioloogiliste mõjuritega kokkupuutest tulenevate ohtude eest tööl (seitsmes üksikdirektiiv direktiivi 89/391/EMÜ artikli 16 lõike 1 tähenduses) (EÜT L 262, 17.10.2000, lk 21), direktiiviga 90/219/EMÜ ja Euroopa standarditega EN 12128; EN 12740; EN 12741.
|
Ohutusmeetmed |
Ohutustase |
|||
|
1 |
2 |
3 |
4 |
|
|
Laboriüksus: isoleerimine |
ei |
jah |
jah |
jah |
|
Laborid eraldatud uste abil |
ei |
jah |
jah |
jah |
|
Ruumis toimuva jälgimiseks peab olema vaateaken või mõni muu vahend |
valikuline |
valikuline |
valikuline |
jah |
|
Personali jaoks peavad olemas olema kätepesuruumid |
jah |
jah |
jah |
jah |
|
Peavad olemas olema desinfitseerimisvahendid (kätele) |
valikuline |
jah |
jah |
jah |
|
Piiratud ligipääs |
ei |
jah |
jah |
jah |
|
Erimeetmed aerosooli kontrolli all hoidmiseks |
ei |
jah, vähendada |
jah, ennetada |
jah, ennetada |
|
Hoiatusmärk “Bioloogiline oht” uksel |
ei |
jah |
jah |
jah |
|
Dušš |
ei |
ei |
valikuline |
jah |
|
Silmatilgad |
jah |
jah |
jah |
jah |
|
Labor: fumigeerimiseks suletav |
ei |
ei |
jah |
jah |
|
Vee-, happe-, leelise-, lahustikindlad, desinfitseeritavad ja saastest vabastatavad, kergesti puhastatavad tööpinnad |
jah (laud) |
jah (laud) |
jah (laud, põrand) |
jah (laud, põrand) |
|
Sissepääs laborisse õhulüüsi kaudu |
ei |
ei |
valikuline |
jah |
|
Vahetu keskkonna rõhu suhtes negatiivne rõhk |
ei |
ei |
valikuline |
jah |
|
Laborisse sisenev ja sellest väljuv õhk peab läbima HEPA filtri |
ei |
ei |
jah (väljuv õhk) |
jah |
|
Autoklaav |
kohapeal |
hoones |
kohapeal |
laboris, kahepoolne |
|
Kaitseriietus |
sobiv kaitseriietus |
sobiv kaitseriietus |
sobiv kaitseriietus (vabatahtlikud jalatsid) |
riiete täielik vahetamine |
|
Kindad |
ei |
valikuline |
jah |
jah |
|
Tõhus kontroll nakkuse levitajate (näiteks näriliste ja putukate) üle |
valikuline |
jah |
jah |
jah |
|
Bioloogilise mõjuri ohutu säilitamine |
jah |
jah |
jah |
jah |
|
Laboris võivad olla ainult seal kasutatavad töövahendid |
ei |
ei |
soovitatav |
jah |
Laborite haldamise ja korraldamisega tegelevad Euroopas mitmed firmad.
On muidki siseriiklikke ja rahvusvahelisi määruseid ja soovitusi, mida tuleb järgida. Maailma Terviseorganisatsioon on oma veebilehell avaldanud laborite bioohutuse käsiraamatu kolmanda väljaande:
http://www.who.int/csr/resources/publications/biosafety/WHO_CDS_CSR_LYO_2004_11/en/.
5. Loomatervishoiuga seotud ohutus
Liikmesriikide veterinaarasutused peavad paika seadma määrused AI-viiruste, eriti KPLG, aga samuti kõigi H5- ja H7-alatüüpi AI-viiruste ohjeldamise kohta. Mõningaid juhiseid pakub maailma loomatervishoiu organisatsiooni maismaaloomade tervishoiu koodeksi 2005 peatükk 1.4.5 milles KPLG on klassifitseeritud 4. ohugrupi patogeenina.
AI-viiruste käsitlemist reguleerivad määrused panevad paika liikmesriigi veterinaarasutused.
Ühenduse referentlabori kohaldatavate minimaalsete ohutusnõuetega, mis on ühtlasi Ühendkuningriigi siseriiklikud nõuded, võib tutvuda järgmisel veebilehel:
http://www.defra.gov.uk/corporate/vla/science/science-viral-ai-reflab.htm.
6. Inimeste tervishoiuga seotud ohutus
AI-viirustega tegelevad laborid peavad olema igal ajahetkel teadlikud sellest, et need on inimeste jaoks vähemalt potentsiaalsed patogeenid, ning kindlustama labori toimimise nii, et välditaks sealsete töötajate nakatamist ning viiruse igasugust väljapääsemist.
Juhised A-tüüpi AI-viiruse esinemiskahtlusega näidiste käsitlemiseks võib leida Maailma Terviseorganisatsiooni (WHO) veebilehelt:
http://www.who.int/csr/disease/avian_influenza/guidelines/handlingspecimens/en/.
(1) Nendel juhtudel tuleb läbi viia täielik proovivõtmine ning proovid tuleb säilitada hilisemaks hindamiseks.

