ISSN 1977-0685
Diario Oficial
de la Unión Europea
L 110

Edición en lengua española
Legislación
61.° año
30 de abril de 2018
|
ISSN 1977-0685 |
||
|
Diario Oficial de la Unión Europea |
L 110 |
|

|
||
|
Edición en lengua española |
Legislación |
61.° año |
|
|
|
|
|
(1) Texto pertinente a efectos del EEE. |
|
ES |
Los actos cuyos títulos van impresos en caracteres finos son actos de gestión corriente, adoptados en el marco de la política agraria, y que tienen generalmente un período de validez limitado. Los actos cuyos títulos van impresos en caracteres gruesos y precedidos de un asterisco son todos los demás actos. |
II Actos no legislativos
REGLAMENTOS
|
30.4.2018 |
ES |
Diario Oficial de la Unión Europea |
L 110/1 |
REGLAMENTO DE EJECUCIÓN (UE) 2018/659 DE LA COMISIÓN
de 12 de abril de 2018
sobre las condiciones para la entrada en la Unión de équidos vivos y de esperma, óvulos y embriones de équidos
(Texto pertinente a efectos del EEE)
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Vista la Directiva 91/496/CEE del Consejo, de 15 de julio de 1991, por la que se establecen los principios relativos a la organización de controles veterinarios de los animales que se introduzcan en la Comunidad procedentes de terceros países y por la que se modifican las Directivas 89/662/CEE, 90/425/CEE y 90/675/CEE (1), y en particular su artículo 3, apartado 2, y su artículo 9, apartado 1, letra c),
Vista la Directiva 92/65/CEE del Consejo, de 13 de julio de 1992, por la que se establecen las condiciones de policía sanitaria aplicables a los intercambios y las importaciones en la Comunidad de animales, esperma, óvulos y embriones no sometidos, con respecto a estas condiciones, a las normativas comunitarias específicas a que se refiere la sección I del anexo A de la Directiva 90/425/CEE (2), y en particular su artículo 17, apartado 3,
Vista la Directiva 2009/156/CE del Consejo, de 30 de noviembre de 2009, relativa a las condiciones de policía sanitaria que regulan los movimientos de équidos y las importaciones de équidos procedentes de terceros países (3), y en particular su artículo 2, letra i), su artículo 12, apartados 1, 4 y 5, su artículo 13, apartado 2, y sus artículos 15, 16, 17 y 19,
Considerando lo siguiente:
|
(1) |
La Directiva 2009/156/CE establece los requisitos zoosanitarios que rigen la importación en la Unión de équidos. Establece que solo se autoriza la importación en la Unión de équidos procedentes de terceros países o partes de terceros países que figuren en una lista elaborada con arreglo a las disposiciones de la misma, y que vayan acompañados del certificado sanitario que se ajuste al modelo establecido asimismo con arreglo a sus disposiciones. El certificado sanitario debe acreditar que los équidos cumplen las condiciones sanitarias establecidas de conformidad con la Directiva en el correspondiente certificado sanitario. |
|
(2) |
La lista de terceros países desde los que los Estados miembros autorizan la importación de équidos vivos y de esperma, óvulos y embriones de équidos, y la regionalización de algunos de esos países, deben establecerse sobre la base de su situación zoosanitaria y de la lista de terceros países y partes de su territorio establecida en la Decisión 2004/211/CE de la Comisión (4). |
|
(3) |
De conformidad con el artículo 12, apartado 2, letra a), de la Directiva 2009/156/CE, los requisitos zoosanitarios establecidos en el presente Reglamento deben basarse en una evaluación del riesgo. El principio, establecido en el artículo 12, apartado 4, de la Directiva 2009/156/CE, de agrupar los países en zonas sanitarias en función de los riesgos comunes ha demostrado su eficacia. Sin embargo, como el término «zona» hace pensar en contigüidad, mientras que algunos riesgos de la misma naturaleza pueden darse en zonas alejadas entre sí, conviene asignar los países a «grupos sanitarios» específicos. |
|
(4) |
La Directiva 92/65/CEE establece los requisitos zoosanitarios que rigen la importación en la Unión de esperma, óvulos y embriones de équidos. Establece que solo se autoriza la importación en la Unión de équidos procedentes de terceros países o partes de terceros países que figuren en una lista elaborada con arreglo a las disposiciones de la misma, y que vayan acompañados del certificado sanitario que se ajuste al modelo establecido asimismo con arreglo a sus disposiciones. El certificado sanitario debe acreditar que las mercancías proceden de centros de recogida y almacenamiento o equipos de recogida y producción que han sido autorizados y ofrecen garantías por lo menos equivalentes a las establecidas en el anexo D, capítulo I, de esa Directiva. |
|
(5) |
La Directiva 92/65/CEE, en su versión modificada por la Directiva 2008/73/CE del Consejo (5), introdujo un procedimiento simplificado para elaborar las listas de los centros de recogida y almacenamiento de esperma y los equipos de recogida y producción de embriones en terceros países, desde los que está autorizada la importación de las mercancías en la Unión. Las listas pueden consultarse en el sitio web de la Comisión (6). |
|
(6) |
El anexo D de la Directiva 92/65/CEE establece determinados requisitos para el esperma, los óvulos y los embriones de équidos, así como condiciones de autorización, supervisión y funcionamiento de los centros de recogida y almacenamiento de esperma y de los equipos de recogida y producción de embriones, así como condiciones zoosanitarias detalladas aplicables a los animales donantes. En consecuencia, es preciso establecer modelos de certificados sanitarios para la importación en la Unión de esperma, óvulos y embriones de équidos. |
|
(7) |
Además, prever la importación en la Unión de las existencias de mercancías que cumplen las disposiciones de la Directiva 92/65/CEE establecidas con anterioridad a la entrada en vigor de las modificaciones que introdujo el Reglamento (UE) n.o 176/2010 de la Comisión (7). En consecuencia, es necesario establecer modelos específicos de certificado sanitario para la importación de partidas de esperma, óvulos y embriones de équidos recogidos o producidos, transformados y almacenados de conformidad con el anexo D de la Directiva 92/65/CEE antes del 1 de septiembre de 2010. |
|
(8) |
Dado que estas mercancías tienen plazos de conservación muy largos, es imposible fijar actualmente una fecha para el agotamiento de las existencias. Por consiguiente, no se puede fijar un límite de utilización de los modelos de certificados sanitarios destinados a estas existencias. |
|
(9) |
Para garantizar la total trazabilidad de las mercancías, deben establecerse en el presente Reglamento modelos de certificado sanitario para la importación en la Unión de esperma de équidos recogido en centros de recogida de esperma autorizados y expedido desde un centro de almacenamiento de esperma autorizado, ya forme este parte o no de un centro de recogida autorizado con un número de autorización diferente. |
|
(10) |
Además, procede que las partidas de mercancías importadas en la Unión desde Suiza vayan acompañadas de certificados sanitarios elaborados conforme a los modelos que se utilizan para el comercio dentro de la Unión de esperma, óvulos y embriones de équidos, establecidos en el anexo D de la Decisión 2010/470/UE de la Comisión (8), con las adaptaciones que recoge el apéndice 2, capítulo VII, sección B, puntos 8 y 9, del anexo 11 del Acuerdo entre la Comunidad Europea y la Confederación Suiza sobre el comercio de productos agrícolas, aprobado mediante la Decisión 2002/309/CE, Euratom del Consejo y de la Comisión (9). |
|
(11) |
El esperma, los óvulos y los embriones de équidos enviados de Canadá a la Unión pueden ir acompañados de certificados sanitarios establecidos de conformidad con el Acuerdo entre la Comunidad Europea y el Gobierno de Canadá sobre medidas sanitarias para proteger la salud pública y la sanidad animal en el comercio de animales vivos y de productos de origen animal (10), aprobado mediante la Decisión 1999/201/CE del Consejo (11). |
|
(12) |
El esperma, los óvulos y los embriones de équidos enviados de Nueva Zelanda a la Unión pueden ir acompañados de certificados sanitarios establecidos de conformidad con el Acuerdo entre la Comunidad Europea y Nueva Zelanda sobre medidas sanitarias para proteger la salud pública y la sanidad animal aplicables al comercio de animales vivos y productos animales (12), aprobado mediante la Decisión 97/132/CE del Consejo (13). |
|
(13) |
Con el fin de simplificar la legislación de la Unión, conviene agrupar en un solo Reglamento las condiciones zoosanitarias y de certificación aplicables a la entrada en la Unión de partidas de équidos y de esperma, óvulos y embriones de équidos, incluida la lista de terceros países y partes de su territorio a partir de los cuales los Estados miembros autorizan la introducción en la Unión de dichas partidas. |
|
(14) |
Con el fin de preservar la situación sanitaria certificada de los équidos durante su transporte entre el tercer país exportador y la Unión, procede establecer requisitos zoosanitarios relativos al transporte de équidos. |
|
(15) |
Deben establecerse disposiciones relativas a la calidad de las pruebas sanitarias y al registro de las vacunaciones. También deben establecerse disposiciones relativas a la confirmación de los resultados analíticos por el laboratorio de referencia de la Unión Europea para enfermedades de los équidos distintas de la peste equina, designado de conformidad con el Reglamento (CE) n.o 180/2008 de la Comisión (14), cuando un muestreo basado en el riesgo de los équidos, llevado a cabo de conformidad con la Decisión 97/794/CE de la Comisión (15), haya producido resultados diferentes de los certificados por el tercer país de envío. |
|
(16) |
Deben determinarse las pruebas para el diagnóstico de la arteritis viral equina y las categorías de équidos machos a las que se aplican los requisitos de prueba para la detección de la arteritis viral equina, sobre la base de las recomendaciones del Comité veterinario científico (16) que figuran en la Decisión 95/329/CE de la Comisión (17), y de las últimas recomendaciones del capítulo 12.9 del Código Sanitario para los Animales Terrestres de la Organización Mundial de Sanidad Animal (OIE), edición de 2016 (18). |
|
(17) |
Debe establecerse un modelo de certificado sanitario específico para el tránsito de équidos vivos por la Unión entre un tercer país, o parte de su territorio, y otro tercer país o parte de su territorio. |
|
(18) |
Con el fin de llevar a cabo los controles necesarios para garantizar una aplicación uniforme por los Estados miembros de las disposiciones relativas a la admisión temporal de caballos registrados, la reintroducción de caballos registrados después de su exportación temporal, el tránsito de équidos y la conversión de la admisión temporal de caballos registrados en admisión definitiva, es necesario establecer disposiciones específicas y adicionales sobre el uso del sistema informático veterinario integrado «Traces», previsto en las Decisiones 2003/24/CE (19) y 2004/292/CE (20) de la Comisión, entre el puesto de inspección fronterizo de entrada, autorizado de conformidad con la Decisión 2009/821/CE de la Comisión (21), y el punto de salida de la Unión. |
|
(19) |
En aras de la coherencia y la simplificación de la legislación de la Unión, el formato de los modelos de certificados sanitarios para la entrada en la Unión de équidos y de esperma, óvulos y embriones de équidos debe basarse en los modelos únicos de certificado veterinario que figuran en el anexo I de la Decisión 2007/240/CE de la Comisión (22). |
|
(20) |
Deben adoptarse disposiciones para determinar, de conformidad con el artículo 19, letra c), de la Directiva 2009/156/CEE, las condiciones que permitan convertir una admisión temporal en una admisión definitiva, incluidas las disposiciones de Traces sobre la información necesaria y el intercambio del documento veterinario común de entrada (DVCE) que figura en el anexo I del Reglamento (CE) n.o 282/2004 de la Comisión (23). |
|
(21) |
Deben establecerse las condiciones zoosanitarias específicas para la reintroducción de caballos registrados, después de su exportación temporal a terceros países para participar en carreras, concursos hípicos y actos culturales, y los correspondientes modelos de certificado deben figurar en un anexo del presente Reglamento. |
|
(22) |
La Decisión 93/444/CEE de la Comisión (24) define el «punto de salida» y exige, en particular, que los animales destinados a ser exportados a un tercer país vayan, en su camino hacia el punto de salida, acompañados de un certificado sanitario aplicable al menos al comercio de animales de sacrificio de la especie en cuestión. Establece asimismo que la autoridad competente del lugar de envío notifique el desplazamiento previsto al punto de salida. Es necesario aclarar que, con el fin de garantizar la trazabilidad, el «punto de salida» debe ser un puesto de inspección fronterizo y que el certificado sanitario mencionado en el artículo 2, apartado 1, de la Decisión 93/444/CEE debe ser el modelo de certificado sanitario que figura en el anexo III de la Directiva 2009/156/CE, también en el caso de los caballos registrados destinados a la exportación temporal. |
|
(23) |
Por razones de seguridad jurídica, deben derogarse las Decisiones 92/260/CEE (25), 93/195/CEE (26), 93/196/CEE (27), 93/197/CEE (28), 94/699/CE (29), 95/329/CE, 2003/13/CE (30), 2004/177/CE (31), 2004/211/CE, 2010/57/UE (32) y 2010/471/UE (33) de la Comisión. |
|
(24) |
Para que los agentes económicos puedan adaptarse a las nuevas normas establecidas en el presente Reglamento, conviene establecer un período transitorio durante el cual los Estados miembros puedan autorizar la introducción en la Unión de équidos y de esperma, óvulos y embriones de équidos que se ajusten a las condiciones establecidas en los modelos de certificado sanitario aplicables antes de la fecha de aplicación del presente Reglamento. |
|
(25) |
Las medidas previstas en el presente Reglamento se ajustan al dictamen del Comité Permanente de Vegetales, Animales, Alimentos y Piensos. |
HA ADOPTADO EL PRESENTE REGLAMENTO:
SECCIÓN 1
Objeto, ámbito de aplicación y definiciones
Artículo 1
Objeto y ámbito de aplicación
El presente Reglamento establece la lista de terceros países y partes de su territorio a partir de los cuales se autoriza la entrada en la Unión de partidas de équidos y de esperma, óvulos y embriones de équidos.
También establece las condiciones zoosanitarias y de certificación veterinaria aplicables a dichas partidas.
Artículo 2
Definiciones
A los efectos del presente Reglamento, se entenderá por:
|
reconocimiento oficial de una parte del territorio de un tercer país con una delimitación geográfica precisa, que contiene una subpoblación de équidos con una situación sanitaria diferenciada por lo que respecta a una o varias enfermedades específicas y que está sujeta a medidas adecuadas de vigilancia, control de enfermedades y bioprotección; |
||||||||||
|
cualquier documento que pueda ser utilizado para demostrar la identidad de un équido y que contenga al menos la información siguiente:
|
||||||||||
|
animal de la especie Equus caballus registrado según lo definido en la Directiva 90/427/CEE del Consejo (35), e identificado mediante un documento de identificación expedido por:
|
||||||||||
|
transporte de équidos o de su esperma, óvulos o embriones a alguno de los territorios enumerados en el anexo I de la Directiva 97/78/CE del Consejo (36); |
||||||||||
|
admisión temporal, reintroducción después de exportación temporal, importación o tránsito; |
||||||||||
|
estatus de un caballo registrado procedente de un tercer país e introducido en el territorio de la Unión por un período inferior a 90 días; |
||||||||||
|
salida de la Unión de un caballo registrado por un período inferior a 90 días; |
||||||||||
|
nueva entrada en la Unión de un caballo registrado procedente de un tercer país después de su exportación temporal; |
||||||||||
|
llegada a la Unión de una partida de équidos o de su esperma, óvulos o embriones por un período indeterminado; |
||||||||||
|
transporte por carretera, ferrocarril o vías navegables del territorio de la Unión de una partida de équidos de un tercer país a otro, o de una parte del territorio de un tercer país a otra parte del territorio de ese mismo tercer país; |
||||||||||
|
cualquier puesto de inspección según se define en el artículo 2, apartado 2, letra f), de la Directiva 91/496/CEE y en el artículo 2, apartado 2, letra g), de la Directiva 97/78/CE y autorizado para la mercancía de que se trate de conformidad con la Decisión 2009/821/CE; |
||||||||||
|
équidos registrados, équidos de abasto o équidos de crianza y de renta, tal como se definen en el artículo 2 de la Directiva 2009/156/CE, y caballos registrados; |
||||||||||
|
fases haploides de la maduración del ovocito, incluidos los ovocitos y óvulos de segundo orden; |
||||||||||
|
cualquier persona física o jurídica sujeta a una o más de las disposiciones del presente Reglamento con responsabilidad sobre équidos o su material reproductivo; |
||||||||||
|
separación de équidos de otros animales durante un período determinado para prevenir la transmisión de determinados patógenos por contacto directo o indirecto, mientras los équidos se someten a observación y, en su caso, a pruebas y tratamiento bajo supervisión de la autoridad veterinaria; |
||||||||||
|
aislamiento de los équidos en locales sometidos a normas de bioprotección específicas bajo control de la autoridad veterinaria; |
||||||||||
|
cuarentena de los équidos
|
||||||||||
|
cuarentena de los équidos en un edificio sellado
|
||||||||||
|
sistema informático veterinario integrado, previsto en las Decisiones 2003/24/CE y 2004/292/CE. |
SECCIÓN 2
Lista de terceros países y partes de su territorio a partir de los cuales se autoriza la entrada en la Unión de équidos y de esperma, óvulos y embriones de équidos
Artículo 3
Lista de terceros países y partes de su territorio a partir de los cuales se autoriza la entrada en la Unión de équidos
1. Los Estados miembros solo autorizarán la entrada en la Unión de partidas de équidos procedentes de los terceros países —o, cuando la Unión aplica la regionalización, de partes del territorio de los terceros países— que figuran en las columnas 2 y 4 del cuadro del anexo I, de conformidad con las indicaciones de dicho anexo, del modo siguiente:
|
a) |
admisión temporal de caballos registrados, tal como se indica en la columna 6 del cuadro del anexo I, que vayan acompañados de un certificado sanitario establecido conforme al modelo de certificado sanitario que figura en la sección A de la parte 1 del anexo II; |
|
b) |
tránsito de équidos, tal como se indica en la columna 15 del cuadro del anexo I, que vayan acompañados de un certificado sanitario establecido conforme al modelo de certificado sanitario que figura en la sección B de la parte 1 del anexo II; |
|
c) |
reintroducción de caballos registrados para participar en carreras, concursos hípicos y actos culturales, después de su exportación temporal, tal como se indica en la columna 7 del cuadro del anexo I, que vayan acompañados de un certificado sanitario establecido conforme al modelo de certificado sanitario que figura, respectivamente, en la sección A o en la sección B de la parte 2 del anexo II; |
|
d) |
importación de caballos registrados, tal como se indica en la columna 8 del cuadro del anexo I, que vayan acompañados de un certificado sanitario establecido conforme al modelo de certificado sanitario que figura en la sección A de la parte 3 del anexo II; |
|
e) |
importación de una partida de équidos para el sacrificio, tal como se indica en la columna 9 del cuadro del anexo I, que vayan acompañados de un certificado sanitario establecido conforme al modelo de certificado sanitario que figura en la sección B de la parte 3 del anexo II; |
|
f) |
importación de équidos registrados y de équidos de crianza y de renta, tal como se indica en la columna 10 del cuadro del anexo I, que vayan acompañados de un certificado sanitario establecido conforme al modelo de certificado sanitario que figura en la sección A de la parte 3 del anexo II. |
2. La autoridad competente del tercer país de envío aplicará las medidas necesarias para cumplir las condiciones específicas o los plazos indicados para ese país en la columna 16 del cuadro del anexo I.
Artículo 4
Terceros países y partes de su territorio a partir de los cuales se autoriza la entrada en la Unión de esperma de équidos
Los Estados miembros solo autorizarán la entrada en la Unión de partidas de esperma de équidos procedentes de los terceros países o, cuando la Unión aplica la regionalización, de partes de su territorio que figuran en las columnas 2 y 4 del cuadro del anexo I, de conformidad con las indicaciones de las columnas 11, 12 y 13 de dicho cuadro, a condición de que la partida cumpla las condiciones siguientes:
|
a) |
la partida se envía desde un centro de recogida o almacenamiento de esperma que figura en una lista establecida conforme al artículo 17, apartado 3, letra b), de la Directiva 92/65/CEE; |
|
b) |
la partida va acompañada de un certificado sanitario establecido conforme al correspondiente modelo de certificado sanitario que figura en la parte 1 del anexo III. |
Artículo 5
Terceros países y partes de su territorio a partir de los cuales se autoriza la entrada en la Unión de óvulos y embriones de équidos
Los Estados miembros solo autorizarán la entrada en la Unión de partidas de óvulos y embriones de équidos procedentes de los terceros países o, cuando la Unión aplica la regionalización, de partes de su territorio que figuran en las columnas 2 y 4 del cuadro del anexo I, de conformidad con las indicaciones de la columna 14 de dicho cuadro, a condición de que la partida cumpla las condiciones siguientes:
|
a) |
la partida la expide un equipo de recogida o producción de embriones que figure en una lista establecida conforme al artículo 17, apartado 3, letra b), de la Directiva 92/65/CEE; |
|
b) |
la partida va acompañada de un certificado sanitario establecido conforme al correspondiente modelo de certificado sanitario que figura en la parte 2 del anexo III. |
SECCIÓN 3
Requisitos generales aplicables a la entrada en la Unión de envíos de équidos y de esperma, óvulos y embriones de équidos
Artículo 6
Certificación
1. Los certificados sanitarios previstos en los artículos 3, 4 y 5 se establecerán y expedirán de conformidad con:
|
a) |
las garantías adicionales o condiciones aplicables especificadas en la columna 16 del anexo I; |
|
b) |
las notas explicativas de la parte 4 del anexo II y la parte 3 del anexo III, respectivamente. |
2. Las disposiciones del apartado 1 no excluirán la utilización de certificación electrónica u otros sistemas autorizados, cuando existan procedimientos armonizados a nivel de la Unión Europea.
Artículo 7
Período de validez de los certificados sanitarios
1. El operador responsable de una partida de équidos o de esperma, óvulos o embriones de équidos destinados a la entrada en la Unión garantizará que la partida se presente a un puesto de inspección fronterizo autorizado al efecto antes de transcurridos 10 días de su certificación en el tercer país de envío.
2. Cuando los équidos se transporten por vía marítima, el período de 10 días mencionado en el apartado 1 se prolongará por el tiempo que dure la travesía.
SECCIÓN 4
Requisitos de transporte para la entrada de équidos en la Unión
Artículo 8
Requisitos generales de sanidad animal
1. El operador responsable de un envío de équidos destinados a la entrada en la Unión garantizará que su transporte cumpla las siguientes condiciones:
|
a) |
los équidos viajan en un medio de transporte solo para équidos destinados a la Unión o, si no es así, van acompañados del certificado sanitario exigido para el tránsito; |
|
b) |
los équidos viajan en un medio de transporte solo para équidos de la misma situación sanitaria certificada, salvo excepciones autorizadas en los requisitos zoosanitarios específicos establecidos en las secciones A y B de la parte 1 y en la sección A de la parte 3 del anexo II; |
|
c) |
los équidos se transportan por carretera o ferrocarril o se trasladan andando únicamente en un tercer país o parte de su territorio autorizado, al menos, para un tipo de entrada de una categoría de équidos como mínimo. |
2. El operador responsable de un envío de équidos destinados a la entrada en la Unión garantizará que se cumplen las siguientes condiciones:
|
a) |
los cajones, contenedores, jaulas o jaulas para el transporte aéreo, y los medios de transporte o sus compartimentos en que viajarán los équidos se limpian y desinfectan, antes de la carga de los animales, con un desinfectante oficialmente reconocido en el país de envío; |
|
b) |
los medios de transporte por ferrocarril o por carretera están diseñados, construidos y son operados de forma que no puedan derramarse excrementos, orina o pienso durante el transporte previsto; |
|
c) |
se aplican medidas para proteger a los animales de los ataques de insectos vectores en caso de que se dé una de las enfermedades siguientes:
En el caso de las enfermedades mencionadas en el inciso i), la protección frente a los vectores consistirá en poner mosquiteras en los cajones, contenedores, jaulas o jaulas para el transporte aéreo, dotarlos de ventilación forzada y mantener cerrado el compartimento de transporte, excepto durante las operaciones de carga, descarga o cuidado de los animales. |
3. El operador responsable de una partida de équidos destinados a la entrada en la Unión garantizará que, durante el viaje, los équidos solo se descarguen en un tercer país o parte de su territorio autorizado para la entrada de équidos en la Unión con arreglo a lo dispuesto en el anexo I.
Artículo 9
Requisitos específicos de sanidad animal para el transporte por vía aérea
1. El operador responsable de un envío de équidos destinados a la entrada en la Unión por vía aérea garantizará que se cumplen las siguientes condiciones:
|
a) |
los cajones, contenedores o jaulas para el transporte aéreo y el espacio aéreo circundante del compartimento de transporte se rocían con un repelente de insectos combinado con un insecticida inmediatamente después del cierre de las puertas del avión; |
|
b) |
el comandante del avión cumplimenta y firma la declaración que figura en la parte 1 del anexo V. |
2. No obstante lo dispuesto en el apartado 3 del artículo 8, los Estados miembros podrán autorizar, a petición del operador del envío, el transbordo directo de un avión a otro en un país que no figure en el anexo I, a condición de que se cumplan las siguientes condiciones:
|
a) |
el transbordo se lleva a cabo en el mismo aeropuerto, en la zona de la misma oficina de aduanas, bajo la supervisión directa de un veterinario oficial o del funcionario de aduanas responsable; |
|
b) |
durante el transbordo, los équidos están protegidos de los ataques de insectos vectores de enfermedades transmisibles a los équidos; |
|
c) |
los équidos no entran en contacto con équidos de una situación sanitaria distinta; |
|
d) |
las medidas previstas en las letras a) y b) del apartado 1 se aplican al avión en que vaya a continuar el viaje; |
|
e) |
el cumplimiento de las condiciones del apartado 1, letra a), y de las letras a) a c) del presente apartado queda acreditado por el veterinario oficial o el funcionario de aduanas responsable en la declaración de transbordo establecida conforme al modelo que figura en la parte 3 del anexo V. |
Artículo 10
Requisitos específicos de sanidad animal para el transporte por vía marítima
1. El operador responsable de un envío de équidos destinados a la entrada en la Unión por vía marítima garantizará que se cumplen las siguientes condiciones:
|
a) |
el buque se dirige directamente a un puerto de la Unión Europea, sin hacer escala en ningún puerto de un tercer país o parte de su territorio que no figure en el anexo I; |
|
b) |
los cajones, contenedores o jaulas y el espacio aéreo circundante del compartimento de transporte se rocían con un repelente de insectos combinado con un insecticida inmediatamente después del cierre del compartimento; |
|
c) |
el capitán del buque cumplimenta y firma la declaración que figura en la parte 2 del anexo V. |
2. No obstante lo dispuesto en la letra a) del apartado 1, los Estados miembros podrán autorizar el transbordo directo de un buque a otro en un país que no figure en el anexo I, a condición de que:
|
a) |
el transbordo se lleve a cabo en el mismo puerto, en la zona de la misma oficina de aduanas, bajo la supervisión directa de un veterinario oficial o del funcionario de aduanas responsable; |
|
b) |
durante el transbordo, los équidos estén protegidos de los ataques de insectos vectores de enfermedades transmisibles a los équidos; |
|
c) |
los équidos no entren en contacto con équidos de una situación sanitaria distinta; |
|
d) |
el cumplimiento de las condiciones del apartado 1, letra b), y de las letras a) a c) del presente apartado quede acreditado por el veterinario oficial o el funcionario de aduanas responsable en la declaración de transbordo establecida conforme al modelo que figura en la parte 3 del anexo V. |
SECCIÓN 5
Requisitos generales para las pruebas y la vacunación de équidos destinados a la entrada en la Unión y de équidos donantes cuyo esperma, óvulos y embriones están destinados a la entrada en la Unión
Artículo 11
Requisitos generales para las pruebas de laboratorio necesarias para la certificación de las partidas de équidos, o de su esperma, óvulos o embriones, destinados a la entrada en la Unión
1. La autoridad competente del tercer país de envío de équidos o de su esperma, óvulos y embriones destinados a la entrada en la Unión garantizará que las pruebas de laboratorio previstas en los certificados sanitarios que figuran en los anexos II y III para la detección del muermo, la durina, la anemia infecciosa equina, la encefalomielitis equina venezolana, la encefalomielitis equina del Este y del Oeste, la encefalitis japonesa, la fiebre del Nilo occidental, la estomatitis vesicular, la arteritis viral equina y la metritis contagiosa equina cumplen, como mínimo, los requisitos de sensibilidad y especificidad establecidos para cada una de estas enfermedades en los correspondientes capítulos de la sección 2.5 del Manual de Pruebas de Diagnóstico y Vacunas para los Animales Terrestres, última edición, de la Organización Mundial de Sanidad Animal (OIE).
2. La autoridad competente del tercer país de envío de équidos destinados a la Unión garantizará que las pruebas de laboratorio previstas en los certificados sanitarios que figuran en el anexo II para la detección de la peste equina se realicen de conformidad con el anexo IV de la Directiva 2009/156/CE.
3. La autoridad competente del tercer país de envío de équidos o de su esperma, óvulos y embriones destinados a la Unión garantizará que se cumpla lo siguiente:
|
a) |
las pruebas mencionadas en los apartados 1 y 2 se lleven a cabo en un laboratorio reconocido por la autoridad competente en el tercer país de envío; |
|
b) |
los datos relativos al muestreo y los resultados de las pruebas queden debidamente consignados en el correspondiente certificado sanitario establecido para la partida en cuestión en los anexos II o III, a partir del informe de laboratorio a disposición del veterinario oficial certificador. |
Artículo 12
Análisis a la llegada a la Unión
1. Cuando un análisis realizado en el Estado miembro de entrada, o en su nombre, con una muestra tomada de conformidad con el artículo 4 de la Decisión 97/794/CE no confirme el resultado de una prueba de laboratorio acreditada en el certificado sanitario que acompaña a los équidos o al esperma, óvulos o embriones de équidos a su entrada en la Unión, y que figura en el anexo II o en el anexo III del presente Reglamento, la autoridad competente de dicho Estado de entrada garantizará que el ensayo se repita en el laboratorio nacional de referencia designado para la enfermedad de que se trate, de conformidad con el artículo 4, apartado 1, del Reglamento (CE) n.o 882/2004 del Parlamento Europeo y del Consejo (38).
2. Cuando las medidas contempladas en el apartado 1 no arrojen un resultado concluyente sobre los controles del cumplimiento realizados de conformidad con el artículo 4 de la Decisión 97/794/CE, la autoridad competente mencionada en el apartado 1 garantizará que la muestra a que se refiere dicho apartado sea sometida a análisis definitivos como sigue:
|
a) |
para la detección de la peste equina, en el laboratorio de referencia de la Unión Europea para la peste equina designado de conformidad con la Directiva 92/35/CEE del Consejo (39); |
|
b) |
para la detección de las enfermedades a que hace referencia el artículo 11, apartado 1, en el laboratorio de referencia de la Unión Europea para enfermedades de los équidos distintas de la peste equina, designado de conformidad con el Reglamento (CE) n.o 180/2008. |
Artículo 13
Vacunación y registro de vacunaciones
1. La autoridad competente del tercer país de envío de équidos o de esperma, óvulos y embriones de équidos con destino a la Unión garantizará que la vacunación acreditada en cualquiera de los certificados sanitarios que figuran en los anexos II y III se lleve a cabo:
|
a) |
siguiendo las instrucciones del fabricante o, si es más estricta, la legislación nacional; |
|
b) |
con una vacuna autorizada que cumpla, como mínimo, los requisitos de seguridad, esterilidad y eficacia establecidos para esa vacuna en el Manual de Pruebas de Diagnóstico y Vacunas para los Animales Terrestres, última edición, de la Organización Mundial de Sanidad Animal (OIE). |
2. Cuando la autoridad competente de un tercer país acredite que la positividad de una prueba serológica de detección de la peste equina está relacionada con una vacunación anterior, la vacunación se documentará en el documento de identificación que acompaña al équido, cuando se disponga de tal documento.
Artículo 14
Requisitos relativos a la arteritis viral equina
1. Los équidos machos no castrados destinados a su entrada en la Unión, excepto los que figuran en el punto 1 del anexo IV, se someterán a pruebas para la detección de la arteritis viral equina, con el fin de comprobar que su esperma está libre del virus causal.
2. La vacunación contra la arteritis viral equina y las pruebas exigidas en el punto 1, letra a), del anexo IV se llevarán a cabo bajo supervisión veterinaria oficial.
3. La vacunación válida contra la arteritis viral equina será válida cuando el équido vaya acompañado por la prueba documental de los antecedentes ininterrumpidos de primovacunación con arreglo a uno de los protocolos previstos en la letra a) del punto 1 del anexo IV, seguidos de revacunación periódica con arreglo a las recomendaciones del fabricante y, en todo caso, a intervalos de no más de 12 meses.
SECCIÓN 6
Identificación de los équidos destinados a la entrada en la Unión
Artículo 15
Identificación de los équidos destinados a la entrada en la Unión
1. Los équidos destinados a la entrada en la Unión se identificarán individualmente para asegurar una correspondencia inequívoca entre el animal y su situación sanitaria acreditada.
Dicha identificación deberá:
|
a) |
o bien cumplir los requisitos del artículo 14 del Reglamento de Ejecución (UE) 2015/262 de la Comisión, o |
|
b) |
al menos, ofrecer la información que figura en los puntos 1, 2, 3 y 6 a 10 de la parte A, y en los puntos 12 a 18 de la parte B, de la sección I de la parte 1 del anexo I del dicho Reglamento. |
2. Los équidos de abasto que vayan a importarse en la Unión se marcarán individualmente con un transpondedor electrónico o un crotal, cuyo número se consignará en el certificado sanitario que acompaña a los animales durante el transporte.
3. Los équidos de abasto que vayan a importarse en la Unión llevarán en la pezuña delantera izquierda una «S» marcada a fuego de manera clara e indeleble de un tamaño no inferior a la mitad de la longitud de la pezuña, en los casos siguientes:
|
a) |
si van marcados individualmente, no obstante lo dispuesto en el apartado 2, mediante un método alternativo indicado en el certificado sanitario, en cuyo caso los animales deberán ser enviados al matadero de destino, de conformidad con el artículo 21, letra a); |
|
b) |
si están destinados a ser enviados al matadero de destino, de conformidad con el artículo 21, letra b). |
SECCIÓN 7
Requisitos específicos de sanidad animal y de certificación aplicables a la entrada en la Unión de envíos de équidos
Artículo 16
Medidas que deben tomar las autoridades competentes para garantizar la trazabilidad de un caballo registrado admitido temporalmente
1. Cuando quede establecido que se cumplen las condiciones de entrada, la autoridad competente del puesto de inspección fronterizo de entrada:
|
a) |
guardará una copia del certificado sanitario a que se refiere el artículo 3, apartado 1, letra a); |
|
b) |
informará, a través de Traces, a la autoridad competente o al puesto de inspección fronterizo de salida, según proceda, de la entrada de un caballo registrado admitido temporalmente, como sigue:
|
|
c) |
presentará al operador indicado como «operador responsable de la partida» en la casilla I.7 del DVCE al menos una copia impresa del DVCE a que se refiere el apartado 1, letra b). |
2. Cuando un caballo registrado vaya a ser desplazado durante su admisión temporal de un Estado miembro a otro, la autoridad competente del lugar de envío:
|
a) |
emitirá, si se cumplen los requisitos zoosanitarios establecidos en los artículos 4 y 5 de la Directiva 2009/156/CE, un certificado sanitario de conformidad con el anexo III de la Directiva 2009/156/CE para cada caballo registrado o lote de caballos registrados del mismo origen y con el mismo destino, y consignará en la casilla I.6 de dicho certificado una referencia al certificado sanitario a que se refiere el artículo 3, apartado 1, letra a), de cada uno de los caballos registrados admitidos temporalmente que constituyen la partida y una referencia al DVCE a que se refiere el apartado 1, letra b), inciso i); |
|
b) |
informará, a través de Traces, a la autoridad competente del lugar de destino del desplazamiento de un caballo registrado a ese Estado miembro y solicitará la verificación de llegada cumplimentando una nueva parte III del DVCE a que se refiere el apartado 1, letra b), inciso i); |
|
c) |
presentará al operador indicado en la casilla I.7 del DVCE, contemplado en el apartado 1, letra b), inciso i), una nueva copia impresa del DVCE en la que figurará la parte III añadida de conformidad con la letra b) del presente apartado; |
|
d) |
anulará o retirará cualquier copia del DVCE presentada al operador de conformidad con el apartado 1, letra c), o, si se había producido un desplazamiento a otro Estado miembro, de conformidad con la letra c) del presente apartado. |
3. La autoridad competente del lugar de destino a la que se hace referencia en el apartado 1, letra b), inciso i), y en el apartado 2, letra b), reconocerá, a través de Traces, de la llegada del caballo registrado y documentará los controles realizados cumplimentando la parte III del DVCE.
4. Al final de la admisión temporal, la autoridad competente a que se refiere el apartado 1, letra b) incisos i) o iii), y que certifica la admisión temporal del caballo registrado admitido temporalmente en el tercer país de origen o en otro tercer país:
|
a) |
informará al puesto de inspección fronterizo de salida, mediante Traces, de la salida de la Unión del caballo registrado admitido temporalmente cumplimentando una nueva parte III del DVCE a que se refiere el apartado 1, letra b), inciso i); |
|
b) |
presentará al operador, indicado en la casilla I.7 del DVCE a que se refiere el apartado 1, letra b), inciso i), una nueva copia impresa del DVCE en la que figurará la parte III añadida de conformidad con la letra a) del presente apartado; |
|
c) |
si el puesto de inspección fronterizo de salida está situado en otro Estado miembro:
|
5. El puesto de inspección fronterizo de salida a que se refiere el apartado 4, letra a), documentará el fin de la admisión temporal del caballo registrado cumplimentando debidamente la parte III del DVCE.
6. Cuando la admisión temporal de un caballo registrado no ha terminado con arreglo al apartado 5 antes de transcurridos 90 días desde la expedición de los DVCE a que hace referencia el apartado 1, letra b), inciso i), se envía automáticamente una alerta a través de Traces al puesto de inspección fronterizo de entrada y a las autoridades competentes a que se refiere el presente artículo, hasta que las autoridades competentes hayan determinado la situación del caballo registrado.
Artículo 17
Responsabilidades del operador con respecto a los caballos registrados admitidos temporalmente
1. El operador responsable de un caballo registrado admitido temporalmente en la Unión, indicado en la casilla I.7 del DVCE a que se refiere el artículo 16, apartado 1, letra b), inciso i), velará por que se cumplan las siguientes condiciones:
|
a) |
en todo momento durante su admisión temporal, el caballo registrado irá acompañado del original del certificado sanitario a que hace referencia el artículo 3, apartado 1, letra a), y del DVCE expedido por el puesto de inspección fronterizo de entrada en la Unión; |
|
b) |
el caballo registrado permanecerá en el correspondiente Estado miembro y en las instalaciones mencionadas en la declaración que acompaña al certificado sanitario a que hace referencia el artículo 3, apartado 1, letra a); |
|
c) |
si el caballo registrado va a trasladarse a otro Estado miembro, irá acompañado de un certificado sanitario de conformidad con el anexo III de la Directiva 2009/156/CE y del DVCE modificado expedido por la autoridad competente de conformidad con el artículo 16, apartado 2; |
|
d) |
las antiguas copias del DVCE se entregarán a la autoridad competente para su anulación o retirada; |
|
e) |
el caballo registrado saldrá de la Unión por un puesto de inspección fronterizo indicado en el certificado sanitario a que hace referencia el artículo 3, apartado 1, letra a), antes de transcurridos 89 días desde la fecha de entrada en la Unión indicada en el correspondiente DVCE. |
2. El operador mencionado en el apartado 1 será responsable de la circulación del caballo registrado durante su admisión temporal en la Unión y, en particular, comunicará:
|
a) |
a la autoridad competente mencionada en el artículo 16, apartado 1, letra b), incisos i) y iii), los cambios de itinerario que vayan a hacerse, en la declaración que acompaña el certificado sanitario a que hace referencia el artículo 3, apartado 1, letra a); |
|
b) |
al puesto de inspección fronterizo de salida, la fecha prevista para la salida de la Unión del caballo registrado admitido temporalmente; |
|
c) |
a la autoridad competente, mencionada en el artículo 16, apartado 1, letra b), incisos i) y iii), y responsable de la explotación, la muerte o la pérdida del caballo registrado o cualquier emergencia sanitaria que requiera asistencia veterinaria más allá de los 89 días de admisión temporal. |
Artículo 18
Reintroducción, después de su exportación temporal, de caballos registrados admitidos temporalmente en la Unión
1. Podrá autorizarse la reintroducción de caballos registrados admitidos temporalmente en la Unión, después de su exportación temporal a un tercer país o parte del territorio de un tercer país autorizado para la reintroducción de caballos registrados para participar en carreras, concursos hípicos o actos culturales específicos, para los cuales se han establecido modelos de certificados sanitarios para la reintroducción en la Unión de conformidad con el artículo 20, apartado 3, a condición de que la reintroducción en la Unión tenga lugar antes de transcurridos 90 días desde la fecha de expedición del DVCE a que hace referencia el artículo 16, apartado 1, letra b), inciso i).
2. A fin de permitir la reintroducción de un caballo registrado a que se refiere el apartado 1, la autoridad competente mencionada en el artículo 16, apartado 1, letra b), incisos i) y iii), que expide el certificado de exportación temporal:
|
a) |
aplicará las medidas previstas en el artículo 16, apartado 4, letras a), b) y, en su caso, c); |
|
b) |
comunicará al puesto de inspección fronterizo la reintroducción prevista a través de Traces, cumplimentando la parte III del DVCE; |
|
c) |
presentará al operador indicado en la casilla I.7 del DVCE, contemplado en el artículo 16, apartado 1, letra b), inciso i), una nueva copia impresa del DVCE en la que figurará la parte III añadida de conformidad con la letra b) del presente apartado; |
|
d) |
anulará o retirará cualquier copia del DVCE presentada de conformidad con el artículo 16, apartado 1, letra c), o si se había producido un desplazamiento a otro Estado miembro, de conformidad con el artículo 16, apartado 2, letra c). |
3. El puesto de inspección fronterizo de entrada:
|
a) |
guardará el original del certificado sanitario a que se refiere el artículo 3, apartado 1, letra c); |
|
b) |
comunicará a través de Traces la reintroducción del caballo registrado:
|
|
c) |
pedirá a la autoridad competente del lugar de destino que verifique y, en su caso, confirme, la llegada del caballo registrado cumplimentando la casilla I.6 del DVCE a que se refiere la letra d); |
|
d) |
presentará al operador una copia impresa del nuevo DVCE en la que se habrá rellenado la casilla II.1 con una referencia al número del DVCE emitido previamente de conformidad con el artículo 16, apartado 1, letra c) o, si antes se había producido un desplazamiento a otro Estado miembro, de conformidad con el artículo 16, apartado 2, letra c), y en el cual se habrá cumplimentado la casilla II.14 en el plazo para la salida de la Unión indicado en el DVCE a que se refiere el artículo 16, apartado 1, letra b), inciso i); |
|
e) |
anulará o retirará cualquier copia del DVCE presentada al operador de conformidad con el artículo 16, apartado 1, letra c), o si se había producido un desplazamiento a otro Estado miembro, de conformidad con el artículo 16, apartado 2, letra c). |
4. Posteriormente a la reintroducción, después de su exportación temporal, de un caballo registrado admitido temporalmente de conformidad con el apartado 1, las disposiciones del artículo 16 se aplicarán durante el período restante inferior a 90 días a partir de la fecha de expedición del DVCE a que se refiere el artículo 16, apartado 1, letra b), inciso i).
Artículo 19
Conversión de la admisión temporal en admisión definitiva y muerte o pérdida de un caballo registrado
1. A petición del operador indicado en la casilla I.7 del DVCE a que hace referencia el artículo 16, apartado 1, letra b), inciso i), presentada a la autoridad competente mencionada en el artículo 16, apartado 1, letra b), incisos i) o iii), o en el artículo 16, apartado 2, letra b), los Estados miembros podrán autorizar la conversión de la admisión temporal de un caballo registrado en admisión permanente, siempre que se cumplan los siguientes requisitos:
|
a) |
de conformidad con el anexo I, estén autorizadas las importaciones de caballos registrados desde el tercer país o la parte del territorio del tercer país de que se trate; |
|
b) |
la autoridad competente del lugar de residencia temporal haya cumplido las siguientes condiciones:
|
2. La autoridad competente mencionada en el apartado 1, o un puesto de inspección fronterizo designado a tal efecto por el Estado miembro:
|
a) |
pondrá fin a la admisión temporal en Traces seleccionando «Conversión en admisión definitiva» en la parte III del DVCE presentado al operador de conformidad con el artículo 16, apartado 1, letra c), o bien, si antes se había producido un desplazamiento a otro Estado miembro, de conformidad con el artículo 16, apartado 2, letra c), o bien, si antes se había producido una reintroducción después de una exportación temporal, de conformidad con el artículo 18, apartado 3, letra c); |
|
b) |
presentará al operador, indicado en la casilla I.7 del DVCE a que se refiere el artículo 16, apartado 1, letra b), inciso i), una nueva copia impresa del DVCE a que se refiere la letra a), o un nuevo DVCE en que se habrá marcado la casilla I.21, «Para el mercado interior»; |
|
c) |
anulará o retirará cualquier copia del DVCE presentada al operador de conformidad con el artículo 16, apartado 1, letra c), o bien, si antes se había producido un desplazamiento a otro Estado miembro, de conformidad con el artículo 16, apartado 2, letra c), o bien, si antes se había producido una reintroducción después de una exportación temporal, de conformidad con el artículo 18, apartado 3, letra c); |
|
d) |
anulará o retirará el original del certificado sanitario a que se refiere el artículo 3, apartado 1, letra a). |
3. Durante el período de conversión, el operador del caballo registrado, indicado en la casilla I.7 del DVCE emitido de conformidad con el artículo 16, apartado 1, letra b), inciso i), o en el artículo 18, apartado 3, letra b), tomará las siguientes medidas:
|
a) |
velará por que un veterinario examine periódicamente al caballo registrado, y documente cada visita, buscando signos clínicos de enfermedades infecciosas; |
|
b) |
guardará un registro documental de los desplazamientos del caballo registrado y las entradas y salidas de équidos en la explotación en que se encuentra; |
|
c) |
cumplirá con los procedimientos aduaneros a que hace referencia el artículo 15 del Reglamento (UE) 2015/262; |
|
d) |
presentará, de conformidad con el artículo 15, apartado 1, del Reglamento (UE) 2015/262, una solicitud para la expedición de un documento de identificación o el registro del documento de identificación existente. |
4. En el caso de muerte o pérdida de un caballo registrado admitido temporalmente en la Unión, la autoridad competente del lugar de la muerte o la pérdida, a petición del correspondiente Estado miembro y en estrecha colaboración con un puesto de inspección fronterizo:
|
a) |
pondrá fin a la admisión temporal en Traces seleccionando «Muerte/Pérdida» en la parte III del DVCE a que se hace referencia en el artículo 16, apartado 1, letra b), inciso i), o en el artículo 18, apartado 3, letra b); |
|
b) |
anulará o retirará cualquier copia del DVCE presentada al operador de conformidad con el artículo 16, apartado 1, letra c), o bien, si antes se había producido un desplazamiento a otro Estado miembro, de conformidad con el artículo 16, apartado 2, letra c), o bien, si antes se había producido una reintroducción después de una exportación temporal, de conformidad con el artículo 18, apartado 3, letra c). |
Artículo 20
Condiciones zoosanitarias específicas relativas a la reintroducción de caballos registrados después de su exportación temporal para participar en carreras, concursos hípicos y actos culturales
1. Los Estados miembros autorizarán la reintroducción de caballos registrados si se cumplen las siguientes condiciones:
|
a) |
el caballo registrado ha permanecido fuera de la Unión Europea menos de 30 días, a menos que se disponga específicamente otra cosa en el apartado 3; |
|
b) |
el caballo registrado no ha residido ni ha transitado por tierra a través de un tercer país o parte del territorio de un tercer país que no esté asignado al mismo grupo sanitario que el tercer país o parte del territorio de un tercer país en el cual el veterinario oficial firmó el certificado sanitario de conformidad con la parte 2, sección A, del anexo II; |
|
c) |
se presenta, a petición del puesto de inspección fronterizo de entrada en la Unión, el certificado sanitario para la exportación temporal firmado por el veterinario oficial en el Estado miembro de origen, o una copia compulsada del mismo. |
2. La autoridad competente que emita el certificado de un caballo registrado para su exportación temporal a un tercer país se asegurará de que, en aplicación del artículo 2, apartado 1, de la Decisión 93/444/CEE, el caballo registrado vaya acompañado hasta el punto de salida de otro Estado miembro de un certificado sanitario conforme al anexo III de la Directiva 2009/156/CE.
3. La reintroducción, tras la exportación temporal durante más de 30 días, de caballos registrados que participan en carreras, concursos hípicos o actos culturales está sujeta a requisitos zoosanitarios específicos, que figuran en el correspondiente modelo de certificado sanitario previsto para cada caso en la sección B de la parte 2 del anexo II.
4. El operador, indicado en la casilla I.7 del DVCE, responsable del envío velará por que durante la exportación temporal el caballo registrado no haya residido ni transitado por tierra a través de un tercer país o parte del territorio de un tercer país que no esté asignado al mismo grupo sanitario que el tercer país o parte del territorio de un tercer país en el cual el veterinario oficial firmó el certificado sanitario de conformidad con la parte 2, sección A, del anexo II.
Artículo 21
Condiciones zoosanitarias específicas relativas a la importación de équidos de abasto
El operador, indicado en la casilla I.7 del DVCE mencionado en el artículo 16, apartado 1, letra b), inciso i), de un envío de équidos de abasto velará por que, tras los controles efectuados en el puesto de inspección fronterizo de entrada en la Unión, los animales:
|
a) |
sean conducidos directamente, sin demora y sin entrar en contacto con équidos de una situación sanitaria distinta, al matadero de destino, donde serán sacrificados antes de transcurridas 72 horas desde su llegada, o |
|
b) |
pasen por un único mercado o centro de concentración autorizado a que hace referencia el artículo 7, apartado 1, de la Directiva 2009/156/CE, indicado en el certificado sanitario a que hace referencia el artículo 3, apartado 1, letra e), del presente Reglamento, desde el que, con arreglo a normas nacionales que garanticen la trazabilidad, serán conducidos al matadero para ser sacrificados lo antes posible, antes de transcurridos cinco días laborables desde su llegada a la Unión, sin entrar en contacto con équidos de una situación sanitaria distinta. |
SECCIÓN 8
Disposiciones transitorias y finales
Artículo 22
Disposiciones transitorias
Durante un período transitorio que finalizará el 31 de diciembre de 2018, los Estados miembros autorizarán la entrada en la Unión de partidas de équidos y de esperma, óvulos y embriones de équidos acompañados de los certificados sanitarios establecidos de conformidad con los modelos de certificado sanitario aplicables antes de la fecha de aplicación del presente Reglamento y especificados en el párrafo segundo del artículo 24.
Artículo 23
Derogaciones
Quedan derogadas las Decisiones 92/260/CEE, 93/195/CEE, 93/196/CEE, 93/197/CEE, 94/699/CE, 95/329/CE, 2003/13/CE, 2004/177/CE, 2004/211/CE, 2010/57/CE y 2010/471/UE.
Toda referencia a dichas Decisiones se entenderá hecha al presente Reglamento.
Artículo 24
Entrada en vigor y aplicabilidad
El presente Reglamento entrará en vigor a los veinte días de su publicación en el Diario Oficial de la Unión Europea.
Será aplicable a partir del 1 de octubre de 2018.
No obstante, el apartado 1, letra b), inciso iii), el apartado 2, letras b), c) y d), el apartado 3, el apartado 4, letras a) y b), y el apartado 5 del artículo 16, así como el apartado 1, letra d), del artículo 17, serán aplicables a partir del 14 de diciembre de 2019.
El presente Reglamento será obligatorio en todos sus elementos y directamente aplicable en cada Estado miembro.
Hecho en Bruselas, el 12 de abril de 2018.
Por la Comisión
El Presidente
Jean-Claude JUNCKER
(1) DO L 268 de 24.9.1991, p. 56.
(2) DO L 268 de 14.9.1992, p. 54.
(3) DO L 192 de 23.7.2010, p. 1.
(4) Decisión 2004/211/CE de la Comisión, de 6 de enero de 2004, por la que se establece la lista de terceros países y partes de su territorio a partir de los cuales los Estados miembros autorizan la importación de équidos vivos y esperma, óvulos y embriones de la especie equina y por la que se modifican las Decisiones 93/195/CEE y 94/63/CE (DO L 73 de 11.3.2004, p. 1).
(5) Directiva 2008/73/CE del Consejo, de 15 de julio de 2008, por la que se simplifican los procedimientos para confeccionar listas y publicar información en los ámbitos veterinario y zootécnico y por la que se modifican las Directivas 64/432/CEE, 77/504/CEE, 88/407/CEE, 88/661/CEE, 89/361/CEE, 89/556/CEE, 90/426/CEE, 90/427/CEE, 90/428/CEE, 90/429/CEE, 90/539/CEE, 91/68/CEE, 91/496/CEE, 92/35/CEE, 92/65/CEE, 92/66/CEE, 92/119/CEE, 94/28/CE, 2000/75/CE, la Decisión 2000/258/CE y las Directivas 2001/89/CE, 2002/60/CE y 2005/94/CE (DO L 219 de 14.8.2008, p. 40).
(6) http://ec.europa.eu/food/animals/semen/equine_en
(7) Reglamento (UE) n.o 176/2010 de la Comisión, de 2 de marzo de 2010, por el que se modifica el anexo D de la Directiva 92/65/CEE del Consejo en lo que respecta a los centros de recogida y almacenamiento de esperma, los equipos de recogida y producción de embriones y las condiciones aplicables a los animales donantes de las especies equina, ovina y caprina y a la manipulación de esperma, óvulos y embriones de dichas especies (DO L 52 de 3.3.2010, p. 14).
(8) Decisión 2010/470/UE de la Comisión, de 26 de agosto de 2010, por la que se establecen modelos de certificados sanitarios para el comercio dentro de la Unión de esperma, óvulos y embriones de animales de las especies equina, ovina y caprina, y de óvulos y embriones de animales de la especie porcina (DO L 228 de 31.8.2010, p. 15).
(9) Decisión 2002/309/CE, Euratom del Consejo y de la Comisión respecto al Acuerdo de cooperación científica y tecnológica de 4 de abril de 2002 sobre la celebración de siete Acuerdos con la Confederación Suiza (DO L 114 de 30.4.2002, p. 1).
(10) DO L 71 de 18.3.1999, p. 3.
(11) Decisión 1999/201/CE del Consejo, de 14 de diciembre de 1998, relativa a la celebración del Acuerdo entre la Comunidad Europea y el Gobierno de Canadá sobre medidas sanitarias para proteger la salud pública y la sanidad animal en el comercio de animales vivos y de productos de origen animal (DO L 71 de 18.3.1999, p. 1).
(12) DO L 57 de 26.2.1997, p. 5.
(13) Decisión 97/132/CE del Consejo, de 17 de diciembre de 1996, relativa a la conclusión del Acuerdo entre la Comunidad Europea y Nueva Zelanda sobre medidas sanitarias aplicables al comercio de animales vivos y productos animales (DO L 57 de 26.2.1997, p. 4).
(14) Reglamento (CE) n.o 180/2008 de la Comisión, de 28 de febrero de 2008, relativo al laboratorio comunitario de referencia para enfermedades de los équidos distintas de la peste equina africana y por el que se modifica el anexo VII del Reglamento (CE) n.o 882/2004 del Parlamento Europeo y del Consejo (DO L 56 de 29.2.2008, p. 4).
(15) Decisión 97/794/CE de la Comisión, de 12 de noviembre de 1997, por la que se establecen las disposiciones de aplicación de la Directiva 91/496/CEE del Consejo en lo referente a los controles veterinarios de los animales vivos que vayan a importarse de terceros países (DO L 323 de 26.11.1997, p. 31).
(16) Informe del Comité veterinario científico sobre la arteritis viral equina, 12 de diciembre de 1994, VI/4994/94, Rev. 4.
(17) Decisión 95/329/CE de la Comisión, de 25 de julio de 1995, por la que se fijan las categorías de équidos machos a las que se aplica el requisito establecido en el inciso ii) de la letra b) del artículo 15 de la Directiva 90/426/CEE del Consejo en relación con la arteritis viral (DO L 191 de 12.8.1995, p. 36).
(18) http://www.oie.int/es/normas-internacionales/codigo-terrestre/acceso-en-linea/?htmfile=chapitre_eav.htm
(19) Decisión 2003/24/CE de la Comisión, de 30 de diciembre de 2002, sobre la creación de un sistema informático veterinario integrado (DO L 8 de 14.1.2003, p. 44).
(20) Decisión 2004/292/CE de la Comisión, de 30 de marzo de 2004, relativa a la aplicación del sistema Traces y por la que se modifica la Decisión 92/486/CEE (DO L 94 de 31.3.2004, p. 63).
(21) Decisión 2009/821/CE de la Comisión, de 28 de septiembre de 2009, por la que se establece una lista de puestos de inspección fronterizos autorizados y se disponen determinadas normas sobre las inspecciones efectuadas por los expertos veterinarios de la Comisión, así como las unidades veterinarias de Traces (DO L 296 de 12.11.2009, p. 1).
(22) Decisión 2007/240/CE de la Comisión, de 16 de abril de 2007, por la que se establecen nuevos certificados veterinarios para la introducción en la Comunidad de animales vivos, esperma, embriones, óvulos y productos de origen animal en el marco de las Decisiones 79/542/CEE, 92/260/CEE, 93/195/CEE, 93/196/CEE, 93/197/CEE, 95/328/CE, 96/333/CE, 96/539/CE, 96/540/CE, 2000/572/CE, 2000/585/CE, 2000/666/CE, 2002/613/CE, 2003/56/CE, 2003/779/CE, 2003/804/CE, 2003/858/CE, 2003/863/CE, 2003/881/CE, 2004/407/CE, 2004/438/CE, 2004/595/CE, 2004/639/CE y 2006/168/CE (DO L 104 de 21.4.2007, p. 37).
(23) Reglamento (CE) n.o 282/2004 de la Comisión, de 18 de febrero de 2004, relativo al establecimiento de un documento para la declaración y el control veterinario de los animales procedentes de terceros países e introducidos en la Comunidad (DO L 49 de 19.2.2004, p. 11).
(24) Decisión 93/444/CEE de la Comisión, de 2 de julio de 1993, relativa a las normas aplicables a los intercambios intracomunitarios de determinados animales vivos y productos destinados a ser exportados a terceros países (DO L 208 de 19.8.1993, p. 34).
(25) Decisión 92/260/CEE de la Comisión, de 10 de abril de 1992, relativa a las condiciones y a los certificados sanitarios necesarios para la admisión temporal de caballos registrados (DO L 130 de 15.5.1992, p. 67).
(26) Decisión 93/195/CEE de la Comisión, de 2 de febrero de 1993, relativa a las condiciones sanitarias y a la certificación veterinaria necesarias para la reintroducción de caballos registrados para participar en carreras, concursos hípicos y actos culturales, después de su exportación temporal (DO L 86 de 6.4.1993, p. 1).
(27) Decisión 93/196/CEE de la Comisión, de 5 de febrero de 1993, relativa a las condiciones sanitarias y a la certificación veterinaria necesarias para la importación de équidos de abasto (DO L 86 de 6.4.1993, p. 7).
(28) Decisión 93/197/CEE de la Comisión, de 5 de febrero de 1993, relativa a las condiciones sanitarias y a la certificación veterinaria necesarias para la importación de équidos registrados y équidos de cría y producción (DO L 86 de 6.4.1993, p. 16).
(29) Decisión 94/699/CE de la Comisión, de 19 de octubre de 1994, por la que se reduce la frecuencia de los controles de identidad y físicos realizados con motivo de la admisión temporal de determinados équidos procedentes de Suecia, Noruega y Finlandia y por la que se deroga la Decisión 93/321/CEE (DO L 280 de 29.10.1994, p. 88).
(30) Decisión 2003/13/CE de la Comisión, de 10 de enero de 2003, sobre la admisión temporal de caballos que participen en el Concurso preolímpico de prueba de 2003 en Grecia (DO L 7 de 11.1.2003, p. 86).
(31) Decisión 2004/177/CE de la Comisión, de 20 de febrero de 2004, sobre la introducción temporal de caballos registrados para participar en los Juegos Olímpicos o los Juegos Paralímpicos de 2004 en Grecia (DO L 55 de 24.2.2004, p. 64).
(32) Decisión 2010/57/UE de la Comisión, de 3 de febrero de 2010, por la que se establecen garantías sanitarias para el tránsito de los équidos transportados a través de los territorios enumerados en el anexo I de la Directiva 97/78/CE del Consejo (DO L 32 de 4.2.2010, p. 9).
(33) Decisión 2010/471/UE de la Comisión, de 26 de agosto de 2010, sobre la importación en la Unión de esperma, óvulos y embriones de animales de la especie equina en lo que se refiere a las listas de centros de recogida y almacenamiento de esperma y de equipos de recogida y producción de embriones y a los requisitos de certificación (DO L 228 de 31.8.2010, p. 52).
(34) Reglamento de Ejecución (UE) 2015/262 de la Comisión, de 17 de febrero de 2015, que establece normas con arreglo a las Directivas 90/427/CEE y 2009/156/CE del Consejo por lo que respecta a los métodos de identificación de los équidos (Reglamento del pasaporte equino) (DO L 59 de 3.3.2015, p. 1).
(35) Directiva 90/427/CEE del Consejo, de 26 de junio de 1990, relativa a las condiciones zootécnicas y genealógicas que regulan los intercambios intracomunitarios de équidos (DO L 224 de 18.8.1990, p. 55).
(36) Directiva 97/78/CE del Consejo, de 18 de diciembre de 1997, por la que se establecen los principios relativos a la organización de controles veterinarios de los productos que se introduzcan en la Comunidad procedentes de terceros países (DO L 24 de 30.1.1998, p. 9).
(37) https://ec.europa.eu/food/sites/food/files/animals/docs/ad_control-measures_bt_guidance_vpe_7068_2012.pdf
(38) Reglamento (CE) n.o 882/2004 del Parlamento Europeo y del Consejo, de 29 de abril de 2004, sobre los controles oficiales efectuados para garantizar la verificación del cumplimiento de la legislación en materia de piensos y alimentos y la normativa sobre salud animal y bienestar de los animales (DO L 165 de 30.4.2004, p. 1).
(39) Directiva 92/35/CEE del Consejo, de 29 de abril de 1992, por la que se establecen las normas de control y las medidas de lucha contra la peste equina (DO L 157 de 10.6.1992, p. 19).
ANEXO I
LISTA DE TERCEROS PAÍSES (1) Y PARTES DE SU TERRITORIO (2) A PARTIR DE LOS CUALES SE AUTORIZA LA ENTRADA EN LA UNIÓN DE PARTIDAS DE ÉQUIDOS Y DE ESPERMA, ÓVULOS Y EMBRIONES DE ÉQUIDOS
|
Código ISO |
Tercer país |
Código de la parte del territorio del tercer país |
Descripción de la parte del territorio del tercer país |
SG |
TA |
Reintroducción |
Importaciones |
Importaciones |
Tránsito |
Condiciones específicas |
|||||
|
RH |
RH |
RH |
ES |
RE + EBP |
SEMEN |
O/E |
Équidos |
|
|||||||
|
RH |
RE |
EBP |
|
|
|
||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
AE |
Emiratos Árabes Unidos |
AE-0 |
Todo el país |
E |
X |
X |
X |
— |
— |
X |
— |
— |
X |
X |
|
|
AR |
Argentina |
AR-0 |
Todo el país |
D |
X |
X |
X |
X |
X |
X |
X |
X |
X |
X |
|
|
AU |
Australia |
AU-0 |
Todo el país |
A |
X |
X |
X |
X |
X |
X |
X |
X |
X |
X |
|
|
BB |
Barbados |
BB-0 |
Todo el país |
D |
X |
X |
X |
— |
— |
X |
— |
— |
— |
X |
|
|
BH |
Baréin |
BH-0 |
Todo el país |
E |
X |
X |
X |
— |
— |
— |
— |
— |
— |
X |
|
|
BM |
Bermudas |
BM-0 |
Todo el país |
D |
X |
X |
X |
— |
— |
X |
— |
— |
— |
X |
|
|
BO |
Bolivia |
BO-0 |
Todo el país |
D |
X |
X |
X |
— |
— |
X |
— |
— |
— |
X |
|
|
BR |
Brasil |
BR-0 |
Todo el país |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
BR-1 |
Los Estados de: Rio Grande do Sul, Santa Catarina, Mato Grosso do Sul, Distrito Federal y Río de Janeiro |
D |
X |
X |
X |
— |
— |
X |
— |
— |
— |
X |
|
||
|
BY |
Bielorrusia |
BY-0 |
Todo el país |
B |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
|
CA |
Canadá |
CA-0 |
Todo el país |
C |
X |
X |
X |
X |
X |
X |
X |
X |
X |
X |
|
|
CH |
Suiza (1) |
CH-0 |
Todo el país |
A |
X |
X |
X |
X |
X |
X |
X |
X |
X |
X |
|
|
CL |
Chile |
CL-0 |
Todo el país |
D |
X |
X |
X |
X |
X |
— |
— |
— |
— |
X |
|
|
CN |
China |
CN-0 |
Todo el país |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
CN-1 |
La zona libre de enfermedades equinas de la ciudad de Conghua, municipio de Guangzhou, provincia de Guandong, incluido el corredor vial de bioseguridad desde y hacia los aeropuertos de Guangzhou y Hong Kong (véase el cuadro 1 para más información) |
G |
X |
X |
X |
— |
— |
— |
— |
— |
— |
X |
|
||
|
CN-2 |
El lugar de celebración del Global Champions Tour, en el aparcamiento n.o 15 de la Expo 2010, y el corredor hasta el Aeropuerto Internacional Shanghai Pudong, en la zona norte de Pudong New y la zona este del distrito de Minhang, en el área metropolitana de Shanghai (véase el cuadro 1 para más información) |
G |
— |
X |
— |
— |
— |
— |
— |
— |
— |
|
Solo si se certifica con arreglo al capítulo 1 de la sección B de la parte 2 del anexo II |
||
|
CR |
Costa Rica |
CR-0 |
Todo el país |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
CR-1 |
Área metropolitana de San José |
D |
— |
X |
— |
— |
— |
— |
— |
— |
— |
|
|
||
|
CU |
Cuba |
CU-0 |
Todo el país |
D |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
DZ |
Argelia |
DZ-0 |
Todo el país |
E |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
|
EG |
Egipto |
EG-0 |
Todo el país |
|
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
EG-1 |
La zona libre de enfermedades equinas establecida en el Hospital Veterinario de las fuerzas Armadas Egipcias situado en la carretera El-Nasr, al otro lado del Club Al Ahly, y el tramo de carretera hasta el Aeropuerto Internacional de El Cairo (véase el cuadro 2 para más información) |
E |
X |
— |
X |
— |
— |
— |
— |
— |
— |
X |
|
||
|
FK |
Islas Malvinas |
FK-0 |
Todo el país |
A |
X |
X |
X |
— |
X |
|
|
|
|
X |
|
|
GL |
Groenlandia |
GL-0 |
Todo el país |
A |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
|
HK |
Hong Kong |
HK-0 |
Todo el país |
G |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
IL |
Israel (3) |
IL-0 |
Todo el país |
E |
X |
X |
X |
X |
X |
X |
X |
|
|
X |
|
|
IS |
Islandia (5) |
IS-0 |
Todo el país |
A |
X |
X |
X |
X |
X |
X |
X |
X |
|
X |
|
|
JM |
Jamaica |
JM-0 |
Todo el país |
D |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
JO |
Jordania |
JO-0 |
Todo el país |
E |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
JP |
Japón |
JP-0 |
Todo el país |
G |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
KG |
Kirguistán |
KG-0 |
Todo el país |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
KG-1 |
Región de Issyk-Kul |
B |
— |
— |
X |
— |
— |
|
— |
— |
— |
X |
|
||
|
KR |
República de Corea |
KR-0 |
Todo el país |
G |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
KW |
Kuwait |
KW-0 |
Todo el país |
E |
X |
X |
X |
— |
— |
— |
— |
— |
— |
X |
|
|
LB |
Líbano |
LB-0 |
Todo el país |
E |
X |
X |
X |
— |
— |
— |
— |
— |
— |
X |
|
|
MA |
Marruecos |
MA-0 |
Todo el país |
E |
X |
X |
X |
X |
X |
X |
X |
X |
|
X |
|
|
ME |
Montenegro |
ME-0 |
Todo el país |
B |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
|
MK |
ARYM (4) |
MK-0 |
Todo el país |
B |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
|
MO |
Macao |
MO-0 |
Todo el país |
G |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
MY |
Malasia |
MY-0 |
Todo el país |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
MY-1 |
Península |
G |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
||
|
MU |
Mauricio |
MU-0 |
Todo el país |
E |
— |
— |
X |
— |
— |
— |
— |
— |
— |
X |
|
|
MX |
México |
MX-0 |
Todo el país |
C |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
|
|
MX-1 |
Área metropolitana de la Ciudad de México |
C |
|
X |
|
|
|
|
|
|
|
|
Solo si se certifica con arreglo al capítulo 1 de la sección B de la parte 2 del anexo II |
|
NO |
Noruega (5) |
NO-1 |
Todo el país |
A |
X |
X |
X |
X |
X |
X |
X |
X |
X |
X |
|
|
NZ |
Nueva Zelanda |
NZ-0 |
Todo el país |
A |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
|
OM |
Omán |
OM-0 |
Todo el país |
E |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
PE |
Perú |
PE-0 |
Todo el país |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
PE-1 |
Región de Lima |
D |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
||
|
PM |
San Pedro y Miquelón |
PM-0 |
Todo el país |
A |
— |
— |
X |
— |
X |
|
|
|
|
X |
|
|
PY |
Paraguay |
PY-0 |
Todo el país |
D |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
|
QA |
Qatar |
QA-0 |
Todo el país |
E |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
RS |
Serbia (6) |
RS-0 |
Todo el país |
B |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
|
RU |
Rusia |
RU-0 |
Todo el país |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
RU-1 |
Provincias de Kaliningrad, Arkhangelsk, Vologda, Murmansk, Leningrad, Novgorod, Pskov, Briansk, Vladimir, Ivanovo, Tver, Kaluga, Kostroma, Moskva, Orjol, Riasan, Smolensk, Tula, Jaroslavl, Nijni Novgorod, Kirov, Belgorod, Voronesh, Kursk, Lipezk, Tambov, Astrahan, Volgograd, Penza, Saratov, Uljanovsk, Rostov, Orenburg, Perm y Kurgan |
B |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
||
|
RU-2 |
Regiones de Stavropol y Krasnodar |
B |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
||
|
RU-3 |
Repúblicas de Karelia, Marij-El, Mordovia, Chuvachia, Kalmykia, Tatarstan, Dagestan, Kabardino-Balkaria, Severnaya Osetia, Ingushetia y Karachaevo-Cherkesia |
B |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
||
|
SA |
Arabia Saudí |
SA-0 |
Todo el país |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
SA-1 |
Todo el país, excepto SA-2 |
E |
X |
X |
X |
— |
— |
X |
— |
— |
— |
X |
|
||
|
SA-2 |
Zonas de protección y de vigilancia de las provincias de Jizan, Asir y Najran descritas en el cuadro 3 |
— |
— |
— |
— |
|
|
— |
|
|
|
|
|
||
|
SG |
Singapur |
SG-0 |
Todo el país |
G |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
TH |
Tailandia |
TH-0 |
Todo el país |
G |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
TN |
Túnez |
TN-0 |
Todo el país |
E |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
|
TR |
Turquía |
TR-0 |
Todo el país |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
TR-1 |
Provincias de Ankara, Edirne, Estambul, Izmir, Kirklareli y Tekirdag |
E |
— |
— |
— |
— |
— |
|
— |
— |
— |
— |
|
||
|
UA |
Ucrania |
UA-0 |
Todo el país |
B |
X |
X |
X |
X |
X |
X |
X |
X |
|
X |
|
|
US |
Estados Unidos de América |
US-0 |
Todo el país |
C |
X |
X |
X |
X |
X |
X |
X |
X |
X |
X |
|
|
UY |
Uruguay |
UY-0 |
Todo el país |
D |
X |
X |
X |
X |
X |
X |
X |
X |
|
X |
|
|
ZA |
Sudáfrica |
ZA-0 |
Todo el país |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
ZA-1 |
Área metropolitana de Ciudad del Cabo (véase el cuadro 4 para más información) |
F |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
Decisión 2008/698/CE de la Comisión |
||
LEYENDA DEL ANEXO I:
|
Animal o producto |
Categorías o condiciones |
|
RH |
Caballos registrados, según se definen en el artículo 2, letra c), del presente Reglamento. |
|
ES |
Équidos de abasto, según se definen en el artículo 2, letra d), de la Directiva 2009/156/CE. |
|
RE |
Équidos registrados, según se definen en el artículo 2, letra c), de la Directiva 2009/156/CE. |
|
EBP |
Équidos de crianza y de renta, según se definen en el artículo 2, letra e), de la Directiva 2009/156/CE. |
|
SEMEN |
Esperma de la especie equina, recogido de acuerdo con el artículo 17, apartado 2, letra b), inciso ii), de la Directiva 92/65/CEE. |
|
O/E |
Óvulos y embriones de la especie equina, recogidos o producidos de acuerdo con el artículo 17, apartado 2, letra b), inciso ii), de la Directiva 92/65/CEE. |
|
Columnas |
Información o descripción de la mercancía |
Certificado sanitario requerido |
|
1-4 |
Descripción del territorio |
NA |
|
5 |
Grupo sanitario |
NA |
|
6 |
Admisión temporal de caballos registrados |
Anexo II, parte 1, sección A |
|
7 |
Reintroducción de caballos registrados después de su exportación temporal para participar en carreras, concursos hípicos y actos culturales |
Anexo II, parte 2, sección A Anexo II, parte 2, sección B, capítulo 1 Anexo II, parte 2, sección B, capítulo 2 |
|
8 |
Importaciones de caballos registrados |
Anexo II, parte 3, sección A |
|
9 |
Importaciones de équidos de abasto |
Anexo II, parte 3, sección B |
|
10 |
Importaciones de équidos registrados y de équidos de crianza y de renta; |
Anexo II, parte 3, sección A |
|
11 |
Importaciones de esperma recogido de caballos registrados |
Anexo III, parte 1, sección A Anexo III, parte 1, sección B Anexo III, parte 1, sección C Anexo III, parte 1, sección D |
|
12 |
Importaciones de esperma recogido de équidos registrados |
Anexo III, parte 1, sección A Anexo III, parte 1, sección B Anexo III, parte 1, sección C Anexo III, parte 1, sección D |
|
13 |
Importaciones de esperma recogido de équidos de crianza y de renta |
Anexo III, parte 1, sección A Anexo III, parte 1, sección B Anexo III, parte 1, sección C Anexo III, parte 1, sección D |
|
14 |
Importación de óvulos y embriones de la especie equina |
Anexo III, parte 2, sección A Anexo III, parte 2, sección B |
|
15 |
Équidos en tránsito |
Anexo II, parte 1, sección B |
|
16 |
Referencia a las condiciones específicas/garantías adicionales |
NA |
Casillas
|
X |
Entrada autorizada |
|
— |
Entrada no autorizada |
Grupos sanitarios
|
Grupo sanitario |
Garantías zoosanitarias específicas requeridas para la entrada de équidos en la Unión |
|
A |
anemia infecciosa equina, arteritis viral equina |
|
B |
anemia infecciosa equina, arteritis viral equina, muermo, durina |
|
C |
anemia infecciosa equina, arteritis viral equina, encefalomielitis equina (del este y del oeste), estomatitis vesicular |
|
D |
anemia infecciosa equina, arteritis viral equina, muermo, durina, encefalomielitis equina (del este y del oeste), encefalomielitis equina venezolana, estomatitis vesicular |
|
E |
anemia infecciosa equina, arteritis viral equina, muermo, durina, peste equina |
|
F |
anemia infecciosa equina, durina, peste equina |
|
G |
anemia infecciosa equina, arteritis viral equina, muermo, durina, encefalitis japonesa |
|
CUADRO 1 |
||||||||||||||||||||||||||||||||||||
|
CN |
China |
CN-1 |
La zona específica indemne de enfermedades equinas de la provincia de Guangdong con la delimitación siguiente:
|
|||||||||||||||||||||||||||||||||
|
CN |
China |
CN-2 |
Delimitación del área metropolitana de Shanghai:
|
|||||||||||||||||||||||||||||||||
|
CUADRO 2 |
|||||||
|
EG |
Egipto |
EG-1 |
La zona indemne de enfermedades equinas, de una superficie de aproximadamente 0,1 km2, establecida alrededor del Hospital Veterinario de las Fuerzas Armadas Egipcias en la carretera El-Nasr, al otro lado del Club Al Ahly, en la parte este de las afueras de El Cairo (en el punto 30° 04′ 19,6″ N 31° 21′ 16,5″ E) y el tramo de 10 km por la carretera El-Nasr y la carretera que conduce al Aeropuerto Internacional de El Cairo.
|
||||
|
CUADRO 3 |
|||||||||||||||||||||
|
SA |
Arabia Saudí |
SA-1 |
Estaciones de cuarentena autorizadas:
|
||||||||||||||||||
|
|
|
SA-2 |
Delimitación de las zonas de protección y vigilancia establecidas conforme al artículo 5, apartado 2, segundo párrafo, letras a) y b), de la Directiva 2009/156/CE:
|
||||||||||||||||||
|
CUADRO 4 |
|||||||||||||||||
|
ZA |
Sudáfrica |
ZA-1 |
Estaciones de cuarentena autorizadas:
|
||||||||||||||
(1) Sin perjuicio de los requisitos específicos de certificación previstos en la Decisión 2002/309/CE, Euratom del Consejo y de la Comisión.
(2) Donde se aplica oficialmente la regionalización de acuerdo con el artículo 13, apartado 2, letra a), de la Directiva 2009/156/CE.
(3) En lo sucesivo, el Estado de Israel, excluidos los territorios bajo administración israelí desde junio de 1967, a saber, los Altos del Golán, la Franja de Gaza, Jerusalén Oriental y el resto de Cisjordania.
(4) antigua República Yugoslava de Macedonia. La denominación definitiva de este país se decidirá cuando finalicen las negociaciones al respecto en las Naciones Unidas.
(5) Sin perjuicio de los requisitos específicos de certificación previstos en el artículo 17 del Acuerdo sobre el Espacio Económico Europeo (DO L 1 de 3.1.1994, p. 3).
(6) Excluido Kosovo, según el estatuto definido en la Resolución n.o 1244 del Consejo de Seguridad de las Naciones Unidas, de 10 de junio de 1999.
ANEXO II
MODELOS DE CERTIFICADOS SANITARIOS Y DE DECLARACIONES PARA LA ENTRADA DE ÉQUIDOS VIVOS EN LA UNIÓN
PARTE 1
Admisión temporal y tránsito
Sección A
Modelo de certificado sanitario y modelo de declaración para la admisión temporal de caballos registrados en la Unión durante un período inferior a 90 días
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
Sección B
Modelo de certificado sanitario y modelo de declaración para el tránsito de équidos vivos por la Unión desde un tercer país o parte del territorio de un tercer país hasta otro tercer país u otra parte del territorio del mismo tercer país
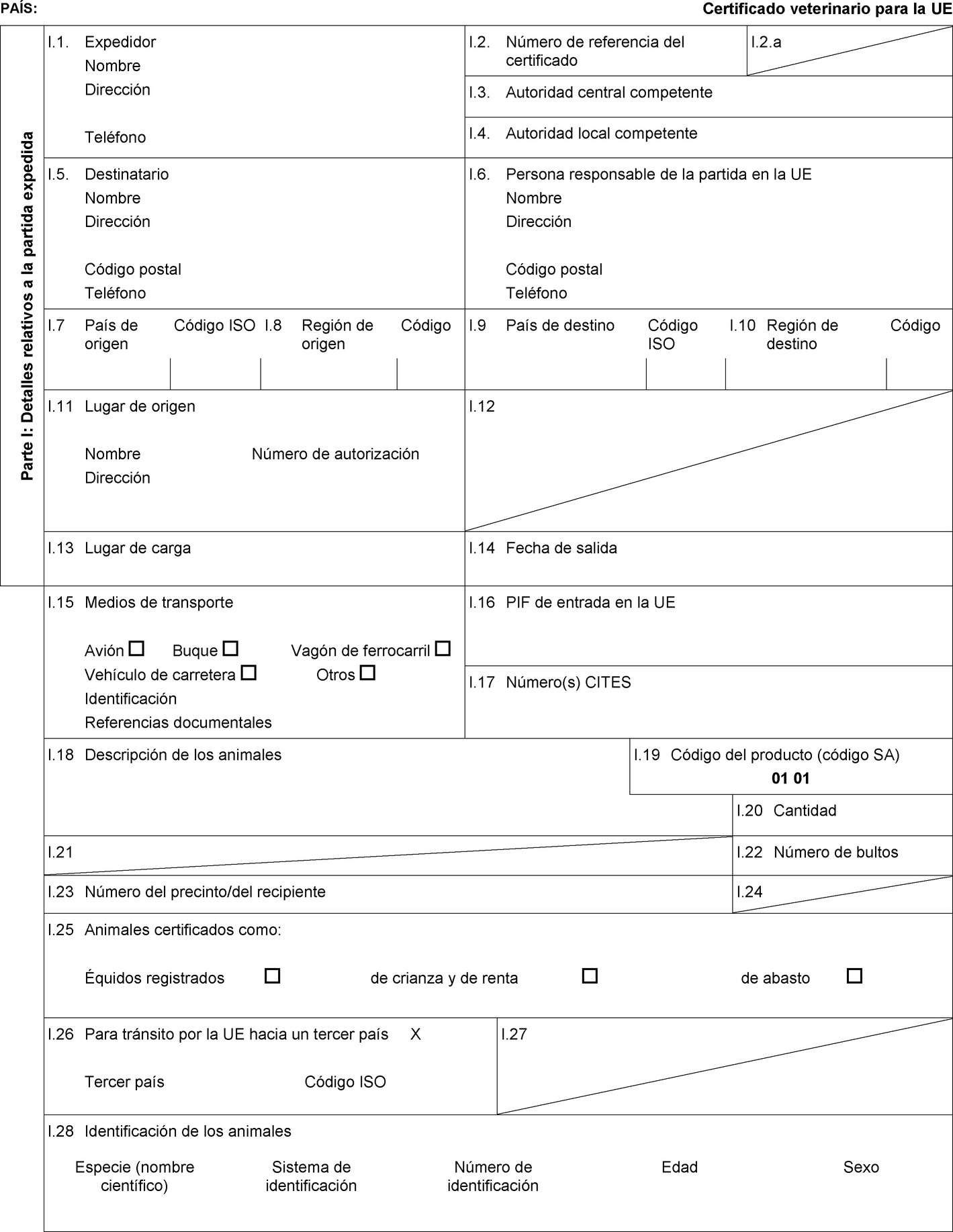 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
PARTE 2
Reintroducción después de la exportación temporal
Sección A
Modelo de certificado sanitario y modelo de declaración para la reintroducción en la Unión de caballos registrados para participar en carreras, concursos hípicos y actos culturales, después de su exportación temporal durante un período inferior a 30 días
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
Sección B
Modelos de certificados sanitarios y de declaraciones para la reintroducción en la Unión de caballos registrados exportados temporalmente para participar en carreras o concursos hípicos específicos
Modelo de certificado sanitario y modelo de declaración para la reintroducción en la Unión de caballos registrados para participar en competiciones, después de su exportación temporal durante un período inferior a 90 días para participar en eventos hípicos bajo los auspicios de la Federación Ecuestre Internacional (FEI)
(Pruebas preparatorias para los Juegos Olímpicos, los Juegos Paralímpicos, los Juegos Ecuestres Mundiales, los Juegos Ecuestres Asiáticos, los Juegos Ecuestres Americanos o la Copa Mundial de Resistencia en los Emiratos Árabes Unidos)
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
Modelo de certificado sanitario y modelo de declaración para la reintroducción en la Unión, después de su exportación temporal durante un período inferior a 90 días, de caballos registrados para participar en concursos hípicos específicos en Australia, Canadá, los Emiratos Árabes Unidos, los Estados Unidos, Hong Kong, Japón, Singapur o Qatar
(certámenes internacionales por grupo y categoría, Copa de Japón, Copa de Melbourne, Copa Mundial de Hípica de Dubái o Carreras internacionales de Hong Kong)
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
PARTE 3
Importaciones
Sección A
Modelo de certificado sanitario y modelo de declaración para la importación en la Unión de un caballo registrado, un équido registrado o un équido de crianza y de renta
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
Sección B
Modelo de certificado sanitario y modelo de declaración para la importación en la Unión de partidas de équidos domésticos de abasto
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
PARTE 4
Notas explicativas del certificado
 Texto de la imagen
Texto de la imagen
ANEXO III
MODELOS DE CERTIFICADOS SANITARIOS PARA LA ENTRADA EN LA UNIÓN DE ESPERMA, ÓVULOS Y EMBRIONES DE ÉQUIDOS
PARTE 1
Modelo de certificado sanitario para la importación de esperma
Sección A
MODELO 1. Modelo de certificado sanitario para la importación de partidas de esperma de équidos recogido después del 30 de septiembre de 2014 de conformidad con la Directiva 92/65/CEE y expedido desde su centro de recogida autorizado de origen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
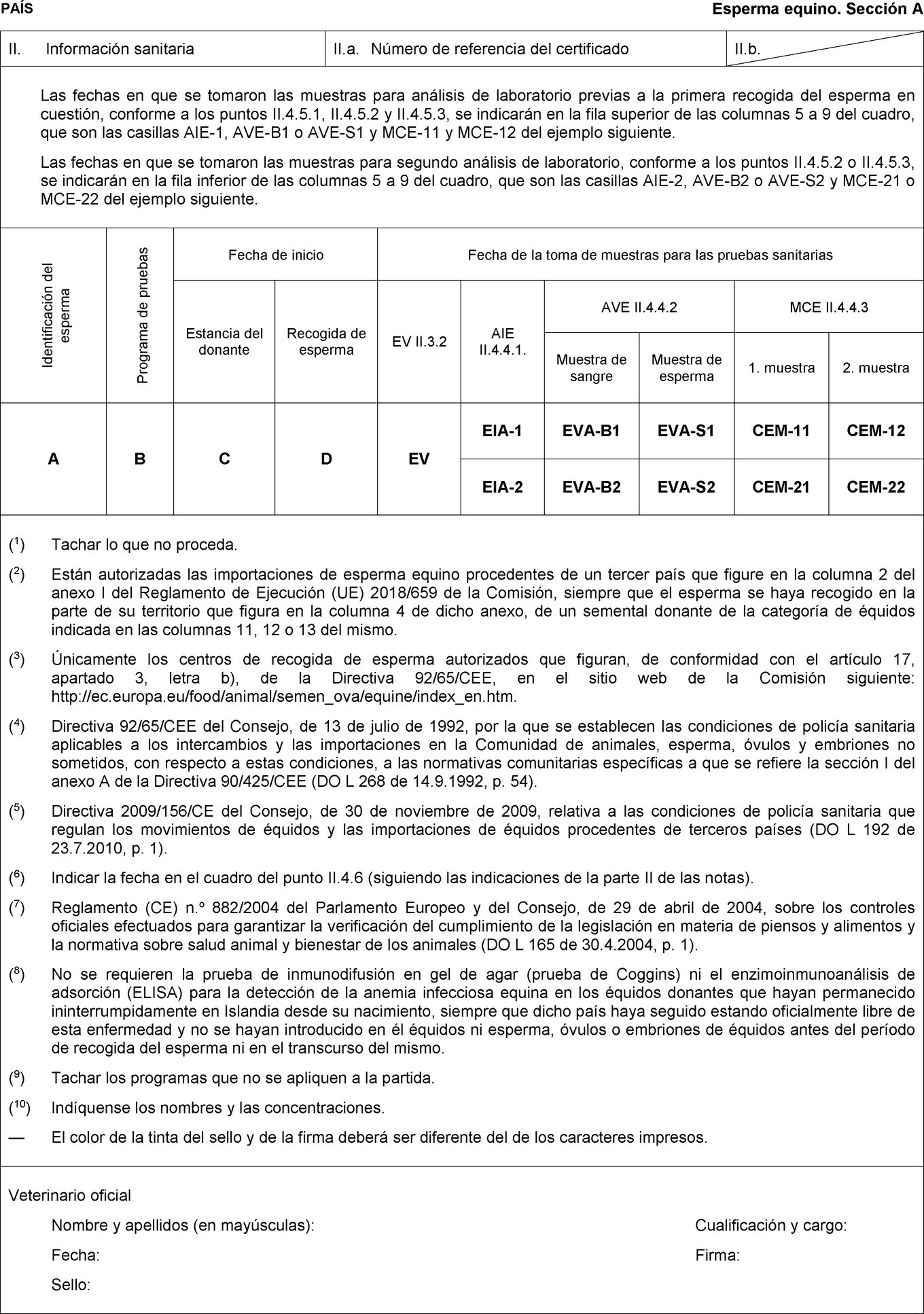 Texto de la imagen
Texto de la imagen
Sección B
MODELO 2. Modelo de certificado sanitario para la importación de partidas de existencias de esperma de équidos recogido, transformado o almacenado de conformidad con la Directiva 92/65/CEE entre el 31 de agosto de 2010 y el 1 de octubre de 2014, ambos exclusive, y expedido después del 31 de agosto de 2010 desde su centro de recogida autorizado de origen
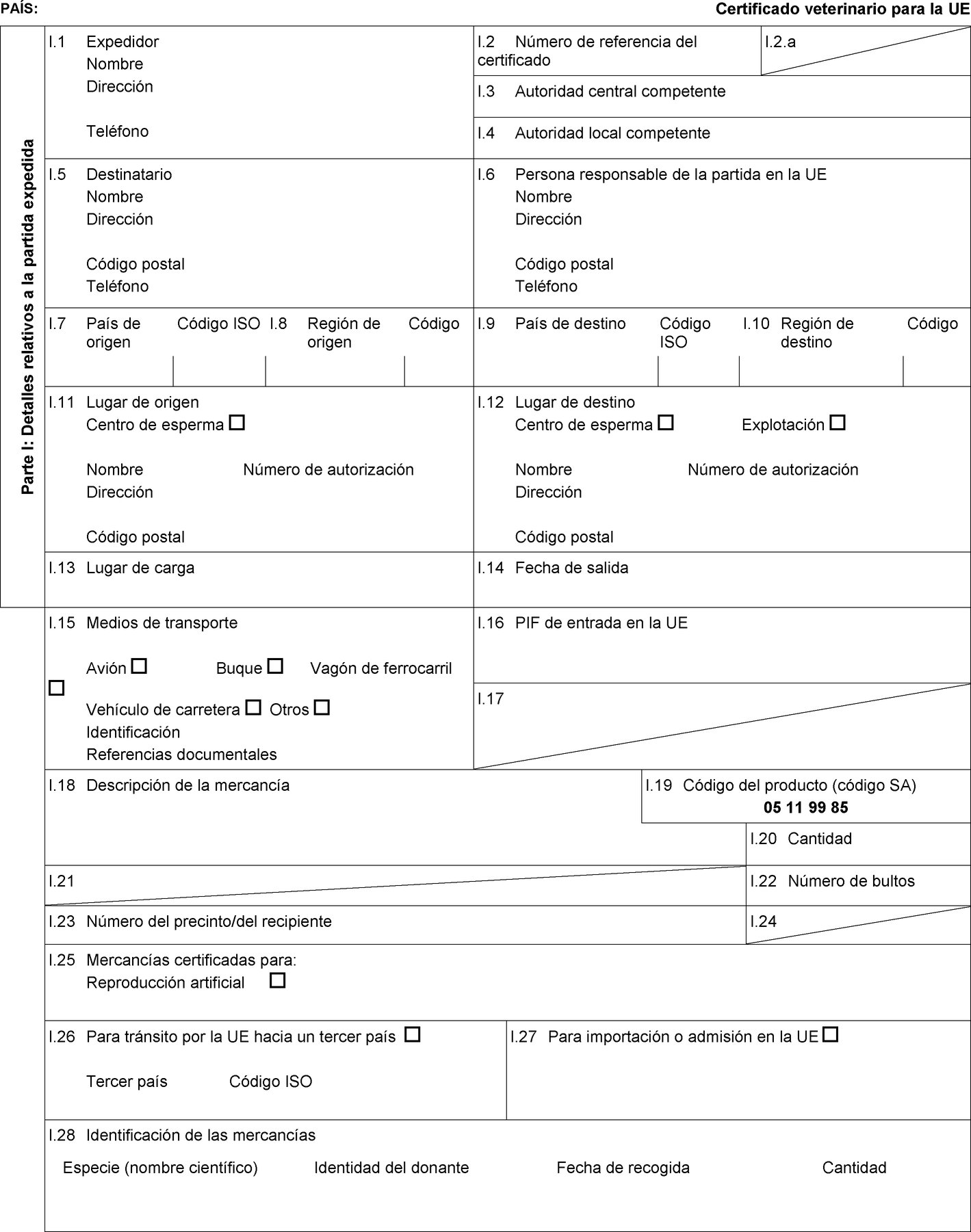 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
Sección C
MODELO 3. Modelo de certificado sanitario para la importación de partidas de existencias de esperma de équidos recogido, transformado o almacenado de conformidad con la Directiva 92/65/CEE antes del 1 de septiembre de 2010, y expedido después del 31 de agosto de 2010 desde su centro de recogida autorizado de origen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
Sección D
MODELO 4. Modelo de certificado sanitario para la importación de partidas de esperma de équidos recogido, transformado y almacenado de conformidad con la Directiva 92/65/CEE después del 30 de septiembre de 2014, y de partidas de existencias de esperma de équidos recogido, transformado y almacenado de conformidad con la Directiva 92/65/CEE entre el 31 de agosto de 2010 y el 1 de octubre de 2014, ambos exclusive, o antes del 1 de septiembre de 2010, y expedido después del 31 de agosto de 2010 desde un centro de almacenamiento de esperma autorizado
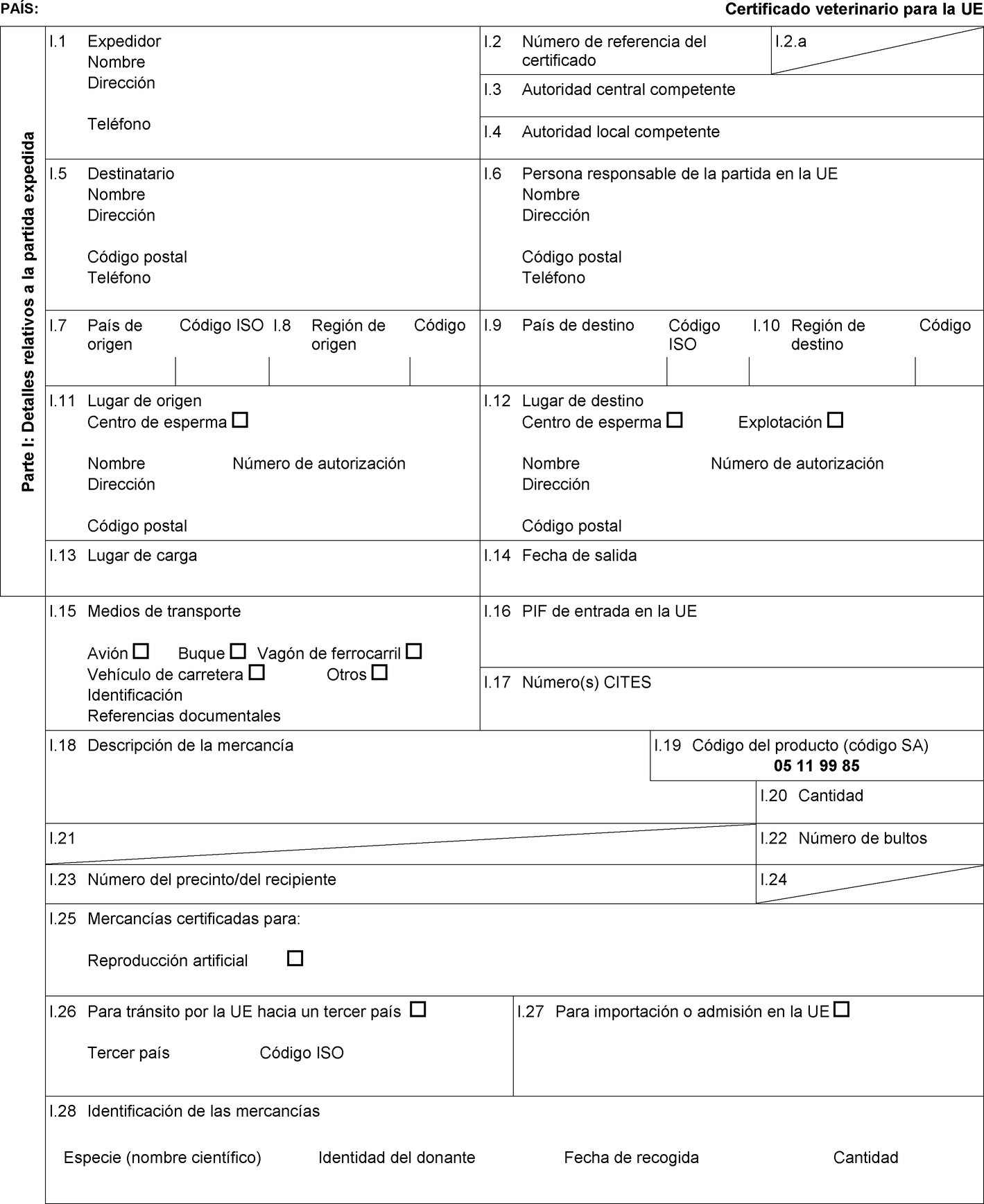 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
PARTE 2
Modelo de certificado sanitario para la importación de óvulos y embriones
Sección A
MODELO 1. Modelo de certificado sanitario para la importación de partidas de óvulos y embriones de équidos recogidos o producidos de conformidad con la Directiva 92/65/CEE después del 30 de septiembre de 2014 y expedidos por su equipo de recogida o producción autorizado de origen
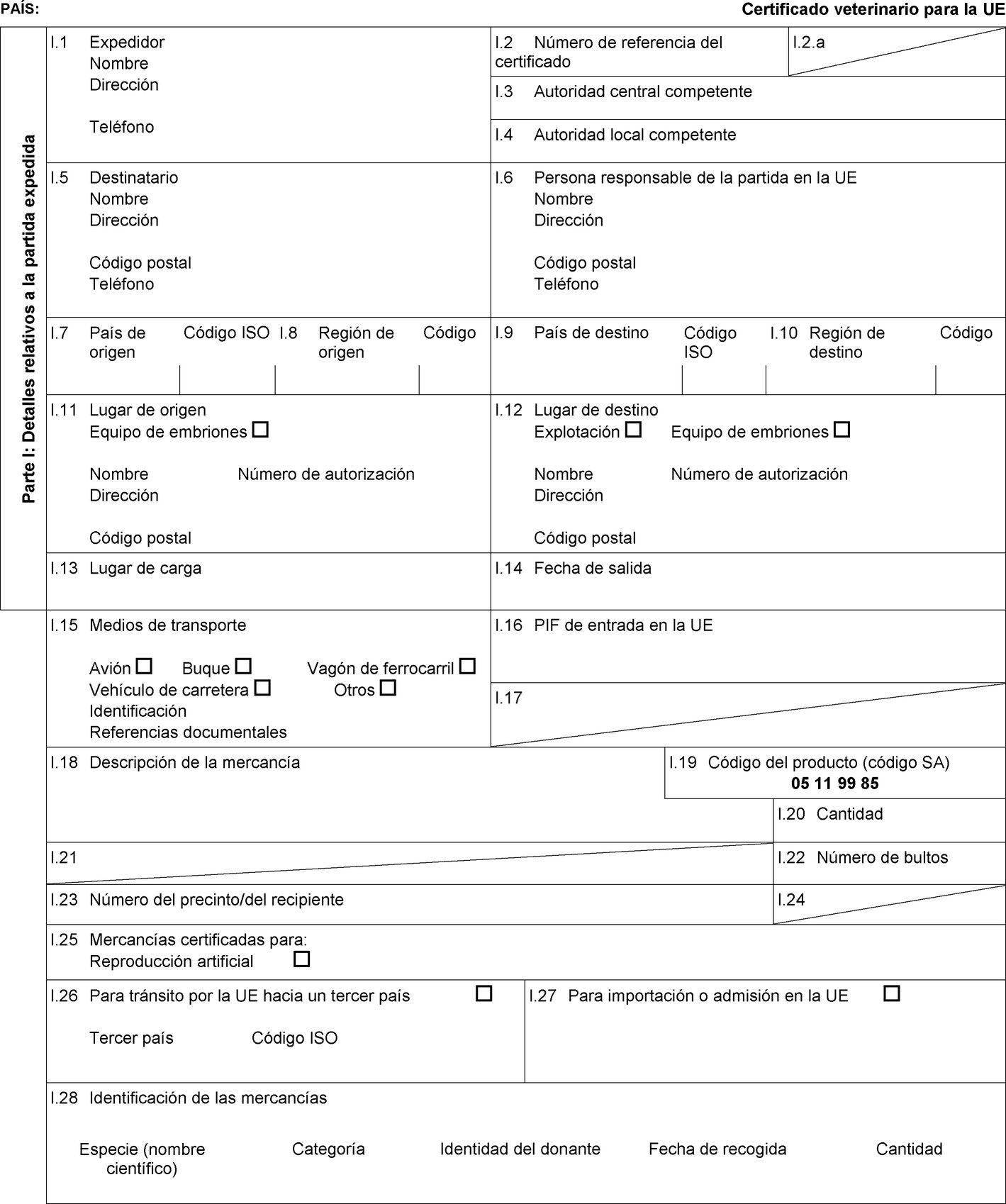 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
Sección B
MODELO 2. Modelo de certificado sanitario para la importación de partidas de existencias de óvulos y embriones de équidos recogidos, transformados y almacenados de conformidad con la Directiva 92/65/CEE entre el 31 de agosto de 2010 y el 1 de octubre de 2014, ambos exclusive, y expedidos después del 31 de agosto de 2010 por un equipo de recogida o de producción de embriones autorizado de origen
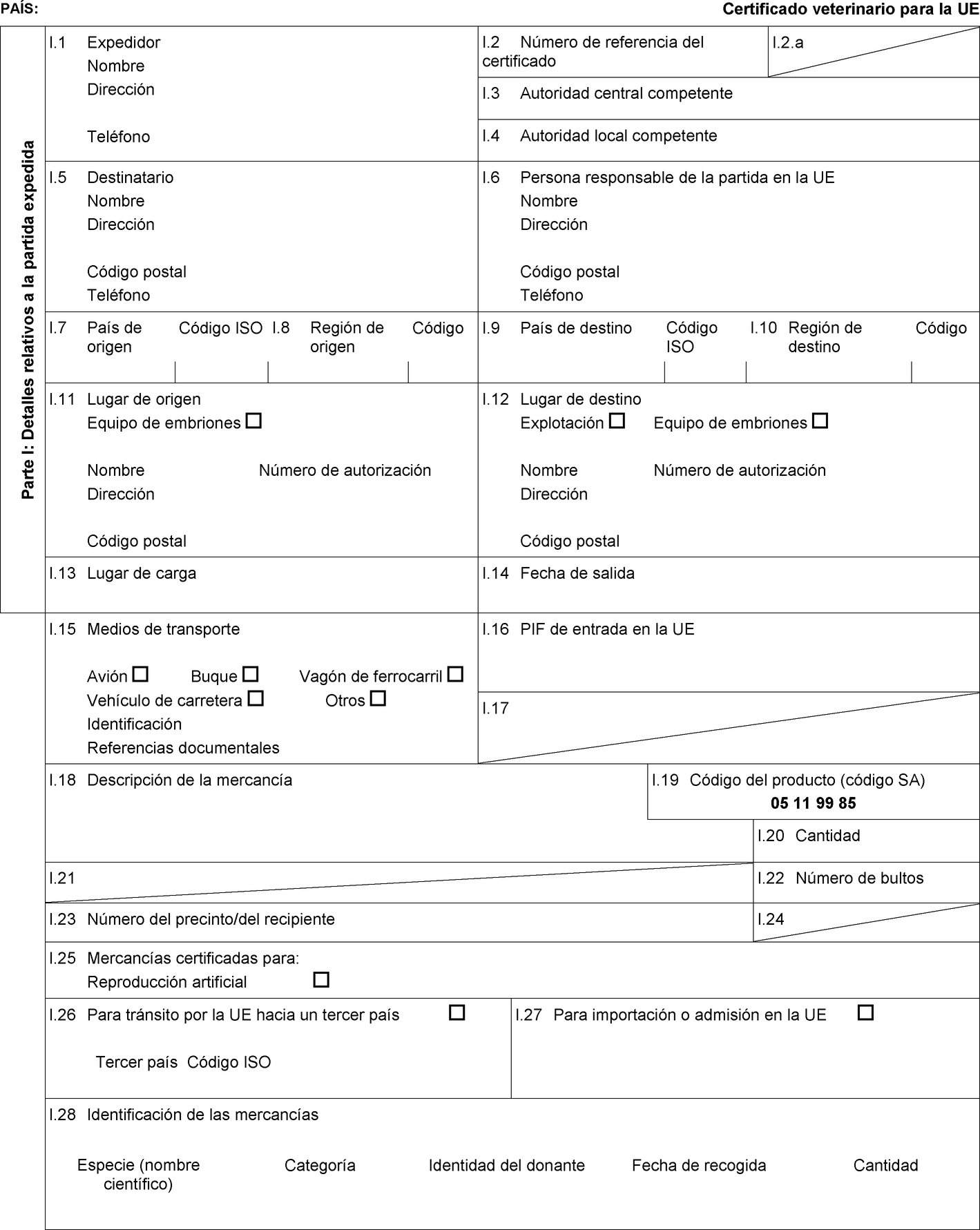 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
 Texto de la imagen
Texto de la imagen
PARTE 3
Notas explicativas del certificado
 Texto de la imagen
Texto de la imagen
ANEXO IV
CATEGORÍAS DE ÉQUIDOS MACHOS A LAS CUALES SE APLICAN LAS CONDICIONES RELATIVAS A LA ARTERITIS VIRAL EQUINA, DE CONFORMIDAD CON EL ARTÍCULO 15, LETRA b), INCISO ii), DE LA DIRECTIVA 2009/156/CE
|
1. |
Los requisitos relativos a la arteritis viral equina establecidos en el artículo 15, letra b), inciso ii), de la Directiva 2009/156/CE se aplicarán a los équidos machos no castrados, con excepción de:
|
|
2. |
La prueba se realizará y certificará, y el resultado y la vacunación se certificarán, bajo supervisión veterinaria oficial. Se revacunará a intervalos regulares siguiendo las instrucciones del fabricante. Se documentarán los números de lote de la vacuna autorizada, los detalles de la primovacunación y de la revacunación y los resultados de las pruebas serológicas o de identificación del agente, si es posible en el documento identificativo (pasaporte), y se pondrán a disposición a efectos de certificación. |
|
3. |
El acoplamiento que se describe en el punto 4.a del artículo 12.9.2. del Código Sanitario para los Animales Terrestres de la Organización Mundial de Sanidad Animal (OIE) se considera equivalente a la prueba de aislamiento del virus mencionada en el punto 1, letra a), inciso i), para demostrar la ausencia del virus de la arteritis equina en el esperma. |
ANEXO V
MODELOS DE DECLARACIONES
PARTE 1
Declaración del comandante del avión
 Texto de la imagen
Texto de la imagen
PARTE 2
Declaración del capitán del buque
 Texto de la imagen
Texto de la imagen
PARTE 3
Modelo de declaración de transbordo
 Texto de la imagen
Texto de la imagen
|
30.4.2018 |
ES |
Diario Oficial de la Unión Europea |
L 110/122 |
REGLAMENTO DE EJECUCIÓN (UE) 2018/660 DE LA COMISIÓN
de 26 de abril de 2018
por el que se renueva la aprobación de la sustancia activa bentazona con arreglo al Reglamento (CE) n.o 1107/2009 del Parlamento Europeo y del Consejo, relativo a la comercialización de productos fitosanitarios, y se modifica el anexo del Reglamento de Ejecución (UE) n.o 540/2011 de la Comisión
(Texto pertinente a efectos del EEE)
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Visto el Reglamento (CE) n.o 1107/2009 del Parlamento Europeo y del Consejo, de 21 de octubre de 2009, relativo a la comercialización de productos fitosanitarios y por el que se derogan las Directivas 79/117/CEE y 91/414/CEE del Consejo (1), y en particular su artículo 20, apartado 1,
Considerando lo siguiente:
|
(1) |
Mediante la Directiva 2000/68/CE de la Comisión (2) se incluyó la bentazona como sustancia activa en el anexo I de la Directiva 91/414/CEE del Consejo (3). |
|
(2) |
Las sustancias activas incluidas en el anexo I de la Directiva 91/414/CEE se consideran aprobadas con arreglo al Reglamento (CE) n.o 1107/2009 y figuran en la parte A del anexo del Reglamento de Ejecución (UE) n.o 540/2011 de la Comisión (4). |
|
(3) |
La aprobación de la sustancia activa bentazona, especificada en la parte A del anexo del Reglamento de Ejecución (UE) n.o 540/2011, expira el 30 de junio de 2018. |
|
(4) |
De conformidad con el artículo 4 del Reglamento (UE) n.o 1141/2010 de la Comisión (5) y dentro del plazo previsto en dicho artículo, se presentó una solicitud de renovación de la inclusión de la bentazona en el anexo I de la Directiva 91/414/CEE. |
|
(5) |
Los solicitantes presentaron los expedientes complementarios requeridos de conformidad con el artículo 9 del Reglamento (UE) n.o 1141/2010. El Estado miembro ponente consideró que la solicitud estaba completa. |
|
(6) |
El Estado miembro ponente elaboró un informe de evaluación de la renovación junto con el Estado miembro coponente, y, el 8 de enero de 2014, lo presentó a la Autoridad Europea de Seguridad Alimentaria (en lo sucesivo, «Autoridad») y a la Comisión. |
|
(7) |
La Autoridad comunicó el informe de evaluación de la renovación al solicitante y a los Estados miembros para que formularan sus observaciones, y transmitió las observaciones recibidas a la Comisión. La Autoridad puso también a disposición del público el expediente resumido complementario. |
|
(8) |
El 20 de abril de 2015, la Autoridad comunicó a la Comisión su conclusión (6) acerca de si cabía esperar que la bentazona cumpliera los criterios de aprobación establecidos en el artículo 4 del Reglamento (CE) n.o 1107/2009. El 8 de octubre de 2015, la Comisión presentó el proyecto de informe de revisión relativo a la bentazona al Comité Permanente de Vegetales, Animales, Alimentos y Piensos. |
|
(9) |
Se ofreció a los solicitantes la posibilidad de presentar observaciones acerca del proyecto de informe de renovación. |
|
(10) |
Se ha determinado, con respecto a uno o más usos representativos de al menos un producto fitosanitario que contiene bentazona, que se cumplen los criterios de aprobación establecidos en el artículo 4 del Reglamento (CE) n.o 1107/2009. Procede, pues, renovar la aprobación de la bentazona. |
|
(11) |
Sin embargo, varios Estados miembros han detectado la presencia de bentazona en las aguas subterráneas en sus programas de control de calidad de las aguas subterráneas y la EFSA indicó que, en relación con ciertos usos y suelos vulnerables, no se puede excluir la contaminación de las aguas subterráneas. |
|
(12) |
Por tanto, en función de los programas de control de calidad de las aguas subterráneas, y teniendo en cuenta la necesidad de garantizar un nivel de seguridad y protección de acuerdo con el alto nivel de protección que se persigue en la Unión, se considera apropiado renovar la aprobación de la bentazona durante un periodo de siete años, lo que garantiza la prioridad de la reevaluación de la bentazona por encima de otras sustancias activas y permite a su vez tomar en consideración los resultados actualizados de los programas de calidad de las aguas subterráneas. |
|
(13) |
La evaluación del riesgo para la renovación de la aprobación de la bentazona se basa en una cantidad limitada de usos representativos, lo que, no obstante, no restringe los usos para los que pueden ser autorizados los productos fitosanitarios que contengan esta sustancia. Procede, por tanto, suprimir la limitación del uso exclusivo como herbicida. |
|
(14) |
Sin embargo, de conformidad con el artículo 14, apartado 1, del Reglamento (CE) n.o 1107/2009, leído en relación con su artículo 6, y teniendo en cuenta los actuales conocimientos científicos y técnicos, es preciso incluir determinadas condiciones y restricciones. Procede, en particular, pedir más información confirmatoria. |
|
(15) |
Procede modificar el anexo del Reglamento de Ejecución (UE) n.o 540/2011 en consecuencia. |
|
(16) |
Mediante el Reglamento de Ejecución (UE) 2017/841 de la Comisión (7) se prorrogó el período de aprobación de la bentazona hasta el 30 de junio de 2018, a fin de que pueda completarse el proceso de renovación antes de que expire la aprobación de dicha sustancia. No obstante, dado que se ha adoptado una decisión sobre la renovación antes de dicha fecha, el presente Reglamento debe aplicarse a partir del 1 de junio de 2018. |
|
(17) |
Las medidas previstas en el presente Reglamento se ajustan al dictamen del Comité Permanente de Vegetales, Animales, Alimentos y Piensos. |
HA ADOPTADO EL PRESENTE REGLAMENTO:
Artículo 1
Renovación de la aprobación de la sustancia activa
Se renueva la aprobación de la sustancia activa bentazona según lo establecido en el anexo I.
Artículo 2
Modificaciones del Reglamento de Ejecución (UE) n.o 540/2011
El anexo del Reglamento de Ejecución (UE) n.o 540/2011 queda modificado con arreglo a lo dispuesto en el anexo II del presente Reglamento.
Artículo 3
Entrada en vigor y fecha de aplicación
El presente Reglamento entrará en vigor a los veinte días de su publicación en el Diario Oficial de la Unión Europea.
Será de aplicación a partir del 1 de junio de 2018.
El presente Reglamento será obligatorio en todos sus elementos y directamente aplicable en cada Estado miembro.
Hecho en Bruselas, el 26 de abril de 2018.
Por la Comisión
El Presidente
Jean-Claude JUNCKER
(1) DO L 309 de 24.11.2009, p. 1.
(2) Directiva 2000/68/CE de la Comisión, de 23 de octubre de 2000, por la que se incluye una sustancia activa (bentazona) en el anexo I de la Directiva 91/414/CEE del Consejo, relativa a la comercialización de productos fitosanitarios (DO L 276 de 28.10.2000, p. 41).
(3) Directiva 91/414/CEE del Consejo, de 15 de julio de 1991, relativa a la comercialización de productos fitosanitarios (DO L 230 de 19.8.1991, p. 1).
(4) Reglamento de Ejecución (UE) n.o 540/2011 de la Comisión, de 25 de mayo de 2011, por el que se establecen disposiciones de aplicación del Reglamento (CE) n.o 1107/2009 del Parlamento Europeo y del Consejo en lo que respecta a la lista de sustancias activas aprobadas (DO L 153 de 11.6.2011, p. 1).
(5) Reglamento (UE) n.o 1141/2010 de la Comisión, de 7 de diciembre de 2010, por el que se establecen el procedimiento para renovar la inclusión de un segundo grupo de sustancias activas en el anexo I de la Directiva 91/414/CEE del Consejo y la lista de dichas sustancias (DO L 322 de 8.12.2010, p. 10).
(6) EFSA Journal 2015; 13(4):4077, 153 pp. doi:10.2903/j.efsa.2015.4077.
(7) Reglamento de Ejecución (UE) 2017/841 de 17 de mayo de 2017 que modifica el Reglamento de Ejecución (UE) n.o 540/2011 en lo que respecta a la ampliación de los períodos de aprobación de las sustancias activas alfa-cipermetrina, Ampelomyces quisqualis cepa: aq 10, benalaxil, bentazona, bifenazato, bromoxinil, carfentrazona-etilo, clorprofam, ciazofamida, desmedifam, dicuat, DPX KE 459 (flupirsulfurón-metilo), etoxazol, famoxadona, fenamidona, flumioxazina, foramsulfurón, Gliocladium catenulatum, cepa: j1446, imazamox, imazosulfurón, isoxaflutol, laminarina, metalaxilo-m, metoxifenozida, milbemectina, oxasulfurón, pendimetalina, fenmedifam, pimetrozina, s-metolacloro y trifloxistrobina (DO L 125 de 18.5.2017, p. 12).
ANEXO I
|
Denominación común y números de identificación |
Denominación UIQPA |
Pureza (1) |
Fecha de aprobación |
Expiración de la aprobación |
Disposiciones específicas |
||||||||
|
Bentazona N.o CAS: 25057-89-0 N.o CICAP: 366 |
2,2-dióxido de 3-isopropil-(1H)-2,1,3-benzotiadiazin-4(3H)-ona |
≥ 960 g/kg 1,2-dicloroetano < 3 mg/kg |
1 de junio de 2018 |
31 de mayo de 2025 |
Para la aplicación de los principios uniformes a los que se refiere el artículo 29, apartado 6, del Reglamento (CE) n.o 1107/2009, se tendrán en cuenta las conclusiones del informe de revisión de la bentazona, y en particular sus apéndices I y II. En su evaluación global, los Estados miembros deberán prestar especial atención a lo siguiente:
Las condiciones de uso incluirán, cuando proceda, medidas de reducción de riesgos. A más tardar el 1 de febrero de 2019, el solicitante presentará a la Comisión, a los Estados miembros y a la Autoridad información confirmatoria sobre los ensayos de nivel 2/3, como se indica actualmente en el marco conceptual de la OCDE para investigar los posibles efectos de mediación endocrina de la bentazona. |
(1) En los informes de revisión se incluyen más datos sobre la identidad y las especificaciones de las sustancias activas correspondientes.
ANEXO II
El anexo del Reglamento de Ejecución (UE) n.o 540/2011 se modifica como sigue:
|
1) |
En la parte A, se suprime la entrada 11, relativa a la bentazona. |
|
2) |
En la parte B, se añade la entrada siguiente:
|
(1) En los informes de revisión se incluyen más datos sobre la identidad y las especificaciones de las sustancias activas correspondientes.
DECISIONES
|
30.4.2018 |
ES |
Diario Oficial de la Unión Europea |
L 110/127 |
DECISIÓN DE EJECUCIÓN (UE) 2018/661 DE LA COMISIÓN
de 26 de abril de 2018
por la que se modifica la Decisión de Ejecución (UE) 2015/750, relativa a la armonización de la banda de frecuencias de 1 452-1 492 MHz para sistemas terrenales capaces de prestar servicios de comunicaciones electrónicas en la Unión, en lo que respecta a su extensión en las bandas de frecuencias armonizadas de 1 427-1 452 MHz y 1 492-1 517 MHz
[notificada con el número C(2018) 2286]
(Texto pertinente a efectos del EEE)
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Vista la Decisión n.o 676/2002/CE del Parlamento Europeo y del Consejo, de 7 de marzo de 2002, sobre un marco regulador de la política del espectro radioeléctrico en la Comunidad Europea (Decisión sobre el espectro radioeléctrico) (1), y en particular su artículo 4, apartado 3,
Considerando lo siguiente:
|
(1) |
La Decisión n.o 243/2012/UE del Parlamento Europeo y del Consejo (2) establece un programa plurianual de política del espectro radioeléctrico (PPER) que fija el objetivo de identificar al menos 1 200 MHz de espectro adecuado para la banda ancha inalámbrica en la Unión a más tardar en 2015, incluido el espectro que ya se encuentra en uso, sobre la base del inventario del espectro. |
|
(2) |
En su dictamen sobre los retos estratégicos a que se enfrenta Europa al abordar la creciente demanda de espectro radioeléctrico para la banda ancha inalámbrica (3), de 20 de febrero de 2013, el Grupo de Política del Espectro Radioeléctrico (RSPG) recomendaba que se evaluara el uso de la banda de frecuencias de 1 427-1 452 MHz para la banda ancha inalámbrica después de 2015 como una extensión de la banda de 1 452-1 492 MHz. Además, el RSPG destacaba en su dictamen las dificultades que podía plantear la posible designación de las bandas de frecuencias de 1 427-1 452 MHz y 1 492-1 518 MHz para la banda ancha inalámbrica, debido a los usos militares ya existentes y los servicios inalámbricos fijos terrenales. El RSPG proponía un nuevo examen del uso de la banda de frecuencias de 1 492-1 518 MHz en función de los resultados de la Conferencia Mundial de Radiocomunicaciones de 2015 (CMR-15). |
|
(3) |
La CMR-15 identificó las bandas de frecuencias de 1 427-1 452 MHz y 1 492-1 518 MHz para las telecomunicaciones móviles internacionales en todo el mundo. En la región 1 de la Unión Internacional de Telecomunicaciones, incluida la Unión Europea, dichas bandas de frecuencias, o porciones de ellas, respectivamente, están atribuidas al servicio móvil (excepto el servicio móvil aeronáutico), al servicio fijo y al servicio de operaciones espaciales Tierra-espacio, a título coprimario. Además, algunos Estados miembros han designado la banda de frecuencias de 1 452-1 518 MHz para la realización de programas y acontecimientos especiales. |
|
(4) |
El 15 de marzo de 2017, de conformidad con el artículo 4, apartado 2, de la Decisión sobre el espectro radioeléctrico, la Comisión otorgó a la Conferencia Europea de Administraciones de Correos y de Telecomunicaciones (CEPT) un mandato para que elaborase condiciones técnicas armonizadas en bandas de frecuencias adicionales de la gama de frecuencias de 1,5 GHz —a saber, las bandas de 1 427-1 452 MHz y 1 492-1 518 MHz— para promover su uso en los servicios inalámbricos de comunicaciones electrónicas de banda ancha terrenales en la Unión. |
|
(5) |
El 16 de noviembre de 2017, en respuesta a dicho mandato, la CEPT publicó su Informe 65 (4), que propone condiciones técnicas armonizadas para los servicios inalámbricos de comunicaciones electrónicas de banda ancha solo para enlace descendente en las bandas de frecuencias de 1 427-1 452 MHz y 1 492-1 517 MHz, teniendo en cuenta la designación a nivel de la Unión de la banda de frecuencias de 1 452-1 492 MHz, en condiciones técnicas armonizadas, para los sistemas terrenales capaces de prestar servicios de comunicaciones electrónicas, de conformidad con la Decisión (UE) 2015/750 de la Comisión (5). |
|
(6) |
La designación a nivel de la Unión de las bandas de frecuencias de 1 427-1 452 MHz y 1 492-1 517 MHz para servicios inalámbricos de comunicaciones electrónicas de banda ancha solo para enlace descendente debe contribuir a alcanzar el objetivo del RSPG en materia de espectro para la banda ancha inalámbrica mediante la adición de 50 MHz de espectro. El uso solo para enlace descendente es importante para gestionar la asimetría del tráfico de datos potenciando la capacidad descendente de los sistemas inalámbricos de banda ancha, inclusive para la prestación de servicios de 5G. |
|
(7) |
En consonancia con las recomendaciones del informe 65 de la CEPT, los Estados miembros deben disponer de flexibilidad a escala nacional para utilizar porciones de las bandas de frecuencias de 1 427-1 452 MHz y 1 492-1 517 MHz a fin de tomar en consideración los acuerdos militares internacionales (6) o responder de forma temporal a necesidades nacionales específicas para el funcionamiento continuado de los servicios inalámbricos fijos terrenales. A este respecto, el informe hace hincapié en la imposibilidad de que los servicios móviles y fijos funcionen en las mismas frecuencias. En consecuencia, redistribuir a escala nacional estas bandas para ponerlas a disposición de la demanda nacional de servicios inalámbricos de comunicaciones electrónicas de banda ancha solo para enlace descendente es un proceso complejo para el que es preciso un calendario adecuado. |
|
(8) |
Al ejercer la flexibilidad a escala nacional, los Estados miembros deben dar preferencia a la disponibilidad de espectro contiguo para los servicios inalámbricos de comunicaciones electrónicas de banda ancha solo para enlace descendente, incluida la banda de frecuencias de 1 452-1 492 MHz, a fin de facilitar mayores anchos de banda de canal de servicios 5G, economías de escala para los equipos, la coexistencia con los servicios de bandas adyacentes, así como la coordinación de frecuencias. |
|
(9) |
Sin perjuicio del derecho de los Estados miembros a organizar el uso del espectro con fines de orden público, seguridad pública y defensa en virtud del artículo 1, apartado 4, de la Decisión sobre el espectro radioeléctrico, los Estados miembros deben designar, en la mayor medida posible, las bandas de frecuencias de 1 427-1 452 MHz y 1 492-1 517 MHz para servicios inalámbricos de comunicaciones electrónicas de banda ancha solo para enlace descendente. |
|
(10) |
La prestación de servicios inalámbricos de comunicaciones electrónicas de banda ancha, solo para enlace descendente, en la totalidad de la banda de frecuencias de 1 427-1 517 MHz debe basarse en una disposición de canales coherente y armonizada, así como en condiciones técnicas mínimas, es decir, lo menos restrictivas posible, para impulsar el mercado único, reducir las interferencias perjudiciales y garantizar la coordinación de frecuencias. |
|
(11) |
Las condiciones y disposiciones técnicas contenidas en el informe 65 de la CEPT también prevén la coexistencia entre los servicios inalámbricos de banda ancha y los servicios de bandas adyacentes. |
|
(12) |
En particular, condiciones y disposiciones técnicas tales como los límites de potencia de las emisiones no deseadas, garantizan que el uso de la banda ancha inalámbrica en la banda de frecuencias de 1 427-1 517 MHz ofrezca la protección adecuada a los servicios de radioastronomía y a los servicios pasivos de exploración de la Tierra por satélite en la banda de frecuencias de 1 400-1 427 MHz, así como a los servicios móviles por satélite en la banda de frecuencias de 1 518-1 559 MHz. Pueden ser necesarias nuevas medidas a escala nacional para favorecer la coexistencia con los servicios de las bandas de frecuencias adyacentes de 1 400-1 427 MHz y 1 518-1 559 MHz, tales como los que operan en los alrededores de los aeropuertos, los puertos marítimos y las estaciones terrenas que se utilizan para recibir señales de búsqueda y salvamento transmitidas vía satélite. Por otra parte, es preciso mejorar el rendimiento de los receptores de las estaciones terrenas móviles, en consonancia con los objetivos y requisitos de la Directiva 2014/53/UE del Parlamento Europeo y del Consejo (7). |
|
(13) |
Teniendo en cuenta que algunas porciones de la banda de frecuencias de 1 452-1 492 MHz no se utilizan en los sistemas de radiodifusión terrenal, deben eliminarse las trabas reglamentarias actualmente existentes en lo que respecta a la coexistencia con dichos servicios en esta banda para hacer posible el despliegue de los servicios inalámbricos de comunicaciones electrónicas de banda ancha solo para enlace descendente. |
|
(14) |
Pueden ser precisos acuerdos transfronterizos de coordinación de frecuencias entre administraciones para garantizar la aplicación de los parámetros establecidos por la presente Decisión para mejorar los servicios inalámbricos de comunicaciones electrónicas de banda ancha, solo para enlace descendente, en las bandas de frecuencias de 1 427-1 452 MHz y 1 492-1 517 MHz a fin de evitar interferencias perjudiciales y mejorar la eficiencia en el uso del espectro. Los acuerdos transfronterizos de coordinación de frecuencias con respecto a los servicios de telemetría aeronáutica deben abordarse bilateral o multilateralmente entre las administraciones correspondientes de la CEPT. |
|
(15) |
Las medidas previstas en la presente Decisión deben ser aplicadas por los Estados miembros con el objetivo último de garantizar la utilización de la banda de frecuencias de 1 427-1 517 MHz completa o, de no existir demanda nacional, una porción de la misma, para los servicios inalámbricos de comunicaciones electrónicas de banda ancha solo para enlace descendente, a fin de contribuir, en la medida de lo posible, a la consecución del objetivo del PPER en materia de espectro. |
|
(16) |
Los Estados miembros deben informar a la Comisión sobre la aplicación de la Decisión y la utilización de la banda a fin de facilitar una evaluación de su impacto a nivel de la Unión, así como su oportuna revisión, en caso necesario. En particular, la justificación para ejercer la flexibilidad nacional en la puesta a disposición de espectro en las bandas de frecuencias de 1 427-1 452 MHz o 1 492-1 517 MHz debe ser evaluada cada dos años. Además, los Estados miembros deben informar cada dos años sobre las medidas nacionales de fomento de la coexistencia con los servicios de radioastronomía y los servicios pasivos de exploración de la Tierra por satélite en la banda de frecuencias de 1 400-1 427 MHz, y los servicios móviles por satélite en la banda de frecuencias de 1 518-1 559 MHz. |
|
(17) |
Las medidas previstas en la presente Decisión se ajustan al dictamen del Comité del Espectro Radioeléctrico. |
HA ADOPTADO LA PRESENTE DECISIÓN:
Artículo 1
La Decisión de Ejecución (UE) 2015/750 queda modificada como sigue:
|
1) |
El título se sustituye por el texto siguiente: «Decisión de Ejecución (UE) 2015/750, de 8 de mayo de 2015, relativa a la armonización de la banda de frecuencias de 1 427-1 517 MHz para sistemas terrenales capaces de prestar servicios de comunicaciones electrónicas en la Unión». |
|
2) |
El artículo 1 se sustituye por el texto siguiente: «Artículo 1 La presente Decisión tiene por objeto armonizar las condiciones de disponibilidad y uso eficiente de la banda de frecuencias de 1 427-1 517 MHz para los sistemas terrenales capaces de prestar servicios de comunicaciones electrónicas en la Unión.». |
|
3) |
En el artículo 2, el apartado 2 se sustituye por el texto siguiente: «2. A más tardar el 1 de octubre de 2018, los Estados miembros designarán y harán disponibles, a título no exclusivo, las bandas de frecuencias de 1 427-1 452 MHz y 1 492-1 517 MHz, o una porción de las mismas, para los sistemas terrenales capaces de prestar servicios inalámbricos de comunicaciones electrónicas de banda ancha, de conformidad con los parámetros establecidos en el anexo.». |
|
4) |
En el artículo 2, el apartado 3 se sustituye por el texto siguiente: «3. Los Estados miembros que designen y hagan disponible únicamente una porción de las bandas de frecuencias de 1 427-1 452 MHz o 1 492-1 517 MHz de conformidad con lo dispuesto en el apartado 2:
|
|
5) |
En el artículo 2 se añade el apartado 4 siguiente: «4. Los Estados miembros velarán por que los sistemas terrenales a que se refiere el apartado 1 den la protección adecuada a los sistemas que operan en bandas adyacentes.». |
|
6) |
En el artículo 2 se añade el apartado 5 siguiente: «5. Los Estados miembros facilitarán acuerdos de coordinación transfronteriza encaminados a permitir el funcionamiento de los sistemas a que se refieren los apartados 1, 2 y 3, tomando en consideración los procedimientos normativos y los derechos existentes, así como los acuerdos internacionales pertinentes.». |
|
7) |
Se añade el artículo 2 bis siguiente: «Artículo 2 bis Los Estados miembros revisarán la aplicación del artículo 2 cada dos años para garantizar la máxima disponibilidad de la banda de frecuencias de 1 427-1 517 MHz para servicios inalámbricos de comunicaciones electrónicas de banda ancha». |
|
8) |
El artículo 4 se sustituye por el texto siguiente: «Artículo 4 Los Estados miembros efectuarán un seguimiento del uso de la banda de frecuencias de 1 427-1 517 MHz y comunicarán sus conclusiones a la Comisión, a petición de esta o por propia iniciativa, con el fin de permitir la oportuna revisión de la presente Decisión en caso necesario.». |
|
9) |
Se añade el artículo 4 bis siguiente: «Artículo 4 bis Los Estados miembros presentarán a la Comisión un informe sobre la aplicación de la presente Decisión, incluido el grado de disponibilidad de las bandas de frecuencias de 1 427-1 452 MHz y 1 492-1 517 MHz, a más tardar, el 1 de noviembre de 2018.». |
|
10) |
El anexo de la Decisión de Ejecución (UE) 2015/750 se sustituye por el texto del anexo de la presente Decisión. |
Artículo 2
Los destinatarios de la presente Decisión son los Estados miembros.
Hecho en Bruselas, el 26 de abril de 2018.
Por la Comisión
Mariya GABRIEL
Miembro de la Comisión
(1) DO L 108 de 24.4.2002, p. 1.
(2) Decisión n.o 243/2012/UE del Parlamento Europeo y del Consejo, de 14 de marzo de 2012, por la que se establece un programa plurianual de política del espectro radioeléctrico (DO L 81 de 21.3.2012, p. 7).
(3) Documento RSPG 13-521 Rev. 1.
(4) Informe 65 de la CEPT, aprobado el 17 de noviembre de 2017 y corregido el 2 de marzo de 2018.
(5) Decisión de Ejecución (UE) 2015/750 de la Comisión, de 8 de mayo de 2015, relativa a la armonización de la banda de frecuencias de 1 452-1 492 MHz para sistemas terrenales capaces de prestar servicios de comunicaciones electrónicas en la Unión (DO L 119 de 12.5.2015, p. 27).
(6) Las bandas de frecuencias de 1 427-1 452 MHz y 1 492-1 518 MHz se utilizan en los sistemas militares marítimos y terrestres con arreglo al Acuerdo Conjunto OTAN Civil-Militar sobre Frecuencias (NJFA) de 2014. Según el punto 14 del Acuerdo, en los casos en que el uso de bandas de radiofrecuencias ha sido armonizado por la OTAN y sus países miembros para uso militar, no queda excluida la utilización para usos civiles.
(7) Directiva 2014/53/UE del Parlamento Europeo y del Consejo, de 16 de abril de 2014, relativa a la armonización de las legislaciones de los Estados miembros sobre la comercialización de equipos radioeléctricos, y por la que se deroga la Directiva 1999/5/CE (DO L 153 de 22.5.2014, p. 62).
ANEXO
ANEXO
PARÁMETROS A QUE SE REFIERE EL ARTÍCULO 2, APARTADOS 1 y 2
A. PARÁMETROS GENERALES
|
1. |
El modo de funcionamiento en la banda de frecuencias de 1 427-1 517 MHz se limitará a la transmisión de la estación base (“solo enlace descendente”). |
|
2. |
Dentro de la banda de frecuencias de 1 427-1 517 MHz se asignarán bloques de tamaño múltiplo de 5 MHz. El límite de frecuencia inferior de un bloque asignado se alineará o se espaciará con valores múltiplos de 5 MHz a partir del borde de la banda inferior de 1 427 MHz. |
|
3. |
La transmisión de la estación base deberá cumplir las condiciones técnicas (máscaras de borde de bloque) establecidas en el presente anexo. |
B. CONDICIONES TÉCNICAS DE LAS ESTACIONES BASE — MÁSCARA DE BORDE DE BLOQUE
Se utilizarán los parámetros técnicos de las estaciones base que figuran a continuación, denominados “máscara de borde de bloque” (BEM por sus siglas en inglés), para garantizar la coexistencia entre redes vecinas cuando no existan acuerdos bilaterales o multilaterales entre los operadores de tales redes. Podrán utilizarse también parámetros técnicos menos estrictos si los operadores o las administraciones de que se trate convienen en ello, siempre que estos parámetros se ajusten a las condiciones técnicas aplicables para la protección de otros servicios o aplicaciones, incluso en bandas adyacentes o sujetas a obligaciones transfronterizas.
La BEM es una máscara para emisiones definida, en función de la frecuencia, con respecto al borde de un bloque de espectro para el que se han concedido derechos de uso a un operador. Consta de unos límites de potencia dentro de bloque y fuera de bloque. El límite de potencia dentro de bloque se aplica a un bloque propiedad de un operador. Los límites de potencia fuera de bloque se aplican al espectro utilizado para los servicios inalámbricos de comunicaciones electrónicas de banda ancha (WBB ECS por sus siglas en inglés) dentro de la banda de frecuencias de 1 427-1 517 MHz que está fuera de un bloque concedido a un operador. Se establecen en el cuadro 2. Los límites de potencia fuera de banda se aplican al espectro fuera de la porción de la banda de frecuencias de 1 427-1 517 MHz, que se utiliza para los WBB ECS a escala nacional.
Además, se definen límites de potencia de coexistencia para los WBB ECS dentro de la banda de 1 427-1 517 MHz al objeto de garantizar la compatibilidad entre estos servicios y otros servicios o aplicaciones radioeléctricos, incluso cuando una porción de las bandas de 1 427-1 452 MHz y de 1 492-1 517 MHz no ha sido designada para los WBB ECS. Los límites de potencia de coexistencia con respecto a los servicios o aplicaciones de las bandas adyacentes (es decir, fuera del espectro utilizado para los WBB ECS) se presentan en los cuadros 3, 4, y 5, y también tienen en cuenta la flexibilidad nacional en la asignación de espectro para los WBB ECS dentro de la banda de frecuencias de 1 427-1 517 MHz en virtud de la presente Decisión.
Podrán aplicarse a nivel nacional medidas técnicas o de procedimiento adicionales (1), o ambas, para garantizar la coexistencia con los servicios y aplicaciones de las bandas adyacentes.
Requisitos dentro de bloque
No es obligatorio un límite de la potencia isótropa radiada equivalente (p.i.r.e.) dentro de bloque para las estaciones base, excepto para el bloque de frecuencias de 1 512-1 517 MHz, para el que se establece dicho límite en el cuadro 1. En el caso de los bloques de frecuencias distintos del bloque de 1 512-1 517 MHz, los Estados miembros podrán fijar un límite de p.i.r.e. no superior a 68 dBm/5MHz, que podrá incrementarse para determinados despliegues, por ejemplo para el uso agregado del espectro en la banda de 1 427-1 512 MHz y espectro en bandas de frecuencias inferiores.
Cuadro 1
P.i.r.e. máxima dentro de bloque por celda (2) para estaciones base de WBB ECS que operan en la banda de 1 512 -1 517 MHz
|
Bloque de frecuencias |
P.i.r.e. máxima dentro de bloque |
Ancho de banda de medición |
|
1 512 -1 517 MHz |
58 dBm |
5 MHz |
Nota explicativa del cuadro 1
Estos requisitos tienen por objeto garantizar la compatibilidad entre los WBB ECS que operan en la banda de frecuencias de 1 512-1 517 MHz y los servicios móviles por satélite que operan en la banda de frecuencias de 1 518-1 525 MHz.
Requisitos fuera de bloque
Cuadro 2
Límites de la p.i.r.e. fuera de bloque de la BEM de la estación base por antena dentro de la banda de frecuencias de 1 427 -1 517 MHz
|
Gama de frecuencias de las emisiones fuera de bloque |
P.i.r.e. media máxima fuera de bloque |
Ancho de banda de medición |
|
– 10 a – 5 MHz desde el borde inferior del bloque |
11 dBm |
5 MHz |
|
– 5 a 0 MHz desde el borde inferior del bloque |
16,3 dBm |
5 MHz |
|
0 a + 5 MHz desde el borde superior del bloque |
16,3 dBm |
5 MHz |
|
+ 5 a + 10 MHz desde el borde superior del bloque |
11 dBm |
5 MHz |
|
Frecuencias dentro de la banda de 1 427 -1 517 MHz cuya separación respecto al borde inferior o superior del bloque es superior a 10 MHz |
9 dBm |
5 MHz |
Requisitos de coexistencia para las bandas adyacentes
Cuadro 3
Límites de potencia de la estación base de emisiones no deseadas en la banda de frecuencias de 1 400 -1 427 MHz para las estaciones base que operan en la banda de frecuencias de 1 427 -1 452 MHz
|
Gama de frecuencias de las emisiones fuera de banda |
Nivel de potencia máximo de las emisiones no deseadas (3) |
Ancho de banda de medición |
|
1 400 -1 427 MHz |
– 72 dBW |
27 MHz |
Nota explicativa del cuadro 3
Este requisito tiene por objeto proteger los servicios de radioastronomía y los servicios pasivos de exploración de la Tierra por satélite en la banda de frecuencias pasiva de 1 400-1 427 MHz de los WBB ECS que operan en la banda de frecuencias de 1 427-1 452 MHz, incluso cuando solo una porción de esta banda de frecuencias está asignada a los WBB ECS. Podrá ser necesario adoptar medidas nacionales adicionales para mejorar la protección de las observaciones de radioastronomía en la banda de frecuencias pasiva de 1 400-1 427 MHz de los WBB ECS.
Cuadro 4
Límites de p.i.r.e. fuera de banda de la estación base por celda (4) en la gama de frecuencias de 1 518 -1 559 MHz para las estaciones base que operan en la banda de frecuencias de 1 492 -1 517 MHz
|
Gama de frecuencias de las emisiones fuera de banda |
P.i.r.e. máxima fuera de banda |
Ancho de banda de medición |
|
1 518 -1 520 MHz |
– 0,8 dBm |
1 MHz |
|
1 520 -1 559 MHz |
– 30 dBm |
1 MHz |
Nota explicativa del cuadro 4
Estos requisitos tienen por objeto deparar una protección adecuada a los servicios móviles por satélite que operan en la banda de frecuencias de 1 518-1 559 MHz, en particular en los puertos marítimos, los aeropuertos y las estaciones terrenas de búsqueda y salvamento del servicio móvil por satélite, de los WBB ECS que operan en la banda de frecuencias de 1 492-1 517 MHz, incluso cuando solo una porción de esta banda de frecuencias está asignada a los WBB ECS. Podrá ser necesario adoptar medidas nacionales adicionales para mejorar la protección de los servicios móviles por satélite en la banda de 1 518-1 559 MHz.
Cuadro 5
Límites de p.i.r.e. fuera de banda de la estación base por celda por debajo de 1 452 MHz y por encima de 1 492 MHz para las estaciones base que operan en la banda de frecuencias de 1 452 -1 492 MHz
|
Gama de frecuencias de las emisiones fuera de banda |
P.i.r.e. media máxima fuera de banda |
Ancho de banda de medición |
|
Por debajo de 1 449 MHz |
– 20 dBm |
1 MHz |
|
1 449 -1 452 MHz |
14 dBm |
3 MHz |
|
1 492 -1 495 MHz |
14 dBm |
3 MHz |
|
Por encima de 1 495 MHz |
– 20 dBm |
1 MHz |
Nota explicativa del cuadro 5
Estos requisitos son aplicables cuando los WBB ECS no están desplegados por debajo de 1 452 MHz o por encima de 1 492 MHz, o ambos. La finalidad de estos requisitos es garantizar la compatibilidad de los WBB ECS dentro de la banda de frecuencias de 1 452-1 492 MHz con los enlaces fijos coordinados, los servicios móviles y los servicios de telemetría aeronáutica limitados a las estaciones terrenas, desplegados en bandas de frecuencias adyacentes por debajo de 1 452 MHz o por encima de 1 492 MHz.
Cuando los WBB ECS se desplieguen dentro de bloques que estén inmediatamente por debajo de 1 452 MHz, los límites indicados en el cuadro 5 para frecuencias por debajo de 1 452 MHz no son aplicables. Cuando los WBB ECS se desplieguen dentro de bloques que estén inmediatamente por encima de 1 492 MHz, los límites indicados en el cuadro 5 para frecuencias por encima de 1 492 MHz no son aplicables. Ello se entiende sin perjuicio de los requisitos fuera de banda establecidos en los cuadros 3 y 4 ni de los requisitos fuera de bloque establecidos en el cuadro 2.
(1) Por ejemplo, una o varias de las siguientes: coordinación de la planificación de frecuencias, coordinación de emplazamientos, límites de potencia dentro de banda más estrictos para las estaciones base, límites de potencia isótropa radiada equivalente fuera de banda para las estaciones de base más estrictos que los que figuran en el cuadro 5.
(2) En un emplazamiento multisectorial, el valor por “celda” se corresponde con el valor de uno de los sectores.
(3) El nivel de potencia de las emisiones no deseadas se entiende aquí como el nivel medido en el puerto de la antena.
(4) En un emplazamiento multisectorial, el valor por “celda” se corresponde con el valor de uno de los sectores.
|
30.4.2018 |
ES |
Diario Oficial de la Unión Europea |
L 110/134 |
DECISIÓN DE EJECUCIÓN (UE) 2018/662 DE LA COMISIÓN
de 27 de abril de 2018
por la que se designa el laboratorio de referencia de la Unión Europea para la influenza aviar y la enfermedad de Newcastle, y por la que se modifica el anexo VII de la Directiva 2005/94/CE del Consejo
[notificada con el número C(2018) 2459]
(Texto pertinente a efectos del EEE)
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Vista la Directiva 92/66/CEE del Consejo, de 14 de julio de 1992, por la que se establecen medidas comunitarias para la lucha contra la enfermedad de Newcastle (1), y en particular su artículo 15, apartado 1,
Vista la Directiva 2005/94/CE del Consejo, de 20 de diciembre de 2005, relativa a medidas comunitarias de lucha contra la influenza aviar y por la que se deroga la Directiva 92/40/CEE (2), y en particular su artículo 63, apartado 2,
Considerando lo siguiente:
|
(1) |
La Directiva 92/66/CEE (*1) establece las medidas mínimas de control que deben tomarse en caso de brote de la enfermedad de Newcastle en aves de corral, palomas mensajeras y otras aves en cautividad. El artículo 15 de dicha Directiva dispone la designación de un laboratorio de referencia de la Unión Europea para la enfermedad de Newcastle a fin de desempeñar las competencias y funciones previstas en dicho artículo. |
|
(2) |
En la Directiva 2005/94/CE se establecen determinadas medidas preventivas relacionadas con la vigilancia y la detección temprana de la influenza aviar y las medidas mínimas de control que deben aplicarse en caso de brote de dicha enfermedad en aves de corral u otras aves cautivas. El artículo 51, apartado 1, de dicha Directiva dispone que el laboratorio citado en su anexo VII, parte 1, será el laboratorio de referencia de la Unión Europea para la influenza aviar y desempeñará las funciones y tareas recogidas en su anexo VII, parte 2. |
|
(3) |
Como consecuencia de la notificación del Reino Unido con arreglo al artículo 50 del Tratado de la Unión Europea, los laboratorios de referencia de la Unión Europea para la influenza aviar y la enfermedad de Newcastle, actualmente designados con arreglo a las Directivas 92/66/CEE y 2005/94/CE, tendrán que interrumpir sus funciones y tareas como laboratorios de referencia de la Unión Europea para estas dos enfermedades. |
|
(4) |
Teniendo en cuenta la gran similitud de la manifestación de la enfermedad, las técnicas de diagnóstico y las competencias y el equipamiento requeridos entre la influenza aviar y la enfermedad de Newcastle, es conveniente designar un único laboratorio de referencia de la Unión Europea para ambas enfermedades. |
|
(5) |
Con el fin de evitar cualquier perturbación de las actividades del laboratorio de referencia de la Unión Europea para la influenza aviar y la enfermedad de Newcastle, y ofrecer al laboratorio recién designado un período de tiempo suficiente para que esté plenamente operativo en sus nuevas competencias y funciones, conviene que las medidas previstas en la presente Decisión se apliquen a partir del 1 de enero de 2019. |
|
(6) |
La Comisión ha llevado a cabo, en estrecha colaboración con los Estados miembros, una convocatoria para seleccionar y designar un laboratorio de referencia de la Unión Europea para la influenza aviar y la enfermedad de Newcastle, teniendo en cuenta los criterios de competencia técnica y científica del laboratorio y de experiencia de su personal. |
|
(7) |
Una vez finalizado el proceso de selección, el laboratorio elegido, el Istituto Zooprofilattico Sperimentale delle Venezie (IZSVe), Legnaro (Italia), debe ser designado laboratorio de referencia de la Unión Europea para la influenza aviar y la enfermedad de Newcastle durante un período indeterminado a partir del 1 de enero de 2019. |
|
(8) |
Las medidas previstas en la presente Decisión de Ejecución se ajustan al dictamen del Comité Permanente de Vegetales, Animales, Alimentos y Piensos. |
HA ADOPTADO LA PRESENTE DECISIÓN:
Artículo 1
Se designa como laboratorio de referencia de la Unión Europea para la influenza aviar y la enfermedad de Newcastle al Istituto Zooprofilattico Sperimentale delle Venezie (IZSVe), Legnaro (Italia).
Artículo 2
En el anexo VII de la Directiva 2005/94/CE, el punto 1 se sustituye por el punto siguiente:
|
«1. |
El laboratorio de referencia de la Unión Europea para la influenza aviar es: Istituto Zooprofilattico Sperimentale delle Venezie (IZSVe), Legnaro (Italia).». |
Artículo 3
La presente Decisión será aplicable a partir del 1 de enero de 2019.
Artículo 4
Los destinatarios de la presente Decisión son los Estados miembros.
Hecho en Bruselas, el 27 de abril de 2018.
Por la Comisión
Vytenis ANDRIUKAITIS
Miembro de la Comisión
(1) DO L 260 de 5.9.1992, p. 1.
(2) DO L 10 de 14.1.2006, p. 16.
(*1) La Directiva 92/66/CEE del Consejo está en proceso de adaptación al TFUE y al Reglamento (UE) 2017/625 del Parlamento Europeo y del Consejo (DO L 95 de 7.4.2017, p. 1) , relativo a los controles oficiales.
|
30.4.2018 |
ES |
Diario Oficial de la Unión Europea |
L 110/136 |
DECISIÓN DE EJECUCIÓN (UE) 2018/663 DE LA COMISIÓN
de 27 de abril de 2018
relativa a determinadas medidas provisionales de protección por lo que respecta a la peste porcina africana en Hungría
[notificada con el número C(2018) 2690]
(El texto en lengua húngara es el único auténtico)
(Texto pertinente a efectos del EEE)
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Vista la Directiva 89/662/CEE del Consejo, de 11 de diciembre de 1989, relativa a los controles veterinarios aplicables en los intercambios intracomunitarios con vistas a la realización del mercado interior (1), y en particular su artículo 9, apartado 3,
Vista la Directiva 90/425/CEE del Consejo, de 26 de junio de 1990, relativa a los controles veterinarios y zootécnicos aplicables en los intercambios intracomunitarios de determinados animales vivos y productos con vistas a la realización del mercado interior (2), y en particular su artículo 10, apartado 3,
Considerando lo siguiente:
|
(1) |
La peste porcina africana es una enfermedad vírica infecciosa que afecta a poblaciones de cerdos domésticos y jabalíes, y puede incidir gravemente en la rentabilidad de la ganadería porcina, perturbando el comercio interior de la Unión y las exportaciones a terceros países. |
|
(2) |
En caso de brote de peste porcina africana en jabalíes, existe el riesgo de que el agente patógeno se propague a otras poblaciones de jabalíes y a explotaciones porcinas. En consecuencia, puede propagarse de un Estado miembro a otro, así como a terceros países, a través del comercio de porcinos vivos o de sus productos. |
|
(3) |
La Directiva 2002/60/CE del Consejo (3) establece las medidas mínimas que deben aplicarse en la Unión para combatir la peste porcina africana. En particular, su artículo 15 prevé la adopción de determinadas medidas a raíz de la confirmación de uno o varios casos de peste porcina africana en jabalíes. |
|
(4) |
Hungría ha informado a la Comisión de la situación actual con respecto a la peste porcina africana en su territorio y, de conformidad con el artículo 15 de la Directiva 2002/60/CE, ha adoptado una serie de medidas, incluido el establecimiento de una zona infectada en la que se aplican las medidas mencionadas en dicho artículo, para evitar la propagación de la mencionada enfermedad. |
|
(5) |
Para prevenir cualquier perturbación innecesaria del comercio interior de la Unión y evitar obstáculos injustificados al comercio por parte de terceros países, es necesario determinar, a nivel de la Unión y en colaboración con Hungría, la zona de dicho Estado miembro infectada de peste porcina africana. |
|
(6) |
Por tanto, a la espera de la reunión del Comité Permanente de Vegetales, Animales, Alimentos y Piensos, es preciso indicar en el anexo de la presente Decisión la zona infectada en Hungría y fijar la duración de la regionalización. |
|
(7) |
La presente Decisión debe reexaminarse en la próxima reunión del Comité Permanente de Vegetales, Animales, Alimentos y Piensos. |
HA ADOPTADO LA PRESENTE DECISIÓN:
Artículo 1
Hungría garantizará que la zona infectada que ha establecido, en la que son aplicables las medidas previstas en el artículo 15 de la Directiva 2002/60/CE, comprenda como mínimo las zonas enumeradas en el anexo de la presente Decisión.
Artículo 2
La presente Decisión será aplicable hasta el 30 de junio de 2018.
Artículo 3
El destinatario de la presente Decisión será Hungría.
Hecho en Bruselas, el 27 de abril de 2018.
Por la Comisión
Vytenis ANDRIUKAITIS
Miembro de la Comisión
(1) DO L 395 de 30.12.1989, p. 13.
(2) DO L 224 de 18.8.1990, p. 29.
(3) Directiva 2002/60/CE del Consejo, de 27 de junio de 2002, por la que se establecen disposiciones específicas de lucha contra la peste porcina africana y se modifica la Directiva 92/119/CEE, en lo que se refiere a la enfermedad de Teschen y a la peste porcina africana (DO L 192 de 20.7.2002, p. 27).
ANEXO
|
Zonas establecidas como zona infectada en Hungría con arreglo al artículo 1 |
Aplicable hasta |
|
Territory of the county of Heves located north of the motorway E 71 |
30 de junio de 2018 |
|
30.4.2018 |
ES |
Diario Oficial de la Unión Europea |
L 110/139 |
DECISIÓN (UE) 2018/664 DE LA JUNTA ÚNICA DE RESOLUCIÓN EN SESIÓN PLENARIA
de 23 de marzo de 2017
por la que se aprueba la gestión relativa a la ejecución del presupuesto y el cierre de las cuentas de la Junta Única de Resolución del ejercicio presupuestario 2015 (JUR/SP/2017/02)
LA JUNTA ÚNICA DE RESOLUCIÓN EN SESIÓN PLENARIA,
Vistos el artículo 50, apartado 1, letra b), y el artículo 63, apartado 8, del Reglamento (UE) n.o 806/2014 del Parlamento Europeo y del Consejo, de 15 de julio de 2014, por el que se establecen normas uniformes y un procedimiento uniforme para la resolución de entidades de crédito y de determinadas empresas de servicios de inversión en el marco de un Mecanismo Único de Resolución y un Fondo Único de Resolución y se modifica el Reglamento (UE) n.o 1093/2010 (1),
Vistos los artículos 103, 104 y 105 del Reglamento Financiero de la Junta Única de Resolución aprobado por la Decisión de la sesión plenaria del 25 de marzo de 2015 (JUR/SP/2015/05) y modificado por la Decisión de la sesión plenaria del 16 de marzo de 2016 (JUR/SP/2016/13),
Vista la Decisión de la sesión plenaria del 6 de enero de 2017, por la que se establece el procedimiento para que la sesión plenaria apruebe la gestión de la presidenta de la Junta Única de Resolución relativa a la ejecución del presupuesto (JUR/SP/2017/01),
Vistas las cuentas anuales finales de la Junta Única de Resolución para el ejercicio presupuestario 2015 aprobado en la sesión del 28 de junio de 2016,
Visto el Informe Anual de Actividades de la Junta Única de Resolución para el ejercicio presupuestario 2015 aprobado en la sesión del 28 de junio de 2016,
Visto el Informe Anual del Tribunal de Cuentas que comprende la declaración de fiabilidad relativa a las cuentas y la legalidad y regularidad de las operaciones subyacentes, así como la buena gestión financiera del ejercicio presupuestario 2015, acompañado de las respuestas de la Junta Única de Resolución,
Visto el Informe del Tribunal de Cuentas con arreglo al artículo 92, apartado 4, del Reglamento (UE) n.o 806/2014, sobre cualquier pasivo contingente (ya sean de la Junta Única de Resolución, del Consejo, de la Comisión o de otro tipo) derivado de la realización por parte de la Junta Única de Resolución, el Consejo y la Comisión de sus funciones de conformidad con dicho Reglamento, junto con las respuestas de la Junta Única de Resolución, el Consejo y la Comisión,
HA DECIDIDO:
|
1. |
Aprobar la gestión de la presidenta de la Junta Única de Resolución relativa a la ejecución del presupuesto de la Junta para el ejercicio presupuestario 2015; |
|
2. |
Aprobar el cierre de las cuentas de la Junta Única de Resolución para el ejercicio presupuestario 2015; |
|
3. |
Establecer sus observaciones en la siguiente moción; |
|
4. |
Ordenar a la presidenta de la Junta Única de Resolución que notifique la presente Decisión al Consejo, la Comisión y el Tribunal de Cuentas para que dispongan su publicación en el Diario Oficial de la Unión Europea y en el sitio web de la JUR. |
Hecho en Bruselas, 23 de marzo de 2017.
La Junta en sesión plenaria
Miembro de la sesión plenaria de la JUR
Frank ELDERSON
(1) DO L 225 de 30.7.2014, p. 1.
|
30.4.2018 |
ES |
Diario Oficial de la Unión Europea |
L 110/140 |
DECISIÓN (UE) 2018/665 DE LA JUNTA EN SESIÓN PLENARIA
de 15 de marzo de 2018
sobre la aprobación de la ejecución del presupuesto y la clausura de las cuentas de la Junta Única de Resolución para el ejercicio financiero de 2016 (SRB/PS/2018/02)
La JUNTA ÚNICA DE RESOLUCIÓN EN SESIÓN PLENARIA,
Visto el artículo 50, apartado 1, letra b), y el artículo 63, apartado 8, del Reglamento (UE) n.o 806/2014 del Parlamento Europeo y del Consejo, de 15 de julio de 2014, por el que se establecen normas uniformes y un procedimiento uniforme para la resolución de entidades de crédito y de determinadas empresas de servicios de inversión en el marco de un Mecanismo Único de Resolución y un Fondo Único de Resolución y se modifica el Reglamento (UE) n.o 1093/2010 (1),
Vistos los artículos 103, 104 y 105 del Reglamento financiero SRB,
Vistas las cuentas anuales definitivas de la SRB para el ejercicio 2016, aprobadas en su reunión de 22 de junio de 2017,
Visto el Informe Anual de Actividades de la Junta Única de Resolución para el ejercicio presupuestario 2016 aprobado en la sesión del 22 de junio de 2017,
Visto el Informe Anual del Tribunal de Cuentas que comprende la declaración de fiabilidad relativa a las cuentas y la legalidad y regularidad de las operaciones subyacentes, así como la buena gestión financiera del ejercicio presupuestario 2016, acompañado de las respuestas de la Junta Única de Resolución,
Visto el Informe de auditoría con arreglo al artículo 92, apartado 4, del Reglamento (UE) n.o 806/2014 sobre cualquier pasivo contingente (ya sean de la Junta Única de Resolución, del Consejo, de la Comisión o de otro tipo) derivado de la realización por parte de la Junta Única de Resolución, el Consejo y la Comisión de sus funciones de conformidad con dicho Reglamento en relación con el ejercicio 2016, junto con las respuestas de la Junta Única de Resolución, el Consejo y la Comisión.
HA DECIDIDO:
|
1. |
Aprobar la gestión de la presidencia de la Junta Única de Resolución relativa a la ejecución del presupuesto de la Junta para el ejercicio presupuestario 2016; |
|
2. |
Aprobar el cierre de las cuentas de la Junta Única de Resolución para el ejercicio presupuestario 2016; |
|
3. |
Establecer sus observaciones en la siguiente moción; |
|
4. |
Ordenar a la Presidencia de la Junta Única de Resolución que notifique esta decisión al Consejo, la Comisión y el Tribunal de cuentas, que disponga su publicación en el Diario Oficial de la Unión Europea y en la página web de la SRB. |
Hecho en Bruselas, el 15 de marzo de 2018.
La Junta en sesión plenaria
Miembro de la sesión plenaria de la SRB
Tuija TAOS
(1) DO L 225 de 30.7.2014, p. 1.