ISSN 1977-0685
Diario Oficial
de la Unión Europea
L 120

Edición en lengua española
Legislación
60.° año
11 de mayo de 2017
|
ISSN 1977-0685 |
||
|
Diario Oficial de la Unión Europea |
L 120 |
|

|
||
|
Edición en lengua española |
Legislación |
60.° año |
|
|
|
Corrección de errores |
|
|
|
* |
|
|
|
|
|
(1) Texto pertinente a efectos del EEE. |
|
ES |
Los actos cuyos títulos van impresos en caracteres finos son actos de gestión corriente, adoptados en el marco de la política agraria, y que tienen generalmente un período de validez limitado. Los actos cuyos títulos van impresos en caracteres gruesos y precedidos de un asterisco son todos los demás actos. |
II Actos no legislativos
REGLAMENTOS
|
11.5.2017 |
ES |
Diario Oficial de la Unión Europea |
L 120/1 |
REGLAMENTO DE EJECUCIÓN (UE) 2017/791 DE LA COMISIÓN
de 26 de abril de 2017
por el que se inscribe una denominación en el Registro de Denominaciones de Origen Protegidas y de Indicaciones Geográficas [Stupavské Zelé (DOP)]
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Visto el Reglamento (UE) n.o 1151/2012 del Parlamento Europeo y del Consejo, de 21 de noviembre de 2012, sobre los regímenes de calidad de los productos agrícolas y alimenticios (1), y en particular su artículo 52, apartado 2,
Considerando lo siguiente:
|
(1) |
De conformidad con el artículo 50, apartado 2, letra a), del Reglamento (UE) n.o 1151/2012, se ha publicado en el Diario Oficial de la Unión Europea la solicitud de registro de la denominación «Stupavské Zelé» presentada por Eslovaquia (2). |
|
(2) |
Al no haberse notificado a la Comisión ninguna declaración de oposición de conformidad con el artículo 51 del Reglamento (UE) n.o 1151/2012, procede registrar la denominación citada. |
HA ADOPTADO EL PRESENTE REGLAMENTO:
Artículo 1
Queda registrada la denominación «Stupavské Zelé» (DOP).
La denominación contemplada en el párrafo primero identifica un producto de la clase 1.6, Frutas, hortalizas y cereales frescos o transformados, del anexo XI del Reglamento de Ejecución (UE) n.o 668/2014 de la Comisión (3).
Artículo 2
El presente Reglamento entrará en vigor a los veinte días de su publicación en el Diario Oficial de la Unión Europea.
El presente Reglamento será obligatorio en todos sus elementos y directamente aplicable en cada Estado miembro.
Hecho en Bruselas, el 26 de abril de 2017.
Por la Comisión,
en nombre del Presidente,
Phil HOGAN
Miembro de la Comisión
(1) DO L 343 de 14.12.2012, p. 1.
(3) Reglamento de Ejecución (UE) n.o 668/2014 de la Comisión, de 13 de junio de 2014, que establece las normas de desarrollo del Reglamento (UE) n.o 1151/2012 del Parlamento Europeo y del Consejo sobre los regímenes de calidad de los productos agrícolas y alimenticios (DO L 179 de 19.6.2014, p. 36).
|
11.5.2017 |
ES |
Diario Oficial de la Unión Europea |
L 120/3 |
REGLAMENTO (UE) 2017/792 DE LA COMISIÓN
de 5 de mayo de 2017
por el que se prohíbe temporalmente la pesca de gallineta nórdica en la zona NAFO 3M por parte de los buques que enarbolan pabellón de un Estado miembro de la Unión Europea
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Visto el Reglamento (CE) n.o 1224/2009 del Consejo, de 20 de noviembre de 2009, por el que se establece un régimen comunitario de control para garantizar el cumplimiento de las normas de la política pesquera común (1), y en particular su artículo 36, apartado 2,
Considerando lo siguiente:
|
(1) |
El Reglamento (UE) 2017/127 del Consejo (2) fija las cuotas para el año 2017. |
|
(2) |
Según la información recibida por la Comisión, las capturas de la población citada en el anexo del presente Reglamento por parte de buques que enarbolan pabellón de la Unión Europea o que están matriculados en la Unión Europea han agotado la cuota intermedia asignada para el período anterior al 1 de julio de 2017. |
|
(3) |
Es necesario, por lo tanto, prohibir las actividades pesqueras dirigidas a esa población hasta el 30 de junio de 2017. |
HA ADOPTADO EL PRESENTE REGLAMENTO:
Artículo 1
Agotamiento de la cuota
La cuota de pesca asignada a los Estados miembros mencionados en el anexo del presente Reglamento respecto a la población citada en dicho anexo para el período comprendido entre el 1 de enero de 2017 y el 30 de junio de 2017, ambas fechas inclusive, se considerará agotada a partir de la fecha indicada en dicho anexo.
Artículo 2
Prohibiciones
Se prohíben las actividades pesqueras dirigidas a la población citada en el anexo del presente Reglamento por parte de los buques que enarbolan pabellón de los Estados miembros o que están matriculados en los Estados miembros mencionados en dicho anexo desde la fecha indicada en el citado anexo hasta el 30 de junio de 2017, inclusive.
Artículo 3
Entrada en vigor
El presente Reglamento entrará en vigor al día siguiente de su publicación en el Diario Oficial de la Unión Europea.
El presente Reglamento será obligatorio en todos sus elementos y directamente aplicable en cada Estado miembro.
Hecho en Bruselas, el 5 de mayo de 2017.
Por la Comisión,
en nombre del Presidente,
João AGUIAR MACHADO
Director General
Dirección General de Asuntos Marítimos y Pesca
(1) DO L 343 de 22.12.2009, p. 1.
(2) Reglamento (UE) 2017/127 del Consejo, de 20 de enero de 2017, por el que se establecen, para 2017, las posibilidades de pesca para determinadas poblaciones y grupos de poblaciones de peces, aplicables en aguas de la Unión y, en el caso de los buques de la Unión, en determinadas aguas no pertenecientes a la Unión (DO L 24 de 28.1.2017, p. 1).
ANEXO
|
N.o |
07/TQ127 |
|
Estado miembro |
Unión Europea (todos los Estados miembros) |
|
Población |
RED/N3M. |
|
Especie |
Gallineta nórdica (Sebastes spp.) |
|
Zona |
NAFO 3M |
|
Período de cierre |
27.2.2017-30.6.2017 |
|
11.5.2017 |
ES |
Diario Oficial de la Unión Europea |
L 120/5 |
REGLAMENTO DE EJECUCIÓN (UE) 2017/793 DE LA COMISIÓN
de 10 de mayo de 2017
por el que se modifica el Reglamento (CE) n.o 180/2008 en lo que respecta a la prórroga del período de designación del laboratorio de referencia de la UE para enfermedades de los équidos distintas de la peste equina africana
(Texto pertinente a efectos del EEE)
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Vista la Directiva 2009/156/CE del Consejo, de 30 de noviembre de 2009, relativa a las condiciones de policía sanitaria que regulan los movimientos de équidos y las importaciones de équidos procedentes de terceros países (1), y en particular su artículo 19, letra d),
Considerando lo siguiente:
|
(1) |
Mediante el Reglamento (CE) n.o 180/2008 de la Comisión (2), la Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail (ANSES) de Francia, con sus laboratorios de sanidad animal y enfermedades de los équidos, fue designada como laboratorio de referencia de la UE para enfermedades de los équidos distintas de la peste equina africana, y en el anexo de dicho Reglamento se definen las funciones, tareas y procedimientos de colaboración con los laboratorios encargados del diagnóstico de las enfermedades infecciosas de los équidos en los Estados miembros. |
|
(2) |
En el Reglamento (CE) n.o 180/2008, adoptado por la Comisión en 2008, la Agence française de sécurité sanitaire des aliments (AFSSA) fue designada como laboratorio de referencia de la UE para enfermedades de los équidos distintas de la peste equina africana por un período inicial de cinco años, que expiró el 30 de junio de 2013. El Reglamento (UE) n.o 208/2011 de la Comisión (3) actualizó el Reglamento (CE) n.o 180/2008 por lo que respecta al nombre de la entidad, esto es, la Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail (ANSES). El Reglamento (CE) n.o 180/2008, modificado por el Reglamento de Ejecución (UE) n.o 72/2013 de la Comisión (4), amplió el período de designación de la ANSES por un período adicional de cinco años, que expira el 30 de junio de 2018. |
|
(3) |
Durante más de ocho años, la ANSES ha cumplido sus funciones, tareas y procedimientos, mejorando notablemente la capacidad de los laboratorios nacionales de referencia para el diagnóstico y el diagnóstico diferencial de determinadas enfermedades de los équidos. |
|
(4) |
Con el fin de garantizar una elevada calidad y uniformidad de los resultados analíticos y de diagnóstico en la Unión, es importante que la ANSES mantenga sus actividades como laboratorio de referencia de la UE para enfermedades de los équidos distintas de la peste equina africana por un período adicional de cinco años. |
|
(5) |
Procede, por tanto, modificar el Reglamento (CE) n.o 180/2008 en consecuencia. |
|
(6) |
Las medidas previstas en el presente Reglamento se ajustan al dictamen del Comité Permanente de Vegetales, Animales, Alimentos y Piensos. |
HA ADOPTADO EL PRESENTE REGLAMENTO:
Artículo 1
En el artículo 1, apartado 1, del Reglamento (CE) n.o 180/2008, la fecha «30 de junio de 2018» se sustituye por «30 de junio de 2023».
Artículo 2
El presente Reglamento entrará en vigor a los veinte días de su publicación en el Diario Oficial de la Unión Europea.
El presente Reglamento será obligatorio en todos sus elementos y directamente aplicable en cada Estado miembro.
Hecho en Bruselas, el 10 de mayo de 2017.
Por la Comisión
El Presidente
Jean-Claude JUNCKER
(1) DO L 192 de 23.7.2010, p. 1.
(2) Reglamento (CE) n.o 180/2008 de la Comisión, de 28 de febrero de 2008, relativo al laboratorio comunitario de referencia para enfermedades de los équidos distintas de la peste equina africana y por el que se modifica el anexo VII del Reglamento (CE) n.o 882/2004 del Parlamento Europeo y del Consejo (DO L 56 de 29.2.2008, p. 4).
(3) Reglamento (UE) n.o 208/2011 de la Comisión, de 2 de marzo de 2011, por el que se modifica el anexo VII del Reglamento (CE) n.o 882/2004 del Parlamento Europeo y del Consejo y los Reglamentos (CE) n.o 180/2008 y (CE) n.o 737/2008 de la Comisión en lo que respecta a las listas y los nombres de los laboratorios de referencia de la UE (DO L 58 de 3.3.2011, p. 29).
(4) Reglamento de Ejecución (UE) n.o 72/2013 de la Comisión, de 25 de enero de 2013, por el que se modifican los Reglamentos (CE) n.o 180/2008 y (CE) n.o 737/2008 en lo referente al período de designación de los laboratorios de referencia de la UE (DO L 26 de 26.1.2013, p. 9).
|
11.5.2017 |
ES |
Diario Oficial de la Unión Europea |
L 120/7 |
REGLAMENTO DE EJECUCIÓN (UE) 2017/794 DE LA COMISIÓN
de 10 de mayo de 2017
por el que se aprueba el uso de dióxido de silicio/tierra de diatomeas como sustancia activa existente en biocidas del tipo de producto 18
(Texto pertinente a efectos del EEE)
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Visto el Reglamento (UE) n.o 528/2012 del Parlamento Europeo y del Consejo, de 22 de mayo de 2012, relativo a la comercialización y el uso de los biocidas (1), y en particular su artículo 89, apartado 1, párrafo tercero,
Considerando lo siguiente:
|
(1) |
El Reglamento Delegado (UE) n.o 1062/2014 de la Comisión (2) establece una lista de las sustancias activas existentes que deben evaluarse para la posible aprobación de su uso en biocidas. Dicha lista incluye el dióxido de silicio/tierra de diatomeas. |
|
(2) |
El dióxido de silicio/tierra de diatomeas ha sido evaluado para su utilización en biocidas del tipo de producto 18 (insecticidas, acaricidas y productos para controlar otros artrópodos), tal como se describe en el anexo V del Reglamento (UE) n.o 528/2012. |
|
(3) |
Francia fue designada autoridad competente evaluadora y presentó el informe de evaluación, junto con sus recomendaciones, el 18 de diciembre de 2015. |
|
(4) |
El 11 de octubre de 2016, de conformidad con el artículo 7, apartado 2, del Reglamento Delegado (UE) n.o 1062/2014, el Comité de Biocidas presentó el dictamen de la Agencia Europea de Sustancias y Mezclas Químicas, teniendo en cuenta las conclusiones de la autoridad competente evaluadora. |
|
(5) |
Según dicho dictamen, cabe esperar que los biocidas del tipo de producto 18 que contienen dióxido de silicio/tierra de diatomeas cumplan los criterios del artículo 19, apartado 1, letra b), del Reglamento (UE) n.o 528/2012, siempre que se cumplan determinadas especificaciones y condiciones de uso. |
|
(6) |
Procede, por tanto, aprobar el uso de dióxido de silicio/tierra de diatomeas en biocidas del tipo de producto 18 con la condición de que se cumplan determinadas especificaciones y condiciones. |
|
(7) |
Antes de aprobar una sustancia activa es conveniente dejar que transcurra un plazo razonable, a fin de que las partes interesadas puedan tomar las medidas preparatorias necesarias para cumplir los nuevos requisitos. |
|
(8) |
Las medidas previstas en el presente Reglamento se ajustan al dictamen del Comité Permanente de Biocidas. |
HA ADOPTADO EL PRESENTE REGLAMENTO:
Artículo 1
Se aprueba el dióxido de silicio/tierra de diatomeas como sustancia activa para su uso en biocidas del tipo de producto 18, siempre que se cumplan las especificaciones y condiciones establecidas en el anexo.
Artículo 2
El presente Reglamento entrará en vigor a los veinte días de su publicación en el Diario Oficial de la Unión Europea.
El presente Reglamento será obligatorio en todos sus elementos y directamente aplicable en cada Estado miembro.
Hecho en Bruselas, el 10 de mayo de 2017.
Por la Comisión
El Presidente
Jean-Claude JUNCKER
(1) DO L 167 de 27.6.2012, p. 1.
(2) Reglamento Delegado (UE) n.o 1062/2014 de la Comisión, de 4 de agosto de 2014, relativo al programa de trabajo para el examen sistemático de todas las sustancias activas existentes contenidas en los biocidas que se mencionan en el Reglamento (UE) n.o 528/2012 del Parlamento Europeo y del Consejo (DO L 294 de 10.10.2014, p. 1).
ANEXO
|
Denominación común |
Denominación IUPAC Números de identificación |
Grado de pureza mínimo de la sustancia activa (1) |
Fecha de aprobación |
Fecha de expiración de la aprobación |
Tipo de producto |
Condiciones específicas |
||||||||||
|
Dióxido de silicio/tierra de diatomeas |
Denominación IUPAC: Dióxido de silicio/tierra de diatomeas N.o CE: no disponible N.o CAS: 61790-53-2 |
1 000 g/kg en peso (100 %) |
1 de noviembre de 2018 |
31 de octubre de 2028 |
18 |
Las autorizaciones de los biocidas están subordinadas a las condiciones siguientes:
|
(1) La pureza indicada en esta columna es el grado de pureza mínimo de la sustancia activa evaluada de conformidad con el artículo 89, apartado 1, del Reglamento (UE) n.o 528/2012. La sustancia activa en el producto comercializado puede tener una pureza igual o diferente, si se ha demostrado que es técnicamente equivalente a la sustancia activa evaluada.
(2) Reglamento (CE) n.o 470/2009 del Parlamento Europeo y del Consejo, de 6 de mayo de 2009, por el que se establecen procedimientos comunitarios para la fijación de los límites de residuos de las sustancias farmacológicamente activas en los alimentos de origen animal, se deroga el Reglamento (CEE) n.o 2377/90 del Consejo y se modifican la Directiva 2001/82/CE del Parlamento Europeo y del Consejo y el Reglamento (CE) n.o 726/2004 del Parlamento Europeo y del Consejo (DO L 152 de 16.6.2009, p. 11).
(3) Reglamento (CE) n.o 396/2005 del Parlamento Europeo y del Consejo, de 23 de febrero de 2005, relativo a los límites máximos de residuos de plaguicidas en alimentos y piensos de origen vegetal y animal y que modifica a la Directiva 91/414/CEE del Consejo (DO L 70 de 16.3.2005, p. 1).
|
11.5.2017 |
ES |
Diario Oficial de la Unión Europea |
L 120/10 |
REGLAMENTO DE EJECUCIÓN (UE) 2017/795 DE LA COMISIÓN
de 10 de mayo de 2017
por el que se aprueba el uso del dióxido de silicio pirógeno sintético amorfo, nano, tratado en superficie, como sustancia activa existente en biocidas del tipo de producto 18
(Texto pertinente a efectos del EEE)
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Visto el Reglamento (UE) n.o 528/2012 del Parlamento Europeo y del Consejo, de 22 de mayo de 2012, relativo a la comercialización y el uso de los biocidas (1), y en particular su artículo 89, apartado 1, párrafo tercero,
Considerando lo siguiente:
|
(1) |
El Reglamento Delegado (UE) n.o 1062/2014 de la Comisión (2) establece una lista de sustancias activas existentes que deben evaluarse de cara a su posible aprobación para su uso en biocidas. Dicha lista incluye el dióxido de silicio (como nanomaterial formado por agregados y aglomerados), que debe pasar a denominarse dióxido de silicio pirógeno sintético amorfo, nano, tratado en superficie, a raíz de su evaluación. |
|
(2) |
El dióxido de silicio pirógeno sintético amorfo, nano, tratado en superficie, ha sido evaluado para ser utilizado en biocidas del tipo de producto 18, insecticidas, acaricidas y productos para controlar otros artrópodos, conforme se describe en el anexo V del Reglamento (UE) n.o 528/2012. |
|
(3) |
Francia fue designada autoridad competente evaluadora y presentó el informe de evaluación, junto con sus recomendaciones, el 18 de diciembre de 2015. |
|
(4) |
De conformidad con lo dispuesto en el artículo 7, apartado 2, del Reglamento Delegado (UE) n.o 1062/2014, el 11 de octubre de 2016 el Comité de Biocidas presentó el dictamen de la Agencia Europea de Sustancias y Mezclas Químicas, teniendo en cuenta las conclusiones de la autoridad competente evaluadora. |
|
(5) |
Según dicho dictamen, cabe esperar que los biocidas del tipo de producto 18 que contienen dióxido de silicio pirógeno sintético amorfo, nano, tratado en superficie, cumplan los requisitos del artículo 19, apartado 1, letra b), del Reglamento (UE) n.o 528/2012, siempre que se cumplan determinadas especificaciones y condiciones relacionadas con su uso. |
|
(6) |
Procede, por tanto, aprobar el uso del dióxido de silicio pirógeno sintético amorfo, nano, tratado en superficie, siempre que se cumplan determinadas especificaciones y condiciones. |
|
(7) |
Dado que el dióxido de silicio pirógeno sintético amorfo, nano, tratado en superficie, es un nanomaterial, la aprobación debe incluir esos nanomateriales, con arreglo a lo dispuesto en el artículo 4, apartado 4, del Reglamento (UE) n.o 528/2012, siempre que se cumplan determinadas especificaciones y condiciones relacionadas con su uso. |
|
(8) |
Antes de aprobar una sustancia activa es conveniente dejar que transcurra un plazo razonable, a fin de que las partes interesadas puedan tomar las medidas preparatorias necesarias para cumplir los nuevos requisitos. |
|
(9) |
Las medidas previstas en el presente Reglamento se ajustan al dictamen del Comité Permanente de Biocidas. |
HA ADOPTADO EL PRESENTE REGLAMENTO:
Artículo 1
Se aprueba el dióxido de silicio pirógeno sintético amorfo, nano, tratado en superficie, como sustancia activa para su uso en biocidas del tipo de producto 18, siempre que se cumplan las especificaciones y condiciones establecidas en el anexo.
Artículo 2
El presente Reglamento entrará en vigor el vigésimo día siguiente al de su publicación en el Diario Oficial de la Unión Europea.
El presente Reglamento será obligatorio en todos sus elementos y directamente aplicable en cada Estado miembro.
Hecho en Bruselas, el 10 de mayo de 2017.
Por la Comisión
El Presidente
Jean-Claude JUNCKER
(1) DO L 167 de 27.6.2012, p. 1.
(2) Reglamento Delegado (UE) n.o 1062/2014 de la Comisión, de 4 de agosto de 2014, relativo al programa de trabajo para el examen sistemático de todas las sustancias activas existentes contenidas en los biocidas que se mencionan en el Reglamento (UE) n.o 528/2012 del Parlamento Europeo y del Consejo (DO L 294 de 10.10.2014, p. 1).
ANEXO
|
Denominación común |
Denominación IUPAC Números de identificación |
Grado de pureza mínimo de la sustancia activa (1) |
Características estructurales de referencia (2) |
Fecha de aprobación |
Fecha de expiración de la aprobación |
Tipo de producto |
Condiciones específicas |
||||||||||||||||
|
Dióxido de silicio pirógeno sintético amorfo, nano, tratado en superficie |
Denominación: silanamina, 1,1,1-trimetil-N-(trimetilsilil)-, productos de hidrolisis con sílice N.o CE: 272-697-1 N.o CAS: 68909-20-6 |
998 g/kg (pureza del núcleo medida después de la combustión) |
|
1 de noviembre de 2018 |
31 de octubre de 2028 |
18 |
Las autorizaciones de los biocidas quedan subordinadas a las condiciones siguientes:
|
(1) La pureza indicada en esta columna es el grado de pureza mínimo de la sustancia activa evaluada de conformidad con el artículo 89, apartado 1, del Reglamento (UE) n.o 528/2012. La sustancia activa en el biocida comercializado puede tener una pureza igual o diferente, si se ha demostrado que es técnicamente equivalente a la sustancia activa evaluada.
(2) Las características estructurales indicadas en esta columna son las de la sustancia activa utilizada para la evaluación realizada de conformidad con el artículo 89, apartado 1 del Reglamento (UE) n.o 528/2012.
(3) Reglamento (CE) n.o 470/2009 del Parlamento Europeo y del Consejo, de 6 de mayo de 2009, por el que se establecen procedimientos comunitarios para la fijación de los límites de residuos de las sustancias farmacológicamente activas en los alimentos de origen animal, se deroga el Reglamento (CEE) n.o 2377/90 del Consejo y se modifican la Directiva 2001/82/CE del Parlamento Europeo y del Consejo y el Reglamento (CE) n.o 726/2004 del Parlamento Europeo y del Consejo (DO L 152 de 16.6.2009, p. 11).
(4) Reglamento (CE) n.o 396/2005 del Parlamento Europeo y del Consejo, de 23 de febrero de 2005, relativo a los límites máximos de residuos de plaguicidas en alimentos y piensos de origen vegetal y animal y que modifica a la Directiva 91/414/CEE del Consejo (DO L 70 de 16.3.2005, p. 1).
|
11.5.2017 |
ES |
Diario Oficial de la Unión Europea |
L 120/13 |
REGLAMENTO DE EJECUCIÓN (UE) 2017/796 DE LA COMISIÓN
de 10 de mayo de 2017
por el que se aprueba el uso de la diclofluanida como sustancia activa existente en biocidas del tipo de producto 21
(Texto pertinente a efectos del EEE)
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Visto el Reglamento (UE) n.o 528/2012 del Parlamento Europeo y del Consejo, de 22 de mayo de 2012, relativo a la comercialización y el uso de los biocidas (1), y en particular su artículo 89, apartado 1, párrafo tercero,
Considerando lo siguiente:
|
(1) |
El Reglamento Delegado (UE) n.o 1062/2014 de la Comisión (2) establece una lista de sustancias activas existentes que deben evaluarse de cara a una posible aprobación para su uso en biocidas. En esa lista figura la sustancia diclofluanida. |
|
(2) |
La diclofluanida se ha evaluado para ser utilizada en productos del tipo de producto 21, productos antiincrustantes, conforme se describe en el anexo V del Reglamento (UE) n.o 528/2012. |
|
(3) |
El Reino Unido fue designado autoridad competente evaluadora y presentó los informes de evaluación, junto con sus recomendaciones, el 22 de octubre de 2015. |
|
(4) |
De conformidad con lo dispuesto en el artículo 7, apartado 2, del Reglamento Delegado (UE) n.o 1062/2014, el 11 de octubre de 2016 el Comité de Biocidas presentó el dictamen de la Agencia Europea de Sustancias y Mezclas Químicas, teniendo en cuenta las conclusiones de la autoridad competente evaluadora. |
|
(5) |
Según dicho dictamen, cabe esperar que los productos del tipo de producto 21 que contienen diclofluanida cumplan los requisitos del artículo 19, apartado 1, letra b), del Reglamento (UE) n.o 528/2012, siempre que se cumplan determinadas especificaciones y condiciones relacionadas con su uso. |
|
(6) |
No obstante, debe confirmarse de nuevo que los riesgos relacionados con el uso de productos antiincrustantes son aceptables, y también que las medidas de reducción del riesgo propuestas son adecuadas. Con el fin de facilitar, en el momento de la renovación de la aprobación de sustancias activas antiincrustantes existentes, el examen y la comparación de los riesgos y las ventajas de estas sustancias, así como de las medidas de reducción del riesgo aplicadas, la fecha de expiración de la aprobación de todas estas sustancias debe ser la misma. |
|
(7) |
Procede, por tanto, aprobar la diclofluanida para su uso en biocidas del tipo de producto 21, siempre que se cumplan determinadas especificaciones y condiciones. |
|
(8) |
Dado que la diclofluanida cumple los criterios de clasificación como sensibilizante cutáneo de categoría 1 conforme a la definición del anexo I del Reglamento (CE) n.o 1272/2008 del Parlamento Europeo y del Consejo (3), los artículos tratados con ella o que la incorporen deben ser debidamente etiquetados en el momento de su introducción en el mercado. |
|
(9) |
Antes de aprobar una sustancia activa es conveniente dejar que transcurra un plazo razonable, a fin de que las partes interesadas puedan tomar las medidas preparatorias necesarias para cumplir los nuevos requisitos. |
|
(10) |
Las medidas previstas en el presente Reglamento se ajustan al dictamen del Comité Permanente de Biocidas. |
HA ADOPTADO EL PRESENTE REGLAMENTO:
Artículo 1
Se aprueba la diclofluanida como sustancia activa para su uso en biocidas del tipo de producto 21, siempre que se cumplan las especificaciones y condiciones establecidas en el anexo.
Artículo 2
El presente Reglamento entrará en vigor el vigésimo día siguiente al de su publicación en el Diario Oficial de la Unión Europea.
El presente Reglamento será obligatorio en todos sus elementos y directamente aplicable en cada Estado miembro.
Hecho en Bruselas, el 10 de mayo de 2017.
Por la Comisión
El Presidente
Jean-Claude JUNCKER
(1) DO L 167 de 27.6.2012, p. 1.
(2) Reglamento Delegado (UE) n.o 1062/2014 de la Comisión, de 4 de agosto de 2014, relativo al programa de trabajo para el examen sistemático de todas las sustancias activas existentes contenidas en los biocidas que se mencionan en el Reglamento (UE) n.o 528/2012 del Parlamento Europeo y del Consejo (DO L 294 de 10.10.2014, p. 1).
(3) Reglamento (CE) n.o 1272/2008 del Parlamento Europeo y del Consejo, de 16 de diciembre de 2008, sobre clasificación, etiquetado y envasado de sustancias y mezclas, y por el que se modifican y derogan las Directivas 67/548/CEE y 1999/45/CE y se modifica el Reglamento (CE) n.o 1907/2006 (DO L 353 de 31.12.2008, p. 1).
ANEXO
|
Denominación común |
Denominación IUPAC Números de identificación |
Grado de pureza mínimo de la sustancia activa (1) |
Fecha de aprobación |
Fecha de expiración de la aprobación |
Tipo de producto |
Condiciones específicas |
||||||||||
|
Diclofluanida |
Denominación IUPAC: N-diclorofluorometiltio-N′,N′-dimetil-N-fenil-sulfamida N.o CE: 214-118-7 N.o CAS: 1085-98-9 |
96 % p/p |
1 de noviembre de 2018 |
31 de diciembre de 2025 |
21 |
En la evaluación del producto se prestará una atención especial a las exposiciones, los riesgos y la eficacia relacionados con cualquiera de los usos contemplados en una solicitud de autorización, pero que no se hayan considerado en la evaluación de riesgos de la sustancia activa a nivel de la Unión. En el caso de que posteriormente se autoricen productos que contengan diclofluanida para su utilización por usuarios no profesionales, las personas que comercialicen productos para usuarios no profesionales se asegurarán de que los productos se suministren con los guantes adecuados. Las autorizaciones de los biocidas quedan subordinadas a las condiciones siguientes:
La introducción en el mercado de artículos tratados está sujeta a la siguiente condición: la persona responsable de la comercialización de un artículo tratado con diclofluanida o que la incorpore deberá velar por que la etiqueta de dicho artículo tratado facilite la información que se indica en el artículo 58, apartado 3, párrafo segundo, del Reglamento (UE) n.o 528/2012. |
(1) La pureza indicada en esta columna es el grado de pureza mínimo de la sustancia activa evaluada de conformidad con el artículo 89, apartado 1, del Reglamento (UE) n.o 528/2012. La sustancia activa en el producto comercializado puede tener una pureza igual o diferente, si se ha demostrado que es técnicamente equivalente a la sustancia activa evaluada.
(2) Reglamento (CE) n.o 470/2009 del Parlamento Europeo y del Consejo, de 6 de mayo de 2009, por el que se establecen procedimientos comunitarios para la fijación de los límites de residuos de las sustancias farmacológicamente activas en los alimentos de origen animal, se deroga el Reglamento (CEE) n.o 2377/90 del Consejo y se modifican la Directiva 2001/82/CE del Parlamento Europeo y del Consejo y el Reglamento (CE) n.o 726/2004 del Parlamento Europeo y del Consejo (DO L 152 de 16.6.2009, p. 11).
(3) Reglamento (CE) n.o 396/2005 del Parlamento Europeo y del Consejo, de 23 de febrero de 2005, relativo a los límites máximos de residuos de plaguicidas en alimentos y piensos de origen vegetal y animal y que modifica a la Directiva 91/414/CEE del Consejo (DO L 70 de 16.3.2005, p. 1).
|
11.5.2017 |
ES |
Diario Oficial de la Unión Europea |
L 120/17 |
REGLAMENTO DE EJECUCIÓN (UE) 2017/797 DE LA COMISIÓN
de 10 de mayo de 2017
por el que se establecen valores de importación a tanto alzado para la determinación del precio de entrada de determinadas frutas y hortalizas
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Visto el Reglamento (UE) n.o 1308/2013 del Parlamento Europeo y del Consejo, de 17 de diciembre de 2013, por el que se crea la organización común de mercados de los productos agrarios y por el que se derogan los Reglamentos (CEE) n.o 922/72, (CEE) n.o 234/79, (CE) n.o 1037/2001 y (CE) n.o 1234/2007 (1),
Visto el Reglamento de Ejecución (UE) n.o 543/2011 de la Comisión, de 7 de junio de 2011, por el que se establecen disposiciones de aplicación del Reglamento (CE) n.o 1234/2007 del Consejo en los sectores de las frutas y hortalizas y de las frutas y hortalizas transformadas (2), y en particular su artículo 136, apartado 1,
Considerando lo siguiente:
|
(1) |
El Reglamento de Ejecución (UE) n.o 543/2011 establece, en aplicación de los resultados de las negociaciones comerciales multilaterales de la Ronda Uruguay, los criterios para que la Comisión fije los valores de importación a tanto alzado de terceros países correspondientes a los productos y períodos que figuran en el anexo XVI, parte A, de dicho Reglamento. |
|
(2) |
De acuerdo con el artículo 136, apartado 1, del Reglamento de Ejecución (UE) n.o 543/2011, el valor de importación a tanto alzado se calcula cada día hábil teniendo en cuenta datos que varían diariamente. Por lo tanto, el presente Reglamento debe entrar en vigor el día de su publicación en el Diario Oficial de la Unión Europea. |
HA ADOPTADO EL PRESENTE REGLAMENTO:
Artículo 1
En el anexo del presente Reglamento quedan fijados los valores de importación a tanto alzado a que se refiere el artículo 136 del Reglamento de Ejecución (UE) n.o 543/2011.
Artículo 2
El presente Reglamento entrará en vigor el día de su publicación en el Diario Oficial de la Unión Europea.
El presente Reglamento será obligatorio en todos sus elementos y directamente aplicable en cada Estado miembro.
Hecho en Bruselas, el 10 de mayo de 2017.
Por la Comisión,
en nombre del Presidente,
Jerzy PLEWA
Director General
Dirección General de Agricultura y Desarrollo Rural
(1) DO L 347 de 20.12.2013, p. 671.
(2) DO L 157 de 15.6.2011, p. 1.
ANEXO
Valores de importación a tanto alzado para la determinación del precio de entrada de determinadas frutas y hortalizas
|
(EUR/100 kg) |
||
|
Código NC |
Código tercer país (1) |
Valor de importación a tanto alzado |
|
0702 00 00 |
EG |
176,8 |
|
MA |
100,6 |
|
|
TR |
89,0 |
|
|
ZZ |
122,1 |
|
|
0707 00 05 |
MA |
79,4 |
|
TR |
116,3 |
|
|
ZZ |
97,9 |
|
|
0709 93 10 |
TR |
134,4 |
|
ZZ |
134,4 |
|
|
0805 10 22 , 0805 10 24 , 0805 10 28 |
EG |
47,7 |
|
MA |
55,9 |
|
|
ZZ |
51,8 |
|
|
0805 50 10 |
TR |
60,0 |
|
ZA |
157,0 |
|
|
ZZ |
108,5 |
|
|
0808 10 80 |
AR |
111,7 |
|
BR |
106,5 |
|
|
CL |
115,0 |
|
|
CN |
145,5 |
|
|
NZ |
124,5 |
|
|
US |
111,3 |
|
|
ZA |
98,7 |
|
|
ZZ |
116,2 |
|
(1) Nomenclatura de países fijada por el Reglamento (UE) n.o 1106/2012 de la Comisión, de 27 de noviembre de 2012, por el que se aplica el Reglamento (CE) n.o 471/2009 del Parlamento Europeo y del Consejo, sobre estadísticas comunitarias relativas al comercio exterior con terceros países, en lo que concierne a la actualización de la nomenclatura de países y territorios (DO L 328 de 28.11.2012, p. 7). El código «ZZ» significa «otros orígenes».
DECISIONES
|
11.5.2017 |
ES |
Diario Oficial de la Unión Europea |
L 120/19 |
DECISIÓN (UE) 2017/798 DEL CONSEJO
de 25 de abril de 2017
por la que se autoriza la apertura de negociaciones con el Gobierno de Japón para un acuerdo entre la Unión Europea y el Gobierno de Japón sobre cooperación en el ámbito de la política de competencia
EL CONSEJO DE LA UNIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea, y en particular sus artículos 103 y 352, en relación con su artículo 218, apartados 3 y 4,
Vista la Recomendación de la Comisión Europea,
Considerando que convendría entablar negociaciones con el objeto de celebrar un acuerdo entre la Unión Europea y el Gobierno de Japón sobre cooperación en el ámbito de la política de competencia,
HA ADOPTADO LA PRESENTE DECISIÓN:
Artículo 1
1. Se autoriza a la Comisión a entablar negociaciones con el Gobierno de Japón para un acuerdo por el que se añadan disposiciones al Acuerdo entre la Comunidad Europea y el Gobierno de Japón sobre cooperación en la lucha contra las actividades contrarias a la competencia (1) acerca del intercambio de pruebas, de modo recíproco, en las investigaciones sobre competencia.
2. Las negociaciones se llevarán a cabo sobre la base de las directrices de negociación del Consejo recogidas en la adenda de la presente Decisión.
Artículo 2
La Comisión será la negociadora de la Unión.
Artículo 3
Las negociaciones se llevarán a cabo en consulta con el Grupo de trabajo sobre «Competencia» del Consejo.
Artículo 4
El destinatario de la presente Decisión es la Comisión.
Hecho en Luxemburgo, el 25 de abril de 2017.
Por el Consejo
El Presidente
I. BORG
(1) DO L 183 de 22.7.2003, p. 12.
|
11.5.2017 |
ES |
Diario Oficial de la Unión Europea |
L 120/20 |
DECISIÓN (UE) 2017/799 DEL CONSEJO
de 5 de mayo de 2017
por la que se nombra a tres miembros y dos suplentes del Comité de las Regiones, propuestos por la República de Chipre
EL CONSEJO DE LA UNIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea, y en particular su artículo 305,
Vista la propuesta del Gobierno de Chipre,
Considerando lo siguiente:
|
(1) |
El 26 de enero de 2015, el 5 de febrero de 2015 y el 23 de junio de 2015, el Consejo adoptó las Decisiones (UE) 2015/116 (1), (UE) 2015/190 (2) y (UE) 2015/994 (3) por las que se nombra a los miembros y suplentes del Comité de las Regiones para el período comprendido entre el 26 de enero de 2015 y el 25 de enero de 2020. El 26 de julio de 2016, mediante la Decisión (UE) 2016/1233 del Consejo (4), D. Georgios GEORGIOU fue sustituido por D. Kyriakos CHATZITTOFIS como miembro y D. Kyriakos CHATZITTOFIS fue sustituido por D. Stavros YEROLATSITES como suplente. |
|
(2) |
Han quedado vacantes tres puestos de miembros del Comité de las Regiones a raíz del término de los mandatos de D. Kyriakos CHATZITTOFIS, D.a Louisa MAVROMMATI y D. Charalambos PITTAS. |
|
(3) |
Ha quedado vacante un puesto de suplente del Comité de las Regiones a raíz del término del mandato de D. Stavros YEROLATSITES. |
|
(4) |
Ha quedado vacante un puesto de suplente a raíz del nombramiento de D. Stavros STAVRINIDES como miembro del Comité de las Regiones. |
HA ADOPTADO LA PRESENTE DECISIÓN:
Artículo 1
Se nombra para el Comité de las Regiones, para el período restante del mandato actual:
|
a) |
como miembros a:
y |
|
b) |
como suplentes a:
|
Artículo 2
La presente Decisión entrará en vigor el día de su adopción.
Hecho en Bruselas, el 5 de mayo de 2017.
Por el Consejo
El Presidente
L. GRECH
(1) Decisión (UE) 2015/116 del Consejo, de 26 de enero de 2015, por la que se nombran miembros y suplentes del Comité de las Regiones para el período comprendido entre el 26 de enero de 2015 y el 25 de enero de 2020 (DO L 20 de 27.1.2015, p. 42).
(2) Decisión (UE) 2015/190 del Consejo, de 5 de febrero de 2015, por la que se nombran miembros y suplentes del Comité de las Regiones para el período comprendido entre el 26 de enero de 2015 y el 25 de enero de 2020 (DO L 31 de 7.2.2015, p. 25).
(3) Decisión (UE) 2015/994 del Consejo, de 23 de junio de 2015, por la que se nombran miembros y suplentes del Comité de las Regiones para el período comprendido entre el 26 de enero de 2015 y el 25 de enero de 2020 (DO L 159 de 25.6.2015, p. 70).
(4) Decisión (UE) 2016/1233 del Consejo, de 26 de julio de 2016, por la que se nombra a un miembro y un suplente del Comité de las Regiones, propuestos por la República de Chipre (DO L 202 de 28.7.2016, p. 41).
|
11.5.2017 |
ES |
Diario Oficial de la Unión Europea |
L 120/22 |
DECISIÓN DE EJECUCIÓN (UE) 2017/800 DE LA COMISIÓN
de 8 de mayo de 2017
por la que se modifica la Decisión 2009/821/CE en lo relativo a las listas de puestos de inspección fronterizos y de unidades veterinarias de Traces
[notificada con el número C(2017) 2899]
(Texto pertinente a efectos del EEE)
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Vista la Directiva 90/425/CEE del Consejo, de 26 de junio de 1990, relativa a los controles veterinarios y zootécnicos aplicables en los intercambios intracomunitarios de determinados animales vivos y productos con vistas a la realización del mercado interior (1), y en particular su artículo 20, apartados 1 y 3,
Vista la Directiva 91/496/CEE del Consejo, de 15 de julio de 1991, por la que se establecen los principios relativos a la organización de controles veterinarios de los animales que se introduzcan en la Comunidad procedentes de terceros países y por la que se modifican las Directivas 89/662/CEE, 90/425/CEE y 90/675/CEE (2), y en particular su artículo 6, apartado 4, párrafo segundo, segunda frase, y apartado 5,
Vista la Directiva 97/78/CE del Consejo, de 18 de diciembre de 1997, por la que se establecen los principios relativos a la organización de controles veterinarios de los productos que se introduzcan en la Comunidad procedentes de terceros países (3), y en particular su artículo 6, apartado 2,
Considerando lo siguiente:
|
(1) |
La Decisión 2009/821/CE de la Comisión (4) establece una lista de puestos de inspección fronterizos autorizados de conformidad con las Directivas 91/496/CEE y 97/78/CE. Esta lista figura en el anexo I de dicha Decisión. |
|
(2) |
A raíz de una comunicación de España, en el puesto de inspección fronterizo del aeropuerto de Alicante, la categoría «otros animales» debe limitarse a los animales de pequeño tamaño. Por lo tanto, debe añadirse la nota 10 a la categoría O en la entrada correspondiente a dicho puesto de inspección fronterizo en el anexo I de la Decisión 2009/821/CE. |
|
(3) |
A raíz de una comunicación de Francia, debe ampliarse la autorización del puesto de inspección fronterizo del aeropuerto de Lyon-Saint Exupéry para incluir los équidos registrados. Procede, por tanto, modificar en consecuencia la entrada correspondiente a ese puesto de inspección fronterizo en el anexo I de la Decisión 2009/821/CE. |
|
(4) |
Los Países Bajos han comunicado que debería suprimirse un centro de inspección en el puesto de inspección fronterizo del puerto de Ámsterdam y que un centro de inspección en el puesto de inspección fronterizo de Rotterdam debería desplazarse a otro emplazamiento. Procede, por tanto, modificar en consecuencia las entradas correspondientes a los mencionados puestos de inspección fronterizos establecidas en el anexo I de la Decisión 2009/821/CE. |
|
(5) |
En el anexo II de la Decisión 2009/821/CE, se establece la lista de unidades centrales, regionales y locales que forman parte del sistema informático veterinario integrado (Traces). |
|
(6) |
A raíz de una comunicación de Irlanda, Italia y Austria, deben introducirse algunos cambios en la lista de unidades locales de Traces establecida en el anexo II de la Decisión 2009/821/CE en lo relativo a dichos países. |
|
(7) |
Procede, por tanto, modificar en consecuencia la Decisión 2009/821/CE. |
|
(8) |
Las medidas previstas en la presente Decisión se ajustan al dictamen del Comité Permanente de Vegetales, Animales, Alimentos y Piensos. |
HA ADOPTADO LA PRESENTE DECISIÓN:
Artículo 1
Los anexos I y II de la Decisión 2009/821/CE quedan modificados con arreglo a lo dispuesto en el anexo de la presente Decisión.
Artículo 2
Los destinatarios de la presente Decisión serán los Estados miembros.
Hecho en Bruselas, el 8 de mayo de 2017.
Por la Comisión
Vytenis ANDRIUKAITIS
Miembro de la Comisión
(1) DO L 224 de 18.8.1990, p. 29.
(2) DO L 268 de 24.9.1991, p. 56.
(3) DO L 24 de 30.1.1998, p. 9.
(4) Decisión 2009/821/CE de la Comisión, de 28 de septiembre de 2009, por la que se establece una lista de puestos de inspección fronterizos autorizados y se disponen determinadas normas sobre las inspecciones efectuadas por los expertos veterinarios de la Comisión, así como las unidades veterinarias de Traces (DO L 296 de 12.11.2009, p. 1).
ANEXO
Los anexos I y II de la Decisión 2009/821/CE quedan modificados como sigue:
|
1) |
El anexo I queda modificado como sigue:
|
|
2) |
El anexo II queda modificado como sigue:
|
|
11.5.2017 |
ES |
Diario Oficial de la Unión Europea |
L 120/26 |
DECISIÓN DE EJECUCIÓN (UE) 2017/801 DE LA COMISIÓN
de 8 de mayo de 2017
que modifica la Decisión de Ejecución (UE) 2016/715 por la que se establecen medidas respecto a determinados frutos originarios de determinados terceros países para prevenir la introducción y propagación en la Unión del organismo nocivo Phyllosticta citricarpa (McAlpine) Van der Aa
[notificada con el número C(2017) 2894]
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Vista la Directiva 2000/29/CE del Consejo, de 8 de mayo de 2000, relativa a las medidas de protección contra la introducción en la Comunidad de organismos nocivos para los vegetales o productos vegetales y contra su propagación en el interior de la Comunidad (1), y en particular su artículo 16, apartado 3, cuarta frase,
Considerando lo siguiente:
|
(1) |
La Guignardia citricarpa Kiely (todas las cepas patógenas para el género Citrus), a la cual, a raíz de que el Congreso Internacional de Botánica aprobase un nuevo código para la nomenclatura de los hongos, se hace referencia con la denominación Phyllosticta citricarpa (McAlpine) Van der Aa, en lo sucesivo «Phyllosticta citricarpa», es un organismo nocivo enumerado en la parte A, sección I, letra c), punto 11, del anexo II de la Directiva 2000/29/CE. No se tiene constancia de su presencia en el territorio de la Unión. Es el agente causante de la mancha negra de los cítricos y una amenaza significativa para el cultivo de cítricos en la Unión. |
|
(2) |
La Decisión de Ejecución (UE) 2016/715 de la Comisión (2) establece medidas en lo que respecta a los frutos de Citrus L., Fortunella Swingle, Poncirus Raf., y sus híbridos, distintos de los frutos de Citrus aurantium L. y Citrus latifolia Tanaka (en lo sucesivo, «frutos especificados»), originarios de Brasil, Sudáfrica o Uruguay, para prevenir la introducción y propagación en la Unión de Phyllosticta citricarpa. |
|
(3) |
Desde la adopción de dicha Decisión, entre mayo y octubre de 2016 los Estados miembros notificaron en repetidas ocasiones interceptaciones de Phyllosticta citricarpa, a raíz de sus inspecciones de importaciones de los frutos especificados originarios de Argentina. |
|
(4) |
La Comisión ha evaluado estas interceptaciones recurrentes y ha llegado a la conclusión de que los controles fitosanitarios en Argentina no garantizan suficientemente la ausencia de Phyllosticta citricarpa. En consecuencia, los controles fitosanitarios vigentes en Argentina son insuficientes para impedir la introducción en la Unión de Phyllosticta citricarpa. |
|
(5) |
Por consiguiente, la introducción en la Unión de los frutos en cuestión debe supeditarse a determinados requisitos. Dichos requisitos han de ser los mismos que los existentes para los frutos especificados originarios de Sudáfrica y Uruguay, y deben aplicarse a los frutos especificados destinados a propósitos distintos de la transformación industrial en zumo, así como a los frutos especificados destinados exclusivamente a la transformación industrial en zumo. |
|
(6) |
Habida cuenta de que las interceptaciones de los frutos especificados originarios de Argentina han afectado a diferentes especies y variedades, no son necesarios ensayos adicionales para la detección de infecciones latentes, como los previstos en el caso de determinados frutos de Citrus sinensis (L.) Osbeck «Valencia» originarios de Sudáfrica y de Uruguay. |
|
(7) |
Procede, por tanto, modificar la Decisión de Ejecución (UE) 2016/715 en consecuencia. |
|
(8) |
Las medidas establecidas en la presente Decisión deben aplicarse a partir del 5 de junio de 2017 a fin de dar tiempo suficiente a los servicios fitosanitarios nacionales, los organismos oficiales responsables y los agentes afectados para adaptarse a los nuevos requisitos. |
|
(9) |
Las medidas previstas en la presente Decisión se ajustan al dictamen del Comité Permanente de Vegetales, Animales, Alimentos y Piensos. |
HA ADOPTADO LA PRESENTE DECISIÓN:
Artículo 1
La Decisión de Ejecución (UE) 2016/715 se modifica como sigue:
|
1) |
El artículo 1 se sustituye por el texto siguiente: «Artículo 1 Objeto La presente Decisión establece medidas respecto a determinados frutos originarios de Argentina, Brasil, Sudáfrica y Uruguay para prevenir la introducción y propagación en la Unión de Phyllosticta citricarpa.». |
|
2) |
En el artículo 2, la letra b) se sustituye por el texto siguiente: «b) «frutos especificados»: frutos de Citrus L., Fortunella Swingle, Poncirus Raf. y sus híbridos, distintos de los frutos de Citrus aurantium L. y Citrus latifolia Tanaka.». |
|
3) |
En el artículo 3, el apartado 1 se sustituye por el texto siguiente: «1. No obstante lo dispuesto en la parte A, sección I, punto 16.4, letras c) y d), del anexo IV de la Directiva 2000/29/CE, los frutos especificados originarios de Argentina, Brasil, Sudáfrica o Uruguay distintos de los frutos destinados exclusivamente a la transformación industrial en zumo se introducirán en la Unión con arreglo a los artículos 4 a 7 de la presente Decisión.». |
|
4) |
Se inserta el artículo 5 bis siguiente: «Artículo 5 bis Introducción en la Unión de frutos especificados originarios de Argentina Los frutos especificados originarios de Argentina irán acompañados de un certificado fitosanitario, con arreglo al artículo 13, apartado 1, inciso ii), párrafo primero, de la Directiva 2000/29/CE, que incluya en el epígrafe “Declaración suplementaria” los siguientes elementos:
|
|
5) |
En el artículo 6, el título y el apartado 1 se sustituyen por el texto siguiente: «Artículo 6 Requisitos aplicables a la inspección de los frutos especificados originarios de Argentina, Sudáfrica y Uruguay dentro de la Unión 1. Los frutos especificados originarios de Argentina, Sudáfrica y Uruguay serán sometidos a una inspección visual en el punto de entrada o en el lugar de destino establecidos de conformidad con la Directiva 2004/103/CE de la Comisión (*1). Dichas inspecciones se llevarán a cabo con muestras de un mínimo de doscientos frutos de cada especie de los frutos especificados por cada lote de 30 toneladas, o una parte de esas 30 toneladas, seleccionados en función de cualquier posible signo de Phyllosticta citricarpa. (*1) Directiva 2004/103/CE de la Comisión, de 7 de octubre de 2004, relativa a los controles de identidad y fitosanitarios de vegetales, productos vegetales u otros objetos enumerados en la parte B del anexo V de la Directiva 2000/29/CE del Consejo, que pueden llevarse a cabo en un lugar distinto del punto de entrada en la Comunidad o en un lugar cercano y por la que se determinan las condiciones relacionadas con dichos controles (DO L 313 de 12.10.2004, p. 16).»." |
|
6) |
En el artículo 7, la letra c) se sustituye por el texto siguiente:
|
|
7) |
En el artículo 8, el apartado 1 se sustituye por el texto siguiente: «1. No obstante lo dispuesto en la parte A, sección I, punto 16.4, letra d), del anexo IV de la Directiva 2000/29/CE, los frutos especificados originarios de Argentina, Brasil, Sudáfrica o Uruguay destinados exclusivamente a la transformación industrial en zumo solo se introducirán y circularán en la Unión con arreglo a los artículos 9 a 17 de la presente Decisión.». |
Artículo 2
La presente Decisión se aplicará a partir del 5 de junio de 2017.
Artículo 3
Los destinatarios de la presente Decisión serán los Estados miembros.
Hecho en Bruselas, el 8 de mayo de 2017.
Por la Comisión
Vytenis ANDRIUKAITIS
Miembro de la Comisión
(1) DO L 169 de 10.7.2000, p. 1.
(2) Decisión de Ejecución (UE) 2016/715 de la Comisión, de 11 de mayo de 2016, por la que se establecen medidas respecto a determinados frutos originarios de determinados terceros países para prevenir la introducción y propagación en la Unión del organismo nocivo Phyllosticta citricarpa (McAlpine) Van der Aa (DO L 125 de 13.5.2016, p. 16).
|
11.5.2017 |
ES |
Diario Oficial de la Unión Europea |
L 120/29 |
DECISIÓN DE EJECUCIÓN (UE) 2017/802 DE LA COMISIÓN
de 10 de mayo de 2017
por la que no se aprueba el PHMB (1600; 1.8) como sustancia activa existente en biocidas del tipo de producto 5
(Texto pertinente a efectos del EEE)
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Visto el Reglamento (UE) n.o 528/2012 del Parlamento Europeo y del Consejo, de 22 de mayo de 2012, relativo a la comercialización y el uso de los biocidas (1), y en particular su artículo 89, apartado 1, párrafo tercero,
Considerando lo siguiente:
|
(1) |
El Reglamento Delegado (UE) n.o 1062/2014 de la Comisión (2) establece una lista de sustancias activas existentes que deben evaluarse para la posible aprobación de su uso en biocidas. Dicha lista incluye el PHMB (1600; 1.8). |
|
(2) |
El PHMB (1600; 1.8) se ha evaluado para su uso en el tipo de producto 5, agua potable, tal como se define en el anexo V del Reglamento (UE) n.o 528/2012. |
|
(3) |
Francia fue designada autoridad competente evaluadora y presentó el informe de evaluación, junto con sus recomendaciones, el 23 de noviembre de 2015. |
|
(4) |
El 12 de octubre de 2016, de conformidad con el artículo 7, apartado 2, del Reglamento Delegado (UE) n.o 1062/2014, el Comité de Biocidas presentó el dictamen de la Agencia Europea de Sustancias y Mezclas Químicas, teniendo en cuenta las conclusiones de la autoridad competente evaluadora. |
|
(5) |
Con arreglo a dicho dictamen, no puede esperarse que los biocidas utilizados para el tipo de producto 5 que contienen PHMB (1600; 1.8) cumplan los requisitos establecidos en el artículo 19, apartado 1, letra b), del Reglamento (UE) n.o 528/2012. Las evaluaciones de los riesgos medioambientales de los escenarios contemplados respecto a este tipo de producto pusieron de manifiesto riesgos inaceptables. |
|
(6) |
No procede, por tanto, aprobar el PHMB (1600; 1.8) para su uso en biocidas del tipo de producto 5. |
|
(7) |
Las medidas previstas en la presente Decisión se ajustan al dictamen del Comité Permanente de Biocidas. |
HA ADOPTADO LA PRESENTE DECISIÓN:
Artículo 1
No se aprueba el uso de PHMB (1600; 1.8) (n.o CE: n. d.; n.o CAS: 27083-27-8 y 32289-58-0) como sustancia activa en biocidas del tipo de producto 5.
Artículo 2
La presente Decisión entrará en vigor a los veinte días de su publicación en el Diario Oficial de la Unión Europea.
Hecho en Bruselas, el 10 de mayo de 2017.
Por la Comisión
El Presidente
Jean-Claude JUNCKER
(1) DO L 167 de 27.6.2012, p. 1.
(2) Reglamento Delegado (UE) n.o 1062/2014 de la Comisión, de 4 de agosto de 2014, relativo al programa de trabajo para el examen sistemático de todas las sustancias activas existentes contenidas en los biocidas que se mencionan en el Reglamento (UE) n.o 528/2012 del Parlamento Europeo y del Consejo (DO L 294 de 10.10.2014, p. 1).
Corrección de errores
|
11.5.2017 |
ES |
Diario Oficial de la Unión Europea |
L 120/31 |
Corrección de errores del Reglamento Delegado (UE) 2017/653 de la Comisión, de 8 de marzo de 2017, por el que se completa el Reglamento (UE) n.o 1286/2014 del Parlamento Europeo y del Consejo, sobre los documentos de datos fundamentales relativos a los productos de inversión minorista empaquetados y los productos de inversión basados en seguros, mediante el establecimiento de normas técnicas de regulación respecto a la presentación, el contenido, el examen y la revisión de los documentos de datos fundamentales y las condiciones para cumplir el requisito de suministro de dichos documentos
( Diario Oficial de la Unión Europea L 100 de 12 de abril de 2017 )
En la página 17, en el anexo II, punto 13, la fórmula se sustituye por el texto siguiente:
«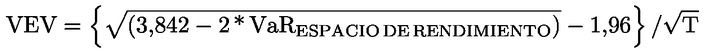 ».
».
En la página 17, en el anexo II, punto 17, la fórmula se sustituye por el texto siguiente:
« ».
».