ISSN 1977-0685
Diario Oficial
de la Unión Europea
L 331

Edición en lengua española
Legislación
57° año
18 de noviembre de 2014
|
ISSN 1977-0685 |
||
|
Diario Oficial de la Unión Europea |
L 331 |
|

|
||
|
Edición en lengua española |
Legislación |
57° año |
|
|
|
Corrección de errores |
|
|
|
* |
||
|
|
* |
|
|
|
|
|
(1) Texto pertinente a efectos del EEE |
|
ES |
Los actos cuyos títulos van impresos en caracteres finos son actos de gestión corriente, adoptados en el marco de la política agraria, y que tienen generalmente un período de validez limitado. Los actos cuyos títulos van impresos en caracteres gruesos y precedidos de un asterisco son todos los demás actos. |
II Actos no legislativos
REGLAMENTOS
|
18.11.2014 |
ES |
Diario Oficial de la Unión Europea |
L 331/1 |
REGLAMENTO DE EJECUCIÓN (UE) No 1225/2014 DEL CONSEJO
de 17 de noviembre de 2014
por el que se aplica el Reglamento (UE) no 269/2014 relativo a medidas restrictivas respecto de acciones que menoscaban o amenazan la integridad territorial, la soberanía y la independencia de Ucrania
EL CONSEJO DE LA UNIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Visto el Reglamento (UE) no 269/2014 del Consejo, de 17 de marzo de 2014, relativo a la adopción de medidas restrictivas respecto de acciones que menoscaban o amenazan la integridad territorial, la soberanía y la independencia de Ucrania (1), y, en particular, su artículo 14, apartado 1,
Considerando lo siguiente:
|
(1) |
El 17 de marzo de 2014 el Consejo adoptó el Reglamento (UE) no 269/2014. |
|
(2) |
Debe modificarse la información relativa a una persona incluida en la lista en virtud del Reglamento (UE) no 269/2014. |
|
(3) |
El anexo I del Reglamento (UE) no 269/2014 debe modificarse en consecuencia. |
HA ADOPTADO EL PRESENTE REGLAMENTO:
Artículo 1
El anexo del Reglamento (UE) no 269/2014 queda modificado del modo establecido en el anexo del presente Reglamento.
Artículo 2
El presente Reglamento entrará en vigor al día siguiente de su publicación en el Diario Oficial de la Unión Europea.
El presente Reglamento será obligatorio en todos sus elementos y directamente aplicable en cada Estado miembro.
Hecho en Bruselas, el 17 de noviembre de 2014.
Por el Consejo
La Presidenta
F. MOGHERINI
(1) DO L 78 de 17.3.2014, p. 6.
ANEXO
La entrada relativa a la siguiente persona que figuran en el Anexo I del Reglamento (UE) no 269/2014 se sustituye por la siguiente.
|
|
Nombre |
Información de identificación |
Exposición de motivos |
Fecha de inclusión |
|
|
«Vladimir Volfovich ZHIRINOVSKY Владимир Вольфович Жириновский |
Nacido el 25.4.1946 en Almaty (también denominada anteriormente Alma-Ata), Kazajistán. |
Miembro del Consejo de la Duma estatal; dirigente del PLDR. Ha apoyado activamente el recurso a las Fuerzas Armadas Rusas en Ucrania y la anexión de Crimea. Ha incitado activamente a la división de Ucrania. Ha firmado, en nombre del PLDR, del cual es presidente, un acuerdo con la denominada “República Popular de Donetsk”. |
12.9.2014» |
|
18.11.2014 |
ES |
Diario Oficial de la Unión Europea |
L 331/3 |
REGLAMENTO (UE) No 1226/2014 DE LA COMISIÓN
de 17 de noviembre de 2014
sobre la autorización de una declaración de propiedades saludables en los alimentos relativa a la reducción del riesgo de enfermedad
(Texto pertinente a efectos del EEE)
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Visto el Reglamento (CE) no 1924/2006 del Parlamento Europeo y del Consejo, de 20 de diciembre de 2006, relativo a las declaraciones nutricionales y de propiedades saludables en los alimentos (1), y, en particular, su artículo 17, apartado 3,
Considerando lo siguiente:
|
(1) |
En el Reglamento (CE) no 1924/2006, se establece que están prohibidas las declaraciones de las propiedades saludables en los alimentos a no ser que las autorice la Comisión de conformidad con ese mismo Reglamento y las incluya en una lista de declaraciones permitidas. |
|
(2) |
En el Reglamento (CE) no 1924/2006 también se establece que los explotadores de empresas alimentarias pueden presentar solicitudes de autorización de declaraciones de propiedades saludables a la autoridad nacional competente de un Estado miembro. Dicha autoridad nacional competente debe remitir las solicitudes válidas a la Autoridad Europea de Seguridad Alimentaria (EFSA), en lo sucesivo, «la Autoridad». |
|
(3) |
Cuando la Autoridad reciba una solicitud, debe informar de ello sin demora a los demás Estados miembros y a la Comisión y emitir un dictamen sobre la declaración de propiedades saludables en cuestión. |
|
(4) |
La Comisión debe tomar una decisión sobre la autorización de las declaraciones de propiedades saludables teniendo en cuenta el dictamen emitido por la Autoridad. |
|
(5) |
A raíz de una solicitud de Lactalis B&C, presentada con arreglo al artículo 14, apartado 1, letra a), del Reglamento (CE) no 1924/2006, se solicitó a la Autoridad que emitiera un dictamen sobre una declaración de propiedades saludables relativa a los efectos de la «grasa para untar con bajo contenido de grasa y grasas trans y rica en ácidos grasos insaturados y omega-3» y la reducción de las concentraciones sanguíneas de colesterol LDL (Consulta no EFSA-Q-2009-00458) (2). La declaración propuesta por el solicitante estaba redactada de la manera siguiente: «Sustituir una grasa rica en ácidos grasos saturados/trans por una grasa rica en ácidos grasos insaturados ayuda a reducir el colesterol LDL. El colesterol LDL es un factor de riesgo cardiovascular». |
|
(6) |
A partir de los datos presentados, la Autoridad llegó a la conclusión, en su dictamen, recibido por la Comisión y los Estados miembros el 25 de mayo de 2011, de que se había establecido una relación de causa- efecto entre el consumo de mezclas de ácidos grasos saturados alimentarios (AGSs) y el aumento en sangre de las concentraciones de colesterol-LDL, y que la sustitución de una mezcla de AGSs por ácidos grasos monoinsaturados cis y/o ácidos grasos poliinsaturados cis en alimentos o en la dieta sobre una base de gramo por gramo reduce las concentraciones de colesterol LDL. Por consiguiente, debe considerarse que una declaración de propiedades saludables que refleje esta conclusión cumple los requisitos establecidos en el Reglamento (CE) no 1924/2006, y debe incluirse en la lista autorizada de declaraciones permitidas de la Unión. La autoridad no consideró necesario para llegar a su conclusión el estudio de intervención clínica del que el solicitante alega tener los derechos de propiedad industrial. Por consiguiente, se considera que no se cumple el requisito establecido en el artículo 21, apartado 1, letra c), del Reglamento (CE) no 1924/2006 y, por tanto, no debe concederse la protección de datos sujetos a derechos de propiedad industrial. |
|
(7) |
En su dictamen, la Autoridad llegó a la conclusión de que para llevar la declaración deben sustituirse cantidades significativas de ácidos grasos saturados por ácidos grasos monoinsaturados y/o poliinsaturados en alimentos o en la dieta sobre una base de gramo por gramo. Por lo tanto, para garantizar que un alimento proporciona cantidades significativas de ácidos grasos monoinsaturados y/o poliinsaturados, conviene limitar la utilización de la declaración a las grasas y los aceites y establecer condiciones de uso como las mencionadas en la declaración nutricional «ALTO CONTENIDO DE GRASAS INSATURADAS» contemplada en el anexo del Reglamento (CE) no 1924/2006. |
|
(8) |
En el artículo 16, apartado 4, del Reglamento (CE) no 1924/2006 se establece que un dictamen favorable a la autorización de una declaración de propiedades saludables debe incluir determinada información. En consecuencia, dicha información debe figurar en el anexo del presente Reglamento por lo que respecta a la declaración autorizada e incluir, en su caso, la redacción revisada de la declaración, sus condiciones específicas de uso, y, cuando sea pertinente, las condiciones o restricciones de uso del alimento o una declaración o advertencia complementaria, con arreglo a las normas establecidas en el Reglamento (CE) no 1924/2006 y en consonancia con los dictámenes de la Autoridad. |
|
(9) |
Uno de los objetivos del Reglamento (CE) no 1924/2006 es garantizar al consumidor la veracidad, claridad, fiabilidad y utilidad de las declaraciones de propiedades saludables, para lo cual han de tenerse en cuenta tanto la redacción como la presentación. Por tanto, cuando la redacción de una declaración tenga el mismo significado para los consumidores que una declaración de propiedades saludables autorizada, por haberse demostrado que existe la misma relación entre una categoría de alimentos, un alimento o uno de sus componentes y la salud, dicha declaración debe estar sujeta a las mismas condiciones de uso indicadas en el anexo del presente Reglamento. |
|
(10) |
Las medidas previstas en el presente Reglamento tienen en cuenta los comentarios de los solicitantes y las personas interesadas recibidos por la Comisión de conformidad con el artículo 16, apartado 6, del Reglamento (CE) no 1924/2006. |
|
(11) |
Las medidas previstas en el presente Reglamento se ajustan al dictamen del Comité Permanente de la Cadena Alimentaria y de Sanidad Animal. |
HA ADOPTADO EL PRESENTE REGLAMENTO:
Artículo 1
1. La declaración de propiedades saludables que figura en el anexo del presente Reglamento podrá realizarse en los alimentos comercializados en la Unión Europea, siempre que se cumplan las condiciones establecidas en dicho anexo.
2. La declaración de propiedades saludables contemplada en el apartado 1 se incluirá en la lista de declaraciones permitidas de la Unión Europea, conforme a lo dispuesto en el artículo 14, apartado 1, del Reglamento (CE) no 1924/2006.
Artículo 2
El presente Reglamento entrará en vigor el vigésimo día siguiente al de su publicación en el Diario Oficial de la Unión Europea.
El presente Reglamento será obligatorio en todos sus elementos y directamente aplicable en cada Estado miembro.
Hecho en Bruselas, el 17 de noviembre de 2014.
Por la Comisión
El Presidente
Jean-Claude JUNCKER
(1) DO L 404 de 30.12.2006, p. 9.
(2) EFSA Journal 2011, 9(5):2168.
ANEXO
Declaración de propiedades saludables permitida
|
Solicitud: disposiciones pertinentes del Reglamento (CE) no 1924/2006 |
Dirección del solicitante |
Nutriente, sustancia, alimento o categoría de alimentos |
Declaración |
Condiciones de uso de la declaración |
Condiciones o restricciones de uso del alimento o bien declaración complementaria o advertencia |
Referencia del dictamen de la EFSA |
|
Artículo 14, apartado 1, letra a): declaración de propiedades saludables relativa a la reducción del riesgo de enfermedad |
Lactalis B&C, ZA Les Placis, 35230, Bourgbarré, Francia |
Ácidos grasos monoinsaturados y/o poliinsaturados |
Se ha demostrado que la sustitución de grasas saturadas por grasas insaturadas en la dieta disminuye/reduce el colesterol en la sangre. Una tasa elevada de colesterol constituye un factor de riesgo de cardiopatías coronarias. |
Esta declaración solo puede utilizarse en alimentos con alto contenido de ácidos grasos insaturados, de acuerdo con la declaración ALTO CONTENIDO DE GRASAS INSATURADAS que figura en el anexo del Reglamento (CE) no 1924/2006. |
La declaración solo puede usarse en grasas y aceites. |
Q-2009-00458 |
|
18.11.2014 |
ES |
Diario Oficial de la Unión Europea |
L 331/6 |
REGLAMENTO DE EJECUCIÓN (UE) No 1227/2014 DE LA COMISIÓN
de 17 de noviembre de 2014
por el que se fija para el año civil 2014 el porcentaje de ajuste de los pagos directos previsto en el Reglamento (CE) no 73/2009 del Consejo y se deroga el Reglamento de Ejecución (UE) no 879/2014 de la Comisión
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Visto el Reglamento (UE) no 1306/2013 del Parlamento Europeo y del Consejo, de 17 de diciembre de 2013, sobre la financiación, gestión y seguimiento de la política agrícola común, por el que se derogan los Reglamentos (CEE) no 352/78, (CE) no 165/94, (CE) no 2799/98, (CE) no 814/2000, (CE) no 1290/2005 y (CE) no 485/2008 del Consejo (1), y, en particular, su artículo 26, apartado 4,
Previa consulta al Comité de los Fondos Agrícolas,
Considerando lo siguiente:
|
(1) |
El 21 de marzo de 2014, la Comisión adoptó una propuesta de Reglamento del Parlamento Europeo y del Consejo que fija un porcentaje de ajuste de los pagos directos previsto en el Reglamento (CE) no 73/2009 para el año civil 2014 (2). No obstante, el Parlamento Europeo y el Consejo no habían determinado aún ese porcentaje el 30 de junio de 2014. Por lo tanto, de conformidad con el artículo 26, apartado 3, del Reglamento (UE) no 1306/2013, la Comisión fijó ese ajuste en el Reglamento de Ejecución (UE) no 879/2014 de la Comisión (3). |
|
(2) |
Las previsiones relativas a los pagos directos y el gasto relacionado con el mercado que figuran en la Nota rectificativa no 1 del Proyecto de Presupuesto de 2015 presentada por la Comisión muestran la necesidad de adaptar el porcentaje de la disciplina financiera previsto en el proyecto de presupuesto de 2015. Dicha nota rectificativa se estableció teniendo en cuenta una disciplina financiera por un importe de 433 millones EUR para la reserva para crisis en el sector agrícola a que se refiere el artículo 25 del Reglamento (UE) no 1306/2013. A fin de tener en cuenta esta nueva información, la Comisión debe adaptar el porcentaje de ajuste establecido en el Reglamento de Ejecución (UE) no 879/2014. |
|
(3) |
Por regla general, los agricultores que presentan una solicitud de ayuda para pagos directos con respecto a un año civil (N) reciben esos pagos en un determinado plazo de pago correspondiente al ejercicio financiero (N + 1). No obstante, los Estados miembros tienen la posibilidad de efectuar pagos tardíos a los agricultores, dentro de ciertos límites, más allá de ese plazo de pago y sin ningún límite temporal. Estos pagos tardíos pueden producirse a lo largo de un ejercicio financiero posterior. Cuando la disciplina financiera se aplica a un año civil dado, el porcentaje de ajuste no debe aplicarse a los pagos cuyas solicitudes de ayuda se presentaron en años civiles distintos de aquellos a los que se aplica la disciplina financiera. Por lo tanto, a fin de garantizar la igualdad de trato de los agricultores, procede prever que el porcentaje de ajuste se aplique únicamente a los pagos cuyas solicitudes de ayuda se hayan presentado en el año civil en el que deba aplicarse la disciplina financiera, con independencia de la fecha en que se efectúe el pago a los agricultores. |
|
(4) |
El artículo 8, apartado 1, del Reglamento (UE) no 1307/2013 del Parlamento Europeo y del Consejo (4), establece que el porcentaje de ajuste aplicado a los pagos directos determinado de conformidad con el artículo 26 del Reglamento (UE) no 1306/2013, únicamente debe aplicarse a los pagos directos superiores a 2 000 EUR que deban efectuarse a los agricultores en el año civil correspondiente. Por otra parte, el artículo 8, apartado 2, del Reglamento (UE) no 1307/2013 establece que, como resultado de la introducción gradual de los pagos directos, el porcentaje de ajuste solo se aplicará a Bulgaria y Rumanía a partir del 1 de enero de 2016 y a Croacia, a partir del 1 de enero de 2022. Por lo tanto, el porcentaje de ajuste que determine el presente Reglamento no debe aplicarse a los pagos a los agricultores de esos Estados miembros. |
|
(5) |
A fin de garantizar que el porcentaje de ajuste adaptado es aplicable a partir de la fecha en que deben comenzar los pagos a los agricultores de conformidad con el Reglamento (UE) no 1306/2013, el presente Reglamento debe aplicarse a partir del 1 de diciembre de 2014. |
|
(6) |
El porcentaje de ajuste adaptado debe tomarse en consideración para el cálculo de la totalidad de los pagos que deben efectuarse a un agricultor por una solicitud de ayuda presentada en el año civil 2014. Por razones de claridad, debe pues derogarse el Reglamento de Ejecución (UE) no 879/2014. |
HA ADOPTADO EL PRESENTE REGLAMENTO:
Artículo 1
1. A efectos de la aplicación del ajuste previsto en los artículos 25 y 26 del Reglamento (UE) no 1306/2013 y de conformidad con el artículo 8, apartado 1, del Reglamento (UE) no 1307/2013, los importes de los pagos a tenor del artículo 2, letra d), del Reglamento (CE) no 73/2009 del Consejo (5) superiores a 2 000 EUR que deban hacerse a un agricultor por una solicitud de ayuda presentada con respecto al año civil 2014 se reducirán un 1,302214 %.
2. La reducción prevista en el apartado 1 no se aplicará en Bulgaria, Croacia y Rumanía.
Artículo 2
Se deroga el Reglamento de Ejecución (UE) no 879/2014.
Artículo 3
El presente Reglamento entrará en vigor el séptimo día siguiente al de su publicación en el Diario Oficial de la Unión Europea.
Será aplicable a partir del 1 de diciembre de 2014.
El presente Reglamento será obligatorio en todos sus elementos y directamente aplicable en cada Estado miembro.
Hecho en Bruselas, el 17 de noviembre de 2014.
Por la Comisión
El Presidente
Jean-Claude JUNCKER
(1) DO L 347 de 20.12.2013, p. 549.
(2) COM(2014) 175.
(3) Reglamento de Ejecución (UE) no 879/2014 de la Comisión, de 12 de agosto de 2014, que fija para el año civil 2014 un porcentaje de ajuste de los pagos directos previsto en el Reglamento (CE) no 73/2009 (DO L 240 de 13.8.2014, p. 20).
(4) Reglamento (UE) no 1307/2013 del Parlamento Europeo y del Consejo, de 17 de diciembre de 2013, que establece normas aplicables a los pagos directos a los agricultores en virtud de los regímenes de ayuda incluidos en el marco de la política agrícola común y por el que se derogan los Reglamentos del Consejo (CE) no 637/2008 y (CE) no 73/2009 (DO L 347 de 20.12.2013, p. 608).
(5) Reglamento (CE) no 73/2009 del Consejo, de 19 de enero de 2009, por el que se establecen disposiciones comunes aplicables a los regímenes de ayuda directa a los agricultores en el marco de la política agrícola común y se instauran determinados regímenes de ayuda a los agricultores y por el que se modifican los Reglamentos (CE) no 1290/2005, (CE) no 247/2006, (CE) no 378/2007 y se deroga el Reglamento (CE) no 1782/2003 (DO L 30 de 31.1.2009, p. 16).
|
18.11.2014 |
ES |
Diario Oficial de la Unión Europea |
L 331/8 |
REGLAMENTO (UE) No 1228/2014 DE LA COMISIÓN
de 17 de noviembre de 2014
por el que se autorizan determinadas declaraciones de propiedades saludables en los alimentos relativas a la reducción del riesgo de enfermedad o se deniega su autorización
(Texto pertinente a efectos del EEE)
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Visto el Reglamento (CE) no 1924/2006 del Parlamento Europeo y del Consejo, de 20 de diciembre de 2006, relativo a las declaraciones nutricionales y de propiedades saludables en los alimentos (1), y, en particular, su artículo 17, apartado 3,
Considerando lo siguiente:
|
(1) |
Con arreglo al Reglamento (CE) no 1924/2006, las declaraciones de propiedades saludables en los alimentos están prohibidas, a no ser que la Comisión las autorice de conformidad con ese mismo Reglamento y las incluya en una lista de declaraciones autorizadas. |
|
(2) |
El Reglamento (CE) no 1924/2006 también establece que todo explotador de una empresa alimentaria puede presentar las solicitudes de autorización de declaraciones de propiedades saludables a la autoridad nacional competente de un Estado miembro. Dicha autoridad nacional competente debe remitir las solicitudes válidas a la Autoridad Europea de Seguridad Alimentaria (EFSA) (en lo sucesivo, «la Autoridad»). |
|
(3) |
Cuando recibe una solicitud, la Autoridad debe informar de ello sin demora a los demás Estados miembros y a la Comisión y emitir un dictamen sobre la declaración de propiedades saludables de que se trate. |
|
(4) |
La Comisión debe tomar una decisión sobre la autorización de las declaraciones de propiedades saludables teniendo en cuenta el dictamen emitido por la Autoridad. |
|
(5) |
A raíz de una solicitud presentada por Abtei Pharma Vertriebs GmbH con arreglo al artículo 14, apartado 1, letra a), del Reglamento (CE) no 1924/2006, se pidió a la Autoridad que emitiera un dictamen sobre una declaración de propiedades saludables en relación con los efectos de unos comprimidos masticables de calcio y vitamina D3 y la pérdida de densidad ósea (pregunta no EFSA-Q-2008-721) (2). La declaración propuesta por el solicitante decía lo siguiente: «Los comprimidos masticables con calcio y vitamina D mejoran la densidad ósea de las mujeres de 50 años o más. Por lo tanto, esos comprimidos masticables pueden reducir el riesgo de fracturas osteoporóticas». |
|
(6) |
En su dictamen, recibido por la Comisión y los Estados miembros el 7 de agosto de 2009, la Autoridad llegó a la conclusión de que los datos presentados permitían determinar que existía una relación causal entre la ingesta de calcio, solo o combinado con vitamina D, y la disminución de la pérdida de densidad mineral ósea (DMO) en mujeres postmenopáusicas. Reducir la pérdida de DMO puede contribuir a disminuir el riesgo de fracturas óseas. Por consiguiente, cabe considerar que dos declaraciones de propiedades saludables que reflejan esta conclusión cumplen los requisitos establecidos en el Reglamento (CE) no 1924/2006, y deben incluirse en la lista autorizada de declaraciones permitidas de la Unión. Sin embargo, la Autoridad llegó a la conclusión de que la información facilitada no era suficiente para establecer las condiciones de uso de las declaraciones. Posteriormente, la Comisión se dirigió de nuevo a la Autoridad a fin de solicitar información adicional que permitiera a los gestores de riesgo establecer las condiciones de uso adecuadas de las declaraciones de propiedades saludables pertinentes. En su dictamen, recibido por la Comisión y los Estados miembros el 17 de mayo de 2010 (pregunta no EFSA-Q-2009-00940) (3), la Autoridad llegó a la conclusión de que para obtener el efecto alegado era necesaria una ingesta diaria mínima de 1 200 mg de calcio de todas las fuentes, o al menos 1 200 mg de calcio y 800 UI (20 μg) de vitamina D de todas las fuentes. |
|
(7) |
Si una declaración de propiedades saludables se refiere solo al calcio, a fin de garantizar que un alimento proporciona una cantidad significativa de calcio, conviene fijar las condiciones de uso que permitan formular la declaración únicamente para los alimentos que contienen al menos 400 mg de calcio por porción cuantificada. |
|
(8) |
Teniendo en cuenta la elevada ingesta de vitamina D necesaria para alcanzar el efecto declarado (20 μg), cuando se hace una declaración de propiedades saludables sobre la combinación de calcio y de vitamina D procede limitar el uso de la declaración a los complementos alimenticios. Con el fin de garantizar que un complemento alimenticio aportará una cantidad importante de calcio y de vitamina D en el marco de la presente declaración, es preciso establecer unas condiciones de uso que limiten la utilización de dicha declaración a los complementos alimenticios que aporten como mínimo 400 mg de calcio y 15 μg de vitamina D por porción diaria. |
|
(9) |
A raíz de una solicitud presentada por DSM Nutritional Products Europe AG con arreglo al artículo 14, apartado 1, letra a), del Reglamento (CE) no 1924/2006, se pidió a la Autoridad que emitiera un dictamen sobre la declaración de propiedades saludables relativa a los efectos de la vitamina D y el riesgo de caídas en hombres y mujeres de 60 años o más (pregunta no EFSA-Q-2010-01233) (4). La declaración propuesta por el solicitante decía lo siguiente: «La vitamina D reduce el riesgo de caídas, que son un factor de riesgo de fracturas». |
|
(10) |
En su dictamen, recibido por la Comisión y los Estados miembros el 30 de septiembre de 2011, la Autoridad llegó a la conclusión de que los datos presentados permitían determinar que existía una relación causal entre la ingesta de vitamina D y la reducción del riesgo de caídas, que está directamente relacionado con la inestabilidad postural y la debilidad muscular. Reducir el riesgo de caídas de hombres y mujeres de 60 años o más es beneficioso para la salud humana, ya que reduce el riesgo de fracturas de huesos. Por consiguiente, debe considerarse que una declaración de propiedades saludables que refleje esta conclusión cumple los requisitos establecidos en el Reglamento (CE) no 1924/2006 y debe incluirse en la lista autorizada de declaraciones permitidas de la Unión. |
|
(11) |
En su dictamen, la Autoridad también llegó a la conclusión de que, para obtener el efecto alegado, era preciso consumir diariamente 800 UI (20 μg) de vitamina D, de todas las fuentes. Habida cuenta de la elevada ingesta de vitamina D necesaria para alcanzar el efecto declarado (20 μg), procede limitar el uso de la declaración a los complementos alimenticios. Para garantizar que un complemento alimenticio aportará una cantidad significativa de vitamina D en el marco de la presente declaración, es preciso establecer unas condiciones de uso que limiten la utilización de dicha declaración a los complementos alimenticios que aporten como mínimo15 μg de vitamina D por porción diaria. |
|
(12) |
En el artículo 16, apartado 4, del Reglamento (CE) no 1924/2006 se establece que un dictamen favorable a la autorización de una declaración de propiedades saludables debe incluir determinada información. En consecuencia, dicha información debe figurar en el anexo I del presente Reglamento por lo que respecta a la declaración autorizada e incluir, en su caso, la redacción revisada de la declaración, sus condiciones específicas de uso, y, cuando sea pertinente, las condiciones o restricciones de utilización del alimento y/o una declaración o advertencia complementaria, con arreglo a las normas establecidas en el Reglamento (CE) no 1924/2006 y en consonancia con los dictámenes de la Autoridad. |
|
(13) |
Uno de los objetivos del Reglamento (CE) no 1924/2006 es garantizar al consumidor la veracidad, claridad, fiabilidad y utilidad de las declaraciones de propiedades saludables, para lo cual han de tenerse en cuenta tanto la redacción como la presentación. Por tanto, cuando la redacción de una declaración tenga el mismo significado para los consumidores que una declaración de propiedades saludables autorizada, por haberse demostrado que existe la misma relación entre una categoría de alimentos, un alimento o uno de sus componentes y la salud, dicha declaración debe estar sujeta a las mismas condiciones de uso indicadas en el anexo I del presente Reglamento. |
|
(14) |
A raíz de una solicitud presentada por GP International Holding B.V. con arreglo al artículo 14, apartado 1, letra a), del Reglamento (CE) no 1924/2006, se pidió a la Autoridad que emitiera un dictamen sobre una declaración de propiedades saludables relativa al clorhidrato de glucosamina y la reducción de la tasa de degeneración del cartílago (pregunta no EFSA-Q-2009-00412) (5). La declaración propuesta por el solicitante decía lo siguiente: «Ralentiza/reduce el proceso de destrucción del cartílago del sistema osteomuscular y, en consecuencia, reduce el riesgo de artrosis». |
|
(15) |
En su dictamen, recibido por la Comisión y los Estados miembros el 29 de octubre de 2009, la Autoridad llegó a la conclusión de que los datos presentados no permitían determinar que existiera una relación causal entre el consumo de clorhidrato de glucosamina y el efecto declarado. Por lo tanto, la declaración no cumple los requisitos del Reglamento (CE) no 1924/2006 y no debe autorizarse. |
|
(16) |
A raíz de una solicitud presentada por la European Natural Soyfood Manufacturers Association (ENSA) (Asociación Europea de Fabricantes de Alimentos de Soja), la European Vegetable Protein Federation (EUVEPRO) (Federación Europea de la Proteína Vegetal) y la Soya Protein Association (SPA) (Asociación de la Proteína de Soja) European Natural Soyfood Manufacturers Association (Asociación Europea de Fabricantes de Alimentos de Soja) con arreglo al artículo 14, apartado 1, letra a), del Reglamento (CE) no 1924/2006, se pidió a la Autoridad que emitiera un dictamen sobre una declaración de propiedades saludables relativa a los efectos de una proteína aislada de soja sobre la reducción de las concentraciones de colesterol LDL en la sangre (pregunta no EFSA-Q-2011-00784) (6). La declaración propuesta por el solicitante decía lo siguiente: «Se ha demostrado que el componente rico en proteínas de la soja disminuye/reduce el colesterol en la sangre, lo cual puede reducir el riesgo de cardiopatías coronarias». |
|
(17) |
En su dictamen, recibido por la Comisión y los Estados miembros el 2 de febrero de 2012, la Autoridad llegó a la conclusión de que los datos presentados no permitían determinar que existiera una relación causal entre el consumo de proteína aislada de soja, según la definición del solicitante, y el efecto declarado. Por lo tanto, la declaración no cumple los requisitos del Reglamento (CE) no 1924/2006 y no debe autorizarse. |
|
(18) |
A raíz de una solicitud presentada por Health Concern B.V. con arreglo al artículo 14, apartado 1, letra a), del Reglamento (CE) no 1924/2006, se pidió a la Autoridad que emitiera un dictamen sobre una declaración de propiedades saludables relativa a los efectos de una combinación de fitoesteroles y Cholesternorm®mix sobre la reducción de las concentraciones de colesterol LDL en la sangre (pregunta no EFSA-Q-2009-00237, EFSAQ-2011-01114) (7). La declaración propuesta por el solicitante decía lo siguiente: «Reduce de forma activa el colesterol». |
|
(19) |
En su dictamen, recibido por la Comisión y los Estados miembros el 17 de julio de 2012, la Autoridad llegó a la conclusión de que los datos presentados no permitían determinar que existiera una relación causal entre el consumo de una combinación de fitoesteroles y Cholesternorm®mix y el efecto declarado en las condiciones de uso propuestas. Por lo tanto, la declaración no cumple los requisitos del Reglamento (CE) no 1924/2006 y no debe autorizarse. |
|
(20) |
A raíz de una solicitud presentada por Minami Nutrition Health BVBA con arreglo al artículo 14, apartado 1, letra a), del Reglamento (CE) no 1924/2006, se pidió a la Autoridad que emitiera un dictamen sobre una declaración de propiedades saludables relativa a los efectos del ácido eicosapentaenoico (EPA) sobre la reducción de la proporción ácido araquidónico (ARA)/EPA en la sangre de los niños con trastorno por déficit de atención con hiperactividad (TDAH) (pregunta no EFSA-Q-2012-00573) (8). La declaración propuesta por el solicitante decía lo siguiente: «Se ha demostrado que el ácido eicosapentaenoico reduce la proporción ARA/EPA en la sangre. Una proporción ARA/EPA elevada es un factor de riesgo en el desarrollo de dificultades de atención en niños que presentan síntomas relacionados con el TDAH. Esos niños presentan asimismo una menor hiperactividad y/o menos comportamientos de oposición concomitantes». |
|
(21) |
En su dictamen, recibido por la Comisión y los Estados miembros el 8 de abril de 2013, la Autoridad llegó a la conclusión de que, según los datos presentados, la población destinataria de la declaración era una población enferma (a saber, niños con TDAH) y que el efecto declarado está relacionado con el tratamiento de una enfermedad. |
|
(22) |
El Reglamento (CE) no 1924/2006 complementa los principios generales de la Directiva 2000/13/CE del Parlamento Europeo y del Consejo, de 20 de marzo de 2000, relativa a la aproximación de las legislaciones de los Estados miembros en materia de etiquetado, presentación y publicidad de los productos alimenticios (9). El artículo 2, apartado 1, letra b), de la Directiva 2000/13/CE establece que el etiquetado no atribuirá a ningún producto alimenticio propiedades de prevención, tratamiento y curación de una enfermedad humana, ni mencionará dichas propiedades. Por lo tanto, al estar prohibida la atribución de propiedades medicinales a los productos alimenticios, no debe autorizarse la declaración de propiedades relativa a los efectos del ácido eicosapentaenoico (EPA) sobre una reducción de la proporción ARA/EPA en la sangre de niños con TDAH. |
|
(23) |
A raíz de una solicitud presentada por McNeil Nutritionals y Raisio Nutrition Ltd. con arreglo al artículo 14, apartado 1, letra a), del Reglamento (CE) no 1924/2006, se pidió a la Autoridad que emitiera un dictamen sobre una declaración de propiedades saludables relativa a los efectos del consumo de 2 g/día de fitoestanoles (ésteres de fitoestanol) como parte de una dieta pobre en grasas saturadas y una reducción de las concentraciones de colesterol LDL en la sangre doble de la que se obtendría con una dieta pobre en grasas saturadas por sí sola (pregunta no EFSA-Q-2012-00915) (10). La declaración propuesta por el solicitante decía lo siguiente: «Consumir 2 g/día de fitoestanoles (ésteres de fitoestanol) como parte de una dieta pobre en grasas saturadas lleva consigo una reducción del colesterol LDL doble de la que se obtendría con una dieta pobre en grasas saturadas por sí sola. Una tasa elevada de colesterol es un factor de riesgo en el desarrollo de cardiopatías coronarias». |
|
(24) |
En su dictamen, recibido por la Comisión y los Estados miembros el 8 de abril de 2013, la Autoridad llegó a la conclusión de que las pruebas presentadas no permitían determinar que el consumo de 2 g/día de fitoestanoles (ésteres de fitoestanol) como parte de una dieta pobre en grasas saturadas llevara consigo una reducción del colesterol LDL doble de la que se obtendría con una dieta pobre en grasas saturadas por sí sola. Por lo tanto, la declaración no cumple los requisitos del Reglamento (CE) no 1924/2006 y no debe autorizarse. |
|
(25) |
Las medidas previstas en el presente Reglamento tienen en cuenta los comentarios formulados a la Comisión por los solicitantes y demás interesados de conformidad con el artículo 16, apartado 6, del Reglamento (CE) no 1924/2006. |
|
(26) |
La adición o utilización de sustancias en productos alimenticios se rige por legislación de la Unión y nacional específica, al igual que sucede con la clasificación de los productos como productos alimenticios o como medicamentos. Cualquier decisión sobre una declaración de propiedades saludables de conformidad con el Reglamento (CE) no 1924/2006, como es el caso de la incorporación de una declaración a la lista de declaraciones autorizadas a la que se refiere su artículo 14, apartado 1, no constituye una autorización de comercialización de la sustancia a la que concierne la declaración, ni una decisión sobre la posibilidad de utilizar la sustancia en productos alimenticios ni la clasificación de un determinado producto como alimento. |
|
(27) |
Las medidas previstas en el presente Reglamento se ajustan al dictamen del Comité Permanente de la Cadena Alimentaria y de Sanidad Animal. |
HA ADOPTADO EL PRESENTE REGLAMENTO:
Artículo 1
1. Las declaraciones de propiedades saludables que figuran en el anexo I del presente Reglamento podrán realizarse sobre los alimentos comercializados en la Unión, siempre que cumplan las condiciones establecidas en dicho anexo.
2. Las declaraciones de propiedades saludables contempladas en el apartado 1 se incluirán en la lista de declaraciones autorizadas de la Unión Europea, conforme a lo dispuesto en el artículo 14, apartado 1, del Reglamento (CE) no 1924/2006.
Artículo 2
Las declaraciones de propiedades saludables que figuran en el anexo II del presente Reglamento no se incluirán en la lista de declaraciones autorizadas en la Unión, conforme a lo dispuesto en el artículo 14, apartado 1, del Reglamento (CE) no 1924/2006.
Artículo 3
El presente Reglamento entrará en vigor el vigésimo día siguiente al de su publicación en el Diario Oficial de la Unión Europea.
El presente Reglamento será obligatorio en todos sus elementos y directamente aplicable en cada Estado miembro.
Hecho en Bruselas, el 17 de noviembre de 2014.
Por la Comisión
El Presidente
Jean-Claude JUNCKER
(1) DO L 404 de 30.12.2006, p. 9.
(2) EFSA Journal (2009) 1180, pp. 1-13.
(3) EFSA Journal (2010), 8(5):1609.
(4) EFSA Journal (2011), 9(9):2382.
(5) EFSA Journal 2009;7(10):1358.
(6) EFSA Journal (2012), 10(2):2555.
(7) EFSA Journal (2012), 10(7):2810.
(8) EFSA Journal (2013), 11(4):3161.
(9) DO L 109 de 6.5.2000, p. 29.
(10) EFSA Journal (2013), 11(4):3160.
ANEXO I
Declaraciones de propiedades saludables autorizadas
|
Solicitud: disposiciones pertinentes del Reglamento (CE) no 1924/2006 |
Dirección del solicitante |
Nutriente, sustancia, alimento o categoría de alimentos |
Declaración |
Condiciones de uso de la declaración |
Condiciones y/o restricciones de uso del alimento o bien declaración y/o advertencia complementaria |
Referencia del dictamen de la EFSA |
|
Artículo 14, apartado 1, letra a): declaración de propiedades saludables relativa a la reducción del riesgo de enfermedad |
Abtei Pharma Vertriebs GmbH, Abtei 1, 37696, Marienmünster, Alemania. |
Calcio |
El calcio contribuye a a reducir la desmineralización ósea en mujeres postmenopáusicas. Una densidad mineral ósea baja es un factor de riesgo de fracturas óseas osteoporóticas. |
Esta declaración solo puede utilizarse en alimentos que aporten al menos 400 mg de calcio por porción cuantificada. Se informará al consumidor de que la declaración está dirigida específicamente a las mujeres a partir de 50 años y de que el efecto beneficioso se obtiene con una ingesta diaria de al menos 1 200 mg de calcio de todas las fuentes. |
Para los alimentos con calcio añadido, la declaración podrá utilizarse únicamente para aquellos destinados a las mujeres a partir de 50 años. |
Q- 2008-721 Q- 2009-00940 |
|
Artículo 14, apartado 1, letra a): declaración de propiedades saludables relativa a la reducción del riesgo de enfermedad |
Abtei Pharma Vertriebs GmbH, Abtei 1, 37696, Marienműnster, Alemania. |
Calcio y vitamina D |
El calcio y la vitamina D contribuyen a reducir la desmineralización ósea en mujeres postmenopáusicas. Una densidad mineral ósea baja es un factor de riesgo de fracturas óseas osteoporóticas. |
La declaración solo puede utilizarse en complementos alimenticios que aporten al menos 400 mg de calcio y 15 μg de vitamina D por porción diaria. Se informará al consumidor de que la declaración está dirigida específicamente a las mujeres a partir de 50 años y de que el efecto beneficioso se obtiene con una ingesta diaria de al menos 1 200 mg de calcio y 20 μg de vitamina D de todas las fuentes. |
Para los complementos alimenticios con calcio y vitamina D añadidos, la declaración podrá utilizarse únicamente para aquellos destinados a las mujeres a partir de 50 años. |
Q- 2008-721 Q- 2009-00940 |
|
Artículo 14, apartado 1, letra a): declaración de propiedades saludables relativa a la reducción del riesgo de enfermedad |
DSM Nutritional Products Europe AG, P.O. Box 2676, 4002 Basel, Suiza. |
Vitamina D |
La vitamina D contribuye a reducir el riesgo de caídas relacionado con la inestabilidad postural y con la debilidad muscular. Las caídas constituyen un factor de riesgo de fracturas óseas en hombres y mujeres a partir de 60 años. |
La declaración solo puede utilizarse en complementos alimenticios que aporten al menos 15 μg de vitamina D por porción diaria. Se informará al consumidor de que el efecto beneficioso se obtiene con una ingesta diaria de 20 μg de vitamina D de todas las fuentes. |
Para los complementos alimenticios con vitamina D añadida, la declaración podrá utilizarse únicamente para aquellos destinados a hombres y mujeres a partir de 60 años. |
Q- 2010-01233 |
ANEXO II
Declaraciones de propiedades saludables denegadas
|
Solicitud: disposiciones pertinentes del Reglamento (CE) no 1924/2006 |
Nutriente, sustancia, alimento o categoría de alimentos |
Declaración |
Referencia del dictamen de la EFSA |
|
Artículo 14, apartado 1, letra a): declaración de propiedades saludables relativa a la reducción del riesgo de enfermedad |
Clorhidrato de glucosamina |
Ralentiza/reduce el proceso de destrucción del cartílago del sistema osteomuscular y, en consecuencia, reduce el riesgo de artrosis. |
Q-2009-00412 |
|
Artículo 14, apartado 1, letra a): declaración de propiedades saludables relativa a la reducción del riesgo de enfermedad |
Proteína aislada de soja |
Se ha demostrado que el componente rico en proteínas de soja disminuye/reduce el colesterol en la sangre, lo cual puede reducir el riesgo de cardiopatías coronarias. |
Q-2011-00784 |
|
Artículo 14, apartado 1, letra a): declaración de propiedades saludables relativa a la reducción del riesgo de enfermedad |
Combinación de fitoesteroles y Cholesternorm®mix |
Reduce de forma activa el colesterol. |
Q-2009-00237 Q-2011-01114 |
|
Artículo 14, apartado 1, letra a): declaración de propiedades saludables relativa a la reducción del riesgo de enfermedad |
Ácido eicosapentanoico (EPA) |
Se ha demostrado que el ácido eicosapentanoico reduce la proporción ARA/EPA en la sangre. Una proporción ARA/EPA elevada es un factor de riesgo en el desarrollo de dificultades de atención en niños que presentan síntomas relacionados con el TDAH. Estos niños también presentan menos hiperactividad y/o menos comportamientos de oposición concomitantes. |
Q-2012-00573 |
|
Artículo 14, apartado 1, letra a): declaración de propiedades saludables relativa a la reducción del riesgo de enfermedad |
Fitoestanoles (ésteres de fitoestanol) |
Consumir 2 g/día de fitoestanoles (ésteres de fitoestanol) como parte de una dieta pobre en grasas saturadas lleva consigo una reducción del colesterol LDL doble de la que se obtendría con una dieta pobre en grasas saturadas por sí sola. Una tasa elevada de colesterol es un factor de riesgo en el desarrollo de cardiopatías coronarias. |
Q-2012-00915 |
|
18.11.2014 |
ES |
Diario Oficial de la Unión Europea |
L 331/14 |
REGLAMENTO (UE) No 1229/2014 DE LA COMISIÓN
de 17 de noviembre de 2014
por el que se deniega la autorización de determinadas declaraciones de propiedades saludables en los alimentos distintas de las relativas a la reducción del riesgo de enfermedad y al desarrollo y la salud de los niños
(Texto pertinente a efectos del EEE)
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Visto el Reglamento (CE) no 1924/2006 del Parlamento Europeo y del Consejo, de 20 de diciembre de 2006, relativo a las declaraciones nutricionales y de propiedades saludables en los alimentos (1), y, en particular, su artículo 18, apartado 5,
Considerando lo siguiente:
|
(1) |
Con arreglo al Reglamento (CE) no 1924/2006, las declaraciones de propiedades saludables en los alimentos están prohibidas a no ser que las autorice la Comisión de conformidad con ese mismo Reglamento y las incluya en una lista de declaraciones autorizadas. |
|
(2) |
El Reglamento (CE) no 1924/2006 también establece que los explotadores de empresas alimentarias pueden presentar solicitudes de autorización de declaraciones de propiedades saludables a la autoridad nacional competente de un Estado miembro. Dicha autoridad nacional competente debe remitir las solicitudes válidas a la Autoridad Europea de Seguridad Alimentaria (EFSA), denominada en lo sucesivo «la Autoridad», para que realice una evaluación científica, así como a la Comisión y a los Estados miembros para información. |
|
(3) |
La Autoridad debe emitir un dictamen sobre la declaración de propiedades saludables en cuestión. |
|
(4) |
La Comisión debe tomar una decisión sobre la autorización de las declaraciones de propiedades saludables teniendo en cuenta el dictamen emitido por la Autoridad. |
|
(5) |
A raíz de una solicitud presentada por Italsur s.r.l. con arreglo al artículo 13, apartado 5, del Reglamento (CE) no 1924/2006, se pidió a la Autoridad que emitiera un dictamen sobre una declaración de propiedades saludables relativa a los efectos de una combinación de berza rizada, remolacha tricolor, espinaca bicolor y col de Saboya en la protección de los lípidos de la sangre frente a los daños provocados por la oxidación (pregunta no EFSA-Q-2013-00574) (2). La declaración propuesta por el solicitante estaba redactada de la manera siguiente: «Contribuye a proteger los lípidos de la sangre de los daños provocados por la oxidación». |
|
(6) |
El 30 de octubre de 2013, la Comisión y los Estados miembros recibieron el dictamen científico de la Autoridad, en el que llegaba a la conclusión de que, a partir de los datos presentados, no quedaba establecida una relación causal entre el consumo de una combinación de berza rizada, remolacha tricolor, espinaca bicolor y col de Saboya y el efecto declarado. Por lo tanto, la declaración no cumple los requisitos del Reglamento (CE) no 1924/2006 y no debe autorizarse. |
|
(7) |
A raíz de una solicitud presentada por Italsur s.r.l. con arreglo al artículo 13, apartado 5, del Reglamento (CE) no 1924/2006, se pidió a la Autoridad que emitiera un dictamen sobre una declaración de propiedades saludables relativa a los efectos de una combinación de espinaca roja, espinaca verde, escarola roja, escarola verde, acelga verde, acelga roja, remolacha roja, remolacha dorada y remolacha blanca en la protección de los lípidos de la sangre frente a los daños provocados por la oxidación (pregunta no EFSA-Q-2013-00575) (3). La declaración propuesta por el solicitante estaba redactada de la manera siguiente: «Contribuye a proteger los lípidos de la sangre de los daños provocados por la oxidación». |
|
(8) |
El 30 de octubre de 2013, la Comisión y los Estados miembros recibieron el dictamen científico de la Autoridad, en el que llegaba a la conclusión de que, a partir de los datos presentados, no quedaba establecida una relación causal entre el consumo de una combinación de espinaca roja, espinaca verde, escarola roja, escarola verde, acelga verde, acelga roja, remolacha roja, remolacha dorada y remolacha blanca y el efecto declarado. Por lo tanto, la declaración no cumple los requisitos del Reglamento (CE) no 1924/2006 y no debe autorizarse. |
|
(9) |
A raíz de una solicitud presentada por Italsur s.r.l. con arreglo al artículo 13, apartado 5, del Reglamento (CE) no 1924/2006, se pidió a la Autoridad que emitiera un dictamen sobre una declaración de propiedades saludables relativa a los efectos de una combinación de berza rizada, acelga tricolor, espinaca bicolor y col de Saboya en el mantenimiento de un nivel normal del colesterol de las LDL en la sangre (pregunta no EFSA-Q-2013-00576) (4). La declaración propuesta por el solicitante estaba redactada de la manera siguiente: «Mantiene un nivel normal de colesterol en la sangre». |
|
(10) |
El 30 de octubre de 2013, la Comisión y los Estados miembros recibieron el dictamen científico de la Autoridad, en el que llegaba a la conclusión de que, a partir de los datos presentados, no quedaba establecida una relación causal entre el consumo de una combinación de berza rizada, remolacha tricolor, espinaca bicolor y col de Saboya y el efecto declarado. Por lo tanto, la declaración no cumple los requisitos del Reglamento (CE) no 1924/2006 y no debe autorizarse. |
|
(11) |
A raíz de una solicitud presentada por Italsur s.r.l. con arreglo al artículo 13, apartado 5, del Reglamento (CE) no 1924/2006, se pidió a la Autoridad que emitiera un dictamen sobre una declaración de propiedades saludables relativa a los efectos de una combinación de espinaca roja, espinaca verde, escarola roja, escarola verde, acelga verde, acelga roja, remolacha roja, remolacha dorada y remolacha blanca en el mantenimiento de un nivel normal del colesterol de las LDL en la sangre (pregunta no EFSA-Q-2013-00579) (5). La declaración propuesta por el solicitante estaba redactada de la manera siguiente: «Mantiene un nivel normal de colesterol en la sangre». |
|
(12) |
El 30 de octubre de 2013, la Comisión y los Estados miembros recibieron el dictamen científico de la Autoridad, en el que llegaba a la conclusión de que, a partir de los datos presentados, no quedaba establecida una relación causal entre el consumo de una combinación de espinaca roja, espinaca verde, escarola roja, escarola verde, acelga verde, acelga roja, remolacha roja, remolacha dorada y remolacha blanca y el efecto declarado. Por lo tanto, la declaración no cumple los requisitos del Reglamento (CE) no 1924/2006 y no debe autorizarse. |
|
(13) |
A raíz de una solicitud presentada por Omikron Italia s.r.l. con arreglo al artículo 13, apartado 5, del Reglamento (CE) no 1924/2006, se pidió a la Autoridad que emitiera un dictamen sobre una declaración de propiedades saludables relativa a los efectos de una combinación de diosmina, troxerrutina y hesperidina en el mantenimiento de la permeabilidad venoso-capilar normal (pregunta no EFSA-Q-2013-00353) (6). La declaración propuesta por el solicitante estaba redactada de la manera siguiente: «La mezcla de flavonoides que contiene 300 mg de diosmina, 300 mg de troxerrutina y 100 mg de hesperidina ayuda a mantener la permeabilidad venoso-capilar fisiológica». |
|
(14) |
El 13 de enero de 2014, la Comisión y los Estados miembros recibieron el dictamen científico de la Autoridad, en el que llegaba a la conclusión de que, a partir de los datos presentados, no quedaba establecida una relación causal entre el consumo de una combinación de diosmina, troxerrutina y hesperidina y el efecto declarado. Por lo tanto, la declaración no cumple los requisitos del Reglamento (CE) no 1924/2006 y no debe autorizarse. |
|
(15) |
A raíz de una solicitud presentada por Omikron Italia s.r.l. con arreglo al artículo 13, apartado 5, del Reglamento (CE) no 1924/2006, se pidió a la Autoridad que emitiera un dictamen sobre una declaración de propiedades saludables relativa a los efectos de una combinación de diosmina, troxerrutina y hesperidina en el mantenimiento del tono venoso (pregunta no EFSA-Q-2013-00354) (7). La declaración propuesta por el solicitante estaba redactada de la manera siguiente: «La mezcla de flavonoides que contiene 300 mg de diosmina, 300 mg de troxerrutina y 100 mg de hesperidina ayuda a mantener el tono venoso fisiológico». |
|
(16) |
El 13 de enero de 2014, la Comisión y los Estados miembros recibieron el dictamen científico de la Autoridad, en el que llegaba a la conclusión de que, a partir de los datos presentados, no quedaba establecida una relación causal entre el consumo de una combinación de diosmina, troxerrutina y hesperidina y el efecto declarado. Por lo tanto, la declaración no cumple los requisitos del Reglamento (CE) no 1924/2006 y no debe autorizarse. |
|
(17) |
A raíz de una solicitud presentada por Italsur s.r.l. con arreglo al artículo 13, apartado 5, del Reglamento (CE) no 1924/2006, se pidió a la Autoridad que emitiera un dictamen sobre una declaración de propiedades saludables relativa a los efectos del guiso de cebada denominado orzotto en la protección de los lípidos de la sangre frente a los daños provocados por la oxidación (pregunta no EFSA-Q-2013-00578) (8). La declaración propuesta por el solicitante estaba redactada de la manera siguiente: «Contribuye a proteger los lípidos de la sangre de los daños provocados por la oxidación». |
|
(18) |
El 10 de enero de 2014, la Comisión y los Estados miembros recibieron el dictamen científico de la Autoridad, en el que llegaba a la conclusión de que, a partir de los datos presentados, no quedaba establecida una relación causal entre el consumo del guiso de cebada denominado orzotto y el efecto declarado. Por lo tanto, la declaración no cumple los requisitos del Reglamento (CE) no 1924/2006 y no debe autorizarse. |
|
(19) |
Las medidas previstas en el presente Reglamento se ajustan al dictamen del Comité Permanente de la Cadena Alimentaria y de Sanidad Animal. |
HA ADOPTADO EL PRESENTE REGLAMENTO:
Artículo 1
Las declaraciones de propiedades saludables que figuran en el anexo del presente Reglamento no se incluirán en la lista de declaraciones autorizadas en la Unión conforme a lo dispuesto en el artículo 13, apartado 3, del Reglamento (CE) no 1924/2006.
Artículo 2
El presente Reglamento entrará en vigor el vigésimo día siguiente al de su publicación en el Diario Oficial de la Unión Europea.
El presente Reglamento será obligatorio en todos sus elementos y directamente aplicable en cada Estado miembro.
Hecho en Bruselas, el 17 de noviembre de 2014.
Por la Comisión
El Presidente
Jean-Claude JUNCKER
(1) DO L 404 de 30.12.2006, p. 9.
(2) EFSA Journal 2013; 11(10):3413.
(3) EFSA Journal 2013; 11(10):3414.
(4) EFSA Journal 2013; 11(10):3415.
(5) EFSA Journal 2013; 11(10):3416.
(6) EFSA Journal 2014; 12(1):3511.
(7) EFSA Journal 2014; 12(1):3512.
(8) EFSA Journal 2014; 12(1):3519.
ANEXO
Declaraciones de propiedades saludables denegadas
|
Solicitud: disposiciones pertinentes del Reglamento (CE) no 1924/2006 |
Nutriente, sustancia, alimento o categoría de alimentos |
Declaración |
Referencia del dictamen de la EFSA |
|
Artículo 13, apartado 5: declaración de propiedades saludables basada en pruebas científicas recientemente obtenidas o que incluya una solicitud de protección de los datos sujetos a derechos de propiedad industrial |
Una combinación de col negra toscana, acelga suiza tricolor, espinaca bicolor y col de Saboya |
Contribuye a proteger los lípidos de la sangre frente al daño oxidativo |
Q-2013-00574 |
|
Artículo 13, apartado 5: declaración de propiedades saludables basada en pruebas científicas recientemente obtenidas o que incluya una solicitud de protección de los datos sujetos a derechos de propiedad industrial |
Una combinación de espinaca roja, espinaca verde, escarola roja, escarola verde, acelga verde, acelga roja, acelga suiza roja, acelga suiza dorada y acelga suiza blanca |
Contribuye a proteger los lípidos de la sangre frente al daño oxidativo |
Q-2013-00575 |
|
Artículo 13, apartado 5: declaración de propiedades saludables basada en pruebas científicas recientemente obtenidas o que incluya una solicitud de protección de los datos sujetos a derechos de propiedad industrial |
Una combinación de col negra toscana, acelga suiza tricolor, espinaca bicolor y col de Saboya |
Mantiene un nivel normal de colesterol en la sangre |
Q-2013-00576 |
|
Artículo 13, apartado 5: declaración de propiedades saludables basada en pruebas científicas recientemente obtenidas o que incluya una solicitud de protección de los datos sujetos a derechos de propiedad industrial |
Una combinación de espinaca roja, espinaca verde, escarola roja, escarola verde, acelga verde, acelga roja, acelga suiza roja, acelga suiza dorada y acelga suiza blanca |
Mantiene un nivel normal de colesterol en la sangre |
Q-2013-00579 |
|
Artículo 13, apartado 5: declaración de propiedades saludables basada en pruebas científicas recientemente obtenidas o que incluya una solicitud de protección de los datos sujetos a derechos de propiedad industrial |
Una combinación de diosmina, troxerutina y hesperidina |
La mezcla de flavonoides que contiene 300 mg de diosmina, 300 mg de troxerutina y 100 mg de hesperidina ayuda a mantener la permeabilidad venoso-capilar fisiológica |
Q-2013-00353 |
|
Artículo 13, apartado 5: declaración de propiedades saludables basada en pruebas científicas recientemente obtenidas o que incluya una solicitud de protección de los datos sujetos a derechos de propiedad industrial |
Una combinación de diosmina, troxerutina y hesperidina |
La mezcla de flavonoides que contiene 300 mg de diosmina, 300 mg de troxerutina y 100 mg de hesperidina ayuda a mantener el tono venoso fisiológico |
Q-2013-00354 |
|
Artículo 13, apartado 5: declaración de propiedades saludables basada en pruebas científicas recientemente obtenidas o que incluya una solicitud de protección de los datos sujetos a derechos de propiedad industrial |
Guiso de cebada denominado orzotto |
Contribuye a proteger los lípidos de la sangre frente al daño oxidativo |
Q-2013-00578 |
|
18.11.2014 |
ES |
Diario Oficial de la Unión Europea |
L 331/18 |
REGLAMENTO DE EJECUCIÓN (UE) No 1230/2014 DE LA COMISIÓN
de 17 de noviembre de 2014
relativo a la autorización del bilisinato de cobre como aditivo en piensos para todas las especies de animales
(Texto pertinente a efectos del EEE)
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Visto el Reglamento (CE) no 1831/2003 del Parlamento Europeo y del Consejo, de 22 de septiembre de 2003, sobre los aditivos en la alimentación animal (1), y, en particular, su artículo 9, apartado 2,
Considerando lo siguiente:
|
(1) |
El Reglamento (CE) no 1831/2003 regula la autorización del uso de aditivos en la alimentación animal y los motivos y procedimientos para su concesión. |
|
(2) |
Se ha presentado una solicitud de autorización del bilisinato de cobre de conformidad con el artículo 7 del Reglamento (CE) no 1831/2003. Dicha solicitud iba acompañada de la información y la documentación exigidas en el artículo 7, apartado 3, del Reglamento (CE) no 1831/2003. |
|
(3) |
La solicitud se refiere a la autorización del bilisinato de cobre como aditivo en piensos para todas las especies de animales, que debe clasificarse en la categoría de «aditivos nutricionales». |
|
(4) |
En su dictamen de 3 de julio de 2014 (2), la Autoridad Europea de Seguridad Alimentaria («la Autoridad») concluyó que, en las condiciones de uso propuestas, el bilisinato de cobre no tiene efectos negativos en la salud animal, la salud humana ni el medio ambiente, y que puede considerarse esta sustancia una fuente eficaz de cobre para todas las especies de animales. La Autoridad no considera que sean necesarios requisitos específicos de seguimiento posterior a la comercialización. La Autoridad verificó además el informe sobre el método de análisis del aditivo para piensos que presentó el laboratorio de referencia establecido mediante el Reglamento (CE) no 1831/2003. |
|
(5) |
La evaluación del bilisinato de cobre muestra que se cumplen los requisitos de autorización establecidos en el artículo 5 del Reglamento (CE) no 1831/2003. Por consiguiente, procede autorizar el uso de dicha sustancia según lo especificado en el anexo del presente Reglamento. |
|
(6) |
Las medidas previstas en el presente Reglamento se ajustan al dictamen del Comité Permanente de Vegetales, Animales, Alimentos y Piensos. |
HA ADOPTADO EL PRESENTE REGLAMENTO:
Artículo 1
Se autoriza el uso como aditivo en la alimentación animal del preparado que figura en el anexo, perteneciente a la categoría de «aditivos nutricionales» y al grupo funcional «compuestos de oligoelementos», en las condiciones que se establecen en dicho anexo.
Artículo 2
El presente Reglamento entrará en vigor el vigésimo día siguiente al de su publicación en el Diario Oficial de la Unión Europea.
El presente Reglamento será obligatorio en todos sus elementos y directamente aplicable en cada Estado miembro.
Hecho en Bruselas, el 17 de noviembre de 2014.
Por la Comisión
El Presidente
Jean-Claude JUNCKER
(1) DO L 268 de 18.10.2003, p. 29.
(2) EFSA Journal 2014; 12(7):3796.
ANEXO
|
Número de identificación del aditivo |
Nombre del titular de la autorización |
Aditivo |
Composición, fórmula química, descripción y método analítico |
Especie animal o categoría de animales |
Edad máxima |
Contenido mínimo |
Contenido máximo |
Otras disposiciones |
Fin del período de autorización |
||||||||||||||||||||||||||||
|
Contenido del elemento (Cu) en mg/kg de pienso completo con un contenido de humedad del 12 % |
|||||||||||||||||||||||||||||||||||||
|
Categoría de aditivos nutricionales. Grupo funcional: compuestos de oligoelementos |
|||||||||||||||||||||||||||||||||||||
|
3b411 |
— |
Bilisinato de cobre |
Caracterización del aditivo en polvo o granulado, con un contenido de cobre ≥ 14,5 % y de lisina ≥ 84,0 %. Caracterización de la sustancia activa Quelato de cobre de L-lisinato-HCl Fórmula química: Cu(C6H13N2O2)2 × 2HCl Número CAS: 53383-24-7 Métodos analíticos (1) Para la cuantificación de la lisina en los aditivos para piensos:
Para la cuantificación del cobre total en el aditivo para piensos y las premezclas:
Para la determinación del cobre total en las materias primas para piensos y los piensos compuestos:
|
Todas las especies de animales |
— |
— |
Bovinos:
Ovinos: 15 (total). Lechones hasta las 12 semanas: 170 (total). Crustáceos: 50 (total). Otros animales: 25 (total). |
|
8 de diciembre de 2024 |
||||||||||||||||||||||||||||
(1) Puede hallarse información detallada sobre los métodos analíticos en la siguiente dirección del laboratorio de referencia: https://ec.europa.eu/jrc/en/eurl/feed-additives/evaluation-reports
|
18.11.2014 |
ES |
Diario Oficial de la Unión Europea |
L 331/22 |
REGLAMENTO DE EJECUCIÓN (UE) No 1231/2014 DE LA COMISIÓN
de 17 de noviembre de 2014
por el que se establecen valores de importación a tanto alzado para la determinación del precio de entrada de determinadas frutas y hortalizas
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Visto el Reglamento (CE) no 1308/2013 del Parlamento Europeo y del Consejo, de 17 de diciembre de 2013, por el que se crea la organización común de mercados de los productos agrarios y por el que se derogan los Reglamentos (CEE) no 922/72, (CEE) no 234/79, (CE) no 1037/2001 y (CE) no 1234/2007 (1),
Visto el Reglamento de Ejecución (UE) no 543/2011 de la Comisión, de 7 de junio de 2011, por el que se establecen disposiciones de aplicación del Reglamento (CE) no 1234/2007 del Consejo en los sectores de las frutas y hortalizas y de las frutas y hortalizas transformadas (2), y, en particular, su artículo 136, apartado 1,
Considerando lo siguiente:
|
(1) |
El Reglamento de Ejecución (UE) no 543/2011 establece, en aplicación de los resultados de las negociaciones comerciales multilaterales de la Ronda Uruguay, los criterios para que la Comisión fije los valores de importación a tanto alzado de terceros países correspondientes a los productos y períodos que figuran en el anexo XVI, parte A, de dicho Reglamento. |
|
(2) |
De acuerdo con el artículo 136, apartado 1, del Reglamento de Ejecución (UE) no 543/2011, el valor de importación a tanto alzado se calcula cada día hábil teniendo en cuenta datos que varían diariamente. Por lo tanto, el presente Reglamento debe entrar en vigor el día de su publicación en el Diario Oficial de la Unión Europea. |
HA ADOPTADO EL PRESENTE REGLAMENTO:
Artículo 1
En el anexo del presente Reglamento quedan fijados los valores de importación a tanto alzado a que se refiere el artículo 136 del Reglamento de Ejecución (UE) no 543/2011.
Artículo 2
El presente Reglamento entrará en vigor el día de su publicación en el Diario Oficial de la Unión Europea.
El presente Reglamento será obligatorio en todos sus elementos y directamente aplicable en cada Estado miembro.
Hecho en Bruselas, el 17 de noviembre de 2014.
Por la Comisión,
en nombre del Presidente,
Jerzy PLEWA
Director General de Agricultura y Desarrollo Rural
(1) DO L 347 de 20.12.2013, p. 671.
(2) DO L 157 de 15.6.2011, p. 1.
ANEXO
Valores de importación a tanto alzado para la determinación del precio de entrada de determinadas frutas y hortalizas
|
(EUR/100 kg) |
||
|
Código NC |
Código tercer país (1) |
Valor de importación a tanto alzado |
|
0702 00 00 |
AL |
94,9 |
|
MA |
77,1 |
|
|
MK |
78,8 |
|
|
ZZ |
83,6 |
|
|
0707 00 05 |
AL |
67,4 |
|
JO |
194,1 |
|
|
TR |
128,5 |
|
|
ZZ |
130,0 |
|
|
0709 93 10 |
AL |
65,0 |
|
MA |
52,3 |
|
|
TR |
125,4 |
|
|
ZZ |
80,9 |
|
|
0805 20 10 |
MA |
130,6 |
|
ZZ |
130,6 |
|
|
0805 20 30, 0805 20 50, 0805 20 70, 0805 20 90 |
TR |
74,4 |
|
ZZ |
74,4 |
|
|
0805 50 10 |
TR |
78,7 |
|
ZZ |
78,7 |
|
|
0806 10 10 |
BR |
293,5 |
|
LB |
337,2 |
|
|
PE |
282,9 |
|
|
TR |
149,1 |
|
|
US |
303,0 |
|
|
ZZ |
273,1 |
|
|
0808 10 80 |
BR |
54,0 |
|
CA |
135,3 |
|
|
CL |
80,6 |
|
|
MD |
29,7 |
|
|
NZ |
144,2 |
|
|
US |
102,4 |
|
|
ZA |
108,6 |
|
|
ZZ |
93,5 |
|
|
0808 30 90 |
CN |
75,6 |
|
ZZ |
75,6 |
|
(1) Nomenclatura de países fijada por el Reglamento (UE) no 1106/2012 de la Comisión, de 27 de noviembre de 2012, por el que se aplica el Reglamento (CE) no 471/2009 del Parlamento Europeo y del Consejo, sobre estadísticas comunitarias relativas al comercio exterior con terceros países, en lo que concierne a la actualización de la nomenclatura de países y territorios (DO L 328 de 28.11.2012, p. 7). El código «ZZ» significa «otros orígenes».
DECISIONES
|
18.11.2014 |
ES |
Diario Oficial de la Unión Europea |
L 331/24 |
DECISIÓN 2014/800/PESC DEL CONSEJO
de 17 de noviembre de 2014
por la que se inicia la Misión asesora de la Unión Europea para la reforma del sector de la seguridad civil en Ucrania (EUAM Ucrania) y se modifica la Decisión 2014/486/PESC
EL CONSEJO DE LA UNIÓN EUROPEA,
Visto el Tratado de la Unión Europea y, en particular, su artículo 28, su artículo 42, apartado 4, y su artículo 43, apartado 2,
Vista la Decisión 2014/486/PESC del Consejo, de 22 de julio de 2014, relativa a la Misión asesora de la Unión Europea para la reforma del sector de la seguridad civil en Ucrania (EUAM Ucrania) (1), y, en particular, su artículo 4,
Vista la propuesta de la Alta Representante de la Unión para Asuntos Exteriores y Política de Seguridad,
Considerando lo siguiente:
|
(1) |
El 22 de julio de 2014, el Consejo adoptó la Decisión 2014/486/PESC. |
|
(2) |
El 20 de octubre de 2014, el Consejo aprobó el plan de operación de EUAM Ucrania. |
|
(3) |
A recomendación del Comandante de la Operación Civil y una vez alcanzada la capacidad operativa inicial de EUAM Ucrania, esta debe iniciarse el 1 de diciembre de 2014. |
|
(4) |
En la Decisión 2014/486/PESC se preveía un importe de referencia financiera de 2 680 000 EUR para el período que va hasta el 30 de noviembre de 2014. Debe preverse un nuevo importe de referencia financiera para el período de 12 meses que comienza el 1 de diciembre de 2014. En consecuencia, debe modificarse la Decisión 2014/486/PESC. |
|
(5) |
EUAM Ucrania se llevará a cabo en el contexto de una situación que puede deteriorarse y que podría obstaculizar el logro de los objetivos de la acción exterior de la Unión que se indican en el artículo 21 del Tratado. |
HA ADOPTADO LA PRESENTE DECISIÓN:
Artículo 1
La Misión asesora de la Unión Europea para la reforma del sector de la seguridad civil en Ucrania (EUAM Ucrania) se iniciará el 1 de diciembre de 2014.
Artículo 2
El Comandante de la Operación Civil de EUAM Ucrania queda autorizado con efecto inmediato para iniciar la ejecución de la operación.
Artículo 3
En el artículo 14 de la Decisión 2014/486/PESC el apartado 1 se sustituye por el texto siguiente:
«1. El importe de referencia financiera destinado a la cobertura de los gastos relacionados con EUAM Ucrania hasta el 30 de noviembre de 2014 ascenderá a 2 680 000 EUR. El importe de referencia financiera destinado a la cobertura de los gastos relacionados con EUAM Ucrania durante el período comprendido entre el 1 de diciembre de 2014 y el 30 de noviembre de 2015 ascenderá a 13 100 000 EUR. El importe de referencia financiera para los períodos subsiguientes será fijado por el Consejo.»
Artículo 4
La presente Decisión entrará en vigor el día de su adopción.
Hecho en Bruselas, el 17 de noviembre de 2014.
Por el Consejo
La Presidenta
F. MOGHERINI
(1) DO L 217 de 23.7.2014, p. 42.
|
18.11.2014 |
ES |
Diario Oficial de la Unión Europea |
L 331/26 |
DECISIÓN 2014/801/PESC DEL CONSEJO
de 17 de noviembre de 2014
por la que se modifica la Decisión 2014/145/PESC relativa a medidas restrictivas respecto de acciones que menoscaban o amenazan la integridad territorial, la soberanía y la independencia de Ucrania
EL CONSEJO DE LA UNIÓN EUROPEA,
Visto el Tratado de la Unión Europea y, en particular, su artículo 29,
Considerando lo siguiente:
|
(1) |
El 17 de marzo de 2014, el Consejo adoptó la Decisión 2014/145/PESC (1). |
|
(2) |
Debe modificarse la información relativa a una persona incluida en virtud de la Decisión 2014/145/PESC. |
|
(3) |
El anexo de la Decisión 2014/145/PESC debe ser modificado en consecuencia. |
HA ADOPTADO LA PRESENTE DECISIÓN:
Artículo 1
El anexo de la Decisión 2014/145/PESC queda modificado del modo establecido en el anexo de la presente Decisión.
Artículo 2
La presente Decisión entrará en vigor al día siguiente de su publicación en el Diario Oficial de la Unión Europea.
Hecho en Bruselas, el 17 de noviembre de 2014.
Por el Consejo
La Presidenta
F. MOGHERINI
(1) Decisión 2014/145/PESC del Consejo, de 17 de marzo de 2014, relativa a medidas restrictivas respecto de acciones que menoscaban o amenazan la integridad territorial, la soberanía y la independencia de Ucrania (DO L 78 de 17.3.2014, p. 16).
ANEXO
La entrada relativa a la siguiente persona que figuran en el Anexo de la Decisión 2014/145/PESC se sustituye por la siguiente entrada:
|
|
Nombre |
Información de identificación |
Exposición de motivos |
Fecha de inclusión |
|
|
«Vladimir Volfovich ZHIRINOVSKY Владимир Вольфович Жириновский |
Nacido el 25.4.1946 en Almaty (también denominada anteriormente Alma-Ata), Kazajistán. |
Miembro del Consejo de la Duma estatal; dirigente del PLDR. Ha apoyado activamente el recurso a las Fuerzas Armadas Rusas en Ucrania y la anexión de Crimea. Ha incitado activamente a la división de Ucrania. Ha firmado, en nombre del PLDR, del cual es presidente, un acuerdo con la denominada “República Popular de Donetsk”. |
12.9.2014» |
|
18.11.2014 |
ES |
Diario Oficial de la Unión Europea |
L 331/28 |
DECISIÓN DE EJECUCIÓN DE LA COMISIÓN
de 14 de noviembre de 2014
por la que se modifican las Decisiones 2010/470/UE y 2010/472/UE en lo que respecta a los requisitos zoosanitarios relativos a la tembladera para el comercio y las importaciones a la Unión de embriones de ovinos y caprinos
[notificada con el número C(2014) 8339]
(Texto pertinente a efectos del EEE)
(2014/802/UE)
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Vista la Directiva 92/65/CEE del Consejo, de 13 de julio de 1992, por la que se establecen las condiciones de policía sanitaria aplicables a los intercambios y las importaciones en la Comunidad de animales, esperma, óvulos y embriones no sometidos, con respecto a estas condiciones, a las normativas comunitarias específicas a que se refiere la sección I del anexo A de la Directiva 90/425/CEE (1), y, en particular, su artículo 11, apartado 3, primer guion, su artículo 17, apartado 2, letra b), su artículo 18, apartado 1, primer guion, y su artículo 19, frase introductoria y letra b),
Considerando lo siguiente:
|
(1) |
En la parte A del anexo IV de la Decisión 2010/470/UE de la Comisión (2), se establece el modelo de certificado sanitario para el comercio dentro de la Unión de partidas de óvulos y embriones de animales de las especies ovina y caprina recogidos o producidos después del 31 de agosto de 2010. |
|
(2) |
En la parte 2 del anexo IV de la Decisión 2010/472/UE de la Comisión (3), se establece el modelo de certificado sanitario para la importación a la Unión de partidas de óvulos y embriones de animales de las especies ovina y caprina. |
|
(3) |
El Reglamento (CE) no 999/2001 del Parlamento Europeo y del Consejo (4) establece disposiciones para la prevención, el control y la erradicación de determinadas encefalopatías espongiformes transmisibles (EET) en los animales de las especies bovina, ovina y caprina. En el capítulo A del anexo VIII de dicho Reglamento, se establecen las condiciones para el comercio dentro de la Unión de animales vivos, esperma y embriones. Además, en su anexo IX figuran las condiciones para la importación a la Unión de animales vivos, embriones, óvulos y productos de origen animal. |
|
(4) |
Teniendo en cuenta las nuevas pruebas científicas, se modificó el Reglamento (CE) no 999/2001 mediante el Reglamento (UE) no 630/2013 de la Comisión (5). Estas modificaciones, relacionadas con la tembladera, se reflejaron en la Decisión de Ejecución 2013/470/UE de la Comisión (6), concretamente en el modelo de certificado sanitario para el comercio dentro de la Unión de partidas de óvulos y embriones de animales de las especies ovina y caprina que figura en la parte A del anexo IV de la Decisión 2010/470/UE, y en el modelo de certificado sanitario para la importación a la Unión de partidas de óvulos y embriones de animales de las especies ovina y caprina que figura en la parte 2 del anexo IV de la Decisión 2010/472/UE, con un período transitorio hasta el 31 de diciembre de 2014. |
|
(5) |
De conformidad con el dictamen científico sobre el riesgo de transmisión de la tembladera clásica a través de la transferencia de embriones obtenidos in vivo de ovinos que adoptó la Autoridad Europea de Seguridad Alimentaria (EFSA) el 24 de enero de 2013, en el que se llegó a la conclusión de que podía considerarse insignificante el riesgo de transmisión de la tembladera clásica por la implantación de embriones de ovinos homocigotos o heterocigotos con el alelo ARR, siempre que se siguieran las recomendaciones y los procedimientos de la OIE relativas a la transferencia de embriones, se modificaron las disposiciones pertinentes del Reglamento (CE) no 999/2001 mediante el Reglamento (UE) no 1148/2014 de la Comisión (7). |
|
(6) |
Por consiguiente, procede modificar el modelo de certificado sanitario para el comercio dentro de la Unión de partidas de óvulos y embriones de las especies ovina y caprina que figura en la parte A del anexo IV de la Decisión 2010/470/UE y el modelo de certificado sanitario para las importaciones a la Unión de partidas de óvulos y embriones de las especies ovina y caprina que figura en la parte 2 del anexo IV de la Decisión 2010/472/UE para reflejar los requisitos que establece el Reglamento (CE) no 999/2001, según ha sido modificado por el Reglamento (UE) no 1148/2014. |
|
(7) |
Asimismo, es preciso modificar algunas referencias al Reglamento (CE) no 999/2001 que se recogen en el modelo de certificado sanitario para el comercio dentro de la Unión de partidas de óvulos y embriones de las especies ovina y caprina que figura en la parte A del anexo IV de la Decisión 2010/470/UE para evitar cualquier ambigüedad. |
|
(8) |
Por otra parte, se requiere una formulación más precisa del modelo de certificado sanitario para las importaciones a la Unión de partidas de óvulos y embriones de las especies ovina y caprina que figura en la parte 2 del anexo IV de la Decisión 2010/472/UE para que quede claro que el régimen de pruebas relacionadas con la enfermedad hemorrágica epizoótica (EHE) se aplica a las hembras donantes de los ovinos y caprinos. |
|
(9) |
Procede, por tanto, modificar las Decisiones 2010/470/UE y 2010/472/UE en consecuencia. |
|
(10) |
Las medidas previstas en la presente Decisión se ajustan al dictamen del Comité Permanente de la Cadena Alimentaria y de Sanidad Animal. |
HA ADOPTADO LA PRESENTE DECISIÓN:
Artículo 1
El anexo IV de la Decisión 2010/470/UE queda modificado con arreglo a lo dispuesto en el anexo I de la presente Decisión.
Artículo 2
El anexo IV de la Decisión 2010/472/UE queda modificado con arreglo a lo dispuesto en el anexo II de la presente Decisión.
Artículo 3
La presente Decisión será aplicable a partir del 1 de enero de 2015.
Artículo 4
Los destinatarios de la presente Decisión serán los Estados miembros.
Hecho en Bruselas, el 14 de noviembre de 2014.
Por la Comisión
Vytenis ANDRIUKAITIS
Miembro de la Comisión
(1) DO L 268 de 14.9.1992, p. 54.
(2) Decisión 2010/470/UE de la Comisión, de 26 de agosto de 2010, por la que se establecen modelos de certificados sanitarios para el comercio dentro de la Unión de esperma, óvulos y embriones de animales de las especies equina, ovina y caprina, y de óvulos y embriones de animales de la especie porcina (DO L 228 de 31.8.2010, p. 15).
(3) Decisión 2010/472/UE de la Comisión, de 26 de agosto de 2010, relativa a las importaciones a la Unión de esperma, óvulos y embriones de animales de las especies ovina y caprina (DO L 228 de 31.8.2010, p. 74).
(4) Reglamento (CE) no 999/2001 del Parlamento Europeo y del Consejo, de 22 de mayo de 2001, por el que se establecen disposiciones para la prevención, el control y la erradicación de determinadas encefalopatías espongiformes transmisibles (DO L 147 de 31.5.2001, p. 1).
(5) Reglamento (UE) no 630/2013 de la Comisión, de 28 de junio de 2013, que modifica los anexos del Reglamento (CE) no 999/2001 del Parlamento Europeo y del Consejo, por el que se establecen disposiciones para la prevención, el control y la erradicación de determinadas encefalopatías espongiformes transmisibles (DO L 179 de 29.6.2013, p. 60).
(6) Decisión de Ejecución 2013/470/UE de la Comisión, de 20 de septiembre de 2013, por la que se modifican las Decisiones 2010/470/UE y 2010/472/UE en lo que respecta a los requisitos zoosanitarios relativos a la tembladera para el comercio y las importaciones en la Unión de esperma, óvulos y embriones de animales de las especies ovina y caprina (DO L 252 de 24.9.2013, p. 32).
(7) Reglamento (UE) no 1148/2014 de la Comisión, de 28 de octubre de 2014, que modifica los anexos II, VII, VIII, IX y X del Reglamento (CE) no 999/2001 del Parlamento Europeo y del Consejo, por el que se establecen disposiciones para la prevención, el control y la erradicación de determinadas encefalopatías espongiformes transmisibles (DO L 308 de 29.10.2014, p. 66).
ANEXO I
En el anexo IV de la Decisión 2010/470/UE, se sustituye la parte A por el texto siguiente:
«PARTE A
Modelo de certificado sanitario IVA para el comercio dentro de la Unión de partidas de óvulos y embriones de animales de las especies ovina y caprina, recogidos o producidos de conformidad con la Directiva 92/65/CEE del Consejo después del 31 de agosto de 2010 y expedidos por su equipo de recogida o producción de embriones autorizado de origen


 »
»
ANEXO II
En el anexo IV de la Decisión 2010/472/UE, se sustituye la parte 2 por el texto siguiente:
«PARTE 2
Modelo de certificado sanitario para las importaciones de partidas de óvulos y embriones de animales de las especies ovina y caprina
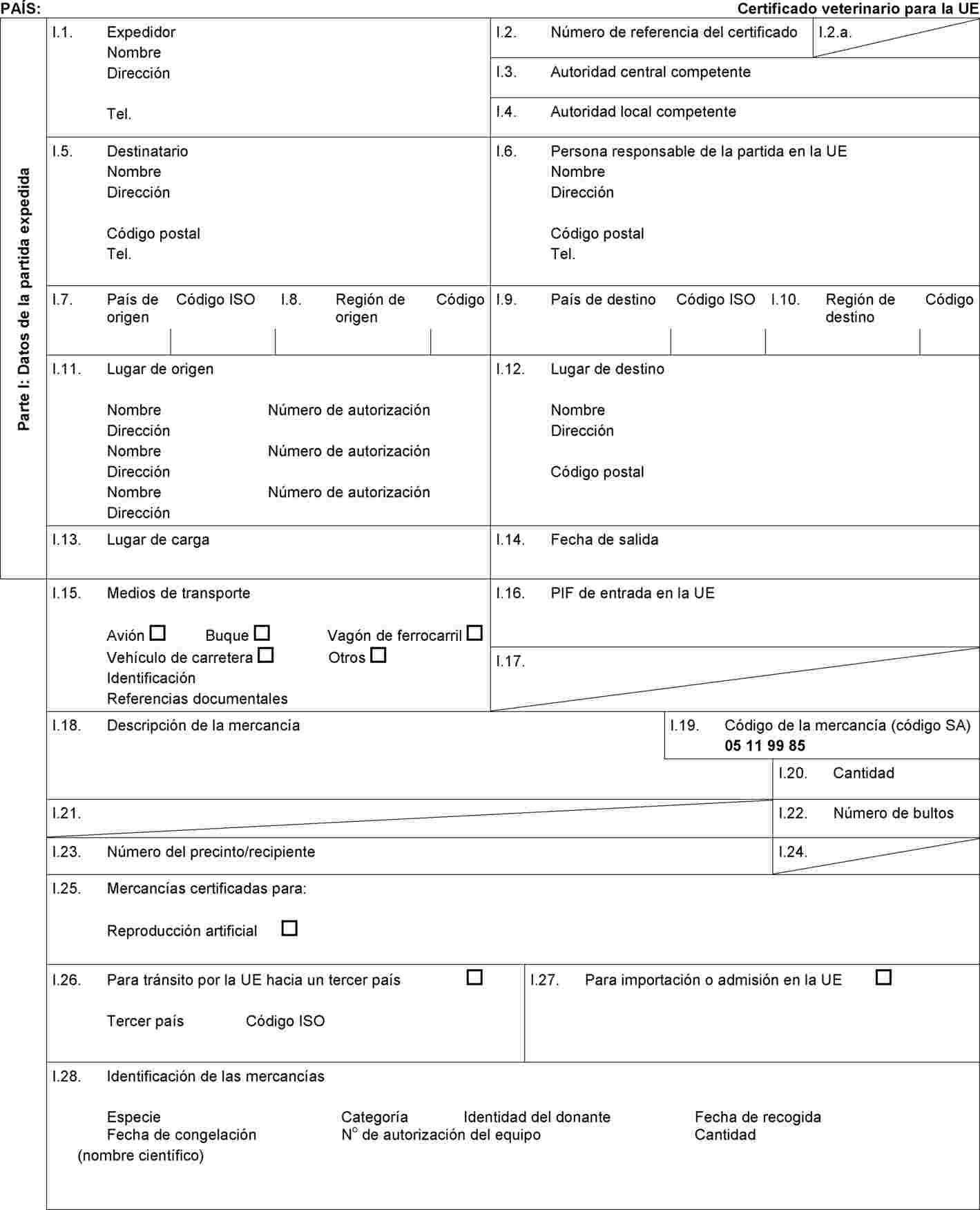
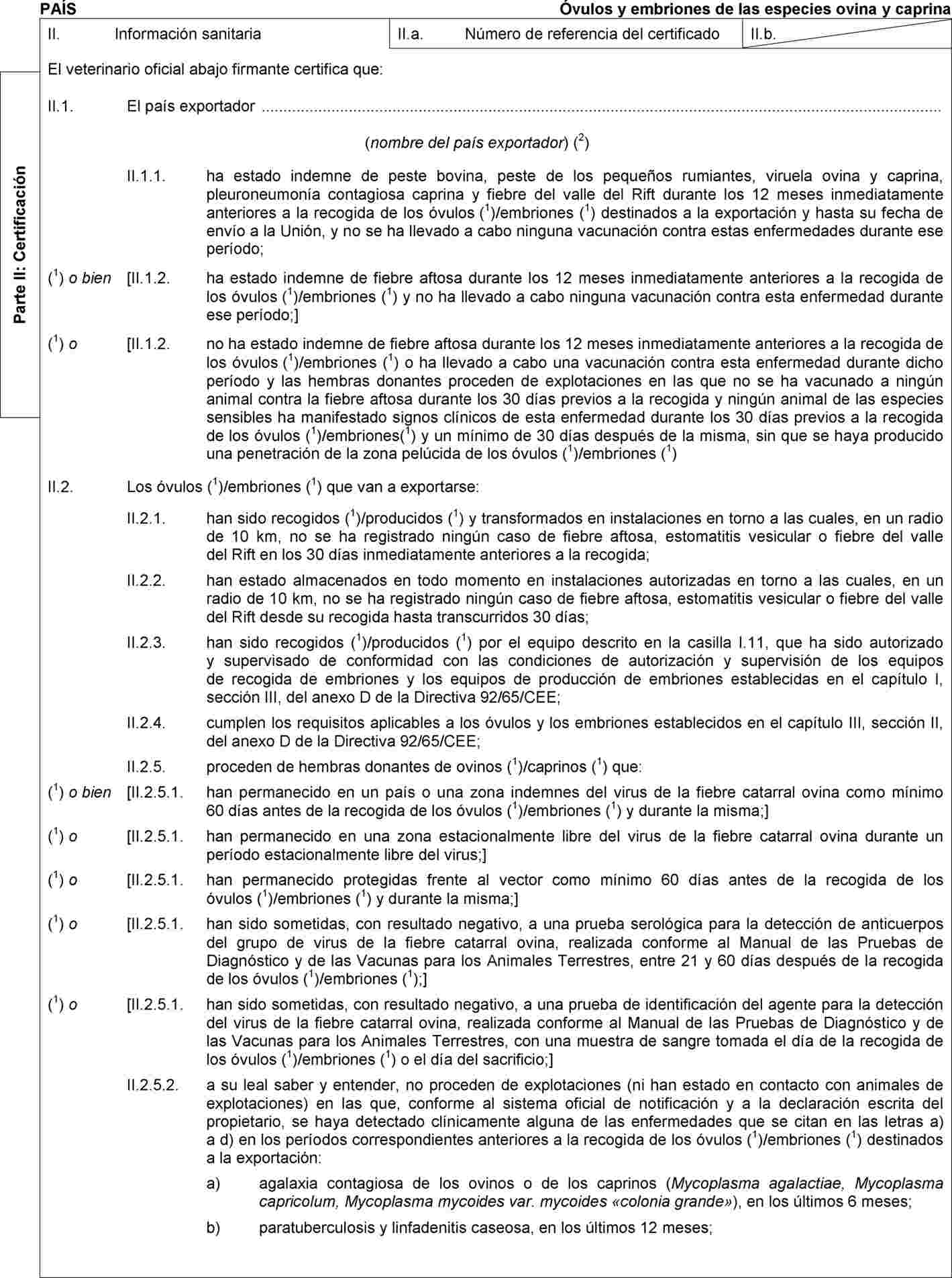


 »
»
ACTOS ADOPTADOS POR ÓRGANOS CREADOS MEDIANTE ACUERDOS INTERNACIONALES
|
18.11.2014 |
ES |
Diario Oficial de la Unión Europea |
L 331/38 |
DECISIÓN No 1/2014 DEL COMITÉ MIXTO UE/SUIZA
de 10 de octubre de 2014
por la que se determinan los casos de exención de la transmisión de los datos a que se refiere el artículo 3, apartado 3, párrafo primero, del anexo I del Acuerdo entre la Comunidad Europea y la Confederación Suiza, de 25 de junio de 2009, relativo a la facilitación de los controles y formalidades en el transporte de mercancías y a las medidas aduaneras de seguridad
(2014/803/UE)
EL COMITÉ MIXTO,
Visto el Acuerdo celebrado entre la Comunidad Europea y la Confederación Suiza, de 25 de junio de 2009, relativo a la facilitación de los controles y formalidades en el transporte de mercancías y a las medidas aduaneras de seguridad (en lo sucesivo, «el Acuerdo»), y, en particular, su artículo 21, apartado 3, en relación con el artículo 3, apartado 3, párrafo segundo, de su anexo I,
Considerando lo siguiente:
|
(1) |
El Acuerdo tiene por objeto mantener la facilitación de los controles y formalidades durante el paso de las mercancías por las fronteras, así como la fluidez de los intercambios comerciales entre las Partes contratantes, garantizando al mismo tiempo un alto nivel de seguridad en la cadena de suministro. |
|
(2) |
Las Partes contratantes se han comprometido a garantizar un nivel de seguridad equivalente en sus respectivos territorios aplicando medidas basadas en la legislación vigente en la Unión Europea. |
|
(3) |
Cuando las mercancías abandonan el territorio aduanero de una Parte contratante con destino a un tercer país a través del territorio aduanero de la otra Parte contratante, los datos de seguridad indicados en la declaración sumaria de salida presentada ante las autoridades competentes de la primera Parte contratante antes mencionada son transmitidos por esta a la autoridad competente de la segunda Parte contratante. |
|
(4) |
El Comité Mixto puede determinar los casos en que la transmisión de los datos no es necesaria, siempre que ello no se haga en detrimento del nivel de seguridad garantizado por el Acuerdo. |
|
(5) |
Los Estados miembros de la Unión Europea y la Confederación Suiza son Partes contratantes en el Convenio de Chicago sobre Aviación Civil Internacional. De conformidad con el anexo 17 de dicho Convenio, para proteger la aviación internacional contra actos de intervención ilícita, las compañías aéreas deben someter toda la carga a controles de seguridad antes de ser embarcada en una aeronave. |
|
(6) |
La Comunidad Europea y la Confederación Suiza se han obligado mutuamente mediante el Acuerdo sobre el transporte aéreo celebrado el 21 de junio de 1999, que regula, en especial, la seguridad y la protección aéreas. |
DECIDE:
Artículo 1
En el caso de las exportaciones de mercancías a que se refiere el artículo 3, apartado 3, párrafo primero, del anexo I del Acuerdo, la transmisión de datos no será necesaria, a condición de que:
|
a) |
las mercancías sean aceptadas por una compañía aérea que se encargue del transporte fuera del territorio aduanero de las Partes contratantes; |
|
b) |
la salida de las mercancías por la aduana de la segunda Parte contratante se efectúe por vía aérea; |
|
c) |
se haya presentado en la aduana competente respecto del lugar por el que se exporten las mercancías una declaración sumaria de salida o una declaración en aduana de exportación que cumpla los requisitos fijados para esa declaración sumaria; |
|
d) |
cuando las mercancías lleguen a la aduana del lugar de salida del territorio aduanero de la segunda Parte contratante, el transportista ponga a disposición de dicha aduana, en caso de que esta la solicite, una copia del documento de acompañamiento de exportación de la Unión o cualquier documento similar expedido por las autoridades aduaneras suizas y que contenga los datos de seguridad de las mercancías exportadas. |
Artículo 2
La presente Decisión entrará en vigor al día siguiente de su adopción.
Hecho en Vacallo, el 10 de octubre de 2014.
Por el Comité Mixto UE-Suiza
La Presidenta
Michaela SCHÄRER-RICKENBACHER
Corrección de errores
|
18.11.2014 |
ES |
Diario Oficial de la Unión Europea |
L 331/40 |
Corrección de errores de la Decisión 2014/252/UE del Consejo, de 14 de abril de 2014, relativa a la celebración del Acuerdo entre la Unión Europea y la República de Turquía sobre readmisión de residentes ilegales
( Diario Oficial de la Unión Europea L 134 de 7 de mayo de 2014 )
En la página 1, en el considerando 3:
donde dice:
|
«(3) |
De conformidad con lo dispuesto en los artículos 1 y 2 del Protocolo no 21 sobre la posición del Reino Unido y de Irlanda respecto del espacio de libertad, seguridad y justicia, anejo al Tratado de la Unión Europea y al Tratado de Funcionamiento de la Unión Europea, y sin perjuicio del artículo 4 del citado Protocolo, el Reino Unido no participa en la adopción de la presente Decisión y, por lo tanto, no queda vinculado por esta ni sujeto a su aplicación.» |
debe decir:
|
«(3) |
De conformidad con el artículo 3 del Protocolo no 21 sobre la posición del Reino Unido y de Irlanda respecto del espacio de libertad, seguridad y justicia, anejo al Tratado de la Unión Europea y al Tratado de Funcionamiento de la Unión Europea, el Reino Unido ha notificado, mediante carta de 21 de septiembre de 2012, su deseo de participar en la adopción y aplicación de la presente Decisión.» |
|
18.11.2014 |
ES |
Diario Oficial de la Unión Europea |
L 331/40 |
Corrección de errores del Reglamento (CE) no 552/2009 de la Comisión, de 22 de junio de 2009, por el que se modifica el Reglamento (CE) no 1907/2006 del Parlamento Europeo y del Consejo, relativo al registro, la evaluación, la autorización y la restricción de las sustancias y preparados químicos (REACH) en lo que respecta a su anexo XVII
( Diario Oficial de la Unión Europea L 164 de 26 de junio de 2009 )
En la página 26, en el anexo por el que se modifica el anexo XVII del Reglamento (CE) no 1907/2006, en su punto 2, entrada 51 del cuadro, columna 2, apartado 1:
donde dice:
|
«1. |
No podrán utilizarse como sustancias o en mezclas en concentraciones superiores al 0,1 en peso del material plastificado, en los juguetes y artículos de puericultura.» |
debe decir:
|
«1. |
No podrán utilizarse como sustancias o en mezclas en concentraciones superiores al 0,1 % en peso del material plastificado, en los juguetes y artículos de puericultura.» |
En la página 26, en el anexo por el que se modifica el anexo XVII del Reglamento (CE) no 1907/2006, en su punto 2, entrada 51 del cuadro, columna 2, apartado 2:
donde dice:
|
«2. |
No se comercializarán los juguetes y artículos de puericultura que contengan dichos ftalatos en una concentración superior al 0,1 en peso del material plastificado.» |
debe decir:
|
«2. |
No se comercializarán los juguetes y artículos de puericultura que contengan dichos ftalatos en una concentración superior al 0,1 % en peso del material plastificado.» |
En la página 26, en el anexo por el que se modifica el anexo XVII del Reglamento (CE) no 1907/2006, en su punto 2, entrada 52 del cuadro, columna 2, apartado 2:
donde dice:
|
«2. |
No se comercializarán los juguetes y artículos de puericultura que contengan dichos ftalatos en una concentración superior al 0,1 % en peso del material plastificado.» |
debe decir:
|
«2. |
No se comercializarán dichos juguetes y artículos de puericultura que contengan los mencionados ftalatos en una concentración superior al 0,1 % en peso del material plastificado.» |