ISSN 1977-0685
doi:10.3000/19770685.L_2012.219.spa
Diario Oficial
de la Unión Europea
L 219

Edición en lengua española
Legislación
55o año
17 de agosto de 2012
|
ISSN 1977-0685 doi:10.3000/19770685.L_2012.219.spa |
||
|
Diario Oficial de la Unión Europea |
L 219 |
|

|
||
|
Edición en lengua española |
Legislación |
55o año |
|
|
|
|
|
(1) Texto pertinente a efectos del EEE |
|
ES |
Los actos cuyos títulos van impresos en caracteres finos son actos de gestión corriente, adoptados en el marco de la política agraria, y que tienen generalmente un período de validez limitado. Los actos cuyos títulos van impresos en caracteres gruesos y precedidos de un asterisco son todos los demás actos. |
II Actos no legislativos
REGLAMENTOS
|
17.8.2012 |
ES |
Diario Oficial de la Unión Europea |
L 219/1 |
REGLAMENTO DE EJECUCIÓN (UE) No 742/2012 DEL CONSEJO
de 16 de agosto de 2012
por el que se aplica el artículo 32, apartado 1, del Reglamento (UE) no 36/2012 relativo a las medidas restrictivas habida cuenta de la situación en Siria
EL CONSEJO DE LA UNIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Visto el Reglamento (UE) no 36/2012 (1) y, en particular, su artículo 32, apartado 1,
Considerando lo siguiente:
|
(1) |
El 18 de enero de 2012 el Consejo adoptó el Reglamento (UE) no 36/2012. |
|
(2) |
De acuerdo con la Decisión de Ejecución 2012/478/PESC del Consejo, de 16 de agosto de 2012, por la que se aplica la Decisión 2011/782/PESC relativa a la adopción de medidas restrictivas contra Siria (2), debe incluirse una entidad más en la lista de personas físicas y jurídicas, entidades u organismos sujetos a medidas restrictivas que figura en el anexo II del Reglamento (UE) no 36/2012. |
HA ADOPTADO EL PRESENTE REGLAMENTO:
Artículo 1
La entidad que figura en el anexo del presente Reglamento se añade a la lista que figura en el anexo II del Reglamento (UE) no 36/2012.
Artículo 2
El presente Reglamento entrará en vigor el día de su publicación en el Diario Oficial de la Unión Europea.
El presente Reglamento será obligatorio en todos sus elementos y directamente aplicable en cada Estado miembro.
Hecho en Bruselas, el 16 de agosto de 2012.
Por el Consejo
El Presidente
A. D. MAVROYIANNIS
(1) DO L 16 de 19.1.2012, p. 1
(2) Véase la página 21 del presente Diario Oficial.
ANEXO
ENTIDAD A LA QUE SE HACE REFERENCIA EN EL ARTÍCULO 1
Entidad
|
|
Nombre |
Información identificatoria |
Motivos |
Fecha de inclusión en la lista |
|
1. |
Drex Technologies Holding S.A. |
Registrada en Luxemburgo con el número B77616, establecida anteriormente en la siguiente dirección: 17, rue Beaumont L-1219 Luxembourg. |
El beneficiario efectivo de Drex Technologies Holding S.A. es Rami Makhlouf, incluido en la lista de personas y entidades sujetas a sanciones de la UE por proporcionar apoyo financiero al régimen sirio. |
16.8.2012 |
|
17.8.2012 |
ES |
Diario Oficial de la Unión Europea |
L 219/3 |
REGLAMENTO DE EJECUCIÓN (UE) No 743/2012 DE LA COMISIÓN
de 9 de agosto de 2012
por el que se inscribe una denominación en el Registro de Denominaciones de Origen Protegidas y de Indicaciones Geográficas Protegidas![]() (Yancheng Long Xia) (IGP)
(Yancheng Long Xia) (IGP)
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Visto el Reglamento (CE) no 510/2006 del Consejo, de 20 de marzo de 2006, sobre la protección de las indicaciones geográficas y de las denominaciones de origen de los productos agrícolas y alimenticios (1), y, en particular, su artículo 7, apartado 4, párrafo primero,
Considerando lo siguiente:
|
(1) |
De conformidad con el artículo 6, apartado 2, párrafo primero, del Reglamento (CE) no 510/2006, la solicitud de registro de la denominación «
|
|
(2) |
Al no haberse notificado a la Comisión ninguna declaración de oposición de conformidad con el artículo 7 del Reglamento (CE) no 510/2006, procede registrar la denominación citada. |
HA ADOPTADO EL PRESENTE REGLAMENTO:
Artículo 1
Queda registrada la denominación que figura en el anexo del presente Reglamento.
Artículo 2
El presente Reglamento entrará en vigor el vigésimo día siguiente al de su publicación en el Diario Oficial de la Unión Europea.
El presente Reglamento será obligatorio en todos sus elementos y directamente aplicable en cada Estado miembro.
Hecho en Bruselas, el 9 de agosto de 2012.
Por la Comisión, en nombre del Presidente
Andris PIEBALGS
Miembro de la Comisión
(1) DO L 93 de 31.3.2006, p. 12.
(2) DO C 359 de 9.12.2011, p. 17.
ANEXO
Productos agrícolas destinados al consumo humano enumerados en el anexo I del Tratado:
Clase 1.7. Pescado, moluscos y crustáceos frescos y productos derivados de ellos
CHINA
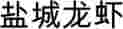 (Yancheng Long Xia) (IGP).
(Yancheng Long Xia) (IGP).
|
17.8.2012 |
ES |
Diario Oficial de la Unión Europea |
L 219/5 |
REGLAMENTO (UE) No 744/2012 DE LA COMISIÓN
de 16 de agosto de 2012
por el que se modifican los anexos I y II de la Directiva 2002/32/CE del Parlamento Europeo y del Consejo con respecto a los contenidos máximos de arsénico, flúor, plomo, mercurio, endosulfán, dioxinas, Ambrosia spp., diclazurilo y lasalocid A de sodio, y los límites de intervención para las dioxinas
(Texto pertinente a efectos del EEE)
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Vista la Directiva 2002/32/CE del Parlamento Europeo y del Consejo, de 7 de mayo de 2002, sobre sustancias indeseables en la alimentación animal (1), y, en particular, su artículo 8, apartado 1,
Considerando lo siguiente:
|
(1) |
La Directiva 2002/32/CE prohíbe la utilización de productos destinados a la alimentación animal cuyo contenido de sustancias indeseables supere los contenidos máximos fijados en su anexo I. En su anexo II se establecen límites de intervención a partir de los cuales se llevan a cabo investigaciones en caso de que aumenten los contenidos de dichas sustancias. |
|
(2) |
Se han establecido contenidos máximos más elevados de arsénico, flúor, plomo y mercurio para la materia prima para piensos carbonato cálcico y contenidos máximos más elevados de arsénico y flúor para la materia prima para piensos óxido de magnesio, pero no para la materia prima para piensos carbonato cálcico y magnésico, que es la mezcla natural de carbonato cálcico y carbonato magnésico. Por razones de coherencia, es apropiado ajustar los contenidos máximos de arsénico, flúor, plomo y mercurio en la materia prima para piensos carbonato cálcico y magnésico a los contenidos máximos existentes en el carbonato cálcico. |
|
(3) |
La Autoridad Europea de Seguridad Alimentaria (EFSA) concluyó en su dictamen científico sobre la seguridad y la eficacia del trihidroxicloruro de dicobre [cloruro tribásico de cobre (TBCC)] como aditivo para piensos (2) que sería apropiado establecer el mismo contenido máximo de arsénico en este aditivo que en el sulfato cúprico pentahidrato y el carbonato cúprico. Procede, por tanto, modificar el contenido máximo de arsénico en el trihidroxicloruro de dicobre. |
|
(4) |
Algunos piensos compuestos para animales de compañía contienen una proporción significativa de las materias primas para piensos harina de pescado, de otros animales acuáticos y sus productos derivados, y/o de algas marinas. Estas materias primas para piensos tienen un alto contenido de arsénico total. Sin embargo, el arsénico presente en estas materias primas para piensos es sobre todo arsénico orgánico, que es la forma menos tóxica. Es, por tanto, apropiado modificar el contenido máximo de arsénico aplicable a los piensos complementarios y completos para animales de compañía que contengan harina de pescado, de otros animales acuáticos y sus productos derivados, y/o de algas marinas. |
|
(5) |
Los dos minerales de zeolita, natrolita y clinoptilolita, son los constituyentes activos de la natrolita-fonolita (E 566) y la clinoptilolita de origen volcánico (E 567). Es, por tanto, apropiado, aplicar el mismo contenido máximo al plomo en la natrolita-fonolita (E 566) y la clinoptilolita de origen volcánico (E 567). |
|
(6) |
A fin de aumentar la sostenibilidad de la cría de los salmónidos, el uso de aceites de pescado se está sustituyendo progresivamente por el de aceites vegetales. Sin embargo, esta sustitución, que influiría muy favorablemente en la sostenibilidad del entorno marino, no es posible en algunos casos debido al muy bajo contenido máximo de endosulfán en los piensos completos para peces. A petición de la Comisión, la Autoridad Europea de Seguridad Alimentaria («EFSA») emitió un dictamen científico. En su declaración sobre la toxicidad oral del endosulfán en los peces (3), la EFSA señaló que no se han observado efectos adversos significativos en los peces (salmón atlántico) expuestos en jaulas de alta mar hasta a un 0,1 mg/kg de endosulfán en los piensos y que solo se han observado efectos adversos de escasa importancia en el salmón expuesto en tanques a contenidos más altos en los piensos que el contenido máximo actual. A partir de un estudio limitado, se obtuvieron algunas indicaciones de que la exposición de la tilapia del Nilo al endosulfán a través de los piensos en tanques produjo efectos adversos. Es, por tanto, apropiado, proponer un contenido máximo más alto de endosulfán en los piensos completos para salmónidos a fin de favorecer el aumento de la sostenibilidad de la cría de peces sin producir efectos adversos para la salud de los peces y la salud humana. |
|
(7) |
Datos recientes indican que los contenidos de dioxinas en la harina de crustáceos, que es un subproducto de la producción de alimentos y se utiliza sobre todo en los piensos para peces ornamentales en una proporción del 1 % al 3 % de pienso, son superiores al contenido máximo actual. A fin de permitir utilizar esta harina para piensos y reducir la cantidad de residuos alimentarios sin poner en peligro la salud humana o animal, es apropiado aumentar ligeramente el contenido máximo de dioxinas en la harina de crustáceos. |
|
(8) |
La Directiva 2002/32/CE tiene como objetivo evitar la difusión de semillas viables de Ambrosia spp. en el medio ambiente. Dado que la molienda o la trituración destruye la capacidad de germinación de las semillas, no es necesario limpiar los granos y las semillas que presentan un contenido no conforme de semillas de Ambrosia spp. antes de la molienda o la trituración, siempre que se tomen medidas de prevención para evitar la difusión de semillas de Ambrosia spp. en el medio ambiente durante el transporte, el almacenamiento o el procesamiento. |
|
(9) |
Con respecto a los coccidiostáticos diclazurilo y lasalocid A de sodio, deben introducirse modificaciones para tener en cuenta las autorizaciones de dichas sustancias concedidas recientemente por el Reglamento (UE) no 169/2011 de la Comisión, de 23 de febrero de 2011, por el que se autoriza el diclazuril como aditivo para piensos destinados a pintadas (titular de la autorización: Janssen Pharmaceutica N.V.) (4), el Reglamento de Ejecución (UE) no 888/2011 de la Comisión, de 5 de septiembre de 2011, relativo a la autorización del diclazuril como aditivo en piensos para pavos de engorde (titular de la autorización: Janssen Pharmaceutica N.V.) y por el que se modifica el Reglamento (CE) no 2430/1999 (5), y el Reglamento de Ejecución (UE) no 900/2011 de la Comisión, de 7 de septiembre de 2011, relativo a la autorización del lasalocid A de sodio como aditivo en piensos para faisanes, pintadas, codornices y perdices que no sean aves ponedoras [titular de la autorización: Alpharma (Bélgica) BVBA] (6). |
|
(10) |
Dado que se propone un aumento del contenido máximo de dioxinas en la harina de crustáceos, es también apropiado aumentar en la misma proporción el límite de intervención aplicable a la harina de crustáceos previsto en el anexo II de la Directiva 2002/32/CE. |
|
(11) |
Las medidas previstas en el presente Reglamento se ajustan al dictamen del Comité permanente de la cadena alimentaria y de sanidad animal y ni el Parlamento Europeo ni el Consejo se han opuesto a ellas. |
HA ADOPTADO EL PRESENTE REGLAMENTO:
Artículo 1
Los anexos I y II de la Directiva 2002/32/CE quedan modificados con arreglo al anexo del presente Reglamento.
Artículo 2
El presente Reglamento entrará en vigor el vigésimo día siguiente al de su publicación en el Diario Oficial de la Unión Europea.
El presente Reglamento será obligatorio en todos sus elementos y directamente aplicable en cada Estado miembro.
Hecho en Bruselas, el 16 de agosto de 2012.
Por la Comisión
El Presidente
José Manuel BARROSO
(1) DO L 140 de 30.5.2002, p. 10.
(2) Comisión Técnica de la EFSA sobre Aditivos y Productos o Sustancias utilizados en los Piensos para Animales (FEEDAP); Dictamen científico sobre la seguridad y la eficacia del trihidroxicloruro de dicobre [cloruro tribásico de cobre (TBCC)] como aditivo para piensos, para todas las especies. EFSA Journal 2011; 9(9):2355. [18 pp.]. doi:10.2903/j.efsa.2011.2355. Disponible en línea en: www.efsa.europa.eu/efsajournal.
(3) EFSA Journal 2011; 9(4):2131. Disponible en línea en: www.efsa.europa.eu/efsajournal.
(4) DO L 49 de 24.2.2011, p. 6.
(5) DO L 229 de 6.9.2011, p. 9.
(6) DO L 231 de 8.9.2011, p. 15.
ANEXO
|
1) |
El anexo I de la Directiva 2002/32/CE queda modificado como sigue:
|
|
2) |
El punto 1, Dioxinas [suma de policlorodibenzo-para-dioxinas (PCDD) y policlorodibenzofuranos (PCDF)] expresada en equivalentes tóxicos de la Organización Mundial de la Salud (EQT-OMS), utilizando los factores de equivalencia de toxicidad de la misma Organización (FET-OMS, 2005)], de la sección: Dioxinas y PCB, del anexo II de la Directiva 2002/32/CE, se sustituye por el texto siguiente:
|
|
17.8.2012 |
ES |
Diario Oficial de la Unión Europea |
L 219/13 |
REGLAMENTO DE EJECUCIÓN (UE) No 745/2012 DE LA COMISIÓN
de 16 de agosto de 2012
por el que se fijan los coeficientes aplicables a los cereales exportados en forma de Scotch whisky (whisky escocés) durante el período 2012-2013
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Visto el Reglamento (CE) no 1234/2007 del Consejo, de 22 de octubre de 2007, por el que se crea una organización común de mercados agrícolas y se establecen disposiciones específicas para determinados productos agrícolas (Reglamento único para las OCM) (1),
Visto el Reglamento (CE) no 1670/2006 de la Comisión, de 10 de noviembre de 2006, por el que se establecen determinadas disposiciones de aplicación del Reglamento (CE) no 1784/2003 del Consejo en lo que respecta a la fijación y concesión de restituciones adaptadas para los cereales exportados en forma de determinadas bebidas espirituosas (2), y, en particular, su artículo 5,
Considerando lo siguiente:
|
(1) |
El artículo 4, apartado 1, del Reglamento (CE) no 1670/2006 establece que las cantidades de cereales por las que se concede la restitución son las situadas bajo control y destiladas, a las que se aplica un coeficiente fijado anualmente para cada Estado miembro interesado. Este coeficiente expresa la relación entre las cantidades totales exportadas y las cantidades totales comercializadas de la bebida espirituosa en cuestión, tomando como base la tendencia observada en la evolución de esas cantidades durante el número de años correspondiente al período medio de envejecimiento de la bebida espirituosa. |
|
(2) |
De acuerdo con la información suministrada por el Reino Unido para el período comprendido entre el 1 de enero y el 31 de diciembre de 2011, este período medio de envejecimiento para el Scotch whisky (whisky escocés) en 2011 era de ocho años. |
|
(3) |
El Reglamento de Ejecución (UE) no 1094/2011 de la Comisión, de 28 de octubre de 2011, por el que se fijan los coeficientes aplicables a los cereales exportados en forma de Scotch whisky (whisky escocés) durante el período 2011-2012 (3), ha dejado de tener efecto ya que afecta a los coeficientes aplicables al período 2011-2012. Procede, por lo tanto, fijar los coeficientes para el período comprendido entre el 1 de octubre de 2012 y el 30 de septiembre de 2013. |
|
(4) |
El artículo 10 del Protocolo 3 del Acuerdo sobre el Espacio Económico Europeo excluye la concesión de restituciones por exportación a Liechtenstein, Islandia y Noruega. Además, la Unión ha firmado con algunos terceros países acuerdos que conllevan la supresión de las restituciones por exportación. Por consiguiente, y en aplicación del artículo 7, apartado 2, del Reglamento (CE) no 1670/2006, conviene tener en cuenta esos extremos para el cálculo del coeficiente correspondiente al período 2012-2013. |
HA ADOPTADO EL PRESENTE REGLAMENTO:
Artículo 1
En el anexo del presente Reglamento se fijan los coeficientes a los que se hace referencia en el artículo 4 del Reglamento (CE) no 1670/2006, aplicables a los cereales utilizados en el Reino Unido para la fabricación de Scotch whisky (whisky escocés), durante el período comprendido entre el 1 de octubre de 2012 y el 30 de septiembre de 2013.
Artículo 2
El presente Reglamento entrará en vigor el día de su publicación en el Diario Oficial de la Unión Europea.
Será aplicable a partir del 1 de octubre de 2012 hasta el 30 de septiembre de 2013.
El presente Reglamento será obligatorio en todos sus elementos y directamente aplicable en cada Estado miembro.
Hecho en Bruselas, el 16 de agosto de 2012.
Por la Comisión
El Presidente
José Manuel BARROSO
(1) DO L 299 de 16.11.2007, p. 1.
(2) DO L 312 de 11.11.2006, p. 33.
(3) DO L 283 de 29.10.2011, p. 30.
ANEXO
|
Coeficientes aplicables al Reino Unido |
||
|
Período de aplicación |
Coeficiente aplicable |
|
|
a la cebada transformada en malta utilizada para la fabricación del whisky de malta |
a los cereales utilizados para la fabricación del whisky de cereales |
|
|
Del 1 de octubre de 2012 al 30 de septiembre de 2013 |
0,229 |
0,152 |
|
17.8.2012 |
ES |
Diario Oficial de la Unión Europea |
L 219/15 |
REGLAMENTO DE EJECUCIÓN (UE) No 746/2012 DE LA COMISIÓN
de 16 de agosto de 2012
por el que se aprueba el granulovirus de Adoxophyes orana como sustancia activa, con arreglo al Reglamento (CE) no 1107/2009 del Parlamento Europeo y del Consejo, relativo a la comercialización de productos fitosanitarios, y se modifica el anexo del Reglamento de Ejecución (UE) no 540/2011
(Texto pertinente a efectos del EEE)
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Visto el Reglamento (CE) no 1107/2009 del Parlamento Europeo y del Consejo, de 21 de octubre de 2009, relativo a la comercialización de productos fitosanitarios y por el que se derogan las Directivas 79/117/CEE y 91/414/CEE del Consejo (1), y, en particular, su artículo 13, apartado 2, y su artículo 78, apartado 2,
Considerando lo siguiente:
|
(1) |
Con arreglo al artículo 80, apartado 1, letra a), del Reglamento (CE) no 1107/2009, la Directiva 91/414/CEE del Consejo (2) es aplicable, con respecto al procedimiento y condiciones de aprobación, a las sustancias activas para las que se haya adoptado una decisión conforme al artículo 6, apartado 3, de dicha Directiva antes del 14 de junio de 2011. Respecto al granulovirus de Adoxophyes orana, las condiciones del artículo 80, apartado 1, letra a), del Reglamento (CE) no 1107/2009 se cumplieron mediante la Decisión 2007/669/CE de la Comisión (3). |
|
(2) |
De conformidad con el artículo 6, apartado 2, de la Directiva 91/414/CEE, Alemania recibió el 29 de noviembre de 2004 una solicitud de Andermatt Biocontrol GmbH para la inclusión del granulovirus de Adoxophyes orana como sustancia activa en el anexo I de dicha Directiva. Mediante la Decisión 2007/669/CE se confirmó que la documentación era «completa», lo que significa que, en principio, podía considerarse que cumplía los requisitos relativos a los datos y la información establecidos en los anexos II y III de la Directiva 91/414/CEE. |
|
(3) |
De conformidad con lo dispuesto en el artículo 6, apartados 2 y 4, de la Directiva 91/414/CEE, se han evaluado los efectos de esta sustancia activa en la salud humana y animal y el medio ambiente en relación con los usos propuestos por el solicitante. El 13 de agosto de 2008, el Estado miembro designado ponente presentó un proyecto de informe de evaluación. |
|
(4) |
El proyecto de informe de evaluación fue sometido a una revisión inter pares por los Estados miembros y la Autoridad Europea de Seguridad Alimentaria (en lo sucesivo, «la Autoridad»). El 4 de abril de 2012, la Autoridad presentó a la Comisión su conclusión sobre la revisión inter pares de la evaluación del riesgo del granulovirus de Adoxophyes orana (4) como sustancia activa en plaguicidas. El proyecto de informe de evaluación fue revisado por los Estados miembros y la Comisión en el Comité permanente de la cadena alimentaria y de sanidad animal y fue adoptado el 13 de julio de 2012 como informe de revisión de la Comisión relativo al granulovirus de Adoxophyes orana. |
|
(5) |
Según los diversos exámenes efectuados, cabe pensar que los productos fitosanitarios que contienen granulovirus de Adoxophyes orana cumplen, en general, los requisitos establecidos en el artículo 5, apartado 1, letras a) y b), y apartado 3, de la Directiva 91/414/CEE, especialmente respecto a los usos examinados y detallados en el informe de revisión de la Comisión. Por consiguiente, procede aprobar el granulovirus de Adoxophyes orana. |
|
(6) |
Sin perjuicio de las obligaciones establecidas en el Reglamento (CE) no 1107/2009 como consecuencia de la aprobación, y teniendo en cuenta la situación específica creada por la transición entre la Directiva 91/414/CEE y el Reglamento (CE) no 1107/2009, debe aplicarse, no obstante, lo siguiente. Debe concederse a los Estados miembros un plazo de seis meses tras la aprobación para que examinen las autorizaciones de los productos fitosanitarios que contengan granulovirus de Adoxophyes orana. Deben asimismo modificar, sustituir o retirar las autorizaciones, según proceda. No obstante el plazo mencionado, debe preverse un plazo más largo para la presentación y la evaluación de la actualización de la documentación completa especificada en el anexo III de la Directiva 91/414/CEE con respecto a cada producto fitosanitario y a cada uso propuesto, de conformidad con los principios uniformes. |
|
(7) |
La experiencia adquirida con las inclusiones en el anexo I de la Directiva 91/414/CEE de sustancias activas evaluadas en el marco del Reglamento (CEE) no 3600/92 de la Comisión, de 11 de diciembre de 1992, por el que se establecen disposiciones de aplicación de la primera fase del programa de trabajo contemplado en el apartado 2 del artículo 8 de la Directiva 91/414/CEE del Consejo, relativa a la comercialización de productos fitosanitarios (5), ha puesto de manifiesto que pueden surgir dificultades a la hora de interpretar las obligaciones de los titulares de las autorizaciones vigentes en lo que se refiere al acceso a los datos. Por tanto, para evitar dificultades añadidas, es necesario aclarar las obligaciones de los Estados miembros, en particular la de verificar que el titular de una autorización demuestre tener acceso a una documentación que cumpla los requisitos del anexo II de la mencionada Directiva. Esta aclaración, no obstante, no impone nuevas obligaciones a los Estados miembros ni a los titulares de autorizaciones además de las derivadas de las directivas ya adoptadas que modifican el anexo I de la citada Directiva o de los reglamentos por los que se aprueban sustancias activas. |
|
(8) |
De conformidad con el artículo 13, apartado 4, del Reglamento (CE) no 1107/2009, debe modificarse en consecuencia el anexo del Reglamento de Ejecución (UE) no 540/2011 de la Comisión, de 25 de mayo de 2011, por el que se aplica el Reglamento (CE) no 1107/2009 del Parlamento Europeo y del Consejo en lo que respecta a la lista de sustancias activas aprobadas (6). |
|
(9) |
Las medidas previstas en el presente Reglamento se ajustan al dictamen del Comité permanente de la cadena alimentaria y de sanidad animal. |
HA ADOPTADO EL PRESENTE REGLAMENTO:
Artículo 1
Aprobación de la sustancia activa
La sustancia activa granulovirus de Adoxophyes orana, especificada en el anexo I, queda aprobada en las condiciones fijadas en dicho anexo.
Artículo 2
Reevaluación de los productos fitosanitarios
1. Con arreglo a lo dispuesto en el Reglamento (CE) no 1107/2009, los Estados miembros modificarán o retirarán, cuando sea necesario, las autorizaciones vigentes para productos fitosanitarios que contengan granulovirus de Adoxophyes orana como sustancia activa a más tardar el 31 de julio de 2013.
Antes de dicha fecha comprobarán, en particular, que se cumplen las condiciones establecidas en el anexo I del presente Reglamento, salvo las indicadas en la columna de disposiciones específicas de dicho anexo, y que el titular de la autorización dispone de documentación que cumple los requisitos del anexo II de la Directiva 91/414/CEE, de acuerdo con las condiciones del artículo 13, apartados 1 a 4, de dicha Directiva y del artículo 62 del Reglamento (CE) no 1107/2009, o tiene acceso a ella.
2. No obstante lo dispuesto en el apartado 1, todo producto fitosanitario autorizado que contenga granulovirus de Adoxophyes orana, bien como única sustancia activa, bien junto con otras sustancias activas, todas ellas incluidas en el anexo del Reglamento de Ejecución (UE) no 540/2011, a más tardar, el 31 de enero de 2013, será objeto de una nueva evaluación por parte de los Estados miembros de acuerdo con los principios uniformes mencionados en el artículo 29, apartado 6, del Reglamento (CE) no 1107/2009, sobre la base de un expediente que cumpla los requisitos del anexo III de la Directiva 91/414/CEE y que tenga en cuenta la columna de disposiciones específicas del anexo I del presente Reglamento. En función de esta evaluación, determinarán si el producto cumple las condiciones expuestas en el artículo 29, apartado 1, del Reglamento (CE) no 1107/2009.
A raíz de dicha determinación, los Estados miembros deberán:
|
a) |
en el caso de un producto que contenga granulovirus de Adoxophyes orana como única sustancia activa, modificar o retirar la autorización, cuando sea necesario, no más tarde del 31 de julio de 2014, o |
|
b) |
en el caso de un producto que contenga granulovirus de Adoxophyes orana entre otras sustancias activas, modificar o retirar la autorización, según proceda, a más tardar el 31 de julio de 2014, o en el plazo que establezca para tal modificación o retirada todo acto por el que se hayan incluido las sustancias en cuestión en el anexo I de la Directiva 91/414/CEE o se hayan aprobado, si este plazo concluye después de dicha fecha. |
Artículo 3
Modificaciones del Reglamento de Ejecución (UE) no 540/2011
El anexo del Reglamento de Ejecución (UE) no 540/2011 queda modificado con arreglo al anexo II del presente Reglamento.
Artículo 4
Entrada en vigor y fecha de aplicación
El presente Reglamento entrará en vigor el vigésimo día siguiente al de su publicación en el Diario Oficial de la Unión Europea.
Será aplicable a partir del 1 de febrero de 2013.
El presente Reglamento será obligatorio en todos sus elementos y directamente aplicable en cada Estado miembro.
Hecho en Bruselas, el 16 de agosto de 2012.
Por la Comisión
El Presidente
José Manuel BARROSO
(1) DO L 309 de 24.11.2009, p. 1.
(2) DO L 230 de 19.8.1991, p. 1.
(3) DO L 274 de 18.10.2007, p. 15.
(4) EFSA Journal (2012), 10(4):2654. Disponible en línea en: www.efsa.europa.eu.
(5) DO L 366 de 15.12.1992, p. 10.
(6) DO L 153 de 11.6.2011, p. 1.
ANEXO I
|
Denominación común y números de identificación |
Denominación UIQPA |
Pureza (1) |
Fecha de aprobación |
Expiración de la aprobación |
Disposiciones específicas |
|
Granulovirus de Adoxophyes orana Colección de cultivos no DSM BV-0001 No CICAP 782 |
No aplicable |
Ninguna impureza relevante |
1 de febrero de 2013 |
31 de enero de 2023 |
Para la aplicación de los principios uniformes a los que se refiere el artículo 29, apartado 6, del Reglamento (CE) no 1107/2009, se tendrán en cuenta las conclusiones del informe de revisión del granulovirus de Adoxophyes orana, en particular sus apéndices I y II, tal como fue finalizado en el Comité permanente de la cadena alimentaria y de sanidad animal el 13 de julio de 2012. |
(1) En el informe de revisión se incluyen más datos sobre la identidad y las especificaciones de las sustancias activas correspondientes.
ANEXO II
En la parte B del anexo del Reglamento de Ejecución (UE) no 540/2011, se añade la entrada siguiente:
|
Número |
Denominación común y números de identificación |
Denominación UIQPA |
Pureza (1) |
Fecha de aprobación |
Expiración de la aprobación |
Disposiciones específicas |
|
«26 |
Granulovirus de Adoxophyes orana Colección de cultivos no DSM BV-0001 No CICAP 782 |
No aplicable |
Ninguna impureza relevante |
1 de febrero de 2013 |
31 de enero de 2023 |
Para la aplicación de los principios uniformes a los que se refiere el artículo 29, apartado 6, del Reglamento (CE) no 1107/2009, se tendrán en cuenta las conclusiones del informe de revisión del granulovirus de Adoxophyes orana, en particular sus apéndices I y II, tal como fue finalizado en el Comité permanente de la cadena alimentaria y de sanidad animal el 13 de julio de 2012.». |
(1) En el informe de revisión se incluyen más datos sobre la identidad y las especificaciones de las sustancias activas correspondientes.
|
17.8.2012 |
ES |
Diario Oficial de la Unión Europea |
L 219/19 |
REGLAMENTO DE EJECUCIÓN (UE) No 747/2012 DE LA COMISIÓN
de 16 de agosto de 2012
por el que se establecen valores de importación a tanto alzado para la determinación del precio de entrada de determinadas frutas y hortalizas
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Visto el Reglamento (CE) no 1234/2007 del Consejo, de 22 de octubre de 2007, por el que se crea una organización común de mercados agrícolas y se establecen disposiciones específicas para determinados productos agrícolas (Reglamento único para las OCM) (1),
Visto el Reglamento de Ejecución (UE) no 543/2011 de la Comisión, de 7 de junio de 2011, por el que se establecen disposiciones de aplicación del Reglamento (CE) no 1234/2007 del Consejo en los sectores de las frutas y hortalizas y de las frutas y hortalizas transformadas (2), y, en particular, su artículo 136, apartado 1,
Considerando lo siguiente:
|
(1) |
El Reglamento de Ejecución (UE) no 543/2011 establece, en aplicación de los resultados de las negociaciones comerciales multilaterales de la Ronda Uruguay, los criterios para que la Comisión fije los valores de importación a tanto alzado de terceros países correspondientes a los productos y períodos que figuran en el anexo XVI, parte A, de dicho Reglamento. |
|
(2) |
De acuerdo con el artículo 136, apartado 1, del Reglamento de Ejecución (UE) no 543/2011, el valor de importación a tanto alzado se calcula cada día hábil teniendo en cuenta datos que varían diariamente. Por lo tanto, el presente Reglamento debe entrar en vigor el día de su publicación en el Diario Oficial de la Unión Europea. |
HA ADOPTADO EL PRESENTE REGLAMENTO:
Artículo 1
En el anexo del presente Reglamento quedan fijados los valores de importación a tanto alzado a que se refiere el artículo 136 del Reglamento de Ejecución (UE) no 543/2011.
Artículo 2
El presente Reglamento entrará en vigor el día de su publicación en el Diario Oficial de la Unión Europea.
El presente Reglamento será obligatorio en todos sus elementos y directamente aplicable en cada Estado miembro.
Hecho en Bruselas, el 16 de agosto de 2012.
Por la Comisión, en nombre del Presidente
José Manuel SILVA RODRÍGUEZ
Director General de Agricultura y Desarrollo Rural
(1) DO L 299 de 16.11.2007, p. 1.
(2) DO L 157 de 15.6.2011, p. 1.
ANEXO
Valores de importación a tanto alzado para la determinación del precio de entrada de determinadas frutas y hortalizas
|
(EUR/100 kg) |
||
|
Código NC |
Código tercer país (1) |
Valor de importación a tanto alzado |
|
0702 00 00 |
MK |
57,4 |
|
ZZ |
57,4 |
|
|
0707 00 05 |
MK |
66,1 |
|
TR |
106,1 |
|
|
ZZ |
86,1 |
|
|
0709 93 10 |
TR |
102,9 |
|
ZZ |
102,9 |
|
|
0805 50 10 |
AR |
87,7 |
|
CL |
88,4 |
|
|
TR |
95,0 |
|
|
UY |
82,8 |
|
|
ZA |
96,2 |
|
|
ZZ |
90,0 |
|
|
0806 10 10 |
BA |
56,7 |
|
EG |
207,4 |
|
|
MK |
50,2 |
|
|
TR |
169,4 |
|
|
ZZ |
120,9 |
|
|
0808 10 80 |
AR |
168,7 |
|
BR |
103,6 |
|
|
CL |
119,7 |
|
|
NZ |
114,1 |
|
|
US |
194,6 |
|
|
ZA |
91,4 |
|
|
ZZ |
132,0 |
|
|
0808 30 90 |
AR |
111,1 |
|
CL |
165,2 |
|
|
CN |
80,2 |
|
|
TR |
145,2 |
|
|
ZA |
101,4 |
|
|
ZZ |
120,6 |
|
|
0809 30 |
TR |
170,0 |
|
ZZ |
170,0 |
|
|
0809 40 05 |
BA |
66,1 |
|
IL |
80,1 |
|
|
ZZ |
73,1 |
|
(1) Nomenclatura de países fijada por el Reglamento (CE) no 1833/2006 de la Comisión (DO L 354 de 14.12.2006, p. 19). El código «ZZ» significa «otros orígenes».
DECISIONES
|
17.8.2012 |
ES |
Diario Oficial de la Unión Europea |
L 219/21 |
DECISIÓN DE EJECUCIÓN 2012/478/PESC DEL CONSEJO
de 16 de agosto de 2012
por la que se aplica la Decisión 2011/782/PESC relativa a la adopción de medidas restrictivas contra Siria
EL CONSEJO DE LA UNIÓN EUROPEA,
Visto el Tratado de la Unión Europea,
Vista la Decisión 2011/782/PESC (1) y, en particular, su artículo 21, apartado 1,
Considerando lo siguiente:
|
(1) |
El 1 de diciembre de 2011 el Consejo adoptó la Decisión 2011/782/PESC. |
|
(2) |
Debe incluirse una entidad más en la lista de personas y entidades sujetas a medidas restrictivas que figura en el anexo I de la Decisión 2011/782/PESC. |
HA ADOPTADO LA PRESENTE DECISIÓN:
Artículo 1
La entidad que figura en el anexo de la presente Decisión se añade a la lista que figura en el anexo I de la Decisión 2011/782/PESC.
Artículo 2
La presente Decisión entrará en vigor el día de su publicación en el Diario Oficial de la Unión Europea.
Hecho en Bruselas, el 16 de agosto de 2012.
Por el Consejo
El Presidente
A. D. MAVROYIANNIS
(1) DO L 319 de 2.12.2011, p. 56.
ANEXO
ENTIDAD A LA QUE SE HACE REFERENCIA EN EL ARTÍCULO 1
Entidad
|
|
Nombre |
Información identificativa |
Motivos |
Fecha de inclusión en la lista |
|
1. |
Drex Technologies Holding S.A. |
Registrada en Luxemburgo con el número B77616, establecida anteriormente en la siguiente dirección: 17, rue Beaumont L-1219 Luxembourg. |
El beneficiario efectivo de Drex Technologies Holding S.A. es Rami Makhlouf, incluido en la lista de personas y entidades sujetas a sanciones de la UE por proporcionar apoyo financiero al régimen sirio. |
16.8.2012 |
|
17.8.2012 |
ES |
Diario Oficial de la Unión Europea |
L 219/23 |
DECISIÓN DE EJECUCIÓN DE LA COMISIÓN
de 14 de agosto de 2012
por la que se modifica la Decisión 2007/777/CE en lo que respecta a las entradas correspondientes a Israel en la lista de terceros países desde los que pueden introducirse en la Unión determinados productos cárnicos
[notificada con el número C(2012) 5703]
(Texto pertinente a efectos del EEE)
(2012/479/UE)
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Vista la Directiva 2002/99/CE del Consejo, de 16 de diciembre de 2002, por la que se establecen las normas zoosanitarias aplicables a la producción, transformación, distribución e introducción de los productos de origen animal destinados al consumo humano (1), y, en particular, su artículo 8, parte introductoria, punto 1, párrafo primero, y punto 4,
Considerando lo siguiente:
|
(1) |
La Decisión 2007/777/CE de la Comisión, de 29 de noviembre de 2007, por la que se establecen las condiciones sanitarias y zoosanitarias y los modelos de certificado para las importaciones de determinados productos cárnicos y de estómagos, vejigas e intestinos tratados destinados al consumo humano procedentes de terceros países, y por la que se deroga la Decisión 2005/432/CE (2), regula la importación, el tránsito y el almacenamiento en la Unión de partidas de productos cárnicos y de estómagos, vejigas e intestinos tratados, según se definen en el Reglamento (CE) no 853/2004 del Parlamento Europeo y del Consejo, de 29 de abril de 2004, por el que se establecen normas específicas de higiene para los alimentos de origen animal (3). |
|
(2) |
La parte 2 del anexo II de la Decisión 2007/777/CE establece la lista de terceros países o partes de terceros países desde los que está autorizada la introducción de productos cárnicos y estómagos, vejigas e intestinos tratados, a condición de que hayan sido sometidos al tratamiento mencionado en dicha lista. Si los terceros países están regionalizados a efectos de la inclusión en la lista, sus territorios regionalizados se definen en la parte 1 de dicho anexo. |
|
(3) |
La parte 4 del anexo II de la Decisión 2007/777/CE establece los tratamientos mencionados en la parte 2 de dicho anexo y asigna un código a cada uno de ellos. En ella se contempla un tratamiento no específico «A» y los tratamientos específicos «B» a «F», en orden decreciente de intensidad. |
|
(4) |
A raíz de los brotes de gripe aviar altamente patógena en determinadas zonas de Israel, la Decisión 2007/777/CE, modificada por el Reglamento de Ejecución (UE) no 532/2012 de la Comisión (4), dispone que las importaciones en la Unión de productos cárnicos y estómagos, vejigas e intestinos tratados de aves de corral, caza de pluma de cría, rátidas de cría y aves de caza silvestres están autorizadas a partir de las zonas de ese tercer país afectadas por el brote solo si dichos productos han sido sometidos al tratamiento específico «D» contemplado en la parte 4 del anexo II de la Decisión 2007/777/CE. La zona de Israel afectada por el brote a la que se aplica la regionalización por razones zoosanitarias se especifica en el cuadro que figura en la parte 1 del anexo II de la misma Decisión. |
|
(5) |
Israel ha controlado con éxito los brotes de gripe aviar altamente patógena, de acuerdo con la información presentada sobre la situación favorable con respecto a dicha enfermedad. Además, la vigilancia ejercida por la autoridad competente de Israel durante el período transcurrido desde el sacrificio de urgencia de las aves de corral en las explotaciones avícolas infectadas y la limpieza y desinfección de los locales no ha revelado que la enfermedad se haya propagado. |
|
(6) |
Procede, por tanto, modificar las entradas correspondientes a Israel en las partes 1 y 2 del anexo II de la Decisión 2007/777/CE con el fin de autorizar las importaciones en la Unión desde todo el territorio de Israel de productos cárnicos y estómagos, vejigas e intestinos tratados de aves de corral, caza de pluma de cría, rátidas de cría y aves de caza silvestres que hayan sido sometidos a un tratamiento no específico «A», de conformidad con la parte 4 del anexo II de la Decisión 2007/777/CE. |
|
(7) |
Procede, por lo tanto, modificar la Decisión 2007/777/CE en consecuencia. |
|
(8) |
Las medidas previstas en la presente Decisión se ajustan al dictamen del Comité permanente de la cadena alimentaria y de sanidad animal. |
HA ADOPTADO LA PRESENTE DECISIÓN:
Artículo 1
El anexo II de la Decisión 2007/777/CE queda modificado con arreglo a lo dispuesto en el anexo de la presente Decisión.
Artículo 2
Los destinatarios de la presente Decisión serán los Estados miembros.
Hecho en Bruselas, el 14 de agosto de 2012.
Por la Comisión
John DALLI
Miembro de la Comisión
(1) DO L 18 de 23.1.2003, p. 11.
(2) DO L 312 de 30.11.2007, p. 49.
(3) DO L 139 de 30.4.2004, p. 55.
(4) DO L 163 de 22.6.2012, p. 1.
ANEXO
El anexo II de la Decisión 2007/777/CE queda modificado como sigue:
|
1) |
En la parte 1, se suprime íntegramente la entrada correspondiente a Israel. |
|
2) |
En la parte 2, la entrada correspondiente a Israel se sustituye por el texto siguiente:
|