ISSN 1977-0928
Diario Oficial
de la Unión Europea
C 305

Edición en lengua española
Comunicaciones e informaciones
61.° año
30 de agosto de 2018
|
ISSN 1977-0928 |
||
|
Diario Oficial de la Unión Europea |
C 305 |
|

|
||
|
Edición en lengua española |
Comunicaciones e informaciones |
61.° año |
|
Sumario |
Página |
|
|
|
II Comunicaciones |
|
|
|
COMUNICACIONES PROCEDENTES DE LAS INSTITUCIONES, ÓRGANOS Y ORGANISMOS DE LA UNIÓN EUROPEA |
|
|
|
Comisión Europea |
|
|
2018/C 305/01 |
No oposición a una concentración notificada (Asunto M.8970 — Sumitomo/Parkwind/Northwester2) ( 1 ) |
|
|
V Anuncios |
|
|
|
PROCEDIMIENTOS ADMINISTRATIVOS |
|
|
|
Oficina Europea de Selección de Personal (EPSO) |
|
|
2018/C 305/13 |
||
|
|
PROCEDIMIENTOS RELATIVOS A LA APLICACIÓN DE LA POLÍTICA DE COMPETENCIA |
|
|
|
Comisión Europea |
|
|
2018/C 305/14 |
Notificación previa de una concentración (Asunto M.9072 — KKR/Altice/SFR Filiale) — Asunto que podría ser tramitado conforme al procedimiento simplificado ( 1 ) |
|
|
|
|
|
(1) Texto pertinente a efectos del EEE. |
|
ES |
|
II Comunicaciones
COMUNICACIONES PROCEDENTES DE LAS INSTITUCIONES, ÓRGANOS Y ORGANISMOS DE LA UNIÓN EUROPEA
Comisión Europea
|
30.8.2018 |
ES |
Diario Oficial de la Unión Europea |
C 305/1 |
No oposición a una concentración notificada
(Asunto M.8970 — Sumitomo/Parkwind/Northwester2)
(Texto pertinente a efectos del EEE)
(2018/C 305/01)
El 30 de julio de 2018, la Comisión decidió no oponerse a la concentración notificada que se cita en el encabezamiento y declararla compatible con el mercado interior. Esta decisión se basa en el artículo 6, apartado 1, letra b), del Reglamento (CE) n.o 139/2004 del Consejo (1). El texto íntegro de la decisión solo está disponible en inglés y se hará público una vez que se elimine cualquier secreto comercial que pueda contener. Estará disponible:
|
— |
en la sección de concentraciones del sitio web de competencia de la Comisión (http://ec.europa.eu/competition/mergers/cases/). Este sitio web permite localizar las decisiones sobre concentraciones mediante criterios de búsqueda tales como el nombre de la empresa, el número de asunto, la fecha o el sector de actividad, |
|
— |
en formato electrónico en el sitio web EUR-Lex (http://eur-lex.europa.eu/homepage.html?locale=es) con el número de documento 32018M8970. EUR-Lex da acceso al Derecho de la Unión en línea. |
IV Información
INFORMACIÓN PROCEDENTE DE LAS INSTITUCIONES, ÓRGANOS Y ORGANISMOS DE LA UNIÓN EUROPEA
Comisión Europea
|
30.8.2018 |
ES |
Diario Oficial de la Unión Europea |
C 305/2 |
Tipo de cambio del euro (1)
29 de agosto de 2018
(2018/C 305/03)
1 euro =
|
|
Moneda |
Tipo de cambio |
|
USD |
dólar estadounidense |
1,1660 |
|
JPY |
yen japonés |
129,73 |
|
DKK |
corona danesa |
7,4571 |
|
GBP |
libra esterlina |
0,90500 |
|
SEK |
corona sueca |
10,6923 |
|
CHF |
franco suizo |
1,1385 |
|
ISK |
corona islandesa |
124,90 |
|
NOK |
corona noruega |
9,7475 |
|
BGN |
leva búlgara |
1,9558 |
|
CZK |
corona checa |
25,745 |
|
HUF |
forinto húngaro |
324,63 |
|
PLN |
esloti polaco |
4,2838 |
|
RON |
leu rumano |
4,6417 |
|
TRY |
lira turca |
7,5236 |
|
AUD |
dólar australiano |
1,5989 |
|
CAD |
dólar canadiense |
1,5093 |
|
HKD |
dólar de Hong Kong |
9,1524 |
|
NZD |
dólar neozelandés |
1,7413 |
|
SGD |
dólar de Singapur |
1,5941 |
|
KRW |
won de Corea del Sur |
1 299,27 |
|
ZAR |
rand sudafricano |
16,8176 |
|
CNY |
yuan renminbi |
7,9626 |
|
HRK |
kuna croata |
7,4370 |
|
IDR |
rupia indonesia |
17 087,73 |
|
MYR |
ringit malayo |
4,8076 |
|
PHP |
peso filipino |
62,375 |
|
RUB |
rublo ruso |
79,4075 |
|
THB |
bat tailandés |
38,140 |
|
BRL |
real brasileño |
4,8451 |
|
MXN |
peso mexicano |
22,3252 |
|
INR |
rupia india |
82,3405 |
(1) Fuente: tipo de cambio de referencia publicado por el Banco Central Europeo.
|
30.8.2018 |
ES |
Diario Oficial de la Unión Europea |
C 305/3 |
Notas explicativas de la nomenclatura combinada de la Unión Europea
(2018/C 305/04)
De conformidad con el artículo 9, apartado 1, letra a), del Reglamento (CEE) n.o 2658/87 del Consejo (1), las notas explicativas de la nomenclatura combinada de la Unión Europea (2) se modifican como sigue:
En la página 379,
|
9401 |
Asientos (excepto los de la partida 9402), incluso los transformables en cama, y sus partes |
Se añade el texto siguiente tras el texto actual:
«A efectos de esta partida, toda referencia al bambú se aplica únicamente a materias vegetales de la partida 1401. Además, a efectos de esta partida, toda referencia a la madera se aplica también a las placas de bambú de la partida 4412. (Véanse también la nota 1 b) y la nota 6 del capítulo 44).»
|
9403 |
Los demás muebles y sus partes |
Se añade el texto siguiente tras el párrafo actual:
«La nota explicativa de la partida 9401 relativa a las referencias a los términos “bambú” y “madera” se aplica mutatis mutandis.»
(1) Reglamento (CEE) n.o 2658/87 del Consejo, de 23 julio de 1987, relativo a la nomenclatura arancelaria y estadística y al arancel aduanero común (DO L 256 de 7.9.1987, p. 1).
|
30.8.2018 |
ES |
Diario Oficial de la Unión Europea |
C 305/4 |
Notas explicativas de la nomenclatura combinada de la Unión Europea
(2018/C 305/05)
De conformidad con el artículo 9, apartado 1, letra a), del Reglamento (CEE) n.o 2658/87 (1) del Consejo, las notas explicativas de la nomenclatura combinada de la Unión Europea (2) se modifican como sigue:
En la página 379,
|
9403 |
Los demás muebles y sus partes |
Se añade el texto siguiente tras el texto actual:
«Esta partida no comprende los “paneles de información” como los “tableros de calle” y “carteles enrollables”.
Deberán clasificarse en otras partidas de la Nomenclatura en las que estén incluidos de forma más específica (por ejemplo, los tableros de calle con superficies para escribir o dibujar se consideran productos de la partida 9610) o en función de su materia constitutiva:
|
a) |
en una partida que comprenda específicamente esos artículos (por ejemplo, las placas de metal común se consideran productos de la partida 8310 y se clasifican en esta partida), o |
|
b) |
en una partida que comprenda varios artículos de esa materia (por ejemplo, las partidas 3926 o 7616). |
Ejemplo de un tablero de calle que se debe clasificar en la partida 9610:

Tablero de calle con una superficie de pizarra.
Ejemplo de un tablero de calle que se debe clasificar en la partida 8310:
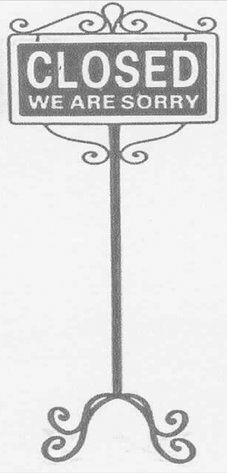
Tablero de calle compuesto exclusivamente de metal común.
Ejemplos de “paneles de información”, que se clasificarán según su materia constitutiva, en una partida que comprenda varios artículos de esta materia:
|
|
|
|
Una base de plástico duro, una parte superior compuesta por un marco de aluminio con una hoja de plástico en el centro cubierta por láminas de PVC transparentes por ambos lados. |
Una base y un marco de aluminio con sujeciones de goma y láminas de PVC transparentes que recubren una hoja de papel. |
|
Partida 7616 (su carácter esencial viene determinado por el marco de aluminio). |
Partida 7616 (su carácter esencial viene determinado por el marco de aluminio). |
|
|
|
|
Una placa central de plástico sujeta a cinco varillas de plástico (barras) de longitud casi idéntica, todas las cuales se pueden orientar en distintas direcciones. Cuatro de ellas tienen un gancho de plástico en su extremo, y en la quinta varilla está montado un capuchón de plástico. |
|
|
Partida 3926 (el producto está compuesto exclusivamente de plástico).». |
|
(1) Reglamento (CEE) n.o 2658/87 del Consejo, de 23 julio de 1987, relativo a la nomenclatura arancelaria y estadística y al arancel aduanero común (DO L 256 de 7.9.1987, p. 1).
|
30.8.2018 |
ES |
Diario Oficial de la Unión Europea |
C 305/6 |
Nueva cara nacional de las monedas de euro destinadas a la circulación
(2018/C 305/06)

Cara nacional de la nueva moneda conmemorativa de 2 euros destinada a la circulación y emitida por Luxemburgo.
Las monedas de euro destinadas a la circulación son de curso legal en toda la zona del euro. Con el fin de informar a las personas que manejan monedas en el ejercicio de su profesión y al público en general, la Comisión publica las características de todos los nuevos motivos de las monedas (1). De conformidad con las conclusiones del Consejo de 10 de febrero de 2009 (2), los Estados miembros de la zona del euro y los países que hayan celebrado un acuerdo monetario con la Unión Europea en el que se prevea la emisión de monedas de euro pueden emitir monedas conmemorativas de euro destinadas a la circulación en determinadas condiciones, en particular que solo se trate de monedas de 2 euros. Estas monedas tienen las mismas características técnicas que las demás monedas de 2 euros, pero presentan en la cara nacional un motivo conmemorativo de gran simbolismo en el ámbito nacional o europeo.
Estado emisor : Luxemburgo
Tema de la conmemoración : El 175 aniversario de la muerte del Gran Duque de Luxemburgo Guillermo I.
Descripción del motivo : El motivo de la moneda muestra, en el lado derecho, la efigie de Su Alteza Real, el Gran Duque Enrique, mirando hacia la izquierda; y, en el lado izquierdo, la efigie de S.A.R. el Gran Duque Guillermo I. Entre las dos efigies aparecen, en vertical, los años «1772-1843», así como el nombre de «Guillaume Ier». En la parte inferior aparece el texto «LUXEMBOURG» y el año «2018».
En la corona circular de la moneda figuran las doce estrellas de la bandera europea.
Volumen estimado de emisión (número de monedas) :
500 000Fecha de emisión : Septiembre de 2018
(1) Las caras nacionales de todas las monedas de euro emitidas en 2002 figuran en el DO C 373 de 28.12.2001, p. 1.
(2) Véanse las conclusiones del Consejo de Asuntos Económicos y Financieros de 10 de febrero de 2009 y la Recomendación de la Comisión, de 19 de diciembre de 2008, relativa a la fijación de directrices comunes respecto de las caras nacionales y la emisión de monedas en euros destinadas a la circulación (DO L 9 de 14.1.2009, p. 52).
Supervisor Europeo de Protección de Datos
|
30.8.2018 |
ES |
Diario Oficial de la Unión Europea |
C 305/7 |
Resumen del dictamen sobre la propuesta de refundición de la Directiva relativa a la reutilización de la información del sector público
(El texto completo del presente dictamen está disponible en inglés, francés y alemán en el sitio web del SEPD: www.edps.europa.eu)
(2018/C 305/07)
La Directiva relativa a la reutilización de la información del sector público (ISP) tiene por objeto facilitar la reutilización de la información del sector público en toda la Unión Europea mediante la armonización de las condiciones básicas que hacen que esta información esté a disposición de los reutilizadores, al objeto de mejorar el desarrollo de productos y servicios comunitarios basados en la ISP y evitar distorsiones de la competencia.
Las nuevas disposiciones incluyen la ampliación del ámbito de aplicación de la Directiva a los documentos conservados por empresas públicas activas en los ámbitos de la contratación, como las entidades que operan en los sectores del agua, la energía, los transportes y los servicios postales. Por otra parte, se aplicará a los documentos en poder de las empresas públicas que actúen como operadores de servicios públicos, en la medida en que tales documentos se elaboren como parte de servicios de interés general. Además, el ámbito de aplicación de la propuesta se ampliará a datos específicos de investigación, como los resultados de los procesos científicos de investigación.
El dictamen se centra en recomendaciones específicas para aclarar mejor la relación y la coherencia de la Directiva ISP con las excepciones del Reglamento general de protección de datos (RGPD) y en la referencia a la legislación aplicable en materia de protección de datos. Además, ofrece otras recomendaciones sobre la anonimización y su relación con los costes y la protección de los datos, centrándose también en una evaluación del impacto sobre la protección de datos y teniendo en cuenta a la vez una «política de reutilización aceptable».
Con este dictamen sobre la reutilización de la información del sector público, el SEPD se basa en el trabajo ya realizado sobre los «macrodatos de calidad» (el «intercambio de información basado en valores de la UE») y, en particular, en los dictámenes del SEPD y las observaciones formales expuestas con anterioridad, de forma coherente con nuestras prácticas en materia de supervisión. También se señalan las cuestiones que necesitan una armonización a nivel de la UE para que la refundición de la Directiva ISP ofrezca los beneficios esperados.
En el contexto del artículo 1, apartado 2, letra g, de la propuesta, el SEPD recomienda que se aclare aún más la relación y la coherencia de la ISP con el RGPD mediante la presentación de una sugerencia de redacción.
Por otra parte, el SEPD propone reintroducir la disposición específica que figura actualmente en el artículo 1, apartado 4, de la Directiva 2013/37/UE en las disposiciones principales de la Directiva e indicar claramente en la propuesta que resulta aplicable la definición de «datos personales» que se recoge en el artículo 4, apartado 1, del RGPD. Asimismo, el SEPD recomienda añadir la referencia a la autoridad de control creada en virtud del artículo 51 del RGPD al artículo 4, apartado 4, de la propuesta.
El SEPD también recomienda que se promueva el uso de la anonimización haciendo referencia a la «información anónima» en el texto jurídico y ampliando el espectro de entidades con derecho a incluir costes de anonimización en los costes que pueden cobrarse a los reutilizadores.
Como última recomendación, el SEPD propone que, en sectores específicos en los que se trabaje con datos sensibles, como el sector sanitario, se prevean evaluaciones del impacto sobre la protección de datos, sobre las que el cedente deberá basar su decisión, y que, en consecuencia, se tengan en cuenta las condiciones de reutilización.
1. INTRODUCCIÓN Y ANTECEDENTES
|
1. |
El 25 de abril de 2018, la Comisión adoptó una propuesta de Directiva por la que se modifica la Directiva 2013/37/UE (tras una revisión de la Directiva 2003/98/CE relativa a la reutilización de la información del sector público) (en lo sucesivo, «la propuesta»). La propuesta forma parte del «Paquete de datos de 2018», que también incluye otros documentos importantes: I) una comunicación de la Comisión titulada «Hacia un espacio común europeo de datos» (en lo sucesivo, la «Comunicación»); II) orientaciones sobre la puesta en común de datos del sector privado, en forma de documento de trabajo (en lo sucesivo, las «Orientaciones»); y III) una evaluación de la Directiva relativa a la reutilización de la información del sector público. |
|
2. |
El objetivo de la propuesta es actualizar y modificar el texto actual de la Directiva 2013/37/UE y la Directiva 2003/98/CE relativa a la reutilización de la información del sector público (la «Directiva ISP»). |
|
3. |
La revisión de la Directiva es una de las tres «medidas» propuestas por la Comisión para lograr un espacio común de datos en la UE (véase la comunicación «marco» de la Comisión COM [2018] 232), junto con las orientaciones sobre la puesta en común de datos del sector privado […] y la actualización de la Recomendación relativa al acceso a la información científica y a su preservación […]. |
|
4. |
Con su propuesta de modificación de la Directiva ISP, la Comisión Europea pretende facilitar la reutilización de la información del sector público, como los datos jurídicos, de tráfico, meteorológicos, económicos y financieros, en toda la Unión Europea mediante la armonización de las condiciones básicas que hacen que esta información esté a disposición de los reutilizadores, a fin de mejorar el desarrollo de productos y servicios comunitarios basados en la ISP y de evitar distorsiones de la competencia. |
|
5. |
En particular, el objetivo general de la propuesta está en consonancia con los objetivos de la Estrategia para el Mercado Único Digital. La propuesta tiene por objeto aumentar la eficacia de la Directiva mediante el refuerzo de disposiciones específicas y su modificación para aumentar la cantidad de información del sector público disponible para su reutilización. Concretamente, la iniciativa también pretende reforzar la posición de las pequeñas y medianas empresas en el mercado de datos mediante la garantía de una competencia más justa y un acceso más sencillo a los mercados, junto con una mejora de la innovación transfronteriza. |
|
6. |
Las nuevas disposiciones pertinentes de la Directiva incluyen la ampliación de su ámbito de aplicación a los documentos conservados por empresas públicas activas en los ámbitos de la contratación, como las entidades que operan en los sectores del agua, la energía, los transportes y los servicios postales. Por otra parte, se aplicará a los documentos en poder de las empresas públicas que actúen como operadores de servicios públicos, en la medida en que tales documentos se elaboren como parte de servicios de interés general. El ámbito de aplicación de la propuesta se ampliará también a datos específicos de investigación, como los resultados de los procesos científicos de investigación (es decir, experimentos y encuestas). En la práctica, la propuesta «[…] establece un marco horizontal que proporciona una armonización mínima de las condiciones de reutilización en todos los ámbitos y sectores». (1) |
|
7. |
El SEPD observa con agrado que, según la Comisión Europea, la refundición de la Directiva ISP tiene por objeto fomentar la reutilización de la información del sector público, tal como se señala en la Comunicación, ya que, con dicha refundición se pretende «reducir los obstáculos de acceso al mercado, en particular para las pequeñas y medianas empresas […]; reducir al mínimo el riesgo de ventaja excesiva del pionero, puesto que esta beneficia a las grandes empresas y limita por tanto el número de reutilizadores potenciales de los datos de que se trate […]; aumentar las oportunidades de negocio fomentando la publicación de datos dinámicos y la utilización de interfaces de programación de aplicaciones (API)». (2) |
|
8. |
La Directiva ISP forma parte de la visión de la UE sobre el fomento de los «macrodatos de calidad». La información del sector público es una fuente esencial de la que se nutren los macrodatos del Mercado Único Digital. El uso inteligente de los datos, incluido su tratamiento a través de la inteligencia artificial, puede tener un efecto transformador en todos los sectores de la economía. |
|
9. |
Ya en septiembre de 2016, el SEPD, mediante el Dictamen sobre la aplicación coherente de los derechos fundamentales en la era de los macrodatos (3), presentó una estrategia para configurar un ciberespacio propio de la UE basado en los valores de la Unión, señalando cuestiones como la concentración del mercado y la información y un mercado débil para las tecnologías de protección del derecho a la intimidad (PET) como aspectos que debían resolverse para minimizar el tratamiento de datos personales sin perder la funcionalidad de los distintos productos o servicios (estrategia inspirada en el principio de protección de la intimidad desde el diseño (4) y por defecto). |
|
10. |
Por otra parte, el SEPD desea hacer hincapié en la importancia para la protección de datos de los siguientes «principios clave», que, según la Comisión Europea, deben ser respetados en el contexto de la reutilización de datos, a saber: I) reducir al mínimo la dependencia de los datos y garantizar una competencia no falseada; II) transparencia y participación de la sociedad a efectos de la reutilización en relación con los ciudadanos o los interesados, así como transparencia y definición clara de la finalidad entre el cedente y los cesionarios; y III) evaluación del impacto sobre la protección de datos y garantías adecuadas de protección de datos para su reutilización (según el principio de «no perjudicar», interpretado desde la perspectiva de la protección de datos). |
|
11. |
Si bien la Comisión Europea ha realizado consultas informales al SEPD, no se le ha realizado ninguna consulta formal, tal como exige el artículo 28, apartado 2, del Reglamento (CE) n.o 45/2001. Por lo tanto, el dictamen se basa en el artículo 41, apartado 2, de dicho Reglamento. El SEPD recomienda que se incluya una referencia a este dictamen en el preámbulo del instrumento que se adopte. |
7. CONCLUSIÓN
Por las razones expuestas, el SEPD recomienda lo siguiente:
|
— |
Modificar el artículo 1, apartado 2, letra g, de la propuesta y establecer una formulación específica sobre la diferencia entre «documentos» y «partes de documentos» a los que no se aplicaría la Directiva ISP por razones de protección de datos. |
|
— |
Añadir una referencia a la autoridad de control creada en virtud del artículo 51 del RGPD en el artículo 4, apartado 4, de la propuesta, con el fin de reforzar el vínculo entre la reutilización de la información del sector público y la protección de los datos personales. |
|
— |
Reintroducir la disposición específica sobre la legislación aplicable en materia de protección de datos que figura actualmente en el artículo 1, apartado 4, de la Directiva 2013/37/UE en la parte sustantiva de la propuesta (incluida la actualización necesaria de las referencias a los instrumentos jurídicos actualmente en vigor). |
|
— |
Hacer más hincapié en el uso de la anonimización en el contexto de la reutilización de la información del sector público mediante la inclusión de una referencia a la «información anónima» en el texto jurídico y la ampliación del espectro de entidades con derecho a incluir costes de anonimización en los costes que pueden cobrarse a los reutilizadores. |
|
— |
Indicar claramente en la propuesta que resulta aplicable la definición de «datos personales» que se recoge en el artículo 4, apartado 1, del RGPD. |
|
— |
Prever, en sectores específicos en los que se trabaje con datos sensibles, como el sector sanitario, evaluaciones del impacto sobre la protección de datos, sobre las que el cedente deberá basar su decisión, y, en consecuencia, tener en cuenta las condiciones de reutilización. |
|
— |
Como último comentario, al presentar estas recomendaciones, el SEPD hace hincapié en la importancia para la protección de datos de los siguientes «principios clave», que, según la Comisión, deben ser respetados en el contexto de la reutilización de datos, a saber:
|
Bruselas, 10 de julio de 2018.
Giovanni BUTTARELLI
Supervisor Europeo de Protección de Datos
(1) Exposición de motivos de la Propuesta de Directiva del Parlamento Europeo y del Consejo relativa a la reutilización de la información del sector público (versión refundida); p. 3.
(2) Comunicación de la Comisión al Parlamento Europeo, al Consejo, al Comité Económico y Social Europeo y al Comité de las Regiones: «Hacia un espacio común europeo de datos»; p. 5.
(3) https://edps.europa.eu/sites/edp/files/publication/16-09-23_bigdata_opinion_en.pdf; p. 9 sobre la reutilización.
(4) Dictamen 05/2018 del Supervisor Europeo de Protección de Datos: Dictamen preliminar sobre la protección de la intimidad desde el diseño
INFORMACIÓN PROCEDENTE DE LOS ESTADOS MIEMBROS
|
30.8.2018 |
ES |
Diario Oficial de la Unión Europea |
C 305/10 |
Comunicación de la Comisión con arreglo al artículo 16, apartado 4, del Reglamento (CE) n.o 1008/2008 del Parlamento Europeo y del Consejo, sobre normas comunes para la explotación de servicios aéreos en la Comunidad
Obligaciones de servicio público respecto a servicios aéreos regulares
(Texto pertinente a efectos del EEE)
(2018/C 305/08)
|
Estado miembro |
Portugal |
||||||
|
Ruta |
Bragança - Vila Real – Viseu – Cascais – Portimão – Cascais – Viseu – Vila Real - Bragança |
||||||
|
Fecha de entrada en vigor de las obligaciones de servicio público |
23 de diciembre de 2018 |
||||||
|
Dirección en la que pueden obtenerse el texto y cualquier otra información o documentación relacionada con las obligaciones de servicio público |
Toda la documentación está disponible en la siguiente dirección de internet: http://www.saphety.com Para más información:
|
|
30.8.2018 |
ES |
Diario Oficial de la Unión Europea |
C 305/11 |
Comunicación de la Comisión con arreglo al artículo 16, apartado 4, del Reglamento (CE) n.o 1008/2008 del Parlamento Europeo y del Consejo, sobre normas comunes para la explotación de servicios aéreos en la Comunidad
Modificación de obligaciones de servicio público respecto a servicios aéreos regulares
(Texto pertinente a efectos del EEE)
(2018/C 305/09)
|
Estado miembro |
Reino Unido |
|||||||||||
|
Rutas |
Oban – Coll Oban – Colonsay Oban – Tiree Coll – Tiree |
|||||||||||
|
Fecha inicial de entrada en vigor de las obligaciones de servicio público |
2 de marzo de 2007 |
|||||||||||
|
Fecha de entrada en vigor de las modificaciones |
16 de mayo de 2019 |
|||||||||||
|
Dirección en la que pueden obtenerse el texto y cualquier otra información o documentación relacionada con la obligación de servicio público |
Toda la documentación estará disponible en la siguiente dirección de internet: http://www.publiccontractsscotland.gov.uk Para más información:
|
|
30.8.2018 |
ES |
Diario Oficial de la Unión Europea |
C 305/12 |
Comunicación de la Comisión con arreglo al artículo 17, apartado 5, del Reglamento (CE) n.o 1008/2008 del Parlamento Europeo y del Consejo, sobre normas comunes para la explotación de servicios aéreos en la Comunidad
Convocatoria de licitación para la explotación de servicios aéreos regulares de conformidad con las obligaciones de servicio público
(Texto pertinente a efectos del EEE)
(2018/C 305/10)
|
Estado miembro |
Reino Unido |
|||||||||||
|
Rutas |
Oban – Coll Oban – Colonsay Oban – Tiree Coll – Tiree |
|||||||||||
|
Periodo de validez del contrato |
Del 16 de mayo de 2019 al 15 de mayo de 2022 |
|||||||||||
|
Plazo de presentación de solicitudes y ofertas |
19 de noviembre de 2018 |
|||||||||||
|
Dirección en la que pueden obtenerse el texto de la convocatoria y cualquier otra información o documentación relacionada con la licitación y con la obligación de servicio público |
Toda la documentación estará disponible en la siguiente dirección de internet: http://www.publiccontractsscotland.gov.uk Para más información:
|
INFORMACIÓN RELATIVA AL ESPACIO ECONÓMICO EUROPEO
Comité Permanente de los Estados de la AELC
|
30.8.2018 |
ES |
Diario Oficial de la Unión Europea |
C 305/13 |
Sustancias peligrosas — Lista de las autorizaciones concedidas por los Estados AELC-EEE de conformidad con el artículo 64, apartado 8, del Reglamento (CE) n.o 1907/2006 (REACH) en el segundo semestre de 2017
(2018/C 305/11)
Subcomité I: Libre circulación de mercancías
A la atención del Comité Mixto del EEE
Con referencia a la Decisión del Comité Mixto del EEE n.o 25/2008, de 14 de marzo de 2008, se invita al Comité Mixto del EEE a que tome nota de las siguientes listas de decisiones de autorización adoptadas con arreglo al artículo 64, apartado 8, del Reglamento (CE) n.o 1907/2006 (REACH) durante el período comprendido entre el 1 de julio y el 31 de diciembre de 2017, en su reunión de 27 de abril de 2018.
ANEXO
Lista de decisiones de autorización
Durante el período comprendido entre el 1 de julio y el 31 de diciembre de 2017, se han tomado en los Estados del EEE-AELC las siguientes decisiones de autorización de conformidad con el artículo 64, apartado 8, del Reglamento (CE) n.o 1907/2006 (REACH):
|
Nombre de la sustancia |
Decisión de la Comisión en virtud del artículo 64, apartado 8, del Reglamento (CE) n.o 1907/2006 |
País |
Fecha de la decisión |
|
Dicromato de amonio |
C(2017) 3237 |
Islandia |
7.7.2017 |
|
Dicromato de sodio |
C(2017) 3453 |
Islandia |
7.7.2017 |
|
Dicromato de sodio |
C(2017) 3764 |
Islandia |
7.7.2017 |
|
Dicromato de sodio |
C(2017) 3765 |
Islandia |
7.7.2017 |
|
Dicromato de sodio |
C(2017) 3801 |
Islandia |
7.7.2017 |
|
Dicromato de sodio |
C(2017) 3806 |
Islandia |
7.7.2017 |
|
Dicromato de sodio |
C(2017) 3816 |
Islandia |
7.7.2017 |
|
1,2-Dicloroetano |
C(2017) 3821 |
Islandia |
7.7.2017 |
|
Dicromato de potasio |
C(2017) 3910 |
Islandia |
7.7.2017 |
|
Trióxido de cromo y tris(cromato) de dicromo |
C(2017) 5001 |
Islandia |
5.10.2017 |
|
Trióxido de cromo y tris(cromato) de dicromo |
C(2017) 5001 |
Liechtenstein |
4.9.2017 |
|
Trióxido de cromo y tris(cromato) de dicromo |
C(2017) 5001 |
Noruega |
18.8.2017 |
|
Bis(2-metoxietil) éter (diglima) |
C(2017) 5025 |
Islandia |
5.10.2017 |
|
Bis(2-metoxietil) éter (diglima) |
C(2017) 5025 |
Liechtenstein |
4.9.2017 |
|
Bis(2-metoxietil) éter (diglima) |
C(2017) 5025 |
Noruega |
18.8.2017 |
|
Cromato de plomo |
C(2017) 5012 |
Islandia |
5.10.2017 |
|
Cromato de plomo |
C(2017) 5012 |
Liechtenstein |
4.9.2017 |
|
Cromato de plomo |
C(2017) 5012 |
Noruega |
18.8.2017 |
|
Trióxido de cromo |
C(2017) 5880 |
Islandia |
5.10.2017 |
|
Trióxido de cromo |
C(2017) 5880 |
Liechtenstein |
20.9.2017 |
|
Trióxido de cromo |
C(2017) 5880 |
Noruega |
25.9.2017 |
|
Trióxido de cromo |
C(2017) 6727 |
Islandia |
9.11.2017 |
|
Trióxido de cromo |
C(2017) 6727 |
Liechtenstein |
25.10.2017 |
|
Trióxido de cromo |
C(2017) 6727 |
Noruega |
8.11.2017 |
|
30.8.2018 |
ES |
Diario Oficial de la Unión Europea |
C 305/15 |
Medicamentos — Lista de autorizaciones de comercialización concedidas por los Estados AELC-EEE para el segundo semestre de 2017
(2018/C 305/12)
Subcomité I — Libre circulación de mercancías
A la atención del Comité Mixto del EEE
Con referencia a la Decisión n.o 74/1999 del Comité Mixto del EEE, de 28 de mayo de 1999, se invita al Comité Mixto del EEE a que tome nota, en su reunión de 23 de marzo de 2018, de las siguientes listas relativas a autorizaciones de comercialización de medicamentos durante el período del 1 de julio al 31 de diciembre de 2017:
|
Anexo I |
Lista de nuevas autorizaciones de comercialización |
|
Anexo II |
Lista de autorizaciones de comercialización renovadas |
|
Anexo III |
Lista de autorizaciones de comercialización ampliadas |
|
Anexo IV |
Lista de autorizaciones de comercialización retiradas |
|
Anexo V |
Lista de autorizaciones de comercialización suspendidas |
ANEXO I
Lista de nuevas autorizaciones de comercialización
Durante el período del 1 de julio al 31 de diciembre de 2017 se concedieron las siguientes autorizaciones de comercialización en los Estados AELC-EEE:
|
Número UE |
Producto |
País |
Fecha de autorización |
|
EU/1/02/226 |
InductOs |
Islandia |
18.8.2017 |
|
EU/1/15/999 |
Zykadia (cambio a incondicional) |
Liechtenstein |
31.8.2017 |
|
EU/1/16/1138 |
Venclyxto |
Liechtenstein |
31.12.2017 |
|
EU/1/16/1155 |
Kyntheum |
Islandia |
16.8.2017 |
|
EU/1/16/1155 |
Kyntheum |
Liechtenstein |
31.8.2017 |
|
EU/1/16/1155 |
Kyntheum |
Noruega |
14.8.2017 |
|
EU/1/17/1179 |
Veltassa |
Islandia |
11.8.2017 |
|
EU/1/17/1179 |
Veltassa |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1179 |
Veltassa |
Noruega |
9.8.2017 |
|
EU/1/17/1181 |
Spherox |
Islandia |
24.7.2017 |
|
EU/1/17/1181 |
Spherox |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1181 |
Spherox |
Noruega |
13.9.2017 |
|
EU/1/17/1184 |
Riximyo |
Islandia |
11.7.2017 |
|
EU/1/17/1185 |
Rixathon |
Islandia |
11.7.2017 |
|
EU/1/17/1191 |
Dinutuximab beta Apeiron |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1194 |
Febuxostat Mylan |
Islandia |
11.7.2017 |
|
EU/1/17/1195 |
Erelzi |
Islandia |
14.7.2017 |
|
EU/1/17/1195 |
Erelzi |
Noruega |
7.7.2017 |
|
EU/1/17/1196 |
Kevzara |
Islandia |
14.7.2017 |
|
EU/1/17/1196 |
Kevzara |
Noruega |
5.7.2017 |
|
EU/1/17/1197 |
Oxervate |
Islandia |
24.7.2017 |
|
EU/1/17/1197 |
OXERVATE |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1197 |
OXERVATE |
Noruega |
17.7.2017 |
|
EU/1/17/1199 |
Cuprior |
Islandia |
13.9.2017 |
|
EU/1/17/1199 |
Cuprior |
Liechtenstein |
31.10.2017 |
|
EU/1/17/1199 |
Cuprior |
Noruega |
13.9.2017 |
|
EU/1/17/1200 |
Besponsa |
Islandia |
24.7.2017 |
|
EU/1/17/1200 |
Besponsa |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1200 |
Besponsa |
Noruega |
13.7.2017 |
|
EU/1/17/1201 |
Skilarence |
Islandia |
14.7.2017 |
|
EU/1/17/1201 |
Skilarence |
Noruega |
7.7.2017 |
|
EU/1/17/1202 |
Ucedane |
Islandia |
12.7.2017 |
|
EU/1/17/1202 |
Ucedane |
Noruega |
5.7.2017 |
|
EU/1/17/1203 |
Insulin lispro Sanofi |
Islandia |
11.8.2017 |
|
EU/1/17/1203 |
Insulin Lispro Sanofi |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1203 |
Insulin lispro Sanofi |
Noruega |
18.8.2017 |
|
EU/1/17/1205 |
Blitzima |
Islandia |
9.8.2017 |
|
EU/1/17/1205 |
Blitzima |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1205 |
Blitzima |
Noruega |
1.8.2017 |
|
EU/1/17/1206 |
Tuxella |
Islandia |
9.8.2017 |
|
EU/1/17/1206 |
Tuxella |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1206 |
Tuxella |
Noruega |
1.8.2017 |
|
EU/1/17/1207 |
Ritemvia |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1207 |
Ritemvia |
Islandia |
10.8.2017 |
|
EU/1/17/1207 |
Ritemvia |
Noruega |
1.8.2017 |
|
EU/1/17/1208 |
Trimbow |
Islandia |
11.8.2017 |
|
EU/1/17/1208 |
Trimbow |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1208 |
Trimbow |
Noruega |
9.8.2017 |
|
EU/1/17/1209 |
Reagila |
Islandia |
9.8.2017 |
|
EU/1/17/1209 |
Reagila |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1209 |
Reaglia |
Noruega |
9.8.2017 |
|
EU/1/17/1210 |
Efavirenz/Emtricitabin/Tenofovirdisproksil Zentiva |
Noruega |
8.8.2017 |
|
EU/1/17/1210 |
Efavirenz/Emtricitabine/Tenofovir disoproxil Zentiva |
Islandia |
10.8.2017 |
|
EU/1/17/1210 |
Efavirenz/Emtricitabine/Tenofovir disoproxil Zentiva |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1211 |
Entecavir Accord |
Islandia |
5.10.2017 |
|
EU/1/17/1211 |
Entecavir Accord |
Liechtenstein |
31.10.2017 |
|
EU/1/17/1211 |
Entecavir Accord |
Noruega |
20.10.2017 |
|
EU/1/17/1212 |
Mavenclad |
Islandia |
13.9.2017 |
|
EU/1/17/1212 |
MAVENCLAD |
Noruega |
30.8.2017 |
|
EU/1/17/1212 |
MAVENCLAD |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1213 |
Maviret |
Islandia |
17.8.2017 |
|
EU/1/17/1213 |
Maviret |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1213 |
Maviret |
Noruega |
7.8.2017 |
|
EU/1/17/1214 |
Bavencio |
Islandia |
4.10.2017 |
|
EU/1/17/1214 |
Bavencio |
Liechtenstein |
31.10.2017 |
|
EU/1/17/1214 |
Bavencio |
Noruega |
25.9.2017 |
|
EU/1/17/1215 |
Fotivda |
Islandia |
13.9.2017 |
|
EU/1/17/1215 |
Fotivda |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1215 |
Fotivda |
Noruega |
31.8.2017 |
|
EU/1/17/1216 |
Imraldi |
Islandia |
12.9.2017 |
|
EU/1/17/1216 |
Imraldi |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1216 |
Imraldi |
Noruega |
11.9.2017 |
|
EU/1/17/1217 |
Nitisinone MendeliKABS |
Islandia |
19.9.2017 |
|
EU/1/17/1217 |
Nitisinone MendeliKABS |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1217 |
Nitisinone MendeliKABS |
Noruega |
1.9.2017 |
|
EU/1/17/1218 |
Rydapt |
Islandia |
4.10.2017 |
|
EU/1/17/1218 |
Rydapt |
Liechtenstein |
31.10.2017 |
|
EU/1/17/1218 |
Rydapt |
Noruega |
25.9.2017 |
|
EU/1/17/1220 |
Tecentriq |
Liechtenstein |
31.10.2017 |
|
EU/1/17/1220 |
Tecentriq |
Noruega |
27.9.2017 |
|
EU/1/17/1220 |
Tecentriq |
Islandia |
5.10.2017 |
|
EU/1/17/1221 |
Kisqali |
Islandia |
12.9.2017 |
|
EU/1/17/1221 |
Kisqali |
Noruega |
30.8.2017 |
|
EU/1/17/1221 |
Kisqali |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1222 |
Efavirenz/Emtricitabine/Tenofovir disoproxil Mylan |
Islandia |
8.11.2017 |
|
EU/1/17/1222 |
Efavirenz/Emtricitabine/Tenofovir disoproxil Mylan |
Liechtenstein |
31.10.2017 |
|
EU/1/17/1222 |
Efavirenz/Emtricitabine/Tenofovir disoproxil Mylan |
Noruega |
27.9.2017 |
|
EU/1/17/1223 |
Vosevi |
Islandia |
16.8.2017 |
|
EU/1/17/1223 |
Vosevi |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1223 |
Vosevi |
Noruega |
8.8.2017 |
|
EU/1/17/1224 |
Xermelo |
Islandia |
4.10.2017 |
|
EU/1/17/1224 |
Xermelo |
Liechtenstein |
31.10.2017 |
|
EU/1/17/1224 |
Xermelo |
Noruega |
3.10.2017 |
|
EU/1/17/1225 |
Symtuza |
Islandia |
5.10.2017 |
|
EU/1/17/1225 |
Symtuza |
Liechtenstein |
31.10.2017 |
|
EU/1/17/1225 |
Symtuza |
Noruega |
11.10.2017 |
|
EU/1/17/1226 |
Lutathera |
Islandia |
10.10.2017 |
|
EU/1/17/1226 |
Lutathera |
Liechtenstein |
31.10.2017 |
|
EU/1/17/1226 |
Lutathera |
Noruega |
3.10.2017 |
|
EU/1/17/1227 |
Entecavir Mylan |
Islandia |
4.10.2017 |
|
EU/1/17/1227 |
Entecavir Mylan |
Liechtenstein |
31.10.2017 |
|
EU/1/17/1227 |
Entecavir Mylan |
Noruega |
27.9.2017 |
|
EU/1/17/1228 |
Tookad |
Islandia |
29.11.2017 |
|
EU/1/17/1228 |
TOOKAD |
Liechtenstein |
31.12.2017 |
|
EU/1/17/1228 |
TOOKAD |
Noruega |
22.11.2017 |
|
EU/1/17/1229 |
Dupixent |
Islandia |
10.10.2017 |
|
EU/1/17/1229 |
Dupixent |
Liechtenstein |
31.10.2017 |
|
EU/1/17/1229 |
Dupixent |
Noruega |
10.10.2017 |
|
EU/1/17/1230 |
Lacosamide Accord |
Islandia |
5.10.2017 |
|
EU/1/17/1230 |
Lacosamide Accord |
Liechtenstein |
31.10.2017 |
|
EU/1/17/1230 |
Lacosamide Accord |
Noruega |
27.9.2017 |
|
EU/1/17/1232 |
Miglustat Gen.Orph |
Islandia |
30.11.2017 |
|
EU/1/17/1232 |
Miglustat Gen.Orph |
Liechtenstein |
31.12.2017 |
|
EU/1/17/1232 |
Miglustat Gen.Orph |
Noruega |
27.11.2017 |
|
EU/1/17/1233 |
Zubsolv |
Islandia |
29.11.2017 |
|
EU/1/17/1233 |
Zubsolv |
Liechtenstein |
31.12.2017 |
|
EU/1/17/1233 |
Zubsolv |
Noruega |
22.11.2017 |
|
EU/1/17/1234 |
Tremfya |
Islandia |
4.12.2017 |
|
EU/1/17/1235 |
Zejula |
Islandia |
4.12.2017 |
|
EU/1/17/1235 |
Zejula |
Liechtenstein |
31.12.2017 |
|
EU/1/17/1235 |
Zejula |
Noruega |
27.11.2017 |
|
EU/1/17/1236 |
Trelegy Ellipta |
Islandia |
30.11.2017 |
|
EU/1/17/1236 |
Trelegy Ellipta |
Liechtenstein |
31.12.2017 |
|
EU/1/17/1236 |
Trelegy Ellipta |
Noruega |
22.11.2017 |
|
EU/1/17/1237 |
Elebrato Ellipta |
Islandia |
30.11.2017 |
|
EU/1/17/1237 |
Elebrato Ellipta |
Liechtenstein |
31.12.2017 |
|
EU/1/17/1237 |
Elebrato Ellipta |
Noruega |
27.11.2017 |
|
EU/1/17/1238 |
Nyxoid |
Islandia |
29.11.2017 |
|
EU/1/17/1238 |
Nyxoid |
Liechtenstein |
31.12.2017 |
|
EU/1/17/1238 |
Nyxoid |
Noruega |
27.11.2017 |
|
EU/1/17/1239 |
VeraSeal |
Islandia |
30.11.2017 |
|
EU/1/17/1239 |
VeraSeal |
Liechtenstein |
31.12.2017 |
|
EU/1/17/1239 |
VeraSeal |
Noruega |
1.12.2017 |
|
EU/1/17/1240 |
Cyltezo |
Islandia |
29.11.2017 |
|
EU/1/17/1240 |
Cyltezo |
Liechtenstein |
31.12.2017 |
|
EU/1/17/1240 |
Cyltezo |
Noruega |
1.12.2017 |
|
EU/1/17/1241 |
Ontruzant |
Islandia |
30.11.2017 |
|
EU/1/17/1241 |
Ontruzant |
Liechtenstein |
31.12.2017 |
|
EU/1/17/1241 |
Ontruzant |
Noruega |
27.11.2017 |
|
EU/1/17/1242 |
Ritonavir Mylan |
Islandia |
29.11.2017 |
|
EU/1/17/1242 |
Ritonavir Mylan |
Liechtenstein |
31.12.2017 |
|
EU/1/17/1242 |
Ritonavir Mylan |
Noruega |
22.11.2017 |
|
EU/1/17/1243 |
Imatinib Teva B.V. |
Islandia |
30.11.2017 |
|
EU/1/17/1243 |
Imatinib Teva B.V. |
Liechtenstein |
31.12.2017 |
|
EU/1/17/1243 |
Imatinib Teva B.V. |
Noruega |
22.11.2017 |
|
EU/1/17/1244 |
Tacforius |
Liechtenstein |
31.12.2017 |
|
EU/2/16/197 |
CLYNAV |
Islandia |
13.7.2017 |
|
EU/2/16/197 |
CLYNAV |
Liechtenstein |
31.8.2017 |
|
EU/2/16/197 |
CLYNAV |
Noruega |
18.7.2017 |
|
EU/2/17/211 |
Prevomax |
Islandia |
13.7.2017 |
|
EU/2/17/211 |
Prevomax |
Noruega |
6.7.2017 |
|
EU/2/17/212 |
Exzolt |
Islandia |
30.8.2017 |
|
EU/2/17/212 |
Exzolt |
Liechtenstein |
31.10.2017 |
|
EU/2/17/212 |
Exzolt |
Noruega |
15.9.2017 |
|
EU/2/17/213 |
Innovax-ND-IBD |
Islandia |
11.9.2017 |
|
EU/2/17/213 |
Innovax-ND-IBD |
Noruega |
18.9.2017 |
|
EU/2/17/214 |
VEPURED |
Islandia |
12.9.2017 |
|
EU/2/17/214 |
VEPURED |
Noruega |
15.9.2017 |
|
EU/2/17/215 |
Suvaxyn PRRS MLV |
Islandia |
11.9.2017 |
|
EU/2/17/215 |
Suvaxyn PRRS MLV |
Liechtenstein |
31.10.2017 |
|
EU/2/17/215 |
Suvaxyn PRRS MLV |
Noruega |
18.9.2017 |
|
EU/2/17/217 |
Nobivac LeuFel |
Islandia |
9.11.2017 |
|
EU/2/17/217 |
Nobivac LeuFel |
Liechtenstein |
31.12.2017 |
|
EU/2/17/217 |
Nobivac LeuFel |
Noruega |
14.11.2017 |
|
EU/2/17/218 |
Bovilis Blue-8 |
Islandia |
1.12.2017 |
|
EU/2/17/218 |
Bovilis Blue-8 |
Liechtenstein |
31.12.2017 |
|
EU/2/17/218 |
Bovilis Blue-8 |
Noruega |
19.12.2017 |
ANEXO II
Lista de autorizaciones de comercialización renovadas
Durante el período del 1 de julio al 31 de diciembre de 2017 se concedieron las siguientes autorizaciones de comercialización renovadas en los Estados AELC-EEE:
|
Número UE |
Producto |
País |
fecha de autorización |
|
EU/1/07/401 |
alli |
Islandia |
14.7.2017 |
|
EU/1/07/401 |
alli |
Liechtenstein |
31.8.2017 |
|
EU/1/07/401 |
alli |
Noruega |
5.7.2017 |
|
EU/1/07/402 |
Increlex |
Islandia |
12.7.2017 |
|
EU/1/07/402 |
INCRELEX |
Noruega |
5.7.2017 |
|
EU/1/07/403 |
Atriance |
Islandia |
11.7.2017 |
|
EU/1/07/416 |
Ecalta |
Islandia |
13.9.2017 |
|
EU/1/07/416 |
Ecalta |
Liechtenstein |
31.10.2017 |
|
EU/1/07/416 |
Ecalta |
Noruega |
22.9.2017 |
|
EU/1/07/421 |
Glubrava |
Islandia |
30.11.2017 |
|
EU/1/07/421 |
Glubrava |
Liechtenstein |
31.12.2017 |
|
EU/1/07/421 |
Glubrava |
Noruega |
22.11.2017 |
|
EU/1/07/424 |
Torisel |
Islandia |
24.7.2017 |
|
EU/1/07/424 |
Torisel |
Liechtenstein |
31.8.2017 |
|
EU/1/07/424 |
Torisel |
Noruega |
1.8.2017 |
|
EU/1/08/446 |
Privigen |
Islandia |
4.12.2017 |
|
EU/1/08/446 |
Privigen |
Liechtenstein |
31.12.2017 |
|
EU/1/08/446 |
Privigen |
Noruega |
5.12.2017 |
|
EU/1/08/453 |
Prepandrix |
Islandia |
4.12.2017 |
|
EU/1/08/453 |
Prepandrix |
Liechtenstein |
31.12.2017 |
|
EU/1/08/453 |
Prepandrix |
Noruega |
5.12.2017 |
|
EU/1/12/784 |
Cuprymina |
Islandia |
11.8.2017 |
|
EU/1/12/784 |
Cuprymina |
Liechtenstein |
31.8.2017 |
|
EU/1/12/784 |
Cuprymina |
Noruega |
9.8.2017 |
|
EU/1/12/787 |
Revestive |
Islandia |
13.7.2017 |
|
EU/1/12/787 |
Revestive |
Noruega |
5.7.2017 |
|
EU/1/12/788 |
Seebri Breezhaler |
Islandia |
11.8.2017 |
|
EU/1/12/788 |
Seebri Breezhaler |
Liechtenstein |
31.8.2017 |
|
EU/1/12/788 |
Seebri Breezhaler |
Noruega |
9.8.2017 |
|
EU/1/12/789 |
Enurev Breezhaler |
Islandia |
24.7.2017 |
|
EU/1/12/789 |
Enurev Breezhaler |
Liechtenstein |
31.8.2017 |
|
EU/1/12/789 |
Enurev Breezhaler |
Noruega |
9.8.2017 |
|
EU/1/12/790 |
Tovanor Breezhaler |
Islandia |
14.8.2017 |
|
EU/1/12/790 |
Tovanor Breezhaler |
Liechtenstein |
31.8.2017 |
|
EU/1/12/790 |
Tovanor Breezhaler |
Noruega |
9.8.2017 |
|
EU/1/12/794 |
Adcetris |
Islandia |
4.12.2017 |
|
EU/1/12/794 |
ADCETRIS |
Liechtenstein |
31.12.2017 |
|
EU/1/12/794 |
ADCETRIS |
Noruega |
27.11.2017 |
|
EU/1/12/795 |
Forxiga |
Islandia |
13.9.2017 |
|
EU/1/12/795 |
Forxiga |
Liechtenstein |
31.10.2017 |
|
EU/1/12/795 |
Forxiga |
Noruega |
27.9.2017 |
|
EU/1/12/796 |
Picato |
Islandia |
24.7.2017 |
|
EU/1/12/796 |
Picato |
Liechtenstein |
31.8.2017 |
|
EU/1/12/796 |
Picato |
Noruega |
8.8.2017 |
|
EU/1/12/797 |
Eylea |
Islandia |
10.8.2017 |
|
EU/1/12/797 |
Eylea |
Liechtenstein |
31.8.2017 |
|
EU/1/12/797 |
Eylea |
Noruega |
18.8.2017 |
|
EU/1/12/798 |
Ibandronic acid Accord |
Islandia |
6.10.2017 |
|
EU/1/12/798 |
Ibandronic acid Accord |
Liechtenstein |
31.10.2017 |
|
EU/1/12/798 |
Ibandronic acid Accord |
Noruega |
27.9.2017 |
|
EU/1/12/799 |
Memantine Merz |
Islandia |
24.7.2017 |
|
EU/1/12/799 |
Memantine Merz |
Liechtenstein |
31.8.2017 |
|
EU/1/12/799 |
Memantine Merz |
Noruega |
9.8.2017 |
|
EU/1/12/800 |
Zoledronic Acid Hospira |
Islandia |
11.9.2017 |
|
EU/1/12/800 |
Zoledronic acid Hospira |
Liechtenstein |
31.8.2017 |
|
EU/1/12/800 |
Zoledronsyre Hospira |
Noruega |
4.9.2017 |
|
EU/1/12/801 |
Constella |
Islandia |
14.9.2017 |
|
EU/1/12/801 |
Constella |
Liechtenstein |
31.10.2017 |
|
EU/1/12/801 |
Constella |
Noruega |
22.9.2017 |
|
EU/1/12/802 |
Capecitabine medac |
Islandia |
12.7.2017 |
|
EU/1/12/803 |
NexoBrid |
Islandia |
30.11.2017 |
|
EU/1/12/803 |
NexoBrid |
Liechtenstein |
31.12.2017 |
|
EU/1/12/803 |
NexoBrid |
Noruega |
11.12.2017 |
|
EU/1/12/805 |
AMYViD |
Islandia |
9.10.2017 |
|
EU/1/12/805 |
Amyvid |
Liechtenstein |
31.10.2017 |
|
EU/1/12/805 |
Amyvid |
Noruega |
3.10.2017 |
|
EU/1/12/806 |
Ryzodeg |
Islandia |
4.10.2017 |
|
EU/1/12/806 |
Ryzodeg |
Liechtenstein |
31.10.2017 |
|
EU/1/12/806 |
Ryzodeg |
Noruega |
10.10.2017 |
|
EU/1/12/807 |
Tresiba |
Islandia |
9.10.2017 |
|
EU/1/12/807 |
Tresiba |
Liechtenstein |
31.10.2017 |
|
EU/1/12/807 |
Tresiba |
Noruega |
10.10.2017 |
|
EU/1/12/808 |
Imatinib Teva |
Islandia |
9.10.2017 |
|
EU/1/12/808 |
Imatinib Teva |
Liechtenstein |
31.10.2017 |
|
EU/1/12/808 |
Imatinib Teva |
Noruega |
27.9.2017 |
|
EU/1/12/809 |
Betmiga |
Islandia |
6.10.2017 |
|
EU/1/12/809 |
Betmiga |
Liechtenstein |
31.10.2017 |
|
EU/1/12/809 |
Betmiga |
Noruega |
3.10.2017 |
|
EU/1/12/811 |
Lyxumia |
Islandia |
6.10.2017 |
|
EU/1/12/811 |
Lyxumia |
Liechtenstein |
31.10.2017 |
|
EU/1/12/811 |
Lyxumia |
Noruega |
9.10.2017 |
|
EU/1/12/812 |
Bexsero |
Islandia |
9.10.2017 |
|
EU/1/12/812 |
Bexsero |
Liechtenstein |
31.10.2017 |
|
EU/1/12/812 |
Bexsero |
Noruega |
3.10.2017 |
|
EU/1/12/814 |
Zaltrap |
Islandia |
9.10.2017 |
|
EU/1/12/814 |
ZALTRAP |
Liechtenstein |
31.10.2017 |
|
EU/1/12/814 |
ZALTRAP |
Noruega |
27.9.2017 |
|
EU/1/12/815 |
Selincro |
Islandia |
30.11.2017 |
|
EU/1/12/815 |
Selincro |
Liechtenstein |
31.12.2017 |
|
EU/1/12/815 |
Selincro |
Noruega |
1.12.2017 |
|
EU/1/13/813 |
Perjeta |
Islandia |
19.12.2017 |
|
EU/1/13/813 |
Perjeta |
Liechtenstein |
31.12.2017 |
|
EU/1/13/817 |
Actelsar HCT |
Liechtenstein |
31.12.2017 |
|
EU/1/13/819 |
JETREA |
Islandia |
15.12.2017 |
|
EU/1/13/819 |
JETREA |
Liechtenstein |
31.12.2017 |
|
EU/1/13/819 |
JETREA |
Noruega |
19.12.2017 |
|
EU/1/13/902 |
Translarna |
Islandia |
12.7.2017 |
|
EU/1/13/902 |
Translarna |
Noruega |
5.7.2017 |
|
EU/1/14/987 |
Holoclar |
Islandia |
19.12.2017 |
|
EU/1/16/1094 |
Ninlaro |
Islandia |
6.10.2017 |
|
EU/1/16/1094 |
Ninlaro |
Liechtenstein |
31.10.2017 |
|
EU/1/16/1094 |
Ninlaro |
Noruega |
26.9.2017 |
|
EU/1/16/1121 |
Zalmoxis |
Islandia |
24.7.2017 |
|
EU/1/16/1121 |
Zalmoxis |
Liechtenstein |
31.8.2017 |
|
EU/1/16/1121 |
Zalmoxis |
Noruega |
4.8.2017 |
|
EU/1/16/1138 |
Venclyxto |
Islandia |
6.11.2017 |
|
EU/1/16/1138 |
Venclyxto |
Noruega |
14.11.2017 |
|
EU/1/16/1139 |
Ocaliva |
Islandia |
8.12.2017 |
|
EU/1/16/1139 |
OCALIVA |
Liechtenstein |
31.12.2017 |
|
EU/1/16/1139 |
OCALIVA |
Noruega |
18.12.2017 |
|
EU/1/16/1143 |
Lartruvo |
Islandia |
6.10.2017 |
|
EU/1/16/1143 |
Lartruvo |
Liechtenstein |
31.10.2017 |
|
EU/1/16/1143 |
Lartruvo |
Noruega |
27.9.2017 |
|
EU/1/16/1169 |
Alecensa |
Islandia |
8.12.2017 |
|
EU/1/16/1169 |
Alecensa |
Liechtenstein |
31.12.2017 |
|
EU/1/16/1169 |
Alecensa |
Noruega |
15.12.2017 |
|
EU/1/43/890 |
Cometriq |
Noruega |
3.8.2017 |
|
EU/2/12/142 |
Cardalis |
Islandia |
4.7.2017 |
|
EU/2/12/144 |
Contacera |
Islandia |
5.12.2017 |
|
EU/2/12/144 |
Contacera |
Liechtenstein |
31.12.2017 |
|
EU/2/12/144 |
Contacera |
Noruega |
15.12.2017 |
|
EU/2/12/145 |
Kexxtone |
Liechtenstein |
31.12.2017 |
|
EU/2/12/145 |
Kexxtone |
Noruega |
28.12.2017 |
|
EU/2/12/147 |
Pexion |
Islandia |
5.12.2017 |
|
EU/2/12/147 |
Pexion |
Liechtenstein |
31.12.2017 |
|
EU/2/12/147 |
Pexion |
Noruega |
6.12.2017 |
ANEXO III
Lista de autorizaciones de comercialización ampliadas
Durante el período del 1 de julio al 31 de diciembre de 2017 se concedieron las siguientes autorizaciones de comercialización ampliadas en los Estados AELC-EEE:
|
Número UE |
Producto |
País |
Fecha de autorización |
|
EU/1/01/177/002 |
SonoVue |
Noruega |
4.9.2017 |
|
EU/1/03/256/022 |
Humira |
Islandia |
19.12.2017 |
|
EU/1/03/256/022 |
Humira |
Noruega |
10.11.2017 |
|
EU/1/04/292/013-015 |
Mimpara |
Islandia |
15.9.2017 |
|
EU/1/04/292/013-015 |
Mimpara |
Noruega |
28.8.2017 |
|
EU/1/06/356/020-022 |
Exjade |
Noruega |
28.11.2017 |
|
EU/1/06/356/020-022 |
Exjade |
Islandia |
1.12.2017 |
|
EU/1/07/418/011-013 |
Celsentri |
Noruega |
3.8.2017 |
|
EU/1/07/418/011-013 |
Celsentri |
Islandia |
13.7.2017 |
|
EU/1/07/422/015 |
Tasigna |
Islandia |
4.12.2017 |
|
EU/1/07/422/015 |
Tasigna |
Noruega |
28.11.2017 |
|
EU/1/07/436/006 |
Isentress |
Islandia |
9.8.2017 |
|
EU/1/07/436/006 |
Isentress |
Noruega |
7.8.2017 |
|
EU/1/08/481/004-005 |
Kuvan |
Islandia |
10.8.2017 |
|
EU/1/08/481/004-005 |
Kuvan |
Noruega |
13.7.2017 |
|
EU/1/09/522/003 |
ellaOne |
Islandia |
1.12.2017 |
|
EU/1/09/522/003 |
ellaOne |
Noruega |
10.11.2017 |
|
EU/1/09/531/022-033 |
Instanyl |
Islandia |
6.11.2017 |
|
EU/1/09/539/005-006 |
Samsca |
Islandia |
5.10.2017 |
|
EU/1/09/539/005-006 |
Samsca |
Noruega |
18.9.2017 |
|
EU/1/10/618 |
Prolia |
Noruega |
27.9.2017 |
|
EU/1/11/703 |
Xgeva |
Noruega |
27.9.2017 |
|
EU/1/12/753/018-019 |
Signifor |
Islandia |
4.10.2017 |
|
EU/1/12/753/018-019 |
Signifor |
Noruega |
18.9.2017 |
|
EU/1/12/787/003 |
Revestive |
Noruega |
5.7.2017 |
|
EU/1/12/787/003 |
Revestive |
Islandia |
13.7.2017 |
|
EU/1/13/846/002-003 |
Xtandi |
Noruega |
3.10.2017 |
|
EU/1/13/846/002-003 |
Xtandi |
Islandia |
6.10.2017 |
|
EU/1/13/860/003 |
Nexium Control |
Islandia |
11.7.2017 |
|
EU/1/13/860/003 |
Nexium Control |
Noruega |
5.7.2017 |
|
EU/1/15/1070/002 |
Oncaspar |
Islandia |
19.12.2017 |
ANEXO IV
Lista de autorizaciones de comercialización retiradas
Durante el período del 1 de julio al 31 de diciembre de 2017 se concedieron las siguientes autorizaciones de comercialización en los Estados AELC-EEE:
|
Número UE |
Producto |
País |
Fecha de retirada |
|
EU/1/00/167 |
Prevenar |
Liechtenstein |
31.12.2017 |
|
EU/1/00/167 |
Prevenar |
Noruega |
11.12.2017 |
|
EU/1/00/167 |
Prevenar |
Islandia |
1.12.2017 |
|
EU/1/07/394 |
Optaflu |
Noruega |
18.10.2017 |
|
EU/1/07/398 |
Optimark |
Islandia |
10.10.2017 |
|
EU/1/09/561 |
Clopidogrel Teva Pharma |
Islandia |
11.7.2017 |
|
EU/1/11/674 |
Repso |
Liechtenstein |
31.8.2017 |
|
EU/1/11/674 |
Repso |
Noruega |
8.8.2017 |
|
EU/1/11/674 |
Repso |
Islandia |
10.8.2017 |
|
EU/1/13/868 |
EVARREST |
Liechtenstein |
31.12.2017 |
|
EU/1/13/868 |
EVARREST |
Noruega |
28.11.2017 |
|
EU/1/13/868 |
EVARREST |
Islandia |
4.12.2017 |
|
EU/1/14/976 |
Zontivity |
Liechtenstein |
31.8.2017 |
|
EU/1/15/996 |
Ristempa |
Liechtenstein |
31.10.2017 |
|
EU/1/15/996 |
Ristempa |
Noruega |
9.10.2017 |
|
EU/1/15/996 |
Ristempa |
Islandia |
9.10.2017 |
|
EU/1/16/1113 |
Enzepi |
Islandia |
11.8.2017 |
|
EU/1/16/1113 |
Enzepi |
Liechtenstein |
31.8.2017 |
|
EU/1/16/1113 |
Enzepi |
Noruega |
8.8.2017 |
ANEXO V
Lista de autorizaciones de comercialización suspendidas
Durante el período del 1 de julio al 31 de diciembre de 2017 se suspendieron las siguientes autorizaciones de comercialización en los Estados AELC-EEE:
|
Número UE |
Producto |
País |
Fecha de suspensión |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V Anuncios
PROCEDIMIENTOS ADMINISTRATIVOS
Oficina Europea de Selección de Personal (EPSO)
|
30.8.2018 |
ES |
Diario Oficial de la Unión Europea |
C 305/34 |
CONVOCATORIA DE CONCURSO-OPOSICIÓN GENERAL
(2018/C 305/13)
La Oficina Europea de Selección de Personal (EPSO) convoca el concurso-oposición general siguiente:
|
|
EPSO/AST-SC/07/18 — AGENTES ARMADOS DE SEGURIDAD Y PROTECCIÓN (SC 1/SC 2) |
La convocatoria de concurso-oposición general se publicará en 24 lenguas en el Diario Oficial de la Unión Europea C 305 A de 30 de agosto de 2018.
Más información en el sitio web de la EPSO: https://epso.europa.eu/
PROCEDIMIENTOS RELATIVOS A LA APLICACIÓN DE LA POLÍTICA DE COMPETENCIA
Comisión Europea
|
30.8.2018 |
ES |
Diario Oficial de la Unión Europea |
C 305/35 |
Notificación previa de una concentración
(Asunto M.9072 — KKR/Altice/SFR Filiale)
Asunto que podría ser tramitado conforme al procedimiento simplificado
(Texto pertinente a efectos del EEE)
(2018/C 305/14)
1.
El 24 de agosto de 2018, la Comisión recibió la notificación de un proyecto de concentración de conformidad con el artículo 4 del Reglamento (CE) n.o 139/2004 del Consejo (1).La presente notificación se refiere a las siguientes empresas:
|
— |
KKR & Co. Inc («KKR») (Estados Unidos). |
|
— |
Altice France S.A. («Altice») (Francia), perteneciente al grupo Altice. |
|
— |
SFR Filiale SAS («SFR Filiale»), bajo el control de Altice. |
KKR y Altice adquieren, a tenor de lo dispuesto en el artículo 3, apartado 1, letra b), del Reglamento de concentraciones, el control conjunto de la totalidad de SFR Filiale.
La concentración se realiza mediante adquisición de acciones.
2.
Las actividades comerciales de las empresas mencionadas son:— KKR: sociedad de inversión que ofrece servicios de gestión de activos y soluciones basadas en los mercados de capitales.
— Altice: servicios de telecomunicaciones, contenidos, medios de comunicación, actividades de ocio y publicidad.
— SFR Filiale: división de torres de telecomunicaciones de la filial de Altice en Francia, SFR S.A.
3.
Tras un examen preliminar, la Comisión considera que la operación notificada podría entrar en el ámbito de aplicación del Reglamento de concentraciones. No obstante, se reserva su decisión definitiva al respecto.En virtud de la Comunicación de la Comisión sobre el procedimiento simplificado para tramitar determinadas concentraciones en virtud del Reglamento (CE) n.o 139/2004 del Consejo (2), el presente asunto podría ser tramitado conforme al procedimiento establecido en dicha Comunicación.
4.
La Comisión invita a los terceros interesados a que le presenten sus posibles observaciones sobre la operación propuesta.Las observaciones deberán obrar en poder de la Comisión en un plazo máximo de diez días a partir de la fecha de la presente publicación, indicando siempre la siguiente referencia:
M.9072 — KKR/Altice/SFR Filiale
Las observaciones podrán enviarse a la Comisión por correo electrónico, fax o correo postal a la siguiente dirección:
|
Correo electrónico: COMP-MERGER-REGISTRY@ec.europa.eu |
|
Fax +32 22964301 |
|
Dirección postal: |
|
Comisión Europea |
|
Dirección General de Competencia |
|
Registro de Concentraciones |
|
1049 Bruxelles/Brussel |
|
BELGIQUE/BELGIË |
(1) DO L 24 de 29.1.2004, p. 1 («Reglamento de concentraciones»).