ANEXO II
El anexo XV del Reglamento (UE) n.o 142/2011 se modifica como sigue:
|
1) |
Los capítulos 1 a 3, letra F, se sustituyen por el texto siguiente: «CAPÍTULO 1 Certificado sanitario de proteína animal transformada, distinta de la derivada de insectos de granja, no destinada al consumo humano, incluidas las mezclas y los productos distintos de los alimentos para animales de compañía que la contengan, que se enviará a la Unión Europea o transitará (2) por ella. 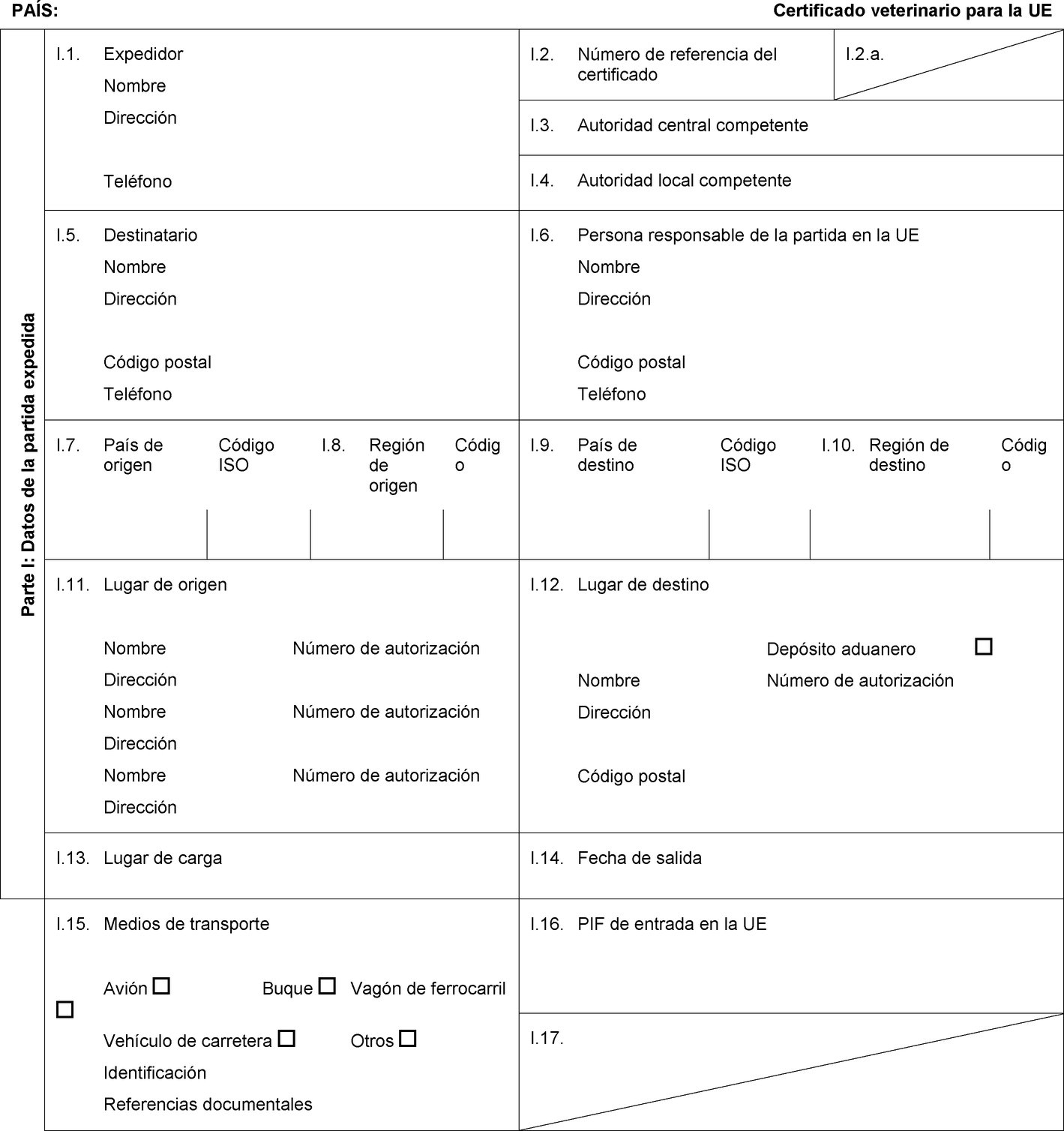 Texto de la imagen
Texto de la imagen
PAÍS: Certificado veterinario para la UE Parte I: Datos de la partida expedida I.1. Expedidor Nombre Dirección Teléfono I.2. Número de referencia del certificado I.2.a. I.3. Autoridad central competente I.4. Autoridad local competente I.5. Destinatario Nombre Dirección Código postal Teléfono I.6. Persona responsable de la partida en la UE Nombre Dirección Código postal Teléfono I.7. País de origen Código ISO I.8. Región de origen Código I.9. País de destino Código ISO I.10. Región de destino Código I.11. Lugar de origen Nombre Número de autorización Dirección Nombre Número de autorización Dirección Nombre Número de autorización Dirección I.12. Lugar de destino Depósito aduanero Nombre Número de autorización Dirección Código postal I.13. Lugar de carga I.14. Fecha de salida I.15. Medios de transporte Avión Buque Vagón de ferrocarril Vehículo de carretera Otros Identificación Referencias documentales I.16. PIF de entrada en la UE I.17. 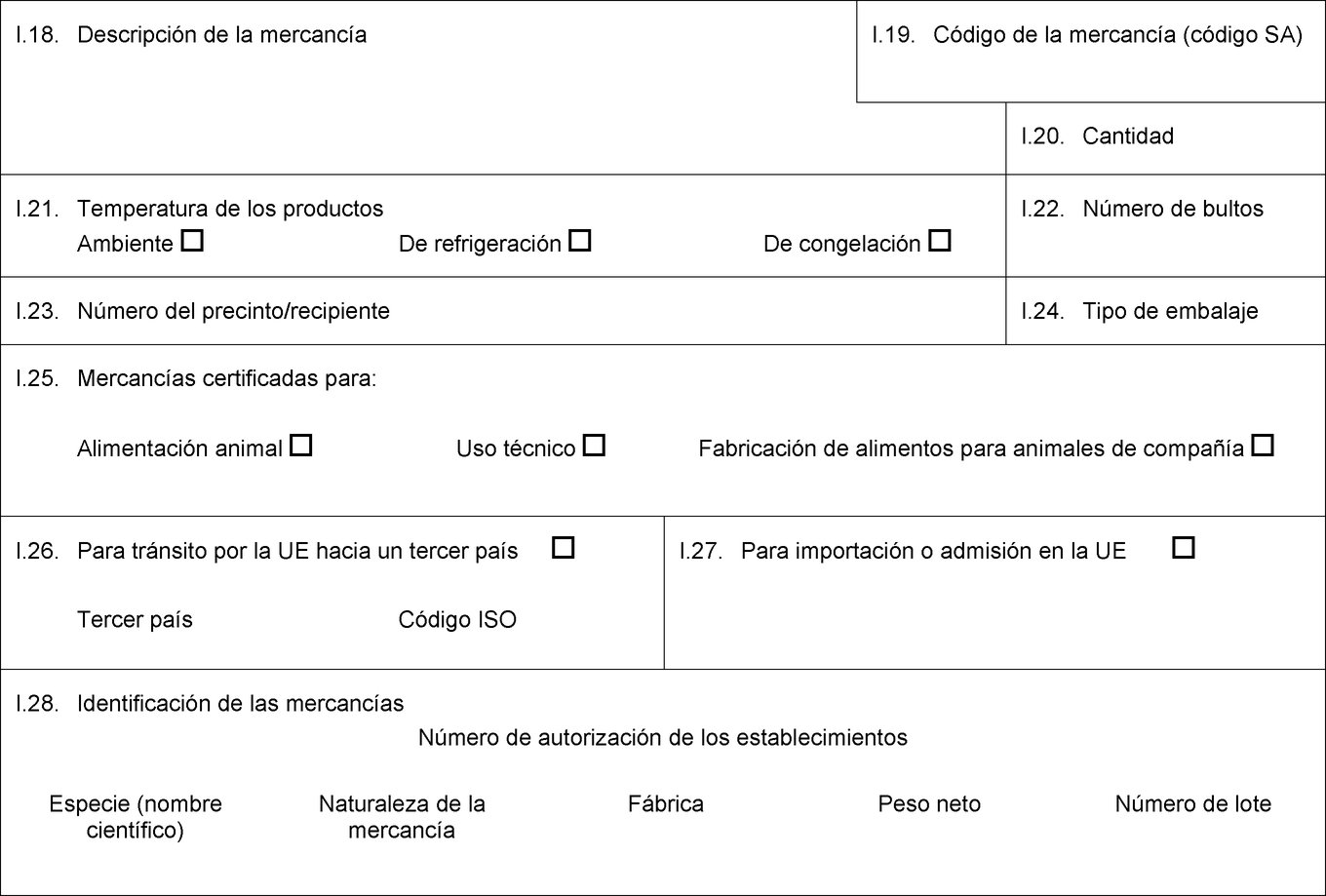 Texto de la imagen
Texto de la imagen
I.18. Descripción de la mercancía I.19. Código de la mercancía (código SA) I.20. Cantidad I.21. Temperatura de los productos Ambiente De refrigeración De congelación I.22. Número de bultos I.23. Número del precinto/recipiente I.24. Tipo de embalaje I.25. Mercancías certificadas para: Alimentación animal Uso técnico Fabricación de alimentos para animales de compañía I.26. Para tránsito por la UE hacia un tercer país Tercer país Código ISO I.27. Para importación o admisión en la UE I.28. Identificación de las mercancías Número de autorización de los establecimientos Especie (nombre científico) Naturaleza de la mercancía Fábrica Peso neto Número de lote  Texto de la imagen
Texto de la imagen
PAÍS Proteína animal transformada distinta de la derivada de insectos de granja no destinada al consumo humano, incluidas las mezclas y los productos distintos de los alimentos para animales de compañía que la contengan II. Información sanitaria II.a. Número de referencia del certificado II.b. El veterinario oficial abajo firmante declara haber leído y comprendido el Reglamento (CE) n.o 1069/2009 del Parlamento Europeo y del Consejo (1a), y en particular su artículo 10, y el Reglamento (UE) n.o 142/2011 de la Comisión (1b), y en particular la sección 1 del capítulo II de su anexo X y el capítulo I de su anexo XIV, y certifica que: II.1. las proteínas o los productos animales transformados descritos contienen exclusivamente proteínas animales no destinadas al consumo humano que: a) han sido elaboradas y almacenadas en un establecimiento o una planta autorizados y supervisados por la autoridad competente con arreglo al artículo 24 del Reglamento (CE) n.o 1069/2009, y b) han sido elaboradas exclusivamente a partir de los subproductos animales siguientes: (2) bien [- las canales y partes de animales sacrificados, o, en el caso de animales de caza, los cuerpos o partes de animales matados que sean aptos para el consumo humano con arreglo a la legislación de la Unión pero no se destinen a ese fin por motivos comerciales;] (2) y/o [- las canales y las siguientes partes de animales sacrificados en un matadero y considerados aptos para el consumo humano a raíz de una inspección ante mortem o los cuerpos y las siguientes partes de animales cazados para el consumo humano de conformidad con la legislación de la Unión: i) las canales o los cuerpos y partes de animales declarados no aptos para el consumo humano de acuerdo con la legislación de la Unión pero que no muestren ningún signo de enfermedad transmisible a personas o animales; ii) las cabezas de aves de corral; iii) los cueros y pieles, incluidos los recortes y la piel dividida, los cuernos y los pies, incluidas las falanges y los huesos carpianos y metacarpianos, tarsianos y metatarsianos; iv) las cerdas; v) las plumas;] (2) y/o [- sangre de animales que no presentaban ningún signo de enfermedad transmisible por la sangre a personas o animales, obtenida de animales que hayan sido sacrificados en un matadero después de haber sido considerados aptos para el sacrificio para el consumo humano a raíz de una inspección ante mortem de conformidad con la legislación de la Unión;] (2) y/o [- subproductos animales generados en la elaboración de productos destinados al consumo humano, incluidos el hueso desgrasado, los chicharrones y los lodos de centrifugado o de separación resultantes de la elaboración de productos lácteos;] (2) y/o [- los productos de origen animal o los productos alimenticios que contengan productos de origen animal que ya no estén destinados al consumo humano por motivos comerciales, problemas de fabricación, defectos de envasado u otros defectos que no conlleven ningún riesgo para la salud pública o la salud animal;] (2) y/o [- la sangre, la placenta, la lana, las plumas, el pelo, los cuernos, los recortes de cascos, uñas o pezuñas y la leche cruda de animales vivos que no presenten signos de enfermedad transmisible a través de esos productos a las personas o los animales;] (2) y/o [- los animales acuáticos y partes de los mismos, salvo los mamíferos marinos, que no muestren ningún signo de enfermedades transmisibles a las personas o los animales;] (2) y/o [- los subproductos animales de animales acuáticos procedentes de establecimientos o plantas que fabrican productos para el consumo humano;] Parte II: Certificación  Texto de la imagen
Texto de la imagen
PAÍS Proteína animal transformada distinta de la derivada de insectos de granja no destinada al consumo humano, incluidas las mezclas y los productos distintos de los alimentos para animales de compañía que la contengan II. Información sanitaria II.a. Número de referencia del certificado II.b. (2) y/o [- el siguiente material de animales que no presenten ningún signo de una enfermedad transmisible a las personas o los animales a través de dicho material: i) las conchas de moluscos despojadas del tejido blando o la carne; ii) los siguientes productos de animales terrestres: — los subproductos de la incubación, — los huevos, — los subproductos de los huevos, incluidas las cáscaras; iii) los pollitos de un día sacrificados por razones comerciales;] (2) y/o [- los invertebrados acuáticos o terrestres, salvo los de especies patógenas para las personas o los animales;] (2) y/o [- los animales, y sus partes, de los órdenes zoológicos de los roedores y los lagomorfos salvo el material de la categoría 1 al que se refiere el artículo 8, letra a), incisos iii), iv) y v), y el material de la categoría 2 al que se refiere el artículo 9, letras a) a g), del Reglamento (CE) n.o 1069/2009;] y c) se han sometido al tratamiento siguiente: (2) bien [calentamiento ininterrumpido durante al menos 20 minutos a una temperatura interna superior a 133 °C, a una presión (absoluta) de al menos 3 bares producida por vapor saturado, con una dimensión granulométrica previa al tratamiento no superior a 50 milímetros;] (2) o [en el caso de proteínas de animales no mamíferos distintas de la harina de pescado, el método de transformación 1-2-3-4-5-7 (indicar el método de transformación) descrito en el anexo IV, capítulo III, del Reglamento (UE) n.o 142/2011 de la Comisión;] (2) o [en el caso de la harina de pescado, el método de transformación 1-2-3-4-5-7 (indicar el método de transformación) descrito en el anexo IV, capítulo III, del Reglamento (UE) n.o 142/2011 de la Comisión;] (2) o [en el caso de la sangre de porcinos, el método de transformación 1-2-3-4-5-7 (indicar el método de transformación) descrito en el anexo IV, capítulo III, del Reglamento (UE) n.o 142/2011 de la Comisión, si en lugar del método 7 se ha aplicado un tratamiento térmico de al menos 80 °C en toda su masa;] II.2. la autoridad competente ha examinado una muestra tomada al azar inmediatamente antes del envío y ha comprobado que cumplía las normas siguientes (3): Salmonella: ausencia en 25 g: n = 5, c = 0, m = 0, M = 0 Enterobacteriaceae: n = 5, c = 2, m = 10, M = 300 en 1 g; II.3. el producto ha sido objeto de todas las precauciones necesarias para evitar que vuelva a contaminarse con agentes patógenos después del tratamiento; II.4. el producto final: (2) bien [está envasado en bolsas nuevas o esterilizadas,]  Texto de la imagen
Texto de la imagen
PAÍS Proteína animal transformada distinta de la derivada de insectos de granja no destinada al consumo humano, incluidas las mezclas y los productos distintos de los alimentos para animales de compañía que la contengan II. Información sanitaria II.a. Número de referencia del certificado II.b. (2) o [es transportado a granel en contenedores o en otros medios de transporte limpiados a fondo y desinfectados antes de su utilización,] y va etiquetado con la indicación «NO APTO PARA EL CONSUMO HUMANO»; II.5. el producto final se ha almacenado en un lugar cerrado; (2) [II.6. la proteína animal transformada o el producto descrito contiene, o se ha obtenido de, subproductos animales de rumiantes y: (2) bien [proviene de un país o región clasificado como de riesgo insignificante de EEB según lo establecido en la Decisión 2007/453/CE, y en el que no ha habido ningún caso autóctono de EEB, y]] (2)o [proviene de un país o región clasificado como de riesgo insignificante de EEB según lo establecido en la Decisión 2007/453/CE, pero en el que se ha registrado un caso autóctono de EEB, y el subproducto animal o producto derivado se ha obtenido de animales que nacieron después de la fecha a partir de la cual entró plenamente en vigor la prohibición de alimentar a los rumiantes con harinas de carne y huesos o con chicharrones derivados de rumiantes (tal como se definen en el Código Sanitario para los Animales Terrestres de la OIE), y] (2) bien [procede de rumiantes distintos de los bovinos, ovinos o caprinos.] (2)o [procede de bovinos, ovinos o caprinos y no contiene ni se ha obtenido de: (2) bien [materiales de bovino, ovino y caprino que no se hayan obtenido de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]] (2)o [a) material especificado de riesgo según se define en el punto 1 del anexo V del Reglamento (CE) n.o 999/2001/UE del Parlamento Europeo y del Consejo (4); b) carne separada mecánicamente obtenida de huesos de bovino, ovino o caprino, excepto de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE de la Comisión (5), y donde no ha habido ningún caso autóctono de EEB; c) subproductos animales o productos derivados obtenidos de bovinos, ovinos o caprinos a los que se ha dado muerte, previo aturdimiento, por laceración del tejido nervioso central mediante la introducción de un instrumento en forma de vara alargada en la cavidad craneal, o mediante inyección de gas en la cavidad craneal, salvo en el caso de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]]] II.7. la proteína animal transformada o el producto descrito: (2) bien [no contienen leche ni productos lácteos de origen ovino o caprino, o no están destinados a la alimentación de animales de granja distintos de los animales de peletería.] (2) o [contienen leche o productos lácteos de origen ovino o caprino y están destinados a la alimentación de animales de granja distintos de los animales de peletería; la leche o productos lácteos: a) se obtiene de ovinos y caprinos que han permanecido continuamente desde su nacimiento en un país donde se cumplen las siguientes condiciones: i) la tembladera clásica es de notificación obligatoria,  Texto de la imagen
Texto de la imagen
PAÍS Proteína animal transformada distinta de la derivada de insectos de granja no destinada al consumo humano, incluidas las mezclas y los productos distintos de los alimentos para animales de compañía que la contengan II. Información sanitaria II.a. Número de referencia del certificado II.b. ii) existe un sistema de concienciación, vigilancia y seguimiento de la tembladera clásica, iii) se aplican restricciones oficiales a las explotaciones de ovinos o caprinos en caso de sospecha de EET o de confirmación de tembladera clásica, iv) se matan y se destruyen los ovinos y caprinos aquejados de tembladera clásica, v) se ha prohibido alimentar a ovinos y caprinos con harina de carne y huesos o chicharrones, tal como se definen en el Código Sanitario para los Animales Terrestres de la Organización Mundial de Sanidad Animal (OIE), derivados de rumiantes, y la prohibición se ha aplicado de forma efectiva en todo el país durante al menos los 7 años precedentes; b) provienen de explotaciones donde no se han impuesto restricciones oficiales debido a una sospecha de EET; c) provienen de explotaciones en las que no se ha diagnosticado ningún caso de tembladera clásica en los 7 años precedentes, o en las que, tras la confirmación de un caso de tembladera clásica: (2) bien [se han matado y destruido, o se han sacrificado, todos los ovinos y caprinos de la explotación, excepto los machos reproductores de genotipo ARR/ARR, las hembras reproductoras que presentan al menos un alelo ARR y ningún alelo VRQ y otros ovinos que presentan al menos un alelo ARR;] (2)o se han matado y destruido todos los animales con tembladera clásica confirmada, y la explotación se ha sometido durante dos años, como mínimo, desde la fecha de confirmación del último caso de tembladera clásica, a una vigilancia intensificada de las EET, habiendo dado negativo las pruebas de EET realizadas con arreglo a los métodos de laboratorio que figuran en el anexo X, capítulo C, punto 3.2 del Reglamento n.o 999/2001 a que se ha sometido a los siguientes animales mayores de 18 meses, excepto los ovinos de genotipo ARR/ARR: — animales que han sido sacrificados para el consumo humano; y — animales que han muerto o a los que se ha dado muerte en la explotación, pero no en el marco de una campaña de erradicación de la enfermedad.]] II.8. [la proteína animal transformada o el producto descrito contienen, o se han obtenido de, subproductos animales de origen no rumiante y, de acuerdo con la declaración del expedidor a que se hace referencia en la casilla I.1, (2) bien [no están destinados a la alimentación de animales de granja distintos de los animales de peletería.] (2)(6)o [están destinados a la producción de piensos para animales de granja no rumiantes, distintos de los animales de peletería, y el expedidor se ha comprometido a garantizar que el puesto de inspección fronterizo de entrada recibirá los resultados de los análisis efectuados de conformidad con los métodos expuestos en el anexo VI del Reglamento (CE) n.o 152/2009 de la Comisión (7).] Notas Parte I: — Casilla I.6: Persona responsable de la partida en la Unión Europea: esta casilla debe cumplimentarse únicamente si se trata de un certificado de mercancía en tránsito por la Unión Europea; puede cumplimentarse si el certificado se refiere a una mercancía que vaya a ser importada en la Unión Europea. — Casilla I.12: Lugar de destino: esta casilla debe rellenarse únicamente si se trata de un certificado de mercancía en tránsito. los productos en tránsito solo pueden almacenarse en zonas francas, depósitos francos y depósitos aduaneros. — Casilla I.15: número de matrícula (vagones o contenedores de ferrocarril y camiones), número de vuelo (avión) o nombre (buque); deberá aportarse la información si se descarga y vuelve a cargar.  Texto de la imagen
Texto de la imagen
PAÍS Proteína animal transformada distinta de la derivada de insectos de granja no destinada al consumo humano, incluidas las mezclas y los productos distintos de los alimentos para animales de compañía que la contengan II. Información sanitaria II.a. Número de referencia del certificado II.b. — Casilla I.19: Indicar el código SA apropiado: 05.05, 05.06, 05.07, 05.11, 23.01 o 23.09. — Casilla I.25: uso técnico: cualquier otro distinto de la alimentación para animales de granja, distintos de los animales de peletería, y la producción o la fabricación de alimentos para animales de compañía. — Casillas I.26 y I.27: cumplimentar según se trate de un certificado de tránsito o de importación. — Casilla I.28: especie: elija una de las siguientes opciones: Aves, Ruminantia, Suidae, Mammalia distintos de Ruminantia o Suidae, Pesca, Mollusca, Crustacea, invertebrados distintos de Mollusca y Crustacea. En el caso de los peces de piscifactoría, indicar el nombre científico. Parte II: (1a) DO L 300 de 14.11.2009, p. 1. (1b) DO L 54 de 26.2.2011, p. 1. (2) Táchese lo que no proceda. (3) Donde: n = número de muestras por analizar; m = valor umbral del número de bacterias; el resultado se considera satisfactorio si el número de bacterias en todas las muestras no es superior a m; M = valor máximo del número de bacterias; el resultado se considera insatisfactorio si el número de bacterias en una o más muestras es igual o superior a M; y c = número de muestras en las cuales el recuento de bacterias puede situarse entre m y M; la muestra sigue considerándose aceptable si el recuento de bacterias de las demás muestras es igual o inferior a m. (4) DO L 147 de 31.5.2001, p. 1. (5) DO L 172 de 30.6.2007, p. 84. (6) La persona responsable de la partida a que se hace referencia en la casilla I.6 debe garantizar que, en caso de que la proteína animal transformada o el producto descrito en el presente certificado sanitario vaya a utilizarse para producir piensos para animales de granja no rumiantes, distintos de los animales de peletería, la partida debe analizarse, de conformidad con los métodos establecidos en el anexo VI del Reglamento (CE) n.o 152/2009, a fin de verificar la ausencia de componentes de origen animal no autorizados. La información sobre el resultado de ese análisis debe adjuntarse al presente certificado sanitario al presentar la partida a un puesto de inspección fronterizo de la UE. (7) DO L 54 de 26.2.2009, p. 1. — El color de la tinta de la firma y del sello debe ser diferente del de los caracteres impresos. — Nota para la persona responsable de la partida en la Unión Europea: el presente certificado se expide únicamente a efectos veterinarios y debe acompañar a la partida hasta el puesto de inspección fronterizo. Veterinario o inspector oficial Nombre y apellidos (en mayúsculas): Cualificación y cargo: Fecha: Firma: Sello: CAPÍTULO 1 bis Certificado sanitario de proteína animal transformada derivada de insectos de granja no destinada al consumo humano, incluidas las mezclas y los productos distintos de los alimentos para animales de compañía que la contengan, que se enviará a la Unión Europea o transitará por ella (2) 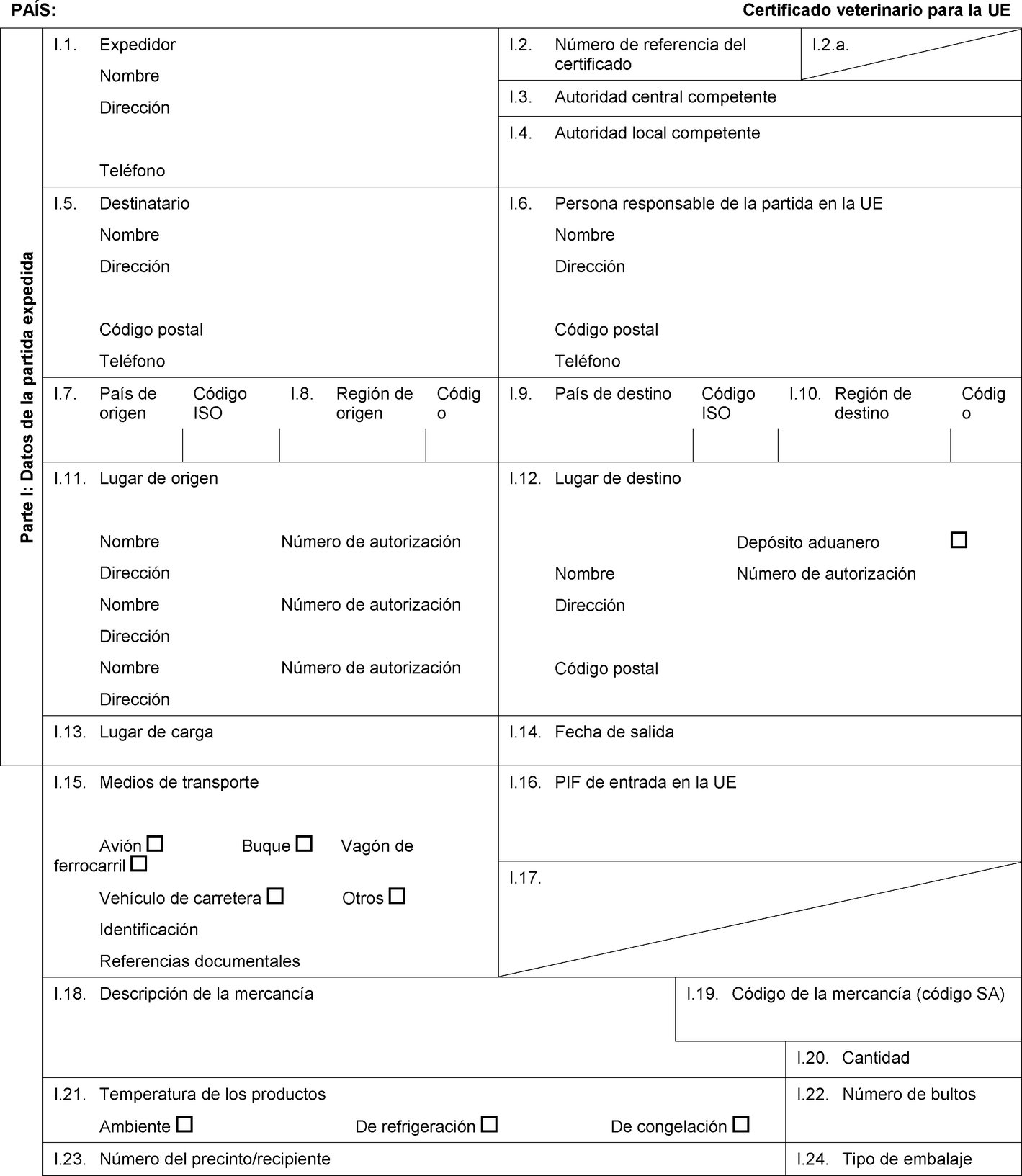 Texto de la imagen
Texto de la imagen
PAÍS: Certificado veterinario para la UE Parte I: Datos de la partida expedida I.1. Expedidor Nombre Dirección Teléfono I.2. Número de referencia del certificado I.2.a. I.3. Autoridad central competente I.4. Autoridad local competente I.5. Destinatario Nombre Dirección Código postal Teléfono I.6. Persona responsable de la partida en la UE Nombre Dirección Código postal Teléfono I.7. País de origen Código ISO I.8. Región de origen Código I.9. País de destino Código ISO I.10. Región de destino Código I.11. Lugar de origen Nombre Número de autorización Dirección Nombre Número de autorización Dirección Nombre Número de autorización Dirección I.12. Lugar de destino Depósito aduanero Nombre Número de autorización Dirección Código postal I.13. Lugar de carga I.14. Fecha de salida I.15. Medios de transporte Avión Buque Vagón de ferrocarril Vehículo de carretera Otros Identificación Referencias documentales I.16. PIF de entrada en la UE I.17. I.18. Descripción de la mercancía I.19. Código de la mercancía (código SA) I.20. Cantidad I.21. Temperatura de los productos Ambiente De refrigeración De congelación I.22. Número de bultos I.23. Número del precinto/recipiente I.24. Tipo de embalaje  Texto de la imagen
Texto de la imagen
I.25. Mercancías certificadas para: Alimentación animal Uso técnico Fabricación de alimentos para animales de compañía I.26. Para tránsito por la UE hacia un tercer país Tercer país Código ISO I.27. Para importación o admisión en la UE I.28. Identificación de las mercancías Número de autorización de los establecimientos Especie (nombre científico) Naturaleza de la mercancía Fábrica Peso neto Número de lote  Texto de la imagen
Texto de la imagen
PAÍS Proteína animal transformada derivada de insectos de granja no destinada al consumo humano, incluidas las mezclas y los productos distintos de los alimentos para animales de compañía que la contengan II. Información sanitaria II.a. Número de referencia del certificado II.b. El veterinario oficial abajo firmante declara haber leído y comprendido el Reglamento (CE) n.o 1069/2009 del Parlamento Europeo y del Consejo (1a), y en particular su artículo 10, y el Reglamento (UE) n.o 142/2011 de la Comisión (1b), y en particular la sección 1 del capítulo II de su anexo X y el capítulo I de su anexo XIV, y certifica que: II.1. la proteína animal transformada derivada de insectos de granja o el producto descrito contienen exclusivamente proteína animal transformada no destinada al consumo humano que: a) ha sido elaborada y almacenada en un establecimiento o una planta autorizados y supervisados por la autoridad competente con arreglo al artículo 24 del Reglamento (CE) n.o 1069/2009, y b) ha sido elaborada exclusivamente a partir de insectos de granja de las siguientes especies: (2) bien [- mosca soldado negra (Hermetia illucens);] (2) y/o [- mosca común (Musca domestica);] (2) y/o [- gusano de la harina (Tenebrio molitor);] (2) y/o [- escarabajo de la cama (Alphitobius diaperinus);] (2) y/o [- grillo doméstico (Acheta domesticus);] (2) y/o [- grillo rayado (Gryllodes sigillatus);] (2) y/o [- grillo bicolor (Gryllus assimilis).] y c) ha sido transformada con el método [1]-[2]-[3]-[4]-[5]-[7] (2) del capítulo III del anexo IV del Reglamento (UE) n.o 142/2011; y d) el sustrato para la alimentación de los insectos de granja solo puede contener productos de origen no animal, o los siguientes productos de origen animal de material de la categoría 3: — harina de pescado, — hemoderivados procedentes de no rumiantes, — fosfato dicálcico y tricálcico de origen animal, — proteínas hidrolizadas de no rumiantes, — proteínas hidrolizadas de pieles y cueros de rumiantes, — gelatina y colágeno de no rumiantes, — huevos y ovoproductos, — leche, productos a base de leche, productos derivados de la leche y calostro, — miel, — grasas extraídas; Parte II: Certificación  Texto de la imagen
Texto de la imagen
PAÍS Proteína animal transformada derivada de insectos de granja no destinada al consumo humano, incluidas las mezclas y los productos distintos de los alimentos para animales de compañía que la contengan II. Información sanitaria II.a. Número de referencia del certificado II.b. y e) el sustrato para la alimentación de los insectos y los propios insectos o sus larvas no han estado en contacto con materiales de origen animal distintos de los mencionados en la letra d), y el sustrato no contenía estiércol, residuos de cocina u otros residuos. II.2. la autoridad competente ha examinado una muestra tomada al azar inmediatamente antes del envío y ha comprobado que cumplía las normas siguientes (3): Salmonella: ausencia en 25 g: n = 5, c = 0, m = 0, M = 0 Enterobacteriaceae: n = 5, c = 2, m = 10, M = 300 en 1 g; II.3. el producto ha sido objeto de todas las precauciones necesarias para evitar que vuelva a contaminarse con agentes patógenos después del tratamiento; II.4. el producto final: (2) bien [está envasado en bolsas nuevas o esterilizadas,] (2) o [es transportado a granel en contenedores o en otros medios de transporte limpiados a fondo y desinfectados antes de su utilización,] y etiquetado con la indicación: “NO APTO PARA EL CONSUMO HUMANO. PROTEÍNA TRANSFORMADA DERIVADA DE INSECTOS. NO DEBE UTILIZARSE EN PIENSOS PARA ANIMALES DE GRANJA, EXCEPTO ANIMALES DE ACUICULTURA Y ANIMALES DE PELETERÍA”; II.5. el producto final se ha almacenado en un lugar cerrado; (2) [II.6. la proteína animal transformada o el producto descrito contiene, o se ha obtenido de, subproductos animales de rumiantes y: (2) bien [proviene de un país o región clasificado como de riesgo insignificante de EEB según lo establecido en la Decisión 2007/453/CE, y en el que no ha habido ningún caso autóctono de EEB, y]] (2) o [proviene de un país o región clasificado como de riesgo insignificante de EEB según lo establecido en la Decisión 2007/453/CE, pero en el que se ha registrado un caso autóctono de EEB, y el subproducto animal o producto derivado se ha obtenido de animales que nacieron después de la fecha a partir de la cual entró plenamente en vigor en el país o la región en cuestión la prohibición de alimentar a los rumiantes con harinas de carne y huesos o con chicharrones derivados de rumiantes (tal como se definen en el Código Sanitario para los Animales Terrestres de la OIE), y]] (2) bien [procede de rumiantes distintos de los bovinos, ovinos o caprinos.]] (2) o [procede de bovinos, ovinos o caprinos y no contiene ni se ha obtenido de: (2) bien [materiales de bovino, ovino y caprino que no se hayan obtenido de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]] (2) o [a) material especificado de riesgo según se define en el punto 1 del anexo V del Reglamento (CE) n.o 999/2001/UE del Parlamento Europeo y del Consejo (4); b) carne separada mecánicamente obtenida de huesos de bovino, ovino o caprino, excepto de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE de la Comisión (5), y donde no ha habido ningún caso autóctono de EEB;  Texto de la imagen
Texto de la imagen
PAÍS Proteína animal transformada derivada de insectos de granja no destinada al consumo humano, incluidas las mezclas y los productos distintos de los alimentos para animales de compañía que la contengan II. Información sanitaria II.a. Número de referencia del certificado II.b. c) subproductos animales o productos derivados obtenidos de bovinos, ovinos o caprinos a los que se ha dado muerte, previo aturdimiento, por laceración del tejido nervioso central mediante la introducción de un instrumento en forma de vara alargada en la cavidad craneal, o mediante la inyección de gas en la cavidad craneal, salvo en el caso de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]]] II.7. la proteína animal transformada o el producto descrito: (2) bien [no contienen leche ni productos lácteos de origen ovino o caprino, o no están destinados a la alimentación de animales de granja distintos de los animales de peletería.] (2) o [contienen leche o productos lácteos de origen ovino o caprino y están destinados a la alimentación de animales de granja distintos de los animales de peletería; la leche o productos lácteos: a) provienen de ovinos y caprinos que han permanecido continuamente desde su nacimiento en un país donde se cumplen las siguientes condiciones: i) la tembladera clásica es de notificación obligatoria, ii) existe un sistema de concienciación, vigilancia y seguimiento de la tembladera clásica, iii) se aplican restricciones oficiales a las explotaciones de ovinos o caprinos en caso de sospecha de EET o de confirmación de tembladera clásica, iv) se matan y se destruyen los ovinos y caprinos aquejados de tembladera clásica, v) se ha prohibido alimentar a ovinos y caprinos con harina de carne y huesos o chicharrones, tal como se definen en el Código Sanitario para los Animales Terrestres de la Organización Mundial de Sanidad Animal (OIE), derivados de rumiantes, y la prohibición se ha aplicado de forma efectiva en todo el país durante al menos los 7 años precedentes; b) provienen de explotaciones donde no se han impuesto restricciones oficiales debido a una sospecha de EET; c) provienen de explotaciones en las que no se ha diagnosticado ningún caso de tembladera clásica en los 7 años precedentes, o en las que, tras la confirmación de un caso de tembladera clásica: (2) bien [se han matado y destruido, o se han sacrificado, todos los ovinos y caprinos de la explotación, excepto los machos reproductores de genotipo ARR/ARR, las hembras reproductoras que presentan al menos un alelo ARR y ningún alelo VRQ y otros ovinos que presentan al menos un alelo ARR;] (2) o se han matado y destruido todos los animales con tembladera clásica confirmada, y la explotación se ha sometido durante dos años, como mínimo, desde la fecha de confirmación del último caso de tembladera clásica, a una vigilancia intensificada de las EET, habiendo dado negativo las pruebas de EET realizadas con arreglo a los métodos de laboratorio que figuran en el punto 3.2 del capítulo C del anexo X del Reglamento n.o 999/2001 a que se ha sometido a los siguientes animales mayores de 18 meses, excepto los ovinos de genotipo ARR/ARR: — animales que han sido sacrificados para el consumo humano; y — animales que han muerto o a los que se ha dado muerte en la explotación, pero no en el marco de una campaña de erradicación de la enfermedad.]] II.8. [la proteína animal transformada o el producto descrito contienen, o se han obtenido de, subproductos animales de origen no rumiante y, de acuerdo con la declaración del expedidor a que se hace referencia en la casilla I.1,  Texto de la imagen
Texto de la imagen
PAÍS Proteína animal transformada derivada de insectos de granja no destinada al consumo humano, incluidas las mezclas y los productos distintos de los alimentos para animales de compañía que la contengan II. Información sanitaria II.a. Número de referencia del certificado II.b. (2) bien [no están destinados a la alimentación de animales de granja distintos de los animales de peletería.] (2) (6)o [están destinados a la producción de piensos para animales de granja no rumiantes, distintos de los animales de peletería, y el expedidor se ha comprometido a garantizar que el puesto de inspección fronterizo de entrada en la Unión Europea recibirá los resultados de los análisis efectuados de conformidad con los métodos expuestos en el anexo VI del Reglamento (CE) n.o 152/2009 de la Comisión (7).] Notas Parte I: — Casilla I.6: Persona responsable de la partida en la Unión Europea: esta casilla debe cumplimentarse únicamente si se trata de un certificado de mercancía en tránsito por la Unión Europea; puede cumplimentarse si el certificado se refiere a una mercancía que vaya a ser importada en la Unión Europea. — Casilla I.12: Lugar de destino: esta casilla debe rellenarse únicamente si se trata del certificado de una mercancía en tránsito. los productos en tránsito solo pueden almacenarse en zonas francas, depósitos francos y depósitos aduaneros. — Casilla I.15: número de matrícula (vagones o contenedores de ferrocarril y camiones), número de vuelo (avión) o nombre (buque); deberá aportarse la información si se descarga y vuelve a cargar. — Casilla I.19: Indicar el código SA apropiado: 05.11, 23.01 o 23.09. — Casilla I.25: uso técnico: cualquier otro distinto de la alimentación para animales de granja, distintos de los animales de peletería, y la producción o la fabricación de alimentos para animales de compañía. — Casillas I.26 y I.27: cumplimentar según se trate de un certificado de tránsito o de importación. — Casilla I.28: especie: insectos, indicar el nombre científico. Parte II: (1a) DO L 300 de 14.11.2009, p. 1. (1b) DO L 54 de 26.2.2011, p. 1. (2) Táchese lo que no proceda. (3) Donde: n = número de muestras por analizar; m = valor umbral del número de bacterias; el resultado se considera satisfactorio si el número de bacterias en todas las muestras no es superior a m; M = valor máximo del número de bacterias; el resultado se considera insatisfactorio si el número de bacterias en una o más muestras es igual o superior a M; y c = número de muestras en las cuales el recuento de bacterias puede situarse entre m y M; la muestra sigue considerándose aceptable si el recuento de bacterias de las demás muestras es igual o inferior a m. (4) DO L 147 de 31.5.2001, p. 1. (5) DO L 172 de 30.6.2007, p. 84.  Texto de la imagen
Texto de la imagen
PAÍS Proteína animal transformada derivada de insectos de granja no destinada al consumo humano, incluidas las mezclas y los productos distintos de los alimentos para animales de compañía que la contengan II. Información sanitaria II.a. Número de referencia del certificado II.b. (6) La persona responsable de la partida a que se hace referencia en la casilla I.6 debe garantizar que, en caso de que la proteína animal transformada o el producto descrito en el presente certificado sanitario vaya a utilizarse para producir piensos para animales de granja no rumiantes, distintos de los animales de peletería, la partida debe analizarse, de conformidad con los métodos establecidos en el anexo VI del Reglamento (CE) n.o 152/2009, a fin de verificar la ausencia de componentes de origen animal no autorizados. La información sobre el resultado de ese análisis debe adjuntarse al presente certificado sanitario al presentar la partida a un puesto de inspección fronterizo de la UE. (7) DO L 54 de 26.2.2009, p. 1. — El color de la tinta de la firma y del sello debe ser diferente del de los caracteres impresos. — Nota para la persona responsable de la partida en la Unión Europea: el presente certificado se expide únicamente a efectos veterinarios y debe acompañar a la partida hasta el puesto de inspección fronterizo. Veterinario o inspector oficial Nombre y apellidos (en mayúsculas): Cualificación y cargo: Fecha: Firma: Sello: CAPÍTULO 2, LETRA A Certificado sanitario de leche, productos lácteos y productos derivados de la leche no destinados al consumo humano que se enviarán a la Unión Europea o transitarán por ella (2) 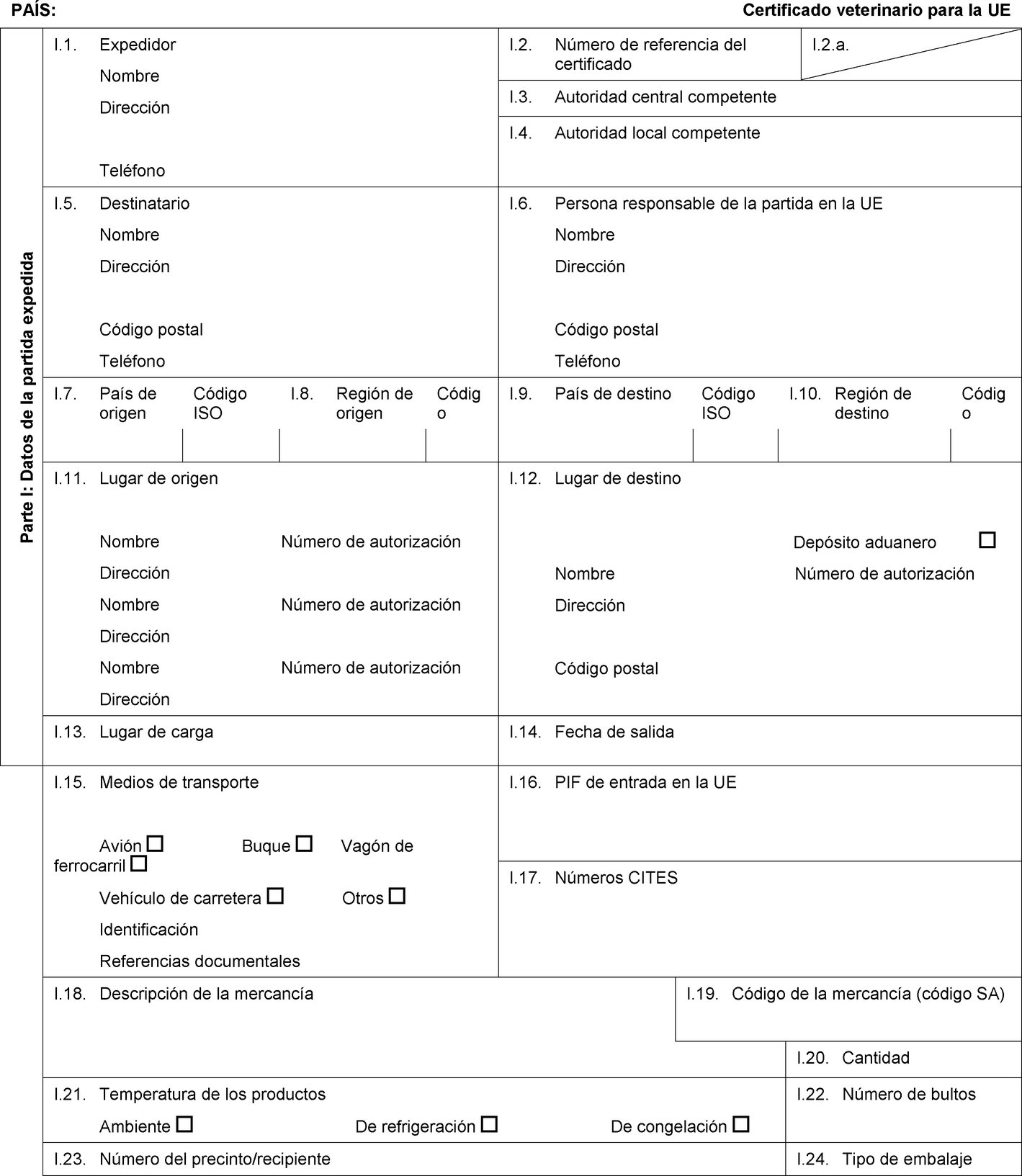 Texto de la imagen
Texto de la imagen
PAÍS: Certificado veterinario para la UE Parte I: Datos de la partida expedida I.1. Expedidor Nombre Dirección Teléfono I.2. Número de referencia del certificado I.2.a. I.3. Autoridad central competente I.4. Autoridad local competente I.5. Destinatario Nombre Dirección Código postal Teléfono I.6. Persona responsable de la partida en la UE Nombre Dirección Código postal Teléfono I.7. País de origen Código ISO I.8. Región de origen Código I.9. País de destino Código ISO I.10. Región de destino Código I.11. Lugar de origen Nombre Número de autorización Dirección Nombre Número de autorización Dirección Nombre Número de autorización Dirección I.12. Lugar de destino Depósito aduanero Nombre Número de autorización Dirección Código postal I.13. Lugar de carga I.14. Fecha de salida I.15. Medios de transporte Avión Buque Vagón de ferrocarril Vehículo de carretera Otros Identificación Referencias documentales I.16. PIF de entrada en la UE I.17. Números CITES I.18. Descripción de la mercancía I.19. Código de la mercancía (código SA) I.20. Cantidad I.21. Temperatura de los productos Ambiente De refrigeración De congelación I.22. Número de bultos I.23. Número del precinto/recipiente I.24. Tipo de embalaje  Texto de la imagen
Texto de la imagen
I.25. Mercancías certificadas para: Alimentación animal Proceso adicional Producción de alimentos para animales de compañía Uso técnico I.26. Para tránsito por la UE hacia un tercer país Tercer país Código ISO I.27. Para importación o admisión en la UE I.28. Identificación de las mercancías Número de autorización de los establecimientos Especie (nombre científico) Fábrica Peso neto Número de lote  Texto de la imagen
Texto de la imagen
PAÍS Leche, productos lácteos y productos derivados de la leche no destinados al consumo humano II. Información sanitaria II.a. Número de referencia del certificado II.b. El veterinario oficial abajo firmante declara haber leído y comprendido el Reglamento (CE) n.o 1069/2009 del Parlamento Europeo y del Consejo (1a), y en particular su artículo 10, y el Reglamento (UE) n.o 142/2011 de la Comisión (1b), y en particular la sección 4 del capítulo II de su anexo X y el capítulo I de su anexo XIV, y certifica que la leche (2), los productos lácteos (2) y los derivados de la leche (2) mencionados en la casilla I.28 cumplen las condiciones siguientes: II.1. han sido producidos y derivados en (indicar el país exportador) (3), (indicar la región) (3), que figura en la parte I del anexo II del Reglamento (UE) n.o 605/2010 de la Comisión y que ha estado indemne de fiebre aftosa y peste bovina al menos los 12 meses previos a la fecha de exportación y durante ese período no ha practicado vacunaciones contra la peste bovina; II.2. han sido producidos a partir de leche cruda de animales que, cuando se produjo el ordeño, no presentaban signos clínicos de ninguna enfermedad transmisible a través de la leche a personas o animales, y que han permanecido durante un mínimo de 30 días antes de la producción en explotaciones que no eran objeto de ninguna restricción oficial por fiebre aftosa o peste bovina; II.3. se trata de leche o productos lácteos que: (2) bien [han sido sometidos a uno o varios de los tratamientos o combinaciones de estos descritos en el punto II.4;] (2) o [constan de lactosuero que va a suministrarse a animales de especies sensibles a la fiebre aftosa y dicho lactosuero se ha obtenido de leche sometida a uno de los tratamientos descritos en el punto II.4, y: (2) bien [el lactosuero se ha recogido como mínimo 16 horas después de la coagulación y tiene un pH inferior a 6;] (2) (5) o [el lactosuero se ha producido como mínimo 21 días antes del envío y durante ese período no se ha detectado caso alguno de fiebre aftosa en el país exportador;] (2) (5) o [el lactosuero ha sido producido el … de … de …… y, dada la duración prevista del transporte, dicha fecha es, como mínimo, 21 días anterior a la presentación de la partida en un puesto de inspección fronterizo de la Unión Europea;]] II.4. han sido sometidos a uno de los tratamientos siguientes: (2) bien [una pasteurización breve a alta temperatura, a 72 °C durante al menos 15 segundos, o una pasteurización equivalente que dé lugar a una reacción negativa en la prueba de la fosfatasa en leche de vaca, en combinación con: (2) bien [una segunda pasteurización breve a alta temperatura, a 72 °C durante al menos 15 segundos, o una pasteurización equivalente que dé lugar a una reacción negativa en la prueba de la fosfatasa en leche de vaca;] (2) o [un procedimiento de desecado posterior combinado con calentamiento adicional a un mínimo de 72 °C en el caso de la leche para pienso;] (2) o [un proceso posterior que permita reducir el pH a un nivel inferior a 6 y mantener ese nivel durante al menos una hora;] (2) (5) o [la condición de que la leche o los productos lácteos hayan sido producidos un mínimo de 21 días antes de la fecha de envío y durante dicho período no se hayan detectado casos de fiebre aftosa en el país exportador;] (2) (5) o [la leche o los productos lácteos han sido producidos el … de … de …… (indicar la fecha) y, dada la duración prevista del transporte, dicha fecha es, como mínimo, 21 días anterior a la de presentación de la partida en un puesto de inspección fronterizo de la Unión Europea;] (2) o [esterilización a un nivel mínimo de F03;]] Parte II: Certificación  Texto de la imagen
Texto de la imagen
PAÍS Leche, productos lácteos y productos derivados de la leche no destinados al consumo humano II. Información sanitaria II.a. Número de referencia del certificado II.b. (2) o [un tratamiento a temperatura ultraalta, a 132 °C durante al menos un segundo en combinación con: (2) bien [un procedimiento de desecado posterior combinado con calentamiento adicional a un mínimo de 72 °C en el caso de la leche para pienso;] (2) o [un proceso posterior que permita reducir el pH a un nivel inferior a 6 y mantener ese nivel durante al menos una hora;] (2) (5) o [la condición de que la leche o los productos lácteos hayan sido producidos un mínimo de 21 días antes de la fecha de envío y durante dicho período no se hayan detectado casos de fiebre aftosa en el país exportador;] (2) (5) o [la leche o los productos lácteos han sido producidos el de de (indicar la fecha) y, dada la duración prevista del transporte, dicha fecha es, como mínimo, 21 días anterior a la de presentación de la partida en un puesto de inspección fronterizo de la Unión Europea;] II.5. se han tomado las precauciones oportunas para que la leche, los productos lácteos o los productos derivados de la leche no se contaminaran después del tratamiento; II.6. la leche, los productos lácteos o los productos derivados de la leche se han envasado: (2) bien [en envases nuevos;] (2) o [en contenedores a granel desinfectados antes de proceder a la carga con un producto autorizado por las autoridades competentes;] y los contenedores están marcados para indicar la naturaleza de la leche, los productos lácteos o los productos derivados de la leche y llevan etiquetas que indican que el producto es de la categoría 3 y que no está destinado al consumo humano; II.7. la leche, los productos lácteos y los derivados de la leche descritos: (2) bien [no contienen leche ni productos lácteos de origen ovino o caprino, o no están destinados a la alimentación de animales de granja distintos de los animales de peletería.] (2) o [contienen leche o productos lácteos de origen ovino o caprino y están destinados a la alimentación de animales de granja distintos de los animales de peletería; la leche o productos lácteos: a) provienen de ovinos y caprinos que han permanecido continuamente desde su nacimiento en un país donde se cumplen las siguientes condiciones: i) la tembladera clásica es de notificación obligatoria, ii) existe un sistema de concienciación, vigilancia y seguimiento de la tembladera clásica, iii) se aplican restricciones oficiales a las explotaciones de ovinos o caprinos en caso de sospecha de EET o de confirmación de tembladera clásica, iv) se matan y se destruyen los ovinos y caprinos aquejados de tembladera clásica, v) se ha prohibido alimentar a ovinos y caprinos con harina de carne y huesos o chicharrones, tal como se definen en el Código Sanitario para los Animales Terrestres de la Organización Mundial de Sanidad Animal (OIE), derivados de rumiantes, y la prohibición se ha aplicado de forma efectiva en todo el país durante al menos los 7 años precedentes; b) provienen de explotaciones donde no se han impuesto restricciones oficiales debido a una sospecha de EET;  Texto de la imagen
Texto de la imagen
PAÍS Leche, productos lácteos y productos derivados de la leche no destinados al consumo humano II. Información sanitaria II.a. Número de referencia del certificado II.b. c) provienen de explotaciones en las que no se ha diagnosticado ningún caso de tembladera clásica en los 7 años precedentes, o en las que, tras la confirmación de un caso de tembladera clásica: (2) bien [se han matado y destruido, o se han sacrificado, todos los ovinos y caprinos de la explotación, excepto los machos reproductores de genotipo ARR/ARR, las hembras reproductoras que presentan al menos un alelo ARR y ningún alelo VRQ y otros ovinos que presentan al menos un alelo ARR;] (2) o [se han matado y destruido todos los animales con tembladera clásica confirmada, y la explotación se ha sometido durante dos años, como mínimo, desde la fecha de confirmación del último caso de tembladera clásica, a una vigilancia intensificada de las EET, habiendo dado negativo las pruebas de EET realizadas con arreglo a los métodos de laboratorio que figuran en el anexo X, capítulo C, punto 3.2, del Reglamento (CE) n.o 999/2001 (6) a que se ha sometido a los siguientes animales mayores de 18 meses, excepto los ovinos de genotipo ARR/ARR: — animales que han sido sacrificados para el consumo humano; y — animales que han muerto o a los que se ha dado muerte en la explotación, pero no en el marco de una campaña de erradicación de la enfermedad.]] Notas Parte I: — Casilla I.6: Persona responsable de la partida en la Unión Europea: esta casilla debe cumplimentarse únicamente si se trata de un certificado de mercancía en tránsito por la Unión Europea; puede cumplimentarse si el certificado se refiere a una mercancía que vaya a ser importada en la Unión Europea. — Casilla I.12: Lugar de destino: esta casilla debe rellenarse únicamente si se trata de un certificado de mercancía en tránsito. — Casilla I.15: indicar la matrícula (vagones o contenedores de ferrocarril y camiones), el número de vuelo (avión) o el nombre (buque). En caso de que la mercancía se descargue y se vuelva a cargar, el expedidor debe informar al puesto de inspección fronterizo de entrada en la Unión Europea. — Casilla I.19: utilizar el código apropiado del Sistema Armonizado (SA) de la Organización Mundial de Aduanas: 04.01, 04.02, 04.03, 04.04, 23.09.10, 23.09.90, 35.01, 35.02 o 35.04. — Casilla I.23: si se utilizan contenedores a granel, indicar su número y el número del precinto (si procede). — Casilla I.25: uso técnico: cualquier otro distinto de la alimentación para animales de granja, distintos de los animales de peletería, y la producción o la fabricación de alimentos para animales de compañía. — Casillas I.26 y I.27: cumplimentar según se trate de un certificado de tránsito o de importación. — Casilla I.28: «Fábrica»: indicar el número de registro del establecimiento de tratamiento o transformación. Parte II: (1a) DO L 300 de 14.11.2009, p. 1. (1b) DO L 54 de 26.2.2011, p. 1.  Texto de la imagen
Texto de la imagen
PAÍS Leche, productos lácteos y productos derivados de la leche no destinados al consumo humano II. Información sanitaria II.a. Número de referencia del certificado II.b. (2) Táchese lo que no proceda. (3) Rellénese si la autorización de importación en la Unión Europea o de tránsito por ella se limita a algunas regiones del tercer país en cuestión. (4) DO L 175 de 10.7.2010, p. 1. (5) Esta condición solo se aplica a los terceros países que figuran en la columna A del anexo I del Reglamento (UE) n.o 605/2010. (6) DO L 147 de 31.5.2001, p. 1. — El color de la tinta de la firma y del sello debe ser diferente del de los caracteres impresos. — Nota para la persona responsable de la partida en la Unión Europea: el presente certificado se expide únicamente a efectos veterinarios y debe acompañar a la partida hasta el puesto de inspección fronterizo. Veterinario o inspector oficial Nombre y apellidos (en mayúsculas): Cualificación y cargo: Fecha: Firma: Sello: CAPÍTULO 2, LETRA B Certificado sanitario de calostro y productos a base de calostro producidos a partir de animales bovinos no destinados al consumo humano que se enviarán a la Unión Europea o transitarán por ella (2)  Texto de la imagen
Texto de la imagen
PAÍS: Certificado veterinario para la UE Parte I: Datos de la partida expedida I.1. Expedidor Nombre Dirección Teléfono I.2. Número de referencia del certificado I.2.a. I.3. Autoridad central competente I.4. Autoridad local competente I.5. Destinatario Nombre Dirección Código postal Teléfono I.6. Persona responsable de la partida en la UE Nombre Dirección Código postal Teléfono I.7. País de origen Código ISO I.8. Región de origen Código I.9. País de destino Código ISO I.10. Región de destino Código I.11. Lugar de origen Nombre Número de autorización Dirección Nombre Número de autorización Dirección Nombre Número de autorización Dirección I.12. Lugar de destino Depósito aduanero Nombre Número de autorización Dirección Código postal I.13. Lugar de carga I.14. Fecha de salida I.15. Medios de transporte Avión Buque Vagón de ferrocarril Vehículo de carretera Otros Identificación Referencias documentales I.16. PIF de entrada en la UE I.17. Números CITES I.18. Descripción de la mercancía I.19. Código de la mercancía (código SA) I.20. Cantidad I.21. Temperatura de los productos Ambiente De refrigeración De congelación I.22. Número de bultos I.23. Número del precinto/recipiente I.24. Tipo de embalaje  Texto de la imagen
Texto de la imagen
I.25. Mercancías certificadas para: Alimentación animal Proceso adicional Producción de alimentos para animales de compañía Uso técnico I.26. Para tránsito por la UE hacia un tercer país Tercer país Código ISO I.27. Para importación o admisión en la UE I.28. Identificación de las mercancías Número de autorización de los establecimientos Especie (nombre científico) Fábrica Peso neto Número de lote  Texto de la imagen
Texto de la imagen
PAÍS Calostro y productos a base de calostro producidos a partir de animales bovinos no destinados al consumo humano II. Información sanitaria II.a. Número de referencia del certificado II.b. El veterinario oficial abajo firmante declara haber leído y comprendido el Reglamento (CE) n.o 1069/2009 del Parlamento Europeo y del Consejo (1a), y en particular su artículo 10, y el Reglamento (UE) n.o 142/2011 de la Comisión (1b), y en particular la sección 4 del capítulo II de su anexo X y el capítulo I de su anexo XIV, y certifica que el calostro (2) o los productos a base de calostro (2) mencionados en la casilla I.28 cumplen las condiciones siguientes: II.1. han sido producidos y derivados en (indicar el país exportador) (3), (indicar la región) (3), que figura en el anexo I del Reglamento (UE) n.o 605/2010 de la Comisión (4), y que ha estado indemne de fiebre aftosa y peste bovina al menos los 12 meses previos a la fecha de exportación y durante ese período no ha practicado vacunaciones contra la peste bovina; II.2. han sido producidos a partir de calostro de animales que, cuando se produjo el ordeño, no presentaban signos clínicos de ninguna enfermedad transmisible a través del calostro a personas o animales, y que han permanecido durante un mínimo de 30 días antes de la fecha de producción en explotaciones que no eran objeto de ninguna restricción oficial por fiebre aftosa o peste bovina; II.3. se trata de calostro o productos a base de calostro de animales bovinos que han sido sometidos a una pasteurización breve a alta temperatura, a 72 °C durante al menos 15 segundos, o una pasteurización equivalente que dé lugar a una reacción negativa en la prueba de la fosfatasa en calostro de vaca, en combinación con: (2) (5) bien [la condición de que el calostro o los productos a base de calostro hayan sido producidos como mínimo en los 21 días anteriores a la fecha de envío y durante dicho período no se haya detectado caso alguno de fiebre aftosa en el país exportador;] (2) (5) o [la condición de que el calostro o los productos a base de calostro hayan sido producidosel … de … de … (indicar la fecha) y, dada la duración prevista del transporte, dicha fecha es, como mínimo, 21 días anterior a la presentación del envío en un puesto de inspección fronterizo de la Unión Europea;] y hayan sido obtenidos de animales sometidos a inspecciones veterinarias periódicas para garantizar que proceden de explotaciones en las que todos los rebaños bovinos: (2) (5) bien han sido reconocidos oficialmente indemnes de tuberculosis y brucelosis (6);] (2) (5) o [no tienen ninguna restricción con arreglo a la legislación nacional del tercer país de origen por lo que se refiere a la erradicación de la tuberculosis y la brucelosis;] y (2) (5) bien [están reconocidos como oficialmente indemnes de leucosis bovina enzoótica (6);] (2) (5) o [están incluidos en un sistema oficial de lucha contra la leucosis bovina enzoótica y en los que no hay signos clínicos ni resultados de pruebas de laboratorio que indiquen la existencia de esta enfermedad durante los últimos dos años;] II.4. se han tomado las precauciones oportunas para evitar la contaminación del calostro o los productos a base de calostro después del tratamiento; II.5. el calostro o los productos a base de calostro se han envasado: (2) bien [en envases nuevos;] (2) o [en contenedores a granel desinfectados antes de proceder a la carga con un producto autorizado por las autoridades competentes;] y los recipientes o contenedores están marcados para indicar la naturaleza del calostro o producto a base de calostro y llevan etiquetas que indican que el producto es de la categoría 3 y que no está destinado al consumo humano; II.6. [no contienen leche ni productos lácteos de origen ovino o caprino.] Notas Parte I: — Casilla I.6: Persona responsable de la partida en la Unión Europea: esta casilla debe cumplimentarse únicamente si se trata de un certificado de mercancía en tránsito por la Unión Europea; puede cumplimentarse si el certificado se refiere a una mercancía que vaya a ser importada en la Unión Europea. Parte II: Certificación  Texto de la imagen
Texto de la imagen
PAÍS Calostro y productos a base de calostro producidos a partir de animales bovinos no destinados al consumo humano II. Información sanitaria II.a. Número de referencia del certificado II.b. — Casilla I.12: Lugar de destino: esta casilla debe rellenarse únicamente si se trata de un certificado de mercancía en tránsito. — Casilla I.15: indicar la matrícula (vagones o contenedores de ferrocarril y camiones), el número de vuelo (avión) o el nombre (buque). En caso de que la mercancía se descargue y se vuelva a cargar en la Unión Europea, el expedidor debe informar al puesto de inspección fronterizo de entrada en la Unión Europea. — Casilla I.19: utilizar el código apropiado del Sistema Armonizado (SA) de la Organización Mundial de Aduanas: 04.04.90; 23.09.10, 23.09.90, 35.01, 35.02 o 35.04. — Casilla I.23: si se utilizan contenedores a granel, indicar su número y el número del precinto (si procede). — Casilla I.25: uso técnico: cualquier otro distinto de la alimentación para animales de granja, distintos de los animales de peletería, y la producción o la fabricación de alimentos para animales de compañía. — Casillas I.26 y I.27: cumplimentar según se trate de un certificado de tránsito o de importación. — Casilla I.28: «Fábrica»: indicar el número de registro del establecimiento de tratamiento o transformación. Parte II: (1a) DO L 300 de 14.11.2009, p. 1. (1b) DO L 54 de 26.2.2011, p. 1. (2) Táchese lo que no proceda. (3) Rellénese si la autorización de introducción en la Unión Europea se limita a algunas regiones del tercer país en cuestión. (4) DO L 175 de 10.7.2010, p. 1. (5) Esta condición solo se aplica a los terceros países autorizados en la columna A del anexo I del Reglamento (UE) n.o 605/2010 de la Comisión (DO L 175 de 10.7.2010, p. 1). (6) Rebaño oficialmente indemne de tuberculosis y de brucelosis, tal como se establece en el anexo A de la Directiva 64/432/CEE del Consejo (DO 121 de 29.7.1964. P. 1977/64), y rebaño oficialmente indemne de leucosis bovina enzoótica, tal como se establece en el capítulo I del anexo D de dicha Directiva. — El color de la tinta del sello y de la firma deberá ser diferente del de los caracteres impresos. — Nota al importador: el presente certificado se expide únicamente a efectos veterinarios y debe acompañar al envío hasta el puesto de inspección fronterizo de la Unión Europea. Veterinario o inspector oficial Nombre y apellidos (en mayúsculas): Cualificación y cargo: Fecha: Firma: Sello: CAPÍTULO 3, LETRA A Certificado sanitario de alimentos en conserva para animales de compañía, que se enviarán a la Unión Europea o transitarán por ella (2) 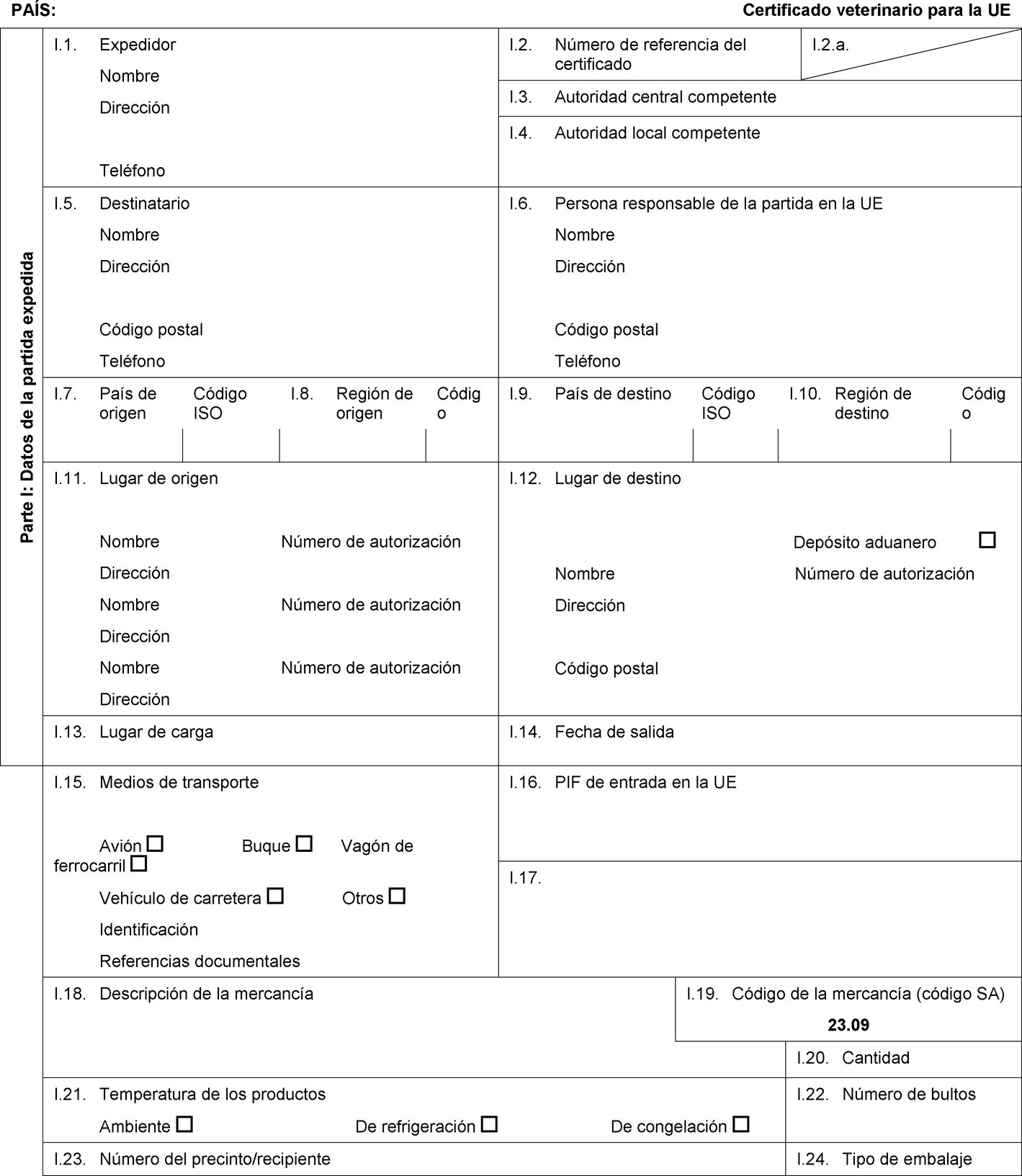 Texto de la imagen
Texto de la imagen
PAÍS: Certificado veterinario para la UE Parte I: Datos de la partida expedida I.1. Expedidor Nombre Dirección Teléfono I.2. Número de referencia del certificado I.2.a. I.3. Autoridad central competente I.4. Autoridad local competente I.5. Destinatario Nombre Dirección Código postal Teléfono I.6. Persona responsable de la partida en la UE Nombre Dirección Código postal Teléfono I.7. País de origen Código ISO I.8. Región de origen Código I.9. País de destino Código ISO I.10. Región de destino Código I.11. Lugar de origen Nombre Número de autorización Dirección Nombre Número de autorización Dirección Nombre Número de autorización Dirección I.12. Lugar de destino Depósito aduanero Nombre Número de autorización Dirección Código postal I.13. Lugar de carga I.14. Fecha de salida I.15. Medios de transporte Avión Buque Vagón de ferrocarril Vehículo de carretera Otros Identificación Referencias documentales I.16. PIF de entrada en la UE I.17. I.18. Descripción de la mercancía I.19. Código de la mercancía (código SA) 23.09 I.20. Cantidad I.21. Temperatura de los productos Ambiente De refrigeración De congelación I.22. Número de bultos I.23. Número del precinto/recipiente I.24. Tipo de embalaje  Texto de la imagen
Texto de la imagen
I.25. Mercancías certificadas para: Alimentos para animales de compañía Uso técnico I.26. Para tránsito por la UE hacia un tercer país Tercer país Código ISO I.27. Para importación o admisión en la UE I.28. Identificación de las mercancías Número de autorización de los establecimientos Especie (nombre científico) Fábrica Peso neto Número de lote  Texto de la imagen
Texto de la imagen
PAÍS Alimentos en conserva para animales de compañía II. Información sanitaria II.a. Número de referencia del certificado II.b. El veterinario oficial abajo firmante declara haber leído y comprendido el Reglamento (CE) n.o 1069/2009 del Parlamento Europeo y del Consejo (1a), y en particular sus artículos 8 y 10, y el Reglamento (UE) n.o 142/2011 de la Comisión (1b), y, en particular, el capítulo II de su anexo XIII, y el capítulo II de su anexo XIV, y certifica que los alimentos para animales de compañía descritos: II.1. han sido elaborados y almacenados en un establecimiento o planta de transformación autorizados y supervisados por la autoridad competente con arreglo al artículo 24 del Reglamento (CE) n.o 1069/2009; II.2. han sido elaborados exclusivamente a partir de los subproductos animales siguientes: (2) bien [- las canales y partes de animales sacrificados, o los cuerpos o partes de animales matados, en el caso de animales de caza, que sean aptos para el consumo humano con arreglo a la legislación de la Unión pero no se destinen a ese fin por motivos comerciales;] (2) y/o [- las canales y las siguientes partes de animales sacrificados en un matadero y considerados aptos para el consumo humano a raíz de una inspección ante mortem o los cuerpos y las siguientes partes de animales de caza matados para el consumo humano de conformidad con la legislación de la Unión: i) las canales o los cuerpos y partes de animales declarados no aptos para el consumo humano de acuerdo con la legislación de la Unión pero que no muestren ningún signo de enfermedad transmisible a personas o animales; ii) las cabezas de aves de corral; iii) los cueros y pieles, incluidos los recortes y la piel dividida, los cuernos y los pies, incluidas las falanges y los huesos carpianos y metacarpianos, tarsianos y metatarsianos; iv) las cerdas; v) las plumas;] (2) y/o [- los subproductos animales de aves de corral y lagomorfos sacrificados en la explotación de conformidad con el artículo 1, apartado 3, letra d), del Reglamento (CE) n.o 853/2004 del Parlamento Europeo y del Consejo (2a), que no presentaban ningún signo de enfermedad transmisible a personas o animales;] (2) y/o [- sangre de animales que no presentaban ningún signo de enfermedad transmisible por la sangre a personas o animales, obtenida de animales que hayan sido sacrificados en un matadero después de haber sido considerados aptos para el sacrificio para el consumo humano a raíz de una inspección ante mortem de conformidad con la legislación de la Unión;] (2) y/o [- los subproductos animales generados en la elaboración de productos destinados al consumo humano, incluidos el hueso desgrasado, los chicharrones y los lodos de centrifugado o de separación resultantes de la elaboración de productos lácteos;] (2) y/o [- los productos de origen animal o los productos alimenticios que contengan productos de origen animal que ya no estén destinados al consumo humano por motivos comerciales, problemas de fabricación, defectos de envasado u otros defectos que no conlleven ningún riesgo para la salud pública o la salud animal;] (2) y/o [- los alimentos para animales de compañía y los piensos de origen animal, o los piensos que contengan subproductos animales o productos derivados que ya no estén destinados a la alimentación animal por motivos comerciales o problemas de fabricación, defectos de envasado u otros defectos que no conlleven ningún riesgo para la salud pública o la salud animal;] (2) y/o [- la sangre, la placenta, la lana, las plumas, el pelo, los cuernos, los recortes de cascos, uñas o pezuñas y la leche cruda de animales vivos que no presenten signos de enfermedad transmisible a través de esos productos a las personas o los animales;] (2) y/o [- los animales acuáticos y partes de los mismos, salvo los mamíferos marinos, que no muestren ningún signo de enfermedades transmisibles a las personas o los animales;] (2) y/o [- los subproductos de animales acuáticos procedentes de plantas o establecimientos que fabriquen productos para el consumo humano;] Parte II: Certificación  Texto de la imagen
Texto de la imagen
PAÍS Alimentos enlatados para animais de companhia II. Informação sanitária II.a. Número de referência do certificado II.b. (2) e/quer [- as seguintes matérias provenientes de animais que não apresentavam quaisquer sinais de doenças transmissíveis através dessas matérias aos seres humanos ou aos animais: i) conchas de moluscos com tecido mole ou carne, ii) os seguintes produtos provenientes de animais terrestres: — subprodutos de incubação, — ovos, — subprodutos de ovos, incluindo cascas de ovos, iii) pintos do dia abatidos por razões comerciais;] (2) e/quer [- subprodutos animais provenientes de invertebrados aquáticos ou terrestres, com exceção de espécies patogénicas para os seres humanos ou animais;] (2) e/quer [- animais e partes de animais das ordens Rodentia e Lagomorpha, com exceção de matérias de categoria 1, tal como referido no artigo 8.o, alínea a), subalíneas iii), iv) e v), do Regulamento (CE) n.o 1069/2009, e matérias de categoria 2, tal como referido no artigo 9.o, alíneas a) a g), do mesmo regulamento;] (2) e/quer [- matérias provenientes de animais tratados com determinadas substâncias proibidas nos termos da Diretiva 96/22/CE do Conselho (2b), sendo a importação das matérias autorizada em conformidade com o artigo 35.o, alínea a), subalínea ii), do Regulamento (CE) n.o 1069/2009.] II.3. Foram submetidos a um tratamento térmico que conduziu a um valor Fc igual ou superior a 3 em recipientes hermeticamente fechados. II.4. Foram analisados por amostragem aleatória de, pelo menos, cinco amostras de cada lote transformado, por meio de um método laboratorial de diagnóstico, a fim de assegurar um tratamento térmico adequado de toda a remessa, conforme previsto no ponto II.3. II.5. Foram objeto de todas as precauções necessárias para evitar a contaminação por agentes patogénicos após o tratamento. (2) [II.6. Os alimentos para animais de companhia descritos no presente certificado (2) quer [derivam de ruminantes que não bovinos, ovinos ou caprinos.] (2) quer [derivam de bovinos, ovinos ou caprinos e não contêm nem derivam de: (2) quer [matérias de origem bovina, ovina e caprina, exceto as provenientes de animais que nasceram e foram criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]] (2) quer [a) matérias de risco especificadas, tal como definidas no anexo V, ponto 1, do Regulamento (CE) n.o 999/2001 do Parlamento Europeu e do Conselho (3); b) carne separada mecanicamente obtida a partir de ossos de bovinos, ovinos ou caprinos, exceto se esses animais tiverem nascido, sido criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB, em conformidade com a Decisão 2007/453/CE da Comissão (4), em que não houve casos nativos de EEB; c) subprodutos animais ou produtos derivados obtidos de bovinos, ovinos ou caprinos que foram abatidos por laceração, após atordoamento, do tecido nervoso central através de um instrumento comprido de forma cilíndrica introduzido na cavidade craniana, ou através da injeção de gás na cavidade craniana, exceto no caso de animais nascidos, criados permanentemente e abatidos num país ou numa região classificado como apresentando um risco negligenciável de EEB em conformidade com a Decisão 2007/453/CE.]]]  Texto de la imagen
Texto de la imagen
PAÍS Alimentos en conserva para animales de compañía II. Información sanitaria II.a. Número de referencia del certificado II.b. Notas Parte I: — Casilla I.6: Persona responsable de la partida en la Unión Europea: esta casilla debe cumplimentarse únicamente si se trata de un certificado de mercancía en tránsito por la Unión Europea; puede cumplimentarse si el certificado se refiere a una mercancía que vaya a ser importada en la Unión Europea. — Casilla I.12: Lugar de destino: esta casilla debe rellenarse únicamente si se trata de un certificado de mercancía en tránsito. los productos en tránsito solo pueden almacenarse en zonas francas, depósitos francos y depósitos aduaneros. — Casilla I.15: número de matrícula (vagones o contenedores de ferrocarril y camiones), número de vuelo (avión) o nombre (buque); deberá aportarse la información si se descarga y vuelve a cargar en la Unión Europea. — Casilla I.23: si se utilizan contenedores a granel, indicar su número y el número del precinto (si procede). — Casilla I.25: uso técnico: cualquier otro distinto de la alimentación para animales de granja, distintos de los animales de peletería, y la producción o la fabricación de alimentos para animales de compañía. — Casillas I.26 y I.27: cumplimentar según se trate de un certificado de tránsito o de importación. — Casilla I.28: especie: elija una de las siguientes opciones: Aves, Ruminantia, Suidae, Mammalia distintos de Ruminantia o Suidae, Pesca, Mollusca, Crustacea, invertebrados distintos de Mollusca y Crustacea. Parte II: (1a) DO L 300 de 14.11.2009, p. 1. (1b) DO L 54 de 26.2.2011, p. 1. (2) Táchese lo que no proceda. (2a) DO L 139 de 30.4.2004, p. 55. (2b) DO L 125 de 23.5.1996, p. 3. (3) DO L 147 de 31.5.2001, p. 1. (4) DO L 172 de 30.6.2007, p. 84. — El color de la tinta de la firma y del sello debe ser diferente del de los caracteres impresos. — Nota para la persona responsable de la partida en la Unión Europea: el presente certificado se expide únicamente a efectos veterinarios y debe acompañar a la partida hasta el puesto de inspección fronterizo. Veterinario o inspector oficial Nombre y apellidos (en mayúsculas): Cualificación y cargo: Fecha: Firma: Sello: CAPÍTULO 3, LETRA B Certificado sanitario de alimentos transformados para animales de compañía, distintos de los alimentos en conserva, que se enviarán a la Unión Europea o transitarán por ella (2) 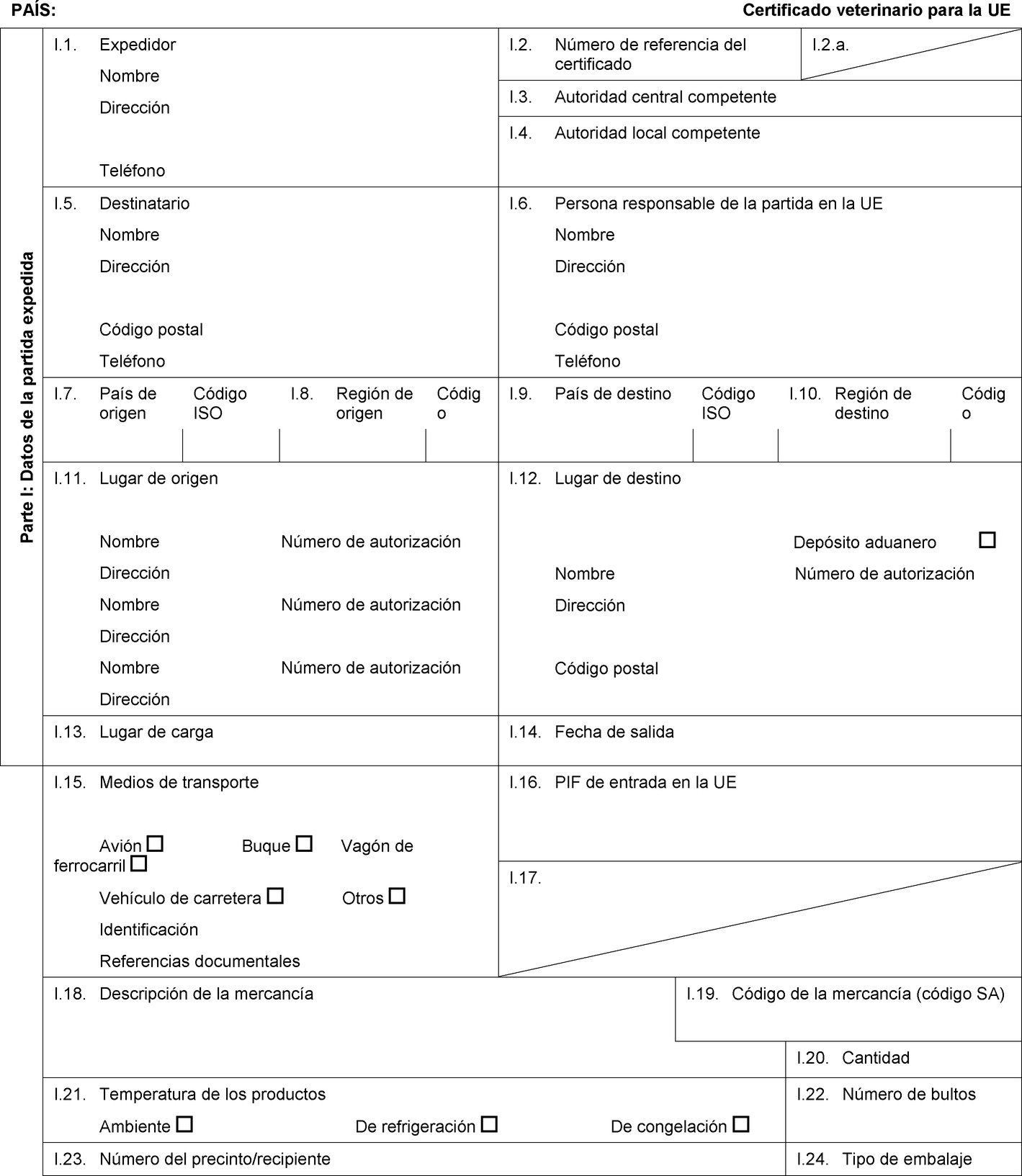 Texto de la imagen
Texto de la imagen
PAÍS: Certificado veterinario para la UE Parte I: Datos de la partida expedida I.1. Expedidor Nombre Dirección Teléfono I.2. Número de referencia del certificado I.2.a. I.3. Autoridad central competente I.4. Autoridad local competente I.5. Destinatario Nombre Dirección Código postal Teléfono I.6. Persona responsable de la partida en la UE Nombre Dirección Código postal Teléfono I.7. País de origen Código ISO I.8. Región de origen Código I.9. País de destino Código ISO I.10. Región de destino Código I.11. Lugar de origen Nombre Número de autorización Dirección Nombre Número de autorización Dirección Nombre Número de autorización Dirección I.12. Lugar de destino Depósito aduanero Nombre Número de autorización Dirección Código postal I.13. Lugar de carga I.14. Fecha de salida I.15. Medios de transporte Avión Buque Vagón de ferrocarril Vehículo de carretera Otros Identificación Referencias documentales I.16. PIF de entrada en la UE I.17. I.18. Descripción de la mercancía I.19. Código de la mercancía (código SA) I.20. Cantidad I.21. Temperatura de los productos Ambiente De refrigeración De congelación I.22. Número de bultos I.23. Número del precinto/recipiente I.24. Tipo de embalaje  Texto de la imagen
Texto de la imagen
I.25. Mercancías certificadas para: Alimentos para animales de compañía Uso técnico I.26. Para tránsito por la UE hacia un tercer país Tercer país Código ISO I.27. Para importación o admisión en la UE I.28. Identificación de las mercancías Número de autorización de los establecimientos Especie (nombre científico) Fábrica Peso neto Número de lote  Texto de la imagen
Texto de la imagen
PAÍS Alimentos transformados para animales de compañía distintos de los alimentos en conserva II. Información sanitaria II.a. Número de referencia del certificado II.b. El veterinario oficial abajo firmante declara haber leído y comprendido el Reglamento (CE) n.o 1069/2009 del Parlamento Europeo y del Consejo (1a), y en particular sus artículos 8 y 10, y el Reglamento (UE) n.o 142/2011 de la Comisión (1b), y, en particular, el capítulo II de su anexo XIII, y el capítulo II de su anexo XIV, y certifica que los alimentos para animales de compañía descritos: II.1. han sido elaborados y almacenados en una planta de transformación autorizada y supervisada por la autoridad competente con arreglo al artículo 24 del Reglamento (CE) n.o 1069/2009; II.2. han sido elaborados exclusivamente a partir de los subproductos animales siguientes: (2) bien [- las canales y partes de animales sacrificados, o los cuerpos o partes de animales matados, en el caso de animales de caza, que sean aptos para el consumo humano con arreglo a la legislación de la Unión pero no se destinen a ese fin por motivos comerciales;] (2) y/o [- las canales y las siguientes partes de animales sacrificados en un matadero y considerados aptos para el consumo humano a raíz de una inspección ante mortem o los cuerpos y las siguientes partes de animales de caza matados para el consumo humano de conformidad con la legislación de la Unión: i) las canales o los cuerpos y partes de animales declarados no aptos para el consumo humano de acuerdo con la legislación de la Unión pero que no muestren ningún signo de enfermedad transmisible a personas o animales; ii) las cabezas de aves de corral; iii) los cueros y pieles, incluidos los recortes y la piel dividida, los cuernos y los pies, incluidas las falanges y los huesos carpianos y metacarpianos, tarsianos y metatarsianos; iv) las cerdas; v) las plumas;] (2) y/o [- los subproductos animales de aves de corral y lagomorfos sacrificados en la explotación de conformidad con el artículo 1, apartado 3, letra d), del Reglamento (CE) n.o 853/2004 del Parlamento Europeo y del Consejo (2a), que no presentaban ningún signo de enfermedad transmisible a personas o animales;] (2) y/o [- sangre de animales que no presentaban ningún signo de enfermedad transmisible por la sangre a personas o animales, obtenida de animales que hayan sido sacrificados en un matadero después de haber sido considerados aptos para el sacrificio para el consumo humano a raíz de una inspección ante mortem de conformidad con la legislación de la Unión;] (2) y/o [- los subproductos animales generados en la elaboración de productos destinados al consumo humano, incluidos el hueso desgrasado, los chicharrones y los lodos de centrifugado o de separación resultantes de la elaboración de productos lácteos;] (2) y/o [- los productos de origen animal o los productos alimenticios que contengan productos de origen animal que ya no estén destinados al consumo humano por motivos comerciales, problemas de fabricación, defectos de envasado u otros defectos que no conlleven ningún riesgo para la salud pública o la salud animal;] (2) y/o [- los alimentos para animales de compañía y los piensos de origen animal, o los piensos que contengan subproductos animales o productos derivados que ya no estén destinados a la alimentación animal por motivos comerciales o problemas de fabricación, defectos de envasado u otros defectos que no conlleven ningún riesgo para la salud pública o la salud animal;] (2) y/o [- la sangre, la placenta, la lana, las plumas, el pelo, los cuernos, los recortes de cascos, uñas o pezuñas y la leche cruda de animales vivos que no presenten signos de enfermedad transmisible a través de esos productos a las personas o los animales;] (2) y/o [- los animales acuáticos y partes de los mismos, salvo los mamíferos marinos, que no muestren ningún signo de enfermedades transmisibles a las personas o los animales;] Parte II: Certificación  Texto de la imagen
Texto de la imagen
PAÍS Alimentos transformados para animales de compañía distintos de los alimentos en conserva II. Información sanitaria II.a. Número de referencia del certificado II.b. (2) y/o [- los subproductos de animales acuáticos procedentes de plantas o establecimientos que fabriquen productos para el consumo humano;] (2) y/o [- el siguiente material de animales que no presenten ningún signo de una enfermedad transmisible a las personas o los animales a través de dicho material: i) las conchas de moluscos despojadas del tejido blando o la carne; ii) los siguientes productos de animales terrestres: — los subproductos de la incubación, — los huevos, — los subproductos de los huevos, incluidas las cáscaras; iii) los pollitos de un día sacrificados por razones comerciales;] (2) y/o [- los subproductos animales de invertebrados acuáticos o terrestres, salvo los de especies patógenas para personas o animales;] (2) y/o [- animales y sus partes de los órdenes zoológicos de los roedores y los lagomorfos, salvo el material de la categoría 1 al que se refiere el artículo 8, letra a), incisos iii), iv) y v), y el material de la categoría 2 al que se refiere el artículo 9, letras a) a g), del Reglamento (CE) n.o 1069/2009;] (2) y/o [- material de animales que han sido tratados con determinadas sustancias prohibidas por la Directiva 96/22/CE del Consejo (2b), y cuya importación está permitida de conformidad con el artículo 35, letra a), inciso ii), del Reglamento (CE) n.o 1069/2009;] II.3. (2) bien [se han sometido a un tratamiento térmico a una temperatura de al menos 90 °C en toda su masa;] (2) o [se han elaborado exclusivamente, por lo que respecta a los ingredientes de origen animal, con productos que: a) en el caso de los subproductos animales o los productos derivados de carne o los productos cárnicos, se sometieron a un tratamiento térmico de al menos 90 °C en toda su masa; b) en el caso de la leche y de los productos lácteos: i) si proceden de los terceros países o las partes de terceros países que figuran en la columna B del anexo I del Reglamento (UE) n.o 605/2010 (3) de la Comisión, han sido sometidos a un tratamiento de pasteurización suficiente para producir una reacción negativa a la prueba de la fosfatasa, ii) tienen un pH reducido a un valor inferior a 6, proceden de los terceros países o las partes de terceros países que figuran en la columna C del anexo I del Reglamento (UE) n.o 605/2010 y han sido sometidos a un tratamiento de pasteurización suficiente para producir una reacción negativa a la prueba de la fosfatasa, iii) si proceden de los terceros países o las partes de terceros países que figuran en la columna C del anexo I del Reglamento (UE) n.o 605/2010, han sido sometidos a un tratamiento de esterilización o a un tratamiento térmico doble, y cada uno de esos tratamientos es suficiente para producir por sí solo una reacción negativa a la prueba de la fosfatasa, iv) si proceden de los terceros países o las partes de terceros países que figuran en la columna C del anexo I del Reglamento (UE) n.o 605/2010 y se ha producido un brote de fiebre aftosa en los 12 meses previos o se ha llevado a cabo una vacunación contra la fiebre aftosa en los 12 meses previos, se han sometido: bien — a un proceso de esterilización que haya permitido alcanzar un valor Fc igual o superior a 3, o — a un tratamiento térmico inicial con efecto de calentamiento mínimo de 72 °C durante al menos 15 segundos, suficiente para producir una reacción negativa a la prueba de la fosfatasa, seguido de:  Texto de la imagen
Texto de la imagen
PAÍS Alimentos transformados para animales de compañía distintos de los alimentos en conserva II. Información sanitaria II.a. Número de referencia del certificado II.b. bien — un segundo tratamiento térmico con un efecto de calentamiento por lo menos igual al alcanzado con el primero, que sea suficiente para producir una reacción negativa a la prueba de la fosfatasa, seguido, en el caso de la leche en polvo o de los productos lácteos en polvo, de un procedimiento de desecado, o — un procedimiento de acidificación que permita que el pH se mantenga por debajo de 6 durante al menos una hora; c) en el caso de la gelatina, se ha producido mediante un procedimiento que garantiza que el material de la categoría 3 sin transformar se somete a un tratamiento con ácidos o bases, seguido de uno o más aclarados y el consiguiente ajuste del pH y, a continuación, una o varias extracciones mediante calentamiento, seguidas de un proceso de purificación mediante filtración y esterilización; d) en el caso de proteínas hidrolizadas obtenidas mediante un procedimiento de producción que incluya medidas apropiadas para minimizar la contaminación del material crudo de la categoría 3 y, en el caso de las proteínas hidrolizadas derivadas total o parcialmente de pieles de rumiantes producidas en una planta de transformación dedicada exclusivamente a la producción de proteínas hidrolizadas, se han utilizado únicamente materiales con un peso molecular inferior a 10 000 dalton y un proceso que implica el preparado de materiales crudos de la categoría 3 mediante encurtido, encalado y lavado intensivo, seguido de: i) la exposición del material a un pH superior a 11 durante más de tres horas a una temperatura superior a 80 °C, seguida de tratamiento térmico a más de 140 °C durante 30 minutos a más de 3,6 bares, o ii) la exposición del material a un pH comprendido entre 1 y 2 y, a continuación, a un pH superior a 11, seguida de un tratamiento térmico a 140 °C durante 30 minutos a 3 bares; e) en el caso de los ovoproductos, han sido sometidos a cualquiera de los métodos de tratamiento 1 a 5 o 7, a los que hace referencia el capítulo III del anexo IV del Reglamento (UE) n.o 142/2011; o han sido tratados de conformidad con lo dispuesto en la sección X, capítulo II, del anexo III del Reglamento (CE) no 853/2004 del Parlamento Europeo, del Consejo; f) en el caso del colágeno, se ha sometido a un procedimiento que garantiza que el material de la categoría 3 sin transformar se somete a un tratamiento con lavado, ajuste del pH con ácidos y bases, seguido de uno o más aclarados, filtración y extrusión, al estar prohibido el uso de conservantes que no estén autorizados con arreglo a la legislación de la Unión; g) en el caso de los hemoderivados, han sido elaborados mediante cualquiera de los métodos de tratamiento 1 a 5 o 7, de acuerdo con lo dispuesto en el capítulo III del anexo IV del Reglamento (UE) n.o 142/2011; h) en el caso de las proteínas transformadas de mamíferos, se han sometido a cualquiera de los métodos de tratamiento 1 a 5 o 7 y, para la sangre de porcinos, a cualquiera de los métodos de tratamiento 1 a 5 o 7; el tratamiento 7 se aplicará a condición de que se haya aplicado un tratamiento térmico en toda la masa a una temperatura mínima de 80 °C; i) en el caso de las proteínas transformadas de animales no mamíferos, salvo la harina de pescado, han sido sometidas a cualquiera de los métodos 1 a 5 o 7, de acuerdo con lo dispuesto en el capítulo III del anexo IV del Reglamento (UE) n.o 142/2011; j) en el caso de la harina de pescado, se ha sometido a uno de los métodos de tratamiento 1 a 7 a los que hace referencia el capítulo III del anexo IV del Reglamento (UE) n.o 142/2011 o a un método y parámetros que garanticen que el producto cumple las normas microbiológicas para productos derivados establecidas en el capítulo I del anexo X del Reglamento (UE) n.o 142/2011; k) en el caso de las grasas extraídas, incluidos los aceites de pescado, se han sometido a uno de los métodos de transformación 1 a 5 o 7 (y al método 6 en el caso del aceite de pescado), tal como se indica en el capítulo III del anexo IV del Reglamento (UE) n.o 142/2011 o se han elaborado de conformidad con el capítulo II de la sección XII del anexo III del Reglamento (CE) n.o 853/2004; las grasas extraídas de rumiantes deberán purificarse de forma que los niveles máximos de impurezas insolubles restantes no superen un 0,15 % del peso;  Texto de la imagen
Texto de la imagen
PAÍS Alimentos transformados para animales de compañía distintos de los alimentos en conserva II. Información sanitaria II.a. Número de referencia del certificado II.b. l) en el caso del fosfato dicálcico, se ha producido mediante un proceso que: i) garantice que todo el material óseo de la categoría 3 se tritura finamente, se desgrasa con agua caliente y se trata con ácido clorhídrico diluido (de una concentración mínima del 4 % y un pH inferior a 1,5) durante un período mínimo de dos días, ii) tras el procedimiento descrito en el inciso i), someta el líquido fosfórico así obtenido a un tratamiento con cal, lo que producirá un precipitado de fosfato dicálcico con un pH comprendido entre 4 y 7; y iii) por último, deje secar al aire dicho precipitado de fosfato dicálcico con una temperatura de entrada comprendida entre 65 y 325 °C y una temperatura final de entre 30 y 65 °C; m) en el caso del fosfato tricálcico, se ha producido mediante un proceso que garantice que: i) todo el material óseo de la categoría 3 se tritura finamente y se desgrasa con flujo contrario de agua caliente (astillas de hueso inferiores a 14 mm), ii) se aplica un calentamiento continuo con vapor a 145 °C durante 30 minutos a 4 bares, iii) se separa el caldo de la proteína de la hidroxiapatita (fosfato tricálcico) mediante centrifugado, y iv) el fosfato tricálcico se granula después de secarlo en un lecho fluidificado con aire a 200 °C; n) en el caso de los subproductos aromatizantes, se han elaborado conforme a un método de tratamiento y a parámetros que garanticen el cumplimiento de las normas microbiológicas a las que hace referencia el punto II.4;] (2)o [se han sometido a tratamiento como secado o fermentación, autorizado por la autoridad competente;] (2)o [en el caso de los invertebrados acuáticos o terrestres, salvo los de especies patógenas para personas o animales, se han sometido a un tratamiento autorizado por la autoridad competente y que garantiza que la comida para animales de compañía no entraña ningún riesgo inaceptable para la salud pública ni la salud animal;] II.4. se han analizado, tomando al menos cinco muestras al azar de cada lote transformado durante el almacenamiento en la planta de transformación o después de él, y cumplen las normas siguientes (4): Salmonella: ausente en 25 g: n = 5, c = 0, m = 0, M = 0 Enterobacteriaceae: n = 5, c = 2, m = 10, M = 300 en 1 gramo; II.5. han sido objeto de las precauciones necesarias para evitar su contaminación con agentes patógenos después del tratamiento; II.6. se han envasado en envases nuevos que, de no tratarse de envases destinados a la venta directa en los que se indique claramente que su contenido se destina exclusivamente a la alimentación de animales de compañía, van etiquetados con la advertencia “NO APTO PARA EL CONSUMO HUMANO”; (2) [II.7. los alimentos para animales de compañía descritos: (2) bien [proceden de rumiantes distintos de los bovinos, ovinos o caprinos;] (2)o [proceden de bovinos, ovinos o caprinos y no contienen ni se han obtenido de: (2) bien [materiales de bovino, ovino y caprino que no se hayan obtenido de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]] (2)o [a) material especificado de riesgo según se define en el punto 1 del anexo V del Reglamento (CE) n.o 999/2001/UE del Parlamento Europeo y del Consejo (5);  Texto de la imagen
Texto de la imagen
PAÍS Alimentos transformados para animales de compañía distintos de los alimentos en conserva II. Información sanitaria II.a. Número de referencia del certificado II.b. b) carne separada mecánicamente obtenida de huesos de bovino, ovino o caprino, excepto de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE de la Comisión (6), y donde no ha habido ningún caso autóctono de EEB; c) subproductos animales o productos derivados obtenidos de bovinos, ovinos o caprinos a los que se ha dado muerte, previo aturdimiento, por laceración del tejido nervioso central mediante la introducción de un instrumento en forma de vara alargada en la cavidad craneal, o mediante la inyección de gas en la cavidad craneal, salvo en el caso de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]]] Notas Parte I: — Casilla I.6: Persona responsable de la partida en la Unión Europea: esta casilla debe cumplimentarse únicamente si se trata de un certificado de mercancía en tránsito por la Unión Europea; puede cumplimentarse si el certificado se refiere a una mercancía que vaya a ser importada en la Unión Europea. — Casilla I.12: Lugar de destino: esta casilla debe rellenarse únicamente si se trata del certificado de una mercancía en tránsito. los productos en tránsito solo pueden almacenarse en zonas francas, depósitos francos y depósitos aduaneros. — Casilla I.15: indicar la matrícula (vagones o contenedores de ferrocarril y camiones), el número de vuelo (avión) o el nombre (buque). En caso de que la mercancía se descargue y se vuelva a cargar, el expedidor debe informar al puesto de inspección fronterizo de entrada en la Unión Europea. — Casilla I.19: Utilizar el código correspondiente del Sistema Armonizado (SA) de las partidas siguientes: 04.01, 04.02, 04.03, 04.04, 04.08, 05.04, 05.05, 05.06, 05.11, 15.01, 15.02, 15.03, 15.04, 23.01, 23.09, 28.35.25, 28.35.26, 35.01, 35.02, 35.03 o 35.04. — Casilla I.23: si se utilizan contenedores a granel, indicar su número y el número del precinto (si procede). — Casilla I.25: uso técnico: cualquier otro distinto de la alimentación para animales de granja, distintos de los animales de peletería, y la producción o la fabricación de alimentos para animales de compañía. — Casillas I.26 y I.27: cumplimentar según se trate de un certificado de tránsito o de importación. — Casilla I.28: especie: elija una de las siguientes opciones: Aves, Ruminantia, Suidae, Mammalia distintos de Ruminantia o Suidae, Pesca, Mollusca, Crustacea, invertebrados distintos de Mollusca y Crustacea. Parte II: (1a) DO L 300 de 14.11.2009, p. 1. (1b) DO L 54 de 26.2.2011, p. 1. (2) Táchese lo que no proceda. (2a) DO L 139 de 30.4.2004, p. 55. (2b) DO L 125 de 23.5.1996, p. 3. (3) DO L 175 de 10.7.2010, p. 1.  Texto de la imagen
Texto de la imagen
PAÍS Alimentos transformados para animales de compañía distintos de los alimentos en conserva II. Información sanitaria II.a. Número de referencia del certificado II.b. (4) Donde: n = número de muestras por analizar; m = valor umbral del número de bacterias; el resultado se considera satisfactorio si el número de bacterias en todas las muestras no es superior a m; M = valor máximo del número de bacterias; el resultado se considera insatisfactorio si el número de bacterias en una o más muestras es igual o superior a M; y c = número de muestras en las cuales el recuento de bacterias puede situarse entre m y M; la muestra sigue considerándose aceptable si el recuento de bacterias de las demás muestras es igual o inferior a m. (5) DO L 147 de 31.5.2001, p. 1. (6) DO L 172 de 30.6.2007, p. 84. — El color de la tinta de la firma y del sello debe ser diferente del de los caracteres impresos. — Nota para la persona responsable de la partida en la Unión Europea: el presente certificado se expide únicamente a efectos veterinarios y debe acompañar al envío hasta el puesto de inspección fronterizo de entrada en la Unión Europea. Veterinario o inspector oficial Nombre y apellidos (en mayúsculas): Cualificación y cargo: Fecha: Firma: Sello: CAPÍTULO 3, LETRA C Certificado sanitario de accesorios masticables para perros, que se enviarán a la Unión Europea o transitarán por ella (2)  Texto de la imagen
Texto de la imagen
PAÍS: Certificado veterinario para la UE Parte I: Datos de la partida expedida I.1. Expedidor Nombre Dirección Teléfono I.2. Número de referencia del certificado I.2.a. I.3. Autoridad central competente I.4. Autoridad local competente I.5. Destinatario Nombre Dirección Código postal Teléfono I.6. Persona responsable de la partida en la UE Nombre Dirección Código postal Teléfono I.7. País de origen Código ISO I.8. Región de origen Código I.9. País de destino Código ISO I.10. Región de destino Código I.11. Lugar de origen Nombre Número de autorización Dirección Nombre Número de autorización Dirección Nombre Número de autorización Dirección I.12. Lugar de destino Depósito aduanero Nombre Número de autorización Dirección Código postal I.13. Lugar de carga I.14. Fecha de salida I.15. Medios de transporte Avión Buque Vagón de ferrocarril Vehículo de carretera Otros Identificación Referencias documentales I.16. PIF de entrada en la UE I.17. I.18. Descripción de la mercancía I.19. Código de la mercancía (código SA) I.20. Cantidad I.21. Temperatura de los productos Ambiente De refrigeración De congelación I.22. Número de bultos I.23. Número del precinto/recipiente I.24. Tipo de embalaje  Texto de la imagen
Texto de la imagen
I.25. Mercancías certificadas para: Alimentos para animales de compañía Uso técnico I.26. Para tránsito por la UE hacia un tercer país Tercer país Código ISO I.27. Para importación o admisión en la UE I.28. Identificación de las mercancías Número de autorización de los establecimientos Especie (nombre científico) Fábrica Peso neto Número de lote  Texto de la imagen
Texto de la imagen
PAÍS Accesorios masticables para perros II. Información sanitaria II.a. Número de referencia del certificado II.b. El veterinario oficial abajo firmante declara haber leído y comprendido el Reglamento (CE) n.o 1069/2009 del Parlamento Europeo y del Consejo (1a), y en particular su artículo 10, y el Reglamento (UE) n.o 142/2011 de la Comisión (1b), y, en particular, el capítulo II de su anexo XIII, y el capítulo II de su anexo XIV, y certifica que los accesorios masticables para perros descritos: II.1. han sido elaborados exclusivamente a partir de los subproductos animales siguientes: (2) bien [- las canales y partes de animales sacrificados, o los cuerpos o partes de animales matados, en el caso de animales de caza, que sean aptos para el consumo humano con arreglo a la legislación de la Unión pero no se destinen a ese fin por motivos comerciales;] (2) y/o [- las canales y las siguientes partes de animales sacrificados en un matadero y considerados aptos para el consumo humano a raíz de una inspección ante mortem o los cuerpos y las siguientes partes de animales de caza matados para el consumo humano de conformidad con la legislación de la Unión: i) las canales o los cuerpos y partes de animales declarados no aptos para el consumo humano de acuerdo con la legislación de la Unión pero que no muestren ningún signo de enfermedad transmisible a personas o animales; ii) las cabezas de aves de corral; iii) los cueros y pieles, incluidos los recortes y la piel dividida, los cuernos y los pies, incluidas las falanges y los huesos carpianos y metacarpianos, tarsianos y metatarsianos; iv) las cerdas; v) las plumas;] (2) y/o [- sangre de animales que no presentaban ningún signo de enfermedad transmisible por la sangre a personas o animales, obtenida de animales que hayan sido sacrificados en un matadero después de haber sido considerados aptos para el sacrificio para el consumo humano a raíz de una inspección ante mortem de conformidad con la legislación de la Unión;] (2) y/o [- los subproductos animales generados en la elaboración de productos destinados al consumo humano, incluidos el hueso desgrasado, los chicharrones y los lodos de centrifugado o de separación resultantes de la elaboración de productos lácteos;] (2) y/o [- los animales acuáticos y partes de los mismos, salvo los mamíferos marinos, que no presentaban ningún signo de enfermedad transmisible a personas o animales;] (2) y/o [- los subproductos de animales acuáticos procedentes de plantas o establecimientos que fabriquen productos para el consumo humano;] (2) y/o [- material de animales que han sido tratados con determinadas sustancias prohibidas por la Directiva 96/22/CE del Consejo (2a), y cuya importación está permitida de conformidad con el artículo 35, letra a), inciso ii), del Reglamento (CE) n.o 1069/2009;] II.2. se han sometido: (2) bien [en el caso de accesorios masticables para perros elaborados a partir de cueros y pieles de ungulados o a partir de pescado, a un tratamiento térmico suficiente para destruir los organismos patógenos (incluida la salmonela); y dichos accesorios están secos;] (2) y/o [en el caso de accesorios masticables para perros elaborados a partir de subproductos animales diferentes de los cueros y pieles de ungulados o del pescado, a un tratamiento térmico a una temperatura de al menos 90 °C en toda su masa;] II.3. se han analizado, tomando al menos cinco muestras al azar de cada lote transformado durante el almacenamiento en la planta de transformación o después de él, y cumplen las normas siguientes (3): Salmonella: ausente en 25 g: n = 5, c = 0, m = 0, M = 0 Enterobacteriaceae: n = 5, c = 2, m = 10, M = 300 en 1 gramo; Parte II: Certificación  Texto de la imagen
Texto de la imagen
PAÍS Accesorios masticables para perros II. Información sanitaria II.a. Número de referencia del certificado II.b. II.4. se han tomado todas las precauciones necesarias para evitar su contaminación con agentes patógenos después del tratamiento; II.5. se han envasado en envases nuevos; (2) [II.6. los accesorios masticables para perros descritos: (2) bien [procede de rumiantes distintos de los bovinos, ovinos o caprinos.]] (2) o [proceden de bovinos, ovinos o caprinos y no contienen ni se han obtenido de: (2) bien [materiales de bovino, ovino y caprino que no se hayan obtenido de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]] (2) o [a) material especificado de riesgo según se define en el punto 1 del anexo V del Reglamento (CE) n.o 999/2001/UE del Parlamento Europeo y del Consejo (4); b) carne separada mecánicamente obtenida de huesos de bovino, ovino o caprino, excepto de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE de la Comisión (5), y donde no ha habido ningún caso autóctono de EEB; c) subproductos animales o productos derivados obtenidos de bovinos, ovinos o caprinos a los que se ha dado muerte, previo aturdimiento, por laceración del tejido nervioso central mediante la introducción de un instrumento en forma de vara alargada en la cavidad craneal, o mediante la inyección de gas en la cavidad craneal, salvo en el caso de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]]] Notas Parte I: — Casilla I.6: Persona responsable de la partida en la Unión Europea: esta casilla debe rellenarse únicamente si se trata de un certificado de mercancía en tránsito; puede cumplimentarse si el certificado se refiere a una mercancía que vaya a ser importada en la Unión Europea. — Casilla I.12: Lugar de destino: esta casilla debe rellenarse únicamente si se trata del certificado de una mercancía en tránsito. los productos en tránsito solo pueden almacenarse en zonas francas, depósitos francos y depósitos aduaneros. — Casilla I.15: número de matrícula (vagones o contenedores de ferrocarril y camiones), número de vuelo (avión) o nombre (buque); deberá aportarse la información si se descarga y vuelve a cargar en la Unión Europea. — Casilla I.19: 05.11, 23.09, 41.01 o 42.05. — Casilla I.23: si se utilizan contenedores a granel, indicar su número y el número del precinto (si procede). — Casilla I.25: uso técnico: cualquier otro distinto de la alimentación para animales de granja, distintos de los animales de peletería, y la producción o la fabricación de alimentos para animales de compañía. — Casillas I.26 y I.27: cumplimentar según se trate de un certificado de tránsito o de importación. — Casilla I.28: especie: elija una de las siguientes opciones: Aves, Ruminantia, Suidae, Mammalia distintos de Ruminantia o Suidae, Pesca, Mollusca, Crustacea, invertebrados distintos de Mollusca y Crustacea. Parte II: (1a) DO L 300 de 14.11.2009, p. 1. (1b) DO L 54 de 26.2.2011, p. 1.  Texto de la imagen
Texto de la imagen
PAÍS Accesorios masticables para perros II. Información sanitaria II.a. Número de referencia del certificado II.b. (2) Táchese lo que no proceda. (2a) DO L 125 de 23.5.1996, p. 3. (3) Donde: — n = número de muestras por analizar; — m = valor umbral del número de bacterias; el resultado se considera satisfactorio si el número de bacterias en todas las muestras no es superior a m; — M = valor máximo del número de bacterias; el resultado se considera insatisfactorio si el número de bacterias en una o más muestras es igual o superior a M; y — c = número de muestras en las cuales el recuento de bacterias puede situarse entre m y M; la muestra sigue considerándose aceptable si el recuento de bacterias de las demás muestras es igual o inferior a m. (4) DO L 147 de 31.5.2001, p. 1. (5) DO L 172 de 30.6.2007, p. 84. — El color de la tinta de la firma y del sello debe ser diferente del de los caracteres impresos. — Nota para la persona responsable de la partida en la Unión Europea: el presente certificado se expide únicamente a efectos veterinarios y debe acompañar al envío hasta el puesto de inspección fronterizo de entrada en la Unión Europea. Veterinario o inspector oficial Nombre y apellidos (en mayúsculas): Cualificación y cargo: Fecha: Firma: Sello: CAPÍTULO 3, LETRA D Certificado sanitario de alimentos crudos para animales de compañía, destinados a la venta directa, o subproductos animales para la alimentación de animales de peletería, que se enviarán a la Unión Europea o transitarán por ella (2)  Texto de la imagen
Texto de la imagen
PAÍS: Certificado veterinario para la UE Parte I: Datos de la partida expedida I.1. Expedidor Nombre Dirección Teléfono I.2. Número de referencia del certificado I.2.a. I.3. Autoridad central competente I.4. Autoridad local competente I.5. Destinatario Nombre Dirección Código postal Teléfono I.6. Persona responsable de la partida en la UE Nombre Dirección Código postal Teléfono I.7. País de origen Código ISO I.8. Región de origen Código I.9. País de destino Código ISO I.10. Región de destino Código I.11. Lugar de origen Nombre Número de autorización Dirección Nombre Número de autorización Dirección Nombre Número de autorización Dirección I.12. Lugar de destino Depósito aduanero Nombre Número de autorización Dirección Código postal I.13. Lugar de carga I.14. Fecha de salida I.15. Medios de transporte Avión Buque Vagón de ferrocarril Vehículo de carretera Otros Identificación Referencias documentales I.16. PIF de entrada en la UE I.17. I.18. Descripción de la mercancía I.19. Código de la mercancía (código SA) I.20. Cantidad I.21. Temperatura de los productos Ambiente De refrigeración De congelación I.22. Número de bultos I.23. Número del precinto/recipiente I.24. Tipo de embalaje  Texto de la imagen
Texto de la imagen
I.25 Kauba lubatud otstarve: Lemmikloomatoit Tehniline otstarve I.26 Transiidiks kolmandasse riiki ELi kaudu Kolmas riik ISO kood I.27 Impordiks või sissepääsuks ELi I.28 Kauba identifitseerimine Ettevõtete loa number Liik (teaduslik nimetus) Kauba liik Tootmisettevõte Netomass Partii number  Texto de la imagen
Texto de la imagen
PAÍS Alimentos crudos para animales de compañía, destinados a la venta directa, o subproductos animales para la alimentación de animales de peletería II. Información sanitaria II.a. Número de referencia del certificado II.b. El veterinario oficial abajo firmante declara haber leído y comprendido el Reglamento (CE) n.o 1069/2009 del Parlamento Europeo y del Consejo (1a), y en particular su artículo 10, y el Reglamento (UE) n.o 142/2011 de la Comisión (1b), y en particular el capítulo II de su anexo XIII, y el capítulo II de su anexo XIV, y certifica que los alimentos crudos para animales de compañía o subproductos animales descritos: II.1. son subproductos animales que cumplen los requisitos sanitarios indicados más abajo; II.2. son subproductos animales: a) derivados de carne que satisface los correspondientes requisitos de salud pública y salud animal establecidos en: — el Reglamento (UE) n.o 206/2010 de la Comisión (3), y los animales de los que se deriva la carne proceden de los terceros países, territorios o partes de los mismos …… (código ISO del país, o códigos de territorios o partes de los mismos); — o el Reglamento (CE) n.o 798/2008 de la Comisión (4), y los animales de los que se deriva la carne proceden de los terceros países, territorios o partes de los mismos …… (código ISO del país, o códigos de territorios o partes de los mismos), enumerados en dicho Reglamento, que han estado libres de la enfermedad de Newcastle y de gripe aviar durante los últimos 12 meses; — o el Reglamento (CE) n.o 119/2009 de la Comisión (5), y los animales de los que se deriva la carne proceden de los terceros países, territorios o partes de los mismos …… (código ISO del país, o códigos de territorios o partes de los mismos), enumerados en dicho Reglamento, que han estado libres de fiebre aftosa, peste bovina, peste porcina clásica, peste porcina africana, enfermedad vesicular porcina, enfermedad de Newcastle y gripe aviar en los últimos 12 meses y en los que no se ha vacunado en ese período (cuando sea pertinente para las especies sensibles a estas enfermedades); b) derivados de animales sometidos a inspección sanitaria ante mortem en el matadero en las 24 horas previas a su sacrificio y que no presentaban ningún signo de las enfermedades, a que hace referencia la letra a), a las que sean sensibles estos animales y contempladas en los Reglamentos mencionados, y c) derivados de animales tratados en el matadero antes del sacrificio o la matanza, y durante los mismos, de acuerdo con las disposiciones pertinentes de la legislación de la Unión, y que han cumplido requisitos al menos equivalentes a los establecidos en los capítulos II y III del Reglamento (CE) n.o 1099/2009 del Consejo (6); o d) en el caso de los piensos para animales de peletería, derivados de animales acuáticos que satisfacen los requisitos de salud pública y salud animal establecidos en la Decisión 2006/766/CE de la Comisión (7), proceden de países o territorios de los mismos (código ISO del país) que figuran en el anexo II de dicha Decisión; II.3.1. consisten solo en los subproductos animales siguientes: a) las canales y partes de animales sacrificados, o los cuerpos o partes de animales cazados, considerados aptos para el consumo humano con arreglo a la legislación de la Unión hasta que, por razones comerciales, sean declarados de manera irreversible subproductos animales;] b) partes de animales sacrificados que han sido rechazadas por no ser aptas para el consumo humano, pero que no presentan ningún signo de enfermedad transmisible a personas o animales y proceden de canales que son aptas para el consumo humano de conformidad con la legislación de la Unión; II.3.2. en el caso de los piensos para animales de peletería, además de lo indicado en el punto II.3.1., consisten también en los subproductos animales siguientes: (2) bien [- los subproductos animales de aves de corral y lagomorfos sacrificados en la explotación de conformidad con el artículo 1, apartado 3, letra d), del Reglamento (CE) n.o 853/2004 del Parlamento Europeo y del Consejo (2a), que no presentaban ningún signo de enfermedad transmisible a personas o animales;] (2) y/o [- sangre de animales que no presentaban ningún signo de enfermedad transmisible por la sangre a personas o animales, obtenida de animales que hayan sido sacrificados en un matadero después de haber sido considerados aptos para el sacrificio para el consumo humano a raíz de una inspección ante mortem de conformidad con la legislación de la Unión;] (2) y/o [- los subproductos animales generados en la elaboración de productos destinados al consumo humano, incluidos el hueso desgrasado, los chicharrones y los lodos de centrifugado o de separación resultantes de la elaboración de productos lácteos;] Parte II: Certificación  Texto de la imagen
Texto de la imagen
PAÍS Alimentos crudos para animales de compañía, destinados a la venta directa, o subproductos animales para la alimentación de animales de peletería II. Información sanitaria II.a. Número de referencia del certificado II.b. (2) y/o [- productos de origen animal o productos alimenticios que contienen productos de origen animal que ya no están destinados al consumo humano por motivos comerciales, problemas de fabricación, defectos de envasado u otros defectos que no conlleven ningún riesgo para la salud pública o la salud animal;] (2) y/o [- los alimentos para animales de compañía y los piensos de origen animal, o los piensos que contengan subproductos animales o productos derivados que ya no estén destinados a la alimentación animal por motivos comerciales o problemas de fabricación, defectos de envasado u otros defectos que no conlleven ningún riesgo para la salud pública o la salud animal;] (2) y/o [- la sangre, la placenta, la lana, las plumas, el pelo, los cuernos, los recortes de cascos, uñas o pezuñas y la leche cruda de animales vivos que no presenten signos de enfermedad transmisible a través de esos productos a las personas o los animales;] (2) y/o [- los animales acuáticos y partes de los mismos, salvo los mamíferos marinos, que no muestren ningún signo de enfermedades transmisibles a las personas o los animales;] (2) y/o [- los subproductos de animales acuáticos procedentes de plantas o establecimientos que fabriquen productos para el consumo humano;] (2) y/o [- el siguiente material de animales que no presenten ningún signo de una enfermedad transmisible a las personas o los animales a través de dicho material: i) las conchas de moluscos despojadas del tejido blando o la carne; ii) los siguientes productos de animales terrestres: — los subproductos de la incubación, — los huevos, — los subproductos de los huevos, incluidas las cáscaras; iii) los pollitos de un día sacrificados por razones comerciales;] (2) y/o [- los subproductos animales de invertebrados acuáticos o terrestres, salvo los de especies patógenas para personas o animales;] (2) y/o [- animales y sus partes de los órdenes zoológicos de los roedores y los lagomorfos, salvo el material de la categoría 1 al que se refiere el artículo 8, letra a), incisos iii), iv) y v), y el material de la categoría 2 al que se refiere el artículo 9, letras a) a g), del Reglamento (CE) n.o 1069/2009;] II.4. se han obtenido y preparado sin que entren en contacto con otros materiales que no cumplan las condiciones establecidas en el Reglamento (CE) n.o 1069/2009 y se han manipulado evitando su contaminación por agentes patógenos; II.5. se han envasado en un envase final etiquetado con la indicación «ALIMENTO CRUDO PARA ANIMALES DE COMPAÑÍA - NO APTO PARA EL CONSUMO HUMANO» o «SUBPRODUCTOS ANIMALES DESTINADOS A LA ALIMENTACIÓN DE ANIMALES DE PELETERÍA - NO APTOS PARA EL CONSUMO HUMANO» y, a continuación, se han colocado en cajas o envases que no tengan pérdidas, precintados oficialmente y etiquetados con la indicación «ALIMENTO CRUDO PARA ANIMALES DE COMPAÑÍA - NO APTO PARA EL CONSUMO HUMANO» o «SUBPRODUCTOS ANIMALES DESTINADOS A LA ALIMENTACIÓN DE ANIMALES DE PELETERÍA - NO APTOS PARA EL CONSUMO HUMANO», así como el nombre y la dirección del establecimiento de destino; II.6. en el caso de alimentos crudos para animales de compañía: a) han sido elaborados y almacenados en una planta de transformación autorizada y supervisada por la autoridad competente con arreglo al artículo 24 del Reglamento (CE) n.o 1069/2009, y b) se han analizado tomando al menos cinco muestras al azar de cada lote durante el almacenamiento (antes del envío) y cumplen las normas siguientes (8):  Texto de la imagen
Texto de la imagen
PAÍS Alimentos crudos para animales de compañía, destinados a la venta directa, o subproductos animales para la alimentación de animales de peletería II. Información sanitaria II.a. Número de referencia del certificado II.b. Salmonella: ausente en 25 g: n = 5, c = 0, m = 0, M = 0 Enterobacteriaceae: n = 5, c = 2, m = 10, M = 5000 en 1 gramo; (2) [II.7. los alimentos crudos para animales de compañía o los subproductos animales para la alimentación de animales de peletería descritos contienen, o se han obtenido de, subproductos animales de rumiantes y: (2) bien [provienen de un país o región clasificado como de riesgo insignificante de EEB según lo establecido en la Decisión 2007/453/CE, y en el que no ha habido ningún caso autóctono de EEB, y]] (2)o [provienen de un país o región clasificado como de riesgo insignificante de EEB según lo establecido en la Decisión 2007/453/CE, pero en el que se ha registrado un caso autóctono de EEB, y el subproducto animal o producto derivado se ha obtenido de animales que nacieron después de la fecha a partir de la cual entró plenamente en vigor la prohibición de alimentar a los rumiantes con harinas de carne y huesos o con chicharrones derivados de rumiantes (tal como se definen en el Código Sanitario para los Animales Terrestres de la OIE), y]] (2) bien [proceden de rumiantes distintos de los bovinos, ovinos o caprinos.]] (2)o [proceden de bovinos, ovinos o caprinos y no contienen ni se han obtenido de: (2) bien [materiales de bovino, ovino y caprino que no se hayan obtenido de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]] (2)o [a) material especificado de riesgo según se define en el punto 1 del anexo V del Reglamento (CE) n.o 999/2001/UE del Parlamento Europeo y del Consejo (9); b) carne separada mecánicamente obtenida de huesos de bovino, ovino o caprino, excepto de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE de la Comisión (10), y donde no ha habido ningún caso autóctono de EEB; c) subproductos animales o productos derivados obtenidos de bovinos, ovinos o caprinos a los que se ha dado muerte, previo aturdimiento, por laceración del tejido nervioso central mediante la introducción de un instrumento en forma de vara alargada en la cavidad craneal, o mediante la inyección de gas en la cavidad craneal, salvo en el caso de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]]] Notas Parte I: — Casilla I.6: Persona responsable de la partida en la Unión Europea: esta casilla debe cumplimentarse únicamente si se trata de un certificado de mercancía en tránsito por la Unión Europea; puede cumplimentarse si el certificado se refiere a una mercancía que vaya a ser importada en la Unión Europea. — Casilla I.12: Lugar de destino: esta casilla debe rellenarse únicamente si se trata de un certificado de mercancía en tránsito. los productos en tránsito solo pueden almacenarse en zonas francas, depósitos francos y depósitos aduaneros. — Casilla I.15: indicar la matrícula (vagones o contenedores de ferrocarril y camiones), el número de vuelo (avión) o el nombre (buque). En caso de que la mercancía se descargue y se vuelva a cargar, el expedidor debe informar al puesto de inspección fronterizo de entrada en la Unión Europea. — Casilla I.19: Utilizar el código correspondiente del Sistema Armonizado (SA) de las partidas siguientes: 04.08, 05.06, 05.08, 05.11, 23.01 o 23.09. — Casilla I.23: si se utilizan contenedores a granel, indicar su número y el número del precinto (si procede). — Casilla I.25: uso técnico: cualquier otro distinto de la alimentación para animales de granja, distintos de los animales de peletería, y la producción o la fabricación de alimentos para animales de compañía. — Casillas I.26 y I.27: cumplimentar según se trate de un certificado de tránsito o de importación.  Texto de la imagen
Texto de la imagen
PAÍS Alimentos crudos para animales de compañía, destinados a la venta directa, o subproductos animales para la alimentación de animales de peletería II. Información sanitaria II.a. Número de referencia del certificado II.b. — Casilla I.28: Tipo de mercancía: seleccionar ‘alimentos crudos para animales de compañía’ o ‘subproducto animal’. Si se trata de materias primas para alimentos de animales de compañía, indicar el nombre científico de las especies. Si se trata de materias primas para alimentos de animales de peletería, elija una de las siguientes opciones: Aves, Ruminantia, Suidae, Mammalia distintos de Ruminantia o Suidae, Pesca, Mollusca, Crustacea, invertebrados distintos de Mollusca y Crustacea. Parte II: (1a) DO L 300 de 14.11.2009, p. 1. (1b) DO L 54 de 26.2.2011, p. 1. (2) Táchese lo que no proceda. (2a) DO L 139 de 30.4.2004, p. 55. (3) DO L 73 de 20.3.2010, p. 1. (4) DO L 226 de 23.8.2008, p. 1. (5) DO L 39 de 10.2.2009, p. 12. (6) DO L 303 de 18.11.2009, p. 1. (7) DO L 320 de 18.11.2006, p. 53. (8) Donde: n = número de muestras por analizar; m = valor umbral del número de bacterias; el resultado se considera satisfactorio si el número de bacterias en todas las muestras no es superior a m; M = valor máximo del número de bacterias; el resultado se considera insatisfactorio si el número de bacterias en una o más muestras es igual o superior a M; y c = número de muestras en las cuales el recuento de bacterias puede situarse entre m y M; la muestra sigue considerándose aceptable si el recuento de bacterias de las demás muestras es igual o inferior a m. (9) DO L 147 de 31.5.2001, p. 1. (10) DO L 172 de 30.6.2007, p. 84. — El color de la tinta de la firma y del sello debe ser diferente del de los caracteres impresos. — Nota para la persona responsable de la partida en la Unión Europea: el presente certificado se expide únicamente a efectos veterinarios y debe acompañar al envío hasta el puesto de inspección fronterizo de la Unión Europea. Veterinario o inspector oficial Nombre y apellidos (en mayúsculas): Cualificación y cargo: Fecha: Firma: Sello: CAPÍTULO 3, LETRA E Certificado sanitario de subproductos aromatizantes, para su uso en la fabricación de alimentos de animales de compañía, que se enviarán a la Unión Europea o transitarán por ella (2) 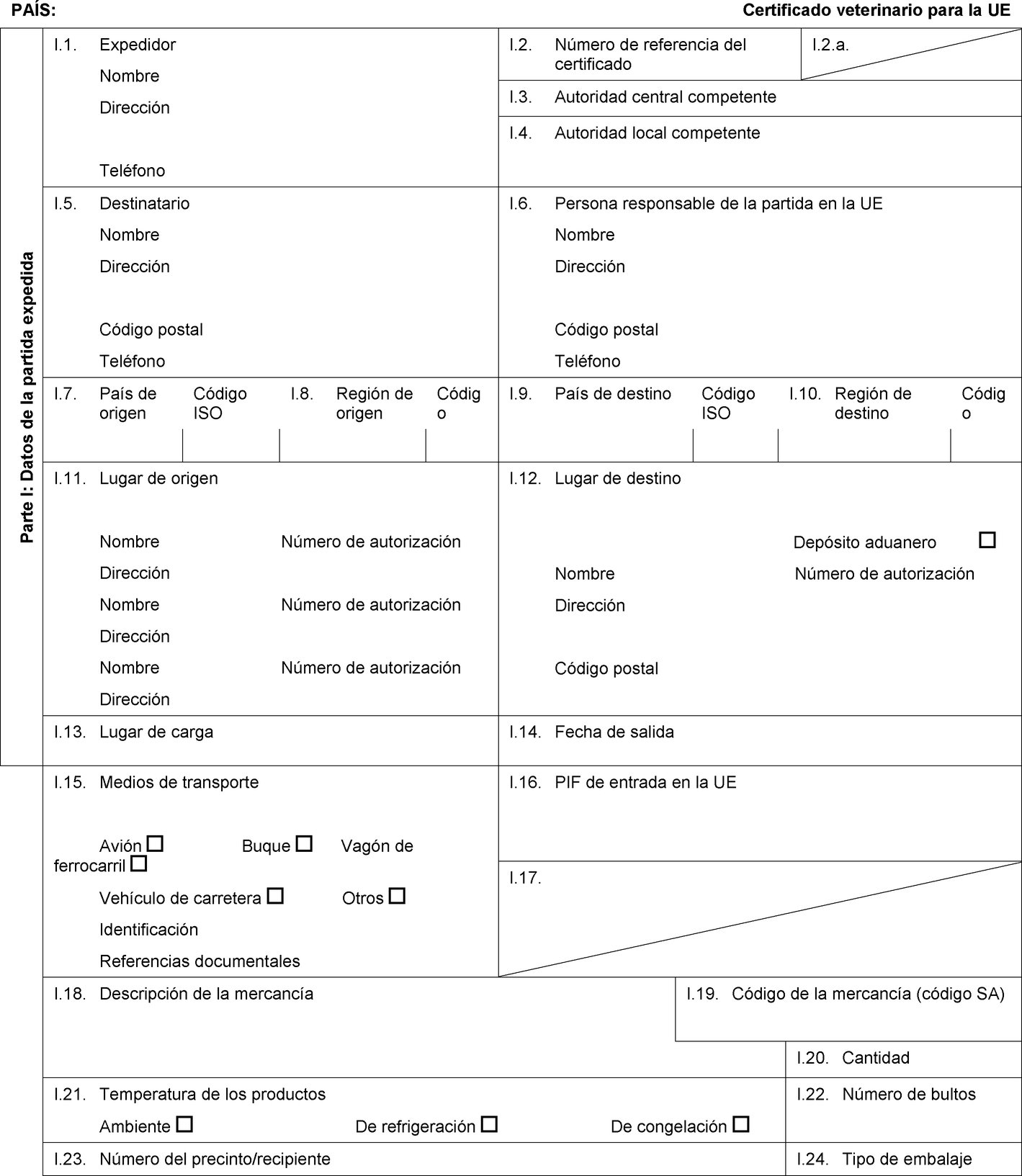 Texto de la imagen
Texto de la imagen
PAÍS: Certificado veterinario para la UE Parte I: Datos de la partida expedida I.1. Expedidor Nombre Dirección Teléfono I.2. Número de referencia del certificado I.2.a. I.3. Autoridad central competente I.4. Autoridad local competente I.5. Destinatario Nombre Dirección Código postal Teléfono I.6. Persona responsable de la partida en la UE Nombre Dirección Código postal Teléfono I.7. País de origen Código ISO I.8. Región de origen Código I.9. País de destino Código ISO I.10. Región de destino Código I.11. Lugar de origen Nombre Número de autorización Dirección Nombre Número de autorización Dirección Nombre Número de autorización Dirección I.12. Lugar de destino Depósito aduanero Nombre Número de autorización Dirección Código postal I.13. Lugar de carga I.14. Fecha de salida I.15. Medios de transporte Avión Buque Vagón de ferrocarril Vehículo de carretera Otros Identificación Referencias documentales I.16. PIF de entrada en la UE I.17. I.18. Descripción de la mercancía I.19. Código de la mercancía (código SA) I.20. Cantidad I.21. Temperatura de los productos Ambiente De refrigeración De congelación I.22. Número de bultos I.23. Número del precinto/recipiente I.24. Tipo de embalaje 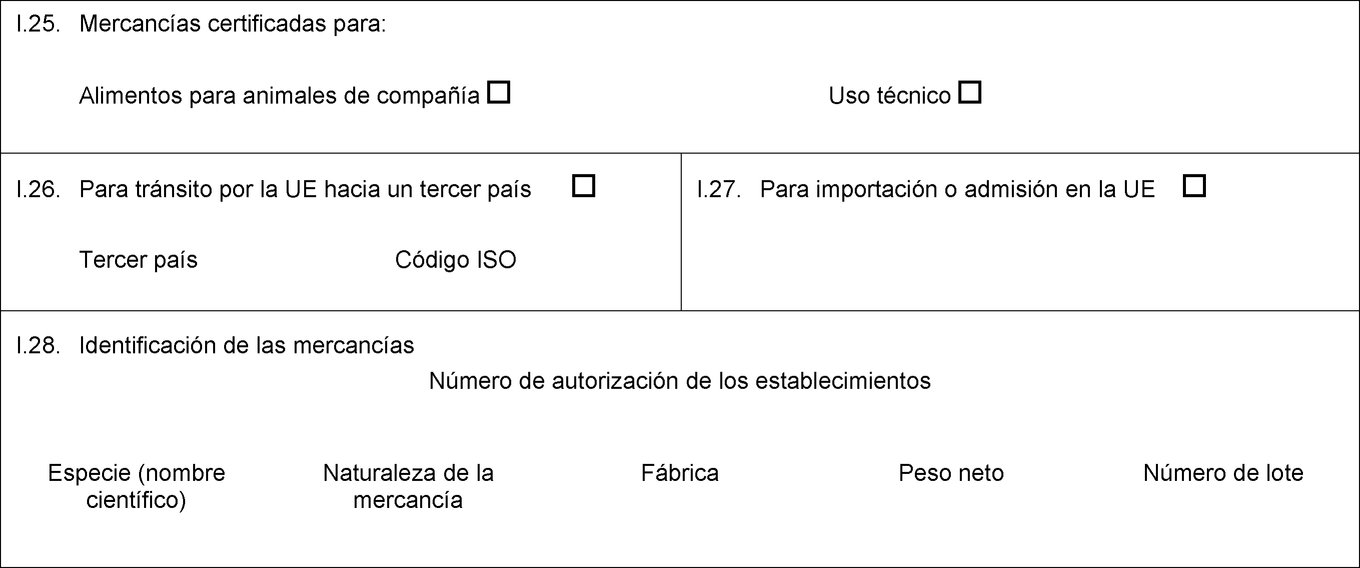 Texto de la imagen
Texto de la imagen
I.25. Mercancías certificadas para: Alimentos para animales de compañía Uso técnico I.26. Para tránsito por la UE hacia un tercer país Tercer país Código ISO I.27. Para importación o admisión en la UE I.28. Identificación de las mercancías Número de autorización de los establecimientos Especie (nombre científico) Naturaleza de la mercancía Fábrica Peso neto Número de lote  Texto de la imagen
Texto de la imagen
PAÍS Subproductos aromatizantes para su uso en la fabricación de alimentos de animales de compañía II. Información sanitaria II.a. Número de referencia del certificado II.b. El veterinario oficial abajo firmante declara haber leído y comprendido el Reglamento (CE) n.o 1069/2009 del Parlamento Europeo y del Consejo (1a), y en particular sus artículos 8 y 10, y el Reglamento (UE) n.o 142/2011 de la Comisión (1b), y, en particular, el capítulo II de su anexo XIII, y el capítulo II de su anexo XIV, y certifica que los subproductos aromatizantes descritos: II.1. son subproductos animales que cumplen los requisitos de sanidad animal indicados más abajo; II.2. han sido elaborados con subproductos animales consistentes exclusivamente en: (2) bien [- las canales y partes de animales sacrificados, o los cuerpos o partes de animales cazados, que sean aptos para el consumo humano con arreglo a la legislación de la Unión pero no se destinen a ese fin por motivos comerciales;] (2) y/o [- las canales y las siguientes partes de animales sacrificados en un matadero y considerados aptos para el consumo humano a raíz de una inspección ante mortem o los cuerpos y las siguientes partes de animales cazados para el consumo humano de conformidad con la legislación de la Unión: i) las canales o los cuerpos y partes de animales declarados no aptos para el consumo humano de acuerdo con la legislación de la Unión pero que no muestren ningún signo de enfermedad transmisible a personas o animales; ii) las cabezas de aves de corral; iii) los cueros y pieles, incluidos los recortes y la piel dividida, los cuernos y los pies, incluidas las falanges y los huesos carpianos y metacarpianos, tarsianos y metatarsianos; iv) las cerdas; v) las plumas;] (2) y/o [- sangre de animales que no presentaban ningún signo de enfermedad transmisible por la sangre a personas o animales, obtenida de animales que hayan sido sacrificados en un matadero después de haber sido considerados aptos para el sacrificio para el consumo humano a raíz de una inspección ante mortem de conformidad con la legislación de la Unión;] (2) y/o [- los subproductos animales generados en la elaboración de productos destinados al consumo humano, incluidos el hueso desgrasado, los chicharrones y los lodos de centrifugado o de separación resultantes de la elaboración de productos lácteos; ] (2) y/o [- los productos de origen animal o los productos alimenticios que contengan productos de origen animal que ya no estén destinados al consumo humano por motivos comerciales, problemas de fabricación, defectos de envasado u otros defectos que no conlleven ningún riesgo para la salud pública o la salud animal;] (2) y/o [- los alimentos para animales de compañía y los piensos de origen animal, o los piensos que contengan subproductos animales o productos derivados que ya no estén destinados a la alimentación animal por motivos comerciales o problemas de fabricación, defectos de envasado u otros defectos que no conlleven ningún riesgo para la salud pública o la salud animal;] (2) y/o [- la sangre, la placenta, la lana, las plumas, el pelo, los cuernos, los recortes de cascos, uñas o pezuñas y la leche cruda de animales vivos que no presenten signos de enfermedad transmisible a través de esos productos a las personas o los animales;] (2) y/o [- los animales acuáticos y partes de los mismos, salvo los mamíferos marinos, que no muestren ningún signo de enfermedades transmisibles a las personas o los animales;] (2) y/o [- los subproductos de animales acuáticos procedentes de plantas o establecimientos que fabriquen productos para el consumo humano;] (2) y/o [- el siguiente material de animales que no presenten ningún signo de una enfermedad transmisible a las personas o los animales a través de dicho material: i) las conchas de moluscos despojadas del tejido blando o la carne; Parte II: Certificación  Texto de la imagen
Texto de la imagen
PAÍS Subproductos aromatizantes para su uso en la fabricación de alimentos de animales de compañía II. Información sanitaria II.a. Número de referencia del certificado II.b. ii) los siguientes productos de animales terrestres: – los subproductos de la incubación, – los huevos, – los subproductos de los huevos, incluidas las cáscaras; iii) los pollitos de un día sacrificados por razones comerciales;] (2) y/o [- los subproductos animales de invertebrados acuáticos o terrestres, salvo los de especies patógenas para personas o animales;] (2) y/o [- animales y sus partes de los órdenes zoológicos de los roedores y los lagomorfos, salvo el material de la categoría 1 al que se refiere el artículo 8, letra a), incisos iii), iv) y v), y el material de la categoría 2 al que se refiere el artículo 9, letras a) a g), del Reglamento (CE) n.o 1069/2009;] (2) y/o [- material de animales que han sido tratados con determinadas sustancias prohibidas por la Directiva 96/22/CE del Consejo (2a), y cuya importación está permitida de conformidad con el artículo 35, letra a), inciso ii), del Reglamento (CE) n.o 1069/2009;] II.3. se han transformado de conformidad con en el anexo XIII, capítulo III, del Reglamento (UE) n.o 142/2011, con el fin de eliminar los agentes patógenos; II.4. se han analizado, tomando al menos cinco muestras al azar de cada lote transformado durante el almacenamiento en la planta de transformación o después de él, y cumplen las normas siguientes (3): Salmonella: ausente en 25 g: n = 5, c = 0, m = 0, M = 0 Enterobacteriaceae: n = 5, c = 2, m = 10, M = 300 en 1 gramo; II.5. el producto final: (2) bien [está envasado en envases nuevos o esterilizados,] (2) o [se ha transportado a granel en contenedores u otros medios de transporte cuidadosamente limpiados y desinfectados con un desinfectante aprobado por la autoridad competente antes de su utilización,] y está etiquetado con la indicación “NO APTO PARA EL CONSUMO HUMANO”; II.6. el producto final se ha almacenado en un lugar cerrado; II.7. el producto final ha sido objeto de todas las precauciones necesarias para evitar su contaminación con agentes patógenos después del tratamiento; (2) [II.8. los subproductos aromatizantes descritos: (2) bien [procede de rumiantes distintos de los bovinos, ovinos o caprinos.]] (2) o [proceden de bovinos, ovinos o caprinos y no contienen ni se han obtenido de: (2) bien [materiales de bovino, ovino y caprino que no se hayan obtenido de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]] (2)o [a) material especificado de riesgo según se define en el punto 1 del anexo V del Reglamento (CE) n.o 999/2001/UE del Parlamento Europeo y del Consejo (4); b) carne separada mecánicamente obtenida de huesos de bovino, ovino o caprino, excepto de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE de la Comisión (5), y donde no ha habido ningún caso autóctono de EEB; c) subproductos animales o productos derivados obtenidos de bovinos, ovinos o caprinos a los que se ha dado muerte, previo aturdimiento, por laceración del tejido nervioso central mediante la introducción de un instrumento en forma de vara alargada en la cavidad craneal, o mediante la inyección de gas en la cavidad craneal, salvo en el caso de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]]]  Texto de la imagen
Texto de la imagen
PAÍS Subproductos aromatizantes para su uso en la fabricación de alimentos de animales de compañía II. Información sanitaria II.a. Número de referencia del certificado II.b. Notas Parte I: — Casilla I.6: Persona responsable de la partida en la Unión Europea: esta casilla debe cumplimentarse únicamente si se trata de un certificado de mercancía en tránsito por la Unión Europea; puede cumplimentarse si el certificado se refiere a una mercancía que vaya a ser importada en la Unión Europea. — Casilla I.12: Lugar de destino: esta casilla debe rellenarse únicamente si se trata de un certificado de mercancía en tránsito. los productos en tránsito solo pueden almacenarse en zonas francas, depósitos francos y depósitos aduaneros. — Casilla I.15: número de matrícula (vagones o contenedores de ferrocarril y camiones), número de vuelo (avión) o nombre (buque); deberá aportarse la información si se descarga y vuelve a cargar en la Unión Europea. — Casilla I.19: Indicar el código SA apropiado: 05.04, 05.06, 05.11 o 23.09. — Casilla I.23: Si se utilizan contenedores a granel, indicar su número y el número del precinto (si procede). — Casilla I.25: uso técnico: cualquier otro distinto de la alimentación para animales de granja, distintos de los animales de peletería, y la producción o la fabricación de alimentos para animales de compañía. — Casillas I.26 y I.27: cumplimentar según se trate de un certificado de tránsito o de importación. — Casilla I.28: — Especies: elija una de las siguientes opciones: Aves, Ruminantia, Suidae, Mammalia distintos de Ruminantia o Suidae, Pesca, Mollusca, Crustacea, invertebrados distintos de Mollusca y Crustacea. — defina el producto aromatizante. Parte II: (1a) DO L 300 de 14.11.2009, p. 1. (1b) DO L 54 de 26.2.2011, p. 1. (2) Táchese lo que no proceda. (2a) DO L 125 de 23.5.1996, p. 3. (3) Donde: n = número de muestras por analizar; m = valor umbral del número de bacterias; el resultado se considera satisfactorio si el número de bacterias en todas las muestras no es superior a m; M = valor máximo del número de bacterias; el resultado se considera insatisfactorio si el número de bacterias en una o más muestras es igual o superior a M; y c = número de muestras en las cuales el recuento de bacterias puede situarse entre m y M; la muestra sigue considerándose aceptable si el recuento de bacterias de las demás muestras es igual o inferior a m. (4) DO L 147 de 31.5.2001, p. 1. (5) DO L 172 de 30.6.2007, p. 84. — El color de la tinta de la firma y del sello debe ser diferente del de los caracteres impresos. — Nota para la persona responsable de la partida en la Unión Europea: el presente certificado se expide únicamente a efectos veterinarios y debe acompañar a la partida hasta el puesto de inspección fronterizo. Veterinario o inspector oficial Nombre y apellidos (en mayúsculas): Cualificación y cargo: Fecha: Firma: Sello: CAPÍTULO 3, LETRA F Certificado sanitario de subproductos animales (3) para la fabricación de alimentos de animales de compañía, que se enviarán a la Unión Europea o transitarán por ella (2) 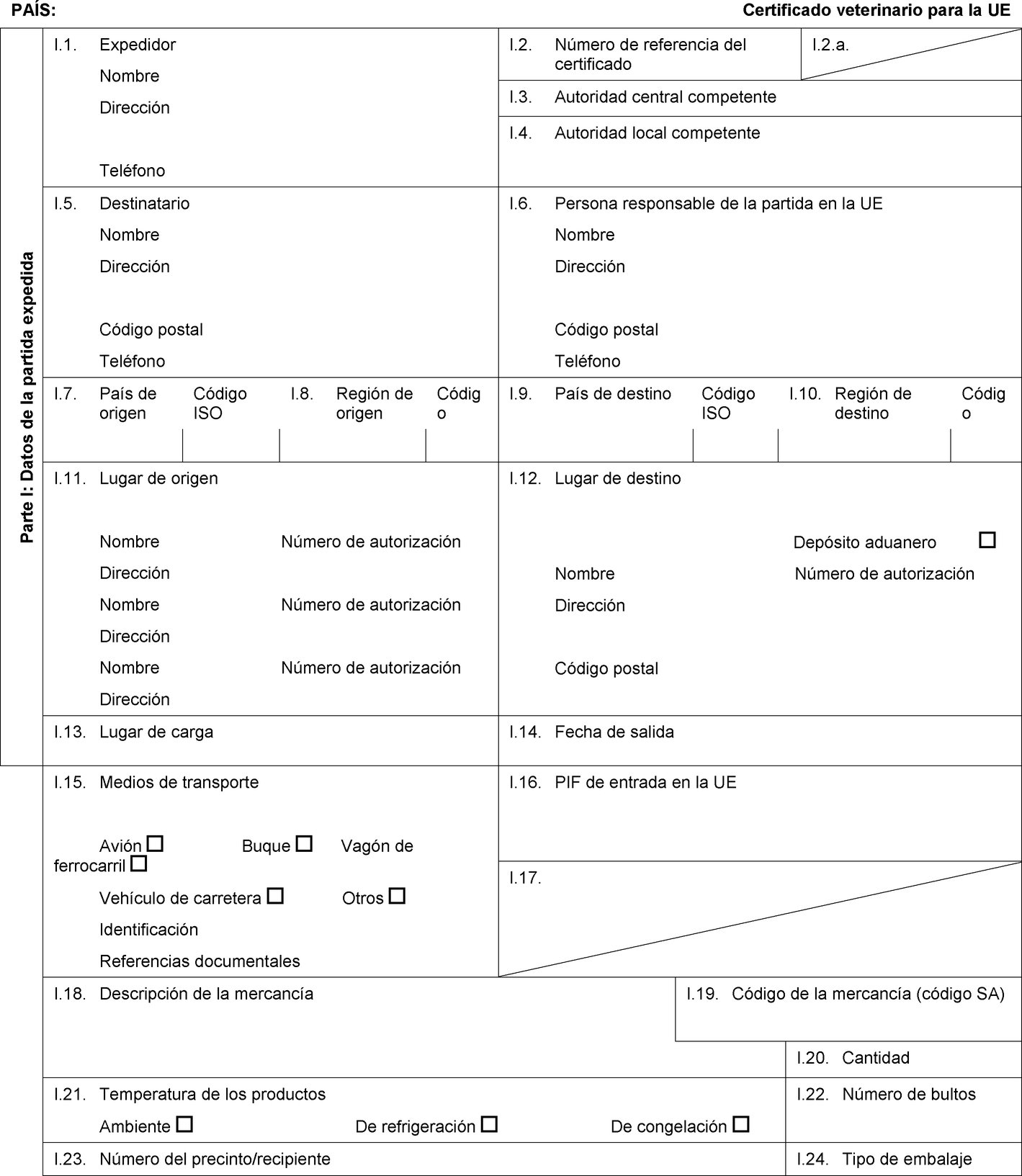 Texto de la imagen
Texto de la imagen
PAÍS: Certificado veterinario para la UE Parte I: Datos de la partida expedida I.1. Expedidor Nombre Dirección Teléfono I.2. Número de referencia del certificado I.2.a. I.3. Autoridad central competente I.4. Autoridad local competente I.5. Destinatario Nombre Dirección Código postal Teléfono I.6. Persona responsable de la partida en la UE Nombre Dirección Código postal Teléfono I.7. País de origen Código ISO I.8. Región de origen Código I.9. País de destino Código ISO I.10. Región de destino Código I.11. Lugar de origen Nombre Número de autorización Dirección Nombre Número de autorización Dirección Nombre Número de autorización Dirección I.12. Lugar de destino Depósito aduanero Nombre Número de autorización Dirección Código postal I.13. Lugar de carga I.14. Fecha de salida I.15. Medios de transporte Avión Buque Vagón de ferrocarril Vehículo de carretera Otros Identificación Referencias documentales I.16. PIF de entrada en la UE I.17. I.18. Descripción de la mercancía I.19. Código de la mercancía (código SA) I.20. Cantidad I.21. Temperatura de los productos Ambiente De refrigeración De congelación I.22. Número de bultos I.23. Número del precinto/recipiente I.24. Tipo de embalaje  Texto de la imagen
Texto de la imagen
I.25. Mercancías certificadas para: Fabricación de alimentos para animales de compañía Proceso adicional Uso técnico I.26. Para tránsito por la UE hacia un tercer país Tercer país Código ISO I.27. Para importación o admisión en la UE I.28. Identificación de las mercancías Número de autorización de los establecimientos Especie (nombre científico) Naturaleza de la mercancía Fábrica Número de bultos Peso neto Número de lote  Texto de la imagen
Texto de la imagen
PAÍS Subproductos animales para la fabricación de alimentos de animales de compañía II. Información sanitaria II.a. Número de referencia del certificado II.b. El veterinario oficial abajo firmante declara haber leído y comprendido el Reglamento (CE) n.o 1069/2009 del Parlamento Europeo y del Consejo (1a) y el Reglamento (UE) n.o 142/2011 de la Comisión (1b), y en particular su anexo XIV, capítulo II, y certifica que los subproductos animales descritos: II.1.1. son subproductos animales que cumplen los requisitos de sanidad animal indicados más abajo; II.1.2. se han obtenido en el territorio de: (1c) de animales: (2) bien [a) que han permanecido en este territorio desde su nacimiento o durante al menos los tres meses previos a la fecha del sacrificio o de la producción;] (2)o [b) que han sido cazados en dicho territorio (1d);] (2)o [c) que proceden de roedores, lagomorfos, animales acuáticos o invertebrados terrestres o acuáticos;] II.1.3. se han obtenido o producido de animales: (2) bien [a) procedentes de explotaciones que: i) no han tenido, entre los animales sensibles a ellas, casos ni brotes de peste bovina, enfermedad vesicular porcina, enfermedad de Newcastle o gripe aviar altamente patógena en los 30 días previos, ni peste porcina clásica o africana en los 40 días previos, entre los animales sensibles a estas enfermedades, como tampoco se han dado en las explotaciones situadas en un radio de 10 km a su alrededor en los 30 días previos; y ii) no han tenido casos ni brotes de fiebre aftosa en los 60 días previos, como tampoco se han dado en las explotaciones situadas en un radio de 25 km a su alrededor en los 30 días previos; y b) que: i) no han sido sacrificados para erradicar epizootias, ii) han permanecido en sus explotaciones de origen al menos durante los 40 días previos a la fecha de su expedición y han sido transportados directamente al matadero sin estar en contacto con otros animales que no cumplían las mismas condiciones sanitarias; iii) han sido sometidos a una inspección sanitaria ante mortem en el matadero en las 24 horas previas a su sacrificio y no presentaban ningún signo de las enfermedades citadas a las que sean sensibles; y iv) han sido tratados en el matadero antes del sacrificio o la matanza, y durante los mismos, de acuerdo con las disposiciones pertinentes de la legislación de la Unión, y que han cumplido requisitos al menos equivalentes a los establecidos en los capítulos II y III del Reglamento (CE) n.o 1099/2009 del Consejo (4);] (2) o [a) que han sido cazados en una zona: i) en la que, en un radio de 25 km, no se ha producido entre los animales sensibles a ellas ningún caso ni brote de las enfermedades siguientes: fiebre aftosa, peste bovina, enfermedad de Newcastle o gripe aviar altamente patógena en los 30 días previos, ni peste porcina clásica o africana en los 40 días previos, y ii) situada a más de 20 km de un país o parte del mismo que no está autorizado a exportar a la Unión Europea material de aves de corral en los 30 días previos o material porcino en los 40 días previos; y b) que tras su matanza han sido transportados en un plazo de 12 horas a un centro de recogida para su refrigeración, e inmediatamente después a un establecimiento de carne de caza, o directamente a este último;] Parte II: Certificación  Texto de la imagen
Texto de la imagen
PAÍS Subproductos animales para la fabricación de alimentos de animales de compañía II. Información sanitaria II.a. Número de referencia del certificado II.b. II.1.4. se han obtenido en un establecimiento en torno al cual, en un radio de 10 km, no se ha producido en los 30 días previos ningún caso o brote de las enfermedades recogidas en el punto II.1.3 entre los animales sensibles a ellas o donde, ante un caso de enfermedad, la preparación de las materias primas que vayan a exportarse a la Unión Europea ha sido autorizada solo después de eliminar toda la carne y de lavar y desinfectar totalmente el establecimiento bajo el control de un veterinario oficial; II.1.5. se han obtenido y elaborado sin que entren en contacto con otros materiales que no cumplan las condiciones especificadas, y se han manipulado evitando su contaminación por agentes patógenos; II.1.6. se han envasado en envases nuevos que no tengan pérdidas y en contenedores precintados oficialmente y etiquetados con la indicación «MATERIA PRIMA DESTINADA EXCLUSIVAMENTE A LA FABRICACIÓN DE ALIMENTOS PARA ANIMALES DE COMPAÑÍA», así como el nombre y la dirección del establecimiento de destino en la Unión Europea; II.1.7. consisten solo en los subproductos animales siguientes: (2) bien [- las canales y partes de animales sacrificados, o los cuerpos o partes de animales cazados, considerados aptos para el consumo humano con arreglo a la legislación de la Unión hasta que, por razones comerciales, sean declarados de manera irreversible subproductos animales;] (2) y/o [- las canales y las siguientes partes de animales sacrificados en un matadero y considerados aptos para el consumo humano a raíz de una inspección ante mortem o los cuerpos y las siguientes partes de animales cazados para el consumo humano de conformidad con la legislación de la Unión: i) las canales o los cuerpos y partes de animales declarados no aptos para el consumo humano de acuerdo con la legislación de la Unión pero que no muestren ningún signo de enfermedad transmisible a personas o animales; ii) las cabezas de aves de corral; iii) los cueros y pieles, incluidos los recortes y la piel dividida, los cuernos y los pies, incluidas las falanges y los huesos carpianos y metacarpianos, tarsianos y metatarsianos; iv) las cerdas; v) las plumas;] (2) y/o [- los subproductos animales generados en la elaboración de productos destinados al consumo humano, incluidos el hueso desgrasado, los chicharrones y los lodos de centrifugado o de separación resultantes de la elaboración de productos lácteos;] (2) y/o [- los productos de origen animal o los productos alimenticios que contengan productos de origen animal que ya no estén destinados al consumo humano por motivos comerciales, problemas de fabricación, defectos de envasado u otros defectos que no conlleven ningún riesgo para la salud pública o la salud animal;] (2) y/o [- los animales acuáticos y partes de los mismos, salvo los mamíferos marinos, que no muestren ningún signo de enfermedades transmisibles a las personas o los animales;] (2) y/o [- los subproductos de animales acuáticos procedentes de plantas o establecimientos que fabriquen productos para el consumo humano;] (2) y/o [- el siguiente material de animales que no presenten ningún signo de una enfermedad transmisible a las personas o los animales a través de dicho material: i) las conchas de moluscos despojadas del tejido blando o la carne; ii) los siguientes productos de animales terrestres: — los subproductos de la incubación, — los huevos, — los subproductos de los huevos, incluidas las cáscaras;  Texto de la imagen
Texto de la imagen
PAÍS Subproductos animales para la fabricación de alimentos de animales de compañía II. Información sanitaria II.a. Número de referencia del certificado II.b. iii) los pollitos de un día sacrificados por razones comerciales;] (2) y/o [- subproductos animales de invertebrados acuáticos o terrestres, salvo los de especies patógenas para personas o animales;] (2) y/o [- animales y sus partes de los órdenes zoológicos de los roedores y los lagomorfos, salvo el material de la categoría 1 al que se refiere el artículo 8, letra a), incisos iii), iv) y v), y el material de la categoría 2 al que se refiere el artículo 9, letras a) a g), del Reglamento (CE) n.o 1069/2009;] (2) y/o [- material de animales que han sido tratados con determinadas sustancias prohibidas por la Directiva 96/22/CE del Consejo (4 a), y cuya importación está permitida de conformidad con el artículo 35, letra a), inciso ii), del Reglamento (CE) n.o 1069/2009;] II.1.8. han sido congelados en la planta de origen o han sido conservados de acuerdo con la legislación de la Unión Europea de manera que se evite su deterioro entre el momento de su expedición y el de su entrega en la planta de destino de la Unión Europea o durante el tránsito por ella; II.1.9. en el caso de materias primas derivadas de animales tratados con determinadas sustancias prohibidas por la Directiva 96/22/CE para la elaboración de alimentos para animales de compañía, cuya importación está permitida de conformidad con el artículo 35, letra a), inciso ii), del Reglamento (CE) n.o 1069/2009: a) se han marcado en el tercer país antes de su entrada en el territorio de la Unión Europea con una cruz de carbón vegetal licuado o carbono activado en todas las caras externas de cada bloque congelado o, si la materia prima se transporta en paletas no separadas en distintos envíos durante el transporte a la fábrica de alimentos para animales de compañía de destino de la Unión Europea o durante el tránsito por ella, en todas las caras externas de cada paleta, de forma que la marca cubra al menos el 70 % de la longitud diagonal del bloque y tenga una anchura de al menos 10 centímetros; b) en el caso de material no congelado, se ha marcado en el tercer país antes de su entrada en el territorio de la Unión Europea pulverizando sobre él carbón vegetal licuado o aplicándole polvo de carbón vegetal de tal manera que el carbón sea claramente visible en él; y c) cuando los subproductos animales son materias primas tratadas como se indica más arriba y materias primas no tratadas, todas las materias primas se han marcado de acuerdo con lo establecido en las letras a) y b). (2)(5)[II.2. Requisitos específicos (2)(6)[II.2.1. Los subproductos de este envío proceden de animales que han permanecido en el territorio mencionado en el punto II.1.2, en el que se aplican regularmente programas de vacunación contra la fiebre aftosa y se ejerce un control oficial del ganado bovino doméstico.] (2)(7)[II.2.2. Los subproductos de este envío consisten solo en subproductos animales derivados de despojos acondicionados de rumiantes domésticos, madurados a una temperatura ambiente superior a + 2 °C al menos durante tres horas o, en el caso de los músculos maseteros de bovinos y de carne deshuesada de animales domésticos, al menos durante 24 horas.]] (2)[II.3. los subproductos animales para la fabricación de alimentos de animales de compañía contienen, o se han obtenido de, subproductos animales de rumiantes y: (2) bien [provienen de un país o región clasificado como de riesgo insignificante de EEB según lo establecido en la Decisión 2007/453/CE, y en el que no ha habido ningún caso autóctono de EEB, y]] (2)o [provienen de un país o región clasificado como de riesgo insignificante de EEB según lo establecido en la Decisión 2007/453/CE, pero en el que se ha registrado un caso autóctono de EEB, y el subproducto animal o producto derivado se ha obtenido de animales que nacieron después de la fecha a partir de la cual entró plenamente en vigor la prohibición de alimentar a los rumiantes con harinas de carne y huesos o con chicharrones derivados de rumiantes (tal como se definen en el Código Sanitario para los Animales Terrestres de la OIE), y]] (2) bien [procede de rumiantes distintos de los bovinos, ovinos o caprinos.]  Texto de la imagen
Texto de la imagen
PAÍS Subproductos animales para la fabricación de alimentos de animales de compañía II. Información sanitaria II.a. Número de referencia del certificado II.b. (2)o [proceden de bovinos, ovinos o caprinos y no contienen ni se han obtenido de: (2) bien [materiales de bovino, ovino y caprino que no se hayan obtenido de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]]] (2)o [a) material especificado de riesgo según se define en el punto 1 del anexo V del Reglamento (CE) n.o 999/2001/UE del Parlamento Europeo y del Consejo (8); b) carne separada mecánicamente obtenida de huesos de bovino, ovino o caprino, excepto de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE de la Comisión (9), y donde no ha habido ningún caso autóctono de EEB; c) subproductos animales o productos derivados obtenidos de bovinos, ovinos o caprinos a los que se ha dado muerte, previo aturdimiento, por laceración del tejido nervioso central mediante la introducción de un instrumento en forma de vara alargada en la cavidad craneal, o mediante la inyección de gas en la cavidad craneal, salvo en el caso de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]]]] Notas Parte I: — Casilla I.6: Persona responsable de la partida en la Unión Europea: esta casilla debe rellenarse únicamente si se trata de un certificado de mercancía en tránsito; puede cumplimentarse si el certificado se refiere a una mercancía que vaya a ser importada en la Unión Europea. — Casilla I.12: Lugar de destino: esta casilla debe rellenarse únicamente si se trata del certificado de una mercancía en tránsito. los productos en tránsito solo pueden almacenarse en zonas francas, depósitos francos y depósitos aduaneros. — Casilla I.15: número de matrícula (vagones o contenedores de ferrocarril y camiones), número de vuelo (avión) o nombre (buque); deberá aportarse la información si se descarga y vuelve a cargar en la Unión Europea. — Casilla I.19: Indicar el código SA apropiado: 05.04, 05.06, 05.07, 05.11.91 o 05.11.99, 23.01, 41.01. — Casilla I.23: Si se utilizan contenedores a granel, indicar su número y el número del precinto (si procede). — Casilla I.25: uso técnico: cualquier otro distinto de la alimentación para animales de granja, distintos de los animales de peletería, y la producción o la fabricación de alimentos para animales de compañía. — Casillas I.26 y I.27: cumplimentar según se trate de un certificado de tránsito o de importación. — Casilla I.28: — especies: elija una de las siguientes opciones: Aves, Ruminantia, Suidae, Mammalia distintos de Ruminantia o Suidae, Pesca, Mollusca, Crustacea, invertebrados distintos de Mollusca y Crustacea. — Fábrica: Indíquese el número de control veterinario del establecimiento autorizado. Parte II: (1a) DO L 300 de 14.11.2009, p. 1. (1b) DO L 54 de 26.2.2011, p. 1.  Texto de la imagen
Texto de la imagen
PAÍS Subproductos animales para la fabricación de alimentos de animales de compañía II. Información sanitaria II.a. Número de referencia del certificado II.b. (1c) Nombre y código ISO del país de exportación tal como figuran en: — la parte 1 del anexo II del Reglamento (UE) n.o 206/2010, — la parte 1 del anexo I del Reglamento (CE) n.o 798/2008, y — la parte 1 del anexo I del Reglamento (CE) n.o 119/2009. Deberá incluirse también el código ISO regional que figura en dichos anexos (cuando proceda para las especies sensibles). (1d) Solo para los países desde los que se autoriza la importación en la Unión Europea de carne de caza de las mismas especies animales destinada al consumo humano. (2) Táchese lo que no proceda. (3) Con exclusión de la sangre cruda, la leche cruda, los cueros y las pieles, las pezuñas, los cuernos, las cerdas y las plumas (véanse en los anexos mencionados los certificados específicos para la importación de estos productos). (4) DO L 303 de 18.11.2009, p. 1. (4 a) DO L 125 de 23.5.1996, p. 3. (5) Garantías adicionales cuando el material de rumiantes domésticos es originario de una zona de un país sudamericano o sudafricano, o parte del mismo, del que solo se permite la exportación a la Unión Europea de carne fresca madurada y deshuesada de rumiantes domésticos para el consumo humano. Se autorizan también los músculos maseteros enteros de bovinos, con las incisiones realizadas de conformidad con lo dispuesto en el anexo I, sección IV, capítulo I, parte B.1, del Reglamento (CE) n.o 854/2004 del Parlamento Europeo y del Consejo (DO L 139 de 30.4.2004, p. 206). (6) Solo para algunos países sudamericanos. (7) Solo para algunos países sudamericanos y sudafricanos. (8) DO L 147 de 31.5.2001, p. 1. (9) DO L 172 de 30.6.2007, p. 84. — El color de la tinta de la firma y del sello debe ser diferente del de los caracteres impresos. — Nota para la persona responsable de la partida en la Unión Europea: el presente certificado se expide únicamente a efectos veterinarios y debe acompañar al envío hasta el puesto de inspección fronterizo de la Unión Europea. Veterinario o inspector oficial Nombre y apellidos (en mayúsculas): Cualificación y cargo: Fecha: Firma: Sello: |
|
2) |
El capítulo 4, letras B a D, se sustituye por el texto siguiente: «CAPÍTULO 4, LETRA B Certificado sanitario de hemoderivados no destinados al consumo humano que puedan utilizarse como ingredientes para piensos y que se enviarán a la Unión Europea o transitarán por ella (2)  Texto de la imagen
Texto de la imagen
PAÍS: Certificado veterinario para la UE Parte I: Datos de la partida expedida I.1. Expedidor Nombre Dirección Teléfono I.2. Número de referencia del certificado I.2.a. I.3. Autoridad central competente I.4. Autoridad local competente I.5. Destinatario Nombre Dirección Código postal Teléfono I.6. Persona responsable de la partida en la UE Nombre Dirección Código postal Teléfono I.7. País de origen Código ISO I.8. Región de origen Código I.9. País de destino Código ISO I.10. Región de destino Código I.11. Lugar de origen Nombre Número de autorización Dirección Nombre Número de autorización Dirección Nombre Número de autorización Dirección I.12. Lugar de destino Depósito aduanero Nombre Número de autorización Dirección Código postal I.13. Lugar de carga I.14. Fecha de salida I.15. Medios de transporte Avión Buque Vagón de ferrocarril Vehículo de carretera Otros Identificación Referencias documentales I.16. PIF de entrada en la UE I.17. I.18. Descripción de la mercancía I.19. Código de la mercancía (código SA) I.20. Cantidad I.21. Temperatura de los productos Ambiente De refrigeración De congelación I.22. Número de bultos I.23. Número del precinto/recipiente I.24. Tipo de embalaje  Texto de la imagen
Texto de la imagen
I.25. Mercancías certificadas para: Alimentación animal Fabricación de alimentos para animales de compañía Uso técnico I.26. Para tránsito por la UE hacia un tercer país Tercer país Código ISO I.27. Para importación o admisión en la UE I.28. Identificación de las mercancías Número de autorización de los establecimientos Especie (nombre científico) Naturaleza de la mercancía Fábrica Número de lote  Texto de la imagen
Texto de la imagen
PAÍS Hemoderivados no destinados al consumo humano que puedan utilizarse como ingredientes para piensos II. Información sanitaria II.a. Número de referencia del certificado II.b. El veterinario oficial abajo firmante declara haber leído y comprendido el Reglamento (CE) n.o 1069/2009 del Parlamento Europeo y del Consejo (1a) y el Reglamento (UE) n.o 142/2011 de la Comisión (1b) y certifica que los hemoderivados descritos: II.1. son hemoderivados que cumplen los requisitos sanitarios indicados más abajo; II.2. son exclusivamente hemoderivados que no se destinan al consumo humano; II.3. han sido elaborados y almacenados en una planta de transformación autorizada y supervisada por la autoridad competente con arreglo al artículo 24 del Reglamento (CE) n.o 1069/2009; II.4. han sido elaborados exclusivamente a partir de los subproductos animales siguientes: (2) bien [sangre de animales sacrificados, considerada apta para el consumo humano de conformidad con la legislación de la Unión, pero que no se destina a este fin por motivos comerciales;] (2)y/o [sangre de animales sacrificados, declarada no apta para el consumo humano de conformidad con la legislación de la Unión, pero que no presentaba ningún signo de enfermedad transmisible a personas o animales, procedente de canales de animales sacrificados en un matadero después de haber sido considerados aptos para el consumo humano a raíz de una inspección ante mortem de conformidad con la legislación de la Unión;] II.5. con el fin de eliminar los patógenos, se han sometido (2) bien [a un tratamiento siguiendo el método (3) descrito en el anexo IV, capítulo III, del Reglamento (UE) n.o 142/2011 de la Comisión;] (2) o [a un tratamiento y parámetros que garanticen que el producto cumple las normas microbiológicas establecidas en el anexo X, capítulo I, del Reglamento (UE) n.o 142/2011 de la Comisión;] (2) o [en el caso de los hemoderivados, incluidos sangre y plasma porcinos secados por vaporización y destinados a la producción de piensos para cerdos, a un tratamiento térmico a una temperatura mínima de 80 °C en toda su masa, y la humedad de la sangre y el plasma secos no supera el 8 % p/p con una actividad del agua (Aw) inferior a 0,60;] II.6. el producto final: (2) bien [está envasado en recipientes nuevos o esterilizados;] (2) o [se ha transportado a granel en contenedores u otros medios de transporte cuidadosamente limpiados y desinfectados con un desinfectante aprobado por la autoridad competente antes de su utilización,] y está etiquetado con la indicación “NO APTO PARA EL CONSUMO HUMANO”; II.7. el producto final se ha almacenado en un lugar cerrado; II.8. el producto final ha sido objeto de todas las precauciones necesarias para evitar su contaminación con agentes patógenos después del tratamiento; (2) y [en el caso de los hemoderivados, incluidos sangre y plasma porcinos secados por vaporización y destinados a la producción de piensos para cerdos, se ha almacenado en seco a temperatura ambiente durante un mínimo de 6 semanas;] II.9. han sido examinados bajo la responsabilidad de la autoridad competente antes del envío, en almacenamiento o a la salida del almacén, tomando al azar una muestra que cumplía las normas siguientes (4): Salmonella: ausente en 25 g: n = 5, c = 0, m = 0, M = 0 Enterobacteriaceae: n = 5, c = 2, m = 10, M = 300 en 1 gramo; Parte II: Certificación  Texto de la imagen
Texto de la imagen
PAÍS Hemoderivados no destinados al consumo humano que puedan utilizarse como ingredientes para piensos II. Información sanitaria II.a. Número de referencia del certificado II.b. (2) [II.10. los hemoderivados descritos (2) bien [proceden de rumiantes distintos de los bovinos, ovinos o caprinos.]] (2) o [proceden de bovinos, ovinos o caprinos y no contienen ni se han obtenido de: (2) bien [materiales de bovino, ovino y caprino que no se hayan obtenido de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]] (2) o [a) material especificado de riesgo según se define en el punto 1 del anexo V del Reglamento (CE) n.o 999/2001/UE del Parlamento Europeo y del Consejo (5); b) carne separada mecánicamente obtenida de huesos de bovino, ovino o caprino, excepto de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE de la Comisión (6), y donde no ha habido ningún caso autóctono de EEB; c) subproductos animales o productos derivados obtenidos de bovinos, ovinos o caprinos a los que se ha dado muerte, previo aturdimiento, por laceración del tejido nervioso central mediante la introducción de un instrumento en forma de vara alargada en la cavidad craneal, o mediante la inyección de gas en la cavidad craneal, salvo en el caso de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]]] II.11. los hemoderivados descritos: (2) bien [no contienen leche ni productos lácteos de origen ovino o caprino, o no están destinados a la alimentación de animales de granja distintos de los animales de peletería.] (2) o [contienen leche o productos lácteos de origen ovino o caprino y están destinados a la alimentación de animales de granja distintos de los animales de peletería, que: a) provienen de ovinos y caprinos que han permanecido continuamente desde su nacimiento en un país donde se cumplen las siguientes condiciones: i) la tembladera clásica es de notificación obligatoria, ii) existe un sistema de concienciación, vigilancia y seguimiento de la tembladera clásica, iii) se aplican restricciones oficiales a las explotaciones de ovinos o caprinos en caso de sospecha de EET o de confirmación de tembladera clásica, iv) se matan y se destruyen los ovinos y caprinos aquejados de tembladera clásica, v) se ha prohibido alimentar a ovinos y caprinos con harina de carne y huesos o chicharrones, tal como se definen en el Código Sanitario para los Animales Terrestres de la Organización Mundial de Sanidad Animal (OIE), derivados de rumiantes, y la prohibición se ha hecho cumplir de forma efectiva en todo el país durante al menos los 7 años precedentes; b) provienen de explotaciones donde no se han impuesto restricciones oficiales debido a una sospecha de EET; c) provienen de explotaciones en las que no se ha diagnosticado ningún caso de tembladera clásica en los 7 años precedentes, o en las que, tras la confirmación de un caso de tembladera clásica:  Texto de la imagen
Texto de la imagen
PAÍS Hemoderivados no destinados al consumo humano que puedan utilizarse como ingredientes para piensos II. Información sanitaria II.a. Número de referencia del certificado II.b. (2) bien [se han matado y destruido, o se han sacrificado, todos los ovinos y caprinos de la explotación, excepto los machos reproductores de genotipo ARR/ARR, las hembras reproductoras que presentan al menos un alelo ARR y ningún alelo VRQ y otros ovinos que presentan al menos un alelo ARR;] (2) o se han matado y destruido todos los animales con tembladera clásica confirmada, y la explotación se ha sometido durante dos años, como mínimo, desde la fecha de confirmación del último caso de tembladera clásica, a una vigilancia intensificada de las EET, habiendo dado negativo las pruebas de EET realizadas con arreglo a los métodos de laboratorio que figuran en el anexo X, capítulo C, punto 3.2 del Reglamento n.o 999/2001 a que se ha sometido a los siguientes animales mayores de 18 meses, excepto los ovinos de genotipo ARR/ARR: — animales que han sido sacrificados para el consumo humano; y — animales que han muerto o a los que se ha dado muerte en la explotación, pero no en el marco de una campaña de erradicación de la enfermedad.]] II.12. [los hemoderivados descritos contienen subproductos animales, o se han obtenido de ellos, de origen no rumiante y, de acuerdo con la declaración del expedidor a que se hace referencia en la casilla I.1, (2) bien [no están destinados a la alimentación de animales de granja distintos de los animales de peletería.] (2)(7) o [están destinados a la producción de piensos para animales de granja no rumiantes, distintos de los animales de peletería, y el expedidor se ha comprometido a garantizar que el puesto de inspección fronterizo de entrada recibirá los resultados de los análisis efectuados de conformidad con los métodos expuestos en el anexo VI del Reglamento (CE) n.o 152/2009 de la Comisión (8).] Notas Parte I: — Casilla I.6: Persona responsable de la partida en la Unión Europea: esta casilla debe cumplimentarse únicamente si se trata de un certificado de mercancía en tránsito por la Unión Europea; puede cumplimentarse si el certificado se refiere a una mercancía que vaya a ser importada en la Unión Europea. — Casilla I.12: Lugar de destino: esta casilla debe rellenarse únicamente si se trata del certificado de una mercancía en tránsito. los productos en tránsito solo pueden almacenarse en zonas francas, depósitos francos y depósitos aduaneros. — Casilla I.15: número de matrícula (vagones o contenedores de ferrocarril y camiones), número de vuelo (avión) o nombre (buque); deberá aportarse la información si se descarga y vuelve a cargar en la Unión Europea. — Casilla I.19: Indicar el código SA apropiado: 05.11.91, 05.11.99, 35.02 o 35.04. — Casilla I.23: Si se utilizan contenedores a granel, indicar su número y el número del precinto (si procede). — Casilla I.25: uso técnico: cualquier otro distinto de la alimentación para animales de granja, distintos de los animales de peletería, y la producción o la fabricación de alimentos para animales de compañía. — Casillas I.26 y I.27: cumplimentar según se trate de un certificado de tránsito o de importación. — Casilla I.28: especie: elija una de las siguientes opciones: Aves, Ruminantia, Suidae, Mammalia distintos de Ruminantia o Suidae, Pesca, Reptilia.  Texto de la imagen
Texto de la imagen
PAÍS Hemoderivados no destinados al consumo humano que puedan utilizarse como ingredientes para piensos II. Información sanitaria II.a. Número de referencia del certificado II.b. Parte II: (1a) DO L 300 de 14.11.2009, p. 1. (1b) DO L 54 de 26.2.2011, p. 1. (2) Táchese lo que no proceda. (3) Insertar el método 1 a 5 o 7, según proceda. (4) Donde: n = número de muestras por analizar; m = valor umbral del número de bacterias; el resultado se considera satisfactorio si el número de bacterias en todas las muestras no es superior a m; M = valor máximo del número de bacterias; el resultado se considera insatisfactorio si el número de bacterias en una o más muestras es igual o superior a M; y c = número de muestras en las cuales el recuento de bacterias puede situarse entre m y M; la muestra sigue considerándose aceptable si el recuento de bacterias de las demás muestras es igual o inferior a m. (5) DO L 147 de 31.5.2001, p. 1. (6) DO L 172 de 30.6.2007, p. 84. (7) La persona responsable de la partida a que se hace referencia en la casilla I.6 debe garantizar que, en caso de que los hemoderivados descritos en el presente certificado sanitario vayan a utilizarse para producir piensos para animales de granja no rumiantes, distintos de los animales de peletería, la partida debe analizarse, de conformidad con los métodos establecidos en el anexo VI del Reglamento (CE) n.o 152/2009, a fin de verificar la ausencia de componentes de origen animal no autorizados. La información sobre el resultado de ese análisis debe adjuntarse al presente certificado sanitario al presentar la partida a un puesto de inspección fronterizo de la Unión Europea. (8) DO L 54 de 26.2.2009, p. 1. — El color de la tinta de la firma y del sello debe ser diferente del de los caracteres impresos. — Nota para la persona responsable de la partida en la Unión Europea: el presente certificado se expide únicamente a efectos veterinarios y debe acompañar al envío hasta el puesto de inspección fronterizo de entrada en la Unión Europea. Veterinario o inspector oficial Nombre y apellidos (en mayúsculas): Cualificación y cargo: Fecha: Firma: Sello: CAPÍTULO 4, LETRA C Certificado sanitario de hemoderivados sin tratar, exceptuando los de équidos, para la fabricación de productos derivados destinados a usos ajenos a la cadena alimentaria de animales de granja, que se enviarán a la Unión Europea o transitarán por ella (2)  Texto de la imagen
Texto de la imagen
PAÍS: Certificado veterinario para la UE Parte I: Datos de la partida expedida I.1. Expedidor Nombre Dirección Teléfono I.2. Número de referencia del certificado I.2.a. I.3. Autoridad central competente I.4. Autoridad local competente I.5. Destinatario Nombre Dirección Código postal Teléfono I.6. Persona responsable de la partida en la UE Nombre Dirección Código postal Teléfono I.7. País de origen Código ISO I.8. Región de origen Código I.9. País de destino Código ISO I.10. Región de destino Código I.11. Lugar de origen Nombre Número de autorización Dirección Nombre Número de autorización Dirección Nombre Número de autorización Dirección I.12. Lugar de destino Depósito aduanero Nombre Número de autorización Dirección Código postal I.13. Lugar de carga I.14. Fecha de salida I.15. Medios de transporte Avión Buque Vagón de ferrocarril Vehículo de carretera Otros Identificación Referencias documentales I.16. PIF de entrada en la UE I.17. I.18. Descripción de la mercancía I.19. Código de la mercancía (código SA) I.20. Cantidad I.21. Temperatura de los productos Ambiente De refrigeración De congelación I.22. Número de bultos I.23. Número del precinto/recipiente I.24. Tipo de embalaje  Texto de la imagen
Texto de la imagen
I.25. Mercancías certificadas para: Uso técnico I.26. Para tránsito por la UE hacia un tercer país Tercer país Código ISO I.27. Para importación o admisión en la UE I.28. Identificación de las mercancías Número de autorización de los establecimientos Especie (nombre científico) Fábrica Número de lote  Texto de la imagen
Texto de la imagen
PAÍS Hemoderivados sin tratar, exceptuando los de équidos, para la fabricación de productos derivados destinados a usos ajenos a la cadena alimentaria de animales de granja II. Información sanitaria II.a. Número de referencia del certificado II.b. El veterinario oficial abajo firmante declara haber leído y comprendido el Reglamento (CE) n.o 1069/2009 del Parlamento Europeo y del Consejo (1a), y en particular su artículo 8, letras c) y d), y su artículo 10, y el Reglamento (UE) n.o 142/2011 de la Comisión (1b), y en particular su anexo XIV, capítulo II, y certifica que los hemoderivados descritos: II.1. son hemoderivados que cumplen los requisitos sanitarios que se indican más abajo; II.2. son exclusivamente hemoderivados que no se destinan al consumo humano o animal; II.3. han sido elaborados y almacenados en una planta supervisada por la autoridad competente o en el establecimiento de recogida exclusivamente a partir de los subproductos animales siguientes: (2) bien [- la sangre de animales sacrificados, considerada apta para el consumo humano de conformidad con la legislación de la Unión, pero que no se destina a este fin por motivos comerciales;] (2) y/o [- la sangre de animales sacrificados, declarada no apta para el consumo humano de conformidad con la legislación de la Unión, pero que no presentaba ningún signo de enfermedad transmisible a personas o animales, procedente de canales de animales sacrificados en un matadero después de haber sido considerados aptos para el consumo humano a raíz de una inspección ante mortem de conformidad con la legislación de la Unión;] (2) y/o [- la sangre de animales sacrificados que no presentaban ningún signo de enfermedad transmisible a personas o animales, obtenida de animales que hayan sido sacrificados en un matadero después de haber sido considerados aptos para el consumo humano a raíz de una inspección ante mortem de conformidad con la legislación de la Unión;] (2) y/o [- la sangre y los hemoderivados procedentes de la elaboración de productos destinados al consumo humano;] (2) y/o [- la sangre y los hemoderivados procedentes de animales vivos que no presentaban signos de ninguna enfermedad transmisible a través de estos productos a personas o animales;] (2) y/o [- los subproductos animales derivados de animales que se hayan sometido a un tratamiento ilegal, tal como se define en el artículo 1, apartado 2, letra d), de la Directiva 96/22/CE del Consejo (2a) o en el artículo 2, letra b), de la Directiva 96/23/CE del Consejo (2b);] (2) y/o [- los subproductos animales que contengan residuos de otras sustancias y contaminantes medioambientales enumerados en el grupo B (3) del anexo I de la Directiva 96/23/CE, si el nivel de dichos residuos es superior al nivel permitido fijado en la legislación de la Unión o, en su defecto, en la legislación nacional; II.4. la sangre a partir de la cual se han elaborado tales productos fue recogida en mataderos autorizados con arreglo a la normativa de la Unión, en mataderos autorizados y supervisados por la autoridad competente del país de recogida, o de animales vivos en instalaciones autorizadas y supervisadas por la autoridad competente del país de la recogida; (2) [II.5. en el caso de los hemoderivados de animales pertenecientes a los taxones de los artiodáctilos, perisodáctilos y proboscídeos, incluidos los cruces entre sus especies, la sangre se recogió en un país o región en el que no se ha registrado ningún caso de peste bovina, peste de los pequeños rumiantes ni fiebre del Valle del Rift durante al menos los 12 meses previos y en el que no se ha vacunado contra esas enfermedades durante al menos los 12 meses previos; y (2) bien [en terceros países, territorios o partes de los mismos (indicar el código ISO del país, o los códigos (3) de territorios o partes de los mismos) en los que no se ha registrado ningún caso de fiebre aftosa durante al menos los 12 meses previos y en los que no se ha vacunado contra esa enfermedad durante al menos los 12 meses previos, y] (2) o [en terceros países, territorios o partes de los mismos (indicar el código ISO del país, o los códigos (3) de territorios o partes de los mismos) en los que no se ha registrado ningún caso de fiebre aftosa durante al menos los 12 meses previos y en los que se están llevando a cabo y controlando oficialmente programas de vacunación contra esa enfermedad en rumiantes domésticos durante al menos los 12 meses previos (4), y]] Parte II: Certificación  Texto de la imagen
Texto de la imagen
PAÍS Hemoderivados sin tratar, exceptuando los de équidos, para la fabricación de productos derivados destinados a usos ajenos a la cadena alimentaria de animales de granja II. Información sanitaria II.a. Número de referencia del certificado II.b. (2) [II.5.1. en el caso de los animales distintos de los suidos y los tayasuidos, en terceros países o regiones en los que: (2) bien [no se ha registrado ningún caso de estomatitis vesicular ni de lengua azul (2) (incluida la presencia de animales seropositivos) como mínimo en los 12 meses previos y no se ha vacunado contra esas enfermedades durante al menos los 12 meses previos;] (2) o [hay animales seropositivos a la estomatitis vesicular y a la lengua azul (2) (4);]] (2) [II.5.2. en el caso de los suidos y los tayasuidos, en los terceros países o regiones en que no se ha registrado ningún caso de enfermedad vesicular porcina, peste porcina clásica y peste porcina africana al menos en los 12 meses previos y no se han vacunado contra esas enfermedades las especies sensibles al menos en los 12 meses previos, y (2) bien [no se ha registrado ningún caso de estomatitis vesicular (incluida la presencia de animales seropositivos) como mínimo en los 12 meses previos y no se ha vacunado contra esa enfermedad durante al menos los 12 meses previos;]] (2) o [hay animales seropositivos a la estomatitis vesicular (4);]]] (2) [II.6. en el caso de los hemoderivados de aves de corral u otras especies aviares, los animales y los productos proceden del territorio de un país o de una región con el código (5) que han estado indemnes de la enfermedad de Newcastle y de la gripe aviar altamente patógena, tal como se define en el Código Sanitario para los Animales Terrestres de la OIE, que al menos en los 12 meses previos no han realizado vacunaciones contra la gripe aviar, en los que los animales de los que proceden los productos no fueron vacunados contra la enfermedad de Newcastle con vacunas preparadas a partir de una cepa madre del virus de la enfermedad de Newcastle con una patogenicidad superior a la de las cepas lentógenas del virus;] II.7. los hemoderivados han sido: (2) bien [envasados en bolsas o botellas nuevas o esterilizadas;] (2) o [se han transportado a granel en contenedores u otros medios de transporte cuidadosamente limpiados y desinfectados con un desinfectante aprobado por la autoridad competente antes de su utilización,] el envase exterior o los contenedores llevan etiquetas con la indicación “NO APTO PARA EL CONSUMO HUMANO O ANIMAL”; II.8. los hemoderivados se han almacenado en un lugar cerrado; II.9. se han tomado todas las precauciones para evitar su contaminación con agentes patógenos durante el transporte; (2) [II.10. los hemoderivados sin tratar descritos (2) bien [proceden de rumiantes distintos de los bovinos, ovinos o caprinos.]] (2) o [proceden de bovinos, ovinos o caprinos y no contienen ni se han obtenido de: (2) bien [materiales de bovino, ovino y caprino que no se hayan obtenido de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]] (2) o [a) material especificado de riesgo según se define en el punto 1 del anexo V del Reglamento (CE) n.o 999/2001/UE del Parlamento Europeo y del Consejo (6); b) carne separada mecánicamente obtenida de huesos de bovino, ovino o caprino, excepto de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE de la Comisión (7), y donde no ha habido ningún caso autóctono de EEB;  Texto de la imagen
Texto de la imagen
PAÍS Hemoderivados sin tratar, exceptuando los de équidos, para la fabricación de productos derivados destinados a usos ajenos a la cadena alimentaria de animales de granja II. Información sanitaria II.a. Número de referencia del certificado II.b. c) subproductos animales o productos derivados obtenidos de bovinos, ovinos o caprinos a los que se ha dado muerte, previo aturdimiento, por laceración del tejido nervioso central mediante la introducción de un instrumento en forma de vara alargada en la cavidad craneal, o mediante la inyección de gas en la cavidad craneal, salvo en el caso de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]]] Notas Parte I: — Casilla I.6: Persona responsable de la partida en la Unión Europea: esta casilla debe cumplimentarse únicamente si se trata de un certificado de mercancía en tránsito por la Unión Europea; puede cumplimentarse si el certificado se refiere a una mercancía que vaya a ser importada en la Unión Europea. — Casillas I.11 y I.12: Número de autorización: el número de registro del establecimiento o planta, asignado por la autoridad competente. — Casilla I.12: Lugar de destino: esta casilla debe rellenarse únicamente si se trata del certificado de una mercancía en tránsito. los productos en tránsito solo pueden almacenarse en zonas francas, depósitos francos y depósitos aduaneros. — Casilla I.15: indicar la matrícula (vagones o contenedores de ferrocarril y camiones), el número de vuelo (avión) o el nombre (buque). En caso de que la mercancía se descargue y se vuelva a cargar en la Unión Europea, el expedidor debe informar al puesto de inspección fronterizo de entrada en la Unión Europea. — Casilla I.19: Utilizar el código correspondiente del Sistema Armonizado (SA) de las partidas siguientes: 05.11, 30.02 o 35.02. — Casilla I.23: si se utilizan contenedores a granel, indicar su número y el número del precinto (si procede). — Casilla I.25: uso técnico: cualquier otro distinto de la alimentación para animales de granja, distintos de los animales de peletería, y la producción o la fabricación de alimentos para animales de compañía. — Casillas I.26 y I.27: cumplimentar según se trate de un certificado de tránsito o de importación. — Casilla I.28.: especie: elija una de las siguientes opciones: Aves, Ruminantia, Suidae, Mammalia distintos de Ruminantia o Suidae, Pesca, Reptilia. Parte II: (1a) DO L 300 de 14.11.2009, p. 1. (1b) DO L 54 de 26.2.2011, p. 1. (2) Táchese lo que no proceda. (2a) DO L 125 de 23.5.1996, p. 3. (2b) DO L 125 de 23.5.1996, p. 10. (3) Indicar el código de territorio tal como figura en el anexo II, parte 1, del Reglamento (UE) n.o 206/2010 (DO L 73 de 20.3.2010, p. 1). (4) En este caso, tras los controles veterinarios previstos en la Directiva 97/78/CE (DO L 24 de 30.1.1998, p. 9), los productos deberán transportarse directamente a el establecimiento del lugar de destino, de conformidad con las condiciones establecidas en el artículo 8, apartado 4, de dicha Directiva.  Texto de la imagen
Texto de la imagen
PAÍS Hemoderivados sin tratar, exceptuando los de équidos, para la fabricación de productos derivados destinados a usos ajenos a la cadena alimentaria de animales de granja II. Información sanitaria II.a. Número de referencia del certificado II.b. (5) Indicar el código de territorio tal como figura en el anexo I, parte 1, del Reglamento (CE) n.o 798/2008 de la Comisión (DO L 226 de 23.8.2008, p. 1). (6) DO L 147 de 31.5.2001, p. 1. (7) DO L 172 de 30.6.2007, p. 84. — El color de la tinta de la firma y del sello debe ser diferente del de los caracteres impresos. — Nota para la persona responsable de la partida en la Unión Europea: el presente certificado se expide únicamente a efectos veterinarios y debe acompañar al envío hasta el puesto de inspección fronterizo de entrada en la Unión Europea. Veterinario o inspector oficial Nombre y apellidos (en mayúsculas): Cualificación y cargo: Fecha: Firma: Sello: CAPÍTULO 4, LETRA D Certificado sanitario de hemoderivados tratados, exceptuando los de équidos, para la fabricación de productos derivados destinados a usos ajenos a la cadena alimentaria de animales de granja, que se enviarán a la Unión Europea o transitarán por ella (2)  Texto de la imagen
Texto de la imagen
PAÍS: Certificado veterinario para la UE Parte I: Datos de la partida expedida I.1. Expedidor Nombre Dirección Teléfono I.2. Número de referencia del certificado I.2.a. I.3. Autoridad central competente I.4. Autoridad local competente I.5. Destinatario Nombre Dirección Código postal Teléfono I.6. Persona responsable de la partida en la UE Nombre Dirección Código postal Teléfono I.7. País de origen Código ISO I.8. Región de origen Código I.9. País de destino Código ISO I.10. Región de destino Código I.11. Lugar de origen Nombre Número de autorización Dirección Nombre Número de autorización Dirección Nombre Número de autorización Dirección I.12. Lugar de destino Depósito aduanero Nombre Número de autorización Dirección Código postal I.13. Lugar de carga I.14. Fecha de salida I.15. Medios de transporte Avión Buque Vagón de ferrocarril Vehículo de carretera Otros Identificación Referencias documentales I.16. PIF de entrada en la UE I.17. I.18. Descripción de la mercancía I.19. Código de la mercancía (código SA) I.20. Cantidad I.21. Temperatura de los productos Ambiente De refrigeración De congelación I.22. Número de bultos I.23. Número del precinto/recipiente I.24. Tipo de embalaje  Texto de la imagen
Texto de la imagen
I.25. Mercancías certificadas para: Uso técnico I.26. Para tránsito por la UE hacia un tercer país Tercer país Código ISO I.27. Para importación o admisión en la UE I.28. Identificación de las mercancías Número de autorización de los establecimientos Especie (nombre científico) Fábrica Número de lote  Texto de la imagen
Texto de la imagen
PAÍS Hemoderivados tratados, exceptuando los de équidos, para la fabricación de productos derivados destinados a usos ajenos a la cadena alimentaria de animales de granja II. Información sanitaria II.a. Número de referencia del certificado II.b. El veterinario oficial abajo firmante declara haber leído y comprendido el Reglamento (CE) n.o 1069/2009 del Parlamento Europeo y del Consejo (1a), y en particular su artículo 8, letras c) y d), y su artículo 10, y el Reglamento (UE) n.o 142/2011 de la Comisión (1b), y en particular u anexo XIV, capítulo II, y certifica que los hemoderivados descritos: II.1. son hemoderivados que cumplen los requisitos sanitarios que se indican más abajo; II.2. son exclusivamente hemoderivados que no se destinan al consumo humano o animal; II.3. han sido elaborados y almacenados en una planta supervisada por la autoridad competente, exclusivamente a partir de los subproductos animales siguientes: (2) bien [- la sangre de animales sacrificados, considerada apta para el consumo humano de conformidad con la legislación de la Unión, pero que no se destina a este fin por motivos comerciales;] (2) y/o [- la sangre de animales sacrificados, declarada no apta para el consumo humano de conformidad con la legislación de la Unión, pero que no presentaba ningún signo de enfermedad transmisible a personas o animales, procedente de canales de animales sacrificados en un matadero después de haber sido considerados aptos para el consumo humano a raíz de una inspección ante mortem de conformidad con la legislación de la Unión;] (2) y/o [- la sangre de animales sacrificados que no presentaban ningún signo de enfermedad transmisible a personas o animales, obtenida de animales que hayan sido sacrificados en un matadero después de haber sido considerados aptos para el consumo humano a raíz de una inspección ante mortem de conformidad con la legislación de la Unión;] (2) y/o [- sangre y hemoderivados procedentes de animales vivos que no presentaban signos clínicos de ninguna enfermedad transmisible a los seres humanos o los animales a través de estos productos;] (2) y/o [- la sangre y los hemoderivados procedentes de la elaboración de productos destinados al consumo humano;] (2) y/o [- subproductos animales que se han obtenido de animales que se hayan sometido a un tratamiento ilegal, tal como se define en el artículo 1, apartado 2, letra d), de la Directiva 96/22/CE del Consejo (2a) o en el artículo 2, letra b), de la Directiva 96/23/CE del Consejo (2b);] (2) y/o [- los subproductos animales que contengan residuos de otras sustancias y contaminantes medioambientales enumerados en el grupo B(3) del anexo I de la Directiva 96/23/CE, si el nivel de dichos residuos es superior al nivel permitido fijado en la legislación de la Unión o, en su defecto, en la legislación nacional;] II.4. la sangre a partir de la cual se han elaborado estos productos fue recogida en mataderos autorizados con arreglo a la normativa de la Unión, en mataderos autorizados y supervisados por la autoridad competente del país de recogida, o de animales vivos en instalaciones autorizadas y supervisadas por la autoridad competente del país de la recogida; (2) [II.5. en el caso de los hemoderivados de artiodáctilos, perisodáctilos y proboscídeos, incluidos sus cruces, con excepción de los suidos y los tayasuidos, los productos se han sometido a uno de los tratamientos que se indican a continuación, garantizándose así la ausencia de agentes patógenos de la fiebre aftosa, la estomatitis vesicular, la peste bovina, la peste de los pequeños rumiantes, la fiebre del Valle del Rift y la fiebre catarral: (2) bien [tratamiento térmico a una temperatura de 65 °C durante por lo menos tres horas, seguido de un control de eficacia;] (2) y/o [irradiación a 25 kGy mediante rayos gamma, seguida de un control de eficacia;] (2) y/o [modificación del pH a 5 durante dos horas, seguida de un control de eficacia;] (2) y/o [tratamiento térmico a una temperatura mínima de 80 °C en toda su masa, seguido de un control de eficacia.]] Parte II: Certificación  Texto de la imagen
Texto de la imagen
PAÍS Hemoderivados tratados, exceptuando los de équidos, para la fabricación de productos derivados destinados a usos ajenos a la cadena alimentaria de animales de granja II. Información sanitaria II.a. Número de referencia del certificado II.b. (2) [II.6. en el caso de los hemoderivados de suidos, tayasuidos, aves de corral u otras especies aviares, los productos se han sometido a uno de los siguientes tratamientos, garantizándose así la ausencia de agentes patógenos de las enfermedades siguientes: fiebre aftosa, estomatitis vesicular, enfermedad vesicular porcina, peste porcina clásica, peste porcina africana, enfermedad de Newcastle y gripe aviar altamente patógena, según proceda en función de las especies; (2) bien [tratamiento térmico a una temperatura de 65 °C durante por lo menos tres horas, seguido de un control de eficacia;] (2) y/o [irradiación a 25 kGy mediante rayos gamma, seguida de un control de eficacia;] (2) y/o [tratamiento térmico a una temperatura mínima de 80 °C, en el caso de los suidos/tayasuidos (2), y de 70 °C, en el caso de las aves de corral y otras especies aviares (2), en toda su masa, seguido de un control de eficacia;]] (2) [II.7. en el caso de los hemoderivados de especies distintas de las enumeradas en los puntos II.5 o II.6, los productos se han sometido al siguiente tratamiento (especificar): ] II.8. los productos han sido: (2) bien [envasados en bolsas o botellas nuevas o esterilizadas;] (2) o [transportados a granel en contenedores u otros medios de transporte cuidadosamente limpiados y desinfectados con un desinfectante aprobado por la autoridad competente antes de su utilización;] y el envase exterior o los contenedores llevan etiquetas con la indicación “NO APTO PARA EL CONSUMO HUMANO O ANIMAL”; II.9. los hemoderivados se han almacenado en un lugar cerrado; II.10. se han tomado todas las precauciones necesarias para evitar su contaminación con agentes patógenos después del tratamiento; (2) [II.11. los hemoderivados tratados descritos (2) bien [proceden de rumiantes distintos de los bovinos, ovinos o caprinos.]] (2) o [proceden de bovinos, ovinos o caprinos y no contienen ni se han obtenido de: (2) bien [materiales de bovino, ovino y caprino que no se hayan obtenido de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]] (2) o [a) material especificado de riesgo según se define en el punto 1 del anexo V del Reglamento (CE) n.o 999/2001/UE del Parlamento Europeo y del Consejo (3); b) carne separada mecánicamente obtenida de huesos de bovino, ovino o caprino, excepto de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE de la Comisión (4), y donde no ha habido ningún caso autóctono de EEB; c) subproductos animales o productos derivados obtenidos de bovinos, ovinos o caprinos a los que se ha dado muerte, previo aturdimiento, por laceración del tejido nervioso central mediante la introducción de un instrumento en forma de vara alargada en la cavidad craneal, o mediante la inyección de gas en la cavidad craneal, salvo en el caso de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]]]  Texto de la imagen
Texto de la imagen
PAÍS Hemoderivados tratados, exceptuando los de équidos, para la fabricación de productos derivados destinados a usos ajenos a la cadena alimentaria de animales de granja II. Información sanitaria II.a. Número de referencia del certificado II.b. Notas Parte I: — Casilla I.6: Persona responsable de la partida en la Unión Europea: esta casilla debe cumplimentarse únicamente si se trata de un certificado de mercancía en tránsito por la Unión Europea; puede cumplimentarse si el certificado se refiere a una mercancía que vaya a ser importada en la Unión Europea. — Casillas I.11 y I.12: Número de autorización: el número de registro del establecimiento o planta, asignado por la autoridad competente. — Casilla I.12: Lugar de destino: esta casilla debe rellenarse únicamente si se trata del certificado de una mercancía en tránsito. los productos en tránsito solo pueden almacenarse en zonas francas, depósitos francos y depósitos aduaneros. — Casilla I.15: indicar la matrícula (vagones o contenedores de ferrocarril y camiones), el número de vuelo (avión) o el nombre (buque). En caso de que la mercancía se descargue y se vuelva a cargar en la Unión Europea, el expedidor debe informar al puesto de inspección fronterizo de entrada en la Unión Europea. — Casilla I.19: Utilizar el código correspondiente del Sistema Armonizado (SA) de las partidas siguientes: 05.11, 30.02, 35.02 o 35.04. — Casilla I.23: si se utilizan contenedores a granel, indicar su número y el número del precinto (si procede). — Casilla I.25: uso técnico: cualquier otro distinto de la alimentación para animales de granja, distintos de los animales de peletería, y la producción o la fabricación de alimentos para animales de compañía. — Casillas I.26 y I.27: cumplimentar según se trate de un certificado de tránsito o de importación. — Casilla I.28., especie: elija una de las siguientes opciones: Aves, Ruminantia, Suidae, Mammalia distintos de Ruminantia o Suidae, Pesca, Reptilia. Parte II: (1a) DO L 300 de 14.11.2009, p. 1. (1b) DO L 54 de 26.2.2011, p. 1. (2) Táchese lo que no proceda. (2a) DO L 125 de 23.5.1996, p. 3. (2b) DO L 125 de 23.5.1996, p. 10. (3) DO L 147 de 31.5.2001, p. 1. (4) DO L 172 de 30.6.2007, p. 84. — El color de la tinta de la firma y del sello debe ser diferente del de los caracteres impresos. — Nota para la persona responsable de la partida en la Unión Europea: el presente certificado se expide únicamente a efectos veterinarios y debe acompañar al envío hasta el puesto de inspección fronterizo de la Unión Europea. Veterinario o inspector oficial Nombre y apellidos (en mayúsculas): Cualificación y cargo: Fecha: Firma: Sello: |
|
3) |
El capítulo 6, letra B, se sustituye por el texto siguiente: «CAPÍTULO 6, LETRA B Certificado sanitario de trofeos de caza u otros preparados de aves y ungulados, consistentes en partes enteras no tratadas, que se enviarán a la Unión Europea o transitarán por ella (2) 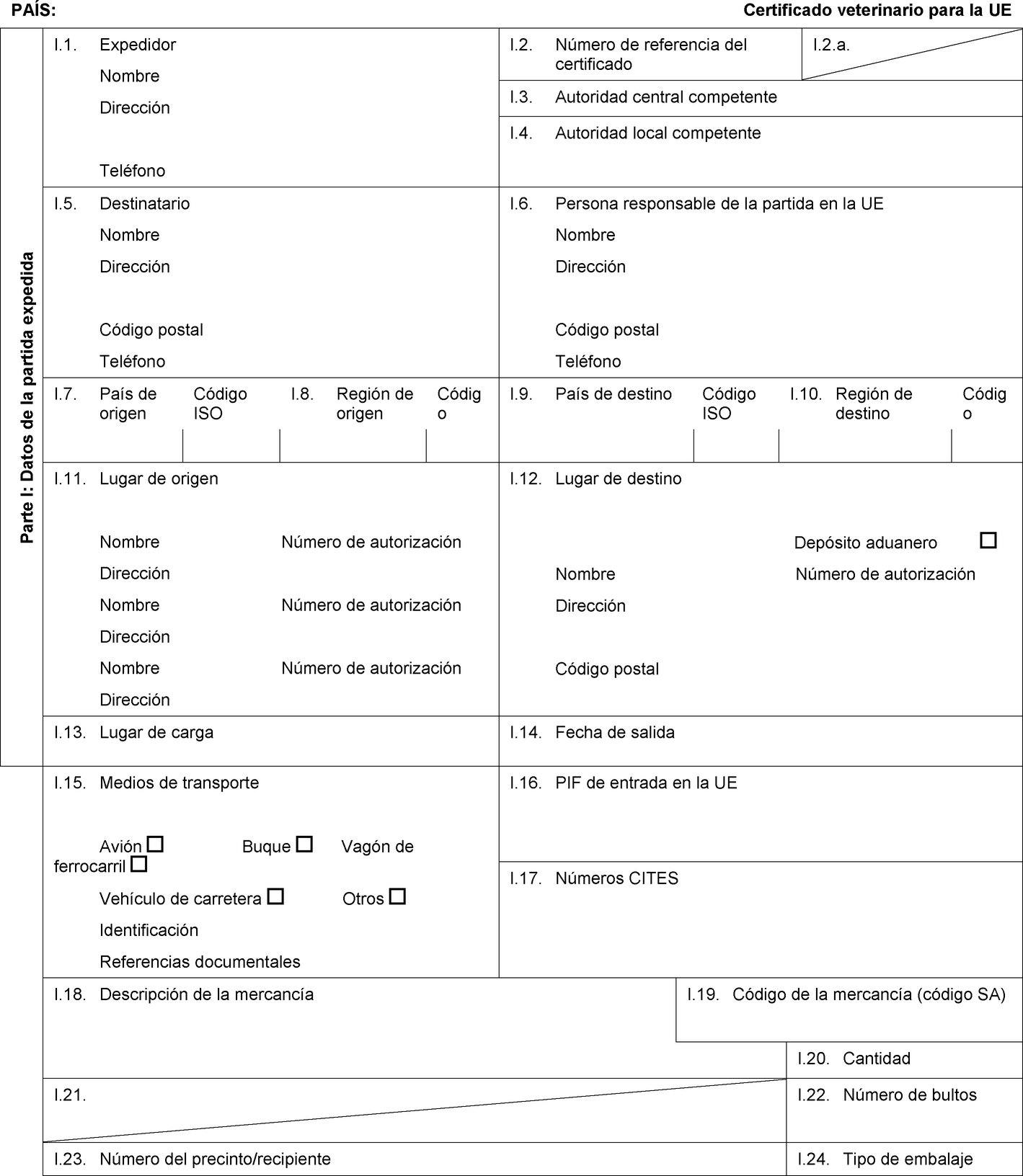 Texto de la imagen
Texto de la imagen
PAÍS: Certificado veterinario para la UE Parte I: Datos de la partida expedida I.1. Expedidor Nombre Dirección Teléfono I.2. Número de referencia del certificado I.2.a. I.3. Autoridad central competente I.4. Autoridad local competente I.5. Destinatario Nombre Dirección Código postal Teléfono I.6. Persona responsable de la partida en la UE Nombre Dirección Código postal Teléfono I.7. País de origen Código ISO I.8. Región de origen Código I.9. País de destino Código ISO I.10. Región de destino Código I.11. Lugar de origen Nombre Número de autorización Dirección Nombre Número de autorización Dirección Nombre Número de autorización Dirección I.12. Lugar de destino Depósito aduanero Nombre Número de autorización Dirección Código postal I.13. Lugar de carga I.14. Fecha de salida I.15. Medios de transporte Avión Buque Vagón de ferrocarril Vehículo de carretera Otros Identificación Referencias documentales I.16. PIF de entrada en la UE I.17. Números CITES I.18. Descripción de la mercancía I.19. Código de la mercancía (código SA) I.20. Cantidad I.21. I.22. Número de bultos I.23. Número del precinto/recipiente I.24. Tipo de embalaje  Texto de la imagen
Texto de la imagen
I.25. Mercancías certificadas para: Uso técnico I.26. Para tránsito por la UE hacia un tercer país Tercer país Código ISO I.27. Para importación o admisión en la UE I.28. Identificación de las mercancías Especie (nombre científico) Número de bultos  Texto de la imagen
Texto de la imagen
PAÍS Trofeos de caza u otros preparados de aves y ungulados consistentes en partes enteras no tratadas II. Información sanitaria II.a. Número de referencia del certificado II.b. El veterinario oficial abajo firmante declara haber leído y comprendido el Reglamento (CE) n.o 1069/2009 del Parlamento Europeo y del Consejo (1a) y el Reglamento (UE) n.o 142/2011 de la Comisión (1b), y en particular su anexo XIV, capítulo II, y certifica que los trofeos de caza descritos: (2) bien [II.1. por lo que respecta a los trofeos de caza u otros preparados de animales de pezuña hendida, salvo los porcinos: a) (región) ha estado indemne de fiebre aftosa y peste bovina al menos durante los 12 meses previos, período durante el que no se ha vacunado contra ninguna de estas enfermedades, y b) los trofeos de caza u otros preparados descritos: i) proceden de animales cazados en el territorio de dicha región, que está autorizada a exportar a la Unión Europea carne fresca de las especies domésticas sensibles correspondientes y que, en los 60 días previos, no ha estado sujeta a restricciones de sanidad animal consecutivas a brotes de enfermedades a las que sean sensibles estos animales, y ii) proceden de animales cazados a una distancia de al menos 20 km de la frontera de un tercer país, o parte del mismo, que no está autorizado a exportar a la Unión Europea trofeos de caza no tratados de animales de pezuña hendida diferentes de los porcinos;] (2) o [II.1. por lo que respecta a los trofeos de caza u otros preparados de jabalíes: a) (región) ha estado indemne de peste porcina clásica, peste porcina africana, enfermedad vesicular porcina, fiebre aftosa y encefalomielitis enteroviral porcina (enfermedad de Teschen) durante los 12 meses previos, período durante el que no se ha vacunado contra ninguna de esas enfermedades, y b) los trofeos de caza u otros preparados descritos: i) proceden de animales cazados en ese territorio, que está autorizado a exportar a la Unión Europea carne fresca de las especies domésticas sensibles correspondientes y que, en los 60 días previos, no ha estado sujeto a restricciones de sanidad animal consecutivas a brotes de enfermedades a las que sean sensibles estos porcinos, y ii) proceden de animales cazados a una distancia de al menos 20 km de la frontera de un tercer país, o parte del mismo, que no está autorizado a exportar a la Unión Europea trofeos de caza no tratados de jabalíes;] (2) o [II.1. por lo que respecta a los trofeos de caza u otros preparados de solípedos, los trofeos de caza u otros preparados descritos se han obtenido de solípedos silvestres cazados en el territorio del país exportador mencionado más arriba;] (2) o [II.1. por lo que respecta a los trofeos de caza u otros preparados de aves de caza: a) (región) está libre de gripe aviar altamente patógena y de la enfermedad de Newcastle, y b) los trofeos de caza u otros preparados descritos han sido obtenidos de aves de caza silvestres cazadas en esa región, que en los 30 días previos no ha estado sujeta a restricciones de sanidad animal consecutivas a brotes de enfermedades a las que sean sensibles estas aves;] II.2. los trofeos de caza u otros preparados descritos han sido envasados sin haber estado en contacto con otros productos de origen animal que pudieran contaminarlos, en envases individuales, transparentes y cerrados para evitar cualquier contaminación posterior; Parte II: Certificación  Texto de la imagen
Texto de la imagen
PAÍS Trofeos de caza u otros preparados de aves y ungulados consistentes en partes enteras no tratadas II. Información sanitaria II.a. Número de referencia del certificado II.b. (2) [II.3. los trofeos de caza u otros preparados descritos (2) bien [proceden de rumiantes distintos de los bovinos, ovinos o caprinos.]] (2) o [proceden de bovinos, ovinos o caprinos y no contienen ni se han obtenido de: (2) bien [materiales de bovino, ovino y caprino que no se hayan obtenido de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]] (2) o [a) material especificado de riesgo según se define en el punto 1 del anexo V del Reglamento (CE) n.o 999/2001/UE del Parlamento Europeo y del Consejo (3); b) carne separada mecánicamente obtenida de huesos de bovino, ovino o caprino, excepto de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE de la Comisión (4), y donde no ha habido ningún caso autóctono de EEB; c) subproductos animales o productos derivados obtenidos de bovinos, ovinos o caprinos a los que se ha dado muerte, previo aturdimiento, por laceración del tejido nervioso central mediante la introducción de un instrumento en forma de vara alargada en la cavidad craneal, o mediante la inyección de gas en la cavidad craneal, salvo en el caso de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]]] Notas Parte I: — Casilla I.6: Persona responsable de la partida en la Unión Europea: esta casilla debe cumplimentarse únicamente si se trata de un certificado de mercancía en tránsito por la Unión Europea; puede cumplimentarse si el certificado se refiere a una mercancía que vaya a ser importada en la Unión Europea. — Casillas I.11 y I.12: Número de autorización: el número de registro del establecimiento o planta, asignado por la autoridad competente. — Casilla I.12: Lugar de destino: esta casilla debe rellenarse únicamente si se trata de un certificado de mercancía en tránsito. los productos en tránsito solo pueden almacenarse en zonas francas, depósitos francos y depósitos aduaneros. — Casilla I.15: número de matrícula (vagones o contenedores de ferrocarril y camiones), número de vuelo (avión) o nombre (buque); deberá aportarse la información si se descarga y vuelve a cargar en la Unión Europea. — Casilla I.19: Indicar el código SA apropiado: 05.05, 05.06, 05.07, 05.11, 96.01 o 97.05. — Casilla I.23: si se utilizan contenedores a granel, indicar su número y el número del precinto (si procede). — Casilla I.25: uso técnico: cualquier otro distinto de la alimentación animal. — Casillas I.26 y I.27: cumplimentar según se trate de un certificado de tránsito o de importación. — Casilla I.28: especie: elija una de las siguientes opciones: Aves, Equidae, Tapiridae, Rhinoceritidae, Antilocapridae, Bovidae, Camelidae, Cervidae, Giraffidae, Hippopotamidae, Moschidae, Suidae, Tayassuidae, Tragulidae y Elephantidae.  Texto de la imagen
Texto de la imagen
PAÍS Trofeos de caza u otros preparados de aves y ungulados consistentes en partes enteras no tratadas II. Información sanitaria II.a. Número de referencia del certificado II.b. Parte II: (1a) DO L 300 de 14.11.2009, p. 1. (1b) DO L 54 de 26.2.2011, p. 1. (2) Táchese lo que no proceda. (3) DO L 147 de 31.5.2001, p. 1. (4) DO L 172 de 30.6.2007, p. 84. — El color de la tinta de la firma y del sello debe ser diferente del de los caracteres impresos. — Nota para la persona responsable de la partida en la Unión Europea: el presente certificado se expide únicamente a efectos veterinarios y debe acompañar al envío hasta el puesto de inspección fronterizo de entrada en la Unión Europea. Veterinario o inspector oficial Nombre y apellidos (en mayúsculas): Cualificación y cargo: Fecha: Firma: Sello: |
|
4) |
El capítulo 8 se sustituye por el texto siguiente: «CAPÍTULO 8 Certificado sanitario de subproductos animales para usos ajenos a la cadena alimentaria animal, o para muestras comerciales (2), que se enviarán a la Unión Europea o transitarán por ella (2) 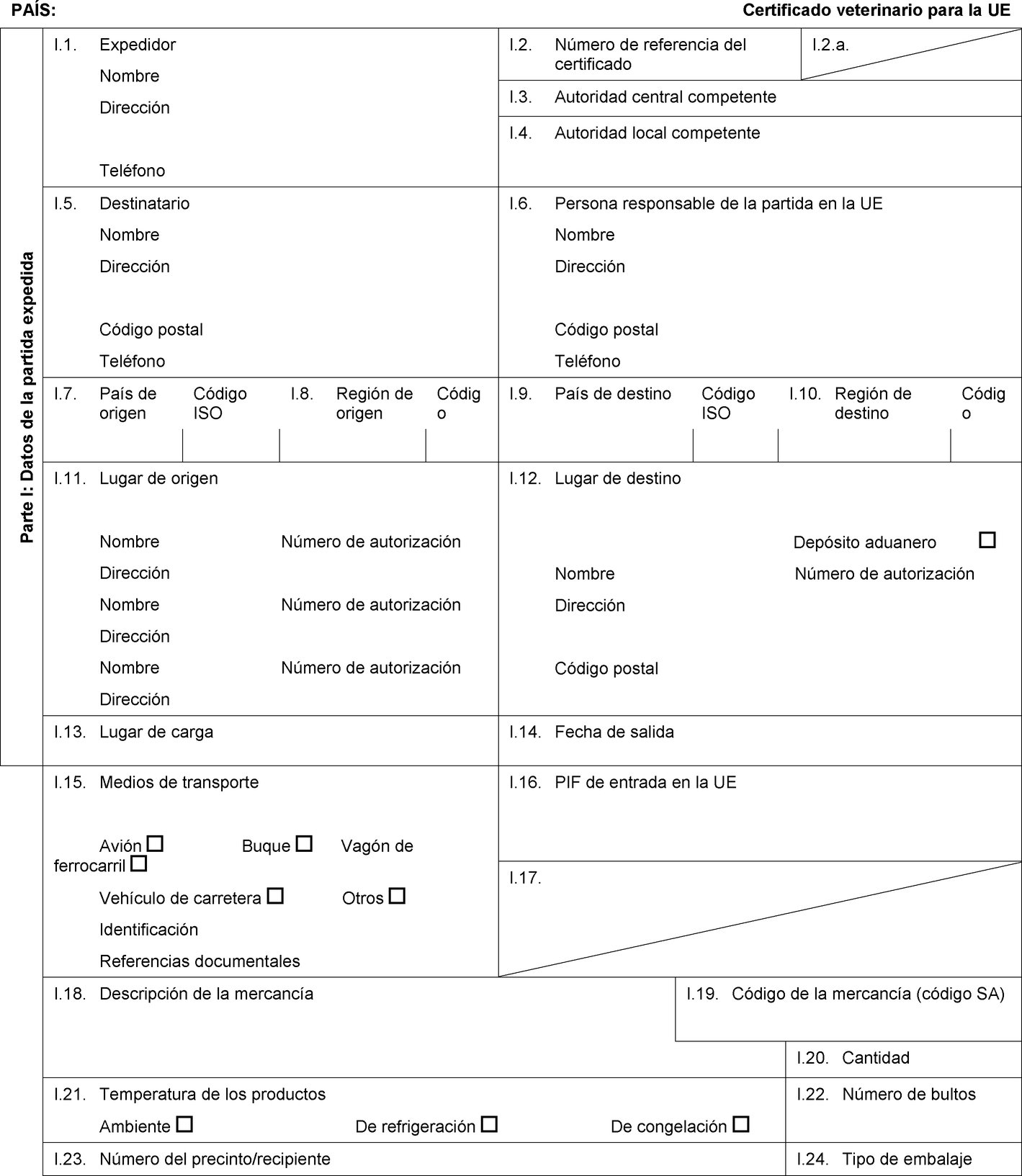 Texto de la imagen
Texto de la imagen
PAÍS: Certificado veterinario para la UE Parte I: Datos de la partida expedida I.1. Expedidor Nombre Dirección Teléfono I.2. Número de referencia del certificado I.2.a. I.3. Autoridad central competente I.4. Autoridad local competente I.5. Destinatario Nombre Dirección Código postal Teléfono I.6. Persona responsable de la partida en la UE Nombre Dirección Código postal Teléfono I.7. País de origen Código ISO I.8. Región de origen Código I.9. País de destino Código ISO I.10. Región de destino Código I.11. Lugar de origen Nombre Número de autorización Dirección Nombre Número de autorización Dirección Nombre Número de autorización Dirección I.12. Lugar de destino Depósito aduanero Nombre Número de autorización Dirección Código postal I.13. Lugar de carga I.14. Fecha de salida I.15. Medios de transporte Avión Buque Vagón de ferrocarril Vehículo de carretera Otros Identificación Referencias documentales I.16. PIF de entrada en la UE I.17. I.18. Descripción de la mercancía I.19. Código de la mercancía (código SA) I.20. Cantidad I.21. Temperatura de los productos Ambiente De refrigeración De congelación I.22. Número de bultos I.23. Número del precinto/recipiente I.24. Tipo de embalaje  Texto de la imagen
Texto de la imagen
I.25. Mercancías certificadas para: Uso técnico I.26. Para tránsito por la UE hacia un tercer país Tercer país Código ISO I.27. Para importación o admisión en la UE I.28. Identificación de las mercancías Número de autorización de los establecimientos Especie (nombre científico) Naturaleza de la mercancía Fábrica Número de bultos Peso neto Número de lote  Texto de la imagen
Texto de la imagen
PAÍS Subproductos animales para la fabricación de productos derivados para usos ajenos a la cadena alimentaria animal, o para muestras comerciales (2) II. Información sanitaria II.a. Número de referencia del certificado II.b. El veterinario oficial abajo firmante declara haber leído y comprendido el Reglamento (CE) n.o 1069/2009 del Parlamento Europeo y del Consejo (1a) y el Reglamento (UE) n.o 142/2011 de la Comisión (1b), y en particular su anexo XIV, capítulo II, y certifica que los subproductos animales descritos: (2) bien [son muestras comerciales consistentes en subproductos animales destinados a estudios o análisis concretos a los que se refiere el anexo I, punto 39, del Reglamento (UE) n.o 142/2011, etiquetados con la indicación “MUESTRA COMERCIAL NO APTA PARA EL CONSUMO HUMANO”.] (2) o [cumplen los requisitos de salud animal establecidos en el punto II.1.]; II.1. los subproductos animales descritos II.1.1. han sido (2) bien [a) obtenidos de materiales importados del tercer país, territorio o parte del mismo (3), autorizado a exportar carne fresca a la Unión Europea;] (2) y/o [b) obtenidos en el país exportador, territorio o parte del mismo (3) de animales que bien i) han permanecido en ese tercer país, territorio o parte del mismo autorizado a exportar carne fresca a la Unión Europea desde su nacimiento o al menos durante los 3 meses previos al sacrificio; y/o ii) han sido cazados en ese tercer país, territorio o parte del mismo (4);] (2) y/o [c) proceden de huevos, leche, roedores, lagomorfos, animales acuáticos o invertebrados terrestres o acuáticos;] (2) [II.1.2. en el caso de materiales distintos de los procedentes de huevos, leche, roedores, lagomorfos, animales acuáticos o invertebrados terrestres o acuáticos, se han obtenido de animales: (2) bien [a) procedentes de explotaciones que: i) no han tenido casos ni brotes de peste bovina, enfermedad vesicular porcina, enfermedad de Newcastle o gripe aviar altamente patógena en los 30 días previos, ni peste porcina clásica o africana en los 40 días previos, entre los animales sensibles a estas enfermedades, como tampoco se han dado en las explotaciones situadas en un radio de 10 km a su alrededor en los 30 días previos; y ii) no han tenido casos ni brotes de fiebre aftosa en los 60 días previos, como tampoco se han dado en las explotaciones situadas en un radio de 25 km a su alrededor en los 30 días previos; y b) que: i) no han sido sacrificados para erradicar epizootias, ii) han permanecido en sus explotaciones de origen al menos durante los 40 días previos a la fecha de su expedición y han sido transportados directamente al matadero sin estar en contacto con otros animales que no cumplían las mismas condiciones sanitarias; iii) han sido sometidos a una inspección sanitaria ante mortem en el matadero en las 24 horas previas a su sacrificio y no presentaban ningún signo de las enfermedades citadas a las que eran sensibles; y iv) han sido tratados en el matadero antes del sacrificio o la matanza, y durante los mismos, de acuerdo con las disposiciones pertinentes de la legislación de la Unión, y que cumplían requisitos al menos equivalentes a los establecidos en los capítulos II y III del Reglamento (CE) n.o 1099/2009 del Consejo (5);] Parte II: Certificación  Texto de la imagen
Texto de la imagen
PAÍS Subproductos animales para la fabricación de productos derivados para usos ajenos a la cadena alimentaria animal, o para muestras comerciales (2) II. Información sanitaria II.a. Número de referencia del certificado II.b. (2) o [a) que han sido cazados en una zona: i) en la que, en un radio de 25 km, no se ha producido entre los animales sensibles a ellas ningún caso ni brote de las enfermedades siguientes: fiebre aftosa, peste bovina, enfermedad de Newcastle o gripe aviar altamente patógena en los 30 días previos, ni peste porcina clásica o africana en los 40 días previos, y ii) situada a más de 20 km de la frontera de otro territorio de un tercer país o parte del mismo que no esté autorizado en esas fechas a exportar a la Unión Europea el material en cuestión; y b) tras su sacrificio han sido transportados en un plazo de 12 horas a un centro de recogida para su refrigeración, e inmediatamente después a un establecimiento de carne de caza, o directamente a este último;] (2) [II.1.3. en el caso de materiales distintos de los derivados de pescado o invertebrados capturados en estado silvestre, se han obtenido en un establecimiento en torno al cual, en un radio de 10 km, no se ha producido en los 30 días previos ningún caso o brote de las enfermedades mencionadas en el punto II.1.2 entre los animales sensibles a ellas o donde, si se ha producido algún caso o brote de una de estas enfermedades, la preparación de las materias primas que vayan a exportarse a la Unión Europea solo se ha autorizado tras la eliminación de toda la carne y la limpieza y desinfección totales del establecimiento bajo el control de un veterinario oficial;] II.1.4. se han obtenido y elaborado sin que entren en contacto con otros materiales que no cumplan las condiciones especificadas, y se han manipulado evitando su contaminación por agentes patógenos; II.1.5. se han envasado en envases nuevos a prueba de pérdidas o en envases limpiados y desinfectados antes de su uso y, en caso de partidas enviadas por vías distintas de la de paquete postal, en recipientes precintados bajo la responsabilidad de la autoridad competente, etiquetados con la indicación «SUBPRODUCTO ANIMAL EXCLUSIVAMENTE PARA FABRICACIÓN DE PRODUCTOS DERIVADOS PARA usos ajenos a la cadena alimentaria ANIMAL» junto con el nombre y la dirección del establecimiento de destino en la Unión Europea; II.1.6. consisten solo en los subproductos animales siguientes: (2) bien [- las canales y partes de animales sacrificados, o los cuerpos o partes de animales cazados, considerados aptos para el consumo humano con arreglo a la legislación de la Unión hasta que, por razones comerciales, sean declarados de manera irreversible subproductos animales;] (2) y/o [- las canales y las siguientes partes de animales sacrificados en un matadero y considerados aptos para el consumo humano a raíz de una inspección ante mortem o los cuerpos y las siguientes partes de animales cazados para el consumo humano de conformidad con la legislación de la Unión: i) las canales o los cuerpos y partes de animales declarados no aptos para el consumo humano de acuerdo con la legislación de la Unión pero que no presentaban ningún signo de enfermedad transmisible a personas o animales; ii) las cabezas de aves de corral; iii) los cueros y pieles, incluidos los recortes y la piel dividida, los cuernos y los pies, incluidas las falanges y los huesos carpianos y metacarpianos, tarsianos y metatarsianos; iv) las cerdas; v) las plumas;] (2) y/o [- los subproductos animales de aves de corral y lagomorfos sacrificados en la explotación de conformidad con el artículo 1, apartado 3, letra d), del Reglamento (CE) n.o 853/2004 del Parlamento Europeo y del Consejo (2a), que no presentaban ningún signo de enfermedad transmisible a personas o animales;] (2) y/o [- sangre de animales que no presentaban ningún signo de enfermedad transmisible por la sangre a personas o animales, obtenida de animales que hayan sido sacrificados en un matadero después de haber sido considerados aptos para el sacrificio para el consumo humano a raíz de una inspección ante mortem de conformidad con la legislación de la Unión;]  Texto de la imagen
Texto de la imagen
PAÍS Subproductos animales para la fabricación de productos derivados para usos ajenos a la cadena alimentaria animal, o para muestras comerciales (2) II. Información sanitaria II.a. Número de referencia del certificado II.b. (2) y/o [- los subproductos animales generados en la elaboración de productos destinados al consumo humano, incluidos el hueso desgrasado, los chicharrones y los lodos de centrifugado o de separación resultantes de la elaboración de productos lácteos;] (2) y/o [- productos de origen animal o productos alimenticios que contienen productos de origen animal que ya no están destinados al consumo humano por motivos comerciales, problemas de fabricación, defectos de envasado u otros defectos que no conlleven ningún riesgo para la salud pública o la salud animal;] (2) y/o [- los alimentos para animales de compañía y los piensos de origen animal, o los piensos que contengan subproductos animales o productos derivados que ya no estén destinados a la alimentación animal por motivos comerciales o problemas de fabricación, defectos de envasado u otros defectos que no conlleven ningún riesgo para la salud pública o la salud animal;] (2) y/o [- la sangre, la placenta, la lana, las plumas, el pelo, los cuernos, los recortes de cascos, uñas o pezuñas y la leche cruda de animales vivos que no presenten signos de enfermedad transmisible a través de esos productos a las personas o los animales;] (2) y/o [- los animales acuáticos y partes de los mismos, salvo los mamíferos marinos, que no muestren ningún signo de enfermedades transmisibles a las personas o los animales;] (2) y/o [- los subproductos animales de animales acuáticos procedentes de establecimientos o plantas que fabrican productos para el consumo humano;] (2) y/o [- el siguiente material de animales que no presenten ningún signo de una enfermedad transmisible a las personas o los animales a través de dicho material: i) las conchas de moluscos despojadas del tejido blando o la carne; ii) los siguientes productos de animales terrestres: — subproductos de la incubación, — huevos, — subproductos de los huevos, incluidas las cáscaras; iii) los pollitos de un día sacrificados por razones comerciales;] (2) y/o [- los subproductos animales de invertebrados acuáticos o terrestres, salvo los de especies patógenas para personas o animales;] (2) y/o [- los animales y sus partes de los órdenes zoológicos de los roedores y los lagomorfos, salvo el material de la categoría 1 al que se refiere el artículo 8, letra a), incisos iii), iv) y v), y el material de la categoría 2 al que se refiere el artículo 9, letras a) a g), del Reglamento (CE) n.o 1069/2009;] (2) y/o [- las pieles de animales muertos que no presentaban signos clínicos de ninguna enfermedad transmisible a través de este producto a las personas o los animales;] II.1.7. han sido congelados en la planta de origen o han sido conservados de acuerdo con la legislación de la Unión Europea de manera que se evite su deterioro entre el momento de su expedición y el de su entrega en la planta de destino. (2)(6) [II.1.8. (2)(7) bien [II.1.8.1. los subproductos animales de este envío proceden de animales del país, territorio o parte del mismo mencionado en el punto II.1.1, en el que se ejecutan con regularidad programas de vacunación contra la fiebre aftosa y se ejerce un control oficial del ganado bovino doméstico.]]  Texto de la imagen
Texto de la imagen
PAÍS Subproductos animales para la fabricación de productos derivados para usos ajenos a la cadena alimentaria animal, o para muestras comerciales (2) II. Información sanitaria II.a. Número de referencia del certificado II.b. (2)(8) y/o [II.1.8.2. los subproductos animales de este envío son subproductos animales obtenidos de despojos o carne deshuesada.]] (2) [II.1.9. los subproductos animales descritos (2) bien [proceden de rumiantes distintos de los bovinos, ovinos o caprinos.]] (2) o [proceden de bovinos, ovinos o caprinos y no contienen ni se han obtenido de: (2) bien [materiales de bovino, ovino y caprino que no se hayan obtenido de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]] (2) o [a) material especificado de riesgo según se define en el punto 1 del anexo V del Reglamento (CE) n.o 999/2001/UE del Parlamento Europeo y del Consejo (9); b) carne separada mecánicamente obtenida de huesos de bovino, ovino o caprino, excepto de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE de la Comisión (10), y donde no ha habido ningún caso autóctono de EEB; c) subproductos animales o productos derivados obtenidos de bovinos, ovinos o caprinos a los que se ha dado muerte, previo aturdimiento, por laceración del tejido nervioso central mediante la introducción de un instrumento en forma de vara alargada en la cavidad craneal, o mediante la inyección de gas en la cavidad craneal, salvo en el caso de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]]] II.1.10 los subproductos animales descritos (2) bien [no contienen leche ni productos lácteos de origen ovino o caprino, o no están destinados a la alimentación de animales de granja distintos de los animales de peletería.] (2) o [contienen leche o productos lácteos de origen ovino o caprino y están destinados a la alimentación de animales de granja distintos de los animales de peletería; la leche o productos lácteos: a) provienen de ovinos y caprinos que han permanecido continuamente desde su nacimiento en un país donde se cumplen las siguientes condiciones: i) la tembladera clásica es de notificación obligatoria, ii) existe un sistema de concienciación, vigilancia y seguimiento de la tembladera clásica, iii) se aplican restricciones oficiales a las explotaciones de ovinos o caprinos en caso de sospecha de EET o de confirmación de tembladera clásica, iv) se matan y se destruyen los ovinos y caprinos aquejados de tembladera clásica, v) se ha prohibido alimentar a ovinos y caprinos con harina de carne y huesos o chicharrones, tal como se definen en el Código Sanitario para los Animales Terrestres de la Organización Mundial de Sanidad Animal (OIE), derivados de rumiantes, y la prohibición se ha aplicado de forma efectiva en todo el país durante al menos los 7 años precedentes; b) provienen de explotaciones donde no se han impuesto restricciones oficiales debido a una sospecha de EET; c) provienen de explotaciones en las que no se ha diagnosticado ningún caso de tembladera clásica en los 7 años precedentes, o en las que, tras la confirmación de un caso de tembladera clásica:  Texto de la imagen
Texto de la imagen
PAÍS Subproductos animales para la fabricación de productos derivados para usos ajenos a la cadena alimentaria animal, o para muestras comerciales (2) II. Información sanitaria II.a. Número de referencia del certificado II.b. (2) bien [se han matado y destruido, o se han sacrificado, todos los ovinos y caprinos de la explotación, excepto los machos reproductores de genotipo ARR/ARR, las hembras reproductoras que presentan al menos un alelo ARR y ningún alelo VRQ y otros ovinos que presentan al menos un alelo ARR;] (2) o se han matado y destruido todos los animales con tembladera clásica confirmada, y la explotación se ha sometido durante dos años, como mínimo, desde la fecha de confirmación del último caso de tembladera clásica, a una vigilancia intensificada de las EET, habiendo dado negativo las pruebas de EET realizadas con arreglo a los métodos de laboratorio que figuran en el anexo X, capítulo C, punto 3.2 del Reglamento n.o 999/2001 a que se ha sometido a los siguientes animales mayores de 18 meses, excepto los ovinos de genotipo ARR/ARR: — animales que han sido sacrificados para el consumo humano; y — animales que han muerto o a los que se ha dado muerte en la explotación, pero no en el marco de una campaña de erradicación de la enfermedad.]]. Notas Parte I: — Casilla I.6: persona responsable de la partida en la Unión Europea: esta casilla debe cumplimentarse únicamente si se trata de un certificado de mercancía en tránsito por la Unión Europea; puede cumplimentarse si el certificado se refiere a una mercancía que vaya a ser importada en la Unión Europea. — Casilla I.11: en caso de envío de muestras comerciales o para análisis: indicar únicamente nombre y dirección del establecimiento. — Casillas I.11 y I.12: número de autorización: el número de registro del establecimiento o planta, asignado por la autoridad competente. — Casilla I.12: lugar de destino: esta casilla debe cumplimentarse en el caso de: — productos para la fabricación de productos derivados para usos ajenos a la cadena alimentaria animal, solo si se trata de un certificado de mercancía en tránsito; los productos en tránsito solo pueden almacenarse en zonas francas, depósitos francos y depósitos aduaneros. — muestras comerciales o productos para análisis: la planta de la Unión Europea indicada en la autorización de la autoridad competente, en su caso. — Casilla I.15: indicar la matrícula (vagones o contenedores de ferrocarril y camiones), el número de vuelo (avión) o el nombre (buque). En caso de que la mercancía se descargue y se vuelva a cargar en la Unión Europea, el expedidor debe informar al puesto de inspección fronterizo de entrada en la Unión Europea. — Casilla I.19: Utilizar el código correspondiente del Sistema Armonizado (SA) de las partidas siguientes: 04.01, 04.02, 04.03, 04.04, 04.08, 05.05, 05.06, 05.07, 05.11.91, 05.11.99, 23.01 o 30.01. — Casilla I.23: si se utilizan contenedores a granel, indicar su número y el número del precinto (si procede). — Casilla I.25: uso técnico: cualquier otro distinto de la alimentación para animales de granja, distintos de los animales de peletería, y la producción o la fabricación de alimentos para animales de compañía. — Casilla I.25: A los efectos del certificado, «uso técnico» incluye el uso como muestra comercial. — Casillas I.26 y I.27: Excepto en el caso de muestras comerciales no enviadas en tránsito, rellénese según se trate de un certificado de tránsito o de importación. — Casilla I.28: — productos para la fabricación de productos derivados para usos ajenos a la cadena alimentaria animal, fábrica: indíquese el número de control veterinario del establecimiento autorizado. — productos para estudios tecnológicos o análisis concretos: la planta de la Unión Europea indicada en la autorización de la autoridad competente, en su caso. — especie: elija una de las siguientes opciones: Aves, Ruminantia, Suidae, Mammalia distintos de Ruminantia o Suidae, Pesca, Mollusca, Crustacea, invertebrados distintos de Mollusca y Crustacea.  Texto de la imagen
Texto de la imagen
PAÍS Subproductos animales para la fabricación de productos derivados para usos ajenos a la cadena alimentaria animal, o para muestras comerciales (2) II. Información sanitaria II.a. Número de referencia del certificado II.b. Parte II: (1a) DO L 300 de 14.11.2009, p. 1. (1b) DO L 54 de 26.2.2011, p. 1. (2) Táchese lo que no proceda. (2a) DO L 139 de 30.4.2004, p. 55. (3) Nombre y código ISO del país de exportación tal como figuran en: — el anexo II, parte 1, del Reglamento (UE) n.o 206/2010 de la Comisión (DO L 73 de 20.3.2010, p. 1); — el anexo I del Reglamento (CE) n.o 798/2008 de la Comisión (DO L 226 de 23.8.2008, p. 1), y — el anexo I del Reglamento (CE) n.o 119/2009 de la Comisión (DO L 39 de 10.2.2009, p. 12). Debe incluirse también el código ISO de los territorios y las partes de los mismos que figuran en los Reglamentos (UE) n.o 206/2010, (CE) n.o 798/2008 y (CE) n.o 119/2009 mencionados en la presente nota (cuando proceda para las especies sensibles). (4) Solo para los países desde los que se autoriza la importación en la Unión Europea de la carne de caza de las mismas especies animales destinada al consumo humano. (5) DO L 303 de 18.11.2009, p. 1. (6) Deben presentarse garantías adicionales cuando el material de rumiantes domésticos es originario de una zona de un país sudamericano o sudafricano, o parte del mismo, del que solo se permite la exportación a la Unión Europea de carne fresca madurada y deshuesada de rumiantes domésticos para el consumo humano. Se autorizan también los músculos maseteros enteros de bovinos, con las incisiones realizadas de conformidad con lo dispuesto en el anexo I, sección IV, capítulo I, parte B.1, del Reglamento (CE) n.o 854/2004 del Parlamento Europeo y del Consejo (DO L 139 de 30.4.2004, p. 206). (7) Solo para algunos países sudamericanos. (8) Solo para algunos países sudamericanos y sudafricanos. (9) DO L 147 de 31.5.2001, p. 1. (10) DO L 172 de 30.6.2007, p. 84. — El color de la tinta de la firma y del sello debe ser diferente del de los caracteres impresos. — Nota para la persona responsable de la partida en la Unión Europea: el presente certificado se expide únicamente a efectos veterinarios y debe acompañar al envío hasta el puesto de inspección fronterizo de entrada en la Unión Europea. Veterinario o inspector oficial Nombre y apellidos (en mayúsculas): Cualificación y cargo: Fecha: Firma: Sello: |
|
5) |
El capítulo 10, letra A; el capítulo 10, letra B; el capítulo 11 y el capítulo 12 se sustituyen por el texto siguiente: «CAPÍTULO 10, LETRA A Certificado sanitario de grasas extraídas no aptas para el consumo humano, para uso como ingredientes para piensos, que se enviarán a la Unión Europea o transitarán por ella (2) 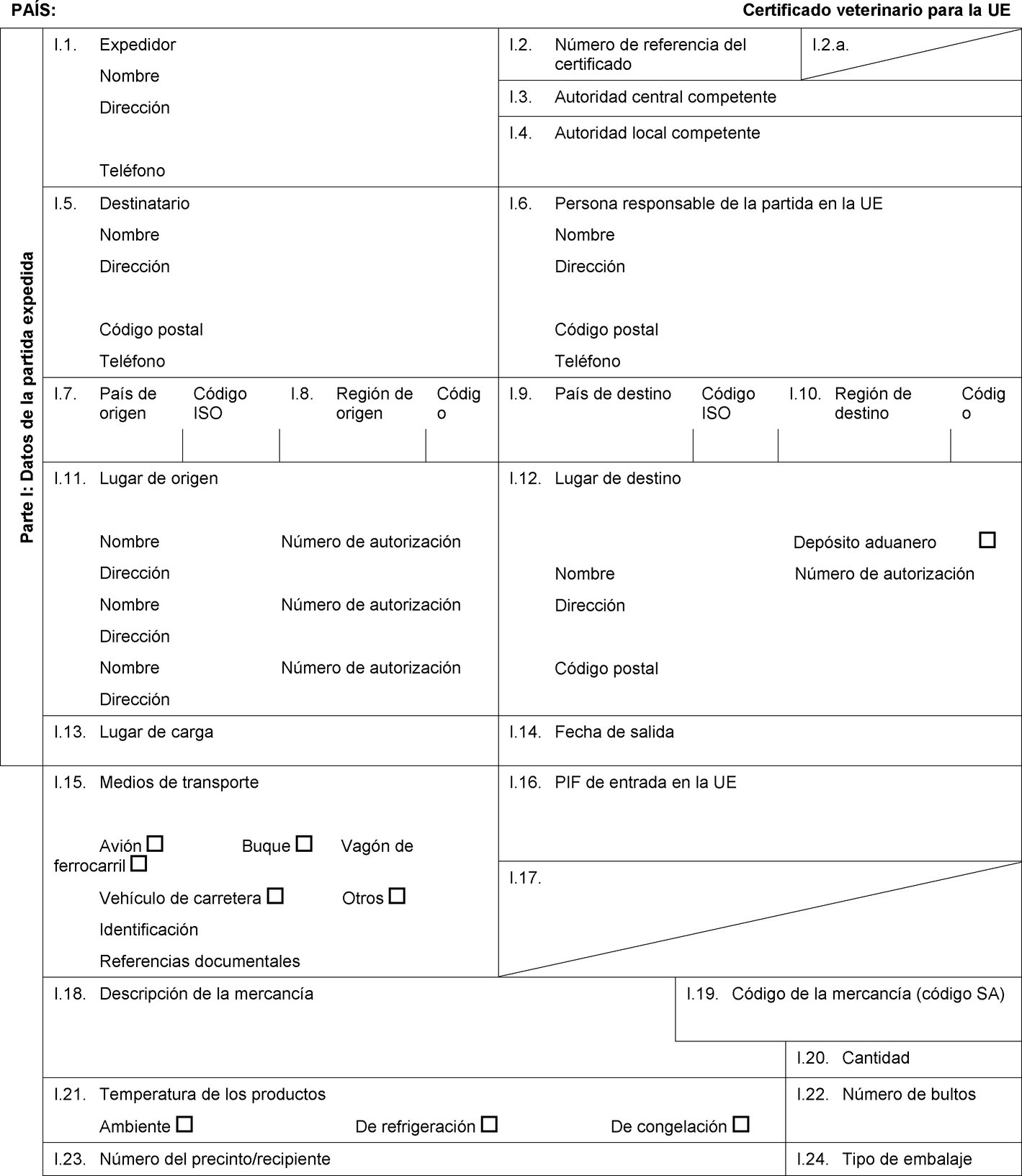 Texto de la imagen
Texto de la imagen
PAÍS: Certificado veterinario para la UE Parte I: Datos de la partida expedida I.1. Expedidor Nombre Dirección Teléfono I.2. Número de referencia del certificado I.2.a. I.3. Autoridad central competente I.4. Autoridad local competente I.5. Destinatario Nombre Dirección Código postal Teléfono I.6. Persona responsable de la partida en la UE Nombre Dirección Código postal Teléfono I.7. País de origen Código ISO I.8. Región de origen Código I.9. País de destino Código ISO I.10. Región de destino Código I.11. Lugar de origen Nombre Número de autorización Dirección Nombre Número de autorización Dirección Nombre Número de autorización Dirección I.12. Lugar de destino Depósito aduanero Nombre Número de autorización Dirección Código postal I.13. Lugar de carga I.14. Fecha de salida I.15. Medios de transporte Avión Buque Vagón de ferrocarril Vehículo de carretera Otros Identificación Referencias documentales I.16. PIF de entrada en la UE I.17. I.18. Descripción de la mercancía I.19. Código de la mercancía (código SA) I.20. Cantidad I.21. Temperatura de los productos Ambiente De refrigeración De congelación I.22. Número de bultos I.23. Número del precinto/recipiente I.24. Tipo de embalaje  Texto de la imagen
Texto de la imagen
I.25. Mercancías certificadas para: Alimentación animal Fabricación de alimentos para animales de compañía Uso técnico I.26. Para tránsito por la UE hacia un tercer país Tercer país Código ISO I.27. Para importación o admisión en la UE I.28. Identificación de las mercancías Número de autorización de los establecimientos Especie (nombre científico) Naturaleza de la mercancía Fábrica Número de bultos Peso neto Número de lote  Texto de la imagen
Texto de la imagen
PAÍS Grasas extraídas no aptas para el consumo humano, para uso como ingredientes para piensos II. Información sanitaria II.a. Número de referencia del certificado II.b. El veterinario oficial abajo firmante declara haber leído y comprendido el Reglamento (CE) n.o 1069/2009 del Parlamento Europeo y del Consejo (1a), y en particular su artículo 10, y el Reglamento (UE) n.o 142/2011 de la Comisión (1b), y en particular su anexo XIV, capítulo II, y certifica que las grasas extraídas descritas: II.1. son grasas extraídas que cumplen los requisitos sanitarios indicados más abajo; II.2. son grasas extraídas que no se destinan al consumo humano; II.3. han sido elaboradas y almacenadas en una fábrica aprobada y supervisada por la autoridad competente con arreglo al artículo 24 del Reglamento (CE) n.o 1069/2009, o al artículo 4, apartado 2, del Reglamento (CE) n.o 853/2004 del Parlamento Europeo y del Consejo (3), con el fin de eliminar los agentes patógenos; II.4. han sido elaborados exclusivamente a partir de los subproductos animales siguientes: (2) bien [- las canales y partes de animales sacrificados, o los cuerpos o partes de animales cazados, que sean aptos para el consumo humano con arreglo a la legislación de la Unión pero no se destinen a ese fin por motivos comerciales;] (2) y/o [- las canales y las siguientes partes de animales sacrificados en un matadero y considerados aptos para el consumo humano a raíz de una inspección ante mortem o los cuerpos y las siguientes partes de animales cazados para el consumo humano de conformidad con la legislación de la Unión: i) las canales o los cuerpos y partes de animales declarados no aptos para el consumo humano de acuerdo con la legislación de la Unión pero que no muestren ningún signo de enfermedad transmisible a personas o animales; ii) las cabezas de aves de corral; iii) los cueros y pieles, incluidos los recortes y la piel dividida, los cuernos y los pies, incluidas las falanges y los huesos carpianos y metacarpianos, tarsianos y metatarsianos; iv) las cerdas; v) las plumas;] (2) y/o [- sangre de animales que no presentaban ningún signo de enfermedad transmisible por la sangre a personas o animales, obtenida de animales que hayan sido sacrificados en un matadero después de haber sido considerados aptos para el sacrificio para el consumo humano a raíz de una inspección ante mortem de conformidad con la legislación de la Unión;] (2) y/o [- los subproductos animales generados en la elaboración de productos destinados al consumo humano, incluidos el hueso desgrasado, los chicharrones y los lodos de centrifugado o de separación resultantes de la elaboración de productos lácteos;] (2) y/o [- los productos de origen animal o los productos alimenticios que contengan productos de origen animal que ya no estén destinados al consumo humano por motivos comerciales, problemas de fabricación, defectos de envasado u otros defectos que no conlleven ningún riesgo para la salud pública o la salud animal;] (2) y/o [- los alimentos para animales de compañía y los piensos de origen animal, o los piensos que contengan subproductos animales o productos derivados que ya no estén destinados a la alimentación animal por motivos comerciales o problemas de fabricación, defectos de envasado u otros defectos que no conlleven ningún riesgo para la salud pública o la salud animal;] (2) y/o [- la sangre, la placenta, la lana, las plumas, el pelo, los cuernos, los recortes de cascos, uñas o pezuñas y la leche cruda de animales vivos que no presenten signos de enfermedad transmisible a través de esos productos a las personas o los animales;] Parte II: Certificación  Texto de la imagen
Texto de la imagen
PAÍS Grasas extraídas no aptas para el consumo humano, para uso como ingredientes para piensos II. Información sanitaria II.a. Número de referencia del certificado II.b. (2) y/o [- los animales acuáticos y partes de los mismos, salvo los mamíferos marinos, que no muestren ningún signo de enfermedades transmisibles a las personas o los animales;] (2) y/o [- los subproductos de animales acuáticos procedentes de plantas o establecimientos que fabriquen productos para el consumo humano;] (2) y/o [- el siguiente material de animales que no presenten ningún signo de una enfermedad transmisible a las personas o los animales a través de dicho material: i) las conchas de moluscos despojadas del tejido blando o la carne; ii) los siguientes productos de animales terrestres: — los subproductos de la incubación, — los huevos, — los subproductos de los huevos, incluidas las cáscaras; iii) los pollitos de un día sacrificados por razones comerciales;] II.5. (2) bien [- en el caso de material de origen porcino, procede de un país, o parte de su territorio, libre de fiebre aftosa en los 24 meses previos y de peste porcina clásica y peste porcina africana en los 12 meses previos;] (2) y/o [- en el caso de material obtenido de aves de corral, procede de un país, o parte de su territorio, libre de la enfermedad de Newcastle y de gripe aviar en los 6 meses previos;] (2) y/o [- en el caso de material obtenido de rumiantes, procede de un país, o parte de su territorio, libre de fiebre aftosa en los 24 meses anteriores y de peste bovina en los 12 meses previos;] (2) y/o [- si se ha producido un brote de las enfermedades mencionadas en el punto II.5. durante los períodos correspondientes, y si las grasas extraídas proceden de especies sensibles, se han sometido a tratamiento térmico de al menos 70 °C durante 30 minutos o de al menos 90 °C durante al menos 15 minutos, y se han recogido y conservado datos sobre los puntos críticos de control de forma que el propietario, el encargado o su representante y, en caso necesario, la autoridad competente, puedan proceder al control del funcionamiento de la planta; entre los datos que es preciso registrar y controlar figuran la dimensión granulométrica, la temperatura crítica y, si procede, el tiempo absoluto, el perfil de presión, la frecuencia de recarga de materia prima y el coeficiente de reciclado de la grasa;] II.6. si proceden de rumiantes, se han purificado de forma que los niveles máximos de impurezas insolubles totales restantes no superen el 0,15 % del peso; II.7. las grasas extraídas: a) se han transformado de acuerdo con lo establecido en el anexo X, capitulo II, sección 3, del Reglamento (UE) n.o 142/2011 de la Comisión, o se han sometido a tratamiento de acuerdo con lo establecido en el anexo III, sección XII, del Reglamento (CE) n.o 853/2004 del Parlamento Europeo y del Consejo, con el fin de eliminar los agentes patógenos, y (2) bien [b) se han envasado en recipientes nuevos o limpios, y desinfectados si fuera necesario para evitar la contaminación, habiéndose tomado las precauciones necesarias para evitar su contaminación;] (2) o [b) cuando esté previsto transportar los productos a granel, los tubos, bombas y depósitos, así como cualquier otro contenedor de transporte a granel o camión cisterna utilizado para transportar los productos desde la fábrica, bien directamente al buque o a los depósitos de costa, bien directamente a las plantas, deberán haber sido inspeccionados bajo la responsabilidad de la autoridad competente y considerados limpios antes de su utilización;] y se han etiquetado con la indicación “NO APTO PARA EL CONSUMO HUMANO”;  Texto de la imagen
Texto de la imagen
PAÍS Grasas extraídas no aptas para el consumo humano, para uso como ingredientes para piensos II. Información sanitaria II.a. Número de referencia del certificado II.b. (2) [II.8. las grasas extraídas descritas: (2) bien [proceden de rumiantes distintos de los bovinos, ovinos o caprinos.]] (2) o [proceden de bovinos, ovinos o caprinos y no contienen ni se han obtenido de: (2) bien [materiales de bovino, ovino y caprino que no se hayan obtenido de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]] (2) o [a) material especificado de riesgo según se define en el punto 1 del anexo V del Reglamento (CE) n.o 999/2001/UE del Parlamento Europeo y del Consejo (4); b) carne separada mecánicamente obtenida de huesos de bovino, ovino o caprino, excepto de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE de la Comisión (5), y donde no ha habido ningún caso autóctono de EEB; c) subproductos animales o productos derivados obtenidos de bovinos, ovinos o caprinos a los que se ha dado muerte, previo aturdimiento, por laceración del tejido nervioso central mediante la introducción de un instrumento en forma de vara alargada en la cavidad craneal, o mediante la inyección de gas en la cavidad craneal, salvo en el caso de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]]] II.9. las grasas extraídas descritas: (2) bien [no contiene leche ni productos lácteos de origen ovino o caprino, o no está destinado a la alimentación de animales de granja distintos de los animales de peletería.] (2) o [contienen leche o productos lácteos de origen ovino o caprino y están destinados a la alimentación de animales de granja distintos de los animales de peletería; la leche o productos lácteos: a) provienen de ovinos y caprinos que han permanecido continuamente desde su nacimiento en un país donde se cumplen las siguientes condiciones: i) la tembladera clásica es de notificación obligatoria, ii) existe un sistema de concienciación, vigilancia y seguimiento de la tembladera clásica, iii) se aplican restricciones oficiales a las explotaciones de ovinos o caprinos en caso de sospecha de EET o de confirmación de tembladera clásica, iv) se matan y se destruyen los ovinos y caprinos aquejados de tembladera clásica, v) se ha prohibido alimentar a ovinos y caprinos con harina de carne y huesos o chicharrones, tal como se definen en el Código Sanitario para los Animales Terrestres de la Organización Mundial de Sanidad Animal (OIE), derivados de rumiantes, y la prohibición se ha aplicado de forma efectiva en todo el país durante al menos los 7 años precedentes; b) provienen de explotaciones donde no se han impuesto restricciones oficiales debido a una sospecha de EET; c) provienen de explotaciones en las que no se ha diagnosticado ningún caso de tembladera clásica en los siete años precedentes, o en las que, tras la confirmación de un caso de tembladera clásica:  Texto de la imagen
Texto de la imagen
PAÍS Grasas extraídas no aptas para el consumo humano, para uso como ingredientes para piensos II. Información sanitaria II.a. Número de referencia del certificado II.b. (2) bien [se han matado y destruido, o se han sacrificado, todos los ovinos y caprinos de la explotación, excepto los machos reproductores de genotipo ARR/ARR, las hembras reproductoras que presentan al menos un alelo ARR y ningún alelo VRQ y otros ovinos que presentan al menos un alelo ARR;] (2) o se han matado y destruido todos los animales con tembladera clásica confirmada, y la explotación se ha sometido durante dos años, como mínimo, desde la fecha de confirmación del último caso de tembladera clásica, a una vigilancia intensificada de las EET, habiendo dado negativo las pruebas de EET realizadas con arreglo a los métodos de laboratorio que figuran en el anexo X, capítulo C, punto 3.2 Reglamento n.o 999/2001 a que se ha sometido a los siguientes animales mayores de 18 meses, excepto los ovinos de genotipo ARR/ARR: — animales que han sido sacrificados para el consumo humano; y — animales que han muerto o a los que se ha dado muerte en la explotación, pero no en el marco de una campaña de erradicación de la enfermedad.]] Notas Parte I: — Casilla I.6: Persona responsable de la partida en la Unión Europea: esta casilla debe cumplimentarse únicamente si se trata de un certificado de mercancía en tránsito por la Unión Europea; puede cumplimentarse si el certificado se refiere a una mercancía que vaya a ser importada en la Unión Europea. — Casilla I.12: Lugar de destino: esta casilla debe rellenarse únicamente si se trata del certificado de una mercancía en tránsito. los productos en tránsito solo pueden almacenarse en zonas francas, depósitos francos y depósitos aduaneros. — Casilla I.15: número de matrícula (vagones o contenedores de ferrocarril y camiones), número de vuelo (avión) o nombre (buque); deberá aportarse la información si se descarga y vuelve a cargar en la Unión Europea. — Casilla I.19: Indicar el código SA apropiado: 04.05, 15.01, 15.02, 15.03, 15.04, 15.05, 15.06, 15.16.10 o 15.18. — Casilla I.23: si se utilizan contenedores a granel, indicar su número y el número del precinto (si procede). — Casilla I.25: uso técnico: cualquier otro distinto de la alimentación para animales de granja, distintos de los animales de peletería o de compañía, y la producción o la fabricación de alimentos para animales de compañía. — Casillas I.26 y I.27: cumplimentar según se trate de un certificado de tránsito o de importación. — Casilla I.28: — especie: elija una de las siguientes opciones: Ruminantia, distintos de Ruminantia — Fábrica: indicar el número de registro del establecimiento de tratamiento o transformación. Parte II: (1a) DO L 300 de 14.11.2009, p. 1. (1b) DO L 54 de 26.2.2011, p. 1. (2) Táchese lo que no proceda. (3) DO L 139 de 30.4.2004, p. 55.  Texto de la imagen
Texto de la imagen
PAÍS Grasas extraídas no aptas para el consumo humano, para uso como ingredientes para piensos II. Información sanitaria II.a. Número de referencia del certificado II.b. (4) DO L 147 de 31.5.2001, p. 1. (5) DO L 172 de 30.6.2007, p. 84. — El color de la tinta de la firma y del sello debe ser diferente del de los caracteres impresos. — Nota para la persona responsable de la partida en la Unión Europea: el presente certificado se expide únicamente a efectos veterinarios y debe acompañar al envío hasta el puesto de inspección fronterizo de la Unión Europea. Veterinario o inspector oficial Nombre y apellidos (en mayúsculas): Cualificación y cargo: Fecha: Firma: Sello: CAPÍTULO 10, LETRA B Certificado sanitario de grasas extraídas no aptas para el consumo humano, para determinados usos ajenos a la cadena alimentaria animal, que se enviarán a la Unión Europea o transitarán por ella (2)  Texto de la imagen
Texto de la imagen
PAÍS: Certificado veterinario para la UE Parte I: Datos de la partida expedida I.1. Expedidor Nombre Dirección Teléfono I.2. Número de referencia del certificado I.2.a. I.3. Autoridad central competente I.4. Autoridad local competente I.5. Destinatario Nombre Dirección Código postal Teléfono I.6. Persona responsable de la partida en la UE Nombre Dirección Código postal Teléfono I.7. País de origen Código ISO I.8. Región de origen Código I.9. País de destino Código ISO I.10. Región de destino Código I.11. Lugar de origen Nombre Número de autorización Dirección Nombre Número de autorización Dirección Nombre Número de autorización Dirección I.12. Lugar de destino Depósito aduanero Nombre Número de autorización Dirección Código postal I.13. Lugar de carga I.14. Fecha de salida I.15. Medios de transporte Avión Buque Vagón de ferrocarril Vehículo de carretera Otros Identificación Referencias documentales I.16. PIF de entrada en la UE I.17. I.18. Descripción de la mercancía I.19. Código de la mercancía (código SA) I.20. Cantidad I.21. Temperatura de los productos Ambiente De refrigeración De congelación I.22. Número de bultos I.23. Número del precinto/recipiente I.24. Tipo de embalaje  Texto de la imagen
Texto de la imagen
I.25. Mercancías certificadas para: Uso técnico I.26. Para tránsito por la UE hacia un tercer país Tercer país Código ISO I.27. Para importación o admisión en la UE I.28. Identificación de las mercancías Número de autorización de los establecimientos Especie(nombre científico) Fábrica Número de bultos Peso neto Número de lote  Texto de la imagen
Texto de la imagen
PAÍS Grasas extraídas no aptas para el consumo humano, para determinados usos ajenos a la cadena alimentaria animal II. Información sanitaria II.a. Número de referencia del certificado II.b. El veterinario oficial abajo firmante declara haber leído y comprendido el Reglamento (CE) n.o 1069/2009 del Parlamento Europeo y del Consejo (1a), y en particular sus artículos 8, 9 y 10, y el Reglamento (UE) n.o 142/2011 de la Comisión (1b), y en particular su anexo XIV, capítulo II, y certifica que las grasas extraídas descritas: II.1. son grasas extraídas no aptas para el consumo humano que cumplen los requisitos sanitarios indicados más abajo; II.2. han sido elaboradas exclusivamente a partir de los subproductos animales siguientes: (2) [II.2.1. en el caso del material destinado a la producción de combustibles renovables a que se hace referencia en el anexo IV, capítulo IV, sección 2, letra L, del Reglamento (UE) n.o 142/2011, biodiésel o productos oleoquímicos, los subproductos animales contemplados en los artículos 8, 9 y 10 del Reglamento (CE) n.o 1069/2009;] (2) [II.2.2. en el caso del material destinado a la producción de combustibles renovables a que se hace referencia en el anexo IV, capítulo IV, sección 2, letra J, del Reglamento (UE) n.o 142/2011, el material se ha preparado exclusivamente con los subproductos animales contemplados en los artículos 9 y 10 del Reglamento (CE) n.o 1069/2009;] (2) [II.2.3. en el caso del material destinado a usos distintos de los productos cosméticos, farmacéuticos o sanitarios, el material se ha preparado exclusivamente con: (2) bien [- subproductos animales que contienen residuos de sustancias autorizadas o de contaminantes que sobrepasen los niveles autorizados mencionados en el artículo 15, apartado 3, de la Directiva 96/23/CE del Consejo (2a);] (2) y/o [- productos de origen animal que hayan sido declarados no aptos para el consumo humano debido a la presencia en ellos de cuerpos extraños;] (2) y/o [- animales, y partes de los mismos, distintos de los indicados en los artículos 8 a 10 del Reglamento (CE) n.o 1069/2009, que murieron sin haber sido sacrificados o matados para el consumo humano, con inclusión de los animales a los que se dio muerte a efectos de la lucha contra alguna enfermedad;] (2) y/o [- canales y partes de animales sacrificados, o cuerpos o partes de animales matados, en el caso de animales de caza, que si bien son aptos para el consumo humano con arreglo a la legislación de la Unión, no se destinan a ese fin por motivos comerciales;] (2) y/o [- canales y las siguientes partes de animales sacrificados en un matadero y considerados aptos para el consumo humano a raíz de una inspección ante mortem o los cuerpos y las siguientes partes de animales de caza matados para el consumo humano de conformidad con la legislación de la Unión: i) las canales o los cuerpos y partes de animales declarados no aptos para el consumo humano de acuerdo con la legislación de la Unión pero que no mostraban ningún signo de enfermedad transmisible a personas o animales; ii) las cabezas de aves de corral; iii) los cueros y pieles, incluidos los recortes y la piel dividida, los cuernos y los pies, incluidas las falanges y los huesos carpianos y metacarpianos, tarsianos y metatarsianos; iv) las cerdas; v) las plumas;] (2) y/o [- sangre de animales que no presentaban ningún signo de enfermedad transmisible por la sangre a personas o animales, obtenida de animales que hayan sido sacrificados en un matadero después de haber sido considerados aptos para el sacrificio para el consumo humano a raíz de una inspección ante mortem de conformidad con la legislación de la Unión;] (2) y/o [- subproductos animales generados en la elaboración de productos destinados al consumo humano, incluidos el hueso desgrasado, los chicharrones y los lodos de centrifugado o de separación resultantes de la elaboración de productos lácteos;] Parte II: Certificación  Texto de la imagen
Texto de la imagen
PAÍS Grasas extraídas no aptas para el consumo humano, para determinados usos ajenos a la cadena alimentaria animal II. Información sanitaria II.a. Número de referencia del certificado II.b. (2) y/o [- productos de origen animal o productos alimenticios que contienen productos de origen animal que ya no están destinados al consumo humano por motivos comerciales, problemas de fabricación, defectos de envasado u otros defectos que no conlleven ningún riesgo para la salud pública o la salud animal;] (2) y/o [- alimentos para animales de compañía y piensos de origen animal, o piensos que contengan subproductos animales o productos derivados que ya no estén destinados a la alimentación animal por motivos comerciales o problemas de fabricación, defectos de envasado u otras deficiencias que no conlleven ningún riesgo para la salud pública o la salud de los animales;] (2) y/o [- sangre, placenta, lana, plumas, pelo, cuernos, recortes de cascos, uñas o pezuñas y leche cruda de animales vivos que no presenten signos de enfermedad transmisible a través de esos productos a las personas o los animales;] (2) y/o [- animales acuáticos y partes de los mismos, salvo los mamíferos marinos, que no muestren ningún signo de enfermedades transmisibles a las personas o los animales;] (2) y/o [- subproductos de animales acuáticos procedentes de plantas o establecimientos que fabriquen productos para el consumo humano;] (2) y/o [- el siguiente material de animales que no presenten ningún signo de una enfermedad transmisible a las personas o los animales a través de dicho material: i) las conchas de moluscos despojadas del tejido blando o la carne; ii) los siguientes productos de animales terrestres: — los subproductos de la incubación, — los huevos, — los subproductos de los huevos, incluidas las cáscaras; iii) los pollitos de un día sacrificados por razones comerciales;] (2) y/o [- invertebrados acuáticos o terrestres, salvo los de especies patógenas para las personas o los animales;] (2) y/o [- animales y partes de animales de los órdenes zoológicos de los roedores y los lagomorfos, salvo el material de la categoría 1 al que se refiere el artículo 8, letra a), incisos iii), iv) y v), y el material de la categoría 2 al que se refiere el artículo 9, letras a) a g), del Reglamento (CE) no 1069/2009;] (2) y/o [- cueros y pieles, pezuñas, plumas, lana, cuernos y pelo de animales muertos que no presentaban ningún signo de enfermedad transmisible a través de esos productos a personas o animales;] (2) y/o [- tejido adiposo de animales que no presentaban ningún signo de enfermedad transmisible a través de dicho material a las personas o los animales, que fueron sacrificados en un matadero y se consideraron aptos para ser sacrificados para el consumo humano tras una inspección ante mortem con arreglo a la legislación de la Unión;]] (2) [II.2.4. en el caso del material destinado a usos distintos de la producción de abonos y enmiendas del suelo de origen orgánico, de productos cosméticos, farmacéuticos o sanitarios: (2) bien [- material especificado de riesgo tal como se define en el artículo 3, apartado 1, letra g), del Reglamento (CE) n.o 999/2001 del Parlamento Europeo y del Consejo (2b);] (2) y/o [- cuerpos enteros o partes de animales muertos que contengan material especificado de riesgo de conformidad con lo dispuesto en el artículo 3, apartado 1, letra g), del Reglamento (CE) no 999/2001 en el momento de la eliminación;] (2) y/o [- subproductos animales que se han obtenido de animales que se hayan sometido a un tratamiento ilegal, tal como se define en el artículo 1, apartado 2, letra d), de la Directiva 96/22/CE del Consejo (2c) o en el artículo 2, letra b), de la Directiva 96/23/CE del Consejo;]  Texto de la imagen
Texto de la imagen
PAÍS Grasas extraídas no aptas para el consumo humano, para determinados usos ajenos a la cadena alimentaria animal II. Información sanitaria II.a. Número de referencia del certificado II.b. (2) y/o [- subproductos animales que contengan residuos de otras sustancias y contaminantes medioambientales enumerados en el grupo B, punto 3, del anexo I de la Directiva 96/23/CE, si el nivel de dichos residuos es superior a los niveles permitidos fijados en la legislación de la Unión o, en su defecto, en la legislación del Estado miembro de importación;]] II.3. las grasas extraídas: a) se han transformado de acuerdo con el método (indicar el método de transformación) según lo establecido en el anexo IV, capítulo III, del Reglamento (UE) n.o 142/2011, con el fin de eliminar todos los agentes patógenos; b) se han marcado antes de su envío a la Unión Europea con triheptanoato de glicerol (GTH), de forma que se consiga una concentración mínima homogénea de 250 mg de GTH por kilogramo de grasa; c) en el caso de grasas extraídas de rumiantes, se han eliminado las impurezas insolubles que superen el 0,15 % en peso; d) se han transportado en condiciones que evitan su contaminación, y e) están etiquetadas con la indicación “NO APTO PARA EL CONSUMO HUMANO O ANIMAL” en su envase o recipiente; (2) [II.4. en el caso del material destinado a la producción de enmiendas del suelo y abonos de origen orgánico o de productos cosméticos, farmacéuticos o sanitarios, las grasas extraídas descritas (2) bien [proceden de rumiantes distintos de los bovinos, ovinos o caprinos.]] (2) o [proceden de bovinos, ovinos o caprinos y no contienen ni se han obtenido de: (2) bien [materiales de bovino, ovino y caprino que no se hayan obtenido de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE;] (2) o [a) material especificado de riesgo según se define en el punto 1 del anexo V del Reglamento (CE) n.o 999/2001/UE del Parlamento Europeo y del Consejo (3); b) carne separada mecánicamente obtenida de huesos de bovino, ovino o caprino, excepto de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE de la Comisión (4), y donde no ha habido ningún caso autóctono de EEB; c) subproductos animales o productos derivados obtenidos de bovinos, ovinos o caprinos a los que se ha dado muerte, previo aturdimiento, por laceración del tejido nervioso central mediante la introducción de un instrumento en forma de vara alargada en la cavidad craneal, o mediante la inyección de gas en la cavidad craneal, salvo en el caso de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]]] Notas Parte I: — Casilla I.6: Persona responsable de la partida en la Unión Europea: esta casilla debe cumplimentarse únicamente si se trata de un certificado de mercancía en tránsito por la Unión Europea; puede cumplimentarse si el certificado se refiere a una mercancía que vaya a ser importada en la Unión Europea. — Casillas I.11 y I.12: Número de autorización: el número de registro del establecimiento o planta, asignado por la autoridad competente.  Texto de la imagen
Texto de la imagen
PAÍS Grasas extraídas no aptas para el consumo humano, para determinados usos ajenos a la cadena alimentaria animal II. Información sanitaria II.a. Número de referencia del certificado II.b. — Casilla I.12: Lugar de destino: esta casilla debe rellenarse únicamente si se trata del certificado de una mercancía en tránsito. los productos en tránsito solo pueden almacenarse en zonas francas, depósitos francos y depósitos aduaneros. — Casilla I.15: indicar la matrícula (vagones o contenedores de ferrocarril y camiones), el número de vuelo (avión) o el nombre (buque). En caso de que la mercancía se descargue y se vuelva a cargar en la Unión Europea, el expedidor debe informar al puesto de inspección fronterizo de entrada en la Unión Europea. — Casilla I.19: Utilizar el código correspondiente del Sistema Armonizado (SA) de las partidas siguientes: 04.05, 15.01, 15.02, 15.03, 15.04, 15.05, 15.06, 15.16 o 15.18. — Casilla I.23: si se utilizan contenedores a granel, indicar su número y el número del precinto (si procede). — Casilla I.25: uso técnico: cualquier otro distinto de la alimentación para animales de granja, distintos de los animales de peletería o de compañía, y la producción o la fabricación de alimentos para animales de compañía. — Casillas I.26 y I.27: cumplimentar según se trate de un certificado de tránsito o de importación. — Casilla I.28: especie: elija una de las siguientes opciones: Ruminantia, distintos de Ruminantia Fábrica: indicar el número de registro del establecimiento de tratamiento o transformación. Parte II: (1a) DO L 300 de 14.11.2009, p. 1. (1b) DO L 54 de 26.2.2011, p. 1. (2) Táchese lo que no proceda. (2a) DO L 125 de 23.5.1996, p. 10. (2b) DO L 147 de 31.5.2001, p. 1. (2c) DO L 125 de 23.5.1996, p. 3. (3) DO L 147 de 31.5.2001, p. 1. (4) DO L 172 de 30.6.2007, p. 84. — El color de la tinta de la firma y del sello debe ser diferente del de los caracteres impresos. — Nota para la persona responsable de la partida en la Unión Europea: el presente certificado se expide únicamente a efectos veterinarios y debe acompañar al envío hasta el puesto de inspección fronterizo de entrada en la Unión Europea. Veterinario o inspector oficial Nombre y apellidos (en mayúsculas): Cualificación y cargo: Fecha: Firma: Sello: CAPÍTULO 11 Certificado sanitario de gelatina y colágeno no destinados al consumo humano, para uso como ingrediente para piensos o para usos ajenos a la cadena alimentaria animal, que se enviarán a la Unión Europea o transitarán por ella (2)  Texto de la imagen
Texto de la imagen
PAÍS: Certificado veterinario para la UE Parte I: Datos de la partida expedida I.1. Expedidor Nombre Dirección Teléfono I.2. Número de referencia del certificado I.2.a. I.3. Autoridad central competente I.4. Autoridad local competente I.5. Destinatario Nombre Dirección Código postal Teléfono I.6. Persona responsable de la partida en la UE Nombre Dirección Código postal Teléfono I.7. País de origen Código ISO I.8. Región de origen Código I.9. País de destino Código ISO I.10. Región de destino Código I.11. Lugar de origen Nombre Número de autorización Dirección Nombre Número de autorización Dirección Nombre Número de autorización Dirección I.12. Lugar de destino Depósito aduanero Nombre Número de autorización Dirección Código postal I.13. Lugar de carga I.14. Fecha de salida I.15. Medios de transporte Avión Buque Vagón de ferrocarril Vehículo de carretera Otros Identificación Referencias documentales I.16. PIF de entrada en la UE I.17. I.18. Descripción de la mercancía I.19. Código de la mercancía (código SA) I.20. Cantidad I.21. Temperatura de los productos Ambiente De refrigeración De congelación I.22. Número de bultos I.23. Número del precinto/recipiente I.24. Tipo de embalaje  Texto de la imagen
Texto de la imagen
I.25. Mercancías certificadas para: Alimentación animal Fabricación de alimentos para animales de compañía Uso técnico I.26. Para tránsito por la UE hacia un tercer país Tercer país Código ISO I.27. Para importación o admisión en la UE I.28. Identificación de las mercancías Número de autorización de los establecimientos Especie (nombre científico) Fábrica Número de bultos Peso neto Número de lote  Texto de la imagen
Texto de la imagen
PAÍS Gelatina y colágeno no destinados al consumo humano, para uso como ingredientes para piensos o con fines externos a la cadena alimentaria animal II. Información sanitaria II.a. Número de referencia del certificado II.b. El veterinario oficial abajo firmante declara haber leído y comprendido el Reglamento (CE) n.o 1069/2009 del Parlamento Europeo y del Consejo (1a), y en particular su artículo 10, y el Reglamento (UE) n.o 142/2011 de la Comisión (1b), y, en particular, su anexo XIV, capítulo I, y certifica que la gelatina o el colágeno (2) descritos: II.1. es gelatina o colágeno (2) que cumple los requisitos sanitarios indicados más abajo; II.2. consiste exclusivamente en gelatina o colágeno (2) que no se destina al consumo humano; II.3. se ha elaborado y almacenado en una fábrica aprobada y supervisada por la autoridad competente de acuerdo con el artículo 24 del Reglamento (CE) n.o 1069/2009, con el fin de eliminar los agentes patógenos; II.4. se ha elaborado exclusivamente a partir de los subproductos animales siguientes: (2) bien [- las canales y partes de animales sacrificados, o los cuerpos o partes de animales cazados, que sean aptos para el consumo humano con arreglo a la legislación de la Unión pero no se destinen a ese fin por motivos comerciales;] (2) y/o [- las canales y las siguientes partes de animales sacrificados en un matadero y considerados aptos para el consumo humano a raíz de una inspección ante mortem o los cuerpos y las siguientes partes de animales cazados para el consumo humano de conformidad con la legislación de la Unión: i) las canales o los cuerpos y partes de animales declarados no aptos para el consumo humano de acuerdo con la legislación de la Unión pero que no mostraban ningún signo de enfermedad transmisible a personas o animales; ii) las cabezas de aves de corral; iii) los cueros y pieles, incluidos los recortes y la piel dividida, los cuernos y los pies, incluidas las falanges y los huesos carpianos y metacarpianos, tarsianos y metatarsianos; iv) las cerdas; v) las plumas;] (2) y/o [- los subproductos animales generados en la elaboración de productos destinados al consumo humano, incluidos el hueso desgrasado, los chicharrones y los lodos de centrifugado o de separación resultantes de la elaboración de productos lácteos;] (2) y/o [- los productos de origen animal o productos alimenticios que contienen productos de origen animal que ya no están destinados al consumo humano por motivos comerciales, problemas de fabricación, defectos de envasado u otros defectos que no conlleven ningún riesgo para la salud pública o la salud animal;] (2) y/o [- los alimentos para animales de compañía y los piensos de origen animal, o los piensos que contengan subproductos animales o productos derivados que ya no estén destinados a la alimentación animal por motivos comerciales o problemas de fabricación, defectos de envasado u otros defectos que no conlleven ningún riesgo para la salud pública o la salud animal;] (2) y/o [- los animales acuáticos y partes de los mismos, salvo los mamíferos marinos, que no muestren ningún signo de enfermedades transmisibles a las personas o los animales;] (2) y/o [- los subproductos de animales acuáticos procedentes de plantas o establecimientos que fabriquen productos para el consumo humano;] II.5. la gelatina o el colágeno (2): a) se ha envasado, embalado, almacenado y transportado en condiciones de higiene satisfactorias, y, en particular, las operaciones de envasado y embalaje se han realizado en un local específico, y solo se han utilizado conservantes autorizados de acuerdo con la legislación de la Unión; Parte II: Certificación  Texto de la imagen
Texto de la imagen
PAÍS Gelatina y colágeno no destinados al consumo humano, para uso como ingredientes para piensos o con fines externos a la cadena alimentaria animal II. Información sanitaria II.a. Número de referencia del certificado II.b. los embalajes y envases de gelatina o colágeno (2) llevan la indicación «GELATINA APTA o COLÁGENO APTO (2) PARA EL CONSUMO ANIMAL»; y (2) bien [b) en el caso de la gelatina, se elaboró mediante un procedimiento que garantizaba que el material de la categoría 3 sin transformar se había sometido a un tratamiento con ácidos o bases, seguido de uno o más aclarados, para ajustar el pH, extracción mediante uno o varios calentamientos sucesivos, seguidos de un proceso de purificación mediante filtración y esterilización, con el fin de eliminar los agentes patógenos;] (2) o [b) en el caso del colágeno, se elaboró mediante un procedimiento que garantizaba que el material de la categoría 3 sin transformar se había sometido a un tratamiento con lavado, ajuste del pH con ácidos o bases, seguido de uno o más aclarados, filtración y extrusión, con el fin de eliminar los agentes patógenos;] (2) [II.6. en el caso de la gelatina o del colágeno (2) derivados de materiales distintos de cueros y pieles: (2) bien [proceden de rumiantes distintos de los bovinos, ovinos o caprinos.]] (2) o [proceden de bovinos, ovinos o caprinos y no contienen ni se han obtenido de: (2) bien [materiales de bovino, ovino y caprino que no se hayan obtenido de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]] (2) o [a) material especificado de riesgo según se define en el punto 1 del anexo V del Reglamento (CE) n.o 999/2001/UE del Parlamento Europeo y del Consejo (3); b) carne separada mecánicamente obtenida de huesos de bovino, ovino o caprino, excepto de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE de la Comisión (4), y donde no ha habido ningún caso autóctono de EEB; c) subproductos animales o productos derivados obtenidos de bovinos, ovinos o caprinos a los que se ha dado muerte, previo aturdimiento, por laceración del tejido nervioso central mediante la introducción de un instrumento en forma de vara alargada en la cavidad craneal, o mediante la inyección de gas en la cavidad craneal, salvo en el caso de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]]] II.7. en el caso de la gelatina o del colágeno (2) derivados de materiales distintos de los cueros y pieles descritos: (2) bien [no contienen leche ni productos lácteos de origen ovino o caprino, o no están destinados a la alimentación de animales de granja distintos de los animales de peletería.] (2) o [contienen leche o productos lácteos de origen ovino o caprino y están destinados a la alimentación de animales de granja distintos de los animales de peletería; la leche o productos lácteos: a) provienen de ovinos y caprinos que han permanecido continuamente desde su nacimiento en un país donde se cumplen las siguientes condiciones: i) la tembladera clásica es de notificación obligatoria, ii) existe un sistema de concienciación, vigilancia y seguimiento de la tembladera clásica, iii) se aplican restricciones oficiales a las explotaciones de ovinos o caprinos en caso de sospecha de EET o de confirmación de tembladera clásica,  Texto de la imagen
Texto de la imagen
PAÍS Gelatina y colágeno no destinados al consumo humano, para uso como ingredientes para piensos o con fines externos a la cadena alimentaria animal II. Información sanitaria II.a. Número de referencia del certificado II.b. iv) se matan y se destruyen los ovinos y caprinos aquejados de tembladera clásica, v) se ha prohibido alimentar a ovinos y caprinos con harina de carne y huesos o chicharrones, tal como se definen en el Código Sanitario para los Animales Terrestres de la Organización Mundial de Sanidad Animal (OIE), derivados de rumiantes, y la prohibición se ha aplicado de forma efectiva en todo el país durante al menos los 7 años precedentes; b) provienen de explotaciones donde no se han impuesto restricciones oficiales debido a una sospecha de EET; c) provienen de explotaciones en las que no se ha diagnosticado ningún caso de tembladera clásica en los 7 años precedentes, o en las que, tras la confirmación de un caso de tembladera clásica: (2) bien [se han matado y destruido, o se han sacrificado, todos los ovinos y caprinos de la explotación, excepto los machos reproductores de genotipo ARR/ARR, las hembras reproductoras que presentan al menos un alelo ARR y ningún alelo VRQ y otros ovinos que presentan al menos un alelo ARR;] (2) o se han matado y destruido todos los animales con tembladera clásica confirmada, y la explotación se ha sometido durante dos años, como mínimo, desde la fecha de confirmación del último caso de tembladera clásica, a una vigilancia intensificada de las EET, habiendo dado negativo las pruebas de EET realizadas con arreglo a los métodos de laboratorio que figuran en el anexo X, capítulo C, punto 3.2 del Reglamento n.o 999/2001 a que se ha sometido a los siguientes animales mayores de 18 meses, excepto los ovinos de genotipo ARR/ARR: — animales que han sido sacrificados para el consumo humano; y — animales que han muerto o a los que se ha dado muerte en la explotación, pero no en el marco de una campaña de erradicación de la enfermedad.]] Notas Parte I: — Casilla I.6: Persona responsable de la partida en la Unión Europea: esta casilla debe cumplimentarse únicamente si se trata de un certificado de mercancía en tránsito por la Unión Europea; puede cumplimentarse si el certificado se refiere a una mercancía que vaya a ser importada en la Unión Europea. — Casilla I.12: Lugar de destino: esta casilla debe rellenarse únicamente si se trata de un certificado de mercancía en tránsito. los productos en tránsito solo pueden almacenarse en zonas francas, depósitos francos y depósitos aduaneros. — Casilla I.15: indicar la matrícula (vagones o contenedores de ferrocarril y camiones), el número de vuelo (avión) o el nombre (buque). En caso de que la mercancía se descargue y se vuelva a cargar en la Unión Europea, el expedidor debe informar al puesto de inspección fronterizo de entrada en la Unión Europea. — Casilla I.19: Utilizar el código correspondiente del Sistema Armonizado (SA) de las partidas siguientes: 35.03 o 35.04. — Casilla I.23: si se utilizan contenedores a granel, indicar su número y el número del precinto (si procede). — Casilla I.25: uso técnico: cualquier otro distinto de la alimentación para animales de granja, distintos de los animales de peletería, y la producción o la fabricación de alimentos para animales de compañía. — Casillas I.26 y I.27: cumplimentar según se trate de un certificado de tránsito o de importación. — Casilla I.28: especie: elija una de las siguientes opciones: Aves, Ruminantia, Suidae, Mammalia distintos de Ruminantia o Suidae, Pesca.  Texto de la imagen
Texto de la imagen
PAÍS Gelatina y colágeno no destinados al consumo humano, para uso como ingredientes para piensos o con fines externos a la cadena alimentaria animal II. Información sanitaria II.a. Número de referencia del certificado II.b. Parte II: (1a) DO L 300 de 14.11.2009, p. 1. (1b) DO L 54 de 26.2.2011, p. 1. (2) Táchese lo que no proceda. (3) DO L 147 de 31.5.2001, p. 1. (4) DO L 172 de 30.6.2007, p. 84. — El color de la tinta de la firma y del sello debe ser diferente del de los caracteres impresos. — Nota para la persona responsable de la partida en la Unión Europea: el presente certificado se expide únicamente a efectos veterinarios y debe acompañar a la partida hasta el puesto de inspección fronterizo. Veterinario o inspector oficial Nombre y apellidos (en mayúsculas): Cualificación y cargo: Fecha: Firma: Sello: CAPÍTULO 12 Certificado sanitario de proteína hidrolizada, fosfato dicálcico y fosfato tricálcico no destinados al consumo humano, para uso como ingrediente para piensos o para usos ajenos a la cadena alimentaria animal, que se enviarán a la Unión Europea o transitarán por ella (2)  Texto de la imagen
Texto de la imagen
PAÍS: Certificado veterinario para la UE Parte I: Datos de la partida expedida I.1. Expedidor Nombre Dirección Teléfono I.2. Número de referencia del certificado I.2.a. I.3. Autoridad central competente I.4. Autoridad local competente I.5. Destinatario Nombre Dirección Código postal Teléfono I.6. Persona responsable de la partida en la UE Nombre Dirección Código postal Teléfono I.7. País de origen Código ISO I.8. Región de origen Código I.9. País de destino Código ISO I.10. Región de destino Código I.11. Lugar de origen Nombre Número de autorización Dirección Nombre Número de autorización Dirección Nombre Número de autorización Dirección I.12. Lugar de destino Depósito aduanero Nombre Número de autorización Dirección Código postal I.13. Lugar de carga I.14. Fecha de salida I.15. Medios de transporte Avión Buque Vagón de ferrocarril Vehículo de carretera Otros Identificación Referencias documentales I.16. PIF de entrada en la UE I.17. I.18. Descripción de la mercancía I.19. Código de la mercancía (código SA) I.20. Cantidad I.21. Temperatura de los productos Ambiente De refrigeración De congelación I.22. Número de bultos I.23. Número del precinto/recipiente I.24. Tipo de embalaje  Texto de la imagen
Texto de la imagen
I.25. Mercancías certificadas para: Alimentación animal Fabricación de alimentos para animales de compañía Uso técnico I.26. Para tránsito por la UE hacia un tercer país Tercer país Código ISO I.27. Para importación o admisión en la UE I.28. Identificación de las mercancías Número de autorización de los establecimientos Especie (nombre científico) Naturaleza de la mercancía Fábrica Número de bultos Peso neto Número de lote  Texto de la imagen
Texto de la imagen
PAÍS Proteína hidrolizada, fosfato dicálcico y fosfato tricálcico para uso como ingredientes para piensos o con fines externos a la cadena alimentaria animal II. Información sanitaria II.a. Número de referencia del certificado II.b. El veterinario oficial abajo firmante declara haber leído y comprendido el Reglamento (CE) n.o 1069/2009 del Parlamento Europeo y del Consejo (1a), y en particular su artículo 10, y el Reglamento (UE) n.o 142/2011 de la Comisión (1b), y en particular su anexo XIV, capítulo I, y certifica que la proteína hidrolizada, el fosfato dicálcico o el fosfato tricálcico (2) descritos: II.1. es proteína hidrolizada, fosfato dicálcico o fosfato tricálcico (2) que cumple los requisitos sanitarios indicados más abajo; II.2. es exclusivamente proteína hidrolizada, fosfato dicálcico o fosfato tricálcico (2) que no se destina al consumo humano; II.3. se ha elaborado y almacenado en una fábrica aprobada y supervisada por la autoridad competente de acuerdo con el artículo 24 del Reglamento (CE) n.o 1069/2009, con el fin de eliminar los agentes patógenos; II.4. se ha elaborado exclusivamente a partir de los subproductos animales siguientes: (2) bien [en el caso del fosfato dicálcico derivado de huesos desgrasados, las canales y partes de animales sacrificados, o los cuerpos o partes de animales cazados, aptos para el consumo humano con arreglo a la legislación de la Unión pero no se destinen a ese fin por motivos comerciales;] (2) o [en el caso de otros materiales: (2) bien [- las canales y partes de animales sacrificados, o los cuerpos o partes de animales cazados, que sean aptos para el consumo humano con arreglo a la legislación de la Unión pero no se destinen a ese fin por motivos comerciales;]] (2) y/o [- las canales y las siguientes partes de animales sacrificados en un matadero y considerados aptos para el consumo humano a raíz de una inspección ante mortem o los cuerpos y las siguientes partes de animales cazados para el consumo humano de conformidad con la legislación de la Unión: i) las canales o los cuerpos y partes de animales declarados no aptos para el consumo humano de acuerdo con la legislación de la Unión pero que no mostraban ningún signo de enfermedad transmisible a personas o animales; ii) las cabezas de aves de corral; iii) los cueros y pieles, incluidos los recortes y la piel dividida, los cuernos y los pies, incluidas las falanges y los huesos carpianos y metacarpianos, tarsianos y metatarsianos; iv) las cerdas; v) las plumas;]] (2) y/o [- la sangre de animales que no presentaban ningún signo de enfermedad transmisible por la sangre a personas o animales, obtenida de animales que hayan sido sacrificados en un matadero después de haber sido considerados aptos para el sacrificio para el consumo humano a raíz de una inspección ante mortem de conformidad con la legislación de la Unión;]] (2) y/o [- los subproductos animales generados en la elaboración de productos destinados al consumo humano, incluidos el hueso desgrasado, los chicharrones y los lodos de centrifugado o de separación resultantes de la elaboración de productos lácteos;]] (2) y/o [- los productos de origen animal, o los productos alimenticios que contienen productos de origen animal, que ya no están destinados al consumo humano por motivos comerciales, problemas de fabricación, defectos de envasado u otros defectos que no conlleven ningún riesgo para la salud pública o la salud animal;]] Parte II: Certificación  Texto de la imagen
Texto de la imagen
PAÍS Proteína hidrolizada, fosfato dicálcico y fosfato tricálcico para uso como ingredientes para piensos o con fines externos a la cadena alimentaria animal II. Información sanitaria II.a. Número de referencia del certificado II.b. (2) y/o [- los alimentos para animales de compañía y los piensos de origen animal, o los piensos que contengan subproductos animales o productos derivados que ya no estén destinados a la alimentación animal por motivos comerciales o problemas de fabricación, defectos de envasado u otros defectos que no conlleven ningún riesgo para la salud pública o la salud animal;]] (2) y/o [- la sangre, la placenta, la lana, las plumas, el pelo, los cuernos, los recortes de cascos, uñas o pezuñas y la leche cruda de animales vivos que no presenten signos de enfermedad transmisible a través de esos productos a las personas o los animales;]] (2) y/o [- los animales acuáticos y partes de los mismos, salvo los mamíferos marinos, que no muestren ningún signo de enfermedades transmisibles a las personas o los animales;]] (2) y/o [- los subproductos de animales acuáticos procedentes de plantas o establecimientos que fabriquen productos para el consumo humano;]] (2) y/o [- el siguiente material de animales que no presenten ningún signo de una enfermedad transmisible a las personas o los animales a través de dicho material: i) las conchas de moluscos despojadas del tejido blando o la carne; ii) los siguientes productos de animales terrestres: — los subproductos de la incubación, — los huevos, — los subproductos de los huevos, incluidas las cáscaras; iii) los pollitos de un día sacrificados por razones comerciales;]] II.5. la proteína hidrolizada, el fosfato dicálcico o el fosfato tricálcico (2): a) se ha envasado y embalado en envases etiquetados con la indicación «NO APTO PARA EL CONSUMO HUMANO», se ha almacenado y transportado en condiciones de higiene satisfactorias y, en particular, las operaciones de envasado y embalaje se han realizado en un local específico y solo se han utilizado conservantes autorizados de acuerdo con la legislación de la Unión, y (2) bien [b) en el caso de la proteína hidrolizada, se produjo mediante un proceso que incluye las medidas apropiadas para reducir al máximo la contaminación de la materia prima de la categoría 3. En el caso de la proteína hidrolizada procedente total o parcialmente de pieles de rumiantes, se produjo en una planta de transformación destinada únicamente a la producción de proteínas hidrolizadas, por un procedimiento que incluye la preparación de las materias primas de la categoría 3 mediante encurtido, encalado y lavado intensivo, seguido de: i) la exposición del material a un pH superior a 11 durante más de tres horas a una temperatura superior a 80 °C, seguida de un tratamiento térmico a más de 140 °C durante treinta minutos a más de 3,6 bares; o ii) la exposición del material a un pH comprendido entre 1 y 2 y, a continuación, a un pH superior a 11, seguida de un tratamiento térmico a más de 140 °C durante 30 minutos a 3 bares;] (2) o [b) en el caso del fosfato dicálcico, se produjo mediante un proceso: i) que garantiza que todo el material óseo de la categoría 3 se tritura finamente, se desgrasa con agua caliente y se trata con ácido clorhídrico diluido (de una concentración mínima del 4 % y un pH inferior a 1,5) durante un período mínimo de dos días, ii) seguido de un tratamiento con cal del líquido fosfórico obtenido, que resulte en un precipitado de fosfato dicálcico con un pH comprendido entre 4 y 7, y  Texto de la imagen
Texto de la imagen
PAÍS Proteína hidrolizada, fosfato dicálcico y fosfato tricálcico para uso como ingredientes para piensos o con fines externos a la cadena alimentaria animal II. Información sanitaria II.a. Número de referencia del certificado II.b. iii) por último, el precipitado se deja secar al aire con una temperatura de entrada comprendida entre 65 °C y 325 °C y una temperatura de salida comprendida entre 30 °C y 65 °C;] (2) o [b) en el caso del fosfato tricálcico, se ha producido mediante un proceso que garantiza: i) que todo el material óseo de la categoría 3 se tritura finamente y se desgrasa con flujo contrario de agua caliente (astillas de hueso inferiores a 14 mm); ii) un calentamiento continuo con vapor a 145 °C durante 30 minutos a 4 bares; iii) la separación del caldo de la proteína y la hidroxiapatita (fosfato tricálcico) mediante centrifugado, y iv) el fosfato tricálcico se granula después de secarlo en un lecho fluidificado con aire a 200 °C;] (2) [II.6. la proteína hidrolizada, el fosfato dicálcico o el fosfato tricálcico (2) descritos: (2) bien [proceden de rumiantes distintos de los bovinos, ovinos o caprinos.]] (2) o [proceden de bovinos, ovinos o caprinos y no contienen ni se han obtenido de: (2) bien [materiales de bovino, ovino y caprino que no se hayan obtenido de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]] (2) o [a) material especificado de riesgo según se define en el punto 1 del anexo V del Reglamento (CE) n.o 999/2001/UE del Parlamento Europeo y del Consejo (3); b) carne separada mecánicamente obtenida de huesos de bovino, ovino o caprino, excepto de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE de la Comisión (4), y donde no ha habido ningún caso autóctono de EEB; c) subproductos animales o productos derivados obtenidos de bovinos, ovinos o caprinos a los que se ha dado muerte, previo aturdimiento, por laceración del tejido nervioso central mediante la introducción de un instrumento en forma de vara alargada en la cavidad craneal, o mediante la inyección de gas en la cavidad craneal, salvo en el caso de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]]] II.7. la proteína hidrolizada, el fosfato dicálcico o el fosfato tricálcico (2) descritos: (2) bien [no contienen leche ni productos lácteos de origen ovino o caprino, o no están destinados a la alimentación de animales de granja distintos de los animales de peletería.] (2) o [contienen leche o productos lácteos de origen ovino o caprino y están destinados a la alimentación de animales de granja distintos de los animales de peletería; la leche o productos lácteos: a) provienen de ovinos y caprinos que han permanecido continuamente desde su nacimiento en un país donde se cumplen las siguientes condiciones: i) la tembladera clásica es de notificación obligatoria, ii) existe un sistema de concienciación, vigilancia y seguimiento de la tembladera clásica, iii) se aplican restricciones oficiales a las explotaciones de ovinos o caprinos en caso de sospecha de EET o de confirmación de tembladera clásica,  Texto de la imagen
Texto de la imagen
PAÍS Proteína hidrolizada, fosfato dicálcico y fosfato tricálcico para uso como ingredientes para piensos o con fines externos a la cadena alimentaria animal II. Información sanitaria II.a. Número de referencia del certificado II.b. iv) se matan y se destruyen los ovinos y caprinos aquejados de tembladera clásica, v) se ha prohibido alimentar a ovinos y caprinos con harina de carne y huesos o chicharrones, tal como se definen en el Código Sanitario para los Animales Terrestres de la Organización Mundial de Sanidad Animal (OIE), derivados de rumiantes, y la prohibición se ha aplicado de forma efectiva en todo el país durante al menos los 7 años precedentes; b) provienen de explotaciones donde no se han impuesto restricciones oficiales debido a una sospecha de EET; c) provienen de explotaciones en las que no se ha diagnosticado ningún caso de tembladera clásica en los 7 años precedentes, o en las que, tras la confirmación de un caso de tembladera clásica: (2) bien [se han matado y destruido, o se han sacrificado, todos los ovinos y caprinos de la explotación, excepto los machos reproductores de genotipo ARR/ARR, las hembras reproductoras que presentan al menos un alelo ARR y ningún alelo VRQ y otros ovinos que presentan al menos un alelo ARR;] (2) o se han matado y destruido todos los animales con tembladera clásica confirmada, y la explotación se ha sometido durante dos años, como mínimo, desde la fecha de confirmación del último caso de tembladera clásica, a una vigilancia intensificada de las EET, habiendo dado negativo las pruebas de EET realizadas con arreglo a los métodos de laboratorio que figuran en el anexo X, capítulo C, punto 3.2 del Reglamento n.o 999/2001 a que se ha sometido a los siguientes animales mayores de 18 meses, excepto los ovinos de genotipo ARR/ARR: — animales que han sido sacrificados para el consumo humano; y — animales que han muerto o a los que se ha dado muerte en la explotación, pero no en el marco de una campaña de erradicación de la enfermedad.]] Notas Parte I: — Casilla I.6: Persona responsable de la partida en la Unión Europea: esta casilla debe cumplimentarse únicamente si se trata de un certificado de mercancía en tránsito por la Unión Europea; puede cumplimentarse si el certificado se refiere a una mercancía que vaya a ser importada en la Unión Europea. — Casilla I.12: Lugar de destino: esta casilla debe rellenarse únicamente si se trata del certificado de una mercancía en tránsito. los productos en tránsito solo pueden almacenarse en zonas francas, depósitos francos y depósitos aduaneros. — Casilla I.15: número de matrícula (vagones o contenedores de ferrocarril y camiones), número de vuelo (avión) o nombre (buque); deberá aportarse información aparte en caso de descarga y recarga. — Casilla I.19: indicar el código SA apropiado: 05.08, 28.35.25, 28.35.26, 29.22, 35.02, 35.03 o 35.04. — Casilla I.23: si se utilizan contenedores a granel, indicar su número y el número del precinto (si procede). — Casilla I.25: uso técnico: cualquier otro distinto de la alimentación para animales de granja, distintos de los animales de peletería, y la producción o la fabricación de alimentos para animales de compañía. — Casillas I.26 y I.27: cumplimentar según se trate de un certificado de tránsito o de importación. — Casilla I.28: — especie: elija una de las siguientes opciones: Aves, Ruminantia, Suidae, Mammalia distintos de Ruminantia o Suidae, Pesca, Mollusca, Crustacea, invertebrados distintos de Mollusca y Crustacea.  Texto de la imagen
Texto de la imagen
PAÍS Proteína hidrolizada, fosfato dicálcico y fosfato tricálcico para uso como ingredientes para piensos o con fines externos a la cadena alimentaria animal II. Información sanitaria II.a. Número de referencia del certificado II.b. — Tipo de mercancía: especifíquese si se trata de proteína hidrolizada, fosfato dicálcico o fosfato tricálcico. — Fábrica: indíquese el número de registro del establecimiento de tratamiento o transformación. Parte II: (1a) DO L 300 de 14.11.2009, p. 1. (1b) DO L 54 de 26.2.2011, p. 1. (2) Táchese lo que no proceda. (3) DO L 147 de 31.5.2001, p. 1. (4) DO L 94 de 1.4.2006, p. 28. — El color de la tinta de la firma y del sello debe ser diferente del de los caracteres impresos. — Nota para la persona responsable de la partida en la Unión Europea: el presente certificado se expide únicamente a efectos veterinarios y debe acompañar al envío hasta el puesto de inspección fronterizo de entrada en la Unión Europea. Veterinario o inspector oficial Nombre y apellidos (en mayúsculas): Cualificación y cargo: Fecha: Firma: Sello: |
|
6) |
El capítulo 18 se sustituye por el texto siguiente: «CAPÍTULO 18 Certificado sanitario de cuernos y productos a base de cuerno, salvo la harina de cuerno, y pezuñas y productos a base de pezuña, salvo la harina de pezuña, destinados a la producción de enmiendas del suelo o abonos de origen orgánico, que se enviarán a la Unión Europea o transitarán por ella (2)  Texto de la imagen
Texto de la imagen
PAÍS: Certificado veterinario para la UE Parte I: Datos de la partida expedida I.1. Expedidor Nombre Dirección Teléfono I.2. Número de referencia del certificado I.2.a. I.3. Autoridad central competente I.4. Autoridad local competente I.5. Destinatario Nombre Dirección Código postal Teléfono I.6. Persona responsable de la partida en la UE Nombre Dirección Código postal Teléfono I.7. País de origen Código ISO I.8. Región de origen Código I.9. País de destino Código ISO I.10. Región de destino Código I.11. Lugar de origen Nombre Número de autorización Dirección Nombre Número de autorización Dirección Nombre Número de autorización Dirección I.12. Lugar de destino Depósito aduanero Nombre Número de autorización Dirección Código postal I.13. Lugar de carga I.14. Fecha de salida I.15. Medios de transporte Avión Buque Vagón de ferrocarril Vehículo de carretera Otros Identificación Referencias documentales I.16. PIF de entrada en la UE I.17. Números CITES I.18. Descripción de la mercancía I.19. Código de la mercancía (código SA) 05.07 I.20. Cantidad I.21. Temperatura de los productos Ambiente De refrigeración De congelación I.22. Número de bultos I.23. Número del precinto/recipiente I.24. Tipo de embalaje  Texto de la imagen
Texto de la imagen
I.25. Mercancías certificadas para: Proceso adicional Uso técnico I.26. Para tránsito por la UE hacia un tercer país Tercer país Código ISO I.27. Para importación o admisión en la UE I.28. Identificación de las mercancías Número de autorización de los establecimientos Especie (nombre científico) Fábrica Peso neto Número de lote  Texto de la imagen
Texto de la imagen
PAÍS Cuernos y productos a base de cuerno, y pezuñas y productos a base de pezuña, salvo la harina de pezuña, destinados a la producción de abonos o enmiendas del suelo de origen orgánico II. Información sanitaria II.a. Número de referencia del certificado II.b. El veterinario oficial abajo firmante declara haber leído y comprendido el Reglamento (CE) n.o 1069/2009 del Parlamento Europeo y del Consejo (1a) y el Reglamento (UE) n.o 142/2011 de la Comisión (1b), y en particular el capítulo II de su anexo XIV, y certifica que los cuernos y productos a base de cuerno, salvo la harina de cuerno, y las pezuñas y productos a base de pezuña, salvo la harina de pezuña (2), descritos II.1. proceden de animales (2) bien [sacrificados en un matadero tras haber sido sometidos a una inspección ante mortem y, a raíz de dicha inspección, declarados aptos para el sacrificio con vistas al consumo humano;] (2) o [que no presentaban signos clínicos de ninguna enfermedad transmisible a personas o animales a través de esos productos;] II.2. los cuernos, productos a base de cuerno, pezuñas y productos a base de pezuña se han sometido a un tratamiento térmico durante una hora a una temperatura central mínima de 80 °C; II.3. los cuernos se han retirado sin abrir la cavidad craneal; II.4. en todas las fases de transformación, almacenamiento y transporte se han adoptado todas las precauciones necesarias para evitar contaminaciones cruzadas; II.5. los cuernos y productos a base de cuerno, salvo la harina de cuerno, y las pezuñas y productos a base de pezuña, salvo la harina de pezuñas, se han envasado: (2) bien [en envases o contenedores nuevos;] (2) o [en contenedores a granel desinfectados antes de proceder a la carga con un producto autorizado por las autoridades competentes;] y los envases o contenedores están marcados con el tipo de subproducto animal (3) y llevan etiquetas con la indicación «NO DESTINADO AL CONSUMO HUMANO O ANIMAL» y el nombre y la dirección del establecimiento de destino en la UE. (2) [II.6. los cuernos y productos a base de cuerno, salvo la harina de cuerno, y las pezuñas y productos a base de pezuña, salvo la harina de pezuñas, descritos: (2) bien [proceden de rumiantes distintos de los bovinos, ovinos o caprinos.]] (2) o [proceden de bovinos, ovinos o caprinos y no contienen ni se han obtenido de: (2) bien [materiales de bovino, ovino y caprino que no se hayan obtenido de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE;] (2) o [a) material especificado de riesgo según se define en el punto 1 del anexo V del Reglamento (CE) n.o 999/2001/UE del Parlamento Europeo y del Consejo (4); b) carne separada mecánicamente obtenida de huesos de bovino, ovino o caprino, excepto de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE de la Comisión (5), y donde no ha habido ningún caso autóctono de EEB; c) subproductos animales o productos derivados obtenidos de bovinos, ovinos o caprinos a los que se ha dado muerte, previo aturdimiento, por laceración del tejido nervioso central mediante la introducción de un instrumento en forma de vara alargada en la cavidad craneal, o mediante la inyección de gas en la cavidad craneal, salvo en el caso de animales nacidos, criados de forma continuada y sacrificados en un país o una región con un riesgo insignificante de EEB según la clasificación de la Decisión 2007/453/CE.]]] Parte II: Certificación  Texto de la imagen
Texto de la imagen
PAÍS Cuernos y productos a base de cuerno, y pezuñas y productos a base de pezuña, salvo la harina de pezuña, destinados a la producción de abonos o enmiendas del suelo de origen orgánico II. Información sanitaria II.a. Número de referencia del certificado II.b. Notas Parte I: — Casilla I.6: Persona responsable de la partida en la Unión Europea: esta casilla debe cumplimentarse únicamente si se trata de un certificado de mercancía en tránsito por la Unión Europea; puede cumplimentarse si el certificado se refiere a una mercancía que vaya a ser importada en la Unión Europea. — Casillas I.11 y I.12: Número de autorización: el número de registro del establecimiento o planta, asignado por la autoridad competente. — Casilla I.12: Lugar de destino: esta casilla debe rellenarse únicamente si se trata del certificado de una mercancía en tránsito. Los productos en tránsito solo pueden almacenarse en zonas francas, depósitos francos y depósitos aduaneros. — Casilla I.15: número de matrícula (vagones o contenedores de ferrocarril y camiones), número de vuelo (avión) o nombre (buque); deberá aportarse la información si se descarga y vuelve a cargar en la Unión Europea. — Casilla I.23: si se utilizan contenedores a granel, indicar su número y el número del precinto (si procede). — Casilla I.25: uso técnico: cualquier otro distinto de la alimentación animal. — Casillas I.26 y I.27: cumplimentar según se trate de un certificado de tránsito o de importación. — Casilla I.28: Tipo de mercancía. Parte II: (1a) DO L 300 de 14.11.2009, p. 1. (1b) DO L 54 de 26.2.2011, p. 1. (2) Táchese lo que no proceda. (3) Tipo de producto: cuernos, productos a base de cuerno, pezuñas o productos a base de pezuña. (4) DO L 147 de 31.5.2001, p. 1. (5) DO L 172 de 30.6.2007, p. 84. — El color de la tinta de la firma y del sello debe ser diferente del de los caracteres impresos. — Nota para la persona responsable de la partida en la Unión Europea: el presente certificado se expide únicamente a efectos veterinarios y debe acompañar al envío hasta el puesto de inspección fronterizo de entrada en la Unión Europea. Veterinario o inspector oficial Nombre y apellidos (en mayúsculas): Cualificación y cargo: Fecha: Firma: Sello: |
|
7) |
El capítulo 20 se sustituye por el texto siguiente: «CAPÍTULO 20 Modelo de declaración a efectos de la importación desde terceros países y el tránsito por la Unión Europea (2) de productos intermedios para uso en la fabricación de medicamentos, medicamentos veterinarios, productos sanitarios médicos o veterinarios, productos sanitarios implantables activos, productos sanitarios para el diagnóstico in vitro, médico o veterinario, reactivos de laboratorio y productos cosméticos 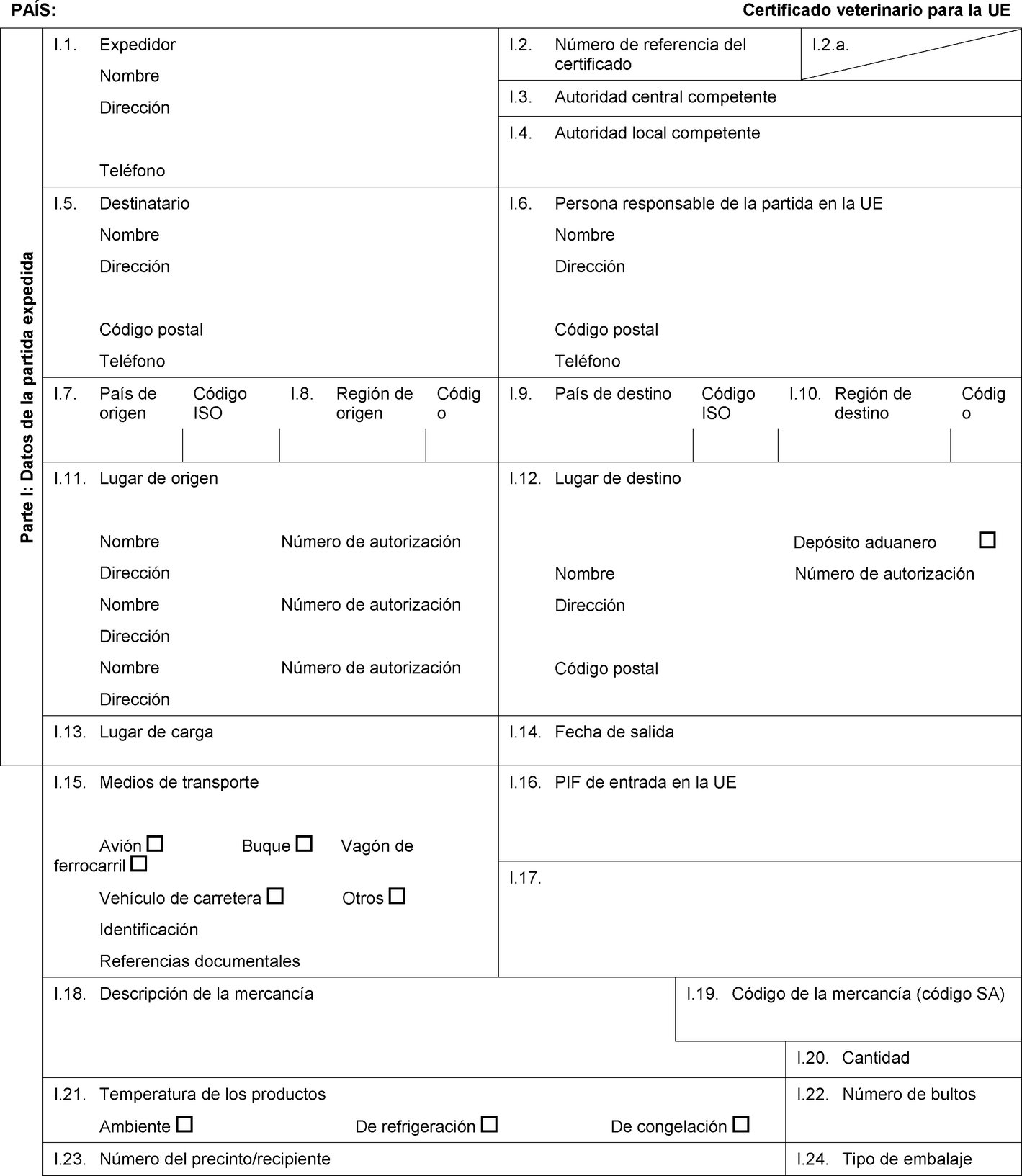 Texto de la imagen
Texto de la imagen
PAÍS: Certificado veterinario para la UE Parte I: Datos de la partida expedida I.1. Expedidor Nombre Dirección Teléfono I.2. Número de referencia del certificado I.2.a. I.3. Autoridad central competente I.4. Autoridad local competente I.5. Destinatario Nombre Dirección Código postal Teléfono I.6. Persona responsable de la partida en la UE Nombre Dirección Código postal Teléfono I.7. País de origen Código ISO I.8. Región de origen Código I.9. País de destino Código ISO I.10. Región de destino Código I.11. Lugar de origen Nombre Número de autorización Dirección Nombre Número de autorización Dirección Nombre Número de autorización Dirección I.12. Lugar de destino Depósito aduanero Nombre Número de autorización Dirección Código postal I.13. Lugar de carga I.14. Fecha de salida I.15. Medios de transporte Avión Buque Vagón de ferrocarril Vehículo de carretera Otros Identificación Referencias documentales I.16. PIF de entrada en la UE I.17. I.18. Descripción de la mercancía I.19. Código de la mercancía (código SA) I.20. Cantidad I.21. Temperatura de los productos Ambiente De refrigeración De congelación I.22. Número de bultos I.23. Número del precinto/recipiente I.24. Tipo de embalaje  Texto de la imagen
Texto de la imagen
I.25. Mercancías certificadas para: Uso técnico I.26. Para tránsito por la UE hacia un tercer país Tercer país Código ISO I.27. Para importación o admisión en la UE I.28. Identificación de las mercancías Número de autorización de los establecimientos Especie (nombre científico) Fábrica Peso neto Número de lote  Texto de la imagen
Texto de la imagen
PAÍS Productos intermedios destinados a la fabricación de medicamentos, medicamentos veterinarios, productos sanitarios médicos o veterinarios, productos sanitarios implantables activos, productos sanitarios para el diagnóstico in vitro, médico o veterinario, reactivos de laboratorio o productos cosméticos II. Información sanitaria II.a. Número de referencia del certificado II.b. DECLARACIÓN El abajo firmante declara que tiene la intención de importar en la Unión Europea o hacer transitar por ella el producto intermedio descrito, que satisface la definición indicada en el anexo I, punto 35, del Reglamento (UE) n.o 142/2011 de la Comisión (1a), y en particular que: 1) está destinado a la fabricación de: (2) bien [- medicamentos,] (2) y/o [- medicamentos veterinarios,] (2) y/o [- productos sanitarios médicos o veterinarios,] (2) y/o [- productos sanitarios implantables activos,] (2) y/o [- productos sanitarios para el diagnóstico in vitro, médico o veterinario,] (2) y/o [- reactivos de laboratorio,] (2) y/o [- productos cosméticos;] 2) sus fases de diseño, transformación y fabricación se han desarrollado lo suficiente como para considerar el material apto directamente o como ingrediente de un producto destinado a tal fin, excepto por el hecho de que requiera alguna manipulación o transformación posterior, como la mezcla, el recubrimiento, el montaje, el embalaje o el etiquetado, que lo haga adecuado para su introducción en el mercado o puesta en servicio como medicamento, medicamento veterinario, producto sanitario médico o veterinario, producto sanitario implantable activo, producto sanitario para el diagnóstico in vitro, médico o veterinario, o producto cosmético de conformidad con la legislación de la Unión Europea (1b) aplicable a dichos productos, o como reactivo de laboratorio; 3) se ha obtenido de: (2) bien [- material que puede proceder de animales sometidos a un tratamiento ilegal, tal como se define en el artículo 1, apartado 2, letra d), de la Directiva 96/22/CE del Consejo (2a) o en el artículo 2, letra b) de la Directiva 96/23/CE del Consejo (2b);] (2) y/o [- las canales y partes de animales sacrificados, o los cuerpos o partes de animales cazados, que sean aptos para el consumo humano con arreglo a la legislación de la Unión pero no se destinen a ese fin por motivos comerciales;] (2) y/o [- las canales y las siguientes partes de animales sacrificados en un matadero y considerados aptos para el consumo humano a raíz de una inspección ante mortem o los cuerpos y las siguientes partes de animales cazados para el consumo humano de conformidad con la legislación de la Unión: i) las canales o los cuerpos y partes de animales declarados no aptos para el consumo humano de acuerdo con la legislación de la Unión pero que no mostraban ningún signo de enfermedad transmisible a personas o animales; ii) las cabezas de aves de corral; iii) los cueros y pieles, incluidos los recortes y la piel dividida, los cuernos y pies, incluidas las falanges y los huesos carpianos y metacarpianos, los tarsianos y metatarsianos, de animales no rumiantes; iv) las cerdas; v) las plumas;] Parte II: Certificación  Texto de la imagen
Texto de la imagen
PAÍS Productos intermedios destinados a la fabricación de medicamentos, medicamentos veterinarios, productos sanitarios médicos o veterinarios, productos sanitarios implantables activos, productos sanitarios para el diagnóstico in vitro, médico o veterinario, reactivos de laboratorio o productos cosméticos II. Información sanitaria II.a. Número de referencia del certificado II.b. (2) y/o [- la sangre de animales que no presentaban ningún signo de enfermedad transmisible por la sangre a las personas o los animales, obtenida de animales no rumiantes que han sido sacrificados en un matadero después de haber sido considerados aptos para el sacrificio para el consumo humano a raíz de una inspección ante mortem de conformidad con la legislación de la Unión;] (2) y/o [- los subproductos animales generados en la elaboración de productos destinados al consumo humano, incluidos el hueso desgrasado, los chicharrones y los lodos de centrifugado o de separación resultantes de la elaboración de productos lácteos;] (2) y/o [- los productos de origen animal o los productos alimenticios que contengan productos de origen animal que ya no estén destinados al consumo humano por motivos comerciales, problemas de fabricación, defectos de envasado u otros defectos que no conlleven ningún riesgo para la salud pública o la salud animal;] (2) y/o [- los alimentos para animales de compañía y los piensos de origen animal, o los piensos que contengan subproductos animales o productos derivados que ya no estén destinados a la alimentación animal por motivos comerciales o problemas de fabricación, defectos de envasado u otros defectos que no conlleven ningún riesgo para la salud pública o la salud animal;] (2) y/o [- la sangre, la placenta, la lana, las plumas, el pelo, los cuernos, los recortes de cascos, uñas o pezuñas y la leche cruda de animales vivos que no presenten signos de enfermedad transmisible a través de esos productos a las personas o los animales;] (2) y/o [- los animales acuáticos y partes de los mismos, salvo los mamíferos marinos, que no muestren ningún signo de enfermedades transmisibles a las personas o los animales;] (2) y/o [- los subproductos de animales acuáticos procedentes de plantas o establecimientos que fabriquen productos para el consumo humano;] (2) y/o [- el siguiente material de animales que no presenten ningún signo de una enfermedad transmisible a las personas o los animales a través de dicho material: i) las conchas de moluscos despojadas del tejido blando o la carne; ii) los siguientes productos de animales terrestres: — los subproductos de la incubación, — los huevos, — los subproductos de los huevos, incluidas las cáscaras; iii) los pollitos de un día sacrificados por razones comerciales;] (2) y/o [- los subproductos animales de invertebrados acuáticos o terrestres, salvo los de especies patógenas para personas o animales;] (2) y/o [- los animales, y sus partes, de los órdenes zoológicos de los roedores y los lagomorfos salvo el material de la categoría 1 al que se refiere el artículo 8, letra a), incisos iii), iv) y v), y el material de la categoría 2 al que se refiere el artículo 9, letras a) a g), del Reglamento (CE) n.o 1069/2009;] (2) y/o [- los productos derivados o a partir de: — los animales acuáticos y partes de los mismos, salvo los mamíferos marinos, que no muestren ningún signo de enfermedad transmisible a personas o animales;]] — los invertebrados acuáticos o terrestres, salvo los de especies patógenas para personas o animales, — los animales, y sus partes, de los órdenes zoológicos de los roedores y los lagomorfos salvo el material de la categoría 1 al que se refiere el artículo 8, letra a), incisos iii), iv) y v), y el material de la categoría 2 al que se refiere el artículo 9, letras a) a g), del Reglamento (CE) n.o 1069/2009;]  Texto de la imagen
Texto de la imagen
PAÍS Productos intermedios destinados a la fabricación de medicamentos, medicamentos veterinarios, productos sanitarios médicos o veterinarios, productos sanitarios implantables activos, productos sanitarios para el diagnóstico in vitro, médico o veterinario, reactivos de laboratorio o productos cosméticos II. Información sanitaria II.a. Número de referencia del certificado II.b. (2) y/o [- los animales, y partes de los mismos, distintos de los indicados en los artículos 8 a 10 del Reglamento (CE) n.o 1069/2009, i) que murieron sin haber sido matados o sacrificados para el consumo humano, con inclusión de los animales a los que se dio muerte a efectos de la lucha contra alguna enfermedad; ii) los fetos; iii) los oocitos, los embriones y el esperma no destinados a la reproducción, y iv) las aves de corral muertas en el huevo;] (2) y/o [- los subproductos animales distintos del material de la categoría 1 o la categoría 3;] 4) su embalaje exterior se ha etiquetado con la indicación «SOLO PARA MEDICAMENTOS / MEDICAMENTOS VETERINARIOS / PRODUCTOS SANITARIOS MÉDICOS O VETERINARIOS / PRODUCTOS SANITARIOS IMPLANTABLES ACTIVOS / PRODUCTOS SANITARIOS PARA EL DIAGNÓSTICO IN VITRO, MÉDICO O VETERINARIO / REACTIVOS DE LABORATORIO / PRODUCTOS COSMÉTICOS» y no está previsto desviarlos en ninguna fase en la Unión Europea para cualquier otro uso; 5) la partida se transportará directamente al lugar de destino en la Unión Europea conforme a lo indicado en el apartado I.12. de la presente declaración, que es: (2) bien [un establecimiento o planta de producción de medicamentos, medicamentos veterinarios, productos sanitarios médicos o veterinarios, productos sanitarios implantables activos, productos sanitarios para el diagnóstico in vitro, médico o veterinario, reactivos de laboratorio o productos cosméticos, registrados de conformidad con el artículo 23 del Reglamento (CE) n.o 1069/2009,] (2) o [un establecimiento o planta autorizados de conformidad con el artículo 24, apartado 1, letra i), del Reglamento (CE) n.o 1069/2009, desde el que solo podrá enviarse a un establecimiento o planta contemplado en el párrafo anterior.] Notas — Casilla I.19: utilizar el código apropiado del Sistema Armonizado (SA), de conformidad con la Decisión 2007/275/CE de la Comisión, de 17 de abril de 2007, relativa a las listas de animales y productos que han de someterse a controles en los puestos de inspección fronterizos con arreglo a las Directivas del Consejo 91/496/CEE y 97/78/CE (DO L 116 de 4.5.2007, p. 9). — Casilla I.25: uso técnico: cualquier otro distinto de la alimentación animal. (1a) DO L 54 de 26.2.2011, p. 1. (1b) Directiva 2001/82/CE del Parlamento Europeo y del Consejo, de 6 de noviembre de 2001, por la que se establece un código comunitario sobre medicamentos veterinarios (DO L 311 de 28.11.2001, p. 1), Directiva 2001/83/CE del Parlamento Europeo y del Consejo, de 6 de noviembre de 2001, por la que se establece un código comunitario sobre medicamentos para uso humano (DO L 311 de 28.11.2001, p. 67), Directiva 93/42/CEE del Consejo, de 14 de junio de 1993, relativa a los productos sanitarios (DO L 169 de 12.7.1993, p. 1), Directiva 98/79/CE del Parlamento Europeo y del Consejo, de 27 de octubre de 1998, sobre productos sanitarios para diagnóstico in vitro (DO L 331 de 7.12.1998, p. 1) y Reglamento (CE) n.o 1223/2009 del Parlamento Europeo y del Consejo, de 2 de noviembre de 2009, sobre los productos cosméticos (DO L 342 de 22.12.2009, p. 59), según proceda. (2) Táchese lo que no proceda. (2a) DO L 125 de 23.5.1996, p. 3. (2b) DO L 125 de 23.5.1996, p. 10. El importador Nombre y apellidos (en mayúsculas): Dirección: Fecha: Firma: |