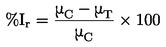|
6)
|
Se añaden los siguientes capítulos C.31 a C.46: «C.31. ENSAYO CON PLANTAS TERRESTRES: ENSAYO DE EMERGENCIA Y CRECIMIENTO DE PLÁNTULAS
INTRODUCCIÓN
|
1.
|
El presente método de ensayo es equivalente a las directrices de ensayo de la OCDE TG 208 (2006). Los métodos de ensayo se revisan periódicamente en función de los avances científicos y de su aplicabilidad con fines reglamentarios. La presente actualización del método de ensayo está diseñada para evaluar los efectos potenciales de las sustancias sobre la emergencia y el crecimiento de plántulas. Sin embargo, no cubre los efectos crónicos ni los efectos sobre la función reproductora (es decir, semillas, formación de las flores, maduración de los frutos). Deben considerarse las condiciones de exposición y las propiedades de la sustancia problema, a fin de garantizar que se utilizan los métodos de ensayo apropiados (por ejemplo, cuando se estudian metales o compuestos metálicos, deben considerarse los efectos del pH y los contra-iones asociados) (1). Este método de ensayo no se ocupa de las plantas expuestas a vapores de las sustancias. El método de ensayo es aplicable a los ensayos de sustancias y mezclas en general, biocidas y productos fitosanitarios (también conocidos como plaguicidas o pesticidas). Se ha desarrollado sobre la base de métodos existentes (2) (3) (4) (5) (6) (7). También se han tenido en cuenta otras referencias pertinentes para los ensayos con plantas (8) (9) (10). En el apéndice 1 se dan las definiciones utilizadas.
|
PRINCIPIO DEL ENSAYO
|
2.
|
El ensayo evalúa los efectos sobre la emergencia y el crecimiento inicial de las plántulas de vegetales superiores tras su exposición a la sustancia problema en el suelo (u otra matriz de suelo adecuada). Las semillas se ponen en contacto con suelo que se ha tratado con la sustancia problema y se evalúan los efectos que presenten después de, generalmente, entre 14 y 21 días tras la emergencia del 50 % de las plántulas del grupo de control. Los parámetros medidos son la evaluación visual de la emergencia de plántulas, el peso seco de los brotes (o el peso fresco de los brotes) y, en algunos casos, la altura de los brotes, así como una evaluación de los efectos nocivos sobre diferentes partes de la planta. Estas mediciones y observaciones se comparan con las de las plantas de control sin tratar.
|
|
3.
|
En función de la vía de exposición prevista, la sustancia problema se incorpora al suelo (o bien a una matriz de suelo artificial) o se aplica a la superficie del suelo, de forma que se represente adecuadamente la posible vía de exposición a la sustancia. La incorporación al suelo se realiza por tratamiento de suelo bruto. Después de la aplicación, el suelo se transfiere a macetas y, a continuación, se siembran en el suelo semillas de la especie vegetal seleccionada. Las aplicaciones en superficie se hacen con suelo en macetas en el que ya se han sembrado las semillas. Las unidades de ensayo (controles y suelos tratados más semillas) se colocan entonces en condiciones adecuadas que permitan la germinación o el crecimiento de las plantas.
|
|
4.
|
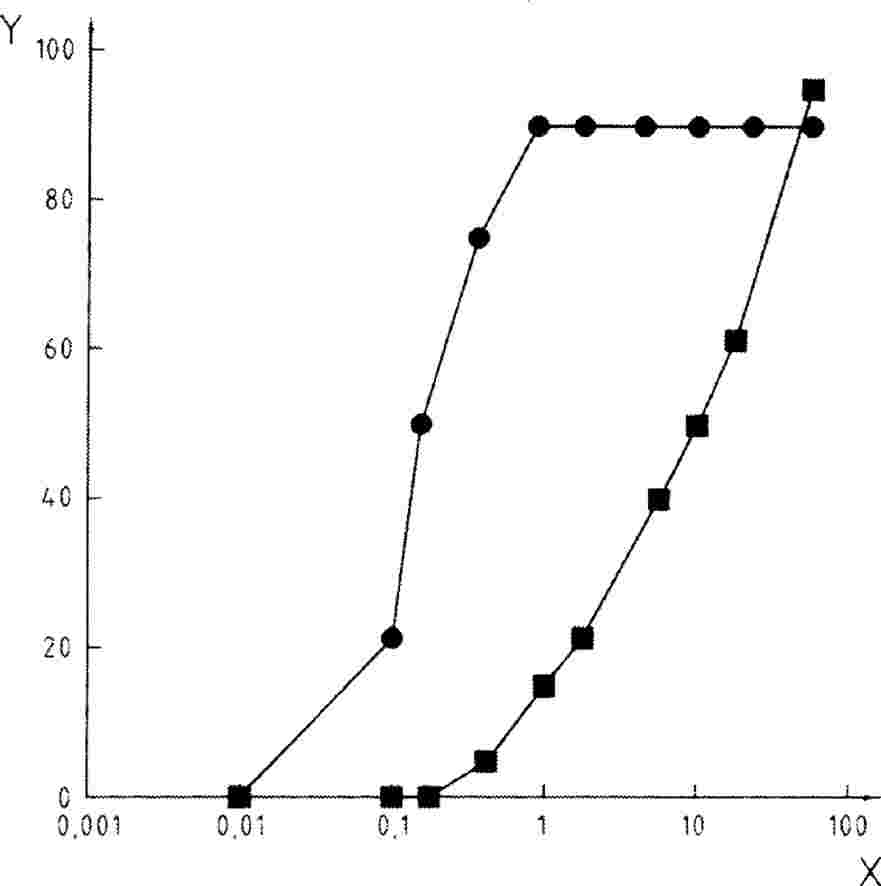
El ensayo puede efectuarse con el fin de determinar la curva dosis-respuesta, o a una sola concentración/tasa como ensayo límite, en función del objetivo del estudio. Si los resultados del ensayo a concentración/tasa única superan un determinado nivel de toxicidad (por ejemplo, si se observan efectos superiores a un x %), se lleva a cabo un ensayo de determinación del intervalo para establecer los límites inferior y superior de toxicidad, seguido de un ensayo a concentración/tasa múltiple para generar una curva dosis-respuesta. Se efectúa un análisis estadístico apropiado para obtener una concentración con efecto x ECx o una tasa de aplicación con efecto x ERx (p. ej., EC25, ER25, EC50, ER50) en relación con el parámetro o parámetros de interés más sensibles. Asimismo, en esta prueba pueden calcularse la concentración sin efecto observado (NOEC) y la concentración mínima con efecto observado (LOEC).
|
INFORMACIÓN SOBRE LA SUSTANCIA PROBLEMA
|
5.
|
La siguiente información es útil para la identificación de la vía prevista de exposición a la sustancia y para el diseño del ensayo: fórmula estructural, pureza, hidrosolubilidad, solubilidad en disolventes orgánicos, coeficiente de reparto 1-octanol/agua, comportamiento de sorción del suelo, presión de vapor, estabilidad de la sustancia en el agua y a la luz, y biodegradabilidad.
|
VALIDEZ DEL ENSAYO
|
6.
|
Para que el ensayo se considere válido, los controles deben cumplir los criterios de comportamiento siguientes:
|
—
|
la emergencia de las plántulas es de al menos un 70 %;
|
|
—
|
las plántulas no presentan efectos fitotóxicos visibles (p. ej., clorosis, necrosis, marchitamiento, deformaciones de las hojas y tallos) y las plantas presentan solo variaciones en el crecimiento y morfología que son normales para la especie concreta de que se trate;
|
|
—
|
la supervivencia media de las plántulas de control emergidas es de al menos el 90 % a lo largo de todo el estudio;
|
|
—
|
las condiciones ambientales de una determinada especie son idénticas y los medios de cultivo contienen la misma cantidad de matriz de suelo, medio de apoyo, o sustrato de la misma fuente.
|
|
SUSTANCIA DE REFERENCIA
|
7.
|
Puede someterse a ensayo una sustancia de referencia a intervalos regulares, con el fin de comprobar que el comportamiento del ensayo y la respuesta de las plantas concretas del ensayo, así como las condiciones de ensayo no han cambiado de forma significativa a lo largo del tiempo. Los datos anteriores de biomasa o de crecimiento de los controles pueden utilizarse también para evaluar el comportamiento del sistema de ensayo en laboratorios concretos, y pueden constituir una medida de control de la calidad intralaboratorio.
|
DESCRIPCIÓN DEL MÉTODO
Suelo natural — sustrato artificial
|
8.
|
Se pueden cultivar las plantas en macetas con suelo de limo arenoso, de arena limosa, o de limo arenoso y arcilloso, que contenga hasta un 1,5 % de carbono orgánico (alrededor del 3 % de materia orgánica). También puede utilizarse tierra comercial para macetas o mezcla de suelo sintético que contenga hasta un 1,5 % de carbono orgánico. No deben utilizarse suelos arcillosos si se sabe que la sustancia problema tiene elevada afinidad por la arcilla. El suelo de campo debe pasarse por un tamiz de 2 mm de luz para homogeneizarlo y eliminar las partículas gruesas. Deben indicarse el tipo y la textura, el porcentaje de carbono orgánico, el pH y el contenido de sal, así como la conductividad electrónica del suelo preparado final. El suelo debe clasificarse con arreglo a un sistema de clasificación normal (11). El suelo puede pasteurizarse o someterse a tratamiento térmico para reducir el efecto de los patógenos del suelo.
|
|
9.
|
El suelo natural puede complicar la interpretación de los resultados y aumentar la variabilidad debido a su diversidad de propiedades físicas y químicas y de poblaciones microbianas. Estas variables, a su vez, alteran la capacidad de retención de humedad, la capacidad de formar enlaces químicos, la aireación y el contenido de nutrientes y de oligoelementos. Además de las variaciones de estos factores físicos, también habrá variaciones en sus propiedades químicas, tales como el pH y el potencial redox, lo que puede afectar a la biodisponibilidad de la sustancia problema (12) (13) (14).
|
|
10.
|
Los sustratos artificiales no se emplean normalmente para los ensayos de productos fitosanitarios, pero pueden ser de utilidad para los ensayos de sustancias o mezclas en general o cuando se desee reducir al mínimo la variabilidad de los suelos naturales y aumentar la comparabilidad de los resultados de los ensayos. Los sustratos utilizados deben estar compuestos de materiales inertes que minimicen la interacción con la sustancia problema, con el vehículo disolvente, o con ambos. Se ha visto que la arena de cuarzo lavada con ácido, la lana mineral y las perlas de vidrio (por ejemplo, de 0,35 a 0,85 mm de diámetro) son materiales inertes adecuados que absorben mínimamente la sustancia problema (15), garantizando así un máximo de disponibilidad de la sustancia para las plántulas a través de la absorción radicular. Entre los sustratos inadecuados figuran la vermiculita, la perlita y otros materiales muy absorbentes. Deben facilitarse nutrientes para el crecimiento vegetal, a fin de asegurarse de que las plantas no sufren deficiencias nutricionales, y, siempre que sea posible, este aspecto debe evaluarse mediante análisis químico o por examen visual de las plantas de control.
|
Criterios de selección de las especies de ensayo
|
11.
|
Las especies seleccionadas deben ser suficientemente amplias, p. ej., teniendo en cuenta su diversidad taxonómica en el reino vegetal, su distribución, abundancia, las características del ciclo de vida específico de la especie y la región de presencia natural, a fin de desarrollar una gama de respuestas (8) (10) (16) (17) (18) (19) (20). Para la selección deben tenerse en cuenta las siguientes características de las posibles especies de ensayo:
|
—
|
las especies tienen semillas uniformes que están fácilmente disponibles a partir de fuentes normales fiables y que presentan una germinación regular, fiable y homogénea, y las plántulas tienen un crecimiento uniforme;
|
|
—
|
las plantas son aptas para el ensayo en laboratorio, y pueden dar resultados fiables y reproducibles, tanto dentro de una misma instalación como en una serie de instalaciones;
|
|
—
|
la sensibilidad de las especies sometidas a ensayo debe ser coherente con las respuestas de las plantas observadas en el medio ambiente expuestas a la sustancia;
|
|
—
|
se han utilizado en cierta medida en ensayos anteriores de toxicidad y su utilización en, por ejemplo, bioensayos de herbicidas, detección de metales pesados, pruebas de resistencia a la salinidad o a los minerales, o estudios de alelopatía indica sensibilidad a una gran variedad de factores de estrés;
|
|
—
|
son compatibles con las condiciones de cultivo del método de ensayo;
|
|
—
|
cumplen los criterios de validez del ensayo.
|
Algunas de las especies de ensayo más utilizadas a lo largo del tiempo se recogen en el apéndice 2, y el apéndice 3 muestra posibles especies no cultivadas.
|
|
12.
|
El número de especies que se ha de someter a ensayo depende de los requisitos normativos correspondientes, por lo que no se especifica en el presente método de ensayo.
|
Aplicación de la sustancia problema
|
13.
|
La sustancia debe aplicarse en un vehículo adecuado (por ejemplo, agua, acetona, etanol, polietilenglicol, goma arábiga, arena). También pueden someterse a ensayo las mezclas (productos formulados o formulaciones) que contienen principios activos y varios coadyuvantes.
|
Incorporación al suelo o al sustrato artificial
|
14.
|
Las sustancias que son hidrosolubles o se suspenden en agua pueden añadirse al agua y, a continuación, la solución se mezcla con el suelo, mediante un dispositivo de mezcla. Este tipo de ensayo puede ser adecuado si la exposición a la sustancia se hace a través del suelo o del agua intersticial del suelo y cuando hay riesgo de absorción radicular. La adición de la sustancia problema no debe superar la capacidad de retención de humedad del suelo. El volumen de agua añadida debe ser el mismo para cada concentración de ensayo, pero debe limitarse para evitar que el suelo se aglutine en agregados.
|
|
15.
|
Las sustancias con poca hidrosolubilidad han de disolverse en un disolvente volátil adecuado (p. ej., acetona, etanol), y mezclarse con arena. El disolvente puede eliminarse de la arena a continuación con una corriente de aire al tiempo que se remueve continuamente la arena. La arena tratada se mezcla con el suelo experimental. Se establece un segundo control que solo recibe arena y disolvente. Se añaden a todos los niveles de tratamiento y al segundo control las mismas cantidades de arena, con disolvente mezclado y eliminado. En el caso de sustancias problema sólidas insolubles, se mezclan la sustancia y el suelo seco en un mezclador adecuado. A continuación se añade el suelo a las macetas y se siembran las semillas de forma inmediata.
|
|
16.
|
Cuando se utiliza un sustrato artificial en lugar de suelo, las sustancias hidrosolubles pueden disolverse en la solución de nutrientes justo antes del inicio del ensayo. Las sustancias que no son hidrosolubles, pero que pueden suspenderse en agua utilizando un vehículo disolvente, deben añadirse con el vehículo a la solución de nutrientes. Las sustancias que no son hidrosolubles y para las que no se dispone de ningún vehículo hidrosoluble no tóxico han de disolverse en un disolvente volátil adecuado. La solución se mezcla con arena o perlas de vidrio, se coloca en un aparato rotativo de vacío y se somete a evaporación, para que quede en la arena o en las perlas una capa uniforme de la sustancia. Una porción pesada de perlas debe someterse a extracción con el mismo disolvente orgánico y se determina en ella la sustancia problema, antes de llenar las macetas.
|
Aplicación en superficie
|
17.
|
En el caso de los productos fitosanitarios, para la aplicación de la sustancia problema se suele rociar la superficie del suelo con la solución de ensayo. Todos los equipos utilizados para realizar los ensayos, incluidos los equipos utilizados para preparar y administrar la sustancia problema, deben ser tales en cuanto a su diseño y capacidad que los ensayos correspondientes puedan realizarse de una manera exacta y que se obtenga una cobertura reproducible. La cobertura debe ser uniforme en todas las superficies del suelo. Se debe tener cuidado para evitar la posibilidad de que las sustancias se adsorban o reaccionen con el equipo (por ejemplo, tubos de plástico y sustancias lipofílicas, o piezas y elementos de acero). Se rocía la sustancia problema en la superficie del suelo simulando las aplicaciones de un tanque de pulverización normal. Generalmente, los volúmenes rociados deben encontrarse en la banda de la práctica agrícola y volúmenes normales (cantidad de agua, etc.). El tipo de boquilla debe seleccionarse para proporcionar una cobertura uniforme de la superficie del suelo. En caso de que se apliquen disolventes y vehículos, debe establecerse un segundo grupo de plantas de control que reciban solo el disolvente o vehículo. Ello no es necesario en el caso de los productos fitosanitarios ensayados como formulaciones.
|
Verificación de la concentración/tasa de la sustancia problema
|
18.
|
Las concentraciones o tasas de aplicación deben confirmarse mediante una verificación analítica adecuada. En el caso de las sustancias solubles, la verificación de todas las concentraciones/tasas de ensayo puede confirmarse mediante el análisis de la concentración máxima de la solución de ensayo utilizada para el ensayo con documentación sobre la posterior dilución y la utilización de equipo de aplicación calibrado (por ejemplo, material analítico de vidrio, calibración del equipo rociador). En el caso de las sustancias insolubles, la verificación del material compuesto debe aportarse con los pesos de la sustancia problema añadidos al suelo. Si se requiere la demostración de la homogeneidad, puede ser necesario analizar el suelo.
|
PROCEDIMIENTO
Diseño del ensayo
|
19.
|
Se plantan en macetas semillas de la misma especie. El número de semillas plantadas por maceta dependerá de la especie, del tamaño de la maceta y de la duración del ensayo. El número de plantas por maceta debe proporcionar unas condiciones de crecimiento adecuadas y evitar la superpoblación durante todo el ensayo. La densidad de plantación máxima es de unas 3-10 semillas por 100 cm2, en función del tamaño de las semillas. Como ejemplo, se recomienda de una a dos plantas de maíz, soja, tomate, pepino o remolacha azucarera por recipiente de 15 cm; tres plantas de colza o guisantes por recipiente de 15 cm; y de cinco a diez plantas de cebolla, trigo, u otras semillas pequeñas por recipiente de 15 cm. El número de semillas y el de macetas replicadas (la réplica se define como una maceta, por lo que las plantas de una misma maceta no constituyen réplicas) deben ser adecuados para optimizar el análisis estadístico (21). Debe tenerse en cuenta que la variabilidad será mayor cuando se trate de especies de ensayo con un número menor de semillas grandes por maceta (réplica), en comparación con las especies de ensayo que permitan utilizar un mayor número de pequeñas semillas por maceta. Plantando un número igual de semillas en cada maceta esta variabilidad puede reducirse al mínimo.
|
|
20.
|
Se utilizan grupos de control para garantizar que los efectos observados están asociados con la exposición a la sustancia problema o se atribuyen solo a esta. El grupo de control adecuado debe ser idéntico al grupo de ensayo en todos los aspectos, salvo en la exposición a la sustancia problema. Todas las plantas de un mismo ensayo, incluidas las de los controles, deben proceder de la misma fuente. Para evitar que haya sesgo, es necesario que sea aleatoria la asignación de las macetas de ensayo y de control.
|
|
21.
|
Deben evitarse las semillas revestidas de insecticida o fungicida (es decir, las semillas tratadas). Sin embargo, algunas autoridades reguladoras permiten la utilización de determinados fungicidas de contacto no sistémicos (por ejemplo, captano, tiram) (22). Si se teme la presencia de patógenos transmitidos con las semillas, estas pueden bañarse brevemente en una solución de hipoclorito al 5 %, lavarse a continuación abundantemente con agua corriente y secarse. No se autoriza ningún tratamiento curativo con otro producto fitosanitario.
|
Condiciones del ensayo
|
22.
|
Las condiciones del ensayo deben aproximarse a las condiciones necesarias para el crecimiento normal de las especies y variedades utilizadas (en el apéndice 4 figuran algunos ejemplos de condiciones de ensayo). Las plantas emergentes deben mantenerse con buenas prácticas hortícolas en cámaras de ambiente controlado, invernaderos o fitotrones. Cuando se utilizan instalaciones de cultivo, estas prácticas suelen incluir el control y el registro con una frecuencia adecuada (como, p. ej., cada día) de la temperatura, la humedad, la concentración de dióxido de carbono, la luz (intensidad, longitud de onda, radiación activa para la fotosíntesis) y el fotoperíodo, los medios de riego, etc., para garantizar un buen crecimiento de las plantas, juzgado por el crecimiento de las plantas control de las especies seleccionadas. Conviene controlar la temperatura de los invernaderos mediante sistemas de ventilación, calefacción o refrigeración. Se recomiendan en general las siguientes condiciones para los ensayos en invernaderos:
|
—
|
temperatura: 22 °C ± 10 °C;
|
|
—
|
fotoperíodo: mínimo de 16 horas de luz;
|
|
—
|
intensidad luminosa: 350 ± 50 μE/m2/s. Puede ser necesario aportar una iluminación adicional si la intensidad desciende por debajo de 200 μE/m2/s, longitud de onda de 400 - 700 nm, excepto en caso de determinadas especies cuyas necesidades de luz sean inferiores.
|
Las condiciones ambientales deben ser objeto de seguimiento y notificación a lo largo de toda la duración del estudio. Las plantas deben cultivarse en macetas no porosas, de plástico o esmaltadas, con una bandeja o platillo debajo de la maceta. Es posible cambiar de posición las macetas periódicamente para minimizar la variabilidad en el crecimiento de las plantas (debida a las diferencias en las condiciones de ensayo en las instalaciones de cultivo). Las macetas deben ser bastante grandes para permitir un crecimiento normal.
|
|
23.
|
Pueden añadirse suplementos de nutrientes del suelo según sea necesario para mantener el vigor de las plantas. La necesidad y el calendario de la adición de nutrientes pueden evaluarse mediante la observación de las plantas de control. Se recomienda regar los recipientes de ensayo por el fondo (p. ej., mediante la utilización de mechas de fibra de vidrio). Sin embargo, puede utilizarse el riego superior al principio para estimular la germinación de las semillas y, en caso de aplicación de la sustancia en la superficie del suelo, para facilitar la introducción de la sustancia en el suelo.
|
|
24.
|
Las condiciones específicas de cultivo han de ser adecuadas para las especies ensayadas y la sustancia problema estudiada. Las plantas de control y las tratadas deben mantenerse en las mismas condiciones ambientales; no obstante, han de adoptarse medidas adecuadas para impedir la exposición cruzada (p. ej., de sustancias volátiles) entre los distintos grupos de tratamiento, así como la exposición de los controles a la sustancia problema.
|
Ensayo a concentración/tasa única
|
25.
|
A la hora de determinar la concentración/tasa adecuada de una sustancia para la realización de un ensayo a una concentración/tasa única (ensayo de tolerancia o límite), debe tenerse en cuenta una serie de factores. En relación con las sustancias en general, entre estos factores figuran las propiedades fisicoquímicas de la sustancia. En el caso de los productos fitosanitarios, hay que considerar las propiedades fisicoquímicas y el régimen de utilización de la sustancia problema, su concentración o tasa de aplicación máxima, el número de aplicaciones por temporada y/o la persistencia de la sustancia problema. Para determinar si una sustancia en general posee propiedades fitotóxicas, puede ser adecuado realizar un ensayo al nivel máximo de 1 000 mg/kg de suelo seco.
|
Ensayo de determinación del intervalo
|
26.
|
En caso necesario, puede realizarse un ensayo de determinación del intervalo para obtener información sobre las concentraciones o tasas que hayan de someterse a ensayo en el estudio definitivo de la relación dosis-respuesta. Para el ensayo de determinación del intervalo, las concentraciones o tasas de ensayo deben estar muy separadas entre sí (p. ej., 0,1, 1,0, 10, 100 y 1 000 mg/kg de suelo seco). En el caso de los productos fitosanitarios, las concentraciones o tasas podrían basarse en la concentración o tasa de aplicación recomendada o máxima; p, ej., 1/100, 1/10, 1/1 de ese valor.
|
Ensayo a concentración/tasa múltiple
|
27.
|
El objetivo del ensayo a concentración/tasa múltiple consiste en establecer la relación dosis-respuesta y determinar un valor de ECx o ERx relacionada con la emergencia, la biomasa y/o los efectos visibles frente a los controles sin exposición, según exijan las autoridades reguladoras.
|
|
28.
|
El número y el espaciado de las concentraciones o tasas deben ser suficientes para generar una relación dosis-respuesta y una ecuación de regresión fiables, y dar una estimación de los valores de ECx o ERx. Las concentraciones/tasas seleccionadas deben englobar los valores de ECx o ERx que haya que determinar. Por ejemplo, si se requiere un valor de EC50 sería aconsejable realizar el ensayo a tasas que produzcan un efecto de entre el 20 y el 80 %. El número recomendado de concentraciones/tasas de ensayo para conseguirlo es como mínimo de cinco en una serie geométrica más un control sin tratar, y espaciadas por un factor que no exceda de tres. Respecto a cada grupo de tratamiento y de control el número de réplicas debe ser como mínimo de cuatro y el número total de semillas, al menos de veinte. Puede ser necesario recurrir a más réplicas de determinadas plantas con un índice de germinación bajo o con hábitos de crecimiento variables, para aumentar la potencia estadística del ensayo. Si se utiliza un número mayor de concentraciones/tasas de ensayo, podrá reducirse el número de réplicas. Si ha de estimarse la NOEC, puede ser necesario utilizar más réplicas para obtener la potencia estadística deseada (23).
|
Observaciones
|
29.
|
Durante el período de observación, es decir, de 14 a 21 días desde el momento en que haya emergido el 50 % de las plantas de control (también del control de disolvente, en su caso), las plantas se examinan con frecuencia (al menos una vez por semana y, en la medida de lo posible, diariamente) para observar la emergencia, así como la fitotoxicidad visible y la mortalidad. Al final del ensayo, deben registrarse la medida del porcentaje de emergencia y la biomasa de las plantas supervivientes, así como los efectos nocivos visibles en diferentes partes de las plantas. Entre estos se incluyen las anomalías del aspecto de las plántulas emergidas, retraso en el crecimiento, clorosis, decoloración, mortalidad y efectos en el desarrollo de las plantas. La biomasa final puede medirse con la media del peso seco final de los brotes de las plantas supervivientes, obtenido recogiendo los brotes desde la superficie del suelo y secándolos, hasta llegar a peso constante, a 60 °C. Otra posibilidad es medir la biomasa final utilizando el peso fresco de los brotes. La altura de los brotes puede ser otro parámetro, si así lo requieren las autoridades reguladoras. Para evaluar las respuestas tóxicas observables, debe utilizarse un sistema uniforme de puntuación de las lesiones visibles. En las referencias (23) y (24) se dan ejemplos para la realización de las evaluaciones visuales cualitativas y cuantitativas.
|
DATOS E INFORME
Análisis estadístico
Ensayo a concentración/tasa única
|
30.
|
Los datos correspondientes a cada especie vegetal deben analizarse mediante un método estadístico adecuado (21). Debe registrarse el nivel del efecto a la concentración/tasa de ensayo, o bien la incapacidad de alcanzar un determinado efecto a la concentración/tasa de ensayo (por ejemplo, < x % de efecto observado a la concentración o tasa y).
|
Ensayo a concentración/tasa múltiple
|
31.
|
Se ha establecido una relación dosis-respuesta en términos de una ecuación de regresión. Pueden utilizarse modelos diferentes: por ejemplo, para estimar la ECx o ERx (p. ej., EC25, ER25, EC50, ER50) y sus límites de confianza en cuanto a la emergencia, pueden ser apropiados los métodos de datos cuánticos, de logit, de probit, de Weibull, de Spearman-Karber, de Spearman-Karber recortado, etc. En cuanto al crecimiento de las plántulas (peso y altura) como parámetros continuos, pueden estimarse los valores de ECx o ERx y sus límites de confianza utilizando un análisis de regresión adecuado [p. ej., el análisis de regresión no lineal de Bruce-Versteeg (25)]. Siempre que sea posible, el valor de R2 debe ser superior o igual a 0,7 para las especies más sensibles, y las concentraciones/tasas de ensayo utilizadas deben englobar los efectos del 20 % al 80 %. Si ha de estimarse la NOEC, debe preferirse la aplicación de ensayos estadísticos potentes y estos deben seleccionarse sobre la base de la distribución de los datos (21) (26).
|
Informe del ensayo
|
32.
|
El informe del ensayo debe presentar los resultados de los estudios, así como una descripción detallada de las condiciones de ensayo, una discusión exhaustiva de los resultados, el análisis de los datos y las conclusiones extraídas del análisis. Deben presentarse un cuadro sinóptico y un resumen de los resultados. El informe deberá incluir lo siguiente:
|
|
Sustancia problema:
|
—
|
datos de identificación de la sustancia, propiedades pertinentes de la sustancia estudiada (p. ej., log Pow, hidrosolubilidad, presión de vapor e información sobre el destino y el comportamiento en el medio ambiente, si se conocen);
|
|
—
|
datos sobre la preparación de la solución de ensayo y verificación de las concentraciones de ensayo según se especifica en el punto 18.
|
|
|
|
Especies de ensayo:
|
—
|
datos sobre el organismo de ensayo: especie/variedad, familia botánica, nombres científico y común, fuente y antecedentes de la semilla lo más detallados posible (es decir, nombre del proveedor, porcentaje de germinación, clase de tamaño de la semilla, número de lote, año o estación de recogida de la semilla, fecha de la determinación del índice de germinación, etc.);
|
|
—
|
número de especies de mono y dicotiledóneas utilizadas;
|
|
—
|
justificación de la selección de las especies;
|
|
—
|
descripción del almacenamiento, tratamiento y conservación de las semillas.
|
|
|
|
Condiciones de ensayo:
|
—
|
instalaciones de ensayo (por ejemplo, cámara de cultivo, fitotrón e invernadero);
|
|
—
|
descripción del sistema de ensayo (por ejemplo, dimensiones y material de las macetas, y cantidades de suelo);
|
|
—
|
características del suelo (o el tipo de textura del suelo: granulometría y clasificación del suelo, propiedades físicas y químicas, como el porcentaje de materia orgánica, porcentaje de carbono orgánico y pH);
|
|
—
|
preparación del suelo o sustrato (p. ej., suelo, suelo artificial, arena y otros) antes del ensayo;
|
|
—
|
descripción del medio nutritivo, en caso de utilizarse;
|
|
—
|
aplicación de la sustancia problema: descripción del método de aplicación, descripción del equipo, tasas de exposición y volúmenes, incluida la verificación química, descripción del método de calibración y descripción de las condiciones ambientales durante la aplicación;
|
|
—
|
condiciones de cultivo: intensidad luminosa (p. ej., radiación correspondiente a la fotosíntesis), fotoperíodo, temperaturas máxima y mínima, régimen y método de riego, fertilización;
|
|
—
|
número de semillas por maceta, número de plantas por dosis, número de réplicas (macetas) por tasa de exposición;
|
|
—
|
tipo y número de controles (controles positivos y/o negativos, control de disolvente en su caso);
|
|
|
|
Resultados:
|
—
|
cuadro de todos los parámetros correspondientes a cada réplica, concentración/tasa de ensayo y especie;
|
|
—
|
número y porcentaje de emergencias en comparación con los controles;
|
|
—
|
mediciones de la biomasa (peso seco o peso fresco de los brotes) de las plantas como porcentaje de la de los controles;
|
|
—
|
altura de los brotes como porcentaje de la de los controles, si se ha medido;
|
|
—
|
porcentaje de las lesiones visibles y descripción cuali y cuantitativa de las lesiones visibles (clorosis, necrosis, marchitamiento, deformación de hojas y tallos, así como eventual ausencia de efectos) causadas por la sustancia problema en comparación con las plantas de control;
|
|
—
|
descripción de la escala de clasificación utilizada para evaluar las lesiones visibles, si se facilita una clasificación visual;
|
|
—
|
en caso de estudios a tasa única, debe indicarse el porcentaje de lesiones;
|
|
—
|
valores de ECx o ERx (p. ej., EC50, ER50, EC25, ER25) y límites de confianza correspondientes; cuando se hace un análisis de regresión, debe aportarse el error típico de la ecuación de regresión, y el error típico de la estimación de los parámetros individuales (p. ej., pendiente, ordenada en el origen);
|
|
—
|
valores de LOEC y NOEC si se calculan;
|
|
—
|
descripción de los procedimientos estadísticos y de las hipótesis utilizadas;
|
|
—
|
representación gráfica de dichos datos y de la relación dosis-respuesta de las especies estudiadas;
|
|
desviaciones de los procedimientos descritos en el presente método de ensayo y de cualquier acontecimiento inusual ocurrido en el ensayo.
|
BIBLIOGRAFÍA
|
(1)
|
Schrader G., Metge K. and Bahadir M. (1998). Importance of salt ions in ecotoxicological tests with soil arthropods. Applied Soil Ecology, 7, 189-193.
|
|
(2)
|
Organización Internacional de Normalización (1993). ISO 11269-1. Calidad del suelo. Determinación de los efectos de los contaminantes sobre la flora del suelo. Parte 1: Método para la medida de la inhibición del crecimiento radicular.
|
|
(3)
|
Organización Internacional de Normalización (1995). ISO 11269-2. Calidad del suelo. Determinación de los efectos de los contaminantes sobre la flora del suelo. Parte 2: Efectos de los suelos contaminados sobre la emergencia y el crecimiento temprano de las plantas superiores.
|
|
(4)
|
American Standard for Testing Material (ASTM) (2002). E 1963-98. Standard Guide for Conducting Terrestrial Plant Toxicity Tests.
|
|
(5)
|
U.S. EPA (1982). FIFRA, 40CFR, Part 158.540. Subdivision J, Parts 122-1 and 123-1.
|
|
(6)
|
US EPA (1996). OPPTS Harmonized Test Guidelines, Series 850. Ecological Effects Test Guidelines:
|
—
|
850.4000: Background — Non-target Plant Testing;
|
|
—
|
850.4025: Target Area Phytotoxicity;
|
|
—
|
850.4100: Terrestrial Plant Toxicity, Tier I (Seedling Emergence);
|
|
—
|
850.4200: Seed Germination/Root Elongation Toxicity Test;
|
|
—
|
850.4225: Seedling Emergence, Tier II;
|
|
—
|
850.4230: Early Seedling Growth Toxicity Test.
|
|
|
(7)
|
AFNOR, X31-201 (1982). Essai d'inhibition de la germination de semences par une substance. AFNOR X31-203/ISO 11269-1 (1993) Détermination des effets des polluants sur la flore du sol: Méthode de mesurage de l'inhibition de la croissance des racines.
|
|
(8)
|
Boutin, C., Freemark, K.E. and Keddy, C.J. (1993). Proposed guidelines for registration of chemical pesticides: Non-target plant testing and evaluation. Technical Report Series No.145. Canadian Wildlife Service (Headquarters), Environment Canada, Hull, Québec, Canada.
|
|
(9)
|
Forster, R., Heimbach, U., Kula, C. and Zwerger, P. (1997). Effects of Plant Protection Products on Non-Target Organisms — A contribution to the Discussion of Risk Assessment and Risk Mitigation for Terrestrial Non-Target Organisms (Flora and Fauna). Nachrichtenbl. Deut. Pflanzenschutzd. No 48.
|
|
(10)
|
Hale, B., Hall, J.C., Solomon, K. and Stephenson, G. (1994). A Critical Review of the Proposed Guidelines for Registration of Chemical Pesticides; Non-Target Plant Testing and Evaluation, Centre for Toxicology, University of Guelph, Ontario Canada.
|
|
(11)
|
Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) y Soil Sc. Soc. Amer. Proc. 26:305 (1962).
|
|
(12)
|
Audus, L.J. (1964). Herbicide behaviour in the soil. In: Audus, L.J. ed. The Physiology and biochemistry of Herbicides, Londres, Nueva York, Academic Press, NY, Chapter 5, pp. 163-206.
|
|
(13)
|
Beall, M.L., Jr. and Nash, R.G. (1969). Crop seedling uptake of DDT, dieldrin, endrin, and heptachlor from soil, J. Agro. 61:571-575.
|
|
(14)
|
Beetsman, G.D., Kenney, D.R. and Chesters, G. (1969). Dieldrin uptake by corn as affected by soil properties, J. Agro. 61:247-250.
|
|
(15)
|
U.S. Food and Drug Administration (FDA) (1987). Environmental Assessment Technical Handbook. Environmental Assessment Technical Assistance Document 4.07, Seedling Growth, 14 pp., FDA, Washington, DC.
|
|
(16)
|
McKelvey, R.A., Wright, J.P., Honegger, J.L. and Warren, L.W. (2002). A Comparison of Crop and Non-crop Plants as Sensitive Indicator Species for Regulatory Testing. Pest Management Science vol. 58:1161-1174
|
|
(17)
|
Boutin, C.; Elmegaard, N. and Kjær, C. (2004). Toxicity testing of fifteen non-crop plant species with six herbicides in a greenhouse experiment: Implications for risk assessment. Ecotoxicology vol. 13(4): 349-369.
|
|
(18)
|
Boutin, C. and Rogers, C.A. (2000). Patterns of sensitivity of plant species to various herbicides — An analysis with two databases. Ecotoxicology vol. 9(4):255-271.
|
|
(19)
|
Boutin, C. and Harper, J.L. (1991). A comparative study of the population dynamics of five species of Veronica in natural habitats. J. Ecol. 9:155-271.
|
|
(20)
|
Boutin, C., Lee, H.-B., Peart, T.E., Batchelor, S.P. and Maguire, R.J. (2000). Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Envir. Toxicol. Chem. 19 (10): 2532-2541.
|
|
(21)
|
OCDE (2006). Draft Guidance Document, Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Series on Testing and Assessment No 54, Organización para la Cooperación y el Desarrollo Económicos, París.
|
|
(22)
|
Hatzios, K.K. and Penner, D. (1985). Interactions of herbicides with other agrochemicals in higher plants. Rev. Weed Sci. 1:1-63.
|
|
(23)
|
Hamill, P.B., Marriage, P.B. and G. Friesen (1977). A method for assessing herbicide performance in small plot experiments. Weed Science 25:386-389.
|
|
(24)
|
Frans, R.E. and Talbert, R.E. (1992). Design of field experiments and the measurement and analysis of plant response. In: B. Truelove (Ed.) Research Methods in Weed Science, 2nd ed. Southern weed Science Society, Auburn, 15-23.
|
|
(25)
|
Bruce, R.D. and Versteeg, D. J. (1992). A Statistical Procedure for Modelling Continuous Toxicity Data. Environmental Toxicology and Chemistry 11, 1485-1492.
|
|
(26)
|
Capítulo C.33 del presente anexo: Ensayo de reproducción de lombrices de tierra (Eisenia fetida / Eisenia andrei).
|
Apéndice 1
Definiciones
Principio activo (p.a.) [o sustancia activa (s.a.)]
: material diseñado para proporcionar un efecto biológico específico (por ejemplo, lucha contra los insectos, lucha contra enfermedades vegetales, lucha contra las malas hierbas en la zona de tratamiento), también conocido como principio activo o sustancia activa de grado técnico.
Sustancia
: sustancia o mezcla.
Productos fitosanitarios (PFS) o plaguicidas
: materiales con una determinada actividad biológica que se utilizan intencionadamente para proteger los cultivos contra las plagas (p. ej., contra enfermedades fúngicas, insectos, y plantas competitivas).
ECx, concentración con efecto al x %, o ERx, tasa con efecto al x %
: concentración o tasa que provoca un cambio o alteración indeseable del x % en el parámetro de ensayo que se mide, en relación con el control (p. ej., una reducción del 25 % o 50 % en la emergencia de las plántulas, en el peso de los brotes, en el número final de plantas presentes, o un aumento de las lesiones visibles en esos porcentajes se corresponderían con una EC25/ER25 o EC50/ER50 respectivamente).
Emergencia
: aparición del coleóptilo o cotiledón por encima de la superficie del suelo.
Formulación
: producto formulado comercial que contiene la sustancia activa (principio activo), también conocido como preparado final (8) o producto típico de uso final.
Concentración mínima con efecto observado (LOEC)
: concentración más baja de la sustancia problema a la que se observa un efecto. En este ensayo, la concentración correspondiente a la LOEC tiene un efecto estadísticamente significativo (p < 0,05) dentro de un determinado período de exposición en comparación con el control, y es superior al valor de NOEC.
Plantas no diana
: plantas que se encuentran fuera de la zona de las plantas diana. En el caso de los productos fitosanitarios, esta denominación se refiere en general a las plantas que se encuentran fuera de la zona de tratamiento.
Concentración sin efecto observado (NOEC)
: concentración más elevada de la sustancia problema a la que no se observa ningún efecto. En este ensayo, la concentración correspondiente a la NOEC no ejerce ningún efecto estadísticamente significativo (p < 0,05) dentro de un determinado período de exposición en comparación con el control.
Fitotoxicidad
: desviaciones perjudiciales (detectadas por medición y por evaluación visual) respecto al modelo normal de aspecto y de crecimiento de las plantas, en respuesta a una sustancia determinada.
Réplica
: unidad experimental que representa al grupo de control o al grupo de tratamiento. En estos estudios, la maceta se define como la réplica.
Evaluación visual
: calificación de las lesiones visibles según las observaciones del porte, vigor, malformaciones, clorosis, necrosis y aspecto general de las plantas, en comparación con un control.
Sustancia problema
: sustancia o mezcla estudiada con este método de ensayo.
Apéndice 2
Lista de especies utilizadas tradicionalmente en el ensayo de plantas
|
Familia
|
Especie
|
Denominación común
|
|
DICOTYLEDONAE
|
|
Apiaceae (Umbelliferae)
|
Daucus carota
|
Zanahoria
|
|
Asteraceae (Compositae)
|
Helianthus annuus
|
Girasol
|
|
Asteraceae (Compositae)
|
Lactuca sativa
|
Lechuga
|
|
Brassicaceae (Cruciferae)
|
Sinapis alba
|
Mostaza blanca
|
|
Brassicaceae (Cruciferae)
|
Brassica campestris, var. chinensis
|
Col de China
|
|
Brassicaceae (Cruciferae)
|
Brassica napus
|
Colza
|
|
Brassicaceae (Cruciferae)
|
Brassica oleracea var. capitata
|
Col
|
|
Brassicaceae (Cruciferae)
|
Brassica rapa
|
Nabo
|
|
Brassicaceae (Cruciferae)
|
Lepidium sativum
|
Mastuerzo
|
|
Brassicaceae (Cruciferae)
|
Raphanus sativus
|
Rábano
|
|
Chenopodiaceae
|
Beta vulgaris
|
Remolacha azucarera
|
|
Cucurbitaceae
|
Cucumis sativus
|
Pepino
|
|
Fabaceae (Leguminosae)
|
Glycine max (G. soja)
|
Soja
|
|
Fabaceae (Leguminosae)
|
Phaseolus aureus
|
Judía mung
|
|
Fabaceae (Leguminosae)
|
Phaseolus vulgaris
|
Judía enana, alubia, habichuela
|
|
Fabaceae (Leguminosae)
|
Pisum sativum
|
Guisante
|
|
Fabaceae (Leguminosae)
|
Trigonella foenum-graecum
|
Fenogreco
|
|
Fabaceae (Leguminosae)
|
Lotus corniculatus
|
Loto de los prados
|
|
Fabaceae (Leguminosae)
|
Trifolium pratense
|
Trébol violeta
|
|
Fabaceae (Leguminosae)
|
Vicia sativa
|
Veza
|
|
Linaceae
|
Linum usitatissimum
|
Lino
|
|
Polygonaceae
|
Fagopyrum esculentum
|
Alforfón
|
|
Solanaceae
|
Solanum lycopersicum
|
Tomate
|
|
MONOCOTYLEDONAE
|
|
Liliaceae (Amarylladaceae)
|
Allium cepa
|
Cebolla
|
|
Poaceae (Gramineae)
|
Avena sativa
|
Avena
|
|
Poaceae (Gramineae)
|
Hordeum vulgare
|
Cebada
|
|
Poaceae (Gramineae)
|
Lolium perenne
|
Ballico
|
|
Poaceae (Gramineae)
|
Oryza sativa
|
Arroz
|
|
Poaceae (Gramineae)
|
Secale cereale
|
Centeno
|
|
Poaceae (Gramineae)
|
Sorghum bicolor
|
Sorgo de grano, caña dulce
|
|
Poaceae (Gramineae)
|
Triticum aestivum
|
Trigo
|
|
Poaceae (Gramineae)
|
Zea mays
|
Maíz
|
Apéndice 3
Lista de posibles especies no cultivadas
Posibles especies según la OCDE para los ensayos de toxicidad con plantas
Nota: El cuadro siguiente ofrece información sobre 52 especies no cultivadas (las referencias para cada entrada figuran entre paréntesis). Las tasas de emergencia indicadas son datos publicados en la bibliografía, y solo tienen valor orientativo general. La experiencia individual puede variar en función del origen de las semillas y de otros factores.
|
FAMILIA Nombre botánico de la especie
(nombre común en español)
|
Duración de vida (9) y hábitat
|
Peso de la semilla
(mg)
|
Fotoperíodo para la germinación o el crecimiento (10)
|
Profundidad de la plantación
(mm) (11)
|
Tiempo para la germinación
(días) (12)
|
Tratamientos especiales (13)
|
Ensayo de toxicidad (14)
|
Proveedores de las semillas (15)
|
Otras referencias (16)
|
|
APIACEAE
Torilis japonica
(cachurro)
|
А, В Zonas alteradas, setos, pastizales (16, 19)
|
1,7 - 1,9 (14, 19)
|
L = D (14)
|
0
(1, 19)
|
5 (50 %) (19)
|
Estratificación en frío (7, 14, 18, 19) Puede ser necesaria una fase de maduración (19) Germinación inhibida por la oscuridad (1, 19) Sin tratamientos especiales (5)
|
POST (5)
|
|
|
|
ASTERACEAE
Bellis perennis
(margarita)
|
Ρ
Pastos, tierras de labor, turba (16, 19)
|
0,09 - 0,17 (4, 19)
|
L = D (14)
|
0
(4)
|
3 (50 %) (19)
11 (100 %) (18)
|
Germinación no afectada por la intensidad de la radiación (18, 19) Sin tratamientos especiales (4, 14)
|
POST (4)
|
A, D, F
|
7
|
|
Centaurea cyanus
(aciano)
|
A
Campos, cunetas, hábitats abiertos (16)
|
4,1 - 4,9 (4, 14)
|
L = D (14)
|
0 - 3 (2, 4, 14)
|
14 - 21 (100 %) (14)
|
Sin tratamientos especiales (2, 4)
|
POST (2, 4)
|
A, D, E, F
|
7
|
|
Centaurea nigra
(aciano negro)
|
Ρ
Campos, cunetas, hábitats abiertos (16, 19)
|
2,4 - 2,6 (14, 19)
|
L = D (14)
|
0 (19)
|
3 (50 %) (19)
4 (97 %) (18)
|
Puede ser necesaria una fase de maduración (18, 19) Germinación inhibida por la oscuridad (19) Sin tratamientos especiales (5, 14, 26)
|
POST (5, 22, 26)
|
A
|
|
|
Inula helenium
(helenio)
|
Ρ
Lugares húmedos, alterados
(16)
|
1 - 1,3 (4, 14, 29)
|
|
0
(4, 29)
|
|
Sin tratamientos especiales (4)
|
POST (4)
|
A, F
|
|
|
Leontodon hispidus
(diente de león hirsuto)
|
Ρ
Campos, cunetas, zonas alteradas (16, 19)
|
0,85 - 1,2 (14, 19)
|
L = D (14)
|
0 (19)
|
4 (50 %) (19)
7 (80 %) (18)
|
Germinación inhibida por la oscuridad (17, 18, 19) Sin tratamientos especiales (5, 23)
|
POST (5, 22, 23)
|
|
|
|
Rudbeckia hirta
(rudbeckia velluda)
|
Β, Ρ Zonas alteradas
(16)
|
0,3 (4, 14)
|
L = D (14)
|
0
(4, 33)
|
< 10 (100 %) (33)
|
Sin tratamientos especiales
(4, 14, 33)
|
POST (4, 33)
|
C, D, E, F
|
|
|
Solidago canadensis
(vara de oro canadiense)
|
Ρ
Pastizales, zonas abiertas (16)
|
0,06 -0,08 (4, 14)
|
L = D (11)
|
0
(4)
|
14 - 21
(11)
|
Mezclar con la misma cantidad de arena y empapar en GA de 500 ppm durante 24 horas (11) Sin tratamientos especiales (4)
|
POST (4)
|
E, F
|
|
|
Xanthium pensylvanicum
(abrojo)
|
A
Campos, hábitats abiertos (16)
|
25 - 61 (14, 29)
|
|
0 (1)
5 (29)
|
|
La germinación puede verse inhibida por la oscuridad (1) Bañar en agua caliente durante 12 horas (29)
|
PRE Y POST (31)
|
A
|
|
|
Xanthium spinosum
(abrojillo)
|
A
Hábitats abiertos (16)
|
200 (14)
|
L = D (14)
L > D (6)
|
10
(6)
|
|
Escarificación (14) Sin tratamientos especiales (6)
|
PRE Y POST (6)
|
A
|
|
|
Xanthium strumarium
(bardana)
|
A
Campos, hábitats abiertos (16)
|
67,4 (14)
|
L = D (14)
|
10 - 20 (6, 21)
|
|
Sin tratamientos especiales
(6, 14, 21)
|
PRE Y POST (6, 21, 28, 31)
|
A
|
|
|
BRASSICACEAE
Cardamine pratensis
(berro de prado)
|
Ρ
Campos, cunetas, turba (16, 19)
|
0,6 (14, 19)
|
L = D (14)
|
0 (19)
|
5 (50 %) (19)
15 (98 %) (18)
|
Germinación inhibida por la oscuridad (8, 19) Sin tratamientos especiales (5, 14, 22)
|
POST (5, 22)
|
F
|
|
|
CARYOPHYLLACEAE
Lychnis flos-cuculi
(flor de cuclillo)
|
Ρ
(16)
|
0,21 (14)
|
L = D (14)
|
|
< 14 (100 %) (14, 25)
|
Puede ser necesaria una fase de maduración (18) Sin tratamientos especiales (5, 14, 15, 22 - 26)
|
POST (5, 15, 22 - 26)
|
F
|
|
|
CHENOPODIACEAE
Chenopodium album
(cenizo)
|
A
Lindes de campos, zonas alteradas (16, 19)
|
0,7 - 1,5 (14, 19, 34)
|
L = D (14)
|
0
(1, 19)
|
2 (50 %) (19)
|
El tratamiento depende del color de la semilla (19) Dormancia en almacenamiento seco (19) Germinación inhibida por la oscuridad (1, 18, 19) Estratificación en frío (18) Sin tratamiento especial (14, 34)
|
PRE Y POST (28, 31, 34)
|
A
|
32
|
|
CLUSIACEAE
Hypericum perforatum
(hipérico)
|
Ρ
Campos, tierras de labor, hábitats abiertos (16, 19)
|
0,1 - 0,23
(14, 19)
|
L = D
(14)
|
0
(1, 19)
|
3 (19)
11 (90 %) (18)
|
Germinación inhibida por la oscuridad (1, 18, 19)
Sin tratamientos especiales (5, 14, 15, 25, 27)
|
POST
(5, 15, 25, 27)
|
A, E, F
|
|
|
CONVOLVULACEAE
Ipomoea hederacea
(trompillo)
|
A
Cunetas, hábitats abiertos, campos de maíz (16)
|
28,2
(14)
|
L > D
(6, 10)
|
10 - 20
(6, 10, 21)
|
4 (100 %)
(10)
|
Germinación no afectada por la intensidad de la radiación (1)
Sin tratamientos especiales (6, 21)
|
PRE Y POST
(6, 12, 21, 28)
|
A
|
|
|
CYPERACEAE
Cyperus rotundus
(coquito)
|
Ρ
Tierras de labor, pastizales, cunetas (16, 30)
|
0,2
(14)
|
L = D
(14)
|
0 (1)
10 - 20 (6, 10)
|
12 (91 %)
(10)
|
Germinación inhibida por la oscuridad (1)
Sin tratamientos especiales (6, 10, 14)
|
PRE Y POST
(6, 28, 31)
|
B
|
7
|
|
FABACEAE
Lotus corniculatus
(cuernecillo)
|
Ρ
Herbazales, cunetas, hábitats abiertos (16, 19)
|
1 - 1,67
(14, 19)
|
L = D (14)
|
|
1 (50 %)
(19)
|
Escarificación (14, 19)
Germinación no afectada por la intensidad de la radiación (18, 19) Sin tratamientos especiales (23, 25)
|
POST
(5, 23, 25)
|
A, D, E, F
|
|
|
Senna obtusifolia
(hediondillo)
|
A
Bosques húmedos (16)
|
23 - 28
(9)
|
L = D (14)
L > D (9)
|
10 - 20
(6, 9)
|
|
Bañar las semillas en agua durante 24 horas (9)
Escarificación (14) La viabilidad de las semillas depende del color (1) Sin tratamientos especiales (6)
|
POST
(6, 9)
|
A
|
|
|
Sesbania exaltata
(cáñamo)
|
A
Suelos aluviales (16)
|
11 - 13
(9, 14)
|
L > D (9)
|
10 - 20
(9, 21)
|
|
Bañar las semillas en agua durante 24 horas (9)
Germinación no afectada por la intensidad de la radiación (18, 1) Sin tratamientos especiales (21)
|
PRE Y POST
(9, 21, 28, 31)
|
A
|
|
|
Trifolium pratense
(trébol rojo)
|
Ρ
Campos, cunetas, tierras de labor (16, 19)
|
1,4 - 1,7
(14, 19)
|
L = D (14)
|
|
1 (50 %)
(19)
|
Escarificación (14, 18)
Puede ser necesaria una fase de maduración (19) Germinación no afectada por la intensidad de la radiación (1, 19) Sin tratamientos especiales (5)
|
POST
(5)
|
A, E, F
|
|
|
LAMIACEAE
Leonurus cardiaca
(agripalma)
|
Ρ
Zonas abiertas (16)
|
0,75 - 1,0
(4, 14)
|
L = D (14)
|
0
(4)
|
|
Sin tratamientos especiales
(4, 14)
|
POST
(4)
|
F
|
|
|
Mentha spicata
(hierbabuena)
|
Ρ
Zonas húmedas (16)
|
2,21
(4)
|
|
0
(4)
|
|
Sin tratamientos especiales
(4)
|
POST
(4)
|
F
|
|
|
Nepeta cataria
(hierba gatera)
|
Ρ
Zonas alteradas (16)
|
0,54
(4, 14)
|
L = D (14)
|
0
(4)
|
|
Sin tratamientos especiales
(2, 4, 14)
|
POST
(2, 4)
|
F
|
|
|
Prunella vulgaris
(consuelda menor)
|
Ρ
Tierras de labor, herbazales, lugares alterados (16, 19)
|
0,58 -1,2
(4, 14, 19)
|
L = D (14)
|
0
(4, 19)
|
5 (50 %) (19)
7 (91 %) (18)
|
Germinación inhibida por la oscuridad (18, 19)
Germinación mejor con semillas mayores (1) Sin tratamientos especiales (4, 14, 22)
|
POST
(4, 22)
|
A, F
|
|
|
Stachys officinalis
(betónica)
|
Ρ
Prados, lindes de campos (19)
|
14 - 18
(14, 19)
|
L = D (14)
|
|
7 (50 %)
(19)
|
Sin tratamientos especiales
(5, 14, 22)
|
POST
(5, 22)
|
F
|
|
|
MALVACEAE
Abutilon theophrasti
(abutilón)
|
A
Campos, hábitats abiertos (16)
|
8,8
(14)
|
L = D (14)
|
10 - 20
(6, 10, 21)
|
4 (84 %)
(10)
|
Escarificación (14)
Sin tratamientos especiales (5, 10, 21)
|
PRE Y POST
(6, 22, 28, 31)
|
A, F
|
|
|
Sida spinosa
(malva de caballo)
|
A
Campos, cunetas (16)
|
3,8
(14)
|
L = D (14)
|
10 - 20
(6, 21)
|
|
Escarificación (14)
Germinación no afectada por la intensidad de la radiación (1) Sin tratamientos especiales (6, 21)
|
PRE Y POST
(6, 21, 28, 31)
|
A, F
|
|
|
PAPAVERACEAE
Papaver rhoeas
(amapola)
|
A
Campos, tierras de labor, lugares alterados (16, 19)
|
0,1 - 0,3
(4, 14, 19, 29)
|
L = D (14)
|
0
(4, 29)
|
4 (50 %)
(19)
|
Estratificación en frío y escarificación (1, 19, 32)
Sin tratamientos especiales (4, 14, 29)
|
POST
(4)
|
A, D, E, F, G
|
|
|
POACEAE
Agrostis tenuis
(agróstide común)
|
Céspedes, pastizales (16)
|
0,07 (14)
|
L > D (Ю)
|
20 (10)
|
10 (62 %) (10)
|
Germinación inhibida por la oscuridad (1, 17 - 19) Sin tratamientos especiales (10)
|
POST (10)
|
A, E
|
|
|
Alopecurus myosuroides
(cola de zorra)
|
A
Campos, hábitats abiertos (16)
|
0,9 - 1,6
(29, 34)
|
L = D (14)
|
2
(29)
|
< 24 (30 %) (34)
|
Escarificación (14) Tratar con 101 mg/l KNO3 (14) Estratificación en caliente (1) Germinación inhibida por la oscuridad (1) Sin tratamientos especiales (34)
|
PRE Y POST
(28, 34)
|
A
|
32
|
|
Avena fatua
(ballueca)
|
A
Zonas cultivadas, hábitats abiertos (16)
|
7 - 37,5 (14, 30)
|
L = D (14)
L > D (6)
|
10 - 20 (6, 10)
|
3 (70 %) (18)
|
Escarificación (7, 32) Germinación inhibida por la oscuridad (1)
Estratificación en frío (1, 18) Sin tratamientos especiales (6, 10, 14)
|
PRE Y POST (6, 10, 28, 31)
|
A
|
|
|
Bromus tectorum
(espiguilla colgante)
|
A
Campos, cunetas, tierras de labor (16)
|
0,45 - 2,28 (14, 29)
|
L = D (14)
|
3 (29)
|
|
Período de maduración (1, 7, 32) Germinación inhibida por la oscuridad (1) Sin tratamientos especiales (14)
|
PRE Y POST (28, 31)
|
A
|
|
|
Cynosurus cristatus
(cola de perro)
|
P
Campos, cunetas, hábitats abiertos (16, 19)
|
0,5 - 0,7 (14, 19, 29)
|
L = D (14)
|
0 (29)
|
3 (50 %) (19)
|
Germinación no afectada por la intensidad de la radiación (19) Sin tratamientos especiales (14, 29)
|
POST (5)
|
A
|
|
|
Digitaria sanguinalis
(garranchuela)
|
A
Campos, turba, hábitats abiertos (16)
|
0,52 - 0,6 (14, 30)
|
L = D (14)
|
10 - 20 (21)
|
7 (75 %)
14 (94 %) (7)
|
Escarificación, estratificación en frío y maduración (1, 7, 14, 32) Tratar con 101 mg/l KNO3 (14) Germinación inhibida por la oscuridad (1) Sin tratamientos especiales (21)
|
PRE Y POST (18, 25, 31)
|
A
|
|
|
Echinochloa crusgalli
(mijera)
|
A
(16)
|
1,5 (14)
|
L = D (14)
L > D (3)
|
10 - 20 (7, 21)
|
|
Escarificación (7, 32) Germinación no afectada por la intensidad de la radiación (1) Sin tratamientos especiales (3, 14, 21)
|
PRE Y POST (3, 21, 28, 31)
|
A
|
|
|
Elymus canadensis
(zacate silvestre de Canadá)
|
P
Lugares ribereños, alterados (16)
|
4 - 5 (14, 30)
|
L = D (11)
|
1
(11)
|
14 - 28
(11)
|
Sin tratamientos especiales
(2, 11)
|
POST (2)
|
C, D, E
|
|
|
Festuca pratensis
(cañuela)
|
P
Campos, zonas húmedas (16, 19)
|
1,53 - 2,2 (16, 19)
|
L = D (14)
L > D (10)
|
20 (10)
|
9 (74 %) (10)
2 (50 %) (19)
|
Sin tratamientos especiales
(10, 19)
|
POST (10)
|
A
|
7
|
|
Hordeum pusillum
(cola de zorro)
|
A
Pastizales, cunetas, hábitats abiertos (16)
|
3,28 (14)
|
|
|
|
Estratificación en caliente (1) Germinación no afectada por la intensidad de la radiación (1)
|
PRE (31)
|
|
7
|
|
Phleum pratense
(fleo de los prados)
|
P
Pastizales, tierras de labor, lugares alterados (16, 19)
|
0,45 (14, 19)
|
L > D (10, 14)
|
0 - 10 (10, 19)
|
2 (74 %) (10)
8 (50 %) (19)
|
Germinación inhibida por la oscuridad (19) Germinación no afectada por la intensidad de la radiación (17) Sin tratamientos especiales (10, 14, 17, 19)
|
POST (10)
|
A, E
|
|
|
POLYGONACEAE
Polygonum convolvulus
(polígono trepador)
|
A
Hábitats abiertos, cunetas (16)
|
5 - 8 (4, 14, 29)
|
L = D (20)
|
0 - 2 (4, 29)
|
|
Estratificación en frío durante 4-8 semanas (1, 2, 4, 20, 29) Germinación no afectada por la intensidad de la radiación (1)
|
PRE Y POST (1, 2, 20, 28, 31)
|
A
|
32
|
|
Polygonum lapathifolium
(hierba pejiguera)
|
A
Suelos húmedos (16)
|
1,8 - 2,5 (14)
|
L > D (6)
|
|
5 (94 %) (18)
|
Germinación no afectada por la intensidad de la radiación (1) Germinación inhibida por la oscuridad (18) Estratificación en frío (1) Sin tratamientos especiales (5)
|
PRE Y POST (6)
|
A, E
|
|
|
Polygonum pennsylvanicum
(polígono de Pennsylvania)
|
A
Campos, hábitats abiertos (16)
|
3,6 - 7 (14, 29)
|
|
2 (29)
|
|
Estratificación en frío durante 4 semanas a 0 - 5 °C (1, 29) Germinación inhibida por la oscuridad (1)
|
PRE (31)
|
A, E
|
|
|
Polygonum persicaria
(persicaria)
|
A
Zonas alteradas, tierras de labor (16, 19)
|
2,1 - 2,3 (14, 19)
|
L > D (13)
|
0 (19)
|
< 14 (13)
2 (50 %) (19)
|
Escarificación, estratificación en frío, tratamiento con GA (14) Estratificación en frío, maduración (17 - 19) Germinación inhibida por la oscuridad (19) Sin tratamientos especiales (13)
|
POST (13)
|
A
|
32
|
|
Rumex crispus
(acedera)
|
P
Tierras de labor, cunetas, zonas abiertas (16, 19)
|
1,3 - 1,5 (4, 14, 19)
|
L = D (14, 33)
|
0
(4, 19, 33)
|
3 (50 %) (19)
6 (100 %) (33)
|
Germinación inhibida por la oscuridad (18, 19) Puede ser necesaria una fase de maduración (18) Sin tratamientos especiales (4, 14, 33)
|
POST (4, 33)
|
A, E
|
32
|
|
PRIMULACEAE
Anagallis arvensis
(anagálide)
|
A
Tierras de labor, herbazales, lugares alterados (16, 19)
|
0,4 - 0,5 (4, 14, 19)
|
L = D (14)
|
|
1 (50 %) (19)
|
Estratificación en frío, tratamiento con GA (1,14, 18, 19, 32) Luz necesaria para la germinación (1) Sin tratamientos especiales (2, 4)
|
POST (2,4)
|
A, F
|
|
|
RANUNCULACEAE
Ranunculus acris
(botón de oro)
|
Ρ
Tierras de labor, cunetas, zonas abiertas (16, 19)
|
1,5 - 2 (14, 19, 29)
|
L = D (14)
|
1
(29)
|
41 - 56 (19, 29)
|
Sin tratamientos especiales
(5, 14, 22, 24 - 26)
|
POST (5, 22, 24 - 26)
|
|
32
|
|
ROSACEAE
Geum urbanum
(hierba de San Benito)
|
Ρ
Setos, zonas húmedas
(16, 19)
|
0,8 - 1,5 (14, 19)
|
L = D (14)
|
0 (19)
|
5 (50 %) (19)
16 (79 %) (18)
|
Germinación inhibida por la oscuridad (18, 19) Estratificación en caliente (1) Sin tratamientos especiales (5, 14, 22, 25, 26)
|
POST (5, 22, 25, 26)
|
A
|
|
|
RUBIACEAE
Galium aparine
(amor de hortelano)
|
A
Tierras de labor, zonas húmedas, lugares alterados (16, 19)
|
7 - 9 (14, 19)
|
L = D (14)
|
|
5 (50 %) (19)
6 (100 %) (18)
|
Estratificación en frío (1, 18, 19) Germinación no afectada por la intensidad de la radiación (18, 19) La luz inhibe la germinación (1) Sin tratamientos especiales (6, 14)
|
PRE Y POST (6, 28)
|
A
|
32
|
|
Galium mollugo
(galio blanco)
|
Ρ
Setos en taludes, zonas abiertas (8)
|
7
(29)
|
L = D (14)
|
2
(29)
|
|
Sin tratamientos especiales
(5, 14, 22, 24, 26, 29)
|
POST (5, 22, 24, 26)
|
A
|
|
|
SCROPHULARIACEAE
Digitalis purpurea
(digital)
|
Ρ, Β Setos, zonas abiertas (16, 19)
|
0,1 - 0,6 (4, 14, 19)
|
L = D (14)
|
0
(4, 19)
|
6 (50 %) (19)
8 (99 %) (18)
|
Germinación inhibida por la oscuridad (1, 17, – 19) Sin tratamientos especiales (4, 22 - 26)
|
POST (4, 22 - 26)
|
D, G, F
|
|
|
Veronica persica
(verónica)
|
A
Tierras de labor, zonas abiertas, lugares alterados (16, 19)
|
0,5 - 0,6 (14, 19)
|
L = D (14)
|
0 (19)
|
3 (19)
5 (96 %) (18)
|
Germinación inhibida por la oscuridad (18, 19) Estratificación en frío (18) Sin tratamientos especiales (14)
|
PRE Y POST (28)
|
A
|
32
|
Proveedores de semillas citados
|
Identidad del proveedor
|
Información del proveedor
|
|
A
|
|
Herbiseed
|
|
New Farm, Mire Lane, West End, Twyford RG10 0NJ Reino Unido + 44 (0) 1189 349 464
|
|
www.herbiseed.com
|
|
|
B
|
|
Tropilab Inc.
|
|
8240 Ulmerton Road, Largo, FL 33771-3948 Estados Unidos
|
|
(727) 344 - 4050
|
|
www.tropilab.com
|
|
|
C
|
|
Pterophylla — Native Plants & Seeds
|
|
#316 Regional Road 60, RR#1, Walsingham, ON N0E 1X0 Canadá (519) 586 — 3985
|
|
|
D
|
|
Applewood Seed Co.
|
|
5380 Vivian St., Arvada, CO 80002 Estados Unidos (303) 431 - 7333
|
|
www.applewoodseed.com
|
|
|
E
|
|
Ernst Conservation Seeds
|
|
9006 Mercer Pike, Meadville, PA 16335 Estados Unidos
|
|
(800) 873 - 3321
|
|
www.ernstseed.com
|
|
|
F
|
|
Chiltern Seeds
|
|
Bortree Stile, Ulverston, Cumbria LA12 7PB Reino Unido
|
|
+ 44 1229 581137
|
|
www.chiltemseeds.co.uk
|
|
|
G
|
|
Thompson & Morgan
|
|
P.O. Box 1051, Fort Erie, ON L2A 6C7 Canadá (800) 274 - 7333
|
|
www.thompson-morgan.com
|
|
REFERENCIAS CITADAS:
|
(1)
|
Baskin, C.C. & Baskin, J.M. 1998. Seeds. Academic Press, Toronto.
|
|
(2)
|
Blackburn, L.G. & Boutin, C. 2003. Subtle effects of herbicide use in the context of genetically modified crops: a case study with glyphosate (Round-Up®). Ecotoxicology, 12:271-285.
|
|
(3)
|
Boutin, C., Lee, H-B., Peart, T., Batchelor, P.S., & Maguire, R.J. 2000. Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Environmental Toxicology & Chemistry, 19(10):2532-2541.
|
|
(4)
|
Boutin, C., Elmegaard, N., & Kjaer, C. 2004. Toxicity testing of fifteen non-crop plant species with six herbicides in a greenhouse experiment: implications for risk assessment. Ecotoxicology, 13:349-369.
|
|
(5)
|
Breeze, V., Thomas, G., & Butler, R. 1992. Use of a model and toxicity data to predict the risks to some wild plant species from drift of four herbicides. Annals of Applied Biology, 121:669-677.
|
|
(6)
|
Brown, R.A., & Farmer, D. 1991. Track-sprayer and glasshouse techniques for terrestrial plant bioassays with pesticides. In: Plants for toxicity assessment: 2nd volume. ASTM STP 1115, J.W. Gorsuch, W.R. Lower, W.Wang, & M.A. Lewis, eds. American Society for Testing and Materials (Sociedad Americana de Pruebas y Materiales). pp. 197 — 208.
|
|
(7)
|
Buhler, D.D. & Hoffman, M.L. 1999. Anderson's guide to practical methods of propagating weeds and other plants. Weed Science Society of America, Lawrence, K.
|
|
(8)
|
Clapham, A.R., Tutin, T.G., & Warburg, E.F. 1981. Excursion flora of the British Isles, 3rd ed. Cambridge University Press, Cambridge.
|
|
(9)
|
Clay, P.A. & Griffin, J.L. 2000. Weed seed production and seedling emergence response to late-season glyphosate applications. Weed Science, 48:481-486.
|
|
(10)
|
Cole, J.F.H. & Canning, L. 1993. Rationale for the choice of species in the regulatory testing of the effects of pesticides on terrestrial non-target plants. BCPC — Weeds. pp. 151 — 156.
|
|
(11)
|
Fiely, M. (Ernst Conservation Seeds). 2004. Comunicación personal. (www.ernstseed.com)
|
|
(12)
|
Fletcher, J.S., Johnson, F.L., & McFarlane, J.C. 1990. Influence of greenhouse versus field testing and taxonomic differences on plant sensitivity to chemical treatment. Environmental Toxicology & Chemistry, 9:769-776.
|
|
(13)
|
Fletcher, J.S., Pfleeger, T.G., Ratsch, H.C., & Hayes, R. 1996. Potential impact of low levels of chlorsulfuron and other herbicides on growth and yield of nontarget plants. Environmental Toxicology & Chemistry, 15(7):1189-1196.
|
|
(14)
|
Flynn, S., Turner, R.M., and Dickie, J.B. 2004. Seed Information Database (release 6.0, Oct 2004) Royal Botanic Gardens, Kew (www.rbgkew.org.uk/data/sid)
|
|
(15)
|
Franzaring, J., Kempenaar, C., & Van der Eerden, L.J.M. 2001. Effects of vapours of chlorpropham and ethofumesate on wild plant species. Environmental Pollution, 114:21-28.
|
|
(16)
|
Gleason, H.A. & Cronquist, A. 1991. Manual of vascular plants of northeastern United States and adjacent Canada, 2nd ed. New York Botanical Garden, Bronx, NY.
|
|
(17)
|
Grime, J.P. 1981. The role of seed dormancy in vegetation dynamics. Annals of Applied Biology, 98:555-558.
|
|
(18)
|
Grime, J.P., Mason, G., Curtis, A.V., Rodman, J., Band, S.R., Mowforth, M.A.G., Neal, A.M., & Shaw, S. 1981. A comparative study of germination characteristics in a local flora. Journal of Ecology, 69:1017-1059.
|
|
(19)
|
Grime, J.P., Hodgson, J.G., & Hunt, R. 1988. Comparative plant ecology: a functional approach to common British species. Unwin Hyman Ltd., Londres.
|
|
(20)
|
Kjaer, C. 1994. Sublethal effects of chlorsulfuron on black bindweed (Polygonum convolvulus L.). Weed Research, 34:453-459.
|
|
(21)
|
Klingaman, T.E., King, C.A., & Oliver, L.R. 1992. Effect of application rate, weed species, and weed stage of growth on imazethapyr activity. Weed Science, 40:227-232.
|
|
(22)
|
Marrs, R.H., Williams, C.T., Frost, A.J., & Plant, R.A. 1989. Assessment of the effects of herbicide spray drift on a range of plant species of conservation interest. Environmental Pollution, 59:71-86.
|
|
(23)
|
Marrs, R.H., Frost, A.J., & Plant, R.A. 1991. Effects of herbicide spray drift on selected species of nature conservation interest: the effects of plant age and surrounding vegetation structure. Environmental Pollution, 69:223-235.
|
|
(24)
|
Marrs, R.H., Frost, A.J., & Plant, R.A. 1991. Effects of mecoprop drift on some plant species of conservation interest when grown in standardized mixtures in microcosms. Environmental Pollution, 73:25-42.
|
|
(25)
|
Marrs, R.H., Frost, A.J., Plant, R.A., & Lunnis, P. 1993. Determination of buffer zones to protect seedlings of non-target plants from the effects of glyphosate spray drift. Agriculture, Ecosystems, & Environment, 45:283-293.
|
|
(26)
|
Marrs, R.H. & Frost, A.J. 1997. A microcosm approach to detection of the effects of herbicide spray drift in plant communities. Journal of Environmental Management, 50:369-388.
|
|
(27)
|
Marshall, E.J.P. & Bernie, J.E. 1985. Herbicide effects on field margin flora. BCPC — Weeds. pp. 1021-1028.
|
|
(28)
|
McKelvey, R.A., Wright, J.P., & Honegger, J.L. 2002. A comparison of crop and non-crop plants as sensitive species for regulatory testing. Pest Management Science 58, 1161-1174.
|
|
(29)
|
Morton, S. (Herbiseed). 2004. Comunicación personal. (http://www.herbiseed.com)
|
|
(30)
|
USDA, NRCS. 2004. The Plants Database, version 3.5. (http://plants.usda.gov). National Plant Data Centre, Baton Rouge, LA 70874-4490 Estados Unidos.
|
|
(31)
|
US EPA. 1999. One-Liner Database. [U.S. E.P.A./Office of Pesticide Programs/Environmental Fate and Effects Division/Environmental Epidemiology Branch].
|
|
(32)
|
Webster, R. H., 1979. Technical Report No. 56: Growing weeds from seeds and other propagules for experimental purposes. Agricultural Research Council Weed Research Organization, Oxford.
|
|
(33)
|
White, A. L. & Boutin, C. (National Wildlife Research Centre, Environment Canada). 2004. Comunicación personal.
|
|
(34)
|
Zwerger, P. & Pestemer, W. 2000. Testing the phytotoxic effects of herbicides on higher terrestrial non-target plants using a plant life-cycle test. Z. PflKrankh. PflSchutz, Sonderh., 17:711-718.
|
Apéndice 4
Ejemplos de condiciones adecuadas de cultivo para determinadas especies cultivadas
Las siguientes condiciones se han considerado idóneas para diez especies cultivadas, y pueden utilizarse como orientación para los ensayos en cámaras de cultivo también con otras especies determinadas:
|
|
Concentración de dióxido de carbono: 350 ± 50 ppm;
|
|
|
Humedad relativa: 70 ± 5 % durante los períodos de luz y 90 ± 5 % durante los períodos de oscuridad;
|
|
|
Temperatura: 25 ± 3 °C por el día, 20 ± 3 °C por la noche;
|
|
|
Fotoperíodo: 16 horas de luz / 8 horas de oscuridad, partiendo de una media de longitud de onda de 400 a 700 nm;
|
|
|
Luz: luminancia de 350 ± 50 μE/m2/s, medida en lo más alto del follaje.
|
Las especies cultivadas son las siguientes:
|
—
|
tomate (Solanum lycopersicum);
|
|
—
|
pepino (Cucumis sativus);
|
|
—
|
lechuga (Lactuca sativa);
|
|
—
|
col (Brassica oleracea var. capitata)
|
|
—
|
zanahoria (Daucus carota);
|
|
—
|
ballico (Lolium perenne);
|
C.32. ENSAYO DE REPRODUCCIÓN DE ENQUITREIDOS
INTRODUCCIÓN
|
1.
|
El presente método de ensayo es equivalente a las directrices de ensayo de la OCDE TG 220 (2004). Está diseñado para utilizarse en la evaluación de los efectos de las sustancias sobre el resultado reproductor del gusano enquitreido, Enchytraeus albidus, Henle 1873, en el suelo. Se basa principalmente en un método desarrollado por el Umweltbundesamt de Alemania (1), que ha sido objeto de un ensayo interlaboratorios (2). También se han considerado otros métodos de ensayo de la toxicidad de las sustancias para los enquitreidos y las lombrices de tierra (3) (4) (5) (6) (7) (8).
|
CONSIDERACIONES INICIALES
|
2.
|
Los anélidos que viven en el suelo del género Enchytraeus son, desde el punto de vista ecológico, especies pertinentes para ensayos ecotoxicológicos. Si bien los enquitreidos se encuentran a menudo en los suelos que contienen lombrices de tierra, también es cierto que suelen abundar en muchos suelos de los que están ausentes las lombrices de tierra. Los enquitreidos puede utilizarse en pruebas de laboratorio, así como en estudios de semicampo y de campo. Desde un punto de vista práctico, muchas especies de Enchytraeus son fáciles de manejar y criar, y su tiempo de generación es considerablemente menor que el de las lombrices de tierra. La duración de un ensayo de reproducción con enquitreidos es, por tanto, de solo 4 - 6 semanas, mientras que con lombrices de tierra (Eisenia fetida) es de 8 semanas.
|
|
3.
|
Puede encontrarse información básica sobre la ecología y la ecotoxicología de los enquitreidos en el medio ambiente terrestre en las referencias (9) (10) (11) (12).
|
PRINCIPIO DEL ENSAYO
|
4.
|
Se exponen enquitreidos adultos a un intervalo de concentraciones de la sustancia problema mezclada con un suelo artificial. El ensayo puede dividirse en dos fases: a) un ensayo de determinación del intervalo, en caso de que no se disponga de suficiente información, en el que la mortalidad es el principal parámetro evaluado tras dos semanas de exposición, y b) un ensayo definitivo de reproducción, en el que se evalúan el número total de juveniles producidos por un animal padre y la supervivencia de los animales padres. La duración del ensayo definitivo es de seis semanas. Tras las tres primeras semanas se extraen las lombrices adultas y se registran los cambios morfológicos. Después de un período adicional de tres semanas, se cuenta el número de descendientes, nacidos de los capullos producidos por los adultos. El resultado reproductor de los animales expuestos a la sustancia problema se compara con el del control o controles a fin de determinar i) la concentración sin efecto observado (NOEC) y/o ii) una ECx (p. ej., EC10, EC50) aplicando un modelo de regresión para estimar la concentración que causaría una reducción del x % del resultado reproductor. Las concentraciones de ensayo deben englobar la ECx (p. ej., EC10, EC50) de forma que el valor de ECx se obtenga por interpolación y no por extrapolación.
|
INFORMACIÓN SOBRE LA SUSTANCIA PROBLEMA
|
5.
|
Es preferible conocer la hidrosolubilidad, el log Kow, el coeficiente de reparto agua/suelo (véase, por ejemplo, el capítulo C.18 o C.19 del presente anexo) y la presión de vapor de la sustancia problema. Es conveniente disponer de información adicional sobre el destino de la sustancia problema en el suelo, tal como las velocidades de hidrólisis y de fotólisis.
|
|
6.
|
Este método de ensayo puede utilizarse para sustancias tanto solubles como insolubles en agua. Sin embargo, el modo de aplicación de la sustancia problema variará en consecuencia. El método de ensayo no es aplicable a las sustancias volátiles, es decir, sustancias cuya constante de Henry o cuyo coeficiente de reparto aire/agua sea superior a uno, o sustancias cuya presión de vapor a 25 °C supere los 0,0133 Pa.
|
VALIDEZ DEL ENSAYO
|
7.
|
Para que el ensayo sea válido, los controles deben cumplir los criterios de comportamiento siguientes:
|
—
|
la mortalidad de adultos no debe ser superior al 20 % al final del ensayo de determinación del intervalo y después de las tres primeras semanas del ensayo de reproducción;
|
|
—
|
en el supuesto de que se utilicen diez adultos por recipiente en el diseño del ensayo, debe haberse producido al final del ensayo una media de al menos veinticinco juveniles por recipiente;
|
|
—
|
el coeficiente de variación alrededor del número medio de juveniles no debe ser superior al 50 % al final del ensayo de reproducción.
|
Cuando un ensayo no cumpla los criterios de validez arriba indicados, el ensayo debe interrumpirse, salvo que pueda aportarse una justificación para continuar con él. La justificación deberá incluirse en el informe.
|
SUSTANCIA DE REFERENCIA
|
8.
|
Es necesario someter a ensayo una sustancia de referencia a intervalos regulares, o bien incluirla en cada ensayo, para verificar que la respuesta de los organismos de ensayo no ha cambiado de forma significativa a lo largo del tiempo. La carbendazima es una sustancia de referencia adecuada de la que se ha visto que afecta a la supervivencia y reproducción de los enquitreidos (13) (14), pero pueden utilizarse otras sustancias cuyos datos de toxicidad sean bien conocidos. En un ensayo interlaboratorios se utilizó una formulación de carbendazima conocida por el nombre comercial de Derosal™, suministrada por AgrEvo Company (Francfort, Alemania) y que contiene 360 g/l de principio activo (32,18 %) (2). La EC50 para la reproducción determinada en la prueba interlaboratorios era del orden de 1,2 ± 0,8 mg de principio activo (p. a.) por kg de masa seca (2). Si se incluye un patrón tóxico positivo en la serie de ensayo, se utiliza una sola concentración y el número de réplicas debe ser el mismo que el de los controles. Por lo que respecta a la carbendazima, se recomienda el ensayo de 1,2 mg p. a./kg de peso seco (ensayo con la formulación líquida).
|
DESCRIPCIÓN DEL ENSAYO
Equipo
|
9.
|
Los recipientes de ensayo serán de vidrio o de otro material químicamente inerte. Son adecuados los frascos de vidrio (por ejemplo, volumen: 0,20 - 0,25 litros; diámetro: ≈ 6 cm). Deben disponer de tapas transparentes (por ejemplo, de vidrio o de polietileno) diseñadas de forma que se reduzca la evaporación, pero permitiendo al mismo tiempo el intercambio de gases entre el suelo y la atmósfera. Las tapas deben ser transparentes para permitir la transmisión de la luz.
|
|
10.
|
Se precisa el equipo normal de laboratorio y, en particular, el siguiente:
|
—
|
microscopio estereoscópico;
|
|
—
|
balanzas exactas adecuadas;
|
|
—
|
equipo adecuado para el control de la temperatura;
|
|
—
|
equipo adecuado para el control de la humedad (no esencial si los recipientes de exposición tienen tapa);
|
|
—
|
incubadora o pequeña sala con aire acondicionado;
|
|
—
|
pinzas, ganchos o asas;
|
|
—
|
cubeta de revelado fotográfico.
|
|
Preparación del suelo artificial
|
11.
|
En este ensayo se utiliza un suelo artificial (5) (7) con la siguiente composición (en peso seco, secado hasta peso constante a 105 °C):
|
—
|
10 % de turba esfágnea, secada al aire y finamente molida (es aceptable un tamaño de partícula de 2 ± 1 mm); antes de su utilización en un ensayo, es recomendable comprobar que un suelo elaborado con un nuevo lote de turba es adecuado para el cultivo de lombrices;
|
|
—
|
20 % de caolín, con un contenido de caolinita preferentemente superior al 30 %;
|
|
—
|
aproximadamente entre 0,3 y 1,0 % de carbonato de calcio (CaCO3, pulverizado, de pureza analítica) para obtener un pH de 6,0 ± 0,5; la cantidad de carbonato de calcio añadido puede depender principalmente de la calidad o naturaleza de la turba;
|
|
—
|
alrededor del 70 % de arena de cuarzo secada al aire (dependiendo de la cantidad necesaria de CaCO3), en su mayor parte en forma de arena fina, con más del 50 % de las partículas de un tamaño entre 50 y 200 μm.
|
Es aconsejable demostrar la aptitud de un suelo artificial para el cultivo de los gusanos y el cumplimiento de los criterios de validez del ensayo antes de utilizar el suelo en un ensayo definitivo. En particular, se recomienda hacer un control de ese tipo para garantizar que los resultados del ensayo no se vean comprometidos si el contenido de carbono orgánico del suelo artificial se reduce, por ejemplo rebajando el contenido de turba al 4-5 % y aumentando análogamente el contenido de arena. Con esta reducción del contenido de carbono orgánico, es posible que disminuyan las posibilidades de adsorción de la sustancia problema al suelo (carbono orgánico) y que aumente la disponibilidad de la sustancia problema para los gusanos. Se ha demostrado que Enchytraeus albidus puede ajustarse a los criterios de validez sobre la reproducción cuando se somete a ensayo en suelos de campo con un contenido de carbono orgánico menor que el mencionado más arriba (p. ej., del 2,7 %) (15), y la experiencia (si bien es limitada) demuestra que esto también puede conseguirse en suelo artificial con un 5 % de turba.
Nota: Cuando se utiliza suelo natural en ensayos adicionales (por ejemplo, de nivel superior), deben demostrarse también la idoneidad del suelo y el respeto de los criterios de validez del ensayo.
|
|
12.
|
Los componentes secos del suelo se mezclan a fondo (por ejemplo, en un mezclador de laboratorio de gran escala). Esta operación debe efectuarse al menos una semana antes de que se inicie el ensayo. El suelo mezclado debe mantenerse durante dos días con el fin de equilibrar o estabilizar la acidez. Para la determinación del pH se utiliza una mezcla de suelo y solución de cloruro de potasio 1 M (KCl) o de cloruro de calcio 0,01 M (CaCl2) en una proporción de 1:5 (véase la referencia (16) y el apéndice 3). Si el suelo es más ácido que la banda exigida (véase el punto 11), puede ajustarse añadiendo una cantidad adecuada de CaCO3. Si el suelo es demasiado alcalino, puede ajustarse mediante la adición de más cantidad de la mezcla, mencionada en el punto 11, pero excluyendo el CaCO3.
|
|
13.
|
La capacidad máxima de retención de agua del suelo artificial se determina de acuerdo con los procedimientos descritos en el apéndice 2. Uno o dos días antes del inicio del ensayo, el suelo artificial seco se prehumedece, añadiéndole una cantidad suficiente de agua desionizada para obtener aproximadamente la mitad del contenido final de agua, que supone de un 40 a un 60 % de la capacidad máxima de retención de agua. Al inicio del ensayo, el suelo prehumedecido se divide en las partes correspondientes al número de concentraciones de ensayo (y de sustancias de referencia en su caso) y de controles utilizados en el ensayo. El contenido de humedad se ajusta al 40 - 60 % de la capacidad máxima de retención de agua mediante la adición de la solución de la sustancia problema y/o añadiendo agua desionizada o destilada (véanse los puntos 19 a 21). Se determina el contenido de humedad al inicio y al final del ensayo (por secado hasta la obtención de un peso constante a 105 °C); dicho contenido debe estar en la banda óptima para la supervivencia de las lombrices. Una estimación general del contenido de humedad del suelo puede obtenerse apretando el suelo suavemente con la mano; si el contenido de humedad es correcto, deben aparecer gotitas de agua entre los dedos.
|
Selección y preparación de los animales de ensayo
|
14.
|
La especie recomendada es Enchytraeus albidus Henle 1837 (gusano blanco), miembro de la familia Enchytraeidae (orden Oligochaeta, filum Annelida). E. albidus es una de las mayores especies de enquitreidos, y se han observado especímenes de hasta 35 mm de longitud (17) (18). E. albidus tiene distribución mundial y se encuentra en hábitats marinos, de agua dulce y terrestres, sobre todo en materia orgánica en descomposición (algas, compost) y raramente en praderas (9). Su amplia tolerancia ecológica y algunas variaciones morfológicas podrían indicar que existen diferentes razas.
|
|
15.
|
E. albidus se encuentra en el comercio, como alimento para peces. Ha de comprobarse si el cultivo está contaminado con otras especies, generalmente más pequeñas (1) (19). Si hay contaminación, se deben lavar todos los gusanos con agua en una placa Petri. Se seleccionan a continuación los ejemplares adultos grandes de E. albidus (empleando un microscopio estereoscópico) para iniciar un nuevo cultivo y se desechan todos los demás gusanos. E. albidus pueden criarse en una amplia gama de materiales orgánicos (véase el apéndice 4). El ciclo de vida de E. albidus es corto, ya que se alcanza la madurez entre los 33 días (a 18 °C) y los 74 días (a 12 °C) (1). Se utilizarán para el ensayo solo los cultivos que hayan permanecido sin problemas en el laboratorio al menos cinco semanas (una generación).
|
|
16.
|
Son también adecuadas otras especies del género Enchytraeus, por ejemplo E. buchholzi Vejdovsky 1879 o E. crypticus Westheide & Graefe 1992 (véase el apéndice 5). Si se utilizan otras especies de Enchytraeus, deben identificarse claramente y hay que indicar los motivos por los que se han seleccionado.
|
|
17.
|
Los animales utilizados en los ensayos son gusanos adultos. Deben tener huevos (puntos blancos) en la región del clitelo, y ser aproximadamente del mismo tamaño (de aproximadamente 1 cm de longitud). No es necesario sincronizar el cultivo de cría.
|
|
18.
|
Si los enquitreidos no se crían en el mismo tipo de suelo y en las mismas condiciones (incluida la alimentación) que se utilizan para el ensayo final, deben aclimatarse durante al menos 24 horas y hasta tres días. Conviene, en un primer momento, aclimatar un número de adultos mayor que el necesario para realizar el ensayo, a fin de dejar margen suficiente para el rechazo de especímenes dañados o inadecuados por cualquier otro concepto. Al final de la fase de aclimatación, se seleccionan para el ensayo solo los gusanos que contengan huevos y no presenten anomalías de comportamiento (por ejemplo, que traten de escapar del suelo). Los gusanos se retiran cuidadosamente utilizando pinzas de joyero, ganchos o asas y se colocan en una placa Petri que contenga una pequeña cantidad de agua dulce. Con este objeto es preferible utilizar agua dulce reconstituida según lo propuesto en el capítulo C.20 del presente anexo (ensayo de reproducción en Daphnia magna), ya que el agua desionizada, desmineralizada o del grifo puede ser nociva para los gusanos. Los gusanos se inspeccionan con un microscopio estereoscópico y se eliminan los que no contengan huevos. Se ha de tener cuidado para retirar y desechar los ácaros o colémbolos que puedan haber infectado los cultivos. Los gusanos sanos no utilizados para el ensayo se devuelven al cultivo madre.
|
Preparación de las concentraciones de ensayo
Sustancia problema hidrosoluble
|
19.
|
Se prepara una solución de la sustancia problema en agua desionizada en una cantidad suficiente para todas las réplicas de una sola concentración de ensayo. Se recomienda utilizar una cantidad apropiada de agua para conseguir el contenido necesario de humedad, es decir, entre el 40 y el 60 % de la capacidad máxima de retención de agua (véase el punto 13). Cada una de las soluciones de la sustancia problema se mezcla a fondo con un lote de suelo prehumedecido antes de introducirla en el recipiente de ensayo.
|
Sustancia problema no hidrosoluble
|
20.
|
En el caso de las sustancias no solubles en el agua, pero solubles en disolventes orgánicos, la sustancia problema puede disolverse en el volumen mínimo posible de un vehículo adecuado (por ejemplo, acetona). Solo deben utilizarse disolventes volátiles. El vehículo se rocía sobre una pequeña cantidad, como, por ejemplo, 2,5 g de arena de cuarzo fina, o se mezcla con ella. El vehículo se elimina por evaporación bajo una campana extractora durante al menos una hora. Esta mezcla de arena de cuarzo y sustancia problema se añade al suelo prehumedecido y se mezcla completamente después de añadir la cantidad adecuada de agua desionizada para obtener la humedad necesaria. La mezcla final se introduce en los recipientes de ensayo.
|
|
21.
|
En el caso de sustancias poco solubles en agua y en disolventes orgánicos, se mezcla el equivalente de 2,5 g de arena de cuarzo finamente molida por recipiente de ensayo con la cantidad de sustancia problema necesaria para obtener la concentración de ensayo deseada. Esta mezcla de arena de cuarzo y sustancia problema se añade al suelo prehumedecido y se mezcla completamente después de añadir la cantidad adecuada de agua desionizada para obtener el contenido necesario de humedad. La mezcla final se divide entre los recipientes de ensayo. Se repite el procedimiento para cada concentración de ensayo, y se prepara asimismo un control adecuado.
|
|
22.
|
Normalmente, las sustancias no deben someterse a ensayo a concentraciones superiores a 1 000 mg/kg de masa seca de suelo. Sin embargo, puede ser necesario efectuar ensayos a concentraciones más elevadas, de conformidad con los objetivos de un ensayo específico.
|
REALIZACIÓN DE LOS ENSAYOS
Grupos de ensayo y controles
|
23.
|
Respecto a cada concentración de ensayo, se coloca en el recipiente de ensayo una cantidad de suelo de ensayo correspondiente a 20 g de peso seco, (véanse los puntos 19 - 21). Se preparan también controles, sin la sustancia problema. A cada recipiente se añaden alimentos con arreglo a los procedimientos descritos en el punto 29. Se asignan aleatoriamente diez gusanos a cada recipiente de ensayo. Los gusanos se transfieren con cuidado a cada recipiente de ensayo y se colocan en la superficie del suelo, por ejemplo utilizando pinzas de joyero, ganchos o asas. El número de réplicas para las concentraciones de ensayo y para los controles dependerá del diseño del ensayo (véase el punto 34). Los recipientes de ensayo se colocan en la incubadora de ensayo de forma aleatoria, y estas posiciones se vuelven a aleatorizar cada semana.
|
|
24.
|
Si se utiliza un vehículo para la aplicación de la sustancia problema, debe someterse a ensayo, además de la serie con la sustancia problema, una serie de control con arena de cuarzo rociada o mezclada con el disolvente. La concentración de disolvente o dispersante ha de ser igual a la usada en los recipientes de ensayo que contienen la sustancia problema. Debe realizarse el ensayo de una serie de control con arena de cuarzo adicional (2,5 g por recipiente) en caso de sustancias que requieran añadirse de conformidad con los procedimientos descritos en el punto 21.
|
Condiciones del ensayo
|
25.
|
La temperatura de ensayo es de 20 ± 2 °C. Para disuadir a los gusanos de escaparse del suelo, se efectúa el ensayo en ciclos controlados de luz y oscuridad (preferentemente de 16 horas de luz y 8 horas de oscuridad) con una iluminación de 400 a 800 lux en la zona de los recipientes de ensayo.
|
|
26.
|
Con el fin de controlar la humedad del suelo, los recipientes se pesan al principio del ensayo y, posteriormente, una vez por semana. La pérdida de peso se compensa con la adición de una cantidad adecuada de agua desionizada. Cabe señalar que la pérdida de agua puede reducirse mediante el mantenimiento de una alta humedad ambiental (> 80 %) en la incubadora de ensayo.
|
|
27.
|
El contenido de humedad y el pH han de medirse al principio y al final tanto de la prueba de determinación del intervalo como del ensayo definitivo. Deben efectuarse mediciones en muestras del suelo control y tratado (todas las concentraciones) que se habrán preparado y mantenido en las mismas condiciones que los cultivos de ensayo, pero sin adición de gusanos. Solo deben añadirse alimentos a estas muestras de suelo al comienzo del ensayo para facilitar la actividad microbiana. La cantidad de alimentos que se añade debe ser la misma que se añade a los cultivos de ensayo. No es necesario añadir más alimentos a estos recipientes durante el ensayo.
|
Alimentación
|
28.
|
Pueden utilizarse alimentos capaces de mantener la población de enquitreidos. Se ha visto que los copos de avena, preferiblemente tratados en el autoclave antes de su utilización para evitar la contaminación microbiana (el calentamiento también es adecuado), constituyen un alimento adecuado.
|
|
29.
|
Los alimentos se añaden, al inicio, mezclando 50 mg de copos de avena molidos con el suelo de cada recipiente antes de introducir los gusanos. Después, los alimentos se suministran una vez por semana hasta el día 21. No se añaden alimentos el día 28, puesto que los adultos se han retirado en esta fase y los gusanos juveniles necesitan relativamente poca comida adicional más allá de este punto. Durante el ensayo, la alimentación se compone de 25 mg de copos de avena molidos por recipiente colocados cuidadosamente en la superficie del suelo para evitar dañar a los gusanos. Con el fin de reducir el crecimiento de hongos, los copos de avena deben enterrarse en el suelo cubriéndolos con pequeñas cantidades de este. Si queda comida sin consumir, la ración alimentaria debe reducirse.
|
Diseño para el ensayo de determinación del intervalo
|
30.
|
Cuando sea necesario, se llevará a cabo un ensayo de determinación del intervalo con, por ejemplo, cinco concentraciones de la sustancia problema, de 0,1, 1,0, 10, 100 y 1 000 mg/kg (peso seco de suelo). Es suficiente con una sola réplica para cada tratamiento y control.
|
|
31.
|
La duración del ensayo de determinación del intervalo es de seis semanas. Al final del ensayo se determina la mortalidad de los gusanos. Se considera que un gusano está muerto si no reacciona ante un estímulo mecánico en el extremo anterior. Puede ser útil disponer de otros datos además de la mortalidad a la hora de decidir sobre el intervalo de concentraciones que debe usarse en el ensayo definitivo. Por tanto, también deben registrarse los cambios en el comportamiento de los adultos (por ejemplo, si se vuelven incapaces de excavar en el suelo o si se quedan inmóviles junto a la pared de vidrio del recipiente de ensayo) y en su morfología (p. ej., si tienen heridas abiertas), además de la eventual presencia de juveniles. Esta última puede determinarse con el método de tinción descrito en el apéndice 6.
|
|
32.
|
La LC50 puede determinarse aproximadamente calculando la media geométrica de los datos de mortalidad. Al determinar el intervalo de concentraciones para el ensayo definitivo, se supone que la concentración con efecto sobre la reproducción es hasta diez veces inferior a la LC50. No obstante, se trata de una relación empírica y en algún caso específico podría ser diferente. Las observaciones adicionales realizadas en el ensayo de determinación del intervalo de concentraciones, tales como la presencia de juveniles, pueden contribuir a afinar el intervalo de concentraciones de la sustancia problema que debe utilizarse en el ensayo definitivo.
|
|
33.
|
Con el fin de determinar de forma exacta la LC50, se recomienda realizar el ensayo utilizando un mínimo de cuatro réplicas de cada concentración de la sustancia problema y un número adecuado de concentraciones que causen al menos cuatro respuestas medias con diferencias estadísticamente significativas a estas concentraciones. Para los controles se utiliza un número similar de concentraciones y de réplicas, en su caso.
|
Diseño para el ensayo definitivo de reproducción
|
34.
|
Se proponen tres diseños sobre la base de las recomendaciones derivadas de una prueba interlaboratorios (2).
|
—
|
Para la determinación de la NOEC deben someterse a ensayo al menos cinco concentraciones en serie geométrica. Se recomienda utilizar cuatro réplicas de cada concentración de ensayo más ocho controles. Las concentraciones deben estar separadas por un factor que no exceda de 1,8.
|
|
—
|
Para la determinación de una ECx (p. ej., EC10, EC50), deben someterse a ensayo al menos cinco concentraciones, entre las que debe quedar englobada la ECx a fin de obtenerla mediante interpolación y no extrapolación. Se recomienda utilizar al menos cuatro réplicas de cada concentración de ensayo y cuatro réplicas de control. El factor de espaciado puede variar, es decir, ser igual o inferior a 1,8 en el intervalo de efecto previsto y superior a 1,8 a concentraciones superiores e inferiores.
|
|
—
|
Un enfoque combinado permite la determinación tanto de la NOEC como de la ECx. Deben utilizarse ocho concentraciones de tratamiento en progresión geométrica. Se recomienda utilizar cuatro réplicas de cada tratamiento más ocho controles. Las concentraciones deben estar separadas por un factor que no exceda de 1,8.
|
|
|
35.
|
Se deben utilizar diez gusanos adultos por recipiente de ensayo (véase el punto 23). Se añaden alimentos a los recipientes de ensayo al inicio del ensayo y, a continuación, una vez por semana (véase el punto 29) hasta el día 21, incluido. El día 21 se toman a mano muestras de suelo y se observan y recuentan los gusanos adultos vivos, y se registran los cambios en el comportamiento (por ejemplo, si se vuelven incapaces de excavar en el suelo o si se quedan inmóviles junto a la pared de vidrio del recipiente de ensayo) y en la morfología (p. ej., si tienen heridas abiertas). A continuación, se retiran todos los gusanos adultos de los recipientes de ensayo y del suelo de ensayo. El suelo de ensayo que contiene los capullos que se hayan producido se incuba durante tres semanas adicionales en las mismas condiciones de ensayo, salvo que solo se añaden alimentos el día 35 (es decir, 25 mg de copos de avena molidos por recipiente).
|
|
36.
|
Después de seis semanas, se efectúa el recuento de los gusanos recién nacidos. Se recomienda el método basado en la tinción con rojo de Bengala (véase el apéndice 6), aunque también se ha comprobado que son adecuadas otras técnicas de extracción y flotación por vía húmeda (pero sin calentamiento) (véase el apéndice 6) (4) (10) (11) (20). Se recomienda la tinción con rojo de Bengala porque la extracción por vía húmeda a partir de un sustrato de suelo puede verse obstaculizada por la turbidez causada por partículas de arcilla en suspensión.
|
Ensayo límite
|
37.
|
Si no se observan efectos a la concentración máxima en el ensayo de determinación del intervalo (es decir, 1 000 mg/kg), el ensayo de reproducción puede realizarse como un ensayo límite con 1 000 mg/kg, con el fin de demostrar que la NOEC para la reproducción es superior a ese valor.
|
Resumen y calendario del ensayo
|
38.
|
Las etapas del ensayo pueden resumirse como sigue:
|
Día
|
Ensayo de determinación del intervalo
|
Ensayo definitivo
|
|
Día –7 o antes
|
|
—
|
Preparación del suelo artificial (mezcla de los componentes secos)
|
|
|
—
|
Preparación del suelo artificial (mezcla de los componentes secos)
|
|
|
Día –5
|
|
—
|
Verificación del pH del suelo artificial
|
|
—
|
Medición de la capacidad máxima de retención de agua del suelo
|
|
|
—
|
Verificación del pH del suelo artificial
|
|
—
|
Medición de la capacidad máxima de retención de agua del suelo
|
|
|
Días –5 a –3
|
|
—
|
Clasificación de las lombrices para su aclimatación
|
|
|
—
|
Clasificación de las lombrices para su aclimatación
|
|
|
Días –3 a 0
|
|
—
|
Aclimatación de las lombrices durante al menos 24 horas
|
|
|
—
|
Aclimatación de las lombrices durante al menos 24 horas
|
|
|
Día –1
|
|
—
|
Prehumidificación del suelo artificial y distribución en lotes
|
|
|
—
|
Prehumidificación del suelo artificial y distribución en lotes
|
|
|
Día 0
|
|
—
|
Preparación de las soluciones madre
|
|
—
|
Aplicación de la sustancia problema
|
|
—
|
Pesada del sustrato problema en los recipientes de ensayo
|
|
—
|
Adición de los alimentos
|
|
—
|
Introducción de las lombrices
|
|
—
|
Medición del pH y del contenido de humedad del suelo
|
|
|
—
|
Preparación de las soluciones madre
|
|
—
|
Aplicación de la sustancia problema
|
|
—
|
Pesada del sustrato problema en los recipientes de ensayo
|
|
—
|
Adición de los alimentos
|
|
—
|
Introducción de las lombrices
|
|
—
|
Medición del pH y del contenido de humedad del suelo
|
|
|
Día 7
|
|
—
|
Comprobación del contenido de humedad del suelo
|
|
|
—
|
Comprobación del contenido de humedad del suelo
|
|
|
Día 14
|
|
—
|
Determinación de la mortalidad de los adultos
|
|
—
|
Estimación del número de juveniles
|
|
—
|
Medición del pH y del contenido de humedad del suelo
|
|
|
—
|
Comprobación del contenido de humedad del suelo
|
|
|
Día 21
|
|
|
—
|
Observación del comportamiento de los adultos
|
|
—
|
Retirada de los adultos
|
|
—
|
Determinación de la mortalidad de los adultos
|
|
—
|
Comprobación del contenido de humedad del suelo
|
|
|
Día 28
|
|
|
—
|
Comprobación del contenido de humedad del suelo
|
|
—
|
Sin adición de alimentos
|
|
|
Día 35
|
|
|
—
|
Comprobación del contenido de humedad del suelo
|
|
|
Día 42
|
|
|
—
|
Recuento de los gusanos juveniles
|
|
—
|
Medición del pH y del contenido de humedad del suelo
|
|
|
DATOS E INFORME
Tratamiento de los resultados
|
39.
|
A pesar de que se da una visión de conjunto en el apéndice 7, en este método de ensayo no se incluye ninguna orientación estadística definitiva para el análisis de los resultados del ensayo.
|
|
40.
|
En la prueba de determinación del intervalo, el parámetro principal es la mortalidad. Sin embargo, también deben registrarse los cambios en el comportamiento (por ejemplo, si se vuelven incapaces de excavar en el suelo o si se quedan inmóviles junto a la pared de vidrio del recipiente de ensayo) y en la morfología (p. ej., si tienen heridas abiertas) de los gusanos adultos, además de la eventual presencia de juveniles. Para determinar la LC50 debe aplicarse en principio el análisis de probit (21) o la regresión logística. No obstante, en aquellos casos en que este método de análisis no sea adecuado (por ejemplo, si se dispone de menos de tres concentraciones con mortalidades parciales) pueden utilizarse métodos alternativos. Entre estos métodos pueden figurar el de medias móviles (22), el método de Spearman-Karber recortado (23) o una interpolación simple (p. ej., media geométrica de LC0 y LC100, calculada multiplicando la raíz cuadrada de LC0 por LC100).
|
|
41.
|
En el ensayo definitivo, el parámetro del ensayo es la fecundidad (es decir, el número de juveniles producidos). Sin embargo, como en el ensayo de determinación del intervalo, deben registrarse en el informe final todos los demás signos de naturaleza nociva. El análisis estadístico requiere que se calculen la media aritmética y la desviación típica por grupo de tratamiento y por grupo de control en cuanto a la reproducción.
|
|
42.
|
Si se ha realizado el análisis de la varianza, la desviación típica, s, y los grados de libertad, df, pueden sustituirse respectivamente por la estimación de la varianza “agrupada” obtenida del ANOVA y por sus grados de libertad, siempre que la varianza no dependa de la concentración. En este caso, se utilizarán las distintas varianzas de los controles y de los grupos tratados. Estos valores son calculados en general por programas estadísticos comerciales utilizando los resultados de cada recipiente como réplicas. Si la “agrupación” de datos de los controles negativo y de disolvente parece más razonable que hacer las pruebas respecto a uno solo de estos conjuntos, debe comprobarse que no son significativamente diferentes (sobre pruebas apropiadas, véanse el punto 45 y el apéndice 7).
|
|
43.
|
La realización de más pruebas estadísticas y de deducciones depende de si los valores de las réplicas se distribuyen normalmente y son homogéneas en lo que respecta a su varianza.
|
Estimación de la NOEC
|
44.
|
Es preferible la aplicación de ensayos potentes. Se debería utilizar la información previa obtenida, por ejemplo a partir de la experiencia con ensayos interlaboratorios u otros datos históricos, sobre si los datos presentan una distribución aproximadamente normal. Es más crítica la homogeneidad de la varianza (homoscedasticidad). La experiencia indica que la varianza suele aumentar cuando sube la media. En estos supuestos, una transformación de los datos podría llevar a la homoscedasticidad. Sin embargo, esta transformación debe basarse en la experiencia con datos históricos, más que en los datos objeto de la investigación. Con datos homogéneos, deben llevarse a cabo pruebas t de comparación múltiple, como la prueba de Williams (α = 0,05, unilateral) (24) (25) o, en algunos casos, la prueba de Dunnett (26) (27). Cabe señalar que, en caso de replicación desigual, los valores t del cuadro deberán corregirse según lo sugerido por Dunnett y Williams. En ocasiones, debido a una gran variación, las respuestas no aumentan o disminuyen regularmente. En este caso de fuerte desviación respecto a la monotonicidad, es más conveniente la prueba de Dunnett. En caso de que haya desviaciones con respecto a la homoscedasticidad, puede resultar razonable analizar más estrechamente los posibles efectos sobre las varianzas, a fin de decidir si las pruebas t pueden aplicarse sin perder mucha potencia (28). De forma alternativa, puede aplicarse una prueba U de comparación múltiple, por ejemplo la prueba U de Bonferroni según Holm (29), o, cuando estos datos presenten heteroscedasticidad pero por lo demás sean coherentes con una relación dosis-respuesta monótona subyacente, otra prueba no paramétrica [por ejemplo, una prueba de Jonckheere-Terpstra (30) (31) o Shirley (32) (33)] y, en general, se dará preferencia a estas pruebas frente a las pruebas t de varianza desigual (véase también el esquema del apéndice 7).
|
|
45.
|
En caso de que se haya realizado un ensayo límite y se cumplan los requisitos previos de procedimientos de ensayos paramétricos (normalidad, homogeneidad), puede utilizarse la prueba t de Student pareada o, si no, el procedimiento de la prueba U de Mann-Whitney (29).
|
Estimación de ECx
|
46.
|
Para calcular cualquier valor de ECx se utilizan las medias por tratamiento para el análisis de regresión (lineal o no lineal), tras haber obtenido una función dosis-respuesta adecuada. En relación con el crecimiento de los gusanos como respuesta continua, pueden calcularse los valores de ECx utilizando el análisis de regresión adecuado (35). Entre las funciones adecuadas para los datos cuánticos (mortalidad/supervivencia y número de descendientes producidos) están las funciones sigmoideas normales, logísticas o de Weibull, con entre dos y cuatro parámetros, algunas de las cuales pueden modelizar también respuestas horméticas. Si la función dosis-respuesta se ha ajustado mediante análisis de regresión lineal, debe determinarse con el análisis de regresión un r2 (coeficiente de determinación) y/o una pendiente significativos antes de estimar la ECx mediante la inserción de un valor correspondiente a x % de la media del control en la ecuación encontrada con el análisis de regresión. Se calculan límites de confianza del 95 % con arreglo al método de Fieller [citado en Finney (21)] u otros métodos adecuados modernos.
|
|
47.
|
Otra posibilidad consiste en modelizar la respuesta como porcentaje o proporción del parámetro del modelo que se interpreta como la respuesta media del control. En estos casos, la curva sigmoidea normal (logística, Weibull) puede ajustarse a menudo fácilmente a los resultados utilizando el método de regresión de probit (21). En estos casos, la función de ponderación ha de ajustarse para respuestas métricas según indica Christensen (36). No obstante, si se ha observado hormesis, el análisis de probit debe ser sustituido por una función logística o de Weibull de cuatro parámetros, ajustada por un método de regresión no lineal (36). Si no puede ajustarse a los datos una función dosis-respuesta adecuada, podrán utilizarse métodos alternativos para calcular el valor de ECx y sus límites de confianza, tales como el método de medias móviles de Thompson (22) y el de Spearman-Karber recortado (23).
|
INFORME DEL ENSAYO
|
48.
|
El informe del ensayo deberá incluir la información siguiente:
|
|
Sustancia problema:
|
—
|
naturaleza física y propiedades fisicoquímicas pertinentes (p, ej., hidrosolubilidad, presión de vapor, etc.),
|
|
—
|
identificación química de la sustancia problema según la nomenclatura de la IUPAC, número CAS, lote de fabricación, lote de acondicionamiento, fórmula estructural y pureza,
|
|
—
|
fecha de expiración de la muestra.
|
|
|
|
Especies de ensayo:
|
—
|
animales utilizados en el ensayo: especie, nombre científico, origen de los organismos y condiciones de cría.
|
|
|
|
Condiciones de ensayo:
|
—
|
ingredientes y preparación del suelo artificial,
|
|
—
|
método de aplicación de la sustancia problema,
|
|
—
|
descripción de las condiciones de ensayo, como la temperatura, la humedad, el pH, etc.,
|
|
—
|
descripción completa del diseño experimental y procedimientos.
|
|
|
|
Resultados del ensayo:
|
—
|
mortalidad de los gusanos adultos tras dos semanas y número de juveniles al final del ensayo de determinación del intervalo,
|
|
—
|
mortalidad de los gusanos adultos tras una exposición de tres semanas y registro completo de los juveniles al final del ensayo de determinación del intervalo,
|
|
—
|
cualquier síntoma físico o patológico y cambio en el comportamiento de los organismos de ensayo que se haya observado,
|
|
—
|
la LC50, la NOEC y/o ECx (p. ej., EC50, EC10) para la reproducción si algunas de ellas son aplicables con intervalos de confianza, y un gráfico del modelo ajustado utilizado para su cálculo, todas las informaciones y observaciones útiles para la interpretación de los resultados.
|
|
Las eventuales desviaciones respecto a los procedimientos descritos en el presente método de ensayo y cualquier acontecimiento inusual ocurrido en el ensayo.
|
BIBLIOGRAFÍA
|
(1)
|
Römbke, J. (1989). Entwicklung eines Reproduktionstests an Bodenorganismen — Enchytraeen. Abschlußbericht des Battelle-Instituts e.V. Frankfurt für das Umweltbundesamt Berlin, FE-Vorhaben 106 03 051/01.
|
|
(2)
|
Römbke, J. and Moser, T. (1999). Organisation and Performance of an International Ringtest for the Validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, 150 + 223 pp.
|
|
(3)
|
Westheide, W. and Bethge-Beilfuss, D. (1991). The sublethal enchytraeid test system: guidelines and some results, In: Modern Ecology: Basic and Applied Aspects. Ed. by Esser, G. and Overdieck, D. pp 497-508. Elsevier, Amsterdam,
|
|
(4)
|
Dirven-Van Breemen, E., Baerselmann, R. and Notenboom, J. (1994). Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) in Bodemecotoxicologisch Onderzoek. RIVM Rapport Nr. 719102025. 46 pp.
|
|
(5)
|
Capítulo C.8 del presente anexo. Toxicidad para gusanos de tierra.
|
|
(6)
|
ISO (Organización Internacional de Normalización) (1993). Calidad del suelo: Efectos de los contaminantes sobre las lombrices de tierra (Eisenia fetida). Parte 1: Determinación de la toxicidad aguda utilizando un sustrato de suelo artificial, no 11268-1. ISO, Ginebra.
|
|
(7)
|
ISO (Organización Internacional de Normalización) (1996). Calidad del suelo: Efectos de los contaminantes en lombrices (Eisenia fetida). Parte 2: Determinación de los efectos en la reproducción, no 11268-2. ISO, Ginebra.
|
|
(8)
|
Rundgren, S. and A.K. Augustsson (1998). Test on the enchytraeid Cognettia sphagnetorum (Vejdovsky 1877). En: Løkke, H. and C.A.M. Van Gestel, Handbook of soil invertebrate toxicity tests. John Wiley and Sons, Chichester, 73-94.
|
|
(9)
|
Kasprzak, K. (1982). Review of enchytraeid community structure and function in agricultural ecosystems. Pedobiologia 23, 217-232.
|
|
(10)
|
Römbke, J. (1995). Enchytraeen (Oligochaeta) als Bioindikator, UWSF — Z. Umweltchem. Ökotox. 7, 246-249.
|
|
(11)
|
Dunger, W. and Fiedler, H.J. (1997). Methoden der Bodenbiologie. G. Fischer Verlag, Stuttgart, Nueva York.
|
|
(12)
|
Didden, W.A.M. (1993). Ecology of terrestrial Enchytraeidae. Pedobiologia 37, 2-29.
|
|
(13)
|
Becker, H. (1991). Bodenorganismen — Prüfungskategorien der Forschung. UWSF — Z. Umweltchem. Ökotox. 3, 19-24.
|
|
(14)
|
Römbke, J. and Federschmidt, A. (1995). Effects of the fungicide Carbendazim on Enchytraeidae in laboratory and field tests, Newsletter on Enchytraeidae 4, 79-96.
|
|
(15)
|
Römbke, J., Riepert, F. & Achazi R. (2000): Enchytraeen als Testorganismen. En: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. & Eisentraeger, A. (eds.). Spektrum Verl., Heidelberg. 59-81.
|
|
(16)
|
ISO (Organización Internacional de Normalización) (1994). Calidad del suelo, Determinación del pH, no 10390. ISO, Ginebra.
|
|
(17)
|
Bell, A.W. (1958). The anatomy of Enchytraeus albidus, with a key to the species of the genus Enchytraeus. Ann. Mus. Novitat. 1902, 1-13.
|
|
(18)
|
Nielsen, C.O. and Christensen, B. (1959). The Enchytraeidae, critical revision and taxonomy of European species. Natura Jutlandica 8-9, 1-160.
|
|
(19)
|
Bouguenec, V. y Giani, N. (1987). Deux nouvelles espèces d'Enchytraeus (Oligochaeta, Enchytraeidae) et redescription d'E. bigeminus. Remarques sur le genre Enchytraeus. Ann. Limnol. 23, 9-22.
|
|
(20)
|
Korinkova, J. and Sigmund, J. (1968). The colouring of bottom-fauna samples before sorting, Vestnik Ceskoslovensko Spolecnosti Zoologicke 32, 300-305.
|
|
(21)
|
Finney, D.J. (1971). Probit Analysis (3rd ed.), pp. 19-76. Cambridge Univ. Press.
|
|
(22)
|
Finney, D.J. (1978). Statistical Method in Biological Assay. — Charles Griffin & Company Ltd, Londres.
|
|
(23)
|
Hamilton, M.A., R.C. Russo and R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714-719; Correction Environ. Sci. Technol. 12(1998), 417.
|
|
(24)
|
Williams, D.A., (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
|
|
(25)
|
Williams, D.A., (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519-531.
|
|
(26)
|
Dunnett C. W., (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
|
|
(27)
|
Dunnett, C.W., (1964) New tables for multiple comparisons with a control. Biometrics 20, 482-491.
|
|
(28)
|
Hoeven, N. van der, (1998). Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7: 355-361.
|
|
(29)
|
Holm, S., (1979): A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
|
|
(30)
|
Jonckheere, A. R. (1954); A Distribution-free k-Sample Test Against Ordered Alternatives, Biometrika 41, 133-145.
|
|
(31)
|
Terpstra, T.J. (1952); The Asymptotic Normality and Consistency of Kendall's Test Against Trend, When Ties are Present in One Ranking, Indagationes Math. 14, 327-333.
|
|
(32)
|
Shirley, E.A. (1979); The comparison of treatment to control group means in toxicology studies, Applied Statistics 28, 144-151.
|
|
(33)
|
Williams, D.A. (1986); A Note on Shirley's Nonparametric Test for Comparing Several Dose Levels with a Zero-Dose Control, Biometrics 42, 183-186.
|
|
(34)
|
Sokal, R.R. and F.J. Rohlf. (1981). Biometry. The Principle and practice of statistics in biological research. 2nd edition. W.H. Freeman and Company. Nueva York.
|
|
(35)
|
Christensen, E.R., (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18, 213-221.
|
|
(36)
|
Van Ewijk, P.H. and J.A. Hoekstra. (1993). Calculation of the EC50 and its confidence interval when sub-toxic stimulus is present. Ecotox, Environ. Safety. 25, 25-32.
|
Apéndice 1
Definiciones
A efectos del presente método de ensayo, se aplicarán las siguientes definiciones:
Sustancia
: sustancia o mezcla.
ECx
(concentración con efecto al x %): concentración que provoca el x % de un efecto sobre los organismos de ensayo dentro de un determinado período de exposición cuando se compara con un control. En este ensayo las concentraciones con efecto se expresan en masa de sustancia problema por masa seca del suelo de ensayo.
LC0
(concentración no letal): concentración de una sustancia problema que no mata a ninguno de los organismos de ensayo expuestos dentro de un determinado período de tiempo. En este ensayo la LC0 se expresa en masa de sustancia problema por masa seca del suelo de ensayo.
LC50
(concentración letal mediana): concentración de una sustancia problema que mata al 50 % de los organismos de ensayo expuestos dentro de un determinado período de tiempo. En este ensayo la LC50 se expresa en masa de sustancia problema por masa seca del suelo de ensayo.
LC100
(concentración totalmente letal): concentración de una sustancia problema que mata al 100 % de los organismos de ensayo expuestos dentro de un determinado período de tiempo. En este ensayo la LC100 se expresa en masa de sustancia problema por masa seca del suelo de ensayo.
LOEC (concentración mínima con efecto observado): concentración mínima de la sustancia problema que tiene un efecto estadísticamente significativo (p < 0,05). En este ensayo la LOEC se expresa en masa de sustancia problema por masa seca del suelo de ensayo. Todas las concentraciones de ensayo superiores a la LOEC deben presentar normalmente un efecto que es estadísticamente diferente del del control. Cualquier desviación respecto de lo anterior en la determinación de la LOEC debe justificarse en el informe de ensayo.
NOEC (concentración sin efecto observado): concentración más elevada de la sustancia problema inmediatamente por debajo de la LOEC a la que no se observa ningún efecto. En este ensayo, la concentración correspondiente a la NOEC no ejerce ningún efecto estadísticamente significativo (p < 0,05) dentro de un determinado período de exposición en comparación con el control.
Tasa de reproducción
: número medio de gusanos juveniles producidos por un número de gusanos adultos durante el período de ensayo.
Sustancia problema
: sustancia o mezcla estudiada con este método de ensayo.
Apéndice 2
Determinación de la capacidad máxima de retención de agua
Determinación de la capacidad de retención de agua del suelo artificial
El siguiente método se ha considerado apropiado. Se describe en el anexo C de la norma ISO DIS 11268-2.
Se recoge una determinada cantidad (p. ej., 5 g) del sustrato de suelo de ensayo, utilizando un dispositivo adecuado (tubo de barrena, etc.). Se cubre el fondo del tubo con un trozo de papel de filtro y, después de llenarlo con agua, se coloca en un soporte en un baño de agua. El tubo debe sumergirse gradualmente hasta que el nivel del agua esté por encima del extremo superior del suelo. A continuación, se debe dejar en el agua alrededor de tres horas. Dado que no puede retenerse toda el agua absorbida por los capilares del suelo, la muestra de suelo debe dejarse escurrir durante un período de dos horas, colocando el tubo en un lecho de arena de cuarzo finamente molida muy húmeda y contenida en un recipiente cerrado (para evitar que se seque). Después, la muestra debe pesarse y secarse hasta obtener una masa constante a 105 °C. La capacidad de retención de agua (WHC) puede calcularse entonces de la manera siguiente:
donde:
|
S
|
=
|
masa del sustrato saturado de agua + masa del tubo + masa del papel de filtro
|
|
T
|
=
|
tara (masa del tubo + masa del papel de filtro)
|
|
D
|
=
|
masa seca del sustrato
|
BIBLIOGRAFÍA:
ISO (Organización Internacional de Normalización) (1996). Calidad del suelo: Efectos de los contaminantes sobre las lombrices de tierra (Eisenia fetida). Parte 2: Determinación de los efectos en la reproducción, no 11268-2. ISO, Ginebra.
Apéndice 3
Determinación del pH del suelo
El siguiente método de determinación del pH de una muestra de suelo se basa en la descripción recogida en la norma ISO 10390 (Calidad del suelo. Determinación del pH).
Una determinada cantidad de suelo se seca a temperatura ambiente durante al menos 12 horas. A continuación se hace una suspensión del suelo (con al menos 5 gramos de este) en cinco veces su volumen de una solución 1 M de cloruro de potasio de grado analítico (KCl) o de una solución 0,01 M de cloruro de calcio de grado analítico (CaCl2). La suspensión se agita enérgicamente durante cinco minutos. Después de agitarla, se deja reposar la suspensión desde 2 horas como mínimo hasta 24 horas como máximo. El pH de la fase líquida se mide a continuación utilizando un pH-metro, que habrá sido calibrado antes de cada medición con una serie adecuada de soluciones amortiguadoras (p. ej., a un pH de 4,0 y 7,0).
BIBLIOGRAFÍA:
ISO (Organización Internacional de Normalización) (1994). Calidad del suelo, Determinación del pH, no 10390. ISO, Ginebra.
Apéndice 4
Condiciones de cultivo de Enchytraeus sp.
Los enquitreidos de la especie Enchytraeus albidus (así como otras especies de Enchytraeus) pueden cultivarse en grandes cajas de plástico (p. ej., de 30 × 60 × 10 cm) rellenas de una mezcla 1:1 de suelo artificial y de suelo de jardín natural sin contaminar. Debe evitarse el material compostado, ya que podría contener sustancias tóxicas, como metales pesados. Hay que eliminar la fauna del suelo antes de su utilización (p. ej., mediante congelación). También puede utilizarse un sustrato que incluya solamente suelo artificial, pero la tasa de reproducción podría ser menor que la obtenida con un sustrato de suelo mixto. El sustrato utilizado para el cultivo debe tener un pH de 6,0 ± 0,5.
El cultivo se mantiene en la oscuridad a una temperatura de 15 a 20 °C ± 2 °C. Deben evitarse las temperaturas superiores a 23 °C. El suelo debe estar húmedo, pero no empapado. El contenido de humedad del suelo es correcto si aparecen gotitas de agua entre los dedos al apretar un puñado de suelo suavemente con la mano. Hay que evitar la aparición de condiciones anóxicas velando por que las tapas de los recipientes de cultivo permitan un adecuado intercambio de gases con la atmósfera. Hay que remover el suelo cuidadosamente cada semana, para facilitar la aireación.
Los gusanos pueden alimentarse de copos de avena. La avena debe conservarse en recipientes herméticamente cerrados y tratados en el autoclave o calentados antes de su utilización, para evitar su infestación por ácaros de la harina (p. ej., Glyzyphagus sp., Astigmata, Acarina) o ácaros depredadores [p. ej., Hypoaspis (Cosmolaelaps) miles, Gamasida, Acarina]. Después del tratamiento térmico, el producto debe molerse de forma que sea fácil de espolvorear sobre la superficie del suelo. De vez en cuando, los copos de avena pueden completarse mediante la adición de vitaminas, leche y aceite de hígado de bacalao. Otras posibles fuentes de alimento son la levadura de panadería o la comida para peces “Tetramin”.
El alimento se aporta aproximadamente dos veces por semana. Se reparte una cantidad apropiada de copos de avena por la superficie del suelo o se introduce cuidadosamente en el sustrato cuando se remueve el suelo para facilitar su aireación. La cantidad absoluta de alimentos aportados depende del número de gusanos presente en el soporte. A título indicativo, la cantidad de alimentos debe incrementarse si se consume íntegramente en el plazo de un día desde que se aporta. Por el contrario, debe reducirse si sigue habiendo alimentos en la superficie en el momento de la segunda aportación (una semana más tarde). Los alimentos contaminados con crecimiento de hongos deben retirarse y sustituirse. Al cabo de tres meses, los gusanos se deben transferir a un sustrato recién preparado.
Se considera que las condiciones de cultivo son satisfactorias si los gusanos: a) no intentan salir del sustrato de suelo, b) se mueven rápidamente por el suelo, c) muestran una superficie externa brillante sin partículas de suelo adheridas, d) son de color más o menos blanquecino, e) presentan diversas bandas de edad en los cultivos, y f) se reproducen continuamente.
Apéndice 5
Realización del ensayo con otras especies de Enchytraeus
Selección de las especies
Pueden utilizarse especies distintas de E. albidus, pero el procedimiento de ensayo y los criterios de validez deberán adaptarse en consecuencia. Como muchas especies de Enchytraeus pueden conseguirse con facilidad y mantenerse satisfactoriamente en el laboratorio, el criterio más importante para seleccionar una especie distinta de E. albidus es la pertinencia ecológica y, de forma adicional, la sensibilidad comparable. También puede haber razones oficiales para un cambio de especies. Por ejemplo, en los países en que no esté presente E. albidus y no pueda importarse (debido, por ejemplo, a restricciones cuarentenarias), será necesario recurrir a otra especie de Enchytraeus.
Ejemplos de especies alternativas adecuadas
|
—
|
Enchytraeus crypticus (Westheide & Graefe 1992): En los últimos años se está utilizando esta especie con frecuencia en estudios ecotoxicológicos debido a la simplicidad de su cría y de sus ensayos. Sin embargo, es pequeña, lo que hace que sea más difícil de manejar que E. albidus (especialmente en las fases previas a la utilización del método de tinción). No se ha determinado con certeza si E. crypticus existe en el campo, ya que solo se ha descrito a partir de cultivos de lombrices de tierra. Por lo tanto, no se conocen sus requisitos ecológicos.
|
|
—
|
Enchytraeus buchholzi (Vejdovsky 1879): Esta denominación cubre probablemente un grupo de especies estrechamente emparentadas que son difíciles de distinguir morfológicamente. No se recomienda su uso en el ensayo mientras no puedan identificarse los individuos utilizados en un ensayo a nivel de especie. E. buchholzi se encuentra generalmente en praderas y lugares alterados, como las cunetas.
|
|
—
|
Enchytraeus luxuriosus: Esta especie fue conocida inicialmente como E. “minutus”, pero se ha descrito recientemente (1). Fue descubierta en primer lugar por U. Graefe (Hamburgo) en una pradera próxima a St. Peter-Ording (Schleswig-Holstein, Alemania). E. luxuriosus tiene un tamaño aproximadamente la mitad del de E. albidus pero es mayor que las demás especies que se comentan en este documento; por ello puede constituir una buena alternativa a E. albidus.
|
|
—
|
Enchytraeus bulbosus (Nielsen & Christensen 1963): Esta especie se ha comunicado hasta la fecha procedente de suelos minerales alemanes y españoles, en los que es habitual, pero no suele ser muy abundante. En comparación con otras especies pequeñas de este género, es relativamente fácil de determinar. No se sabe nada de su comportamiento en ensayos de laboratorio ni de su sensibilidad a las sustancias. No obstante, se ha comprobado que es fácil de cultivar (E. Belotti, comunicación personal).
|
Condiciones de cría
Todas las especies de Enchytraeus arriba mencionadas pueden cultivarse en los mismos sustratos que se utilizan para E. albidus. Su menor tamaño hace que los recipientes de cultivo puedan ser más pequeños y que, si bien pueden utilizarse los mismos alimentos, el tamaño de la ración deba adaptarse. El ciclo de vida de esta especie es más corto que el de E. albidus y el aporte de alimentos debe llevarse a cabo con mayor frecuencia.
Condiciones del ensayo
Las condiciones del ensayo son generalmente las mismas que en el caso de E. albidus, salvo que:
|
—
|
el recipiente de ensayo puede ser más pequeño (aunque no es necesario);
|
|
—
|
la duración del ensayo de reproducción puede ser más reducida (aunque no es necesario), es decir, puede ser de cuatro en vez de seis semanas; sin embargo, la duración del ensayo de determinación del intervalo no debe modificarse;
|
|
—
|
teniendo en cuenta el pequeño tamaño de los gusanos juveniles, se recomienda encarecidamente el uso del método de tinción para el recuento;
|
|
—
|
el criterio de validez relativo al “número de juveniles por recipiente de ensayo en el control” se ha cambiado a “50”.
|
BIBLIOGRAFÍA
|
(1)
|
Schmelz, R.M. and Collado, R. (1999). Enchytraeus luxuriosus sp.nov., a new terrestrial oligochaete species (Enchytraeidae, Clitellata, Annelida). Chem 57, 93-100.
|
Apéndice 6
Descripción detallada de las técnicas de extracción
Tinción con rojo de Bengala
Este método, desarrollado originalmente en ecología lacustre (1), fue propuesto por primera vez para el recuento de juveniles de enquitreidos en el ensayo de reproducción de Enchytraeidae de W. de Coen (Universidad de Gante, Bélgica). Independientemente, el RIVM de Bilthoven desarrolló una versión modificada (rojo de Bengala mezclado con formaldehído en lugar de etanol) (2) (3).
Al final del ensayo definitivo (es decir, al cabo de seis semanas), el suelo de los recipientes de ensayo se transfiere a un recipiente poco profundo. Un recipiente Bellaplast o una cubeta de revelado fotográfico con el fondo acanalado es de utilidad para este propósito, en el segundo caso porque los “canales” restringen el movimiento de los gusanos dentro del campo de observación. Los juveniles se fijan con etanol (unos 5 ml por réplica). Los recipientes se llenan a continuación con agua hasta formar una capa de 1 a 2 cm. Se añaden unas gotas (de 200 a 300 μl) de solución de rojo de Bengala (solución al 1 % en etanol) (en su lugar puede utilizarse eosina al 0,5 %) y se mezclan cuidadosamente los dos componentes. Después de 12 horas, los gusanos deben estar teñidos de color rojizo y ser fáciles de contar porque estarán en la superficie del sustrato. Otra posibilidad es lavar la mezcla de sustrato/alcohol a través de un tamiz (luz de malla: 0,250 mm) antes de proceder al recuento de los gusanos. Mediante este procedimiento, la caolinita, la turba y parte de la arena se eliminarán con el lavado y será más fácil ver y contar los gusanos de color rojizo. El uso de lentes iluminadas (tamaño de la lente de 100 x 75 mm como mínimo, con un factor de ampliación de 2 a 3x) también facilita el recuento.
La técnica de tinción reduce el tiempo del recuento a unos pocos minutos por recipiente y, como orientación, debe ser posible que una persona evalúe todos los recipientes procedentes de un ensayo en un máximo de dos días.
Extracción por vía húmeda
La extracción por vía húmeda debe iniciarse inmediatamente una vez finalizado el ensayo. El suelo de cada recipiente de ensayo se coloca en un tamiz de plástico con una luz de malla de 1 mm aproximadamente. A continuación, los tamices se suspenden en cubetas de plástico, sin tocar el fondo. Las cubetas se llenan cuidadosamente con agua hasta que las muestras de los tamices queden completamente por debajo de la superficie del agua. A fin de garantizar una tasa de recuperación superior al 90 % de los gusanos presentes, debe utilizarse un período de extracción de 3 días a 20 ± 2 °C. Al final del período de extracción se retiran los tamices y el agua (a excepción de un pequeño volumen) se decanta lentamente, teniendo cuidado de no alterar el sedimento que se encuentra en el fondo de las cubetas. A continuación, se agitan ligeramente las cubetas de plástico para suspender el sedimento en el agua sobrenadante. El agua se transfiere a una placa de Petri y, después de que hayan sedimentado las partículas del suelo, los enquitreidos pueden identificarse, retirarse y contarse utilizando un microscopio estereoscópico y pinzas flexibles de acero.
Flotación
En una nota presentada por R. Kuperman se describe un método basado en la flotación (4). Tras fijar con etanol el contenido de un recipiente de ensayo, se cubre el suelo con Ludox (sílice coloidal AM-30, suspensión en agua al 30 % en peso) hasta formar una capa de 10 a 15 mm por encima de la superficie del suelo. Después de mezclar bien el suelo con el agente de flotación durante 2-3 minutos, pueden contarse fácilmente los gusanos juveniles que flotan en la superficie.
Bibliografía
|
(1)
|
Korinkova, J. and Sigmund, J. (1968). The colouring of bottom-fauna samples before sorting, Vestnik Ceskoslovensko Spolecnosti Zoologicke 32, 300-305.
|
|
(2)
|
Dirven-Van Breemen, E., Baerselmann, R. and Notenboom, J. (1994). Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) in Bodemecotoxicologisch Onderzoek. RIVM Rapport Nr. 719102025. 46 pp.
|
|
(3)
|
Posthuma, L., Baerselmann, R., Van Veen, R.P.M. and Dirven-Van Breemen, E.M. (1997). Single and joint toxic effects of copper and zinc on reproduction of Enchytraeus crypticus in relation to sorption of metals in soils. Ecotox. Envir. Safety 38, 108-121.
|
|
(4)
|
Phillips, C.T., Checkai, R.T. and Kuperman, R.G. (1998). An alternative to the O'Connor Method for Extracting Enchytraeids from Soil. SETAC 19th Annual Meeting, Charlotte, EE.UU. Abstract Book No. PMP069, p. 157.
|
Apéndice 7
Resumen de la evaluación estadística de los datos (determinación de la NOEC)

C.33. ENSAYO DE REPRODUCCIÓN DE LOMBRICES DE TIERRA (EISENIA FETIDA / EISENIA ANDREI)
INTRODUCCIÓN
|
1.
|
El presente método de ensayo es equivalente a las directrices de ensayo de la OCDE TG 222 (2004). Está diseñado para utilizarse en la evaluación de los efectos de las sustancias del suelo sobre el resultado reproductor (y otros parámetros subletales) de las especies de lombrices de tierra Eisenia fetida (Savigny 1826) o Eisenia andrei (Andre 1963) (1) (2). El ensayo ha sido objeto de un ensayo interlaboratorios (3). Ya existe un método de ensayo para el ensayo de toxicidad aguda con lombrices de tierra (4). Se ha publicado una serie de otras directrices internacionales y nacionales de ensayos de toxicidad aguda y crónica con lombrices de tierra (5) (6) (7) (8).
|
|
2.
|
Se considera que Eisenia fetida y Eisenia andrei son representantes de la fauna del suelo y de las lombrices de tierra en particular. Se dispone de datos previos sobre la ecología de las lombrices de tierra y su utilización en ensayos ecotoxicológicos (7) (9) (10) (11) (12).
|
PRINCIPIO DEL ENSAYO
|
3.
|
Las lombrices adultas se exponen a un intervalo de concentraciones de la sustancia problema en el suelo bien mezclada con el suelo o bien, en el caso de los plaguicidas, aplicada al interior o a la superficie de suelo mediante procedimientos coherentes con las pautas de utilización de la sustancia. El método de aplicación es específico al propósito del ensayo. El intervalo de concentraciones de ensayo se selecciona para enmarcar aquellas que pueden causar efectos tanto subletales como letales a lo largo de un período de ocho semanas. Los efectos sobre la mortalidad y sobre el crecimiento de las lombrices adultas se determinan después de cuatro semanas de exposición. A continuación, se retiran los adultos del suelo y se evalúan los efectos sobre la reproducción tras un nuevo período de cuatro semanas mediante el recuento del número de descendientes presentes en el suelo. El resultado reproductor de las lombrices expuestas a la sustancia problema se compara con el del control o controles a fin de determinar i) la concentración sin efecto observado (NOEC) y/o ii) una ECx (p. ej., EC10, EC50) aplicando un modelo de regresión para estimar la concentración que causaría una reducción del x % del resultado reproductor. Las concentraciones de ensayo deben englobar la ECx (p. ej., EC10, EC50) de forma que el valor de ECx se obtenga por interpolación y no por extrapolación (véanse las definiciones del apéndice 1).
|
INFORMACIÓN SOBRE LA SUSTANCIA PROBLEMA
|
4.
|
Debe disponerse de la siguiente información relativa a la sustancia problema para facilitar el diseño de los procedimientos adecuados de ensayo:
|
—
|
y, cuando sea posible, información sobre el destino y el comportamiento en el medio ambiente (p. ej., velocidad de fotólisis y velocidad de hidrólisis en caso pertinente según las pautas de aplicación).
|
|
|
5.
|
El presente método de ensayo es aplicable a todas las sustancias con independencia de su hidrosolubilidad. El método de ensayo no es aplicable a las sustancias volátiles, definidas aquí como sustancias cuya constante de Henry o cuyo coeficiente de reparto aire/agua sea superior a uno, ni a las sustancias cuya presión de vapor a 25 °C supere los 0,0133 Pa.
|
|
6.
|
En este método de ensayo no se tiene en cuenta la posible degradación de la sustancia problema a lo largo del período de prueba. Por consiguiente, no puede suponerse que las concentraciones de exposición se van a mantener en sus valores iniciales a lo largo de todo el ensayo. En tal caso, se recomienda realizar el análisis químico de la sustancia problema al inicio y al final del ensayo.
|
SUSTANCIA DE REFERENCIA
|
7.
|
Deben determinarse la NOEC y/o ECx de una sustancia de referencia para ofrecer garantías de que las condiciones de ensayo del laboratorio son adecuadas y para verificar que la respuesta de los organismos de ensayo no cambia estadísticamente a lo largo del tiempo. Se recomienda efectuar un ensayo con una sustancia de referencia al menos una vez al año o, si la frecuencia de los ensayos es menor, en paralelo con la determinación de la toxicidad de una sustancia problema. La carbendazima y el benomilo son sustancias de referencia adecuadas de las que se ha visto que afectan a la reproducción (3). Deben observarse efectos significativos a concentraciones de entre a) 1 y 5 mg de principio activo (p.a.)/kg de peso seco o b) 250 y 500 g/ha o 25 y 50 mg/m2. Si se incluye un patrón tóxico positivo en la serie de ensayo, se utiliza una sola concentración y el número de réplicas debe ser el mismo que el de los controles.
|
VALIDEZ DEL ENSAYO
|
8.
|
Para que el resultado de un ensayo se considere válido, deben cumplirse los siguientes criterios en lo tocante a los controles:
|
—
|
cada réplica (con 10 adultos) debe producir ≥ 30 juveniles al final del ensayo;
|
|
—
|
el coeficiente de variación de la reproducción debe ser ≤ 30 %;
|
|
—
|
la mortalidad de los adultos durante las primeras cuatro semanas de la prueba debe ser ≤ 10 %.
|
Cuando un ensayo no cumpla los criterios de validez arriba indicados, el ensayo debe interrumpirse, salvo que pueda aportarse una justificación para continuar con él. La justificación deberá incluirse en el informe.
|
DESCRIPCIÓN DEL ENSAYO
Equipo
|
9.
|
Deben utilizarse recipientes de ensayo hechos de vidrio o de otro material químicamente inerte, de una capacidad aproximada de uno a dos litros. Los recipientes deben tener una sección de 200 cm2 aproximadamente de superficie, de forma que se consiga una profundidad de sustrato húmedo de unos 5-6 cm al añadir de 500 a 600 g de masa seca de sustrato. El diseño de la tapa del recipiente debe permitir el intercambio de gases entre el sustrato y la atmósfera, y el acceso a la luz (p. ej., mediante una cubierta transparente perforada), y, al mismo tiempo, evitar que se escapen las lombrices. Si la cantidad de sustrato de ensayo utilizado es notablemente superior a 500 o 600 g por recipiente de ensayo, el número de lombrices debe aumentarse proporcionalmente.
|
|
10.
|
Se precisa el equipo normal de laboratorio y, en particular, el siguiente:
|
—
|
microscopio estereoscópico;
|
|
—
|
balanzas de precisión adecuada;
|
|
—
|
equipo adecuado para el control de la temperatura;
|
|
—
|
equipo adecuado para el control de la humedad (no esencial si los recipientes de exposición tienen tapa);
|
|
—
|
incubadora o pequeña sala con aire acondicionado;
|
|
—
|
pinzas, ganchos o asas;
|
|
Preparación del suelo artificial
|
11.
|
En este ensayo se utiliza un suelo artificial (5) (7) con la siguiente composición (en peso seco, secado hasta peso constante a 105 °C):
|
—
|
10 % de turba esfágnea (con un pH lo más cercano posible a 5,5-6,0, sin restos vegetales visibles, finamente molida, secada hasta conseguir un contenido de humedad determinado y medido);
|
|
—
|
20 % de caolín (contenido de caolinita preferentemente superior al 30 por ciento);
|
|
—
|
entre 0,3 y 1,0 % de carbonato de calcio (CaCO3, pulverizado, de pureza analítica) para obtener un pH inicial de 6,0 ± 0,5;
|
|
—
|
70 % de arena de cuarzo secada al aire (dependiendo de la cantidad necesaria de CaCO3), en su mayor parte en forma de arena fina, con más del 50 % de las partículas de un tamaño entre 50 y 200 μm.
|
Nota 1: La cantidad necesaria de CaCO3 dependerá de los componentes del sustrato del suelo, incluidos los alimentos, y debe determinarse por mediciones de submuestras del suelo inmediatamente antes del ensayo. El pH se mide en una muestra mezclada con una solución 1 M de cloruro de potasio (KCl) o una solución 0,01 M de cloruro de calcio (CaCl2) (13).
Nota 2: El contenido de carbono orgánico del suelo artificial puede reducirse, por ejemplo rebajando el contenido de turba al 4-5 % y aumentando análogamente el contenido de arena. Con esta reducción del contenido de carbono orgánico, es posible que disminuyan las posibilidades de adsorción de la sustancia problema al suelo (carbono orgánico) y que aumente la disponibilidad de la sustancia problema para las lombrices. Se ha demostrado que Eisenia fetida puede ajustarse a los criterios de validez sobre la reproducción cuando se somete a ensayo en suelos de campo con un contenido menor de carbono orgánico (p. ej., del 2,7 %) (14), y la experiencia demuestra que esto también puede conseguirse en suelo artificial con un 5 % de turba. Por lo tanto, antes de utilizar un suelo de este tipo en un ensayo definitivo no es necesario demostrar que el suelo artificial permite que el ensayo cumpla los criterios de validez, a menos que el contenido de turba se reduzca más de lo especificado anteriormente.
Nota 3: Cuando se utiliza suelo natural en ensayos adicionales (por ejemplo, de nivel superior), deben demostrarse también la idoneidad del suelo y el respeto de los criterios de validez del ensayo.
|
|
12.
|
Los componentes secos del suelo se mezclan a fondo (por ejemplo, en un mezclador de laboratorio de gran escala), en un lugar bien ventilado. Antes del inicio del ensayo, el suelo artificial seco se humedece, añadiéndole una cantidad suficiente de agua desionizada para obtener aproximadamente la mitad del contenido final de agua, que supone de un 40 a un 60 % de la capacidad máxima de retención de agua (correspondiente al 50 ± 10 % de humedad en masa seca). Esto producirá un sustrato que no presenta agua suelta o libre cuando se comprime en la mano. La capacidad máxima de retención de agua del suelo artificial se determina de acuerdo con los procedimientos descritos en el apéndice 2, la norma ISO 11274 (15) u otra norma equivalente de la UE.
|
|
13.
|
Si la sustancia problema se aplica en la superficie del suelo o se introduce en este sin agua, la cantidad final de agua puede introducirse en el suelo artificial durante la preparación del suelo. Si la sustancia problema se introduce en el suelo junto con algo de agua, el agua adicional puede añadirse junto con la sustancia problema (véase el punto 19).
|
|
14.
|
Se determina el contenido de humedad del suelo al inicio y al final del ensayo de conformidad con la norma ISO 11465 (16) u otra norma equivalente de la UE, y el pH del suelo de conformidad con el apéndice 3, la norma ISO 10390 (13) u otra norma equivalente de la UE. Estas determinaciones deben llevarse a cabo en una muestra del suelo control y en una muestra del suelo de cada concentración de ensayo. El pH del suelo no debe ajustarse cuando se ensayen sustancias ácidas o básicas. El contenido de humedad debe comprobarse a lo largo de todo el ensayo pesando los recipientes de manera periódica (véanse los puntos 26 y 30).
|
Selección y preparación de los animales de ensayo
|
15.
|
La especie usada en el ensayo es Eisenia fetida o Eisenia andrei (1) (2). Para iniciar el ensayo es necesario disponer de lombrices adultas de entre dos meses y un año de edad y con clitelo. Las lombrices deben seleccionarse de un cultivo sincronizado con una estructura de edades relativamente homogénea (apéndice 4). Los individuos de un grupo de ensayo no deben diferir por su edad en más de cuatro semanas.
|
|
16.
|
Las lombrices seleccionadas deben aclimatarse durante al menos un día al tipo de sustrato del suelo artificial que vaya a utilizarse en el ensayo. Durante este período deben darse a las lombrices los mismos alimentos que se vayan a utilizar en el ensayo (véanse los puntos 31 a 33).
|
|
17.
|
Al inicio del ensayo deben pesarse individualmente las lombrices, y asignarse aleatoriamente en grupos de diez a los recipientes de ensayo. Las lombrices se lavan (con agua desionizada) antes de su pesada y se elimina el exceso de agua poniendo brevemente las lombrices sobre papel de filtro. El peso húmedo de cada lombriz debe situarse entre 250 y 600 mg.
|
Preparación de las concentraciones de ensayo
|
18.
|
Pueden seguirse dos métodos de aplicación de la sustancia problema: introducción de la sustancia problema en el suelo (véanse los puntos 19 a 21) o aplicación en la superficie del suelo (véanse los puntos 22 a 24). La selección del método adecuado depende de la finalidad del ensayo. En general, se recomienda la introducción de la sustancia problema en el suelo. No obstante, puede ser necesario recurrir a procedimientos de aplicación que sean coherentes con la práctica agrícola normal (por ejemplo, pulverización de formulaciones líquidas o uso de formulaciones especiales de plaguicidas, tales como gránulos o preparaciones para semillas). Los disolventes utilizados para facilitar el tratamiento del suelo con la sustancia problema deben seleccionarse sobre la base de su baja toxicidad para las lombrices de tierra y debe incluirse en el diseño del ensayo un control adecuado de los disolventes (véase el punto 27).
|
Introducción de la sustancia problema en el suelo
Sustancia problema hidrosoluble
|
19.
|
Inmediatamente antes del inicio del ensayo, se prepara una solución de la sustancia problema en agua desionizada, en cantidad suficiente para todas las réplicas de una misma concentración. Puede ser necesario recurrir a un cosolvente para facilitar la preparación de la solución de ensayo. Es conveniente preparar la cantidad de solución necesaria para alcanzar el contenido final de humedad (del 40 al 60 % de la capacidad máxima de retención de agua). La solución se mezcla a fondo con el sustrato del suelo antes de introducirla en un recipiente de ensayo.
|
Sustancia problema no hidrosoluble
|
20.
|
La sustancia problema se disuelve en una pequeña cantidad de un disolvente orgánico apropiado (p. ej., acetona) y, a continuación, se rocía sobre una pequeña cantidad de arena de cuarzo fina o se mezcla con esta. El disolvente se elimina por evaporación bajo una campana extractora durante al menos unos minutos. La arena tratada se mezcla entonces bien con el suelo artificial prehumedecido. A continuación se añade el volumen necesario de agua desionizada para alcanzar un contenido final de humedad del 40 al 60 % de la capacidad máxima de retención de agua, y se mezcla bien. El suelo queda así listo para ponerse en los recipientes de ensayo. Debe tenerse cuidado con la posibilidad de que algunos disolventes sean tóxicos para las lombrices de tierra.
|
Sustancia problema insoluble en agua y en disolventes orgánicos
|
21.
|
Se prepara una mezcla de 10 g de arena de cuarzo industrial finamente molida con la cantidad de sustancia problema necesaria para obtener la concentración de ensayo en el suelo. Esta mezcla se mezcla bien a su vez con el suelo artificial prehumedecido. A continuación se añade el volumen necesario de agua desionizada para alcanzar un contenido final de humedad del 40 al 60 % de la capacidad máxima de retención de agua, y se mezcla bien. El suelo queda así listo para ponerse en los recipientes de ensayo.
|
Aplicación de la sustancia problema en la superficie del suelo
|
22.
|
El suelo se trata después de haberse añadido las lombrices. Los recipientes de ensayo se llenan primero con el sustrato de suelo humedecido y las lombrices pesadas se colocan en la superficie. Las lombrices sanas se entierran normalmente de forma inmediata en el interior del sustrato y, por consiguiente, las lombrices que queden en la superficie al cabo de 15 minutos se definen como dañadas y deben sustituirse. Si se sustituyen lombrices, deben pesarse las nuevas y las sustituidas, de forma que se conozca el peso vivo total del grupo de lombrices de exposición y el peso total del recipiente con las lombrices al comienzo.
|
|
23.
|
Se aplica la sustancia problema. No debe añadirse al suelo antes de que haya pasado media hora desde la introducción de las lombrices (o si sigue habiendo lombrices en la superficie del suelo), a fin de evitar la exposición directa a la sustancia problema por contacto con la piel. Si la sustancia problema es un plaguicida, puede ser conveniente aplicarla a la superficie del suelo por rociado. La sustancia problema debe aplicarse a la superficie del suelo de la manera más uniforme posible, utilizando un dispositivo de rociado de laboratorio adecuado para simular la aplicación por rociado en el campo. Antes de la aplicación, debe retirarse la tapa del recipiente de ensayo y sustituirse por un forro que proteja las paredes del recipiente frente al aerosol. El forro puede consistir en un recipiente de ensayo al que se ha retirado el fondo. La aplicación debe efectuarse a una temperatura de 20 ± 2 °C y, en el caso de las soluciones, emulsiones o dispersiones acuosas, la tasa de aplicación de agua será de entre 600 y 800 μl/m2. La tasa de aplicación debe comprobarse utilizando una técnica de calibración apropiada. Las formulaciones especiales, como gránulos o preparaciones para semillas, deben aplicarse de forma coherente con la utilización agrícola.
|
|
24.
|
Los recipientes de ensayo deben quedar descubiertos durante una hora para que puedan evaporarse los eventuales disolventes volátiles asociados con la aplicación de la sustancia problema. Debe tenerse cuidado para que en ese tiempo no se escapen las lombrices de los recipientes de ensayo.
|
PROCEDIMIENTO
Grupos de ensayo y controles
|
25.
|
Se recomienda una carga de 10 lombrices de tierra en 500 — 600 g de peso seco de suelo artificial (es decir, 50 a 60 g de suelo por lombriz). Si se utilizan cantidades mayores de suelo, como podría ser el caso si se ensayan plaguicidas con modos de aplicación especiales, tales como preparaciones para semillas, debe mantenerse la carga de 50 - 60 g de suelo por lombriz aumentando el número de lombrices. Se preparan diez lombrices para cada recipiente de control y de tratamiento. Las lombrices se lavan con agua y se escurren; después se ponen en papel absorbente durante un breve período para eliminar el exceso de agua.
|
|
26.
|
A fin de evitar errores sistemáticos en la distribución de las lombrices entre los recipientes de ensayo, la homogeneidad de la población de estudio debe determinarse pesando individualmente 20 lombrices muestreadas aleatoriamente de la población de la que deben tomarse las lombrices de ensayo. Una vez garantizada la homogeneidad, los lotes de lombrices se seleccionan, se pesan, y se asignan a los recipientes de ensayo utilizando un procedimiento de aleatorización. Tras la adición de las lombrices de ensayo, debe medirse el peso de cada recipiente de ensayo a fin de asegurarse de que hay un peso inicial que puede utilizarse como base para el control del contenido de humedad del suelo a lo largo de todo el ensayo, como se describe en el punto 30. Los recipientes de ensayo se cubren entonces, como se describe en el punto 9, y se colocan en la cámara de ensayo.
|
|
27.
|
Se preparan controles adecuados para cada uno de los métodos de aplicación de la sustancia problema descritos en los puntos 18 a 24. Para preparar los controles se siguen los procedimientos pertinentes descritos, salvo que no se añade la sustancia problema. Por lo tanto, en su caso, se utilizan en los controles disolventes orgánicos, arena de cuarzo u otros vehículos, en concentraciones y cantidades iguales a las utilizadas en los tratamientos. Cuando se utiliza un disolvente u otro vehículo para añadir la sustancia problema, debe prepararse y someterse a ensayo un control adicional sin sustancia problema y sin vehículo para asegurarse de que el vehículo no tiene ninguna incidencia sobre el resultado.
|
Condiciones del ensayo
|
28.
|
La temperatura de ensayo es de 20 ± 2 °C. El ensayo se efectúa en ciclos controlados de luz y oscuridad (preferentemente 16 horas de luz y 8 horas de oscuridad) con una iluminación de 400 a 800 lux en la zona de los recipientes de ensayo.
|
|
29.
|
Los recipientes de ensayo no se airean durante el ensayo, pero el diseño de las tapas de los recipientes de ensayo debe permitir los intercambios gaseosos, al tiempo que limita la evaporación de la humedad (véase el punto 9).
|
|
30.
|
Se controla que el contenido de agua del sustrato del suelo en los recipientes de ensayo se mantenga constante a lo largo de todo el ensayo, pesando periódicamente los recipientes de ensayo (menos sus tapas). Las pérdidas se compensan en la medida de lo necesario con agua desionizada. El contenido de agua no debe variar en más de un 10 % respecto al del inicio del ensayo.
|
Alimentación
|
31.
|
Se considera aceptable cualquier alimento del que se haya demostrado que tiene una calidad adecuada para al menos mantener el peso de las lombrices durante el ensayo. La experiencia ha demostrado que la harina de avena y el estiércol de caballo o de vaca son un alimento adecuado. Se deben realizar controles para garantizar que las vacas o caballos de los que se obtiene el estiércol no son objeto de tratamiento con medicamentos o sustancias, tales como factores de crecimiento, nematicidas o productos veterinarios similares, que puedan afectar negativamente a las lombrices durante el ensayo. Se recomienda recoger directamente el estiércol de vaca, ya que la experiencia ha demostrado que el estiércol de vaca disponible en el comercio para utilizarse como abono de jardín puede tener efectos negativos para las lombrices. El estiércol debe secarse al aire, molerse finamente y pasteurizarse antes de su utilización.
|
|
32.
|
Cada lote nuevo de alimentos debe darse a un cultivo de lombrices aparte antes de su utilización en un ensayo para asegurarse de que es de calidad aceptable. El crecimiento y la producción de capullos no deben reducirse respecto a las lombrices mantenidas en un sustrato que no contiene el nuevo lote de alimentos [en las condiciones descritas en el método de ensayo C.8 (4)].
|
|
33.
|
Se facilita alimentación por primera vez un día después de la adición de las lombrices y la aplicación de la sustancia problema al suelo. Aproximadamente 5 g de alimento se reparten por la superficie del suelo de cada recipiente y se humedecen con agua desionizada (unos 5 o 6 ml por recipiente). Posteriormente, se suministra el alimento una vez por semana durante el período de ensayo de cuatro semanas. Si quedan alimentos sin consumir, debe reducirse la ración alimentaria con el fin de evitar el crecimiento de hongos o enmohecimiento. Los adultos se retiran del suelo el día 28 del ensayo. A continuación se administran otros 5 g de alimento a cada recipiente de ensayo. No se vuelve a aportar alimento durante las cuatro semanas restantes del ensayo.
|
Selección de las concentraciones de ensayo
|
34.
|
El conocimiento previo de la toxicidad de la sustancia problema debe ayudar a la hora de seleccionar las concentraciones de ensayo apropiadas, por ejemplo gracias a un ensayo de toxicidad aguda (4) o a un estudio de determinación del intervalo. Cuando sea necesario, se llevará a cabo un ensayo de determinación del intervalo con, por ejemplo, cinco concentraciones de ensayo, de 0,1, 1,0, 10, 100 y 1 000 mg/kg (peso seco de suelo). Es suficiente con una sola réplica para cada tratamiento y control. La duración del ensayo de determinación del intervalo es de dos semanas y al final del mismo se evalúa la mortalidad.
|
Diseño experimental
|
35.
|
Al no poder prescribir para el ensayo la aplicación de un único valor muestral que sirva de resumen, este método de ensayo prevé la determinación de la NOEC y la ECx. Es probable que las autoridades reguladoras exijan la NOEC en un futuro previsible. En el futuro inmediato es posible que se adopte una utilización más amplia de la ECx, como consecuencia de consideraciones estadísticas y ecológicas. Por tanto, se proponen tres diseños sobre la base de las recomendaciones derivadas de una prueba interlaboratorios realizada sobre un método de ensayo de reproducción de enquitreidos (17).
|
|
36.
|
Al determinar la gama de concentraciones, debe tenerse en cuenta lo siguiente:
|
—
|
para la determinación de la NOEC deben someterse a ensayo al menos cinco/doce concentraciones en serie geométrica; se recomienda utilizar cuatro réplicas de cada concentración de ensayo más ocho controles; las concentraciones deben estar espaciadas por un factor que no exceda de 2,0;
|
|
—
|
para la determinación de los valores de ECx (por ejemplo, EC10, EC50), se recomienda un número adecuado de concentraciones que causen al menos cuatro respuestas medias significativamente diferentes desde el punto de vista estadístico a estas concentraciones; se recomienda utilizar al menos dos réplicas de cada concentración de ensayo y seis réplicas de control; el factor de espaciado puede variar, es decir, ser igual o inferior a 1,8 en el intervalo de efecto previsto y superior a 1,8 a concentraciones superiores e inferiores;
|
|
—
|
un enfoque combinado permite la determinación tanto de la NOEC como de la ECx; deben utilizarse ocho concentraciones de tratamiento en progresión geométrica; se recomienda utilizar cuatro réplicas de cada tratamiento más ocho controles; las concentraciones deben estar espaciadas por un factor que no exceda de 1,8.
|
|
Duración del ensayo y mediciones
|
37.
|
El día 28 se observan y recuentan las lombrices adultas vivas. También debe registrarse cualquier anomalía que se observe en el comportamiento (por ejemplo, si se vuelven incapaces de excavar en el suelo o si se quedan inmóviles) y en la morfología (por ejemplo, heridas abiertas). A continuación, se retiran y se pesan todas las lombrices adultas de los recipientes de ensayo. La transferencia del suelo que contiene las lombrices a una bandeja limpia antes de la evaluación puede facilitar la búsqueda de las lombrices adultas. Las lombrices extraídas del suelo deben lavarse (con agua desionizada) antes de pesarse y se elimina el exceso de agua poniendo brevemente las lombrices en papel de filtro. Las eventuales lombrices que no se encuentren en esta fase se registrarán como muertas, ya que es de suponer que estas lombrices hayan muerto y se hayan descompuesto antes de la evaluación.
|
|
38.
|
Si el suelo se ha retirado de los recipientes, ahora se devuelve a ellos (sin las lombrices adultas, pero todavía con los eventuales capullos producidos). El suelo se incuba a continuación durante cuatro semanas adicionales en las mismas condiciones de ensayo, salvo que la alimentación solo tiene lugar una vez al comienzo de esta fase del ensayo (véase el punto 33).
|
|
39.
|
Al final del segundo período de cuatro semanas, se determinan el número de juveniles nacidos de los capullos en el suelo de ensayo y el número de capullos, mediante los procedimientos descritos en el apéndice 5. También deben registrarse a lo largo del ensayo todos los signos de daño o deterioro de las lombrices.
|
Ensayo límite
|
40.
|
Si no se observan efectos a la concentración máxima utilizada en el ensayo de determinación del intervalo (es decir, 1 000 mg/kg), el ensayo de reproducción se realizaría como ensayo límite, con una concentración de ensayo de 1 000 mg/kg. El ensayo límite ofrecerá la oportunidad de demostrar que la NOEC para la reproducción es superior a la concentración límite, reduciendo al mínimo el número de lombrices utilizadas en el ensayo. Deben utilizarse ocho réplicas tanto para el suelo tratado como para el control.
|
DATOS E INFORME
Tratamiento de los resultados
|
41.
|
A pesar de que se da una visión de conjunto en el apéndice 6, en este método de ensayo no se incluye ninguna orientación estadística definitiva para el análisis de los resultados del ensayo.
|
|
42.
|
Un parámetro es la mortalidad. Sin embargo, también deben registrarse los cambios en el comportamiento (por ejemplo, si se vuelven incapaces de excavar en el suelo o si se quedan inmóviles junto a la pared de vidrio del recipiente de ensayo) y en la morfología (p. ej., si tienen heridas abiertas) de las lombrices adultas, además de la eventual presencia de juveniles. Para determinar la LC50 debe aplicarse en principio el análisis de probit (18) o la regresión logística. No obstante, en aquellos casos en que este método de análisis no sea adecuado (por ejemplo, si se dispone de menos de tres concentraciones con mortalidades parciales) pueden utilizarse métodos alternativos. Entre estos métodos pueden figurar el de medias móviles (19), el método de Spearman-Karber recortado (20) o una interpolación simple (p. ej., media geométrica de LC0 y LC100, calculada multiplicando la raíz cuadrada de LC0 por LC100).
|
|
43.
|
El otro parámetro es la fecundidad (es decir, el número de juveniles producidos). Sin embargo, como en el ensayo de determinación del intervalo, deben registrarse en el informe final todos los demás signos de naturaleza nociva. El análisis estadístico requiere que se calculen la media aritmética

y la desviación típica por grupo de tratamiento y por grupo de control en cuanto a la reproducción. |
|
44.
|
Si se ha realizado el análisis de la varianza, la desviación típica, s, y los grados de libertad, df, pueden sustituirse respectivamente por la estimación de la varianza “agrupada” obtenida del ANOVA y por sus grados de libertad, siempre que la varianza no dependa de la concentración. En este caso, se utilizarán las distintas varianzas de los controles y de los grupos tratados. Estos valores son calculados en general por programas estadísticos comerciales utilizando los resultados de cada recipiente como réplicas. Si la “agrupación” de datos de los controles negativo y de disolvente parece más razonable que hacer las pruebas frente a uno solo de estos conjuntos, debe comprobarse que no son significativamente diferentes (sobre pruebas apropiadas véanse el punto 47 y el apéndice 6).
|
|
45.
|
La realización de más pruebas estadísticas y de deducciones depende de si los valores de las réplicas se distribuyen normalmente y son homogéneas en lo que respecta a su varianza.
|
Estimación de la NOEC
|
46.
|
Es preferible la aplicación de ensayos potentes. Se debería utilizar la información previa obtenida, por ejemplo a partir de la experiencia con ensayos interlaboratorios u otros datos históricos, sobre si los datos presentan una distribución aproximadamente normal. Es más crítica la homogeneidad de la varianza (homoscedasticidad). La experiencia indica que la varianza suele aumentar cuando sube la media. En estos supuestos, una transformación de los datos podría llevar a la homoscedasticidad. Sin embargo, esta transformación debe basarse en la experiencia con datos históricos, más que en los datos objeto de la investigación. Con datos homogéneos, deben llevarse a cabo pruebas t de comparación múltiple, como la prueba de Williams (α = 0,05, unilateral) (21) (22) o, en algunos casos, la prueba de Dunnett (23) (24). Cabe señalar que, en caso de replicación desigual, los valores t del cuadro deberán corregirse según lo sugerido por Dunnett y Williams. En ocasiones, debido a una gran variación, las respuestas no aumentan o disminuyen regularmente. En este caso de fuerte desviación respecto a la monotonicidad, es más conveniente la prueba de Dunnett. En caso de que haya desviaciones con respecto a la homoscedasticidad, puede resultar razonable analizar más estrechamente los posibles efectos sobre las varianzas, a fin de decidir si las pruebas t pueden aplicarse sin perder mucha potencia (25). De forma alternativa, puede aplicarse una prueba U de comparación múltiple, por ejemplo la prueba U de Bonferroni según Holm (26), o, cuando estos datos presenten heteroscedasticidad pero por lo demás sean coherentes con una relación dosis-respuesta monótona subyacente, otra prueba no paramétrica [por ejemplo, una prueba de Jonckheere-Terpstra (27) (28) o Shirley (29) (30)] y, en general, se dará preferencia a estas pruebas frente a las pruebas t de varianza desigual (véase también el esquema del apéndice 6).
|
|
47.
|
En caso de que se haya realizado un ensayo límite y se cumplan los requisitos previos de procedimientos de ensayos paramétricos (normalidad, homogeneidad), puede utilizarse la prueba t de Student pareada o, si no, el procedimiento de la prueba U de Mann-Whitney (31).
|
Estimación de ECx
|
48.
|
Para calcular cualquier valor de ECx se utilizan las medias por tratamiento para el análisis de regresión (lineal o no lineal), tras haber obtenido una función dosis-respuesta adecuada. En relación con el crecimiento de las lombrices como respuesta continua, pueden calcularse los valores de ECx utilizando el análisis de regresión adecuado (32). Entre las funciones adecuadas para los datos cuánticos (mortalidad/supervivencia) y número de descendientes producidos están las funciones sigmoideas normales, logísticas o de Weibull, con entre dos y cuatro parámetros, algunas de las cuales pueden modelizar también respuestas horméticas. Si la función dosis-respuesta se ha ajustado mediante análisis de regresión lineal, debe determinarse con el análisis de regresión un r2 (coeficiente de determinación) y/o una pendiente significativos antes de estimar la ECx mediante la inserción de un valor correspondiente a x % de la media del control en la ecuación encontrada con el análisis de regresión. Se calculan límites de confianza del 95 % con arreglo al método de Fieller [citado en Finney (18)] u otros métodos adecuados modernos.
|
|
49.
|
Otra posibilidad consiste en modelizar la respuesta como porcentaje o proporción del parámetro del modelo que se interpreta como la respuesta media del control. En estos casos, la curva sigmoidea normal (logística, Weibull) puede ajustarse a menudo fácilmente a los resultados utilizando el método de regresión de probit (18). En estos casos, la función de ponderación ha de ajustarse para respuestas métricas según indica Christensen (33). No obstante, si se ha observado hormesis, el análisis de probit debe ser sustituido por una función logística o de Weibull de cuatro parámetros, ajustada por un método de regresión no lineal (34). Si no puede ajustarse a los datos una función dosis-respuesta adecuada, podrán utilizarse métodos alternativos para calcular el valor de ECx y sus límites de confianza, tales como el método de medias móviles de Thompson (19) y el de Spearman-Karber recortado (20).
|
INFORME DEL ENSAYO
|
50.
|
El informe del ensayo deberá incluir la información siguiente:
|
|
Sustancia problema:
|
—
|
descripción definitiva de la sustancia problema, lote de fabricación, lote de acondicionamiento y número CAS, pureza;
|
|
—
|
propiedades de la sustancia problema (p. ej., log Kow, hidrosolubilidad, presión de vapor, constante de Henry (H) e información sobre el destino y el comportamiento).
|
|
|
|
Organismos de ensayo:
|
—
|
animales utilizados en el ensayo: especie, nombre científico, origen de los organismos y condiciones de cría,
|
|
—
|
edad, intervalo de tamaños (masas) de los organismos de ensayo.
|
|
|
|
Condiciones del ensayo:
|
—
|
datos de la preparación del suelo para el ensayo;
|
|
—
|
capacidad máxima de retención de agua del suelo;
|
|
—
|
descripción de la técnica utilizada para aplicar la sustancia problema al suelo;
|
|
—
|
datos de las sustancias auxiliares utilizadas para la administración de la sustancia problema;
|
|
—
|
datos de calibrado para el equipo de rociado, si procede;
|
|
—
|
descripción del diseño experimental y del procedimiento;
|
|
—
|
tamaño de los recipientes de ensayo y volumen del suelo de ensayo;
|
|
—
|
condiciones del ensayo: intensidad luminosa, duración de los ciclos de luz y oscuridad, temperatura;
|
|
—
|
descripción del régimen alimentario, tipo y cantidad del alimento utilizado en el ensayo, fechas de alimentación;
|
|
—
|
pH y contenido de agua del suelo al inicio y al final del ensayo.
|
|
|
|
Resultados del ensayo:
|
—
|
mortalidad de los adultos (%) en cada recipiente de ensayo al final de las cuatro primeras semanas del ensayo;
|
|
—
|
masa total de los adultos al comienzo del ensayo en cada recipiente de ensayo;
|
|
—
|
cambios en el peso corporal de los adultos vivos (% del peso inicial) de cada recipiente de ensayo tras las cuatro primeras semanas del ensayo;
|
|
—
|
número de juveniles producidos en cada recipiente de ensayo al final del ensayo;
|
|
—
|
descripción de los síntomas manifiestos o patológicos, o de los cambios claros de comportamiento;
|
|
—
|
resultados obtenidos con la sustancia de referencia;
|
|
—
|
la LC50, la NOEC y/o ECx (p. ej., EC50, EC10) para la reproducción si algunas de ellas son aplicables con intervalos de confianza, y un gráfico del modelo ajustado utilizado para su cálculo, todas las informaciones y observaciones útiles para la interpretación de los resultados;
|
|
—
|
representación gráfica de la relación dosis-respuesta;
|
|
—
|
resultados aplicables a cada recipiente de ensayo;
|
|
Las eventuales desviaciones respecto a los procedimientos descritos en el presente método de ensayo y cualquier acontecimiento inusual ocurrido en el ensayo.
|
BIBLIOGRAFÍA
|
(1)
|
Jaenicke, J. (1982). “Eisenia foetida” is two biological species. Megadrilogica 4, 6-8.
|
|
(2)
|
Oien, N. and J. Stenerson (1984). Esterases of earthworm — III. Electrophoresis reveals that Eisenia foetida (Savigny) is two species. Comp. Biochem. Physiol. 78c (2), 277 — 282.
|
|
(3)
|
Kula, C. (1996). Development of a test method on sublethal effects of pesticides on the earthworm species Eisenia fetida/Eisenia andrei — comparison of two ringtests. En: Riepert, F., Kula, C. (1996): Development of laboratory methods for testing effects of chemicals and pesticides on collembola and earthworms. Mitt. Biol. Bundesamst. f. Land- Forstwirtsch. Berlín-Dahlem, 320, p. 50-82.
|
|
(4)
|
Capítulo C.8 del presente anexo. Ensayo de toxicidad aguda para gusanos de tierra.
|
|
(5)
|
ISO (Organización Internacional de Normalización) (1996). Calidad del suelo: Efectos de los contaminantes sobre las lombrices de tierra (Eisenia fetida). Parte 2: Determinación de los efectos en la reproducción, no 11268-2. ISO, Ginebra.
|
|
(6)
|
ISO (Organización Internacional de Normalización) (1993). Calidad del suelo: Efectos de los contaminantes sobre las lombrices de tierra (Eisenia fetida). Parte 1: Determinación de la toxicidad aguda utilizando un sustrato de suelo artificial, no 11268-1. ISO, Ginebra.
|
|
(7)
|
SETAC (1998). Advances in Earthworm Ecotoxicology. Sheppard, S.C., Bembridge, J.D., Holmstrup, M., y L. Posthuma, (eds). SETAC Press, 456 pp.
|
|
(8)
|
EPA (1996). Ecological effects test guidelines. Earthworm Subchronic Toxicity Test (850.62.00). United States Environmental Protection Agency. Office of Prevention, Pesticides and Toxic Substances. EPA712-C-96-167, April 1996.
|
|
(9)
|
Bouché, M.B. (1972). Lombriciens de France, Écologie et systématique. Publication de l'Institut National de la Recherche Agronomique.
|
|
(10)
|
Edwards, C.A. (1983). Development of a standardized laboratory method for assessing the toxicity of chemical substances to earthworms. Informe EUR 8714 EN, Comisión de las Comunidades Europeas.
|
|
(11)
|
Greig-Smith, P.W., H. Becker, P.J. Edwards and F. Heimbach (eds.) (1992). Ecotoxicology of Earthworms. Intercept.
|
|
(12)
|
Edwards, C.A. and J. P. Bohlen, (1996). Biology and ecology of Earthworms, 3rd Edition. Chapman and Hall, Londres.
|
|
(13)
|
ISO (Organización Internacional de Normalización) (1994). Calidad del suelo, Determinación del pH, no 10390. ISO, Ginebra.
|
|
(14)
|
Hund-Rinke, K, Römbke, J., Riepert, F. & Achazi R. (2000): Beurteilung der Lebensraumfunktion von Böden mit Hilfe von Regenwurmtests. En: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. & Eisentraeger, A. (eds.). Spektrum Verl., Heidelberg. 59-81.
|
|
(15)
|
ISO (Organización Internacional de Normalización) (1992). Calidad del suelo. Determinación de la característica de retención de agua. Métodos de laboratorio, no 11274. ISO, Ginebra.
|
|
(16)
|
ISO (Organización Internacional de Normalización) (1993). Calidad del suelo. Determinación de la materia seca y del contenido en agua en términos de masa. Método gravimétrico, no 11465. ISO, Ginebra.
|
|
(17)
|
Römbke, J. and Th. Moser (1999). Organisation and Performance of an International Ringtest for the validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, 150+ 223 pp.
|
|
(18)
|
Finney, D.J. (1971). Probit Analysis (3rd ed.), pp. 19-76. Cambridge Univ. Press.
|
|
(19)
|
Finney, D.J. (1978). Statistical Method in Biological Assay. — Charles Griffin & Company Ltd, Londres.
|
|
(20)
|
Hamilton, M.A., R.C. Russo and R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714-719; Correction Environ. Sci. Technol. 12(1998), 417.
|
|
(21)
|
Williams, D.A., (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
|
|
(22)
|
Williams, D.A., (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519-531.
|
|
(23)
|
Dunnett C. W., (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
|
|
(24)
|
Dunnett, C.W., (1964) New tables for multiple comparisons with a control. Biometrics 20, 482-491.
|
|
(25)
|
Hoeven, N. van der, (1998). Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7: 355-361.
|
|
(26)
|
Holm, S., (1979): A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
|
|
(27)
|
Jonckheere, A. R. (1954); A Distribution-free k-Sample Test Against Ordered Alternatives, Biometrika 41, 133-145.
|
|
(28)
|
Terpstra, T. J. (1952); The Asymptotic Normality and Consistency of Kendall's Test Against Trend, When Ties are Present in One Ranking, Indagationes Math. 14, 327-333.
|
|
(29)
|
Shirley, E. A. (1979); The comparison of treatment to control group means in toxicology studies, Applied Statistics 28, 144-151.
|
|
(30)
|
Williams, D.A. (1986); A Note on Shirley's Nonparametric Test for Comparing Several Dose Levels with a Zero-Dose Control, Biometrics 42, 183-186.
|
|
(31)
|
Sokal, R.R. and F.J. Rohlf. (1981). Biometry. The Principle and practice of statistics in biological research. 2nd edition. W.H. Freeman and Company. Nueva York.
|
|
(32)
|
Bruce, R.D. and Versteeg, D.J. (1992). A Statistical Procedure for Modelling Continuous Toxicity Data. Environmental Toxicology and Chemistry 11:1485-1494.
|
|
(33)
|
Christensen, E.R., (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18, 213-221.
|
|
(34)
|
Van Ewijk, P.H. and J.A. Hoekstra. (1993). Calculation of the EC50 and its confidence interval when sub-toxic stimulus is present. Ecotox, Environ. Safety. 25, 25-32.
|
Apéndice 1
Definiciones
En este método de ensayo se aplican las siguientes definiciones:
Sustancia
: sustancia o mezcla.
ECx
(concentración con efecto al x %): concentración que provoca el x % de un efecto sobre los organismos de ensayo dentro de un determinado período de exposición cuando se compara con un control. Por ejemplo, una EC50 es una concentración de la que se estima que causa un efecto sobre un parámetro de un ensayo en el 50 % de una población expuesta a lo largo de un determinado período de exposición. En este ensayo, las concentraciones con efecto se expresan en masa de sustancia problema por masa seca del suelo de ensayo o en masa de sustancia problema por unidad de superficie del suelo.
LC0
(concentración no letal): concentración de una sustancia problema que no mata a ninguno de los organismos de ensayo expuestos dentro de un determinado período de tiempo. En este ensayo la LC0 se expresa en masa de sustancia problema por masa seca del suelo de ensayo.
LC50
(concentración letal mediana): concentración de una sustancia problema que mata al 50 % de los organismos de ensayo expuestos dentro de un determinado período de tiempo. En este ensayo, la LC50 se expresa en masa de sustancia problema por masa seca del suelo de ensayo o en masa de sustancia problema por unidad de superficie del suelo.
LC100
(concentración totalmente letal): concentración de una sustancia problema que mata al 100 % de los organismos de ensayo expuestos dentro de un determinado período de tiempo. En este ensayo la LC100 se expresa en masa de sustancia problema por masa seca del suelo de ensayo.
LOEC (concentración mínima con efecto observado): concentración mínima de la sustancia problema que tiene un efecto estadísticamente significativo (p < 0,05). En este ensayo, la LOEC se expresa en masa de sustancia problema por masa seca del suelo de ensayo o en masa de sustancia problema por unidad de superficie del suelo. Todas las concentraciones de ensayo superiores a la LOEC deben presentar normalmente un efecto que es estadísticamente diferente del del control. Cualquier desviación respecto de lo anterior debe justificarse en el informe de ensayo.
NOEC (concentración sin efecto observado): concentración más elevada de la sustancia problema inmediatamente por debajo de la LOEC a la que no se observa ningún efecto. En este ensayo, la concentración correspondiente a la NOEC no ejerce ningún efecto estadísticamente significativo (p < 0,05) dentro de un determinado período de exposición en comparación con el control.
Tasa de reproducción
: número medio de lombrices juveniles producidas por un número de lombrices adultas durante el período de ensayo.
Sustancia problema
: sustancia o mezcla estudiada con este método de ensayo.
Apéndice 2
Determinación de la capacidad máxima de retención de agua del suelo
Se ha comprobado que el siguiente método es adecuado para determinar la capacidad máxima de retención de agua del suelo. Se describe en el anexo C de la norma ISO DIS 11268-2 (1).
Se recoge una determinada cantidad (p. ej., 5 g) del sustrato de suelo de ensayo, utilizando un dispositivo adecuado de muestreo (tubo de barrena, etc.). Se cubre el fondo del tubo con un trozo de papel de filtro, se llena de agua y se coloca a continuación en un soporte en un baño de agua. El tubo debe sumergirse gradualmente hasta que el nivel del agua esté por encima del extremo superior del suelo. A continuación, se debe dejar en el agua alrededor de tres horas. Dado que no puede retenerse toda el agua absorbida por los capilares del suelo, la muestra de suelo debe dejarse escurrir durante un período de dos horas, colocando el tubo en un lecho de arena de cuarzo finamente molida muy húmeda y contenida en un recipiente tapado (para evitar que se seque). La muestra debe pesarse y secarse hasta obtener una masa constante a 105 oC. La capacidad de retención de agua (WHC) puede calcularse de la manera siguiente:
donde:
|
S
|
=
|
masa del sustrato saturado de agua + masa del tubo + masa del papel de filtro
|
|
T
|
=
|
tara (masa del tubo + masa del papel de filtro)
|
|
D
|
=
|
masa seca del sustrato
|
BIBLIOGRAFÍA:
|
(1)
|
ISO (Organización Internacional de Normalización) (1996). Calidad del suelo: Efectos de los contaminantes sobre las lombrices de tierra (Eisenia fetida). Parte 2: Determinación de los efectos en la reproducción, no 11268-2. ISO, Ginebra.
|
Apéndice 3
Determinación del pH del suelo
El siguiente método de determinación del pH de un suelo se basa en la descripción recogida en la norma ISO DIS 10390: Calidad del suelo. Determinación del pH (1).
Una determinada cantidad de suelo se seca a temperatura ambiente durante al menos 12 horas. A continuación se hace una suspensión del suelo (con al menos 5 gramos de este) en cinco veces su volumen de una solución 1 M de cloruro de potasio de grado analítico (KCl) o de una solución 0,01 M de cloruro de calcio de grado analítico (CaCl2). Después de agitarla enérgicamente durante 5 minutos, se deja reposar la suspensión desde 2 horas como mínimo hasta 24 horas como máximo. El pH de la fase líquida se mide a continuación utilizando un pH-metro, que habrá sido calibrado antes de cada medición con una serie adecuada de soluciones amortiguadoras (p. ej., a un pH de 4,0 y 7,0).
BIBLIOGRAFÍA:
|
(1)
|
ISO (Organización Internacional de Normalización) (1994). Calidad del suelo. Determinación del pH, no 10390. ISO, Ginebra.
|
Apéndice 4
Cultivo de Eisenia fetida / Eisenia andrei
La cría se realiza preferentemente en una cámara climatizada a 20 °C ± 2 °C. A esta temperatura y con el aporte de alimentos suficientes, las lombrices maduran al cabo de unos 2 o 3 meses.
Ambas especies pueden cultivarse con una amplia gama de residuos animales. El medio de cría recomendado es una mezcla 50:50 de estiércol de caballo o de vaca y de turba. Se deben realizar controles para garantizar que las vacas o caballos de los que se obtiene el estiércol no son objeto de tratamiento con medicamentos o sustancias, tales como factores de crecimiento, nematicidas o productos veterinarios similares, que puedan afectar negativamente a las lombrices durante el ensayo. Se recomienda recoger directamente estiércol de vaca procedente de una fuente “ecológica”, ya que la experiencia ha demostrado que el estiércol disponible en el comercio para utilizarse como abono de jardín puede tener efectos negativos para las lombrices. El medio debe tener un valor de pH aproximadamente entre 6 y 7 (ajustado con carbonato de calcio) y una conductividad iónica baja (menos de 6 mS/cm o menos del 0,5 % de concentración salina), y no debe presentar una contaminación excesiva de amoníaco ni de orina animal. El sustrato debe estar húmedo, pero no demasiado mojado. Son adecuadas las cajas de cría de 10 a 50 l de capacidad.
Para obtener lombrices homogéneas en cuanto a su edad y masa, lo mejor es iniciar el cultivo con capullos. Una vez establecido el cultivo, se mantiene colocando lombrices adultas en una caja de cría con sustrato fresco durante un plazo de 14 a 28 días, a fin de permitir la producción de nuevos capullos. A continuación, se retiran los adultos, y los juveniles obtenidos de los capullos se utilizan como base para el cultivo siguiente. Las lombrices se alimentan de forma continua con residuos animales y se trasladan a sustrato fresco de vez en cuando. La experiencia ha demostrado que la harina de avena o el estiércol de caballo o de vaca finamente molido y secado al aire son un alimento adecuado. Hay que asegurarse de que las vacas o caballos de los que se obtiene el estiércol no son objeto de tratamiento con medicamentos o sustancias, tales como factores de crecimiento, que puedan afectar negativamente a las lombrices durante el cultivo a largo plazo. Las lombrices nacidas de los capullos se utilizan en los ensayos cuando tienen entre 2 y 12 meses de edad y se consideran adultas.
Puede considerarse que las lombrices están sanas si se mueven a través del sustrato, no intentan abandonarlo y se reproducen continuamente. Es signo de agotamiento del sustrato que las lombrices se muevan muy lentamente y tengan el extremo posterior de color amarillo. En este caso, se recomienda el aporte de sustrato fresco y/o una reducción de la densidad de población.
Apéndice 5
Técnicas de recuento de las lombrices juveniles nacidas de los capullos
La selección manual de las lombrices presentes en el sustrato del suelo es muy lenta. Se recomiendan, por lo tanto, dos métodos alternativos:
|
a)
|
Los recipientes de ensayo se colocan en un baño de agua, inicialmente a la temperatura de 40 oC pero que va aumentando hasta los 60 °C. Tras un período de 20 minutos aproximadamente, las lombrices juveniles deben aparecer en la superficie del suelo, de donde se pueden retirar fácilmente y contar.
|
|
b)
|
El suelo de ensayo puede lavarse a través de un tamiz usando el método elaborado por van Gestel et al. (1), siempre que la turba y el estiércol o harina de avena añadidos al suelo estuvieran molidos hasta formar un polvo fino. Se ponen uno encima de otro dos tamices cuya luz de malla sea de 0,5 mm (diámetro 30 cm). El contenido de un recipiente de ensayo se lava a través de los tamices con una fuerte corriente de agua del grifo, dejando las lombrices jóvenes y los capullos principalmente en el tamiz superior. Es importante señalar que la totalidad de la superficie del tamiz superior debe mantenerse húmeda durante esta operación, de forma que las lombrices juveniles floten en una película de agua, lo que les impide deslizarse a través de los poros del tamiz. Los mejores resultados se obtienen utilizando una alcachofa de ducha.
|
Una vez que todo el sustrato del suelo se ha lavado a través del tamiz, los juveniles y los capullos se pasan a una cubeta arrastrándolos con agua desde el tamiz superior. El contenido de la cubeta se deja reposar para que los capullos vacíos floten en la superficie del agua y los capullos llenos y las lombrices juveniles vayan al fondo. El agua de la cubeta puede decantarse y las lombrices juveniles y los capullos se transfieren a una placa de Petri que contenga un poco de agua. Las lombrices pueden retirarse para su recuento con una aguja o unas pinzas.
La experiencia ha demostrado que el método a) es más adecuado para la extracción de lombrices juveniles, que podrían ser arrastradas, incluso a través de un tamiz de 0,5 mm.
Siempre debe determinarse la eficiencia del método utilizado para retirar las lombrices (y los capullos cuando proceda) del sustrato de suelo. En el caso de que los juveniles se recojan mediante la técnica de clasificación manual, es recomendable realizar la operación dos veces con todas las muestras.
Bibliografía:
|
(1)
|
Van Gestel, C.A.M., W.A. van Dis, E.M. van Breemen, P.M. Sparenburg (1988). Comparison of two methods determining the viability of cocoons produced in earthworm toxicity experiments. Pedobiologia 32:367-371.
|
Apéndice 6
Resumen de la evaluación estadística de los datos (determinación de la NOEC)

C.34. DETERMINACIÓN DE LA INHIBICIÓN DE LA ACTIVIDAD DE BACTERIAS ANAEROBIAS. REDUCCIÓN DE LA PRODUCCIÓN DE GAS DE LODOS (DE DEPURADORA) EN CONDICIONES ANAERÓBICAS
INTRODUCCIÓN
|
1.
|
El presente método de ensayo es equivalente a las directrices de ensayo de la OCDE TG 224 (2007). Las sustancias vertidas al medio acuático pasan por zonas tanto aeróbicas como anaeróbicas, en las que pueden degradarse y/o pueden inhibir la actividad bacteriana; en algunos casos pueden permanecer en las zonas anaeróbicas sin alterarse durante décadas o más aún. En el tratamiento de las aguas residuales, la primera fase, de sedimentación primaria, es aeróbica en el líquido sobrenadante y anaeróbica en el lodo subyacente. Posteriormente, en la segunda fase, hay una zona aeróbica en el tanque de aireación del lodo activado y una zona anaeróbica en el lodo subyacente en el tanque de sedimentación secundaria. El lodo de estas dos fases se somete normalmente a tratamiento anaeróbico, con producción de metano y dióxido de carbono que se utilizan normalmente para la producción de electricidad. En el medio ambiente en general, es probable que las sustancias que alcanzan los sedimentos de las bahías, los estuarios y el mar permanezcan en estas zonas anaeróbicas de forma indefinida si no son biodegradables. Algunas sustancias llegan en grandes proporciones preferentemente a estas zonas debido a sus propiedades físicas, tales como su baja hidrosolubilidad o su alta adsorción a los sólidos en suspensión, así como a que no pueden biodegradarse en condiciones aeróbicas.
|
|
2.
|
Si bien es deseable que las sustancias vertidas al medio ambiente sean biodegradables en condiciones tanto aeróbicas como anaeróbicas, es esencial que tales sustancias no inhiban la actividad de los microorganismos de ninguna de las zonas. En el Reino Unido ha habido algunos casos de inhibición completa de la producción de metano debidos, por ejemplo, a la presencia de pentaclorofenol en los vertidos industriales, lo que ha implicado el transporte, muy costoso, de los lodos inhibidos desde los digestores hasta sitios “seguros”, y la importación de lodos de digestión no contaminados procedentes de instalaciones próximas. Pero ha habido muchos casos de alteración menos grave de la digestión por algunas otras sustancias, incluidos los hidrocarburos alifáticos halogenados (limpieza en seco) y los detergentes, con reducción significativa de la eficiencia de la digestión.
|
|
3.
|
Solo un método de ensayo, el C.11 (1), se refiere a la inhibición de la actividad bacteriana (respiración del lodo activado) y evalúa el efecto de las sustancias problema sobre la tasa de consumo de oxígeno en presencia de sustrato. El método ha sido ampliamente utilizado para la detección temprana de posibles efectos nocivos de las sustancias sobre el tratamiento aeróbico de las aguas residuales, así como para indicar las concentraciones no inhibitorias de las sustancias problema utilizadas en los diferentes ensayos de biodegradabilidad. El método de ensayo C.43 (2) ofrece una oportunidad limitada para determinar la toxicidad de una sustancia problema en cuanto a la producción de gas por lodos anaeróbicos, diluidos a una décima parte de su concentración normal de sólidos para que se pueda alcanzar la precisión requerida en la evaluación del porcentaje de biodegradación. Como el lodo diluido podría ser más sensible a las sustancias inhibidoras, el grupo de la ISO decidió preparar un método que utilizara lodo sin diluir. Se estudiaron al menos tres textos (de Dinamarca, Alemania y el Reino Unido) y, por último, se prepararon dos normas ISO, una con lodos sin diluir, la ISO 13641-1 (3) y otra con dilución a una centésima, la ISO 13641-2 (4), para representar fangos y sedimentos con bajas poblaciones de bacterias. Ambos métodos han sido sometidos a un ensayo interlaboratorios (5); la parte 1 se confirmó como norma aceptable, pero no hubo consenso acerca de la parte 2. El Reino Unido consideraba que el método requiere más investigación, ya que una proporción significativa de los participantes informaron de una producción de gas muy escasa o nula, en parte debido a que el porcentaje del espacio para el gas era demasiado elevado (del 75 %) para una sensibilidad óptima.
|
|
4.
|
En trabajos anteriores realizados en el Reino Unido (6) (7) se describe un método manométrico que utiliza lodo de digestión sin diluir, más lodos de depuradora sin tratar como sustrato, en frascos de 500 ml; el equipo era pesado y resultaba nauseabundo el mal olor de los lodos sin tratar. Más tarde, Wilson et al. (10) aplicaron con éxito el equipo más compacto y cómodo de Shelton y Tiedje (8), desarrollado por Battersby y Wilson (9). Kawahara et al. (11) prepararon con éxito lodos más homogéneos en el laboratorio para su uso en pruebas de biodegradabilidad anaeróbica y de inhibición en relación con una serie de sustancias. Asimismo, el lodo sin tratar se sustituyó como sustrato para llevar a cabo un ensayo con lodo anaeróbico diluido a una centésima o con fangos, sedimentos, etc., de baja actividad bacteriana.
|
|
5.
|
Este método puede proporcionar información útil para predecir el efecto probable de una sustancia problema sobre la producción de gas en digestores anaeróbicos. Sin embargo, solamente mediante ensayos más largos que simulen de forma más próxima el funcionamiento de los digestores de trabajo cabe indicar si puede producirse la adaptación de los microorganismos a la sustancia problema o si es posible que las sustancias que puedan absorberse y adsorberse en los lodos lleguen a generar una concentración tóxica en un plazo más largo de lo que permite este ensayo.
|
PRINCIPIO DEL ENSAYO
|
6.
|
Unas alícuotas de una mezcla de lodos de digestión anaeróbica (con entre 20 g/l y 40 g/l de sólidos totales) y una solución de sustrato degradable se incuban solas y simultáneamente con una gama de concentraciones de la sustancia problema en recipientes sellados durante un plazo de hasta 3 días. La cantidad de gas producido (metano y dióxido de carbono) se mide por el aumento de presión (Pa) en los frascos. El porcentaje de inhibición de la producción de gas que se debe a las distintas concentraciones de la sustancia problema se calcula a partir de las cantidades producidas en los respectivos frascos de ensayo y de control. Las concentraciones (EC50 y con otro efecto) se calculan a partir de las gráficas del porcentaje de inhibición frente a la concentración de las sustancias problema o, más generalmente, su logaritmo.
|
INFORMACIÓN SOBRE LA SUSTANCIA PROBLEMA
|
7.
|
Las sustancias problema deben utilizarse normalmente en la forma más pura fácilmente disponible, dado que las impurezas de ciertas sustancias, por ejemplo de los clorofenoles, pueden ser mucho más tóxicas que la sustancia problema en sí. No obstante, debe considerarse la necesidad de someter a ensayo las sustancias problema en la forma en que se producen o se comercializan. El uso de productos formulados no se recomienda en principio, pero puede ser adecuado en el caso de sustancias problema poco solubles. Entre las propiedades de la sustancia problema que deben conocerse se cuentan la solubilidad en agua y en algunos disolventes orgánicos, la presión de vapor, el coeficiente de adsorción, la hidrólisis y la biodegradabilidad en condiciones anaeróbicas.
|
APLICABILIDAD DEL MÉTODO
|
8.
|
El ensayo es aplicable a las sustancias tanto solubles como insolubles en agua, incluidas las sustancias volátiles. No obstante, ha de prestarse una atención especial a los materiales de baja hidrosolubilidad [véase la referencia (12)] y de alta volatilidad. Asimismo, pueden utilizarse inóculos procedentes de otras zonas anaeróbicas como, por ejemplo, fangos, suelos saturados o sedimentos. Los sistemas bacterianos anaerobios que se han expuesto previamente a sustancias tóxicas pueden adaptarse para mantener su actividad en presencia de sustancias xenobióticas. Los inóculos de sistemas bacterianos adaptados pueden mostrar mayor tolerancia a las sustancias problema en comparación con los inóculos procedentes de sistemas no adaptados.
|
SUSTANCIAS DE REFERENCIA
|
9.
|
Para comprobar el procedimiento se somete a ensayo una sustancia de referencia, preparando unos recipientes adecuados en paralelo como parte del proceso normal de ensayo; se ha comprobado que el 3,5-diclorofenol es un inhibidor estable de la producción anaeróbica de gas, así como del consumo de oxígeno por los lodos activados y de otras reacciones bioquímicas. Se ha demostrado que otras dos sustancias son más inhibidoras de la producción de metano que el 3,5-diclorofenol, a saber, el bis-tiocianato de metileno y el pentaclorofenol, pero los resultados con estas sustancias no se han validado. No se recomienda el pentaclorofenol por no estar fácilmente disponible en forma pura.
|
REPRODUCIBILIDAD DE LOS RESULTADOS
|
10.
|
En un ensayo interlaboratorios internacional (5) solo se encontró una reproducibilidad moderada en los valores de la EC50 entre los diez laboratorios participantes en cuanto al 3,5-diclorofenol y al ácido 2-bromo-etanosulfónico (el intervalo para la primera sustancia fue de 32 - 502 mg/l y para la segunda de 220 - 2 190 mg/l).
|
Número de laboratorios
|
En mg/l
|
En mg/g de lodo
|
|
Media
|
Desviación típica
|
CV (%)
|
Media
|
Desviación típica
|
CV (%)
|
|
|
3,5-Diclorofenol
|
|
10
|
153
|
158
|
103
|
5
|
4,6
|
92
|
|
|
Ácido 2-bromo-etanosulfónico
|
|
10
|
1 058
|
896
|
85
|
34
|
26
|
76
|
|
Datos de EC50 del ensayo interlaboratorios — lodo sin diluir
|
11.
|
Los elevados coeficientes de variación entre laboratorios reflejan en gran medida las diferencias en cuanto a la sensibilidad de los microorganismos de los lodos debidas a una eventual exposición previa o a la ausencia de exposición previa a la sustancia problema o a sustancias químicamente relacionadas con ella. La precisión con la que se determinó el valor de EC50 sobre la base de la concentración en el lodo era apenas mejor que la correspondiente al valor “volumétrico” (mg/l). Los tres laboratorios que comunicaron la precisión de sus valores de EC50 para el 3,5-diclorofenol indicaron unos coeficientes de variación mucho menores (22, 9 y 18 %, respectivamente para la EC50 en mg/g) que los de las medias del conjunto de los diez laboratorios. Las medias individuales de los tres laboratorios fueron de 3,1, 3,2 y 2,8 mg/g, respectivamente. Los valores menores y aceptables de los coeficientes de variación dentro de los laboratorios, frente a los valores mucho más elevados entre laboratorios, a saber, del 9 al 22 % frente al 92 %, indican que existen importantes diferencias en las propiedades de los distintos lodos.
|
DESCRIPCIÓN DEL MÉTODO
Equipo
|
12.
|
Se utilizará material habitual de laboratorio, además de lo siguiente:
|
a)
|
Incubador, antichispas y con temperatura controlada a 35 °C ± 2 °C;
|
|
b)
|
Recipientes de ensayo de vidrio resistentes a la presión de un tamaño nominal adecuado (17), cada uno provisto de un tapón con revestimiento estanco a los gases, capaz de resistir unos 2 bar o 2 × 105 Pa (para el revestimiento puede utilizarse, p. ej., PTFE = politetrafluoroetileno). Se recomienda utilizar frascos de suero de vidrio de 125 ml de volumen nominal, con un volumen real de unos 160 ml, cerrados con tapones de suero (18) y cápsulas de aluminio, pero también pueden utilizarse sin problemas frascos de volumen total entre 0,1 y 1 litro;
|
|
c)
|
Manómetro de precisión
(19)
y agujas fijadas
La producción total de gas (metano y dióxido de carbono) se mide por medio de un manómetro adaptado para permitir la medición y la evacuación del gas producido. Un ejemplo de instrumento apropiado es un manómetro de precisión portátil conectado a una aguja de jeringa; una llave de tres vías estanca para los gases facilita la liberación del exceso de presión (apéndice 1). Es necesario mantener lo más bajo posible el volumen interno de la llave y de los tubos del transductor de presión, con el fin de que los errores introducidos por despreciar el volumen del equipo sean insignificantes;
|
|
d)
|
Recipientes aislados, para el transporte de los lodos de digestión;
|
|
e)
|
Llaves de presión de tres vías;
|
|
f)
|
Tamiz, con malla de 1 mm2;
|
|
g)
|
Depósito, para los lodos de digestión, frasco de polietileno de alta densidad o de vidrio, de 5 litros de capacidad, provisto de un agitador y de dispositivos para el paso de una corriente de gas nitrógeno (véase el punto 13) a través del espacio libre;
|
|
h)
|
Filtros de membrana (0,2 μm) para esterilizar el sustrato;
|
|
i)
|
Microjeringas, para la conexión, estanca a los gases, del transductor de presión [véase el punto 12, letra c)] al espacio libre de las botellas [véase el punto 12, letra b)]; también para añadir a los frascos los eventuales materiales de ensayo líquidos insolubles;
|
|
j)
|
Caja de guantes, opcional pero recomendada, con una ligera presión positiva de nitrógeno.
|
|
Reactivos
|
13.
|
Deben utilizarse siempre reactivos de pureza analítica. Debe utilizarse en todo el ensayo gas nitrógeno de pureza elevada, con un contenido en oxígeno inferior a 5μl/l.
|
Agua
|
14.
|
En caso de que sea necesario realizar una dilución en cualquier fase, utilícese agua desionizada desgasificada anteriormente. No es necesario controlar analíticamente esta agua, pero hay que velar por el mantenimiento periódico del equipo de desionización. También debe usarse agua desionizada para la preparación de las soluciones madre. Antes de la adición del inóculo anaerobio a cualquier solución o dilución de material problema, hay que asegurarse de que estas están exentas de oxígeno. Se hace pasando gas nitrógeno a través del agua de dilución (o a través de las diluciones) durante 1 hora antes de añadir el inóculo, o bien calentando el agua de dilución hasta el punto de ebullición y enfriándola a continuación a temperatura ambiente en una atmósfera exenta de oxígeno.
|
Lodo digerido
|
15.
|
Recoger lodos de digestión activos de un digestor de una depuradora de aguas residuales o, alternativamente, de un digestor de laboratorio, que trate lodos procedentes sobre todo de aguas residuales domésticas. Puede encontrarse en otras referencias (11) información práctica en relación con los lodos de digestores de laboratorio. Si está previsto utilizar un inóculo adaptado puede considerarse la posibilidad de recurrir a lodos de digestión procedentes de una depuradora de aguas residuales industriales. Para recoger los lodos han de utilizarse frascos de boca ancha, hechos de polietileno de alta densidad o de material similar que pueda expandirse. Hay que añadir lodo a los frascos de muestreo hasta que el nivel quede a alrededor de 1 cm del extremo superior de los frascos, cerrarlos herméticamente, de preferencia con una llave de seguridad [punto 12, letra e)], y ponerlos en recipientes aislados [punto 12, letra d)] para reducir el contraste de temperatura, hasta que se transfieran a un incubador mantenido a 35 °C ± 2 °C. Al abrir los frascos ha de tenerse precaución para liberar el exceso de presión de los gases aflojando cuidadosamente el cierre, o mediante una llave de liberación de presión de tres vías [punto 12, letra e)]. Es preferible utilizar el lodo en el plazo de unas horas desde su recogida; si no es así, puede conservarse a 35 °C ± 2 °C con el espacio libre lleno de nitrógeno, hasta un máximo de tres días, plazo en el que normalmente se pierde poca actividad.
Advertencia: Los lodos de digestión producen gases inflamables que presentan riesgo de incendio y de explosión; también contienen organismos potencialmente patógenos, por lo que es necesario tomar las precauciones adecuadas para manipular los lodos. Por motivos de seguridad, no deben utilizarse recipientes de vidrio para la recogida de lodos.
|
Inóculo
|
16.
|
Inmediatamente antes de utilizarlo, mezclar el lodo mediante agitación suave y pasarlo a través de un tamiz de 1 mm2 de malla [punto 12, letra f)] a un frasco adecuado [punto 12, letra g)] a través de cuyo espacio libre se hace pasar una corriente de nitrógeno. Se reserva una muestra para la medición de la concentración de sólidos secos totales [véase, por ejemplo, la norma ISO 11923 (13) o alguna norma equivalente de la UE]. En general, los lodos se utilizan sin dilución. La concentración de sólidos está generalmente entre el 2 y el 4 % (p/v). Compruébese el valor de pH del lodo y, si es necesario, ajústese a 7 ± 0,5.
|
Sustrato de ensayo
|
17.
|
Se disuelven 10 g de caldo nutritivo (p. ej., Oxoid), 10 g de extracto de levadura y 10 g de D-glucosa en agua desionizada, y se diluye hasta 100 ml. Se esteriliza por filtración a través de un filtro de membrana de 0,2 μm [punto 12, letra h)] y se utiliza inmediatamente o se conserva a 4 °C durante un plazo máximo de un día.
|
Sustancia problema
|
18.
|
Se prepara una solución madre distinta para cada sustancia problema hidrosoluble, que contenga, por ejemplo, 10 g/l de la sustancia en agua de dilución exenta de oxígeno (punto 14). Los volúmenes de estas soluciones madre deben ser adecuados para preparar las mezclas de reacción con concentraciones graduadas. Otra posibilidad consiste en preparar una serie de diluciones de cada solución madre de forma que el volumen añadido a los frascos de ensayo sea el mismo para cada concentración final necesaria. Hay que ajustar el pH de las soluciones madre a 7 ± 0,2, si es necesario;
|
|
19.
|
Para las sustancias problema insuficientemente hidrosolubles, consúltese la norma ISO 10634 (12) o alguna norma equivalente de la UE. Si se necesita utilizar un disolvente orgánico, evítense los disolventes tales como el cloroformo y el tetracloruro de carbono, de los que se sabe que inhiben fuertemente la producción de metano. Se prepara una disolución de la sustancia insoluble en agua a una concentración adecuada en un disolvente volátil adecuado como, por ejemplo, acetona o éter dietílico. Se añaden a frascos de ensayo vacíos [punto 12, letra b)] los volúmenes requeridos de la disolución en disolvente y se evapora el disolvente antes de añadir los lodos. Para otros tratamientos, utilícese la norma ISO 10634 (12) o norma equivalente de la UE, teniendo en cuenta que los eventuales tensioactivos que se utilicen para producir emulsiones pueden resultar inhibidores para la producción anaeróbica de gas. Si se considera que la presencia de disolventes orgánicos y emulsificantes produce artefactos, la sustancia problema puede añadirse directamente a la mezcla de ensayo en forma de polvo o líquido. Las sustancias volátiles y las sustancias líquidas insolubles en agua pueden inyectarse en frascos de suero inoculado, utilizando microjeringas [punto 12, letra i)].
|
|
20.
|
Se añade la sustancia problema a los frascos para obtener una serie geométrica de concentraciones como, por ejemplo, 500 mg/l, 250 mg/l, 125 mg/l, 62,5 mg/l, 31,2 mg/l and 15,6 mg/l. Si no se conoce el intervalo de toxicidad de sustancias similares, debe efectuarse en primer lugar un ensayo preliminar de determinación del intervalo, con las concentraciones de 1 000 mg/l, 100 mg/l y 10 mg/l para establecer el intervalo adecuado.
|
Sustancia de referencia
|
21.
|
Se prepara una solución acuosa de 3,5-diclorofenol (10 g/l) añadiendo gradualmente al sólido la cantidad mínima de solución de hidróxido de sodio 5 mol/l, agitando a la vez, hasta que se haya disuelto. Añadir a continuación agua de dilución desoxigenada (punto 14) hasta el volumen necesario; puede facilitarse la disolución con un baño de ultrasonidos. Pueden utilizarse otras sustancias de referencia cuando se ha obtenido el intervalo medio de la EC50 en al menos tres ensayos con diferentes inóculos (diferentes fuentes o diferentes momentos de recogida).
|
INTERFERENCIAS/ERRORES
|
22.
|
Resulta probable que algunos componentes de los lodos puedan reaccionar con inhibidores potenciales de manera que estos queden indisponibles para los microorganismos, con lo que se reduciría o incluso se anularía la inhibición. Además, en el supuesto de que los lodos ya contengan una sustancia inhibidora, se obtendrían resultados erróneos cuando dicha sustancia fuera objeto de ensayo. Aparte de estas posibilidades, se ha identificado una serie de factores que pueden dar lugar a resultados falsos. Se recogen en el apéndice 3, junto con métodos para eliminar o, al menos, reducir los errores.
|
PROCEDIMIENTO DE ENSAYO
|
23.
|
El número de réplicas necesarias depende del grado de precisión necesario para los índices de inhibición. Si los cierres de los frascos son suficientemente estancos a los gases durante el tiempo del ensayo, se debe utilizar un solo lote (al menos con tres réplicas) de frascos de ensayo a cada concentración exigida. Del mismo modo, se utiliza un solo lote de frascos con la sustancia de referencia y un solo conjunto de controles. No obstante, en el caso de que los cierres de los frascos sean fiables para únicamente una o unas pocas perforaciones, se debe utilizar un lote (por ejemplo, por triplicado) de frascos de ensayo para cada intervalo (t) en el que sea necesario disponer de resultados para todas las concentraciones de la sustancia problema que se hayan de someter a ensayo. Del mismo modo, se deben utilizar “t” lotes de frascos para la sustancia de referencia y para los controles.
|
|
24.
|
Se recomienda utilizar una caja de guantes [punto 12, letra j)]. Al menos 30 minutos antes de comenzar el ensayo, se pone en marcha un flujo de gas nitrógeno a través de una caja de guantes con todo el equipo necesario. Hay que velar por que la temperatura del lodo esté en el intervalo de 35 °C ± 2 °C durante la manipulación y el cerrado de los frascos.
|
Ensayo preliminar
|
25.
|
En caso de que se desconozca la actividad del lodo, se recomienda proceder a un ensayo preliminar. Se deben establecer controles para obtener unas concentraciones de sólidos de, por ejemplo, 10 g/l, 20 g/l y 40 g/l más el sustrato, pero sin sustancia problema. Asimismo, se deben utilizar distintos volúmenes de la mezcla de reacción para disponer de tres o cuatro proporciones de volumen del espacio libre y volumen del líquido. A partir de los resultados de los volúmenes de gas producidos a distintos intervalos de tiempo, se eligen las condiciones más adecuadas que permitan la obtención de dos mediciones diarias que indiquen volúmenes significativos de gases y liberación de presión al día con sensibilidad óptima (20) sin temor a las explosiones.
|
Adición de las sustancias problema
|
26.
|
Las sustancias problema hidrosolubles se añaden a los frascos de ensayo vacíos [punto 12, letra b)] como soluciones acuosas (punto 18). Se utilizan conjuntos de frascos al menos por triplicado para cada concentración de una serie de concentraciones (punto 20). En el caso de las sustancias problema poco solubles e insolubles, se inyectan soluciones de estas en disolventes orgánicos con una microjeringa en los frascos vacíos para obtener conjuntos de réplicas para cada concentración de una serie de cinco concentraciones de sustancia problema. Se evapora el disolvente mediante un chorro de gas nitrógeno sobre la superficie de las soluciones contenidas en los frascos de ensayo. Otra posibilidad consiste en añadir las sustancias sólidas insolubles pesándolas directamente en los frascos de ensayo.
|
|
27.
|
Si las sustancias líquidas insolubles y poco solubles en agua no se añaden utilizando un disolvente, se añaden directamente mediante una microjeringa a los frascos de ensayo tras la adición del inóculo y del sustrato de ensayo (véase el punto 30). Las sustancias problema volátiles pueden añadirse de la misma manera.
|
Adición de inóculo y sustrato
|
28.
|
Se agita un volumen adecuado del lodo de digestión tamizado (véase el punto 16) en un frasco de 5 litros [punto 12, letra g)], mientras se pasa una corriente de gas nitrógeno a través del espacio libre. Los frascos de ensayo que contienen soluciones acuosas o soluciones en disolventes evaporados de las sustancias problema se purgan con una corriente de gas nitrógeno durante unos dos minutos para extraer el aire. Se dispensan en los frascos de ensayo alícuotas de, por ejemplo, 100 ml del lodo bien mezclado, utilizando una pipeta de boca ancha o una probeta. Es esencial llenar la pipeta de una sola vez hasta el volumen exacto de lodo exigido, dada la facilidad de sedimentación de los sólidos del lodo. Si se toma una cantidad excesiva, se ha de vaciar la pipeta y volver a empezar.
|
|
29.
|
A continuación se añade suficiente cantidad de solución de sustrato (punto 17) para conseguir una concentración en la mezcla de 2 g/l de cada uno de los siguientes componentes: caldo nutritivo, extracto de levadura y D-glucosa, mientras que se sigue pasando nitrógeno. A continuación se muestra un ejemplo de lotes de ensayo.
|
Concentración final en masa de la sustancia problema en los frascos de ensayo
(mg/l)
|
Volumen de la sustancia problema
(ml)
|
Reactivos y medios
(ml)
|
|
Solución madre a)10 g/lpunto 18
|
Solución madre b)1 g/lpunto 18
|
Agua de dilución
punto 14
|
Inóculo
punto 16
|
Sustrato
punto 17
|
|
0
|
—
|
0
|
1,0
|
100
|
2
|
|
1
|
—
|
0,1
|
0,9
|
100
|
2
|
|
3,3
|
—
|
0,33
|
0,67
|
100
|
2
|
|
10
|
0,1
|
—
|
0,9
|
100
|
2
|
|
33
|
0,33
|
—
|
0,67
|
100
|
2
|
|
100
|
1,0
|
—
|
0
|
100
|
2
|
|
Volumen total del frasco = 160 ml. Volumen de líquido = 103 ml.
Volumen de gas = 57 ml, o el 35,6 % del volumen total.
|
|
|
30.
|
Del mismo modo se purga con gas nitrógeno un número suficiente de frascos de ensayo vacíos para ensayar las eventuales sustancias problema volátiles o líquidas insolubles (véase el punto 27).
|
Controles y sustancia de referencia
|
31.
|
Se preparan conjuntos al menos triplicados de frascos con lodo y sustrato solamente, para actuar de controles. Se preparan frascos replicados adicionales con lodo y sustrato más una cantidad suficiente de solución madre de la sustancia de referencia, 3,5-diclorofenol (punto 21), para obtener una concentración final de 150 mg/l. Esta concentración debe inhibir la producción de gas en alrededor del 50 %. Otra posibilidad es preparar un intervalo de concentraciones de la sustancia de referencia. Además, se preparan cuatro frascos adicionales para la medición del pH, con lodo, agua desoxigenada y sustrato. Se añade la sustancia problema a dos frascos a la concentración más alta ensayada y se añade agua desoxigenada a los otros dos frascos.
|
|
32.
|
Ha de velarse por que todos los frascos (sustancias problema y de referencia, y controles) contengan el mismo volumen de líquido (VR); en caso necesario, se añade agua desionizada desoxigenada (punto 14) para completar el volumen. El espacio libre debe constituir entre el 10 % y el 40 % del volumen de los frascos, seleccionándose el valor real a partir de los datos obtenidos en el ensayo preliminar. Después de añadir a los frascos todos los componentes, se retira la aguja que suministra el gas y se cierra cada frasco con tapón de caucho y cápsula de aluminio [punto 12, letra b)], humedeciendo el tapón con una gota de agua desionizada para ayudar a su inserción. Se mezcla el contenido de cada frasco por agitación.
|
Incubación de los frascos
|
33.
|
Se transfieren los frascos al incubador de temperatura controlada, provisto preferentemente de un dispositivo de agitación, y se mantienen a 35 °C ± 2 °C. Los frascos se incuban en la oscuridad. Después de aproximadamente 1 hora, se iguala la presión de los frascos a la atmosférica mediante la inserción de una aguja de jeringa, unida al manómetro [punto 12, letra c)], a través del cierre de cada frasco, uno tras otro; se abre la llave hasta que el manómetro indique presión cero y, por último, se cierra la llave. La aguja debe insertarse a un ángulo de unos 45° para evitar la fuga de gas de los frascos. Si los frascos se incuban sin mecanismo de agitación, hay que agitarlos manualmente dos veces al día durante todo el período de incubación para equilibrar el sistema. Los frascos se incuban en posición invertida para evitar cualquier pérdida de gas a través del tapón. Sin embargo, la inversión no es apropiada en los casos en que quepa la posibilidad de que las sustancias problema insolubles se adhieran al fondo del frasco.
|
Medida de la presión
|
34.
|
Cuando los frascos hayan alcanzado la temperatura de 35 °C ± 2 °C, se mide y registra el pH del contenido de dos de los cuatro frascos preparados al efecto y se desecha este contenido; los frascos restantes siguen incubándose en la oscuridad. Se mide y se registra la presión de los frascos dos veces al día durante el siguiente período de 48 a 72 horas, mediante la inserción de la aguja del manómetro a través del cierre de cada frasco, uno tras otro, secando la aguja después de cada medida. Todas las partes del frasco deben mantenerse a la temperatura de incubación durante la medición, que debe llevarse a cabo lo más deprisa posible. Se registra la lectura de la presión una vez se haya estabilizado. A continuación se abre la llave para ventilar, y se cierra cuando la presión llegue a cero. Se prosigue el ensayo por lo general durante un período de 48 horas desde el momento de la primera igualación de la presión, designado “tiempo 0”. El número de lecturas y de ventilaciones debe limitarse en el caso de las sustancias volátiles a uno (al final de la incubación) o dos para reducir al mínimo las pérdidas de sustancia problema (10).
|
|
35.
|
Si la lectura de la presión es negativa, no se debe abrir la llave. A veces se acumula la humedad en la aguja de jeringa y en los tubos, lo que se pone de manifiesto por la lectura de una pequeña presión negativa. En tal caso, se extrae la aguja, se agitan los tubos, se secan con un paño y se pone una nueva aguja.
|
Medición del pH
|
36.
|
Se mide y se registra el pH del contenido de cada frasco, después de la última medida de la presión.
|
DATOS E INFORME
Expresión de los resultados
|
37.
|
Se calculan la suma y la media de las presiones registradas en cada intervalo de tiempo para cada serie de frascos replicados y se calcula la media de la presión de gas global acumulada en cada intervalo de tiempo para cada serie de réplicas. Se trazan las curvas de la media de la producción de gas acumulada (Pa) frente al tiempo, correspondientes a los frascos de control, de ensayo y de referencia. Se selecciona un tiempo de la parte lineal de la curva, normalmente 48 horas, y se calcula el porcentaje de inhibición (I) para cada concentración a partir de la ecuación [1]:
|
I = (1 – Pt/PC) × 100
|
[1],
|
donde
|
I
|
=
|
porcentaje de inhibición, en %;
|
|
Pt
|
=
|
presión del gas producido con el material de ensayo al tiempo seleccionado, en pascales (Pa);
|
|
Pc
|
=
|
presión del gas producido en el control al mismo tiempo, en pascales (Pa).
|
Es aconsejable trazar ambas gráficas, es decir, la gráfica de I frente a la concentración y también frente al logaritmo de la concentración, de manera que se pueda seleccionar la curva que se aproxime más a la linealidad. Se determina el valor de la EC50 (mg/l) visualmente o por análisis de regresión a partir de esa curva más próxima a la linealidad. A efectos de comparación, puede resultar más útil expresar la concentración de la sustancia en mg/g de sólidos secos totales. Para obtener esta concentración, se divide la concentración volumétrica (mg/l) por la concentración volumétrica de sólidos del lodo seco (g/l) (punto 16).
|
|
38.
|
Se calcula el porcentaje de inhibición obtenido por la concentración única de la sustancia de referencia utilizada o la EC50 si se ha estudiado un número suficiente de concentraciones.
|
|
39.
|
El valor medio de la presión del gas producido en el control Pc (Pa) se convierte en volumen recurriendo a la curva de calibración del manómetro (apéndice 2) y a partir de ese valor se calcula el rendimiento de gas, expresado como volumen producido en 48 horas por 100 ml de lodo sin diluir, a una concentración de sólidos de entre el 2 % (20 g/l) y el 4 % (40 g/l).
|
Criterios de validez
|
40.
|
Los resultados del ensayo interlaboratorios de la ISO (5) ha puesto de manifiesto que la sustancia de referencia (3,5-diclorofenol) causaba una inhibición del 50 % de la producción de gas en un intervalo de concentraciones de 32 mg/l a 510 mg/l, con una media de 153 mg/l (punto 10). Este intervalo es tan amplio que no resulta posible establecer como criterios de validez unos límites precisos de la inhibición; para que sea posible, será necesario que se consiga saber cómo producir inóculos menos variables. El volumen de gas producido en los frascos de control en 48 horas varía entre 21 ml/g de materia seca de lodo y 149 ml/g (media de 72 ml/g). No había ninguna relación evidente entre el volumen de gas producido y el correspondiente valor de EC50. El pH final variaba entre 6,1 y 7,5.
|
|
41.
|
El ensayo se considera válido cuando se obtiene una inhibición de más del 20 % en el control de referencia que contiene 150 mg/l de 3,5-diclorofenol, se producen más de 50 ml de gas por gramo de materia seca en el control en blanco y el valor del pH está comprendido entre 6,2 y 7,5 al final de la prueba.
|
Informe del ensayo
|
42.
|
El informe del ensayo debe incluir la información siguiente:
|
|
Sustancia problema
|
—
|
nombre común, nombre químico, número CAS, fórmula estructural y propiedades fisicoquímicas pertinentes;
|
|
—
|
pureza (impurezas) de la sustancia problema.
|
|
|
|
Condiciones del ensayo
|
—
|
volumen del contenido líquido y del espacio libre en los recipientes de ensayo;
|
|
—
|
descripción de los recipientes de ensayo y medición del gas (por ejemplo, tipo de manómetro);
|
|
—
|
aplicación de la sustancia problema y de la sustancia de referencia al sistema de ensayo, concentraciones de ensayo utilizadas y empleo eventual de disolventes;
|
|
—
|
datos del inóculo empleado: nombre de la depuradora de aguas residuales, descripción de la fuente de aguas residuales tratadas (por ejemplo, temperatura de funcionamiento, tiempo de retención del lodo, aguas residuales predominantemente domésticas o residuos industriales, etc.), concentración de sólidos, actividad de producción de gas del digestor anaeróbico, exposición previa o posible adaptación anterior a sustancias tóxicas o lugar de recogida de fangos, sedimentos, etc.;
|
|
—
|
temperatura de la incubación e intervalo;
|
|
|
|
Resultados
|
—
|
valores de pH al final del ensayo;
|
|
—
|
todos los datos medidos obtenidos con los recipientes de ensayo, de control en blanco y de sustancia de referencia, cuando proceda (por ejemplo, presión en Pa o milibares) en forma de cuadro;
|
|
—
|
porcentaje de inhibición en los frascos de ensayo y de referencia, y curvas de inhibición-concentración;
|
|
—
|
cálculo de los valores de EC50, expresada en mg/l y en mg/g;
|
|
—
|
producción de gas por g de lodo en 48 horas;
|
|
—
|
motivos del eventual rechazo de resultados del ensayo;
|
|
—
|
discusión de los resultados, incluidas la eventual desviación de los procedimientos de este método de ensayo y la eventual desviación de los resultados del ensayo respecto a lo que cabría esperar, debido a interferencias y errores;
|
|
—
|
indicación de si el objetivo del ensayo es medir la toxicidad para microorganismos que hayan sufrido o no exposición previa.
|
|
|
BIBLIOGRAFÍA
|
(1)
|
Capítulo C.11 del presente anexo. Lodo activado: prueba de inhibición de la respiración.
|
|
(2)
|
Capítulo C.43 del presente anexo. Biodegradabilidad anaeróbica de las sustancias orgánicas en lodo digerido: método de medición de la producción de gases.
|
|
(3)
|
Organización Internacional de Normalización (2003) ISO 13641-1 Water Quality — Determination of inhibition of gas production of anaerobic bacteria — Part 1: General Test.
|
|
(4)
|
Organización Internacional de Normalización (2003) ISO 13641-2 Water Quality — Determination of inhibition of gas production of anaerobic bacteria — Part 2: Test for low biomass concentrations.
|
|
(5)
|
ISO (2000) Ring test of ISO 13641-1 and ISO 13641-2. Determination of inhibition of activity of anaerobic bacteria. BL 6958/A. Evans MR, Painter HA. Brixham Environmental Laboratory, AstraZeneca UK Ltd., Brixham, TQ5 8BA UK.
|
|
(6)
|
Swanwick JD, Foulkes M (1971). Inhibition of anaerobic digestion of sewage sludge by chlorinated hydrocarbons. Wat. Pollut. Control, 70, 58-70.
|
|
(7)
|
HMSO (1986) Determination of the inhibitory effects of chemicals and waste waters on the anaerobic digestion of sewage sludge. ISBN 0 117519 43 X, En: Methods for the Examination of Waters and Associated Materials UK.
|
|
(8)
|
Shelton DR, Tiedje JM (1984). General method for determining anaerobic biodegradation potential. Appl. Env. Microbiol. 47 850-857.
|
|
(9)
|
Battersby NS and Wilson V (1988). Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic compounds under methanogenic conditions. Chemosphere 17, 2441-2460.
|
|
(10)
|
Wilson V, Painter HA and Battersby NS (1992). A screening method for assessing the inhibition of the anaerobic gas production from sewage sludge. Proc. Int. Symp. on Ecotoxicology. Ecotoxicological Relevance of Test Methods, GSF Forschungzentrum, Neuherberg, Alemania (1990). Eds. Steinberg C y Kettrup A, pp. 117-132 (1992).
|
|
(11)
|
Kawahara K, Yakabe Y, Chida T, and Kida K (1999). Evaluation of laboratory-made sludge for an anaerobic biodegradability test and its use for assessment of 13 chemicals. Chemosphere, 39 (12), 2007-2018.
|
|
(12)
|
Organización Internacional de Normalización (1995) ISO 10634. Calidad del agua. Líneas directrices para la preparación y tratamiento de los compuestos orgánicos poco solubles en agua para la subsecuente evaluación de su biodegradabilidad en medio acuoso.
|
|
(13)
|
Organización Internacional de Normalización, ISO 11923 (1997) Calidad del agua. Determinación de los sólidos en suspensión. Método de filtración por filtro de fibra de vidrio..
|
Apéndice 1
Ejemplo de aparato para medir la producción de biogás mediante la presión del gas

Leyenda:
|
1
|
—
|
Manómetro
|
|
2
|
—
|
Llave de tres vías estanca al gas
|
|
3
|
—
|
Aguja de jeringa
|
|
4
|
—
|
Cierre estanco a los gases (cápsula y tapón)
|
|
5
|
—
|
Espacio libre
|
|
6
|
—
|
Inóculo de lodo digerido
|
Recipiente de ensayo mantenido en un ambiente a 35 °C ± 2 °C
Apéndice 2
Conversión DE las lecturas del manómetro
Las lecturas del manómetro pueden relacionarse con los volúmenes de gas por medio de una curva patrón y a partir de esta se puede calcular el volumen de gas producido por g de lodo seco en 48 horas. Este índice de actividad se utiliza como uno de los criterios con los que se evalúa la validez de los resultados del ensayo. La curva de calibración se obtiene inyectando volúmenes conocidos de gas a 35 °C ± 2 °C en frascos de suero que contienen un volumen de agua igual al de la mezcla de reacción, VR.
|
—
|
Poner en cinco frascos de suero alícuotas de VR ml de agua, mantenida a 35 °C ± 2 °C. Cerrar los frascos y ponerlos en baño de agua a 35 °C ± 2 °C durante 1 hora para equilibrarlos;
|
|
—
|
Conectar el manómetro, dejar que se estabilice y ajustar a cero;
|
|
—
|
Introducir la aguja de jeringa a través del cierre de uno de los frascos, abrir la llave hasta que la lectura del manómetro sea cero y cerrar la llave a continuación;
|
|
—
|
Repetir el mismo procedimiento con los demás frascos;
|
|
—
|
Inyectar en cada frasco 1 ml de aire a 35 °C ± 2 °C. Insertar la aguja (unida al manómetro) a través del cierre de uno de los frascos y dejar que se estabilice la lectura de la presión. Registrar la presión, abrir la llave hasta que la lectura de la presión sea cero y, a continuación, cerrar la llave;
|
|
—
|
Repetir el mismo procedimiento con los demás frascos;
|
|
—
|
Repetir todo el proceso con 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml y 50 ml de aire;
|
|
—
|
Trazar una curva de conversión de la presión (Pa) frente al volumen de gas inyectado (ml). La respuesta del instrumento es lineal a lo largo del intervalo de 0 Pa a 70 000 Pa, y de 0 ml a 50 ml de producción de gas.
|
Apéndice 3
Factores identificados que pueden dar lugar a resultados falsos
a) Calidad de los cierres
Se encuentran en el comercio distintos tipos de tapones para los frascos de suero; muchos de ellos, que contienen caucho butílico, pierden su estanqueidad cuando se perforan con una aguja en las condiciones del ensayo. A veces la presión cae muy lentamente una vez que se ha perforado el tapón con la aguja de jeringa. Se recomienda el uso de tapones estancos al gas para evitar las fugas [punto 12, letra b)].
b) Humedad en la aguja de jeringa
A veces se acumula la humedad en la aguja de jeringa y en los tubos, lo que se pone de manifiesto por la lectura de una pequeña presión negativa. Para corregir esto, se retira la aguja, se agitan los tubos, se secan con un paño y se pone una nueva aguja [puntos 12, letra c), y 35].
c) Contaminación con oxígeno
Los métodos anaeróbicos están expuestos a error debido a la contaminación con oxígeno, lo que puede provocar una producción de gas más baja. En este método, dicha posibilidad debe reducirse al mínimo mediante la utilización de técnicas estrictamente anaeróbicas, incluido el uso de la caja de guantes.
d) Sustratos gruesos en el lodo
La producción anaeróbica de gas y la sensibilidad del lodo se ven influidas por los sustratos que se transfieren con el inóculo a los frascos de ensayo. El lodo digerido de digestores anaeróbicos domésticos suele contener todavía materia reconocible, como pelo y residuos vegetales de celulosa, lo que tiende a hacer difícil la toma de muestras representativas. La materia insoluble gruesa puede retirarse tamizando el lodo, lo que facilita la toma de muestras representativas (punto 16).
e) Sustancias problema volátiles
Las sustancias problema volátiles se liberarán al espacio libre de los frascos de ensayo. Esto puede dar lugar a la pérdida de una parte del material de ensayo por el sistema durante la evacuación tras las mediciones de la presión, lo que puede dar unos valores demasiado elevados de la EC50. El error puede reducirse mediante una adecuada elección de la proporción entre el volumen del espacio libre y el del líquido y evitando la evacuación tras las mediciones de la presión (10).
f) Producción de gas no lineal
Si la gráfica de la producción acumulada media de gas frente al tiempo de incubación no es aproximadamente lineal a lo largo del período de 48 h, la exactitud del ensayo puede verse reducida. A fin de superar este problema, puede ser aconsejable utilizar lodo de digestión procedente de una fuente distinta y/o añadir una concentración aumentada de la sustancia problema, de caldo nutritivo, de extracto de levadura y de glucosa (punto 29).
Apéndice 4
Aplicación a muestras ambientales con baja concentración de biomasa: fangos, sedimentos, etc., de carácter anaeróbico
INTRODUCCIÓN
A.1. En general, la actividad microbiana específica (volumen de gas producido por g de sólidos secos) de fangos, sedimentos o suelos anaeróbicos de origen natural es mucho más baja que la de los lodos anaeróbicos procedentes de aguas residuales. Por ello, cuando se trata de medir los efectos inhibidores de las sustancias sobre estas muestras menos activas, es necesario modificar algunas de las condiciones experimentales. Con estas muestras menos activas se dispone en general de dos posibilidades:
|
a)
|
proceder a un ensayo preliminar modificado (punto 25) con la muestra de fango, suelo, etc., sin diluir a 35 °C ± 2 °C o a la temperatura del lugar de recogida de la muestra, para conseguir una simulación más exacta (como en la parte 1 de ISO 13641);
|
|
b)
|
o efectuar el ensayo con un lodo de digestión diluido (1 en 100) para simular la baja actividad que se espera de la muestra ambiental, pero manteniendo la temperatura a 35 °C ± 2 °C (como en la parte 2 de ISO 13641).
|
A.2. La opción a) puede conseguirse siguiendo el método descrito aquí (equivalente a la parte 1 de la norma ISO 13641), pero es esencial efectuar un ensayo preliminar (punto 25) para determinar las condiciones óptimas, salvo que estas ya se conozcan por ensayos anteriores. La muestra de fango o de sedimento debe homogeneizarse completamente, por ejemplo en un mezclador, y, en caso necesario, diluirse con una pequeña proporción de agua desgasificada de dilución (punto 14), de modo que sea lo suficientemente fluida como para poder transferirse mediante una pipeta de punta ancha o una probeta. En caso de que se considere que pueden ser insuficientes los nutrientes, la muestra de fango puede centrifugarse (en condiciones anaeróbicas) y volver a suspenderse en un medio mineral que contenga extracto de levadura (A.11)
A.3. Opción b): Este planteamiento imita razonablemente bien la baja actividad de las muestras ambientales, pero carece de la alta concentración de sólidos en suspensión presentes en estas muestras. No se conoce el papel de estos sólidos en la inhibición, pero es posible que la reacción entre las sustancias problema y los componentes del fango, junto con la adsorción de las sustancias problema en los sólidos, den lugar a una disminución de la toxicidad de la sustancia problema.
A.4. La temperatura es otro factor importante: para conseguir una simulación estricta, los ensayos deben realizarse a la temperatura del lugar de la muestra, ya que se sabe que hay distintos grupos de bacterias productoras de metano que funcionan a distintos intervalos de temperatura, a saber, los termófilos (~ 30 – 35 °C), los mesófilos (20 – 25 °C) y los psicrófilos (< 20 °C), y que pueden mostrar diferentes pautas de inhibición.
A.5. Duración. En el ensayo general (parte 1), utilizando lodos sin diluir, la producción de gas en los 2-4 días siempre ha sido suficiente, mientras que en la parte 2, con lodos diluidos a la centésima, se produce en ese plazo una cantidad insuficiente o nula de gas en el ensayo interlaboratorios. Madsen et al. (1996), en la descripción de este último ensayo, dicen que debe durar al menos 7 días.
Ensayos efectuados con bajas concentraciones de biomasa (opción b)
Deben introducirse los siguientes cambios y modificaciones, que se añaden a algunos de los actuales puntos y subpuntos del texto principal, o los sustituyen.
A.6. En el punto 6 se añade el texto siguiente: Principio del ensayo:
“Esta técnica puede utilizarse con lodo anaerobio diluido a la centésima, en parte para simular la baja actividad de fangos y sedimentos. La temperatura de incubación puede ser de 35 °C o bien la del lugar del que se haya tomado la muestra. Dado que la actividad bacteriana es mucho menor que en el caso del lodo sin diluir, el período de incubación debe ampliarse a 7 días como mínimo.”.
A.7. En el punto 12, letra a), se añade el texto siguiente:
“el incubador debe ser capaz de funcionar a temperaturas tan bajas como 15 °C.”.
A.8. Se añade un reactivo más tras el punto 13:
“Ácido fosfórico (H3PO4), 85 % en masa en agua.”.
A.9. Se añade el siguiente texto al final del punto 16:
“Se utiliza en el ensayo una concentración final de 0,20 ± 0,05 g/l de sólidos secos totales.”.
A.10. Punto 17. Sustrato de ensayo
No se emplea este sustrato, sino que se sustituye por extracto de levadura (véanse los puntos 17; A. 11, A. 12, A. 13).
A.11. Se requiere la presencia de un medio mineral, con oligoelementos, para diluir el lodo anaerobio y, por motivos prácticos, se añade a este medio el sustrato orgánico, extracto de levadura.
Tras el punto 17 se añade el texto siguiente:
|
“a)
|
Medio mineral de ensayo, con extracto de levadura.
|
Se prepara a partir de un medio de ensayo concentrado 10 veces [punto 17, letra b); A.12] con una solución de oligoelementos [punto 17, letra c); A. 13]. Utilícese sulfuro de sodio nonahidratado recién suministrado [punto 17, letra b); A. 12] o lávese y séquese antes de su utilización a fin de asegurarse de que dispone de suficiente capacidad reductora. Si el ensayo se lleva a cabo sin utilizar una caja de guantes [punto 12, letra j)], será necesario aumentar la concentración de sulfuro de sodio en la solución madre a 2 g/l (desde 1 g/l). También es posible añadir sulfuro de sodio de una solución madre adecuada a través del tapón de los frascos de ensayo cerrados, ya que este proceso reduce el riesgo de oxidación, hasta obtener una concentración final de 0,2 g/l. Otra posibilidad es utilizar citrato de titanio (III) [punto 17, letra b)]. Se añade a través del tapón de los frascos de ensayo cerrados hasta obtener una concentración de entre 0,8 mmol/l y 1,0 mmol/l. El citrato de titanio (III) es un agente reductor muy eficaz y de baja toxicidad, que se prepara de la forma siguiente: Se disuelven 2,94 g de citrato de trisodio dihidratado en 50 ml de agua de dilución exenta de oxígeno (punto 14) (lo que se traduce en una solución de 200 mmol/l) y se añaden 5 ml de una solución de cloruro de titanio (III) (15 g/100 ml de agua de dilución). Se neutraliza el pH a 7 ± 0,5 con carbonato de sodio y se introduce en un frasco de suero apropiado bajo una corriente de gas nitrógeno. La concentración de citrato de titanio (III) en esta solución madre es igual a 164 mmol/l. El medio de ensayo debe utilizarse inmediatamente o conservarse a 4 °C durante un máximo de un día.
|
A.12.
|
b)
|
Medio de ensayo concentrado diez veces, elaborado con los siguientes componentes:
|
dihidrogenofosfato de potasio anhidro (KH2PO4)
|
2,7 g
|
|
hidrogenofosfato de disodio (Na2HPO4)
|
4,4 g
|
|
(u 11,2 g de dodecahidrato)
cloruro de amonio (NH4Cl)
|
5,3 g
|
|
cloruro de calcio dihidratado (CaC12 · 2H2O)
|
0,75 g
|
|
cloruro de magnesio hexahidratado (MgCl2 · 6H2O)
|
1,0 g
|
|
cloruro de hierro (II) tetrahidratado (FeCl2 · 4H2O)
|
0,2 g
|
|
resazurina (indicador redox)
|
0,01 g
|
|
sulfuro de sodio nonahidratado (Na2S · 9H2O)
|
1,0 g
|
|
(o citrato de titanio (III)) concentración final
|
0,8 mmol/l a 1,0 mmol/l
|
|
solución de oligoelementos [véase punto 17, letra c); A.13]
|
10,0 ml
|
|
extracto de levadura
|
100 g
|
|
disolver en agua de dilución (punto 14) y enrasar a:
|
1 000 ml
|
|
|
A.13.
|
c)
|
Solución de oligoelementos, preparada con los componentes siguientes:
|
cloruro de manganeso (II) tetrahidratado (MnCl2 · 4H2O)
|
0,5 g
|
|
ácido orto-bórico (H3BO3)
|
0,05 g
|
|
cloruro de zinc (ZnCl2)
|
0,05 g
|
|
cloruro de cobre (II) (CuCl2)
|
0,03 g
|
|
molibdato de sodio dihidratado (Na2MoO4 · 2H2O)
|
0,01 g
|
|
cloruro de cobalto (II) hexahidratado (CoCl2 · 6H2O)
|
1,0 g
|
|
cloruro de níquel (II) hexahidratado (NiCl2 · 6H2O)
|
0,1 g
|
|
selenito de disodio (Na2SeO3)
|
0,05 g
|
|
disolver en agua de dilución (punto 14) y enrasar a:
|
1 000 ml”.
|
|
A.14. Punto 25: Ensayo preliminar
Es fundamental efectuar un ensayo preliminar como se describe en el punto 24, con la diferencia de que la concentración de sólidos del lodo debe ser una centésima de las concentraciones indicadas, es decir, 0,1 g/l, 0,2 g/l y 0,4 g/l. La duración de la incubación debe ser como mínimo de 7 días.
Nota: En el ensayo interlaboratorios (5) el volumen del espacio libre era demasiado alto, con el 75 % del volumen total; debe estar en el intervalo recomendado de entre el 10 % y el 40 %. El criterio pertinente es que el volumen de gas producido en torno al 80 % de inhibición se pueda medir con una precisión aceptable (por ejemplo, de ± 5 % a ± 10 %).
A.15. Puntos 26 a 30: Adición de sustancia problema, inóculo y sustrato
La adición se hace de la misma forma que se describe en estos puntos, pero la solución de sustrato (punto 17) se sustituye por el medio de ensayo más sustrato de extracto de levadura (A.11).
Además, la concentración final de sólidos del lodo seco se reduce de 2 g/l — 4 g/l a 0,2 ± 0,05 g/l (A.9). En el cuadro A.1, que sustituye al cuadro que figura en el punto 29, se indican dos ejemplos de la adición de componentes a la mezcla de ensayo.
A.16. Punto 33: Incubación de los frascos
A causa de la disminución prevista de la velocidad de producción de gas, la incubación se lleva a cabo durante al menos 7 días.
A.17. Punto 34: Medidas de la presión
Para medir la presión en el espacio libre de los frascos se utiliza el mismo procedimiento que se describe en el punto 34 si hay que conocer las cantidades presentes en la fase gaseosa. Si van a medirse las cantidades totales de CO2 y de CH4, hay que reducir el pH de la fase líquida a alrededor de 2 mediante la inyección de H3PO4 a cada frasco pertinente y se mide la presión tras 30 minutos de agitación a la temperatura de ensayo. Sin embargo, puede obtenerse más información sobre la calidad del inóculo midiendo la presión en cada frasco antes y después de la acidificación. Por ejemplo, cuando la velocidad de producción de CO2 es mucho más elevada que la de metano, la sensibilidad de las bacterias fermentadoras puede verse alterada o las bacterias metanógenas pueden verse afectadas preferentemente por la sustancia problema.
A.18. Punto 36: Medición del pH
Si se utiliza H3PO4, han de prepararse especialmente para la medición del pH varios frascos más a los que no se habrá añadido ningún H3PO4.
BIBLIOGRAFÍA:
Madsen, T, Rasmussen, HB; and Nilsson, L (1996), Methods for screening anaerobic biodegradability and toxicity of organic chemicals. Project No.336, Water Quality Institute, Danish Environment Protection Agency, Copenhague.
Cuadro A.1.
Ejemplos de organización del ensayo respecto a los lotes de ensayo
|
Componentes de la mezcla de reacción
|
Ejemplo 1
|
Ejemplo 2
|
Orden normal de adición
|
|
Concentración en el inóculo preparado (gl/l)
|
0,42
|
2,1
|
—
|
|
Volumen de inóculo añadido (ml)
|
45
|
9
|
4
|
|
Concentración de inóculo en los frascos de ensayo (g/l)
|
0,20
|
0,20
|
—
|
|
Volumen de medio de ensayo añadido (ml)
|
9
|
9
|
2
|
|
Volumen de agua de dilución añadida (ml)
|
36
|
72
|
3
|
|
Concentración de extracto de levadura en los frascos de ensayo (g/l)
|
9,7
|
9,7
|
—
|
|
Volumen de solución madre de sustancia problema (ml)
|
3
|
3
|
1
|
|
Volumen total de líquido (ml)
|
93
|
93
|
—
|
Apéndice 5
Definiciones
A efectos del presente método de ensayo, se aplicarán las siguientes definiciones:
Sustancia
: sustancia o mezcla.
Sustancia problema
: sustancia o mezcla estudiada con este método de ensayo.
C.35. PRUEBA DE TOXICIDAD PARA LUMBRICULUS EN SEDIMENTOS Y AGUA CON SEDIMENTO ENRIQUECIDO
INTRODUCCIÓN
|
1.
|
El presente método de ensayo es equivalente a las directrices de ensayo de la OCDE TG 225 (2007). Los animales endobentónicos que ingieren sedimentos pueden estar muy expuestos a las sustancias ligadas a los sedimentos, por lo que merecen especial atención; véanse, por ejemplo, las referencias (1), (2), (3). Entre estos animales que ingieren sedimentos, los oligoquetos acuáticos desempeñan un importante papel en los sedimentos de los sistemas acuáticos. Por la bioturbación del sedimento y por servir de presa, estos animales pueden influir mucho en la biodisponibilidad de tales sustancias para otros organismos, como, por ejemplo, los peces bentívoros. En contraste con los organismos epibentónicos, los oligoquetos acuáticos endobentónicos (por ejemplo, Lumbriculus variegatus) se entierran en el sedimento e ingieren partículas de sedimento por debajo de la superficie de este. Esto hace que los organismos de ensayo queden expuestos a la sustancia problema a través de todas las posibles vías de absorción, como, por ejemplo, contacto con partículas de sedimento contaminadas, o ingestión de tales partículas, pero también a través del agua intersticial y del agua sobrenadante).
|
|
2.
|
El presente método de ensayo está diseñado para evaluar los efectos de la exposición prolongada del oligoqueto endobentónico Lumbriculus variegatus (Müller) a las sustancias asociadas a los sedimentos. Se basa en los actuales protocolos de ensayo de toxicidad y de bioacumulación del sedimento; véanse por ejemplo las referencias (3), (4), (5), (6), (7), (8), (9), (10). La descripción del método se refiere a condiciones de ensayo estáticas. La situación de exposición aplicada en el presente método de ensayo es el enriquecimiento del sedimento con la sustancia problema. El objetivo de enriquecer el sedimento consiste en simular un sedimento contaminado con la sustancia problema.
|
|
3.
|
Las sustancias que tienen que someterse a ensayo respecto a organismos que viven en los sedimentos suelen permanecer en este compartimento durante largos plazos. Los organismos que viven en los sedimentos pueden sufrir exposición a través de varias vías. La importancia relativa de cada vía de exposición y el tiempo que tarda cada una de ellas en contribuir a los efectos tóxicos generales dependen de las propiedades fisicoquímicas de la sustancia correspondiente y de su destino final en el animal. En el caso de las sustancias que se adsorben fuertemente (por ejemplo, con log Kow > 5) o en el de las sustancias que se unen covalentemente con el sedimento, la ingestión de alimentos contaminados puede constituir una vía de exposición significativa. A fin de no subestimar la toxicidad de tales sustancias, los alimentos necesarios para el crecimiento y la reproducción de los organismos de ensayo se añaden al sedimento antes de aplicar la sustancia problema (11). El método de ensayo que se describe es lo suficientemente detallado para que pueda efectuarse el ensayo, sin perjuicio de posibles adaptaciones del diseño experimental en función de las condiciones específicas de cada laboratorio y de las diversas características de las sustancias problema.
|
|
4.
|
El método de ensayo tiene por objeto determinar los efectos de la sustancia problema sobre la reproducción y la biomasa de los organismos de ensayo. Los parámetros biológicos medidos son el número total de gusanos supervivientes y la biomasa (peso seco) al final de la exposición. Estos datos se analizan bien aplicando un modelo de regresión para estimar la concentración que causaría un efecto del x % (p. ej., EC50, EC25, y EC10), o bien realizando contrastes estadísticos de hipótesis para determinar la concentración sin efecto observado (NOEC) y la concentración mínima con efecto observado (LOEC).
|
|
5.
|
En el capítulo C.27 del presente anexo, “Ensayo de toxicidad para quironómidos en sistemas sedimento-agua con sedimento enriquecido” (6), se aportan muchos datos fundamentales y útiles para la realización del presente método de ensayo de toxicidad en los sedimentos. Por lo tanto, dicho documento ha servido de base sobre la cual se han aportado las modificaciones necesarias para la realización de ensayos de toxicidad en los sedimentos con Lumbriculus variegatus. Otros documentos a los que se hace referencia son, por ejemplo, la Standard Guide for Determination of the Bioaccumulation of Sediment-Associated Contaminants by Benthic Invertebrates de la ASTM (3), los Methods for Measuring the Toxicity and Bioaccumulation of Sediment-Associated Contaminants with Freshwater Invertebrates de la U.S. EPA (7), y la Standard Guide for Collection, Storage, Characterization, and Manipulation of Sediments for Toxicological Testing and for selection of samplers used to collect benthic invertebrates de la ASTM (12). Además, la experiencia práctica obtenida durante el ensayo interlaboratorios del método de ensayo [(13), informe del ensayo interlaboratorios] y los datos de la bibliografía han sido importantes fuentes de información para elaborar el presente documento.
|
CONDICIONES PREVIAS E INFORMACIÓN ORIENTATIVA
|
6.
|
Antes de empezar el estudio ha de obtenerse información sobre la sustancia problema, como las precauciones de seguridad, las condiciones adecuadas de conservación y los métodos analíticos. En la referencia 14 se ofrecen orientaciones sobre los ensayos de sustancias con propiedades fisicoquímicas que dificultan la realización del ensayo.
|
|
7.
|
Antes de llevar a cabo el ensayo, debe conocerse la siguiente información acerca de la sustancia problema:
|
—
|
nombre común, nombre químico (de preferencia la denominación IUPAC), fórmula estructural, número de registro CAS, pureza;
|
|
|
8.
|
La siguiente información adicional se considera útil antes de empezar el ensayo:
|
—
|
coeficiente de reparto octanol/agua Kow;
|
|
—
|
coeficiente de reparto carbono orgánico-agua, expresado como Koc;
|
|
—
|
fototransformación en el agua;
|
|
|
9.
|
Antes del inicio del ensayo debe conseguirse información sobre determinadas características de los sedimentos que se vayan a utilizar (7). En los puntos 22 a 25 se encuentran más detalles al respecto.
|
PRINCIPIO DEL ENSAYO
|
10.
|
Se exponen gusanos de estado fisiológico similar (sincronizadas como se describe en el apéndice 5) a una serie de concentraciones de la sustancia tóxica aplicada a la fase sedimentaria de un sistema sedimento-agua. Deben utilizarse como medio sedimentos artificiales y agua reconstituida. Los recipientes de ensayo sin adición de la sustancia problema sirven de controles. La sustancia problema se introduce en el sedimento en bruto para cada nivel de concentración, con el fin de minimizar la variabilidad entre las réplicas de cada nivel de concentración, y los organismos de ensayo se introducen posteriormente en los recipientes de ensayo en los que las concentraciones de sedimento y agua se habrán equilibrado (véase el punto 29). Los animales de ensayo se exponen a los sistemas sedimento-agua durante un período de 28 días. Teniendo en cuenta el bajo contenido de nutrientes en el sedimento artificial, este debe enriquecerse con una fuente de alimentos (véanse los puntos 22 a 23, y el apéndice 4) para velar por que los gusanos crezcan y se reproduzcan en condiciones controladas. De esta manera se garantiza que los animales de ensayo se exponen a través del agua y del sedimento, así como de sus alimentos.
|
|
11.
|
El parámetro preferido para este tipo de estudio es la ECx (p. ej., EC50, EC25, y EC10; concentración con efecto que afecta al x % de los organismos de ensayo) para la reproducción o la biomasa, comparando con el control. No obstante, ha de observarse que, considerando la elevada incertidumbre de las ECx bajas (p. ej., EC10, EC25) con unos límites de confianza del 95 % extremadamente elevados (véase, p. ej., la referencia 15) y la potencia estadística calculada durante el contraste de hipótesis, se acepta que la EC50 es el parámetro más sólido. Por otra parte, la concentración sin efecto observado (NOEC) y la concentración mínima con efecto observado (LOEC) pueden calcularse en relación con la biomasa y con la reproducción, si el diseño del ensayo y los datos permiten estos cálculos (véanse los puntos 34 a 38). El objetivo del estudio, la determinación de CEx o de la NOEC, determinará el diseño del ensayo.
|
ENSAYOS DE REFERENCIA
|
12.
|
Se espera que el comportamiento de los organismos de control demuestre suficientemente la capacidad de un laboratorio para realizar el ensayo y, si se dispone de datos históricos, la repetibilidad del ensayo. Además, pueden llevarse a cabo ensayos de toxicidad de referencia a intervalos regulares con un tóxico de referencia para evaluar la sensibilidad de los organismos de ensayo. Mediante ensayos de toxicidad de referencia de 96 h en el agua se pueden demostrar satisfactoriamente la sensibilidad y el estado de los animales de ensayo (4) (7). En el apéndice 6 y en el informe sobre el ensayo interlaboratorios del método de ensayo (13) se incluye información sobre la toxicidad del pentaclorofenol (PCP) en ensayos completos (28 días de exposición al sedimento enriquecido). La toxicidad aguda, solo en el agua, del PCP se describe, por ejemplo, en la referencia 16. Esta información puede utilizarse para comparar la sensibilidad del organismo de ensayo en ensayos de referencia con PCP como tóxico de referencia. Se ha recomendado utilizar como tóxico de referencia con L. variegatus el cloruro de potasio (KCl) o el sulfato de cobre (CuSO4) (4)(7). Hasta la fecha, el establecimiento de criterios de calidad basados en los datos de toxicidad de KCl resulta difícil debido a la falta de datos bibliográficos con L. variegatus. En los puntos (17) a (21) se encuentra información sobre la toxicidad del cobre para L. variegatus.
|
VALIDEZ DEL ENSAYO
|
13.
|
Para que un ensayo sea válido, debe cumplir los siguientes criterios:
|
—
|
Un ensayo interlaboratorios (13) ha puesto de manifiesto que, en el caso de Lumbriculus variegatus, el número medio de gusanos vivos por réplica en los controles debe haberse multiplicado por un factor de al menos 1,8 al final de la exposición en comparación con el número de gusanos por réplica al inicio de la exposición.
|
|
—
|
El pH del agua sobrenadante debe estar entre 6 y 9 a lo largo de todo el ensayo.
|
|
—
|
La concentración de oxígeno en el agua sobrenadante no debe estar por debajo del 30 % del valor de saturación de aire a la temperatura de ensayo durante el ensayo.
|
|
DESCRIPCIÓN DEL MÉTODO DE ENSAYO
Sistema de ensayo
|
14.
|
Se recomiendan los sistemas estáticos, sin renovación del agua sobrenadante. Si la proporción entre sedimento y agua (véase el punto 15) es la correcta, una aireación suave será suficiente en principio para mantener la calidad del agua en unos niveles aceptables para los organismos de ensayo (por ejemplo, maximizar los niveles de oxígeno disuelto, minimizar la acumulación de los productos de excreción). Solo en casos excepcionales deben utilizarse sistemas semiestáticos o dinámicos, con renovación intermitente o continua del agua sobrenadante, ya que se supone que la renovación regular del agua sobrenadante afecta al equilibrio químico (por ejemplo, con pérdidas de la sustancia problema del sistema de ensayo).
|
Recipientes y equipo del ensayo
|
15.
|
La exposición debe llevarse a cabo en vasos de precipitados de, por ejemplo, 250 ml de capacidad y 6 cm de diámetro. Pueden utilizarse otros recipientes de vidrio adecuados que garanticen una altura adecuada de sedimento y de agua sobrenadante. Cada recipiente debe recibir una capa de aproximadamente 1,5-3 cm del sedimento artificial. La proporción de la altura de la capa de sedimento respecto a la altura del agua sobrenadante debe ser de 1:4. Los recipientes deben ser de capacidad adecuada para la tasa de carga, es decir, para el número de gusanos de ensayo añadido por unidad de peso del sedimento (véase también el punto 39).
|
|
16.
|
Los recipientes de ensayo y demás equipo que hayan de entrar en contacto con la sustancia problema serán íntegramente de vidrio o de otro material químicamente inerte. Se tendrá cuidado de no utilizar, con ninguna parte del equipo, materiales que puedan disolver o adsorber la sustancia problema o lixiviar otras sustancias y tener algún efecto adverso sobre los animales de ensayo. En todos los equipos en contacto con los medios de ensayo debe utilizarse politetrafluoroetileno (PTFE), acero inoxidable o vidrio. En el caso de sustancias orgánicas de las que se sepa que se adsorben al vidrio, puede ser necesario utilizar vidrio silanizado. Será necesario, en estos casos, deshacerse de los equipos una vez usados.
|
Especie de ensayo
|
17.
|
La especie de ensayo utilizada en este tipo de estudios es el oligoqueto de agua dulce Lumbriculus variegatus (Müller). Esta especie es tolerante a una amplia gama de tipos de sedimentos, y es ampliamente utilizada en los ensayos de toxicidad y de bioacumulación en el sedimento [por ejemplo, (3) (5) (7) (9) (13) (15) (16) (22) (23) (24) (25) (26) (27) (28) (29) (30) (31) (32) (33) (34) (35)]. Deben indicarse el origen de los animales de ensayo, la confirmación de la identidad de la especie [p. ej., (36)], así como las condiciones de cultivo. No es necesario identificar la especie antes de realizar cada ensayo si los organismos proceden de un cultivo del propio laboratorio.
|
Cultivo de los organismos de ensayo
|
18.
|
Con el fin de disponer de un número suficiente de gusanos para la realización de los ensayos de toxicidad en los sedimentos, es útil mantener los gusanos en un cultivo de laboratorio permanente. En el apéndice 5 se encuentran orientaciones sobre los métodos de cultivo en laboratorio de Lumbriculus variegatus, así como fuentes de cultivos de inicio. Para más detalles sobre el cultivo de esta especie, véanse las referencias (3), (7), (27).
|
|
19.
|
Para garantizar que los ensayos se realizan con animales de la misma especie, es muy recomendable el establecimiento de cultivos de una única especie. Ha de velarse por que los cultivos y especialmente los gusanos utilizados en los ensayos no presenten enfermedades ni anomalías observables.
|
Agua
|
20.
|
Se recomienda utilizar como agua sobrenadante en las pruebas agua reconstituida con arreglo al capítulo C.1 del presente anexo (37); esta también podrá utilizarse para los cultivos de laboratorio de los gusanos (para la preparación, véase el apéndice 2). En caso necesario, podrá utilizarse agua natural. El agua seleccionada debe ser tal que permita el crecimiento y la reproducción de la especie de ensayo durante los períodos de aclimatación y de ensayo, sin que se observen comportamientos ni aspectos anormales. Se ha demostrado que Lumbriculus variegatus sobrevive, crece y se reproduce en este tipo de agua (30), que aporta una normalización máxima de las condiciones de ensayo y de cultivo. Si se utiliza agua reconstituida, debe indicarse su composición y el agua debe caracterizarse antes de usarse, al menos por su pH, contenido de oxígeno y dureza (expresada en mg de CaCO3/l). Puede aportar información útil el análisis del agua antes de usarla, para detectar en ella la presencia de microcontaminantes; véase, por ejemplo, el apéndice 3.
|
|
21.
|
El pH del agua sobrenadante debe estar en la banda de 6,0 a 9,0 (véase el punto 13). Si se espera una mayor producción de amoníaco, se considera útil mantener el pH entre 6,0 y 8,0. Para el ensayo de, por ejemplo, ácidos orgánicos débiles, es conveniente ajustar el pH amortiguando el agua utilizada en el ensayo, según lo descrito, por ejemplo, en la referencia (16). La dureza total del agua utilizada en el ensayo debe estar entre 90 y 300 mg CaCO3 por litro en el caso del agua natural. El apéndice 3 resume los criterios adicionales para que el agua de dilución sea aceptable con arreglo a las directrices no 210 de la OCDE (38).
|
Sedimento
|
22.
|
Dado que es posible que no se disponga a lo largo de todo el año de sedimentos naturales no contaminados procedentes de una fuente particular, y que la presencia de organismos endógenos y de microcontaminantes pueda influir en el ensayo, resulta preferible utilizar sedimento artificial (también denominado formulado, reconstituido o sintético). El uso de un sedimento artificial reduce al mínimo la variabilidad de las condiciones de ensayo, así como la introducción de fauna endógena. El siguiente sedimento artificial se basa en el sedimento artificial según (6), (39) y (40). Se recomienda utilizarlo en este tipo de ensayo [(6), (10), (30), (41), (42), (43)]:
|
a)
|
4-5 % de turba esfágnea (peso seco); es importante utilizar turba en forma de polvo, con un grado medio de descomposición, finamente molida (tamaño de partícula ≤ 0,5 mm) y secada solo al aire;
|
|
b)
|
20 ± 1 % de caolín (peso seco), con un contenido de caolinita preferentemente superior al 30 %;
|
|
c)
|
75-76 % de arena de cuarzo (peso seco) (arena fina, granulometría ≤ 2 mm, pero > 50 % de las partículas con un tamaño en la banda de 50-200 μm);
|
|
d)
|
agua desionizada, 30–50 % del peso seco del sedimento, además de los componentes del sedimento seco;
|
|
e)
|
carbonato de calcio de calidad químicamente pura (CaCO3) añadido para ajustar el pH de la mezcla final del sedimento;
|
|
f)
|
el contenido de carbono orgánico total (COT) de la mezcla final debe ser del 2 % (± 0,5 %) del peso seco del sedimento, ajustado mediante el empleo de cantidades adecuadas de turba y arena, según las letras a) y c);
|
|
g)
|
alimento, por ejemplo hojas en polvo de ortiga (Urtica sp., de conformidad con las normas farmacéuticas, para consumo humano), o una mezcla de hojas en polvo de Urtica sp. con alfacelulosa (1:1), en la proporción del 0,4 - 0,5 % de peso seco del sedimento, además de los componentes del sedimento seco; en el apéndice 4 se ofrecen detalles al respecto.
|
|
|
23.
|
Debe conocerse el origen de la turba, del caolín, del alimento y de la arena. Además de la letra g), el capítulo C.27 del presente anexo (6) recoge una lista de materias vegetales alternativas que pueden utilizarse como fuente de nutrientes: hojas deshidratadas de morera (Morus alba), trébol blanco (Trifolium repens), espinaca (Spinacia oleracea) o cereales.
|
|
24.
|
La fuente elegida de alimento debe añadirse antes del enriquecimiento del sedimento con la sustancia problema, o durante el mismo. La fuente elegida de alimento debe permitir al menos la reproducción aceptable de los controles. Puede aportar información útil el análisis del sedimento artificial o de sus componentes antes de la utilización para detectar la presencia de microcontaminantes. En el apéndice 4 se describe un ejemplo de preparación del sedimento artificial. Puede aceptarse también la mezcla de componentes secos si se demuestra que, tras la adición de agua sobrenadante, no se produce separación de los componentes del sedimento (por ejemplo, flotación de partículas de turba), y que la turba o el sedimento están suficientemente acondicionados (véanse también el punto 25 y el apéndice 4). El sedimento artificial debe caracterizarse al menos por el origen de los componentes, la granulometría (porcentaje de arena, limo y arcilla), el contenido de carbono orgánico total (COT), el contenido de agua y el pH. La medición del potencial redox es opcional.
|
|
25.
|
En caso necesario, por ejemplo con fines de ensayo específicos, pueden también servir como sedimento para el ensayo o el cultivo sedimentos naturales procedentes de lugares exentos de contaminación (3). Sin embargo, si se utiliza sedimento natural, debe caracterizarse al menos por su origen (lugar de recogida), pH y amoníaco del agua intersticial, contenido de carbono orgánico total (COT) y contenido de nitrógeno, granulometría (porcentaje de arena, limo y arcilla), y contenido porcentual de agua (7), y debe estar exento de toda contaminación y de otros organismos que pudieran competir con los organismos de ensayo o convertirlos en sus presas. La medición del potencial redox y de la capacidad de intercambio catiónico es opcional. También se recomienda que el sedimento natural, antes de enriquecerse con la sustancia problema, se someta durante siete días a las mismas condiciones que vayan a reinar posteriormente en el ensayo. Al final de este período de acondicionamiento, el agua sobrenadante debe retirarse y eliminarse.
|
|
26.
|
El sedimento que vaya a utilizarse debe ser tal que permita la supervivencia y la reproducción de los organismos de control durante el período de exposición, sin que se observen comportamientos ni aspectos anormales. Los gusanos de control deben enterrarse en el sedimento, e ingerir este. La reproducción de los controles debe ajustarse al menos al criterio de validez, tal como se describe en el punto 13. La presencia o ausencia de deyecciones en la superficie del sedimento, que indican que los gusanos ingieren el sedimento, debe registrarse y puede ser útil para la interpretación de los resultados del ensayo con respecto a las vías de exposición. Puede obtenerse información adicional sobre la ingestión de sedimento utilizando métodos descritos en las referencias (24), (25), (44) y (45), que especifican la ingestión de sedimento o la selección de partículas en los organismos de ensayo.
|
|
27.
|
En las referencias (3), (7) y (12) se describen procedimientos de manipulación de los sedimentos naturales antes de su empleo en el laboratorio. En el apéndice 4 se describen la preparación y la conservación del sedimento artificial recomendado para utilizarse en el ensayo de Lumbriculus.
|
Aplicación de la sustancia problema
|
28.
|
La sustancia problema debe introducirse en el sedimento. Como se espera que la mayoría de las sustancias problema tengan escasa hidrosolubilidad, con el fin de preparar la solución madre deben disolverse en un volumen lo más pequeño posible de un disolvente orgánico apropiado (por ejemplo, acetona, n-hexano, ciclohexano). La solución madre debe diluirse con el mismo disolvente para preparar las soluciones problema. Los principales criterios para la selección de un agente solubilizante adecuado deben ser la toxicidad y la volatilidad del disolvente, y la solubilidad de la sustancia problema en el disolvente elegido. Para cada nivel de concentración debe utilizarse el mismo volumen de la solución correspondiente. La sustancia problema debe introducirse en el sedimento en bruto para cada nivel de concentración, con el fin de minimizar la variabilidad de su concentración entre las réplicas. Cada una de las soluciones de ensayo se mezcla a continuación con arena de cuarzo, según se describe en el punto 22 (por ejemplo, 10 g de arena de cuarzo por recipiente de ensayo). Para que toda la arena de cuarzo quede sumergida, se considera suficiente un volumen de 0,20-0,25 ml/g de arena. A continuación debe evaporarse el disolvente hasta sequedad. Para reducir al mínimo las pérdidas de sustancia problema por coevaporación (por ejemplo, dependiendo de la presión de vapor de la sustancia), la arena recubierta debe utilizarse inmediatamente después del secado. La arena seca se mezcla con la cantidad adecuada de sedimento artificial del correspondiente nivel de concentración. La cantidad de arena aportada por la mezcla de sustancia problema y arena tiene que tenerse en cuenta a la hora de preparar el sedimento (es decir, el sedimento debe prepararse entonces con menos arena). La ventaja principal de este procedimiento es que prácticamente no se introduce disolvente en el sedimento (7). Como alternativa, por ejemplo en caso de sedimento de campo, es posible añadir la sustancia problema a una porción secada y finamente molida del sedimento como se describe anteriormente en relación con la arena de cuarzo, o mezclando la sustancia problema en el sedimento húmedo por agitación, con evaporación posterior de los eventuales agentes solubilizantes empleados. Debe velarse por que la sustancia problema añadida al sedimento se distribuya de forma total y homogénea por el sedimento. Si es necesario, pueden analizarse submuestras para confirmar las concentraciones objetivo en el sedimento, y para determinar el grado de homogeneidad. También puede ser útil analizar submuestras de las soluciones de ensayo para confirmar las concentraciones objetivo en el sedimento. Dado que se utiliza un disolvente para depositar la sustancia problema sobre la arena de cuarzo, debe emplearse un control del disolvente, que se preparará con la misma cantidad de disolvente que los sedimentos de ensayo. Deben indicase el método utilizado para añadir la sustancia problema (enriquecimiento) y los motivos para la elección de un procedimiento concreto distinto de lo descrito más arriba. El método de enriquecimiento podrá adaptarse a las propiedades fisicoquímicas de la sustancia problema, por ejemplo para evitar pérdidas por volatilización durante la fase de enriquecimiento o de equilibrado. En Environment Canada (1995) se encuentran orientaciones adicionales sobre los procedimientos de enriquecimiento (46).
|
|
29.
|
Una vez que se ha preparado el sedimento enriquecido, que se ha distribuido entre los recipientes de ensayo replicados, y que se ha completado con agua de ensayo, es aconsejable dejar que la sustancia problema se reparta entre el sedimento y la fase acuosa [véanse, p. ej., las referencias (3), (7) y (9)]. Esto debe efectuarse de preferencia en las mismas condiciones de temperatura y aireación utilizadas en el ensayo. El tiempo adecuado para el reparto equilibrado depende de la sustancia y del sedimento, y puede ser del orden de horas o de días, aunque en ciertos casos raros puede llegar a ser de varias semanas (4 o 5 semanas) [véanse, p. ej., las referencias (27) y (47)]. En este ensayo no se espera hasta alcanzar el equilibrio completo, pero se recomienda respetar un período de reparto de 48 horas a 7 días. De esta manera se reducirá al mínimo el tiempo necesario para la degradación de la sustancia problema. En función del objeto del estudio, por ejemplo cuando se van a simular las condiciones ambientales, el sedimento enriquecido podrá equilibrarse o envejecerse durante un plazo más largo.
|
|
30.
|
Al final de este período de equilibrado, hay que tomar muestras al menos del agua sobrenadante y de la masa del sedimento, al menos a la concentración más elevada y a una inferior, para determinar la concentración de la sustancia problema. Estas determinaciones analíticas de la sustancia problema deben permitir el cálculo del balance de masas y la expresión de los resultados sobre la base de las concentraciones iniciales medidas. En general, el muestreo perturba o destruye el sistema sedimento-agua. Por lo tanto, no suele ser posible utilizar las mismas réplicas para la toma de muestras del sedimento y de los gusanos. Hay que preparar recipientes “analíticos” adicionales de dimensiones adecuadas, tratados de la misma manera (incluida la presencia de los organismos de ensayo) pero que no se utilizan para las observaciones biológicas. Las dimensiones del recipiente deben seleccionarse para proporcionar los volúmenes de muestra requeridos por el método analítico. En el punto 53 se recogen datos sobre el muestreo.
|
REALIZACIÓN DEL ENSAYO
Ensayo preliminar
|
31.
|
Cuando no se disponga de información sobre la toxicidad de la sustancia problema para Lumbriculus variegatus, puede ser útil proceder a un experimento preliminar para determinar el intervalo de concentraciones adecuadas para el ensayo definitivo, y para optimizar las condiciones de realización del ensayo definitivo. Con este fin se utiliza una serie de concentraciones de la sustancia problema, muy diferentes entre sí. Los gusanos se exponen a cada concentración de la sustancia problema durante un plazo (por ejemplo, 28 días como en el ensayo definitivo) que permita la estimación de las concentraciones de ensayo adecuadas; no hace falta utilizar réplicas. Debe observarse y registrarse durante el ensayo preliminar el comportamiento de los gusanos, por ejemplo una tendencia a evitar el sedimento, que pueda deberse a la sustancia problema o al sedimento. No deben utilizarse en el ensayo preliminar concentraciones superiores a 1 000 mg/kg de peso seco del sedimento.
|
Ensayo definitivo
|
32.
|
En el ensayo definitivo deben utilizarse al menos cinco concentraciones seleccionadas, por ejemplo, sobre la base del resultado del ensayo preliminar de determinación del intervalo (punto 31), según se describe en los puntos 35, 36, 37 y 38.
|
|
33.
|
Además de la serie de ensayo se prepara un control (sobre las réplicas, véanse los puntos 36, 37 y 38) con todos los componentes salvo la sustancia problema. Si se utiliza algún agente solubilizante para la aplicación de la sustancia problema, no debe tener ningún efecto significativo sobre los organismos de ensayo, lo cual ha de demostrarse mediante un control adicional que solo contenga disolvente.
|
Diseño del ensayo
|
34.
|
El diseño del ensayo se refiere a la selección del número de concentraciones de ensayo y al intervalo entre las mismas, al número de recipientes por concentración y al número de gusanos añadidos a cada recipiente. Los diseños para la estimación de ECx, para la estimación de la NOEC, y para realizar un ensayo límite se describen en los puntos 35, 36, 37 y 38.
|
|
35.
|
La concentración con efecto (por ejemplo, EC50 EC25, EC10) y el rango de concentraciones a las que resulta interesante el efecto de la sustancia problema tienen que estar abarcados entre las concentraciones incluidas en el ensayo. Debe evitarse extrapolar muy por debajo de la concentración mínima que afecta a los organismos de ensayo o por encima de la mayor concentración estudiada. Si —en casos excepcionales— se lleva a cabo tal extrapolación, es preciso dar una explicación completa en el informe.
|
|
36.
|
Si ha de estimarse la ECx, deben someterse a ensayo al menos cinco concentraciones y un mínimo de tres réplicas por cada concentración; se recomienda utilizar seis réplicas para el control o —en caso de que se utilice— para el control del disolvente, a fin de mejorar la estimación de la variabilidad del control. En cualquier caso, es recomendable utilizar suficientes concentraciones de ensayo para poder hacer una buena estimación del modelo. El factor entre concentraciones no debe ser mayor de dos (puede permitirse una excepción en los casos en que la pendiente de la curva dosis-respuesta sea poco pronunciada). El número de réplicas de cada tratamiento puede reducirse si aumenta el número de concentraciones de ensayo con respuestas en el intervalo del 5–95 %. El aumento del número de réplicas o la reducción del tamaño del intervalo entre concentraciones de ensayo tiende a estrechar los intervalos de confianza del ensayo.
|
|
37.
|
Si hay que estimar los valores de LOEC/NOEC, deben utilizarse al menos cinco concentraciones de ensayo con un mínimo de cuatro réplicas (se recomiendan seis réplicas para el control o —en caso de que se utilice— para el control del disolvente, a fin de mejorar la estimación de la variabilidad del control), y el factor entre concentraciones no debe exceder de dos. En el apéndice 6 figura información sobre la potencia estadística constatada durante los contrastes de hipótesis en el ensayo interlaboratorios del método de ensayo.
|
|
38.
|
Puede llevarse a cabo un ensayo límite (con una sola concentración de ensayo y controles) si no se esperan efectos a concentraciones de hasta 1 000 mg/kg de peso seco de sedimento (p. ej., a partir de datos de un ensayo preliminar de determinación del intervalo), o si el ensayo con una sola concentración es adecuado para confirmar un valor NOEC de interés. En este último caso, debe incluirse en el informe del ensayo una justificación detallada de la selección de la concentración límite. La finalidad del ensayo límite es someter a ensayo una concentración suficientemente elevada como para permitir a los responsables excluir cualquier efecto tóxico de la sustancia problema, y el límite se establece a una concentración que no se espera encontrar en la realidad en ninguna situación. Se recomienda la concentración de 1 000 mg/kg (peso seco). Generalmente hacen falta al menos seis réplicas tanto de las unidades de tratamiento como de las de control. En el apéndice 6 figura información sobre la potencia estadística constatada durante los contrastes de hipótesis en el ensayo interlaboratorios del método de ensayo.
|
Condiciones de exposición
Organismos de ensayo
|
39.
|
La prueba se lleva a cabo con al menos diez gusanos en cada réplica utilizada para la determinación de los parámetros biológicos. Este número de gusanos corresponde aproximadamente a 50-100 mg de biomasa húmeda. Suponiendo un contenido seco del 17,1 % (48), esto resulta aproximadamente en 9-17 mg de biomasa seca por recipiente. La EPA estadounidense (2000 (7)) recomienda utilizar una tasa de carga inferior o igual a 1:50 (biomasa seca: COT). Para el sedimento artificial descrito en el punto 22, esto representa aproximadamente 43 g de sedimento (peso seco) por diez gusanos con un contenido de carbono orgánico total (COT) de un 2,0 % de sedimento seco. En los casos en que se utilicen más de diez gusanos por recipiente, el importe del sedimento y del agua sobrenadante debe ajustarse en consecuencia.
|
|
40.
|
Todos los gusanos empleados en un ensayo deben proceder de la misma fuente, y su estado fisiológico debe ser similar (véase el apéndice 5). Deben seleccionarse gusanos de tamaño similar (véase el punto 39). Se recomienda pesar una submuestra del lote o población de gusanos antes del ensayo, para calcular el peso medio.
|
|
41.
|
Se toman del cultivo los gusanos que se vayan a utilizar en un ensayo (véanse más detalles en el anexo 5). Se toman animales grandes (adultos) que no muestren signos de fragmentación reciente y se transfieren a placas de vidrio (p. ej., placas Petri) que contengan agua limpia. A continuación se sincronizan según el método descrito en el apéndice 5. Después de la regeneración durante un período de 10 a 14 días, deben utilizarse para el ensayo gusanos completos de tamaño similar, que naden o se arrastren activamente tras un suave estímulo mecánico. Si las condiciones de ensayo son diferentes de las condiciones de cultivo (por ejemplo, en cuanto a la temperatura, régimen de luz y agua sobrenadante), una fase de aclimatación de 24 h a la temperatura, régimen de luz, y con la misma agua sobrenadante que en el ensayo debe ser suficiente para que los gusanos se adapten a las condiciones de ensayo. Los oligoquetos adaptados deben asignarse aleatoriamente a los recipientes de ensayo.
|
Alimentación
|
42.
|
Dado que se añade alimento al sedimento antes de la aplicación de la sustancia problema (o durante la misma), los gusanos no reciben alimentación adicional durante el ensayo.
|
Luz y temperatura
|
43.
|
El fotoperíodo en el cultivo y el ensayo suele ser de 16 horas (3), (7). La intensidad luminosa debe mantenerse baja (por ejemplo, de 100 a 500 lx) para imitar las condiciones naturales en la superficie del sedimento, y se mide al menos una vez durante el período de exposición. La temperatura debe ser de 20 °C ± 2 °C en toda la duración del ensayo. En una determinada fecha de medición, la diferencia de temperatura entre los recipientes de ensayo no debe ser superior a ± 1 °C. Los recipientes de ensayo deben colocarse en la incubadora de ensayo o en la zona de ensayo de forma aleatoria, por ejemplo con el fin de minimizar los sesgos de reproducción debido a la ubicación del recipiente.
|
Aireación
|
44.
|
El agua sobrenadante de los recipientes de ensayo debe airearse suavemente (por ejemplo, 2 - 4 burbujas por segundo) mediante una pipeta Pasteur situada aprox. 2 cm por encima de la superficie del sedimento, con el fin de reducir al mínimo la perturbación de este. Se debe procurar que la concentración de oxígeno disuelto no caiga por debajo del 30 % del valor de saturación de aire). El suministro de aire debe medirse y, si fuera necesario, ajustarse al menos una vez al día durante los días laborables.
|
Medición de la calidad del agua
|
45.
|
Deben medirse en el agua sobrenadante los siguientes parámetros de calidad del agua:
|
Temperatura:
|
al menos en un recipiente de ensayo de cada nivel de concentración y en un recipiente de los controles una vez por semana y al inicio y al final del período de exposición; si es posible, la temperatura en el medio ambiente (aire ambiente o baño de agua) podrá registrarse también, por ejemplo a intervalos de una hora;
|
|
Concentración de oxígeno disuelto:
|
al menos en un recipiente de ensayo de cada nivel de concentración y en un recipiente de los controles una vez por semana y al inicio y al final del período de exposición; expresado en mg/l y en % del valor de saturación de aire;
|
|
Suministro de aire:
|
debe medirse por lo menos una vez al día durante los días laborables y, si fuera necesario, ajustarse;
|
|
pH:
|
al menos en un recipiente de ensayo de cada nivel de concentración y en un recipiente de los controles una vez por semana y al inicio y al final del período de exposición;
|
|
Dureza total del agua:
|
al menos en una réplica de los controles y en un recipiente de ensayo del nivel más elevado de concentración al inicio y al final del período de exposición; expresada en mg/l CaCO3;
|
|
Contenido total de amoníaco:
|
al menos en una réplica de los controles y en un recipiente de ensayo de cada nivel de concentración al inicio del período de exposición y, posteriormente, 3 veces por semana; expresado en mg/l NH4
+ o NH3 o en N amoniacal total.
|
Si la medición de los parámetros de calidad del agua exige la extracción de muestras significativas de agua de los recipientes, puede ser aconsejable establecer recipientes aparte para las mediciones de la calidad del agua, a fin de no alterar la relación agua-sedimento en volumen.
|
Observaciones biológicas
|
46.
|
Durante la exposición, hay que observar los recipientes de ensayo a fin de comprobar visualmente las eventuales diferencias de comportamiento de los gusanos (por ejemplo, tendencia a evitar el sedimento, deyecciones visibles en la superficie del sedimento) en comparación con los controles. Las observaciones se registrarán.
|
|
47.
|
Al final del ensayo se examina cada réplica (pueden excluirse del examen los recipientes adicionales reservados para los análisis químicos). Debe utilizarse un método conveniente para recuperar la totalidad de los gusanos del recipiente de ensayo. Debe tenerse cuidado para recuperar todos los gusanos sin lesionarlos. Un método posible es el tamizado de los gusanos a partir del sedimento. Puede utilizarse una malla de acero inoxidable de una luz adecuada. Se decanta con cuidado la mayor parte del agua sobrenadante, y el agua restante se agita con el sedimento para producir un lodo, que puede pasarse a través del tamiz. Con una luz de 500 μm, la mayoría de las partículas del sedimento pasará el tamiz con gran rapidez; sin embargo, el cribado debe hacerse con rapidez, a fin de impedir que los gusanos se arrastren al interior o a través de la luz. Con una luz de 250 μm se impedirá a los gusanos arrastrarse al interior o a través de la luz; no obstante, se debe tener cuidado para que quede retenida en el tamiz la menor cantidad posible de partículas del sedimento. El lodo tamizado de cada uno de los recipientes replicados puede pasarse por el tamiz una segunda vez a fin de garantizar que se recuperan todos los gusanos. Un método alternativo podría ser el calentamiento del sedimento colocando los recipientes de ensayo en un baño de agua a 50-60 °C; los gusanos saldrán del sedimento, y podrán recogerse de su superficie mediante el uso de una pipeta de boca ancha pulida al fuego. Otro método alternativo podría consistir en obtener un lodo del sedimento y verterlo en una bandeja poco profunda de tamaño adecuado. A partir de la capa somera de lodo, es posible recoger los gusanos con una aguja de acero o unas pinzas de relojero (que deben utilizarse más bien como horquilla que como pinzas, para evitar dañar a los gusanos) y transferirlos a agua limpia. Después de extraer los gusanos del lodo de sedimento, se lavan en el medio de ensayo y se cuentan.
|
|
48.
|
Con independencia del método utilizado, los laboratorios deben demostrar que su personal es capaz de recuperar una media del 90 % como mínimo de los organismos del conjunto del sedimento. Por ejemplo, podría añadirse al sedimento de los controles o al sedimento de ensayo un cierto número de organismos de ensayo, y determinarse la recuperación después de 1 h (7).
|
|
49.
|
Debe registrarse y evaluarse el número total de ejemplares vivos y muertos por réplica. Se consideran muertos los gusanos que pertenecen a los siguientes grupos:
|
a)
|
no presentan ninguna reacción después de un suave estímulo mecánico;
|
|
b)
|
presentan signos de descomposición [en combinación con la letra a)];
|
|
c)
|
falta cierto número de gusanos.
|
Por otra parte, los gusanos vivos pueden asignarse a uno de los tres grupos siguientes:
|
a)
|
gusanos completos grandes (adultos) sin regiones corporales regeneradas;
|
|
b)
|
gusanos completos con regiones corporales regeneradas, de color más claro (es decir, con la parte posterior nueva, con la parte anterior nueva, o con las partes anterior y posterior nuevas);
|
|
c)
|
gusanos incompletos (es decir, gusanos fragmentados recientemente con regiones corporales no regeneradas).
|
Estas observaciones adicionales no son obligatorias, pero pueden usarse para mejorar la interpretación de los resultados biológicos [por ejemplo, un alto número de gusanos asignados al grupo c) puede indicar un retraso de la reproducción o de la regeneración en un determinado tratamiento]. Además, debe registrarse si se observa alguna diferencia de aspecto (por ejemplo, lesiones en el tegumento, secciones corporales edematosas) entre los gusanos tratados y los de control.
|
|
50.
|
Inmediatamente después del recuento o evaluación, los gusanos vivos encontrados en cada réplica se transfieren a platillos de balanza secos, previamente tarados y etiquetados (un platillo por réplica), y se matan poniendo una gota de etanol por platillo. Los platillos de balanza se colocan en una estufa a 100 ± 5 °C y se dejan secar durante una noche, tras lo cual se pesan, después de enfriarse en un desecador, y se determina el peso seco de los gusanos (de preferencia en g, con una precisión de al menos cuatro decimales).
|
|
51.
|
Además del peso seco total, puede determinarse el peso seco sin cenizas, como se describe en (49), para tener en cuenta los componentes inorgánicos procedentes del sedimento ingerido presente en el aparato digestivo de los gusanos.
|
|
52.
|
La biomasa se determina como biomasa total por réplica, incluidas los gusanos adultos y jóvenes. Los gusanos muertos no deben tenerse en cuenta para la determinación de la biomasa por réplica.
|
Verificación de las concentraciones de la sustancia problema
Muestreo
|
53.
|
Las muestras para el análisis químico de la sustancia problema deben tomarse al menos a la concentración más elevada y a una inferior, al menos al final de la fase de equilibrado (antes de añadir los organismos de ensayo) y al final del ensayo. Deben muestrearse para el análisis al menos el sedimento en bruto y el agua sobrenadante. Deben tomarse al menos dos muestras por matriz y tratamiento, en cada fecha de muestreo. Una de las dos muestras duplicadas puede almacenarse como reserva (para analizarse, por ejemplo, en el caso de que los análisis iniciales se sitúen fuera del intervalo del ± 20 % de la concentración nominal). En caso de propiedades químicas específicas, por ejemplo si se espera una rápida degradación de la sustancia problema, se podrá modificar el calendario de los análisis (por ejemplo, tomar muestras con mayor frecuencia, analizar más niveles de concentración) sobre la base de un juicio experto. En tal caso podrán tomarse muestras en fechas de muestreo intermedias (por ejemplo, el día 7 tras el inicio de la exposición).
|
|
54.
|
Deben tomarse muestras del agua sobrenadante, decantándola con cuidado o haciendo sifón, con objeto de reducir al mínimo la perturbación del sedimento. Debe señalarse el volumen de las muestras.
|
|
55.
|
Después de que se haya retirado el agua sobrenadante, el sedimento debe homogeneizarse y transferirse a un recipiente adecuado. Se registra el peso de la muestra de sedimento húmedo.
|
|
56.
|
Si se requiere además el análisis de la sustancia problema en el agua intersticial, las muestras de sedimento homogeneizadas y pesadas deben centrifugarse para obtener el agua intersticial. Por ejemplo, aproximadamente 200 ml del sedimento húmedo pueden cargarse en vasos de centrífuga de 250 ml. A continuación se centrifugan las muestras sin filtrar para aislar el agua intersticial, por ejemplo a 10 000 ± 600 × g durante 30 a 60 minutos a una temperatura no superior a la temperatura utilizada en el ensayo. Después de centrifugar, se decanta o se pipetea el sobrenadante, teniendo cuidado de no introducir partículas del sedimento, y se registra el volumen. Se registra el peso del precipitado de sedimento restante. Así se puede facilitar la estimación del balance de masas o la recuperación de la sustancia problema en el sistema agua-sedimento, si se determina en cada fecha de muestreo el peso del sedimento seco. En algunos casos puede resultar imposible analizar las concentraciones en el agua intersticial debido a que el tamaño de la muestra es demasiado pequeño.
|
|
57.
|
A falta de su análisis inmediato, todas las muestras deben conservarse siguiendo un método adecuado como, p. ej., en las condiciones de almacenamiento recomendadas para una degradación mínima de la sustancia problema particular (por ejemplo, las muestras tomadas del medio ambiente suelen conservarse a – 18 °C en la oscuridad). Antes de empezar el estudio ha de obtenerse información sobre las condiciones adecuadas de almacenamiento de la sustancia problema particular (por ejemplo, la duración y la temperatura del almacenamiento, los procedimientos de extracción, etc.).
|
Métodos analíticos
|
58.
|
Como la totalidad del procedimiento se rige principalmente por la exactitud, la precisión y la sensibilidad del método analítico utilizado para la sustancia problema, es necesario controlar experimentalmente que la precisión y la reproducibilidad del análisis químico, así como la recuperación de la sustancia problema de las muestras tanto de agua como de sedimento, son satisfactorias para el método particular, al menos a los niveles de concentración de ensayo más elevado y más bajo. Ha de comprobarse también que la sustancia problema no es detectable en las cámaras de control a concentraciones superiores al límite de cuantificación. En caso necesario, hay que corregir las concentraciones nominales para tener en cuenta las recuperaciones de la sustancia introducida en recipientes de control de calidad (por ejemplo, cuando la recuperación esté fuera del 80 - 120 % de la cantidad introducida). Todas las muestras deben manipularse a lo largo de todo el ensayo de manera que se minimicen la contaminación y las pérdidas (por ejemplo, derivadas de la adsorción de la sustancia problema al dispositivo de muestreo).
|
|
59.
|
Deben registrarse y consignarse en el informe la recuperación de la sustancia problema, el límite de cuantificación y el límite de detección en el sedimento y en el agua.
|
DATOS E INFORME
Tratamiento de los resultados
|
60.
|
Las principales variables de respuesta obligatorias del ensayo que han de evaluarse estadísticamente son la biomasa y el número total de gusanos por réplica. Con carácter facultativo, también pueden evaluarse la reproducción (como aumento del número de gusanos) y el crecimiento (como incremento de la biomasa seca). En este caso, debe obtenerse una estimación del peso seco de los gusanos al comienzo de la exposición mediante, por ejemplo, la medición del peso seco de una submuestra representativa del lote de gusanos sincronizados que se vaya a utilizar en el ensayo.
|
|
61.
|
Aunque la mortalidad no es un parámetro de este ensayo, debe evaluarse en la medida de lo posible. Con el fin de estimar la mortalidad, se consideran muertos los gusanos que no responden a un suave estímulo mecánico o que muestran signos de descomposición, así como los gusanos que falten. La mortalidad debe al menos registrarse y tenerse en cuenta en la interpretación de los resultados del ensayo.
|
|
62.
|
Las concentraciones con efecto deben expresarse en mg/kg de peso seco del sedimento. Si la recuperación de la sustancia problema medida en el sedimento, o en el sedimento y el agua sobrenadante al comienzo de la exposición, se sitúa entre el 80 y el 120 % de las concentraciones nominales, las concentraciones con efecto (ECx, NOEC, LOEC) podrán expresarse sobre la base de las concentraciones nominales. Si la recuperación se aparta de las concentraciones nominales en más del ± 20 % de las concentraciones nominales, las concentraciones con efecto (ECx, NOEC, LOEC) deberán basarse en las concentraciones medidas al inicio de la exposición, por ejemplo teniendo en cuenta el balance de masas de la sustancia problema en el sistema de ensayo (véase el punto 30). En estos casos, puede obtenerse información adicional del análisis de las soluciones madre o de aplicación con el fin de confirmar que los sedimentos de ensayo se han preparado correctamente.
|
ECx
|
63.
|
Los valores de ECx para los parámetros descritos en el punto 60 se calculan utilizando métodos estadísticos apropiados (por ejemplo, análisis de probit, función logística o de Weibull, método de Spearman-Karber recortado o interpolación simple). En las referencias (15) y (50) se dan orientaciones sobre la evaluación estadística. Se obtiene una ECx insertando en la ecuación encontrada un valor correspondiente al x % de la media del control. Para calcular la EC50 o alguna otra ECx, las medias por tratamiento (

) deben someterse a análisis de regresión. |
NOEC/LOEC
|
64.
|
Cuando se pretende determinar la NOEC/NOEL mediante análisis estadístico, es necesario disponer de estadísticas por recipiente (se considera que cada uno de los recipientes es una réplica). Se deben utilizar métodos estadísticos apropiados. En general, los efectos adversos de la sustancia problema en comparación con el control se investigan utilizando contrastes de hipótesis unilaterales (más pequeños) a p ≤ 0,05. En los puntos siguientes se presentan ejemplos. En las referencias (15) y (50) se dan orientaciones sobre la selección de métodos estadísticos adecuados.
|
|
65.
|
La distribución normal de los datos puede comprobarse, por ejemplo, con la prueba de la bondad del ajuste de Kolmogorov-Smirnov, la prueba de la relación del intervalo a la desviación típica (prueba R/s), o la prueba de Shapiro-Wilk) (bilateral, p ≤ 0,05). Para comprobar la homogeneidad de la varianza pueden utilizarse las pruebas de Cochran, de Levene o de Bartlett (bilateral, p ≤ 0,05). Si se cumplen los requisitos previos de los procedimientos de ensayos paramétricos (normalidad, homogeneidad de la varianza) puede efectuarse un análisis de la varianza (ANOVA) de un factor, seguido de pruebas de comparación múltiple. Las comparaciones de pares (p. ej., prueba t de Dunnett) o las pruebas de tendencia de ajuste secuencial (p. ej., prueba de Williams) pueden utilizarse para determinar si existen diferencias significativas (p ≤ 0,05) entre los controles y las distintas concentraciones de la sustancia problema. De lo contrario, para determinar la LOEC y la NOEC deben utilizarse métodos no paramétricos (p. ej., prueba U de Bonferroni según Holm o prueba de tendencia de Jonckheere-Terpstra).
|
Ensayo límite
|
66.
|
Si se realiza un ensayo límite (comparación del control y de un solo tratamiento) y se cumplen los requisitos previos de procedimientos de ensayos paramétricos (normalidad, homogeneidad), pueden evaluarse las respuestas métricas (número total de gusanos, y biomasa como peso seco de gusanos) con la prueba de Student (prueba t). Si estos requisitos no se satisfacen, puede utilizarse la prueba t de varianzas desiguales (prueba t de Welch) o una prueba no paramétrica, tal como la prueba U de Mann-Whitney. En el apéndice 6 figura información sobre la potencia estadística constatada durante los contrastes de hipótesis en el ensayo interlaboratorios del método.
|
|
67.
|
Para determinar la existencia de diferencias significativas entre los controles (control y control del disolvente), las réplicas de cada control pueden someterse a ensayo según lo descrito para el ensayo límite. En caso de que tales ensayos no detecten diferencias significativas, pueden agruparse todas las réplicas de control y de control del disolvente. En caso contrario, todos los tratamientos deben compararse con el control del disolvente.
|
Interpretación de los resultados
|
68.
|
Los resultados se interpretarán con precaución si ha habido alguna desviación respecto al presente método de ensayo y cuando las concentraciones medidas de las soluciones de ensayo se encuentren a niveles cercanos al límite de detección del método analítico utilizado. Deberán indicarse las eventuales desviaciones respecto al presente método de ensayo.
|
Informe del ensayo
|
69.
|
El informe del ensayo debe recoger, como mínimo, la siguiente información:
|
—
|
Sustancia problema:
|
—
|
datos de identificación de la sustancia (nombre común, nombre químico, fórmula estructural, número CAS, etc.), incluida la pureza y el método de análisis cuantitativo de la sustancia problema; fuente de la sustancia problema, identidad y concentración de los eventuales disolventes utilizados;
|
|
—
|
cualquier información disponible sobre la naturaleza física y propiedades fisicoquímicas obtenida antes del inicio del ensayo [por ejemplo, hidrosolubilidad, presión de vapor, coeficiente de reparto en el suelo (o en el sedimento, si se conoce), log Kow, estabilidad en el agua, etc.];
|
|
|
—
|
Especie de ensayo:
|
—
|
denominación científica, fuente, eventuales tratamientos previos, aclimatación, condiciones de cultivo, etc.;
|
|
|
—
|
Condiciones del ensayo:
|
—
|
procedimiento de ensayo aplicado (p. ej., estático, semiestático o dinámico);
|
|
—
|
diseño del ensayo (p. ej., número, material y tamaño de las cámaras de ensayo, volumen de agua por recipiente, masa y volumen del sedimento por recipiente, (en caso de procedimiento dinámico o semiestático: tasa de renovación del volumen de agua), eventual aireación antes del ensayo y durante el mismo, número de réplicas, número de gusanos por réplica al inicio de la exposición, número de concentraciones de ensayo, duración de los períodos de acondicionamiento, de equilibrado y de exposición, frecuencia del muestreo);
|
|
—
|
altura del sedimento y del agua sobrenadante;
|
|
—
|
método de pretratamiento y de enriquecimiento o aplicación de la sustancia problema;
|
|
—
|
concentraciones nominales de ensayo, información detallada sobre el muestreo para el análisis químico, y métodos analíticos con los que se han determinado las concentraciones de la sustancia problema;
|
|
—
|
características de los sedimentos según se describen en los puntos 24-25, y las demás medidas eventualmente realizadas; preparación del sedimento artificial;
|
|
—
|
preparación del agua de ensayo (si se utiliza agua reconstituida) y características (concentración de oxígeno, pH, conductividad, dureza, y cualquier otra medición realizada) antes del inicio del ensayo;
|
|
—
|
información detallada sobre la alimentación de los animales, incluidos el tipo de alimento, la preparación, la cantidad y el régimen alimentario;
|
|
—
|
intensidad luminosa y fotoperíodo(s);
|
|
—
|
métodos utilizados para la determinación de todos los parámetros biológicos (p. ej., muestreo, inspección, pesada de los organismos de ensayo) y todos los parámetros abióticos (p. ej., parámetros de calidad del agua y del sedimento);
|
|
—
|
volúmenes o pesos de todas las muestras para el análisis químico;
|
|
—
|
información pormenorizada sobre el tratamiento de todas las muestras para el análisis químico, incluidos datos de la preparación, almacenamiento, métodos de adición de la sustancia problema (enriquecimiento), extracción y procedimientos analíticos (y precisión del análisis) de la sustancia problema, y recuperaciones de la sustancia problema;
|
|
|
—
|
Resultados:
|
—
|
calidad del agua en los recipientes de ensayo (pH, temperatura, concentración de oxígeno disuelto, dureza, concentraciones de amoniaco, y cualquier otra medición realizada);
|
|
—
|
contenido de carbono orgánico total (COT), relación de peso seco a peso húmedo, pH del sedimento, y cualquier otra medición realizada;
|
|
—
|
número total y, si se ha determinado, número de gusanos completos e incompletos en cada cámara de ensayo al final del ensayo;
|
|
—
|
peso seco de los gusanos de cada cámara de ensayo al final del ensayo y, si se mide, peso seco de una submuestra de los gusanos al inicio del ensayo;
|
|
—
|
eventuales comportamientos anormales observados en comparación con los controles (por ejemplo, tendencia a evitar el sedimento, presencia o ausencia de deyecciones);
|
|
—
|
eventual mortalidad observada;
|
|
—
|
estimación de los parámetros de toxicidad (p. ej., ECx, NOEC o LOEC), y métodos estadísticos empleados para su determinación;
|
|
—
|
concentraciones de ensayo nominales, concentraciones de ensayo medidas y resultados de todos los análisis efectuados para determinar la concentración de la sustancia problema en los recipientes de ensayo;
|
|
—
|
eventuales desviaciones respecto de los criterios de validez;
|
|
|
—
|
Evaluación de los resultados:
|
—
|
cumplimiento por los resultados de los criterios de validez recogidos en el punto 13;
|
|
—
|
discusión de los resultados, incluida la influencia que puedan tener sobre ellos las eventuales desviaciones respecto al presente método de ensayo.
|
|
|
BIBLIOGRAFÍA
|
(1)
|
CE (2003). Technical Guidance Document in support of Commission Directive 93/67/EEC on Risk Assessment for new notified substances, Commission Regulation (EC) No 1488/94 on Risk Assessment for existing substances and Directive 98/8/EC of the European Parliament and of the Council concerning the placing of biocidal products on the market; Part I - IV. Oficina de Publicaciones Oficiales de la CE (Comisión Europea), Luxemburgo.
|
|
(2)
|
OCDE (1992a). Report of the OECD workshop on effects assessment of chemicals in sediment. Monografías de la OCDE no 60. Organización para la Cooperación y el Desarrollo Económicos, París.
|
|
(3)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. En: ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(4)
|
ASTM International (2002). Standard Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, E1706-00. En: ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(5)
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. and Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269-279.
|
|
(6)
|
Capítulo C.27 del presente anexo, “Ensayo de toxicidad para quironómidos en sistemas sedimento-agua con sedimento enriquecido”.
|
|
(7)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
(8)
|
Environment Canada (1997). Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius). Biological Test Method. Report SPE 1/RM/32. Diciembre de 1997.
|
|
(9)
|
Hill, I.R., Matthiessen, P., Heimbach, F. (eds), 1993, Guidance document on Sediment Toxicity Tests and Bioassays for freshwater and Marine Environments, From the SETAC-Europe Workshop On Sediment Toxicity Assessment, 8-10 November 1993, Renesse (NL).
|
|
(10)
|
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Editado por M. Streloke y H. Köpp. Berlín 1995.
|
|
(11)
|
Riedhammer C. & B. Schwarz-Schulz (2001). The Newly Proposed EU Risk Assessment Concept for the Sediment Compartment. J. Soils Sediments 1(2), 105-110.
|
|
(12)
|
ASTM International (2004). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing and for selection of samplers used to collect benthic invertebrates. American Society for Testing and Materials, E 1391-03.
|
|
(13)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. En cooperación con R. Nagel y B. Karaoglan. Informe para la Agencia Medioambiental Federal de Alemania (Umweltbundesamt Berlin), R & D No.: 202 67 429.
|
|
(14)
|
OCDE (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
(15)
|
Environment Canada (2003). Guidance Document on Statistical Methods for Environmental Toxicity Tests; fifth draft, marzo de 2003; Report EPS 1/RM/___
|
|
(16)
|
Nikkilä A., Halme A., Kukkonen J.V.K. (2003). Toxicokinetics, toxicity and lethal body residues of two chlorophenols in the oligochaete worm, Lumbriculus variegatus, in different sediments. Chemosphere 51: 35-46.
|
|
(17)
|
Baily H.C., & Liu D.H.W. (1980). Lumbriculus variegatus, a Benthic Oligochaete, as a Bioassay Organism. p. 205-215. En J.C. Eaton, P.R. Parrish, and A.C. Hendricks (eds). Aquatic Toxicology, ASTM STP 707. American Society for Testing and Materials.
|
|
(18)
|
Chapman K. K., Benton M. J., Brinkhurst R. O. & Scheuerman P. R. (1999). Use of the aquatic oligochaetes Lumbriculus variegatus and Tubifex tubifex for assessing the toxicity of copper and cadmium in a spiked-artificial-sediment toxicity test. Environmental Toxicology. 14(2): 271-278.
|
|
(19)
|
Meyer J.S., Boese C.J. & Collyard S.A. (2002). Whole-body accumulation of copper predicts acute toxicity to an aquatic oligochaete (Lumbriculus variegatus) as pH and calcium are varied. Comp. Biochem. Physiol. Part C 133:99-109.
|
|
(20)
|
Schubauer-Berigan M.K., Dierkes J.R., Monson P.D. & Ankley G.T. (1993). pH-dependent toxicity of cadmium, copper, nickel, lead and zinc to Ceriodaphnia dubia, Pimephales promelas, Hyalella azteca and Lumbriculus variegatus. Environ. Toxicol. Chem. 12(7):1261-1266.
|
|
(21)
|
West, C.W., V.R. Mattson, E.N. Leonard, G.L. Phipps & G.T. Ankley (1993). Comparison of the relative sensitivity of three benthic invertebrates to copper-contaminated sediments from the Keweenaw Waterway. Hydrobiol. 262:57-63.
|
|
(22)
|
Ingersoll, C.G., Ankley, G.T., Benoit D.A., Brunson, E.L., Burton, G.A., Dwyer, F.J., Hoke, R.A., Landrum, P. F., Norberg-King, T. J. and Winger, P.V. (1995). Toxicity and bioaccumulation of sediment-associated contaminants using freshwater invertebrates: A review of methods and applications. Environ. Toxicol. Chem. 14, 1885-1894.
|
|
(23)
|
Kukkonen, J. and Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457-1468.
|
|
(24)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998a). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196-2202.
|
|
(25)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998b). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183-194.
|
|
(26)
|
Landrum, P.F., Gedeon, M.L., Burton, G.A., Greenberg. M.S., & Rowland, C.D. (2002). Biological Responses of Lumbriculus variegatus Exposed to Fluoranthene-Spiked Sediment. Arch. Environ. Contam. Toxicol. 42: 292-302.
|
|
(27)
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191-201.
|
|
(28)
|
Ingersoll, C.G., Brunson, E.L., Wang N., Dwyer, F.J., Ankley, G.T., Mount D.R., Huckins J., Petty. J. and Landrum, P. F. (2003). Uptake and depuration of non-ionic organic contaminants from sediment by the oligochaete, Lumbriculus variegatus. Environmental Toxicology and Chemistry 22, 872-885.
|
|
(29)
|
Rodríguez, P. & Reynoldson, T.B. (1999). Laboratory methods and criteria for sediment bioassessment. En: A. Mudroch, J.M. Azcue & P. Mudroch (eds.): Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
|
|
(30)
|
Liebig, M., Egeler, Ph. Oehlmann, J., & Knacker, Th. (2005). Bioaccumulation of 14C-17α-ethinylestradiol by the oligochaete Lumbriculus variegatus in artificial sediment. Chemosphere 59, 271-280.
|
|
(31)
|
Brust, K., O. Licht, V. Hultsch, D. Jungmann & R. Nagel (2001). Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Environ. Toxicol. Chemistry, Vol. 20, pp. 2000–2007.
|
|
(32)
|
Oetken, M., K.-U. Ludwichowski & R. Nagel (2000). Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG-AltstoffV. By order of the Federal Environmental Agency (Umweltbundesamt Berlin), FKZ 360 12 001, March 2000.
|
|
(33)
|
Leppänen M.T. & Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503-1508.
|
|
(34)
|
Dermott R. & Munawar M. (1992). A simple and sensitive assay for evaluation of sediment toxicity using Lumbriculus variegatus (Müller). Hydrobiologia 235/236: 407-414.
|
|
(35)
|
Drewes C.D. & Fourtner C.R. (1990). Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Develop. Biol. 138: 94-103.
|
|
(36)
|
Brinkhurst, R.O. (1971). A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. No. 22.
|
|
(37)
|
Capítulo C.1 del presente anexo: Toxicidad aguda en peces.
|
|
(38)
|
OCDE (1992c). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OCDE, París.
|
|
(39)
|
Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G. & Nagel, R. (1997). Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere 35, 835-852.
|
|
(40)
|
Meller, M., P. Egeler, J. Roembke, H. Schallnass, R. Nagel and B. Streit. (1998). Short-term Toxicity of Lindane, Hexachlorobenzene and Copper Sulphate on Tubificid Sludgeworms (Oligochaeta) in Artificial Media. Ecotox. and Environ. Safety, 39, 10-20.
|
|
(41)
|
Egeler, Ph., Römbke, J., Knacker, Th., Franke, C. & Studinger, G. (1999). Workshop on “Bioaccumulation: Sediment test using benthic oligochaetes”, 26-27.04.1999, Hochheim/Main, Germany. Report on the R+D-project No. 298 67 419, Umweltbundesamt, Berlín.
|
|
(42)
|
Suedel, B.C. and Rodgers, J.H. (1993). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13, 1163-1175.
|
|
(43)
|
Naylor, C. and C. Rodrigues. (1995). Development of a test method for Chironomus riparius using a formulated sediment. Chemosphere 31: 3291-3303.
|
|
(44)
|
Kaster, J.L., Klump, J.V., Meyer, J., Krezoski, J. & Smith, M.E. (1984). Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia 11, 181-184.
|
|
(45)
|
Martínez-Madrid, M., Rodríguez, P., Pérez-Iglesias, J.I. & Navarro, E. (1999). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology 8, 111-124.
|
|
(46)
|
Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
|
|
(47)
|
Landrum, P.F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Technol. 23, 588-595.
|
|
(48)
|
Brooke, L.T., Ankley, G.T., Call, D.J. & Cook, P.M. (1996). Gut content and clearance for three species of freshwater invertebrates. Environ. Toxicol. Chem. 15, 223-228.
|
|
(49)
|
Mount, D.R., Dawson, T.D. & Burkhard, L.P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Environ. Toxicol. Chem. 18, 1244-1249.
|
|
(50)
|
OCDE 2006. Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. OECD Series on Testing and Assessment No. 54, OCDE, París, Francia.
|
|
(51)
|
Liebig M., Meller M. & Egeler P. (2004). Sedimenttoxizitätstests mit aquatischen Oligochaeten — Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Proceedings 5/2004: Statusseminar Sedimentkontakttests. March 24-25, 2004. BfG (Bundesanstalt für Gewässerkunde), Coblenza, Alemania, pp. 107-119.
|
Bibliografía adicional sobre procedimientos estadísticos:
Dunnett, C.W. (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
Dunnett, C.W. (1964). New tables for multiple comparisons with a control. Biometrics 20, 482-491.
Finney, D.J. (1971). Probit Analysis (3rd ed.), pp. 19-76. Cambridge Univ. Press.
Finney, D.J. (1978). Statistical Method in Biological Assay. Charles Griffin & Company Ltd, Londres.
Hamilton, M.A., R.C. Russo and R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714-719; Corrección: Environ. Sci. Technol. 12 (1998), 417.
Holm, S. (1979). A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
Sokal, R.R. and F.J. Rohlf. (1981) Biometry. The principles and practice of statistics in biological research. 2nd edition. W.H. Freeman and Company. Nueva York,
Miller, R.G., Jr. (1986). Beyond ANOVA, basics of applied statistics. John Wiley & Sons. Nueva York,
Shapiro S.S. & Wilk M.B (1965). An analysis of variance test for normality (complete samples). Biometrika 52: 591-611.
Williams, D.A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
Williams, D.A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519 531.
Apéndice 1
Definiciones
A efectos del presente método de ensayo, se aplicarán las siguientes definiciones:
|
|
Sustancia: sustancia o mezcla.
|
|
|
El período de acondicionamiento se utiliza para estabilizar el componente microbiano del sedimento y eliminar, por ejemplo, el amoníaco procedente de los componentes del sedimento; tiene lugar antes del enriquecimiento del sedimento con la sustancia problema. Por lo general, el agua sobrenadante se descarta tras el acondicionamiento.
|
|
|
ECx
: concentración de la sustancia problema en el sedimento que da lugar a un efecto del X % (por ejemplo, del 50 %) en un parámetro biológico dentro del período de exposición establecido.
|
|
|
El período de equilibrado se utiliza para permitir la distribución de la sustancia problema entre la fase sólida, el agua intersticial y el agua sobrenadante; tiene lugar tras el enriquecimiento del sedimento con la sustancia problema y antes de que se añadan los organismos de ensayo.
|
|
|
Fase de exposición: tiempo durante el cual los organismos de ensayo se exponen a la sustancia problema.
|
|
|
Sedimento artificial (o sedimento reconstituido, formulado o sintético): mezcla de materiales empleada para imitar los componentes físicos de un sedimento natural.
|
|
|
Concentración mínima con efecto observado (LOEC): concentración más baja de sustancia problema que se ha empleado en el ensayo con la que se observa un efecto tóxico significativo (a p ≤ 0,05) en comparación con el control. Sin embargo, es necesario también que todas las concentraciones de ensayo superiores a la LOEC ejerzan un efecto superior o igual al que se observa con dicha concentración. Si no se cumplen estas dos condiciones, es preciso dar una explicación completa sobre cómo se ha elegido la LOEC (y, por tanto, la NOEC).
|
|
|
Concentración sin efecto observado (NOEC): concentración de ensayo inmediatamente inferior a la LOEC que, en comparación con el control, no ejerce ningún efecto estadísticamente significativo (p ≤ 0,05) dentro del período de exposición establecido.
|
|
|
Coeficiente de reparto octanol/agua (Kow; expresado a veces como Pow): es la relación entre la solubilidad de una sustancia en n-octanol y en agua, en equilibrio, y representa la lipofilia de la sustancia (capítulo A.24 del presente anexo). Se utiliza Kow (o su logaritmo, log Kow) como indicación del potencial de bioacumulación de una sustancia por los organismos acuáticos.
|
|
|
Coeficiente de reparto carbono orgánico-agua (Koc): relación de la concentración de una sustancia en la fracción de carbono orgánico de un sedimento respecto a su concentración en el agua, en equilibrio.
|
|
|
Agua sobrenadante: agua que cubre el sedimento en el recipiente de ensayo.
|
|
|
Agua intersticial: agua que ocupa el espacio entre las partículas de sedimento o de suelo.
|
|
|
Sedimento enriquecido: sedimento al que se ha añadido sustancia problema.
|
|
|
Sustancia problema: sustancia o mezcla estudiada con este método de ensayo.
|
Apéndice 2
Composición del agua reconstituida recomendada
[tomada del capítulo C.1 del presente anexo (1)]
|
a)
|
Solución de cloruro de calcio
Se disuelven 11,76 g CaCl2 · 2H2O en agua desionizada; se enrasa a 1 l con agua desionizada.
|
|
b)
|
Solución de sulfato de magnesio
Se disuelven 4,93 g MgSO4 · 7H2O en agua desionizada; se enrasa a 1 l con agua desionizada.
|
|
c)
|
Solución de bicarbonato de sodio
Se disuelven 2,59 g NaHCO3 en agua desionizada; se enrasa a 1 l con agua desionizada.
|
|
d)
|
Solución de cloruro de potasio
Se disuelven 0,23 g KCl en agua desionizada; se enrasa a 1 l con agua desionizada.
|
Los productos químicos deben ser de calidad analítica.
La conductividad del agua destilada o desionizada no debe ser mayor de 10 μScm– 1.
Se mezclan 25 ml de cada una de las soluciones a) a d) y el volumen total se lleva a 1 l con agua desionizada. La suma de los iones de calcio y de magnesio en estas soluciones es igual a 2,5 mmol/l.
La relación de los iones Ca:Mg es de 4:1 y la de los iones Na:K, de 10:1. La alcalinidad o capacidad de ácido KS4.3 de esta solución es de 0,8 mmol/l.
Se airea el agua de dilución hasta que se alcance la saturación de oxígeno y, a continuación, se conserva durante unos dos días sin más aireación antes de su utilización.
BIBLIOGRAFÍA
|
(1)
|
Capítulo C.1 del presente anexo: Toxicidad aguda en peces.
|
Apéndice 3
Características FISICOQUÍMICAS DE UN AGUA DE DILUCIÓN ACEPTABLE
|
Componente
|
Concentraciones
|
|
Partículas
|
< 20 mg/l
|
|
Carbono orgánico total
|
< 2 μg/l
|
|
Amoníaco no ionizado
|
< 1 μg/l
|
|
Cloro residual
|
< 10 μg/l
|
|
Plaguicidas organofosforados totales
|
< 50 ng/l
|
|
Plaguicidas organoclorados totales y bifenilos policlorados
|
< 50 ng/l
|
|
Cloro orgánico total
|
< 25 ng/l
|
|
[adoptada de OCDE (1992) (1)]
|
Bibliografía
|
(1)
|
OCDE (1992). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OCDE, París.
|
Apéndice 4
Sedimento artificial recomendado: orientaciones sobre la preparación y el almacenamiento
Componentes del sedimento
|
Componente
|
Características
|
Porcentaje de peso seco de sedimento
|
|
Turba
|
Turba esfágnea, grado de descomposición: “medio”, secada al aire, sin restos vegetales visibles, finamente molida (tamaño de partícula ≤ 0,5 mm)
|
5 ± 0,5
|
|
Arena de cuarzo
|
Granulometría: ≤ 2 mm, pero > 50 % de las partículas deben encontrarse en la banda de 50 - 200 μm
|
75 - 76
|
|
Caolín
|
Contenido en caolinita ≥ 30 %
|
20 ± 1
|
|
Fuente de alimento
|
Por ejemplo, polvo de Urtica (Folia Urticae), hoja de Urtica dioica (ortiga), finamente molida (tamaño de partícula ≤ 0,5 mm); de conformidad con normas farmacéuticas, para consumo humano; además del sedimento seco
|
0,4 - 0,5 %)
|
|
Carbono orgánico
|
Ajustado mediante adición de turba y arena
|
2 ± 0,5
|
|
Carbonato de calcio
|
CaCO3, pulverizado, químicamente puro, además del sedimento seco
|
0,05 - 1
|
|
Agua desionizada
|
Conductividad ≤ 10 μS/cm, además del sedimento seco
|
30 - 50
|
Nota: Si se esperan elevadas concentraciones de amoníaco, por ejemplo si se sabe que la sustancia problema inhibe la nitrificación, puede ser útil sustituir un 50 % del polvo de ortiga, rico en nitrógeno, por celulosa [por ejemplo, α-celulosa en polvo, químicamente pura, tamaño de partícula ≤ 0,5 mm; (1, 2)].
Preparación
La turba se seca al aire y se tritura hasta convertirse en un polvo fino. Se prepara en agua desionizada una suspensión de la cantidad necesaria de polvo de turba, utilizando un dispositivo de homogeneización de prestaciones elevadas. El pH de esta suspensión se ajusta a 5,5 ± 0,5 con CaCO3. La suspensión se deja durante al menos dos días con agitación suave a 20 ± 2 °C, para estabilizar el pH e implantar un componente microbiano estable. Se vuelve a medir el pH, que debe estar a 6,0 ± 0,5. A continuación se mezcla la suspensión de turba con los demás componentes (arena y caolín) y con agua desionizada para obtener un sedimento homogéneo con un contenido de agua del 30–50 % del peso seco del sedimento. Se vuelve a medir el pH de la mezcla final y se ajusta a 6,5-7,5 con CaCO3 en caso necesario. No obstante, si se espera que se produzca amoníaco, puede ser útil mantener el pH del sedimento por debajo de 7,0 (por ejemplo, entre 6,0 y 6,5). Se toman muestras del sedimento para determinar el peso seco y el contenido de carbono orgánico. Si se espera que se produzca amoníaco, el sedimento artificial puede dejarse durante siete días en las mismas condiciones que vayan a darse posteriormente en el ensayo (por ejemplo, relación sedimento-agua de 1:4, altura de la capa de sedimento como en los recipientes de ensayo) antes de enriquecerse con la sustancia problema, es decir, debe cubrirse con agua, que ha de airearse. Al final de este período de acondicionamiento, el agua sobrenadante debe retirarse y eliminarse. A continuación, la arena de cuarzo enriquecida con la sustancia problema se mezcla con el sedimento para cada nivel de tratamiento, el sedimento se reparte en los recipientes de ensayo replicados, y se cubre con el agua de ensayo. Los recipientes se incuban a continuación en las mismas condiciones que vayan a darse posteriormente en el ensayo. Entonces es cuando comienza el período de equilibrado. El agua sobrenadante debe airearse.
La fuente elegida de alimento debe añadirse antes del enriquecimiento del sedimento con la sustancia problema, o durante el mismo. Puede mezclarse con la suspensión de turba al principio (véase más arriba). No obstante, puede evitarse la degradación excesiva de la fuente de alimento antes de añadir los organismos de ensayo —por ejemplo, en caso de que sea largo el período de equilibrado— reduciendo al mínimo el tiempo transcurrido entre la adición de alimento y el inicio de la exposición. Con el fin de garantizar que el alimento está añadido con la sustancia problema, la fuente de alimento debe mezclarse con el sedimento como muy tarde el día en que la sustancia problema se introduce en el sedimento.
Almacenamiento
Los componentes secos del sedimento artificial pueden almacenarse en un lugar fresco y seco, o a temperatura ambiente. El sedimento preparado enriquecido con la sustancia problema debe utilizarse en el ensayo inmediatamente. Hasta el momento de su análisis, es posible conservar, en las condiciones recomendadas para las sustancia problema concreta, muestras del sedimento enriquecido.
BIBLIOGRAFÍA
|
(1)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. En cooperación con R. Nagel y B. Karaoglan. Informe para la Agencia Medioambiental Federal de Alemania (Umweltbundesamt Berlin), R & D No.: 202 67 429.
|
|
(2)
|
Liebig M., Meller M. & Egeler P. (2004). Sedimenttoxizitätstests mit aquatischen Oligochaeten — Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Proceedings 5/2004: Statusseminar Sedimentkontakttests. March 24-25, 2004. BfG (Bundesanstalt für Gewässerkunde), Coblenza, Alemania, pp. 107-119.
|
Apéndice 5
Métodos de cultivo de Lumbriculus variegatus
El organismo Lumbriculus variegatus (Müller), Lumbriculidae, Oligochaeta, es un habitante de los sedimentos de agua dulce, y se utiliza ampliamente en ensayos ecotoxicológicos. Puede cultivarse fácilmente en condiciones de laboratorio. A continuación se recoge una descripción general de los métodos de cultivo.
Métodos de cultivo
Las condiciones de cultivo de Lumbriculus variegatus se detallan en Phipps et al. (1993) (1), Brunson et al. (1998) (2), ASTM (2000) (3), y U.S. EPA (2000) (4). Un breve resumen de estas condiciones figura a continuación. Una importante ventaja de L. variegatus es su rápida reproducción, lo que se traduce en el veloz aumento de la biomasa de las poblaciones cultivadas en laboratorio [por ejemplo, (1), (3), (4), (5)].
Los gusanos pueden someterse a cultivo en acuarios grandes (57-80 l) a 23 °C con un fotoperíodo de 16 horas de luz y 8 horas de oscuridad (100-1 000 lx) utilizando agua natural renovada diariamente (45-50 l por acuario). El sustrato se prepara cortando en tiras servilletas de papel marrón sin blanquear, que pueden mezclarse a continuación con agua de cultivo durante unos segundos, para dar lugar a pequeños fragmentos de sustrato de papel. Este sustrato puede entonces utilizarse directamente en los acuarios de cultivo de Lumbriculus, cubriendo la superficie del fondo del tanque, o conservarse congelado en agua desionizada para su uso posterior. Un sustrato nuevo puesto en el tanque suele durar aproximadamente dos meses.
Cada cultivo de gusanos comienza con 500-1 000 gusanos y se alimenta 3 veces por semana con 10 ml de suspensión que contienen 6 g de comida para cultivo inicial de truchas, en condiciones dinámicas o de renovación. Los cultivos estáticos o semiestáticos deben recibir alimentos a una dosis inferior para evitar el crecimiento de hongos y bacterias.
En estas condiciones, el número de individuos presentes en el cultivo se duplica, por lo general, cada 10 o 14 días.
Otra posibilidad consiste en cultivar Lumbriculus variegatus en un sistema consistente en una capa de arena de cuarzo utilizada para el sedimento artificial (1-2 cm de profundidad) y agua reconstituida. Pueden utilizarse para el cultivo recipientes de vidrio o de acero inoxidable con una altura de 12 a 20 cm. El agua debe airearse suavemente (por ejemplo, 2 burbujas por segundo) mediante una pipeta Pasteur situada a unos 2 cm por encima de la superficie del sedimento. Para evitar la acumulación de, p. ej., amoníaco, el agua sobrenadante debe cambiarse utilizando un sistema dinámico, o bien de forma manual, al menos una vez por semana. Los oligoquetos pueden mantenerse a temperatura ambiente con un fotoperíodo de 16 horas de luz (de intensidad de 100 a 1 000 lx) y 8 horas de oscuridad. En el cultivo semiestático (renovación del agua una vez por semana), los gusanos se alimentan dos veces por semana con TetraMin (p. ej., de 0,6 a 0,8 mg por cm2 de superficie del sedimento), que puede aplicarse en forma de suspensión de 50 mg de TetraMin por ml de agua desionizada.
Pueden retirarse de los cultivos los ejemplares de Lumbriculus variegatus, por ejemplo transfiriendo sustrato con una red de malla fina a otro vaso de precipitados, o tomando solo los organismos con una pipeta de vidrio de boca ancha pulida al fuego (de unos 5 mm de diámetro). Si a ese otro vaso de precipitados se transfiere a la vez sustrato, el vaso de precipitados que contenga sustrato y gusanos se deja una noche en condiciones dinámicas, con lo que se eliminará el sustrato del vaso, mientras que los gusanos se mantendrán en el fondo del recipiente. Estos pueden introducirse en tanques de cultivo recién preparados, o seguir el procedimiento para el ensayo, tal como se indica en las referencias (3) y (4), o a continuación.
Una cuestión que debe considerarse de forma crítica si se utiliza L. variegatus en pruebas con sedimentos es su modo de reproducción [arquitomía o morfalaxis (véase, p. ej., (6)]. Esta reproducción asexual resulta en dos fragmentos, que no se alimentan durante un determinado período de tiempo, hasta que se regenera la cabeza o la cola [por ejemplo, (7), (8)]. Esto significa que en L. variegatus la exposición por ingestión de sedimento contaminado no tiene lugar de forma continua.
Por lo tanto, debe realizarse una sincronización para reducir al mínimo la reproducción y regeneración incontroladas, y la gran variación consiguiente en los resultados de los ensayos. Tal variación puede producirse en los casos en los que determinados individuos, que se han fragmentado y, por lo tanto, no se alimentan durante un cierto tiempo, están menos expuestos a la sustancia problema que otros individuos, que no se fragmentan durante el ensayo (9), (10), (11). Entre 10 y 14 días antes de la fecha de inicio de la exposición, los gusanos deben fragmentarse artificialmente (sincronización). Para esta sincronización deben seleccionarse gusanos grandes (adultos), que de preferencia no muestren signos de morfalaxis reciente. Estos gusanos pueden colocarse en un portaobjetos de vidrio con una gota de agua de cultivo, y diseccionarse por la región mediana del cuerpo con un bisturí. Debe velarse por que los extremos posteriores sean de tamaño similar. Debe dejarse entonces que los extremos posteriores regeneren nuevas cabezas en un recipiente de cultivo que contenga el mismo sustrato utilizado en el cultivo y agua reconstituida, hasta el inicio de la exposición. La regeneración de cabezas nuevas queda de manifiesto cuando los gusanos sincronizados se entierran en el sustrato (la presencia de cabezas regeneradas podrá confirmarse mediante la inspección de una submuestra representativa con un microscopio binocular). Se prevé que los organismos de ensayo se encontrarán después en un estado fisiológico similar. Esto significa que, cuando se produzca durante el ensayo la reproducción por morfalaxis en gusanos sincronizados, se espera que prácticamente todos los animales queden expuestos de la misma forma al sedimento enriquecido. Debe darse alimento a los gusanos sincronizados tan pronto como estos empiecen a enterrarse en el sustrato, o 7 días después de la disección. El régimen de alimentación debe ser comparable al de los cultivos normales, aunque podría ser recomendable alimentar los gusanos sincronizados con la misma fuente de alimento que se vaya a utilizar en el ensayo. Los gusanos deben mantenerse a la temperatura de ensayo, a 20 ± 2 °C. Después de la regeneración deben utilizarse para el ensayo gusanos completos intactos, que naden o se arrastren activamente tras un suave estímulo mecánico. Deben evitarse las lesiones o la autotomía de los gusanos, por ejemplo manipulándolos con pipetas de bordes pulidos al fuego, o palillos dentales de acero inoxidable.
Fuentes de cultivos iniciales de Lumbriculus variegatus [direcciones de los EE.UU. tomadas de (4)]
|
Europa
|
|
ECT Oekotoxikologie GmbH
|
|
Böttgerstr. 2-14
|
|
D-65439 Flörsheim/Main
|
|
Alemania
|
|
|
Bayer Crop Science AG
|
|
Development — Ecotoxicology
|
|
Alfred-Nobel-Str. 50
|
|
D-40789 Monheim
|
|
Alemania
|
|
|
|
|
|
University of Joensuu
|
|
Laboratory of Aquatic Toxicology
|
|
Dept. of Biology
|
|
Yliopistokatu 7, P.O. Box 111
|
|
FIN-80101 Joensuu
|
|
Finlandia
|
|
|
Dresden University of Technology
|
|
Institut für Hydrobiologie
|
|
Fakultät für Forst-, Geo- und Hydrowissenschaften
|
|
Mommsenstr. 13
|
|
D-01062 Dresde
|
|
Alemania
|
|
|
|
|
|
C.N.R.- I.R.S.A.
|
|
Italian National Research Council
|
|
Water Research Institute
|
|
Via Mornera 25
|
|
I-20047 Brugherio MI
|
|
|
|
|
|
|
EE.UU.
|
|
U.S. Environmental Protection Agency
|
|
Mid-Continent Ecological Division
|
|
6201 Congdon Boulevard
|
|
Duluth, MN 55804
|
|
|
Michigan State University
|
|
Department of Fisheries and Wildlife
|
|
No. 13 Natural Resources Building
|
|
East Lansing, MI 48824-1222
|
|
|
|
|
|
U.S. Environmental Protection Agency
|
|
Environmental Monitoring System Laboratory
|
|
26 W. Martin Luther Dr.
|
|
Cincinnati, OH 45244
|
|
|
Wright State University
|
|
Institute for Environmental Quality
|
|
Dayton, OH 45435
|
|
|
|
|
|
Columbia Environmental Research Center
|
|
U.S. Geological Survey
|
|
4200 New Haven Road
|
|
Columbia, MO 65201
|
|
|
Great Lakes Environmental Research
|
|
Laboratory, NOAA
|
|
2205 Commonwealth Boulevard
|
|
Ann Arbor, MI 48105-1593
|
|
BIBLIOGRAFÍA
|
(1)
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. and Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269-279.
|
|
(2)
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191-201.
|
|
(3)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. En: ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(4)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
(5)
|
Kukkonen, J. and Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457-1468.
|
|
(6)
|
Drewes C.D. & Fourtner C.R. (1990). Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Develop. Biol. 138: 94-103.
|
|
(7)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998a). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196-2202.
|
|
(8)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998b). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183-194.
|
|
(9)
|
Brust, K., O. Licht, V. Hultsch, D. Jungmann & R. Nagel (2001). Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Environ. Toxicol. Chemistry, Vol. 20, pp. 2000–2007.
|
|
(10)
|
Oetken, M., K.-U. Ludwichowski & R. Nagel (2000). Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG-AltstoffV. By order of the Federal Environmental Agency (Umweltbundesamt Berlin), FKZ 360 12 001, March 2000.
|
|
(11)
|
Leppänen M.T. & Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503-1508.
|
Apéndice 6
Resumen de los resultados del ensayo interlaboratorios
“Ensayo de toxicidad del sedimento con Lumbriculus variegatus”
Cuadro 1.
Resultado de los distintos ciclos del ensayo interlaboratorios: número medio de los gusanos de los controles y de los controles de disolvente al final del ensayo; SD = desviación típica; CV = coeficiente de variación.
|
|
Número medio de gusanos en los controles
|
SD
|
CV (%)
|
n
|
Número medio de gusanos en los controles de disolvente
|
SD
|
CV (%)
|
n
|
|
|
32,3
|
7,37
|
22,80
|
3
|
39,0
|
3,61
|
9,25
|
3
|
|
|
40,8
|
6,55
|
16,05
|
6
|
36,0
|
5,29
|
14,70
|
3
|
|
|
41,5
|
3,54
|
8,52
|
2
|
38,5
|
7,05
|
18,31
|
4
|
|
|
16,3
|
5,99
|
36,67
|
6
|
30,8
|
6,70
|
21,80
|
4
|
|
|
24,3
|
10,69
|
43,94
|
3
|
26,3
|
3,06
|
11,60
|
3
|
|
|
28,5
|
8,29
|
29,08
|
4
|
30,7
|
1,15
|
3,77
|
3
|
|
|
28,3
|
3,72
|
13,14
|
6
|
28,8
|
2,56
|
8,89
|
6
|
|
|
25,3
|
5,51
|
21,74
|
3
|
27,7
|
1,53
|
5,52
|
3
|
|
|
23,8
|
2,99
|
12,57
|
4
|
21,3
|
1,71
|
8,04
|
4
|
|
|
36,8
|
8,80
|
23,88
|
6
|
35,0
|
4,20
|
11,99
|
6
|
|
|
33,0
|
3,58
|
10,84
|
6
|
33,5
|
1,73
|
5,17
|
4
|
|
|
20,7
|
2,73
|
13,22
|
6
|
15,0
|
6,68
|
44,56
|
4
|
|
|
42,0
|
7,07
|
16,84
|
6
|
43,7
|
0,58
|
1,32
|
3
|
|
|
18,2
|
3,60
|
19,82
|
6
|
21,7
|
4,04
|
18,65
|
3
|
|
|
32,0
|
3,95
|
12,34
|
6
|
31,3
|
4,79
|
15,32
|
4
|
|
Media interlaboratorios
|
29,59
|
|
20,10
|
|
30,61
|
|
13,26
|
|
|
SD
|
8,32
|
|
10,03
|
|
7,57
|
|
10,48
|
|
|
n
|
15
|
|
|
|
15
|
|
|
|
|
mín
|
16,3
|
|
|
|
15,0
|
|
|
|
|
máx
|
42,0
|
|
|
|
43,7
|
|
|
|
|
CV (%)
|
28,1
|
|
|
|
24,7
|
|
|
|
Cuadro 2.
Resultado de los distintos ciclos del ensayo interlaboratorios: peso seco total medio de los gusanos por réplica de los controles y de los controles de disolvente al final del ensayo; SD = desviación típica; CV = coeficiente de variación.
|
|
Peso seco total de los gusanos por réplica (controles)
|
SD
|
CV (%)
|
n
|
Peso seco total de los gusanos por réplica (controles de disolvente)
|
SD
|
CV (%)
|
n
|
|
|
24,72
|
6,31
|
25,51
|
3
|
27,35
|
4,08
|
14,93
|
3
|
|
|
30,17
|
2,04
|
6,75
|
6
|
33,83
|
10,40
|
30,73
|
3
|
|
|
23,65
|
3,61
|
15,25
|
2
|
28,78
|
4,68
|
16,28
|
4
|
|
|
12,92
|
6,83
|
52,91
|
6
|
24,90
|
6,84
|
27,47
|
4
|
|
|
21,31
|
4,17
|
19,57
|
3
|
25,87
|
5,30
|
20,49
|
3
|
|
|
22,99
|
4,86
|
21,16
|
4
|
24,64
|
5,09
|
20,67
|
3
|
|
|
18,91
|
1,91
|
10,09
|
6
|
19,89
|
1,77
|
8,89
|
6
|
|
|
24,13
|
1,63
|
6,75
|
3
|
25,83
|
2,17
|
8,41
|
3
|
|
|
22,15
|
3,18
|
14,34
|
4
|
22,80
|
2,60
|
11,40
|
4
|
|
|
35,20
|
8,12
|
23,07
|
6
|
31,42
|
8,45
|
26,90
|
6
|
|
|
41,28
|
5,79
|
14,02
|
6
|
41,42
|
4,37
|
10,55
|
4
|
|
|
15,17
|
5,78
|
38,09
|
6
|
10,50
|
3,42
|
32,53
|
4
|
|
|
35,69
|
8,55
|
23,94
|
6
|
38,22
|
1,23
|
3,21
|
3
|
|
|
19,57
|
5,21
|
26,65
|
6
|
28,58
|
6,23
|
21,81
|
3
|
|
|
29,40
|
2,16
|
7,34
|
6
|
31,15
|
2,70
|
8,67
|
4
|
|
Media interlaboratorios
|
25,15
|
|
20,36
|
|
27,68
|
|
17,53
|
|
|
SD
|
7,87
|
|
12,56
|
|
7,41
|
|
9,10
|
|
|
n
|
15
|
|
|
|
15
|
|
|
|
|
mín.
|
12,9
|
|
|
|
10,5
|
|
|
|
|
máx.
|
41,3
|
|
|
|
41,4
|
|
|
|
|
CV (%)
|
31,3
|
|
|
|
26,8
|
|
|
|
Cuadro 3.
Toxicidad del PCP: Resumen de los parámetros de la prueba interlaboratorios; medias interlaboratorios de EC50, NOEC y LOEC; SD = desviación típica; CV = coeficiente de variación.
|
Parámetro biológico
|
|
Media interlaboratorios (mg/kg)
|
mín
|
máx
|
Factor interlaboratorios
|
SD
|
CV (%)
|
Media geométr. (mg/kg)
|
|
Número total de gusanos
|
EC50
|
23,0
|
4,0
|
37,9
|
9,4
|
10,7
|
46,3
|
19,9
|
|
NOEC
|
9,9
|
2,1
|
22,7
|
10,7
|
7,2
|
72,3
|
7,6
|
|
LOEC
|
27,9
|
4,7
|
66,7
|
14,2
|
19,4
|
69,4
|
20,9
|
|
DDM (%)
|
22,5
|
7,1
|
39,1
|
|
|
|
|
|
Peso seco total de los gusanos
|
EC50
|
20,4
|
7,3
|
39,9
|
5,5
|
9,1
|
44,5
|
18,2
|
|
NOEC
|
9,3
|
2,1
|
20,0
|
9,4
|
6,6
|
70,4
|
7,4
|
|
LOEC
|
25,7
|
2,1
|
50,0
|
23,5
|
16,8
|
65,5
|
19,4
|
|
DDM (%)
|
24,8
|
10,9
|
44,7
|
|
|
|
|
|
Mortalidad/supervivencia
|
LC50
|
25,3
|
6,5
|
37,2
|
5,7
|
9,4
|
37,4
|
23,1
|
|
NOEC
|
16,5
|
2,1
|
40,0
|
18,8
|
10,3
|
62,4
|
12,8
|
|
LOEC
|
39,1
|
4,7
|
66,7
|
14,2
|
18,1
|
46,2
|
32,6
|
|
Reproducción (aumento del número de gusanos por réplica)
|
EC50
|
20,0
|
6,7
|
28,9
|
4,3
|
7,6
|
37,9
|
18,3
|
|
NOEC
|
7,9
|
2,1
|
20,0
|
9,4
|
5,2
|
66,0
|
6,4
|
|
LOEC
|
22,5
|
2,1
|
50,0
|
23,5
|
15,4
|
68,6
|
16,0
|
|
DDM (%)
|
29,7
|
13,9
|
47,9
|
|
|
|
|
|
Crecimiento (aumento de biomasa por réplica)
|
EC50
|
15,3
|
5,7
|
29,9
|
5,2
|
7,1
|
46,5
|
13,7
|
|
NOEC
|
8,7
|
2,1
|
20,0
|
9,4
|
6,0
|
68,1
|
6,9
|
|
LOEC
|
24,0
|
2,1
|
50,0
|
23,5
|
15,7
|
65,5
|
17,3
|
|
DDM (%)
|
32,2
|
13,6
|
65,2
|
|
|
|
|
|
DDM: diferencia detectable mínima respecto a los valores de control durante los contrastes de hipótesis; se utiliza como medida de la potencia estadística.
|
BIBLIOGRAFÍA
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. En cooperación con R. Nagel y B. Karaoglan. Informe para la Agencia Medioambiental Federal de Alemania (Umweltbundesamt Berlin), R & D No.: 202 67 429.
C.36. ENSAYO DE REPRODUCCIÓN DE UN ÁCARO PREDADOR [HYPOASPIS (GEOLAELAPS) ACULEIFER] EN EL SUELO
INTRODUCCIÓN
|
1.
|
El presente método de ensayo es equivalente a las directrices de ensayo de la OCDE TG 226 (2008). El presente método de ensayo está diseñado para evaluar los efectos de las sustancias del suelo sobre el resultado reproductor de la especie de ácaro del suelo Hypoaspis (Geolaelaps) aculeifer Canestrini (Acari: Laelapidae), permitiendo así la estimación de la inhibición de la tasa específica de crecimiento de la población (1), (2). Por resultado reproductor se entiende aquí el número de juveniles al final del período de ensayo. H. aculeifer representa un nivel trófico adicional al de las especies para las que ya se dispone de métodos de ensayo. Para los fines del presente método de ensayo se considera adecuado un ensayo de reproducción sin discriminación ni cuantificación de las diferentes fases del ciclo reproductivo. Para las sustancias con una situación de exposición distinta de la exposición a través del suelo, podrían ser apropiados otros enfoques (3).
|
|
2.
|
Se considera que Hypoaspis (Geolaelaps) aculeifer es un representante pertinente de la fauna del suelo y de los ácaros predadores en particular. Presenta una distribución universal (5) y puede recogerse y criarse en el laboratorio fácilmente. En el apéndice 7 se recoge un resumen sobre la biología de H. aculeifer. Se dispone de datos previos sobre la ecología de esta especie de ácaros y sobre su utilización en ensayos ecotoxicológicos (4), (5), (6), (7), (8), (9), (10), (11), (12).
|
PRINCIPIO DEL ENSAYO
|
3.
|
Se exponen hembras adultas a un intervalo de concentraciones de la sustancia problema mezclada con un suelo artificial. El ensayo se inicia con 10 hembras adultas por réplica (recipiente). En el ensayo no se introducen machos, ya que la experiencia ha demostrado que las hembras se aparean inmediatamente o poco después de salir de la fase de deutoninfa, si hay machos presentes. Además, la inclusión de los machos prolongaría el ensayo de manera que se haría necesaria una laboriosa discriminación de las fases de desarrollo. Así pues, el apareamiento en sí no forma parte del ensayo. Las hembras se introducen en el ensayo a los 28-35 días del inicio del período de puesta de huevos en el proceso de sincronización (véase el apéndice 4), ya que entonces puede considerarse que las hembras se han apareado y han superado la fase de preoviposición. A 20 °C, el ensayo termina el día 14 después de la introducción de las hembras (día 0), lo que permite que los primeros descendientes de los controles alcancen la fase de deutoninfa (véase el apéndice 4). Para obtener la variable principal medida, se determina el número de juveniles por recipiente de ensayo y, además, el número de hembras supervivientes. El resultado reproductor de los ácaros expuestos a la sustancia problema se compara con el de los controles para determinar la ECx (por ejemplo, EC10, EC50) o la concentración sin efecto observado (NOEC) (véanse las definiciones en el apéndice 1), dependiendo del diseño experimental (véase el punto 29). En el apéndice 8 figura un resumen del programa de ensayo.
|
INFORMACIÓN SOBRE LA SUSTANCIA PROBLEMA
|
4.
|
Es preferible conocer la hidrosolubilidad, el log Kow, el coeficiente de reparto agua/suelo y la presión de vapor de la sustancia problema. Es conveniente disponer de información adicional sobre el destino de la sustancia problema en el suelo, tal como las velocidades de degradación biótica y abiótica.
|
|
5.
|
Este método de ensayo puede utilizarse para sustancias tanto solubles como insolubles en agua. Sin embargo, el modo de aplicación de la sustancia problema variará en consecuencia. El método de ensayo no es aplicable a las sustancias volátiles, es decir, sustancias cuya constante de Henry o cuyo coeficiente de reparto aire/agua sea superior a uno, o sustancias cuya presión de vapor a 25 °C supere los 0,0133 Pa.
|
VALIDEZ DEL ENSAYO
|
6.
|
Para que el resultado de un ensayo se considere válido, deben cumplirse los siguientes criterios en lo tocante a los controles sin tratar:
|
—
|
La mortalidad media de las hembras adultas no debe ser superior al 20 % al final del ensayo;
|
|
—
|
El número medio de juveniles por réplica (con 10 hembras adultas introducidas) debe ser como mínimo de 50 al final del ensayo;
|
|
—
|
El coeficiente de variación calculado para el número de ácaros juveniles por réplica no debe ser superior al 30 % al final del ensayo definitivo.
|
|
SUSTANCIA DE REFERENCIA
|
7.
|
Debe determinarse la ECx y/o la NOEC de una sustancia de referencia para tener garantías de que las condiciones de ensayo del laboratorio son adecuadas y para verificar que la respuesta de los organismos de ensayo no cambia a lo largo del tiempo. El dimetoato (no CAS 60-51-5) es una sustancia de referencia apropiada que ha mostrado que afecta al tamaño de la población (4). El ácido bórico (no CAS 10043-35-3) puede utilizarse como sustancia de referencia alternativa. Con esta sustancia se tiene menos experiencia. Son posibles dos opciones de diseño:
|
—
|
La sustancia de referencia puede someterse a ensayo en paralelo a la determinación de la toxicidad de cada sustancia problema a una sola concentración, de la que se debe haber demostrado previamente, en un estudio de la relación dosis-respuesta, que provoca un efecto de reducción > 50 % de la descendencia. En este caso, el número de réplicas debe ser el mismo que en los controles (véase el punto 29).
|
|
—
|
Como alternativa, la sustancia de referencia se puede someter 1-2 veces al año a un ensayo de determinación de la relación dosis-respuesta. En función del diseño elegido, varían el número de concentraciones y réplicas y el factor de separación (véase el punto 29), pero debería lograrse una respuesta con un efecto de entre el 10 y el 90 % (factor de espaciado de 1,8). La EC50 del dimetoato basada en el número de juveniles debe oscilar entre 3,0 y 7,0 mg de sustancia activa /kg de suelo (peso seco). Sobre la base de los resultados obtenidos con ácido bórico hasta ahora, la EC50 basada en el número de juveniles debe estar en el intervalo comprendido entre 100 y 500 mg/kg de suelo (peso seco).
|
|
DESCRIPCIÓN DEL ENSAYO
Recipientes y equipo del ensayo
|
8.
|
Deben usarse recipientes de ensayo de 3 a 5 cm de diámetro (altura del suelo ≥ 1,5 cm), de vidrio u otro material químicamente inerte y que tengan una tapa que ajuste bien. Se prefieren las tapas de rosca y, en ese caso, los recipientes podrían airearse dos veces por semana. Otra posibilidad consiste en utilizar tapas que permitan el intercambio gaseoso directo entre el sustrato y la atmósfera (por ejemplo, de gasa). Dado que el contenido de humedad debe mantenerse suficientemente alto durante el ensayo, es esencial controlar el peso de cada recipiente experimental durante el ensayo y añadir agua en caso necesario. Esto puede ser especialmente importante en caso de que no se disponga de tapas de rosca. Si se utiliza un recipiente de ensayo no transparente, la tapa debe estar hecha de un material que permita la entrada de luz (por ejemplo, una tapa transparente perforada) y que evite al mismo tiempo que se escapen los ácaros. El tamaño y el tipo de recipiente de ensayo dependen del método de extracción (véanse más detalles en el anexo 5). En el caso de que se aplique directamente al recipiente de ensayo la extracción por calor, puede añadirse un tamiz de fondo de luz de malla adecuada (sellada hasta la extracción), y la profundidad del suelo debe ser suficiente para permitir un gradiente de temperatura y de humedad.
|
|
9.
|
Se precisa el equipo normal de laboratorio y, en particular, el siguiente:
|
—
|
recipientes, preferentemente de vidrio, con tapa de rosca;
|
|
—
|
microscopio estereoscópico;
|
|
—
|
pinceles para transferir los ácaros;
|
|
—
|
balanzas de precisión adecuada;
|
|
—
|
equipo adecuado para el control de la temperatura;
|
|
—
|
equipo adecuado para el control de la humedad del aire (no esencial si los recipientes de exposición tienen tapa);
|
|
—
|
incubadora o pequeña sala de temperatura controlada;
|
|
—
|
equipos de extracción (véase el apéndice 5) (13);
|
|
—
|
panel luminoso superior, con control de la luz;
|
|
—
|
tarros de recogida para los ácaros extraídos.
|
|
Preparación del suelo artificial
|
10.
|
Para este ensayo se utiliza suelo artificial. Este consta de los componentes siguientes (todos los valores en peso seco):
|
—
|
5 % de turba esfágnea, secada al aire y finamente molida (es aceptable un tamaño de partícula de 2 ± 1 mm);
|
|
—
|
20 % de caolín, con un contenido de caolinita preferentemente superior al 30 %;
|
|
—
|
alrededor del 74 % de arena industrial secada al aire (dependiendo de la cantidad necesaria de CaCO3), en su mayor parte en forma de arena fina, con más del 50 % de las partículas de un tamaño entre 50 y 200 μm. La cantidad exacta de arena depende de la cantidad de CaCO3 (véase más abajo), juntas deben constituir el 75 %.
|
|
—
|
< 1,0 % de carbonato de calcio (CaCO3, pulverizado, de pureza analítica) para obtener un pH de 6,0 ± 0,5; la cantidad de carbonato de calcio añadido puede depender principalmente de la calidad o naturaleza de la turba (véase la nota 1).
|
Nota 1: La cantidad necesaria de CaCO3 depende de los componentes del sustrato del suelo y debe determinarse midiendo el pH de submuestras del suelo inmediatamente antes de ensayo (14).
Nota 2: El contenido de turba del suelo artificial se aparta del de otros métodos de ensayo con organismos del suelo, en la mayoría de los cuales se utiliza un 10 % de turba [véase, p. ej., (15)]. Sin embargo, con arreglo a la OEPP (16), un suelo agrícola típico no tiene más de un 5 % de materia orgánica, y la reducción del contenido de turba refleja, pues, la disminución de las posibilidades de sorción de la sustancia problema al carbono orgánico en un suelo natural.
Nota 3: En caso necesario, por ejemplo con fines de ensayo específicos, pueden también servir como sustrato de ensayo o cultivo suelos naturales procedentes de lugares exentos de contaminación. No obstante, si se utiliza suelo natural, este debe caracterizarse al menos por su origen (lugar de recogida), pH, textura (granulometría) y contenido de materia orgánica. Si se dispone de ellos, deben incluirse el tipo y el nombre del suelo con arreglo a la clasificación del suelo, y el suelo ha de estar libre de toda contaminación. En caso de que la sustancia problema sea un metal o un compuesto organo-metálico, debe determinarse también la capacidad de intercambio catiónico (CEC) del suelo natural. Debe prestarse especial atención al cumplimiento de los criterios de validez, ya que no es frecuente disponer de información de base sobre los suelos naturales.
|
|
11.
|
Los componentes secos del suelo se mezclan a fondo (por ejemplo, en un mezclador de laboratorio de gran escala). Para la determinación del pH se utiliza una mezcla de suelo y solución de cloruro de potasio (KCl) 1 M o de cloruro de calcio (CaCl2) 0,01 M en una proporción de 1:5 [véanse la referencia (14) y el apéndice 3]. Si el suelo es más ácido que la banda exigida (véase el punto 10), puede ajustarse añadiendo una cantidad adecuada de CaCO3. Si el suelo es demasiado alcalino, puede ajustarse mediante la adición de más cantidad de la mezcla que incluye los tres primeros componentes descritos en el punto 10, pero excluyendo el CaCO3.
|
|
12.
|
La capacidad máxima de retención de agua del suelo artificial se determina de acuerdo con los procedimientos descritos en el apéndice 2. Entre dos y siete días antes del inicio del ensayo, el suelo artificial seco se prehumedece, añadiéndole una cantidad suficiente de agua destilada o desionizada para obtener aproximadamente la mitad del contenido final de agua, que supone de un 40 a un 60 % de la capacidad máxima de retención de agua. El contenido de humedad se ajusta al 40-60 % de la capacidad máxima de retención de agua mediante la adición de la solución de la sustancia problema y/o añadiendo agua desionizada o destilada (véanse los puntos 16 a 18). Debe obtenerse una estimación general adicional del contenido de humedad del suelo apretando este suavemente con la mano; si el contenido de humedad es correcto, deben aparecer gotitas de agua entre los dedos.
|
|
13.
|
Se determina el contenido de humedad del suelo al inicio y al final del ensayo, secándolo hasta peso constante a 105 °C, de conformidad con la norma ISO 11465 (17), y el pH del suelo de conformidad con el apéndice 3, o la norma ISO 10390 (14). Estas mediciones deben realizarse con muestras adicionales sin ácaros, tanto del suelo de los controles como del suelo de cada concentración de ensayo. El pH del suelo no debe ajustarse cuando se ensayen sustancias ácidas o básicas. El contenido de humedad debe comprobarse a lo largo de todo el ensayo pesando los recipientes de manera periódica (véanse los puntos 20 y 24).
|
Selección y preparación de los animales de ensayo
|
14.
|
La especie usada en el ensayo es Hypoaspis (Geolaelaps) aculeifer (Canestrini, 1883). Para iniciar el ensayo se requieren ácaros hembras adultos, obtenidos a partir de una cohorte sincronizada. Los ácaros deben introducirse a los 7-14 días después de haberse convertido en adultos, a los 28-35 días desde el inicio de la puesta de huevos en la sincronización (véanse el punto 3 y el apéndice 4). Debe indicarse la fuente de los ácaros o el proveedor, así como el mantenimiento del cultivo de laboratorio. Si se mantiene un cultivo de laboratorio, se recomienda confirmar la identidad de la especie al menos una vez al año. En el apéndice 6 se incluye una ficha de identificación.
|
Preparación de las concentraciones de ensayo
|
15.
|
La sustancia problema se mezcla con el suelo. Los disolventes orgánicos utilizados para facilitar el tratamiento del suelo con la sustancia problema deben seleccionarse sobre la base de su baja toxicidad para los ácaros y debe incluirse en el diseño del ensayo un control adecuado de los disolventes (véase el punto 29).
|
Sustancia problema hidrosoluble
|
16.
|
Se prepara una solución de la sustancia problema en agua desionizada en una cantidad suficiente para todas las réplicas de una sola concentración de ensayo. Se recomienda utilizar una cantidad apropiada de agua para conseguir el contenido necesario de humedad, es decir, entre el 40 y el 60 % de la capacidad máxima de retención de agua (véase el punto 12). Cada una de las soluciones de la sustancia problema se mezcla a fondo con un lote de suelo prehumedecido antes de introducirla en el recipiente de ensayo.
|
Sustancia problema no hidrosoluble
|
17.
|
En el caso de las sustancias no hidrosolubles en el agua, pero solubles en disolventes orgánicos, la sustancia problema puede disolverse en el volumen mínimo posible de un vehículo adecuado (por ejemplo, acetona). Solo deben utilizarse disolventes volátiles. Cuando se utilicen tales vehículos, todas las concentraciones de ensayo y el control deben contener la misma cantidad mínima del vehículo. El vehículo se rocía sobre una pequeña cantidad, como, por ejemplo, 10 g de arena de cuarzo fina, o se mezcla con ella. El contenido de arena total del sustrato debe corregirse para tener en cuenta esta cantidad. El vehículo se elimina por evaporación bajo una campana extractora durante al menos una hora. Esta mezcla de arena de cuarzo y sustancia problema se añade al suelo prehumedecido y se mezcla completamente, añadiendo la cantidad adecuada de agua desionizada para obtener la humedad necesaria. La mezcla final se introduce en los recipientes de ensayo. Obsérvese que algunos disolventes pueden ser tóxicos para los ácaros. Se recomienda, por tanto, utilizar un control de agua adicional sin vehículo, si no se conoce la toxicidad del disolvente para los ácaros. Si se demuestra adecuadamente que el disolvente (en las concentraciones que deben aplicarse) no tiene ningún efecto, puede excluirse el control de agua.
|
Sustancia problema poco soluble en agua y en disolventes orgánicos
|
18.
|
En el caso de sustancias poco solubles en agua y en disolventes orgánicos, se mezcla el equivalente de 2,5 g de arena de cuarzo finamente molida por recipiente de ensayo (por ejemplo, 10 g de arena de cuarzo fina para cuatro réplicas) con la cantidad de sustancia problema necesaria para obtener la concentración de ensayo deseada. El contenido de arena total del sustrato debe corregirse para tener en cuenta esta cantidad. Esta mezcla de arena de cuarzo y sustancia problema se añade al suelo prehumedecido y se mezcla completamente después de añadir la cantidad adecuada de agua desionizada para obtener el contenido necesario de humedad. La mezcla final se divide entre los recipientes de ensayo. Se repite el procedimiento con cada concentración de ensayo, y se prepara asimismo un control adecuado.
|
PROCEDIMIENTO
Grupos de ensayo y controles
|
19.
|
Se recomienda utilizar en cada recipiente de control y de tratamiento diez hembras adultas en 20 g de peso seco de suelo artificial. Los organismos de ensayo deben añadirse en el plazo de dos horas tras la preparación del sustrato de ensayo final (es decir, después de la aplicación de la sustancia problema). En casos específicos (por ejemplo, si el envejecimiento se considera un factor determinante), puede prolongarse el tiempo transcurrido entre la preparación del sustrato de ensayo final y la adición de los ácaros [para más detalles de este envejecimiento, véase (18)]. Sin embargo, en tales casos debe proporcionarse una justificación científica.
|
|
20.
|
Después de añadir los ácaros al suelo, se les aporta alimento y debe medirse el peso inicial de cada recipiente de ensayo, para utilizarlo de referencia en la supervisión del contenido de humedad del suelo a lo largo de todo el ensayo, como se describe en el punto 24. Los recipientes de ensayo se cubren entonces, como se describe en el punto 8, y se colocan en la cámara de ensayo.
|
|
21.
|
Se preparan controles adecuados para cada uno de los métodos de aplicación de la sustancia problema descritos en los puntos 15 a 18. Para preparar los controles se siguen los procedimientos pertinentes descritos, salvo que no se añade la sustancia problema. Por lo tanto, en su caso, se utilizan en los controles disolventes orgánicos, arena de cuarzo u otros vehículos, en concentraciones y cantidades como en los tratamientos. Cuando se utiliza un disolvente u otro vehículo para añadir la sustancia problema, debe prepararse y someterse a ensayo un control adicional sin sustancia problema y sin vehículo en caso de que no se conozca la toxicidad del disolvente (véase el punto 17).
|
Condiciones del ensayo
|
22.
|
La temperatura de ensayo debe ser de 20 ± 2 °C. La temperatura debe registrarse al menos una vez al día y ajustarse cuando sea necesario. El ensayo se efectúa en ciclos controlados de luz y oscuridad (preferentemente 16 horas de luz y 8 horas de oscuridad) con una iluminación de 400 a 800 lux en la zona de los recipientes de ensayo. En aras de la comparabilidad, dichas condiciones son las mismas que en otros ensayos ecotoxicológicos del suelo [p. ej., (15)].
|
|
23.
|
Debe garantizarse el intercambio de gases por aireación de los recipientes de ensayo al menos dos veces por semana en caso de que se utilicen tapas de rosca. Si se utilizan tapas de gasa, deberá prestarse especial atención al mantenimiento del contenido de humedad del suelo (véanse los puntos 8 y 24).
|
|
24.
|
Se controla que el contenido de agua del sustrato del suelo en los recipientes de ensayo se mantenga constante a lo largo de todo el ensayo, pesando periódicamente (p. ej., una vez por semana) los recipientes de ensayo y, en caso necesario, añadiéndoles agua. Las pérdidas se compensan en la medida de lo necesario con agua desionizada. El contenido de humedad durante el ensayo no debe diferir en más de un 10 % del valor inicial.
|
Alimentación
|
25.
|
Se ha comprobado que los ácaros del queso [Tyrophagus putrescentiae (Schrank, 1781)] son una fuente de alimentación adecuada. También pueden ser adecuados los pequeños colémbolos [por ejemplo, juveniles de Folsomia candida (Willem, 1902) o de Onychiurus fimatus (19), (20)], los enquitreidos [por ejemplo, Enchytraeus crypticus (Westheide & Graefe, 1992)] o los nematodos [por ejemplo, Turbatrix silusiae (de Man, 1913)] (21). Se recomienda controlar los alimentos antes de utilizarlos en un ensayo. El tipo y la cantidad de los alimentos deben garantizar un número suficiente de juveniles para cumplir los criterios de validez (punto 6). Para la selección de la presa, debe considerarse el modo de acción de la sustancia problema (por ejemplo, un acaricida puede ser tóxico también para los ácaros de alimento, véase el punto 26).
|
|
26.
|
Los alimentos deben aportarse ad libitum (pero cada vez una pequeña cantidad, como la punta de una espátula). A este fin, también puede utilizarse un extractor de baja succión como se propone en el ensayo con colémbolos o un pincel fino. Normalmente es suficiente aportar alimento al comienzo del ensayo y dos o tres veces por semana. Cuando resulte que la sustancia problema es tóxica para la presa, debe considerarse la posibilidad de aumentar la frecuencia de la alimentación, o de utilizar otra fuente.
|
Selección de las concentraciones de ensayo
|
27.
|
El conocimiento previo de la toxicidad de la sustancia problema debe ayudar a la hora de seleccionar las concentraciones de ensayo apropiadas, por ejemplo gracias a un estudio de determinación del intervalo. Cuando sea necesario, se llevará a cabo un ensayo de determinación del intervalo con cinco concentraciones de la sustancia problema en el intervalo de 0,1-1 000 mg/kg de suelo seco, con al menos una réplica de los tratamientos y del control. La duración de la prueba de determinación del intervalo es de 14 días, tras los cuales se determinan la mortalidad de los ácaros adultos y el número de juveniles. El intervalo de concentraciones para el ensayo final debe elegirse preferentemente de manera que incluya las concentraciones a las que se ve afectado el número de juveniles, pero no la supervivencia de la generación materna. Esto, sin embargo, puede no ser posible para las sustancias que provocan efectos letales y subletales a concentraciones casi similares. La concentración con efecto (por ejemplo, EC50, EC25, EC10) y el rango de concentraciones a las que resulta interesante el efecto de la sustancia problema tienen que estar abarcados entre las concentraciones incluidas en el ensayo. Extrapolar muy por debajo de la menor concentración que afecte a los organismos de ensayo o por encima de la mayor concentración estudiada debe limitarse a casos excepcionales, de los que deberá ofrecerse una explicación completa en el informe.
|
Diseño experimental
Ensayos de relación dosis-respuesta
|
28.
|
Se proponen tres diseños sobre la base de las recomendaciones derivadas de otra prueba interlaboratorios [ensayo de reproducción de enquitreidos (22)]. La conveniencia general de todos estos diseños fue confirmada por el resultado de la validación con H. aculeifer.
|
|
29.
|
Al determinar el intervalo de concentraciones, debe tenerse en cuenta lo siguiente:
|
—
|
para la determinación de una ECx (p. ej., EC10, EC50), deben someterse a ensayo al menos doce concentraciones; se recomienda utilizar al menos dos réplicas de cada concentración de ensayo y seis réplicas de control; el factor de espaciado puede variar, es decir, ser igual o inferior a 1,8 en el intervalo de efecto previsto y superior a 1,8 a concentraciones superiores e inferiores;
|
|
—
|
para la determinación de la NOEC deben someterse a ensayo al menos cinco concentraciones en serie geométrica; se recomienda utilizar cuatro réplicas de cada concentración de ensayo más ocho controles; las concentraciones deben estar espaciadas por un factor que no exceda de 2,0;
|
|
—
|
un enfoque combinado permite la determinación tanto de la NOEC como de la ECx; deben utilizarse ocho concentraciones de tratamiento en progresión geométrica; se recomienda utilizar cuatro réplicas de cada tratamiento más ocho controles; las concentraciones deben estar espaciadas por un factor que no exceda de 1,8.
|
|
Ensayo límite
|
30.
|
Si no se observan efectos a la concentración máxima utilizada en el ensayo de determinación del intervalo (es decir, 1 000 mg/kg de peso seco de suelo), el ensayo definitivo de reproducción se puede realizar como ensayo límite, con una concentración de ensayo de 1 000 mg/kg de peso seco de suelo. El ensayo límite ofrecerá la oportunidad de demostrar que la NOEC o la EC10 para la reproducción es superior a la concentración límite, reduciendo al mínimo el número de ácaros utilizados en el ensayo. Deben utilizarse ocho réplicas tanto para el suelo tratado como para el control.
|
Duración del ensayo y mediciones
|
31.
|
Deben registrarse todas las eventuales diferencias observadas entre el comportamiento y la morfología de los ácaros en los recipientes de control y en los de tratamiento.
|
|
32.
|
El día 14, los ácaros supervivientes se extraen del suelo utilizando calor o luz, u otro método adecuado (véase el apéndice 5). Se cuentan por separado el número de juveniles (es decir, larvas, protoninfas y deutoninfas) y el de adultos. Los eventuales ácaros adultos que no se encuentren en esta fase se registrarán como muertos, suponiendo que tales ácaros han muerto y se han descompuesto antes de la evaluación. La eficacia de la extracción debe validarse una o dos veces al año mediante controles con números conocidos de adultos y de juveniles. La eficacia debe ser superior al 90 % por término medio, combinando todas las fases de desarrollo (véase el apéndice 5). Los recuentos de adultos y de juveniles no se ajustarán para tener en cuenta la eficacia.
|
DATOS E INFORME
Tratamiento de los resultados
|
33.
|
En los puntos 36 a 41 figura información sobre los métodos estadísticos que pueden utilizarse para analizar los resultados del ensayo. Además debe consultarse el documento 54 de la OCDE sobre Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application (31).
|
|
34.
|
El parámetro principal del ensayo es el resultado reproductor, que aquí se refiere al número de juveniles producidos por recipiente de ensayo replicado (con 10 hembras adultas introducidas). El análisis estadístico requiere que se calculen la media aritmética (X) y la varianza (s2) del resultado reproductor por tratamiento y por control. X y s2 se utilizan en procedimientos de análisis de la varianza (ANOVA), tales como la prueba t de Student, el ensayo de Dunnett, o el ensayo de Williams, así como para el cálculo de los intervalos de confianza del 95 %.
Nota: Este parámetro principal es equivalente a la fecundidad medida como número de juveniles vivos producidos durante el ensayo, dividido por el número de madres introducidas al inicio del ensayo.
|
|
35.
|
El número de hembras supervivientes en los controles sin tratar es un importante criterio de validez y ha de documentarse. Como en el ensayo de determinación del intervalo, también deben registrarse en el informe final todos los demás signos de naturaleza nociva.
|
ECx
|
36.
|
Los valores de ECx, junto con sus correspondientes límites de confianza del 95 % inferior y superior para el parámetro descrito en el punto 34, se calculan utilizando métodos estadísticos apropiados (por ejemplo, análisis de probit, función logística o de Weibull, método de Spearman-Karber recortado o interpolación simple). Se obtiene una ECx insertando en la ecuación encontrada un valor correspondiente al x % de la media del control. Para calcular la EC50 o alguna otra ECx, las medias por tratamiento (X) deben someterse a análisis de regresión.
|
NOEC/LOEC
|
37.
|
Cuando se pretenda determinar la NOEC/NOEL mediante análisis estadístico, será necesario disponer de estadísticas por recipiente (se considera que cada uno de los recipientes es una réplica). Se deben utilizar métodos estadísticos apropiados según el documento 54 de la OCDE sobre Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application. En general, los efectos adversos de la sustancia problema en comparación con el control se investigan utilizando contrastes de hipótesis unilaterales (inferiores) a p ≤ 0,05. En los puntos siguientes se presentan ejemplos.
|
|
38.
|
La distribución normal de los datos puede comprobarse, por ejemplo, con la prueba de la bondad del ajuste de Kolmogorov-Smirnov, la prueba de la relación del intervalo a la desviación típica (prueba R/s), o la prueba de Shapiro-Wilk) (bilateral, p ≤ 0,05). Para comprobar la homogeneidad de la varianza pueden utilizarse las pruebas de Cochran, de Levene o de Bartlett (bilateral, p ≤ 0,05). Si se cumplen los requisitos previos de los procedimientos de ensayos paramétricos (normalidad, homogeneidad de la varianza) puede efectuarse un análisis de la varianza (ANOVA) de un factor, seguido de pruebas de comparación múltiple. Las comparaciones múltiples (por ejemplo, prueba t de Dunnett) o las pruebas de tendencia de ajuste secuencial (p. ej., prueba de Williams en el caso de una relación dosis-respuesta monótona) pueden utilizarse para determinar si existen diferencias significativas (p ≤ 0,05) entre los controles y las diversas concentraciones de la sustancia problema (selección del ensayo recomendado de acuerdo con el documento 54 de la OCDE sobre Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application). De lo contrario, para determinar la NOEC y la LOEC deben utilizarse métodos no paramétricos (p. ej., prueba U de Bonferroni según Holm o prueba de tendencia de Jonckheere-Terpstra).
|
Ensayo límite
|
39.
|
Si se realiza un ensayo límite (comparación del control y de un solo un tratamiento) y se cumplen los requisitos previos de procedimientos de ensayos paramétricos (normalidad, homogeneidad), pueden evaluarse las respuestas métricas con la prueba de Student (prueba t). Si estos requisitos no se satisfacen, puede utilizarse la prueba t de varianzas desiguales (prueba t de Welch) o una prueba no paramétrica, tal como la prueba U de Mann-Whitney.
|
|
40.
|
Para determinar la existencia de diferencias significativas entre los controles (control y control del disolvente), las réplicas de cada control pueden someterse a ensayo según lo descrito para el ensayo límite. En caso de que tales ensayos no detecten diferencias significativas, pueden agruparse todas las réplicas de control y de control del disolvente. En caso contrario, todos los tratamientos deben compararse con el control del disolvente.
|
Informe del ensayo
|
41.
|
El informe del ensayo debe incluir al menos la información siguiente:
|
—
|
Sustancia problema
|
—
|
identidad de la sustancia problema, nombre, lote de fabricación, lote de acondicionamiento y número CAS, pureza;
|
|
—
|
propiedades fisicoquímicas de la sustancia problema [por ejemplo, log Kow, hidrosolubilidad, presión de vapor, constante de Henry (H) y de preferencia información sobre el destino de la sustancia problema en el suelo].
|
|
|
—
|
Organismos de ensayo
|
—
|
identificación y proveedor de los organismos de ensayo, descripción de las condiciones de cultivo;
|
|
—
|
intervalo de edad de los organismos de ensayo.
|
|
|
—
|
Condiciones del ensayo
|
—
|
descripción del diseño experimental y del procedimiento;
|
|
—
|
datos de la preparación del suelo para el ensayo; especificación detallada de si se utiliza suelo natural (origen, historia, granulometría, pH, contenido de materia orgánica y, si se dispone de ella, clasificación del suelo);
|
|
—
|
capacidad máxima de retención de agua del suelo;
|
|
—
|
descripción de la técnica utilizada para aplicar la sustancia problema al suelo;
|
|
—
|
datos de las sustancias auxiliares utilizadas para la administración de la sustancia problema;
|
|
—
|
tamaño de los recipientes de ensayo y peso seco de suelo de ensayo por recipiente;
|
|
—
|
condiciones del ensayo: intensidad luminosa, duración de los ciclos de luz y oscuridad, temperatura;
|
|
—
|
descripción del régimen alimentario, tipo y cantidad del alimento utilizado en el ensayo, fechas de alimentación;
|
|
—
|
pH y contenido de agua del suelo al inicio del ensayo y durante el mismo (control y cada tratamiento);
|
|
—
|
descripción detallada del método de extracción y eficacia de la extracción.
|
|
|
—
|
Resultados del ensayo
|
—
|
número de juveniles determinado en cada recipiente de ensayo al final del ensayo;
|
|
—
|
número de hembras adultas y mortalidad de adultos ( %) determinados en cada recipiente de ensayo al final del ensayo;
|
|
—
|
descripción de los síntomas manifiestos o de los cambios claros de comportamiento;
|
|
—
|
resultados obtenidos con la sustancia de referencia;
|
|
—
|
estadísticas resumidas (CEx y/o NOEC) incluidos los límites de confianza del 95 % y descripción del método de cálculo;
|
|
—
|
representación gráfica de la relación concentración-respuesta;
|
|
—
|
eventuales desviaciones respecto a los procedimientos descritos en el presente método de ensayo y cualquier acontecimiento inusual ocurrido en el ensayo.
|
|
|
BIBLIOGRAFÍA
|
(1)
|
Casanueva, M.E. (1993). Phylogenetic studies of the free-living and arthropod associated Laelapidae (Acari: Mesostigmata). Gayana Zool. 57, 21-46.
|
|
(2)
|
Tenorio, J. M. (1982). Hypoaspidinae (Acari: Gamasida: Laelapidae) of the Hawaiian Islands. Pacific Insects 24, 259-274.
|
|
(3)
|
Bakker, F.M., Feije, R., Grove, A. J., Hoogendorn, G., Jacobs, G., Loose, E.D. and van Stratum, P. (2003). A laboratory test protocol to evaluate effects of plant protection products on mortality and reproduction of the predatory mite Hypoaspis aculeifer Canestrini (Acari: Laelapidae) in standard soil. JSS — Journal of Soils and Sediments 3, 73-77.
|
|
(4)
|
Karg, W. (1993). Die freilebenden Gamasina (Gamasides), Raubmilben. Segunda edición en: Dahl, F. (Hrsg.): Die Tierwelt Deutschlands 59. Teil, G. Fischer, Jena, 523 pp.
|
|
(5)
|
Ruf, A. (1991). Do females eat males?: Laboratory studies on the popualation development of Hypoaspis aculeifer (Acari: Parasitiformes). En: F. Dusbabek & V. Bukva (eds.): Modern Acarology. Academia Prague & SPD Academic Publishing bv, The Hague, Vol. 2, 487-492.
|
|
(6)
|
Ruf, A. (1995). Sex ratio and clutch size control in the soil inhabiting predatory mite Hypoaspis aculeifer (Canestrini 1883) (Mesostigmata, Dermanyssidae). Proc. 2nd Symp. EURAAC: p 241-249.
|
|
(7)
|
Ruf, A. (1996). Life-history patterns in soil-inhabiting mesostigmatid mites. Proc. IXth Internat. Congr. Acarol. 1994, Columbus, Ohio: p 621-628.
|
|
(8)
|
Krogh, P.H. and Axelsen, J.A. (1998). Test on the predatory mite Hypoaspis aculeifer preying on the collembolan Folsomia fimetaria. En: Lokke, H. and van Gestel, C.A.M.: Handbook of soil invertebrate toxicity tests. John Wiley Sons, Chichester, p 239-251.
|
|
(9)
|
Løkke, H., Janssen, C.R., Lanno, R.P., Römbke, J., Rundgren, S. and Van Straalen, N.M. (2002). Soil Toxicity Tests — Invertebrates. En: Test Methods to Determine Hazards of Sparingly Soluble Metal Compounds in Soils. Fairbrother, A., Glazebrook, P.W., Van Straalen, N.M. and Tarazona, J.V. (eds.). SETAC Press, Pensacola, USA. 128 pp.
|
|
(10)
|
Schlosser, H.-J. and Riepert, F. (1991/92). Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilben (Gamasina). Teil 1: Biologie der Bodenraubmilbe Hypoaspis aculeifer Canestrini, 1883 (Gamasina) unter Laborbedingungen. Zool. Beiträge, 34, 395-433.
|
|
(11)
|
Schlosser, H.-J. and Riepert, F. (1992). Entwicklung eines Prüfverfahrens für Chemikalien an Boden-raubmilben (Gamasina). Teil 2: Erste Ergebnisse mit Lindan und Kaliumdichromat in subletaler Dosierung. Zool. Beitr. N.F. 34, 413-433.
|
|
(12)
|
Heckmann, L.-H., Maraldo, K. and Krogh, P. H. (2005). Life stage specific impact of dimethoate on the predatory mite Hypoaspis aculeifer Canestrini (Gamasida: Laelapidae). Environmental Science & Technology 39, 7154-7157.
|
|
(13)
|
Petersen, H. (1978). Some properties of two high-gradient extractors for soil microarthropods, and an attempt to evaluate their extraction efficiency. Natura Jutlandica 20, 95-122.
|
|
(14)
|
ISO (Organización Internacional de Normalización) (1994). Calidad del suelo. Determinación del pH, no 10390. ISO, Ginebra.
|
|
(15)
|
Capítulo C.8 del presente anexo. Toxicidad para gusanos de tierra.
|
|
(16)
|
OEPP (2003). EPPO Standards. Environmental risk assessment scheme for plant protection products. Chapter 8. Soil Organisms and Functions. Bull. OEPP/EPPO Bull. 33, 195-209.
|
|
(17)
|
ISO (Organización Internacional de Normalización) (1993). Calidad del suelo. Determinación de la materia seca y del contenido en agua en términos de masa. Método gravimétrico, no 11465. ISO, Ginebra.
|
|
(18)
|
Fairbrother, A., Glazebrock, P.W., Van Straalen, N.M. and Tarazona, J.V. 2002. Test Methods to Determine Hazards of Sparingly Soluble Metal Compounds in Soils. SETAC Press, Pensacola, FL, EE.UU.
|
|
(19)
|
Chi, H. 1981. Die Vermehrungsrate von Hypoaspis aculeifer Canestrini (Acarina, Laelapidae) bei Ernährung mit Onychiurus fimatus Gisin (Collenbola). Ges.allg..angew. Ent. 3:122-125.
|
|
(20)
|
Schlosser, H.J., und Riepert, F. 1992. Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilden (Gamasina). Zool.Beitr. N.F. 34(3):395-433.
|
|
(21)
|
Heckmann, L.-H., Ruf, A., Nienstedt, K. M. and Krogh, P. H. 2007. Reproductive performance of the generalist predator Hypoaspis aculeifer (Acari: Gamasida) when foraging on different invertebrate prey. Applied Soil Ecology 36, 130-135.
|
|
(22)
|
Capítulo C.32 del presente anexo. Ensayo de reproducción de enquitreidos.
|
|
(23)
|
ISO (Organización Internacional de Normalización) (1994). Calidad del suelo: Efectos de los contaminantes sobre las lombrices de tierra (Eisenia fetida). Parte 2: Determinación de los efectos en la reproducción, no 11268-2. ISO, Ginebra.
|
|
(24)
|
Southwood, T.R.E. (1991). Ecological methods. With particular reference to the study of insect populations. (2nd ed.). Chapman & Hall, Londres, 524 pp.
|
|
(25)
|
Dunger, W. and Fiedler, H.J. (1997). Methoden der Bodenbiologie (2nd ed.). G. Fischer, Jena, 539 pp.
|
|
(26)
|
Lesna, I. and Sabelis, M.W. (1999). Diet-dependent female choice for males with “good genes” in a soil predatory mite. Nature 401, 581-583.
|
|
(27)
|
Ruf, A. (1989). Die Bedeutung von Arrhenotokie und Kannibalismus für die Populationsentwicklung von Hypoaspis aculeifer (Canestrini 1883) (Acari, Gamasina). Mitt. Deut. Ges. Allg. Angew. Ent. 7, 103-107.
|
|
(28)
|
Ruf, A. (1993). Die morphologische Variabilität und Fortpflanzungsbiologie der Raubmilbe Hypoaspis aculeifer (Canestrini 1883) (Mesostigmata, Dermanyssidae). Tesis doctoral, Universidad de Bremen.
|
|
(29)
|
Ignatowicz, S. (1974). Observations on the biology and development of Hypoaspis aculeifer Canestrini, 1885 (Acarina, Gamasides). Zoologica Poloniae 24, 11-59.
|
|
(30)
|
Kevan, D.K. McE. and Sharma, G.D. (1964). Observations on the biology of Hypoaspis aculeifer (Canestrini, 1884), apparently new to North America (Acarina: Mesostigmata: Laelaptidae). Acarologia 6, 647-658.
|
|
(31)
|
OCDE (2006c). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD Environmental Health and Safety Publications, Series on Testing and Assessment No. 54. ENV/JM/MONO(2006)18.
|
Apéndice 1
Definiciones
En este método de ensayo se aplican las siguientes definiciones (en este ensayo todas las concentraciones con efecto se expresan en masa de sustancia problema por masa seca del suelo de ensayo):
Sustancia
: sustancia o mezcla.
NOEC (concentración sin efecto observado): concentración de la sustancia problema a la que no se observa ningún efecto. En este ensayo, la concentración correspondiente a la NOEC no ejerce ningún efecto estadísticamente significativo (p < 0,05) dentro de un determinado período de exposición en comparación con el control.
LOEC (concentración mínima con efecto observado): concentración mínima de la sustancia problema que tiene un efecto estadísticamente significativo (p < 0,05) dentro de un determinado período de exposición en comparación con el control.
ECx
(concentración con efecto al x %): concentración que provoca el x % de un efecto sobre los organismos de ensayo dentro de un determinado período de exposición cuando se compara con un control. Por ejemplo, una EC50 es una concentración de la que se estima que causa un efecto sobre un parámetro de un ensayo en el 50 % de una población expuesta a lo largo de un determinado período de exposición.
Sustancia problema
: sustancia o mezcla estudiada con este método de ensayo.
Apéndice 2
Determinación de la capacidad máxima de retención de agua del suelo
Se considera que el siguiente método es adecuado para determinar la capacidad máxima de retención de agua del suelo. Se describe en el anexo C de la norma ISO DIS 11268-2: Calidad del suelo. Efectos de los contaminantes en lombrices (Eisenia fetida). Parte 2: Determinación de los efectos en la reproducción (23).
Se recoge una determinada cantidad (p. ej., 5 g) del sustrato de suelo de ensayo, utilizando un dispositivo adecuado de muestreo (tubo de barrena, etc.). Se cubre el fondo del tubo con un trozo de papel de filtro impregnado de agua y se coloca a continuación en un soporte en un baño de agua. El tubo debe sumergirse gradualmente hasta que el nivel del agua esté por encima del extremo superior del suelo. A continuación, se debe dejar en el agua alrededor de tres horas. Dado que no puede retenerse toda el agua absorbida por los capilares del suelo, la muestra de suelo debe dejarse escurrir durante un período de dos horas, colocando el tubo en un lecho de arena de cuarzo finamente molida muy húmeda y contenida en un recipiente tapado (para evitar que se seque). Después, la muestra debe pesarse y secarse hasta obtener una masa constante a 105 °C. La capacidad de retención de agua (WHC) puede calcularse entonces de la manera siguiente:

donde:
S= masa del sustrato saturado de agua + masa del tubo + masa del papel de filtro
T= tara (masa del tubo + masa del papel de filtro)
D= masa seca del sustrato
Apéndice 3
Determinación del pH del suelo
El siguiente método de determinación del pH de un suelo se basa en la descripción recogida en la norma ISO DIS 10390: Calidad del suelo. Determinación del pH (16).
Una determinada cantidad de suelo se seca a temperatura ambiente durante al menos 12 horas. A continuación se hace una suspensión del suelo (con al menos 5 gramos de este) en cinco veces su volumen de una solución 1 M de cloruro de potasio de grado analítico (KCl) o de una solución 0,01 M de cloruro de calcio de grado analítico (CaCl2). Después de agitarla enérgicamente durante 5 minutos, se deja reposar la suspensión desde 2 horas como mínimo hasta 24 horas como máximo. El pH de la fase líquida se mide a continuación utilizando un pH-metro, que habrá sido calibrado antes de cada medición con una serie adecuada de soluciones amortiguadoras (p. ej., a un pH de 4,0 y 7,0).
Apéndice 4
Cría de Hypoaspis (Geolaelaps) aculeifer, ácaros de alimento y sincronización del cultivo
Cría de Hypoaspis (Geolaelaps) aculeifer:
Los cultivos pueden mantenerse en recipientes de plástico o en tarros de vidrio rellenos de una mezcla de yeso y carbón vegetal en polvo, en la proporción 9:1. El yeso puede mantenerse húmedo añadiendo unas gotas de agua destilada o desionizada, en caso necesario. Las temperaturas óptimas de cría son de 20 ± 2 °C; el régimen de luz/oscuridad no es pertinente para esta especie. Las presas pueden ser ácaros de las especies Typrophagus putrescentiae o Caloglyphus sp. (los ácaros de alimento deben tratarse con prudencia ya que pueden provocar alergias en los seres humanos), pero los nematodos, los enquitreidos y los colémbolos también pueden ser adecuados como presa. Su origen debe registrarse. El desarrollo de la población puede empezar con una sola hembra porque los machos se forman en huevos sin fecundar. Las generaciones se solapan en gran medida. Una hembra puede vivir al menos 100 días y puede depositar aproximadamente 100 huevos durante su vida. La tasa máxima de puesta de huevos la alcanzan entre los días 10 y 40 (tras hacerse adultas) y supone 2,2 huevos hembra– 1 día– 1. El tiempo de desarrollo desde la fase de huevo a la de hembra adulta es de unos 20 días a 20 °C. Deben mantenerse y tratarse varios cultivos previamente.
Cría de Typrophagus putrescentiae:
Los ácaros se mantienen en un recipiente de vidrio relleno de polvo fino de levadura de cerveza, que se pone en un cubo de plástico lleno de solución de KNO3, a fin de impedir que se escapen los animales. Los ácaros de alimento se colocan encima de este polvo. Después, se mezclan cuidadosamente con el polvo (que ha de sustituirse dos veces por semana) con ayuda de una espátula.
Sincronización del cultivo:
Los especímenes que se utilicen en el ensayo deben ser de edad similar (de unos 7 días tras alcanzar la fase de adultos). A una temperatura de cría de 20 °C, esto se efectúa de la manera siguiente:
Se transfieren hembras a un recipiente de cría limpio y se añade suficiente alimento.
|
—
|
Tras dejar dos o tres días para que puedan poner huevos, se retiran las hembras.
|
|
—
|
Se toman hembras adultas para el ensayo cuando han pasado entre 28 y 35 días desde la fecha de inicio de la transferencia de las hembras a los recipientes de cría limpios.
|
Las hembras adultas pueden distinguirse con facilidad de los machos y de otras fases del desarrollo por su mayor tamaño, su forma inflada y su escudo dorsal marrón (los machos son más delgados y planos), y los juveniles son de color blanco a crema. El desarrollo de los ácaros sigue aproximadamente la pauta descrita a continuación a 20 °C (véase la figura): huevo 5 días, larva 2 días, protoninfa 5 días, deutoninfa 7 días, período previo a la puesta de huevos por la hembra 2 días. A partir de ese momento, los ácaros son adultos.
Figura
Desarrollo de Hypoaspis (Geolaelaps) aculeifer a 20 °C (retirada = hembras utilizadas para el ensayo).

Los animales de ensayo adultos se retiran del cultivo sincronizado y se introducen en los recipientes de ensayo cuando han pasado entre 28 y 35 días desde el momento en que las madres empezaron a poner huevos (es decir, 7-14 días desde que se han convertido en adultos). De esta manera se garantiza que los animales de ensayo han superado su período previo a la puesta de huevos y se han apareado con machos que también están presentes en el recipiente de cultivo. Según se deduce de observaciones efectuadas en cultivos de laboratorio, las hembras se aparean inmediatamente o poco después de convertirse en adultos si hay machos presentes (Ruf, Vaninnen, obs. pers.). El período de siete días se ha elegido para facilitar la integración en el trabajo del laboratorio y para amortiguar las diferencias de desarrollo individual de los ácaros. La puesta de huevos debe iniciarse con al menos el mismo número de hembras que se vaya a necesitar al final para el ensayo (si, por ejemplo, se van a necesitar 400 hembras para el ensayo, debe permitirse que pongan huevos al menos 400 hembras durante dos o tres días). El punto de partida para la población sincronizada deben ser al menos 1 200 huevos (la proporción de machos y hembras debe estar cerca de 1:1, y la mortalidad próxima a 0,2). Para evitar el canibalismo, es más práctico no mantener más de 20-30 hembras ponedoras de huevos en un mismo recipiente.
Apéndice 5
Métodos de extracción
Para los microartrópodos, la extracción por calor es un método adecuado para separar los especímenes del suelo o sustrato (véase la figura a continuación). El método se basa en la actividad de los organismos, por lo que solo podrán registrarse los especímenes móviles. El principio de la extracción por calor es ir empeorando gradualmente las condiciones que ofrece la muestra a los organismos, a fin de que estos abandonen el sustrato y caigan a un líquido de fijación (por ejemplo, etanol). Los puntos cruciales son la duración de la extracción y el gradiente de condiciones para los organismos, de buenas a moderadas y de moderadas a malas. La duración de la extracción para realizar ensayos ecotoxicológicos tiene que ser lo más breve posible, ya que un eventual crecimiento de la población durante la fase de extracción podría falsear los resultados. Por otra parte, las condiciones de temperatura y humedad de la muestra han de estar siempre en un intervalo que permita a los ácaros moverse. El calentamiento de la muestra de suelo lleva a la desecación del sustrato. Si la desecación es demasiado rápida, algunos ácaros podrían desecarse también antes de conseguir escapar.
Por lo tanto, se propone el siguiente procedimiento (24) (25):
|
|
Aparato: Embudo Tullgren o métodos comparables como, por ejemplo, el de McFadyen (calentamiento desde arriba, la muestra se pone sobre un embudo).
|
|
|
Régimen de calefacción: 25 °C durante 12 h, 35 °C durante 12 h, 45 oC durante 24 horas (en total, 48 h). La temperatura debe medirse en el sustrato.
|
|
|
Líquido de fijación: etanol al 70 %.
|
|
|
Detalles: Tomar el frasco de vidrio utilizado para el ensayo. Retirar la tapa y cubrir la boca con un trozo de malla o de tela. La tela utilizada debe tener una luz de malla de 1,0 a 1,5 mm; se fija con una goma elástica. Con cuidado se pone boca abajo el frasco y se introduce en el aparato de extracción. La tela impide que el sustrato caiga al líquido de fijación, pero permite que los ácaros salgan de la muestra. Se pone en marcha el régimen de calefacción después de haber introducido todos los frascos. Se finaliza la extracción a las 48 horas. Se retiran los frascos de fijación y se efectúa el recuento de los ácaros por medio de un microscopio de disección.
|
La eficacia de extracción del método elegido debe haberse demostrado una o dos veces al año con recipientes que contengan un número conocido de ácaros juveniles y de adultos en sustrato de ensayo sin tratar. La eficacia debe ser ≥ 90 % por término medio, combinando todas las fases de desarrollo.
Dispositivo de extracción tipo Tullgren
Cómo preparar el frasco de ensayo una vez terminado el ensayo, antes de la extracción

Apéndice 6
Identificación de Hypoaspis (Geolaelaps) aculeifer
|
Subclase/orden/suborden:
|
|
Familia:
|
|
Género/subgénero/especie:
|
|
Acari/Parasitiformes/Gamasida
|
|
Laelapidae
|
|
Hypoaspis (Geolaelaps) aculeifer
|
|
Autor y fecha:
|
F. Faraji, Ph.D. (MITOX), 23 de enero de 2007
|
|
Bibliografía utilizada
|
Karg, W. (1993). Die freilebenden Gamasina (Gamasides), Raubmilben. Tierwelt Deutschlands 59, 2a edición revisada: 1-523.
Hughes, A.M. (1976). The mites of stored food and houses. Ministry of Agriculture, Fisheries and Food, Technical Bulletin 9: 400 pp.
Krantz, G.W. (1978). A manual of Acarology. Oregon State University Book Stores, Inc., 509 pp.
|
|
Características determinantes:
|
Rostro con borde denticulado redondeado; surcos del hipostoma con más de 6 dentículos; sedas dorsales caudales Z4 no muy largas; sedas dorsales setiformes; escudo genital normal, no muy agrandado y sin alcanzar el escudo anal; mitad posterior del escudo dorsal sin sedas desemparejadas; patas II y IV con algunas macrosedas gruesas; seda dorsal Z5 unas dos veces más larga que la J5; dedo fijo de los quelíceros con 12-14 dientes y dedo móvil con 2 dientes; idiosoma 520-685 μm de largo.
La especie Hypoaspis miles también se utiliza en la lucha biológica y podría confundirse con H. aculeifer. La principal diferencia es la siguiente:
H. miles pertenece al subgénero Cosmolaelaps y tiene sedas dorsales en forma de cuchilla, mientras que H. aculeifer pertenece al subgénero Geolaelaps y tiene sedas dorsales setiformes.
|

Apéndice 7
Información básica sobre la biología de Hypoaspis (Geolaelaps) aculeifer
La especie Hypoaspis aculeifer pertenece a la familia Lealapidae, orden Acari (ácaros), clase Arachnida, tribu Arthropoda. Vive en todos los tipos de suelo y se alimenta de otros ácaros, nematodos, enquitreidos y colémbolos (26). En caso de escasez de alimento se hacen caníbales (27). Los ácaros predadores están segmentados en idiosoma y gnatosoma. No hay una diferenciación clara del idiosoma en prosoma (cabeza) y opistosoma (abdomen). El gnatosoma (escudo capitular) contiene las piezas para la alimentación, como son los palpos y quelíceros. Los quelíceros están trifurcados y provistos de dientes de forma distinta. Además de para alimentarse, los machos utilizan los quelíceros principalmente para transferir los espermatóforos a las hembras. El idiosoma está cubierto casi completamente por un escudo dorsal. Una gran parte del idiosoma de las hembras está ocupada por los órganos reproductores, que destacan en particular poco antes de la puesta de huevos. Ventralmente se encuentran dos escudos, el esternal y el genital. Todas las patas están provistas de cerdas y espinas. Las cerdas se utilizan para sujetarse cuando se desplazan en el interior o en la superficie del suelo. El primer par de patas se utiliza principalmente como antenas. El segundo par de patas se utiliza no solo para el movimiento, sino también para agarrar la presa. Las espinas del cuarto par de patas pueden servir de protección así como de “motor de desplazamiento” (28). Los machos tienen 0,55-0,65 mm de longitud y un peso de 10-15 μg. Las hembras tienen 0,8-0,9 mm de longitud y un peso de 50-60 μg (8) (28) (figura 1).
Figura 1.
Hembra, macho, protoninfa y larva de H. aculeifer.

A 23 °C, los ácaros maduran sexualmente a los 16 días (hembras) y 18 días (machos), respectivamente (6). Las hembras portan el esperma por el solenostoma, de donde se transfiere a continuación al ovario. En el ovario el esperma madura y se conserva. La fertilización se realiza únicamente después de la maduración del esperma en el ovario. Los huevos fecundados y sin fecundar son depositados por las hembras en agregados o por separado, de preferencia en cavidades o agujeros. Las hembras que se han apareado pueden producir juveniles de ambos sexos, mientras que de los huevos de hembras que no se han apareado solo salen juveniles machos. Durante el desarrollo se pasa por cuatro fases hasta llegar a la etapa de adulto (huevo — larva, larva — protoninfa, protoninfa — deutoninfa, deutoninfa — adulto).
El huevo es de color blanco lechoso, hialino, elíptico y de unos 0,37 mm de longitud, con una cubierta sólida. Según (8), las larvas tienen un tamaño entre 0,42 y 0,45 mm. Solo tienen tres pares de patas. En la región de la cabeza se desarrollan palpos y quelíceros. Los quelíceros, que tienen unos cuantos dentículos, se utilizan para la eclosión de los huevos. Tras la primera muda, 1-2 días después de la eclosión, se desarrollan las protoninfas. También son de color blanco, tienen un tamaño de 0,45-0,62 mm (8) y cuatro pares de patas. En los quelíceros están totalmente presentes los dientes. A partir de esta fase, los ácaros empiezan a buscar comida. Con este fin, la cutícula de las presas se perfora con los quelíceros y se introduce en la presa una secreción para la digestión extraintestinal. El ácaro puede entonces aspirar la masa alimentaria. Los quelíceros pueden también utilizarse para arrancar partículas mayores de pepitas alimentarias (28). Tras una nueva muda se forman las deutoninfas. Tienen un tamaño de 0,60-0,80 mm (8) y son de color amarillo a marrón claro. A partir de esta fase pueden distinguirse las hembras y los machos. Tras una nueva muda, durante la cual los animales están inactivos y se forma el escudo marrón (aproximadamente después de 14 días), los ácaros son adultos (28) (29) (30). La duración de su vida está entre 48 y 100 días a 25 °C (27).
Apéndice 8
Resumen Y calendario de las principales acciones que deben emprenderse a fin de realizar el ensayo con Hypoaspis
|
Tiempo (días)
Inicio del ensayo = día 0
|
Actividad/tarea
|
|
Día – 35
a día – 28
|
Transferencia de las hembras a partir del cultivo madre a recipientes limpios para iniciar la sincronización
Dos días después: extracción de las hembras
Dos o tres veces por semana: aporte de alimento suficiente
|
|
Día -5 (+/– 2)
|
Preparación del suelo artificial
|
|
Día -4 (+/– 2)
|
Determinación de la WHC del suelo artificial
Secado durante una noche
Día siguiente: Pesada de muestras y cálculo de la WHC
|
|
Día – 4 (+/– 2)
|
Prehumidificación del suelo artificial para alcanzar entre el 20 y el 30 % de la WHC
|
|
Día 0
|
Inicio del ensayo: adición de la sustancia problema al suelo artificial
Introducción de 10 hembras en cada réplica
Pesada de cada réplica
Establecimiento de controles abióticos para determinar el grado de humedad y el pH, dos réplicas por cada tratamiento
Secado de los controles de humedad durante una noche
Día siguiente: pesada de los controles de humedad
Día siguiente: medición del pH de los controles abióticos secados
|
|
Días 3, 6, 9, 12 (aprox.)
|
Aporte de la suficiente cantidad de organismos de presa a cada réplica
Pesada de cada réplica y adición eventual de la cantidad de agua evaporada
|
|
Día 14
|
Finalización del ensayo, inicio de la extracción de todas las réplicas y de los controles de eficacia de la extracción
Secado del contenido de agua de los controles durante una noche
Día siguiente: pesada del contenido de agua de los controles
Día siguiente: medición del pH de los controles secados
|
|
Día 16
|
Finalización de la extracción
|
|
Día 16 +
|
Registro del número de adultos y de juveniles en el material extraído
Informe de los resultados en los cuadros del modelo
Informe del procedimiento de ensayo en las fichas del protocolo del ensayo
|
C.37. ENSAYO DE VEINTIÚN DÍAS EN PECES: CRIBADO A CORTO PLAZO DE LA ACTIVIDAD ESTROGÉNICA Y ANDROGÉNICA Y DE LA INHIBICIÓN DE LA AROMATASA
INTRODUCCIÓN
|
1.
|
El presente método de ensayo reproduce las directrices de ensayo (TG) 230 de la OCDE (2009). La necesidad de desarrollar y validar un ensayo en peces capaz de detectar determinadas sustancias con actividad endocrina radica en la preocupación de que los niveles medioambientales de sustancias puedan provocar efectos adversos tanto en los seres humanos como en la vida silvestre, debido a la interacción de dichas sustancias con el sistema endocrino. En 1998, la OCDE promovió una actuación de alta prioridad orientada a revisar las directrices existentes, así como a desarrollar otras nuevas para la selección y la evaluación de los alteradores endocrinos potenciales. Una faceta de esta actuación consistió en elaborar las directrices del ensayo para el cribado de sustancias activas sobre el sistema endocrino de especies de peces. El ensayo de cribado endocrino de veintiún días en peces se ha sometido a un amplio programa de validación, el cual consiste en varios estudios interlaboratorios con sustancias seleccionadas con el objeto de demostrar la pertinencia y la fiabilidad del ensayo en términos de detección de sustancias estrogénicas e inhibidoras de la aromatasa (1, 2, 3, 4, 5) en las tres especies de peces en estudio (el pez cabeza gorda, el medaka y el pez cebra). La detección de actividad androgénica es posible en el pez cabeza gorda y en el medaka, pero no en el pez cebra. El presente método de ensayo no permite la detección de sustancias antiandrogénicas. El trabajo de validación ha sido revisado por un grupo de expertos designados por los Coordinadores Nacionales del Programa de Directrices de Ensayo (6). El ensayo no se ha diseñado para identificar mecanismos específicos de alteración hormonal, ya que los animales del ensayo poseen un eje hipotálamo-hipófisis-gónadas (HPG) intacto, que puede responder a las sustancias que afectan a dicho eje en diferentes niveles. El ensayo sobre reproducción de peces a corto plazo (TG 229 de la OCDE) incluye la fecundidad y, en su caso, la histopatología gonadal del pez cabeza gorda, así como todos los parámetros incluidos en el presente método de ensayo. Las TG 229 de la OCDE ofrecen un cribado de las sustancias que afectan a la reproducción mediante diversos mecanismos, incluidas las modalidades endocrinas. Este factor debe tenerse en cuenta antes de seleccionar el método de ensayo más adecuado.
|
|
2.
|
El presente método de análisis describe un ensayo de cribado in vivo en el que peces macho sexualmente maduros y peces hembra que están desovando se mantienen en una misma ubicación y se exponen a una sustancia durante una parte limitada de su ciclo de vida (veintiún días). Al término del periodo de exposición de veintiún días, dependiendo de la especie utilizada, se miden uno o dos parámetros biomarcadores en machos y hembras que sirvan de indicadores de la inhibición de la aromatasa, de la actividad estrogénica o de la actividad androgénica de la sustancia problema. Estos parámetros son la vitelogenina (VTG) y caracteres sexuales secundarios. La vitelogenina se mide en el pez cabeza gorda, el medaka y el pez cebra, mientras que los caracteres sexuales secundarios se miden únicamente en el pez cabeza gorda y el medaka.
|
|
3.
|
Este bioensayo sirve de ensayo de cribado in vivo en relación con determinados mecanismos de acción endocrinos y su aplicación debe considerarse en el contexto del “OECD Conceptual Framework for the Testing and Assessment of Endocrine Disrupting Chemicals” (Marco teórico para el estudio y la evaluación de los alteradores endocrinos de la OCDE) (28).
|
CONSIDERACIONES INICIALES Y LIMITACIONES
|
4.
|
La vitelogenina se produce normalmente en el hígado de los vertebrados ovíparos hembra como respuesta a los estrógenos endógenos circulantes. Es un precursor de las proteínas de la yema de huevo y, una vez que se produce en el hígado, viaja a través del torrente sanguíneo hasta el ovario, donde los huevos en desarrollo la absorben y modifican. La vitelogenina apenas se detecta en el plasma de los peces hembra inmaduros y de los machos porque no tienen suficientes estrógenos en circulación; no obstante, el hígado puede sintetizar y secretar vitelogenina como respuesta a la estimulación estrogénica exógena.
|
|
5.
|
La medición de la vitelogenina sirve para detectar sustancias con distintos mecanismos de acción estrogénica. La detección de sustancias estrogénicas es posible gracias a la medición de la inducción de la vitelogenina en los peces macho, lo cual ha quedado suficientemente documentado en los estudios revisados por expertos científicos [por ejemplo, (7)]. La inducción de la vitelogenina también ha quedado demostrada tras la exposición a andrógenos aromatizables (8, 9). Una reducción del nivel circulante de estrógenos en las hembras, por ejemplo, mediante la inhibición de la aromatasa que convierte el andrógeno endógeno en el estrógeno natural 17β-estradiol, provoca una disminución del nivel de vitelogenina, lo cual se utiliza para detectar sustancias con propiedades inhibidoras de la aromatasa (10, 11). La relevancia biológica de la respuesta de la vitelogenina tras la inhibición de estrógenos o de la aromatasa ha quedado establecida y se ha documentado ampliamente. Sin embargo, es posible que la producción de VTG en las hembras también pueda verse afectada por la toxicidad general y por mecanismos de acción tóxicos no endocrinos como, por ejemplo, la hepatotoxicidad.
|
|
6.
|
Se han logrado desarrollar varios métodos de medición de manera satisfactoria al tiempo que se han armonizado para el uso rutinario. Este es el caso de los métodos de enzimoinmunoanálisis de adsorción (ELISA) específicos para cada especie, que usan la inmunoquímica para la cuantificación de la vitelogenina producida en pequeñas muestras sanguíneas o hepáticas recogidas en distintos peces (12, 13, 14, 15, 16, 17, 18). Se recogen muestras sanguíneas de pez cabeza gorda, homogeneizados de cabeza/cola o muestras sanguíneas de pez cebra y muestras hepáticas de medaka para medir la VTG. En el caso del medaka existe una buena correlación entre la VTG medida en la sangre y en el hígado (19). En el apéndice 6 se recogen los procedimientos recomendados para la recogida de muestras para el análisis de la vitelogenina. Hay una gran variedad de juegos de medición de la vitelogenina, los cuales deben basarse en un método ELISA específico para cada especie.
|
|
7.
|
Los caracteres sexuales secundarios de los peces macho de determinadas especies son cuantificables y visibles externamente, además de responder a los niveles circulantes de andrógenos endógenos; este es el caso del pez cabeza gorda y del medaka, pero no así del pez cebra, que no posee caracteres sexuales secundarios cuantificables. Las hembras conservan la capacidad de desarrollar caracteres sexuales secundarios masculinos tras su exposición a sustancias androgénicas en el agua. Hay varios estudios disponibles en la bibliografía científica que documentan este tipo de respuesta en el pez cabeza gorda (20) y el medaka (21). Una disminución de los caracteres sexuales secundarios en los machos debería interpretarse con cautela debido a la baja potencia estadística y debe basarse en opiniones de expertos y en la ponderación de las pruebas. Dada la ausencia de caracteres sexuales secundarios cuantificables que respondan a las sustancias con acción androgénica, hay limitaciones en el uso del pez cebra en este ensayo.
|
|
8.
|
En el pez cabeza gorda, el principal indicador de exposición androgénica exógena es el número de tubérculos nupciales ubicados en el hocico del pez hembra. En el medaka, el número de tubérculos papilares constituye el principal marcador de exposición exógena a sustancias androgénicas en las hembras. El apéndice 5A y el apéndice 5B presentan los procedimientos recomendados para la evaluación de los caracteres sexuales en el pez cabeza gorda y el medaka, respectivamente.
|
|
9.
|
Las definiciones utilizadas en el presente método se recogen en el apéndice 1.
|
PRINCIPIO DEL ENSAYO
|
10.
|
En el ensayo, se exponen juntos en recipientes de ensayo peces macho y hembra con capacidad reproductora. Su edad adulta y capacidad reproductora permite diferenciar claramente cada sexo y, por lo tanto, permite realizar un análisis de cada parámetro en relación con el sexo y garantiza su sensibilidad con respecto a las sustancias exógenas. Al finalizar el ensayo, el sexo se confirma con un examen macroscópico de las gónadas tras la apertura ventral del abdomen con unas tijeras. En el apéndice 2 se incluye un resumen de las condiciones relevantes del bioensayo. El ensayo comienza normalmente con muestras de peces de una población en periodo de desove. No deben utilizarse animales senescentes. En la sección dedicada a la selección de los peces se incluyen pautas relativas a la edad de los peces y su capacidad reproductora. El ensayo se realiza con tres concentraciones de exposición a la sustancia, así como con un control del agua y, en caso necesario, un control del disolvente. Se utilizan dos recipientes o réplicas por tratamiento (cada recipiente contiene cinco machos y cinco hembras) con medaka y pez cebra, mientras que con el pez cabeza gorda se utilizan cuatro recipientes o réplicas por tratamiento (cada recipiente contiene dos machos y cuatro hembras). Esta distribución sirve para adaptarse al comportamiento territorial del pez cabeza gorda macho a la vez que mantiene una potencia suficiente del ensayo. La exposición se lleva a cabo durante veintiún días y el muestreo de peces se lleva a cabo en el vigesimoprimer día de exposición.
|
|
11.
|
Cuando se realiza el muestreo el vigesimoprimer día, todos los animales son sacrificados de forma compasiva. Se miden los caracteres sexuales secundarios en el pez cabeza gorda y el medaka (véanse el apéndice 5A y el apéndice 5B); se recogen muestras de sangre para determinar la vitelogenina en el pez cebra y el pez cabeza gorda; también se pueden recoger muestras de la cabeza o cola para determinar la vitelogenina en el pez cebra (apéndice 6), además de recoger muestras hepáticas en el medaka para analizar la VTG (apéndice 6).
|
CRITERIOS DE ACEPTACIÓN DEL ENSAYO
|
12.
|
Para que los resultados del ensayo sean aceptables, deben cumplirse las condiciones siguientes:
|
—
|
la mortalidad en los controles del agua (o de disolvente) no ha de superar el 10 % al final del ensayo;
|
|
—
|
la concentración de oxígeno disuelto ha de ser, al menos, del 60 % del valor de saturación en el aire a lo largo de todo el periodo de exposición;
|
|
—
|
en ningún momento del periodo de exposición la temperatura del agua debe variar en más de ± 1,5 °C entre los recipientes de ensayo y debe mantenerse en un intervalo de 2 °C dentro de las gamas establecidas para la especie de ensayo (apéndice 2); y
|
|
—
|
debe haber pruebas disponibles para demostrar que las concentraciones de la sustancia problema en la solución se han mantenido debidamente dentro de un rango de ± 20 % de la media los valores medidos.
|
|
DESCRIPCIÓN DEL MÉTODO
Equipo
|
13.
|
Se empleará el equipo común de laboratorio y, en particular:
|
a)
|
medidores de oxígeno y pH;
|
|
b)
|
equipo para determinar la dureza y la alcalinidad del agua;
|
|
c)
|
dispositivo adecuado de regulación de la temperatura, con supervisión preferiblemente continua;
|
|
d)
|
recipientes de material químicamente inerte y con una capacidad adecuada a la carga y la densidad de población recomendadas (véase el apéndice 2);
|
|
e)
|
sustrato de desove del pez cabeza gorda y del pez cebra (en el apéndice 4 figura la información necesaria); y
|
|
f)
|
una balanza suficientemente exacta (esto es, exactitud de ± 0,5 mg).
|
|
Agua
|
14.
|
Puede utilizarse para el ensayo toda agua en la que la especie de ensayo muestre unas tasas de crecimiento y supervivencia a largo plazo adecuadas. Su calidad ha de ser constante a lo largo de todo el ensayo. El pH del agua debe hallarse entre 6,5 y 8,5, si bien a lo largo de un mismo ensayo debe permanecer en un intervalo de ± 0,5 unidades de pH. Deben tomarse periódicamente muestras para su análisis con el fin de cerciorarse de que el agua de dilución no interfiere en los resultados del ensayo (por ejemplo, por complejación de la sustancia problema). Cuando se sepa que un agua de dilución es de calidad relativamente constante, conviene proceder, por ejemplo, cada tres meses a la determinación de los metales pesados (por ejemplo, Cu, Pb, Zn, Hg, Cd y Ni), aniones y cationes principales (por ejemplo, Ca2+, Mg2+, Na+, K+, Cl– y SO4
2–), plaguicidas (por ejemplo, organofosforados totales y organoclorados totales), carbono orgánico total y sólidos en suspensión. Si se demuestra que la calidad del agua es constante al menos durante un año, los análisis pueden ser menos frecuentes y espaciarse más (por ejemplo, cada seis meses). En el apéndice 3 se recogen algunas características químicas de un agua de dilución aceptable.
|
Soluciones de ensayo
|
15.
|
Las soluciones de ensayo a las concentraciones elegidas se preparan por dilución de una solución madre. La solución madre se prepara preferiblemente por simple mezcla o agitación de la sustancia problema en el agua de dilución (por ejemplo, mediante un agitador o ultrasonidos). Pueden emplearse columnas de saturación (columnas de solubilidad) para lograr la concentración adecuada de solución madre. No se recomienda usar un disolvente portador. Sin embargo, en el caso de que sea necesario usar un disolvente, debe realizarse un control de disolvente en paralelo y con la misma concentración de disolvente que en los tratamientos con la sustancia problema. En el caso de sustancias difíciles, un disolvente puede ser técnicamente la mejor solución. Debe consultarse el documento de orientación de la OCDE sobre los ensayos de toxicidad acuática con sustancias y mezclas difíciles (22). La elección del disolvente vendrá determinada por las propiedades químicas de la sustancia. El documento de orientación de la OCDE recomienda un máximo de 100 μl/l, que debe respetarse. Sin embargo, una revisión reciente (23) puso de relieve otras cuestiones relativas al uso de disolventes para realizar ensayos sobre la actividad endocrina. Por lo tanto, se recomienda que la concentración del disolvente, en caso necesario, se reduzca al mínimo siempre que sea técnicamente posible (esto dependerá de las propiedades fisicoquímicas de la sustancia problema).
|
|
16.
|
Se utilizará un sistema de ensayo dinámico. Este tipo de sistemas aporta y diluye continuamente una solución madre de la sustancia problema (por ejemplo, bomba dosificadora, diluidor proporcional o sistema saturador) para distribuir una serie de concentraciones en los recipientes de ensayo. Los caudales de las soluciones madre y del agua de dilución deben supervisarse con regularidad, preferiblemente todos los días, y no deberían variar en más del 10 % a lo largo del ensayo. Debe evitarse el uso de tubos de plástico de baja calidad u otros materiales que puedan contener sustancias biológicamente activas. Al seleccionar el material para el sistema dinámico, debe tenerse en cuenta la posible adsorción de la sustancia problema a este material.
|
Preparación de los peces
|
17.
|
Los peces de ensayo deben seleccionarse de una población de laboratorio, preferentemente de una misma población, que se mantenga al menos en las dos semanas antes del ensayo en condiciones de calidad del agua e iluminación similares a las del ensayo. Es importante que la tasa de carga y la densidad de población (las definiciones pueden consultarse en el apéndice 1) sean las adecuadas para la especie de ensayo utilizada (véase el apéndice 2).
|
|
18.
|
Después de un periodo de adaptación de 48 horas, se registra la mortalidad y se aplican los criterios siguientes:
|
—
|
si la mortalidad es superior al 10 % de la población en siete días, se rechaza todo el lote;
|
|
—
|
si la mortalidad se halla entre el 5 y el 10 % de la población, se prolonga otros siete días el periodo de aclimatación; si durante este segundo periodo la mortalidad supera el 5 %, se rechaza todo el lote;
|
|
—
|
si la mortalidad es inferior al 5 % de la población en siete días, se acepta el lote.
|
|
|
19.
|
Los peces no deben recibir tratamiento terapéutico alguno durante el periodo de aclimatación, el periodo de preexposición ni durante el periodo de exposición.
|
Preexposición y selección de los peces
|
20.
|
Se recomienda un periodo de preexposición de una semana, en el que los animales están en recipientes similares a los utilizados en el ensayo real. Los peces deben ser alimentados ad libitum durante todo el periodo de preparación y durante la fase de exposición. La fase de exposición comienza con peces adultos sexualmente dimórficos, procedentes de un suministro para laboratorio de animales maduros para la reproducción (por ejemplo, con caracteres sexuales secundarios visibles, en lo que respecta al pez cabeza gorda y al medaka) y en desove activo. Únicamente a modo de orientación general (esto es, no debe tenerse en cuenta sin atender a la situación reproductora real de un lote de peces determinado), los peces cabeza gorda deben tener aproximadamente 20 (± 2) semanas de edad, suponiendo que se hayan criado a 25 ± 2 °C durante toda su vida. Los medaka deben tener aproximadamente 16 (± 2) semanas, suponiendo que se hayan cultivado a 25 ± 2 °C durante toda su vida. Los peces cebra deben tener aproximadamente 16 (± 2) semanas, suponiendo que se hayan cultivado a 26 ± 2 °C durante toda su vida.
|
DISEÑO DEL ENSAYO
|
21.
|
Se utilizan tres concentraciones de la sustancia problema, un control (agua) y, si es necesario, un control de disolvente. Los datos se pueden analizar con el objeto de determinar diferencias estadísticamente significativas entre las respuestas de los grupos de tratamiento y de los controles. Estos análisis indicarán si son necesarias otros ensayos a largo plazo para determinar efectos adversos (es decir, supervivencia, desarrollo, crecimiento y reproducción) de la sustancia, más que para su uso en la evaluación de riesgos (24).
|
|
22.
|
En lo que respecta al pez cebra y al medaka, en el vigesimoprimer día del experimento se realiza un muestreo de machos y hembras de cada nivel de tratamiento (cinco machos y cinco hembras en cada una de las dos réplicas) y de los controles para medir la vitelogenina y los caracteres sexuales secundarios, si procede. En lo que respecta al pez cabeza gorda, en el vigesimoprimer día de exposición se realiza un muestreo de machos y hembras (dos machos y cuatro hembras en cada una de las cuatro réplicas) y de los controles para medir la vitelogenina y los caracteres sexuales secundarios.
|
Selección de las concentraciones de ensayo
|
23.
|
A efectos de este ensayo, la concentración de ensayo máxima debe establecerse de acuerdo con la concentración máxima tolerada (en lo sucesivo, MTC, por sus siglas en inglés), la cual se determina mediante un ensayo de determinación de intervalo u otros datos de toxicidad, o fijarse en 10 mg/l o en la solubilidad máxima en agua, eligiéndose el valor que sea menor. La MTC se define como la concentración máxima de ensayo de la sustancia que redunda en una mortalidad inferior al 10 %. Con este planteamiento se asume que existen datos empíricos de toxicidad aguda u otros datos de toxicidad a partir de los cuales se puede estimar la MTC. La estimación de la MTC puede ser inexacta y, por lo general, debe aplicarse un juicio profesional.
|
|
24.
|
Se requieren tres concentraciones de ensayo, separadas por un factor constante no superior a 10, así como un control del agua de dilución (y un control de disolvente si es necesario). Se recomienda emplear una gama de factores de separación entre 3,2 y 10.
|
PROCEDIMIENTO
Selección y pesada de los peces del ensayo
|
25.
|
Es importante que el peso de los peces varíe lo menos posible al inicio del ensayo. En el apéndice 2 figuran los intervalos de peso apropiados en cada una de las especies recomendadas para este ensayo. Para todo el lote de peces utilizado en el ensayo, el intervalo de pesos individuales de los peces macho y hembra al inicio del ensayo debe mantenerse, si es posible, en un intervalo de ± 20 % de la media aritmética del mismo sexo. Se recomienda pesar una submuestra de la población de peces antes del ensayo para calcular el peso medio.
|
Condiciones de exposición
Duración
|
26.
|
La duración del ensayo es de veintiún días, tras un periodo de preexposición. El periodo de preexposición recomendado es una semana.
|
Alimentación
|
27.
|
Los peces deben ser alimentados ad libitum con alimentos adecuados (apéndice 2) a un ritmo suficiente para mantener la condición física. Debe tenerse cuidado para evitar el crecimiento microbiano y la turbidez del agua. Como pauta general, la ración diaria puede dividirse en dos o tres porciones iguales para realizar varias tomas al día y deben transcurrir al menos tres horas entre cada toma. Una sola ración mayor resulta aceptable, especialmente los fines de semana. La alimentación de los peces debe suprimirse durante las 12 horas anteriores a la toma de muestras o la autopsia.
|
|
28.
|
Se debe evaluar la presencia de contaminantes en la comida de los peces, como plaguicidas organoclorados, hidrocarburos aromáticos policíclicos (HAP) o bifenilos policlorados (PCB). Deben evitarse los alimentos con un alto nivel de fitoestrógenos que puedan comprometer la respuesta del ensayo a agonistas de estrógenos conocidos (por ejemplo, el 17 beta-estradiol).
|
|
29.
|
La comida sobrante y la materia fecal deben retirarse de los recipientes de ensayo al menos dos veces por semana, por ejemplo, limpiando bien el fondo de cada recipiente con un sifón.
|
Iluminación y temperatura
|
30.
|
El fotoperiodo y la temperatura del agua han de ser adecuados para la especie utilizada (apéndice 2).
|
Frecuencia de los análisis y mediciones
|
31.
|
Antes de que comience el periodo de exposición, debe garantizarse el funcionamiento correcto del sistema de distribución de la sustancia. Deben estar dispuestos todos los métodos analíticos, incluidos los conocimientos suficientes sobre la estabilidad química del sistema de ensayo. Durante el ensayo, las concentraciones de la sustancia problema se determinan a intervalos regulares, de la siguiente manera: los caudales de diluyente y de solución madre de la sustancia tóxica deben comprobarse preferentemente todos los días, pero al menos dos veces por semana, y no deben variar en más del 10 % a lo largo del ensayo. Se recomienda que las concentraciones reales de sustancia problema se midan en todos los recipientes al comienzo del ensayo y, posteriormente, cada semana.
|
|
32.
|
Se recomienda basar los resultados en las concentraciones medidas. Sin embargo, si la concentración de sustancia problema en la solución se ha mantenido debidamente dentro del ± 20 % de la concentración nominal durante todo el ensayo, los resultados pueden basarse en los valores nominales o en los valores medidos.
|
|
33.
|
En algunos casos puede estar indicado filtrar (por ejemplo, con un filtro de 0,45 μm de diámetro de poro) o centrifugar las muestras. En caso necesario, el procedimiento recomendado es el centrifugado. Sin embargo, si se demuestra que el material del ensayo no se adsorbe a los filtros, también puede aceptarse la filtración.
|
|
34.
|
Durante el ensayo deben medirse el oxígeno disuelto, la temperatura y el pH en todos los recipientes de ensayo, al menos una vez por semana. La dureza total y la alcalinidad deben medirse en los controles y en uno de los recipientes con la concentración más alta al menos una vez por semana. La temperatura debe someterse a supervisión continua al menos en un recipiente de ensayo.
|
Observaciones
|
35.
|
En el transcurso del ensayo o al término del mismo, se evalúa una serie de respuestas biológicas generales (por ejemplo, la supervivencia) o básicas (por ejemplo, los niveles de vitelogenina). A continuación se describen la medición y la evaluación de estos parámetros y su utilidad.
|
Supervivencia
|
36.
|
Durante el periodo del ensayo hay que examinarse diariamente los peces, registrar la mortalidad y retirar los peces muertos lo antes posible. Los peces muertos no deben ser reemplazados en los recipientes de control ni en los de tratamiento. El sexo de los peces que mueran durante el ensayo debe determinarse mediante la evaluación macroscópica de las gónadas.
|
Comportamiento y aspecto
|
37.
|
Debe anotarse todo comportamiento anómalo (con respecto a los controles), tales como signos de toxicidad general, incluida la hiperventilación, la descoordinación al nadar, la pérdida de equilibrio o una inactividad o alimentación atípicas. También deben indicarse las anomalías externas (por ejemplo, hemorragia o decoloración). Estos signos de toxicidad deben considerarse detenidamente durante la interpretación de los datos, ya que pueden indicar concentraciones a las que los biomarcadores de la actividad endocrina no resultan fiables. Estas observaciones sobre el comportamiento también pueden proporcionar información cualitativa útil para los posibles requisitos futuros de ensayos en peces. Por ejemplo, se ha observado agresividad territorial en machos normales o hembras masculinizadas del pez cabeza gorda expuestos a andrógenos, mientras que en el pez cebra se ha observado el comportamiento característico del apareamiento y desove al amanecer se ha reducido u obstaculizado debido a una exposición estrogénica o antiandrogénica.
|
|
38.
|
Como algunos elementos del aspecto (principalmente el color) pueden cambiar rápidamente con la manipulación, es importante que las observaciones cualitativas se realicen antes de retirar a los animales del sistema del ensayo. La experiencia hasta la fecha con el pez cabeza gorda sugiere que algunas sustancias con actividad endocrina pueden, inicialmente, inducir cambios en las siguientes características externas: color del cuerpo (claro u oscuro), patrones de coloración (presencia de franjas verticales) y forma del cuerpo (zona de la cabeza y del pecho). Por lo tanto, deben realizarse durante el ensayo y al término del estudio observaciones del aspecto físico de los peces.
|
Sacrificio compasivo de los peces
|
39.
|
El vigesimoprimer día, es decir, al final de la exposición, los peces deben ser sacrificados con unas cantidades adecuadas de tricaína [metanosulfonato de tricaína, metacaína, MS-222 (CAS 886-86-2)], 100 — 500 mg/l, amortiguados con 300 mg/l de NaHCO 3 (bicarbonato sódico, CAS 144-55-8) para reducir la irritación de la membrana mucosa; a continuación se realiza un muestreo de sangre o tejido para determinar el nivel de vitelogenina, tal y como se explica en la sección dedicada a la vitelogenina.
|
Observación de los caracteres sexuales secundarios
|
40.
|
Algunas sustancias con actividad endocrina pueden inducir cambios en los caracteres sexuales secundarios especializados (número de tubérculos nupciales en el pez cabeza gorda macho o tubérculos papilares en el medaka macho). En particular, las sustancias con determinados mecanismos de acción pueden provocar la aparición anómala de caracteres sexuales secundarios en los animales del sexo opuesto; por ejemplo, los agonistas de los receptores de andrógenos, como la trembolona, la metiltestosterona y la dihidrotestosterona, pueden provocar que el pez cabeza gorda hembra desarrolle tubérculos nupciales pronunciados o que el medaka hembra desarrolle tubérculos papilares (11, 20, 21). También se ha observado que los agonistas receptores de estrógenos pueden reducir el número de tubérculos nupciales y el tamaño de la almohadilla dorsal en los machos adultos (25, 26). Estas observaciones morfológicas macroscópicas pueden proporcionar información cualitativa y cuantitativa útil para los posibles requisitos futuros de ensayos en peces. El número y el tamaño de los tubérculos nupciales en el pez cabeza gorda y de los tubérculos papilares en el medaka pueden cuantificarse directamente o, de manera más práctica, en especímenes conservados. Los procedimientos recomendados para la evaluación de los caracteres sexuales secundarios en el pez cabeza gorda y en el medaka se pueden consultar en el apéndice 5A y el apéndice 5B, respectivamente.
|
Vitelogenina (VTG)
|
41.
|
Se extrae sangre de la arteria o de la vena caudal con un túbulo capilar para microhematocrito heparinizado o mediante una punción cardíaca con una jeringa. En función del tamaño de los peces, los volúmenes de sangre que se pueden extraer suelen oscilar entre los 5 y los 60 μl por individuo en el caso del pez cabeza gorda y entre los 5 y los 15 μl por individuo en el caso del pez cebra. El plasma se separa de la sangre mediante centrifugado y se guarda con inhibidores de la proteasa a – 80 °C hasta que se analice para determinar la vitelogenina. De manera alternativa, en el medaka se utilizará el hígado y en el pez cebra se puede usar el homogeneizado de cabeza/cola como tejido de origen para la determinación de la vitelogenina (apéndice 6). La medición de la VTG debe basarse en un método ELISA homólogo validado con ayuda de anticuerpos homólogos y de un patrón de VTG homólogo. Se recomienda utilizar un método capaz de detectar niveles de VTG tan bajos como unos pocos ng/ml de plasma (o ng/mg de tejido), que es el nivel de base en los peces macho no expuestos.
|
|
42.
|
El control de calidad del análisis de la vitelogenina se realizará mediante patrones, blancos y, como mínimo, análisis duplicados. Para cada método ELISA debe realizarse una prueba del efecto de matriz (efecto de dilución de la muestra) para determinar el factor mínimo de dilución de la muestra. Cada placa ELISA utilizada en ensayos de VTG debe incluir las siguientes muestras de control de calidad: al menos 6 patrones de calibración que cubran la gama de concentraciones previstas de vitelogenina y al menos un blanco de ensayo de fijación no específico (analizado por duplicado). La absorbancia de estos blancos debe ser inferior al 5 % de la absorbancia máxima del patrón de calibración. Se analizarán como mínimo dos partes alícuotas (duplicados de pocillos) de cada dilución de la muestra. Los duplicados de los pocillos que varíen en más del 20 % deben volver a analizarse.
|
|
43.
|
El coeficiente de correlación (R2) de las curvas de calibración debe ser superior a 0,99. Sin embargo, una elevada correlación no es suficiente para garantizar una predicción adecuada de la concentración en todas las gamas. Además de tener una correlación suficientemente alta para la curva de calibración, la concentración de cada patrón, calculada a partir de la curva de calibración, debe encontrarse entre el 70 y 120 % de su concentración nominal. Si las concentraciones nominales presentan la tendencia de apartarse de la línea de regresión de calibración (por ejemplo, en concentraciones más bajas), es posible que sea necesario dividir la curva de calibración en rangos bajos y altos o utilizar un modelo no lineal para adaptar adecuadamente los datos de absorbancia. Si la curva se divide, ambos segmentos de línea deben tener un R2 > 0,99.
|
|
44.
|
El límite de detección (LOD) se define como la concentración más baja del patrón analítico, y el límite de cuantificación (LOQ) se define como la concentración más baja del patrón analítico multiplicada por el factor de dilución más bajo.
|
|
45.
|
Cada día que se realicen ensayos de vitelogenina, se analizará una muestra de enriquecimiento preparada con un patrón de referencia interensayos (apéndice 7). La relación entre la concentración prevista y la concentración medida se indicará junto con los resultados de cada conjunto de ensayos que se hayan realizado ese día.
|
DATOS E INFORME
Evaluación de las respuestas de los biomarcadores mediante el análisis de la varianza (ANOVA)
|
46.
|
Para identificar la posible actividad endocrina de una sustancia, se comparan las respuestas entre los grupos de tratamiento y los grupos de control mediante el análisis de la varianza (ANOVA). Cuando se usa un control de disolvente, debe realizarse una prueba estadística apropiada entre los controles de agua de dilución y los de disolvente para cada parámetro. En la OCDE, 2006c (27) pueden consultarse las directrices relativas a la gestión de los datos de los controles de agua de dilución y los de disolvente en posteriores análisis estadísticos. Todos los datos relativos a las respuestas biológicas deben analizarse y comunicarse por separado respecto a cada sexo. Si las hipótesis necesarias relativas a los métodos paramétricos no se cumplen –distribución no normal (por ejemplo, prueba de Shapiro-Wilk) o varianza heterogénea (prueba de Bartlett o Levene)–, deberá estudiarse la posibilidad de transformar los datos para homogeneizar las varianzas antes de efectuar el ANOVA o un ANOVA ponderado. En caso de relación dosis-respuesta no monótona puede utilizarse la prueba de Dunnett (paramétrica) sobre comparaciones de varios pares o un ajuste Mann-Whitney con Bonferroni (no paramétrico). Se pueden usar otras pruebas estadísticas (por ejemplo, la prueba de Jonckheere-Terpstra o la prueba de Williams) si la relación dosis-respuesta es aproximadamente monótona. En el apéndice 8 se incluye un diagrama de flujo estadístico como ayuda para la toma de decisiones en relación con la prueba estadística más adecuada. Asimismo, se puede obtener más información en el documento de la OCDE relativo a los enfoques actuales sobre el análisis estadístico de datos sobre ecotoxicidad (27).
|
Preparación de informes sobre los resultados del ensayo
|
47.
|
Los datos del estudio deben incluir:
|
|
Instalaciones de ensayo:
|
—
|
Personal responsable y sus tareas en el estudio.
|
|
—
|
Cada laboratorio debe haber demostrado su competencia en el uso de una gama de sustancias representativas.
|
|
|
|
Sustancia problema:
|
—
|
Caracterización de la sustancia problema.
|
|
—
|
Naturaleza física y propiedades fisicoquímicas pertinentes.
|
|
—
|
Método y frecuencia de preparación de las concentraciones de ensayo.
|
|
—
|
Información sobre la estabilidad y la biodegradabilidad.
|
|
|
|
Disolvente:
|
—
|
Caracterización del disolvente (naturaleza, concentración utilizada).
|
|
—
|
Justificación de la elección del disolvente (si fuera distinto al agua).
|
|
|
|
Animales de ensayo:
|
—
|
Proveedor e instalación específica del proveedor.
|
|
—
|
Edad de los peces al comienzo del ensayo y estado reproductivo o de desove.
|
|
—
|
Datos sobre el procedimiento de aclimatación de los animales.
|
|
—
|
Peso corporal de los peces al principio de la exposición (a partir de una submuestra de la población de peces).
|
|
|
|
Condiciones del ensayo:
|
—
|
Procedimiento de ensayo utilizado (tipo de prueba, tasa de carga, densidad de población, etc.).
|
|
—
|
Método de preparación de las soluciones madre y caudal.
|
|
—
|
Concentraciones nominales del ensayo, concentraciones medidas cada semana de las soluciones de ensayo y método analítico utilizado, medias de los valores medidos y desviaciones físicas de los recipientes de ensayo, así como pruebas de que las mediciones corresponden a las concentraciones de la sustancia del ensayo en la solución verdadera.
|
|
—
|
Características del agua de dilución (incluido el pH, la dureza, la alcalinidad, la temperatura, la concentración de oxígeno disuelto, los niveles residuales de cloro, el carbono orgánico total, los sólidos en suspensión y cualquier otra medición que se haya realizado).
|
|
—
|
Calidad del agua dentro de los recipientes de ensayo: pH, dureza, temperatura y concentración de oxígeno disuelto.
|
|
—
|
Información detallada sobre la alimentación (por ejemplo, tipo de alimentos, origen, cantidad suministrada y frecuencia) y análisis de los contaminantes pertinentes, si estuvieran disponibles (por ejemplo, PCB, HAP y plaguicidas organoclorados).
|
|
|
|
Resultados
|
—
|
Pruebas de que los controles han cumplido los criterios de aceptación del ensayo.
|
|
—
|
Datos sobre la mortalidad acaecida en cualquiera de las concentraciones y en los controles del ensayo.
|
|
—
|
Técnicas de análisis estadístico utilizadas, tratamiento de los datos y justificación de las técnicas utilizadas.
|
|
—
|
Datos relativos a las observaciones biológicas de morfología macroscópica, incluidos los caracteres sexuales secundarios y la vitelogenina.
|
|
—
|
Resultados de los análisis de datos, preferentemente en formato tabular y gráfico.
|
|
—
|
Incidencia de toda reacción anómala de los peces y de todo efecto visible producido por la sustancia problema.
|
|
|
ORIENTACIÓN PARA LA INTERPRETACIÓN Y LA ACEPTACIÓN DE LOS RESULTADOS DEL ENSAYO
|
48.
|
Esta sección contiene una serie de consideraciones que deben tenerse en cuenta en la interpretación de los resultados del ensayo con respecto a los diversos parámetros medidos. Los resultados deben interpretarse con cautela cuando la sustancia problema parezca provocar una toxicidad manifiesta o afectar al estado general del animal de ensayo.
|
|
49.
|
Al ajustar la gama de concentraciones del ensayo, se debe tener cuidado de no superar la concentración máxima tolerada, de forma que se pueda realizar una interpretación significativa de los datos. Es importante contar al menos con un tratamiento en el que no haya indicios de efectos tóxicos. Los signos de enfermedades y de efectos tóxicos deben evaluarse y registrarse exhaustivamente. Por ejemplo, es posible que la producción de VTG en las hembras también se vea afectada por la toxicidad general y mecanismos de acción tóxicos no endocrinos como, por ejemplo, hepatotoxicidad. No obstante, la interpretación de los efectos puede corroborarse con otros niveles de tratamiento que no se hayan visto afectados por la toxicidad sistémica.
|
|
50.
|
Hay varios aspectos que deben tenerse en cuenta con respecto a la aceptación de los resultados del ensayo. Como pauta, los niveles de VTG en los grupos de control de machos y hembras deben diferenciarse y estar separados aproximadamente por tres órdenes de magnitud en el pez cabeza gorda y en el pez cebra, y aproximadamente por un orden de magnitud en el medaka. En los informes de validación (1, 2, 3, 4) figuran ejemplos de la gama de valores obtenidos en los grupos de control y de tratamiento. Los valores altos de VTG en los machos de control podrían comprometer la capacidad de respuesta del ensayo y su capacidad para detectar agonistas débiles de estrógenos. Los valores bajos de VTG en las hembras de control podrían comprometer la capacidad de respuesta del ensayo y su capacidad para detectar inhibidores de la aromatasa y antagonistas de los estrógenos. Para elaborar esta orientación se utilizaron los estudios de validación.
|
|
51.
|
Si un laboratorio no hubiera realizado el ensayo antes o si se hubieran producido cambios importantes (por ejemplo, cambio de cepa o del proveedor de los peces), se aconseja realizar un estudio de competencia técnica. Se recomienda utilizar sustancias que abarquen una variedad de mecanismos de acción o de impactos en varios parámetros del ensayo. En la práctica, se insta a cada laboratorio a recopilar sus propios datos de control históricos relativos a los machos y a las hembras, así como a realizar controles positivos con una sustancia con actividad estrogénica (por ejemplo, el 17beta-estradiol a 100 ng/l o un agonista débil conocido) que se traduzca en un aumento de la VTG en los peces macho, con una sustancia inhibidora de la aromatasa (por ejemplo, fadrozol o procloraz a 300 μg/l) que dé como resultado una reducción de la VTG en los peces hembra, y con una sustancia con actividad androgénica (por ejemplo, 17beta-trembolona a 5 μg/l) que produzca la inducción de caracteres sexuales secundarios en las hembras del pez cabeza gorda y del medaka. Todos estos datos pueden compararse con los datos disponibles de los estudios de validación (1, 2, 3) para garantizar la competencia de los laboratorios.
|
|
52.
|
En general, las mediciones de vitelogenina deben considerarse positivas si se produce un aumento estadísticamente significativo de la VTG en los machos (p < 0,05) o una disminución estadísticamente significativa en las hembras (p < 0,05), como mínimo en la dosis máxima del ensayo en comparación con el grupo de control y en ausencia de signos de toxicidad general. Un resultado positivo también se verá respaldado por la demostración de una relación biológicamente plausible entre la dosis y la curva de respuesta. Como se ha mencionado anteriormente, la reducción de vitelogenina podría no deberse totalmente a un origen endocrino; sin embargo, un resultado positivo, por lo general, se debe interpretar como una prueba de actividad endocrina in vivo y, normalmente, debe conllevar acciones para obtener más aclaraciones.
|
BIBLIOGRAFÍA
|
(1)
|
OCDE (2006a). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1A). OECD Environmental Health and Safety Publications Series on Testing and Assessment No.60, ENV/JM/MONO(2006)27.
|
|
(2)
|
OCDE (2006b). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1B). OECD Environmental Health and Safety Publications Series on Testing and Assessment No.61, ENV/JM/MONO(2006)29.
|
|
(3)
|
OCDE (2007). Final report of the Validation of the 21-day Fish Screening Assay for the Detection of Endocrine Active Substances. Phase 2: Testing Negative Substances. OECD Environmental Health and Safety Publications Series on Testing and Assessment No.78, ENV/JM/MONO(2007)25.
|
|
(4)
|
Owens JW (2007). Phase 3 report of the validation of the OECD Fish Screening Assay. Proyecto de CEFIC LRI, endocrino. http://www.cefic-lri.org/index.php?page=projects (acceso 18/09/08).
|
|
(5)
|
US EPA 2007. Validation of the Fish Short-Term Reproduction Assay: Integrated Summary Report. Informe no publicado del 15 de diciembre de 2007. Agencia de Protección del Medio Ambiente de EE. UU., Washington, DC. 104 páginas.
|
|
(6)
|
OCDE, 2008. Report of the Validation Peer Review for the 21-Day Fish Endocrine Screening Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. OECD Environmental Health and Safety Publications Series on Testing and Assessment No.94, ENV/JM/MONO(2008)21.
|
|
(7)
|
Sumpter and Jobling (1995). Vitellogenesis as a biomarker for estrogenic contamination of the aquatic environment. Environmental Health Perspectives;103 Suppl 7:173-8 Review.
|
|
(8)
|
Pawlowski S, Sauer A, Shears JA, Tyler CR, Braunbeck T (2004). Androgenic and estrogenic effects of the synthetic androgen 17alpha-methyltestosterone on sexual development and reproductive performance in the fathead minnow (Pimephales promelas) determined using the gonadal recrudescence assay. Aquatic Toxicology; 68(3):277-91.
|
|
(9)
|
Andersen L, Goto-Kazato R, Trant JM, Nash JP, Korsgaard B, Bjerregaard P (2006). Short-term exposure to low concentrations of the synthetic androgen methyltestosterone affects vitellogenin and steroid levels in adult male zebrafish (Danio rerio). Aquatic Toxicology; 76(3-4):343-52.
|
|
(10)
|
Ankley GT, Kahl MD, Jensen KM, Hornung MW, Korte JJ, Makynen EA, Leino RL (2002). Evaluation of the aromatase inhibitor fadrozole in a short-term reproduction assay with the fathead minnow (Pimephales promelas). Toxicological Sciences; 67(1):121-30.
|
|
(11)
|
Panter GH, Hutchinson TH, Hurd KS, Sherren A, Stanley RD, Tyler CR (2004). Successful detection of (anti-)androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development. Aquatic Toxicology; 70(1):11-21.
|
|
(12)
|
Parks LG, Cheek AO, Denslow ND, Heppell SA, McLachlan JA, LeBlanc GA, Sullivan CV (1999). Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds. Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology; 123(2):113-25.
|
|
(13)
|
Panter GH, Tyler CR, Maddix S, Campbell PM, Hutchinson TH, Länge R, Lye C, Sumpter JP, 1999. Application of an ELISA to quantify vitellogenin concentrations in fathead minnows (Pimephales promelas) exposed to endocrine disrupting chemicals. CEFIC-EMSG research report reference AQ001. CEFIC, Bruselas, Bélgica.
|
|
(14)
|
Fenske M., van Aerle, R.B., Brack, S.C., Tyler, C.R., Segner, H., (2001). Development and validation of a homologous zebrafish (Danio rerio Hamilton- Buchanan) vitellogenin enzyme-linked immunosorbent assay (ELISA) and its application for studies on estrogenic chemicals. Comp. Biochem. Phys. C 129 (3): 217-232.
|
|
(15)
|
Holbech H, Andersen L, Petersen GI, Korsgaard B, Pedersen KL, Bjerregaard P. (2001). Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio). Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology; 130: 119-131
|
|
(16)
|
Rose J, Holbech H, Lindholst C, Noerum U, Povlsen A, Korsgaard B, Bjerregaard P. 2002. Vitellogenin induction by 17ß-estradiol and 17ß-ethinylestradiol in male zebrafish (Danio rerio). Comp. Biochem. Physiol. C. 131: 531-539.
|
|
(17)
|
Brion F, Nilsen BM, Eidem JK, Goksoyr A, Porcher JM, Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio). Environmental Toxicology and Chemistry; vol 21: 1699-1708.
|
|
(18)
|
Yokota H, Morita H, Nakano N, Kang IJ, Tadokoro H, Oshima Y, Honjo T, Kobayashi K. 2001. Development of an ELISA for determination of the hepatic vitellogenin in Medaka (Oryzias latipes). Jpn J Environ Toxicol 4:87–98.
|
|
(19)
|
Tatarazako N, Koshio M, Hori H, Morita M and Iguchi T., 2004. Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the Medaka. Journal of Health Science 50:301-308.
|
|
(20)
|
Ankley GT, Jensen KM, Makynen EA, Kahl MD, Korte JJ, Homung MW, Henry TR, Denny JS, Leino RL, Wilson VS, Cardon MC, Hartig PC, Gray LE (2003). Effects of the androgenic growth promoter 17-beta-trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environmental Toxicology and Chemistry; 22(6): 1350-60.
|
|
(21)
|
Seki M, Yokota H, Matsubara H, Maeda M, Tadokoro H, Kobayashi K (2004). Fish full life-cycle testing for androgen methyltestosterone on medaka (Oryzias latipes). Environmental Toxicology and Chemistry; 23(3):774-81.
|
|
(22)
|
OCDE (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No 23. París.
|
|
(23)
|
Hutchinson TH, Shillabeer N, Winter MJ, Pickford DB, 2006a. Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Review. Aquatic Toxicology, 76; pp.69–92.
|
|
(24)
|
Hutchinson TH, Ankley GT, Segner H, Tyler CR, 2006b. Screening and testing for endocrine disruption in fish-biomarkers as “signposts”, not “traffic lights”, in risk assessment. Environmental Health Perspectives;114 Suppl 1:106-14.
|
|
(25)
|
Miles-Richardson, SR, Kramer VJ, Fitzgerald SD, Render JA, Yamini B, Barbee SJ, Giesy JP. 1999. Effects of waterborne exposure to 17B-estradiol on secondary sex characteristics and gonads of the fathead minnow (Pimephales promelas). Aquat. Lett., Suppl. 47, 129-145.
|
|
(26)
|
Martinovic, D., L.S. Blake, E.J. Durhan, K.J. Greene, M.D. Kahl, K.M., Jensen, E.A. Makynen, D.L. Villeneuve y G.T. Ankley. 2008. Characterization of reproductive toxicity of vinclozolin in the fathead minnow and co-treatment with an androgen to confirm an anti-androgenic mode of action. Microbiol. Lett., Suppl. Chem. Soc, pp. 27, 478-488.
|
|
(27)
|
OCDE (2006c). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD environmental Health and Safety Publications Series on Testing and Assessment No.54. ENV/JM/MONO(2006)18
|
|
(28)
|
OCDE (2012). OECD Conceptual Framework for Testing and Assessment of Endocrine Disrupters (revised). Annex I to Draft Guidance Document on Standardised Test Guidelines for Evaluating Chemicals for Endocrine Disruption. Series on Testing and Assessment No 150. ENV/JM/MONO(2012)22
|
Apéndice 1
Abreviaturas y definiciones
Sustancia
: Sustancia o mezcla.
CV
: Coeficiente de variación.
ELISA
: Enzimoinmunoanálisis de adsorción.
Tasa de carga
: Peso húmedo de los peces por volumen de agua.
Densidad de población
: Número de peces por volumen de agua.
VTG (vitelogenina)
: Fosfolipoglucoproteína precursora de la proteína de la yema de huevo que normalmente se produce en las hembras sexualmente activas de todas las especies ovíparas.
Eje HPG
: Eje hipotálamo-hipófisis-gónadas.
MTC
: Concentración máxima tolerada, que constituye aproximadamente el 10 % de LC50.
Sustancia problema
: Toda sustancia o mezcla estudiada con este método de ensayo.
Apéndice 2
Condiciones experimentales para el ensayo de cribado endocrino de peces
|
|
Pez cabeza gorda
(Pimephales romelas)
|
Medaka
(Oryzias latipes)
|
Pez cebra
(Danio rerio)
|
|
|
Dinámico
|
Dinámico
|
Dinámico
|
|
|
25 ± 2 °C
|
25 ± 2 °C
|
26 ± 2 °C
|
|
4.
|
Calidad de la iluminación
|
|
Bombillas fluorescentes (amplio espectro)
|
Bombillas fluorescentes (amplio espectro)
|
Bombillas fluorescentes (amplio espectro)
|
|
|
10-20 μE/m2/s, 540-1 000 lux o 50-100 ft-c (niveles ambiente de laboratorio)
|
10-20 μE/m2/s, 540-1 000 lux o 50-100 ft-c (niveles ambiente de laboratorio)
|
10-20 μE/m2/s, 540-1 000 lux o 50-100 ft-c (niveles ambiente de laboratorio)
|
|
6.
|
Fotoperiodo (las transiciones del amanecer o del anochecer son opcionales; sin embargo, no se han considerado necesarias)
|
|
16 h de luz, 8 h de oscuridad
|
12-16 h de luz, 12-8 h de oscuridad
|
12-16 h de luz, 12-8 h de oscuridad
|
|
|
< 5 g por l
|
< 5 g por l
|
< 5 g por l
|
|
8.
|
Tamaño del recipiente de ensayo
|
|
10 l (mínimo)
|
2 l (mínimo)
|
5 l (mínimo)
|
|
9.
|
Volumen de la solución de ensayo
|
|
8 l (mínimo)
|
1,5 l (mínimo)
|
4 l (mínimo)
|
|
10.
|
Sustituciones de volumen de las soluciones de ensayo
|
|
6 diarias como mínimo
|
5 diarias como mínimo
|
5 diarias como mínimo
|
|
11.
|
Edad de los organismos de ensayo
|
|
Véase el punto 20.
|
Véase el punto 20.
|
Véase el punto 20.
|
|
12.
|
Peso húmedo aproximado de los peces adultos (g)
|
|
Hembras: 1,5 ± 20 %
Machos: 2,5 ± 20 %
|
Hembras: 0,35 ± 20 %
Machos: 0,35 ± 20 %
|
Hembras: 0,65 ± 20 %
Machos: 0,4 ± 20 %
|
|
13.
|
Número de peces por recipiente de ensayo
|
|
6 (2 machos y 4 hembras)
|
10 (5 machos y 5 hembras)
|
10 (5 machos y 5 hembras)
|
|
14.
|
Número de tratamientos
|
|
= 3 (más los controles correspondientes)
|
= 3 (más los controles correspondientes)
|
= 3 (más los controles correspondientes)
|
|
15.
|
Número de recipientes por tratamiento
|
|
4 como mínimo
|
2 como mínimo
|
2 como mínimo
|
|
16.
|
Número de peces por concentración de ensayo
|
|
16 hembras adultas y 8 machos (4 hembras y 2 machos en cada recipiente replicado)
|
10 hembras adultas y 10 machos (5 hembras y 5 machos en cada recipiente replicado)
|
10 hembras adultas y 10 machos (5 hembras y 5 machos en cada recipiente replicado)
|
|
17.
|
Régimen de alimentación
|
|
Adultos o nauplios vivos o congelados de artemia salina dos o tres veces al día (ad libitum), alimentos disponibles comercialmente o una combinación de las opciones mencionadas
|
Nauplios de artemia salina dos o tres veces al día (ad libitum), alimentos disponibles comercialmente o una combinación de las opciones mencionadas
|
Nauplios de artemia salina dos o tres veces al día (ad libitum), alimentos disponibles comercialmente o una combinación de las opciones mencionadas
|
|
|
Ninguna, a menos que la concentración de OD sea inferior al 60 % de la saturación del aire
|
Ninguna, a menos que la concentración de OD sea inferior al 60 % de la saturación del aire
|
Ninguna, a menos que la concentración de OD sea inferior al 60 % de la saturación del aire
|
|
|
Agua superficial limpia, de pozo o reconstituida, o agua corriente desclorada
|
Agua superficial limpia, de pozo o reconstituida, o agua corriente desclorada
|
Agua superficial limpia, de pozo o reconstituida, o agua corriente desclorada
|
|
20.
|
Periodo de preexposición
|
|
Se recomiendan 7 días
|
Se recomiendan 7 días
|
Se recomiendan 7 días
|
|
21.
|
Duración de la exposición a la sustancia
|
|
21 días
|
21 días
|
21 días
|
|
22.
|
Parámetros biológicos
|
|
Supervivencia
Comportamiento
Caracteres sexuales secundarios
VTG
|
Supervivencia
Comportamiento
Caracteres sexuales secundarios
VTG
|
Supervivencia
Comportamiento
VTG
|
|
23.
|
Aceptabilidad del ensayo
|
|
Oxígeno disuelto > 60 % de saturación; temperatura media de 25 ± 2 °C; 90 % de supervivencia de los peces en los controles; concentraciones medidas del ensayo dentro del 20 % de las medias medidas por nivel de tratamiento.
|
Oxígeno disuelto > 60 % de saturación; temperatura media de 24 ± 2 °C; 90 % de supervivencia de los peces en los controles; concentraciones medidas del ensayo dentro del 20 % de las medias medidas por nivel de tratamiento.
|
Oxígeno disuelto > 60 % de saturación; temperatura media de 26 ± 2 °C; 90 % de supervivencia de los peces en los controles; concentraciones medidas del ensayo dentro del 20 % de las medias medidas por nivel de tratamiento.
|
Apéndice 3
Características químicas de un agua de dilución aceptable
|
Componente
|
CONCENTRACIONES
|
|
Partículas
|
< 20 mg/l
|
|
Carbono orgánico total
|
< 2 mg/l
|
|
Amoníaco no ionizado
|
< 1 μg/l
|
|
Cloro residual
|
< 10 μg/l
|
|
Plaguicidas organofosforados totales
|
< 50 ng/l
|
|
Plaguicidas organoclorados totales y bifenilos policlorados
|
< 50 ng/l
|
|
Cloro orgánico total
|
< 25 ng/l
|
Apéndice 4A
SUSTRATO DE DESOVE DEL PEZ CEBRA
Bandeja de desove
: cualquier placa de instrumentos de vidrio; por ejemplo, 22 × 15 × 5,5 cm (largo x ancho x fondo), cubiertos con una rejilla de alambre de acero inoxidable extraíble (2 mm de abertura de malla). La rejilla debe cubrir la placa de instrumentos por debajo del nivel del borde.

El sustrato de desove debe estar fijado a la rejilla; debe proporcionar una estructura en la que los peces puedan introducirse. Por ejemplo, son adecuadas las plantas artificiales de acuario hechas de material plástico de color verde (Nota: Debe tenerse en cuenta la posible adsorción de la sustancia problema al material de plástico). El material de plástico debe lixiviarse en un volumen suficiente de agua caliente durante un tiempo para garantizar que no pasan sustancias al agua del ensayo. Cuando se utilicen materiales de vidrio, hay que asegurarse de que los peces no puedan resultar heridos ni quedar hacinados durante sus acciones vigorosas.
La distancia entre la bandeja y los paneles de vidrio debe ser de 3 cm como mínimo para garantizar que el desove no se realice fuera de la bandeja. Los huevos desovados en la bandeja caen a través de la rejilla y se puede recoger una muestra entre 45 y 60 minutos después de activar la iluminación. Los huevos transparentes no se adhieren y se pueden contar fácilmente con luz transversal. Cuando se utilicen cinco hembras por recipiente, una cantidad de hasta veinte huevos diarios puede considerarse una cifra baja, una cantidad de hasta 100 huevos se considera una cifra intermedia y una cantidad superior a 100 se considera una cifra alta. La bandeja de desove se retira para recoger los huevos, y se vuelve a introducir en el recipiente de ensayo, lo más tarde posible por la tarde o muy temprano por la mañana. El tiempo transcurrido hasta la reintroducción no debe superar una hora ya que, de lo contrario, la señal del sustrato de desove puede inducir algún apareamiento y desove a una hora poco habitual. Si la situación requiriera una introducción posterior de la bandeja de desove, debería hacerse al menos nueve horas después de activar la iluminación. A esta última hora del día ya no se induce el desove.
Apéndice 4B
Sustrato de desove del pez cabeza gorda
En cada recipiente de ensayo se colocan dos o tres tejas y bandejas de desove combinadas de plástico/cerámica/vidrio o de acero inoxidable (por ejemplo, un canalón semicircular gris de 80 mm de largo colocado sobre una bandeja con borde de 130 mm de largo) (véase la imagen). Ha quedado demostrado que las tejas de PVC o cerámica bien preparadas resultan adecuadas como sustrato de desove (Thorpe et al., 2007).
Se recomienda someter a abrasión las tejas para mejorar la adherencia. La bandeja también debe controlarse para evitar que los peces accedan a los huevos que hayan caído, a menos que la eficiencia de la adherencia de los huevos haya quedado demostrada en el sustrato de desove utilizado.

La base se ha diseñado para contener los huevos que no se adhieran a la superficie de la teja y que, por lo tanto, caigan al fondo del depósito (o los huevos que directamente se coloquen en la base de plástico plana). Todos los sustratos de desove deben lixiviarse durante 12 horas como mínimo, con agua de dilución, antes de usarse.
BIBLIOGRAFÍA
Thorpe KL, Benstead R, Hutchinson TH, Tyler CR, 2007. An optimised experimental test procedure for measuring chemical effects on reproduction in the fathead minnow, Pimephales promelas. Aquatic Toxicology, 81, 90–98.
Apéndice 5A
EVALUACIÓN DE LOS CARACTERES SEXUALES SECUNDARIOS EN EL PEZ CABEZA GORDA PARA LA DETECCIÓN DE DETERMINADAS SUSTANCIAS CON ACTIVIDAD ENDOCRINA
Descripción general
Entre las características potencialmente importantes del aspecto físico de los peces cabeza gorda adultos en los ensayos sobre alteradores endocrinos se incluyen el color del cuerpo (es decir, claro u oscuro), los modelos de coloración (es decir, la presencia o ausencia de franjas verticales), la forma del cuerpo (es decir, forma de la zona de la cabeza y del pecho, distensión del abdomen) y caracteres sexuales secundarios específicos (es decir, número y tamaño de tubérculos nupciales, tamaño de la almohadilla dorsal y ovipositor).
Los tubérculos nupciales se encuentran en la cabeza (almohadilla dorsal) de los peces cabeza gorda macho con actividad reproductiva y, habitualmente, están dispuestos siguiendo un modelo simétrico bilateral (Jensen et al. 2001). Las hembras de control y los machos y hembras juveniles no presentan desarrollo de tubérculos (Jensen et al. 2001). Puede haber hasta ocho tubérculos distintos alrededor de los ojos y entre las narinas de los machos. Los tubérculos más abundantes y de mayor tamaño se encuentran en dos líneas paralelas que aparecen justo debajo de las narinas y encima de la boca. Muchos peces tienen grupos de tubérculos debajo de la mandíbula inferior; los que más cerca están de la boca aparecen, en general, en forma de par simple, mientras que los de posición más ventral pueden estar formados hasta por cuatro tubérculos. El número real de tubérculos rara vez supera los 30 (rango, 18-28; Jensen et al. 2001). Los tubérculos predominantes (en términos de número) aparecen como una estructura individual y relativamente redonda, con una altura que equivale aproximadamente al radio. Los machos con mayor actividad reproductiva también tienen, al menos algunos, tubérculos que engrosan y protruyen de forma que no pueden diferenciarse como estructuras individuales.
Algunos tipos de sustancias que alteran la actividad endocrina pueden provocar la aparición anómala de determinados caracteres sexuales secundarios en el sexo opuesto; por ejemplo, los agonistas de receptores de andrógenos, como la 17beta-metiltestosterona o la 17beta-trembolona, pueden provocar que los peces cabeza gorda hembra desarrollen tubérculos nupciales (Smith 1974; Ankley et al. 2001; 2003), mientras que los agonistas de receptores de estrógenos pueden reducir el número o el tamaño de los tubérculos nupciales en los machos (Miles-Richardson et al. 1999; Harries et al. 2000).
A continuación se presenta una descripción de la caracterización de los tubérculos nupciales en el pez cabeza gorda, con arreglo a los procedimientos utilizados en el laboratorio de la Agencia de Protección del Medio Ambiente de Estados Unidos, ubicado en Duluth, Minnesota. Algunos productos o equipos específicos se pueden sustituir por materiales comparables disponibles.
La mejor visualización se logra con una lupa iluminada o con un microscopio de disección iluminado 3X. Observe los peces en posición dorsal, con la parte anterior hacia delante (con la cabeza orientada hacia el observador).
|
a)
|
Coloque los peces en una placa de Petri pequeña (por ejemplo, de 100 mm de diámetro), con la parte anterior hacia delante y la ventral hacia abajo. Enfoque el visor para permitir la identificación de los tubérculos. Suave y lentamente, gire los peces de un lado a otro para identificar las zonas de los tubérculos. Cuente y clasifique los tubérculos.
|
|
b)
|
Repita esta observación en la superficie ventral de la cabeza colocando el pez sobre la cara dorsal, con la parte anterior hacia delante en la placa de Petri.
|
|
c)
|
Las observaciones deben llevarse a cabo en dos minutos con cada pez.
|
Recuento y clasificación de tubérculos
Se han determinado seis áreas concretas para evaluar la presencia y el desarrollo de tubérculos en peces cabeza gorda adultos. Se ha elaborado una plantilla para cartografiar la ubicación y la cantidad de los tubérculos presentes (véase el final de este apéndice). Se registra el número de tubérculos y su tamaño puede clasificarse cuantitativamente de la siguiente manera: 0: ausencia; 1: presente; 2: agrandado y 3: pronunciado, para cada organismo (véase la figura 1).
Tipo 0: ausencia de tubérculos. Tipo 1: presente, que se asigna cuando algún tubérculo tiene un solo punto cuya altura sea casi equivalente a su radio (diámetro). Tipo 2: agrandado, que se asigna cuando hay tejido que se parece a un asterisco, habitualmente con una gran base radial con ranuras o surcos que salen del centro. La altura de los tubérculos suele ser más irregular, pero a veces pueden presentar una forma redondeada. Tipo 3: pronunciado; habitualmente son bastante grandes y redondeados con una estructura menos definida. En ocasiones, estos tubérculos se unen y forman una sola masa en torno a una sola área o una combinación de áreas (B, C y D, que se describen a continuación). El color y el diseño son similares a los del tipo 2, pero, en ocasiones, son bastante indiscriminados. Con este sistema de puntuación, el resultado será, en general, una clasificación de tubérculos inferior a 50 en un macho de control normal con un recuento de tubérculos de 18 a 20 (Jensen et al. 2001).
Figura 1

El número real de tubérculos en algunos peces puede ser superior al de los recuadros de la plantilla (apéndice A) en un área de clasificación determinada. En tal caso, pueden marcarse otros números de clasificación a la derecha o a la izquierda del recuadro. Por lo tanto, no es necesario que la plantilla sea simétrica. Otra técnica para la cartografía de los tubérculos que se emparejan o unen verticalmente a lo largo del plano horizontal de la boca consiste en el doble marcado de dos puntos de clasificación de los tubérculos en un mismo recuadro.
Regiones de cartografía:
A— Tubérculos situados alrededor del ojo. Ubicación dorsal a ventral alrededor del borde anterior del ojo. Habitualmente múltiples en los machos de control maduros, no presentes en las hembras de control y, en general, en parejas (uno cerca de cada ojo) o aislados en las hembras expuestas a andrógenos.
B— Tubérculos situados entre las narinas (poros de los canales sensoriales). Normalmente, en parejas en los machos de control a niveles más altos de desarrollo (2: agrandado o 3: pronunciado). No están presentes en las hembras de control y presentan una cierta incidencia y desarrollo en las hembras expuestas a andrógenos.
C— Tubérculos situados en posición inmediatamente anterior a las narinas en paralelo con la boca. Generalmente agrandados o pronunciados en los machos de control maduros. Presentes o agrandados en los machos menos desarrollados o en las hembras tratadas con andrógenos.
D— Tubérculos situados en paralelo con la línea de la boca. En general, se clasifican como desarrollados en los machos de control. Ausentes en las hembras de control, pero presentes en las hembras expuestas a andrógenos.
E— Tubérculos situados en la mandíbula inferior, cerca de la boca, por lo general pequeños y habitualmente en parejas. Varían en los machos de control o tratados y en las hembras tratadas.
F— Tubérculos situados en posición ventral con respecto a la región E. Habitualmente son pequeños y aparecen en parejas. Presentes en los machos de control y en las hembras expuestas a andrógenos.
BIBLIOGRAFÍA
|
(1)
|
Ankley GT, Jensen KM, Kahl MD, Korte JJ, Makynen ME. 2001. Description and evaluation of a short-term reproduction test with the fathead minnow (Pimephales promelas). Environ Toxicol Chem 20:1276-1290.
|
|
(2)
|
Ankley GT, Jensen KM, Makynen EA, Kahl MD, Korte JJ, Hornung MW, Henry TR, Denny JS, Leino RL, Wilson VS, Cardon MC, Hartig PC, Gray EL. 2003. Effects of the androgenic growth promoter 17-β trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environ Toxicol Chem 22:1350-1360.
|
|
(3)
|
Harries JE, Runnalls T, Hill E, Harris CA,Maddix S, Sumpter JP, Tyler CR. 2000. Development of a reproductive performance test for endocrine disrupting chemicals using pair-breeding fathead minnows (Pimephales promelas). Environ Sci Technol 34:3003-3011.
|
|
(4)
|
Jensen KM, Korte JJ, Kahl MD, Pasha MS, Ankley GT. 2001. Aspects of basic reproductive biology and endocrinology in the fathead minnow (Pimephales promelas). Comp Biochem Physiol C 128:127-141.
|
|
(5)
|
Kahl MD, Jensen KM, Korte JJ, Ankley GT. 2001. Effects of handling on endocrinology and reproductive performance of the fathead minnow. J Fish Biol 59:515-523.
|
|
(6)
|
Miles-Richardson SR, Kramer VJ, Fitzgerald SD, Render JA, Yamini B, Barbee SJ, Giesy JP. 1999. Effects of waterborne exposure of 17-estradiol on secondary sex characteristics and gonads of fathead minnows (Pimephales promelas). Aquat Toxicol 47:129-145.
|
|
(7)
|
Smith RJF. 1974. Effects of 17-methyltestosterone on the dorsal pad and tubercles of fathead minnows (Pimephales promelas). Can J Zool 52:1031-1038.
|
|
Plantilla de tubérculos
|
Clasificación numérica
|
|
ID
|
1: presente
|
|
Fecha
|
2: agrandado
|
|
Puntuación total
|
3: pronunciado
|
|
|
C
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
|
|
D
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
Apéndice 5B
Evaluación de los caracteres sexuales secundarios en el medaka para la detección de determinadas sustancias con actividad endocrina
A continuación se presenta una descripción de la medición de los tubérculos papilares (21), que constituyen los caracteres sexuales secundarios del medaka (Oryzias latipes).
|
1)
|
Tras la extirpación del hígado (apéndice 6), el cadáver se coloca en un tubo cónico que contiene aproximadamente 10 ml de formol tamponado neutro al 10 % (arriba la cabeza y abajo la cola). Si la gónada se fija con una solución distinta al formol tamponado neutro al 10 %, con una cuchilla realice un corte transversal en el cadáver entre la región anterior de la aleta anal y el ano, con cuidado de no dañar el gonoporo y la propia gónada (fig. 3). Coloque la parte craneal del cuerpo del pez en la solución de fijación para conservar la gónada y la parte caudal del cuerpo del pez en el formol tamponado neutro al 10 %, tal y como se ha descrito anteriormente.
|
|
2)
|
Tras colocar el cuerpo del pez en formol tamponado neutro al 10 %, sujete la región anterior de la aleta anal con unas pinzas y dóblela durante unos 30 segundos para mantener abierta la aleta anal. Al sujetar la aleta anal con las pinzas, agarre varios radios de la aleta de la región anterior, con cuidado de no provocar arañazos en los tubérculos papilares.
|
|
3)
|
Tras mantener abierta la aleta anal durante 30 segundos aproximadamente, conserve el cuerpo del pez en formol tamponado neutro al 10 % a temperatura ambiente hasta que se lleve a cabo la medición de los tubérculos papilares (la medición debe realizarse cuando hayan trascurrido como mínimo 24 horas desde la fijación).
|
Medición
|
1)
|
Tras fijar el cuerpo del pez en formol tamponado neutro al 10 % durante 24 horas como mínimo, tome el cadáver del pez del tubo cónico y retire el formol con un papel de filtro (o una servilleta de papel).
|
|
2)
|
Coloque el pez con el abdomen orientado hacia arriba. A continuación, corte con cuidado la aleta anal con unas tijeras pequeñas de disección (es preferible cortar la aleta anal con una pequeña cantidad de pterigióforo).
|
|
3)
|
Tome la región anterior de la aleta anal cortada con ayuda de unas pinzas y colóquela en un portaobjetos de vidrio con unas cuantas gotas de agua. A continuación, cubra la aleta anal con un cubreobjetos de vidrio. Asegúrese de no provocar arañazos en los tubérculos papilares al agarrar la aleta anal con las pinzas.
|
|
4)
|
Cuente el número de segmentos de los radios con tubérculos papilares con ayuda del contador en un microscopio biológico (microscopio vertical o invertido). Los tubérculos papilares se reconocen cuando se puede ver una pequeña formación de procesos en el margen posterior del segmento. Anote en la hoja de cálculo el número de segmentos con tubérculos papilares en cada radio de la aleta (por ejemplo, primer radio de la aleta: 0; segundo radio de la aleta: 10; tercer radio de la aleta: 12, etc.), e introduzca en la hoja de cálculo de Excel la suma de estas cantidades para cada pez. En caso necesario, haga una fotografía de la aleta anal y cuente el número de segmentos con tubérculos papilares que aparecen en la fotografía.
|
|
5)
|
Después de la medición, coloque la aleta anal en el tubo cónico que se describe en el punto 1 y consérvela.
|
Fig. 1.
Diagrama que muestra las diferencias sexuales en la forma y el tamaño de la aleta anal. A: macho; B: hembra. Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Universidad de Tokio, IV, 2: 209-218.

Fig. 2.
A: Tubérculos en los segmentos de unión del radio de la aleta anal. J.P.: segmento: A.S.: espacio axial; P.: tubérculo. B: extremidad distal del radio de la aleta. En el extremo hay actinotricos. Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Universidad de Tokio, IV, 2: 209-218.

Fig. 3.
Fotografía del cuerpo de un pez que muestra el lugar del corte cuando la gónada se fija con una solución de fijación distinta al formol tamponado neutro al 10 %. En ese caso, el resto del cuerpo se cortará entre la región anterior de la aleta anal y la región anal con una cuchilla (línea roja) y la parte de la cabeza del cuerpo del pez se introducirá en la solución de fijación para la gónada y la parte de la cola del cuerpo del pez se introducirá en el formol tamponado neutro al 10 %.

Apéndice 6
Procedimientos recomendados para la recogida de muestras para el análisis de vitelogenina
Se debe tener cuidado para evitar la contaminación cruzada entre las muestras de VTG de machos y hembras.
Procedimiento 1A: Pez cabeza gorda, extracción de sangre de la vena o la arteria caudal
Tras anestesiar, el pedúnculo caudal se corta parcialmente con una hoja de bisturí y se extrae sangre de la vena o la arteria caudal con un tubo capilar para microhematocrito heparinizado. Una vez recogida la sangre, el plasma se aísla rápidamente mediante centrifugado durante 3 minutos a 15 000 g (o, de manera alternativa, durante 10 minutos a 15 000 g a 4 °C). Si se desea, se puede determinar el porcentual hematocrito después del centrifugado. A continuación, se retira la parte de plasma del tubo para microhematocrito y se conserva en un tubo de centrífuga con 0,13 unidades de aprotinina (inhibidor de la proteasa) a – 80 °C hasta que pueda determinarse la vitelogenina. Según el tamaño del pez cabeza gorda (en función del sexo), los volúmenes de plasma que se pueden recoger oscilan, en general, entre 5 y 60 microlitros por pez (Jensen et al. 2001).
Procedimiento 1B: Pez cabeza gorda, extracción de sangre del corazón
También se puede recoger sangre mediante punción cardíaca mediante una jeringa heparinizada (1 000 unidades de heparina por ml). La sangre se transfiere a tubos Eppendorf (que se han mantenido en hielo) y, a continuación, se centrifugan (5 min, 7 000 g, a temperatura ambiente). El plasma debe transferirse a tubos Eppendorf limpios (en partes alícuotas si el volumen del plasma lo permite) y congelarse de inmediato a – 80 °C hasta que se analice (Panter et al., 1998).
Procedimiento 2A: Medaka, extirpación del hígado del medaka
Extraiga los peces del ensayo del recipiente de ensayo.
|
1)
|
Los peces del ensayo deben extraerse del recipiente de ensayo con la red cuchara pequeña. Tenga cuidado de no dejar caer los peces del ensayo en otros recipientes.
|
|
2)
|
En principio, los peces del ensayo deben extraerse en el orden siguiente: control, control de disolvente (si procede), concentración más baja, concentración media, concentración más alta y control positivo. Además, deben extraerse todos los machos de una cámara de ensayo antes de extraer el resto de hembras.
|
|
3)
|
El sexo de cada uno de los peces del ensayo se determina con arreglo a los caracteres sexuales secundarios externos (por ejemplo, la forma de la aleta anal).
|
|
4)
|
Coloque los peces del ensayo en un recipiente de transporte y llévelo al puesto de trabajo para proceder a la extirpación del hígado. Verifique que las etiquetas del recipiente de ensayo y del recipiente de transporte sean correctas y para confirmar que el número de peces extraídos del recipiente de ensayo y el número de peces que quedan en dicho recipiente coincidan con los números previstos.
|
|
5)
|
Si no se pudiera determinar el sexo mediante el aspecto externo de los peces, extraiga todos los peces de la cámara de ensayo. En ese caso, el sexo deberá determinarse mediante la observación de la gónada o de los caracteres sexuales secundarios con un microscopio estereoscópico.
|
Extirpación del hígado
|
1)
|
Transfiera el pez del ensayo desde el recipiente de transporte a la solución anestésica con la red cuchara pequeña.
|
|
2)
|
Una vez anestesiado, transfiera el pez del ensayo al papel de filtro (o una servilleta de papel) con unas pinzas (de tipo normal). Al agarrar el pez del ensayo, coloque las pinzas a los lados de la cabeza para evitar que se rompa la cola.
|
|
3)
|
Retire el agua de la superficie del pez del ensayo con el papel de filtro (o la servilleta de papel).
|
|
4)
|
Coloque el pez con el abdomen orientado hacia arriba. A continuación, realice una pequeña incisión transversal a medio camino entre la región ventral del cuello y la región media del abdomen con ayuda de unas tijeras de disección.
|
|
5)
|
Introduzca las tijeras de disección en la pequeña incisión y realice una incisión en el abdomen desde un punto posterior a la cavidad branquial hasta la cara interior del ano y a lo largo de la línea media del abdomen. Tenga cuidado de no introducir las tijeras de disección a demasiada profundidad para evitar daños en el hígado y la gónada.
|
|
6)
|
Realice las siguientes operaciones con un microscopio estereoscópico.
|
|
7)
|
Coloque el pez del ensayo con el abdomen orientado hacia arriba sobre la servilleta de papel (también se pueden utilizar placas de Petri o portaobjetos de vidrio).
|
|
8)
|
Extienda las paredes de la cavidad abdominal con unas pinzas de precisión hasta que se expongan los órganos internos. Si es necesario, también se pueden exponer los órganos internos retirando un lado de la pared de la cavidad abdominal.
|
|
9)
|
Exponga la parte unida del hígado y de la vesícula biliar con otras pinzas de precisión. A continuación, sujete el conducto biliar y desprenda la vesícula con un corte. Tenga cuidado para no romper la vesícula.
|
|
10)
|
Sujete el esófago y separe el tubo gastrointestinal del hígado de la misma manera. Tenga cuidado para que no se salga el contenido del tubo gastrointestinal. Separe el tracto gastrointestinal caudal del ano y extraiga el tubo de la cavidad abdominal.
|
|
11)
|
Recorte la masa de grasa y otros tejidos del entorno del hígado. Tenga cuidado de no arañar el hígado.
|
|
12)
|
Sujete el área del hilio hepático con las pinzas de precisión y extraiga el hígado de la cavidad abdominal.
|
|
13)
|
Coloque el hígado en el portaobjetos de vidrio. Con ayuda de las pinzas de precisión, retire los eventuales restos de grasa y tejidos externos (por ejemplo, la mucosa abdominal) de la superficie del hígado, si fuera necesario.
|
|
14)
|
Mida el peso del hígado con un microtubo de 1,5 ml como tara con una balanza analítica electrónica. Registre el valor en la hoja de cálculo (precisión de: 0,1 mg). Confirme la información de identificación de la etiqueta del microtubo.
|
|
15)
|
Cierre el tapón del microtubo que contiene el hígado. Guárdelo en una gradilla de refrigeración (o una gradilla con hielo).
|
|
16)
|
Tras extirpar un hígado, limpie los instrumentos de disección o sustitúyalos por otros que estén limpios.
|
|
17)
|
Extirpe los hígados de todos los peces del recipiente de transporte, tal y como se ha descrito anteriormente.
|
|
18)
|
Una vez que se haya extirpado el hígado de todos los peces del contenedor de transporte (es decir, todos los machos o las hembras de un recipiente de ensayo), coloque todas las muestras de hígado en una gradilla para tubos con una etiqueta de identificación y guárdelas en un congelador. Cuando los hígados se vayan a someter a un pretratamiento poco después de la extirpación, las muestras se llevan al puesto de trabajo más próximo en una gradilla de refrigeración (o una gradilla con hielo).
|
Tras la extirpación del hígado, el cadáver del pez puede utilizarse para medir los caracteres sexuales secundarios.
Muestra
Guarde las muestras hepáticas recogidas de los peces del ensayo a ≤ – 70 °C si no van a utilizarse en un pretratamiento poco después de la extirpación.
Fig. 1
Se hace una incisión con unas tijeras justo en la zona anterior a las aletas pectorales.

Fig. 2
Se realiza una incisión en la línea media del abdomen con las tijeras hasta un punto aproximadamente 2 mm anterior al ano.
Fig. 3
Las paredes abdominales se extienden con unas pinzas para exponer el hígado y otros órganos internos. (Otra posibilidad es sujetar lateralmente las paredes abdominales).

Fig. 4
El hígado se somete a disección roma y se extirpa con pinzas.

Fig. 5
Se tira levemente con fórceps de los intestinos.

Fig. 6
Los dos extremos de los intestinos y los eventuales elementos mesentéricos se cortan con unas tijeras.

Fig. 7 (hembra)
El procedimiento es idéntico con la hembra.
Fig. 8
El procedimiento una vez finalizado.

Procedimiento 2 B: Medaka (Oryzias latipes), pretratamiento del hígado para el análisis de la vitelogenina.
Tome el frasco de tampón de homogeneización del juego ELISA y enfríelo con hielo picado (temperatura de la solución: ≤ 4 °C). Si se utiliza el tampón de homogeneización del sistema ELISA EnBio, descongele la solución a temperatura ambiente y, a continuación, enfríe el frasco con hielo picado.
Calcule el volumen del tampón de homogeneización para el hígado con arreglo a su peso (añada 50 μl de tampón de homogeneización por cada mg de peso del hígado para su homogeneización). Por ejemplo, si el hígado pesa 4,5 mg, el volumen de tampón de homogeneización para el hígado será de 225 μl. Prepare una lista de volúmenes de tampón de homogeneización para todos los hígados.
Preparación del hígado para el pretratamiento
|
1)
|
Justo antes del pretratamiento, saque del congelador el microtubo de 1,5 ml que contiene el hígado.
|
|
2)
|
El pretratamiento del hígado de los machos debe realizarse antes del de las hembras para evitar la contaminación con vitelogenina. Además, el pretratamiento de los grupos del ensayo debe realizarse en el orden siguiente: control, control de disolvente (si procede), concentración más baja, concentración media, concentración más alta y control positivo.
|
|
3)
|
El número de microtubos de 1,5 ml que contienen muestras de hígado y que se extraen del congelador en un momento determinado no debe superar al número de microtubos que se puedan centrifugar en ese momento.
|
|
4)
|
Disponga los microtubos de 1,5 ml con las muestras hepáticas siguiendo el orden del número de muestra de la gradilla con hielo (no es necesario descongelar el hígado).
|
Realización del pretratamiento
1. Adición del tampón de homogeneizado
|
1)
|
Compruebe en la lista el volumen del tampón de homogeneización que debe utilizarse para una muestra concreta de hígado y ajuste la micropipeta (intervalo de volumen: 100 - 1 000 μl) al volumen correspondiente. Coloque una punta limpia en la micropipeta.
|
|
2)
|
Tome el tampón de homogeneización del frasco de reactivo y añada el tampón al microtubo de 1,5 ml que contiene el hígado.
|
|
3)
|
Añada el tampón de homogeneización a todos los microtubos de 1,5 ml que contienen el hígado siguiendo el procedimiento descrito anteriormente. No es necesario cambiar la punta de la micropipeta por una nueva. No obstante, si la punta se contamina o se cree que puede estar contaminada, debe reemplazarse.
|
2. Homogeneización del hígado
|
1)
|
Conecte una nueva mano de mortero de homogeneización al homogeneizador de microtubos.
|
|
2)
|
Introduzca la mano de mortero en el microtubo de 1,5 ml. Sujete el homogeneizador de microtubos para comprimir el hígado entre la superficie de la mano de mortero y la pared interior del microtubo de 1,5 ml.
|
|
3)
|
Ponga en marcha el homogeneizador de microtubos entre 10 y 20 segundos. Enfríe el microtubo de 1,5 ml con hielo picado durante la operación.
|
|
4)
|
Levante la mano de mortero del microtubo de 1,5 ml y déjelo en reposo durante unos 10 segundos. A continuación, realice una comprobación visual del estado de la suspensión.
|
|
5)
|
Si se observan trozos de hígado en la suspensión, repita las operaciones 3 y 4 para preparar de forma satisfactoria el homogeneizado de hígado.
|
|
6)
|
Enfríe el homogeneizado de hígado suspendido en la gradilla con hielo hasta su centrifugado.
|
|
7)
|
Cambie la mano de mortero por una nueva para cada homogeneizado.
|
|
8)
|
Realice el homogeneizado de todos los hígados con el tampón de homogeneización de acuerdo con el procedimiento descrito anteriormente.
|
3. Centrifugado del homogeneizado de hígado suspendido
|
1)
|
Confirme que la temperatura de la cámara de centrifugado refrigerada es ≤ 5 °C.
|
|
2)
|
Inserte los microtubos de 1,5 ml que contienen el homogeneizado de hígado suspendido en una centrífuga refrigerada (en caso necesario, ajuste el equilibrio).
|
|
3)
|
Centrifugue el homogeneizado de hígado suspendido a 13 000 g durante 10 minutos a ≤ 5 °C. No obstante, si los sobrenadantes se separan correctamente, el tiempo y la fuerza centrífuga podrán ajustarse según resulte necesario.
|
|
4)
|
Tras el centrifugado, verifique que los sobrenadantes estén debidamente separados (superficie: lípidos; capa intermedia: sobrenadantes; capa inferior: tejido hepático). Si la separación no es correcta, centrifugue de nuevo la suspensión en las mismas condiciones.
|
|
5)
|
Retire todas las muestras de la centrífuga refrigerada y dispóngalas siguiendo el orden de número de muestra en la gradilla con hielo. Tenga cuidado de no volver a suspender cada capa separada después del centrifugado.
|
4. Recogida de los sobrenadantes
|
1)
|
Coloque cuatro microtubos de 0,5 ml para el almacenamiento del sobrenadante en la gradilla de tubos.
|
|
2)
|
Aspire 30 μl de cada sobrenadante (separado en forma de capa intermedia) con la micropipeta y páselos a un microtubo de 0,5 ml. Tenga cuidado de no aspirar los lípidos de la superficie ni el tejido hepático de la capa inferior.
|
|
3)
|
Aspire el sobrenadante y páselo a dos microtubos más de 0,5 ml de la misma manera que se ha descrito anteriormente.
|
|
4)
|
Aspire el resto del sobrenadante con la micropipeta (si es posible: ≥ 100 μl). A continuación, pase el sobrenadante al microtubo de 0,5 ml restante. Tenga cuidado de no aspirar los lípidos de la superficie ni el tejido hepático de la capa inferior.
|
|
5)
|
Cierre el tapón del microtubo de 0,5 ml y anote el volumen de sobrenadante en la etiqueta. A continuación, enfríe inmediatamente los microtubos en la gradilla con hielo.
|
|
6)
|
Cambie la punta de la micropipeta por una nueva para cada sobrenadante. Si se adhiere a la punta una gran cantidad de lípidos, cámbiela inmediatamente por una nueva para evitar la contaminación del extracto de hígado con grasa.
|
|
7)
|
Pase todo el sobrenadante centrifugado a cuatro microtubos de 0,5 ml de acuerdo con el procedimiento descrito anteriormente.
|
|
8)
|
Tras pasar el sobrenadante a los microtubos de 0,5 ml, colóquelos en la gradilla de tubos con su etiqueta de identificación y, a continuación, colóquelos inmediatamente en el congelador. Si las concentraciones de VTG se miden inmediatamente después del pretratamiento, mantenga refrigerado un microtubo de 0,5 ml (con 30 μl de sobrenadante) en la gradilla de tubos y transfiérala al puesto de trabajo en el que vaya a realizarse la prueba ELISA. En ese caso, coloque el resto de microtubos en las gradillas de tubos e introdúzcalas en el congelador.
|
|
9)
|
Tras recoger el sobrenadante, elimine el residuo de forma adecuada.
|
Almacenamiento de la muestra
Almacene los microtubos de 0,5 ml que contengan el sobrenadante del homogeneizado de hígado a ≤ – 70 °C hasta que se vayan a utilizar en la prueba ELISA.
Procedimiento 3A: Pez cebra, extracción de sangre de la vena o de la arteria caudal
Tras anestesiar, el pedúnculo caudal se corta transversalmente y se extrae sangre de la arteria o de la vena caudal con un tubo capilar para microhematocrito heparinizado. El volumen de sangre varía entre 5 y 15 μl según el tamaño del pez. Se añade al tubo microcapilar un volumen igual de tampón de aprotinina (6 μgml en PBS) y el plasma se separa de la sangre por centrifugado (5 minutos a 600 g). El plasma se recoge en los tubos de ensayo y se conserva a – 20 °C hasta que se analice para determinar la vitelogenina u otras proteínas de interés.
Procedimiento 3B: Pez cebra, extracción de sangre por punción cardíaca
Para evitar la coagulación de la sangre y el deterioro de la proteína, las muestras se recogen en un tampón con solución salina tamponada con fosfato (PBS) que contiene heparina (1 000 unidades/ml) y aprotinina inhibidora de la proteasa (2 TIU/ml). Se recomiendan la la sal amónica de la heparina y la aprotinina liofilizada como ingredientes del tampón. Para la recogida de las muestras de sangre se recomienda usar una jeringa (1 ml) con una aguja fina fija (por ejemplo, Braun Omnikan-F). La jeringa debe llenarse previamente con el tampón (aproximadamente 100 μl) para eluir completamente los pequeños volúmenes de sangre de cada pez. Las muestras de sangre se toman mediante punción cardíaca. En un primer momento, el pez debe anestesiarse con MS-222 (100 mg/l). El plano anestésico adecuado permite al usuario distinguir el latido del pez cebra. Mientras puncione el corazón, mantenga una ligera presión en el pistón de la jeringa. Los volúmenes de sangre que pueden extraerse oscilan entre los 20 y los 40 microlitros. Tras la punción cardíaca, la mezcla de tampón y sangre debe pasarse al tubo de ensayo. El plasma se separa de la sangre por centrifugado (20 min; 5 000 g) y debe conservarse a – 80 °C hasta que se necesite para realizar el análisis.
Procedimiento 3C: PNT: Pez cebra, homogeneización de la cabeza y la cola
|
1)
|
Los peces son anestesiados y sacrificados de conformidad con la descripción del ensayo.
|
|
2)
|
La cabeza y la cola se separan del cuerpo mediante sendos cortes de acuerdo con la figura 1.
|
Importante: Todos los instrumentos de disección y la tabla de corte deben enjuagarse y limpiarse a fondo (por ejemplo, con etanol al 96 %) entre cada uno de los peces para evitar que haya “contaminación con vitelogenina” de las hembras o entre los machos inducidos y los machos no inducidos.
Figura 1

|
3)
|
El peso de la cabeza y la cola juntas de cada pez se mide con precisión de un mg.
|
|
4)
|
Tras el pesaje, las partes se colocan en tubos adecuados (por ejemplo, Eppendorf de 1,5 ml) y se congelan a – 80 C hasta que se realice la homogeneización o se homogeneizan directamente con hielo con dos manos de mortero de plástico. (Se pueden utilizar otros métodos si estos se llevan a cabo con hielo y el resultado es una masa homogénea.) Importante: Los tubos deben numerarse correctamente de modo que la cabeza y la cola de los peces puedan correlacionarse con la parte correspondiente del cuerpo que se haya utilizado para la histología gonadal.
|
|
5)
|
Cuando se logra obtener una masa homogénea, se añade el tampón de homogenización (22) enfriado con hielo, con un peso que sea cuatro veces el peso del tejido. Siga trabajando con las manos de mortero hasta que la mezcla sea homogénea. Nota importante: Se utilizan manos de mortero nuevas para cada pez.
|
|
6)
|
Las muestras se colocan en hielo hasta que se realiza el centrifugado a 4 °C y a 50 000 g durante 30 minutos.
|
|
7)
|
Utilice una pipeta para pasar porciones de 20 μl de sobrenadante a dos tubos como mínimo, sumergiendo la punta de la pipeta por debajo de la capa de grasa de la superficie y, con cuidado, succionando el sobrenadante sin partículas de grasa ni de precipitado.
|
|
8)
|
Los tubos se conservan a – 80 °C hasta que se utilicen.
|
Apéndice 7
Muestras de enriquecimiento de la vitelogenina y patrón de referencia interensayos
Cada día que se realicen ensayos de vitelogenina, se analizará una muestra de enriquecimiento preparada mediante un patrón de referencia interensayos. La vitelogenina utilizada para realizar el patrón de referencia interensayos procederá de un lote distinto del usado para preparar los patrones de calibración del ensayo que se esté llevando a cabo.
La muestra de enriquecimiento se elaborará añadiendo una cantidad conocida del patrón interensayos a una muestra de plasma de los machos de control. La muestra se enriquecerá para lograr una concentración de vitelogenina entre 10 y 100 veces la concentración de vitelogenina esperada en los peces macho de control. La muestra de plasma de machos de control que se enriquece puede provenir de un solo pez o puede ser un compuesto procedente de varios peces.
Se analizará una submuestra del plasma de los machos de control no enriquecido en, como mínimo, dos pocillos duplicados. La muestra enriquecida también se analizará en, como mínimo, dos pocillos duplicados. La cantidad media de vitelogenina de las dos muestras no enriquecidas de plasma de los machos de control se añadirá a la cantidad calculada de vitelogenina que se haya añadido para enriquecer las muestras a fin de determinar la concentración prevista. La relación entre esta concentración prevista y la concentración medida se indicará junto con los resultados de cada conjunto de ensayos que se hayan realizado ese día.
Apéndice 8
Diagrama de flujo para tomar decisiones para el análisis estadístico

C.38. ENSAYO SOBRE METAMORFOSIS DE ANFIBIOS
INTRODUCCIÓN
|
1.
|
El presente método de ensayo reproduce las directrices de ensayo (TG) 231 de la OCDE (2009). La necesidad de desarrollar y validar un ensayo capaz de detectar determinadas sustancias activas en el sistema tiroideo de las especies de vertebrados radica en la preocupación por que los niveles de sustancias en el medio ambiente puedan provocar efectos adversos tanto en los seres humanos como en la vida silvestre. En 1998, la OCDE promovió una actuación de alta prioridad orientada a revisar las directrices existentes y desarrollar otras nuevas para la selección y evaluación de los alteradores endocrinos potenciales. Una faceta de esta actuación consistió en elaborar las directrices del ensayo para el cribado de las sustancias activas en el sistema tiroideo de las especies de vertebrados. Se propuso una mejora en el estudio Toxicidad oral por administración continuada (28 días) en roedores (capítulo B.7 del presente anexo) y el Ensayo sobre metamorfosis de anfibios (AMA). El método de ensayo mejorado B.7 se sometió a una validación y se ha publicado un método de ensayo revisado. El Ensayo sobre metamorfosis de anfibios (AMA) se sometió a un exhaustivo programa de validación que incluye estudios intralaboratorios e interlaboratorios que demuestran la relevancia y la fiabilidad del ensayo (1, 2). Posteriormente, la validación del ensayo fue objeto de revisión por parte de un grupo de expertos independientes (3). Este método de ensayo es el resultado de la experiencia adquirida durante los estudios de validación para la detección de sustancias con actividad tiroidea, así como de trabajos realizados en otros países miembros de la OCDE.
|
PRINCIPIO DEL ENSAYO
|
2.
|
El Ensayo sobre metamorfosis de anfibios (AMA) es un ensayo de cribado concebido para identificar empíricamente las sustancias que pueden interferir con el funcionamiento normal del eje hipotálamo-hipófisis-tiroides (HPT). El AMA representa un modelo de vertebrado generalizado en la medida en que se basa en las estructuras y las funciones conservadas del eje HPT. Se trata de un ensayo importante porque la metamorfosis de los anfibios constituye un proceso dependiente de la tiroides que se ha estudiado en profundidad y que responde a las sustancias con actividad dentro del eje HPT, además de ser el único ensayo que detecta la actividad de la tiroides en un animal en proceso de desarrollo morfológico.
|
|
3.
|
El diseño experimental general implica exponer renacuajos de Xenopus laevis que se encuentran en la fase 51 a tres concentraciones distintas, como mínimo, de una sustancia problema y a un control con agua de dilución durante 21 días. Hay cuatro réplicas de cada tratamiento del ensayo. La densidad larval al comienzo del ensayo es de veinte renacuajos por recipiente de ensayo en todos los grupos de tratamiento. Los parámetros de observación son la longitud de las extremidades posteriores (HLL, por sus siglas en inglés), la distancia entre el hocico y la abertura cloacal (SVL, por sus siglas en inglés), la fase de desarrollo, el peso húmedo, la histología tiroidea y las observaciones diarias de mortalidad.
|
DESCRIPCIÓN DEL MÉTODO
Especies de ensayo
|
4.
|
La especie Xenopus laevis se cría habitualmente en laboratorios de todo el mundo y es fácil de obtener a través de proveedores comerciales. En esta especie se puede inducir fácilmente la reproducción durante todo el año mediante inyecciones de gonadotrofina coriónica humana (hCG) y las larvas resultantes se pueden criar habitualmente hasta las fases de desarrollo deseadas en grandes cantidades para permitir su uso en protocolos de ensayo en fases concretas. Es preferible que las larvas utilizadas en el ensayo se deriven de adultos criados internamente. Como alternativa, aunque no es el procedimiento preferido, se pueden enviar los huevos o los embriones al laboratorio que realiza el ensayo para la aclimatación de los mismos. No se aceptará el envío de ejemplares en fases larvarias para su uso en el ensayo.
|
Equipo y suministros
|
5.
|
Los siguientes equipos y suministros son necesarios para llevar a cabo este ensayo:
|
a)
|
sistema de exposición (véase la descripción que aparece más adelante);
|
|
b)
|
acuarios de vidrio o de acero inoxidable (véase la descripción que aparece más adelante);
|
|
d)
|
aparatos de control de temperatura (por ejemplo, calefactores o enfriadores, ajustables a 22 ± 1 °C);
|
|
f)
|
microscopio de disección binocular;
|
|
g)
|
cámara digital con un mínimo de 4 megapíxeles de resolución y apta para su uso en microscopía;
|
|
h)
|
programas informáticos de digitalización de imágenes;
|
|
i)
|
placa de Petri (por ejemplo, de 100 × 15 mm) o cámara de plástico transparente de un tamaño equivalente;
|
|
j)
|
balanza analítica con precisión de tres decimales (mg);
|
|
k)
|
aparato de medición de oxígeno disuelto;
|
|
m)
|
medidor de la intensidad de la luz que pueda medir en unidades lux;
|
|
n)
|
diversas herramientas e instrumental de vidrio de laboratorio;
|
|
o)
|
pipetas ajustables (de 10 a 5 000 μl) o un surtido de pipetas de tamaños equivalentes;
|
|
p)
|
sustancia problema en cantidades suficientes para llevar a cabo el estudio, preferiblemente de un mismo lote; e
|
|
q)
|
instrumentación analítica adecuada para la sustancia problema o servicios analíticos contratados.
|
|
Posibilidad de someter a ensayo la sustancia
|
6.
|
El AMA se basa en un protocolo de exposición acuosa por el cual se introduce la sustancia problema en las cámaras del ensayo a través de un sistema dinámico. Sin embargo, los métodos dinámicos conllevan restricciones sobre los tipos de sustancias que pueden someterse a ensayo según las propiedades fisicoquímicas de la sustancia en sí. Por lo tanto, antes de utilizar este protocolo, debe obtenerse información básica sobre la sustancia que sea pertinente para determinar la posibilidad de someterla a ensayo, y debe consultarse el documento de orientación de la OCDE sobre ensayos de toxicidad acuática con sustancias y mezclas dificultosas (4). Entre las características que indican que la sustancia puede resultar difícil de someter a ensayo en sistemas acuáticos se incluyen las siguientes: coeficientes altos de reparto octanol/agua (log Kow), alta volatilidad, susceptibilidad a la hidrólisis y susceptibilidad a la fotólisis en condiciones de iluminación ambiente de laboratorio. Hay otros factores que también pueden resultar significativos a la hora de determinar la posibilidad de someter la sustancia a ensayo y que deben determinarse caso por caso. Si no se consigue realizar correctamente un ensayo con una sustancia utilizando un sistema de flujo dinámico, podrá emplearse un sistema de renovación estática. Si ninguno de los dos sistemas es capaz de admitir la sustancia problema, la opción predeterminada es no ensayarla utilizando este protocolo.
|
Sistema de exposición
|
7.
|
Cuando sea posible, se prefiere un sistema de diluyente dinámico a un sistema de renovación estática. Si las propiedades físicas o químicas de cualquiera de las sustancias problema no favorecen el uso de un sistema de diluyente dinámico, puede utilizarse otro sistema de exposición (por ejemplo, renovación estática). Los componentes del sistema en contacto con el agua deben ser de vidrio, acero inoxidable o politetrafluoroetileno. Sin embargo, se pueden utilizar plásticos adecuados que no comprometan el estudio. Los recipientes de exposición deben ser acuarios de vidrio o acero inoxidable, equipados de tuberías, con un volumen del recipiente aproximado entre los 4,0 y los 10,0 l, y una profundidad mínima del agua que oscile entre los 10 y los 15 cm. El sistema debe ser capaz de acoger todas las concentraciones de exposición y un control, con cuatro réplicas por tratamiento. El caudal de cada recipiente debe ser constante y tener en cuenta tanto el mantenimiento de las condiciones biológicas como la exposición a la sustancia (por ejemplo, 25 ml/min). Los recipientes de tratamiento deben asignarse aleatoriamente a una posición del sistema de exposición para reducir los posibles efectos posicionales, incluyendo ligeras variaciones de temperatura, intensidad de la luz, etc. Debe utilizarse iluminación fluorescente para proporcionar un fotoperiodo de 12 horas de luz y 12 horas de oscuridad, con una intensidad que varíe entre 600 y 2 000 lux (lumen/m2) en la superficie del agua. La temperatura del agua debe mantenerse a 22 ± 1 °C, el pH debe mantenerse entre 6,5 y 8,5, y la concentración de oxígeno disuelto (OD) debe ser superior a 3,5 mg/l (> 40 % de la saturación de aire) en cada recipiente del ensayo. La temperatura del agua, el pH y el oxígeno disuelto deben medirse cada semana como mínimo; preferiblemente, la temperatura debe medirse de manera continua al menos en un recipiente del ensayo. En el apéndice 1 figuran las condiciones experimentales en las que debe ejecutarse el protocolo. Para obtener más información sobre la configuración de sistemas de exposición dinámica o de sistemas de renovación estática, consulte la ASTM Standard Guide for Conducting Acute Toxicity Tests on Test Materials with Fishes, Macroinvertebrates, and Amphibians (5), así como pruebas generales de toxicología acuática.
|
Calidad del agua
|
8.
|
Puede utilizarse cualquier agua que esté disponible localmente (por ejemplo, agua de manantial o agua del grifo pasada por filtro de carbón) y permita el crecimiento y el desarrollo normales de renacuajos de X. laevis. Como la calidad del agua local puede variar considerablemente de una zona a otra, debe analizarse, en particular si no hay disponibles datos históricos sobre la adecuación del agua para criar Xenopus. Debe prestarse una atención especial a que el agua esté libre de cobre, cloro y cloraminas, ya que todas estas sustancias son tóxicas para las ranas y los renacuajos. Asimismo, se recomienda analizar el agua en lo que respecta a los niveles de fondo de fluoruro, perclorato y clorato (subproductos de la desinfección del agua potable), ya que todos estos aniones son sustratos del transportador de yodo de la glándula tiroidea y unos niveles altos de cada uno de estos aniones pueden alterar el resultado del estudio. El análisis debe realizarse antes de que se inicien las pruebas y, normalmente, el agua del ensayo debe estar libre de estos aniones.
|
Concentración de yodo en el agua del ensayo
|
9.
|
A fin de que la glándula tiroidea sintetice la HT, debe haber suficiente yoduro disponible para las larvas mediante una combinación de fuentes acuosas y dietéticas. En la actualidad no hay directrices derivadas empíricamente en lo que respecta a las concentraciones mínimas de yoduro. No obstante, la disponibilidad de yoduro puede afectar a la capacidad de respuesta del sistema tiroideo ante los agentes con actividad tiroidea, y se sabe que modula la actividad basal de la glándula tiroidea, aspecto que merece atención a la hora de interpretar los resultados histopatológicos de la glándula. Por lo tanto, deben registrarse las concentraciones medidas de yoduro acuoso en el agua del ensayo. Según los datos disponibles de los estudios de validación, se ha demostrado que el protocolo funciona bien cuando las concentraciones de yoduro (I–) en el agua oscilan entre los 0,5 y los 10 μg/l. Idealmente, la concentración mínima de yoduro en el agua del ensayo debe ser de 0,5 μg/l. Si el agua del ensayo se ha reconstituido a partir de agua desionizada, debe añadirse yodo a una concentración mínima de 0,5 μg/l. En el informe debe figurar la eventual adición suplementaria al agua del ensayo de yodo u otras sales.
|
Mantenimiento de los animales
Cría y cuidado de los adultos
|
10.
|
La cría y el cuidado de los adultos se llevan de acuerdo con las directrices normalizadas y se remite al lector a la guía estándar para llevar a cabo el ensayo de teratogenicidad con embriones de rana (FETAX) (6) para obtener información más detallada. Estas directrices normalizadas proporcionan un ejemplo de métodos adecuados para el cuidado y la cría, pero no se exige su cumplimiento estricto. Para inducir la cría, se inyecta gonadotrofina coriónica humana (hCG) a parejas (3-5) de hembras y machos adultos. A los especímenes de hembra y macho se les inyectan aproximadamente entre 800 y 1 000 UI y entre 600 y 800 UI, respectivamente, de hCG disuelta en una solución salina con una concentración entre el 0,6 y el 0,9 %. Las parejas de cría se mantienen en grandes recipientes, sin alteraciones y en condiciones estáticas con el objeto de fomentar el amplexo. El fondo de cada recipiente de cría debe tener un fondo falso de malla de acero inoxidable o plástico que permita que las masas de huevos caigan al fondo del recipiente. Normalmente, las ranas inyectadas a última hora de la tarde depositarán la mayor parte de sus huevos a media mañana del día siguiente. Cuando se haya liberado y fertilizado una cantidad suficiente de huevos, deben retirarse los adultos de los recipientes de cría.
|
Cuidado y selección de las larvas
|
11.
|
Una vez que se hayan retirado los adultos de los recipientes de cría, se recogen los huevos y se evalúa su viabilidad mediante un subconjunto representativo de los embriones de todos los recipientes de cría. Deben conservarse los mejores desoves individuales (se recomiendan 2 o 3 para evaluar la calidad de los desoves) con arreglo a la viabilidad embrionaria y la presencia de un número adecuado (un mínimo de 1 500) de embriones. Todos los organismos utilizados en un estudio deben provenir de un solo desove (es decir, no deben mezclarse los desoves). Los embriones se trasladan a una bandeja o recipiente plano de gran tamaño y se retiran todos los huevos que claramente estén muertos o sean anómalos [véase la definición en (5)], con una pipeta o un cuentagotas. Los embriones sanos de cada uno de los tres desoves se transfieren a tres tanques de eclosión separados. Cuatro días después de colocarlos en los recipientes de incubación, se selecciona el mejor desove de acuerdo con su viabilidad y éxito de eclosión y las larvas se transfieren a un número adecuado de recipientes de cría a 22 ± 1 °C. Además, se transfieren algunas larvas más a recipientes extra para usarlas como sustitutas si se registran casos de mortalidad en los recipientes de cría durante la primera semana. Este procedimiento mantiene una densidad constante de organismos y, por ello, reduce la divergencia en el desarrollo dentro de la cohorte de un mismo desove. Todos los recipientes de cría deben limpiarse con ayuda de un sifón a diario. Como medida de precaución, se prefieren los guantes de vinilo o nitrilo a los guantes de látex. Cada día deben retirarse las larvas muertas y agregarse las larvas de sustitución para mantener la densidad de organismos durante la primera semana. La alimentación debe realizarse, como mínimo, dos veces al día.
|
|
12.
|
Durante la fase previa a la exposición, los renacuajos se aclimatan a las condiciones de la fase de exposición en sí, incluido el tipo de alimento, la temperatura, el ciclo de luz y oscuridad y el medio de cultivo. Por lo tanto, se recomienda utilizar la misma agua de cultivo o dilución en la fase previa a la exposición y en la fase de exposición. Si se utiliza un sistema de cultivo estático para mantener los renacuajos durante la fase previa a la exposición, el medio de cultivo debe reemplazarse completamente al menos dos veces por semana. Debe evitarse el hacinamiento, provocado por grandes densidades de larvas, durante el periodo previo a la exposición, porque podría afectar de manera notable al desarrollo de los renacuajos durante la fase del ensayo posterior. Por lo tanto, la densidad de cría no debe superar aproximadamente los cuatro renacuajos por litro de medio de cultivo (sistema de exposición estática) o los 10 renacuajos por litro de medio de cultivo (por ejemplo, con un caudal de 50 ml/min en la fase previa a la exposición o en el sistema de cultivo). En estas condiciones, los renacuajos deberían desarrollarse de las fases 45/46 a la fase 51 en doce días. Deben inspeccionarse los renacuajos representativos de esta población cada día para comprobar su fase de desarrollo y, de esta manera, poder hacer una estimación del momento adecuado para iniciar la exposición. Debe tenerse cuidado de minimizar el estrés y los traumatismos para los renacuajos, especialmente durante la transferencia, la limpieza de los acuarios y la manipulación de las larvas. Deben evitarse las situaciones o actividades estresantes, tales como los ruidos fuertes o incesantes, los golpes en los acuarios, las vibraciones en los acuarios, un exceso de actividad en el laboratorio y los cambios rápidos en el entorno (disponibilidad de luz, temperatura, pH, OD, caudales de agua, etc.). Si los renacuajos no se desarrollan hasta la fase 51 en un plazo de 17 días a partir de su fertilización, esto se podría achacar a un exceso de estrés.
|
Cultivo y alimentación de las larvas
|
13.
|
Los renacuajos se alimentan, por ejemplo con los alimentos comerciales para larvas utilizados en los estudios de validación (véase también el apéndice 1), durante todo el periodo previo a la exposición [tras la fase 45/46 Nieuwkoop y Faber (NF) (8)] y durante todo el periodo del ensayo de veintiún días, o con otra dieta que haya demostrado permitir la obtención de unos resultados equivalentes al Ensayo sobre metamorfosis de anfibios. El régimen de alimentación durante el periodo previo a la exposición debe ajustarse con cuidado para cubrir las necesidades de los renacuajos en desarrollo; es decir, deben suministrarse pequeñas porciones de alimento a los renacuajos recién salidos del huevo varias veces al día (como mínimo, dos veces). Debe evitarse un exceso de alimento para: i) mantener la calidad del agua, y ii) para evitar que los filtros de las branquias se atasquen con partículas de alimentos y residuos. En lo que respecta a los alimentos de los renacuajos utilizados en los estudios de validación, las raciones diarias de alimentos deben ir aumentando a medida que crecen los renacuajos, hasta llegar aproximadamente a 30 mg por animal y por día poco antes de iniciar el ensayo. En los estudios de validación se ha demostrado que este alimento comercial permite el crecimiento y desarrollo adecuados de los renacuajos de X. laevis, y que está formado por partículas finas que quedan suspendidas en la columna de agua durante un largo periodo de tiempo y pueden eliminarse con el flujo. Por lo tanto, la cantidad total diaria de alimento debe dividirse en porciones más pequeñas y suministrarse al menos dos veces al día. Este régimen de alimentación se resume en la tabla 1. Deben registrarse las tasas de alimentación. La alimentación se puede realizar en seco o prepararse una solución madre con agua de dilución. Cada dos días debe prepararse una nueva solución madre que, cuando no se utilice, debe conservarse a 4 °C.
Tabla 1.
Régimen de alimentación con alimento comercial para renacuajos utilizado en los estudios de validación de los renacuajos de X. laevis durante la parte en vida del AMA en condiciones dinámicas
|
Día de estudio
|
Ración de alimento (mg de alimento por animal y día)
|
|
0-4
|
30
|
|
5-7
|
40
|
|
8-10
|
50
|
|
11-14
|
70
|
|
15-21
|
80
|
|
Química analítica
|
14.
|
Antes de llevar a cabo un estudio, debe evaluarse la estabilidad de la sustancia problema con la información existente sobre su solubilidad, degradabilidad y volatilidad. Deben recogerse muestras de las soluciones de ensayo de cada recipiente de réplica a cada concentración para realizar los análisis de química analítica al iniciar el ensayo (día 0) y durante el ensayo deben recogerse cuatro muestras como mínimo cada semana. Asimismo, se recomienda analizar cada concentración del ensayo durante la preparación del sistema, antes de iniciar el ensayo, para comprobar su comportamiento. Se recomienda también analizar las soluciones madre cuando se cambien, en particular si el volumen de la solución madre no proporciona unas cantidades de sustancia adecuadas para cubrir todos los periodos de muestreo habituales. En el caso de las sustancias que no puedan detectarse en algunas o en todas las concentraciones utilizadas en un ensayo, las soluciones madre deben medirse y los caudales del sistema deben medirse para poder calcular las concentraciones nominales.
|
Suministro de la sustancia
|
15.
|
El método utilizado para introducir la sustancia problema en el sistema puede variar en función de sus propiedades fisicoquímicas. Las sustancias solubles en agua pueden disolverse en alícuotas de agua del ensayo a una concentración que permita su suministro a la concentración objetivo del ensayo en un sistema dinámico. Las sustancias líquidas a temperatura ambiente y escasamente solubles en agua pueden introducirse a través de métodos de saturación líquido:líquido. Las sustancias sólidas a temperatura ambiente y escasamente solubles en agua pueden introducirse mediante columnas de saturación de lana de vidrio (7). Se prefiere utilizar un sistema de ensayo sin portador; sin embargo, las distintas sustancias problema presentarán diversas propiedades fisicoquímicas que, probablemente, exigirán planteamientos distintos para la preparación del agua de exposición a la sustancia. Es preferible hacer todo lo posible por evitar el recurso a disolventes o portadores, por las razones siguientes: i) determinados disolventes pueden provocar toxicidad o respuestas endocrinas no deseadas o inesperadas; ii) las sustancias problema que se encuentran por encima de su solubilidad en el agua (algo que puede ocurrir con frecuencia cuando se usan disolventes) pueden provocar determinaciones incorrectas de las concentraciones eficaces; y iii) el uso de disolventes en ensayos a largo plazo puede provocar un nivel importante de “biopelículas” asociadas a la actividad microbiana. En el caso de las sustancias difíciles de utilizar en los ensayos, se puede utilizar un disolvente como último recurso; para determinar el mejor método debe consultarse el documento de orientación de la OCDE sobre ensayos de toxicidad acuática con sustancias y mezclas dificultosas (4). La selección del disolvente vendrá determinada por las propiedades químicas de la sustancia. Entre los disolventes que han demostrado su eficacia en los ensayos de toxicidad acuática se incluyen la acetona, el etanol, el metanol, la dimetilformamida y el trietilenglicol. En caso de que se utilice un disolvente portador, las concentraciones de disolvente deben ser inferiores a la concentración sin efecto observado (NOEC) de toxicidad crónica. El documento de orientación de la OCDE recomienda 100 μl/l como máximo; una reseña reciente recomienda que se utilicen concentraciones tan bajas como 20 μl/l de agua de dilución (12). Si se utilizan disolventes portadores, deben evaluarse controles de los disolventes correspondientes, además de los controles sin disolvente (agua limpia). Si no se puede administrar una sustancia a través del agua, debido bien a las características fisicoquímicas (baja solubilidad), bien a una disponibilidad limitada de la sustancia, se puede plantear su introducción a través de la dieta. Se han llevado a cabo trabajos preliminares sobre las exposiciones con la dieta; no obstante, esta vía de exposición no se utiliza habitualmente. El método seleccionado debe quedar documentado y verificarse analíticamente.
|
Selección de las concentraciones de ensayo
Establecimiento de la concentración alta de ensayo
|
16.
|
A efectos de este ensayo, la concentración alta del ensayo debe corresponder al límite de solubilidad de la sustancia problema, la concentración máxima tolerada (MTC, de sus siglas en inglés) de las sustancias con toxicidad aguda o 100 mg/l, lo que sea más bajo.
|
|
17.
|
La MTC se define como la concentración máxima de ensayo de la sustancia que da como resultado una mortalidad aguda inferior al 10 %. Con este planteamiento se asume que existen datos empíricos de mortalidad aguda a partir de los cuales se puede estimar la MTC. La estimación de la MTC puede ser inexacta y, por lo general, debe aplicarse el juicio de un profesional. Aunque el uso de modelos de regresión es tal vez el planteamiento más adecuado técnicamente para estimar la MTC, se puede derivar una aproximación útil de la MTC a partir de los datos existentes sobre toxicidad aguda, utilizando un tercio del valor de la LC50 aguda. No obstante, es posible que no haya datos de toxicidad aguda de la especie del ensayo. Si no hay datos disponibles sobre toxicidad aguda específica de la especie, se puede realizar una prueba de LC50 de 96 horas con renacuajos representativos (es decir, en la misma fase) de los que forman parte del AMA. Opcionalmente, si hubiera disponibles datos de otras especies acuáticas (por ejemplo, estudios de LC50 con peces o con otras especies anfibias), podrá aplicarse el juicio profesional para realizar una estimación probable de la MTC recurriendo a una extrapolación entre especies.
|
|
18.
|
Por otra parte, si la sustancia no presenta toxicidad aguda y es soluble por encima de los 100 mg/l, este nivel de 100 mg/l debe considerarse la concentración más alta del ensayo (HTC, de sus siglas en inglés), ya que esta concentración se considera típicamente como una concentración “prácticamente no tóxica”.
|
|
19.
|
Aunque no es el procedimiento recomendado, se pueden utilizar métodos de renovación estática cuando los métodos dinámicos resulten inadecuados para alcanzar la MTC. Si se utilizan métodos de renovación estática, la estabilidad de la sustancia problema debe documentarse y permanecer dentro de los límites de los criterios de comportamiento. Se recomiendan periodos de renovación de veinticuatro horas. No son aceptables los periodos de renovación superiores a 72 horas. Asimismo, deben medirse parámetros de calidad del agua (por ejemplo, OD, temperatura, pH, etc.) al final de cada periodo de renovación, justo antes de la renovación.
|
Intervalo de concentraciones de ensayo
|
20.
|
Hay un mínimo necesario de tres concentraciones de ensayo y un control de agua limpia (y, en caso necesario, un control del vehículo). El diferencial mínimo de concentración de ensayo entre la más alta y la más baja debe ser aproximadamente un orden de magnitud. El factor máximo de separación de dosis es 0,1 y el mínimo, 0,33.
|
PROCEDIMIENTO
Inicio y realización del ensayo
Día 0
|
21.
|
La exposición debe comenzar cuando un número suficiente de renacuajos de la población previa a la exposición haya alcanzado la fase de desarrollo 51, con arreglo a Nieuwkoop y Faber (8), y cuya edad sea igual o inferior a 17 días a partir de la fertilización. Para la selección de los animales del ensayo, deben agruparse renacuajos sanos y de aspecto normal de la población, en un mismo recipiente que contenga un volumen adecuado de agua de dilución. Para determinar la fase de desarrollo, hay que retirar, uno a uno, los renacuajos del recipiente de agrupación, con una pequeña red o un filtro, y transferirlos a una cámara de medición transparente (por ejemplo, una placa de Petri de 100 mm) que contenga agua de dilución. Para determinar la fase, es preferible no utilizar anestesia, pero se pueden anestesiar los renacuajos individualmente con 100 mg/l de metanosulfonato de tricaína (por ejemplo, MS-222), tamponada adecuadamente con bicarbonato sódico (pH 7,0), antes de su manipulación. Si se utiliza, debe consultarse a laboratorios experimentados la metodología de uso apropiado de, por ejemplo, MS-222 como anestesia, que deberá incluirse en los resultados del ensayo. Los animales deben tratarse con cuidado durante este traslado para minimizar el estrés por manipulación y evitar lesiones.
|
|
22.
|
La etapa de desarrollo de los animales se determina con un microscopio de disección binocular. Para reducir la variabilidad fundamental de la fase de desarrollo, es importante que se realice esta determinación de las fases con la máxima precisión posible. Según Nieuwkoop y Faber (8), el principal punto de referencia de desarrollo para seleccionar los organismos en la fase 51 es la morfología de las extremidades posteriores. Las características morfológicas de las extremidades posteriores deben analizarse con el microscopio. Aunque debe consultarse toda la guía de Nieuwkoop y Faber (8) para obtener información exhaustiva sobre la determinación de las fases de los renacuajos, estas se pueden determinar de manera fiable mediante puntos de referencia morfológicos prominentes. Puede utilizarse la tabla siguiente para simplificar y armonizar el proceso de determinación de las fases durante todo el estudio mediante la identificación de esos puntos de referencia morfológicos prominentes, correspondientes a distintas fases, partiendo de la base de que el desarrollo es normal.
Tabla 2.
Puntos de referencia morfológicos prominentes de fase de acuerdo con las pautas de Nieuwkoop y Faber.
|
Puntos de referencia morfológicos prominentes
|
Fase de desarrollo
|
|
51
|
52
|
53
|
54
|
55
|
56
|
57
|
58
|
59
|
60
|
61
|
62
|
63
|
64
|
65
|
66
|
|
Extremidades posteriores
|
X
|
X
|
X
|
X
|
X
|
X
|
X
|
|
|
|
|
|
|
|
|
|
|
Extremidades anteriores
|
|
|
|
|
|
X
|
X
|
X
|
X
|
X
|
|
|
|
|
|
|
|
Estructura craneofacial
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
X
|
|
|
|
|
Morfología del nervio olfativo
|
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
|
|
|
|
Longitud de la cola
|
|
|
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
X
|
|
|
23.
|
Para iniciar el ensayo, todos los renacuajos deben encontrarse en la fase 51. El punto de referencia morfológico de fase más prominente de esa fase es la morfología de las extremidades posteriores, que se muestra en la figura 1.
Figura 1.
Morfología de las extremidades posteriores de un renacuajo de X. laevis en la fase 51.

|
|
24.
|
Además de la selección de la fase de desarrollo, se puede utilizar una selección opcional del tamaño de los animales del experimento. Para ello, debe medirse toda la longitud del cuerpo (y no la SVL) en el día 0 para obtener una submuestra de aproximadamente 20 renacuajos en la fase 51 NF. Tras calcular la longitud media de todo el cuerpo de este grupo de animales, pueden establecerse los límites mínimo y máximo de toda la longitud del cuerpo de los animales del experimento, dejando un intervalo del valor medio ± 3 mm (los valores medios de la longitud de todo el cuerpo se encuentran entre 24,0 y 28,1 mm para los renacuajos en la fase 51). Sin embargo, la determinación de las fases de desarrollo constituye el principal parámetro para establecer si los animales están listos para el ensayo. Los renacuajos que presenten malformaciones o lesiones visibles macroscópicamente deben excluirse del ensayo.
|
|
25.
|
Los renacuajos que reúnan los criterios de fase descritos anteriormente se mantendrán en un recipiente con agua de cultivo limpia hasta que finalice el proceso de determinación de fases. Una vez finalizada la determinación de fases, las larvas se distribuyen aleatoriamente en los recipientes de tratamiento de exposición hasta que cada recipiente contenga veinte larvas. A continuación, se inspecciona cada recipiente de tratamiento para determinar si hay animales de aspecto anómalo (por ejemplo, lesiones, comportamiento anómalo al nadar, etc.). Los renacuajos que presenten un aspecto manifiestamente poco saludable deben retirarse de los recipientes de tratamiento y sustituirse por larvas recién seleccionadas del recipiente de agrupación.
|
Observaciones
|
26.
|
Para obtener más información sobre los procedimientos de finalización del ensayo y el procesamiento de los renacuajos, véase el documento de orientación de la OCDE sobre histología de la tiroides de los anfibios (9).
|
Mediciones del día 7
|
27.
|
El día 7 se retirarán de cada recipiente de ensayo cinco renacuajos por réplica seleccionados aleatoriamente. El procedimiento aleatorio utilizado debe garantizar la misma probabilidad de selección a cada organismo del ensayo. Esto puede lograrse con cualquier método de aleatorización, pero se exige que cada renacuajo se recoja con la red. Los renacuajos no seleccionados se devuelven al recipiente de origen y los renacuajos seleccionados son sacrificados de manera compasiva en una concentración de 150 a 200 mg/l de, por ejemplo, MS-222, tamponada adecuadamente con bicarbonato sódico hasta alcanzar un valor de pH 7,0. Los renacuajos sacrificados se enjuagan con agua y se secan con material absorbente; a continuación se determina el peso corporal con precisión de un miligramo. Se determinan la distancia de las extremidades posteriores, la longitud entre el hocico y la abertura cloacal, y la fase de desarrollo (con un microscopio binocular de disección) de cada renacuajo.
|
Mediciones del día 21 (fin del ensayo)
|
28.
|
Al finalizar el ensayo (día 21), los renacuajos restantes se retiran de los recipientes del ensayo y se sacrifican de manera compasiva en una concentración de 150 a 200 mg/l de, por ejemplo, MS-222, tamponada adecuadamente con bicarbonato sódico, como se ha indicado anteriormente. Los renacuajos se enjuagan con agua y se secan con material absorbente, y, a continuación, se determina el peso corporal con precisión de un miligramo. Se miden la fase de desarrollo, la SVL y la longitud de las extremidades posteriores de cada renacuajo.
|
|
29.
|
Todas las larvas se colocan en fijador de Davidson durante un periodo de 48 a 72 horas, bien como muestras de cuerpo completo, bien como muestras de tejido recortado de la cabeza que contenga la mandíbula inferior para realizar evaluaciones histológicas. En lo que respecta a la histopatología, debe obtenerse una muestra total de cinco renacuajos de cada recipiente replicado. Como la altura de las células foliculares depende de la fase (10), el planteamiento de muestreo más apropiado para análisis histológicos consiste en utilizar individuos de la misma fase, siempre que sea posible. Para seleccionar individuos de la misma fase, se debe determinar la fase de todas las larvas antes de su selección y su procesamiento posterior para recopilar y conservar los datos. Esto es necesario porque la divergencia normal en el desarrollo redundará en unas distribuciones de fase diferenciadas en cada recipiente replicado.
|
|
30.
|
Los animales seleccionados para el estudio histopatológico (n = 5 de cada réplica) deben coincidir con la fase mediana de los controles (réplicas agrupadas), siempre que sea posible. Si hay recipientes replicados con más de cinco larvas en la fase adecuada, se seleccionarán cinco larvas de forma aleatoria.
|
|
31.
|
Si hay recipientes replicados con menos de cinco larvas en la fase adecuada, se seleccionarán individuos de forma aleatoria que se encuentren en la fase de desarrollo inmediatamente anterior o posterior para obtener una muestra de tamaño total de cinco larvas por réplica. Preferiblemente, la decisión de recoger más larvas que se encuentren en la fase de desarrollo inmediatamente anterior o posterior debe tomarse con arreglo a una evaluación general de la distribución de fases en el control y los tratamientos con las sustancias. Es decir, si el tratamiento con la sustancia está asociado a un retraso en el desarrollo, debe realizarse entonces un muestreo adicional de larvas de la fase anterior. Por el contrario, si el tratamiento con la sustancia está asociado a una aceleración del desarrollo, debe realizarse entonces un muestreo adicional de larvas de la fase posterior.
|
|
32.
|
En los casos de alteraciones graves del desarrollo de los renacuajos debido al tratamiento con la sustancia problema, es posible que no se produzca un solapamiento entre la distribución de las fases de los tratamientos con la sustancia y la fase de desarrollo mediana del control calculada. Solo en estos casos debe modificarse el proceso de selección utilizando una fase distinta a la fase mediana del control con el fin de lograr un muestreo de larvas de la misma fase para el estudio histopatológico de la tiroides. Por otra parte, si las fases no están determinadas (es decir, en caso de asincronía), deben seleccionarse aleatoriamente cinco renacuajos de cada réplica para llevar a cabo el análisis histológico. Deben indicarse los motivos que justifiquen el muestreo de cualquier larva que no se encuentre en una fase equivalente a la fase de desarrollo mediana del control.
|
Determinación de parámetros biológicos
|
33.
|
Durante la fase de exposición de veintiún días, si bien se requiere la observación diaria de los animales del ensayo, en los días 7 y 21 del mismo se miden los parámetros principales. En la tabla 3 figura un resumen de los parámetros de medición y los puntos temporales de observación correspondientes. En los documentos de orientación de la OCDE (9) se proporciona información más detallada sobre los procedimientos técnicos para medir los parámetros principales y las evaluaciones histológicas.
Tabla 3.
Puntos temporales de observación de los parámetros principales en el AMA.
|
Parámetros principales
|
Diariamente
|
Día 7
|
Día 21
|
|
|
ߦ
|
|
|
|
|
|
ߦ
|
ߦ
|
|
—
|
Longitud de las extremidades posteriores
|
|
|
ߦ
|
ߦ
|
|
—
|
Distancia entre el hocico y la abertura cloacal
|
|
|
ߦ
|
ߦ
|
|
|
|
ߦ
|
ߦ
|
|
—
|
Histología de la glándula tiroidea
|
|
|
|
ߦ
|
|
Parámetros principales
|
34.
|
La fase de desarrollo, la longitud de las extremidades posteriores, la SVL y el peso húmedo constituyen los parámetros principales del AMA; más adelante se analizará brevemente cada uno de ellos. Se puede obtener más información técnica para recopilar estos datos en los documentos de orientación recogidos en la bibliografía, incluidos los procedimientos de análisis asistido por ordenador cuyo uso se recomienda.
|
Fase de desarrollo
|
35.
|
La fase de desarrollo de los renacuajos de X. laevis se determina mediante los criterios de determinación de fases de Nieuwkoop y Faber (8). Los datos relativos a las fases de desarrollo se utilizan para determinar si el desarrollo se ha acelerado, es asíncrono, se ha retrasado o no se ha visto afectado. La aceleración o el retraso en el desarrollo se determinan estableciendo una comparación entre la fase mediana alcanzada por los grupos de control y por los grupos tratados. El desarrollo asíncrono se refleja cuando los tejidos examinados no presentan malformaciones ni anomalías, pero el tiempo relativo de la morfogénesis o del desarrollo de distintos tejidos se ve alterado en un mismo renacuajo.
|
Longitud de las extremidades posteriores
|
36.
|
La diferenciación y el crecimiento de las extremidades posteriores se encuentran bajo el control de las hormonas tiroideas y constituyen puntos de referencia del desarrollo muy importantes, ya utilizados para determinar la fase de desarrollo. El desarrollo de las extremidades posteriores constituye un criterio cualitativo en la determinación de la fase de desarrollo, pero en este caso se considera un parámetro cuantitativo. Por lo tanto, la longitud de las extremidades posteriores se mide como parámetro para detectar el efecto sobre el eje tiroideo (figura 2). Por motivos de coherencia, la longitud de las extremidades posteriores se mide en la extremidad posterior izquierda. La longitud de las extremidades posteriores se evalúa tanto en el día 7 como en el día 21 del ensayo. El día 7, la medición de la longitud de las extremidades posteriores resulta sencilla, tal y como se ilustra en la figura 2. Sin embargo, la medición de la longitud de las extremidades posteriores el día 21 resulta más complicada debido a que las extremidades están dobladas. Por lo tanto, las mediciones de la longitud de las extremidades posteriores el día 21 deben comenzar en la pared corporal y seguir la línea media de la extremidad a través de cualquier desviación angular. Los cambios en la longitud de las extremidades posteriores el día 7, aunque no resulten evidentes el día 21, se siguen considerando significativos en relación con una posible actividad tiroidea. Las mediciones de longitud se obtienen a partir de fotografías digitales mediante un programa informático de análisis de imágenes, tal y como se describe en el documento de orientación de la OCDE sobre histología de la tiroides de los anfibios (9).
|
Longitud del cuerpo y peso húmedo
|
37.
|
La determinación de la distancia entre el hocico y la abertura cloacal (SVL) (figura 2) y el peso húmedo se incluyen en el protocolo del ensayo para la evaluación de los posibles efectos de las sustancias problema en el ritmo de crecimiento de los renacuajos, en comparación con el grupo de control, además de resultar útiles para la detección de toxicidad general de la sustancia problema. Como la eliminación del agua adherida para determinar el peso puede dar lugar a situaciones de estrés para los renacuajos y puede provocar daños en la piel, estas mediciones se realizan en los renacuajos de la submuestra del día 7 y en todos los renacuajos restantes el día que finaliza el ensayo (día 21). Por motivos de coherencia, se debe utilizar la parte anterior de la abertura cloacal como límite posterior de la medición.
|
|
38.
|
La distancia entre el hocico y la abertura cloacal (SVL) se utiliza para evaluar el crecimiento de los renacuajos, tal y como se ilustra en la figura 2.
Figura 2.
(A) Tipos de medición de longitud del cuerpo y (B) mediciones de las extremidades posteriores de renacuajos de X. laevis (1).
|
Histología de la glándula tiroidea
|
39.
|
Si bien la fase de desarrollo y la longitud de las extremidades posteriores constituyen parámetros importantes para evaluar los cambios relacionados con la exposición en el desarrollo metamórfico, el retraso en el desarrollo no se puede considerar, por sí solo, un indicador de diagnóstico de actividad antitiroidea. Es posible que algunos de los cambios solo se puedan observar mediante un análisis histopatológico ordinario. Entre los criterios de diagnóstico se incluyen la hipertrofia/atrofia de la glándula tiroidea, la hipertrofia de células foliculares y la hiperplasia de células foliculares; y, como criterios cualitativos adicionales: el área de la luz folicular, la calidad de los coloides y la altura o forma de las células foliculares. Debe indicarse la clasificación de gravedad (4 grados). Se puede obtener información sobre la obtención y el procesamiento de muestras para el análisis histológico y sobre la realización de estos análisis con muestras de tejido en “Amphibian Metamorphosis Assay: Part 1 — Technical guidance for morphologic sampling and histological preparation” (“Ensayo sobre metamorfosis de anfibios: Parte 1 — Orientación técnica para el muestreo morfológico y la preparación histológica”); y en “Amphibian Metamorphosis Assay: Part 2 — Approach to reading studies, diagnostic criteria, severity grading and atlas” (“Ensayo sobre metamorfosis de anfibios: Parte 2 — Planteamiento de la lectura de estudios, criterios de diagnóstico, clasificación de la gravedad y atlas”) (9). Los laboratorios que realicen el ensayo por primera vez deben consultar a anatomopatólogos con experiencia para recibir formación antes de llevar a cabo el análisis histológico y la evaluación de la glándula tiroides. Los cambios evidentes y significativos de los parámetros principales que indiquen una aceleración o una asincronía del desarrollo pueden excluir la necesidad de realizar dicho análisis con la glándula tiroidea. Sin embargo, la ausencia de cambios morfológicos evidentes o de pruebas de retraso en el desarrollo impone la realización de análisis histopatológicos.
|
Mortalidad
|
40.
|
Cada día hay que comprobar si hay renacuajos muertos en todos los recipientes del ensayo; las cifras de cada recipiente deben quedar registradas. Debe registrarse la fecha, la concentración y el número de recipiente de toda mortalidad observada. Los animales muertos deben extraerse del recipiente del ensayo en cuanto se observen. Las tasas de mortalidad que superen el 10 % podrían indicar unas condiciones incorrectas del ensayo o efectos tóxicos de la sustancia problema.
|
Observaciones complementarias
|
41.
|
Deben registrarse los casos de comportamiento anómalo y las malformaciones y lesiones visibles macroscópicamente. Debe registrarse la fecha, la concentración y el número de recipiente de toda observación de comportamiento anómalo y de malformaciones o lesiones macroscópicas. El comportamiento normal se caracteriza por la suspensión de los renacuajos en la columna de agua con la cola elevada por encima de la cabeza, el movimiento regular y rítmico de la aleta de la cola, la subida periódica a la superficie, la formación del opérculo y la respuesta ante estímulos. El comportamiento anómalo incluiría, por ejemplo, flotar en la superficie, quedarse en el fondo del recipiente, nadar de forma inversa o irregular, ausencia de actividad en la superficie y de respuesta ante estímulos. Deben registrarse asimismo las eventuales grandes diferencias en el consumo de alimentos entre tratamientos. Las malformaciones y lesiones macroscópicas podrían incluir anomalías morfológicas (por ejemplo, deformidades de las extremidades), lesiones hemorrágicas, infecciones bacterianas o fúngicas, entre otras. Estas determinaciones son cualitativas y deben considerarse similares a los indicios clínicos de enfermedad o estrés, además de establecerse comparándolas con los animales de control. Si la incidencia o la tasa de incidencia son superiores en los recipientes expuestos que en los de control, se deben considerar como prueba de toxicidad clara.
|
DATOS E INFORME
Recopilación de datos
|
42.
|
Todos los datos deben recopilarse mediante sistemas electrónicos o manuales conformes a las buenas prácticas de laboratorio (BPL). Los datos del estudio deben incluir:
|
|
Sustancia problema:
|
—
|
Caracterización de la sustancia problema: propiedades físicas y químicas, información sobre estabilidad y biodegradabilidad.
|
|
—
|
Información y datos sobre la sustancia: método y frecuencia de preparación de las diluciones. La información sobre la sustancia problema incluye las concentraciones reales y nominales de la sustancia problema y, en algunos casos, de la sustancia no original, según corresponda. Es posible que se requieran mediciones de la sustancia problema tanto en las soluciones madre como en las soluciones del ensayo.
|
|
—
|
Disolvente (si fuera distinto al agua): justificación del disolvente seleccionado y caracterización del disolvente (tipo, concentración utilizada).
|
|
|
|
Condiciones de ensayo:
|
—
|
Registros operativos: consisten en observaciones correspondientes al funcionamiento del sistema del ensayo y del entorno y la infraestructura de apoyo. Los registros típicos incluyen los siguientes elementos: temperatura ambiente, temperatura del ensayo, fotoperiodo, estado de los componentes esenciales del sistema de exposición (por ejemplo, bombas, contadores de ciclos, presiones), caudales, niveles de agua, cambios de botella de solución y registros de alimentación. En los parámetros generales de calidad del agua se incluyen los elementos siguientes: pH, OD, conductividad, yodo total, alcalinidad y dureza.
|
|
—
|
Desviaciones del método de ensayo: esta información debe incluir cualquier información o descripción explicativa de las desviaciones del método de ensayo.
|
|
|
|
Resultados:
|
—
|
Observaciones y datos biológicos: incluyen las observaciones diarias de mortalidad, el consumo de alimentos, el comportamiento anómalo al nadar, el letargo, la pérdida de equilibrio, las malformaciones y las lesiones, entre otras. Las observaciones y los datos recopilados a intervalos predeterminados incluyen los siguientes elementos: fase de desarrollo, longitud de las extremidades posteriores, distancia entre el hocico y la abertura cloacal, y peso húmedo.
|
|
—
|
Técnicas analíticas estadísticas y justificación de las técnicas utilizadas; resultados de los análisis estadísticos, preferiblemente en formato de tabla.
|
|
—
|
Datos histológicos: incluyen descripciones explicativas, así como la clasificación de la gravedad y las puntuaciones de incidencia de observaciones específicas, tal y como se detallan en el documento de orientación de histopatología.
|
|
—
|
Observaciones concretas: estas observaciones deben incluir descripciones explicativas del estudio que no se ajusten a las categorías descritas anteriormente.
|
|
|
Presentación de datos
|
43.
|
El apéndice 2 contiene hojas de cálculo para la recopilación de datos diarios que se pueden utilizar como orientación para introducir datos brutos y para calcular estadísticas de resumen. Asimismo, se proporcionan tablas informativas que resultan cómodas para comunicar los resúmenes de datos sobre parámetros. En el apéndice 2 se pueden consultar tablas informativas para evaluaciones histológicas.
|
Criterios de comportamiento y aceptabilidad y validez del ensayo
|
44.
|
En general, las grandes desviaciones del método de ensayo generarán datos no aceptables para su interpretación o comunicación. Por lo tanto, los siguientes criterios que figuran en la tabla 4 se han concebido como orientación a la hora de determinar la calidad del ensayo realizado y el comportamiento general de los organismos de control.
Tabla 4.
Criterios de comportamiento del AMA.
|
Criterio
|
Límites aceptables
|
|
Concentraciones de ensayo
|
Se mantienen con un CV ≤ 20 % (variabilidad de la concentración medida del ensayo; de sus siglas en inglés) durante el ensayo de veintiún días.
|
|
Mortalidad en los controles
|
≤ 10 %: la mortalidad en cualquiera de las réplicas de los controles no debe ser superior a dos renacuajos.
|
|
Fase de desarrollo mediana mínima de los controles al final del ensayo
|
57
|
|
Extensión de la fase de desarrollo en el grupo de control
|
Los percentiles 10 y 90 de la distribución de las fases de desarrollo no deben variar en más de cuatro fases.
|
|
Oxígeno disuelto
|
≥ 40 % de saturación de aire (23)
|
|
pH
|
El pH debe mantenerse entre 6,5 y 8,5. Los diferenciales entre réplicas o entre tratamientos no deben ser superiores a 0,5.
|
|
Temperatura del agua
|
22° ± 1 °C: los diferenciales entre réplicas o entre tratamientos no deben ser superiores a 0,5 °C.
|
|
Concentraciones del ensayo sin toxicidad manifiesta
|
≥ 2
|
|
Comportamiento de las réplicas
|
Se pueden ver comprometidas dos réplicas como máximo en todo el ensayo.
|
|
Condiciones especiales relativas al uso de un disolvente
|
Si se utiliza un disolvente portador, deben utilizarse tanto un control de disolvente como un control de agua limpia, y los resultados deben registrarse.
|
|
Las diferencias estadísticamente significativas entre los grupos de control de disolvente y de control de agua se tratan de forma especial. Encontrará más información más adelante.
|
|
Condiciones especiales del sistema de renovación estática
|
Deben comunicarse los análisis de sustancias representativas antes y después de la renovación.
|
|
Los niveles de amoníaco se deben medir justo antes de la renovación.
|
|
Todos los parámetros de calidad del agua enumerados en la tabla 1 del apéndice 1 deben medirse justo antes de la renovación.
|
|
El periodo de renovación no debe superar las 72 horas.
|
|
Horario de alimentación adecuado (el 50 % de la ración diaria de alimento comercial para renacuajos)
|
|
Validez del ensayo
|
45.
|
Se deben cumplir los siguientes requisitos para considerar aceptable o válido un ensayo:
|
|
Experimento válido en un ensayo determinado como negativo en relación con la actividad tiroidea:
|
1)
|
En cualquier tratamiento (incluidos los controles), la mortalidad no puede superar el 10 %. En cualquier réplica, la mortalidad no puede superar los tres renacuajos; de lo contrario, se considera que la réplica se ha comprometido.
|
|
2)
|
Para llevar a cabo el análisis, debe haber al menos dos niveles de tratamiento con las cuatro réplicas sin comprometer.
|
|
3)
|
Para llevar a cabo el análisis, debe haber al menos dos niveles de tratamiento sin toxicidad manifiesta.
|
|
|
|
Experimento válido en un ensayo determinado como positivo en relación con la actividad tiroidea:
|
1)
|
La mortalidad en el grupo de control no puede afectar a más de dos renacuajos por réplica.
|
|
|
Pauta de decisión para llevar a cabo el AMA
|
46.
|
Se desarrolló una pauta de decisión para el AMA con el fin de proporcionar ayuda lógica en la realización e interpretación de los resultados del bioensayo (véase el diagrama de flujo de la figura 3). Básicamente, la pauta de decisión pondera los parámetros de forma que el desarrollo adelantado, el desarrollo asíncrono y la histopatología tiroidea tienen un mayor peso, mientras que el desarrollo retrasado, la distancia entre el hocico y la abertura cloacal y el peso húmedo, que son parámetros que pueden verse afectados por la toxicidad general, se consideran de menor peso.
Figura 3.
Pauta de decisión para llevar a cabo el AMA.

|
Desarrollo adelantado (determinado mediante la fase de desarrollo, la SVL y la HLL)
|
47.
|
Se sabe que el adelanto del desarrollo solo se produce mediante efectos relacionados con las hormonas tiroideas. Estos pueden ser efectos en el tejido periférico, como una interacción directa con el receptor de la hormona tiroidea (como con la T4) o efectos que alteran los niveles circulantes de las hormonas tiroideas. En cualquier caso, se considera prueba suficiente para indicar que la sustancia tiene actividad tiroidea. Hay dos formas de evaluar el adelanto del desarrollo. En primer lugar, la fase de desarrollo general se puede evaluar mediante el método armonizado detallado en Nieuwkoop y Faber (8). En segundo lugar, se pueden cuantificar características morfológicas específicas, como la longitud de las extremidades posteriores, tanto en el día 7 como en el 21, que se relacionan positivamente con los efectos agonistas sobre el receptor de la hormona tiroidea. Si se produce un adelanto estadísticamente significativo en el desarrollo o en la longitud de las extremidades posteriores, el ensayo indicará que la sustancia tiene actividad tiroidea.
|
|
48.
|
La evaluación de los animales del ensayo para comprobar la presencia de un desarrollo acelerado con respecto a la población de control se basará en los resultados de los análisis estadísticos realizados con respecto a los cuatro parámetros siguientes:
|
—
|
longitud de las extremidades posteriores (normalizada por la SVL) el día 7 del ensayo;
|
|
—
|
longitud de las extremidades posteriores (normalizada por la SVL) el día 21 del ensayo;
|
|
—
|
etapa de desarrollo en el día 7 del ensayo; y
|
|
—
|
etapa de desarrollo en el día 21 del ensayo.
|
|
|
49.
|
Deben llevarse a cabo análisis estadísticos de la longitud de las extremidades posteriores basándose en las mediciones de la longitud de la extremidad posterior izquierda. La longitud de las extremidades posteriores se normaliza utilizando la relación de la longitud de las extremidades posteriores con la distancia entre el hocico y la abertura cloacal de un individuo. Después se compara la media de los valores normalizados de cada nivel de tratamiento. En este sentido, la aceleración del desarrollo se establece por un aumento importante de la longitud (normalizada) media de las extremidades posteriores de un grupo de tratamiento con la sustancia en comparación con el grupo de control los días 7 o 21 del ensayo (véase el apéndice 3).
|
|
50.
|
Deben realizarse análisis estadísticos de la fase de desarrollo basándose en la determinación de las fases de desarrollo de acuerdo con los criterios morfológicos descritos por Nieuwkoop y Faber (8). La aceleración del desarrollo se determina cuando el análisis multicuántico detecta un aumento importante de los valores de la fase de desarrollo en un grupo de tratamiento con la sustancia en comparación con el grupo de control los días 7 o 21 del ensayo.
|
|
51.
|
En el método de ensayo AMA, un efecto significativo en cualquiera de los cuatro parámetros mencionados anteriormente se considera suficiente para una detección positiva de un desarrollo acelerado. Es decir, unos efectos significativos en la longitud de las extremidades posteriores en un momento determinado no exigen la corroboración mediante efectos significativos en la longitud de las extremidades posteriores en el otro momento alternativo ni mediante efectos significativos en la fase de desarrollo en ese momento en cuestión. A su vez, unos efectos significativos en la fase de desarrollo en un momento determinado no exigen la corroboración mediante efectos significativos en la fase de desarrollo en el otro momento alternativo ni mediante efectos significativos en la longitud de las extremidades posteriores en ese momento en cuestión. No obstante, el peso de la prueba del adelanto del desarrollo aumentará si se detectan efectos significativos en más de un parámetro.
|
Desarrollo asíncrono (determinado mediante criterios de la fase de desarrollo)
|
52.
|
El desarrollo asíncrono se caracteriza por la perturbación del ritmo relativo de la morfogénesis o del desarrollo de distintos tejidos en un mismo renacuajo. La incapacidad para establecer claramente la fase de desarrollo de un organismo mediante el conjunto de parámetros morfológicos que se considera típico en cualquier fase específica sugiere que los tejidos se están desarrollando de forma asíncrona a través de la metamorfosis. El desarrollo asíncrono es un indicador de actividad tiroidea. Los únicos mecanismos de acción conocidos que causan desarrollo asíncrono tienen lugar debido a los efectos de sustancias en la acción periférica de la hormona tiroidea o en el metabolismo de la hormona tiroidea en los tejidos en desarrollo, como se observa con los inhibidores de las desyodasas.
|
|
53.
|
La evaluación de los animales de ensayo para comprobar la presencia de desarrollo asíncrono en relación con la población de control se basará en el examen morfológico macroscópico de los animales de ensayo los días 7 y 21 del mismo.
|
|
54.
|
La descripción del desarrollo normal del Xenopus laevis por Nieuwkoop y Faber (8) proporciona el marco para identificar un orden secuencial en la remodelación del tejido normal. El término “desarrollo asíncrono” hace referencia específicamente a las desviaciones en el desarrollo morfológico macroscópico de los renacuajos que impiden la determinación definitiva de una fase de desarrollo de conformidad con los criterios de Nieuwkoop y Faber (8) porque los puntos de referencia morfológicos clave reflejan características de fases distintas.
|
|
55.
|
Tal y como implica el término “desarrollo asíncrono”, solo deben considerarse los casos que reflejen desviaciones en la progresión de la remodelación de ciertos tejidos con respecto a la progresión de la remodelación de otros tejidos. Algunos fenotipos clásicos incluyen el retraso o la ausencia de la aparición de las extremidades anteriores, a pesar de un desarrollo normal o adelantado de los tejidos de las extremidades posteriores y de la cola, o la reabsorción precoz de las branquias en relación con la fase de morfogénesis de las extremidades posteriores y de reabsorción de la cola. Se registrará que un animal presenta desarrollo asíncrono si no puede asignarse a una fase porque no cumple la mayoría de los criterios de desarrollo de los puntos de referencia correspondiente a una fase concreta de Nieuwkoop y Faber (8), o si se produce un retraso o una aceleración extremos de una o varias características principales (por ejemplo, reabsorción completa de la cola, pero sin emergencia de las extremidades anteriores). Esta evaluación se realiza cualitativamente y debe examinar todo el conjunto de características de referencia enumeradas por Nieuwkoop y Faber (8). Sin embargo, no es necesario registrar la fase de desarrollo de las diversas características de referencia de los animales observados. A los animales registrados con desarrollo asíncrono no se les asigna una fase de desarrollo de Nieuwkoop y Faber (8).
|
|
56.
|
Por lo tanto, un criterio principal para designar casos de desarrollo morfológico anómalo como casos de “desarrollo asíncrono” es que se vea alterado el ritmo relativo de la remodelación de tejidos y de la morfogénesis de tejidos, sin que sea manifiestamente anómala la morfología de los tejidos afectados. Un ejemplo que ilustra esta interpretación de anomalías morfológicas macroscópicas es que el retraso en la morfogénesis de las extremidades posteriores en relación con el desarrollo de otros tejidos cumplirá el criterio de “desarrollo asíncrono”, mientras que los casos con ausencia de extremidades posteriores, presencia de dedos anómalos (por ejemplo, ectrodactilia o polidactilia), u otras malformaciones manifiestas en las extremidades, no deben considerarse “desarrollo asíncrono”.
|
|
57.
|
En este contexto, los principales puntos de referencia morfológicos cuya progresión metamórfica coordinada ha de evaluarse deben incluir la morfogénesis de las extremidades posteriores, la morfogénesis de las extremidades anteriores, la aparición de las extremidades anteriores, la fase de reabsorción de la cola (en particular, la reabsorción de la aleta de la cola) y la morfología de la cabeza (por ejemplo, tamaño de las branquias y fase de reabsorción de las branquias, morfología de la mandíbula inferior, protrusión del cartílago de Meckel).
|
|
58.
|
En función del mecanismo de acción de la sustancia, se pueden producir diferentes fenotipos morfológicos macroscópicos. Algunos fenotipos clásicos incluyen el retraso o la ausencia de la aparición de las extremidades anteriores, a pesar de un desarrollo normal o adelantado de los tejidos de las extremidades posteriores y de la cola, así como la reabsorción precoz de las branquias en relación con las extremidades posteriores y la remodelación de la cola.
|
Histopatología
|
59.
|
Si la sustancia no provoca una toxicidad manifiesta y no acelera el desarrollo ni causa un desarrollo asíncrono, se realiza una evaluación histopatológica de la glándula tiroidea con ayuda del documento de orientación correspondiente (9). El retraso del desarrollo, en ausencia de toxicidad, constituye un indicador importante de actividad antitiroidea, pero el análisis de la fase de desarrollo es menos sensible y tiene menos valor diagnóstico que el análisis histopatológico de la glándula tiroidea. Por lo tanto, en este caso es necesario llevar a cabo el análisis histopatológico de la glándula tiroidea. Se han demostrado efectos en la histología de la glándula tiroidea en ausencia de efectos en el desarrollo. Si se producen cambios en la histopatología de la tiroides, se considerará que la sustancia tiene actividad tiroidea. Si no se producen retrasos en el desarrollo ni se observan lesiones histológicas en la glándula tiroidea, se considerará que la sustancia no tiene actividad tiroidea. Esta decisión se fundamenta en que la glándula tiroidea se encuentra bajo la influencia de la TSH y cualquier sustancia que altere la hormona tiroidea circulante de forma suficiente como para alterar la secreción de TSH dará como resultado cambios histopatológicos en la glándula tiroidea. Son varios los modos y mecanismos de acción que pueden alterar la hormona tiroidea circulante. Por lo tanto, aunque el nivel de la hormona tiroidea indica un efecto relacionado con la tiroides, resulta insuficiente para determinar cuál es el modo o el mecanismo de acción relacionado con la respuesta.
|
|
60.
|
Como este parámetro no se presta al uso de los métodos estadísticos básicos, la determinación de un efecto relacionado con la exposición a una sustancia se establecerá según la opinión experta de un histopatólogo.
|
Retraso en el desarrollo (determinado según la fase de desarrollo, HLL, BW y SVL)
|
61.
|
Se puede producir un retraso en el desarrollo mediante mecanismos antitiroideos y mediante toxicidad indirecta. Los retrasos leves en el desarrollo con signos evidentes de toxicidad indican probablemente un efecto tóxico inespecífico. La evaluación de la toxicidad no tiroidea constituye un elemento esencial del ensayo para reducir la probabilidad de resultados positivos falsos. Una mortalidad excesiva refleja claramente que se están produciendo otros mecanismos tóxicos. De forma similar, las reducciones leves en el crecimiento, determinadas mediante el peso húmedo o la SVL, también sugieren toxicidad no tiroidea. Con las sustancias que afectan negativamente al desarrollo normal se observan con frecuencia aumentos aparentes en el crecimiento. Por consiguiente, la presencia de animales de mayor tamaño no indica necesariamente que haya toxicidad no tiroidea. Sin embargo, nunca hay que basarse exclusivamente en el crecimiento para determinar la toxicidad tiroidea. Más bien, debe utilizarse el crecimiento junto con la fase de desarrollo y la histopatología de la tiroides para determinar si hay actividad tiroidea. Hay otros parámetros que también deberían tenerse en cuenta para determinar una toxicidad manifiesta, incluyendo edemas, lesiones hemorrágicas, letargo, reducción del consumo de alimentos, comportamiento errático o alterado al nadar, etc. Si todas las concentraciones del ensayo reflejan indicios de toxicidad manifiesta, debe volver a evaluarse la sustancia problema a concentraciones más bajas antes de determinar si la sustancia presenta una posible actividad o inactividad tiroidea.
|
|
62.
|
Los retrasos en el desarrollo estadísticamente significativos, a falta de otros indicios de toxicidad manifiesta, indican que la sustancia tiene actividad tiroidea (antagonista). A falta de respuestas estadísticas sólidas, este resultado puede reforzarse con los resultados del estudio histopatológico de la tiroides.
|
Análisis estadísticos
|
63.
|
Los análisis estadísticos de los datos deben seguir, preferiblemente, los procedimientos descritos en el documento “Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application” (11). En lo que respecta a todos los parámetros cuantitativos continuos (HLL, SVL, peso húmedo) coherentes con una relación dosis-respuesta monótona, debe aplicarse la prueba de Jonckheere-Terpstra de ajuste secuencial para establecer un efecto significativo del tratamiento.
|
|
64.
|
En lo que respecta a los parámetros continuos no coherentes con una relación dosis-respuesta monótona, los datos deben evaluarse para determinar su normalidad (preferiblemente con la prueba de Shapiro-Wilk o la de Anderson-Darling) y la homogeneidad de la varianza (preferiblemente con la prueba de Levene). Ambas pruebas se realizan con los valores residuales de un análisis de varianza (ANOVA). Se pueden utilizar juicios de expertos en lugar de estas pruebas formales para determinar la normalidad y la homogeneidad de la varianza, aunque se prefieren las pruebas formales. En caso de anormalidad o de heterogeneidad en la varianza, se debe buscar una transformación para estabilizar la varianza. Si los datos (quizás después de una transformación) se distribuyen normalmente con una varianza homogénea, se determinará un efecto significativo del tratamiento a partir de una prueba de Dunnett. Si los datos (quizás después de una transformación) se distribuyen normalmente con una varianza heterogénea, se determinará un efecto significativo del tratamiento a partir de una prueba de Tamhane-Dunnett o T3, o a partir de la prueba U de Mann-Whitney-Wilcoxon. Cuando no se pueda encontrar ninguna transformación normalizadora, se determinará un efecto significativo del tratamiento a partir de la prueba U de Mann-Whitney-Wilcoxon, utilizando un ajuste de Bonferroni-Holm a los valores p. La prueba de Dunnett se aplica independientemente de cualquier prueba F del ANOVA y la prueba de Mann-Whitney se aplica independientemente de cualquier prueba general de Kruskal-Wallis.
|
|
65.
|
No se espera una mortalidad significativa, pero este factor debe evaluarse con el procedimiento de ajuste secuencial de la prueba de Cochran-Armitage cuando los datos sean coherentes con la monotonicidad de la relación dosis-respuesta y, en caso contrario, con una prueba exacta de Fisher con corrección de Bonferroni-Holm.
|
|
66.
|
Un efecto significativo del tratamiento en cuanto a la fase de desarrollo se determina a partir de la aplicación secuencial de la prueba de Jonckheere-Terpstra aplicada a las medianas de las réplicas. Por otra parte, y de forma preferible, se debe usar la prueba multicuántica de Jonckheere entre los percentiles 20 y 80 para determinar los efectos, ya que tiene en cuenta los cambios en el perfil de distribución.
|
|
67.
|
La unidad adecuada de análisis es la réplica, de forma que los datos se componen de las medianas de las réplicas si se utiliza la prueba de Jonckheere-Terpstra o la prueba U de Mann-Whitney, o bien de las medias de las réplicas si se utiliza la prueba de Dunnett. La monotonicidad de la relación dosis-respuesta puede evaluarse visualmente a partir de las medias o medianas de las réplicas y de los tratamientos, o a partir de pruebas formales, como las descritas anteriormente (11). Con menos de cinco réplicas por tratamiento o control, deben utilizarse las versiones exactas de permutación de las pruebas de Jonckheere-Terpstra y Mann-Whitney, si están disponibles. La significación estadística de todas las pruebas indicadas se establece en el nivel de significación 0,05.
|
|
68.
|
La figura 4 presenta un diagrama de flujo para realizar pruebas estadísticas con los datos continuos.
Figura 4.
Diagrama de flujo para métodos estadísticos con datos continuos de respuesta.

|
Consideraciones especiales sobre el análisis de datos
Uso de los niveles de tratamiento comprometidos
|
69.
|
Hay varios factores que se tienen en cuenta a la hora de determinar si una réplica o un tratamiento entero demuestran toxicidad manifiesta y deben eliminarse del análisis. La toxicidad manifiesta se define como más de dos mortalidades en cualquier réplica que únicamente puedan explicarse por toxicidad en lugar de por un error técnico. Entre otros signos de toxicidad manifiesta se incluyen hemorragia, comportamientos anómalos, forma anómala de nadar, anorexia y cualquier otro signo clínico de enfermedad. En lo que respecta a los signos de toxicidad subletales, es posible que sea necesario realizar evaluaciones cualitativas, que siempre deben hacerse en relación con el grupo de control de agua limpia.
|
Controles de disolvente
|
70.
|
El uso de un disolvente solo debe plantearse como último recurso una vez considerado el resto de opciones de introducción de la sustancia. Si se utiliza un disolvente, debe llevarse a cabo conjuntamente con un control de agua limpia. Al finalizar el ensayo, debe efectuarse una evaluación de los efectos potenciales del disolvente. Esto se realiza mediante una comparación estadística del grupo de control de disolvente y el grupo de control de agua limpia. Los parámetros más relevantes que se deben tener en cuenta en este análisis son la fase de desarrollo, la SVL y el peso húmedo, ya que pueden verse afectados por toxicidades no tiroideas. Si se detectan diferencias estadísticamente significativas en estos parámetros entre el grupo de control de agua limpia y el grupo de control de disolvente, se deben determinar los parámetros del ensayo relativos a las mediciones de respuesta con el control de agua limpia. Si no hay diferencias estadísticamente significativas entre el control de agua limpia y el control de disolvente para todas las variables de respuesta medidas, se deben determinar los parámetros del ensayo relativos a las mediciones de respuesta con una combinación de los controles de agua de dilución y disolvente.
|
Grupos de tratamiento que llegan a la fase de desarrollo 60 y posteriores
|
71.
|
Tras la fase 60, los renacuajos presentan una reducción de tamaño y peso debido a la reabsorción de tejido y a la reducción de contenido absoluto de agua. Por ello, no se pueden utilizar adecuadamente las mediciones del peso húmedo y la SVL en los análisis estadísticos para establecer las diferencias en las tasas de crecimiento. Por consiguiente, los datos relativos al peso húmedo y a la longitud de los organismos en fases superiores a NF60 deben censurarse y no pueden utilizarse en los análisis de medias o medianas de las réplicas. Se pueden emplear dos planteamientos para analizar estos parámetros relativos al crecimiento.
|
|
72.
|
Uno de los planteamientos consiste en tener en cuenta únicamente los renacuajos en fases de desarrollo iguales o inferiores a la fase 60 en relación con los análisis estadísticos del peso húmedo o la SVL. Se cree que este planteamiento proporciona información bastante sólida sobre la gravedad de los posibles efectos sobre el crecimiento, siempre que se retire de los análisis solo una pequeña proporción de los animales del ensayo (≤ 20 %). Si presenta un desarrollo superior a la fase 60 una mayor cantidad de renacuajos (≥ 20 %) a una o más concentraciones nominales, en ese caso debe realizarse un análisis ANOVA bifactorial con una estructura de varianza anidada en todos los renacuajos con el objeto de evaluar los efectos sobre el crecimiento derivados de los tratamientos con la sustancia, al tiempo que se tiene en cuenta el efecto del desarrollo en fases tardías en el crecimiento. El apéndice 3 proporciona orientación sobre el análisis ANOVA bifactorial del peso y de la longitud.
|
BIBLIOGRAFÍA
|
(1)
|
OCDE (2004), Report of the Validation of the Amphibian Metamorphosis Assay for the detection of thyroid active substances: Phase 1 — Optimisation of the Test Protocol. Environmental Health and Safety Publications. Series on Testing and Assessment. No 77, París.
|
|
(2)
|
OCDE (2007), Final Report of the Validation of the Amphibian Metamorphosis Assay: Phase 2 — Multi-chemical Interlaboratory Study. Environmental Health and Safety Publications. Series on Testing and Assessment. No 76. París.
|
|
(3)
|
OCDE (2008), Report of the Validation Peer Review for the Amphibian Metamorphosis Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. Environmental Health and Safety Publications. Series on Testing and Assessment. No 92. París.
|
|
(4)
|
OCDE (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No 23. París.
|
|
(5)
|
ASTM (2002) Standard Guide for Conducting Acute Toxicity Tests on Test Materials with Fishes, Macroinvertebrates, and Amphibians. American Society for Testing and Materials, ASTM E E729-96 (2002), Filadelfia, Pensilvania.
|
|
(6)
|
ASTM (2004) Standard Guide for Conducting the Frog Embryo Teratogenesis Assay — Xenopus (FETAX). E 1439-98.
|
|
(7)
|
Kahl, M.D., Russom, C.L., DeFoe, D.L. and Hammermeister, D.E. (1999) Saturation units for use in aquatic bioassays. Chemosphere 39, pp. 539-551.
|
|
(8)
|
Nieuwkoop, P.D. and Faber, J. (1994) Normal Table of Xenopus laevis. Garland Publishing, Nueva York.
|
|
(9)
|
OCDE (2007), Guidance Document on Amphibian Thyroid Histology. Environmental Health and Safety Publications. Series on Testing and Assessment. No 82. París.
|
|
(10)
|
Dodd, M.H.I. and Dodd, J.M. (1976) Physiology of Amphibia. Lofts, B. (ed.), Academic Press, Nueva York, pp. 467-599.
|
|
(11)
|
OCDE (2006), Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Environmental Health and Safety Publications. Series on Testing and Assessment, No 54. París.
|
|
(12)
|
Hutchinson TH, Shillabeer N, Winter MJ, Pickford DB, 2006. Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Review. Aquatic Toxicology, 76; pp. 69–92.
|
Apéndice 1
Tabla 1
Condiciones experimentales del ensayo sobre metamorfosis de anfibios de veintiún días
|
Animal de ensayo
|
Larvas de Xenopus laevis
|
|
Fase larval inicial
|
Fase 51 de Nieuwkoop y Faber
|
|
Periodo de exposición
|
21 días
|
|
Criterios de selección de las larvas
|
Fase de desarrollo y longitud total (opcional)
|
|
Concentraciones de ensayo
|
Mínimo de tres concentraciones que abarcan aproximadamente un orden de magnitud
|
|
Régimen de exposición
|
flujo dinámico (preferida) o renovación estática
|
|
Caudal del sistema del ensayo
|
25 ml/min (sustitución completa del volumen aproximadamente cada 2,7 h)
|
|
Parámetros principales / Días de determinación
|
Mortalidad
|
Diariamente
|
|
Fase de desarrollo
|
D 7 y 21
|
|
Longitud de las extremidades posteriores
|
D 7 y 21
|
|
Distancia entre el hocico y la abertura cloacal
|
D 7 y 21
|
|
Peso corporal húmedo
|
D 7 y 21
|
|
Histología de la tiroides
|
D 21
|
|
Agua de dilución / control de laboratorio
|
Agua corriente desclorada (filtro de carbón) o fuente de laboratorio equivalente
|
|
Densidad de larvas
|
20 larvas / recipiente de ensayo (5/l)
|
|
Solución del ensayo / Recipiente de ensayo
|
4-10 l (10-15 cm de agua como mínimo) / Recipiente de ensayo de vidrio o acero inoxidable (por ejemplo, 22,5 × 14 × 16,5 cm)
|
|
Replicación
|
4 recipientes de ensayo replicados / concentración y control del ensayo
|
|
Tasa de mortalidad aceptable en los controles
|
≤ 10 % por recipiente de ensayo replicado
|
|
Fijación de la tiroides
|
Número fijado
|
Todos los renacuajos (inicialmente se evalúan cinco por réplica)
|
|
Región
|
Cabeza o todo el cuerpo
|
|
Líquido de fijación
|
Fijador de Davidson
|
|
Alimentación
|
Alimentos
|
Sera Micron® o equivalente
|
|
Cantidad/frecuencia
|
Véase la tabla 1 para consultar el régimen de alimentación con Sera Micron®
|
|
Iluminación
|
Fotoperiodo
|
12 h de luz: 12 h de oscuridad
|
|
Intensidad
|
De 600 a 2 000 lux (medición realizada en la superficie del agua)
|
|
Temperatura del agua
|
22° ± 1 °C
|
|
pH
|
De 6,5 a 8,5
|
|
Concentración de oxígeno disuelto (OD)
|
> 3,5 mg/l (> 40 % de saturación de aire)
|
|
Programa de muestras de química analítica
|
Una vez/semana (cuatro eventos de muestra/ensayo)
|
Apéndice 2
Tablas informativas de datos brutos y datos resumidos
Tabla 1
Información general sobre la sustancia problema
|
Información sobre la sustancia
|
|
|
Introduzca la sustancia problema, las unidades de concentración y los tratamientos
|
|
|
Sustancia problema:
|
|
|
|
|
Unidades de concentración:
|
|
|
|
|
Tratamiento 1
|
|
|
|
|
Tratamiento 2
|
|
|
|
|
Tratamiento 3
|
|
|
|
|
Tratamiento 4
|
|
|
|
|
|
|
|
|
|
Fecha (día 0):
|
|
Introduzca la fecha (dd/mm/aa)
|
|
|
Fecha (día 7):
|
|
Introduzca la fecha (dd/mm/aa)
|
|
|
Fecha (día 21):
|
|
Introduzca la fecha (dd/mm/aa)
|
Tabla 2
Hojas de recopilación de datos brutos de los días 7 y 21
|
DÍA X
FECHA 00/00/00
|
|
|
Concentración
|
Número de tratamiento
|
Número de réplica
|
Número de individuo
|
Identificador de individuo
|
Fase de desarrollo
|
Distancia SVL (mm)
|
Longitud de extremidades posteriores (mm)
|
Peso húmedo de todo el organismo (mg)
|
|
FILA
|
TTO
|
No TTO
|
REP
|
IND
|
ID#
|
FASE
|
BL
|
HLL
|
PESO
|
|
1
|
0,00
|
1
|
|
|
|
|
|
|
|
|
2
|
0,00
|
1
|
|
|
|
|
|
|
|
|
3
|
0,00
|
1
|
|
|
|
|
|
|
|
|
4
|
0,00
|
1
|
|
|
|
|
|
|
|
|
5
|
0,00
|
1
|
|
|
|
|
|
|
|
|
6
|
0,00
|
1
|
|
|
|
|
|
|
|
|
7
|
0,00
|
1
|
|
|
|
|
|
|
|
|
8
|
0,00
|
1
|
|
|
|
|
|
|
|
|
9
|
0,00
|
1
|
|
|
|
|
|
|
|
|
10
|
0,00
|
1
|
|
|
|
|
|
|
|
|
11
|
0,00
|
1
|
|
|
|
|
|
|
|
|
12
|
0,00
|
1
|
|
|
|
|
|
|
|
|
13
|
0,00
|
1
|
|
|
|
|
|
|
|
|
14
|
0,00
|
1
|
|
|
|
|
|
|
|
|
15
|
0,00
|
1
|
|
|
|
|
|
|
|
|
16
|
0,00
|
1
|
|
|
|
|
|
|
|
|
17
|
0,00
|
1
|
|
|
|
|
|
|
|
|
18
|
0,00
|
1
|
|
|
|
|
|
|
|
|
19
|
0,00
|
1
|
|
|
|
|
|
|
|
|
20
|
0,00
|
1
|
|
|
|
|
|
|
|
|
21
|
0,00
|
2
|
|
|
|
|
|
|
|
|
22
|
0,00
|
2
|
|
|
|
|
|
|
|
|
23
|
0,00
|
2
|
|
|
|
|
|
|
|
|
24
|
0,00
|
2
|
|
|
|
|
|
|
|
|
25
|
0,00
|
2
|
|
|
|
|
|
|
|
|
26
|
0,00
|
2
|
|
|
|
|
|
|
|
|
27
|
0,00
|
2
|
|
|
|
|
|
|
|
|
28
|
0,00
|
2
|
|
|
|
|
|
|
|
|
29
|
0,00
|
2
|
|
|
|
|
|
|
|
|
30
|
0,00
|
2
|
|
|
|
|
|
|
|
|
31
|
0,00
|
2
|
|
|
|
|
|
|
|
|
32
|
0,00
|
2
|
|
|
|
|
|
|
|
|
33
|
0,00
|
2
|
|
|
|
|
|
|
|
|
34
|
0,00
|
2
|
|
|
|
|
|
|
|
|
35
|
0,00
|
2
|
|
|
|
|
|
|
|
|
36
|
0,00
|
2
|
|
|
|
|
|
|
|
|
37
|
0,00
|
2
|
|
|
|
|
|
|
|
|
38
|
0,00
|
2
|
|
|
|
|
|
|
|
|
39
|
0,00
|
2
|
|
|
|
|
|
|
|
|
40
|
0,00
|
2
|
|
|
|
|
|
|
|
|
41
|
0,00
|
3
|
|
|
|
|
|
|
|
|
42
|
0,00
|
3
|
|
|
|
|
|
|
|
|
43
|
0,00
|
3
|
|
|
|
|
|
|
|
|
44
|
0,00
|
3
|
|
|
|
|
|
|
|
|
45
|
0,00
|
3
|
|
|
|
|
|
|
|
|
46
|
0,00
|
3
|
|
|
|
|
|
|
|
|
47
|
0,00
|
3
|
|
|
|
|
|
|
|
|
48
|
0,00
|
3
|
|
|
|
|
|
|
|
|
49
|
0,00
|
3
|
|
|
|
|
|
|
|
|
50
|
0,00
|
3
|
|
|
|
|
|
|
|
|
51
|
0,00
|
3
|
|
|
|
|
|
|
|
|
52
|
0,00
|
3
|
|
|
|
|
|
|
|
|
53
|
0,00
|
3
|
|
|
|
|
|
|
|
|
54
|
0,00
|
3
|
|
|
|
|
|
|
|
|
55
|
0,00
|
3
|
|
|
|
|
|
|
|
|
56
|
0,00
|
3
|
|
|
|
|
|
|
|
|
57
|
0,00
|
3
|
|
|
|
|
|
|
|
|
58
|
0,00
|
3
|
|
|
|
|
|
|
|
|
59
|
0,00
|
3
|
|
|
|
|
|
|
|
|
60
|
0,00
|
3
|
|
|
|
|
|
|
|
|
61
|
0,00
|
4
|
|
|
|
|
|
|
|
|
62
|
0,00
|
4
|
|
|
|
|
|
|
|
|
63
|
0,00
|
4
|
|
|
|
|
|
|
|
|
64
|
0,00
|
4
|
|
|
|
|
|
|
|
|
65
|
0,00
|
4
|
|
|
|
|
|
|
|
|
66
|
0,00
|
4
|
|
|
|
|
|
|
|
|
67
|
0,00
|
4
|
|
|
|
|
|
|
|
|
68
|
0,00
|
4
|
|
|
|
|
|
|
|
|
69
|
0,00
|
4
|
|
|
|
|
|
|
|
|
70
|
0,00
|
4
|
|
|
|
|
|
|
|
|
71
|
0,00
|
4
|
|
|
|
|
|
|
|
|
72
|
0,00
|
4
|
|
|
|
|
|
|
|
|
73
|
0,00
|
4
|
|
|
|
|
|
|
|
|
74
|
0,00
|
4
|
|
|
|
|
|
|
|
|
75
|
0,00
|
4
|
|
|
|
|
|
|
|
|
76
|
0,00
|
4
|
|
|
|
|
|
|
|
|
77
|
0,00
|
4
|
|
|
|
|
|
|
|
|
78
|
0,00
|
4
|
|
|
|
|
|
|
|
|
79
|
0,00
|
4
|
|
|
|
|
|
|
|
|
80
|
0,00
|
4
|
|
|
|
|
|
|
|
Tabla 3
Resúmenes calculados de los datos de los parámetros de los días 7 y 21
|
|
|
Fase de desarrollo
|
SVL (mm)
|
Longitud extremidades posteriores (mm)
|
Peso (mg)
|
|
TTO
|
RÉP
|
MÍN
|
MEDIANA
|
MÁX
|
MEDIA
|
DESV TÍP
|
MEDIA
|
DESV TÍP
|
MEDIA
|
DESV TÍP
|
|
1
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
Nota: Los cálculos de las celdas corresponden a las entradas de datos de la tabla 2.
|
Tabla 4:
Datos de mortalidad diaria
|
Día del ensayo
|
Fecha
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
|
0
|
00/00/00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Recuento por réplicas
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Recuento por tratamientos
|
0
|
|
|
|
0
|
|
|
|
0
|
|
|
|
0
|
|
|
|
|
Nota: Los cálculos de las celdas corresponden a las entradas de datos de la tabla 1.
|
Tabla 5
Criterios de calidad del agua
Sistema de exposición (renovación dinámica/estática):
Temperatura:
Intensidad de la luz:
Ciclo luz-oscuridad:
Alimentos:
Tasa de alimentación:
pH del agua:
Concentración de yodo en el agua del ensayo:
Tabla 6
Resumen de datos químicos
|
Nombre de la sustancia:
|
|
No CAS:
|
|
Día del ensayo
|
Fecha
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
|
0
|
00/00/00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nota: Los cálculos de las celdas corresponden a las entradas de datos de la tabla 1.
|
Tabla 7
Tablas de notificación de histopatología para los criterios básicos
|
Fecha:
|
Sustancia:
|
|
|
Anatomopatólogo:
|
|
|
Hipertrofia de la glándula tiroidea
|
Atrofia de la glándula tiroidea
|
Hipertrofia de las células foliculares
|
Hiperplasia de las células foliculares
|
|
Hipertrofia de la glándula tiroidea
|
Atrofia de la glándula tiroidea
|
Hipertrofia de las células foliculares
|
Hiperplasia de las células foliculares
|
|
ID animal control — réplica 1
|
|
|
|
|
|
ID animal dosis — réplica 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID animal control — réplica 2
|
|
|
|
|
|
ID animal dosis — réplica 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Total:
|
|
|
|
|
Total:
|
|
|
|
|
|
|
Hipertrofia de la glándula tiroidea
|
Atrofia de la glándula tiroidea
|
Hipertrofia de las células foliculares
|
Hiperplasia de las células foliculares
|
|
|
Hipertrofia de la glándula tiroidea
|
Atrofia de la glándula tiroidea
|
Hipertrofia de las células foliculares
|
Hiperplasia de las células foliculares
|
|
ID animal dosis — réplica 1
|
|
|
|
|
|
ID animal dosis — réplica 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID animal dosis — réplica 2
|
|
|
|
|
|
ID animal dosis — réplica 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Total:
|
|
|
|
|
Total:
|
|
|
|
|
Tabla 8:
Criterios adicionales sobre histopatología
|
Fecha:
|
Sustancia:
|
|
|
Anatomopatólogo:
|
|
|
|
|
|
|
|
|
Aumento del área de la luz folicular
|
Reducción del área de la luz folicular
|
Aumento del área de la luz folicular
|
Reducción del área de la luz folicular
|
|
ID animal control — réplica 1
|
|
|
|
Animal dosis ID — réplica 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID animal control — réplica 2
|
|
|
|
Animal de dosis ID — réplica 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Total:
|
|
|
Total:
|
|
|
|
|
Aumento del área de la luz folicular
|
Reducción del área de la luz folicular
|
|
|
Aumento del área de la luz folicular
|
Reducción del área de la luz folicular
|
|
ID animal dosis — réplica 1
|
|
|
|
ID animal dosis — réplica 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID animal dosis — réplica 2
|
|
|
|
ID animal dosis — réplica 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Total:
|
|
|
Total:
|
|
|
Tabla 9
Descripciones explicativas de los hallazgos histopatológicos
|
Fecha:
|
|
Sustancia:
|
|
Anatomopatólogo:
|
|
|
Descripción explicativa
|
|
ID animal control — réplica 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID animal control — réplica 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID animal dosis — réplica 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID animal dosis — réplica 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID animal dosis — réplica 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID animal dosis — réplica 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID animal dosis — réplica 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID animal dosis — réplica 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tabla 10
Plantilla de tabla de resumen de presentación del día x (7 o 21) del AMA
|
|
|
Control
|
Dosis 1
|
Dosis 2
|
Dosis 3
|
|
Parámetro
|
Réplica
|
Media
|
DT
|
CV
|
N
|
Media
|
DT
|
CV
|
N
|
Valor p
|
Media
|
DT
|
CV
|
N
|
Valor p
|
Media
|
DT
|
CV
|
N
|
Valor p
|
|
Longitud de la extremidad posterior
(mm)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Media:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SVL
(mm)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Media:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Peso húmedo
(mg)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Media:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tabla 11
Plantilla de tabla de resumen de presentación de datos relativos a la fase de desarrollo del día × (7 o 21) del AMA
|
|
|
Control
|
Dosis 1
|
Dosis 2
|
Dosis 3
|
|
|
Réplica
|
Mediana
|
Mín
|
Máx
|
N
|
Mediana
|
Mín
|
Máx
|
N
|
Valor p
|
Mediana
|
Mín
|
Máx
|
N
|
Valor p
|
Mediana
|
Mín
|
Máx
|
Mediana
|
Valor p
|
|
Fase de desarrollo
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Media:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Apéndice 3
Análisis alternativo de peso y longitud en caso de desarrollo en fases tardías en más del 20 % de los renacuajos a una o más concentraciones
Si una cantidad mayor de renacuajos presenta un desarrollo superior a la fase 60 (≥ 20 %) a una o más concentraciones nominales, en ese caso debe realizarse un análisis ANOVA bifactorial con una estructura de varianza anidada en todos los renacuajos con el objeto de evaluar los efectos en el crecimiento derivados del tratamiento con la sustancia, al tiempo que se tiene en cuenta el efecto del desarrollo en fases tardías en el crecimiento.
La propuesta consiste en utilizar todos los datos, pero teniendo en cuenta el efecto del desarrollo en fases tardías. Esto se puede llevar a cabo con un análisis ANOVA de dos factores, con una estructura de varianza anidada. Defina Fase tardía = «Sí» de un animal si su fase de desarrollo es la 61 o posterior. En caso contrario, defina Fase tardía = «No». A continuación se puede llevar a cabo un análisis ANOVA bifactorial (concentración y fase tardía, y su interacción), con Rep(Conc) como un factor aleatorio y Renacuajo(Rep) como otro efecto aleatorio. Este sigue tratando la réplica como la unidad de análisis y aporta básicamente los mismos resultados que un análisis ponderado de medias de réplica*fase tardía, ponderado con el número de animales por media. Si los datos no cumplen los requisitos de homogeneidad de la varianza o de normalidad de ANOVA, se puede llevar a cabo una transformación normalizada ordinal por rangos para eliminar esa objeción.
Además de las pruebas F de ANOVA clásico para analizar los efectos de Conc, Fase tardía y sus interacciones, la prueba F de interacción se puede “dividir” en dos pruebas F de ANOVA adicionales, una sobre las respuestas medias en las concentraciones de Fase tardía = «No» y otra sobre las respuestas medias en las concentraciones de Fase tardía = «Sí». En cada nivel de Fase tardía se realizan más comparaciones de las medias de tratamiento con respecto al control. Se puede llevar a cabo un análisis de tendencia con comparaciones por pares simples o con contrastes adecuados si hay indicios de una relación dosis-respuesta no monótona dentro de un nivel de la variable Fase tardía. Se realiza un ajuste Bonferroni-Holm a los valores p solo si el corte F correspondiente no es significativo. Esto se puede realizar con SAS y, supuestamente, con otros paquetes de programas estadísticos. Pueden surgir complicaciones cuando no haya animales en fase tardía en algunas concentraciones, pero estas situaciones se pueden gestionar de forma muy sencilla.
Apéndice 4
Definiciones
Sustancia:: sustancia o mezcla.
Sustancia problema:: toda sustancia o mezcla estudiada con este método de ensayo.
C.39. ENSAYO SOBRE LA REPRODUCCIÓN DE COLÉMBOLOS EN EL SUELO
INTRODUCCIÓN
|
1.
|
El presente método de ensayo reproduce las directrices de ensayo (TG) 232 de la OCDE (2009). Este método de ensayo se ha diseñado para evaluar los efectos de las sustancias en el resultado reproductor de los colémbolos en el suelo. Está basado en procedimientos existentes (1) (2). Las especies Folsomia candida partenogenética y la Folsomia fimetaria de reproducción sexual son dos de las más accesibles de los colémbolos, las cuales se pueden cultivar y están disponibles comercialmente. Cuando hay que evaluar hábitats específicos no cubiertos por las dos especies, el procedimiento también se puede ampliar a otras especies de colémbolos si cumplen los criterios de validez del ensayo.
|
|
2.
|
Los colémbolos que viven en el suelo son especies ecológicamente relevantes para ensayos ecotoxicológicos. Los colémbolos son hexápodos con un exoesqueleto delgado y muy permeable al aire y al agua, y representan especies de artrópodos con una ruta y una tasa de exposición distintas en comparación con las lombrices de tierra y los enquitreidos.
|
|
3.
|
Las densidades de población de los colémbolos suelen llegar a 105 m– 2 en el suelo y en capas de detritus de hojarasca de muchos ecosistemas terrestres (3) (4). Los adultos miden típicamente entre 0,5 y 5 mm, y su contribución a la respiración y la biomasa animal total del suelo es baja, se estima que oscila entre el 1 % y el 5 % (5). Por lo tanto, es posible que su función más importante sea la de reguladores potenciales de procesos mediante la depredación de microorganismos y microfauna. Los colémbolos son presas de una gran variedad de invertebrados endogeicos y epigeicos, como ácaros, ciempiés, arañas, carábidos y estafilínidos. Los colémbolos contribuyen a los procesos de descomposición de los suelos ácidos, donde tal vez sean los invertebrados del suelo más importantes, aparte de los enquitreidos, ya que las lombrices de tierra y los diplópodos suelen estar ausentes.
|
|
4.
|
F. fimetaria tiene una distribución mundial y es común en varios tipos de suelo, desde suelos arenosos hasta suelos francos y de mull a mor. Se trata de un colémbolo sin ojos ni pigmentos. Se ha registrado su presencia en suelos agrícolas de toda Europa (6). Presenta un hábito de alimentación omnívora, que incluye entre sus alimentos hifas fúngicas, bacterias, protozoos y detritus. Interactúa por su alimentación con las infecciones de hongos patógenos de las plantas (7) y puede afectar a las micorrizas, como se sabe que sucede con F. candida. Como la mayor parte de las especies de colémbolos, se reproducen sexualmente, lo que exige la presencia permanente de machos para la fertilización de los huevos.
|
|
5.
|
F. candida también se distribuye por todo el mundo. Aunque no es frecuente en la mayoría de los suelos naturales, suele aparecer en grandes cantidades en las zonas ricas en humus. Se trata de un colémbolo sin ojos ni pigmentos. Cuenta con una furca (órgano para saltar) bien desarrollada, un movimiento de carrera activo y salta fácilmente si se le molesta. La función ecológica de F. candida es similar a la función de la F. fimetaria, pero los hábitats son suelos más ricos en materia orgánica. Se reproduce partenogenéticamente. Los machos pueden aparecer en una proporción de menos de 1 por mil.
|
PRINCIPIO DEL ENSAYO
|
6.
|
Se exponen colémbolos adultos (F. fimetaria) o juveniles (F. candida) sincrónicos a un intervalo de concentraciones de la sustancia problema mezclada con un suelo artificial modificado (8) y un contenido en materia orgánica del 5 % (o un suelo alternativo). El escenario del ensayo se puede dividir en dos pasos:
|
—
|
En los casos en que no haya suficiente información disponible sobre la toxicidad, un estudio de determinación del intervalo en el que la mortalidad y la reproducción sean los principales parámetros que se evalúen transcurridas dos semanas en el caso de F. fimetaria y tres semanas en el caso de F. candida.
|
|
—
|
Un ensayo de reproducción definitivo en el que se evalúe el número total de juveniles producido por los animales parentales, así como la supervivencia de estos. La duración de este ensayo definitivo es de tres semanas para F. fimetaria y de cuatro semanas para F. candida.
|
El efecto tóxico de la sustancia problema en la mortalidad y el resultado reproductor de los adultos se expresa como LCx y ECx, ajustando los datos a un modelo adecuado mediante regresión no lineal con el fin de estimar la concentración que provocaría un x % de mortalidad o de reducción en el resultado reproductor, respectivamente; o bien de manera alternativa como valor NOEC/LOEC (9).
|
INFORMACIÓN SOBRE LA SUSTANCIA PROBLEMA
|
7.
|
Preferiblemente, deberían conocerse las propiedades físicas, la hidrosolubilidad, el log Kow, el coeficiente de reparto agua/suelo y la presión de vapor de la sustancia problema. Sería deseable contar con información adicional sobre el destino de la sustancia problema en el suelo, como los índices de fotólisis e hidrólisis y la degradación biótica. Cuando estén disponibles, deben documentarse la identificación química de la sustancia problema conforme a la nomenclatura de la IUPAC, el número de registro CAS, el lote de fabricación, el lote de acondicionamiento, la fórmula estructural y la pureza.
|
|
8.
|
Este método de ensayo puede utilizarse con sustancias solubles o insolubles en el agua. Sin embargo, el modo de aplicación de la sustancia problema variará en consecuencia. El método de ensayo no es aplicable a sustancias volátiles, es decir, sustancias cuya constante de Henry o cuyo coeficiente de reparto aire/agua son superiores a uno, o sustancias cuya presión de vapor es superior a 0,0133 Pa a 25 °C.
|
VALIDEZ DEL ENSAYO
|
9.
|
Deberán cumplirse los criterios siguientes en los controles no tratados para que un resultado del ensayo pueda considerarse válido:
|
—
|
la mortalidad media de los adultos no debe superar el 20 % al final del ensayo;
|
|
—
|
el número medio de juveniles por recipiente debe ser, como mínimo, de cien al final del ensayo; y
|
|
—
|
el coeficiente de variación calculado para el número de juveniles debe ser inferior al 30 % al final del ensayo definitivo.
|
|
SUSTANCIA DE REFERENCIA
|
10.
|
Debe analizarse una sustancia de referencia a su concentración EC50 para el tipo de suelo elegido para el ensayo, a intervalos regulares o posiblemente en paralelo con cada serie de ensayo con el objeto de comprobar si la respuesta de los organismos de ensayo en el sistema de ensayo se encuentra en el nivel normal. Una sustancia de referencia adecuada es el ácido bórico, que debe reducir la reproducción en un 50 % (10) (11) a alrededor de 100 mg/kg de peso seco de suelo para ambas especies.
|
DESCRIPCIÓN DEL ENSAYO
Recipientes y equipo del ensayo
|
11.
|
Son recipientes adecuados para el ensayo los que puedan albergar 30 g de suelo húmedo. El material debe ser vidrio o plástico inerte (no tóxico). Sin embargo, debe evitarse el uso de recipientes de plástico si la exposición a la sustancia problema se reduce debido a la sorción. Los recipientes de ensayo deben contar con una sección transversal que permita que la profundidad real del suelo en cuestión en el interior del recipiente de ensayo sea de 2 a 4 cm. Los recipientes deben contar con tapas (por ejemplo, de vidrio o polietileno) diseñadas para reducir la evaporación del agua al tiempo que permitan el intercambio de gases entre el suelo y la atmósfera. El recipiente debe ser, como mínimo, parcialmente transparente para permitir la transmisión de la luz.
|
|
12.
|
Se precisa un equipo normal de laboratorio y, en particular el siguiente:
|
—
|
balanzas de precisión adecuada;
|
|
—
|
equipo adecuado para controlar la temperatura;
|
|
—
|
equipo adecuado para controlar la humedad del aire (no es esencial si los recipientes de ensayo están cubiertos con tapas);
|
|
—
|
incubadora o pequeña sala con control de temperatura;
|
|
—
|
pinzas o dispositivo de flujo de aire con baja succión.
|
|
Preparación del suelo del ensayo
|
13.
|
Se utiliza un suelo artificial modificado (8) con un contenido en materia orgánica del 5 %. También puede utilizarse un suelo natural, ya que el suelo artificial no se parece a los suelos naturales. La composición recomendada del suelo artificial es la siguiente (basándose en pesos secos, secado hasta peso constante a 105 °C):
|
—
|
5 % de turba esfágnea, secada al aire y triturada finamente (es aceptable un tamaño de partícula de 2 ± 1 mm);
|
|
—
|
20 % de caolín (con un contenido de caolinita preferentemente superior al 30 %);
|
|
—
|
aproximadamente un 74 % de arena industrial secada al aire (en función de la cantidad de CaCO3 necesaria), arena predominantemente fina con más de un 50 % de partículas de entre 50 y 200 micras. La cantidad exacta de arena depende de la cantidad de CaCO3 (véase más adelante) y, en conjunto, deben sumar un 75 %.
|
|
—
|
1,0 % de carbonato cálcico (CaCO3, pulverizado, de grado analítico) para obtener un pH de 6,0 ± 0,5; la cantidad de carbonato cálcico que se debe añadir dependerá principalmente de la calidad o el tipo de turba (véase la nota 1).
|
Nota 1: La cantidad de CaCO3 necesaria dependerá de los componentes del sustrato del suelo y debe determinarse midiendo inmediatamente antes del ensayo el pH de submuestras de suelo húmedo preincubadas.
Nota 2: Se recomienda medir el pH y, opcionalmente, la relación C/N, la capacidad de intercambio catiónico (CEC) y el contenido en materia orgánica del suelo para permitir la normalización en una fase posterior y mejorar la interpretación de los resultados.
Nota 3: En caso necesario, por ejemplo para fines específicos del ensayo, los suelos naturales de lugares no contaminados también pueden utilizarse como sustrato de ensayo o cultivo. No obstante, si se utiliza suelo natural, debe caracterizarse al menos por el origen (lugar de recogida), el pH, la textura (granulometría), la CEC y el contenido en materia orgánica, además de tener que estar libre de toda contaminación. En el caso del suelo natural, es aconsejable demostrar su idoneidad para el ensayo y para cumplir los criterios de validez del ensayo antes de utilizarlo en un ensayo definitivo.
|
|
14.
|
Los componentes secos del suelo se mezclan concienzudamente (por ejemplo, en un mezclador de laboratorio de gran escala). La capacidad de retención de agua máxima (WHC) del suelo artificial se determina de conformidad con los procedimientos descritos en el apéndice 5. El contenido de humedad del suelo del ensayo debe optimizarse para conseguir una estructura de suelo poroso suelto que permita la entrada de los colémbolos en los poros. Normalmente, corresponde a una banda entre el 40 y el 60 % de la WHC máxima.
|
|
15.
|
Para equilibrar o estabilizar la acidez, el suelo artificial seco se humedece previamente añadiendo suficiente agua desionizada para obtener aproximadamente la mitad del contenido de agua final entre 2 y 7 días antes de que comience el ensayo. Para determinar el pH, se utiliza una mezcla de suelo y cloruro potásico (KCl) 1 M, o una solución 0,01 M de cloruro cálcico (CaCl2) en una relación de 1:5 (de acuerdo con el apéndice 6). Si el suelo es más ácido que el intervalo requerido, se puede ajustar añadiendo una cantidad adecuada de CaCO3. Si el suelo es demasiado alcalino, se puede ajustar añadiendo un ácido inorgánico inofensivo para los colémbolos.
|
|
16.
|
El suelo humedecido previamente se divide en un número de partes equivalente al número de concentraciones de ensayo (más la sustancia de referencia, cuando proceda) y de controles utilizados en el ensayo. Se añaden las sustancias problema y se ajusta el contenido de agua de acuerdo con el punto 24.
|
Selección y preparación de los animales del ensayo
|
17.
|
F. candida partenogenética es la recomendada, ya que en el ensayo interlaboratorios del método de ensayo (11) esta especie cumplió los criterios de validez con respecto a la supervivencia con mayor frecuencia que F. fimetaria. Si se utiliza otra especie, debe cumplir los criterios de validez que figuran en el punto 9. Al inicio del ensayo, los animales deben estar bien alimentados y tener una edad de 23 a 26 días, en lo que respecta a F. fimetaria, y entre 9 y 12 días en lo que respecta a F. candida. En cada réplica, el número de F. fimetaria debe ser de 10 machos y 10 hembras; en el caso de F. candida, deben utilizarse 10 hembras (véanse los apéndices 2 y 3). Los animales sincrónicos se seleccionan de forma aleatoria de las placas y se comprueba el estado de salud y físico de cada lote que se añade a una réplica. Cada grupo de 10 o 20 individuos se añade a un recipiente de ensayo seleccionado de forma aleatoria, y se seleccionan las hembras de gran tamaño de F. fimetaria para garantizar una distinción adecuada de los machos de F. fimetaria.
|
Preparación de las concentraciones de ensayo
|
18.
|
Se pueden utilizar cuatro métodos de aplicación de la sustancia problema: 1) introducir la sustancia problema en el suelo con agua como vehículo; 2) introducir la sustancia problema en el suelo con un disolvente orgánico como vehículo; 3) introducir la sustancia problema en el suelo con arena como vehículo; o 4) aplicar la sustancia problema en la superficie del suelo. La selección del método adecuado depende de las características de la sustancia y de la finalidad del ensayo. En general, se recomienda introducir la sustancia problema en el suelo. No obstante, pueden ser necesarios procedimientos de aplicación coherentes con el uso práctico de la sustancia problema (por ejemplo, la pulverización de una fórmula líquida o el uso de fórmulas de plaguicidas especiales, como preparaciones para semillas o gránulos). El suelo se trata antes de añadir los colémbolos, salvo cuando se añade la sustancia problema a la superficie del suelo; se debe permitir que los colémbolos entren en el suelo.
|
Sustancia problema soluble en agua
|
19.
|
Se prepara una solución de la sustancia problema en agua desionizada, en una cantidad suficiente para realizar todas las réplicas de una concentración de ensayo. Cada solución de la sustancia problema se mezcla bien con un solo lote de suelo humedecido previamente antes de introducirse en el recipiente de ensayo.
|
Sustancia problema insoluble en agua
|
20.
|
En lo que respecta a las sustancias insolubles en agua, pero solubles en disolventes orgánicos, la sustancia problema puede disolverse en el volumen más pequeño posible de un disolvente adecuado (por ejemplo, acetona) que siga garantizando la mezcla correcta de la sustancia en el suelo y su mezcla con una parte de la arena de cuarzo necesaria. Solo deben utilizarse disolventes volátiles. Cuando se utilice un disolvente orgánico, todas las concentraciones de ensayo y un control negativo de disolvente adicional deben contener la misma cantidad mínima de disolvente. Los recipientes de aplicación deben permanecer destapados durante un periodo determinado para permitir que el disolvente asociado a la aplicación de la sustancia problema se evapore, velando por que la sustancia problema no se disipe durante este periodo.
|
Sustancia problema poco soluble en agua y en disolventes orgánicos
|
21.
|
En lo que respecta a las sustancias poco solubles en agua y en disolventes orgánicos, se mezcla arena de cuarzo, que debe formar parte de la arena total añadida al suelo, con la cantidad de la sustancia problema necesaria para obtener la concentración de ensayo deseada. Esta mezcla de arena de cuarzo y de sustancia problema se añade al suelo previamente humedecido y se mezcla bien tras añadir una cantidad adecuada de agua desionizada para obtener la humedad necesaria. La mezcla final se divide entre los recipientes de ensayo. El procedimiento se repite con cada concentración del ensayo y se prepara también un control adecuado.
|
Aplicación de la sustancia problema en la superficie del suelo
|
22.
|
Si la sustancia problema es un plaguicida, podría resultar adecuado aplicarla en la superficie del suelo mediante pulverización. El suelo se trata después de añadir los colémbolos. Los recipientes de ensayo se llenan en primer lugar con el sustrato del suelo humedecido, se añaden los animales y, a continuación, se pesan los recipientes de ensayo. Para evitar toda exposición directa de los animales a la sustancia problema mediante un contacto directo, la sustancia problema se aplica como mínimo media hora después de introducir los colémbolos. La sustancia problema debe aplicarse en la superficie del suelo de la manera más uniforme posible con ayuda de un dispositivo de pulverización adecuado a escala de laboratorio para simular la aplicación por pulverización sobre el terreno. La aplicación debe producirse a una temperatura determinada con ± 2 °C de variación y, en lo que respecta a las soluciones, emulsiones o dispersiones acuosas, con una tasa de aplicación de agua conforme a las recomendaciones de la evaluación de riesgos. Esta tasa debe comprobarse con una técnica de calibración adecuada. Las fórmulas especiales, como la preparación para semillas o los gránulos, pueden aplicarse de acuerdo con el uso agrícola. El alimento se añade después de la pulverización.
|
PROCEDIMIENTO
Condiciones de ensayo
|
23.
|
La temperatura media del ensayo debe ser de 20 ± 1 °C con un intervalo de temperatura de 20 ± 2 °C. El ensayo se lleva a cabo con ciclos controlados de luz-oscuridad (preferiblemente, 12 horas de luz y 12 horas de oscuridad) con una iluminación de 400 a 800 lux en el área de los recipientes de ensayo.
|
|
24.
|
A fin de comprobar la humedad del suelo, los recipientes se pesan al principio, a la mitad y al final del ensayo. Las pérdidas de peso superiores al 2 % se reponen añadiendo agua desionizada. Cabe señalar que la pérdida de agua puede reducirse manteniendo un alto nivel de humedad ambiental (superior al 80 %) en la incubadora del ensayo.
|
|
25.
|
El pH debe medirse al principio y al final del estudio de determinación del intervalo y del ensayo definitivo. Las mediciones deben realizarse con una muestra extra de control y con una muestra extra de las muestras de suelo tratado (todas las concentraciones) que se habrán preparado y mantenido de la misma forma que los cultivos del ensayo, pero sin añadir colémbolos.
|
Procedimiento y mediciones del ensayo
|
26.
|
Para cada concentración de ensayo, se coloca en el recipiente de ensayo una cantidad de suelo de ensayo correspondiente a 30 g de peso en fresco. También se preparan controles de agua, sin la sustancia problema. Si se utiliza un vehículo para aplicar la sustancia problema, debe analizarse una serie de control que contenga solo el vehículo, además de la serie del ensayo. La concentración de disolvente o dispersante ha de ser igual a la utilizada en los recipientes de ensayo que contienen la sustancia problema.
|
|
27.
|
Los distintos ejemplares de colémbolos se trasladan con cuidado a cada recipiente de ensayo (se asignan aleatoriamente a los recipientes de ensayo) y se colocan en la superficie del suelo. Para trasladar los animales de forma eficaz, se puede utilizar un dispositivo de flujo de aire de baja succión. El número de réplicas de las concentraciones de ensayo y de los controles depende del diseño de ensayo que se utilice. Los recipientes de ensayo se colocan aleatoriamente en la incubadora del ensayo y estas posiciones se vuelven a aleatorizar cada semana.
|
|
28.
|
En lo que respecta a los veinte adultos del ensayo con F. fimetaria, se deben utilizar 10 machos y 10 hembras de entre 23 y 26 días de edad por cada recipiente de ensayo. El día 21 se extraen los colémbolos del suelo y se cuentan. En lo que respecta a F. fimetaria, el sexo se discrimina por tamaño en el lote de animales sincronizado que se utiliza para el ensayo. Las hembras son claramente más grandes que los machos (véase el apéndice 3).
|
|
29.
|
En lo que respecta al ensayo con F. candida, deben utilizarse juveniles de entre 9 y 12 días por cada recipiente de ensayo. El día 28 se extraen los colémbolos de la tierra y se cuentan.
|
|
30.
|
Como fuente de alimentos adecuada, se añade a cada recipiente una cantidad suficiente, por ejemplo de 2-10 mg, de levadura granulada seca de panadería para uso doméstico disponible en el mercado, al principio del ensayo y una vez transcurridas dos semanas aproximadamente.
|
|
31.
|
Al final del ensayo se evalúan la mortalidad y la reproducción. Transcurridas tres (F. fimetaria) o cuatro semanas (F. candida), se extraen los colémbolos del suelo de ensayo (véase el apéndice 4) y se cuentan (12). Un colémbolo se registra como muerto si no está presente en la extracción. El proceso de extracción y el de recuento deben validarse. La validez implica una eficacia de extracción de juveniles superior al 95 %, por ejemplo, añadiendo un número conocido al suelo.
|
|
32.
|
En el apéndice 2 se incluyen un resumen práctico y el calendario de los procedimientos del ensayo.
|
Diseño del ensayo
Ensayo de determinación del intervalo
|
33.
|
Cuando sea necesario, se realiza un ensayo de determinación del intervalo con, por ejemplo, cinco concentraciones de la sustancia problema de 0,1, 1,0, 10, 100 y 1 000 mg/kg de peso seco de suelo, y dos réplicas de cada tratamiento y control. La información adicional procedente de ensayos con sustancias similares o de publicaciones sobre mortalidad o reproducción de los colémbolos también podría resultar útil para decidir el intervalo de concentraciones que debe utilizarse en el ensayo de determinación del intervalo.
|
|
34.
|
La duración del ensayo de determinación del intervalo es de dos semanas con F. fimetaria y de tres semanas con F. candida, para garantizar que se produzca una sola eclosión de juveniles. Al final del ensayo se evalúan la mortalidad y la reproducción de los colémbolos. Debe registrarse el número de adultos y la aparición de juveniles.
|
Ensayo definitivo
|
35.
|
Para determinar la ECx (por ejemplo, EC10, EC50), deben analizarse doce concentraciones. Se recomiendan, como mínimo, dos réplicas para cada tratamiento de concentración del ensayo y seis réplicas de control. El factor de separación puede variar en función del patrón dosis-respuesta.
|
|
36.
|
Para determinar la NOEC/LOEC, deben analizarse al menos cinco concentraciones en una serie geométrica. Se recomiendan cuatro réplicas de cada tratamiento de concentración del ensayo más ocho controles. Las concentraciones deben estar separadas por un factor no superior a 1,8.
|
|
37.
|
Un planteamiento combinado permite determinar tanto la NOEC/LOEC como la ECx. En lo que respecta a este planteamiento combinado, deben utilizarse ocho concentraciones de tratamiento en una serie geométrica. Se recomiendan cuatro réplicas de cada tratamiento más ocho controles. Las concentraciones deben estar separadas por un factor no superior a 1,8.
|
|
38.
|
Si no se observan efectos a la concentración más alta de la prueba de determinación del intervalo (es decir, 1 000 mg/kg), el ensayo de reproducción puede llevarse a cabo como prueba límite, utilizando una concentración de ensayo de 1 000 mg/kg y el control. Una prueba límite brindará la oportunidad de demostrar que no se produce ningún efecto estadísticamente significativo a la concentración límite. Deben utilizarse ocho réplicas tanto con el suelo tratado como con el control.
|
DATOS E INFORME
Tratamiento de los resultados
|
39.
|
El resultado reproductor es el parámetro principal (por ejemplo, el número de juveniles producidos por recipiente de ensayo). El análisis estadístico, por ejemplo con los procedimientos ANOVA, compara los tratamientos mediante la prueba t de Student, la prueba de Dunnett o la prueba de Williams. Se calculan intervalos de confianza del 95 % para las medias de cada tratamiento.
|
|
40.
|
El número de adultos supervivientes en los controles no tratados constituye un importante criterio de validez y debe quedar documentado. Al igual que en la prueba de determinación del intervalo, el resto de signos perjudiciales también debe registrarse en el informe final.
|
LCx y ECx
|
41.
|
Los valores de ECx, incluyendo sus límites de confianza del 95 % inferior y superior para el parámetro, se calculan con métodos estadísticos adecuados (por ejemplo, función logística o de Weibull, método de Spearman-Karber recortado o la interpolación simple). El valor de ECx se obtiene insertando un valor correspondiente al x % de la media del control en la ecuación determinada. Para calcular el valor EC50 o cualquier otro valor de ECx, todo el conjunto de datos debe someterse a un análisis de regresión. El valor de LC50 se estima habitualmente mediante un análisis de probit o similar que tiene en cuenta los datos de mortalidad con distribución binomial.
|
NOEC/LOEC
|
42.
|
Si un análisis estadístico tiene por objeto determinar la NOEC/LOEC, son necesarias las estadísticas por recipiente (los recipientes individuales se consideran réplicas). Deben utilizarse métodos estadísticos adecuados de conformidad con el Documento 54 de la OCDE relativo a los enfoques actuales del análisis estadístico de datos sobre ecotoxicidad: guía de aplicación (9). En general, los efectos adversos de la sustancia problema en comparación con los del control se analizan mediante pruebas de hipótesis unilaterales, para p ≤ 0,05.
|
|
43.
|
La distribución normal y la homogeneidad de la varianza pueden evaluarse con una prueba estadística adecuada; por ejemplo, la prueba de Shapiro-Wilk y la prueba de Levene, respectivamente (p ≤ 0,05). Se pueden llevar a cabo un análisis de varianza (ANOVA) de un factor y pruebas posteriores de comparaciones múltiples. Las pruebas de comparaciones múltiples (por ejemplo, la prueba de Dunnett) o las pruebas de ajuste secuencial (por ejemplo, la prueba de Williams) se pueden utilizar para calcular si hay diferencias significativas (p ≤ 0,05) entre los controles y las diversas concentraciones de la sustancia problema [la selección de la prueba recomendada debe ser conforme con el Documento 54 de la OCDE (9)]. De lo contrario, se pueden utilizar métodos no paramétricos (por ejemplo, la prueba de U de Bonferroni de acuerdo con la prueba de tendencia de Jonckheere-Terpstra) para determinar la NOEC y la LOEC.
|
Ensayo límite
|
44.
|
Si se ha realizado un ensayo límite (comparación solo del control y de un tratamiento) y se cumplen los requisitos previos de los procedimientos de pruebas paramétricas (normalidad, homogeneidad), se pueden evaluar las respuestas métricas con la prueba de Student (prueba t). Si estos requisitos no se satisfacen, puede utilizarse la prueba t de varianzas desiguales (prueba t de Welch) o una prueba no paramétrica, como la prueba U de Mann-Whitney.
|
|
45.
|
Para determinar las diferencias significativas entre los controles (control y control de disolvente), se pueden analizar las réplicas de cada control, tal y como se describen para el ensayo límite. Si estas pruebas no detectan diferencias significativas, se pueden combinar todas las réplicas de control y de control de disolvente. De lo contrario, todos los tratamientos deben compararse con el control de disolvente.
|
Informe del ensayo
|
46.
|
El informe del ensayo debe incluir, como mínimo, la información siguiente:
|
|
Sustancia problema:
|
—
|
identidad de la sustancia problema, lote de fabricación, lote de acondicionamiento y número CAS y pureza;
|
|
—
|
propiedades fisicoquímicas de la sustancia problema (por ejemplo, log Kow, hidrosolubilidad, presión de vapor, constante de Henry (H) y, preferiblemente, información sobre el destino de la sustancia problema en el suelo), si estuvieran disponibles;
|
|
—
|
se deben especificar la fórmula de la sustancia problema y de los aditivos si no se va a analizar la sustancia pura.
|
|
|
|
Organismos de ensayo:
|
—
|
identificación de la especie y proveedor de los organismos de ensayo, descripción de las condiciones de cría e intervalo de edad de los organismos de ensayo.
|
|
|
|
Condiciones de ensayo:
|
—
|
descripción del diseño experimental y del procedimiento;
|
|
—
|
información detallada sobre la preparación del suelo de ensayo, especificaciones detalladas si se utiliza suelo natural (origen, historial, granulometría, pH, contenido en materia orgánica);
|
|
—
|
capacidad de retención de agua del suelo;
|
|
—
|
descripción de la técnica utilizada para aplicar la sustancia problema al suelo;
|
|
—
|
condiciones de ensayo: intensidad de la luz, duración de los ciclos de luz-oscuridad, temperatura;
|
|
—
|
descripción del régimen de alimentación, tipo y cantidad del alimento utilizado en el ensayo, fechas de alimentación;
|
|
—
|
pH y contenido de agua del suelo al principio y al final del ensayo (control y cada tratamiento);
|
|
—
|
descripción detallada del método de extracción y de la eficacia de la extracción.
|
|
|
|
Resultados de los ensayos
|
—
|
número de juveniles determinado en cada recipiente de ensayo al final del ensayo;
|
|
—
|
número de adultos y su mortalidad ( %) en cada recipiente de ensayo al final del ensayo;
|
|
—
|
descripción de síntomas fisiológicos o patológicos obvios o cambios de comportamiento distintivos;
|
|
—
|
resultados obtenidos con la sustancia de referencia.
|
|
—
|
valores de NOEC/LOEC, LCx de la mortalidad y ECx de la reproducción (en su mayoría, LC50, LC10, EC50 y EC10) junto con los intervalos de confianza del 95 %; un gráfico del modelo ajustado que se haya usado en los cálculos, su ecuación de función y sus parámetros [véase (9)];
|
|
—
|
toda la información y las observaciones útiles para la interpretación de los resultados;
|
|
—
|
potencia del ensayo real si se realizan pruebas de hipótesis (9);
|
|
—
|
desviaciones de los procedimientos descritos en este método de ensayo y cualquier suceso inusual durante el mismo;
|
|
—
|
en lo que respecta a la NOEC, cuando se realice una estimación, la diferencia detectable mínima.
|
|
|
BIBLIOGRAFÍA
|
(1)
|
Wiles JA and Krogh PH (1998). Testing with the collembolans I. viridis, F. candida and F. fimetaria. In Handbook of soil invertebrate toxicity tests (ed. H Løkke and CAM Van Gestel), pp. 131-156. John Wiley & Sons, Ltd., Chichester
|
|
(2)
|
ISO (1999). Calidad del suelo. Inhibición de la reproducción de Collembola (Folsomia candida) por contaminantes del suelo. No 11267. Organización Internacional de Normalización, Ginebra.
|
|
(3)
|
Burges A and Raw F (Eds) (1967) Soil Biology. Academic Press. Londres.
|
|
(4)
|
Petersen H and Luxton M (1982). A comparative analysis of soil fauna populations and their role in decomposition processes. Oikos 39: 287-388.
|
|
(5)
|
Petersen H (1994). A review of collembolan ecology in ecosystem context. Acta Zoologica Fennica 195: 111-118.
|
|
(6)
|
Hopkin SP (1997). Biology of the Springtails (Insecta: Collembola). Oxford University Press. 330 pp. (ISBN 0-19-854084-1).
|
|
(7)
|
Ulber B (1983). Einfluss von Onychirurus fimatus Gisin (Collembola, Onychiuridae) und Folsomia fimetaria L. (Collembola, Isotomidae) auf Pythium ultimum Trow. einen Erreger des Wurzelbrandes der Zuckerrübe. In New trends in soil Biology (Lebrun Ph, André HM, De Medts A, Grégoire-Wibo, Wauthy G (Eds), Proceedings of the VI. international colloquium on soil zoology, Louvain-la-Neuve (Bélgica), 30 de agosto - 2 de septiembre de 1982, I Dieu-Brichart, Ottignies-Louvain-la-Neuve, pp. 261-268.
|
|
(8)
|
Capítulo C.36 del presente anexo. Ensayo de reproducción de un ácaro predador (Hypoaspis (Geolaelaps) aculeifer) en el suelo.
|
|
(9)
|
OCDE (2006). Current approaches in the statistical analysis of ecotoxicity data: a guidance to application. OECD series on testing and assessment Number 54, ENV/JM/MONO(2006)18, OCDE, París.
|
|
(10)
|
Scott-Fordsmand JJ and Krogh PH (2005) Background report on prevalidation of an OECD springtail test guideline. Environmental Project No 986. Miljøstyrelsen 61 pp. Ministerio de Medio Ambiente de Dinamarca.
|
|
(11)
|
Krogh, P.H., 2009. Toxicity testing with the collembolans Folsomia fimetaria and Folsomia candida and the results of a ringtest. Agencia de Protección del Medio Ambiente de Dinamarca, Proyecto de Medio Ambiente no 1256, pp. 66.
|
|
(12)
|
Krogh PH, Johansen K and Holmstrup M (1998). Automatic counting of collembolans for laboratory experiments. Appl. Soil Ecol. 7, 201-205.
|
|
(13)
|
Fjellberg A (1980). Identification keys to Norwegian collembolans. Norsk Entomologisk Forening.
|
|
(14)
|
Edwards C.A. (1955). Simple techniques for rearing Collembola, Symphyla and other small soil inhabiting arthropods. In Soil Zoology (Kevan D.K. McE., Ed). Butterworths, Londres, pp. 412-416.
|
|
(15)
|
Goto HE (1960) Simple techniques for the rearing of Collembola and a not on the use of a fungistatic substance in the cultures. Entomologists' Monthly Magazine 96:138-140.
|
Apéndice 1
DEFINICIONES
Las definiciones siguientes son aplicables a este método de ensayo (en este ensayo, todas las concentraciones con efecto se expresan en forma de masa de sustancia problema por masa seca del suelo de ensayo):
Sustancia
: sustancia o mezcla.
NOEC (concentración sin efecto observado)
: concentración de la sustancia problema con la que no se observan efectos. En este ensayo, la concentración correspondiente a la NOEC no presenta ningún efecto estadísticamente significativo (p < 0,05) en un periodo de exposición determinado en comparación con el control.
LOEC (concentración mínima con efecto observado)
: concentración más baja de la sustancia problema que presenta un efecto estadísticamente significativo (p < 0,05) en un periodo de exposición determinado en comparación con el control.
ECx (concentración con efecto del x %)
: concentración que provoca un x % de un efecto en los organismos de ensayo dentro de un periodo de exposición determinado en comparación con el control. Por ejemplo, una EC50 es una concentración que se ha estimado que provoca un efecto en un parámetro del ensayo en el 50 % de una población expuesta durante un periodo de exposición determinado.
Sustancia problema
: cualquier sustancia o mezcla que se haya analizado con este método de ensayo.
Apéndice 2
Acciones principales y calendario para realizar un ensayo con colémbolos
Los pasos del ensayo se pueden resumir de la siguiente manera:
|
Tiempo (día)
|
Acción
|
|
De – 23 a – 26
|
Preparar cultivo sincrónico de F. fimetaria
|
|
-14
|
Preparar suelo artificial (mezcla de componentes secos)
Verificar el pH del suelo artificial y ajustar según convenga
Medir la WHC máxima del suelo
|
|
De – 9 a – 12
|
Preparar cultivo sincrónico de F. candida
|
|
De – 2 a – 7
|
Prehumedecer el suelo.
|
|
– 1
|
Distribuir los juveniles en lotes
Preparar las soluciones madre y aplicar la sustancia problema si se requiere disolvente
|
|
0
|
Preparar las soluciones madre y aplicar la sustancia problema si se trata de una sustancia sólida hidrosoluble, o si se quiere una aplicación superficial
Medir el pH del suelo y pesar los recipientes
Añadir alimento; introducir los colémbolos
|
|
14
|
Ensayo de determinación del intervalo de F. fimetaria: finalizar el ensayo, extraer los animales, medir el pH del suelo y la pérdida de agua (peso)
Ensayos definitivos: medir el contenido de humedad y reponer agua, y añadir 2-10 mg de levadura
|
|
21
|
Ensayo definitivo de F. fimetaria: finalizar el ensayo, extraer los animales, medir el pH del suelo y la pérdida de agua (peso);
Ensayo de determinación del intervalo de F. candida: finalizar el ensayo, extraer los animales, medir el pH del suelo y la pérdida de agua (peso).
|
|
28
|
Ensayo definitivo de F. candida: finalizar el ensayo, extraer los animales, medir el pH del suelo y la pérdida de agua (peso).
|
Apéndice 3
Orientaciones sobre la cría y la sincronización de F. fimetaria y F. candida
El tiempo y las duraciones que figuran en estas orientaciones deben comprobarse para cada cepa concreta de colémbolos con el fin de asegurarse de que estas duraciones permitan la cría de suficientes juveniles sincronizados. Básicamente, la incidencia de oviposición después de que los adultos sean trasladados a un sustrato fresco y después de que los huevos eclosionen determina el día más adecuado para recoger los huevos y los juveniles sincrónicos.
Se recomienda contar con un cultivo madre permanente compuesto, por ejemplo, por 50 recipientes o placas de Petri. El cultivo madre debe mantenerse en buen estado de alimentación, mediante el aporte de alimento y de agua y la eliminación de los restos de alimentos y cadáveres, cada semana. Una cantidad demasiado pequeña de colémbolos en el sustrato puede provocar inhibición por un crecimiento mayor de hongos. Si el cultivo madre se utiliza con demasiada frecuencia para la producción de huevos, el cultivo puede agotarse. El agotamiento se refleja en forma de adultos muertos y moho en el sustrato. Los huevos restantes de la producción de animales sincrónicos pueden utilizarse para rejuvenecer el cultivo.
En un cultivo sincrónico de F. fimetaria, los machos se distinguen de las hembras principalmente por el tamaño. Los machos son claramente más pequeños que las hembras, y la velocidad al caminar de los machos es superior a la de las hembras. La selección correcta del sexo requiere poca práctica y puede confirmarse mediante la inspección microscópica del área genital (13).
1. Cría
1.a. Preparación del sustrato de cultivo
El sustrato de cultivo es yeso (sulfato cálcico) con carbón activado. Esto proporciona un sustrato húmedo y la función del carbón es absorber los gases residuales y los excrementos (14) (15). Se pueden utilizar distintos tipos de carbón para facilitar las observaciones de los colémbolos. Por ejemplo, con F. candida y con F. fimetaria se usa carbón en polvo (produce un yeso de color negro o gris):
Componentes del sustrato:
|
—
|
20 ml de carbón activado
|
|
—
|
200 ml de agua destilada
|
o bien
|
—
|
50 g de carbón activado pulverizado
|
|
—
|
260-300 ml de agua destilada
|
La mezcla de sustrato debe reposar antes de usarla.
1.b. Cría
Los colémbolos se mantienen en recipientes tales como placas de Petri (90 × 13 mm), con el fondo cubierto por una capa de sustrato de yeso/carbón de 0,5 cm. Se cultivan a 20 ± 1 °C, con un ciclo de luz-oscuridad de 12-12 horas (400-800 lux). Los recipientes se mantienen húmedos en todo momento, asegurándose de que la humedad relativa del aire en su interior sea del 100 %. Esto se puede garantizar con la presencia de agua libre en el yeso poroso, pero evitando que se genere una capa de agua sobre la superficie del yeso. La pérdida de agua se puede evitar proporcionando aire ambiente húmedo. Los individuos muertos deben retirarse de los recipientes, así como todo alimento que tenga moho. Para estimular la producción de huevos, es necesario trasladar los animales adultos a placas de Petri con un nuevo sustrato recién preparado con yeso/carbón.
1.c. Fuente de alimentos
Se utiliza levadura seca granulada de panadería como único suministro de alimentos, tanto para F. candida como para F fimetaria. Una vez o dos veces a la semana se suministran alimentos frescos para evitar que se genere moho. Los alimentos se colocan directamente sobre el yeso, formando un pequeño montón. La masa de levadura de panadería añadida debe ajustarse al tamaño de la población de colémbolos pero, como norma general, son suficientes entre 2 y 15 mg.
2. Sincronización
El ensayo debe llevarse a cabo con animales sincronizados para obtener unos animales de ensayo homogéneos, de estadio y tamaño idénticos. Por otra parte, la sincronización permite la discriminación entre machos y hembras de F. fimetaria a partir de las tres semanas de edad, sobre la base del dimorfismo sexual, es decir, las diferencias de tamaño. El procedimiento que se indica a continuación es una sugerencia sobre la obtención de animales sincronizados (los pasos prácticos son opcionales).
2.a. Sincronización.
|
—
|
Prepare los recipientes con una capa de sustrato de yeso/carbón de 0,5 cm.
|
|
—
|
Para la puesta de huevos, transfiera a los recipientes entre 150 y 200 adultos de F. fimetaria y entre 50 y 100 de F. candida de los 15 o 20 mejores recipientes del cultivo madre con un sustrato de 4 a 8 semanas, y aliméntelos con 15 mg de levadura de panadería. Evite tomar juveniles junto con los adultos, ya que la presencia de juveniles puede inhibir la producción de huevos.
|
|
—
|
Mantenga el cultivo a 20 ± 1 °C (la media debe ser de 20 °C) y un ciclo de luz-oscuridad de 12-12 horas (400-800 lux). Asegúrese de que haya alimento fresco disponible y que el aire esté saturado con agua. La falta de alimentos puede provocar que los animales defequen sobre los huevos, lo que provocaría el crecimiento de hongos en los huevos, o que F. candida canibalice sus propios huevos. Transcurridos diez días, los huevos se recogen con cuidado, con una aguja y una espátula, y se trasladan a un “papel para huevos” (trocitos de papel de filtro sumergidos en una lechada de yeso/carbón), que se coloca en un recipiente con un sustrato fresco de yeso/carbón. Se añaden unos granos de levadura al sustrato para atraer a los juveniles y provocar que salgan del papel para huevos. Es importante que el papel para huevos y el sustrato estén húmedos; de lo contrario, los huevos se deshidratarán. Como alternativa, los animales adultos pueden retirarse de las cajas de cultivo de sincronización después de que hayan producido huevos durante dos o tres días.
|
|
—
|
Cuando han transcurrido tres días, la mayor parte de los huevos que se encuentran en el papel para huevos habrán eclosionado, y se podrán encontrar algunos juveniles debajo del papel para huevos.
|
|
—
|
Para que los juveniles sean de una edad uniforme, el papel para huevos con huevos no eclosionados se retira de la placa de Petri con unas pinzas. Los juveniles, que ahora tienen entre 0 y 3 días, permanecen en la placa y se alimentan con levadura de panadería. Los huevos sin eclosionar se descartan.
|
|
—
|
Los huevos y los juveniles que han eclosionado se cultivan de la misma forma que los adultos. En particular en lo que respecta a F. fimetaria se deben tomar las siguientes medidas: tras garantizar que hay suficiente alimento fresco, se retira el alimento viejo enmohecido y, después de una semana, los juveniles se distribuyen en nuevas placas de Petri, siempre que la densidad sea superior a 200.
|
2.b. Manipulación de los colémbolos al principio del ensayo
|
—
|
Se recogen ejemplares de F. candida de 9 a 12 días o de F. fimetaria de 23 a 26 días, por ejemplo mediante succión, y se sueltan en un pequeño recipiente con sustrato húmedo de yeso/carbón; su estado físico se comprueba con el microscopio binocular (se eliminan los animales lesionados y dañados). Todos los pasos deben llevarse a cabo mientras los colémbolos se mantienen en una atmósfera húmeda para evitar el estrés por desecación, por ejemplo mediante superficies húmedas, etc.
|
|
—
|
Se pone boca abajo el recipiente y se le dan golpecitos para trasladar los colémbolos al suelo. La electricidad estática debe neutralizarse; de lo contrario, los animales podrían volar por el aire o adherirse al lateral del recipiente de ensayo y desecarse. Se puede utilizar un ionizador o un trapo húmedo debajo del recipiente para lograr la neutralización.
|
|
—
|
El alimento debe repartirse por toda la superficie del suelo, no solo en un montón.
|
|
—
|
Durante el transporte y durante el periodo del ensayo, se deben evitar los golpes u otros trastornos físicos en los recipientes de ensayo, ya que esto podría aumentar la compactación del suelo y dificultar la interacción entre los colémbolos.
|
3. Especies alternativas de colémbolos
Se pueden seleccionar otras especies de colémbolos para realizar el ensayo, de acuerdo con este método de ensayo, como las especies Proisotoma minuta, Isotoma viridis, Isotoma anglicana, Orchesella cincta, Sinella curviseta, Paronychiurus kimi, Orthonychiurus folsomi o Mesaphorura macrochaeta. Antes de usar estas otras especies deben cumplirse una serie de requisitos previos:
|
—
|
se deben identificar de manera inequívoca;
|
|
—
|
debe indicarse la justificación de la selección de la especie;
|
|
—
|
se debe garantizar que la biología de la reproducción se incluya en la fase del ensayo, de forma que constituya un objetivo potencial durante la exposición;
|
|
—
|
debe conocerse el ciclo vital: edad a la maduración, duración del desarrollo de los huevos y estadios sujetos a exposición;
|
|
—
|
el sustrato del ensayo y el suministro de alimento deben proporcionar las condiciones óptimas de crecimiento y reproducción;
|
|
—
|
la variabilidad debe ser lo suficientemente baja como para permitir una estimación precisa y correcta de la toxicidad.
|
Apéndice 4
Extracción y recuento de los animales
1. Se pueden usar dos métodos de extracción.
|
1.a.
|
Primer método: Se puede usar un extractor de gradiente de temperatura controlada con arreglo a los principios de MacFadyen (1). El calor procede de un elemento calefactor situado en la parte superior de la caja de extracción (que se regula mediante una resistencia térmica colocada en la superficie de la muestra de suelo). La temperatura del líquido enfriado que rodea al recipiente de recogida se regula mediante una resistencia térmica situada en la superficie de la caja de recogida (colocada debajo del núcleo de suelo). Las resistencias térmicas se conectan a una unidad de control programable que aumenta la temperatura de acuerdo con una planificación previa. Los animales se recogen en la caja de recogida enfriada (2 ·C) con una capa de yeso/carbón en el fondo. La extracción comienza a 25 °C y la temperatura aumenta automáticamente cada 12 horas en 5 °C, y dura en total 48 horas. La extracción finaliza tras doce horas a 40 °C.
|
|
1.b.
|
Segundo método: Tras el periodo de incubación experimental, se evalúa por flotación el número de colémbolos juveniles presentes. Para ello, se realiza la prueba en los recipientes de un volumen aproximado de 250 ml. Al final de la prueba se añaden aproximadamente 200 ml de agua destilada. El suelo se agita suavemente con un pincel fino para que los colémbolos puedan flotar hasta la superficie del agua. Se puede añadir al agua una pequeña cantidad de tinta fotográfica negra de Kentmere, aproximadamente 0,5 ml, para facilitar el recuento aumentando el contraste entre el agua y los colémbolos de color blanco. La tinta no es tóxica para los colémbolos.
|
2. Recuento:
Los recuentos numéricos pueden realizarse a la vista o con un microscopio óptico, colocando una rejilla sobre el recipiente de flotación o fotografiando la superficie de cada recipiente y, posteriormente, contando los colémbolos mediante imágenes ampliadas o la proyección de diapositivas. Los recuentos también pueden realizarse con técnicas de procesamiento de imágenes digitales (12). Deben validarse todas las técnicas.
Apéndice 5
Determinación de la WHC máxima del suelo
Se ha considerado apropiado el siguiente método para determinar la máxima capacidad de retención de agua (WHC) del suelo. Este método se describe en el anexo C de ISO DIS 11268-2 [Calidad del suelo. Efectos de los contaminantes en lombrices (Eisenia fetida). Parte 2: Determinación de los efectos en la reproducción].
Se recoge una cantidad definida (por ejemplo, 5 g) del sustrato de suelo del ensayo con un dispositivo de muestreo apropiado (tornillo sin fin, etc.). Se cubre el fondo del tubo con un trozo húmedo de papel de filtro y, a continuación, se coloca en una gradilla en un baño de agua. El tubo debe sumergirse gradualmente hasta que el nivel de agua quede por encima del del suelo. Luego debe dejarse en el agua durante unas tres horas. Como no se puede retener toda el agua absorbida por los capilares del suelo, la muestra de suelo debe drenarse durante dos horas, colocando el tubo en un lecho de arena de cuarzo triturada muy finamente, colocado dentro de un recipiente tapado (para evitar que se seque). Después hay que pesar la muestra y secarla hasta masa constante a 105 °C. La capacidad de retención de agua (WHC) debe calcularse de la siguiente manera:

Donde:
|
S
|
=
|
sustrato saturado de agua + masa del tubo + masa del papel de filtro
|
|
T
|
=
|
tara (masa del tubo + masa del papel de filtro)
|
|
D
|
=
|
masa seca del sustrato
|
Apéndice 6
Determinación del pH del suelo
El siguiente método para calcular el pH de un suelo se basa en la descripción hecha en ISO DIS 10390: Calidad del suelo. Determinación del pH.
Una cantidad determinada de suelo se seca a temperatura ambiente durante 12 horas como mínimo. A continuación se elabora una suspensión del suelo (que contenga como mínimo 5 g de suelo), en cinco veces su volumen de una solución 1 M de cloruro potásico de grado analítico (KCl) o de una solución de 0,01 M de cloruro cálcico de grado analítico (CaCl2). Después, la suspensión se agita bien, durante cinco minutos, y se deja reposar durante dos horas como mínimo, pero nunca más de 24 horas. A continuación, se mide el pH de la fase líquida con un pH-metro calibrado antes de cada medición con una serie adecuada de soluciones tampón (por ejemplo, pH de 4,0 y 7,0).
C.40. ENSAYO DE TOXICIDAD A LO LARGO DEL CICLO DE VIDA DE LOS QUIRONÓMIDOS EN SISTEMAS SEDIMENTO-AGUA CON AGUA O SEDIMENTO ENRIQUECIDOS
INTRODUCCIÓN
|
1.
|
El presente método de ensayo reproduce las directrices de ensayo (TG) 233 de la OCDE (2010). Se ha diseñado para evaluar en el díptero de agua dulce Chironomus sp. los efectos de la exposición durante toda la vida a sustancias y abarca completamente la primera generación (generación P) y la primera parte de la segunda generación (generación F1). Se trata de una ampliación de los métodos de ensayo existentes C.28 (1) o C.27 (15), que aplican un escenario de exposición con agua enriquecida o con sedimento enriquecido, respectivamente. Tiene en cuenta los protocolos existentes sobre ensayos de toxicidad para Chironomus riparius y Chironomus dilutus [anteriormente denominado C. tentans (2)] que se han elaborado en Europa y América del Norte (3) (4) (5) (6) (7) (8) (9), y posteriormente sometido a ensayos interlaboratorios (1) (7) (10) (11) (12). Pueden utilizarse asimismo otras especies de quironómidos bien documentadas como, por ejemplo, Chironomus yoshimatsui (13) (14). La duración de la exposición completa es de aproximadamente cuarenta y cuatro días para C. riparius y C. yoshimatsui, y de aproximadamente cien días para C. dilutus.
|
|
2.
|
En este método de ensayo se describe tanto el escenario de exposición en agua como el escenario de exposición en sedimento. La selección del escenario de exposición adecuado depende de la aplicación que se prevea para el ensayo. El escenario de exposición en agua, con enriquecimiento de la columna de agua, pretende simular un caso de aerosol errático de un plaguicida y comprende el pico inicial de concentración en aguas superficiales. El enriquecimiento del agua también es útil para otros tipos de exposición (incluyendo los derrames de sustancias), pero no para procesos de acumulación en el sedimento que duren más que el periodo del ensayo. En ese caso y cuando las escorrentías son la principal vía de entrada de los plaguicidas en las masas de agua, un diseño de sedimento enriquecido podría resultar más adecuado. Si otros escenarios de exposición resultaran interesantes, el diseño del ensayo podría adaptarse fácilmente. Por ejemplo, si la distribución de la sustancia problema entre la fase acuosa y la capa de sedimento no resulta interesante y hay que minimizar la adsorción en el sedimento, se puede contemplar la posibilidad de usar un sedimento artificial sustituto (por ejemplo, arena de cuarzo).
|
|
3.
|
Las sustancias que deben someterse a ensayo con respecto a organismos que viven en los sedimentos pueden persistir en un sedimento durante largos periodos. Los organismos que viven en los sedimentos pueden estar expuestos a través de varias vías de exposición. La importancia relativa de cada vía de exposición y el tiempo que tarda cada una de ellas en contribuir al efecto tóxico general dependen de las propiedades fisicoquímicas de la sustancia correspondiente. En el caso de las sustancias que se adsorben fuertemente o en el de las sustancias que se unen covalentemente con el sedimento, la ingestión de alimentos contaminados puede constituir una vía de exposición significativa. A fin de no subestimar la toxicidad de las sustancias muy lipofílicas, puede considerarse la adición de alimentos al sedimento antes de aplicar la sustancia problema (véase el punto 31). Por lo tanto, se pueden incluir todas las vías de exposición y todas las fases de la vida.
|
|
4.
|
Los parámetros medidos son el número total de adultos que aparecen (tanto en la primera como en la segunda generación), la tasa de desarrollo (tanto en la primera como en la segunda generación), la proporción de sexos de los adultos vivos y que aparecen totalmente (tanto en la primera como en la segunda generación), el número de cordones de huevos por hembra (solo en la primera generación) y la fertilidad de los cordones de huevos (solo en la primera generación).
|
|
5.
|
Se recomiendan encarecidamente los sedimentos artificiales, que presentan diversas ventajas sobre los sedimentos naturales:
|
—
|
se reduce la variabilidad experimental porque se constituye una “matriz normalizada” reproducible y desaparece la necesidad de conseguir sedimentos limpios y no contaminados;
|
|
—
|
pueden iniciarse los ensayos en cualquier momento sin problemas de variabilidad estacional del sedimento en cuestión, y no es necesario aplicar ningún tratamiento previo al sedimento para eliminar la fauna endógena;
|
|
—
|
se reduce el coste en comparación con la recogida sobre el terreno de cantidades suficientes y necesarias para las pruebas sistemáticas;
|
|
—
|
los sedimentos artificiales permiten realizar comparaciones de toxicidad entre distintos estudios y clasificaciones de las sustancias, de manera consecuente (3).
|
|
|
6.
|
En el apéndice 1 se dan las definiciones utilizadas.
|
PRINCIPIO DEL ENSAYO
|
7.
|
Se exponen quironómidos de primer estadio larvario a un intervalo de concentraciones de la sustancia problema en un sistema de sedimento-agua. El ensayo comienza colocando las larvas de primer estadio (primera generación) en vasos de ensayo que contienen sedimento enriquecido o, alternativamente, el agua se enriquece con la sustancia problema después de añadir las larvas. Se evalúan la aparición de los quironómidos, el tiempo hasta su aparición y la proporción de sexos de los dípteros vivos que aparecen completamente. Los adultos aparecidos se trasladan a jaulas de cría para facilitar la enjambración, el apareamiento y la oviposición. Se evalúan el número de cordones de huevos producidos y su fertilidad. De estos cordones de huevos se obtienen las larvas de primer estadio de la segunda generación. Estas larvas se colocan en vasos de ensayo recién preparados (con un procedimiento de enriquecimiento igual al de la primera generación) para determinar la viabilidad de la segunda generación mediante una evaluación de su aparición, del tiempo transcurrido hasta la aparición y de la proporción de sexos de los dípteros vivos que aparecen totalmente (en el apéndice 5 figura un esquema del ensayo del ciclo de vida). Todos los datos se analizan mediante un modelo de regresión, para estimar la concentración que provocaría una reducción del x % en el parámetro relevante, o mediante pruebas de hipótesis para determinar una concentración sin efecto observado (NOEC). Esto último requiere una comparación mediante pruebas estadísticas de las respuestas de los grupos de tratamiento con las respuestas del control correspondiente. Cabe señalar que, en el caso del agua enriquecida, cuando las sustancias se degradan rápidamente, las fases posteriores de la vida de cada generación (por ejemplo, la fase pupal) pueden verse expuestas a un nivel de concentración muy inferior en el agua sobrenadante que las larvas de primer estadio. Si esto fuera preocupante y se necesitara un nivel de exposición comparable para cada fase de la vida, se podrán plantear las siguientes modificaciones en el método de ensayo:
|
—
|
series paralelas con enriquecimiento en diferentes fases de la vida; o
|
|
—
|
enriquecimiento repetido (o renovación del agua sobrenadante) del sistema del ensayo durante las dos fases del ensayo (primera y segunda generación), de modo que los intervalos de enriquecimiento (renovación) se ajusten a las características del destino de la sustancia problema.
|
Estas modificaciones solo son viables en el escenario de agua enriquecida, pero no en el del sedimento enriquecido.
|
INFORMACIÓN SOBRE LA SUSTANCIA PROBLEMA
|
8.
|
Deben conocerse la hidrosolubilidad de la sustancia problema, su presión de vapor, su log K
ow, su reparto medido o calculado en el sedimento y su estabilidad en el agua y en el sedimento. Para cuantificar la sustancia problema presente en el agua sobrenadante, en el agua intersticial y en el sedimento, debe disponerse de un método analítico fiable, cuya exactitud y límite de detección sean conocidos y se indiquen. Entre la información útil se incluyen la fórmula estructural y la pureza de la sustancia problema. También resulta útil conocer el destino químico de la sustancia problema (por ejemplo, disipación, degradación abiótica y biótica, etc.). En la referencia (16) se ofrece más orientación sobre los ensayos de sustancias con propiedades fisicoquímicas que dificultan la realización del ensayo.
|
SUSTANCIAS DE REFERENCIA
|
9.
|
Las sustancias de referencia pueden someterse periódicamente a ensayos para asegurarse de que la sensibilidad de la población del laboratorio no ha variado. Al igual que sucede con las dafnias, sería suficiente realizar un ensayo agudo de 48 horas (de acuerdo con 17). Sin embargo, hasta que se disponga de unas directrices validadas de toxicidad aguda, puede plantearse un ensayo de toxicidad crónica conforme al capítulo C.28 de este anexo. Ejemplos de sustancias tóxicas de referencia usadas con buenos resultados en ensayos interlaboratorios y pruebas de validación son los siguientes: lindano, trifluralina, pentaclorofenol, cloruro de cadmio y cloruro de potasio (1) (3) (6) (7) (18).
|
VALIDEZ DEL ENSAYO
|
10.
|
Para que el ensayo sea válido deben darse las condiciones siguientes:
|
—
|
la aparición media en el grupo de control debe ser, como mínimo, del 70 % al final del periodo de exposición de ambas generaciones (1) (7);
|
|
—
|
en lo que respecta a C. riparius y C. yoshimatsui, el 85 % del total de dípteros adultos aparecidos en el grupo de control, en ambas generaciones, debe producirse entre los 12 y los 23 días después de la inserción de las larvas de primer estadio en los recipientes; en lo que respecta a la especie C. dilutus, resulta aceptable un periodo de 20 a 65 días;
|
|
—
|
la proporción media de sexos de adultos vivos que aparecen completamente (en forma de fracción de hembras o machos) en el grupo de control de ambas generaciones debe ser, como mínimo, de 0,4 y, como máximo, de 0,6;
|
|
—
|
en cada jaula de cría, el número de cordones de huevos en los controles de la primera generación debe ser, como mínimo, de 0,6 por hembra añadida a la jaula de cría;
|
|
—
|
la fracción de cordones de huevos fértiles de cada jaula de cría de los controles de la primera generación debe ser, como mínimo, de 0,6;
|
|
—
|
al final del periodo de exposición de ambas generaciones, deben medirse el pH y la concentración de oxígeno disuelto de cada recipiente; la concentración de oxígeno debe ser, como mínimo, del 60 % del valor de saturación de aire (ASV (24)) y el pH del agua sobrenadante debe ser de 6 a 9 en todos los recipientes de ensayo;
|
|
—
|
la temperatura del agua no debe variar en más de ± 1,0 °C.
|
|
DESCRIPCIÓN DEL MÉTODO
Recipientes de ensayo y jaulas de cría
|
11.
|
Las larvas se exponen en vasos de vidrio de 600 ml con un diámetro aproximado de 8,5 cm (véase el apéndice 5). Pueden utilizarse otros recipientes que garanticen una altura adecuada de sedimento y de agua sobrenadante. La superficie del sedimento debe ser suficiente para proporcionar de 2 a 3 cm2 por larva. La proporción de la altura de la capa de sedimento respecto a la altura del agua sobrenadante debe ser aproximadamente de 1:4. Deben utilizarse jaulas de cría (como mínimo de 30 cm en las tres dimensiones) con una gasa (luz de malla aproximada de 1 mm) en la parte superior y en un lateral de la jaula, como mínimo (véase el apéndice 5). En cada jaula se coloca un cristalizador de 2 l, que contiene agua y sedimento del ensayo, para la oviposición. También en el cristalizador, la proporción de la altura de la capa de sedimento respecto a la altura del agua sobrenadante debe ser de 1:4. Después de recoger los cordones de huevos del cristalizador, se colocan en una placa de microtitulación de 12 pocillos (un cordón por pocillo que contenga como mínimo 2,5 ml de agua procedente del cristalizador enriquecido), tras lo cual las placas se cubren con una tapa para evitar una evaporación importante. También pueden utilizarse otros recipientes adecuados para conservar los cordones de huevos. Con la excepción de las placas de microtitulación, todos los recipientes de ensayo y otros aparatos que entren en contacto con el sistema del ensayo deben estar hechos totalmente de vidrio o de otro material químicamente inerte (por ejemplo, politetrafluoroetileno).
|
Selección de la especie
|
12.
|
La especie que debe usarse preferentemente en el ensayo es Chironomus riparius. También puede utilizarse la especie C. yoshimatsui. La especie C. dilutus también es adecuada, pero resulta más difícil de manipular y requiere un periodo de ensayo más largo. En el apéndice 2 se presenta información detallada sobre los métodos de cultivo de C. riparius. También hay información disponible sobre las condiciones de cultivo de C. dilutus (5) y C. yoshimatsui (14). Hay que confirmar la identificación de la especie antes de realizar los ensayos, pero no es necesario hacerlo antes de cada ensayo si los organismos proceden de un cultivo del propio laboratorio.
|
Sedimento
|
13.
|
Es preferible utilizar un sedimento artificial (también denominado formulado, reconstituido o sintético). Sin embargo, si se utiliza sedimento natural, deben determinarse sus características (al menos, el pH y el contenido de carbono orgánico, pero es recomendable determinar otros parámetros, como la relación C/N y la granulometría) y debe estar libre de toda contaminación y de otros organismos que pudieran competir con las larvas de quironómidos o consumirlas. Asimismo, antes del ensayo, se recomienda acondicionar los sedimentos durante siete días a las condiciones del ensayo. Se recomienda el siguiente sedimento artificial (1) (20) (21), tal y como se describe en (1):
|
a.
|
4-5 % de turba (peso seco): con un pH lo más cercano posible al intervalo 5,5 y 6,0; es importante usar turba en forma de polvo, finamente molida (tamaño de partículas ≤ 1 mm) y secada solo al aire;
|
|
b.
|
20 % de caolín (peso seco), con un contenido de caolinita preferentemente superior al 30 %;
|
|
c.
|
75-76 % de arena de cuarzo (peso seco); debe predominar la arena fina, con más del 50 % de las partículas de un tamaño entre 50 y 200 μm);
|
|
d.
|
Agua desionizada añadida para obtener un contenido de humedad en la mezcla final en el rango del 30–50 %;
|
|
e.
|
Carbonato de calcio de calidad químicamente pura (CaCO3) añadido para ajustar el pH de la mezcla final del sedimento a 7,0 ± 0,5;
|
|
f.
|
El contenido de carbono orgánico de la mezcla final debe ser del 2 % (± 0,5 %), ajustado mediante el empleo de las cantidades adecuadas de turba y arena, según las letras a) y c).
|
|
|
14.
|
Debe conocerse el origen de la turba, del caolín y de la arena. Hay que comprobar que los componentes del sedimento no presentan contaminación química (por ejemplo, con metales pesados, compuestos organoclorados o compuestos organofosforados). En el apéndice 3 se describe un ejemplo de preparación del sedimento artificial. Puede aceptarse también la mezcla de componentes secos si se demuestra que, tras la adición de agua sobrenadante, no se produce separación de los componentes del sedimento (por ejemplo, flotación de partículas de turba), y que la turba o el sedimento están suficientemente acondicionados.
|
Agua
|
15.
|
Es adecuada como agua para el ensayo cualquier agua que se ajuste a las características químicas de un agua de dilución aceptable según se indica en los apéndices 2 y 4. Puede utilizarse como agua de cultivo y agua de ensayo cualquier agua adecuada, agua natural (superficial o subterránea), agua reconstituida (véase el apéndice 2) o agua del grifo desclorada, siempre que los quironómidos sobrevivan en ella durante las fases de cultivo y ensayo sin mostrar signos de presión. Al inicio del ensayo, el pH del agua de ensayo debe estar entre 6 y 9 y la dureza total no debe superar el valor de 400 mg/l en CaCO3. Sin embargo, si se sospecha interacción entre los iones responsables de la dureza y la sustancia problema, debe utilizarse agua menos dura (por tanto, en esta situación no debe emplearse el medio M4 de Elendt). Debe usarse el mismo tipo de agua a lo largo de todo el estudio. Las características de calidad del agua recogidas en el apéndice 4 deben medirse al menos dos veces al año o cuando se sospeche que pueden haber cambiado de forma significativa.
|
Soluciones madre — agua enriquecida
|
16.a.
|
Las concentraciones de ensayo se calculan a partir de las concentraciones en la columna de agua, es decir, en el agua sobrenadante, que recubre al sedimento. Las soluciones de ensayo de las concentraciones elegidas se preparan generalmente por dilución de una solución madre. A ser posible, estas soluciones madre deben prepararse disolviendo la sustancia problema en el agua del ensayo. En algunos casos puede ser necesario utilizar disolventes o dispersantes para obtener una solución madre a la concentración deseada. Como ejemplos de disolventes adecuados pueden darse los siguientes: acetona, éter monoetílico de etilenglicol, éter dimetílico de etilenglicol, dimetilformamida y trietilenglicol. Los dispersantes que pueden utilizarse son Cremophor RH40, Tween 80, metilcelulosa al 0,01 % y HCO-40. La concentración del agente solubilizante en el medio de ensayo final debe ser mínima (es decir, ≤ 0,1 ml/l) y la misma en todos los tratamientos. Cuando se emplea un agente solubilizante, ello no debería provocar efectos significativos en la supervivencia, tal y como se revela mediante un control de disolvente en comparación con un control negativo (agua). No obstante, debe hacerse todo lo posible por evitar el uso de dichas sustancias.
|
Soluciones madre — sedimento enriquecido
|
16.b.
|
Los sedimentos enriquecidos de la concentración elegida se preparan por lo general añadiendo una solución de la sustancia problema directamente al sedimento. La solución madre de la sustancia problema preparada con agua desionizada se mezcla con el sedimento artificial mediante un molino de rodillos, una mezcladora de piensos o a mano. Si la sustancia problema es poco hidrosoluble, puede disolverse en el mínimo volumen posible de un disolvente orgánico apropiado (por ejemplo, hexano, acetona o cloroformo). Esta solución se mezcla a continuación con 10 g de arena de cuarzo fina por cada recipiente de ensayo. Se permite que el disolvente se evapore; debe eliminarse totalmente de la arena y, a continuación, la arena se mezcla con la cantidad de sedimento adecuada. Para solubilizar, dispersar o emulsionar la sustancia problema solo pueden utilizarse agentes que se volatilicen rápidamente. No hay que olvidar que la arena aportada por la mezcla de sustancia problema y arena debe tenerse en cuenta a la hora de preparar el sedimento (es decir, en ese caso, el sedimento debe prepararse con menos arena). Debe tenerse cuidado para asegurarse de que la sustancia problema añadida al sedimento se distribuya de forma total y homogénea por el sedimento. En caso necesario, deben analizarse submuestras para determinar el grado de homogeneidad.
|
DISEÑO DEL ENSAYO
|
17.
|
El diseño del ensayo se refiere a la selección del número y de la separación de las concentraciones de ensayo, el número de recipientes de cada concentración, el número de larvas por recipiente y el número de cristalizadores y jaulas de cría. A continuación se describen los diseños para obtener la ECx, y la NOEC y el de una prueba de límite.
|
Diseño para análisis de regresión
|
18.
|
La concentración con efecto (ECx) y el intervalo de concentración en el que el efecto de la sustancia problema resulta de interés deben quedar abarcados por el ensayo, de forma que el parámetro no quede extrapolado fuera de los límites de los datos generados. Debe evitarse una extrapolación muy inferior a la concentración más baja o muy superior a la más alta. Puede resultar útil llevar a cabo una prueba preliminar de determinación del intervalo de concentraciones de acuerdo con los métodos de ensayo C.27 o C.28 para seleccionar un intervalo adecuado de concentraciones del ensayo.
|
|
19.
|
En lo que respecta a un planteamiento de ECx, se requieren como mínimo cinco concentraciones y ocho réplicas por concentración. Para cada concentración deben utilizarse dos jaulas de cría (A y B). Las ocho réplicas se dividen en dos grupos de cuatro réplicas, un grupo para cada jaula de cría. Esta agrupación de réplicas es necesaria debido al número de dípteros que se necesitan en la jaula para realizar evaluaciones de reproducción sólidas. Sin embargo, la segunda generación tiene de nuevo ocho réplicas, que se inician desde las poblaciones expuestas en las jaulas de cría. El factor entre concentraciones no debe ser mayor que dos (puede permitirse una excepción en los casos en que la pendiente de la curva dosis-respuesta sea poco pronunciada). El número de réplicas de cada tratamiento se puede reducir a seis (tres por cada jaula de cría) si aumenta el número de concentraciones de ensayo con respuestas distintas. El aumento del número de réplicas o la reducción del tamaño de los intervalos de concentraciones de ensayo tienden a estrechar los intervalos de confianza en relación con la ECX.
|
Diseño para estimar una NOEC
|
20.
|
En lo que respecta a un planteamiento de NOEC, se deben usar cinco concentraciones de ensayo con un mínimo de ocho réplicas (cuatro para cada jaula de cría, A y B), y el factor entre concentraciones no debe ser superior a dos. El número de réplicas debe ser suficiente para garantizar una potencia estadística adecuada que permita detectar una diferencia del 20 % con respecto al control y al nivel de significación del 5 % (α = 0,05). En lo que respecta a la tasa de desarrollo, la fecundidad y la fertilidad, suele ser apropiado realizar un análisis de varianza (ANOVA), seguido por la prueba de Dunnett o la prueba de Williams (22-25). En lo que respecta a la tasa de aparición y a la proporción de sexos, pueden resultar apropiadas la prueba de Cochran-Armitage, la prueba exacta de Fisher (con la corrección de Bonferroni) o la prueba de Mantel-Haentzal.
|
Ensayo límite
|
21.
|
Se puede llevar a cabo un ensayo límite (una sola concentración de ensayo y control o controles) si no se observan efectos en la prueba preliminar opcional de determinación del intervalo de concentraciones hasta con una concentración máxima. El objetivo del ensayo límite es indicar si se han encontrado efectos tóxicos de la sustancia problema en unos niveles superiores a la concentración límite analizada. Para el agua se sugieren 100 mg/l y, para el sedimento, 1 000 mg/kg (peso seco). Generalmente hacen falta al menos ocho réplicas tanto de las unidades de tratamiento como de las de control. Debe demostrarse una potencia estadística adecuada que permita detectar una diferencia del 20 % respecto al control con un nivel de significación del 5 % (α = 0,05). Con respuestas métricas (por ejemplo, tasa de desarrollo), la prueba t es un método estadístico adecuado si los datos cumplen los requisitos de esta prueba (normalidad, varianzas homogéneas). Si estos requisitos no se satisfacen, puede utilizarse una prueba t de varianzas desiguales o una prueba no paramétrica, como la prueba de Wilcoxon-Mann-Whitney. En relación con la tasa de aparición, resulta adecuada la prueba exacta de Fisher.
|
PROCEDIMIENTO
Condiciones de exposición
Preparación del sistema agua-sedimento (enriquecimiento del agua)
|
22. a.
|
Se añade sedimento artificial (véanse los puntos 13 y 14 y el apéndice 3) a cada recipiente de ensayo y al cristalizador para formar una capa de al menos 1,5 cm (en el cristalizador puede ser algo menor) y de 3 cm como máximo. Se añade agua (véase el punto 15) de forma que la proporción de la altura de la capa de sedimento y la altura del agua no sea superior a 1:4. Tras preparar los recipientes de ensayo, el sistema de sedimento-agua debe airearse suavemente durante unos siete días, antes de añadir las larvas de primer estadio de la primera o la segunda generación (véanse el punto 14 y el apéndice 3). El sistema sedimento-agua de los cristalizadores no se airea durante el ensayo, ya que no tiene que asegurar la supervivencia de las larvas (los cordones de huevos ya se han recogido antes de que eclosionen). Para evitar que se separen los ingredientes del sedimento y se resuspendan las partículas finas durante la adición del agua de ensayo a la columna de agua, se puede cubrir el sedimento con un disco de plástico mientras se vierte el agua encima, y retirar el disco inmediatamente a continuación. Puede ser adecuado también utilizar otros dispositivos.
|
Preparación del sistema agua-sedimento (enriquecimiento del sedimento)
|
22. b.
|
Se colocan en los recipientes y en el cristalizador sedimentos enriquecidos preparados de conformidad con el punto 16.b, y se añade agua sobrenadante para conseguir una proporción de volumen de sedimento-agua de 1:4. La altura de la capa de sedimento debe encontrarse entre 1,5 y 3 cm (puede ser algo inferior en el cristalizador). Para evitar que se separen los ingredientes del sedimento y se resuspendan las partículas finas durante la adición del agua de ensayo a la columna de agua, se puede cubrir el sedimento con un disco de plástico mientras se vierte el agua encima, y retirar el disco inmediatamente a continuación. Puede ser adecuado también utilizar otros dispositivos. Una vez preparado el sedimento enriquecido con el agua sobrenadante, es conveniente dejar que la sustancia problema se reparta pasando del sedimento a la fase acuosa (4) (5) (7) (18). Preferentemente, esto debe efectuarse en las mismas condiciones de temperatura y aireación que el ensayo. El tiempo adecuado para el equilibrado depende de la sustancia y del sedimento, y puede ser del orden de horas o de días, aunque en ciertos casos poco frecuentes puede llegar a ser de hasta cinco semanas. Como esto daría ocasión para la degradación de muchas sustancias, no se espera hasta alcanzar el equilibrio completo, sino que se recomienda un periodo de equilibrado de 48 horas. Sin embargo, cuando se sabe que la vida media de degradación de la sustancia en el sedimento es prolongada (véase el punto 8), puede ampliarse el tiempo de equilibrado. Al final de este periodo de equilibrado adicional, debe medirse la concentración de la sustancia problema en el agua sobrenadante, en el agua intersticial y en el sedimento, al menos con la concentración más elevada y con una inferior (véase el apartado 38). Estas determinaciones analíticas de la sustancia problema permiten el cálculo del balance de masas y la expresión de los resultados sobre la base de las concentraciones medidas.
|
|
23.
|
Los recipientes de ensayo tienen que estar tapados (por ejemplo, con placas de vidrio). Cuando sea necesario durante el estudio, los niveles de agua pueden completarse hasta el volumen original para compensar la evaporación. En esta operación debe utilizarse agua destilada o desionizada para evitar la acumulación de sales. Los cristalizadores de las jaulas de cría no se tapan y pueden ajustarse, aunque no es necesario, para compensar la pérdida de agua durante el periodo del ensayo, ya que los cordones de huevos solo están en contacto con el agua durante un día aproximadamente, y los cristalizadores se utilizan solamente durante una breve fase del ensayo.
|
Adición de los organismos de ensayo
|
24.
|
Cuatro o cinco días antes de la adición de las larvas de primer estadio de la primera generación, se deben tomar masas de huevos del cultivo para colocarlas en pequeños recipientes con medio de cultivo. Puede utilizarse un medio viejo del cultivo madre o un medio recién preparado. En cualquier caso, se debe añadir al medio de cultivo una pequeña cantidad de alimento; por ejemplo, unas gotas de filtrado de una suspensión muy bien triturada de alimento para peces en copos (véase el apéndice 2). Solo deben utilizarse masas de huevos recién puestas. Normalmente, las larvas empiezan a eclosionar un par de días después de la puesta de los huevos (entre dos y tres días en el caso de C. riparius, a 20 °C, y entre uno y cuatro días en lo que respecta a C. dilutus, a 23 °C, y C. yoshimatsui, a 25 °C); el crecimiento de las larvas se produce en cuatro estadios, cada uno de ellos de cuatro a ocho días de duración. En el ensayo deben utilizarse larvas del primer estadio (como máximo, 48 horas después de la eclosión). El estadio de las larvas puede comprobarse mediante el ancho de la cápsula de la cabeza (7).
|
|
25.
|
Veinte larvas de primer estadio de la primera generación se asignan aleatoriamente a cada recipiente de ensayo que contenga el sistema de sedimento-agua, con una pipeta roma. La aireación del agua se interrumpe mientras se añaden las larvas a los recipientes de ensayo, situación que debe mantenerse durante 24 horas tras la adición de las larvas (véase el punto 32). Con arreglo al diseño del ensayo utilizado (véanse los puntos 19 y 20), el número de larvas utilizadas por concentración es como mínimo de 120 (seis réplicas por concentración) en el caso del planteamiento de ECx, y de 160 en el caso del planteamiento de NOEC (ocho réplicas por concentración). En el diseño del sedimento enriquecido, la exposición comienza al añadir las larvas.
|
Enriquecimiento del agua sobrenadante
|
26.
|
Veinticuatro horas después de añadir las larvas de primer estadio de la primera generación, la columna de agua sobrenadante se enriquece con la sustancia problema y se vuelve a iniciar una ligera aireación (las posibles modificaciones del diseño del ensayo se pueden consultar en el punto 7). Utilizando una pipeta, se aplican pequeños volúmenes de las soluciones madre de la sustancia problema por debajo de la superficie del agua. A continuación debe mezclarse el agua sobrenadante, con cuidado de no alterar el sedimento. En el caso del diseño de agua enriquecida, la exposición comienza con el enriquecimiento del agua (es decir, un día después de añadir las larvas).
|
Recogida de los adultos aparecidos
|
27.
|
Los dípteros aparecidos de la primera generación se recogen una vez al día como mínimo, pero preferiblemente dos veces (véase el punto 36), de los recipientes de ensayo, con ayuda de un aspirador, un extractor o de un dispositivo similar (véase el apéndice 5). Se debe tener especial cuidado para no causar daños en los adultos. Los dípteros recogidos de los cuatro recipientes de ensayo de un mismo tratamiento se dejan en una jaula de cría a la que han sido asignados previamente. El día de la primera aparición (de los machos), los cristalizadores se enriquecen mediante pipeteo con un pequeño volumen de la solución madre de la sustancia problema por debajo de la superficie del agua (diseño de agua enriquecida). A continuación debe mezclarse el agua sobrenadante, con cuidado de no alterar el sedimento. La concentración de la sustancia problema en el cristalizador es nominalmente el mismo que la de los recipientes de ensayo asignados a esa jaula de cría en concreto. En lo que respecta al diseño de sedimento enriquecido, los cristalizadores se preparan en torno al día 11 a partir del inicio de la exposición (es decir, la adición de las larvas de primera generación), de forma que se puedan equilibrar durante unas 48 horas antes de que se produzcan los primeros cordones de huevos.
|
|
28.
|
Los cordones de huevos se recogen del cristalizador que se encuentra en la jaula de cría con unas pinzas o una pipeta roma. Cada cordón de huevos se coloca en un recipiente que contiene medio de cultivo del cristalizador del cual se haya recogido (por ejemplo, un pocillo de una microplaca de 12 pocillos con un volumen mínimo de 2,5 ml de medio). Los recipientes que contienen los cordones de huevos se cubren con una tapa para evitar una evaporación significativa. Los cordones de huevos se conservan para su observación durante seis días como mínimo después de su producción, para clasificarlos como fértiles o infértiles.
Para comenzar con la segunda generación, se seleccionan al menos tres cordones de huevos fértiles, pero preferiblemente seis, de cada jaula de cría, y se permite que eclosionen junto con algo de alimento. Estos cordones de huevos deberían haberse producido en el pico de la oviposición, que normalmente se produce en torno al día 19 en los controles. Idealmente, la segunda generación de todos los tratamientos comienza el mismo día, pero es posible que esto no siempre sea así debido a los efectos de la sustancia en el desarrollo de las larvas. En ese caso, las concentraciones más altas pueden iniciarse después de los tratamientos más bajos y el control (de disolvente).
|
|
29. a.
|
En el diseño de agua enriquecida, el sistema de sedimento-agua de la segunda generación se prepara enriqueciendo la columna de agua sobrenadante con la sustancia problema aproximadamente una hora antes de añadir las larvas de primer estadio a los recipientes de ensayo. Utilizando una pipeta, se aplican pequeños volúmenes de las soluciones de la sustancia problema por debajo de la superficie del agua. A continuación debe mezclarse el agua sobrenadante, con cuidado de no alterar el sedimento. Tras el enriquecimiento se suministra una ligera aireación.
|
|
29. b.
|
En el diseño de sedimento enriquecido, los recipientes de exposición que contienen el sistema de sedimento-agua de la segunda generación se preparan de la misma manera que los de la primera generación.
|
|
30.
|
Veinte larvas de primer estadio (como máximo, 48 horas después de la eclosión) de la segunda generación se asignan aleatoriamente a cada recipiente de ensayo que contenga el sistema enriquecido de sedimento-agua, con una pipeta roma. La aireación del agua se interrumpe mientras se añaden las larvas de primer estadio a los recipientes de ensayo, situación que debe mantenerse durante 24 horas más tras la adición de las larvas. Con arreglo al diseño del ensayo utilizado (véanse los puntos 19 y 20), el número de larvas utilizadas por concentración es como mínimo de 120 (seis réplicas por concentración) en el caso del planteamiento de ECX, y de 160 en el caso del planteamiento de NOEC (ocho réplicas por concentración).
|
Alimentos
|
31.
|
Es necesario alimentar a las larvas de los recipientes de ensayo, preferiblemente cada día o, como mínimo, tres veces a la semana. Una cantidad de 0,25 a 0,5 mg (de 0,35 a 0,5 mg para C. yoshimatsui) de alimento para peces (una suspensión en agua o en alimentos muy bien triturados; por ejemplo, Tetra-Min o Tetra-Phyll, véase la información del apéndice 2) por larva y por día es una cantidad adecuada de alimento para las larvas jóvenes durante los diez primeros días de su desarrollo. Las larvas de más edad pueden necesitar algo más de comida: entre 0,5 y 1,0 mg por larva al día debería ser suficiente durante el resto del ensayo. La ración alimentaria debe reducirse en todos los tratamientos y controlarse si se observa crecimiento de hongos o si se aprecia mortalidad en los controles. Si no puede detenerse el desarrollo fúngico, hay que repetir el ensayo.
La relevancia toxicológica de la exposición por ingestión es, en general, superior en las sustancias con una gran afinidad por el carbono orgánico o en las sustancias que se fijan covalentemente al sedimento. Por lo tanto, cuando se realicen pruebas con sustancias con estas propiedades, la cantidad de alimento necesario para garantizar la supervivencia y el crecimiento natural de las larvas puede añadirse al sedimento artificial antes del periodo de estabilización, en función del requisito reglamentario. Para evitar el deterioro de la calidad del agua, debe utilizarse material vegetal en lugar de alimento para peces; por ejemplo, la adición de un 0,5 % de hojas muy trituradas (peso seco) de ortiga (Urtica dioica), morera (Morus alba), trébol blanco (Trifolium repens), espinacas (Spinacia oleracea) u otro material vegetal (Cerophyl o α-celulosa). La adición de la ración completa de una fuente de alimento orgánico al sedimento antes del enriquecimiento no es algo trivial en lo que respecta a la calidad del agua y las características biológicas (21), ni tampoco constituye un método normalizado, pero hay estudios recientes que señalan que este método funciona (19) (26). Los dípteros adultos de la jaula de cría normalmente no necesitan alimento, pero la fecundidad y la fertilidad mejoran cuando se ofrece una almohadilla de algodón empapada en una solución de sacarosa saturada como fuente de alimento para los adultos aparecidos (34).
|
Condiciones de incubación
|
32.
|
Se aporta aireación suave al agua sobrenadante de los recipientes de ensayo transcurridas 24 horas de la adición de las larvas de primer estadio de las dos generaciones, y se continúa a lo largo de todo el ensayo (debe tenerse cuidado para que la concentración de oxígeno disuelto no caiga por debajo del 60 % del ASV). La aireación se proporciona mediante una pipeta Pasteur de vidrio, cuya salida se encuentra a 2-3 cm por encima de la capa de sedimento y que genera unas cuantas burbujas por segundo. Cuando se realicen ensayos con sustancias volátiles, no hay que airear el sistema de sedimento-agua; no obstante, hay que satisfacer el criterio de validez de un mínimo del 60 % del ASV (punto 10). Se ofrece más orientación en (16).
|
|
33.
|
El ensayo con C. riparius se lleva a cabo a una temperatura constante de 20 °C (± 2 °C). En el caso de C. dilutus y C. yoshimatsui, las temperaturas recomendadas son 23 °C y 25 °C (± 2 °C), respectivamente. Se usa un fotoperiodo de 16 horas, con una intensidad luminosa de 500 a 1 000 lux. En lo que respecta a las jaulas de cría, se puede incluir una hora más en la fase del amanecer y del atardecer.
|
Duración de la exposición
|
34.
|
Diseño de agua enriquecida: El periodo de exposición de la primera generación comienza cuando el agua sobrenadante de los recipientes de ensayo se enriquece con la sustancia problema (esto sucede un día después de la inserción de las larvas; en el punto 7 se pueden consultar posibles modificaciones del diseño de la exposición). La exposición de la segunda generación de larvas comienza de inmediato, ya que se insertan en un sistema de sedimento-agua que ya se ha enriquecido. La duración máxima de la exposición de la primera generación es de 27 días y, la de la segunda generación, de 28 días (las larvas de la primera generación pasan un día en los recipientes sin exposición) en el caso de C. riparius y C. yoshimatsui. Teniendo en cuenta el solapamiento, la duración total del ensayo es de 44 días aproximadamente. En lo que respecta a C. dilutus, la duración máxima de la exposición es de 64 y 65 días para la primera y la segunda generación, respectivamente. La duración total es de cien días aproximadamente.
Diseño de sedimento enriquecido: la exposición comienza con la adición de las larvas y dura, como máximo, 28 días para las dos generaciones de C. riparius y C. yoshimatsui, y 65 días como máximo para las dos generaciones de C. dilutus.
|
Observaciones
Aparición
|
35.
|
Para ambas generaciones, se determinan el tiempo de desarrollo y el número total de dípteros machos y hembras vivos que aparecen totalmente. Los machos se pueden identificar fácilmente gracias a sus antenas plumosas y la postura de su fino cuerpo.
|
|
36.
|
Los recipientes de ensayo de las dos generaciones deben observarse, como mínimo, tres veces por semana para realizar la evaluación visual de cualquier comportamiento anómalo de las larvas (por ejemplo, si se salen del sedimento, si nadan de forma poco habitual), en comparación con el control. Durante el periodo de aparición, que comienza unos 12 días después de la inserción de las larvas en el caso de C. riparius y C. yoshimatsui (20 días en el caso de C. dilutus), se cuentan los dípteros aparecidos y se clasifican por sexo al menos una vez, pero preferiblemente dos veces al día (temprano por la mañana y al final de la tarde). Tras la identificación, los dípteros de la primera generación se retiran con cuidado de los recipientes y se transfieren a una jaula de cría. Los dípteros de la segunda generación se retiran y se sacrifican después de la identificación. Los cordones de huevos depositados en los recipientes de ensayo de la primera generación deben recogerse individualmente y transferirse con un mínimo de 2,5 ml de agua original a microplacas de 12 pocillos (u otros recipientes adecuados), que se cubren con una tapa para evitar una evaporación significativa. Asimismo, hay que registrar el número de larvas muertas y de pupas visibles que no hayan conseguido dar lugar a adultos. En el apéndice 5 se presentan ejemplos de una jaula de cría, un recipiente de ensayo y un extractor.
|
Reproducción
|
37.
|
Los efectos en la reproducción se evalúan mediante el número de cordones de huevos producidos por la primera generación de dípteros y la fertilidad de dichos cordones de huevos. Los cordones de huevos se recogen una vez al día del cristalizador que se ha colocado en cada recipiente de cría. Los cordones de huevos deben recogerse y transferirse con un mínimo de 2,5 ml de agua original a una microplaca de 12 pocillos (un cordón de huevos en cada pocillo) u otros recipientes adecuados, que se cubren con una tapa para evitar una evaporación significativa. Se documentan las siguientes características de cada cordón de huevos: día de producción, tamaño (normal, es decir, 1,0 ± 0,3 cm; o pequeño, típicamente ≤ 0,5 cm), estructura (normal = forma de plátano con una cadena de huevos en espiral; o anómala, por ejemplo, una cadena de huevos que no forman espiral) y fertilidad (fértiles o infértiles). A lo largo de los seis días posteriores a su producción, se evalúa la fertilidad de un cordón de huevos. Un cordón de huevos se considera fértil cuando eclosiona como mínimo una tercera parte de los huevos. El número total de hembras añadidas a la jaula de cría se utiliza para calcular el número de cordones de huevos por hembra y el número de cordones de huevos fértiles por hembra. En caso necesario, el número de huevos de un cordón se puede estimar de forma no destructiva con el método de recuento de anillas (que se detalla en las referencias 32 y 33).
|
Mediciones analíticas
Concentración de la sustancia problema
|
38.
|
Como mínimo, deben analizarse muestras del agua sobrenadante, del agua intersticial y del sedimento al inicio de la exposición (en el caso del enriquecimiento del agua, preferiblemente una hora tras la aplicación) y al final del ensayo, a la concentración máxima y a una inferior. Esto se aplica a los recipientes de las dos generaciones. En los cristalizadores de la jaula de cría solo se analiza el agua sobrenadante, ya que este es el elemento con el que entran en contacto los cordones de huevos (en el diseño de sedimento enriquecido se puede plantear una confirmación analítica de la concentración en el sedimento). En caso necesario, se pueden realizar otras mediciones del sedimento, del agua intersticial o del agua sobrenadante durante el ensayo. Estas determinaciones de la concentración de la sustancia problema indican el comportamiento y el reparto de la sustancia problema en el sistema agua-sedimento. El muestreo de sedimento y agua intersticial al principio del ensayo y durante su realización (véase el punto 39) requiere más recipientes de ensayo para llevar a cabo determinaciones analíticas. Es posible que las mediciones del sedimento en el diseño de agua enriquecida no resulten necesarias si el reparto de la sustancia problema entre el agua y el sedimento ha quedado determinado claramente en un estudio de agua y sedimento en condiciones comparables (por ejemplo, relación sedimento-agua, tipo de aplicación, contenido de carbono orgánico en el sedimento), o si se demuestra que las concentraciones medidas en el agua sobrenadante se mantienen entre un 80 y un 120 % de las concentraciones iniciales nominales o medidas.
|
|
39.
|
Cuando se hagan mediciones intermedias (por ejemplo, el día 7 o el día 14) y si los análisis necesitan grandes muestras que no puedan tomarse de los recipientes de ensayo sin afectar al sistema de ensayo, las determinaciones analíticas deben llevarse a cabo con muestras de recipientes de ensayo adicionales tratados de la misma manera (incluida la presencia de los organismos de ensayo), pero que no se utilizan para las observaciones biológicas.
|
|
40.
|
El procedimiento recomendado para aislar el agua intersticial es la centrifugación, por ejemplo, a 10 000 g y a 4 °C durante 30 minutos. Sin embargo, si se demuestra que la sustancia problema no se adsorbe a los filtros, también puede aceptarse la filtración. En algunos casos puede resultar imposible analizar las concentraciones en el agua intersticial debido a que el volumen de la muestra es demasiado pequeño.
|
Parámetros fisicoquímicos
|
41.
|
El pH, el oxígeno disuelto en el agua de ensayo y la temperatura del agua en los recipientes de ensayo y los cristalizadores deben medirse de forma adecuada (véase el punto 10). La dureza y el amoníaco deben medirse en los controles, así como en un recipiente de ensayo y en un cristalizador, a la concentración más alta, al principio y al final del ensayo.
|
DATOS E INFORME
Tratamiento de los resultados
|
42.
|
El objetivo de este ensayo de ciclo de vida es determinar el efecto de la sustancia problema en la reproducción y, a lo largo de dos generaciones, la tasa de desarrollo y el número total de dípteros machos y hembras vivos que aparecen totalmente. En lo que respecta a la tasa de aparición, deben agruparse los datos de los machos y las hembras. Si no hay diferencias estadísticamente significativas entre las sensibilidades en cuanto a la tasa de desarrollo de los distintos sexos, se pueden agrupar los resultados de los machos y las hembras para realizar un análisis estadístico.
|
|
43.
|
Las concentraciones con efecto expresadas en forma de concentraciones en el agua sobrenadante (en el caso del agua enriquecida) o en el sedimento (en el caso del sedimento enriquecido) se calculan habitualmente sobre la base de las concentraciones medidas al principio de la exposición (véase el punto 38). Por lo tanto, en el caso del agua enriquecida, se calcula el promedio de cada tratamiento de las concentraciones medidas típicamente al principio de la exposición en el agua sobrenadante de los recipientes de ambas generaciones, así como las de los cristalizadores. En el caso del sedimento enriquecido, se calcula el promedio de cada tratamiento de las concentraciones medidas típicamente al principio de la exposición de ambas generaciones (y, opcionalmente, las de los cristalizadores).
|
|
44.
|
Para calcular una estimación puntual, es decir, una ECx, se pueden usar las estadísticas por recipiente y por jaula de cría como verdaderas réplicas. Al calcular un intervalo de confianza para cualquier ECx, debe tenerse en cuenta la variabilidad entre recipientes, o bien hay que demostrar que esta variabilidad es tan pequeña que puede despreciarse. Cuando el modelo sigue el método de los mínimos cuadrados, debe aplicarse una transformación a las estadísticas por recipiente a fin de mejorar la homogeneidad de la varianza. Sin embargo, los valores de ECx deben calcularse después de haber vuelto a transformar la respuesta al valor original (31).
|
|
45.
|
Cuando la finalidad del análisis estadístico es determinar la NOEC mediante contrastes de hipótesis, hay que tener en cuenta la variabilidad entre recipientes, lo que se garantiza aplicando métodos ANOVA (por ejemplo, los procedimientos de las pruebas de Williams y de Dunnett). La prueba de Williams resultaría adecuada cuando se espera una relación dosis-respuesta monótona, en teoría, y la prueba de Dunnett sería adecuada cuando no se sostenga la hipótesis de monotonicidad. También puede ser adecuado realizar ensayos más sólidos (27) en situaciones en las que no se cumplen los supuestos habituales de ANOVA (31).
|
Tasa de aparición
|
46.
|
Las tasas de aparición son datos cuantales y pueden ser analizados con la prueba de Cochran-Armitage aplicada de forma secuencial, cuando se prevé una relación dosis-respuesta monótona y estos datos son coherentes con dicha previsión. En caso contrario, puede utilizarse una prueba exacta de Fisher o la prueba de Mantel-Haentzal con los valores p ajustados según Bonferroni-Holm. Si hay pruebas de que la variabilidad entre réplicas en una misma concentración es mayor de lo que indicaría una distribución binomial (lo que se denomina generalmente varianza “extrabinomial”), hay que utilizar una prueba de Cochran-Armitage o una prueba exacta de Fisher que sean sólidas, tal y como se propone en (27).
Se calcula la suma de dípteros vivos (machos más hembras) aparecidos por recipiente, ne
, y se divide por el número de larvas introducidas, na
:

donde:
|
ER
|
=
|
tasa de aparición
|
|
ne
|
=
|
número de dípteros vivos aparecidos por recipiente
|
|
na
|
=
|
número de larvas introducidas por recipiente (normalmente, 20)
|
Cuando ne
es superior a na
(es decir, cuando de forma no intencional se ha introducido un número de larvas superior al número previsto) na
debe hacerse igual a ne
.
|
|
47.
|
Otro planteamiento que resulta más adecuado para las muestras de gran tamaño, cuando existe una varianza extrabinomial, consiste en tratar la tasa de aparición como una respuesta continua y utilizar procedimientos coherentes con estos datos de la ER. Se define aquí como muestra de gran tamaño la que corresponde a la situación en que tanto el número de dípteros aparecidos como el número de no aparecidos es superior a cinco, por (recipiente de) réplica.
|
|
48.
|
Para aplicar los métodos ANOVA, hay que transformar primero los valores de ER mediante la transformación arcoseno de la raíz cuadrada o la transformación de Tukey-Freeman para obtener una distribución normal aproximada y uniformizar las varianzas. Cuando se usan las frecuencias absolutas es posible aplicar la prueba de Cochran-Armitage, la prueba exacta de Fisher (Bonferroni) o la prueba de Mantel-Haentzal. La transformación arcoseno de la raíz cuadrada se aplica tomando la función inversa del seno (sen-1) de la raíz cuadrada de ER.
|
|
49.
|
En lo que respecta a las tasas de aparición, los valores de ECx se calculan mediante un análisis de regresión [por ejemplo, modelos probit, logit o Weibull (28)]. Si no sirve el análisis de regresión (por ejemplo, cuando hay menos de dos respuestas parciales), se utilizan otros métodos no paramétricos, tales como la media móvil o la interpolación simple.
|
Tasa de desarrollo
|
50.
|
El tiempo medio de desarrollo representa el intervalo de tiempo medio que transcurre entre la introducción de las larvas (día 0 del ensayo) y la aparición de la cohorte experimental de dípteros (para calcular el tiempo real de desarrollo hay que tener en cuenta la edad de las larvas en el momento de introducirlas). La tasa de desarrollo (unidad: 1/día) es la inversa del tiempo de desarrollo y corresponde a la porción de desarrollo larvario que se produce en un día. Es preferible utilizar la tasa de desarrollo para evaluar estos estudios de toxicidad en los sedimentos, ya que su varianza es menor y es más homogénea y próxima a la distribución normal en comparación con el tiempo de desarrollo. Por tanto, pueden usarse procedimientos de ensayos paramétricos más potentes con la tasa de desarrollo que con el tiempo de desarrollo. Considerando la tasa de desarrollo como una respuesta continua, es posible estimar los valores de ECx mediante análisis de regresión [por ejemplo, (29) (30)]. La NOEC para la tasa promedio de desarrollo puede determinarse con métodos ANOVA, como la prueba de Williams o la prueba de Dunnett. Como los machos aparecen antes que las hembras, es decir, presentan una tasa de desarrollo más alta, tiene sentido calcular la tasa de desarrollo de cada sexo por separado, además de la correspondiente a los dípteros en total.
|
|
51.
|
En lo que respecta a las pruebas estadísticas, se supone que el número de dípteros observados en el día de inspección x ha aparecido a la media del intervalo de tiempo entre el día x y el día x – l (l = longitud del intervalo de inspección, que es normalmente de 1 día). La tasa de desarrollo media por recipiente (
) se calcula mediante la siguiente fórmula:
donde:
|
|
:
|
tasa de desarrollo media por recipiente
|
|
i
|
:
|
índice del intervalo de inspección
|
|
m
|
:
|
número máximo de intervalos de inspección
|
|
fi
|
:
|
número de dípteros aparecidos en el intervalo de inspección i
|
|
ne
|
:
|
número total de dípteros aparecidos al final del experimento (Σfi
)
|
|
xi
|
:
|
tasa de desarrollo de los dípteros aparecidos en el intervalo i
|

donde:
|
díai
|
:
|
día de inspección (días desde la introducción de las larvas)
|
|
li
|
:
|
longitud del intervalo de inspección i (en días, generalmente 1 día)
|
|
Proporción de sexos
|
52.
|
Las proporciones de sexos son datos cuánticos y, por lo tanto, deben evaluarse mediante una prueba exacta de Fisher u otros métodos adecuados. La proporción de sexos natural de C. riparius es uno, es decir, los machos y las hembras son igualmente abundantes. Para ambas generaciones, los datos relativos a la proporción de sexos deben tratarse de forma idéntica. Como el número máximo de dípteros por recipiente (es decir, 20) es demasiado bajo para un análisis estadístico significativo, el número total de dípteros totalmente aparecidos y vivos de cada sexo se suma en todos los recipientes de un mismo tratamiento. Estos datos no transformados se contrastan con los datos del control (disolvente) o los datos de control combinados en una tabla de contingencia 2 × 2.
|
Reproducción
|
53.
|
La reproducción, al igual que la fecundidad, se calcula como el número de cordones de huevos por hembra. Más concretamente, el número total de cordones de huevos producidos en una jaula de cría se divide por el número total de hembras vivas en buen estado que se hayan añadido a esa jaula. Se puede calcular una NOEC para la fecundidad mediante métodos ANOVA, por ejemplo la prueba de Williams o la prueba de Dunnett.
|
|
54.
|
La fertilidad de los cordones de huevos se utiliza para cuantificar el número de cordones de huevos fértiles por hembra. El número total de cordones de huevos fértiles producidos en una jaula de cría se divide por el número total de hembras vivas en buen estado que se hayan añadido a esa jaula. Se puede calcular una NOEC para la fertilidad con métodos ANOVA, por ejemplo, la prueba de Williams o la prueba de Dunnett.
|
Informe del ensayo
|
55.
|
El informe del ensayo debe proporcionar la información siguiente:
|
|
Sustancia problema:
|
—
|
naturaleza física y propiedades fisicoquímicas (hidrosolubilidad, presión de vapor, log K
ow, coeficiente de reparto en el suelo [o en el sedimento, si se conoce], estabilidad en el agua y en el sedimento, etc.); y
|
|
—
|
datos de identificación química (nombre común, nombre químico, fórmula estructural, número CAS, etc.), incluida la pureza y el método de análisis cuantitativo de la sustancia problema.
|
|
|
|
Especie de ensayo:
|
—
|
organismos utilizados en el ensayo: especie, nombre científico, origen de los organismos y condiciones de cría;
|
|
—
|
información sobre la manipulación de las masas de huevos y las larvas;
|
|
—
|
información sobre la manipulación de los adultos aparecidos de la primera generación con ayuda de un extractor, etc. (véase el apéndice 5); y
|
|
—
|
edad de los organismos del ensayo en el momento de introducirlos en los recipientes de ensayo de primera y segunda generación.
|
|
|
|
Condiciones de ensayo:
|
—
|
sedimento utilizado, es decir, si es natural o (artificial) formulado;
|
|
—
|
sedimento natural: lugar y descripción de la zona de recogida del sedimento, incluyendo, si es posible, el historial de contaminación; características del sedimento: pH, contenido de carbono orgánico, relación C/N y granulometría (si procede);
|
|
—
|
sedimento artificial: preparación, ingredientes y características (contenido de carbono orgánico, pH, humedad, etc., medidos al principio del ensayo);
|
|
—
|
preparación del agua de ensayo (si se utiliza agua reconstituida) y características (concentración de oxígeno, pH, dureza, etc., al inicio del ensayo);
|
|
—
|
altura del sedimento y del agua sobrenadante de los recipientes de ensayo y los cristalizadores;
|
|
—
|
volumen de agua sobrenadante y agua intersticial, peso del sedimento húmedo con y sin agua intersticial de los recipientes de ensayo y los cristalizadores;
|
|
—
|
recipientes de ensayo (material y tamaño);
|
|
—
|
cristalizadores (material y tamaño);
|
|
—
|
jaulas de cría (material y tamaño);
|
|
—
|
método de preparación de las soluciones madre y las concentraciones del ensayo para los recipientes de ensayo y los cristalizadores;
|
|
—
|
aplicación de la sustancia problema en los recipientes de ensayo y en los cristalizadores: concentraciones de ensayo, número de réplicas y disolventes, en caso necesario;
|
|
—
|
condiciones de incubación de los recipientes de ensayo: temperatura, ciclo de luz e intensidad, aireación (burbujas por segundo);
|
|
—
|
condiciones de incubación de las jaulas de cría y los cristalizadores: temperatura, ciclo de luz e intensidad;
|
|
—
|
condiciones de incubación de los cordones de huevos en las microplacas (u otros recipientes): temperatura, ciclo de luz e intensidad; e
|
|
—
|
información detallada sobre la alimentación, incluidos el tipo de alimento, la preparación, la cantidad y el régimen alimentario.
|
|
|
|
Resultados:
|
—
|
concentraciones de ensayo nominales, concentraciones de ensayo medidas y resultados de todos los análisis efectuados para determinar la concentración de la sustancia problema en los recipientes de ensayo y los cristalizadores;
|
|
—
|
calidad del agua en los recipientes de ensayo y los cristalizadores, es decir, pH, temperatura, oxígeno disuelto, dureza y amoníaco;
|
|
—
|
sustitución del agua de ensayo evaporada de los recipientes de ensayo, si procede;
|
|
—
|
número de dípteros machos y hembras aparecidos por recipiente y por día de primera y segunda generación;
|
|
—
|
proporción de sexos de los dípteros totalmente aparecidos y vivos, por tratamiento, de la primera y la segunda generación;
|
|
—
|
número de larvas que no hayan conseguido aparecer como dípteros, por recipiente, de la primera y la segunda generación;
|
|
—
|
porcentaje o fracción de aparición por réplica y concentración de ensayo (dípteros machos y hembras combinados) de primera y segunda generación;
|
|
—
|
tasa media de desarrollo de los dípteros totalmente aparecidos y vivos por réplica y tasa de tratamiento (dípteros machos y hembras separados y en conjunto) de primera y segunda generación;
|
|
—
|
número de cordones de huevos depositados en los cristalizadores por jaula de cría y día;
|
|
—
|
características de cada hilera de huevos (tamaño, forma y fertilidad);
|
|
—
|
fecundidad: número total de cordones de huevos por número total de hembras añadidas a la jaula de cría;
|
|
—
|
fertilidad: número total de cordones de huevos fértiles por número total de hembras añadidas a la jaula de cría;
|
|
—
|
estimación de los parámetros de toxicidad como, por ejemplo, ECx (con intervalos de confianza asociados), NOEC y métodos estadísticos empleados para su determinación; y
|
|
—
|
análisis de los resultados, incluida la eventual influencia que tengan sobre ellos las desviaciones respecto al presente método de ensayo.
|
|
|
BIBLIOGRAFÍA
|
(1)
|
Capítulo C.28 del presente anexo. Ensayo sobre toxicidad para quironómidos en sistemas sedimento-agua con agua enriquecida.
|
|
(2)
|
Shobanov, N.A., Kiknadze, I.I. and M.G. Butler (1999), Palearctic and Nearctic Chironomus (Camptochironomus) tentans Fabricius are different species (Diptera: Chironomidae). Entomologica Scandinavica, 30: pp. 311–322.
|
|
(3)
|
Fleming, R. et al. (1994), Sediment Toxicity Tests for Poorly Water-Soluble Substances, Final Report to the European Commission, Report No: EC 3738. Agosto de 1994. WRc, Reino Unido.
|
|
(4)
|
SETAC (1993), Guidance Document on Sediment toxicity Tests and Bioassays for Freshwater and Marine Environments, From the WOSTA Workshop held in the Netherlands.
|
|
(5)
|
ASTM International (2009), E1706-05E01: Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, en: Annual Book of ASTM Standards, Volume 11.06, Biological Effects and Environmental Fate; Biotechnology. ASTM International, West Conshohocken, PA.
|
|
(6)
|
Environment Canada (1997), Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius), Biological Test Method, Report SPE 1/RM/32, diciembre de 1997.
|
|
(7)
|
US-EPA (2000), Methods for Measuring the Toxicity and Bioaccumulation of Sediment-associated Contaminants with Freshwater Invertebrates, segunda edición, EPA 600/R-99/064, marzo 2000; revisión de la primera edición de junio de 1994.
|
|
(8)
|
US-EPA/OPPTS 850.1735 (1996), Whole Sediment Acute Toxicity Invertebrates.
|
|
(9)
|
US-EPA/OPPTS 850.1790 (1996), Chironomid Sediment toxicity Test.
|
|
(10)
|
Milani, D., Day, K.E., McLeay, D.J. and R.S. Kirby (1996), Recent intra- and inter-laboratory studies related to the development and standardisation of Environment Canada's biological test methods for measuring sediment toxicity using freshwater amphipods (Hyalella azteca) and midge larvae (Chironomus riparius), Technical Report, Environment Canada, National Water Research Institute, Burlington, Ontario, Canadá.
|
|
(11)
|
Norberg-King, T.J., Sibley, P.K., Burton, G.A., Ingersoll, C.G., Kemble, N.E., Ireland, S., Mount, D.R. and C.D. Rowland (2006), Interlaboratory evaluation of Hyalella azteca and Chironomus tentans short-term and long-term sediment toxicity tests, Environ. Toxicol. Chem., 25: pp. 2662-2674.
|
|
(12)
|
Taenzler, V., Bruns, E., Dorgerloh, M., Pfeifle, V. and L. Weltje (2007), Chironomids: suitable test organisms for risk assessment investigations on the potential endocrine-disrupting properties of pesticides, Ecotoxicology, 16: pp. 221-230.
|
|
(13)
|
Sugaya, Y. (1997), Intra-specific variations of the susceptibility of insecticides in Chironomus yoshimatsui, Jp. J. Sanit. Zool., 48: pp. 345-350.
|
|
(14)
|
Kawai, K. (1986), Fundamental studies on chironomid allergy, I. Culture methods of some Japanese chironomids (Chironomidae, Diptera), Jp. J. Sanit. Zool., 37: pp. 47-57.
|
|
(15)
|
Capítulo C.27 del presente anexo. Ensayo de toxicidad para quironómidos en sistemas sedimentos — agua con sedimento enriquecido.
|
|
(16)
|
OCDE (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Environment, Health and Safety Publications, Series on Testing and Assessment No 23, ENV/JM/MONO(2000)6, OCDE, París.
|
|
(17)
|
Weltje, L., Rufli, H., Heimbach, F., Wheeler, J., Vervliet-Scheebaum, M. and M. Hamer (2010), The chironomid acute toxicity test: development of a new test system, Integr. Environ. Assess. Management.
|
|
(18)
|
Environment Canada. (1995), Guidance Document on Measurement of Toxicity Test Precision Using Control Sediments Spiked with a Reference Toxicant, Report EPS 1/RM/30, septiembre de 1995.
|
|
(19)
|
Oetken, M, Nentwig, G., Löffler, D, Ternes, T. and J. Oehlmann (2005), Effects of pharmaceuticals on aquatic invertebrates, Part I, The antiepileptic drug carbamazepine, Arch. Environ. Contam. Toxicol., 49: pp. 353-361.
|
|
(20)
|
Suedel, B.C. and J.H. Rodgers (1994), Development of formulated reference sediments for freshwater and estuarine sediment testing, Environ. Toxicol. Chem., 13: pp. 1163-1175.
|
|
(21)
|
Naylor, C. and C. Rodrigues (1995), Development of a test method for Chironomus riparius using a formulated sediment, Chemosphere, 31: pp. 3291-3303.
|
|
(22)
|
Dunnett, C.W. (1964), A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statis. Assoc., 50: pp. 1096-1121.
|
|
(23)
|
Dunnett, C.W. (1964), New tables for multiple comparisons with a control, Biometrics, 20: pp. 482-491.
|
|
(24)
|
Williams, D.A. (1971), A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27: pp. 103-117.
|
|
(25)
|
Williams, D.A. (1972), The comparison of several dose levels with a zero dose control. Biometrics, 28: pp. 510-531.
|
|
(26)
|
Jungmann, D., Bandow, C., Gildemeister, T., Nagel, R., Preuss, T.G., Ratte, H.T., Shinn, C., Weltje, L. and H.M. Maes (2009), Chronic toxicity of fenoxycarb to the midge Chironomus riparius after exposure in sediments of different composition. J Soils Sediments, 9: pp. 94-102.
|
|
(27)
|
Rao, J.N.K. and A.J. Scott (1992), A simple method for the analysis of clustered binary data. Biometrics, 48: pp. 577-585.
|
|
(28)
|
Christensen, E.R. (1984), Dose-response functions in aquatic toxicity testing and the Weibull model, Water Res., 18: pp. 213-221.
|
|
(29)
|
Bruce, R.D. and D.J. Versteeg (1992), A statistical procedure for modelling continuous toxicity data, Environ. Toxicol. Chem., 11: pp. 1485-1494.
|
|
(30)
|
Slob, W. (2002), Dose-response modelling of continuous endpoints. Toxicol. Sci., 66: pp. 298-312.
|
|
(31)
|
OCDE (2006), Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application, OECD Series on Testing and Assessment No 54, 146 pp., ENV/JM/MONO(2006)18, OCDE, París.
|
|
(32)
|
Benoit, D.A., Sibley, P.K., Juenemann, J.L. and G.T. Ankley (1997), Chironomus tentans life-cycle test: design and evaluation for use in assessing toxicity of contaminated sediments, Environ. Toxicol. Chem., 16: pp. 1165-1176.
|
|
(33)
|
Vogt, C., Belz, D., Galluba, S., Nowak, C., Oetken, M. and J. Oehlmann (2007), Effects of cadmium and tributyltin on development and reproduction of the non-biting midge Chironomus riparius (Diptera) — baseline experiments for future multi-generation studies, J. Environ. Sci. Health Part A, 42: pp. 1-9.
|
|
(34)
|
OCDE (2010), Validation report of the Chironomid full life-cycle toxicity test, Forthcoming publication in the Series on Testing and Assessment, OCDE, París.
|
Apéndice 1
Definiciones
A efectos del presente método de ensayo, aplicarán las siguientes definiciones:
Sustancia
: sustancia o mezcla.
Sedimento artificial (o reconstituido, formulado o sintético): mezcla de materiales empleada para imitar los componentes físicos de un sedimento natural.
Agua sobrenadante
: agua situada sobre el sedimento en el recipiente de ensayo.
Agua intersticial
: agua que ocupa el espacio entre las partículas del sedimento y del suelo.
Agua enriquecida
: agua a la que se ha añadido la sustancia problema.
Sustancia problema
: toda sustancia o mezcla estudiada con este método de ensayo.
Apéndice 2
Recomendaciones para el cultivo de Chironomus riparius
|
1.
|
Las larvas de Chironomus pueden criarse en cristalizadores o en recipientes más grandes. Sobre el fondo del recipiente se extiende arena de cuarzo fina, en una capa delgada de unos 5 a 10 mm de espesor. Se ha comprobado que la tierra de diatomeas (por ejemplo, Merck, Art 8117) también es un sustrato adecuado (es suficiente una capa más fina, de muy pocos milímetros). A continuación se añade agua adecuada hasta una altura de varios centímetros. Los niveles deben mantenerse rellenando con agua en la medida necesaria para compensar las pérdidas por evaporación y evitar la desecación. En caso necesario, es posible sustituir el agua. Debe aportarse una aireación suave. Los recipientes de cría de las larvas deben mantenerse en una jaula adecuada para evitar que se escapen los adultos que aparezcan. La jaula debe ser lo suficientemente grande como para permitir el enjambrado de los adultos aparecidos, ya que en caso contrario puede que no haya copulación (las dimensiones mínimas son de unos 30 × 30 × 30 cm).
|
|
2.
|
Las jaulas deben mantenerse a temperatura ambiente o en una zona de temperatura ambiente constante a 20 ± 2 °C con un fotoperiodo de 16 horas de luz (de intensidad alrededor de 1 000 lux) y 8 horas de oscuridad. Se ha comunicado que una humedad relativa del aire de menos del 60 % puede impedir la reproducción.
|
Agua de dilución
|
3.
|
Puede emplearse cualquier agua natural o sintética que sea adecuada. Se suelen utilizar agua de pozo, agua del grifo desclorada y medios artificiales (como, por ejemplo, medio M4 o M7 de Elendt, véase más abajo). Es necesario airear el agua antes de utilizarla. En caso necesario, el agua de cultivo puede renovarse sacando cuidadosamente, por vertido o con sifón, el agua usada de los recipientes de cultivo sin destruir los tubos de las larvas.
|
Alimentación de las larvas
|
4.
|
Las larvas de Chironomus deben alimentarse con comida para peces en copos (Tetra Min®, Tetra Phyll® u otra marca similar de comida comercial para peces), a un régimen de aproximadamente 250 mg por recipiente al día. Puede administrarse como polvo molido seco o como suspensión en agua: se añade 1,0 g de comida en copos a 20 ml de agua de dilución y se mezcla para obtener un resultado homogéneo. Este preparado se puede suministrar a un régimen de unos 5 ml por recipiente al día (se debe agitar antes de usar). Las larvas de más edad pueden recibir más alimento.
|
|
5.
|
La alimentación se ajusta según la calidad del agua. Si el medio de cultivo se pone turbio, hay que reducir la alimentación. Se debe supervisar cuidadosamente la adición de comida. Si la comida es demasiado escasa, se provocará la emigración de las larvas hacia la columna de agua, mientras que si es excesiva aumentará la actividad microbiana y se reducirá la concentración de oxígeno. Ambas situaciones pueden producir un descenso de la tasa de crecimiento.
|
|
6.
|
También se pueden añadir células de algas verdes (como, por ejemplo, Scenedesmus subspicatus, Chlorella vulgaris) cuando se preparan recipientes de cultivo nuevos.
|
Alimentación de los adultos aparecidos
|
7.
|
Algunos investigadores han sugerido que un disco de algodón empapado en una solución saturada de sacarosa puede servir de alimento para los adultos emergidos.
|
Aparición
|
8.
|
A 20 ± 2 °C, los adultos empiezan a aparecer en los recipientes de cría de larvas, aproximadamente a los 13-15 días. Los machos se distinguen fácilmente porque tienen antenas plumosas y un cuerpo delgado.
|
Masas de huevos
|
9.
|
Una vez haya adultos en la jaula de cría, deben supervisarse todos los recipientes de cría de larvas tres veces por semana para observar la puesta de masas gelatinosas de huevos. Cuando se encuentren, las masas de huevos deben retirarse con cuidado y transferirse a una pequeña placa que contenga una muestra del agua de cría. Las masas de huevos se emplean para preparar un nuevo recipiente de cultivo (por ejemplo, de 2 a 4 masas de huevos por recipiente) o para los ensayos de toxicidad.
|
|
10.
|
Las larvas de primer estadio deben salir de los huevos al cabo de 2 o 3 días.
|
Establecimiento de nuevos recipientes de cultivo
|
11.
|
Cuando se hayan establecido los cultivos, debe ser posible establecer un nuevo recipiente de cultivo de larvas cada semana o con menos frecuencia, según los requisitos del ensayo, eliminando los recipientes más viejos una vez han aparecido los dípteros adultos. Con este sistema, se obtendrá un suministro regular de adultos, con una gestión mínima.
|
Preparación de las soluciones de ensayo “M4” y “M7”
|
12.
|
Elendt (1990) describió el medio “M4”. El “M7” se prepara como el medio “M4”, salvo en lo relativo a las sustancias indicadas en la tabla 1, cuyas concentraciones son cuatro veces más bajas en el medio “M7” que en el “M4”. La solución de ensayo no debe prepararse de acuerdo con Elendt y Bias (1990), porque las concentraciones de NaSiO3 × 5H2O, NaNO3, KH2PO4 y K2HPO4 indicadas para la preparación de las soluciones madre no son adecuadas.
|
Preparación del medio “M7”
|
13.
|
Las soluciones madre (I) se preparan por separado cada una y a partir de ellas se prepara una solución madre combinada (II) (véase la tabla 1). Se toman 50 ml de la solución madre combinada (II) junto con las cantidades de solución madre de cada macronutriente que figuran en la tabla 2, y se llevan a 1 litro con agua desionizada para preparar el medio “M7”. Se prepara una solución madre de vitaminas añadiendo tres vitaminas al agua desionizada como se indica en la tabla 3, y se añade al medio “M7” final 0,1 ml de la solución madre de vitaminas combinadas, poco antes de su empleo. La solución madre de vitaminas se conserva congelada en pequeñas partes alícuotas. El medio se airea y se estabiliza.
|
Tabla 1
Soluciones madre de oligoelementos para los medios M4 y M7
|
Soluciones madre (I)
|
Cantidad (mg) enrasada a 1 litro con agua desionizada
|
Para preparar la solución madre combinada (II): mezclar las siguientes cantidades (ml) de soluciones madre (I) y enrasar a 1 litro con agua desionizada.
|
Concentraciones finales en las soluciones de ensayo (mg/l)
|
|
M4
|
M7
|
M4
|
M7
|
|
H3BO3
(25)
|
57 190
|
1,0
|
0,25
|
2,86
|
0,715
|
|
MnCl2 × 4H2O (25)
|
7 210
|
1,0
|
0,25
|
0,361
|
0,090
|
|
LiCl (25)
|
6 120
|
1,0
|
0,25
|
0,306
|
0,077
|
|
RbCl (25)
|
1 420
|
1,0
|
0,25
|
0,071
|
0,018
|
|
SrCl2 × 6H2O (25)
|
3 040
|
1,0
|
0,25
|
0,152
|
0,038
|
|
NaBr (25)
|
320
|
1,0
|
0,25
|
0,016
|
0,004
|
|
Na2MoO4 × 2H2O (25)
|
1 260
|
1,0
|
0,25
|
0,063
|
0,016
|
|
CuCl2 × 2H2O (25)
|
335
|
1,0
|
0,25
|
0,017
|
0,004
|
|
ZnCl2
|
260
|
1,0
|
1,0
|
0,013
|
0,013
|
|
CaCl2 × 6H2O
|
200
|
1,0
|
1,0
|
0,010
|
0,010
|
|
KI
|
65
|
1,0
|
1,0
|
0,0033
|
0,0033
|
|
Na2SeO3
|
43,8
|
1,0
|
1,0
|
0,0022
|
0,0022
|
|
NH4VO3
|
11,5
|
1,0
|
1,0
|
0,00058
|
0,00058
|
|
Na2EDTA × 2H2O (25)
(26)
|
5 000
|
20,0
|
5,0
|
2,5
|
0,625
|
|
FeSO4 × 7H2O (25)
(26)
|
1 991
|
20,0
|
5,0
|
1,0
|
0,249
|
Tabla 2
Soluciones madre de macronutrientes para los medios M4 y M7
|
|
Cantidad enrasada a 1 litro con agua desionizada
(mg)
|
Cantidad de soluciones madre de macronutrientes añadida para preparar los medios M4 y M7
(ml/l)
|
Concentraciones finales en las soluciones de ensayo de M4 y M7
(mg/l)
|
|
CaCl2 · 2H2O
|
293 800
|
1,0
|
293,8
|
|
MgSO4 · 7H2O
|
246 600
|
0,5
|
123,3
|
|
KCl
|
58 000
|
0,1
|
5,8
|
|
NaHCO3
|
64 800
|
1,0
|
64,8
|
|
NaSiO3 · 9H2O
|
50 000
|
0,2
|
10,0
|
|
NaNO3
|
2 740
|
0,1
|
0,274
|
|
KH2PO4
|
1 430
|
0,1
|
0,143
|
|
K2HPO4
|
1 840
|
0,1
|
0,184
|
Tabla 3
Solución madre de vitaminas para los medios M4 y M7
Las tres soluciones de vitaminas se combinan para formar una única solución madre de vitaminas.
|
|
Cantidad enrasada a 1 litro con agua desionizada
(mg)
|
Cantidad de solución madre de vitaminas añadida para preparar los medios M4 y M7
(ml/l)
|
Concentraciones finales en las soluciones de ensayo de M4 y M7
(mg/l)
|
|
Clorhidrato de tiamina
|
750
|
0,1
|
0,075
|
|
Cianocobalamina (B12)
|
10
|
0,1
|
0,0010
|
|
Biotina
|
7,5
|
0,1
|
0,00075
|
BIBLIOGRAFÍA
BBA (1995), Long-term toxicity test with Chironomus riparius: Development and validation of a new test system, edición de M. Streloke y H. Köpp. Berlín.
Elendt, B.P. (1990), Selenium deficiency in Crustacea, Protoplasma, 154: pp. 25-33.
Elendt, B.P. and W.-R. Bias (1990), Trace nutrient deficiency in Daphnia magna cultured in standard medium for toxicity testing, Effects on the optimisation of culture conditions on life history parameters of D. magna, Water Research, 24: pp. 1157-1167.
Apéndice 3
Preparación del sedimento artificial
COMPOSICIÓN DEL SEDIMENTO
La composición del sedimento artificial debe ser la siguiente:
|
Componente
|
Características
|
% de sedimento (peso seco)
|
|
Turba
|
Turba esfágnea, de pH lo más próximo posible a 5,5-6,0, sin restos vegetales visibles, finamente triturada (tamaño de partícula ≤ 1 mm) y secada al aire
|
4 - 5
|
|
Arena de cuarzo
|
Granulometría: Más del 50 % de las partículas deben encontrarse en la banda de 50-200 μm
|
75 - 76
|
|
Caolín
|
Contenido en caolinita ≥ 30 %
|
20
|
|
Carbono orgánico
|
Ajustado mediante adición de turba y arena
|
2 (± 0,5)
|
|
Carbonato de calcio
|
CaCO3, pulverizado, químicamente puro
|
0,05 - 0,1
|
|
Agua
|
Conductividad ≤ 10 μS/cm
|
30 - 50
|
PREPARACIÓN
La turba se seca al aire y se tritura hasta convertirse en un polvo fino. Se prepara en agua desionizada una suspensión de la cantidad necesaria de polvo de turba, utilizando un dispositivo de homogeneización de prestaciones elevadas. El pH de esta suspensión se ajusta a 5,5 ± 0,5 con CaCO3. La suspensión se deja durante al menos dos días con agitación suave a 20 ± 2 °C, para estabilizar el pH e implantar un componente microbiano estable. Se vuelve a medir el pH, que debe quedar a 6,0 ± 0,5. A continuación se mezcla la suspensión de turba con los demás componentes (arena y caolín) y con agua desionizada para obtener un sedimento homogéneo con un contenido de agua del 30–50 % del peso seco del sedimento. Se vuelve a medir el pH de la mezcla final y se ajusta a 6,5-7,5 con CaCO3 en caso necesario. Se toman muestras del sedimento para determinar el peso seco y el contenido de carbono orgánico. Se recomienda a continuación que el sedimento artificial, antes de emplearse en el ensayo de toxicidad para quironómidos, se someta durante siete días a las mismas condiciones que vayan a reinar posteriormente en el ensayo.
ALMACENAMIENTO
Los componentes secos utilizados para preparar el sedimento artificial pueden almacenarse en un lugar fresco y seco, a temperatura ambiente. El sedimento (húmedo) ya preparado no debe almacenarse antes de su empleo en el ensayo. Debe utilizarse inmediatamente tras el tiempo de acondicionamiento de 7 días con que termina su preparación.
BIBLIOGRAFÍA
OECD (1984), Earthworm, Acute Toxicity Test, Test Guideline No 207, Guidelines for the Testing of Chemicals, OCDE, París.
Meller, M., Egeler, P., Roembke, J., Schallnass, H., Nagel, R. and B. Streit (1998), Short-term toxicity of lindane, hexachlorobenzene and copper sulfate on tubificid sludgeworms (Oligochaeta) in artificial media, Ecotox. Environ. Safety, 39: pp. 10-20.
Apéndice 4
Características químicas aceptables del agua de dilución
|
COMPONENTE
|
CONCENTRACIONES
|
|
Partículas
|
< 20 mg/l
|
|
Carbono orgánico total
|
< 2 mg/l
|
|
Amoníaco no ionizado
|
< 1 μg/l
|
|
Dureza como CaCO3
|
< 400 mg/l (27)
|
|
Cloro residual
|
< 10 μg/l
|
|
Plaguicidas organofosforados totales
|
< 50 ng/l
|
|
Plaguicidas organoclorados totales y bifenilos policlorados
|
< 50 ng/l
|
|
Cloro orgánico total
|
< 25 ng/l
|
Apéndice 5
Orientación sobre los resultados del ensayo
Ejemplo de una jaula de cría:

|
A
|
:
|
Gasa en la parte superior y al menos en uno de los lados de la jaula (luz de malla aproximada de 1 mm).
|
|
B
|
:
|
Abertura para colocar los adultos aparecidos en el interior de la jaula de cría y para retirar de los cristalizadores los cordones de huevos puestos (no se muestran en este gráfico).
|
|
C
|
:
|
Jaula de cría con un tamaño mínimo de 30 cm de largo, 30 cm de altura y 30 cm de ancho.
|
Ejemplo de un recipiente de ensayo:
|
A
|
:
|
Pipeta Pasteur para el suministro de aire al agua sobrenadante.
|
|
B
|
:
|
Tapa de cristal para evitar que se escapen los dípteros aparecidos.
|
|
C
|
:
|
Capa de la superficie de agua.
|
|
D
|
:
|
Recipiente de ensayo (vaso de vidrio de 600 ml como mínimo).
|
|
E
|
:
|
Capa de sedimento.
|
Ejemplo de extractor para la captura de dípteros adultos (las flechas indican la dirección del flujo de aire):

|
A
|
:
|
Tubo de vidrio (diámetro interior de 5 mm aproximadamente) conectado a una bomba de autocebado.
|
|
B
|
:
|
Corcho de goma vulcanizada, perforado con el tubo de vidrio (A). En el interior, la abertura del tubo de vidrio (A) se tapa con un poco de algodón y una gasa (luz de la malla de 1 mm aproximadamente) para evitar daños en los dípteros cuando son succionados por el extractor.
|
|
C
|
:
|
Recipiente transparente (de plástico o vidrio, de una longitud aproximada de 15 cm) para los dípteros capturados.
|
|
D
|
:
|
Corcho de goma vulcanizada, perforado con el tubo (E). Para soltar los dípteros en la jaula de cría, se retira el corcho D del recipiente C.
|
|
E
|
:
|
Tubo (de plástico o vidrio, diámetro interior de 8 mm aproximadamente) para recoger los dípteros adultos del recipiente.
|
Presentación esquemática de un ensayo de ciclo de vida:
|
A
|
:
|
Primera generación: recipientes de ensayo que contienen un sistema de sedimento-agua, ocho réplicas y veinte larvas de primer estadio por recipiente.
|
|
B
|
:
|
Cuatro recipientes de ensayo por cada jaula de cría, A y B.
|
|
C
|
:
|
Jaulas de cría (A y B) para el enjambrado, el apareamiento y la oviposición.
|
|
D
|
:
|
Cristalizadores donde caen los cordones de huevos.
|
|
E
|
:
|
Microplacas, un pocillo para cada cordón de huevos.
|
|
F
|
:
|
Segunda generación: recipientes de ensayo que contienen un sistema de sedimento-agua, ocho réplicas y veinte larvas de primer estadio por recipiente.
|
C.41. ENSAYO DE DESARROLLO SEXUAL EN PECES
INTRODUCCIÓN
|
1.
|
El presente método de ensayo reproduce las directrices de ensayo (TG) 234 de la OCDE (2011). Se basa en una decisión de 1998 de desarrollar nuevos métodos de ensayo, o actualizar métodos existentes, para la selección y evaluación de los alteradores endocrinos potenciales. El ensayo de desarrollo sexual en peces (FSDT) se identificó como un método de ensayo prometedor que abarca una fase de la vida sensible de los peces que responde a sustancias similares a los estrógenos y los andrógenos. El método de ensayo fue sometido a un ejercicio de validación interlaboratorios entre los años 2006 y 2010, en el que se validaron el medaka (Oryzias latipes), el pez cebra (Danio rerio) y el espinoso (Gasterosteus aculeatus); en el caso del pez cabeza gorda (Pimephales promelas), este fue validado parcialmente (41) (42) (43). Este protocolo incluye el medaka, el espinoso y el pez cebra. El protocolo constituye, en principio, una mejora de las directrices TG 210 de la OCDE, Ensayo de toxicidad en las primeras fases de vida de los peces (1), donde la exposición continúa hasta que los peces se diferencian sexualmente, es decir, cuando han transcurrido aproximadamente 60 días desde la eclosión (dph), en lo que respecta al medaka japonés, el espinoso y el pez cebra (el periodo de exposición podría ser más corto o más largo para otras especies que pudieran validarse en el futuro), y se añade la observación de efectos sobre el sistema endocrino. El FSDT evalúa los efectos en las primeras fases de la vida, así como las posibles consecuencias negativas de las sustancias sospechosas de alterar el sistema endocrino (por ejemplo, estrógenos, andrógenos e inhibidores de la esteroidogénesis) en relación con el desarrollo sexual. La combinación de los dos parámetros endocrinos principales, la concentración de vitelogenina (VTG) y la proporción de sexos fenotípicos permite que el ensayo indique el mecanismo de acción de la sustancia problema. Debido al cambio relevante para la población de la proporción de sexos fenotípicos, el FSDT se puede utilizar para llevar a cabo evaluaciones de peligros y riesgos. No obstante, si el ensayo se utiliza para evaluar peligros y riesgos, no debe utilizarse el espinoso, porque los datos de validación disponibles hasta el momento reflejan que, en esta especie, las alteraciones de la proporción de sexos fenotípicos debidas a las sustancias problema fueron poco frecuentes.
|
|
2.
|
El protocolo se basa en peces expuestos a sustancias a través del agua, durante el periodo lábil sexual en el que se espera que los peces sean más sensibles a los efectos de las sustancias que alteran el sistema endocrino e interfieren en el desarrollo sexual. Se miden dos parámetros principales como indicadores de aberraciones del desarrollo asociadas al sistema endocrino: las concentraciones de VTG y las proporciones de sexos determinadas mediante la histología de las gónadas. La histopatología de las gónadas (evaluación y determinación de fases de los ovocitos y de las células espermatogénicas) es opcional. Además, el sexo genético se determina siempre que sea posible (por ejemplo, en el medaka japonés y en el espinoso). La presencia de un marcador del sexo genético constituye una ventaja considerable, ya que aumenta la potencia de las estadísticas de la proporción de sexos y permite la detección de la inversión de sexo fenotípico del individuo. Otros parámetros principales que deben medirse incluyen la tasa de eclosión, la supervivencia, la longitud y el peso corporal. El método de ensayo podría adaptarse a otras especies distintas a las mencionadas anteriormente, siempre que dichas especies se sometan a una validación igual a la lograda con el medaka japonés, el espinoso y el pez cebra, que los peces de control se diferencien sexualmente al final del ensayo, que los niveles de VTG sean lo suficientemente altos como para detectar las variaciones significativas relacionadas con las sustancias, y que se establezca la sensibilidad del sistema de ensayo mediante sustancias de referencia con actividad endocrina [(anti)estrógenos, (anti)andrógenos, inhibidores de la aromatasa, etc.]. Asimismo, todo informe de validación que haga referencia a datos del FSDT utilizando otras especies debe ser revisado por la OCDE y los resultados de la validación deben considerarse igual de satisfactorios.
|
Consideraciones iniciales y limitaciones
|
3.
|
La VTG se produce normalmente en el hígado de los vertebrados ovíparos hembra como respuesta a los estrógenos endógenos circulantes (2). Es un precursor de las proteínas de la yema de huevo y, una vez que se produce en el hígado, viaja a través del torrente sanguíneo hasta el ovario, donde los huevos en desarrollo la absorben y modifican. La síntesis de la VTG es muy limitada, aunque detectable, en los peces inmaduros y en los peces macho adultos porque no cuentan con suficientes estrógenos circulantes. No obstante, el hígado puede sintetizar y secretar VTG como respuesta a una estimulación de estrógenos exógena (3) (4) (5).
|
|
4.
|
La medición de la VTG sirve para detectar las sustancias con mecanismos de acción estrogénicos, antiestrogénicos y androgénicos, así como las sustancias que interfieren con la esteroidogénesis como, por ejemplo, los inhibidores de la aromatasa. La detección de sustancias estrogénicas es posible mediante la medición de la inducción de VTG en los peces macho, algo que ha quedado documentado de forma abundante en la bibliografía revisada por expertos. La inducción de VTG también ha quedado demostrada tras la exposición a andrógenos aromatizables (6) (7). Una reducción del nivel circulante de estrógenos en las hembras, por ejemplo mediante la inhibición de la aromatasa que convierte el andrógeno endógeno en el estrógeno natural 17β-estradiol, provoca una disminución del nivel de concentración de VTG, lo que se utiliza para detectar las sustancias con propiedades inhibidoras de la aromatasa o, más ampliamente, los inhibidores de la esteroidogénesis (33). La relevancia biológica de la respuesta de la VTG tras la administración de estrógenos o la inhibición de la aromatasa ha quedado establecida y se ha documentado ampliamente (8) (9). Sin embargo, es posible que la producción de VTG en las hembras también pueda verse afectada por la toxicidad general y unos mecanismos de acción tóxicos no endocrinos.
|
|
5.
|
Se ha conseguido desarrollar varios métodos de medición, que se han armonizado para el uso rutinario para cuantificar la VTG en la sangre, el hígado, todo el cuerpo o en muestras homogeneizadas de cabeza/cola recogidas de distintos peces. Tal es el caso para el pez cebra, el espinoso y el medaka, y también para la especie validada parcialmente, el pez cabeza gorda; están disponibles los métodos de enzimoinmunoanálisis de adsorción (ELISA) específicos para cada especie, que usan inmunoquímica para la cuantificación de la VTG (5) (10) (11) (12) (13) (14) (15) (16). En el medaka y el pez cebra hay una buena correlación entre la VTG medida en el plasma sanguíneo, en el hígado y en las muestras homogeneizadas, aunque estas tienden a presentar unos valores ligeramente inferiores a los plasmáticas (17) (18) (19). En el apéndice 5 se recogen los procedimientos recomendados para la recogida de muestras para el análisis de VTG.
|
|
6.
|
El cambio en la proporción de sexos fenotípicos constituye un parámetro que refleja la inversión de sexo. En principio, los estrógenos, los antiestrógenos, los andrógenos, los antiandrógenos y las sustancias inhibidoras de la esteroidogénesis pueden afectar a la proporción de sexos de los peces en desarrollo (20). Se ha demostrado que esta inversión de sexo es parcialmente reversible en el pez cebra (21) tras la exposición a una sustancia similar a los estrógenos, mientras que la inversión de sexo tras una exposición a una sustancia similar a los andrógenos es permanente (30). El sexo se define como hembra, macho, hermafrodita (con ovocitos y células espermatogénicas en una gónada) o indiferenciado, y se determina en cada pez mediante el examen histológico de las gónadas. Se proporciona orientación en el apéndice 7 y en el documento de orientación de la OCDE sobre el diagnóstico de histopatología relacionada con el sistema endocrino de las gónadas de los peces (22).
|
|
7.
|
El sexo genético se examina mediante marcadores genéticos cuando están presentes en una especie de pez determinada. En el medaka, los genes XX de la hembra o XY del macho se pueden detectar mediante la reacción en cadena de la polimerasa (PCR), o se puede analizar el gen del dominio DM ligado a Y (DMY, negativo o positivo), tal y como se describe en (23) (24). Con respecto al espinoso hay un método de PCR equivalente para determinar el sexo genético, que se describe en el apéndice 10. Cuando el sexo genético se puede vincular individualmente al sexo fenotípico, la potencia del ensayo mejora y, por lo tanto, el sexo genético debería determinarse en las especies que tengan marcadores documentados del sexo genético.
|
|
8.
|
Los dos parámetros endocrinos principales, la VTG y la proporción de sexos, pueden demostrar, en conjunto, el mecanismo de acción (MDA) endocrino de la sustancia (tabla 1). La proporción de sexos constituye un biomarcador relevante para la población (25) (26) y, para algunos mecanismos de acción bien definidos, los resultados del FSDT podrían utilizarse para llevar a cabo evaluaciones de peligros y riesgos, cuando el organismo regulador lo considere conveniente. Estos mecanismos de acción son, en la actualidad, estrógenos, los andrógenos y los inhibidores de la esteroidogénesis.
Tabla 1
Reacción de los parámetros endocrinos a los distintos mecanismos de acción de las sustancias:
↑ = aumento, ↓ = disminución, — = no investigado
|
MDA
|
VTG ♂
|
VTG ♀
|
Proporción de sexos
|
Referencias
|
|
Agonista de estrógenos débil
|
↑
|
↑
|
↑♀ o ↑Indif.
|
(27) (40)
|
|
Agonista de estrógenos fuerte
|
↑
|
↑
|
↑♀ o ↑Indif., sin ♂
|
(28) (40)
|
|
Antagonista de estrógenos
|
—
|
—
|
↓♀, ↑Indif.
|
(29)
|
|
Agonista de andrógenos
|
↓ o —
|
↓ o —
|
↑ ♂, sin ♀
|
(28) (30)
|
|
Antagonista de andrógenos
|
—
|
—
|
↑♀
↑Hermafrodita
|
(31)
|
|
Inhibidor de la aromatasa
|
↓
|
↓
|
↓♀
|
(33)
|
|
|
9.
|
El FSDT no abarca la fase de vida reproductiva de los peces y, por lo tanto, las sustancias de las que se crea que afectan a la reproducción con unas concentraciones menores que al desarrollo sexual deben evaluarse en un ensayo que abarque la reproducción.
|
|
10.
|
Las definiciones utilizadas en el presente método se recogen en el apéndice 1.
|
|
11.
|
El FSDT in vivo se ha concebido para detectar las sustancias con propiedades androgénicas y estrogénicas, así como con propiedades antiandrogénicas, antiestrogénicas y de inhibición de la esteroidogénesis. Las fases de validación del FSDT (1 y 2) abarcaban las sustancias estrogénicas, androgénicas e inhibidoras de la esteroidogénesis. Los efectos de los antagonistas de estrógenos y andrógenos en el FSDT se pueden consultar en la tabla 1, pero estos MDA están menos documentados en la actualidad.
|
PRINCIPIO DEL ENSAYO
|
12.
|
En el ensayo se exponen los peces, desde el huevo recién fertilizado hasta que finaliza la diferenciación sexual, a al menos tres concentraciones de la sustancia problema disuelta en agua. Las condiciones del ensayo deben ser dinámicas, a menos que no sea posible debido a la disponibilidad o al carácter de la sustancia problema (por ejemplo, una solubilidad limitada). El ensayo comienza con la colocación de huevos recién fertilizados (antes de la segmentación del blastodisco) en las cámaras del ensayo. La carga de las cámaras se describe, para cada especie, en el punto 27. En lo que respecta a las especies de peces validadas, el medaka, el espinoso y el pez cebra, el ensayo termina el día 60 después de la eclosión. Cuando finaliza el ensayo, todos los peces son sacrificados sin crueldad. Se recoge una muestra biológica (plasma sanguíneo, hígado u homogeneizado de cabeza/cola) para realizar el análisis de VTG de cada pez y la parte restante se fija para llevar a cabo la evaluación histológica de las gónadas, a fin de determinar el sexo fenotípico; opcionalmente, se puede llevar a cabo la evaluación histopatológica (por ejemplo, fases de las gónadas, grado de hermafroditismo). En las especies que presentan los marcadores adecuados (apéndices 9 y 10), se recoge una muestra biológica (la aleta anal o dorsal) a fin de determinar el sexo genético.
|
|
13.
|
En el apéndice 2 se puede consultar un resumen de las condiciones relevantes del ensayo específicas para las especies validadas: medaka, espinoso y pez cebra.
|
INFORMACIÓN SOBRE LA SUSTANCIA PROBLEMA
|
14.
|
Deben estar disponibles los resultados de un ensayo de toxicidad aguda u otro ensayo de toxicidad a corto plazo [por ejemplo, el método de ensayo C.14 (34) y las TG 210 de la OCDE (1)], realizados preferiblemente con las especies seleccionadas para este ensayo. Esto implica que la hidrosolubilidad y la presión de vapor de la sustancia problema sean conocidas y que haya disponible un método analítico fiable, cuyo límite de detección y precisión sean conocidos y figuren en el informe, para calcular la cantidad de sustancia en las cámaras del ensayo.
|
|
15.
|
Otra información útil incluye la fórmula estructural de la sustancia, su pureza, su estabilidad en el agua y a la luz, pKa, Pow y los resultados de un ensayo de biodegradabilidad fácil (método de ensayo C.4) (35).
|
Criterios de aceptación del ensayo
|
16.
|
Para que los resultados del ensayo sean aceptables, deben cumplirse las condiciones siguientes:
|
—
|
la concentración de oxígeno disuelto debe ser, como mínimo, del 60 % del valor de saturación de aire (ASV) a lo largo del ensayo;
|
|
—
|
en ningún momento del periodo de exposición la temperatura del agua debe variar en más de ± 1,5 °C entre las cámaras de ensayo y siempre debe mantenerse dentro de los intervalos de temperatura especificados para la especie sometida a ensayo (apéndice 2);
|
|
—
|
debe haber disponible un método validado para el análisis de la sustancia problema con un límite de detección muy por debajo de la concentración nominal mínima, y deben recopilarse pruebas para demostrar que las concentraciones de la sustancia problema en la solución se han mantenido de forma satisfactoria dentro de aproximadamente el ±20 % de los valores medios medidos;
|
|
—
|
la tasa global de supervivencia de los huevos fertilizados en los controles y, en su caso, en los controles de disolvente, ha de ser superior o igual a los límites establecidos en el apéndice 2;
|
|
—
|
los criterios de aceptación relativos al crecimiento y a las proporciones de sexos al finalizar el ensayo se basan en los datos procedentes de los grupos de control (control de disolvente y control de agua combinados, a menos que sean muy diferentes; en ese caso, solo el de disolvente):
|
|
Medaka
|
Pez cebra
|
Espinoso
|
|
Crecimiento
|
Peso húmedo del pez, secado con material absorbente
|
> 150 mg
|
> 75 mg
|
> 120 mg
|
|
Longitud (longitud estándar)
|
> 20 mm
|
> 14 mm
|
> 20 mm
|
|
Proporción de sexos (% de machos o hembras)
|
30-70 %
|
30-70 %
|
30-70 %
|
|
|
—
|
Cuando se utiliza un disolvente, no deben apreciarse efectos significativos en la supervivencia ni efectos alteradores del sistema endocrino ni otros efectos adversos en las primeras fases de la vida en el estudio de un control de disolvente.
|
Si se observa una desviación de los criterios de aceptación del ensayo, se deben tener en cuenta las consecuencias en relación con la fiabilidad de los datos del ensayo y dichas consideraciones deben incluirse en el informe.
|
DESCRIPCIÓN DEL MÉTODO DE ENSAYO
Cámaras de ensayo
|
17.
|
Se puede utilizar cualquier tipo de cámara de vidrio, acero inoxidable u otro material químicamente inerte. Las dimensiones de las cámaras deben ser suficientes para que se cumplan los criterios de carga que se indican más adelante. Se recomienda colocar las cámaras de ensayo de forma aleatoria en la zona donde se lleve a cabo el ensayo. Se prefiere un diseño aleatorio de bloques, con todas las concentraciones presentes en cada bloque, a un diseño totalmente aleatorio. Las cámaras de ensayo han de protegerse de toda perturbación no deseada.
|
Selección de las especies
|
18.
|
En el apéndice 2 figura una lista de especies recomendadas. En el apartado 2 se encuentran los procedimientos de inclusión de las nuevas especies.
|
Mantenimiento de los peces parentales
|
19.
|
En las TG 210 de la OCDE (1) se puede consultar la información relativa al mantenimiento de los peces parentales en condiciones satisfactorias. Los peces parentales deben recibir alimentos adecuados una o dos veces al día.
|
Manipulación de los embriones y las larvas
|
20.
|
Inicialmente, los embriones y las larvas pueden quedar expuestos, dentro de una cámara principal, en cámaras más pequeñas de vidrio o acero inoxidable, con laterales o extremos de malla para permitir el flujo de la sustancia problema por toda la cámara. Puede provocarse un flujo no turbulento a través de estas pequeñas cámaras, suspendiéndolas de un brazo que las desplace en sentido vertical, pero de manera que los organismos permanezcan siempre sumergidos.
|
|
21.
|
Si se utilizan cubetas, rejillas o mallas para mantener los huevos en la cámara principal de ensayo, deben retirarse después de la eclosión de las larvas, pero deben conservarse las mallas para impedir que los peces se escapen. Si hubiera que transferir las larvas, no deben quedar expuestas al aire y no deben utilizarse redes para retirar los peces de los contenedores de los huevos. El momento de dicho traslado varía según la especie y no siempre es necesario.
|
Agua
|
22.
|
Es adecuada para el ensayo toda agua en la que la especie de ensayo demuestre una supervivencia de los controles tan buena al menos como en el agua descrita en el apéndice 3. Su calidad ha de ser constante a lo largo de todo el ensayo. Deben tomarse muestras periódicamente para el análisis con el fin de cerciorarse de que el agua de dilución no interfiere en los resultados del ensayo (por ejemplo, por reacción con la sustancia problema) ni afecta negativamente al comportamiento de los peces reproductores. Hay que medir el carbono orgánico total, la conductividad, el pH y los sólidos en suspensión, por ejemplo cada tres meses, cuando se sepa que el agua de dilución tiene una calidad relativamente constante. Si se cuestiona la calidad del agua, deben llevarse a cabo mediciones de metales pesados (por ejemplo, Cu, Pb, Zn, Hg, Cd, Ni), aniones y cationes principales (por ejemplo, Ca2+, Mg2+, Na+, K+, Cl–, SO4
2–) y plaguicidas. En el punto 34 se puede consultar información detallada sobre el análisis de las sustancias y la recogida del agua.
|
Soluciones de ensayo
|
23.
|
Si es posible en la práctica, debe utilizarse un sistema dinámico. Para los ensayos dinámicos se requiere un sistema que aporte y diluya continuamente la solución madre de la sustancia problema (por ejemplo, bomba dosificadora, diluidor proporcional o sistema saturador) para distribuir una serie de concentraciones en las cámaras de ensayo. Los caudales de las soluciones madre y del agua de dilución deben comprobarse con regularidad durante el ensayo y no deberían variar en más del 10 % a lo largo del ensayo. Se considera adecuado un caudal equivalente al menos a cinco veces el volumen de las cámaras de ensayo cada 24 horas (1). Debe tenerse cuidado para evitar el uso de tubos de plástico u otros materiales que pudieran contener sustancias biológicamente activas o que pudieran adsorber la sustancia problema.
|
|
24.
|
La solución madre se prepara preferiblemente sin utilizar disolventes, por simple mezcla o agitación mecánica de la sustancia problema en el agua de dilución (por ejemplo, mediante un agitador o ultrasonidos). Si la sustancia problema resulta difícil de disolver en agua, deben seguirse los procedimientos descritos en el documento de orientación de la OCDE sobre ensayos de toxicidad acuática con sustancias y mezclas problemáticas (36). Debe evitarse el uso de disolventes, pero en algunos casos pueden ser necesarios para obtener una solución madre con la concentración deseada. En (36) se dan ejemplos de disolventes adecuados.
|
|
25.
|
Deben evitarse las condiciones semiestáticas en el ensayo, a menos que se proporcione una justificación por motivos apremiantes relacionados con la sustancia problema (por ejemplo, estabilidad, disponibilidad limitada, coste elevado o peligro). En la técnica semiestática pueden seguirse dos procedimientos de renovación distintos. Se pueden preparar nuevas soluciones de ensayo en cámaras limpias y, con cuidado, transferir los huevos y las larvas supervivientes a las nuevas cámaras, o se pueden retener los organismos del ensayo en las cámaras de ensayo mientras se cambia cada día una parte (dos tercios como mínimo) del agua del ensayo.
|
PROCEDIMIENTO
Condiciones de exposición
Recogida de huevos y duración
|
26.
|
Para evitar sesgos genéticos, se recogen huevos de, como mínimo, tres parejas o grupos reproductores, que se mezclan y se seleccionan aleatoriamente para iniciar el ensayo. En lo que respecta al espinoso, véase la descripción de la fertilización artificial incluida en el apéndice 11. El ensayo debe comenzar lo antes posible una vez fertilizados los huevos; preferiblemente, los embriones se sumergen en las soluciones de ensayo antes de que empiece la segmentación del blastodisco o lo antes posible después de esta fase, y a más tardar a las 12 horas de la fertilización. El ensayo debe continuar hasta finalizar la diferenciación sexual en el grupo de control (60 días después de la eclosión en el caso del medaka, el espinoso y el pez cebra).
|
Carga
|
27.
|
El número de huevos fertilizados al principio del ensayo debe ser, como mínimo, de 120 por concentración, dividido entre un mínimo de 4 réplicas (se acepta la asignación de raíces cuadradas al control). Los huevos deben distribuirse de forma aleatoria (mediante tablas estadísticas para aleatorización) entre los tratamientos. La tasa de carga (véase la definición en el apéndice 1) debe ser lo suficientemente baja como para mantener una concentración de oxígeno disuelto del 60 % del ASV como mínimo, sin una ventilación directa de las cámaras. En los ensayos dinámicos, se recomienda una tasa de carga que no supere los 0,5 g/l en 24 horas ni los 5 g/l de solución en ningún momento. A más tardar 28 días después de la fertilización, debe volver a distribuirse el número de peces por réplica, de forma que cada réplica contenga un número de peces lo más similar posible. Si se produce mortalidad relacionada con la exposición, el número de réplicas debe reducirse de forma adecuada para que la densidad de peces de los distintos niveles de tratamiento se mantenga lo más similar posible.
|
Luz y temperatura
|
28.
|
El fotoperiodo y la temperatura del agua han de ser adecuados para la especie utilizada en el ensayo (en el apéndice 2 se pueden consultar las condiciones experimentales del FSDT).
|
Alimentación
|
29.
|
El alimento y su suministro son vitales y es esencial que se suministre el alimento correcto para cada fase en los intervalos adecuados y en un nivel suficiente para facilitar el crecimiento normal. La alimentación debe ser ad libitum, minimizando el excedente. Para obtener una tasa de crecimiento suficiente, los peces deben ser alimentados al menos dos veces al día (se acepta una vez al día durante los fines de semana), y las tomas deben estar separadas como mínimo por tres horas. El alimento sobrante y las heces deben retirarse, según resulte necesario, para evitar que se acumulen los residuos. Conforme se vaya ganando experiencia, el alimento y los regímenes alimentarios se ajustarán continuamente para mejorar la supervivencia y optimizar el crecimiento. Por lo tanto, se debe hacer lo posible por confirmar el régimen propuesto con expertos reconocidos. La alimentación debe detenerse 24 horas antes del fin del ensayo. En el apéndice 2 se incluye una lista de ejemplos de alimentos apropiados [véase también el Marco de ensayos con peces de la OCDE (39)].
|
Concentraciones de ensayo
|
30.
|
Las concentraciones de la sustancias problema deben separarse tal y como se indica en el apéndice 4. Deben utilizarse, como mínimo, tres concentraciones del ensayo en al menos cuatro réplicas. Para seleccionar el intervalo de concentraciones de ensayo debe tenerse presente la curva que relaciona la LC50 con el periodo de exposición de los estudios de toxicidad aguda disponibles. Se recomienda usar cinco concentraciones de ensayo si los datos van a utilizarse en evaluaciones de riesgos.
|
|
31.
|
No es preciso someter a ensayo concentraciones de la sustancia superiores al 10 % de la LC50 adulta aguda, o 10 mg/l, si esta es más baja. La concentración máxima del ensayo debe ser del 10 % de la LC50 en la fase de vida juvenil o larvaria.
|
Controles
|
32.
|
Debe llevarse a cabo un control de agua de dilución (≥ 4 réplicas) y, si procede, un control de disolvente (≥ 4 réplicas), además de las concentraciones de ensayo. Solo deben utilizarse en el ensayo los disolventes investigados que hayan demostrado no provocar ninguna influencia estadísticamente significativa en los parámetros del ensayo.
|
|
33.
|
Cuando se utilice un disolvente, su concentración final no debe ser superior a 0,1 ml/l (36) y en todas las cámaras del ensayo debe haber la misma concentración, salvo en el control de agua de dilución. No obstante, se debe hacer todo lo posible por evitar el uso de dicho disolvente, o mantener las concentraciones del disolvente al mínimo.
|
Frecuencia de las mediciones y de las determinaciones analíticas
|
34.
|
El análisis químico de la concentración de la sustancia problema debe llevarse a cabo antes de comenzar el ensayo para comprobar su conformidad con los criterios de aceptación. Todas las réplicas deben analizarse individualmente al principio y al final del ensayo. Una réplica por concentración de ensayo se debe analizar al menos una vez a la semana durante el ensayo, cambiando sistemáticamente entre las réplicas (1, 2, 3, 4, 1, 2…). Si las muestras se guardan para analizarlas posteriormente, debe validarse previamente el método de almacenamiento de las muestras. Las muestras deben filtrarse (por ejemplo, con un tamaño de poro de 0,45 μm) o centrifugarse para garantizar que las determinaciones se realicen con la sustancia en una solución verdadera.
|
|
35.
|
Durante el ensayo, deben medirse el oxígeno disuelto, el pH, la dureza total, la conductividad, la salinidad (si procede) y la temperatura en todas las cámaras del ensayo. Como mínimo, el oxígeno disuelto, la salinidad (si procede) y la temperatura deben medirse cada semana, y el pH, la conductividad y la dureza deben medirse al principio y al final del ensayo. La temperatura debe someterse, preferiblemente, a un control continuo al menos en una cámara de ensayo.
|
|
36.
|
Los resultados deben basarse en concentraciones medidas. Sin embargo, si la concentración de la sustancia problema en la solución se ha mantenido debidamente dentro de ± 20 % de la concentración nominal durante todo el ensayo, los resultados pueden basarse en los valores nominales o en los valores medidos.
|
Observaciones y mediciones
Fase de desarrollo embrionario
|
37.
|
La exposición debe comenzar lo antes posible después de la fertilización y antes de la segmentación del blastodisco, a más tardar a las 12 horas de la fertilización, para garantizar la exposición durante el desarrollo temprano de los embriones.
|
Eclosión y supervivencia
|
38.
|
Al menos una vez al día deben observarse y contarse las eclosiones y los supervivientes. Los embriones, las larvas y los peces juveniles muertos deben retirarse en cuanto se observen, ya que pueden descomponerse rápidamente y pueden ser destruidos por las acciones del resto de peces. Dicha retirada ha de hacerse con sumo cuidado para no tocar ni dañar físicamente los huevos y larvas adyacentes, pues son extremadamente delicados y sensibles. Los criterios para considerar que un organismo está muerto varían según la fase del desarrollo:
|
—
|
Huevos: sobre todo en las fases más tempranas, disminución acusada de translucidez y cambio de la coloración debido a la coagulación y/o precipitación de proteínas, que les da un aspecto blanco opaco.
|
|
—
|
Larvas y peces juveniles: inmovilidad o ausencia de movimiento respiratorio o ausencia de latido cardiaco o coloración blanca opaca del sistema nervioso central o ausencia de reacción a los estímulos mecánicos.
|
|
Aspecto anómalo
|
39.
|
El número de larvas o peces que presenten anomalías en la forma del cuerpo debe quedar registrado y deben describirse el aspecto y la naturaleza de la anomalía. Cabe señalar que la presencia de larvas y embriones anómalos se da en condiciones normales y que su proporción puede alcanzar varias unidades porcentuales en los controles de algunas especies. Los animales que presenten anomalías solo deben retirarse de las cámaras de ensayo cuando estén muertos. No obstante, de conformidad con la Directiva 2010/63/UE del Parlamento Europeo y del Consejo, de 22 de septiembre de 2010, relativa a la protección de los animales utilizados para fines científicos, si las anomalías provocan dolor, sufrimiento y angustia o daño duradero, y se puede prever de manera fiable la muerte, los animales deben ser anestesiados y sacrificados de acuerdo con la descripción del punto 44 y tratados como parte de la mortalidad en lo que respecta al análisis de datos.
|
Comportamiento anómalo
|
40.
|
Las anomalías como, por ejemplo, la hiperventilación, la natación descoordinada, la inactividad atípica y el comportamiento atípico en la alimentación, deben registrarse en el momento de su aparición.
|
Peso
|
41.
|
Al final del ensayo deben sacrificarse todos los peces supervivientes (se anestesiarán si hubiera que recoger muestras de sangre) y debe medirse el peso húmedo individual (secado con material absorbente).
|
Longitud
|
42.
|
Al final del ensayo deben medirse las longitudes individuales (longitud estándar).
|
|
43.
|
Estas observaciones se traducirán en la disponibilidad de algunos o de la totalidad de los datos siguientes para elaborar los informes:
|
—
|
mortalidad acumulativa;
|
|
—
|
número de peces sanos al final del ensayo;
|
|
—
|
tiempo de inicio y fin de la eclosión;
|
|
—
|
longitud y peso de los animales supervivientes;
|
|
—
|
número de peces deformes;
|
|
—
|
número de larvas que presenten un comportamiento anómalo.
|
|
Muestreo de peces
|
44.
|
El muestreo de peces se lleva a cabo al finalizar el ensayo. Los peces de la muestra deben ser sacrificados con, por ejemplo, MS-222 (100-500 mg por litro, tamponado con 200 mg de NaHCO3 por litro) o FA-100 (4-alil-2-metoxifenol: eugenol), y deben medirse y pesarse individualmente con su peso húmedo (secados con material absorbente), o deben anestesiarse si hay que recoger una muestra de sangre (véase el punto 49).
|
Muestreo para el análisis de VTG y la determinación del sexo mediante evaluación histológica
|
45.
|
Se debe hacer un muestreo de todos los peces y prepararlos para analizar el sexo y la VTG. Todos los peces deben analizarse histológicamente para determinar el sexo. En lo que respecta a las mediciones de VTG, se acepta un submuestreo de, como mínimo, dieciséis peces de cada réplica. Si los resultados del submuestreo no resultan claros, debe analizarse la VTG de más peces.
|
|
46.
|
El procedimiento de muestreo para el análisis de VTG y la determinación del sexo depende del método de análisis de la VTG:
|
Método del homogeneizado de cabeza/cola para el análisis de la VTG
|
47.
|
Los peces son sacrificados. Se separan la cabeza y la cola del cuerpo de cada pez, haciendo cortes con un bisturí justo detrás de las aletas pectorales y justo detrás de la aleta dorsal (véase la figura 1). Las partes de la cabeza y de la cola de cada pez se agrupan, se pesan y se numeran individualmente, se congelan en nitrógeno líquido y se conservan a – 70 °C o menos para realizar el análisis de la VTG. La parte del cuerpo del pez se numera y se fija con un fijador adecuado para realizar la evaluación histológica (22). Con este método se evalúan la VTG y la histopatología de cada individuo y, de esta forma, se puede relacionar un posible cambio en el nivel de VTG con el sexo fenotípico del pez o con su sexo genético (medaka y espinoso). Para obtener más información, consulte las orientaciones sobre homogeneización (apéndice 5) y las orientaciones sobre cuantificación de la VTG (apéndice 6).
|
Método del homogeneizado de hígado para el análisis de la VTG
|
48.
|
Los peces son sacrificados. El hígado se extrae mediante disección y se conserva a una temperatura igual o inferior a – 70 °C. Los procedimientos recomendados para la extirpación y el tratamiento previo del hígado están disponibles en las TG 229 de la OCDE (37) o en el capítulo C.37 de este anexo (38). A continuación, los hígados se homogeneizan individualmente tal y como se describe en las TG 229 de la OCDE o en el capítulo C.37 de este anexo. El sobrenadante recogido se utiliza para medir la VTG con una técnica ELISA homóloga [en el apéndice 6 se puede consultar un ejemplo de cuantificación en el pez cebra, o en las TG 229 de la OCDE (37) con respecto al medaka]. De acuerdo con este planteamiento, también se pueden tener datos de peces individuales tanto sobre la VTG como sobre la histología de las gónadas.
|
Método del plasma sanguíneo para el análisis de la VTG
|
49.
|
Se recoge sangre de los peces anestesiados mediante punción cardiaca, a través de la vena caudal o con un corte de la cola, y se centrifuga a 4 °C para recoger el plasma. El plasma se conserva a una temperatura igual o inferior a – 70 °C hasta que se utilice. Se sacrifica el pez completo y se fija para evaluar la histología. Tanto las muestras de plasma como los peces se numeran individualmente para relacionar los niveles de VTG con el sexo de los peces.
Figura 1
Corte de un pez para medir la VTG en un homogeneizado de cabeza/cola y realizar la evaluación histológica de la parte central

|
Determinación del sexo genético
|
50.
|
Se recoge una muestra biológica para determinar el sexo genético de peces individuales en las especies que presentan los marcadores adecuados. En lo que respecta al medaka, se recoge la aleta anal o la aleta dorsal. En el apéndice 9 se ofrece una descripción detallada, incluyendo el muestreo de tejido y la determinación del sexo mediante un método de PCR. Igualmente, en lo que respecta al espinoso, en el apéndice 10 se incluye una descripción del muestreo de tejido y un método de PCR para determinar el sexo.
|
Medición de la VTG
|
51.
|
La medición de la VTG debe basarse en un método cuantitativo y validado analíticamente. Debe disponerse de información sobre la variabilidad intraensayo e interensayo del método utilizado en un laboratorio determinado. El origen de la variabilidad interlaboratorio e intralaboratorio se basa (probablemente) en las distintas fases de desarrollo de la población de peces. Teniendo en cuenta la variabilidad de la medición de la VTG, las NOEC que se basen únicamente en este parámetro deben tratarse con mucha atención. Hay varios métodos disponibles para evaluar la producción de VTG en las especies de peces consideradas en este ensayo. Una técnica de medición que resulta tanto relativamente sensible como específica consiste en la determinación de las concentraciones de proteínas mediante un enzimoinmunoanálisis de adsorción (ELISA). Deben utilizarse anticuerpos homólogos (que se generan contra la VTG de la misma especie) y los patrones homólogos más importantes.
|
Determinación del sexo
|
52.
|
En función del procedimiento de muestreo de la VTG, el pez entero o la parte central restante de cada pez se coloca en un casete de procesamiento previamente etiquetado y se fija con un fijador adecuado para la determinación histológica del sexo (también, opcionalmente, para la determinación de las fases de las gónadas). En el apéndice 7 y en el documento de orientación de la OCDE sobre el diagnóstico de la histopatología relacionada con el sistema endocrino de las gónadas de los peces (22) se proporciona orientación sobre la fijación y la inclusión. Tras el procesamiento, los peces se incluyen en bloques de parafina. Los individuos deben colocarse longitudinalmente en el bloque de parafina. De cada individuo se toman, como mínimo, seis secciones longitudinales (de 3-5 μm de grosor), en un plano frontal, incluyendo tejido de ambas gónadas. El intervalo entre estas secciones debe ser, aproximadamente, de 50 μm en los machos, y de 250 μm en las hembras. No obstante, como cada bloque contendrá, a menudo, tanto machos como hembras (si se incorpora más de un individuo a cada bloque), el intervalo entre las secciones de estos bloques debe ser aproximadamente de 50 μm, hasta que se obtengan al menos seis secciones de las gónadas de cada macho. Posteriormente, el intervalo entre las secciones puede aumentarse hasta unos 250 μm en las hembras. Las secciones se tiñen con hematoxilina y eosina, y se examinan con un microscopio óptico centrándose en el sexo (macho, hembra, hermafrodita o indiferenciado). El hermafroditismo se define como la presencia de más de un ovocito en los testículos por cada grupo de seis secciones analizadas, o de células espermatogénicas (sí/no) en los ovarios. La histopatología y la determinación de las fases de los ovarios y los testículos son opcionales pero, si se investigan, los resultados deben analizarse estadísticamente y registrarse. Cabe señalar que algunas especies de peces, de forma natural, no cuentan con un par de gónadas desarrolladas completamente y es posible que solo haya una gónada presente (por ejemplo, el medaka y, ocasionalmente, el pez cebra). Todas las observaciones deben quedar registradas.
|
|
53.
|
La determinación del sexo genético en cada medaka se basa en la presencia o ausencia del gen de determinación del sexo masculino del medaka, DMY, que se encuentra en el cromosoma Y. El sexo genotípico del medaka se puede identificar secuenciando el gen DMY del ADN extraído de, por ejemplo, un trozo de aleta anal o aleta dorsal. La presencia de DMY indica un individuo XY (macho), sea cual sea el fenotipo, mientras que la ausencia de DMY indica un individuo XX (hembra), sea cual sea el fenotipo (23). En el apéndice 9 se incluyen orientaciones sobre la preparación del tejido y el método de PCR. La determinación del sexo genético en el espinoso se realiza también mediante un método de PCR, que se describe en el apéndice 10.
|
|
54.
|
Debe indicarse la aparición de hermafroditismo (su definición se puede consultar en el apéndice 1).
|
Características sexuales secundarias
|
55.
|
Las características sexuales secundarias están controladas por el sistema endocrino en especies como el medaka; por lo tanto, deben realizarse, si es posible, observaciones del aspecto físico de los peces al final de la exposición. En el medaka, la formación papilar en la parte posterior de la aleta anal de las hembras es sensible a los andrógenos. En el capítulo C.37 de este anexo (38) se incluyen fotografías relevantes de los caracteres sexuales secundarios de los machos y de hembras androgenizadas.
|
DATOS E INFORME
Tratamiento de los resultados
|
56.
|
Es importante que la prueba estadística válida más fuerte determine el parámetro. La réplica es la unidad experimental, pero la variabilidad dentro de las réplicas debe incluirse en las pruebas estadísticas. En el apéndice 8 se ha incluido un diagrama de flujo de decisiones como ayuda para determinar la prueba estadística más adecuada que debe utilizarse con arreglo a las características de los datos obtenidos del ensayo. El nivel de significación estadística es de 0,05 para todos los parámetros incluidos.
|
Proporciones de sexos y sexo genético
|
57.
|
Las proporciones de sexos deben analizarse para determinar el efecto significativo (planteamiento de NOEC/LOEC) de la exposición mediante Jonckheere-Terpstra (prueba de tendencia) si existe una relación dosis-respuesta monótona. Si no se encuentra monotonicidad, debe aplicarse una prueba entre pares: se debe utilizar la prueba de Dunnett si se pueden obtener la normalidad y la varianza homogénea. Se debe utilizar Tamhane-Dunnett si hay varianza heterogénea. De lo contrario, se debe utilizar la prueba exacta de Mann-Whitney con el ajuste de Bonferroni-Holm. En el apéndice 8 hay un diagrama de flujo que describe las pruebas estadísticas de las proporciones de sexos. Las proporciones de sexos deben presentarse en tablas, en forma de proporciones de concentraciones ± DT de machos, hembras, hermafroditas e indiferenciados. Se debe destacar la significación estadística. En el informe de validación de la fase 2 del FSDT (42) figuran algunos ejemplos. El sexo genético debe indicarse en forma de porcentaje de inversión del sexo fenotípico en machos, hembras, hermafroditas e indiferenciados.
|
Concentraciones de VTG
|
58.
|
Las concentraciones de VTG deben analizarse para establecer el efecto significativo (planteamiento de NOEC/LOEC) de la exposición. La prueba de Dunnett es preferible a la prueba t con corrección de Bonferroni. Cuando se utilice una corrección de Bonferroni, se prefiere la corrección de Bonferroni-Holm. Debe tenerse en cuenta la posibilidad de transformación logarítmica de la VTG para lograr la homogeneidad de la varianza y la normalidad. A continuación, si la relación concentración-respuesta es coherente con la monotonicidad, la prueba de Jonckheere-Terpstra será preferible a cualquiera de las pruebas mencionadas anteriormente. Si se utilizan pruebas t o la prueba de Dunnett, no es necesario realizar una prueba F de significación de ANOVA para continuar. Se puede obtener más información en el diagrama de flujo del apéndice 8. Los resultados deben indicarse en tablas, en forma de medias de concentración ± DT para machos, hembras, hermafroditas e indiferenciados, por separado. Debe resaltarse la significación estadística de las hembras fenotípicas y los machos fenotípicos. En el informe de validación de la fase 2 del FSDT (42) figuran algunos ejemplos.
|
Concentraciones reales de la sustancia problema
|
59.
|
Las concentraciones reales en las cámaras de la sustancia problema deben analizarse a las frecuencias descritas en el punto 34. Los resultados deben indicarse en tablas en forma de concentración media ± DT sobre la base de las réplicas, así como sobre la de las concentraciones, con información sobre el número de muestras y resaltando los valores atípicos respecto a concentración media del tratamiento ± 20 %. En el informe de validación de la fase 2 del FSDT (42) se pueden consultar ejemplos.
|
Interpretación de los resultados
|
60.
|
Los resultados del ensayo deben interpretarse con prudencia cuando las concentraciones medidas de la sustancia problema en las soluciones del ensayo se aproximen a los límites de detección del método de análisis.
|
Informe del ensayo
|
61.
|
El informe del ensayo debe incluir la información siguiente:
|
|
Sustancia problema
|
—
|
Propiedades físicas y químicas relevantes; identificación química, datos que incluyan la pureza y el método de análisis para la cuantificación de la sustancia problema.
|
|
|
|
Condiciones de ensayo
|
—
|
Procedimiento de ensayo utilizado (por ejemplo, renovación dinámica o semiestática); diseño del ensayo, incluyendo las concentraciones de ensayo, método de preparación de las soluciones madre (en un anexo), frecuencia de renovación (cuando se usen, deben indicarse el agente solubilizante y su concentración).
|
|
—
|
Concentraciones de ensayo nominales, medias de los valores medidos y sus desviaciones típicas en las cámaras de ensayo, así como el método mediante el cual se hayan logrado (el método de análisis utilizado debe presentarse en un anexo); prueba de que las mediciones corresponden a las concentraciones de la sustancia problema en solución verdadera.
|
|
—
|
Calidad del agua en las cámaras de ensayo: pH, dureza, temperatura y concentración de oxígeno disuelto.
|
|
—
|
Información detallada sobre la alimentación (por ejemplo, tipo de alimentos, origen, cantidad suministrada y frecuencia) y análisis de los contaminantes, si fueran relevantes (por ejemplo, PCB, HAP y plaguicidas organoclorados).
|
|
|
|
Resultados
|
—
|
Prueba de que los controles satisfacen los criterios de validez: los datos sobre la tasa de eclosión deben presentarse en tablas, en forma de porcentaje por réplica y por concentración. Deben destacarse los valores atípicos respecto a los criterios de aceptación (en los controles). La supervivencia debe presentarse en forma de porcentaje por réplica y por concentración. Deben destacarse los valores atípicos de los criterios de validez (en los controles).
|
|
—
|
Deben indicarse claramente los resultados obtenidos con los distintos parámetros observados: supervivencia de los embriones y éxito de la eclosión; anomalías externas; longitud y peso; mediciones de la VTG (ng/g de homogeneizado, ng/ml de plasma o ng/mg de hígado); histología de las gónadas, proporción de sexos, datos sobre el sexo genético; incidencia de cualquier reacción inusual de los peces y cualquier efecto visible producido por la sustancia problema.
|
|
|
|
62.
|
Los resultados deben presentarse en forma de valores medios ± desviación típica (DT) o error típico (EE). La estadística debe indicarse, como mínimo, en forma de NOEC y LOEC e intervalos de confianza. Debe respetarse el diagrama de flujo estadístico (apéndice 8).
|
BIBLIOGRAFÍA
|
(1)
|
OCDE (1992), Fish, Early Life Stage Toxicity Test, Test Guideline No 210, Guidelines for the Testing of Chemicals, OCDE, París.
|
|
(2)
|
Jobling, S., D. Sheahan, J.A. Osborne, P. Matthiessen and J.P. Sumpter, 1996, “Inhibition of testicular growth in rainbow trout (Oncorhynchus mykiss) exposed to estrogenic alkylphenolic chemicals”, Environmental Toxicology and Chemistry 15, pp. 194-202.
|
|
(3)
|
Sumpter, J.P. and S. Jobling, 1995, “Vitellogenesis As A Biomarker for Estrogenic Contamination of the Aquatic Environment”, Environmental Health Perspectives 103, pp. 173-178.
|
|
(4)
|
Tyler, C.R., R.van Aerle, T.H. Hutchinson, S. Maddix and H. Trip (1999), “An in vivo testing system for endocrine disruptors in fish early life stages using induction of vitellogenin”, Environmental Toxicology and Chemistry 18, pp. 337-347.
|
|
(5)
|
Holbech, H., L. Andersen, G.I. Petersen, B. Korsgaard, K.L. Pedersen and P. Bjerregaard (2001a), “Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio)”, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 130, pp. 119-131.
|
|
(6)
|
Andersen, L., P. Bjerregaard and B. Korsgaard ( 2003), “Vitellogenin induction and brain aromatase activity in adult male and female zebrafish exposed to endocrine disrupters”, Fish Physiology and Biochemistry 28, pp. 319-321.
|
|
(7)
|
Orn, S., H. Holbech, T.H. Madsen, L. Norrgren and G.I. Petersen (2003), “Gonad development and vitellogenin production in zebrafish (Danio rerio) exposed to ethinylestradiol and methyltestosterone”, Aquatic Toxicology 65, pp. 397-411.
|
|
(8)
|
Panter, G.H., T.H. Hutchinson, R. Lange, C.M. Lye, J.P. Sumpter, M. Zerulla and C.R. Tyler (2002), “Utility of a juvenile fathead minnow screening assay for detecting (anti-)estrogenic substances”, Environmental Toxicology and Chemistry 21, pp. 319-326.
|
|
(9)
|
Sun, L.W., J.M. Zha, P.A. Spear and Z.J. Wang (2007), “Toxicity of the aromatase inhibitor letrozole to Japanese medaka (Oryzias latipes) eggs, larvae and breeding adults”, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 145, pp. 533-541.
|
|
(10)
|
Parks, L.G., A.O. Cheek, N.D. Denslow, S.A. Heppell, J.A. McLachlan, G.A. LeBlanc and C.V.Sullivan (1999), “Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds”, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 123, pp. 113-125.
|
|
(11)
|
Brion, F., B.M. Nilsen, J.K. Eidem, A. Goksoyr and J.M. Porcher (2002), “Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio)”, Environmental Toxicology and Chemistry 21, pp. 1699-1708.
|
|
(12)
|
Nishi, K., M. Chikae, Y. Hatano, H. Mizukami, M. Yamashita, R. Sakakibara and E. Tamiya (2002), “Development and application of a monoclonal antibody-based sandwich ELISA for quantification of Japanese medaka (Oryzias latipes) vitellogenin”, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 132, pp. 161-169.
|
|
(13)
|
Hahlbeck, E., I. Katsiadaki, I. Mayer, M. Adolfsson-Erici, J. James and B.E. Bengtsson (2004), “The juvenile three-spined stickleback (Gasterosteus aculeatus L.) as a model organism for endocrine disruption — II — kidney hypertrophy, vitellogenin and spiggin induction”, Aquatic Toxicology 70, pp. 311-326.
|
|
(14)
|
Tatarazako, N., M. Koshio, H. Hori, M. Morita, and T. Iguchi (2004), “Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the medaka”, Journal of Health Science 50, pp. 301-308.
|
|
(15)
|
Eidem, J.K., H. Kleivdal, K. Kroll, N. Denslow, R. van Aerle, C. Tyler, G. Panter, T. Hutchinson and A. Goksoyr (2006), “Development and validation of a direct homologous quantitative sandwich ELISA for fathead minnow (Pimephales promelas) vitellogenin. Aquatic Toxicology”, 78, pp. 202-206.
|
|
(16)
|
Jensen, K.M. and G.T. Ankley (2006), “Evaluation of a commercial kit for measuring vitellogenin in the fathead minnow (Pimephales promelas)”, Ecotoxicology and Environmental Safety 64, pp. 101-105.
|
|
(17)
|
Holbech, H., Petersen, G. I., Norman, A., Örn, S, Norrgren, L. and Bjerregaard, P (2001b), “Suitability of zebrafish as test organism for detection of endocrine disrupting chemicals. Comparison of vitellogenin in plasma and whole body homogenate from zebrafish (Danio rerio) and rainbow trout (Oncorhynchus mykiss)”, Consejo de Ministros Nórdico, TemaNord 2001:597, pp. 48-51.
|
|
(18)
|
Nilsen, B.M., K. Berg, J.K. Eidem, S.I. Kristiansen, F. Brion, J.M. Porcher and A. Goksoyr (2004), “Development of quantitative vitellogenin-ELISAs for fish test species used in endocrine disruptor screening”, Analytical and Bioanalytical Chemistry 378, pp. 621-633.
|
|
(19)
|
Orn, S., S. Yamani, and L. Norrgren (2006), “Comparison of vitellogenin induction, sex ratio, and gonad morphology between zebrafish and Japanese medaka after exposure to 17 alpha-ethinylestradiol and 17 beta-trenbolone”, Archives of Environmental Contamination and Toxicology 51, pp. 237-243.
|
|
(20)
|
Scholz, S. and N. Kluver (2009), “Effects of Endocrine Disrupters on Sexual, Gonadal Development in Fish, Sexual Development” 3, pp. 136-151.
|
|
(21)
|
Fenske, M., G. Maack, C. Schafers and H. Segner (2005), “An environmentally relevant concentration of estrogen induces arrest of male gonad development in zebrafish, Danio rerio”, Environmental Toxicology and Chemistry 24, pp. 1088-1098.
|
|
(22)
|
OCDE (2010), Guidance Document on the Diagnosis of Endocrine-related Histopathology in Fish Gonads, Series on Testing and Assessment No 123, ENV/JM/MONO(2010)14, OCDE, París.
|
|
(23)
|
Kobayashi, T., M. Matsuda, H. Kajiura-Kobayashi, A. Suzuki, N. Saito, M. Nakamoto, N. Shibata, and Y. Nagahama (2004), “Two DM domain genes, DMY and DMRT1, involved in testicular differentiation and development in the medaka, Oryzias latipes”, Developmental Dynamics 231, pp. 518-526.
|
|
(24)
|
Shinomiya, A., H. Otake, K. Togashi, S. Hamaguchi, and M. Sakaizumi (2004), “Field survey of sex-reversals in the medaka, Oryzias latipes: genotypic sexing of wild populations”, Zoological Science 21, pp. 613-619.
|
|
(25)
|
Kidd, K.A., P.J. Blanchfield, K.H. Mills, V.P. Palace, R.E. Evans, J.M. Lazorchak and R.W. Flick (2007), “Collapse of a fish population after exposure to a synthetic estrogen”, Proceedings of the National Academy of Sciences of the United States of America 104, pp. 8897-8901.
|
|
(26)
|
Palace,V.P., R.E. Evans, K.G. Wautier, K.H. Mills, P.J. Blanchfield, B.J. Park, C.L. Baron and K.A. Kidd (2009), “Interspecies differences in biochemical, histopathological, and population responses in four wild fish species exposed to ethynylestradiol added to a whole lake”, Canadian Journal of Fisheries and Aquatic Sciences 66, pp. 1920-1935.
|
|
(27)
|
Panter, G.H., T.H. Hutchinson, K.S. Hurd, J. Bamforth, R.D. Stanley, S. Duffell, A. Hargreaves, S. Gimeno, and C.R. Tyler (2006), “Development of chronic tests for endocrine active chemicals — Part 1. An extended fish early-life stage test for oestrogenic active chemicals in the fathead minnow (Pimephales promelas)”, Aquatic Toxicology 77, pp. 279-290.
|
|
(28)
|
Holbech, H., K. Kinnberg, G.I. Petersen, P. Jackson, K. Hylland, L. Norrgren and P. Bjerregaard (2006), “Detection of endocrine disrupters: Evaluation of a Fish Sexual Development Test (FSDT)”, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 144, pp. 57-66.
|
|
(29)
|
Andersen, L., K. Kinnberg, H. Holbech, B. Korsgaard and P. Bjerregaard (2004), “Evaluation of a 40 day assay for testing endocrine disrupters: Effects of an anti-estrogen and an aromatase inhibitor on sex ratio and vitellogenin concentrations in juvenile zebrafish (Danio rerio)”, Fish Physiology and Biochemistry 30, pp. 257-266.
|
|
(30)
|
Morthorst, J.E., H. Holbech and P. Bjerregaard (2010), “Trenbolone causes irreversible masculinization of zebrafish at environmentally relevant concentrations”, Aquatic Toxicology 98, pp. 336-343.
|
|
(31)
|
Kiparissis,Y., T.L. Metcalfe, G.C. Balch and C.D. Metcalf (2003), “Effects of the antiandrogens, vinclozolin and cyproterone acetate on gonadal development in the Japanese medaka (Oryzias latipes)”, Aquatic Toxicology 63, pp. 391-403.
|
|
(32)
|
Panter, G.H., T.H. Hutchinson, K.S. Hurd, A. Sherren, R.D. Stanley and C.R. Tyler (2004), “Successful detection of (anti-) androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development”, Aquatic Toxicology 70, pp. 11-21.
|
|
(33)
|
Kinnberg, K., H. Holbech, G.I. Petersen and P. Bjerregaard (2007), “Effects of the fungicide prochloraz on the sexual development of zebrafish (Danio rerio)”, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 145, pp. 165-170.
|
|
(34)
|
Capítulo C.14 del presente anexo. Ensayo de crecimiento en peces juveniles.
|
|
(35)
|
Capítulo C.4 del presente anexo. Biodegradabilidad fácil.
|
|
(36)
|
OCDE (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Series on Testing and Assessment No 23, OCDE, París.
|
|
(37)
|
OCDE (2009), Fish Short Term Reproduction Assay, Test Guideline No 229, Guidelines for the Testing of Chemicals, OCDE, París
|
|
(38)
|
Capítulo C.37 del presente anexo. Ensayo de veintiún días en peces cribado a corto plazo de la actividad estrogénica y androgénica y de la inhibición de la aromatasa.
|
|
(39)
|
OCDE (2012), Fish Toxicity Testing Framework, Series on Testing and Assessment No 171, OCDE, París
|
|
(40)
|
Schäfers, C., Teigeler, M., Wenzel, A., Maack, G., Fenske, M., Segner, H (2007), “Concentration- and time-dependent effects of the synthetic estrogen, 17 alpha-ethinylestradiol, on reproductive capabilities of the zebrafish, Danio rerio”, Journal of Toxicology and Environmental Health-Part A, 70, 9-10 pp. 768-779.
|
|
(41)
|
OCDE (2011), Validation Report (Phase 1) for the Fish Sexual Development Test, Series on Testing and Assessment No 141, ENV/JM/MONO(2011)22, OCDE, París.
|
|
(42)
|
OCDE (2011), Validation Report ( Phase 2) for the Fish Sexual Development Test, Series on Testing and Assessment No 142, ENV/JM/MONO(2011)23, OCDE, París.
|
|
(43)
|
OCDE (2011), Peer Review Report of the validation of the Fish Sexual Development Test, Series on Testing and Assessment No 143, ENV/JM/MONO(2011)24, OCDE, París.
|
|
(44)
|
Directiva 2010/63/UE del Parlamento Europeo y del Consejo, de 22 de septiembre de 2010, relativa a la protección de los animales utilizados para fines científicos, DO L 276 de 20.10.2010, p. 33.
|
Apéndice 1
Abreviaturas y definiciones
Parámetro principal
: provoca un efecto a nivel de población.
ASV
: valor de saturación de aire.
Biomarcador
: provoca un efecto a nivel de individuo.
Sustancia
: sustancia o mezcla.
Dph
: días después de la eclosión.
DMY
: gen del dominio DM específico de Y necesario para el desarrollo de los machos en el medaka.
ELISA
: enzimoinmunoanálisis de adsorción.
Peso del pez
: peso húmedo del pez (secado con material absorbente).
FSDT
: ensayo sobre desarrollo sexual en peces.
Eje HPG
: eje hipotálamo-hipófisis-gónadas.
Pez hermafrodita
: pez con más de un ovocito en los testículos, en las seis secciones analizadas, o con células espermatogénicas en los ovarios (sí/no).
Tasa de carga
: peso húmedo de los peces por volumen de agua.
MDA
: mecanismo de acción.
RT-PCR
: reacción en cadena de la polimerasa con retrotranscriptasa.
Sustancia problema
: sustancia o mezcla estudiada con este método de ensayo.
Pez indiferenciado
: pez con gónadas que no presentan células germinales discernibles.
VTG
: vitelogenina.
Apéndice 2
Condiciones experimentales para el FSDT (especies de agua dulce)
|
|
Medaka (Oryzias latipes)
|
Pez cebra (Danio rerio)
|
Espinoso (Gasterostreus aculeatus)
|
|
|
Dinámico o semiestático
|
Dinámico o semiestático
|
Dinámico o semiestático
|
|
|
25 ± 2 °C
|
27 ± 2 °C
|
20 ± 2 °C
|
|
4.
|
Calidad de la iluminación
|
|
Bombillas fluorescentes (amplio espectro)
|
Bombillas fluorescentes (amplio espectro)
|
Bombillas fluorescentes (amplio espectro)
|
|
|
10-20 μE/m2/s, 540-1 080 lux o 50-100 ft-c (niveles ambiente de laboratorio)
|
10-20 μE/m2/s, 540-1 080 lux o 50-100 ft-c (niveles ambiente de laboratorio)
|
10-20 μE/m2/s, 540-1 080 lux o 50-100 ft-c (niveles ambiente de laboratorio)
|
|
|
12-16 h de luz, 8-12 h de oscuridad
|
12-16 h de luz, 8-12 h de oscuridad
|
16 h de luz, 8 h de oscuridad
|
|
7.
|
Tamaño mínimo de cámara
|
|
Las cámaras individuales deben contener, como mínimo, 7 l de volumen de agua.
|
Las cámaras individuales deben contener, como mínimo, 7 l de volumen de agua.
|
Las cámaras individuales deben contener, como mínimo, 7 l de volumen de agua.
|
|
8.
|
Sustituciones de volumen de las soluciones de ensayo
|
|
5 diarias como mínimo
|
5 diarias como mínimo
|
5 diarias como mínimo
|
|
9.
|
Edad de los organismos del ensayo al iniciar la exposición
|
|
Huevos recién fertilizados (fase de blástula temprana)
|
Huevos recién fertilizados (fase de blástula temprana)
|
Huevos recién fertilizados
|
|
10.
|
No de huevos por tratamiento
|
|
Mínimo 120
|
Mínimo 120
|
Mínimo 120
|
|
11.
|
Número de tratamientos
|
|
3 como mínimo (más los controles correspondientes)
|
3 como mínimo (más los controles correspondientes)
|
3 como mínimo (más los controles correspondientes)
|
|
12.
|
No de réplicas por tratamiento
|
|
4 como mínimo (a menos que haya asignación de raíz cuadrada a los controles)
|
4 como mínimo (a menos que haya asignación de raíz cuadrada a los controles)
|
4 como mínimo (a menos que haya asignación de raíz cuadrada a los controles)
|
|
13.
|
Régimen de alimentación
|
|
Ejemplares vivos de Artemia, gambas artemia adultas congeladas, alimento en copos, etc. Se recomienda alimentar dos veces al día.
|
Alimentos fritos especiales, vivos de Artemia, gambas artemia adultas congeladas, alimento en copos, etc. Se recomienda alimentar dos veces al día.
|
Ejemplares vivos de Artemia, gambas artemia adultas congeladas, alimento en copos, etc. Se recomienda alimentar dos veces al día.
|
|
|
Ninguna, a menos que la concentración de OD sea inferior a una saturación del 60 %.
|
Ninguna, a menos que la concentración de OD sea inferior a una saturación del 60 %.
|
Ninguna, a menos que la concentración de OD sea inferior a una saturación del 70 %.
|
|
|
Agua limpia superficial, de pozo o reconstituida
|
Agua limpia superficial, de pozo o reconstituida
|
Agua limpia superficial, de pozo o reconstituida
|
|
16.
|
Duración de la exposición a la sustancia problema
|
|
60 dph
|
60 dph
|
60 dph
|
|
17.
|
Parámetros biológicos
|
|
Éxito de la eclosión, supervivencia, morfología a nivel macroscópico, VTG, histología de las gónadas, sexo genético, proporción de sexos
|
Éxito de la eclosión, supervivencia, morfología a nivel macroscópico, VTG, histología de las gónadas, proporción de sexos
|
Éxito de la eclosión, supervivencia, morfología a nivel macroscópico, VTG, histología de las gónadas, proporción de sexos
|
|
18.
|
Criterios de aceptabilidad del ensayo para las réplicas combinadas de los controles
|
|
Éxito de la eclosión > 80 %
|
Éxito de la eclosión > 80 %
|
Supervivencia tras la eclosión ≥ 70 %
|
|
Supervivencia tras la eclosión ≥ 70 %
|
Supervivencia tras la eclosión ≥ 70 %
|
Éxito de la eclosión > 80 %
|
|
Crecimiento (peso húmedo de los peces, secados con material absorbente) > 150 mg
|
Crecimiento (peso húmedo de los peces, secados con material absorbente) > 75 mg
|
Crecimiento (peso húmedo de los peces, secados con material absorbente) > 120 mg
|
|
Longitud (longitud estándar) > 20 mm
|
Longitud (longitud estándar) > 14 mm
|
Longitud (longitud estándar) > 20 mm
|
|
Proporción de sexos (% de machos o hembras)
30-70 %
|
Proporción de sexos (% de machos o hembras) 30-70 %
|
Proporción de sexos (% de machos o hembras) 30-70 %
|
Apéndice 3
Características químicas de un agua de dilución aceptable
|
COMPONENTE
|
CONCENTRACIÓN
|
|
Materia en partículas
|
< 20 mg/l
|
|
Carbono orgánico total
|
< 2 mg/l
|
|
Amoníaco no ionizado
|
< 1 μg/l
|
|
Cloro residual
|
< 10 μg/l
|
|
Plaguicidas organofosforados totales
|
< 50 ng/l
|
|
Plaguicidas organoclorados totales y bifenilos policlorados
|
< 50 ng/l
|
|
Cloro orgánico total
|
< 25 ng/l
|
Apéndice 4
Del método de ensayo c.14/ orientaciones sobre las concentraciones de ensayo
|
Columna (número de concentraciones entre 100 y 10, o entre 10 y 1) (28)
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
|
32
|
46
|
56
|
63
|
68
|
72
|
75
|
|
10
|
22
|
32
|
40
|
46
|
52
|
56
|
|
3,2
|
10
|
18
|
25
|
32
|
37
|
42
|
|
1,0
|
4,6
|
10
|
16
|
22
|
27
|
32
|
|
|
2,2
|
5,6
|
10
|
15
|
19
|
24
|
|
|
1,0
|
3,2
|
6,3
|
10
|
14
|
18
|
|
|
|
1,8
|
4,0
|
6,8
|
10
|
13
|
|
|
|
1,0
|
2,5
|
4,6
|
7,2
|
10
|
|
|
|
|
1,6
|
3,2
|
5,2
|
7,5
|
|
|
|
|
1,0
|
2,2
|
3,7
|
5,6
|
|
|
|
|
|
1,5
|
2,7
|
4,2
|
|
|
|
|
|
1,0
|
1,9
|
3,2
|
|
|
|
|
|
|
1,4
|
2,4
|
|
|
|
|
|
|
1,0
|
1,8
|
|
|
|
|
|
|
|
1,3
|
|
|
|
|
|
|
|
1,0
|
Apéndice 5
Orientaciones para la homogeneización de la cabeza y la cola de los ejemplares juveniles de pez cebra, pez cabeza gorda, espinoso y medaka
La finalidad de esta sección es describir los procedimientos que tienen lugar antes de la cuantificación de la concentración de VTG. Se pueden utilizar otros procedimientos que den como resultado una cuantificación comparable de la VTG. Es opcional determinar la concentración de VTG en el plasma sanguíneo o el hígado, en lugar del homogeneizado de cabeza/cola.
Procedimiento
|
1.
|
Los peces son anestesiados y sacrificados de conformidad con la descripción del ensayo.
|
|
2.
|
Se cortan la cabeza y la cola para separarlas del pez de acuerdo con la descripción del ensayo. Importante: Todos los instrumentos de disección y la tabla de corte deben enjuagarse y limpiarse a fondo (por ejemplo, con etanol al 96 %) entre cada uno de los peces para evitar que haya “contaminación de la VTG” de las hembras o de los machos inducidos a los machos no inducidos.
|
|
3.
|
El peso de la cabeza y la cola juntas de cada pez se mide con precisión de un mg.
|
|
4.
|
Tras el pesaje, las partes se colocan en los tubos correspondientes (por ejemplo, Eppendorf de 1,5 ml) y se congelan a – 80 °C hasta que se produzca la homogeneización o se homogeneizan directamente en hielo con dos manos de mortero de plástico. (Se pueden utilizar otros métodos si estos se llevan a cabo con hielo y el resultado es una masa homogénea.) Importante: Los tubos deben numerarse correctamente de modo que la cabeza y la cola de los peces puedan correlacionarse con la parte correspondiente del cuerpo que se haya utilizado para la histología gonadal.
|
|
5.
|
Cuando se logra una masa homogénea, se añade una cantidad de cuatro a diez veces el peso del tejido del tampón de homogenización
(29) enfriado con hielo (se debe indicar la dilución). Siga trabajando con el mortero hasta que la mezcla sea homogénea. Nota importante: Se utilizan morteros nuevos para cada pez.
|
|
6.
|
Las muestras se colocan en hielo hasta que se realiza la centrifugación a 4 °C a 50 000 g durante 30 min.
|
|
7.
|
Utilice una pipeta para colocar porciones de 20 a 50 μl de sobrenadante (indique la cantidad) en dos tubos como mínimo, sumergiendo el extremo de la pipeta por debajo de la capa de grasa de la superficie y, con cuidado, succionando el sobrenadante sin fracciones de grasa ni de precipitado.
|
|
8.
|
Los tubos se conservan a – 80 °C hasta que se utilicen.
|
Nota: El tampón de homogeneización debe utilizarse el mismo día que se elabore. Colóquelo en hielo durante su uso.
Apéndice 6
Orientaciones para la cuantificación de la vitelogenina del homogeneizado de cabeza y cola en el pez cebra (Danio rerio) (modificado de holbech et al., 2001). se pueden utilizar otros procedimientos con anticuerpos y patrones homólogos.
|
1.
|
Las placas de microtitulación (certificadas Maxisorp F96, Nunc, Roskilde, Dinamarca) recubiertas previamente con IgG antilipovitelina de pez cebra de 5 μg/ml se descongelan y se lavan tres veces con tampón de lavado (*).
|
|
2.
|
El patrón de vitelogenina purificada de pez cebra (30) se diluye en serie hasta las concentraciones de 0,2, 0,5, 1, 2, 5, 10 y 20 ng/ml en tampón de dilución (**) y las muestras se diluyen, como mínimo, 200 veces (para evitar el efecto de matriz) en el tampón de dilución y se aplican a las placas. Se aplica un control del ensayo por duplicado. Se aplican 150 μl a cada pocillo. Los patrones se aplican por duplicado y las muestras, por triplicado. Se incuban hasta el día siguiente a 4 °C en un agitador.
|
|
3.
|
Las placas se lavan cinco veces con tampón de lavado (*).
|
|
4.
|
El HRP acoplado a una cadena de dextrano (por ejemplo, AMDEX A/S, Dinamarca) y los anticuerpos conjugados se diluyen en tampón de lavado; la dilución concreta varía por lote y antigüedad. Se aplican 150 μl a cada pocillo y las placas se incuban durante una hora a temperatura ambiente en un agitador.
|
|
5.
|
Las placas se lavan cinco veces con tampón de lavado (*) y el fondo de las placas se limpia bien con etanol.
|
|
6.
|
Se aplican 150 μl de TMB plus (***) a cada pocillo. La placa se debe proteger de la luz con papel de aluminio y hay que observar el desarrollo del color en un agitador.
|
|
7.
|
Cuando la curva de calibración se haya desarrollado completamente, la actividad enzimática se detiene añadiendo 150 μl de 0,2 M H2SO4 a cada pocillo.
|
|
8.
|
La absorbancia se mide a 450 nm (por ejemplo, en un lector de placas Molecular Devices Thermomax). Los datos se analizan con los programas informáticos correspondientes (por ejemplo, Softmax).
|
|
(*)
|
Tampón de lavado:
|
Solución madre de PBS (****)
|
500,0
|
ml
|
|
BSA
|
5,0
|
g
|
|
Tween 20
|
5,0
|
ml
|
|
Ajuste el pH a 7,3 y envase a 5 l con H2O filtrada por filtro miliporo. Conserve a 4 °C.
|
|
|
(**)
|
Tampón de dilución:
|
Solución madre de PBS (****)
|
100,0
|
ml
|
|
BSA
|
3,0
|
g
|
|
Tween 20
|
1,0
|
ml
|
|
Ajuste el pH a 7,3 y envase a 1 l con H2O filtrada por filtro miliporo. Conserve a 4 °C.
|
|
|
(***)
|
TMB plus es un sustrato “listo para usar” producido por KemEnTec (Dinamarca). Es sensible a la luz. Conserve a 4 °C.
|
|
(****)
|
Solución madre de PBS
|
NaCl
|
160,0
|
g
|
|
KH2PO4
|
4,0
|
g
|
|
Na2HPO4 2H2O
|
26,6
|
g
|
|
KCl
|
4,0
|
g
|
|
Ajuste el pH a 6,8 y enrase a 2 l con agua filtrada por filtro miliporo. Conserve a temperatura ambiente.
|
|
Apéndice 7
Orientaciones para la preparación de las secciones de tejido destinados a la determinación del sexo y las fases de las gónadas
La finalidad de esta sección es describir los procedimientos que tienen lugar antes de la evaluación de las secciones histológicas. Se pueden utilizar otros procedimientos que den como resultado una determinación similar del sexo y de las fases de las gónadas.
Con algunas excepciones, estos procedimientos son similares para el medaka (JMD) y el pez cebra (ZF).
Sacrificio, autopsia y fijación de tejidos
Objetivos:
|
1.
|
Organizar el sacrificio compasivo de los peces.
|
|
2.
|
Obtener los pesos corporales y las mediciones necesarios.
|
|
3.
|
Evaluar los caracteres sexuales secundarios.
|
|
4.
|
Diseccionar tejidos para analizar la VTG.
|
|
5.
|
Fijación de las gónadas.
|
Procedimientos:
|
1.
|
Los peces deben ser sacrificados inmediatamente antes de la autopsia. Por lo tanto, a menos que haya varios disectores disponibles, no se deben sacrificar varios peces al mismo tiempo.
|
|
2.
|
Con la pequeña red de inmersión, se extrae un pez de la cámara experimental y se traslada a la zona de autopsia en el contenedor de transporte.
|
|
3.
|
El pez se coloca en la solución de sacrificio indoloro. El pez se retira de la solución cuando deja de respirar y no responde a estímulos externos.
|
|
4.
|
Se obtiene el peso húmedo del pez.
|
|
5.
|
Para preparar los tejidos destinados al análisis de la VTG, los peces se pueden colocar sobre un corcho en la platina de un microscopio de disección.
|
a.
|
En el caso del pez cebra, se corta la cabeza justo detrás de la aleta pectoral, y la cola se corta justo detrás de la aleta dorsal.
|
|
b.
|
En el caso del medaka, el abdomen se abre con una incisión realizada con mucho cuidado, que se extiende a lo largo de la línea media ventral, desde la cintura escapular hasta un punto anterior al ano. Con las pinzas pequeñas y las tijeras pequeñas, se extirpa el hígado con cuidado.
|
|
|
6.
|
Las muestras para el análisis de la VTG se colocan en tubos Eppendorf y se congelan de inmediato en nitrógeno líquido.
|
|
7.
|
El cadáver, incluyendo las gónadas, se coloca en un casete de plástico para tejidos previamente etiquetado, que se traslada a fijador de Davidson o de Bouin. El volumen de fijador debe ser, como mínimo, de diez veces el volumen aproximado de los tejidos. El recipiente de fijador se agita suavemente durante cinco segundos para eliminar las burbujas de aire del casete.
|
|
8.
|
|
a.
|
Todos los tejidos se mantienen en fijador de Davidson durante una noche y, al día siguiente, se trasladan a recipientes individuales de formol tamponado neutro al 10 %. Los recipientes con casetes se agitan suavemente durante cinco segundos para garantizar la penetración adecuada del formol en los casetes.
|
|
b.
|
Los tejidos permanecen en fijador de Bouin durante 24 horas y, posteriormente, se trasladan a etanol al 70 %.
|
|
Procesamiento de los tejidos
Objetivos:
|
1.
|
Deshidratar el tejido para que la parafina penetre adecuadamente.
|
|
2.
|
Impregnar el tejido con parafina para mantener su integridad y crear una superficie firme para la microtomía.
|
Procedimientos:
|
3.
|
Los casetes de tejido etiquetados se retiran de la conservación en formol o etanol y se colocan en las cestas de procesamiento. La cesta de procesamiento se carga en el procesador de tejidos.
|
|
4.
|
Se selecciona el programa de procesamiento.
|
|
5.
|
Una vez que el procesador de tejidos finaliza el ciclo de procesamiento, las cestas pueden transferirse al puesto de inclusión.
|
Inclusión
Objetivo:
Orientar correctamente la muestra en parafina solidificada para microtomía.
Procedimientos:
|
1.
|
Las cestas de casetes se retiran del procesador y se sumergen en la cámara delantera llena de parafina de la consola térmica del puesto de inclusión, o bien se llevan los casetes a un calentador de parafina separado.
|
|
2.
|
El primer casete que se vaya a incluir se retira de la cámara delantera de la consola térmica o del calentador de parafina. Se retira la tapa del casete y se elimina, y la etiqueta del casete se verifica con los registros del animal para resolver las posibles discrepancias antes de la inclusión.
|
|
3.
|
Se selecciona un molde de inclusión de un tamaño adecuado.
|
|
4.
|
El molde se coloca debajo de la boquilla de la consola de dispensación y se llena de parafina fundida.
|
|
5.
|
La muestra se retira del casete y se coloca en la parafina fundida en el molde. Este proceso debe repetirse con 4 a 8 muestras por molde de parafina. La posición de cada pez se marca colocando el pez no 1 a 180 grados de los peces 2-4/8.
|
|
6.
|
Se añade más parafina para cubrir la muestra.
|
|
7.
|
El molde con la base del casete se coloca en la placa de refrigeración de la consola criogénica.
|
|
8.
|
Una vez que la parafina se haya solidificado, el bloque (es decir, la parafina endurecida que contiene los tejidos y la base del casete) se retira del molde.
|
Microtomía
Objetivo:
Cortar y montar las secciones histológicas para la tinción.
Procedimientos:
|
1.
|
La fase inicial de la microtomía, denominada “recorte”, se realiza de la forma siguiente:
|
a.
|
El bloque de parafina se coloca en el mandril del micrótomo.
|
|
b.
|
El mandril se hace avanzar girando la rueda del micrótomo y se cortan secciones gruesas de la superficie de parafina del bloque hasta que la cuchilla llega a los tejidos incluidos.
|
|
c.
|
El grosor de sección del micrótomo se ajusta entre 3 y 5 micras. El mandril se hace avanzar y se cortan varias secciones del bloque para eliminar cualquier artefacto creado en la superficie de corte del tejido al realizar el recorte basto.
|
|
d.
|
El bloque se puede retirar del mandril y colocarse boca abajo, sobre hielo, para empapar el tejido.
|
|
|
2.
|
La fase siguiente de la microtomía consiste en el corte final y el montaje de las secciones de tejido en portaobjetos. Estos procedimientos se realizan de la forma siguiente:
|
a.
|
Si el bloque se ha colocado en hielo, se retira del hielo y se vuelve a colocar en el mandril del micrótomo.
|
|
b.
|
Con el grosor de sección del micrótomo ajustado a 3-5 micras, se hace avanzar el mandril girando la rueda del micrótomo. Se cortan secciones del bloque hasta que se crea una “cinta” que contenga al menos una sección aceptable, incluyendo las gónadas. (Según resulte necesario durante la división, el bloque puede retirarse del mandril, colocarse en hielo para empapar el tejido y volver a colocarse en el mandril.)
|
|
c.
|
Las secciones flotan planas sobre la superficie del agua, en el baño de agua. Se intenta obtener al menos una sección que no tenga arrugas ni burbujas de aire atrapadas debajo.
|
|
d.
|
Se sumerge un portaobjetos del microscopio debajo de la mejor sección, que se levanta y se saca del agua mediante el portaobjetos. Este proceso se denomina “montaje” de la sección en el portaobjetos.
|
|
e.
|
Se preparan tres secciones para un conjunto de peces. La segunda y la tercera secciones se toman a intervalos de 50 micras después de la primera sección. Si los peces no se han incluido con las gónadas en el mismo nivel de sección, se realizan más secciones para asegurarse de que se obtengan de cada pez al menos seis secciones que incluyan las gónadas.
|
|
f.
|
Con un rotulador para portaobjetos, se registra en el portaobjetos el número de bloque del que se ha producido el portaobjetos.
|
|
g.
|
El portaobjetos se coloca en una bandeja de tinción.
|
|
h.
|
El bloque se retira del mandril y se coloca boca abajo para guardarlo.
|
|
Tinción, colocación del cubreobjetos y etiquetado del portaobjetos
Objetivos:
|
—
|
Teñir las secciones para realizar el examen histopatológico.
|
|
—
|
Sellar permanentemente los tejidos montados y teñidos.
|
|
—
|
Identificar permanentemente las secciones teñidas de forma que se permita una trazabilidad completa.
|
Procedimientos:
|
1.
|
Tinción
|
a.
|
Los portaobjetos se secan al aire durante la noche antes de teñirlos.
|
|
b.
|
Las secciones se tiñen con hematoxilina-eosina.
|
|
|
2.
|
Colocación del cubreobjetos
|
a.
|
Los cubreobjetos se pueden colocar manual o automáticamente.
|
|
b.
|
Se sumerge un portaobjetos en xileno o TissueClear, y el exceso de xileno o TissueClear se retira del portaobjetos golpeando con cuidado.
|
|
c.
|
Se aplica aproximadamente 0,1 ml de medio de montaje cerca del extremo del portaobjetos opuesto al extremo esmerilado, o en el cubreobjetos.
|
|
d.
|
El cubreobjetos se inclina formando un ángulo poco pronunciado cuando se coloca en el portaobjetos.
|
|
|
3.
|
Etiquetado
|
e.
|
Cada etiqueta de portaobjetos debe contener los datos siguientes.
|
i.
|
Nombre del laboratorio
|
|
iii.
|
No de muestra / no de portaobjetos
|
|
iv.
|
Sustancia / grupo de tratamiento
|
|
|
Apéndice 8
Diagrama de flujo estadístico para el análisis de la vitelogenina

Diagrama de flujo estadístico para el análisis de las proporciones de sexo

Apéndice 9
Orientaciones para el muestreo de tejidos a fin de determinar el sexo genético y de determinar el sexo genético mediante el método de PCR
Muestreo, preparación y conservación de tejidos antes de determinar el sexo genético mediante el método de PCR en el medaka (elaborado por el Laboratorio de Organismos Acuáticos de Bayer CropScience AG)
|
1.
|
Con unas tijeras finas se corta la aleta anal o dorsal de cada pez y se coloca en un tubo lleno de 100 μl de tampón de extracción 1 (se puede consultar más información sobre la preparación del tampón más adelante). Las tijeras deben limpiarse después de su uso con cada pez en un vaso lleno de H2O destilada y deben secarse con una servilleta de papel.
|
|
2.
|
A continuación, los tejidos de la aleta se homogeneizan con una mano de mortero de teflón de microtubo para llevar a cabo la lisis de las células. Con cada tubo se utilizará una nuevoa mano de mortero para evitar contaminaciones. Las manos de mortero se dejan por la noche en NaOH 0,5 M, se enjuagan durante cinco minutos en H2O destilada y se guardan en etanol o en medio estéril después de pasarlos por autoclave hasta que se vayan a utilizar.
|
|
3.
|
También se puede conservar el tejido de aleta sin tampón de extracción 1 en hielo seco y, después, en un frigorífico a – 80 °C, para evitar que degenere el ADN. Pero la extracción funciona mejor si se extrae el ADN al mismo tiempo (véase la manipulación más arriba; las muestras deben descongelarse en hielo tras conservarlas a – 80 °C, antes de que los tubos se llenen de tampón).
|
|
4.
|
Tras la homogeneización, todos los tubos se colocan en un baño de agua y se llevan a ebullición durante 15 minutos a 100 °C.
|
|
5.
|
A continuación, se pipetean 100 μl del tampón de extracción 2 a cada tubo (se puede consultar más información sobre la preparación del tampón más adelante). Las muestras se conservan a temperatura ambiente durante 15 minutos y, mientras tanto, se agitan ocasionalmente, con suavidad, con la mano.
|
|
6.
|
Posteriormente, todos los tubos se vuelven a colocar en el baño de agua y se llevan a ebullición durante 15 minutos más a 100 °C.
|
|
7.
|
Hasta que se realicen los análisis, los tubos se congelan a – 20 °C.
|
Preparación de los tampones
Tampón de PCR 1:
|
|
500 mg de N-lauroilsarcosina (por ejemplo, Merck KGaA, Darmstadt, Alemania)
|
|
|
Añadir 100 ml de H2O destilada
|
Tampón de PCR 2:
|
|
20 g de Chelex (por ejemplo, Biorad, Múnich, Alemania)
|
|
|
Hinchar en 100 ml de H2O destilada
|
Determinación del sexo genético (mediante el método de PCR) en el medaka (elaborado por el Laboratorio de Organismos Acuáticos de Bayer CropScience AG y el Biozentrum de la Universidad de Wurzburgo)
Los tubos preparados y congelados (descritos en el apartado anterior) se descongelan en hielo. A continuación, se centrifugan con una centrífuga Eppendorf (30 seg a la velocidad máxima, a temperatura ambiente). Para la de PCR se utiliza el sobrenadante transparente separado del precipitado. Hay que evitar obligatoriamente que se transfieran restos de Chelex (localizado en el precipitado) a la reacción PCR, porque esto interferiría con la actividad de la polimerasa “Taq”. El sobrenadante se utiliza directamente o se puede conservar congelado (a – 20 °C) y volver a descongelarlo en varios ciclos sin afectar negativamente al ADN a la hora de realizar análisis posteriores.
1. Preparación de la “mezcla de reacción” (25 μl por muestra)
|
|
Volumen
|
Concentración final
|
|
Cadena molde de ADN
|
De 0,5 a 2 μl
|
|
|
Tampón 10x para PCR con MgCl2
|
2,5 μl
|
1x
|
|
Nucleótidos (de dATP, dCTP, dGTP y dTTP)
|
4 μl (5 mM)
|
200 μM
|
|
Cebador directo (10 μM) (véase el punto 3-5 más adelante)
|
0,5 μl
|
200 nM
|
|
Cebador inverso (10 μM) (véase el punto 3-5 más adelante)
|
0,5 μl
|
200 nM
|
|
DMSO
|
1,25 μl
|
5 %
|
|
Agua (apta para PCR)
|
Hasta 25 μl
|
|
|
Polimerasa-E Taq
|
0,3 μl
|
1,5 U
|
|
Tampón 10x para PCR con MgCl2: Tris/HCl 670 mM (pH 8,8 a 25 °C), (NH4)2SO4 160 mM, MgCl2 25 mM, Tween 20 al 0,1 %
|
Para cada PCR (véase el punto 3-5 más adelante), se requiere el cebador especial como nueva combinación de “mezcla de reacción” y de la cantidad necesaria y adecuada de molde de ADN para cada muestra (véase más arriba). Los volúmenes correspondientes se transferirán a nuevos tubos mediante pipetas. A continuación, todos los tubos se cierran, se agitan (aproximadamente durante 10 segundos) y se centrifugan (10 segundos a temperatura ambiente). Después pueden comenzar los respectivos programas de PCR. También se utilizarán un control positivo (muestra de ADN de ejemplo con actividad conocida y resultados claros) y un control negativo (1 μl de H2O destilada) en cada programa de PCR.
2. Preparación del gel de agarosa (1 %) — Durante la ejecución de los programas de PCR:
|
—
|
Disuelva 3 g de agarosa en 300 ml de tampón TAE 1 × (gel de agarosa al 1 %).
|
|
—
|
Esta solución debe llevarse a ebullición con un microondas (2-3 min aproximadamente).
|
|
—
|
Transfiera la solución caliente a una caja de moldeado especial, colocada sobre hielo.
|
|
—
|
Cuando hayan transcurrido unos 20 minutos, el gel de agarosa estará listo para usarlo.
|
|
—
|
Conserve el gel de agarosa en tampón TAE 1 × hasta que finalicen los programas de PCR.
|
3. Programa de PCR-actina:
La finalidad de esta reacción PCR es demostrar que el ADN de la muestra no ha sufrido daños.
|
—
|
Cebador especial:
|
—
|
“Mact1 (superior/directo)” → TTC AAC AGC CCT GCC ATG TA
|
|
—
|
“Mact2 (inferior/inverso)” → GCA GCT CAT AGC TCT TCT CCA GGG AG
|
|
|
—
|
Programa:
|
—
|
Ciclo (35 veces):
|
Desnaturalización
|
→ 45 seg a 95 °C
|
|
Hibridación
|
→ 45 seg a 56 °C
|
|
Alargamiento
|
→ 1 min a 68 °C
|
|
|
4. Programa de PCR de genes X e Y:
Las muestras con ADN intacto se utilizarán en este programa de PCR para detectar los genes X e Y. El ADN masculino debería presentar una doble banda y el ADN femenino debería presentar una única banda (después de la tinción y la electroforesis en gel). En esta serie del programa se deben incluir un control positivo para los machos (muestra XY) y uno para las hembras (muestra XX).
|
—
|
Cebador especial:
|
—
|
“PG 17,5” (superior/directo) → CCG GGT GCC CAA GTG CTC CCG CTG
|
|
—
|
“PG 17,6” (inferior/inverso) → GAT CGT CCC TCC ACA GAG AAG AGA
|
|
|
—
|
Programa:
|
—
|
Ciclo (40 veces):
|
Desnaturalización
|
→ 45 seg a 95 °C
|
|
Hibridación
|
→ 45 seg a 55 °C
|
|
Alargamiento
|
→ 1 min 30 seg a 68 °C
|
|
|
5. Programa de PCR del gen Y como “control” para el programa de PCR de genes X e Y:
Este programa de PCR verifica los resultados del “programa de PCR de genes X e Y”. Las “muestras de machos” deberían presentar una única banda y las “muestras de hembras” no deberían presentar ninguna banda (después de la tinción y la electroforesis en gel).
|
—
|
Cebador especial:
|
—
|
“DMTYa (superior/directo)” → GGC CGG GTC CCC GGG TG
|
|
—
|
“DMTYd (inferior/inverso)” → TTT GGG TGA ACT CAC ATG G
|
|
|
—
|
Programa:
|
—
|
Ciclo (40 veces):
|
Desnaturalización
|
→ 45 seg a 95 °C
|
|
Hibridación
|
→ 45 seg a 56 °C
|
|
Alargamiento
|
→ 1 min a 68 °C
|
|
|
6. Tinción de las muestras de PCR:
Solución de tinción:
|
|
Azul de bromofenol al 0,25 %
|
Pipetee 1 μl de la solución de tinción en cada tubo.
7. Inicio de la electroforesis en gel:
|
—
|
El gel de agarosa al 1 % preparado se transfiere a una cámara de electroforesis en gel llena de tampón TAE 1x.
|
|
—
|
Se pipetean de 10 a 15 μl de cada muestra de PCR teñida en una ranura del gel de agarosa.
|
|
—
|
Asimismo, se pipetean de 5 a 15 μl de la “escala” 1 kb (Invitrogen) en otra ranura.
|
|
—
|
Inicie la electroforesis a 200 V.
|
|
—
|
Pare una vez transcurridos de 30 a 45 minutos.
|
8. Determinación de las bandas:
|
—
|
Limpie el gel de agarosa con H2O destilada.
|
|
—
|
A continuación, transfiera el gel de agarosa a bromuro de etidio durante un periodo de 15 a 30 minutos.
|
|
—
|
Luego se debe captar una imagen del gel de agarosa con una caja de rayos UV.
|
|
—
|
Por último, las muestras se analizan comparándolas con la banda (o bandas) de control positivo y la escala.
|
Apéndice 10
Orientación sobre el muestreo de tejido para determinar el sexo genético con el método de PCR en el espinoso
Muestreo de tejidos y extracción de ADN
El ADN puede extraerse con diversos reactivos disponibles en el mercado y con sistemas de extracción tanto manuales como automáticos. A continuación se describe el protocolo utilizado en el laboratorio Cefas de Weymouth y, cuando procede, se han añadido planteamientos alternativos.
|
1.
|
Con unas tijeras finas se corta un trocito de tejido (10-20 mg) del área dorsolateral (tras retirar la cabeza y la cola para el análisis de VTG) de cada pez. El tejido se introduce en un tubo, que se coloca directamente en nitrógeno líquido (para conservarlo a – 80 °C) o se llena con etanol al 70 % (para su transporte y posterior almacenamiento a 4 °C). Las tijeras se limpian después de cada pez con etanol al 70 % y, a continuación, con agua destilada, y se secan con una servilleta de papel.
|
|
2.
|
El etanol (si lo hubiera) se elimina por aspiración y el tejido se macera durante la noche con proteinasa K en 400 μl de tampón ATL (Qiagen). Una parte alícuota (200 μl) del macerado se transfiere a un bloque S de 96 pocillos (Qiagen) y el ADN se extrae en formato de 96 pocillos mediante el Qiagen Universal BioRobot y el kit QIamp Investigator BioRobot. El ADN se eluye en 50 μl de agua libre de desoxirribonucleasa y de ribonucleasa. Si se utilizan tejidos duros para extraer el ADN (como una espina o una aleta pectoral), es posible que haya que homogeneizar la muestra en el tampón de lisis con un instrumento para lisis de tejidos FastPrep® o un sistema de alteración de tejidos equivalente.
O bien:
|
a)
|
El tejido se macera durante la noche con proteinasa K en 400 μl de tampón de lisis G2 (Qiagen) y se extrae el ADN de 200 μl del macerado con el kit EZ-1 DNA easy tissue y el biorrobot EZ-1, o con el mini kit DNA easy tissue. El ADN se eluye en un volumen de 50 μl.
|
|
b)
|
Los tejidos se procesan con el reactivo DNAzol. En resumen, las muestras de tejido se lisan en 1 ml de DNAzol durante 10 minutos en un microtubo de centrífuga de 1,5 ml y, a continuación, se centrifugan a 13 000 rpm durante 5 minutos para eliminar todas las partículas. A continuación, la muestra lisada se transfiere a un nuevo microtubo de centrífuga de 1,5 ml que contiene 500 μl de etanol de grado molecular al 100 %, y luego se centrifuga a 13 000 rpm durante 10 minutos para precipitar el ADN. El etanol se elimina y se sustituye por 400 μl de etanol de grado molecular al 70 %, se centrifuga a 13 000 rpm durante 5 minutos y el precipitado de ADN se disuelve en 50 μl de agua libre de desoxirribonucleasa y de ribonucleasa. De nuevo, cuando se utilicen los tejidos duros (aleta pectoral), es posible que haya que homogeneizar la muestra en el tampón de lisis con un instrumento para lisis de tejidos FastPrep® o un sistema de alteración de tejidos equivalente antes de extraer el ADN.
|
|
|
3.
|
El ADN se conserva a – 20 °C hasta que sea necesario.
|
Nota importante: se deben usar guantes durante los procedimientos.
Análisis de reacción en cadena de la polimerasa (PCR)
Se han realizado amplificaciones con 2,5 μl del ADN extraído en un volumen de reacción de 50 μl, utilizando los cebadores de locus de isocitrato deshidrogenasa (de acuerdo con la descripción de Peichel et al., 2004. Current Biology 1:1416-1424):
|
Cebador directo
|
5' GGG ACG AGC AAG ATT TAT TGG 3'
|
|
Cebador inverso
|
5' TAT AGT TAG CCA GGA GAT GG 3'
|
Hay muchos proveedores de reactivos para PCR adecuados. El método descrito a continuación es el que se utiliza actualmente en el laboratorio Cefas de Weymouth.
1. Preparación de la “mezcla de reacción” (50 μl por muestra)
La mezcla maestra se prepara de la siguiente manera. Se puede preparar por adelantado y conservar congelada a – 20 °C hasta que se necesite. Se debe elaborar suficiente mezcla maestra para un control negativo (solo agua de calidad de biología molecular).
|
|
Volumen (concentración madre)/muestra
|
Concentración final
|
|
Tampón de reacción 5x GoTaq®
|
10 μl
|
1x
|
|
MgCl2
|
5 μl (25 mM)
|
2,5 mM
|
|
Nucleótidos (dATP, dCTP, dGTP, dTTP)
|
0,5 μl (25 mM cada uno)
|
250 μM cada uno
|
|
Cebador directo
|
0,5 μl (0,1 nmol/μl)
|
2,0 μM
|
|
Cebador inverso
|
0,5 μl (0,1 nmol/μl)
|
2,0 μM
|
|
Agua de calidad de biología molecular
|
30,75 μl
|
|
|
Polimerasa GoTaq
|
0,25 μl
|
1,25 U
|
|
—
|
Ponga 47,5 μl en un tubo para PCR de pared fina de 0,5 ml etiquetado.
|
|
—
|
Añada 2,5 μl del ADN depurado al tubo etiquetado correctamente. Repita con todas las muestras y el control negativo.
|
|
—
|
Cubra con dos gotas de aceite mineral. También se puede utilizar un termociclador con tapa calentada.
|
|
—
|
Las muestras se desnaturalizan en un termociclador Peltier PTC-225 a 94 ± 2 °C durante 5 minutos y, a continuación, se efectúan 39 ciclos a 94 ± 2 °C durante 1 minuto; a 55 ± 2 °C durante 1 minuto; a 72 ± 2 °C durante 1 minuto; y una extensión final a 72 ± 2 °C durante 10 minutos.
|
2. Preparación del gel de agarosa (2 %):
Tradicionalmente, los productos para PCR se resuelven en un gel de agarosa al 20 % que contenga bromuro de etidio.
También se pueden utilizar sistemas de electroforesis basados en capilares.
|
—
|
Pese 2 g de agarosa en 100 ml de tampón TAE 1x.
|
|
—
|
Caliente en un microondas (aproximadamente, 2-3 min) para disolver la agarosa.
|
|
—
|
Añada 2 gotas de concentración final de bromuro de etidio de 0,5 μg/ml.
|
|
—
|
Transfiera la solución caliente al equipo de moldeado de gel.
|
|
—
|
Deje que el gel se endurezca.
|
3. Electroforesis en gel:
|
—
|
Transfiera el gel de agarosa al equipo de electroforesis y sumérjalo en un tampón TAE 1x.
|
|
—
|
Cargue 20 μl de cada muestra a un pocillo distinto, añadiendo un marcador de peso molecular (escala de 100 bp de ADN, Promega) a un pocillo vacío.
|
|
—
|
La electroforesis se realiza a 120 V durante un periodo de 30 a 45 minutos.
|
4. Visualización de los productos de amplificación
Si el bromuro de etidio se ha incorporado al gel de agarosa de acuerdo con la descripción anterior, los productos de ADN se visualizan debajo de una fuente de rayos UV. El gel de agarosa también se puede teñir cubriendo el gel en una solución diluida de bromuro de etidio (0,5 μg/ml en agua) durante 30 minutos antes de la visualización.
Apéndice 11
Orientación sobre el procedimiento de fertilización artificial del espinoso
La finalidad de esta sección es describir los procedimientos para obtener huevos fertilizados de espinoso con vistas a utilizarlos en el FSDT.
Procedimientos
Obtención de esperma de los machos
|
1.
|
Se sacrifica un macho de coloración marcada de la población deseada.
|
|
2.
|
Se diseccionan los testículos de cada lado del pez. Los testículos, en general, son estructuras muy pigmentadas, en forma de vara, que se ven fácilmente en la línea media lateral del cuerpo. Utilice uno de los métodos siguientes:
|
|
3.
|
Con un par de tijeras finas, empiece por la cloaca y realice una incisión de 1 a 1,5 cm con un solo corte y una inclinación de unos 45 grados.
|
|
4.
|
Utilice un bisturí para realizar una pequeña incisión en el lateral del pez ligeramente posterior a la pelvis y justo debajo de las placas laterales.
|
|
5.
|
Los testículos se extirpan con unas pinzas finas y se colocan en una placa de Petri.
|
|
6.
|
Cada testículo se cubre con 100 μl de solución final de Hank
(31) recién preparada.
|
|
7.
|
Los testículos se cortan en dados pequeños con una hoja de cuchilla o un bisturí. De esta forma se libera el esperma y se da a la solución de Hank un aspecto lechoso.
|
|
8.
|
El fluido que contiene el esperma se añade a un tubo con cuidado de no introducir ningún trozo de tejido de los testículos al pipetear.
|
|
9.
|
Se añaden al tubo 800 μl de solución final de Hank y se mezclan bien.
|
|
10.
|
En caso necesario, el macho se puede conservar fijándolo con etanol al 100 % u otro fijador que se desee. Esto resulta especialmente importante si el estudio va a asignar el origen parental de los descendientes.
|
Nota importante: Aunque la mayor parte de las soluciones madre necesarias pueden prepararse por adelantado,
la solución madre 5
y, posteriormente, la
solución final
, deben utilizarse
frescas
y prepararse el mismo día en que se vayan a utilizar.
|
Solución madre 1
|
|
NaCl
|
8,00 g
|
|
KCl
|
0,40 g
|
|
Agua destilada (DW)
|
100 ml
|
|
Solución madre 2
|
|
Na2HPO4 (anhidro)
|
0,358 g
|
|
KH2PO4
|
0,60 g
|
|
DW
|
100 ml
|
|
Solución madre 3
|
|
CaCl2
|
0,72 g
|
|
DW
|
50 ml
|
|
Solución madre 4
|
|
MgSO4 · 7H2O
|
1,23 g
|
|
DW
|
50 ml
|
|
Solución madre 5 (recién preparada)
|
|
NaHCO3
|
0,35 g
|
|
DW
|
10 ml
|
Nota: Si ya tiene alguna de las sales anteriormente mencionadas, pero con un contenido en agua distinto (es decir, 2H2O en lugar de anhidro), puede utilizarlas, pero primero debe ajustar el peso con arreglo al peso molecular.
En lo que respecta a la solución final de Hank, combine en el orden siguiente:
|
Solución madre 1
|
1,0 ml
|
|
Solución madre 2
|
0,1 ml
|
|
Solución madre 3
|
0,1 ml
|
|
DW
|
8,6 ml
|
|
Solución madre 4
|
0,1 ml
|
|
Solución madre 5
|
0,1 ml
|
Mezcle bien antes de usar.
Fertilización
|
1.
|
Se identifican hembras grandes y grávidas entre la población deseada; las hembras estarán listas para presionarlas únicamente cuando se vean huevos sobresaliendo de la cloaca. Las hembras que están listas presentan la postura característica con la “cabeza arriba”.
|
|
2.
|
Con suavidad, pase un dedo por el lateral del pez, hacia la cola, para facilitar la expulsión de un ovisaco en una nueva placa de Petri. Repita el procedimiento en el otro lado y devuelva el pez a su recipiente.
|
|
3.
|
Los huevos pueden extenderse (formando una sola capa) con un pincel fino. Es importante intentar exponer la mayor cantidad de huevos posible al esperma, por lo que maximizar el área de la superficie de los huevos le resultará útil. Nota importante: Mantenga los huevos húmedos colocando tejido húmedo a su alrededor (es importante que los huevos no toquen el agua directamente, ya que esto puede endurecer prematuramente el corion e impedir la fertilización). Hay una gran variación en el número de huevos que cada hembra puede producir pero, como promedio, deberían obtenerse unos 150 huevos de una misma hembra grávida.
|
|
4.
|
Se extienden 25 μl de esperma en la mezcla de Hank de manera uniforme por toda la superficie de los huevos con ayuda del pincel. Los huevos se endurecerán rápidamente y cambiarán de color (en un minuto) una vez comience la fertilización. Si la cantidad estimada de huevos es superior a 150, repita el procedimiento. De igual manera, si los huevos no se endurecen en un minuto, añada un poco más de esperma. Nota importante: La adición de más esperma no mejora necesariamente la tasa de fertilización.
|
|
5.
|
Hay que dejar que los huevos y la solución de esperma “interactúen” durante 15 minutos como mínimo, y los huevos fertilizados deben colocarse en los acuarios de exposición en un periodo de 1,5 horas después de la fertilización.
|
|
6.
|
El procedimiento se repite con otra hembra hasta que se recoge el número deseado de huevos.
|
|
7.
|
Aparte unos cuantos huevos del último lote y fíjelos en ácido acético al 10 %.
|
Recuento y distribución de los huevos en los acuarios de ensayo
|
1.
|
Los huevos deben distribuirse de manera uniforme entre cada nivel de tratamiento para evitar variaciones genéticas. Cada lote de huevos fertilizados debe separarse en grupos del mismo tamaño (tantos como niveles de tratamiento haya) con un instrumento romo (es decir, pinzas de entomología de lámina ancha o un asa de inoculación). Si el objetivo son cuatro réplicas por tratamiento, con 20 huevos cada una, habrá que distribuir 80 huevos por acuario de exposición. Nota importante: Es recomendable añadir un 20 % extra (es decir, 96 huevos por nivel de tratamiento) hasta que esté seguro de obtener unas tasas de fertilización del 100 %.
|
|
2.
|
Los huevos de espinoso son muy proclives a las infecciones fúngicas fuera del nido protegido por el padre. En este sentido, es muy importante el tratamiento de todos los huevos con azul de metileno durante los primeros cinco días del ensayo. Se prepara una solución madre de azul de metileno de 1 mg/ml y se añade al acuario de exposición para obtener una concentración final máxima de 2,125 mg/l. Nota importante: Los espinosos no deben quedar expuestos al azul de metileno una vez se produce la eclosión; por lo tanto, el sistema debe estar libre de azul de metileno al llegar el día 6.
|
|
3.
|
Los huevos se inspeccionan cada día y los huevos muertos o no fertilizados deben quedar registrados como tales. Nota importante: Los huevos nunca deben estar fuera del agua hasta que eclosionen, ni siquiera durante periodos muy breves.
|
C. 42 BIODEGRADABILIDAD EN AGUA DE MAR
INTRODUCCIÓN GENERAL
|
1.
|
El presente método de ensayo reproduce las directrices de ensayo (TG) 306 de la OCDE (1992). Cuando se desarrollaron los métodos de ensayo originales, no se sabía hasta qué punto podían aplicarse al entorno marino los resultados de los ensayos de cribado de biodegradabilidad fácil con agua dulce, efluente de alcantarillado o lodo activado como inóculo. Se han comunicado resultados variables sobre este aspecto [por ejemplo, (1)].
|
|
2.
|
Muchas aguas residuales industriales, que contienen diversas sustancias, llegan al mar por descarga directa o a través de los estuarios y ríos en los que los tiempos de residencia son bajos en comparación con el periodo necesario para que se produzca la biodegradación completa de muchas de las sustancias presentes. Debido a la mayor concienciación sobre la necesidad de proteger el entorno marino frente a las crecientes cargas de sustancias y la necesidad de estimar la concentración probable de sustancias en el mar, se han desarrollado métodos de ensayo de biodegradabilidad en agua de mar.
|
|
3.
|
Los métodos descritos en este documento utilizan agua de mar natural como fase acuosa y como fuente de microorganismos. En un intento por cumplir los métodos de biodegradabilidad fácil en agua dulce, se investigó el uso de agua de mar ultrafiltrada y centrifugada, así como el uso de sedimentos marinos como inóculos. Esas investigaciones no tuvieron éxito. El medio de ensayo, por lo tanto, es agua de mar natural pretratada para eliminar las partículas gruesas.
|
|
4.
|
A fin de evaluar la biodegradabilidad última con el método del frasco de agitación, deben utilizarse concentraciones relativamente altas de la sustancia problema debido a la poca sensibilidad del método analítico de carbono orgánico disuelto (COD). Esto, a su vez, requiere la adición al agua de mar de nutrientes minerales (N y P), cuyas bajas concentraciones, de lo contrario, limitarían la eliminación del COD. También es necesario añadir los nutrientes con el método del frasco cerrado debido a la concentración de la sustancia problema añadida.
|
|
5.
|
Por tanto, los métodos no constituyen pruebas de biodegradabilidad fácil, ya que no se añade ningún inóculo además de los microorganismos que ya están presentes en el agua de mar. Los ensayos tampoco simulan el entorno marino, ya que se añaden los nutrientes y la concentración de la sustancia problema es mucho mayor que la que estaría presente en el mar. Por estos motivos, los métodos se proponen en una nueva subsección llamada “Biodegradabilidad en agua de mar”.
|
APLICACIÓN
|
6.
|
Los resultados de los ensayos, que se realizarían porque la pauta de uso y eliminación de la sustancia en cuestión indica una ruta hacia el mar, dan una primera impresión de la biodegradabilidad en agua de mar. Si el resultado es positivo (eliminación del COD superior al 70 %; demanda teórica de oxígeno, DTO, superior al 60 %), se puede concluir que hay potencial de biodegradación en el entorno marino. Sin embargo, un resultado negativo no excluye dicho potencial, sino que indica que se requieren más estudios; por ejemplo, utilizando la concentración más baja posible de la sustancia problema.
|
|
7.
|
En cualquier caso, si se requiere un valor más definitivo para la tasa o el nivel de biodegradación en agua de mar en una zona concreta, habría que aplicar otros métodos más complejos y sofisticados y, por lo tanto, más caros. Por ejemplo, podría aplicarse un ensayo de simulación con una concentración de la sustancia problema más próxima a la concentración ambiental probable. Asimismo, podría utilizarse agua de mar no enriquecida y no pretratada, obtenida del lugar de interés, y la biodegradación primaria podría ir seguida de un análisis químico específico. En lo que respecta a la biodegradabilidad última, serían necesarias sustancias marcadas con 14C, de forma que pudieran medirse las tasas de desaparición de 14C orgánico soluble y la producción de 14CO2 con unas concentraciones ambientalmente realistas.
|
SELECCIÓN DE LOS MÉTODOS
|
8.
|
La selección del método que se vaya a utilizar depende de diversos factores. La tabla siguiente se incluye para facilitar la selección. Aunque las sustancias con una hidrosolubilidad inferior al equivalente de unos 5 mg C/l no se pueden analizar con el método del frasco de agitación, al menos en principio, las sustancias poco solubles pueden analizarse con el método del frasco cerrado.
Tabla
Ventajas y desventajas de la prueba del frasco de agitación y del frasco cerrado
|
MÉTODO
|
VENTAJAS
|
DESVENTAJAS
|
|
FRASCO DE AGITACIÓN
|
|
—
|
aparato sencillo, excepto el analizador de C
|
|
—
|
la duración de 60 días no constituye un problema
|
|
—
|
no hay interferencias por nitrificación
|
|
—
|
puede adaptarse para las sustancias volátiles
|
|
|
—
|
requiere un analizador de C
|
|
—
|
utiliza 5-40 mg COD/1; puede tener un efecto inhibidor
|
|
—
|
la determinación del COD resulta difícil en concentraciones bajas en agua de mar (efecto de cloruro)
|
|
—
|
COD alto en ocasiones en agua de mar
|
|
|
FRASCO CERRADO
|
|
—
|
determinación final simple
|
|
—
|
utiliza una concentración baja de la sustancia problema (2 mg/l); por lo tanto, hay menos probabilidades de inhibición
|
|
—
|
se adapta fácilmente para las sustancias volátiles
|
|
|
—
|
puede resultar difícil mantener la hermeticidad de los frascos
|
|
—
|
el crecimiento bacteriano en la pared puede provocar valores falsos
|
|
—
|
los valores de captación en blanco de O2 pueden ser altos, especialmente después de 28 días; se pueden superar envejeciendo el agua de mar
|
|
—
|
posibles interferencias de la captación de O2 por la nitrificación
|
|
|
MÉTODO DEL FRASCO DE AGITACIÓN
INTRODUCCIÓN
|
1.
|
Este método es una variante con agua de mar del ensayo de detección de la OCDE modificado que se describe en el capítulo C.4B de este anexo (2). Se concluyó como resultado de un ensayo interlaboratorios organizado para la Comisión Europea (CE) por el Instituto de Calidad del Agua de Dinamarca (3).
|
|
2.
|
En común con el método del frasco cerrado para agua marina adjunto, los resultados de este ensayo no se deben considerar indicadores de biodegradabilidad fácil, sino que deben utilizarse específicamente para obtener información sobre la biodegradabilidad de las sustancias en entornos marinos.
|
PRINCIPIO DEL MÉTODO
|
3.
|
Una cantidad predeterminada de la sustancia problema se disuelve en el medio de ensayo para lograr una concentración de 5-40 mg de carbono orgánico disuelto (COD)/l. Si los límites de sensibilidad de los análisis de carbono orgánico mejoran, el uso de concentraciones más bajas de la sustancia problema puede resultar favorable, en particular en caso de sustancias inhibidoras. La solución de la sustancia problema en el medio del ensayo se incuba con agitación en la oscuridad o en luz difusa, en condiciones aeróbicas, a una temperatura fija (controlada a ± 2 °C) que, normalmente, se encontrará en un intervalo de 15-20 °C. En aquellos casos en los que el objetivo del estudio sea simular situaciones ambientales, se pueden realizar ensayos fuera de este intervalo de temperaturas normales. La duración máxima recomendada del ensayo es de unos 60 días. La degradación va seguida de mediciones del COD (degradación última) y, en algunos casos, mediante análisis específico (degradación primaria).
|
INFORMACIÓN SOBRE LA SUSTANCIA PROBLEMA
|
4.
|
A fin de saber si el ensayo puede aplicarse o no a una sustancia concreta, hay que conocer algunas de sus propiedades. El contenido de carbono orgánico de la sustancia debe establecerse, su volatilidad debe ser tal que no se produzcan pérdidas importantes durante el ensayo, y su solubilidad en agua debe ser superior al equivalente de 25-40 mg C/l. Asimismo, la sustancia problema no debe adsorberse de forma significativa sobre superficies de vidrio. La información sobre la pureza o las proporciones relativas de los principales componentes de la sustancia problema es necesaria para poder interpretar los resultados obtenidos, en particular cuando el resultado está próximo al nivel “umbral”.
|
|
5.
|
La información sobre la toxicidad de la sustancia problema para las bacterias, por ejemplo, como se mide en los ensayos de tasa de respiración a corto plazo (4), puede resultar útil al seleccionar las concentraciones adecuadas del ensayo y puede ser esencial para interpretar correctamente los valores bajos de biodegradación. No obstante, esta información no siempre es suficiente para interpretar los resultados obtenidos en el ensayo de biodegradación y entonces el procedimiento descrito en el punto 18 resulta más adecuado.
|
SUSTANCIAS DE REFERENCIA
|
6.
|
Deben utilizarse sustancias de referencia adecuadas para comprobar la actividad microbiana de la muestra de agua de mar. El benzoato sódico, el acetato sódico y la anilina son ejemplos de sustancias que pueden utilizarse con este fin. Las sustancias de referencia deben degradarse en un intervalo de tiempo razonablemente corto; de lo contrario, se recomienda repetir el ensayo con otra muestra de agua de mar.
|
|
7.
|
En el ensayo interlaboratorios de la CE, en el que se tomaron muestras de agua de mar en distintos lugares y en momentos distintos del año (3), la fase de latencia (tL) y el tiempo que se tarda en lograr una degradación del 50 % (t50), excluida la fase de latencia, fueron de 1 a 4 días y de 1 a 7 días, respectivamente, en relación con el benzoato sódico. En lo que respecta a la anilina, la tL varió entre 0 y 10 días, mientras que el t50 varió entre 1 y 10 días.
|
REPRODUCIBILIDAD Y SENSIBILIDAD DEL MÉTODO
|
8.
|
La reproducibilidad del método se estableció en el ensayo interlaboratorios (3). La concentración más baja de la sustancia problema con la cual se puede utilizar este método con análisis del COD está determinada en gran parte por el límite de detección del análisis de carbono orgánico (aproximadamente 0,5 mg C/l en la actualidad) y la concentración de carbono orgánico disuelto en el agua de mar utilizada (generalmente, unos 3-5 mg/l de agua procedente de mar abierto). La concentración de fondo de COD no debe superar aproximadamente el 20 % de la concentración total de COD después de añadir la sustancia problema. Si esto no resulta viable, la concentración de referencia de COD puede reducirse, en ocasiones, envejeciendo el agua de mar antes de realizar el ensayo. Si se usa el método únicamente con un análisis químico específico (mediante el cual se mide la degradación primaria), el investigador debe documentar, suministrando información adicional, si se puede esperar o no la degradabilidad última. Esta información adicional puede consistir en los resultados de otros ensayos de biodegradabilidad fácil o inherente.
|
DESCRIPCIÓN DEL MÉTODO
Equipo
|
9.
|
Equipo normal de laboratorio, además de lo siguiente:
|
a.
|
máquina agitadora compatible con matraces Erlenmeyer de 0,5-2 litros, con control automático de la temperatura o utilizada en una sala a temperatura constante de 15-20 °C, controlada a ± 2 °C,
|
|
b.
|
matraces Erlenmeyer de 0,5-2 litros de cuello estrecho,
|
|
c.
|
aparato de filtración por membrana o centrifugadora,
|
|
d.
|
filtros de membrana de 0,2 a 0,45 μm,
|
|
e.
|
analizador de carbono,
|
|
f.
|
equipo para análisis específicos (opcional).
|
|
Agua de mar
|
10.
|
Tome una muestra de agua de mar en un recipiente que se haya limpiado a fondo y transpórtela al laboratorio, preferiblemente en un plazo de uno o dos días desde su recogida. Durante el transporte, no permita que la temperatura de la muestra supere demasiado la temperatura que se vaya a utilizar en el ensayo. Identifique con precisión la ubicación del muestreo y descríbala en términos de su estado de contaminación y nutrientes. En particular en lo que respecta a las aguas costeras, incluya en esta caracterización un recuento de colonias de microbios heterótrofos y la determinación de las concentraciones de nitrato, amonio y fosfato disueltos.
|
|
11.
|
Incluya los datos siguientes con respecto a la muestra de agua de mar:
|
—
|
profundidad a la que se ha tomado la muestra,
|
|
—
|
aspecto de la muestra (turbia, etc.),
|
|
—
|
temperatura en el momento de recogida,
|
|
—
|
tiempo transcurrido entre la recogida y el uso en el ensayo.
|
|
|
12.
|
Si el contenido de COD de la muestra de agua de mar resultara ser alto (punto 8), se recomienda envejecer el agua de mar durante una semana antes de usarla. El envejecimiento se realiza en condiciones aeróbicas a la temperatura del ensayo y en la oscuridad o en luz difusa. En caso necesario, mantener las condiciones aeróbicas mediante una aireación suave. Durante el envejecimiento, se reduce el contenido de material orgánico fácilmente degradable. En el ensayo interlaboratorios (3) no se reveló ninguna diferencia entre el potencial de degradación de las muestras de agua de mar envejecidas y recién recogidas. Antes de usarla, trate previamente el agua de mar para eliminar las partículas gruesas, por ejemplo mediante filtración con un filtro de nailon o un filtro de papel grueso (no deben ser filtros de membrana o GF-C), o mediante sedimentación y decantación. Debe indicarse el procedimiento utilizado. Lleve a cabo el tratamiento previo después del envejecimiento, si se utiliza.
|
Soluciones madre de nutrientes minerales
|
13.
|
Prepare las siguientes soluciones madre, utilizando reactivos de grado analítico:
|
a)
|
Ortofosfato potásico de dihidrógeno, KH2PO4
|
8,50 g
|
|
Ortofosfato dipotásico de hidrógeno, K2HPO4
|
21,75 g
|
|
Ortofosfato disódico de hidrógeno dihidratado, Na2HPO4 · 2H2O
|
33,30 g
|
|
Cloruro de amonio, NH4Cl
|
0,50 g
|
|
Disuelva y enrase con agua destilada a 1 litro.
|
|
|
b)
|
Cloruro de calcio, CaCl2
|
27,50 g
|
|
Disuelva y enrase con agua destilada a 1 litro.
|
|
|
c)
|
Sulfato de magnesio heptahidratado, MgSO4 · 7H2O
|
22,50 g
|
|
Disuelva y enrase con agua destilada a 1 litro.
|
|
|
d)
|
Cloruro de hierro (III) hexahidratado, FeCl3 · 6H2O
|
0,25 g
|
|
Disuelva y enrase con agua destilada a 1 litro.
|
|
La precipitación en la solución d) puede evitarse añadiendo una gota de HCl concentrado o 0,4 g de ácido etilendiamino (EDTA, sal disódica) por litro. Si se forma un precipitado en una solución madre, cámbiela por una solución recién preparada.
|
Preparación del medio de ensayo
|
14.
|
Añada 1 ml de cada una de las soluciones madre anteriormente mencionadas por litro de agua de mar pretratada.
|
Inóculo
|
15.
|
No añada un inóculo concreto además de los microorganismos ya presentes en el agua de mar. Determine (opcionalmente) el número de heterótrofos que formen colonias en el medio de ensayo de agua de mar (y, preferiblemente, también en las muestras originales de agua de mar), por ejemplo mediante recuento de placas, utilizando agar marino. Esto resulta deseable, en particular, con las muestras de lugares costeros o contaminados. Compruebe la actividad microbiana heterotrófica del agua de mar llevando a cabo una prueba con una sustancia de referencia.
|
Preparación de los frascos
|
16.
|
Hay que asegurarse de que todos los recipientes de vidrio estén escrupulosamente limpios, no necesariamente estériles (por ejemplo, utilizando ácido clorhídrico alcohólico), enjuagados y secos antes de usarlos para evitar la contaminación con residuos de ensayos anteriores. Los frascos también deben limpiarse antes de utilizarlos por primera vez.
|
|
17.
|
Evalúe las sustancias problema al mismo tiempo en frascos duplicados, junto con un frasco único para la sustancia de referencia. Lleve a cabo un ensayo en blanco, por duplicado, sin sustancia problema y sin sustancia de referencia; para determinar los blancos analíticos. Disuelva las sustancias problema en el medio del ensayo (puede añadirse cómodamente mediante una solución madre concentrada) para obtener las concentraciones iniciales deseadas que, normalmente, son de 5-40 mg COD/l. Evalúe la sustancia de referencia, normalmente a una concentración inicial correspondiente a 20 mg de COD/l. Si se utilizan las soluciones madre de las sustancias problema o de referencia, hay que asegurarse de que la salinidad del medio de agua de mar no se modifique demasiado.
|
|
18.
|
Si se prevén efectos tóxicos, o no pueden descartarse, puede ser recomendable incluir un experimento de inhibición, por duplicado, en el diseño del ensayo. Añada las sustancias problema y de referencia al mismo recipiente; normalmente, la concentración de la sustancia de referencia es la misma que en el ensayo de control (es decir, 20 mg COD/l) para permitir la comparación.
|
|
19.
|
Aporte cantidades adecuadas de las soluciones de ensayo en los matraces Erlenmeyer (aproximadamente la mitad del volumen del frasco constituye una cantidad adecuada) y, posteriormente, ponga una tapa suelta en cada frasco (por ejemplo, papel de aluminio) que permita el intercambio de gases entre el frasco y el entorno. (Si se va a utilizar el análisis de COD, los tapones de algodón no son adecuados.) Coloque los recipientes en el agitador y agite continuamente a una velocidad suave (por ejemplo, 100 rpm) durante todo el ensayo. Controle la temperatura (15-20 °C, con un margen de ± 2 °C) y proteja los recipientes de la luz para evitar que aparezcan algas. Hay que asegurarse de que el aire esté libre de materiales tóxicos.
|
Ensayo de control fisicoquímico (opcional)
|
20.
|
Si se sospecha de la existencia de mecanismos abióticos de degradación o pérdida, como la hidrólisis (que constituye un problema solo con los análisis específicos), la volatilización o la adsorción, se recomienda realizar un experimento de control fisicoquímico. Esto se puede llevar a cabo añadiendo cloruro de mercurio (II) (HgCl2) (32) (50-100 mg/l) a los recipientes con sustancia problema para detener la actividad microbiana. Una reducción importante del COD o de la concentración de una sustancia específica en el ensayo de control fisicoquímico indica la presencia de mecanismos de eliminación abióticos. Si se utiliza cloruro de mercurio, debe prestarse atención a las interferencias o al envenenamiento catalítico en el análisis de COD.
|
Número de frascos
|
21.
|
En una serie típica se usan los siguientes frascos:
|
Frascos 1 y 2
|
:
|
contienen la sustancia problema (suspensión de ensayo).
|
|
Frascos 3 y 4
|
:
|
contienen solo agua de mar (blanco).
|
|
Frasco 5
|
:
|
contiene la sustancia de referencia (control del procedimiento).
|
|
Frasco 6
|
:
|
contiene la sustancia problema y la de referencia (control de toxicidad); es opcional.
|
|
Frasco 7
|
:
|
contiene la sustancia problema y un agente de esterilización (control estéril abiótico); es opcional.
|
|
Análisis de COD
|
22.
|
En el transcurso del ensayo, retire muestras a intervalos adecuados para analizar el COD (apéndice 1). Siempre se deben recoger las muestras al principio del ensayo (día 0) y el día 60. En total se necesita un mínimo de cinco muestras para describir el transcurso de la degradación. No se puede establecer un calendario fijo de muestreo, ya que la tasa de biodegradación varía. Lleve a cabo la determinación COD por duplicado en cada muestra.
|
Muestreo
|
23.
|
El volumen necesario de las muestras depende del método de análisis (análisis específico), del analizador de carbono utilizado y del procedimiento (filtración por membrana o centrifugado) que se seleccionen para el tratamiento de las muestras antes de determinar el carbono (puntos 25 y 26). Antes de realizar el muestreo, hay que asegurarse de que el medio del ensayo se mezcle bien y que cualquier material adherido a la pared del frasco quede disuelto o suspendido.
|
|
24.
|
Filtre por membrana o centrifugue inmediatamente después del muestreo. En caso necesario, conserve las muestras filtradas o centrifugadas a 2-4 °C, durante 48 horas como máximo, o por debajo de los -18 °C durante periodos más largos (si se sabe que la sustancia no se verá afectada, acidifique hasta un pH 2 antes de guardar las muestras).
|
|
25.
|
Los filtros de membrana (0,2-0,45 μm) resultan adecuados si se garantiza que no liberan carbono ni adsorben la sustancia en la fase de filtrado; por ejemplo, filtros de membrana de policarbonato. Algunos filtros de membrana están impregnados de agentes tensioactivos para la hidrofilización y pueden liberar cantidades considerables de carbono disuelto. Prepare estos filtros hirviéndolos en agua desionizada durante tres periodos consecutivos, cada uno de una hora. Tras la ebullición, conserve los filtros en agua desionizada. Elimine los 20 primeros ml del filtrado.
|
|
26.
|
El centrifugado de las muestras puede elegirse como alternativa a la filtración por membrana. Centrifugue a 40 000 ms– 2 (~ 4 000 g) durante 15 minutos, preferiblemente en una centrífuga refrigerada.
Nota: La diferenciación del carbono orgánico total (COT) con respecto al COD (COT/COD) mediante centrifugado a concentraciones muy bajas no parece funcionar, ya que bien no se eliminan todas las bacterias o bien se vuelve a disolver carbono como parte del plasma bacteriano. Con concentraciones del ensayo más altas (más de 10 mg C por litro), el error de centrifugado parece ser comparativamente pequeño.
|
Frecuencia de muestreo
|
27.
|
Si los análisis se realizan inmediatamente después del muestreo, evalúe el tiempo de muestreo siguiente teniendo en cuenta el resultado de la determinación analítica.
|
|
28.
|
Si las muestras se conservan (punto 24) para un análisis posterior, recoja más muestras del mínimo necesario de cinco. Analice en primer lugar las últimas muestras y, con una selección gradual “hacia atrás” de las muestras apropiadas para el análisis, se puede obtener una buena descripción de la curva de biodegradación con un número relativamente pequeño de determinaciones analíticas. Si no se ha producido degradación al final del ensayo, no es necesario analizar más muestras y, en ese caso, la estrategia “hacia atrás” puede ahorrar importantes costes analíticos.
|
|
29.
|
Si se observa una meseta en la curva de degradación antes del día 60, finalice el ensayo. Si la degradación ya ha empezado de manera evidente el día 60, pero no ha alcanzado una meseta, amplíe el experimento durante un tiempo adicional.
|
DATOS E INFORME
Tratamiento de los resultados
|
30.
|
Registre los resultados analíticos en la ficha de datos adjunta (apéndice 2) y calcule los valores de biodegradación tanto de la sustancia problema como de la sustancia de referencia a partir de la ecuación siguiente:

donde:
|
Dt
|
=
|
degradación porcentual de COD o eliminación de sustancia específica en el tiempo t.
|
|
Co
|
=
|
concentración inicial de COD o de la sustancia específica en el medio de ensayo.
|
|
Ct
|
=
|
concentración de COD o de la sustancia específica en el medio de ensayo en el tiempo t.
|
|
Cbl(0)
|
=
|
concentración inicial de COD o de la sustancia específica en el blanco.
|
|
Cbl(t)
|
=
|
concentración de COD o de la sustancia específica en el blanco en el tiempo t.
|
|
|
31.
|
Establezca la degradación como el porcentaje de eliminación de COD (degradación última) o de eliminación de la sustancia específica (degradación primaria) en el tiempo t. Calcule las concentraciones de COD con precisión de 0,1 mg por litro y redondee las medias de los valores Dt al porcentaje entero más próximo.
|
|
32.
|
Ilustre gráficamente el curso de la degradación en un diagrama, tal y como se indica en la figura “Validez e interpretación de los resultados”. Si no hay suficientes datos, calcule a partir de la curva la fase de latencia (tL) y el tiempo necesario para alcanzar la eliminación del 50 % a partir del final de la fase de latencia (t50).
|
Informe del ensayo
|
33.
|
El informe del ensayo debe incluir la información siguiente:
|
|
Sustancia problema:
|
—
|
naturaleza física y, en su caso, propiedades fisicoquímicas,
|
|
—
|
datos de identificación.
|
|
|
|
Condiciones de ensayo:
|
—
|
ubicación y descripción del lugar de muestreo; estado de contaminación y de nutrientes (recuento de colonias, nitrato, amonio y fosfato, si procede),
|
|
—
|
características de la muestra (fecha de muestreo, profundidad, aspecto, temperatura, salinidad), COD (opcional), tiempo transcurrido entre la recogida y el uso en el ensayo,
|
|
—
|
método utilizado (si procede) para envejecer el agua de mar,
|
|
—
|
método utilizado en el tratamiento previo (filtración o sedimentación) del agua de mar,
|
|
—
|
método utilizado para determinar el COD,
|
|
—
|
método utilizado para el análisis específico (opcional),
|
|
—
|
método utilizado para determinar el número de heterótrofos en el agua de mar (método de recuento de placas o procedimiento alternativo) (opcional),
|
|
—
|
otros métodos (opcionales) utilizados para caracterizar el agua de mar (mediciones de ATP, etc.).
|
|
|
|
Resultados:
|
—
|
datos analíticos indicados en una ficha de datos (apéndice 2),
|
|
—
|
el curso del ensayo de degradación se representa gráficamente en un diagrama que muestre la fase de latencia (tL), la pendiente y el tiempo (a partir del final de la fase de latencia) hasta alcanzar la eliminación del 50 % (t50). La fase de latencia puede estimarse gráficamente como se indica en la figura de la sección “Validez e interpretación de los resultados”, o se puede considerar más fácil como el tiempo necesario para una degradación del 10 %,
|
|
—
|
porcentaje de degradación medido cuando han transcurrido 60 días o al final del ensayo.
|
|
|
|
Discusión de los resultados.
|
|
Validez e interpretación de los resultados
|
34.
|
Los resultados obtenidos con las sustancias de referencia como, por ejemplo, benzoato sódico, acetato sódico o anilina, deben ser comparables con los resultados obtenidos en el ensayo interlaboratorios (3) (véase la sección “Sustancias de referencia”, punto 7). Si los resultados obtenidos con las sustancias de referencia son atípicos, el ensayo deberá repetirse utilizando otra muestra de agua de mar. Aunque es posible que los resultados de los ensayos de inhibición no siempre puedan interpretarse fácilmente debido a la contribución de COD por la sustancia problema, una reducción importante de la velocidad de eliminación de COD total, en comparación con la de control, constituye un signo positivo de efectos tóxicos.
|
|
35.
|
Debido a las concentraciones de ensayo relativamente altas que se utilizan en comparación con los sistemas más naturales (y, consiguientemente, a la proporción desfavorable entre las concentraciones de las sustancias problema y otras fuentes de carbono), el método debe considerarse como una prueba preliminar que se puede utilizar para indicar si una sustancia es o no fácilmente biodegradable. Por consiguiente, un resultado bajo no significa necesariamente que la sustancia problema no sea biodegradable en los entornos marinos, sino que indica que será necesario trabajar más para establecerlo.
En la figura siguiente se presenta un ejemplo de experimento de degradación teórico que ilustra una forma viable de estimar los valores de tL (duración de la “fase de latencia”) y t50 (intervalo de tiempo, a partir de tL), necesario para alcanzar una eliminación del 50 %.

|
MÉTODO DEL FRASCO CERRADO
INTRODUCCIÓN
|
1.
|
Este método es una variante con agua de mar del ensayo del frasco cerrado (5) y se estableció como resultado de un ensayo interlaboratorios organizado para la Comisión Europea (CE) por el Instituto de Calidad del Agua de Dinamarca (3).
|
|
2.
|
En común con el método del frasco de agitación marino adjunto, los resultados de este ensayo no se deben considerar indicaciones de biodegradabilidad fácil, sino que deben utilizarse específicamente para obtener información sobre la biodegradabilidad de las sustancias en entornos marinos.
|
PRINCIPIO DEL MÉTODO
|
3.
|
Una cantidad predeterminada de la sustancia problema se disuelve en el medio de ensayo en una concentración habitualmente de 2-10 mg de sustancia problema por litro (se pueden utilizar una o varias concentraciones). La solución se conserva en un frasco cerrado lleno en la oscuridad, en un baño a temperatura constante o en un entorno cerrado controlado a ± 1 °C, en un intervalo de 15-20 °C. En aquellos casos en los que el objetivo del estudio sea simular situaciones ambientales, se pueden realizar ensayos fuera de este intervalo de temperaturas normales, siempre que se realicen los ajustes adecuados para controlar la temperatura. La degradación se sigue mediante análisis del oxígeno durante un periodo de 28 días.
|
|
4.
|
El ensayo interlaboratorios demostró que si el ensayo se ampliaba a más de 28 días no podía recopilarse información útil, en la mayoría de los casos, debido a interferencias graves. Los valores de demanda biológica de oxígeno (DBO) en blanco eran excesivamente altos, probablemente debido al crecimiento en la pared, provocado por la falta de agitación, y a la nitrificación. Por lo tanto, la duración recomendada es de 28 días pero, si el valor de DBO en blanco se mantiene dentro del límite del 30 % (puntos 15 y 40), el ensayo podría prolongarse.
|
INFORMACIÓN SOBRE LA SUSTANCIA PROBLEMA
|
5.
|
A fin de saber si el ensayo puede aplicarse o no a una sustancia concreta, hay que conocer algunas de sus propiedades. La fórmula empírica es necesaria para calcular la demanda teórica de oxígeno (DTO) (véase el apéndice 3); de lo contrario, se debe calcular la demanda química de oxígeno (DQO) de la sustancia para que sirva de valor de referencia. El uso de la DQO es menos satisfactorio, ya que algunas sustancias no se oxidan completamente en la prueba de DQO.
|
|
6.
|
La solubilidad de la sustancia debe ser, como mínimo, de 2 mg/l, aunque en principio se pueden analizar sustancias menos solubles (por ejemplo, con un baño de ultrasonidos), así como sustancias volátiles. Disponer de información sobre la pureza o las proporciones relativas de los principales componentes de la sustancia problema es necesario para poder interpretar los resultados obtenidos, en particular cuando el resultado está próximo al nivel “umbral”.
|
|
7.
|
La información sobre la toxicidad de la sustancia para las bacterias, por ejemplo, como se mide en las pruebas de respiración a corto plazo (4), puede resultar muy útil para seleccionar las concentraciones adecuadas del ensayo y puede ser esencial para interpretar correctamente los valores bajos de biodegradación. No obstante, esta información no siempre es suficiente para interpretar los resultados obtenidos en el ensayo de biodegradación y el procedimiento descrito en el punto 27 resulta más adecuado.
|
SUSTANCIAS DE REFERENCIA
|
8.
|
Deben utilizarse sustancias de referencia adecuadas para comprobar la actividad microbiana de la muestra de agua de mar. Para ello se puede utilizar anilina, acetato sódico o benzoato sódico, por ejemplo. Se debe producir una degradación de estas sustancias, al menos del 60 % (de su DTO), en un intervalo de tiempo razonablemente corto; de lo contrario, se recomienda que el ensayo se repita con otra muestra de agua de mar.
|
|
9.
|
En el ensayo interlaboratorios de la CE, en el que se tomaron muestras de agua de mar en distintos lugares y en momentos distintos del año, la fase de latencia (tL) y el tiempo que se tarda en lograr una degradación del 50 % (t50), excluida la fase de latencia, fueron de 0 a 2 días y de 1 a 4 días, respectivamente, en relación con el benzoato sódico. En lo que respecta a la anilina, los valores de tL y t50 fueron de 0 a 7 y de 2 a 12 días, respectivamente.
|
REPRODUCIBILIDAD
|
10.
|
La reproducibilidad de los métodos se estableció en el ensayo interlaboratorios de la CE (3).
|
DESCRIPCIÓN DEL MÉTODO
Equipo
|
11.
|
Equipo normal de laboratorio, además de lo siguiente:
|
a)
|
se pueden utilizar frascos de DBO de 250 a 300 ml, con tapones de vidrio, o un frasco de cuello estrecho de 250 ml con tapones de vidrio;
|
|
b)
|
varios frascos de 2, 3 y 4 litros, con marcas de litro, para preparar el experimento y llenar los frascos de DBO;
|
|
c)
|
baño de agua o sala a temperatura constante para mantener los frascos a una temperatura constante (± 1 °C), sin luz;
|
|
d)
|
equipo para analizar el oxígeno disuelto;
|
|
e)
|
filtros de membrana de 0,2-0,45 μm (opcional);
|
|
f)
|
equipo para análisis específicos (opcional).
|
|
Agua de mar
|
12.
|
Recoja una muestra de agua de mar en un recipiente que se haya limpiado a fondo y transpórtela al laboratorio, preferiblemente en un plazo de uno o dos días desde su recogida. Durante el transporte, no permita que la temperatura de la muestra supere demasiado la temperatura que se vaya a utilizar en el ensayo.
|
|
13.
|
Identifique con precisión la ubicación del muestreo y descríbala en términos de su estado de contaminación y nutricional. En particular en lo que respecta a las aguas costeras o contaminadas, incluya en esta caracterización un recuento de colonias de microbios heterótrofos y la determinación de las concentraciones de nitrato, amonio y fosfato disueltos.
|
|
14.
|
Incluya los datos siguientes con respecto a la muestra de agua de mar:
|
—
|
profundidad a la que se ha tomado la muestra,
|
|
—
|
aspecto de la muestra (turbia, etc.),
|
|
—
|
temperatura en el momento de recogida,
|
|
—
|
carbono orgánico disuelto (COD),
|
|
—
|
tiempo transcurrido entre la recogida y el uso en el ensayo.
|
|
|
15.
|
Si el contenido en COD de la muestra resulta ser alto, o si se cree que la DBO en blanco tras 28 días puede ser superior al 30 % de la de las sustancias de referencia, se recomienda envejecer el agua de mar aproximadamente durante una semana antes de usarla.
|
|
16.
|
Envejezca la muestra conservándola en condiciones aeróbicas a la temperatura del ensayo y en la oscuridad o en luz difusa. En caso necesario, mantenga las condiciones aeróbicas mediante una aireación suave. Durante el envejecimiento, se reduce el contenido de material orgánico fácilmente degradable. En el ensayo interlaboratorios (3) no se reveló ninguna diferencia entre el potencial de degradación de las muestras de agua de mar envejecidas y recién recogidas.
|
|
17.
|
Antes de usarla, trate previamente el agua de mar para eliminar las partículas gruesas, por ejemplo con un filtro de nailon o un filtro de papel grueso (no deben ser filtros de membrana o GF-C), o mediante sedimentación y decantación. Indique el procedimiento utilizado. Aplique el tratamiento previo después del envejecimiento, si se va a utilizar.
|
Soluciones madre de nutrientes minerales
|
18.
|
Prepare las siguientes soluciones madre, utilizando reactivos de grado analítico:
|
a)
|
Ortofosfato potásico de dihidrógeno, KH2PO4
|
8,50 g
|
|
Ortofosfato dipotásico de hidrógeno, K2HPO4
|
21,75 g
|
|
Ortofosfato disódico de hidrógeno dihidratado, Na2HPO4 · 2H2O
|
33,30 g
|
|
Cloruro de amonio, NH4Cl
|
0,50 g
|
|
Disuelva y enrase con agua destilada a 1 litro.
|
|
|
b)
|
Cloruro de calcio, CaCl2
|
27,50 g
|
|
Disuelva y enrase con agua destilada a 1 litro.
|
|
|
c)
|
Sulfato de magnesio heptahidratado, MgSO4 · 7H2O
|
22,50 g
|
|
Disuelva y enrase con agua destilada a 1 litro.
|
|
|
d)
|
Cloruro de hierro (III) hexahidratado, FeCl3 · 6H2O
|
0,25 g
|
|
Disuelva y enrase con agua destilada a 1 litro.
|
|
La precipitación en la solución d) puede evitarse añadiendo una gota de HCl concentrado o 0,4 g de ácido etilendiaminotetraacético (EDTA, sal disódica) por litro. Si se forma un precipitado en una solución madre, cámbiela por una solución recién preparada.
|
Preparación del medio de ensayo
|
19.
|
Añada, por litro de agua de mar pretratada, 1 ml de cada una de las soluciones madre anteriormente mencionadas. Sature el medio de ensayo con aire, a la temperatura del ensayo, aireando con aire comprimido limpio durante unos 20 minutos. Determine la concentración de oxígeno disuelto por motivos de control. La concentración saturada de oxígeno disuelto en función de la salinidad y la temperatura puede leerse en el nomograma incluido con este método de ensayo (apéndice 4).
|
Inóculo
|
20.
|
No añada un inóculo concreto además de los microorganismos ya presentes en el agua de mar. Determine (opcionalmente) el número de heterótrofos que formen colonias en el medio de ensayo de agua de mar (y, preferiblemente, también en la muestra original de agua de mar), por ejemplo mediante recuento en placas, utilizando agar marino. Esto resulta deseable en particular con las muestras de lugares costeros o contaminados. Compruebe la actividad microbiana heterótrofa del agua de mar llevando a cabo una prueba con una sustancia de referencia.
|
Preparación de los frascos de ensayo
|
21.
|
Realice todas las manipulaciones necesarias, incluyendo el envejecimiento y el tratamiento previo del agua de mar, a la temperatura de ensayo seleccionada, entre 15 y 20 °C, garantizando la limpieza, pero no la esterilidad, de todos los recipientes de vidrio.
|
|
22.
|
Prepare grupos de frascos de DBO para la determinación de la DBO de las sustancias problema y de referencia en series experimentales simultáneas. Realice todos los análisis en frascos duplicados (en blanco y sustancias de referencia y problema); es decir, prepare dos frascos para cada determinación. Realice los análisis como mínimo los días 0, 5, 15 y 28 (cuatro determinaciones). Para realizar los análisis de oxígeno, cuatro determinaciones requieren un total de 3 × 2 × 4 = 24 frascos (en blanco y sustancias de referencia y problema), y, por lo tanto, unos 8 litros de medio de ensayo (para una concentración de sustancia de ensayo).
|
|
23.
|
Prepare soluciones separadas de las sustancias problema y de referencia en grandes frascos de volumen suficiente (punto 11), primero añadiendo las sustancias problema y de referencia, directamente o mediante una solución madre concentrada, a los frascos parcialmente llenos. Añada más medio de ensayo para conseguir las concentraciones finales deseadas. Si se utilizan soluciones madre de las sustancias problema o de referencia, hay que asegurarse de que la salinidad del medio de agua de mar no se modifique demasiado.
|
|
24.
|
Seleccione las concentraciones de las sustancias problema y de referencia, teniendo en cuenta lo siguiente:
|
a)
|
la solubilidad del oxígeno disuelto en el agua de mar a la temperatura del ensayo y la salinidad predominantes (véase el nomograma incluido en el apéndice 4),
|
|
b)
|
la DBO en blanco del agua de mar, y
|
|
c)
|
la biodegradabilidad prevista de la sustancia problema.
|
|
|
25.
|
A 15 °C y 20 °C y una salinidad de 32 partes por mil (agua oceánica), la solubilidad del oxígeno disuelto es aproximadamente de 8,1 y 7,4 mg/l, respectivamente. El consumo de oxígeno del agua de mar en sí (respiración en blanco) puede ser de 2 mg O2/l o más, si no se ha envejecido el agua de mar. Por ello, para garantizar una concentración de oxígeno significativa restante después de la oxidación de la sustancia problema, hay que utilizar una concentración inicial de la sustancia problema de unos 23 mg/l (dependiendo de la DTO) en caso de sustancias de las cuales se espera que se degraden completamente en las condiciones del ensayo (como las sustancias de referencia). Evalúe las sustancias menos degradables a concentraciones mayores, de unos 10 mg/l como máximo, siempre que no se produzcan efectos tóxicos. Puede resultar útil realizar ensayos paralelos con una concentración baja (unos 2 mg/l) y alta (unos 10 mg/l) de la sustancia problema.
|
|
26.
|
Debe determinarse un blanco de oxígeno en paralelo en frascos que no contengan ni la sustancia problema ni la de referencia.
|
|
27.
|
Si se van a determinar efectos inhibidores, prepare la siguiente serie de soluciones en frascos de gran tamaño separados (punto 13):
|
a)
|
2 mg por litro de una sustancia fácilmente degradable; por ejemplo, cualquiera de las sustancias de referencia mencionadas,
|
|
b)
|
x mg por litro de la sustancia problema (x es habitualmente 2),
|
|
c)
|
2 mg por litro de la sustancia fácilmente degradable más x mg por litro de la sustancia problema.
|
|
Ensayo de control fisicoquímico (opcional)
|
28.
|
Si se selecciona la opción de usar análisis específicos, se puede realizar un experimento fisicoquímico para comprobar si la sustancia problema se elimina mediante mecanismos abióticos, como la hidrólisis o la adsorción. Se puede llevar a cabo un ensayo de control fisicoquímico añadiendo cloruro de mercurio (II) (HgCl2) (33) (50–100 mg/l) a frascos duplicados con sustancia problema para detener la actividad microbiana. Una reducción importante de la concentración de una sustancia específica durante el ensayo indica la presencia de mecanismos de eliminación abióticos.
|
Número de frascos de DBO en una serie típica
|
29.
|
En una serie típica se usan los siguientes frascos:
|
—
|
al menos ocho que contengan la sustancia problema,
|
|
—
|
al menos ocho que contengan únicamente el agua de mar enriquecida con nutrientes,
|
|
—
|
al menos ocho que contengan la sustancia de referencia, y cuando sea necesario,
|
|
—
|
seis frascos que contengan las sustancias problema y de referencia (control de toxicidad).
|
|
PROCEDIMIENTO
|
30.
|
Tras su preparación, inyecte inmediatamente con sifón cada solución, desde el cuarto más bajo (no desde el fondo) del frasco grande adecuado, para llenar el grupo de frascos de DBO correspondiente. Analice inmediatamente los controles a cero (tiempo cero) para determinar el oxígeno disuelto (punto 33) o consérvelos para realizar un análisis químico posterior mediante precipitación con MnCl2 [cloruro de manganeso (II)] y NaOH (hidróxido sódico).
|
|
31.
|
Incube los frascos de DBO paralelos restantes a la temperatura del ensayo (15-20 °C), manténgalos en la oscuridad y retírelos de la zona de incubación a intervalos de tiempo adecuados (por ejemplo, tras 5, 15 y 28 días, como mínimo) y lleve a cabo un análisis para determinar el nivel de oxígeno disuelto (punto 33).
|
|
32.
|
Filtre con membrana (0,2-0,45 μm) o centrifugue durante 15 minutos las muestras para hacer los análisis específicos (opcional). Consérvelas, como máximo, durante 48 horas a 2-4 °C, o durante periodos más largos a – 18 °C, si no se van a analizar inmediatamente (si se sabe que la sustancia problema no se va a ver afectada, acidifique hasta un valor de pH 2 antes de guardarlas).
|
Determinación del oxígeno disuelto
|
33.
|
Determine la concentración de oxígeno disuelto mediante un método químico o electroquímico reconocido nacional o internacionalmente.
|
DATOS E INFORME
Tratamiento de los resultados
|
34.
|
Registre los resultados analíticos en las fichas de datos adjuntas (apéndice 5).
|
|
35.
|
Calcule la DBO como la diferencia de la reducción de oxígeno entre un blanco y una solución de la sustancia problema en las condiciones del ensayo. Divida la reducción de oxígeno neta entre la concentración (p/v) de la sustancia para expresar la DBO en forma de mg de DBO/mg de la sustancia problema. La degradación se define como la proporción de la demanda bioquímica de oxígeno con respecto a, preferiblemente, la demanda teórica de oxígeno (DTO) o la demanda química de oxígeno (DQO), expresada en forma de porcentaje (véase el punto 36).
|
|
36.
|
Calcule los valores de biodegradación de cada tiempo de muestreo, tanto para la sustancia problema como para la de referencia, con cualquiera de las ecuaciones siguientes:

donde:
|
DTO
|
=
|
demanda teórica de oxígeno (calculada, apéndice 3)
|
|
DQO
|
=
|
demanda química de oxígeno, determinada experimentalmente
|
Nota: En ocasiones, las dos formas de cálculo (porcentaje de la DTO o porcentaje de la DQO) no dan los mismos resultados; es preferible utilizar la DTO, ya que algunas sustancias no se oxidan completamente en el ensayo de DQO.
|
|
37.
|
Ilustre gráficamente el curso de la degradación en un diagrama (puede consultar un ejemplo en la sección “Validez e interpretación de los resultados”). Si no hay suficientes datos, calcule la fase de latencia (tL) y el tiempo (t50) para alcanzar la eliminación del 50 % a partir del final de la fase de latencia utilizando la curva de biodegradación.
|
|
38.
|
Si se utilizan análisis específicos (opcional), indique el porcentaje de degradación primaria como porcentaje de eliminación de la sustancia específica en el periodo del ensayo (corregido para tener en cuenta los blancos analíticos).
|
Informe del ensayo
|
39.
|
El informe del ensayo debe incluir la información siguiente:
|
|
Sustancia problema:
|
—
|
naturaleza física y, en su caso, propiedades fisicoquímicas;
|
|
—
|
datos de identificación.
|
|
|
|
Condiciones de ensayo:
|
—
|
ubicación y descripción del lugar de muestreo: estado de contaminación y nutrientes (recuento de colonias, nitrato, amonio y fosfato, si procede);
|
|
—
|
características de la muestra (fecha de muestreo, profundidad, aspecto, temperatura, salinidad), COD (opcional), tiempo transcurrido entre la recogida y el uso en el ensayo;
|
|
—
|
método utilizado (si procede) para envejecer el agua de mar;
|
|
—
|
método utilizado en el tratamiento previo (filtración o sedimentación) del agua de mar;
|
|
—
|
método utilizado para determinar la DQO (si se realiza);
|
|
—
|
método utilizado para medir el oxígeno;
|
|
—
|
procedimiento de dispersión de las sustancias poco solubles en las condiciones del ensayo;
|
|
—
|
método utilizado para determinar el número de heterótrofos en el agua de mar (método de recuento en placas o procedimiento alternativo);
|
|
—
|
método utilizado para determinar el COD en agua de mar (opcional);
|
|
—
|
método utilizado para el análisis específico (opcional);
|
|
—
|
otros métodos opcionales utilizados para caracterizar el agua de mar (mediciones de ATP, etc.).
|
|
|
|
Resultados:
|
—
|
datos analíticos indicados en una ficha de datos (adjunta en el apéndice 5);
|
|
—
|
el curso del ensayo de degradación se representa gráficamente en un diagrama que muestre la fase de latencia (tL), la pendiente y el tiempo (a partir del final de la fase de latencia) hasta alcanzar el 50 % de la absorción de oxígeno final provocada por la oxidación de la sustancia problema (t50). La fase de latencia puede estimarse gráficamente como se indica en la figura adjunta, o se puede considerar más fácilmente como el tiempo necesario para una degradación del 10 %;
|
|
—
|
porcentaje de degradación medida tras 28 días.
|
|
|
|
Discusión de los resultados.
|
|
Validez e interpretación de los resultados
|
40.
|
La respiración en blanco no debe superar el 30 % del oxígeno en el frasco del ensayo. Si no se puede satisfacer este criterio utilizando agua de mar recién recogida, debe envejecerse (estabilizarse) el agua de mar antes de usarla.
|
|
41.
|
Debe tenerse en cuenta la posibilidad de que las sustancias que contienen nitrógeno pueden afectar a los resultados.
|
|
42.
|
Los resultados obtenidos con las sustancias de referencia, benzoato sódico y anilina, deben ser comparables con los resultados obtenidos en el ensayo interlaboratorios (3) (punto 9). Si los resultados obtenidos con las sustancias de referencia son atípicos, el ensayo deberá repetirse utilizando otra muestra de agua de mar.
|
|
43.
|
La sustancia problema puede considerarse inhibidora para las bacterias (en la concentración utilizada) si la DBO de la mezcla de sustancias de referencia y problema es inferior a la suma de la DBO de las soluciones de las dos sustancias por separado.
|
|
44.
|
Debido a las concentraciones del ensayo relativamente altas en comparación con la mayoría de los sistemas naturales y, consiguientemente, a la proporción desfavorable entre las concentraciones de la sustancia problema y otras fuentes de carbono, el método debe considerarse como una prueba preliminar que se puede utilizar para indicar si una sustancia es o no fácilmente biodegradable. Por consiguiente, un resultado bajo no significa necesariamente que la sustancia problema no sea biodegradable en los entornos marinos, sino que indica que será necesario realizar más estudios para establecerlo.
A continuación se presenta un ejemplo de un experimento de degradación teórica que ilustra una forma viable de estimar los valores de tL (longitud de la “fase de latencia”) y t50, el intervalo de tiempo (que comienza en tL), necesarios para alcanzar el 50 % de la absorción de oxígeno final provocada por la oxidación de la sustancia problema:
|
BIBLIOGRAFÍA
|
(1)
|
de Kreuk J.F. and Hanstveit A.O. (1981). Determination of the biodegradability of the organic fraction of chemical wastes. Chemosphere, 10 (6); 561-573.
|
|
(2)
|
Capítulo C.4-B del presente anexo. Determinación de biodegradabilidad “fácil”, parte III, ensayo de detección de la OCDE modificado.
|
|
(3)
|
Nyholm N. and Kristensen P. (1987). Screening Test Methods for Assessment of Biodegradability of Chemical Substances in Seawater. Final Report of the ring test programme 1984-1985, marzo de 1987, Comisión de las Comunidades Europeas.
|
|
(4)
|
Capítulo C.11 del presente anexo. Biodegradación. Lodo activado: prueba de inhibición de la respiración.
|
|
(5)
|
Capítulo C.4-E del presente anexo. Determinación de la biodegradabilidad “fácil”, parte VI, ensayo del frasco cerrado.
|
Apéndice 1
Determinación del carbono orgánico en agua de mar
MÉTODO DEL FRASCO DE AGITACIÓN
Para determinar el carbono orgánico de una muestra de agua, los compuestos orgánicos de la muestra se oxidan para producir dióxido de carbono, generalmente utilizando una de las tres técnicas siguientes:
|
—
|
oxidación húmeda por persulfato/irradiación UV;
|
|
—
|
oxidación húmeda por persulfato/temperatura alta (116-130 °C);
|
El CO2 formado se cuantifica por espectrometría de infrarrojos o volumetría. Otra posibilidad es que el CO2 se reduzca a metano, que se cuantifica en un detector de ionización de llama (FID).
El método de persulfato/UV se utiliza habitualmente para analizar agua “limpia” con un bajo contenido en partículas. Los dos últimos métodos pueden aplicarse a la mayoría de los tipos de muestras de agua, ya que la oxidación por persulfato/temperatura alta es la más adecuada para las muestras de bajo nivel, y la técnica de combustión se puede aplicar a las muestras con un contenido de carbono orgánico no volátil (CONV) muy por encima de 1 mg C/l.
Interferencias
Los tres métodos dependen de la eliminación o la compensación del carbono inorgánico (CI) presente en la muestra. La purga de CO2 de la muestra acidificada es el método que se utiliza con mayor frecuencia para eliminar el CI, aunque esto también provoca una pérdida de compuestos orgánicos volátiles (1). La eliminación completa o la compensación del CI deben garantizarse para cada matriz de la muestra y el carbono orgánico volátil (COV) debe determinarse además del CONV, en función del tipo de muestra.
Las concentraciones altas de cloruro dan como resultado una reducción de la eficacia de la oxidación con el método de persulfato/UV (2). Sin embargo, la aplicación de un reactivo de oxidación modificado por la adición de nitrato de mercurio (II) puede eliminar esta interferencia. Se recomienda utilizar el máximo volumen de muestra tolerable para evaluar cada tipo de muestra que contenga cloruro. Las concentraciones altas de sal en la muestra analizada mediante el método de combustión pueden provocar que el catalizador se cubra de sal y una corrosión excesiva del tubo de combustión. Se deben tomar las precauciones indicadas en el manual del fabricante.
Las muestras muy turbias, así como las muestras que contienen partículas, pueden oxidarse de forma incompleta cuando se utiliza el método de persulfato/UV.
Ejemplo de método adecuado
El carbono orgánico no volátil se determina mediante oxidación con persulfato/irradiación UV y la consiguiente cuantificación del CO2 formado mediante espectrometría de infrarrojos no dispersiva.
El reactivo de oxidación se modifica de acuerdo con las sugerencias que se dan en (2), tal y como se describe en el manual del fabricante:
|
a)
|
8,2 g de HgCl2 y 9,6 g de Hg(NO3)2 · H2O se disuelven en varios cientos de mililitros de agua de reactivo con baja concentración de carbono.
|
|
b)
|
20 g de K2S2O8 se disuelven en la solución con sales de mercurio.
|
|
c)
|
Se añaden a la mezcla 5 ml de HNO3 (conc.).
|
|
d)
|
El reactivo se diluye hasta llegar a 1 000 ml.
|
La interferencia del cloruro se elimina utilizando un volumen de muestra de 40 μl para un contenido de cloruro del 10 %, y un volumen de muestra de 200 μl para un contenido de cloruro al 1,9 %. Se pueden analizar de acuerdo con este método muestras con grandes concentraciones de cloruro o volúmenes de muestras más grandes siempre que se evite la acumulación de cloruro en el recipiente de oxidación. Posteriormente se puede determinar el carbono orgánico volátil, si procede, en función del tipo de muestra en cuestión.
BIBLIOGRAFÍA
|
(1)
|
ISO, Calidad del agua. Determinación del carbono orgánico total. Proyecto de norma internacional ISO/DIS 8245, 16 de enero de 1986.
|
|
(2)
|
American Public Health Association, Standard Methods for the Estimation of Water and Wastewater. American Water Works Association y Water Pollution Control Federation, 16a ed., 1985.
También de interés (presenta una descripción de un sistema de autoanálisis):
|
|
(3)
|
Schreurs W. (1978). An automated colorimetric method for the determination of dissolved organic carbon in seawater by UV destruction. Hydrobiological Bulletin 12, pp. 137-142.
|
Apéndice 2
Biodegradación en agua de mar
MÉTODO DEL FRASCO DE AGITACIÓN
FICHA DE DATOS
|
2.
|
FECHA DE COMIENZO DEL ENSAYO:
|
|
3.
|
SUSTANCIA PROBLEMA:
Nombre:
|
Concentración de solución madre:
|
mg/l como sustancia
|
|
Concentración inicial en el medio, to:
|
mg/l como sustancia
|
|
:
|
mg COD/l
|
|
|
4.
|
AGUA DE MAR:
Origen:
Fecha de recogida:
Profundidad a la que se ha tomado la muestra:
Aspecto en el momento de recogida (por ejemplo, turbia, etc.):
|
Salinidad en el momento de recogida:
|
‰
|
|
Temperatura en el momento de recogida:
|
°C
|
|
COD “x” horas después de la recogida:
|
mg/l
|
Tratamiento previo al ensayo (por ejemplo, filtración, sedimentación, envejecimiento, etc.):
|
Recuento de colonias microbianas
|
|
colonias/ml
|
|
|
|
colonias/ml
|
|
Otras características
|
|
|
|
|
5.
|
DETERMINACIONES DE CARBONO:
Analizador de carbono:
|
|
No de frasco
|
|
COD tras n días (mg/l)
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
Ensayo: agua de mar enriquecida con nutrientes con sustancia problema
|
1
|
a1
|
|
|
|
|
|
|
a2
|
|
|
|
|
|
|
media, Ca(t)
|
|
|
|
|
|
|
2
|
b1
|
|
|
|
|
|
|
b2
|
|
|
|
|
|
|
media, Cb(t)
|
|
|
|
|
|
|
En blanco: agua enriquecida con nutrientes sin sustancia problema
|
1
|
c1
|
|
|
|
|
|
|
c2
|
|
|
|
|
|
|
media, Cc(t)
|
|
|
|
|
|
|
2
|
d1
|
|
|
|
|
|
|
d2
|
|
|
|
|
|
|
media, Cd(t)
|
|
|
|
|
|
| media,

|
|
|
|
|
|
|
|
|
|
|
|
|
|
6.
|
EVALUACIÓN DE LOS DATOS EN BRUTO:
|
No de frasco
|
Cálculo de los resultados
|
% de degradación tras n días
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
1
|
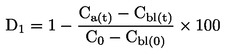
|
0
|
|
|
|
|
|
2
|
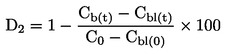
|
0
|
|
|
|
|
|
Media (34)
|

|
0
|
|
|
|
|
|
Nota:
|
Se pueden utilizar formatos similares cuando la degradación vaya seguida de un análisis específico y para la sustancia de referencia y los controles de toxicidad.
|
|
|
7.
|
DEGRADACIÓN ABIÓTICA (opcional)
|
|
Tiempo (días)
|
|
0
|
t
|
|
Conc. de COD (mg/l) en el control estéril
|
Cs(o)
|
Cs(t)
|

|
Apéndice 3
Cálculo de la demanda bioquímica teórica y de oxígeno
MÉTODO DEL FRASCO CERRADO
La DTO de la sustancia CcHhClclNnNanaOoPpSs de peso molecular PM se calcula con:
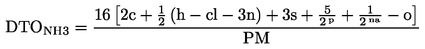
Este cálculo implica que C se mineraliza a CO2, H a H2O, P a P2O5, y Na a Na2O. El halógeno se elimina como halogenuro de hidrógeno y el nitrógeno, como amoníaco.
Ejemplo:
Glucosa C6H12O6, PM = 180

Los pesos moleculares de las sales distintas a las de los metales alcalinos se calculan con arreglo al supuesto de que las sales se han hidrolizado.
Se supone que el azufre se oxida al estado + 6.
Ejemplo:
n-Dodecilbenceno-sulfonato de sodio C18H29SO3Na, PM = 348

En el caso de las sustancias que contienen nitrógeno, este puede eliminarse como amoníaco, nitrito o nitrato, con arreglo a las distintas demandas bioquímicas teóricas de oxígeno.


Supongamos que se ha observado la formación completa de nitrato mediante análisis en el caso de una amina secundaria:
(C12H25)2 NH, PM = 353

Apéndice 4
Apéndice 5
Biodegradación en agua de mar
MÉTODO DEL FRASCO CERRADO
FICHA DE DATOS
|
2.
|
FECHA DE COMIENZO DEL ENSAYO:
|
|
3.
|
SUSTANCIA PROBLEMA:
Nombre:
|
Concentración de solución madre:
|
mg/l
|
|
Conc. inicial en medio de agua de mar:
|
mg/l
|
|
DTO o DQO:
|
mg de O2/mg de sustancia problema
|
|
|
4.
|
AGUA DE MAR:
Origen:
Fecha de recogida:
Profundidad a la que se ha tomado la muestra:
Aspecto en el momento de recogida (por ejemplo, turbia, etc.):
|
Salinidad en el momento de recogida:
|
‰
|
|
Temperatura en el momento de recogida:
|
°C
|
|
COD “x” horas después de la recogida:
|
mg/l
|
Tratamiento previo al ensayo (por ejemplo, filtración, sedimentación, envejecimiento, etc.):
|
Recuento de colonias microbianas
|
|
colonias/ml
|
|
|
|
colonias/ml
|
|
Otras características
|
|
|
|
|
5.
|
MEDIO DE ENSAYO:
|
Temperatura tras la aireación:
|
°C
|
|
Concentración de O2 tras la aireación y que permanece antes del inicio del ensayo:
|
mg de O2/l
|
|
|
6.
|
DETERMINACIÓN DEL OD:
Método: Winkler/electrodo
|
|
No de frasco
|
|
mg de O2/l después de n días
|
|
0
|
5
|
15
|
28
|
|
Ensayo: agua de mar enriquecida con nutrientes con sustancia problema
|
1
|
a1
|
|
|
|
|
|
2
|
a2
|
|
|
|
|
|
Media del ensayo
|

|
|
|
|
|
|
Blanco: agua de mar enriquecida con nutrientes, sin sustancia problema
|
1
|
c1
|
|
|
|
|
|
2
|
c2
|
|
|
|
|
|
Media del blanco
|

|
|
|
|
|
Nota: Pueden utilizarse formatos similares para las sustancias de referencia y los controles de toxicidad.
|
|
7.
|
REDUCCIÓN DEL OD: % DEGRADACIÓN ( %D):
|
|
Reducción del OD tras n días
|
|
5
|
15
|
28
|
|
(mb
– mt
) (35)
|
|
|
|
|

|
|
|
|
|
C.43. BIODEGRADABILIDAD ANAERÓBICA DE LAS SUSTANCIAS ORGÁNICAS EN LODO DIGERIDO: POR MEDICIÓN DE LA PRODUCCIÓN DE GASES
INTRODUCCIÓN
|
1.
|
El presente método de ensayo reproduce las directrices de ensayo (TG) 311 de la OCDE (2006). Hay una serie de ensayos de cribado para evaluar la biodegradabilidad aeróbica de las sustancias orgánicas [métodos de ensayo C.4, C.9, C.10 y C.11 (1) y TG 302C de la OCDE (2)], y los resultados de la aplicación de estos métodos se han utilizado con buenos resultados para predecir el destino de las sustancias en el entorno aeróbico, en particular en las fases aeróbicas del tratamiento de las aguas residuales. Hay diversas proporciones de sustancias insolubles en agua, así como de sustancias que se adsorben sobre sólidos de las aguas residuales, que también se tratan aeróbicamente, ya que están presentes en las aguas residuales sedimentadas. Sin embargo, las grandes fracciones de estas sustancias están fijadas a los lodos sedimentados primarios, que se separan de las aguas residuales sin tratar, en depósitos de sedimentación, antes de tratar aeróbicamente las aguas residuales sedimentadas, o los sobrenadantes. El lodo, que contiene algunas de las sustancias solubles en el líquido intersticial, pasa a continuación a digestores calentados para su tratamiento anaeróbico. Hasta ahora no había ensayos en esta serie para evaluar la biodegradabilidad anaeróbica en los digestores anaeróbicos, y el presente ensayo va dirigido a cubrir esa laguna; no es aplicable necesariamente a otros compartimentos ambientales anóxicos.
|
|
2.
|
Se han utilizado para evaluar la biodegradabilidad anaeróbica, con buenos resultados, técnicas respirométricas que miden las cantidades de gas producidas, principalmente metano (CH4) y dióxido de carbono (CO2), en condiciones anaeróbicas. Birch et al. (3) revisaron estos procedimientos y concluyeron que el trabajo de Shelton y Tiedje (4), basado en estudios anteriores (5) (6) (7), era el más exhaustivo. El método (4), que otros (8) siguieron desarrollando y se ha convertido en la norma en Estados Unidos (9) (10), no resolvía los problemas relacionados con las distintas solubilidades del CO2 y CH4 en el medio del ensayo ni con el cálculo de la producción teórica de gas de una sustancia problema. El informe ECETOC (3) recomendaba la medición adicional del contenido en carbono inorgánico disuelto (CID) del líquido sobrenadante, lo que hacía que la técnica pudiera aplicarse de forma más general. El método ECETOC se sometió a un ejercicio de calibración internacional (o ensayo interlaboratorios) y se convirtió en la norma ISO 11734 (11).
|
|
3.
|
Este método de ensayo, basado en la norma ISO 11734 (11), describe un método de cribado para evaluar la potencial biodegradabilidad anaeróbica de las sustancias orgánicas en una situación concreta (es decir, en un digestor anaeróbico, en un momento y dentro de un intervalo de concentración de microorganismos determinados). Como se utiliza un lodo diluido con una concentración relativamente alta de la sustancia problema y la duración del ensayo suele ser superior al tiempo de retención en los digestores anaeróbicos, las condiciones del ensayo no se corresponden exactamente con las condiciones en los digestores anaeróbicos, ni resultan aplicables para evaluar la biodegradabilidad anaeróbica de las sustancias orgánicas en unas condiciones ambientales distintas. El lodo se expone a la sustancia problema durante un periodo máximo de 60 días, que es un periodo superior al tiempo de retención normal del lodo (de 25 a 30 días) en los digestores anaeróbicos, aunque en las instalaciones industriales los tiempos de retención pueden ser mucho más largos. Las previsiones basadas en los resultados de este ensayo no son tan seguras como en el caso de la biodegradación aeróbica, ya que las pruebas acumuladas sobre el comportamiento de las sustancias problema en los ensayos aeróbicos “fáciles” y en los ensayos de simulación y el entorno aeróbico son suficientes para asegurar que existe una relación; en lo que respecta al entorno anaeróbico hay muy pocas pruebas similares. Se puede suponer que la biodegradación anaeróbica completa se produce si se logra entre el 75 y el 80 % de la producción de gas teórica. Las grandes proporciones de sustancia con respecto a la biomasa que se utilizan en estos ensayos implican que una sustancia que supera las pruebas presenta una mayor probabilidad de degradación en un digestor anaeróbico. Por otra parte, es posible que las sustancias que no consiguen convertirse en gas durante el ensayo no persistan necesariamente con unas proporciones de sustancia-biomasa más realistas ambientalmente. Asimismo, se producen otras reacciones anaeróbicas por las que las sustancias pueden degradarse, al menos parcialmente, por ejemplo mediante decloración, pero este ensayo no detecta dichas reacciones. No obstante, al aplicar métodos analíticos específicos para determinar la sustancia problema, se puede seguir su desaparición (véanse los puntos 6, 30, 44 y 53).
|
PRINCIPIO DEL ENSAYO
|
4.
|
El lodo digerido lavado (36), que contiene concentraciones bajas (< 10 mg/l) de carbono inorgánico (CI), se diluye unas diez veces hasta lograr una concentración de sólidos total de 1 a 3 g/l, y se incuba a 35 °C ± 2 °C en recipientes sellados con la sustancia problema a 20-100 mg C/l, durante 60 días como máximo. Se mide la actividad del lodo llevando a cabo controles en blanco paralelos con inóculo de lodo en el medio, pero sin la sustancia problema.
|
|
5.
|
Se mide el aumento de la presión de los espacios libres de los recipientes, resultante de la producción de dióxido de carbono y metano. Gran parte del CO2 producido se disolverá en la fase líquida o se transformará en carbonato o carbonato de hidrógeno en las condiciones del ensayo. Este carbono inorgánico se mide al final del ensayo.
|
|
6.
|
La cantidad de carbono (inorgánico más metano) resultante de la biodegradación de la sustancia problema se calcula a partir de la producción de gas neta y de la formación de CI neta en la fase líquida que excedan de los valores del control en blanco. El grado de biodegradación se calcula a partir del CI total y del C metánico producidos, en forma de porcentaje de la cantidad medida o calculada del carbono que se añade como sustancia problema. El proceso de biodegradación puede seguirse realizando mediciones intermedias solamente de la producción de gas. Además, se puede determinar la biodegradación primaria mediante análisis específicos al principio y al final del ensayo.
|
INFORMACIÓN SOBRE LA SUSTANCIA PROBLEMA
|
7.
|
Es necesario conocer las características de pureza, hidrosolubilidad, volatilidad y adsorción de la sustancia problema para poder interpretar correctamente los resultados. El contenido de carbono orgánico ( % p/p) de la sustancia problema debe conocerse a partir de su estructura química o por medición. En lo que respecta a las sustancias problema volátiles, conocer la constante de la ley de Henry, por medición o por cálculo, resulta útil para decidir si el ensayo es aplicable o no. También es conveniente disponer de información sobre la toxicidad de la sustancia problema para las bacterias anaeróbicas a la hora de seleccionar una concentración de ensayo adecuada y para interpretar los resultados que indiquen una escasa biodegradabilidad. Se recomienda incluir un control de la inhibición salvo que se sepa que la sustancia problema no es inhibidora de la actividad microbiana anaeróbica [véanse el punto 21 y la norma ISO 13641-1 (12)].
|
APLICABILIDAD DEL MÉTODO DE ENSAYO
|
8.
|
El método de ensayo puede aplicarse a sustancias hidrosolubles; también puede aplicarse a sustancias poco solubles e insolubles, siempre que se utilice un método de dosificación exacta; por ejemplo, véase la norma ISO 10634 (13). En general, la decisión se ha de tomar caso por caso en lo que respecta a las sustancias volátiles. Es posible que haya que aplicar medidas especiales como, por ejemplo, impedir la liberación de gas durante el ensayo.
|
SUSTANCIAS DE REFERENCIA
|
9.
|
Para comprobar el procedimiento, se realiza un ensayo con una sustancia de referencia preparando recipientes adecuados en paralelo como parte de las series normales del ensayo. El fenol, el benzoato sódico y el polietilenglicol 400 son algunos ejemplos y cabría esperar que se degraden en más de un 60 % de la producción de gas teórica (es decir, metano y carbono inorgánico) en un plazo de 60 días (3) (14).
|
REPRODUCIBILIDAD DE LOS RESULTADOS DEL ENSAYO
|
10.
|
En un ensayo interlaboratorios internacional (14) se logró una buena reproducibilidad en las mediciones de la presión de gas entre recipientes triplicados. La desviación típica relativa (coeficiente de variación, COV) se encontraba generalmente por debajo del 20 %, aunque este valor aumentaba con frecuencia a más del 20 % en presencia de sustancias tóxicas o cerca del final del periodo de incubación de 60 días. En los recipientes de volumen inferior a 150 ml también se encontraron desviaciones mayores. Los valores finales de pH de los medios del ensayo se encontraban dentro del intervalo de 6,5 a 7,0.
|
|
11.
|
En el ensayo interlaboratorios se obtuvieron los resultados siguientes.
|
Sustancia problema
|
Datos totales
n1
|
Degradación media
(de los datos totales)
(%)
|
Desviación típica relativa
(de los datos totales)
(%)
|
Datos válidos
n2
|
Degradación media
(de los datos válidos)
(%)
|
Desviación típica relativa
(de los datos válidos)
(%)
|
Datos > 60 % de degradación en los ensayos válidos
n3
|
|
Ácido palmítico
|
36
|
68,7 ± 30,7
|
45
|
27
|
72,2 + 18,8
|
26
|
19 = 70 % (37)
|
|
Polietilenglicol 400
|
38
|
79,8 ± 28,0
|
35
|
29
|
77,7 + 17,8
|
23
|
24 = 83 % (37)
|
|
|
12.
|
Los coeficientes de variación de la media de todos los valores obtenidos con el ácido palmítico y el polietilenglicol 400 ascendieron al 45 % (n = 36) y al 35 % (n = 38), respectivamente. Cuando los valores inferiores al 40 % y superiores al 100 % se omitieron (se supuso que los primeros se debían a condiciones subóptimas y los segundos, a razones desconocidas), los COV se redujeron al 26 % y al 23 %, respectivamente. Las proporciones de valores “válidos” que lograron al menos una degradación del 60 % fueron un 70 % para el ácido palmítico y un 83 % para el polietilenglicol 400. Las proporciones de la biodegradación porcentual derivadas de las mediciones de CID fueron relativamente bajas, pero variables. En lo que respecta al ácido palmítico, el intervalo fue del 0 al 35 %, con una media del 12 % y un COV del 92 %; para el polietilenglicol 400, el intervalo osciló entre el 0 y el 40 %, con una media del 24 % y un COV del 54 %.
|
DESCRIPCIÓN DEL MÉTODO DE ENSAYO
Equipo
|
13.
|
Se requieren un equipo de laboratorio habitual y los elementos siguientes:
|
a.
|
Incubadora a prueba de chispas y controlada a 35 °C ± 2 °C.
|
|
b.
|
Recipientes de ensayo de vidrio resistente a la presión, de un tamaño nominal adecuado (38), cada uno de ellos con un tapón estanco a los gases capaz de resistir 2 bar aproximadamente. El volumen de espacio libre debe ser aproximadamente del 10 al 30 % del volumen total. Si se libera biogás regularmente, un volumen de espacio libre en torno al 10 % resulta apropiado, pero si la liberación de gas se realiza solo al final del ensayo, resulta apropiado un 30 %. Se recomienda usar frascos de suero de vidrio con un volumen nominal de 125 ml y un volumen total aproximado de 160 ml, sellados con un tapón de frascos de suero (39) y con cápsulas de aluminio, cuando se libera presión cada vez que se realiza el muestreo;
|
|
c.
|
Dispositivo (40) para medir la presión, adaptado para permitir la medición y la evacuación del gas producido; por ejemplo, un manómetro manual preciso y conectado a una aguja de jeringa adecuada; una válvula de tres vías estanca a los gases facilita la liberación del exceso de presión (apéndice 1). Esto es necesario para mantener el volumen interno de los tubos del transductor de presión y de la válvula lo más bajo posible, de forma que los errores introducidos al ignorar el volumen del equipo resulten insignificantes.
Nota: Las lecturas de presión se utilizan directamente para calcular la cantidad de carbono producido en el espacio libre (puntos 42 a 44). Por otra parte, las lecturas de presión pueden convertirse en volúmenes (a 35 °C, presión atmosférica) del gas producido mediante un gráfico de conversión. Este gráfico se elabora a partir de los datos obtenidos inyectando volúmenes conocidos de gas nitrógeno en una serie de recipientes de ensayo (por ejemplo, frascos de suero) a 35° +/- 2 °C y registrando las lecturas resultantes de la presión estabilizada (véase el apéndice 2). El cálculo se incluye en la nota del punto 44.
Advertencia: Se debe proceder con cuidado para evitar lesiones producidas con agujas cuando se utilicen microjeringas.
|
|
d.
|
Analizador de carbono, adecuado para calcular directamente el carbono inorgánico en un intervalo de 1 a 200 mg/l.
|
|
e.
|
Jeringas de alta precisión para tomar muestras gaseosas y líquidas.
|
|
f.
|
Agitadores magnéticos y sus barritas (opcional).
|
|
g.
|
Caja de guantes (recomendado).
|
|
Reactivos
|
14.
|
Deben utilizarse siempre reactivos de pureza analítica.
|
Agua
|
15.
|
Agua destilada o desionizada (desoxigenada mediante corriente de gas nitrógeno con menos de 5 μl/l de oxígeno) que contenga menos de 2 mg/l de carbono orgánico disuelto (COD).
|
Medio de ensayo
|
16.
|
El medio de dilución se prepara para contener los componentes siguientes en las cantidades indicadas:
|
Fosfato potásico de dihidrógeno anhidro (KH2PO4)
|
0,27 g
|
|
Fosfato disódico de hidrogeno dodecahidratado (Na2HPO4 · 12H2O)
|
1,12 g
|
|
Cloruro de amonio (NH4Cl)
|
0,53 g
|
|
Cloruro de calcio dihidratado (CaCl2 · 2H2O)
|
0,075g
|
|
Cloruro de magnesio hexahidratado (MgCl2 · 6H2O)
|
0,10 g
|
|
Cloruro de hierro (II) tetrahidratado (FeCl2 · 4H2O)
|
0,02 g
|
|
Resazurina (indicador de oxígeno)
|
0,001g
|
|
Sulfuro sódico nonahidratado (Na2S · 9H2O)
|
0,10 g
|
|
Solución madre de oligoelementos (opcional, punto 18)
|
10 ml
|
|
Añadir agua desoxigenada (punto 15)
|
Hasta 1 litro
|
Nota: Debe utilizarse sulfuro sódico recién suministrado o debe lavarse y secarse antes de usarlo para garantizar suficiente capacidad reductora. El ensayo puede realizarse sin utilizar una caja de guantes (véase el punto 26). En ese caso, la concentración final de sulfuro sódico en el medio debe aumentarse a 0,20 g de Na2S×9H2O por litro. El sulfuro sódico también puede añadirse de una solución madre anaeróbica adecuada a través del tapón de los recipientes de ensayo cerrados, ya que este procedimiento reducirá el riesgo de oxidación. El sulfuro sódico puede reemplazarse con citrato de titanio (III), que se añade a través del tapón de los recipientes de ensayo cerrados con una concentración final de 0,8 a 1,0 mmol/l. El citrato de titanio (III) es un agente reductor muy eficaz y de baja toxicidad, que se prepara de la forma siguiente: disuelva 2,94 g de citrato trisódico dihidratado en 50 ml de agua desoxigenada (para producir una solución de 200 mmol/l) y añada 5 ml de una solución de cloruro de titanio (III) al 15 % (p/v). Neutralice a pH 7 ± 0,2 con álcalis minerales y póngalo en un recipiente adecuado en corriente de nitrógeno. La concentración de citrato de titanio (III) de esta solución madre es de 164 mmol/l.
|
|
17.
|
Mezcle los componentes del medio de ensayo, excepto el agente reductor (sulfuro sódico, citrato de titanio) y pase por la solución una corriente de gas nitrógeno durante unos 20 minutos, justo antes de usarla, para eliminar el oxígeno. A continuación, añada el volumen adecuado de la solución recién preparada del agente reductor (preparada en agua desoxigenada), justo antes de usar el medio. Ajuste el pH del medio, en caso necesario, con ácido mineral o álcali diluido a 7 ± 0,2.
|
Solución madre de oligoelementos (opcional)
|
18.
|
Se recomienda que el medio de ensayo contenga los siguientes oligoelementos para mejorar los procesos de degradación anaeróbicos, especialmente si se utilizan bajas concentraciones (por ejemplo, 1 g/l) de inóculo (11).
|
Cloruro de manganeso tetrahidratado (MnCl2 · 4H2O)
|
50 mg
|
|
Ácido bórico (H3BO3)
|
5 mg
|
|
Cloruro de cinc (ZnCl2)
|
5 mg
|
|
Cloruro de cobre (II) (CuCl2)
|
3 mg
|
|
Molibdato disódico dihidratado (Na2MoO4 · 2H2O)
|
1 mg
|
|
Cloruro de cobalto hexahidratado (CoCl2 · 6H2O)
|
100 mg
|
|
Cloruro de níquel hexahidratado (NiCl2 · 6H2O)
|
10 mg
|
|
Selenito disódico (Na2SeO3)
|
5 mg
|
|
Añadir agua desoxigenada (punto 15)
|
Hasta 1 litro
|
|
Sustancia problema
|
19.
|
Añada la sustancia problema como solución madre, suspensión, emulsión o directamente como sólido o líquido, o absorbido en un filtro de fibra de vidrio para conseguir una concentración no superior a 100 mg/l de carbono orgánico. Si se utilizan soluciones madre, preparar una solución adecuada con agua (punto 15) (previamente desoxigenada mediante corriente de gas nitrógeno), de una fuerza tal que el volumen añadido sea inferior al 5 % del volumen total de la mezcla de reacción. Ajuste el pH de la solución madre a un pH de 7 ± 0,2 en caso necesario. En lo que respecta a las sustancias insuficientemente solubles en agua, se debe consultar la norma ISO 10634 (13). Si se utiliza un disolvente, prepare un control adicional con solamente el disolvente añadido al medio inoculado. Deben evitarse los disolventes orgánicos conocidos por inhibir la producción de metano, tales como el cloroformo y el tetracloruro de carbono.
Advertencia: Las sustancias problema tóxicas deben manipularse con cuidado, así como aquellas sustancias cuyas propiedades no se conozcan.
|
Sustancias de referencia
|
20.
|
Se han utilizado con buenos resultados para comprobar el procedimiento sustancias de referencia como el benzoato sódico, el fenol y el polietilenglicol 400, con una biodegradación superior al 60 % en 60 días. Prepare una solución madre (en agua desoxigenada) de la sustancia de referencia seleccionada, de la misma forma que con la sustancia problema, y ajuste el pH a 7 ± 0,2 en caso necesario.
|
Control de inhibición (condicional)
|
21.
|
Con el fin de obtener información sobre la toxicidad de la sustancia problema para los microorganismos anaeróbicos y averiguar cuál es la concentración de ensayo más adecuada, añada la sustancia problema y la sustancia de referencia a un recipiente que contenga el medio de ensayo (véase el punto 16), cada una con las mismas concentraciones añadidas, respectivamente [véanse los puntos 19 y 20 y la norma ISO 13641-1 (12)].
|
Lodo digerido
|
22.
|
Recoja el lodo digerido de un digestor de una planta de tratamiento de aguas residuales que procese sobre todo aguas domésticas. El lodo debe caracterizarse completamente y debe incluirse su información de referencia (véase el punto 54). Si se ha previsto utilizar un inóculo adaptado, puede plantearse el uso de un lodo digerido de una planta de tratamiento de aguas residuales industriales. Utilice frascos de cuello ancho hechos de polietileno de alta densidad o de un material similar, que se pueda expandir, para recoger el lodo digerido. Añada lodo hasta que quede a 1 cm aproximadamente de la parte superior de los frascos y selle herméticamente, preferiblemente con una válvula de seguridad. Tras su transporte al laboratorio, el lodo recogido puede utilizarse directamente o colocarse en un digestor a escala de laboratorio. Libere el exceso de biogás abriendo con cuidado los frascos de lodo. También se puede utilizar lodo anaeróbico producido en laboratorio como fuente de inóculo, pero es posible que su espectro de actividad se haya visto afectado.
Advertencia: El lodo digerido produce gases inflamables que presentan riesgos de incendio y explosión. También contiene organismos potencialmente patógenos; por lo tanto, se deben tomar las precauciones adecuadas a la hora de manipular el lodo. Por motivos de seguridad, no se deben utilizar recipientes de vidrio para recoger lodo.
|
|
23.
|
Para reducir la producción de gas de fondo y reducir la influencia de los controles en blanco, se puede plantear la digestión previa del lodo. Si se requiere la digestión previa, se debe permitir la digestión del lodo sin añadir nutrientes ni sustratos, a 35 °C ± 2 °C durante 7 días como máximo. Se ha establecido que una digestión previa durante unos cinco días suele provocar una reducción óptima de la producción de gas del blanco sin aumentos inaceptables en los periodos de latencia o de incubación durante la fase del ensayo, ni tampoco pérdida de actividad con respecto a un pequeño número de sustancias evaluadas.
|
|
24.
|
En lo que respecta a las sustancias problema que sean, o se espere que sean, poco biodegradables, se puede contemplar la posibilidad de una exposición previa del lodo a la sustancia problema para obtener un inóculo mejor adaptado. En tal caso, añada la sustancia problema con una concentración de carbono orgánico de 5 a 20 mg/l al lodo digerido e incube durante dos semanas como máximo. Lave con cuidado el lodo previamente expuesto antes de usarlo (véase el punto 25) e indique en el informe del ensayo las condiciones de la exposición previa.
|
Inóculo
|
25.
|
Lave el lodo (véanse los puntos 22 a 24) justo antes de usarlo para reducir la concentración de CI a menos de 10 mg/l en la suspensión final del ensayo. Centrifugue el lodo en tubos herméticos (por ejemplo, 3 000 g durante cinco minutos) y deseche el sobrenadante. Suspenda el precipitado resultante en un medio desoxigenado (puntos 16 y 17), vuelva a centrifugar la suspensión y deseche el líquido sobrenadante. Si el CI no se hubiera reducido lo suficiente, el procedimiento de lavado del lodo puede repetirse dos veces como máximo. Esto no parece afectar negativamente a los microorganismos. Por último, suspenda el precipitado en el volumen necesario de medio de ensayo y determine la concentración de sólidos totales [por ejemplo, ISO 11923 (15)]. La concentración final de sólidos totales en los recipientes de ensayo debe encontrarse dentro de un intervalo de 1 a 3 g/l (o aproximadamente el 10 % de la concentración del lodo digerido no diluido). Las operaciones anteriores deben realizarse de tal manera que el lodo tenga el mínimo contacto con el oxígeno (por ejemplo, utilizando una atmósfera de nitrógeno).
|
PROCEDIMIENTO DE ENSAYO
|
26.
|
Realice los procedimientos iniciales siguientes con técnicas que mantengan el mínimo contacto posible entre el lodo digerido y el oxígeno; por ejemplo, puede que sea necesario trabajar con una caja de guantes en una atmósfera de nitrógeno o purgar los frascos con nitrógeno (4).
|
Preparación de los recipientes de ensayo y de control
|
27.
|
Prepare recipientes de ensayo como mínimo triplicados (véase el punto 13-b) para la sustancia problema, los controles en blanco, la sustancia de referencia, los controles de inhibición (condicionales) y las cámaras de control de presión (procedimiento opcional) (véanse los puntos 7 y 19 a 21). Asimismo, pueden prepararse más recipientes con el fin de evaluar la biodegradación primaria mediante análisis específicos de la sustancia problema. Se puede utilizar el mismo conjunto de controles en blanco con varias sustancias problema en el mismo ensayo, siempre que los volúmenes de los espacios libres sean homogéneos.
|
|
28.
|
Prepare el inóculo diluido antes de añadirlo a los recipientes, por ejemplo, con una pipeta de boca ancha. Añada partes alícuotas de un inóculo bien mezclado (punto 25), de forma que la concentración de sólidos totales sea la misma en todos los recipientes (entre 1 y 3 g/l). Añada las soluciones madre de la sustancia problema y de la de referencia tras ajustar el pH a 7 ± 0,2, en caso necesario. La sustancia problema y la sustancia de referencia deben añadirse utilizando la vía de administración más apropiada (punto 19).
|
|
29.
|
La concentración de ensayo de carbono orgánico debe encontrarse, normalmente, entre los 20 y los 100 mg/l (punto 4). Si la sustancia problema es tóxica, la concentración de ensayo debe reducirse a 20 mg C/l, o incluso a menos si solo fuera a medirse la biodegradación primaria con análisis específicos. Cabe señalar que la variabilidad de los resultados del ensayo aumenta a concentraciones de ensayo inferiores.
|
|
30.
|
En lo que respecta a los recipientes en blanco, añada una cantidad equivalente del vehículo utilizado para aportar la sustancia problema en lugar de una solución madre, suspensión o emulsión. Si la sustancia problema se ha administrado con filtros de fibra de vidrio o disolventes orgánicos, añada a los blancos un filtro o un disolvente de volumen equivalente que se haya evaporado. Prepare una réplica extra con la sustancia problema para medir el valor del pH. Ajuste el pH a 7 ± 0,2, en caso necesario, con pequeñas cantidades de ácido mineral o álcali diluido. Se deben añadir las mismas cantidades de agentes neutralizadores a todos los recipientes de ensayo. Estas adiciones no deberían tener que hacerse, porque ya se ha ajustado el valor del pH de las soluciones madre de la sustancia problema y la sustancia de referencia (véanse los puntos 19 y 20). Si va a medirse la biodegradación primaria, debe tomarse una muestra adecuada del recipiente de control de pH, o de un recipiente de ensayo adicional, y la concentración de la sustancia problema debe medirse con análisis específicos. Se pueden añadir imanes cubiertos a todos los recipientes si van a agitarse las mezclas de reacción (opcional).
|
|
31.
|
Hay que asegurarse de que el volumen total de líquido V1 y el volumen de espacio libre Vh sean iguales en todos los recipientes; se deben anotar y registrar los valores de V1 y Vh. Cada recipiente debe sellarse con un tapón para gases y transferirse desde la caja de guantes (véase el punto 26) a la incubadora (véase el punto 13-a).
|
Sustancias problema insolubles
|
32.
|
Añada directamente a los recipientes preparados cantidades pesadas de las sustancias que sean poco solubles en el agua. Cuando sea necesario utilizar un disolvente (véase el punto 19), transfiera la solución o la suspensión de la sustancia problema a los recipientes vacíos. En la medida de lo posible, evapore el disolvente pasando gas nitrógeno por los recipientes y, a continuación, añada el resto de ingredientes, a saber, el lodo diluido (punto 25) y el agua desoxigenada, según resulte necesario. También debe prepararse un control de disolvente adicional (véase el punto 19). En lo que respecta a otros métodos de adición de sustancias insolubles, se puede consultar la norma ISO 10634 (13). Las sustancias problema líquidas pueden introducirse con una jeringa en los recipientes herméticos completamente preparados, si se prevé que el pH inicial no supere 7 ± 1; de lo contrario, introdúzcalas de la manera descrita anteriormente (véase el punto 19).
|
Incubación y mediciones de la presión de gas
|
33.
|
Incube los recipientes preparados a 35 °C ± 2 °C durante una hora aproximadamente, para permitir el equilibrado y eliminar el gas sobrante a la atmósfera, por ejemplo agitando cada recipiente, introduciendo la aguja del manómetro (punto 13-c) a través del cierre hermético y abriendo la válvula hasta que el manómetro marque cero. Si en esta fase, o cuando se realicen mediciones intermedias, la presión del espacio libre es inferior a la atmosférica, deberá introducirse gas nitrógeno para restablecer la presión atmosférica. Cierre la válvula (véase el punto 13-c) y continúe incubando en la oscuridad, asegurándose de que todas las partes de los recipientes se mantengan a la temperatura de digestión. Observe los recipientes después de incubar durante un periodo de 24 a 48 horas. Rechace los recipientes si su contenido presenta un claro color rosa en el líquido sobrenadante, es decir, si la resazurina (véase el punto 16) ha cambiado de color, lo que indica la presencia de oxígeno (véase el punto 50). Aunque el sistema puede tolerar pequeñas cantidades de oxígeno, las concentraciones más altas pueden inhibir gravemente el curso de la biodegradación anaeróbica. El rechazo de un solo recipiente individual de un conjunto de triplicados puede aceptarse, pero la incidencia de otros fallos aparte de este debe conllevar una investigación de los procedimientos experimentales, así como la repetición del ensayo.
|
|
34.
|
Mezcle con cuidado el contenido de cada recipiente, removiendo o agitando durante unos minutos al menos dos o tres veces a la semana, y poco antes de cada medición de presión. La agitación vuelve a poner en suspensión el inóculo y garantiza el equilibrio gaseoso. Todas las mediciones de presión deben realizarse rápidamente, ya que los recipientes de ensayo pueden estar sujetos a una disminución de la temperatura, lo que puede provocar lecturas falsas. Mientras se mide la presión, todo el recipiente de ensayo, incluido el espacio libre, debe mantenerse a la temperatura de digestión. Mida la presión de gas, por ejemplo, introduciendo a través del tapón la aguja de la jeringa (punto 13-c) conectada al manómetro. Se debe tener cuidado para evitar la entrada de agua en la aguja de la jeringa; si esto ocurre, habrá que secar las partes húmedas y colocar una nueva aguja. La presión debe medirse en milibares (véase el punto 42). La presión del gas en los recipientes puede medirse periódicamente (por ejemplo, cada semana) y, opcionalmente, liberar el gas sobrante a la atmósfera. Por otro lado, la presión se puede medir únicamente al final del ensayo para determinar la cantidad de biogás producido.
|
|
35.
|
Se recomienda realizar lecturas intermedias de la presión de gas, ya que un aumento de presión ofrece orientación sobre el momento en que se puede finalizar el ensayo y permite seguir la cinética (véase el punto 6).
|
|
36.
|
Normalmente, el ensayo finaliza tras un periodo de incubación de 60 días, a menos que la curva de biodegradación obtenida de las mediciones de presión haya alcanzado antes de ese momento la fase de meseta; esta fase es aquella en la que se alcanza la degradación máxima y la curva de biodegradación se estabiliza. Si el valor de meseta es inferior al 60 %, la interpretación resulta problemática, porque indica que solo se ha mineralizado parte de la molécula o que se ha cometido un error. Si al final del periodo de incubación normal se está produciendo gas, pero es obvio que no se ha alcanzado una fase de meseta, se debe plantear una prolongación del ensayo para comprobar si se alcanzará o no dicha meseta (más del 60 %).
|
Medición del carbono inorgánico
|
37.
|
Al final del ensayo, tras la última medición de la presión de gas, hay que dejar que el lodo sedimente. Abra cada recipiente, por turnos, e inmediatamente tome una muestra para determinar la concentración (mg/l) de carbono inorgánico (CI) en el líquido sobrenadante. No debe aplicarse centrifugación ni filtración al líquido sobrenadante, ya que se produciría una pérdida inaceptable de dióxido de carbono disuelto. Si el líquido no pudiera analizarse al tomar la muestra, se debe conservar en un frasco sellado, sin espacio libre, y se debe refrigerar a unos 4 °C durante dos días como máximo. Después de la medición del CI, mida y registre el valor de pH.
|
|
38.
|
Otra posibilidad es, determinar indirectamente el CI del sobrenadante mediante la liberación del CI disuelto como dióxido de carbono que puede medirse en el espacio libre. Después de la última medición de la presión de gas, ajuste la presión de cada uno de los recipientes de ensayo a la presión atmosférica. Acidifique el contenido de cada recipiente a aproximadamente un pH de 1, añadiendo ácido mineral concentrado (por ejemplo, H2SO4) a través del tapón de los recipientes sellados. Incube los recipientes agitados a 35 °C ± 2 °C durante 24 horas aproximadamente y mida con el manómetro la presión de gas resultante del dióxido de carbono desprendido.
|
|
39.
|
Lleve a cabo lecturas similares del blanco correspondiente, la sustancia de referencia y, si se hubieran incluido, los recipientes de control de inhibición (véase el punto 21).
|
|
40.
|
En algunos casos, en particular si se utilizan los mismos recipientes de control con varias sustancias problema, se debe plantear la posibilidad de realizar mediciones de las concentraciones intermedias de CI en los recipientes de ensayo y de control, si procede. En este caso, se debe preparar un número suficiente de recipientes para realizar todas las mediciones intermedias. Se prefiere este procedimiento a recoger todas las muestras de un mismo recipiente. Esta última opción solo puede realizarse si el volumen necesario para el análisis del CID no se considera demasiado alto. La medición del CID debe realizarse después de medir la presión de gas sin liberar el gas sobrante, como se describe a continuación:
|
—
|
tome el volumen más pequeño posible de las muestras de sobrenadante con una jeringa, a través del tapón, sin abrir los recipientes, y determine el CI de la muestra;
|
|
—
|
después de tomar la muestra, libere o no el gas sobrante;
|
|
—
|
hay que tener en cuenta que incluso una pequeña disminución del volumen del sobrenadante (por ejemplo, del 1 %) puede provocar un aumento significativo del volumen del gas en el espacio libre (Vh);
|
|
—
|
las ecuaciones (véase el punto 44) se corrigen aumentando el Vh en la ecuación 3, en caso necesario.
|
|
Análisis específicos
|
41.
|
Si hay que calcular la degradación anaeróbica primaria (véase el punto 30), tome un volumen apropiado de la muestra para análisis específicos al principio y al final del ensayo de los recipientes que contienen la sustancia problema. Si se lleva a cabo esto, hay que tener en cuenta que los volúmenes del espacio libre (Vh) y del líquido (Vl) variarán; esto debe tenerse en cuenta a la hora de calcular los resultados de la producción de gas. También se pueden tomar muestras para realizar análisis específicos de las mezclas adicionales preparadas previamente con ese fin (punto 30).
|
DATOS E INFORME
Tratamiento de los resultados
|
42.
|
Por razones prácticas, la presión del gas se mide en milibares (1 mbar = 1h Pa = 105 Pa; 1 Pa = 1 N/m2), el volumen en litros y la temperatura en grados Celsius.
|
Carbono en el espacio libre
|
43.
|
Como 1 mol de metano y 1 mol de dióxido de carbono contienen, cada uno, 12 g de carbono, la masa de carbono de un volumen determinado de gas emitido puede expresarse de la siguiente forma:
|
m= 12 × 103×n
|
Ecuación [1]
|
donde:
|
m
|
=
|
masa de carbono (mg) en un volumen determinado de gas emitido;
|
|
12
|
=
|
masa atómica relativa del carbono;
|
|
n
|
=
|
número de moles de gas en el volumen determinado.
|
Si se genera en grandes cantidades un gas distinto al metano o al dióxido de carbono (por ejemplo, N2O), la fórmula [1] debe modificarse para describir la posibilidad de los efectos de los gases generados.
|
|
44.
|
De acuerdo con las leyes de los gases, n puede expresarse de la siguiente forma:
|

|
Ecuación [2]
|
donde:
|
p
|
=
|
presión del gas (Pascales);
|
|
V
|
=
|
volumen del gas (m3);
|
|
R
|
=
|
constante molar de los gases [8,314 J/(mol K)];
|
|
T
|
=
|
temperatura de incubación (grados Kelvin).
|
Mediante la combinación de las ecuaciones [1] y [2] y su racionalización para tener en cuenta la producción de gas del control en blanco:
|

|
Ecuación [3]
|
donde:
|
mh
|
=
|
masa de carbono neto producido como gas en el espacio libre (mg);
|
|
Dp
|
=
|
media de la diferencia entre la presión inicial y la presión final en los recipientes de ensayo menos la media correspondiente de los recipientes en blanco (milibares);
|
|
Vh
|
=
|
volumen del espacio libre en el recipiente (l);
|
|
0,1
|
=
|
conversión tanto de newtons/m2 a milibares como de m3 a litros.
|
La ecuación [4] debe utilizarse para la temperatura normal de incubación de 35 °C (308 K):
|
mh
= 0,468(Δp·Vh
)
|
Ecuación [4]
|
Nota: Cálculo alternativo del volumen. Las lecturas del manómetro se convierten a ml de gas producido mediante la curva patrón generada representando el volumen (ml) inyectado frente a la lectura del manómetro (apéndice 2). El número de moles (n) de gas en el espacio libre de cada recipiente se calcula dividiendo la producción de gas acumulada (ml) por 25 286 ml/mol, que es el volumen ocupado por un mol de gas a 35 °C y con una presión atmosférica normal. Dado que 1 mol de CH4 y 1 mol de CO2 contienen cada uno 12 g de carbono, la cantidad de carbono (mg) en el espacio libre (mh
) se obtiene mediante la ecuación [5]:
|
mh
= 12 × 103×n
|
Ecuación [5]
|
Racionalización para tener en cuenta la producción de gas de control en blanco:
|

|
Ecuación [6]
|
donde:
|
mh
|
=
|
masa de carbono neto producido como gas en el espacio libre (mg);
|
|
ΔV
|
=
|
media de la diferencia entre el volumen de gas producido en el espacio libre de los recipientes de ensayo y los recipientes de control en blanco;
|
|
25 286
|
=
|
volumen ocupado por 1 mol de gas a 35 °C y 1 atmósfera.
|
|
|
45.
|
El curso de la biodegradación puede seguirse representando el aumento de la presión acumulada Dp (milibares) frente al tiempo, si procede. Partiendo de esta curva, se identifica y registra la fase de latencia (días). La fase de latencia es el tiempo transcurrido desde el comienzo del ensayo hasta que comienza una degradación significativa(se puede consultar un ejemplo en el apéndice 3). Si se han tomado y analizado muestras intermedias de sobrenadante (véanse los puntos 40, 46 y 47), entonces puede representarse el C total producido (en gas más en líquido), en lugar de solo la presión acumulada.
|
Carbono en el líquido
|
46.
|
La cantidad de metano en el líquido se ignora, ya que se sabe que su solubilidad en agua es muy baja. Calcule la masa de carbono inorgánico en el líquido de los recipientes de ensayo utilizando la ecuación [7]:
|
ml
=Cnet
×Vl
|
Ecuación [7]
|
donde:
|
ml
|
=
|
masa de carbono inorgánico en el líquido (mg);
|
|
Cnet
|
=
|
concentración de carbono inorgánico en los recipientes de ensayo menos la de los recipientes de control al final del ensayo (mg/l);
|
|
Vl
|
=
|
volumen de líquido en el recipiente (l).
|
|
Carbono gasificado total
|
47.
|
Calcule la masa total de carbono presente gasificado en el recipiente utilizando la ecuación [8]:
donde:
|
|
mt = masa total de carbono gasificado (mg);
|
|
|
mh
y ml
se corresponden con las definiciones anteriores.
|
|
Carbono de la sustancia problema
|
48.
|
Calcule la masa de carbono en los recipientes del ensayo, derivada de la sustancia problema añadida, utilizando la ecuación [9]:
donde:
|
mv
|
=
|
masa de carbono de la sustancia problema (mg);
|
|
Cc
|
=
|
concentración de carbono de la sustancia problema en el recipiente de ensayo (mg/l);
|
|
Vl
|
=
|
volumen de líquido del recipiente de ensayo (l).
|
|
Grado de biodegradación
|
49.
|
Calcule el porcentaje de biodegradación correspondiente al gas del espacio libre mediante la ecuación [10] y el porcentaje total de biodegradación mediante la ecuación [11]:
|
Dh
= (mh
/mv
) × 100
|
Ecuación [10]
|
|
Dt
= (mt
/mv
) × 100
|
Ecuación [11]
|
donde:
|
|
Dh = biodegradación correspondiente al gas del espacio libre ( %);
|
|
|
Dt = biodegradación total ( %);
|
|
|
mh
, mv
y mt
se corresponden con las definiciones anteriores.
|
El grado de biodegradación primaria se calcula a partir de las mediciones (opcionales) de la concentración de la sustancia problema al principio y al final de la incubación, mediante la ecuación [12]:
|
Dp
= (1 –Se
/Si
) × 100
|
Ecuación [12]
|
donde:
|
Dp
|
=
|
degradación primaria de la sustancia problema ( %);
|
|
Si
|
=
|
concentración inicial de la sustancia problema (mg/l);
|
|
Se
|
=
|
concentración de la sustancia problema al final (mg/l).
|
Si el método de análisis indica concentraciones importantes de la sustancia problema en el inóculo de lodo anaeróbico no modificado, se debe utilizar la ecuación [13]:
|
Dp
1
= [1 – (Se
–Seb
)/(Si
–Sib
)] × 100
|
Ecuación [13]
|
donde:
|
Dp
1
|
=
|
degradación primaria corregida de la sustancia problema ( %);
|
|
Sib
|
=
|
concentración “aparente” inicial de la sustancia problema en los controles en blanco (mg/l);
|
|
Seb
|
=
|
concentración “aparente” de la sustancia problema en los controles en blanco al final (mg/l).
|
|
Validez de los resultados
|
50.
|
Solo deben utilizarse las lecturas de presión de los recipientes que no presenten coloración rosa (véase el punto 33). La contaminación por oxígeno se minimiza mediante el uso de unas técnicas de manipulación anaeróbica adecuadas.
|
|
51.
|
Hay que tener en cuenta que el ensayo es válido si la sustancia referencia alcanza una meseta que constituya una biodegradación superior al 60 % (41).
|
|
52.
|
Si el pH al final del ensayo supera el intervalo de 7 ± 1 y se ha producido una biodegradación insuficiente, se debe repetir el ensayo con una mayor capacidad de tampón del medio.
|
Inhibición de la degradación
|
53.
|
La producción de gas en los recipientes que contienen tanto la sustancia problema como la sustancia de referencia debe ser, como mínimo, igual a la de los recipientes que solo contienen la sustancia de referencia; de lo contrario, se indica una inhibición de la producción de gas. En algunos casos, la producción de gas en los recipientes que contienen la sustancia problema sin sustancia de referencia será inferior a la de los controles en blanco, lo que indica que la sustancia problema es inhibidora.
|
Informe del ensayo
|
54.
|
El informe del ensayo deberá incluir la información siguiente:
|
|
Sustancia problema:
|
—
|
nombre común, nombre químico, número CAS, fórmula estructural y propiedades fisicoquímicas pertinentes;
|
|
—
|
pureza (impurezas) de la sustancia problema.
|
|
|
|
Condiciones de ensayo:
|
—
|
volúmenes del líquido diluido del digestor (Vl
) y del espacio libre (Vh
) en el recipiente;
|
|
—
|
descripción de los recipientes de ensayo y principales características de la medición del biogás (por ejemplo, tipo de manómetro) y del analizador de CI;
|
|
—
|
aplicación de la sustancia problema y de la sustancia de referencia al sistema del ensayo: la concentración de ensayo utilizada y eventual uso de disolventes;
|
|
—
|
detalles del inóculo utilizado: nombre de la planta de tratamiento de aguas residuales, descripción del origen de las aguas residuales tratadas (por ejemplo, temperatura de trabajo, tiempo de retención del lodo, predominancia de aguas domésticas, etc.), concentración, cualquier información necesaria para fundamentar esto e información sobre el eventual tratamiento previo del inóculo (por ejemplo, digestión previa, exposición previa);
|
|
—
|
temperatura de incubación;
|
|
|
|
Resultados:
|
—
|
valores de pH y CI al final del ensayo;
|
|
—
|
concentración de la sustancia problema al principio y al final del ensayo, si se hubiera realizado una medición específica;
|
|
—
|
todos los datos medidos y recopilados con los recipientes de ensayo, blanco, sustancia de referencia y control de inhibición, si procede [por ejemplo, presión en milibares, concentración de carbono inorgánico (mg/l)], en formato tabular (los datos medidos del espacio libre y del líquido deben indicarse por separado);
|
|
—
|
tratamiento estadístico de los datos, duración del ensayo y diagrama de la biodegradación de la sustancia problema, la sustancia de referencia y el control de inhibición;
|
|
—
|
porcentaje de biodegradación de la sustancia problema y la sustancia de referencia;
|
|
—
|
motivos del eventual rechazo de los resultados del ensayo;
|
|
—
|
discusión de los resultados.
|
|
|
BIBLIOGRAFÍA
|
(1)
|
Los capítulos siguientes del presente anexo.
|
|
C.4. Determinación de la biodegradabilidad “fácil”
|
|
|
C.9. Biodegradación. Método de Zahn-Wellens
|
|
|
C.10. Prueba de simulación de tratamiento aeróbico de aguas residuales:
A: Unidades de lodo activado, B: Biopelículas
|
|
|
C.11. Biodegradación. Lodo activado: prueba de inhibición de la respiración
|
|
|
(2)
|
OCDE (2009) Inherent Biodegradability: Modified MITI Test (II), OECD Guideline for Testing of Chemicals, No 302C, OCDE, París.
|
|
(3)
|
Birch, R. R., Biver, C., Campagna, R., Gledhill, W.E., Pagga,U., Steber, J., Reust, H. and Bontinck, W.J. (1989) Screening of chemicals for anaerobic biodegradation. Chemosphere 19, pp. 1527-1550. (Publicado también como ECETOC Technical Report No 28, junio de 1988).
|
|
(4)
|
Shelton D.R. and Tiedje, J.M. (1984) General method for determining anaerobic biodegradation potential. Appl. Environ. Microbiology, 47, pp. 850-857.
|
|
(5)
|
Owen, W.F., Stuckey, DC., Healy J.B., Jr, Young L.Y. and McCarty, P.L. (1979) Bioassay for monitoring biochemical methane potential and anaerobic toxicity. Water Res. 13, pp. 485-492.
|
|
(6)
|
Healy, J.B.Jr. and Young, L.Y. (1979) Anaerobic biodegradation of eleven aromatic compounds to methane. Appl. Environ. Microbiol. 38, pp. 84-89.
|
|
(7)
|
Gledhill, W.E. (1979) Proposed standard practice for the determination of the anaerobic biodegradation of organic chemicals. Documento de trabajo. Draft 2 No 35.24. American Society for Testing Materials, Filadelfia.
|
|
(8)
|
Battersby, N.S. and Wilson, V. (1988) Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic chemicals under methanogenic conditions. Chemosphere, 17, pp. 2441-2460.
|
|
(9)
|
E1192-92. Standard Test Method for Determining the Anaerobic Biodegradation Potential of Organic Chemicals. ASTM, Filadelfia.
|
|
(10)
|
US-EPA (1998) Fate, Transport and Transformation Test Guidelines OPPTS 835.3400 Anaerobic Biodegradability of Organic Chemicals.
|
|
(11)
|
Organización Internacional de Normalización (1995) ISO 11734. Calidad del agua. Evaluación de la biodegradabilidad anaerobia “final” de los compuestos orgánicos con lodos en digestión. Método por medida de la producción de biogás.
|
|
(12)
|
Organización Internacional de Normalización (2003), ISO 13641-1. Calidad del agua. Determinación de la inhibición de la producción de gas de las bacterias anaerobias. Parte 1. Prueba general.
|
|
(13)
|
Organización Internacional de Normalización (1995) ISO 10634 Calidad del agua. Líneas directrices para la preparación y tratamiento de los compuestos orgánicos poco solubles en agua para la subsecuente evaluación de su biodegradabilidad en medio acuoso.
|
|
(14)
|
Pagga, U. and Beimborn, D.B., (1993) Anaerobic biodegradation test for organic compounds. Chemosphere, 27, pp. 1499-1509.
|
|
(15)
|
Organización Internacional de Normalización (1997) ISO 11923 Calidad de agua — Determinación de los sólidos en suspensión por filtración con filtros de fibra de vidrio.
|
Apéndice 1
Ejemplo de un aparato medidor de la producción de biogás mediante la presión de gas

Leyenda:
|
1
|
—
|
Manómetro
|
|
2
|
—
|
Válvula estanca a los gases de 3 vías
|
|
3
|
—
|
Aguja de jeringa
|
|
4
|
—
|
Cierre estanco a los gases (cápsula y tapón)
|
|
5
|
—
|
Espacio libre (Vh
)
|
|
6
|
—
|
Inóculo de lodo digerido (Vl
)
|
Recipientes de ensayo en un ambiente a 35 °C ± 2 °C
Apéndice 2
Conversión del manómetro
Las lecturas del manómetro pueden relacionarse con los volúmenes de gas mediante una curva patrón obtenida al inyectar volúmenes conocidos de aire a 35 °C ± 2 °C en frascos de suero que contienen un volumen de agua igual al de la mezcla de reacción, V
R:
|
—
|
Ponga alícuotas de V
R ml de agua, mantenida a 35 °C ± 2 °C, en cinco frascos de suero. Selle los frascos y colóquelos en un baño de agua a 35 °C durante una hora para equilibrar.
|
|
—
|
Encienda el manómetro, deje que se estabilice y ajuste a cero.
|
|
—
|
Introduzca la aguja de la jeringa a través del tapón de uno de los frascos, abra la válvula hasta que el medidor de presión lea cero y cierre la válvula.
|
|
—
|
Repita el procedimiento con el resto de frascos.
|
|
—
|
Inyecte 1 ml de aire a 35 °C ± 2 °C en cada frasco. Introduzca la aguja (unida al manómetro) a través del tapón de uno de los frascos y deje que la lectura de presión se estabilice. Registre la presión, abra la válvula hasta que la presión medida sea cero y, a continuación, cierre la válvula.
|
|
—
|
Repita el procedimiento con el resto de frascos.
|
|
—
|
Repita el procedimiento anterior en su totalidad utilizando 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml y 50 ml de aire.
|
|
—
|
Trace una curva de conversión de la presión (Pa) frente al volumen de gas inyectado Vb (ml). La respuesta del instrumento es lineal a lo largo del intervalo de 0 a 70 000 Pa, y de 0 a 50 ml de producción de gas.
|
Apéndice 3
Ejemplo de curva de degradación (aumento de la presión neta acumulada)

Apéndice 4
Ejemplo de fichas de datos para el ensayo de biodegradación anaeróbica — ficha de datos para la sustancia problema
|
Laboratorio: …
|
Sustancia problema:
|
Ensayo no: …
|
|
Temperatura del ensayo: …(°C)
|
Volumen del espacio libre (V
h): …(l)
|
Volumen de líquido (V
l): …(l)
|
|
Carbono en la sustancia problema C
c,v: …(mg/l)
|
mv
(42): …(mg)
|
|
|
Día
|
p
1 (ensayo)
(mbar)
|
p
2 (ensayo)
(mbar)
|
p
3 (ensayo)
(mbar)
|
p (ensayo)
media
(mbar)
|
p
4 (en blanco)
(mbar)
|
p
5 (en blanco)
(mbar)
|
p
6 (en blanco)
(mbar)
|
p (en blanco)
media
(mbar)
|
p (neto)
media
de ensayo — en blanco (mbar)
|
D
p (neto)
acumulada
(mbar)
|
m
h
C en espacio libre (43)
(mg)
|
D
h
Biodegradación (44)
(%)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
IC, 1
Ensayo
(mg)
|
C
IC, 2
Ensayo
(mg)
|
C
IC, 3
Ensayo
(mg)
|
C
IC
Media del ensayo
(mg)
|
C
IC, 4
En blanco
(mg)
|
C
IC, 5
En blanco
(mg)
|
C
IC, 6
En blanco
(mg)
|
C
IC
Media en blanco
(mg)
|
C
IC, net
Media
de ensayo — en blanco
(mg)
|
m
l
C líquido (45)
(mg)
|
m
t
C total (46)
(mg)
|
D
t
Biodegradación (47)
(%)
|
|
CI (final)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH (final)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Laboratorio: …
|
Sustancia de referencia: …
|
Ensayo no: …
|
|
Temperatura del ensayo: …(°C)
|
Volumen de espacio libre (V
h): …(l)
|
Volumen de líquido (V
l): …(litros)
|
|
Carbono en la sustancia de referencia C
c,v: (mg/l)
|
mv
(48): …(mg)
|
|
|
Día
|
p
1 (ref.)
(mbar)
|
p
2 (ref.)
(mbar)
|
p
3 (ref.)
(mbar)
|
p (ref.)
media
(mbar)
|
p
4 (inhib.)
(mbar)
|
p
5 (inhib.)
(mbar)
|
p
6 (inhib.)
(mbar)
|
p (inhib.)
media
(mbar)
|
p (ref.)
ref. — en blanco
(mbar)
|
D
p (ref.)
acumulada
(mbar)
|
m
h
C en espacio libre (49)
(mg)
|
D
h
Biodegradación (50)
(%)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
IC, 1
ref.
(mg)
|
C
IC, 2
ref.
(mg)
|
C
IC, 3
ref.
(mg)
|
C
IC
media ref.
(mg)
|
C
IC, 4
inhib.
(mg)
|
C
IC, 5
inhib.
(mg)
|
C
IC, 6
inhib.
(mg)
|
C
IC
media inhib.
(mg)
|
C
IC, net
ref. — inhib.
(mg)
|
m
l
C líquido (51)
(mg)
|
m
t
C total (52)
(mg)
|
D
t
Biodegradación (53)
(%)
|
|
CI (final)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH (final)
|
|
|
|
|
|
|
|
|
|
|
|
|
C.44. LIXIVIACIÓN EN COLUMNAS DE SUELO
INTRODUCCIÓN
|
1.
|
El presente método de ensayo reproduce las directrices de ensayo (TG) 312 de la OCDE (2004). Las sustancias artificiales pueden llegar al suelo directamente mediante una aplicación deliberada (por ejemplo, productos agroquímicos) o por vías indirectas (por ejemplo, aguas residuales → lodos residuales → suelo o aire → deposición húmeda o seca). Para evaluar los riesgos de estas sustancias, es importante estimar su potencial de transformación en el suelo y de migración (lixiviación) a capas más profundas del suelo y, con el tiempo, a las aguas subterráneas.
|
|
2.
|
Hay varios métodos disponibles para medir el potencial de lixiviación de las sustancias en el suelo en condiciones controladas en laboratorio, a saber: cromatografía en capa fina del suelo, cromatografía en capa gruesa del suelo, cromatografía en columna del suelo y mediciones de adsorción y desorción (1) (2). En lo que respecta a las sustancias no ionizadas, el coeficiente de reparto n-octanol-agua (Pow) permite una primera estimación de su potencial de adsorción y lixiviación (3) (4) (5).
|
|
3.
|
El método que se describe en este método de ensayo se basa en una cromatografía en columna de suelo de un suelo alterado (la definición se puede consultar en el apéndice 1). Se llevan a cabo dos tipos de experimentos para determinar, en primer lugar, el potencial de lixiviación de la sustancia problema, y, en segundo lugar, el potencial de lixiviación de los productos de transformación (estudio con residuos envejecidos) en suelos en condiciones controladas de laboratorio (54). El método de ensayo se basa en los métodos existentes (6) (7) (8) (9) (10) (11).
|
|
4.
|
En un taller organizado por la OCDE sobre la selección de suelos y sedimentos, celebrado en Belgirate (Italia) en 1995 (12), se llegó a un acuerdo sobre el número y los tipos de suelo que se deben utilizar en este método de ensayo. En el taller también se hicieron recomendaciones sobre la recogida, la manipulación y el almacenamiento de muestras de suelo para llevar a cabo experimentos de lixiviación.
|
PRINCIPIO DEL MÉTODO DE ENSAYO
|
5.
|
Se rellenan con suelo unas columnas hechas de material inerte adecuado (por ejemplo, vidrio, acero inoxidable, aluminio, teflón, PVC, etc.) y, posteriormente, se saturan y equilibran con una solución de “lluvia artificial” (la definición se puede consultar en el apéndice 1), y se dejan escurrir. A continuación, la superficie de cada columna de suelo se trata con la sustancia problema o con residuos envejecidos de la sustancia problema. Luego se aplica lluvia artificial a las columnas de suelo y se recoge el lixiviado. Después del proceso de lixiviado, se retira el suelo de las columnas y se divide en un número adecuado de segmentos, en función de la información que se necesite obtener del estudio. A continuación se determina en cada segmento de suelo y en el lixiviado la presencia de la sustancia problema y, si procede, de los productos de transformación o de otras sustancias de interés.
|
APLICABILIDAD DEL MÉTODO DE ENSAYO
|
6.
|
El método de ensayo es aplicable a las sustancias problema (no marcadas o marcadas radiactivamente: por ejemplo,14C) para las cuales existe un método analítico con suficiente exactitud y sensibilidad. El método de ensayo no debe aplicarse a las sustancias volátiles del suelo y del agua y que, por lo tanto, no permanecen en el suelo o en el lixiviado en las condiciones experimentales de este método de ensayo.
|
INFORMACIÓN SOBRE LA SUSTANCIA PROBLEMA
|
7.
|
Para medir el comportamiento de lixiviación en las columnas de suelo pueden utilizarse sustancias no marcadas o marcadas radiactivamente. Para estudiar la lixiviación de los productos de transformación (residuos envejecidos de la sustancia problema) y para calcular el balance de masas es necesario disponer de material marcado radiactivamente. Se recomienda el marcado con 14C, pero también pueden resultar útiles otros isótopos, como 13C, 15N, 3H, 32P. En la medida de lo posible, el marcador debe ubicarse en la parte o partes más estables de la molécula. La pureza de la sustancia problema debe ser al menos del 95 %.
|
|
8.
|
La mayor parte de las sustancias deben aplicarse como sustancia individual. Sin embargo, en lo que respecta a las sustancias activas de productos fitosanitarios, se pueden utilizar productos formulados para estudiar la lixiviación de la sustancia problema original, pero su evaluación resulta particularmente necesaria cuando es probable que la mezcla afecte a la tasa de liberación (por ejemplo, fórmulas granulares de liberación o controlada). En lo que respecta a los requisitos específicos de las mezclas para diseñar el ensayo, puede resultar útil consultar a la autoridad reguladora antes de llevar a cabo dicho ensayo. En los estudios de lixiviación de residuos envejecidos, debe utilizarse la sustancia problema original pura.
|
|
9.
|
Antes de llevar a cabo ensayos de lixiviación en columnas del suelo, debe disponerse, preferiblemente, de la siguiente información sobre la sustancia problema:
|
(1)
|
hidrosolubilidad [método de ensayo A.6] (13);
|
|
(2)
|
solubilidad en disolventes orgánicos;
|
|
(3)
|
presión de vapor [método de ensayo] (13) y constante de la ley de Henry;
|
|
(4)
|
coeficiente de reparto n-octanol/agua [métodos de ensayo A.8 y A.24 ] (13);
|
|
(5)
|
coeficiente de adsorción (Kd, Kf o KOC) [métodos de ensayo C.18 o C.19 ] (13);
|
|
(6)
|
hidrólisis [método de ensayo C.7] (13);
|
|
(7)
|
constante de disociación (pKa) [OCDE TG 112] (25);
|
|
(8)
|
transformación aerobia y anaerobia en el suelo [método de ensayo C.23] (13).
|
Nota: La temperatura a la cual se han realizado estas mediciones debe indicarse en los respectivos informes de ensayo.
|
|
10.
|
La cantidad de sustancia problema aplicada a las columnas de suelo debe ser suficiente para permitir la detección de, al menos, el 0,5 % de la dosis aplicada en cualquiera de los segmentos individuales. En lo que respecta a las sustancias activas de productos fitosanitarios, la cantidad de sustancia problema aplicada puede corresponderse con la tasa de uso máxima recomendada (una sola aplicación).
|
|
11.
|
Debe haber disponible un método analítico adecuado, de exactitud, precisión y sensibilidad conocidas para la cuantificación de la sustancia problema y, si procede, de sus productos de transformación en el suelo y en el lixiviado. También deben conocerse el límite de detección analítica de la sustancia problema y sus productos de transformación significativos (normalmente, al menos todos los productos de transformación ≥ 10 % de la dosis aplicada observados en los estudios de las vías de transformación, pero preferiblemente cualquier producto de transformación relevante con un posible riesgo) (véase el punto 17).
|
SUSTANCIAS DE REFERENCIA
|
12.
|
Para evaluar la movilidad relativa de la sustancia problema en el suelo deben utilizarse sustancias de referencia con un comportamiento de lixiviación conocido, como la atrazina o el monurón, que se pueden considerar lixiviadores moderados sobre el terreno (1) (8) (11). Asimismo, una sustancia de referencia polar no sorbente y no degradable (por ejemplo, tritio, bromuro, fluoresceína y eosina) para trazar el movimiento del agua en la columna puede resultar útil para confirmar las propiedades hidrodinámicas de la columna de suelo.
|
|
13.
|
También puede resultar útil para emplear patrones analíticos para la caracterización o la identificación de los productos de transformación encontrados en los segmentos de suelo y en los lixiviados mediante cromatografía, espectroscopia u otros métodos relevantes.
|
DEFINICIONES Y UNIDADES
CRITERIOS DE CALIDAD
Recuperación
|
15.
|
La suma de los porcentajes de la sustancia problema encontrados en los segmentos de suelo y en el lixiviado de la columna, después de la lixiviación, determina la recuperación para un experimento de lixiviación. Las recuperaciones deben encontrarse entre el 90 y el 110 %, en caso de sustancias marcadas radiactivamente (11), y entre el 70 y el 110 % en caso de sustancias no marcadas (8).
|
Repetibilidad y sensibilidad del método analítico
|
16.
|
La repetibilidad del método analítico para cuantificar la sustancia problema y los productos de transformación puede comprobarse mediante un análisis duplicado del mismo extracto de un segmento de suelo o de un lixiviado (véase el punto 11).
|
|
17.
|
El límite de detección (LOD) del método analítico de la sustancia problema y de los productos de transformación debe ser, como mínimo, de 0,01 mg · kg– 1 en cada segmento de suelo o lixiviado (como sustancia problema), o del 0,5 % de la dosis aplicada en cualquier segmento individual, si este valor es menor. El límite de cuantificación (LOQ) también debe especificarse.
|
DESCRIPCIÓN DEL MÉTODO DE ENSAYO
Sistema de ensayo
|
18.
|
En el ensayo se utilizan columnas de lixiviación (divisibles o no divisibles) en secciones hechas de un material inerte adecuado (por ejemplo, vidrio, acero inoxidable, aluminio, teflón, PVC, etc.), con un diámetro interior mínimo de 4 cm y una altura mínima de 35 cm. Los materiales de las columnas deben evaluarse para establecer las posibles interacciones con la sustancia problema o sus productos de transformación. En el apéndice 2 se pueden consultar ejemplos de columnas adecuadas divisibles y no divisibles.
|
|
19.
|
Para llenar y compactar las columnas de suelo se utilizan una cuchara, un émbolo y un aparato vibrador.
|
|
20.
|
Para aplicar la lluvia artificial a las columnas de suelo, se pueden utilizar bombas de pistón o peristálticas, cabezales de ducha, frascos Mariotte o unos simples embudos de decantación.
|
Equipo de laboratorio y sustancias
|
21.
|
Se precisa el equipo normal de laboratorio y, en particular, el siguiente:
|
(1)
|
instrumentos analíticos tales como equipos de cromatografía (de gases, de líquidos de alta resolución o de capa fina), incluidos los sistemas de detección adecuados para el análisis de sustancias marcadas o no marcadas, o un método de dilución isotópica inversa;
|
|
(2)
|
instrumentos de identificación (por ejemplo, espectrometría de masas, cromatografía de gases con espectrometría de masas, cromatografía de líquidos de alta resolución con espectrometría de masas, resonancia magnética nuclear, etc.);
|
|
(3)
|
contador de centelleo de líquidos para la sustancia problema marcada radiactivamente;
|
|
(4)
|
oxidante para la combustión del material marcado;
|
|
(5)
|
aparato de extracción (por ejemplo, tubos de centrífuga para la extracción en frío y aparato Soxhlet para la extracción continua bajo reflujo);
|
|
(6)
|
instrumental para concentrar soluciones y extractos (por ejemplo, evaporador rotatorio).
|
|
|
22.
|
Entre las sustancias utilizadas se incluyen las siguientes: disolventes orgánicos de grado analítico, como acetona, metanol, etc.; líquido de centelleo; solución de CaCl2 0,01 M en agua destilada o desionizada (equivalente a la lluvia artificial).
|
Sustancia problema
|
23.
|
Para aplicar la sustancia problema a la columna de suelo debe disolverse en agua (desionizada o destilada). Si la sustancia problema es poco soluble en agua, puede aplicarse como producto formulado (si es necesario, después de suspenderla o emulsionarla en agua) o en algún disolvente orgánico. Si se utiliza un disolvente orgánico, este debe reducirse al mínimo y debe evaporarse de la superficie de la columna de suelo antes de iniciar el procedimiento de lixiviación. Las fórmulas sólidas, como los gránulos, deben aplicarse en su forma sólida sin agua; para que se produzca una distribución mejor por la superficie de la columna de suelo, el producto formulado puede mezclarse con una pequeña cantidad de arena de cuarzo (por ejemplo, 1 g) antes de la aplicación.
|
|
24.
|
La cantidad de sustancia problema aplicada a las columnas de suelo debe ser suficiente para permitir en cualquiera de los segmentos la detección de, al menos, el 0,5 % de la dosis aplicada. En lo que respecta a las sustancias activas de los productos fitosanitarios, esta dosis puede basarse en la tasa de uso máxima recomendada (tasa de una sola aplicación) y, para la lixiviación de tanto la sustancia original como de las envejecidas, debe estar relacionada con el área superficial de la columna de suelo utilizada (55).
|
Sustancia de referencia
|
25.
|
En los experimentos de lixiviación debe utilizarse una sustancia de referencia (véase el punto 12). Debe aplicarse a la superficie de la columna de suelo de la misma forma que la sustancia problema, con una tasa adecuada que permita la detección correcta, bien como patrón interno junto con la sustancia problema en la misma columna de suelo, bien sola en una columna de suelo separada. Es preferible que ambas sustancias se evalúen en la misma columna, salvo cuando se hayan marcado de forma similar.
|
Suelos
Selección del suelo
|
26.
|
Para llevar a cabo estudios de lixiviación con la sustancia problema original, deben utilizarse tres o cuatro suelos de diversos pH, contenido de carbono orgánico y textura (12). En la tabla 1 siguiente se incluye una orientación sobre la selección de suelos para realizar experimentos de lixiviación. En lo que respecta a las sustancias problema ionizables, los suelos seleccionados deben abarcar una gran variedad de pH para poder evaluar la movilidad de la sustancia en su forma ionizada y no ionizada; como mínimo, tres suelos deben tener un pH al que la sustancia problema se encuentre en su forma móvil.
Tabla 1
Orientación sobre la selección de suelos para estudios de lixiviación
|
No de suelo
|
Valor de pH
|
Carbono orgánico
%
|
Contenido de arcilla
%
|
Textura (56)
|
|
1
|
> 7,5
|
3,5 - 5,0
|
20 - 40
|
Franco-arcilloso
|
|
2
|
5,5 - 7,0
|
1,5 - 3,0
|
15 - 25
|
Franco-limoso
|
|
3
|
4,0 - 5,5
|
3,0 - 4,0
|
15 -30
|
Limoso
|
|
4
|
< 4,0 - 6,0 (57)
|
< 0,5 - 1,5 (57)
(58)
|
< 10 - 15 (57)
|
Franco-arenoso
|
|
5
|
< 4,5
|
> 10 (59)
|
< 10
|
Franco-arenoso/arena
|
|
|
27.
|
En ocasiones, es posible que se necesiten otros tipos de suelo para representar regiones más frías, templadas y tropicales. Por lo tanto, si se prefieren otros tipos de suelo, deben caracterizarse mediante los mismos parámetros y deben presentar variaciones en sus propiedades similares a las de los suelos descritos en la orientación sobre la selección de suelos para estudios de lixiviación (véase la tabla 1 anterior), aunque no satisfagan los criterios con exactitud.
|
|
28.
|
En los estudios de lixiviación con “residuos envejecidos” debe utilizarse un único suelo (12). Este suelo debe tener un contenido de arena superior al 70 % y un contenido de carbono orgánico entre el 0,5 y el 1,5 % (por ejemplo, el suelo no 4 de la tabla 1). Es posible que haya que utilizar más suelos si los datos sobre los productos de transformación son importantes.
|
|
29.
|
Todos los suelos deben caracterizarse, como mínimo, en lo que respecta a la textura (porcentaje de arena, limo y arcilla, con arreglo a los sistemas de clasificación de la FAO y del USDA (14)], el pH, la capacidad de intercambio catiónico, el contenido de carbono orgánico, la densidad aparente (en lo que respecta al suelo alterado) y la capacidad de retención de agua. La medición de la biomasa microbiana solo es necesaria en el suelo que se utiliza en el periodo de envejecimiento o incubación que se lleva a cabo antes que el experimento de lixiviación de las sustancias envejecidas. La información sobre otras propiedades del suelo (por ejemplo, la clasificación del suelo, la mineralogía de la arcilla o la superficie específica) puede resultar útil para interpretar los resultados de este estudio. Para determinar las características del suelo se pueden utilizar los métodos recomendados en las referencias (15) (16) (17) (18) (19).
|
Recogida y conservación de los suelos
|
30.
|
Los suelos deben tomarse de la capa superior (horizonte A), a una profundidad máxima de 20 cm. Deben retirarse los restos de vegetación, macrofauna y piedras. Los suelos (salvo los utilizados para envejecer la sustancia problema) se secan al aire a temperatura ambiente (preferiblemente, entre 20 y 25 °C). Se efectúa una desagregación con la fuerza mínima, de modo que la textura original del suelo cambie lo menos posible. Los suelos se tamizan con un tamiz de ≤ 2 mm. Se recomienda una homogeneización cuidadosa, ya que esto aumenta la reproducibilidad de los resultados. Antes de utilizar los suelos, se pueden conservar a temperatura ambiente y mantenerse secos al aire (12). No se recomienda ningún límite de tiempo de conservación, pero los suelos almacenados durante más de tres años deben volver a analizarse, antes de usarlos, para determinar su contenido de carbono orgánico y pH.
|
|
31.
|
Debe disponerse de información detallada sobre el historial de las zonas del terreno en las que se hayan recogido los suelos del ensayo. Los detalles deben incluir la ubicación exacta [definida exactamente por sus coordenadas geográficas o de UTM (proyección universal transversal de Mercator/cero geodésico horizontal europeo)], la cubierta de vegetación, los tratamientos con sustancias fitosanitarias, los tratamientos con fertilizantes orgánicos e inorgánicos, la adición de materiales biológicos o la contaminación accidental (12). Si el suelo se hubiera tratado con la sustancia problema o con sus análogos estructurales durante los cuatro años anteriores, no debe utilizarse en estudios de lixiviación.
|
Condiciones de ensayo
|
32.
|
Durante el periodo del ensayo, las columnas de lixiviación del suelo deben mantenerse en la oscuridad y a temperatura ambiente, siempre que esta temperatura se mantenga en un intervalo de ± 2 °C. Las temperaturas recomendadas se encuentran entre 18 y 25 °C.
|
|
33.
|
Debe aplicarse lluvia artificial (CaCl2 0,01 M) continuamente sobre la superficie de las columnas de suelo, a una tasa de 200 mm durante 48 horas (60); esta tasa equivale a una aplicación de 251 ml para una columna de un diámetro interior de 4 cm. Si fuera necesario para la finalidad del ensayo, se pueden utilizar también otras tasas de precipitaciones artificiales y duraciones más prolongadas.
|
Realización del ensayo
Lixiviación con la sustancia problema original
|
34.
|
Se rellenan columnas de lixiviación, al menos por duplicado con tierra no tratada, secada al aire y tamizada (menos de 2 mm) hasta alcanzar una altura aproximada de 30 cm. Para obtener una compactación uniforme, se añade tierra a las columnas en pequeñas porciones con una cuchara y se presiona con un émbolo, con una vibración simultánea y suave de la columna, hasta que la parte superior de la columna de suelo deje de hundirse. Se requiere un relleno uniforme para obtener resultados reproducibles de las columnas de lixiviación. Se puede obtener más información sobre las técnicas de relleno de las columnas en las referencias (20), (21) y (22). Para controlar la reproducibilidad del procedimiento de relleno, se calcula el peso total del suelo rellenado en las columnas (61); los pesos de las columnas duplicadas deben ser similares.
|
|
35.
|
Después del relleno, las columnas de suelo se humedecen previamente con lluvia artificial (CaCl2 0,01 M), de abajo arriba, para desplazar el aire de los poros del suelo mediante el agua. Posteriormente, se deja que las columnas de suelo se equilibren y el agua sobrante se elimina por gravedad. En la referencia (23) se pueden consultar métodos de saturación de columnas.
|
|
36.
|
A continuación, la sustancia problema o la sustancia de referencia se aplican a las columnas de suelo (véanse también los puntos 23-25). Para conseguir una distribución homogénea, las soluciones, suspensiones o emulsiones de la sustancia problema o de la sustancia de referencia deben aplicarse de manera uniforme sobre la superficie de las columnas de suelo. Si se recomienda la incorporación al suelo para aplicar una sustancia problema, debe mezclarse con una pequeña cantidad (por ejemplo, 20 g) de tierra y añadirse a la superficie de la columna de suelo.
|
|
37.
|
A continuación, las superficies de las columnas de suelo se cubren con un disco de vidrio sinterizado, perlas de vidrio, filtros de fibra de vidrio o un papel de filtro redondo para distribuir la lluvia artificial de manera uniforme por toda la superficie, así como para evitar que las gotas de lluvia alteren la superficie del suelo. Cuanto más grande sea el diámetro de la columna, más cuidado habrá que tener con la aplicación de la lluvia artificial en las columnas de suelo con el fin de garantizar una distribución uniforme de la lluvia artificial por la superficie del suelo. A continuación, se añade la lluvia artificial a las columnas de suelo por goteo, con la ayuda de una bomba de pistón o peristáltica, o con un embudo de decantación. Preferentemente, los lixiviados deben recogerse por fracciones y deben registrarse sus volúmenes respectivos (62).
|
|
38.
|
Tras la lixiviación y después de dejar que las columnas se drenen, las columnas de suelo se dividen en un número adecuado de segmentos, según la información que se necesite obtener del estudio; los segmentos se someten a extracción con los disolventes o las mezclas de disolventes adecuados, y se analiza su contenido de sustancia problema y, si procede, de productos de transformación, de radiactividad total y de sustancia de referencia. Los lixiviados o las fracciones de lixiviado se analizan directamente o previa extracción con respecto a los mismos productos. Cuando se utiliza la sustancia problema marcada radiactivamente, deben identificarse todas las fracciones que contengan ≥ 10 % de la radiactividad aplicada.
|
Lixiviación con residuos envejecidos
|
39.
|
El suelo fresco (no secado al aire previamente) se trata a una tasa correspondiente a la superficie de las columnas de suelo (véase el punto 24) con la sustancia problema marcada radiactivamente e incubada en condiciones aerobias de acuerdo con el método de ensayo C.23 (13). El periodo de incubación (envejecimiento) debe ser lo suficientemente largo como para producir unas cantidades importantes de productos de transformación; se recomienda un periodo de envejecimiento de una semivida de la sustancia problema (63), pero no debe ser superior a 120 días. Antes de la lixiviación, se analiza el suelo envejecido para determinar la sustancia problema y sus productos de transformación.
|
|
40.
|
Las columnas de lixiviación se rellenan hasta alcanzar una altura de 28 cm con el mismo suelo (pero secado al aire) utilizado en el experimento de envejecimiento como se describe en el punto 34, y también se determina el peso total de las columnas de suelo rellenadas. A continuación, las columnas de suelo se humedecen previamente, tal y como se describe en el punto 35.
|
|
41.
|
Luego se aplican la sustancia problema y sus productos de transformación a la superficie de las columnas de suelo, en forma de residuos de suelo envejecido (véase el punto 39), formando un segmento de suelo de 2 cm. La altura total de las columnas de suelo (suelo no tratado + suelo envejecido) no debe superar, preferiblemente, los 30 cm (véase el punto 34).
|
|
42.
|
La lixiviación se lleva a cabo tal y como se describe en el punto 37.
|
|
43.
|
Después de la lixiviación, los segmentos de suelo y los lixiviados se analizan como se indica en el punto 38 para determinar la sustancia problema, sus productos de transformación y la radiactividad no extraída. Para determinar qué cantidad de residuos envejecidos se ha retenido en la capa superior de 2 cm después de la lixiviación, este segmento debe analizarse por separado.
|
DATOS E INFORME
Tratamiento de los resultados
|
44.
|
Las cantidades de sustancia problema, productos de transformación, residuos no extraíbles y, si se hubiera incluido, sustancia de referencia, deben expresarse en forma de porcentaje de la dosis inicial aplicada por cada segmento de suelo y fracción de lixiviado. Debe incluirse una representación gráfica de cada columna, trazando los porcentajes obtenidos en función de la profundidad del suelo.
|
|
45.
|
Cuando se incluya una sustancia de referencia en estos estudios de lixiviación de columnas, la lixiviación de una sustancia puede evaluarse con arreglo a una escala relativa utilizando factores de movilidad relativa (FMR, su definición se puede consultar en el apéndice 3) (1) (11), que permite comparar los datos de lixiviación de varias sustancias obtenidos con distintos tipos de suelo. En el apéndice 3 se incluyen ejemplos de valores de FMR de diversas sustancias fitosanitarias.
|
|
46.
|
Las estimaciones de Koc (coeficiente normalizado de adsorción de carbono) y Kom (coeficiente normalizado de distribución de materia orgánica) también se pueden obtener de los resultados de lixiviación de las columnas, mediante la distancia de lixiviación o las correlaciones establecidas entre los FMR y el Kom o el Koc, (4) o aplicando una teoría cromatográfica simple (24). Sin embargo, este último método debe utilizarse con precaución, en particular cuando se tiene en cuenta que el proceso de lixiviación no conlleva únicamente condiciones de flujo saturado, sino más bien sistemas no saturados.
|
Interpretación de los resultados
|
47.
|
Los estudios de lixiviación de columnas descritos en este método permiten calcular el potencial de lixiviación o de movilidad en el suelo de la sustancia problema (en el estudio de lixiviación original) o de sus productos de transformación (en el estudio de lixiviación de residuos envejecidos). Estos ensayos no predicen cuantitativamente el comportamiento de lixiviación en condiciones sobre el terreno, pero se pueden utilizar para comparar la “capacidad de lixiviación” de una sustancia con otras cuyo comportamiento de lixiviación pudiera conocerse (24). Del mismo modo, no miden cuantitativamente el porcentaje de sustancia aplicada que puede llegar a las aguas subterráneas (11). No obstante, los resultados de los estudios de lixiviación de columnas pueden servir de ayuda para decidir si deben realizarse otras pruebas de semicampo o sobre el terreno con sustancias que presentan un gran potencial de movilidad en los ensayos de laboratorio.
|
Informe del ensayo
|
48.
|
El informe deberá incluir:
|
|
Sustancia problema y sustancia de referencia (cuando se utilice):
|
—
|
nombre común, nombre químico (nomenclatura IUPAC y CAS), número CAS, estructura química (indicando la posición marcada cuando se utilice material marcado radiactivamente) y propiedades fisicoquímicas relevantes;
|
|
—
|
purezas (impurezas) de la sustancia problema;
|
|
—
|
pureza radioquímica de la sustancia marcada y actividad específica (si procede).
|
|
|
|
Suelos de ensayo:
|
—
|
datos del lugar de recogida;
|
|
—
|
propiedades de los suelos, como pH, contenido de carbono orgánico y de arcilla, textura y densidad aparente (con respecto al suelo alterado);
|
|
—
|
actividad microbiana del suelo (únicamente con los suelos utilizados para envejecer la sustancia problema);
|
|
—
|
duración de la conservación del suelo y condiciones de conservación.
|
|
|
|
Condiciones de ensayo:
|
—
|
fechas de realización de los estudios;
|
|
—
|
longitud y diámetro de las columnas de lixiviación;
|
|
—
|
peso total del suelo de las columnas de suelo;
|
|
—
|
cantidad de sustancia problema y, si procede, sustancia de referencia aplicada;
|
|
—
|
cantidad, frecuencia y duración de la aplicación de lluvia artificial;
|
|
—
|
temperatura del montaje experimental;
|
|
—
|
número de réplicas (al menos dos);
|
|
—
|
métodos de análisis de la sustancia problema, de los productos de transformación y, si procede, de la sustancia de referencia en los distintos segmentos de suelo y lixiviados;
|
|
—
|
métodos de caracterización e identificación de los productos de transformación en los segmentos de suelo y lixiviados.
|
|
|
|
Resultados del ensayo:
|
—
|
tablas de resultados expresados en forma de concentraciones y porcentajes de dosis aplicada a los segmentos de suelo y los lixiviados;
|
|
—
|
balance de masas, si procede;
|
|
—
|
volúmenes de lixiviado;
|
|
—
|
distancias de lixiviación y, si procede, factores de movilidad relativa;
|
|
—
|
representación gráfica del porcentaje encontrado en los segmentos de suelo frente a la profundidad del segmento de suelo;
|
|
—
|
evaluación e interpretación de los resultados.
|
|
|
BIBLIOGRAFÍA
|
(1)
|
Guth, J.A., Burkhard, N. and Eberle, D.O. (1976). Experimental Models for Studying the Persistence of Pesticides in Soil. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides.
|
|
(2)
|
Russel, M.H. (1995). Recommended approaches to assess pesticide mobility in soil. In progress in Pesticide Biochemistry and Toxicology, Vol. 9 (Environmental Behaviour of Agrochemicals — T.R. Roberts y P.C. Kearney, Eds.). J. Wiley & Sons.
|
|
(3)
|
Briggs, G.G. (1981). Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficient, water solubilities, bioconcentration factors, and the parachor. J.Agric. Food Chem. 29, pp. 1050-1059.
|
|
(4)
|
Chiou, C.T., Porter, P.E. and Schmedding, D.W. (1983). Partition equilibria of non-ionic organic compounds between soil organic matter and water. Environ. Sci. Technol. 17, pp. 227-231.
|
|
(5)
|
Guth, J.A. (1983). Untersuchungen zum Verhalten von Pflanzenschutzmitteln im Boden. Bull. Bodenkundliche Gesellschaft Schweiz 7, 26-33.
|
|
(6)
|
US-Environmental Protection Agency. (1982). Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate.
|
|
(7)
|
Agriculture Canada (1987). Environmental Chemistry and Fate Guidelines for registration of pesticides in Canada.
|
|
(8)
|
Anexo I de la Directiva 95/36/CE de la Comisión, de 14 de julio de 1995, por la que se modifica la Directiva 91/414/CEE del Consejo relativa a la comercialización de productos fitosanitarios, DO L 172 de 22.7.1995, p. 8.
|
|
(9)
|
Dutch Commission for Registration of Pesticides (1991). Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air.
|
|
(10)
|
BBA (1986). Richtlinie für die amtliche Prüfung von Pflanzenschutzmitteln, Teil IV, 4-2. Versickerungsverhalten von Pflanzenschutzmitteln.
|
|
(11)
|
SETAC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed.
|
|
(12)
|
OCDE (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments. Belgirate, Italia, 18-20 de enero de 1995.
|
|
(13)
|
Los capítulos siguientes del presente anexo:
|
|
Capítulo A.4, Presión de vapor
|
|
|
Capítulo A.6, Hidrosolubilidad
|
|
|
Capítulo A.8, Coeficiente de reparto, método del frasco agitado
|
|
|
Capítulo A.24, Coeficiente de reparto, método de HPLC
|
|
|
Capítulo C.7, Degradación — degradación abiótica: hidrólisis en función del pH
|
|
|
Capítulo C.18, Adsorción/desorción mediante un método equilibrado por lotes
|
|
|
Capítulo C.23, Transformación aerobia y anaerobia en el suelo.
|
|
|
(14)
|
Soil Texture Classification (US and FAO systems). Weed Science, 33, Supl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26, 305 (1962).
|
|
(15)
|
Methods of Soil Analysis (1982). Part 2, Chemical and Microbiological Properties (A.L. Page, R.H. Miller y D.R. Kelney, Eds.). Agronomy Series No 9, 2a Ed.
|
|
(16)
|
Methods of Soil Analysis (1982). Part 2, Chemical and Microbiological Properties (A.L. Page, R.H. Miller y D.R. Kelney, Eds.). Agronomy Series No 9, 2a Ed.
|
|
(17)
|
ISO Standard Compendium Environment (1994). Soil Quality — General aspects; chemical and physical methods of analysis; biological methods of analysis. 1a Ed.
|
|
(18)
|
Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt/Main.
|
|
(19)
|
Scheffer, F. and Schachtschabel, P. (1998). Lehrbuch der Bodenkunde. F. Enke Verlag, Stuttgart.
|
|
(20)
|
Weber, J.B. y Peeper, T.F. (1977). In Research Methods in Weed Science, 2nd Edition (B. Truelove, Ed.). Soc. Weed Sci., Auburn, Alabama, 73-78.
|
|
(21)
|
Weber, J.B., Swain, L.R., Strek, H.J. and Sartori, J.L. (1986). In Research Methods in Weed Science, 3rd Edition (N.D. Camper, Ed.). Soc. Weed Sci., Champaign, IL, 190-200.
|
|
(22)
|
Oliveira, et al. (1996). Packing of sands for the production of homogeneous porous media. Soil Sci. Soc. Amer. J. 60(1): pp. 49-53.
|
|
(23)
|
Shackelford, C. D. (1991). Laboratory diffusion testing for waste disposal. — A review. J. Contam. Hydrol. 7, pp. 177-217.
|
|
(24)
|
(Hamaker, J.W. (1975). Interpretation of soil leaching experiments. In Environmental Dynamics of Pesticides (R. Haque, V.H. Freed, Eds), 115-133. Plenum Press, Nueva York.
|
|
(25)
|
OCDE (1981). Dissociation constants in water. OECD Guideline for Testing of Chemicals, No 4112, OCDE, París
|
Apéndice 1
Definiciones y unidades
Residuos de suelo envejecidos
: sustancia problema y productos de transformación presentes en el suelo tras la aplicación y después de un periodo lo suficientemente largo como para permitir el transporte y los procesos de adsorción, metabolismo y disipación que alteran la distribución y la naturaleza química de parte de la sustancia aplicada (1).
Lluvia artificial
: solución de CaCl2 0,01 M en agua destilada o desionizada.
Distancia media de lixiviación
: parte inferior de la sección de suelo en la que la sustancia recuperada acumulada es igual al 50 % de la sustancia problema recuperada total (experimento de lixiviación normal), o (parte inferior de la sección de suelo en la que la sustancia recuperada acumulada es igual al 50 % de la sustancia problema recuperada total) — ((grosor de la capa de residuos envejecidos)/2) [estudio de lixiviación con residuos envejecidos].
Sustancia
: sustancia o mezcla.
Lixiviado
: fase acuosa percolada a través de un perfil de suelo o una columna de suelo (1).
Lixiviación
: proceso por el cual una sustancia se mueve hacia abajo, a través del perfil del suelo o de una columna de suelo (1).
Distancia de lixiviación
: segmento de suelo más profundo en el que se ha encontrado un valor ≥ 0,5 % de la sustancia problema aplicada o del residuo envejecido después del proceso de lixiviación (equivalente a la profundidad de penetración).
Límite de detección (LOD) y límite de cuantificación (LOQ)
: el límite de detección (LOD) es la concentración de una sustancia por debajo de la cual no se puede distinguir la identidad de esa sustancia de la de artefactos analíticos. El límite de cuantificación (LOC) es la concentración de una sustancia por debajo de la cual no puede determinarse dicha concentración con una exactitud aceptable.
Factor de movilidad relativa, FMR
: [distancia de lixiviación de la sustancia problema (cm)]/[distancia de lixiviación de la sustancia de referencia (cm)].
Sustancia problema
: sustancia o mezcla estudiada con este método de ensayo.
Producto de transformación
: todas las sustancias resultantes de reacciones de transformación bióticas o abióticas de la sustancia problema, incluyendo el CO2 y los productos ligados a los residuos.
Suelo
: mezcla de componentes químicos minerales y orgánicos, en la que entre estos últimos se encuentran compuestos de alto contenido de carbono y nitrógeno, con grandes pesos moleculares, y que está poblada por pequeños organismos (microorganismos en su mayoría). El suelo se puede manipular en dos estados:
|
—
|
no alterado, tal y como se ha ido desarrollando a lo largo del tiempo, en capas características de distintos tipos de suelo;
|
|
—
|
alterado, tal y como suele encontrarse en campos de cultivo o como ocurre cuando se toman muestras cavando, que después se utilizan en este método de ensayo (2).
|
|
(1)
|
Holland, P.T. (1996). Glossary of Terms Relating to Pesticides. IUPAC Reports on Pesticide (36). Pure & Appl. Chem. 68, pp. 1167-1193.
|
|
(2)
|
OECD Test Guideline 304 A: Inherent Biodegradability in Soil (adoptada el 12 de mayo de 1981).
|
Apéndice 2
Figura 1:
Ejemplo de columnas de lixiviación no divisibles hechas de vidrio
Con una longitud de 35 cm y un diámetro interior de 5 cm (1)

|
(1)
|
Drescher, N. (1985). Moderner Acker- und Pflanzenbau aus Sicht der Pflanzenschutzmittelindustrie. In Unser Boden — 70 Jahre Agrarforschung der BASF AG, 225-236. Verlag Wissenschaft und Politik, Colonia.
|
Figura 2:
Ejemplo de una columna metálica divisible con un diámetro interior de 4 cm (1)

|
(1)
|
Burkhard, N., Eberle D.O. and Guth, J.A. (1975). Model systems for studying the environmental behaviour of pesticides. Environmental Quality and Safety, Suppl. Vol. III, pp. 203-213.
|
Apéndice 3
Ejemplos de factores de movilidad relativa
(64)
(FMR) para diversas sustancias fitosanitarias (1) (2) y las correspondientes clases de movilidad
(66)
|
Intervalo de FMR
|
Sustancia (FMR)
|
Clase de movilidad
|
|
≤ 0,15
|
Paratión (< 0,15), Flurodifeno (0,15)
|
I
Inmóvil
|
|
0,15 - 0,8
|
Profenofós (0,18), Propiconazol (0,23), Diazinón (0,28), Diurón (0,38) Terbutilazina (0,52), Metidatión (0,56), Prometrina (0,59), Propazina (0,64), Alacloro (0,66), Metolacloro (0,68)
|
II
Ligeramente móvil
|
|
0,8 - 1,3
|
Monurón (65) (1,00), Atrazina (1,03), Simazina (1,04), Fluometurón (1,18 )
|
III
Moderadamente móvil
|
|
1,3 - 2,5
|
Prometón (1,67), Cianazina (1,85), Bromacilo (1,91), Karbutilato (1,98)
|
IV
Bastante móvil
|
|
2,5 - 5,0
|
Carbofurano (3,00), Dioxacarb (4,33)
|
V
Móvil
|
|
> 5,0
|
Monocrotofós (> 5,0), Dicrotofós (> 5,0)
|
VI
Muy móvil
|
|
(1)
|
Guth, J.A. (1985). Adsorption/desorption. In Joint International Symposium “Physicochemical Properties and their Role in Environmental Hazard Assessment.” Canterbury, UK, 1-3 de julio de 1985.
|
|
(2)
|
Guth, J.A. and Hörmann, W.D. (1987). Problematik und Relevanz von Pflanzenschutzmittel-Spuren im Grund (Trink-) Wasser. Schr.Reihe Verein WaBoLu, 68, 91-106.
|
|
(3)
|
Harris, C.I. (1967). Movement of herbicides in soil. Weeds 15, pp. 214-216.
|
|
(4)
|
Helling, C.S. (1971). Pesticide mobility in soils. Soil Sci. Soc. Am. Proc. 35, pp. 743-748.
|
|
(5)
|
McCall, P.J., Laskowski, D.A., Swann, R.L. and Dishburger, H.J. (1981). Measurements of sorption coefficients of organic chemicals and their use in environmental fate analysis. In Test Protocols for Environmental Fate and Movement of Toxicants. Proceedings of AOAC Symposium, AOAC, Washington D.C.
|
|
(6)
|
Hollis, J.M. (1991). Mapping the vulnerability of aquifers and surface waters to pesticide contamination at the national/regional scale. BCPC Monograph No. 47 Pesticides in Soil and Water, pp. 165-174.
|
C.45. ESTIMACIÓN DE LAS EMISIONES AL MEDIO AMBIENTE DE MADERA TRATADA CON CONSERVANTES: MÉTODO DE LABORATORIO PARA PRODUCTOS DE MADERA NO RECUBIERTOS Y QUE ESTÁN EN CONTACTO CON AGUA DULCE O AGUA DE MAR
INTRODUCCIÓN
|
1.
|
El presente método de ensayo reproduce las directrices de ensayo (TG) 313 de la OCDE (2007). Las emisiones al medio ambiente de madera tratada con conservantes deben cuantificarse para poder llevar a cabo una evaluación de riesgos ambientales de la madera tratada. Este método de ensayo describe un método de laboratorio para estimar las emisiones de la madera tratada con conservantes en dos situaciones en las que las emisiones pueden entrar en contacto con el medio ambiente:
|
—
|
Emisiones de madera tratada en contacto con agua dulce. Las emisiones de la superficie de la madera tratada podrían entrar en el agua.
|
|
—
|
Emisiones de madera tratada en contacto con agua de mar. Las emisiones de la superficie de la madera tratada podrían entrar en el agua de mar.
|
|
|
2.
|
Este método de ensayo va dirigido a la evaluación de las emisiones de la madera y de los productos de madera que no están recubiertos y están en contacto con agua dulce o agua de mar. Las clases de uso se utilizan internacionalmente y sirven para clasificar el peligro biológico al que puede verse sujeto el producto tratado. Las clases de uso definen también la situación en la que se utiliza el producto tratado y determinan los compartimentos ambientales (aire, agua y suelo) que se pueden encontrar en una situación de riesgo debido a la madera tratada con conservantes.
|
|
3.
|
El método de ensayo consiste en un procedimiento de laboratorio para obtener muestras (medio receptor) del agua utilizada para sumergir la madera tratada, en intervalos de tiempo crecientes después de la exposición. La cantidad de emisiones en el medio receptor se relaciona con la superficie de la madera y con la duración de la exposición para estimar un flujo en mg/m2/día. De esta forma, se puede estimar el flujo (tasa de lixiviación) después de aumentar los periodos de exposición.
|
|
4.
|
La cantidad de emisiones se puede utilizar en una evaluación de riesgos ambientales de la madera tratada.
|
CONSIDERACIONES INICIALES
|
5.
|
El mecanismo de lixiviación en la superficie de la madera por agua dulce no se supone idéntico en su naturaleza y gravedad al lixiviado de una superficie de madera por el agua de mar. Por lo tanto, en lo que respecta a los productos conservantes de la madera o las mezclas utilizadas para tratar la madera usada en los entornos marinos, es necesario un estudio de lixiviación de la madera en relación con el agua de mar.
|
|
6.
|
La madera, en el caso de la madera tratada con un conservante, debe ser representativa de la madera utilizada comercialmente. Debe tratarse de acuerdo con las instrucciones del fabricante del conservante y de conformidad con las normas y especificaciones correspondientes. Deben indicarse los parámetros del acondicionamiento posterior al tratamiento de la madera, y previo al inicio del ensayo.
|
|
7.
|
Las muestras de madera empleadas deben ser representativas de los productos utilizados (por ejemplo, con respecto a la especie, la densidad y otras características).
|
|
8.
|
El ensayo se puede aplicar a la madera mediante un proceso de penetración o una aplicación superficial, o bien a una madera tratada que tenga un tratamiento superficial obligatorio adicional (por ejemplo, pintura aplicada como requisito para su uso comercial).
|
|
9.
|
La composición, la cantidad, el pH y la forma física del agua son importantes para determinar la cantidad, el contenido y la naturaleza de las emisiones de la madera.
|
PRINCIPIO DEL MÉTODO DE ENSAYO
|
10.
|
Las muestras problema de la madera tratada con conservantes se sumergen en agua. Se recoge el agua (medio receptor), que se analiza químicamente varias veces a lo largo de un periodo de exposición suficiente para realizar cálculos estadísticos. A partir de los resultados analíticos se calculan las tasas de emisiones en mg/m2/día. Deben registrarse los periodos de muestreo. Los ensayos con muestras no tratadas pueden interrumpirse si los valores de referencia son nulos en los tres primeros puntos de datos.
|
|
11.
|
La inclusión de muestras de madera no tratada permite determinar los niveles de referencia del medio receptor procedentes de la madera, aparte de las del conservante utilizado.
|
CRITERIOS DE CALIDAD
Exactitud
|
12.
|
La exactitud del método de ensayo para estimar la emisión depende de que las muestras problema sean representativas de la madera tratada comercialmente, de la representatividad del agua en relación con el agua real y de la representatividad del régimen de exposición con respecto a las condiciones naturales.
|
|
13.
|
La exactitud, la precisión y la repetibilidad del método analítico deben determinarse antes de llevar a cabo el ensayo.
|
Reproducibilidad
|
14.
|
Se recogen y analizan tres muestras de agua, y el valor medio se toma como valor de emisión. La reproducibilidad de los resultados en un laboratorio y entre distintos laboratorios depende del régimen de inmersión y de la madera utilizada como muestra problema.
|
Intervalo aceptable de resultados
|
15.
|
Se acepta el intervalo de resultados de este ensayo cuando los valores superiores e inferiores varían en menos de un orden de magnitud.
|
CONDICIONES DE ENSAYO
Agua
|
16.
|
Casos de lixiviación de agua dulce: se recomienda usar agua desionizada (por ejemplo, ASTM D 1193 tipo II) en el ensayo de lixiviación cuando vaya a evaluarse madera expuesta a agua dulce. La temperatura del agua debe ser de 20 °C +/– 2 °C, y el pH y la temperatura del agua medidos deben incluirse en el informe del ensayo. El análisis de muestras del agua utilizada, tomadas antes de la inmersión de las muestras tratadas, permite estimar la presencia de las sustancias analizadas en el agua. Este control sirve para determinar los niveles de referencia de las sustancias que, posteriormente, se analizan químicamente.
|
|
17.
|
Casos de lixiviación de agua de mar: se recomienda usar agua de mar sintética (por ejemplo, ASTM D 1141, agua de mar de sustitución, sin metales pesados) en el ensayo de lixiviación cuando vaya a evaluarse madera expuesta a agua de mar. La temperatura del agua debe ser de 20 °C +/– 2 °C, y el pH y la temperatura del agua medidos deben incluirse en el informe del ensayo. El análisis de muestras del agua utilizada, tomadas antes de la inmersión de las muestras tratadas, permite estimar la presencia de las sustancias analizadas en el agua. Este control sirve para analizar los niveles de referencia de las sustancias importantes.
|
Muestras de madera problema
|
18.
|
Las especies de madera deben ser típicas de las especies de madera utilizadas para evaluar la eficacia de los conservantes de la madera. Las especies recomendadas son Pinus sylvestris L. (pino silvestre), Pinus resinosa Ait. (pino rojo) o Pinus spp (pino). Se pueden realizar ensayos adicionales con otras especies.
|
|
19.
|
Debe utilizarse madera de fibra recta, sin nudos. Debe evitarse el material de aspecto resinoso. La madera debe ser típica de la disponible en el mercado. Deben registrarse el origen, la densidad y el número de anillos anuales por cada 10 mm.
|
|
20.
|
En cuanto a las muestras de madera problema, se recomiendan grupos de cinco, de conformidad con los bloques de tamaño (25 × 50 × 15 mm) de la norma EN 113 con las caras longitudinales paralelas a la fibra de la madera, aunque se pueden utilizar otras dimensiones, como 50 × 150 × 10 mm. La muestra problema debe quedar completamente sumergida en el agua. Las muestras problema serán de madera de albura al 100 %. Cada muestra se marca de manera unívoca para poder identificarla durante todo el ensayo.
|
|
21.
|
Todas las muestras problema deben cepillarse, o serrarse en plano, y las superficies no deben lijarse.
|
|
22.
|
El número de conjuntos de muestras de madera problema que se utilicen en el análisis es, como mínimo, de cinco: tres conjuntos de muestras se tratan con conservante, un conjunto de muestras no se trata y otro conjunto de muestras se utiliza para estimar el contenido de humedad de las muestras del ensayo antes del tratamiento (secadas en horno). Se preparan suficientes muestras de ensayo para permitir la selección de tres conjuntos de muestras que se encuentren en el intervalo del 5 % respecto al valor de la media de las retenciones de conservante del grupo de muestras problema.
|
|
23.
|
Todas las muestras problema se sellan en el extremo con una sustancia que impida la penetración de conservantes en el corte transversal de las muestras, o impide la lixiviación de las muestras a través del corte transversal. Es necesario distinguir entre las muestras utilizadas en los procesos de aplicación superficial y en los de penetración, para aplicar el producto de sellado de los extremos. La aplicación del producto de sellado de los extremos debe tener lugar antes del tratamiento solo en los casos de aplicación superficial.
|
|
24.
|
El corte transversal debe quedar abierto para los tratamientos de procesos de penetración. Por lo tanto, los extremos de las muestras deben sellarse al final del periodo de acondicionamiento. La emisión debe estimarse únicamente con respecto a la superficie longitudinal. Los productos de sellado deben inspeccionarse y, en caso necesario, volver a aplicarse antes de iniciar la lixiviación, y no deben volver a aplicarse una vez haya comenzado la lixiviación.
|
Recipiente de inmersión
|
25.
|
El recipiente está hecho de un material inerte y es suficientemente grande para contener cinco muestras de madera EN 113 en 500 ml de agua, lo que da como resultado una proporción de superficie con respecto al volumen de agua de 0,4 cm2/ml.
|
Estructura de las muestras problema
|
26.
|
Las muestras problema se colocan en una estructura que permita que todas las superficies expuestas de la muestra estén en contacto con el agua.
|
PROCEDIMIENTO DE TRATAMIENTO CON CONSERVANTE
Preparación de las muestras problema tratadas
|
27.
|
La muestra de madera problema que debe tratarse con el conservante estudiado se trata siguiendo el método especificado para el conservante, que puede consistir en un proceso de tratamiento por penetración o en un proceso de aplicación superficial, el cual se puede llevar a cabo por inmersión, con un aerosol o con una brocha.
|
Conservantes que deben aplicarse con un proceso de tratamiento por penetración
|
28.
|
Debe prepararse una solución del conservante que logre la absorción o la retención especificadas cuando se aplique mediante el proceso de tratamiento por penetración. La muestra de madera problema se pesa y se miden sus dimensiones. El proceso de tratamiento por penetración debe especificarse para la aplicación del conservante a la madera que se vaya a utilizar en la clase de uso 4 o 5. La muestra se vuelve a pesar después del tratamiento y se calcula la retención del conservante (kg/m3) a partir de la ecuación siguiente:

|
|
29.
|
En este ensayo se puede utilizar la madera tratada en una planta de procesamiento industrial (por ejemplo, por impregnación en vacío). Los procedimientos utilizados deben quedar registrados y la retención del material tratado de esta forma debe analizarse y registrarse.
|
Conservantes que deben aplicarse con procesos de aplicación superficial
|
30.
|
Entre los procesos de aplicación superficial se incluyen la inmersión, la pulverización o el untado con brocha de las muestras de madera problema. El proceso y la tasa de aplicación (por ejemplo, litros/m2) deben ser los especificados para la aplicación superficial del conservante.
|
|
31.
|
Debe tenerse en cuenta también, en este caso, que se puede utilizar madera tratada en una planta de procesamiento industrial. Los procedimientos utilizados deben quedar registrados y la retención del material tratado de esta forma debe analizarse y registrarse.
|
Acondicionamiento de las muestras problema después del tratamiento
|
32.
|
Después del tratamiento, las muestras problema tratadas deben acondicionarse de acuerdo con las recomendaciones del proveedor del conservante estudiado, con arreglo a los requisitos de la etiqueta del conservante o de conformidad con las prácticas de tratamiento comercial o la norma EN 252.
|
Preparación y selección de muestras problema
|
33.
|
Tras el acondicionamiento posterior al tratamiento, se calcula la retención media del grupo de muestras problema y se seleccionan aleatoriamente para realizar las mediciones de lixiviación tres conjuntos representativos de muestras con una retención que se encuentre en el intervalo del 5 % respecto al valor de la media del grupo.
|
PROCEDIMIENTO DE MEDICIÓN DE EMISIONES DE CONSERVANTE
Método de inmersión
|
34.
|
Las muestras problema se pesan y; posteriormente, se sumergen totalmente en el agua y se registra la fecha y la hora. Se tapa el recipiente para reducir la evaporación.
|
|
35.
|
El agua se cambia en los intervalos siguientes: 6 horas, 1 día, 2 días, 4 días, 8 días, 15 días, 22 días, 29 días (nota: estos tiempos son totales, no son tiempos de intervalos). Deben registrarse la hora y la fecha del cambio del agua, así como la masa de agua recuperada del recipiente.
|
|
36.
|
Cada vez que se cambie el agua, debe conservarse una muestra del agua en la que hayan estado sumergidas las muestras problema para realizar análisis químicos posteriores.
|
|
37.
|
El procedimiento de muestreo permite calcular el perfil de la cantidad de emisiones con respecto al tiempo. Las muestras deben almacenarse en unas condiciones que conserven el analito; por ejemplo, en un frigorífico en la oscuridad para reducir el crecimiento microbiano en la muestra antes del análisis.
|
MEDICIONES DE LAS EMISIONES
Muestras tratadas
|
38.
|
El agua recogida se analiza químicamente para evaluar la sustancia activa o los productos de degradación o transformación relevantes, si procede.
|
Muestras no tratadas
|
39.
|
La recogida del agua (medio receptor) en este sistema y el análisis posterior de las sustancias lixiviadas de las muestras de madera no tratada permiten estimar la posible tasa de emisión del conservante de la madera no tratada. La recogida y el análisis del medio receptor tras aumentar los periodos de exposición permiten estimar cómo cambia la tasa de emisión a lo largo del tiempo. Este análisis constituye un procedimiento de control para determinar los niveles de referencia de la sustancia problema en madera no tratada, con el objeto de confirmar que la madera utilizada como origen de las muestras no se había tratado previamente con el conservante.
|
DATOS E INFORME
Análisis químicos
|
40.
|
El agua recogida se analiza químicamente y el resultado del análisis del agua se expresa en las unidades correspondientes; por ejemplo, μg/l.
|
Notificación de datos
|
41.
|
Se registran todos los resultados. El apéndice incluye un ejemplo de una sugerencia de formulario de registro para un conjunto de muestras problema tratadas, así como una tabla resumen para calcular los valores medios de emisión en cada intervalo de muestreo.
|
|
42.
|
El flujo de emisión diario en mg/m2/día se calcula tomando la media de las tres mediciones de las tres réplicas y dividiendo por el número de días de inmersión.
|
Informe del ensayo
|
43.
|
En el informe del ensayo se proporcionará, como mínimo, la información siguiente:
|
—
|
nombre del proveedor del conservante que se somete al ensayo;
|
|
—
|
nombre o código específico y único del conservante evaluado;
|
|
—
|
nombre comercial o común de las sustancias activas, con una descripción general de los coformulantes (por ejemplo, codisolvente, resina) y la composición en % m/m de los ingredientes;
|
|
—
|
la retención o carga pertinente (en kg/m3 o l/m2, respectivamente) especificadas para la madera utilizada en contacto con el agua;
|
|
—
|
las especies de madera utilizadas, con su densidad y tasa de crecimiento en anillos por cada 10 mm;
|
|
—
|
la carga o retención del conservante evaluado y la fórmula utilizada para calcular la retención, expresada en l/m2 o kg/m3;
|
|
—
|
el método de aplicación del conservante, especificando el calendario de tratamiento utilizado en un proceso de penetración, así como el método de aplicación en caso de utilizar un tratamiento superficial;
|
|
—
|
la fecha de aplicación del conservante y una estimación del contenido de humedad de las muestras problema, expresado en forma de porcentaje;
|
|
—
|
los procedimientos de acondicionamiento utilizados, especificando el tipo, las condiciones y la duración;
|
|
—
|
especificación del producto de sellado de extremos utilizado y del número de aplicaciones;
|
|
—
|
especificación de cualquier tratamiento posterior de la madera; por ejemplo, especificación del proveedor, el tipo, las características y la carga de una pintura;
|
|
—
|
la hora y la fecha de cada inmersión, la cantidad de agua utilizada para sumergir las muestras problema en cada caso, y la cantidad de agua absorbida por la madera durante la inmersión;
|
|
—
|
toda variación del método descrito y cualquier factor que pudiera haber afectado a los resultados.
|
|
BIBLIOGRAFÍA
|
(1)
|
Norma europea EN 84:1997: Protectores de la madera. Prueba de envejecimiento acelerado de las maderas tratadas antes de los ensayos biológicos. Prueba de deslavado.
|
|
(2)
|
Norma europea EN 113/A1:2004. Protectores de la madera. Métodos de ensayo para la determinación de la eficacia preventiva contra los basidiomicetos destructores de la madera. Determinación de los valores tóxicos.
|
|
(3)
|
Norma europea EN 252:1989. Ensayo de campo para determinar la eficacia protectora relativa de un protector de madera en contacto con el suelo.
|
|
(4)
|
Norma europea EN 335 — Parte 1: 2006. Durabilidad de la madera y de los productos derivados de la madera. Clases de uso: definiciones — Parte 1: Aspectos generales.
|
|
(5)
|
American Society for Testing and Materials Standards, ASTM D 1141 — 1998. Standard Practice for the Preparation of Substitute Ocean Water, Without Heavy Metals. Annual Book of ASTM Standards, Volume 11.02.
|
|
(6)
|
American Society for Testing and Materials Standards, ASTM D 1193-77 Type II — 1983. Specifications for Reagent Water. Annual Book of ASTM Standards, Volume 11.01.
|
Apéndice 1
Formulario de registro del método de ensayo
Estimación de las emisiones al medio ambiente de madera tratada con conservantes: método de laboratorio para productos de madera no recubiertos y que están en contacto con agua dulce o agua de mar
|
Laboratorio de ensayo
|
|
|
Conservante de madera
|
|
Proveedor del conservante
|
|
|
Nombre o código específico y único del conservante
|
|
|
Nombre comercial o común del conservante
|
|
|
Coformulantes
|
|
|
Retención pertinente de la madera utilizada en contacto con el agua
|
|
|
Aplicación
|
|
Método de aplicación
|
|
|
Fecha de aplicación
|
|
|
Fórmula utilizada para calcular la retención:
|
|
|
Procedimiento de acondicionamiento
|
|
|
Duración del acondicionamiento
|
|
|
Producto de sellado de extremos / número de aplicaciones
|
|
|
Tratamiento posterior
|
Si procede
|
|
Muestras problema
|
|
Especies de madera
|
|
|
Densidad de la madera
|
(mínimo … valor medio … máximo)
|
|
Tasa de crecimiento (anillos por cada 10 mm)
|
(mínimo … valor medio … máximo)
|
|
Contenido de humedad
|
|
|
Conjuntos de ensayo
(67)
|
Retención (por ejemplo, kg/m3)
|
|
Tratado, “x”
|
Valor medio y desviación típica o intervalo de cinco muestras
|
|
Tratado, “y”
|
Valor medio y desviación típica o intervalo de cinco muestras
|
|
Tratado, “z”
|
Valor medio y desviación típica o intervalo de cinco muestras
|
|
Sin tratamiento
|
|
|
Variación de los parámetros del método de ensayo
|
Por ejemplo, calidad del agua, dimensiones de las muestras problema, etc.
|
|
Hora
|
Cambio de agua
|
Masa de la muestra
|
Absorción de agua
|
Muestra de agua
|
|
Con tratamiento (media)
|
Sin tratamiento
|
Con tratamiento (media)
|
Sin tratamiento
|
|
Agua del ensayo
|
x
|
y
|
z
|
|
|
Fecha
|
g
|
g
|
g
|
g
|
no
|
pH
|
pH
|
pH
|
pH
|
|
Inicio
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 h
|
|
|
|
|
|
1
|
|
|
|
|
|
24 h
|
|
|
|
|
|
2
|
|
|
|
|
|
2 días
|
|
|
|
|
|
3
|
|
|
|
|
|
4 días
|
|
|
|
|
|
4
|
|
|
|
|
|
8 días
|
|
|
|
|
|
5
|
|
|
|
|
|
15 días
|
|
|
|
|
|
6
|
|
|
|
|
|
22 días
|
|
|
|
|
|
7
|
|
|
|
|
|
29 días
|
|
|
|
|
|
8
|
|
|
|
|
|
|
|
Deben elaborarse tablas separadas para cada sustancia activa
|
Hora
|
Cambio de agua
|
Resultados analíticos
|
|
Muestras no tratadas
|
Muestras tratadas
|
|
Concentración de sustancia activa en el agua
mg/l
|
Cantidad emitida
mg/m2
|
Tasa de emisión
mg/m2/día
|
Concentración de sustancia activa en el agua
|
Cantidad emitida
|
Tasa de emisión
|
|
x
|
y
|
z
|
Media
|
x
|
y
|
z
|
Media
|
x
|
y
|
z
|
Media
|
|
|
Fecha
|
mg/l
|
mg/l
|
mg/l
|
mg/l
|
mg/m2
|
mg/m2
|
mg/m2
|
mg/m2
|
mg/m2/día
|
mg/m2/día
|
mg/m2/día
|
mg/m2/día
|
|
6 h
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
24 h
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 días
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 días
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 días
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15 días
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
22 días
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
29 días
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nota: Como los resultados de las muestras no tratadas pueden tener que utilizarse para corregir las tasas de emisión de las muestras tratadas, los resultados de las muestras no tratadas deben aparecer en primer lugar y todos los valores de las muestras tratadas deben ser “valores corregidos”. Es posible que también se introduzca una corrección para tener en cuenta el análisis de agua inicial.
Apéndice 2
Definiciones
Sustancia
: sustancia o mezcla.
Sustancia problema
: sustancia o mezcla estudiada con este método de ensayo.
C.46. BIOACUMULACIÓN EN OLIGOQUETOS BENTÓNICOS QUE VIVEN EN LOS SEDIMENTOS
INTRODUCCIÓN
|
1.
|
Este método de ensayo reproduce las directrices de ensayo (TG) 315 de la OCDE (2008), sobre los animales endobentónicos que ingieren sedimentos y pueden quedar expuestos a sustancias ligadas a los sedimentos (1). Entre estas especies que ingieren sedimentos, los oligoquetos acuáticos desempeñan un papel importante en los fondos de los sistemas acuáticos. Viven en el sedimento y, con frecuencia, representan las especies más abundantes, en particular en los hábitats con condiciones ambientales adversas para otros animales. Mediante bioturbación del sedimento y al actuar como presa, estos animales pueden influir enormemente en la biodisponibilidad de dichas sustancias para otros organismos; por ejemplo, los peces bentívoros. A diferencia de los organismos epibentónicos, los oligoquetos acuáticos endobentónicos se refugian en el sedimento e ingieren partículas del sedimento por debajo de la superficie de este. Por ello, estos organismos quedan expuestos a sustancias por muchas vías de absorción, incluyendo el contacto directo, la ingestión de partículas de sedimento contaminadas, el agua intersticial y el agua sobrenadante. En el apéndice 6 se describen algunas especies de oligoquetos bentónicos que se utilizan actualmente en ensayos ecotoxicológicos.
|
|
2.
|
Entre los parámetros que caracterizan la bioacumulación de una sustancia se incluyen, en primer lugar, el factor de bioacumulación (BAF), la constante de la velocidad de absorción del sedimento (ks) y la constante de la velocidad de eliminación (ke). En el apéndice 1 se incluyen definiciones detalladas de estos parámetros.
|
|
3.
|
Para evaluar el potencial de bioacumulación de las sustancias en general, además de para investigar la bioacumulación de las sustancias que tienden a repartirse dentro o sobre los sedimentos, se requiere un método de ensayo específico para el compartimento (1) (2) (3) (4).
|
|
4.
|
Este método de ensayo se ha diseñado para evaluar la bioacumulación de las sustancias asociadas a sedimentos en gusanos oligoquetos endobentónicos. El sedimento se enriquece con la sustancia problema. El uso de sedimento enriquecido va destinado a simular un sedimento contaminado.
|
|
5.
|
Este método se basa en métodos existentes de ensayo de toxicidad y bioacumulación de sedimentos (1) (4) (5) (6) (7) (8) (9). Los documentos siguientes también son útiles: los debates y resultados de un taller internacional (11) y el resultado de un ensayo interlaboratorios internacional (12).
|
|
6.
|
Este ensayo se aplica a las sustancias orgánicas estables y neutras que tienden a asociarse con los sedimentos. La bioacumulación de compuestos organometálicos estables asociados a los sedimentos también puede medirse con este método (12). No es aplicable a los metales y otros oligoelementos (11) sin modificar el diseño del ensayo con respecto a los volúmenes de sustrato y agua y, posiblemente, el tamaño de la muestra de tejido.
|
REQUISITO PREVIO E INFORMACIÓN SOBRE LA SUSTANCIA PROBLEMA
|
7.
|
En la actualidad solo hay unas cuantas relaciones cuantitativas estructura-actividad (QSAR) firmemente establecidas con respecto a los procesos de bioacumulación (14). La relación más utilizada es la correlación entre la bioacumulación y la bioconcentración de las sustancias orgánicas estables y su lipofilia [expresada en forma de logaritmo del coeficiente de reparto octanol-agua (log Kow); en el apéndice 1 se puede encontrar la definición], respectivamente, que se ha desarrollado para describir el reparto de una sustancia entre el agua y los peces. Las correlaciones del compartimento del sedimento también se han establecido mediante esta relación (15) (16) (17) (18). La correlación log Kow-log BCF como QSAR principal puede resultar útil para realizar una primera estimación preliminar del potencial de bioacumulación de las sustancias asociadas a sedimentos. Sin embargo, el BAF puede verse afectado por el contenido de lípidos del organismo del ensayo y el contenido de carbono orgánico del sedimento. Por lo tanto, el coeficiente de reparto carbono orgánico-agua (Kow) también se puede utilizar como determinante principal de la bioacumulación de sustancias orgánicas asociadas a sedimentos.
|
|
8.
|
Este ensayo es aplicable a:
|
—
|
sustancias estables y orgánicas con valores de log Kow entre 3,0 y 6,0 (5) (19), y sustancias superlipofílicas que reflejan un log Kow superior a 6,0 (5);
|
|
—
|
sustancias que pertenecen a una clase de sustancias orgánicas conocidas por su potencial de bioacumulación en los organismos vivos; por ejemplo, agentes tensioactivos o sustancias con gran adsorción (por ejemplo, Koc alto).
|
|
|
9.
|
La información sobre la sustancia problema, como las precauciones de seguridad, las condiciones adecuadas de conservación y la estabilidad, así como los métodos analíticos, debe obtenerse antes de iniciar el estudio. En las referencias (20) y (21) se ofrece más orientación sobre los análisis de sustancias con propiedades fisicoquímicas que dificultan estos ensayos. Antes de llevar a cabo un ensayo de bioacumulación con oligoquetos acuáticos, se debe conocer la siguiente información sobre la sustancia problema:
|
—
|
nombre común, nombre químico (preferiblemente, el nombre IUPAC), fórmula estructural, número de registro CAS, pureza;
|
|
—
|
solubilidad en agua [método de ensayo A.6 (22) ];
|
|
—
|
coeficiente de reparto octanol-agua Kow [métodos de ensayo A.8, A.24 (22)];
|
|
—
|
coeficiente de reparto sedimento-agua, expresado como Kd o Koc [método de ensayo C.19 (22)];
|
|
—
|
hidrólisis [método de ensayo C.7] (22);
|
|
—
|
fototransformación en el agua (23);
|
|
—
|
presión de vapor [método de ensayo A.4 (22)];
|
|
—
|
biodegradabilidad fácil [métodos de ensayo C.4 y C.29 (22)];
|
|
—
|
tensión superficial [método de ensayo A.5 (22)];
|
|
—
|
concentración crítica de micelas (24).
|
Además, sería pertinente contar con la información siguiente, si estuviera disponible:
|
—
|
biodegradación en el entorno acuático [métodos de ensayo C.24 y C.25 (22)];
|
|
—
|
constante de la ley de Henry.
|
|
|
10.
|
Las sustancias problema marcadas radiactivamente pueden facilitar el análisis de las muestras de agua, de sedimento y biológicas, y pueden utilizarse para determinar si deben llevarse a cabo o no la identificación y la cuantificación de los productos de degradación. El método descrito aquí se validó en un ensayo interlaboratorios internacional (12) para las sustancias marcadas con 14C. Si se miden los residuos radiactivos totales, el factor de bioacumulación (BAF) se basa en la sustancia original, incluyendo los eventuales productos de degradación retenidos. También se puede combinar un estudio de metabolismo con un estudio de bioacumulación mediante el análisis y la cuantificación del porcentaje de la sustancia original y sus productos de degradación en muestras tomadas al final de la fase de absorción, o en el nivel máximo de bioacumulación. En cualquier caso, se recomienda que el cálculo del BAF se base en la concentración de la sustancia original en los organismos y no solo en los residuos radiactivos totales.
|
|
11.
|
Además de las propiedades de la sustancia problema, otra información necesaria es la toxicidad para las especies de oligoquetos que se vayan a utilizar en el ensayo, como la concentración letal mediana (LC50) durante el tiempo necesario para la fase de absorción a fin de garantizar que las concentraciones de exposición seleccionadas sean muy inferiores a los niveles tóxicos. Cuando sea posible, se dará prioridad a los valores de toxicidad derivados de estudios a largo plazo con parámetros subletales (EC50). Si esos datos no estuvieran disponibles, un ensayo de toxicidad aguda en condiciones idénticas a las del ensayo de bioacumulación, o ensayos de toxicidad con otras especies representativas, pueden proporcionar información útil.
|
|
12.
|
Debe disponerse de un método analítico adecuado de exactitud, precisión y sensibilidad conocidas para la cuantificación de la sustancia en las soluciones de ensayo, en el sedimento y en el material biológico, así como de datos sobre la preparación y la conservación de las muestras, junto con fichas de datos de seguridad de los materiales. Asimismo, deben conocerse los límites de detección analítica de la sustancia problema en el agua, el sedimento y el tejido de los gusanos. Si se utiliza una sustancia problema marcada radiactivamente, también deben conocerse la radiactividad específica (es decir, Bq mol– 1), la posición del átomo marcado radiactivamente y el porcentaje de radiactividad asociado a las impurezas. La radiactividad específica de la sustancia problema debe ser lo más alta posible para detectar las concentraciones de ensayo más bajas posibles (11).
|
|
13.
|
Debe disponerse de la información sobre las características del sedimento que se vaya a utilizar (por ejemplo, el origen del sedimento o de sus componentes, el pH y la concentración de amoníaco del agua intersticial (sedimentos de campo), el contenido de carbono orgánico (COT), la granulometría (porcentaje de arena, limo y arcilla) y el porcentaje de peso seco (6).
|
PRINCIPIO DEL ENSAYO
|
14.
|
El ensayo está compuesto por dos fases: la fase de absorción (exposición) y la fase de eliminación (posexposición). Durante la fase de absorción, los gusanos se exponen a un sedimento enriquecido con la sustancia problema, que se recubre con agua reconstituida y se equilibra de la forma adecuada (11). Se mantienen en condiciones idénticas grupos de gusanos de control sin la sustancia problema.
|
|
15.
|
En la fase de eliminación, los gusanos se trasladan a un sistema agua-sedimento sin sustancia problema. La fase de eliminación es necesaria para obtener información sobre la tasa a la que los organismos del ensayo excretan la sustancia problema (19) (25). Siempre es necesaria una fase de eliminación, a menos que la absorción de la sustancia problema durante la fase de exposición haya sido insignificante (por ejemplo, si no hay ninguna diferencia estadística entre la concentración de la sustancia problema en los gusanos del ensayo y en los gusanos de control). Si no se alcanza un estado estable durante la fase de absorción, se puede determinar la cinética (BAFk, constante o constantes de la velocidad de absorción y de eliminación) a través de los resultados de la fase de eliminación. La variación de la concentración de la sustancia problema en el interior o en la superficie de los gusanos es objeto de seguimiento a lo largo de ambas fases del ensayo.
|
|
16.
|
Durante la fase de absorción, se realizan mediciones hasta que el BAF alcanza un estado de meseta o estable. De forma predeterminada, la duración de la fase de absorción debe ser de 28 días. La experiencia práctica ha demostrado que una fase de absorción de 12 a 14 días es suficiente para que varias sustancias orgánicas neutras y estables alcancen el estado estable (6) (8) (9).
|
|
17.
|
Sin embargo, si no se alcanza el estado estable en 28 días, la fase de eliminación comienza con el traslado de los oligoquetos expuestos a recipientes que contienen el mismo medio sin la sustancia problema. La fase de eliminación finaliza cuando se alcanza el 10 % de la concentración medida en los gusanos el día 28 de la fase de absorción, o tras una duración máxima de 10 días. El nivel de residuos en los gusanos al final de la fase de eliminación se indica como parámetro adicional; por ejemplo, como residuos no eliminados (NER). El factor de bioacumulación (BAFss) se calcula, preferentemente, como la proporción de concentración en los gusanos (Ca) y en el sedimento (Cs) en un estado aparentemente estable y como el factor de bioacumulación cinética, el BAFK, esto es, como la proporción de la constante de la velocidad de absorción del sedimento (ks) y la constante de la velocidad de eliminación (ke), suponiendo una cinética de primer orden. Si no se alcanza un estado estable en 28 días, hay que calcular el BAFK a partir de la constante o constantes de la velocidad de absorción y de la velocidad de eliminación. Se puede consultar el cálculo en el apéndice 2. Si no se puede aplicar una cinética de primer orden, se deben utilizar modelos más complejos [apéndice 2 y referencia (25)].
|
|
18.
|
Si no se logra un estado estable en 28 días, la fase de absorción puede prorrogarse, opcionalmente, sometiendo a grupos de gusanos expuestos –si estuvieran disponibles– a nuevas mediciones hasta alcanzar el estado estable; no obstante, y de forma paralela, la fase de eliminación debe comenzar el día 28 de la fase de absorción.
|
|
19.
|
La constante de la velocidad de absorción, la constante de la velocidad de eliminación (o constantes, cuando se incluyan modelos más complejos), el factor de bioacumulación cinética (BAFk) y, cuando sea posible, los límites de confianza de cada uno de estos parámetros se calculan a partir de ecuaciones de modelos informatizados (véanse los modelos en el apéndice 2). La adecuación del ajuste de cualquier modelo puede determinarse a partir del coeficiente de correlación o del coeficiente de determinación (si los coeficientes están próximos a la unidad, la adecuación es buena).
|
|
20.
|
Para reducir la variabilidad de los resultados del ensayo de las sustancias orgánicas con gran lipofilia, los factores de bioacumulación deben expresarse, además, en relación con el contenido lipídico de los organismos del ensayo y con el contenido de carbono orgánico total (COT) del sedimento (factor de acumulación biota-sedimento o BSAF por kg de COT del sedimento y por kg de contenido lipídico de los gusanos). Este método se basa en experiencias y correlaciones teóricas para el compartimento acuático, donde –en lo que respecta a algunas clases de sustancias– hay una clara relación entre el potencial de bioacumulación de una sustancia y su lipofilia, algo que se ha establecido adecuadamente para los peces como organismos modelo (14) (25) (27). También hay una relación entre el contenido lipídico de los peces del ensayo y la bioacumulación observada de dichas sustancias. Se han encontrado correlaciones similares en los organismos bentónicos (15) (16) (17) (18). Si se dispone de suficiente tejido de gusanos, puede determinarse el contenido lipídico de los animales de ensayo con el mismo material biológico que se utilice para determinar la concentración de la sustancia problema. No obstante, resulta práctico utilizar animales de control aclimatados, por lo menos al principio o, preferiblemente, al final de la fase de absorción para medir el contenido lipídico, que después se puede utilizar para normalizar los valores de BAF.
|
VALIDEZ DEL ENSAYO
|
21.
|
Para que el ensayo sea válido han de darse las condiciones siguientes:
|
—
|
La mortalidad acumulada de los gusanos (controles y de tratamientos) hasta el final del ensayo no debe superar el 20 % del número inicial.
|
|
—
|
Además, debe demostrarse que los gusanos se refugian en el sedimento para tener en cuenta la máxima exposición. En el punto 28 se ofrecen los detalles al respecto.
|
|
DESCRIPCIÓN DEL MÉTODO
Especies de ensayo
|
22.
|
En el ensayo se pueden utilizar varias especies de oligoquetos acuáticos. En el apéndice 6 se enumeran las especies utilizadas con más frecuencia.
|
|
23.
|
Deben realizarse a intervalos regulares (por ejemplo, cada mes) ensayos de toxicidad (96 horas, solo en agua) con un tóxico de referencia, como el cloruro de potasio (KCl) o el sulfato de cobre (CuSO4) (1), para demostrar el estado de salud de los animales del ensayo (1) (6). Si no se realizan ensayos de toxicidad de referencia a intervalos regulares, se debe comprobar el lote de organismos que se vaya a utilizar en un ensayo de bioacumulación de sedimentos utilizando un tóxico de referencia. La medición del contenido en lípidos también podría proporcionar información útil sobre el estado de los animales.
|
Cultivo de los organismos de ensayo
|
24.
|
Con el fin de disponer de un número suficiente de gusanos para realizar ensayos de bioacumulación, los gusanos deben conservarse en un cultivo de laboratorio de una sola especie. En el apéndice 6 se resumen los métodos de cultivo de las especies seleccionadas para el ensayo. Se pueden consultar los detalles en las referencias (8) (9) (10) (18) (28) (29) (30) (31) (32).
|
Equipo
|
25.
|
Se tendrá cuidado de no utilizar, con ninguna parte del equipo, materiales que puedan disolver o adsorber la sustancia problema o lixiviar otras sustancias, o tener algún efecto adverso sobre los animales de ensayo. Pueden utilizarse cámaras normales rectangulares o cilíndricas, de materiales químicamente inertes y de una capacidad adecuada para la tasa de carga, es decir, para el número de gusanos de ensayo. Debe evitarse el uso de tubos de plástico blando para administrar agua o aire. Se debe utilizar politetrafluoroetileno, acero inoxidable o vidrio en cualquier equipo que esté en contacto con los medios del ensayo. En el caso de sustancias con elevados coeficientes de adsorción, como los piretroides sintéticos, puede ser necesario emplear vidrio silanizado. Será necesario, en estos casos, deshacerse de los equipos una vez usados (5). En lo que respecta a las sustancias marcadas radiactivamente y las sustancias volátiles, se debe tener cuidado de evitar desprendimientos y el escape de la sustancia problema desprendida. Deben utilizarse trampas (por ejemplo, frascos de lavado de gases de vidrio) que contengan absorbentes adecuados para retener los residuos que puedan evaporarse de las cámaras de ensayo (11).
|
Agua
|
26.
|
El agua sobrenadante debe ser tal que permita la supervivencia de la especie de ensayo durante los periodos de aclimatación y de ensayo, sin que aparezcan ningún comportamiento ni aspecto anormales. Se recomienda utilizar agua reconstituida de acuerdo con el método de ensayo C.1 (25) como agua sobrenadante, tanto en los ensayos como en los cultivos de gusanos del laboratorio. Se ha demostrado que varias especies de ensayo pueden sobrevivir, crecer y reproducirse en esta agua (8), y se proporciona la máxima armonización de las condiciones de ensayo y de cultivo. El agua debe caracterizarse al menos por el pH, la conductividad y la dureza. El análisis de microcontaminantes en el agua antes de usarla puede proporcionar información útil (apéndice 4).
|
|
27.
|
Durante toda la duración de un ensayo, el agua deberá tener una calidad constante. El pH del agua sobrenadante debe encontrarse entre 6 y 9. La dureza total debe encontrarse entre 90 y 400 mg de CaCO3 por litro al iniciar el ensayo (7). En el método de ensayo C.1 se indican los intervalos del pH y la dureza del agua reconstituida mencionada (25). Si se sospecha una interacción entre los iones de dureza y la sustancia problema, debe utilizarse un agua menos dura. En el apéndice 4 se resumen otros criterios relativos al agua de dilución aceptable, de conformidad con las TG 210 de la OCDE (34).
|
Sedimento
|
28.
|
La calidad del sedimento debe ser tal que permita la supervivencia y, preferentemente, la reproducción de los organismos de ensayo durante los periodos de aclimatación y de ensayo, sin que aparezcan comportamientos ni aspectos anómalos en los animales. Los gusanos deben refugiarse en el sedimento. El comportamiento excavador puede afectar a la exposición y, por consiguiente, al BAF. Por lo tanto, se debe registrar si los organismos del ensayo evitan el sedimento o si se refugian en él, cuando la turbidez del agua sobrenadante permita dichas observaciones. Los gusanos (de control y de tratamientos) deben refugiarse en el sedimento en un periodo de 24 horas a partir de su adición a los recipientes de ensayo. Si se observara la ausencia de excavación o la evasión del sedimento de forma permanente (por ejemplo, más del 20 % durante más de la mitad de la fase de absorción), esto indica que las condiciones del ensayo no son adecuadas, que los organismos del ensayo no están sanos o que la concentración de la sustancia problema provoca dicho comportamiento. En ese caso, hay que detener el ensayo y repetirlo mejorando las condiciones. Se puede obtener más información sobre la ingestión del sedimento utilizando los métodos descritos en (35) y (36), que especifican la ingestión de sedimento o la selección de partículas en los organismos de ensayo. Si se puede observar, deben registrarse, como mínimo, la presencia o la ausencia de deyecciones en la superficie del sedimento, que indican la ingestión del sedimento por parte de los gusanos, y esto debe tenerse en cuenta a la hora de interpretar los resultados del ensayo con respecto a las vías de exposición.
|
|
29.
|
Se recomienda usar un sedimento artificial basado en el suelo artificial descrito en el método de ensayo C.8 (40) tanto en los ensayos como en los cultivos de laboratorio de los gusanos (apéndice 5), ya que es posible que no haya sedimentos naturales de una calidad adecuada durante todo el año. Asimismo, pueden influir en el ensayo los organismos nativos, además de la posible presencia de microcontaminantes en los sedimentos naturales. En el sedimento artificial pueden sobrevivir, crecer y reproducirse varias especies de ensayo (8).
|
|
30.
|
El sedimento artificial debe caracterizarse, al menos, por el origen de los componentes, la granulometría (porcentaje de arena, limo y arcilla), el carbono orgánico total (COT), el contenido de agua y el pH. La medición del potencial de oxidorreducción es opcional. Sin embargo, los sedimentos naturales de lugares no contaminados pueden utilizarse como sedimentos de ensayo o de cultivo (1). Los sedimentos naturales deben caracterizarse, como mínimo, por su origen (lugar de recogida), pH y amoníaco del agua intersticial, carbono orgánico total (COT), granulometría (porcentaje de arena, limo y arcilla) y porcentaje de contenido de agua (6). También se recomienda que el sedimento natural, antes de enriquecerse con la sustancia problema, se someta durante siete días a las mismas condiciones que vayan a reinar posteriormente en el ensayo, si se espera la aparición de amoníaco. Al final de este periodo de acondicionamiento, el agua sobrenadante debe eliminarse y descartarse. El análisis del sedimento o de sus componentes para detectar microcontaminantes antes de la utilización podría aportar información útil.
|
Preparación
|
31.
|
La manipulación de los sedimentos naturales antes de utilizarlos en el laboratorio se describe en (1) (6) (44). En el apéndice 5 se describe un ejemplo de preparación del sedimento artificial.
|
Almacenamiento
|
32.
|
El almacenamiento de los sedimentos naturales en el laboratorio debe ser lo más breve posible. La Agencia de Protección del Medio Ambiente de EE. UU. (6) recomienda un periodo de almacenamiento máximo de 8 semanas a 4 ± 2 °C en la oscuridad. No debe quedar espacio libre por encima del sedimento en los recipientes de almacenamiento. En el apéndice 5 se incluyen recomendaciones relativas al almacenamiento del sedimento artificial.
|
Aplicación de la sustancia problema
|
33.
|
El sedimento se enriquece con la sustancia problema. El procedimiento de enriquecimiento conlleva el recubrimiento de uno o varios de los componentes del sedimento con la sustancia problema. Por ejemplo, la arena de cuarzo, o una parte de la misma (por ejemplo, 10 g de arena de cuarzo por recipiente de ensayo), puede empaparse con una solución de la sustancia problema en un disolvente adecuado que, posteriormente, se evapora lentamente hasta secarse. La fracción recubierta puede mezclarse a continuación con el sedimento húmedo. La cantidad de arena proporcionada por la mezcla de sustancia problema y arena debe tenerse en cuenta a la hora de preparar el sedimento; es decir, el sedimento, por lo tanto, debe prepararse con menos arena (6).
|
|
34.
|
Con un sedimento natural, la sustancia problema puede añadirse enriqueciendo una parte seca del sedimento, tal y como se ha descrito anteriormente en relación con el sedimento artificial, o bien removiendo la sustancia problema con el sedimento húmedo, con la posterior evaporación del eventual agente solubilizante utilizado. Los disolventes que pueden utilizarse para enriquecer el sedimento húmedo son el etanol, el metanol, el éter monometílico de etilenglicol, el éter dimetílico de etilenglicol, la dimetilformamida y el trietilenglicol (5) (34). Los principales criterios para la selección de un agente solubilizante adecuado deben ser la toxicidad y la volatilidad del disolvente, además de la solubilidad de la sustancia problema en el disolvente elegido. En Environment Canada (1995) (41) se ofrece más orientación sobre los procedimientos de enriquecimiento. Debe velarse por que la sustancia problema añadida al sedimento se distribuya de forma total y homogénea por el sedimento. Deben analizarse submuestras replicadas del sedimento enriquecido para comprobar las concentraciones de la sustancia problema en el sedimento, y para determinar el grado de homogeneidad de la distribución de la sustancia problema.
|
|
35.
|
Una vez preparado con el agua sobrenadante el sedimento enriquecido, es conveniente dejar que la sustancia problema se reparta entre la fase de sedimento y la fase acuosa. Preferentemente, esto debe efectuarse en las mismas condiciones de temperatura y aireación que el ensayo. El tiempo adecuado para el equilibrado depende de la sustancia y del sedimento, y puede ser del orden de horas o de días, aunque en ciertos casos poco frecuentes puede llegar a ser de varias semanas (4 o 5 semanas) (28) (42). En este ensayo no se espera hasta llegar al equilibrio, pero se recomienda un periodo de equilibrado entre 48 horas y 7 días. En función del objetivo del estudio, por ejemplo cuando deben imitarse las condiciones ambientales, el sedimento enriquecido puede equilibrarse o envejecerse durante un periodo más largo (11).
|
REALIZACIÓN DEL ENSAYO
Ensayo preliminar
|
36.
|
Puede ser útil proceder a un experimento preliminar para optimizar las condiciones de realización del ensayo definitivo como, por ejemplo, la selección de las concentraciones de la sustancia problema y la duración de las fases de absorción y de eliminación. El comportamiento de los gusanos como, por ejemplo, la evasión del sedimento, es decir, que los gusanos se escapen del sedimento, algo que puede ser provocado por la sustancia problema o por el sedimento en sí, debe observarse y registrarse durante un ensayo preliminar. La evasión del sedimento también se puede utilizar como parámetro subletal en un ensayo preliminar para estimar las concentraciones de la sustancia problema que deben utilizarse en un ensayo de bioacumulación.
|
Condiciones de exposición
Duración de la fase de absorción
|
37.
|
Los organismos de ensayo se exponen a la sustancia problema durante la fase de absorción. La primera muestra debe tomarse entre 4 y 24 horas a partir del inicio de la fase de absorción. La fase de absorción debe durar 28 días como máximo (1) (6) (11), salvo si puede demostrarse que se alcanza antes el equilibrio. El estado estable se alcanza: i) cuando es paralelo al eje de tiempo la gráfica de los factores de bioacumulación en cada periodo de muestreo, frente al tiempo; ii) cuando tres análisis sucesivos del BAF realizados en las muestras tomadas a intervalos de dos días como mínimo no varían más de ± 20 % entre sí; y iii) cuando no hay diferencias importantes entre los tres periodos de muestreo (según las comparaciones estadísticas como, por ejemplo, el análisis de la varianza y el análisis de regresión). Si el estado estable no se alcanza en 28 días, la fase de absorción puede finalizar dando comienzo a la fase de eliminación, y el BAFK puede calcularse a partir de las constantes de las velocidades de absorción y de eliminación (véanse también los puntos 16 a 18).
|
Duración de la fase de eliminación
|
38.
|
La primera muestra debe tomarse entre 4 y 24 horas a partir del inicio de la fase de eliminación, ya que pueden producirse cambios rápidos en los residuos de los tejidos durante el periodo inicial. Se recomienda poner fin a la fase de eliminación cuando la concentración de la sustancia problema sea inferior al 10 % de la concentración en estado estable, o después de una duración máxima de 10 días. El nivel de residuos en los gusanos al finalizar la fase de eliminación debe indicarse como parámetro secundario. Sin embargo, este plazo de tiempo puede regirse por el periodo durante el cual la concentración de la sustancia problema en los gusanos permanece por encima del límite de detección analítico.
|
Organismos de ensayo
Cantidades de gusanos de ensayo
|
39.
|
El número de gusanos por muestra debe proporcionar una masa de tejido de gusanos tal que la masa de sustancia problema por muestra, al principio de la fase de absorción y al final de la fase de eliminación, sea significativamente superior al límite de detección de la sustancia problema en el material biológico. En las partes mencionadas de las fases de absorción y eliminación, la concentración en los animales de ensayo suele ser relativamente baja (6) (8) (18). Dado que el peso individual de muchas especies de oligoquetos acuáticos es muy bajo (de 5 a 10 mg de peso húmedo por individuo en lo que respecta a las especies Lumbriculus variegatus y Tubifex tubifex), los gusanos de una cámara de ensayo de replicada determinada pueden agruparse para realizar el pesaje y el análisis de la sustancia problema. En las especies de ensayo con un mayor peso individual (por ejemplo, Branchiura sowerbyi) se pueden utilizar réplicas que contengan un solo individuo, pero en esos casos el número de réplicas debe aumentarse a cinco por punto de muestreo (11). No obstante, cabe señalar que la especie B. sowerbyi no se incluyó en el ensayo interlaboratorios (12) y, por lo tanto, no se recomienda como especie preferente en el método.
|
|
40.
|
Deben utilizarse gusanos de tamaño similar (en lo que respecta a la especie L. variegatus, véase el apéndice 6). Los gusanos deben tener el mismo origen y deben ser animales adultos o grandes de la misma clase de edad (véase el apéndice 6). El peso y la edad de un animal pueden afectar de forma significativa a los valores de BAF (por ejemplo, debido a la presencia de huevos o al contenido lipídico distinto); estos parámetros deben quedar registrados correctamente. Para medir el peso húmedo y seco medio, hay que pesar una submuestra de gusanos antes de iniciar el ensayo.
|
|
41.
|
Con las especies Tubifex tubifex y Lumbriculus variegatus, se espera que haya reproducción durante el periodo de ensayo. La ausencia de reproducción en un ensayo de bioacumulación debe quedar registrada y debe tenerse en cuenta a la hora de interpretar los resultados del ensayo.
|
Carga
|
42.
|
Deben utilizarse grandes proporciones sedimento/gusanos y agua/gusanos para minimizar la reducción de la concentración de la sustancia problema en el sedimento durante la fase de absorción, así como para evitar reducciones de la concentración de oxígeno disuelto. La tasa de carga seleccionada también debe corresponderse con las densidades de población naturales de las especies seleccionadas (43). Por ejemplo, en el caso de Tubifex tubifex, se recomienda una tasa de carga de 1 a 4 mg de tejido de gusanos (peso húmedo) por gramo de sedimento húmedo (8) (11). Las referencias (1) y (6) recomiendan una tasa de carga ≤ 1 g de peso seco de tejido de gusanos por 50 g de carbono orgánico en el sedimento para la especie L. variegatus.
|
|
43.
|
Los gusanos que vayan a utilizarse en un ensayo deben extraerse del cultivo tamizando el sedimento del cultivo. Los animales (gusanos adultos o grandes sin signos de fragmentación reciente) se transfieren a placas de vidrio (por ejemplo, placas de Petri) que contengan agua limpia. Si las condiciones del ensayo son distintas a las del cultivo, una fase de aclimatación de 24 horas debería ser suficiente. Antes de pesarlos, debe eliminarse el agua sobrante de los gusanos. Esto se puede hacer colocando con cuidado los gusanos sobre una servilleta de papel previamente humedecida. No se recomienda utilizar papel absorbente para secar los gusanos, ya que esto puede provocarles estrés o daños. Brunson et al. (1998) recomiendan utilizar gusanos no secados de aproximadamente 1,33 veces la biomasa objetivo. Este 33 % adicional corresponde a la diferencia entre los gusanos secados y no secados (28).
|
|
44.
|
Al comenzar la fase de absorción (día 0 del ensayo), los organismos del ensayo se retiran de la cámara de aclimatación y se distribuyen aleatoriamente en los recipientes (por ejemplo, placas de Petri) que contienen agua reconstituida, añadiendo grupos de dos gusanos a cada recipiente hasta que cada recipiente contenga diez gusanos. A continuación, estos grupos de gusanos se transfieren aleatoriamente a recipientes de ensayo separados, por ejemplo con unas pinzas de acero blando. Los recipientes de ensayo se incuban después en las condiciones del ensayo.
|
Alimentación
|
45.
|
Teniendo en cuenta el bajo contenido en nutrientes del sedimento artificial, el sedimento debe modificarse con una fuente de alimentación. Con el fin de no subestimar la exposición de los organismos del ensayo, por ejemplo alimentándolos de forma selectiva con alimentos no contaminados, los alimentos necesarios para la reproducción y el crecimiento de los organismos del ensayo deben añadirse al sedimento una vez, antes o durante la aplicación de la sustancia problema (véase el apéndice 5).
|
Proporción sedimento-agua
|
46.
|
La proporción sedimento-agua recomendada es 1:4 (45). Esta proporción se considera adecuada para mantener las concentraciones de oxígeno en los niveles adecuados, así como para evitar la acumulación de amoníaco en el agua sobrenadante. El contenido de oxígeno en el agua sobrenadante debe mantenerse ≥ 40 % de la saturación. El agua sobrenadante de los recipientes de ensayo debe airearse suavemente (por ejemplo, de dos a cuatro burbujas por segundo), con una pipeta Pasteur colocada aproximadamente a 2 cm por encima de la superficie del sedimento, de forma que se minimice la alteración del sedimento.
|
Iluminación y temperatura
|
47.
|
El fotoperiodo del cultivo y del ensayo es de 16 horas (1) (6). La intensidad de la luz en el área del ensayo debe mantenerse a unos 500-1 000 lux. La temperatura de ensayo debe ser de 20 ± 2 °C durante todo el ensayo.
|
Concentraciones de ensayo
|
48.
|
Se utiliza una sola concentración de ensayo (lo más baja posible) para determinar la cinética de absorción, pero se puede utilizar una segunda concentración (más alta) [por ejemplo, (46)]. En ese caso, se toman muestras y se analizan en estado estable o después de 28 días para confirmar el BAF medido en la concentración más baja (11). La concentración más alta debe seleccionarse para poder excluir los efectos adversos (por ejemplo, seleccionando aproximadamente el 1 % de la concentración de efectos crónicos, ECX, más baja que se conozca, tal y como se derive de los estudios de toxicidad crónica pertinentes). La concentración de ensayo inferior debe ser significativamente superior al límite de detección en el sedimento y en las muestras biológicas por el método analítico utilizado. Si la concentración con efecto de la sustancia problema está cerca del límite de detección analítica, se recomienda usar una sustancia problema marcada radiactivamente con una radiactividad específica alta.
|
Réplicas tratadas y de control
|
49.
|
El número mínimo de réplicas tratadas para realizar las mediciones cinéticas debe ser de tres por punto de muestreo (11) durante las fases de absorción y eliminación. Deben utilizarse réplicas adicionales, por ejemplo para otras fechas de muestreo opcionales. En lo que respecta a la fase de eliminación, se prepara un número correspondiente de réplicas con un sedimento no enriquecido y agua sobrenadante, de forma que los gusanos tratados puedan transferirse de los recipientes tratados designados a los recipientes no tratados al final de la fase de absorción. El número total de réplicas tratadas debe ser suficiente tanto en la fase de absorción como en la de eliminación.
|
|
50.
|
Por otra parte, los gusanos designados para el muestreo durante la fase de eliminación pueden exponerse en un único recipiente grande que contenga sedimento enriquecido del mismo lote que el utilizado en la cinética de absorción. Debe demostrarse que las condiciones del ensayo (por ejemplo, profundidad del sedimento, proporción sedimento-agua, carga, temperatura, calidad del agua) son comparables a las de las réplicas designadas para la fase de absorción. Al final de la fase de absorción, deben tomarse muestras de gusanos, agua y sedimento de este recipiente para su análisis, y debe extraerse, con cuidado, un número suficiente de gusanos grandes que no presenten signos de fragmentación reciente para transferirlos a las réplicas preparadas para la fase de eliminación (por ejemplo, diez organismos por recipiente replicado).
|
|
51.
|
Si no se utiliza otro disolvente que no sea el agua, deben proporcionarse al menos nueve réplicas de un control negativo (al menos tres muestreadas al principio, tres al final de la absorción y tres al final de la eliminación) para realizar análisis biológicos y de referencia. Si se utiliza algún agente solubilizante para aplicar la sustancia problema, debe realizarse un control de disolvente (deben muestrearse al menos tres réplicas al principio, tres al final de la fase de absorción y tres al final de la fase de eliminación). En ese caso, deben proporcionarse al menos cuatro réplicas de un control negativo (sin disolvente) para el muestreo al final de la fase de absorción. Estas réplicas pueden compararse biológicamente con el control de disolvente para obtener información en cuanto a una posible influencia del disolvente sobre los organismos de ensayo. En el apéndice 3 pueden consultarse los detalles.
|
Frecuencia de las mediciones de la calidad del agua
|
52.
|
Como mínimo, deben medirse los siguientes parámetros de calidad del agua en el agua sobrenadante durante la fase de absorción y la fase de eliminación:
|
Temperatura
|
En un recipiente de cada nivel de tratamiento por fecha de muestreo, y en un recipiente de control una vez a la semana y al inicio y al final del periodo de absorción y de eliminación; también se puede registrar la temperatura en el medio circundante (aire ambiente o baño de agua), o en un recipiente de ensayo representativo, por ejemplo de forma continua o cada hora.
|
|
Contenido de oxígeno disuelto
|
En un recipiente de cada nivel de tratamiento y en un recipiente de control por fecha de muestreo; expresado como mg/l y % de ASV (valor de saturación de aire).
|
|
Suministro de aire
|
Se controla al menos una vez al día (días hábiles) y se ajusta en caso necesario.
|
|
pH
|
En un recipiente tratado de cada nivel de tratamiento por fecha de muestreo, y en un recipiente de control una vez a la semana y al principio y al final del periodo de absorción y de eliminación.
|
|
Dureza total del agua
|
Al menos en un recipiente tratado y en un recipiente de ensayo de control al principio y al final del periodo de absorción y de eliminación; se expresa como mg/l de CaCO3.
|
|
Contenido total de amoníaco
|
Al menos en un recipiente tratado y en un recipiente de ensayo de control al principio y al final del periodo de absorción y de eliminación; se expresa como mg/l de NH4
+, NH3 o N amoniacal total.
|
|
Muestreo y análisis de gusanos, sedimento y agua
Calendario de muestreo
|
53.
|
En el apéndice 3 figuran ejemplos de calendarios de muestreo con una fase de absorción de 28 días y una fase de eliminación de 10 días.
|
|
54.
|
Se toman muestras del agua y del sedimento de las cámaras de ensayo para determinar la concentración de la sustancia problema antes de introducir los gusanos, y durante las fases de absorción y de eliminación. Durante el ensayo se determinan las concentraciones de la sustancia problema en los gusanos, el sedimento y el agua para controlar la distribución de las sustancia problema en los compartimentos del sistema de ensayo.
|
|
55.
|
Se deben recoger muestras de gusanos, sedimento y agua al menos en seis ocasiones, durante tanto la fase de absorción como la de eliminación.
|
|
56.
|
Hay que continuar con el muestreo hasta que se haya alcanzado una meseta (estado estable) (véase el apéndice 1) o durante 28 días. Si no se hubiera alcanzado el nivel de meseta en 28 días, se debe dar comienzo a la fase de eliminación. Cuando se inicie la fase de eliminación, hay que transferir los gusanos designados a cámaras replicadas que contengan sedimento no tratado y agua (véanse también los puntos 17 y 18).
|
Muestreo y preparación de las muestras
|
57.
|
Las muestras de agua se obtienen por decantación, extracción con sifón o pipeteo de un volumen suficiente para medir la cantidad de sustancia problema en la muestra.
|
|
58.
|
El agua sobrenadante restante se decanta o se extrae con sifón cuidadosamente de las cámaras de ensayo. Las muestras de sedimento deben tomarse con cuidado para provocar la mínima alteración a los gusanos.
|
|
59.
|
Retire todos los gusanos de la réplica de ensayo en el momento del muestreo, por ejemplo mediante la suspensión del sedimento con el agua sobrenadante y la extensión del contenido de cada réplica en una bandeja poco profunda para retirar los gusanos con unas pinzas de acero blando. Enjuague los gusanos rápidamente con agua en un vaso poco profundo o una bandeja de acero. Elimine el exceso de agua. Transfiera los gusanos con cuidado a un recipiente previamente pesado y pese los gusanos. Sacrifique los gusanos por congelación (por ejemplo, ≤ – 18 °C). La presencia y el número de capullos y juveniles deben quedar registrados.
|
|
60.
|
En general, los gusanos deben pesarse y sacrificarse inmediatamente después del muestreo, sin fase de purga intestinal, para obtener un BAF prudente que incluya el contenido intestinal contaminado, así como para evitar pérdidas de residuos corporales durante un eventual periodo de purga intestinal en agua (8). No se prevé la eliminación significativa de las sustancias con un log Kow superior a 5 durante el eventual periodo de purga intestinal solo en agua, mientras que las sustancias con log Kow inferior a 4 pueden perderse en cantidades importantes (47).
|
|
61.
|
Durante la fase de eliminación, los gusanos vacían el intestino en el sedimento limpio. Esto significa que las mediciones realizadas justo antes de la fase de eliminación incluyen contenidos intestinales contaminados, mientras que después del periodo inicial de 4 a 24 horas de la fase de eliminación se supone que la mayor parte del contenido intestinal contaminado ha sido reemplazado por sedimento limpio (11) (47). En ese caso, la concentración en los gusanos de esta muestra puede considerarse la concentración de tejido después de la purga intestinal. Para tener en cuenta la dilución de la concentración de la sustancia problema por el sedimento no contaminado durante la fase de eliminación, es posible estimar el peso del contenido intestinal a partir de la relación entre el peso húmedo de los gusanos y el peso de las cenizas de los gusanos, o de la relación entre el peso seco de los gusanos y el peso de las cenizas de los gusanos.
|
|
62.
|
Si la finalidad de un estudio concreto es medir la biodisponibilidad y los verdaderos residuos de tejidos en los organismos de ensayo, en ese caso se debe pesar, purgar en agua limpia durante un periodo de 6 horas (47) y pesar de nuevo antes del análisis al menos una submuestra de animales tratados (por ejemplo, procedentes de tres recipientes replicados adicionales). A continuación se pueden comparar los datos relativos al peso y a la concentración corporal de los gusanos de esta submuestra con los valores obtenidos de gusanos no purgados. Los gusanos designados para medir la eliminación no deben purgarse antes de su traslado a un sedimento limpio para minimizar el estrés adicional en los animales.
|
|
63.
|
Es preferible analizar de inmediato, después de extraerlas (es decir, en uno o dos días), las muestras de agua, sedimento y gusanos para evitar la degradación u otras pérdidas y para calcular las tasas aproximadas de absorción y eliminación, conforme se vaya desarrollando el ensayo. El análisis inmediato evita también retrasos en la determinación del momento en que se alcanza una meseta.
|
|
64.
|
A falta de análisis inmediato, las muestras deben conservarse en condiciones adecuadas. Se debe obtener información sobre la estabilidad y las condiciones de conservación adecuadas para la sustancia problema en cuestión antes de empezar el estudio (por ejemplo, duración y temperatura de conservación, procedimientos de extracción, etc.). Si dicha información no estuviera disponible y se considerara necesaria, se podría trabajar al mismo tiempo con tejidos de control enriquecidos para determinar la estabilidad de la conservación.
|
Calidad del método analítico
|
65.
|
Como la totalidad del procedimiento se rige principalmente por la exactitud, la precisión y la sensibilidad del método analítico utilizado para la sustancia problema, es necesario comprobar experimentalmente que la precisión y la reproducibilidad del análisis químico, así como la recuperación de la sustancia problema en las muestras de agua, sedimento y gusanos son satisfactorias para este método en cuestión. Asimismo, se debe comprobar que la sustancia problema no se pueda detectar en las cámaras de control en concentraciones superiores a las de referencia. En caso necesario, hay que corregir los valores de Cw, Cs y Ca en relación con los valores de recuperación y referencia de los controles. Las muestras se deben manipular durante todo el ensayo de forma que se minimicen la contaminación y las pérdidas (por ejemplo, las resultantes de la adsorción de la sustancia problema en el dispositivo de muestreo).
|
|
66.
|
Deben registrarse y notificarse la recuperación general y la recuperación de la sustancia problema en gusanos, sedimentos, agua y, si se hubieran utilizado, en las trampas que contengan absorbentes para retener la sustancia problema evaporada.
|
|
67.
|
Como se recomienda el uso de sustancias marcadas radiactivamente, se puede analizar la radiactividad total (es decir, la de la sustancia original y la de los productos de degradación). Sin embargo, si fuera viable analíticamente, la cuantificación de la sustancia original y de los productos de degradación en estado estable o al final de la fase de absorción podría proporcionar información importante. Si se ha previsto realizar dichas mediciones, las muestras deben someterse, a continuación, a unos procedimientos de extracción adecuados, de forma que la sustancia original pueda cuantificarse por separado. Cuando un producto de degradación detectado represente un porcentaje significativo (por ejemplo, más del 10 %) de la radiactividad medida en los organismos de ensayo en estado estable o al final de la fase de absorción, se recomienda identificar dichos productos de degradación (5).
|
|
68.
|
Debido a la biomasa individual baja, no suele ser posible determinar la concentración de la sustancia problema en cada gusano individual, a menos que se utilice la especie Branchiura sowerbyi (40-50 mg de peso húmedo por gusano) como especie de ensayo (11). Por lo tanto, se acepta la agrupación de los individuos muestreados de un recipiente de ensayo determinado, pero esto limita los procedimientos estadísticos que pueden aplicarse a los datos. Si una potencia y un procedimiento estadísticos específicos constituyen aspectos importantes, debe incluirse en el ensayo un número adecuado de animales de ensayo o de cámaras de ensayo replicadas para dar cabida al agrupamiento, al procedimiento y a la potencia que se desean.
|
|
69.
|
Se recomienda expresar el BAF en función del peso húmedo total y del peso seco total, y, cuando resulte necesario (por ejemplo, con las sustancias muy lipofílicas), en función del contenido lipídico y del COT del sedimento. Deben utilizarse métodos adecuados para determinar el contenido lipídico (48) (49). Se puede recomendar la técnica de extracción por cloroformo/metanol (50) como método estándar (48). Sin embargo, para evitar el uso de disolventes clorados debe utilizarse una modificación validada en un estudio interlaboratorios del método de Bligh y Dyer (50), como se describe en (51). Como los diversos métodos pueden no dar valores idénticos (48), es importante precisar bien el método utilizado. Cuando sea posible (es decir, si se dispone de suficiente tejido de gusanos), el contenido lipídico se mide en la misma muestra o el mismo extracto que se haya utilizado para el análisis de la sustancia problema, puesto que los lípidos deben, a menudo, retirarse del extracto antes de que este se pueda analizar por cromatografía (5). No obstante, resulta práctico utilizar animales de control aclimatados, por lo menos al principio o, preferiblemente, al final de la fase de absorción, para medir el contenido lipídico, por ejemplo en tres muestras.
|
DATOS E INFORME
Tratamiento de los resultados
|
70.
|
La curva de absorción de la sustancia problema se obtiene representando en escala aritmética la concentración de la sustancia problema en el interior o en la superficie de los gusanos durante la fase de absorción frente al tiempo. Si la curva alcanza una meseta, se debe calcular el BAFss de estado estable:
|
|
71.
|
Determine el factor de acumulación cinética (BAFK) como la relación ks/ke. La constante de eliminación (ke) se calcula normalmente a partir de la curva de eliminación (es decir, la gráfica de la concentración de la sustancia problema en los gusanos durante la fase de eliminación). A continuación se calcula la constante de la velocidad de absorción (ks) a partir de la cinética de la curva de absorción. Para obtener el BAFK y las constantes de velocidad, ks y ke, se utilizarán preferiblemente métodos informáticos de estimación de parámetros no lineales (véase el apéndice 2). En caso de que la eliminación claramente no sea de primer orden, será necesario emplear otros modelos más complejos (25) (27) (52).
|
|
72.
|
El factor de acumulación biota-sedimento (BSAF) se determina normalizando el BAFK para tener en cuenta el contenido lipídico de los gusanos y el contenido de carbono orgánico total en el sedimento.
|
Interpretación de los resultados
|
73.
|
Los resultados se interpretarán con precaución cuando las concentraciones medidas de las concentraciones de ensayo se encuentren en niveles cercanos al límite de detección del método de análisis utilizado.
|
|
74.
|
Unas curvas de absorción y de eliminación claramente definidas indican la buena calidad de los datos de bioacumulación. Por lo general, los límites de confianza de los valores de BAF obtenidos en estudios con un diseño adecuado no deben superar el 25 % (5).
|
Informe del ensayo
|
75.
|
El informe del ensayo incluirá la información siguiente:
|
|
Sustancia problema:
|
—
|
naturaleza física y propiedades fisicoquímicas como, por ejemplo, log Kow o hidrosolubilidad;
|
|
—
|
datos de identificación química; origen de la sustancia problema, identidad y concentración de los eventuales disolventes utilizados;
|
|
—
|
si estuvieran marcados radiactivamente, la posición precisa de los átomos marcados, la radiactividad específica y el porcentaje de radiactividad asociado a las impurezas.
|
|
|
|
Especies de ensayo:
|
—
|
denominación científica, cepa, fuente, eventuales tratamientos previos, aclimatación, edad, rango de tamaños, etc.
|
|
|
|
Condiciones de ensayo:
|
—
|
procedimiento de ensayo aplicado (por ejemplo, estático, semiestático o dinámico);
|
|
—
|
tipo y características de la iluminación y del fotoperiodo o fotoperiodos utilizados;
|
|
—
|
diseño del ensayo [por ejemplo, número, material y tamaño de las cámaras de ensayo, volumen de agua, masa y volumen del sedimento, tasa de sustitución del volumen de agua (en los procedimientos dinámicos o semiestáticos), eventual aireación utilizada antes y durante el ensayo, número de réplicas, número de gusanos por réplica, número de concentraciones de ensayo, duración de las fases de absorción y de eliminación, frecuencia de muestreo];
|
|
—
|
método de preparación y aplicación de la sustancia problema, así como los motivos para elegir un método específico;
|
|
—
|
concentraciones de ensayo nominales;
|
|
—
|
origen de los componentes del agua artificial y del sedimento o, si se utilizaran medios naturales, origen del agua y del sedimento, descripción del eventual tratamiento previo, resultados de la posible demostración de la capacidad de los animales de ensayo para vivir o reproducirse en los medios utilizados, características del sedimento [pH y amoníaco del agua intersticial, en los sedimentos naturales), carbono orgánico total (COT), granulometría (porcentaje de arena, limo y arcilla), porcentaje del contenido de agua y cualesquiera otras mediciones realizadas]; y características del agua [pH, dureza, conductividad, temperatura, concentración de oxígeno disuelto, niveles de cloro residuales (si se hubieran medido) y cualquier otra medición realizada];
|
|
—
|
peso nominal y peso seco medido en porcentaje de peso húmedo (o relación entre el peso seco y el peso húmedo) del sedimento artificial, el peso seco medido en porcentaje de peso húmedo (o relación entre el peso seco y el peso húmedo) en los sedimentos de campo;
|
|
—
|
calidad del agua en las cámaras de ensayo, caracterizada por su temperatura, pH, amonio, dureza total y concentración de oxígeno disuelto;
|
|
—
|
información pormenorizada sobre el tratamiento de las muestras de agua, sedimento y gusanos, incluidos los datos de preparación, conservación, procedimientos de enriquecimiento, extracción y procedimientos (y precisión) del análisis de la sustancia problema y del contenido lipídico, y recuperaciones de la sustancia problema.
|
|
|
|
Resultados
|
—
|
mortalidad de los gusanos de control y los gusanos de cada cámara de ensayo, y cualquier efecto subletal observado, incluyendo el comportamiento anómalo (por ejemplo, evasión del sedimento, presencia o ausencia de deyecciones, falta de reproducción);
|
|
—
|
peso seco medido en porcentaje de peso húmedo (o relación entre el peso seco y el peso húmedo) del sedimento y de los organismos problema (resulta útil para la normalización);
|
|
—
|
contenido lipídico de los gusanos;
|
|
—
|
curvas que indiquen las cinéticas de absorción y de eliminación de la sustancia problema en los gusanos y el tiempo hasta alcanzar el estado estable;
|
|
—
|
Ca, Cs y Cw (con la desviación típica y el rango, si procede) de todos los tiempos de muestreo (Ca expresada en g kg– 1 del peso húmedo y seco de todo el cuerpo; Cs expresada en g kg– 1 del peso húmedo y seco del sedimento; y Cw en mg l– 1). Si se necesita conocer el factor de acumulación biota-sedimento (BSAF, véase la definición en el apéndice 1), por ejemplo para poder comparar los resultados de dos o más ensayos realizados con animales de diferente contenido lipídico, Ca debe expresarse además en g kg– 1 de contenido lipídico del organismo, y Cs debe expresarse en g kg– 1 de carbono orgánico (CO) del sedimento;
|
|
—
|
pueden indicarse también el BAF (expresado en kg de sedimento húmedo kg– 1 de gusanos mojados), la constante de la velocidad de absorción del sedimento ks (expresada en g de sedimento húmedo kg– 1 de gusanos húmedos d– 1), y la constante de la velocidad de eliminación ke (expresada en d– 1); y el BSAF (expresado en kg de CO en el sedimento kg– 1 de contenido lipídico de los gusanos);
|
|
—
|
residuos no eliminados (NER) al final de la fase de eliminación;
|
|
—
|
si se miden, los porcentajes de la sustancia original, productos de degradación y residuos ligados (es decir, el porcentaje de la sustancia problema que no se pueda extraer con métodos de extracción habituales) detectados en los animales de ensayo;
|
|
—
|
métodos utilizados para realizar los análisis estadísticos de los datos.
|
|
|
|
Evaluación de resultados
|
—
|
cumplimiento por los resultados de los criterios de validez recogidos en el punto 21;
|
|
—
|
resultados inesperados o poco habituales como, por ejemplo, eliminación incompleta de la sustancia problema de los animales de ensayo; en esos casos, los resultados de los eventuales estudios preliminares pueden proporcionar información útil.
|
|
|
Apéndice 1
Definiciones y unidades
|
|
Sedimento artificial (o sedimento reconstituido, formulado o sintético): mezcla de materiales empleada para imitar los componentes físicos de un sedimento natural.
|
|
|
Bioacumulación: aumento de la concentración de la sustancia problema en el interior o en la superficie de un organismo respecto a la concentración de esta sustancia en el medio circundante. La bioacumulación es el resultado de procesos tanto de bioconcentración como de biomagnificación (véase más abajo).
|
|
|
El factor de bioacumulación (BAF) en cualquier momento de la fase de absorción de este ensayo de bioacumulación es la concentración de la sustancia problema en la superficie o en el interior del organismo de ensayo (Ca en g·kg– 1 de peso seco o húmedo) dividida por la concentración de la sustancia en el medio circundante (Cs en g·kg– 1 de peso seco o húmedo de sedimento). Con el fin de hacer referencia a las unidades de Ca y Cs, el BAF contiene las unidades de kg de sedimento kg– 1 de los gusanos (15).
|
|
|
Factores de bioacumulación: se calculan directamente a partir de la proporción de la constante de la velocidad de absorción de sedimento dividida por la constante de la velocidad de eliminación [ks y ke, respectivamente (véase más abajo)] y se denominan factor de bioacumulación cinética (BAFK).
|
|
|
Bioconcentración: es el aumento de la concentración de la sustancia problema en el interior o en la superficie de un organismo, derivado exclusivamente de la absorción a través de la superficie corporal, respecto a la concentración de la sustancia problema en el medio circundante.
|
|
|
Biomagnificación: es el aumento de la concentración de la sustancia problema en el interior o en la superficie de un organismo derivado principalmente de la absorción a través de comida o presas contaminadas, respecto a la concentración de esta sustancia problema en la comida o en la presa. La biomagnificación puede provocar la transferencia o la acumulación de la sustancia problema dentro de las redes alimentarias.
|
|
|
El factor de acumulación biota-sedimento (BSAF) es la concentración, normalizada teniendo en cuenta los lípidos, de la sustancia problema en la superficie o en el interior del organismo de ensayo en el estado estable dividida entre la concentración, normalizada teniendo en cuenta el carbono orgánico, de la sustancia en el sedimento en el estado estable. Ca, en ese caso, se expresa como g kg– 1 de contenido lipídico del organismo; y Cs se expresa como g kg– 1 de contenido orgánico del sedimento.
|
|
|
El periodo de acondicionamiento se utiliza para estabilizar el componente microbiano del sedimento y eliminar, por ejemplo, el amoníaco derivado de los componentes del sedimento; tiene lugar antes de enriquecer el sedimento con la sustancia problema. Por lo general, el agua sobrenadante se descarta después del acondicionamiento.
|
|
|
La eliminación de una sustancia problema es la pérdida de esta sustancia por parte del tejido del organismo de ensayo mediante procesos activos o pasivos que se producen independientemente de la presencia o ausencia de la sustancia problema en el medio circundante.
|
|
|
La fase de eliminación es el tiempo, tras la transferencia de los organismos de ensayo desde un medio contaminado a un medio exento de la sustancia problema, durante el cual se estudia la eliminación (o la pérdida neta) de la sustancia por los organismos de ensayo.
|
|
|
La constante de la velocidad de eliminación (ke) es el valor numérico que define la velocidad de reducción de la concentración de la sustancia problema en el organismo de ensayo, tras la transferencia de los organismos de ensayo desde un medio que contiene la sustancia problema a un medio exento de ella; ke se expresa en d– 1.
|
|
|
El periodo de equilibrado se utiliza para permitir la distribución de la sustancia problema entre la fase sólida, el agua intersticial y el agua sobrenadante; tiene lugar después de enriquecer el sedimento con la sustancia problema y antes de añadir los organismos de ensayo.
|
|
|
El coeficiente de reparto octanol-agua (Kow) es la relación entre la solubilidad de una sustancia en n-octanol y en agua, en equilibrio; también se expresa en ocasiones como Pow. El logaritmo de Kow (log Kow) se utiliza como indicación del potencial de bioacumulación de una sustancia por los organismos acuáticos.
|
|
|
El coeficiente de reparto carbono orgánico — agua (Koc) es la relación de la concentración de una sustancia en la fracción de carbono orgánico de un sedimento respecto a su concentración en el agua, en equilibrio.
|
|
|
Agua sobrenadante: es el agua situada encima del sedimento en el recipiente de ensayo.
|
|
|
Una meseta o el estado estable se define como el equilibrio entre los procesos de absorción y de eliminación que se dan simultáneamente durante la fase de exposición. El estado estable se alcanza en la representación gráfica del BAF de cada periodo de muestreo con respecto al tiempo, cuando la curva se hace paralela al eje del tiempo y tres análisis sucesivos del BAF realizados con muestras tomadas a intervalos de, al menos, dos días, presentan una diferencia máxima de ± 20 % entre sí, y no hay diferencias estadísticamente significativas entre los tres puntos temporales de muestreo. Si las sustancias problema se absorben con lentitud, es más apropiado que los intervalos sean de siete días (5).
|
|
|
Agua intersticial: es el agua que ocupa el espacio entre las partículas del sedimento o del suelo.
|
|
|
La constante de la velocidad de absorción del sedimento (ks) es el valor numérico que define la velocidad del aumento de la concentración de la sustancia problema en el organismo de ensayo, procedente de la absorción del sedimento. ks se expresa en g de sedimento kg– 1 de gusanos d– 1.
|
|
|
Sedimento enriquecido: sedimento al que se ha añadido la sustancia problema.
|
|
|
El factor de bioacumulación en el estado estable (BAFss) es el BAF en dicho estado y no cambia significativamente a lo largo de un periodo prolongado, durante el cual se mantiene constante la concentración de la sustancia problema en el medio circundante (Cs en g kg– 1 de peso húmedo o seco del sedimento).
|
|
|
La fase de absorción o de exposición es el tiempo durante el cual los organismos de ensayo se exponen a la sustancia problema.
|
Apéndice 2
Cálculo de los parámetros de absorción y de eliminación
El parámetro principal del ensayo de bioacumulación es el factor de bioacumulación, el BAF. El BAF medido puede calcularse dividiendo la concentración de la sustancia problema en el organismo de ensayo, Ca, entre la concentración de la sustancia problema en el sedimento, Cs, en estado estable. Si el estado estable no se alcanza durante la fase de absorción, el BAF se calculará de la misma forma en el día 28. Sin embargo, ha de señalarse si el BAF se basa o no en las concentraciones en el estado estable.
El medio preferido para obtener el factor de bioacumulación cinética (BAFK), la constante de velocidad de absorción del sedimento (ks) y la constante de la velocidad de eliminación (ke) consiste en utilizar métodos de estimación de parámetros no lineales con un ordenador. Dada la serie temporal de los factores de acumulación media (Ca, valores medios de cada fecha de muestreo/Cs, valores medios de cada fecha de muestreo = AF) de la fase de absorción según el peso húmedo de los gusanos y del sedimento, y la ecuación modelo
|
AF(t) = BAF × (1 – eke × t)
|
[ecuación 1]
|
donde AF(t) es la relación entre la concentración de la sustancia problema en los gusanos y su concentración en el sedimento en un momento determinado (t) de la fase de absorción, estos programas informáticos calculan los valores de BAFK, ks y ke.
Cuando se alcanza el estado estable durante la fase de absorción (es decir, t = ∞), la ecuación 1 se puede reducir a:
|
|
[ecuación 2]
|
donde
|
ks
|
=
|
constante de la velocidad de absorción en el tejido [g de sedimento kg– 1 de los gusanos d– 1]
|
|
ke
|
=
|
constante de la velocidad de eliminación [d– 1]
|
Entonces, ks/ke × Cs es una aproximación a la concentración de la sustancia problema en el tejido de los gusanos en el estado estable (Ca,ss).
El factor de acumulación biota-sedimento (BSAF) debe calcularse de la forma siguiente:

donde foc es la fracción de carbono orgánico del sedimento en peso seco, y flip es la fracción de lípidos de los gusanos, en peso seco o en peso húmedo.
Dada una serie temporal de valores de concentración, se puede modelar la cinética de eliminación con las siguientes ecuaciones modelo y un método de estimación de parámetros no lineales basado en cálculos informáticos.
Se recomienda como punto de inicio predeterminado el residuo corporal medio medido al final de la fase de absorción. El valor modelado o estimado a partir de la fase de absorción solo debe utilizarse, por ejemplo, si el valor medido se desvía de forma significativa del residuo de cuerpo modelado. En el punto 50 se puede consultar otra exposición previa de gusanos destinados a la eliminación; con este planteamiento, se cree que las muestras de estos gusanos previamente expuestos el día 0 de la fase de eliminación proporcionan un residuo corporal realista para iniciar con él la cinética de eliminación.
Si la representación de los datos frente al tiempo indica un declive exponencial constante de la concentración de la sustancia problema en los animales, puede utilizarse un modelo monocompartimental (ecuación 4) para describir la evolución temporal de la eliminación.
|

|
[ecuación 3]
|
Los procesos de eliminación a veces resultan bifásicos, con un rápido declive de Ca durante las primeras etapas, que luego se convierte en una pérdida más lenta de la sustancia problema en las fases posteriores de la eliminación [véanse, por ejemplo, (8) (19) (25)]. Las dos fases pueden interpretarse bajo la suposición de que hay dos compartimentos diferentes en el organismo, desde los que se pierde la sustancia problema a diferentes velocidades. En estos casos hay que consultar la bibliografía específica, como, por ejemplo (15) (16) (17) (25).
Por ejemplo, la ecuación siguiente (25) describe una eliminación bicompartimental:
|
|
[ecuación 4]
|
A y B representan el tamaño de los compartimentos (en porcentaje de residuo de tejido total), donde A es el compartimento de pérdida rápida de la sustancia y B el compartimento de pérdida lenta de la sustancia problema. La suma de A y B es igual al 100 % de todo el volumen de los compartimentos de los animales en estado estable. ka y kb representan las constantes de eliminación correspondientes [d– 1]. Si el modelo bicompartimental se aplica a los datos de depuración, la constante de la velocidad de absorción ks puede determinarse de la siguiente manera (53) (54):
|

|
[ecuación 5]
|
Sin embargo, estas ecuaciones modelo deben utilizarse con precaución, especialmente cuando se producen cambios en la biodisponibilidad de la sustancia problema durante el ensayo (42).
Como alternativa a las ecuaciones modelo anteriores, también se pueden calcular las constantes cinéticas (ks y ke) de una sola vez aplicando el modelo de cinética de primer orden a todos los datos de las fases tanto de absorción como de eliminación juntos. Para encontrar una descripción de un método que permita este cálculo combinado de las constantes de velocidad de absorción y de eliminación, pueden consultarse las referencias (55) (56) y (57).
Los residuos no eliminados (NER) deben calcularse como parámetro secundario, multiplicando por 100 la relación entre la concentración media en los gusanos (Ca) el día 10 de la fase de eliminación y la concentración media en los gusanos (Ca) en estado estable (día 28 de la fase de absorción):

Apéndice 3
Ejemplo de calendario de muestreo de un ensayo de bioacumulación de 28 días
a) Fase de absorción (incluida una fase de equilibrado de cuatro días)
|
Día
|
Actividades
|
|
– 6
|
Preparación de la suspensión de turba para el sedimento; acondicionamiento de la suspensión durante 48 horas.
|
|
– 4
|
Enriquecimiento del sedimento o de la fracción del sedimento; mezcla de todos los componentes del sedimento; toma de muestras del sedimento tratado y del de control de disolventes para determinar la concentración del objeto del ensayo; adición de agua sobrenadante; incubación en las condiciones del ensayo (fase de equilibrado).
|
|
– 3/– 2
|
Separación de los organismos de ensayo del cultivo para aclimatación.
|
|
0
|
Medición de la calidad del agua (véase el punto 52); extracción de réplicas para tomar muestras de agua y sedimento para determinar la concentración de la sustancia problema; distribución aleatoria de los gusanos en las cámaras de ensayo; retención de suficientes submuestras de gusanos para determinar los valores analíticos de referencia; control del suministro de aire, si se utilizara un sistema de ensayo cerrado.
|
|
1
|
Extracción de las réplicas para el muestreo; control del suministro de aire, comportamiento de los gusanos, calidad del agua (véase el punto 56); toma de muestras de agua, sedimento y gusanos para determinar la concentración de la sustancia problema.
|
|
2
|
Control del suministro de aire, del comportamiento de los gusanos y de la temperatura.
|
|
3
|
Como el día 1.
|
|
4 - 6
|
Como el día 2.
|
|
7
|
Como el día 1; compensar el agua evaporada en caso necesario.
|
|
8 - 13
|
Como el día 2.
|
|
14
|
Como el día 1; compensar el agua evaporada en caso necesario.
|
|
15 - 20
|
Como el día 2.
|
|
21
|
Como el día 1; compensar el agua evaporada en caso necesario.
|
|
22 - 27
|
Como el día 2.
|
|
28
|
Como el día 1; medición de la calidad del agua (véase el punto 52); fin de la fase de absorción; retención de suficientes submuestras de gusanos para determinar los valores analíticos de referencia, el peso húmedo y seco y el contenido lipídico; transferencia de los gusanos desde las réplicas expuestas restantes a los recipientes que contienen sedimento limpio para la fase de eliminación (sin purga intestinal); muestreo de agua, sedimento y gusanos de los controles de disolvente; muestreo de las soluciones trampa, si se hubieran instalado.
|
|
|
Las actividades previas a la exposición (fase de equilibrado) deben programarse teniendo en cuenta las propiedades de la sustancia problema. Si es necesario, hay que acondicionar el sedimento preparado bajo agua sobrenadante a 20 ± 2 °C durante 7 días; en este caso, ¡hay que preparar antes el sedimento!
|
|
|
Las actividades descritas para el día 2 deben realizarse diariamente (al menos en los días hábiles).
|
b) Fase de eliminación
|
Día
|
Actividades
|
|
-6
|
Preparación de la suspensión de turba para el sedimento; acondicionamiento de la suspensión durante 48 horas.
|
|
-4
|
Mezcla de todos los componentes del sedimento; toma de muestras del sedimento tratado y del de control de disolventes para determinar la concentración del objeto del ensayo; adición de agua sobrenadante; incubación en las condiciones del ensayo.
|
|
0 (día 28 de la fase de absorción)
|
Medición de la calidad del agua (véase el punto 52); transferencia de los gusanos desde las réplicas expuestas restantes a los recipientes que contienen sedimento limpio; una vez transcurridas de 4 a 6 h, extracción de las réplicas para tomar muestras de agua, sedimento y gusanos, para determinar la concentración de la sustancia problema; distribución aleatoria de los gusanos en las cámaras de ensayo.
|
|
1
|
Extracción de las réplicas para el muestreo; control del suministro de aire, comportamiento de los gusanos, calidad del agua (véase el punto 52); toma de muestras de agua, sedimento y gusanos para determinar la concentración de la sustancia problema.
|
|
2
|
Control del suministro de aire, del comportamiento de los gusanos y de la temperatura.
|
|
3
|
Como el día 1.
|
|
4
|
Como el día 2.
|
|
5
|
Como el día 1.
|
|
6
|
Como el día 2.
|
|
7
|
Como el día 1; compensar el agua evaporada en caso necesario.
|
|
8 — 9
|
Como el día 2.
|
|
10
|
Como el día 1; fin de la fase de eliminación; medición de la calidad del agua (véase el punto 52); muestreo de agua, sedimento y gusanos de los controles de disolvente; muestreo de las soluciones trampa, si se hubieran instalado.
|
|
|
La preparación del sedimento antes del inicio de la fase de eliminación debe hacerse de la misma forma que antes de la fase de absorción.
|
|
|
Las actividades descritas para el día 2 deben realizarse diariamente (al menos en los días hábiles).
|
Apéndice 4
Algunas características fisicoquímicas de un agua de dilución aceptable
|
COMPONENTE
|
CONCENTRACIÓN
|
|
Partículas
|
< 20 mg/l
|
|
Carbono orgánico total
|
< 2 μg/l
|
|
Amoníaco no ionizado
|
< 1 μg/l
|
|
Cloro residual
|
< 10 μg/l
|
|
Plaguicidas organofosforados totales
|
< 50 ng/l
|
|
Plaguicidas organoclorados totales y bifenilos policlorados
|
< 50 ng/l
|
|
Cloro orgánico total
|
< 25 ng/l
|
COMPOSICIÓN DEL AGUA RECONSTITUIDA RECOMENDADA
|
a)
|
Solución de cloruro de calcio
Disuelva 11,76 g de CaCl2 · 2 H2O en agua desionizada; enrase a 1 l con agua desionizada.
|
|
b)
|
Solución de sulfato de magnesio
Disuelva 4,93 g de MgSO4 · 7 H2O en agua desionizada; enrase a 1 l con agua desionizada.
|
|
c)
|
Solución de bicarbonato de sodio
Disuelva 2,59 g de NaHCO3 en agua desionizada; enrase a 1 l con agua desionizada.
|
|
d)
|
Solución de cloruro de potasio
Disuelva 0,23 g de KCl en agua desionizada; enrase a 1 l con agua desionizada.
|
Todas las sustancias deben ser de grado analítico.
La conductividad del agua destilada o desionizada no debe superar los 10 μScm– 1.
Se mezclan 25 ml de cada solución, de la a) hasta la d), y se enrasa a 1 l con agua desionizada. La suma de los iones de calcio y magnesio de estas soluciones es 2,5 mmol/l.
La proporción de iones de Ca:Mg es 4:1; la proporción de iones de Na:K es 10:1. La alcalinidad o capacidad de ácido KS4.3 de esta solución es de 0,8 mmol/l.
Hay que airear el agua de dilución hasta lograr la saturación de oxígeno; a continuación, debe conservarse durante dos días aproximadamente sin volver a airearla antes de usarla.
El pH de un agua de dilución aceptable debe encontrarse en un intervalo de 6 a 9.
Apéndice 5
Sedimento artificial: recomendaciones sobre su preparación y almacenamiento
A diferencia de los requisitos del método de ensayo C.8 (40), se recomienda que el contenido de turba del sedimento artificial sea del 2 % en lugar del 10 % del peso seco, para que corresponda a un contenido orgánico de sedimentos naturales de bajo a moderado (58).
Porcentaje de componentes secos del sedimento artificial:
|
Componente
|
Características
|
% de sedimento seco
|
|
Turba
|
Turba esfágnea, grado de descomposición: “intermedio”, secada al aire, sin restos vegetales visibles, muy triturada (granulometría ≤ 0,5 mm)
|
2 ± 0,5
|
|
Arena de cuarzo
|
Granulometría: ≤ 2 mm, pero más del 50 % de las partículas deben encontrarse en la banda de 50-200 μm
|
76
|
|
Caolín
|
Contenido en caolinita ≥ 30 %
|
22 ± 1
|
|
Fuente de alimento
|
Folia urticae, hojas en polvo de Urtica sp. (ortiga), muy trituradas (granulometría ≤ 0,5 mm), o una mezcla de hojas en polvo de Urtica sp. con alfa-celulosa (1: 1); de conformidad con las normas farmacéuticas, para consumo humano; añadida al sedimento seco
|
0,4 - 0,5 %
|
|
Carbonato de calcio
|
CaCO3, pulverizado, químicamente puro, añadido al sedimento seco
|
0,05 - 1
|
|
Agua desionizada
|
Conductividad ≤ 10 μS/cm, añadida al sedimento seco
|
30 - 50
|
Si se espera una concentración elevada de amoníaco, por ejemplo si se sabe que la sustancia problema inhibe la nitrificación, puede ser útil sustituir el 50 % del polvo de ortiga rico en nitrógeno por celulosa (por ejemplo, polvo de α-celulosa, químicamente puro, granulometría de partículas ≤ 0,5 mm).
Preparación
La turba se seca al aire y se tritura hasta conseguir un polvo fino (granulometría ≤ 0,5 mm, sin restos de plantas visibles). Se prepara una suspensión de la cantidad necesaria de polvo de turba mediante una parte del agua desionizada que se vaya a añadir al sedimento seco [un volumen de agua de 11,5 × peso seco de la turba ha resultado útil para producir una lechada de turba que pueda agitarse (8)] con un dispositivo de homogeneización de altas prestaciones.
El pH de esta suspensión se ajusta a 5,5 ± 0,5 con CaCO3. La suspensión se acondiciona durante al menos dos días, removiendo suavemente a 20 ± 2 °C, para estabilizar el pH y establecer un componente microbiano estable. Se vuelve a medir el pH y se ajusta a 6,0 ± 0,5 con CaCO3 en caso necesario. A continuación, toda la suspensión se mezcla con el resto de componentes secos, teniendo en cuenta cualquier otra porción utilizada en el enriquecimiento. Se añade el agua desionizada restante para obtener un sedimento homogéneo. Se vuelve a medir el pH y se ajusta a 6,5 - 7,5 con CaCO3, en caso necesario. Sin embargo, si se espera que se forme amoníaco, puede resultar útil mantener el pH del sedimento por debajo de 7,0 (por ejemplo, entre 6,0 y 6,5). Se toman muestras del sedimento para determinar el peso seco y el carbono orgánico total. Si se espera que se forme amoníaco, el sedimento artificial puede acondicionarse durante siete días en las mismas condiciones que vayan a prevalecer en el ensayo posterior (por ejemplo, proporción sedimento-agua 1:4, altura de la capa de sedimento como en los recipientes de ensayo), antes de enriquecerlo con la sustancia problema; es decir, debe rellenarse con agua, que debe haberse aireado. Al final del periodo de acondicionamiento, el agua sobrenadante debe eliminarse y descartarse. Se toman muestras del sedimento para determinar el peso seco y el contenido de carbono orgánico total (por ejemplo, tres muestras).
Posteriormente, la arena de cuarzo enriquecida se mezcla con el sedimento en cada nivel de tratamiento; el sedimento se distribuye en los recipientes de ensayo replicados y se recubre con el agua de ensayo (por ejemplo, proporción sedimento-agua 1: 4, altura de la capa de sedimento como en los recipientes de ensayo). A continuación, los recipientes se incuban en las mismas condiciones que vayan a prevalecer en el ensayo posterior. Aquí es donde comienza el periodo de equilibrado. El agua sobrenadante debe airearse.
La fuente de alimento elegida debe añadirse antes o durante el enriquecimiento del sedimento con la sustancia problema. Inicialmente puede mezclarse con la suspensión de turba (véase más arriba). Sin embargo, se puede evitar la degradación excesiva de la fuente de alimento antes de añadir los organismos de ensayo (por ejemplo, en caso de que el periodo de equilibrado sea largo), manteniendo el periodo transcurrido entre la adición del alimento y el inicio de la exposición lo más breve posible. A fin de garantizar que el alimento esté en suficiente contacto con la sustancia problema, la fuente de alimento debe mezclarse con el sedimento, a más tardar el día en que el sedimento se enriquece con la sustancia problema. Se pueden hacer excepciones cuando la duración del periodo de equilibrado provoca una degradación microbiana excesiva del alimento antes de añadir los organismos de ensayo. Se toman muestras del sedimento para determinar el peso seco y el contenido de carbono orgánico total (por ejemplo, tres muestras de sedimento enriquecido o de control).
El peso seco de los componentes (turba, arena y caolín) debe indicarse en g y en porcentaje de peso seco total.
El volumen de agua que vaya a añadirse a los componentes secos durante la preparación del sedimento también debe indicarse en porcentaje del peso seco total (por ejemplo, 100 % del peso seco + 46 % de agua significa que 1 000 g de peso seco reciben, en total, 460 ml de agua, lo que se traduce en 1 460 g de sedimento húmedo).
Almacenamiento
Los componentes secos del sedimento artificial pueden almacenarse en un lugar fresco y seco, a temperatura ambiente. El sedimento húmedo preparado puede almacenarse (para usarlo posteriormente en el cultivo solamente) a 4 ± 2 °C en la oscuridad, durante un periodo de 2 a 4 semanas, a partir del día de preparación (8).
Una vez se haya añadido la sustancia problema al sedimento, este debe utilizarse inmediatamente, salvo que se disponga de información en el sentido de que ese sedimento concreto puede conservarse sin que se vean afectadas la toxicidad ni la biodisponibilidad de la sustancia problema. Es posible conservar muestras de sedimento enriquecido hasta el momento de su análisis en las condiciones recomendadas para la sustancia problema concreta.
Apéndice 6
Especies de oligoquetos recomendadas para los ensayos de bioacumulación
Tubifex tubifex (MÜLLER), Tubificidae, Oligochaeta
El oligoqueto tubifícido (Tubificidae, Oligochaeta) Tubifex tubifex (Müller) habita en sedimentos de agua dulce, en tubos recubiertos con moco. En estos tubos, los gusanos se encuentran cabeza abajo e ingieren partículas de sedimento utilizando los microorganismos y los restos orgánicos asociados. La parte posterior suele ondular en el agua sobrenadante para poder respirar. Aunque esta especie habita en una gran variedad de tipos de sedimento de todo el hemisferio norte, Tubifex tubifex prefiere granulometrías relativamente finas (59). La idoneidad de esta especie para los ensayos ecotoxicológicos se describe, por ejemplo, en (8) (29) (31) (39) (60) (62) (63).
Métodos de cultivo
Con el fin de disponer de un número suficiente de Tubifex tubifex para realizar ensayos de bioacumulación, los gusanos deben conservarse en un cultivo de laboratorio permanente. Para el cultivo de T. tubifex (8) se recomienda un sistema consistente en un sedimento artificial basado en el suelo artificial empleado en el método de ensayo C.8 (40), y agua reconstituida de acuerdo con el método de ensayo C.1.
Como recipientes de cultivo se pueden utilizar recipientes de vidrio o acero inoxidable, de una altura de 12 a 20 cm. Cada recipiente de cultivo se carga con una capa de sedimento artificial húmedo, preparado de acuerdo con la descripción del apéndice 5. La profundidad de la capa de sedimento debe permitir el comportamiento normal de excavación de los gusanos (profundidad mínima de 2 cm para la especie T. tubifex). Se añade agua reconstituida al sistema. Se debe tener cuidado para minimizar la alteración del sedimento. La masa de agua se airea suavemente (por ejemplo, dos burbujas por segundo, con aire filtrado por membrana de 0,45 μm) con una pipeta Pasteur colocada 2 cm por encima de la superficie del sedimento. La temperatura recomendada del cultivo es de 20 ± 2 °C.
Los gusanos se añaden al sistema de cultivo con una carga máxima de 20 000 individuos/m2 de la superficie del sedimento. Una carga mayor puede provocar una reducción del crecimiento y de las tasas de reproducción (43).
En los cultivos de sedimento artificial hay que alimentar a los gusanos. Una dieta consistente en alimento para peces muy triturado como, por ejemplo, TetraMin®, puede servir como nutrición adicional (8); Klerks 1994, comunicación personal. Las tasas de alimentación deben permitir un crecimiento y una reproducción suficientes, y deben mantener al mínimo la acumulación de amoníaco y el crecimiento fúngico en el cultivo. El alimento puede administrarse dos veces a la semana (por ejemplo, 0,6 – 0,8 mg por cm2 de la superficie del sedimento). La experiencia práctica ha demostrado que la aplicación de alimento en suspensión y homogeneizado en agua desionizada puede facilitar la distribución homogénea del alimento por la superficie del sedimento en los recipientes de cultivo.
Para evitar la acumulación de amoníaco, el agua sobrenadante debe cambiarse con un sistema dinámico o, al menos una vez a la semana, manualmente. El sedimento debe cambiarse cada tres meses en los cultivos madre.
El muestreo de gusanos del cultivo se puede llevar a cabo tamizando el sedimento del cultivo con un tamiz de 1 mm, si se necesitan solo adultos. Para retener los capullos, se puede utilizar una malla de 0,5 mm y para los gusanos juveniles, un tamiz de 0,25 mm. Los tamices se pueden colocar en agua reconstituida una vez que el sedimento los haya atravesado. Los gusanos salen de la malla y se pueden recoger del agua con unas pinzas de acero blandas o con una pipeta de bordes redondeados.
Solo se utilizan ejemplares intactos y claramente identificados de Tubifex tubifex [por ejemplo, (64)] para iniciar un ensayo o nuevos cultivos. Deben descartarse los gusanos enfermos o lesionados, así como los capullos infestados de hifas fúngicas.
Un cultivo sincronizado puede suministrar gusanos de una edad concreta a los intervalos adecuados, si se desea. Los recipientes de los nuevos cultivos se preparan a los intervalos escogidos (por ejemplo, cada dos semanas), empezando con los animales de una edad concreta (por ejemplo, capullos). En las condiciones de cultivo descritas en este documento, los gusanos son adultos una vez transcurridas de 8 a 10 semanas. Los cultivos se pueden recoger cuando los gusanos han puesto nuevos capullos; por ejemplo, después de diez semanas. Los adultos recogidos se pueden utilizar en ensayos y con los capullos se pueden iniciar nuevos cultivos.
Lumbriculus variegatus (MÜLLER), Lumbriculidae, Oligochaeta
La especie Lumbriculus variegatus (Lumbriculidae, Oligochaeta) también habita los sedimentos de agua dulce de todo el mundo y se utiliza ampliamente en los ensayos ecotoxicológicos. En las referencias (1) (6) (9) (36) se puede obtener información sobre la biología, las condiciones de cultivo y la sensibilidad de la especie. Lumbriculus variegatus también puede cultivarse en el sedimento artificial recomendado para T. tubifex, con ciertas limitaciones de acuerdo con (8). Como en la naturaleza L. variegatus prefiere sedimentos más gruesos que T. tubifex (59), los cultivos de laboratorio con el sedimento artificial utilizado con T. tubifex pueden extinguirse después de un periodo de 4 a 6 meses. La experiencia práctica ha demostrado que L. variegatus se puede mantener en un sustrato arenoso (por ejemplo, arena de cuarzo, gravilla fina) en un sistema dinámico con alimento para peces como fuente de nutrición a lo largo de varios años sin renovar el sustrato. Una de las grandes ventajas de L. variegatus frente a otras especies de oligoquetos acuáticos es su rápida reproducción, que provoca una biomasa que aumenta rápidamente en las poblaciones de cultivos de laboratorio (1) (6) (9) (10).
Métodos de cultivo
Las condiciones de cultivo de Lumbriculus variegatus se explican detalladamente en Phipps et al. (1993) (10), Brunson et al. (1998) (28), ASTM (2000) (1), U.S. EPA (2000) (6). A continuación se resumen brevemente estas condiciones.
Los gusanos pueden cultivarse en grandes acuarios (57 – 80 l) a 23 °C, con un fotoperiodo luz:oscuridad de 16:8 (100 – 1 000 lux), con agua natural renovada diariamente (45 – 50 l por acuario). El sustrato se prepara cortando en tiras servilletas de papel marrón sin blanquear, que después pueden mezclarse con el agua del cultivo durante unos segundos para producir trocitos de sustrato de papel. Este sustrato puede utilizarse directamente en los acuarios de cultivo de Lumbriculus, recubriendo la superficie del fondo del recipiente, o se puede conservar congelado en agua desionizada para utilizarlo posteriormente. El nuevo sustrato en el recipiente durará generalmente unos dos meses.
Cada cultivo de gusanos comienza con 500 – 1 000 gusanos, que se alimentan con 10 ml de suspensión que contiene 6 g de alimento inicial para truchas, tres veces a la semana, en condiciones de renovación o dinámicas. Los cultivos estáticos o semiestáticos deben recibir menos alimento para evitar el crecimiento de bacterias y hongos. El alimento y el sustrato de papel deben analizarse para detectar la presencia de las sustancias que vayan a usarse en los ensayos de bioacumulación.
En estas condiciones, el número de individuos del cultivo se duplica, generalmente, en un periodo de entre 10 y 14 días.
Lumbriculus variegatus se puede extraer de los cultivos, por ejemplo transfiriendo a otro vaso el sustrato con una red de malla fina, o transfiriendo los organismos con una pipeta de boca amplia (de unos 5 mm de diámetro) de vidrio de extremos redondeados. Si se contransfiere sustrato a este vaso, el vaso que contiene gusanos y sustrato se deja por la noche en condiciones dinámicas, que eliminarán el sustrato de la misma, mientras que los gusanos se quedarán en el fondo del recipiente. A continuación se pueden introducir en recipientes de cultivo recién preparados o se pueden seguir preparando para el ensayo, tal y como se indica en (1) y (6). Deben evitarse las lesiones o la autotomía en los gusanos, por ejemplo utilizando pipetas con bordes redondeados o varillas de acero inoxidable para manipularlos.
Una cuestión que debe considerarse críticamente a la hora de usar L. variegatus en los ensayos de bioacumulación en sedimentos es su modo de reproducción (arquitomía seguida de morfalaxis). Esta reproducción asexual da como resultado dos fragmentos, que no se alimentan durante un determinado periodo, hasta que se regenera la parte de la cabeza o la cola [por ejemplo, (36) (37)]. Esto significa que en el caso de L. variegatus, es posible que la absorción de sedimento y contaminante por ingestión no se produzca continuamente como en los turbifícidos, que no se reproducen por fragmentación.
Por lo tanto, debe realizarse una sincronización para minimizar la reproducción y la regeneración sin control, y la consiguiente gran variación en los resultados del ensayo. Esta variación puede ocurrir cuando algunos individuos, que se han fragmentado y, por lo tanto, no se alimentan durante un periodo determinado, quedan menos expuestos a las sustancia problema que otros individuos, que no se fragmentan durante el ensayo; por ejemplo, (38). En un periodo de entre 10 y 14 días antes del inicio de la exposición, los gusanos deben fragmentarse artificialmente (sincronización) (65). Deben utilizarse gusanos grandes que, preferiblemente, no muestren signos de fragmentación reciente. Estos gusanos se pueden colocar en un portaobjetos de vidrio, en una gota de agua de cultivo, y se pueden diseccionar en la zona mediana del cuerpo con un bisturí. Se debe comprobar que los extremos posteriores sean de un tamaño similar. A continuación, hay que dejar que los extremos posteriores regeneren nuevas cabezas en un recipiente de cultivo que contenga el mismo sustrato que el utilizado en el cultivo y agua reconstituida hasta el inicio de la exposición. La regeneración de cabezas nuevas se indica cuando los gusanos sincronizados se refugian en el sustrato (la presencia de cabezas regeneradas puede confirmarse inspeccionando una submuestra representativa con un microscopio binocular). Después, se espera que los organismos del ensayo presenten un estado fisiológico similar. Esto significa que, cuando se produce la regeneración por morfalaxis en gusanos sincronizados durante el ensayo, se espera que prácticamente todos los animales queden expuestos de igual manera al sedimento enriquecido. La alimentación de los gusanos sincronizados debe realizarse una vez, en cuanto los gusanos empiecen a refugiarse en el sustrato, o siete días después de la disección. El régimen de alimentación debe ser comparable al de los cultivos regulares, pero puede resultar recomendable alimentar los gusanos sincronizados con la misma fuente de alimento que vaya a utilizarse en el ensayo. Los gusanos deben mantenerse a la temperatura del ensayo, a 20 ± 2 °C. Después de la regeneración, deben utilizarse en el ensayo gusanos completos e intactos de tamaño similar, que naden o se arrastren activamente ante un pequeño estímulo mecánico. Deben evitarse las lesiones o la autotomía en los gusanos; por ejemplo, utilizando pipetas con bordes redondeados o varillas de acero inoxidable para manipularlos.
Cuando se utiliza la Lumbriculus variegatus en el ensayo y si las condiciones son las adecuadas (6), debe producirse un aumento del número de gusanos durante el ensayo debido al modo específico de reproducción de esta especie. La ausencia de reproducción en un ensayo de bioacumulación con L. variegatus debe quedar registrada y debe tenerse en cuenta a la hora de interpretar los resultados del ensayo.
Branchiura sowerbyi (BEDDARD), Tubificidae, Oligochaeta (sin validación en el ensayo interlaboratorios)
La especie Branchiura sowerbyi habita en diversos tipos de sedimentos, en pantanos, lagos, estanques y ríos, originalmente en zonas tropicales. También se puede encontrar en las masas de agua templada del hemisferio norte. Sin embargo, esta especie es más abundante en los sedimentos de barro y arcilla con un alto contenido en materia orgánica. Además, los gusanos viven en la capa de sedimento. Hasta el extremo posterior de los gusanos suele quedar dentro del sedimento. Esta especie se identifica fácilmente gracias a los filamentos branquiales de su parte posterior. Los adultos pueden llegar a medir entre 9 y 11 cm de largo, con un peso húmedo de 40-50 mg. Los gusanos presentan una alta tasa de reproducción, duplicando su población en menos de dos semanas y en las condiciones de temperatura y alimentación que se describen más adelante [Aston et al., 1982, (65)]. B. sowerbyi se ha utilizado en estudios de toxicidad y bioacumulación [Marchese y Brinkhurst 1996, (31) Roghair et al. 1996, (67) respectivamente].
Métodos de cultivo
A continuación se presenta un resumen de las condiciones de cultivo de la especie Branchiura sowerbyi (proporcionado por Mercedes R. Marchese, INALI, Argentina, y Carla J. Roghair, RIVM, Países Bajos).
No se requiere una sola técnica para cultivar los organismos. Los organismos pueden cultivarse con sedimento natural no contaminado (31). La experiencia práctica ha demostrado que un medio compuesto por sedimento natural y arena mejora el estado de los gusanos en comparación con un sedimento natural puro (32) (67). Para el cultivo se pueden utilizar vasos de 3 l que contengan 1 500 ml de medio de agua/sedimento, compuestas por 375 ml de sedimento natural no contaminado (aproximadamente un 10 % de carbono orgánico total; aproximadamente un 17 % de las partículas ≤ 63 μm), 375 ml de arena limpia (M32) y 750 ml de agua reconstituida o agua del grifo desclorada (31) (32) (67). También se pueden utilizar servilletas de papel como sustrato de cultivo, pero el crecimiento de la población será más lento que en el sedimento natural. En los sistemas semiestáticos, la capa de agua del vaso se airea lentamente y el agua sobrenadante debe cambiarse cada semana.
Cada vaso contiene 25 gusanos jóvenes al principio. Tras dos meses, se extraen los gusanos grandes del sedimento con unas pinzas y se colocan en un nuevo vaso con un medio recién preparado de sedimento/agua. El vaso viejo contiene también capullos y gusanos jóvenes. De esta forma se pueden recoger hasta 400 gusanos jóvenes por vaso. Los gusanos adultos se pueden utilizar en la reproducción al menos durante un año.
Los cultivos deben mantenerse a una temperatura de 21 a 25 °C. La variación de temperatura debe mantenerse por debajo de ± 2 °C. El tiempo necesario para el desarrollo del embrión a partir de un huevo puesto hasta que el gusano joven sale del capullo es aproximadamente de tres semanas a 25 °C. La producción de huevos obtenida por gusano superviviente en la especie B. sowerbyi ha resultado estar entre 6,36 (31) y 11,2 (30) en el barro a 25 °C. El número de huevos por capullo varía entre 1,8 y 2,8 (66) (69) o hasta 8 (68).
Cada semana hay que medir el oxígeno disuelto, la dureza del agua, la temperatura y el pH. Se puede añadir alimento para peces (por ejemplo, TetraMin®) en forma de suspensión, dos o tres veces por semana, ad libitum. Los gusanos también se pueden alimentar con lechuga descongelada ad libitum.
Una gran ventaja de esta especie es la gran biomasa individual (hasta 40-50 mg de peso húmedo por individuo). Por lo tanto, esta especie se puede utilizar en ensayos de bioacumulación de sustancias problema no marcadas radiactivamente. Puede exponerse en los sistemas utilizados con T. tubifex o L. variegatus con un solo individuo por réplica (11). Sin embargo, en ese caso, el número de réplicas debe aumentar, a menos que se utilicen cámaras de ensayo más grandes (11). Asimismo, el criterio de validez relacionado con el comportamiento de excavación debe ajustarse para esta especie.
BIBLIOGRAFÍA
|
(1)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. En ASTM International 2004 Annual Book of Standards. Volumen 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(2)
|
Comisión Europea (CE) (2003). Technical Guidance Document on Risk Assessment in support of Commission Directive 93/67/EEC on Risk Assessment for new notified substances, Commission Regulation (EC) No 1488/94 on Risk Assessment for existing substances and Directive 98/8/EC of the European Parliament and of the Council concerning the placing of biocidal products on the market; Part I — IV. Oficina de Publicaciones Oficiales de la Unión Europea (Comisión Europea), Luxemburgo.
|
|
(3)
|
OCDE (1992a). Report of the OECD workshop on effects assessment of chemicals in sediment. OECD Monographs No 60. Organización de Cooperación y Desarrollo Económico (OCDE), París.
|
|
(4)
|
Ingersoll, C.G., Ankley, G.T., Benoit D.A., Brunson, E.L., Burton, G.A., Dwyer, F.J., Hoke, R.A., Landrum, P. F., Norberg-King, T. J. and Winger, P.V. (1995). Toxicity and bioaccumulation of sediment-associated contaminants using freshwater invertebrates: A review of methods and applications. Environ. Toxicol. Chem. 14, pp. 1885-1894.
|
|
(5)
|
Capítulo C.13 del presente anexo. Bioconcentración: Ensayo dinámico con peces.
|
|
(6)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Segunda edición. EPA 600/R-99/064, Agencia de Protección del Medio Ambiente de EE. UU., Duluth, Minnesota, marzo de 2000.
|
|
(7)
|
Capítulo C.27 del presente anexo. Ensayo de toxicidad para quironómidos en sistemas sedimento-agua con sedimento enriquecido.
|
|
(8)
|
Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G. & Nagel, R. (1997). Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere 35, pp. 835-852.
|
|
(9)
|
Ingersoll, C.G., Brunson, E.L., Wang N., Dwyer, F.J., Ankley, G.T., Mount D.R., Huckins J., Petty. J. and Landrum, P. F. (2003). Uptake and depuration of nonionic organic contaminants from sediment by the oligochaete, Lumbriculus variegatus. Environmental Toxicology and Chemistry 22, pp. 872-885.
|
|
(10)
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. and Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, pp. 269-279.
|
|
(11)
|
Egeler, Ph., Römbke, J., Knacker, Th., Franke, C. & Studinger, G. (1999). Workshop on “Bioaccumulation: Sediment test using benthic oligochaetes”, 26.-27.04.1999, Hochheim/Main, Alemania. Report on the R+D-project No 298 67 419, Umweltbundesamt, Berlín.
|
|
(12)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. and Gilberg, D. (2006). Validation of a sediment bioaccumulation test with endobenthic aquatic oligochaetes by an international ring test. Report to the Federal Environmental Agency (Umweltbundesamt Dessau), R&D No: 202 67 437.
|
|
(13)
|
Kelly, J.R., Levine, S.N., Buttel, L.A., Kelly, A.C., Rudnick, D.T. and Morton, R.D. (1990). Effects of tributyltin within a Thalassia seagrass ecosystem. Estuaries 13, pp. 301-310.
|
|
(14)
|
Nendza, M. (1991). QSARs of bioaccumulation: Validity assessment of log Kow/log BCF correlations. En: R. Nagel y R. Loskill (eds.): Bioaccumulation in aquatic systems. Contributions to the assessment. Proceedings of an international workshop, Berlín 1990. VCH, Weinheim
|
|
(15)
|
Landrum, P.F., Lee II, H. and Lydy, M.J. (1992). Toxicokinetics in aquatic systems: Model comparisons and use in hazard assessment. Environ. Toxicol. Chem. 11, pp. 1709-1725.
|
|
(16)
|
Markwell, R.D., Connell, D.W. and Gabric, A.J. (1989). Bioaccumulation of lipophilic compounds from sediments by oligochaetes. Wat. Res. 23, pp. 1443-1450.
|
|
(17)
|
Gabric, A.J., Connell, D.W. and Bell, P.R.F. (1990). A kinetic model for bioconcentration of lipophilic compounds by oligochaetes. Wat. Wat. Res. 24, pp. 1225-1231.
|
|
(18)
|
Kukkonen, J. and Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, pp. 1457-1468.
|
|
(19)
|
Franke, C., Studinger, G., Berger, G., Böhling, S., Bruckmann, U., Cohors-Fresenborg, D. and Jöhncke, U. (1994). The assessment of bioaccumulation. Chemosphere 29, pp. 1501-1514.
|
|
(20)
|
OCDE (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No 23.
|
|
(21)
|
U.S. EPA (1996). Special Considerations for Conducting Aquatic Laboratory Studies. Ecological Effects Test Guidelines. OPPTS 850.1000. Borrador público. EPA 712-C-96-113. Agencia de Protección Ambiental de EE. UU.
|
|
(22)
|
Los capítulos siguientes del presente anexo:
|
|
Capítulo A.4, Presión de vapor
|
|
|
Capítulo A.5, Tensión superficial
|
|
|
Capítulo A.6, Hidrosolubilidad
|
|
|
Capítulo A.8, Coeficiente de reparto, método del frasco agitado
|
|
|
Capítulo A.24, Coeficiente de reparto, método HPLC
|
|
|
Capítulo C.7, Degradación — degradación abiótica: hidrólisis en función del pH
|
|
|
Capítulo C.4 A-F, Determinación de la biodegradabilidad “fácil”
|
|
|
Capítulo C.19, Cálculo del coeficiente de adsorción (Koc) en suelos y en lodos de aguas residuales mediante cromatografía líquida de alta resolución (HPLC)
|
|
|
Capítulo C.29, Biodegradabilidad fácil — CO2 en recipientes sellados
|
|
|
(23)
|
OCDE (1996). Direct Phototransformation of chemicals in water. Environmental Health and Safety Guidance Document Series on Testing and Assessment of Chemicals No 3. OCDE, París.
|
|
(24)
|
Antoine, M.D., Dewanathan, S. and Patonay, G. (1991). Determination of critical micelles concentration of surfactants using a near-infrared hydrophobicity probe. Microchem. J. 43, pp. 165-172.
|
|
(25)
|
Beek, B., S. Boehling, U. Bruckmann, C. Franke, U. Joehncke and G. Studinger (2000). The assessment of bioaccumulation. In Hutzinger, O. (editor), The Handbook of Environmental Chemistry, Vol. 2 Part J (Vol. editor: B. Beek): Bioaccumulation — New Aspects and Developments. Springer-Verlag Berlín Heidelberg: pp. 235-276.
|
|
(26)
|
Spacie, A. and Hamelink, J.L. (1982). Alternative models for describing the bioconcentration of organics in fisb. Environ. Toxicol. Chem. 1, pp. 309-320.
|
|
(27)
|
Hawker, D.W. and Connell, D.W. (1988). Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Wat. Res. 22, pp. 701-707.
|
|
(28)
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. and Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, pp. 191-201.
|
|
(29)
|
Reynoldson, T.B., Thompson, S.P. and Bamsey, J.L. (1991). A sediment bioassay using the tubificid oligochaete worm Tubifex tubifex. Environ. Toxicol. Chem. 10, pp. 1061-1072.
|
|
(30)
|
Aston, R.J. and Milner, A.G.P. (1981). Conditions for the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) in activated sludge. Aquaculture 26, pp. 155-160.
|
|
(31)
|
Marchese, M.R. and Brinkhurst, R.O. (1996). A comparison of two tubificid species as candidates for sublethal bioassay tests relevant to subtropical and tropical regions. Hydrobiologia 334, pp. 163-168.
|
|
(32)
|
Roghair, C.J. and Buijze, A. (1994). Development of sediment toxicity tests. IV. A bioassay to determine the toxicity of field sediments to the oligochaete worm Branchiura sowerbyi. RIVM Report 719102027.
|
|
(33)
|
Capítulo C. 1 del presente anexo: Ensayo de toxicidad aguda en peces.
|
|
(34)
|
OCDE (1992c). Guidelines for Testing of Chemicals No 210. Fish, Early-life Stage Toxicity Test. OCDE, París.
|
|
(35)
|
Kaster, J.L., Klump, J.V., Meyer, J., Krezoski, J. & Smith, M.E. (1984). Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia 11, pp. 181-184.
|
|
(36)
|
Leppänen, M.T. y Kukkonen, J.V.K. 1998: Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: pp. 183-194.
|
|
(37)
|
Leppänen, M.T. & Kukkonen, J.V.K. 1998: Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: pp. 2196-2202.
|
|
(38)
|
Leppänen M.T. & Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, pp. 1503-1508.
|
|
(39)
|
Martínez-Madrid, M., Rodríguez, P., Pérez-Iglesias, J.I. & Navarro, E. (1999). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology 8, pp. 111-124.
|
|
(40)
|
Capítulo C.8 del presente anexo: Ensayo de toxicidad para gusanos de tierra.
|
|
(41)
|
Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
|
|
(42)
|
Landrum, P.F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Toxicol. 23, pp. 588-595.
|
|
(43)
|
Poddubnaya, T.L. (1980). Life cycles of mass species of Tubificidae (Oligochaeta). En: R.O. Brinkhurst y D.G. Cook (eds.): Aquatic Oligochaeta Biology, pp. 175-184. Plenum Press, Nueva York.
|
|
(44)
|
ASTM (1998). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing. American Society for Testing and Materials, E 1391-94.
|
|
(45)
|
Hooftman, R.N., van de Guchte, K. & Roghair, C.J. (1993). Development of ecotoxicological test systems to assess contaminated sediments. Joint report no. 1: Acute and (sub)chronic tests with the model compound chlorpyrifos. RIVM-719102022.
|
|
(46)
|
Franke, C. (1996). How meaningful is the bioconcentration factor for risk assessment?. Chemosphere 32, pp. 1897-1905.
|
|
(47)
|
Mount, D.R., Dawson, T.D. & Burkhard, L.P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Environ. Toxicol. Chem. 18, pp. 1244-1249.
|
|
(48)
|
Randall, R.C., Lee II, H., Ozretich, R.J., Lake, J.L. & Pruell, R.J. (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Envir. Environ.Toxicol. Chem. 10, pp. 1431-1436.
|
|
(49)
|
Gardner, W.S., Frez, W.A., Cichocki, E.A. & Parrish, C.C. (1985). Micromethods for lipids in aquatic invertebrates. Limnology and Oceanography, 30, 1099-1105.
|
|
(50)
|
Bligh, E.G. & Dyer, W.J. (1959). A rapid method of total lipid extraction and purification. Can. J. Biochem. Physiol. 37, pp. 911-917.
|
|
(51)
|
De Boer, J., Smedes, F., Wells, D. & Allan, A. (1999). Report on the QUASH interlaboratory study on the determination of total-lipid in fish and shellfish. Round 1 SBT-2. Exercise 1000. EU, Standards, Measurement and Testing Programme.
|
|
(52)
|
Kristensen, P. (1991). Bioconcentration in fish: comparison of bioconcentration factors derived from OECD and ASTM testing methods; influence of particulate matter to the bioavailability of chemicals. Water Quality Institute, Denmark.
|
|
(53)
|
Zok, S., Görge, G., Kalsch, W. & Nagel, R. (1991). Bioconcentration, metabolism and toxicity of substituted anilines in the zebrafish (Brachydanio rerio). Sci. Total Environment 109/110, pp. 411-421
|
|
(54)
|
Nagel, R. (1988). Umweltchemikalien und Fische — Beiträge zu einer Bewertung. Habilitationsschrift, Johannes Gutenberg-Universität Mainz, Alemania.
|
|
(55)
|
Janssen, M.P.M., A Bruins, T.H. De Vries & Van Straalen, N.M. (1991). Comparison of cadmium kinetics in four soil arthropod species. Arch. Environ. Contam. Toxicol. 20: pp. 305-312.
|
|
(56)
|
Van Brummelen, T.C. y Van Straalen, N.M. (1996). Uptake and elimination of benzo(a)pyrene in the terrestrial isopod Porcellio scaber. Arch. Environ. Contam. Toxicol. 31: pp. 277-285.
|
|
(57)
|
Sterenborg, I., Vork, N.A., Verkade, S.K., Van Gestel, C.A.M. & Van Straalen, N.M. (2003). Dietary zinc reduces uptake but not metallothionein binding and elimination of cadmium in the springtail Orchesella cincta. Environ. Toxicol. Chemistry 22: pp. 1167-1171.
|
|
(58)
|
Suedel, B.C. & Rodgers, J.H. (1993). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13, pp. 1163-1175.
|
|
(59)
|
Wachs, B. (1967). Die Oligochaeten-Fauna der Fließgewässer unter besonderer Berücksichtigung der Beziehung zwischen der Tubificiden-Besiedlung und dem Substrat. Arch. Hydr. 63, pp. 310-386.
|
|
(60)
|
Oliver, B. G. (1987). Biouptake of chlorinated hydrocarbons from laboratory-spiked and field sediments by oligochaete worms. Environ. Sci. Technol. 21, pp. 785-790.
|
|
(61)
|
Chapman, P.M., Farrell, M.A. & Brinkhurst, R.O. (1982a). Relative tolerances of selected aquatic oligochaetes to individual pollutants and environmental factors. Aquatic Toxicology 2, pp. 47-67.
|
|
(62)
|
Chapman, P.M., Farrell, M.A. y Brinkhurst, R.O. (1982b). Relative tolerances of selected aquatic oligochaetes to combinations of pollutants and environmental factors. Aquatic Toxicology 2, pp. 69-78.
|
|
(63)
|
Rodríguez, P. & Reynoldson, T.B. (1999). Laboratory methods and criteria for sediment bioassessment. En: A. Mudroch, J.M. Azcue y P. Mudroch (eds.): Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
|
|
(64)
|
Brinkhurst, R.O. (1971). A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. No 22.
|
|
(65)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No: 202 67 429.
|
|
(66)
|
Aston, R.J., Sadler, K. & Milner, A.G.P. (1982). The effect of temperature on the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) on activated sludge. Aquaculture 29, pp. 137-145.
|
|
(67)
|
Roghair, C.J., Buijze, A., Huys, M.P.A., Wolters-Balk, M.A.H., Yedema, E.S.E. & Hermens, J.L.M. (1996). Toxicity and toxicokinetics for benthic organisms; II: QSAR for base-line toxicity to the midge Chironomus riparius and the tubificid oligochaete worm Branchiura sowerbyi. RIVM Report 719101026.
|
|
(68)
|
Aston, R.J. (1984). The culture of Branchiura sowerbyi (Tubificidae, Oligochaeta) using cellulose substrate. Aquaculture 40, pp. 89-94.
|
|
(69)
|
Bonacina, C., Pasteris, A., Bonomi, G. & Marzuoli, D. (1994). Quantitative observations on the population ecology of Branchiura sowerbyi (Oligochaeta, Tubificidae). Hydrobiologia, 278, pp. 267-274
|
» |