1992L0065 — ES — 03.07.2004 — 007.002
Este documento es un instrumento de documentación y no compromete la responsabilidad de las instituciones
Modificado por:
Modificado por:
|
A1
|
Acta de adhesión de Austria, de Finlandia y de Suecia
|
C 241
|
21
|
29.8.1994
|
|
|
(adaptada por Decisión 95/1/CE, Euratom, CECA del Consejo)
|
L 001
|
1
|
..
|
|
►A2
|
Acta relativa a las condiciones de adhesión de la República Checa, la República de Estonia, la República de Chipre, la República de Letonia, la República de Lituania, la República de Hungría, la República de
Malta, la República de Polonia, la República de Eslovenia y la República Eslovaca, y a las adaptaciones de los Tratados en los que se fundamenta la Unión
|
L 236
|
33
|
23.9.2003
|
▼B
DIRECTIVA 92/65/CEE DEL CONSEJO
de 13 de julio de 1992
por la que se establecen las condiciones de policía sanitaria aplicables a los intercambios y las importaciones en la Comunidad de animales, esperma, óvulos y embriones no sometidos, con respecto a estas condiciones, a las normativas comunitarias específicas a que se refiere la sección I del Anexo A de la Directiva 90/425/CEE
EL CONSEJO DE LAS COMUNIDADES EUROPEAS,
Visto el Tratado constitutivo de la Comunidad Económica Europea y, en particular, su artículo 43,
Vistas las propuestas de la Comisión (
1
),
Vistos los dictámenes del Parlamento Europeo (
2
),
Vistos los dictámenes del Comité Económico y Social (
3
),
Considerando que los animales vivos y los productos de origen animal están incluidos en la lista de productos que figura en el Anexo II del Tratado; que la comercialización de dichos animales y productos constituye una fuente de ingresos para una parte de la población agraria;
Considerando que, para garantizar un desarrollo racional de dicho sector y aumentar su productividad, procede establecer a nivel comunitario normas de policía sanitaria para los animales y los productos en cuestión;
Considerando que la Comunidad debe adoptar las medidas destinadas a establecer progresivamente el mercado interior en el transcurso de un período que terminará el 31 de diciembre de 1992;
Considerando que, para la consecución de los objetivos antes mencionados, el Consejo ha establecido normas de policía sanitaria relativas al ganado vacuno, porcino, ovino y caprino, equino, las aves de corral y los huevos incubables, el pescado y los productos de la pesca, los moluscos bivalvos, el esperma de vacuno y de porcino, los embriones de vacuno, la carne fresca, la carne de aves de corral, los productos cárnicos y la carne de caza y de conejo;
Considerando que es preciso establecer normas de policía sanitaria que regulen la comercialización de animales y de productos de origen animal no sometidos todavía a las normas antes mencionadas;
Considerando que procede prever que la presente Directiva se aplique sin perjuicio del Reglamento (CEE) no 3626/82 del Consejo, de 3 de diciembre de 1982, relativo a la aplicación en la Comunidad del Convenio sobre el comercio internacional de especies amenazadas de fauna y flora silvestres (
4
);
Considerando que, respecto a determinados aspectos técnicos, procede hacer referencia a la Directiva 64/432/CEE del Consejo, de 26 de junio de 1964, relativa a problemas de policía sanitaria en materia de intercambios intracomunitarios de animales de las especies bovina y porcina (
5
) y a la Directiva 85/511/CEE del Consejo, de 18 de noviembre de 1985, por la que se establecen medidas comunitarias de lucha contra la fiebre aftosa (
6
);
Considerando que, en lo que se refiere a la organización de los controles y al curso que deba darse a éstos, así como a las medidas de protección que deban aplicarse, es conveniente referirse a las normas generales establecidas en la Directiva 90/425/CEE del Consejo, de 26 de junio de 1990, relativa a los controles veterinarios y zootécnicos aplicables en los intercambios intracomunitarios de determinados animales vivos y productos con vistas a la realización del mercado interior (
7
);
Considerando que, salvo disposiciones en contrario, deben liberalizarse los intercambios de animales y de productos de origen animal, sin perjuicio del recurso a posibles medidas de salvaguardia;
Considerando que, debido a los riesgos considerables de propagación de enfermedades a que están expuestos los animales, es conveniente especificar, para determinados animales y productos de origen animal, los requisitos especiales que deben cumplir al comercializarse con fines de intercambio, en particular con destino a regiones que disponen de un estatuto sanitario avanzado;
Considerando que la situación específica del Reino Unido de Gran Bretaña e Irlanda del Norte y de Irlanda debida a su situación insular justifica, por el hecho de que dichos Estados están indemnes de rabia desde hace largo tiempo, las disposiciones especiales encaminadas a garantizar que la comercialización en el Reino Unido y en Irlanda de perros y gatos no originarios de dichos países no implique riesgos de introducción de la rabia en dichos Estados, sin que por ello se vea afectada la supresión de los controles veterinarios en las fronteras de los Estados miembros;
Considerando que el certificado sanitario constituye el medio más adecuado para garantizar y controlar el cumplimiento de dichos requisitos;
Considerando que, para mantener la situación sanitaria de la Comunidad, es conveniente someter, en el momento de su comercialización, los animales y productos de origen animal a que se refiere la presente Directiva a los requisitos mínimos previstos para los intercambios y controlar su respeto conforme a los principios y normas de la Directiva 90/675/CEE del Consejo, de 10 de diciembre de 1990, por la que se establecen los principios relativos a la organización de controles veterinarios de los productos que se introduzcan en la Comunidad procedentes de terceros países (
8
);
Considerando que procede prever un procedimiento que establezca una estrecha cooperación entre los Estados miembros y la Comisión en el seno del Comité veterinario permanente;
Considerando que es oportuno que el plazo de la incorporación fijado en el 1 de enero de 1994, en el artículo 29, no tenga repercusiones en la supresión de los controles veterinarios en las fronteras el 1 de enero de 1993,
HA ADOPTADO LA PRESENTE DIRECTIVA:
CAPÍTULO I
Disposiciones generales
Artículo 1
▼M7
La presente Directiva establece las condiciones de policía sanitaria aplicables a los intercambios y las importaciones en la Comunidad de animales, esperma, óvulos y embriones no sometidos a los requisitos zoosanitarios establecidos en los actos comunitarios específicos mencionados en el anexo F.
▼B
La presente Directiva se aplicará sin perjuicio de las disposiciones adoptadas en el marco del Reglamento (CEE) no 3626/82.
La presente Directiva no afectará a las normas nacionales aplicables a los animales de compañía, sin que el mantenimiento de dichas normas obste a la supresión de los controles veterinarios en las fronteras entre Estados miembros.
Artículo 2
1. A efectos de la presente Directiva, se entenderá por:
|
a)
|
«intercambios» : los intercambios definidos en el apartado 3 del artículo 2 de la Directiva 90/425/CEE;
|
|
b)
|
«animales» : los ejemplares pertenecientes a las especies animales distintas de las contempladas en las Directivas 64/432/CEE, 90/426/CEE (
9
), 90/539/CEE (
10
), 91/67/CEE (
11
), 91/68/CEE (
12
), 91/492/CEE (
13
) y 91/493/CEE (
14
);
|
|
c)
|
«organismo, instituto o centro oficialmente autorizado» : cualquier instalación permanente, limitada geográficamente, autorizada con arreglo al artículo 13, en la que habitualmente se mantengan o críen una o varias especies animales, con o sin fines comerciales, y exclusivamente con una o varias de las finalidades siguientes:
— exposición de dichos animales y educación del público,
— conservación de las especies,
— investigación científica básica o aplicada, o cría de animales con tal fin;
|
|
d)
|
«enfermedades de declaración obligatoria» : las enfermedades que se mencionan en el Anexo A.
|
2. Además, se aplicarán, mutatis mutandis, las definiciones, distintas de las de los centros y organismos autorizados, contempladas en el artículo 2 de las Directivas 64/432/CEE, 91/67/CEE y 90/539/CEE.
CAPÍTULO II
Disposiciones aplicables a los intercambios
Artículo 3
Los Estados miembros velarán por que no se prohíban ni restrinjan los intercambios a los que se refiere el primer párrafo del artículo 1 de policía sanitaria distintos de los que resulten de la aplicación de la presente Directiva o de la normativa comunitaria, y, en particular, de las medidas de salvaguardia que se hubieren adoptado.
▼
En espera de disposiciones comunitarias en la materia, Suecia podrá mantener sus normas nacionales en lo que se refiere a las serpientes y otros reptiles que le sean enviados.
▼B
Artículo 4
Los Estados miembros adoptarán las medidas necesarias para que, en aplicación de la letra a) del apartado 1 del artículo 4 de la Directiva 90/425/CEE, los animales contemplados en los artículos 5 a 10 de la presente Directiva sólo puedan ser objeto de intercambios si, sin perjuicio del artículo 13 y de las disposiciones particulares que se adopten en aplicación del artículo 24, cumplen las condiciones establecidas en los artículos 5 a 10 y si proceden de explotaciones o comercios contemplados en los apartados 1 y 3 del artículo 12 de la presente Directiva, que estén registrados por la autoridad competente y que se comprometan:
— a hacer examinar con regularidad a los animales que posean, con arreglo al apartado 3 del artículo 3 de la Directiva 90/425/CEE;
— a declarar a la autoridad competente, además de la aparición de enfermedades cuya declaración sea obligatoria, la aparición de las enfermedades a las que se refiere el Anexo B, para las cuales el Estado miembro de que se trate haya establecido un programa de lucha o de vigilancia;
— a respetar las medidas nacionales específicas de lucha contra una enfermedad que tenga especial importancia para un Estado miembro determinado y que sea objeto de un programa establecido con arreglo al artículo 14 o de una decisión, de conformidad con el apartado 2 del artículo 15;
— a comercializar con fines de intercambio solamente animales que no presenten ningún síntoma de enfermedad y que procedan de explotaciones o de zonas que no sean objeto de ninguna medida de prohibición por motivos de policía sanitaria y, en lo que respecta a los animales a los que no acompañe un certificado sanitario o el documento comercial contemplado en los artículos 5 a 11, solamente animales acompañados de una autocertificación del empresario que acredite que los animales de que se trata no presentan ningún síntoma aparente de enfermedad y que su explotación no está sometida a medidas de restricción de policía sanitaria;
— a cumplir los requisitos que permitan garantizar el bienestar de los animales que posean.
Artículo 5
1. Los Estados miembros velarán por que los simios (simiae y prosimiae) sólo sean objeto de intercambios entre organismos, institutos o centros oficialmente autorizados por las autoridades competentes de los Estados miembros, conforme al artículo 13, y de que vayan acompañados de un certificado veterinario conforme al modelo que figura en el Anexo E, que deberá completar el veterinario oficial del organismo, del instituto o del centro de origen, para garantizar el estado sanitario de los animales.
2. No obstante lo dispuesto en el apartado 1, la autoridad competente de un Estado miembro podrá autorizar la adquisición, por un organismo, instituto o centro autorizado, de simios pertenecientes a un particular.
Artículo 6
A. Los Estados miembros velarán por que, sin perjuicio de los artículos 14 y 15, sólo puedan ser objeto de intercambios los ungulados de especies no contampladas en las Directivas 64/432/CEE, 90/426/CEE y 91/68/CEE que cumplan los requisitos siguientes:
1) de forma general:
a) estar identificados con arreglo a la letra c) del apartado 1 del artículo 3 de la Directiva 90/425/CEE;
b) no deber ser eliminados en el marco de un programa de erradicación de una enfermedad contagiosa;
c) no estar vacunados contra la fiebre aftosa y cumplir los requisitos pertinentes de la Directiva 85/511/CEE y del artículo 4 bis de la Directiva 64/432/CEE;
d) proceder de una explotación de las mencionadas en las letras b) y c) del apartado 2 del artículo 3 de la Directiva 64/432/CEE que no sea objeto de ninguna medida de policía sanitaria, ni, en particular, de las adoptadas en aplicación de las Directivas 85/511/CEE, 80/217/CEE (
15
) y 91/68/CEE, y haber permanecido siempre en ella desde su nacimiento o durante los treinta días anteriores a su expedición;
▼M7
e) ir acompañados de un certificado conforme al modelo que figura en la parte 1 del anexo E, completado con el siguiente certificado:

▼M7 —————
▼B
2) si se tratare de rumiantes:
a) proceder de una cabaña oficialmente indemne de tuberculosis y oficialmente indemne o indemne de brucelosis, de conformidad con la Directiva 64/432/CEE o de la Directiva 91/68/CEE y cumplir, por lo que respecta a las normas de policía sanitaria, los requisitos pertinentes establecidos para la especie bovina en las letras c), d), f), g) y h) del apartado 2 del artículo 3 de la Directiva 64/432/CEE, o en el artículo 3 de la Directiva 91/68/CEE;
▼M7
b) cuando no procedan de una cabaña que cumpla los requisitos establecidos en la letra a), proceder de una explotación en la que no se haya detectado ningún caso de brucelosis ni de tuberculosis durante los cuarenta y dos días anteriores al cargamento de los animales y en la que los rumiantes hayan sido sometidos dentro de los treinta días anteriores a la expedición y con resultado negativo a una prueba para la brucelosis y la tuberculosis;
▼
c) con arreglo al procedimiento establecido en el artículo 26, podrán adoptarse disposiciones relativas a la leucosis.
▼B
3) si se trata de suidos:
a) no proceder de una zona sometida a medidas de prohibición relacionadas con la existencia de peste porcina africana en aplicación del artículo 9 bis de la Directiva 64/432/CEE;
b) proceder de una explotación que no esté sometida a ninguna de las restricciones establecidas en la Directiva 80/217/CEE a causa de la peste porcina clásica;
c) proceder de una cabaña indemne de brucelosis conforme a la Directiva 64/432/CEE y cumplir los requisitos de policía sanitaria pertinentes establecidos para la especie porcina en la Directiva 64/432/CEE;
d) cuando no procedan de una cabaña que cumpla los requisitos establecidos en la letra c), haber sido sometidos, en el curso de los treinta días anteriores a su expedición y con resultado negativo, a una prueba encaminada a demostrar la ausencia de anticuerpos contra la brucelosis;
▼M7 —————
▼M7
4) los requisitos sobre pruebas a los que se hace referencia en este artículo, así como los criterios a ellos asociados, podrán establecerse conforme al procedimiento contemplado en el artículo 26. Estas decisiones tendrán en cuenta el caso de los rumiantes criados en las regiones árticas de la Comunidad.
Mientras no se adopten las decisiones previstas en el párrafo anterior, se seguirán aplicando las normas nacionales.
▼B
B. La Directiva 64/432/CEE se modifica del siguiente modo:
1) En las letras b) y c) del artículo 2, se sustituyen las palabras «de la especie bovina» por las palabras «de las especies bovinas (incluidas las especies Bubalus bubalus)».
2) Se inserta el artículo siguiente:
«Artículo 10 bis
Los certificados sanitarios cuyo modelo figura en el Anexo F podrán modificarse o completarse con arreglo al procedimiento previsto en el artículo 12, en particular para tener en cuenta lo dispuesto en el artículo 6 de la Directiva 92/65/CEE.»
Artículo 7
A. Los Estados miembros velarán por que las aves distintas de aquellas a las que se refiere la Directiva 90/539/CEE sólo puedan ser objeto de intercambios si cumplen los requisitos siguientes:
1) de modo general:
a) proceder de una explotación en la que no se haya diagnosticado la influencia aviar en el transcurso de los treinta días anteriores a la expedición;
b) proceder de una explotación o de una zona que no esté sometida a restricciones en virtud de medidas de lucha contra la enfermedad de Newcastle.
A la espera de la aplicación de las medidas comunitarias a las que se refiere el artículo 19 de la Directiva 90/539/CEE, los requisitos nacionales en materia de lucha contra la enfermedad de Newcastle seguirán siendo de aplicación, respetando las disposiciones generales del Tratado;
c) cuando hayan sido importadas de un tercer país y no obstante lo dispuesto en el tercer guión del apartado 1 del artículo 10 de la Directiva 91/496/CEE, haber sido sometidas a una cuarentena en la explotación en la que hayan sido introducidas tras su recepción en el territorio de la Comunidad;
2) además, cuando se trate de psitácidos:
a) no proceder de una explotación ni haber estado en contacto con animales de una explotación en la que se haya diagnosticado la psitacosis (Chlamida psittaci).
La prohibición deberá durar por lo menos dos meses, a partir del último caso diagnosticado y de un tratamiento efectuado bajo control veterinario, reconocido con arreglo al procedimiento establecido en el artículo 26;
b) estar identificados de conformidad con lo dispuesto en la letra c) del apartado 1 del artículo 3 de la Directiva 90/425/CEE.
Los métodos de identificación de los psitácidos, y en particular de los psitácidos enfermos, se determinarán con arreglo al procedimiento establecido en el artículo 26;
c) ir acompañados de un documento comercial visado por un veterinario oficial o por el veterinario que se encuentre a cargo de la explotación o del comercio de origen y en quien la autoridad competente haya delegado esta competencia.
B. En el punto 2 del segundo párrafo del artículo 2 de la Directiva 91/495/CEE del Consejo, de 27 de noviembre de 1990, relativa a los problemas sanitarios y de policía sanitaria en materia de producción y puesta en el mercado de carne de conejo y de caza de cría (
16
), se insertarán las palabras «y las aves corredoras (ratites)» después de las palabras «la Directiva 90/539/CEE».
En el punto 1 del párrafo segundo del artículo 2 de la Directiva 90/539/CEE del Consejo, de 15 de octubre de 1990, relativa a las condiciones de policía sanitaria que regulan los intercambios intracomunitarios y las importaciones de aves de corral y de los huevos para incubar procedentes de terceros países (
17
), se añaden las palabras «y las aves corredoras (ratites)» después de las palabras «y perdices».
Artículo 8
Los Estados miembros velarán por que las abejas (Apis melifera) sólo se destinen a los intercambios cuando cumplan los requisitos siguientes:
a) proceder de una zona no sometida a una prohibición vínculada a la aparición de loque americana.
La prohibición tendrá una duración mínima de treinta días, a partir del último caso observado y de la fecha en la que todas las colmenas situadas en un radio de tres kilómetros hayan sido controladas por la autoridad competente y todas las colmenas infectadas hayan sido quemadas o tratadas y controladas a satisfacción de dicha autoridad competente.
Con arreglo al procedimiento establecido en el artículo 26, y previo dictamen del Comité científico veterinario, se podrán aplicar a los abejorros los requisitos a que están sometidas las abejas (Apis melifera) o requisitos equivalentes.
b) ir acompañados de un certificado sanitario, conforme al modelo que figura en el Anexo E, que deberá expedir la autoridad competente para acreditar el cumplimiento de los requisitos previstos en la letra a).
Artículo 9
1. Los Estados miembros velarán por que sólo se intercambien los lagomorfos que cumplan los requisitos siguientes:
a) no proceder de una explotación ni haber estado en contacto con animales de una explotación en la que haya parecido la rabia o se haya supuesto su aparición durante el último mes;
b) proceder de una explotación en la que ningún animal presente síntomas clínicos de mixomatosis.
2. Los Estados miembros que exijan un certificado sanitario para los traslados de lagomorfos en su territorio podrán exigir que los animales que les estén destinados vayan acompañados de un certificado sanitario conforme al modelo que figura en el Anexo E, completado con el siguiente certificado:
«El abajo firmante, …, certifica que la partida mencionada anteriormente cumple los requisitos del artículo l9 de la Directiva 92/65/CEE y que los animales no han presentado ningún síntoma clínico de enfermedad en el examen.»
.
Este certificado deberá ser expedido por el veterinario oficial o por el veterinario que tenga a su cargo la explotación de origen y en quien la autoridad competente haya delegado dicha competencia y, para los criaderos industriales, por el veterinario oficial.
Este certificado deberá ser expedido por el veterinario oficial o por el veterinario que tenga a su cargo la explotación de origen y en quien la autoridad competente haya delegado dicha competencia y, para los criaderos industriales, por el veterinario oficial.
Los Estados miembros que deseen recurrir a esta facultad informarán a la Comisión, que deberá cerciorarse del cumplimiento del requisito previsto en el primer párrafo.
3. Irlanda y el Reino Unido podrán exigir la presentación de un certificado sanitario que atestigüe el cumplimiento del requisito establecido en la letra a) del apartado 1.
Artículo 10
1. Los Estados miembros velarán por que se prohíban los intercambios de
►M5
————— ◄ visones y zorros que procedan de una explotación o que hayan estado en contacto con animales de una explotación en la que haya aparecido la rabia o se haya supuesto su aparición en el transcurso de los últimos seis meses, cuando no hayan sido sometidos a una vacunación sistemática.
▼M5
2. Para que puedan ser objeto de intercambios, los gatos, los perros y los hurones deberán cumplir las condiciones previstas en los artículos 5 y 16 del Reglamento (CE) no 998/2003 del Parlamento Europeo y del Consejo, de 26 de mayo de 2003, por el que se aprueban las normas zoosanitarias aplicables a los desplazamientos de animales de compañía sin ánimo comercial y se modifica la Directiva 92/65/CEE del Consejo (
18
);
El certificado que acompañe a los animales deberá acreditar además la realización de un examen clínico 24 horas antes del envío por un veterinario autorizado por la autoridad competente y que determine que los animales gozan de buena salud y que pueden soportar el transporte hasta el lugar de destino.
3. No obstante lo dispuesto en el apartado 2, cuando los intercambios vayan destinados a Irlanda, Reino Unido o Suecia, los gatos, los perros y los hurones deberán cumplir las condiciones previstas en los artículos 6 y 16 del Reglamento (CE) no 998/2003;
El certificado que acompañe a los animales deberá acreditar además la realización de un examen clínico 24 horas antes del envío por un veterinario autorizado por la autoridad competente y que determine que los animales gozan de buena salud y que pueden soportar el transporte hasta el lugar de destino.
▼A2
4. Sin perjuicio de lo dispuesto en los apartados 2 y 3, Irlanda, Chipre, Malta y el Reino Unido podrán mantener su normativa nacional relativa a la cuarentena con respecto a todos los carnívoros,
►M5
salvo las especies contempladas en los apartados 2 y 3, ◄ primates, murciélagos y otros animales sensibles a la rabia contemplados en la presente Directiva cuando no se pueda demostrar que éstos hayan nacido en la explotación de origen y hayan sido mantenidos en cautividad en la misma desde su nacimiento, sin que el mantenimiento de dichas normativas obste a la supresión de los controles veterinarios en las fronteras entre Estados miembros.
▼B
5. La Decisión 90/638/CEE queda modificada del siguiente modo:
1) Se añadirá el siguiente guión en el artículo 1:
— «en relación con los programas de lucha contra la rabia: los criterios que se indican en el Anexo III.»
2) Se añadirá el siguiente Anexo:
«ANEXO III
Criterios que deberán adoptarse para los programas contra la rabia:
Los programas contra la rabia deberán incluir al menos:
a) los criterios contemplados en los puntos 1 a 7 del Anexo I;
b) información detallada sobre la región o regiones en las que tendrá lugar la inmunización oral de los zorros y sobre sus límites naturales. Esta(s) región(es) cubrirá(n) al menos 6 000 km2 o la totalidad del territorio de un Estado miembro y podrá(n) incluir zonas limítrofes de terceros países;
c) información detallada sobre las vacunas propuestas, el sistema de distribución, la densidad y la frecuencia de colocación de los cebos;
d) en su caso, todos los detalles, el coste y la finalidad de las medidas de conservación o protección de la flora y de la fauna emprendidas por organizaciones con fines lucrativos en el territorio cubierto por estos proyectos.»
6. El Consejo, por mayoría cualificada y a propuesta de la Comisión, designará un centro específico responsable de establecer los criterios necesarios para la normalización de las pruebas serológicas y decidirá las atribuciones de dicho centro.
7. Los Estados miembros velarán por que los gastos que ocasione la aplicación de la prueba serológica corran a cargo de los importadores.»
▼M5 —————
▼
Artículo 10 bis
En lo que se refiere a la rabia y con arreglo al procedimiento previsto en el artículo 26, previa presentación de las justificaciones pertinentes se modificarán los artículos 9 y 10 con objeto de tener en cuenta la situación de Finlandia y Suecia, a fin de aplicarles las mismas disposiciones aplicables a los Estados miembros que tienen una situación equivalente.
▼B
Artículo 11
1. Los Estados miembros velarán por que, sin perjuicio de las decisiones que deberán adoptarse en aplicación de los artículos 21 y 23, sólo sean objeto de intercambios el esperma, los óvulos y los embriones que cumplan las condiciones contempladas en los apartados 2, 3 y 4.
2. El esperma de las especies ovina, caprina y equina deberá, sin perjuicio de los posibles criterios que deban respetarse para la inclusión de los équidos en los libros genealógicos para determinadas razas específicas:
— haber sido recogido y tratado para la inseminación artificial en una estación o un centro autorizados, desde un punto de vista sanitario, de conformidad con el capítulo I del Anexo D o, cuando se trate de ovinos y caprinos y no obstante lo anteriormente dicho, en una explotación que cumpla los requisitos de la Directiva 91/68/CEE,
— haber sido recogido en animales que cumplan las condiciones establecidas en el capítulo II del Anexo D (admisión y control de rutina de los animales),
— haber sido recogido, tratado y conservado de conformidad con lo dispuesto en el capítulo III del Anexo D,
— ir acompañado, en su traslado a otro Estado miembro, de un certificado sanitario conforme a un modelo que deberá determinarse con arreglo al procedimiento previsto en el artículo 26.
3. Los óvulos y los embriones de las especies ovina/caprina, porcina y equina deberán:
— haber sido tomados por un equipo de recogida autorizado por la autoridad competente del Estado miembro y tratados en un laboratorio adaptado, y en hembras donantes que cumplan las condiciones fijadas en el capítulo IV del Anexo D,
— haber sido tratados y almacenados de conformidad con las disposiciones aprobadas en el capítulo III del Anexo D,
— ir acompañados, en su expedición a otro Estado miembro, de un certificado sanitario conforme a un modelo que deberá determinarse con arreglo al procedimiento previsto en el artículo 26.
El esperma utilizado para la inseminación de las hembras donantes deberá ser conforme a lo dispuesto en el apartado 2 para los ovinos, los caprinos y los équidos, y a lo dispuesto en la Directiva 90/429/CEE para los porcinos. Podrán establecerse posibles garantías adicionales mediante el procedimiento del artículo 26.
4. La Comisión presentará, antes del 31 de diciembre de 1997, un informe acompañado de posibles propuestas apropiadas sobre la aplicación del presente artículo, habida cuenta, en particular, de la evolución científica y tecnológica.
Artículo 12
1. Las normas de control previstas en la Directiva 90/425/CEE se aplicarán, en particular por lo que se refiere a la organización y al curso que deba darse a los controles que deberán efectuarse, a los animales y al esperma, óvulos y embriones a que hace referencia la presente Directiva que vayan acompañados de un certificado sanitario. Los demás animales deberán proceder de explotaciones sometidas a los principios de dicha Directiva por lo que respecta a los controles que deberán efectuarse en origen y en destino.
2. El artículo 10 de la Directiva 90/425/CEE se aplicará a los animales, esperma, óvulos y embriones a que se refiere la presente Directiva.
3. A efectos de intercambios se harán extensivas las disposiciones del artículo 12 de la Directiva 90/425/CEE a los comercios que, de modo permanente u ocasional, posean animales de los mencionados en los artículos 7, 9 y 10.
4. La información del lugar de destino a que se refiere el apartado 2 del artículo 4 de la Directiva 90/425/CEE para los animales, esperma, óvulos o embriones que, de conformidad con la presente Directiva, vayan acompañados de un certificado sanitario, deberá efectuarse mediante el sistema ANIMO.
5. Sin perjuicio de las disposiciones específicas establecidas en la presente Directiva, cuando existan sospechas de incumplimiento de la presente Directiva o dudas acerca de la salud de los animales o de la calidad de los espermas, óvulos y embriones mencionados en el artículo 1, la autoridad competente efectuará cuantos controles considere oportunos.
6. Los Estados miembros adoptarán las medidas administrativas o penales adecuadas para sancionar cualquier infracción de la presente Directiva, en particular cuando se compruebe que los certificados o documentos expedidos no corresponden al estado real de los animales mencionados en el artículo 1, que la identificación de los animales o el marcado de los espermas, ovulos y embriones de que se trate no se ajusta a dicha normativa, o que los citados animales o productos no han sido sometidos a los controles previstos en la presente Directiva.
Artículo 13
1. Los intercambios de animales de las especies sensibles a las enfermedades mencionadas en el Anexo A o a las enfermedades mencionadas en el Anexo B, en caso de que el Estado miembro de destino se beneficie de las garantías previstas en los artículos 14 y 15, así como los intercambios de esperma, óvulos o embriones de dichos animales, entre organismos, institutos o centros autorizados de conformidad con el Anexo C, estarán supeditados a la presentación de un documento de transporte que recoja las indicaciones del modelo que figura en el Anexo E. Dicho documento, que deberá cumplimentar el veterinario responsable del organismo, instituto o centro de origen de que se trate, deberá precisar que los animales, esperma, óvulos o embriones proceden de un organismo, de un instituto o de un centro autorizado de conformidad con el Anexo C y deberá acompañar a los animales, esperma, óvulos o embriones durante el transporte.
2.
a) Por lo que respecta a las enfermedades de declaración obligatoria, los organismos, institutos o centros deberán, para ser autorizados, presentar a la autoridad competente del Estado miembro todos los documentos justificativos pertinentes referentes a los requisitos del Anexo C.
b) Una vez recibido el expediente relativo a la solicitud de autorización o de renovación de la misma, la autoridad competente la estudiará a la vista de la información recogida en dicho expediente y, en su caso, de los resultados de los controles efectuados in situ.
c) La autoridad competente retirará la autorización de conformidad con lo dispuesto en el apartado 3 del Anexo C.
d) Cada Estado miembro comunicará a la Comisión la lista de los organismos, institutos y centros autorizados, así como cualquier modificación de dicha lista. La Comisión transmitirá dicha información a los demás Estados miembros.
▼
e) Suecia dispondrá de un plazo de dos años a partir de la fecha de entrada en vigor del Tratado de adhesión para aplicar las medidas previstas relativas a los organismos, institutos o centros.
▼B
Artículo 14
1. En caso de que un Estado miembro elabore o haya elaborado, bien directamente, bien por medio de los criadores, un programa opcional u obligatorio de lucha o de vigilancia contra una de las enfermedades enumeradas en el Anexo B, podrá someter dicho programa a la Comisión indicando, en particular,
— la situación de la enfermedad en su territorio,
— el carácter obligatorio de la notificación de la enfermedad,
— la justificación del programa, teniendo en cuenta la importancia de la enfermedad y sus ventajas desde el punto de vista de la relación coste/beneficios,
— la zona geográfica en la que se va a aplicar el programa,
— los distintos estatutos aplicables a los establecimientos, los requisitos exigidos para cada especie en relación con la introducción en la cría y los procedimientos de pruebas,
— los procedimientos de control del programa, con inclusión del grado de asociación de los criadores en la ejecución del programa de lucha o de vigilancia,
— las consecuencias que deben deducirse de la pérdida del estatuto de la explotación, por el motivo que fuere,
— las medidas que se han de adoptar en caso de observancia de resultados positivos en los controles efectuados con arreglo al programa,
— el carácter no discriminatorio entre los intercambios en el territorio del Estado miembro de que se trate y los intercambios intracomunitarios.
2. La Comisión examinará los programas comunicados por los Estados miembros. Los programas podrán ser aprobados, con arreglo al procedimiento previsto en el artículo 26 y cumpliendo los criterios mencionados en el apartado 1. Con arreglo al mismo procedimiento, podrán definirse al mismo tiempo, o a más tardar tres meses después de la presentación de los programas, las garantías complementarias generales o limitadas que podrán exigirse en los intercambios. Dichas garantías deberán equivaler, como máximo, a las que el Estado miembro aplique en el ámbito nacional.
3. Los programas presentados por los Estados miembros podrán modificarse o completarse con arreglo al procedimiento previsto en el artículo 26. Con arreglo al mismo procedimiento podrán modificarse las garantías a que se refiere el apartado 2.
Artículo 15
1. En caso de que un Estado miembro considere que su territorio está total o parcialmente libre de una de las enfermedades mencionadas en el Anexo B a las que son sensibles los animales contemplados en la presente Directiva, presentará a la Comisión las justificaciones correspondientes. Precisará, en particular:
— la naturaleza de la enfermedad y el historial de su aparición en su territorio,
— los resultados de las pruebas de vigilancia basadas en una investigación serológica, microbiológica, patológica o epidemiológica,
— desde cuándo la enfermedad debe declararse obligatoriamente ante las autoridades competentes,
— la duración de la vigilancia efectuada,
— en su caso, el período durante el cual ha estado prohibida la vacunación contra la enfermedad y la zona geográfica en la que se ha aplicado dicha prohibición,
— las normas que permitan el control de la ausencia de la enfermedad.
2. La Comisión, previo examen de las justificaciones previstas en el apartado 1, someterá al Comité veterinario permanente la aprobación o el rechazo del plan presentado por el Estado miembro. Si el mencionado plan fuere aceptado, las garantías complementarias generales o limitadas que puedan exigirse en los intercambios se definirán con arreglo al procedimiento previsto en el artículo 26. Dichas garantías serán, como máximo, equivalentes a las que el Estado miembro aplique a nivel nacional.
Mientras no se tome esta decisión, el Estado miembro interesado podrá mantener en los intercambios los requisitos pertinentes necesarios para mantener su situación.
3. El Estado miembro interesado comunciará a la Comisión cualquier modificación de las justificaciones mencionadas en el apartado 1. A la luz de la información comunicada, las garantías definidas conforme al apartado 2 podrán modificarse o suprimirse con arreglo al procedimiento previsto en el artículo 26.
CAPÍTULO III
Disposiciones aplicables a las importaciones en la Comunidad
Artículo 16
Las disposiciones aplicables a las importaciones de animales, esperma, óvulos y embriones a que se refiere la presente Directiva deberán ser al menos equivalentes a las establecidas en el capítulo II.
▼M5
Por lo que respecta a los gatos, los perros y los hurones, las condiciones de importación deberán ser al menos equivalentes a las del capítulo III del Reglamento (CE) no 998/2003.
El certificado que acompañe a los animales deberá acreditar además la realización de un examen clínico 24 horas antes del envío por un veterinario autorizado por la autoridad competente y que determine que los animales gozan de buena salud y que pueden soportar el transporte hasta el lugar de destino.
▼B
Artículo 17
1. A efectos de la aplicación uniforme del artículo 16, serán de aplicación las disposiciones de los apartados siguientes.
2. Solamente podrán importarse en la Comunidad los animales y el esperma, óvulos y embriones a que se hace referencia en el artículo 11 que cumplan los siguientes requisitos:
a) proceder de un tercer país que figure en una lista que deberá elaborarse de conformidad con lo dispuesto en la letra a) del apartado 3;
b) ir acompañados de un certificado sanitario, con arreglo a un modelo que se elaborará según el procedimiento previsto en el artículo 26, que irá firmado por la autoridad competente del país exportador y que certificará que dichos animales, esperma, óvulos o embriones cumplen las condiciones adicionales, u ofrecen las garantías equivalentes a que se hace referencia en el apartado 4, o proceden de centros, organismos, institutos o estaciones de recogida autorizados que ofrecen dichas garantías.
3. Con arreglo al procedimiento previsto en el artículo 26, se establecerán:
▼M7
a) una lista de terceros países o partes de terceros países que puedan proporcionar a los Estados miembros y a la Comisión garantías equivalentes a las previstas en el capítulo II en relación con los animales, el esperma, los óvulos y los embriones.
b) sin perjuicio de lo dispuesto en la Decisión 94/63/CE de la Comisión de 31 de enero de 1994, por la que se establece la lista de los países terceros a partir de los cuales los Estados miembros autorizan las importaciones de esperma, óvulos y embriones de las especies ovina y caprina y de óvulos y de embriones de la especie porcina (
19
), una lista de los centros de recogida para los que dichos terceros países puedan dar las garantías previstas en el artículo 11.
La Comisión informará a los Estados miembros sobre cualquier propuesta de modificación de las listas de centros, y los Estados miembros dispondrán de diez días laborables, a partir de la fecha de recepción de las propuestas de modificaciones, para enviar por escrito observaciones a la Comisión.
Si en dicho plazo de diez días laborables no se recibieran observaciones por escrito de los Estados miembros, se considerará que éstos aceptan las modificaciones propuestas, y las importaciones se autorizarán conforme a las listas modificadas cuando la Comisión notifique a las autoridades competentes de los Estados miembros y al tercer país en cuestión que las modificaciones se han publicado en el sitio web de la Comisión.
En caso de que en el plazo de diez días laborables se recibieran observaciones por escrito de al menos un Estado miembro, la Comisión informará de ello a los Estados miembros y al Comité permanente de la cadena alimentaria y de sanidad animal en su siguiente reunión, con el fin de adoptar una decisión conforme al procedimiento contemplado en el segundo apartado del artículo 26.
▼B
c) las condiciones específicas de policía sanitaria — en particular las encaminadas a proteger la Comunidad contra determinadas enfermedades exóticas — o garantías equivalentes a las previstas en la presente Directiva.
Las condiciones específicas y las garantías equivalentes fijadas para los terceros países no podrán ser más favorables que las previstas en el capítulo II.
4. Sólo podrán incluirse en la lista a la que se hace referencia en el apartado 3 los terceros países o las partes de terceros países:
a) procedentes de los cuales no estén prohibidas las importaciones
— debido a la ausencia de enfermedades de las mencionadas en el Anexo A o de cualquier otra enfermedad exótica en la Comunidad;
— en aplicación de los artículos 6, 7 y 14 de la Directiva 72/462/CEE y del artículo 17 de las Directivas 91/495/CEE y 71/118/CEE (
20
) o bien, en el caso de los demás animales a los que se refiere la presente Directiva, por decisión adoptada con arreglo al procedimiento establecido en el artículo 26 y habida cuenta de la situación sanitaria de los mismos;
b) que, habida cuenta de la legislación y la organización de su servicio veterinario y de sus servicios de inspección, de las atribuciones de los mismos y del control al que estén sujetos, hayan sido reconocidos capaces de garantizar la aplicación de la legislación vigente, de conformidad con el apartado 2 del artículo 3 de la Directiva 72/462/CEE;
c) cuyo servicio veterinario esté en condiciones de garantizar el cumplimiento de requisitos sanitarios equivalentes, al menos, a los establecidos en el capítulo II.
5. Expertos de la Comisión y de los Estados miembros efectuarán controles in situ para comprobar si las garantías ofrecidas por el país tercero en cuanto a las condiciones de producción y de comercialización pueden considerarse equivalentes a las que se aplican en la Comunidad.
Los expertos de los Estados miembros encargados de efectuar los controles serán nombrados por la Comisión, a propuesta de los Estados miembros.
Dichos controles se realizarán por cuenta de la Comunidad, que se hará cargo de los gastos correspondientes.
6. Hasta que no se efectúen los controles a que se hace referencia en el apartado 5, seguirán aplicándose las disposiciones nacionales aplicables en materia de inspección aplicables en los terceros países, sin perjuicio de que se informe, en el Comité veterinario permanente, de los incumplimientos de las garantías ofrecidas, de conformidad con lo dispuesto en el apartado 3, que se hubieren observado en dichas inspecciones.
Artículo 18
1. Los Estados miembros velarán por que los animales, esperma, óvulos y embriones a que hace referencia la presente Directiva únicamente se importen en la Comunidad:
— si fueren acompañados de un certificado expedido por el veterinario oficial.
— El modelo de certificado se establecerá, en función de las especies, con arreglo al procedimiento previsto en el artículo 26,
— si hubieren pasado los controles previstos en las Directivas 90/675/CEE y 91/496/CEE (
21
),
— si hubieren sido sometidos, antes del embarque hacia el territorio de la Comunidad, a un control a cargo de un veterinario oficial para asegurarse de que se respetan las condiciones de transporte previstas en la Directiva 91/628/CEE (
22
), en particular en lo relativo al abastecimiento de agua y de alimento,
— cuando se trate de los animales a que se hace referencia en los artículos 5 a 10, si hubieren sido sometidos antes de su importación a una cuarentena cuyas modalidades deberán fijarse con arreglo al procedimiento establecido en el artículo 26.
2. En espera del establecimiento de las normas de desarrollo del presente artículo, seguirán aplicándose las normas nacionales aplicables a las importaciones procedentes de terceros países para los cuales aún no se hayan adoptado requisitos a nivel comunitario, siempre que tales normas no sean más favorables que las establecidas en el capítulo II.
Artículo 19
Se fijarán con arreglo al procedimiento previsto en el artículo 26:
a) las condiciones específicas de policía sanitaria, para la importación en la Comunidad, la índole y el contenido de los documentos de acompañamiento de los animales destinados a zoos, circos, parques de atracciones o laboratorios de experimentación, según las especies;
b) garantías adicionales a las previstas para las distintas especies animales a que hace referencia la presente Directiva, para proteger las especies comunitarias afectadas.
Artículo 20
Se aplicarán los principios y normas establecidos en la Directiva 90/675/CEE, en particular en lo relativo a la organización y al curso que deba darse a los controles que deberán efectuar los Estados miembros, así como a las medidas de salvaguardia que deban aplicarse.
En espera de la aplicación de las decisiones previstas en el punto 3 del artículo 8 y en el artículo 30 de la Directiva 91/496/CEE, seguirán aplicándose las normas nacionales pertinentes de desarrollo de la observancia de los principios y normas a que se hace referecia en el párrafo primero del presente artículo.
CAPÍTULO IV
Disposiciones comunes y finales
Artículo 21
Los posibles modelos de certificados aplicables a los intercambios y las condiciones de policía sanitaria que deberán cumplir los animales, esperma, óvulos y embriones distintos de los mencionados en los artículos 5 a 11 para poder ser objeto de intercambios se determinarán, en la medida en que sea necesario, con arreglo al procedimiento previsto en el artículo 26.
Artículo 22
Los Anexos se modificarán, en caso necesario, con arreglo al procedimiento previsto en el artículo 26.
▼
Volverá a estudiarse el Anexo B antes de la fecha de entrada en vigor del Tratado de adhesión con objeto, en particular, de modificar la lista de enfermedades para incluir aquéllas a que son proclives los rumiantes y los suidos, así como aquéllas transmisibles mediante espermas, óvulos y embriones de los ovinos.
▼B
Artículo 23
Con arreglo al procedimiento previsto en el artículo 26, podrán establecerse, en caso necesario y no obstante lo dispuesto
►M7
————— ◄ en el capítulo II, condiciones específicas para la circulación de los animales que acompañen a circos y feriantes y para los intercambios de animales, esperma, óvulos y embriones destinados a zoos.
Artículo 24
1. Los Estados miembros estarán autorizados a supeditar a la presentación de un certificado sanitario que atestigüe el cumplimiento de los requisitos de la presente Directiva la introducción en su territorio de los animales (incluídos los pájaros de aviario), esperma, óvulos y embriones mencionados en la misma que hayan transitado a través del territorio de un tercer país.
2. Los Estados miembros que recurran a la facultad prevista en el apartado 1 informarán de ello a la Comisión y a los demás Estados miembros en el Comité veterinario permanente.
Artículo 25
1. En el Anexo A de la Directiva 90/425/CEE se añadirá la siguiente mención:
«Directiva 92/65/CEE del Consejo, de 13 de julio de 1992, por la que se definen las condiciones de policía sanitaria que rigen los intercambios y las importaciones en la Comunidad de animales, esperma, óvulos y embriones no sometidos, con respecto a estas condiciones, a las normativas comunitarias específicas a que se refiere la sección I del Anexo A de la Directiva 90/425/CEE (DO no L 268 de 14. 9. 1992, p. 54)»
.
▼M7
Artículo 26
1. La Comisión estará asistida por el Comité permanente de la cadena alimentaria y de sanidad animal creado por el artículo 58 del Reglamento (CE) no 178/2002 del Parlamento Europeo y del Consejo (
23
).
2. En los casos en que se haga referencia al presente apartado, serán de aplicación los artículos 5 y 7 de la Decisión 1999/468/CE.
El plazo contemplado en el apartado 6 del artículo 5 de la Decisión 1999/468/CE (
24
) queda fijado en tres meses.
3. El Comité aprobará su reglamento interno.
▼B
Artículo 27
Los Estados miembros que apliquen un régimen alternativo de control que ofrezca garantías equivalentes a las previstas en la presente Directiva para los movimientos, en su territorio respectivo, de los animales, esperma, óvulos y embriones mencionados en la misma, podrán concederse, sobre una base de reciprocidad, excepciones a lo dispuesto en la letra f) del punto 1 del apartado A del artículo 6, en la letra b) del artículo 8 y en la letra b) del apartado 1 del artículo 11.
Artículo 28
Con arreglo al procedimiento establecido en el artículo 26, podrán aprobarse, por un período de tres años, medidas transitorias para facilitar el paso al nuevo régimen establecido en la presente Directiva.
Artículo 29
1. Los Estados miembros pondrán en vigor las disposiciones legales, reglamentarias y administrativas necesarias para dar cumplimiento a lo dispuesto en la presente Directiva antes del 1 de enero de 1994. Informarán de ello inmediatamente a la Comisión.
Cuando los Estados miembros adopten dichas disposiciones, éstas incluirán una referencia a la presente Directiva o irán acompañadas de tal referencia en el momento de su publicación oficial. Los Estados miembros establecerán las modalidades de dicha referencia.
2. Los Estados miembros comunicarán a la Comisión el texto de las disposiciones fundamentales de Derecho interno que adopten dentro del ámbito regulado por la presente Directiva.
3. El establecimiento de la fecha de expiración del plazo de incorporación en el 1 de enero de 1994 no obstará para la supresión de los controles veterinarios en las fronteras prevista en las Directivas 89/662/CEE y 90/425/CEE.
Artículo 30
Los destinatarios de la presente Directiva serán los Estados miembros.
▼M6
ANEXO A
Enfermedades de declaración obligatoria en el contexto de la presente Directiva
|
Enfermedad
|
Orden/familia/especie principalmente considerada
|
|
Peste equina africana
|
Equidae
|
|
Peste porcina africana
|
Suidae y Tayassuidae
|
|
Influenza aviar
|
Aves
|
|
Loque americana
|
Apis
|
|
Carbunco bacteridiano
|
Bovidae, Camelidae, Cervidae, Elephantidae, Equidae e Hippopotamidae
|
|
Lengua azul
|
Antilocapridae, Bovidae, Cervidae, Giraffidae y Rhinocerotidae
|
|
Brucella abortus
|
Antilocapridae, Bovidae, Camelidae, Cervidae, Giraffidae, Hippopotamidae y Tragulidae
|
|
Brucella melitensis
|
Antilocapridae, Bovidae, Camelidae, Cervidae, Giraffidae, Hippopotamidae y Tragulidae
|
|
Brucella ovis
|
Camelidae, Tragulidae, Cervidae, Giraffidae, Bovidae y Antilocapridae
|
|
Brucella suis
|
Cervidae, Leporidae, Ovibos moschatus, Suidae y Tayassuidae
|
|
Peste porcina clásica
|
Suidae y Tayassuidae
|
|
Perineumonía contagiosa bovina
|
Bovidae (incluidos cebú, búfalo, bisonte y yak)
|
|
Ebola
|
Primates no humanos
|
|
Fiebre aftosa
|
Artiodactyla y elefantes asiáticos
|
|
Necrosis hematopoyética infecciosa
|
Salmonidae
|
|
Dermatosis nodular contagiosa
|
Bovidae y Giraffidae
|
|
Virus de la viruela del mono
|
Roedores y primates no humanos
|
|
Mycobacterium bovis
|
Mammalia, en particular Antilocapridae, Bovidae, Camelidae, Cervidae, Giraffidae y Tragulidae
|
|
Enfermedad de Newcastle
|
Aves
|
|
Peste de los pequeños rumiantes
|
Bovidae y Suidae
|
|
Encefalomielitis enterovírica porcina
|
Suidae
|
|
Psitacosis
|
Psittaciformes
|
|
Rabia
|
Carnivora y Chiroptera
|
|
Fiebre del Valle del Rift
|
Bovidae, Camelus spp. y Rhinocerotidae
|
|
Peste bovina
|
Artiodactyla
|
|
Pequeño escarabajo de la colmena (Aethina tumida)
|
Apis y Bombus
|
|
Viruela ovina y caprina
|
Bovidae
|
|
Enfermedad vesicular porcina
|
Suidae y Tayassuidae
|
|
Ácaro Tropilaelaps (Tropilaelaps spp.)
|
Apis
|
|
Estomatitis vesicular
|
Artiodactyla y Equidae
|
|
EET
|
Bovidae, Cervidae, Felidae y Mustelidae
|
▼B
ANEXO B
LISTA DE ENFERMEDADES PARA LAS QUE PUEDEN RECONOCERSE PROGRAMAS NACIONALES EN VIRTUD DE LA PRESENTE DIRECTIVA
|
Visones
|
Enteritis viral
Enfermedad aleutiana
|
|
Abejas
|
Loque europea
Varroasis y acariosis
|
|
Simios y félidos
|
Tuberculosis
|
|
Rumiantes
|
Tuberculosis
|
|
Lagomorfos
|
Mixomatosis
Enfermedades virales y hermorrágicas
Tularemia
|
▼M3
ANEXO C
CONDICIONES DE AUTORIZACIÓN DE LOS ORGANISMOS, INSTITUTOS O CENTROS
1) Para ser oficialmente autorizados, de conformidad con lo dispuesto en el apartado 2 del artículo 13 de la presente Directiva, los organismos, institutos o centros definidos en la letra c) del apartado 1 del artículo 2 deberán:
a) estar claramente delimitados y separados de su entorno o los animales confinados y situados de tal forma que no supongan riesgo sanitario alguno para explotaciones agrarias cuya situación sanitaria pueda verse amenazada;
b) contar con medios adecuados para capturar, confinar y aislar a los animales, así como disponer de instalaciones de cuarentena apropiadas para los animales procedentes de fuentes no autorizadas;
c) estar indemnes de las enfermedades enumeradas en el anexo A y de las enumeradas en el anexo B, si el país considerado cuenta con un programa a tenor de lo previsto en el artículo 14. Al objeto de que un organismo, instituto o centro pueda ser declarado indemne de tales enfermedades, la autoridad competente examinará los registros sobre el estado de salud de los animales de los tres últimos años, como mínimo, y los resultados de las pruebas clínicas y de laboratorio realizadas sobre los animales en el organismo, instituto o centro. No obstante este requisito, se autorizarán nuevos establecimientos si los animales mantenidos en los mismos proceden de establecimientos autorizados;
d) llevar registros actualizados en los que se indique:
i) el número y la identidad (edad, sexo, especie e identificación individual siempre que resulte factible) de los animales de cada especie presentes en el establecimiento,
ii) el número y la identidad (edad, sexo, especie e identificación individual siempre que resulte factible) de los animales que lleguen al establecimiento o lo abandonen, junto con información sobre su origen o destino, el transporte hasta el establecimiento o a partir del mismo y el estado de salud de los animales,
iii) los resultados de los análisis de sangre y cualesquiera otros procedimientos de diagnóstico,
iv) los casos de enfermedad y, cuando proceda, el tratamiento administrado,
v) los resultados de los exámenes post-mortem realizados sobre los animales que hayan muerto en el establecimiento, incluidos los nacidos muertos,
vi) las observaciones realizadas durante cualquier período de aislamiento o cuarentena;
e) bien haber celebrado un acuerdo con un laboratorio competente para llevar a cabo los exámenes post-mortem, bien disponer de uno o varios locales adecuados en los que dichos exámenes puedan ser efectuados por una persona capacitada bajo el control del veterinario autorizado;
f) haber tomado disposiciones adecuadas o bien contar con instalaciones in situ para la eliminación adecuada de los cuerpos de los animales que mueren por enfermedad o por eutanasia;
g) obtener, mediante contrato u otro instrumento jurídico, los servicios de un veterinario autorizado por la autoridad competente y sujeto al control de la misma, el cual:
i) cumplirá mutatis mutandis los requisitos a que se refiere el subapartado B del apartado 3 del artículo 14 de la Directiva 64/432/CEE;
ii) se cerciorará de que las autoridades competentes aprueban medidas adecuadas de control y vigilancia de las enfermedades en relación con la situación sanitaria del país de que se trate y de que éstas se aplican en el organismo, instituto o centro. Tales medidas incluirán:
— un plan anual de vigilancia de las enfermedades que incluya el control adecuado de las zoonosis en los animales,
— exámenes clínicos, de laboratorio y post-mortem de los animales que presumiblemente estén afectados por enfermedades transmisibles,
— la vacunación, en su caso, de los animales sensibles contra las enfermedades infecciosas, exclusivamente de conformidad con la normativa comunitaria,
iii) se asegurará de que toda muerte sospechosa o cualquier otro síntoma que lleve a pensar que los animales han contraído una o varias de las enfermedades mencionadas en los anexos A y B se notifique sin demora a la autoridad competente, si esa enfermedad concreta es de declaración obligatoria en el Estado miembro correspondiente;
iv) se cerciorará de que los animales que entren hayan permanecido aislados en la medida de lo necesario, con arreglo a los requisitos de la presente Directiva y, en su caso, a las instrucciones dadas por la autoridad competente;
v) será responsable de la observancia cotidiana de los requisitos zoosanitarios de la presente Directiva y de la normativa comunitaria sobre el bienestar de los animales durante el transporte y la eliminación de desperdicios animales;
h) en el supuesto de que se mantengan animales destinados a laboratorios de experimentación, ajustarse a lo dispuesto en el artículo 5 de la Directiva 86/609/CEE.
2) La autorización se mantendrá cuando se cumplan los siguientes requisitos:
a) los locales deberán estar sujetos al control de un veterinario oficial de la autoridad competente, el cual:
i) visitará los locales del organismo, instituto o centro una vez al año, como mínimo,
ii) supervisará la actividad del veterinario autorizado y la aplicación del plan anual de vigilancia de las enfermedades,
iii) se asegurará de que se cumple lo dispuesto en la presente Directiva;
b) únicamente se introducirán en el establecimiento animales procedentes de otro organismo, instituto o centro autorizado, de conformidad con lo previsto en la presente Directiva;
c) el veterinario oficial deberá comprobar que:
— se observa lo dispuesto en la presente Directiva,
— los resultados de los exámenes clínicos, post-mortem y de laboratorio realizados sobre los animales no revelan la presencia de alguna de las enfermedades enumeradas en los anexos A y B;
d) el organismo, instituto o centro, una vez obtenida la autorización, deberá conservar los registros a que se refiere la letra d) del apartado 1 durante un período mínimo de diez años;
3) No obstante lo dispuesto en el apartado 1 del artículo 5 y la letra b) del anterior apartado 2, podrán introducirse animales, incluidos monos (simiae y prosimiae), que no procedan de un organismo, instituto o centro autorizado en un organismo, instituto o centro autorizado, siempre que dichos animales se sometan a cuarentena bajo control oficial y de conformidad con las instrucciones de la autoridad competente antes de pasar a formar parte de la colección del establecimiento.
En el caso de los monos (simiae y prosimiae), se observarán los requisitos de cuarentena establecidos en el Código zoosanitario internacional de la OIE (capítulo 2.10.1 y apéndice 3.5.1).
Para otros animales que sean sometidos a cuarentena de conformidad con la letra b) del punto 2 del presente anexo, el periodo de cuarentena deberá ser, como mínimo, de 30 días en relación con las enfermedades que figuran en el anexo A.
4) Los animales confinados en un organismo, instituto o centro autorizado, sólo podrán abandonar dicho establecimiento cuando estén destinados a otro organismo, instituto o centro autorizado, en dicho Estado miembro o en otro Estado miembro; no obstante, en el supuesto de que no vayan destinados a un organismo, instituto o centro autorizado, sólo podrán abandonar el establecimiento de acuerdo con las exigencias de la autoridad competente para garantizar que no hay riesgo alguno de propagación de enfermedades.
5) En el supuesto de que un Estado miembro disfrute de garantías adicionales en virtud de la normativa comunitaria, podrá exigir que se impongan al organismo, instituto o centro autorizado requisitos y obligaciones de certificación adicionales con respecto a las especies sensibles.
6) La autorización se suspenderá total o parcialmente, se retirará o se restituirá en las siguientes condiciones:
a) cuando la autoridad competente compruebe que no se han cumplido los requisitos del apartado 2, o se haya producido un cambio de uso que ya no esté cubierto por el artículo 2 de la presente Directiva, se suspenderá o retirará la autorización;
b) cuando se notifique que existen sospechas de la presencia de alguna de las enfermedades enumeradas en los anexos A o B, la autoridad competente suspenderá la autorización del organismo, instituto o centro, hasta que quede oficialmente descartada tal sospecha. Dependiendo de la enfermedad considerada y del riesgo de propagación de la enfermedad, la suspensión se referirá al establecimiento en su conjunto o únicamente a ciertas categorías de animales sensibles a dicha enfermedad. La autoridad competente velará por que se tomen las medidas necesarias para confirmar o descartar la sospecha y evitar toda propagación de la enfermedad, con arreglo a la normativa comunitaria que regule las medidas de lucha contra la enfermedad considerada y los intercambios comerciales de animales;
c) si se confirma la sospecha de enfermedad, el organismo, instituto o centro sólo volverá a recibir la autorización cuando, tras erradicarse la enfermedad y el foco de infección en los locales, lo que incluirá una limpieza y desinfección adecuadas, se cumplan nuevamente las condiciones del apartado 1 del presente anexo, a excepción de la establecida en la letra c) de dicho apartado;
d) la autoridad competente informará a la Comisión de la suspensión, retirada o restitución de la autorización de cualquier organismo, instituto o centro.
▼B
ANEXO D
▼M1
CAPÍTULO I
I. Condiciones de autorización de los centros de recogida de esperma
Los centros de recogida de esperma deberán:
1) estar bajo la supervisión de un veterinario del centro;
2) disponer al menos de lo siguiente:
a) habitáculos para los animales, que puedan cerrarse con llave y, en el caso de que haya équidos, una zona de ejercicio, que estén separados físicamente de las instalaciones de recogida y de las salas de transformación y almacenamiento,
b) instalaciones de aislamiento que no estén directamente comunicadas con los habitáculos normales de los animales,
c) instalaciones de recogida de esperma que incluyan una sala separada para la limpieza y desinfección o esterilización del equipo,
d) una sala de transformación del esperma separada de las instalaciones de recogida, que no tiene que estar necesariamente en el mismo lugar,
e) una sala de almacenamiento de esperma, que no tiene que estar necesariamente en el mismo lugar;
3) estar construidos o aislados de tal forma que se evite todo contacto con animales que se encuentren en el exterior;
4) estar construidos de tal forma que todo el centro, salvo las oficinas y, cuando exista, la zona de ejercicio para équidos, pueda limpiarse y desinfectarse fácilmente.
II. Condiciones de vigilancia de los centros de recogida de esperma
Los centros de recogida de esperma deberán:
1) estar bajo vigilancia para que en ellos sólo haya animales de las especies cuyo esperma vaya a recogerse; no obstante, podrán admitirse otros animales domésticos, siempre que no presenten riesgos de infección para las especies cuyo esperma vaya a recogerse y cumplan las condiciones establecidas por el veterinario del centro; si, en el caso de los équidos, el centro de recogida comparte un local con un centro de inseminación artificial o natural, las yeguas, los receladores y los sementales destinados a la inseminación natural serán admitidos, siempre que cumplan los requisitos de los puntos 1, 2, 3 y 4 de la sección A del capítulo II del Anexo D;
2) ser controlados para cerciorarse de que se llevan registros que permitan conocer:
— la especie, la raza, la fecha de nacimiento y la identificación de cada animal presente en el centro,
— las entradas de animales en el centro y las salidas del mismo,
— el historial sanitario de los animales que se mantengan en él, así como todas las pruebas de diagnóstico y sus resultados, los tratamientos y las vacunaciones realizados,
— la fecha de recogida y transformación del esperma,
— el destino del esperma,
— el almacenamiento del esperma;
3) ser inspeccionados por un veterinario oficial durante el período de apareamiento, al menos una vez al año en el caso de animales con apareamiento estacional y dos veces al año tratándose de reproducción no estacional, con el fin de examinar y comprobar todos los asuntos relacionados con las condiciones de autorización y supervisión;
4) disponer de una vigilancia que impida la entrada de cualquier persona no autorizada. Además, los visitantes autorizados deberán ser admitidos con arreglo a las condiciones fijadas por el veterinario del centro;
5) emplear personal competente que haya recibido una formación adecuada sobre las técnicas de desinfección e higiene para evitar la propagación de enfermedades;
6) estar bajo vigilancia para cerciorarse de que:
— ninguno de los animales que se mantienen en el centro se emplea para reproducción natural, al menos treinta días antes de la primera recogida de esperma y durante el período de recogida;
— la recogida, la transformación y el almacenamiento del esperma se realizan exclusivamente en los locales previstos para ello;
— todos los utensilios que durante la recogida o la transformación entren en contacto con el esperma o el animal donante se desinfectan o esterilizan adecuadamente antes de cada uso, o bien son nuevos y desechables y se eliminan después de usarlos;
— si, en el caso de équidos, el centro de recogida comparte locales con un centro de inseminación artificial o natural, deberá haber una separación estricta entre los instrumentos y el equipo utilizados para la inseminación artificial o natural, los instrumentos y el equipo que entren en contacto con los animales donantes u otros animales que se mantengan en el centro y el esperma;
— los productos de origen animal que se utilicen en la transformación del esperma, como diluyentes, aditivos o extendedores, no presentan ningún riesgo para la salud de los animales o han sido sometidos a un tratamiento previo para eliminar dicho riesgo;
— en caso de esperma congelado o refrigerado, se utilizan agentes criogénicos que no se hayan empleado previamente con otros productos de origen animal;
— todos los recipientes utilizados para el almacenamiento o el transporte de esperma se desinfectan o esterilizan, según convenga, antes de cada uso, o bien son nuevos y desechables y se eliminan después de usarlos;
7) garantizar la identificación de cada dosis de esperma, de forma que pueda determinarse el Estado miembro de origen, la fecha de recogida, la especie, la raza y la identidad del animal donante, así como el nombre o el número del centro autorizado que haya efectuado la recogida.
▼B
CAPÍTULO II
Condiciones aplicables en los centros y estaciones de recogida
Requisitos relativos a la admisión de machos donantes
▼M1
A. SEMENTALES
Sólo podrán destinarse a la recogida de esperma los sementales que, a satisfacción del veterinario del centro, cumplan los requisitos siguientes:
1) no presenten signos de enfermedad infecciosa o contagiosa en el momento de su admisión ni el día de la recogida del esperma;
2) procedan del territorio o, en caso de regionalización, de una parte del territorio de un Estado miembro o de un tercer país y de una explotación sometidos a supervisión veterinaria, qu cumplen los requisitos de la Directiva 90/426/CEE del Consejo;
3) hayan permanecido, en los treinta días anteriores a la recogida de esperma, en explotaciones en las que ningún équido haya presentado signos clínicos de arteritis viral equina durante ese período;
4) hayan permanecido, en los sesenta días anteriores a la recogida de esperma, en explotaciones en las que ningún équido haya presentado signos clínicos de metritis contagiosa equina durante ese período;
5) no hayan sido utilizados para cubriciones naturales en los treinta días anteriores a la primera recogida de esperma ni durante el período de recogida;
6) hayan sido sometidos a las pruebas siguientes, realizadas y certificadas en un laboratorio reconocido por la autoridad competente con arreglo al programa que se establece en el punto 7:
i) prueba de inmunodifusión en agar-agar (prueba de Coggins), para la detección de la anemia infecciosa equina, con resultado negativo;
ii) prueba de seroneutralización para la detección de la arteritis viral equina; a menos que se obtenga negativo con una dilución de suero de 1/4, se realizará una prueba de aislamiento del virus con una parte alícuota de todo el esperma del semental donante, prueba que deberá dar resultado negativo;
iii) una prueba para la detección de la metritis contagiosa equina realizada en dos ocasiones con un intervalo de 7 días mediante el aislamiento del germen Taylorella equigenitalis a partir del líquido preeyaculatorio o de una muestra de esperma y de hisopos genitales tomados al menos del prepucio, de la uretra y de la fosa uretral, con resultados negativos en todos los casos;
7) hayan sido sometidos a uno de los programas de prueba siguientes:
i) en caso de que el esperma se recoja para destinarlo al comercio en estado fresco o refrigerado:
— si los sementales donantes permanecen de manera ininterrumpida en el centro de recogida durante los treinta días anteriores a la primera recogida de esperma y durante el período de recogida, y ningún équido de dicho centro está en contacto directo con équidos de estado sanitario inferior, las pruebas previstas en los incisos i), ii) y iii) del apartado 6 se realizarán al menos catorce días después del inicio del período de permanencia mencionado y, como mínimo, una vez al año, al comienzo del período de apareamiento;
— si los sementales donantes no permanecen de manera ininterrumpida en el centro de recogida u otros équidos de dicho centro están en contacto directo con équidos de un estado sanitario inferior, las pruebas previstas en los incisos i), ii) y iii) del apartado 6 se realizarán dentro de los catorce días anteriores a la primera recogida de esperma y al menos una vez al año, al comienzo del período de apareamiento; además, la prueba prevista en el inciso i) del apartado 6 deberá repetirse con un intervalo no superior a cientoveinte días durante el período de recogida de esperma; la prueba prevista en el inciso ii) del apartado 6 se realizará como máximo treinta días antes de cada recogida de esperma, a menos que se confirme, mediante un prueba de aislamiento del virus que deberá realizarse anualmente, que un semental seropositivo a la arteritis infecciosa equina no es excretor;
ii) en caso de que el esperma se recoja para destinarlo al comercio en estado congelado, se realizará el programa de ensayo contemplado en el inciso i) o, alternativamente, las pruebas establecidas en los incisos i), ii) y iii) del apartado 6 durante los treinta días de almacenamiento obligatorio del esperma y al menos catorce días después de la recogida del esperma, independientemente de que el semental se hayan mantenido o no en el mismo lugar.
▼B
B. OVINOS Y CAPRINOS
1. Sólo podrán destinarse a la recogida de esperma los ovinos y caprinos de los centros, estaciones y explotaciones que, a satisfacción del veterinario oficial:
a) tengan buena salud en el momento de la recogida,
b) cumplan los requisitos establecidos en los artículos 4, 5 y 6 de la Directiva 91/68/CEE relativa a los intercambios intracomunitarios.
Además, se someterá a los animales donantes, con resultado negativo, en el curso de los treinta días anteriores a la recogida, a:
— una prueba para la detección de la brucelosis (brucella melitensis), de conformidad con el Anexo C de la Directiva 91/68/CEE,
— una prueba para la detección de la epididimitis contagiosa del morueco (brucella ovis), de conformidad con el Anexo D de la Directiva 91/68/CEE,
— una prueba de aislamiento del virus de la enfermedad de Border;
c) hayan sido objeto de las pruebas y controles pertinentes encaminados a garantizar el cumplimiento de los requisitos de las letras a) y b) anteriores.
2. Los exámenes contemplados en el punto 1 deberán ser efectuados por un laboratorio autorizado por el Estado miembro.
▼M1
C. Si alguno de los exámenes contemplados en los apartados A y B resultare positivo, el animal deberá aislarse y su esperma, recogido a partir de la fecha del último examen negativo, no podrá ser comercializado. Lo mismo ocurrirá con el esperma de los demás animales que permanezcan en la explotación o la estación de recogida a partir de la fecha en la que el examen haya dado positivo. Sólo podrán reanudarse los intercambios cuando se haya restablecido la situación sanitaria.
CAPÍTULO III
Requisitos aplicables al esperma, los óvulos y los embriones
El esperma, los óvulos y los embriones deberán haberse recogido, transformado y conservado con arreglo a los principios siguientes:
a) el lavado de los óvulos y los embriones, incluso en el caso de los équidos, deberá efectuarse según las condiciones que se establezcan con arreglo al procedimiento previsto en el artículo 26; a la espera de que se adopten tales condiciones, se aplicarán normas internacionales; la zona pelúcida de los óvulos y los embriones deberá permanecer intacta antes y después del lavado; sólo podrán lavarse al mismo tiempo óvulos y embriones de la misma donante; tras el lavado, deberá examinarse la zona pelúcida de cada óvulo y embrión, en toda su superficie, con un aumento de cincuenta veces como mínimo, y certificarse que está intacta y libre de cualquier cuerpo extraño adherente;
b) el medio y las soluciones utilizados para la recogida, transformación (examen, lavado y tratamiento), conservación y congelación de óvulos y embriones deberán esterilizarse con arreglo a métodos autorizados y manipularse de modo que permanezcan estériles; deberán añadirse antibióticos a los medios de recogida, lavado y conservación de óvulos y embriones, y a los diluyentes de esperma; en caso necesario, podrán establecerse normas en virtud del procedimiento previsto en el artículo 26;
c) todo el material utilizado para la recogida, transformación, conservación y congelación de esperma, óvulos y embriones se deberá desinfectar o esterilizar, según convenga, antes de su uso, o deberá ser nuevo y desechable y se eliminará después del mismo;
d) podrán realizarse pruebas adicionales en virtud del procedimiento previsto en el artículo 26, en particular con los líquidos de recogida o de lavado, a fin de determinar que no hay gérmenes patógenos;
e) los óvulos y embriones que se hayan sometido con resultado satisfactorio al examen previsto en la letra a) y el esperma se colocarán en recipientes estériles que serán debidamente identificados, contendrán únicamente productos de un donante, macho o hembra, y se sellarán inmediatamente;
la identificación, que se realizará con arreglo al procedimiento previsto en el artículo 26, deberá permitir que puedan determinarse al menos el país de origen, la fecha de recogida, la especie, la raza, la identidad del animal donante y el nombre o el número del centro o del equipo de recogida;
f) el esperma, los óvulos y los embriones congelados deberán colocarse en recipientes estériles con nitrógeno líquido que no presenten riesgo de contaminación para el producto;
g) el esperma, los óvulos y los embriones congelados deberán almacenarse en condiciones autorizadas durante un período mínimo de treinta días antes de su expedición;
h) el esperma, los óvulos y los embriones deberán transportarse en recipientes que se hayan limpiado, desinfectado o esterilizado, según convenga, antes de su uso, o que sean nuevos, desechables y se eliminen después de usarlos.
CAPÍTULO IV
Hembras donantes
Sólo podrán destinarse a la recogida de embriones u óvulos las hembras que, a satisfacción del veterinario oficial, cumplan los requisitos de las Directivas sobre comercio intracomunitario de animales vivos de reproducción y de producción aplicables a su especie, y procedan de rebaños que también los cumplen.
La Directiva 64/432/CEE del Consejo será aplicable a los animales de la especie porcina; la Directiva 91/68/CEE del Consejo se aplicará a ovinos y caprinos.
Además de los requisitos establecidos en la Directiva 90/426/CEE del Consejo, los équidos deberán haber permanecido, durante los sesenta días anteriores a la recogida de óvulos o embriones, en una explotación en la que no se hayan dado signos clínicos de metritis contagiosa equina. No deberán ser utilizadas para la monta natural durante el período de treinta días precedente a la recogida de óvulos o de embriones.
▼M3
ANEXO E
Parte 1


Parte 2
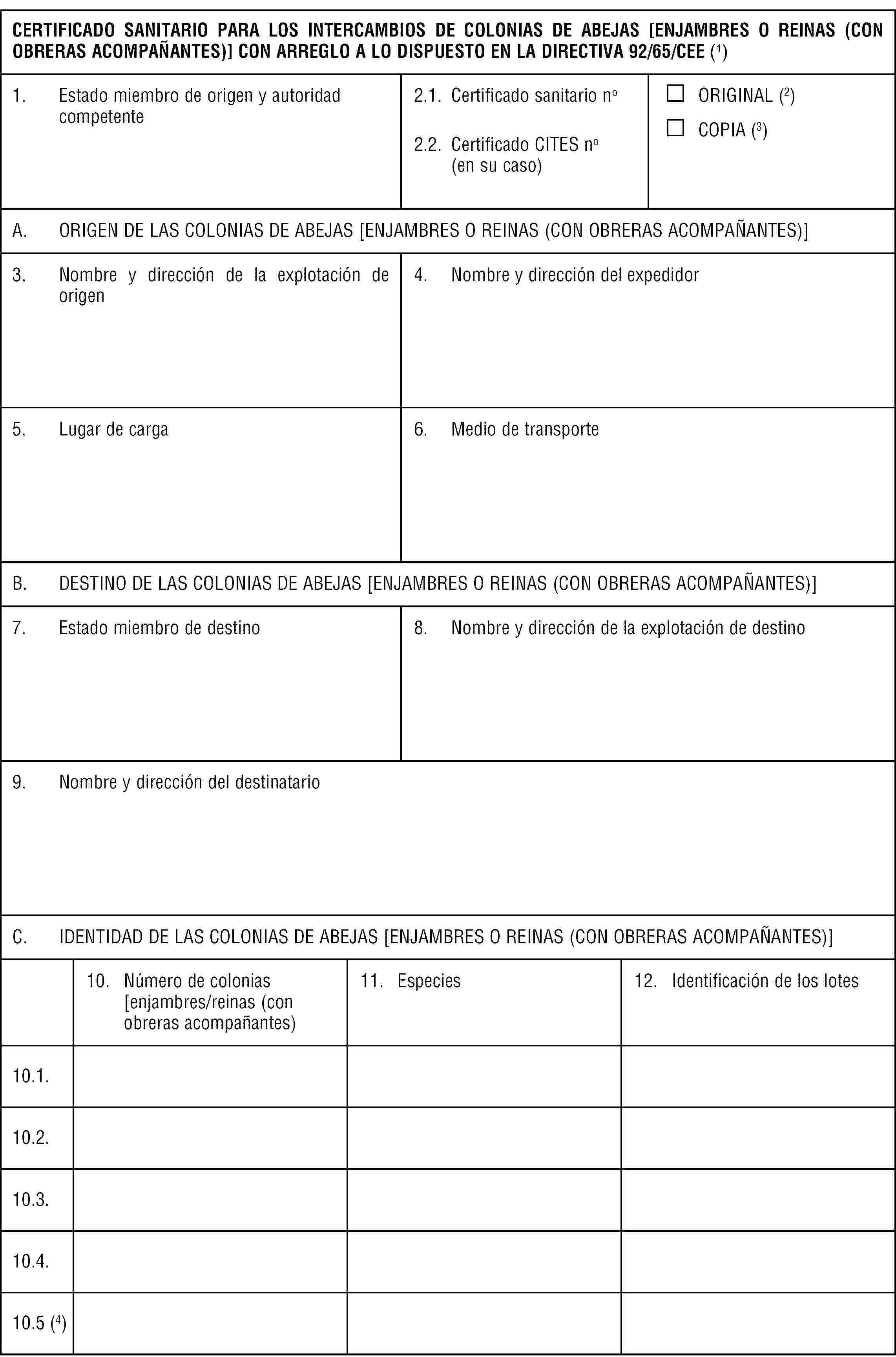

Parte 3


▼M7
ANEXO F
Directiva 64/432/CEE del Consejo, de 26 de junio de 1964, relativa a problemas de policía sanitaria en materia de intercambios intracomunitarios de animales de las especies bovina y porcina.
Directiva 88/407/CEE del Consejo, de 14 de junio de 1988, por la que se fijan las exigencias de policía sanitaria aplicables a los intercambios intracomunitarios y a las importaciones de esperma congelado de animales de la especie bovina.
Directiva 89/556/CEE del Consejo, de 25 de septiembre de 1989, relativa a las condiciones de policía sanitaria aplicables a los intercambios intracomunitarios y a las importaciones procedentes de terceros países de embriones de animales domésticos de la especie bovina.
Directiva 90/426/CEE del Consejo, de 26 de junio de 1990, relativa a las condiciones de policía sanitaria que regulan los movimientos de équidos y las importaciones de équidos procedentes de países terceros.
Directiva 90/429/CEE del Consejo, de 26 de junio de 1990, por la que se fijan las normas de policía sanitaria aplicables a los intercambios intracomunitarios y a las importaciones de esperma de animales de la especie porcina.
Directiva 90/539/CEE del Consejo, de 15 de octubre de 1990, relativa a las condiciones de policía sanitaria que regulan los intercambios intracomunitarios y las importaciones de aves de corral y de huevos para incubar procedentes de países terceros.
Directiva 91/67/CEE del Consejo, de 28 de enero de 1991, relativa a las condiciones de policía sanitaria aplicables a la puesta en el mercado de animales y de productos de la acuicultura.
Directiva 91/68/CEE del Consejo, de 28 de enero de 1991, relativa a las normas de policía sanitaria que regulan los intercambios intracomunitarios de animales de las especies ovina y caprina.
Directiva 2004/68/CE del Consejo, de 26 de abril de 2004, por la que se establecen normas zoosanitarias para la importación y tránsito en la Comunidad de determinados ungulados vivos, se modifican las Directivas 90/426/CEE y 92/65/CEE y se deroga la Directiva 72/462/CEE.






