EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 32010R1152
Commission Regulation (EU) No 1152/2010 of 8 December 2010 amending, for the purpose of its adaptation to technical progress, Regulation (EC) No 440/2008 laying down test methods pursuant to Regulation (EC) No 1907/2006 of the European Parliament and of the Council on the Registration, Evaluation, Authorisation and Restriction of Chemicals (REACH) Text with EEA relevance
Reglamento (UE) n ° 1152/2010 de la Comisión, de 8 de diciembre de 2010 , que modifica, con vistas a su adaptación al progreso técnico, el Reglamento (CE) n ° 440/2008, por el que se establecen métodos de ensayo de acuerdo con el Reglamento (CE) n ° 1907/2006 del Parlamento Europeo y del Consejo relativo al registro, la evaluación, la autorización y la restricción de las sustancias y preparados químicos (REACH) Texto pertinente a efectos del EEE
Reglamento (UE) n ° 1152/2010 de la Comisión, de 8 de diciembre de 2010 , que modifica, con vistas a su adaptación al progreso técnico, el Reglamento (CE) n ° 440/2008, por el que se establecen métodos de ensayo de acuerdo con el Reglamento (CE) n ° 1907/2006 del Parlamento Europeo y del Consejo relativo al registro, la evaluación, la autorización y la restricción de las sustancias y preparados químicos (REACH) Texto pertinente a efectos del EEE
OJ L 324, 9.12.2010, p. 13–38
(BG, ES, CS, DA, DE, ET, EL, EN, FR, IT, LV, LT, HU, MT, NL, PL, PT, RO, SK, SL, FI, SV)
Special edition in Croatian: Chapter 15 Volume 009 P. 246 - 271
 In force
In force
|
9.12.2010 |
ES |
Diario Oficial de la Unión Europea |
L 324/13 |
REGLAMENTO (UE) No 1152/2010 DE LA COMISIÓN
de 8 de diciembre de 2010
que modifica, con vistas a su adaptación al progreso técnico, el Reglamento (CE) no 440/2008, por el que se establecen métodos de ensayo de acuerdo con el Reglamento (CE) no 1907/2006 del Parlamento Europeo y del Consejo relativo al registro, la evaluación, la autorización y la restricción de las sustancias y preparados químicos (REACH)
(Texto pertinente a efectos del EEE)
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Visto el Reglamento (CE) no 1907/2006 del Parlamento Europeo y del Consejo, de 18 de diciembre de 2006, relativo al registro, la evaluación, la autorización y la restricción de las sustancias y preparados químicos (REACH), por el que se crea la Agencia Europea de Sustancias y Preparados Químicos, se modifica la Directiva 1999/45/CE y se derogan el Reglamento (CEE) no 793/93 del Consejo y el Reglamento (CE) no 1488/94 de la Comisión así como la Directiva 76/769/CEE del Consejo y las Directivas 91/155/CEE, 93/67/CEE, 93/105/CE y 2000/21/CE de la Comisión (1), y, en particular, su artículo 13, apartado 3,
Considerando lo siguiente:
|
(1) |
El Reglamento (CE) no 440/2008 de la Comisión (2) incluye los métodos de ensayo para la determinación de las propiedades fisicoquímicas, toxicológicas y ecotoxicológicas de las sustancias, que deben aplicarse a efectos del Reglamento (CE) no 1907/2006. |
|
(2) |
Es necesario actualizar el Reglamento (CE) no 440/2008 para incluir con carácter prioritario dos nuevos métodos de ensayo in vitro de la irritación ocular adoptados recientemente por la OCDE, a fin de reducir el número de animales utilizados en los experimentos, de acuerdo con la Directiva 86/609/CEE del Consejo, de 24 de noviembre de 1986, relativa a la aproximación de las disposiciones legales, reglamentarias y administrativas de los Estados miembros respecto a la protección de los animales utilizados para experimentación y otros fines científicos (3). Se ha consultado a los interesados sobre el presente proyecto. |
|
(3) |
Procede, por tanto, modificar el Reglamento (CE) no 440/2008 en consecuencia. |
|
(4) |
Las medidas previstas en el presente Reglamento se ajustan al dictamen del Comité establecido en virtud del artículo 133 del Reglamento (CE) no 1907/2006. |
HA ADOPTADO EL PRESENTE REGLAMENTO:
Artículo 1
En la parte B del anexo del Reglamento (CE) no 440/2008 se añaden los métodos B. 47 y B. 48 tal como se recogen en el anexo del presente Reglamento.
Artículo 2
El presente Reglamento entrará en vigor el tercer día siguiente al de su publicación en el Diario Oficial de la Unión Europea.
El presente Reglamento será obligatorio en todos sus elementos y directamente aplicable en cada Estado miembro.
Hecho en Bruselas, el 8 de diciembre de 2010.
Por la Comisión
El Presidente
José Manuel BARROSO
(1) DO L 396 de 30.12.2006, p. 1.
(2) DO L 142 de 31.5.2008, p. 1.
(3) DO L 358 de 18.12.1986, p. 1.
ANEXO
«B. 47. MÉTODO DE ENSAYO DE LA OPACIDAD Y PERMEABILIDAD DE LA CÓRNEA DE BOVINO PARA DETECTAR AGENTES CORROSIVOS E IRRITANTES INTENSOS PARA LOS OJOS
INTRODUCCIÓN
|
1. |
El método de ensayo de la opacidad y permeabilidad de la córnea de bovino (Bovine Corneal Opacity and Permeability, BCOP) es un procedimiento in vitro que puede utilizarse, en ciertas circunstancias y con limitaciones específicas, para clasificar sustancias y mezclas como “agentes corrosivos e irritantes intensos para los ojos” (1) (2) (3). A efectos de este método de ensayo, se entiende por “agentes irritantes intensos” aquellos que inducen lesiones oculares que persisten en el conejo durante al menos 21 días tras su administración. Aunque no se considera válido para sustituir completamente al ensayo in vivo en ojo de conejo, se recomienda utilizar el BCOP como parte de una estrategia de ensayo gradual para la clasificación normativa y el etiquetado dentro de un ámbito específico de aplicabilidad (4) (5). Las sustancias y mezclas problema (6) pueden clasificarse como agentes corrosivos o irritantes intensos sin necesidad de efectuar más pruebas con conejos. Las sustancias que den resultado negativo tendrían que someterse a ensayo con conejos siguiendo una estrategia de ensayo secuencial, como se describe en las Directrices de ensayo 405 de la OCDE (7) (método B. 5 del presente anexo). |
|
2. |
El objetivo del presente método de ensayo es describir los procedimientos utilizados para evaluar la posible corrosividad o capacidad de irritación intensa para los ojos de una sustancia problema en función de su capacidad para inducir opacidad y aumento de la permeabilidad en una córnea aislada de bovino. Los efectos tóxicos para la córnea se miden mediante a) el descenso de la transmisión luminosa (opacidad) y b) el aumento del paso del pigmento fluoresceína sódica (permeabilidad). Los resultados de la evaluación de la opacidad y de la permeabilidad de la córnea tras su exposición a la sustancia problema se combinan para obtener una puntuación de la capacidad de irritación in vitro (conocida por sus siglas en inglés, IVIS), que se utiliza para clasificar el nivel de capacidad de irritación de la sustancia problema. |
|
3. |
También se han ensayado utilizando el método de ensayo BCOP agentes irritantes oculares que provocan lesiones que desaparecen en menos de 21 días, así como sustancias no irritantes. Sin embargo, no se han evaluado oficialmente la exactitud ni la fiabilidad del método de ensayo BCOP respecto a las sustancias de estas categorías. |
|
4. |
En el apéndice 1 se dan las definiciones pertinentes. |
CONSIDERACIONES INICIALES Y LIMITACIONES
|
5. |
El presente método de ensayo se basa en el protocolo del método de ensayo BCOP del Comité de Coordinación Interagencias sobre la Validación de Métodos Alternativos estadounidense (Interagency Coordinating Committee on the Validation of Alternative Methods, ICCVAM) (8), elaborado siguiendo un estudio de validación internacional (4) (5) (9), con aportaciones del Centro Europeo para la Validación de Métodos Alternativos (European Centre for the Validation of Alternative Methods, ECVAM) y del Centro Japonés para la Validación de Métodos Alternativos (Japanese Center for the Validation of Alternative Methods, JaCVAM). El protocolo se basa en información obtenida del Protocolo 124 del Institute for In Vitro Sciences (IIVS) e INVITTOX (10), que representa el protocolo utilizado en el estudio de prevalidación del ensayo BCOP, financiado por la Comunidad Europea y realizado en 1997-1998. Ambos protocolos se basan en la metodología del ensayo BCOP comunicada por primera vez por Gautheron et al. (11). |
|
6. |
Las limitaciones que se han detectado en este método de ensayo están relacionadas con la elevada tasa de falsos resultados positivos de alcoholes y cetonas y la elevada tasa de falsos resultados negativos de sólidos, observadas en la base de datos de validación (véase el punto 44) (5). Si se excluyen de la base de datos las sustancias de estas clases químicas y físicas, mejora sustancialmente la exactitud del ensayo BCOP en los sistemas de clasificación de la UE, EPA y SGA (5). Teniendo en cuenta el objeto de este ensayo (es decir, tan solo identificar agentes corrosivos o irritantes intensos para los ojos), no importa que sean elevadas las tasas de falsos resultados negativos, ya que las sustancias correspondientes se someterían posteriormente a ensayo con conejos o a otros ensayos in vitro validados adecuadamente, en función de las exigencias normativas, utilizando una estrategia de ensayo secuencial en un enfoque de ponderación de los datos. Por otra parte, la actual base de datos de validación no permite una evaluación adecuada de algunas clases de sustancias o productos (por ejemplo, mezclas). Sin embargo, los investigadores pueden considerar la posibilidad de utilizar este método de ensayo con todos los tipos de material problema (incluidas las mezclas), con lo cual un resultado positivo podría aceptarse como indicación de una respuesta corrosiva o irritante intensa para los ojos. Sin embargo, los resultados positivos obtenidos con alcoholes o cetonas deben interpretarse con precaución, debido al riesgo de sobrepredicción. |
|
7. |
Todos los procedimientos con ojos de bovino y córneas de bovino deben ajustarse a las normas y procedimientos aplicables de la instalación de ensayo en relación con la manipulación de materiales derivados de animales, entre los que figuran los tejidos o los líquidos intersticiales. Se recomienda observar las precauciones universales de laboratorio (12). |
|
8. |
Una de las limitaciones del método de ensayo consiste en que, a pesar de que tiene en cuenta algunos de los efectos oculares evaluados con el método de ensayo de la capacidad de irritación ocular en el conejo y, hasta cierto punto, su gravedad, no atiende a las lesiones de la conjuntiva ni del iris. Asimismo, aunque la reversibilidad de las lesiones de la córnea no puede evaluarse per se en el ensayo BCOP, se ha propuesto, sobre la base de los estudios en ojo de conejo, que la evaluación de la profundidad inicial de la lesión de la córnea puede utilizarse para distinguir entre efectos reversibles e irreversibles (13). Finalmente, el BCOP no permite la evaluación del potencial de toxicidad sistémica asociado con la exposición ocular. |
|
9. |
Se está trabajando actualmente para seguir caracterizando la utilidad y las limitaciones del ensayo BCOP para detectar los agentes irritantes no intensos y los agentes no irritantes (véase también el punto 45). También se anima a los usuarios a presentar muestras o datos a las organizaciones de validación para una evaluación oficial de posibles usos futuros del método de ensayo BCOP, incluida la detección de agentes irritantes no intensos y agentes no irritantes. |
|
10. |
Cuando algún laboratorio establezca inicialmente este ensayo, deben utilizarse las sustancias para demostrar la aptitud que se indican en el apéndice 2. Los laboratorios pueden utilizar estas sustancias para demostrar su competencia técnica en la realización del método de ensayo BCOP antes de presentar, con fines de clasificación normativa de peligros, los datos obtenidos con este ensayo. |
PRINCIPIO DEL ENSAYO
|
11. |
El método de ensayo BCOP es un modelo organotípico con mantenimiento a corto plazo del funcionamiento fisiológico y bioquímico normal de la córnea de bovino in vitro. En este método de ensayo, la lesión provocada por la sustancia problema se evalúa mediante la medición cuantitativa de los cambios producidos en la opacidad y en la permeabilidad de la córnea, utilizando un opacímetro y un espectrofotómetro de luz visible, respectivamente. Las dos mediciones se combinan para calcular la IVIS, que se utiliza para asignar una categoría de clasificación de peligro por irritación in vitro a fin de predecir el potencial de irritación ocular in vivo de una sustancia problema (véanse los criterios de decisión). |
|
12. |
El método de ensayo BCOP utiliza córneas aisladas de ojos de ganado bovino recién sacrificado. La opacidad de la córnea se mide cuantitativamente como cantidad de luz transmitida a través de la córnea. La permeabilidad se mide cuantitativamente como cantidad del pigmento fluoresceína sódica que atraviesa todo el espesor de la córnea y se detecta así en el medio que se encuentra en la cámara posterior. Las sustancias problema se aplican a la superficie epitelial de la córnea poniéndolas en la cámara anterior del soporte de córnea. En el apéndice 3 se ofrece una descripción y un diagrama de un soporte de córnea utilizado en el BCOP. Los soportes de córnea pueden obtenerse de diferentes fuentes comerciales o bien construirse en el propio laboratorio. |
Fuente y edad de los ojos de bovino y selección de la especie animal
|
13. |
El ganado bovino enviado a los mataderos se sacrifica normalmente para el consumo humano o con otros fines comerciales. Como fuente de córneas para el BCOP se utilizan solo animales sanos que se consideren adecuados para entrar en la cadena alimentaria humana. Debido a que el ganado bovino presenta una amplia variedad de peso, en función de la raza, edad y sexo, no se recomienda ningún peso concreto del animal en el momento del sacrificio. |
|
14. |
Puede variar el tamaño de la córnea cuando se utilizan ojos de animales de distintas edades. Las córneas con un diámetro horizontal > 30,5 mm y un espesor central de la córnea (ECC) ≥ 1 100 μm suelen obtenerse de animales de más de ocho años, mientras que las córneas con un diámetro horizontal < 28,5 mm y un ECC < 900 μm suelen proceder de animales de menos de cinco años (14). Por este motivo, no suelen utilizarse ojos de animales de más de sesenta meses de edad. Tradicionalmente no se utilizan tampoco ojos de animales de menos de doce meses, ya que estos ojos están aún en fase de desarrollo y el espesor y el diámetro de su córnea son considerablemente más pequeños que los observados en ojos de bovinos adultos. Sin embargo, es admisible el uso de córneas de animales jóvenes (es decir, de entre seis y doce meses de edad) porque presentan ciertas ventajas, como una mayor disponibilidad, una variabilidad pequeña en cuanto a la edad, y un peligro reducido en cuanto a la posible exposición de los trabajadores a la encefalopatía espongiforme bovina (15). Como puede ser útil una evaluación más completa del efecto del tamaño o del espesor de la córnea sobre la sensibilidad ante sustancias corrosivas e irritantes, se anima a los usuarios a informar sobre la edad o el peso estimados de los animales de los que proceden las córneas utilizadas en un estudio. |
Recogida y transporte de los ojos al laboratorio
|
15. |
Los ojos son recogidos por los empleados del matadero. Para minimizar las lesiones mecánicas o de otro tipo que pueden sufrir los ojos, estos deben enuclearse lo antes posible tras la muerte. A fin de evitar la exposición de los ojos a sustancias potencialmente irritantes, los empleados del matadero no deben utilizar detergentes cuando laven la cabeza del animal. |
|
16. |
Los ojos deben sumergirse completamente en solución salina equilibrada de Hank (conocida por sus siglas en inglés, HBSS) en un recipiente de tamaño adecuado, y transportarse al laboratorio de manera que se reduzcan al mínimo su deterioro y su contaminación bacteriana. Como los ojos se recogen durante el proceso de sacrificio, pueden estar expuestos a la sangre y a otras sustancias biológicas, además de bacterias y otros microorganismos. Por tanto, es importante garantizar que se reduce al mínimo el riesgo de contaminación (por ejemplo, manteniendo en hielo el recipiente con los ojos o añadiendo antibióticos a la HBSS utilizada para conservar los ojos durante el transporte [por ejemplo, 100 UI/mL de penicilina y 100 g/mL de estreptomicina]). |
|
17. |
Debe reducirse al mínimo el tiempo transcurrido entre la recogida de los ojos y la utilización de las córneas en el BCOP (lo normal es efectuar todo el proceso en un solo día), y hay que demostrar que ese tiempo no altera los resultados del ensayo. Estos resultados se basan en los criterios de selección de los ojos, así como en las respuestas obtenidas con controles positivos y negativos. Todos los ojos utilizados en el ensayo deben proceder del mismo grupo de ojos recogidos un día concreto. |
Criterios de selección de los ojos utilizados en el BCOP
|
18. |
Tras su llegada al laboratorio, los ojos se someten a un atento examen para detectar posibles defectos, como un aumento de la opacidad, arañazos o neovascularización. Solo deben utilizarse las córneas de ojos que no presenten estos defectos. |
|
19. |
La calidad de cada córnea se evalúa también en otras fases posteriores del ensayo. Se deben rechazar las córneas que, tras un periodo inicial de estabilización de una hora, tengan una opacidad de más de siete unidades de opacidad (nota: el opacímetro debe calibrarse con los patrones de opacidad utilizados para establecer las unidades de opacidad; véase el apéndice 3). |
|
20. |
Cada grupo de tratamiento (sustancia problema, controles negativos y positivos simultáneos) consiste en un mínimo de tres ojos. Para el control negativo en el ensayo BCPO deben utilizarse tres córneas. Puesto que todas las córneas se extraen del globo entero y se montan en las cámaras de córnea, existe la posibilidad de que haya artefactos procedentes de la manipulación que influyan en los distintos valores de opacidad y permeabilidad de la córnea (incluido el control negativo). Por otra parte, los valores de opacidad y permeabilidad de las córneas de control negativo se utilizan para corregir los valores de opacidad y permeabilidad de las córneas tratadas con la muestra problema y con los controles positivos a efectos del cálculo de la IVIS. |
PROCEDIMIENTO
Preparación de los ojos
|
21. |
Se disecan córneas libres de defectos, a las que les queda un borde de 2 o 3 mm de esclerótica para facilitar la manipulación posterior, atendiendo a no lesionar el epitelio ni el endotelio de la córnea. Las córneas aisladas se montan en soportes de córnea, diseñados especialmente, que consisten en un compartimento anterior y otro posterior, en contacto respectivamente con el lado epitelial y el lado endotelial de la córnea. Ambas cámaras se llenan hasta rebosar con medio esencial mínimo de Eagle (EMEM) precalentado, empezando por la cámara posterior y evitando la formación de burbujas. El dispositivo se estabiliza después a 32 ± 1 °C durante al menos una hora para que las córneas alcancen un estado de equilibrio con el medio y consigan una actividad metabólica normal, dentro de lo posible (la temperatura aproximada de la superficie de la córnea in vivo es de 32 °C). |
|
22. |
Tras el periodo de estabilización, se añade a ambas cámaras nuevo EMEM precalentado y se toman lecturas de la opacidad de base de cada córnea. Deben desecharse las córneas que muestren lesiones tisulares macroscópicas (por ejemplo, arañazos, pigmentación, neovascularización) o una opacidad de más de siete unidades de opacidad. Se calcula la opacidad media de todas las córneas estabilizadas. Se seleccionan como control negativo (o de disolvente) al menos tres córneas con valores de opacidad próximos al valor medio de todas las córneas. El resto de las córneas se distribuye después en grupos de tratamiento y de control positivo. |
|
23. |
Como la capacidad térmica del agua es superior a la del aire, el agua ofrece condiciones de temperatura más estables para la incubación. Por tanto, se recomienda utilizar un baño de agua para mantener los soportes de córnea y su contenido a 32 ± 1 °C. Sin embargo, también pueden utilizarse incubadoras de aire, si se toman precauciones para mantener la estabilidad de la temperatura (por ejemplo, precalentando los soportes y los medios). |
Aplicación de la sustancia problema
|
24. |
Se utilizan dos protocolos de tratamiento diferentes, uno para líquidos y agentes tensioactivos (sólidos o líquidos) y otro para sólidos que no son agentes tensioactivos. |
|
25. |
Los líquidos se someten a ensayo sin diluir, mientras que los agentes tensioactivos se llevan antes a una concentración del 10 % p/v en solución de cloruro sódico al 0,9 %, agua destilada u otro disolvente del que se haya demostrado que no posee efectos negativos sobre el sistema de ensayo. Los semisólidos, cremas y ceras se someten a ensayo en principio como líquidos. Debe justificarse adecuadamente si se utilizan otras concentraciones de dilución. Las córneas se exponen a los líquidos y agentes tensioactivos durante 10 minutos. La utilización de otros tiempos de exposición exige una explicación científica adecuada. |
|
26. |
Los sólidos que no son agentes tensioactivos se someten a ensayo en principio como soluciones o suspensiones a una concentración del 20 % en solución de cloruro sódico al 0,9 %, agua destilada u otro disolvente del que se haya demostrado que no posee efectos negativos sobre el sistema de ensayo. En ciertas circunstancias y con una justificación científica adecuada, es posible someter a ensayo los sólidos sin diluir mediante aplicación directa sobre la superficie de la córnea, utilizando el método de cámara abierta (véase el punto 29). Las córneas se exponen a los sólidos durante cuatro horas, pero, como sucede con los líquidos y agentes tensioactivos, es posible utilizar otros tiempos de exposición si se cuenta con una explicación científica adecuada. |
|
27. |
Pueden utilizarse distintos métodos de tratamiento, en función de la naturaleza física y de las características químicas de la sustancia problema (por ejemplo, sólidos, líquidos, líquidos viscosos frente a líquidos no viscosos). El factor crítico consiste en velar por que la sustancia problema cubra adecuadamente la superficie epitelial y se elimine adecuadamente durante las fases de lavado. Suele utilizarse un método de cámara cerrada cuando se estudian sustancias problema líquidas desde no viscosas hasta ligeramente viscosas, mientras que se usa en principio un método de cámara abierta con sustancias problema líquidas viscosas y semiviscosas, así como con sólidos sin diluir. |
|
28. |
En el método de cámara cerrada, se introduce en la cámara anterior (a través de los orificios de administración que se encuentran en la superficie superior de la cámara) una cantidad suficiente de sustancia problema (750 μL) para cubrir la cara epitelial de la córnea, y los agujeros se tapan a continuación con los tapones de la cámara durante la exposición. Es importante que cada córnea quede expuesta a una sustancia problema durante el periodo adecuado. |
|
29. |
En el método de cámara abierta, antes del tratamiento se retiran el anillo de cierre de la ventana y la ventana de cristal de la cámara anterior. La sustancia problema o de control (750 μL, o una cantidad suficiente de sustancia problema para cubrir completamente la córnea) se aplica directamente sobre la superficie epitelial de la córnea utilizando una micropipeta. Si una sustancia problema resulta difícil de pipetear, puede introducirse a presión en una pipeta del tipo de desplazamiento positivo para facilitar su aplicación. La punta de pipeta de la pipeta de desplazamiento positivo se inserta en la punta de dispensación de la jeringa, de forma que el material pueda cargarse en la punta de desplazamiento bajo presión. Simultáneamente, se oprime el émbolo de la jeringa mientras se arrastra hacia arriba el pistón de la pipeta. Si aparece alguna burbuja de aire en la punta de la pipeta, se retira (se expulsa) el producto problema y se repite el proceso hasta que la punta se quede llena sin ninguna burbuja de aire. En caso necesario, puede utilizarse una jeringa normal (sin aguja), ya que permite medir un volumen exacto de sustancia problema y facilita su aplicación sobre la superficie epitelial de la córnea. Tras la aplicación de la sustancia, se vuelve a colocar la ventana de cristal de la cámara anterior para crear de nuevo un sistema cerrado. |
Incubación tras la exposición
|
30. |
Tras el periodo de exposición, la sustancia problema, el control negativo o la sustancia de control positivo se retiran de la cámara anterior y se lava el epitelio al menos tres veces (o hasta que no quede ningún rastro visible de la sustancia problema) utilizando EMEM con rojo de fenol. Se utiliza para el lavado el medio con rojo de fenol porque observando el cambio de color de esta sustancia puede determinarse la efectividad del lavado de materias ácidas o alcalinas. Las córneas se lavan más de tres veces si el rojo de fenol sigue sin colorearse (amarillo o púrpura) o sigue viéndose la sustancia problema. Una vez el medio ha quedado libre de sustancia problema, se lavan las córneas una última vez con EMEM sin rojo de fenol. Se utiliza EMEM sin rojo de fenol en el lavado final para eliminar el rojo de fenol de la cámara anterior antes de medir la opacidad. La cámara anterior vuelve a llenarse a continuación con EMEM nuevo sin rojo de fenol. |
|
31. |
En el caso de líquidos o agentes tensioactivos, las córneas, una vez lavadas, se incuban otras dos horas a 32 ± 1 °C. En ciertas circunstancias puede ser útil prolongar este tiempo tras la exposición, extremo que debe estudiarse en cada caso. Las córneas tratadas con sólidos se lavan a fondo al final del periodo de exposición de cuatro horas, pero no es necesario prolongar su incubación. |
|
32. |
Al final del periodo de incubación tras la exposición en el caso de líquidos y agentes tensioactivos y al final del periodo de exposición de cuatro horas en el caso de sólidos que no son agentes tensioactivos, se registran la opacidad y la permeabilidad de cada córnea. Asimismo, se observa visualmente cada córnea y se registran las observaciones pertinentes (por ejemplo, abrasión tisular, sustancia problema residual, opacidad no uniforme). Estas observaciones pueden ser importantes ya que pueden reflejarse en variaciones de las lecturas del opacímetro. |
Sustancias de control
|
33. |
En cada experimento se incluyen controles simultáneos negativos (o del disolvente/vehículo) y positivos. |
|
34. |
Cuando se somete a ensayo una sustancia líquida al 100 %, se incluye en el método de ensayo BCOP un control negativo simultáneo (por ejemplo, solución de cloruro sódico al 0,9 % o agua destilada), de forma que puedan detectarse los eventuales cambios inespecíficos del sistema de ensayo y se disponga de una base de referencia para los parámetros del ensayo. También permite evitar que las condiciones del ensayo provoquen de forma inadecuada una respuesta de irritación. |
|
35. |
Cuando se somete a ensayo una sustancia líquida diluida, un agente tensioactivo o un sólido, se incluye en el método de ensayo BCOP un grupo de control simultáneo del disolvente/vehículo, de forma que puedan detectarse los eventuales cambios inespecíficos del sistema de ensayo y se disponga de una base de referencia para los parámetros del ensayo. Solo pueden utilizarse disolventes/vehículos de los que se haya demostrado que carecen de efectos adversos sobre el sistema de ensayo. |
|
36. |
Se incluye como control positivo simultáneo en cada experimento un agente irritante ocular conocido, a fin de verificar que se provoca una respuesta adecuada. Como en el presente método se utiliza el ensayo BCOP para identificar agentes corrosivos o irritantes intensos, lo mejor es que el control positivo sea una sustancia de referencia que induzca una respuesta intensa con este método de ensayo. Sin embargo, para asegurar la posibilidad de evaluar la variabilidad de las respuestas del control positivo a lo largo del tiempo, no debe ser excesiva la magnitud de la respuesta de irritación. |
|
37. |
Pueden citarse como ejemplos de controles positivos en caso de sustancias problema líquidas la dimetilformamida o el hidróxido sódico al 1 %. Como ejemplo de control positivo en caso de sustancias problema sólidas está el imidazol al 20 % (peso/volumen) en solución de cloruro sódico al 0,9 %. |
|
38. |
Es útil disponer de sustancias de referencia para evaluar el potencial de irritación ocular de sustancias desconocidas dentro de una clase específica de sustancias o productos, o para evaluar la capacidad de irritación relativa de un agente irritante ocular dentro de una gama específica de respuestas de irritación. |
Parámetros medidos
|
39. |
La opacidad se determina mediante la cantidad de luz transmitida a través de la córnea. La opacidad de la córnea se mide cuantitativamente con ayuda de un opacímetro, que permite medir los valores de opacidad en una escala continua. |
|
40. |
La permeabilidad se determina por la cantidad de pigmento fluoresceína sódica que penetra en todas las capas de células de la córnea (es decir, desde el epitelio de la superficie exterior de la córnea hasta el endotelio de su superficie interior). Se añade a la cámara anterior del soporte de córnea 1 mL de solución de fluoresceína sódica (4 o 5 mg/mL cuando se estudian líquidos y agentes tensioactivos o sólidos no tensioactivos, respectivamente), en contacto con el lado epitelial de la córnea, mientras que la cámara posterior, en contacto con el lado endotelial de la córnea, se llena con EMEM nuevo. El soporte se incuba a continuación en posición horizontal durante 90 ± 5 min a 32 ± 1 °C. La cantidad de fluoresceína sódica que atraviesa la córnea hasta la cámara posterior se mide cuantitativamente mediante espectrofotometría UV/VIS. Las mediciones espectrofotométricas evaluadas a 490 nm se registran como valores de absorbancia o densidad óptica (DO490), medidos en una escala continua. Los valores de permeabilidad a la fluoresceína se determinan utilizando los valores de DO490 conseguidos mediante un espectrofotómetro de luz visible con un camino óptico normal de 1 cm. |
|
41. |
También puede utilizarse un lector de placa de microvaloración de 96 pocillos siempre que: a) pueda establecerse la banda de linealidad del lector de placas para determinar los valores de DO490 de fluoresceína; y b) se utilice el volumen correcto de muestras de fluoresceína en la placa de 96 pocillos para obtener unos valores de DO490 equivalentes a los conseguidos con un camino óptico normal de 1 cm (esto puede exigir que los pocillos estén completamente llenos [generalmente, 360 μL]). |
DATOS E INFORME
Evaluación de los datos
|
42. |
Una vez corregidos los valores de opacidad y de permeabilidad media (DO490) para tener en cuenta los valores de opacidad de fondo y de permeabilidad (DO490) del control negativo, los valores medios de opacidad y permeabilidad (DO490) se combinan en una fórmula empírica para calcular la puntuación de la capacidad de irritación in vitro (IVIS) de cada grupo de tratamiento, de la manera siguiente: IVIS = valor medio de opacidad + (15 × valor medio de permeabilidad [DO490]) Sina et al. (16) comunican que esta fórmula se ha obtenido mediante estudios internos e interlaboratorios. Los datos obtenidos con una serie de 36 compuestos en un estudio interlaboratorios se sometieron a análisis con múltiples variables para determinar la ecuación que se ajustara mejor a los datos in vivo e in vitro. Este análisis fue efectuado por científicos de dos empresas diferentes, que propusieron ecuaciones casi idénticas. |
|
43. |
Los valores de opacidad y permeabilidad deben evaluarse también independientemente para determinar si una sustancia problema ha inducido corrosividad o irritación intensa mediante solo uno de los dos parámetros (véase la parte siguiente, sobre criterios de decisión). |
Criterios de decisión
|
44. |
Las sustancias que induzcan una IVIS ≥ 55,1 se definen como corrosivas o irritantes intensas. Como se indica en el punto 1, si la sustancia problema no se identifica como corrosiva o irritante intensa para los ojos, deben realizarse otras pruebas con fines de clasificación y etiquetado. El método de ensayo BCOP tiene una exactitud general del 79 % (113/143) al 81 % (119/147), una tasa de falsos positivos del 19 % (20/103) al 21 % (22/103), y una tasa de falsos negativos del 16 % (7/43) al 25 % (10/40), en relación con los datos obtenidos mediante el método de ensayo de ojos de conejo in vivo, clasificados según los sistemas de clasificación de la EPA (1), UE (2), o SGA (3). Si se excluyen de la base de datos las sustancias de ciertas clases químicas (es decir, alcoholes y cetonas) o físicas (es decir, sólidos), la exactitud del método BCOP en el conjunto de los sistemas de clasificación de la UE, EPA y SGA varía del 87 % (72/83) al 92 % (78/85), las tasas de falsos positivos van del 12 % (7/58) al 16 % (9/56), y las tasas de falsos negativos van del 0 % (0/27) al 12 % (3/26). |
|
45. |
Incluso aunque una sustancia problema no se clasifique como corrosiva o irritante intensa para los ojos, los datos del BCOP pueden ser útiles, junto con los datos del ensayo in vivo con ojos de conejo o de otro ensayo in vitro validado adecuadamente, para seguir evaluando la utilidad y las limitaciones del método de ensayo BCOP a efectos de la detección de agentes irritantes no intensos y agentes no irritantes (se está elaborando un documento de orientación sobre el uso de métodos de ensayo in vitro de la toxicidad ocular). |
Criterios de aceptación del estudio
|
46. |
Se considera que un ensayo es aceptable si el control positivo da una IVIS comprendida en el intervalo de dos desviaciones típicas respecto a la media histórica del momento, que debe actualizarse al menos cada tres meses, o cada vez que se efectúe un ensayo aceptable en caso de laboratorios en los que no sea frecuente efectuar estos ensayos (es decir, con una frecuencia que no llegue a mensual). Las respuestas de los controles negativos o del disolvente/vehículo deben llevar a unos valores de opacidad y permeabilidad inferiores a los límites superiores establecidos para los valores de opacidad y permeabilidad de fondo de las córneas de bovino tratadas con el respectivo control negativo o del disolvente/vehículo. |
Informe del ensayo
|
47. |
El informe del ensayo debe incluir la siguiente información, en caso de que corresponda a la realización del estudio: Sustancias problema y de control
Información referente al promotor y al laboratorio
Justificación del método de ensayo y del protocolo utilizados Integridad del método de ensayo Procedimiento utilizado para garantizar la integridad (es decir, la exactitud y la fiabilidad) del método de ensayo a lo largo del tiempo (por ejemplo, ensayo periódico de sustancias utilizadas para demostrar la aptitud, utilización de datos anteriores de controles negativos y positivos). Criterios de aceptabilidad del ensayo
Condiciones del ensayo
Resultados
Discusión de los resultados Conclusión |
BIBLIOGRAFÍA
|
(1) |
U.S. EPA (1996). Label Review Manual: 2nd Edition. EPA737-B-96-001. Washington, DC: U.S. Environmental Protection Agency. |
|
(2) |
Reglamento (CE) no 1272/2008 del Parlamento Europeo y del Consejo, de 16 de diciembre de 2008, sobre clasificación, etiquetado y envasado de sustancias y mezclas, y por el que se modifican y derogan las Directivas 67/548/CEE y 1999/45/CE y se modifica el Reglamento (CE) no 1907/2006. DO L 353 de 31.12.2008, p. 1. |
|
(3) |
Naciones Unidas (2007). Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos (SGA), segunda edición revisada, Naciones Unidas, Nueva York y Ginebra, 2007. Disponible en la dirección: [http://www.unece.org/trans/danger/publi/ghs/ghs_rev02/02files_s.html] |
|
(4) |
ESAC (2007). Statement on the conclusion of the ICCVAM retrospective study on organotypic in vitro assays as screening tests to identify potential ocular corrosives and severe eye irritants. Disponible en la dirección: [http://ecvam.jrc.it/index.htm] |
|
(5) |
ICCVAM (2007). Test Method Evaluation Report - In Vitro Ocular Toxicity Test Methods for Identifying Ocular Severe Irritants and Corrosives. Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program (NTP) Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM). NIH Publication No.: 07-4517. Disponible en la dirección: [http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_tmer.htm] |
|
(6) |
Reglamento (CE) no 1907/2006 del Parlamento Europeo y del Consejo, de 18 de diciembre de 2006, relativo al registro, la evaluación, la autorización y la restricción de las sustancias y preparados químicos (REACH), por el que se crea la Agencia Europea de Sustancias y Preparados Químicos, se modifica la Directiva 1999/45/CE y se derogan el Reglamento (CEE) no 793/93 del Consejo y el Reglamento (CE) no 1488/94 de la Comisión, así como la Directiva 76/769/CEE del Consejo y las Directivas 91/155/CEE, 93/67/CEE, 93/105/CE y 2000/21/CE de la Comisión. DO L 396 de 30.12.2006, p. 1. |
|
(7) |
OCDE (2002). Directrices de ensayo TG 405. OECD Guidelines for Testing of Chemicals. Acute eye irritation/corrosion. Disponible en la dirección: [http://www.oecd.org/document/40/0,2340,en_2649_34377_37051368_1_1_1_1,00.html] |
|
(8) |
ICCVAM (2007). ICCVAM Recommended BCOP Test Method Protocol. In: ICCVAM Test Method Evaluation Report - In Vitro Ocular Toxicity Test Methods for Identifying Ocular Severe Irritants and Corrosives. Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program (NTP) Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM). NIH Publication No.: 07-4517. Disponible en la dirección: [http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_tmer.htm] |
|
(9) |
ICCVAM. (2006). Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Bovine Corneal Opacity and Permeability Test Method. NIH Publication No.: 06-4512. Research Triangle Park: National Toxicology Program. Disponible en la dirección: [http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_ice.htm] |
|
(10) |
INVITTOX (1999). Protocol 124: Bovine Corneal Opacity and Permeability Assay – SOP of Microbiological Associates Ltd. Ispra, Italia: European Centre for the Validation of Alternative Methods (ECVAM). |
|
(11) |
Gautheron, P., Dukic, M., Alix, D. and Sina, J.F. (1992). Bovine corneal opacity and permeability test: An in vitro assay of ocular irritancy. Fundam. Appl. Toxicol. 18:442-449. |
|
(12) |
Siegel, J.D., Rhinehart, E., Jackson, M., Chiarello, L., and the Healthcare Infection Control Practices Advisory Committee (2007). Guideline for Isolation Precautions: Preventing Transmission of Infectious Agents in Healthcare Settings. Disponible en la dirección: [http://www.cdc.gov/ncidod/dhqp/pdf]. |
|
(13) |
Maurer, J.K., Parker, R.D. and Jester, J.V. (2002). Extent of corneal injury as the mechanistic basis for ocular irritation: key findings and recommendations for the development of alternative assays. Reg. Tox. Pharmacol. 36:106-117. |
|
(14) |
Doughty, M.J., Petrou, S. and Macmillan, H. (1995). Anatomy and morphology of the cornea of bovine eyes from a slaughterhouse. Can. J. Zool. 73:2159-2165. |
|
(15) |
Collee, J. and Bradley, R. (1997). BSE: A decade on - Part I. The Lancet 349: 636-641. |
|
(16) |
Sina, J.F., Galer, D.M., Sussman, R.S., Gautheron, P.D., Sargent, E.V., Leong, B., Shah, P.V., Curren, R.D., and Miller, K. (1995). A collaborative evaluation of seven alternatives to the Draize eye irritation test using pharmaceutical intermediates. Fundam Appl Toxicol 26:20-31. |
|
(17) |
ICCVAM (2006). Background review document, Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Bovine Corneal Opacity and Permeability (BCOP) Test Method. Disponible en la dirección: [http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_bcop.htm] |
|
(18) |
ICCVAM (2006). Background review document, Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Isolated Chicken Eye (ICE) Test Method. Disponible en la dirección: [http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_bcop.htm] |
Apéndice 1
DEFINICIONES
Exactitud: Grado de concordancia entre los resultados obtenidos con el método de ensayo y los valores de referencia aceptados. Se trata de una medida del comportamiento del método de ensayo y es un aspecto de su «pertinencia». Este término y el de «concordancia» se suelen usar indistintamente para indicar la proporción de resultados correctos de un método de ensayo.
Sustancias de referencia: Sustancias utilizadas como patrón para comparar con una sustancia problema. Las sustancias de referencia deben presentar las siguientes propiedades: a) una fuente coherente y fiable; b) similitud estructural y funcional con la clase de las sustancias problema; c) características físicas y químicas conocidas; d) datos de apoyo sobre los efectos conocidos, y e) potencia conocida en la banda de la respuesta deseada.
Córnea: Parte transparente delantera del globo ocular que cubre el iris y la pupila y permite el paso de la luz al interior.
Opacidad de la córnea: Medición del grado de opacidad de la córnea tras su exposición a una sustancia problema. Un aumento de la opacidad de la córnea indica que esta ha sufrido una lesión. La opacidad puede evaluarse subjetivamente, como se hace en el ensayo con ojo de conejo de Draize, u objetivamente con un instrumento como un «opacímetro».
Permeabilidad de la córnea: Medición cuantitativa de la lesión del epitelio corneal mediante determinación de la cantidad del pigmento fluoresceína sódica que pasa a través de todas las capas de células corneales.
Categoría 1 de la EPA: Corrosión (destrucción irreversible del tejido ocular) o afectación o irritación de la córnea, persistente durante más de 21 días (1).
Categoría R41 de la UE: Producción de una lesión de los tejidos oculares o un deterioro físico importante de la visión, como consecuencia de la aplicación de una sustancia problema a la superficie anterior del ojo, y que no es totalmente reversible en los 21 días siguientes a la aplicación (2).
Tasa de falsos negativos: Proporción de todas las sustancias positivas identificadas erróneamente como negativas por un método de ensayo. Es uno de los indicadores del comportamiento del método de ensayo.
Tasa de falsos positivos: Proporción de todas las sustancias negativas identificadas erróneamente como positivas por un método de ensayo. Es uno de los indicadores del comportamiento del método de ensayo.
SGA (Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos): Sistema que propone la clasificación de sustancias químicas y sus mezclas según tipos y niveles normalizados de peligros físicos, sanitarios y ambientales, y que hace referencia a los elementos correspondientes de comunicación, como pictogramas, palabras de advertencia, indicaciones de peligro, consejos de prudencia, y fichas de datos de seguridad, a efectos de proporcionar información sobre sus efectos adversos con el fin de proteger a la población (incluidos empresarios, trabajadores, transportistas, consumidores y personal de respuesta a emergencias) y al medio ambiente (3).
Categoría 1 del SGA: Producción de una lesión de los tejidos oculares o una degradación física severa de la vista, como consecuencia de la aplicación de una sustancia problema en la superficie anterior del ojo, y que no es totalmente reversible en los 21 días siguientes a la aplicación (3).
Peligro: Propiedad inherente de un agente o situación que tiene capacidad para provocar efectos adversos cuando un organismo, sistema o (sub)población se expone a dicho agente.
Puntuación de la capacidad de irritación in vitro (In Vitro Irritancy Score, IVIS): Fórmula empírica utilizada en el ensayo BCOP mediante la cual se combinan en una sola puntuación in vitro los valores medios de opacidad y de permeabilidad de cada grupo de tratamiento. IVIS = valor medio de opacidad + (15 x valor medio de permeabilidad).
Control negativo: Muestra paralela no tratada que contiene todos los componentes de un sistema de ensayo. Esta muestra se somete al mismo proceso que las muestras tratadas con sustancia problema y otras muestras de control para determinar si el disolvente interactúa con el sistema de ensayo.
Sustancias no irritantes: Sustancias no clasificadas como irritantes oculares en las categorías I, II, o III de la EPA, en la categoría R41 o R36 de la UE, ni en las categorías 1, 2A o 2B del SGA.
Sustancias corrosivas oculares: a) Sustancias que provocan una lesión irreversible de los tejidos oculares; b) sustancias clasificadas como irritantes oculares de la categoría 1 del SGA, categoría I de la EPA, o categoría R41 de la UE (1) (2) (3).
Sustancias irritantes oculares: a) Sustancias que producen un cambio reversible en el ojo como consecuencia de su aplicación a la superficie anterior de este; b) sustancias clasificadas como irritantes oculares de la categoría II o III de la EPA, categoría R36 de la UE, o en las categorías 2A o 2B del SGA (1) (2) (3).
Sustancias irritantes intensas oculares: a) Sustancias que provocan lesiones de los tejidos oculares como consecuencia de su aplicación a la superficie anterior del ojo, y que no se resuelven en los 21 días siguientes a la aplicación, o una degradación física severa de la visión; b) sustancias clasificadas como irritantes oculares de la categoría 1 del SGA, categoría I de la EPA, o categoría R41 de la UE (1) (2) (3).
Opacímetro: Instrumento utilizado para medir la opacidad de la córnea evaluando cuantitativamente la transmisión de la luz a través de esta. El instrumento clásico tiene dos compartimentos, cada uno provisto de su propia fuente de luz y una célula fotoeléctrica. Un compartimento se utiliza para la córnea tratada, y el otro para calibrar y poner a cero el instrumento. Se envía la luz de una lámpara halógena a una célula fotoeléctrica a través de un compartimento de control (cámara vacía sin ventanas ni líquido) y se compara con la luz enviada a una célula fotoeléctrica a través del compartimento experimental, que alberga a la cámara que contiene la córnea. Se compara la diferencia en la transmisión luminosa a partir de las células fotoeléctricas y se presenta un valor numérico de opacidad en un indicador digital.
Control positivo: Muestra paralela que contiene todos los componentes de un sistema de ensayo y que se trata con una sustancia de la que se sabe que induce una respuesta positiva. Para asegurar la posibilidad de evaluar la variabilidad de las respuestas del control positivo a lo largo del tiempo, no debe ser excesiva la intensidad de la respuesta.
Fiabilidad: Medida del grado en que un método de ensayo puede aplicarse de forma reproducible a lo largo del tiempo, en un mismo laboratorio o en distintos laboratorios, utilizando el mismo protocolo. Se evalúa calculando la reproducibilidad intra e interlaboratorios y la repetibilidad intralaboratorios.
Control del disolvente/vehículo: Muestra no tratada que contiene todos los componentes de un sistema de ensayo, incluido el disolvente o vehículo, y que se somete al mismo proceso que las muestras tratadas con sustancia problema y otras muestras de control, a fin de determinar la respuesta de base correspondiente a las muestras tratadas con la sustancia problema disuelta en el mismo disolvente o vehículo. Cuando se somete a ensayo con un control negativo simultáneo, esta muestra pone de manifiesto también si el disolvente o vehículo interactúa con el sistema de ensayo.
Ensayo gradual: Estrategia de ensayo por fases, en la que se revisa toda la información existente sobre una sustancia problema, siguiendo un orden especificado, en un proceso de ponderación de los datos en cada fase, a fin de determinar si se dispone de información suficiente para tomar una decisión sobre la clasificación de un peligro, antes de pasar a la fase siguiente. Si puede establecerse la capacidad de irritación de una sustancia problema con la información disponible, no hace falta efectuar más ensayos. Si no puede establecerse la capacidad de irritación de una sustancia problema con la información disponible, se aplica un procedimiento secuencial de ensayos con animales por fases hasta que pueda efectuarse una clasificación inequívoca.
Método de ensayo validado: Método de ensayo sobre el cual se han completado estudios de validación para determinar su pertinencia (incluida su exactitud) y su fiabilidad con un fin específico. Es importante señalar que un método de ensayo validado puede tener un comportamiento insuficiente en términos de exactitud y fiabilidad como para considerarse aceptable a efectos del fin propuesto.
Ponderación de los datos: Proceso de consideración de los aspectos favorables y desfavorables de los distintos elementos de información a efectos de alcanzar y confirmar una conclusión en cuanto al peligro potencial de una sustancia.
Apéndice 2
Sustancias utilizadas para demostrar la aptitud del método de ensayo BCOP
Antes de proceder al uso sistemático de un método de ensayo que se ajuste al presente método de ensayo, es posible que los laboratorios deseen demostrar su aptitud técnica, identificando correctamente la clasificación de las diez sustancias recomendadas del cuadro 1 en cuanto a su corrosividad ocular. Estas sustancias se han seleccionado para representar la gama de respuestas de irritación/corrosión ocular local, sobre la base de los resultados conseguidos en el ensayo con ojo de conejo in vivo (TG 405) (es decir, categorías 1, 2A, 2B o no clasificada ni etiquetada según el SGA de la ONU (3) (7). Sin embargo, considerando la utilidad validada de estos ensayos (es decir, identificar solamente sustancias corrosivas/irritantes intensas oculares), solo hay dos resultados del ensayo a efectos de clasificación (sustancia corrosiva / irritante intensa o sustancia no corrosiva / no irritante intensa) para demostrar la aptitud del método. Otros criterios de selección son que las sustancias se encuentren en el mercado, que se disponga de datos de referencia in vivo de calidad, y que haya datos de calidad procedentes de los dos métodos in vitro para los que se están elaborando directrices de ensayo. Por este motivo, se han seleccionado sustancias irritantes de la lista recomendada por el ICCVAM de 122 sustancias de referencia para la validación de métodos de ensayo de la toxicidad ocular in vitro (véase el apéndice H: Sustancias de referencia recomendadas por el ICCVAM) (5). Se encuentran datos de referencia en los documentos de revisión de fondo del ICCVAM para el método de ensayo BCOP y para el de ojo de pollo aislado (ICE) (17) (18).
Cuadro 1
Sustancias recomendadas para demostrar la aptitud técnica con el BCOP
|
Sustancia |
No CAS |
Clase química (1) |
Estado físico |
Clasificación in vivo (2) |
Clasificación in vitro (3) |
|
Cloruro de benzalconio (5 %) |
8001-54-5 |
Compuesto onio |
Líquido |
Categoría 1 |
Corrosivo/irritante intenso |
|
Clorhexidina |
55-56-1 |
Amina, amidina |
Sólido |
Categoría 1 |
Corrosivo/irritante intenso |
|
Ácido dibenzoil-L-tartárico |
2743-38-6 |
Ácido carboxílico, éster |
Sólido |
Categoría 1 |
Corrosivo/irritante intenso |
|
Imidazol |
288-32-4 |
Heterociclo |
Sólido |
Categoría 1 |
Corrosivo/irritante intenso |
|
Ácido tricloroacético (30 %) |
76-03-9 |
Ácido carboxílico |
Líquido |
Categoría 1 |
Corrosivo/irritante intenso |
|
Cloruro de 2,6-diclorobenzoílo |
4659-45-4 |
Haluro de acilo |
Líquido |
Categoría 2A |
No corrosivo/no irritante intenso |
|
2-Metil-acetoacetato de etilo |
609-14-3 |
Cetona, éster |
Líquido |
Categoría 2B |
No corrosivo/no irritante intenso |
|
Nitrato de amonio |
6484-52-2 |
Sal inorgánica |
Sólido |
Categoría 2A |
No corrosivo/no irritante intenso |
|
Glicerol |
56-81-5 |
Alcohol |
Líquido |
No etiquetado |
No corrosivo/no irritante intenso |
|
n-Hexano |
110-54-3 |
Hidrocarburo (acíclico) |
Líquido |
No etiquetado |
No corrosivo/no irritante intenso |
|
Abreviaturas: No CAS: número de registro del Chemical Abstracts Service |
|||||
Apéndice 3
SOPORTE DE CÓRNEA PARA EL MÉTODO BCOP
|
1. |
Los soportes de córnea para el método BCOP se hacen de material inerte, como polipropileno. Los soportes están formados por dos mitades (una cámara anterior y una cámara posterior), y tienen dos cámaras internas cilíndricas similares. Cada cámara alberga un volumen de 5 mL y termina en una ventana de cristal, a través de la cual se efectúan las mediciones de la opacidad. Cada cámara interna tiene unas dimensiones de 1,7 cm de diámetro y 2,2 cm de profundidad (4). Para evitar fugas se utiliza una junta tórica situada en la cámara posterior. Las córneas se colocan, con el lado endotelial hacia abajo, sobre la junta tórica de las cámaras posteriores, y las cámaras anteriores se colocan sobre el lado epitelial de las córneas. Las cámaras se mantienen en su posición mediante tres tornillos inoxidables situados en los bordes externos de la cámara. El extremo de cada cámara tiene una ventana de cristal que puede retirarse para facilitar el acceso a la córnea. Para evitar fugas, se pone también una junta tórica entre la ventana de cristal y la cámara. En la parte superior de cada cámara hay dos agujeros que permiten introducir y retirar el medio y las sustancias problema. Se cierran con tapones de goma durante los periodos de tratamiento y de incubación.
|
OPACÍMETRO
|
2. |
El opacímetro es un dispositivo que mide la transmisión luminosa. Se envía a una célula fotoeléctrica la luz de una lámpara halógena a través de un compartimento de control (cámara vacía sin ventanas ni líquido) y se compara con la luz enviada a una célula fotoeléctrica a través del compartimento experimental, que alberga la cámara que contiene la córnea. Se compara la diferencia en la transmisión luminosa a partir de las células fotoeléctricas y se presenta un valor numérico de opacidad en un indicador digital. Se determina el número de unidades de opacidad. |
|
3. |
Las respuestas del opacímetro deben ser lineales a lo largo de una gama de lecturas de opacidad que incluya los valores de corte utilizados para las diferentes clasificaciones descritas por el modelo de predicción (es decir, hasta el valor de corte que determina la corrosividad / capacidad de irritación intensa). Para garantizar que las lecturas son lineales y exactas hasta la zona de 75-80 unidades de opacidad, es necesario calibrar el opacímetro utilizando una serie de calibradores. Estos (que son unas hojas opacas de poliéster) se introducen en la cámara de calibración (cámara para córneas diseñada para contener los calibradores) y se toman las lecturas en el opacímetro. La cámara de calibración está designada para mantener los calibradores a la misma distancia aproximadamente entre la luz y la célula fotoeléctrica a la que se colocarían las córneas durante las mediciones de la opacidad. El opacímetro se calibra en primer lugar a cero unidades de opacidad utilizando la cámara de calibración sin ningún calibrador. A continuación se ponen en esta cámara tres calibradores diferentes, uno a uno, y se miden las opacidades correspondientes. A los calibradores 1, 2 y 3 deben corresponderles unas lecturas de opacidad iguales a sus valores establecidos de 75, 150, y 225 unidades de opacidad, respectivamente, ± 5 %. |
B. 48. MÉTODO DE ENSAYO DE OJO DE POLLO AISLADO PARA DETECTAR AGENTES CORROSIVOS E IRRITANTES INTENSOS PARA LOS OJOS
INTRODUCCIÓN
|
1. |
El método de ensayo de ojo de pollo aislado (Isolated Chicken Eye, ICE) es un procedimiento in vitro que puede utilizarse, en ciertas circunstancias y con limitaciones específicas, para clasificar sustancias y mezclas como agentes corrosivos e irritantes intensos para los ojos (1) (2) (3). A efectos de este método de ensayo, se entiende por “agentes irritantes intensos” aquellos que inducen lesiones oculares que persisten en el conejo durante al menos 21 días tras su administración. Aunque no se considera válido para sustituir completamente al ensayo in vivo en ojo de conejo, se recomienda utilizar el ICE como parte de una estrategia de ensayo gradual para la clasificación normativa y el etiquetado dentro de un ámbito específico de aplicabilidad (4) (5). Las sustancias y mezclas problema (6) que den resultado positivo en este ensayo pueden clasificarse como agentes corrosivos o irritantes intensos sin necesidad de efectuar más pruebas con conejos. Las sustancias que den resultado negativo tendrían que someterse a ensayo con conejos siguiendo una estrategia de ensayo secuencial, como se describe en las Directrices de ensayo 405 de la OCDE (7) (método B.5 del presente anexo). |
|
2. |
El objetivo del presente método de ensayo es describir los procedimientos utilizados para evaluar la posible corrosividad o capacidad de irritación intensa para los ojos de una sustancia problema en función de su capacidad para causar toxicidad en un ojo enucleado de pollo. Los efectos tóxicos sobre la córnea se miden mediante a) una evaluación cualitativa de la opacidad, b) una evaluación cualitativa de las lesiones provocadas al epitelio sobre la base de una aplicación de fluoresceína en el ojo (retención de fluoresceína), c) una medición cuantitativa del aumento del espesor (inflamación), y d) una evaluación cualitativa de las lesiones morfológicas macroscópicas de la superficie. Las evaluaciones de la opacidad, la inflamación y las lesiones de la córnea tras la exposición de esta a una sustancia problema se efectúan por separado y después se combinan para llegar a una clasificación de la capacidad de irritación ocular. |
|
3. |
También se han ensayado utilizando el método ICE agentes irritantes oculares que provocan lesiones que desaparecen en menos de 21 días, así como agentes no irritantes. Sin embargo, no se han evaluado oficialmente la exactitud ni la fiabilidad del método de ensayo ICE respecto a las sustancias de estas categorías. |
|
4. |
En el apéndice 1 se dan las definiciones pertinentes. |
CONSIDERACIONES INICIALES Y LIMITACIONES
|
5. |
El presente método de ensayo se basa en el protocolo del método de ensayo ICE del Comité de Coordinación Interagencias sobre la Validación de Métodos Alternativos estadounidense (Interagency Coordinating Committee on the Validation of Alternative Methods, ICCVAM) (8), elaborado siguiendo un estudio de validación internacional (4) (5) (9), con aportaciones del Centro Europeo para la Validación de Métodos Alternativos (European Centre for the Validation of Alternative Methods, ECVAM), del Centro Japonés para la Validación de Métodos Alternativos (Japanese Center for the Validation of Alternative Methods, JaCVAM), y del Departamento de Toxicología y Farmacología Aplicada de Calidad de la Vida de TNO de los Países Bajos (TNO Quality of Life Department of Toxicology and Applied Pharmacology). El protocolo se basa en la información obtenida a partir de protocolos publicados, así como del protocolo actualmente utilizado por TNO (10) (11) (12) (13) (14). |
|
6. |
Las limitaciones que se han detectado en este método están relacionadas con la tasa de falsos resultados positivos de alcoholes y con las tasas de falsos resultados negativos de sólidos y sustancias tensioactivas (véase el punto 47) (4). Si se excluyen de la base de datos las sustancias de estas clases químicas y físicas, mejora sustancialmente la exactitud del ensayo ICE en los sistemas de clasificación de la UE, EPA y SGA (4). Teniendo en cuenta el objeto de este ensayo (es decir, tan solo identificar agentes corrosivos o irritantes intensos para los ojos), no importa que sean elevadas las tasas de falsos resultados negativos, ya que las sustancias correspondientes se someterían posteriormente a ensayo con conejos o a otros ensayos in vitro validados adecuadamente, en función de las exigencias normativas, utilizando una estrategia de ensayo secuencial en un enfoque de ponderación de los datos. Por otra parte, la actual base de datos de validación no permite una evaluación adecuada de algunas clases de sustancias o productos (por ejemplo, mezclas). Sin embargo, los investigadores pueden considerar la posibilidad de utilizar este método de ensayo para estudiar todos los tipos de material (incluidas las mezclas), con lo cual un resultado positivo podría aceptarse como indicación de una respuesta corrosiva o irritante intensa para los ojos. Sin embargo, los resultados positivos obtenidos con alcoholes deben interpretarse con precaución, debido al riesgo de sobrepredicción. |
|
7. |
Todos los procedimientos con ojos de pollo deben ajustarse a las normas y procedimientos aplicables de la instalación de ensayo en relación con la manipulación de materiales derivados del hombre o de animales, entre los que figuran los tejidos o los líquidos intersticiales. Se recomienda observar las precauciones universales de laboratorio (15). |
|
8. |
Una de las limitaciones del método de ensayo consiste en que, a pesar de que tiene en cuenta algunos de los efectos oculares evaluados con el método de ensayo de la capacidad de irritación ocular en el conejo y, hasta cierto punto, su gravedad, no atiende a las lesiones de la conjuntiva ni del iris. Asimismo, aunque la reversibilidad de las lesiones de la córnea no puede evaluarse per se en el ensayo ICE, se ha propuesto, sobre la base de los estudios en ojo de conejo, que la evaluación de la profundidad inicial de la lesión de la córnea puede utilizarse para distinguir entre efectos reversibles e irreversibles (16). Finalmente, el método de ensayo ICE no permite la evaluación del potencial de toxicidad sistémica asociado con la exposición ocular. |
|
9. |
Se está trabajando actualmente para seguir caracterizando la utilidad y las limitaciones del método de ensayo ICE para detectar los agentes irritantes no intensos y los agentes no irritantes (véase también el punto 48). También se anima a los usuarios a presentar muestras o datos a las organizaciones de validación para una evaluación oficial de posibles usos futuros del método de ensayo ICE, incluida la detección de agentes irritantes no intensos y agentes no irritantes. |
|
10. |
Cuando algún laboratorio establezca inicialmente este ensayo, deben utilizarse las sustancias para demostrar la aptitud que se indican en el apéndice 2. Los laboratorios pueden utilizar estas sustancias para demostrar su competencia técnica en la realización del método de ensayo ICE antes de presentar, con fines de clasificación normativa de peligros, los datos obtenidos con este ensayo. |
PRINCIPIO DEL ENSAYO
|
11. |
El método de ensayo ICE es un modelo organotípico con mantenimiento a corto plazo del ojo de pollo in vitro. En este método de ensayo, las lesiones provocadas por la sustancia problema se evalúan determinando la inflamación, la opacidad y la retención de fluoresceína en la córnea. Mientras que los dos últimos parámetros implican una evaluación cualitativa, el análisis de la inflamación de la córnea permite una evaluación cuantitativa. Cada medición se convierte en una puntuación cuantitativa utilizada para calcular un índice general de irritación, o bien se somete a una categorización cualitativa para asignarle una clasificación de corrosividad y capacidad de irritación intensa ocular in vitro. Cada uno de estos resultados puede utilizarse a continuación para predecir el potencial de corrosividad o capacidad de irritación intensa de una sustancia problema (véanse los criterios de decisión). |
Fuente y edad de los ojos de pollo
|
12. |
Tradicionalmente se han venido utilizando para este ensayo los ojos tomados de pollos obtenidos de mataderos donde se sacrifican para el consumo humano, con lo que se suprime la necesidad de disponer de animales de laboratorio. Solo se utilizan los ojos de animales sanos considerados adecuados para entrar en la cadena alimentaria humana. |
|
13. |
Aunque aún no se ha efectuado ningún estudio comparativo para evaluar la edad óptima de los pollos, la edad y el peso de los pollos usados tradicionalmente en este método de ensayo corresponden a los pollos tiernos que se suelen tratar en los mataderos de aves de corral (es decir, de unas siete semanas de edad y entre 1, 5 y 2,5 kg). |
Recogida y transporte de los ojos al laboratorio
|
14. |
Las cabezas deben retirarse inmediatamente después de la sedación de los pollos, generalmente por choque eléctrico, y de la incisión del cuello para su sangrado. Las fuentes locales de pollos deben estar situadas cerca del laboratorio de forma que las cabezas puedan transferirse desde el matadero al laboratorio en poco tiempo, a fin de reducir al mínimo el deterioro y la contaminación bacteriana. Debe reducirse al mínimo el tiempo transcurrido entre la recogida de las cabezas de pollo y la utilización de los ojos en el método de ensayo ICE (lo normal es que no exceda de dos horas), y hay que demostrar que ese tiempo no altera los resultados del ensayo. Estos resultados se basan en los criterios de selección de los ojos, así como en las respuestas obtenidas con controles positivos y negativos. Todos los ojos utilizados en el ensayo deben proceder del mismo grupo de ojos recogidos un día concreto. |
|
15. |
Como los ojos se disecan en el laboratorio, las cabezas intactas se transportan desde el matadero a temperatura ambiente en cajas de plástico humidificadas mediante toallas mojadas con solución salina isotónica. |
Criterios de selección de los ojos utilizados en el ICE
|
16. |
Se desechan los ojos que tienen una elevada tinción de fluoresceína de base (es decir, > 0,5) o una elevada puntuación de opacidad de la córnea (es decir, > 0,5) una vez han sido enucleados. |
|
17. |
Cada grupo de tratamiento y control positivo simultáneo consiste en al menos tres ojos. El grupo de control negativo o el control del disolvente (si se utiliza un disolvente distinto de la solución salina) consiste en al menos un ojo. |
PROCEDIMIENTO
Preparación de los ojos
|
18. |
Se cortan los párpados cuidadosamente, procurando no dañar la córnea. se evalúa rápidamente la integridad de la córnea mediante la aplicación de una gota de fluoresceína sódica al 2 % (p/v) a la superficie de la córnea durante unos segundos, seguida de lavado con solución salina isotónica. Los ojos tratados con fluoresceína se examinan a continuación con un microscopio de lámpara de hendidura para asegurarse de que la córnea está ilesa (es decir, tiene puntuaciones de retención de fluoresceína y de opacidad de la córnea ≤ 0,5). |
|
19. |
Los ojos que no presenten lesiones se extraen del cráneo, teniendo cuidado de no lesionar la córnea. El globo ocular se extrae de la órbita sujetando firmemente con pinzas quirúrgicas la membrana nictitante, y los músculos del ojo se cortan con unas tijeras curvas de punta roma. Es importante no causar lesiones a la córnea por una presión excesiva (es decir, artefactos de compresión). |
|
20. |
Cuando se retira el ojo de la órbita, debe quedar con él una porción visible del nervio óptico. Una vez retirado de la órbita, el ojo se pone en una gasa hidrófila y se retiran, cortándolos, la membrana nictitante y demás tejidos conjuntivos. |
|
21. |
El ojo enucleado se monta en un soporte de acero inoxidable, con la córnea situada verticalmente. El soporte se transfiere a continuación a la cámara de un aparato de perfusión (16), donde se posiciona de manera que toda la córnea reciba el goteo de solución salina isotónica. Las cámaras de los aparatos de perfusión deben estar termostatizadas a 32 ± 1,5 °C. El apéndice 3 incluye un diagrama de un aparato de perfusión normal y del soporte para los ojos, que pueden obtenerse comercialmente o bien construirse en el propio laboratorio. El aparato puede modificarse para cubrir las necesidades de un laboratorio concreto (por ejemplo, para albergar un número diferente de ojos). |
|
22. |
Una vez colocados en el aparato de perfusión, los ojos se vuelven a examinar con un microscopio de lámpara de hendidura para asegurarse de que no han sufrido ninguna lesión durante el proceso de disección. También debe medirse en este momento el espesor de la córnea en el vértice corneal, utilizando el medidor de profundidad con el microscopio de lámpara de hendidura. Deben sustituirse los ojos que presenten a) una puntuación de retención de fluoresceína > 0,5; b) una opacidad corneal > 0,5; o c) cualquier otro signo de lesión. En cuanto a los ojos que no se hayan rechazado por ninguno de estos criterios, deberán rechazarse también los ojos con una espesor de la córnea que se desvíe en más de un 10 % del valor medio de todos los ojos. Los usuarios deben ser conscientes de que con los microscopios de lámpara de hendidura pueden obtenerse diferentes mediciones del espesor de la córnea con diferentes ajustes de la anchura de la hendidura. Esta debe fijarse en 0,095 mm. |
|
23. |
Una vez examinados y aprobados todos los ojos, se incuban durante unos 45 o 60 minutos para estabilizarlos con el sistema de ensayo antes de administrar la sustancia. Tras el periodo de estabilización, se registra una medición de referencia inicial del espesor y de la opacidad de la córnea que sirva como referencia de base (es decir, a tiempo = 0). La puntuación de fluoresceína determinada en el momento de la disección se utiliza como medición de base respecto a este parámetro. |
Aplicación de la sustancia problema
|
24. |
Inmediatamente después de efectuar las mediciones de referencia inicial, se retira el ojo (en su soporte) del aparato de perfusión, se pone en posición horizontal y se aplica a la córnea la sustancia problema. |
|
25. |
Normalmente, las sustancias problema líquidas se estudian sin diluir, pero, en caso necesario, pueden someterse a dilución (por ejemplo, como parte del diseño del estudio). El disolvente preferido para disolver estas sustancias es la solución salina fisiológica. Sin embargo, también pueden utilizarse otros disolventes en condiciones controladas, pero es necesario demostrar la idoneidad de los disolventes que sean distintos de la solución salina fisiológica. |
|
26. |
Las sustancias problema líquidas se aplican a la córnea de forma que quede cubierta con la sustancia problema toda la superficie de la córnea de forma homogénea; el volumen normal es de 0,03 mL. |
|
27. |
Cuando sea posible, las sustancias sólidas deben triturarse de la manera más fina posible con un mortero o con otro instrumento de trituración comparable. El polvo resultante se aplica a la córnea de forma que su superficie quede cubierta uniformemente con la sustancia problema; la cantidad normal es de 0,03 g. |
|
28. |
La sustancia problema (líquida o sólida) se aplica durante 10 segundos y después se retira del ojo lavando con solución salina isotónica (aproximadamente 20 mL) a temperatura ambiente. El ojo (en su soporte) se vuelve a poner a continuación en el aparato de perfusión, en la posición vertical inicial. |
Sustancias de control
|
29. |
En cada experimento se deben incluir controles simultáneos negativos (o del disolvente/vehículo) y positivos. |
|
30. |
Cuando se estudian líquidos al 100 % o sólidos, se utiliza solución salina fisiológica como control negativo simultáneo en el método de ensayo ICE a fin de detectar cambios inespecíficos del sistema de ensayo y garantizar que las condiciones del ensayo no provocan inadecuadamente una respuesta de irritación. |
|
31. |
Cuando se estudian líquidos diluidos, se incluye en el método de ensayo un grupo de control simultáneo del disolvente/vehículo a fin de detectar cambios inespecíficos del sistema de ensayo y garantizar que las condiciones del ensayo no provocan inadecuadamente una respuesta de irritación. Como se indica en el punto 25, solo pueden utilizarse los disolventes/vehículos de los que se haya demostrado que carecen de efectos adversos sobre el sistema de ensayo. |
|
32. |
Se incluye como control positivo simultáneo en cada experimento un agente irritante ocular conocido, a fin de verificar que se provoca una respuesta adecuada. Como en el presente método se utiliza el ensayo ICE para identificar agentes corrosivos o irritantes intensos, el control positivo debe ser una sustancia de referencia que induzca una respuesta intensa con este método de ensayo. No obstante, para asegurar la posibilidad de evaluar la variabilidad de las respuestas del control positivo a lo largo del tiempo, no debe ser excesiva la intensidad de la respuesta. Debe generarse una cantidad suficiente de datos in vitro del control positivo, de forma que se pueda calcular una banda aceptable, definida estadísticamente, para el control positivo. Si no se dispone de datos anteriores adecuados con el método de ensayo ICE respecto a un control positivo determinado, es posible que deban efectuarse estudios para conseguir esta información. |
|
33. |
Pueden citarse como ejemplo de controles positivos para sustancias problema líquidas el ácido acético al 10 % o el cloruro de benzalconio al 5 %, mientras que son ejemplos de controles positivos para sustancias problema sólidas el hidróxido sódico o el imidazol. |
|
34. |
Es útil disponer de sustancias de referencia para evaluar el potencial de irritación ocular de sustancias desconocidas dentro de una clase específica de sustancias o productos, o para evaluar la capacidad de irritación relativa de un irritante ocular dentro de una gama específica de respuestas de irritación. |
Parámetros medidos
|
35. |
Las córneas tratadas se evalúan antes de su tratamiento y empezando a los 30, 75, 120, 180 y 240 minutos (± 5 minutos) después del lavado tras el tratamiento. Esta cadencia permite conseguir un número adecuado de mediciones a lo largo del periodo de tratamiento de cuatro horas, dejando tiempo suficiente entre mediciones para que puedan efectuarse las observaciones requeridas con todos los ojos. |
|
36. |
Los parámetros evaluados son la opacidad de la córnea, la inflamación, la retención de fluoresceína y los efectos morfológicos (por ejemplo, lesiones punteadas o aflojamiento del epitelio). A cada uno de los tiempos antes citados se determinan todos los parámetros, salvo la retención de fluoresceína (que se determina solo antes del tratamiento y a los 30 minutos tras la exposición a la sustancia problema). |
|
37. |
Se recomienda tomar fotografías para documentar la opacidad de la córnea, la retención de fluoresceína, los efectos morfológicos y, en su caso, la histopatología. |
|
38. |
Tras el examen final a las cuatro horas, los usuarios deberían conservar los ojos en un fijador adecuado (por ejemplo, formol neutro amortiguado) para su eventual examen histopatológico. |
|
39. |
La inflamación de la córnea se determina mediante mediciones del espesor de la córnea efectuadas con un paquímetro óptico en un microscopio de lámpara de hendidura. Se expresa en porcentaje y se calcula con la fórmula siguiente a partir de las mediciones del espesor de la córnea:
|
|
40. |
Se calcula el porcentaje medio de inflamación de la córnea de todos los ojos del ensayo a todos los tiempos de observación. A partir de la mayor puntuación media de inflamación de la córnea, observada a cualquiera de los tiempos seleccionados, se adjudica a cada sustancia problema una puntuación general de categoría. |
|
41. |
La puntuación de la opacidad de la córnea se calcula utilizando el área de esta opacificada más densamente. Se calcula el valor medio de opacidad de la córnea de todos los ojos del ensayo a todos los tiempos de observación. A partir de la mayor puntuación media de opacidad de la córnea, observada a cualquiera de los tiempos seleccionados, se adjudica a cada sustancia problema una puntuación general de categoría (cuadro 1). Cuadro 1 Puntuaciones de opacidad de la córnea
|
|
42. |
El valor medio de retención de fluoresceína de todos los ojos del ensayo se calcula solo al tiempo de observación de 30 minutos, y se utiliza para obtener la puntuación general de categoría asignada a cada sustancia problema (cuadro 2). Cuadro 2 Puntuaciones de retención de fluoresceína
|
|
43. |
Entre los efectos morfológicos figuran el “punteamiento” de las células del epitelio corneal, el “aflojamiento” del epitelio, la rugosidad “de la superficie corneal y el”“pegado” de la sustancia problema a la córnea. Estas observaciones pueden presentar una intensidad variable y darse simultáneamente. La clasificación de estas observaciones es subjetiva, según la interpretación del investigador. |
DATOS E INFORME
Evaluación de los datos
|
44. |
Los resultados de la opacidad de la córnea, de la inflamación y de la retención de fluoresceína deben evaluarse por separado a fin de llegar a una clasificación ICE para cada parámetro. Las clases ICE de cada parámetro se combinan a continuación para generar una clasificación según la capacidad de irritación de cada sustancia problema. |
Criterios de decisión
|
45. |
Una vez evaluado cada uno de los parámetros, pueden asignarse las clases ICE en función de unas bandas predeterminadas. La interpretación del espesor de la córnea (cuadro 3), la opacidad (cuadro 4), y la retención de fluoresceína (cuadro 5) utilizando cuatro clases ICE se efectúa según las siguientes escalas: Cuadro 3 Criterios de clasificación ICE según el espesor de la córnea
Cuadro 4 Criterios de clasificación ICE según la opacidad
Cuadro 5 Criterios de clasificación ICE según la retención media de fluoresceína
|
|
46. |
La clasificación general de capacidad de irritación in vitro de una sustancia problema se evalúa leyendo la clasificación de capacidad de irritación correspondiente a la combinación de categorías obtenidas con la inflamación de la córnea, la opacidad de esta y la retención de fluoresceína, y aplicando el esquema presentado en el cuadro 6. Cuadro 6 Clasificación general de la capacidad de irritación in vitro
|
|
47. |
Como se indica en el punto 1, si la sustancia problema no se identifica como corrosiva o irritante intensa para los ojos, deben realizarse otras pruebas con fines de clasificación y etiquetado. El método de ensayo ICE tiene una exactitud general del 83 % (120/144) al 87 % (134/154), una tasa de falsos positivos del 6 % (7/122) al 8 % (9/116), y una tasa de falsos negativos del 41 % (13/32) al 50 % (15/30) respecto a la detección de agentes corrosivos e irritantes intensos para los ojos, en relación con los datos obtenidos mediante el método de ensayo de ojos de conejo in vivo, clasificados según los sistemas de clasificación de la EPA (1), UE (2), o SGA (3). Si se excluyen de la base de datos las sustancias de ciertas clases químicas (es decir, alcoholes y agentes tensioactivos) y físicas (es decir, sólidos), la exactitud del método ICE en el conjunto de los sistemas de clasificación de la UE, EPA y SAE varía del 91 % (75/82) al 92 % (69/75), las tasas de falsos positivos van del 5 % (4/73) al 6 % (4/70), y las tasas de falsos negativos van del 29 % (2/7) al 33 % (3/9) (4). |
|
48. |
Incluso aunque una sustancia problema no se clasifique como corrosiva o irritante intensa para los ojos, los datos del ICE pueden ser útiles, junto con los datos del ensayo in vivo con ojos de conejo o de otro ensayo in vitro validado adecuadamente, para seguir evaluando la utilidad y las limitaciones del método de ensayo ICE a efectos de la detección de agentes irritantes no intensos y agentes no irritantes (se está elaborando un documento de orientación sobre el uso de métodos de ensayo in vitro de la toxicidad ocular). |
Criterios de aceptación del estudio
|
49. |
Se considera que un ensayo es aceptable si los controles negativos o del vehículo/disolvente simultáneos y los controles positivos simultáneos reciben una clasificación de capacidad de irritación correspondiente a las clases de agentes no irritantes y de agentes irritantes intensos / corrosivos, respectivamente. |
Informe del ensayo
|
50. |
El informe del ensayo debe incluir la siguiente información, en caso de que corresponda a la realización del estudio: Sustancias problema y de control
Información referente al promotor y al laboratorio
Justificación del método de ensayo y del protocolo utilizados Integridad del método de ensayo Procedimiento utilizado para garantizar la integridad (es decir, la exactitud y la fiabilidad) del método de ensayo a lo largo del tiempo (por ejemplo, ensayo periódico de sustancias utilizadas para demostrar la aptitud, utilización de datos anteriores de controles negativos y positivos). Criterios de aceptabilidad del ensayo Cuando corresponda, bandas aceptables de controles de referencias simultáneos según los datos históricos. Condiciones del ensayo
Resultados
Discusión de los resultados Conclusión |
BIBLIOGRAFÍA
|
(1) |
U.S. EPA (1996). Label Review Manual: 2nd Edition. EPA737-B-96-001. Washington, DC: U.S. Environmental Protection Agency. |
|
(2) |
Reglamento (CE) no 1272/2008 del Parlamento Europeo y del Consejo, de 16 de diciembre de 2008, sobre clasificación, etiquetado y envasado de sustancias y mezclas, y por el que se modifican y derogan las Directivas 67/548/CEE y 1999/45/CE y se modifica el Reglamento (CE) no 1907/2006 (DO L 353 de 31.12.2008, p. 1). |
|
(3) |
Naciones Unidas (2007). Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos (SGA), segunda edición revisada, Naciones Unidas, Nueva York y Ginebra, 2007. Disponible en: [http://www.unece.org/trans/danger/publi/ghs/ghs_rev02/02files_s.html] |
|
(4) |
ICCVAM (2007). Test Method Evaluation Report - In Vitro Ocular Toxicity Test Methods for Identifying Ocular Severe Irritants and Corrosives. Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program (NTP) Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM). NIH Publication No.: 07-4517. Disponible en la dirección: [http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_tmer.htm] |
|
(5) |
ESAC (2007). Statement on the conclusion of the ICCVAM retrospective study on organotypic in vitro assays as screening tests to identify potential ocular corrosives and severe eye irritants. Disponible en la dirección: [http://ecvam.jrc.it/index.htm]. |
|
(6) |
Reglamento (CE) no 1907/2006 del Parlamento Europeo y del Consejo, de 18 de diciembre de 2006, relativo al registro, la evaluación, la autorización y la restricción de las sustancias y preparados químicos (REACH), por el que se crea la Agencia Europea de Sustancias y Preparados Químicos, se modifica la Directiva 1999/45/CE y se derogan el Reglamento (CEE) no 793/93 del Consejo y el Reglamento (CE) no 1488/94 de la Comisión, así como la Directiva 76/769/CEE del Consejo y las Directivas 91/155/CEE, 93/67/CEE, 93/105/CE y 2000/21/CE de la Comisión (DO L 396 de 30.12.2006, p. 1). |
|
(7) |
OCDE (2002). Directrices de ensayo TG 405. OECD Guidelines for Testing of Chemicals. Acute eye irritation/corrosion. Disponible en la dirección: [http://www.oecd.org/document/40/0, 2340, en_2649_34377_37051368_1_1_1_1,00.html] |
|
(8) |
ICCVAM (2007). ICCVAM Recommended ICE Test Method Protocol. In: ICCVAM Test Method Evaluation Report - In Vitro Ocular Toxicity Test Methods for Identifying Ocular Severe Irritants and Corrosives. Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program (NTP) Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM). NIH Publication No.: 07-4517. Disponible en la dirección: [http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_tmer.htm] |
|
(9) |
ICCVAM. (2006). Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Isolated Chicken Eye Test Method. NIH Publication No.: 06-4513. Research Triangle Park: National Toxicology Program. Disponible en la dirección: [http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_ice.htm] |
|
(10) |
Prinsen, M.K. and Koëter, B.W.M. (1993). Justification of the enucleated eye test with eyes of slaughterhouse animals as an alternative to the Draize eye irritation test with rabbits. Fd. Chem. Toxicol. 31:69-76. |
|
(11) |
INVITTOX (1994). Protocol 80: Chicken enucleated eye test (CEET). Disponible en la dirección: [http://ecvam.jrc.it/index.htm]. |
|
(12) |
Balls, M., Botham, P.A., Bruner, L.H. and Spielmann H. (1995). The EC/HO international validation study on alternatives to the Draize eye irritation test. Toxicol. In Vitro 9:871-929. |
|
(13) |
Prinsen, M.K. (1996). The chicken enucleated eye test (CEET): A practical (pre)screen for the assessment of eye irritation/corrosion potential of test materials. Food Chem. Toxicol. 34:291-296. |
|
(14) |
Chamberlain, M., Gad, S.C., Gautheron, P. and Prinsen, M.K. (1997). IRAG Working Group I: Organotypic models for the assessment/prediction of ocular irritation. Food Chem. Toxicol. 35:23-37. |
|
(15) |
Siegel, J.D., Rhinehart, E., Jackson, M., Chiarello, L., and the Healthcare Infection Control Practices Advisory Committee (2007). Guideline for Isolation Precautions: Preventing Transmission of Infectious Agents in Healthcare Settings. Disponible en la dirección: [http://www.cdc.gov/ncidod/dhqp/pdf/isolation2007.pdf]. |
|
(16) |
Maurer, J.K., Parker, R.D. and Jester J.V. (2002). Extent of corneal injury as the mechanistic basis for ocular irritation: key findings and recommendations for the development of alternative assays. Reg. Tox. Pharmacol. 36:106-117. |
|
(17) |
Burton, A.B.G., M. York and R.S. Lawrence (1981). The in vitro assessment of severe irritants. Fd. Cosmet.- Toxicol.- 19, 471-480. |
|
(18) |
ICCVAM (2006). Background review document, Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Bovine Corneal Opacity and Permeability (BCOP) Test Method. Disponible en la dirección: [http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_bcop.htm] |
|
(19) |
ICCVAM (2006). Background review document, Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe IrritantsIsolated Chicken Eye (ICE) Test Method. Disponible en la dirección: [http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_bcop.htm] |
Apéndice 1
DEFINICIONES
Exactitud: Grado de concordancia entre los resultados obtenidos con el método de ensayo y los valores de referencia aceptados. Se trata de una medida del comportamiento del método de ensayo y es un aspecto de su «pertinencia». Este término y el de «concordancia» se suelen usar indistintamente para indicar la proporción de resultados correctos de un método de ensayo.
Sustancias de referencia: Sustancias utilizadas como patrón para comparar con una sustancia problema. Las sustancias de referencia deben presentar las siguientes propiedades: a) un origen coherente y fiable; b) similitud estructural y funcional con la clase de sustancias problema; c) características físicas y químicas conocidas; c) datos de apoyo sobre los efectos conocidos, y e) potencia conocida en la banda de la respuesta deseada.
Córnea: Parte transparente delantera del globo ocular que cubre el iris y la pupila y permite el paso de la luz al interior.
Opacidad de la córnea: Medida del grado de opacidad de la córnea tras su exposición a una sustancia problema. Un aumento de la opacidad de la córnea indica que esta ha sufrido una lesión.
Inflamación de la córnea: Medición objetiva en el ensayo ICE de la magnitud de la dilatación de la córnea tras su exposición a una sustancia problema. Se expresa en porcentaje y se calcula a partir de las mediciones del espesor de la córnea de referencia de base (antes de la administración de la sustancia) y de los espesores registrados a intervalos regulares tras la exposición a la sustancia problema en el ensayo ICE. El grado de inflamación de la córnea indica las lesiones que esta ha sufrido.
Categoría 1 de la EPA: Corrosión (destrucción irreversible del tejido ocular) o afectación o irritación de la córnea, persistente durante más de 21 días (1).
Categoría R41 de la UE: Producción de una lesión de los tejidos oculares o un deterioro físico importante de la visión, como consecuencia de la aplicación de una sustancia problema en la superficie anterior del ojo, y que no es totalmente reversible en los 21 días siguientes a la aplicación (2).
Tasa de falsos negativos: Proporción de todas las sustancias positivas identificadas erróneamente como negativas por un método de ensayo. Es uno de los indicadores del comportamiento del método de ensayo.
Tasa de falsos positivos: Proporción de todas las sustancias negativas identificadas erróneamente como positivas por un método de ensayo. Es uno de los indicadores del comportamiento del método de ensayo.
Retención de fluoresceína: Medición subjetiva en el ensayo ICE de la cantidad de fluoresceína sódica retenida por las células epiteliales de la córnea tras la exposición de esta a una sustancia problema. El grado de retención de fluoresceína indica las lesiones que ha sufrido el epitelio de la córnea.
SGA (Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos): Sistema que propone la clasificación de sustancias químicas y sus mezclas según tipos y niveles normalizados de peligros físicos, sanitarios y ambientales, y que hace referencia a los elementos correspondientes de comunicación, como pictogramas, palabras de advertencia, indicaciones de peligro, consejos de prudencia, y fichas de datos de seguridad, a efectos de proporcionar información sobre sus efectos adversos con el fin de proteger a la población (incluidos empresarios, trabajadores, transportistas, consumidores y personal de respuesta a emergencias) y al medio ambiente (3).
Categoría 1 del SGA: Producción de una lesión de los tejidos oculares o una degradación física severa de la vista, como consecuencia de la aplicación de una sustancia problema en la superficie anterior del ojo, y que no es totalmente reversible en los 21 días siguientes a la aplicación (3).
Peligro: Propiedad inherente de un agente o situación que tiene capacidad para provocar efectos adversos cuando un organismo, sistema o (sub)población se expone a dicho agente.
Control negativo: Muestra paralela no tratada que contiene todos los componentes de un sistema de ensayo. Esta muestra se somete al mismo proceso que las muestras tratadas con sustancia problema y otras muestras de control para determinar si el disolvente interactúa con el sistema de ensayo.
Sustancias no irritantes: Sustancias no clasificadas como irritantes oculares en las categorías I, II, o III de la EPA, en la categoría R41 o R36 de la UE, ni en las categorías 1, 2A o 2B del SGA (1) (2) (3).
Sustancias corrosivas oculares: a) Sustancias que provocan una lesión irreversible de los tejidos oculares; b) sustancias clasificadas como irritantes oculares de la categoría 1 del SGA, categoría I de la EPA, o categoría R41 de la UE (1) (2) (3).
Sustancias irritantes oculares: a) Sustancias que producen un cambio reversible en el ojo como consecuencia de su aplicación a la superficie anterior de este; b) sustancias clasificadas como irritantes oculares en las categorías II, o III de la EPA, categoría R36 de la UE, o en las categorías 2A o 2B del SGA (1) (2) (3).
Sustancias irritantes intensas oculares: a) Sustancias que provocan lesiones de los tejidos oculares como consecuencia de su aplicación en la superficie anterior del ojo, y que no se resuelven en los 21 días siguientes a la aplicación, o una degradación física severa de la visión; b) sustancias clasificadas como irritantes oculares de la categoría 1 del SGA, categoría I de la EPA, o categoría R41 de la UE (1) (2) (3).
Control positivo: Muestra paralela que contiene todos los componentes de un sistema de ensayo y que se trata con una sustancia de la que se sabe que induce una respuesta positiva. Para asegurar la posibilidad de evaluar la variabilidad de las respuestas del control positivo a lo largo del tiempo, no debe ser excesiva la intensidad de la respuesta.
Fiabilidad: Medida del grado en que un método de ensayo puede aplicarse de forma reproducible a lo largo del tiempo, en un mismo laboratorio o en distintos laboratorios, utilizando el mismo protocolo. Se evalúa calculando la reproducibilidad intra e interlaboratorios y la repetibilidad intralaboratorios.
Microscopio de lámpara de hendidura: Instrumento utilizado para examinar directamente el ojo con el aumento de un microscopio binocular creando una imagen estereoscópica en vertical. En el método de ensayo ICE, este instrumento se utiliza para ver las estructuras anteriores del ojo del pollo, así como para medir objetivamente el espesor de la córnea con ayuda de un medidor de profundidad.
Control del disolvente/vehículo: Muestra no tratada que contiene todos los componentes de un sistema de ensayo, incluido el disolvente o vehículo, y que se somete al mismo proceso que las muestras tratadas con sustancia problema y otras muestras de control a fin de determinar la respuesta de base correspondiente a las muestras tratadas con la sustancia problema disuelta en el mismo disolvente o vehículo. Cuando se somete a ensayo con un control negativo simultáneo, esta muestra pone de manifiesto también si el disolvente o vehículo interactúa con el sistema de ensayo.
Ensayo gradual: Estrategia de ensayo por fases, en la que se revisa toda la información existente sobre una sustancia problema, siguiendo un orden especificado en un proceso de ponderación de los datos en cada fase, a fin de determinar si se dispone de información suficiente para tomar una decisión sobre la clasificación de un peligro, antes de pasar a la fase siguiente. Si puede establecerse la capacidad de irritación de una sustancia problema con la información disponible, no hace falta efectuar más ensayos. Si no puede establecerse la capacidad de irritación de una sustancia problema con la información disponible, se aplica un procedimiento secuencial de ensayos con animales por fases hasta que pueda efectuarse una clasificación inequívoca.
Método de ensayo validado: Método de ensayo sobre el cual se han completado estudios de validación para determinar su pertinencia (incluida su exactitud) y su fiabilidad con un fin específico. Es importante señalar que un método de ensayo validado puede tener un comportamiento insuficiente en términos de exactitud y fiabilidad como para considerarse aceptable a efectos del fin propuesto.
Ponderación de los datos: Proceso de consideración de los aspectos favorables y desfavorables de los distintos elementos de información a efectos de alcanzar y confirmar una conclusión en cuanto al peligro potencial de una sustancia.
Apéndice 2
SUSTANCIAS UTILIZADAS PARA DEMOSTRAR LA APTITUD DEL MÉTODO DE ENSAYO ICE
Antes de proceder al uso sistemático de un método de ensayo que se ajuste a este método de ensayo, es posible que los laboratorios deseen demostrar su aptitud técnica, identificando correctamente la clasificación de las diez sustancias recomendadas del cuadro 1 en cuanto a su corrosividad ocular. Estas sustancias se ha seleccionado para representar la gama de respuestas de irritación/corrosión ocular local, sobre la base de los resultados conseguidos en el ensayo con ojo de conejo in vivo (TG 405) (es decir, categorías 1, 2A, 2B o no clasificada o etiquetada según el SGA de la ONU (3) (7). Sin embargo, considerando la utilidad validada de estos ensayos (es decir, identificar solamente sustancias corrosivas/irritantes intensas oculares), solo hay dos resultados del ensayo a efectos de clasificación (sustancia corrosiva/irritante intensa o sustancia no corrosiva/no irritante intensa) para demostrar la aptitud del método. Otros criterios de selección son que las sustancias se encuentren en el mercado, que se disponga de datos de referencia in vivo de calidad, y que haya datos de calidad procedentes de los dos métodos in vitro para los que se están elaborando directrices de ensayo. Por este motivo, se han seleccionado sustancias irritantes de la lista recomendada por el ICCVAM de 122 sustancias de referencia para la validación de métodos de ensayo de la toxicidad ocular in vitro (véase el apéndice H: Lista de sustancias de referencia recomendadas por el ICCVAM) (4). Se encuentran datos de referencia en los documentos de revisión de fondo del ICCVAM para el método de ensayo de la opacidad y permeabilidad de la córnea de bovino (BCOP) y para el ICE (18) (19).
Cuadro 1
Sustancias recomendadas para demostrar la aptitud técnica con ICE
|
Productos químicos |
No CAS |
Clase química (9) |
Estado físico |
Clasificación (10) in vivo |
Clasificación (11) in vitro |
|
Cloruro de benzalconio (5 %) |
8001-54-5 |
Compuesto onio |
Líquido |
Categoría 1 |
Corrosivo/irritante intenso |
|
Clorhexidina |
55-56-1 |
Amina, amidina |
Sólido |
Categoría 1 |
Corrosivo/irritante intenso |
|
Ácido dibenzoil-L-tartárico |
2743-38-6 |
Ácido carboxílico, éster |
Sólido |
Categoría 1 |
Corrosivo/irritante intenso |
|
Imidazol |
288-32-4 |
Heterociclo |
Sólido |
Categoría 1 |
Corrosivo/irritante intenso |
|
Ácido tricloroacético (30 %) |
76-03-9 |
Ácido carboxílico |
Líquido |
Categoría 1 |
Corrosivo/irritante intenso |
|
Cloruro de 2,6-diclorobenzoílo |
4659-45-4 |
Haluro de acilo |
Líquido |
Categoría 2A |
No corrosivo/no irritante intenso |
|
2-metil-acetoacetato de etilo |
609-14-3 |
Cetona, éster |
Líquido |
Categoría 2B |
No corrosivo/no irritante intenso |
|
Nitrato de amonio |
6484-52-2 |
Sal inorgánica |
Sólido |
Categoría 2A |
No corrosivo/no irritante intenso |
|
Glicerol |
56-81-5 |
Alcohol |
Líquido |
No etiquetado |
No corrosivo/no irritante intenso |
|
n-Hexano |
110-54-3 |
Hidrocarburo (acíclico) |
Líquido |
No etiquetado |
No corrosivo/no irritante intenso |
|
Abreviaturas: No CAS: número de registro del Chemical Abstracts Service |
|||||
Apéndice 3
Diagramas del aparato de perfusión y del soporte para los ojos utilizados en el método ICE
(En Burton et al. (17) se encuentran otras descripciones genéricas del aparato de perfusión y del soporte para los ojos)
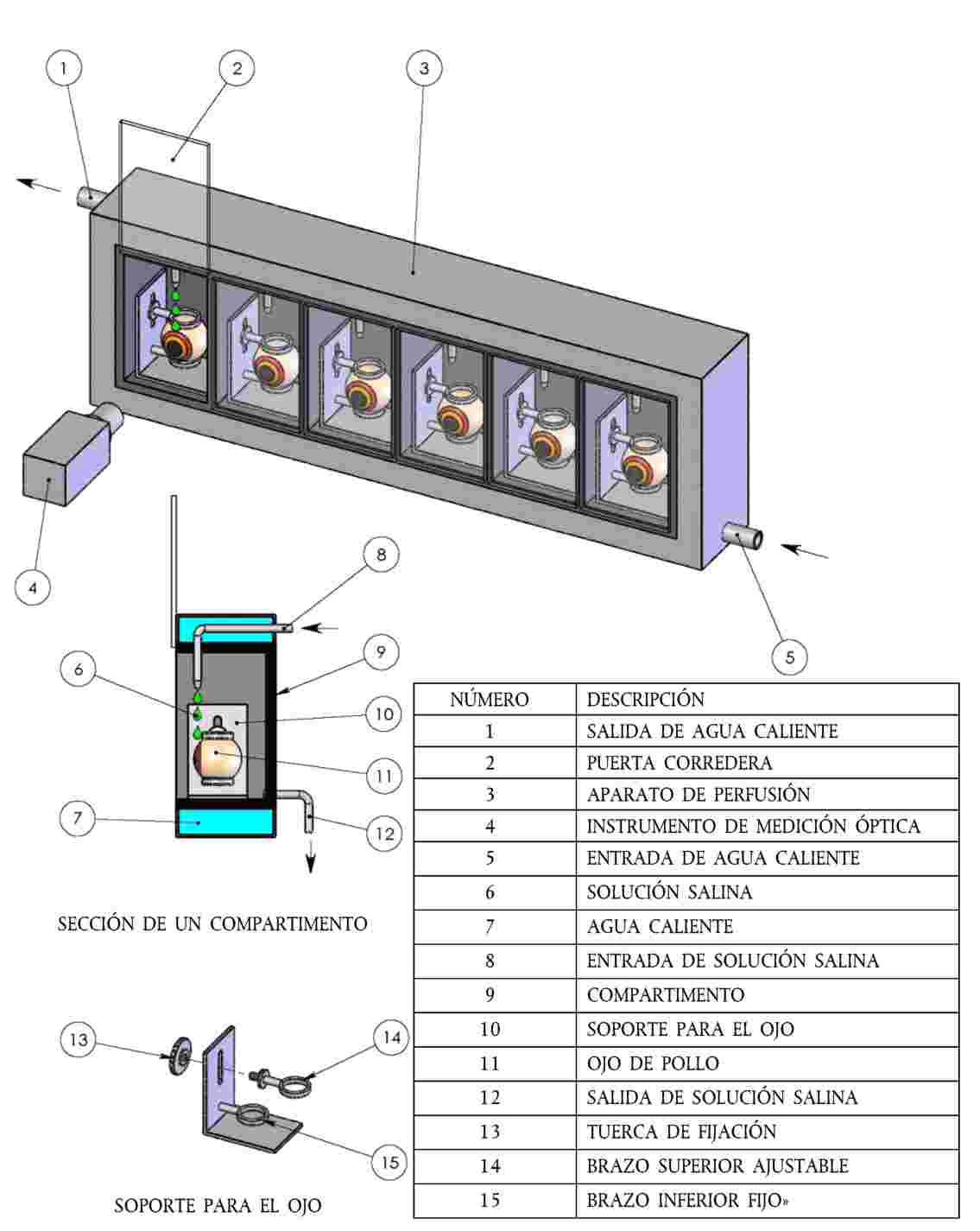
(1) La clase química se ha asignado a cada sustancia problema utilizando un sistema de clasificación habitual, basado en el sistema de clasificación de materias médicas de la National Library of Medicine (MeSH) (se puede encontrar en la dirección http//www.nlm.nih.gov/mesh).
(2) Sobre la base de los resultados obtenidos en el ensayo con ojos de conejo in vivo (TG 405 de la OCDE) y utilizando el SGA de la ONU (3) (7).
(3) Sobre la base de los resultados obtenidos con el método de ensayo BCOP y con el ICE.
(4) Estas dimensiones corresponden al soporte de córnea utilizado para vacas de entre 12 y 60 meses de edad. En caso de que se utilicen animales de entre 6 y 12 meses de edad, puede ser necesario diseñar el soporte de manera que cada cámara albergue un volumen de 4 mL, y cada una de las cámaras internas mida 1,5 cm de diámetro y 2,2 cm de profundidad. Es importante que en todos los soportes de córnea de nuevo diseño la proporción entre la superficie de córnea expuesta y el volumen de la cámara posterior sea la misma que en el soporte de córnea tradicional. Se trata de una condición necesaria para asegurar que los valores de permeabilidad se determinan correctamente a efectos del cálculo de la puntuación IVIS con la fórmula propuesta.
(5) Puntuaciones de inflamación de la córnea aplicables solo si el espesor se mide con un microscopio de lámpara de hendidura Haag-Streit BP900 con un medidor de profundidad no I y una anchura de la hendidura ajustada a 9½, lo que equivale a 0,095 mm. Los usuarios deben tener en cuenta que los microscopios de lámpara de hendidura pueden dar diferentes mediciones del espesor de la córnea con diferentes ajustes de la anchura de la hendidura.
(6) Véase el cuadro 1.
(7) Véase el cuadro 2.
(8) Combinaciones menos probables.
(9) La clase química se ha asignado a cada sustancia problema utilizando un sistema de clasificación habitual, basado en el sistema de clasificación de materias médicas de la National Library of Medicine (MeSH) (se puede encontrar en la dirección http//www.nlm.nih.gov/mesh).
(10) Sobre la base de los resultados obtenidos en el ensayo con ojos de conejo in vivo (TG 405 de la OCDE) y utilizando el SGA de la ONU (3) (7).
(11) Sobre la base de los resultados obtenidos con el método de ensayo BCOP y con el ICE.



