ISSN 1977-0669
Επίσημη Εφημερίδα
της Ευρωπαϊκής Ένωσης
L 331

Έκδοση στην ελληνική γλώσσα
Νομοθεσία
57ό έτος
18 Νοεμβρίου 2014
|
ISSN 1977-0669 |
||
|
Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης |
L 331 |
|

|
||
|
Έκδοση στην ελληνική γλώσσα |
Νομοθεσία |
57ό έτος |
|
|
|
Διορθωτικά |
|
|
|
* |
||
|
|
* |
|
|
|
|
|
(1) Κείμενο που παρουσιάζει ενδιαφέρον για τον ΕΟΧ |
|
EL |
Οι πράξεις των οποίων οι τίτλοι έχουν τυπωθεί με λευκά στοιχεία αποτελούν πράξεις τρεχούσης διαχειρίσεως που έχουν θεσπισθεί στο πλαίσιο της γεωργικής πολιτικής και είναι γενικά περιορισμένης χρονικής ισχύος. Οι τίτλοι όλων των υπολοίπων πράξεων έχουν τυπωθεί με μαύρα στοιχεία και επισημαίνονται με αστερίσκο. |
II Μη νομοθετικές πράξεις
ΚΑΝΟΝΙΣΜΟΙ
|
18.11.2014 |
EL |
Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης |
L 331/1 |
ΕΚΤΕΛΕΣΤΙΚΌΣ ΚΑΝΟΝΙΣΜΌΣ (ΕΕ) αριθ. 1225/2014 ΤΟΥ ΣΥΜΒΟΥΛΊΟΥ
της 17ης Νοεμβρίου 2014
για την εφαρμογή του κανονισμού (ΕΕ) αριθ. 269/2014 σχετικά με περιοριστικά μέτρα όσον αφορά δράσεις που υπονομεύουν ή απειλούν την εδαφική ακεραιότητα, την κυριαρχία και την ανεξαρτησία της Ουκρανίας
ΤΟ ΣΥΜΒΟΥΛΙΟ ΤΗΣ ΕΥΡΩΠΑΪΚΗΣ ΕΝΩΣΗΣ,
Έχοντας υπόψη τη Συνθήκη για τη λειτουργία της Ευρωπαϊκής Ένωσης,
Έχοντας υπόψη τον κανονισμό (ΕΕ) αριθ. 269/2014 του Συμβουλίου, της 17ης Μαρτίου 2014, σχετικά με περιοριστικά μέτρα για ενέργειες που υπονομεύουν ή απειλούν την εδαφική ακεραιότητα, την κυριαρχία και την ανεξαρτησία της Ουκρανίας (1), και ιδίως το άρθρο 14 παράγραφος 1,
Εκτιμώντας τα ακόλουθα:
|
(1) |
Στις 17 Μαρτίου 2014 το Συμβούλιο εξέδωσε τον κανονισμό (ΕΕ) αριθ. 269/2014. |
|
(2) |
Θα πρέπει να τροποποιηθούν οι πληροφορίες σχετικά με ένα άτομο που περιλαμβάνεται στον κατάλογο σύμφωνα με τον κανονισμό (ΕΕ) αριθ. 269/2014. |
|
(3) |
Το παράρτημα Ι του κανονισμού (ΕΕ) αριθ. 269/2014 θα πρέπει άρα να τροποποιηθεί αναλόγως, |
ΕΞΕΔΩΣΕ ΤΟΝ ΠΑΡΟΝΤΑ ΚΑΝΟΝΙΣΜΟ:
Άρθρο 1
Το παράρτημα Ι του κανονισμού (ΕΕ) αριθ. 269/2014 τροποποιείται σύμφωνα με το παράρτημα του παρόντος κανονισμού.
Άρθρο 2
Ο παρών κανονισμός αρχίζει να ισχύει την επομένη της δημοσίευσής του στην Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης.
Ο παρών κανονισμός είναι δεσμευτικός ως προς όλα τα μέρη του και ισχύει άμεσα σε κάθε κράτος μέλος.
Βρυξέλλες, 17 Νοεμβρίου 2014.
Για το Συμβούλιο
Η Πρόεδρος
F. MOGHERINI
(1) ΕΕ L 78 της 17.3.2014, σ. 6.
ΠΑΡΑΡΤΗΜΑ
Οι καταχωρίσεις για το ακόλουθο πρόσωπο, στο παράρτημα Ι του κανονισμού (ΕΕ) αριθ. 269/2014 αντικαθίστανται από τις ακόλουθες καταχωρίσεις.
|
|
Ονομασία |
Αναγνωριστικά στοιχεία |
Αιτιολογία |
Ημερομηνία καταχώρισης |
|
|
Vladimir Volfovich ZHIRINOVSKY Владимир Вольфович Жириновский |
Γεννηθείς στις 25.4.1946 στο Almaty (προηγουμένως ονομαζόμενο και Alma-Ata), Καζαχστάν |
Μέλος του Κρατικού Συμβουλίου της Δούμα, αρχηγός του κόμματος LDPR. Υποστήριξε ενεργά την εμπλοκή των ενόπλων δυνάμεων της Ρωσίας στην Ουκρανία και την προσάρτηση της Κριμαίας. Υποστήριξε σθεναρά τον διαχωρισμό της Ουκρανίας. Υπέγραψε εξ ονόματος του κόμματος LDPR, του οποίου προεδρεύει, συμφωνία με την επονομαζόμενη Λαϊκή Δημοκρατία του Donetsk. |
12.9.2014 |
|
18.11.2014 |
EL |
Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης |
L 331/3 |
ΚΑΝΟΝΙΣΜΌΣ (ΕΕ) αριθ. 1226/2014 ΤΗΣ ΕΠΙΤΡΟΠΉΣ
της 17ης Νοεμβρίου 2014
σχετικά με την έγκριση ισχυρισμού υγείας ο οποίος διατυπώνεται για τα τρόφιμα και αφορά τη μείωση του κινδύνου εκδήλωσης ασθένειας
(Κείμενο που παρουσιάζει ενδιαφέρον για τον ΕΟΧ)
Η ΕΥΡΩΠΑΪΚΗ ΕΠΙΤΡΟΠΗ,
Έχοντας υπόψη τη Συνθήκη για τη λειτουργία της Ευρωπαϊκής Ένωσης,
Έχοντας υπόψη τον κανονισμό (ΕΚ) αριθ. 1924/2006 του Ευρωπαϊκού Κοινοβουλίου και του Συμβουλίου, της 20ής Δεκεμβρίου 2006, σχετικά με τους ισχυρισμούς διατροφής και υγείας που διατυπώνονται στα τρόφιμα (1), και ιδίως το άρθρο 17 παράγραφος 3,
Εκτιμώντας τα ακόλουθα:
|
(1) |
Σύμφωνα με τον κανονισμό (ΕΚ) αριθ. 1924/2006, οι ισχυρισμοί υγείας για τα τρόφιμα απαγορεύονται, εκτός εάν έχουν εγκριθεί από την Επιτροπή σύμφωνα με τον εν λόγω κανονισμό και εάν περιλαμβάνονται σε κατάλογο επιτρεπόμενων ισχυρισμών. |
|
(2) |
Ο κανονισμός (ΕΚ) αριθ. 1924/2006 προβλέπει επίσης ότι οι αιτήσεις για την έγκριση ισχυρισμών υγείας μπορούν να υποβάλλονται από τους υπευθύνους των επιχειρήσεων τροφίμων στην αρμόδια εθνική αρχή ενός κράτους μέλους. Η αρμόδια εθνική αρχή διαβιβάζει τις έγκυρες αιτήσεις στην Ευρωπαϊκή Αρχή για την Ασφάλεια των Τροφίμων (EFSA), στο εξής «η Αρχή». |
|
(3) |
Μετά την παραλαβή της αίτησης, η Αρχή ενημερώνει χωρίς καθυστέρηση τα υπόλοιπα κράτη μέλη και την Επιτροπή σχετικά με την αίτηση και διατυπώνει γνώμη για τον εν λόγω ισχυρισμό υγείας. |
|
(4) |
Η Επιτροπή αποφασίζει για την έγκριση των ισχυρισμών υγείας, λαμβάνοντας υπόψη τη γνώμη της Αρχής. |
|
(5) |
Ύστερα από αίτηση που υποβλήθηκε από τη Lactalis B&C, σύμφωνα με το άρθρο 14 παράγραφος 1 στοιχείο α) του κανονισμού (ΕΚ) αριθ. 1924/2006, η Αρχή κλήθηκε να εκδώσει γνώμη σχετικά με ισχυρισμό υγείας για «λιπαρές ουσίες για επάλειψη με χαμηλά λιπαρά και χαμηλά trans-λιπαρά οξέα και πλούσια σε ακόρεστα λιπαρά οξέα και λιπαρά οξέα ωμέγα- 3» και για τη μείωση των συγκεντρώσεων χοληστερόλης LDL (ερώτηση αριθ. ΕΑΑΤ-Q-2009-00458) (2). Ο ισχυρισμός που προτάθηκε από τον αιτούντα είχε την ακόλουθη διατύπωση: «Αντικαθιστά λίπη πλούσια σε κεκορεσμένα/τρανς-λιπαρά οξέα με λίπη πλούσια σε ακόρεστα λιπαρά οξέα που βοηθούν στη μείωση της χοληστερόλης LDL. Η χοληστερόλη LDL αποτελεί παράγοντα κινδύνου για καρδιαγγειακές παθήσεις». |
|
(6) |
Στις 25 Μαΐου 2011 η Επιτροπή και τα κράτη μέλη παρέλαβαν την επιστημονική γνώμη της Αρχής, που κατέληγε στο συμπέρασμα ότι, με βάση τα στοιχεία που υποβλήθηκαν, τεκμηριώνεται η σχέση αιτίου-αποτελέσματος μεταξύ της κατανάλωσης μειγμάτων κεκορεσμένων λιπαρών οξέων με τη διατροφή και της αύξησης των συγκεντρώσεων χοληστερόλης LDL στο αίμα, και ότι η αντικατάσταση ενός μείγματος κεκορεσμένων λιπαρών οξέων στη διατροφή με cis-μονοακόρεστα λιπαρά οξέα και/ή cis-πολυακόρεστα λιπαρά οξέα στα τρόφιμα ή τη διατροφή, γραμμάριο ανά γραμμάριο, μειώνει τις συγκεντρώσεις χοληστερόλης LDL. Συνεπώς, ένας ισχυρισμός υγείας που αντικατοπτρίζει το συμπέρασμα αυτό θα πρέπει να θεωρηθεί ότι συμμορφώνεται με τις απαιτήσεις του κανονισμού (ΕΚ) αριθ. 1924/2006 και θα πρέπει να συμπεριληφθεί στον κατάλογο της Ένωσης με τους επιτρεπόμενους ισχυρισμούς. Η κλινική μελέτη παρέμβασης, για την οποία ο αιτών ζήτησε εμπιστευτική εξέταση, δεν θεωρήθηκε απαραίτητη από την αρχή για να καταλήξει στα συμπεράσματά της. Συνεπώς, κρίνεται ότι η απαίτηση που ορίζεται στο άρθρο 21 παράγραφος 1 στοιχείο γ) του κανονισμού (ΕΚ) αριθ. 1924/2006 δεν ικανοποιείται και, επομένως, δεν πρέπει να χορηγηθεί προστασία των δεδομένων βιομηχανικής ιδιοκτησίας. |
|
(7) |
Στη γνώμη της, η Αρχή καταλήγει στο συμπέρασμα ότι για να χρησιμοποιηθεί ο ισχυρισμός αυτός, σημαντικές ποσότητες κεκορεσμένων λιπαρών οξέων θα πρέπει να αντικατασταθούν από μονοακόρεστα και/ή πολυακόρεστα λιπαρά οξέα στα τρόφιμα ή τη διατροφή, γραμμάριο ανά γραμμάριο. Επομένως, προκειμένου να διασφαλιστεί ότι ένα τρόφιμο παρέχει σημαντικές ποσότητες μονοακόρεστων και/ή πολυακόρεστων λιπαρών οξέων, είναι σκόπιμο να περιοριστεί η χρήση του ισχυρισμού σε λίπη και έλαια και να προβλεφθούν όροι χρήσης τους όποως εκείνοι που καθορίζονται στον ισχυρισμό διατροφής «ΥΨΗΛΗ ΠΕΡΙΕΚΤΙΚΟΤΗΤΑ ΣΕ ΑΚΟΡΕΣΤΑ ΛΙΠΑΡΑ», όπως αναφέρεται στο παράρτημα του κανονισμού (ΕΚ) αριθ. 1924/2006. |
|
(8) |
Το άρθρο 16 παράγραφος 4 του κανονισμού (ΕΚ) αριθ. 1924/2006 προβλέπει ότι μια γνωμοδότηση υπέρ της έγκρισης ενός ισχυρισμού υγείας θα περιλαμβάνει ορισμένα στοιχεία. Συνεπώς, τα στοιχεία αυτά θα πρέπει να παρατίθενται στο παράρτημα του παρόντος κανονισμού όσον αφορά τον εγκεκριμένο ισχυρισμό και να περιλαμβάνουν, κατά περίπτωση, την αναθεωρημένη διατύπωση του ισχυρισμού, τους ειδικούς όρους χρήσης του ισχυρισμού και, όταν κρίνεται σκόπιμο, τους όρους ή τους περιορισμούς χρήσης του τροφίμου και/ή πρόσθετη δήλωση ή προειδοποίηση, σύμφωνα με τους κανόνες που θεσπίζονται στον κανονισμό (ΕΚ) αριθ. 1924/2006 και σύμφωνα με τις γνώμες της Αρχής. |
|
(9) |
Ένας από τους σκοπούς του κανονισμού (ΕΚ) αριθ. 1924/2006 είναι να εξασφαλίζει ότι οι ισχυρισμοί υγείας είναι αληθείς, σαφείς, αξιόπιστοι και χρήσιμοι για τον καταναλωτή και ότι η διατύπωση και η παρουσίαση λαμβάνονται υπόψη ως προς αυτό. Επομένως, όταν η διατύπωση των ισχυρισμών έχει το ίδιο νόημα για τους καταναλωτές με τη διατύπωση ενός εγκεκριμένου ισχυρισμού υγείας, επειδή καταδεικνύουν την ίδια σχέση που υπάρχει μεταξύ μιας κατηγορίας τροφίμων, ενός τροφίμου ή ενός από τα συστατικά του και της υγείας, θα πρέπει να υπόκεινται στους ίδιους όρους χρήσης που καθορίζονται στο παράρτημα του παρόντος κανονισμού. |
|
(10) |
Τα σχόλια των αιτούντων και του κοινού τα οποία παρέλαβε η Επιτροπή, σύμφωνα με το άρθρο 16 παράγραφος 6 του κανονισμού (ΕΚ) αριθ. 1924/2006, ελήφθησαν υπόψη κατά τον καθορισμό των μέτρων που προβλέπονται στον παρόντα κανονισμό. |
|
(11) |
Τα μέτρα που προβλέπονται στον παρόντα κανονισμό είναι σύμφωνα με τη γνώμη της μόνιμης επιτροπής για την τροφική αλυσίδα και την υγεία των ζώων, |
ΕΞΕΔΩΣΕ ΤΟΝ ΠΑΡΟΝΤΑ ΚΑΝΟΝΙΣΜΟ:
Άρθρο 1
1. Ο ισχυρισμός υγείας που παρατίθεται στο παράρτημα του παρόντος κανονισμού μπορεί να διατυπώνεται για τρόφιμα που διατίθενται στην αγορά της Ένωσης σύμφωνα με τους όρους που προβλέπονται στο εν λόγω παράρτημα.
2. Οι ισχυρισμοί υγείας που αναφέρονται στην παράγραφο 1 περιλαμβάνονται στον κατάλογο επιτρεπόμενων ισχυρισμών της Ένωσης που αναφέρεται στο άρθρο 14 παράγραφος 1 του κανονισμού (ΕΚ) αριθ. 1924/2006.
Άρθρο 2
Ο παρών κανονισμός αρχίζει να ισχύει την εικοστή ημέρα από τη δημοσίευσή του στην Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης.
Ο παρών κανονισμός είναι δεσμευτικός ως προς όλα τα μέρη του και ισχύει άμεσα σε κάθε κράτος μέλος.
Βρυξέλλες, 17 Νοεμβρίου 2014.
Για την Επιτροπή
Ο Πρόεδρος
Jean-Claude JUNCKER
(1) ΕΕ L 404 της 30.12.2006, σ. 9.
(2) EFSA Journal 2011· 9(5):2168.
ΠΑΡΑΡΤΗΜΑ
Επιτρεπόμενος ισχυρισμός υγείας
|
Αίτηση — Σχετικές διατάξεις του κανονισμού (ΕΚ) αριθ. 1924/2006 |
Διεύθυνση αιτούντος |
Θρεπτικό συστατικό, ουσία, τρόφιμο ή κατηγορία τροφίμων |
Ισχυρισμός |
Όροι χρήσης του ισχυρισμού |
Προϋποθέσεις και/ή περιορισμοί χρήσης του τροφίμου και/ή πρόσθετη δήλωση ή προειδοποίηση |
Αριθ. αναφοράς της γνώμης της EFSA |
|
Ισχυρισμός υγείας σύμφωνα με το άρθρο 14 παράγραφος 1 στοιχείο α) ο οποίος αφορά τη μείωση του κινδύνου εκδήλωσης ασθένειας |
Lactalis B&C, ZA Les Placis, 35230 Bourgbarré, Γαλλία |
Μονοακόρεστα και/ή πολυακόρεστα λιπαρά οξέα |
Η αντικατάσταση των κεκορεσμένων λιπαρών με ακόρεστα λιπαρά στη διατροφή έχει αποδειχθεί ότι μειώνει/περιορίζει τα επίπεδα χοληστερόλης στο αίμα. Τα υψηλά επίπεδα χοληστερόλης συνιστούν παράγοντα κινδύνου για την ανάπτυξη στεφανιαίας καρδιακής νόσου. |
Ο ισχυρισμός μπορεί να χρησιμοποιηθεί μόνο για τρόφιμα που έχουν υψηλή περιεκτικότητα σε ακόρεστα λιπαρά οξέα τα οποία αναφέρονται στον ισχυρισμό ΥΨΗΛΗ ΠΕΡΙΕΚΤΙΚΟΤΗΤΑ ΣΕ ΑΚΟΡΕΣΤΑ ΛΙΠΑΡΑ, όπως αναφέρεται στο παράρτημα του κανονισμού (ΕΚ) αριθ. 1924/2006. |
Ο ισχυρισμός μπορεί να χρησιμοποιείται μόνο σε λίπη και έλαια. |
Q-2009-00458 |
|
18.11.2014 |
EL |
Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης |
L 331/6 |
ΕΚΤΕΛΕΣΤΙΚΌΣ ΚΑΝΟΝΙΣΜΌΣ (EE) αριθ. 1227/2014 ΤΗΣ ΕΠΙΤΡΟΠΉΣ
της 17ης Νοεμβρίου 2014
σχετικά με τον καθορισμό του ποσοστού αναπροσαρμογής των άμεσων ενισχύσεων που προβλέπεται στον κανονισμό (ΕΚ) αριθ. 73/2009 του Συμβουλίου όσον αφορά το ημερολογιακό έτος 2014 και για την κατάργηση του εκτελεστικού κανονισμού (ΕΕ) αριθ. 879/2014 της Επιτροπής
Η ΕΥΡΩΠΑΪΚΗ ΕΠΙΤΡΟΠΗ,
Έχοντας υπόψη τη Συνθήκη για τη λειτουργία της Ευρωπαϊκής Ένωσης,
Έχοντας υπόψη τον κανονισμό (ΕΕ) αριθ. 1306/2013 του Ευρωπαϊκού Κοινοβουλίου και του Συμβουλίου, της 17ης Δεκεμβρίου 2013, σχετικά με τη χρηματοδότηση, τη διαχείριση και την παρακολούθηση της κοινής γεωργικής πολιτικής και την κατάργηση των κανονισμών (ΕΟΚ) αριθ. 352/78, (ΕΚ) αριθ. 165/94, (ΕΚ) αριθ. 2799/98, (ΕΚ) αριθ. 814/2000, (ΕΚ) αριθ. 1290/2005 και (ΕΚ) αριθ. 485/2008 του Συμβουλίου (1), και ιδίως το άρθρο 26 παράγραφος 4,
Έπειτα από διαβούλευση με την επιτροπή των γεωργικών ταμείων,
Εκτιμώντας τα ακόλουθα:
|
(1) |
Στις 21 Μαρτίου 2014 η Επιτροπή ενέκρινε πρόταση κανονισμού του Ευρωπαϊκού Κοινοβουλίου και του Συμβουλίου σχετικά με τον καθορισμό του ποσοστού αναπροσαρμογής των άμεσων ενισχύσεων που προβλέπεται στον κανονισμό (ΕΚ) αριθ. 73/2009 του Συμβουλίου, όσον αφορά το ημερολογιακό έτος 2014 (2). Το Ευρωπαϊκό Κοινοβούλιο και το Συμβούλιο δεν είχαν καθορίσει το εν λόγω ποσοστό αναπροσαρμογής έως τις 30 Ιουνίου 2014. Επομένως, σύμφωνα με το άρθρο 26 παράγραφος 3 του κανονισμού (ΕΕ) αριθ. 1306/2013, η Επιτροπή καθόρισε το ποσοστό αναπροσαρμογής με τον εκτελεστικό κανονισμό (ΕΕ) αριθ. 879/2014 της Επιτροπής (3). |
|
(2) |
Οι προβλέψεις για τις άμεσες ενισχύσεις και τις δαπάνες που σχετίζονται με την αγορά, οι οποίες περιλαμβάνονται στη διορθωτική επιστολή αριθ. 1 της Επιτροπής στο σχέδιο προϋπολογισμού 2015, καταδεικνύουν την ανάγκη προσαρμογής του ποσοστού της δημοσιονομικής πειθαρχίας που ελήφθη υπόψη στο σχέδιο προϋπολογισμού του 2015. Η εν λόγω διορθωτική επιστολή συντάχθηκε αφού ελήφθη υπόψη ποσό δημοσιονομικής πειθαρχίας ύψους 433 εκατ. ευρώ για το αποθεματικό για κρίσεις στον γεωργικό τομέα, το οποίο αναφέρεται στο άρθρο 25 του κανονισμού (ΕΕ) αριθ. 1306/2013. Προκειμένου να ληφθούν υπόψη οι νέες αυτές πληροφορίες, η Επιτροπή θα πρέπει να τροποποιήσει το ποσοστό αναπροσαρμογής που καθορίζεται στον εκτελεστικό κανονισμό (ΕΕ) αριθ. 879/2014. |
|
(3) |
Κατά γενικό κανόνα, οι γεωργοί που υποβάλλουν αίτηση ενίσχυσης για άμεσες ενισχύσεις για ένα ημερολογιακό έτος (N) λαμβάνουν τις ενισχύσεις εντός καθορισμένης προθεσμίας πληρωμής στο πλαίσιο του οικονομικού έτους (N + 1). Ωστόσο, τα κράτη μέλη έχουν τη δυνατότητα να πραγματοποιούν καθυστερημένες πληρωμές στους γεωργούς, εντός ορισμένων ορίων, πέραν αυτής της προθεσμίας πληρωμής και χωρίς κανένα χρονικό όριο. Οι εν λόγω καθυστερημένες πληρωμές είναι δυνατόν να πραγματοποιηθούν σε μεταγενέστερο οικονομικό έτος. Όταν η δημοσιονομική πειθαρχία ισχύει για ορισμένο ημερολογιακό έτος, το ποσοστό αναπροσαρμογής δεν θα πρέπει να εφαρμόζεται στις ενισχύσεις για τις οποίες έχουν υποβληθεί αιτήσεις ενίσχυσης κατά τα ημερολογιακά έτη πέραν εκείνου για το οποίο ισχύει η δημοσιονομική πειθαρχία. Ως εκ τούτου, για να εξασφαλισθεί η ίση μεταχείριση των γεωργών είναι σκόπιμο να προβλεφθεί ότι το ποσοστό αναπροσαρμογής πρέπει να εφαρμοστεί μόνο για τις ενισχύσεις για τις οποίες έχουν υποβληθεί αιτήσεις ενίσχυσης κατά το ημερολογιακό έτος για το οποίο εφαρμόζεται η δημοσιονομική πειθαρχία, ανεξάρτητα από την ημερομηνία καταβολής της ενίσχυσης στους γεωργούς. |
|
(4) |
Το άρθρο 8 παράγραφος 1 του κανονισμού (ΕΕ) αριθ. 1307/2013 του Ευρωπαϊκού Κοινοβουλίου και του Συμβουλίου (4) προβλέπει ότι το ποσοστό αναπροσαρμογής που εφαρμόζεται στις άμεσες ενισχύσεις, το οποίο καθορίζεται σύμφωνα με το άρθρο 26 του κανονισμού (ΕΕ) αριθ. 1306/2013, εφαρμόζεται μόνο στις άμεσες ενισχύσεις ύψους άνω των 2 000 ευρώ, που χορηγούνται στους γεωργούς κατά το αντίστοιχο ημερολογιακό έτος. Επίσης, το άρθρο 8 παράγραφος 2 του κανονισμού (ΕΕ) αριθ. 1307/2013 προβλέπει ότι λόγω της σταδιακής εισαγωγής των αμέσων ενισχύσεων, το ποσοστό προσαρμογής εφαρμόζεται στη Βουλγαρία και στη Ρουμανία μόνο από την 1η Ιανουαρίου 2016 και στην Κροατία από την 1η Ιανουαρίου 2022. Συνεπώς, το ποσοστό αναπροσαρμογής που καθορίζεται από τον παρόντα κανονισμό δεν θα πρέπει να εφαρμοστεί στις ενισχύσεις που χορηγούνται στους γεωργούς των εν λόγω κρατών μελών. |
|
(5) |
Για να εξασφαλιστεί ότι το τροποποιημένο ποσοστό αναπροσαρμογής εφαρμόζεται από την ημερομηνία κατά την οποία πρόκειται να αρχίσουν οι ενισχύσεις στους γεωργούς, σύμφωνα με τον κανονισμό (ΕΕ) αριθ. 1306/2013, ο παρών κανονισμός θα πρέπει να εφαρμοστεί από την 1η Δεκεμβρίου 2014. |
|
(6) |
Το τροποποιημένο ποσοστό αναπροσαρμογής θα πρέπει να λαμβάνεται υπόψη για τον υπολογισμό της συνολικής ενίσχυσης που πρόκειται να χορηγηθεί στους γεωργούς για τις αιτήσεις ενίσχυσης που υποβάλλονται για το ημερολογιακό έτος 2014. Επομένως, για λόγους σαφήνειας, θα πρέπει να καταργηθεί ο εκτελεστικός κανονισμός (ΕΕ) αριθ. 879/2014, |
ΕΞΕΔΩΣΕ ΤΟΝ ΠΑΡΟΝΤΑ ΚΑΝΟΝΙΣΜΟ:
Άρθρο 1
1. Για την εφαρμογή της αναπροσαρμογής που προβλέπεται στα άρθρα 25 και 26 του κανονισμού (ΕΕ) αριθ. 1306/2013 και σύμφωνα με το άρθρο 8 παράγραφος 1 του κανονισμού (ΕΕ) αριθ. 1307/2013, μειώνονται κατά 1,302214 % τα ποσά των πληρωμών, κατά την έννοια του άρθρου 2 στοιχείο δ) του κανονισμού (ΕΚ) αριθ. 73/2009 του Συμβουλίου (5), ύψους άνω των 2 000 ευρώ, τα οποία χορηγούνται στους γεωργούς για τις αιτήσεις ενίσχυσης που υποβάλλονται όσον αφορά το ημερολογιακό έτος 2014.
2. Η μείωση που προβλέπεται στην παράγραφο 1 δεν ισχύει για τη Βουλγαρία, την Κροατία και τη Ρουμανία.
Άρθρο 2
Ο εκτελεστικός κανονισμός (ΕΕ) αριθ. 879/2014 καταργείται.
Άρθρο 3
Ο παρών κανονισμός αρχίζει να ισχύει την έβδομη ημέρα από τη δημοσίευσή του στην Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης.
Εφαρμόζεται από την 1η Δεκεμβρίου 2014.
Ο παρών κανονισμός είναι δεσμευτικός ως προς όλα τα μέρη του και ισχύει άμεσα σε κάθε κράτος μέλος.
Βρυξέλλες, , 17 Νοεμβρίου 2014.
Για την Επιτροπή
Ο Πρόεδρος
Jean-Claude JUNCKER
(1) ΕΕ L 347 της 20.12.2013, σ. 549.
(2) COM(2014)175.
(3) Εκτελεστικός κανονισμός (ΕΕ) αριθ. 879/2014 της Επιτροπής, της 12ης Αυγούστου 2014, σχετικά με τον καθορισμό του ποσοστού αναπροσαρμογής των άμεσων ενισχύσεων που προβλέπεται στον κανονισμό (ΕΚ) αριθ. 73/2009 του Συμβουλίου στο πλαίσιο του ημερολογιακού έτους 2014 (ΕΕ L 240 της 13.8.2014, σ. 20).
(4) Κανονισμός (ΕΕ) αριθ. 1307/2013 του Ευρωπαϊκού Κοινοβουλίου και του Συμβουλίου, της 17ης Δεκεμβρίου 2013, περί θεσπίσεως κανόνων για άμεσες ενισχύσεις στους γεωργούς βάσει καθεστώτων στήριξης στο πλαίσιο της κοινής γεωργικής πολιτικής και για την κατάργηση του κανονισμού (ΕΚ) αριθ. 637/2008 και του κανονισμού (ΕΚ) αριθ. 73/2009 του Συμβουλίου (ΕΕ L 347 της 20.12.2013, σ. 608).
(5) Κανονισμός (ΕΚ) αριθ. 73/2009 του Συμβουλίου, της 19ης Ιανουαρίου 2009, σχετικά με τη θέσπιση κοινών κανόνων για τα καθεστώτα άμεσης στήριξης για τους γεωργούς στο πλαίσιο της κοινής γεωργικής πολιτικής και τη θέσπιση ορισμένων καθεστώτων στήριξης για τους γεωργούς, για την τροποποίηση των κανονισμών (ΕΚ) αριθ. 1290/2005, (ΕΚ) αριθ. 247/2006, (ΕΚ) αριθ. 378/2007 και για την κατάργηση του κανονισμού (ΕΚ) αριθ. 1782/2003 (ΕΕ L 30 της 31.1.2009, σ. 16).
|
18.11.2014 |
EL |
Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης |
L 331/8 |
ΚΑΝΟΝΙΣΜΌΣ (ΕΕ) αριθ. 1228/2014 ΤΗΣ ΕΠΙΤΡΟΠΉΣ
της 17ης Νοεμβρίου 2014
σχετικά με την έγκριση και την άρνηση έγκρισης ορισμένων ισχυρισμών υγείας οι οποίοι διατυπώνονται για τα τρόφιμα και αφορούν τη μείωση του κινδύνου εκδήλωσης ασθένειας
(Κείμενο που παρουσιάζει ενδιαφέρον για τον ΕΟΧ)
Η ΕΥΡΩΠΑΪΚΗ ΕΠΙΤΡΟΠΗ,
Έχοντας υπόψη τη Συνθήκη για τη λειτουργία της Ευρωπαϊκής Ένωσης,
Έχοντας υπόψη τον κανονισμό (ΕΚ) αριθ. 1924/2006 του Ευρωπαϊκού Κοινοβουλίου και του Συμβουλίου, της 20ής Δεκεμβρίου 2006, σχετικά με τους ισχυρισμούς διατροφής και υγείας που διατυπώνονται στα τρόφιμα (1), και ιδίως το άρθρο 17 παράγραφος 3,
Εκτιμώντας τα ακόλουθα:
|
(1) |
Σύμφωνα με τον κανονισμό (ΕΚ) αριθ. 1924/2006, απαγορεύονται οι ισχυρισμοί υγείας στα τρόφιμα αν δεν έχουν εγκριθεί από την Επιτροπή σύμφωνα με τον εν λόγω κανονισμό και αν δεν περιλαμβάνονται σε κατάλογο επιτρεπόμενων ισχυρισμών. |
|
(2) |
Ο κανονισμός (ΕΚ) αριθ. 1924/2006 προβλέπει επίσης ότι οι αιτήσεις για την έγκριση ισχυρισμών υγείας μπορούν να υποβάλλονται από τους υπευθύνους των επιχειρήσεων τροφίμων στην αρμόδια εθνική αρχή ενός κράτους μέλους. Η αρμόδια εθνική αρχή διαβιβάζει τις έγκυρες αιτήσεις στην Ευρωπαϊκή Αρχή για την Ασφάλεια των Τροφίμων (EFSA), εφεξής αποκαλούμενη «η Αρχή». |
|
(3) |
Μετά την παραλαβή της αίτησης, η Αρχή ενημερώνει χωρίς καθυστέρηση τα υπόλοιπα κράτη μέλη και την Επιτροπή σχετικά με την αίτηση και διατυπώνει γνώμη για τον εν λόγω ισχυρισμό υγείας. |
|
(4) |
Η Επιτροπή αποφασίζει για την έγκριση των ισχυρισμών υγείας, λαμβάνοντας υπόψη τη γνώμη της Αρχής. |
|
(5) |
Μετά την αίτηση που υπέβαλε η Abtei Pharma Vertriebs GmbH σύμφωνα με το άρθρο 14 παράγραφος 1 στοιχείο α) του κανονισμού (ΕΚ) αριθ. 1924/2006, η Αρχή κλήθηκε να εκδώσει γνώμη σχετικά με ισχυρισμό υγείας ο οποίος αφορούσε μασώμενα δισκία ασβεστίου και βιταμίνης D3 και την απώλεια οστικής μάζας (Ερώτηση αριθ. EFSA-Q-2008-721) (2). Ο ισχυρισμός που προτάθηκε από τον αιτούντα είχε την ακόλουθη διατύπωση: «Τα μασώμενα δισκία με ασβέστιο και βιταμίνη D βελτιώνουν την οστική πυκνότητα στις γυναίκες ηλικίας 50 ετών και άνω. Ως εκ τούτου, τα μασώμενα δισκία μπορούν να μειώσουν τον κίνδυνο καταγμάτων λόγω οστεοπόρωσης». |
|
(6) |
Με βάση τα υποβληθέντα στοιχεία, η Αρχή στη γνώμη της, η οποία παρελήφθη από την Επιτροπή και τα κράτη μέλη στις 7 Αυγούστου 2009, κατέληγε στο συμπέρασμα ότι δεν τεκμηριώνεται η σχέση αιτίου-αποτελέσματος μεταξύ της πρόσληψης ασβεστίου, είτε μόνου είτε σε συνδυασμό με βιταμίνη D, και της μείωσης της απώλειας οστικής πυκνότητας (BMD) σε μετεμμηνοπαυσιακές γυναίκες. Η μείωση της απώλειας οστικής πυκνότητας μπορεί να συμβάλει στη μείωση του κινδύνου καταγμάτων. Συνεπώς, δύο ισχυρισμοί υγείας που αντικατοπτρίζουν το συμπέρασμα αυτό θα πρέπει να θεωρηθεί ότι συμμορφώνονται με τις απαιτήσεις του κανονισμού (ΕΚ) αριθ. 1924/2006 και θα πρέπει να συμπεριληφθούν στον κατάλογο της Ένωσης με τους επιτρεπόμενους ισχυρισμούς. Εντούτοις, η Αρχή κατέληξε στο συμπέρασμα ότι τα στοιχεία που υποβλήθηκαν ήταν ανεπαρκή για την τεκμηρίωση όρων χρήσης για τους ισχυρισμούς. Κατόπιν, η Επιτροπή απευθύνθηκε εκ νέου στην Αρχή για να ζητήσει περαιτέρω συμβουλές, ώστε οι διαχειριστές κινδύνων να είναι σε θέση να καθορίσουν τους δέοντες όρους χρήσης για τους σχετικούς ισχυρισμούς υγείας. Στη γνώμη της, η οποία παραλήφθηκε από την Επιτροπή και τα κράτη μέλη στις 17 Μαΐου 2010 (ερώτηση αριθ. EFSA-Q-2009-00940) (3), η Αρχή κατέληξε στο συμπέρασμα ότι θα πρέπει να καταναλώνονται καθημερινά τουλάχιστον 1 200 mg ασβεστίου από όλες τις πηγές ή τουλάχιστον 1 200 mg ασβεστίου και 800 I.U. (20 μg) βιταμίνης D από όλες τις πηγές για να επιτευχθεί η κατά τους ισχυρισμούς επίδραση. |
|
(7) |
Όταν ο ισχυρισμός υγείας διατυπώνεται μόνο σχετικά με το ασβέστιο, για να διασφαλιστεί ότι ένα τρόφιμο περιέχει σημαντική ποσότητα ασβεστίου είναι σκόπιμο να καθοριστούν όροι χρήσης που επιτρέπουν τη διατύπωση του ισχυρισμού μόνο σχετικά με τρόφιμα που παρέχουν τουλάχιστον 400 mg ασβεστίου ανά δόση, όπως αυτή ορίζεται ποσοτικά. |
|
(8) |
Λαμβανομένης υπόψη της υψηλής δόσης πρόσληψης βιταμίνης D που απαιτείται για να επιτευχθεί η κατά τους ισχυρισμούς επίδραση (20 μg), όταν ο ισχυρισμός υγείας γίνεται αναφορικά με τον συνδυασμό ασβεστίου και βιταμίνης D είναι σκόπιμο να περιορίζεται η χρήση του ισχυρισμού σε συμπληρώματα διατροφής. Προκειμένου να διασφαλιστεί ότι ένα συμπλήρωμα διατροφής παρέχει σημαντική ποσότητα ασβεστίου και βιταμίνης D στο πλαίσιο του εν λόγω ισχυρισμού, είναι σκόπιμο να καθοριστούν όροι χρήσης που να επιτρέπουν τη διατύπωση του ισχυρισμού μόνο για τα συμπληρώματα διατροφής που παρέχουν τουλάχιστον 400 mg ασβεστίου και 15 μg βιταμίνης D ανά ημερήσια μερίδα. |
|
(9) |
Μετά την αίτηση που υπέβαλε η DSM Nutritional Products Europe AG σύμφωνα με το άρθρο 14 παράγραφος 1 στοιχείο α) του κανονισμού (ΕΚ) αριθ. 1924/2006, η Αρχή κλήθηκε να εκδώσει γνώμη σχετικά με ισχυρισμό υγείας ο οποίος αφορούσε την επίδραση της βιταμίνης D και τον κίνδυνο πτώσης για άνδρες και γυναίκες ηλικίας 60 ετών και άνω (Ερώτηση αριθ. EFSA-Q-2010-01233) (4). Ο ισχυρισμός που προτάθηκε από τον αιτούντα είχε την ακόλουθη διατύπωση: «Η βιταμίνη D μειώνει τον κίνδυνο πτώσης. Η πτώση αποτελεί παράγοντα κινδύνου για κατάγματα». |
|
(10) |
Με βάση τα υποβληθέντα στοιχεία, η Αρχή, στη γνώμη της, η οποία παρελήφθη από την Επιτροπή και τα κράτη μέλη στις 30 Σεπτεμβρίου 2011, κατέληγε στο συμπέρασμα ότι τεκμηριώνεται η σχέση αιτίου-αποτελέσματος μεταξύ, αφενός, της πρόσληψης βιταμίνης D και, αφετέρου, της μείωσης του κινδύνου πτώσης που συνδέεται θετικά με την ορθοστατική αστάθεια και τη μυϊκή αδυναμία. Η μείωση του κινδύνου πτώσης μεταξύ των ανδρών και των γυναικών ηλικίας 60 ετών και άνω είναι ευεργετική για την ανθρώπινη υγεία λόγω της μείωσης του κινδύνου καταγμάτων. Συνεπώς, ένας ισχυρισμός υγείας που αντικατοπτρίζει το συμπέρασμα αυτό θα πρέπει να θεωρηθεί ότι συμμορφώνεται με τις απαιτήσεις του κανονισμού (ΕΚ) αριθ. 1924/2006 και θα πρέπει να συμπεριληφθεί στον κατάλογο της Ένωσης με τους επιτρεπόμενους ισχυρισμούς. |
|
(11) |
Στη γνώμη της, η Αρχή κατέληξε επίσης στο συμπέρασμα ότι θα πρέπει να καταναλώνονται καθημερινά 800 I.U. (20 μg) βιταμίνης D από όλες τις πηγές για να επιτευχθεί η κατά τους ισχυρισμούς επίδραση. Λαμβανομένης υπόψη της υψηλής δόσης πρόσληψης βιταμίνης D που απαιτείται για να επιτευχθεί η κατά τους ισχυρισμούς επίδραση (20 μg), είναι σκόπιμο να περιορίζεται η χρήση του ισχυρισμού σε συμπληρώματα διατροφής. Προκειμένου να διασφαλιστεί ότι ένα συμπλήρωμα διατροφής θα παρέχει σημαντική ποσότητα βιταμίνης D στο πλαίσιο του εν λόγω ισχυρισμού, είναι σκόπιμο να καθοριστούν όροι χρήσης που να επιτρέπουν τη διατύπωση του ισχυρισμού μόνο για τα συμπληρώματα διατροφής που παρέχουν τουλάχιστον 15 μg βιταμίνης D ανά ημερήσια μερίδα. |
|
(12) |
Το άρθρο 16 παράγραφος 4 του κανονισμού (ΕΚ) αριθ. 1924/2006 προβλέπει ότι μια γνώμη υπέρ της έγκρισης ενός ισχυρισμού υγείας θα πρέπει να περιλαμβάνει ορισμένα στοιχεία. Συνεπώς, τα στοιχεία αυτά θα πρέπει να παρατίθενται στο παράρτημα I του παρόντος κανονισμού όσον αφορά τους εγκεκριμένους ισχυρισμούς και να περιλαμβάνουν, κατά περίπτωση, την αναθεωρημένη διατύπωση του ισχυρισμού, τους ειδικούς όρους χρήσης του ισχυρισμού και, αν κρίνεται σκόπιμο, τους όρους ή τους περιορισμούς χρήσης του τροφίμου και/ή πρόσθετη δήλωση ή προειδοποίηση, σύμφωνα με τους κανόνες που θεσπίζονται στον κανονισμό (ΕΚ) αριθ. 1924/2006 και σύμφωνα με τις γνώμες της Αρχής. |
|
(13) |
Ένας από τους σκοπούς του κανονισμού (ΕΚ) αριθ. 1924/2006 είναι να εξασφαλίζει ότι οι ισχυρισμοί υγείας είναι αληθείς, σαφείς, αξιόπιστοι και χρήσιμοι για τον καταναλωτή και ότι η διατύπωση και η παρουσίαση λαμβάνονται υπόψη ως προς αυτό. Επομένως, όταν η διατύπωση των ισχυρισμών έχει το ίδιο νόημα για τους καταναλωτές με τη διατύπωση ενός εγκεκριμένου ισχυρισμού υγείας, επειδή καταδεικνύουν την ίδια σχέση που υπάρχει μεταξύ, αφενός, μιας κατηγορίας τροφίμων, ενός τροφίμου ή ενός από τα συστατικά του και, αφετέρου, της υγείας, θα πρέπει να υπόκεινται στους ίδιους όρους χρήσης που καθορίζονται στο παράρτημα I του παρόντος κανονισμού. |
|
(14) |
Μετά την αίτηση που υπέβαλε η GP International Holding BV σύμφωνα με το άρθρο 14 παράγραφος 1 στοιχείο α) του κανονισμού (ΕΚ) αριθ. 1924/2006, η Αρχή να εκδώσει γνώμη σχετικά με ισχυρισμό υγείας που αφορά την υδροχλωρική γλυκοζαμίνη και τα μειωμένα ποσοστά εκφύλισης χόνδρων (ερώτηση αριθ. EFSA-Q-2009-00412) (5). Ο ισχυρισμός που προτάθηκε από τον αιτούντα είχε την ακόλουθη διατύπωση: «Επιβραδύνει/μειώνει τη διαδικασία καταστροφής των χόνδρων του μυοσκελετικού συστήματος και κατά συνέπεια μειώνει τον κίνδυνο οστεοαρθρίτιδας». |
|
(15) |
Με βάση τα υποβληθέντα στοιχεία, η Αρχή στη γνώμη της, η οποία παρελήφθη από την Επιτροπή και τα κράτη μέλη στις 29 Οκτωβρίου 2009, κατέληγε στο συμπέρασμα ότι δεν τεκμηριώνεται η σχέση αίτιου-αποτελέσματος μεταξύ της πρόσληψης υδροχλωρικής γλυκοζαμίνης και της αναφερόμενης επίδρασης. Συνεπώς, εφόσον ο ισχυρισμός δεν συμμορφώνεται με τις απαιτήσεις του κανονισμού (ΕΚ) αριθ. 1924/2006, δεν θα πρέπει να εγκριθεί. |
|
(16) |
Μετά την αίτηση που υπέβαλε η ένωση ευρωπαίων παραγωγών φυσικών τροφίμων με βάση τη σόγια (ENSA), την ευρωπαϊκή ομοσπονδία φυτικών πρωτεϊνών (EUVEPRO) και την ένωση παραγωγών πρωτεΐνης σόγιας (SpA) σύμφωνα με το άρθρο 14 παράγραφος 1 στοιχείο α) του κανονισμού (ΕΚ) αριθ. 1924/2006, η Αρχή κλήθηκε να εκφέρει γνώμη σχετικά με ισχυρισμό υγείας ο οποίος αφορούσε την επίδραση της καθαρής πρωτεΐνης σόγιας στη μείωση των συγκεντρώσεων χοληστερόλης LDL στο αίμα (ερώτηση αριθ. EFSA-Q-2011-00784) (6). Ο ισχυρισμός που προτάθηκε από τον αιτούντα είχε την ακόλουθη διατύπωση: «Έχει αποδειχθεί ότι το πρωτεϊνούχο συστατικό της σόγιας μειώνει/περιορίζει τα επίπεδα χοληστερόλης στο αίμα· η μείωση των επιπέδων χοληστερόλης στο αίμα μειώνει τον κίνδυνο καρδιοπάθειας (στεφανιαίας νόσου)». |
|
(17) |
Με βάση τα υποβληθέντα στοιχεία, η Αρχή στη γνώμη της, η οποία παρελήφθη από την Επιτροπή και τα κράτη μέλη στις 2 Φεβρουαρίου 2012, κατέληγε στο συμπέρασμα ότι δεν τεκμηριώνεται η σχέση αιτίου-αποτελέσματος μεταξύ της κατανάλωσης καθαρής πρωτεΐνης σόγιας, όπως ορίζεται από τον αιτούντα, και της ισχυριζόμενης επίδρασης. Συνεπώς, εφόσον ο ισχυρισμός δεν συμμορφώνεται με τις απαιτήσεις του κανονισμού (ΕΚ) αριθ. 1924/2006, δεν θα πρέπει να εγκριθεί. |
|
(18) |
Μετά την αίτηση που υπέβαλε η Health Concern BV σύμφωνα με το άρθρο 14 παράγραφος 1 στοιχείο α) του κανονισμού (ΕΚ) αριθ. 1924/2006, η Αρχή κλήθηκε να εκδώσει γνώμη σχετικά με ισχυρισμό υγείας ο οποίος αφορούσε έναν συνδυασμό φυτοστερολών και Cholesternorm®mix, αφενός, και τη μείωση των συγκεντρώσεων χοληστερόλης LDL στο αίμα, αφετέρου (ερώτηση αριθ. EFSA-Q-2009-00237, EFSA-Q-2011-01114) (7). Ο ισχυρισμός που προτάθηκε από τον αιτούντα είχε την ακόλουθη διατύπωση: «Μειώνει ενεργά τη χοληστερόλη». |
|
(19) |
Με βάση τα υποβληθέντα στοιχεία, η Αρχή στη γνώμη της, η οποία παρελήφθη από την Επιτροπή και τα κράτη μέλη στις 17 Ιουλίου 2012, κατέληγε στο συμπέρασμα ότι δεν τεκμηριώνεται η σχέση αιτίου-αποτελέσματος μεταξύ της κατανάλωσης ενός συνδυασμού φυτοστερολών και Cholesternorm®mix, και της ισχυριζόμενης επίδρασης σύμφωνα με τους προτεινόμενους όρους χρήσης. Συνεπώς, εφόσον ο ισχυρισμός δεν συμμορφώνεται με τις απαιτήσεις του κανονισμού (ΕΚ) αριθ. 1924/2006, δεν θα πρέπει να εγκριθεί. |
|
(20) |
Μετά την αίτηση που υπέβαλε η Minami Nutrition Health BVBA σύμφωνα με το άρθρο 14 παράγραφος 1 στοιχείο α) του κανονισμού (ΕΚ) αριθ. 1924/2006, η Αρχή κλήθηκε να εκδώσει γνώμη σχετικά με ισχυρισμό υγείας που αφορούσε την επίδραση του εικοσαπενταενοϊκού οξέος (EPA) στη μείωση της αναλογίας αραχιδονικού οξέος (AA)/EPA στο αίμα παιδιών με διαταραχή έλλειψης προσοχής με υπερκινητικότητα (ADHD) (ερώτηση αριθ. EFSA-Q-2012-00573) (8). Ο ισχυρισμός που προτάθηκε από τον αιτούντα είχε την ακόλουθη διατύπωση: «Το EPA έχει αποδειχθεί ότι μειώνει την αναλογία AA/EPA στο αίμα. Μια υψηλή αναλογία AA/EPA αποτελεί παράγοντα κινδύνου για την ανάπτυξη διαταραχών συγκέντρωσης σε παιδιά με συμπτώματα παρόμοια με εκείνα της ADHD. Τα παιδιά αυτά χαρακτηρίζονται επίσης από λιγότερη υπερκινητικότητα και/ή συνυπάρχουσα αντιθετική συμπεριφορά». |
|
(21) |
Με βάση τα υποβληθέντα στοιχεία, η Αρχή στη γνώμη της, που παρελήφθη από την Επιτροπή και τα κράτη μέλη στις 8 Απριλίου 2013, κατέληξε στο συμπέρασμα ότι ο πληθυσμός-στόχος για τον ισχυρισμό είναι ασθενής πληθυσμός (δηλαδή παιδιά με ADHD) και ότι η κατά τους ισχυρισμούς επίδραση σχετίζεται με τη θεραπεία μιας ασθένειας. |
|
(22) |
Ο κανονισμός (ΕΚ) αριθ. 1924/2006 συμπληρώνει τις γενικές αρχές της οδηγίας 2000/13/ΕΚ του Ευρωπαϊκού Κοινοβουλίου και του Συμβουλίου, της 20ής Μαρτίου 2000, για προσέγγιση των νομοθεσιών των κρατών μελών σχετικά με την επισήμανση, την παρουσίαση και τη διαφήμιση των τροφίμων (9). Το άρθρο 2 παράγραφος 1 στοιχείο β) της οδηγίας 2000/13/ΕΚ ορίζει ότι στην επισήμανση δεν πρέπει να αποδίδονται στα τρόφιμα ιδιότητες πρόληψης, αγωγής ή θεραπείας ανθρώπινης νόσου, ούτε να αναφέρονται τέτοιες ιδιότητες. Συνεπώς, εφόσον ο καταλογισμός φαρμακευτικών ιδιοτήτων στα τρόφιμα απαγορεύεται, ο ισχυρισμός όσον αφορά την επίδραση του εικοσαπενταενοϊκού οξέος (EPA) σε μια μείωση της αναλογίας ΑΑ/EPA στο αίμα σε παιδιά με ADHD δεν θα πρέπει να εγκριθεί. |
|
(23) |
Μετά την αίτηση που υπέβαλαν οι McNeil Nutritionals και Raisio Nutrition Ltd. σύμφωνα με το άρθρο 14 παράγραφος 1 στοιχείο α) του κανονισμού (ΕΚ) αριθ. 1924/2006, η Αρχή κλήθηκε να εκδώσει γνώμη σχετικά με ισχυρισμό υγείας αναφορικά με την κατανάλωση 2g/ημέρα φυτοστανολών (ως εστέρων φυτοστανολών) ως μέρος διατροφής με χαμηλή περιεκτικότητα σε κορεσμένα λίπη και τη δύο φορές μεγαλύτερη μείωση των συγκεντρώσεων χοληστερόλης LDL στο αίμα, σε σύγκριση με μια διατροφή με χαμηλή περιεκτικότητα σε κορεσμένα λίπη (ερώτηση αριθ. EFSA-Q-2012-00915) (10). Ο ισχυρισμός που προτάθηκε από τον αιτούντα είχε την ακόλουθη διατύπωση: «Η κατανάλωση 2 g/ημέρα φυτοστανολών (ως εστέρων φυτοστανολών) ως μέρος μιας διατροφής με χαμηλή περιεκτικότητα σε κορεσμένα λίπη έχει ως αποτέλεσμα δύο φορές μεγαλύτερη μείωση των συγκεντρώσεων χοληστερόλης LDL στο αίμα απ' ό,τι μια διατροφή χαμηλή σε κορεσμένα λίπη. Τα υψηλά επίπεδα χοληστερόλης συνιστούν παράγοντα κινδύνου για την ανάπτυξη στεφανιαίας νόσου». |
|
(24) |
Με βάση τα υποβληθέντα στοιχεία, η Αρχή στη γνώμη της, η οποία παρελήφθη από την Επιτροπή και τα κράτη μέλη στις 8 Απριλίου 2013, κατέληγε στο συμπέρασμα ότι τα αποδεικτικά στοιχεία που υποβλήθηκαν από τον αιτούντα δεν αποδεικνύουν ότι η κατανάλωση 2 g/ημέρα φυτοστανολών (ως εστέρων φυτοστανολών) ως μέρος μιας διατροφής με χαμηλή περιεκτικότητα σε κορεσμένα λίπη έχει ως αποτέλεσμα δύο φορές μεγαλύτερη μείωση των συγκεντρώσεων χοληστερόλης LDL στο αίμα απ' ό,τι μια διατροφή χαμηλή σε κορεσμένα λίπη. Συνεπώς, εφόσον ο ισχυρισμός δεν συμμορφώνεται με τις απαιτήσεις του κανονισμού (ΕΚ) αριθ. 1924/2006, δεν θα πρέπει να εγκριθεί. |
|
(25) |
Τα σχόλια των αιτούντων και του κοινού τα οποία παρέλαβε η Επιτροπή, σύμφωνα με το άρθρο 16 παράγραφος 6 του κανονισμού (ΕΚ) αριθ. 1924/2006, ελήφθησαν υπόψη κατά τον καθορισμό των μέτρων που προβλέπονται στον παρόντα κανονισμό. |
|
(26) |
Η προσθήκη ουσιών ή η χρήση ουσιών στα τρόφιμα διέπεται από ειδική ενωσιακή και εθνική νομοθεσία, όπως και η ταξινόμηση προϊόντων ως τροφίμων ή φαρμάκων. Κάθε απόφαση σχετικά με ισχυρισμό υγείας σύμφωνα με τον κανονισμό (ΕΚ) αριθ. 1924/2006, όπως η ένταξη στον κατάλογο των επιτρεπόμενων ισχυρισμών που αναφέρεται στο άρθρο 14 παράγραφος 1 του εν λόγω κανονισμού, δεν συνιστά άδεια για την εμπορία της ουσίας για την οποία γίνεται ο ισχυρισμός, απόφαση σχετικά με το κατά πόσον μπορεί να χρησιμοποιηθεί αυτή η ουσία στα τρόφιμα, ούτε ταξινόμηση ενός συγκεκριμένου προϊόντος ως τροφίμου. |
|
(27) |
Τα μέτρα που προβλέπονται στον παρόντα κανονισμό είναι σύμφωνα με τη γνώμη της μόνιμης επιτροπής για την τροφική αλυσίδα και την υγεία των ζώων, |
ΕΞΕΔΩΣΕ ΤΟΝ ΠΑΡΟΝΤΑ ΚΑΝΟΝΙΣΜΟ:
Άρθρο 1
1. Οι ισχυρισμοί υγείας που παρατίθενται στο παράρτημα I του παρόντος κανονισμού μπορούν να διατυπώνονται για τρόφιμα που διατίθενται στην ενωσιακή αγορά σύμφωνα με τους όρους που προβλέπονται στο εν λόγω παράρτημα.
2. Οι ισχυρισμοί υγείας που αναφέρονται στην παράγραφο 1 περιλαμβάνονται στον κατάλογο επιτρεπόμενων ισχυρισμών της Ένωσης που αναφέρεται στο άρθρο 14 παράγραφος 1 του κανονισμού (ΕΚ) αριθ. 1924/2006.
Άρθρο 2
Οι ισχυρισμοί υγείας που παρατίθενται στο παράρτημα II του παρόντος κανονισμού δεν περιλαμβάνονται στον κατάλογο επιτρεπόμενων ισχυρισμών της Ένωσης όπως προβλέπεται στο άρθρο 14 παράγραφος 1 του κανονισμού (ΕΚ) αριθ. 1924/2006.
Άρθρο 3
Ο παρών κανονισμός αρχίζει να ισχύει την εικοστή ημέρα από τη δημοσίευσή του στην Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης.
Ο παρών κανονισμός είναι δεσμευτικός ως προς όλα τα μέρη του και ισχύει άμεσα σε κάθε κράτος μέλος.
Βρυξέλλες, 17 Νοεμβρίου 2014.
Για την Επιτροπή
Ο Πρόεδρος
Jean-Claude JUNCKER
(1) ΕΕ L 404 της 30.12.2006, σ. 9.
(2) EFSA Journal (2009) 1180, σ. 1-13.
(3) EFSA Journal (2010)· 8(5):1609.
(4) EFSA Journal (2011)· 9(9):2382.
(5) EFSA Journal 2009· 7(10):1358.
(6) EFSA Journal 2012· 10(2):2555.
(7) EFSA Journal 2012· 10(7):2810.
(8) EFSA Journal 2013· 11(4):3161.
(9) ΕΕ L 109 της 6.5.2000, σ. 29.
(10) EFSA Journal 2013· 11(4):3160.
ΠΑΡΑΡΤΗΜΑ I
Επιτρεπόμενοι ισχυρισμοί υγείας
|
Αίτηση — Σχετικές διατάξεις του κανονισμού (ΕΚ) αριθ. 1924/2006 |
Διεύθυνση αιτούντος |
Θρεπτικά συστατικά, ουσίες, τρόφιμα ή κατηγορία τροφίμων |
Ισχυρισμός |
Όροι χρήσης του ισχυρισμού |
Όροι και/ή περιορισμοί χρήσης του τροφίμου και/ή πρόσθετη δήλωση ή προειδοποίηση |
Αριθ. αναφοράς της γνώμης της EFSA |
|
Ισχυρισμός υγείας σύμφωνα με το άρθρο 14 παράγραφος 1 στοιχείο α) ο οποίος αφορά τη μείωση του κινδύνου εκδήλωσης ασθένειας |
Abtei Pharma Vertriebs GmbH, Abtei 1, 37696, Marienműnster, Γερμανία |
Ασβέστιο |
Το ασβέστιο συμβάλλει στη μείωση της απώλειας της οστικής πυκνότητας σε μετεμμηνοπαυσιακές γυναίκες. Η χαμηλή οστική πυκνότητα είναι ένας παράγοντας κινδύνου για κατάγματα λόγω οστεοπόρωσης. |
O ισχυρισμός μπορεί να χρησιμοποιηθεί μόνο για τρόφιμα που παρέχουν τουλάχιστον 400 mg ασβεστίου ανά δόση όπως ορίζεται ποσοτικά. Ο καταναλωτής θα πρέπει να πληροφορείται ότι ο ισχυρισμός προορίζεται ειδικά για τις γυναίκες 50 ετών και άνω και ότι τα ευεργετικά αποτελέσματα εξασφαλίζονται με την ημερήσια πρόσληψη τουλάχιστον 1 200 mg ασβεστίου από όλες τις πηγές. |
Για τα τρόφιμα με πρόσθετο ασβέστιο, ο ισχυρισμός μπορεί να χρησιμοποιηθεί μόνο για εκείνα που απευθύνονται σε γυναίκες 50 ετών και άνω. |
Q-2008-721 Q-2009-00940 |
|
Ισχυρισμός υγείας σύμφωνα με το άρθρο 14 παράγραφος 1 στοιχείο α) ο οποίος αφορά τη μείωση του κινδύνου εκδήλωσης ασθένειας |
Abtei Pharma Vertriebs GmbH, Abtei 1, 37696, Marienműnster, Γερμανία |
Ασβέστιο και βιταμίνη D |
Το ασβέστιο και η βιταμίνη D συμβάλλουν στη μείωση της απώλειας της οστικής πυκνότητας σε μετεμμηνοπαυσιακές γυναίκες. Η χαμηλή οστική πυκνότητα είναι ένας παράγοντας κινδύνου για κατάγματα λόγω οστεοπόρωσης. |
O ισχυρισμός μπορεί να χρησιμοποιηθεί μόνο για συμπληρώματα διατροφής που παρέχουν τουλάχιστον 400 mg ασβεστίου και 15 μg βιταμίνης D ανά ημερήσια δόση. Ο καταναλωτής θα πρέπει να πληροφορείται ότι ο ισχυρισμός προορίζεται ειδικά για τις γυναίκες 50 ετών και άνω και ότι τα ευεργετικά αποτελέσματα εξασφαλίζονται με την ημερήσια πρόσληψη τουλάχιστον 1 200 mg ασβεστίου και 20 μg βιταμίνης D από όλες τις πηγές. |
Για τα τρόφιμα με πρόσθετο ασβέστιο και/ή βιταμίνη D, ο ισχυρισμός μπορεί να χρησιμοποιηθεί μόνο για εκείνα που απευθύνονται σε γυναίκες 50 ετών και άνω. |
Q-2008-721 Q-2009-00940 |
|
Ισχυρισμός υγείας σύμφωνα με το άρθρο 14 παράγραφος 1 στοιχείο α) ο οποίος αφορά τη μείωση του κινδύνου εκδήλωσης ασθένειας |
DSM Nutritional Products Europe AG, P.O. Box 2676, 4002 Βασιλεία, Ελβετία |
Βιταμίνη D |
Η βιταμίνη D συμβάλλει στη μείωση του κινδύνου πτώσης, που συνδέεται θετικά με την ορθοστατική αστάθεια και τη μυϊκή αδυναμία. Η πτώση αποτελεί παράγοντα κινδύνου για κατάγματα μεταξύ των ανδρών και γυναικών ηλικίας 60 ετών και άνω. |
O ισχυρισμός μπορεί να χρησιμοποιηθεί μόνο για συμπληρώματα διατροφής που παρέχουν τουλάχιστον 15 μg βιταμίνης D ανά ημερήσια δόση. Ο καταναλωτής θα πρέπει να πληροφορείται ότι τα ευεργετικά αποτελέσματα εξασφαλίζονται με την ημερήσια πρόσληψη 20 μg βιταμίνης D από όλες τις πηγές. |
Για τα τρόφιμα με πρόσθετη βιταμίνη D, ο ισχυρισμός μπορεί να χρησιμοποιηθεί μόνο για εκείνα που απευθύνονται σε άνδρες και γυναίκες 60 ετών και άνω. |
Q-2010-01233 |
ΠΑΡΑΡΤΗΜΑ II
Απορριφθέντες ισχυρισμοί υγείας
|
Αίτηση — Σχετικές διατάξεις του κανονισμού (ΕΚ) αριθ. 1924/2006 |
Θρεπτικά συστατικά, ουσίες, τρόφιμα ή κατηγορία τροφίμων |
Ισχυρισμός |
Αριθ. αναφοράς της γνώμης της EFSA |
|
Ισχυρισμός υγείας σύμφωνα με το άρθρο 14 παράγραφος 1 στοιχείο α) ο οποίος αφορά τη μείωση του κινδύνου εκδήλωσης ασθένειας |
Υδροχλωρική γλυκοζαμίνη |
Επιβραδύνει/μειώνει τη διαδικασία καταστροφής των χόνδρων του μυοσκελετικού συστήματος και κατά συνέπεια μειώνει τον κίνδυνο οστεοαρθρίτιδας. |
Q-2009-00412 |
|
Ισχυρισμός υγείας σύμφωνα με το άρθρο 14 παράγραφος 1 στοιχείο α) ο οποίος αφορά τη μείωση του κινδύνου εκδήλωσης ασθένειας |
Καθαρή πρωτεΐνη σόγιας |
Έχει αποδειχθεί ότι το πρωτεϊνούχο συστατικό της σόγιας μειώνει/περιορίζει τα επίπεδα χοληστερόλης στο αίμα· η μείωση των επιπέδων χοληστερόλης στο αίμα μπορεί να μειώσει τον κίνδυνο καρδιοπάθειας (στεφανιαίας νόσου). |
Q-2011-00784 |
|
Ισχυρισμός υγείας σύμφωνα με το άρθρο 14 παράγραφος 1 στοιχείο α) ο οποίος αφορά τη μείωση του κινδύνου εκδήλωσης ασθένειας |
Φυτοστερόλες σε συνδυασμό με Cholesternorm®mix |
Μειώνει ενεργά τη χοληστερόλη. |
Q-2009-00237 Q-2011-01114 |
|
Ισχυρισμός υγείας σύμφωνα με το άρθρο 14 παράγραφος 1 στοιχείο α) ο οποίος αφορά τη μείωση του κινδύνου εκδήλωσης ασθένειας |
Εικοσαπενταενοϊκό οξύ (EPA) |
Το EPA έχει αποδειχθεί ότι μειώνει την αναλογία AA/EPA στο αίμα. Μία υψηλή αναλογία AA/EPA αποτελεί παράγοντα κινδύνου για την ανάπτυξη διαταραχών συγκέντρωσης σε παιδιά με συμπτώματα παρόμοια με εκείνα της ADHD. Τα παιδιά αυτά χαρακτηρίζονται επίσης από λιγότερη υπερκινητικότητα και/ή συνυπάρχουσα αντιθετική συμπεριφορά. |
Q-2012-00573 |
|
Ισχυρισμός υγείας σύμφωνα με το άρθρο 14 παράγραφος 1 στοιχείο α) ο οποίος αφορά τη μείωση του κινδύνου εκδήλωσης ασθένειας |
Φυτοστανόλες (ως εστέρες φυτοστανολών) |
Η κατανάλωση 2 g/ημέρα φυτοστανολών (ως εστέρων φυτοστανολών) ως μέρος μιας διατροφής με χαμηλή περιεκτικότητα σε κορεσμένα λίπη έχει ως αποτέλεσμα δύο φορές μεγαλύτερη μείωση των συγκεντρώσεων χοληστερόλης LDL στο αίμα από μια διατροφή χαμηλή σε κορεσμένα λίπη. Τα υψηλά επίπεδα χοληστερόλης συνιστούν παράγοντα κινδύνου για την ανάπτυξη στεφανιαίας νόσου. |
Q-2012-00915 |
|
18.11.2014 |
EL |
Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης |
L 331/14 |
ΚΑΝΟΝΙΣΜΌΣ (ΕΕ) αριθ. 1229/2014 ΤΗΣ ΕΠΙΤΡΟΠΉΣ
της 17ης Νοεμβρίου 2014
σχετικά με την άρνηση έγκρισης ορισμένων ισχυρισμών υγείας που διατυπώνονται για τα τρόφιμα, διαφορετικών από τους ισχυρισμούς που αφορούν τη μείωση του κινδύνου εκδήλωσης νόσου και την ανάπτυξη και την υγεία των παιδιών
(Κείμενο που παρουσιάζει ενδιαφέρον για τον ΕΟΧ)
Η ΕΥΡΩΠΑΪΚΗ ΕΠΙΤΡΟΠΗ,
Έχοντας υπόψη τη Συνθήκη για τη λειτουργία της Ευρωπαϊκής Ένωσης,
Έχοντας υπόψη τον κανονισμό (ΕΚ) αριθ. 1924/2006 του Ευρωπαϊκού Κοινοβουλίου και του Συμβουλίου, της 20ής Δεκεμβρίου 2006, σχετικά με τους ισχυρισμούς επί θεμάτων διατροφής και υγείας που διατυπώνονται για τα τρόφιμα (1), και ιδίως το άρθρο 18 παράγραφος 5,
Εκτιμώντας τα ακόλουθα:
|
(1) |
Σύμφωνα με τον κανονισμό (ΕΚ) αριθ. 1924/2006, απαγορεύονται οι ισχυρισμοί υγείας που διατυπώνονται για τα τρόφιμα εάν δεν έχουν εγκριθεί από την Επιτροπή σύμφωνα με τον εν λόγω κανονισμό και εάν δεν περιλαμβάνονται σε κατάλογο επιτρεπόμενων ισχυρισμών. |
|
(2) |
Ο κανονισμός (ΕΚ) αριθ. 1924/2006 προβλέπει επίσης ότι οι αιτήσεις για την έγκριση ισχυρισμών υγείας μπορούν να υποβάλλονται από τους υπευθύνους των επιχειρήσεων τροφίμων στην αρμόδια εθνική αρχή ενός κράτους μέλους. Η εθνική αρμόδια αρχή πρέπει να διαβιβάζει τις έγκυρες αιτήσεις στην Ευρωπαϊκή Αρχή για την Ασφάλεια των Τροφίμων (ΕFSA), που στο εξής αναφέρεται ως «η Αρχή», για επιστημονική αξιολόγηση, καθώς και στην Επιτροπή και στα κράτη μέλη για ενημέρωση. |
|
(3) |
Η Αρχή διατυπώνει γνώμη για τον υπό εξέταση ισχυρισμό υγείας. |
|
(4) |
Η Επιτροπή αποφασίζει για την έγκριση των ισχυρισμών υγείας, λαμβάνοντας υπόψη τη γνώμη της Αρχής. |
|
(5) |
Μετά την αίτηση που υποβλήθηκε από την Italsur s.r.l. σύμφωνα με το άρθρο 13 παράγραφος 5 του κανονισμού (ΕΚ) αριθ. 1924/2006, η Αρχή κλήθηκε να εκδώσει γνώμη σχετικά με ισχυρισμό υγείας ο οποίος αφορούσε την επίδραση του συνδυασμού λαχανίδας Τοσκάνης, «τρίχρωμων» σέσκουλων, «δίχρωμου» σπανακιού και «κυανού» λάχανου Σαβοΐας και την προστασία των λιπιδίων του αίματος από οξειδωτικές βλάβες (Ερώτηση αριθ. EFSA-Q-2013-00574) (2). Ο ισχυρισμός που προτάθηκε από τον αιτούντα είχε την ακόλουθη διατύπωση: «συμβάλλει στην προστασία των λιπιδίων του αίματος από οξειδωτικές βλάβες». |
|
(6) |
Στις 30 Οκτωβρίου 2013 η Επιτροπή και τα κράτη μέλη παρέλαβαν την επιστημονική γνώμη της Αρχής, που κατέληγε στο συμπέρασμα ότι, με βάση τα στοιχεία που υποβλήθηκαν, δεν τεκμηριώνεται επιστημονικά η σχέση αιτίου-αποτελέσματος μεταξύ της κατανάλωσης του συνδυασμού λαχανίδας Τοσκάνης, «τρίχρωμων» σέσκουλων, «δίχρωμου» σπανακιού και «κυανού» λάχανου Σαβοΐας και της κατά τους ισχυρισμούς επίδρασης. Συνεπώς, εφόσον ο ισχυρισμός δεν συμμορφώνεται με τις απαιτήσεις του κανονισμού (ΕΚ) αριθ. 1924/2006, δεν θα πρέπει να εγκριθεί. |
|
(7) |
Μετά την αίτηση που υποβλήθηκε από την Italsur s.r.l. σύμφωνα με το άρθρο 13 παράγραφος 5 του κανονισμού (ΕΚ) αριθ. 1924/2006, η Αρχή κλήθηκε να εκδώσει γνώμη σχετικά με ισχυρισμό υγείας ο οποίος αφορούσε την επίδραση του συνδυασμού κόκκινου σπανακιού, πράσινου σπανακιού, κόκκινου κιχώριου, πράσινου κιχώριου, πρασινόφυλλων σέσκουλων, κοκκινόφυλλων σέσκουλων, σέσκουλων με κόκκινο μίσχο, σέσκουλων με κίτρινο μίσχο και σέσκουλων με λευκό μίσχο και την προστασία των λιπιδίων του αίματος από οξειδωτικές βλάβες (Ερώτηση αριθ. EFSA-Q-2013-00575) (3). Ο ισχυρισμός που προτάθηκε από τον αιτούντα είχε την ακόλουθη διατύπωση: «συμβάλλει στην προστασία των λιπιδίων του αίματος από οξειδωτικές βλάβες». |
|
(8) |
Στις 30 Οκτωβρίου 2013 η Επιτροπή και τα κράτη μέλη παρέλαβαν την επιστημονική γνώμη της Αρχής, που κατέληγε στο συμπέρασμα ότι, με βάση τα στοιχεία που υποβλήθηκαν, δεν τεκμηριώνεται επιστημονικά η σχέση αιτίου-αποτελέσματος μεταξύ της κατανάλωσης του συνδυασμού κόκκινου σπανακιού, πράσινου σπανακιού, κόκκινου κιχώριου, πράσινου κιχώριου, πρασινόφυλλων σέσκουλων, κοκκινόφυλλων σέσκουλων, σέσκουλων με κόκκινο μίσχο, σέσκουλων με κίτρινο μίσχο και σέσκουλων με λευκό μίσχο και της κατά τους ισχυρισμούς επίδρασης. Συνεπώς, εφόσον ο ισχυρισμός δεν συμμορφώνεται με τις απαιτήσεις του κανονισμού (ΕΚ) αριθ. 1924/2006, δεν θα πρέπει να εγκριθεί. |
|
(9) |
Μετά την αίτηση που υποβλήθηκε από την Italsur s.r.l. σύμφωνα με το άρθρο 13 παράγραφος 5 του κανονισμού (ΕΚ) αριθ. 1924/2006, η Αρχή κλήθηκε να εκδώσει γνώμη σχετικά με ισχυρισμό υγείας ο οποίος αφορούσε την επίδραση του συνδυασμού λαχανίδας Τοσκάνης, «τρίχρωμων» σέσκουλων, «δίχρωμου» σπανακιού και «κυανού» λάχανου Σαβοΐας και τη διατήρηση των φυσιολογικών επιπέδων της χοληστερόλης LDL στο αίμα (Ερώτηση αριθ. EFSA-Q-2013-00576) (4). Ο ισχυρισμός που προτάθηκε από τον αιτούντα είχε την ακόλουθη διατύπωση: «διατηρεί τα φυσιολογικά επίπεδα χοληστερόλης στο αίμα». |
|
(10) |
Στις 30 Οκτωβρίου 2013 η Επιτροπή και τα κράτη μέλη παρέλαβαν την επιστημονική γνώμη της Αρχής, που κατέληγε στο συμπέρασμα ότι, με βάση τα στοιχεία που υποβλήθηκαν, δεν τεκμηριώνεται επιστημονικά η σχέση αιτίου-αποτελέσματος μεταξύ της κατανάλωσης του συνδυασμού λαχανίδας Τοσκάνης, «τρίχρωμων» σέσκουλων, «δίχρωμου» σπανακιού και «κυανού» λάχανου Σαβοΐας και της κατά τους ισχυρισμούς επίδρασης. Συνεπώς, εφόσον ο ισχυρισμός δεν συμμορφώνεται με τις απαιτήσεις του κανονισμού (ΕΚ) αριθ. 1924/2006, δεν θα πρέπει να εγκριθεί. |
|
(11) |
Μετά την αίτηση που υποβλήθηκε από την Italsur s.r.l. σύμφωνα με το άρθρο 13 παράγραφος 5 του κανονισμού (ΕΚ) αριθ. 1924/2006, η Αρχή κλήθηκε να εκδώσει γνώμη σχετικά με ισχυρισμό υγείας ο οποίος αφορούσε την επίδραση του συνδυασμού κόκκινου σπανακιού, πράσινου σπανακιού, κόκκινου κιχώριου, πράσινου κιχώριου, πρασινόφυλλων σέσκουλων, κοκκινόφυλλων σέσκουλων, σέσκουλων με κόκκινο μίσχο, σέσκουλων με κίτρινο μίσχο και σέσκουλων με λευκό μίσχο και τη διατήρηση των φυσιολογικών επιπέδων της χοληστερόλης LDL στο αίμα (Ερώτηση αριθ. EFSA-Q-2013-00579) (5). Ο ισχυρισμός που προτάθηκε από τον αιτούντα είχε την ακόλουθη διατύπωση: «διατηρεί τα φυσιολογικά επίπεδα χοληστερόλης στο αίμα». |
|
(12) |
Στις 30 Οκτωβρίου 2013 η Επιτροπή και τα κράτη μέλη παρέλαβαν την επιστημονική γνώμη της Αρχής, που κατέληγε στο συμπέρασμα ότι, με βάση τα στοιχεία που υποβλήθηκαν, δεν τεκμηριώνεται επιστημονικά η σχέση αιτίου-αποτελέσματος μεταξύ της κατανάλωσης του συνδυασμού κόκκινου σπανακιού, πράσινου σπανακιού, κόκκινου κιχώριου, πράσινου κιχώριου, πρασινόφυλλων σέσκουλων, κοκκινόφυλλων σέσκουλων, σέσκουλων με κόκκινο μίσχο, σέσκουλων με κίτρινο μίσχο και σέσκουλων με λευκό μίσχο και της κατά τους ισχυρισμούς επίδρασης. Συνεπώς, εφόσον ο ισχυρισμός δεν συμμορφώνεται με τις απαιτήσεις του κανονισμού (ΕΚ) αριθ. 1924/2006, δεν θα πρέπει να εγκριθεί. |
|
(13) |
Μετά την αίτηση που υποβλήθηκε από την Omikron Italia S.r.l. σύμφωνα με το άρθρο 13 παράγραφος 5 του κανονισμού (ΕΚ) αριθ. 1924/2006, η Αρχή κλήθηκε να εκδώσει γνώμη σχετικά με ισχυρισμό υγείας ο οποίος αφορούσε την επίδραση του συνδυασμού διοσμίνης, τροξερουτίνης και εσπεριδίνης και τη διατήρηση της φυσιολογικής διαπερατότητας των τριχοειδών αγγείων (Ερώτηση αριθ. EFSA-Q-2013-00353) (6). Ο ισχυρισμός που προτάθηκε από τον αιτούντα είχε την ακόλουθη διατύπωση: «το φλαβονοειδές μείγμα που περιέχει 300 mg διοσμίνης, 300 mg τροξερουτίνης και 100 mg εσπεριδίνης συνεπικουρεί στη διατήρηση της φυσιολογικής διαπερατότητας των τριχοειδών αγγείων». |
|
(14) |
Στις 13 Ιανουαρίου 2014 η Επιτροπή και τα κράτη μέλη παρέλαβαν την επιστημονική γνώμη της Αρχής, που κατέληγε στο συμπέρασμα ότι, με βάση τα στοιχεία που υποβλήθηκαν, δεν τεκμηριώνεται επιστημονικά η σχέση αιτίου-αποτελέσματος μεταξύ της κατανάλωσης του συνδυασμού διοσμίνης, τροξερουτίνης και εσπεριδίνης και της κατά τους ισχυρισμούς επίδρασης. Συνεπώς, εφόσον ο ισχυρισμός δεν συμμορφώνεται με τις απαιτήσεις του κανονισμού (ΕΚ) αριθ. 1924/2006, δεν θα πρέπει να εγκριθεί. |
|
(15) |
Μετά την αίτηση που υποβλήθηκε από την Omikron Italia S.r.l. σύμφωνα με το άρθρο 13 παράγραφος 5 του κανονισμού (ΕΚ) αριθ. 1924/2006, η Αρχή κλήθηκε να εκδώσει γνώμη σχετικά με ισχυρισμό υγείας ο οποίος αφορούσε την επίδραση του συνδυασμού διοσμίνης, τροξερουτίνης και εσπεριδίνης και τη διατήρηση του φυσιολογικού φλεβικού τόνου (Ερώτηση αριθ. EFSA-Q-2013-00354) (7). Ο ισχυρισμός που προτάθηκε από τον αιτούντα είχε την ακόλουθη διατύπωση: «το φλαβονοειδές μείγμα που περιέχει 300 mg διοσμίνης, 300 mg τροξερουτίνης και 100 mg εσπεριδίνης συνεπικουρεί στη διατήρηση του φυσιολογικού φλεβικού τόνου». |
|
(16) |
Στις 13 Ιανουαρίου 2014 η Επιτροπή και τα κράτη μέλη παρέλαβαν την επιστημονική γνώμη της Αρχής, που κατέληγε στο συμπέρασμα ότι, με βάση τα στοιχεία που υποβλήθηκαν, δεν τεκμηριώνεται επιστημονικά η σχέση αιτίου-αποτελέσματος μεταξύ της κατανάλωσης του συνδυασμού διοσμίνης, τροξερουτίνης και εσπεριδίνης και της κατά τους ισχυρισμούς επίδρασης. Συνεπώς, εφόσον ο ισχυρισμός δεν συμμορφώνεται με τις απαιτήσεις του κανονισμού (ΕΚ) αριθ. 1924/2006, δεν θα πρέπει να εγκριθεί. |
|
(17) |
Μετά την αίτηση που υποβλήθηκε από την Italsur srl, σύμφωνα με το άρθρο 13 παράγραφος 5 του κανονισμού (ΕΚ) αριθ. 1924/2006, η Αρχή κλήθηκε να εκδώσει γνώμη σχετικά με ισχυρισμό υγείας ο οποίος αφορούσε την επίδραση της κριθαρόσουπας «Orzotto» και την προστασία των λιπιδίων του αίματος από οξειδωτικές βλάβες (Ερώτηση αριθ. EFSA-Q-2013-00578) (8). Ο ισχυρισμός που προτάθηκε από τον αιτούντα είχε την ακόλουθη διατύπωση: «συμβάλλει στην προστασία των λιπιδίων του αίματος από οξειδωτικές βλάβες». |
|
(18) |
Στις 10 Ιανουαρίου 2014 η Επιτροπή και τα κράτη μέλη παρέλαβαν την επιστημονική γνώμη της Αρχής, που κατέληγε στο συμπέρασμα ότι, με βάση τα στοιχεία που υποβλήθηκαν, δεν τεκμηριώνεται επιστημονικά η σχέση αιτίου-αποτελέσματος μεταξύ της κατανάλωσης της κριθαρόσουπας «Orzotto» και της κατά τους ισχυρισμούς επίδρασης. Συνεπώς, εφόσον ο ισχυρισμός δεν συμμορφώνεται με τις απαιτήσεις του κανονισμού (ΕΚ) αριθ. 1924/2006, δεν θα πρέπει να εγκριθεί. |
|
(19) |
Τα μέτρα που προβλέπονται στον παρόντα κανονισμό είναι σύμφωνα με τη γνώμη της μόνιμης επιτροπής για την τροφική αλυσίδα και την υγεία των ζώων, |
ΕΞΕΔΩΣΕ ΤΟΝ ΠΑΡΟΝΤΑ ΚΑΝΟΝΙΣΜΟ:
Άρθρο 1
Οι ισχυρισμοί υγείας που παρατίθενται στο παράρτημα του παρόντος κανονισμού δεν περιλαμβάνονται στον κατάλογο της Ένωσης με τους επιτρεπόμενους ισχυρισμούς ο οποίος προβλέπεται στο άρθρο 13 παράγραφος 3 του κανονισμού (ΕΚ) αριθ. 1924/2006.
Άρθρο 2
Ο παρών κανονισμός αρχίζει να ισχύει την εικοστή ημέρα από τη δημοσίευσή του στην Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης.
Ο παρών κανονισμός είναι δεσμευτικός ως προς όλα τα μέρη του και ισχύει άμεσα σε κάθε κράτος μέλος.
Βρυξέλλες, 17 Νοεμβρίου 2014.
Για την Επιτροπή
Ο Πρόεδρος
Jean-Claude JUNCKER
(1) ΕΕ L 404 της 30.12.2006, σ. 9.
(2) The EFSA Journal 2013· 11(10):3413.
(3) The EFSA Journal 2013· 11(10):3414.
(4) The EFSA Journal 2013· 11(10):3415.
(5) The EFSA Journal 2013· 11(10):3416.
(6) The EFSA Journal 2014· 12(1):3511.
(7) The EFSA Journal 2014· 12(1):3512.
(8) The EFSA Journal 2014· 12(1):3519.
ΠΑΡΑΡΤΗΜΑ
Ισχυρισμοί υγείας που απορρίφθηκαν
|
Αίτηση — Σχετικές διατάξεις του κανονισμού (ΕΚ) αριθ. 1924/2006 |
Θρεπτικό συστατικό, ουσία, τρόφιμο ή κατηγορία τροφίμων |
Ισχυρισμός |
Αρ. γνώμης EFSA |
|
Άρθρο 13 παράγραφος 5, ισχυρισμός υγείας ο οποίος βασίζεται σε νέα επιστημονικά στοιχεία και/ή περιλαμβάνει αίτημα προστασίας δεδομένων βιομηχανικής ιδιοκτησίας |
Συνδυασμός λαχανίδας Τοσκάνης, «τρίχρωμων» σέσκουλων, «δίχρωμου» σπανακιού και «κυανού» λάχανου Σαβοΐας |
Συμβάλλει στην προστασία των λιπιδίων του αίματος από οξειδωτικές βλάβες |
Q-2013-00574 |
|
Άρθρο 13 παράγραφος 5, ισχυρισμός υγείας ο οποίος βασίζεται σε νέα επιστημονικά στοιχεία και/ή περιλαμβάνει αίτημα προστασίας δεδομένων βιομηχανικής ιδιοκτησίας |
Συνδυασμός κόκκινου σπανακιού, πράσινου σπανακιού, κόκκινου κιχώριου, πράσινου κιχώριου, πρασινόφυλλων σέσκουλων, κοκκινόφυλλων σέσκουλων, σέσκουλων με κόκκινο μίσχο, σέσκουλων με κίτρινο μίσχο και σέσκουλων με λευκό μίσχο |
Συμβάλλει στην προστασία των λιπιδίων του αίματος από οξειδωτικές βλάβες |
Q-2013-00575 |
|
Άρθρο 13 παράγραφος 5, ισχυρισμός υγείας ο οποίος βασίζεται σε νέα επιστημονικά στοιχεία και/ή περιλαμβάνει αίτημα προστασίας δεδομένων βιομηχανικής ιδιοκτησίας |
Συνδυασμός λαχανίδας Τοσκάνης, «τρίχρωμων» σέσκουλων, «δίχρωμου» σπανακιού και «κυανού» λάχανου Σαβοΐας |
Διατηρεί τα φυσιολογικά επίπεδα χοληστερόλης στο αίμα |
Q-2013-00576 |
|
Άρθρο 13 παράγραφος 5, ισχυρισμός υγείας ο οποίος βασίζεται σε νέα επιστημονικά στοιχεία και/ή περιλαμβάνει αίτημα προστασίας δεδομένων βιομηχανικής ιδιοκτησίας |
Συνδυασμός κόκκινου σπανακιού, πράσινου σπανακιού, κόκκινου κιχώριου, πράσινου κιχώριου, πρασινόφυλλων σέσκουλων, κοκκινόφυλλων σέσκουλων, σέσκουλων με κόκκινο μίσχο, σέσκουλων με κίτρινο μίσχο και σέσκουλων με λευκό μίσχο |
Διατηρεί τα φυσιολογικά επίπεδα χοληστερόλης στο αίμα |
Q-2013-00579 |
|
Άρθρο 13 παράγραφος 5, ισχυρισμός υγείας ο οποίος βασίζεται σε νέα επιστημονικά στοιχεία και/ή περιλαμβάνει αίτημα προστασίας δεδομένων βιομηχανικής ιδιοκτησίας |
Συνδυασμός διοσμίνης, τροξερουτίνης και εσπεριδίνης |
Το φλαβονοειδές μείγμα που περιέχει 300 mg διοσμίνης, 300 mg τροξερουτίνης και 100 mg εσπεριδίνης συνεπικουρεί στη διατήρηση της φυσιολογικής διαπερατότητας των τριχοειδών αγγείων |
Q-2013-00353 |
|
Άρθρο 13 παράγραφος 5, ισχυρισμός υγείας ο οποίος βασίζεται σε νέα επιστημονικά στοιχεία και/ή περιλαμβάνει αίτημα προστασίας δεδομένων βιομηχανικής ιδιοκτησίας |
Συνδυασμός διοσμίνης, τροξερουτίνης και εσπεριδίνης |
Το φλαβονοειδές μείγμα που περιέχει 300 mg διοσμίνης, 300 mg τροξερουτίνης και 100 mg εσπεριδίνης συνεπικουρεί στη διατήρηση του φυσιολογικού φλεβικού τόνου |
Q-2013-00354 |
|
Άρθρο 13 παράγραφος 5, ισχυρισμός υγείας ο οποίος βασίζεται σε νέα επιστημονικά στοιχεία και/ή περιλαμβάνει αίτημα προστασίας δεδομένων βιομηχανικής ιδιοκτησίας |
Κριθαρόσουπα «Orzotto» |
Συμβάλλει στην προστασία των λιπιδίων του αίματος από οξειδωτικές βλάβες |
Q-2013-00578 |
|
18.11.2014 |
EL |
Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης |
L 331/18 |
ΕΚΤΕΛΕΣΤΙΚΌΣ ΚΑΝΟΝΙΣΜΌΣ (ΕΕ) αριθ. 1230/2014 ΤΗΣ ΕΠΙΤΡΟΠΉΣ
της 17ης Νοεμβρίου 2014
σχετικά με τη χορήγηση άδειας για τον διλυσινικό χαλκό ως πρόσθετη ύλη ζωοτροφών για όλα τα ζωικά είδη
(Κείμενο που παρουσιάζει ενδιαφέρον για τον ΕΟΧ)
Η ΕΥΡΩΠΑΪΚΗ ΕΠΙΤΡΟΠΗ,
Έχοντας υπόψη τη Συνθήκη για τη λειτουργία της Ευρωπαϊκής Ένωσης,
Έχοντας υπόψη τον κανονισμό (ΕΚ) αριθ. 1831/2003 του Ευρωπαϊκού Κοινοβουλίου και του Συμβουλίου, της 22ας Σεπτεμβρίου 2003, για τις πρόσθετες ύλες που χρησιμοποιούνται στη διατροφή των ζώων (1), και ιδίως το άρθρο 9 παράγραφος 2,
Εκτιμώντας τα ακόλουθα:
|
(1) |
Ο κανονισμός (ΕΚ) αριθ. 1831/2003 προβλέπει τη χορήγηση άδειας πρόσθετων υλών για τη διατροφή των ζώων και τους όρους και τις διαδικασίες για τη χορήγηση της εν λόγω άδειας. |
|
(2) |
Σύμφωνα με το άρθρο 7 του κανονισμού (ΕΚ) αριθ. 1831/2003, υποβλήθηκε αίτηση για τη χορήγηση άδειας της ουσίας. Η εν λόγω αίτηση συνοδευόταν από τα στοιχεία και τα έγγραφα που απαιτούνται βάσει του άρθρου 7 παράγραφος 3 του κανονισμού (ΕΚ) αριθ. 1831/2003. |
|
(3) |
Η αίτηση αφορά τη χορήγηση άδειας για τον διλυσινικό χαλκό ως πρόσθετη ύλη ζωοτροφών για όλα τα ζωικά είδη, ουσία η οποία ταξινομείται στην κατηγορία πρόσθετων υλών «θρεπτικές πρόσθετες ύλες». |
|
(4) |
Η γνώμη που εξέδωσε η Ευρωπαϊκή Αρχή για την Ασφάλεια των Τροφίμων («η Αρχή») στις 3 Ιουλίου 2014 (2) κατέληγε στο συμπέρασμα ότι ο διλυσινικός χαλκός, υπό τους προτεινόμενους όρους χρήσης, δεν έχει δυσμενείς επιδράσεις στην υγεία των ζώων, στην υγεία του ανθρώπου ή στο περιβάλλον και ότι μπορεί να θεωρηθεί πραγματική πηγή χαλκού για όλα τα ζωικά είδη. Η Αρχή δεν θεωρεί ότι υπάρχει ανάγκη να θεσπιστούν ειδικές απαιτήσεις παρακολούθησης μετά τη διάθεση στην αγορά. Η Αρχή επαλήθευσε, επίσης, την έκθεση σχετικά με τη μέθοδο ανάλυσης της πρόσθετης ύλης ζωοτροφών στις ζωοτροφές, η οποία υποβλήθηκε από το εργαστήριο αναφοράς το οποίο συστάθηκε με τον κανονισμό (ΕΚ) αριθ. 1831/2003. |
|
(5) |
Από την αξιολόγηση του διλυσινικού χαλκού διαπιστώνεται ότι πληρούνται οι όροι για τη χορήγηση άδειας που προβλέπονται στο άρθρο 5 του κανονισμού (ΕΚ) αριθ. 1831/2003. Συνεπώς, θα πρέπει να χορηγηθεί άδεια για τη χρήση της εν λόγω ουσίας, όπως καθορίζεται στο παράρτημα του παρόντος κανονισμού. |
|
(6) |
Τα μέτρα που προβλέπονται στον παρόντα κανονισμό είναι σύμφωνα με τη γνώμη της μόνιμης επιτροπής για τα φυτά, τα ζώα, τα τρόφιμα και τις ζωοτροφές, |
ΕΞΕΔΩΣΕ ΤΟΝ ΠΑΡΟΝΤΑ ΚΑΝΟΝΙΣΜΟ:
Άρθρο 1
Η ουσία που παρατίθεται στο παράρτημα και ανήκει στην κατηγορία πρόσθετων υλών «διατροφικές πρόσθετες ύλες» και στη λειτουργική ομάδα «ενώσεις ιχνοστοιχείων» επιτρέπεται να χρησιμοποιείται ως πρόσθετη ύλη στη διατροφή των ζώων υπό τους όρους που παρατίθενται στο εν λόγω παράρτημα.
Άρθρο 2
Ο παρών κανονισμός αρχίζει να ισχύει την εικοστή ημέρα από τη δημοσίευσή του στην Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης.
Ο παρών κανονισμός είναι δεσμευτικός ως προς όλα τα μέρη του και ισχύει άμεσα σε κάθε κράτος μέλος.
Βρυξέλλες, 17 Νοεμβρίου 2014.
Για την Επιτροπή
Ο Πρόεδρος
Jean-Claude JUNCKER
(1) ΕΕ L 268 της 18.10.2003, σ. 29.
(2) EFSA Journal 2014· 12(7):3796.
ΠΑΡΑΡΤΗΜΑ
|
Αριθμός ταυτοποίησης της πρόσθετης ύλης |
Επωνυμία του κατόχου της άδειας |
Πρόσθετη ύλη |
Σύνθεση, χημικός τύπος, περιγραφή, αναλυτική μέθοδος |
Είδος ή κατηγορία ζώου |
Μέγιστη ηλικία |
Ελάχιστη περιεκτικότητα |
Μέγιστη περιεκτικότητα |
Άλλες διατάξεις |
Λήξη της περιόδου ισχύος της άδειας |
||||||||||||||||||||||||||||
|
Περιεκτικότητα στοιχείου (Cu) σε mg/kg πλήρους ζωοτροφής με περιεκτικότητα σε υγρασία 12 % |
|||||||||||||||||||||||||||||||||||||
|
Κατηγορία θρεπτικών πρόσθετων υλών. Λειτουργική ομάδα: ενώσεις ιχνοστοιχείων |
|||||||||||||||||||||||||||||||||||||
|
3b411 |
— |
Διλυσινικός χαλκός |
Χαρακτηρισμός της πρόσθετης ύλης Σκόνη ή κόκκοι με περιεκτικότητα σε χαλκό ≥ 14,5 % και σε λυσίνη ≥ 84,0 %. Χαρακτηρισμός της δραστικής ουσίας Χηλικό σύμπλοκο χαλκού — υδροχλωρικής L-λυσίνης Χημικός τύπος: Cu(C6H13N2O2)2 × 2HCl Αριθμός CAS: 53383-24-7 Αναλυτικές μέθοδοι (1) Για τον ποσοτικό προσδιορισμό της περιεκτικότητας της πρόσθετης ύλης ζωοτροφών σε λυσίνη:
Για τον προσδιορισμό της ολικής περιεκτικότητας της πρόσθετης ύλης και των προμειγμάτων σε χαλκό:
Για τον προσδιορισμό της συνολικής περιεκτικότητας των πρώτων υλών ζωοτροφών και των σύνθετων ζωοτροφών σε χαλκό:
|
Όλα τα ζωικά είδη |
— |
— |
Βοοειδή:
Πρόβατα: 15 (σύνολο). Χοιρίδια έως και 12 εβδομάδων: 170 (σύνολο). Καρκινοειδή: 50 (σύνολο). Λοιπά ζώα: 25 (σύνολο). |
|
8 Δεκεμβρίου 2024 |
||||||||||||||||||||||||||||
(1) Πληροφορίες σχετικά με τις αναλυτικές μεθόδους διατίθενται στην ακόλουθη διεύθυνση του εργαστηρίου αναφοράς: https://ec.europa.eu/jrc/en/eurl/feed-additives/evaluation-reports
|
18.11.2014 |
EL |
Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης |
L 331/22 |
ΕΚΤΕΛΕΣΤΙΚΌΣ ΚΑΝΟΝΙΣΜΌΣ (ΕΕ) αριθ. 1231/2014 ΤΗΣ ΕΠΙΤΡΟΠΉΣ
της 17ης Νοεμβρίου 2014
για καθορισμό των κατ' αποκοπή τιμών εισαγωγής για τον προσδιορισμό της τιμής εισόδου ορισμένων οπωροκηπευτικών
Η ΕΥΡΩΠΑΪΚΗ ΕΠΙΤΡΟΠΗ,
Έχοντας υπόψη τη Συνθήκη για τη λειτουργία της Ευρωπαϊκής Ένωσης,
Έχοντας υπόψη τον κανονισμό (ΕΕ) αριθ. 1308/2013 του Ευρωπαϊκού Κοινοβουλίου και του Συμβουλίου, της 17ης Δεκεμβρίου 2013, για τη θέσπιση κοινής οργάνωσης των αγορών γεωργικών προϊόντων και την κατάργηση των κανονισμών (ΕΟΚ) αριθ. 922/72, (ΕΟΚ) αριθ. 234/79, (ΕΚ) αριθ. 1037/2001 και (ΕΚ) αριθ. 1234/2007 του Συμβουλίου (1),
Έχοντας υπόψη τον εκτελεστικό κανονισμό (ΕΕ) αριθ. 543/2011 της Επιτροπής, της 7ης Ιουνίου 2011, για τη θέσπιση λεπτομερών κανόνων εφαρμογής του κανονισμού (ΕΚ) αριθ. 1234/2007 του Συμβουλίου όσον αφορά τους τομείς των οπωροκηπευτικών και των μεταποιημένων οπωροκηπευτικών (2), και ιδίως το άρθρο 136 παράγραφος 1,
Εκτιμώντας τα ακόλουθα:
|
(1) |
Ο εκτελεστικός κανονισμός (ΕΕ) αριθ. 543/2011 προβλέπει, κατ' εφαρμογή των αποτελεσμάτων των πολυμερών εμπορικών διαπραγματεύσεων του Γύρου της Ουρουγουάης, τα κριτήρια για τον καθορισμό από την Επιτροπή των κατ' αποκοπή τιμών εισαγωγής από τρίτες χώρες, για τα προϊόντα και τις περιόδους που ορίζονται στο παράρτημα XVI μέρος A του εν λόγω κανονισμού. |
|
(2) |
Η κατ' αποκοπή τιμή εισαγωγής υπολογίζεται κάθε εργάσιμη ημέρα, σύμφωνα με το άρθρο 136 παράγραφος 1 του εκτελεστικού κανονισμού (ΕΕ) αριθ. 543/2011, λαμβανομένων υπόψη των ημερήσιων μεταβλητών στοιχείων. Συνεπώς, ο παρών κανονισμός θα πρέπει να αρχίσει να ισχύει την ημέρα της δημοσίευσής του στην Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης, |
ΕΞΕΔΩΣΕ ΤΟΝ ΠΑΡΟΝΤΑ ΚΑΝΟΝΙΣΜΟ:
Άρθρο 1
Οι κατ' αποκοπή τιμές εισαγωγής που αναφέρονται στο άρθρο 136 του εκτελεστικού κανονισμού (ΕΕ) αριθ. 543/2011 καθορίζονται στο παράρτημα του παρόντος κανονισμού.
Άρθρο 2
Ο παρών κανονισμός αρχίζει να ισχύει την ημέρα της δημοσίευσής του στην Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης.
Ο παρών κανονισμός είναι δεσμευτικός ως προς όλα τα μέρη του και ισχύει άμεσα σε κάθε κράτος μέλος.
Βρυξέλλες, 17 Νοεμβρίου 2014.
Για την Επιτροπή,
εξ ονόματος του Προέδρου,
Jerzy PLEWA
Γενικός Διευθυντής Γεωργίας και Αγροτικής Ανάπτυξης
(1) ΕΕ L 347 της 20.12.2013, σ. 671.
(2) ΕΕ L 157 της 15.6.2011, σ. 1.
ΠΑΡΑΡΤΗΜΑ
Οι κατ' αποκοπή τιμές εισαγωγής για τον προσδιορισμό της τιμής εισόδου ορισμένων οπωροκηπευτικών
|
(ευρώ/100 kg) |
||
|
Κωδικός ΣΟ |
Κωδικός τρίτων χωρών (1) |
Κατ' αποκοπή τιμή εισαγωγής |
|
0702 00 00 |
AL |
94,9 |
|
MA |
77,1 |
|
|
MK |
78,8 |
|
|
ZZ |
83,6 |
|
|
0707 00 05 |
AL |
67,4 |
|
JO |
194,1 |
|
|
TR |
128,5 |
|
|
ZZ |
130,0 |
|
|
0709 93 10 |
AL |
65,0 |
|
MA |
52,3 |
|
|
TR |
125,4 |
|
|
ZZ |
80,9 |
|
|
0805 20 10 |
MA |
130,6 |
|
ZZ |
130,6 |
|
|
0805 20 30, 0805 20 50, 0805 20 70, 0805 20 90 |
TR |
74,4 |
|
ZZ |
74,4 |
|
|
0805 50 10 |
TR |
78,7 |
|
ZZ |
78,7 |
|
|
0806 10 10 |
BR |
293,5 |
|
LB |
337,2 |
|
|
PE |
282,9 |
|
|
TR |
149,1 |
|
|
US |
303,0 |
|
|
ZZ |
273,1 |
|
|
0808 10 80 |
BR |
54,0 |
|
CA |
135,3 |
|
|
CL |
80,6 |
|
|
MD |
29,7 |
|
|
NZ |
144,2 |
|
|
US |
102,4 |
|
|
ZA |
108,6 |
|
|
ZZ |
93,5 |
|
|
0808 30 90 |
CN |
75,6 |
|
ZZ |
75,6 |
|
(1) Ονοματολογία των χωρών που ορίζεται στον κανονισμό (ΕΕ) αριθ. 1106/2012 της Επιτροπής, της 27ης Νοεμβρίου 2012, για την εφαρμογή του κανονισμού (ΕΚ) αριθ. 471/2009 του Ευρωπαϊκού Κοινοβουλίου και του Συμβουλίου για τις κοινοτικές στατιστικές του εξωτερικού εμπορίου με τις τρίτες χώρες, όσον αφορά την επικαιροποίηση της ονοματολογίας των χωρών και εδαφών (ΕΕ L 328 της 28.11.2012, σ. 7). Ο κωδικός «ZZ» αντιπροσωπεύει «άλλες χώρες καταγωγής».
ΑΠΟΦΑΣΕΙΣ
|
18.11.2014 |
EL |
Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης |
L 331/24 |
ΑΠΌΦΑΣΗ 2014/800/ΚΕΠΠΑ ΤΟΥ ΣΥΜΒΟΥΛΊΟΥ
της 17ης Νοεμβρίου 2014
για την έναρξη της συμβουλευτικής αποστολής της Ευρωπαϊκής Ένωσης για τη μεταρρύθμιση του τομέα της μη στρατιωτικής ασφάλειας στην Ουκρανία (EUAM Ukraine) και την τροποποίηση της απόφασης 2014/486/ΚΕΠΠΑ
ΤΟ ΣΥΜΒΟΥΛΙΟ ΤΗΣ ΕΥΡΩΠΑΪΚΗΣ ΕΝΩΣΗΣ,
Έχοντας υπόψη τη Συνθήκη για την Ευρωπαϊκή Ένωση, και ιδίως το άρθρο 28, το άρθρο 42 παράγραφος 4 και το άρθρο 43 παράγραφος 2,
Έχοντας υπόψη την απόφαση 2014/486/ΚΕΠΠΑ του Συμβουλίου, της 22ας Ιουλίου 2014, για τη συμβουλευτική αποστολή της Ευρωπαϊκής Ένωσης για τη μεταρρύθμιση του τομέα της μη στρατιωτικής ασφάλειας στην Ουκρανία (EUAM Ukraine) (1), και ιδίως το άρθρο 4,
Λαμβάνοντας υπόψη την πρόταση της Ύπατης Εκπροσώπου της Ένωσης για θέματα εξωτερικής πολιτικής και πολιτικής ασφαλείας,
Εκτιμώντας τα εξής:
|
(1) |
Στις 22 Ιουλίου 2014 το Συμβούλιο εξέδωσε την απόφαση 2014/486/ΚΕΠΠΑ. |
|
(2) |
Στις 20 Οκτωβρίου 2014 το Συμβούλιο ενέκρινε το σχέδιο επιχειρήσεων για την EUAM Ukraine. |
|
(3) |
Κατόπιν της σύστασης του διοικητή μη στρατιωτικών επιχειρήσεων, και την επίτευξη της αρχικής επιχειρησιακής δυνατότητας από την EUAM Ukraine, η αποστολή θα πρέπει να αρχίσει την 1η Δεκεμβρίου 2014. |
|
(4) |
Στην απόφαση 2014/486/ΚΕΠΠΑ προβλέπεται το δημοσιονομικό ποσό αναφοράς ύψους 2 680 000 EUR για την περίοδο μέχρι τις 30 Νοεμβρίου 2014. Θα πρέπει να προβλεφθεί νέο δημοσιονομικό ποσό αναφοράς για τη δωδεκάμηνη περίοδο που αρχίζει την 1η Δεκεμβρίου 2014. Συνεπώς, θα πρέπει να τροποποιηθεί η απόφαση 2014/486/ΚΕΠΠΑ. |
|
(5) |
Η EUAM Ukraine θα διεξαχθεί μέσα σε ένα πλαίσιο που μπορεί να επιδεινωθεί και θα μπορούσε να παρεμποδίσει την επίτευξη των στόχων της εξωτερικής δράσης της Ένωσης όπως ορίζονται στο άρθρο 21 της Συνθήκης, |
ΕΞΕΔΩΣΕ ΤΗΝ ΠΑΡΟΥΣΑ ΑΠΟΦΑΣΗ:
Άρθρο 1
Η συμβουλευτική αποστολή της Ευρωπαϊκής Ένωσης για τη μεταρρύθμιση του τομέα της μη στρατιωτικής ασφάλειας στην Ουκρανία (EUAM Ukraine) εκκινεί την 1η Δεκεμβρίου 2014.
Άρθρο 2
Ο διοικητής μη στρατιωτικών επιχειρήσεων της EUAM Ukraine εξουσιοδοτείται, με άμεση ισχύ, να αρχίσει την εκτέλεση της επιχείρησης.
Άρθρο 3
Το άρθρο 14 παράγραφος 1 της απόφασης 2014/486/ΚΕΠΠΑ αντικαθίσταται από το εξής:
«1. Το δημοσιονομικό ποσό αναφοράς που αποσκοπεί να καλύψει τις δαπάνες σχετικά με την EUAM Ukraine έως τις 30 Νοεμβρίου 2014 ανέρχεται σε 2 680 000 EUR. Το δημοσιονομικό ποσό αναφοράς που αποσκοπεί να καλύψει τις δαπάνες σχετικά με την EUAM Ukraine για την περίοδο από την 1η Δεκεμβρίου 2014 μέχρι την 30ή Νοεμβρίου 2015 ανέρχεται σε 13 100 000 EUR. Το ποσό δημοσιονομικής αναφοράς για τις μετέπειτα περιόδους αποφασίζεται από το Συμβούλιο.»
Άρθρο 4
Η παρούσα απόφαση αρχίζει να ισχύει την ημέρα της έκδοσής της.
Βρυξέλλες, 17 Νοεμβρίου 2014.
Για το Συμβούλιο
Η Πρόεδρος
F. MOGHERINI
(1) ΕΕ L 217 της 23.7.2014, σ. 42.
|
18.11.2014 |
EL |
Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης |
L 331/26 |
ΑΠΌΦΑΣΗ 2014/801/ΚΕΠΠΑ ΤΟΥ ΣΥΜΒΟΥΛΊΟΥ
της 17ης Νοεμβρίου 2014
για την τροποποίηση της απόφασης 2014/145/ΚΕΠΠΑ σχετικά με περιοριστικά μέτρα όσον αφορά δράσεις που υπονομεύουν ή απειλούν την εδαφική ακεραιότητα, την κυριαρχία και την ανεξαρτησία της Ουκρανίας
ΤΟ ΣΥΜΒΟΥΛΙΟ ΤΗΣ ΕΥΡΩΠΑΪΚΗΣ ΕΝΩΣΗΣ,
Έχοντας υπόψη τη Συνθήκη για την Ευρωπαϊκή Ένωση, και ιδίως το άρθρο 29,
Εκτιμώντας τα ακόλουθα:
|
(1) |
Στις 17 Μαρτίου 2014 το Συμβούλιο εξέδωσε την απόφαση 2014/145/ΚΕΠΠΑ (1). |
|
(2) |
Θα πρέπει να τροποποιηθούν οι πληροφορίες σχετικά με ένα πρόσωπο που έχει τεθεί στον κατάλογο σύμφωνα με την απόφαση 2014/145/ΚΕΠΠΑ. |
|
(3) |
Το παράρτημα της απόφασης 2014/145/ΚΕΠΠΑ θα πρέπει άρα να τροποποιηθεί αναλόγως, |
ΕΞΕΔΩΣΕ ΤΗΝ ΠΑΡΟΥΣΑ ΑΠΟΦΑΣΗ:
Άρθρο 1
Το παράρτημα της απόφασης 2014/145/ΚΕΠΠΑ τροποποιείται σύμφωνα με το παράρτημα της παρούσας απόφασης.
Άρθρο 2
Η παρούσα απόφαση τίθεται σε ισχύ την επομένη της δημοσίευσής της στην Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης.
Βρυξέλλες, 17 Νοεμβρίου 2014.
Για το Συμβούλιο
Η Πρόεδρος
F. MOGHERINI
(1) Απόφαση 2014/145/ΚΕΠΠΑ του Συμβουλίου, της 17ης Μαρτίου 2014, σχετικά με περιοριστικά μέτρα όσον αφορά δράσεις που υπονομεύουν ή απειλούν την εδαφική ακεραιότητα, την κυριαρχία και την ανεξαρτησία της Ουκρανίας (ΕΕ L 78 της 17.3.2014, σ. 16).
ΠΑΡΑΡΤΗΜΑ
Οι καταχωρίσεις για το κάτωθι πρόσωπο που περιλαμβάνονται στο παράρτημα της απόφασης 2014/145/ΚΕΠΠΑ αντικαθίστανται ως εξής:
|
|
Ονοματεπώνυμο |
Πληροφορίες ταυτοποίησης |
Αιτιολογία |
Ημερομηνία καταχώρισης |
|
|
«Vladimir Volfovich ZHIRINOVSKY Владимир Вольфович Жириновский |
Γεννηθείς στις 25.4.1946 στο Almaty (προηγουμένως ονομαζόμενο και Alma-Ata), Καζακστάν |
Μέλος του Κρατικού Συμβουλίου της Δούμα, αρχηγός του κόμματος LDPR. Υποστήριξε ενεργά την εμπλοκή των ενόπλων δυνάμεων της Ρωσίας στην Ουκρανία και την προσάρτηση της Κριμαίας. Υποστήριξε σθεναρά τον διαχωρισμό της Ουκρανίας. Υπέγραψε εξ ονόματος του κόμματος LDPR, του οποίου προεδρεύει, συμφωνία με την επονομαζόμενη “Λαϊκή Δημοκρατία του Donetsk”. |
12.9.2014» |
|
18.11.2014 |
EL |
Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης |
L 331/28 |
ΕΚΤΕΛΕΣΤΙΚΉ ΑΠΌΦΑΣΗ ΤΗΣ ΕΠΙΤΡΟΠΉΣ
της 14ης Νοεμβρίου 2014
για την τροποποίηση των αποφάσεων 2010/470/ΕΕ και 2010/472/ΕΕ όσον αφορά τις απαιτήσεις υγειονομικού ελέγχου σχετικά με την τρομώδη νόσο των προβάτων για το εμπόριο και τις εισαγωγές στην Ένωση εμβρύων αιγοπροβάτων
[κοινοποιηθείσα υπό τον αριθμό C(2014) 8339]
(Κείμενο που παρουσιάζει ενδιαφέρον για τον ΕΟΧ)
(2014/802/EE)
Η ΕΥΡΩΠΑΪΚΗ ΕΠΙΤΡΟΠΗ,
Έχοντας υπόψη τη Συνθήκη για τη λειτουργία της Ευρωπαϊκής Ένωσης,
Έχοντας υπόψη την οδηγία 92/65/ΕΟΚ του Συμβουλίου, της 13ης Ιουλίου 1992, που καθορίζει τους όρους υγειονομικού ελέγχου που διέπουν το εμπόριο και τις εισαγωγές στην Κοινότητα ζώων, σπέρματος, ωαρίων και εμβρύων που δεν υπόκεινται, όσον αφορά τους όρους υγειονομικού ελέγχου, στις ειδικές κοινοτικές ρυθμίσεις που αναφέρονται στο τμήμα I του παραρτήματος Α της οδηγίας 90/425/ΕΟΚ (1), και ιδίως το άρθρο 11 παράγραφος 3 τρίτη περίπτωση, το άρθρο 17 παράγραφος 2 στοιχείο β), το άρθρο 18 παράγραφος 1 πρώτη περίπτωση καθώς και το άρθρο 19 εισαγωγική φράση και στοιχείο β),
Εκτιμώντας τα ακόλουθα:
|
(1) |
Το παράρτημα IV μέρος Α της απόφασης 2010/470/ΕΕ της Επιτροπής (2) καθορίζει το υπόδειγμα υγειονομικού πιστοποιητικού για το εμπόριο εντός της Ένωσης παρτίδων ωαρίων και εμβρύων αιγοπροβάτων που έχουν συλλεχθεί ή παραχθεί μετά τις 31 Αυγούστου 2010. |
|
(2) |
Το παράρτημα IV μέρος 2 της απόφασης 2010/472/ΕΕ της Επιτροπής (3) καθορίζει το υπόδειγμα υγειονομικού πιστοποιητικού για τις εισαγωγές στην Ένωση παρτίδων ωαρίων και εμβρύων αιγοπροβάτων. |
|
(3) |
Ο κανονισμός (ΕΚ) αριθ. 999/2001 του Ευρωπαϊκού Κοινοβουλίου και του Συμβουλίου (4) θεσπίζει κανόνες πρόληψης, καταπολέμησης και εξάλειψης ορισμένων μεταδοτικών σπογγωδών εγκεφαλοπαθειών (ΜΣΕ) στα βοοειδή και τα αιγοπρόβατα. Το κεφάλαιο Α του παραρτήματος VIII του εν λόγω κανονισμού θεσπίζει τους όρους που διέπουν το ενδοενωσιακό εμπόριο ζώντων ζώων, σπέρματος και εμβρύων. Επιπλέον, το παράρτημα IX του εν λόγω κανονισμού θεσπίζει τους όρους για τις εισαγωγές στην Ένωση ζώντων ζώων, εμβρύων, ωαρίων και προϊόντων ζωικής προέλευσης από τρίτες χώρες. |
|
(4) |
Βάσει νέων επιστημονικών στοιχείων, ο κανονισμός (ΕΚ) αριθ. 999/2001 τροποποιήθηκε με τον κανονισμό (ΕΕ) αριθ. 630/2013 της Επιτροπής (5). Οι τροποποιήσεις αυτές, σχετικά με την τρομώδη νόσο των προβάτων, αντανακλώνται με την εκτελεστική απόφαση 2013/470/ΕΕ της Επιτροπής (6) στο υπόδειγμα υγειονομικού πιστοποιητικού για το ενδοενωσιακό εμπόριο παρτίδων ωαρίων και εμβρύων αιγοειδών και προβατοειδών που καθορίζεται στο μέρος Α του παραρτήματος IV της απόφασης 2010/470/ΕΕ και στο υπόδειγμα υγειονομικού πιστοποιητικού για εισαγωγές στην Ένωση παρτίδων ωαρίων και εμβρύων αιγοειδών και προβατοειδών που καθορίζεται στο μέρος 2 του παραρτήματος IV της απόφασης 2010/472/ΕΕ, με μεταβατική περίοδο έως τις 31 Δεκεμβρίου 2014. |
|
(5) |
Σύμφωνα με επιστημονική γνώμη της Ευρωπαϊκής Αρχής για την Ασφάλεια των Τροφίμων (EFSA), που εκδόθηκε στις 24 Ιανουαρίου 2013, σχετικά με τον κίνδυνο μετάδοσης της κλασικής τρομώδους νόσου μέσω της μεταφοράς in vivo γονιμοποιημένων εμβρύων σε προβατοειδή, και η οποία κατέληγε στο συμπέρασμα ότι ο κίνδυνος μετάδοσης της κλασικής τρομώδους νόσου από την εμφύτευση ομόζυγων ή ετερόζυγων εμβρύων ARR προβατοειδών θα μπορούσε να θεωρηθεί αμελητέος, υπό τον όρο ότι τηρούνται οι συστάσεις του OIE και οι διαδικασίες σχετικά με τη μεταφορά εμβρύων, οι σχετικές διατάξεις του κανονισμού (ΕΚ) αριθ. 999/2001 τροποποιήθηκαν με τον κανονισμό (ΕΕ) αριθ. 1148/2014 της Επιτροπής (7). |
|
(6) |
Το υπόδειγμα υγειονομικού πιστοποιητικού για το ενδοενωσιακό εμπόριο παρτίδων ωαρίων και εμβρύων αιγοειδών και προβατοειδών, το οποίο καθορίζεται στο παράρτημα IV μέρος Α της απόφασης 2010/470/ΕΕ, και το υπόδειγμα υγειονομικού πιστοποιητικού για τις εισαγωγές στην Ένωση παρτίδων ωαρίων και εμβρύων αιγοπροβάτων, το οποίο καθορίζεται στο παράρτημα IV μέρος 2 της απόφασης 2010/472/ΕΕ, θα πρέπει, συνεπώς, να τροποποιηθούν ώστε να αντικατοπτρίζουν τις απαιτήσεις που ορίζονται στον κανονισμό (ΕΚ) αριθ. 999/2001, όπως τροποποιήθηκε με τον κανονισμό (ΕΕ) αριθ. 1148/2014. |
|
(7) |
Επιπλέον, στο υπόδειγμα υγειονομικού πιστοποιητικού για το ενδοενωσιακό εμπόριο παρτίδων ωαρίων και εμβρύων αιγοπροβάτων, το οποίο ορίζεται στο παράρτημα IV μέρος Α της απόφασης 2010/470/ΕΕ, χρειάζεται να τροποποιηθούν ορισμένες παραπομπές στον κανονισμό (ΕΚ) αριθ. 999/2001 για την εξάλειψη κάθε αμφιβολίας. |
|
(8) |
Εξάλλου, στο υπόδειγμα υγειονομικού πιστοποιητικού για τις εισαγωγές στην Ένωση παρτίδων ωαρίων και εμβρύων αιγοπροβάτων, το οποίο ορίζεται στο παράρτημα IV μέρος 2 της απόφασης 2010/472/ΕΕ, απαιτείται πιο ακριβής διατύπωση προκειμένου να εξασφαλιστεί σαφής κατανόηση σχετικά με το ότι τα συστήματα δοκιμών που αναφέρονται σε επιζωοτική αιμορραγική νόσο (EHD) εφαρμόζονται στα θηλυκά ζώα δότες αιγοειδών ή προβατοειδών. |
|
(9) |
Συνεπώς, θα πρέπει να τροποποιηθούν αναλόγως οι αποφάσεις 2010/470/ΕΕ και 2010/472/ΕΕ. |
|
(10) |
Τα μέτρα που προβλέπονται στην παρούσα απόφαση είναι σύμφωνα με τη γνώμη της μόνιμης επιτροπής για την τροφική αλυσίδα και την υγεία των ζώων, |
ΕΞΕΔΩΣΕ ΤΗΝ ΠΑΡΟΥΣΑ ΑΠΟΦΑΣΗ:
Άρθρο 1
Το παράρτημα IV της απόφασης 2010/470/ΕΕ τροποποιείται σύμφωνα με το παράρτημα I της παρούσας απόφασης.
Άρθρο 2
Το παράρτημα IV της απόφασης 2010/472/ΕΕ τροποποιείται σύμφωνα με το παράρτημα II της παρούσας απόφασης.
Άρθρο 3
Η παρούσα απόφαση αρχίζει να εφαρμόζεται από την 1η Ιανουαρίου 2015.
Άρθρο 4
Η παρούσα απόφαση απευθύνεται στα κράτη μέλη.
Βρυξέλλες, 14 Νοεμβρίου 2014.
Για την Επιτροπή
Vytenis ANDRIUKAITIS
Μέλος της Επιτροπής
(1) ΕΕ L 268 της 14.9.1992, σ. 54.
(2) Απόφαση 2010/470/ΕΕ της Επιτροπής, της 26ης Αυγούστου 2010, για τον καθορισμό υποδειγμάτων υγειονομικών πιστοποιητικών για το εμπόριο εντός της Ένωσης όσον αφορά το σπέρμα, τα ωάρια και τα έμβρυα ιπποειδών και αιγοπροβάτων καθώς και τα ωάρια και τα έμβρυα χοίρων (ΕΕ L 228 της 31.8.2010, σ. 15).
(3) Απόφαση 2010/472/ΕΕ της Επιτροπής, της 26ης Αυγούστου 2010, για τις εισαγωγές στην Ένωση σπέρματος, ωαρίων και εμβρύων αιγοπροβάτων (ΕΕ L 228 της 31.8.2010, σ. 74).
(4) Κανονισμός (ΕΚ) αριθ. 999/2001 του Ευρωπαϊκού Κοινοβουλίου και του Συμβουλίου, της 22ας Μαΐου 2001, για τη θέσπιση κανόνων πρόληψης, καταπολέμησης και εξάλειψης ορισμένων μεταδοτικών σπογγωδών εγκεφαλοπαθειών (ΕΕ L 147 της 31.5.2001, σ. 1).
(5) Κανονισμός (ΕΕ) αριθ. 630/2013 της Επιτροπής, της 28ης Ιουνίου 2013, για την τροποποίηση των παραρτημάτων του κανονισμού (ΕΚ) αριθ. 999/2001 του Ευρωπαϊκού Κοινοβουλίου και του Συμβουλίου για τη θέσπιση κανόνων πρόληψης, καταπολέμησης και εξάλειψης ορισμένων μεταδοτικών σπογγωδών εγκεφαλοπαθειών (ΕΕ L 179 της 29.6.2013, σ. 60).
(6) Εκτελεστική απόφαση 2013/470/ΕΕ της Επιτροπής, της 20ής Σεπτεμβρίου 2013, για την τροποποίηση των αποφάσεων 2010/470/ΕΕ και 2010/472/ΕΕ όσον αφορά τους όρους υγειονομικού ελέγχου σχετικά με την τρομώδη νόσο των προβάτων για το εμπόριο και τις εισαγωγές στην Ένωση, σπέρματος, ωαρίων και εμβρύων των αιγοειδών και προβατοειδών (ΕΕ L 252 της 24.9.2013, σ. 32).
(7) Κανονισμός (ΕΕ) αριθ. 1148/2014 της Επιτροπής, της 28ης Οκτωβρίου 2014, για την τροποποίηση των παραρτημάτων II, VII, VIII, IX και X του κανονισμού (ΕΚ) αριθ. 999/2001 του Ευρωπαϊκού Κοινοβουλίου και του Συμβουλίου για τη θέσπιση κανόνων πρόληψης, καταπολέμησης και εξάλειψης ορισμένων μεταδοτικών σπογγωδών εγκεφαλοπαθειών (ΕΕ L 308 της 29.10.2014, σ. 66).
ΠΑΡΑΡΤΗΜΑ I
Στο παράρτημα IV της απόφασης 2010/470/ΕΚ, το μέρος Α αντικαθίσταται από το ακόλουθο κείμενο:
«ΜΕΡΟΣ A
Υπόδειγμα υγειονομικού πιστοποιητικού IVA για ενδοενωσιακό εμπόριο παρτίδων ωαρίων και εμβρύων αιγοπροβάτων που συλλέχθηκαν ή παρήχθησαν σύμφωνα με την οδηγία 92/65/ΕΟΚ του Συμβουλίου μετά τις 31 Αυγούστου 2010 και απεστάλησαν από εγκεκριμένη ομάδα συλλογής ή παραγωγής από την οποία κατάγονται τα ωάρια ή τα έμβρυα.


 »
»
ΠΑΡΑΡΤΗΜΑ II
Στο παράρτημα IV της απόφασης 2010/472/ΕΚ, το μέρος Α αντικαθίσταται από το ακόλουθο κείμενο:
«ΜΕΡΟΣ 2
Υπόδειγμα υγειονομικού πιστοποιητικού για τις εισαγωγές παρτίδων ωαρίων και εμβρύων αιγοπροβάτων

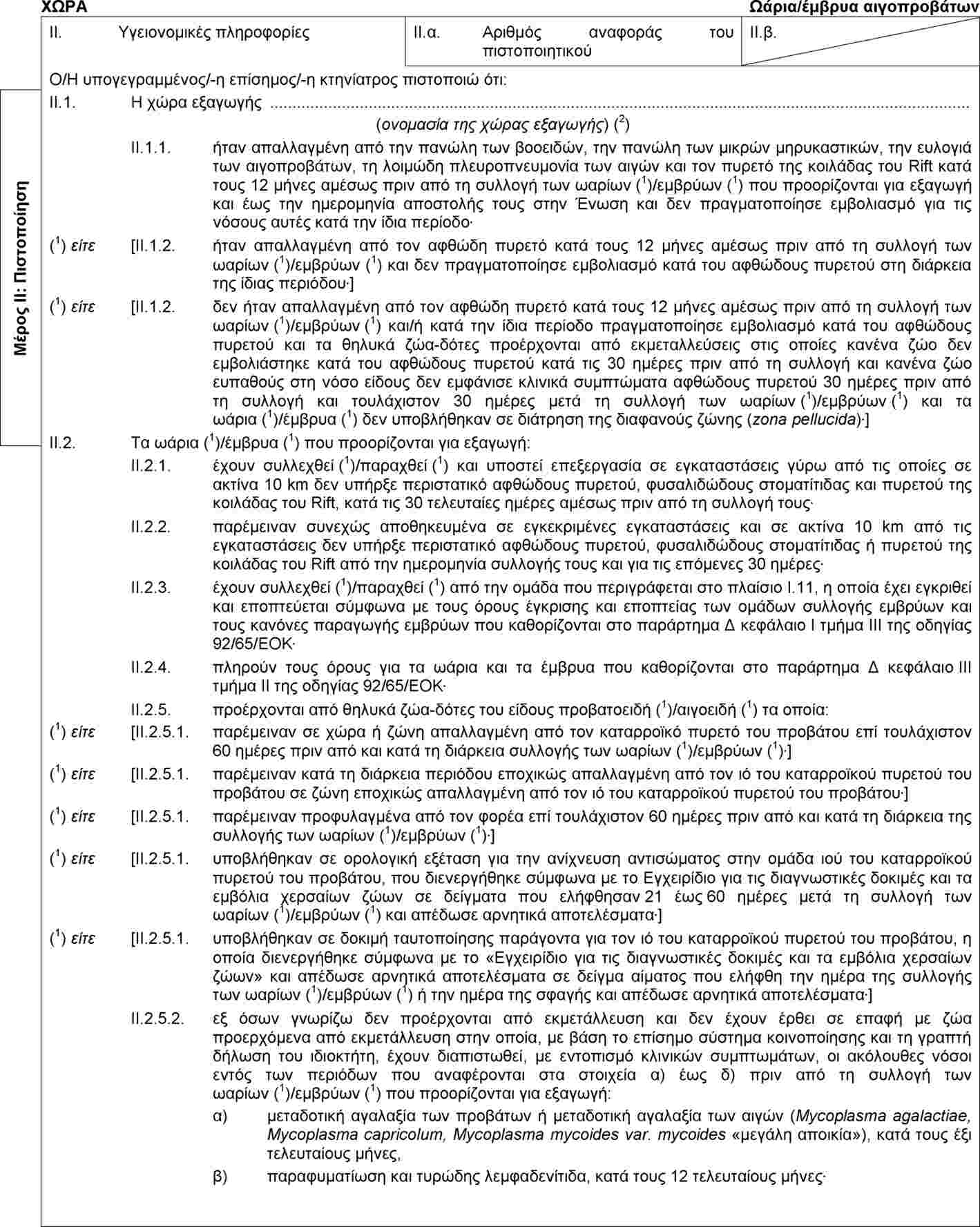
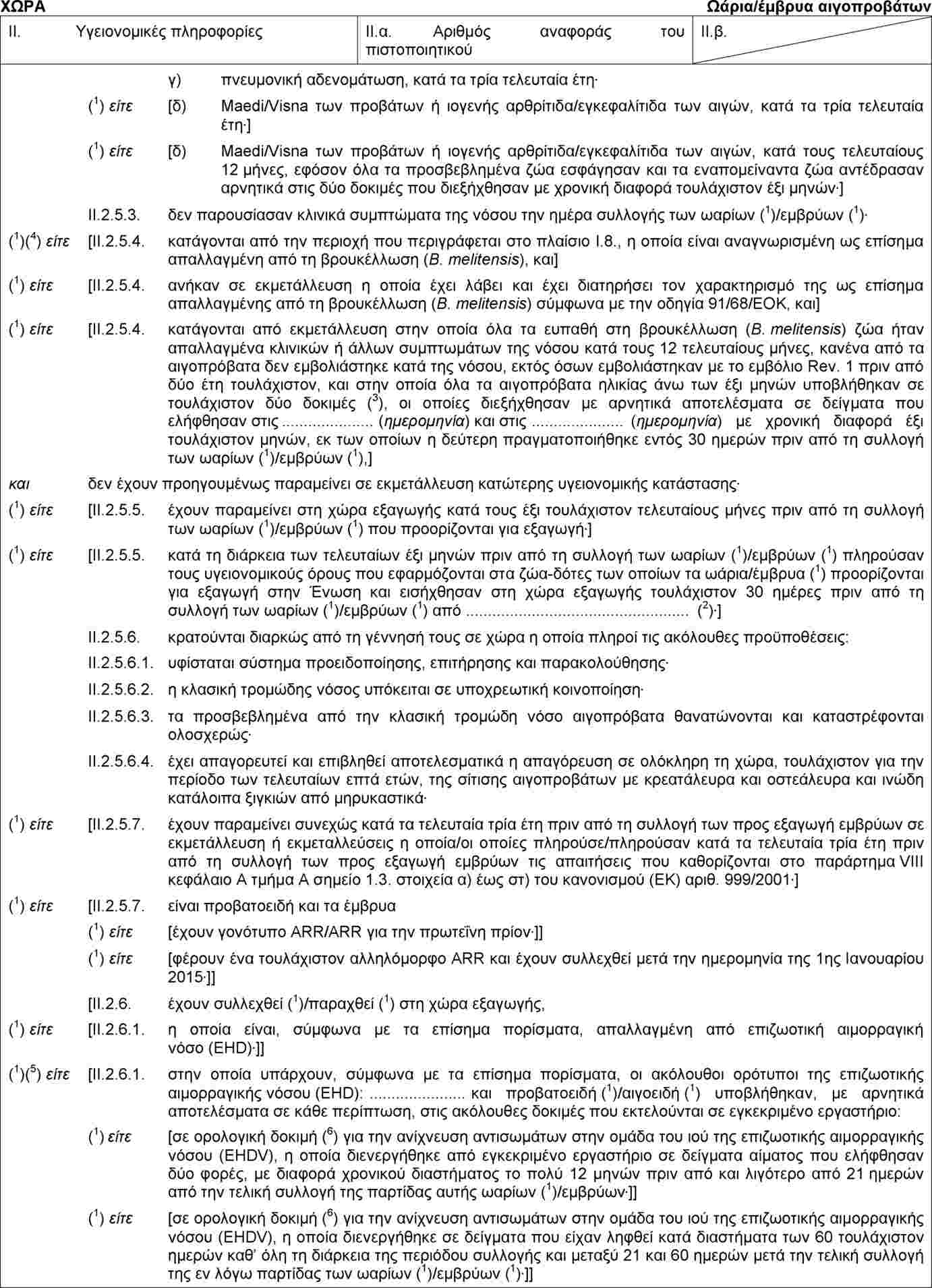

 »
»
ΠΡΑΞΕΙΣ ΠΟΥ ΕΚΔΙΔΟΝΤΑΙ ΑΠΟ ΦΟΡΕΙΣ ΠΟΥ ΕΧΟΥΝ ΣΥΣΤΑΘΕΙ ΜΕ ΔΙΕΘΝΕΙΣ ΣΥΜΦΩΝΙΕΣ
|
18.11.2014 |
EL |
Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης |
L 331/38 |
ΑΠΌΦΑΣΗ αριθ. 1/2014 ΤΗΣ ΜΕΙΚΤΉΣ ΕΠΙΤΡΟΠΉΣ EE-ΕΛΒΕΤΊΑΣ
της 10ης Οκτωβρίου 2014
για τον προσδιορισμό των περιπτώσεων απαλλαγής από τη διαβίβαση των δεδομένων που προβλέπεται στο άρθρο 3 παράγραφος 3 πρώτο εδάφιο του παραρτήματος Ι της συμφωνίας μεταξύ της Ευρωπαϊκής Κοινότητας και της Ελβετικής Συνομοσπονδίας, της 25ης Ιουνίου 2009, για τη διευκόλυνση των ελέγχων και των διατυπώσεων κατά τη μεταφορά εμπορευμάτων, καθώς και για τα τελωνειακά μέτρα ασφάλειας
(2014/803/EE)
Η ΜΕΙΚΤΗ ΕΠΙΤΡΟΠΗ,
Έχοντας υπόψη τη συμφωνία μεταξύ της Ευρωπαϊκής Κοινότητας και της Ελβετικής Συνομοσπονδίας, της 25ης Ιουνίου 2009, για τη διευκόλυνση των ελέγχων και των διατυπώσεων κατά τη μεταφορά εμπορευμάτων καθώς και για τα τελωνειακά μέτρα ασφάλειας («η συμφωνία»), και ιδίως το άρθρο 21 παράγραφος 3 και το παράρτημα I άρθρο 3 παράγραφος 3 πρώτο εδάφιο·
Εκτιμώντας τα ακόλουθα:
|
(1) |
Η συμφωνία αποσκοπεί στη διατήρηση της διευκόλυνσης των ελέγχων και των διατυπώσεων κατά τη διέλευση των εμπορευμάτων από τα σύνορα, καθώς και της ομαλής ροής των εμπορικών συναλλαγών μεταξύ των δύο συμβαλλόμενων μερών, εξασφαλίζοντας ταυτόχρονα υψηλό επίπεδο ασφάλειας στην αλυσίδα εφοδιασμού. |
|
(2) |
Τα συμβαλλόμενα μέρη δεσμεύθηκαν να διασφαλίσουν ισοδύναμο επίπεδο ασφάλειας, στα αντίστοιχα εδάφη τους, με μέτρα που στηρίζονται στην ισχύουσα νομοθεσία στην Ευρωπαϊκή Ένωση. |
|
(3) |
Όταν τα εμπορεύματα εξέρχονται από το τελωνειακό έδαφος ενός συμβαλλόμενου μέρους με προορισμό τρίτη χώρα διερχόμενα από το τελωνειακό έδαφος του άλλου συμβαλλόμενου μέρους, τα δεδομένα ασφάλειας τα οποία περιλαμβάνονται στη συνοπτική διασάφηση εξόδου που κατατίθεται στην αρμόδια αρχή του πρώτου συμβαλλόμενου μέρους διαβιβάζονται από την εν λόγω αρχή στην αρμόδια αρχή του δεύτερου συμβαλλόμενου μέρους. |
|
(4) |
Η μεικτή επιτροπή μπορεί να προσδιορίσει τις περιπτώσεις στις οποίες η διαβίβαση αυτών των δεδομένων δεν είναι αναγκαία, στον βαθμό που δεν θίγεται το επίπεδο ασφάλειας που εγγυάται η παρούσα συμφωνία. |
|
(5) |
Τα κράτη μέλη της Ευρωπαϊκής Ένωσης και η Ελβετική Συνομοσπονδία είναι συμβαλλόμενα μέρη της σύμβασης του Σικάγου για τη Διεθνή Πολιτική Αεροπορία. Δυνάμει του παραρτήματος 17 της εν λόγω σύμβασης, για την προστασία της διεθνούς αεροπορίας από έκνομες ενέργειες, οι αερομεταφορείς υποβάλλουν το σύνολο των μεταφερόμενων εμπορευμάτων σε ελέγχους ασφάλειας πριν από τη φόρτωσή τους σε αεροσκάφος. |
|
(6) |
Η Ευρωπαϊκή Κοινότητα και η Ελβετική Συνομοσπονδία δεσμεύονται από τη συμφωνία για τις αεροπορικές μεταφορές της 21ης Ιουνίου 1999, η οποία διέπει ιδίως την ασφάλεια των αεροπορικών μεταφορών, |
ΑΠΟΦΑΣΙΖΕΙ:
Άρθρο 1
Στην περίπτωση των εξαγωγών εμπορευμάτων που αναφέρεται στο άρθρο 3 παράγραφος 3 πρώτο εδάφιο του παραρτήματος I της συμφωνίας, η διαβίβαση των δεδομένων δεν είναι απαραίτητη εφόσον:
|
α) |
τα εμπορεύματα παραλαμβάνονται από αεροπορική εταιρεία η οποία τα μεταφέρει εκτός του τελωνειακού εδάφους των συμβαλλόμενων μερών· |
|
β) |
η έξοδος των εμπορευμάτων από το τελωνείο στο δεύτερο συμβαλλόμενο μέρος γίνεται αεροπορικώς· |
|
γ) |
έχει προσκομισθεί στο τελωνείο που είναι αρμόδιο για τον τόπο στον οποίο εξάγονται τα εμπορεύματα συνοπτική διασάφηση εξόδου ή τελωνειακή διασάφηση εξαγωγής ανταποκρινόμενη στις προϋποθέσεις που έχουν καθορισθεί για την εν λόγω συνοπτική διασάφηση· |
|
δ) |
κατά την άφιξη των εμπορευμάτων στο τελωνείο του σημείου εξόδου από το τελωνειακό έδαφος του δεύτερου συμβαλλόμενου μέρους, ο μεταφορέας θέτει στη διάθεση του εν λόγω τελωνείου, εφόσον αυτό το ζητήσει, αντίγραφο του συνοδευτικού εγγράφου εξαγωγής ή άλλου παρεμφερούς εγγράφου που έχει εκδοθεί από τις ελβετικές τελωνειακές αρχές και περιέχει τα δεδομένα ασφαλείας για τα εξαγόμενα εμπορεύματα. |
Άρθρο 2
Η παρούσα απόφαση αρχίζει να ισχύει την επομένη της έκδοσής της.
Βακάλο, 10 Οκτωβρίου 2014.
Για τη μεικτή επιτροπή ΕΕ-Ελβετίας,
Η Πρόεδρος
Michaela SCHÄRER-RICKENBACHER
Διορθωτικά
|
18.11.2014 |
EL |
Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης |
L 331/40 |
Διορθωτικό στην απόφαση 2014/252/ΕΕ του Συμβουλίου, της 14ης Απριλίου 2014, σχετικά με τη σύναψη της συμφωνίας μεταξύ της Ευρωπαϊκής Ένωσης και της Δημοκρατίας της Τουρκίας για την επανεισδοχή προσώπων που διαμένουν χωρίς άδεια
( Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης L 134 της 7ης Μαΐου 2014 )
Στη σελίδα 1, αιτιολογική σκέψη 3:
αντί:
|
«3. |
Σύμφωνα με τα άρθρα 1 και 2 του πρωτοκόλλου (αριθ. 21) για τη θέση του Ηνωμένου Βασιλείου και της Ιρλανδίας ως προς τον χώρο ελευθερίας, ασφάλειας και δικαιοσύνης, το οποίο προσαρτάται στη Συνθήκη για την Ευρωπαϊκή Ένωση και στη Συνθήκη για τη λειτουργία της Ευρωπαϊκής Ένωσης, και με την επιφύλαξη του άρθρου 4 του εν λόγω πρωτοκόλλου, το Ηνωμένο Βασίλειο δεν μετέχει στην έκδοση της παρούσας απόφασης ούτε δεσμεύεται από αυτήν ούτε υποχρεούται να την εφαρμόσει.» |
διάβαζε:
|
«3. |
Σύμφωνα με το άρθρο 3 του πρωτοκόλλου αριθ. 21 για τη θέση του Ηνωμένου Βασιλείου και της Ιρλανδίας ως προς τον χώρο ελευθερίας, ασφάλειας και δικαιοσύνης, το οποίο προσαρτάται στη Συνθήκη για την Ευρωπαϊκή Ένωση και στη Συνθήκη για τη λειτουργία της Ευρωπαϊκής Ένωσης, το Ηνωμένο Βασίλειο κοινοποίησε, με επιστολή της 21ης Σεπτεμβρίου 2012, την επιθυμία του να μετέχει στην έκδοση και εφαρμογή της παρούσας απόφασης.» |
|
18.11.2014 |
EL |
Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης |
L 331/40 |
Διορθωτικό στον κανονισμό (ΕΚ) αριθ. 552/2009 της Επιτροπής, της 22ας Ιουνίου 2009, για την τροποποίηση του παραρτήματος XVII του κανονισμού (ΕΚ) αριθ. 1907/2006 του Ευρωπαϊκού Κοινοβουλίου και του Συμβουλίου για την καταχώριση, την αξιολόγηση, την αδειοδότηση και τους περιορισμούς των χημικών προϊόντων (REACH)
( Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης L 164 της 26ης Ιουνίου 2009 )
Στη σελίδα 26, στο σημείο 2 του παραρτήματος, το οποίο τροποποιεί το παράρτημα XVII του κανονισμού (ΕΚ) αριθ. 1907/2006, στην καταχώριση 52 δεύτερη στήλη σημείο 2:
αντί:
«Τα παιχνίδια και τα αντικείμενα παιδικής φροντίδας που περιέχουν τις φθαλικές αυτές ενώσεις σε συγκεντρώσεις μεγαλύτερες του 0,1 % κατά βάρος του πλαστικοποιημένου υλικού δεν πρέπει να διατίθενται στην αγορά.»
διάβαζε:
«Τέτοια παιχνίδια και αντικείμενα παιδικής φροντίδας που περιέχουν τις φθαλικές αυτές ενώσεις σε συγκεντρώσεις μεγαλύτερες του 0,1 % κατά βάρος του πλαστικοποιημένου υλικού δεν πρέπει να διατίθενται στην αγορά.»