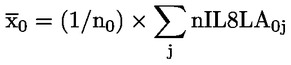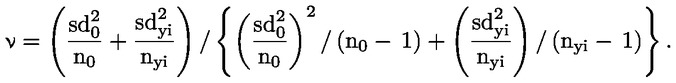|
8)
|
Στο μέρος Β προστίθενται τα ακόλουθα κεφάλαια:
«B.63 ΔΟΚΙΜΗ ΔΙΑΛΟΓΗΣ ΤΟΞΙΚΟΤΗΤΑΣ ΣΤΗΝ ΑΝΑΠΑΡΑΓΩΓΗ/ΑΝΑΠΤΥΞΗ
ΕΙΣΑΓΩΓΗ
|
1.
|
Η παρούσα μέθοδος δοκιμών είναι ισοδύναμη με την κατευθυντήρια γραμμή δοκιμών (TG) 421 του ΟΟΣΑ (2016). Οι κατευθυντήριες γραμμές του ΟΟΣΑ για τον έλεγχο χημικών ουσιών αναθεωρούνται ανά διαστήματα ώστε να λαμβάνονται υπόψη οι εξελίξεις στον επιστημονικό τομέα. Η αρχική κατευθυντήρια γραμμή δοκιμών διαλογής 421 εγκρίθηκε το 1995, βάσει ενός πρωτοκόλλου για την προκαταρκτική δοκιμή διαλογής τοξικότητας στην αναπαραγωγή που συζητήθηκε σε δύο συναντήσεις εμπειρογνωμόνων, στο Λονδίνο το 1990 (1) και στο Τόκυο το 1992 (2).
|
|
2.
|
Η παρούσα μέθοδος δοκιμών έχει επικαιροποιηθεί με παραμέτρους που αφορούν τους ενδοκρινικούς διαταράκτες, στο πλαίσιο της δράσης πρώτης προτεραιότητας που ξεκίνησε ο ΟΟΣΑ το 1998 με σκοπό την αναθεώρηση των υφιστάμενων κατευθυντήριων γραμμών δοκιμών και την ανάπτυξη νέων κατευθυντήριων γραμμών δοκιμών για τη διαλογή και τη διεξαγωγή δοκιμών σε δυνητικούς ενδοκρινικούς διαταράκτες (3). Για παράδειγμα, η TG 407 (μελέτη τοξικότητας από το στόμα, 28 ημερών, με επαναλαμβανόμενη δόση σε τρωκτικά, κεφάλαιο B.7 του παρόντος παραρτήματος) του ΟΟΣΑ, ενισχύθηκε το 2008 με παραμέτρους κατάλληλες για την ανίχνευση ενδοκρινικής δραστηριότητας υπό δοκιμή χημικών ουσιών. Ο στόχος της επικαιροποίησης της TG 421 ήταν η συμπερίληψη ορισμένων παραμέτρων σχετικά με τους ενδοκρινικούς διαταράκτες σε TG διαλογής στις οποίες οι περίοδοι έκθεσης καλύπτουν ορισμένες από τις ευαίσθητες περιόδους κατά την ανάπτυξη (προγεννητική ή πρώτη μεταγεννητική περίοδος).
|
|
3.
|
Οι επιλεχθείσες πρόσθετες παράμετροι σχετικά με τους ενδοκρινικούς διαταράκτες, που αποτελούν επίσης μέρος της TG 443 (εκτεταμένη μελέτη τοξικότητας στην αναπαραγωγή μίας γενεάς, κεφάλαιο B.56 του παρόντος παραρτήματος), περιλήφθηκαν στην TG 421 βάσει μελέτης σκοπιμότητας στην οποία θίγονται επιστημονικά και τεχνικά θέματα που σχετίζονται με τη συμπερίληψή τους, καθώς και πιθανές προσαρμογές του σχεδιασμού δοκιμής που χρειάζονται για τη συμπερίληψή τους (4).
|
|
4.
|
Η παρούσα μέθοδος δοκιμών έχει σχεδιαστεί για να παρέχει πληροφορίες σχετικά με τις επιδράσεις μιας υπό δοκιμή χημικής ουσίας στις αναπαραγωγικές επιδόσεις αρσενικών και θηλυκών ατόμων, όπως η λειτουργία των γονάδων, η συμπεριφορά ζευγαρώματος, η σύλληψη, η ανάπτυξη του κυήματος και ο τοκετός. Δεν αποτελεί εναλλακτική μέθοδο ούτε αντικαθιστά τις υφιστάμενες μεθόδους δοκιμών B.31, B.34, B.35 ή B.56.
|
ΑΡΧΙΚΕΣ ΕΚΤΙΜΗΣΕΙΣ
|
5.
|
Η παρούσα μέθοδος δοκιμών διαλογής μπορεί να χρησιμοποιηθεί για την παροχή αρχικών πληροφοριών σχετικά με τις πιθανές επιδράσεις στην αναπαραγωγή και/ή την ανάπτυξη, είτε σε πρώιμο στάδιο της αξιολόγησης των τοξικολογικών ιδιοτήτων χημικών ουσιών είτε σχετικά με χημικές ουσίες που προκαλούν ανησυχία. Μπορεί επίσης να χρησιμοποιηθεί ως μέρος ενός συνόλου αρχικών δοκιμών διαλογής για υπάρχουσες χημικές ουσίες για τις οποίες οι διαθέσιμες τοξικολογικές πληροφορίες είναι ελάχιστες ή ανύπαρκτες, ως μελέτη προσδιορισμού εύρους δόσεων με σκοπό τη διεξαγωγή πιο εκτεταμένων μελετών της αναπαραγωγής/ανάπτυξης, ή όταν θεωρηθεί για άλλους λόγους κατάλληλη. Κατά τη διεξαγωγή της μελέτης θα πρέπει να εφαρμόζονται οι γενικές αρχές και τα κριτήρια που περιγράφονται στο έγγραφο καθοδήγησης αριθ. 19 του ΟΟΣΑ σχετικά με την αναγνώριση, την αξιολόγηση και τη χρήση κλινικών σημείων ως ανώδυνων παραμέτρων για τα πειραματόζωα που χρησιμοποιούνται σε αξιολογήσεις ασφάλειας (5).
|
|
6.
|
Η παρούσα μέθοδος δοκιμών δεν παρέχει ολοκληρωμένες πληροφορίες για όλες τις πτυχές της αναπαραγωγής και της ανάπτυξης. Πιο συγκεκριμένα, παρέχει περιορισμένα μόνο μέσα ανίχνευσης των μεταγεννητικών εκδηλώσεων της προγεννητικής έκθεσης, ή των επαγόμενων κατά τη μεταγεννητική έκθεση πιθανών επιδράσεων. Λόγω (μεταξύ άλλων) των σχετικά μικρών αριθμών ζώων που περιλαμβάνονται στις ομάδες δόσεων, της επιλεκτικότητας των παραμέτρων και της μικρής διάρκειας της μελέτης, η παρούσα μέθοδος δεν θα παρέχει αποδεικτικά στοιχεία που να στηρίζουν οριστικούς ισχυρισμούς περί ανυπαρξίας επιδράσεων. Επιπλέον, σε περίπτωση απουσίας δεδομένων από άλλες δοκιμές τοξικότητας στην αναπαραγωγή/ανάπτυξη, τα θετικά αποτελέσματα είναι χρήσιμα για την αρχική αξιολόγηση της επικινδυνότητας και συμβάλλουν στη διαδικασία λήψης αποφάσεων όσον αφορά την αναγκαιότητα και το χρονοδιάγραμμα διεξαγωγής πρόσθετων δοκιμών.
|
|
7.
|
Τα αποτελέσματα που προκύπτουν από τις σχετικές με το ενδοκρινικό σύστημα παραμέτρους θα πρέπει να μελετώνται στο πλαίσιο του εννοιολογικού πλαισίου για τον έλεγχο και την αξιολόγηση χημικών ενδοκρινικών διαταρακτών (Conceptual Framework for Testing and Assessment of Endocrine Disrupting Chemicals) του ΟΟΣΑ (6). Σε αυτό το εννοιολογικό πλαίσιο, η ενισχυμένη TG 421 του ΟΟΣΑ περιλαμβάνεται στο επίπεδο 4 ως in vivo δοκιμασία που παρέχει δεδομένα για τις δυσμενείς επιδράσεις των παραμέτρων που σχετίζονται με το ενδοκρινικό σύστημα. Εντούτοις, ένα ενδοκρινικό σήμα μπορεί να μη θεωρηθεί επαρκώς ισχυρό στοιχείο ώστε μια χημική ουσία να χαρακτηριστεί ενδοκρινικός διαταράκτης.
|
|
8.
|
Στην παρούσα μέθοδο δοκιμών θεωρείται ότι η υπό δοκιμή χημική ουσία χορηγείται από το στόμα. Εάν χρησιμοποιηθούν άλλες οδοί έκθεσης, ενδέχεται να χρειαστούν τροποποιήσεις.
|
|
9.
|
Πριν από τη χρήση της μεθόδου δοκιμών σε μείγμα για την παραγωγή δεδομένων για συγκεκριμένο κανονιστικό σκοπό, θα πρέπει να εξετάζεται αν –και, εάν ναι, για ποιον λόγο– μπορεί να αποδώσει αποτελέσματα κατάλληλα για τον επιδιωκόμενο σκοπό. Τέτοια εξέταση δεν χρειάζεται όταν οι κανονιστικές ρυθμίσεις επιβάλλουν τον έλεγχο του μείγματος.
|
|
10.
|
Οι ορισμοί που χρησιμοποιούνται παρατίθενται στο προσάρτημα 1.
|
ΑΡΧΗ ΤΗΣ ΔΟΚΙΜΗΣ
|
11.
|
Η υπό δοκιμή χημική ουσία χορηγείται σε διαβαθμισμένες δόσεις σε αρκετές ομάδες αρσενικών και θηλυκών ατόμων. Η χορήγηση των δόσεων στα αρσενικά θα πρέπει να διαρκεί τουλάχιστον τέσσερις εβδομάδες και να φθάνει μέχρι και την ημέρα πριν από την προγραμματισμένη θανάτωση (σε αυτό το χρονοδιάγραμμα περιλαμβάνονται τουλάχιστον δύο εβδομάδες πριν το ζευγάρωμα, η περίοδος του ζευγαρώματος και περίπου δύο εβδομάδες μετά το ζευγάρωμα). Δεδομένης της περιορισμένης περιόδου χορήγησης των δόσεων στα αρσενικά πριν από το ζευγάρωμα, η γονιμότητα ενδέχεται να μην αποτελεί ιδιαίτερα ευαίσθητο δείκτη της τοξικότητας στους όρχεις. Ως εκ τούτου, είναι ιδιαίτερα σημαντική η διεξαγωγή αναλυτικής ιστολογικής εξέτασης. Ο συνδυασμός περιόδου χορήγησης πριν από το ζευγάρωμα διάρκειας δύο εβδομάδων και επακόλουθων παρατηρήσεων όσον αφορά το ζευγάρωμα/γονιμότητα με συνολική περίοδο χορήγησης τουλάχιστον τεσσάρων εβδομάδων, ακολουθούμενων από αναλυτική ιστοπαθολογική εξέταση των γονάδων των αρσενικών, θεωρείται επαρκής για την ανίχνευση της πλειονότητας των επιδράσεων στη γονιμότητα των αρσενικών και τη σπερματογένεση.
|
|
12.
|
Η χορήγηση δόσεων στα θηλυκά θα πρέπει να διαρκεί καθ’ όλο το διάστημα διεξαγωγής της μελέτης. Η εν λόγω χορήγηση περιλαμβάνει δύο εβδομάδες πριν από το ζευγάρωμα (με στόχο να καλυφθούν τουλάχιστον δύο πλήρεις κύκλοι οίστρου), το μεταβλητό χρονικό διάστημα μέχρι τη σύλληψη, τη διάρκεια της εγκυμοσύνης και τουλάχιστον δεκατρείς ημέρες μετά τη γέννηση, έως και την ημέρα πριν από την προγραμματισμένη θανάτωση.
|
|
13.
|
Η διάρκεια της μελέτης, μετά τον εγκλιματισμό και την αξιολόγηση του κύκλου οίστρου πριν από τη χορήγηση των δόσεων, εξαρτάται από τις επιδόσεις των θηλυκών και είναι κατά προσέγγιση 63 ημέρες [τουλάχιστον 14 ημέρες πριν από το ζευγάρωμα, (έως) 14 ημέρες ζευγαρώματος, 22 ημέρες κύησης, 13 ημέρες γαλουχίας].
|
|
14.
|
Τα ζώα εξετάζονται με προσοχή καθημερινά κατά τη διάρκεια της περιόδου χορήγησης για τυχόν συμπτώματα τοξικότητας. Τα ζώα που πεθαίνουν ή θανατώνονται κατά τη διάρκεια της περιόδου δοκιμής νεκροτομούνται και, στο τέλος της δοκιμής, αυτά που έχουν επιζήσει θανατώνονται και νεκροτομούνται επίσης.
|
ΠΕΡΙΓΡΑΦΗ ΤΗΣ ΜΕΘΟΔΟΥ
Επιλογή ζωικού είδους
|
15.
|
Η παρούσα μέθοδος δοκιμών έχει σχεδιαστεί για χρήση με επίμυ. Η διερεύνηση των παραμέτρων που προσδιορίζονται στην παρούσα μέθοδο δοκιμών σε άλλα είδη τρωκτικών πρέπει να αιτιολογείται αναλυτικά. Στο διεθνές πρόγραμμα επικύρωσης για την ανίχνευση ενδοκρινικών διαταρακτών της TG 407 του ΟΟΣΑ (που αντιστοιχεί στο κεφάλαιο B.7 του παρόντος παραρτήματος), ο επίμυς ήταν το μόνο είδος που χρησιμοποιήθηκε. Δεν θα πρέπει να χρησιμοποιούνται φυλές με χαμηλή γονιμότητα ή γνωστή υψηλή συχνότητα εμφάνισης αναπτυξιακών ελαττωμάτων. Θα πρέπει να χρησιμοποιούνται υγιή παρθένα ζώα, που δεν έχουν υποβληθεί προηγουμένως σε πειράματα. Τα πειραματόζωα θα πρέπει να χαρακτηρίζονται ως προς το είδος, τη φυλή, το φύλο, το βάρος και την ηλικία. Στην αρχή της μελέτης, η διακύμανση των βαρών των χρησιμοποιούμενων ζώων θα πρέπει να είναι ελάχιστη και να μην υπερβαίνει το 20 % της μέσης τιμής για κάθε φύλο. Σε περίπτωση που η μελέτη διεξάγεται ως προκαταρκτικό στάδιο μακροχρόνιας μελέτης ή μελέτης πλήρους γενεάς, συνιστάται να χρησιμοποιούνται και στις δύο μελέτες ζώα της ίδιας φυλής και προέλευσης.
|
Στέγαση και διατροφή
|
16.
|
Σε όλες οι διαδικασίες πρέπει να τηρούνται τα τοπικά πρότυπα φροντίδας των πειραματόζωων. H θερμοκρασία του θαλάμου πειραματόζωων πρέπει να είναι 22 °C (± 3 °). Αν και η σχετική υγρασία θα πρέπει να είναι τουλάχιστον 30 % και, κατά προτίμηση, να μην υπερβαίνει το 70 %, εκτός από τις περιόδους καθαρισμού του θαλάμου, εν τούτοις θα πρέπει να επιδιώκεται μια τιμή 50-60 %. Ο φωτισμός πρέπει να είναι τεχνητός και η φωτοπερίοδος 12ωρη. Για τη διατροφή μπορούν να χρησιμοποιούνται συνήθη εργαστηριακά σιτηρέσια, με απεριόριστη παροχή πόσιμου νερού. Όταν η υπό δοκιμή χημική ουσία χορηγείται μέσω της παρούσας μεθόδου, η επιλογή σιτηρεσίου ενδέχεται να επηρεάζεται από την ανάγκη κατάλληλης ανάμειξης της ουσίας.
|
|
17.
|
Τα ζώα θα πρέπει να στεγάζονται σε μικρές ομάδες του ίδιου φύλου. Επιτρέπεται η ατομική στέγαση, εάν αιτιολογείται επιστημονικά. Σε περίπτωση ομαδικής στέγασης, κάθε κλωβός δεν πρέπει να περιέχει περισσότερα από πέντε ζώα. Οι διαδικασίες ζευγαρώματος θα πρέπει να εκτελούνται σε κλωβούς κατάλληλους για τον σκοπό αυτό. Τα έγκυα θηλυκά θα πρέπει να στεγάζονται σε ατομικούς κλωβούς και θα πρέπει να τους παρέχονται υλικά φωλιάσματος. Τα θηλυκά κατά τη γαλουχία τοποθετούνται σε ατομικούς κλωβούς μαζί με τα νεογνά τους.
|
|
18.
|
Η τροφή πρέπει να υποβάλλεται τακτικά σε ανάλυση ώστε να εντοπίζονται τυχόν ξένες προσμείξεις. Ένα δείγμα του σιτηρεσίου θα πρέπει να διατηρείται έως την οριστικοποίηση της έκθεσης.
|
Προετοιμασία των ζώων
|
19.
|
Υγιή νεαρά ενήλικα ζώα κατανέμονται τυχαία στις ομάδες μαρτύρων και αγωγής. Οι κλωβοί θα πρέπει να διατάσσονται με τρόπο ώστε να ελαχιστοποιούνται οι πιθανές επιδράσεις της θέσης τους. Τα ζώα ταυτοποιούνται με αποκλειστικό αναγνωριστικό και παραμένουν στα κλουβιά τους τουλάχιστον πέντε ημέρες πριν από την έναρξη της μελέτης για να μπορέσουν να εγκλιματιστούν στις εργαστηριακές συνθήκες.
|
Παρασκευή των δόσεων
|
20.
|
Συνιστάται η χορήγηση της υπό δοκιμή χημικής ουσίας από το στόμα, εκτός εάν θεωρούνται καταλληλότερες άλλες οδοί χορήγησης. Όταν επιλέγεται η οδός από το στόμα, η υπό δοκιμή χημική ουσία χορηγείται συνήθως με στομαχικό καθετήρα· εντούτοις, οι υπό δοκιμή χημικές ουσίες μπορούν εναλλακτικά να χορηγούνται μέσω του σιτηρεσίου ή του πόσιμου νερού.
|
|
21.
|
Εφόσον είναι αναγκαίο, παρασκευάζεται διάλυμα ή εναιώρημα της υπό δοκιμή χημικής ουσίας σε κατάλληλο φορέα. Συνιστάται, οσάκις είναι δυνατό, να εξετάζεται πρώτα η δυνατότητα χρήσης υδατικού διαλύματος/εναιωρήματος, κατόπιν το ενδεχόμενο διαλύματος/γαλακτώματος σε λάδι (π.χ. αραβοσιτέλαιο) και, τέλος, η χρήση διαλύματος σε άλλους φορείς. Σε περίπτωση που ο φορέας δεν είναι το νερό, θα πρέπει να είναι γνωστά τα τοξικά χαρακτηριστικά του. Θα πρέπει να προσδιορίζεται η σταθερότητα και η ομοιογένεια της υπό δοκιμή χημικής ουσίας στον φορέα.
|
ΔΙΑΔΙΚΑΣΙΑ
Αριθμός και φύλο των ζώων
|
22.
|
Συνιστάται κάθε ομάδα να περιλαμβάνει αρχικά τουλάχιστον 10 αρσενικά και 12-13 θηλυκά. Πριν από την έκθεση, θα αξιολογείται η κυκλικότητα του οίστρου των θηλυκών και τα ζώα που δεν παρουσιάζουν τυπικούς κύκλους 4-5 ημερών δεν θα περιλαμβάνονται στη μελέτη· ως εκ τούτου, συνιστάται η προσθήκη επιπλέον θηλυκών στις ομάδες ώστε αυτές να αποτελούνται από 10 θηλυκά έκαστη. Εκτός της περίπτωσης έντονων τοξικών επιδράσεων, αναμένεται ότι κατ’ αυτόν τον τρόπο θα εξασφαλίζονται τουλάχιστον 8 έγκυα θηλυκά ανά ομάδα, που είναι συνήθως ο ελάχιστος αποδεκτός αριθμός έγκυων θηλυκών ανά ομάδα. Στόχος είναι να προκαλούνται επαρκείς κυοφορίες και απόγονοι για να εξασφαλίζεται η ουσιαστική αξιολόγηση της ικανότητας της υπό δοκιμή χημικής ουσίας να επιδρά στη γονιμότητα, στην κύηση, στη μητρική συμπεριφορά και στη συμπεριφορά θηλασμού των ζώων, καθώς και στην αύξηση και την ανάπτυξη των απογόνων της F1 από τη σύλληψη ως τη 13η ημέρα μετά τον τοκετό.
|
Δοσολογία
|
23.
|
Κατά κανόνα πρέπει να χρησιμοποιούνται τουλάχιστον τρεις ομάδες δοκιμής και μία ομάδα μαρτύρων. Τα επίπεδα των δόσεων μπορούν να καθορίζονται βάσει πληροφοριών από δοκιμές οξείας τοξικότητας ή αποτελέσματα από μελέτες επαναλαμβανόμενης δόσης. Εκτός από τη χορήγηση της υπό δοκιμή χημικής ουσίας, τα ζώα της ομάδας μαρτύρων θα πρέπει να υφίστανται την ίδια ακριβώς μεταχείριση όπως τα υποκείμενα των ομάδων δοκιμής. Εάν χρησιμοποιείται φορέας για τη χορήγηση της υπό δοκιμή χημικής ουσίας, η ομάδα μαρτύρων πρέπει να λαμβάνει τον φορέα στον μέγιστο χρησιμοποιούμενο όγκο.
|
|
24.
|
Τα επίπεδα των δόσεων θα πρέπει να επιλέγονται λαμβανομένων υπόψη τυχόν υφιστάμενων δεδομένων για την τοξικότητα και την (τοξικο-)κινητική. Επίσης, θα πρέπει να λαμβάνεται υπόψη ότι ενδέχεται να υπάρχουν διαφορές στην ευαισθησία μεταξύ έγκυων και μη έγκυων ζώων. Το υψηλότερο επίπεδο δόσης πρέπει να επιλέγεται με σκοπό να προκαλέσει τοξικές εκδηλώσεις, όχι όμως τον θάνατο ή έντονη οδύνη. Στη συνέχεια επιλέγεται φθίνουσα σειρά δοσολογικών επιπέδων με σκοπό τον εντοπισμό απόκρισης συνδεόμενης με τη δόση και του χαμηλότερου επιπέδου δόσης στο οποίο δεν παρατηρούνται δυσμενείς επιδράσεις (ΝΟΑΕL). Για τον καθορισμό της φθίνουσας σειράς δοσολογικών επιπέδων η βέλτιστη επιλογή είναι συνήθως ο υποδιπλασιασμός ή υποτετραπλασιασμός, ενώ η προσθήκη μιας τέταρτης ομάδας δοκιμής είναι συχνά προτιμότερη από τη χρησιμοποίηση πολύ μεγάλων συντελεστών (π.χ. άνω του 10) μεταξύ των δόσεων.
|
|
25.
|
Όταν παρατηρείται γενική τοξικότητα (π.χ. μειωμένο βάρος σώματος, επιδράσεις στο ήπαρ, την καρδιά, τους πνεύμονες, τους νεφρούς κ.λπ.) ή άλλη αλλαγή που μπορεί να μην είναι τοξική αντίδραση (π.χ. μειωμένη πρόσληψη τροφής, διόγκωση του ήπατος), οι παρατηρούμενες επιδράσεις στις παραμέτρους που συνδέονται με ευαισθησία του ενδοκρινικού συστήματος θα πρέπει να ερμηνεύονται με προσοχή.
|
Οριακή δοκιμή
|
26.
|
Εάν μια δοκιμή από το στόμα σύμφωνα με τις περιγραφόμενες για την παρούσα μελέτη διαδικασίες, με επίπεδο δόσης τουλάχιστον 1 000 mg/kg βάρους σώματος/ημέρα ή, εφόσον πρόκειται για χορήγηση μέσω του σιτηρεσίου ή του πόσιμου νερού, με αντίστοιχη εκατοστιαία αναλογία στο σιτηρέσιο ή στο πόσιμο νερό, δεν έχει ως αποτέλεσμα παρατηρήσιμες τοξικές επιδράσεις και εάν, βάσει των διαθέσιμων δεδομένων για χημικές ουσίες ανάλογης δομής, δεν αναμένεται τοξικότητα, η πλήρης μελέτη με αρκετά επίπεδα δόσης μπορεί να μην είναι απαραίτητη. Μπορεί να χρησιμοποιηθεί οριακή δοκιμή, εκτός εάν, με βάση την έκθεση του ανθρώπου, διαφαίνεται η ανάγκη χρησιμοποίησης υψηλότερου επιπέδου δόσης από το στόμα. Σε περίπτωση χορήγησης από άλλη οδό, όπως εισπνοή ή εφαρμογή στο δέρμα, η μέγιστη εφικτή συγκέντρωση μπορεί να εξαρτάται συχνά από τις φυσικές και χημικές ιδιότητες των υπό δοκιμή ουσιών.
|
Χορήγηση των δόσεων
|
27.
|
Η δόση της υπό δοκιμή χημικής ουσίας στα ζώα χορηγείται καθημερινά επί 7 ημέρες την εβδομάδα. Όταν η υπό δοκιμή χημική ουσία χορηγείται με καθετήρα, η χορήγηση πρέπει να γίνεται εφάπαξ με τη βοήθεια στομαχικού καθετήρα ή κατάλληλης διασωλήνωσης. Ο μέγιστος όγκος υγρού που μπορεί να χορηγηθεί εφάπαξ εξαρτάται από το μέγεθος του πειραματόζωου. Ο όγκος δεν θα πρέπει να υπερβαίνει το 1 ml/100 g βάρους σώματος, εκτός της περίπτωσης υδατικών διαλυμάτων όπου μπορούν να χρησιμοποιούνται 2 ml/100 g βάρους σώματος. Εκτός από την περίπτωση των ερεθιστικών ή διαβρωτικών υπό δοκιμή χημικών ουσιών, οι οποίες σε υψηλότερες συγκεντρώσεις συνήθως προκαλούν εντονότερες επιδράσεις, η μεταβλητότητα των όγκων δοκιμής πρέπει να ελαχιστοποιείται με ρύθμιση της συγκέντρωσης, ώστε να εξασφαλίζεται σταθερός όγκος σε όλα τα επίπεδα δόσης.
|
|
28.
|
Για τις υπό δοκιμή χημικές ουσίες που χορηγούνται με την τροφή ή το πόσιμο νερό, πρέπει να εξασφαλίζεται ότι οι χορηγούμενες ποσότητες υπό δοκιμή χημικής ουσίας δεν επηρεάζουν το κανονικό διατροφικό ισοζύγιο ή ισοζύγιο νερού. Όταν η υπό δοκιμή χημική ουσία χορηγείται μέσω του σιτηρεσίου, μπορεί να χρησιμοποιείται είτε σταθερή συγκέντρωση στο σιτηρέσιο (ppm) είτε σταθερό επίπεδο δόσης, εκφρασμένο επί του βάρους σώματος του ζώου. Η χρησιμοποιούμενη εναλλακτική επιλογή πρέπει να διευκρινίζεται. Για υπό δοκιμή χημικές ουσίες που χορηγούνται με καθετήρα, η δόση θα πρέπει να χορηγείται την ίδια περίπου ώρα κάθε μέρα και να ρυθμίζεται τουλάχιστον κάθε εβδομάδα ώστε να διατηρείται σταθερό επίπεδο δόσης ως προς το βάρος του σώματος.
|
Χρονοδιάγραμμα πειράματος
|
29.
|
Η χορήγηση δόσεων και στα δύο φύλα θα πρέπει να ξεκινά τουλάχιστον δύο εβδομάδες πριν από το ζευγάρωμα, αφού έχουν εγκλιματιστεί για τουλάχιστον πέντε ημέρες και τα θηλυκά έχουν υποβληθεί σε διαδικασία διαλογής ως προς την κανονικότητα των κύκλων οίστρου (στη διάρκεια περιόδου δύο εβδομάδων πριν από την αγωγή). Η μελέτη θα πρέπει να προγραμματίζεται κατά τρόπον ώστε η αξιολόγηση των κύκλων οίστρου να ξεκινά σε σύντομο χρονικό διάστημα αφότου τα ζώα έχουν φθάσει σε πλήρη σεξουαλική ωρίμανση. Το εν λόγω διάστημα μπορεί να διαφέρει ελαφρώς για διαφορετικές φυλές επιμύων σε διαφορετικά εργαστήρια, π.χ. επίμυες Sprague Dawley ηλικίας 10 εβδομάδων, επίμυες Wistar ηλικίας περίπου 12 εβδομάδων. Οι μητέρες με απογόνους πρέπει να θανατώνονται τη 13η ημέρα μετά τον τοκετό, ή σύντομα μετά από αυτό. Η ημέρα γέννησης (όταν έχει ολοκληρωθεί ο τοκετός) ορίζεται ως η ημέρα 0 μετά τον τοκετό. Τα θηλυκά που δεν εμφανίζουν ενδείξεις συνουσίας θανατώνονται 24-26 ημέρες μετά την τελευταία ημέρα της περιόδου ζευγαρώματος. Η χορήγηση συνεχίζεται και στα δύο φύλα κατά τη διάρκεια της περιόδου ζευγαρώματος. Στα αρσενικά η χορήγηση θα πρέπει να συνεχίζεται και μετά την περίοδο ζευγαρώματος, τουλάχιστον έως ότου ολοκληρωθεί η ελάχιστη συνολική περίοδος χορήγησης των 28 ημερών. Στη συνέχεια θανατώνονται ή, εναλλακτικά, διατηρούνται και συνεχίζουν να λαμβάνουν δόσεις με σκοπό την πιθανή πραγματοποίηση δεύτερου ζευγαρώματος, εάν χρειαστεί.
|
|
30.
|
Η καθημερινή χορήγηση στα γονικά θηλυκά θα πρέπει να συνεχίζεται καθ’ όλη τη διάρκεια της κύησης και τουλάχιστον μέχρι και τη 13η ημέρα μετά τον τοκετό ή την ημέρα πριν τη θανάτωση. Για μελέτες όπου η υπό δοκιμή χημική ουσία χορηγείται μέσω εισπνοής ή διά του δέρματος, η χορήγηση θα πρέπει να συνεχίζεται τουλάχιστον μέχρι και τη 19η ημέρα της κύησης, και θα πρέπει να ξεκινά εκ νέου το συντομότερο δυνατό, το αργότερο μέχρι την 4η ημέρα μετά τη γέννηση.
|
|
31.
|
Στο παράρτημα 2 παρατίθεται χρονοδιάγραμμα διεξαγωγής των πειραμάτων.
|
Διαδικασία ζευγαρώματος
|
32.
|
Κανονικά, στην παρούσα μελέτη θα πρέπει να χρησιμοποιούνται ζευγαρώματα 1:1 (ένα αρσενικό προς ένα θηλυκό). Μπορεί να υπάρξουν εξαιρέσεις, στην περίπτωση περιστασιακών θανάτων αρσενικών. Το θηλυκό θα πρέπει να τοποθετείται μαζί με το ίδιο αρσενικό μέχρις ότου παρατηρηθούν ενδείξεις συνουσίας ή μέχρι να παρέλθει διάστημα δύο εβδομάδων. Κάθε πρωί, τα θηλυκά πρέπει να εξετάζονται για την παρουσία σπέρματος ή κολπικού βύσματος. Ως ημέρα 0 της κύησης ορίζεται η ημέρα κατά την οποία επιβεβαιώνονται οι ενδείξεις ζευγαρώματος (ανιχνεύεται κολπικό βύσμα ή σπέρμα). Σε περίπτωση που το ζευγάρωμα αποδειχθεί ανεπιτυχές, πρέπει να εξετάζεται το ενδεχόμενο νέου ζευγαρώματος των θηλυκών με ελεγμένα αρσενικά της ίδιας ομάδας.
|
Μέγεθος γέννας
|
33.
|
Την 4η ημέρα μετά τη γέννηση, το μέγεθος κάθε γέννας μπορεί να ρυθμίζεται διά της απομάκρυνσης των πλεοναζόντων νεογνών με τυχαία επιλογή, ούτως ώστε να παραμένουν, όπου είναι εφικτό, τέσσερα ή πέντε νεογνά ανά φύλο ανά γέννα, ανάλογα με το σύνηθες μέγεθος γέννας στη φυλή των επιμύων που χρησιμοποιείται. Από δυο από τα πλεονάζοντα νεογνά θα πρέπει να συλλέγονται δείγματα αίματος, τα οποία θα συγκεντρώνονται και θα χρησιμοποιούνται για τον προσδιορισμό των επιπέδων Τ4 στον ορό. Δεν ενδείκνυται η επιλεκτική απομάκρυνση νεογνών, π.χ. βάσει του σωματικού βάρους ή της πρωκτογεννητικής απόστασης (AGD). Όταν ο αριθμός των αρσενικών ή θηλυκών νεογνών δεν φθάνει τα τέσσερα ή πέντε νεογνά ανά φύλο ανά γέννα, είναι αποδεκτή η μερική ρύθμιση (π.χ. έξι αρσενικά και τέσσερα θηλυκά). Δεν απομακρύνεται κανένα νεογνό όταν το μέγεθος της γέννας είναι χαμηλότερο του στόχου (8 ή 10 νεογνά/γέννα). Εάν υπάρχει ένα μόνο νεογνό πάνω από τον στόχο απομάκρυνσης, θα απομακρύνεται μόνο ένα νεογνό, το οποίο θα χρησιμοποιείται για συλλογή αίματος με σκοπό την πιθανή διενέργεια αξιολογήσεων της T4.
|
|
34.
|
Εάν δεν ρυθμιστεί το μέγεθος της γέννας, την 4η ημέρα μετά τη γέννηση θανατώνονται δύο νεογνά ανά γέννα και λαμβάνονται δείγματα αίματος για μέτρηση των συγκεντρώσεων θυρεοειδικών ορμονών στον ορό. Ει δυνατόν, τα δύο νεογνά ανά γέννα θα πρέπει να είναι θηλυκά προκειμένου να διατηρηθούν τα αρσενικά νεογνά για αξιολογήσεις διατηρούμενων θηλών, εκτός εάν η απομάκρυνση των δύο νεογνών θα είχε ως αποτέλεσμα να μην υπάρχουν άλλα θηλυκά προς αξιολόγηση κατά τη λήξη της μελέτης. Δεν απομακρύνεται κανένα νεογνό εάν έτσι το μέγεθος της γέννας θα μειωνόταν κάτω από τα 8 έως 10 νεογνά/γέννα (ανάλογα με το κανονικό μέγεθος γέννας στη χρησιμοποιούμενη φυλή επιμύων). Εάν υπάρχει ένα μόνο νεογνό πάνω από το κανονικό μέγεθος γέννας, θα απομακρύνεται μόνο ένα νεογνό, το οποίο θα χρησιμοποιείται για συλλογή αίματος με σκοπό την πιθανή διενέργεια αξιολογήσεων της T4.
|
Παρατηρήσεις εν ζωή
Κλινικές παρατηρήσεις
|
35.
|
Καθ’ όλη τη διάρκεια της περιόδου δοκιμής θα πρέπει να διεξάγονται γενικές κλινικές παρατηρήσεις τουλάχιστον μία φορά τη μέρα, και συχνότερα σε περίπτωση που παρατηρηθούν τοξικά συμπτώματα. Αυτές οι παρατηρήσεις θα πρέπει να διεξάγονται κατά προτίμηση τις ίδιες ώρες κάθε ημέρα, λαμβανομένου υπόψη του χρόνου κορύφωσης των αναμενόμενων επιδράσεων μετά τη χορήγηση της δόσης. Σχετικές μεταβολές στη συμπεριφορά, σημεία δύσκολου ή παρατεταμένου τοκετού και όλα τα σημεία τοξικότητας, συμπεριλαμβανομένης της θνησιμότητας, πρέπει να καταγράφονται. Οι εν λόγω καταγραφές θα πρέπει να περιλαμβάνουν τη χρονική στιγμή εμφάνισης, τη σοβαρότητα και τη διάρκεια των τοξικών συμπτωμάτων.
|
Σωματικό βάρος και κατανάλωση τροφής/νερού
|
36.
|
Τα αρσενικά και τα θηλυκά θα πρέπει να ζυγίζονται κατά την πρώτη ημέρα της χορήγησης και, στη συνέχεια, τουλάχιστον μία φορά την εβδομάδα, καθώς και κατά τη λήξη της μελέτης. Στη διάρκεια της κύησης, τα θηλυκά πρέπει να ζυγίζονται τις ημέρες 0, 7, 14 και 20, και εντός 24 ωρών από τον τοκετό (ημέρα 0 ή 1η ημέρα μετά τον τοκετό) και τουλάχιστον την 4η και 13η ημέρα μετά τον τοκετό. Οι παρατηρήσεις αυτές θα πρέπει να αναφέρονται ξεχωριστά για κάθε ενήλικο ζώο.
|
|
37.
|
Στη διάρκεια της περιόδου πριν από το ζευγάρωμα, της εγκυμοσύνης και της γαλουχίας, η κατανάλωση τροφής πρέπει να μετράται τουλάχιστον μια φορά την εβδομάδα. Η μέτρηση της κατανάλωσης τροφής κατά το ζευγάρωμα είναι προαιρετική. Η κατανάλωση νερού στη διάρκεια των εν λόγω περιόδων θα πρέπει επίσης να μετράται, όταν η υπό δοκιμή χημική ουσία χορηγείται μέσω πόσιμου νερού.
|
Οιστρικοί κύκλοι
|
38.
|
Οι οιστρικοί κύκλοι θα πρέπει να παρακολουθούνται πριν από την έναρξη της αγωγής προκειμένου να επιλέγονται για τη δοκιμή θηλυκά με κανονική κυκλικότητα (βλ. παράγραφο 22). Επίσης, θα πρέπει να παρακολουθούνται καθημερινά κολπικά επιχρίσματα, από την έναρξη της περιόδου αγωγής μέχρις ότου διαπιστωθούν ενδείξεις ζευγαρώματος. Εάν υπάρχει ανησυχία για οξείες αγχογόνες επιδράσεις που μπορεί να μεταβάλλουν τους οιστρικούς κύκλους με την έναρξη της χορήγησης, τα εργαστήρια μπορούν να υποβάλλουν τα ζώα σε έκθεση 2 εβδομάδων και, στη συνέχεια, να συλλέγουν καθημερινά κολπικά επιχρίσματα προκειμένου να παρακολουθούν τον οιστρικό κύκλο για τουλάχιστον δύο εβδομάδες κατά την περίοδο πριν από το ζευγάρωμα, και να συνεχίζουν την παρακολούθηση καθ’ όλη τη διάρκεια της περιόδου ζευγαρώματος μέχρι να ανιχνευθούν ενδείξεις ζευγαρώματος. Κατά τη λήψη κολπικών/τραχηλικών κυττάρων, θα πρέπει να λαμβάνεται μέριμνα ώστε να αποφεύγεται η διαταραχή των βλεννογόνων που μπορεί να επαγάγει ψευδοκύηση (7) (8).
|
Παράμετροι σχετικές με τους απογόνους
|
39.
|
Η διάρκεια της κύησης πρέπει να καταγράφεται και υπολογίζεται από την ημέρα 0 της εγκυμοσύνης. Κάθε γέννα πρέπει να εξετάζεται το συντομότερο δυνατό μετά τον τοκετό για να προσδιορίζεται ο αριθμός και το φύλο των νεογνών, τα θνησιγενή νεογνά, τα ζώντα νεογνά, τα καχεκτικά νεογνά (νεογνά μεγέθους αρκετά μικρότερου από τα αντίστοιχα νεογνά μάρτυρες) και η παρουσία μακροσκοπικώς ορατών ανωμαλιών.
|
|
40.
|
Τα ζώντα νεογνά πρέπει να καταμετρώνται και να προσδιορίζεται το φύλο τους, ενώ οι ομάδες των νεογνών που γεννήθηκαν από την ίδια μητέρα πρέπει να ζυγίζονται εντός 24 ωρών από τον τοκετό (ημέρα 0 ή 1 μετά τον τοκετό) και τουλάχιστον την 4η και τη 13η ημέρα μετά τον τοκετό. Πέραν των παρατηρήσεων που περιγράφονται στην παράγραφο 35, θα πρέπει να καταγράφεται τυχόν μη φυσιολογική συμπεριφορά των απογόνων.
|
|
41.
|
Η πρωκτογεννητική απόσταση κάθε νεογνού θα πρέπει να μετράται την ίδια ημέρα μεταγεννητικά, μεταξύ της μεταγεννητικής ημέρας (ΜΓΗ) 0 και 4. Θα πρέπει να προσδιορίζεται το σωματικό βάρος του νεογνού την ημέρα μέτρησης της πρωκτογεννητικής απόστασης, η οποία θα πρέπει να κανονικοποιείται σε ένα μέτρο του μεγέθους του νεογνού, κατά προτίμηση στην κυβική ρίζα του σωματικού βάρους (9). Θα πρέπει να καταμετράται ο αριθμός των θηλών/άλων στα αρσενικά νεογνά τη 12η ή 13η ΜΓΗ, όπως συνιστάται στο έγγραφο καθοδήγησης αριθ. 151 του ΟΟΣΑ (10).
|
Εξετάσεις κλινικής βιοχημείας
|
42.
|
Λαμβάνονται δείγματα αίματος από καθορισμένο σημείο με βάση το ακόλουθο χρονοδιάγραμμα:
|
—
|
από τουλάχιστον δύο νεογνά ανά γέννα την 4η ημέρα μετά τη γέννηση, εάν το επιτρέπει ο αριθμός των νεογνών (βλ. παραγράφους 33-34)
|
|
—
|
από όλες τις μητέρες και από τουλάχιστον δύο νεογνά ανά γέννα κατά τη λήξη της μελέτης τη 13η ημέρα, και
|
|
—
|
από όλα τα ενήλικα αρσενικά κατά τη λήξη της μελέτης.
|
|
Όλα τα δείγματα αίματος αποθηκεύονται υπό κατάλληλες συνθήκες. Δείγματα αίματος νεογνών 13ης ΜΓΗ και των ενήλικων αρσενικών αξιολογούνται ως προς τα επίπεδα θυρεοειδικών ορμονών (T4). Ανάλογα με την περίπτωση, διενεργείται περαιτέρω αξιολόγηση της T4 σε δείγματα αίματος από τις μητέρες και νεογνά 4ης ΜΓΗ. Ανάλογα με την περίπτωση, μπορούν να μετρηθούν προαιρετικά και άλλες ορμόνες. Το αίμα νεογνών μπορεί να συγκεντρώνεται ανά γέννα για τη διενέργεια αναλύσεων θυρεοειδικών ορμονών. Οι θυρεοειδικές ορμόνες (T4 και TSH) θα πρέπει, κατά προτίμηση να μετρώνται ως «σύνολο».
|
43.
|
Οι ακόλουθοι παράγοντες ενδέχεται να επηρεάζουν τη μεταβλητότητα και τις απόλυτες τιμές συγκέντρωσης των προσδιοριζόμενων ορμονών:
|
—
|
ο χρόνος θανάτωσης, λόγω της ημερήσιας διακύμανσης των συγκεντρώσεων ορμονών,
|
|
—
|
η μέθοδος θανάτωσης, και ως εκ τούτου πρέπει να αποφεύγεται η περιττή καταπόνηση των ζώων, που μπορεί να επηρεάσει τις συγκεντρώσεις των ορμονών,
|
|
—
|
οι σειρές αντιδραστηρίων (κιτ) ορμονικού προσδιορισμού που ενδέχεται να διαφέρουν ως προς τις πρότυπες καμπύλες τους.
|
|
|
44.
|
Τα δείγματα πλάσματος που προορίζονται ειδικά για ορμονικό προσδιορισμό θα πρέπει να λαμβάνονται σε παραπλήσια ώρα της ημέρας. Οι αριθμητικές τιμές που προκύπτουν από ανάλυση των συγκεντρώσεων ορμονών διαφέρουν ανάλογα με τα διάφορα κιτ δοκιμασιών που είναι διαθέσιμα στο εμπόριο.
|
Παθολογοανατομία
Νεκροψία-νεκροτομή
|
45.
|
Σε περίπτωση θανάτωσης ή θανάτου κατά τη διάρκεια της μελέτης, τα ενήλικα αρσενικά θα πρέπει να εξετάζονται μακροσκοπικά για τυχόν ανωμαλίες ή παθολογικές αλλοιώσεις. Ιδιαίτερη προσοχή θα πρέπει να δίδεται στα όργανα του αναπαραγωγικού συστήματος. Ο αριθμός των σημείων εμφύτευσης θα πρέπει να καταγράφεται. Θα πρέπει να εξετάζονται κολπικά επιχρίσματα το πρωί της ημέρας της νεκροψίας για να προσδιοριστεί το στάδιο του οιστρικού κύκλου και να καταστεί εφικτή η συσχέτιση με την ιστοπαθολογία των ωοθηκών.
|
|
46.
|
Οι όρχεις και επιδιδυμίδες, ο προστάτης και οι σπερματοδόχοι κύστεις με τους πηκτοειδείς αδένες στο σύνολό τους, όλων των αρσενικών ενήλικων ζώων θα πρέπει να απαλλάσσονται από τυχόν προσφυόμενους ιστούς, ανάλογα με την περίπτωση, και να ζυγίζονται νωπά όσο το δυνατόν συντομότερα μετά την ανατομή ώστε να αποφεύγεται η ξήρανσή τους. Επιπλέον, μπορούν να μετρώνται προαιρετικά τα βάρη οργάνων όπως το σύμπλεγμα ανελκτήρων του πρωκτού και βολβοσηραγγωδών μυών, οι βολβοουρηθραίοι αδένες (αδένες του Cowper) και η βάλανος του πέους στα αρσενικά και ωοθήκες σε ζεύγη (βάρος σε νωπή κατάσταση) και η μήτρα (περιλαμβανομένου του τραχήλου) στα θηλυκά· σε περίπτωση που περιλαμβάνονται, τα εν λόγω βάρη θα πρέπει να μετρώνται το συντομότερο δυνατό μετά την ανατομή.
|
|
47.
|
Τα νεκρά νεογνά και τα νεογνά που θανατώνονται τη 13η ημέρα μετά τον τοκετό, ή σε σύντομο χρονικό διάστημα μετά από αυτήν, θα πρέπει, τουλάχιστον, να εξετάζονται προσεκτικά εξωτερικά για μακροσκοπικές ανωμαλίες. Ιδιαίτερη προσοχή θα πρέπει να δίνεται στα εξωτερικά όργανα του γεννητικού συστήματος, τα οποία θα πρέπει να εξετάζονται για τυχόν ύπαρξη σημείων ανώμαλης ανάπτυξης. Τη 13η ΜΓΗ θα πρέπει να λαμβάνεται και να φυλάσσεται ο θυρεοειδής από 1 αρσενικό και 1 θηλυκό νεογνό ανά γέννα.
|
|
48.
|
Οι ωοθήκες, οι όρχεις, άλλα όργανα του γεννητικού συστήματος (μήτρα και τράχηλος, επιδιδυμίδες, προστάτης, σπερματοδόχοι κύστεις και πηκτοειδείς αδένες), ο θυρεοειδής και όλα τα όργανα που παρουσιάζουν μακροσκοπικές βλάβες, από όλα τα ενήλικα ζώα, πρέπει να διατηρούνται. Η μονιμοποίηση σε φορμόλη δεν συνιστάται για τη συνήθη εξέταση των όρχεων και των επιδιδυμίδων. Μια αποδεκτή μέθοδος είναι η χρήση μονιμοποιητικού Bouin ή τροποποιημένου μονιμοποιητικού Davidson (11). Ο ινώδης χιτώνας (tunica albuginea) μπορεί να διατρυπάται με βελόνα, με ήπιες κινήσεις, σε μικρό βάθος και στα δύο άκρα ώστε να διευκολύνεται η διείσδυση του μονιμοποιητικού υλικού.
|
Ιστοπαθολογία
|
49.
|
Θα πρέπει να διενεργούνται αναλυτικές ιστολογικές εξετάσεις των ωοθηκών, των όρχεων και των επιδιδυμίδων (με ιδιαίτερη έμφαση στα στάδια της σπερματογένεσης και την ιστοπαθολογία της δομής των διάμεσων κυττάρων των όρχεων) των ζώων της ομάδας στην οποία χορηγείται η υψηλότερη δόση και της ομάδας μαρτύρων. Εφόσον απαιτείται, μπορεί να εξετάζονται και τα άλλα διατηρούμενα όργανα, περιλαμβανομένου του θυρεοειδούς νεογνών και ενήλικων ζώων. Μετά τη μονιμοποίηση μπορεί να προσδιορίζεται το βάρος του θυρεοειδούς. Ο καθαρισμός θα πρέπει και στην περίπτωση αυτή να πραγματοποιείται με μεγάλη προσοχή και μόνο μετά τη μονιμοποίηση, ώστε να μην προκαλείται βλάβη στους ιστούς. Οι βλάβες των ιστών μπορούν να βλάψουν την εγκυρότητα της ιστοπαθολογικής ανάλυσης. Οι εξετάσεις επεκτείνονται στα ζώα των ομάδων άλλων δόσεων εάν στην ομάδα της υψηλότερης δόσης έχουν παρατηρηθεί αλλοιώσεις. Το έγγραφο καθοδήγησης σχετικά με την ιστοπαθολογία (11) παρέχει επιπρόσθετες πληροφορίες για την ανατομή, τη μονιμοποίηση, την τομή και την ιστολογική ανάλυση των ενδοκρινικών ιστών.
|
ΔΕΔΟΜΕΝΑ ΚΑΙ ΑΝΑΦΟΡΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ
Δεδομένα
|
50.
|
Πρέπει να παρέχονται δεδομένα για κάθε ζώο ξεχωριστά. Επιπλέον, όλα τα δεδομένα θα πρέπει να συνοψίζονται σε μορφή πινάκων, όπου θα δίνεται για κάθε ομάδα δοκιμής ο αριθμός των ζώων στην αρχή της δοκιμής, ο αριθμός των ζώων που βρέθηκαν νεκρά κατά τη διάρκεια της δοκιμής ή θανατώθηκαν με ευθανασία, η χρονική στιγμή κάθε θανάτου ή θανάτωσης, ο αριθμός των γόνιμων ζώων, ο αριθμός των έγκυων θηλυκών, ο αριθμός των ζώων που εμφάνισαν σημεία τοξικότητας, μια περιγραφή των παρατηρηθέντων σημείων τοξικότητας, συμπεριλαμβανομένης της χρονικής στιγμής εμφάνισης, της διάρκειας και της σοβαρότητας κάθε τοξικής δράσης, οι τύποι των ιστοπαθολογικών αλλοιώσεων και κάθε σχετικό στοιχείο για τις γέννες. Στο προσάρτημα 3 παρέχεται ένας μορφότυπος συνοπτικής αναφοράς σε μορφή πίνακα που έχει αποδεχθεί ιδιαίτερα χρήσιμος για την αξιολόγηση των επιδράσεων στην αναπαραγωγή/ανάπτυξη.
|
|
51.
|
Λόγω του περιορισμένου μεγέθους της μελέτης, οι στατιστικές αναλύσεις υπό μορφή ελέγχων σημαντικότητας είναι περιορισμένης αξίας για πολλές παραμέτρους, ιδίως τις παραμέτρους σχετικά με την αναπαραγωγή. Σε περίπτωση χρήσης στατιστικών αναλύσεων, η επιλεγόμενη μέθοδος θα πρέπει να είναι κατάλληλη για την κατανομή της υπό εξέταση μεταβλητής, και να επιλέγεται πριν από την έναρξη της μελέτης. Η στατιστική ανάλυση πρωκτογεννητικής απόστασης και διατηρούμενων θηλών θα πρέπει να βασίζεται σε ατομικά στοιχεία για κάθε νεογνό, και θα πρέπει να λαμβάνονται υπόψη οι επιδράσεις στη γέννα. Όπου αρμόζει, μονάδα της ανάλυσης θα πρέπει να είναι η γέννα από την ίδια μητέρα. Η στατιστική ανάλυση σωματικού βάρους των νεογνών θα πρέπει να βασίζεται σε ατομικά στοιχεία για κάθε νεογνό, και θα πρέπει να λαμβάνεται υπόψη το πλήθος νεογνών της γέννας. Λόγω του μικρού μεγέθους της ομάδας, μπορεί να είναι χρήσιμη η χρήση ιστορικών δεδομένων μαρτύρων (π.χ. σχετικά με το μέγεθος της γέννας), εάν υπάρχουν, ως βοήθημα στην ερμηνεία της μελέτης.
|
Αξιολόγηση των αποτελεσμάτων
|
52.
|
Τα ευρήματα της παρούσας μελέτης τοξικότητας θα πρέπει να αξιολογούνται ως προς τις παρατηρούμενες επιδράσεις, τα ευρήματα της νεκροψίας και τα μικροσκοπικά ευρήματα. Στην αξιολόγηση περιλαμβάνεται η σχέση μεταξύ της δόσης της υπό δοκιμή χημικής ουσίας και της παρουσίας ή απουσίας, της συχνότητας εμφάνισης και της σοβαρότητας των ανωμαλιών, συμπεριλαμβανομένων των μακροσκοπικών αλλοιώσεων, των ταυτοποιημένων οργάνων στόχων, της στειρότητας, των κλινικών ανωμαλιών, των επιδράσεων στις επιδόσεις στην αναπαραγωγή και στις γέννες, των μεταβολών στα σωματικά βάρη, των επιδράσεων στη θνησιμότητα και κάθε άλλου τοξικού φαινομένου.
|
|
53.
|
Λόγω της σύντομης περιόδου αγωγής των αρσενικών, κατά την αξιολόγηση των επιδράσεων στην αναπαραγωγή των αρσενικών, μαζί με τα δεδομένα για τη γονιμότητα θα πρέπει να εξετάζεται και η ιστοπαθολογία των όρχεων και των επιδιδυμίδων. Επικουρικά, χρήσιμη στην ερμηνεία της μελέτης μπορεί να είναι και η χρήση ιστορικών δεδομένων μαρτύρων (π.χ. σχετικά με το μέγεθος της γέννας, την πρωκτογεννητική απόσταση, τις διατηρούμενες θηλές, τα επίπεδα T4 στον ορό), εάν υπάρχουν.
|
|
54.
|
Για τον ποιοτικό έλεγχο προτείνεται η συλλογή ιστορικών δεδομένων μαρτύρων και ο υπολογισμός συντελεστών μεταβλητότητας για τα αριθμητικά δεδομένα, ιδίως όσον αφορά τις παραμέτρους που συνδέονται με την ανίχνευση ενδοκρινικών διαταρακτών. Τα δεδομένα αυτά μπορούν να χρησιμοποιούνται για συγκρίσεις κατά την αξιολόγηση πραγματικών μελετών.
|
Έκθεση δοκιμής
|
55.
|
Η έκθεση δοκιμής θα πρέπει να περιλαμβάνει τα ακόλουθα στοιχεία:
|
|
Υπό δοκιμή χημική ουσία:
|
—
|
πηγή, αριθμός παρτίδας, καταληκτική ημερομηνία χρήσης, αν υπάρχει,
|
|
—
|
σταθερότητα της υπό δοκιμή χημικής ουσίας, εάν είναι γνωστή,
|
|
|
|
Μονοσυστατική ουσία:
|
—
|
φυσική εμφάνιση, υδατοδιαλυτότητα και πρόσθετες σχετικές φυσικοχημικές ιδιότητες,
|
|
—
|
ταυτοποίηση της χημικής ουσίας, όπως ονομασία IUPAC ή CAS, αριθμός CAS, κωδικός SMILES ή InChI, συντακτικός τύπος, καθαρότητα, χημική ταυτότητα προσμίξεων, κατά περίπτωση και στο μέτρο του δυνατού, κ.λπ.,
|
|
|
|
Πολυσυστατική ουσία, UVCB και μείγματα:
|
—
|
περιγράφονται, στο μέτρο του δυνατού, με τη χημική ταυτότητα των συστατικών (βλ. ανωτέρω), την ποσότητα στην οποία απαντούν και τις σχετικές φυσικοχημικές τους ιδιότητες.
|
|
|
|
Φορέας (εάν χρησιμοποιείται):
|
—
|
αιτιολόγηση της επιλογής του φορέα, εάν δεν είναι το νερό.
|
|
|
|
Πειραματόζωα:
|
—
|
είδος/φυλή χρησιμοποιηθέντων ζώων,
|
|
—
|
αριθμός, ηλικία και φύλο των ζώων,
|
|
—
|
προέλευση των ζώων, συνθήκες στέγασης, σιτηρέσιο κ.λπ.,
|
|
—
|
βάρος κάθε ζώου κατά την έναρξη της δοκιμής.
|
|
—
|
αιτιολόγηση της επιλογής άλλου είδους εκτός από τον επίμυ.
|
|
|
|
Συνθήκες δοκιμής:
|
—
|
αιτιολόγηση της επιλογής των επιπέδων δόσης,
|
|
—
|
λεπτομέρειες σχετικά με το παρασκεύασμα της υπό δοκιμή χημικής ουσίας/τροφής και τις επιτευχθείσες συγκεντρώσεις, σταθερότητα και ομοιογένεια του παρασκευάσματος,
|
|
—
|
λεπτομέρειες σχετικά με τη χορήγηση της υπό δοκιμή χημικής ουσίας,
|
|
—
|
κατά περίπτωση, μετατροπή της συγκέντρωσης της υπό δοκιμή χημικής ουσίας στο σιτηρέσιο ή το πόσιμο νερό (ppm) σε πραγματική δόση (mg/kg βάρους σώματος/ημέρα),
|
|
—
|
λεπτομέρειες σχετικά με την ποιότητα της τροφής και του νερού,
|
|
—
|
αναλυτική περιγραφή της διαδικασίας τυχαιοποίησης για την επιλογή των νεογνών προς απομάκρυνση, εφόσον απαιτείται.
|
|
|
|
Αποτελέσματα:
|
—
|
βάρος του σώματος/μεταβολές βάρους σώματος,
|
|
—
|
κατανάλωση τροφής και νερού, εφόσον είναι διαθέσιμα,
|
|
—
|
δεδομένα τοξικής αντίδρασης ανά φύλο και δόση, περιλαμβανομένης της γονιμότητας, της κύησης, καθώς και όποιων άλλων σημείων τοξικότητας,
|
|
—
|
τοξικές ή άλλες επιδράσεις στην αναπαραγωγή, στα νεογνά, στη μεταγεννητική ανάπτυξη κ.λπ.,
|
|
—
|
φύση, σοβαρότητα και διάρκεια των κλινικών παρατηρήσεων (αναστρέψιμων και μη),
|
|
—
|
αριθμός ενήλικων θηλυκών με κανονικό ή μη κανονικό οιστρικό κύκλο και διάρκεια του κύκλου,
|
|
—
|
αριθμός ζώντων νεογνών και απώλειες μετά την εμφύτευση,
|
|
—
|
δεδομένα για το βάρος του σώματος των νεογνών,
|
|
—
|
πρωκτογεννητική απόσταση για όλα τα νεογνά (και βάρος σώματος την ημέρα της μέτρησης της πρωκτογεννητικής απόστασης)
|
|
—
|
διατηρούμενες θηλές σε αρσενικά νεογνά,
|
|
—
|
επίπεδα θυρεοειδικών ορμονών, σε νεογνά 13ης ΜΓΗ και σε ενήλικα αρσενικά (και σε μητέρες και νεογνά 4ης ΜΓΗ, εφόσον μετρώνται)
|
|
—
|
αριθμός νεογνών με μακροσκοπικά ορατές ανωμαλίες, μακροσκοπική αξιολόγηση των εξωτερικών γεννητικών οργάνων, αριθμός καχεκτικών νεογνών,
|
|
—
|
χρόνος θανάτου των ζώων κατά τη διάρκεια της μελέτης ή επιβίωση έως το τέλος,
|
|
—
|
αριθμός εμφυτευμένων νεογνών, μέγεθος γέννας και βάρη νεογνών γέννας κατά τη χρονική στιγμή της καταγραφής,
|
|
—
|
βάρος σώματος κατά τη θανάτωση και δεδομένα βάρους οργάνων για τα γονικά ζώα,
|
|
—
|
λεπτομερής περιγραφή των ιστοπαθολογικών ευρημάτων,
|
|
—
|
δεδομένα για την απορρόφηση (εάν υπάρχουν διαθέσιμα),
|
|
—
|
στατιστική ανάλυση των αποτελεσμάτων, κατά περίπτωση.
|
|
Εξέταση των αποτελεσμάτων
Συμπεράσματα
|
Ερμηνεία των αποτελεσμάτων
|
56.
|
Η μελέτη θα παράσχει αξιολογήσεις της τοξικότητας στην αναπαραγωγή/ανάπτυξη που συνδέεται με τη χορήγηση επαναλαμβανόμενων δόσεων (βλ. παραγράφους 5 και 6). Μπορεί να περιλαμβάνει υπόδειξη της ανάγκης διενέργειας περαιτέρω ερευνών και παρέχει καθοδήγηση όσον αφορά τον σχεδιασμό επακόλουθων μελετών. Για την ερμηνεία των αποτελεσμάτων που αφορούν την αναπαραγωγή και την ανάπτυξη θα πρέπει να χρησιμοποιείται ως βοήθημα το έγγραφο καθοδήγησης αριθ. 43 του ΟΟΣΑ (12). Στο έγγραφο καθοδήγησης αριθ. 106 του ΟΟΣΑ για την ιστολογική αξιολόγηση των ενδοκρινικών και αναπαραγωγικών δοκιμών σε τρωκτικά (11) παρέχονται πληροφορίες σχετικά με την προετοιμασία και την αξιολόγηση των (ενδοκρινικών) οργάνων και των κολπικών επιχρισμάτων που μπορεί να είναι χρήσιμα για την παρούσα TG.
|
ΒΙΒΛΙΟΓΡΑΦΙΑ
|
(1)
|
OECD (1990). Room Document No 1 for the 14th Joint Meeting of the Chemicals Group and Management Committee. Διατίθεται κατόπιν αιτήματος από τον Οργανισμό για την Οικονομική Συνεργασία και την Ανάπτυξη, Παρίσι.
|
|
(2)
|
OECD (1992). Chairman’s Report of the ad hoc Expert Meeting on Reproductive Toxicity Screening Methods, Tokyo, 27th-29th October, 1992. Διατίθεται κατόπιν αιτήματος από τον Οργανισμό για την Οικονομική Συνεργασία και την Ανάπτυξη, Παρίσι.
|
|
(3)
|
OECD (1998). Report of the First Meeting of the OECD Endocrine Disrupter Testing and Assessment (EDTA) Task Force, 10th-11th March 1998. Διατίθεται κατόπιν αιτήματος από τον Οργανισμό για την Οικονομική Συνεργασία και την Ανάπτυξη, Παρίσι.
|
|
(4)
|
OECD (2015). Feasibility Study for Minor Enhancements of TG 421/422 with ED Relevant Endpoints. Environment, Health and Safety Publications, Series on Testing and Assessment (No 217), Organisation for Economic Cooperation and Development, Paris.
|
|
(5)
|
OECD (2000). Guidance Document on the Recognition, Assessment, and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluations. Series on Testing and Assessment, (No 19), Organisation for Economic Cooperation and Development,.Paris.
|
|
(6)
|
OECD (2011). Guidance Document on Standardised Test Guidelines for Evaluating Chemicals for Endocrine Disruption. Environment, Health and Safety Publications, Series on Testing and Assessment(No 150), Organisation for Economic Cooperation and Development, Paris.
|
|
(7)
|
Goldman, J.M., Murr A.S., Buckalew A.R., Ferrell J.M. and Cooper R.L. (2007). The Rodent Estrous Cycle: Characterization of Vaginal Cytology and its Utility in Toxicological Studies, Birth Defects Research, Part B, 80 (2), 84-97.
|
|
(8)
|
Sadleir R.M.F.S (1979). Cycles and Seasons, in Auston C.R. and Short R.V. (eds.), Reproduction in Mammals: I. Germ Cells and Fertilization, Cambridge, New York.
|
|
(9)
|
Gallavan R.H. Jr, Holson J.F., Stump D.G., Knapp J.F. and Reynolds V.L.(1999). Interpreting the Toxicologic Significance of Alterations in Anogenital Distance: Potential for Confounding Effects of Progeny Body Weights, Reproductive Toxicology, 13: 383-390.
|
|
(10)
|
OECD (2013). Guidance Document in Support of the Test Guideline on the Extended One Generation Reproductive Toxicity Study. Environment, Health and Safety Publications, Series on Testing and Assessment (No 151), Organisation for Economic Cooperation and Development, Paris.
|
|
(11)
|
OECD (2009). Guidance Document for Histologic Evaluation of Endocrine and Reproductive Tests in Rodents. Environment, Health and Safety Publications, Series on Testing and Assessment (No106), Organisation for Economic Cooperation and Development, Paris.
|
|
(12)
|
OECD (2008). Guidance Document on Mammalian Reproductive Toxicity Testing and Assessment. Environment, Health and Safety Publications, Series on Testing and Assessment (No 43), Organisation for Economic Cooperation and Development, Paris.
|
Προσάρτημα 1
ΟΡΙΣΜΟΙ [ΒΛ. ΕΠΙΣΗΣ ΤΟ ΕΓΓΡΑΦΟ ΚΑΘΟΔΗΓΗΣΗΣ ΑΡΙΘ. 150 ΤΟΥ ΟΟΣΑ (6)]
Ανδρογονικότητα: η ικανότητα μιας χημικής ουσίας να δρα όπως μια φυσική ανδρογόνος ορμόνη (π.χ. τεστοστερόνη) στον οργανισμό θηλαστικού.
Αντιανδρογονικότητα: η ικανότητα μιας χημικής ουσίας να καταστέλλει τη δράση μιας φυσικής ανδρογόνου ορμόνης (π.χ. τεστοστερόνη) στον οργανισμό θηλαστικού.
Αντιοιστρογονικότητα: η ικανότητα μιας χημικής ουσίας να καταστέλλει τη δράση μιας φυσικής οιστρογόνου ορμόνης (π.χ. 17β-οιστραδιόλη) στον οργανισμό θηλαστικού.
Αντιθυρεοειδική δραστηριότητα: η ικανότητα μιας χημικής ουσίας να καταστέλλει τη δράση μιας φυσικής θυρεοειδικής ορμόνης (π.χ. T3) στον οργανισμό θηλαστικού.
Χημικό προϊόν: μια ουσία ή ένα μείγμα.
Τοξικότητα στην ανάπτυξη: η εκδήλωση τοξικότητας στην αναπαραγωγή, η οποία περιλαμβάνει προγεννητικές, περιγεννητικές και μεταγεννητικές δομικές ή λειτουργικές διαταραχές των απογόνων.
Δοσολογία: γενικός όρος που περιλαμβάνει τη δόση, τη συχνότητα και τη διάρκεια χορήγησης.
Δόση: η χορηγούμενη ποσότητα υπό δοκιμή χημικής ουσίας. Η δόση εκφράζεται σε βάρος υπό δοκιμή χημικής ουσίας ανά μονάδα βάρους πειραματόζωου ανά ημέρα (π.χ. mg/kg βάρους σώματος/ημέρα) ή σε σταθερή συγκέντρωση στην τροφή.
Έκδηλη τοξικότητα: γενικός όρος που δηλώνει σαφή σημεία τοξικότητας μετά από χορήγηση της υπό δοκιμή χημικής ουσίας. Αυτά πρέπει να επαρκούν για την εκτίμηση της επικινδυνότητας και να είναι τέτοια ώστε η αύξηση της χορηγούμενης δόσης να αναμένεται ότι θα προκαλέσει σοβαρές τοξικές εκδηλώσεις και πιθανώς θνησιμότητα.
Εξασθένιση της γονιμότητας: αντιπροσωπεύει διαταραχές των αναπαραγωγικών λειτουργιών ή της ικανότητας αρσενικών ή θηλυκών.
Τοξικότητα στη μητέρα: δυσμενείς επιδράσεις σε κυοφορούντα θηλυκά, είτε ειδικής εκδήλωσης (άμεση επίδραση) είτε μη ειδικής εκδήλωσης (έμμεση επίδραση).
NOAEL (no-observed-adverse effect level): πρόκειται για το υψηλότερο επίπεδο δόσης στο οποίο δεν παρατηρούνται δυσμενείς επιδράσεις λόγω της αγωγής.
Οιστρογονικότητα: η ικανότητα μιας χημικής ουσίας να δρα όπως μια φυσική οιστρογόνος ορμόνη (π.χ. 17β-οιστραδιόλη) στον οργανισμό θηλαστικού.
Τοξικότητα στην αναπαραγωγή: αντιπροσωπεύει τις επιβλαβείς επιδράσεις στους απογόνους και/ή την εξασθένιση των αναπαραγωγικών λειτουργιών ή ικανότητας αρσενικών και θηλυκών.
Υπό δοκιμή χημική ουσία: κάθε ουσία ή μείγμα που υποβάλλεται σε δοκιμή με τη χρήση της παρούσας μεθόδου δοκιμών.
Θυρεοειδική δραστηριότητα: η ικανότητα μιας χημικής ουσίας να δρα όπως μια φυσική θυρεοειδική ορμόνη (π.χ. T3) στον οργανισμό θηλαστικού.
Επικύρωση: επιστημονική διαδικασία που αποσκοπεί στον χαρακτηρισμό των λειτουργικών απαιτήσεων και περιορισμών μιας μεθόδου δοκιμών και στην απόδειξη της αξιοπιστίας της και της καταλληλότητάς της για συγκεκριμένο σκοπό.
Προσάρτημα 2
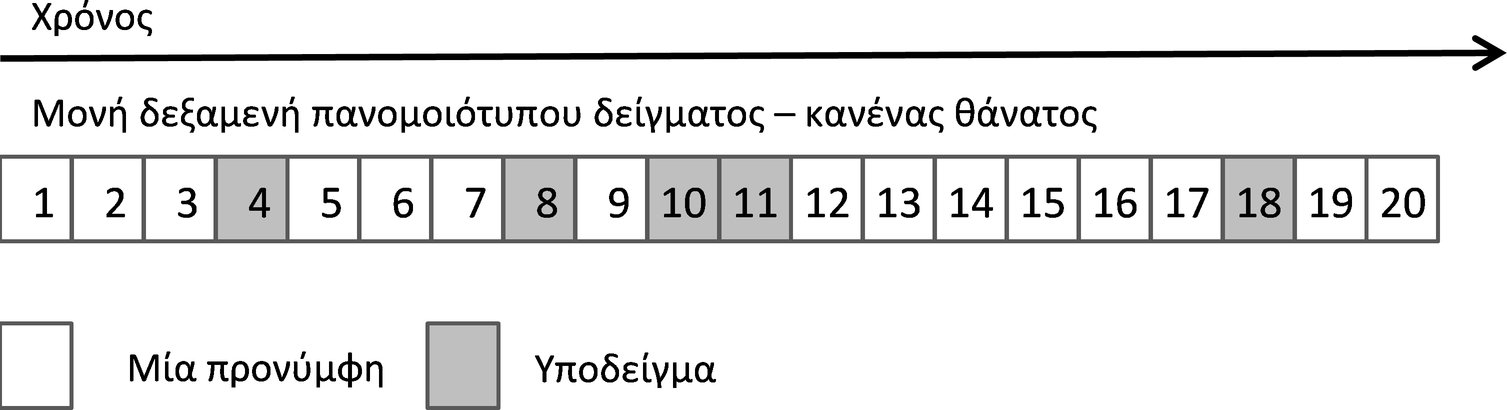
ΔΙΑΓΡΑΜΜΑ ΤΟΥ ΠΕΙΡΑΜΑΤΙΚΟΥ ΧΡΟΝΟΔΙΑΓΡΑΜΜΑΤΟΣ ΜΕ ΤΗ ΜΕΓΙΣΤΗ ΔΙΑΡΚΕΙΑ ΤΗΣ ΜΕΛΕΤΗΣ, ΒΑΣΕΙ ΠΛΗΡΟΥΣ ΠΕΡΙΟΔΟΥ ΖΕΥΓΑΡΩΜΑΤΟΣ 14 ΗΜΕΡΩΝ

Προσάρτημα 3
ΣΥΝΟΠΤΙΚΟΣ ΠΙΝΑΚΑΣ ΤΩΝ ΕΠΙΔΡΑΣΕΩΝ ΣΤΗΝ ΑΝΑΠΑΡΑΓΩΓΗ/ΑΝΑΠΤΥΞΗ
|
ΠΑΡΑΤΗΡΗΣΕΙΣ
|
ΤΙΜΕΣ
|
|
|
|
Δοσολογία (μονάδες)
|
0 (μάρτυρας)
|
…
|
…
|
…
|
…
|
|
Ζεύγη κατά την έναρξη (N)
|
|
|
|
|
|
|
Οιστρικός κύκλος (τουλάχιστον μέση διάρκεια και συχνότητα μη κανονικών κύκλων)
|
|
|
|
|
|
|
Θηλυκά που παρουσιάζουν ενδείξεις συνουσίας (N)
|
|
|
|
|
|
|
Θηλυκά που καθίστανται έγκυα (N)
|
|
|
|
|
|
|
Ημέρες σύλληψης 1 - 5 (N)
|
|
|
|
|
|
|
Ημέρες σύλληψης 6 -… (21) (N)
|
|
|
|
|
|
|
Εγκυμοσύνη ≤ 21 ημέρες (N)
|
|
|
|
|
|
|
Εγκυμοσύνη = 22 ημέρες (N)
|
|
|
|
|
|
|
Εγκυμοσύνη ≥ 23 ημέρες (N)
|
|
|
|
|
|
|
Μητέρες με ζώντα νεογνά (N)
|
|
|
|
|
|
|
Μητέρες με ζώντα νεογνά την 4η ημέρα (N)
|
|
|
|
|
|
|
Εμφυτευμένα έμβρυα/μητέρα (μέσος όρος)
|
|
|
|
|
|
|
Ζώντα νεογνά/μητέρα κατά τη γέννα (μέσος όρος)
|
|
|
|
|
|
|
Ζώντα νεογνά/μητέρα κατά την 4η ημέρα (μέσος όρος)
|
|
|
|
|
|
|
Αναλογία φύλων (α/θ) κατά τη γέννα (μέσος όρος)
|
|
|
|
|
|
|
Αναλογία φύλων (α/θ) κατά την 4η ημέρα (μέσος όρος)
|
|
|
|
|
|
|
Βάρος γέννας κατά τη γέννηση (μέσος όρος)
|
|
|
|
|
|
|
Βάρος γέννας κατά την 4η ημέρα (μέσος όρος)
|
|
|
|
|
|
|
Βάρος νεογνών κατά τη γέννηση (μέσος όρος)
|
|
|
|
|
|
|
Βάρος νεογνών κατά τη μέτρηση της πρωκτογεννητικής απόστασης (μέσος όρος αρσενικών, μέσος όρος θηλυκών)
|
|
|
|
|
|
|
Πρωκτογεννητική απόσταση νεογνών κατά την ίδια μεταγεννητική ημέρα, τη γέννηση – την 4η ημέρα (μέσος όρος αρσενικών, μέσος όρος θηλυκών, καταγραφή της ΜΓΗ)
|
|
|
|
|
|
|
Βάρος νεογνών κατά την 4η ημέρα (μέσος όρος)
|
|
|
|
|
|
|
Διατηρούμενες θηλές αρσενικών νεογνών τη 13η ημέρα (μέσος όρος)
|
|
|
|
|
|
|
Βάρος νεογνών κατά τη 13η ημέρα (μέσος όρος)
|
|
|
|
|
|
|
|
|
ΜΗ ΦΥΣΙΟΛΟΓΙΚΑ ΝΕΟΓΝΑ
|
|
Μητέρες με 0
|
|
|
|
|
|
|
Μητέρες με 1
|
|
|
|
|
|
|
Μητέρες με ≥ 2
|
|
|
|
|
|
|
|
|
ΑΠΩΛΕΙΑ ΑΠΟΓΟΝΩΝ
|
|
|
|
Προγεννητική/μετά την εμφύτευση (εμφυτευμένα έμβρυα μείον ζώντα νεογνά)
|
|
Θηλυκά με 0
|
|
|
|
|
|
|
Θηλυκά με 1
|
|
|
|
|
|
|
Θηλυκά με 2
|
|
|
|
|
|
|
Θηλυκά με ≥ 3
|
|
|
|
|
|
|
|
|
Μεταγεννητική (ζώντα κατά τη γέννα μείον ζώντα κατά τη 13η ΜΓΗ)
|
|
Θηλυκά με 0
|
|
|
|
|
|
|
Θηλυκά με 1
|
|
|
|
|
|
|
Θηλυκά με 2
|
|
|
|
|
|
|
Θηλυκά με ≥ 3
|
|
|
|
|
|
B.64 ΣΥΝΔΥΑΣΜΟΣ ΜΕΛΕΤΗΣ ΤΟΞΙΚΟΤΗΤΑΣ ΕΠΑΝΑΛΑΜΒΑΝΟΜΕΝΗΣ ΔΟΣΗΣ ΜΕ ΤΗ ΔΟΚΙΜΗ ΔΙΑΛΟΓΗΣ ΤΟΞΙΚΟΤΗΤΑΣ ΣΤΗΝ ΑΝΑΠΑΡΑΓΩΓΗ/ΑΝΑΠΤΥΞΗ
ΕΙΣΑΓΩΓΗ
|
1.
|
Η παρούσα μέθοδος δοκιμών είναι ισοδύναμη με την κατευθυντήρια γραμμή δοκιμών (TG) 422 του ΟΟΣΑ (2016). Οι κατευθυντήριες γραμμές του ΟΟΣΑ για τον έλεγχο χημικών ουσιών αναθεωρούνται ανά διαστήματα ώστε να λαμβάνονται υπόψη οι επιστημονικές εξελίξεις. Η αρχική κατευθυντήρια γραμμή δοκιμών διαλογής 422 εγκρίθηκε το 1996, βάσει ενός πρωτοκόλλου για συνδυασμένη δοκιμή επαναλαμβανόμενης δόσης και διαλογής αναπαραγωγής/ανάπτυξης που συζητήθηκε σε δύο συναντήσεις εμπειρογνωμόνων, στο Λονδίνο το 1990 (1) και στο Τόκυο το 1992 (2).
|
|
2.
|
Η παρούσα μέθοδος δοκιμών συνδυάζει ένα μέρος που συνίσταται στη διαλογή ως προς την τοξικότητα στην αναπαραγωγή/ανάπτυξη, το οποίο βασίζεται στην εμπειρία που απέκτησαν τα κράτη μέλη από τη χρήση της αρχικής μεθόδου σε υφιστάμενες χημικές ουσίες υψηλού όγκου παραγωγής και σε διερευνητικές μελέτες με ουσίες που χρησιμεύουν ως θετικοί μάρτυρες (3) (4), και ένα άλλο μέρος σχετικό με την τοξικότητα επαναλαμβανόμενης δόσης σύμφωνα με την κατευθυντήρια γραμμή 407 του ΟΟΣΑ (μελέτη τοξικότητας από το στόμα, 28 ημερών, με επαναλαμβανόμενη δόση σε τρωκτικά, που αντιστοιχεί στο κεφάλαιο B.7 του παρόντος παραρτήματος).
|
|
3.
|
Η παρούσα μέθοδος δοκιμών έχει επικαιροποιηθεί με παραμέτρους που αφορούν τους ενδοκρινικούς διαταράκτες, στο πλαίσιο της δράσης πρώτης προτεραιότητας που ξεκίνησε ο ΟΟΣΑ το 1998 με σκοπό την αναθεώρηση των υφιστάμενων κατευθυντήριων γραμμών δοκιμών και την ανάπτυξη νέων κατευθυντήριων γραμμών δοκιμών για τη διαλογή και τη διεξαγωγή δοκιμών σε δυνητικούς ενδοκρινικούς διαταράκτες (5). Σε αυτό το πλαίσιο, η TG 407 (που αντιστοιχεί στο κεφάλαιο B.7 του παρόντος παραρτήματος) ενισχύθηκε το 2008 με παραμέτρους κατάλληλες για την ανίχνευση ενδοκρινικής δραστηριότητας υπό δοκιμή χημικών ουσιών. Ο στόχος της επικαιροποίησης της TG 422 ήταν η συμπερίληψη ορισμένων παραμέτρων σχετικά με τους ενδοκρινικούς διαταράκτες σε TG διαλογής στις οποίες οι περίοδοι έκθεσης καλύπτουν ορισμένες από τις ευαίσθητες περιόδους κατά την ανάπτυξη (προγεννητική ή πρώτη μεταγεννητική περίοδος).
|
|
4.
|
Οι επιλεχθείσες πρόσθετες παράμετροι σχετικά με τους ενδοκρινικούς διαταράκτες, που αποτελούν επίσης μέρος της TG 443 (εκτεταμένη μελέτη τοξικότητας στην αναπαραγωγή μίας γενεάς, που αντιστοιχεί στο κεφάλαιο B.56 του παρόντος παραρτήματος), περιλήφθηκαν στην TG 422 βάσει μελέτης σκοπιμότητας στην οποία θίγονται επιστημονικά και τεχνικά θέματα που σχετίζονται με τη συμπερίληψή τους, καθώς και πιθανές προσαρμογές του σχεδιασμού δοκιμής που χρειάζονται για τη συμπερίληψή τους (6).
|
|
5.
|
Η παρούσα μέθοδος δοκιμών έχει σχεδιαστεί για να παρέχει πληροφορίες σχετικά με τις επιδράσεις μιας υπό δοκιμή χημικής ουσίας στην αναπαραγωγική συμπεριφορά αρσενικών και θηλυκών ατόμων, όπως η λειτουργία των γονάδων, η συμπεριφορά ζευγαρώματος, η σύλληψη, η ανάπτυξη του κυήματος και ο τοκετός. Δεν αποτελεί εναλλακτική μέθοδο ούτε αντικαθιστά τις υφιστάμενες μεθόδους δοκιμών B.31, B.34, B.35 ή B.56.
|
ΑΡΧΙΚΕΣ ΕΚΤΙΜΗΣΕΙΣ
|
6.
|
Κατά την εκτίμηση και αξιολόγηση των τοξικών χαρακτηριστικών μιας υπό δοκιμή χημικής ουσίας, μπορεί να προσδιοριστεί η τοξικότητά της από το στόμα με τη χρήση επαναλαμβανόμενης δόσης μετά τη λήψη αρχικών πληροφοριών για την τοξικότητα μέσω δοκιμών οξείας τοξικότητας. Η παρούσα μελέτη παρέχει πληροφορίες σχετικά με τους κινδύνους για την υγεία που είναι πιθανό να προκύψουν από την επαναλαμβανόμενη έκθεση για σχετικά περιορισμένη χρονική περίοδο. Η μέθοδος περιλαμβάνει τη βασική μελέτη τοξικότητας με επαναλαμβανόμενη δόση, που μπορεί να χρησιμοποιείται για χημικές ουσίες για τις οποίες δεν δικαιολογείται η διεξαγωγή μελέτης 90 ημερών (π.χ. όταν ο όγκος παραγωγής δεν υπερβαίνει συγκεκριμένα όρια) ή ως προκαταρκτικό στάδιο μιας μακροχρόνιας μελέτης. Κατά τη διεξαγωγή της μελέτης θα πρέπει να εφαρμόζονται οι γενικές αρχές και τα κριτήρια που περιγράφονται στο έγγραφο καθοδήγησης αριθ. 19 του ΟΟΣΑ σχετικά με την αναγνώριση, την αξιολόγηση και τη χρήση κλινικών σημείων ως ανώδυνων παραμέτρων για τα πειραματόζωα που χρησιμοποιούνται σε αξιολογήσεις ασφάλειας (7).
|
|
7.
|
Επίσης, περιλαμβάνει δοκιμή διαλογής ως προς την τοξικότητα στην αναπαραγωγή/ανάπτυξη και, ως εκ τούτου, μπορεί να χρησιμοποιηθεί και για την παροχή αρχικών πληροφοριών σχετικά με τις δυνητικές επιδράσεις στις αναπαραγωγικές επιδόσεις αρσενικών και θηλυκών όπως η λειτουργία των γονάδων, η συμπεριφορά ζευγαρώματος, η σύλληψη, η ανάπτυξη του κυήματος και ο τοκετός, είτε σε πρώιμο στάδιο της αξιολόγησης των τοξικολογικών ιδιοτήτων υπό δοκιμή χημικών ουσιών είτε για χημικές ουσίες που προκαλούν ανησυχία. Η παρούσα μέθοδος δοκιμών δεν παρέχει ολοκληρωμένες πληροφορίες για όλες τις πτυχές της αναπαραγωγής και της ανάπτυξης. Πιο συγκεκριμένα, παρέχει περιορισμένα μόνο μέσα ανίχνευσης των μεταγεννητικών εκδηλώσεων της προγεννητικής έκθεσης, ή των επαγόμενων κατά τη μεταγεννητική έκθεση πιθανών επιδράσεων. Λόγω (μεταξύ άλλων) της επιλεκτικότητας των παραμέτρων και της μικρής διάρκειας της μελέτης, η παρούσα μέθοδος δεν θα παρέχει αποδεικτικά στοιχεία που να στηρίζουν οριστικούς ισχυρισμούς περί ανυπαρξίας επιδράσεων στην αναπαραγωγή/ανάπτυξη. Επιπλέον, σε περίπτωση απουσίας δεδομένων από άλλες δοκιμές τοξικότητας στην αναπαραγωγή/ανάπτυξη, τα θετικά αποτελέσματα είναι χρήσιμα για την αρχική αξιολόγηση της επικινδυνότητας και συμβάλλουν στη διαδικασία λήψης αποφάσεων όσον αφορά την αναγκαιότητα και το χρονοδιάγραμμα διεξαγωγής πρόσθετων δοκιμών.
|
|
8.
|
Τα αποτελέσματα που προκύπτουν από τις σχετικές με το ενδοκρινικό σύστημα παραμέτρους θα πρέπει να μελετώνται στο πλαίσιο του εννοιολογικού πλαισίου για τον έλεγχο και την αξιολόγηση χημικών ενδοκρινικών διαταρακτών (Conceptual Framework for Testing and Assessment of Endocrine Disrupting Chemicals) του ΟΟΣΑ (8). Σε αυτό το εννοιολογικό πλαίσιο, η ενισχυμένη TG 422 του ΟΟΣΑ περιλαμβάνεται στο επίπεδο 4 ως in vivo δοκιμασία που παρέχει δεδομένα για τις δυσμενείς επιδράσεις των παραμέτρων που σχετίζονται με το ενδοκρινικό σύστημα. Εντούτοις, ένα ενδοκρινικό σήμα μπορεί να μη θεωρηθεί επαρκώς ισχυρό στοιχείο ώστε μια χημική ουσία να χαρακτηριστεί ενδοκρινικός διαταράκτης.
|
|
9.
|
Η μέθοδος δοκιμών δίδει μεγαλύτερη έμφαση στις νευρολογικές επιδράσεις ως ειδική παράμετρο καθώς και στην ανάγκη προσεκτικής κλινικής παρατήρησης των ζώων με σκοπό τη συγκέντρωση όσο το δυνατόν περισσοτέρων πληροφοριών. Επιδιώκεται η αναγνώριση χημικών ουσιών με νευροτοξικό δυναμικό, για τις οποίες ενδέχεται να χρειάζεται περαιτέρω εις βάθος διερεύνηση. Επιπλέον, η μέθοδος μπορεί επίσης να παράσχει βασικές ενδείξεις επιδράσεων στο ανοσοποιητικό σύστημα.
|
|
10.
|
Σε περίπτωση απουσίας δεδομένων από άλλες μελέτες συστηματικής τοξικότητας, τοξικότητας στην αναπαραγωγή/ανάπτυξη, νευροτοξικότητας και/ή ανοσοτοξικότητας, τα θετικά αποτελέσματα είναι χρήσιμα για την αρχική αξιολόγηση της επικινδυνότητας και συμβάλλουν στη διαδικασία λήψης αποφάσεων όσον αφορά την αναγκαιότητα και το χρονοδιάγραμμα διεξαγωγής πρόσθετων δοκιμών. Η δοκιμή μπορεί να είναι ιδιαίτερα χρήσιμη ως μέρος του συνόλου εξέτασης δεδομένων πληροφοριών (SIDS) του ΟΟΣΑ για την αξιολόγηση υφιστάμενων χημικών ουσιών για τις οποίες οι διαθέσιμες τοξικολογικές πληροφορίες είναι περιορισμένες ή ανύπαρκτες, και μπορεί να χρησιμοποιηθεί ως εναλλακτική λύση αντί της διεξαγωγής δύο χωριστών δοκιμών για την τοξικότητα επαναλαμβανόμενης δόσης (TG 407 του ΟΟΣΑ, που αντιστοιχεί στο κεφάλαιο B.7 του παρόντος παραρτήματος) και την τοξικότητα στην αναπαραγωγή/ανάπτυξη (TG 421 του ΟΟΣΑ, που αντιστοιχεί στο κεφάλαιο B.63 του παρόντος παραρτήματος) αντίστοιχα. Μπορεί επίσης να χρησιμοποιηθεί ως μελέτη προσδιορισμού εύρους δόσεων για πιο εκτεταμένες μελέτες της αναπαραγωγής/ανάπτυξης, ή όταν θεωρηθεί για άλλους λόγους κατάλληλη.
|
|
11.
|
Γενικά, σε ό,τι αφορά την ευαισθησία, θεωρείται ότι υπάρχουν διαφορές μεταξύ των έγκυων και των μη έγκυων ζώων. Κατά συνέπεια, ο προσδιορισμός των επιπέδων δόσεων που είναι επαρκή για την αξιολόγηση της γενικής συστηματικής τοξικότητας και της ειδικής τοξικότητας στην αναπαραγωγή/ανάπτυξη με την παρούσα συνδυαστική δοκιμή μπορεί να είναι πιο περίπλοκος απ’ ό,τι όταν οι μεμονωμένες δοκιμές διεξάγονται χωριστά. Επιπλέον, η ερμηνεία των αποτελεσμάτων της δοκιμής όσον αφορά τη γενική συστηματική τοξικότητα μπορεί να είναι πιο δύσκολη απ’ ό,τι όταν διεξάγεται χωριστή μελέτη επαναλαμβανόμενης δόσης, ιδίως όταν οι ορολογικές και οι ιστοπαθολογικές παράμετροι δεν αξιολογούνται κατά την ίδια χρονική στιγμή στη μελέτη. Εξαιτίας αυτών των πολύπλοκων τεχνικών πτυχών, για τη διεξαγωγή της παρούσας συνδυαστικής δοκιμής διαλογής απαιτείται σημαντική εμπειρία στη διεξαγωγή δοκιμών τοξικότητας. Από την άλλη πλευρά, πέραν του μικρότερου πλήθους χρησιμοποιούμενων ζώων, η συνδυαστική μελέτη μπορεί να προσφέρει έναν καλύτερο τρόπο διάκρισης των άμεσων επιδράσεων στην αναπαραγωγή/ανάπτυξη από τις επιδράσεις που θεωρούνται δευτερογενείς προς άλλες (συστηματικές) επιδράσεις.
|
|
12.
|
Στην παρούσα δοκιμή, η διάρκεια της περιόδου χορήγησης είναι μεγαλύτερη απ’ ό,τι στην κλασική μελέτη επαναλαμβανόμενης δόσης 28 ημερών. Ωστόσο, στην παρούσα δοκιμή χρησιμοποιείται μικρότερο πλήθος ζώων από κάθε φύλο ανά ομάδα σε σύγκριση με τη διεξαγωγή κλασικής μελέτης επαναλαμβανόμενης δόσης 28 ημερών συν μια δοκιμή διαλογής ως προς την τοξικότητα στην αναπαραγωγή/ανάπτυξη.
|
|
13.
|
Στην παρούσα μέθοδο δοκιμών θεωρείται ότι η υπό δοκιμή χημική ουσία χορηγείται από το στόμα. Εάν χρησιμοποιηθούν άλλες οδοί έκθεσης, ενδέχεται να χρειαστούν τροποποιήσεις.
|
|
14.
|
Πριν από τη χρήση της μεθόδου δοκιμών σε μείγμα για την παραγωγή δεδομένων για συγκεκριμένο κανονιστικό σκοπό, θα πρέπει να εξετάζεται αν –και, εάν ναι, για ποιον λόγο– μπορεί να αποδώσει αποτελέσματα κατάλληλα για τον επιδιωκόμενο σκοπό. Τέτοια εξέταση δεν χρειάζεται όταν οι κανονιστικές ρυθμίσεις επιβάλλουν τον έλεγχο του μείγματος.
|
|
15.
|
Οι ορισμοί που χρησιμοποιούνται παρατίθενται στο προσάρτημα 1.
|
ΑΡΧΗ ΤΗΣ ΔΟΚΙΜΗΣ
|
16.
|
Η υπό δοκιμή χημική ουσία χορηγείται σε διαβαθμισμένες δόσεις σε αρκετές ομάδες αρσενικών και θηλυκών ατόμων. Η χορήγηση των δόσεων στα αρσενικά θα πρέπει να διαρκεί τουλάχιστον τέσσερις εβδομάδες και να φθάνει μέχρι και την ημέρα πριν από την προγραμματισμένη θανάτωση (σε αυτό το χρονοδιάγραμμα περιλαμβάνονται τουλάχιστον δύο εβδομάδες πριν το ζευγάρωμα, η περίοδος του ζευγαρώματος και περίπου δύο εβδομάδες μετά το ζευγάρωμα). Λόγω της περιορισμένης περιόδου χορήγησης των δόσεων στα αρσενικά πριν από το ζευγάρωμα, η γονιμότητα ενδέχεται να μην αποτελεί ιδιαίτερα ευαίσθητο δείκτη της τοξικότητας στους όρχεις. Ως εκ τούτου, είναι ιδιαίτερα σημαντική ηδιεξαγωγή αναλυτικής ιστολογικής εξέτασης. Ο συνδυασμός μιας περιόδου χορήγησης διάρκειας δύο εβδομάδων πριν από το ζευγάρωμα και επακόλουθων παρατηρήσεων όσον αφορά το ζευγάρωμα/γονιμότητα με συνολική περίοδο χορήγησης τουλάχιστον τεσσάρων εβδομάδων, ακολουθούμενων από αναλυτική ιστοπαθολογική εξέταση των γονάδων των αρσενικών, θεωρείται επαρκής για την ανίχνευση της πλειονότητας των επιδράσεων στη γονιμότητα των αρσενικών και τη σπερματογένεση.
|
|
17.
|
Η χορήγηση δόσεων στα θηλυκά θα πρέπει να διαρκεί καθ’ όλο το διάστημα διεξαγωγής της μελέτης. Η εν λόγω χορήγηση περιλαμβάνει δύο εβδομάδες πριν από το ζευγάρωμα (με στόχο να καλυφθούν τουλάχιστον δύο πλήρεις κύκλοι οίστρου), το μεταβλητό χρονικό διάστημα μέχρι τη σύλληψη, τη διάρκεια της εγκυμοσύνης και τουλάχιστον δεκατρείς ημέρες μετά τη γέννηση, έως και την ημέρα πριν από την προγραμματισμένη θανάτωση.
|
|
18.
|
Η διάρκεια της μελέτης, μετά τον εγκλιματισμό και την αξιολόγηση του κύκλου οίστρου πριν από τη χορήγηση των δόσεων, εξαρτάται από τις επιδόσεις των θηλυκών και είναι κατά προσέγγιση 63 ημέρες [τουλάχιστον 14 ημέρες πριν από το ζευγάρωμα, (έως) 14 ημέρες ζευγαρώματος, 22 ημέρες κύησης, 13 ημέρες γαλουχίας].
|
|
19.
|
Τα ζώα εξετάζονται με προσοχή καθημερινά κατά τη διάρκεια της περιόδου χορήγησης για τυχόν συμπτώματα τοξικότητας. Τα ζώα που πεθαίνουν ή θανατώνονται κατά τη διάρκεια της δοκιμής νεκροτομούνται και, στο τέλος της δοκιμής, αυτά που έχουν επιζήσει θανατώνονται και νεκροτομούνται επίσης.
|
ΠΕΡΙΓΡΑΦΗ ΤΗΣ ΜΕΘΟΔΟΥ
Επιλογή ζωικού είδους
|
20.
|
Η παρούσα μέθοδος δοκιμών έχει σχεδιαστεί για χρήση με επίμυ. Η διερεύνηση των παραμέτρων που προσδιορίζονται στην παρούσα TG 422 σε άλλα είδη τρωκτικών πρέπει να αιτιολογείται αναλυτικά. Στο διεθνές πρόγραμμα επικύρωσης για την ανίχνευση ενδοκρινικών διαταρακτών της TG 407, ο επίμυς ήταν το μόνο είδος που χρησιμοποιήθηκε. Δεν θα πρέπει να χρησιμοποιούνται φυλές με χαμηλή γονιμότητα ή γνωστή υψηλή συχνότητα εμφάνισης αναπτυξιακών ελαττωμάτων. Θα πρέπει να χρησιμοποιούνται υγιή παρθένα ζώα, που δεν έχουν υποβληθεί προηγουμένως σε πειράματα. Τα πειραματόζωα θα πρέπει να χαρακτηρίζονται ως προς το είδος, τη φυλή, το φύλο, το βάρος και την ηλικία. Στην αρχή της μελέτης, η διακύμανση των βαρών των χρησιμοποιούμενων ζώων θα πρέπει να είναι ελάχιστη και να μην υπερβαίνει το ± 20 % της μέσης τιμής για κάθε φύλο. Σε περίπτωση που η μελέτη διεξάγεται ως προκαταρκτικό στάδιο μακροχρόνιας μελέτης ή μελέτης πλήρους γενεάς, συνιστάται να χρησιμοποιούνται και στις δύο μελέτες ζώα της ίδιας φυλής και προέλευσης.
|
Στέγαση και διατροφή
|
21.
|
Σε όλες οι διαδικασίες πρέπει να τηρούνται τα τοπικά πρότυπα φροντίδας των πειραματόζωων. Η θερμοκρασία του θαλάμου πειραματόζωων θα πρέπει να είναι 22 °C (± 3 °C). Η σχετική υγρασία θα πρέπει να είναι τουλάχιστον 30 % και, κατά προτίμηση, να μην υπερβαίνει το 70 %, εκτός από τις περιόδους καθαρισμού του θαλάμου. Ο φωτισμός πρέπει να είναι τεχνητός και η φωτοπερίοδος 12ωρη. Για τη διατροφή μπορούν να χρησιμοποιούνται συνήθη εργαστηριακά σιτηρέσια, με απεριόριστη παροχή πόσιμου νερού. Όταν η υπό δοκιμή χημική ουσία χορηγείται μέσω της παρούσας μεθόδου, η επιλογή σιτηρεσίου ενδέχεται να επηρεάζεται από την ανάγκη κατάλληλης ανάμειξης της ουσίας.
|
|
22.
|
Τα ζώα θα πρέπει να στεγάζονται σε μικρές ομάδες του ίδιου φύλου. Επιτρέπεται η ατομική στέγαση, εάν αιτιολογείται επιστημονικά. Σε περίπτωση ομαδικής στέγασης, κάθε κλωβός δεν πρέπει να περιέχει περισσότερα από πέντε ζώα. Οι διαδικασίες ζευγαρώματος θα πρέπει να εκτελούνται σε κλωβούς κατάλληλους για τον σκοπό αυτό. Τα έγκυα θηλυκά θα πρέπει να στεγάζονται σε ατομικούς κλωβούς και θα πρέπει να τους παρέχονται υλικά φωλιάσματος. Τα θηλυκά κατά τη γαλουχία τοποθετούνται σε ατομικούς κλωβούς μαζί με τα νεογνά τους.
|
|
23.
|
Η τροφή πρέπει να υποβάλλεται τακτικά σε ανάλυση ώστε να εντοπίζονται τυχόν ξένες προσμείξεις. Ένα δείγμα του σιτηρεσίου θα πρέπει να διατηρείται έως την οριστικοποίηση της έκθεσης.
|
Προετοιμασία των ζώων
|
24.
|
Λαμβάνονται τυχαία υγιή, νεαρά, ενήλικα ζώα και κατανέμονται στις ομάδες και τους κλωβούς του πειράματος. Οι κλωβοί θα πρέπει να διατάσσονται με τρόπο ώστε να ελαχιστοποιούνται οι πιθανές επιδράσεις της θέσης τους. Τα ζώα ταυτοποιούνται με αποκλειστικό αναγνωριστικό και παραμένουν στα κλουβιά τους τουλάχιστον πέντε ημέρες πριν από την έναρξη της μελέτης προκειμένου να εγκλιματιστούν στις εργαστηριακές συνθήκες.
|
Παρασκευή των δόσεων
|
25.
|
Συνιστάται η χορήγηση της υπό δοκιμή χημικής ουσίας από το στόμα, εκτός εάν θεωρούνται καταλληλότερες άλλες οδοί χορήγησης. Όταν επιλέγεται η οδός από το στόμα, η υπό δοκιμή χημική ουσία χορηγείται συνήθως με στομαχικό καθετήρα· εντούτοις, οι υπό δοκιμή χημικές ουσίες μπορούν εναλλακτικά να χορηγούνται μέσω του σιτηρεσίου ή του πόσιμου νερού.
|
|
26.
|
Εφόσον είναι αναγκαίο, παρασκευάζεται διάλυμα ή εναιώρημα της υπό δοκιμή χημικής ουσίας σε κατάλληλο φορέα. Συνιστάται να εξετάζεται ως πρώτη επιλογή, εφόσον είναι δυνατόν, η χρήση υδατικού διαλύματος/εναιωρήματος, έπειτα η χρήση διαλύματος/εναιωρήματος σε έλαιο (π.χ. αραβοσιτέλαιο) και, ως τελευταία επιλογή, η χρήση διαλύματος σε άλλο φορέα. Σε περίπτωση που ο φορέας δεν είναι το νερό, θα πρέπει να είναι γνωστά τα τοξικά χαρακτηριστικά του. Θα πρέπει να προσδιορίζεται η σταθερότητα και η ομοιογένεια της υπό δοκιμή χημικής ουσίας στον φορέα.
|
ΔΙΑΔΙΚΑΣΙΑ
Αριθμός και φύλο των ζώων
|
27.
|
Συνιστάται κάθε ομάδα να περιλαμβάνει αρχικά τουλάχιστον 10 αρσενικά και 12-13 θηλυκά. Πριν από την έκθεση, θα αξιολογείται η κυκλικότητα του οίστρου των θηλυκών και τα ζώα που δεν παρουσιάζουν τυπικούς κύκλους 4-5 ημερών δεν θα περιλαμβάνονται στη μελέτη· ως εκ τούτου, συνιστάται η προσθήκη επιπλέον θηλυκών στις ομάδες ώστε αυτές να αποτελούνται από 10 θηλυκά έκαστη. Εκτός της περίπτωσης έντονων τοξικών επιδράσεων, αναμένεται ότι κατ’ αυτόν τον τρόπο θα εξασφαλίζονται τουλάχιστον 8 έγκυα θηλυκά ανά ομάδα, που είναι συνήθως ο ελάχιστος αποδεκτός αριθμός έγκυων θηλυκών ανά ομάδα. Στόχος είναι να προκαλούνται επαρκείς κυοφορίες και απόγονοι για να εξασφαλίζεται η ουσιαστική αξιολόγηση της ικανότητας της υπό δοκιμή χημικής ουσίας να επιδρά στη γονιμότητα, στην κύηση, στη μητρική συμπεριφορά και στη συμπεριφορά θηλασμού των ζώων, καθώς και στην αύξηση και την ανάπτυξη των απογόνων της F1 από τη σύλληψη ως τη 13η ημέρα μετά τον τοκετό. Εάν προβλέπονται θανατώσεις κατά τη διάρκεια της δοκιμασίας, ο αριθμός αυξάνεται ανάλογα κατά τον αριθμό των ζώων που πρόκειται να θανατωθούν πριν την ολοκλήρωση της μελέτης. Θα πρέπει να εξετάζεται το ενδεχόμενο χρήσης επιπρόσθετης δορυφορικής ομάδας πέντε ζώων ανά φύλο στην ομάδα μαρτύρων και στην ομάδα μέγιστης δόσης, με σκοπό την παρατήρηση της αναστρεψιμότητας, της εμμονής ή της καθυστερημένης εμφάνισης συστηματικών τοξικών επιδράσεων επί 14 ημέρες τουλάχιστον μετά την αγωγή. Τα ζώα της δορυφορικής ομάδας δεν θα ζευγαρώνουν και, κατά συνέπεια, δεν χρησιμοποιούνται για την αξιολόγηση της τοξικότητας στην αναπαραγωγή/ανάπτυξη.
|
Δοσολογία
|
28.
|
Κατά κανόνα πρέπει να χρησιμοποιούνται τουλάχιστον τρεις ομάδες δοκιμής και μία ομάδα μαρτύρων. Εάν δεν διατίθενται κατάλληλα δεδομένα γενικής τοξικότητας, είναι δυνατόν να εκπονηθεί μελέτη προσδιορισμού του εύρους (ζώα της ίδιας φυλής και προέλευσης) για να διευκολύνει τον καθορισμό των δόσεων που θα χρησιμοποιηθούν. Εκτός από τη χορήγηση της υπό δοκιμή χημικής ουσίας, τα ζώα της ομάδας μαρτύρων θα πρέπει να υφίστανται την ίδια ακριβώς μεταχείριση όπως τα υποκείμενα των ομάδων δοκιμής. Εάν χρησιμοποιείται φορέας για τη χορήγηση της υπό δοκιμή χημικής ουσίας, η ομάδα μαρτύρων πρέπει να λαμβάνει τον φορέα στον μέγιστο χρησιμοποιούμενο όγκο.
|
|
29.
|
Τα επίπεδα των δόσεων θα πρέπει να επιλέγονται λαμβανομένων υπόψη τυχόν υφιστάμενων δεδομένων για την τοξικότητα και την (τοξικο-)κινητική. Επίσης, θα πρέπει να λαμβάνεται υπόψη ότι ενδέχεται να υπάρχουν διαφορές στην ευαισθησία μεταξύ έγκυων και μη έγκυων ζώων. Το υψηλότερο επίπεδο δόσης πρέπει να επιλέγεται με σκοπό να προκαλέσει τοξικές εκδηλώσεις, όχι όμως τον θάνατο ούτε έντονη οδύνη. Στη συνέχεια επιλέγεται φθίνουσα σειρά δοσολογικών επιπέδων με σκοπό τον εντοπισμό απόκρισης συνδεόμενης με τη δόση και του χαμηλότερου επιπέδου δόσης στο οποίο δεν παρατηρούνται δυσμενείς επιδράσεις. Η βέλτιστη επιλογή είναι συνήθως ο υποδιπλασιασμός ή υποτετραπλασιασμός, ενώ η προσθήκη μιας τέταρτης ομάδας δοκιμής είναι συχνά προτιμότερη από τη χρησιμοποίηση πολύ μεγάλων συντελεστών (π.χ. άνω του 10) μεταξύ των δόσεων.
|
|
30.
|
Όταν παρατηρείται γενική τοξικότητα (π.χ. μειωμένο βάρος σώματος, επιδράσεις στο ήπαρ, την καρδιά, τους πνεύμονες, τους νεφρούς κ.λπ.) ή άλλη αλλαγή που μπορεί να μην είναι τοξική αντίδραση (π.χ. μειωμένη πρόσληψη τροφής, διόγκωση του ήπατος), οι παρατηρούμενες επιδράσεις στις παραμέτρους που συνδέονται με ευαισθησία του ενδοκρινικού συστήματος θα πρέπει να ερμηνεύονται με προσοχή.
|
Οριακή δοκιμή
|
31.
|
Εάν μια δοκιμή από το στόμα σύμφωνα με τις περιγραφόμενες για την παρούσα μελέτη διαδικασίες, με επίπεδο δόσης τουλάχιστον 1 000 mg/kg βάρους σώματος/ημέρα ή, εφόσον πρόκειται για χορήγηση μέσω του σιτηρεσίου, με αντίστοιχη εκατοστιαία αναλογία στο σιτηρέσιο ή στο πόσιμο νερό (βάσει μετρήσεων του βάρους σώματος), δεν έχει ως αποτέλεσμα παρατηρήσιμες τοξικές επιδράσεις και εάν, βάσει των διαθέσιμων δεδομένων για χημικές ουσίες ανάλογης δομής, δεν αναμένεται τοξικότητα, είναι δυνατόν να μην απαιτείται διεξαγωγή πλήρους μελέτης με πολλά επίπεδα δόσεων. Μπορεί να χρησιμοποιηθεί οριακή δοκιμή, εκτός εάν, με βάση την έκθεση του ανθρώπου, διαφαίνεται η ανάγκη χρησιμοποίησης υψηλότερου επιπέδου δόσης. Σε περίπτωση χορήγησης από άλλη οδό, όπως εισπνοή ή εφαρμογή στο δέρμα, η μέγιστη εφικτή έκθεση μπορεί να εξαρτάται συχνά από τις φυσικές και χημικές ιδιότητες των υπό δοκιμή ουσιών.
|
Χορήγηση των δόσεων
|
32.
|
Η δόση της υπό δοκιμή χημικής ουσίας χορηγείται στα ζώα καθημερινά επί 7 ημέρες την εβδομάδα. Όταν η υπό δοκιμή χημική ουσία χορηγείται με καθετήρα, η χορήγηση πρέπει να γίνεται εφάπαξ με τη βοήθεια στομαχικού καθετήρα ή κατάλληλης διασωλήνωσης. Ο μέγιστος όγκος υγρού που μπορεί να χορηγηθεί εφάπαξ εξαρτάται από το μέγεθος του πειραματόζωου. Ο όγκος δεν θα πρέπει να υπερβαίνει το 1 ml/100 g βάρους σώματος, εκτός της περίπτωσης υδατικών διαλυμάτων όπου μπορούν να χρησιμοποιούνται 2 ml/100 g βάρους σώματος. Εκτός από την περίπτωση των ερεθιστικώνή διαβρωτικών υπό δοκιμή χημικών ουσιών, οι οποίες σε υψηλότερες συγκεντρώσεις συνήθως προκαλούν εντονότερες επιδράσεις, η μεταβλητότητα των όγκων δοκιμής πρέπει να ελαχιστοποιείται με ρύθμιση της συγκέντρωσης, ώστε να εξασφαλίζεται σταθερός όγκος σε όλα τα επίπεδα δόσης.
|
|
33.
|
Για τις υπό δοκιμή χημικές ουσίες που χορηγούνται με την τροφή ή το πόσιμο νερό, πρέπει να εξασφαλίζεται ότι οι χορηγούμενες ποσότητες υπό δοκιμή χημικής ουσίας δεν επηρεάζουν το κανονικό διατροφικό ισοζύγιο ή ισοζύγιο νερού. Όταν η υπό δοκιμή χημική ουσία χορηγείται μέσω του σιτηρεσίου, μπορεί να χρησιμοποιείται είτε σταθερή συγκέντρωση στο σιτηρέσιο (ppm) είτε σταθερό επίπεδο δόσης, εκφρασμένο επί του βάρους σώματος του ζώου. Η χρησιμοποιούμενη εναλλακτική επιλογή πρέπει να διευκρινίζεται. Για υπό δοκιμή χημικές ουσίες που χορηγούνται με καθετήρα, η δόση θα πρέπει να χορηγείται την ίδια περίπου ώρα κάθε μέρα και να ρυθμίζεται τουλάχιστον κάθε εβδομάδα ώστε να διατηρείται σταθερό επίπεδο δόσης ως προς το βάρος του σώματος. Όταν η συνδυαστική μελέτη χρησιμοποιείται ως προκαταρκτικό στάδιο μακροχρόνιας μελέτης ή πλήρους μελέτης τοξικότητας στην αναπαραγωγή, θα πρέπει να χρησιμοποιείται παρόμοιο σιτηρέσιο και στις δύο μελέτες.
|
Χρονοδιάγραμμα πειράματος
|
34.
|
Η χορήγηση δόσεων και στα δύο φύλα θα πρέπει να ξεκινά δύο εβδομάδες πριν από το ζευγάρωμα, αφού έχουν εγκλιματιστεί για τουλάχιστον πέντε ημέρες και τα θηλυκά έχουν υποβληθεί σε διαδικασία διαλογής ως προς την κανονικότητα των κύκλων οίστρου (στη διάρκεια περιόδου δύο εβδομάδων πριν από την αγωγή). Η μελέτη θα πρέπει να προγραμματίζεται κατά τρόπον ώστε η αξιολόγηση των κύκλων οίστρου να ξεκινά σε σύντομο χρονικό διάστημα αφότου τα ζώα έχουν φθάσει σε πλήρη σεξουαλική ωρίμανση. Το εν λόγω διάστημα μπορεί να διαφέρει ελαφρώς για διαφορετικές φυλές επιμύων σε διαφορετικά εργαστήρια, π.χ. επίμυες Sprague Dawley ηλικίας 10 εβδομάδων, επίμυες Wistar ηλικίας περίπου 12 εβδομάδων. Οι μητέρες με απογόνους πρέπει να θανατώνονται τη 13η ημέρα μετά τον τοκετό, ή σύντομα μετά από αυτό. Για να αφεθούν οι μητέρες σε ολονύκτια νηστεία πριν από την αιμοληψία (εφόσον προτιμηθεί αυτή η επιλογή), δεν χρειάζεται να θανατωθούν οι μητέρες και τα νεογνά την ίδια ημέρα. Η ημέρα γέννησης (όταν έχει ολοκληρωθεί ο τοκετός) ορίζεται ως η ημέρα 0 μετά τον τοκετό. Τα θηλυκά που δεν εμφανίζουν ενδείξεις συνουσίας θανατώνονται 24-26 ημέρες μετά την τελευταία ημέρα της περιόδου ζευγαρώματος. Η χορήγηση συνεχίζεται και στα δύο φύλα κατά τη διάρκεια της περιόδου ζευγαρώματος. Στα αρσενικά η χορήγηση θα πρέπει να συνεχίζεται και μετά την περίοδο ζευγαρώματος, τουλάχιστον έως ότου ολοκληρωθεί η ελάχιστη συνολική περίοδος χορήγησης των 28 ημερών. Στη συνέχεια θανατώνονται ή, εναλλακτικά, διατηρούνται και συνεχίζουν να λαμβάνουν δόσεις με σκοπό την πιθανή πραγματοποίηση δεύτερου ζευγαρώματος, εάν χρειαστεί.
|
|
35.
|
Η καθημερινή χορήγηση στα γονικά θηλυκά θα πρέπει να συνεχίζεται καθ’ όλη τη διάρκεια της κύησης και τουλάχιστον μέχρι και τη 13η ημέρα μετά τον τοκετό ή την ημέρα πριν τη θανάτωση. Για μελέτες όπου η υπό δοκιμή χημική ουσία χορηγείται μέσω εισπνοής ή διά του δέρματος, η χορήγηση θα πρέπει να συνεχίζεται τουλάχιστον μέχρι και τη 19η ημέρα της κύησης, και θα πρέπει να ξεκινά εκ νέου το συντομότερο δυνατό, το αργότερο μέχρι την 4η ημέρα μετά τη γέννηση (ΜΓΗ).
|
|
36.
|
Τα ζώα που ανήκουν σε δορυφορική ομάδα για την οποία έχουν προγραμματιστεί επακόλουθες παρατηρήσεις, εφόσον προβλέπονται, δεν ζευγαρώνονται. Θα πρέπει να διατηρούνται για τουλάχιστον 14 ακόμη ημέρες μετά την πρώτη προγραμματισμένη θανάτωση των μητέρων, χωρίς αγωγή, προκειμένου να διαπιστωθεί τυχόν καθυστερημένη εκδήλωση, ή εμμονή, ή ανάρρωση από τοξικές επιδράσεις.
|
|
37.
|
Στο παράρτημα 2 παρατίθεται διάγραμμα του χρονοδιαγράμματος διεξαγωγής των πειραμάτων.
|
Οιστρικοί κύκλοι
|
38.
|
Οι οιστρικοί κύκλοι θα πρέπει να παρακολουθούνται πριν από την έναρξη της αγωγής προκειμένου να επιλέγονται για τη δοκιμή θηλυκά με κανονική κυκλικότητα (βλ. παράγραφο 27). Επίσης, θα πρέπει να παρακολουθούνται καθημερινά κολπικά επιχρίσματα, από την έναρξη της περιόδου αγωγής μέχρις ότου διαπιστωθούν ενδείξεις ζευγαρώματος. Εάν υπάρχει ανησυχία για οξείες αγχογόνες επιδράσεις που μπορεί να μεταβάλλουν τους οιστρικούς κύκλους με την έναρξη της χορήγησης, τα εργαστήρια μπορούν να υποβάλλουν τα ζώα σε έκθεση 2 εβδομάδων και, στη συνέχεια, να συλλέγουν καθημερινά κολπικά επιχρίσματα προκειμένου να παρακολουθούν τον οιστρικό κύκλο για τουλάχιστον δύο εβδομάδες κατά την περίοδο πριν από το ζευγάρωμα, και να συνεχίζουν την παρακολούθηση καθ’ όλη τη διάρκεια της περιόδου ζευγαρώματος μέχρι να ανιχνευθούν ενδείξεις ζευγαρώματος. Κατά τη λήψη κολπικών/τραχηλικών κυττάρων, θα πρέπει να λαμβάνεται μέριμνα ώστε να αποφεύγεται η διαταραχή των βλεννογόνων που μπορεί να επαγάγει ψευδοκύηση (8) (9).
|
Διαδικασία ζευγαρώματος
|
39.
|
Κανονικά, στην παρούσα μελέτη θα πρέπει να χρησιμοποιούνται ζευγαρώματα 1:1 (ένα αρσενικό προς ένα θηλυκό). Μπορεί να υπάρξουν εξαιρέσεις, στην περίπτωση περιστασιακών θανάτων αρσενικών. Το θηλυκό θα πρέπει να τοποθετείται μαζί με το ίδιο αρσενικό μέχρις ότου παρατηρηθούν ενδείξεις συνουσίας ή μέχρι να παρέλθει διάστημα δύο εβδομάδων. Κάθε πρωί, τα θηλυκά πρέπει να εξετάζονται για την παρουσία σπέρματος ή κολπικού βύσματος. Ως ημέρα 0 της κύησης ορίζεται η ημέρα κατά την οποία επιβεβαιώνονται οι ενδείξεις ζευγαρώματος (ανιχνεύεται κολπικό βύσμα ή σπέρμα). Σε περίπτωση που το ζευγάρωμα αποδειχθεί ανεπιτυχές, πρέπει να εξετάζεται το ενδεχόμενο νέου ζευγαρώματος των θηλυκών με ελεγμένα αρσενικά της ίδιας ομάδας.
|
Μέγεθος γέννας
|
40.
|
Την 4η ημέρα μετά τη γέννηση, το μέγεθος κάθε γέννας μπορεί να ρυθμίζεται διά της απομάκρυνσης των πλεοναζόντων νεογνών με τυχαία επιλογή, ούτως ώστε να παραμένουν, όπου είναι εφικτό, τέσσερα ή πέντε νεογνά ανά φύλο ανά γέννα, ανάλογα με το σύνηθες μέγεθος γέννας στη φυλή των επιμύων που χρησιμοποιείται. Από δύο από τα πλεονάζοντα νεογνά θα πρέπει να συλλέγονται δείγματα αίματος, να συγκεντρώνονται και να χρησιμοποιούνται για τον προσδιορισμό των επιπέδων της T4 στον ορό. Δεν ενδείκνυται η επιλεκτική απομάκρυνση νεογνών, π.χ. βάσει του σωματικού βάρους ή της πρωκτογεννητικής απόστασης (AGD). Όταν ο αριθμός των αρσενικών ή θηλυκών νεογνών δεν φθάνει τα τέσσερα ή πέντε νεογνά ανά φύλο ανά γέννα, είναι αποδεκτή η μερική ρύθμιση (π.χ. έξι αρσενικά και τέσσερα θηλυκά). Δεν απομακρύνεται κανένα νεογνό όταν το μέγεθος της γέννας είναι χαμηλότερο του στόχου (8 ή 10 νεογνά/γέννα). Εάν υπάρχει ένα μόνο νεογνό πάνω από τον στόχο απομάκρυνσης, θα απομακρύνεται μόνο ένα νεογνό, το οποίο θα χρησιμοποιείται για συλλογή αίματος με σκοπό την πιθανή διενέργεια αξιολογήσεων της T4.
|
|
41.
|
Εάν δεν ρυθμιστεί το μέγεθος της γέννας, την 4η ημέρα μετά τη γέννηση θανατώνονται δύο νεογνά ανά γέννα και λαμβάνονται δείγματα αίματος για μέτρηση των συγκεντρώσεων θυρεοειδικών ορμονών στον ορό. Ει δυνατόν, τα δύο νεογνά ανά γέννα θα πρέπει να είναι θηλυκά προκειμένου να διατηρηθούν τα αρσενικά νεογνά για αξιολογήσεις διατηρούμενων θηλών, εκτός εάν η απομάκρυνση των δύο νεογνών θα είχε ως αποτέλεσμα να μην υπάρχουν άλλα θηλυκά προς αξιολόγηση κατά τη λήξη της μελέτης. Δεν απομακρύνεται κανένα νεογνό εάν έτσι το μέγεθος της γέννας θα μειωνόταν κάτω από τα 8 έως 10 νεογνά/γέννα (ανάλογα με το κανονικό μέγεθος γέννας στη χρησιμοποιούμενη φυλή επιμύων). Εάν υπάρχει ένα μόνο νεογνό πάνω από το κανονικό μέγεθος γέννας, θα απομακρύνεται μόνο ένα νεογνό, το οποίο θα χρησιμοποιείται για συλλογή αίματος με σκοπό την πιθανή διενέργεια αξιολογήσεων της T4.
|
Παρατηρήσεις
|
42.
|
Θα πρέπει να διεξάγονται γενικές κλινικές παρατηρήσεις τουλάχιστον μια φορά ημερησίως, κατά προτίμηση την ίδια ώρα κάθε ημέρα και λαμβανομένου υπόψη του χρόνου κορύφωσης των αναμενόμενων επιδράσεων μετά τη χορήγηση της δόσης. Η κατάσταση της υγείας των ζώων θα πρέπει να καταγράφεται. Όλα τα ζώα εξετάζονται τουλάχιστον δύο φορές την ημέρα για τη διαπίστωση νοσηρότητας και θνησιμότητας.
|
|
43.
|
Όλα τα γονικά ζώα πρέπει να υποβάλλονται σε λεπτομερή κλινική παρατήρηση μία φορά πριν από την πρώτη έκθεση (προκειμένου να γίνουν συγκρίσεις της κατάστασης κάθε ζώου) και στη συνέχεια τουλάχιστον μια φορά την εβδομάδα. Οι παρατηρήσεις αυτές πρέπει να διενεργούνται κατά προτίμηση την ίδια ώρα κάθε ημέρα, έξω από τους κλωβούς σε έναν τυποποιημένο χώρο. Οι παρατηρήσεις πρέπει να καταγράφονται επιμελώς, κατά προτίμηση με χρήση συστημάτων βαθμολόγησης, τα οποία προσδιορίζονται διεξοδικά από το εργαστήριο που διεξάγει τις δοκιμές. Καταβάλλεται προσπάθεια ώστε οι συνθήκες της δοκιμής να παρουσιάζουν τις ελάχιστες δυνατές διακυμάνσεις και οι παρατηρήσεις να διεξάγονται κατά προτίμηση από άτομα που δεν γνωρίζουν την αγωγή. Σημεία που θα πρέπει να καταγράφονται είναι, μεταξύ άλλων, μεταβολές στο δέρμα, το τρίχωμα, τους οφθαλμούς και τους βλεννογόνους, εκκρίσεις και απεκκρίσεις, καθώς και δραστηριότητα του αυτόνομου νευρικού συστήματος (π.χ. δακρύρροια, ανόρθωση τριχών, μεταβολή του μεγέθους της κόρης του οφθαλμού, ασυνήθης ρυθμός αναπνοής). Καταγράφονται επίσης μεταβολές στο βάδισμα, στη στάση και στην αντίδραση κατά τη μεταχείριση, καθώς και η εμφάνιση κλονικών ή τονικών κινήσεων, στερεότυπων κινήσεων (όπως υπερβολική περιποίηση του τριχώματος, συνεχές κυκλικό βάδισμα), δυσχερούς ή παρατεταμένου τοκετού ή περίεργης συμπεριφοράς (όπως αυτοτραυματισμός, βάδισμα προς τα πίσω) (10).
|
|
44.
|
Μία φορά στη διάρκεια της μελέτης θα πρέπει να αξιολογείται η αισθητηριακή ανταπόκριση σε διαφορετικών ειδών ερεθίσματα (π.χ. ακουστικά, οπτικά και ιδιοδεκτικά ερεθίσματα) (8) (9) (11), η δύναμη λαβής (12) και η κινητικότητα (13) σε πέντε αρσενικά και πέντε θηλυκά που επιλέγονται τυχαία από κάθε ομάδα. Λεπτομερέστερη περιγραφή των διαδικασιών που μπορούν να ακολουθηθούν δίνονται στις αντίστοιχες βιβλιογραφικές παραπομπές. Εναλλακτικές διαδικασίες, διαφορετικές από τις περιγραφόμενες στις βιβλιογραφικές παραπομπές, μπορούν να χρησιμοποιηθούν επίσης. Στα αρσενικά, οι εν λόγω παρατηρήσεις των λειτουργιών θα πρέπει να γίνονται προς το τέλος της περιόδου χορήγησης των δόσεών τους, λίγο πριν την προγραμματισμένη θανάτωση αλλά πριν από τη δειγματοληψία αίματος για αιματολογικές εξετάσεις ή αναλύσεις κλινικής χημείας (βλ. παραγράφους 53-56, περιλαμβανομένης της υποσημείωσης 1). Στη διάρκεια αυτών των δοκιμών, τα θηλυκά θα πρέπει να βρίσκονται σε κατάσταση ανάλογη από άποψη φυσιολογίας και θα πρέπει, κατά προτίμηση, να υποβάλλονται σε δοκιμή τουλάχιστον εφάπαξ την τελευταία εβδομάδα της γαλουχίας (π.χ. LD 6-13), λίγο πριν από την προγραμματισμένη θανάτωση. Στον βαθμό που είναι εφικτό, θα πρέπει να ελαχιστοποιείται το χρονικό διάστημα χωρισμού των νεογνών από τις μητέρες.
|
|
45.
|
Οι παρατηρήσεις των λειτουργιών που γίνονται εφάπαξ προς το τέλος της μελέτης μπορούν να παραλειφθούν όταν η μελέτη διεξάγεται ως προκαταρκτικό στάδιο επακόλουθης υποχρόνιας (90 ημερών) ή μακροχρόνιας μελέτης. Στην περίπτωση αυτή, οι παρατηρήσεις των λειτουργιών θα πρέπει να περιλαμβάνονται στην επακόλουθη αυτή μελέτη. Από την άλλη πλευρά όμως, η ύπαρξη δεδομένων για τις λειτουργίες από την παρούσα μελέτη επαναλαμβανόμενης δόσης είναι δυνατόν να διευκολύνει την επιλογή επίπεδων δόσεων για μια επακόλουθη υποχρόνια ή μακροχρόνια μελέτη.
|
|
46.
|
Κατ’ εξαίρεση, οι παρατηρήσεις των λειτουργιών μπορούν επίσης να παραλείπονται όταν οι ομάδες εμφανίζουν εκδηλώσεις τοξικότητας σε βαθμό που παρεμποδίζει σημαντικά την εκτέλεση της δοκιμής λειτουργιών.
|
|
47.
|
Η διάρκεια της κύησης πρέπει να καταγράφεται και υπολογίζεται από την ημέρα 0 της εγκυμοσύνης. Κάθε γέννα πρέπει να εξετάζεται το συντομότερο δυνατό μετά τον τοκετό για να προσδιορίζεται ο αριθμός και το φύλο των νεογνών, τα θνησιγενή νεογνά, τα ζώντα νεογνά, τα καχεκτικά νεογνά (νεογνά αρκετά μικρότερου μεγέθους από τα αντίστοιχα νεογνά μάρτυρες) και η παρουσία μακροσκοπικώς ορατών ανωμαλιών.
|
|
48.
|
Τα ζώντα νεογνά πρέπει να καταμετρώνται και να προσδιορίζεται το φύλο τους, ενώ οι ομάδες των νεογνών που γεννήθηκαν από την ίδια μητέρα πρέπει να ζυγίζονται εντός 24 ωρών από τον τοκετό (ημέρα 0 ή 1 μετά τον τοκετό) και τουλάχιστον την 4η και τη 13η ημέρα μετά τον τοκετό. Πέραν των παρατηρήσεων επί των γονικών ζώων (βλ. παραγράφους 43 και 44), θα πρέπει να καταγράφεται τυχόν μη φυσιολογική συμπεριφορά των απογόνων.
|
|
49.
|
Η πρωκτογεννητική απόσταση κάθε νεογνού θα πρέπει να μετράται την ίδια ημέρα μεταγεννητικά, μεταξύ της μεταγεννητικής ημέρας (ΜΓΗ) 0 και 4. Θα πρέπει να προσδιορίζεται το σωματικό βάρος του νεογνού την ημέρα μέτρησης της πρωκτογεννητικής απόστασης, η οποία θα πρέπει να κανονικοποιείται σε ένα μέτρο του μεγέθους του νεογνού, κατά προτίμηση στην κυβική ρίζα του σωματικού βάρους (14). Θα πρέπει να καταμετράται ο αριθμός των θηλών/άλων στα αρσενικά νεογνά τη 12η ή 13η ΜΓΗ, όπως συνιστάται στο έγγραφο καθοδήγησης αριθ. 151 του ΟΟΣΑ (15).
|
Σωματικό βάρος και κατανάλωση τροφής/νερού
|
50.
|
Τα αρσενικά και τα θηλυκά θα πρέπει να ζυγίζονται κατά την πρώτη ημέρα της χορήγησης και, στη συνέχεια, τουλάχιστον μία φορά την εβδομάδα, καθώς και κατά τη λήξη της μελέτης. Στη διάρκεια της κύησης, τα θηλυκά πρέπει να ζυγίζονται τις ημέρες 0, 7, 14 και 20, και εντός 24 ωρών από τον τοκετό (ημέρα 0 ή 1η ημέρα μετά τον τοκετό) και τουλάχιστον την 4η και 13η ημέρα μετά τον τοκετό. Οι παρατηρήσεις αυτές θα πρέπει να αναφέρονται ξεχωριστά για κάθε ενήλικο ζώο.
|
|
51.
|
Στη διάρκεια της περιόδου πριν από το ζευγάρωμα, της εγκυμοσύνης και της γαλουχίας, η κατανάλωση τροφής πρέπει να μετράται τουλάχιστον μια φορά την εβδομάδα. Η μέτρηση της κατανάλωσης τροφής κατά το ζευγάρωμα είναι προαιρετική. Η κατανάλωση νερού στη διάρκεια των εν λόγω περιόδων θα πρέπει επίσης να μετράται, όταν η υπό δοκιμή χημική ουσία χορηγείται μέσω του νερού.
|
Αιματολογικές εξετάσεις
|
52.
|
Μια φορά στη διάρκεια της μελέτης, θα πρέπει να πραγματοποιούνται οι ακόλουθες αιματολογικές εξετάσεις σε πέντε αρσενικά και πέντε θηλυκά που επιλέγονται τυχαία από κάθε ομάδα: προσδιορισμός αιματοκρίτη, συγκέντρωσης αιμοσφαιρίνης, αριθμού ερυθρών αιμοσφαιρίων, δικτυοερυθροκυττάρων, αριθμού λευκών αιμοσφαιρίων και λευκοκυτταρικού τύπου, αριθμού αιμοπεταλίων, χρόνου πήξεως και πηκτικότητας του αίματος. Εάν υπάρχουν υπόνοιες ότι η υπό δοκιμή χημική ουσία ή οι θεωρητικοί μεταβολίτες της έχουν οξειδωτικές ιδιότητες, θα πρέπει να προσδιορίζονται επίσης, μεταξύ άλλων, η συγκέντρωση μεθαιμοσφαιρίνης και τα σωμάτια Heinz.
|
|
53.
|
Τα δείγματα αίματος θα πρέπει να λαμβάνονται από καθορισμένο σημείο. Κατά τη δειγματοληψία, τα θηλυκά θα πρέπει να βρίσκονται σε ανάλογη από φυσιολογικής απόψεως κατάσταση. Για την αποφυγή των πρακτικών δυσκολιών που συνδέονται με τη μεταβλητότητα της χρονικής στιγμής έναρξης της κύησης, η αιμοληψία από τα θηλυκά μπορεί να πραγματοποιείται στο τέλος της περιόδου πριν από το ζευγάρωμα ως εναλλακτική λύση αντί της αιμοληψίας αμέσως πριν ή κατά την ευθανασία των ζώων. Τα δείγματα αίματος των αρσενικών θα πρέπει, κατά προτίμηση, να λαμβάνονται αμέσως πριν ή κατά την ευθανασία των ζώων. Εναλλακτικά, η αιμοληψία στα αρσενικά μπορεί να πραγματοποιείται στο τέλος της περιόδου πριν από το ζευγάρωμα, όταν έχει επιλεγεί το συγκεκριμένο χρονικό σημείο για τα θηλυκά.
|
|
54.
|
Τα δείγματα αίματος θα πρέπει να αποθηκεύονται υπό κατάλληλες συνθήκες.
|
Εξετάσεις κλινικής βιοχημείας
|
55.
|
Θα πρέπει να διενεργούνται εξετάσεις κλινικής βιοχημείας για τη διερεύνηση σοβαρών τοξικών επιδράσεων στους ιστούς και, ειδικότερα, επιδράσεων στους νεφρούς και το ήπαρ, σε δείγματα αίματος που λαμβάνονται από τα επιλεγμένα πέντε αρσενικά και πέντε θηλυκά κάθε ομάδας. Συνιστάται να παραμένουν νηστικά τα ζώα τη νύχτα που προηγείται της αιμοληψίας (22). Οι εξετάσεις στο πλάσμα ή στον ορό του αίματος θα πρέπει να περιλαμβάνουν προσδιορισμό νατρίου, καλίου, γλυκόζης, ολικής χοληστερόλης, ουρίας, κρεατινίνης, ολικής πρωτεΐνης και αλβουμίνης, δύο τουλάχιστον ενζύμων ενδεικτικών ηπατοκυτταρικής επίδρασης (όπως της αμινοτρανσφεράσης της αλανίνης, της αμινοτρασφεράσης του ασπαρτικού και της αφυδρογονάσης της σορβιτόλης) και των χολικών οξέων. Η μέτρηση και άλλων ενζύμων (ηπατικής ή άλλης προέλευσης) και της χολερυθρίνης είναι δυνατόν να παρέχει χρήσιμες πληροφορίες σε ορισμένες περιπτώσεις.
|
|
56.
|
Λαμβάνονται δείγματα αίματος από καθορισμένο σημείο με βάση το ακόλουθο χρονοδιάγραμμα:
|
—
|
από τουλάχιστον δύο νεογνά ανά γέννα την 4η ημέρα μετά τη γέννηση, εάν το επιτρέπει ο αριθμός των νεογνών (βλ. παραγράφους 40-41)
|
|
—
|
από όλες τις μητέρες και από τουλάχιστον δύο νεογνά ανά γέννα κατά τη λήξη της μελέτης τη 13η ημέρα, και
|
|
—
|
από όλα τα ενήλικα αρσενικά κατά τη λήξη της μελέτης.
|
Όλα τα δείγματα αίματος αποθηκεύονται υπό κατάλληλες συνθήκες. Δείγματα αίματος νεογνών 13ης ΜΓΗ και των ενήλικων αρσενικών αξιολογούνται ως προς τα επίπεδα θυρεοειδικών ορμονών (T4). Ανάλογα με την περίπτωση, διενεργείται περαιτέρω αξιολόγηση της T4 σε δείγματα αίματος από τις μητέρες και νεογνά 4ης ΜΓΗ. Ανάλογα με την περίπτωση, μπορούν να μετρηθούν προαιρετικά και άλλες ορμόνες. Το αίμα νεογνών μπορεί να συγκεντρώνεται ανά γέννα για τη διενέργεια αναλύσεων θυρεοειδικών ορμονών. Οι θυρεοειδικές ορμόνες (T4 και TSH) θα πρέπει, κατά προτίμηση να μετρώνται ως «σύνολο».
|
|
57.
|
Προαιρετικά, κατά την τελευταία εβδομάδα της μελέτης μπορούν να διεξαχθούν οι ακόλουθες αναλύσεις ούρων σε πέντε τυχαία επιλεγμένα αρσενικά κάθε ομάδας χρησιμοποιώντας ούρα συλλεχθέντα σε καθορισμένο χρόνο: προσδιορισμός όψης, όγκου, ωσμωτικότητας ή ειδικού βάρους, pH, πρωτεϊνών, γλυκόζης και αίματος/αιμοκυττάρων.
|
|
58.
|
Επιπλέον, εξετάζεται κατά πόσο είναι σκόπιμο να μελετηθούν δείκτες του ορού για τυχόν γενικές ιστικές βλάβες. Άλλοι προσδιορισμοί που απαιτούνται όταν οι γνωστές ιδιότητες της υπό δοκιμή χημικής ουσίας ενδέχεται ή αναμένεται να επηρεάσουν τα σχετικά μεταβολικά χαρακτηριστικά αφορούν το ασβέστιο, τα φωσφορικά, τα τριγλυκερίδια και τη γλυκόζη μετά από νηστεία, ειδικές ορμόνες, τη μεθαιμοσφαιρίνη και τη χολινεστεράση. Τα εν λόγω χαρακτηριστικά πρέπει να προσδιορίζονται κατά περίπτωση.
|
|
59.
|
Οι ακόλουθοι παράγοντες ενδέχεται να επηρεάζουν τη μεταβλητότητα και τις απόλυτες τιμές συγκέντρωσης των προσδιοριζόμενων ορμονών:
|
—
|
ο χρόνος θανάτωσης, λόγω της ημερήσιας διακύμανσης των συγκεντρώσεων ορμονών,
|
|
—
|
η μέθοδος θανάτωσης, και ως εκ τούτου πρέπει να αποφεύγεται η περιττή καταπόνηση των ζώων, που μπορεί να επηρεάσει τις συγκεντρώσεις των ορμονών,
|
|
—
|
οι σειρές αντιδραστηρίων (κιτ) ορμονικού προσδιορισμού που ενδέχεται να διαφέρουν ως προς τις πρότυπες καμπύλες τους.
|
|
|
60.
|
Τα δείγματα πλάσματος που προορίζονται ειδικά για ορμονικό προσδιορισμό θα πρέπει να λαμβάνονται σε παραπλήσια ώρα της ημέρας. Οι αριθμητικές τιμές που προκύπτουν από ανάλυση των συγκεντρώσεων ορμονών διαφέρουν ανάλογα με τα διάφορα κιτ δοκιμασιών που είναι διαθέσιμα στο εμπόριο.
|
|
61.
|
Εάν τα ιστορικά δεδομένα αναφοράς είναι ανεπαρκή, θα πρέπει να εξετάζεται το ενδεχόμενο προσδιορισμού των μεταβλητών αιματολογίας και κλινικής βιοχημείας πριν από την έναρξη της χορήγησης των δόσεων ή, κατά προτίμηση, σε μια ομάδα ζώων που δεν περιλαμβάνεται στις πειραματικές ομάδες. Για τα θηλυκά, τα δεδομένα πρέπει να αφορούν γαλουχούντα ζώα.
|
ΠΑΘΟΛΟΓΟΑΝΑΤΟΜΙΑ
Νεκροψία-νεκροτομή
|
62.
|
Όλα τα ενήλικα ζώα της μελέτης πρέπει να υποβάλλονται σε πλήρη, λεπτομερή νεκροψία-νεκροτομή η οποία περιλαμβάνει προσεκτική εξέταση της εξωτερικής επιφάνειας του σώματος, όλων των στομίων, της κρανιακής, θωρακικής και περιτοναϊκής κοιλότητας και του περιεχομένου τους. Ιδιαίτερη προσοχή θα πρέπει να δίδεται στα όργανα του αναπαραγωγικού συστήματος. Ο αριθμός των σημείων εμφύτευσης θα πρέπει να καταγράφεται. Θα πρέπει να εξετάζονται κολπικά επιχρίσματα την ημέρα της νεκροψίας για να προσδιοριστεί το στάδιο του οιστρικού κύκλου και να καταστεί εφικτή η συσχέτιση με την ιστοπαθολογία των αναπαραγωγικών οργάνων των θηλυκών.
|
|
63.
|
Οι όρχεις και επιδιδυμίδες, ο προστάτης και οι σπερματοδόχοι κύστεις με τους πηκτοειδείς αδένες στο σύνολό τους, όλων των αρσενικών ενήλικων ζώων θα πρέπει να απαλλάσσονται από τυχόν προσφυόμενους ιστούς, ανάλογα με την περίπτωση, και να ζυγίζονται νωπά όσο το δυνατόν συντομότερα μετά την ανατομή ώστε να αποφεύγεται η ξήρανσή τους. Επιπλέον, μπορούν να μετρώνται προαιρετικά τα βάρη οργάνων όπως το σύμπλεγμα ανελκτήρων του πρωκτού και βολβοσηραγγωδών μυών, οι βολβοουρηθραίοι αδένες (αδένες του Cowper) και η βάλανος του πέους στα αρσενικά και ωοθήκες σε ζεύγη (βάρος σε νωπή κατάσταση) και η μήτρα (περιλαμβανομένου του τραχήλου) στα θηλυκά· σε περίπτωση που περιλαμβάνονται, τα εν λόγω βάρη θα πρέπει να μετρώνται το συντομότερο δυνατό μετά την ανατομή. Οι ωοθήκες, οι όρχεις, οι επιδιδυμίδες, άλλα όργανα του αναπαραγωγικού συστήματος, και όλα τα όργανα που εμφανίζουν μακροσκοπικές αλλοιώσεις, από όλα τα ενήλικα ζώα, θα πρέπει να διατηρούνται.
|
|
64.
|
Οι θυρεοειδείς αδένες από όλα τα ενήλικα αρσενικά και θηλυκά και από ένα αρσενικό και θηλυκό νεογνό 13ης ΜΓΗ από κάθε γέννα θα πρέπει να διατηρούνται σε μέσο μονιμοποίησης κατάλληλο για το είδος ιστοπαθολογικής εξέτασης στο οποίο ενδεχομένως να υποβληθούν στο μέλλον. Μετά τη μονιμοποίηση μπορεί να προσδιορίζεται το βάρος του θυρεοειδούς. Ο καθαρισμός θα πρέπει και στην περίπτωση αυτή να πραγματοποιείται με μεγάλη προσοχή και μόνο μετά τη μονιμοποίηση, ώστε να μην προκαλείται βλάβη στους ιστούς. Οι βλάβες των ιστών μπορούν να βλάψουν την εγκυρότητα της ιστοπαθολογικής ανάλυσης. Τα δείγματα αίματος πρέπει να λαμβάνονται από καθορισμένο σημείο ακριβώς πριν από τη θανάτωση των ζώων ή κατά τη διάρκειά της και να διατηρούνται υπό κατάλληλες συνθήκες (βλ. παράγραφο 56).
|
|
65.
|
Επιπλέον, για τουλάχιστον πέντε ενήλικα αρσενικά και θηλυκά, τυχαία επιλεγμένα από κάθε ομάδα (εκτός όσων είναι ετοιμοθάνατα και/ή θανατώνονται με ευθανασία πριν από τη λήξη της μελέτης), το ήπαρ, οι νεφροί, τα επινεφρίδια, ο θύμος αδένας, ο σπλήνας, ο εγκέφαλος και η καρδιά θα πρέπει να απαλλάσσονται από τυχόν προσφυόμενους ιστούς, ανάλογα με την περίπτωση, και να ζυγίζονται νωπά όσο το δυνατόν συντομότερα μετά την ανατομή ώστε να αποφευχθεί η ξήρανσή τους. Οι ακόλουθοι ιστοί θα πρέπει να διατηρούνται σε μονιμοποιητικό μέσο κατάλληλο και για τον τύπο ιστού και για το είδος ιστοπαθολογικής εξέτασης στο οποίο προβλέπεται να υποβληθούν: κάθε ιστός που εμφανίζει μακροσκοπικές αλλοιώσεις, εγκέφαλος (αντιπροσωπευτικές περιοχές του κυρίου τμήματος, της παρεγκεφαλίδας και της γέφυρας), νωτιαίος μυελός, οφθαλμοί, στόμαχος, λεπτό και παχύ έντερο (συμπεριλαμβανομένων παϋέριων πλακών), ήπαρ, νεφροί,επινεφρίδια, σπλήνας, καρδιά, θύμος αδένας, τραχεία και πνεύμονες (διατηρημένοι με εμφύσηση μονιμοποιητικού υλικού, ακολουθούμενη από εμβάπτιση), γεννητικοί αδένες (όρχεις και ωοθήκες), άλλα όργανα του γεννητικού συστήματος (μήτρα και τράχηλος της μήτρας, επιδιδυμίδες, προστάτης και σπερματοδόχοι κύστεις με τους πηκτοειδείς αδένες), κολπική κοιλότητα, ουροδόχος κύστη, λεμφαδένες [πέραν του εγγύτερου παροχετεύοντα αδένα, θα πρέπει να λαμβάνεται και άλλος ένας λεμφαδένας ανάλογα με την πείρα του εργαστηρίου (16)], περιφερειακό νεύρο (ισχιακό ή κνημιαίο) κατά προτίμηση από θέση πολύ κοντά στον μυ, σκελετικός μυς και οστό με μυελό των οστών (τομή ή, εναλλακτικά, πρόσφατο παρασκεύασμα αναρροφηθέντος μυελού). Συνιστάται να μονιμοποιούνται οι όρχεις με εμβάπτιση σε μονιμοποιητικό υλικό Bouin ή τροποποιημένο μονιμοποιητικό υλικό Davidson (16) (17) (18)· για τους συγκεκριμένους ιστούς δεν συνιστάται μονιμοποίηση σε φορμόλη. Ο ινώδης χιτώνας (tunica albuginea) μπορεί να διατρυπάται με βελόνα, με ήπιες κινήσεις, σε μικρό βάθος και στα δύο άκρα ώστε να διευκολύνεται η διείσδυση του μονιμοποιητικού υλικού. Κλινικά και άλλα ευρήματα ενδεχομένως υποδεικνύουν ότι θα πρέπει να εξεταστούν και άλλοι πρόσθετοι ιστοί. Κάθε όργανο που, λόγω των γνωστών ιδιοτήτων της υπό δοκιμή χημικής ουσίας, θεωρείται πιθανό να αποτελεί όργανο-στόχο, πρέπει επίσης να διατηρείται.
|
|
66.
|
Από τους ακόλουθους ιστούς είναι δυνατόν να ληφθούν πολύτιμες ενδείξεις για ενδοκρινικές επιδράσεις: γεννητικοί αδένες (όρχεις και ωοθήκες), άλλα όργανα του γεννητικού συστήματος (μήτρα και τράχηλος της μήτρας, επιδιδυμίδες, σπερματοδόχοι κύστεις με τους πηκτοειδείς αδένες, ραχιαιοπλάγιος και κοιλιακός λοβός προστάτη), κολπική κοιλότητα, υπόφυση, αρσενικός μαστικός αδένας και επινεφρίδιος αδένας. Δεν έχουν τεκμηριωθεί επαρκώς οι μεταβολές στους αρσενικούς μαστικούς αδένες, αλλά η παράμετρος αυτή ενδέχεται να είναι πολύ ευαίσθητη σε ουσίες με οιστρογόνο δράση. Η παρατήρηση οργάνων/ιστών που δεν απαριθμούνται στην παράγραφο 65 είναι προαιρετική.
|
|
67.
|
Τα νεκρά νεογνά και τα νεογνά που θανατώνονται τη 13η ημέρα μετά τον τοκετό, ή σε σύντομο χρονικό διάστημα μετά από αυτήν, θα πρέπει, τουλάχιστον, να εξετάζονται προσεκτικά εξωτερικά για μακροσκοπικές ανωμαλίες. Ιδιαίτερη προσοχή θα πρέπει να δίνεται στα εξωτερικά όργανα του αναπαραγωγικού συστήματος, τα οποία θα πρέπει να εξετάζονται για τυχόν ύπαρξη σημείων ανώμαλης ανάπτυξης.
|
Ιστοπαθολογία
|
68.
|
Θα πρέπει να διεξάγονται πλήρεις ιστοπαθολογικές εξετάσεις στα διατηρημένα όργανα και ιστούς των επιλεγμένων ζώων στις ομάδες μαρτύρων και υψηλής δόσης (με ιδιαίτερη έμφαση στα στάδια της σπερματογένεσης στους γεννητικούς αδένες των αρσενικών και στην ιστοπαθολογία της δομής των διάμεσων κυττάρων των όρχεων). Εφόσον απαιτείται, μπορεί να εξετάζεται και ο θυρεοειδής αδένας νεογνών και των υπόλοιπων ενήλικων ζώων. Οι εξετάσεις θα πρέπει να γίνονται και στα ζώα των ομάδων άλλων δόσεων εάν στην ομάδα υψηλής δόσης παρατηρηθούν μεταβολές σχετιζόμενες με την αγωγή. Το έγγραφο καθοδήγησης σχετικά με την ιστοπαθολογία (10) παρέχει επιπρόσθετες πληροφορίες για την ανατομή, τη μονιμοποίηση, την τομή και την ιστολογική ανάλυση των ενδοκρινικών ιστών.
|
|
69.
|
Θα πρέπει να εξετάζονται όλες οι μακροσκοπικές βλάβες. Για λόγους συμβολής στην αποσαφήνιση των NOAEL, θα πρέπει να εξετάζονται όργανα-στόχοι σε άλλες ομάδες δόσης, ιδίως σε ομάδες που θεωρείται ότι παρουσιάζουν NOAEL.
|
|
70.
|
Όταν χρησιμοποιείται δορυφορική ομάδα, εκτελείται ιστοπαθολογική εξέταση στους ιστούς και στα όργανα τα οποία έχει διαπιστωθεί ότι εμφανίζουν επιδράσεις στις ομάδες που υποβάλλονται σε αγωγή.
|
ΔΕΔΟΜΕΝΑ ΚΑΙ ΑΝΑΦΟΡΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ
Δεδομένα
|
71.
|
Πρέπει να παρέχονται δεδομένα για κάθε ζώο ξεχωριστά. Επιπλέον, όλα τα δεδομένα θα συνοψίζονται σε μορφή πινάκων, όπου θα δίνεται για κάθε ομάδα δοκιμής ο αριθμός των ζώων στην αρχή της δοκιμής, ο αριθμός των ζώων που βρέθηκαν νεκρά κατά τη διάρκεια της δοκιμής ή θανατώθηκαν με ευθανασία, η χρονική στιγμή κάθε θανάτου ή θανάτωσης, ο αριθμός των γόνιμων ζώων, ο αριθμός των έγκυων θηλυκών, ο αριθμός των ζώων που εμφάνισαν σημεία τοξικότητας, μια περιγραφή των παρατηρηθέντων σημείων τοξικότητας, συμπεριλαμβανομένης της χρονικής στιγμής εμφάνισης, της διάρκειας και της σοβαρότητας κάθε τοξικής δράσης, οι τύποι των ιστοπαθολογικών αλλοιώσεων και κάθε σχετικό στοιχείο για τις γέννες. Στο προσάρτημα 3 παρέχεται ένας μορφότυπος συνοπτικής αναφοράς σε μορφή πίνακα που έχει αποδεχθεί ιδιαίτερα χρήσιμος για την αξιολόγηση των επιδράσεων στην αναπαραγωγή/ανάπτυξη.
|
|
72.
|
Όταν είναι δυνατόν, τα αριθμητικά αποτελέσματα αξιολογούνται με τη βοήθεια κατάλληλης στατιστικής μεθόδου γενικής αποδοχής. Με τη σύγκριση των επιδράσεων σε ένα εύρος δόσεων αποφεύγεται η χρήση πολλών ελέγχων t. Οι στατιστικές μέθοδοι πρέπει να επιλέγονται κατά τον σχεδιασμό της μελέτης. Η στατιστική ανάλυση πρωκτογεννητικής απόστασης και διατηρούμενων θηλών θα πρέπει να βασίζεται σε ατομικά στοιχεία για κάθε νεογνό, και θα πρέπει να λαμβάνονται υπόψη οι επιδράσεις στη γέννα. Όπου αρμόζει, μονάδα της ανάλυσης θα πρέπει να είναι η γέννα από την ίδια μητέρα. Η στατιστική ανάλυση σωματικού βάρους των νεογνών θα πρέπει να βασίζεται σε ατομικά στοιχεία για κάθε νεογνό, και θα πρέπει να λαμβάνεται υπόψη το πλήθος νεογνών της γέννας. Λόγω του περιορισμένου μεγέθους της μελέτης, οι στατιστικές αναλύσεις υπό μορφή ελέγχων σημαντικότητας είναι περιορισμένης αξίας για πολλές παραμέτρους, ιδίως τις παραμέτρους σχετικά με την αναπαραγωγή. Ορισμένες από τις πλέον ευρέως χρησιμοποιούμενες μεθόδους, ιδίως παραμετρικοί έλεγχοι για μέτρα κεντρικής τάσης, είναι ακατάλληλες. Σε περίπτωση χρήσης στατιστικών αναλύσεων, η επιλεγόμενη μέθοδος θα πρέπει να είναι κατάλληλη για την κατανομή της υπό εξέταση μεταβλητής, και να επιλέγεται πριν από την έναρξη της μελέτης.
|
Αξιολόγηση των αποτελεσμάτων
|
73.
|
Τα ευρήματα της παρούσας μελέτης τοξικότητας θα πρέπει να αξιολογούνται ως προς τις παρατηρούμενες επιδράσεις, τα ευρήματα της νεκροψίας-νεκροτομής και τα μικροσκοπικά ευρήματα. Στην αξιολόγηση περιλαμβάνεται η σχέση μεταξύ της δόσης της υπό δοκιμή χημικής ουσίας και της παρουσίας ή απουσίας, της συχνότητας εμφάνισης και της σοβαρότητας των ανωμαλιών, συμπεριλαμβανομένων των μακροσκοπικών αλλοιώσεων, των ταυτοποιημένων οργάνων στόχων, της στειρότητας, των κλινικών ανωμαλιών, των επιδράσεων στις επιδόσεις στην αναπαραγωγή και στις γέννες, των μεταβολών στα σωματικά βάρη, των επιδράσεων στη θνησιμότητα και κάθε άλλου τοξικού φαινομένου.
|
|
74.
|
Λόγω της σύντομης περιόδου αγωγής των αρσενικών, κατά την αξιολόγηση των επιδράσεων στην αναπαραγωγή των αρσενικών, μαζί με τα δεδομένα για τη γονιμότητα θα πρέπει να εξετάζεται και η ιστοπαθολογία των όρχεων και των επιδιδυμίδων. Επικουρικά, χρήσιμη στην ερμηνεία της μελέτης μπορεί να είναι και η χρήση ιστορικών δεδομένων μαρτύρων (π.χ. σχετικά με το μέγεθος της γέννας, την πρωκτογεννητική απόσταση, τις διατηρούμενες θηλές, τα επίπεδα T4 στον ορό), εάν υπάρχουν.
|
|
75.
|
Για τον ποιοτικό έλεγχο προτείνεται η συλλογή ιστορικών δεδομένων ως μάρτυρα και ο υπολογισμός συντελεστών μεταβλητότητας για τα αριθμητικά δεδομένα, ιδίως όσον αφορά τις παραμέτρους που συνδέονται με την ανίχνευση ενδοκρινικών διαταρακτών. Τα δεδομένα αυτά μπορούν να χρησιμοποιούνται για συγκρίσεις κατά την αξιολόγηση πραγματικών μελετών.
|
Έκθεση δοκιμής
|
76.
|
Η έκθεση δοκιμής θα πρέπει να περιλαμβάνει τα ακόλουθα στοιχεία:
|
|
Υπό δοκιμή χημική ουσία:
|
—
|
πηγή, αριθμός παρτίδας, καταληκτική ημερομηνία χρήσης, αν υπάρχει,
|
|
—
|
σταθερότητα της υπό δοκιμή χημικής ουσίας, εάν είναι γνωστή,
|
|
|
|
Μονοσυστατική ουσία:
|
—
|
φυσική εμφάνιση, υδατοδιαλυτότητα και πρόσθετες σχετικές φυσικοχημικές ιδιότητες,
|
|
—
|
ταυτοποίηση της χημικής ουσίας, όπως ονομασία IUPAC ή CAS, αριθμός CAS, κωδικός SMILES ή InChI, συντακτικός τύπος, καθαρότητα, χημική ταυτότητα προσμίξεων, κατά περίπτωση και στο μέτρο του δυνατού, κ.λπ.,
|
|
|
|
Πολυσυστατική ουσία, UVCB και μείγματα:
|
—
|
περιγράφονται, στο μέτρο του δυνατού, με τη χημική ταυτότητα των συστατικών (βλ. ανωτέρω), την ποσότητα στην οποία απαντούν και τις σχετικές φυσικοχημικές τους ιδιότητες.
|
Φορέας (εάν χρησιμοποιείται):
|
—
|
αιτιολόγηση της επιλογής του φορέα, εάν δεν είναι το νερό.
|
|
|
|
Πειραματόζωα:
|
—
|
είδος/φυλή χρησιμοποιηθέντων ζώων,
|
|
—
|
αριθμός, ηλικία και φύλο των ζώων,
|
|
—
|
προέλευση των ζώων, συνθήκες στέγασης, σιτηρέσιο κ.λπ.,
|
|
—
|
βάρος κάθε ζώου κατά την έναρξη της δοκιμής,
|
|
—
|
αιτιολόγηση της επιλογής άλλου είδους εκτός από τον επίμυ.
|
|
|
|
Συνθήκες δοκιμής:
|
—
|
αιτιολόγηση της επιλογής των επιπέδων δόσης,
|
|
—
|
λεπτομέρειες σχετικά με το παρασκεύασμα της υπό δοκιμή χημικής ουσίας/τροφής και τις επιτευχθείσες συγκεντρώσεις, σταθερότητα και ομοιογένεια του παρασκευάσματος,
|
|
—
|
λεπτομέρειες σχετικά με τη χορήγηση της υπό δοκιμή χημικής ουσίας,
|
|
—
|
κατά περίπτωση, μετατροπή της συγκέντρωσης της υπό δοκιμή χημικής ουσίας στο σιτηρέσιο ή το πόσιμο νερό (ppm) σε πραγματική δόση (mg/kg βάρους σώματος/ημέρα),
|
|
—
|
λεπτομέρειες σχετικά με την ποιότητα της τροφής και του νερού,
|
|
—
|
αναλυτική περιγραφή της διαδικασίας τυχαιοποίησης για την επιλογή των νεογνών προς απομάκρυνση, εφόσον απαιτείται.
|
|
|
|
Αποτελέσματα:
|
—
|
βάρος του σώματος/μεταβολές βάρους σώματος,
|
|
—
|
κατά περίπτωση, κατανάλωση τροφής και νερού,
|
|
—
|
δεδομένα τοξικής αντίδρασης ανά φύλο και δόση, περιλαμβανομένης της γονιμότητας, της κύησης, καθώς και όποιων άλλων σημείων τοξικότητας,
|
|
—
|
τοξικές ή άλλες επιδράσεις στην αναπαραγωγή, στους απογόνους, στη μεταγεννητική ανάπτυξη κ.λπ.,
|
|
—
|
φύση, σοβαρότητα και διάρκεια των κλινικών παρατηρήσεων (αναστρέψιμων και μη),
|
|
—
|
αξιολόγηση των αισθητήριων λειτουργιών, της δύναμης της λαβής και της κινητικότητας,
|
|
—
|
αιματολογικές εξετάσεις με τις αντίστοιχες τιμές αναφοράς,
|
|
—
|
εξετάσεις κλινικής βιοχημείας με τις αντίστοιχες τιμές αναφοράς,
|
|
—
|
αριθμός ενήλικων θηλυκών με κανονικό ή μη κανονικό οιστρικό κύκλο και διάρκεια του κύκλου,
|
|
—
|
αριθμός ζώντων νεογνών και απώλειες μετά την εμφύτευση,
|
|
—
|
αριθμός νεογνών με μακροσκοπικά ορατές ανωμαλίες, μακροσκοπική εξέταση των εξωτερικών γεννητικών οργάνων, αριθμός καχεκτικών νεογνών,
|
|
—
|
χρόνος θανάτου κατά τη διάρκεια της μελέτης ή επιβίωση έως τη λήξη της,
|
|
—
|
αριθμός εμφυτευμένων νεογνών, μέγεθος γέννας και βάρη νεογνών γέννας κατά τη χρονική στιγμή της καταγραφής,
|
|
—
|
δεδομένα για το βάρος του σώματος των νεογνών,
|
|
—
|
πρωκτογεννητική απόσταση για όλα τα νεογνά (και βάρος σώματος την ημέρα της μέτρησης της πρωκτογεννητικής απόστασης)
|
|
—
|
διατηρούμενες θηλές σε αρσενικά νεογνά,
|
|
—
|
επίπεδα θυρεοειδικών ορμονών, σε νεογνά 13ης ΜΓΗ και σε ενήλικα αρσενικά (και σε μητέρες και νεογνά 4ης ΜΓΗ, εφόσον μετρώνται),
|
|
—
|
βάρος σώματος κατά τη θανάτωση και δεδομένα βάρους οργάνων για τα γονικά ζώα,
|
|
—
|
ευρήματα νεκροψίας-νεκροτομής,
|
|
—
|
λεπτομερής περιγραφή των ιστοπαθολογικών ευρημάτων,
|
|
—
|
δεδομένα για την απορρόφηση (εάν υπάρχουν διαθέσιμα),
|
|
—
|
στατιστική ανάλυση των αποτελεσμάτων, κατά περίπτωση.
|
|
|
|
Εξέταση των αποτελεσμάτων
|
|
Ερμηνεία των αποτελεσμάτων
|
77.
|
Η μελέτη θα παράσχει αξιολογήσεις της τοξικότητας στην αναπαραγωγή/ανάπτυξη που συνδέεται με τη χορήγηση επαναλαμβανόμενων δόσεων. Πιο συγκεκριμένα, δεδομένου ότι δίνεται έμφαση σε παραμέτρους τόσο γενικής τοξικότητας όσο και τοξικότητας στην αναπαραγωγή/ανάπτυξη, τα αποτελέσματα της μελέτης επιτρέπουν τη διάκριση μεταξύ των επιδράσεων στην αναπαραγωγή/ανάπτυξη χωρίς γενική τοξικότητα και εκείνων που εκφράζονται μόνο σε επίπεδα που είναι τοξικά και για τα γονικά ζώα (βλ. παραγράφους 7-11). Μπορεί να περιλαμβάνει υπόδειξη της ανάγκης διενέργειας περαιτέρω ερευνών και παρέχει καθοδήγηση όσον αφορά τον σχεδιασμό επακόλουθων μελετών. Για την ερμηνεία των αποτελεσμάτων που αφορούν την αναπαραγωγή και την ανάπτυξη θα πρέπει να χρησιμοποιείται ως βοήθημα το έγγραφο καθοδήγησης αριθ. 43 του ΟΟΣΑ (19). Στο έγγραφο καθοδήγησης αριθ. 106 του ΟΟΣΑ για την ιστολογική αξιολόγηση των ενδοκρινικών και αναπαραγωγικών δοκιμών σε τρωκτικά (16) παρέχονται πληροφορίες σχετικά με την προετοιμασία και την αξιολόγηση των (ενδοκρινικών) οργάνων και των κολπικών επιχρισμάτων, που μπορεί να είναι χρήσιμες για την παρούσα μέθοδο δοκιμών.
|
ΒΙΒΛΙΟΓΡΑΦΙΑ
|
(1)
|
OECD (1990). Room Document No 1 for the 14th Joint Meeting of the Chemicals Group and Management Committee. Διατίθεται κατόπιν αιτήματος από τον Οργανισμό για την Οικονομική Συνεργασία και την Ανάπτυξη, Παρίσι.
|
|
(2)
|
OECD (1992). Chairman’s Report of the ad hoc Expert Meeting on Reproductive Toxicity Screening Methods, Tokyo, 27th-29th October, 1992. Διατίθεται κατόπιν αιτήματος από τον Οργανισμό για την Οικονομική Συνεργασία και την Ανάπτυξη, Παρίσι.
|
|
(3)
|
Mitsumori K., Kodama Y., Uchida O., Takada K., Saito M. Naito K., Tanaka S., Kurokawa Y., Usami, M., Kawashima K., Yasuhara K., Toyoda K., Onodera H., Furukawa F., Takahashi M. and Hayashi Y. (1994). Confirmation Study, Using Nitro-Benzene, of the Combined Repeat Dose and Reproductive/ Developmental Toxicity Test Protocol Proposed by the Organization for Economic Cooperation and Development (OECD). J. Toxicol, Sci., 19, 141-149.
|
|
(4)
|
Tanaka S., Kawashima K., Naito K., Usami M., Nakadate M., Imaida K., Takahashi M., Hayashi Y., Kurokawa Y. and Tobe M. (1992). Combined Repeat Dose and Reproductive/Developmental Toxicity Screening Test (OECD): Familiarization Using Cyclophosphamide. Fundam. Appl. Toxicol., 18, 89-95.
|
|
(5)
|
OECD (1998). Report of the First Meeting of the OECD Endocrine Disrupter Testing and Assessment (EDTA) Task Force, 10th-11th March 1998, Available upon request at Organisation for Economic Cooperation and Development, Paris.
|
|
(6)
|
OECD (2015). Feasibility Study for Minor Enhancements of TG 421/422 with ED Relevant Endpoints. Environment, Health and Safety Publications, Series on Testing and Assessment (No 217), Organisation for Economic Cooperation and Development, Paris.
|
|
(7)
|
OECD (2000). Guidance Document on the Recognition, Assessment, and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluations, Environment, Health and Safety Publications, Series on Testing and Assessment, (No 19), Organisation for Economic Cooperation and Development, Paris.
|
|
(8)
|
Goldman J.M., Murr A.S., Buckalew A.R., Ferrell J.M.and Cooper R.L. (2007). The Rodent Estrous Cycle: Characterization of Vaginal Cytology and its Utility in Toxicological Studies, Birth Defects Research, Part B, 80 (2), 84-97.
|
|
(9)
|
Sadleir R.M.F.S. (1979). Cycles and Seasons, in Auston C.R. and Short R.V. (Eds.), Reproduction in Mammals: I. Germ Cells and Fertilization, Cambridge, New York.
|
|
(10)
|
IPCS (1986). Principles and Methods for the Assessment of Neurotoxicity Associated with Exposure to Chemicals. Environmental Health Criteria Document (No 60).
|
|
(11)
|
Moser V.C., McDaniel K.M. and Phillips P.M. (1991). Rat Strain and Stock Comparisons Using a Functional Observational Battery: Baseline Values and Effects of Amitraz. Toxicol. Appl. Pharmacol., 108, 267-283.
|
|
(12)
|
Meyer O.A., Tilson H.A., Byrd W.C. and Riley M.T. (1979). A Method for the Routine Assessment of Fore- and Hindlimb Grip Strength of Rats and Mice. Neurobehav. Toxicol., 1, 233-236.
|
|
(13)
|
Crofton K.M., Howard J.L., Moser V.C., Gill M.W., Reiter L.W., Tilson H.A., MacPhail R.C. (1991). Interlaboratory Comparison of Motor Activity Experiments: Implication for Neurotoxicological Assessments. Neurotoxicol. Teratol. 13, 599-609.
|
|
(14)
|
Gallavan R.H. Jr, J.F. Holson, D.G. Stump, J.F. Knapp and V.L. Reynolds. (1999). «Interpreting the Toxicologic Significance of Alterations in Anogenital Distance: Potential for Confounding Effects of Progeny Body Weights», Reproductive Toxicology, 13: 383-390.
|
|
(15)
|
OECD (2013). Guidance Document in Support of the Test Guideline on the Extended One Generation Reproductive Toxicity Study. Environment, Health and Safety Publications, Series on Testing and Assessment (No 151). Organisation for Economic Cooperation and Development, Paris.
|
|
(16)
|
OECD (2009).Guidance Document for Histologic Evaluation of Endocrine and Reproductive Tests in Rodents. Environment, Health and Safety Publications, Series on Testing and Assessment (No. 106) Organisation for Economic Cooperation and Development, Paris.
|
|
(17)
|
Hess RA and Moore BJ. (1993). Histological Methods for the Evaluation of the Testis. Στο: Methods in Reproductive Toxicology, Chapin RE and Heindel JJ (Eds.). Academic Press: San Diego, CA, pp. 52-85.
|
|
(18)
|
Latendresse JR, Warbrittion AR, Jonassen H, Creasy DM. (2002). Fixation of Testes and Eyes Using a Modified Davidson’s Fluid: Comparison with Bouin’s Fluid and Conventional Davidson’s fluid. Toxicol. Pathol. 30, 524-533.
|
|
(19)
|
OECD (2008). Guidance Document on Mammalian Reproductive Toxicity Testing and Assessment. Environment, Health and Safety Publications, Series on Testing and Assessment (No 43), Organisation for Economic Cooperation and Development, Paris.
|
|
(20)
|
OECD (2011), Guidance Document on Standardised Test Guidelines for Evaluating Chemicals for Endocrine Disruption (No 150), Organisation for Economic Cooperation and Development, Paris.
|
Προσάρτημα 1
ΟΡΙΣΜΟΙ (ΒΛ. ΕΠΙΣΗΣ (20) GD 150 ΤΟΥ ΟΟΣΑ)
Ανδρογονικότητα η ικανότητα μιας χημικής ουσίας να δρα όπως μια φυσική ανδρογόνος ορμόνη (π.χ. τεστοστερόνη) στον οργανισμό θηλαστικού.
Αντιανδρογονικότητα η ικανότητα μιας χημικής ουσίας να καταστέλλει τη δράση μιας φυσικής ανδρογόνου ορμόνης (π.χ. τεστοστερόνη) στον οργανισμό θηλαστικού.
Αντιοιστρογονικότητα η ικανότητα μιας χημικής ουσίας να καταστέλλει τη δράση μιας φυσικής οιστρογόνου ορμόνης (π.χ. 17β-οιστραδιόλη) στον οργανισμό θηλαστικού.
Αντιθυρεοειδική δραστηριότητα η ικανότητα μιας χημικής ουσίας να καταστέλλει τη δράση μιας φυσικής θυρεοειδικής ορμόνης (π.χ. T3) στον οργανισμό θηλαστικού.
Χημικό προϊόν μια ουσία ή ένα μείγμα.
Τοξικότητα στην ανάπτυξη η εκδήλωση τοξικότητας στην αναπαραγωγή, η οποία περιλαμβάνει προγεννητικές, περιγεννητικές και μεταγεννητικές δομικές ή λειτουργικές διαταραχές των απογόνων.
Δόση η χορηγούμενη ποσότητα υπό δοκιμή χημικής ουσίας. Η δόση εκφράζεται σε βάρος υπό δοκιμή χημικής ουσίας ανά μονάδα βάρους πειραματόζωου ανά ημέρα (π.χ. mg/kg βάρους σώματος/ημέρα) ή σε σταθερή συγκέντρωση στην τροφή.
Δοσολογία γενικός όρος που περιλαμβάνει τη δόση, τη συχνότητα και τη διάρκεια χορήγησης.
Έκδηλη τοξικότητα γενικός όρος που δηλώνει σαφή σημεία τοξικότητας μετά από χορήγηση της υπό δοκιμή χημικής ουσίας. Αυτά πρέπει να επαρκούν για την εκτίμηση του κινδύνου και να είναι τέτοια ώστε η αύξηση της χορηγούμενης δόσης να αναμένεται ότι θα προκαλέσει σοβαρές τοξικές εκδηλώσεις και πιθανώς θνησιμότητα.
Εξασθένιση της γονιμότητας αντιπροσωπεύει διαταραχές των αναπαραγωγικών λειτουργιών η της ικανότητας αρσενικών ή θηλυκών.
Τοξικότητα στη μητέρα: δυσμενείς επιδράσεις σε κυοφορούντα θηλυκά, είτε ειδικής εκδήλωσης (άμεση επίδραση) είτε μη ειδικής εκδήλωσης (έμμεση επίδραση), που σχετίζονται με την κατάσταση κύησης.
NOAEL (no-observed-adverse effect level): πρόκειται για το υψηλότερο επίπεδο δόσης στο οποίο δεν παρατηρούνται δυσμενείς επιδράσεις λόγω της αγωγής.
Οιστρογονικότητα η ικανότητα μιας χημικής ουσίας να δρα όπως μια φυσική οιστρογόνος ορμόνη (π.χ. 17β-οιστραδιόλη) στον οργανισμό θηλαστικού.
Τοξικότητα στην αναπαραγωγή αντιπροσωπεύει τις επιβλαβείς επιδράσεις στους απογόνους και/ή την εξασθένιση των αναπαραγωγικών λειτουργιών ή ικανότητας αρσενικών και θηλυκών.
Υπό δοκιμή χημική ουσία κάθε ουσία ή μείγμα που υποβάλλεται σε δοκιμή με τη χρήση της παρούσας μεθόδου δοκιμών.
Θυρεοειδική δραστηριότητα η ικανότητα μιας χημικής ουσίας να δρα όπως μια φυσική θυρεοειδική ορμόνη (π.χ. T3) στον οργανισμό θηλαστικού.
Επικύρωση επιστημονική διαδικασία που αποσκοπεί στον χαρακτηρισμό των λειτουργικών απαιτήσεων και περιορισμών μιας μεθόδου δοκιμών και στην απόδειξη της αξιοπιστίας της και της καταλληλότητάς της για συγκεκριμένο σκοπό.
Προσάρτημα 2
ΔΙΑΓΡΑΜΜΑ ΤΟΥ ΠΕΙΡΑΜΑΤΙΚΟΥ ΧΡΟΝΟΔΙΑΓΡΑΜΜΑΤΟΣ ΜΕ ΤΗ ΜΕΓΙΣΤΗ ΔΙΑΡΚΕΙΑ ΤΗΣ ΜΕΛΕΤΗΣ, ΒΑΣΕΙ ΠΛΗΡΟΥΣ ΠΕΡΙΟΔΟΥ ΖΕΥΓΑΡΩΜΑΤΟΣ 14 ΗΜΕΡΩΝ


Προσάρτημα 3
ΣΥΝΟΠΤΙΚΟΣ ΠΙΝΑΚΑΣ ΤΩΝ ΕΠΙΔΡΑΣΕΩΝ ΣΤΗΝ ΑΝΑΠΑΡΑΓΩΓΗ/ΑΝΑΠΤΥΞΗ
|
ΠΑΡΑΤΗΡΗΣΕΙΣ
|
ΤΙΜΕΣ
|
|
Δοσολογία (μονάδες)…….
|
0 (μάρτυρας)
|
…
|
…
|
…
|
…
|
|
Ζεύγη κατά την έναρξη (N)
|
|
|
|
|
|
|
Οιστρικός κύκλος (τουλάχιστον μέση διάρκεια και συχνότητα μη κανονικών κύκλων)
|
|
|
|
|
|
|
Θηλυκά που παρουσιάζουν ενδείξεις συνουσίας (N)
|
|
|
|
|
|
|
Θηλυκά που καθίστανται έγκυα (N)
|
|
|
|
|
|
|
Ημέρες σύλληψης 1 - 5 (N)
|
|
|
|
|
|
|
Ημέρες σύλληψης 6 -… (23) (N)
|
|
|
|
|
|
|
Εγκυμοσύνη ≤ 21 ημέρες (N)
|
|
|
|
|
|
|
Εγκυμοσύνη = 22 ημέρες (N)
|
|
|
|
|
|
|
Εγκυμοσύνη ≥ 23 ημέρες (N)
|
|
|
|
|
|
|
Μητέρες με ζώντα νεογνά (N)
|
|
|
|
|
|
|
Μητέρες με ζώντα νεογνά την 4η ημέρα (N)
|
|
|
|
|
|
|
Εμφυτευμένα έμβρυα/μητέρα (μέσος όρος)
|
|
|
|
|
|
|
Ζώντα νεογνά/μητέρα κατά τη γέννα (μέσος όρος)
|
|
|
|
|
|
|
Ζώντα νεογνά/μητέρα κατά την 4η ημέρα (μέσος όρος)
|
|
|
|
|
|
|
Αναλογία φύλων (α/θ) κατά τη γέννα (μέσος όρος)
|
|
|
|
|
|
|
Αναλογία φύλων (α/θ) κατά την 4η ημέρα (μέσος όρος)
|
|
|
|
|
|
|
Βάρος γέννας κατά τη γέννηση (μέσος όρος)
|
|
|
|
|
|
|
Βάρος γέννας κατά την 4η ημέρα (μέσος όρος)
|
|
|
|
|
|
|
Βάρος νεογνών κατά τη γέννηση (μέσος όρος)
|
|
|
|
|
|
|
Βάρος νεογνών κατά τη μέτρηση της πρωκτογεννητικής απόστασης (μέσος όρος αρσενικών, μέσος όρος θηλυκών)
|
|
|
|
|
|
|
Πρωκτογεννητική απόσταση νεογνών κατά την ίδια μεταγεννητική ημέρα, τη γέννηση – την 4η ημέρα (μέσος όρος αρσενικών, μέσος όρος θηλυκών, καταγραφή της ΜΓΗ)
|
|
|
|
|
|
|
Βάρος νεογνών κατά την 4η ημέρα (μέσος όρος)
|
|
|
|
|
|
|
Βάρος νεογνών κατά την 13η ημέρα (μέσος όρος)
|
|
|
|
|
|
|
Διατηρούμενες θηλές αρσενικών νεογνών τη 13η ημέρα (μέσος όρος)
|
|
|
|
|
|
|
ΜΗ ΦΥΣΙΟΛΟΓΙΚΑ ΝΕΟΓΝΑ
|
|
Μητέρες με 0
|
|
|
|
|
|
|
Μητέρες με 1
|
|
|
|
|
|
|
Μητέρες με ≥ 2
|
|
|
|
|
|
|
ΑΠΩΛΕΙΑ ΑΠΟΓΟΝΩΝ
|
|
Προγεννητική (εμφυτευμένα έμβρυα μείον ζώντα νεογνά)
|
|
Θηλυκά με 0
|
|
|
|
|
|
|
Θηλυκά με 1
|
|
|
|
|
|
|
Θηλυκά με 2
|
|
|
|
|
|
|
Θηλυκά με ≥ 3
|
|
|
|
|
|
|
Μεταγεννητική (ζώντα κατά τη γέννα μείον ζώντα κατά τη 13η ΜΓΗ)
|
|
Θηλυκά με 0
|
|
|
|
|
|
|
Θηλυκά με 1
|
|
|
|
|
|
|
Θηλυκά με 2
|
|
|
|
|
|
|
Θηλυκά με ≥ 3
|
|
|
|
|
|
B.65
IN VITRO ΜΕΘΟΔΟΣ ΔΟΚΙΜΩΝ ΦΡΑΓΜΟΥ ΜΕΜΒΡΑΝΗΣ ΓΙΑ ΔΙΑΒΡΩΣΗ ΤΟΥ ΔΕΡΜΑΤΟΣ
ΕΙΣΑΓΩΓΗ
|
1.
|
Η παρούσα μέθοδος δοκιμών είναι ισοδύναμη με την κατευθυντήρια γραμμή δοκιμών (TG) 435 του ΟΟΣΑ (2015). Η διάβρωση του δέρματος αναφέρεται στην πρόκληση μη αναστρέψιμης βλάβης στο δέρμα που εκδηλώνεται με τη μορφή ορατής νέκρωσης που διαπερνά την επιδερμίδα φθάνοντας στο χόριο μετά από εφαρμογή υπό δοκιμή χημικής ουσίας, όπως ορίζεται στο Παγκόσμια Εναρμονισμένο Σύστημα Ταξινόμησης και Επισήμανσης των Χημικών Ουσιών των Ηνωμένων Εθνών [Globally Harmonized System of Classification and Labelling of Chemicals (GHS)] (1) και στον κανονισμό (ΕΕ) 1272/2008 για την ταξινόμηση, την επισήμανση και τη συσκευασία των ουσιών και των μειγμάτων (CLP) της Ευρωπαϊκής Ένωσης (24). Η παρούσα μέθοδος δοκιμών, που είναι ισοδύναμη με την επικαιροποιημένη κατευθυντήρια γραμμή δοκιμών αριθ. 435 του ΟΟΣΑ, αποτελεί in vitro μέθοδο δοκιμών φραγμού μεμβράνης που μπορεί να χρησιμοποιηθεί για τον προσδιορισμό των διαβρωτικών χημικών ουσιών. Στην παρούσα μέθοδο δοκιμών χρησιμοποιείται μια τεχνητή μεμβράνη, σχεδιασμένη έτσι ώστε να αντιδρά στις διαβρωτικές χημικές ουσίες κατά τρόπο ανάλογο με δέρμα ζώου in situ.
|
|
2.
|
Η διαβρωτικότητα στο δέρμα αξιολογείται παραδοσιακά μέσω εφαρμογής της υπό δοκιμή χημικής ουσίας στο δέρμα ζώντων ζώων και την αξιολόγηση της έκτασης της βλάβης στους ιστούς μετά από καθορισμένο χρονικό διάστημα (2). Πέραν της παρούσας μεθόδου δοκιμών, έχουν εγκριθεί αρκετές άλλες in vitro μέθοδοι δοκιμών ως εναλλακτικές λύσεις (3)(4) αντί της τυπικής in vivo διαδικασίας σε δέρμα κουνελιού (κεφάλαιο B.4 του παρόντος παραρτήματος, που ισοδυναμεί με την TG 404 του ΟΟΣΑ) που χρησιμοποιείται για τον προσδιορισμό διαβρωτικών χημικών ουσιών (2). Στη στρατηγική κλιμακωτών δοκιμών και αξιολόγησης του GHS του ΟΗΕ για την αξιολόγηση και την ταξινόμηση της διαβρωτικότητας στο δέρμα, και στο έγγραφο καθοδήγησης «Ολοκληρωμένη προσέγγιση για τη διεξαγωγή δοκιμών και την αξιολόγηση (IATA) για τον ερεθισμό/διάβρωση του δέρματος» του ΟΟΣΑ συνιστάται η χρήση επικυρωμένων και αποδεκτών in vitro μεθόδων δοκιμών βάσει των ενοτήτων 3 και 4 (1)(5). Στην IATA περιγράφονται ορισμένες ενότητες για την ομαδοποίηση πηγών πληροφοριών και εργαλείων ανάλυσης, και i) παρέχεται καθοδήγηση σχετικά με τον τρόπο ενσωμάτωσης και χρήσης των υφιστάμενων δεδομένων δοκιμών και δεδομένων εκτός δοκιμών για την αξιολόγηση του δυναμικού των χημικών ουσιών για ερεθισμό και διάβρωση του δέρματος και ii) προτείνεται μια προσέγγιση σε περίπτωση που απαιτείται η διεξαγωγή περαιτέρω δοκιμών, συμπεριλαμβανομένων και των περιπτώσεων όπου λαμβάνονται αρνητικά αποτελέσματα (5). Στο πλαίσιο αυτής της τμηματικής προσέγγισης, τα θετικά αποτελέσματα από μεθόδους δοκιμών in vitro μπορούν να χρησιμοποιηθούν για την ταξινόμηση μιας χημικής ουσίας ως διαβρωτικής χωρίς να χρειαστεί να διεξαχθούν δοκιμές σε ζώα, ώστε να περιορίζεται και να βελτιώνεται η χρήση των ζώων και να αποφεύγεται η πρόκληση πόνου και αγωνίας.
|
|
3.
|
Έχουν ολοκληρωθεί μελέτες επικύρωσης για το in vitro μοντέλο φραγμού μεμβράνης που διατίθεται στο εμπόριο με την επωνυμία Corrositex® (6)(7)(8), στις οποίες καταδεικνύεται συνολική ορθότητα πρόβλεψης της διαβρωτικότητας στο δέρμα 79 % (128/163), ευαισθησία 85 % (76/89) και ειδικότητα 70 % (52/74) σε μια βάση δεδομένων 163 ουσιών και μειγμάτων (7). Δεδομένης της αναγνωρισμένης εγκυρότητάς της, η εν λόγω επικυρωμένη μέθοδος αναφοράς (VRM) συνιστάται για χρήση στο πλαίσιο στρατηγικής κλιμακωτών δοκιμών για την αξιολόγηση της δυνητικής επικινδυνότητας διάβρωσης του δέρματος που ενέχουν οι χημικές ουσίες (5)(7). Για να καταστεί δυνατή η χρήση in vitro μοντέλου φραγμού μεμβράνης για τη διάβρωση του δέρματος για κανονιστικούς σκοπούς, θα πρέπει να προσδιορίζεται η αξιοπιστία, η καταλληλότητα (ορθότητα) και οι περιορισμοί της σε σχέση με την προτεινόμενη χρήση της, ούτως ώστε να διασφαλίζεται ότι είναι παρεμφερή με τα αντίστοιχα χαρακτηριστικά της επικυρωμένης μεθόδου αναφοράς (9), σύμφωνα με τα προκαθορισμένα πρότυπα επιδόσεων (10). Η αμοιβαία αποδοχή δεδομένων του ΟΟΣΑ θα διασφαλίζεται μόνον αφού τυχόν προτεινόμενη νέα ή επικαιροποιημένη μέθοδος που συμμορφώνεται με τα πρότυπα επιδόσεων επανεξεταστεί και συμπεριληφθεί στην ισοδύναμη κατευθυντήρια γραμμή δοκιμών του ΟΟΣΑ. Επί του παρόντος, η κατευθυντήρια γραμμή 435 του ΟΟΣΑ και η παρούσα μέθοδος δοκιμών καλύπτουν μόνο μία in vitro μέθοδο, το εμπορικά διαθέσιμο μοντέλο Corrositex®.
|
|
4.
|
Άλλες μέθοδοι δοκιμών για τη διεξαγωγή δοκιμών διαβρωτικότητας στο δέρμα βασίζονται στη χρήση ανασυσταθέντος ανθρώπινου δέρματος (TG 431 ΟΟΣΑ) (3) και απομονωμένου δέρματος επίμυος (TG 430 ΟΟΣΑ) (4). Η παρούσα κατευθυντήρια γραμμή δοκιμών προβλέπει επίσης την ταξινόμηση των διαβρωτικών χημικών ουσιών στις τρεις υποκατηγορίες διαβρωτικότητας του GHS του ΟΗΕ και στις τρεις ομάδες συσκευασίας μεταφοράς του ΟΗΕ για τη διαβρωτικότητα. Αυτή η κατευθυντήρια γραμμή δοκιμών εγκρίθηκε αρχικά το 2006 και επικαιροποιήθηκε το 2015 ώστε να παραπέμπει στο έγγραφο καθοδήγησης IATA και για λόγους επικαιροποίησης του καταλόγου ουσιών ελέγχου ικανότητας.
|
ΟΡΙΣΜΟΙ
|
5.
|
Οι χρησιμοποιούμενοι ορισμοί παρατίθενται στο προσάρτημα.
|
ΑΡΧΙΚΕΣ ΕΚΤΙΜΗΣΕΙΣ ΚΑΙ ΠΕΡΙΟΡΙΣΜΟΙ
|
6.
|
Η δοκιμή που περιγράφεται στην παρούσα μέθοδο δοκιμών επιτρέπει τον προσδιορισμό διαβρωτικών υπό δοκιμή χημικών ουσιών και την ταξινόμηση των διαβρωτικών ουσιών σε υποκατηγορίες σύμφωνα με το GHS του ΟΗΕ / τον κανονισμό CLP (πίνακας 1). Επιπλέον, αυτή η μέθοδος δοκιμών μπορεί να χρησιμοποιηθεί για να ληφθούν αποφάσεις περί της διαβρωτικότητας ή μη ειδικών κατηγοριών χημικών ουσιών, π.χ. οργανικών και ανόργανων οξέων, παραγώγων οξέων (25) καιβάσεων για ορισμένες δοκιμές που αφορούν τις μεταφορές (7)(11)(12). Στην παρούσα μέθοδο δοκιμών περιγράφεται μια γενική διαδικασία, παρεμφερής με αυτήν της επικυρωμένης μεθόδου δοκιμών αναφοράς (7). Η παρούσα μέθοδος δοκιμών δεν παρέχει επαρκείς πληροφορίες σχετικά με τον ερεθισμό του δέρματος, αλλά η μέθοδος δοκιμών B.46 (ισοδύναμη με την TG 439 του ΟΟΣΑ) αφορά ειδικά τον ερεθισμό του δέρματος in vitro (13). Για την πλήρη αξιολόγηση των τοπικών επιδράσεων στο δέρμα μετά από εφάπαξ έκθεση του δέρματος, ανατρέξτε στο έγγραφο καθοδήγησης του ΟΟΣΑ για τις ολοκληρωμένες προσεγγίσεις για τη διεξαγωγή δοκιμών και την αξιολόγηση (5).
Πίνακας 1
Η κατηγορία και οι υποκατηγορίες ουσιών διαβρωτικών του δέρματος κατά το GHS του ΟΗΕ (26)
|
Κατηγορία διαβρωτικών (κατηγορία 1) (για αρχές που δεν χρησιμοποιούν υποκατηγορίες)
|
Υποκατηγορίες δυνητικά διαβρωτικών (26) (για αρχές που χρησιμοποιούν υποκατηγορίες, περιλαμβανομένου του κανονισμού CLP)
|
Διαβρωτικό σε ≥ 1 από 3 ζώα
|
|
Έκθεση
|
Παρατήρηση
|
|
Διαβρωτικό
|
Υποκατηγορία διαβρωτικών 1Α
|
≤ 3 λεπτά
|
≤ 1 ώρα
|
|
Υποκατηγορία διαβρωτικών 1Β
|
> 3 λεπτά / ≤ 1 ώρα
|
≤ 14 ημέρες
|
|
Υποκατηγορία διαβρωτικών 1C
|
> 1 ώρα / ≤ 4 ώρες
|
≤ 14 ημέρες
|
|
|
7.
|
Ένας περιορισμός της επικυρωμένης μεθόδου δοκιμών (7) είναι ότι πολλές μη διαβρωτικές χημικές ουσίες και ορισμένες διαβρωτικές χημικές ουσίες μπορεί να μην πληρούν τα κριτήρια ώστε να υποβληθούν σε δοκιμές, βάσει των αποτελεσμάτων της αρχικής δοκιμής συμβατότητας (βλ. παράγραφο 13). Οι υδατικές χημικές ουσίες με pH που κυμαίνεται από 4,5 έως 8,5 συχνά δεν πληρούν τα κριτήρια ώστε να υποβληθούν σε δοκιμές· εντούτοις, το 85 % των χημικών ουσιών με pH εντός της συγκεκριμένης κλίμακας που υποβλήθηκαν σε δοκιμές ήταν μη διαβρωτικές σε δοκιμές σε ζώα (7). Η in vitro μέθοδος φραγμού μεμβράνης μπορεί να χρησιμοποιηθεί για τον έλεγχο στερεών (διαλυτών ή μη διαλυτών στο νερό), υγρών (υδατικών ή μη υδατικών) και γαλακτωμάτων. Εντούτοις, οι υπό δοκιμή χημικές ουσίες που δεν προκαλούν ανιχνεύσιμες μεταβολές στη δοκιμή συμβατότητας [αλλαγή χρώματος στο σύστημα ανίχνευσης χημικών ουσιών (CDS) της επικυρωμένης μεθόδου δοκιμών αναφοράς] δεν μπορούν να υποβληθούν σε δοκιμή με τη μέθοδο φραγμού μεμβράνης και θα πρέπει να ελέγχονται με χρήση άλλων μεθόδων δοκιμών.
|
ΑΡΧΗ ΤΗΣ ΔΟΚΙΜΗΣ
|
8.
|
Το σύστημα δοκιμής απαρτίζεται από δύο στοιχεία: έναν συνθετικό μακρομοριακό βιοφραγμό και ένα σύστημα ανίχνευσης χημικών ουσιών (CDS)· η παρούσα μέθοδος δοκιμών ανιχνεύει μέσω του φραγμού μεμβράνης CDS τις βλάβες που προκαλούν οι διαβρωτικές χημικές ουσίες μετά την εφαρμογή τους στην επιφάνεια του συνθετικού μακρομοριακού φραγμού μεμβράνης (7), προφανώς μέσω του ή των ίδιων μηχανισμών διάβρωσης που λειτουργούν και στο ζωντανό δέρμα.
|
|
9.
|
Η διείσδυση διαμέσου του φραγμού μεμβράνης («διαφυγή») μπορεί να μετρηθεί με χρήση διαφόρων διαδικασιών ή CDS, περιλαμβανομένης της αλλαγής του χρώματος χρωματικού δείκτη pH ή κάποιας άλλης ιδιότητας του διαλύματος δείκτη κάτω από τον φραγμό.
|
|
10.
|
Ο φραγμός μεμβράνης θα πρέπει να ελέγχεται ως προς την εγκυρότητά του, δηλαδή την καταλληλότητα και την αξιοπιστία του για τον σκοπό για τον οποίο προορίζεται. Στο πλαίσιο του εν λόγω ελέγχου θα πρέπει να διασφαλίζεται ότι τα διάφορα παρασκευάσματα συνάδουν με τις ιδιότητες του φραγμού, π.χ. μπορούν να διατηρούν έναν φραγμό όταν χρησιμοποιούνται μη διαβρωτικές χημικές ουσίες και να παρέχουν τη δυνατότητα κατηγοριοποίησης των διαβρωτικών ιδιοτήτων των χημικών ουσιών με βάση τις διάφορες υποκατηγορίες διαβρωτικότητας του GHS του ΟΗΕ (1). Η ταξινόμηση βασίζεται στον χρόνο που απαιτείται για τη διείσδυση μιας χημικής ουσίας μέσω του φραγμού μεμβράνης στο διάλυμα δείκτη.
|
ΑΠΟΔΕΙΞΗ ΤΕΧΝΙΚΗΣ ΙΚΑΝΟΤΗΤΑΣ
|
11.
|
Πριν εντάξουν στην καθημερινή πρακτική την in vitro μέθοδο φραγμού μεμβράνης, που συμμορφώνεται με την παρούσα μέθοδο δοκιμών, τα εργαστήρια θα πρέπει να αποδεικνύουν την τεχνική τους ικανότητα ταξινομώντας σωστά τις δώδεκα συνιστώμενες στον πίνακα 2 ουσίες ελέγχου ικανότητας. Σε περιπτώσεις όπου μια απαριθμούμενη ουσία δεν είναι διαθέσιμη, ή εφόσον δικαιολογείται, μπορεί να χρησιμοποιείται άλλη ουσία για την οποία υπάρχουν επαρκή δεδομένα αναφοράς in vivo και in vitro [π.χ. από τον κατάλογο χημικών ουσιών αναφοράς (10)], υπό την προϋπόθεση ότι εφαρμόζονται τα ίδια κριτήρια επιλογής που περιγράφονται στον πίνακα 1.
Πίνακας 2
Ουσίες ελέγχου ικανότητας
(27)
|
Ουσία (28)
|
CASRN
|
Χημική κατηγορία
|
In vivo υποκατηγορία του GHS του ΟΗΕ (29)
|
In vitro υποκατηγορία του GHS του ΟΗΕ (29)
|
|
Τριφθοριούχο βόριο διένυδρο
|
13319-75-0
|
Ανόργανα οξέα
|
1A
|
1A
|
|
Νιτρικό οξύ
|
7697-37-2
|
Ανόργανα οξέα
|
1A
|
1A
|
|
Πενταχλωρίδιο του φωσφόρου
|
10026-13-8
|
Πρόδρομες ουσίες ανόργανων οξέων
|
1A
|
1A
|
|
Βαλεριανυλοχλωρίδιο
|
638-29-9
|
Χλωρίδια οξέων
|
1B
|
1B
|
|
Υδροξείδιο του νατρίου
|
1310-73-2
|
Ανόργανες βάσεις
|
1B
|
1B
|
|
1-(2-Αμινοαιθυλο)-πιπεραζίνη
|
140-31-8
|
Αλειφατικές αμίνες
|
1B
|
1B
|
|
Βενζυλοσουλφονυλοχλωρίδιο
|
98-09-9
|
Χλωρίδια οξέων
|
1C
|
1C
|
|
N,N-Διμεθυλοβενζυλαμίνη
|
103-83-3
|
Ανιλίνες
|
1C
|
1C
|
|
Τετρααιθυλενοπενταμίνη
|
112-57-2
|
Αλειφατικές αμίνες
|
1C
|
1C
|
|
Ευγενόλη
|
97-53-0
|
Φαινόλες
|
NC
|
NC
|
|
Ακρυλικός εννεϋλεστέρας
|
2664-55-3
|
Ακρυλικές/μεθακρυλικές ενώσεις
|
NC
|
NC
|
|
Όξινο ανθρακικό νάτριο
|
144-55-8
|
Ανόργανα άλατα
|
NC
|
NC
|
|
ΔΙΑΔΙΚΑΣΙΑ
|
12.
|
Στις ακόλουθες παραγράφους περιγράφονται τα στοιχεία και οι διαδικασίες μεθόδου δοκιμών τεχνητού φραγμού μεμβράνης για την αξιολόγηση της διαβρωτικότητας (7)(15), με βάση την υφιστάμενη επικυρωμένη μέθοδο αναφοράς, τη μέθοδο Corrositex® του εμπορίου. Ο φραγμός μεμβράνης και τα διαλύματα συμβατότητας/δείκτη και κατηγοριοποίησης μπορούν να κατασκευαστούν, να παρασκευαστούν ή να αποκτηθούν από το εμπόριο, όπως στην περίπτωση της μεθόδου Corrositex®. Για την επικυρωμένη μέθοδο δοκιμών αναφοράς διατίθεται παράδειγμα πρωτοκόλλου μεθόδου δοκιμών (7). Οι δοκιμές θα πρέπει να διεξάγονται σε θερμοκρασία περιβάλλοντος (17-25 °C) και τα στοιχεία της μεθόδου θα πρέπει να πληρούν τις ακόλουθες προϋποθέσεις.
|
Δοκιμή συμβατότητας χημικών ουσιών
|
13.
|
Πριν από τη διεξαγωγή της δοκιμής φραγμού μεμβράνης, διεξάγεται δοκιμή συμβατότητας για να προσδιοριστεί εάν η υπό δοκιμή χημική ουσία είναι ανιχνεύσιμη από το CDS. Εάν το CDS δεν ανιχνεύει την υπό δοκιμή χημική ουσία, η μέθοδος δοκιμών φραγμού μεμβράνης δεν είναι κατάλληλη για την αξιολόγηση της συγκεκριμένης ουσίας και θα πρέπει να χρησιμοποιηθεί διαφορετική μέθοδος δοκιμών. Το CDS και οι συνθήκες έκθεσης που χρησιμοποιούνται για τη δοκιμή συμβατότητας θα πρέπει να αντικατοπτρίζουν την έκθεση στην επακόλουθη δοκιμή φραγμού μεμβράνης.
|
Δοκιμή κατηγορίας χρονικής κλίμακας για υπό δοκιμή χημική ουσία
|
14.
|
Εφόσον αρμόζει για τη μέθοδο δοκιμών, μια υπό δοκιμή χημική ουσία που έχει χαρακτηριστεί συμβατή βάσει της δοκιμής συμβατότητας θα πρέπει να υποβάλλεται σε δοκιμή κατηγορίας χρονικής κλίμακας, δηλαδή μια δοκιμή διαλογής για τη διάκριση μεταξύ ασθενών και ισχυρών οξέων ή βάσεων. Για παράδειγμα, στην επικυρωμένη μέθοδο δοκιμών αναφοράς χρησιμοποιείται δοκιμή κατηγοριοποίησης χρονικής κλίμακας προκειμένου να υποδειχθεί ποια από τις δύο χρονικές κλίμακες θα πρέπει να χρησιμοποιηθεί με βάση το κατά πόσον ανιχνεύεται σημαντικό όξινο/αλκαλικό απόθεμα. Για τον προσδιορισμό της διαβρωτικότητας και της υποκατηγορίας διαβρωτικότητας στο δέρμα κατά GHS του ΟΗΕ θα πρέπει να χρησιμοποιούνται δύο διαφορετικές χρονικές κλίμακες διαφυγής, με βάση το όξινο/αλκαλικό απόθεμα της υπό δοκιμή χημικής ουσίας.
|
ΣΤΟΙΧΕΙΑ ΤΗΣ ΜΕΘΟΔΟΥ ΔΟΚΙΜΩΝ ΦΡΑΓΜΟΥ ΜΕΜΒΡΑΝΗΣ
Φραγμός μεμβράνης
|
15.
|
Ο φραγμός μεμβράνης απαρτίζεται από δύο στοιχεία: μια πρωτεϊνούχο μακρομοριακή υδατική γέλη και μια διαπερατή μεμβράνη υποστήριξης. Η πρωτεϊνούχος γέλη θα πρέπει να είναι αδιαπέρατη από τα υγρά και τα στερεά, αλλά να μπορεί να διαβρωθεί και να καταστεί διαπερατή. Ο πλήρως κατασκευασμένος φραγμός μεμβράνης θα πρέπει να αποθηκεύεται υπό προκαθορισμένες συνθήκες που έχει καταδειχθεί ότι αποτρέπουν κάθε αλλοίωση της γέλης, π.χ. ξήρανση, ανάπτυξη μικροβίων, μετατόπιση ή ράγισμα, που θα μπορούσε να υποβαθμίσει τις επιδόσεις της. Θα πρέπει να καθορίζεται η αποδεκτή περίοδος αποθήκευσης και τα παρασκευάσματα φραγμού μεμβράνης δεν πρέπει να χρησιμοποιούνται μετά από αυτή την περίοδο.
|
|
16.
|
Η διαπερατή μεμβράνη υποστήριξης παρέχει μηχανική στήριξη στην πρωτεϊνούχο γέλη κατά τη διεργασία σχηματισμού της γέλης και την έκθεση στην υπό δοκιμή χημική ουσία. Η μεμβράνη υποστήριξης θα πρέπει να αποτρέπει τη χαλάρωση ή τη μετατόπιση της γέλης και θα πρέπει να είναι εύκολα διαπερατή από όλες τις υπό δοκιμή χημικές ουσίες.
|
|
17.
|
Η πρωτεϊνούχος γέλη αποτελείται από πρωτεΐνες, π.χ. κερατίνη, κολλαγόνο, ή μείγματα πρωτεϊνών που σχηματίζουν μία μήτρα γέλης, και χρησιμεύει ως στόχος για την υπό δοκιμή χημική ουσία. Το πρωτεϊνούχο υλικό τοποθετείται στην επιφάνεια της μεμβράνης υποστήριξης και αφήνεται να σχηματίσει γέλη προτού ο φραγμός μεμβράνης τοποθετηθεί πάνω από το διάλυμα δείκτη. Το πάχος και η πυκνότητα της πρωτεϊνούχου γέλης θα πρέπει να είναι ομοιόμορφα σε όλη τη γέλη και δεν θα πρέπει να υπάρχουν φυσαλίδες αέρα ή ελαττώματα που θα μπορούσαν να βλάψουν τη λειτουργική ακεραιότητά της.
|
Σύστημα ανίχνευσης χημικών ουσιών (CDS)
|
18.
|
Το διάλυμα δείκτης, που είναι το ίδιο διάλυμα που χρησιμοποιήθηκε για τη δοκιμή συμβατότητας, θα πρέπει να αποκρίνεται στην παρουσία υπό δοκιμή χημικής ουσίας. Θα πρέπει να χρησιμοποιείται χρωματικός δείκτης ή συνδυασμός χρωματικών δεικτών pH, π.χ. ερυθρό κρεζόλης και πορτοκαλί του μεθυλίου, που θα αλλάξουν χρώμα παρουσία της υπό δοκιμή χημικής ουσίας. Το σύστημα μέτρησης μπορεί να είναι οπτικό ή ηλεκτρονικό.
|
|
19.
|
Τα συστήματα ανίχνευσης που αναπτύσσονται για την ανίχνευση της διέλευσης της υπό δοκιμή χημικής ουσίας μέσω της μεμβράνης φραγμού θα πρέπει να αξιολογούνται ως προς την καταλληλότητα και την αξιοπιστία τους προκειμένου να καταδεικνύεται το φάσμα των χημικών ουσιών που μπορούν να ανιχνευθούν καθώς και τα ποσοτικά όρια της ανίχνευσης.
|
ΕΠΙΔΟΣΕΙΣ ΔΟΚΙΜΗΣ
Συναρμολόγηση των στοιχείων της μεθόδου δοκιμών
|
20.
|
Ο φραγμός μεμβράνης τοποθετείται σε φιαλίδιο (ή σωλήνα) που περιέχει το διάλυμα δείκτη κατά τρόπον ώστε η μεμβράνη υποστήριξης να έρχεται σε πλήρη επαφή με το διάλυμα δείκτη χωρίς να υπάρχουν φυσαλίδες αέρα. Θα πρέπει να λαμβάνεται μέριμνα ώστε να διασφαλίζεται η ακεραιότητα του φραγμού.
|
Εφαρμογή της υπό δοκιμή χημικής ουσίας
|
21.
|
Κατάλληλη ποσότητα της υπό δοκιμή χημικής ουσίας, π.χ. 500 μl υγρού ή 500 mg στερεού που έχει κονιοποιηθεί σε λεπτούς κόκκους (7), επιστρώνεται προσεκτικά και κατανέμεται ομοιόμορφα στην επάνω επιφάνεια του φραγμού μεμβράνης. Προετοιμάζεται κατάλληλος αριθμός πανομοιότυπων φιαλιδίων, π.χ. τέσσερις (7) για κάθε υπό δοκιμή χημική ουσία και τους αντίστοιχους μάρτυρες (βλ. παραγράφους 23 έως 25). Καταγράφεται η χρονική στιγμή εφαρμογής της υπό δοκιμή χημικής ουσίας στον φραγμό μεμβράνης. Προκειμένου να διασφαλίζεται η ορθή καταγραφή των σύντομων χρόνων διάβρωσης, η υπό δοκιμή χημική ουσία τοποθετείται σε κάθε πανομοιότυπο φιαλίδιο αφού παρέλθει ένα ορισμένο χρονικό διάστημα μετά την τοποθέτηση στο προηγούμενο φιαλίδιο.
|
Μέτρηση διεισδύσεων φραγμού μεμβράνης
|
22.
|
Κάθε φιαλίδιο παρακολουθείται δεόντως, καταγράφεται η χρονική στιγμή της πρώτης παρατηρούμενης αλλαγής στο διάλυμα δείκτη, δηλαδή της διείσδυσης μέσω του φραγμού, και προσδιορίζεται ο χρόνος μεταξύ της εφαρμογής και της διείσδυσης μέσω του φραγμού μεμβράνης.
|
Μάρτυρες
|
23.
|
Σε δοκιμές που περιλαμβάνουν τη χρήση φορέα ή διαλύτη με την υπό δοκιμή χημική ουσία, ο φορέας ή ο διαλύτης θα πρέπει να είναι συμβατοί με το σύστημα φραγμού μεμβράνης, δηλ. να μην υποβαθμίζουν την ακεραιότητα του συστήματος φραγμού μεμβράνης, και δεν θα πρέπει να αλλοιώνουν τη διαβρωτικότητα της υπό δοκιμή χημικής ουσίας. Ανάλογα με την περίπτωση, ένας μάρτυρας διαλύτη (ή φορέα) θα πρέπει να υποβάλλεται σε δοκιμή παράλληλα με την υπό δοκιμή χημική ουσία προκειμένου να καταδεικνύεται η συμβατότητα του διαλύτη με το σύστημα φραγμού μεμβράνης.
|
|
24.
|
Ένας θετικός (διαβρωτικός) μάρτυρας μέτριας διαβρωτικής δραστηριότητας, π.χ. 110 ± 15 mg υδροξειδίου του νατρίου (υποκατηγορία διαβρωτικών 1B του GHS του ΟΗΕ) (7), θα πρέπει να υποβάλλεται σε δοκιμή παράλληλα με την υπό δοκιμή χημική ουσία προκειμένου να αξιολογείται κατά πόσον οι επιδόσεις του συστήματος δοκιμής είναι αποδεκτές. Ένας δεύτερος θετικός μάρτυρας της ίδιας χημικής κατηγορίας με την υπό δοκιμή χημική ουσία μπορεί να είναι χρήσιμος για την αξιολόγηση του σχετικού δυναμικού διαβρωτικότητας μιας διαβρωτικής ουσίας. Θα πρέπει να επιλέγονται θετικοί μάρτυρες μέτριας διαβρωτικότητας (π.χ. υποκατηγορία 1Β του GHS του ΟΗΕ) προκειμένου να ανιχνεύονται αλλαγές που επιμηκύνουν ή συντομεύουν τον χρόνο διείσδυσης σε βαθμό μη αποδεκτό σε σχέση με την καθορισμένη τιμή αναφοράς, και που, ως εκ τούτου, υποδεικνύουν ότι το σύστημα δοκιμής δεν λειτουργεί σωστά. Για τον σκοπό αυτό, οι εξαιρετικά διαβρωτικές (υποκατηγορία 1Α του GHS του ΟΗΕ) ή οι μη διαβρωτικές χημικές ουσίες δεν είναι ιδιαίτερα χρήσιμες. Μια διαβρωτική χημική ουσία υποκατηγορίας 1B του GHS του ΟΗΕ θα επιτρέψει τον εντοπισμό ιδιαίτερα σύντομου ή ιδιαίτερα αργού χρόνου διαφυγής. Ένα ασθενές διαβρωτικό (υποκατηγορία 1C του GHS του ΟΗΕ) μπορεί να χρησιμοποιείται ως θετικός μάρτυρας για τη μέτρηση της ικανότητας της μεθόδου δοκιμών να διακρίνει με συνέπεια τις ασθενώς διαβρωτικές από τις μη διαβρωτικές ουσίες. Ανεξάρτητα από τη χρησιμοποιούμενη προσέγγιση, θα πρέπει να αναπτύσσεται ένα αποδεκτό εύρος απόκρισης θετικού μάρτυρα με βάση το ιστορικό εύρος χρόνων διαφυγής για τους χρησιμοποιούμενους θετικούς μάρτυρες, όπως οι μέσες τιμές ± 2-3 τυπικές αποκλίσεις. Σε κάθε μελέτη, θα πρέπει να καθορίζεται ο ακριβής χρόνος διαφυγής για τον θετικό μάρτυρα ούτως ώστε να είναι εφικτός ο εντοπισμός των αποκλίσεων που δεν εμπίπτουν στο αποδεκτό εύρος.
|
|
25.
|
Επίσης, θα πρέπει να υποβάλλεται σε δοκιμή αρνητικός (μη διαβρωτικός) μάρτυρας, π.χ. 10 % κιτρικό οξύ, 6 % προπιονικό οξύ (7), παράλληλα με την υπό δοκιμή χημική ουσία, ως ένα ακόμη μέτρο ποιοτικού ελέγχου που καταδεικνύει τη λειτουργική ακεραιότητα του φραγμού μεμβράνης.
|
Κριτήρια αποδοχής της μελέτης
|
26.
|
Σύμφωνα με τις καθιερωμένες χρονικές παραμέτρους για καθεμία από τις υποκατηγορίες διαβρωτικότητας του GHS του ΟΗΕ, ο χρόνος (σε λεπτά) που παρέρχεται μεταξύ της εφαρμογής μιας υπό δοκιμή χημικής ουσίας στον φραγμό μεμβράνης και της διείσδυσης διαμέσου του φραγμού χρησιμοποιείται για την πρόβλεψη της διαβρωτικότητας της υπό δοκιμή χημικής ουσίας. Προκειμένου μια μελέτη να θεωρηθεί αποδεκτή, ο παράλληλος θετικός μάρτυρας θα πρέπει να εμφανίζει τον αναμενόμενο χρόνο απόκρισης διείσδυσης (π.χ. 8-16 λεπτά χρόνου διαφυγής για το υδροξείδιο του νατρίου, εφόσον χρησιμοποιείται ως θετικός μάρτυρας), ο παράλληλος αρνητικός μάρτυρας δεν θα πρέπει να είναι διαβρωτικός, και, εφόσον περιλαμβάνεται, ο παράλληλος μάρτυρας με διαλύτη δεν θα πρέπει να είναι ούτε διαβρωτικός ούτε να αλλοιώνει το δυναμικό διαβρωτικότητας της υπό δοκιμή χημικής ουσίας. Πριν χρησιμοποιήσουν στην καθημερινή πρακτική μια μέθοδο που συμφωνεί με την παρούσα μέθοδο δοκιμών, τα εργαστήρια θα πρέπει να μπορούν να αποδείξουν την τεχνική τους ικανότητα, χρησιμοποιώντας τις συνιστώμενες δώδεκα ουσίες που εμφαίνονται στον πίνακα 2. Για τις νέες μεθόδους παρόμοιου τύπου («me-too») που αναπτύσσονται βάσει της παρούσας μεθόδου δοκιμών και οι οποίες είναι δομικά και λειτουργικά παρεμφερείς με την επικυρωμένη μέθοδο αναφοράς (14), θα πρέπει να χρησιμοποιούνται τα προκαθορισμένα πρότυπα επιδόσεων για να καταδεικνύεται η αξιοπιστία και η ορθότητα της νέας μεθόδου, πριν από τη χρήση της για τη διεξαγωγή δοκιμών για κανονιστικούς σκοπούς (10).
|
Ερμηνεία των αποτελεσμάτων και κατηγοριοποίηση διαβρωτικότητας των υπό δοκιμή χημικών ουσιών
|
27.
|
Ο χρόνος (σε λεπτά) που παρέρχεται μεταξύ της εφαρμογής της υπό δοκιμή χημικής ουσίας στον φραγμό μεμβράνης και της διείσδυσης μέσω της μεμβράνης χρησιμοποιείται για την ταξινόμηση της υπό δοκιμή χημικής ουσίας ως προς τις υποκατηγορίες διαβρωτικών του GHS του ΟΗΕ (1) και, ανάλογα με την περίπτωση, την ομάδα συσκευασίας ΟΗΕ (16). Για κάθε προτεινόμενη μέθοδο δοκιμών καθορίζονται τιμές χρόνου αποκοπής για καθεμία από τις τρεις υποκατηγορίες διαβρωτικών. Κατά τις τελικές αποφάσεις σχετικά με τους χρόνους αποκοπής θα πρέπει να λαμβάνεται υπόψη η ανάγκη ελαχιστοποίησης της υποτίμησης της επικινδυνότητας διάβρωσης κατά την ταξινόμηση (ψευδοαρνητικά αποτελέσματα). Στην παρούσα κατευθυντήρια γραμμή δοκιμών θα πρέπει να χρησιμοποιούνται οι χρόνοι αποκοπής της μεθόδου Corrositex®, όπως δίνονται στον πίνακα 3, διότι αυτή είναι η μοναδική μέθοδος δοκιμών που εμπίπτει επί του παρόντος στην κατευθυντήρια γραμμή δοκιμών (7).
Πίνακας 3
Μοντέλο πρόβλεψης Corrositex®
|
Μέσος χρόνος διαφυγής (λεπτά)
|
Πρόβλεψη του GHS του ΟΗΕ (32)
|
|
Χημικές ουσίες δοκιμής κατηγορίας 1 (30) (καθορίζονται βάσει της δοκιμής κατηγοριοποίησης της μεθόδου)
|
Χημικές ουσίες δοκιμής κατηγορίας 2 (31) (καθορίζονται βάσει της δοκιμής κατηγοριοποίησης της μεθόδου)
|
|
0-3 λεπτά
|
0-3 λεπτά
|
Διαβρωτικό προαιρετική υποκατηγορία 1A
|
|
> 3 έως 60 λεπτά
|
> 3 έως 30 λεπτά
|
Διαβρωτικό προαιρετική υποκατηγορία 1Β
|
|
> 60 έως 240 λεπτά
|
> 30 έως 60 λεπτά
|
Διαβρωτικό προαιρετική υποκατηγορία 1C
|
|
> 240 λεπτά
|
> 60 λεπτά
|
Μη διαβρωτικό
|
|
ΔΕΔΟΜΕΝΑ ΚΑΙ ΑΝΑΦΟΡΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ
Δεδομένα
|
28.
|
Ο χρόνος (σε λεπτά) που παρέρχεται μεταξύ της εφαρμογής και της διείσδυσης μέσω του φραγμού για την υπό δοκιμή χημική ουσία και τον θετικό μάρτυρα/-ες θα πρέπει να αναφέρεται υπό μορφή πίνακα ως δεδομένα μεμονωμένων πανομοιότυπων δειγμάτων, καθώς και ως μέση τιμή ± τυπική απόκλιση για κάθε δοκιμή.
|
Έκθεση δοκιμής
|
29.
|
Η έκθεση δοκιμής θα πρέπει να περιλαμβάνει τα ακόλουθα στοιχεία:
|
|
Υπό δοκιμή χημική ουσία και μάρτυρες:
|
—
|
Μονοσυστατική ουσία: ταυτοποίηση της χημικής ουσίας, όπως ονομασία IUPAC ή CAS, αριθμός CAS, κωδικός SMILES ή InChI, συντακτικός τύπος, καθαρότητα, χημική ταυτότητα προσμίξεων, κατά περίπτωση και στο μέτρο του δυνατού, κ.λπ.,
|
|
—
|
Πολυσυστατική ουσία, UVCB και μείγμα: περιγράφονται, στο μέτρο του δυνατού, με τη χημική ταυτότητα των συστατικών (βλ. ανωτέρω), την ποσότητα στην οποία απαντούν και τις σχετικές φυσικοχημικές τους ιδιότητες,
|
|
—
|
φυσική εμφάνιση, υδατοδιαλυτότητα και πρόσθετες σχετικές φυσικοχημικές ιδιότητες,
|
|
—
|
προέλευση, αριθμός παρτίδας εάν είναι διαθέσιμος,
|
|
—
|
κατεργασία της υπό δοκιμή χημικής ουσίας/μάρτυρα πριν από τη δοκιμή, εάν ισχύει (π.χ. θέρμανση, κονιοποίηση),
|
|
—
|
σταθερότητα της υπό δοκιμή χημικής ουσίας, καταληκτική ημερομηνία χρήσης ή ημερομηνία νέας ανάλυσης, εάν είναι γνωστή,
|
|
|
|
Φορέας:
|
—
|
ταυτοποίηση, συγκέντρωση (κατά περίπτωση), όγκος που χρησιμοποιήθηκε,
|
|
—
|
αιτιολόγηση της επιλογής του φορέα.
|
|
|
|
Χρησιμοποιούμενο in vitro μοντέλο φραγμού μεμβράνης και πρωτόκολλο, περιλαμβανομένης της καταδειχθείσας ορθότητας και αξιοπιστίας
|
|
|
Συνθήκες δοκιμής:
|
—
|
περιγραφή του χρησιμοποιηθέντος εξοπλισμού και διαδικασιών προετοιμασίας,
|
|
—
|
προέλευση και σύνθεση του χρησιμοποιηθέντος in vitro φραγμού μεμβράνης,
|
|
—
|
σύνθεση και ιδιότητες του διαλύματος δείκτη,
|
|
—
|
ποσότητες υπό δοκιμή χημικής ουσίας και μαρτύρων,
|
|
—
|
αριθμός πανομοιότυπων δειγμάτων,
|
|
—
|
περιγραφή και αιτιολόγηση της δοκιμής κατηγοριοποίησης χρονικής κλίμακας,
|
|
—
|
περιγραφή των κριτηρίων αξιολόγησης και ταξινόμησης που εφαρμόστηκαν,
|
|
—
|
κατάδειξη της τεχνικής ικανότητας διεξαγωγής της μεθόδου δοκιμών προτού χρησιμοποιηθεί στην καθημερινή πρακτική, μέσω ελέγχου των χημικών ουσιών ελέγχου ικανότητας.
|
|
|
|
Αποτελέσματα:
|
—
|
παρουσίαση υπό μορφή πίνακα των ατομικών ανεπεξέργαστων δεδομένων από μεμονωμένα δείγματα δοκιμής και μάρτυρα για κάθε πανομοιότυπο δείγμα,
|
|
—
|
περιγραφή άλλων επιδράσεων που παρατηρήθηκαν,
|
|
—
|
ταξινόμηση στην οποία κατέληξε η δοκιμή, με αναφορά του μοντέλου πρόβλεψης / των κριτηρίων απόφασης που χρησιμοποιήθηκαν.
|
|
Εξέταση των αποτελεσμάτων
Συμπεράσματα
|
ΒΙΒΛΙΟΓΡΑΦΙΑ
|
(1)
|
United Nations (UN) (2013). Globally Harmonized System of Classification and Labelling of Chemicals (GHS), Fifth Revised Edition, UN New York and Geneva, 2013. Διατίθεται στον δικτυακό τόπο: http://www.unece.org/trans/danger/publi/ghs/ghs_rev05/05files_e.html.
|
|
(2)
|
Κεφάλαιο B.4 του παρόντος παραρτήματος: Οξείας μορφής ερεθισμός/διάβρωση του δέρματος.
|
|
(3)
|
Κεφάλαιο B.40α του παρόντος παραρτήματος: Διάβρωση του δέρματος in vitro: μέθοδος δοκιμών σε ανασυσταθείσα ανθρώπινη επιδερμίδα (RhE).
|
|
(4)
|
Κεφάλαιο B.40 του παρόντος παραρτήματος: Διάβρωση του δέρματος in vitro: Διαδερμική ηλεκτρική αντίσταση (TER).
|
|
(5)
|
OECD (2015). Guidance Document on Integrated Approaches to Testing and Assessment of Skin Irritation/Corrosion. Environment, Health and Safety Publications, Series on Testing and Assessment, (No 203). Organisation for Economic Cooperation and Development, Paris.
|
|
(6)
|
Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhutter, H.-G. and Liebsch, M. (1998). The ECVAM International Validation Study on In Vitro Tests for Skin Corrosivity. 2. Results and Evaluation by the Management Team. Toxicology In Vitro 12, 483-524.
|
|
(7)
|
ICCVAM (1999). Corrositex®. An In Vitro Test Method for Assessing Dermal Corrosivity Potential of Chemicals. The Results of an Independent Peer Review Evaluation Coordinated by ICCVAM, NTP and NICEATM. NIEHS, NIH Publication (No 99-4495.)
|
|
(8)
|
Gordon V.C., Harvell J.D. and Maibach H.I. (1994). Dermal Corrosion, the Corrositex® System: A DOT Accepted Method to Predict Corrosivity Potential of Test Materials. In vitro Skin Toxicology-Irritation, Phototoxicity, Sensitization. Alternative Methods in Toxicology 10, 37-45.
|
|
(9)
|
OECD (2005). Guidance Document on the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment. Environmental, Health and Safety Publications. Series on testing and Assessment (No 34).
|
|
(10)
|
OECD (2014). Performance Standards for the Assessment of Proposed Similar or Modified In Vitro Membrane Barrier Test Method for Skin Corrosion in Relation to TG 435. Organisation for Economic Cooperation and Development, Paris. Διατίθεται στον δικτυακό τόπο: http://www.oecd.org/chemicalsafety/testing/PerfStand-TG430-June14.pdf.
|
|
(11)
|
ECVAM (2001). Statement on the Application of the CORROSITEX® Assay for Skin Corrosivity Testing. 15th Meeting of ECVAM Scientific Advisory Committee (ESAC), Ispra, Italy. ATLA 29, 96-97.
|
|
(12)
|
U.S. DOT (2002). Exemption DOT-E-10904 (Fifth Revision). (September 20, 2002). Washington, D.C., U.S. DOT.
|
|
(13)
|
Κεφάλαιο B.46 του παρόντος παραρτήματος: Δερματικός ερεθισμός in vitro: μέθοδος δοκιμών σε ανασυσταθείσα ανθρώπινη επιδερμίδα. ICCVAM (2004). ICCVAM Recommended Performance Standards for In Vitro Test Methods for Skin Corrosion. NIEHS, NIH Publication No 04-4510. Διατίθεται στον δικτυακό τόπο: http://www.ntp.niehs.nih.gov/iccvam/docs/dermal_docs/ps/ps044510.pdf.
|
|
(14)
|
U.S. EPA (1996). Method 1120, Dermal Corrosion. Διατίθεται στον δικτυακό τόπο: http://www.epa.gov/osw/hazard/testmethods/sw846/pdfs/1120.pdf.
|
|
(15)
|
United Nations (UN) (2013). UN Recommendations on the Transport of Dangerous Goods, Model Regulations, 18th Revised Edition (Part, Chapter 2.8), UN, 2013. Διατίθεται στον δικτυακό τόπο: http://www.unece.org/fileadmin/DAM/trans/danger/publi/unrec/rev18/English/Rev18_Volume1_Part2.pdf.
|
Προσάρτημα
ΟΡΙΣΜΟΙ
Ορθότητα
: ο βαθμός συμφωνίας μεταξύ των αποτελεσμάτων της μεθόδου δοκιμών και των αποδεκτών τιμών αναφοράς. Αποτελεί κριτήριο επιδόσεων της μεθόδου δοκιμών και μια από τις πτυχές της «καταλληλότητας». Συχνά ο όρος χρησιμοποιείται εναλλακτικά προς τη «συμφωνία» για να δηλώσει το ποσοστό ορθών αποτελεσμάτων μιας μεθόδου δοκιμών (9).
Χημικό προϊόν
: μια ουσία ή ένα μείγμα.
Σύστημα ανίχνευσης χημικών ουσιών (CDS)
: σύστημα οπτικής ή ηλεκτρονικής μέτρησης με διάλυμα δείκτη που αντιδρά στην παρουσία μιας υπό δοκιμή χημικής ουσίας, π.χ. με αλλαγή του χρωματικού δείκτη ή του συνδυασμού χρωματικών δεικτών pH, των οποίων το χρώμα αλλάζει παρουσία της υπό δοκιμή χημικής ουσίας, ή με άλλα είδη χημικών ή ηλεκτροχημικών αντιδράσεων.
Συμφωνία
: μέτρο των επιδόσεων των μεθόδων δοκιμών με τις οποίες λαμβάνονται κατηγορηματικά αποτελέσματα και μια από τις πτυχές της καταλληλότητας. Ο όρος χρησιμοποιείται ενίοτε εναλλακτικά προς τον όρο «ορθότητα», και ορίζεται ως το ποσοστό επί του συνόλου των υπό δοκιμή χημικών ουσιών που έχουν ταξινομηθεί ορθά ως θετικές ή αρνητικές. Η συμφωνία εξαρτάται σε μεγάλο βαθμό από τον επιπολασμό των θετικών ουσιών στα είδη των υπό δοκιμή χημικών ουσιών που ελέγχονται (9).
GHS (Globally Harmonised System for the Classification and Labelling of Chemicals – Παγκόσμια Εναρμονισμένο Σύστημα Ταξινόμησης και Επισήμανσης των Χημικών Προϊόντων)
: σύστημα που προτείνει την ταξινόμηση των χημικών προϊόντων (ουσιών και μειγμάτων) με βάση τυποποιημένα είδη και βαθμούς φυσικής επικινδυνότητας και επικινδυνότητας για την υγεία και το περιβάλλον και καλύπτει τα αντίστοιχα στοιχεία γνωστοποίησης, όπως εικονογράμματα, προειδοποιητικές λέξεις, δηλώσεις επικινδυνότητας, δηλώσεις προφύλαξης και δελτία δεδομένων ασφαλείας, με τα οποία γνωστοποιούνται πληροφορίες σχετικά με τις δυσμενείς επιδράσεις με σκοπό την προστασία των ανθρώπων (εργοδοτών, εργαζομένων, μεταφορέων, καταναλωτών και διασωστών) και του περιβάλλοντος (1).
IATA (Integrated Approach on Testing and Assessment)
: ολοκληρωμένη προσέγγιση για τη διεξαγωγή δοκιμών και την αξιολόγηση.
Μείγμα
: ένα μείγμα ή διάλυμα που αποτελείται από δύο ή περισσότερες ουσίες.
Μονοσυστατική ουσία
: ουσία που ορίζεται από την ποσοτική της σύνθεση και της οποίας ένα κύριο συστατικό περιέχεται σε ποσοστό τουλάχιστον 80 % κ.β.
Πολυσυστατική ουσία
: ουσία που ορίζεται από την ποσοτική της σύνθεση και της οποίας περισσότερα από ένα κύρια συστατικά περιέχονται σε συγκέντρωση ≥ 10 % κ.β. και < 80 % κ.β. Οι πολυσυστατικές ουσίες είναι προϊόντα μεταποιητικών διεργασιών. Η διαφορά μεταξύ μείγματος και πολυσυστατικής ουσίας είναι ότι το μείγμα λαμβάνεται με ανάμειξη δύο ή περισσότερων ουσιών, χωρίς χημική αντίδραση. Οι πολυσυστατικές ουσίες είναι προϊόντα χημικών αντιδράσεων.
NC
: μη διαβρωτικό.
Πρότυπα επιδόσεων
: πρότυπα που βασίζονται σε επικυρωμένη μέθοδο δοκιμών και παρέχουν τη βάση για την αξιολόγηση της συγκρισιμότητας προτεινόμενης μεθόδου δοκιμών η οποία είναι μηχανιστικά και λειτουργικά παρεμφερής. Περιλαμβάνονται i) βασικά στοιχεία της μεθόδου δοκιμών, ii) κατάλογος ελάχιστων ουσιών αναφοράς, οι οποίες έχουν επιλεγεί μεταξύ των χημικών ουσιών που χρησιμοποιήθηκαν για την απόδειξη των αποδεκτών επιδόσεων της επικυρωμένης μεθόδου αναφοράς, και iii) τα ανάλογα επίπεδα αξιοπιστίας και ορθότητας, που βασίζονται στα επιτευχθέντα για την επικυρωμένη μέθοδο δοκιμών και τα οποία πρέπει να επιδεικνύει η προτεινόμενη μέθοδος δοκιμών, όταν αξιολογείται με χρήση του καταλόγου ελαχίστων ουσιών αναφοράς (9).
Καταλληλότητα
: περιγραφή της σχέσης της μεθόδου δοκιμών με την υπό μελέτη επίδραση και του κατά πόσον αυτή είναι αρμόζουσα και χρήσιμη για συγκεκριμένο σκοπό. Πρόκειται για τον βαθμό στον οποίο η μέθοδος δοκιμών μετρά ή προβλέπει σωστά τη βιολογική επίδραση υπό μελέτη. Η καταλληλότητα εμπεριέχει συνεκτίμηση της ορθότητας (συμφωνίας) της μεθόδου δοκιμών (9).
Αξιοπιστία
: μέτρο του βαθμού στον οποίο μια μέθοδος δοκιμών μπορεί να αναπαράγεται διαχρονικά στο ίδιο εργαστήριο και μεταξύ εργαστηρίων, όταν εφαρμόζεται με το ίδιο πρωτόκολλο. Εκτιμάται με υπολογισμό της ενδοεργαστηριακής και της διεργαστηριακής αναπαραγωγιμότητας (9).
Ευαισθησία
: το ποσοστό του συνόλου των θετικών/δραστικών χημικών ουσιών που ταξινομείται σωστά με τη μέθοδο δοκιμών. Αποτελεί μέτρο ορθότητας των μεθόδων δοκιμών με τις οποίες λαμβάνονται κατηγορηματικά αποτελέσματα, καθώς και σημαντικό κριτήριο αξιολόγησης της καταλληλότητας των μεθόδων δοκιμών (9).
Διάβρωση του δέρματος in vivo
: η πρόκληση μη αναστρέψιμων βλαβών στο δέρμα, όπως εμφανούς νεκρώσεως που διαπερνά την επιδερμίδα φθάνοντας στο χόριο, μετά την εφαρμογή της υπό δοκιμή χημικής ουσίας για χρονικό διάστημα έως 4 ωρών. Τυπικές διαβρωτικές αντιδράσεις είναι τα έλκη, η αιμορραγία, οι αιματηρές εσχάρες και, στο τέλος της παρατήρησης μετά παρέλευση 14 ημερών, ο αποχρωματισμός λόγω λευκοδερμίας, επιφάνειες με τέλεια αλωπεκία και ουλές. Για την αξιολόγηση των αμφισβητήσιμων αλλοιώσεων θα πρέπει να διερευνάται η δυνατότητα ιστοπαθολογικής εξέτασης.
Ειδικότητα
: το ποσοστό του συνόλου των αρνητικών/αδρανών χημικών ουσιών που ταξινομείται σωστά με τη μέθοδο δοκιμών. Αποτελεί μέτρο ορθότητας των μεθόδων δοκιμών με τις οποίες λαμβάνονται κατηγορηματικά αποτελέσματα, καθώς και σημαντικό κριτήριο αξιολόγησης της καταλληλότητας των μεθόδων δοκιμών (9).
Ουσία
: ένα χημικό στοιχείο και οι ενώσεις του σε φυσική κατάσταση ή όπως λαμβάνονται με οποιαδήποτε παραγωγική διεργασία, στα οποία συμπεριλαμβάνονται όλα τα πρόσθετα που απαιτούνται για να διατηρείται η σταθερότητά του, καθώς και τυχόν προσμείξεις που προκύπτουν από τη χρησιμοποιούμενη διεργασία, αλλά από τα οποία εξαιρούνται οι διαλύτες που είναι δυνατόν να διαχωριστούν χωρίς να επηρεαστεί η σταθερότητα της ουσίας ούτε να μεταβληθεί η σύνθεσή της.
Υπό δοκιμή χημική ουσία
: κάθε ουσία ή μείγμα που υποβάλλεται σε δοκιμή με τη χρήση της παρούσας μεθόδου δοκιμών.
UVCB
: ουσίες άγνωστης ή ασταθούς σύνθεσης, πολύπλοκα προϊόντα αντιδράσεων ή βιολογικά υλικά.
B.66
IN VITRO ΔΟΚΙΜΑΣΙΕΣ ΔΙΕΝΕΡΓΟΠΟΙΗΣΗΣ ΣΤΑΘΕΡΩΣ ΔΙΑΜΟΛΥΝΘΕΝΤΩΝ ΚΥΤΤΑΡΩΝ ΓΙΑ ΤΗΝ ΑΝΙΧΝΕΥΣΗ ΑΓΩΝΙΣΤΩΝ ΚΑΙ ΑΝΤΑΓΩΝΙΣΤΩΝ ΤΩΝ ΥΠΟΔΟΧΕΩΝ ΟΙΣΤΡΟΓΟΝΩΝ
ΓΕΝΙΚΗ ΕΙΣΑΓΩΓΗ
Κατευθυντήρια γραμμή δοκιμών του ΟΟΣΑ με βάση τις επιδόσεις
|
1.
|
Η παρούσα μέθοδος δοκιμών είναι ισοδύναμη με την κατευθυντήρια γραμμή δοκιμών (TG) 455 του ΟΟΣΑ (2016). Η TG 455 είναι μια κατευθυντήρια γραμμή δοκιμών με βάση τις επιδόσεις (PBTG), στην οποία περιγράφονται οι in vitro δοκιμασίες διενεργοποίησης σταθερώς διαμολυνθέντων κυττάρων για την ανίχνευση αγωνιστών και ανταγωνιστών των υποδοχέων οιστρογόνων (δοκιμασίες ER TA). Περιλαμβάνει αρκετές μηχανιστικά και λειτουργικά παρεμφερείς μεθόδους δοκιμών για τον προσδιορισμό των αγωνιστών και ανταγωνιστών των υποδοχέων οιστρογόνων (δηλ. ERα και/ή ERβ) και αναμένεται να διευκολύνει την ανάπτυξη νέων παρεμφερών ή τροποποιημένων μεθόδων δοκιμών, σύμφωνα με τις αρχές επικύρωσης που καθορίζονται στο έγγραφο καθοδήγησης «Guidance Document on the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment» (Έγγραφο καθοδήγησης για την επικύρωση και τη διεθνή αποδοχή νέων ή επικαιροποιημένων μεθόδων δοκιμών για την αξιολόγηση του κινδύνου) του ΟΟΣΑ (1). Οι πλήρως επικυρωμένες μέθοδοι δοκιμών αναφοράς (προσάρτημα 2 και προσάρτημα 3) που αποτελούν τη βάση για την εν λόγω PBTG είναι οι ακόλουθες:
|
—
|
Η δοκιμασία διενεργοποίησης σταθερώς διαμολυνθέντων κυττάρων (STTA) (2) όπου χρησιμοποιείται η κυτταρική σειρά (h) ERα-HeLa-9903, και
|
|
—
|
Η δοκιμασία ER TA VM7Luc (3) όπου χρησιμοποιείται η κυτταρική σειρά VM7Luc4E2 (33), η οποία εκφράζει κυρίως τον hERα με κάποια συμβολή και του hERβ (4)(5).
|
Όσον αφορά την ανάπτυξη και την επικύρωση παρεμφερών δοκιμασιών για την ίδια παράμετρο επικινδυνότητας, θα πρέπει να χρησιμοποιούνται τα διαθέσιμα πρότυπα επιδόσεων (6) (7). Επιτρέπουν την έγκαιρη τροποποίηση της PBTG 455, ούτως ώστε να υπάρχει η δυνατότητα να προστίθενται νέες παρεμφερείς δοκιμασίες σε μια επικαιροποιημένη PBTG· εντούτοις, παρεμφερείς δοκιμασίες θα προστίθενται μόνο αφού τις εξετάσει ο ΟΟΣΑ και συμφωνήσει ότι πληρούνται τα πρότυπα επιδόσεων. Οι δοκιμασίες που περιλαμβάνονται στην TG 455 μπορούν να χρησιμοποιούνται αδιακρίτως για τη συαμμόρφωση προς τις απαιτήσεις των χωρών μελών του ΟΟΣΑ όσον αφορά τα αποτελέσματα δοκιμών σχετικά με τη διενεργοποίηση των υποδοχέων οιστρογόνων, με παράλληλη αξιοποίηση της αμοιβαίας αποδοχής δεδομένων του ΟΟΣΑ.
|
Ιστορικό και αρχές των δοκιμασιών που περιλαμβάνονται στην παρούσα μέθοδο δοκιμών
|
2.
|
Το 1998 o ΟΟΣΑ ανέλαβε μια δράση πρώτης προτεραιότητας με σκοπό την αναθεώρηση των υφιστάμενων και την εκπόνηση νέων κατευθυντήριων γραμμών δοκιμών για τη διαλογή και τις δοκιμές δυνητικών ενδοκρινικών διαταρακτών. Το εννοιακό πλαίσιο του ΟΟΣΑ για τη διεξαγωγή δοκιμών και την αξιολόγηση δυνητικών ενδοκρινικών διαταρακτών αναθεωρήθηκε το 2012. Το αρχικό και το αναθεωρημένο εννοιακό πλαίσιο περιλαμβάνονται ως παραρτήματα στο έγγραφο καθοδήγησης του ΟΟΣΑ «Standardised Test Guidelines for Evaluating Chemicals for Endocrine Disruption» (Τυποποιημένες κατευθυντήριες γραμμές δοκιμών για την αξιολόγηση του δυναμικού χημικών ουσιών ως ενδοκρινικών διαταρακτών) (8). Το εννοιακό πλαίσιο περιλαμβάνει πέντε επίπεδα, καθένα εκ των οποίων αντιστοιχεί σε διαφορετικό επίπεδο βιολογικής πολυπλοκότητας. Οι δοκιμασίες διενεργοποίησης (TA) ER που περιγράφονται στην παρούσα μέθοδο δοκιμών κατατάσσονται στο επίπεδο 2, το οποίο περιλαμβάνει «in vitro δοκιμασίες για την παροχή δεδομένων σχετικά με επιλεγμένους ενδοκρινικούς μηχανισμούς/οδούς». Η παρούσα μέθοδος δοκιμών αφορά in vitro δοκιμασίες διενεργοποίησης (TA) που έχουν σχεδιαστεί για τον προσδιορισμό των αγωνιστών και ανταγωνιστών των υποδοχέων οιστρογόνων (ER).
|
|
3.
|
Η αλληλεπίδραση των οιστρογόνων με τους ER μπορεί να επηρεάσει τη μεταγραφή των ελεγχόμενων από τα οιστρογόνα γονιδίων, με αποτέλεσμα την επαγωγή ή την αναστολή κυτταρικών διεργασιών, περιλαμβανομένων όσων είναι αναγκαίες για τον πολλαπλασιασμό των κυττάρων, τη φυσιολογική ανάπτυξη του εμβρύου και την αναπαραγωγική λειτουργία (9)(10)(11). Η διατάραξη των φυσιολογικών οιστρογονικών συστημάτων μπορεί να προκαλέσει δυσμενείς επιπτώσεις στη φυσιολογική ανάπτυξη (οντογένεση), την αναπαραγωγική υγεία και την ακεραιότητα του αναπαραγωγικού συστήματος.
|
|
4.
|
Οι in vitro δοκιμασίες TA βασίζονται στην άμεση ή έμμεση αλληλεπίδραση των ουσιών με ειδικό υποδοχέα που ρυθμίζει τη μεταγραφή προϊόντος γονιδίου αναφοράς. Οι δοκιμασίες αυτές χρησιμοποιούνται ευρέως για την αξιολόγηση της γονιδιακής έκφρασης που ρυθμίζεται από ειδικούς πυρηνικούς υποδοχείς όπως οι ER (12) (13) (14) (15) (16). Έχουν προταθεί για την ανίχνευση της οιστρογονικής διενεργοποίησης που ρυθμίζεται από τον ER (17) (18) (19). Υπάρχουν τουλάχιστον δύο κύριοι υποτύποι πυρηνικών ER, οι α και β, που κωδικοποιούνται από διαφορετικά γονίδια. Οι αντίστοιχες πρωτεΐνες έχουν διαφορετικές βιολογικές λειτουργίες καθώς και διαφορετικές κατανομές στους ιστούς και συγγένειες δέσμευσης προσδεμάτων (20)(21)(22)(23)(24)(25)(26). Ο πυρηνικός ERα διαμεσολαβεί την κλασική οιστρογονική απόκριση (27)(28)(29)(30) και, ως εκ τούτου, τα περισσότερα μοντέλα που αναπτύσσονται σήμερα για τη μέτρηση της ενεργοποίησης ή αναστολής των ER αφορούν ειδικά τον ERα. Οι δοκιμασίες χρησιμοποιούνται για τον προσδιορισμό των χημικών ουσιών πουενεργοποιούν (ή αναστέλλουν) τον ER μετά τη δέσμευση του προσδέματος, μετά την οποία το σύμπλοκο υποδοχέα-προσδέματος συνδέεται σε ειδικά στοιχεία απόκρισης του DNA και διενεργοποιεί ένα γονίδιο αναφοράς, με αποτέλεσμα αυξημένη κυτταρική έκφραση μιας πρωτεΐνης δείκτη. Στις δοκιμασίες αυτές μπορούν να χρησιμοποιηθούν διαφορετικές αποκρίσεις γονιδίων αναφοράς. Σε συστήματα που βασίζονται στη λουσιφεράση, το ένζυμο λουσιφεράση μετασχηματίζει το υπόστρωμα λουσιφερίνη σε βιοφωταυγές προϊόν που μπορεί να μετρηθεί ποσοτικά με λουμινόμετρο. Άλλα παραδείγματα κοινών γονιδίων αναφοράς είναι η φθορίζουσα πρωτεΐνη και το γονίδιο LacZ, που κωδικοποιεί τη β-γαλακτοσιδάση, ένα ένζυμο που μπορεί να μετασχηματίσει το άχρωμο υπόστρωμα X-gal (5-βρωμο-4-χλωρο-3-ινδολυλογαλακτοπυρανοζίτης) σε κυανό προϊόν που μπορεί να προσδιοριστεί ποσοτικά με φασματοφωτόμετρο. Τα εν λόγω γονίδια αναφοράς μπορούν να αξιολογηθούν γρήγορα και με χαμηλό κόστος με χρήση εμπορικά διαθέσιμων κιτ δοκιμής.
|
|
5.
|
Μελέτες επικύρωσης της STTA και των δοκιμασιών VM7Luc έχουν καταδείξει την καταλληλότητα και την αξιοπιστία τους ως προς τον σκοπό για τον οποίο προορίζονται (3)(4)(5)(30). Τα πρότυπα επιδόσεων για τις δοκιμασίες ER TA με βάση τη φωταύγεια που χρησιμοποιούν κυτταρικές σειρές μαστού περιλαμβάνονται στην έκθεση αξιολόγησης μεθόδων δοκιμών ICCVAM για τη μέθοδο δοκιμών LUMI-CELL® ER (VM7Luc ER TA): An In Vitro Assay for Identifying Human Estrogen Receptor Agonist and Antagonist Activity of Chemicals (3). Τα εν λόγω πρότυπα επιδόσεων έχουν τροποποιηθεί με σκοπό να μπορούν να εφαρμόζονται και στις δύο δοκιμασίες ΤΑ, την STTA και τη VM7Luc (2).
|
|
6.
|
Οι ορισμοί και οι συντομογραφίες που χρησιμοποιούνται στην παρούσα μέθοδο δοκιμών παρατίθενται στο προσάρτημα 1.
|
Πεδίο εφαρμογής και περιορισμοί που σχετίζονται με τις δοκιμασίες TA
|
7.
|
Οι δοκιμασίες αυτές προτείνονται για σκοπούς διαλογής και απόδοσης προτεραιότητας, αλλά μπορούν επίσης να παρέχουν πληροφορίες μηχανιστικού χαρακτήρα που μπορούν να χρησιμοποιηθούν στο πλαίσιο προσέγγισης βάρους της απόδειξης. Αφορούν TA που επάγεται από τη δέσμευση χημικών ουσιών στους ER σε σύστημα in vitro. Ως εκ τούτου, τα αποτελέσματα δεν θα πρέπει να παρεκβάλλονται άμεσα στην πολύπλοκη σηματοδότηση και ρύθμιση του ακέραιου ενδοκρινικού συστήματος in vivo.
|
|
8.
|
Η TA που διαμεσολαβείται από τους ER θεωρείται ένας από τους κύριους μηχανισμούς διατάραξης του ενδοκρινικού συστήματος, αν και υπάρχουν και άλλοι μηχανισμοί όπως i) αλληλεπιδράσεις με άλλους υποδοχείς και ενζυμικά συστήματα του ενδοκρινικού συστήματος, ii) σύνθεση ορμονών, iii) μεταβολική ενεργοποίηση και/ή αδρανοποίηση ορμονών, iv) κατανομή των ορμονών στους ιστούς στόχους, και v) απομάκρυνση των ορμονών από το σώμα. Καμία από τις δοκιμασίες στο πλαίσιο της παρούσας μεθόδου δοκιμών δεν αφορά τους συγκεκριμένους τρόπους δράσης.
|
|
9.
|
Η παρούσα μέθοδος δοκιμών αφορά την ικανότητα των χημικών ουσιών να ενεργοποιούν (δηλ. να δρουν ως αγωνιστές) καθώς επίσης και να καταστέλλουν (δηλ. να δρουν ως ανταγωνιστές) της μεταγραφής που εξαρτάται από τους ER. Ορισμένες χημικές ουσίες μπορούν να δρουν τόσο ως αγωνιστές όσο και ως ανταγωνιστές, ανάλογα με τον τύπο του εκάστοτε κυττάρου, και είναι γνωστές ως επιλεκτικοί ρυθμιστές των υποδοχέων οιστρογόνων (SERM). Πριν από την εξαγωγή συμπεράσματος περί μη δέσμευσής τους στον ER, οι χημικές ουσίες που είναι αρνητικές στις δοκιμασίες αυτές μπορούν να αξιολογούνται σε δοκιμασία δέσμευσης στον υποδοχέα. Επιπλέον, οι δοκιμασίες χρησιμεύουν στη διευκρίνιση της δράσης του γονικού μορίου μόνον εφόσον ληφθούν υπόψη οι περιορισμένες μεταβολικές ικανότητες των in vitro κυτταρικών συστημάτων. Δεδομένου ότι κατά την επικύρωση χρησιμοποιήθηκαν μόνο μεμονωμένες χημικές ουσίες, δεν έχει εξεταστεί η εφαρμοσιμότητα σε μείγματα δοκιμών. Η μέθοδος δοκιμών είναι πάντως θεωρητικά εφαρμόσιμη στον έλεγχο πολυσυστατικών ουσιών, UVCB και μειγμάτων. Πριν από τη χρήση της μεθόδου δοκιμών σε πολυσυστατική ουσία, UVCB ή μείγμα για την παραγωγή δεδομένων για συγκεκριμένο κανονιστικό σκοπό, θα πρέπει να εξετάζεται αν –και, εάν ναι, για ποιον λόγο– μπορεί να αποδώσει αποτελέσματα κατάλληλα για τον επιδιωκόμενο σκοπό. Τέτοια εξέταση δεν χρειάζεται όταν οι κανονιστικές ρυθμίσεις επιβάλλουν τον έλεγχο του μείγματος.
|
|
10.
|
Για λόγους πληροφόρησης, στον πίνακα 1 παρατίθενται τα αποτελέσματα δοκιμών αγωνιστών για τις 34 ουσίες που υποβλήθηκαν σε δοκιμή στο πλαίσιο αμφότερων των πλήρως επικυρωμένων μεθόδων δοκιμών αναφοράς που περιγράφονται στην παρούσα μέθοδο δοκιμών. Εξ αυτών των ουσιών, οι 26 είναι ταξινομημένες ως οριστικοί αγωνιστές ER και οι 8 ως αρνητικές με βάση δημοσιευμένες εργασίες, περιλαμβανομένων και in vitro δοκιμασιών για δέσμευση στους ER και για TA, και/ή της μητροτροφικής δοκιμασίας (2)(3)(18)(31)(32)(33)(34). Στον πίνακα 2 παρατίθενται τα αποτελέσματα δοκιμών ανταγωνιστών για τις 15 ουσίες που υποβλήθηκαν σε δοκιμή στο πλαίσιο αμφότερων των πλήρως επικυρωμένων μεθόδων δοκιμών αναφοράς που περιγράφονται στην παρούσα μέθοδο δοκιμών. Εξ αυτών των ουσιών, οι 4 είναι ταξινομημένες ως οριστικοί/θεωρούμενοι ανταγωνιστές ER και οι 10 ως αρνητικές με βάση δημοσιευμένες εργασίες, περιλαμβανομένων και in vitro δοκιμασιών για δέσμευση στους ER και για TA (2)(3)(18)(31). Όσον αφορά τα δεδομένα που παρουσιάζονται συνοπτικά στον πίνακα 1 και στον πίνακα 2, υπήρξε 100 % συμφωνία μεταξύ των δύο μεθόδων δοκιμών αναφοράς σχετικά με τις ταξινομήσεις όλων των ουσιών, με εξαίρεση μία ουσία (μιφεπριστόνη) για δοκιμασία ανταγωνιστών, και κάθε ουσία ταξινομήθηκε σωστά ως αγωνιστής/ανταγωνιστής ER ή ως αρνητική. Συμπληρωματικές πληροφορίες σχετικά με την εν λόγω ομάδα χημικών ουσιών καθώς και πρόσθετων χημικών ουσιών που υποβλήθηκαν σε δοκιμή με τις μεθόδους ER TA STTA και VM7Luc στη διάρκεια των μελετών επικύρωσης παρέχονται στα πρότυπα επιδόσεων για την ERTA (6)(7), προσάρτημα 2 (πίνακες 1, 2 και 3).
|
Πίνακας 1
Επισκόπηση των αποτελεσμάτων από τις δοκιμασίες STTA και ER TA VM7Luc για ουσίες που υποβλήθηκαν σε δοκιμή και στις δύο δοκιμασίες αγωνιστών και ταξινομήθηκαν ως αγωνιστές ER (ΘΕΤ.) ή αρνητικές (ΑΡΝ.)
|
|
Ουσία
|
CASRN
|
Δοκιμασία STTA (35)
|
Δοκιμασία ER TA VM7Luc (36)
|
Πηγή δεδομένων για ταξινόμηση (38)
|
|
Δράση ΤΑ ER
|
Τιμή PC10 (M)
|
Τιμή PC50
(2) (M)
|
Δράση ΤΑ ER
|
Τιμή EC50
(2), (37) (M)
|
Άλλες ER TA (34)
|
Δέσμευση στους ER
|
Μητροτροφική
|
|
1
|
17β-Οιστραδιόλη (1)
|
50-28-2
|
ΘΕΤ.
|
< 1,00 × 10-11
|
< 1,00 × 10-11
|
ΘΕΤ.
|
5,63 × 10-12
|
ΘΕΤ. (227/227)
|
ΘΕΤ.
|
ΘΕΤ.
|
|
2
|
17α-Οιστραδιόλη (1)
|
57-91-0
|
ΘΕΤ.
|
7,24 × 10-11
|
6,44 × 10-10
|
ΘΕΤ.
|
1,40 × 10-9
|
ΘΕΤ.(11/11)
|
ΘΕΤ.
|
ΘΕΤ.
|
|
3
|
17α-Αιθινυλοιστραδιόλη (1)
|
57-63-6
|
ΘΕΤ.
|
< 1,00 × 10-11
|
< 1,00 × 10-11
|
ΘΕΤ.
|
7,31 × 10-12
|
ΘΕΤ.(22/22)
|
ΘΕΤ.
|
ΘΕΤ.
|
|
4
|
17β-Τρενβολόνη
|
10161-33-8
|
ΘΕΤ.
|
1,78 × 10-8
|
2,73 × 10-7
|
ΘΕΤ.
|
4,20 × 10-8
|
ΘΕΤ. (2/2)
|
Δ/Ε
|
Δ/Ε
|
|
5
|
19-Νορτεστοστερόνη (1)
|
434-22-0
|
ΘΕΤ.
|
9,64 × 10-9
|
2,71 × 10-7
|
ΘΕΤ.
|
1,80 × 10-6
|
ΘΕΤ.(4/4)
|
ΘΕΤ.
|
ΘΕΤ.
|
|
6
|
4-Κουμυλοφαινόλη (1)
|
599-64-4
|
ΘΕΤ.
|
1,49 × 10-7
|
1,60 × 10-6
|
ΘΕΤ.
|
3,20 × 10-7
|
ΘΕΤ.(5/5)
|
ΘΕΤ.
|
Δ/Ε
|
|
7
|
4-tert-Οκτυλοφαινόλη (1)
|
140-66-9
|
ΘΕΤ.
|
1,85 × 10-9
|
7,37 × 10-8
|
ΘΕΤ.
|
3,19 × 10-8
|
ΘΕΤ.(21/24)
|
ΘΕΤ.
|
ΘΕΤ.
|
|
8
|
Απιγενίνη (1)
|
520-36-5
|
ΘΕΤ.
|
1,31 × 10-7
|
5,71 × 10-7
|
ΘΕΤ.
|
1,60 × 10-6
|
ΘΕΤ.(26/26)
|
ΘΕΤ.
|
Δ/Ε
|
|
9
|
Ατραζίνη (1)
|
1912-24-9
|
ΑΡΝ.
|
–
|
–
|
ΑΡΝ.
|
–
|
ΑΡΝ. (30/30)
|
ΑΡΝ.
|
Δ/Ε
|
|
10
|
Δισφαινόλη A (1)
|
80-05-7
|
ΘΕΤ.
|
2,02 × 10-8
|
2,94 × 10-7
|
ΘΕΤ.
|
5,33 × 10-7
|
ΘΕΤ. (65/65)
|
ΘΕΤ.
|
ΘΕΤ.
|
|
11
|
Δισφαινόλη B (1)
|
77-40-7
|
ΘΕΤ.
|
2,36 × 10-8
|
2,11 × 10-7
|
ΘΕΤ.
|
1,95 × 10-7
|
ΘΕΤ.(6/6)
|
ΘΕΤ.
|
ΘΕΤ.
|
|
12
|
Φθαλικό βουτύλιο βενζύλιο (1)
|
85-68-7
|
ΘΕΤ.
|
1,14 × 10-6
|
4,11 × 10-6
|
ΘΕΤ.
|
1,98 × 10-6
|
ΘΕΤ.(12/14)
|
ΘΕΤ.
|
ΑΡΝ.
|
|
13
|
Κορτικοστερόνη (1)
|
50-22-6
|
ΑΡΝ.
|
—
|
—
|
ΑΡΝ.
|
—
|
ΑΡΝ.(6/6)
|
ΑΡΝ.
|
Δ/Ε
|
|
14
|
Κουμεστρόλη (1)
|
479-13-0
|
ΘΕΤ.
|
1,23 × 10-9
|
2,00 × 10-8
|
ΘΕΤ.
|
1,32 × 10-7
|
ΘΕΤ.(30/30)
|
ΘΕΤ.
|
Δ/Ε
|
|
15
|
Δαϊδζεΐνη (1)
|
486-66-8
|
ΘΕΤ.
|
1,76 × 10-8
|
1,51 × 10-7
|
ΘΕΤ.
|
7,95 × 10-7
|
ΘΕΤ.(39/39)
|
ΘΕΤ.
|
ΘΕΤ.
|
|
16
|
Διαιθυλοστιλβεστρόλη (1)
|
56-53-1
|
ΘΕΤ.
|
< 1,00 × 10-11
|
2,04 × 10-11
|
ΘΕΤ.
|
3,34 × 10-11
|
ΘΕΤ.(42/42)
|
ΘΕΤ.
|
Δ/Ε
|
|
17
|
Φθαλικό δι-n-βουτύλιο
|
84-74-2
|
ΘΕΤ.
|
4,09 × 10-6
|
|
ΘΕΤ.
|
4,09 × 10-6
|
ΘΕΤ.(6/11)
|
ΘΕΤ.
|
ΑΡΝ.
|
|
18
|
4-Υδροξυβενζοϊκό αιθύλιο
|
120-47-8
|
ΘΕΤ.
|
5,00 × 10-6
|
(χωρίς PC50)
|
ΘΕΤ.
|
2,48 × 10-5
|
ΘΕΤ.
|
|
Δ/Ε
|
|
19
|
Οιστρόνη (1)
|
53-16-7
|
ΘΕΤ.
|
3,02 × 10-11
|
5,88 × 10-10
|
ΘΕΤ.
|
2,34 × 10-10
|
ΘΕΤ.(26/28)
|
ΘΕΤ.
|
ΘΕΤ.
|
|
20
|
Γενιστεΐνη (1)
|
446-72-0
|
ΘΕΤ.
|
2,24 × 10-9
|
2,45 × 10-8
|
ΘΕΤ.
|
2,71 × 10-7
|
ΘΕΤ.(100/102)
|
ΘΕΤ.
|
ΘΕΤ.
|
|
21
|
Αλοπεριδόλη
|
52-86-8
|
ΑΡΝ.
|
—
|
—
|
ΑΡΝ.
|
—
|
ΑΡΝ. (2/2)
|
ΑΡΝ.
|
Δ/Ε
|
|
22
|
Καμφερόλη (1)
|
520-18-3
|
ΘΕΤ.
|
1,36 × 10-7
|
1,21 × 10-6
|
ΘΕΤ.
|
3,99 × 10-6
|
ΘΕΤ.(23/23)
|
ΘΕΤ.
|
Δ/Ε
|
|
23
|
Κεπόνη (1)
|
143-50-0
|
ΘΕΤ.
|
7,11 × 10-7
|
7,68 × 10-6
|
ΘΕΤ.
|
4,91 × 10-7
|
ΘΕΤ.(14/18)
|
ΘΕΤ.
|
Δ/Ε
|
|
24
|
Κετοκοναζόλη
|
65277-42-1
|
ΑΡΝ.
|
—
|
—
|
ΑΡΝ.
|
—
|
ΑΡΝ. (2/2)
|
ΑΡΝ.
|
Δ/Ε
|
|
25
|
Λινουρόνη (1)
|
330-55-2
|
ΑΡΝ.
|
—
|
—
|
ΑΡΝ.
|
—
|
ΑΡΝ. (8/8)
|
ΑΡΝ.
|
Δ/Ε
|
|
26
|
meso-Εξεστρόλη (1)
|
84-16-2
|
ΘΕΤ.
|
< 1,00 × 10-11
|
2,75 × 10-11
|
ΘΕΤ.
|
1,65 × 10-11
|
ΘΕΤ.(4/4)
|
ΘΕΤ.
|
Δ/Ε
|
|
27
|
Μεθυλοτεστοστερόνη (1)
|
58-18-4
|
ΘΕΤ.
|
1,73 × 10-7
|
4,11 × 10-6
|
ΘΕΤ.
|
2,68 × 10-6
|
ΘΕΤ.(5/6)
|
ΘΕΤ.
|
Δ/Ε
|
|
28
|
Μορίνη
|
480-16-0
|
ΘΕΤ.
|
5,43 × 10-7
|
4,16 × 10-6
|
ΘΕΤ.
|
2,37 × 10-6
|
ΘΕΤ.(2/2)
|
ΘΕΤ.
|
Δ/Ε
|
|
29
|
Νορεθυνοδρέλη (1)
|
68-23-5
|
ΘΕΤ.
|
1,11 × 10-11
|
1,50 × 10-9
|
ΘΕΤ.
|
9,39 × 10-10
|
ΘΕΤ.(5/5)
|
ΘΕΤ.
|
Δ/Ε
|
|
30
|
p,p’-Methoxychlor (1)
|
72-43-5
|
ΘΕΤ.
|
1,23 × 10-6
|
(χωρίς PC50) (2)
|
ΘΕΤ.
|
1,92 × 10-6
|
ΘΕΤ.(24/27)
|
ΘΕΤ.
|
ΘΕΤ.
|
|
31
|
Φαινοβαρβιτάλη (1)
|
57-30-7
|
ΑΡΝ.
|
—
|
—
|
ΑΡΝ.
|
—
|
ΑΡΝ. (2/2)
|
ΑΡΝ.
|
Δ/Ε
|
|
32
|
Ρεσερπίνη
|
50-55-5
|
ΑΡΝ.
|
—
|
—
|
ΑΡΝ.
|
—
|
ΑΡΝ. (4/4)
|
ΑΡΝ.
|
Δ/Ε
|
|
33
|
Σπειρονολακτόνη (1)
|
52-01-7
|
ΑΡΝ.
|
—
|
—
|
ΑΡΝ.
|
—
|
ΑΡΝ. (4/4)
|
ΑΡΝ.
|
Δ/Ε
|
|
34
|
Τεστοστερόνη
|
58-22-0
|
ΘΕΤ.
|
2,82 × 10-8
|
9,78 × 10-6
|
ΘΕΤ.
|
1,75 × 10-5
|
ΘΕΤ.(5/10)
|
ΘΕΤ.
|
Δ/Ε
|
|
Συντμήσεις: CASRN = αριθμός μητρώου της υπηρεσίας Chemical Abstracts Service, M = γραμμομοριακή, EC50 = ήμισυ της μέγιστης αποτελεσματικής συγκέντρωσης της υπό δοκιμή χημικής ουσίας, ΑΡΝ. = αρνητική, ΘΕΤ. = θετική, Δ/Ε = δεν ελέγχθηκε, PC10 (και PC50) = η συγκέντρωση υπό δοκιμή ουσίας στην οποία η απόκριση είναι το 10 % (ή το 50 % για την PC50) της απόκρισης που επάγεται από τον θετικό μάρτυρα (E2, 1 nm) σε κάθε τρυβλίο.
|
Πίνακας 2
Σύγκριση των αποτελεσμάτων από τις δοκιμασίες STTA και ER TA VM7Luc για ουσίες που υποβλήθηκαν σε δοκιμή και στις δύο δοκιμασίες ανταγωνιστών και ταξινομήθηκαν ως ανταγωνιστές ER (ΘΕΤ.) ή αρνητικές (ΑΡΝ.)
|
|
Ουσία (3)
|
CASRN
|
Δοκιμασία STTA ER (39)
|
Δοκιμασία ER ΤΑ VM7Luc (40)
|
Πιθανές επιδράσεις STTA ER (42)
|
Συναινετική ταξινόμηση (43) ICCVAM
|
MeSH (44) Χημική κατηγορία
|
Κατηγορία προϊόντος (45)
|
|
Δράση ΤΑ ER
|
Τιμή IC50
(4) (M)
|
Δράση ΤΑ ER
|
Τιμή IC50
(4), (41) (M)
|
|
1
|
4-Υδροξυταμοξιφαίνη
|
68047-06-3
|
ΘΕΤ.
|
3,97 × 10-9
|
ΘΕΤ.
|
2,08 × 10-7
|
μέτρια ΘΕΤ.
|
ΘΕΤ.
|
Υδρογονάνθρακας (κυκλικός)
|
Φαρμακευτικό προϊόν
|
|
2
|
Διβενζο[a.h]ανθρακένιο
|
53-70-3
|
ΘΕΤ.
|
Χωρίς IC50
|
ΘΕΤ.
|
Χωρίς IC50
|
ΘΕΤ.
|
Θ/ΘΕΤ.
|
Πολυκυκλική ένωση
|
Εργαστηριακή χημική ουσία, φυσικό προϊόν
|
|
3
|
Μιφεπριστόνη
|
84371-65-3
|
ΘΕΤ.
|
5,61 × 10-6
|
ΑΡΝ.
|
—
|
ήπια ΘΕΤ.
|
ΑΡΝ.
|
Στεροειδές
|
Φαρμακευτικό προϊόν
|
|
4
|
Υδροχλωρική ραλοξιφαίνη
|
82640-04-8
|
ΘΕΤ.
|
7,86 × 10-10
|
ΘΕΤ.
|
1,19 × 10-9
|
μέτρια ΘΕΤ.
|
ΘΕΤ.
|
Υδρογονάνθρακας (κυκλικός)
|
Φαρμακευτικό προϊόν
|
|
5
|
Ταμοξιφαίνη
|
10540-29-1
|
ΘΕΤ.
|
4,91 × 10-7
|
ΘΕΤ.
|
8,17 × 10-7
|
ΘΕΤ.
|
ΘΕΤ.
|
Υδρογονάνθρακας (κυκλικός)
|
Φαρμακευτικό προϊόν
|
|
6
|
17β-Οιστραδιόλη
|
50-28-2
|
ΑΡΝ.
|
—
|
ΑΡΝ.
|
—
|
Θ/ΑΡΝ.
|
Θ/ΑΡΝ.
|
Στεροειδές
|
Φαρμακευτικό προϊόν, κτηνιατρικός παράγοντας
|
|
7
|
Απιγενίνη
|
520-36-5
|
ΑΡΝ.
|
—
|
ΑΡΝ.
|
—
|
ΑΡΝ.
|
ΑΡΝ.
|
Ετεροκυκλική ένωση
|
Χρωστική, φυσικό προϊόν, ενδιάμεση φαρμακευτική ουσία,
|
|
8
|
Ατραζίνη
|
1912-24-9
|
ΑΡΝ.
|
—
|
ΑΡΝ.
|
—
|
ΑΡΝ.
|
Θ/ΑΡΝ.
|
Ετεροκυκλική ένωση
|
Ζιζανιοκτόνο
|
|
9
|
Φθαλικό δι-n-βουτύλιο
|
84-74-2
|
ΑΡΝ.
|
—
|
ΑΡΝ.
|
—
|
ΑΡΝ.
|
ΑΡΝ.
|
Εστέρας, φθαλικό οξύ
|
Συστατικό καλλυντικών, βιομηχανική χημική ουσία, πλαστικοποιητής
|
|
10
|
Φεναριμόλη
|
60168-88-9
|
ΑΡΝ.
|
—
|
ΑΡΝ.
|
—
|
δεν ελέγχθηκε
|
Δ/Ε
|
Ετεροκυκλική ένωση, πυριμιδίνη
|
Μυκητοκτόνο
|
|
11
|
Φλαβόνη
|
525-82-6
|
ΑΡΝ.
|
—
|
ΑΡΝ.
|
—
|
Θ/ΑΡΝ.
|
Θ/ΑΡΝ.
|
Φλαβονοειδές, ετεροκυκλική ένωση
|
Φυσικό προϊόν, φαρμακευτικό προϊόν
|
|
12
|
Φλουταμίδη
|
13311-84-7
|
ΑΡΝ.
|
—
|
ΑΡΝ.
|
—
|
ΑΡΝ.
|
Θ/ΑΡΝ.
|
Αμίδιο
|
Φαρμακευτικό προϊόν, κτηνιατρικός παράγοντας
|
|
13
|
Γενιστεΐνη
|
446-72-0
|
ΑΡΝ.
|
—
|
ΑΡΝ.
|
—
|
Θ/ΑΡΝ.
|
ΑΡΝ.
|
Φλαβονοειδές, ετεροκυκλική ένωση
|
Φυσικό προϊόν, φαρμακευτικό προϊόν
|
|
14
|
p-n-Εννεϋλοφαινόλη
|
104-40-5
|
ΑΡΝ.
|
—
|
ΑΡΝ.
|
—
|
δεν ελέγχθηκε
|
ΑΡΝ.
|
Φαινόλη
|
Ενδιάμεση χημική ουσία
|
|
15
|
Ρεσβερατρόλη
|
501-36-0
|
ΑΡΝ.
|
—
|
ΑΡΝ.
|
—
|
Θ/ΑΡΝ.
|
ΑΡΝ.
|
Υδρογονάνθρακας (κυκλικός)
|
Φυσικό προϊόν
|
|
Συντμήσεις: CASRN = αριθμός μητρώου της υπηρεσίας Chemical Abstracts Service, M = γραμμομοριακή, IC50 = το ήμισυ της μέγιστης ανασταλτικής συγκέντρωσης της υπό δοκιμή χημικής ουσίας, ΑΡΝ. = αρνητική, Θ/ΑΡΝ.= θεωρούμενη αρνητική, ΘΕΤ. = θετική, Θ/ΘΕΤ. = θεωρούμενη θετική.
|
ΣΤΟΙΧΕΙΑ ΤΗΣ ΔΟΚΙΜΑΣΙΑΣ ER TA
Βασικά στοιχεία της δοκιμασίας
|
11.
|
Η παρούσα μέθοδος δοκιμών εφαρμόζεται σε δοκιμασίες που χρησιμοποιούν σταθερώς διαμολυνθέντα ή ενδογενή υποδοχέα ERα και σταθερώς διαμολυνθέν κατασκεύασμα γονιδίου αναφοράς υπό τον έλεγχο ενός ή περισσότερων στοιχείων απόκρισης σε οιστρογόνα· ενδέχεται ωστόσο να υπάρχουν και άλλοι υποδοχείς, όπως ο ERβ. Πρόκειται για βασικά στοιχεία της δοκιμασίας.
|
Μάρτυρες
|
12.
|
Θα πρέπει να περιγράφεται η βάση των προτεινόμενων παράλληλων προτύπων αναφοράς για καθεμία από τις δοκιμασίες αγωνιστών και ανταγωνιστών. Οι παράλληλοι μάρτυρες (αρνητικός, διαλύτης και θετικός), ανάλογα με την περίπτωση, χρησιμεύουν ως ένδειξη της λειτουργικότητας της δοκιμασίας υπό τις συνθήκες δοκιμής και παρέχουν μια βάση για συγκρίσεις μεταξύ πειραμάτων· αποτελούν συνήθως μέρος των κριτηρίων αποδοχής για συγκεκριμένο πείραμα (1).
|
Τυπικές διαδικασίες ποιοτικού ελέγχου
|
13.
|
Οι τυπικές διαδικασίες ποιοτικού ελέγχου θα πρέπει να διεκπεραιώνονται σύμφωνα με τα οριζόμενα για κάθε δοκιμασία προκειμένου να διασφαλίζεται ότι η κυτταρική σειρά παραμένει σταθερή κατόπιν πολλαπλών ανακαλλιεργειών, ελεύθερη μυκοπλάσματος (δηλ. ελεύθερη βακτηριακής μόλυνσης), και διατηρεί την ικανότητα να παρέχει τις αναμενόμενες διαμεσολαβούμενες από τους ER αποκρίσεις με την πάροδο του χρόνου. Οι κυτταρικές σειρές θα πρέπει να ελέγχονται περαιτέρω ως προς την ορθότητα της ταυτότητάς τους καθώς και για άλλους παράγοντες μόλυνσης (π.χ. μύκητες, ζυμομύκητες και ιούς).
|
Απόδειξη της τεχνικής ικανότητας του εργαστηρίου
|
14.
|
Πριν από τη διεξαγωγή δοκιμών με άγνωστες χημικές ουσίες με οποιαδήποτε εκ των δοκιμασιών στο πλαίσιο της παρούσας μεθόδου, κάθε εργαστήριο θα πρέπει να αποδεικνύει την τεχνική ικανότητά του ως προς τη χρήση της δοκιμασίας. Για να αποδείξει την τεχνική ικανότητά του, κάθε εργαστήριο θα πρέπει να υποβάλλει σε δοκιμή τις 14 ουσίες ελέγχου ικανότητας που απαριθμούνται στον πίνακα 3 για τη δοκιμασία αγωνιστών και τις 10 ουσίες ελέγχου ικανότητας του πίνακα 4 για τη δοκιμασία ανταγωνιστών. Οι εν λόγω δοκιμές ελέγχου τεχνικής ικανότητας θα επιβεβαιώνουν επίσης τη δυνατότητα απόκρισης του συστήματος δοκιμών. Ο κατάλογος ουσιών ελέγχου ικανότητας είναι ένα υποσύνολο των ουσιών αναφοράς που περιλαμβάνονται στα πρότυπα επιδόσεων για τις δοκιμασίες ER TA (6). Οι εν λόγω ουσίες είναι διαθέσιμες στο εμπόριο, αντιπροσωπεύουν τις κατηγορίες χημικών ουσιών που συνδέονται συνήθως με δράση αγωνιστή ή ανταγωνιστή ER, παρουσιάζουν το κατάλληλο φάσμα ισχύος που αναμένεται για τους αγωνιστές/ανταγωνιστές ER (δηλ. ισχυρές έως ασθενείς) και περιλαμβάνουν αρνητικές ουσίες. Οι δοκιμές των ουσιών ελέγχου ικανότητας θα πρέπει να επαναλαμβάνονται τουλάχιστον δύο φορές, σε διαφορετικές ημέρες. Η τεχνική ικανότητα αποδεικνύεται μέσω της ορθής ταξινόμησης (θετική/αρνητική) κάθε ουσίας ελέγχου ικανότητας. Οι δοκιμές ελέγχου ικανότητας θα πρέπει να επαναλαμβάνονται από κάθε τεχνικό κατά την εκμάθηση των δοκιμασιών. Ανάλογα με τον τύπο κυττάρων, ορισμένες από τις εν λόγω ουσίες ελέγχου τεχνικής ικανότητας μπορεί να συμπεριφέρονται ως SERM και να δρουν τόσο ως αγωνιστές όσο και ως ανταγωνιστές. Ωστόσο, οι ουσίες ελέγχου ικανότητας ταξινομούνται στους πίνακες 3 και 4 βάσει της γνωστής κύριας δράσης τους, η οποία και θα πρέπει να χρησιμοποιείται για την αξιολόγηση της τεχνικής ικανότητας.
|
|
15.
|
Για να αποδείξει τις επιδόσεις του και για λόγους ποιοτικού ελέγχου, κάθε εργαστήριο θα πρέπει να δημιουργεί βάσεις ιστορικών δεδομένων για τους αγωνιστές και τους ανταγωνιστές με δεδομένα προτύπου αναφοράς (π.χ. 17β-οιστραδιόλη και ταμοξιφαίνη), χημικών ουσιών θετικού και αρνητικού μάρτυρα και μάρτυρα διαλύτη (π.χ. DMSO). Αρχικά, η βάση δεδομένων θα πρέπει να δημιουργείται από τουλάχιστον 10 ανεξάρτητες σειρές δοκιμών αγωνιστών (π.χ. 17β-οιστραδιόλη) και 10 ανεξάρτητες σειρές δοκιμών ανταγωνιστών (π.χ. ταμοξιφαίνη). Η βάση δεδομένων θα πρέπει να διευρύνεται με την προσθήκη των αποτελεσμάτων μελλοντικών αναλύσεων των εν λόγω προτύπων αναφοράς και μαρτύρων διαλύτη προκειμένου το εργαστήριο να διασφαλίζει τη διαχρονική συνοχή και τις επιδόσεις της βιοδοκιμασίας.
|
Πίνακας 3
Κατάλογος (14) ουσιών ελέγχου ικανότητας για δοκιμασία αγωνιστών (53)
|
Αριθ. (52)
|
Ουσία
|
CASRN
|
Αναμενόμενη απόκριση (46)
|
Δοκιμασία STTA
|
Δοκιμασία ER TA VM7Luc
|
Χημική κατηγορία MeSH (50)
|
Κατηγορία προϊόντος (51)
|
|
Τιμή PC10 (M) (47)
|
Τιμή PC50 (M) (47)
|
Περιοχή συγκεντρώσεων δοκιμής (M)
|
Τιμή VM7Luc EC50 (M) (48)
|
Υψηλότερη συγκέντρωση για τη δοκιμή προσδιορισμού εύρους (M) (49)
|
|
14
|
Διαιθυλοστιλβεστρόλη
|
56-53-1
|
ΘΕΤ.
|
< 1,00 × 10-11
|
2,04 × 10-11
|
10-14 – 10-8
|
3,34 × 10-11
|
3,73 × 10-4
|
Υδρογονάνθρακας (κυκλικός)
|
Φαρμακευτικό προϊόν, κτηνιατρικός παράγοντας
|
|
12
|
17α-Οιστραδιόλη
|
57-91-0
|
ΘΕΤ.
|
4,27 × 10-11
|
6,44 × 10-10
|
10-11 – 10-5
|
1,40 × 10-9
|
3,67 × 10-3
|
Στεροειδές
|
Φαρμακευτικό προϊόν, κτηνιατρικός παράγοντας
|
|
15
|
meso-Εξεστρόλη
|
84-16-2
|
ΘΕΤ.
|
< 1,00 × 10-11
|
2,75 × 10-11
|
10-11 – 10-5
|
1,65 × 10-11
|
3,70 × 10-3
|
Υδρογονάνθρακας (κυκλικός), φαινόλη
|
Φαρμακευτικό προϊόν, κτηνιατρικός παράγοντας
|
|
11
|
4-tert-Οκτυλοφαινόλη
|
140-66-9
|
ΘΕΤ.
|
1,85 × 10-9
|
7,37 × 10-8
|
10-11 – 10-5
|
3,19 × 10-8
|
4,85 × 10-3
|
Φαινόλη
|
Ενδιάμεση χημική ουσία
|
|
9
|
Γενιστεΐνη
|
446-72-0
|
ΘΕΤ.
|
2,24 × 10-9
|
2,45 × 10-8
|
10-11 – 10-5
|
2,71 × 10-7
|
3,70 × 10-4
|
Φλαβονοειδές, ετεροκυκλική ένωση
|
Φυσικό προϊόν, φαρμακευτικό προϊόν
|
|
6
|
Δισφαινόλη Α
|
80-05-7
|
ΘΕΤ.
|
2,02 × 10-8
|
2,94 × 10-7
|
10-11 – 10-5
|
5,33 × 10-7
|
4,38 × 10-3
|
Φαινόλη
|
Ενδιάμεση χημική ουσία
|
|
2
|
Καμφερόλη
|
520-18-3
|
ΘΕΤ.
|
1,36 × 10-7
|
1,21 × 10-6
|
10-11 – 10-5
|
3,99 × 10-6
|
3,49 × 10-3
|
Φλαβονοειδές, ετεροκυκλική ένωση
|
Φυσικό προϊόν
|
|
3
|
Φθαλικό βενζύλιο βουτύλιο
|
85-68-7
|
ΘΕΤ.
|
1,14 × 10-6
|
4,11 × 10-6
|
10-11 – 10-5
|
1,98 × 10-6
|
3,20 × 10-4
|
Καρβοξυλικό οξύ, εστέρας, φθαλικό οξύ
|
Πλαστικοποιητής, βιομηχανική χημική ουσία
|
|
4
|
p,p'-Methoxychlor
|
72-43-5
|
ΘΕΤ.
|
1,23 × 10-6
|
—
|
10-11 – 10-5
|
1,92 × 10-6
|
2,89 × 10-3
|
Υδρογονάνθρακας (αλογονωμένος)
|
Φυτοφάρμακο, κτηνιατρικός παράγοντας
|
|
1
|
4-Υδροξυβενζοϊκό αιθύλιο
|
120-47-8
|
ΘΕΤ.
|
5,00 × 10-6
|
—
|
10-11 – 10-5
|
2,48 × 10-5
|
6,02 × 10-3
|
Καρβοξυλικό οξύ, φαινόλη
|
Φαρμακευτικό προϊόν, συντηρητικό
|
|
17
|
Ατραζίνη
|
1912-24-9
|
ΑΡΝ.
|
—
|
—
|
10-10 – 10-4
|
—
|
4,64 × 10-4
|
Ετεροκυκλική ένωση
|
Ζιζανιοκτόνο
|
|
20
|
Σπειρονολακτόνη
|
52-01-7
|
ΑΡΝ.
|
—
|
—
|
10-11 – 10-5
|
—
|
2,40 × 10-3
|
Λακτόνη, στεροειδές
|
Φαρμακευτικό προϊόν
|
|
21
|
Κετοκοναζόλη
|
65277-42-1
|
ΑΡΝ.
|
—
|
—
|
10-11 – 10-5
|
—
|
9,41 × 10-5
|
Ετεροκυκλική ένωση
|
Φαρμακευτικό προϊόν
|
|
22
|
Ρεσερπίνη
|
50-55-5
|
ΑΡΝ.
|
—
|
—
|
10-11 – 10-5
|
—
|
1,64 × 10-3
|
Ετεροκυκλική ένωση, ινδόλη
|
Φαρμακευτικό προϊόν, κτηνιατρικός παράγοντας
|
|
Συντμήσεις: CASRN = αριθμός μητρώου της υπηρεσίας Chemical Abstracts Service, EC50 = ήμισυ της μέγιστης αποτελεσματικής συγκέντρωσης της υπό δοκιμή χημικής ουσίας, ΑΡΝ. = αρνητική, ΘΕΤ. = θετική, PC10 (και PC50) = η συγκέντρωση υπό δοκιμή ουσίας στην οποία η απόκριση είναι το 10 % (ή το 50 % για την PC50) της απόκρισης που επάγεται από τον θετικό μάρτυρα (E2, 1 nm) σε κάθε τρυβλίο.
|
Πίνακας 4
Κατάλογος (10) ουσιών ελέγχου ικανότητας για δοκιμασία ανταγωνιστών
|
|
Ουσία (5)
|
CASRN
|
Δοκιμασία STTA ER (54)
|
Δοκιμασία ER ΤΑ VM7Luc (55)
|
Πιθανές επιδράσεις STTA ER (54)
|
Ταξινόμηση (58) συναίνεσης ICCVAM
|
MeSH (59) Χημική κατηγορία
|
Κατηγορία προϊόντος (60)
|
|
Δράση ΤΑ ER
|
IC50 (M)
|
Περιοχή συγκεντρώσεων δοκιμής (M)
|
Δράση ΤΑ ER
|
IC50
(56) (M)
|
Υψηλότερη συγκέντρωση για τη δοκιμή προσδιορισμού εύρους (M) (57)
|
|
1
|
4-Υδροξυταμοξιφαίνη
|
68047-06-3
|
ΘΕΤ.
|
3,97 × 10-9
|
10-12 – 10-7
|
ΘΕΤ.
|
2,08 × 10-7
|
2,58 × 10-4
|
μέτρια ΘΕΤ.
|
ΘΕΤ.
|
Υδρογονάνθρακας (κυκλικός)
|
Φαρμακευτικό προϊόν
|
|
2
|
Υδροχλωρική ραλοξιφαίνη
|
82640-04-8
|
ΘΕΤ.
|
7,86 × 10-10
|
10-12 – 10-7
|
ΘΕΤ.
|
1,19 × 10-9
|
1,96 × 10-4
|
μέτρια ΘΕΤ.
|
ΘΕΤ.
|
Υδρογονάνθρακας (κυκλικός)
|
Φαρμακευτικό προϊόν
|
|
3
|
Ταμοξιφαίνη
|
10540-29-1
|
ΘΕΤ.
|
4,91 × 10-7
|
10-10 – 10-5
|
ΘΕΤ.
|
8,17 × 10-7
|
2,69 × 10-4
|
ΘΕΤ.
|
ΘΕΤ.
|
Υδρογονάνθρακας (κυκλικός)
|
Φαρμακευτικό προϊόν
|
|
4
|
17β-Οιστραδιόλη
|
50-28-2
|
ΑΡΝ.
|
—
|
10-9 – 10-4
|
ΑΡΝ.
|
—
|
3,67 × 10-3
|
να είναι αρνητική (*4)
|
Θ/ΑΡΝ.
|
Στεροειδές
|
Φαρμακευτικό προϊόν, κτηνιατρικός παράγοντας
|
|
5
|
Απιγενίνη
|
520-36-5
|
ΑΡΝ.
|
—
|
10-9 – 10-4
|
ΑΡΝ.
|
—
|
3,70 × 10-4
|
ΑΡΝ.
|
ΑΡΝ.
|
Ετεροκυκλική ένωση
|
Χρωστική, φυσικό προϊόν, ενδιάμεση φαρμακευτική ουσία,
|
|
6
|
Φθαλικό δι-n-βουτύλιο
|
84-74-2
|
ΑΡΝ.
|
—
|
10-8 – 10-3
|
ΑΡΝ.
|
—
|
3,59 × 10-3
|
ΑΡΝ.
|
ΑΡΝ.
|
Εστέρας, φθαλικό οξύ
|
Συστατικό καλλυντικών, βιομηχανική χημική ουσία, πλαστικοποιητής
|
|
7
|
Φλαβόνη
|
525-82-6
|
ΑΡΝ.
|
—
|
10-8 – 10-3
|
ΑΡΝ.
|
—
|
4,50 × 10-4
|
να είναι αρνητική (*4)
|
Θ/ΑΡΝ.
|
Φλαβονοειδές, ετεροκυκλική ένωση
|
Φυσικό προϊόν, φαρμακευτικό προϊόν
|
|
8
|
Γενιστεΐνη
|
446-72-0
|
ΑΡΝ.
|
—
|
10-9 – 10-4
|
ΑΡΝ.
|
—
|
3,70 × 10-4
|
να είναι αρνητική (*4)
|
ΑΡΝ.
|
Φλαβονοειδές, ετεροκυκλική ένωση
|
Φυσικό προϊόν, φαρμακευτικό προϊόν
|
|
9
|
p-n-Εννεϋλοφαινόλη
|
104-40-5
|
ΑΡΝ.
|
—
|
10-9 – 10-4
|
ΑΡΝ.
|
—
|
4,54 × 10-4
|
δεν ελέγχθηκε
|
ΑΡΝ.
|
Φαινόλη
|
Ενδιάμεση χημική ουσία
|
|
10
|
Ρεσβερατρόλη
|
501-36-0
|
ΑΡΝ.
|
—
|
10-8 – 10-3
|
ΑΡΝ.
|
—
|
4,38 × 10-4
|
να είναι αρνητική (*4)
|
ΑΡΝ.
|
Υδρογονάνθρακας (κυκλικός)
|
Φυσικό προϊόν
|
|
Συντμήσεις: CASRN = αριθμός μητρώου της υπηρεσίας Chemical Abstracts Service, M = γραμμομοριακή, IC50 = το ήμισυ της μέγιστης ανασταλτικής συγκέντρωσης της υπό δοκιμή χημικής ουσίας, ΑΡΝ. = αρνητική, Θ/ΑΡΝ.= θεωρούμενη αρνητική, ΘΕΤ. = θετική.
|
Κριτήρια αποδοχής σειρών δοκιμών
|
16.
|
Η αποδοχή ή η απόρριψη μιας σειράς δοκιμών βασίζεται στην αξιολόγηση των αποτελεσμάτων που λαμβάνονται για τα πρότυπα αναφοράς και τους μάρτυρες που χρησιμοποιήθηκαν για κάθε πείραμα. Οι τιμές των PC50 (EC50) ή IC50 για τα πρότυπα αναφοράς θα πρέπει να πληρούν τα κριτήρια αποδοχής, όπως καθορίζονται για την επιλεγμένη δοκιμασία (για την STTA βλ. προσάρτημα 2, για την ER TA VM7Luc βλ. προσάρτημα 3), και όλοι οι θετικοί/αρνητικοί μάρτυρες θα πρέπει να είναι σωστά ταξινομημένοι για κάθε αποδεκτό πείραμα. Η ικανότητα συνεπούς διεξαγωγής της δοκιμασίας θα πρέπει να αποδεικνύεται μέσω της ανάπτυξης και διατήρησης βάσης ιστορικών δεδομένων για τα πρότυπα αναφοράς και τους μάρτυρες (βλ. παράγραφο 15). Ως μέτρο της εντός του εργαστηρίου αναπαραγωγιμότητας μπορούν να χρησιμοποιηθούν οι τυπικές αποκλίσεις ή οι συντελεστές μεταβλητότητας για τους μέσους όρους των παραμέτρων προσαρμογής των καμπυλών προτύπων αναφοράς από πολλαπλά πειράματα. Επιπλέον, αναφορικά με τα κριτήρια αποδοχής, θα πρέπει να διασφαλίζεται η συμμόρφωση με τις ακόλουθες αρχές:
|
—
|
Τα δεδομένα θα πρέπει να είναι επαρκή για την ποσοτική αξιολόγηση της ενεργοποίησης ER (για τη δοκιμασία αγωνιστών) ή της καταστολής ER (για τη δοκιμασία ανταγωνιστών) (δηλ. δραστικότητα και ισχύς).
|
|
—
|
Η μέση δραστηριότητα των γονιδίων αναφοράς για τη συγκέντρωση αναφοράς του οιστρογόνου αναφοράς θα πρέπει να αντιστοιχεί τουλάχιστον στην ελάχιστη δραστηριότητα που καθορίζεται στη δοκιμασία σε σχέση με αυτήν του μάρτυρα (διαλύτη) φορέα προκειμένου να διασφαλίζεται επαρκής ευαισθησία. Για τις δοκιμασίες ER TA STTA και VM7Luc, πρόκειται για το τετραπλάσιο της δραστηριότητας του μέσου μάρτυρα φορέα σε κάθε τρυβλίο.
|
|
—
|
Οι συγκεντρώσεις που ελέγχονται θα πρέπει να παραμένουν εντός του φάσματος διαλυτότητας των υπό δοκιμή χημικών ουσιών και να μην εμφανίζουν κυτταροτοξικότητα.
|
|
Ανάλυση των δεδομένων
|
17.
|
Για την ταξινόμηση θετικής ή αρνητικής απόκρισης, θα πρέπει να χρησιμοποιείται η καθορισμένη για κάθε δοκιμασία διαδικασία ερμηνείας.
|
|
18.
|
Η συμμόρφωση με τα κριτήρια αποδοχής (παράγραφος 16) υποδεικνύει ότι η δοκιμασία λειτουργεί σωστά, αλλά δεν διασφαλίζει ότι οποιαδήποτε συγκεκριμένη σειρά δοκιμών θα παράξει ορθά δεδομένα. Η επανάληψη των αποτελεσμάτων της πρώτης σειράς δοκιμών αποτελεί την καλύτερη ένδειξη ότι παρήχθησαν ορθά δεδομένα. Εάν παραχθούν αναπαραγώγιμα αποτελέσματα από δύο σειρές δοκιμών (π.χ. και οι δύο σειρές δοκιμών υποδεικνύουν ως θετική μια υπό δοκιμή χημική ουσία), δεν είναι απαραίτητο να διεξαχθεί τρίτη σειρά δοκιμών.
|
|
19.
|
Εάν από δύο σειρές δοκιμών δεν παραχθούν αναπαραγώγιμα αποτελέσματα (π.χ. μια υπό δοκιμή χημική ουσία είναι θετική σε μια σειρά δοκιμών και αρνητική στην άλλη σειρά δοκιμών), ή εάν απαιτείται υψηλότερος βαθμός βεβαιότητας όσον αφορά το αποτέλεσμα της παρούσας δοκιμασίας, θα πρέπει να διεξάγονται τουλάχιστον τρεις ανεξάρτητες σειρές δοκιμών. Σε αυτή την περίπτωση, η ταξινόμηση βασίζεται στα δύο από τα τρία αποτελέσματα που συμφωνούν μεταξύ τους.
|
Γενικά κριτήρια ερμηνείας των δεδομένων
|
20.
|
Επί του παρόντος δεν υφίσταται καθολικά αποδεκτή μέθοδος ερμηνείας των δεδομένων ER TA. Εντούτοις, η ποιοτική (π.χ. θετική/αρνητική) και/ή η ποσοτική (π.χ. EC50, PC50, IC50) αξιολόγηση της διαμεσολαβούμενης από τους ER δραστηριότητας θα πρέπει να βασίζεται σε εμπειρικά δεδομένα και ορθή επιστημονική κρίση. Ει δυνατόν, τα θετικά αποτελέσματα θα πρέπει να συνοδεύονται από περιγραφή τόσο του μεγέθους της επίδρασης σε σύγκριση με τον μάρτυρα φορέα (διαλύτη) ή το οιστρογόνο αναφοράς όσο και της συγκέντρωσης στην οποία εκδηλώνεται η επίδραση (π.χ. EC50, PC50, RPCmax, IC50 κ.λπ.).
|
Έκθεση δοκιμής
|
21.
|
Η έκθεση δοκιμής θα πρέπει να περιλαμβάνει τα ακόλουθα στοιχεία:
|
|
Δοκιμασία:
|
—
|
χρησιμοποιηθείσα δοκιμασία,
|
|
—
|
μάρτυρας/πρότυπο αναφοράς/υπό δοκιμή χημική ουσία,
|
|
—
|
πηγή, αριθμός παρτίδας, καταληκτική ημερομηνία χρήσης, εφόσον υπάρχει,
|
|
—
|
σταθερότητα της υπό δοκιμή χημικής ουσίας, εάν είναι γνωστή,
|
|
—
|
διαλυτότητα και σταθερότητα της υπό δοκιμή χημικής ουσίας στον διαλύτη, εάν είναι γνωστές,
|
|
—
|
μέτρηση του pH, της ωσμωμοριακότητας και του ιζήματος του θρεπτικού μέσου καλλιέργειας στο οποίο προστέθηκε η υπό δοκιμή χημική ουσία, κατά περίπτωση.
|
|
|
|
Μονοσυστατική ουσία:
|
—
|
φυσική εμφάνιση, υδατοδιαλυτότητα και πρόσθετες σχετικές φυσικοχημικές ιδιότητες,
|
|
—
|
ταυτοποίηση της χημικής ουσίας, όπως ονομασία IUPAC ή CAS, αριθμός CAS, κωδικός SMILES ή InChI, συντακτικός τύπος, καθαρότητα, χημική ταυτότητα προσμίξεων, κατά περίπτωση και στο μέτρο του δυνατού, κ.λπ.,
|
|
|
|
Πολυσυστατική ουσία, UVCB και μείγματα:
|
—
|
περιγράφονται, στο μέτρο του δυνατού, με τη χημική ταυτότητα των συστατικών (βλ. ανωτέρω), την ποσότητα στην οποία απαντούν και τις σχετικές φυσικοχημικές τους ιδιότητες.
|
|
|
|
Διαλύτης/φορέας:
|
—
|
χαρακτηρισμός (φύση, προμηθευτής και παρτίδα),
|
|
—
|
αιτιολόγηση της επιλογής του διαλύτη/φορέα,
|
|
—
|
διαλυτότητα και σταθερότητα της υπό δοκιμή χημικής ουσίας στον διαλύτη/φορέα, εάν είναι γνωστές,
|
|
|
|
Κύτταρα:
|
—
|
τύπος και προέλευση των κυττάρων:
|
—
|
εκφράζεται ο ER ενδογενώς; Εάν όχι, ποιος ή ποιοι υποδοχείς διαμολύνθηκαν;
|
|
—
|
κατασκευάσματα γονιδίων αναφοράς που χρησιμοποιήθηκαν (περιλαμβανομένων των ειδών προέλευσης),
|
|
—
|
μέθοδος επιλογής για τη διατήρηση της σταθερής διαμόλυνσης (κατά περίπτωση),
|
|
—
|
είναι η μέθοδος διαμόλυνσης κατάλληλη για σταθερές σειρές;
|
|
|
—
|
αριθμός ανακαλλιεργειών των κυττάρων (από την απόψυξη),
|
|
—
|
αριθμός ανακαλλιεργειών των κυττάρων κατά την απόψυξη,
|
|
—
|
μέθοδοι διατήρησης των κυτταροκαλλιεργειών.
|
|
|
|
Συνθήκες δοκιμής:
|
—
|
περιορισμοί διαλυτότητας,
|
|
—
|
περιγραφή των μεθόδων αξιολόγησης της βιωσιμότητας που εφαρμόστηκαν,
|
|
—
|
σύνθεση των θρεπτικών μέσων, συγκέντρωση CO2,
|
|
—
|
συγκεντρώσεις της υπό δοκιμή χημικής ουσίας,
|
|
—
|
όγκος του φορέα και της υπό δοκιμή χημικής ουσίας που προστέθηκε,
|
|
—
|
θερμοκρασία και υγρασία επώασης,
|
|
—
|
πυκνότητα των κυττάρων κατά την έναρξη και κατά τη διάρκεια της αγωγής,
|
|
—
|
θετικά και αρνητικά πρότυπα αναφοράς,
|
|
—
|
αντιδραστήρια γονιδίων αναφοράς (όνομα προϊόντος, προμηθευτής και παρτίδα),
|
|
—
|
κριτήρια χαρακτηρισμού των σειρών δοκιμής ως θετικών, αρνητικών ή αμφίβολων.
|
|
|
|
Έλεγχος αποδοχής:
|
—
|
συντελεστές διαφοράς στην επαγωγή για κάθε τρυβλίο δοκιμασίας και κατά πόσο πληρούν τις ελάχιστες απαιτήσεις στο πλαίσιο της δοκιμασίας με βάση τους ιστορικούς μάρτυρες,
|
|
—
|
πραγματικές τιμές για τα κριτήρια αποδοχής, π.χ. log10EC50, log10PC50, logIC50 και τιμές κλίσης Hill, για τους παράλληλους θετικούς μάρτυρες/πρότυπα αναφοράς.
|
|
|
|
Αποτελέσματα:
|
—
|
ανεπεξέργαστα και κανονικοποιημένα δεδομένα,
|
|
—
|
το μέγιστο επίπεδο πολλαπλάσιας επαγωγής,
|
|
—
|
δεδομένα κυτταροτοξικότητας,
|
|
—
|
η χαμηλότερη αποτελεσματική συγκέντρωση (LEC), εάν υπάρχει,
|
|
—
|
τιμές RPCMax, PCMax, PC50, IC50 και/ή EC50, κατά περίπτωση,
|
|
—
|
σχέση συγκέντρωσης-απόκρισης, όπου είναι δυνατόν,
|
|
—
|
στατιστικές αναλύσεις, εάν υπάρχουν, μαζί με μια ένδειξη του βαθμού σφάλματος και του επιπέδου εμπιστοσύνης (π.χ. SEM, SD, CV ή 95 % CI) και περιγραφή του τρόπου υπολογισμού των εν λόγω τιμών.
|
|
|
|
Εξέταση των αποτελεσμάτων
|
|
ΒΙΒΛΙΟΓΡΑΦΙΑ
|
(1)
|
OECD (2005). Guidance Document on the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment. Environment, Health and Safety Publications, Series on Testing and Assessment (No 34.), Organisation for Economic Cooperation and Development, Paris.
|
|
(2)
|
OECD (2015). Report of the Inter-Laboratory Validation for Stably Transfected Transactivation Assay to detect Estrogenic and Anti-estrogenic Activity. Environment, Health and Safety Publications, Series on Testing and Assessment (No 225), Organisation for Economic Cooperation and Development, Paris.
|
|
(3)
|
ICCVAM (2011). ICCVAM Test Method Evaluation Report on the LUMI-CELL® ER (BG1Luc ER TA) Test Method, an In Vitro Method for Identifying ER Agonists and Antagonists, National Institute of Environmental Health Sciences: Research Triangle Park, NC.
|
|
(4)
|
Pujol P. et al. (1998). Differential Expression of Estrogen Receptor-Alpha and -Beta Messenger RNAs as a Potential Marker of Ovarian Carcinogenesis, Cancer. Res., 58(23): p. 5367-73.
|
|
(5)
|
Rogers J.M. and Denison M.S. (2000). Recombinant Cell Bioassays for Endocrine Disruptors: Development of a Stably Transfected Human Ovarian Cell Line for the Detection of Estrogenic and Anti-Estrogenic Chemicals, In Vitro and Molecular Toxicology: Journal of Basic and Applied Research, 13(1): p. 67-82.
|
|
(6)
|
OECD (2012). Performance Standards For Stably Transfected Transactivation In Vitro Assay to Detect Estrogen Receptor Agonists (for TG 455). Environment, Health and Safety Publications, Series on Testing and Assessment (No 173.), Organisation for Economic Cooperation and Development, Paris.
|
|
(7)
|
OECD (2015). Performance Standards For Stably Transfected Transactivation In Vitro Assay to Detect Estrogen Receptor Antagonists. Environment, Health and Safety Publications, Series on Testing and Assessment (No 174.), Organisation for Economic Cooperation and Development, Paris.
|
|
(8)
|
OECD (2012). Guidance Document on Standardized Test Guidelines for Evaluating Chemicals for Endocrine Disruption. Environment, Health and Safety Publications, Series on Testing and Assessment (No 150.), Organisation for Economic Cooperation and Development, Paris.
|
|
(9)
|
Cavailles V. (2002). Estrogens and Receptors: an Evolving Concept. Climacteric, 5 Suppl 2: p. 20- 6.
|
|
(10)
|
Welboren W.J. et al. (2009). Genomic Actions of Estrogen Receptor Alpha: What are the Targets and how are they Regulated? Endocr. Relat. Cancer, 16(4): p. 1073-89.
|
|
(11)
|
Younes M. and Honma N. (2011). Estrogen Receptor Beta, Arch. Pathol. Lab. Med., 135(1): p. 63- 6.
|
|
(12)
|
Jefferson W.N., et al. (2002). Assessing Estrogenic Activity of Phytochemicals Using Transcriptional Activation and Immature Mouse Uterotrophic Responses, Journal of Chromatography B, 777(1-2): p. 179-189.
|
|
(13)
|
Sonneveld E. et al. (2006). Comparison of In Vitro and In Vivo Screening Models for Androgenic and Estrogenic Activities, Toxicol. Sci., 89(1): p. 173-187.
|
|
(14)
|
Takeyoshi M. et al. (2002). The Efficacy of Endocrine Disruptor Screening Tests in Detecting Anti- Estrogenic Effects Downstream of Receptor-Ligand Interactions, Toxicology Letters, 126(2): p. 91- 98.
|
|
(15)
|
Combes R.D. (2000). Endocrine Disruptors: a Critical Review of In Vitro and In Vivo Testing Strategies for Assessing their Toxic Hazard to Humans, ATLA Alternatives to Laboratory Animals,28(1): p. 81-118.
|
|
(16)
|
Escande A. et al. (2006). Evaluation of Ligand Selectivity Using Reporter Cell Lines Stably Expressing Estrogen Receptor Alpha or Beta, Biochem. Pharmacol,71(10): p. 1459-69.
|
|
(17)
|
Gray L.E. Jr. (1998). Tiered Screening and Testing Strategy for Xenoestrogens and Antiandrogens, Toxicol. Lett, 102-103, 677-680.
|
|
(18)
|
EDSTAC (1998). Endocrine Disruptor Screening and Testing Advisory Committee (EDSTAC) Final Report.
|
|
(19)
|
ICCVAM (2003). ICCVAM Evaluation of In Vitro Test Methods for Detecting Potential Endocrine Disruptors: Estrogen Receptor and Androgen Receptor Binding and Transcriptional Activation Assays.
|
|
(20)
|
Gustafsson J.Ö. (1999). Estrogen Receptor ß - A New Dimension in Estrogen Mechanism of Action, Journal of Endocrinology, 163(3): p. 379-383.
|
|
(21)
|
Ogawa S. et al. (1998). The Complete Primary Structure of Human Estrogen Receptor ß (hERß) and its Heterodimerization with ERαIn Vivo and In Vitro, Biochemical and Biophysical Research Communications, 243(1): p. 122-126.
|
|
(22)
|
Enmark E. et al. (1997). Human Estrogen Receptor ß-Gene Structure, Chromosomal Localization, and Expression Pattern, Journal of Clinical Endocrinology and Metabolism,82(12): p. 4258-4265.
|
|
(23)
|
Ball L.J. et al. (2009). Cell Type- and Estrogen Receptor-Subtype Specific Regulation of Selective Estrogen Receptor Modulator Regulatory Elements, Molecular and Cellular Endocrinology, 299(2): p. 204-211.
|
|
(24)
|
Barkhem T. et al. (1998). Differential Response of Estrogen Receptor Alpha and Estrogen Receptor Beta to Partial Estrogen Agonists/Antagonists, Mol. Pharmacol, 54(1): p. 105-12.
|
|
(25)
|
Deroo B.J. and Buensuceso A.V. (2010). Minireview: Estrogen Receptor-ß: Mechanistic Insights from Recent Studies, Molecular Endocrinology, 24(9): p. 1703-1714.
|
|
(26)
|
Harris D.M. et al. (2005). Phytoestrogens Induce Differential Estrogen Receptor Alpha- or Beta- Mediated Responses in Transfected Breast Cancer Cells, Experimental Biology and Medicine, 230(8): p. 558-568.
|
|
(27)
|
Anderson J.N. Clark J.H. and Peck E.J.Jr. (1972). The Relationship Between Nuclear Receptor- Estrogen Binding and Uterotrophic Responses, Biochemical and Biophysical Research Communications, 48(6): p. 1460-1468.
|
|
(28)
|
Toft D. (1972). The Interaction of Uterine Estrogen Receptors with DNA, Journal of Steroid Biochemistry, 3(3): p. 515-522.
|
|
(29)
|
Gorski J. et al. (1968), Hormone Receptors: Studies on the Interaction of Estrogen with the Uterus, Recent Progress in Hormone Research, 24: p. 45-80.
|
|
(30)
|
Jensen E.V. et al. (1967), Estrogen-Receptor Interactions in Target Tissues, Archives d’Anatomie Microscopique et de Morphologie Experimentale, 56(3):p. 547-569.
|
|
(31)
|
ICCVAM (2002). Background Review Document: Estrogen Receptor Transcriptional Activation (TA) Assay. Appendix D, Substances Tested in the ER TA Assay, NIH Publication Report (No 03-4505.).
|
|
(32)
|
Kanno J. et al. (2001). The OECD Program to Validate the Rat Uterotrophic Bioassay to Screen Compounds for In Vivo Estrogenic Responses: Phase 1, Environ. Health Persp., 109:785-94.
|
|
(33)
|
Kanno J. et al. (2003). The OECD Program to Validate the Rat Uterotrophic Bioassay: Phase Two Dose -Response Studies, Environ. Health Persp., 111:1530-1549.
|
|
(34)
|
Kanno J. et al. (2003), The OECD Program to Validate the Rat Uterotrophic Bioassay: Phase Two – Coded Single-Dose Studies, Environ. Health Persp., 111:1550-1558.
|
|
(35)
|
Geisinger et al. (1989) Characterization of a human ovarian carcinoma cell line with estrogen and progesterone receptors, Cancer 63, 280-288.
|
|
(36)
|
Baldwin et al. (1998) BG-1 ovarian cell line: an alternative model for examining estrogen-dependent growth in vitro, In Vitro Cell. Dev. Biol. – Animal, 34, 649-654.
|
|
(37)
|
Li, Y. et al. (2014) Research resource: STR DNA profile and gene expression comparisons of human BG-1 cells and a BG-1/MCF-7 clonal variant, Mol. Endo. 28, 2072-2081.
|
|
(38)
|
Rogers, J.M. and Denison, M.S. (2000) Recombinant cell bioassays for endocrine disruptors: development of a stably transfected human ovarian cell line for the detection of estrogenic and anti-estrogenic chemicals, In Vitro & Molec. Toxicol. 13, 67-82.
|
Προσάρτημα 1
ΟΡΙΣΜΟΙ ΚΑΙ ΣΥΝΤΟΜΟΓΡΑΦΙΕΣ
Κριτήρια αποδοχής
: Ελάχιστα πρότυπα για τις επιδόσεις των πειραματικών ελέγχων και πρότυπα αναφοράς. Για να θεωρηθεί ένα πείραμα έγκυρο, θα πρέπει να πληρούνται όλα τα κριτήρια αποδοχής.
Ορθότητα (συμφωνία)
: ο βαθμός συμφωνίας μεταξύ των αποτελεσμάτων της δοκιμασίας και των αποδεκτών τιμών αναφοράς. Αποτελεί κριτήριο επιδόσεων της δοκιμασίας και μια από τις πτυχές της καταλληλότητας. Συχνά ο όρος χρησιμοποιείται εναλλακτικά προς τη «συμφωνία» για να δηλώσει το ποσοστό ορθών αποτελεσμάτων μιας δοκιμασίας (1).
Αγωνιστής
: ουσία που επάγει απόκριση, π.χ. μεταγραφή, όταν δεσμεύεται σε ειδικό υποδοχέα.
Ανταγωνιστής
: τύπος προσδέματος υποδοχέα ή χημικής ουσίας που δεν επάγει βιολογική απόκριση καθαυτό/καθαυτή όταν δεσμεύεται σε υποδοχέα, αλλά εμποδίζει ή εξασθενεί αποκρίσεις διαμεσολαβούμενες από αγωνιστές.
Αντιοιστρογόνος δραστηριότητα
: η ικανότητα μιας χημικής ουσίας να καταστέλλει τη δράση της 17β-οιστραδιόλης η οποία διαμεσολαβείται από τους υποδοχείς οιστρογόνων.
Μορφολογία των κυττάρων
: το σχήμα και η εμφάνιση των κυττάρων που καλλιεργούνται σε μονοστιβάδα σε μία μεμονωμένη κοιλότητα τρυβλίου ιστοκαλλιέργειας. Η μορφολογία των θνήσκοντων κυττάρων είναι συχνά μη φυσιολογική.
CF
: (Conceptual Framework) το εννοιακό πλαίσιο του ΟΟΣΑ για τη διεξαγωγή δοκιμών και την αξιολόγηση των ενδοκρινικών διαταρακτών.
Κατεργασία με ενεργό άνθρακα/δεξτράνη
: κατεργασία του ορού που χρησιμοποιείται στην κυτταροκαλλιέργεια. Η κατεργασία με ενεργό άνθρακα/δεξτράνη (η οποία αναφέρεται συχνά ως «απογύμνωση») απομακρύνει τις ενδογενείς ορμόνες και τις πρωτεΐνες που δεσμεύουν τις ορμόνες.
Χημικό προϊόν
: μια ουσία ή ένα μείγμα.
Κυτταροτοξικότητα
: επιβλαβείς επιδράσεις στη δομή ή τη λειτουργία των κυττάρων που μπορούν να καταλήξουν στον θάνατο των κυττάρων και οι οποίες αποτυπώνονται στη μείωση του αριθμού των κυττάρων που είναι παρόντα στην κοιλότητα στο τέλος της περιόδου έκθεσης, ή στη μείωση της ικανότητας κάποιου μέτρου της κυτταρικής λειτουργίας σε σύγκριση με τον παράλληλο μάρτυρα με φορέα.
CV
: συντελεστής μεταβλητότητας
DCC-FBS
: βόειος εμβρυϊκός ορός που έχει υποστεί κατεργασία με ενεργό άνθρακα επιχρισμένο με δεξτράνη.
DMEM
: τροποποιημένο μέσο Eagle του Dulbecco
DMSO
: διμεθυλοσουλφοξείδιο
E2
: 17β-οιστραδιόλη
EC50
: ήμισυ της μέγιστης αποτελεσματικής συγκέντρωσης της υπό δοκιμή χημικής ουσίας.
ED
: ενδοκρινική διαταραχή
hERα
: ανθρώπινος υποδοχέας οιστρογόνων α
hERβ
: ανθρώπινος υποδοχέας οιστρογόνων β
EFM
: μέσο ελεύθερο οιστρογόνων. Τροποποιημένο μέσο Eagle του Dulbecco (DMEM), συμπληρωμένο με 4,5 % κατεργασμένου με ενεργό άνθρακα/δεξτράνη FBS, 1,9 % L-γλουταμίνη και 0,9 % Pen-Strep.
ER
: υποδοχέας οιστρογόνων
ERE
: στοιχείο απόκρισης στα οιστρογόνα
Οιστρογονική δραστηριότητα
: η ικανότητα μιας χημικής ουσίας να μιμείται την ικανότητα της 17β-οιστραδιόλης να δεσμεύεται στους υποδοχείς οιστρογόνων και να τους ενεργοποιεί. Η μεσολαβούμενη από τον hERα οιστρογονική δράση μπορεί να ανιχνευτεί με την παρούσα μέθοδο δοκιμών.
ERTA
: διενεργοποίηση υποδοχέα οιστρογόνων
FBS
: βόειος εμβρυϊκός ορός
HeLa
: αθάνατη ανθρώπινη τραχηλική κυτταρική σειρά
HeLa9903
: υποκλώνος των κυττάρων HeLa ο οποίος έχει διαμολυνθεί σταθερώς με hERα και γονίδιο αναφοράς λουσιφεράσης
IC
50
: ήμισυ της μέγιστης αποτελεσματικής συγκέντρωσης μιας ανασταλτικής χημικής ουσίας
ICCVAM
: (Interagency Coordinating Committee on the Validation of Alternative Methods) Διυπηρεσιακή Συντονιστική Επιτροπή για την Επικύρωση Εναλλακτικών Μεθόδων (ΗΠΑ)
Διεργαστηριακή αναπαραγωγιμότητα
: μέτρο του βαθμού στον οποίο διαφορετικά ειδικευμένα εργαστήρια, που χρησιμοποιούν το ίδιο πρωτόκολλο και ελέγχουν τις ίδιες ουσίες, μπορούν να παράγουν ανάλογα αποτελέσματα από ποιοτική και ποσοτική άποψη. Η διεργαστηριακή αναπαραγωγιμότητα προσδιορίζεται κατά τις διαδικασίες προεπικύρωσης και επικύρωσης και αποτελεί ένδειξη του κατά πόσον υπάρχει δυνατότητα επιτυχούς μεταφοράς μιας δοκιμής μεταξύ εργαστηρίων· καλείται επίσης «αναπαραγωγιμότητα μεταξύ εργαστηρίων» (1).
Ενδοεργαστηριακή αναπαραγωγιμότητα
: προσδιορισμός του βαθμού στον οποίο ειδικευμένα άτομα μπορούν να επαναλάβουν με επιτυχία τα ίδια αποτελέσματα εντός του ίδιου εργαστηρίου, χρησιμοποιώντας συγκεκριμένο πρωτόκολλο σε διαφορετικές χρονικές στιγμές. Καλείται επίσης «αναπαραγωγιμότητα εντός εργαστηρίου» (1).
LEC
: (lowest effective concentration) η χαμηλότερη συγκέντρωση της υπό δοκιμή χημικής ουσίας που επάγει απόκριση (δηλαδή η χαμηλότερη συγκέντρωση της υπό δοκιμή χημικής ουσίας στην οποία η πολλαπλάσια επαγωγή είναι στατιστικά διαφορετική από τον παράλληλο μάρτυρα με φορέα).
Δοκιμή παρόμοιου τύπου («me-too»)
: έκφραση της καθομιλουμένης που παραπέμπει σε δοκιμασία η οποία είναι δομικά και λειτουργικά ανάλογη με επικυρωμένη και εγκεκριμένη μέθοδο δοκιμών αναφοράς. Ο όρος χρησιμοποιείται εναλλακτικά προς την «παρεμφερή μέθοδο δοκιμών».
MT
: μεταλλοθειονίνη
MMTV
: ιός καρκίνου του μαστού του ποντικού
OHT
: 4-υδροξυταμοξιφαίνη
PBTG
: κατευθυντήρια γραμμή δοκιμών με βάση τις επιδόσεις
PC (θετικός μάρτυρας)
: ισχυρά δραστική ουσία, κατά προτίμηση 17β-οιστραδιόλη, που περιλαμβάνεται σε όλες τις δοκιμές με σκοπό τη διασφάλιση της ορθής λειτουργίας της δοκιμασίας.
PC
10
: η συγκέντρωση υπό δοκιμή χημικής ουσίας στην οποία η μετρούμενη δραστηριότητα σε δοκιμασία αγωνιστών αντιστοιχεί στο 10 % της μέγιστης δραστηριότητας που επάγεται από τον θετικό μάρτυρα (E2 σε 1 nM για τη δοκιμασία STTA) σε κάθε τρυβλίο.
PC
50
: η συγκέντρωση υπό δοκιμή χημικής ουσίας στην οποία η μετρούμενη δραστηριότητα σε δοκιμασία αγωνιστών αντιστοιχεί στο 50 % της μέγιστης δραστηριότητας που επάγεται από τον θετικό μάρτυρα (E2 σε 1 nM για τη δοκιμασία STTA) σε κάθε τρυβλίο.
PC
Max
: η συγκέντρωση υπό δοκιμή χημικής ουσίας που επάγει την RPCMax
Πρότυπα επιδόσεων
: πρότυπα που βασίζονται σε επικυρωμένη δοκιμασία και παρέχουν τη βάση για την αξιολόγηση της συγκρισιμότητας προτεινόμενης δοκιμασίας η οποία είναι μηχανιστικά και λειτουργικά παρεμφερής. Στα πρότυπα επιδόσεων περιλαμβάνονται 1) τα βασικά στοιχεία της δοκιμασίας, 2) κατάλογος ελάχιστων ουσιών αναφοράς, οι οποίες έχουν επιλεγεί μεταξύ των χημικών ουσιών που χρησιμοποιήθηκαν για την απόδειξη των αποδεκτών επιδόσεων της επικυρωμένης μεθόδου αναφοράς, και 3) τα συγκρίσιμα επίπεδα ορθότητας και αξιοπιστίας, που βασίζονται στα επιτευχθέντα για την επικυρωμένη μέθοδο δοκιμών και τα οποία πρέπει να επιδεικνύει η προτεινόμενη δοκιμασία όταν αξιολογείται με χρήση του καταλόγου ελαχίστων ουσιών αναφοράς (1).
Ουσίες ελέγχου ικανότητας
: υποσύνολο των ουσιών αναφοράς που περιλαμβάνονται στα πρότυπα επιδόσεων και οι οποίες μπορούν να χρησιμοποιούνται από τα εργαστήρια για να αποδεικνύουν την τεχνική τους ικανότητα στη διεξαγωγή τυποποιημένης μεθόδου δοκιμών. Τα κριτήρια επιλογής για τις εν λόγω ουσίες είναι συνήθως τα εξής: αντιπροσωπεύουν όλο το φάσμα αποκρίσεων, διατίθενται στο εμπόριο και συνοδεύονται από διαθέσιμα δεδομένα αναφοράς υψηλής ποιότητας.
Τεχνική ικανότητα
: η αποδεδειγμένη ικανότητα ορθής διεξαγωγής δοκιμασίας, πριν από τη διεξαγωγή δοκιμών με άγνωστες ουσίες.
Οιστρογόνο αναφοράς (θετικός μάρτυρας, PC)
: 17β-οιστραδιόλη (E2, CAS 50-28-2).
Πρότυπο αναφοράς
: ουσία αναφοράς που χρησιμοποιείται για την κατάδειξη της επάρκειας μιας δοκιμασίας. Η 17β-οιστραδιόλη είναι το πρότυπο αναφοράς για τις δοκιμασίες ER TA STTA και VM7Luc.
Μέθοδοι δοκιμών αναφοράς
: Οι δοκιμές στις οποίες βασίζεται η PBTG 455.
Καταλληλότητα
: περιγραφή της σχέσης μιας δοκιμασίας με την υπό μελέτη επίδραση και του κατά πόσον είναι κατάλληλη και χρήσιμη για συγκεκριμένο σκοπό. Πρόκειται για τον βαθμό στον οποίο η δοκιμασία μετρά ή προβλέπει σωστά τη βιολογική επίδραση υπό μελέτη. Η καταλληλότητα εμπεριέχει συνεκτίμηση της ορθότητας (συμφωνίας) μιας δοκιμασίας (1).
Αξιοπιστία
: μέτρο του βαθμού στον οποίο μια δοκιμασία μπορεί να αναπαράγεται διαχρονικά στο ίδιο εργαστήριο και μεταξύ εργαστηρίων, όταν εφαρμόζεται με το ίδιο πρωτόκολλο. Εκτιμάται με υπολογισμό της ενδοεργαστηριακής και της διεργαστηριακής αναπαραγωγιμότητας.
RLU
: (Relative Light Units) σχετικές μονάδες φωτός
RNA
: ριβονουκλεϊκό οξύ
RPC
Max
: το μέγιστο επίπεδο απόκρισης που επάγεται από υπό δοκιμή χημική ουσία, εκφραζόμενο ως ποσοστό της απόκρισης που επάγεται από 1 nM E2 στο ίδιο τρυβλίο
RPMI
: θρεπτικό μέσο RPMI 1 640 που συμπληρώνεται με 0,9 % Pen-Strep και 8,0 % βόειου εμβρυϊκού ορού (FBS)
Σειρά δοκιμών
: μεμονωμένο πείραμα βάσει του οποίου εκτιμάται η χημική δράση στο βιολογικό αποτέλεσμα της δοκιμασίας. Κάθε σειρά δοκιμών αποτελεί ένα πλήρες πείραμα που διεξάγεται σε πανομοιότυπες κοιλότητες ταυτόχρονα επιστρωμένων κυττάρων που προέρχονται από κοινό απόθεμα κυττάρων.
Ανεξάρτητη σειρά δοκιμών
: χωριστό, ανεξάρτητο πείραμα διά του οποίου εκτιμάται η χημική δράση στο βιολογικό αποτέλεσμα της δοκιμασίας, με χρήση κυττάρων από διαφορετικό απόθεμα και πρόσφατα αραιωμένων χημικών ουσιών, και το οποίο διεξάγεται σε διαφορετικές ημέρες ή την ίδια ημέρα από άλλο προσωπικό.
SD
: τυπική απόκλιση
Ευαισθησία
: το ποσοστό του συνόλου των θετικών/δραστικών χημικών ουσιών που ταξινομούνται σωστά με τη δοκιμασία. Αποτελεί μέτρο ορθότητας μιας δοκιμασίας με την οποία λαμβάνονται κατηγορηματικά αποτελέσματα, καθώς και σημαντικό κριτήριο αξιολόγησης της καταλληλότητας της δοκιμασίας (1).
Ειδικότητα
: το ποσοστό του συνόλου των αρνητικών/αδρανών χημικών ουσιών που ταξινομείται σωστά με τη δοκιμή. Αποτελεί μέτρο ορθότητας μιας δοκιμασίας με την οποία λαμβάνονται κατηγορηματικά αποτελέσματα, καθώς και σημαντικό κριτήριο αξιολόγησης της καταλληλότητας της δοκιμασίας (1).
Σταθερή διαμόλυνση
: η διαμόλυνση καλλιεργημένων κυττάρων με DNA κατά τρόπον ώστε να επιτυγχάνεται η σταθερή ενσωμάτωσή του στο γονιδίωμα των κυττάρων, με αποτέλεσμα τη σταθερή έκφραση των διαμολυνθέντων γονιδίων. Οι κλώνοι σταθερώς διαμολυθέντων κυττάρων επιλέγονται με σταθερούς δείκτες (π.χ. αντοχή στο G418).
Δοκιμασία STTA
: δοκιμασία διενεργοποίησης σταθερώς διαμολυνθέντων κυττάρων, η δοκιμασία μεταγραφικής ενεργοποίησης ERα με χρήση της κυτταρικής σειράς HeLa 9 903.
Μελέτη
: Το πλήρες φάσμα πειραματικών εργασιών που εκτελείται για την αξιολόγηση μιας μεμονωμένης, συγκεκριμένης ουσίας με χρήση συγκεκριμένης δοκιμασίας. Μια μελέτη περιλαμβάνει όλα τα στάδια, δηλ. δοκιμές αραίωσης της υπό δοκιμή χημικής ουσίας, προκαταρκτικές σειρές δοκιμών προσδιορισμού εύρους τιμών, όλες τις απαραίτητες ολοκληρωμένες σειρές δοκιμών, αναλύσεις δεδομένων, διασφάλιση ποιότητας, αξιολογήσεις κυτταροτοξικότητας, κ.λπ. Η ολοκλήρωση μιας μελέτης επιτρέπει την ταξινόμηση της δραστηριότητας της υπό δοκιμή χημικής ουσίας επί του στόχου της τοξικότητας (δραστική, αδρανής ή αβέβαιη), η οποία εκτιμάται από τη χρησιμοποιούμενη δοκιμασία, καθώς και μια εκτίμηση της ισχύος σε σχέση με τη θετική χημική ουσία αναφοράς.
Ουσία
: σύμφωνα με τον κανονισμό REACH (61), μια ουσία ορίζεται ως ένα χημικό στοιχείο και οι ενώσεις του σε φυσική κατάσταση ή όπως λαμβάνονται από οποιαδήποτε διεργασία παρασκευής, συμπεριλαμβανομένου κάθε προσθέτου που είναι απαραίτητο για τη διατήρηση της σταθερότητάς της και κάθε πρόσμειξης που προέρχεται από τη χρησιμοποιούμενη διεργασία, αποκλειόμενου κάθε διαλύτη που μπορεί να διαχωρισθεί, χωρίς να επηρεάσει τη σταθερότητα της ουσίας ή να μεταβάλει τη σύνθεσή της. Ένας παρόμοιος ορισμός χρησιμοποιείται και στο GHS του ΟΗΕ (1).
TA (διενεργοποίηση): η έναρξη της σύνθεσης mRNA ως απόκριση σε ειδικό χημικό σήμα, όπως η δέσμευση οιστρογόνου στον υποδοχέα οιστρογόνων
Δοκιμασία
: στο πλαίσιο της παρούσας μεθόδου δοκιμών, μια δοκιμασία είναι μία από τις μεθοδολογίες που θεωρείται ότι πληρούν τα περιγραφόμενα κριτήρια επιδόσεων. Μεταξύ των στοιχείων της δοκιμασίας περιλαμβάνεται, για παράδειγμα, η συγκεκριμένη κυτταρική σειρά με τις σχετικές συνθήκες ανάπτυξης, το συγκεκριμένο μέσο στο οποίο διεξάγεται η δοκιμή, οι συνθήκες προετοιμασίας των τρυβλίων, η διάταξη και οι αραιώσεις των υπό δοκιμή χημικών ουσιών μαζί με τυχόν άλλα μέτρα ελέγχου της ποιότητας και σχετικά στάδια αξιολόγησης δεδομένων.
Υπό δοκιμή χημική ουσία
: κάθε ουσία ή μείγμα που υποβάλλεται σε δοκιμή με τη χρήση της παρούσας μεθόδου δοκιμών.
Μεταγραφή
: σύνθεση mRNA
UVCB
: ουσίες άγνωστης ή ασταθούς σύνθεσης, προϊόντα πολύπλοκων αντιδράσεων και βιολογικά υλικά:
Επικυρωμένη μέθοδος δοκιμών
: δοκιμασία για την οποία έχουν ολοκληρωθεί μελέτες επικύρωσης προκειμένου να προσδιοριστούν η καταλληλότητα (συμπεριλαμβανομένης της ορθότητας) και η αξιοπιστία της για συγκεκριμένο σκοπό. Είναι σημαντικό να σημειωθεί ότι οι επιδόσεις επικυρωμένης μεθόδου δοκιμών από πλευράς ορθότητας και αξιοπιστίας ενδέχεται να μην επαρκούν για να κριθεί αποδεκτή για τον προτεινόμενο σκοπό (1).
Επικύρωση
: η διαδικασία διά της οποίας διακριβώνεται η αξιοπιστία και η καταλληλότητα μιας συγκεκριμένης προσέγγισης, μεθόδου, δοκιμασίας, διεργασίας ή αξιολόγησης για καθορισμένο σκοπό (1).
VC (μάρτυρας με φορέα)
: ο διαλύτης που χρησιμοποιείται για τη διάλυση των υπό δοκιμή χημικών ουσιών και των χημικών ουσιών μαρτύρων υποβάλλεται σε δοκιμή αποκλειστικά ως φορέας, χωρίς διαλυμένη χημική ουσία.
VM7
: αθανατοποιημένο κύτταρο αδενοκαρκινώματος που εκφράζει ενδογενώς τον υποδοχέα οιστρογόνων.
VM7Luc4E2
: η κυτταρική σειρά VM7Luc4E2 προήλθε από αθανατοποιημένα ανθρώπινα κύτταρα αδενοκαρκινώματος VM7 που εκφράζουν ενδογενώς και τις δύο μορφές του υποδοχέα οιστρογόνων (ERα και ERβ) και τα οποία έχουν διαμολυνθεί σταθερώς με το πλασμίδιο pGudLuc7.ERE. Το πλασμίδιο αυτό περιέχει τέσσερα αντίγραφα ενός συνθετικού ολιγονουκλεοτιδίου που περιλαμβάνει το στοιχείο απόκρισης στα οιστρογόνα ανάντη του υποκινητή του ιού καρκίνου του μαστού του ποντικού (MMTV) και το γονίδιο λουσιφεράσης της πυγολαμπίδας.
Ασθενής θετικός μάρτυρας
: ασθενώς δραστική ουσία που επιλέγεται από τον κατάλογο χημικών ουσιών αναφοράς που περιλαμβάνεται σε όλες τις δοκιμές με σκοπό τη διασφάλιση της ορθής λειτουργίας της δοκιμασίας.
Προσάρτημα 2
ΔΟΚΙΜΑΣΙΑ ΔΙΕΝΕΡΓΟΠΟΙΗΣΗΣ ΣΤΑΘΕΡΩΣ ΔΙΑΜΟΛΥΝΘΕΝΤΩΝ ΑΝΘΡΩΠΙΝΩΝ ΥΠΟΔΟΧΕΩΝ ΟΙΣΤΡΟΓΟΝΩΝ Α ΓΙΑ ΤΗΝ ΑΝΙΧΝΕΥΣΗ ΤΗΣ ΔΡΑΣΤΙΚΟΤΗΤΑΣ ΧΗΜΙΚΩΝ ΟΥΣΙΩΝ ΩΣ ΑΓΩΝΙΣΤΩΝ ΚΑΙ ΑΝΤΑΓΩΝΙΣΤΩΝ ΟΙΣΤΡΟΓΟΝΩΝ ΜΕ ΧΡΗΣΗ ΤΗΣ ΚΥΤΤΑΡΙΚΗΣ ΣΕΙΡΑΣ HERΑ-HELA-9903
ΑΡΧΙΚΕΣ ΕΚΤΙΜΗΣΕΙΣ ΚΑΙ ΠΕΡΙΟΡΙΣΜΟΙ (ΒΛ. ΕΠΙΣΗΣ ΓΕΝΙΚΗ ΕΙΣΑΓΩΓΗ)
|
1.
|
Στην παρούσα δοκιμασία διενεργοποίησης (TA) χρησιμοποιείται η κυτταρική σειρά hERα-HeLa-9903 για την ανίχνευση της δράσης αγωνιστών οιστρογόνων που μεσολαβείται από τον ανθρώπινο υποδοχέα οιστρογόνων α (hERα). Στη μελέτη επικύρωσης της δοκιμασίας διενεργοποίησης σταθερά διαμολυνθέντων κυττάρων (STTA) που διενήργησε το ιαπωνικό Ινστιτούτο Αξιολόγησης και Έρευνας Χημικών Ουσιών (CERI) με χρήση της κυτταρικής σειράς hERα-HeLa-9903 για την ανίχνευση της δράσης αγωνιστών και ανταγωνιστών οιστρογόνων που μεσολαβείται από τον ανθρώπινο υποδοχέα οιστρογόνων α (hERα), κατεδείχθη η καταλληλότητα και η αξιοπιστία της δοκιμασίας για τον προβλεπόμενο σκοπό (1).
|
|
2.
|
Η παρούσα δοκιμασία έχει σχεδιαστεί ειδικά για την ανίχνευση της μεσολαβούμενης από τον hERα TA μέσω μέτρησης της χημειοφωταύγειας ως παραμέτρου. Ωστόσο, έχουν αναφερθεί σήματα φωταύγειας που δεν μεσολαβούνται από υποδοχείς σε συγκεντρώσεις φυτοοιστρογόνων υψηλότερες του 1 μΜ, λόγω υπερενεργοποίησης του γονιδίου αναφοράς λουσιφεράσης (2) (3). Παρότι η καμπύλη δόσης-απόκρισης υποδεικνύει ότι η πραγματική ενεργοποίηση του συστήματος ER λαμβάνει χώρα σε χαμηλότερες συγκεντρώσεις, η έκφραση της λουσιφεράσης που επιτυγχάνεται σε υψηλές συγκεντρώσεις φυτοοιστρογόνων ή ανάλογων ενώσεων για τις οποίες υπάρχουν υπόνοιες ότι επάγουν ανάλογη με τα φυτοοιστρογόνα υπερενεργοποίηση του γονιδίου αναφοράς λουσιφεράσης πρέπει να εξετάζεται προσεκτικά σε συστήματα δοκιμασίας ER TA σταθερώς διαμολυνθέντων κυττάρων (προσάρτημα 1).
|
|
3.
|
Πριν από τη χρήση της παρούσας δοκιμασίας για κανονιστικούς σκοπούς, θα πρέπει να μελετηθούν οι ενότητες «ΓΕΝΙΚΗ ΕΙΣΑΓΩΓΗ» και «ΣΤΟΙΧΕΙΑ ΔΟΚΙΜΑΣΙΑΣ ER TA». Οι ορισμοί και οι συντομογραφίες που χρησιμοποιούνται στην παρούσα κατευθυντήρια γραμμή δοκιμών παρατίθενται στο προσάρτημα 2.1.
|
ΑΡΧΗ ΤΗΣ ΔΟΚΙΜΑΣΙΑΣ (ΒΛΕΠΕ ΕΠΙΣΗΣ ΓΕΝΙΚΗ ΕΙΣΑΓΩΓΗ)
|
4.
|
Η δοκιμασία χρησιμοποιείται για την ανίχνευση της σύνδεσης του υποδοχέα οιστρογόνων με πρόσδεμα. Μετά τη δέσμευση του προσδέματος, το σύμπλοκο υποδοχέα-προσδέματος μετατοπίζεται στον πυρήνα όπου δεσμεύει ειδικά στοιχεία απόκρισης του DNA και διενεργοποιεί ένα γονίδιο αναφοράς λουσιφεράσης της πυγολαμπίδας, με αποτέλεσμα την αύξηση της κυτταρικής έκφρασης του ενζύμου λουσιφεράση. Η λουσιφερίνη είναι υπόστρωμα που μετασχηματίζεται από το ένζυμο λουσιφεράση σε βιοφωταυγές προϊόν που μπορεί να μετρηθεί ποσοτικά με λουμινόμετρο. Η δραστηριότητα της λουσιφεράσης μπορεί να αξιολογηθεί γρήγορα και με χαμηλό κόστος με χρήση διαφόρων κιτ δοκιμής του εμπορίου.
|
|
5.
|
Το σύστημα δοκιμής χρησιμοποιεί την κυτταρική σειρά hERα-HeLa-9903, η οποία προέρχεται από όγκο ανθρώπινου τραχήλου, με δύο σταθερώς εντεθειμένα κατασκευάσματα: i) το κατασκεύασμα έκφρασης του hERα (που κωδικοποιεί τον ανθρώπινο υποδοχέα πλήρους μήκους), και ii) ένα κατασκεύασμα γονιδίου αναφοράς λουσιφεράσης της πυγολαμπίδας που φέρει πέντε διαδοχικές επαναλήψεις στοιχείου απόκρισης στα οιστρογόνα (ERE) λεκιθογενίνης που υποκινείται από ένα στοιχείο ΤΑΤΑ υποκινητή μεταλλοθειονίνης ποντικού (MT). Το κατασκεύασμα TATA MT ποντικού έχει αποδειχθεί ότι παρουσιάζει τις βέλτιστες επιδόσεις και, ως εκ τούτου, χρησιμοποιείται ευρέως. Κατά συνέπεια, η εν λόγω κυτταρική σειρά hERα-HeLa-9903 μπορεί να μετρά την ικανότητα μιας υπό δοκιμή χημικής ουσίας να επάγει τη μεσολαβούμενη από τον hERα διενεργοποίηση της έκφρασης του γονιδίου λουσιφεράσης.
|
|
6.
|
Στην περίπτωση της δοκιμασίας αγωνιστών ER, η ερμηνεία των δεδομένων βασίζεται στο κατά πόσον το μέγιστο επίπεδο απόκρισης που επάγεται από υπό δοκιμή χημική ουσία ισοδυναμεί ή υπερβαίνει απόκριση αγωνιστών ίση με το 10 % της απόκρισης που επάγεται από συγκέντρωση που επάγει τη μέγιστη απόκριση (1 nM) του θετικού μάρτυρα (PC) 17β-οιστραδιόλη (E2) (δηλ. την PC10). Στην περίπτωση δοκιμασίας ανταγωνιστών ER, η ερμηνεία των δεδομένων βασίζεται στο κατά πόσον η απόκριση εμφανίζει κατά 30 % τουλάχιστον μείωση δραστηριότητας σε σχέση με την απόκριση που επάγεται από τον εμβολιασμένο μάρτυρα (25 pM E2) χωρίς κυτταροτοξικότητα. Η ανάλυση και η ερμηνεία των δεδομένων εξετάζονται αναλυτικά στις παραγράφους 34 - 48.
|
ΔΙΑΔΙΚΑΣΙΑ
Κυτταρικές σειρές
|
7.
|
Για τη δοκιμασία θα πρέπει να χρησιμοποιείται η σταθερώς διαμολυνθείσα κυτταρική σειρά hERα-HeLa-9903. Η κυτταρική σειρά μπορεί να ληφθεί από την τράπεζα κυττάρων της Ιαπωνικής Συλλογής Ερευνητικών Βιολογικών Πόρων (JCRB) (62), μετά από την υπογραφή συμφωνίας μεταφοράς υλικού.
|
|
8.
|
Κατά τη διεξαγωγή δοκιμών θα πρέπει να χρησιμοποιούνται μόνο κύτταρα που έχει διαπιστωθεί ότι είναι ελεύθερα μυκοπλάσματος. Η RT-PCR (αλυσιδωτή αντίδραση πολυμεράσης πραγματικού χρόνου) είναι η προτιμώμενη μέθοδος ευαίσθητης ανίχνευσης μόλυνσης από μυκόπλασμα (4) (5) (6).
|
Σταθερότητα της κυτταρικής σειράς
|
9.
|
Για την παρακολούθηση της σταθερότητας της κυτταρικής σειράς, ως πρότυπα αναφοράς για τη δοκιμασία αγωνιστών θα πρέπει να χρησιμοποιούνται οι E2, 17α-οιστραδιόλη, 17α-μεθυλοτεστοστερόνη και κορτικοστερόνη, και θα πρέπει να μετράται μια πλήρης καμπύλη συγκέντρωσης-απόκρισης στην περιοχή συγκεντρώσεων δοκιμής που παρατίθεται στον πίνακα 1 τουλάχιστον μία φορά σε κάθε διεξαγωγή της δοκιμασίας, ενώ τα αποτελέσματα θα πρέπει να συμφωνούν με τα αποτελέσματα που παρέχονται στον πίνακα 1.
|
|
10.
|
Στην περίπτωση δοκιμασίας ανταγωνιστών, θα πρέπει να μετρώνται ταυτόχρονα με κάθε σειρά δοκιμών πλήρεις καμπύλες συγκέντρωσης για δύο πρότυπα αναφοράς, την ταμοξιφαίνη και τη φλουταμίδη. Θα πρέπει να παρακολουθείται η ορθότητα της ταξινόμησης των δύο χημικών ουσιών ως θετικών ή αρνητικών.
|
Συνθήκες καλλιέργειας και επίστρωσης κυττάρων
|
11.
|
Τα κύτταρα θα πρέπει να διατηρούνται σε θρεπτικό μέσο ελάχιστων τροφικών απαιτήσεων Eagle (EMEM) χωρίς ερυθρό της φαινόλης, συμπληρούμενο με 60 mg/l του αντιβιοτικού καναμυκίνη και 10 % βόειου εμβρυϊκού ορού κατεργασμένου με επιχρισμένο με δεξτράνη ενεργό άνθρακα (DCC-FBS), σε επωαστήρα CO2 (5 % CO2) στους 37±1°C. Μετά την επίτευξη συρροής 75–90 %, τα κύτταρα μπορούν να ανακαλλιεργηθούν σε 10 ml 0,4 x 105 – 1 x 105 κυττάρων/ml για τρυβλίο κυτταροκαλλιέργειας των 100 mm. Τα κύτταρα θα πρέπει να εναιωρούνται με 10 % FBS-EMEM (που είναι το ίδιο με το EMEM με DCC-FBS) και, κατόπιν, να επιστρώνονται σε κοιλότητες τρυβλίου μικροτιτλοδότησης σε πυκνότητα 1 x 104 κυττάρων/(100 μl x κοιλότητα). Στη συνέχεια, τα κύτταρα θα πρέπει να προεπωάζονται σε επωαστήρα 5 % CO2 στους 37°±1°C επί 3 ώρες, πριν από την έκθεση στη χημική ουσία. Ο πλαστικός εξοπλισμός θα πρέπει να είναι ελεύθερος οιστρογονικής δραστηριότητας.
|
|
12.
|
Για τη διατήρηση της ακεραιότητας της απόκρισης, τα κύτταρα θα πρέπει να καλλιεργούνται για περισσότερες από μία ανακαλλιέργειες από το κατεψυγμένο απόθεμα στα εγκλιματισμένα θρεπτικά μέσα, ενώ δεν θα πρέπει να καλλιεργούνται για περισσότερες από 40 ανακαλλιέργειες. Για την κυτταρική σειρά hERα-HeLa-9903, αυτό δεν υπερβαίνει τους τρεις μήνες. Ωστόσο, η καλλιέργεια των κυττάρων υπό ακατάλληλες συνθήκες ενδέχεται να έχει ως συνέπεια τη μείωση των επιδόσεών τους.
|
|
13.
|
Το DCC-FBS μπορεί να παρασκευάζεται σύμφωνα με τα όσα περιγράφονται στο προσάρτημα 2.2, ή να λαμβάνεται από το εμπόριο.
|
Κριτήρια αποδοχής
Θετικά και αρνητικά πρότυπα αναφοράς για τη δοκιμασία αγωνιστών ER
|
14.
|
Πριν και κατά τη διάρκεια της μελέτης, θα πρέπει να επαληθεύεται η αποκρισιμότητα του συστήματος δοκιμής με χρήση των κατάλληλων συγκεντρώσεων ενός ισχυρού οιστρογόνου (της E2), ενός ασθενούς οιστρογόνου (17α-οιστραδιόλη), ενός ιδιαίτερα ασθενούς αγωνιστή (17α-μεθυλοτεστοστερόνη) και μιας αρνητικής ουσίας (κορτικοστερόνη). Στον πίνακα 1 φαίνονται οι αποδεκτές τιμές εύρους που προέκυψαν από τη μελέτη επικύρωσης (1). Τα εν λόγω 4 παράλληλα πρότυπα αναφοράς θα πρέπει να περιλαμβάνονται σε κάθε πείραμα και τα αποτελέσματα θα πρέπει να εμπίπτουν εντός των καθορισμένων αποδεκτών ορίων. Σε διαφορετική περίπτωση, θα πρέπει να προσδιορίζεται η αιτία μη συμμόρφωσης με τα κριτήρια αποδοχής (π.χ. χειρισμοί των κυττάρων, και ορός και αντιβιοτικά για την ποιότητα και συγκέντρωση) και να επαναλαμβάνεται η δοκιμασία. Εφόσον επιτευχθεί η συμμόρφωση με τα κριτήρια αποδοχής, είναι απολύτως απαραίτητηη συνεπής χρήση των υλικών για τις καλλιέργειες των κυττάρων, προκειμένου να διασφαλίζεται ο περιορισμός στο ελάχιστο της μεταβλητότητας των τιμών EC50, PC50 και PC10. Τα τέσσερα παράλληλα πρότυπα αναφοράς, που πρέπει να περιλαμβάνονται σε κάθε πείραμα (το οποίο διεξάγεται υπό τις ίδιες συνθήκες, περιλαμβανομένων των υλικών, του επιπέδου ανακαλλιέργειας των κυττάρων και του τεχνικού προσωπικού), μπορούν να διασφαλίζουν την ευαισθησία της δοκιμασίας, δεδομένου ότι οι τιμές PC10 των τριών θετικών προτύπων αναφοράς θα πρέπει να περιλαμβάνονται εντός του αποδεκτού εύρους, όπως και οι τιμές PC50 και EC50, εφόσον μπορούν να υπολογιστούν (βλ. πίνακα 1).
|
Πίνακας 1
Αποδεκτές τιμές εύρους των τεσσάρων προτύπων αναφοράς για τη δοκιμασία αγωνιστών ER
|
Ονομασία
|
logPC50
|
logPC10
|
logEC50
|
Κλίση Hill
|
Εύρος δοκιμής
|
|
17β-οιστραδιόλη (Ε2) Αριθ. CAS: 50-28-2
|
-11,4~-10,1
|
<-11
|
-11,3~-10,1
|
0,7~1,5
|
10-14~10-8M
|
|
17α-οιστραδιόλη Αριθ. CAS: 57-91-0
|
-9,6~-8,1
|
-10,7~-9,3
|
-9,6~-8,4
|
0,9~2,0
|
10-12~10-6M
|
|
Κορτικοστερόνη Αριθ. CAS: 50-22-6
|
—
|
—
|
—
|
—
|
10-10~10-4M
|
|
17α-μεθυλοτεστοστερόνη Αριθ. CAS: 58-18-4
|
-6,0~-5,1
|
-8,0~-6,2
|
—
|
—
|
10-11~10-5M
|
Θετικά και αρνητικά πρότυπα αναφοράς για τη δοκιμασία ανταγωνιστών ER
|
15.
|
Πριν και κατά τη διάρκεια της μελέτης, θα πρέπει να επαληθεύεται η αποκρισιμότητα του συστήματος δοκιμής με χρήση των κατάλληλων συγκεντρώσεων θετικής ουσίας (ταμοξιφαίνη) και αρνητικής ουσίας (φλουταμίδη). Στον πίνακα 2 φαίνονται οι αποδεκτές τιμές εύρους που προέκυψαν από τη μελέτη επικύρωσης (1). Τα εν λόγω δύο παράλληλα πρότυπα αναφοράς θα πρέπει να περιλαμβάνονται σε κάθε πείραμα και τα αποτελέσματα θα πρέπει να κρίνονται ορθά, όπως ορίζεται στα κριτήρια. Σε διαφορετική περίπτωση, θα πρέπει να προσδιορίζεται η αιτία μη συμμόρφωσης με τα κριτήρια αποδοχής (π.χ. χειρισμοί των κυττάρων, και ορός και αντιβιοτικά για την ποιότητα και συγκέντρωση) και να επαναλαμβάνεται η δοκιμασία. Επιπλέον, θα πρέπει να υπολογίζονται οι τιμές IC50 για θετική ουσία (ταμοξιφαίνη) και τα αποτελέσματα θα πρέπει να περιλαμβάνονται εντός των καθορισμένων αποδεκτών ορίων. Εφόσον επιτευχθεί η συμμόρφωση με τα κριτήρια αποδοχής, είναι απολύτως απαραίτητη η συνεπής χρήση των υλικών για τις καλλιέργειες των κυττάρων, προκειμένου να διασφαλίζεται ο περιορισμός στο ελάχιστο της μεταβλητότητας των τιμών IC50. Τα δύο παράλληλα πρότυπα αναφοράς, που πρέπει να περιλαμβάνονται σε κάθε πείραμα (το οποίο διεξάγεται υπό τις ίδιες συνθήκες, περιλαμβανομένων των υλικών, του επιπέδου ανακαλλιέργειας των κυττάρων και του τεχνικού προσωπικού), μπορούν να διασφαλίζουν την ευαισθησία της δοκιμασίας (βλ. πίνακα 2).
|
Πίνακας 2
Κριτήρια και αποδεκτές τιμές εύρους των δύο προτύπων αναφοράς για τη δοκιμασία ανταγωνιστών ER
|
Ονομασία
|
Κριτήρια
|
LogIC50
|
Εύρος δοκιμής
|
|
Ταμοξιφαίνη Αριθ. CAS: 10540-29-1
|
Θετική: Θα πρέπει να υπολογιστεί το IC50
|
-5,942~-7,596
|
10-10~10-5M
|
|
Φλουταμίδη Αριθ. CAS: 13311-84-7
|
Αρνητική: Δεν θα πρέπει να υπολογιστεί το IC30
|
—
|
10-10~10-5M
|
Θετικοί μάρτυρες και μάρτυρες με φορέα
|
16.
|
Ο θετικός μάρτυρας (PC) για τη δοκιμασία αγωνιστών ER (1 nM E2) και για τη δοκιμασία ανταγωνιστών ER (10 μΜ TAM) θα πρέπει να ελέγχεται τουλάχιστον τρεις φορές σε κάθε τρυβλίο. Ο φορέας που χρησιμοποιείται για τη διάλυση μιας υπό δοκιμή χημικής ουσίας θα πρέπει να ελέγχεται ως μάρτυρας με φορέα τουλάχιστον τρεις φορές σε κάθε τρυβλίο. Πέραν του εν λόγω μάρτυρα με φορέα, εάν ο θετικός μάρτυρας χρησιμοποιεί διαφορετικό φορέα από ό,τι η υπό δοκιμή χημική ουσία, θα πρέπει να ελέγχεται και άλλος μάρτυρας με φορέα τουλάχιστον τρεις φορές στο ίδιο τρυβλίο με τον θετικό μάρτυρα.
|
Κριτήρια ποιότητας για τη δοκιμασία αγωνιστών ER
|
17.
|
Η μέση δραστηριότητα της λουσιφεράσης του θετικού μάρτυρα (1 nM E2) θα πρέπει να είναι τουλάχιστον τετραπλάσια σε σχέση με τη μέση τιμή του μάρτυρα με φορέα σε κάθε τρυβλίο. Το κριτήριο αυτό διαμορφώνεται βάσει της αξιοπιστίας των τιμών παραμέτρου που προέκυψαν από τη μελέτη επικύρωσης (ιστορικά, η δραστικότητα αυτή είναι πολλαπλάσια κατά τέσσερις έως τριάντα φορές).
|
|
18.
|
Όσον αφορά τον ποιοτικό έλεγχο της δοκιμασίας, η πολλαπλάσια επαγωγή που αντιστοιχεί στην τιμή του PC10 του παράλληλου θετικού μάρτυρα (1 nM E2) θα πρέπει να είναι μεγαλύτερη από 1+2SD της τιμής πολλαπλάσιας επαγωγής (=1) του παράλληλου μάρτυρα με φορέα. Για λόγους ιεράρχησης προτεραιοτήτων, η τιμή του θετικού μάρτυρα PC10 μπορεί να είναι χρήσιμη για την απλούστευση της απαιτούμενης ανάλυσης δεδομένων σε σύγκριση με τη στατιστική ανάλυση. Παρότι η στατιστική ανάλυση παρέχει πληροφορίες σχετικά με τη σημαντικότητα, δεν αποτελεί ποσοτική παράμετρο όσον αφορά το δυναμικό με βάση τη συγκέντρωση και, ως εκ τούτου, είναι λιγότερο χρήσιμη για τους σκοπούς της ιεράρχησης προτεραιοτήτων.
|
Κριτήρια ποιότητας για τη δοκιμασία ανταγωνιστών ER
|
19.
|
Η μέση δραστηριότητα της λουσιφεράσης του εμβολιασμένου μάρτυρα (25 pM E2) θα πρέπει να είναι τουλάχιστον τετραπλάσια σε σχέση με τη μέση τιμή του μάρτυρα με φορέα σε κάθε τρυβλίο. Το κριτήριο αυτό διαμορφώνεται βάσει της αξιοπιστίας των τιμών παραμέτρου που προέκυψαν από τη μελέτη επικύρωσης.
|
|
20.
|
Όσον αφορά τον ποιοτικό έλεγχο της δοκιμασίας, η σχετική μεταγραφική ενεργοποίηση (RTA) της E2 1 nM θα πρέπει να είναι μεγαλύτερη από 100 %, ενώ η RTA 1 μΜ 4-υδροξυταμοξιφαίνης (OHT) θα πρέπει να είναι μικρότερη από 40,6 % και η RTA 100 μΜ διγιτονίνης (Dig) θα πρέπει να είναι μικρότερη από 0 %.
Απόδειξη της τεχνικής ικανότητας του εργαστηρίου (βλ. παράγραφο 14 και πίνακες 3 και 4 στην ενότητα «ΣΤΟΙΧΕΙΑ ΤΗΣ ΔΟΚΙΜΑΣΙΑΣ ER TA» της παρούσας μεθόδου δοκιμών)
|
Φορέας
|
21.
|
Ως παράλληλος μάρτυρας με φορέα θα πρέπει να χρησιμοποιείται το διμεθυλοσουλφοξείδιο (DMSO), ή κατάλληλος διαλύτης, στην ίδια συγκέντρωση που χρησιμοποιείται για τους διάφορους θετικούς και αρνητικούς μάρτυρες και τις υπό δοκιμή χημικές ουσίες. Οι υπό δοκιμή χημικές ουσίες θα πρέπει να διαλύονται σε διαλύτη που διαλύει τη συγκεκριμένη υπό δοκιμή χημική ουσία και που αναμειγνύεται με το θρεπτικό μέσο των κυττάρων. Κατάλληλοι φορείς είναι το νερό, η αιθανόλη (καθαρότητας 95 % έως 100 %) και το DMSO. Εάν χρησιμοποιηθεί το DMSO, το επίπεδο δεν πρέπει να υπερβαίνει το 0,1 % κ.ό. Για οποιονδήποτε φορέα, θα πρέπει να καταδεικνύεται ότι ο μέγιστος όγκος που χρησιμοποιήθηκε δεν είναι κυτταροτοξικός και δεν επηρεάζει τις επιδόσεις της δοκιμασίας.
|
Παρασκευή των υπό δοκιμή χημικών ουσιών
|
22.
|
Γενικά, οι υπό δοκιμή χημικές ουσίες θα πρέπει να διαλύονται σε DMSO ή άλλο κατάλληλο διαλύτη και να αραιώνονται διαδοχικά με τον ίδιο διαλύτη σε κοινή αναλογία 1:10 προκειμένου να παρασκευάζονται τα διαλύματα για αραίωση με το θρεπτικό μέσο.
|
Διαλυτότητα και κυτταροτοξικότητα: ζητήματα σχετικά με τον προσδιορισμό εύρους
|
23.
|
Θα πρέπει να διεξάγεται προκαταρκτική δοκιμή για να προσδιορίζεται το κατάλληλο εύρος συγκεντρώσεων της υπό δοκιμή χημικής ουσίας και να διαπιστώνονται τυχόν προβλήματα διαλυτότητας και κυτταροτοξικότητας. Αρχικά, οι χημικές ουσίες ελέγχονται έως τη μέγιστη συγκέντρωση του 1 μl/ml, 1 mg/ml, ή 1 mM, όποιο από τα τρία είναι χαμηλότερο. Με βάση τον βαθμό κυτταροτοξικότητας ή αδιαλυτότητας που παρατηρείται κατά την προκαταρκτική δοκιμή, κατά την πρώτη οριστική σειρά δοκιμών η χημική ουσία θα πρέπει να ελέγχεται σε λογαριθμικές διαδοχικές αραιώσεις ξεκινώντας από τη μέγιστη αποδεκτή συγκέντρωση (π.χ. 1 mM, 100 μΜ, 10 μΜ, κ.λπ.) και να καταγράφεται η παρουσία θολερότητας ή ο σχηματισμός ιζήματος ή η κυτταροτοξικότητα. Οι συγκεντρώσεις στη δεύτερη και, εάν είναι απαραίτητο, στην τρίτη σειρά δοκιμών θα πρέπει να προσαρμόζονται αναλόγως προκειμένου να χαρακτηρίζεται καλύτερα η καμπύλη συγκέντρωσης-απόκρισης και να αποφεύγονται συγκεντρώσεις που διαπιστώνεται ότι είναι μη διαλυτές ή επάγουν υπερβάλλουσα κυτταροτοξικότητα.
|
|
24.
|
Όσον αφορά τους αγωνιστές και ανταγωνιστές ER, η παρουσία αυξανόμενων επιπέδων κυτταροτοξικότητας μπορεί να αλλοιώσει σε σημαντικό βαθμό ή να εξαλείψει την τυπική σιγμοειδή απόκριση και θα πρέπει να συνεκτιμάται κατά την ερμηνεία των δεδομένων. Θα πρέπει να χρησιμοποιούνται μέθοδοι δοκιμών κυτταροτοξικότητας που μπορούν να παράσχουν πληροφορίες σχετικά με το 80 % της κυτταρικής βιωσιμότητας, με χρήση κατάλληλης δοκιμασίας βάσει της εμπειρίας του εργαστηρίου.
|
|
25.
|
Σε περίπτωση που τα αποτελέσματα της δοκιμής κυτταροτοξικότητας δείχνουν ότι η συγκέντρωση της υπό δοκιμή χημικής ουσίας έχει ως αποτέλεσμα τη μείωση του πλήθους των κυττάρων κατά 20 % ή περισσότερο, η εν λόγω συγκέντρωση θα πρέπει να θεωρείται κυτταρροτοξική, και οι συγκεντρώσεις που είναι ισοδύναμες ή υπερβαίνουν την κυτταροτοξική συγκέντρωση θα πρέπει να αποκλείονται από την αξιολόγηση.
|
Έκθεση σε χημικές ουσίες και οργάνωση τρυβλίων της δοκιμασίας
|
26.
|
Η διαδικασία για τις αραιώσεις των χημικών ουσιών (στάδια 1 και 2) και την έκθεση των κυττάρων (στάδιο 3) μπορεί να διενεργηθεί ως εξής:
Στάδιο 1: Κάθε υπό δοκιμή χημική ουσία θα πρέπει να αραιώνεται διαδοχικά σε DMSO, ή κατάλληλο διαλύτη, και να προστίθεται στις κοιλότητες τρυβλίου μικροτιτλοδότησης έτσι ώστε να προκύπτουν οι τελικές διαδοχικές συγκεντρώσεις που έχουν καθοριστεί βάσει της προκαταρκτικής δοκιμής προσδιορισμού εύρους (κατά κανόνα, μια σειρά π.χ. 1 mM, 100 μΜ, 10 μΜ, 1μΜ, 100 nM, 10 nM, 1 nM, 100 pM και 10 pM (10-3-10-11 M)) για δοκιμές εις τριπλούν.
Στάδιο 2: Αραίωση χημικής ουσίας: Αραιώνονται πρώτα 1,5 μl της υπό δοκιμή χημικής ουσίας σε διαλύτη μέχρις όγκου 500 μl θρεπτικού μέσου.
Στάδιο 3: Έκθεση των κυττάρων στη χημική ουσία: Προστίθενται 50 μl αραίωσης με θρεπτικό μέσο (που παρασκευάστηκε κατά το στάδιο 2) σε κοιλότητα της δοκιμασίας που περιέχει 104 κύτταρα/100 μl/κοιλότητα.
Ο συνιστώμενος τελικός όγκος μέσου που πρέπει να υπάρχει σε κάθε κοιλότητα είναι 150 μl. Τα δείγματα και τα πρότυπα αναφοράς της δοκιμής μπορούν να κατανεμηθούν όπως φαίνεται στους πίνακες 3 και 4.
|
Πίνακας 3
Παράδειγμα κατανομής συγκεντρώσεων τρυβλίου των προτύπων αναφοράς στο τρυβλίο δοκιμασίας αγωνιστών ER
|
Σειρά
|
17α-Μεθυλοτεστοστερόνη
|
Κορτικοστερόνη
|
17α-Οιστραδιόλη
|
E2
|
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
|
A
|
συγκ. 1 (10 μΜ)
|
→
|
→
|
100 μΜ
|
→
|
→
|
1 μΜ
|
→
|
→
|
10 nM
|
→
|
→
|
|
Β
|
συγκ. 2 (1 μΜ)
|
→
|
→
|
10 μΜ
|
→
|
→
|
100 nM
|
→
|
→
|
1 nM
|
→
|
→
|
|
Γ
|
συγκ. 3 (100 nM)
|
→
|
→
|
1 μΜ
|
→
|
→
|
10 nM
|
→
|
→
|
100 pM
|
→
|
→
|
|
Δ
|
συγκ. 4 (10 nM)
|
→
|
→
|
100 nM
|
→
|
→
|
1 nM
|
→
|
→
|
10 pM
|
→
|
→
|
|
E
|
συγκ. 5 (1 nM)
|
→
|
→
|
10 nM
|
→
|
→
|
100 pM
|
→
|
→
|
1 pM
|
→
|
→
|
|
ΣΤ
|
συγκ. 6 (100 pM)
|
→
|
→
|
1 nM
|
→
|
→
|
10 pM
|
→
|
→
|
0,1 pM
|
→
|
→
|
|
Ζ
|
συγκ. 7 (10 pM)
|
→
|
→
|
100 pM
|
→
|
→
|
1 pM
|
→
|
→
|
0,01 pM
|
→
|
→
|
|
H
|
VC
|
→
|
→
|
→
|
→
|
→
|
PC
|
→
|
→
|
→
|
→
|
→
|
|
VC: Μάρτυρας με φορέα (0,1 % DMSO), PC: Θετικός μάρτυρας (1 nM E2)
|
|
27.
|
Τα πρότυπα αναφοράς (E2, 17α-οιστραδιόλη, 17α-μεθυλοτεστοστερόνη και κορτικοστερόνη) θα πρέπει να ελέγχονται σε κάθε σειρά δοκιμών (πίνακας 3). Σε κάθε τρυβλίο δοκιμασίας της δοκιμής θα πρέπει να περιλαμβάνονται μόνο οι κοιλότητες θετικού μάρτυρα με 1 nM E2 που μπορούν να προκαλέσουν μέγιστη επαγωγή E2 και οι κοιλότητες μάρτυρα με φορέα που έχουν υποστεί κατεργασία με DMSO (ή κατάλληλο διαλύτη) (πίνακας 4). Σε περίπτωση που στο ίδιο πείραμα χρησιμοποιούνται κύτταρα διαφορετικής προέλευσης (π.χ. διαφορετικού αριθμού ανακαλλιέργειας, διαφορετικής παρτίδας κ.λπ.), τα πρότυπα αναφοράς θα πρέπει να ελέγχονται για τα κύτταρα όλων των προελεύσεων.
|
Πίνακας 4
Παράδειγμα κατανομής συγκεντρώσεων τρυβλίου των υπό δοκιμή χημικών ουσιών και των χημικών ουσιών μαρτύρων τρυβλίου στο τρυβλίο δοκιμασίας αγωνιστών ER
|
Σειρά
|
Υπό δοκιμή χημική ουσία 1
|
Υπό δοκιμή χημική ουσία 2
|
Υπό δοκιμή χημική ουσία 3
|
Υπό δοκιμή χημική ουσία 4
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
|
A
|
συγκ. 1 (10 μΜ)
|
→
|
→
|
1 mM
|
→
|
→
|
1 μΜ
|
→
|
→
|
10 nM
|
→
|
→
|
|
Β
|
συγκ. 2 (1 μΜ)
|
→
|
→
|
100 μΜ
|
→
|
→
|
100 nM
|
→
|
→
|
1 nM
|
→
|
→
|
|
Γ
|
συγκ. 3 (100 nM)
|
→
|
→
|
10 μΜ
|
→
|
→
|
10 nM
|
→
|
→
|
100 pM
|
→
|
→
|
|
Δ
|
συγκ. 4 (10 nM)
|
→
|
→
|
1 μΜ
|
→
|
→
|
1 nM
|
→
|
→
|
10 pM
|
→
|
→
|
|
E
|
συγκ. 5 (1 nM)
|
→
|
→
|
100 nM
|
→
|
→
|
100 pM
|
→
|
→
|
1 pM
|
→
|
→
|
|
ΣΤ
|
συγκ. 6 (100 pM)
|
→
|
→
|
10 nM
|
→
|
→
|
10 pM
|
→
|
→
|
0,1 pM
|
→
|
→
|
|
Ζ
|
συγκ. 7 (10 pM)
|
→
|
→
|
1 nM
|
→
|
→
|
1 pM
|
→
|
→
|
0,01 pM
|
→
|
→
|
|
H
|
VC
|
→
|
→
|
→
|
→
|
→
|
PC
|
→
|
→
|
→
|
→
|
→
|
|
VC: Μάρτυρας με φορέα (0,1 % DMSO), PC: Θετικός μάρτυρας (1 nM E2)
|
Πίνακας 5
Παράδειγμα κατανομής συγκεντρώσεων τρυβλίου των προτύπων αναφοράς στο τρυβλίο δοκιμασίας ανταγωνιστών ER

|
28.
|
Για την αξιολόγηση της ανταγωνιστικής δραστηριότητας των χημικών ουσιών, οι κοιλότητες δοκιμασίας στις σειρές A έως Ζ θα πρέπει να εμβολιάζονται με 25 pM E2. Τα πρότυπα αναφοράς (ταμοξιφαίνη και φλουταμίδη) θα πρέπει να ελέγχονται σε κάθε σειρά δοκιμών. Σε κάθε τρυβλίο δοκιμασίας της δοκιμής θα πρέπει να περιλαμβάνονται οι κοιλότητες θετικού μάρτυρα που υποβάλλονται σε κατεργασία με 1 nM E2 και οι οποίες μπορούν να χρησιμοποιούνται για σκοπούς ποιοτικού ελέγχου της κυτταρικής σειράς hERα-HeLa-9903, οι κοιλότητες μάρτυρα με φορέα που υποβάλλονται σε κατεργασία με DMSO (ή κατάλληλο διαλύτη), οι κοιλότητες 0,1 % DMSO που υποβάλλονται σε κατεργασία με προσθήκη DMSO στην εμβολιασθείσα E2 και που αντιστοιχούν στον εμβολιασμένο μάρτυρα, οι κοιλότητες που υποβάλλονται σε κατεργασία με τελική συγκέντρωση 1 μΜ OHT και οι κοιλότητες που υποβάλλονται σε κατεργασία με 100 μΜ Dig (πίνακας 5). Το επακόλουθο τρυβλίο δοκιμασίας θα πρέπει να έχει την ίδια διάταξη τρυβλίου χωρίς τις κοιλότητες προτύπων αναφοράς (πίνακας 6). Σε περίπτωση που στο ίδιο πείραμα χρησιμοποιούνται κύτταρα διαφορετικής προέλευσης (π.χ. διαφορετικού αριθμού ανακαλλιέργειας, διαφορετικής παρτίδας κ.λπ.), τα πρότυπα αναφοράς θα πρέπει να ελέγχονται για τα κύτταρα όλων των προελεύσεων.
|
Πίνακας 6
Παράδειγμα κατανομής συγκεντρώσεων τρυβλίου των υπό δοκιμή χημικών ουσιών και των χημικών ουσιών μαρτύρων τρυβλίου στο τρυβλίο δοκιμασίας ανταγωνιστών ER

|
29.
|
Θα πρέπει να επιβεβαιώνεται η έλλειψη φαινομένων άκρου (edge effects), όπου απαιτείται, και εάν υπάρχουν υπόνοιες για τέτοια φαινόμενα θα πρέπει να τροποποιείται η διάταξη του τρυβλίου με σκοπό την αποφυγή τους. Για παράδειγμα, μπορεί να εφαρμόζεται διάταξη τρυβλίου στην οποία αποκλείονται οι κοιλότητες των άκρων.
|
|
30.
|
Μετά την προσθήκη των χημικών ουσιών, τα τρυβλία δοκιμασίας θα πρέπει να επωάζονται σε επωαστήρα 5 % CO2 στους 37±1oC επί 20-24 ώρες με σκοπό την επαγωγή των προϊόντων γονιδίου αναφοράς.
|
|
31.
|
Ειδική μέριμνα θα πρέπει να λαμβάνεται για τις ενώσεις υψηλής πτητικότητας. Σε αυτές τις περιπτώσεις, μια παρακείμενη κοιλότητα μάρτυρα μπορεί να οδηγήσει στη λήψη ψευδοθετικού αποτελέσματος, ενδεχόμενο που θα πρέπει να συνεκτιμάται με βάση τις αναμενόμενες τιμές και τις τιμές ιστορικών μαρτύρων. Στις λίγες περιπτώσεις στις οποίες η πτητικότητα μπορεί να αποτελεί πρόβλημα, συνιστάται η χρήση καλυμμάτων σφράγισης των τρυβλίων καθώς μπορεί να βοηθήσει στην αποτελεσματική απομόνωση των κοιλοτήτων κατά τη διάρκεια των δοκιμών.
|
|
32.
|
Προκειμένου να διασφαλίζεται η ανεξαρτησία, θα πρέπει να διεξάγονται επαναλαμβανόμενες οριστικές δοκιμές για την ίδια χημική ουσία σε διαφορετικές ημέρες.
|
Δοκιμασία λουσιφεράσης
|
33.
|
Για τη δοκιμασία μπορεί να χρησιμοποιείται αντιδραστήριο δοκιμασίας λουσιφεράσης του εμπορίου [π.χ. Steady-Glo® Luciferase Assay System (Promega, E2510, ή ισοδύναμο)] ή τυποποιημένο σύστημα δοκιμασίας λουσιφεράσης (π.χ. Promega, E1500, ή ισοδύναμο), εφόσον πληρούνται τα κριτήρια αποδοχής. Τα αντιδραστήρια της δοκιμασίας θα πρέπει να επιλέγονται με βάση την ευαισθησία του λουμινόμετρου που θα χρησιμοποιηθεί. Όταν χρησιμοποιείται το τυποποιημένο σύστημα δοκιμασίας λουσιφεράσης, πριν από την προσθήκη του υποστρώματος θα πρέπει να χρησιμοποιείται αντιδραστήριο λύσης κυτταροκαλλιέργειας (π.χ. Promega, E1531, ή ισοδύναμο). Η εφαρμογή του αντιδραστηρίου λουσιφεράσης θα πρέπει να πραγματοποιείται με βάση τις οδηγίες του παρασκευαστή.
|
ΑΝΑΛΥΣΗ ΤΩΝ ΔΕΔΟΜΕΝΩΝ
Δοκιμασία αγωνιστών ER
|
34.
|
Στην περίπτωση δοκιμασίας αγωνιστών ER, για τη μέτρηση της σχετικής μεταγραφικής δραστηριότητας στον θετικό μάρτυρα PC (1 nM E2) μπορούν να αναλύονται τα σήματα φωταύγειας από το ίδιο τρυβλίο με βάση τα ακόλουθα στάδια (άλλες ισοδύναμες μαθηματικές διαδικασίες είναι επίσης αποδεκτές):
|
Στάδιο 1: Υπολογισμός της μέσης τιμής για τον μάρτυρα με φορέα.
Στάδιο 2: Αφαίρεση της μέσης τιμής του μάρτυρα με φορέα από κάθε κοιλότητα με σκοπό την κανονικοποίηση των δεδομένων.
Στάδιο 3: Υπολογισμός της μέσης τιμής του κανονικοποιημένου θετικού μάρτυρα.
Στάδιο 4: Διαίρεση της κανονικοποιημένης τιμής κάθε κοιλότητας του τρυβλίου διά της μέσης τιμής του κανονικοποιημένου θετικού μάρτυρα (PC=100 %).
Η τελική τιμή κάθε κοιλότητας είναι η σχετική μεταγραφική δραστηριότητα για τη συγκεκριμένη κοιλότητα σε σύγκριση με την απόκριση θετικού μάρτυρα.
Στάδιο 5: Υπολογισμός της μέσης τιμής της σχετικής μεταγραφικής δραστηριότητας για κάθε ομάδα συγκέντρωσης της υπό δοκιμή χημικής ουσίας. Η απόκριση περιλαμβάνει δύο διαστάσεις: τη μέση μεταγραφική δραστηριότητα (απόκριση) και τη συγκέντρωση στην οποία εμφανίζεται η απόκριση (βλ. επόμενη ενότητα).
Παράμετροι επαγωγής EC50, PC50 και PC10
|
35.
|
Για τον υπολογισμό της EC50 είναι απαραίτητη η πλήρης καμπύλη συγκέντρωσης-απόκρισης, χωρίς ωστόσο αυτό να είναι πάντοτε εφικτό ή χρήσιμο στην πράξη λόγω των περιορισμών του εύρους συγκεντρώσεων της δοκιμής (π.χ. λόγω προβλημάτων κυτταροτοξικότητας ή διαλυτότητας). Εντούτοις, καθώς η EC50 και το μέγιστο επίπεδο επαγωγής (που αντιστοιχεί στην ανώτατη τιμή της εξίσωσης Hill) είναι διαφωτιστικές παράμετροι, θα πρέπει να αναφέρονται, όταν αυτό είναι εφικτό. Για τον υπολογισμό της EC50 και του μέγιστου επιπέδου επαγωγής, θα πρέπει να χρησιμοποιείται κατάλληλο λογισμικό στατιστικής ανάλυσης (π.χ. το λογισμικό στατιστικής ανάλυσης Graphpad Prism). Εάν η λογιστική εξίσωση Hill είναι εφαρμοστέα στα δεδομένα απόκρισης συγκέντρωσης, η EC50 θα πρέπει να υπολογίζεται βάσει της ακόλουθης εξίσωσης (7):
Y= ελάχιστη απόκριση + (μέγιστη απόκριση – ελάχιστη απόκριση) / (1+10 exp ((log EC50 -X) x κλίση Hill)), όπου:
X είναι ο λογάριθμος της συγκέντρωσης και
Y είναι η απόκριση, και η Y ξεκινά από την ελάχιστη απόκριση και καταλήγει στη μέγιστη απόκριση ακολουθώντας πορεία σιγμοειδούς καμπύλης. Στη λογιστική εξίσωση Hill, η ελάχιστη απόκριση είναι καθορισμένη σε τιμή μηδέν.
|
|
36.
|
Για κάθε υπό δοκιμή χημική ουσία, θα πρέπει να παρέχονται τα ακόλουθα:
η RPCMax, η οποία είναι το μέγιστο επίπεδο απόκρισης που επάγεται από υπό δοκιμή χημική ουσία, εκφραζόμενη ως ποσοστό της απόκρισης που επάγεται από 1 nM E2 στο ίδιο τρυβλίο, καθώς και η PCMax (η συγκέντρωση που συνδέεται με την RPCMax), και
για τις θετικές χημικές ουσίες, οι συγκεντρώσεις που επάγουν την PC10 και, κατά περίπτωση, την PC50.
|
|
37.
|
Η τιμή PCx μπορεί να υπολογιστεί μέσω παρεκβολής μεταξύ 2 σημείων των συντεταγμένων X-Y, ένα αμέσως υψηλότερο και ένα αμέσως χαμηλότερο από μια τιμή PCx. Αν τα σημεία δεδομένων που βρίσκονται αμέσως υψηλότερα και αμέσως χαμηλότερα από την τιμή PCx έχουν ως συντεταγμένες τις (a,b) και (c,d) αντίστοιχα, τότε η τιμή PCx μπορεί να υπολογιστεί βάσει της ακόλουθης εξίσωσης:
log[PCx] = log[c]+(x-d)/(d-b)
|
|
38.
|
Στο σχήμα 1 παρακάτω παρέχονται περιγραφές των τιμών θετικού μάρτυρα (PC).
Σχήμα 1
Παράδειγμα υπολογισμού τιμών θετικού μάρτυρα (PC). Ο PC (1 nM E2) περιλαμβάνεται σε κάθε τρυβλίο δοκιμασίας

|
Δοκιμασία ανταγωνιστών ER
|
39.
|
Στην περίπτωση δοκιμασίας ανταγωνιστών ER, για τη μέτρηση της σχετικής μεταγραφικής δραστηριότητας (RTA) στον εμβολιασμένο μάρτυρα PC (25 pM E2) μπορούν να αναλύονται τα σήματα φωταύγειας από το ίδιο τρυβλίο με βάση τα ακόλουθα στάδια (άλλες ισοδύναμες μαθηματικές διαδικασίες είναι επίσης αποδεκτές):
Στάδιο 1: Υπολογισμός της μέσης τιμής για τον μάρτυρα με φορέα.
Στάδιο 2: Αφαίρεση της μέσης τιμής του μάρτυρα με φορέα από κάθε κοιλότητα με σκοπό την κανονικοποίηση των δεδομένων. Στάδιο 3: Υπολογισμός της μέσης τιμής του κανονικοποιημένου εμβολιασμένου μάρτυρα.
Στάδιο 4: Διαίρεση της κανονικοποιημένης τιμής κάθε κοιλότητας του τρυβλίου διά της μέσης τιμής του κανονικοποιημένου εμβολιασμένου μάρτυρα (εμβολιασμένος μάρτυρας = 100 %).
Η τελική τιμή κάθε κοιλότητας είναι η σχετική μεταγραφική δραστηριότητα για τη συγκεκριμένη κοιλότητα σε σύγκριση με την απόκριση εμβολιασμένου μάρτυρα.
Στάδιο 5: Υπολογισμός της μέσης τιμής της σχετικής μεταγραφικής δραστηριότητας για κάθε αγωγή.
|
Παράμετροι επαγωγής IC30 και IC50
|
40.
|
Για τις θετικές χημικές ουσίες, θα πρέπει να παρέχονται οι συγκεντρώσεις που επάγουν την IC30 και, κατά περίπτωση, την IC50.
|
|
41.
|
Η τιμή ICx μπορεί να υπολογιστεί μέσω παρεκβολής μεταξύ 2 σημείων των συντεταγμένων X-Y, ένα αμέσως υψηλότερο και ένα αμέσως χαμηλότερο από μια τιμή ICx. Αν τα σημεία δεδομένων που βρίσκονται αμέσως υψηλότερα και αμέσως χαμηλότερα από την τιμή ICx έχουν ως συντεταγμένες τις (c,d) και (a,b) αντίστοιχα, τότε η τιμή ICx μπορεί να υπολογιστεί βάσει της ακόλουθης εξίσωσης:
lin ICx = a-(b-(100-x)) (a-c)/(b-d)
Σχήμα 2
Παράδειγμα υπολογισμού τιμών IC. Ο εμβολιασμένος μάρτυρας (25 pM E2) περιλαμβάνεται σε κάθε τρυβλίο δοκιμασίας

RTA: σχετική μεταγραφική δραστηριότητα
|
|
42.
|
Τα αποτελέσματα θα πρέπει να βασίζονται σε δύο (ή τρεις) ανεξάρτητες σειρές δοκιμών. Σε περίπτωση που από δύο σειρές δοκιμών προκύπτουν συγκρίσιμα και, ως εκ τούτου, αναπαραγώγιμα αποτελέσματα, δεν είναι απαραίτητη η διεξαγωγή τρίτης σειράς δοκιμών. Για να είναι αποδεκτά, τα αποτελέσματα θα πρέπει να πληρούν τις ακόλουθες προϋποθέσεις:
|
—
|
να πληρούν τα κριτήρια αποδοχής (βλ. κριτήρια αποδοχής, παράγραφοι 14-20),
|
|
—
|
να είναι αναπαραγώγιμα.
|
|
Κριτήρια ερμηνείας των δεδομένων
Πίνακας 7
Κριτήρια λήψης απόφασης χαρακτηρισμού του αποτελέσματος ως θετικού ή αρνητικού στη δοκιμασία αγωνιστών ER
|
Θετικό
|
Εάν προκύψει RPCMax που ισοδυναμεί ή υπερβαίνει το 10 % της απόκρισης του θετικού μάρτυρα σε τουλάχιστον δύο από δύο ή δύο από τρεις σειρές δοκιμών.
|
|
Αρνητικό
|
Εάν η RPCMax δεν αντιστοιχεί σε τουλάχιστον 10 % της απόκρισης του θετικού μάρτυρα σε δύο από δύο ή δύο από τρεις σειρές δοκιμών.
|
Πίνακας 8
Κριτήρια λήψης απόφασης χαρακτηρισμού του αποτελέσματος ως θετικού ή αρνητικού στη δοκιμασία ανταγωνιστών ER
|
Θετικό
|
Εάν υπολογίζεται η IC30 σε τουλάχιστον δύο από δύο ή δύο από τρεις σειρές δοκιμών.
|
|
Αρνητικό
|
Εάν δεν μπορεί να υπολογιστεί η IC30 σε δύο από δύο ή δύο από τρεις σειρές δοκιμών.
|
|
43.
|
Τα κριτήρια ερμηνείας των δεδομένων φαίνονται στους πίνακες 7 και 8. Για τα θετικά αποτελέσματα θα πρέπει να αναφέρεται τόσο το μέγεθος της επίδρασης όσο και η συγκέντρωση στην οποία εμφανίζεται η επίδραση. Και τα δύο αυτά επιτυγχάνονται όταν τα αποτελέσματα εκφράζονται ως συγκέντρωση στην οποία επιτυγχάνεται το 50 % (PC50) ή το 10 % (PC10) των τιμών θετικού μάρτυρα (PC) για τη δοκιμασία αγωνιστών, και ως συγκέντρωση στην οποία αναστέλλεται το 50 % (IC50) ή το 30 % (IC30) της τιμής του εμβολιασμένου μάρτυρα για τη δοκιμασία ανταγωνιστών. Ωστόσο, μια υπό δοκιμή χημική ουσία χαρακτηρίζεται θετική εάν η μέγιστη απόκριση που επάγει (RPCMax) είναι ίση ή υπερβαίνει το 10 % της απόκρισης του θετικού μάρτυρα σε τουλάχιστον δύο από δύο ή δύο από τρεις σειρές δοκιμών, ενώ θεωρείται αρνητική εάν η RPCMax δεν αντιστοιχεί στο 10 % τουλάχιστον της απόκρισης του θετικού μάρτυρα σε δύο από δύο ή δύο από τρεις σειρές δοκιμών.
|
|
44.
|
Οι τιμές των PC10, PC50 και PCMax στη δοκιμασία αγωνιστών ER και οι τιμές των IC30 και IC50 στη δοκιμασία ανταγωνιστών ER μπορούν να υπολογιστούν με χρήση υπολογιστικού φύλλου που διατίθεται με την κατευθυντήρια γραμμή δοκιμών στον δημόσιο δικτυακό τόπο του ΟΟΣΑ (63).
|
|
45.
|
Ο υπολογισμός των τιμών PC10 ή PC50 και IC30 ή IC50 τουλάχιστον δύο φορές αναμένεται ότι θα είναι επαρκής. Εντούτοις, σε περίπτωση που η προκύπτουσα γραμμή βάσης για τα δεδομένα στο ίδιο εύρος συγκεντρώσεων εμφανίζει μεταβλητότητα με απαράδεκτα υψηλό συντελεστή μεταβλητότητας (CV, %), τα δεδομένα δεν μπορούν να θεωρηθούν αξιόπιστα και θα πρέπει να προσδιορίζεται η αιτία της υψηλής μεταβλητότητας. Ο συντελεστής μεταβλητότητας των τριπλών ανεπεξέργαστων δεδομένων (δηλ. τα δεδομένα έντασης φωταύγειας) των σημείων δεδομένων που χρησιμοποιούνται για τον υπολογισμό του PC10 θα πρέπει να μην υπερβαίνει το 20 %.
|
|
46.
|
Η συμμόρφωση με τα κριτήρια αποδοχής υποδεικνύει ότι το σύστημα δοκιμασίας λειτουργεί σωστά, αλλά δεν διασφαλίζει ότι οποιαδήποτε συγκεκριμένη σειρά δοκιμών θα παράξει ορθά δεδομένα. Η επανάληψη των αποτελεσμάτων της πρώτης σειράς δοκιμών είναι ο καλύτερος τρόπος να επιβεβαιώνεται ότι παρήχθησαν ορθά δεδομένα.
|
|
47.
|
Σε περίπτωση δοκιμασίας αγωνιστών ER, όταν απαιτούνται περισσότερες πληροφορίες για τις θετικές υπό δοκιμή χημικές ουσίες, για σκοπούς πέρα από τη διαλογή και την ιεράρχηση προτεραιοτήτων της παρούσας κατευθυντήριας γραμμής δοκιμών, ιδίως για τις χημικές ουσίες PC10-PC49 και για τις χημικές ουσίες για τις οποίες υπάρχουν υπόνοιες ότι υπερενεργοποιούν τη λουσιφεράση, μπορεί να χρησιμοποιηθεί ανταγωνιστής του ERα για να επιβεβαιωθεί ότι η παρατηρούμενη δραστηριότητα λουσιφεράσης αποτελεί αποκλειστικά και μόνο απόκριση που σχετίζεται με τον ERα (βλ. προσάρτημα 2.1).
|
ΕΚΘΕΣΗ ΔΟΚΙΜΗΣ
|
48.
|
Βλ. παράγραφο 20 της ενότητας «ΣΤΟΙΧΕΙΑ ΔΟΚΙΜΑΣΙΑΣ ER TA».
|
ΒΙΒΛΙΟΓΡΑΦΙΑ
|
(1)
|
OECD (2015). Report of the Inter-Laboratory Validation for Stably Transfected Transactivation Assay to detect Estrogenic and Anti-estrogenic Activity. Environment, Health and Safety Publications, Series on Testing and Assessment (No 225), Organisation for Economic Cooperation and Development, Paris.
|
|
(2)
|
Escande A., et al. (2006). Evaluation of Ligand Selectivity Using Reporter Cell Lines Stably Expressing Estrogen Receptor Alpha or Beta, Biochem. Pharmacol., 71, 1 459-1 469.
|
|
(3)
|
Kuiper G.G., et al. (1998). Interaction of Estrogenic Chemicals and Phytoestrogens with Estrogen Receptor Beta, Endocrinol., 139, 4 252-4 263.
|
|
(4)
|
Spaepen M., et al. (1992). Detection of Bacterial and Mycoplasma Contamination in Cell Cultures by Polymerase Chain Reaction, FEMS Microbiol. Lett., 78(1), 89-94.
|
|
(5)
|
Kobayashi H., et al. (1995). Rapid Detection of Mycoplasma Contamination in Cell Cultures by Enzymatic Detection of Polymerase Chain Reaction (PCR) Products, J. Vet. Med. Sci., 57(4), 769- 71.
|
|
(6)
|
Dussurget O. and Roulland-Dussoix D. (1994). Rapid, Sensitive PCR-Based Detection of Mycoplasmas in Simulated Samples of Animal Sera, Appl. Environ. Microbiol., 60(3), 953-9.
|
|
(7)
|
De Lean A., Munson P.J. and Rodbard D. (1978). Simultaneous Analysis of Families of Sigmoidal Curves: Application to Bioassay, Radioligand Assay, and Physiological Dose-Response Curves, Am. J. Physiol., 235, E97-El02.
|
Προσάρτημα 2.1
ΨΕΥΔΟΘΕΤΙΚΕΣ ΕΚΒΑΣΕΙΣ: ΑΞΙΟΛΟΓΗΣΗ ΣΗΜΑΤΩΝ ΦΩΤΑΥΓΕΙΑΣ ΠΟΥ ΔΕΝ ΜΕΣΟΛΑΒΟΥΝΤΑΙ ΑΠΟ ΥΠΟΔΟΧΕΑ
|
1.
|
Οι ψευδοθετικές εκβάσεις στη δοκιμασία αγωνιστών ER μπορεί να οφείλονται σε ενεργοποίηση του γονιδίου λουσιφεράσης χωρίς μεσολάβηση ER ή σε άμεση ενεργοποίηση του γονιδιακού προϊόντος ή σε φθορισμό από άσχετη πηγή. Τέτοιες επιδράσεις αναγνωρίζονται από ατελή ή ασυνήθη καμπύλη δόσης-απόκρισης. Σε περίπτωση που υπάρχουν υπόνοιες για παρόμοιες επιδράσεις, θα πρέπει να εξετάζεται η επίδραση ενός ανταγωνιστή ER [π.χ. 4-υδροξυταμοξιφαίνη (OHT) σε μη τοξική συγκέντρωση] επί της απόκρισης. Ο καθαρός ανταγωνιστής ICI 1827 80 μπορεί να μην είναι κατάλληλος για αυτόν τον σκοπό, δεδομένου ότι επαρκής συγκέντρωση ICI 1827 80 μπορεί να μειώσει την τιμή του μάρτυρα με φορέα (VC), με αποτέλεσμα να επηρεαστεί η ανάλυση δεδομένων.
|
|
2.
|
Για να διασφαλίζεται η εγκυρότητα της προσέγγισης, θα πρέπει να ελέγχονται τα ακόλουθα στο ίδιο τρυβλίο:
|
—
|
αγωνιστική δραστικότητα της άγνωστης χημικής ουσίας με/χωρίς 10 μΜ OHT
|
|
—
|
1 nM E2 (εις τριπλούν) ως θετικός μάρτυρας αγωνιστή
|
|
—
|
1 nM E2 + OHT (εις τριπλούν)
|
|
Κριτήρια ερμηνείας των δεδομένων
Σημείωση: όλες οι κοιλότητες θα πρέπει να υποβάλλονται σε αγωγή με την ίδια συγκέντρωση του φορέα.
|
—
|
Εάν η αγωνιστική δραστικότητα της άγνωστης χημικής ουσίας ΔΕΝ επηρεάζεται από την αγωγή με τον ανταγωνιστή ER, ταξινομείται ως «αρνητική».
|
|
—
|
Εάν η αγωνιστική δραστικότητα της άγνωστης χημικής ουσίας αναστέλλεται πλήρως, εφαρμόστε τα κριτήρια λήψης απόφασης.
|
|
—
|
Εάν η αγωνιστική δραστικότητα στη χαμηλότερη συγκέντρωση ισούται με ή υπερβαίνει την απόκριση PC10, η άγνωστη χημική ουσία αναστέλλεται σε ποσοστό ίσο ή μεγαλύτερο από αυτόν της απόκρισης PC10. Υπολογίζεται η διαφορά στις αποκρίσεις μεταξύ των κοιλοτήτων που δεν υποβλήθηκαν σε αγωγή και των κοιλοτήτων που υποβλήθηκαν σε αγωγή με τον ανταγωνιστή ER, και αυτή η διαφορά θα πρέπει να θεωρείται η πραγματική απόκριση και να χρησιμοποιείται για τον υπολογισμό των κατάλληλων παραμέτρων για τη λήψη απόφασης περί της ταξινόμησης.
|
Ανάλυση δεδομένων
Έλεγχος του προτύπου επιδόσεων.
Έλεγχος του συντελεστή μεταβλητότητας (CV) μεταξύ των κοιλοτήτων που υποβλήθηκαν σε αγωγή υπό τις ίδιες συνθήκες.
|
1.
|
Υπολογισμός της μέσης τιμής του μάρτυρα με φορέα (VC)
|
|
2.
|
Αφαίρεση της μέσης τιμής μάρτυρα με φορέα από την τιμή κάθε κοιλότητας που δεν υποβλήθηκε σε αγωγή με OHT
|
|
3.
|
Υπολογισμός της μέσης τιμής OHT
|
|
4.
|
Αφαίρεση της μέσης τιμής μάρτυρα με φορέα από την τιμή κάθε κοιλότητας που υποβλήθηκε σε αγωγή με OHT
|
|
5.
|
Υπολογισμός της μέσης τιμής θετικού μάρτυρα
|
|
6.
|
Υπολογισμός της σχετικής μεταγραφικής δραστικότητας όλων των υπόλοιπων κοιλοτήτων σε σχέση με τον θετικό μάρτυρα.
|
Προσάρτημα 2.2
ΠΑΡΑΣΚΕΥΗ ΟΡΟΥ ΠΟΥ ΥΠΟΒΑΛΛΕΤΑΙ ΣΕ ΚΑΤΕΡΓΑΣΙΑ ΜΕ ΕΠΙΧΡΙΣΜΕΝΟ ΜΕ ΔΕΞΤΡΑΝΗ ΕΝΕΡΓΟ ΑΝΘΡΑΚΑ (DCC)
|
1.
|
Η κατεργασία ορού με επιχρισμένο με δεξτράνη ενεργό άνθρακα (DCC) αποτελεί γενική μέθοδο απομάκρυνσης των οιστρογονικών ενώσεων από τον ορό που προστίθεται στο θρεπτικό μέσο των κυττάρων, με σκοπό τον αποκλεισμό της εσφαλμένης απόκρισης που συνδέεται με κατάλοιπα οιστρογόνων στον ορό. Με τη διαδικασία αυτή μπορούν να υποβληθούν σε κατεργασία 500 ml βόειου εμβρυϊκού ορού (FBS).
|
Στοιχεία
|
2.
|
Θα χρειαστούν τα ακόλουθα υλικά και εξοπλισμός:
|
Υλικά
|
Εξάνυδρο χλωριούχο μαγνήσιο (MgCl2·6H2O)
|
|
Ρυθμιστικό διάλυμα HEPES 1 M (pH 7,4)
|
|
Υπερκαθαρό νερό από σύστημα φίλτρων
|
Εξοπλισμός
Αποστειρωμένος σε αυτόκαυστο γυάλινος περιέκτης (το μέγεθός του θα πρέπει να προσαρμόζεται κατάλληλα) Φυγόκεντρος εργαστηρίου γενικής χρήσης (που μπορεί να ρυθμιστεί σε θερμοκρασία 4 °C)
Διαδικασία
|
3.
|
Η ακόλουθη διαδικασία έχει προσαρμοστεί για τη χρήση σωλήνων φυγοκέντρου 50 ml:
[Ημέρα 1] Παρασκευή εναιωρήματος επιχρισμένου με δεξτράνη ενεργού άνθρακα με 1 L υπερκαθαρού νερού που περιέχει 1,5 mM MgCl2, 0,25 M σακχαρόζης, 2,5 g ενεργού άνθρακα, 0,25 g δεξτράνης και 5 mM HEPES και ολονύχτια ανάδευση στους 4 °C.
[Ημέρα 2] Μετάγγιση του εναιωρήματος σε σωλήνες φυγοκέντρου των 50 ml και φυγοκέντρηση στις 10 000 σ.α.λ. στους 4 °C επί 10 λεπτά. Αφαίρεση του υπερκείμενου υγρού και φύλαξη του μισού ιζήματος ενεργού άνθρακα στους 4 °C για χρήση την ημέρα 3. Εναιώρηση του υπόλοιπου μισού ενεργού άνθρακα με FBS που έχει αποψυχθεί με ήπιο τρόπο ώστε να αποφευχθεί η καθίζηση, αδρανοποίηση σε θερμοκρασία 56 °C επί 30 λεπτά και, κατόπιν, μεταφορά σε αποστειρωμένο γυάλινο περιέκτη, π.χ. φιάλη Erlenmeyer. Ολονύχτια ανάδευση του εναιωρήματος στους 4 °C.
[Ημέρα 3] Μετάγγιση του εναιωρήματος με το FBS σε σωλήνες φυγοκέντρου και φυγοκέντρηση στις 10 000 σ.α.λ. στους 4 °C επί 10 λεπτά. Συλλογή του FBS και μεταφορά στο νέο ίζημα ενεργού άνθρακα που έχει παρασκευαστεί και φυλαχθεί την ημέρα 2. Εναιώρηση του ιζήματος ενεργού άνθρακα και ολονύχτια ήπια ανάδευση του εναιωρήματος σε αποστειρωμένο γυάλινο περιέκτη στους 4 °C.
[Ημέρα 4] Μετάγγιση του εναιωρήματος για φυγοκέντρηση στις 10 000 σ.α.λ. στους 4 °C επί 10 λεπτά και αποστείρωση του υπερκείμενου υγρού με διήθηση μέσα από στείρο φίλτρο 0,2 μm. Αυτός ο ορός FBS που έχει υποβληθεί σε κατεργασία με DCC θα πρέπει να φυλάσσεται στους -20 °C και μπορεί να χρησιμοποιηθεί εντός διαστήματος ενός έτους το πολύ.
|
Προσαρτημα 3
ΔΟΚΙΜΑΣΙΑ ΔΙΕΝΕΡΓΟΠΟΙΗΣΗΣ ΥΠΟΔΟΧΕΑ ΟΙΣΤΡΟΓΟΝΩΝ VM7LUC ΓΙΑ ΤΟΝ ΠΡΟΣΔΙΟΡΙΣΜΟ ΑΓΩΝΙΣΤΩΝ ΚΑΙ ΑΝΤΑΓΩΝΙΣΤΩΝ ΥΠΟΔΟΧΕΑ ΟΙΣΤΡΟΓΟΝΩΝ
ΑΡΧΙΚΕΣ ΕΚΤΙΜΗΣΕΙΣ ΚΑΙ ΠΕΡΙΟΡΙΣΜΟΙ (ΒΛ. ΕΠΙΣΗΣ ΓΕΝΙΚΗ ΕΙΣΑΓΩΓΗ)
|
1.
|
Η παρούσα δοκιμασία χρησιμοποιεί την κυτταρική σειρά VM7Luc4E2 (64). Έχει επικυρωθεί από το National Toxicology Program Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM), και την Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) (Διυπηρεσιακή Συντονιστική Επιτροπή για την Επικύρωση Εναλλακτικών Μεθόδων) (1). Οι κυτταρικές σειρές VM7Luc εκφράζουν κατά κύριο λόγο ενδογενή ERα και μικρή ποσότητα ERβ (2) (3) (4).
|
|
2.
|
Η παρούσα δοκιμασία εφαρμόζεται σε ευρύ φάσμα ουσιών, υπό την προϋπόθεση ότι μπορούν να διαλυθούν σε διμεθυλοσουλφοξείδιο (DMSO, CASRN 67-68-5), δεν αντιδρούν με το DMSO ή το μέσο κυτταροκαλλιέργειας και δεν είναι κυτταροτοξικές στις υπό δοκιμή συγκεντρώσεις. Σε περίπτωση που δεν είναι εφικτή η χρήση DMSO, μπορεί να χρησιμοποιείται άλλος φορέας όπως η αιθανόλη ή το νερό (βλ. παράγραφο 12). Οι καταδειχθείσες επιδόσεις της δοκιμασίας (αντ-)αγωνιστών VM7Luc ER TA υποδεικνύουν ότι η εν λόγω δοκιμασία μπορεί να παρέχει διαφωτιστικά δεδομένα σχετικά με τους μηχανισμούς δράσης που μεσολαβούνται από τους ER, τα οποία μπορούν να λαμβάνονται υπόψη για την κατά προτεραιότητα ιεράρχηση των ουσιών προς διεξαγωγή περαιτέρω δοκιμών.
|
|
3.
|
Η παρούσα δοκιμασία έχει σχεδιαστεί ειδικά για την ανίχνευση της μεσολαβούμενης από τον hERα και τον hERβ TA μέσω μέτρησης της χημειοφωταύγειας ως παραμέτρου. Η χρήση της χημειοφωταύγειας στις βιοδοκιμασίες αποτελεί ευρέως διαδεδομένη πρακτική διότι η φωταύγεια έχει υψηλή αναλογία σήματος προς υπόβαθρο. Εντούτοις, ουσίες που αναστέλλουν το ένζυμο λουσιφεράση μπορούν να προκαλέσουν σύγχυση ως προς τη δραστικότητα της λουσιφεράσης της πυγολαμπίδας σε κυτταρικές δοκιμασίες, προκαλώντας είτε φαινομενική αναστολή είτε αυξημένη φωταύγεια λόγω σταθεροποίησης πρωτεϊνών. Επιπλέον, σε ορισμένες δοκιμασίες γονιδίου αναφοράς ER που χρησιμοποιούν τη λουσιφεράση, έχουν αναφερθεί σήματα φωταύγειας που δεν μεσολαβούνται από υποδοχείς σε συγκεντρώσεις φυτοοιστρογόνων υψηλότερες του 1 μΜ λόγω υπερενεργοποίησης του γονιδίου αναφοράς λουσιφεράσης (9) (11). Παρότι η καμπύλη δόσης-απόκρισης υποδεικνύει ότι η πραγματική ενεργοποίηση του συστήματος ER λαμβάνει χώρα σε χαμηλότερες συγκεντρώσεις, η έκφραση της λουσιφεράσης που επιτυγχάνεται σε υψηλές συγκεντρώσεις φυτοοιστρογόνων ή ανάλογων ενώσεων για τις οποίες υπάρχουν υπόνοιες ότι επάγουν ανάλογη με τα φυτοοιστρογόνα υπερενεργοποίηση του γονιδίου αναφοράς λουσιφεράσης πρέπει να εξετάζεται προσεκτικά σε συστήματα δοκιμασίας ER TA σταθερώς διαμολυνθέντων κυττάρων (βλ. προσάρτημα 2).
|
|
4.
|
Πριν από τη χρήση της παρούσας δοκιμασίας για κανονιστικούς σκοπούς, θα πρέπει να μελετηθούν οι ενότητες «ΓΕΝΙΚΗ ΕΙΣΑΓΩΓΗ» και «ΣΤΟΙΧΕΙΑ ΔΟΚΙΜΑΣΙΑΣ ER TA». Οι ορισμοί και οι συντομογραφίες που χρησιμοποιούνται στην παρούσα μέθοδο δοκιμών παρατίθενται στο προσάρτημα 1.
|
ΑΡΧΗ ΤΗΣ ΔΟΚΙΜΑΣΙΑΣ (ΒΛ. ΕΠΙΣΗΣ ΓΕΝΙΚΗ ΕΙΣΑΓΩΓΗ)
|
5.
|
Η δοκιμασία χρησιμοποιείται για τον προσδιορισμό της δέσμευσης προσδεμάτων στον ER, την οποία ακολουθεί η μετατόπιση του συμπλόκου υποδοχέα-προσδέματος στον πυρήνα. Στον πυρήνα, το σύμπλοκο υποδοχέα-προσδέματος δεσμεύεται σε ειδικά στοιχεία απόκρισης του DNA και διενεργοποιεί το γονίδιο αναφοράς (luc), με αποτέλεσμα την παραγωγή λουσιφεράσης και την επακόλουθη εκπομπή φωτός, η οποία μπορεί να προσδιοριστεί ποσοτικά με χρήση λουμινόμετρου. Η δραστηριότητα της λουσιφεράσης μπορεί να αξιολογηθεί γρήγορα και με χαμηλό κόστος με χρήση διαφόρων κιτ δοκιμής του εμπορίου. Η ER TA VM7Luc χρησιμοποιεί μια ανθρώπινη κυτταρική σειρά αδενοκαρκινώματος του μαστού που αποκρίνεται στον ER, τη VM7, η οποία έχει διαμολυνθεί σταθερά με κατασκεύασμα γονιδίου αναφοράς luc της πυγολαμπίδας υπό τον έλεγχο τεσσάρων στοιχείων απόκρισης σε οιστρογόνα που βρίσκονται ανάντη του υποκινητή ιούκαρκίνου του μαστού του ποντικού (MMTV), για την ανίχνευση ουσιών με in vitro δραστικότητα αγωνιστή ή ανταγωνιστή για τον ER. Ο εν λόγω υποκινητής MMTV παρουσιάζει περιορισμένη μόνο διασταυρούμενη αντίδραση σε άλλες στεροειδείς και μη στεροειδείς ορμόνες (8). Τα κριτήρια για την ερμηνεία των δεδομένων περιγράφονται αναλυτικά στην παράγραφο 41. Εν συντομία, η θετική απόκριση προσδιορίζεται βάσει καμπύλης συγκέντρωσης-απόκρισης που περιέχει τουλάχιστον τρία σημεία με μη επικαλυπτόμενες ράβδους σφάλματος (μέση τιμή ± SD), καθώς και βάσει της μεταβολής του πλάτους [κανονικοποιημένη σχετική μονάδα φωτός (RLU)] κατά τουλάχιστον 20 % της μέγιστης τιμής του προτύπου αναφοράς (17β-οιστραδιόλη [E2, CASRN 50-28-2] για τη δοκιμασία αγωνιστών, υδροχλωρική ραλοξιφαίνη [Ral, CASRN 84 449-90-1]/E2 για τη δοκιμασία ανταγωνιστών).
|
ΔΙΑΔΙΚΑΣΙΑ
Κυτταρική σειρά
|
6.
|
Για τη δοκιμασία θα πρέπει να χρησιμοποιείται η σταθερώς διαμολυνθείσα κυτταρική σειρά VM7Luc4E2. Προς το παρόν η κυτταρική σειρά διατίθεται μόνο κατόπιν σύναψης συμφωνίας άδειας τεχνικής συνδρομής με το πανεπιστήμιο της Καλιφόρνια (Davis, Καλιφόρνια, ΗΠΑ) (65) και τη Xenobiotic Detection Systems Inc. (Durham, Βόρεια Καρολίνα, ΗΠΑ) (66).
|
Σταθερότητα της κυτταρικής σειράς
|
7.
|
Για τη διατήρηση της σταθερότητας και της ακεραιότητας της κυτταρικής σειράς, τα κύτταρα θα πρέπει να καλλιεργούνται για περισσότερες από μία ανακαλλιέργειες από το κατεψυγμένο απόθεμα σε θρεπτικά μέσα συντήρησης κυττάρων (βλ. παράγραφο 9). Τα κύτταρα δεν θα πρέπει να καλλιεργούνται για περισσότερες από 30 ανακαλλιέργειες. Για την κυτταρική σειρά VM7Luc4E2, οι 30 ανακαλλιέργειες διαρκούν περίπου τρεις μήνες.
|
Συνθήκες καλλιέργειας και επίστρωσης κυττάρων
|
8.
|
Για τη διασφάλιση της ποιότητας όλων των υλικών και των μεθόδων, με σκοπό τη διαφύλαξη της ακεραιότητας, της εγκυρότητας και της αναπαραγωγιμότητας κάθε εκτελούμενης εργασίας, θα πρέπει να ακολουθούνται οι διαδικασίες που περιγράφονται στο υλικό καθοδήγησης σχετικά με την ορθή πρακτική καλλιέργειας κυττάρων (5) (6).
|
|
9.
|
Τα κύτταρα VM7Luc4E2 συντηρούνται σε θρεπτικό μέσο RPMI 1 640 που έχει συμπληρωθεί με 0,9 % Pen-Strep και 8,0 % βόειου εμβρυϊκού ορού (FBS) σε επωαστήρα καλλιέργειας ιστών αποκλειστικής χρήσης, σε θερμοκρασία 37oC ± 1oC, υγρασία 90 % ± 5 % και 5,0 % ± 1 % CO2/αέρα.
|
|
10.
|
Μετά την επίτευξη συρροής ~80 %, τα κύτταρα VM7Luc4E2 ανακαλλιεργούνται και εγκλιματίζονται σε περιβάλλον ελεύθερο οιστρογόνων επί 48 ώρες, προτού επιστρωθούν σε τρυβλία 96 κοιλοτήτων με σκοπό την έκθεσή τους στις υπό δοκιμή χημικές ουσίες και την ανάλυση της επαγόμενης από τα οιστρογόνα δραστικότητας λουσιφεράσης. Το ελεύθερο οιστρογόνων μέσο (EFM) περιέχει τροποποιημένο μέσο Eagle του Dulbecco (DMEM) χωρίς ερυθρό της φαινόλης, συμπληρωμένο με 4,5 % κατεργασμένου με ενεργό άνθρακα/δεξτράνη FBS, 1,9 % L-γλουταμίνη, και 0,9 % Pen-Strep. Ο πλαστικός εξοπλισμός θα πρέπει να είναι στο σύνολό του ελεύθερος οιστρογονικής δραστικότητας [βλ. αναλυτικό πρωτόκολλο (7)].
|
Κριτήρια αποδοχής
|
11.
|
Η αποδοχή ή απόρριψη μιας δοκιμής εξαρτάται από την αξιολόγηση των αποτελεσμάτων των προτύπων αναφοράς και των μαρτύρων κάθε πειράματος που διεξήχθη σε τρυβλίο 96 κοιλοτήτων. Κάθε πρότυπο αναφοράς ελέγχεται σε πολλές συγκεντρώσεις και λαμβάνονται πολλαπλά δείγματα από κάθε συγκέντρωση αναφοράς και μάρτυρα. Τααποτελέσματα συγκρίνονται με τους ποιοτικούς ελέγχους (QC) για τις εν λόγω παραμέτρους που έχουν ληφθεί από τις βάσεις ιστορικών δεδομένων αγωνιστών και ανταγωνιστών που δημιουργεί κάθε εργαστήριο στο πλαίσιο της διαδικασίας απόδειξης της τεχνικής ικανότητας. Οι βάσεις ιστορικών δεδομένων επικαιροποιούνται διαρκώς με τις τιμές προτύπων αναφοράς και μαρτύρων. Οι αλλαγές στον εξοπλισμό ή τις εργαστηριακές συνθήκες ενδέχεται να επιβάλουν την επικαιροποίηση των βάσεων ιστορικών δεδομένων.
|
Δοκιμή αγωνιστών
Δοκιμή προσδιορισμού εύρους
|
•
|
Επαγωγή: Η επαγωγή των τρυβλίων θα πρέπει να μετράται με διαίρεση της μέσης ανώτατης τιμής σχετικής μονάδας φωτός των προτύπων αναφοράς E2 (RLU) διά της μέσης τιμής RLU των μαρτύρων DMSO. Συνήθως επιτυγχάνεται πενταπλάσια επαγωγή αλλά, για σκοπούς ελέγχου αποδοχής, η επαγωγή θα πρέπει να είναι τετραπλάσια ή μεγαλύτερη.
|
|
•
|
Αποτελέσματα μάρτυρα DMSO: Οι τιμές RLU των μαρτύρων με διαλύτη δεν θα πρέπει να υπερβαίνουν κατά περισσότερο από 2,5 φορές την τυπική απόκλιση της μέσης τιμής RLU των ιστορικών μαρτύρων με διαλύτη.
|
|
•
|
Σε περίπτωση που ένα πείραμα δεν πληροί οποιοδήποτε από τα δύο κριτήρια αποδοχής, θα πρέπει να απορρίπτεται και να επαναλαμβάνεται.
|
Συνολική δοκιμή
Περιλαμβάνει τα κριτήρια αποδοχής της δοκιμής προσδιορισμού εύρους αγωνιστών και τα ακόλουθα κριτήρια:
|
•
|
Αποτελέσματα προτύπων αναφοράς: Η πρότυπη καμπύλη συγκέντρωσης-απόκρισης προτύπων αναφοράς E2 θα πρέπει να είναι σιγμοειδούς σχήματος και να περιλαμβάνει τουλάχιστον τρεις τιμές εντός του γραμμικού τμήματός της.
|
|
•
|
Αποτελέσματα θετικού μάρτυρα: Οι τιμές RLU του μάρτυρα methoxychlor θα πρέπει να υπερβαίνουν τη μέση τιμή του DMSO συν τρεις φορές την τυπική απόκλιση από τη μέση τιμή του DMSO.
|
|
•
|
Σε περίπτωση που ένα πείραμα δεν πληροί οποιοδήποτε από τα κριτήρια αποδοχής, θα πρέπει να απορρίπτεται και να επαναλαμβάνεται.
|
Δοκιμή ανταγωνιστών
Δοκιμή προσδιορισμού εύρους
|
•
|
Μείωση: Η μείωση στα τρυβλία θα πρέπει να μετράται με διαίρεση της μέσης ανώτατης τιμής RLU των προτύπων αναφοράς Ral/E2 διά της μέσης τιμής RLU των μαρτύρων DMSO. Συνήθως επιτυγχάνεται πενταπλάσια μείωση αλλά, για σκοπούς ελέγχου αποδοχής, η μείωση θα πρέπει να είναι τριπλάσια ή μεγαλύτερη.
|
|
•
|
Αποτελέσματα μαρτύρων E2: Οι τιμές RLU των μαρτύρων E2 δεν θα πρέπει να υπερβαίνουν κατά περισσότερο από 2,5 φορές την τυπική απόκλιση της μέσης τιμής RLU των ιστορικών μαρτύρων E2.
|
|
•
|
Αποτελέσματα μαρτύρων DMSO: Οι τιμές RLU των μαρτύρων DMSO δεν θα πρέπει να υπερβαίνουν κατά περισσότερο από 2,5 φορές την τυπική απόκλιση της μέσης τιμής RLU των ιστορικών μαρτύρων με διαλύτη.
|
|
•
|
Σε περίπτωση που ένα πείραμα δεν πληροί οποιοδήποτε από τα κριτήρια αποδοχής, θα απορρίπτεται και θα επαναλαμβάνεται.
|
Συνολική δοκιμή
Περιλαμβάνει τα κριτήρια αποδοχής της δοκιμής προσδιορισμού εύρους ανταγωνιστών και τα ακόλουθα κριτήρια:
|
•
|
Αποτελέσματα προτύπων αναφοράς: Η πρότυπη καμπύλη συγκέντρωσης-απόκρισης προτύπων αναφοράς Ral/E2 θα πρέπει να είναι σιγμοειδούς σχήματος και να περιλαμβάνει τουλάχιστον τρεις τιμές εντός του γραμμικού τμήματός της.
|
|
•
|
Αποτελέσματα θετικού μάρτυρα: Οι τιμές RLU του μάρτυρα ταμοξιφαίνης/Ε2 δεν θα πρέπει να υπερβαίνουν τη μέση τιμή μάρτυρα Ε2 μείον τρεις φορές την τυπική απόκλιση από τη μέση τιμή μάρτυρα Ε2.
|
|
•
|
Σε περίπτωση που ένα πείραμα δεν πληροί οποιοδήποτε από τα κριτήρια αποδοχής, θα απορρίπτεται και θα επαναλαμβάνεται.
|
Πρότυπα αναφοράς, θετικοί μάρτυρες και μάρτυρες με φορέα
Μάρτυρας με φορέα (δοκιμασίες αγωνιστών και ανταγωνιστών)
|
12.
|
Ο φορέας που χρησιμοποιείται για τη διάλυση των υπό δοκιμή χημικών ουσιών θα πρέπει να ελέγχεται ως μάρτυρας με φορέα. Ο φορέας που χρησιμοποιήθηκε κατά την επικύρωση της δοκιμασίας ER TA VM7Luc ήταν 1 % κ.ό. διμεθυλοσουλφοξείδιο (DMSO, CASRN 67-68-5) (βλ. παράγραφο 24). Σε περίπτωση που χρησιμοποιείται φορέας διαφορετικός από το DMSO, όλα τα πρότυπα αναφοράς, οι μάρτυρες και οι υπό δοκιμή χημικές ουσίες θα πρέπει να ελέγχονται στον ίδιο φορέα, ανάλογα με την περίπτωση.
|
Πρότυπο αναφοράς (προσδιορισμός εύρους αγωνιστών)
|
13.
|
Το πρότυπο αναφοράς είναι η E2 (CASRN 50-28-2). Για δοκιμές προσδιορισμού του εύρους, το πρότυπο αναφοράς περιλαμβάνει τέσσερις συγκεντρώσεις E2 από διαδοχικές αραιώσεις (1,84 x 10-10, 4,59 x 10-11, 1,15 x 10-11 και 2,87 x 10-12 M), με κάθε συγκέντρωση να ελέγχεται σε διπλές κοιλότητες.
|
Πρότυπο αναφοράς (ολοκληρωμένη δοκιμή αγωνιστών)
|
14.
|
Η E2 για ολοκληρωμένες δοκιμές περιλαμβάνει 11 συγκεντρώσεις E2 από διαδοχικές αραιώσεις 1:2 (από 3,67 x 10-10 έως 3,59 x 10-13 M) σε διπλές κοιλότητες.
|
Πρότυπο αναφοράς (προσδιορισμός εύρους ανταγωνιστών)
|
15.
|
Το πρότυπο αναφοράς αποτελεί συνδυασμό Ral (CASRN 84 449-90-1) και E2 (CASRN 50-28-2). Τα πρότυπα Ral/E2 για δοκιμές προσδιορισμού εύρους περιλαμβάνουν τρεις συγκεντρώσεις Ral από διαδοχικές αραιώσεις (3,06 x 10-9, 7,67 x 10-10 και 1,92 x 10-10 M) συν καθορισμένη συγκέντρωση (9,18 × 10-11 M) E2 σε διπλές κοιλότητες.
|
Πρότυπο αναφοράς (ολοκληρωμένη δοκιμή ανταγωνιστών)
|
16.
|
Τα πρότυπα Ral/E2 για ολοκληρωμένες δοκιμές περιλαμβάνουν διαδοχικές αραιώσεις Ral 1:2 (από 2,45 x 10-8 έως 9,57 x 10-11M) συν καθορισμένη συγκέντρωση (9,18 × 10-11 M) E2 που περιλαμβάνει εννέα συγκεντρώσεις Ral/E2 σε διπλές κοιλότητες.
|
Ασθενής θετικός μάρτυρας (αγωνιστών)
|
17.
|
Ο ασθενής θετικός μάρτυρας είναι 9,06 x 10-6 M p,p'-methoxychlor (methoxychlor, CASRN 72-43-5) σε EFM.
|
Ασθενής θετικός μάρτυρας (ανταγωνιστών)
|
18.
|
Ο ασθενής θετικός μάρτυρας είναι ταμοξιφαίνη (CASRN 10 540-29-1) 3,36 x 10-6 M με 9,18 × 10-11 M E2 σε EFM.
|
Μάρτυρας E2 (μόνο για δοκιμασία ανταγωνιστών)
|
19.
|
Ο μάρτυρας E2 είναι 9,18 × 10-11 M E2 σε EFM και χρησιμοποιείται ως αρνητικός μάρτυρας γραμμής βάσης.
|
Πολλαπλάσια επαγωγή (αγωνιστές)
|
20.
|
Η επαγωγή δραστικότητας λουσιφεράσης του προτύπου αναφοράς (E2) μετράται με διαίρεση της μέσης ανώτατης τιμής RLU του προτύπου αναφοράς E2 διά της μέσης τιμής RLU του μάρτυρα DMSO, και το αποτέλεσμα θα πρέπει να είναι μεγαλύτερο από τετραπλάσιο.
|
Πολλαπλάσια μείωση (ανταγωνιστές)
|
21.
|
Η μέση δραστικότητα λουσιφεράσης του προτύπου αναφοράς (Ral/E2) μετράται με διαίρεση της μέσης ανώτατης τιμής RLU του προτύπου αναφοράς Ral/E2 διά της μέσης τιμής RLU του μάρτυρα DMSO, και το αποτέλεσμα θα πρέπει να είναι μεγαλύτερο από τριπλάσιο.
Απόδειξη της τεχνικής ικανότητας του εργαστηρίου (βλ. παράγραφο 14 και πίνακες 3 και 4 στην ενότητα «ΣΤΟΙΧΕΙΑ ΤΗΣ ΔΟΚΙΜΑΣΙΑΣ ER TA» της παρούσας μεθόδου δοκιμών)
|
Φορέας
|
22.
|
Οι υπό δοκιμή χημικές ουσίες θα πρέπει να διαλύονται σε διαλύτη που διαλύει την υπό δοκιμή χημική ουσία και που αναμειγνύεται με το θρεπτικό μέσο των κυττάρων. Κατάλληλοι φορείς είναι το νερό, η αιθανόλη (καθαρότητας 95 % έως 100 %) και το DMSO. Εάν χρησιμοποιηθεί το DMSO, το επίπεδο δεν πρέπει να υπερβαίνει το 1 % κ.ό. Για οποιονδήποτε φορέα, θα πρέπει να καταδεικνύεται ότι ο μέγιστος όγκος που χρησιμοποιήθηκε δεν είναι κυτταροτοξικός και δεν επηρεάζει τις επιδόσεις της δοκιμασίας. Τα πρότυπα αναφοράς και οι μάρτυρες διαλύονται σε 100 % διαλύτη και κατόπιν αραιώνονται σε κατάλληλες συγκεντρώσεις με EFM.
|
Προετοιμασία των υπό δοκιμή χημικών ουσιών
|
23.
|
Οι υπό δοκιμή χημικές ουσίες διαλύονται σε 100 % DMSO και κατόπιν αραιώνονται σε κατάλληλες συγκεντρώσεις με EFM. Πριν από τη διάλυση και την αραίωσή τους, θα πρέπει να λαμβάνεται μέριμνα ώστε όλες οι υπό δοκιμή χημικές ουσίες να ισορροπούν σε θερμοκρασία δωματίου. Τα διαλύματα των υπό δοκιμή χημικών ουσιών που χρησιμοποιούνται σε κάθε πείραμα θα πρέπει να έχουν παρασκευαστεί πρόσφατα. Τα διαλύματα δεν θα πρέπει να εμφανίζουν εμφανές ίζημα ή θολερότητα. Τα αποθέματα προτύπων αναφοράς και μαρτύρων μπορούν να παρασκευάζονται μαζικά, ωστόσο το τελικό πρότυπο αναφοράς, οι αραιώσεις των μαρτύρων και οι υπό δοκιμή χημικές ουσίες που χρησιμοποιούνται σε κάθε πείραμα θα πρέπει να έχουν παρασκευαστεί πρόσφατα και να χρησιμοποιούνται εντός 24 ωρών από την παρασκευή τους.
|
Διαλυτότητα και κυτταροτοξικότητα: ζητήματα σχετικά με τον προσδιορισμό εύρους
|
24.
|
Οι δοκιμές προσδιορισμού εύρους περιλαμβάνουν διαδοχικές αραιώσεις 1:10 επτά σημείων που εκτελούνται εις διπλούν. Αρχικά, οι υπό δοκιμή χημικές ουσίες ελέγχονται στη μέγιστη συγκέντρωση 1 mg/ml (~1 mM) για τις δοκιμές αγωνιστών και 20 μg/ml (~10 μΜ) για τις δοκιμές ανταγωνιστών. Τα πειράματα προσδιορισμού εύρους χρησιμοποιούνται για τον προσδιορισμό των ακόλουθων στοιχείων:
|
|
—
|
αρχικές συγκεντρώσεις της υπό δοκιμή χημικής ουσίας που θα χρησιμοποιηθούν στις ολοκληρωμένες δοκιμές
|
|
—
|
αραιώσεις της υπό δοκιμή χημικής ουσίας (1:2 ή 1:5) που θα χρησιμοποιηθούν στις ολοκληρωμένες δοκιμές
|
|
25.
|
Στα πρωτόκολλα των δοκιμασιών αγωνιστών και ανταγωνιστών περιλαμβάνεται αξιολόγηση της βιωσιμότητας των κυττάρων / της κυτταροτοξικότητας (7), η οποία εντάσσεται στις δοκιμές προσδιορισμού εύρους και τις ολοκληρωμένες δοκιμές. Η μέθοδος κυτταροτοξικότητας που χρησιμοποιήθηκε για την αξιολόγηση της βιωσιμότητας των κυττάρων κατά την επικύρωση της ER TA VM7Luc (1) ήταν διαβαθμισμένη ποιοτική μέθοδος οπτικής παρατήρησης· ωστόσο, μπορεί να χρησιμοποιηθεί ποσοτική μέθοδος για τον προσδιορισμό της κυτταροτοξικότητας (βλ. πρωτόκολλο (7)). Δεδομένα από συγκεντρώσεις υπό δοκιμή χημικών ουσιών που επάγουν μείωση της βιωσιμότητας άνω του 20 % δεν μπορούν να χρησιμοποιηθούν.
|
Έκθεση σε υπό δοκιμή χημικές ουσίες και οργάνωση τρυβλίου της δοκιμασίας
|
26.
|
Τα κύτταρα καταμετρώνται και επιστρώνονται σε τρυβλία καλλιέργειας ιστών 96 κοιλοτήτων (2 x 105 κύτταρα ανά κοιλότητα) σε EFM και επωάζονται επί 24 ώρες προκειμένου να προσκολληθούν στο τρυβλίο. Το EFM αφαιρείται και αντικαθίσταται από τις υπό δοκιμή χημικές ουσίες και τις χημικές ουσίες αναφοράς σε EFM, και επωάζεται επί 19-24 ώρες. Ειδική μέριμνα θα πρέπει να λαμβάνεται για τις εξαιρετικά πτητικές ουσίες, καθότι από τις διπλανές κοιλότητες μάρτυρα μπορεί να προκύψουν ψευδοθετικές εκβάσεις. Σε αυτές τις περιπτώσεις συνιστάται η χρήση καλυμμάτων σφράγισης καθώς μπορεί να βοηθήσει στην αποτελεσματική απομόνωση μεμονωμένων κοιλοτήτων κατά τη διάρκεια των δοκιμών.
|
Δοκιμές προσδιορισμού εύρους
|
27.
|
Κατά τις δοκιμές προσδιορισμού εύρους χρησιμοποιούνται όλες οι κοιλότητες του τρυβλίου 96 κοιλοτήτων για τον εις διπλούν έλεγχο έως έξι υπό δοκιμή χημικών ουσιών υπό μορφή διαδοχικών αραιώσεων 1:10 επτά σημείων (βλ. σχήματα 1 και 2).
|
|
—
|
Στο πλαίσιο των δοκιμών προσδιορισμού εύρους αγωνιστών χρησιμοποιούνται τέσσερις εις διπλούν συγκεντρώσεις E2 ως πρότυπο αναφοράς και τέσσερις πανομοιότυπες κοιλότητες για τον μάρτυρα DMSO.
|
|
—
|
Στο πλαίσιο των δοκιμών προσδιορισμού εύρους ανταγωνιστών χρησιμοποιούνται τρεις ες διπλούν συγκεντρώσεις Ral/E2 με 9,18 × 10-11 M E2 ως πρότυπο αναφοράς, και τρεις πανομοιότυπες κοιλότητες για τους μάρτυρες Ε2 και DMSO.
|
Σχήμα 1
Διάταξη τρυβλίου 96 κοιλοτήτων δοκιμής προσδιορισμού εύρους αγωνιστών

Συντομογραφίες: E2-1 έως E2-4 = συγκεντρώσεις του προτύπου αναφοράς E2 (από τις υψηλές στις χαμηλές)· TC1-1 έως TC1-7 = συγκεντρώσεις (από τις υψηλές στις χαμηλές) της υπό δοκιμή χημικής ουσίας 1 (TC1)· TC2-1 έως TC2-7 = συγκεντρώσεις (από τις υψηλές στις χαμηλές) της υπό δοκιμή χημικής ουσίας 2 (TC2)· TC3-1 έως TC3-7 = συγκεντρώσεις (από τις υψηλές στις χαμηλές) της υπό δοκιμή χημικής ουσίας 3 (TC3)· TC4-1 έως TC4-7 = συγκεντρώσεις (από τις υψηλές στις χαμηλές) της υπό δοκιμή χημικής ουσίας 4 (TC4)· TC5-1 έως TC5-7 = συγκεντρώσεις (από τις υψηλές στις χαμηλές) της υπό δοκιμή χημικής ουσίας 5 (TC5)· TC6-1 έως TC6-7 = συγκεντρώσεις (από τις υψηλές στις χαμηλές) της υπό δοκιμή χημικής ουσίας 6 (TC6)· VC = μάρτυρας με φορέα [DMSO (1 % κ.ό. EFM.)].
Σχήμα 2
Διάταξη τρυβλίου 96 κοιλοτήτων δοκιμής προσδιορισμού εύρους ανταγωνιστών
Συντομογραφίες: E2 = μάρτυρας E2· Ral-1 έως Ral-3 = συγκεντρώσεις του προτύπου αναφοράς ραλοξιφαίνη/E2 (από τις υψηλές στις χαμηλές)· TC1-1 έως TC1-7 = συγκεντρώσεις (από τις υψηλές στις χαμηλές) της υπό δοκιμή χημικής ουσίας 1 (TC1)· TC2-1 έως TC2-7 = συγκεντρώσεις (από τις υψηλές στις χαμηλές) της υπό δοκιμή χημικής ουσίας 2 (TC2)· TC3-1 έως TC3-7 = συγκεντρώσεις (από τις υψηλές στις χαμηλές) της υπό δοκιμή χημικής ουσίας 3 (TC3)· TC4-1 έως TC4-7 = συγκεντρώσεις (από τις υψηλές στις χαμηλές) της υπό δοκιμή χημικής ουσίας 4 (TC4)· TC5-1 έως TC5-7 = συγκεντρώσεις (από τις υψηλές στις χαμηλές) της υπό δοκιμή χημικής ουσίας 5 (TC5)· TC6-1 έως TC6-7 = συγκεντρώσεις (από τις υψηλές στις χαμηλές) της υπό δοκιμή χημικής ουσίας 6 (TC6)· VC = μάρτυρας με φορέα [DMSO (1 % κ.ό. EFM.)].
Σημείωση: Όλες οι υπό δοκιμή χημικές ουσίες ελέγχονται παρουσία 9,18 × 10-11 M E2.
|
28.
|
Ο συνιστώμενος τελικός όγκος μέσου που πρέπει να υπάρχει σε κάθε κοιλότητα είναι 200 μl. Χρησιμοποιείτε μόνο τρυβλία δοκιμής στα οποία η βιωσιμότητα των κυττάρων στο σύνολο των κοιλοτήτων είναι 80 % και άνω.
|
|
29.
|
Ο προσδιορισμός των αρχικών συγκεντρώσεων για τις ολοκληρωμένες δοκιμές
αγωνιστών
περιγράφεται διεξοδικά στο πρωτόκολλο αγωνιστών (7). Εν συντομία, χρησιμοποιούνται τα ακόλουθα κριτήρια:
|
|
—
|
Εάν στην καμπύλη συγκέντρωσης της υπό δοκιμής χημικής ουσίας δεν υπάρχουν σημεία που υπερβαίνουν τη μέση τιμή συν τρεις φορές την τυπική απόκλιση του μάρτυρα DMSO, οι ολοκληρωμένες δοκιμές θα διεξάγονται με χρήση διαδοχικής αραίωσης 1:211 σημείων, ξεκινώντας από τη μέγιστη διαλυτή συγκέντρωση.
|
|
—
|
Εάν στην καμπύλη συγκέντρωσης της υπό δοκιμή χημικής ουσίας υπάρχουν σημεία που υπερβαίνουν τη μέση τιμή συν τρεις φορές την τυπική απόκλιση του μάρτυρα DMSO, η αρχική συγκέντρωση που θα χρησιμοποιηθεί για το πρόγραμμα αραιώσεων 11 σημείων στο πλαίσιο των ολοκληρωμένων δοκιμών θα πρέπει να είναι κατά έναν λογάριθμο υψηλότερη από τη συγκέντρωση από την οποία προκύπτει η υψηλότερη προσαρμοσμένη τιμή RLU στο πλαίσιο του προσδιορισμού εύρους. Το πρόγραμμα αραιώσεων 11 σημείων θα βασίζεται σε αραιώσεις είτε 1:2 είτε 1:5, σύμφωνα με τα ακόλουθα κριτήρια:
|
Θα πρέπει να χρησιμοποιείται διαδοχική αραίωση 1:211 σημείων εάν το προκύπτον εύρος συγκέντρωσης περιλαμβάνει το πλήρες εύρος των αποκρίσεων βάσει της καμπύλης απόκρισης συγκέντρωσης που προέκυψε κατά τη δοκιμή προσδιορισμού εύρους. Διαφορετικά, χρησιμοποιήστε αραίωση 1:5.
|
|
|
—
|
Εάν μια υπό δοκιμή χημική ουσία εμφανίζει διφασική καμπύλη συγκέντρωσης απόκρισης κατά τη δοκιμή προσδιορισμού εύρους, θα πρέπει να εξακριβώνονται και οι δύο φάσεις στο πλαίσιο των ολοκληρωμένων δοκιμών.
|
|
30.
|
Ο προσδιορισμός των αρχικών συγκεντρώσεων για τις ολοκληρωμένες δοκιμές
ανταγωνιστών
περιγράφεται διεξοδικά στο πρωτόκολλο ανταγωνιστών (7). Εν συντομία, χρησιμοποιούνται τα ακόλουθα κριτήρια:
|
|
—
|
Εάν στην καμπύλη συγκέντρωσης της υπό δοκιμής χημικής ουσίας δεν υπάρχουν σημεία που είναι μικρότερα από τη μέση τιμή μείον τρεις φορές την τυπική απόκλιση του μάρτυρα Ε2, οι ολοκληρωμένες δοκιμές θα διεξάγονται με χρήση διαδοχικής αραίωσης 1:211 σημείων, ξεκινώντας από τη μέγιστη διαλυτή συγκέντρωση.
|
|
—
|
Εάν στην καμπύλη συγκέντρωσης της υπό δοκιμή χημικής ουσίας υπάρχουν σημεία που είναι μικρότερα από τη μέση τιμή μείον τρεις φορές την τυπική απόκλιση του μάρτυρα Ε2, η αρχική συγκέντρωση που θα χρησιμοποιηθεί για το πρόγραμμα αραιώσεων 11 σημείων στο πλαίσιο των ολοκληρωμένων δοκιμών θα πρέπει να είναι μία από τις ακόλουθες.
|
—
|
Η συγκέντρωση από την οποία προκύπτει η χαμηλότερη προσαρμοσμένη τιμή RLU στο πλαίσιο του προσδιορισμού εύρους
|
|
—
|
Η μέγιστη διαλυτή συγκέντρωση (βλ. πρωτόκολλο ανταγωνιστών (7), σχήμα 14-2)
|
|
—
|
Η χαμηλότερη κυτταροτοξική συγκέντρωση (για σχετικό παράδειγμα, βλέπε πρωτόκολλο ανταγωνιστών (7), σχήμα 14-3)
|
|
|
—
|
Το πρόγραμμα αραιώσεων 11 σημείων θα βασίζεται είτε σε αραιώσεις 1:2 είτε σε αραιώσεις 1:5, σύμφωνα με τα ακόλουθα κριτήρια:
|
Θα πρέπει να χρησιμοποιείται διαδοχική αραίωση 1:211 σημείων εάν το προκύπτον εύρος συγκέντρωσης περιλαμβάνει το πλήρες εύρος των αποκρίσεων βάσει της καμπύλης απόκρισης συγκέντρωσης που προέκυψε κατά τη δοκιμή προσδιορισμού εύρους. Διαφορετικά, θα πρέπει να χρησιμοποιείται αραίωση 1:5.
|
|
Συνολικές δοκιμές
|
31.
|
Οι ολοκληρωμένες δοκιμές περιλαμβάνουν διαδοχικές αραιώσεις 11 σημείων (διαδοχικές αραιώσεις είτε 1:2 είτε 1:5 βάσει της αρχικής συγκέντρωσης για τα κριτήρια των ολοκληρωμένων δοκιμών), με κάθε συγκέντρωση να ελέγχεται σε τριπλές κοιλότητες του τρυβλίου 96 κοιλοτήτων (βλ. σχήματα 3 και 4).
|
|
—
|
Στις ολοκληρωμένες δοκιμές αγωνιστών, ως πρότυπο αναφοράς χρησιμοποιούνται 11 συγκεντρώσεις E2 εις διπλούν. Σε κάθε τρυβλίο περιλαμβάνονται τέσσερις πανομοιότυπες κοιλότητες για τον μάρτυρα DMSO και τέσσερις πανομοιότυπες κοιλότητες για τον μάρτυρα methoxychlor (9,06 x 10-6 M).
|
|
—
|
Στις ολοκληρωμένες δοκιμές ανταγωνιστών, ως πρότυπο αναφοράς χρησιμοποιούνται εννέα συγκεντρώσεις Ral/E2 με 9,18 × 10-11 M E2 εις διπλούν, με τέσσερις πανομοιότυπες κοιλότητες για τον μάρτυρα E2 9,18 x 10-11 M, τέσσερις πανομοιότυπες κοιλότητες για τους μάρτυρες DMSO, και τέσσερις πανομοιότυπες κοιλότητες για την ταμοξιφαίνη 3,36 x 10-6 M.
|
Σχήμα 3
Διάταξη τρυβλίου 96 κοιλοτήτων ολοκληρωμένων δοκιμών αγωνιστών

Συντομογραφίες: TC1-1 έως TC1-11 = συγκεντρώσεις (από τις υψηλές στις χαμηλές) της υπό δοκιμή χημικής ουσίας 1· TC2-1 έως TC2-11 = συγκεντρώσεις (από τις υψηλές στις χαμηλές) της υπό δοκιμή χημικής ουσίας 2· E2-1 έως E2-11 = συγκεντρώσεις του προτύπου αναφοράς E2 (από τις υψηλές στις χαμηλές)· Meth = ασθενής θετικός μάρτυρας p,p'-methoxychlor· VC = μάρτυρας με φορέα EFM DMSO (1 % κ.ό.)
Σχήμα 4
Διάταξη τρυβλίου 96 κοιλοτήτων ολοκληρωμένων δοκιμών ανταγωνιστών

Συντομογραφίες: E2 = μάρτυρας E2· Ral-1 έως Ral-9 = συγκεντρώσεις του προτύπου αναφοράς ραλοξιφαίνη/E2 (από τις υψηλές στις χαμηλές)· Tam = ασθενής θετικός μάρτυρας ταμοξιφαίνη/E2· TC1-1 έως TC1-11 = συγκεντρώσεις (από τις υψηλές στις χαμηλές) της υπό δοκιμή χημικής ουσίας 1 (TC1)· TC2-1 έως TC2-11 = συγκεντρώσεις (από τις υψηλές στις χαμηλές) της υπό δοκιμή χημικής ουσίας 2 (TC2)· VC = μάρτυρας με φορέα [DMSO (1 % κ.ό. EFM.)].
Σημείωση: Όπως επισημάνθηκε, όλες οι κοιλότητες αναφοράς και δοκιμής περιέχουν καθορισμένη συγκέντρωση E2 (9,18 x 10-11 M)
|
32.
|
Προκειμένου να διασφαλίζεται η ανεξαρτησία, θα πρέπει να διεξάγονται επαναλαμβανόμενες ολοκληρωμένες δοκιμές για την ίδια χημική ουσία σε διαφορετικές ημέρες. Θα πρέπει να διεξάγονται τουλάχιστον δύο ολοκληρωμένες δοκιμές. Εάν τα αποτελέσματα των δοκιμών είναι αντιφατικά μεταξύ τους (π.χ. μία δοκιμή είναι θετική και η άλλη αρνητική), ή εάν μία από τις δοκιμές είναι ανεπαρκής, θα πρέπει να διεξάγεται τρίτη, συμπληρωματική δοκιμή.
|
Μέτρηση φωταύγειας
|
33.
|
Η φωταύγεια μετράται στο φάσμα από 300 έως 650 nm, με χρήση λουμινόμετρου έγχυσης και λογισμικού που ελέγχει τον όγκο έγχυσης και το μεσοδιάστημα μετρήσεων (7). Η εκπομπή φωτός από κάθε κοιλότητα εκφράζεται ως RLU ανά κοιλότητα.
|
ΑΝΑΛΥΣΗ ΤΩΝ ΔΕΔΟΜΕΝΩΝ
Προσδιορισμός της EC50/IC50
|
34.
|
Η τιμή της EC50 [ήμισυ της μέγιστης αποτελεσματικής συγκέντρωσης υπό δοκιμή χημικής ουσίας (αγωνιστές)] και η τιμή της IC50 [ήμισυ της μέγιστης συγκέντρωσης αναστολής υπό δοκιμή χημικής ουσίας (ανταγωνιστές)] προσδιορίζονται από τα δεδομένα συγκέντρωσης-απόκρισης. Όσον αφορά υπό δοκιμή χημικές ουσίες που είναι θετικές σε μία ή περισσότερες συγκεντρώσεις, η συγκέντρωση που επάγει τη μισή μέγιστη απόκριση (IC50 ή EC50) υπολογίζεται με χρήση ανάλυσης συνάρτησης Hill ή κατάλληλου εναλλακτικού τρόπου. Η συνάρτηση Hill είναι ένα λογιστικό μαθηματικό μοντέλο τεσσάρων παραμέτρων που συσχετίζει τη συγκέντρωση της υπό δοκιμή χημικής ουσίας με την απόκριση (ακολουθώντας, τυπικά, σιγμοειδή καμπύλη) με χρήση της ακόλουθης εξίσωσης:
|

όπου:
Y= απόκριση (δηλ. RLU),
X= ο λογάριθμος συγκέντρωσης,
ελάχιστη= η ελάχιστη απόκριση,
μέγιστη= η μέγιστη απόκριση,
lg EC50 (ή lg IC50)= ο λογάριθμος του X ως η ενδιάμεση απόκριση μεταξύ μέγιστης και ελάχιστης,
κλίση Hill= η κλίση της καμπύλης.
Με το μοντέλο υπολογίζονται οι βέλτιστες αρμόζουσες τιμές στις παραμέτρους μέγιστης απόκρισης, ελάχιστης απόκρισης, κλίσης Hill, και IC50 και EC50. Για τον υπολογισμό των τιμών EC50 και IC50 θα πρέπει να χρησιμοποιείται το κατάλληλο λογισμικό στατιστικής ανάλυσης (π.χ. το λογισμικό Graphpad PrismR).
Προσδιορισμός έκτοπων τιμών
|
35.
|
Για την εξαγωγή ορθού στατιστικού συμπεράσματος μπορεί να είναι χρήσιμη η συμπερίληψη (ενδεικτικά) του ελέγχου Q-test [βλ. πρωτόκολλα αγωνιστών και ανταγωνιστών (7)] για τον προσδιορισμό των «μη χρησιμοποιήσιμων» κοιλοτήτων που θα αποκλειστούν από την ανάλυση των δεδομένων.
|
|
36.
|
Όσον αφορά τα πανομοιότυπα δείγματα προτύπου αναφοράς E2 (μέγεθος δείγματος: δύο), κάθε προσαρμοσμένη τιμή RLU για δείγμα με καθορισμένη συγκέντρωση E2 θεωρείται έκτοπη εάν υπερβαίνει ή υπολείπεται κατά 20 % της προσαρμοσμένης τιμής RLU για τη συγκεκριμένη συγκέντρωση στη βάση ιστορικών δεδομένων.
|
Συλλογή και προσαρμογή των δεδομένων λουμινόμετρου για δοκιμές προσδιορισμού εύρους
|
37.
|
Τα ανεπεξέργαστα δεδομένα του λουμινόμετρου θα πρέπει να καταχωρίζονται σε υπόδειγμα υπολογιστικού φύλλου ειδικά σχεδιασμένου για τη δοκιμασία. Θα πρέπει να προσδιορίζεται κατά πόσον υπάρχουν σημεία δεδομένων έκτοπων τιμών που πρέπει να αφαιρεθούν. (Για τις παραμέτρους που προσδιορίζονται στις αναλύσεις, βλέπε κριτήρια αποδοχής δοκιμής). Θα πρέπει να εκτελούνται οι ακόλουθοι υπολογισμοί:
|
Αγωνιστής
|
Στάδιο 1
|
Υπολογισμός της μέσης τιμής για τον μάρτυρα με φορέα (VC) DMSO.
|
|
Στάδιο 2
|
Αφαίρεση της μέσης τιμής του μάρτυρα με φορέα DMSO από κάθε κοιλότητα με σκοπό την κανονικοποίηση των δεδομένων.
|
|
Στάδιο 3
|
Υπολογισμός της μέσης πολλαπλάσιας επαγωγής για το πρότυπο αναφοράς (E2).
|
|
Στάδιο 4
|
Υπολογισμός της μέσης τιμής EC50 για τις υπό δοκιμή χημικές ουσίες.
|
Ανταγωνιστής
|
Στάδιο 1
|
Υπολογισμός της μέσης τιμής για τον μάρτυρα με φορέα (VC) DMSO.
|
|
Στάδιο 2
|
Αφαίρεση της μέσης τιμής του μάρτυρα με φορέα DMSO από κάθε κοιλότητα με σκοπό την κανονικοποίηση των δεδομένων.
|
|
Στάδιο 3
|
Υπολογισμός της μέσης πολλαπλάσιας μείωσης για το πρότυπο αναφοράς (Ral/E2).
|
|
Στάδιο 4
|
Υπολογισμός της μέσης τιμής για το πρότυπο αναφοράς Ε2.
|
|
Στάδιο 5
|
Υπολογισμός της μέσης τιμής IC50 για τις υπό δοκιμή χημικές ουσίες.
|
Συλλογή και προσαρμογή των δεδομένων λουμινόμετρου για ολοκληρωμένες δοκιμές
|
38.
|
Τα ανεπεξέργαστα δεδομένα του λουμινόμετρου θα πρέπει να καταχωρίζονται σε υπόδειγμα υπολογιστικού φύλλου ειδικά σχεδιασμένου για τη δοκιμασία. Θα πρέπει να προσδιορίζεται κατά πόσον υπάρχουν σημεία δεδομένων έκτοπων τιμών που πρέπει να αφαιρεθούν. (Για τις παραμέτρους που προσδιορίζονται στις αναλύσεις, βλέπε κριτήρια αποδοχής δοκιμής). Εκτελούνται οι ακόλουθοι υπολογισμοί:
|
Αγωνιστής
|
Στάδιο 1
|
Υπολογισμός της μέσης τιμής για τον μάρτυρα με φορέα (VC) DMSO.
|
|
Στάδιο 2
|
Αφαίρεση της μέσης τιμής του μάρτυρα με φορέα DMSO από κάθε κοιλότητα με σκοπό την κανονικοποίηση των δεδομένων.
|
|
Στάδιο 3
|
Υπολογισμός της μέσης πολλαπλάσιας επαγωγής για το πρότυπο αναφοράς (E2).
|
|
Στάδιο 4
|
Υπολογισμός της μέσης τιμής EC50 για το E2 και τις υπό δοκιμή χημικές ουσίες.
|
|
Στάδιο 5
|
Υπολογισμός της μέσης προσαρμοσμένης τιμής RLU για το methoxychlor.
|
Ανταγωνιστής
|
Στάδιο 1
|
Υπολογισμός της μέσης τιμής για τον μάρτυρα με φορέα (VC) DMSO.
|
|
Στάδιο 2
|
Αφαίρεση της μέσης τιμής του μάρτυρα με φορέα DMSO από κάθε κοιλότητα με σκοπό την κανονικοποίηση των δεδομένων.
|
|
Στάδιο 3
|
Υπολογισμός της μέσης πολλαπλάσιας επαγωγής για το πρότυπο αναφοράς (Ral/E2).
|
|
Στάδιο 4
|
Υπολογισμός της μέσης τιμής IC50 για το Ral/E2 και τις υπό δοκιμή χημικές ουσίες.
|
|
Στάδιο 5
|
Υπολογισμός της μέσης προσαρμοσμένης τιμής RLU για την ταμοξιφαίνη.
|
|
Στάδιο 6
|
Υπολογισμός της μέσης τιμής για το πρότυπο αναφοράς Ε2.
|
Κριτήρια ερμηνείας των δεδομένων
|
39.
|
Η ER TA VM7Luc προορίζεται για χρήση στο πλαίσιο προσέγγισης βάρους της απόδειξης με σκοπό τη διευκόλυνση της κατά προτεραιότητα ιεράρχησης των ουσιών για τη διεξαγωγή in vivo δοκιμών ED. Μέρος της εν λόγω διαδικασίας ιεράρχησης προτεραιοτήτων θα είναι η ταξινόμηση της υπό δοκιμή χημικής ουσίας ως θετικής ή αρνητικής όσον αφορά τη δραστικότητα είτε αγωνιστή είτε ανταγωνιστή για τον ER. Στον πίνακα 1 περιγράφονται τα κριτήρια λήψης απόφασης περί θετικής ή αρνητικής ουσίας που χρησιμοποιήθηκαν στη μελέτη επικύρωσης ER TA VM7Luc.
|
Πίνακας 1
Κριτήρια λήψης απόφασης περί θετικής ή αρνητικής ουσίας
|
|
|
ΔΡΑΣΤΙΚΟΤΗΤΑ ΑΓΩΝΙΣΤΗ
|
|
Θετικά
|
|
—
|
Όλες οι υπό δοκιμή χημικές ουσίες που ταξινομούνται ως θετικές ως προς τη δραστικότητα αγωνιστή για τον ER θα πρέπει να έχουν καμπύλη συγκέντρωσης-απόκρισης που περιλαμβάνει μια γραμμή βάσης, ακολουθούμενη από θετική κλίση, και η οποία καταλήγει σε πλατώ ή σε κορυφή. Σε ορισμένες περιπτώσεις, μπορούν να προσδιορίζονται μόνο δύο από τα εν λόγω χαρακτηριστικά (γραμμή βάσης–κλίση ή κλίση–κορυφή).
|
|
—
|
Η γραμμή που καθορίζει τη θετική κλίση θα πρέπει να περιέχει τουλάχιστον τρία σημεία με μη επικαλυπτόμενες ράβδους σφάλματος (μέση τιμή ± SD). Τα σημεία που σχηματίζουν τη γραμμή βάσης αποκλείονται, αλλά το γραμμικό τμήμα της καμπύλης μπορεί να περιλαμβάνει την κορυφή ή το πρώτο σημείο του πλατώ της καμπύλης.
|
|
—
|
Για την ταξινόμηση μιας ουσίας ως θετικής απαιτείται πλάτος απόκρισης, δηλ. της διαφοράς μεταξύ γραμμής βάσης και κορυφής, που αντιστοιχεί στο 20 % τουλάχιστον της μέγιστης τιμής για το πρότυπο αναφοράς E2 [δηλ. 2 000 RLU ή περισσότερο, όταν η μέγιστη τιμή απόκρισης των προτύπων αναφοράς (E2) είναι προσαρμοσμένη στις 10 000 RLU].
|
|
—
|
Ει δυνατόν, θα πρέπει να υπολογίζεται μια τιμή EC50 για κάθε θετική υπό δοκιμή χημική ουσία.
|
|
|
Αρνητικά
|
Η μέση προσαρμοσμένη RLU για καθορισμένη συγκέντρωση ισούται ή είναι μικρότερη της μέσης τιμής RLU μάρτυρα DMSO συν τρεις φορές την τυπική απόκλιση της RLU DMSO.
|
|
Ανεπαρκή
|
Δεδομένα που δεν μπορούν να θεωρηθούν έγκυρα για την κατάδειξη είτε της παρουσίας είτε της απουσίας δραστικότητας, λόγω σημαντικών ποιοτικών ή ποσοτικών περιορισμών, θεωρούνται ανεπαρκή και δεν μπορούν να χρησιμοποιούνται για να προσδιοριστεί κατά πόσον η υπό δοκιμή χημική ουσία είναι θετική ή αρνητική. Οι χημικές ουσίες θα πρέπει να υποβάλλονται εκ νέου σε δοκιμή.
|
|
|
|
ΔΡΑΣΤΙΚΟΤΗΤΑ ΑΝΤΑΓΩΝΙΣΤΗ
|
|
Θετικά
|
|
—
|
Από τα δεδομένα της υπό δοκιμή χημικής ουσίας προκύπτει καμπύλη συγκέντρωσης-απόκρισης που περιλαμβάνει μια γραμμή βάσης, ακολουθούμενη από αρνητική κλίση.
|
|
—
|
Η γραμμή που καθορίζει την αρνητική κλίση θα πρέπει να περιέχει τουλάχιστον τρία σημεία με μη επικαλυπτόμενες ράβδους σφάλματος. Τα σημεία που σχηματίζουν τη γραμμή βάσης αποκλείονται, αλλά το γραμμικό τμήμα της καμπύλης μπορεί να περιλαμβάνει το πρώτο σημείο του πλατώ της καμπύλης.
|
|
—
|
Θα πρέπει να διαπιστώνεται τουλάχιστον 20 % μείωση της δραστικότητας σε σχέση με τη μέγιστη τιμή για το πρότυπο αναφοράς Ral/E2 (δηλ. 8 000 RLU ή λιγότερες όταν η μέγιστη τιμή απόκρισης του προτύπου αναφοράς [Ral/E2] προσαρμόζεται στις 10 000 RLU).
|
|
—
|
Οι υψηλότερες μη κυτταροτοξικές συγκεντρώσεις της υπό δοκιμή χημικής ουσίας θα πρέπει να είναι μικρότερες ή ίσες προς 1x10-5 M.
|
|
—
|
Ει δυνατόν, θα πρέπει να υπολογίζεται μια τιμή IC50 για κάθε θετική υπό δοκιμή χημική ουσία.
|
|
|
Αρνητικά
|
Όλα τα σημεία δεδομένων υπερβαίνουν την τιμή EC80 (80 % της απόκρισης E2, ή 8 000 RLU), σε συγκεντρώσεις μικρότερες από 1,0 x 10-5 M.
|
|
Ανεπαρκή
|
Δεδομένα που δεν μπορούν να θεωρηθούν έγκυρα για την κατάδειξη είτε της παρουσίας είτε της απουσίας δραστικότητας, λόγω σημαντικών ποιοτικών ή ποσοτικών περιορισμών, θεωρούνται ανεπαρκή και δεν μπορούν να χρησιμοποιούνται για να προσδιοριστεί κατά πόσον η υπό δοκιμή χημική ουσία είναι θετική ή αρνητική. Η χημική ουσία θα πρέπει να υποβάλλεται εκ νέου σε δοκιμή.
|
|
40.
|
Ει δυνατόν, για τα θετικά αποτελέσματα θα πρέπει να αναφέρεται τόσο το μέγεθος της επίδρασης όσο και η συγκέντρωση στην οποία εμφανίζεται η επίδραση. Στα σχήματα 5 και 6 φαίνονται παραδείγματα θετικών, αρνητικών και ανεπαρκών δεδομένων.
|
Σχήμα 5
Παραδείγματα αγωνιστών: θετικά, αρνητικά και ανεπαρκή δεδομένα

Η διακεκομμένη γραμμή υποδεικνύει το 20 % της απόκρισης E2, 2000 προσαρμοσμένες και κανονικοποιημένες RLU.
Σχήμα 6
Παραδείγματα ανταγωνιστών: θετικά, αρνητικά και ανεπαρκή δεδομένα

Η διακεκομμένη γραμμή υποδεικνύει το 80 % της απόκρισης Ral/E2, 8 000 προσαρμοσμένες και κανονικοποιημένες RLU.
Η συνεχής γραμμή υποδεικνύει 1,00 x 10-5 M. Για να θεωρηθεί μια απόκριση θετική, θα πρέπει να είναι κάτω από τη γραμμή 8 000 RLU, και σε συγκεντρώσεις κάτω του 1,00 x 10-5 M.
Οι συγκεντρώσεις που επισημαίνονται με αστερίσκους στο διάγραμμα της meso-εξεστρόλης υποδεικνύουν βαθμολογίες βιωσιμότητας 2 ή μεγαλύτερες.
Τα αποτελέσματα δοκιμών για τη meso-εξεστρόλη θεωρούνται ανεπαρκή δεδομένα διότι η μόνη απόκριση που είναι κάτω από 8 000 RLU εμφανίζεται στα 1,00 x 10-5 M.
|
41.
|
Οι τιμές των EC50 και IC50 μπορούν να υπολογίζονται με χρήση συνάρτησης Hill τεσσάρων παραμέτρων [για περισσότερες λεπτομέρειες, βλέπε πρωτόκολλο αγωνιστών και πρωτόκολλο ανταγωνιστών (7)]. Η συμμόρφωση με τα κριτήρια αποδοχής υποδεικνύει ότι το σύστημα λειτουργεί σωστά, αλλά δεν διασφαλίζει ότι οποιαδήποτε συγκεκριμένη σειρά δοκιμών θα παράξει ορθά δεδομένα. Η επανάληψη των αποτελεσμάτων της πρώτης σειράς δοκιμών αποτελεί τον βέλτιστο τρόπο να επιβεβαιώνεται ότι παρήχθησαν ορθά δεδομένα (βλ. παράγραφο 19 της ενότητας «ΣΤΟΙΧΕΙΑ ΔΟΚΙΜΑΣΙΑΣ ER TA»).
|
ΕΚΘΕΣΗ ΔΟΚΙΜΗΣ
|
42.
|
Βλ. παράγραφο 20 της ενότητας «ΣΤΟΙΧΕΙΑ ΔΟΚΙΜΑΣΙΑΣ ER TA».
|
ΒΙΒΛΙΟΓΡΑΦΙΑ
|
(1)
|
ICCVAM. (2011). ICCVAM Test Method Evaluation Report on the LUMI-CELL® ER (BG1Luc ER TA) Test Method: An In Vitro Method for Identifying ER Agonists and Antagonists, National Institute of Environmental Health Sciences: Research Triangle Park, NC.
|
|
(2)
|
Monje P., Boland R. (2001). Subcellular Distribution of Native Estrogen Receptor α and β Isoforms in Rabbit Uterus and Ovary, J. Cell Biochem., 82(3): 467-479.
|
|
(3)
|
Pujol P., et al. (1998). Differential Expression of Estrogen Receptor-Alpha and -Beta Messenger RNAs as a Potential Marker of Ovarian Carcinogenesis, Cancer Res., 58(23): 5 367-5 373.
|
|
(4)
|
Weihua Z., et al. (2000). Estrogen Receptor (ER) β, a Modulator of ERα in the Uterus, Proceedings of the National Academy of Sciences of the United States of America 97(11): 936-5 941.
|
|
(5)
|
Balls M., et al. (2006). The Importance of Good Cell Culture Practice (GCCP), ALTEX, 23(Suppl): p. 270-273.
|
|
(6)
|
Coecke S., et al. (2005). Guidance on Good Cell Culture Practice: a Report of the Second ECVAM Task Force on Good Cell Culture Practice, Alternatives to Laboratory Animals, 33: p. 261-287.
|
|
(7)
|
ICCVAM (2011). ICCVAM Test Method Evaluation Report, The LUMI-CELL® ER (BG1Luc ER TA) Test Method: An In Vitro Assay for Identifying Human Estrogen Receptor Agonist and Antagonist Activity of Chemicals, NIH Publication No 11-7 850.
|
|
(8)
|
Rogers J.M., Denison M.S. (2000). Recombinant Cell Bioassays for Endocrine Disruptors: Development of a Stably Transfected Human Ovarian Cell Line for the Detection of Estrogenic and Anti-Estrogenic Chemicals, In Vitro Mol. Toxicol.,13(1):67-82.
|
|
(9)
|
Escande A., et al. (2006). Evaluation of Ligand Selectivity Using Reporter Cell Lines Stably Expressing Estrogen Receptor Alpha or Beta, Biochem. Pharmacol., 71(10):1 459-69.
|
|
(10)
|
Thorne N., Inglese J., Auld D.S. (2010). Illuminating Insights into Firefly Luciferase and Other Bioluminescent Reporters Used in Chemical Biology, Chemistry and Biology,17(6):646-57.
|
|
(11)
|
Kuiper G.G, et al. (1998). Interaction of Estrogenic Chemicals and Phytoestrogens with Estrogen Receptor Beta, Endocrinology,139(10):4 252-63.
|
|
(12)
|
Geisinger, et al. (1989). Characterization of a human ovarian carcinoma cell line with estrogen and progesterone receptors, Cancer 63, 280-288.
|
|
(13)
|
Baldwin, et al. (1998). BG-1 ovarian cell line: an alternative model for examining estrogen-dependent growth in vitro, In Vitro Cell. Dev. Biol. – Animal, 34, 649-654.
|
|
(14)
|
Li, Y., et al. (2014). Research resource: STR DNA profile and gene expression comparisons of human BG-1 cells and a BG-1/MCF-7 clonal variant, Mol. Endo. 28, 2072-2081.
|
|
(15)
|
Rogers, J.M. and Denison, M.S. (2000). Recombinant cell bioassays for endocrine disruptors:development of a stably transfected human ovarian cell line for the detection of estrogenicand anti-estrogenic chemicals, In Vitro & Molec. Toxicol. 13, 67-82.
|
Προσαρτημα 4
ΔΟΚΙΜΑΣΙΑ ΔΙΕΝΕΡΓΟΠΟΙΗΣΗΣ ΣΤΑΘΕΡΩΣ ΔΙΑΜΟΛΥΝΘΕΝΤΩΝ ΑΝΘΡΩΠΙΝΩΝ ΥΠΟΔΟΧΕΩΝ ΟΙΣΤΡΟΓΟΝΩΝ Α ΓΙΑ ΤΗΝ ΑΝΙΧΝΕΥΣΗ ΤΗΣ ΔΡΑΣΤΙΚΟΤΗΤΑΣ ΧΗΜΙΚΩΝ ΟΥΣΙΩΝ ΩΣ ΑΓΩΝΙΣΤΩΝ ΚΑΙ ΑΝΤΑΓΩΝΙΣΤΩΝ ΟΙΣΤΡΟΓΟΝΩΝ ΜΕ ΧΡΗΣΗ ΤΗΣ ΚΥΤΤΑΡΙΚΗΣ ΣΕΙΡΑΣ ERΑ CALUX
ΑΡΧΙΚΕΣ ΕΚΤΙΜΗΣΕΙΣ ΚΑΙ ΠΕΡΙΟΡΙΣΜΟΙ (ΒΛΕΠΕ ΕΠΙΣΗΣ ΓΕΝΙΚΗ ΕΙΣΑΓΩΓΗ)
|
1.
|
Στη δοκιμασία διενεργοποίησης ERα CALUX χρησιμοποιείται η ανθρώπινη κυτταρική σειρά U2OS για την ανίχνευση της δραστικότητας αγωνιστή ή ανταγωνιστή οιστρογόνων που μεσολαβείται από τον ανθρώπινο υποδοχέα οιστρογόνων α (hERα). Η μελέτη επικύρωσης της βιοδοκιμασίας σταθερώς διαμολυνθέντων ανθρώπινων κυττάρων ERα CALUX της BioDetection Systems BV (Άμστερνταμ, Κάτω Χώρες) κατέδειξε την καταλληλότητα και την αξιοπιστία της δοκιμασίας για τον σκοπό για τον οποίο προορίζεται (1). Η κυτταρική σειρά ERα CALUX εκφράζει μόνο τον ανθρώπινο ERα (2) (3).
|
|
2.
|
Η παρούσα δοκιμασία έχει σχεδιαστεί ειδικά για την ανίχνευση της μεσολαβούμενης από τον hERα διενεργοποίησης μέσω μέτρησης της βιοφωταύγειας ως παραμέτρου. Η χρήση βιοφωταύγειας είναι ευρέως διαδεδομένη στις βιοδοκιμασίες λόγω του υψηλού λόγου σήματος προς θόρυβο (4).
|
|
3.
|
Έχει αναφερθεί ότι συγκεντρώσεις φυτοοιστρογόνων υψηλότερες του 1 μΜ υπερενεργοποιούν το γονίδιο αναφοράς λουσιφεράσης, με αποτέλεσμα φωταύγεια που δεν μεσολαβείται από υποδοχέα (5) (6) (7). Ως εκ τούτου, οι υψηλότερες συγκεντρώσεις φυτοοιστρογόνων ή άλλων ανάλογων ενώσεων που μπορούν να υπερενεργοποιούν την έκφραση λουσιφεράσης πρέπει να εξετάζονται προσεκτικά στο πλαίσιο των δοκιμασιών διενεργοποίησης ER σταθερώς διαμολυνθέντων κυττάρων (βλ. προσάρτημα 2).
|
|
4.
|
Πριν από τη χρήση της παρούσας δοκιμασίας για κανονιστικούς σκοπούς, θα πρέπει να μελετηθούν οι ενότητες «ΓΕΝΙΚΗ ΕΙΣΑΓΩΓΗ» και «ΣΤΟΙΧΕΙΑ ΔΟΚΙΜΑΣΙΑΣ ER TA». Οι ορισμοί και οι συντομογραφίες που χρησιμοποιούνται στην παρούσα μέθοδο δοκιμών παρατίθενται στο προσάρτημα 1.
|
ΑΡΧΗ ΤΗΣ ΔΟΚΙΜΑΣΙΑΣ (ΒΛ. ΕΠΙΣΗΣ ΓΕΝΙΚΗ ΕΙΣΑΓΩΓΗ)
|
5.
|
Η βιοδοκιμασία χρησιμοποιείται για την αξιολόγηση της δέσμευσης προσδεμάτων στον ER, την οποία ακολουθεί η μετατόπιση του συμπλόκου υποδοχέα-προσδέματος στον πυρήνα. Στον πυρήνα, το σύμπλοκο υποδοχέα-προσδέματος δεσμεύει ειδικά στοιχεία απόκρισης του DNA και διενεργοποιεί ένα γονίδιο αναφοράς λουσιφεράσης της πυγολαμπίδας, με αποτέλεσμα την αύξηση της κυτταρικής έκφρασης του ενζύμου λουσιφεράση. Μετά την προσθήκη λουσιφερίνης, του υποστρώματος της λουσιφεράσης, η λουσιφερίνη μετασχηματίζεται σε βιοφωταυγές προϊόν. Το φως που προκύπτει μπορεί να ανιχνευτεί και να προσδιοριστεί ποσοτικά εύκολα με χρήση λουμινόμετρου.
|
|
6.
|
Το σύστημα δοκιμής χρησιμοποιεί σταθερώς διαμολυνθέντα κύτταρα ERα CALUX. Τα κύτταρα ERα CALUX προήλθαν από την κυτταρική σειρά U2OS οστεοβλαστικού οστεοσαρκώματος του ανθρώπου. Τα ανθρώπινα κύτταρα U2OS διαμολύνθηκαν σταθερά με 3xHRE-TATA-Luc και pSG5-neo-hERα, με χρήση της μεθόδου συγκατακρήμνισης με φωσφορικό ασβέστιο. Η κυτταρική σειρά U2OS προτιμήθηκε ως η βέλτιστη επιλογή για χρήση ως κυτταρική σειρά γονιδίου αναφοράς που αποκρίνεται στα οιστρογόνα (και σε άλλες στεροειδείς ορμόνες), καθώς παρατηρήθηκε ότι εμφανίζει περιορισμένη ή καθόλου ενδογενή δραστικότητα υποδοχέων. Η απουσία ενδογενών υποδοχέων αξιολογήθηκε με χρήση μόνο πλασμιδίων γονιδίου αναφοράς λουσιφεράσης, ενώ δεν παρατηρείται καθόλου δραστικότητα μετά την προσθήκη προσδεμάτων υποδοχέων. Επιπλέον, η εν λόγω κυτταρική σειρά υποστήριζε ισχυρές μεσολαβούμενες από ορμόνες αποκρίσεις όταν εισάγονταν παροδικά σύστοιχοι υποδοχείς (2) (3) (8).
|
|
7.
|
Οι δοκιμές χημικών ουσιών για οιστρογόνο ή αντιοιστρογόνο δραστικότητα με χρήση της κυτταρικής σειράς ERα CALUX περιλαμβάνουν μια σειρά δοκιμών προδιαλογής και σειρές ολοκληρωμένων δοκιμών. Κατά τη σειρά δοκιμών προδιαλογής, προσδιορίζεται η διαλυτότητα, η κυτταροτοξικότητα και ένα επεξεργασμένο φάσμα συγκεντρώσεων των υπό δοκιμή χημικών ουσιών για ολοκληρωμένες δοκιμές. Στη διάρκεια των σειρών ολοκληρωμένων δοκιμών, τα επεξεργασμένα φάσματα συγκεντρώσεων των υπό δοκιμή χημικών ουσιών ελέγχονται στο πλαίσιο των βιοδοκιμασιών ERα CALUX, ενώ, στη συνέχεια, ακολουθεί η ταξινόμηση των υπό δοκιμή χημικών ουσιών ως προς την αγωνιστική ή ανταγωνιστική δράση.
|
|
8.
|
Τα κριτήρια για την ερμηνεία των δεδομένων περιγράφονται αναλυτικά στην παράγραφο 59. Εν συντομία, μια υπό δοκιμή χημική ουσία θεωρείται θετική ως προς την αγωνιστική δράση εφόσον τουλάχιστον δύο διαδοχικές συγκεντρώσεις της εμφανίζουν απόκριση ίση ή υψηλότερη από το 10 % της μέγιστης απόκρισης του προτύπου αναφοράς 17β-οιστραδιόλη (PC10). Μια υπό δοκιμή χημική ουσία θεωρείται θετική ως προς την ανταγωνιστική δράση εφόσον τουλάχιστον δύο διαδοχικές συγκεντρώσεις της εμφανίζουν απόκριση ίση ή χαμηλότερη από το 80 % της μέγιστης απόκρισης του προτύπου αναφοράς ταμοξιφαίνη (PC80).
|
ΔΙΑΔΙΚΑΣΙΑ
Κυτταρικές σειρές
|
9.
|
Για τη δοκιμασία θα πρέπει να χρησιμοποιείται η σταθερώς διαμολυνθείσα κυτταρική σειρά ERα CALUX U2OS. Η κυτταρική σειρά μπορεί να ληφθεί από την BioDetection Systems BV (Άμστερνταμ, Κάτω Χώρες), μέσω σύναψης συμφωνίας αδείας τεχνικής συνδρομής.
|
|
10.
|
Θα πρέπει να χρησιμοποιούνται μόνο κυτταρικές σειρές που είναι ελεύθερες μυκοπλάσματος. Οι χρησιμοποιούμενες παρτίδες κυττάρων θα πρέπει είτε να είναι πιστοποιημένα αρνητικές ως προς τη μόλυνση από μυκόπλασμα είτε να εξετάζονται για παρουσία μυκοπλάσματος πριν τη χρήση. Για την ευαίσθητη ανίχνευση μόλυνσης από μυκόπλασμα, θα πρέπει να χρησιμοποιείται η RT-PCR (αλυσιδωτή αντίδραση πολυμεράσης πραγματικού χρόνου) (9).
|
Σταθερότητα της κυτταρικής σειράς
|
11.
|
Για τη διατήρηση της σταθερότητας και της ακεραιότητάς τους, τα κύτταρα CALUX θα πρέπει να φυλάσσονται σε υγρό άζωτο (-80°C). Μετά την απόψυξη των κυττάρων για την έναρξη νέας καλλιέργειας, τα κύτταρα θα πρέπει να ανακαλλιεργούνται τουλάχιστον δύο φορές προτού χρησιμοποιηθούν για την αξιολόγηση της δραστικότητας αγωνιστή και ανταγωνιστή οιστρογόνου. Τα κύτταρα δεν θα πρέπει να ανακαλλιεργούνται περισσότερες από 30 φορές.
|
|
12.
|
Προκειμένου να διασφαλίζεται η παρακολούθηση της σταθερότητας της κυτταρικής σειράς με την πάροδο του χρόνου, θα πρέπει να επαληθεύεται η αποκρισιμότητα του συστήματος δοκιμής αγωνιστικής και ανταγωνιστικής δράσης, μέσω της αξιολόγησης της EC50 ή της IC50 του προτύπου αναφοράς. Επιπλέον, θα πρέπει να παρακολουθείται η σχετική επαγωγή του δείγματος θετικού μάρτυρα (PC) και του δείγματος αρνητικού μάρτυρα (NC). Τα αποτελέσματα θα πρέπει να συμμορφώνονται με τα κριτήρια αποδοχής για την αγωνιστική (πίνακας 3Γ) ή την ανταγωνιστική (πίνακας 4Γ) βιοδοκιμασία ERα CALUX. Τα πρότυπα αναφοράς, οι θετικοί και οι αρνητικοί μάρτυρες παρατίθενται στους πίνακες 1 και 2 για την αγωνιστική και την ανταγωνιστική δράση αντίστοιχα.
|
Συνθήκες καλλιέργειας και επίστρωσης κυττάρων
|
13.
|
Τα κύτταρα U2OS θα πρέπει να καλλιεργούνται σε θρεπτικό μέσο [θρεπτικό μέσο DMEM/F12 (1:1) με ερυθρό φαινόλης ως δείκτη pH, συμπληρούμενο με βόειο εμβρυϊκό ορό (7,5 %), μη απαραίτητα αμινοξέα (1 %), 10 μονάδες/ml πενικιλίνης, στρεπτομυκίνης και γενετισίνης (G-418) ως δείκτη επιλογής]. Τα κύτταρα θα πρέπει να τοποθετούνται σε επωαστήρα CO2 (5 % CO2) σε θερμοκρασία 37°C και υγρασία 100 %. Όταν επιτευχθεί συρροή κυττάρων 85-95 %, τα κύτταρα θα πρέπει είτε να ανακαλλιεργούνται είτε να προετοιμάζονται για εμβολιασμό σε τρυβλία μικροτιτλοδότησης 96 κοιλοτήτων. Στην τελευταία περίπτωση, τα κύτταρα θα πρέπει να εναιωρούνται εκ νέου με πυκνότητα 1x105 κύτταρα/ml σε θρεπτικό μέσο δοκιμασίας ελεύθερο οιστρογόνων (DMEM/F12 (1:1) χωρίς ερυθρό φαινόλης, συμπληρωμένο με βόειο εμβρυϊκό ορό που έχει υποβληθεί σε κατεργασία με επιχρισμένο με δεξτράνη ενεργό άνθρακα (5 % κ.ό.), μη απαραίτητα αμινοξέα (1 % κ.ό.), 10 μονάδες/ml πενικιλίνης και στρεπτομυκίνης), και να επιστρώνονται στις κοιλότητες των τρυβλίων μικροτιτλοδότησης 96 κοιλοτήτων (100 μl ομογενοποιημένου κυτταρικού εναιωρήματος). Τα κύτταρα θα πρέπει να προεπωάζονται σε επωαστήρα CO2 (5 % CO2, 37°C, 100 % υγρασία) επί 24 ώρες πριν από την έκθεση. Ο πλαστικός εξοπλισμός θα πρέπει να ελεύθερος οιστρογόνων.
|
Κριτήρια αποδοχής
|
14.
|
Η αγωνιστική και ανταγωνιστική δράση της υπό δοκιμή χημικής ουσίας ελέγχεται σε σειρές δοκιμών. Μια σειρά δοκιμών περιλαμβάνει έως 6 τρυβλία μικροτιτλοδότησης. Κάθε σειρά δοκιμών περιλαμβάνει τουλάχιστον 1 πλήρη σειρά αραιώσεων ενός προτύπου αναφοράς, ενός δείγματος θετικού μάρτυρα, ενός δείγματος αρνητικού μάρτυρα και μαρτύρων με διαλύτη. Στα σχήματα 1 και 2 παρατίθεται η διάταξη τρυβλίου για τις σειρές δοκιμών αγωνιστικής και ανταγωνιστικής δράσης.
|
|
15.
|
Κάθε αραίωση των προτύπων αναφοράς, των υπό δοκιμή χημικών ουσιών, όλων των μαρτύρων με διαλύτη, και των θετικών και αρνητικών μαρτύρων θα πρέπει να αναλύεται εις τριπλούν. Καθεμιά από τις τριπλές αναλύσεις θα πρέπει να συμμορφώνεται με τις απαιτήσεις που παρατίθενται στον πίνακα 3Α και στον πίνακα 4Α.
|
|
16.
|
Στο πρώτο τρυβλίο κάθε σειράς δοκιμών μετράται μια πλήρης σειρά αραιώσεων του προτύπου αναφοράς (17β-οιστραδιόλη για την αγωνιστική δράση, ταμοξιφαίνη για την ανταγωνιστική δράση). Για να είναι εφικτή η σύγκριση των αποτελεσμάτων της ανάλυσης των υπόλοιπων 5 τρυβλίων μικροτιτλοδότησης με το πρώτο τρυβλίο μικροτιτλοδότησης που περιέχει την πλήρη καμπύλη συγκέντρωσης-απόκρισης του προτύπου αναφοράς, όλα τα τρυβλία θα πρέπει να περιέχουν 3 δείγματα μάρτυρες: τον μάρτυρα με διαλύτη, τη μέγιστη συγκέντρωση του ελεγχθέντος προτύπου αναφοράς, και την κατά προσέγγιση συγκέντρωση EC50 (αγωνιστική δράση) ή IC50 (ανταγωνιστική δράση) του προτύπου αναφοράς. Ο λόγος των μέσων δειγμάτων μαρτύρων στο πρώτο τρυβλίο και των υπόλοιπων 5 τρυβλίων θα πρέπει να συμμορφώνεται με τις απαιτήσεις που παρατίθενται στον πίνακα 3Γ (αγωνιστική δράση) ή τον πίνακα 4Γ (ανταγωνιστική δράση).
|
|
17.
|
Για καθένα από τα τρυβλία μικροτιτλοδότησης μιας σειράς δοκιμών, υπολογίζεται ο συντελεστής z (10). Ο συντελεστής z θα πρέπει να υπολογίζεται με χρήση των αποκρίσεων στην υψηλότερη και τη χαμηλότερη συγκέντρωση του προτύπου αναφοράς. Ένα τρυβλίο μικροτιτλοδότησης θεωρείται έγκυρο εφόσον συμμορφώνεται με τις απαιτήσεις που αναφέρονται στον πίνακα 3Γ (αγωνιστική δράση) ή τον πίνακα 4Γ (ανταγωνιστική δράση).
|
|
18.
|
Το πρότυπο αναφοράς θα πρέπει να εμφανίζει σιγμοειδή καμπύλη δόσης-απόκρισης. Η EC50 ή η IC50 που προκύπτει από την απόκριση της σειράς αραιώσεων του προτύπου αναφοράς θα πρέπει να ανταποκρίνεται στις απαιτήσεις που παρατίθενται στον πίνακα 3Γ (αγωνιστική δράση) ή τον πίνακα 4Γ (ανταγωνιστική δράση).
|
|
19.
|
Κάθε σειρά δοκιμών θα πρέπει να περιλαμβάνει ένα δείγμα θετικού μάρτυρα και ένα δείγμα αρνητικού μάρτυρα. Η υπολογισθείσα σχετική επαγωγή αμφότερων των δειγμάτων θετικού και αρνητικού μάρτυρα θα πρέπει να ανταποκρίνεται στις απαιτήσεις που παρατίθενται στον πίνακα 3Γ (αγωνιστική δράση) και τον πίνακα 4Γ (ανταγωνιστική δράση).
|
|
20.
|
Στη διάρκεια όλων των μετρήσεων, ο συντελεστής επαγωγής της υψηλότερης συγκέντρωσης του προτύπου αναφοράς θα πρέπει να μετράται μέσω διαίρεσης της μέσης απόκρισης σε σχετικές μονάδες φωτός (RLU) του υψηλότερου προτύπου αναφοράς 17β-οιστραδιόλης διά της μέσης απόκρισης RLU μάρτυρα με διαλύτη αναφοράς. Ο συντελεστής επαγωγής θα πρέπει να συμμορφώνεται με τις ελάχιστες απαιτήσεις για την πολλαπλάσια επαγωγή που παρατίθενται στον πίνακα 3Γ (αγωνιστική δράση) ή τον πίνακα 4Γ (ανταγωνιστική δράση).
|
|
21.
|
Μόνο τα τρυβλία μικροτιτλοδότησης που πληρούν όλα τα προαναφερθέντα κριτήρια αποδοχής θεωρούνται έγκυρα και μπορούν να χρησιμοποιούνται για την αξιολόγηση της απόκρισης των υπό δοκιμή χημικών ουσιών.
|
|
22.
|
Τα κριτήρια αποδοχής εφαρμόζονται σε αμφότερες τις σειρές δοκιμών προδιαλογής και τις σειρές ολοκληρωμένων δοκιμών.
|
Πίνακας 1
Συγκεντρώσεις προτύπου αναφοράς, θετικού μάρτυρα (PC) και αρνητικού μάρτυρα (NC) για τη βιοδοκιμασία CALUX αγωνιστικής δράσης
|
|
Ουσία
|
Αριθμός CAS
|
Εύρος δοκιμής (Μ)
|
|
Πρότυπο αναφοράς
|
17β-οιστραδιόλη
|
50-28-2
|
1*10-13 – 1*10-10
|
|
Θετικός μάρτυρας (PC)
|
17α-μεθυλοτεστοστερόνη
|
58-18-4
|
3*10-6
|
|
Αρνητικός μάρτυρας (NC):
|
κορτικοστερόνη
|
50-22-6
|
1*10-8
|
Πίνακας 2
Συγκεντρώσεις προτύπου αναφοράς, θετικού μάρτυρα (PC) και αρνητικού μάρτυρα (NC) για τη βιοδοκιμασία CALUX ανταγωνιστικής δράσης
|
|
Ουσία
|
Αριθμός CAS
|
Εύρος δοκιμής (Μ)
|
|
Πρότυπο αναφοράς
|
ταμοξιφαίνη
|
10540-29-1
|
3*10–9 – 1*10–5
|
|
Θετικός μάρτυρας (PC)
|
4-υδροξυταμοξιφαίνη
|
68047-06-3
|
1*10–9
|
|
Αρνητικός μάρτυρας (NC):
|
ρεσβερατρόλη
|
501-36-0
|
1*10–5
|
Πίνακας 3
Κριτήρια αποδοχής για τη βιοδοκιμασία ERα CALUX αγωνιστικής δράσης
|
A - μεμονωμένα δείγματα σε τρυβλίο
|
Κριτήριο
|
|
1
|
Μέγιστο %SD τριπλών κοιλοτήτων (για NC, PC, κάθε αραίωση της υπό δοκιμή χημικής ουσίας και το πρότυπο αναφοράς, εκτός του C0)
|
< 15 %
|
|
2
|
Μέγιστο %SD τριπλών κοιλοτήτων [για τους μάρτυρες με διαλύτη προτύπου αναφοράς και τους μάρτυρες με διαλύτη της υπό δοκιμή χημικής ουσίας (C0, SC)]
|
< 30 %
|
|
3
|
Μέγιστη διαρροή LDH, ως μέτρο κυτταροτοξικότητας
|
< 120 %
|
|
B - εντός μεμονωμένου τρυβλίου μικροτιτλοδότησης
|
|
|
4
|
Λόγος του μάρτυρα με διαλύτη προτύπου αναφοράς (C0, τρυβλίο 1) και του μάρτυρα με διαλύτη της υπό δοκιμή χημικής ουσίας (SC, τρυβλία 2 έως x)
|
0,5 έως 2,0
|
|
5
|
Λόγος της κατά προσέγγιση EC50 και των υψηλότερων συγκεντρώσεων προτύπου αναφοράς στο τρυβλίο 1 και της κατά προσέγγιση EC50 και των υψηλότερων συγκεντρώσεων προτύπου αναφοράς στα τρυβλία 2 έως x (C4, C8)
|
0,70 έως 1,30
|
|
6
|
Συντελεστής z για κάθε τρυβλίο
|
>0,6
|
|
Γ - σε μεμονωμένη σειρά αναλύσεων (όλα τα τρυβλία σε μεμονωμένη σειρά)
|
|
|
7
|
Σιγμοειδής καμπύλη προτύπου αναφοράς
|
Ναι (17β-οιστραδιόλη)
|
|
8
|
Πρότυπο αναφοράς εύρους EC50 17β-οιστραδιόλη
|
4*10-12 – 4*10-11 M
|
|
9
|
Ελάχιστη πολλαπλάσια επαγωγή της υψηλότερης συγκέντρωσης 17β-οιστραδιόλης, σε σχέση με τον μάρτυρα με διαλύτη προτύπου αναφοράς
|
5
|
|
10
|
Σχετική επαγωγή (%) θετικού μάρτυρα
|
> 30 %
|
|
11
|
Σχετική επαγωγή (%) αρνητικού μάρτυρα
|
< 10 %
|
PC: θετικός μάρτυρας, NC: αρνητικός μάρτυρας, SC: μάρτυρας με διαλύτη υπό δοκιμή χημικής ουσίας, C0: μάρτυρας με διαλύτη προτύπου αναφοράς, SD: τυπική απόκλιση, LDH: γαλακτική αφυδρογονάση
Πίνακας 4
Κριτήρια αποδοχής για τη βιοδοκιμασία ERα CALUX αγωνιστικής δράσης
|
A - μεμονωμένα δείγματα σε τρυβλίο
|
Κριτήριο
|
|
1
|
Μέγιστο %SD τριπλών κοιλοτήτων [για NC, PC, κάθε αραίωση της υπό δοκιμή χημικής ουσίας και το πρότυπο αναφοράς, μάρτυρα με διαλύτη (C0)]
|
< 15 %
|
|
2
|
Μέγιστο %SD τριπλών κοιλοτήτων [για μάρτυρα με φορέα (VC) και υψηλότερη συγκέντρωση προτύπου αναφοράς (C8)]
|
< 30 %
|
|
3
|
Μέγιστη διαρροή LDH, ως μέτρο κυτταροτοξικότητας
|
< 120 %
|
|
B - εντός μεμονωμένου τρυβλίου μικροτιτλοδότησης
|
|
|
4
|
Λόγος του μάρτυρα με διαλύτη προτύπου αναφοράς (C0, τρυβλίο 1) και του μάρτυρα με διαλύτη της υπό δοκιμή χημικής ουσίας (SC, τρυβλία 2 έως x)
|
0,70 έως 1,30
|
|
5
|
Λόγος των κατά προσέγγιση συγκεντρώσεων προτύπου αναφοράς IC50 τρυβλίο 1 και των κατά προσέγγιση συγκεντρώσεων προτύπου αναφοράς IC50 στα τρυβλία 2 έως x (C4)
|
0,70 έως 1,30
|
|
6
|
Λόγος των υψηλότερων συγκεντρώσεων προτύπου αναφοράς στο τρυβλίο 1 και των υψηλότερων συγκεντρώσεων προτύπου αναφοράς στα τρυβλία 2 έως x (C8)
|
0,50 έως 2,0
|
|
7
|
Συντελεστής z για κάθε τρυβλίο
|
>0,6
|
|
Γ - σε μεμονωμένη σειρά αναλύσεων (όλα τα τρυβλία σε μεμονωμένη σειρά)
|
|
|
8
|
Σιγμοειδής καμπύλη προτύπου αναφοράς
|
Ναι (ταμοξιφαίνη)
|
|
9
|
Πρότυπο αναφοράς εύρους IC50 (ταμοξιφαίνη)
|
1*10-8 - 1*10-7 M
|
|
10
|
Ελάχιστη πολλαπλάσια επαγωγή του μάρτυρα με διαλύτη προτύπου αναφοράς, σε σχέση με την υψηλότερη συγκέντρωση ταμοξιφαίνης
|
2.5
|
|
11
|
Σχετική επαγωγή (%) θετικού μάρτυρα
|
< 70 %
|
|
12
|
Σχετική επαγωγή (%) αρνητικού μάρτυρα
|
>85 %
|
PC: θετικός μάρτυρας, NC: αρνητικός μάρτυρας, VC: μάρτυρας με φορέα (μάρτυρας με διαλύτη χωρίς καθορισμένη συγκέντρωση του προτύπου αναφοράς αγωνιστών), SC: μάρτυρας με διαλύτη υπό δοκιμή χημικής ουσίας, C0: μάρτυρας με διαλύτη προτύπου αναφοράς, SD: τυπική απόκλιση, LDH: γαλακτική αφυδρογονάση
Μάρτυρας με διαλύτη/φορέα, πρότυπα αναφοράς, θετικοί μάρτυρες, αρνητικοί μάρτυρες
|
23.
|
Τόσο για τη σειρά δοκιμών προδιαλογής όσο και για τις σειρές ολοκληρωμένων δοκιμών, θα πρέπει να χρησιμοποιείται ο ίδιος μάρτυρας με διαλύτη/φορέα, πρότυπα αναφοράς, θετικοί και αρνητικοί μάρτυρες. Επιπλέον, θα πρέπει να χρησιμοποιείται η ίδια συγκέντρωση προτύπων αναφοράς, θετικών και αρνητικών μαρτύρων.
|
Μάρτυρας με διαλύτη
|
24.
|
Ο διαλύτης που χρησιμοποιείται για τη διάλυση των υπό δοκιμή χημικών ουσιών θα πρέπει να ελέγχεται ως μάρτυρας με διαλύτη. Ως φορέας κατά την επικύρωση της βιοδοκιμασίας ERα CALUX χρησιμοποιήθηκε διμεθυλοσουλφοξείδιο (DMSO, 1 % κ.ό., CASRN 67-68-5). Σε περίπτωση που χρησιμοποιείται διαλύτης άλλος από το DMSO, όλα τα πρότυπα αναφοράς, οι μάρτυρες και οι υπό δοκιμή χημικές ουσίες θα πρέπει να ελέγχονται στον ίδιο φορέα. Επισημαίνεται ότι ο μάρτυρας με διαλύτη για τις μελέτες ανταγωνιστικής δράσης περιέχει καθορισμένη συγκέντρωση του προτύπου αναφοράς αγωνιστών 17β-οιστραδιόλη (κατά προσέγγιση συγκέντρωση EC50). Για τον έλεγχο του διαλύτη που χρησιμοποιείται για τις μελέτες ανταγωνιστικής δράσης, θα πρέπει να παρασκευάζεται και να ελέγχεται μάρτυρας με φορέα.
|
Μάρτυρας με φορέα (ανταγωνιστική δράση)
|
25.
|
Για τις δοκιμές ανταγωνιστικής δράσης, το θρεπτικό μέσο της δοκιμασίας συμπληρώνεται με καθορισμένη συγκέντρωση του προτύπου αναφοράς αγωνιστών 17β-οιστραδιόλη (κατά προσέγγιση συγκέντρωση EC50). Για τον έλεγχο του διαλύτη που χρησιμοποιείται για τη διάλυση των υπό δοκιμή χημικών ουσιών που θα ελεγχθούν ως προς την ανταγωνιστική δράση, θα πρέπει να παρασκευάζεται καθορισμένη συγκέντρωση του προτύπου αναφοράς αγωνιστών 17β-οιστραδιόλη. Το εν λόγω δείγμα μάρτυρα υποδεικνύεται ως ο μάρτυρας με φορέα. Ως φορέας κατά την επικύρωση της βιοδοκιμασίας ERα CALUX χρησιμοποιήθηκε διμεθυλοσουλφοξείδιο (DMSO, 1 % κ.ό., CASRN 67-68-5). Σε περίπτωση που χρησιμοποιείται διαλύτης άλλος από το DMSO, όλα τα πρότυπα αναφοράς, οι μάρτυρες και οι υπό δοκιμή χημικές ουσίες θα πρέπει να ελέγχονται στον ίδιο φορέα.
|
Πρότυπα αναφοράς
|
26.
|
Το πρότυπο αναφοράς αγωνιστικής δράσης είναι η 17β-οιστραδιόλη (πίνακας 1). Τα πρότυπα αναφοράς φέρονται σε σειρά αραιώσεων οκτώ συγκεντρώσεων 17β-οιστραδιόλης (1*10-13, 3*10-13, 1*10-12, 3*10-12, 6*10-12, 1*10-11, 3*10-11, 1*10-10 M).
|
|
27.
|
Το πρότυπο αναφοράς αγωνιστικής δράσης είναι η ταμοξιφαίνη (πίνακας 2). Τα πρότυπα αναφοράς φέρονται σε σειρά αραιώσεων οκτώ συγκεντρώσεων ταμοξιφαίνης (3*10-9, 1*10-8, 3*10-8, 1*10-7, 3*10-7, 1*10-6, 3*10-6, 1*10-5 M). Καθεμία εκ των συγκεντρώσεων του προτύπου αναφοράς ανταγωνιστικής δράσης συνεπωάζεται με καθορισμένη συγκέντρωση του προτύπου αναφοράς αγωνιστικής δράσης 17β-οιστραδιόλη (3*10-12 M).
|
Θετικός μάρτυρας
|
28.
|
Ο θετικός μάρτυρας για τις μελέτες αγωνιστικής δράσης είναι η 17α-μεθυλοτεστοστερόνη (πίνακας 1).
|
|
29.
|
Ο θετικός μάρτυρας για τις μελέτες ανταγωνιστικής δράσης είναι η 4-υδροξυταμοξιφαίνη (πίνακας 2). Ο θετικός μάρτυρας ανταγωνιστικής δράσης συνεπωάζεται με καθορισμένη συγκέντρωση του προτύπου αναφοράς αγωνιστικής δράσης 17β-οιστραδιόλη (3*10-12 M).
|
Αρνητικός μάρτυρας
|
30.
|
Ο αρνητικός μάρτυρας για τις μελέτες αγωνιστικής δράσης είναι η κορτικοστερόνη (πίνακας 1).
|
|
31.
|
Ο αρνητικός μάρτυρας για τις μελέτες ανταγωνιστικής δράσης είναι η ρεσβερατρόλη (πίνακας 2). Ο αρνητικός μάρτυρας ανταγωνιστικής δράσης συνεπωάζεται με καθορισμένη συγκέντρωση του προτύπου αναφοράς αγωνιστικής δράσης 17β-οιστραδιόλη (3*10-12 M).
|
Απόδειξη της τεχνικής ικανότητας του εργαστηρίου (βλ. παράγραφο 14 και πίνακες 3 και 4 στην ενότητα «ΣΤΟΙΧΕΙΑ ΤΗΣ ΔΟΚΙΜΑΣΙΑΣ ER TA» της παρούσας μεθόδου δοκιμών)
Φορέας
|
32.
|
Ο διαλύτης που χρησιμοποιείται για τη διάλυση των υπό δοκιμή χημικών ουσιών θα πρέπει να διαλύει πλήρως την υπό δοκιμή χημική ουσία και θα πρέπει να αναμειγνύεται με το θρεπτικό μέσο κυτταροκαλλιέργειας. Κατάλληλοι διαλύτες είναι το DMSO, το νερό και η αιθανόλη (καθαρότητας 95 % έως 100 %). Σε περίπτωση που ως διαλύτης χρησιμοποιείται το DMSO, η μέγιστη συγκέντρωση του DMSO κατά την επώαση δεν θα πρέπει να υπερβαίνει το 1 % κ.ό. Πριν από τη χρήση, ο διαλύτης θα πρέπει να ελέγχεται προκειμένου να διαπιστώνεται ότι δεν είναι κυτταροτοξικός και δεν παρεμποδίζει τις επιδόσεις της δοκιμασίας.
|
Προετοιμασία των προτύπων αναφοράς, των θετικών μαρτύρων, των αρνητικών μαρτύρων και των υπό δοκιμή χημικών ουσιών
|
33.
|
Τα πρότυπα αναφοράς, οι θετικοί μάρτυρες, οι αρνητικοί μάρτυρες και οι υπό δοκιμή χημικές ουσίες διαλύονται σε 100 % DMSO (ή σε κατάλληλο διαλύτη). Στη συνέχεια παρασκευάζονται κατάλληλες (διαδοχικές) αραιώσεις στον ίδιο διαλύτη. Πριν από τη διάλυση, όλες οι ουσίες θα πρέπει να αφήνονται να ισορροπήσουν σε θερμοκρασία δωματίου. Τα πρόσφατα παρασκευασθέντα διαλύματα αποθέματος προτύπων αναφοράς, θετικών μαρτύρων, αρνητικών μαρτύρων και υπό δοκιμή χημικών ουσιών δεν θα πρέπει να περιέχουν εμφανές ίζημα ή θολερότητα. Τα αποθέματα προτύπων αναφοράς και μαρτύρων μπορούν να παρασκευάζονται μαζικά. Πριν από κάθε πείραμα, θα πρέπει να εξασφαλίζεται η ύπαρξη πρόσφατα παρασκευασθέντων διαλυμάτων αποθέματος των υπό δοκιμή χημικών ουσιών. Οι τελικές αραιώσεις προτύπων αναφοράς, θετικών μαρτύρων, αρνητικών μαρτύρων και υπό δοκιμή χημικών ουσιών που χρησιμοποιούνται σε κάθε πείραμα θα πρέπει να έχουν παρασκευαστεί πρόσφατα και να χρησιμοποιούνται εντός 24 ωρών από την παρασκευή τους.
|
Διαλυτότητα, κυτταροτοξικότητα και προσδιορισμός εύρους
|
34.
|
Κατά τη σειρά δοκιμών προδιαλογής, προσδιορίζεται η διαλυτότητα των υπό δοκιμή χημικών ουσιών στον επιλεγμένο διαλύτη. Παρασκευάζεται μέγιστη συγκέντρωση αποθέματος 0,1 M. Σε περίπτωση που η συγκεκριμένη συγκέντρωση παρουσιάζει προβλήματα διαλυτότητας, θα πρέπει να παρασκευάζονται διαλύματα μικρότερης συγκέντρωσης μέχρις ότου διαλυθούν πλήρως οι υπό δοκιμή χημικές ουσίες. Κατά τη σειρά δοκιμών προδιαλογής, ελέγχονται διαδοχικές αραιώσεις 1:10 της υπό δοκιμή χημικής ουσίας. Η μέγιστη συγκέντρωση δοκιμασίας για τις δοκιμές αγωνιστών ή ανταγωνιστών είναι 1 mM. Μετά την προδιαλογή, υπολογίζεται ένα κατάλληλο επεξεργασμένο εύρος συγκεντρώσεων για τις υπό δοκιμή χημικές ουσίες, το οποίο θα πρέπει να ελέγχεται κατά τις σειρές ολοκληρωμένων δοκιμών. Οι αραιώσεις που χρησιμοποιούνται για τις ολοκληρωμένες δοκιμές θα πρέπει να είναι 1x, 3x, 10x, 30x, 100x, 300x, 1000x και 3000x.
|
|
35.
|
Στο πρωτόκολλο δοκιμασίας αγωνιστών και ανταγωνιστών περιλαμβάνονται δοκιμές κυτταροτοξικότητας (11). Οι δοκιμές κυτταροτοξικότητας είναι ενσωματωμένες τόσο στη σειρά δοκιμών προδιαλογής όσο και στις σειρές ολοκληρωμένων δοκιμών. Η μέθοδος που χρησιμοποιήθηκε για την αξιολόγηση της κυτταροτοξικότητας κατά την επικύρωση της βιοδοκιμασίας ERα CALUX ήταν η δοκιμή διαρροής γαλακτικής αφυδρογονάσης (LDH), σε συνδυασμό με την ποιοτική οπτική επιθεώρηση των κυττάρων (βλ. προσάρτημα 4.1) μετά από έκθεση στις υπό δοκιμή χημικές ουσίες. Ωστόσο, για τον προσδιορισμό της κυτταροτοξικότητας μπορούν να χρησιμοποιηθούν και άλλες ποσοτικές μέθοδοι [π.χ. η χρωματομετρική δοκιμασία με βάση το τετραζόλιο (MTT) ή η βιοδοκιμασία κυτταροτοξικότητας CALUX]. Σε γενικές γραμμές, οι συγκεντρώσεις υπό δοκιμή χημικών ουσιών που εμφανίζουν μείωση της κυτταρικής βιωσιμότητας μεγαλύτερη του 20 % θεωρούνται κυτταροτοξικές και, ως εκ τούτου, δεν μπορούν να χρησιμοποιηθούν για την αξιολόγηση δεδομένων. Όσον αφορά τη δοκιμασία διαρροής LDH, η συγκέντρωση της υπό δοκιμή χημικής ουσίας θεωρείται κυτταροτοξική όταν το ποσοστό της διαρροής LDH υπερβαίνει το 120 %.
|
Έκθεση σε υπό δοκιμή χημικές ουσίες και οργάνωση τρυβλίου της δοκιμασίας
|
36.
|
Μετά από θρυψινισμό μιας φιάλης καλλιέργειας με πλήρη συρροή κυττάρων, τα κύτταρα εναιωρούνται εκ νέου σε 1x105 κύτταρα/ml σε ελεύθερο οιστρογόνων θρεπτικό μέσο δοκιμασίας. Στις εσωτερικές κοιλότητες τρυβλίου μικροτιτλοδότησης 96 κοιλοτήτων επιστρώνονται 100 μl επανεναιωρηθέντων κυττάρων. Οι εξωτερικές κοιλότητες πληρούνται με 200 μl ρυθμιστικού διαλύματος φωσφορικών αλάτων (PBS) (βλ. σχήματα 1 και 2). Τα επιστρωμένα κύτταρα προεπωάζονται επί 24 ώρες σε επωαστήρα CO2 (5 % CO2, 37 °C, 100 % υγρασία).
|
|
37.
|
Μετά την προεπώαση, τα τρυβλία επιθεωρούνται οπτικά για τυχόν κυτταροτοξικότητα (βλ. προσάρτημα 4.1) ή μόλυνση και ως προς τη συρροή. Στις δοκιμές χρησιμοποιούνται μόνο τα τρυβλία που δεν εμφανίζουν καθόλου ορατή κυτταροτοξικότητα ή μόλυνση και παρουσιάζουν συρροή σε ποσοστό τουλάχιστον 85 %. Το θρεπτικό μέσο αφαιρείται προσεκτικά από τις εσωτερικές κοιλότητες και αντικαθίσταται από 200 μl ελεύθερου οιστρογόνων θρεπτικού μέσου δοκιμασίας που περιέχει κατάλληλες διαδοχικές αραιώσεις των προτύπων αναφοράς, των υπό δοκιμή χημικών ουσιών, των θετικών μαρτύρων,των αρνητικών μαρτύρων και των μαρτύρων με διαλύτη (πίνακας 5: μελέτες αγωνιστών· πίνακας 6: μελέτες ανταγωνιστών). Όλα τα πρότυπα αναφοράς, οι υπό δοκιμή χημικές ουσίες, οι θετικοί μάρτυρες, οι αρνητικοί μάρτυρες και οι μάρτυρες με διαλύτη ελέγχονται εις τριπλούν. Στο σχήμα 1 παρέχεται η διάταξη του τρυβλίου για τις δοκιμές αγωνιστών. Στο σχήμα 2 παρέχεται η διάταξη του τρυβλίου για τις δοκιμές ανταγωνιστών. Η διάταξη του τρυβλίου για τις δοκιμές προδιαλογής είναι πανομοιότυπη με την αντίστοιχη διάταξη για τις ολοκληρωμένες δοκιμές. Όσον αφορά τις δοκιμές ανταγωνιστών, όλες οι εσωτερικές κοιλότητες, εκτός των κοιλοτήτων μάρτυρα με φορέα (VC), περιέχουν επίσης καθορισμένη συγκέντρωση του προτύπου αναφοράς αγωνιστικής δράσης 17β-οιστραδιόλη (3*10-12 M). Επισημαίνεται ότι τα πρότυπα αναφοράς C8 και C4 θα πρέπει να προστίθενται σε κάθε τρυβλίο TC.
|
|
38.
|
Μετά την έκθεση των κυττάρων σε όλες τις χημικές ουσίες, τα τρυβλία μικροτιτλοδότησης 96 κοιλοτήτων θα πρέπει να επωάζονται για 24 ακόμη ώρες σε επωαστήρα CO2 (5 % CO2, 37 °C, 100 % υγρασία).
|
Σχήμα 1
Διάταξη των τρυβλίων μικροτιτλοδότησης 96 κοιλοτήτων για προδιαλογή και αξιολόγηση της αγωνιστικής δράσης
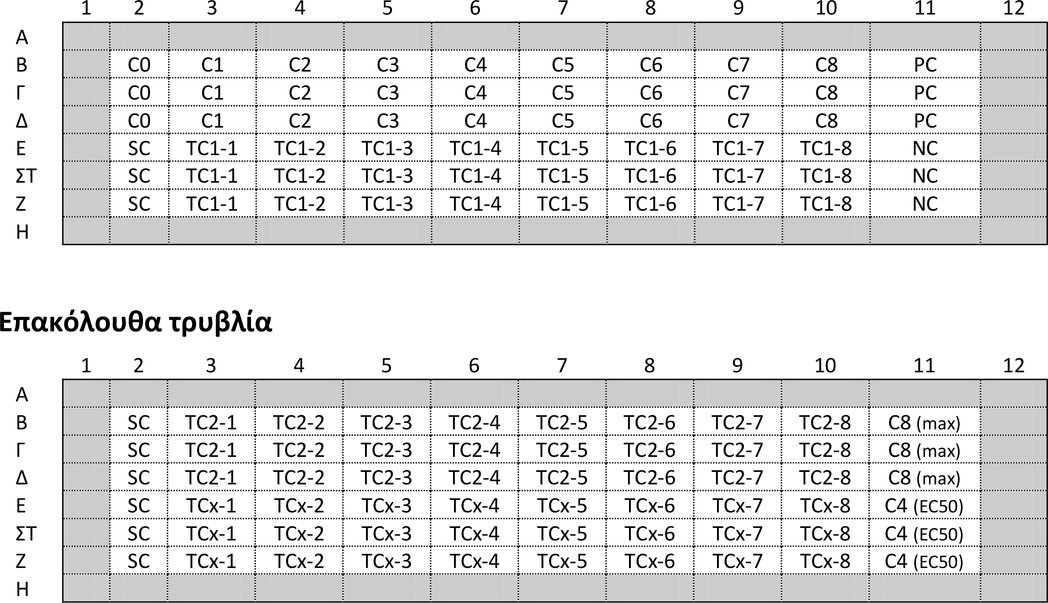
C0 = διαλύτης προτύπου αναφοράς.
C(1-8) = σειρά αραιώσεων (1-8, χαμηλές προς υψηλές συγκεντρώσεις) προτύπου αναφοράς.
PC = θετικός μάρτυρας.
NC = αρνητικός μάρτυρας.
TCx-(1-8) = αραιώσεις (1-8, χαμηλές προς υψηλές συγκεντρώσεις) της υπό δοκιμή χημικής ουσίας για τη σειρά δοκιμών προδιαλογής και την αξιολόγηση της αγωνιστικής δράσης της υπό δοκιμή χημικής ουσίας x.
SC = μάρτυρας με διαλύτη της υπό δοκιμή χημικής ουσίας (ιδανικά ο ίδιος διαλύτης με το C0, αλλά πιθανώς από άλλη παρτίδα).
Σκιασμένα κελιά: = Εξωτερικές κοιλότητες, με έως 200 μl PBS.
Σχήμα 2
Διάταξη τρυβλίων μικροτιτλοδότησης 96 κοιλοτήτων για την προδιαλογή ανταγωνιστικής δράσης και την αξιολόγηση της ανταγωνιστικής επίδρασης

C0 = διαλύτης προτύπου αναφοράς.
C(1-8) = σειρά αραιώσεων (1-8, χαμηλές προς υψηλές συγκεντρώσεις) προτύπου αναφοράς.
NC = αρνητικός μάρτυρας.
PC = θετικός μάρτυρας.
TCx-(1-8) = αραιώσεις (1-8, χαμηλές προς υψηλές συγκεντρώσεις) της υπό δοκιμή χημικής ουσίας για τη σειρά δοκιμών προδιαλογής και την αξιολόγηση της αγωνιστικής δράσης της υπό δοκιμή χημικής ουσίας x.
SC = μάρτυρας με διαλύτη της υπό δοκιμή χημικής ουσίας (ιδανικά ο ίδιος διαλύτης με το C0, αλλά πιθανώς από άλλη παρτίδα).
VC = μάρτυρας με φορέα (μάρτυρας με διαλύτη χωρίς καθορισμένη συγκέντρωση του προτύπου αναφοράς αγωνιστών 17β-οιστραδιόλη).
Σκιασμένα κελιά: = Εξωτερικές κοιλότητες, με έως 200 μl PBS.
Σημείωση: όλες οι εσωτερικές κοιλότητες, εκτός των κοιλοτήτων μάρτυρα με φορέα (VC), περιέχουν επίσης καθορισμένη συγκέντρωση προτύπου αναφοράς αγωνιστών 17β-οιστραδιόλη (3,0*10-12 M)
Μέτρηση της φωταύγειας
|
39.
|
Η μέτρηση της φωταύγειας περιγράφεται αναλυτικά στο πρωτόκολλο δοκιμασίας αγωνιστών και ανταγωνιστών (10). Το θρεπτικό μέσο θα πρέπει να αφαιρείται από τις κοιλότητες και τα κύτταρα θα πρέπει να λύονται μετά από 24 ώρες επώασης προκειμένου να ανοιχτεί η κυτταρική μεμβράνη και να μετρηθεί η δραστικότητα λουσιφεράσης.
|
|
40.
|
Για τη διαδικασία μέτρησης της φωταύγειας απαιτείται λουμινόμετρο με 2 εγχυτές. Η αντίδραση της λουσιφεράσης εκκινείται μέσω έγχυσης του υποστρώματος λουσιφερίνη. Η αντίδραση διακόπτεται με προσθήκη 0,2 M NaOH. Η αντίδραση διακόπτεται για την αποτροπή της μεταφοράς φωταύγειας από μία κοιλότητα σε άλλη.
|
|
41.
|
Το φως που εκπέμπεται από κάθε κοιλότητα εκφράζεται υπό μορφή σχετικών μονάδων φωτός (RLU) ανά κοιλότητα.
|
Σειρά δοκιμών προδιαλογής
|
42.
|
Τα αποτελέσματα της ανάλυσης προδιαλογής χρησιμοποιούνται για τον προσδιορισμό ενός επεξεργασμένου εύρους συγκεντρώσεων των υπό δοκιμή χημικών ουσιών για τη διεξαγωγή ολοκληρωμένων δοκιμών. Η αξιολόγηση των αποτελεσμάτων ανάλυσης προδιαλογής και ο προσδιορισμός του επεξεργασμένου εύρους των υπό δοκιμή χημικών ουσιών για τη διεξαγωγή ολοκληρωμένων δοκιμών περιγράφονται εις βάθος στο πρωτόκολλο δοκιμασίας αγωνιστών και ανταγωνιστών (10). Εδώ δίνεται μια συνοπτική παρουσίαση των διαδικασιών προσδιορισμού του εύρους συγκεντρώσεων των υπό δοκιμή χημικών ουσιών για τη διεξαγωγή δοκιμών αγωνιστών και ανταγωνιστών. Για καθοδήγηση σχετικά με τον σχεδιασμό των διαδοχικών αραιώσεων, βλέπε πίνακες 5 και 6.
|
Επιλογή συγκεντρώσεων για την αξιολόγηση των αγωνιστικών επιδράσεων
|
43.
|
Κατά τη σειρά δοκιμών προδιαλογής, οι υπό δοκιμή χημικές ουσίες θα πρέπει να ελέγχονται με χρήση των διαδοχικών αραιώσεων που φαίνονται στους πίνακες 5 (αγωνιστική δράση) και 6 (ανταγωνιστική δράση). Όλες οι συγκεντρώσεις θα πρέπει να ελέγχονται σε τριπλές κοιλότητες, σύμφωνα με τη διάταξη τρυβλίου που φαίνεται στο σχήμα 1 (αγωνιστική δράση) ή 2 (ανταγωνιστική δράση).
|
|
44.
|
Μόνο τα αποτελέσματα ανάλυσης που πληρούν τα κριτήρια αποδοχής (πίνακας 3) θεωρούνται έγκυρα και μπορούν να χρησιμοποιούνται για την αξιολόγηση της απόκρισης των υπό δοκιμή χημικών ουσιών. Σε περίπτωση που ένα ή περισσότερα τρυβλία μικροτιτλοδότησης σε μια σειρά ανάλυσης δεν πληροί τα κριτήρια αποδοχής, τα αντίστοιχα τρυβλία μικροτιτλοδότησης θα πρέπει να αναλύονται εκ νέου. Σε περίπτωση που το πρώτο τρυβλίο που περιέχει την πλήρη σειρά αραιώσεων του προτύπου αναφοράς δεν πληροί τα κριτήρια αποδοχής, ολόκληρη η σειρά δοκιμών (6 τρυβλία) θα πρέπει να αναλύεται εκ νέου.
|
|
45.
|
Τα αρχικά εύρη συγκεντρώσεων των υπό δοκιμή χημικών ουσιών θα πρέπει να προσαρμόζονται και η σειρά δοκιμών προδιαλογής θα πρέπει να επαναλαμβάνεται εάν
|
—
|
παρατηρηθεί κυτταροτοξικότητα. Η διαδικασία προδιαλογής θα πρέπει να επαναλαμβάνεται με χαμηλότερες μη κυτταροτοξικές συγκεντρώσεις της υπό δοκιμή χημικής ουσίας.
|
|
—
|
κατά την προδιαλογή της υπό δοκιμή χημικής ουσίας δεν εμφανίζεται πλήρης καμπύλη δόσης-απόκρισης, διότι από τις ελεγχθείσες συγκεντρώσεις προκύπτει μέγιστη επαγωγή. Η σειρά δοκιμών προδιαλογής θα πρέπει να επαναλαμβάνεται με χρήση χαμηλότερων συγκεντρώσεων της υπό δοκιμή χημικής ουσίας.
|
|
|
46.
|
Όταν παρατηρείται έγκυρη απόκριση που σχετίζεται με τη δόση, θα πρέπει να επιλέγεται η (χαμηλότερη) συγκέντρωση στην οποία παρατηρείται μέγιστη επαγωγή χωρίς κυτταροτοξικότητα. Η υψηλότερη συγκέντρωση της υπό δοκιμή χημικής ουσίας που θα ελεγχθεί στις ολοκληρωμένες δοκιμές θα πρέπει να είναι τριπλάσια της εν λόγω επιλεγμένης συγκέντρωσης.
|
|
47.
|
Θα πρέπει να προετοιμάζεται πλήρης, επεξεργασμένη σειρά αραιώσεων με τα στάδια αραίωσης που φαίνονται στον πίνακα 5, ξεκινώντας από την υψηλότερη συγκέντρωση, όπως προσδιορίστηκε ανωτέρω.
|
|
48.
|
Υπό δοκιμή χημική ουσία που δεν επάγει αγωνιστική επίδραση θα πρέπει να ελέγχεται στο πλαίσιο των σειρών ολοκληρωμένων δοκιμών, αρχής γενομένης από την υψηλότερη, μη κυτταροτοξική συγκέντρωση που προσδιορίζεται κατά την προδιαλογή.
|
Επιλογή συγκεντρώσεων για την αξιολόγηση των ανταγωνιστικών επιδράσεων
|
49.
|
Μόνο τα αποτελέσματα ανάλυσης που πληρούν τα κριτήρια αποδοχής (πίνακας 4) θεωρούνται έγκυρα και μπορούν να χρησιμοποιούνται για την αξιολόγηση της απόκρισης των υπό δοκιμή χημικών ουσιών. Σε περίπτωση που ένα ή περισσότερα τρυβλία μικροτιτλοδότησης σε μια σειρά ανάλυσης δεν πληροί τα κριτήρια αποδοχής, τα αντίστοιχα τρυβλία μικροτιτλοδότησης θα πρέπει να αναλύονται εκ νέου. Σε περίπτωση που το πρώτο τρυβλίο που περιέχει την πλήρη σειρά αραιώσεων του προτύπου αναφοράς δεν πληροί τα κριτήρια αποδοχής, ολόκληρη η σειρά δοκιμών (6 τρυβλία) θα πρέπει να αναλύεται εκ νέου.
|
|
50.
|
Τα αρχικά εύρη συγκεντρώσεων των υπό δοκιμή χημικών ουσιών θα πρέπει να προσαρμόζονται και η σειρά δοκιμών προδιαλογής θα πρέπει να επαναλαμβάνεται εάν
|
—
|
παρατηρηθεί κυτταροτοξικότητα. Η διαδικασία προδιαλογής θα πρέπει να επαναλαμβάνεται με χαμηλότερες μη κυτταροτοξικές συγκεντρώσεις της υπό δοκιμή χημικής ουσίας.
|
|
—
|
κατά την προδιαλογή της υπό δοκιμή χημικής ουσίας δεν εμφανίζεται πλήρης καμπύλη δόσης-απόκρισης, διότι από τις ελεγχθείσες συγκεντρώσεις προκύπτει μέγιστη αναστολή. Η προδιαλογή θα πρέπει να επαναλαμβάνεται με χρήση χαμηλότερων συγκεντρώσεων της υπό δοκιμή χημικής ουσίας.
|
|
|
51.
|
Όταν διαπιστώνεται έγκυρη απόκριση που σχετίζεται με τη δόση, θα πρέπει να επιλέγεται η (χαμηλότερη) συγκέντρωση στην οποία παρατηρείται μέγιστη αναστολή χωρίς κυτταροτοξικότητα. Η υψηλότερη συγκέντρωση της υπό δοκιμή χημικής ουσίας που θα ελεγχθεί στις ολοκληρωμένες δοκιμές θα πρέπει να είναι τριπλάσια της εν λόγω επιλεγμένης συγκέντρωσης.
|
|
52.
|
Θα πρέπει να προετοιμάζεται πλήρης, επεξεργασμένη σειρά αραιώσεων με τα στάδια αραίωσης που φαίνονται στον πίνακα 6, ξεκινώντας από την υψηλότερη συγκέντρωση, όπως προσδιορίστηκε ανωτέρω.
|
|
53.
|
Υπό δοκιμή χημικές ουσίες που δεν επάγουν ανταγωνιστικές επιδράσεις θα πρέπει να ελέγχονται στο πλαίσιο των σειρών ολοκληρωμένων δοκιμών, αρχής γενομένης από την υψηλότερη, μη κυτταροτοξική συγκέντρωση που προσδιορίζεται κατά την προδιαλογή.
|
Σειρές ολοκληρωμένων δοκιμών
|
54.
|
Μετά την επιλογή των επεξεργασμένων ευρών συγκεντρώσεων, οι υπό δοκιμή χημικές ουσίες θα πρέπει να ελέγχονται ολοκληρωμένα με χρήση των διαδοχικών αραιώσεων που φαίνονται στους πίνακες 5 (αγωνιστική δράση) και 6 (ανταγωνιστική δράση). Όλες οι συγκεντρώσεις θα πρέπει να ελέγχονται σε τριπλές κοιλότητες, σύμφωνα με τη διάταξη τρυβλίου που φαίνεται στο σχήμα 1 (αγωνιστική δράση) ή 2 (ανταγωνιστική δράση).
|
|
55.
|
Μόνο τα αποτελέσματα ανάλυσης που πληρούν τα κριτήρια αποδοχής (πίνακες 3 και 4) θεωρούνται έγκυρα και μπορούν να χρησιμοποιούνται για την αξιολόγηση της απόκρισης των υπό δοκιμή χημικών ουσιών. Σε περίπτωση που ένα ή περισσότερα τρυβλία μικροτιτλοδότησης σε μια σειρά ανάλυσης δεν πληροί τα κριτήρια αποδοχής, τα αντίστοιχα τρυβλία μικροτιτλοδότησης θα πρέπει να αναλύονται εκ νέου. Σε περίπτωση που το πρώτο τρυβλίο που περιέχει την πλήρη σειρά αραιώσεων του προτύπου αναφοράς δεν πληροί τα κριτήρια αποδοχής, ολόκληρη η σειρά δοκιμών (6 τρυβλία) θα πρέπει να αναλύεται εκ νέου.
|
Πίνακας 5
Συγκέντρωση και αραιώσεις των προτύπων αναφοράς, των μαρτύρων και των υπό δοκιμή χημικών ουσιών που χρησιμοποιούνται στις δοκιμές αγωνιστών
|
Πρότυπο αναφοράς 17β-οιστραδιόλη
|
TCx - συγκέντρωση αραίωσης
|
TCx - συγκέντρωση αραίωσης
|
Μάρτυρες
|
|
συγκ. (M)
|
σειράς δοκιμών προδιαλογής
|
σειρών ολοκληρωμένων δοκιμών
|
συγκ. (M)
|
|
C0
|
0
|
TCx-1
|
10 000 000 x
|
TCx-1
|
3 000 x
|
PC
|
3*10-6
|
|
C1
|
1*10-13
|
TCx-2
|
1 000 000 x
|
TCx-2
|
1 000 x
|
NC
|
1*10-8
|
|
C2
|
3*10-13
|
TCx-3
|
100 000 x
|
TCx-3
|
300 x
|
C0
|
0
|
|
C3
|
1*10-12
|
TCx-4
|
10 000 x
|
TCx-4
|
100 x
|
SC
|
0
|
|
C4
|
3*10-12
|
TCx-5
|
1 000 x
|
TCx-5
|
30 x
|
|
|
|
C5
|
6*10-12
|
TCx-6
|
100 x
|
TCx-6
|
10 x
|
|
|
|
C6
|
1*10-11
|
TCx-7
|
10 x
|
TCx-7
|
3 x
|
|
|
|
C7
|
3*10-11
|
TCx-8
|
1 x
|
TCx-8
|
1 x
|
|
|
|
C8
|
1*10-10
|
|
|
|
|
|
|
|
TCx - υπό δοκιμή χημική ουσία x
PC - θετικός μάρτυρας (17α-μεθυλοτεστοστερόνη)
NC - αρνητικός μάρτυρας (κορτικοστερόνη)
C0 - μάρτυρας με διαλύτη προτύπου αναφοράς
SC - μάρτυρας με διαλύτη υπό δοκιμή χημικής ουσίας
|
Πίνακας 6
Συγκέντρωση και αραιώσεις των προτύπων αναφοράς, των μαρτύρων και των υπό δοκιμή χημικών ουσιών που χρησιμοποιούνται στις δοκιμές ανταγωνιστών
|
Πρότυπο αναφοράς ταμοξιφαίνη
|
TCx - συγκέντρωση αραίωσης
|
TCx - συγκέντρωση αραίωσης
|
Μάρτυρες
|
|
συγκ. (M)
|
σειράς δοκιμών προδιαλογής
|
σειρών ολοκληρωμένων δοκιμών
|
συγκ. (M)
|
|
C0
|
0
|
TCx-1
|
10 000 000 x
|
TCx-1
|
3 000 x
|
PC
|
1*10-9
|
|
C1
|
3*10-9
|
TCx-2
|
1 000 000 x
|
TCx-2
|
1 000 x
|
NC
|
1*10-5
|
|
C2
|
1*10-8
|
TCx-3
|
100 000 x
|
TCx-3
|
300 x
|
C0
|
0
|
|
C3
|
3*10-8
|
TCx-4
|
10 000 x
|
TCx-4
|
100 x
|
SC
|
0
|
|
C4
|
1*10-7
|
TCx-5
|
1 000 x
|
TCx-5
|
30 x
|
|
|
|
C5
|
3*10-7
|
TCx-6
|
100 x
|
TCx-6
|
10 x
|
Συμπλήρωμα αγωνιστών
|
|
C6
|
1*10-6
|
TCx-7
|
10 x
|
TCx-7
|
3 x
|
συγκ. (M)
|
|
C7
|
3*10-6
|
TCx-8
|
1 x
|
TCx-8
|
1 x
|
17β-οιστραδιόλη
|
3*10-12
|
|
C8
|
1*10-5
|
|
|
|
|
|
|
|
TCx - υπό δοκιμή χημική ουσία x
PC - θετικός μάρτυρας (4-υδροξυταμοξιφαίνη)
NC - αρνητικός μάρτυρας (ρεσβερατρόλη)
C0 - μάρτυρας με διαλύτη προτύπου αναφοράς
SC - μάρτυρας με διαλύτη υπό δοκιμή χημικής ουσίας
VC - μάρτυρας με φορέα (δεν περιέχει καθορισμένη συγκέντρωση του προτύπου αναφοράς αγωνιστικής δράσης 17β-οιστραδιόλη (3,0*10-12 M)
|
Συλλογή και ανάλυση δεδομένων
|
56.
|
Μετά τη σειρά δοκιμών προδιαλογής και τις σειρές ολοκληρωμένων δοκιμών, οι EC10, EC50, PC10, PC50 και η μέγιστη επαγωγή (TCxmax) θα πρέπει να προσδιορίζονται για τη διεξαγωγή δοκιμών αγωνιστικής δράσης. Όσον αφορά τις δοκιμές ανταγωνιστικής δράσης, θα πρέπει να υπολογίζονται οι IC20, IC50, PC80, PC50 και η ελάχιστη επαγωγή (TCxmin). Στο σχήμα 3 (αγωνιστική δράση) και 4 (ανταγωνιστική δράση) παρέχεται γραφική αναπαράσταση των εν λόγω παραμέτρων. Οι απαιτούμενες παράμετροι υπολογίζονται με βάση τη σχετική επαγωγή κάθε υπό δοκιμή χημικής ουσίας [σε σχέση με τη μέγιστη επαγωγή του προτύπου αναφοράς (=100 %)]. Θα πρέπει να χρησιμοποιείται μη γραμμική παλινδρόμηση (μεταβαλλόμενη κλίση, 4 παράμετροι) για την αξιολόγηση των δεδομένων σύμφωνα με την ακόλουθη εξίσωση:

όπου:
X = λογάριθμος δόσης ή συγκέντρωσης
Y = απόκριση [σχετική επαγωγή (%)]
μέγιστη = μέγιστη επαγωγή (%)
ελάχιστη = ελάχιστη επαγωγή (%)
logEC50 = λογάριθμος συγκέντρωσης στην οποία παρατηρείται το 50 % της μέγιστης απόκρισης
κλίση Hill = συντελεστής κλίσης ή κλίση Hill
|
|
57.
|
Τα ανεπεξέργαστα δεδομένα από το λουμινόμετρο, εκφραζόμενα ως σχετικές μονάδες φωτός (RLU), θα πρέπει να μεταφέρονται στο υπολογιστικό φύλλο ανάλυσης δεδομένων που έχει σχεδιαστεί ειδικά για τη σειρά δοκιμών προδιαλογής και τις σειρές ολοκληρωμένων δοκιμών. Τα ανεπεξέργαστα δεδομένα θα πρέπει να πληρούν τα κριτήρια αποδοχής που εμφαίνονται στους πίνακες 3A και 3B (αγωνιστική δράση) ή 4A και 4B (ανταγωνιστική δράση). Σε περίπτωση που τα ανεπεξέργαστα δεδομένα πληρούν τα κριτήρια αποδοχής, εκτελούνται τα ακόλουθα στάδια υπολογισμού προκειμένου να προσδιοριστούν οι απαιτούμενες παράμετροι:
|
Αγωνιστική δράση
|
—
|
Αφαίρεση της μέσης RLU του μάρτυρα με διαλύτη προτύπου αναφοράς από καθένα από τα ανεπεξέργαστα δεδομένα ανάλυσης των προτύπων αναφοράς.
|
|
—
|
Αφαίρεση της μέσης RLU για τον μάρτυρα με διαλύτη της υπό δοκιμή χημικής ουσίας από καθένα από τα ανεπεξέργαστα δεδομένα ανάλυσης των υπό δοκιμή χημικών ουσιών.
|
|
—
|
Υπολογισμός της σχετικής επαγωγής κάθε συγκέντρωσης του προτύπου αναφοράς. Ορισμός της επαγωγής της υψηλότερης συγκέντρωσης του προτύπου αναφοράς σε 100 %.
|
|
—
|
Υπολογισμός της σχετικής επαγωγής κάθε συγκέντρωσης της υπό δοκιμή χημικής ουσίας σε σύγκριση με την υψηλότερη συγκέντρωση του προτύπου αναφοράς ως 100 %.
|
|
—
|
Αξιολόγηση των αποτελεσμάτων ανάλυσης μετά από μη γραμμική παλινδρόμηση (μεταβαλλόμενη κλίση, 4 παράμετροι).
|
|
—
|
Προσδιορισμός των EC50 και EC10 του προτύπου αναφοράς.
|
|
—
|
Προσδιορισμός των EC50 και EC10 των υπό δοκιμή χημικών ουσιών.
|
|
—
|
Προσδιορισμός της μέγιστης σχετικής επαγωγής της υπό δοκιμή χημικής ουσίας (TCmax).
|
|
—
|
Προσδιορισμός των PC10 και PC50 των υπό δοκιμή χημικών ουσιών.
|
Για τις υπό δοκιμή χημικές ουσίες μπορεί να μην είναι πάντοτε εφικτή η επίτευξη πλήρους καμπύλης δόσης-απόκρισης λόγω, π.χ., προβλημάτων κυτταροτοξικότητας ή διαλυτότητας. Συνεπώς, οι EC50, EC10 και PC50 δεν μπορούν να προσδιοριστούν. Σε αυτή την περίπτωση, μπορούν να προσδιορίζονται μόνο οι PC10 και TCmax.
Ανταγωνιστική δράση
|
—
|
Αφαίρεση της μέσης RLU της υψηλότερης συγκέντρωσης προτύπου αναφοράς από καθένα από τα ανεπεξέργαστα δεδομένα ανάλυσης των προτύπων αναφοράς.
|
|
—
|
Αφαίρεση της μέσης RLU της υψηλότερης συγκέντρωσης προτύπου αναφοράς από καθένα από τα ανεπεξέργαστα δεδομένα ανάλυσης των υπό δοκιμή χημικών ουσιών.
|
|
—
|
Υπολογισμός της σχετικής επαγωγής κάθε συγκέντρωσης του προτύπου αναφοράς. Ορισμός της επαγωγής της χαμηλότερης συγκέντρωσης του προτύπου αναφοράς σε 100 %.
|
|
—
|
Υπολογισμός της σχετικής επαγωγής κάθε συγκέντρωσης της υπό δοκιμή χημικής ουσίας σε σύγκριση με τη χαμηλότερη συγκέντρωση του προτύπου αναφοράς ως 100 %.
|
|
—
|
Αξιολόγηση των αποτελεσμάτων ανάλυσης μετά από μη γραμμική παλινδρόμηση (μεταβαλλόμενη κλίση, 4 παράμετροι).
|
|
—
|
Προσδιορισμός των IC50 και IC20 του προτύπου αναφοράς.
|
|
—
|
Προσδιορισμός των IC50 και IC20 των υπό δοκιμή χημικών ουσιών.
|
|
—
|
Προσδιορισμός της ελάχιστης σχετικής επαγωγής της υπό δοκιμή χημικής ουσίας (TCmin).
|
|
—
|
Προσδιορισμός των PC80 και PC50 των υπό δοκιμή χημικών ουσιών.
|
Σχήμα 3
Επισκόπηση των παραμέτρων που προσδιορίζονται στη δοκιμασία αγωνιστών
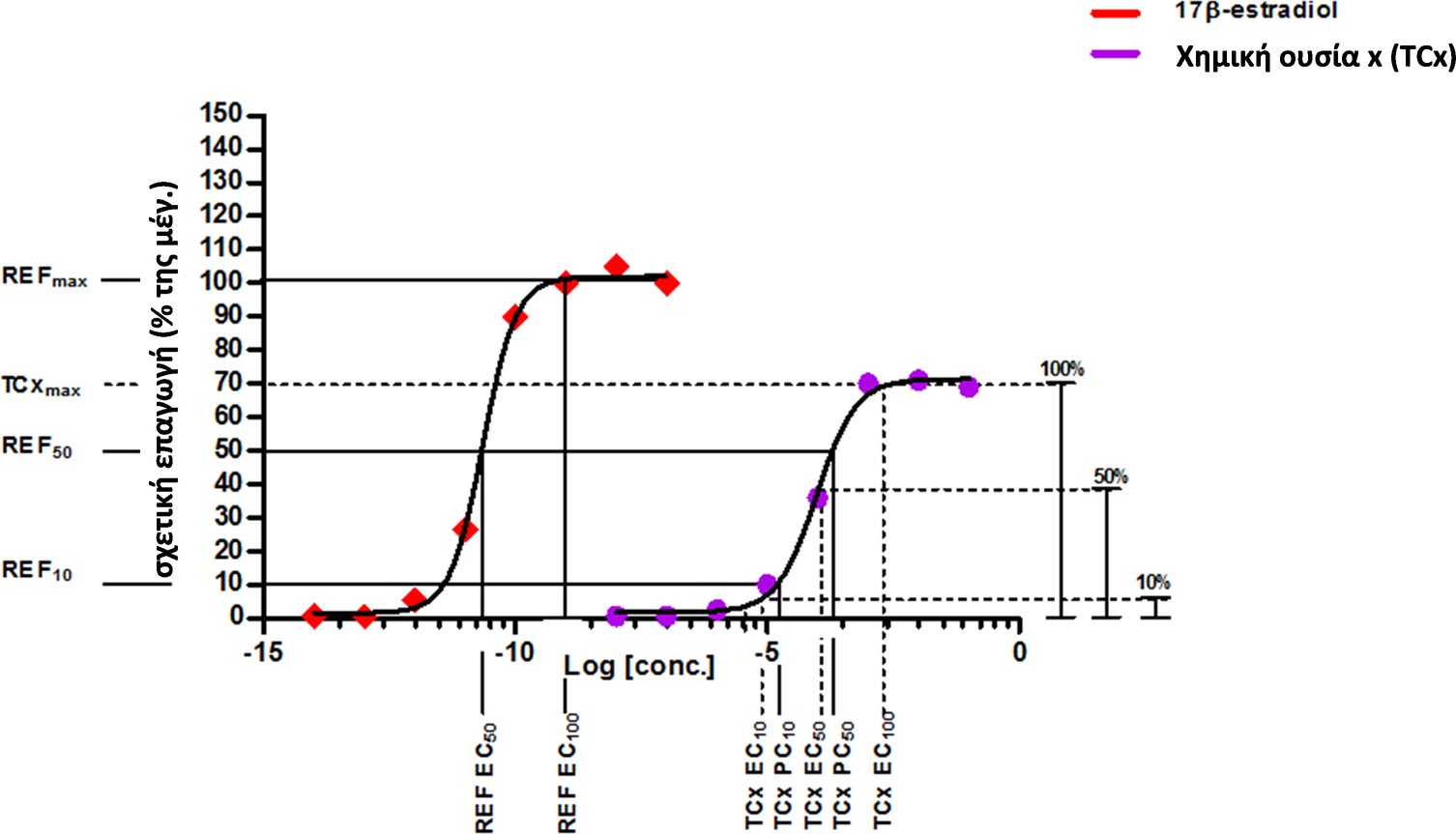
EC10 = συγκέντρωση ουσίας στην οποία παρατηρείται το 10 % της μέγιστης απόκρισής της.
EC50 = συγκέντρωση ουσίας στην οποία παρατηρείται το 50 % της μέγιστης απόκρισής της.
PC10 =συγκέντρωση υπό δοκιμή χημικής ουσίας στην οποία η απόκρισή της είναι ίση με την EC10 του προτύπου αναφοράς.
PC50 =συγκέντρωση υπό δοκιμή χημικής ουσίας στην οποία η απόκρισή της είναι ίση με την EC50 του προτύπου αναφοράς.
TCxmax = μέγιστη σχετική επαγωγή της υπό δοκιμή χημικής ουσίας.
Σχήμα 4
Επισκόπηση των παραμέτρων που προσδιορίζονται στη δοκιμασία ανταγωνιστών

IC20 = συγκέντρωση ουσίας στην οποία παρατηρείται το 80 % της μέγιστης απόκρισής της (20 % αναστολή).
IC50 = συγκέντρωση ουσίας στην οποία παρατηρείται το 50 % της μέγιστης απόκρισής της (50 % αναστολή).
PC80 = συγκέντρωση υπό δοκιμή χημικής ουσίας στην οποία η απόκρισή της είναι ίση με την IC20 του προτύπου αναφοράς.
PC50 = συγκέντρωση υπό δοκιμή χημικής ουσίας στην οποία η απόκρισή της είναι ίση με την IC50 του προτύπου αναφοράς.
TCxmin = ελάχιστη σχετική επαγωγή της υπό δοκιμή χημικής ουσίας.
Για τις υπό δοκιμή χημικές ουσίες μπορεί να μην είναι πάντοτε εφικτή η επίτευξη πλήρους καμπύλης δόσης-απόκρισης λόγω, π.χ., προβλημάτων κυτταροτοξικότητας ή διαλυτότητας. Συνεπώς, οι IC50, IC20 και PC50 δεν μπορούν να προσδιοριστούν. Σε αυτή την περίπτωση, μπορούν να προσδιορίζονται μόνο οι PC20 και TCmin.
|
58.
|
Τα αποτελέσματα θα πρέπει να βασίζονται σε δύο (ή τρεις) ανεξάρτητες σειρές δοκιμών. Σε περίπτωση που από δύο σειρές δοκιμών προκύπτουν συγκρίσιμα και, ως εκ τούτου, αναπαραγώγιμα αποτελέσματα, δεν είναι απαραίτητη η διεξαγωγή τρίτης σειράς δοκιμών. Για να είναι αποδεκτά, τα αποτελέσματα θα πρέπει να πληρούν τις ακόλουθες προϋποθέσεις:
|
—
|
να πληρούν τα κριτήρια αποδοχής (βλ. κριτήρια αποδοχής, παράγραφοι 14-22),
|
|
—
|
να είναι αναπαραγώγιμα.
|
|
Κριτήρια ερμηνείας των δεδομένων
|
59.
|
Για την ερμηνεία των δεδομένων και τη λήψη απόφασης σχετικά με το κατά πόσον μια υπό δοκιμή χημική ουσία θεωρείται θετική ή αρνητική, πρέπει να χρησιμοποιούνται τα ακόλουθα κριτήρια:
|
Για κάθε σειρά ολοκληρωμένων δοκιμών, μια υπό δοκιμή χημική ουσία θεωρείται θετική εφόσον:
|
1
|
Η TCmax είναι ίση ή υπερβαίνει το 10 % της μέγιστης απόκρισης του προτύπου αναφοράς (REF10).
|
|
2
|
Τουλάχιστον 2 διαδοχικές συγκεντρώσεις της υπό δοκιμή χημικής ουσίας είναι ίσες ή υπερβαίνουν το REF10.
|
|
|
Για κάθε σειρά ολοκληρωμένων δοκιμών, μια υπό δοκιμή χημική ουσία θεωρείται αρνητική εφόσον:
|
1
|
Η TCmax δεν υπερβαίνει το 10 % της μέγιστης απόκρισης του προτύπου αναφοράς (REF10).
|
|
2
|
Λιγότερες από 2 συγκεντρώσεις της υπό δοκιμή χημικής ουσίας είναι ίσες ή υπερβαίνουν το REF10.
|
|
|
Για κάθε σειρά ολοκληρωμένων δοκιμών, μια υπό δοκιμή χημική ουσία θεωρείται θετική εφόσον:
|
1
|
Η TCmin είναι ίση ή χαμηλότερη από το 80 % της μέγιστης απόκρισης του προτύπου αναφοράς (REF80 = 20 % αναστολή).
|
|
2
|
Τουλάχιστον 2 διαδοχικές συγκεντρώσεις της υπό δοκιμή χημικής ουσίας είναι ίσες ή χαμηλότερες από το REF80.
|
|
|
Για κάθε σειρά ολοκληρωμένων δοκιμών, μια υπό δοκιμή χημική ουσία θεωρείται αρνητική εφόσον:
|
1
|
Η TCmin υπερβαίνει το 80 % της μέγιστης απόκρισης του προτύπου αναφοράς (REF80 = 20 % αναστολή).
|
|
2
|
Λιγότερες από 2 συγκεντρώσεις της υπό δοκιμή χημικής ουσίας είναι ίσες ή χαμηλότερες από το REF80.
|
|
|
|
60.
|
Για την εκτίμηση του δυναμικού θετικής απόκρισης μιας υπό δοκιμή χημικής ουσίας, θα πρέπει να αναφέρεται το μέγεθος της επίδρασης (αγωνιστική δράση: TCmax, ανταγωνιστική δράση: TCmin) και η συγκέντρωση στην οποία εμφανίζεται η επίδραση (αγωνιστική δράση: EC10, EC50, PC10, PC50, ανταγωνιστική δράση: IC20, IC50, PC80, PC50).
|
ΕΚΘΕΣΗ ΔΟΚΙΜΗΣ
|
61.
|
Βλ. παράγραφο 20 της ενότητας «ΣΤΟΙΧΕΙΑ ΔΟΚΙΜΑΣΙΑΣ ER TA»
|
ΒΙΒΛΙΟΓΡΑΦΙΑ
|
(1)
|
OECD (2016). Draft Validation report of the (anti-) ERα CALUX bioassay - transactivation bioassay for the detection of compounds with (anti)estrogenic potential. Environmental Health and Safety Publications, Series on Testing and Assessment (No 240). Organisation for Economic Cooperation and Development, Paris
|
|
(2)
|
Sonneveld E, Jansen HJ, Riteco JA, Brouwer A, van der Burg B. (2005). Development of androgen- and estrogen-responsive bioassays, members of a panel of human cell line-based highly selective steroid-responsive bioassays. Toxicol Sci. 83(1), 136-148.
|
|
(3)
|
Quaedackers ME, van den Brink CE, Wissink S, Schreurs RHMM, Gustafsson JA, van der Saag PT, and van der Burg B. (2001). 4-Hydroxytamoxifen trans-represses nuclear factor-kB Activity in human osteoblastic U2OS cells through estrogen receptor (ER)α and not through ERβ. Endocrinology 142(3), 1156-1166.
|
|
(4)
|
Thorne N, Inglese J and Auld DS. (2010). Illuminating Insights into Firefly Luciferase and Other Bioluminescent Reporters Used in Chemical Biology, Chemistry and Biology17(6):646-57.
|
|
(5)
|
Escande A, Pillon A, Servant N, Cravedi JP, Larrea F, Muhn P, Nicolas JC, Cavaillès V and Balaguer P. (2006). Evaluation of ligand selectivity using reporter cell lines stably expressing estrogen receptor alpha or beta. Biochem. Pharmacol., 71, 1459-1469.
|
|
(6)
|
Kuiper GG, Lemmen JG, Carlsson B, Corton JC, Safe SH, van der Saag PT, van der Burg B and Gustafsson JA. (1998). Interaction of estrogenic chemicals and phytoestrogens with estrogen receptor beta. Endocrinol., 139, 4252-4263.
|
|
(7)
|
Sotoca AM, Bovee TFH, Brand W, Velikova N, Boeren S, Murk AJ, Vervoort J, Rietjens IMCM. (2010). Superinduction of estrogen receptor mediated gene expression in luciferase based reporter gene assays is mediated by a post-transcriptional mechanism. J. Steroid. Biochem. Mol. Biol., 122, 204–211.
|
|
(8)
|
Sonneveld E, Riteco JAC, Jansen HJ, Pieterse B, Brouwer A, Schoonen WG, and van der Burg B. (2006). Comparison of in vitro and in vivo screening models for androgenic and estrogenic activities. Toxicol. Sci., 89(1), 173–187.
|
|
(9)
|
Kobayashi H, Yamamoto K, Eguchi M, Kubo M, Nakagami S, Wakisaka S, Kaizuka M and Ishii H. (1995). Rapid detection of mycoplasma contamination in cell cultures by enzymatic detection of polymerase chain reaction (PCR) products. J. Vet. Med. Sci., 57(4), 769-771.
|
|
(10)
|
Zhang J-H, Chung TDY, and Oldenburg KR. (1999). A simple statistical parameter for use in evaluation and validation of high throuphut screening assays. J. Biomol. Scr., 4, 67-73
|
|
(11)
|
Besselink H, Middelhof I, and Felzel, E. (2014). Transactivation assay for the detection of compounds with (anti)estrogenic potential using ERα CALUX cells. BioDetection Systems BV (BDS). Amsterdam, the Netherlands.
|
Προσάρτημα 4.1
ΟΠΤΙΚΗ ΕΠΙΘΕΩΡΗΣΗ ΤΗΣ ΚΥΤΤΑΡΙΚΗΣ ΒΙΩΣΙΜΟΤΗΤΑΣ
B.67
IN VITRO ΔΟΚΙΜΕΣ ΓΟΝΙΔΙΑΚΗΣ ΜΕΤΑΛΛΑΞΗΣ ΣΕ ΚΥΤΤΑΡΑ ΘΗΛΑΣΤΙΚΩΝ ΜΕ ΧΡΗΣΗ ΤΟΥ ΓΟΝΙΔΙΟΥ ΘΥΜΙΔΙΝΟΚΙΝΑΣΗΣ
ΕΙΣΑΓΩΓΗ
|
1.
|
Η παρούσα μέθοδος δοκιμών είναι ισοδύναμη με την κατευθυντήρια γραμμή δοκιμών 490 του ΟΟΣΑ (2016). Οι μέθοδοι δοκιμών επανεξετάζονται και αναθεωρούνται κατά περιόδους υπό το φως των επιστημονικών εξελίξεων, των μεταβαλλόμενων κανονιστικών αναγκών και της καλής μεταχείρισης των ζώων. Η δοκιμασία λεμφώματος ποντικών (MLA) και η δοκιμή TK6 με χρήση του γενετικού τόπου της θυμιδινοκινάσης (TK) περιλαμβάνονταν αρχικά στη μέθοδο δοκιμών B.17. Αργότερα, η διεθνής ομάδα εργασίας εμπειρογνωμόνων MLA της διεθνούς ημερίδας για τις δοκιμές γονιδιοτοξικότητας (IWGT) ανέπτυξε διεθνώς εναρμονισμένες συστάσεις για κριτήρια αποδοχής δοκιμασιών και την ερμηνεία δεδομένων για την MLA (1)(2)(3)(4)(5), οι οποίες ενσωματώθηκαν στην παρούσα νέα μέθοδο δοκιμών B.67. Η παρούσα μέθοδος δοκιμών έχει συνταχθεί για την MLA και, λόγω του ότι χρησιμοποιεί επίσης τον γενετικό τόπο TK, τη δοκιμή TK6. Ενώ η MLA χρησιμοποιείται ευρέως για κανονιστικούς σκοπούς, η χρήση της TK6 είναι πολύ πιο σπάνια. Πρέπει να επισημανθεί ότι παρά την ομοιότητα μεταξύ των παραμέτρων, οι δύο κυτταρικές σειρές δεν μπορούν να υποκαταστήσουν η μία την άλλη και, ως εκ τούτου, στο πλαίσιο κανονιστικών προγραμμάτων μπορεί ευλόγως να προτιμάται η μία εκ των δύο για συγκεκριμένη κανονιστική χρήση. Για παράδειγμα, η επικύρωση της MLA κατέδειξε την καταλληλότητά της για την ανίχνευση όχι μόνο γονιδιακών μεταλλάξεων αλλά και της ικανότητας μιας υπό δοκιμή χημικής ουσίας να επάγει δομικές χρωμοσωμικές βλάβες. Η παρούσα μέθοδος δοκιμών αποτελεί μέρος μιας σειράς μεθόδων δοκιμών γενετικής τοξικολογίας. Ο ΟΟΣΑ έχει συντάξει ένα έγγραφο με συνοπτικές πληροφορίες για τις δοκιμές γενετικής τοξικολογίας και μια επισκόπηση των πρόσφατων αλλαγών που έγιναν στις κατευθυντήριες γραμμές δοκιμών γενετικής τοξικότητας του ΟΟΣΑ (6).
|
|
2.
|
Ο σκοπός των in vitro δοκιμών γονιδιακής μετάλλαξης σε κύτταρα θηλαστικών είναι η ανίχνευση γονιδιακών μεταλλάξεων που προκαλούνται από χημικές ουσίες. Οι κυτταρικές σειρές που χρησιμοποιούνται στις εν λόγω δοκιμές μετρούν τις εξελικτικές μεταλλάξεις σε γονίδια αναφοράς, συγκεκριμένα στο ενδογενές γονίδιο της θυμιδινοκινάσης (TK για τα ανθρώπινα κύτταρα και Tk για τα κύτταρα τρωκτικών, καλούμενα αμφότερα TK στην παρούσα μέθοδο δοκιμών). Η παρούσα μέθοδος δοκιμών προορίζεται για χρήση με δύο κυτταρικές σειρές: την κυτταρική σειρά λεμφώματος ποντικού TK+/--3.7.2C L5178Y (γενικά καλούμενη L5178Y) και την ανθρώπινη λεμφοβλαστοειδή κυτταρική σειρά TK6 (γενικά καλούμενη TK6). Παρότι οι δύο κυτταρικές σειρές διαφέρουν λόγω της προέλευσής τους, της κυτταρικής ανάπτυξης, της κατάστασης ως προς το p53 και άλλα σημεία, οι δοκιμές γονιδιακών μεταλλάξεων TK μπορούν να διεξάγονται με ανάλογο τρόπο και στους δύο τύπους κυττάρων, όπως περιγράφεται στην παρούσα μέθοδο δοκιμών.
|
|
3.
|
Η αυτοσωμική και ετερόζυγη φύση του γονιδίου της θυμιδινοκινάσης επιτρέπει την ανίχνευση βιώσιμων αποικιών από κύτταρα που δεν διαθέτουν θυμιδινοκινάση λόγω μετάλλαξης της TK+/-
σε TK-/-
. Η έλλειψη αυτή μπορεί να είναι το αποτέλεσμα γενετικών συμβάντων που επηρεάζουν το γονίδιο TK, περιλαμβανομένων των γονιδιακών μεταλλάξεων (σημειακές μεταλλάξεις, μεταλλάξεις μετατόπισης αναγνωστικού πλαισίου, μικρές απαλείψεις κ.λπ.) και των χρωμοσωμικών συμβάντων (μεγάλες απαλείψεις, χρωμοσωμικές αναδιατάξεις και μιτωτικός ανασυνδυασμός). Τα τελευταία συμβάντα εκφράζονται ως απώλεια ετεροζυγωτικότητας, η οποία αποτελεί συνήθη γενετική αλλοίωση των ογκοκατασταλτικών γονιδίων στην ανθρώπινη ογκογένεση. Θεωρητικά, η απώλεια ολόκληρου του χρωμοσώματος που φέρει το γονίδιο TK λόγω εξασθένησης της ατράκτου και/ή μιτωτικού μη διαχωρισμού μπορεί να ανιχνευθεί με την MLA. Πράγματι, ένας συνδυασμός κυτταρογενετικής και μοριακής ανάλυσης καταδεικνύει με σαφήνεια ότι ορισμένα προϊόντα μετάλλαξης TK MLA είναι αποτέλεσμα μη διαχωρισμού. Ωστόσο, η προσέγγιση βάρους της απόδειξης δείχνει ότι οι δοκιμές γονιδιακής μετάλλαξης TK δεν μπορούν να ανιχνεύσουν αξιόπιστα τις ανευπλοειδογόνες ουσίες όταν εφαρμόζονται τα τυποποιημένα κριτήρια κυτταροτοξικότητας (όπως περιγράφεται στην παρούσα μέθοδο δοκιμών) και, ως εκ τούτου, είναι ακατάλληλες για την ανίχνευση ανευπλοειδογόνων ουσιών (7)(8)(9).
|
|
4.
|
Στις δοκιμές γονιδιακής μετάλλαξης TK παράγονται δύο διακριτές φαινοτυπικές κατηγορίες προϊόντων μετάλλαξης TK· τα φυσιολογικώς αναπτυσσόμενα προϊόντα μετάλλαξης που αναπτύσσονται με τον ίδιο ρυθμό με τα ετερόζυγα κύτταρα TK, και τα βραδέως αναπτυσσόμενα προϊόντα μετάλλαξης που αναπτύσσονται με παρατεταμένους χρόνους διπλασιασμού. Τα φυσιολογικώς αναπτυσσόμενα και τα βραδέως αναπτυσσόμενα προϊόντα μετάλλαξης αναγνωρίζονται ως προϊόντα μετάλλαξης μεγάλων και μικρών αποικιών στην MLA και ως προϊόντα μετάλλαξης πρώιμα και όψιμα εμφανιζόμενων αποικιών στην TK6. Η μοριακή και κυτταρογενετική φύση των προϊόντων μετάλλαξης μικρών και μεγάλων αποικιών MLA έχει μελετηθεί λεπτομερώς (8)(10)(11)(12)(13). Η μοριακή και κυτταρογενετική φύση των πρώιμα εμφανιζόμενων και των όψιμα εμφανιζόμενων προϊόντων μετάλλαξης TK6 έχει επίσης μελετηθεί λεπτομερώς (14)(15)(16)(17). Τα βραδέως αναπτυσσόμενα προϊόντα μετάλλαξης έχουν υποστεί γενετικές βλάβες που προϋποθέτουν τη θεωρητική ύπαρξη γονιδίου/-ων ρύθμισης της ανάπτυξης εγγύς του γενετικού τόπου TK, με αποτέλεσμα παρατεταμένους χρόνους διπλασιασμού και τον σχηματισμό όψιμα εμφανιζόμενων ή μικρών αποικιών (18). Η επαγωγή βραδέως αναπτυσσόμενων προϊόντων μετάλλαξης έχει συνδεθεί με χημικές ουσίες που επάγουν μακροσκοπικές δομικές αλλαγές στο χρωμοσωμικό επίπεδο. Τα κύτταρα των οποίων οι βλάβες δεν προϋποθέτουν τα θεωρητικά ρυθμιστικά γονίδια κοντά στον γενετικό τόπο TK αναπτύσσονται με ρυθμούς παρόμοιους με τα γονικά κύτταρα και εξελίσσονται σε φυσιολογικώς αναπτυσσόμενα προϊόντα μετάλλαξης. Η επαγωγή κυρίως φυσιολογικώς αναπτυσσόμενων προϊόντων μετάλλαξης συνδέεται με χημικές ουσίες που δρουν κυρίως ως μεταλλαξιγόνα σημειακών μεταλλάξεων. Κατά συνέπεια, είναι απαραίτητη η καταμέτρηση και των βραδέως αναπτυσσόμενων και των φυσιολογικώς αναπτυσσόμενων προϊόντων μετάλλαξης προκειμένου να ανακτώνται όλα τα προϊόντα μετάλλαξης και να διαπιστώνεται, σε έναν βαθμό, ο τύπος βλαβών (μεταλλαξιγόνα έναντι κλαστογόνων) που επάγει η υπό δοκιμή χημική ουσία (10)(12)(18)(19).
|
|
5.
|
Η μέθοδος δοκιμών έχει οργανωθεί κατά τρόπον ώστε να παρέχει γενικές πληροφορίες που εφαρμόζονται τόσο στην MLA όσο και στην TK6, καθώς και εξειδικευμένη καθοδήγηση για τις μεμονωμένες δοκιμές.
|
|
6.
|
Οι χρησιμοποιούμενοι ορισμοί παρατίθενται στο προσάρτημα 1.
|
ΑΡΧΙΚΕΣ ΕΚΤΙΜΗΣΕΙΣ ΚΑΙ ΠΕΡΙΟΡΙΣΜΟΙ
|
7.
|
Στις δοκιμές που διεξάγονται in vitro απαιτείται εν γένει η χρήση εξωγενούς πηγής μεταβολικής ενεργοποίησης. Το εξωγενές σύστημα μεταβολικής ενεργοποίησης δεν μιμείται απόλυτα τις συνθήκες που επικρατούν in vivo.
|
|
8.
|
Θα πρέπει να λαμβάνεται μέριμνα ώστε να αποφεύγονται συνθήκες που μπορούν να οδηγήσουν σε τεχνητά θετικά αποτελέσματα (δηλ. πιθανή αλληλεπίδραση με το σύστημα δοκιμής) που δεν προκύπτουν από την αλληλεπίδραση μεταξύ της υπό δοκιμή χημικής ουσίας και του γενετικού υλικού του κυττάρου· τέτοιες συνθήκες είναι οι μεταβολές του pH ή της ωσμωμοριακότητας, η αλληλεπίδραση με τα συστατικά του θρεπτικού μέσου (20)(21) και τα υπέρμετρα επίπεδα κυτταροτοξικότητας (22)(23)(24). Η κυτταροτοξικότητα που υπερβαίνει τα συνιστώμενα μέγιστα επίπεδα κυτταροτοξικότητας, όπως ορίζονται στην παράγραφο 28, θεωρείται υπέρμετρη για την MLA και την TK6. Επιπλέον, θα πρέπει να επισημανθεί ότι οι υπό δοκιμή χημικές ουσίες που είναι ανάλογα θυμιδίνης ή συμπεριφέρονται σαν ανάλογα θυμιδίνης μπορούν να αυξήσουν τη συχνότητα των προϊόντων μετάλλαξης μέσω επιλεκτικής ανάπτυξης των αυθόρμητων προϊόντων μετάλλαξης υποβάθρου κατά την αγωγή των κυττάρων και απαιτούν πρόσθετες μεθόδους δοκιμών για την επαρκή αξιολόγησή τους (25).
|
|
9.
|
Για τα βιομηχανικά νανοϋλικά, ενδέχεται να χρειάζονται ειδικές προσαρμογές της παρούσας μεθόδου δοκιμών, οι οποίες όμως δεν περιγράφονται στην παρούσα μέθοδο δοκιμών.
|
|
10.
|
Πριν από τη χρήση της μεθόδου δοκιμών για τη διεξαγωγή δοκιμών σε μείγμα για την παραγωγή δεδομένων για συγκεκριμένο κανονιστικό σκοπό, θα πρέπει να εξετάζεται αν –και, εάν ναι, για ποιον λόγο– μπορεί να αποδώσει επαρκή αποτελέσματα για τον επιδιωκόμενο σκοπό. Τέτοια εξέταση δεν χρειάζεται όταν οι κανονιστικές ρυθμίσεις επιβάλλουν τον έλεγχο του μείγματος.
|
|
11.
|
Τα μεταλλαγμένα κύτταρα που παρουσιάζουν έλλειψη δραστικότητας του ενζύμου θυμιδινοκινάση λόγω μετάλλαξης του TK
+/- σε TK
-/- παρουσιάζουν αντοχή στην κυτταροστατική δράση του πυριμιδινικού αναλόγου τριφθοροθυμιδίνη (TFT). Τα κύτταρα με TK είναι ευαίσθητα στην TFT, η οποία εμποδίζει τον κυτταρικό μεταβολισμό και σταματά την περαιτέρω κυτταρική διαίρεση. Έτσι, τα μεταλλαγμένα κύτταρα μπορούν να πολλαπλασιάζονται παρουσία TFT και να σχηματίζουν ορατές αποικίες, ενώ τα κύτταρα που περιέχουν το ένζυμο TK δεν μπορούν.
|
ΑΡΧΗ ΤΗΣ ΔΟΚΙΜΗΣ
|
12.
|
Τα εναιωρημένα κύτταρα εκτίθενται στην υπό δοκιμή χημική ουσία, με και χωρίς εξωγενή πηγή μεταβολικής ενεργοποίησης (βλ. παράγραφο 19), για κατάλληλο χρονικό διάστημα (βλ. παράγραφο 33), και κατόπιν ανακαλλιεργούνται για να προσδιοριστεί η κυτταροτοξικότητα και για να επιτραπεί η φαινοτυπική έκφραση πριν από την επιλογή των προϊόντων μετάλλαξης. Η κυτταροτοξικότητα προσδιορίζεται βάσει της σχετικής συνολικής ανάπτυξης (RTG, βλ. παράγραφο 25) για την MLA και βάσει της σχετικής επιβίωσης (RS, βλ. παράγραφο 26) για την TK6. Οι καλλιέργειες υπό αγωγή διατηρούνται σε θρεπτικό μέσο για ικανό χρονικό διάστημα που είναι χαρακτηριστικό για κάθε κυτταρικό τύπο (βλ. παράγραφο 37), ώστε να μπορέσει να επιτευχθεί η βέλτιστη δυνατή φαινοτυπική έκφραση των προκληθεισών μεταλλάξεων. Μετά τη φαινοτυπική έκφραση, προσδιορίζεται η συχνότητα των προϊόντων μετάλλαξης με ανακαλλιέργεια γνωστού αριθμού κυττάρων σε θρεπτικό μέσο που περιέχει τον παράγοντα επιλογής για την ανίχνευση αποικιών μεταλλαγμένων κυττάρων και σε θρεπτικό μέσο χωρίς παράγοντα επιλογής για τον προσδιορισμό της απόδοσης κλωνοποίησης (βιωσιμότητα). Έπειτα από κατάλληλο χρόνο επώασης, μετρούνται οι αποικίες. Η συχνότητα των προϊόντων μετάλλαξης υπολογίζεται βάσει του αριθμού μεταλλαγμένων αποικιών, διορθωμένου ως προς την απόδοση κλωνοποίησης κατά τη χρονική στιγμή της επιλογής των προϊόντων μετάλλαξης.
|
ΠΕΡΙΓΡΑΦΗ ΤΗΣ ΜΕΘΟΔΟΥ
Προετοιμασίες
Κύτταρα
|
13.
|
Για την MLA: Λόγω του ότι η MLA αναπτύχθηκε και χαρακτηρίστηκε με χρήση της υποσειράς TK
+/- -3.7.2C των κυττάρων L5178Y, για την MLA θα πρέπει να χρησιμοποιηθεί η συγκεκριμένη υποσειρά. Η κυτταρική σειρά L5178Y προήλθε από προκληθέν από μεθυλοχολανθρένιο θυμικό λέμφωμα από ποντικό DBA-2 (26). Οι Clive και συνεργάτες υπέβαλαν σε αγωγή κύτταρα L5178Y (καλούμενα από τον Clive TK+/+ -3) με μεθανοσουλφονικό αιθύλιο και απομόνωσαν έναν κλώνο TK-/- (καλούμενο TK-/- -3.7) με χρήση βρωμοδεσοξυουριδίνης ως παράγοντα επιλογής. Από τον κλώνο TK-/- απομονώθηκε ένας αυθόρμητος κλώνος TK+/- (καλούμενος TK+/- -3.7.2.) και ένας υποκλώνος (καλούμενος TK+/--3.7.2C), οι οποίοι χαρακτηρίστηκαν για χρήση στην MLA (27). Ο καρυότυπος της κυτταρικής σειράς έχει δημοσιευτεί (28)(29)(30)(31). Ο χαρακτηριστικός αριθμός χρωμοσωμάτων είναι 40. Υπάρχει ένα μετακεντρικό χρωμόσωμα (t12,13) που πρέπει να μετράται ωςένα χρωμόσωμα. Ο γενετικός τόπος της TK βρίσκεται στο περιφερικό άκρο του χρωμοσώματος 11. Η κυτταρική σειρά L5178Y TK
+/- -3.7.2C έχει μεταλλάξεις και στα δύο αλληλόμορφα p53 και παράγει μεταλλαγμένη πρωτεΐνη p53 (32) (33). Η ικανότητα της δοκιμής να ανιχνεύει μεγάλης κλίμακας βλάβες πιθανότατα οφείλεται στην κατάσταση του p53 της κυτταρικής σειράς TK+/--3.7.2C (17).
|
|
14.
|
Για την TK6: Η TK6 είναι μια ανθρώπινη λεμφοβλαστοειδής κυτταρική σειρά. Η γονική κυτταρική σειρά είναι μια κυτταρική σειρά μετασχηματισμένη από τον ιό Epstein-Barr, η WI-L2, η οποία προήλθε αρχικά από ένα αγόρι ηλικίας 5 ετών με κληρονομική σφαιροκυττάρωση. Ο πρώτος κλώνος που απονώθηκε, ο HH4, υπέστη μεταλλαξιγένεση με ICR191 και παρήχθη μια ετερόζυγη κυτταρική σειρά TK, η TK6 (34). Τα κύτταρα TK6 είναι σχεδόν διπλοειδή και ο αντιπροσωπευτικός καρυότυπος είναι 47, XY, 13+, t(14, 20), t(3, 21) (35). Ο γενετικός τόπος TK στον άνθρωπο βρίσκεται στον μεγάλο βραχίονα του χρωμοσώματος 17. Η TK6 είναι μια κυτταρική σειρά με λειτουργικό p53, διότι διαθέτει αλληλουχία p53 αγρίου τύπου και στα δύο αλληλόμορφα και εκφράζει μόνο την πρωτεΐνη p53 αγρίου τύπου (36).
|
|
15.
|
Για αμφότερες τις MLA και TK6, την πρώτη φορά που δημιουργείται ή ανανεώνεται μια κύρια αποθεματική καλλιέργεια, συνιστάται το εργαστήριο δοκιμών να βεβαιώνεται για την απουσία μόλυνσης από μυκόπλασμα, να προσδιορίζει τον καρυότυπο των κυττάρων ή να χρωματίζει τα χρωμοσώματα που φέρουν τον γενετικό τόποTK και να ελέγχει τους χρόνους διπλασιασμού των πληθυσμών. Η φυσιολογική διάρκεια του κυτταρικού κύκλου των κυττάρων που χρησιμοποιούνται στο εργαστήριο δοκιμών θα πρέπει να καθορίζεται και να συμφωνεί με τα δημοσιευμένα χαρακτηριστικά των κυττάρων (16)(19)(37). Η κύρια αποθεματική καλλιέργεια θα πρέπει να φυλάσσεται σε θερμοκρασία -150° C ή χαμηλότερη και να χρησιμοποιείται για την παρασκευή όλων των κυτταρικών αποθεμάτων εργασίας.
|
|
16.
|
Είτε πριν από τη δημιουργία μεγάλου αριθμού κρυοσυντηρούμενων αποθεμάτων εργασίας είτε ακριβώς πριν από τη χρήση σε πείραμα, η καλλιέργεια ενδέχεται να χρειάζεται να καθαριστεί από προϋπάρχοντα μεταλλαγμένα κύτταρα [εκτός εάν η συχνότητα προϊόντων μετάλλαξης (MF) του μάρτυρα με διαλύτη εμπίπτει ήδη εντός του αποδεκτού εύρους – βλ. πίνακα 2 για την MLA)]. Αυτό επιτυγχάνεται με χρήση μεθοτρεξάτης (αμινοπτερίνη) για την αρνητική επιλογή ενάντια στα κύτταρα με έλλειψη TK, και την προσθήκη θυμιδίνης, υποξανθίνης και γλυκίνης (L5178Y) ή 2'-δεοξυκυτιδίνης (TK6) στην καλλιέργεια προκειμένου να διασφαλίζεται η βέλτιστη ανάπτυξη των κυττάρων με λειτουργική TK (19)(38)(39), και (40) για την TK6. Γενικές συμβουλές σχετικά με την ορθή πρακτική για τη συντήρηση των κυτταροκαλλιεργειών καθώς και ειδικές συμβουλές για τα κύτταρα L5178Y και TK6 παρέχονται στις παραπομπές (19)(31)(37)(39)(41). Για τα εργαστήρια που χρειάζονται κύριες αποθεματικές κυτταροκαλλιέργειες για να ξεκινήσουν την MLA ή την TK6, και για την προμήθεια νέων κύριων αποθεματικών κυτταροκαλλιεργειών, διατίθεται αποθετήριο καλά χαρακτηρισμένων κυττάρων (37).
|
Θρεπτικά μέσα και συνθήκες καλλιέργειας
|
17.
|
Για τη διατήρηση των καλλιεργειών στο πλαίσιο αμφότερων των δοκιμών θα πρέπει να χρησιμοποιούνται κατάλληλο θρεπτικό μέσο και κατάλληλες συνθήκες επώασης (δοχεία καλλιέργειας, ατμόσφαιρα με ύγρανση και 5 % CO2, θερμοκρασία επώασης 37 °C). Οι κυτταρικές καλλιέργειες θα πρέπει πάντοτε να διατηρούνται υπό συνθήκες που διασφαλίζουν ότι αναπτύσσονται κατά τη λογαριθμική φάση. Παίζει σημαντικό ρόλο το θρεπτικό μέσο και οι συνθήκες καλλιέργειας να επιλέγονται έτσι ώστε να διασφαλίζεται η άριστη ανάπτυξη των κυττάρων κατά τη διάρκεια της περιόδου έκφρασης και η κλωνοποίηση μεταλλαγμένων και μη κυττάρων. Όσον αφορά τόσο την MLA όσο και την TK6, είναι εξίσου σημαντικό οι συνθήκες καλλιέργειας να διασφαλίζουν την άριστη ανάπτυξη τόσο των προϊόντων μετάλλαξης TK μεγάλων αποικιών/πρώιμης εμφάνισης όσο και των προϊόντων μετάλλαξης μικρών αποικιών/όψιμης εμφάνισης Περισσότερες λεπτομέρειες για τις καλλιέργειες, περιλαμβανομένης της ανάγκης κατάλληλης θερμικής αδρανοποίησης ορού αλόγου, σε περίπτωση που κατά την επιλογή προϊόντων μετάλλαξης χρησιμοποιείται το θρεπτικό μέσο RPMI, παρέχονται στις παραπομπές (19)(31)(38)(39)(40)(42).
|
Παρασκευή των καλλιεργειών
|
18.
|
Τα κύτταρα πολλαπλασιάζονται από αποθεματικές καλλιέργειες, εμβολιαζόμενα σε θρεπτικό μέσο καλλιέργειας σε πυκνότητα τέτοια ώστε οι εναιωρημένες καλλιέργειες να εξακολουθούν να αναπτύσσονται εκθετικά κατά τις περιόδους αγωγής και έκφρασης.
|
Μεταβολική ενεργοποίηση
|
19.
|
Όταν χρησιμοποιούνται κύτταρα L5178Y και TK6, που έχουν ανεπαρκή ενδογενή μεταβολική ικανότητα, θα πρέπει να χρησιμοποιούνται και εξωγενή συστήματα μεταβολισμού. Το συνηθέστερα χρησιμοποιούμενο σύστημα, που συνιστάται εκτός αν ειδικοί λόγοι υπαγορεύουν διαφορετικά, είναι ένα μεταμιτοχονδριακό κλάσμα εμπλουτισμένο με συμπαράγοντα (S9), που παρασκευάζεται από ήπαρ τρωκτικών (κατά κανόνα επιμύων) και το οποίο έχει υποβληθεί σε κατεργασία με ενζυμοεπαγωγικούς παράγοντες όπως το Aroclor 1254 (43)(44)(45) ή ο συνδυασμός φαινοβαρβιτάλης και β-ναφθοφλαβόνης (46)(47)(48)(49)(50)(51). Ο συνδυασμός αυτός δεν αντιβαίνει στη σύμβαση της Στοκχόλμης για τους έμμονους οργανικούς ρύπους (52) και έχει αποδειχθεί εξίσου αποτελεσματικός με το Aroclor 1254 στην επαγωγή οξειδασώνμεικτής λειτουργίας (45)(46)(47)(48)(49). Το κλάσμα S9 χρησιμοποιείται συνήθως σε συγκεντρώσεις που κυμαίνονται από 1 έως 2 %, αλλά οι οποίες επιτρέπεται να αυξηθούν σε 10 % κ.ό. στο τελικό θρεπτικό μέσο της δοκιμής. Η επιλογή του τύπου και της συγκέντρωσης του χρησιμοποιούμενου εξωγενούς συστήματος μεταβολικής ενεργοποίησης ή μεταβολικού επαγωγέα μπορεί να επηρεαστεί από την κατηγορία των υπό δοκιμή χημικών ουσιών.
|
Σκευάσματα της υπό δοκιμή χημικής ουσίας
|
20.
|
Οι στερεές υπό δοκιμή χημικές ουσίες θα πρέπει να διαλύονται σε κατάλληλους διαλύτες και να αραιώνονται, εφόσον χρειάζεται, πριν από την αγωγή των κυττάρων (βλ. παράγραφο 21). Οι υγρές υπό δοκιμή χημικές ουσίες επιτρέπεται να προστίθενται κατευθείαν στο σύστημα δοκιμής και/ή να αραιώνονται πριν από την αγωγή του συστήματος δοκιμής. Οι αέριες ή πτητικές υπό δοκιμή χημικές ουσίες θα πρέπει να υποβάλλονται στη δοκιμή με κατάλληλες τροποποιήσεις των τυποποιημένων πρωτοκόλλων, π.χ. αγωγή σε σφραγισμένα δοχεία καλλιέργειας (53) (54) (55). Τα σκευάσματα της υπό δοκιμή χημικής ουσίας θα πρέπει να ετοιμάζονται ακριβώς πριν από την αγωγή, εκτός αν τα στοιχεία σχετικά με τη σταθερότητα της ουσίας αποδεικνύουν ότι είναι αποδεκτή η φύλαξη.
|
ΣΥΝΘΗΚΕΣ ΔΟΚΙΜΗΣ
Διαλύτες
|
21.
|
Θα πρέπει να επιλέγεται διαλύτης που να προσφέρει τη μεγαλύτερη διαλυτότητα της υπό δοκιμή χημικής ουσίας, χωρίς να επηρεάζει δυσμενώς τη διεξαγωγή της δοκιμής, π.χ. μεταβάλλοντας την ανάπτυξη των κυττάρων, αλλοιώνοντας την υπό δοκιμή χημική ουσία, αντιδρώντας με τα δοχεία καλλιέργειας ή αποδυναμώνοντας το σύστημα μεταβολικής ενεργοποίησης. Συνιστάται να εξετάζεται πρώτα, στο μέτρο του δυνατού, αν μπορεί να χρησιμοποιηθεί υδατικός διαλύτης (ή θρεπτικό μέσο καλλιέργειας). Καθιερωμένοι διαλύτες είναι το νερό και το διμεθυλοσουλφοξείδιο. Η συγκέντρωση του διαλύτη στο τελικό θρεπτικό μέσο αγωγής δεν θα πρέπει να υπερβαίνει γενικά το 1 % κ.ό., προκειμένου για οργανικούς διαλύτες, ή το 10 % κ.ό. στην περίπτωση των υδατικών διαλυτών (αλατούχο διάλυμα ή νερό). Εάν χρησιμοποιούνται άλλοι πλην των καθιερωμένων διαλυτών (π.χ. αιθανόλη ή ακετόνη), η χρήση τους θα πρέπει να τεκμηριώνεται με στοιχεία που αποδεικνύουν τη συμβατότητά τους με τις υπό δοκιμή χημικές ουσίες και με το σύστημα δοκιμής, καθώς και την απουσία γενετικής τοξικότητας στη χρησιμοποιούμενη συγκέντρωση. Εάν δεν υπάρχουν αυτά τα στοιχεία, είναι σημαντικό να προστίθενται μάρτυρες που δεν υποβάλλονται σε αγωγή (βλ. προσάρτημα 1, Ορισμοί) για να αποδεικνύεται ότι ο επιλεγμένος διαλύτης δεν επάγει επιβλαβείς ή μεταλλαξιγόνες επιδράσεις.
|
ΜΕΤΡΗΣΗ ΤΗΣ ΚΥΤΤΑΡΟΤΟΞΙΚΟΤΗΤΑΣ ΚΑΙ ΕΠΙΛΟΓΗ ΣΥΓΚΕΝΤΡΩΣΕΩΝ ΑΓΩΓΗΣ
|
22.
|
Κατά τον καθορισμό της υψηλότερης συγκέντρωσης της υπό δοκιμή χημικής ουσίας θα πρέπει να αποφεύγονται οι συγκεντρώσεις που μπορούν να οδηγήσουν σε τεχνητά θετικές αποκρίσεις, όπως εκείνες που προκαλούν υπέρμετρη κυτταροτοξικότητα (βλ. παράγραφο 28), καθίζηση στο θρεπτικό μέσο καλλιέργειας (βλ. παράγραφο 29) ή έντονες μεταβολές του pH ή της ωσμωμοριακότητας (βλ. παράγραφο 8). Εάν η υπό δοκιμή χημική ουσία προκαλεί έντονη μεταβολή του pH του θρεπτικού μέσου κατά την προσθήκη της, το pH μπορεί να ρυθμίζεται με προσθήκη ρυθμιστικού διαλύματος στο τελικό θρεπτικό μέσο αγωγής, με σκοπό να αποφεύγονται τα τεχνητά θετικά αποτελέσματα και να διατηρούνται κατάλληλες συνθήκες καλλιέργειας.
|
|
23.
|
Η επιλογή συγκεντρώσεων βασίζεται στην κυτταροτοξικότητα και άλλες παραμέτρους (βλ. παραγράφους 27-30). Μολονότι η αξιολόγηση της κυτταροτοξικότητας σε αρχική δοκιμή μπορεί να είναι χρήσιμη για τον ακριβέστερο καθορισμό των συγκεντρώσεων που θα χρησιμοποιηθούν στο κύριο πείραμα, δεν είναι υποχρεωτική η διεξαγωγή αρχικής δοκιμής. Ακόμη και εάν διενεργηθεί αρχική αξιολόγηση της κυτταροτοξικότητας, εξακολουθεί να απαιτείται η μέτρηση της κυτταροτοξικότητας για κάθε καλλιέργεια στο κύριο πείραμα. Σε περίπτωση διεξαγωγής πειράματος προσδιορισμού εύρους, αυτό θα πρέπει να καλύπτει ευρύ φάσμα συγκεντρώσεων και μπορεί είτε να τερματίζεται την 1η ημέρα μετά την αγωγή είτε να συνεχίζεται για χρονικό διάστημα έκφρασης 2 ημερών έως την επιλογή των προϊόντων μετάλλαξης (εφόσον φαίνεται ότι οι χρησιμοποιούμενες συγκεντρώσεις είναι οι κατάλληλες).
|
|
24.
|
Η κυτταροτοξικότητα θα πρέπει να προσδιορίζεται για κάθε επιμέρους καλλιέργεια δοκιμής και καλλιέργεια μάρτυρα: οι μέθοδοι για την MLA (2) και την TK6 (15) καθορίζονται βάσει της διεθνώς αποδεκτής πρακτικής.
|
|
25.
|
Όσον αφορά τόσο την έκδοση με άγαρ όσο και την έκδοση μικροτιτλοδότησης της MLA: η κυτταροτοξικότητα θα πρέπει να αξιολογείται με χρήση της σχετικής συνολικής ανάπτυξης (RTG), η οποία ορίστηκε για πρώτη φορά από τους Clive και Spector το 1975 (2). Αυτό το μέτρο περιλαμβάνει τη σχετική ανάπτυξη εναιωρήματος (RSG: καλλιέργεια δοκιμής έναντι μάρτυρα με διαλύτη) κατά την αγωγή των κυττάρων, τον χρόνο έκφρασης και τη σχετική απόδοση κλωνοποίησης (RCE: καλλιέργεια δοκιμής έναντι μάρτυρα με διαλύτη) κατά τη χρονική στιγμή επιλογής των προϊόντων μετάλλαξης (2). Θα πρέπει να επισημανθεί ότι η RSG περιλαμβάνει τυχόν απώλεια κυττάρων στην καλλιέργεια δοκιμής στη διάρκεια της αγωγής (βλ. προσάρτημα 2 για τους τύπους).
|
|
26.
|
Για την TK6: η κυτταροτοξικότητα θα πρέπει να αξιολογείται με χρήση της σχετικής επιβίωσης (RS), δηλαδή της απόδοσης κλωνοποίησης κυττάρων επιστρωμένων αμέσως μετά την αγωγή, προσαρμοσμένης ως προς τυχόν απώλεια κυττάρων κατά τη διάρκεια της αγωγής, βάσει του καταμετρούμενου αριθμού κυττάρων, σε σύγκριση με τον αρνητικό μάρτυρα (στον οποίο έχει αποδοθεί επιβίωση 100 %) (βλ. προσάρτημα 2 για τον τύπο).
|
|
27.
|
Θα πρέπει να αξιολογούνται τουλάχιστον τέσσερις συγκεντρώσεις δοκιμής (χωρίς τον διαλύτη και τους θετικούς μάρτυρες) που πληρούν τα κριτήρια αποδοχής (ενδεδειγμένη κυτταροτοξικότητα, αριθμός κυττάρων κ.λπ.). Αν και συνιστάται η χρήση διπλών καλλιεργειών, μπορούν να χρησιμοποιούνται σε κάθε συγκέντρωση δοκιμής είτε πολλαπλές πανομοιότυπες καλλιέργειες είτε μοναδικές καλλιέργειες. Τα αποτελέσματα που προκύπτουν από τις πανομοιότυπες καλλιέργειες σε δεδομένη συγκέντρωση θα πρέπει να αναφέρονται χωριστά αλλά μπορούν να συνενώνονται για την ανάλυση δεδομένων (55). Για τις υπό δοκιμή χημικές ουσίες με ελάχιστη ή μηδενική κυτταροτοξικότητα, κατάλληλες είναι συνήθως οι συγκεντρώσεις που απέχουν μεταξύ τους κατά παράγοντα ίσο με 2 ή 3 περίπου. Σε περίπτωση κυτταροτοξικότητας, οι επιλεγόμενες συγκεντρώσεις θα πρέπει να καλύπτουν το φάσμα τιμών κυτταροτοξικότητας που κυμαίνεται από τη συγκέντρωση που προκαλεί την κυτταροτοξικότητα η οποία περιγράφεται στην παράγραφο 28 μέχρι τις συγκεντρώσεις στις οποίες παρατηρείται μέτρια και ελάχιστη ή μηδενική κυτταροτοξικότητα. Πολλές υπό δοκιμή χημικές ουσίες παρουσιάζουν καμπύλες συγκέντρωσης-απόκρισης με μεγάλη κλίση και, για να καλυφθεί το συνολικό φάσμα τιμών κυτταροτοξικότητας ή για να μελετηθεί λεπτομερώς η σχέση συγκέντρωσης-απόκρισης, μπορεί να είναι αναγκαία η χρήση συγκεντρώσεων με μικρότερα διαστήματα μεταξύ τους και περισσότερων από τέσσερις συγκεντρώσεις, ιδίως σε περιπτώσεις όπου απαιτείται επανάληψη του πειράματος (βλ. παράγραφο 70). Η χρήση περισσότερων από 4 συγκεντρώσεις μπορεί να είναι ιδιαίτερα σημαντική όταν χρησιμοποιούνται μονές καλλιέργειες.
|
|
28.
|
Εάν η μέγιστη συγκέντρωση βασίζεται στην κυτταροτοξικότητα, η υψηλότερη συγκέντρωση θα πρέπει να αποσκοπεί στην επίτευξη μεταξύ 20 και 10 % RTG για την MLA, και μεταξύ 20 και 10 % RS για την TK6 (παράγραφος 67).
|
|
29.
|
Για δυσδιάλυτες υπό δοκιμή χημικές ουσίες που δεν είναι κυτταροτοξικές σε συγκεντρώσεις χαμηλότερες από τη συγκέντρωση μέγιστης διαλυτότητας, η αναλυόμενη μέγιστη συγκέντρωση θα πρέπει να επιφέρει θολερότητα ή ίζημα ορατό με γυμνό οφθαλμό ή με τη βοήθεια ανεστραμμένου μικροσκοπίου στο τέλος της αγωγής με την υπό δοκιμή χημική ουσία. Ακόμη και αν εμφανίζεται κυτταροτοξικότητα σε συγκεντρώσεις υψηλότερες από τη συγκέντρωση μέγιστης διαλυτότητας, συνιστάται να διεξάγεται η δοκιμή σε μία μόνο συγκέντρωση που επιφέρει θολερότητα ή ορατό ίζημα, διότι μπορεί να προκύψουν τεχνητές επιδράσεις από το ίζημα. Λόγω του ότι στις MLA και TK6 χρησιμοποιούνται καλλιέργειες σε εναιώρημα, θα πρέπει να λαμβάνεται ιδιαίτερα μέριμνα ώστε να διασφαλίζεται ότι το ίζημα δεν παρεμποδίζει τη διεξαγωγή της δοκιμής. Ο προσδιορισμός της διαλυτότητας στο θρεπτικό μέσο καλλιέργειας πριν από το πείραμα μπορεί επίσης να είναι χρήσιμος.
|
|
30.
|
Εάν δεν παρατηρηθεί ίζημα ούτε περιοριστική κυτταροτοξικότητα, η ανώτατη συγκέντρωση δοκιμής θα πρέπει να αντιστοιχεί στη μικρότερη από τις τιμές 10 mM, 2 mg/ml ή 2 μl/ml (57)(58). Όταν η υπό δοκιμή χημική ουσία δεν έχει καθορισμένη σύνθεση, π.χ. ουσία άγνωστης ή ασταθούς σύνθεσης, προϊόντα πολύπλοκων αντιδράσεων ή βιολογικά υλικά [δηλ. χημικές ουσίες άγνωστης ή ασταθούς σύνθεσης (UVCB)], εκχυλίσματα από το περιβάλλον κ.λπ., η ανώτατη συγκέντρωση θα πρέπει ενδεχομένως να είναι υψηλότερη (π.χ. 5 mg/ml), ελλείψει επαρκούς κυτταροτοξικότητας, προκειμένου να αυξηθεί η συγκέντρωση του κάθε συστατικού. Επισημαίνεται, ωστόσο, ότι οι απαιτήσεις αυτές μπορεί να διαφέρουν για τα φαρμακευτικά προϊόντα για τον άνθρωπο (59).
|
Μάρτυρες
|
31.
|
Για κάθε συνθήκη του πειράματος, θα πρέπει να συμπεριλαμβάνονται παράλληλοι αρνητικοί μάρτυρες (βλ. παράγραφο 21), αποτελούμενοι μόνο από τον διαλύτη στο θρεπτικό μέσο της αγωγής και υποβαλλόμενοι στην ίδια μεταχείριση όπως και οι καλλιέργειες.
|
|
32.
|
Απαιτούνται παράλληλοι θετικοί μάρτυρες για να αποδεικνύεται αφενός η ικανότητα του εργαστηρίου να αναγνωρίζει τα μεταλλαξιγόνα υπό τις συνθήκες του χρησιμοποιούμενου πρωτοκόλλου δοκιμής και, αφετέρου, η αποτελεσματικότητα του εξωγενούς συστήματος μεταβολικής ενεργοποίησης (κατά περίπτωση), και να αποδεικνύεται η επαρκής ανίχνευση αμφότερων των προϊόντων μετάλλαξης TK μικρών αποικιών/όψιμης εμφάνισης και μεγάλων αποικιών/πρώιμης εμφάνισης. Παραδείγματα θετικών μαρτύρων παρέχονται κατωτέρω στον πίνακα 1. Μπορούν να χρησιμοποιηθούν εναλλακτικές θετικές ουσίες μάρτυρες, εφόσον η χρήση τους αιτιολογείται. Επειδή οι in vitro δοκιμές γενετικής τοξικότητας σε κύτταρα θηλαστικών είναι επαρκώς τυποποιημένες για βραχυχρόνιες αγωγές (3-4 ωρών) που πραγματοποιούνται ταυτόχρονα με και χωρίς μεταβολική ενεργοποίηση με την ίδια διάρκεια αγωγής, η χρήση θετικών μαρτύρων μπορεί να περιορίζεται σε μια μεταλλαξιγόνο ουσία που απαιτεί μεταβολική ενεργοποίηση. Στην περίπτωση αυτή, αυτή η μοναδική απόκριση στον θετικό μάρτυρα θα καταδείξει τόσο τη δραστηριότητα του συστήματος μεταβολικής ενεργοποίησης όσο και την αποκρισιμότητα του συστήματος δοκιμής. Ωστόσο, σε περίπτωση μακροχρόνιας αγωγής (δηλ. 24 ωρών χωρίς S9) θα πρέπει να προβλέπεται χωριστός θετικός μάρτυρας, διότι η διάρκεια της αγωγής διαφέρει από αυτήν της δοκιμής με μεταβολική ενεργοποίηση. Κάθε θετικός μάρτυρας θα πρέπει να χρησιμοποιείται σε μία ή περισσότερες συγκεντρώσεις που αναμένεται να έχουν ως αποτέλεσμα αναπαραγώγιμη και ανιχνεύσιμη αύξηση σε σχέση με την τιμή υποβάθρου, για να καταδεικνύεται η ευαισθησία του συστήματος δοκιμής, και η απόκριση δεν θα πρέπει να διακυβεύεται εξαιτίας κυτταροτοξικότητας που υπερβαίνει τα όρια που προβλέπονται στην παρούσα μέθοδο δοκιμών (βλ. παράγραφο 28).
|
Πίνακας 1
Συνιστώμενες ουσίες αναφοράς για την αξιολόγηση της τεχνικής ικανότητας του εργαστηρίου και την επιλογή θετικών μαρτύρων
|
Κατηγορία
|
Ουσία
|
CASRN
|
|
1. Μεταλλαξιγόνα που δρουν χωρίς μεταβολική ενεργοποίηση
|
|
Μεθανοσουλφονικός μεθυλεστέρας
|
66-27-3
|
|
Μιτομυκίνη C
|
50-07-7
|
|
4-Νιτροκινολιν-Ν-οξείδιο
|
56-57-5
|
|
2. Μεταλλαξιγόνα που απαιτούν μεταβολική ενεργοποίηση
|
|
Βενζο(α)πυρένιο
|
50-32-8
|
|
Κυκλοφωσφαμίδιο, μονοένυδρο
|
50-18-0 (6055-19-2)
|
|
7,12-Διμεθυλοβενζανθρακένιο
|
57-97-6
|
|
3-Μεθυλοχολανθρένιο
|
56-49-5
|
ΔΙΑΔΙΚΑΣΙΑ
Αγωγή με την υπό δοκιμή χημική ουσία
|
33.
|
Πολλαπλασιαζόμενα κύτταρα υποβάλλονται σε αγωγή με την υπό δοκιμή χημική ουσία με και χωρίς σύστημα μεταβολικής ενεργοποίησης. Η έκθεση θα πρέπει να διαρκεί για κατάλληλο χρονικό διάστημα (συνήθως 3 έως 4 ώρες αρκούν). Επισημαίνεται, ωστόσο, ότι οι απαιτήσεις αυτές μπορεί να διαφέρουν για τα φαρμακευτικά προϊόντα για τον άνθρωπο (59). Όσον αφορά την MLA, σε περιπτώσεις όπου η βραχυχρόνια αγωγή αποδίδει αρνητικά αποτελέσματα και υπάρχουν πληροφορίες που υποδεικνύουν την ανάγκη πιο μακροχρόνιας αγωγής [π.χ. ανάλογα νουκλεοσιδίων, δυσδιάλυτες χημικές ουσίες (5)(59)], θα πρέπει να εξετάζεται το ενδεχόμενο διεξαγωγής της δοκιμής με μεγαλύτερο χρονικό διάστημα αγωγής, δηλαδή 24 ώρες χωρίς S9.
|
|
34.
|
Ο ελάχιστος αριθμός χρησιμοποιούμενων κυττάρων για κάθε καλλιέργεια δοκιμής (μάρτυρα και αγωγής) σε κάθε στάδιο της δοκιμής θα πρέπει να βασίζεται στην αυθόρμητη συχνότητα προϊόντων μετάλλαξης. Μια γενική υπόδειξη είναι η αγωγή και ανακαλλιέργεια επαρκών κυττάρων σε κάθε πειραματική καλλιέργεια ώστε να διατηρούνται τουλάχιστον 10, αλλά ιδανικά 100, αυθόρμητα προϊόντα μετάλλαξης σε όλες τις φάσεις της δοκιμής (αγωγή, φαινοτυπική έκφραση και επιλογή προϊόντων μετάλλαξης) (56).
|
|
35.
|
Όσον αφορά την MLA, η συνιστώμενη αποδεκτή συχνότητα αυθόρμητων προϊόντων μετάλλαξης κυμαίνεται μεταξύ 35-140 × 10-6 (έκδοση με άγαρ) και 50-170 × 10-6 (έκδοση μικροτιτλοδότησης) (βλ. πίνακα 2). Για να διατηρούνται τουλάχιστον 10, και ιδανικά 100, αυθόρμητα προϊόντα μετάλλαξης που επιβιώνουν της αγωγής για κάθε καλλιέργεια δοκιμής, πρέπει να υποβάλλονται σε αγωγή τουλάχιστον 6 × 106 κύτταρα. Με αγωγή αυτού του αριθμού κυττάρων και τη διατήρηση επαρκών κυττάρων κατά την έκφραση και την κλωνοποίηση για επιλογή προϊόντων μετάλλαξης, εξασφαλίζεται επαρκής αριθμός προϊόντων μετάλλαξης (10 ή περισσότερα) σε όλες τις φάσεις του πειράματος, ακόμη και για τις καλλιέργειες που υποβάλλονται σε αγωγή σε συγκεντρώσεις που επάγουν 90 % κυτταροτοξικότητα (όπως μετριέται βάσει RTG 10 %) (19)(38)(39).
|
|
36.
|
Στην TK6, η συχνότητα αυθόρμητων προϊόντων μετάλλαξης κυμαίνεται κατά κανόνα μεταξύ 2 και 10 × 10-6. Για να επιβιώνουν τουλάχιστον 10 αυθόρμητα προϊόντα μετάλλαξης σε κάθε καλλιέργεια, πρέπει να υποβάλλονται σε αγωγή τουλάχιστον 20 × 106 κύτταρα. Με αγωγή αυτού του αριθμού κυττάρων εξασφαλίζεται επαρκής αριθμός αυθόρμητων προϊόντων μετάλλαξης (10 ή περισσότερα), ακόμη και για καλλιέργειες που υποβάλλονται σε αγωγή σε συγκεντρώσεις που επάγουν 90 % κυτταροτοξικότητα (10 % RS). Επιπλέον, επαρκής αριθμός κυττάρων πρέπει να καλλιεργείται κατά το χρονικό διάστημα έκφρασης και να επιστρώνεται για επιλογή προϊόντων μετάλλαξης (60).
|
Χρόνος φαινοτυπικής έκφρασης και μέτρηση της συχνότητας προϊόντων μετάλλαξης
|
37.
|
Στο τέλος της περιόδου αγωγής, τα κύτταρα καλλιεργούνται για καθορισμένο χρονικό διάστημα ώστε να επιτυγχάνεται σχεδόν βέλτιστη φαινοτυπική έκφραση των πρόσφατα προκληθέντων προϊόντων μετάλλαξης για καθεμία κυτταρική σειρά χωριστά. Στην MLA, το χρονικό διάστημα φαινοτυπικής έκφρασης είναι 2 ημέρες. Στην TK6, το χρονικό διάστημα φαινοτυπικής έκφρασης είναι 3-4 ημέρες. Εάν χρησιμοποιείται αγωγή διάρκειας 24 ωρών, το χρονικό διάστημα έκφρασης ξεκινά μετά το πέρας της αγωγής.
|
|
38.
|
Στη διάρκεια του χρονικού διαστήματος φαινοτυπικής έκφρασης, τα κύτταρα καταμετρώνται καθημερινά. Στην MLA, οι καθημερινές καταμετρήσεις κυττάρων χρησιμοποιούνται για τον υπολογισμό της ημερήσιας ανάπτυξης του εναιωρήματος (SG). Μετά την περίοδο έκφρασης διάρκειας 2 ημερών, τα κύτταρα εναιωρούνται σε θρεπτικό μέσο με και χωρίς παράγοντα επιλογής με σκοπό τον προσδιορισμό των αριθμών των προϊόντων μετάλλαξης (τρυβλία επιλογής) και της απόδοσης της κλωνοποίησης (τρυβλία βιωσιμότητας) αντίστοιχα. Όσον αφορά την MLA, υπάρχουν δύο εξίσου αποδεκτές μέθοδοι κλωνοποίησης επιλογής προϊόντων μετάλλαξης· μία στην οποία χρησιμοποιείται άγαρ και μία άλλη στην οποία χρησιμοποιείται υγρό θρεπτικό μέσο σε τρυβλία 96 κοιλοτήτων (19) (38) (39). Η κλωνοποίηση στην TK6 διεξάγεται με χρήση υγρού μέσου και τρυβλίων 96 κοιλοτήτων (16).
|
|
39.
|
Η τριφθοροθυμιδίνη (TFT) είναι ο μόνος συνιστώμενος παράγοντας επιλογής για τα προϊόντα μετάλλαξης TK (61).
|
|
40.
|
Στην MLA, τα τρυβλία με άγαρ και τα τρυβλία μικροτιτλοδότησης καταμετρώνται μετά από επώαση διάρκειας 10-12 ημερών. Στην TK6, οι αποικίες των τρυβλίων μικροτιτλοδότησης βαθμολογούνται μετά από 10-14 ημέρες για τα πρώιμα εμφανιζόμενα προϊόντα μετάλλαξης. Για τη μέτρηση των βραδέως αναπτυσσόμενων (όψιμα εμφανιζόμενων) προϊόντων μετάλλαξης TK6 χρειάζεται εκ νέου τροφοδότηση των κυττάρων με θρεπτικό μέσο και TFT, μετά την καταμέτρηση των πρώιμα εμφανιζόμενων προϊόντων μετάλλαξης, και, στη συνέχεια, επώαση των τρυβλίων για επιπλέον χρονικό διάστημα 7-10 ημερών (62). Για την εξέταση του ζητήματος της καταμέτρησης των βραδέως και των φυσιολογικώς αναπτυσσόμενων προϊόντων μετάλλαξης TK, ανατρέξτε στις παραγράφους 42 και 44.
|
|
41.
|
Οι κατάλληλοι υπολογισμοί για τις δύο δοκιμές, περιλαμβανομένων των δύο μεθόδων (με άγαρ και μικροτιτλοδότηση) για την MLA, περιλαμβάνονται στο προσάρτημα 2. Στη μέθοδο με άγαρ της MLA, καταμετρώνται οι αποικίες και ο αριθμός των αποικιών με προϊόντα μετάλλαξης προσαρμόζεται βάσει της απόδοσης κλωνοποίησης προκειμένου να υπολογιστεί η συχνότητα προϊόντων μετάλλαξης (MF). Στην έκδοση μικροτιτλοδότησης της MLA και την TK6, η απόδοση κλωνοποίησης προσδιορίζεται και για τα τρυβλία επιλογής και για τα τρυβλία απόδοσης κλωνοποίησης, σύμφωνα με την κατανομή Poisson (63). Η MF υπολογίζεται με βάση τις εν λόγω δύο αποδόσεις κλωνοποίησης.
|
Χαρακτηρισμός αποικιών προϊόντων μετάλλαξης
|
42.
|
Στην MLA, εάν η υπό δοκιμή χημική ουσία είναι θετική (βλ. παραγράφους 62-63), θα πρέπει να πραγματοποιείται χαρακτηρισμός των αποικιών βάσει του μεγέθους ή της ανάπτυξής τους για τουλάχιστον μία από τις καλλιέργειες δοκιμής (κατά κανόνα στην υψηλότερη αποδεκτή θετική συγκέντρωση) και για τους αρνητικούς και τους θετικούς μάρτυρες. Εάν η υπό δοκιμή χημική ουσία είναι αρνητική (βλ. παράγραφο 64), θα πρέπει να πραγματοποιείται χαρακτηρισμός των αποικιών προϊόντων μετάλλαξης για τους αρνητικούς και τους θετικούς μάρτυρες. Στη μέθοδο μικροτιτλοδότησης της MLA, τα προϊόντα μετάλλαξης μικρών αποικιών ορίζονται ως εκείνα που καλύπτουν λιγότερο από το 25 % της διαμέτρου της κοιλότητας, και τα προϊόντα μετάλλαξης μεγάλων αποικιών ως εκείνα που καλύπτουν περισσότερο από το 25 % της διαμέτρου της κοιλότητας. Στη μέθοδο με άγαρ χρησιμοποιείται αυτόματος μετρητής αποικιών για την καταμέτρηση των αποικιών προϊόντων μετάλλαξης και την εκτίμηση του μεγέθους τους. Οι προσεγγίσεις αναφορικά με την εκτίμηση του μεγέθους των αποικιών περιγράφονται αναλυτικά στη βιβλιογραφία (19)(38)(40). Ο χαρακτηρισμός των αποικιών του αρνητικού και του θετικού μάρτυρα είναι απαραίτητος προκειμένου να αποδεικνύεται η ορθή διεξαγωγή των μελετών.
|
|
43.
|
Η υπό δοκιμή χημική ουσία δεν μπορεί να χαρακτηριστεί αρνητική εάν δεν ανιχνευτούν ικανοποιητικά προϊόντα μετάλλαξης μεγάλων και μικρών αποικιών στον θετικό μάρτυρα. Ο χαρακτηρισμός των αποικιών μπορεί να χρησιμοποιείται για την παροχή γενικών πληροφοριών αναφορικά με την ικανότητα της υπό δοκιμή χημικής ουσίας να επάγει σημειακές μεταλλάξεις και/ή χρωμοσωμικά συμβάντα (παράγραφος 4).
|
|
44.
|
TK6: Τα φυσιολογικώς αναπτυσσόμενα και τα βραδέως αναπτυσσόμενα προϊόντα μετάλλαξης διαφοροποιούνται βάσει του διαφορετικού χρόνου επώασης (βλ. παράγραφο 40). Στην TK6, γενικά, τόσο τα πρώιμα εμφανιζόμενα όσο και τα όψιμα εμφανιζόμενα προϊόντα μετάλλαξης βαθμολογούνται για όλες τις καλλιέργειες, περιλαμβανομένων των αρνητικών και των θετικών μαρτύρων. Ο χαρακτηρισμός των αποικιών του αρνητικού και του θετικού μάρτυρα είναι απαραίτητος προκειμένου να αποδεικνύεται η ορθή διεξαγωγή των μελετών. Η υπό δοκιμή χημική ουσία δεν μπορεί να χαρακτηριστεί αρνητική εάν δεν ανιχνευτούν ικανοποιητικά πρώιμα εμφανιζόμενα και όψιμα εμφανιζόμενα προϊόντα μετάλλαξης στον θετικό μάρτυρα. Ο χαρακτηρισμός των αποικιών μπορεί να χρησιμοποιείται για την παροχή γενικών πληροφοριών αναφορικά με την ικανότητα της υπό δοκιμή χημικής ουσίας να επάγει σημειακές μεταλλάξεις και/ή χρωμοσωμικά συμβάντα (παράγραφος 4).
|
Τεχνική ικανότητα του εργαστηρίου
|
45.
|
Για να αποδείξει ότι διαθέτει επαρκή εμπειρία στη διεξαγωγή της δοκιμής πριν την εντάξει στην τρέχουσα πρακτική του, το εργαστήριο θα πρέπει να έχει πραγματοποιήσει σειρά πειραμάτων με θετικές χημικές ουσίες αναφοράς που δρουν μέσω διαφόρων μηχανισμών (τουλάχιστον μία που δρα με και μία που δρα χωρίς μεταβολική ενεργοποίηση, επιλεγμένες μεταξύ των χημικών ουσιών που απαριθμούνται στον πίνακα 1) και διάφορους αρνητικούς μάρτυρες (περιλαμβανομένων καλλιεργειών χωρίς αγωγή και διαφόρων διαλυτών/φορέων). Οι αποκρίσεις των εν λόγω θετικών και αρνητικών μαρτύρων θα πρέπει να συμφωνούν με τη βιβλιογραφία. Αυτό δεν ισχύει για τα εργαστήρια που έχουν πείρα, δηλ. διαθέτουν βάση ιστορικών δεδομένων, όπως ορίζεται στις παραγράφους 47-50. Στην MLA, οι τιμές που λαμβάνονται για τους θετικούς και τους αρνητικούς μάρτυρες θα πρέπει να συμφωνούν με τις συστάσεις IWGT (βλ. πίνακα 2).
|
|
46.
|
Θα πρέπει να διερευνάται ένα σύνολο επιλεγμένων ουσιών που χρησιμοποιούνται ως θετικοί μάρτυρες (βλ. πίνακα 1) με βραχυχρόνιες και μακροχρόνιες αγωγές (εάν χρησιμοποιούνται μακροχρόνιες αγωγές) απουσία μεταβολικής ενεργοποίησης, καθώς επίσης και με βραχυχρόνια αγωγή παρουσία μεταβολικής ενεργοποίησης, προκειμένου να καταδεικνύεται η τεχνική ικανότητα ανίχνευσης μεταλλαξιγόνων χημικών ουσιών, να διαπιστώνεται η αποτελεσματικότητα του συστήματος μεταβολικής ενεργοποίησης και να καταδεικνύεται η καταλληλότητα των συνθηκών ανάπτυξης κυττάρων στη διάρκεια της αγωγής, της φαινοτυπικής έκφρασης και της επιλογής προϊόντων μετάλλαξης και των διαδικασιών καταμέτρησης. Θα πρέπει να επιλέγεται ένα φάσμα συγκεντρώσεων των επιλεγμένων χημικών ουσιών που να επιφέρουν αναπαραγώγιμες και σχετιζόμενες με τη συγκέντρωση αυξήσεις σε σχέση με τις τιμές υποβάθρου, για να αποδεικνύονται η ευαισθησία και το δυναμικό εύρος του συστήματος δοκιμής.
|
Ιστορικά δεδομένα για μάρτυρες
|
47.
|
Το εργαστήριο θα πρέπει να καθορίζει:
|
—
|
εύρος και κατανομή ιστορικών δεδομένων για θετικούς μάρτυρες,
|
|
—
|
εύρος και κατανομή ιστορικών δεδομένων για αρνητικούς μάρτυρες (χωρίς αγωγή, με διαλύτη).
|
|
|
48.
|
Κατά την αρχική συγκέντρωση δεδομένων για ιστορική κατανομή όσον αφορά τους αρνητικούς μάρτυρες, οι παράλληλοι αρνητικοί μάρτυρες θα πρέπει να συμφωνούν με τα δημοσιευμένα δεδομένα για αρνητικούς μάρτυρες. Καθώς θα προστίθενται περισσότερα πειραματικά δεδομένα στην κατανομή των μαρτύρων, οι παράλληλοι αρνητικοί μάρτυρες θα πρέπει, στην ιδανική περίπτωση, να βρίσκονται εντός των ορίων ελέγχου 95 % της εν λόγω κατανομής (64)(65).
|
|
49.
|
Η βάση ιστορικών δεδομένων του εργαστηρίου για αρνητικούς μάρτυρες θα πρέπει αρχικά να δημιουργείται με δεδομένα από τουλάχιστον 10 πειράματα, αν και είναι προτιμότερο να αποτελείται από τουλάχιστον 20 πειράματα που έχουν εκτελεστεί σε συγκρίσιμες πειραματικές συνθήκες. Τα εργαστήρια θα πρέπει να χρησιμοποιούν μεθόδους ποιοτικού ελέγχου, όπως διαγράμματα ελέγχου [π.χ. διαγράμματα C ή X-bar (65)], για να προσδιορίζουν τη μεταβλητότητα των δεδομένων τους που αφορούν τους θετικούς και αρνητικούς μάρτυρες και να αποδεικνύουν ότι έχουν τη μεθοδολογία υπό έλεγχο (66). Περαιτέρω λεπτομέρειες και συστάσεις σχετικά με τον τρόπο δημιουργίας και χρήσης των ιστορικών δεδομένων διατίθενται στη βιβλιογραφία (64).
|
|
50.
|
Τα δεδομένα για αρνητικούς μάρτυρες θα πρέπει να αποτελούνται από τις συχνότητες προϊόντων μετάλλαξης από μονές καλλιέργειες ή, κατά προτίμηση, από πανομοιότυπες καλλιέργειες, όπως περιγράφεται στην παράγραφο 27. Οι παράλληλοι αρνητικοί μάρτυρες θα πρέπει, στην ιδανική περίπτωση, να βρίσκονται εντός των ορίων ελέγχου 95 % της κατανομής της βάσης ιστορικών δεδομένων του εργαστηρίου για αρνητικούς μάρτυρες. Όταν τα δεδομένα για αρνητικούς μάρτυρες δεν βρίσκονται εντός του ορίου ελέγχου 95 %, μπορεί να είναι αποδεκτή η προσθήκη τους στην ιστορική κατανομή μαρτύρων εφόσον τα εν λόγω δεδομένα δεν είναι ακραίες έκτοπες τιμές και υπάρχουν στοιχεία που αποδεικνύουν ότι το σύστημα δοκιμής είναι υπό έλεγχο (βλ. παράγραφο 49) και ότι δεν πρόκειται για τεχνικό ή ανθρώπινο σφάλμα.
|
|
51.
|
Κάθε αλλαγή του πειραματικού πρωτοκόλλου θα πρέπει να εξετάζεται υπό το πρίσμα της συμφωνίας των δεδομένων με τις υφιστάμενες βάσεις ιστορικών δεδομένων του εργαστηρίου για μάρτυρες. Τυχόν σημαντικές ανακολουθίες θα πρέπει να έχουν ως αποτέλεσμα τη δημιουργία νέας βάσης ιστορικών δεδομένων για μάρτυρες.
|
ΔΕΔΟΜΕΝΑ ΚΑΙ ΑΝΑΦΟΡΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ
Παρουσίαση των αποτελεσμάτων
|
52.
|
Στην παρουσίαση των δεδομένων για αμφότερες τις MLA και TK6 θα πρέπει να περιλαμβάνονται, και για τις καλλιέργειες που υποβλήθηκαν σε αγωγή και για τις καλλιέργειες μαρτύρων, τα δεδομένα που απαιτούνται για τον υπολογισμό της κυτταροτοξικότητας (RTG ή RS αντίστοιχα) και τις συχνότητες προϊόντων μετάλλαξης, όπως περιγράφεται κατωτέρω.
|
|
53.
|
Για την MLA, θα πρέπει να παρέχονται για κάθε καλλιέργεια δεδομένα για την RSG, την RTG, την απόδοση κλωνοποίησης κατά τη χρονική στιγμή της επιλογής προϊόντων μετάλλαξης και τον αριθμό των αποικιών προϊόντων μετάλλαξης (για την έκδοση με άγαρ) ή τον αριθμό των κενών κοιλοτήτων (για την έκδοση μικροτιτλοδότησης). Η συχνότητα προϊόντων μετάλλαξης (MF) θα πρέπει να εκφράζεται ως ο αριθμός των μεταλλαγμένων κυττάρων ανά εκατομμύριο κυττάρων που επιβιώνουν. Εάν η απόκριση είναι θετική, θα πρέπει να παρέχονται οι MF (και/ή το ποσοστό της συνολικής MF) των μικρών και των μεγάλων αποικιών για τουλάχιστον μία συγκέντρωση της υπό δοκιμή χημικής ουσίας (κατά κανόνα η υψηλότερη θετική συγκέντρωση) και για τους θετικούς και αρνητικούς μάρτυρες. Σε περίπτωση αρνητικής απόκρισης, θα πρέπει να παρέχεται η MF των μικρών και των μεγάλων αποικιών για τον αρνητικό και τον θετικό μάρτυρα.
|
|
54.
|
Για την TK6, θα πρέπει να παρέχονται για κάθε καλλιέργεια δεδομένα για την RS, την απόδοση κλωνοποίησης κατά τη χρονική στιγμή επιλογής των προϊόντων μετάλλαξης και τον αριθμό των κενών κοιλοτήτων για τα πρώιμα εμφανιζόμενα και τα όψιμα εμφανιζόμενα προϊόντα μετάλλαξης. Η MF θα πρέπει να εκφράζεται ως ο αριθμός μεταλλαγμένων κυττάρων ανά πλήθος κυττάρων που επιβιώνουν, ενώ θα πρέπει να περιλαμβάνεται η συνολική MF καθώς και η MF (και/ή το ποσοστό της συνολικής MF) των πρώιμα εμφανιζόμενων και των όψιμα εμφανιζόμενων προϊόντων μετάλλαξης.
|
Κριτήρια αποδοχής
|
55.
|
Για αμφότερες τις MLA και TK6, πριν από την εξαγωγή τελικών αποτελεσμάτων για συγκεκριμένη υπό δοκιμή χημική ουσία θα πρέπει να πληρούνται τα ακόλουθα κριτήρια:
|
—
|
να έχουν εφαρμοστεί δύο πειραματικές συνθήκες (βραχυχρόνια αγωγή με και χωρίς μεταβολική ενεργοποίηση - βλ. παράγραφο 33), εκτός εάν από τη μία προκύψουν θετικά αποτελέσματα,
|
|
—
|
να υπάρχει η δυνατότητα ανάλυσης επαρκούς αριθμού κυττάρων και συγκεντρώσεων (βλ. παραγράφους 27, 34-36),
|
|
—
|
τα κριτήρια επιλογής της ανώτατης συγκέντρωσης είναι σύμφωνα με αυτά που περιγράφονται στις παραγράφους 28-30.
|
|
Κριτήρια αποδοχής για τους αρνητικούς και τους θετικούς μάρτυρες
|
56.
|
Η ανάλυση που διεξήγαγε η ομάδα εργασίας εμπειρογνωμόνων MLA της IWGT σε μεγάλο πλήθος δεδομένων MLA οδήγησε σε διαμόρφωση συναίνεσης σε διεθνές επίπεδο όσον αφορά τα συγκεκριμένα κριτήρια αποδοχής για την MLA (1)(2)(3)(4)(5). Ως εκ τούτου, η παρούσα μέθοδος δοκιμών περιλαμβάνει συγκεκριμένες συστάσεις για τον προσδιορισμό της δυνατότητας αποδοχής των αρνητικών και των θετικών μαρτύρων, και για την αξιολόγηση των αποτελεσμάτων για κάθε επιμέρους ουσία στην MLA. Η βάση δεδομένων για την TK6 είναι πολύ μικρότερη και δεν έχει αξιολογηθεί από ομάδα εργασίας.
|
|
57.
|
Για την MLA, κάθε πείραμα θα πρέπει να αξιολογείται ως προς το κατά πόσον ο μάρτυρας χωρίς αγωγή / μάρτυρας με διαλύτη πληροί τα κριτήρια αποδοχής της ομάδας εργασίας MLA της IWGT [(4) και πίνακας 2 παρακάτω] σε σχέση με τις ακόλουθες παραμέτρους: 1) την MF (επισημαίνεται ότι οι αποδεκτές βάσει της IWGT συχνότητες προϊόντων μετάλλαξης είναι διαφορετικές για την έκδοση με άγαρ και την έκδοση μικροτιτλοδότησης της MLA), 2) την απόδοση κλωνοποίησης (CE) κατά τη χρονική στιγμή επιλογής των προϊόντων μετάλλαξης, και 3) την ανάπτυξη εναιωρήματος (SG) για τον μάρτυρα με διαλύτη (βλ. προσάρτημα 2 για τους τύπους).
Πίνακας 2
Κριτήρια αποδοχής για την MLA
|
Παράμετρος
|
Μέθοδος μαλακού άγαρ
|
Μέθοδος μικροτιτλοδότησης
|
|
Συχνότητα προϊόντων μετάλλαξης
|
35 – 140 × 10-6
|
50 – 170 × 10-6
|
|
Απόδοση κλωνοποίησης
|
65 – 120 %
|
65 – 120 %
|
|
Ανάπτυξη εναιωρήματος
|
πολλαπλάσια κατά 8 – 32 φορές (αγωγή 3-4 ωρών) πολλαπλάσια κατά 32 – 180 φορές (αγωγή 24 ωρών, εφόσον διεξαχθεί)
|
πολλαπλάσια κατά 8 – 32 φορές (αγωγή 3-4 ωρών) πολλαπλάσια κατά 32 – 180 φορές (αγωγή 24 ωρών, εφόσον διεξαχθεί)
|
|
|
58.
|
Για την MLA, κάθε δοκιμή θα πρέπει επίσης να αξιολογείται ως προς το κατά πόσον ο θετικός μάρτυρας/-ες πληροί τουλάχιστον ένα από τα ακόλουθα δύο κριτήρια αποδοχής που ανέπτυξε η ομάδα εργασίας της IWGT:
|
—
|
ο θετικός μάρτυρας θα πρέπει να παρουσιάζει απόλυτη αύξηση της συνολικής συχνότητας προϊόντων μετάλλαξης (MF), ήτοι αύξηση που υπερβαίνει την αυθόρμητη MF υποβάθρου [επαγόμενη MF (IMF)] τουλάχιστον 300 × 10-6. Τουλάχιστον το 40 % της IMF θα πρέπει να αποτυπώνεται στην MF των μικρών αποικιών,
|
|
—
|
ο θετικός μάρτυρας παρουσιάζει αύξηση στην MF μικρών αποικιών κατά τουλάχιστον 150 × 10-6 πάνω από την αύξηση που παρατηρείται στον παράλληλο μάρτυρα χωρίς αγωγή / μάρτυρα με διαλύτη (IMF μικρών αποικιών 150 × 10-6).
|
|
|
59.
|
Για την TK6, μια δοκιμή είναι αποδεκτή εάν θεωρείται αποδεκτή η προσθήκη του παράλληλου αρνητικού μάρτυρα στη βάση δεδομένων του εργαστηρίου για ιστορικούς αρνητικούς μάρτυρες, όπως περιγράφεται στις παραγράφους 48-49. Επιπλέον, οι παράλληλοι θετικοί μάρτυρες (βλ. παράγραφο 32) θα πρέπει να επάγουν αποκρίσεις συμβατές με εκείνες που έχουν καταχωριστεί στη βάση ιστορικών δεδομένων για θετικούς μάρτυρες και να επιφέρουν στατιστικά σημαντική αύξηση σε σχέση με τον παράλληλο αρνητικό μάρτυρα.
|
|
60.
|
Σε αμφότερες τις δοκιμές, το ανώτατο όριο κυτταροτοξικότητας που παρατηρείται στην καλλιέργεια που χρησιμεύει ως θετικός μάρτυρας θα πρέπει να είναι το ίδιο με αυτό των πειραματικών καλλιεργειών. Δηλαδή η RTG/RS δεν θα πρέπει να είναι μικρότερη από το 10 %. Για να αποδειχθεί ότι πληρούνται τα κριτήρια για τον θετικό μάρτυρα, αρκεί η χρήση μιας μονής καλλιέργειας (ή μιας από τις συγκεντρώσεις των καλλιεργειών θετικού μάρτυρα, εάν χρησιμοποιούνται περισσότερες από μία συγκεντρώσεις). Επιπλέον, η MF του θετικού μάρτυρα θα πρέπει να περιλαμβάνεται εντός του αποδεκτού εύρους τιμών που έχει καθοριστεί για το εργαστήριο.
|
Αξιολόγηση και ερμηνεία των αποτελεσμάτων
|
61.
|
Για την MLA, σημαντικό έργο σχετικά με τη βιολογική σημασία και τα κριτήρια για μια θετική απόκριση έχει πραγματοποιήσει η ομάδα εργασίας εμπειρογνωμόνων λεμφώματος ποντικού της IWGT (4). Ως εκ τούτου, η παρούσα μέθοδος δοκιμών περιλαμβάνει συγκεκριμένες συστάσεις για την ερμηνεία των αποτελεσμάτων της υπό δοκιμή χημικής ουσίας που προκύπτουν από την MLA (βλ. παραγράφους 62-64). Η βάση δεδομένων για την TK6 είναι πολύ μικρότερη και δεν έχει αξιολογηθεί από ομάδα εργασίας. Συνεπώς, οι παρεχόμενες συστάσεις για την ερμηνεία των δεδομένων για την TK6 είναι γενικότερου χαρακτήρα (βλ. παραγράφους 65-66). Για τις δύο δοκιμές ισχύουν πρόσθετες απαιτήσεις (βλ. παραγράφους 67-71).
|
MLA
|
62.
|
Για τη διασφάλιση της βιολογικής σημασίας της αυξημένης MF, συνιστάται η υιοθέτηση μιας προσέγγισης στην οποία ορίζονται οι θετικές και οι αρνητικές αποκρίσεις. Αντί της στατιστικής ανάλυσης που χρησιμοποιείται συνήθως για άλλες δοκιμές, αυτή η προσέγγιση βασίζεται στη χρήση προκαθορισμένης επαγόμενης συχνότητας προϊόντων μετάλλαξης (δηλ. αύξηση της MF πάνω από τον παράλληλο μάρτυρα), η οποία καλείται Global Evaluation Factor (καθολικός παράγοντας αξιολόγησης - GEF) και η οποία βασίζεται στην ανάλυση της κατανομής των δεδομένων MF αρνητικού μάρτυρα από συμμετέχοντα εργαστήρια (4). Για την έκδοση με άγαρ της MLA ο GEF είναι 90 × 10-6, ενώ για την έκδοση μικροτιτλοδότησης της MLA ο GEF είναι 126 × 10-6.
|
|
63.
|
Υπό την προϋπόθεση ότι πληρούται το σύνολο των κριτηρίων αποδοχής, μια υπό δοκιμή χημική ουσία θεωρείται σαφώς θετική εάν, σε οποιαδήποτε από τις πειραματικές συνθήκες που εξετάστηκαν (βλ. παράγραφο 33), η αύξηση της MF πάνω από το παράλληλο υπόβαθρο υπερβαίνει τον GEF και η αύξηση συνδέεται με τη συγκέντρωση (π.χ. με χρήση ελέγχου τάσης). Θεωρείται τότε ότι η υπό δοκιμή χημική ουσία είναι ικανή να επάγει μεταλλάξεις σε αυτό το σύστημα δοκιμής.
|
|
64.
|
Υπό την προϋπόθεση ότι πληρούται το σύνολο των κριτηρίων αποδοχής, μια υπό δοκιμή χημική ουσία θεωρείται σαφώς αρνητική εάν, σε οποιαδήποτε από τις πειραματικές συνθήκες που εξετάστηκαν (βλ. παράγραφο 33), δεν προκύπτει απόκριση που να συνδέεται με τη συγκέντρωση ή, εάν υπάρχει αύξηση της MF, αυτή δεν υπερβαίνει τον GEF. Θεωρείται τότε ότι η υπό δοκιμή χημική ουσία δεν είναι ικανή να επάγει μεταλλάξεις σε αυτό το σύστημα δοκιμής.
|
TK6
|
65.
|
Υπό την προϋπόθεση ότι πληρούνται όλα τα κριτήρια αποδοχής, η υπό δοκιμή χημική ουσία θεωρείται σαφώς θετική εάν, σε οποιαδήποτε από τις πειραματικές συνθήκες που εξετάστηκαν (βλ. παράγραφο 33):
|
—
|
τουλάχιστον σε μία από τις συγκεντρώσεις δοκιμής εμφανίζεται στατιστικά σημαντική αύξηση σε σχέση με τον παράλληλο αρνητικό μάρτυρα
|
|
—
|
η αύξηση σχετίζεται με τη συγκέντρωση, όταν αξιολογείται με κατάλληλο έλεγχο τάσης (βλ. παράγραφο 33)
|
|
—
|
κάποιο από τα αποτελέσματα βρίσκεται εκτός της κατανομής των ιστορικών δεδομένων για αρνητικούς μάρτυρες (π.χ. όριο ελέγχου σε επίπεδο 95 % με βάση την κατανομή Poisson· βλ. παράγραφο 48).
|
|
Όταν πληρούνται όλα αυτά τα κριτήρια, η υπό δοκιμή χημική ουσία θεωρείται ικανή να επάγει μεταλλάξεις σε αυτό το σύστημα δοκιμής. Συστάσεις για τις πλέον κατάλληλες στατιστικές μεθόδους έχουν διατυπωθεί στη βιβλιογραφία (66)(67).
|
66.
|
Υπό την προϋπόθεση ότι πληρούνται όλα τα κριτήρια αποδοχής, η υπό δοκιμή χημική ουσία θεωρείται σαφώς αρνητική εάν, σε όλες τις πειραματικές συνθήκες που εξετάστηκαν (βλ. παράγραφο 33):
|
—
|
σε καμία από τις συγκεντρώσεις δοκιμής δεν εμφανίζεται στατιστικά σημαντική αύξηση σε σχέση με τον παράλληλο αρνητικό μάρτυρα
|
|
—
|
δεν παρατηρείται σχετιζόμενη με τη συγκέντρωση αύξηση, όταν αξιολογείται με κατάλληλο έλεγχο τάσης
|
|
—
|
όλα τα αποτελέσματα βρίσκονται εντός της κατανομής των ιστορικών δεδομένων για αρνητικούς μάρτυρες (π.χ. όριο ελέγχου σε επίπεδο 95 % με βάση την κατανομή Poisson· βλ. παράγραφο 48).
|
Θεωρείται τότε ότι η υπό δοκιμή χημική ουσία δεν είναι ικανή να επάγει μεταλλάξεις σε αυτό το σύστημα δοκιμής.
|
Για αμφότερες τις δοκιμές MLA και TK6:
|
67.
|
Εάν η μέγιστη συγκέντρωση βασίζεται στην κυτταροτοξικότητα, θα πρέπει να επιδιώκεται η επίτευξη ανώτατης συγκέντρωσης μεταξύ 20 και 10 % RTG/RS. Είναι κοινά αποδεκτό ότι τα θετικά αποτελέσματα που βρίσκονται μόνο μεταξύ 20 και 10 % RTG/RS θα πρέπει να ερμηνεύονται με προσοχή, καθώς και ότι ένα αποτέλεσμα δεν θα θεωρείται θετικό σε περίπτωση που παρατηρήθηκε αύξηση της MF μόνο στο 10 % ή σε μικρότερο ποσοστό RTG/RS (εφόσον αξιολογήθηκε) (2)(59).
|
|
68.
|
Υπάρχουν ορισμένες καταστάσεις στις οποίες η συλλογή πρόσθετων πληροφοριών ενδέχεται να συμβάλει στο να χαρακτηριστεί μια υπό δοκιμή χημική ουσία μη μεταλλαξιγόνος, όταν δεν υπάρχει καλλιέργεια που να παρουσιάζει τιμή RTG μεταξύ 10-20 % RTG/RS. Οι καταστάσεις αυτές περιγράφονται συνοπτικά ακολούθως: 1) δεν υπάρχουν ενδείξεις μεταλλαξιγένεσης (π.χ. δεν υπάρχει απόκριση δόσης, ούτε συχνότητες προϊόντων μετάλλαξης που να υπερβαίνουν εκείνες που παρατηρούνται στον παράλληλο αρνητικό μάρτυρα ή στα ιστορικά εύρη υποβάθρου κ.λπ.) σε σειρά σημείων δεδομένων εντός της κλίμακας 100 % έως 20 % RTG/RS, και υπάρχει τουλάχιστον ένα σημείο δεδομένων εντός της κλίμακας 20 και 25 % RTG/RS, 2) δεν υπάρχουν ενδείξεις μεταλλαξιγένεσης (π.χ. δεν υπάρχει απόκριση δόσης, ούτε συχνότητες προϊόντων μετάλλαξης που να υπερβαίνουν όσες παρατηρούνται στον παράλληλο αρνητικό μάρτυρα ή στα ιστορικά εύρη υποβάθρου κ.λπ.) σε σειρά σημείων δεδομένων εντός της κλίμακας 100 % έως 25 % RTG/RS, και υπάρχει επίσης ένα αρνητικό σημείο δεδομένων ελαφρώς κάτω του 10 % RTG/RS. Και στις δύο αυτές καταστάσεις, η υπό δοκιμή χημική ουσία μπορεί να θεωρηθεί οριστικά αρνητική.
|
|
69.
|
Δεν απαιτείται επαλήθευση των σαφώς θετικών ή αρνητικών αποκρίσεων.
|
|
70.
|
Όταν η απόκριση δεν είναι ούτε σαφώς αρνητική ούτε σαφώς θετική, όπως περιγράφεται ανωτέρω, και/ή για να διαπιστωθεί η βιολογική σημασία ενός αποτελέσματος, τα δεδομένα θα πρέπει να αξιολογούνται με βάση την κρίση των ειδικών και/ή περαιτέρω διερεύνηση. Η επανάληψη του πειράματος, ενδεχομένως με χρήση διαφορετικών πειραματικών συνθηκών [π.χ. διαστήματα μεταξύ των συγκεντρώσεων για την αύξηση της πιθανότητας επίτευξης σημείων δεδομένων εντός της κλίμακας 10-20 % RTG/RS, χρήση άλλων συνθηκών μεταβολικής ενεργοποίησης (δηλ. συγκέντρωση S9 ή προέλευση S9) και διάρκεια αγωγής] μπορεί να είναι χρήσιμη.
|
|
71.
|
Σε σπάνιες περιπτώσεις, ακόμη και μετά από περαιτέρω διερεύνηση, το σύνολο δεδομένων δεν επιτρέπει να συναχθούν θετικά ή αρνητικά αποτελέσματα. Κατά συνέπεια, η απόκριση της υπό δοκιμή χημικής ουσίας θα πρέπει να κρίνεται αμφίβολη (να ερμηνεύεται ως εξίσου δυνάμενη να είναι είτε θετική είτε αρνητική).
|
ΕΚΘΕΣΗ ΔΟΚΙΜΗΣ
|
72.
|
Η έκθεση δοκιμής θα πρέπει να περιλαμβάνει τα ακόλουθα στοιχεία:
|
|
Υπό δοκιμή χημική ουσία:
|
—
|
πηγή, αριθμός παρτίδας, καταληκτική ημερομηνία χρήσης, εφόσον υπάρχει,
|
|
—
|
σταθερότητα της υπό δοκιμή χημικής ουσίας, εάν είναι γνωστή,
|
|
—
|
διαλυτότητα και σταθερότητα της υπό δοκιμή χημικής ουσίας στον διαλύτη, εάν είναι γνωστές,
|
|
—
|
μέτρηση του pH, της ωσμωμοριακότητας και του ιζήματος του θρεπτικού μέσου καλλιέργειας στο οποίο προστέθηκε η υπό δοκιμή χημική ουσία, κατά περίπτωση.
|
|
|
Μονοσυστατική ουσία:
|
—
|
φυσική εμφάνιση, υδατοδιαλυτότητα και πρόσθετες σχετικές φυσικοχημικές ιδιότητες,
|
|
—
|
ταυτοποίηση της χημικής ουσίας, όπως ονομασία IUPAC ή CAS, αριθμός CAS, κωδικός SMILES ή InChI, συντακτικός τύπος, καθαρότητα, χημική ταυτότητα προσμίξεων, κατά περίπτωση και στο μέτρο του δυνατού, κ.λπ.,
|
|
|
|
Πολυσυστατική ουσία, UVCB και μείγματα:
|
—
|
περιγράφονται, στο μέτρο του δυνατού, με τη χημική ταυτότητα των συστατικών (βλ. ανωτέρω), την ποσότητα στην οποία απαντούν και τις σχετικές φυσικοχημικές τους ιδιότητες.
|
|
|
|
|
Διαλύτης:
|
—
|
αιτιολόγηση της επιλογής του διαλύτη,
|
|
—
|
εκατοστιαία αναλογία του διαλύτη στο τελικό θρεπτικό μέσο καλλιέργειας.
|
|
|
|
Κύτταρα:
|
|
Για κύριες εργαστηριακές καλλιέργειες:
|
—
|
τύπος και προέλευση των κυττάρων, και ιστορικό στο εργαστήριο δοκιμών,
|
|
—
|
χαρακτηριστικά καρυότυπου και/ή χαρακτηριστικός αριθμός χρωμοσωμάτων,
|
|
—
|
μέθοδοι διατήρησης των κυτταροκαλλιεργειών,
|
|
—
|
χρόνοι διπλασιασμού των κυττάρων.
|
|
|
|
|
Συνθήκες δοκιμής:
|
—
|
αιτιολόγηση της επιλογής των συγκεντρώσεων και του αριθμού των κυτταρικών καλλιεργειών, περιλαμβανομένων π.χ. των δεδομένων κυτταροτοξικότητας και των περιορισμών διαλυτότητας,
|
|
—
|
σύνθεση των θρεπτικών μέσων, συγκέντρωση CO2, επίπεδο υγρασίας,
|
|
—
|
συγκέντρωση της υπό δοκιμή χημικής ουσίας, εκφραζόμενη ως τελική συγκέντρωση στο θρεπτικό μέσο καλλιέργειας (π.χ. μg ή mg/mL ή mΜ θρεπτικού μέσου καλλιέργειας),
|
|
—
|
συγκέντρωση (και/ή όγκος) του διαλύτη και της υπό δοκιμή χημικής ουσίας που προστέθηκαν στο θρεπτικό μέσο καλλιέργειας,
|
|
—
|
πυκνότητα των κυττάρων κατά την αγωγή,
|
|
—
|
τύπος και σύσταση του συστήματος μεταβολικής ενεργοποίησης (προέλευση του S9, μέθοδος παρασκευής του μείγματος S9, συγκέντρωση ή όγκος του μείγματος S9 και του S9 στο τελικό θρεπτικό μέσο καλλιέργειας, ποιοτικοί έλεγχοι του S9),
|
|
—
|
χημικές ουσίες που χρησιμοποιήθηκαν ως θετικοί και αρνητικοί μάρτυρες, τελικές συγκεντρώσεις για κάθε συνθήκη αγωγής,
|
|
—
|
διάρκεια της περιόδου έκφρασης (συμπεριλαμβανομένου του αριθμού των ανακαλλιεργηθέντων κυττάρων και των χρονοδιαγραμμάτων ανακαλλιέργειας και τροφοδοσίας, κατά περίπτωση),
|
|
—
|
ταυτότητα του παράγοντα επιλογής και συγκέντρωσή του,
|
|
—
|
για την MLA, θα πρέπει να αναφέρεται η χρησιμοποιηθείσα έκδοση (άγαρ ή μικροτιτλοδότηση),
|
|
—
|
κριτήρια αποδοχής των δοκιμών,
|
|
—
|
μέθοδοι που χρησιμοποιήθηκαν για την καταγραφή του αριθμού των βιώσιμων και των μεταλλαγμένων κυττάρων,
|
|
—
|
μέθοδοι μέτρησης της κυτταροτοξικότητας,
|
|
—
|
τυχόν συμπληρωματικές πληροφορίες που αφορούν την κυτταροτοξικότητα και τη μέθοδο που χρησιμοποιήθηκε,
|
|
—
|
διάρκεια των χρόνων επώασης μετά την επίστρωση,
|
|
—
|
ορισμός των αποικιών σχετικά με το μέγεθος και τον τύπο τους (συμπεριλαμβανομένων των κριτηρίων κατάταξης σε «μικρές» και «μεγάλες» αποικίες, όπου απαιτείται),
|
|
—
|
κριτήρια χαρακτηρισμού των μελετών ως θετικών, αρνητικών ή αμφίβολων,
|
|
—
|
μέθοδοι που χρησιμοποιούνται για τον προσδιορισμό του pH, της ωσμωμοριακότητας, εφόσον προσδιορίζεται, και της καθίζησης, εάν χρειάζεται.
|
|
|
|
Αποτελέσματα:
|
—
|
αριθμός κυττάρων που υποβλήθηκαν σε αγωγή και αριθμός κυττάρων ανακαλλιέργειας για κάθε καλλιέργεια,
|
|
—
|
παράμετροι τοξικότητας (RTG για την MLA και RS για την TK6),
|
|
—
|
σημεία καθίζησης και χρόνος προσδιορισμού,
|
|
—
|
αριθμός κυττάρων που επιστρώθηκαν σε επιλεκτικό και μη επιλεκτικό μέσο,
|
|
—
|
αριθμός αποικιών σε μη επιλεκτικό μέσο και αριθμός ανθεκτικών αποικιών σε επιλεκτικό μέσο, και αντίστοιχες συχνότητες προϊόντων μετάλλαξης,
|
|
—
|
μέγεθος αποικιών για τους αρνητικούς και τους θετικούς μάρτυρες και, εάν η υπό δοκιμή χημική ουσία είναι θετική, τουλάχιστον μία συγκέντρωση, και σχετικές συχνότητες προϊόντων μετάλλαξης,
|
|
—
|
σχέση συγκέντρωσης-απόκρισης, όπου είναι δυνατόν,
|
|
—
|
δεδομένα για παράλληλους αρνητικούς μάρτυρες (με διαλύτη) και θετικούς μάρτυρες (συγκεντρώσεις και διαλύτες),
|
|
—
|
δεδομένα για τους ιστορικούς αρνητικούς (με διαλύτη) και θετικούς μάρτυρες (συγκεντρώσεις και διαλύτες), με εύρη τιμών, μέσες τιμές και τυπικές αποκλίσεις· αριθμός δοκιμών στις οποίες βασίζονται οι ιστορικοί μάρτυρες,
|
|
—
|
στατιστικές αναλύσεις (για μεμονωμένες καλλιέργειες και συγκεντρωτικές πανομοιότυπες καλλιέργειες, ανάλογα με την περίπτωση), και τιμές p, εάν υπάρχουν· και για την MLA, η αξιολόγηση GEF.
|
|
|
|
Εξέταση των αποτελεσμάτων
|
|
ΒΙΒΛΙΟΓΡΑΦΙΑ
|
(1)
|
Moore, M.M., Honma, M. Clements, J. (Rapporteur), Awogi, T., Bolcsfoldi, G., Cole, J., Gollapudi, B., Harrington-Brock, K., Mitchell, A., Muster, W., Myhr, B., O'Donovan, M., Ouldelhkim, M-C., San, R., Shimada, H. and Stankowski, L.F. Jr. (2000). Mouse Lymphoma Thymidine Kinase Locus (TK) Gene Mutation Assay: International Workshop on Genotoxicity Test Procedures (IWGTP) Workgroup Report, Environ. Mol. Mutagen., 35 (3): 185-190.
|
|
(2)
|
Moore, M.M., Honma, M., Clements, J., Harrington-Brock, K., Awogi, T., Bolcsfoldi, G., Cifone, M., Collard, D., Fellows, M., Flanders, K., Gollapudi, B., Jenkinson, P., Kirby, P., Kirchner, S., Kraycer, J., McEnaney, S., Muster, W., Myhr, B., O’Donovan, M., Oliver, Ouldelhkim, M-C., Pant, K., Preston, R., Riach, C., San, R., Shimada, H. and Stankowski, L.F. Jr. (2002). Mouse Lymphoma Thymidine Kinase Locus Gene Mutation Assay: Follow-Up International Workshop on Genotoxicity Test Procedures, New Orleans, Louisiana, (April 2000), Environ. Mol. Mutagen., 40 (4): 292-299.
|
|
(3)
|
Moore, M.M., Honma, M., Clements, J., Bolcsfoldi, G., Cifone, M., Delongchamp, R., Fellows, M., Gollapudi, B., Jenkinson, P., Kirby, P., Kirchner, S., Muster, W., Myhr, B., O’Donovan, M., Ouldelhkim, M-C., Pant, K., Preston, R., Riach, C., San, R., Stankowski, L.F. Jr., Thakur, A., Wakuri, S. and Yoshimura, I. (2003). Mouse Lymphoma Thymidine Kinase Locus Gene Mutation Assay: International Workshop (Plymouth, UK) on Genotoxicity Test Procedures Workgroup Report, Mutation Res., 540: 127-140.
|
|
(4)
|
Moore, M.M., Honma, M., Clements, J., Bolcsfoldi, G., Burlinson, B., Cifone, M., Clarke, J., Delongchamp, R., Durward, R., Fellows, M., Gollapudi, B., Hou, S., Jenkinson, P., Lloyd, M., Majeska, J., Myhr, B., O’Donovan, M., Omori, T., Riach, C., San, R., Stankowski, L.F. Jr., Thakur, A.K., Van Goethem, F., Wakuri, S. and Yoshimura, I. (2006). Mouse Lymphoma Thymidine Kinase Gene Mutation Assay: Follow-Up Meeting of the International Workshop on Genotoxicity Tests – Aberdeen, Scotland, 2003 – Assay Acceptance Criteria, Positive Controls, and Data Evaluation, Environ. Mol. Mutagen., 47 (1): 1-5.
|
|
(5)
|
Moore, M.M., Honma, M., Clements, J., Bolcsfoldi, G., Burlinson, B., Cifone, M., Clarke, J., Clay, P., Doppalapudi, R., Fellows, M., Gollapudi, B., Hou, S., Jenkinson, P., Muster, W., Pant, K., Kidd, D.A., Lorge, E., Lloyd, M., Myhr, B., O’Donovan, M., Riach, C., Stankowski, L.F. Jr., Thakur A.K. and Van Goethem, F. (2007). Mouse Lymphoma Thymidine Kinase Mutation Assay: Meeting of the International Workshop on Genotoxicity Testing, San Francisco, 2005, Recommendations for 24-h Treatment, Mutation. Res., 627 (1): 36-40.
|
|
(6)
|
OECD (2016). Overview of the set of OECD Genetic Toxicology Test Guidelines and updates performed in 2014-2015. ENV Publications. Series on Testing and Assessment, No 234, OECD, Paris.
|
|
(7)
|
Fellows M.D., Luker, T., Cooper, A. and O'Donovan, M.R. (2012). Unusual Structure-Genotoxicity Relationship in Mouse Lymphoma Cells Observed with a Series of Kinase Inhibitors. Mutation, Res., 746 (1): 21-28.
|
|
(8)
|
Honma, M., Momose, M., Sakamoto, H., Sofuni, T. and Hayashi, M. (2001). Spindol Poisons Induce Allelic Loss in Mouse Lymphoma Cells Through Mitotic Non-Disjunction. Mutation Res., 493 (1-2): 101-114.
|
|
(9)
|
Wang, J., Sawyer, J.R., Chen, L., Chen, T., Honma, M., Mei, N. and Moore, M.M. (2009). The Mouse Lymphoma Assay Detects Recombination, Deletion, and Aneuploidy, Toxicol. Sci.., 109 (1): 96-105.
|
|
(10)
|
Applegate, M.L., Moore, M.M., Broder, C.B., Burrell, A., and Hozier, J.C. (1990). Molecular Dissection of Mutations at the Heterozygous Thymidine Kinase Locus in Mouse Lymphoma Cells. Proc. National. Academy. Sci. USA, 87 (1): 51-55.
|
|
(11)
|
Hozier, J., Sawyer, J., Moore, M., Howard, B. and Clive, D. (1981). Cytogenetic Analysis of the L5178Y/TK+/- Leads to TK-/- Mouse Lymphoma Mutagenesis Assay System, Mutation Res., 84 (1): 169-181.
|
|
(12)
|
Hozier, J., Sawyer, J., Clive, D. and Moore, M.M. (1985). Chromosome 11 Aberrations in Small Colony L5178Y TK-/- Mutants Early in their Clonal History, Mutation Res., 147 (5): 237-242.
|
|
(13)
|
Moore, M.M., Clive, D., Hozier, J.C., Howard, B.E., Batson, A.G., Turner, N.T. and Sawyer, J. (1985). Analysis of Trifluorothymidine-Resistant (TFTr) Mutants of L5178Y/TK+/- Mouse Lymphoma Cells. Mutation Res., 151 (1): 161-174.
|
|
(14)
|
Liber H.L., Call K.M. and Little J.B. (1987). Molecular and Biochemical Analyses of Spontaneous and X-Ray-Induced Mutants in Human Lymphoblastoid Cells. Mutation Res., 178 (1): 143-153.
|
|
(15)
|
Li C.Y., Yandell D.W. and Little J.B. (1992). Molecular Mechanisms of Spontaneous and Induced Loss of Heterozygosity in Human Cells In Vitro. Somat. Cell Mol. Genet., 18 (1): 77-87.
|
|
(16)
|
Honma M., Hayashi M. and Sofuni T. (1997). Cytotoxic and Mutagenic Responses to X-Rays and Chemical Mutagens in Normal and P53-Mutated Human Lymphoblastoid Cells. Mutation. Res., 374 (1): 89-98.
|
|
(17)
|
Honma, M., Momose, M., Tanabe, H., Sakamoto, H., Yu, Y., Little, J.B., Sofuni, T. and Hayashi, M. (2000). Requirement of Wild-Type P53 Protein for Maintenance of Chromosomal Integrity. Mol. Carcinogen., 28 (4): 203-14.
|
|
(18)
|
Amundson S.A. and Liber H.L. (1992). A Comparison of Induced Mutation at Homologous Alleles of the TK Locus in Human Cells. II. Molecular Analysis of Mutants. Mutation Res., 267 (1): 89-95.
|
|
(19)
|
Schisler M.R., Moore M.M. and Gollapudi B.B. (2013). In Vitro Mouse Lymphoma (L5178Y TK+/- -3.7.2C) Forward Mutation Assay. In Protocols in Genotoxicity Assessment A. Dhawan and M. Bajpayee (Eds.), Springer Protocols, Humana Press: 27-50.
|
|
(20)
|
Long, L.H., Kirkland, D., Whitwell, J. and Halliwell, B. (2007). Different Cytotoxic and Clastogenic Effects of Epigallocatechin Gallate in Various Cell-Culture Media Due to Variable Rates of its Oxidation in the Culture Medium, Mutation Res., 634 (1-2): 177-183.
|
|
(21)
|
Nesslany, F., Simar-Meintieres, S., Watzinger, M., Talahari, I. and Marzin, D. (2008). Characterization of the Genotoxicity of Nitrilotriacetic Acid. Environ. Mol. Mutagen., 49 (6): 439-452.
|
|
(22)
|
Brusick D. (1986). Genotoxic Effects in Cultured Mammalian Cells Produced by Low pH Treatment Conditions and Increased Ion Concentrations. Environ. Mutagen., 8 (6): 879-886.
|
|
(23)
|
Morita, T., Nagaki, T., Fukuda, I. and Okumura, K. (1992). Clastogenicity of Low pH to Various Cultured Mammalian Cells. Mutation Res., 268 (2): 297-305.
|
|
(24)
|
Scott, D., Galloway, S.M., Marshall, R.R., Ishidate, M.Jr, Brusick, D., Ashby, J. and Myhr, B.C. (1991). Genotoxicity under Extreme Culture Conditions. A report from ICPEMC Task Group 9. Mutation Res., 257: 147-204.
|
|
(25)
|
Wang J., Heflich R.H. and Moore M.M. (2007). A Method to Distinguish Between the De Novo Induction of Thymidine Kinase Mutants and the Selection of Pre-Existing Thymidine Kinase Mutants in the Mouse Lymphoma Assay. Mutation Res., 626 (1-2): 185-190.
|
|
(26)
|
Fischer, G.A. (1958). Studies on the Culture of Leukemic Cells In Vitro. Ann. N.Y. Academy Sci., 76: 673-680.
|
|
(27)
|
Clive, D., Johnson, K.O., Spector, J.F.S., Batson, A.G. and Brown, M.M.M. (1979). Validation and Characterization of the L5178Y/TK+/– Mouse Lymphoma Mutagen Assay System. Mutation Res., 59(1): 61-108.
|
|
(28)
|
Sawyer, J., Moore, M.M., Clive, D. and Hozier, J. (1985). Cytogenetic Characterization of the L5178Y TK+/- 3.7.2C Mouse Lymphoma Cell Line, Mutation Res., 147 (5): 243-253.
|
|
(29)
|
Sawyer J.R., Moore M.M. and Hozier J.C. (1989). High-Resolution Cytogenetic Characterization of the L5178Y TK+/- Mouse Lymphoma Cell Line, Mutation Res., 214 (2): 181-193.
|
|
(30)
|
Sawyer, J.R., Binz, R.L., Wang, J. and Moore, M.M. (2006). Multicolor Spectral Karyotyping of the L5178Y TK+/--3.7.2C Mouse Lymphoma Cell Line, Environ. Mol. Mutagen., 47 (2): 127-131.
|
|
(31)
|
Fellows, M.D., McDermott, A., Clare, K.R., Doherty, A. and Aardema, M.J. (2014). The Spectral Karyotype of L5178Y TK+/- Mouse Lymphoma Cells Clone 3.7.2C and Factors Affecting Mutant Frequency at the Thymidine Kinase (TK) Locus in the Microtitre Mouse Lymphoma Assay, Environ. Mol. Mutagen., 55 (1): 35-42.
|
|
(32)
|
Storer, R.D., Jraynak, A.R., McKelvey, T.W., Elia, M.C., Goodrow, T.L. and DeLuca, J.G. (1997). The Mouse Lymphoma L5178Y TK+/- Cell Line is Heterozygous for a Codon 170 Mutation in the P53 Tumor Suppressor Gene. Mutation. Res., 373 (2): 157-165.
|
|
(33)
|
Clark L.S., Harrington-Brock, K., Wang, J., Sargent, L., Lowry, D., Reynolds, S.H. and Moore, M.M. (2004). Loss of P53 Heterozygosity is not Responsible for the Small Colony Thymidine Kinase Mutant Phenotype in L5178Y Mouse Lymphoma Cells. Mutagen., 19 (4): 263-268.
|
|
(34)
|
Skopek T.R., Liber, H.L., Penman, B.W. and Thilly, W.G. (1978). Isolation of a Human Lymphoblastoid Line Heterozygous at the Thymidine Kinase Locus: Possibility for a Rapid Human Cell Mutation Assay. Biochem. Biophys. Res. Commun., 84 (2): 411-416.
|
|
(35)
|
Honma M. (2005). Generation of Loss of Heterozygosity and its Dependency on P53 Status in Human Lymphoblastoid Cells. Environ. Mol. Mutagen., 45 (2-3): 162-176.
|
|
(36)
|
Xia, F., Wang, X., Wang, Y.H., Tsang, N.M., Yandell, D.W., Kelsey, K.T. and Liber, H.L. (1995). Altered P53 Status Correlates with Differences in Sensitivity to Radiation-Induced Mutation and Apoptosis in Two Closely Related Human Lymphoblast Lines. Cancer. Res., 55 (1): 12-15.
|
|
(37)
|
Lorge, E., M. Moore, J. Clements, M. O Donovan, M. Honma, A. Kohara, J. van Benthem, S. Galloway, M.J. Armstrong, V. Thybaud, B. Gollapudi, M. Aardema, J. Kim, A. Sutter, D.J. Kirkland (2015). Standardized Cell Sources and Recommendations for Good Cell Culture Practices in Genotoxicity Testing. (Χειρόγραφο υπό επεξεργασία).
|
|
(38)
|
Lloyd M. and Kidd D. (2012). The Mouse Lymphoma Assay. Springer Protocols: Methods in Molecular Biology 817, Genetic Toxicology Principles and Methods, ed. Parry and Parry, Humana Press. ISBN, 978-1-61779-420-9, 35-54.
|
|
(39)
|
Mei N., Guo X. and Moore M.M. (2014). Methods for Using the Mouse Lymphoma Assay to Screen for Chemical Mutagenicity and Photo-Mutagenicity. Στο: Optimization in Drug Discover: In Vitro Methods: Yan Z and Caldwell(Eds) , 2nd Edition, GW· Humana Press, Totowa, NJ.
|
|
(40)
|
Liber H.L. and Thilly W.G. (1982). Mutation Assay at the Thymidine Kinase Locus in Diploidhuman Lymphoblasts. Mutation Res., 94 (2): 467-485.
|
|
(41)
|
Coecke, S., Balls, M., Bowe, G., Davis, J., Gstraunthaler, G., Hartung, T., Hay, R., Merten, OW., Price, A., Schechtman, L., Stacey, G. and Stokes, W. (2005). Guidance on Good Cell Culture Practice. A Report of the Second ECVAM Task Force on Good Cell Culture Practice. ATLA, 33 (3): 261-287.
|
|
(42)
|
Moore M.M. and Howard B.E. (1982). Quantitation of Small Colony Trifluorothymidine-Resistant Mutants of L5178Y/TK+/- Mouse Lymphoma Cells in RPMI-1640 Medium, Mutation Res., 104 (4-5): 287-294.
|
|
(43)
|
Ames B.N., McCann J. and Yamasaki E. (1975). Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian Microsome Mutagenicity Test. Mutation Res., 31 (6): 347-364.
|
|
(44)
|
Maron D.M. and Ames B.N. (1983). Revised Methods for the Salmonella Mutagenicity Test. Mutation Res., 113 (3-4): 173-215.
|
|
(45)
|
Natarajan, A.T., Tates, A.D, Van Buul, P.P.W., Meijers, M. and De Vogel, N. (1976). Cytogenetic Effects of Mutagens/Carcinogens After Activation in a Microsomal System In Vitro, I. Induction of Chromosomal Aberrations and Sister Chromatid Exchanges by Diethylnitrosamine (DEN) and Dimethylnitrosamine (DMN) in CHO Cells in the Presence of Rat-Liver Microsomes. Mutation Res., 37 (1): 83-90.
|
|
(46)
|
Matsuoka A., Hayashi M. and Ishidate M. Jr. (1979). Chromosomal Aberration Tests on 29 Chemicals Combined with S9 Mix In Vitro. Mutation Res., 66 (3): 277-290.
|
|
(47)
|
Ong T.M., et al. (1980). Differential Effects of Cytochrome P450-Inducers on Promutagen Activation Capabilities and Enzymatic Activities of S-9 from Rat Liver, J. Environ. Pathol. Toxicol., 4 (1): 55-65
|
|
(48)
|
Elliott, B.M., Combes, R.D., Elcombe, C.R., Gatehouse, D.G., Gibson, G.G., Mackay, J.M. and Wolf, R.C. (1992). Report of UK Environmental Mutagen Society Working Party. Alternatives to Aroclor 1254-Induced S9 in In Vitro Genotoxicity Assays. Mutagen., 7 (3): 175-177.
|
|
(49)
|
Matsushima, T., Sawamura, M., Hara, K. and Sugimura, T. (1976). A Safe Substitute for Polychlorinated Biphenyls as an Inducer of Metabolic Activation Systems. Στο: In Vitro Metabolic Activation in Mutagenesis Testing. de Serres F.J., et al. (Eds, Elsevier, North-Holland, pp. 85-88.
|
|
(50)
|
Galloway S.M., et al. (1994). Report from Working Group on In Vitro Tests for Chromosomal Aberrations. Mutation Res., 312 (3): 241-261.
|
|
(51)
|
Johnson T.E., Umbenhauer D.R. and Galloway S.M. (1996). Human Liver S-9 Metabolic Activation: Proficiency in Cytogenetic Assays and Comparison with Phenobarbital/Beta-Naphthoflavone or Aroclor 1254 Induced Rat S-9, Environ. Mol. Mutagen., 28 (1): 51-59.
|
|
(52)
|
UNEP (2001). Σύμβαση της Στοκχόλμης για τους έμμονους οργανικούς ρύπους, Πρόγραμμα των Ηνωμένων Εθνών για το Περιβάλλον (UNEP).
|
|
(53)
|
Krahn D.F., Barsky F.C. and McCooey K.T. (1982). CHO/HGPRT Mutation Assay: Evaluation of Gases and Volatile Liquids. Στο: Genotoxic Effects of Airborne Agents Tice R.R., Costa D.L.and Schaich K.M. (Eds.). New York, Plenum, pp. 91-103.
|
|
(54)
|
Zamora, P.O., Benson, J.M., Li, A.P. and Brooks, A.L. (1983). Evaluation of an Exposure System Using Cells Grown on Collagen Gels for Detecting Highly Volatile Mutagens in the CHO/HGPRT Mutation Assay. Environ. Mutagen., 5 (6): 795-801.
|
|
(55)
|
Asakura M., Sasaki T., Sugiyama T., Arito H., Fukushima, S. and Matsushima, T. (2008). An Improved System for Exposure of Cultured Mammalian Cells to Gaseous Compounds in the Chromosomal Aberration Assay. Mutation Res., 652 (2): 122-130.
|
|
(56)
|
Arlett C.F., et al. (1989). Mammalian Cell Gene Mutation Assays Based upon Colony Formation. Στο: Statistical Evaluation of Mutagenicity Test Data, Kirkland, D.J. (Ed.), CambridgeUniversity Press, pp. 66-101.
|
|
(57)
|
Morita T., Honma M. and Morikawa K. (2012). Effect of Reducing the Top Concentration Used in the In Vitro Chromosomal Aberration Test in CHL Cells on the Evaluation of Industrial Chemical Genotoxicity. Mutation Res., 741 (1-2): 32-56.
|
|
(58)
|
Brookmire L., Chen J.J. and Levy D.D. (2013). Evaluation of the Highest Concentrations Used in the In Vitro Chromosome Aberrations Assay. Environ. Mol. Mutagen., 54 (1): 36-43.
|
|
(59)
|
USFDA (2012). International Conference on Harmonisation (ICH) Guidance S2 (R1) on Genotoxicity Testing and Data Interpretation for Pharmaceuticals Intended For Human Use. Διατίθεται στον δικτυακό τόπο: [https://www.federalregister.gov/a/2012-13774].
|
|
(60)
|
Honma M. and Hayashi M. (2011). Comparison of In Vitro Micronucleus and Gene Mutation Assay Results for P53-Competent Versus P53-Deficient Human Lymphoblastoid Cells. Environ. Mol. Mutagen., 52 (5): 373-384.
|
|
(61)
|
Moore-Brown, M.M., Clive, D., Howard, B.E., Batson, A.G. and Johnson, K.O. (1981). The Utilization of Trifluorothymidine (TFT) to Select for Thymidine Kinase-Deficient (TK-/-) Mutants from L5178Y/TK+/- Mouse Lymphoma Cells, Mutation Res., 85 (5): 363-378.
|
|
(62)
|
Liber H.L., Yandell D.W. and Little J.B. (1989). A Comparison of Mutation Induction at the TK and HRPT Loci in Human Lymphoblastoid Cells; Quantitative Differences are Due to an Additional Class of Mutations at the Autosomal TK locus. Mutation Res., 216 (1): 9-17.
|
|
(63)
|
Furth E.E., Thilly, W.G., Penman, B.W., Liber, H.L. and Rand, W.M. (1981). Quantitative Assay for Mutation in Diploid Human Lymphoblasts Using Microtiter Plates. Anal. Biochem., 110 (1): 1-8.
|
|
(64)
|
Hayashi, M, Dearfield, K., Kasper, P., Lovell, D., Martus, H. J. and Thybaud, V. (2011). Compilation and Use of Genetic Toxicity Historical Control Data, Mutation Res., 723 (2): 87-90.
|
|
(65)
|
Ryan T.P. (2000). Statistical Methods for Quality Improvement. John Wiley and Sons, New York 2nd Edition.
|
|
(66)
|
OECD (2014). Statistical analysis supporting the revision of the genotoxicity Test Guidelines. Environmental, Health and Safety Publications, Series on Testing and Assessment (No 199.), Organisation for Economic Cooperation and Development, Paris.
|
|
(67)
|
Fleiss J.L., Levin B. and Paik M.C. (2003). Statistical Methods for Rates and Proportions, Third Edition, New York: John Wiley & Sons.
|
Προσάρτημα 1
ΟΡΙΣΜΟΙ
Ανευπλοειδογόνος ουσία
: κάθε χημική ουσία ή διεργασία που προκαλεί ανευπλοειδία σε κύτταρα ή οργανισμούς, μέσω της αντίδρασής της με τα συστατικά του κυτταρικού κύκλου μιτωτικής και μειωτικής διαίρεσης.
Ανευπλοειδία
: κάθε απόκλιση από τον φυσιολογικό διπλοειδή (ή απλοειδή) αριθμό χρωμοσωμάτων κατά ένα ή περισσότερα χρωμοσώματα, όχι όμως κατά πλήρεις σειρές χρωμοσωμάτων (πολυπλοειδία).
Μεταλλαξιγόνα υποκατάστασης ζευγών βάσεων
: χημικές ουσίες που προκαλούν υποκατάσταση ζευγών βάσεων στο DNA.
Χημικό προϊόν
: μια ουσία ή ένα μείγμα.
Απόδοση κλωνοποίησης
: το ποσοστό των κυττάρων που επιστρώνονται σε χαμηλή πυκνότητα και μπορούν να αναπτυχθούν σε καταμετρήσιμη αποικία.
Κλαστογόνο
: κάθε χημική ουσία ή διεργασία που προκαλεί δομικές χρωμοσωμικές εκτροπές σε πληθυσμούς κυττάρων ή οργανισμούς.
Κυτταροτοξικότητα
: για τις δοκιμασίες που καλύπτονται στην παρούσα μέθοδο δοκιμών, η κυτταροτοξικότητα ορίζεται ως μείωση της σχετικής συνολικής ανάπτυξης (RTG) ή της σχετικής επιβίωσης (RS) για τις δοκιμές MLA και TK6 αντίστοιχα.
Εξελικτική μετάλλαξη
: γονιδιακή μετάλλαξη από τον γονικό τύπο προς το προϊόν μετάλλαξης, που προκαλεί τροποποίηση ή απώλεια της ενζυμικής δραστηριότητας ή της λειτουργίας της κωδικοποιούμενης πρωτεΐνης.
Μεταλλαξιγόνα μετατόπισης αναγνωστικού πλαισίου
: χημικές ουσίες που προκαλούν προσθήκη ή απάλειψη ενός ή πολλών ζευγών βάσεων στο μόριο DNA.
Γονιδιοτοξικός
: γενικός όρος που καλύπτει όλα τα είδη βλαβών του DNA ή των χρωμοσωμάτων, μεταξύ των οποίων τις ρήξεις, τις προσθήκες, τις αναδιατάξεις, τις μεταλλάξεις, τις χρωμοσωμικές εκτροπές και την ανευπλοειδία. Δεν προκαλούν όλα τα είδη γονιδιοτοξικών επιδράσεων μεταλλάξεις ή μόνιμη χρωμοσωμική βλάβη.
Μιτωτικός ανασυνδυασμός
: στη διάρκεια της μίτωσης, ο ανασυνδυασμός μεταξύ ομόλογων χρωματίδων που μπορεί να οδηγήσει σε επαγωγή δίκλωνων ρήξεων του DNA ή απώλεια ετεροζυγωτικότητας.
Μεταλλαξιγόνο
: παράγοντας που προκαλεί κληρονομήσιμη μεταβολή μίας ή περισσότερων αλληλουχιών ζευγών βάσεων του DNA σε γονίδια ή της δομής των χρωμοσωμάτων (χρωμοσωμικές εκτροπές).
Συχνότητα προϊόντων μετάλλαξης (mutant frequency, MF)
: ο αριθμός των παρατηρουμένων μεταλλαγμένων κυττάρων διά του αριθμού βιώσιμων κυττάρων.
Χρόνος φαινοτυπικής έκφρασης
: περίοδος μετά την αγωγή κατά την οποία η γενετική αλλοίωση εγκαθίσταται στο γονιδίωμα και τυχόν προϋπάρχοντα γονιδιακά προϊόντα μειώνονται σε βαθμό τέτοιο ώστε να αλλοιώνεται το φαινοτυπικό χαρακτηριστικό.
Σχετική επιβίωση (relative survival, RS)
: η RS χρησιμοποιείται ως το μέτρο της σχετιζόμενης με την αγωγή κυτταροτοξικότητας στην TK6. Είναι η σχετική απόδοση κλωνοποίησης (CE) των κυττάρων που επιστρώνονται αμέσως μετά την αγωγή, διορθωμένη ως προς τυχόν απώλεια κυττάρων κατά την αγωγή, σε σύγκριση με την απόδοση κλωνοποίησης του αρνητικού μάρτυρα.
Σχετική ανάπτυξη εναιωρήματος (relative suspension growth, RSG)
: στην MLA, η σχετική συνολική ανάπτυξη εναιωρήματος δύο ημερών της καλλιέργειας δοκιμής σε σύγκριση με τη συνολική ανάπτυξη εναιωρήματος δύο ημερών του αρνητικού μάρτυρα/μάρτυρα με διαλύτη (Clive and Spector, 1975). Η RSG θα πρέπει να περιλαμβάνει τη σχετική ανάπτυξη της καλλιέργειας δοκιμής σε σύγκριση με τον αρνητικό μάρτυρα/μάρτυρα με διαλύτη κατά τη διάρκεια της περιόδου αγωγής.
Σχετική συνολική ανάπτυξη (relative total growth, RTG)
: η RTG χρησιμοποιείται ως το μέτρο της σχετιζόμενης με την αγωγή κυτταροτοξικότητας στην MLA. Αποτελεί μέτρο της σχετικής (ως προς τον μάρτυρα με φορέα) ανάπτυξης των καλλιεργειών δοκιμής κατά τη φάση της αγωγής, της έκφρασης δύο ημερών και της επιλογής προϊόντων μετάλλαξης της δοκιμής. Η RSG κάθε καλλιέργειας δοκιμής πολλαπλασιάζεται με τη σχετική απόδοση κλωνοποίησης της καλλιέργειας δοκιμής κατά τη χρονική στιγμή της επιλογής προϊόντων μετάλλαξης και εκφράζεται σε σχέση με την απόδοση κλωνοποίησης του αρνητικού μάρτυρα/μάρτυρα με διαλύτη (Clive and Spector, 1975).
Ηπατικά κλάσματα S9
: υπερκείμενο υγρό ομογενοποιήματος ήπατος μετά από φυγοκέντρηση σε 9 000 g, δηλ. ανεπεξέργαστο εκχύλισμα ήπατος.
Μείγμα S9
: μείγμα του ηπατικού κλάσματος S9 με συμπαράγοντες αναγκαίους για τη δράση των μεταβολικών ενζύμων.
Ανάπτυξη εναιωρήματος (suspension growth, SG)
: ο συντελεστής αύξησης του αριθμού των κυττάρων στη διάρκεια των φάσεων αγωγής και έκφρασης της MLA. Η SG υπολογίζεται πολλαπλασιάζοντας τον συντελεστή αύξησης την ημέρα 1 επί τον συντελεστή αύξησης την ημέρα 2 για τη βραχυχρόνια αγωγή (3 ή 4 ωρών). Σε περίπτωση που εφαρμόζεται αγωγή 24 ωρών, η SG είναι ο συντελεστής αύξησης στη διάρκεια της αγωγής 24 ωρών επί τους συντελεστές αύξησης τις ημέρες έκφρασης 1 και 2.
Μάρτυρας με διαλύτη
: γενικός όρος για τον προσδιορισμό των καλλιεργειών-μαρτύρων που λαμβάνουν μόνο τον διαλύτη ο οποίος χρησιμοποιείται για τη διάλυση της υπό δοκιμή χημικής ουσίας.
Υπό δοκιμή χημική ουσία
: κάθε ουσία ή μείγμα που υποβάλλεται σε δοκιμή με τη χρήση της παρούσας μεθόδου δοκιμών.
Μάρτυρες που δεν υποβάλλονται σε αγωγή
: καλλιέργειες που δεν υφίστανται καμία αγωγή (δηλ. ούτε με την υπό δοκιμή χημική ουσία ούτε με διαλύτη), αλλά ετοιμάζονται με τον ίδιο τρόπο με τις καλλιέργειες που λαμβάνουν την υπό δοκιμή χημική ουσία.
Προσάρτημα 2
ΤΥΠΟΙ
Κυτταροτοξικότητα
Για αμφότερες τις εκδόσεις (άγαρ και μικροτιτλοδότησης) της MLA
Η κυτταροτοξικότητα ορίζεται ως η σχετική συνολική ανάπτυξη (RTG) που περιλαμβάνει τη σχετική ανάπτυξη εναιωρήματος (RSG) κατά τη διάρκεια της περιόδου έκφρασης διάρκειας δύο ημερών και τη σχετική απόδοση κλωνοποίησης (RCE) που μετράται κατά τη χρονική στιγμή της επιλογής των προϊόντων μετάλλαξης. Οι RTG, RSG και RCE εκφράζονται όλες ως ποσοστά.
Υπολογισμός της RSG: Η ανάπτυξη εναιωρήματος 1 (SG1) είναι ο ρυθμός ανάπτυξης μεταξύ της ημέρας 0 και της ημέρας 1 (συγκέντρωση κυττάρων την ημέρα 1 / συγκέντρωση κυττάρων την ημέρα 0) και η ανάπτυξη εναιωρήματος 2 (SG2) είναι ο ρυθμός ανάπτυξης μεταξύ της ημέρας 1 και της ημέρας 2 (συγκέντρωση κυττάρων την ημέρα 2 / συγκέντρωση κυττάρων την ημέρα 1). Η RSG είναι η συνολική SG (SG1 x SG2) για την υποβληθείσα σε αγωγή καλλιέργεια σε σύγκριση με τον μάρτυρα χωρίς αγωγή / μάρτυρα με διαλύτη. Δηλαδή: RSG = [SG1(δοκιμή) x SG2(δοκιμή)] / [SG1(μάρτυρας) x SG2(μάρτυρας)] Η SG1 θα πρέπει να υπολογίζεται από την αρχική συγκέντρωση κυττάρων που χρησιμοποιήθηκε στην αρχή της αγωγής των κυττάρων. Κατ’ αυτόν τον τρόπο αποτυπώνεται τυχόν διαφορετική κυτταροτοξικότητα που εμφανίζεται στην ή στις καλλιέργειες δοκιμής κατά τη διάρκεια της αγωγής των κυττάρων.
Η RCE είναι η σχετική απόδοση κλωνοποίησης της καλλιέργειας δοκιμής σε σύγκριση με τη σχετική απόδοση κλωνοποίησης του μάρτυρα χωρίς αγωγή / μάρτυρα με διαλύτη που μετράται κατά τη χρονική στιγμή της επιλογής προϊόντων μετάλλαξης.
Σχετική συνολική ανάπτυξη (RTG):
RTG = RSG x RCE
TK6
Σχετική επιβίωση (RS):
Η κυτταροτοξικότητα αξιολογείται βάσει της σχετικής επιβίωσης, δηλαδή της απόδοσης κλωνοποίησης (CE) κυττάρων επιστρωμένων αμέσως μετά την αγωγή, προσαρμοσμένη ως προς τυχόν απώλεια κυττάρων κατά τη διάρκεια της αγωγής, σε σύγκριση με την απόδοση κλωνοποίησης στους αρνητικούς μάρτυρες (στους οποίους έχει αποδοθεί επιβίωση 100 %). Η προσαρμογή ως προς την απώλεια κυττάρων κατά την αγωγή μπορεί να υπολογιστεί ως εξής:
Η RS για καλλιέργεια που υποβάλλεται σε αγωγή υπολογίζεται ως εξής:

Συχνότητα προϊόντων μετάλλαξης για αμφότερες τις δοκιμές MLA και TK6
Η συχνότητα προϊόντων μετάλλαξης (MF) είναι η απόδοση κλωνοποίησης μεταλλαγμένων αποικιών σε επιλεκτικό μέσο (CEM), προσαρμοσμένη ως προς την απόδοση κλωνοποίησης σε μη επιλεκτικό μέσο κατά τη χρονική στιγμή της επιλογής προϊόντων μετάλλαξης (CEV). Δηλαδή MF=CEM/CEV. Ο υπολογισμός αυτών των δύο τιμών απόδοσης κλωνοποίησης περιγράφεται παρακάτω για τις μεθόδους κλωνοποίησης με άγαρ και μικροτιτλοδότηση.
Έκδοση MLA με άγαρ: Στην έκδοση της MLA με μαλακό άγαρ, ο αριθμός των αποικιών στο τρυβλίο επιλογής προϊόντων μετάλλαξης (CM) και ο αριθμός αποικιών στο μη επιλεκτικό τρυβλίο ή τρυβλίο απόδοσης κλωνοποίησης (καταμέτρηση βιώσιμων κυττάρων) (CV) υπολογίζονται μέσω απευθείας καταμέτρησης των κλώνων. Όταν επιστρώνονται 600 κύτταρα για την απόδοση κλωνοποίησης (CE) για τα τρυβλία επιλογής προϊόντων μετάλλαξης (CEM) και τα μη επιλεκτικά τρυβλία ή τρυβλία απόδοσης κλωνοποίησης (καταμέτρηση βιώσιμων κυττάρων) (CEV) και 3 x 106 κύτταρα χρησιμοποιούνται για επιλογή προϊόντων μετάλλαξης,
CEM = CM / (3 x 106) = (CM / 3) x 10-6
CEV = CV / 600
Έκδοση μικροτιτλοδότησης MLA και TK6:
Στην έκδοση μικροτιτλοδότησης της MLA, οι CM και CV προσδιορίζονται ως το γινόμενο του συνολικού αριθμού κοιλοτήτων (TW) επί του πιθανού αριθμού αποικιών ανά κοιλότητα (P) στα τρυβλία μικροτιτλοδότησης.
CM = PM x TWM
CV = PV x TWV
Από τον μηδενικό όρο της κατανομής Poisson (Furth et al., 1981), το P προκύπτει από τον τύπο
P = - ln (EW / TW)
όπου EW είναι οι κενές κοιλότητες και TW είναι οι συνολικές κοιλότητες. Ως εκ τούτου:
CEM = CM / TM = (PM x TWM) / TM
CEV = CV / TV = (PV x TWV) / TV
Στην έκδοση μικροτιτλοδότησης της MLA, οι συχνότητες προϊόντων μετάλλαξης μικρών και μεγάλων αποικιών υπολογίζονται με πανομοιότυπο τρόπο, με χρήση του σχετικού αριθμού κενών κοιλοτήτων για τις μικρές και τις μεγάλες αποικίες.
Στην TK6, οι συχνότητες προϊόντων μετάλλαξης μικρών και μεγάλων αποικιών βασίζονται στα πρώιμα εμφανιζόμενα και τα όψιμα εμφανιζόμενα προϊόντα μετάλλαξης.
B.68 IN VITRO ΜΕΘΟΔΟΣ ΔΟΚΙΜΩΝ ΒΡΑΧΥΧΡΟΝΙΑΣ ΕΚΘΕΣΗΣ ΓΙΑ ΤΟΝ ΠΡΟΣΔΙΟΡΙΣΜΟ i) ΧΗΜΙΚΩΝ ΟΥΣΙΩΝ ΠΟΥ ΠΡΟΚΑΛΟΥΝ ΣΟΒΑΡΗ ΟΦΘΑΛΜΙΚΗ ΒΛΑΒΗ ΚΑΙ ii) ΧΗΜΙΚΩΝ ΟΥΣΙΩΝ ΠΟΥ ΔΕΝ ΕΠΙΒΑΛΛΕΤΑΙ ΝΑ ΤΑΞΙΝΟΜΗΘΟΥΝ ΩΣ ΠΡΟΣ ΤΟΝ ΟΦΘΑΛΜΙΚΟ ΕΡΕΘΙΣΜΟ H ΤΗ ΣΟΒΑΡΗ ΟΦΘΑΛΜΙΚΗ ΒΛΑΒΗ
ΕΙΣΑΓΩΓΗ
|
1.
|
Η παρούσα μέθοδος δοκιμών είναι ισοδύναμη με την κατευθυντήρια γραμμή δοκιμών (TG) 491 του ΟΟΣΑ (2017). Η μέθοδος βραχυχρόνιας έκθεσης (STE) είναι in vitro μέθοδος που μπορεί να χρησιμοποιείται σε ορισμένες περιστάσεις και με συγκεκριμένους περιορισμούς για την ταξινόμηση και την επισήμανση της επικινδυνότητας των χημικών προϊόντων (ουσιών και μειγμάτων) που προκαλούν σοβαρή οφθαλμική βλάβη, καθώς και εκείνων που δεν επιβάλλεται να ταξινομηθούν ως ουσίες που προκαλούν είτε σοβαρή οφθαλμική βλάβη είτε οφθαλμικό ερεθισμό, όπως ορίζονται στο Παγκόσμια Εναρμονισμένο Σύστημα Ταξινόμησης και Επισήμανσης των Χημικών Ουσιών (GHS) των Ηνωμένων Εθνών (1) και στον κανονισμό (ΕΕ) 1272/2008 για την ταξινόμηση, την επισήμανση και τη συσκευασία των ουσιών και των μειγμάτων (CLP) της Ευρωπαϊκής Ένωσης (67).
|
|
2.
|
Εδώ και πολλά χρόνια, το δυναμικό επικινδυνότητας των χημικών προϊόντων για τους οφθαλμούς αξιολογείται με χρήση κυρίως μιας in vivo οφθαλμικής δοκιμής σε κουνέλια [μέθοδος δοκιμών B.5 (8), ισοδύναμη με την TG 405 του ΟΟΣΑ]. Είναι γενικά αποδεκτό ότι, στο εγγύς μέλλον, καμία μεμονωμένη εναλλακτική δοκιμή in vitro δεν θα μπορέσει να αντικαταστήσει πλήρως την in vivo οφθαλμική δοκιμή σε κουνέλια από την άποψη της πρόβλεψης του πλήρους φάσματος αποκρίσεων σοβαρής οφθαλμικής βλάβης / οφθαλμικού ερεθισμού για τις διάφορες χημικές κατηγορίες. Εντούτοις, στοχευμένοι συνδυασμοί εναλλακτικών μεθόδων δοκιμών στο πλαίσιο (κλιμακωτής) στρατηγικής δοκιμών θα μπορούσαν κάλλιστα να αντικαταστήσουν πλήρως την οφθαλμική δοκιμή σε κουνέλια (2). Η καθοδική προσέγγιση έχει σχεδιαστεί για τη διεξαγωγή δοκιμών χημικών ουσιών για τις οποίες μπορεί να αναμένεται, με βάση τις υπάρχουσες πληροφορίες, ότι παρουσιάζουν υψηλό δυναμικό ερεθιστικότητας ή προκαλούν σοβαρή οφθαλμική βλάβη. Αντιθέτως, η ανοδική προσέγγιση έχει σχεδιαστεί για τη διεξαγωγή δοκιμών χημικών ουσιών για τις οποίες μπορεί να αναμένεται, με βάση τις υπάρχουσες πληροφορίες, ότι δεν προκαλούν οφθαλμικό ερεθισμό σε βαθμό που να απαιτείται η ταξινόμησή τους. Παρότι η μέθοδος δοκιμών STE δεν θεωρείται ότι αντικαθιστά πλήρως την in vivo οφθαλμική δοκιμή σε κουνέλια, εντούτοις είναι κατάλληλη για χρήση στο πλαίσιο κλιμακωτής στρατηγικής δοκιμών για λόγους κανονιστικής ταξινόμησης και επισήμανσης, όπως η καθοδική/ανοδική προσέγγιση, για τον προσδιορισμό, χωρίς περαιτέρω δοκιμές, i) των χημικών ουσιών που προκαλούν σοβαρή οφθαλμική βλάβη (κατηγορία 1 κατά GHS του ΟΗΕ / κανονισμό CLP) και ii) των χημικών ουσιών (με εξαίρεση τις ουσίες υψηλής πτητικότητας και όλες τις στερεές χημικές ουσίες, εκτός των επιφανειοδραστικών) που δεν επιβάλλεται να ταξινομηθούν ως ουσίες που προκαλούν οφθαλμικό ερεθισμό ή σοβαρή οφθαλμική βλάβη (καμία κατηγορία κατά GHS του ΟΗΕ / κανονισμό CLP) (1)(2). Ωστόσο, για την οριστική ταξινόμηση μιας χημικής ουσίας για την οποία η μέθοδος δοκιμών STE δεν προβλέπει ότι προκαλεί σοβαρή οφθαλμική βλάβη (κατηγορία 1 κατά GHS του ΟΗΕ / κανονισμό CLP) ούτε την κατατάσσει σε κατηγορία GHS του ΟΗΕ / κανονισμού CLP (δεν προκαλεί σοβαρή οφθαλμική βλάβη ούτε οφθαλμικό ερεθισμό) θα χρειαστούν συμπληρωματικές δοκιμές. Επιπλέον, θα πρέπει να ζητείται η γνώμη των αρμόδιων ρυθμιστικών αρχών πριν από τη χρήση της μεθόδου STE στο πλαίσιο ανοδικής προσέγγισης βάσει συστημάτων ταξινόμησης εκτός από το GHS του ΟΗΕ / τον κανονισμό CLP. Η επιλογή της καταλληλότερης μεθόδου δοκιμών και η χρήση αυτής είναι ζητήματα που θα πρέπει να εξετάζονται στο πλαίσιο των πληροφοριών που παρέχονται στο έγγραφο καθοδήγησης «Ολοκληρωμένη προσέγγιση για τη διεξαγωγή δοκιμών και την αξιολόγηση για τη σοβαρή οφθαλμική βλάβη και τον οφθαλμικό ερεθισμό» του ΟΟΣΑ (14).
|
|
3.
|
Σκοπός της παρούσας μεθόδου δοκιμών είναι η περιγραφή των διαδικασιών που εφαρμόζονται για την αξιολόγηση του δυναμικού οφθαλμικής επικινδυνότητας που ενέχει η υπό δοκιμή ουσία, με βάση την ικανότητά της να προκαλεί κυτταροτοξικότητα στο πλαίσιο της μεθόδου δοκιμών βραχυχρόνιας έκθεσης. Η κυτταροτοξική επίδραση των χημικών ουσιών στα επιθηλιακά κύτταρα του κερατοειδούς αποτελεί σημαντικό τρόπο δράσης που οδηγεί στην πρόκληση βλάβης στο επιθήλιο του κερατοειδούς και οφθαλμικό ερεθισμό. Η κυτταρική βιωσιμότητα στη μέθοδο δοκιμών STE αξιολογείται διά του ποσοτικού προσδιορισμού, μετά την εκχύλισή του από τα κύτταρα, του κυανού άλατος φορμαζάνης που παράγεται από τα ζώντα κύτταρα μέσω ενζυμικής μετατροπής της χρωστικής ζωτικής χρώσης MTT (βρωμιούχο 3-(4,5-διμεθυλοθειαζολ-2-υλο)-2,5-διφαινυλοτετραζόλιο), γνωστής και ως βρωμιούχο τετραζόλιο-κυανό του θειαζολυλίου (3). Η επιτευχθείσα κυτταρική βιωσιμότητα συγκρίνεται με τον μάρτυρα με διαλύτη (σχετική βιωσιμότητα) και χρησιμοποιείται για να εκτιμηθεί η δυνητική οφθαλμική επικινδυνότητα που ενέχει η υπό δοκιμή χημική ουσία. Μια υπό δοκιμή χημική ουσία ταξινομείται ως κατηγορίας 1 κατά GHS του ΟΗΕ / κανονισμό CLP όταν αμφότερες οι συγκεντρώσεις 5 % και 0,05 % δίνουν κυτταρική βιωσιμότητα μικρότερη ή ίση με (≤) 70 %. Αντιθέτως, μια χημική ουσία προβλέπεται ότι αποτελεί ουσία καμίας κατηγορίας κατά GHS του ΟΗΕ / κανονισμό CLP όταν αμφότερες οι συγκεντρώσεις 5 % και 0,05 % δίνουν κυτταρική βιωσιμότητα υψηλότερη από (>) 70 %.
|
|
4.
|
Ο όρος «υπό δοκιμή χημική ουσία» χρησιμοποιείται στην παρούσα μέθοδο δοκιμών για να δηλώσει την ύλη που υποβάλλεται σε δοκιμή και δεν σχετίζεται με την εφαρμοσιμότητα της μεθόδου δοκιμών STE στον έλεγχο ουσιών και/ή μειγμάτων. Οι ορισμοί παρατίθενται στο προσάρτημα.
|
ΑΡΧΙΚΕΣ ΕΚΤΙΜΗΣΕΙΣ ΚΑΙ ΠΕΡΙΟΡΙΣΜΟΙ
|
5.
|
Η παρούσα μέθοδος δοκιμών βασίζεται σε πρωτόκολλο που ανέπτυξε η Kao Corporation (4), το οποίο αποτέλεσε αντικείμενο δύο διαφορετικών μελετών επικύρωσης: μίας μελέτης της επιτροπής επικύρωσης της ΙαπωνικήςΕταιρείας Εναλλακτικών Μεθόδων προς τα Πειράματα σε Ζώα (JSAAE) (5) και μίας δεύτερης μελέτης του Ιαπωνικού Κέντρου για την Επικύρωση Εναλλακτικών Μεθόδων (JaCVAM) (6). Τα NICEATM/ICCVAM πραγματοποίησαν αξιολόγηση από ομοτίμους με βάση τις εκθέσεις των μελετών επικύρωσης και τα έγγραφα επισκόπησης των διαθέσιμων δεδομένων σχετικά με τη μέθοδο δοκιμών (7).
|
|
6.
|
Όταν η μέθοδος δοκιμών STE χρησιμοποιήθηκε για τον προσδιορισμό χημικών προϊόντων (ουσιών και μειγμάτων) που προκαλούν σοβαρή οφθαλμική βλάβη [κατηγορία 1 κατά GHS του ΟΗΕ / κανονισμό CLP (1)], τα δεδομένα που ελήφθησαν για 125 χημικά προϊόντα (περιλαμβανομένων ουσιών και μειγμάτων), παρουσίαζαν συνολική ορθότητα 83 % (104/125), ποσοστό ψευδοθετικών εκβάσεων 1 % (1/86) και ποσοστό ψευδοαρνητικών εκβάσεων 51 % (20/39) σε σύγκριση με την in vivo οφθαλμική δοκιμή σε κουνέλια (7). Το ποσοστό ψευδοαρνητικών εκβάσεων δεν είναι κρίσιμης σημασίας στο παρόν πλαίσιο, δεδομένου ότι όλες οι υπό δοκιμή χημικές ουσίες που επάγουν κυτταρική βιωσιμότητα ≤ 70 % σε συγκέντρωση 5 % και > 70 % σε συγκέντρωση 0,05 % ελέγχονται στη συνέχεια με επαρκώς επικυρωμένες μεθόδους δοκιμών in vitro ή, ως έσχατη επιλογή, με την in vivo οφθαλμική δοκιμή, ανάλογα με τις κανονιστικές απαιτήσεις και σύμφωνα με τη στρατηγική διαδοχικών δοκιμών και τις επί του παρόντος συνιστώμενες προσεγγίσεις βάρους της απόδειξης (1) (8). Υποβλήθηκαν σε δοκιμή κυρίως μονοσυστατικές ουσίες, αν και υπάρχουν επίσης περιορισμένα δεδομένα σχετικά με τις δοκιμές μειγμάτων. Η μέθοδος δοκιμών είναι πάντως τεχνικά εφαρμόσιμη στον έλεγχο πολυσυστατικών ουσιών και μειγμάτων. Ωστόσο, πριν από τη χρήση της παρούσας μεθόδου δοκιμών σε μείγμα για την παραγωγή δεδομένων για συγκεκριμένο κανονιστικό σκοπό, θα πρέπει να εξετάζεται αν –και, εάν ναι, για ποιον λόγο– μπορεί να αποδώσει αποτελέσματα κατάλληλα για τον επιδιωκόμενο σκοπό. Τέτοια εξέταση δεν χρειάζεται όταν οι κανονιστικές ρυθμίσεις επιβάλλουν τον έλεγχο του μείγματος. Η μέθοδος δοκιμών STE δεν παρουσίασε άλλα ειδικά μειονεκτήματα όταν χρησιμοποιήθηκε για τον προσδιορισμό υπό δοκιμή χημικών ουσιών ως ουσιών κατηγορίας 1 κατά GHS του ΟΗΕ / κανονισμό CLP. Οι ερευνητές μπορούν να εξετάζουν το ενδεχόμενο να χρησιμοποιούν την παρούσα μέθοδο δοκιμών, οπότε και η κυτταρική βιωσιμότητα ≤ 70 % σε συγκέντρωση 5 % και 0,05 % θα πρέπει να γίνεται δεκτή ως ενδεικτική απόκρισης που προκαλεί σοβαρή οφθαλμική βλάβη που θα πρέπει να ταξινομηθεί ως κατηγορίας 1 κατά GHS του ΟΗΕ / κανονισμό CLP χωρίς τη διεξαγωγή περαιτέρω δοκιμών.
|
|
7.
|
Όταν η μέθοδος δοκιμών STE χρησιμοποιήθηκε για τον προσδιορισμό χημικών προϊόντων (ουσιών και μειγμάτων) που δεν χρειάζονται ταξινόμηση ως προς τον οφθαλμικό ερεθισμό και τη σοβαρή οφθαλμική βλάβη (καμία κατηγορία 1 GHS του ΟΗΕ / κανονισμό CLP), τα δεδομένα που ελήφθησαν για 130 χημικά προϊόντα (περιλαμβανομένων ουσιών και μειγμάτων), παρουσίαζαν συνολική ορθότητα 85 % (110/130), ποσοστό ψευδοαρνητικών εκβάσεων 12 % (9/73) και ποσοστό ψευδοθετικών εκβάσεων 19 % (11/57) σε σύγκριση με την in vivo οφθαλμική δοκιμή σε κουνέλια (7). Όταν από το σύνολο δεδομένων αποκλείονται οι ουσίες υψηλής πτητικότητας και οι στερεές ουσίες, εκτός των επιφανειοδραστικών, η συνολική ορθότητα βελτιώνεται σε 90 % (92/102), το ποσοστό ψευδοαρνητικών εκβάσεων σε 2 % (1/54), και το ποσοστό ψευδοθετικών εκβάσεων σε 19 % (9/48) (7). Ως εκ τούτου, τα πιθανά μειονεκτήματα της μεθόδου δοκιμών STE, όταν χρησιμοποιείται για τον προσδιορισμό χημικών ουσιών που δεν χρειάζονται ταξινόμηση ως ουσίες που προκαλούν οφθαλμικό ερεθισμό και σοβαρή οφθαλμική βλάβη (καμία κατηγορία κατά GHS του ΟΗΕ / κανονισμό CLP), είναι το υψηλό ποσοστό ψευδοαρνητικών εκβάσεων με i) ουσίες υψηλής πτητικότητας με τάση ατμών πάνω από 6 kPa και ii) στερεά χημικά προϊόντα (ουσίες και μείγματα) εκτός των επιφανειοδραστικών και των μειγμάτων που αποτελούνται μόνο από επιφανειοδραστικά. Αυτά τα χημικά προϊόντα αποκλείονται από το πεδίο εφαρμοσιμότητας της μεθόδου δοκιμών STE (7).
|
|
8.
|
Εκτός των χημικών προϊόντων που αναφέρονται στις παραγράφους 6 και 7, στο σύνολο δεδομένων που παρήχθη με τη μέθοδο δοκιμών STE περιλαμβάνονται επίσης εσωτερικά δεδομένα της επιχείρησης για 40 μείγματα, τα οποία, όταν συγκρίθηκαν με τα δεδομένα της in vivo οφθαλμικής δοκιμής Draize, εμφάνισαν ορθότητα 88 % (35/40), ποσοστό ψευδοθετικών εκβάσεων 50 % (5/10) και ποσοστό ψευδοαρνητικών εκβάσεων 0 % (0/30) όσον αφορά την πρόβλεψη για μείγματα που δεν χρειάζονται ταξινόμηση βάσει των συστημάτων ταξινόμησης GHS του ΟΗΕ / κανονισμού CLP (9). Ως εκ τούτου, η μέθοδος δοκιμών STE μπορεί να εφαρμόζεται για τον προσδιορισμό μειγμάτων ως μειγμάτων «καμίας κατηγορίας» κατά GHS του ΟΗΕ / κανονισμό CLP στο πλαίσιο ανοδικής προσέγγισης, με εξαίρεση τα στερεά μείγματα, εκτός εκείνων που αποτελούνται μόνο από επιφανειοδραστικά, κατά προέκταση του περιορισμού της στις στερεές χημικές ουσίες. Επιπλέον, τα μείγματα που περιέχουν ουσίες με τάση ατμών υψηλότερη από 6kPa θα πρέπει να αξιολογούνται με προσοχή, προκειμένου να αποφεύγονται ενδεχόμενες υποπροβλέψεις, και η αξιολόγησή τους θα πρέπει να αιτιολογείται κατά περίπτωση.
|
|
9.
|
Η μέθοδος δοκιμών STE δεν μπορεί να χρησιμοποιείται για τον χαρακτηρισμό υπό δοκιμή χημικών ουσιών ως «κατηγορίας 2 κατά GHS του ΟΗΕ / κανονισμό CLP» ή «κατηγορίας 2Α (οφθαλμικός ερεθισμός) ή 2Β (ήπιος οφθαλμικός ερεθισμός) κατά GHS του ΟΗΕ / κανονισμό CLP», λόγω του σημαντικού αριθμού χημικών ουσιών κατηγορίας 1 κατά GHS του ΟΗΕ / κανονισμό CLP που υποπροβλέπονται ως κατηγορίας 2, 2Α ή 2Β και των χημικών ουσιών καμίας κατηγορίας κατά GHS του ΟΗΕ / κανονισμό CLP που υπερπροβλέπονται ως κατηγορίας 2, 2Α ή 2Β (7). Για τον σκοπό αυτό, ενδέχεται να απαιτούνται περαιτέρω δοκιμές με άλλη κατάλληλη μέθοδο.
|
|
10.
|
Η μέθοδος δοκιμών STE είναι κατάλληλη για υπό δοκιμή χημικές ουσίες που διαλύονται ή εναιωρούνται ομοιόμορφα για τουλάχιστον 5 λεπτά σε φυσιολογικό ορό, σε 5 % διμεθυλοσουλφοξείδιο (DMSO) σε αλατούχο διάλυμα, ή σε ορυκτέλαιο. Η μέθοδος δοκιμών STE δεν είναι κατάλληλη για υπό δοκιμή χημικές ουσίες που είναι μη διαλυτές ή δεν μπορούν να εναιωρηθούν ομοιόμορφα για τουλάχιστον 5 λεπτά σε φυσιολογικό ορό, σε 5 % διμεθυλοσουλφοξείδιο (DMSO) σε αλατούχο διάλυμα, ή σε ορυκτέλαιο. Η χρήση ορυκτελαίου στη μέθοδο δοκιμών STE είναι εφικτή λόγω της βραχυχρόνιας έκθεσης. Ως εκ τούτου, η μέθοδος δοκιμών STE είναι κατάλληλη για την πρόβλεψη του δυναμικού οφθαλμικής επικινδυνότητας μη υδατοδιαλυτών χημικών ουσιών (π.χ. λιπαρές αλκοόλες ή κετόνες μακράς αλυσίδας άνθρακα) εφόσον μπορούν να αναμειχθούν με τουλάχιστον έναν από τους ανωτέρω προτεινόμενους διαλύτες (4).
|
|
11.
|
Ο όρος «υπό δοκιμή χημική ουσία» χρησιμοποιείται στην παρούσα μέθοδο δοκιμών για να δηλώσει την ύλη που υποβάλλεται σε δοκιμή (68) και δεν σχετίζεται με την εφαρμοσιμότητα της μεθόδου δοκιμών STE στον έλεγχο ουσιών και/ή μειγμάτων.
|
ΑΡΧΗ ΤΗΣ ΔΟΚΙΜΗΣ
|
12.
|
Η μέθοδος δοκιμών STE είναι μια in vitro δοκιμασία που βασίζεται στην κυτταροτοξικότητα και που διεξάγεται σε συνεχή μονοστιβάδα κυττάρων Statens Seruminstitut Rabbit Cornea (SIRC), η οποία φέρεται σε τρυβλίο μικροτιτλοδότησης 96 κοιλοτήτων από πολυκαρβονικό εστέρα (4). Μετά από έκθεση διάρκειας πέντε λεπτών σε υπό δοκιμή χημική ουσία, η κυτταροτοξικότητα προσδιορίζεται ποσοτικά ως η σχετική βιωσιμότητα των κυττάρων SIRC με χρήση της δοκιμασίας MTT (4). Η μειωμένη κυτταρική βιωσιμότητα χρησιμοποιείται για την πρόβλεψη των δυνητικών δυσμενών επιδράσεων που προκαλούν οφθαλμική βλάβη.
|
|
13.
|
Έχει αναφερθεί ότι το 80 % διαλύματος που ενσταλάζεται στον οφθαλμό κουνελιού απεκκρίνεται μέσω του σάκου του επιπεφυκότα εντός τριών έως τεσσάρων λεπτών, ενώ ποσότητα άνω του 80 % διαλύματος που ενσταλάζεται στον ανθρώπινο οφθαλμό απεκκρίνεται εντός ενός ή δύο λεπτών (10). Με τη μέθοδο δοκιμών STE επιχειρείται η προσέγγιση αυτών των χρόνων έκθεσης και χρησιμοποιείται η κυτταροτοξικότητα ως παράμετρος για την αξιολόγηση της έκτασης της βλάβης που προκαλείται στα κύτταρα SIRC μετά από έκθεση διάρκειας πέντε λεπτών στην υπό δοκιμή χημική ουσία.
|
ΑΠΟΔΕΙΞΗ ΤΕΧΝΙΚΗΣ ΙΚΑΝΟΤΗΤΑΣ
|
14.
|
Πριν εντάξουν στην καθημερινή πρακτική τη μέθοδο δοκιμών STE που περιγράφεται στην παρούσα μέθοδο δοκιμών, τα εργαστήρια θα πρέπει να αποδεικνύουν την τεχνική τους ικανότητα ταξινομώντας σωστά τις έντεκα συνιστώμενες ουσίες του πίνακα 1. Οι εν λόγω ουσίες επιλέχτηκαν ως αντιπροσωπευτικές του πλήρους φάσματος αποκρίσεων όσον αφορά τη σοβαρή οφθαλμική βλάβη ή τον οφθαλμικό ερεθισμό με βάση τα αποτελέσματα in vivo οφθαλμικών δοκιμών σε κουνέλια (TG 405) και το σύστημα ταξινόμησης GHS του ΟΗΕ / τον κανονισμό CLP (1). Άλλα κριτήρια επιλογής ήταν: οι ουσίες θα πρέπει να διατίθενται στο εμπόριο και θα πρέπει να υπάρχουν διαθέσιμα in vivo δεδομένα αναφοράς υψηλής ποιότητας καθώς και in vitro δεδομένα υψηλής ποιότητας από τη μέθοδο δοκιμών STE (3). Σε περιπτώσεις όπου μια απαριθμούμενη ουσία δεν είναι διαθέσιμη, ή εφόσον αιτιολογείται, μπορεί να χρησιμοποιείται άλλη ουσία για την οποία υπάρχουν επαρκή δεδομένα αναφοράς in vivo και in vitro, υπό την προϋπόθεση ότι εφαρμόζονται τα ίδια κριτήρια επιλογής που περιγράφονται στο παρόν σημείο.
Πίνακας 1
Κατάλογος ουσιών ελέγχου ικανότητας
|
Ουσία
|
CASRN
|
Χημική κατηγορία (69)
|
Φυσική κατάσταση
|
Κατηγορία in vivo κατά GHS του ΟΗΕ / κανονισμό CLP (70)
|
Διαλύτης στη δοκιμή STE
|
Κατηγορία STE κατά GHS του ΟΗΕ / κανονισμό CLP
|
|
Χλωριούχο βενζαλκόνιο (10 %, υδατικό)
|
8001-54-5
|
Ένωση κατιόντων υδριδίων
|
Υγρό
|
Κατηγορία 1
|
Αλατούχο διάλυμα
|
Κατηγορία 1
|
|
Triton X-100 (100 %)
|
9002-93-1
|
Αιθέρας
|
Υγρό
|
Κατηγορία 1
|
Αλατούχο διάλυμα
|
Κατηγορία 1
|
|
Acid Red 92
|
18472-87-2
|
Ετεροκυκλική ένωση, βρωμιούχος ένωση, χλωριούχος ένωση
|
Στερεό
|
Κατηγορία 1
|
Αλατούχο διάλυμα
|
Κατηγορία 1
|
|
Υδροξείδιο του νατρίου
|
1310-73-2
|
Άλκαλι Ανόργανο χημικό προϊόν
|
Στερεό
|
Κατηγορία 1 (71)
|
Αλατούχο διάλυμα
|
Κατηγορία 1
|
|
Βουτυρολακτόνη
|
96-48-0
|
Λακτόνη, ετεροκυκλική ένωση
|
Υγρό
|
Κατηγορία 2A (κατηγορία 2 στον κανονισμό CLP)
|
Αλατούχο διάλυμα
|
Αδύνατη η διατύπωση πρόβλεψης
|
|
1-Οκτανόλη
|
111-87-5
|
Αλκοόλη
|
Υγρό
|
Κατηγορία 2A/B (72)(κατηγορία 2 στον κανονισμό CLP)
|
Ορυκτέλαιο
|
Αδύνατη η διατύπωση πρόβλεψης
|
|
Κυκλοπεντανόλη
|
96-41-3
|
Αλκοόλη, υδρογονάνθρακας, κυκλικός
|
Υγρό
|
Κατηγορία 2A/B (73) (κατηγορία 2 στον κανονισμό CLP)
|
Αλατούχο διάλυμα
|
Αδύνατη η διατύπωση πρόβλεψης
|
|
Οξικός 2-αιθοξυ-αιθυλεστέρας
|
111-15-9
|
Αλκοόλη, αιθέρας
|
Υγρό
|
Καμία κατηγορία
|
Αλατούχο διάλυμα
|
Καμία κατηγορία
|
|
Δωδεκάνιο
|
112-40-3
|
Υδρογονάνθρακας, άκυκλος
|
Υγρό
|
Καμία κατηγορία
|
Ορυκτέλαιο
|
Καμία κατηγορία
|
|
Μεθυλοϊσοβουτυλοκετόνη
|
108-10-1
|
Κετόνη
|
Υγρό
|
Καμία κατηγορία
|
Ορυκτέλαιο
|
Καμία κατηγορία
|
|
Θειική 1,1-διμεθυλογουανιδίνη
|
598-65-2
|
Αμιδίνη, ένωση θείου
|
Στερεό
|
Καμία κατηγορία
|
Αλατούχο διάλυμα
|
Καμία κατηγορία
|
|
Συντομογραφίες: CASRN = αριθμός μητρώου της υπηρεσίας Chemical Abstracts Service
|
|
ΔΙΑΔΙΚΑΣΙΑ
Παρασκευή της κυτταρικής μονοστιβάδας
|
15.
|
Για τη διεξαγωγή της μεθόδου δοκιμών STE θα πρέπει να χρησιμοποιείται η κυτταρική σειρά κερατοειδούς κουνελιού SIRC. Συνιστάται τα κύτταρα SIRC να λαμβάνονται από καλώς πιστοποιημένη τράπεζα κυττάρων, όπως η American Type Culture Collection CCL60.
|
|
16.
|
Τα κύτταρα SIRC καλλιεργούνται στους 37 °C και σε ατμόσφαιρα με ύγρανση και 5 % CO2 εντός φιάλης καλλιέργειας που περιέχει θρεπτικό μέσο που αποτελείται από θρεπτικό μέσο ελάχιστων τροφικών απαιτήσεων Eagle (MEM), συμπληρωμένο με 10 % βόειου εμβρυϊκού ορού (FBS), 2 mM L-γλουταμίνης, 50–100 μονάδες/ml πενικιλίνης και 50–100 μg/ml στρεπτομυκίνης. Τα κύτταρα που έχουν συρρεύσει στη φιάλη καλλιέργειας θα πρέπει να διαχωρίζονται με χρήση διαλύματος θρυψίνης-αιθυλενοδιαμινοτετραοξικού οξέος, με ή χωρίς χρήση ξέστρου κυττάρων. Τα κύτταρα πολλαπλασιάζονται (π.χ. 2 έως 3 ανακαλλιέργειες) σε φιάλη καλλιέργειας προτού χρησιμοποιηθούν σε δοκιμές στην καθημερινή πρακτική, και δεν θα πρέπει να υποβάλλονται σε περισσότερες από 25 ανακαλλιέργειες μετά την απόψυξη.
|
|
17.
|
Στη συνέχεια, τα κύτταρα που είναι έτοιμα για χρήση στη δοκιμή STE φέρονται στην κατάλληλη πυκνότητα και εμβολιάζονται στα τρυβλία 96 κοιλοτήτων. Η συνιστώμενη πυκνότητα εμβολιασμού κυττάρων είναι 6,0 × 103 κύτταρα ανά κοιλότητα, όταν τα κύτταρα χρησιμοποιούνται τέσσερις ημέρες μετά τον εμβολιασμό, ή 3,0 × 103 κύτταρα ανά κοιλότητα, όταν τα κύτταρα χρησιμοποιούνται πέντε ημέρες μετά τον εμβολιασμό, σε όγκο καλλιέργειας 200 μl. Τα κύτταρα που χρησιμοποιούνται για τη δοκιμή STE και τα οποία εμβολιάζονται σε θρεπτικό μέσο στην κατάλληλη πυκνότητα φτάνουν σε συρροή άνω του 80 % κατά τη χρονική στιγμή της δοκιμής, δηλαδή τέσσερις ή πέντε ημέρες μετά τον εμβολιασμό.
|
Εφαρμογή των υπό δοκιμή χημικών ουσιών και των μαρτύρων
|
18.
|
Ο διαλύτης πρώτης επιλογής για τη διάλυση ή την εναιώρηση υπό δοκιμή χημικών ουσιών είναι ο φυσιολογικός ορός. Εάν η υπό δοκιμή χημική ουσία παρουσιάζει χαμηλή διαλυτότητα ή δεν μπορεί να διαλυθεί ή να εναιωρηθεί ομοιόμορφα για τουλάχιστον πέντε λεπτά σε αλατούχο διάλυμα, ως διαλύτης δεύτερης επιλογής χρησιμοποιείται 5 % DMSO (CAS#67-68-5) σε αλατούχο διάλυμα. Για υπό δοκιμή χημικές ουσίες που δεν μπορούν να διαλυθούν ή να εναιωρηθούν ομοιόμορφα για τουλάχιστον πέντε λεπτά σε αλατούχο διάλυμα ή σε 5 % DMSO σε αλατούχο διάλυμα, ως διαλύτης τρίτης επιλογής χρησιμοποιείται ορυκτέλαιο (CAS#8042-47-5).
|
|
19.
|
Οι υπό δοκιμή χημικές ουσίες διαλύονται ή εναιωρούνται ομοιόμορφα στον επιλεγμένο διαλύτη σε συγκέντρωση 5 % κ.β. και αραιώνονται περαιτέρω σε διαδοχικές αραιώσεις κατά 10 φορές μέχρι συγκέντρωσης 0,5 % και 0,05 %. Κάθε υπό δοκιμή χημική ουσία πρέπει να υποβάλλεται σε δοκιμή σε συγκεντρώσεις 5 % και 0,05 %. Τα κύτταρα που καλλιεργούνται στο τρυβλίο 96 κοιλοτήτων εκτίθενται σε 200 μl/κοιλότητα του διαλύματος (ή εναιωρήματος) της υπό δοκιμή χημικής ουσίας σε συγκέντρωση είτε 5 % είτε 0,05 % για πέντε λεπτά σε θερμοκρασία δωματίου. Οι υπό δοκιμή χημικές ουσίες (μονοσυστατικές ή πολυσυστατικές ουσίες ή μείγματα) θεωρούνται αμιγείς ουσίες και αραιώνονται ή εναιωρούνται σύμφωνα με τη μέθοδο, ανεξάρτητα από την καθαρότητά τους.
|
|
20.
|
Σε κάθε τρυβλίο της κάθε επανάληψης, ως μάρτυρας θρεπτικού μέσου χρησιμοποιείται το θρεπτικό μέσο που περιγράφεται στην παράγραφο 16. Επιπλέον, τα κύτταρα πρέπει να εκτίθενται και σε δείγματα μάρτυρα με διαλύτη σε κάθε τρυβλίο κάθε επανάληψης. Οι διαλύτες που απαριθμούνται στην παράγραφο 18 είναι αποδεδειγμένο ότι δεν προκαλούν δυσμενείς επιδράσεις στη βιωσιμότητα των κυττάρων SIRC.
|
|
21.
|
Στη μέθοδο δοκιμών STE, ως θετικός μάρτυρας σε κάθε τρυβλίο κάθε επανάληψης πρέπει να χρησιμοποιείται 0,01 % λαυρυλοθειικού νατρίου (SLS) σε αλατούχο διάλυμα. Για τον υπολογισμό της κυτταρικής βιωσιμότητας του θετικού μάρτυρα, θα πρέπει σε κάθε τρυβλίο κάθε επανάληψης να περιλαμβάνεται μάρτυρας με αλατούχο διάλυμα.
|
|
22.
|
Ένα τυφλό δείγμα είναι απαραίτητο για τον προσδιορισμό της αντιστάθμισης οπτικής πυκνότητας και θα πρέπει να λαμβάνεται από κοιλότητες που περιέχουν μόνο αλατούχο ρυθμιστικό διάλυμα φωσφορικών ιόντων, αλλά όχι ασβέστιο και μαγνήσιο (PBS-) ή κύτταρα.
|
|
23.
|
Κάθε δείγμα (υπό δοκιμή χημικής ουσίας σε συγκέντρωση 5 % και 0,05 %, μάρτυρα θρεπτικού μέσου, μάρτυρα με διαλύτη και θετικού μάρτυρα) θα πρέπει να ελέγχεται εις τριπλούν σε κάθε επανάληψη, μέσω έκθεσης των κυττάρων σε 200 μl κατάλληλης υπό δοκιμή χημικής ουσίας ή χημικής ουσίας μάρτυρα για πέντε λεπτά σε θερμοκρασία δωματίου.
|
|
24.
|
Οι ουσίες συγκριτικής αξιολόγησης είναι χρήσιμες για την αξιολόγηση του δυναμικού οφθαλμικού ερεθισμού άγνωστων χημικών ουσιών συγκεκριμένης χημικής κατηγορίας ή κατηγορίας προϊόντων ή για την αξιολόγηση του σχετικού ερεθιστικού δυναμικού ενός ερεθιστικού των οφθαλμών εντός συγκεκριμένου φάσματος αποκρίσεων ερεθισμού.
|
Μέτρηση της κυτταρικής βιωσιμότητας
|
25.
|
Μετά την έκθεση, τα κύτταρα εκπλένονται δύο φορές με 200 μl PBS και προστίθενται 200 μl διαλύματος MTT (0,5 mg MTT/ml θρεπτικού μέσου). Μετά από την πάροδο χρόνου αντίδρασης δύο ωρών σε επωαστήρα (37 °C, 5 % CO2), μεταγγίζεται το διάλυμα MTT, εκχυλίζεται η φορμαζάνη MTT με προσθήκη 200 μl 0,04 N υδροχλωρικού οξέος–ισοπροπανόλης για 60 λεπτά στο σκοτάδι σε θερμοκρασία δωματίου, και μετράται η απορρόφηση του διαλύματος φορμαζάνης MTT στα 570 nm με συσκευή ανάγνωσης τρυβλίων. Οι υπό δοκιμή χημικές ουσίες (έγχρωμες ουσίες ή άμεσα αναγωγικά της MTT) παρεμποδίζουν τη δοκιμασία MTT μόνο εάν στο σύστημα δοκιμής διατηρηθεί σημαντική ποσότητα υπό δοκιμή χημικής ουσίας κατόπιν έκπλυσης μετά την έκθεση, όπως συμβαίνει με τους ιστούς τρισδιάστατου ανασυσταθέντος ανθρώπινου κερατοειδούς ή ανασυσταθείσας ανθρώπινης επιδερμίδας, χωρίς, ωστόσο, να ισχύει το ίδιο για τις δισδιάστατες κυτταρικές καλλιέργειες που χρησιμοποιούνται για τη μέθοδο δοκιμών STE.
|
Ερμηνεία των αποτελεσμάτων και μοντέλο πρόβλεψης
|
26.
|
Οι τιμές οπτικής πυκνότητας (ΟD) που προκύπτουν για κάθε υπό δοκιμή χημική ουσία χρησιμοποιούνται στη συνέχεια για τον υπολογισμό της κυτταρικής βιωσιμότητας σε σχέση με τον μάρτυρα με διαλύτη, ο οποίος ορίζεται ίσος με 100 %. Η σχετική κυτταρική βιωσιμότητα εκφράζεται ως ποσοστό και υπολογίζεται με διαίρεση της οπτικής πυκνότητας της υπό δοκιμή χημικής ουσίας διά της οπτικής πυκνότητας του μάρτυρα με διαλύτη αφού αφαιρεθεί η οπτική πυκνότητα του τυφλού δείγματος και από τις δύο τιμές.

Αντίστοιχα, η σχετική κυτταρική βιωσιμότητα κάθε μάρτυρα με διαλύτη εκφράζεται ως ποσοστό και υπολογίζεται με διαίρεση της οπτικής πυκνότητας κάθε μάρτυρα με διαλύτη διά της οπτικής πυκνότητας του μάρτυρα θρεπτικού μέσου αφού αφαιρεθεί η οπτική πυκνότητα του τυφλού δείγματος και από τις δύο τιμές.
|
|
27.
|
Θα πρέπει να εκτελούνται τρεις ανεξάρτητες επαναλήψεις, καθεμία εκ των οποίων περιλαμβάνει τρεις πανομοιότυπες κοιλότητες (n=9). Για τον υπολογισμό του αριθμητικού μέσου όρου της σχετικής κυτταρικής βιωσιμότητας χρησιμοποιείται ο αριθμητικός μέσος όρος των τριών κοιλοτήτων για κάθε υπό δοκιμή χημική ουσία και μάρτυρα με διαλύτη σε κάθε ανεξάρτητη επανάληψη. Ο τελικός αριθμητικός μέσος όρος της κυτταρικής βιωσιμότητας προκύπτει από τις τρεις ανεξάρτητες επαναλήψεις.
|
|
28.
|
Παρακάτω δίνονται οι τιμές αποκοπής για την κυτταρική βιωσιμότητα για τον χαρακτηρισμό των υπό δοκιμή χημικών ουσιών που προκαλούν σοβαρή οφθαλμική βλάβη (κατηγορίας 1 κατά GHS του ΟΗΕ / κανονισμό CLP) και των υπό δοκιμή χημικών ουσιών για τις οποίες δεν απαιτείται ταξινόμηση ως προς τον οφθαλμικό ερεθισμό ή τη σοβαρή οφθαλμική βλάβη (καμίας κατηγορίας κατά GHS του ΟΗΕ / κανονισμό CLP).
|
Πίνακας 2
Μοντέλο πρόβλεψης της μεθόδου δοκιμών STE
|
Κυτταρική βιωσιμότητα
|
Ταξινόμηση κατά GHS του ΟΗΕ / κανονισμό CLP
|
Εφαρμοσιμότητα
|
|
Σε 5 %
|
Σε 0,05 %
|
|
> 70 %
|
> 70 %
|
Καμία κατηγορία
|
Ουσίες και μείγματα, με εξαίρεση τα ακόλουθα: i) ουσίες υψηλής πτητικότητας με τάση ατμών πάνω από 6 kPa (74) και ii) στερεά χημικά προϊόντα (ουσίες και μείγματα), με εξαίρεση τα επιφανειοδραστικά και τα μείγματα που αποτελούνται μόνο από επιφανειοδραστικά
|
|
≤ 70 %
|
> 70 %
|
Αδύνατη η διατύπωση πρόβλεψης
|
Άνευ αντικειμένου
|
|
≤ 70 %
|
≤ 70 %
|
Κατηγορία 1
|
Ουσίες και μείγματα (75)
|
Κριτήρια αποδοχής
|
29.
|
Τα αποτελέσματα των δοκιμών κρίνονται αποδεκτά εφόσον πληρούνται όλα τα ακόλουθα κριτήρια:
|
α)
|
η οπτική πυκνότητα του μάρτυρα θρεπτικού μέσου (που εκτίθεται σε θρεπτικό μέσο) θα πρέπει να είναι 0,3 ή υψηλότερη, μετά την αφαίρεση της οπτικής πυκνότητας του τυφλού δείγματος.
|
|
β)
|
η βιωσιμότητα του μάρτυρα με διαλύτη θα πρέπει να είναι 80 % ή υψηλότερη σε σχέση με τον μάρτυρα θρεπτικού μέσου. Σε περίπτωση που σε κάθε επανάληψη χρησιμοποιούνται πολλοί μάρτυρες με διαλύτη, η κυτταρική βιωσιμότητα για καθένα από τους εν λόγω μάρτυρες θα πρέπει να είναι υψηλότερη από 80 % προκειμένου να πληρούν τα κριτήρια οι υπό δοκιμή χημικές ουσίες που ελέγχονται με τους εν λόγω διαλύτες.
|
|
γ)
|
η κυτταρική βιωσιμότητα που προκύπτει με τον θετικό μάρτυρα (0,01 % SLS) θα πρέπει να εμπίπτει εντός δύο τυπικών αποκλίσεων του ιστορικού μέσου όρου. Το ανώτατο και το κατώτατο όριο αποδοχής για τον θετικό μάρτυρα θα πρέπει να επικαιροποιείται συχνά, δηλ. κάθε τρεις μήνες, ή κάθε φορά που διεξάγεται αποδεκτή δοκιμή σε εργαστήρια όπου δεν διεξάγονται συχνά δοκιμές (δηλ. λιγότερο από μια φορά τον μήνα). Σε περίπτωση που ένα εργαστήριο δεν ολοκληρώσει επαρκή αριθμό πειραμάτων ώστε να καθορίσει στατιστικά αξιόπιστη κατανομή θετικών μαρτύρων, επιτρέπεται να χρησιμοποιεί το ανώτατο και το κατώτατο όριο αποδοχής που έχουν καθοριστεί από τον φορέα ανάπτυξης της μεθόδου, δηλ. μεταξύ 21,1 % και 62,3 %, σύμφωνα με τα εργαστηριακά ιστορικά δεδομένα του, ενώ διαμορφώνει εσωτερική κατανομή στη διάρκεια των πρώτων δοκιμών στο πλαίσιο της καθημερινής πρακτικής.
|
|
δ)
|
Η τυπική απόκλιση της τελικής κυτταρικής βιωσιμότητας που προκύπτει από τις τρεις ανεξάρτητες επαναλήψεις θα πρέπει να μην υπερβαίνει το 15 % για αμφότερες τις συγκεντρώσεις 5 % και 0,05 % της υπό δοκιμή χημικής ουσίας.
|
|
Σε περίπτωση που δεν πληρούται ένα ή περισσότερα από τα εν λόγω κριτήρια, τα αποτελέσματα θα πρέπει να απορρίπτονται και θα πρέπει να διεξάγονται τρεις επιπλέον ανεξάρτητες επαναλήψεις.
ΔΕΔΟΜΕΝΑ ΚΑΙ ΑΝΑΦΟΡΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ
Δεδομένα
|
30.
|
Τα δεδομένα για κάθε επιμέρους κοιλότητα (π.χ. οι τιμές κυτταρικής βιωσιμότητας) κάθε επανάληψης καθώς και ο συνολικός μέσος όρος, η SD και η ταξινόμηση πρέπει να αναφέρονται.
|
Έκθεση δοκιμής
|
31.
|
Η έκθεση δοκιμής θα πρέπει να περιλαμβάνει τα ακόλουθα στοιχεία:
|
|
Υπό δοκιμή χημική ουσία και μάρτυρες
|
—
|
Μονοσυστατική ουσία: ταυτοποίηση της χημικής ουσίας, όπως ονομασία/-ες IUPAC ή CAS, αριθμός/-οί CAS, κωδικός SMILES ή InChI, συντακτικός τύπος και/ή άλλα αναγνωριστικά στοιχεία,
|
|
—
|
Πολυσυστατική ουσία, UVCB και μείγμα: χαρακτηρισμός, στο μέτρο του δυνατού, π.χ. χημική ταυτότητα (βλ. ανωτέρω), καθαρότητα, ποσότητα και σχετικές φυσικοχημικές ιδιότητες (βλ. ανωτέρω) των συστατικών, εφόσον είναι διαθέσιμα,
|
|
—
|
φυσική κατάσταση, πτητικότητα, pH, LogP, μοριακό βάρος, χημική κατηγορία, και πρόσθετες σχετικές φυσικοχημικές ιδιότητες που σχετίζονται με τη διενέργεια της μελέτης, εφόσον είναι διαθέσιμα,
|
|
—
|
καθαρότητα, χημική ταυτότητα των προσμείξεων, κατά περίπτωση και στο μέτρο του δυνατού, κ.λπ.,
|
|
—
|
κατεργασία πριν από τη δοκιμή, εάν ισχύει (π.χ. θέρμανση, λειοτρίβηση),
|
|
—
|
συνθήκες φύλαξης και σταθερότητα, εφόσον είναι διαθέσιμα.
|
|
|
|
Συνθήκες και διαδικασίες μεθόδου δοκιμών
|
—
|
Όνομα και διεύθυνση του χορηγού, της εγκατάστασης δοκιμών και του διευθυντή της μελέτης,
|
|
—
|
Περιγραφή της χρησιμοποιούμενης μεθόδου δοκιμών,
|
|
—
|
Χρησιμοποιούμενη κυτταρική σειρά, προέλευσή αυτής, αριθμός ανακαλλιεργειών και συρροή των κυττάρων που χρησιμοποιούνται για τις δοκιμές,
|
|
—
|
Λεπτομέρειες σχετικά με τη χρησιμοποιούμενη διαδικασία δοκιμής,
|
|
—
|
Αριθμός επαναλήψεων και πανομοιότυπων δειγμάτων που χρησιμοποιήθηκαν,
|
|
—
|
Συγκεντρώσεις της υπό δοκιμή χημικής ουσίας που χρησιμοποιήθηκαν (εφόσον διαφέρουν από τις συνιστώμενες),
|
|
—
|
Αιτιολόγηση της επιλογής του διαλύτη για κάθε υπό δοκιμή χημική ουσία,
|
|
—
|
Διάρκεια της έκθεσης στην υπό δοκιμή χημική ουσία (εφόσον διαφέρει από τη συνιστώμενη),
|
|
—
|
Περιγραφή τυχόν τροποποιήσεων της διαδικασίας δοκιμής,
|
|
—
|
Περιγραφή των χρησιμοποιούμενων κριτηρίων αξιολόγησης και λήψης αποφάσεων,
|
|
—
|
Παραπομπή στον μέσο όρο και την τυπική απόκλιση ιστορικών θετικών μαρτύρων,
|
|
—
|
Απόδειξη της τεχνικής ικανότητας του εργαστηρίου όσον αφορά την εφαρμογή της μεθόδου δοκιμών (π.χ. με δοκιμές των ουσιών ελέγχου ικανότητας) ή απόδειξη της διαχρονικής αναπαραγωγιμότητας των επιδόσεων της μεθόδου.
|
|
|
|
Αποτελέσματα
|
—
|
Για κάθε υπό δοκιμή χημική ουσία και μάρτυρα, και για κάθε ελεγχθείσα συγκέντρωση, θα πρέπει να παρέχονται υπό μορφή πίνακα οι επιμέρους τιμές οπτικής πυκνότητας ανά πανομοιότυπη κοιλότητα, ο αριθμητικός μέσος όρος των τιμών οπτικής πυκνότητας για κάθε ανεξάρτητη επανάληψη, το ποσοστό (%) κυτταρικής βιωσιμότητας για κάθε ανεξάρτητη επανάληψη, και ο αριθμητικός μέσος όρος (%) τελικής κυτταρικής βιωσιμότητας και η τυπική απόκλιση των τριών επαναλήψεων,
|
|
—
|
Τα αποτελέσματα για το θρεπτικό μέσο, τον διαλύτη και τον θετικό μάρτυρα, που καταδεικνύουν ότι πληρούνται τα κατάλληλα κριτήρια αποδοχής της μελέτης,
|
|
—
|
Περιγραφή άλλων επιδράσεων που παρατηρήθηκαν,
|
|
—
|
Η συνολική ταξινόμηση στην οποία κατέληξε η δοκιμή, με αναφορά του μοντέλου πρόβλεψης / των κριτηρίων λήψης απόφασης που χρησιμοποιήθηκαν.
|
|
|
|
Εξέταση των αποτελεσμάτων
|
|
ΒΙΒΛΙΟΓΡΑΦΙΑ
|
(1)
|
United Nations UN (2013). Globally Harmonized System of Classification and Labelling of Chemicals (GHS). Fifth revised edition. New York & Geneva: United Nations Publications. ISBN: 978-92-1-117006-1. Διατίθεται στον δικτυακό τόπο: http://www.unece.org/trans/danger/publi/ghs/ghs_rev05/05files_e.html.
|
|
(2)
|
Scott L, et al. (2010). A proposed Eye Irritation Testing Strategy to Reduce and Replace in vivo Studies Using Bottom-Up and Top-Down Approaches. Toxicol. In Vitro 24, 1-9.
|
|
(3)
|
Mosmann T. (1983). Rapid Colorimetric Assay for Cellular Growth and Survival: Application to 7 Proliferation and Cytotoxicity Assays. J. Immunol. Methods 65, 55-63.
|
|
(4)
|
Takahashi Y, et al. (2008). Development of the Short Time Exposure (STE) Test: an In Vitro Eye Irritation Test Using SIRC Cells. Toxicol. In Vitro 22,760-770.
|
|
(5)
|
Sakaguchi H, et al. (2011). Validation Study of the Short Time Exposure (STE) Test to Assess the Eye Irritation Potential of Chemicals. Toxicol. In Vitro 25,796-809.
|
|
(6)
|
Kojima H, et al. (2013). Second-Phase Validation of Short Time Exposure Tests for Assessment of Eye Irritation Potency of Chemicals. Toxicol. In Vitro 27, pp.1855-1869.
|
|
(7)
|
ICCVAM (2013). Short Time Exposure (STE) Test Method Summary Review Document, NIH. Διατίθεται στον δικτυακό τόπο: [http://www.ntp.niehs.nih.gov/iccvam/docs/ocutox_docs/STE-SRD-NICEATM-508.pdf].
|
|
(8)
|
Κεφάλαιο B.5 του παρόντος παραρτήματος, Οξείας μορφής ερεθισμός/διάβρωση των οφθαλμών.
|
|
(9)
|
Saito K, et al. (2015). Predictive Performance of the Short Time Exposure Test for Identifying Eye Irritation Potential of Chemical Mixtures.
|
|
(10)
|
Mikkelson TJ, Chrai SS and Robinson JR. (1973). Altered Bioavailability of Drugs in the Eye Due to Drug-Protein Interaction. J. Pharm. Sci.1648-1653.
|
|
(11)
|
ECETOC (1998). Eye Irritation Reference Chemicals Data Bank. Technical Report (No 48. (2)), Brussels, Belgium.
|
|
(12)
|
Gautheron P, et al. (1992). Bovine Corneal Opacity and Permeability Test: an In Vitro Assay of Ocular Irritancy. Fundam Appl Toxicol. 18, 442–449.
|
|
(13)
|
OECD (2005). Guidance Document on the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment. Environmental, Health and Safety Publications, Series on Testing and Assessment (No 34). Organisation for Economic Cooperation and Development, Paris.
|
|
(14)
|
OECD (2017). Guidance Document on an Integrated Approaches on Testing and Assessment for Serious Eye Damage and Eye irritation. Environmental, Health and Safety Publications, Series on Testing and Assessment (No 263). Organisation for Economic Cooperation and Development, Paris.
|
Προσάρτημα
ΟΡΙΣΜΟΙ
Ορθότητα
: ο βαθμός συμφωνίας μεταξύ των αποτελεσμάτων της μεθόδου δοκιμών και των αποδεκτών τιμών αναφοράς. Αποτελεί μέτρο των επιδόσεων της μεθόδου δοκιμών και μια από τις πτυχές της καταλληλότητας. Συχνά ο όρος χρησιμοποιείται εναλλακτικά προς τη «συμφωνία» για να δηλώσει το ποσοστό ορθών αποτελεσμάτων μιας μεθόδου δοκιμών (13).
Ουσία συγκριτικής αξιολόγησης
: ουσία που χρησιμοποιείται ως πρότυπο για σύγκριση με μια υπό δοκιμή χημική ουσία. Μια ουσία συγκριτικής αξιολόγησης πρέπει να διαθέτει τις ακόλουθες ιδιότητες: i) σταθερή και αξιόπιστη πηγή προμήθειας, ii) δομική και λειτουργική ομοιότητα προς την κατηγορία των υπό δοκιμή ουσιών, iii) γνωστά φυσικά/χημικά χαρακτηριστικά, iv) υποστηρικτικά στοιχεία σχετικά με τις γνωστές επιδράσεις, και v) γνωστή ισχύς στο φάσμα της επιθυμητής απόκρισης.
Ανοδική (bottom-up) προσέγγιση
: κλιμακωτή προσέγγιση που χρησιμοποιείται για υπό δοκιμή χημικές ουσίες για τις οποίες υπάρχουν υπόνοιες ότι δεν επιβάλλεται να ταξινομηθούν ως προς τον οφθαλμικό ερεθισμό ή τη σοβαρή οφθαλμική βλάβη. Η προσέγγιση αυτή αρχίζει με τον προσδιορισμό των χημικών ουσιών που δεν επιβάλλεται να ταξινομηθούν (αρνητική έκβαση) με βάση άλλες χημικές ουσίες (θετική έκβαση).
Χημικό προϊόν
: μια ουσία ή ένα μείγμα.
Οφθαλμικός ερεθισμός
: πρόκληση αλλοιώσεων του οφθαλμού, οι οποίες εμφανίζονται μετά την εφαρμογή της υπό δοκιμή χημικής ουσίας στην εμπρόσθια επιφάνειά του και είναι πλήρως αναστρέψιμες εντός 21 ημερών από την εφαρμογή της ουσίας. Μπορεί να χρησιμοποιηθεί εναλλακτικά προς τους όρους «αναστρέψιμες επιδράσεις στους οφθαλμούς» και «κατηγορία 2 κατά GHS του ΟΗΕ / κανονισμό CLP».
Ποσοστό ψευδοαρνητικής έκβασης
: το ποσοστό του συνόλου των θετικών χημικών ουσιών που εσφαλμένα χαρακτηρίζονται αρνητικές με μια μέθοδο δοκιμών. Αποτελεί έναν από τους δείκτες επιδόσεων της μεθόδου δοκιμών.
Ποσοστό ψευδοθετικής έκβασης
: το ποσοστό του συνόλου των αρνητικών χημικών ουσιών που εσφαλμένα χαρακτηρίζονται θετικές με μια μέθοδο δοκιμών. Αποτελεί έναν από τους δείκτες επιδόσεων της μεθόδου δοκιμών.
Επικινδυνότητα
: εγγενής ιδιότητα ενός παράγοντα ή μιας κατάστασης που μπορεί να έχει δυσμενείς επιδράσεις όταν ένας οργανισμός, ένα σύστημα ή ένας (υπο)πληθυσμός εκτίθεται στον παράγοντα.
Μάρτυρας θρεπτικού μέσου
: πανομοιότυπο δείγμα που περιέχει όλα τα στοιχεία ενός συστήματος δοκιμής και δεν υποβάλλεται σε αγωγή. Το δείγμα αυτό υποβάλλεται σε δοκιμή μαζί με τα δείγματα που έχουν υποβληθεί σε αγωγή με την υπό δοκιμή χημική ουσία και με άλλα δείγματα μάρτυρες, ούτως ώστε να διαπιστώνεται αν ο διαλύτης αλληλεπιδρά με το σύστημα δοκιμής.
Μείγμα
: ένα μείγμα ή διάλυμα που αποτελείται από δύο ή περισσότερες ουσίες.
Μονοσυστατική ουσία
: ουσία που ορίζεται από την ποσοτική της σύνθεση και της οποίας ένα κύριο συστατικό περιέχεται σε ποσοστό τουλάχιστον 80 % κ.β.
MTT
: βρωμιούχο 3-(4,5-διμεθυλοθειαζολ-2-υλο)-2,5-διφαινυλοτετραζόλιο, βρωμιούχο τετραζόλιο-κυανό του θειαζολυλίου.
Πολυσυστατική ουσία
: ουσία που ορίζεται από την ποσοτική της σύνθεση και της οποίας περισσότερα από ένα κύρια συστατικά περιέχονται σε συγκέντρωση ≥ 10 % κ.β. και < 80 % κ.β. Οι πολυσυστατικές ουσίες είναι προϊόντα μεταποιητικών διεργασιών. Η διαφορά μεταξύ μείγματος και πολυσυστατικής ουσίας είναι ότι το μείγμα λαμβάνεται με ανάμειξη δύο ή περισσότερων ουσιών, χωρίς χημική αντίδραση. Οι πολυσυστατικές ουσίες είναι προϊόντα χημικών αντιδράσεων.
OD
: (Optical Density) οπτική πυκνότητα.
Θετικός μάρτυρας
: πανομοιότυπο δείγμα που περιέχει όλα τα στοιχεία ενός συστήματος δοκιμής και υποβάλλεται σε αγωγή με ουσία που είναι γνωστό ότι επάγει θετική απόκριση. Για να διασφαλίζεται η δυνατότητα αξιολόγησης της μεταβλητότητας της απόκρισης του θετικού μάρτυρα σε συνάρτηση με τον χρόνο, το μέγεθος της θετικής απόκρισης δεν θα πρέπει να είναι υπερβολικό.
Καταλληλότητα
: περιγραφή της σχέσης της δοκιμής με την υπό μελέτη επίδραση και του κατά πόσον αυτή έχει σημασία και είναι χρήσιμη για συγκεκριμένο σκοπό. Πρόκειται για τον βαθμό στον οποίο η δοκιμή μετρά ή προβλέπει σωστά τη βιολογική επίδραση υπό μελέτη. Η καταλληλότητα εμπεριέχει συνεκτίμηση της ορθότητας (συμφωνίας) της μεθόδου δοκιμών (10).
Αξιοπιστία
: μέτρο του βαθμού στον οποίο μια μέθοδος δοκιμών μπορεί να αναπαράγεται διαχρονικά στο ίδιο εργαστήριο και μεταξύ εργαστηρίων, όταν εφαρμόζεται με το ίδιο πρωτόκολλο. Εκτιμάται με υπολογισμό της ενδοεργαστηριακής και της διεργαστηριακής αναπαραγωγιμότητας, καθώς και της ενδοεργαστηριακής επαναληψιμότητας (13).
Ευαισθησία
: το ποσοστό του συνόλου των θετικών/δραστικών χημικών ουσιών που ταξινομείται σωστά με τη δοκιμή. Αποτελεί μέτρο ορθότητας των μεθόδων δοκιμών με τις οποίες λαμβάνονται κατηγορηματικά αποτελέσματα, καθώς και σημαντικό κριτήριο αξιολόγησης της καταλληλότητας των μεθόδων δοκιμών (10).
Σοβαρή οφθαλμική βλάβη
: πρόκληση βλάβης στους οφθαλμικούς ιστούς ή σοβαρής μείωσης της όρασης, κατόπιν εφαρμογής της υπό δοκιμή χημικής ουσίας στην πρόσθια επιφάνεια του οφθαλμού, η οποία δεν είναι πλήρως αναστρέψιμη εντός 21 ημερών από την εφαρμογή. Μπορεί να χρησιμοποιηθεί εναλλακτικά προς τους όρους «μη αναστρέψιμες επιδράσεις στους οφθαλμούς» και «κατηγορία 1 κατά GHS του ΟΗΕ / κανονισμό CLP».
Μάρτυρας με διαλύτη/φορέα
: δείγμα που δεν υποβάλλεται σε αγωγή και περιέχει όλα τα στοιχεία ενός συστήματος δοκιμής, συμπεριλαμβανομένου του διαλύτη ή του φορέα. Το δείγμα αυτό υποβάλλεται σε δοκιμή μαζί με τα δείγματα που έχουν υποβληθεί σε αγωγή με την υπό δοκιμή χημική ουσία και με άλλα δείγματα μάρτυρες, με σκοπό τον καθορισμό της βασικής απόκρισης των δειγμάτων που υποβάλλονται σε αγωγή με την υπό δοκιμή χημική ουσία διαλυμένη στον ίδιο διαλύτη ή φορέα. Όταν το εν λόγω δείγμα υποβάλλεται σε δοκιμή με παράλληλο μάρτυρα θρεπτικού μέσου, καταδεικνύει επίσης αν ο διαλύτης ή ο φορέας αλληλεπιδρά με το σύστημα δοκιμής.
Ειδικότητα
: το ποσοστό του συνόλου των αρνητικών/αδρανών χημικών ουσιών που ταξινομείται σωστά με τη δοκιμή. Αποτελεί μέτρο ορθότητας των μεθόδων δοκιμών με τις οποίες λαμβάνονται κατηγορηματικά αποτελέσματα, καθώς και σημαντικό κριτήριο αξιολόγησης της καταλληλότητας των μεθόδων δοκιμών (13).
Ουσία
: ένα χημικό στοιχείο και οι ενώσεις του σε φυσική κατάσταση ή όπως λαμβάνονται με οποιαδήποτε παραγωγική διεργασία, στα οποία συμπεριλαμβάνονται όλα τα πρόσθετα που απαιτούνται για να διατηρείται η σταθερότητά του, καθώς και τυχόν προσμείξεις που προκύπτουν από τη χρησιμοποιούμενη διεργασία, αλλά από τα οποία εξαιρούνται οι διαλύτες που είναι δυνατόν να διαχωριστούν χωρίς να επηρεαστεί η σταθερότητα της ουσίας ούτε να μεταβληθεί η σύνθεσή της.
Επιφανειοδραστική ουσία
: ονομάζεται επίσης τασιενεργή ουσία και είναι χημική ουσία, όπως τα απορρυπαντικά, που μπορεί να μειώσει την επιφανειακή τάση ενός υγρού και, ως εκ τούτου, του επιτρέπει να σχηματίζει αφρό ή να διεισδύει σε στερεά· είναι επίσης γνωστή ως διαβρεκτικό μέσο.
Υπό δοκιμή χημική ουσία
: κάθε ουσία ή μείγμα που υποβάλλεται σε δοκιμή με τη χρήση της παρούσας μεθόδου δοκιμών.
Κλιμακωτή στρατηγική δοκιμών
: στρατηγική δοκιμών κατά βαθμίδες, στο πλαίσιο της οποίας όλες οι υφιστάμενες πληροφορίες για μια υπό δοκιμή χημική ουσία εξετάζονται με συγκεκριμένη σειρά, με χρήση διαδικασίας βάρους της απόδειξης σε κάθε στάδιο, προκειμένου να διαπιστώνεται, πριν από τη μετάβαση στο επόμενο στάδιο, αν διατίθενται επαρκείς πληροφορίες για να ληφθεί απόφαση περί ταξινόμησης κινδύνου. Εάν σε υπό δοκιμή χημική ουσία μπορεί να αποδοθεί δυναμικό ερεθιστικότητας βάσει των υφιστάμενων πληροφοριών, δεν απαιτούνται περαιτέρω δοκιμές. Εάν βάσει των υφιστάμενων πληροφοριών δεν είναι εφικτή η απόδοση δυναμικού ερεθιστικότητας σε υπό δοκιμή χημική ουσία, εφαρμόζεται κλιμακωτή διαδικασία διαδοχικών δοκιμών σε ζώα έως ότου καταστεί εφικτή η βέβαιη ταξινόμηση της ουσίας.
Καθοδική (top-down) προσέγγιση
: κλιμακωτή προσέγγιση που χρησιμοποιείται για υπό δοκιμή χημική ουσία για την οποία υπάρχουν υπόνοιες ότι προκαλεί σοβαρή οφθαλμική βλάβη. Η προσέγγιση αυτή αρχίζει με τον προσδιορισμό των χημικών ουσιών που προκαλούν σοβαρή οφθαλμική βλάβη (θετική έκβαση) σε σχέση με άλλες χημικές ουσίες (αρνητική έκβαση).
Παγκοσμίως Εναρμονισμένο Σύστημα Ταξινόμησης και Επισήμανσης των Χημικών Προϊόντων των Ηνωμένων Εθνών (United Nations Globally Harmonized System of Classification and Labelling of Chemicals) (GHS του ΟΗΕ)
: σύστημα που προτείνει την ταξινόμηση των χημικών προϊόντων (ουσιών και μειγμάτων) με βάση τυποποιημένα είδη και βαθμούς φυσικής επικινδυνότητας και επικινδυνότητας για την υγεία και το περιβάλλον και καλύπτει τα αντίστοιχα στοιχεία γνωστοποίησης, όπως εικονογράμματα, προειδοποιητικές λέξεις, δηλώσεις επικινδυνότητας, δηλώσεις προφύλαξης και δελτία δεδομένων ασφαλείας, με τα οποία γνωστοποιούνται πληροφορίες σχετικά με τις δυσμενείς επιδράσεις με σκοπό την προστασία των ανθρώπων (εργοδοτών, εργαζομένων, μεταφορέων, καταναλωτών και διασωστών) και του περιβάλλοντος (1).
Κατηγορία 1 κατά GHS του ΟΗΕ / κανονισμό CLP
: βλ. «Σοβαρή οφθαλμική βλάβη».
Κατηγορία 2 κατά GHS του ΟΗΕ / κανονισμό CLP
: βλ. «Οφθαλμικός ερεθισμός».
Καμία κατηγορία κατά GHS του ΟΗΕ / κανονισμό CLP
: χημικά προϊόντα που δεν ταξινομούνται ως κατηγορίας 1 ή 2 κατά GHS του ΟΗΕ / κανονισμό CLP (ή κατηγορίας 2A ή 2B κατά GHS του ΟΗΕ).
UVCB
: ουσίες άγνωστης ή ασταθούς σύνθεσης, πολύπλοκα προϊόντα αντιδράσεων ή βιολογικά υλικά.
B.69 ΜΕΘΟΔΟΣ ΔΟΚΙΜΩΝ ΣΕ ΑΝΑΣΥΣΤΑΘΕΝ ΕΠΙΘΗΛΙΟ ΟΜΟΙΟ ΜΕ ΑΝΘΡΩΠΙΝΟ ΚΕΡΑΤΟΕΙΔΗ (RhCE) ΓΙΑ ΤΟΝ ΠΡΟΣΔΙΟΡΙΣΜΟ ΧΗΜΙΚΩΝ ΟΥΣΙΩΝ ΠΟΥ ΔΕΝ ΕΠΙΒΑΛΛΕΤΑΙ ΝΑ ΤΑΞΙΝΟΜΗΘΟΥΝ ΚΑΙ ΝΑ ΕΠΙΣΗΜΑΝΘΟΥΝ ΩΣ ΠΡΟΣ ΤΟΝ ΟΦΘΑΛΜΙΚΟ ΕΡΕΘΙΣΜΟ H ΤΗ ΣΟΒΑΡΗ ΟΦΘΑΛΜΙΚΗ ΒΛΑΒΗ
ΕΙΣΑΓΩΓΗ
|
1.
|
Η παρούσα μέθοδος δοκιμών είναι ισοδύναμη με την κατευθυντήρια γραμμή δοκιμών (TG) 492 του ΟΟΣΑ (2017). Η σοβαρή οφθαλμική βλάβη αναφέρεται στην πρόκληση βλάβης στους ιστούς των οφθαλμών ή τη σοβαρή μείωση της όρασης, η οποία εμφανίζεται μετά την εφαρμογή υπό δοκιμή χημικής ουσίας στην εμπρόσθια επιφάνεια του οφθαλμού και δεν είναι πλήρως αναστρέψιμη εντός 21 ημερών από την εφαρμογή της ουσίας, όπως ορίζεται στο Παγκοσμίως Εναρμονισμένο Σύστημα Ταξινόμησης και Επισήμανσης των Χημικών Ουσιών (GHS) των Ηνωμένων Εθνών (1) και στον κανονισμό (ΕΕ) 1272/2008 για την ταξινόμηση, την επισήμανση και τη συσκευασία των ουσιών και των μειγμάτων (CLP) της Ευρωπαϊκής Ένωσης (76). Επίσης, σύμφωνα με το GHS του ΟΗΕ και τον κανονισμό CLP, οφθαλμικός ερεθισμός είναι η πρόκληση αλλοιώσεων του οφθαλμού, οι οποίες εμφανίζονται μετά την εφαρμογή της υπό δοκιμή χημικής ουσίας στην εμπρόσθια επιφάνεια του οφθαλμού και είναι πλήρως αναστρέψιμες εντός 21 ημερών από την εφαρμογή της ουσίας. Οι χημικές ουσίες που προκαλούν σοβαρή οφθαλμική βλάβη ταξινομούνται στην κατηγορία 1 κατά GHS του ΟΗΕ / κανονισμό CLP, ενώ οι χημικές ουσίες που προκαλούν οφθαλμικό ερεθισμό ταξινομούνται στην κατηγορία 2 κατά GHS του ΟΗΕ / κανονισμό CLP. Οι υπό δοκιμή χημικές ουσίες που δεν ταξινομούνται ως προς τον οφθαλμικό ερεθισμό ή τη σοβαρή οφθαλμική βλάβη ορίζονται ως εκείνες που δεν πληρούν τις απαιτήσεις για να ταξινομηθούν στην κατηγορία 1 ή 2 (2Α ή 2Β) κατά GHS του ΟΗΕ / κανονισμό CLP, και ως εκ τούτου χαρακτηρίζονται «καμίας κατηγορίας κατά GHS του ΟΗΕ και κανονισμό CLP».
|
|
2.
|
Η εκτίμηση της σοβαρής οφθαλμικής βλάβης και του οφθαλμικού ερεθισμού πραγματοποιείται κατά κανόνα με τη χρήση πειραματόζωων [μέθοδος δοκιμών B.5 (2)]. Η επιλογή της καταλληλότερης μεθόδου δοκιμών και η χρήση αυτής είναι ζητήματα που θα πρέπει να εξετάζονται στο πλαίσιο των πληροφοριών που παρέχονται στο έγγραφο καθοδήγησης «Ολοκληρωμένη προσέγγιση για τη διεξαγωγή δοκιμών και την αξιολόγηση για τη σοβαρή οφθαλμική βλάβη και τον οφθαλμικό ερεθισμό» του ΟΟΣΑ (39).
|
|
3.
|
Στην παρούσα μέθοδο δοκιμών περιγράφεται μια in vitro διαδικασία που επιτρέπει τον χαρακτηρισμό χημικών προϊόντων (ουσιών και μειγμάτων) για τα οποία δεν απαιτείται ταξινόμηση και επισήμανση ως προς τον οφθαλμικό ερεθισμό ή τη σοβαρή οφθαλμική βλάβη σύμφωνα με το GHS του ΟΗΕ και τον κανονισμό CLP. Στη μέθοδο χρησιμοποιείται ανασυσταθέν επιθήλιο όμοιο με ανθρώπινο κερατοειδή (reconstructed human cornea-like epithelium, RhCE), το οποίο μιμείται σε μεγάλο βαθμό τις ιστολογικές, μορφολογικές, βιοχημικές και φυσιολογικές ιδιότητες του επιθηλίου του ανθρώπινου κερατοειδούς. Άλλες τέσσερις επιστημονικά έγκυρες in vitro μέθοδοι δοκιμών έχουν επικυρωθεί και εγκριθεί ως μέθοδοι δοκιμών B.47 (3), B.48 (4), B.61 (5) και B.68 (6) με σκοπό την κάλυψη της παραμέτρου «σοβαρή οφθαλμική βλάβη / οφθαλμικός ερεθισμός» της ανθρώπινης υγείας.
|
|
4.
|
Στην παρούσα μέθοδο δοκιμών περιλαμβάνονται δύο επικυρωμένες δοκιμές στις οποίες χρησιμοποιούνται μοντέλα RhCE του εμπορίου. Έχουν διενεργηθεί μελέτες επικύρωσης για την αξιολόγηση του οφθαλμικού ερεθισμού / της σοβαρής οφθαλμικής βλάβης (7)(8)(9)(10)(11)(12)(13) με χρήση της δοκιμής οφθαλμικού ερεθισμού (EIT) EpiOcular™ και της δοκιμής οφθαλμικού ερεθισμού (EIT) του επιθηλίου του ανθρώπινου κερατοειδούς (HCE) SkinEthic™. Στις δοκιμές αυτές χρησιμοποιούνται εμπορικά διαθέσιμα ιστικά μορφώματα RhCE, τα οποία αναφέρονται στο κείμενο που ακολουθεί ως «επικυρωμένες μέθοδοι αναφοράς» VRM 1 και VRM2 αντίστοιχα. Με βάση τις εν λόγω μελέτες επικύρωσης και τη σχετική ανεξάρτητη αξιολόγηση από ομοτίμους (9)(12) εξήχθη το συμπέρασμα ότι οι EpiOcular™ EIT και SkinEthic™ HCE EIT μπορούν να χαρακτηρίζουν ορθά τα χημικά προϊόντα (ουσίες και μείγματα) για τα οποία δεν απαιτείται ταξινόμηση και επισήμανση ως προς τον οφθαλμικό ερεθισμό / τη σοβαρή οφθαλμική βλάβη σύμφωνα με το GHS του ΟΗΕ, και συνιστώνται ως επιστημονικά έγκυρες για τον συγκεκριμένο σκοπό (13).
|
|
5.
|
Είναι γενικά αποδεκτό ότι, στο εγγύς μέλλον, καμία μεμονωμένη μέθοδος δοκιμών in vitro δεν θα μπορέσει να αντικαταστήσει πλήρως την in vivo οφθαλμική δοκιμή Draize (2)(14) από την άποψη της πρόβλεψης του πλήρους φάσματος των αποκρίσεων σοβαρής οφθαλμικής βλάβης / οφθαλμικού ερεθισμού για τις διάφορες χημικές κατηγορίες. Εντούτοις, στοχευμένοι συνδυασμοί διαφόρων εναλλακτικών μεθόδων δοκιμών στο πλαίσιο (κλιμακωτών) στρατηγικών δοκιμών, όπως η ανοδική/καθοδική προσέγγιση, θα μπορούσαν ενδεχομένως να αντικαταστήσουν πλήρως την οφθαλμική δοκιμή Draize (15). Η ανοδική προσέγγιση (15) έχει σχεδιαστεί για χρήση σε περίπτωση που, με βάση τις υπάρχουσες πληροφορίες, μια χημική ουσία δεν αναμένεται να προκαλέσει οφθαλμικό ερεθισμό σε βαθμό που να απαιτείται η ταξινόμησή της, ενώ η καθοδική προσέγγιση (15) έχει σχεδιαστεί για χρήση σε περίπτωση που, με βάση τις υπάρχουσες πληροφορίες, μια χημική ουσία αναμένεται να προκαλέσει σοβαρή οφθαλμική βλάβη. Οι δοκιμές EpiOcular™ EIT και SkinEthic™ HCE EITσυνιστώνται για τον χαρακτηρισμό χημικών ουσιών για τις οποίες δεν επιβάλλεται η ταξινόμηση ως προς τον οφθαλμικό ερεθισμό ή τη σοβαρή οφθαλμική βλάβη σύμφωνα με το GHS του ΟΗΕ / τον κανονισμό CLP (καμία κατηγορία) χωρίς τη διεξαγωγή περαιτέρω δοκιμών, στο πλαίσιο στρατηγικής δοκιμών όπως η ανοδική/καθοδική προσέγγιση που προτείνουν οι Scott et al., π.χ. ως αρχικό στάδιο στο πλαίσιο ανοδικής προσέγγισης ή ως ένα από τα τελευταία στάδια μιας καθοδικής προσέγγισης (15). Ωστόσο, οι δοκιμές EpiOcular™ EIT και SkinEthic™ HCE EIT δεν προορίζονται για τη διαφοροποίηση μεταξύ της κατηγορίας 1 (σοβαρή οφθαλμική βλάβη) και της κατηγορίας 2 (οφθαλμικός ερεθισμός) κατά GHS του ΟΗΕ / κανονισμό CLP. Η διαφοροποίηση αυτή θα πρέπει να γίνεται σε άλλη βαθμίδα της στρατηγικής δοκιμών (15). Ως εκ τούτου, σε περίπτωση υπό δοκιμή χημικής ουσίας που χαρακτηρίζεται ουσία για την οποία απαιτείται ταξινόμηση ως προς οφθαλμικό ερεθισμό / σοβαρή οφθαλμική βλάβη με τις δοκιμές EpiOcular™ EIT ή SkinEthic™ HCE EIT, θα απαιτηθεί η διεξαγωγή συμπληρωματικών δοκιμών (in vitro και/ή in vivo) για την εξαγωγή οριστικού συμπεράσματος (καμία κατηγορία, κατηγορία 2 ή κατηγορία 1 κατά GHS του ΟΗΕ / κανονισμό CLP), με χρήση, για παράδειγμα, της μεθόδου δοκιμών B.47, B.48, B.61 ή B.68.
|
|
6.
|
Σκοπός της παρούσας μεθόδου δοκιμών είναι η περιγραφή της διαδικασίας που εφαρμόζεται για την αξιολόγηση του δυναμικού οφθαλμικού κινδύνου που ενέχει η υπό δοκιμή ουσία, με βάση την ικανότητά της να προκαλεί κυτταροτοξικότητα σε ιστικό μόρφωμα RhCE, όπως μετράται από τη δοκιμή MTT (16) (βλ. παράγραφο 21). Η βιωσιμότητα του ιστού RhCE μετά από έκθεση σε υπό δοκιμή χημική ουσία προσδιορίζεται βάσει σύγκρισης με ιστούς που έχουν υποβληθεί σε αγωγή με τον αρνητικό μάρτυρα [ποσοστό (%) βιωσιμότητας], και, στη συνέχεια, χρησιμοποιείται για την πρόβλεψη του δυναμικού οφθαλμικού κινδύνου που ενέχει η υπό δοκιμή χημική ουσία.
|
|
7.
|
Υπάρχουν διαθέσιμα πρότυπα επιδόσεων (17) που διευκολύνουν την επικύρωση νέων ή τροποποιημένων in vitro δοκιμών που βασίζονται σε RhCE, ανάλογων με τις δοκιμές EpiOcular™ EIT και SkinEthic™ HCE EIT, σύμφωνα με τις αρχές του εγγράφου καθοδήγησης αριθ. 34 του ΟΟΣΑ (18), και επιτρέπουν την έγκαιρη τροποποίηση της TG 492 του ΟΟΣΑ ούτως ώστε να συμπεριληφθούν σε αυτήν. Η αμοιβαία αποδοχή δεδομένων (Mutual Acceptance of Data/MAD) βάσει της συμφωνίας του ΟΟΣΑ είναι διασφαλισμένη μόνο για δοκιμές που έχουν επικυρωθεί σύμφωνα με τα πρότυπα επιδόσεων, εφόσον αυτές έχουν κριθεί από τον ΟΟΣΑ και έχουν περιληφθεί στην αντίστοιχη κατευθυντήρια γραμμή δοκιμών.
|
ΟΡΙΣΜΟΙ
|
8.
|
Οι ορισμοί παρατίθενται στο προσάρτημα 1.
|
ΑΡΧΙΚΕΣ ΕΚΤΙΜΗΣΕΙΣ ΚΑΙ ΠΕΡΙΟΡΙΣΜΟΙ
|
9.
|
Η παρούσα μέθοδος δοκιμών βασίζεται σε τρισδιάστατα ιστικά μορφώματα RhCE του εμπορίου, που παράγονται είτε με χρήση πρωτογενών κερατινοκυττάρων ανθρώπινης επιδερμίδας (EpiOcular™ OCL-200) είτε ανθρώπινων αθανατοποιημένων επιθηλιακών κυττάρων του κερατοειδούς (SkinEthic™ HCE/S). Τα ιστικά μορφώματα των EpiOcular™ OCL-200 και SkinEthic™ HCE/S RhCE είναι παρόμοια με την in vivo τρισδιάστατη δομή του επιθηλίου του κερατοειδούς και παράγονται με χρήση κυττάρων από τα υπό μελέτη είδη (19)(20). Επιπλέον, οι δοκιμές μετρούν απευθείας την κυτταροτοξικότητα που προκύπτει από τη διείσδυση της χημικής ουσίας μέσω του κερατοειδούς και την πρόκληση βλαβών στα κύτταρα και τους ιστούς· στη συνέχεια, το συνολικό αποτέλεσμα της in vivo σοβαρής οφθαλμικής βλάβης/οφθαλμικού ερεθισμού προσδιορίζεται βάσει της κυτταροτοξικής απόκρισης. Βλάβες στα κύτταρα μπορούν να προκληθούν με διάφορους τρόπους δράσης (βλ. παράγραφο 20), αλλά η κυτταροτοξικότητα διαδραματίζει σημαντικό, εάν όχι τον κύριο, μηχανιστικό ρόλο όσον αφορά τον χαρακτήρα της απόκρισης συνολικής σοβαρής οφθαλμικής βλάβης/οφθαλμικού ερεθισμού σε μια χημική ουσία, η οποία εκδηλώνεται in vivo κυρίως μέσω θολερότητας του κερατοειδούς, ιρίτιδας, ερυθήματος του επιπεφυκότος και/ή οιδήματος του επιπεφυκότος, ανεξαρτήτως των χημικών διεργασιών που οδηγούν στην ιστική βλάβη.
|
|
10.
|
Στη μελέτη επικύρωσης της παρούσας μεθόδου δοκιμών ελέγχθηκε ευρύ φάσμα χημικών ουσιών, οι οποίες κάλυπταν μεγάλη ποικιλία τύπων χημικών ουσιών, χημικών κατηγοριών, μοριακών βαρών, logP, χημικών δομών κ.λπ. Η βάση δεδομένων επικύρωσης της EpiOcular™ EIT περιελάμβανε συνολικά 113 χημικές ουσίες, καλύπτοντας 95 διαφορετικές οργανικές λειτουργικές ομάδες, σύμφωνα με την ανάλυση εργαλειοθήκης QSAR του ΟΟΣΑ (8). Αυτές ήταν κυρίως μονοσυστατικές ουσίες, αλλά στη μελέτη περιελήφθησαν επίσης αρκετές πολυσυστατικές ουσίες (περιλαμβανομένων 3 ομοπολυμερών, 5 συμπολυμερών και 10 οιονεί πολυμερών). Σε ό,τι αφορά τη φυσική κατάσταση και τις κατηγορίες GHS του ΟΗΕ/κανονισμού CLP, η κατανομή των 113 χημικών ουσιών που ελέγχθηκαν ήταν η ακόλουθη: 13 υγρά κατηγορίας 1, 15 στερεά κατηγορίας 1, 6 υγρά κατηγορίας 2A, 10 στερεά κατηγορίας 2A, 7 υγρά κατηγορίας 2B, 7 στερεά κατηγορίας 2B, 27 υγρά καμίας κατηγορίας και 28 στερεά καμίας κατηγορίας (8). Η βάση δεδομένων επικύρωσης της SkinEthic™ HCE EIT περιελάμβανε συνολικά 200 χημικές ουσίες, καλύπτοντας 165 διαφορετικές οργανικές λειτουργικές ομάδες (8)(10)(11). Αυτές ήταν κυρίως μονοσυστατικές ουσίες, αλλά στη μελέτη περιελήφθησαν επίσης αρκετές πολυσυστατικές ουσίες (περιλαμβανομένων 10 πολυμερών). Σε ό,τι αφορά τη φυσική κατάσταση και τις κατηγορίες GHS του ΟΗΕ/κανονισμού CLP, η κατανομή των 200 χημικών ουσιών που ελέγχθηκαν ήταν η ακόλουθη: 27 υγρά κατηγορίας 1, 24 στερεά κατηγορίας 1, 19 υγρά κατηγορίας 2A, 10 στερεά κατηγορίας 2A, 9 υγρά κατηγορίας 2B, 8 στερεά κατηγορίας 2B, 50 υγρά καμίας κατηγορίας και 53 στερεά καμίας κατηγορίας (10)(11).
|
|
11.
|
Η παρούσα μέθοδος δοκιμών εφαρμόζεται σε ουσίες και μείγματα, καθώς και σε στερεά, υγρά, ημιστερεά και κηρούς. Τα υγρά μπορεί να είναι υδατικά ή μη· και τα στερεά μπορεί να είναι υδατοδιαλυτά ή μη. Τα στερεά πρέπει, κατά το δυνατόν, να μετατρέπονται σε λεπτόκοκκη σκόνη πριν από την εφαρμογή· δεν απαιτείται άλλη προκατεργασία του δείγματος. Αέρια και αερολύματα δεν έχουν αξιολογηθεί ακόμη με μελέτη επικύρωσης. Παρότι η τεχνολογία RhCE μπορεί θεωρητικά να χρησιμοποιηθεί στη δοκιμή αερίων και αερολυμάτων, αυτά δεν μπορούν να εξεταστούν με την παρούσα μέθοδο δοκιμών.
|
|
12.
|
Υπό δοκιμή χημικές ουσίες που απορροφούν το φως στο ίδιο φάσμα με το άλας φορμαζάνης MTT (με φυσικό τρόπο ή μετά από αγωγή) και υπό δοκιμή χημικές ουσίες ικανές να ανάγουν άμεσα τη χρωστική ζωτικής χρώσης ΜΤΤ (σε άλας φορμαζάνης MTT) μπορεί να παρεμποδίζουν τις μετρήσεις βιωσιμότητας των ιστών, καθιστώντας αναγκαία τη χρήση προσαρμοσμένων μαρτύρων για διορθώσεις. Το είδος των προσαρμοσμένων μαρτύρων που μπορεί να απαιτούνται ποικίλλει ανάλογα με το είδος της παρεμποδιστικής δράσης της υπό δοκιμή χημικής ουσίας και της χρησιμοποιούμενης διαδικασίας ποσοτικού προσδιορισμού του άλατος φορμαζάνης MTT (βλ. παραγράφους 36-42).
|
|
13.
|
Βάσει των αποτελεσμάτων που προέκυψαν από τις μελέτες προεπικύρωσης (21)(22) και τις πλήρεις μελέτες επικύρωσης (8)(10)(11), κατεδείχθη ότι αμφότερες οι δοκιμές EpiOcular™ EIT και SkinEthic™ HCE EIT μπορούν να διεξαχθούν από εργαστήρια που θεωρείται ότι δεν διαθέτουν πείρα στη διεξαγωγή των δοκιμασιών, καθώς και ότι είναι αναπαραγώγιμες εντός και μεταξύ εργαστηρίων. Με βάση τις εν λόγω μελέτες, το επίπεδο αναπαραγωγιμότητας από την άποψη της συμφωνίας των προβλέψεων που μπορεί να αναμένεται από την EpiOcular™ EIT από δεδομένα για 113 χημικές ουσίες ανέρχεται σε 95 % εντός εργαστηρίου και 93 % μεταξύ εργαστηρίων. Το επίπεδο αναπαραγωγιμότητας από την άποψη της συμφωνίας των προβλέψεων που μπορεί να αναμένεται από τη SkinEthic™ HCE EIT από δεδομένα για 120 χημικές ουσίες ανέρχεται σε 92 % εντός εργαστηρίου και 95 % μεταξύ εργαστηρίων.
|
|
14.
|
Η μέθοδος δοκιμών EpiOcular™ EIT μπορεί να χρησιμοποιείται για τον προσδιορισμό χημικών ουσιών που δεν επιβάλλεται να ταξινομηθούν ως προς τον οφθαλμικό ερεθισμό ή τη σοβαρή οφθαλμική βλάβη βάσει του συστήματος ταξινόμησης GHS του ΟΗΕ και του κανονισμού CLP. Με βάση τα δεδομένα που προέκυψαν από τη μελέτη επικύρωσης (8), η EpiOcular™ EIT παρουσιάζει συνολική ορθότητα 80 % (βάσει 112 χημικών ουσιών), ευαισθησία 96 % (βάσει 57 χημικών ουσιών), ποσοστό ψευδοαρνητικής έκβασης 4 % (βάσει 57 χημικών ουσιών), ειδικότητα 63 % (βάσει 55 χημικών ουσιών) και ποσοστό ψευδοθετικής έκβασης 37 % (βάσει 55 χημικών ουσιών), σε σύγκριση με δεδομένα αναφοράς της in vivo οφθαλμικής δοκιμής σε κουνέλια (μέθοδος δοκιμών B.5) (2)(14) που ταξινομήθηκαν με βάση το σύστημα ταξινόμησης GHS του ΟΗΕ και τον κανονισμό CLP. Βάσει μελέτης στην οποία ελέγχθηκαν 97 υγρά αγροχημικά σκευάσματα με την EpiOcular™ EIT, διαπιστώθηκαν ανάλογες επιδόσεις της μεθόδου δοκιμής για τον συγκεκριμένο τύπο μειγμάτων με εκείνες που προέκυψαν από τη μελέτη επικύρωσης (23). Τα 97 σκευάσματα κατανέμονταν ως εξής: 21 κατηγορίας 1, 19 κατηγορίας 2A, 14 κατηγορίας 2B και 43 καμίας κατηγορίας, τα οποία ταξινομήθηκαν σύμφωνα με το σύστημα ταξινόμησης του GHS του ΟΗΕ βάσει δεδομένων αναφοράς της in vivo οφθαλμικής δοκιμής σε κουνέλια (μέθοδος δοκιμών B.5) (2)(14). Προέκυψε συνολική ορθότητα 82 % (βάσει 97 σκευασμάτων), ευαισθησία 91 % (βάσει 54 σκευασμάτων), ποσοστό ψευδοαρνητικής έκβασης 9 % (βάσει 54 σκευασμάτων), ειδικότητα 72 % (βάσει 43 σκευασμάτων) και ποσοστό ψευδοθετικής έκβασης 28 % (βάσει 43 σκευασμάτων) (23).
|
|
15.
|
Η μέθοδος δοκιμών SkinEthic™ HCE EIT μπορεί να χρησιμοποιείται για τον προσδιορισμό χημικών ουσιών που δεν επιβάλλεται να ταξινομηθούν ως προς τον οφθαλμικό ερεθισμό ή τη σοβαρή οφθαλμική βλάβη βάσει του συστήματος ταξινόμησης GHS του ΟΗΕ και του κανονισμού CLP. Με βάση τα δεδομένα που προέκυψαν από τη μελέτη επικύρωσης (10) (11), η SkinEthic™ HCE EIT παρουσιάζει συνολική ορθότητα 84 % (βάσει 200 χημικών ουσιών), ευαισθησία 95 % (βάσει 97 χημικών ουσιών), ποσοστό ψευδοαρνητικής έκβασης 5 % (βάσει 97 χημικών ουσιών), ειδικότητα 72 % (βάσει 103 χημικών ουσιών) και ποσοστό ψευδοθετικής έκβασης 28 % (βάσει 103 χημικών ουσιών), σε σύγκριση με δεδομένα αναφοράς της in vivo οφθαλμικής δοκιμής σε κουνέλια (μέθοδος δοκιμών B.5) (2)(14) που ταξινομήθηκαν με βάση το σύστημα ταξινόμησης GHS του ΟΗΕ και τον κανονισμό CLP.
|
|
16.
|
Τα ποσοστά ψευδοαρνητικής έκβασης που προέκυψαν και από τις δύο δοκιμές RhCE, είτε με ουσίες είτε με μείγματα, εμπίπτουν στο 12 % συνολικής πιθανότητας χαρακτηρισμού των χημικών ουσιών είτε στην κατηγορία 2 κατά GHS του ΟΗΕ και κανονισμό CLP είτε σε καμία κατηγορία κατά GHS του ΟΗΕ και κανονισμό CLP βάσει της in vivo οφθαλμικής δοκιμής Draize, στο πλαίσιο επαναλαμβανόμενων δοκιμών· αυτό οφείλεται στην εγγενή μεταβλητότητα εντός δοκιμής που παρουσιάζει η μέθοδος (24). Τα ποσοστά ψευδοθετικής έκβασης που προέκυψαν και από τις δύο μεθόδους δοκιμών RhCE, είτε με ουσίες είτε με μείγματα, δεν είναι κρίσιμης σημασίας στο πλαίσιο της παρούσας μεθόδου δοκιμών, καθώς για όλες τιςυπό δοκιμή χημικές ουσίες που δίνουν βιωσιμότητα ιστών ίση ή χαμηλότερη από τις καθορισμένες τιμές αποκοπής (βλ. παράγραφο 44) θα απαιτηθούν περαιτέρω δοκιμές με άλλες μεθόδους in vitro, ανάλογα με τις κανονιστικές απαιτήσεις, με χρήση στρατηγικής διαδοχικών δοκιμών στο πλαίσιο προσέγγισης βάρους της απόδειξης. Οι εν λόγω μέθοδοι δοκιμών μπορούν να χρησιμοποιούνται για όλους τους τύπους χημικών ουσιών, οπότε και ένα αρνητικό αποτέλεσμα θα πρέπει να γίνεται δεκτό ως λόγος για τη μη ταξινόμηση μιας χημικής ουσίας ως προς οφθαλμικό ερεθισμό και σοβαρή οφθαλμική βλάβη (καμία κατηγορία κατά GHS του ΟΗΕ και κανονισμό CLP). Θα πρέπει να ζητείται η γνώμη των αρμόδιων ρυθμιστικών αρχών πριν από τη χρήση των EpiOcular™ EIT and SkinEthic™ HCE EIT βάσει συστημάτων ταξινόμησης άλλων εκτός από το GHS του ΟΗΕ / τον κανονισμό CLP.
|
|
17.
|
Ένας περιορισμός της παρούσας μεθόδου δοκιμών είναι ότι δεν επιτρέπει τη διάκριση μεταξύ οφθαλμικού ερεθισμού / αναστρέψιμων επιδράσεων στους οφθαλμούς (κατηγορία 2) και σοβαρής οφθαλμικής βλάβης / μη αναστρέψιμων επιδράσεων στους οφθαλμούς (κατηγορία 1), βάσει του GHS του ΟΗΕ και του κανονισμού CLP, ούτε μεταξύ ερεθιστικών για τους οφθαλμούς (προαιρετική κατηγορία 2A) και ήπιων ερεθιστικών για τους οφθαλμούς (προαιρετική κατηγορία 2B), βάσει του GHS του ΟΗΕ (1). Για τους σκοπούς αυτούς απαιτείται η διεξαγωγή περαιτέρω δοκιμών με άλλες μεθόδους in vitro.
|
|
18.
|
Ο όρος «υπό δοκιμή χημική ουσία» χρησιμοποιείται στην παρούσα μέθοδο δοκιμών για να δηλώσει την ύλη που υποβάλλεται σε δοκιμή (77) και δεν σχετίζεται με την εφαρμοσιμότητα της μεθόδου δοκιμών RhCE στον έλεγχο ουσιών και/ή μειγμάτων.
|
ΑΡΧΗ ΤΗΣ ΔΟΚΙΜΗΣ
|
19.
|
Η υπό δοκιμή χημική ουσία εφαρμόζεται τοπικά σε δύο τουλάχιστον τρισδιάστατα ιστικά μορφώματα RhCE και η κυτταρική βιωσιμότητα μετράται μετά την έκθεση και μετά από περίοδο επώασης κατόπιν αγωγής. Οι ιστοί RhCE ανασυστήνονται από πρωτογενή κερατινοκύτταρα ανθρώπινης επιδερμίδας ή αθανατοποιημένα επιθηλιακά κύτταρα ανθρώπινου κερατοειδούς, που έχουν καλλιεργηθεί για αρκετές ημέρες για να σχηματίσουν ένα στρωματοποιημένο, ισχυρά διαφοροποιημένο πλακώδες επιθήλιο, παρόμοιο μορφολογικά με το επιθήλιο του ανθρώπινου κερατοειδούς. Το ιστικό μόρφωμα EpiOcular™ RhCE αποτελείται από τουλάχιστον 3 βιώσιμα στρώματα κυττάρων και μια μη κερατινοποιημένη επιφάνεια, σχηματίζοντας δομή παρόμοια με του κερατοειδούς, ανάλογη με αυτή που παρατηρείται in vivo. Το ιστικό μόρφωμα SkinEthic™ HCE RhCE αποτελείται από τουλάχιστον 4 βιώσιμα στρώματα κυττάρων, στα οποία περιλαμβάνονται κυλινδρικά βασικά κύτταρα, μεταβατικά πτερυγοειδή κύτταρα και επιφανειακά πλακώδη κύτταρα, παρόμοια με τα κύτταρα του φυσιολογικού επιθηλίου του ανθρώπινου κερατοειδούς (20)(26).
|
|
20.
|
Η σοβαρή οφθαλμική βλάβη / ο οφθαλμικός ερεθισμός που επάγονται από χημικά προϊόντα και εκδηλώνονται in vivo κυρίως με θολερότητα του κερατοειδούς, ιρίτιδα, ερύθημα του επιπεφυκότα και/ή οίδημα του επιπεφυκότα, είναι το αποτέλεσμα μιας σειράς διαδοχικών συμβάντων που ξεκινούν με τη διείσδυση της χημικής ουσίας διαμέσου του κερατοειδούς και/ή του επιπεφυκότα και την πρόκληση βλάβης στα κύτταρα. Βλάβη στα κύτταρα μπορεί να προκληθεί με διάφορους τρόπους δράσης, όπως: λύση της κυτταρικής μεμβράνης (π.χ. από επιφανειοδραστικές ουσίες, οργανικούς διαλύτες)· πήξη μακρομορίων (ιδίως πρωτεϊνών) (π.χ. λόγω επιφανειοδραστικών ουσιών, οργανικών διαλυτών, αλκαλίων και οξέων)· σαπωνοποίηση λιπιδίων (π.χ. λόγω αλκαλίων)· και αλκυλίωση ή άλλες ομοιοπολικές αλληλεπιδράσεις με μακρομόρια (π.χ. λόγω λευκαντικών, υπεροξειδίων και αλκυλιωτών) (15)(27)(28). Ωστόσο, έχει καταδειχθεί ότι η κυτταροτοξικότητα διαδραματίζει σημαντικό, αν όχι τον κύριο, μηχανιστικό ρόλο όσον αφορά τη γενική αντίδραση σοβαρής οφθαλμικής βλάβης / οφθαλμικού ερεθισμού σε μια χημική ουσία, ανεξαρτήτως των φυσικοχημικών διεργασιών που προκαλούν την ιστική βλάβη (29)(30). Επιπλέον, το δυναμικό πρόκλησης σοβαρής οφθαλμικής βλάβης / οφθαλμικού ερεθισμού μιας χημικής ουσίας καθορίζεται πρωτίστως από τον βαθμό του αρχικού τραύματος (31), το οποίο συνδέεται με τον βαθμό της κυτταρικής νέκρωσης (29) και με την έκταση των επακόλουθων αποκρίσεων και τελικών εκβάσεων (32). Έτσι, τα ελαφρά ερεθιστικά επηρεάζουν γενικά μόνο το επιφανειακό επιθήλιο του κερατοειδούς, τα ήπια και μέτρια ερεθιστικά προκαλούν βλάβη πρωτίστως στο επιθήλιο και στο επιφανειακό στρώμα, ενώ τα ισχυρά ερεθιστικά προκαλούν βλάβη στο επιθήλιο, το εν τω βάθει στρώμα και, ενίοτε, στο ενδοθήλιο του κερατοειδούς (30)(33). Η μέτρηση της βιωσιμότητας του ιστικού μορφώματος RhCE μετά από τοπική έκθεση σε υπό δοκιμή χημική ουσία για τον προσδιορισμό χημικών ουσιών για τις οποίες δεν επιβάλλεται να ταξινομηθούν ως προς σοβαρή οφθαλμική βλάβη / οφθαλμικό ερεθισμό (καμία κατηγορία κατά GHS του ΟΗΕ και κανονισμό CLP) βασίζεται στην παραδοχή ότι όλες οι χημικές ουσίες που προκαλούν σοβαρή οφθαλμική βλάβη ή οφθαλμικό ερεθισμό θα επάγουν κυτταροτοξικότητα στο επιθήλιο του κερατοειδούς και/ή στον επιπεφυκότα.
|
|
21.
|
Η βιωσιμότητα του ιστού RhCE μετράται παραδοσιακά με βάση την ενζυμική μετατροπή της χρωστικής ζωτικής χρώσης MTT [βρωμιούχο 3-(4,5-διμεθυλοθειαζολ-2-υλο)-2,5-διφαινυλοτετραζόλιο· βρωμιούχο τετραζόλιο-κυανό του θειαζολυλίου· αριθ. CAS 298-93-1] από τα βιώσιμα κύτταρα του ιστού σε κυανό άλας φορμαζάνης MTT, το οποίο προσδιορίζεται ποσοτικά μετά την εκχύλισή του από τους ιστούς (16). Ως χημικές ουσίες για τις οποίες δεν επιβάλλεται η ταξινόμηση και η επισήμανση με βάση το GHS του ΟΗΕ / τον κανονισμό CLP (καμία κατηγορία) χαρακτηρίζονται οι ουσίες που δεν μειώνουν τη βιωσιμότητα των ιστών κάτω από ένα καθορισμένο όριο (δηλαδή βιωσιμότητα ιστών > 60 %, στις EpiOcular™ EIT και SkinEthic™ HCE EITL (78), ή > 50 % στη SkinEthic™ HCE EITS (79)) (βλ. παράγραφο 44).
|
ΑΠΟΔΕΙΞΗ ΤΕΧΝΙΚΗΣ ΙΚΑΝΟΤΗΤΑΣ
|
22.
|
Πριν από την ένταξη των δοκιμών RhCE στην καθημερινή τους πρακτική για κανονιστικούς σκοπούς, τα εργαστήρια θα πρέπει να αποδεικνύουν την τεχνική τους ικανότητα πραγματοποιώντας ορθές προβλέψεις για τις δεκαπέντε χημικές ουσίες ελέγχου ικανότητας που απαριθμούνται στον πίνακα 1. Οι εν λόγω χημικές ουσίες επιλέχτηκαν μεταξύ των χημικών ουσιών που χρησιμοποιήθηκαν στις μελέτες επικύρωσης των επικυρωμένων μεθόδων αναφοράς (8)(10)(11). Η επιλογή περιλαμβάνει, στο μέτρο του δυνατού, χημικές ουσίες οι οποίες: i) καλύπτουν διαφορετικές φυσικές καταστάσεις· ii) καλύπτουν το πλήρες φάσμα αποκρίσεων σοβαρής οφθαλμικής βλάβης / οφθαλμικού ερεθισμού in vivo βάσει αποτελεσμάτων υψηλής ποιότητας που προέκυψαν από την in vivo οφθαλμική δοκιμή αναφοράς σε κουνέλια (μέθοδος δοκιμών B.5) (2)(14), το σύστημα ταξινόμησης GHS του ΟΗΕ (κατηγορίες 1, 2A, 2B, ή καμία κατηγορία) (1) και το σύστημα ταξινόμησης του κανονισμού CLP (κατηγορίες 1, 2 ή καμία κατηγορία)· iii) καλύπτουν τους διάφορους παράγοντες ταξινόμησης in vivo (24)(25)· iv) είναι αντιπροσωπευτικές των χημικών κατηγοριών που χρησιμοποιήθηκαν στη μελέτη επικύρωσης (8)(10)(11)· v) καλύπτουν ένα ορθό και ευρύ αντιπροσωπευτικό μέρος των οργανικών λειτουργικών ομάδων (8)(10)(11)· vi) έχουν καλά προσδιορισμένες χημικές δομές (8)(10)(11)· vii) είναι έγχρωμες και/ή άμεσα αναγωγικά της MTT· viii) παρήγαγαν αναπαραγώγιμα αποτελέσματα στις μεθόδους δοκιμών RhCE στη διάρκεια των σχετικών επικυρώσεων· ix) προβλέφθηκαν σωστά από τις μεθόδους δοκιμών RhCE στη διάρκεια των σχετικών μελετών επικύρωσης· x) καλύπτουν το πλήρες φάσμα των in vitro αποκρίσεων βάσει δεδομένων μεθόδων δοκιμών RhCE υψηλής ποιότητας (βιωσιμότητα 0 έως 100 %)· xi) διατίθενται στο εμπόριο· και xii) δεν έχουν απαγορευτικό κόστος απόκτησης και/ή απόρριψης. Σε περιπτώσεις στις οποίες μια απαριθμούμενη χημική ουσία δεν είναι διαθέσιμη ή δεν μπορεί να χρησιμοποιηθεί για άλλους βάσιμους λόγους, μπορεί να χρησιμοποιείται άλλη χημική ουσία, π.χ. από τις χημικές ουσίες που χρησιμοποιήθηκαν κατά την επικύρωση της επικυρωμένης μεθόδου αναφοράς (VRM). Τέτοιες αποκλίσεις θα πρέπει ωστόσο να αιτιολογούνται.
Πίνακας 1
Κατάλογος χημικών ουσιών ελέγχου ικανότητας
|
Χημική ονομασία
|
CASRN
|
Οργανική λειτουργική ομάδα (80)
|
Φυσική κατάσταση
|
Βιωσιμότητα VRM1 (%) (81)
|
Βιωσιμότητα VRM2 (%) (82)
|
Πρόβλεψη VRM
|
Αναγωγικό της MTT
|
Παρεμπόδιση λόγω χρώματος
|
|
In vivo κατηγορία 1 (83)
|
|
|
Θειογλυκολικός μεθυλεστέρας
|
2365-48-2
|
Εστέρας καρβοξυλικού οξέος· θειοαλκοόλη
|
Υ
|
10,9±6,4
|
5,5±7,4
|
Αδύνατη η διατύπωση πρόβλεψης
|
Ναι (ισχυρό)
|
Όχι
|
|
Ακρυλικό υδροξυαιθύλιο
|
818-61-1
|
Ακρυλική ένωση· αλκοόλη
|
Υ
|
7,5±4,7 (84)
|
1,6±1,0
|
Αδύνατη η διατύπωση πρόβλεψης
|
Όχι
|
Όχι
|
|
2,5-Διμεθυλο-2,5-εξανοδιόλη
|
110-03-2
|
Αλκοόλη
|
Σ
|
2,3±0,2
|
0,2±0,1
|
Αδύνατη η διατύπωση πρόβλεψης
|
Όχι
|
Όχι
|
|
Οξαλικό νάτριο
|
62-76-0
|
Οξοκαρβοξυλικό οξύ
|
Σ
|
29,0±1,2
|
5,3±4,1
|
Αδύνατη η διατύπωση πρόβλεψης
|
Όχι
|
Όχι
|
|
In vivo κατηγορία 2A (83)
|
|
|
Δι-D-γλυκονικό N,N''-δις(4-χλωροφαινυλο)-3,12-διιμινο-2,4,11,13-τετρααζαδεκατετρανοδιιμιδαμίδιο (20 %, υδατικό) (85)
|
18472-51-0
|
Αρωματικό ετεροκυκλικό αλογονίδιο· αρυλαλογονίδιο· διυδροξυλική ομάδα· γουανιδίνη
|
Υ
|
4,0±1,1
|
1,3±0,6
|
Αδύνατη η διατύπωση πρόβλεψης
|
Όχι
|
Ναι (ασθενές)
|
|
Βενζοϊκό νάτριο
|
532-32-1
|
Αρύλιο· καρβοξυλικό οξύ
|
Σ
|
3,5±2,6
|
0,6±0,1
|
Αδύνατη η διατύπωση πρόβλεψης
|
Όχι
|
Όχι
|
|
In vivo κατηγορία 2B (83)
|
|
|
Διαιθυλοτολουαμίδιο
|
134-62-3
|
Βενζαμίδιο
|
Υ
|
15,6±6,3
|
2,8±0,9
|
Αδύνατη η διατύπωση πρόβλεψης
|
Όχι
|
Όχι
|
|
2,2-Διμεθυλο-3-μεθυλενοδικυκλο[2.2.1]επτάνιο
|
79-92-5
|
Αλκάνιο, διακλαδισμένο με τριτοταγές άτομο άνθρακα· αλκένιο· δικυκλοεπτάνιο· καρβοκυκλικές ενώσεις γεφυρωμένων δακτυλίων· κυκλοαλκάνιο
|
Σ
|
4,7±1,5
|
15,8±1,1
|
Αδύνατη η διατύπωση πρόβλεψης
|
Όχι
|
Όχι
|
|
Καμία κατηγορία in vivo
(83)
|
|
|
Αιθυλοθειικό 1-αιθυλο-3-μεθυλιμιδαζόλιο
|
342573-75-5
|
Αλκοξύ· αμμωνιακό άλας· αρύλιο· ιμιδαζόλιο· θειικό άλας
|
Υ
|
79,9±6,4
|
79,4±6,2
|
Καμία κατηγορία
|
Όχι
|
Όχι
|
|
Δικαπρυλυλικός αιθέρας
|
629-82-3
|
Αλκοξύ· αιθέρας
|
Υ
|
97,8±4,3
|
95,2±3,0
|
Καμία κατηγορία
|
Όχι
|
Όχι
|
|
Πιπερονυλοβουτοξείδιο
|
51-03-6
|
Αλκοξύ· βενζοδιοξόλη· βενζύλιο· αιθέρας
|
Υ
|
104,2±4,2
|
96,5±3,5
|
Καμία κατηγορία
|
Όχι
|
Όχι
|
|
Πολυαιθυλενογλυκόλη (PEG-40) υδρογονωμένο ρικινέλαιο
|
61788-85-0
|
Ακυλάλη· αλκοόλη· αλλύλιο· αιθέρας
|
Παχύρρευστο
|
77,6±5,4
|
89,1±2,9
|
Καμία κατηγορία
|
Όχι
|
Όχι
|
|
1-(4-Χλωροφαινυλο)-3-(3,4-διχλωροφαινυλ)ουρία
|
101-20-2
|
Αρωματικό ετεροκυκλικό αλογονίδιο· αρυλαλογονίδιο· παράγωγα ουρίας
|
Σ
|
106,7±5,3
|
101,9±6,6
|
Καμία κατηγορία
|
Όχι
|
Όχι
|
|
2,2'-Μεθυλενο-δις(6-(2H)-βενζοτριαζολ-2-υλο)-4-(1,1,3,3-τετραμεθυλοβουτυλο)-φαινόλη)
|
103597-45-1
|
Αλκάνιο, διακλαδισμένο με τεταρτοταγές άτομο άνθρακα· συμπυκνωμένες καρβοκυκλικές αρωματικές ενώσεις· συμπυκνωμένες κορεσμένες ετεροκυκλικές ενώσεις· πρόδρομες κινοειδείς ενώσεις· tert-βουτύλιο
|
Σ
|
102,7±13,4
|
97,7±5,6
|
Καμία κατηγορία
|
Όχι
|
Όχι
|
|
Τετραφθοροβορικό κάλιο
|
14075-53-7
|
Ανόργανο άλας
|
Σ
|
88,6±3,3
|
92,9±5,1
|
Καμία κατηγορία
|
Όχι
|
Όχι
|
|
Συντομογραφίες: CASRN = αριθμός μητρώου της υπηρεσίας Chemical Abstracts Service· GHS του ΟΗΕ = Παγκοσμίως Εναρμονισμένο Σύστημα Ταξινόμησης και Επισήμανσης των Χημικών Προϊόντων των Ηνωμένων Εθνών (United Nations Globally Harmonized System of Classification and Labelling of Chemicals) (1)· VRM1 = επικυρωμένη μέθοδος αναφοράς, EpiOcular™ EIT· VRM2 = επικυρωμένη μέθοδος αναφοράς, SkinEthic™ HCE EIT· Παρεμπόδιση λόγω χρώματος = παρεμπόδιση, λόγω χρώματος, της τυπικής μέτρησης απορρόφησης [οπτικής πυκνότητας (OD)] της φορμαζάνης MTT.
|
|
|
23.
|
Στο πλαίσιο της δοκιμής απόδειξης ικανότητας, συνιστάται να ελέγχουν οι χρήστες τις ιδιότητες φραγμού των ιστών σύμφωνα με τις προδιαγραφές του παραγωγού των ιστικών μορφωμάτων RhCE, μετά την παραλαβή τους (βλ. παραγράφους 25, 27 και 30). Αυτό έχει ιδιαίτερη σημασία στις περιπτώσεις μεταφοράς των ιστών σε μεγάλες αποστάσεις/με μεγάλη διάρκεια. Μετά την επιτυχή εδραίωση μιας δοκιμής και αφού επιτευχθεί και αποδειχθεί η ικανότητα χρήσης της, ο εν λόγω έλεγχος δεν είναι απαραίτητος ως συνήθης πρακτική. Παρόλα αυτά, όταν η δοκιμή εισάγεται στη συνήθη πρακτική, συνιστάται να συνεχίζεται η αξιολόγηση των ιδιοτήτων φραγμού σε τακτά διαστήματα.
|
ΔΙΑΔΙΚΑΣΙΑ
|
24.
|
Επί του παρόντος, η παρούσα μέθοδος δοκιμών καλύπτει τις επιστημονικά έγκυρες δοκιμές EpiOcular™ EIT και SkinEthic™ HCE EIT (9)(12)(13), που αναφέρονται ως «επικυρωμένη μέθοδος αναφοράς» (VRM1 και VRM2 αντίστοιχα). Οι τυποποιημένες διαδικασίες λειτουργίας (SOP) για τις μεθόδους δοκιμών RhCE είναι διαθέσιμες και θα πρέπει να χρησιμοποιούνται κατά την εφαρμογή και τη χρήση των μεθόδων δοκιμών στο εργαστήριο (34)(35). Στις ακόλουθες παραγράφους και στο προσάρτημα 2 περιγράφονται τα κύρια στοιχεία και διαδικασίες των δοκιμών RhCE.
|
ΣΤΟΙΧΕΙΑ ΤΩΝ ΜΕΘΟΔΩΝ ΔΟΚΙΜΩΝ RHCE
Γενικοί όροι
|
25.
|
Θα πρέπει να χρησιμοποιούνται σχετικά κύτταρα ανθρώπινης προέλευσης για την ανασύσταση του τρισδιάστατου ιστού επιθηλίου παρόμοιου με του κερατοειδούς, ο οποίος θα πρέπει να αποτελείται από σταδιακώς στρωματοποιημένα αλλά όχι κερατινοποιημένα κύτταρα. Το ιστικό μόρφωμα RhCE παρασκευάζεται σε ενθέματα με πορώδη συνθετική μεμβράνη μέσω της οποίας μπορούν να διέρχονται οι θρεπτικές ουσίες προς τα κύτταρα. Στο παρόμοιο με κερατοειδή ανασυσταθέν επιθήλιο θα πρέπει να υπάρχουν πολλαπλές στοιβάδες βιώσιμων, μη κερατινοποιημένων επιθηλιακών κυττάρων. Η επιθηλιακή επιφάνεια του ιστικού μορφώματος RhCE θα πρέπει να βρίσκεται σε άμεση επαφή με τον αέρα ώστε να επιτρέπεται η άμεση τοπική έκθεση στις υπό δοκιμή χημικές ουσίες κατά τρόπο ανάλογο με αυτόν διά του οποίου θα εκτίθετο το επιθήλιο του κερατοειδούς in vivo. Το ιστικό μόρφωμα RhCE θα πρέπει να σχηματίζει λειτουργικό φραγμό, ανθεκτικό στην ταχεία διείσδυση των κυτταροτοξικών ουσιών συγκριτικής αξιολόγησης, π.χ. Triton X-100 ή δωδεκυλοσουλφονικού νατρίου (SDS). Η λειτουργία φραγμού θα πρέπει να αποδεικνύεται και μπορεί να αξιολογείται μέσω του προσδιορισμού είτε του χρόνου έκθεσης που απαιτείται για τη μείωση της βιωσιμότητας των ιστών κατά 50 % (ET50) κατά την εφαρμογή ουσίας συγκριτικής αξιολόγησης σε καθορισμένη, σταθερή συγκέντρωση (π.χ. 100 μl Triton X-1000,3 % κ.ό.) είτε της συγκέντρωσης στην οποία μια ουσία συγκριτικής αξιολόγησης μειώνει τη βιωσιμότητα των ιστών κατά 50 % (IC50) μετά από καθορισμένο χρόνο διάστημα έκθεσης (π.χ. 30 λεπτά αγωγής με 50 μl SDS) (βλ. παράγραφο 30). Οι ιδιότητες συγκράτησης του ιστικού μορφώματος RhE θα πρέπει να αποτρέπουν την παράκαμψη του βιώσιμου ιστού από την υπό δοκιμή χημική ουσία, η οποία μπορεί να έχει ως αποτέλεσμα ατελή μοντελοποίηση της έκθεσης του κερατοειδούς. Τα κύτταρα ανθρώπινης προέλευσης που χρησιμοποιούνται για τη δημιουργία του ιστικού μορφώματος RhCE θα πρέπει να είναι ελεύθερα μολύνσεων από βακτήρια, ιούς, μυκόπλασμα και μύκητες. Ο προμηθευτής θα πρέπει να ελέγχει τη στειρότητα του ιστικού μορφώματος ως προς την απουσία μόλυνσης από μύκητες και βακτήρια.
|
Λειτουργικοί όροι
Βιωσιμότητα
|
26.
|
Για τον προσδιορισμό της τάξης μεγέθους της βιωσιμότητας χρησιμοποιείται η δοκιμασία MTT (16). Τα βιώσιμα κύτταρα του ιστικού μορφώματος RhCE ανάγουν τη χρωστική ζωτικής χρώσης MTT σε κυανό ίζημα άλατος φορμαζάνης ΜΤΤ, το οποίο εκχυλίζεται στη συνέχεια από τον ιστό με χρήση ισοπροπανόλης (ή παρεμφερούς διαλύτη). Η τάξη μεγέθουςτου εκχυλισθέντος άλατος φορμαζάνης MTT μπορεί να προσδιοριστεί ποσοτικά με χρήση είτε τυπικής μέτρησης απορρόφησης [οπτικής πυκνότητας (OD)] είτε μέσω διαδικασίας HPLC/UPLC-φασματοφωτομετρίας (36). Η οπτική πυκνότητα του διαλύτη εκχύλισης πρέπει να είναι αρκούντως χαμηλή, δηλαδή μικρότερη από 0,1. Οι χρήστες του ιστικού μορφώματος RhCE πρέπει να εξασφαλίζουν ότι κάθε παρτίδα του ιστικού μορφώματος RhCE πληροί καθορισμένα κριτήρια για τον αρνητικό μάρτυρα. Στον πίνακα 2 φαίνονται οι αποδεκτές κλίμακες τιμών οπτικής πυκνότητας του αρνητικού μάρτυρα για τις επικυρωμένες μεθόδους αναφοράς. Οι χρήστες HPLC/UPLC-φασματοφωτομετρίας θα πρέπει να χρησιμοποιούν τις κλίμακες τιμών οπτικής πυκνότητας αρνητικού μάρτυρα που φαίνονται στον πίνακα 2 ως κριτήριο αποδοχής για τον αρνητικό μάρτυρα. Θα πρέπει να τεκμηριώνεται στην έκθεση δοκιμής ότι οι ιστοί που υποβάλλονται σε αγωγή με τον αρνητικό μάρτυρα είναι σταθεροί σε καλλιέργεια (δηλαδή δίνουν παραπλήσιες τιμές στις μετρήσεις βιωσιμότητας ιστού) για τη διάρκεια της περιόδου έκθεσης της δοκιμής. Ο παρασκευαστής του ιστού θα πρέπει να ακολουθεί ανάλογη διαδικασία στο πλαίσιο του ποιοτικού ελέγχου για την αποδέσμευση παρτίδων ιστών, αλλά στη συγκεκριμένη περίπτωση ενδέχεται να ισχύουν διαφορετικά κριτήρια αποδοχής από εκείνα που φαίνονται στον πίνακα 2. Ο φορέας ανάπτυξης/προμηθευτής του ιστικού μορφώματος RhCE θα πρέπει να προσδιορίζει κλίμακα τιμών αποδοχής (ανώτερο και κατώτερο όριο) για τις τιμές OD αρνητικού μάρτυρα (στις συνθήκες της μεθόδου δοκιμών ποιοτικού ελέγχου).
|
Πίνακας 2
Κλίμακες τιμών αποδοχής για τις τιμές OD αρνητικού μαρτύρα (για τους χρήστες της δοκιμής)
|
Δοκιμή
|
Κατώτερο όριο αποδοχής
|
Ανώτερο όριο αποδοχής
|
|
EpiOcular™ EIT (OCL-200) – VRM1 (για τα πρωτόκολλα υγρών και στερεών)
|
> 0,8 (86)
|
< 2,5
|
|
SkinEthic™ HCE EIT (HCE/S) – VRM2 (για τα πρωτόκολλα υγρών και στερεών)
|
> 1,0
|
≤ 2,5
|
Λειτουργία φραγμού
|
27.
|
Το ιστικό μόρφωμα RhCE θα πρέπει να είναι αρκούντως παχύ και ανθεκτικό ώστε να ανθίσταται στην ταχεία διείσδυση των κυτταροτοξικών ουσιών συγκριτικής αξιολόγησης, όπως εκτιμάται π.χ. βάσει της ET50 (Triton X-100) ή της IC50 (SDS) (πίνακας 3). Η φραγματική λειτουργία κάθε παρτίδας του ιστικού μορφώματος RhCE θα πρέπει να καταδεικνύεται από τον φορέα ανάπτυξης/πωλητή του ιστικού μορφώματος RhCE κατά την προμήθεια των ιστών στον τελικό χρήστη (βλ. παράγραφο 30).
|
Μορφολογία
|
28.
|
Η ιστολογική εξέταση του ιστικού μορφώματος RhCE θα πρέπει να αναδεικνύει δομή επιθηλίου παρόμοιου με ανθρώπινο κερατοειδή (που να περιλαμβάνει τουλάχιστον 3 στοιβάδες βιώσιμων επιθηλιακών κυττάρων και μη κερατινοποιημένη επιφάνεια). Για τις επικυρωμένες μεθόδους αναφοράς, η κατάλληλη μορφολογία έχει εξακριβωθεί από τον φορέα ανάπτυξης/προμηθευτή και, ως εκ τούτου, δεν είναι απαραίτητο να καταδεικνύεται εκ νέου από χρήστη της μεθόδου δοκιμών για κάθε χρησιμοποιούμενη παρτίδα ιστών.
|
Αναπαραγωγιμότητα
|
29.
|
Τα αποτελέσματα για τους θετικούς και αρνητικούς μάρτυρες της μεθόδου δοκιμών πρέπει να εμφανίζουν διαχρονική αναπαραγωγιμότητα.
|
Έλεγχος ποιότητας
|
30.
|
Το ιστικό μόρφωμα RhCE θα πρέπει να χρησιμοποιείται μόνο εφόσον ο φορέας ανάπτυξης/προμηθευτής αποδεικνύει ότι κάθε παρτίδα του ιστικού μορφώματος RhCE ανταποκρίνεται σε καθορισμένα κριτήρια αποδέσμευσης παρτίδων παραγωγής, τα σημαντικότερα από τα οποία είναι εκείνα που αφορούν τη βιωσιμότητα (παράγραφος 26) και τη λειτουργία φραγμού (παράγραφος 27). Ο φορέας ανάπτυξης/προμηθευτής του ιστικού μορφώματος RhCE θα πρέπει να καθορίζει κλίμακα τιμών αποδοχής (ανώτερα και κατώτερα όρια) για τις λειτουργίες φραγμού όπως μετράται από τις ET50 ή IC50 (βλ. παραγράφους 25 και 26). Η κλίμακα τιμών αποδοχής των ET50 και IC50 που χρησιμοποιείται ως κριτήριο αποδέσμευσης παρτίδων ποιοτικού ελέγχου από τον φορέα ανάπτυξης/προμηθευτή των ιστικών μορφωμάτων RhCE (που χρησιμοποιούνται στις επικυρωμένες μεθόδους αναφοράς) φαίνεται στον πίνακα 3. Ο φορέας ανάπτυξης/προμηθευτής του ιστικού μορφώματος RhCE θα πρέπει να παρέχει στους χρήστες της μεθόδου δοκιμών στοιχεία που καταδεικνύουν τη συμμόρφωση με το σύνολο των κριτηρίων αποδέσμευσης παρτίδων παραγωγής ώστε να μπορούν να συμπεριλαμβάνουν τις εν λόγω πληροφορίες στην έκθεση δοκιμής. Μόνο αποτελέσματα που προκύπτουν με ιστούς που πληρούν όλα αυτά τα κριτήρια αποδέσμευσης παρτίδων παραγωγής μπορούν να γίνονται δεκτά για την πραγματοποίηση αξιόπιστης πρόβλεψης σχετικά με χημικές ουσίες που δεν επιβάλλεται να ταξινομηθούν και να επισημανθούν ως ουσίες που προκαλούν οφθαλμικό ερεθισμό ή σοβαρή οφθαλμική βλάβη με βάση το GHS του ΟΗΕ / τον κανονισμό CLP.
|
Πίνακας 3
Κριτήριο ποιοτικού ελέγχου για την αποδέσμευση παρτίδων
|
Δοκιμή
|
Κατώτερο όριο αποδοχής
|
Ανώτερο όριο αποδοχής
|
|
EpiOcular™ EIT (OCL-200) – VRM1 (100 μl Triton X-1000,3 % κ.ό.)
|
ET50 = 12,2 min
|
ET50 = 37,5 min
|
|
SkinEthic™ HCE EIT (HCE/S) – VRM2 (αγωγή 30 λεπτών με 50 μl SDS)
|
IC50 = 1 mg/ml
|
IC50 = 3,2 mg/ml
|
Εφαρμογή των υπό δοκιμή χημικών ουσιών και των μαρτύρων
|
31.
|
Σε κάθε σειρά δοκιμών πρέπει να χρησιμοποιούνται τουλάχιστον δύο πανομοιότυπα δείγματα ιστού για κάθε υπό δοκιμή χημική ουσία και κάθε μάρτυρα. Χρησιμοποιούνται δύο διαφορετικά πρωτόκολλα αγωγής, ένα για τις υγρές και ένα για τις στερεές υπό δοκιμή χημικές ουσίες (34)(35). Και για τις δύο μεθόδους, και για τα δύο πρωτόκολλα, η επιφάνεια των ιστών θα πρέπει να διαβρέχεται με αλατούχο ρυθμιστικό διάλυμα φωσφορικών ιόντων Dulbecco ελεύθερο ασβεστίου και μαγνησίου (DPBS ελεύθερο Ca2+/Mg2+) πριν από την εφαρμογή των υπό δοκιμή χημικών ουσιών, ώστε να προσομοιώνονται οι συνθήκες υγρασίας των ανθρώπινων οφθαλμών. Η αγωγή των ιστών ξεκινά με την έκθεση στην υπό δοκιμή χημική ουσία ή ουσίες και τους μάρτυρες. Και για τα δύο πρωτόκολλα αγωγής σε αμφότερες τις επικυρωμένες μεθόδους αναφοράς, θα πρέπει να εφαρμόζεται επαρκής ποσότητα της υπό δοκιμή χημικής ουσίας ή μάρτυρα ώστε να καλύπτεται ομοιόμορφα η επιφάνεια του επιθηλίου και, ταυτόχρονα, να αποφεύγονται οι πλεονάζουσες δόσεις (βλ. παραγράφους 32 και 33) (προσάρτημα 2).
|
|
32.
|
Οι υπό δοκιμή χημικές ουσίες που μπορούν να φέρονται με σιφώνιο (πιπέτα) στους 37 °C ή σε χαμηλότερες θερμοκρασίες (με χρήση σιφωνίου θετικής εκτόπισης, εάν χρειάζεται) αντιμετωπίζονται ως υγρά στις επικυρωμένες μεθόδους αναφοράς, διαφορετικά θα πρέπει να αντιμετωπίζονται ως στερεά (βλ. παράγραφο 33). Στις επικυρωμένες μεθόδους αναφοράς, οι υγρές υπό δοκιμή χημικές ουσίες επιστρώνονται ομοιόμορφα στην επιφάνεια των ιστών (δηλ. εφαρμόζονται τουλάχιστον 60 μl/cm2) (βλ. προσάρτημα 2) (33)(34). Τα τριχοειδή φαινόμενα (φαινόμενα επιφανειακής τάσης) που μπορεί να εμφανιστούν λόγω των χαμηλών όγκων που εφαρμόζονται στο ένθεμα (στην επιφάνεια του ιστού) θα πρέπει να αποφεύγονται, στο μέτρο του δυνατού, ούτως ώστε να εξασφαλίζεται η χορήγηση της ορθής ποσότητας δόσεων στον ιστό. Οι ιστοί που υποβάλλονται σε αγωγή με υγρές υπό δοκιμή χημικές ουσίες επωάζονται επί 30 λεπτά σε τυπικές συνθήκες καλλιέργειας (37±2 °C, 5±1 % CO2, ≥ 95 % RH). Στο τέλος της περιόδου έκθεσης, η υγρή υπό δοκιμή χημική ουσία και οι μάρτυρες θα πρέπει να αφαιρούνται προσεκτικά από την επιφάνεια των ιστών μέσω διεξοδικής έκπλυσης με DPBS ελεύθερο Ca2+/Mg2+ σε θερμοκρασία δωματίου. Το στάδιο έκπλυσης ακολουθείται από εμβύθιση μετά την έκθεση σε πρόσφατο θρεπτικό μέσο σε θερμοκρασία δωματίου (για την αφαίρεση τυχόν χημικής ουσίας που έχει απορροφηθεί από τον ιστό) για προκαθορισμένο χρονικό διάστημα, η διάρκεια του οποίου εξαρτάται από τη χρησιμοποιούμενη επικυρωμένη μέθοδο αναφοράς. Μόνο για τη VMR1, πριν από τη διεξαγωγή της δοκιμασίας MTT εφαρμόζεται επώαση μετά την έκθεση σε πρόσφατο θρεπτικό μέσο σε τυπικές συνθήκες καλλιέργειας [βλ. προσάρτημα 2, (34)(35)].
|
|
33.
|
Οι υπό δοκιμή χημικές ουσίες που δεν φέρονται με σιφώνιο σε θερμοκρασίες έως 37 °C αντιμετωπίζονται ως στερεά στις επικυρωμένες μεθόδους αναφοράς (VRM). Η υπό δοκιμή χημική ουσία θα πρέπει να εφαρμόζεται σε επαρκή ποσότητα ώστε να καλύπτει ολόκληρη την επιφάνεια του ιστού, θα πρέπει δηλαδή να εφαρμόζονται τουλάχιστον 60 mg/cm2 (προσάρτημα 2). Τα στερεά θα πρέπει, κατά το δυνατόν, να ελέγχονται σε μορφή λεπτόκοκκης σκόνης. Οι ιστοί που υποβάλλονται σε αγωγή με στερεές υπό δοκιμή χημικές ουσίες επωάζονται για προκαθορισμένο χρονικό διάστημα (ανάλογα με τη χρησιμοποιούμενη επικυρωμένη μέθοδο αναφοράς) σε τυπικές συνθήκες καλλιέργειας [βλ. προσάρτημα 2, (34) (35)]. Στο τέλος της περιόδου έκθεσης, η στερεή υπό δοκιμή χημική ουσία και οι μάρτυρες θα πρέπει να αφαιρούνται προσεκτικά από την επιφάνεια των ιστών μέσω διεξοδικής έκπλυσης με DPBS ελεύθερο Ca2+/Mg2+ σε θερμοκρασία δωματίου. Το στάδιο έκπλυσης ακολουθείται από εμβύθιση μετά την έκθεση σε πρόσφατο θρεπτικό μέσο σε θερμοκρασία δωματίου (για την αφαίρεση τυχόν χημικής ουσίας που έχει απορροφηθεί από τον ιστό) για προκαθορισμένο χρονικό διάστημα, η διάρκεια του οποίου εξαρτάται από τη χρησιμοποιούμενη επικυρωμένη μέθοδο αναφοράς, και επώαση μετά την έκθεση σε πρόσφατο θρεπτικό μέσο σε τυπικές συνθήκες καλλιέργειας, πριν από τη διεξαγωγή της δοκιμασίας MTT [βλ. προσάρτημα 2 (34)(35)].
|
|
34.
|
Σε κάθε σειρά δοκιμών θα πρέπει να περιλαμβάνονται αρνητικοί και θετικοί μάρτυρες προκειμένου να καταδεικνύεται ότι η βιωσιμότητα (που προσδιορίζεται με τον αρνητικό μάρτυρα) και η ευαισθησία (που προσδιορίζεται με τον θετικό μάρτυρα) των ιστών περιλαμβάνονται εντός της κλίμακας τιμών αποδοχής που καθορίζονται βάσει των ιστορικών δεδομένων. Ο παράλληλος αρνητικός μάρτυρας παρέχει επίσης τη γραμμή βάσης (βιωσιμότητα ιστού 100 %) για τον υπολογισμό της σχετικής εκατοστιαίας βιωσιμότητας των ιστών που υποβάλλονται σε αγωγή με την υπό δοκιμή χημική ουσία (%Viabilitytest). Η συνιστώμενη ουσία θετικού μάρτυρα προς χρήση με τις επικυρωμένες μεθόδους αναφοράς (VRM) είναι ο αμιγής οξικός μεθυλεστέρας (αριθ. CAS 79-20-9, διατίθεται στο εμπόριο μεταξύ άλλων από τη Sigma-Aldrich, αριθ. κατ. 45997, υγρό). Οι συνιστώμενες ουσίες αρνητικού μάρτυρα προς χρήση με τις επικυρωμένες μεθόδους αναφοράς VRM1 και VRM2 είναι το υπερκαθαρό H2O και το DPBS ελεύθερο Ca2+/Mg2+ αντίστοιχα. Αυτές ήταν οι ουσίες μάρτυρες που χρησιμοποιήθηκαν στις μελέτες επικύρωσης των επικυρωμένων μεθόδων αναφοράς και είναι οι ουσίες μάρτυρες για τις οποίες υπάρχουν τα περισσότερα ιστορικά δεδομένα. Η χρήση κατάλληλων εναλλακτικών θετικών ή αρνητικών μαρτύρων θα πρέπει να αιτιολογείται επαρκώς επιστημονικά. Οι αρνητικοί και οι θετικοί μάρτυρες θα πρέπει να υποβάλλονται σε δοκιμή με το ή τα ίδια πρωτόκολλα με αυτά που χρησιμοποιούνται για τις υπό δοκιμή χημικές ουσίες που περιλαμβάνονται στη σειρά δοκιμών (δηλ. για τα υγρά και/ή τα στερεά). Η εφαρμογή θα πρέπει να ακολουθείται από έκθεση αγωγής, έκπλυση, εμβύθιση μετά την έκθεση, και επώαση μετά την έκθεση κατά περίπτωση, όπως περιγράφεται για τους μάρτυρες που υποβάλλονται σε δοκιμή παράλληλα με τις υγρές υπό δοκιμή χημικές ουσίες (βλ. παράγραφο 32) ή για τους μάρτυρες που υποβάλλονται σε δοκιμή παράλληλα με τις στερεές υπό δοκιμή χημικές ουσίες (βλ. παράγραφο 33), πριν από τη διεξαγωγή της δοκιμασίας MTT (βλ. παράγραφο 35) (34)(35). Ένα μόνο σύνολο αρνητικών και θετικών μαρτύρων αρκεί για όλες τις υπό δοκιμή χημικές ουσίες της ίδιας φυσικής κατάστασης (υγρά ή στερεά) που περιλαμβάνονται στην ίδια σειρά δοκιμών.
|
Μετρήσεις βιωσιμότητας ιστών
|
35.
|
Η δοκιμασία MTT αποτελεί τυποποιημένη ποσοτική μέθοδο (16) η οποία πρέπει να χρησιμοποιείται για τη μέτρηση της βιωσιμότητας των ιστών στο πλαίσιο της παρούσας μεθόδου δοκιμών. Είναι συμβατή με τη χρήση σε τρισδιάστατο ιστικό μόρφωμα. Η δοκιμασία MTT διεξάγεται αμέσως μετά την περίοδο επώασης μετά την έκθεση. Στις επικυρωμένες μεθόδους αναφοράς (VRM), το δείγμα ιστικού μορφώματος RhCE τοποθετείται σε 0,3 ml διαλύματος MTT 1 mg/ml επί 180±15 λεπτά σε τυπικές συνθήκες καλλιέργειας. Η χρωστική ζωτικής χρώσης MTT ανάγεται σε κυανό ίζημα άλατος φορμαζάνης ΜΤΤ από τα βιώσιμα κύτταρα του ιστικού μορφώματος RhCE. Στη συνέχεια, εκχυλίζεται από τον ιστό το σχηματιζόμενο κυανό ίζημα άλατος φορμαζάνης MTT με χρήση κατάλληλου όγκου ισοπροπανόλης (ή παρεμφερούς διαλύτη) (34)(35). Οι ιστοί που υποβάλλονται σε δοκιμή με υγρές υπό δοκιμή χημικές ουσίες θα πρέπει να εκχυλίζονται από το επάνω και το κάτω μέρος των ιστών, ενώ οι ιστοί που υποβάλλονται σε δοκιμή με στερεές υπό δοκιμή χημικές ουσίες και έγχρωμα υγρά θα πρέπει να εκχυλίζονται μόνο από το κάτω μέρος του ιστού (ώστε να ελαχιστοποιείται τυχόν μόλυνση του διαλύματος εκχύλισης ισοπροπανόλης με υπό δοκιμή χημική ουσία που ενδεχομένως έχει παραμείνει στον ιστό). Οι ιστοί που υποβάλλονται σε δοκιμή με υγρές υπό δοκιμή χημικές ουσίες οι οποίες δεν απομακρύνονται εύκολα με έκπλυση μπορούν επίσης να εκχυλίζονται μόνο από το κάτω μέρος του ιστού. Οι αρνητικοί και θετικοί μάρτυρες που εξετάζονται παράλληλα θα πρέπει να αντιμετωπίζονται με τρόπο ανάλογο με αυτόν της υπό δοκιμή χημικής ουσίας. Το εκχυλισθέν άλας φορμαζάνης MTT μπορεί να προσδιορίζεται ποσοτικά είτε μέσω τυπικής μέτρησης απορρόφησης (OD) στα 570 nm με φίλτρο μέγιστης ζώνης διάβασης ±30 nm είτε μέσω διαδικασίας HPLC/UPLC-φασματοφωτομετρίας (βλ. παράγραφο 42) (11)(36).
|
|
36.
|
Οι οπτικές ιδιότητες της υπό δοκιμή χημικής ουσίας ή η χημική δράση της επί της MTT μπορεί να παρεμποδίσουν τη μέτρηση του άλατος φορμαζάνης MTT, με αποτέλεσμα εσφαλμένη εκτίμηση της βιωσιμότητας των ιστών. Οι υπό δοκιμή χημικές ουσίες μπορεί να παρεμποδίσουν τη μέτρηση του άλατος φορμαζάνης MTT επειδή ανάγουν άμεσα την MTT σε κυανή φορμαζάνη ΜΤΤ και/ή επειδή δρουν παρεμποδιστικά ως έγχρωμες ουσίες, εάν η υπό δοκιμή χημική ουσία απορροφά το φως, εκ φύσεως ή κατά την αγωγή, στο ίδιο φάσμα με τη φορμαζάνη ΜΤΤ (δηλ. περίπου στα 570 nm). Θα πρέπει να διενεργούνται προέλεγχοι πριν από τη δοκιμή προκειμένου να επιτρέπεται ο προσδιορισμός των δυνητικών άμεσων αναγωγικών της MTT και/ή των έγχρωμων χημικών ουσιών με παρεμποδιστική δράση, και θα πρέπει να διενεργούνται πρόσθετοι έλεγχοι για την ανίχνευση και τη διόρθωση της δυνητικής παρεμποδιστικής δράσης των εν λόγω υπό δοκιμή χημικών ουσιών (βλ. παραγράφους 37-41). Αυτό είναι ιδιαίτερα σημαντικό όταν μια συγκεκριμένη υπό δοκιμή χημική ουσία δεν απομακρύνεται ολοκληρωτικά από το ιστικό μόρφωμα RhCE μέσω έκπλυσης ή όταν διαπερνά το παρόμοιο με κερατοειδή επιθήλιο, και, ως εκ τούτου, εξακολουθεί να είναι παρούσα στα ιστικά μορφώματα RhCE κατά την εκτέλεση της δοκιμασίας MTT. Όσον αφορά υπό δοκιμή χημικές ουσίες που απορροφούν το φως στο ίδιο φάσμα με αυτό του άλατος φορμαζάνης MTT (εκ φύσεως ή μετά από αγωγή), οι οποίες δεν είναι συμβατές με την τυπική μέτρηση απορρόφησης (OD) της φορμαζάνης MTT λόγω υπέρμετρα ισχυρής παρεμποδιστικής δράσης, δηλαδή ισχυρή απορρόφηση στα 570±30 nm, μπορεί να χρησιμοποιείται διαδικασία HPLC/UPLC-φασματοφωτομετρίας για τη μέτρηση του άλατος φορμαζάνης MTT (βλ. παραγράφους 41 και 42) (11)(36). Ο τρόπος ανίχνευσης και διόρθωσης της άμεσης αναγωγής της MTT και της παρεμποδιστικής δράσης των έγχρωμων ουσιών περιγράφεται λεπτομερώς στις SOP των επικυρωμένων μεθόδων αναφοράς (34)(35). Επεξηγηματικά διαγράμματα ροής που παρέχουν καθοδήγηση σχετικά με τον τρόπο προσδιορισμού και μεταχείρισης των άμεσων αναγωγικών της MTT και/ή των έγχρωμων ουσιών με παρεμποδιστική δράση για τις VRM1 και VRM2 παρέχονται επίσης στα προσαρτήματα III και IV αντίστοιχα.
|
|
37.
|
Για τον προσδιορισμό της δυνητικής παρεμποδιστικής δράσης υπό δοκιμή χημικών ουσιών που απορροφούν το φως στο ίδιο φάσμα με αυτό του άλατος φορμαζάνης MTT (εκ φύσεως ή μετά από αγωγή) και τη λήψη απόφασης σχετικά με την ανάγκη πρόσθετων μαρτύρων, η υπό δοκιμή χημική ουσία προστίθεται σε νερό και/ή ισοπροπανόλη και επωάζεται για κατάλληλο χρονικό διάστημα σε θερμοκρασία δωματίου [βλ. προσάρτημα 2, (34)(35)]. Εάν η υπό δοκιμή χημική ουσία σε νερό και/ή ισοπροπανόλη απορροφά επαρκή ποσότητα φωτός στο φάσμα 570±20 nm για τη VRM1 (βλ. προσάρτημα 3), ή εάν λαμβάνεται έγχρωμο διάλυμα όταν αναμιγνύεται η υπό δοκιμή χημική ουσία με νερό για τη VRM2 (βλ. προσάρτημα 4), η υπό δοκιμή χημική ουσία θεωρείται ότι παρεμποδίζει την τυπική μέτρηση απορρόφησης (OD) του άλατος φορμαζάνης MTT και θα πρέπει να διενεργούνται περαιτέρω έλεγχοι για τις έγχρωμες ουσίες ή, εναλλακτικά, θα πρέπει να χρησιμοποιείται διαδικασία HPLC/UPLC-φασματοφωτομετρίας, οπότε οι εν λόγω έλεγχοι δεν είναι απαραίτητοι (βλ. παραγράφους 41 και 42 και προσαρτήματα III και IV)(34)(35). Κατά την πραγματοποίηση της τυπικής μέτρησης απορρόφησης (OD), κάθε υπό δοκιμή χημική ουσία με παρεμποδιστική δράση εφαρμόζεται τουλάχιστον σε δύο πανομοιότυπα δείγματα βιώσιμου ιστού, τα οποία υποβάλλονται σε όλα τα στάδια της δοκιμής, αλλά τα οποία επωάζονται με θρεπτικό μέσο αντί διαλύματος MTT κατά το στάδιο της επώασης της MTT προκειμένου να χρησιμεύσουν ως μάρτυρας μη ειδικού χρώματος σε ζώντες ιστούς (NSCliving) (34)(35). Ο έλεγχος μάρτυρα NSCliving πρέπει να διενεργείται ταυτόχρονα με τον έλεγχο της έγχρωμης υπό δοκιμή χημικής ουσίας και, σε περίπτωση πολλαπλών δοκιμών, πρέπει να διεξάγεται ανεξάρτητος έλεγχος NSCliving με κάθε εκτελούμενη δοκιμή (σε κάθε σειρά δοκιμών) λόγω της εγγενούς βιολογικής μεταβλητότητας των ζωντανών ιστών. Η πραγματική βιωσιμότητα των ιστών υπολογίζεται ως εξής: η εκατοστιαία βιωσιμότητα των ιστών που μετρήθηκε με ζωντανούς ιστούς που εκτέθηκαν στην παρεμποδιστική υπό δοκιμή χημική ουσία και επωάστηκαν με το διάλυμα ΜΤΤ (%Viabilitytest) μείον την εκατοστιαία μη ειδική εμφάνιση χρώματος που μετρήθηκε με τους ζωντανούς ιστούς που εκτέθηκαν στην παρεμποδιστική υπό δοκιμή χημική ουσία και επωάστηκαν με θρεπτικό μέσο χωρίς ΜΤΤ ταυτόχρονα με την υπό διόρθωση δοκιμή (%NSCliving), δηλαδή πραγματική βιωσιμότητα ιστών = [%Viabilitytest] - [%NSCliving].
|
|
38.
|
Για τον προσδιορισμό των άμεσων αναγωγικών της MTT, κάθε υπό δοκιμή χημική ουσία θα πρέπει να προστίθεται σε πρόσφατο διάλυμα MTT. Κατάλληλη ποσότητα υπό δοκιμή χημικής ουσίας προστίθεται σε διάλυμα MTT και το μείγμα επωάζεται για περίπου 3 ώρες σε τυπικές συνθήκες καλλιέργειας (βλ. προσαρτήματα III και IV)(34)(35). Εάν το μείγμα MTT που περιέχει την υπό δοκιμή χημική ουσία (ή εναιώρημα για τις μη διαλυτές υπό δοκιμή χημικές ουσίες) αποκτήσει κυανό/ιώδες χρώμα, η υπό δοκιμή χημική ουσία θεωρείται ότι ανάγει άμεσα την MTT και, επομένως, θα πρέπει να διενεργείται περαιτέρω λειτουργικός έλεγχος σε μη βιώσιμα ιστικά μορφώματα RhCE, ανεξάρτητα από τη χρήση της τυπικής μέτρησης απορρόφησης (OD) ή διαδικασίας HPLC/UPLC-φασματοφωτομετρίας. Σε αυτόν τον πρόσθετο λειτουργικό έλεγχο χρησιμοποιούνται αδρανοποιημένοι ιστοί με υπολειμματική μόνο μεταβολική δραστηριότητα, οι οποίοι, ωστόσο, απορροφούν και κατακρατούν την υπό δοκιμή χημική ουσία σε βαθμό παρόμοιο με τους βιώσιμους ιστούς. Οι αδρανοποιημένοι ιστοί της VRM1 παρασκευάζονται με έκθεση σε χαμηλή θερμοκρασία («αδρανοποιημένοι με κατάψυξη»). Οι αδρανοποιημένοι ιστοί της VRM2 παρασκευάζονται με παρατεταμένη επώαση (π.χ. τουλάχιστον 24±1 ώρες) σε νερό, ακολουθούμενη από φύλαξη σε χαμηλή θερμοκρασία («αδρανοποιημένοι με νερό»). Κάθε υπό δοκιμή χημική ουσία που ανάγει την MTT εφαρμόζεται σε τουλάχιστον δύο αδρανοποιημένα πανομοιότυπα δείγματα ιστού τα οποία υποβάλλονται σε όλα τα στάδια της διαδικασίας δοκιμής προκειμένου να προκληθεί μη ειδική αναγωγή της MTT (NSMTT) (34)(35). Ένας μοναδικός μάρτυρας NSMTT ανά υπό δοκιμή χημική ουσία αρκεί, ανεξάρτητα από τον αριθμό των ανεξάρτητων δοκιμών/σειρών δοκιμών που διεξάγονται. Η πραγματική βιωσιμότητα των ιστών υπολογίζεται ως εξής: η εκατοστιαία βιωσιμότητα των ιστών που μετρήθηκε με ζωντανούς ιστούς που εκτέθηκαν στο αναγωγικό της MTT (%Viabilitytest) μείον την εκατοστιαία μη ειδική αναγωγή της MTT που μετρήθηκε με τους αδρανοποιημένους ιστούς που εκτέθηκαν στο ίδιο αναγωγικό της MTT, υπολογιζόμενη σε σχέση με τον αρνητικό μάρτυρα που ελέγχθηκε ταυτόχρονα με την υπό διόρθωση δοκιμή (%NSMTT), δηλαδή πραγματική βιωσιμότητα ιστών = [%Viabilitytest] – [%NSMTT].
|
|
39.
|
Για τις υπό δοκιμή χημικές ουσίες που διαπιστώνεται ότι παρουσιάζουν τόσο παρεμποδιστική δράση λόγω χρώματος (βλ. παράγραφο 37) όσο και άμεση αναγωγή της MTT (βλ. παράγραφο 38) θα απαιτηθεί επίσης ένα τρίτο σύνολο μαρτύρων κατά την εκτέλεση της τυπικής μέτρησης απορρόφησης (OD), πέραν των μαρτύρων NSMTT και NSCliving που περιγράφονται στις προηγούμενες παραγράφους. Αυτό συμβαίνει συνήθως σε περιπτώσεις σκουρόχρωμων υπό δοκιμή χημικών ουσιών που απορροφούν το φως στο φάσμα 570±30 nm (π.χ. κυανές, ιώδεις, μαύρες), διότι το εγγενές χρώμα τους παρεμποδίζει την αξιολόγηση της ικανότητάς τους να ανάγουν απευθείας την MTT όπως περιγράφεται στην παράγραφο 38. Κατά συνέπεια, μαζί με τους μάρτυρες NSCliving χρειάζεται κατά κανόνα να χρησιμοποιούνται και μάρτυρες NSMTT. Υπό δοκιμή χημικές ουσίες για τις οποίες εκτελούνται αμφότεροι οι έλεγχοι μαρτύρων NSMTT και NSCliving μπορεί να απορροφηθούν και να συγκρατηθούν από τους ζωντανούς και τους αδρανοποιημένους ιστούς. Ως εκ τούτου, σε αυτή την περίπτωση, ο μάρτυρας NSMTT μπορεί να διορθώσει τη δοκιμή όχι μόνο ως προς την πιθανή άμεση αναγωγή της MTT από την υπό δοκιμή χημική ουσία αλλά και ως προς την παρεμπόδιση λόγω χρώματος που οφείλεται στην απορρόφηση της υπό δοκιμή χημικής ουσίας από τους αδρανοποιημένους ιστούς. Κατ’ αυτόν τον τρόπο ενδέχεται να προκύψει διπλή διόρθωση ως προς την παρεμπόδιση λόγω χρώματος, δεδομένου ότι ο μάρτυρας NSCliving διορθώνει ήδη τη δοκιμή ως προς τηνπαρεμπόδιση λόγω χρώματος που οφείλεται στην απορρόφηση της υπό δοκιμή χημικής ουσίας από τους ζωντανούς ιστούς. Για την αποφυγή πιθανής διπλής διόρθωσης ως προς την παρεμπόδιση λόγω χρώματος, πρέπει να χρησιμοποιείται τρίτος μάρτυρας μη ειδικής εμφάνισης χρώματος σε αδρανοποιημένους ιστούς (NSCkilled) (βλ. προσαρτήματα III και IV)(34)(35). Σε αυτόν τον πρόσθετο μάρτυρα, η υπό δοκιμή χημική ουσία εφαρμόζεται σε τουλάχιστον δύο πανομοιότυπα δείγματα αδρανοποιημένου ιστού, τα οποία υποβάλλονται σε όλα τα στάδια της διαδικασίας δοκιμής αλλά τα οποία επωάζονται με θρεπτικό μέσο αντί διαλύματος ΜΤΤ κατά το στάδιο της επώασης ΜΤΤ. Ένας μοναδικός μάρτυρας NSCkilled ανά υπό δοκιμή χημική ουσία αρκεί, ανεξάρτητα από τον αριθμό των ανεξάρτητων δοκιμών δοκιμών/σειρών δοκιμών που εκτελούνται, αλλά θα πρέπει να χρησιμοποιείται ταυτόχρονα με τον μάρτυρα NSMTT και με την ίδια παρτίδα ιστών. Η πραγματική βιωσιμότητα των ιστών υπολογίζεται ως εξής: η εκατοστιαία βιωσιμότητα των ιστών που μετρήθηκε με ζωντανούς ιστούς που εκτέθηκαν στην υπό δοκιμή χημική ουσία (%Viabilitytest) μείον τον %NSMTT μείον τον %NSCliving
συν την εκατοστιαία μη ειδική εμφάνιση χρώματος που μετρήθηκε με τους αδρανοποιημένους ιστούς που εκτέθηκαν στην παρεμποδιστική υπό δοκιμή χημική ουσία και επωάστηκαν με θρεπτικό μέσο χωρίς ΜΤΤ, υπολογιζόμενη σε σχέση με τον αρνητικό μάρτυρα που χρησιμοποιήθηκε ταυτόχρονα με την υπό διόρθωση δοκιμή (%NSCkilled), ήτοι: πραγματική βιωσιμότητα ιστών = [%Viabilitytest] – [%NSMTT] – [%NSCliving] + [%NSCkilled].
|
|
40.
|
Είναι σημαντικό να επισημανθεί ότι οι παρεμποδίσεις λόγω μη ειδικής αναγωγής της MTT και λόγω μη ειδικού χρώματος ενδέχεται να αυξήσουν την OD (κατά την εκτέλεση μετρήσεων απορρόφησης προτύπου) του εκχυλίσματος ιστού πάνω από την περιοχή γραμμικότητας του φασματοφωτόμετρου, και ότι η μη ειδική αναγωγή της MTT μπορεί επίσης να αυξήσει το εμβαδόν της κορυφής του άλατος φορμαζάνης MTT (κατά την εκτέλεση μετρήσεων HPLC/UPLC-φασματοφωτομετρίας) του εκχυλίσματος ιστού πάνω από την περιοχή γραμμικότητας του φασματοφωτόμετρου. Με βάση τα παραπάνω, είναι σημαντικό κάθε εργαστήριο να καθορίζει την περιοχή τιμών γραμμικότητας OD / εμβαδού κορυφής του φασματοφωτόμετρού του π.χ. με φορμαζάνη MTT (CAS # 57360-69-7), η οποία διατίθεται στο εμπόριο π.χ. από τη Sigma-Aldrich (αρ. κατ. M2003), προτού ξεκινήσει τις δοκιμές χημικών ουσιών για κανονιστικούς σκοπούς.
|
|
41.
|
Η τυπική μέτρηση απορρόφησης (OD) με χρήση φασματοφωτόμετρου είναι κατάλληλη για την αξιολόγηση των υπό δοκιμή χημικών ουσιών που είναι άμεσα αναγωγικά της MTT και των παρεμποδιστικών λόγω χρώματος χημικών ουσιών, όταν η παρατηρούμενη παρεμπόδιση της μέτρησης του άλατος φορμαζάνης της MTT δεν είναι ιδιαίτερα ισχυρή (δηλαδή οι OD των εκχυλισμάτων που μετρώνται με την υπό δοκιμή χημική ουσία χωρίς καμία διόρθωση ως προς την άμεση αναγωγή της MTT και/ή την παρεμπόδιση λόγω χρώματος περιλαμβάνονται εντός της περιοχής γραμμικότητας του φασματοφωτόμετρου). Εντούτοις, τα αποτελέσματα για υπό δοκιμή χημικές ουσίες σε σχέση με τις οποίες προκύπτει %NSMTT και/ή %NSCliving ≥ 60 % (VRM1, και VRM2 για το πρωτόκολλο υγρών) ή 50 % (VRM2 για το πρωτόκολλο στερεών) του αρνητικού μάρτυρα θα πρέπει να λαμβάνονται υπόψη με επιφυλακτικότητα, διότι αυτή είναι η τιμή αποκοπής που χρησιμοποιείται στις επικυρωμένες μεθόδους αναφοράς (VRM) για τη διάκριση μεταξύ ταξινομημένων και μη ταξινομημένων χημικών ουσιών (βλ. παράγραφο 44). Ωστόσο, η τυπική απορρόφηση (OD) δεν μπορεί να μετρηθεί όταν η παρεμπόδιση της μέτρησης του άλατος φορμαζάνης ΜΤΤ είναι ιδιαίτερα ισχυρή (δηλαδή δίνει μη διορθωμένες οπτικές πυκνότητες των εκχυλισμάτων ιστού δοκιμής που βρίσκονται εκτός της περιοχής γραμμικότητας του φασματοφωτόμετρου). Οι έγχρωμες υπό δοκιμή χημικές ουσίες ή οι υπό δοκιμή χημικές ουσίες που καθίστανται έγχρωμες όταν έρχονται σε επαφή με το νερό ή την ισοπροπανόλη και οι οποίες παρεμποδίζουν υπέρμετρα την τυπική μέτρηση απορρόφησης (OD) του άλατος φορμαζάνης της MTT μπορούν, ωστόσο, να αξιολογούνται με χρήση HPLC/UPLC-φασματοφωτομετρίας (βλ. προσαρτήματα III και IV). Αυτό οφείλεται στο ότι το σύστημα HPLC/UPLC επιτρέπει τον διαχωρισμό της φορμαζάνης MTT από τη χημική ουσία πριν από τον ποσοτικό προσδιορισμό της (36). Για αυτόν τον λόγο, δεν χρειάζονται ποτέ μάρτυρες NSCliving ή NSCkilled όταν χρησιμοποιείται HPLC/UPLC-φασματοφωτομετρία, ανεξάρτητα από την υπό δοκιμή χημική ουσία. Εντούτοις, μάρτυρες NSMTT θα πρέπει να χρησιμοποιούνται σε περίπτωση που υπάρχουν υπόνοιες ότι η υπό δοκιμή χημική ουσία ανάγει άμεσα την MTT (βάσει της διαδικασίας που περιγράφεται στην παράγραφο 38). Μάρτυρες NSMTT θα πρέπει επίσης να χρησιμοποιούνται με υπό δοκιμή χημικές ουσίες που έχουν χρώμα (εγγενές ή εμφανιζόμενο κατά την επαφή με νερό) που παρεμποδίζει την αξιολόγηση της ικανότητας άμεσης αναγωγής της MTT, όπως περιγράφεται στην παράγραφο 38. Όταν γίνεται χρήση HPLC/UPLC-φασματοφωτομετρίας για τη μέτρηση της φορμαζάνης MTT, η εκατοστιαία βιωσιμότητα των ιστών υπολογίζεται ως το ποσοστό του εμβαδού της κορυφής της φορμαζάνης MTT που μετράται με ζωντανούς ιστούς που εκτίθενται στην υπό δοκιμή χημική ουσία σε σχέση με την κορυφή της φορμαζάνης MTT που μετράται με τον παράλληλο αρνητικό μάρτυρα. Για τις υπό δοκιμή χημικές ουσίες που ανάγουν άμεσα την MTT, η πραγματική βιωσιμότητα υπολογίζεται ως εξής: %Viabilitytest
μείον %NSMTT, όπως περιγράφεται στην τελευταία πρόταση της παραγράφου 38. Τέλος, πρέπει να επισημανθεί ότι οι άμεσοι αναγωγείς της MTT ή οι άμεσοι αναγωγείς της ΜΤΤ οι οποίοι έχουν επίσης παρεμποδιστική δράση λόγω χρώματος, και οι οποίοι κατακρατούνται στους ιστούς μετά την αγωγή και ανάγουν την MTT σε τέτοιο βαθμό ώστε να δίνουν OD (με τυπική μέτρηση OD) ή εμβαδά κορυφών (με χρήση UPLC/HPLC-φασματοφωτομετρίας) εκτός της περιοχής γραμμικότητας του φασματοφωτόμετρου, δεν μπορούν να αξιολογηθούν με μεθόδους δοκιμών RhCE, αν και δεν αναμένεται να εμφανίζονται παρά σε πολύ σπάνιες περιπτώσεις.
|
|
42.
|
Η HPLC/UPLC-φασματοφωτομετρία μπορεί να χρησιμοποιηθεί με όλα τα είδη υπό δοκιμή χημικών ουσιών (έγχρωμων, μη έγχρωμων, αναγωγικών της MTT και μη αναγωγικών της MTT) για τη μέτρηση της φορμαζάνης MTT (11)(36). Λόγω της ποικιλίας των συστημάτων HPLC/UPLC-φασματοφωτομετρίας, δεν είναι εφικτό ο κάθε χρήστης να διασφαλίσει την ύπαρξη πανομοιότυπων συνθηκών συστήματος. Για τον λόγο αυτό, πριν από τη χρήση του συστήματος HPLC/UPLC-φασματοφωτομετρίας για τον ποσοτικό προσδιορισμό της φορμαζάνης MTT από εκχυλίσματα ιστών, θα πρέπει να καταδεικνύεται η καταλληλότητά του για τον συγκεκριμένο σκοπό διά της εκπλήρωσης των κριτηρίων αποδοχής για σειρά τυποποιημένων παραμέτρων συμμόρφωσης που βασίζονται στις παραμέτρους που περιγράφονται στην καθοδήγηση της αμερικανικής Υπηρεσίας Τροφίμων και Φαρμάκων για τον κλάδο σχετικά με την επικύρωση των βιοαναλυτικών μεθόδων (36)(38). Οι εν λόγω κύριες παράμετροι και τα κριτήρια αποδοχής τους παρατίθενται στο προσάρτημα 5. Εφόσον εκπληρούνται τα κριτήρια αποδοχής που καθορίζονται στο προσάρτημα 5, το σύστημα HPLC/UPLC-φασματοφωτομετρίας θεωρείται κατάλληλο και έτοιμο για μέτρηση της φορμαζάνης MTT υπό τις πειραματικές συνθήκες που περιγράφονται στην παρούσα μέθοδο δοκιμών.
|
Κριτήρια αποδοχής
|
43.
|
Για κάθε σειρά δοκιμών στην οποία γίνεται χρήση παρτίδων ιστών RhCE που έχει διαπιστωθεί ότι πληρούν τα κριτήρια ποιοτικού ελέγχου (βλ. παράγραφο 30), οι ιστοί που υποβάλλονται σε αγωγή με τον αρνητικό μάρτυρα θα πρέπει να παρουσιάζουν οπτική πυκνότητα αντιπροσωπευτική της ποιότητας των ιστών μετά τα στάδια αποστολής και παραλαβής και τις διεργασίες πρωτοκόλλου και δεν θα πρέπει να βρίσκονται εκτός των καθορισμένων ορίων που εμφαίνονται στον πίνακα 2 (βλ. παράγραφο 26). Παρομοίως, οι ιστοί που υποβάλλονται σε αγωγή με τον θετικό μάρτυρα, δηλ. τον οξικό μεθυλεστέρα, θα πρέπει να παρουσιάζουν μέση βιωσιμότητα ιστών < 50 % σε σχέση με τον αρνητικό μάρτυρα στην VRM1 με χρήση των πρωτοκόλλων υγρών ή στερεών, και ≤ 30 % (πρωτόκολλο υγρών) ή ≤ 20 % (πρωτόκολλο στερεών) σε σχέση με τον αρνητικό μάρτυρα στην VRM2, ούτως ώστε να αντικατοπτρίζεται η ικανότητά τους να αποκρίνονται σε ερεθιστική υπό δοκιμή χημική ουσία υπό τις συνθήκες της μεθόδου δοκιμών (34)(35). Η μεταβλητότητα της δράσης των υπό δοκιμή χημικών ουσιών και των μαρτύρων μεταξύ των πανομοιότυπων δειγμάτων ιστών θα πρέπει να περιλαμβάνεται εντός των αποδεκτών ορίων (δηλαδή η διαφορά βιωσιμότητας μεταξύ δύο πανομοιότυπων δειγμάτων ιστών δεν θα πρέπει να υπερβαίνει το 20 % ή η τυπική απόκλιση (SD) μεταξύ τριών πανομοιότυπων δειγμάτων ιστών δεν θα πρέπει να υπερβαίνει το 18 %). Σε περίπτωση που είτε ο αρνητικός είτε ο θετικός μάρτυρας που περιλαμβάνονται σε μια σειρά δοκιμών είναι εκτός των αποδεκτών πεδίων τιμών, η σειρά θεωρείται ότι δεν πληροί τα κριτήρια και θα πρέπει να επαναλαμβάνεται. Εάν η μεταβλητότητα της δράσης μιας υπό δοκιμή χημικής ουσίας μεταξύ πανομοιότυπων δειγμάτων ιστών είναι εκτός του αποδεκτού πεδίου τιμών, η δοκιμή πρέπει να θεωρείται ότι δεν πληροί τα κριτήρια και θα πρέπει να επαναλαμβάνεται.
|
Ερμηνεία των αποτελεσμάτων και μοντέλο πρόβλεψης
|
44.
|
Οι τιμές OD / τα εμβαδά κορυφής που μετρώνται με τα εκχυλίσματα πανομοιότυπων δειγμάτων ιστών για κάθε υπό δοκιμή χημική ουσία θα πρέπει να χρησιμοποιούνται για τον υπολογισμό της μέσης εκατοστιαίας βιωσιμότητας των ιστών (μέση τιμή μεταξύ πανομοιότυπων δειγμάτων ιστών), κανονικοποιημένης ως προς τον αρνητικό μάρτυρα, ο οποίος ορίζεται ίσος με 100 %. Στον πίνακα 4 φαίνεται η εκατοστιαία τιμή αποκοπής για τη βιωσιμότητα των ιστών κατά τον προσδιορισμό υπό δοκιμή χημικών ουσιών οι οποίες δεν επιβάλλεται να ταξινομηθούν ως προς τον οφθαλμικό ερεθισμό ή τη σοβαρή οφθαλμική βλάβη (καμία κατηγορία κατά GHS του ΟΗΕ και κανονισμό CLP). Ως εκ τούτου, τα αποτελέσματα ερμηνεύονται ως εξής:
|
—
|
Η υπό δοκιμή χημική ουσία χαρακτηρίζεται ουσία για την οποία δεν επιβάλλεται ταξινόμηση και επισήμανση βάσει του GHS του ΟΗΕ και του κανονισμού CLP (καμία κατηγορία) εάν η μέση εκατοστιαία βιωσιμότητα των ιστών μετά την έκθεση και την επώαση μετά την έκθεση υπερβαίνει (>) την καθορισμένη εκατοστιαία τιμή αποκοπής βιωσιμότητας των ιστών, όπως φαίνεται στον πίνακα 4. Σε αυτή την περίπτωση, δεν είναι απαραίτητη η δοκιμή με άλλες μεθόδους.
|
|
—
|
Εάν η μέση εκατοστιαία βιωσιμότητα των ιστών μετά την έκθεση και την επώαση μετά την έκθεση είναι μικρότερη ή ίση με την καθορισμένη εκατοστιαία τιμή αποκοπής για την ιστική βιωσιμότητα, δεν μπορεί να γίνει πρόβλεψη, όπως φαίνεται στον πίνακα 4. Σε αυτή την περίπτωση θα χρειαστεί δοκιμή με άλλες μεθόδους, διότι οι μέθοδοι δοκιμών RhCE δίνουν ένα ορισμένο ποσοστό ψευδοθετικών αποτελεσμάτων (βλ. παραγράφους 14-15) και δεν είναι εφικτή η διάκριση μεταξύ των κατηγοριών 1 και 2 του GHS του ΟΗΕ και του κανονισμού CLP (βλ. παράγραφο 17).
|
Πίνακας 4
Μοντέλα πρόβλεψης βάσει της ταξινόμησης του GHS του ΟΗΕ και του κανονισμού CLP
|
VRM
|
Καμία κατηγορία
|
Αδύνατη η διατύπωση πρόβλεψης
|
|
VRM 1 - EpiOcular™ EIT (και για τα δύο πρωτόκολλα)
|
Μέση βιωσιμότητα ιστών > 60 %
|
Μέση βιωσιμότητα ιστών ≤ 60 %
|
|
VRM 2 - SkinEthic™ HCE EIT (για το πρωτόκολλο υγρών)
|
Μέση βιωσιμότητα ιστών > 60 %
|
Μέση βιωσιμότητα ιστών ≤ 60 %
|
|
VRM2 - SkinEthic™ HCE EIT (για το πρωτόκολλο στερεών)
|
Μέση βιωσιμότητα ιστών > 50 %
|
Μέση βιωσιμότητα ιστών ≤ 50 %
|
|
|
45.
|
Για τις υπό δοκιμή χημικές ουσίες των οποίων το αποτέλεσμα δεν επιδέχεται αμφισβήτηση, αρκεί μία μόνο δοκιμή, αποτελούμενη από δύο τουλάχιστον πανομοιότυπα δείγματα ιστού. Όταν όμως το αποτέλεσμα είναι οριακό, όπως η ασυμφωνία μεταξύ των μετρήσεων των πανομοιότυπων δειγμάτων και/ή μια μέση εκατοστιαία τιμή βιωσιμότητας ιστών ίση με 60 ± 5 % (VRM1, και VRM2 για το πρωτόκολλο υγρών) ή 50 ± 5 % (VRM2 για το πρωτόκολλο στερεών), θα πρέπει να εξετάζεται το ενδεχόμενο εκτέλεσης δεύτερης δοκιμής, ακόμη και τρίτης δοκιμής, σε περίπτωση ασυμφωνίας μεταξύ των αποτελεσμάτων των δύο πρώτων δοκιμών.
|
|
46.
|
Ανάλογα με την περίπτωση και εφόσον αιτιολογείται, μπορεί να εξετάζεται το ενδεχόμενο καθορισμού διαφορετικών εκατοστιαίων τιμών αποκοπής για τη βιωσιμότητα ιστών για συγκεκριμένους τύπους μειγμάτων, προκειμένου να αυξηθούν οι συνολικές επιδόσεις της μεθόδου δοκιμών για τους συγκεκριμένους τύπους μειγμάτων (βλ. παράγραφο 14). Η χρήση χημικών ουσιών συγκριτικής αξιολόγησης μπορεί να είναι χρήσιμη για την αξιολόγηση του δυναμικού πρόκλησης σοβαρής οφθαλμικής βλάβης / οφθαλμικού ερεθισμού άγνωστων υπό δοκιμή ουσιών ή κατηγοριών προϊόντων, ή για την αξιολόγηση του σχετικού δυναμικού οφθαλμικής τοξικότητας ταξινομημένης χημικής ουσίας εντός συγκεκριμένου φάσματος θετικών αποκρίσεων.
|
ΔΕΔΟΜΕΝΑ ΚΑΙ ΑΝΑΦΟΡΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ
Δεδομένα
|
47.
|
Τα δεδομένα από μεμονωμένα πανομοιότυπα δείγματα ιστών σε μια σειρά δοκιμών (π.χ. τιμές OD / εμβαδόν κορυφής φορμαζάνης MTT και δεδομένα υπολογισθείσας εκατοστιαίας βιωσιμότητας των ιστών για την υπό δοκιμή χημική ουσία και τους μάρτυρες, και η τελική πρόβλεψη της μεθόδου δοκιμών RhCE) θα πρέπει να αναφέρονται υπό μορφή πίνακα για κάθε υπό δοκιμή χημική ουσία, συμπεριλαμβανομένων των δεδομένων από επαναλήψεις δοκιμών, ανάλογα με την περίπτωση. Επιπλέον, θα πρέπει να αναφέρεται η μέση εκατοστιαία βιωσιμότητα των ιστών και η διαφορά βιωσιμότητας μεταξύ δύο πανομοιότυπων δειγμάτων ιστού (εάν n=2 πανομοιότυπα δείγματα ιστού) ή η SD (εάν n≥ 3 πανομοιότυπα δείγματα ιστού) για κάθε μεμονωμένη υπό δοκιμή χημική ουσία και μάρτυρα. Για κάθε υπό δοκιμή χημική ουσία θα πρέπει να αναφέρονται τυχόν παρατηρούμενες παρεμποδίσεις της μέτρησης της φορμαζάνης MTT λόγω άμεσης αναγωγής της MTT και/ή παρεμπόδισης λόγω χρώματος.
|
Έκθεση δοκιμής
|
48.
|
Η έκθεση δοκιμής θα πρέπει να περιλαμβάνει τα ακόλουθα στοιχεία:
Υπό δοκιμή χημική ουσία
|
|
Μονοσυστατική ουσία
|
—
|
ταυτοποίηση της χημικής ουσίας, όπως ονομασία/-ες IUPAC ή CAS, αριθμός/-οί CAS, κωδικός SMILES ή InChI, συντακτικός τύπος και/ή άλλα αναγνωριστικά στοιχεία,
|
|
—
|
φυσική κατάσταση, πτητικότητα, pH, LogP, μοριακό βάρος, χημική κατηγορία, και πρόσθετες σχετικές φυσικοχημικές ιδιότητες που σχετίζονται με τη διενέργεια της μελέτης, εφόσον είναι διαθέσιμα,
|
|
—
|
καθαρότητα, χημική ταυτότητα των προσμείξεων, κατά περίπτωση και στο μέτρο του δυνατού κ.λπ.,
|
|
—
|
κατεργασία πριν από τη δοκιμή, εάν ισχύει (π.χ. θέρμανση, λειοτρίβηση),
|
|
—
|
συνθήκες φύλαξης και σταθερότητα, εφόσον είναι διαθέσιμα.
|
|
|
|
Πολυσυστατική ουσία, UVCB και μείγμα
|
—
|
χαρακτηρισμός, στο μέτρο του δυνατού, π.χ. χημική ταυτότητα (βλ. ανωτέρω), καθαρότητα, ποσότητα και σχετικές φυσικοχημικές ιδιότητες (βλ. ανωτέρω) των συστατικών, εφόσον είναι διαθέσιμα,
|
|
—
|
φυσική κατάσταση και πρόσθετες σχετικές φυσικοχημικές ιδιότητες που σχετίζονται με τη διενέργεια της μελέτης, εφόσον είναι διαθέσιμα,
|
|
—
|
καθαρότητα, χημική ταυτότητα των προσμείξεων, κατά περίπτωση και στο μέτρο του δυνατού κ.λπ.,
|
|
—
|
κατεργασία πριν από τη δοκιμή, εάν ισχύει (π.χ. θέρμανση, λειοτρίβηση),
|
|
—
|
συνθήκες φύλαξης και σταθερότητα, εφόσον είναι διαθέσιμα.
|
|
Θετικοί και αρνητικοί μάρτυρες
|
—
|
ταυτοποίηση της χημικής ουσίας, όπως ονομασία/-ες IUPAC ή CAS, αριθμός/-οί CAS, κωδικός SMILES ή InChI, συντακτικός τύπος και/ή άλλα αναγνωριστικά στοιχεία,
|
|
—
|
φυσική κατάσταση, πτητικότητα, μοριακό βάρος, χημική κατηγορία, και πρόσθετες σχετικές φυσικοχημικές ιδιότητες που σχετίζονται με τη διενέργεια της μελέτης, εφόσον είναι διαθέσιμα,
|
|
—
|
καθαρότητα, χημική ταυτότητα των προσμείξεων, κατά περίπτωση και στο μέτρο του δυνατού κ.λπ.,
|
|
—
|
κατεργασία πριν από τη δοκιμή, εάν ισχύει (π.χ. θέρμανση, λειοτρίβηση),
|
|
—
|
συνθήκες φύλαξης και σταθερότητα, εφόσον είναι διαθέσιμα,
|
|
—
|
αιτιολόγηση της χρήσης διαφορετικού αρνητικού μάρτυρα από το υπερκαθαρό H2O ή το DPBS ελεύθερο Ca2+/Mg2+, εάν ισχύει,
|
|
—
|
αιτιολόγηση της χρήσης διαφορετικού θετικού μάρτυρα από τον αμιγή οξικό μεθυλεστέρα, εάν ισχύει,
|
|
—
|
παραπομπή σε ιστορικά αποτελέσματα θετικών και αρνητικών μαρτύρων που καταδεικνύουν την εφαρμογή κατάλληλων κριτηρίων αποδοχής των σειρών δοκιμών.
|
Πληροφορίες σχετικά με τον χορηγό και την εγκατάσταση δοκιμών
|
—
|
όνομα και διεύθυνση του χορηγού, της εγκατάστασης δοκιμών και του διευθυντή της μελέτης.
|
|
—
|
Ιστικό μόρφωμα RhCE και πρωτόκολλο που χρησιμοποιήθηκαν (με αιτιολόγηση των επιλογών, εάν ισχύει)
|
Συνθήκες της μεθόδου δοκιμών
|
—
|
ιστικό μόρφωμα RhCE που χρησιμοποιήθηκε, περιλαμβανομένου του αριθμού παρτίδας,
|
|
—
|
μήκος κύματος και ζώνη διάβασης (κατά περίπτωση) που χρησιμοποιήθηκαν για τον ποσοτικό προσδιορισμό της φορμαζάνης MTT, και περιοχή γραμμικότητας της συσκευής μέτρησης (π.χ. φασματοφωτόμετρο),
|
|
—
|
περιγραφή της μεθόδου που χρησιμοποιήθηκε για τον ποσοτικό προσδιορισμό της φορμαζάνης MTT,
|
|
—
|
περιγραφή του συστήματος HPLC/UPLC-φασματοφωτομετρίας που χρησιμοποιήθηκε, κατά περίπτωση,
|
|
—
|
πλήρη στοιχεία τεκμηρίωσης για το συγκεκριμένο ιστικό μόρφωμα RhCE που χρησιμοποιήθηκε, συμπεριλαμβανομένων των επιδόσεών του. Τα εν λόγω δεδομένα πρέπει να περιλαμβάνουν τα ακόλουθα, χωρίς να περιορίζονται σ’ αυτά:
|
i)
|
ποιοτικός έλεγχος βιωσιμότητας (προμηθευτής)
|
|
ii)
|
βιωσιμότητα υπό τις συνθήκες της μεθόδου δοκιμών (χρήστης),
|
|
iii)
|
ποιοτικός έλεγχος λειτουργίας φραγμού,
|
|
iv)
|
μορφολογία, εάν διατίθεται,
|
|
v)
|
αναπαραγωγιμότητα και προβλεπτική ικανότητα,
|
|
vi)
|
άλλοι ποιοτικοί έλεγχοι του ιστικού μορφώματος RhCE, εάν διατίθενται,
|
|
|
—
|
παραπομπή σε ιστορικά δεδομένα για το ιστικό μόρφωμα RhCE. Τα εν λόγω δεδομένα πρέπει να περιλαμβάνουν τα ακόλουθα, χωρίς να περιορίζονται σ’ αυτά: αποδοχή των δεδομένων ποιοτικού ελέγχου σε σχέση με ιστορικά δεδομένα για τις παρτίδες,
|
|
—
|
δήλωση ότι η εγκατάσταση δοκιμών έχει αποδείξει την τεχνική της ικανότητα να χρησιμοποιεί τη μέθοδο δοκιμών προτού την εντάξει στην καθημερινή της πρακτική διά του ελέγχου των χημικών ουσιών ελέγχου ικανότητας.
|
Κριτήρια της σειράς δοκιμών και της αποδοχής δοκιμής
|
—
|
μέσες τιμές και πεδία τιμών αποδοχής του θετικού και αρνητικού μάρτυρα βάσει ιστορικών δεδομένων,
|
|
—
|
αποδεκτή μεταβλητότητα μεταξύ πανομοιότυπων δειγμάτων ιστού για τους θετικούς και τους αρνητικούς μάρτυρες,
|
|
—
|
αποδεκτή μεταβλητότητα μεταξύ πανομοιότυπων δειγμάτων ιστού για την υπό δοκιμή χημική ουσία.
|
Διαδικασία δοκιμής
|
—
|
λεπτομέρειες για την εφαρμοσθείσα διαδικασία δοκιμών,
|
|
—
|
χρησιμοποιηθείσες δόσεις της υπό δοκιμή χημικής ουσίας και των μαρτύρων,
|
|
—
|
διάρκεια και θερμοκρασία περιόδων έκθεσης και εμβύθισης μετά την έκθεση και επώασης μετά την έκθεση (ανάλογα με την περίπτωση),
|
|
—
|
περιγραφή τυχόν τροποποιήσεων της διαδικασίας δοκιμής,
|
|
—
|
αναφορά των χρησιμοποιηθέντων μαρτύρων για υπό δοκιμή χημικές ουσίες που είναι άμεσα αναγωγικά της ΜΤΤ ή /και έγχρωμες, κατά περίπτωση,
|
|
—
|
αριθμός των πανομοιότυπων δειγμάτων ιστού που χρησιμοποιήθηκαν ανά υπό δοκιμή χημική ουσία και μάρτυρα (θετικός μάρτυρας, αρνητικός μάρτυρας, NSMTT, NSCliving και NSCkilled, κατά περίπτωση).
|
Αποτελέσματα
|
—
|
δεδομένα σε μορφή πίνακα από τις επιμέρους υπό δοκιμή χημικές ουσίες και τους μάρτυρες, για κάθε σειρά δοκιμών (περιλαμβανομένων των επαναληπτικών πειραμάτων, ανάλογα με την περίπτωση) και κάθε μέτρηση πανομοιότυπου δείγματος, περιλαμβανομένης της τιμής OD ή του εμβαδού κορυφής της φορμαζάνης MTT, της εκατοστιαίας βιωσιμότητας ιστών, της μέσης εκατοστιαίας βιωσιμότητας ιστών, της διαφοράς μεταξύ των πανομοιότυπων δειγμάτων ιστού ή της SD, και της τελικής πρόβλεψης,
|
|
—
|
κατά περίπτωση, αποτελέσματα των μαρτύρων που χρησιμοποιήθηκαν για τα άμεσα αναγωγικά της MTT και/ή τις έγχρωμες υπό δοκιμή χημικές ουσίες, συμπεριλαμβανομένης της τιμής OD ή του εμβαδού της κορυφής της φορμαζάνης MTT, του %NSMTT, του %NSCliving, του %NSCkilled, της διαφοράς μεταξύ των πανομοιότυπων δειγμάτων ιστού ή της SD, της τελικής ορθής εκατοστιαίας βιωσιμότητας ιστών, και της τελικής πρόβλεψης,
|
|
—
|
αποτελέσματα που προέκυψαν με την υπό δοκιμή χημική ουσία/-ες και τους μάρτυρες σε σχέση με τα καθορισμένα κριτήρια αποδοχής για τη σειρά δοκιμών και τη δοκιμή,
|
|
—
|
περιγραφή άλλων παρατηρηθεισών επιδράσεων, π.χ. χρώση των ιστών από έγχρωμη υπό δοκιμή χημική ουσία.
|
Εξέταση των αποτελεσμάτων
Συμπέρασμα
|
ΒΙΒΛΙΟΓΡΑΦΙΑ
|
(1)
|
UN (2015). United Nations Globally Harmonized System of Classification and Labelling of Chemicals (GHS). ST/SG/AC.10/30/Rev.6, Sixth Revised Edition, New York and Geneva: United Nations. Διατίθεται στον δικτυακό τόπο: http://www.unece.org/fileadmin/DAM/trans/danger/publi/ghs/ghs_rev06/English/ST-SG-AC10-30-Rev6e.pdf.
|
|
(2)
|
Κεφάλαιο B.5 του παρόντος παραρτήματος: Οξείας μορφής ερεθισμός/διάβρωση των οφθαλμών.
|
|
(3)
|
Κεφάλαιο B.47 του παρόντος παραρτήματος: Μέθοδος δοκιμών αδιαφάνειας και διαπερατότητας του βόειου κερατοειδούς για τον προσδιορισμό i) χημικών ουσιών που προκαλούν σοβαρή οφθαλμική βλάβη και ii) χημικών ουσιών που δεν επιβάλλεται να ταξινομηθούν ως προς τον οφθαλμικό ερεθισμό ή τη σοβαρή οφθαλμική βλάβη.
|
|
(4)
|
Κεφάλαιο B.48 του παρόντος παραρτήματος: Μέθοδος δοκιμών σε απομονωμένους οφθαλμούς ορνιθίων για τον προσδιορισμό i) χημικών ουσιών που προκαλούν σοβαρή οφθαλμική βλάβη και ii) χημικών ουσιών που δεν επιβάλλεται να ταξινομηθούν.
|
|
(5)
|
Κεφάλαιο B.61 του παρόντος παραρτήματος: Μέθοδος δοκιμών διαρροής φλουορεσκεΐνης για τον προσδιορισμό διαβρωτικών και ισχυρών ερεθιστικών των οφθαλμών.
|
|
(6)
|
Κεφάλαιο B.68 του παρόντος παραρτήματος: In Vitro μέθοδος δοκιμών βραχυχρόνιας έκθεσης για τον προσδιορισμό i) χημικών ουσιών που προκαλούν σοβαρή οφθαλμική βλάβη και ii) χημικών ουσιών για τις οποίες δεν επιβάλλεται να ταξινομηθούν ως προς τον οφθαλμικό ερεθισμό ή τη σοβαρή οφθαλμική βλάβη.
|
|
(7)
|
Freeman, S.J., Alépée N., Barroso, J., Cole, T., Compagnoni, A., Rubingh, C., Eskes, C., Lammers, J., McNamee, P., Pfannenbecker, U., Zuang, V. (2010). Prospective Validation Study of Reconstructed Human Tissue Models for Eye Irritation Testing. ALTEX 27, Special Issue 2010,261-266.
|
|
(8)
|
EC EURL ECVAM (2014). The EURL ECVAM - Cosmetics Europe prospective validation study of Reconstructed human Cornea-like Epithelium (RhCE)-based test methods for identifying chemicals not requiring classification and labelling for serious eye damage/eye irritation: Validation Study Report. EUR 28125 EN· doi:10.2787/41680. Διατίθεται στον δικτυακό τόπο: http://publications.jrc.ec.europa.eu/repository/handle/JRC100280.
|
|
(9)
|
EURL ECVAM Science Advisory Committee (2014). ESAC Opinion on the EURL ECVAM Eye Irritation Validation Study (EIVS) on EpiOcular™ EIT and SkinEthic™ HCE and a related Cosmetics Europe study on HPLC/UPLC-spectrophotometry as an alternative endpoint detection system for MTT-formazan. ESAC Opinion No 2014-03 of 17 November 2014 EUR 28173 EN· doi: 10.2787/043697. Διατίθεται στον δικτυακό τόπο: http://publications.jrc.ec.europa.eu/repository/handle/JRC103702.
|
|
(10)
|
Alépée, N., Leblanc, V., Adriaens, E., Grandidier, M.H., Lelièvre, D, Meloni, M., Nardelli, L., Roper, C.S, Santirocco, E., Toner, F., Van Rompay, A., Vinall, J., Cotovio, J. (2016). Multi-laboratory validation of SkinEthic HCE test method for testing serious eye damage/eye irritation using liquid chemicals. Toxicol. In Vitro 31, 43-53.
|
|
(11)
|
Alépée, N., Adriaens, E., Grandidier, M.H., Meloni, M., Nardelli, L., Vinall, C.J., Toner, F., Roper, C.S, Van Rompay, A.R., Leblanc, V., Cotovio, J. (2016). Multi-laboratory evaluation of SkinEthic HCE test method for testing serious eye damage/eye irritation using solid chemicals and overall performance of the test method with regard to solid and liquid chemicals testing. Toxicol. In Vitro 34, 55-70.
|
|
(12)
|
EURL ECVAM Science Advisory Committee (2016). ESAC Opinion on the SkinEthic™ Human Corneal Epithelium (HCE) Eye Irritation Test (EIT). ESAC Opinion No 2016-02 of 24 June 2016 EUR 28175 EN· doi: 10.2787/390390. Διατίθεται στον δικτυακό τόπο: http://publications.jrc.ec.europa.eu/repository/handle/JRC103704.
|
|
(13)
|
EC EURL ECVAM (2016). Recommendation on the Use of the Reconstructed human Cornea-like Epithelium (RhCE) Test Methods for Identifying Chemicals not Requiring Classification and Labelling for Serious Eye Damage/Eye Irritation According to UN GHS. (Χειρόγραφο υπό επεξεργασία).
|
|
(14)
|
Draize, J.H., Woodard, G., Calvery, H.O. (1944). Methods for the Study of Irritation and Toxicity of Substances Applied Topically to the Skin and Mucous Membranes. Journal of Pharmacol. and Exp. Therapeutics 82, 377-390.
|
|
(15)
|
Scott, L., Eskes, C., Hoffmann, S., Adriaens, E., Alépée, N., Bufo, M., Clothier, R., Facchini, D., Faller, C., Guest, R., Harbell, J., Hartung, T., Kamp, H., Le Varlet, B., Meloni, M., McNamee, P., Osborne, R., Pape, W., Pfannenbecker, U., Prinsen, M., Seaman, C., Spielman, H., Stokes, W., Trouba, K., Van den Berghe, C., Van Goethem, F., Vassallo, M., Vinardell, P., Zuang, V. (2010). A Proposed Eye Irritation Testing Strategy to Reduce and Replace In Vivo Studies Using Bottom-Up and Top-Down Approaches. Toxicol. In Vitro 24, 1-9.
|
|
(16)
|
Mosmann, T. (1983). Rapid Colorimetric Assay for Cellular Growth and Survival: Application to Proliferation and Cytotoxicity Assays. J. Immunol. Methods 65, 55-63.
|
|
(17)
|
OECD (2016). Series on Testing and Assessment No 216: Performance Standards for the Assessment of Proposed Similar or Modified In Vitro Reconstructed Human Cornea-Like Epithelium (RhCE) Test Methods for Identifying Chemicals not Requiring Classification and Labelling for Eye Irritation or Serious Eye Damage, Based on the Validated Reference Methods EpiOcular™ EIT and SkinEthic™ HCE EIT described in TG 492. Organisation for Economic Cooperation and Development, Paris.
|
|
(18)
|
OECD (2005). Series on Testing and Assessment No 34: Guidance Document on the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment. Organisation for Economic Cooperation and Development, Paris.
|
|
(19)
|
Kaluzhny, Y., Kandárová, H., Hayden, P., Kubilus, J., d’Argembeau-Thornton, L., Klausner, M. (2011). Development of the EpiOcular™ Eye Irritation Test for Hazard Identification and Labelling of Eye Irritating Chemicals in Response to the Requirements of the EU Cosmetics Directive and REACH Legislation. Altern. Lab. Anim. 39, 339-364.
|
|
(20)
|
Nguyen, D.H., Beuerman, R.W., De Wever, B., Rosdy, M. (2003). Three-dimensional construct of the human corneal epithelium for in vitro toxicology. Στο: Salem, H., Katz, S.A. (Eds), Alternative Toxicological Methods, CRC Press, pp. 147-159.
|
|
(21)
|
Pfannenbecker, U., Bessou-Touya, S., Faller, C., Harbell, J., Jacob, T., Raabe, H., Tailhardat, M., Alépée, N., De Smedt, A., De Wever, B., Jones, P., Kaluzhny, Y., Le Varlet, B., McNamee, P., Marrec-Fairley, M., Van Goethem, F. (2013). Cosmetics Europe multi-laboratory pre-validation of the EpiOcular™ reconstituted Human Tissue Test Method for the Prediction of Eye Irritation. Toxicol. In Vitro 27, 619-626.
|
|
(22)
|
Alépée, N., Bessou-Touya, S., Cotovio, J., de Smedt, A., de Wever, B., Faller, C., Jones, P., Le Varlet, B., Marrec-Fairley, M., Pfannenbecker, U., Tailhardat, M., van Goethem, F., McNamee, P. (2013). Cosmetics Europe Multi-Laboratory Pre-Validation of the SkinEthic™ Reconstituted Human Corneal Epithelium Test Method for the Prediction of Eye Irritation. Toxicol. In Vitro 27, 1476-1488.
|
|
(23)
|
Kolle, S.N., Moreno, M.C.R., Mayer, W., van Cott, A., van Ravenzwaay, B., Landsiedel, R. (2015). The EpiOcular™ Eye Irritation Test is the Method of Choice for In Vitro Eye Irritation Testing of Agrochemical Formulations: Correlation Analysis of EpiOcular™ Eye Irritation Test and BCOP Test Data to UN GHS, US EPA and Brazil ANIVSA Classifications. Altern. Lab. Anim. 43, 1-18.
|
|
(24)
|
Adriaens, E., Barroso, J., Eskes, C., Hoffmann, S., McNamee, P., Alépée, N., Bessou-Touya, S., De Smedt, A., De Wever, B., Pfannenbecker, U., Tailhardat, M., Zuang, V. (2014). Retrospective Analysis of the Draize Test for Serious Eye Damage/Eye Irritation: Importance of Understanding the In Vivo Endpoints Under UN GHS/EU CLP for the Development and Evaluation of In Vitro Test Methods. Arch. Toxicol. 88, 701-723.
|
|
(25)
|
Barroso, J., Pfannenbecker, U., Adriaens, E., Alépée, N., Cluzel, M., De Smedt, A., Hibatallah, J., Klaric, M., Mewes, K.R., Millet, M., Templier, M., McNamee, P. (2017). Cosmetics Europe compilation of historical serious eye damage/eye irritation in vivo data analysed by drivers of classification to support the selection of chemicals for development and evaluation of alternative methods/strategies: the Draize eye test Reference Database (DRD). Arch. Toxicol. 91, 521-547.
|
|
(26)
|
Meloni, M., De Servi, B., Marasco, D., Del Prete, S. (2011). Molecular mechanism of ocular surface damage: Application to an in vitro dry eye model on human corneal epithelium. Molecular Vision 17, 113-126.
|
|
(27)
|
Hackett, R.B., McDonald, T.O. (1991). Eye Irritation. Στο Advances in Modern Toxicology: Dermatoxicology Marzulli F.N.and Maibach H.I. (Eds.), 4th Edition, pp. 749–815. Washington, DC, USA: Hemisphere Publishing Corporation.
|
|
(28)
|
Fox, D.A., Boyes, W.K. (2008). Toxic Responses of the Ocular and Visual System. In Cassaret and Doull’s Toxicology: The Basic Science of Poisons Klaassen C.D.(Ed.), 7th Edition, pp. 665–697. Withby, ON, Canada: McGraw-Hill Ryerson.
|
|
(29)
|
Jester, J.V., Li, H.F., Petroll, W.M., Parker, R.D., Cavanagh, H.D., Carr, G.J., Smith, B., Maurer, J.K. (1998). Area and Depth of Surfactant Induced Corneal Injury Correlates with Cell Death. Invest. Ophthalmol. Vis. Sci. 39, 922–936.
|
|
(30)
|
Maurer, J.K., Parker, R.D., Jester, J.V. (2002). Extent of Corneal Injury as the Mechanistic Basis for Ocular Irritation: Key Findings and Recommendations for the Development of Alternative Assays. Reg. Tox. Pharmacol. 36, 106-117.
|
|
(31)
|
Jester, J.V., Li, L., Molai, A., Maurer, J.K. (2001). Extent of Corneal Injury as a Mechanistic Basis for Alternative Eye Irritation Tests. Toxicol. In Vitro 15, 115–130.
|
|
(32)
|
Jester, J.V., Petroll, W.M., Bean, J., Parker, R.D., Carr, G.J., Cavanagh, H.D., Maurer, J.K. (1998). Area and Depth of Surfactant-Induced Corneal Injury Predicts Extent of Subsequent Ocular Responses. Invest. Ophthalmol. Vis. Sci. 39, 2610–2625.
|
|
(33)
|
Jester, J.V. (2006). Extent of Corneal Injury as a Biomarker for Hazard Assessment and the Development of Alternative Models to the Draize Rabbit Eye Test. Cutan. Ocul. Toxicol. 25, 41–54.
|
|
(34)
|
EpiOcular™ EIT SOP, Version 8 (March 05, 2013). EpiOcular™ EIT for the Prediction of Acute Ocular Irritation of Chemicals. Διατίθεται στον δικτυακό τόπο: [https://ecvam-dbalm.jrc.ec.europa.eu/beta/index.cfm/methodsAndProtocols/index].
|
|
(35)
|
SkinEthic™ HCE EIT SOP, Version 1. (July 20, 2015). SkinEthic™ HCE Eye Irritation Test (EITL for Liquids, EITS for Solids) for the Prediction of Acute Ocular Irritation of Chemicals. Διατίθεται στον δικτυακό τόπο: https://ecvam-dbalm.jrc.ec.europa.eu/beta/index.cfm/methodsAndProtocols/index.
|
|
(36)
|
Alépée, N., Barroso, J., De Smedt, A., De Wever, B., Hibatallah, J., Klaric, M., Mewes, K.R., Millet, M., Pfannenbecker, U., Tailhardat, M., Templier, M., McNamee, P. (2015). Use of HPLC/UPLC-Spectrophotometry for Detection of Formazan in In Vitro Reconstructed Human Tissue (RhT)-Based Test Methods Employing the MTT-Reduction Assay to Expand their Applicability to Strongly Coloured Test Chemicals. Toxicol. In Vitro 29, 741-761.
|
|
(37)
|
Kaluzhny, Y., Kandárová, H., Handa, Y., DeLuca, J., Truong, T., Hunter, A., Kearney, P., d’Argembeau-Thornton, L., Klausner, M. (2015). EpiOcular™ Eye Irritation Test (EIT) for Hazard Identification and Labeling of Eye Irritating Chemicals: Protocol Optimization for Solid Materials and Extended Shipment Times. Altern. Lab Anim. 43, 101-127.
|
|
(38)
|
US FDA (2001). Guidance for Industry: Bioanalytical Method Validation. U.S. Department of Health and Human Services, Food and Drug Administration. May 2001. Διατίθεται στον δικτυακό τόπο: http://www.fda.gov/downloads/Drugs/Guidances/ucm070107.pdf.
|
|
(39)
|
OECD (2017). Guidance Document on an Integrated Approaches on Testing and Assessment for Serious Eye Damage and Eye irritation. Series on Testing and Assessment No 263. ENV Publications, Organisation for Economic Cooperation and Development, Paris.
|
Προσάρτημα 1
ΟΡΙΣΜΟΙ
Ορθότητα
: ο βαθμός συμφωνίας μεταξύ των αποτελεσμάτων της μεθόδου δοκιμών και των αποδεκτών τιμών αναφοράς. Αποτελεί κριτήριο επιδόσεων της μεθόδου δοκιμών και μια από τις πτυχές της «καταλληλότητας». Συχνά ο όρος χρησιμοποιείται εναλλακτικά προς την «συμφωνία» για να δηλώσει το ποσοστό ορθών αποτελεσμάτων μιας μεθόδου δοκιμών (18).
Χημική ουσία συγκριτικής αξιολόγησης
: χημική ουσία που χρησιμοποιείται ως πρότυπο για σύγκριση με μια υπό δοκιμή χημική ουσία. Οι χημικές ουσίες συγκριτικής αξιολόγησης θα πρέπει να διαθέτουν τις ακόλουθες ιδιότητες: i) συνεπείς και αξιόπιστες πηγές προέλευσης για τον προσδιορισμό και τον χαρακτηρισμό τους, ii) δομική, λειτουργική ομοιότητα και/ή ομοιότητα χημικής κατηγορίας ή κατηγορίας προϊόντος με την υπό δοκιμή χημική ουσία/-ες, iii) γνωστές φυσικοχημικές ιδιότητες; iv) δεδομένα τεκμηρίωσης γνωστών επιδράσεων, και v) γνωστή ισχύ στο φάσμα της επιθυμητής απόκρισης.
Ανοδική προσέγγιση (bottom-up)
: κλιμακωτή προσέγγιση που χρησιμοποιείται για υπό δοκιμή χημικές ουσίες για τις οποίες θεωρείται ότι δεν επιβάλλεται να ταξινομηθούν και να επισημανθούν ως προς τον οφθαλμικό ερεθισμό ή τη σοβαρή οφθαλμική βλάβη. Η προσέγγιση αυτή αρχίζει με τον προσδιορισμό των χημικών ουσιών που δεν επιβάλλεται να ταξινομηθούν και να επισημανθούν (αρνητική έκβαση) με βάση άλλες χημικές ουσίες (θετική έκβαση).
Χημικό προϊόν
: μια ουσία ή ένα μείγμα.
Συμφωνία
: βλ. «ορθότητα».
Κερατοειδής
: το διαφανές τμήμα του πρόσθιου τμήματος του οφθαλμικού βολβού, το οποίο καλύπτει την ίριδα και την κόρη και επιτρέπει την είσοδο φωτός στο εσωτερικό του οφθαλμού.
CV
: (Coefficient of Variation) συντελεστής μεταβλητότητας.
Dev
: (Deviation) απόκλιση.
EIT
: (Eye Irritation Test) δοκιμή οφθαλμικού ερεθισμού.
EURL ECVAM
: εργαστήριο αναφοράς της Ευρωπαϊκής Ένωσης για τις εναλλακτικές μεθόδους αντί των δοκιμών σε ζώα.
Οφθαλμικός ερεθισμός
: πρόκληση αλλοιώσεων του οφθαλμού, οι οποίες εμφανίζονται μετά την εφαρμογή της υπό δοκιμή χημικής ουσίας στην εμπρόσθια επιφάνειά του και είναι πλήρως αναστρέψιμες εντός 21 ημερών από την εφαρμογή της ουσίας. Μπορεί να χρησιμοποιηθεί εναλλακτικά προς τους όρους «αναστρέψιμες επιδράσεις στους οφθαλμούς» και «κατηγορία 2 κατά GHS του ΟΗΕ / κανονισμό CLP».
ET50
: χρόνος έκθεσης που απαιτείται για να μειωθεί η βιωσιμότητα των ιστών κατά 50 % μετά την εφαρμογή καθορισμένης συγκέντρωσης της ουσίας συγκριτικής αξιολόγησης.
Ποσοστό ψευδοαρνητικής έκβασης
: το ποσοστό όλων των θετικών ουσιών που εσφαλμένα χαρακτηρίζονται αρνητικές με μια μέθοδο δοκιμών. Αποτελεί έναν από τους δείκτες επιδόσεων της μεθόδου δοκιμών.
Ποσοστό ψευδοθετικής έκβασης
: το ποσοστό όλων των αρνητικών ουσιών που εσφαλμένα χαρακτηρίζονται θετικές με μια μέθοδο δοκιμών. Αποτελεί έναν από τους δείκτες επιδόσεων της μεθόδου δοκιμών.
Επικινδυνότητα
: εγγενής ιδιότητα ενός παράγοντα ή μιας κατάστασης που μπορεί να έχει δυσμενείς επιδράσεις όταν οργανισμός, σύστημα ή (υπο)πληθυσμός εκτεθεί στον συγκεκριμένο παράγοντα.
HCE
: επιθήλιο ανθρώπινου κερατοειδούς SkinEthic™.
HPLC
: υγροχρωματογραφία υψηλής απόδοσης.
IC50
: συγκέντρωση στην οποία μια χημική ουσία συγκριτικής αξιολόγησης μειώνει τη βιωσιμότητα των ιστών κατά 50 % μετά από καθορισμένο χρόνο έκθεσης (π.χ. αγωγή 30 λεπτών με SDS).
Πλεονάζουσα δόση
: ποσότητα υπό δοκιμή χημικής ουσίας που εφαρμόζεται στο ιστικό μόρφωμα RhCE και υπερβαίνει την απαιτούμενη για την πλήρη και ομοιόμορφη κάλυψη της επιφάνειας του επιθηλίου.
Μη αναστρέψιμες επιδράσεις στους οφθαλμούς
: βλ. «Σοβαρή οφθαλμική βλάβη».
LLOQ
: (Lower Limit of Quantification) κατώτερο όριο ποσοτικοποίησης.
LogP
: λογάριθμος του συντελεστή κατανομής σε οκτανόλη/νερό.
Μείγμα
: ένα μείγμα ή διάλυμα που αποτελείται από δύο ή περισσότερες ουσίες.
Μονοσυστατική ουσία
: ουσία που ορίζεται από την ποσοτική της σύνθεση και της οποίας ένα κύριο συστατικό περιέχεται σε ποσοστό τουλάχιστον 80 % κ.β.
Πολυσυστατική ουσία
: ουσία που ορίζεται από την ποσοτική της σύνθεση και της οποίας περισσότερα από ένα κύρια συστατικά περιέχονται σε συγκέντρωση ≥ 10 % κ.β. και < 80 % κ.β. Οι πολυσυστατικές ουσίες είναι προϊόντα μεταποιητικών διεργασιών. Η διαφορά μεταξύ μείγματος και πολυσυστατικής ουσίας είναι ότι το μείγμα λαμβάνεται με ανάμειξη δύο ή περισσότερων ουσιών, χωρίς χημική αντίδραση. Οι πολυσυστατικές ουσίες είναι προϊόντα χημικών αντιδράσεων.
MTT
: βρωμιούχο 3-(4,5-διμεθυλοθειαζολ-2-υλο)-2,5-διφαινυλοτετραζόλιο, βρωμιούχο τετραζόλιο-κυανό του θειαζολυλίου.
Αρνητικός μάρτυρας
: δείγμα που περιέχει όλα τα στοιχεία ενός συστήματος δοκιμής και υποβάλλεται σε αγωγή με ουσία που είναι γνωστό ότι δεν επάγει θετική απόκριση στο σύστημα δοκιμής. Το δείγμα αυτό υποβάλλεται σε δοκιμή μαζί με τα δείγματα που έχουν υποβληθεί σε αγωγή με την υπό δοκιμή χημική ουσία και με άλλα δείγματα μάρτυρες, και χρησιμοποιείται για τον προσδιορισμό της 100 % βιωσιμότητας των ιστών.
Δεν ταξινομείται
: χημικές ουσίες που δεν ταξινομούνται ως προς τον οφθαλμικό ερεθισμό (κατηγορία 2 κατά GHS του ΟΗΕ / κανονισμό CLP, κατηγορία 2A ή 2B κατά GHS του ΟΗΕ) ή τη σοβαρή οφθαλμική βλάβη (κατηγορία 1 κατά GHS του ΟΗΕ / κανονισμό CLP). Μπορεί να χρησιμοποιηθεί εναλλακτικά προς τον όρο «καμία κατηγορία κατά GHS του ΟΗΕ».
NSCkilled
: (Non-Specific Colour in killed tissues) μάρτυρας μη ειδικού χρώματος σε αδρανοποιημένους ιστούς.
NSCliving
: (Non-Specific Colour in living tissues) μάρτυρας μη ειδικού χρώματος σε ζωντανούς ιστούς.
NSMTT
: (Non-Specific MTT reduction) μη ειδική αναγωγή της MTT.
OD
: (Optical Density) οπτική πυκνότητα.
Πρότυπα επιδόσεων
: πρότυπα που βασίζονται σε επικυρωμένη μέθοδο δοκιμών η οποία κρίθηκε ότι είναι επιστημονικά έγκυρη, και παρέχουν τη βάση για την αξιολόγηση της συγκρισιμότητας προτεινόμενης μεθόδου δοκιμών η οποία είναι μηχανιστικά και λειτουργικά παρεμφερής. Σε αυτά περιλαμβάνονται: i) βασικά στοιχεία της μεθόδου δοκιμών, ii) κατάλογος ελάχιστων ουσιών αναφοράς, οι οποίες έχουν επιλεγεί μεταξύ των χημικών ουσιών που χρησιμοποιήθηκαν για την απόδειξη των αποδεκτών επιδόσεων της επικυρωμένης μεθόδου αναφοράς, και (iii) τα συγκρίσιμα επίπεδα ορθότητας και αξιοπιστίας, που βασίζονται στα επιτευχθέντα για την επικυρωμένη μέθοδο δοκιμών και τα οποία πρέπει να επιδεικνύει η προτεινόμενη μέθοδος δοκιμών όταν αξιολογείται με χρήση του καταλόγου ελαχίστων ουσιών αναφοράς (18).
Θετικός μάρτυρας
: δείγμα που περιέχει όλα τα στοιχεία ενός συστήματος δοκιμής και υποβάλλεται σε αγωγή με ουσία που είναι γνωστό ότι επάγει θετική απόκριση στο σύστημα δοκιμής. Το δείγμα αυτό υποβάλλεται σε δοκιμή μαζί με τα δείγματα που έχουν υποβληθεί σε αγωγή με την υπό δοκιμή χημική ουσία και με άλλα δείγματα μάρτυρες. Για να διασφαλίζεται η δυνατότητα αξιολόγησης της μεταβλητότητας της απόκρισης του θετικού μάρτυρα σε συνάρτηση με τον χρόνο, το μέγεθος της θετικής απόκρισης δεν θα πρέπει να είναι υπερβολικό.
Καταλληλότητα
: περιγραφή της σχέσης της δοκιμής με την υπό μελέτη επίδραση και του κατά πόσον αυτή έχει σημασία και είναι χρήσιμη για συγκεκριμένο σκοπό. Πρόκειται για τον βαθμό στον οποίο η δοκιμή μετρά ή προβλέπει σωστά τη βιολογική επίδραση υπό μελέτη. Η καταλληλότητα εμπεριέχει συνεκτίμηση της ορθότητας (συμφωνίας) της μεθόδου δοκιμών (18).
Αξιοπιστία
: μέτρο του βαθμού στον οποίο μια μέθοδος δοκιμών μπορεί να αναπαράγεται διαχρονικά στο ίδιο εργαστήριο και μεταξύ εργαστηρίων, όταν εφαρμόζεται με το ίδιο πρωτόκολλο. Εκτιμάται με υπολογισμό της ενδοεργαστηριακής και της διεργαστηριακής αναπαραγωγιμότητας, καθώς και της ενδοεργαστηριακής επαναληψιμότητας (18).
Δοκιμή υποκατάστασης
: δοκιμή που έχει σχεδιαστεί για να υποκαταστήσει δοκιμή χρησιμοποιούμενη στην καθημερινή πρακτική και αποδεκτή για τον προσδιορισμό της επικινδυνότητας και/ή την εκτίμηση κινδύνου και η οποία, όπως έχει διαπιστωθεί, εξασφαλίζει ισοδύναμη ή βελτιωμένη προστασία της υγείας του ανθρώπου ή των ζώων ή του περιβάλλοντος, κατά περίπτωση, σε σύγκριση με την αποδεκτή δοκιμή, για όλες τις πιθανές περιπτώσεις δοκιμής και υπό δοκιμή χημικές ουσίες (18).
Αναπαραγωγιμότητα
: η συμφωνία μεταξύ των αποτελεσμάτων που προκύπτουν από τη διεξαγωγή επαναληπτικών δοκιμών με την ίδια υπό δοκιμή χημική ουσία και με τη χρήση του ίδιου πρωτοκόλλου δοκιμών (βλ. «αξιοπιστία») (18).
Αναστρέψιμες επιδράσεις στους οφθαλμούς
: βλ. «Οφθαλμικός ερεθισμός».
RhCE
: (Reconstructed human Cornea-like Epithelium) ανασυσταθέν επιθήλιο παρόμοιο με τον ανθρώπινο κερατοειδή.
Σειρά δοκιμών
: η σειρά περιλαμβάνει μία ή περισσότερες υπό δοκιμή χημικές ουσίες που υποβάλλονται σε δοκιμή ταυτόχρονα με αρνητικό μάρτυρα και θετικό μάρτυρα.
SD
: (Standard Deviation) τυπική απόκλιση.
Ευαισθησία
: το ποσοστό του συνόλου των θετικών/δραστικών υπό δοκιμή χημικών ουσιών που ταξινομούνται σωστά με τη δοκιμή. Αποτελεί μέτρο ορθότητας των μεθόδων δοκιμών με τις οποίες λαμβάνονται κατηγορηματικά αποτελέσματα, καθώς και σημαντικό κριτήριο αξιολόγησης της καταλληλότητας των μεθόδων δοκιμών (18).
Σοβαρή οφθαλμική βλάβη
: πρόκληση βλάβης στους οφθαλμικούς ιστούς ή σοβαρής μείωσης της όρασης, κατόπιν εφαρμογής της υπό δοκιμή χημικής ουσίας στην πρόσθια επιφάνεια του οφθαλμού, η οποία δεν είναι πλήρως αναστρέψιμη εντός 21 ημερών από την εφαρμογή. Μπορεί να χρησιμοποιηθεί εναλλακτικά προς τους όρους «μη αναστρέψιμες επιδράσεις στους οφθαλμούς» και «κατηγορία 1 κατά GHS του ΟΗΕ / κανονισμό CLP».
Τυποποιημένες διαδικασίες λειτουργίας (Standard Operating Procedures, SOP)
: επίσημες γραπτές διαδικασίες που περιγράφουν αναλυτικά τον τρόπο εκτέλεσης συγκεκριμένων εργαστηριακών εργασιών της καθημερινής πρακτικής σε σχέση με συγκεκριμένες δοκιμές. Είναι υποχρεωτικές βάσει της ορθής εργαστηριακής πρακτικής (GLP).
Ειδικότητα
: το ποσοστό του συνόλου των αρνητικών/αδρανών υπό δοκιμή χημικών ουσιών που ταξινομούνται σωστά με τη δοκιμή. Αποτελεί μέτρο ορθότητας των μεθόδων δοκιμών με τις οποίες λαμβάνονται κατηγορηματικά αποτελέσματα, καθώς και σημαντικό κριτήριο αξιολόγησης της καταλληλότητας των μεθόδων δοκιμών (18).
Ουσία
: ένα χημικό στοιχείο και οι ενώσεις του σε φυσική κατάσταση ή όπως λαμβάνονται με οποιαδήποτε παραγωγική διεργασία, στα οποία συμπεριλαμβάνονται όλα τα πρόσθετα που απαιτούνται για να διατηρείται η σταθερότητά του, καθώς και τυχόν προσμείξεις που προκύπτουν από τη χρησιμοποιούμενη διεργασία, αλλά από τα οποία εξαιρούνται οι διαλύτες που είναι δυνατόν να διαχωριστούν χωρίς να επηρεαστεί η σταθερότητα της ουσίας ούτε να μεταβληθεί η σύνθεσή της.
Δοκιμή
: μια μεμονωμένη υπό δοκιμή χημική ουσία η οποία υποβάλλεται ταυτόχρονα σε δοκιμή σε τουλάχιστον δύο πανομοιότυπα δείγματα ιστών, όπως ορίζεται στην αντίστοιχη SOP.
Βιωσιμότητα των ιστών
: παράμετρος με την οποία μετράται η συνολική δραστηριότητα κυτταρικού πληθυσμού σε ανασυσταθέντα ιστό, ως ικανότητα αναγωγής της χρωστικής ζωτικής χρώσης ΜΤΤ, η οποία, ανάλογα με τη μετρούμενη παράμετρο και τον χρησιμοποιούμενο σχεδιασμό δοκιμής, συσχετίζεται με τον συνολικό αριθμό και/ή τη ζωτικότητα των ζωντανών κυττάρων.
Καθοδική (top-down) προσέγγιση
: κλιμακωτή προσέγγιση που χρησιμοποιείται για υπό δοκιμή χημική ουσία για την οποία υπάρχουν υπόνοιες ότι προκαλεί σοβαρή οφθαλμική βλάβη. Η προσέγγιση αυτή αρχίζει με τον προσδιορισμό των χημικών ουσιών που προκαλούν σοβαρή οφθαλμική βλάβη (θετική έκβαση) σε σχέση με άλλες χημικές ουσίες (αρνητική έκβαση).
Υπό δοκιμή χημική ουσία
: κάθε ουσία ή μείγμα που υποβάλλεται σε δοκιμή με τη χρήση της παρούσας μεθόδου δοκιμών.
Κλιμακωτή στρατηγική δοκιμών
: στρατηγική δοκιμών κατά βαθμίδες, στο πλαίσιο της οποίας χρησιμοποιούνται μέθοδοι δοκιμών κατά διαδοχικό τρόπο. Όλες οι υφιστάμενες πληροφορίες για μια υπό δοκιμή χημική ουσία εξετάζονται σε κάθε στάδιο με χρήση διαδικασίας βάρους της απόδειξης, προκειμένου να διαπιστώνεται, πριν από τη μετάβαση στο επόμενο στάδιο της στρατηγικής, αν διατίθενται επαρκείς πληροφορίες για να ληφθεί απόφαση περί ταξινόμησης κινδύνου. Εάν σε υπό δοκιμή χημική ουσία μπορεί να αποδοθεί δυναμικό επικινδυνότητας/ισχύς βάσει των υφιστάμενων πληροφοριών σε συγκεκριμένο στάδιο, δεν απαιτούνται περαιτέρω δοκιμές (18).
ULOQ
: (Upper Limit of Quantification) ανώτερο όριο ποσοτικοποίησης.
Παγκοσμίως Εναρμονισμένο Σύστημα Ταξινόμησης και Επισήμανσης των Χημικών Προϊόντων των Ηνωμένων Εθνών (United Nations Globally Harmonized System of Classification and Labelling of Chemicals) (GHS του ΟΗΕ)
: σύστημα που προτείνει την ταξινόμηση των χημικών προϊόντων (ουσιών και μειγμάτων) με βάση τυποποιημένα είδη και βαθμούς φυσικής επικινδυνότητας και επικινδυνότητας για την υγεία και το περιβάλλον και καλύπτει τα αντίστοιχα στοιχεία γνωστοποίησης, όπως εικονογράμματα, προειδοποιητικές λέξεις, δηλώσεις επικινδυνότητας, δηλώσεις προφύλαξης και δελτία δεδομένων ασφαλείας, με τα οποία γνωστοποιούνται πληροφορίες σχετικά με τις δυσμενείς επιδράσεις με σκοπό την προστασία των ανθρώπων (εργοδοτών, εργαζομένων, μεταφορέων, καταναλωτών και διασωστών) και του περιβάλλοντος (1).
Κατηγορία 1 κατά GHS του ΟΗΕ / κανονισμό CLP
: βλ. «Σοβαρή οφθαλμική βλάβη».
Κατηγορία 2 κατά GHS του ΟΗΕ / κανονισμό CLP
: βλ. «Οφθαλμικός ερεθισμός».
Καμία κατηγορία κατά GHS του ΟΗΕ / κανονισμό CLP
: χημικά προϊόντα που δεν πληρούν τις απαιτήσεις ταξινόμησης ως κατηγορίας 1 ή 2 κατά GHS του ΟΗΕ / κανονισμό CLP (ή κατηγορίας 2A ή 2B κατά GHS του ΟΗΕ). Μπορεί να χρησιμοποιηθεί εναλλακτικά προς τον όρο «δεν ταξινομείται».
UPLC
: (Ultra-High Performance Liquid Chromatography) υγροχρωματογραφία υπερυψηλής απόδοσης.
UVCB
: ουσίες άγνωστης ή ασταθούς σύνθεσης, πολύπλοκα προϊόντα αντιδράσεων ή βιολογικά υλικά.
Έγκυρη μέθοδος δοκιμών
: μέθοδος δοκιμών που θεωρείται επαρκούς καταλληλότητας και αξιοπιστίας για συγκεκριμένο σκοπό και βασίζεται σε επιστημονικά τεκμηριωμένες αρχές. Οι μέθοδοι δοκιμών δεν είναι ποτέ έγκυρες με την απόλυτη σημασία του όρου, αλλά μόνο σε σχέση με καθορισμένο σκοπό (18).
Επικυρωμένη μέθοδος δοκιμών
: μέθοδος δοκιμών για την οποία έχουν ολοκληρωθεί μελέτες επικύρωσης προκειμένου να προσδιοριστούν η καταλληλότητα (συμπεριλαμβανομένης της ορθότητας) και η αξιοπιστία της για συγκεκριμένο σκοπό. Είναι σημαντικό να σημειωθεί ότι οι επιδόσεις επικυρωμένης μεθόδου δοκιμών από πλευράς ορθότητας και αξιοπιστίας ενδέχεται να μην επαρκούν για να κριθεί αποδεκτή για τον προτεινόμενο σκοπό (18).
VRM
: (Validated Reference Method) επικυρωμένη μέθοδος αναφοράς.
VRM1
: η EpiOcular™ EIT αναφέρεται ως η επικυρωμένη μέθοδος αναφοράς 1.
VRM2
: η SkinEthic™ HCE EIT αναφέρεται ως η επικυρωμένη μέθοδος αναφοράς 2.
Βάρος της απόδειξης
: διαδικασία εξέτασης της ισχύος και των αδυναμιών διαφόρων πληροφοριών για τη συναγωγή και την τεκμηρίωση συμπεράσματος σχετικά με το δυναμικό επικινδυνότητας που ενέχει μια υπό δοκιμή χημική ουσία.
Προσάρτημα 2
ΚΥΡΙΑ ΣΤΟΙΧΕΙΑ ΤΩΝ ΔΟΚΙΜΩΝ RHCE ΠΟΥ ΕΧΟΥΝ ΕΠΙΚΥΡΩΘΕΙ ΓΙΑ ΤΟΝ ΠΡΟΣΔΙΟΡΙΣΜΟ ΧΗΜΙΚΩΝ ΟΥΣΙΩΝ ΠΟΥ ΔΕΝ ΕΠΙΒΑΛΛΕΤΑΙ ΝΑ ΤΑΞΙΝΟΜΗΘΟΥΝ ΚΑΙ ΝΑ ΕΠΙΣΗΜΑΝΘΟΥΝ ΩΣ ΠΡΟΣ ΤΟΝ ΟΦΘΑΛΜΙΚΟ ΕΡΕΘΙΣΜΟ Ή ΤΗ ΣΟΒΑΡΗ ΟΦΘΑΛΜΙΚΗ ΒΛΑΒΗ
|
Στοιχεία δοκιμής
|
EpiOcular™ EIT
(VRM 1)
|
SkinEthic™ HCE EIT
(VRM 2)
|
|
Πρωτόκολλα
|
Υγρά
(φέρονται με σιφώνιο στους 37±1°C ή σε χαμηλότερες θερμοκρασίες επί 15 λεπτά)
|
Στερεά
(δεν φέρονται με σιφώνιο)
|
Υγρά και παχύρρευστα
(φέρονται με σιφώνιο)
|
Στερεά
(δεν φέρονται με σιφώνιο)
|
|
Επιφάνεια μοντέλου
|
0,6 cm2
|
0,6 cm2
|
0,5 cm2
|
0,5 cm2
|
|
Αριθμός πανομοιότυπων δειγμάτων ιστού
|
Τουλάχιστον 2
|
Τουλάχιστον 2
|
Τουλάχιστον 2
|
Τουλάχιστον 2
|
|
Προέλεγχος για παρεμπόδιση λόγω χρώματος
|
50 μl + 1 ml H2O επί 60 λεπτά στους 37±2 °C, 5±1 % CO2, ≥95 % RH (μη έγχρωμες υπό δοκιμή χημικές ουσίες), ή 50 μl + 2 ml ισοπροπανόλης με ανάμειξη επί 2-3 ώρες σε θερμοκρασία δωματίου (έγχρωμες υπό δοκιμή χημικές ουσίες)
|
 εάν η οπτική πυκνότητα της υπό δοκιμή χημικής ουσίας στα 570±20 nm, μετά την αφαίρεση της οπτικής πυκνότητας για την ισοπροπανόλη ή το νερό, είναι > 0,08 (που αντιστοιχεί στο 5 % περίπου της μέσης οπτικής πυκνότητας του αρνητικού μάρτυρα), θα πρέπει να χρησιμοποιηθούν ζωντανοί προσαρμοσμένοι μάρτυρες εάν η οπτική πυκνότητα της υπό δοκιμή χημικής ουσίας στα 570±20 nm, μετά την αφαίρεση της οπτικής πυκνότητας για την ισοπροπανόλη ή το νερό, είναι > 0,08 (που αντιστοιχεί στο 5 % περίπου της μέσης οπτικής πυκνότητας του αρνητικού μάρτυρα), θα πρέπει να χρησιμοποιηθούν ζωντανοί προσαρμοσμένοι μάρτυρες
|
|
50 mg + 1 ml H2O επί 60 λεπτά στους 37±2 °C, 5±1 % CO2, ≥95 % RH (μη έγχρωμες υπό δοκιμή χημικές ουσίες)
και/ή
50 mg + 2 ml ισοπροπανόλης με ανάμειξη επί 2-3 ώρες σε θερμοκρασία δωματίου (έγχρωμες και μη έγχρωμες υπό δοκιμή χημικές ουσίες)
|
 εάν η οπτική πυκνότητα της υπό δοκιμή χημικής ουσίας στα 570±20 nm, μετά την αφαίρεση της οπτικής πυκνότητας για την ισοπροπανόλη ή το νερό, είναι > 0,08 (που αντιστοιχεί στο 5 % περίπου της μέσης οπτικής πυκνότητας του αρνητικού μάρτυρα), θα πρέπει να χρησιμοποιηθούν ζωντανοί προσαρμοσμένοι μάρτυρες εάν η οπτική πυκνότητα της υπό δοκιμή χημικής ουσίας στα 570±20 nm, μετά την αφαίρεση της οπτικής πυκνότητας για την ισοπροπανόλη ή το νερό, είναι > 0,08 (που αντιστοιχεί στο 5 % περίπου της μέσης οπτικής πυκνότητας του αρνητικού μάρτυρα), θα πρέπει να χρησιμοποιηθούν ζωντανοί προσαρμοσμένοι μάρτυρες
|
|
10 μl + 90 μl H2O αναμεμειγμένα επί 30±2 λεπτά σε θερμοκρασία δωματίου (RT, 18-28°C)
|
 εάν η υπό δοκιμή χημική ουσία είναι έγχρωμη, πρέπει να χρησιμοποιηθούν ζωντανοί προσαρμοσμένοι μάρτυρες εάν η υπό δοκιμή χημική ουσία είναι έγχρωμη, πρέπει να χρησιμοποιηθούν ζωντανοί προσαρμοσμένοι μάρτυρες
|
|
10 mg + 90 μl H2O αναμεμειγμένα επί 30±2 λεπτά σε θερμοκρασία δωματίου
|
 εάν η υπό δοκιμή χημική ουσία είναι έγχρωμη, πρέπει να χρησιμοποιηθούν ζωντανοί προσαρμοσμένοι μάρτυρες εάν η υπό δοκιμή χημική ουσία είναι έγχρωμη, πρέπει να χρησιμοποιηθούν ζωντανοί προσαρμοσμένοι μάρτυρες
|
|
|
Προέλεγχος για άμεση αναγωγή της MTT
|
50 μl + 1 ml MTT 1 mg/ml διαλύματος επί 180±15 λεπτά στους 37±2 °C, 5±1 % CO2, ≥95 % RH
|
 εάν το διάλυμα αποκτήσει κυανό/ιώδες χρώμα, θα πρέπει να χρησιμοποιηθούν αδρανοποιημένοι με κατάψυξη προσαρμοσμένοι μάρτυρες εάν το διάλυμα αποκτήσει κυανό/ιώδες χρώμα, θα πρέπει να χρησιμοποιηθούν αδρανοποιημένοι με κατάψυξη προσαρμοσμένοι μάρτυρες
(χρησιμοποιούνται 50 μl αποστειρωμένου απιονισμένου νερού σε διάλυμα MTT ως αρνητικός μάρτυρας)
|
|
50 mg + 1 ml MTT 1 mg/ml διαλύματος επί 180±15 λεπτά στους 37±2 °C, 5±1 % CO2, ≥95 % RH
|
 εάν το διάλυμα αποκτήσει κυανό/ιώδες χρώμα, θα πρέπει να χρησιμοποιηθούν αδρανοποιημένοι με κατάψυξη προσαρμοσμένοι μάρτυρες εάν το διάλυμα αποκτήσει κυανό/ιώδες χρώμα, θα πρέπει να χρησιμοποιηθούν αδρανοποιημένοι με κατάψυξη προσαρμοσμένοι μάρτυρες
(χρησιμοποιούνται 50 μl αποστειρωμένου απιονισμένου νερού σε διάλυμα MTT ως αρνητικός μάρτυρας)
|
|
30 μl + 300 μl MTT 1 mg/ml διαλύματος επί 180± 15 λεπτά στους 37±2 °C, 5±1 % CO2, ≥95 % RH
|
 εάν το διάλυμα αποκτήσει κυανό/ιώδες χρώμα, θα πρέπει να χρησιμοποιηθούν αδρανοποιημένοι σε νερό προσαρμοσμένοι μάρτυρες εάν το διάλυμα αποκτήσει κυανό/ιώδες χρώμα, θα πρέπει να χρησιμοποιηθούν αδρανοποιημένοι σε νερό προσαρμοσμένοι μάρτυρες
(χρησιμοποιούνται 30 μl αποστειρωμένου απιονισμένου νερού σε διάλυμα MTT ως αρνητικός μάρτυρας)
|
|
30 mg + 300 μl MTT 1 mg/ml διαλύματος επί 180± 15 λεπτά στους 37±2 °C, 5±1 % CO2, ≥95 % RH
|
 εάν το διάλυμα αποκτήσει κυανό/ιώδες χρώμα, θα πρέπει να χρησιμοποιηθούν αδρανοποιημένοι σε νερό προσαρμοσμένοι μάρτυρες εάν το διάλυμα αποκτήσει κυανό/ιώδες χρώμα, θα πρέπει να χρησιμοποιηθούν αδρανοποιημένοι σε νερό προσαρμοσμένοι μάρτυρες
(χρησιμοποιούνται 30 μl αποστειρωμένου απιονισμένου νερού σε διάλυμα MTT ως αρνητικός μάρτυρας)
|
|
|
Προκαταρκτική αγωγή
|
20 μl DPBS ελεύθερο Ca2+/Mg2+
επί 30 ± 2 λεπτά στους 37±2 °C, 5±1 % CO2, ≥95 % RH, προστατευμένο από το φως.
|
20 μl DPBS ελεύθερο Ca2+/Mg2+
επί 30±2 λεπτά στους 37±2 °C, 5±1 % CO2, ≥95 % RH, προστατευμένο από το φως.
|
—
|
—
|
|
Δόσεις αγωγής και εφαρμογή
|
50 μl (83,3 μl/cm2)
|
50 mg (83,3 mg/cm2) με χρήση βαθμονομημένου εργαλείου (π.χ. κοφτή κουταλιά βαθμονομημένη να χωράει 50 mg χλωριούχου νατρίου).
|
10 μl DPBS ελεύθερο Ca2+/Mg2+ + 30 ± 2 μl (60 μl/cm2)
Για παχύρρευστο, χρησιμοποιήστε πλέγμα νάιλον
|
30 μl DPBS ελεύθερο Ca2+/Mg2+ >+ 30 ± 2 mg (60 mg/cm2)
|
|
Χρόνος και θερμοκρασία έκθεσης
|
30 λεπτά (± 2 λεπτά)
σε θρεπτικό μέσο
στους 37±2 °C, 5±1 % CO2, ≥95 % RH
|
6 ώρες (± 0,25 ώρες)
σε θρεπτικό μέσο
στους 37±2 °C, 5±1 % CO2, ≥95 % RH
|
30 λεπτά (± 2 λεπτά)
σε θρεπτικό μέσο
στους 37±2 °C, 5±1 % CO2, ≥95 % RH
|
4 ώρες (± 0,1 ώρες)
σε θρεπτικό μέσο
στους 37±2 °C, 5±1 % CO2, ≥95 % RH
|
|
Έκπλυση σε θερμοκρασία δωματίου
|
3 φορές σε 100 ml DPBS ελεύθερο Ca2+/Mg2+
|
3 φορές σε 100 ml DPBS ελεύθερο Ca2+/Mg2+
|
20 ml DPBS ελεύθερο Ca2+/Mg2+
|
25 ml DPBS ελεύθερο Ca2+/Mg2+
|
|
Εμβύθιση μετά την έκθεση
|
12 λεπτά (± 2 λεπτά) σε θερμοκρασία δωματίου σε θρεπτικό μέσο
|
25 λεπτά (± 2 λεπτά) σε θερμοκρασία δωματίου σε θρεπτικό μέσο
|
30 λεπτά (± 2 λεπτά) στους 37°C, 5 % CO2, 95 % RH σε θρεπτικό μέσο
|
30 λεπτά (± 2 λεπτά) σε θερμοκρασία δωματίου σε θρεπτικό μέσο
|
|
Επώαση μετά την έκθεση
|
120 λεπτά (± 15 λεπτά) σε θρεπτικό μέσο στους 37±2 °C, 5±1 % CO2, ≥95 % RH
|
18 ώρες (± 0,25 ώρες) σε θρεπτικό μέσο στους 37±2 °C, 5±1 % CO2, ≥95 % RH
|
καμία
|
18 ώρες (± 0,5 ώρες) σε θρεπτικό μέσο στους 37±2 °C, 5±1 % CO2, ≥95 % RH
|
|
Αρνητικός μάρτυρας
|
50 μl H2O
Παράλληλη δοκιμή
|
50 μl H2O
Παράλληλη δοκιμή
|
30 ± 2 μl DPBS ελεύθερο Ca2+/Mg2+
Παράλληλη δοκιμή
|
30 ± 2 μl DPBS ελεύθερο Ca2+/Mg2+
Παράλληλη δοκιμή
|
|
Θετικός μάρτυρας
|
50 μl οξικού μεθυλεστέρα
Παράλληλη δοκιμή
|
50 μl οξικού μεθυλεστέρα
Παράλληλη δοκιμή
|
30 ± 2 μl οξικού μεθυλεστέρα
Παράλληλη δοκιμή
|
30 ± 2 μl οξικού μεθυλεστέρα
Παράλληλη δοκιμή
|
|
Διάλυμα MTT
|
300 μl 1 mg/ml
|
300 μl 1 mg/ml
|
300 μl 1 mg/ml
|
300 μl 1 mg/ml
|
|
Χρόνος και θερμοκρασία επώασης ΜΤΤ
|
180 λεπτά (± 15 λεπτά) στους 37±2 °C, 5±1 % CO2, ≥95 % RH
|
180 λεπτά (± 15 λεπτά) στους 37±2 °C, 5±1 % CO2, ≥95 % RH
|
180 λεπτά (± 15 λεπτά) στους 37±2 °C, 5±1 % CO2, ≥95 % RH
|
180 λεπτά (± 15 λεπτά) στους 37±2 °C, 5±1 % CO2, ≥95 % RH
|
|
Διαλύτης εκχύλισης
|
2 ml ισοπροπανόλης
(εκχύλιση από το επάνω και το κάτω τμήμα του ενθέματος με διάτρηση του ιστού)
|
2 ml ισοπροπανόλης
(εκχύλιση από το κάτω τμήμα του ενθέματος με διάτρηση του ιστού)
|
1,5 ml ισοπροπανόλης
(εκχύλιση από το επάνω και το κάτω τμήμα του ενθέματος)
|
1,5 ml ισοπροπανόλης
(εκχύλιση από το κάτω τμήμα του ενθέματος)
|
|
Χρόνος και θερμοκρασία εκχύλισης
|
2-3 ώρες με ανάδευση (~120 σ.α.λ.) σε θερμοκρασία δωματίου ή ολονυχτίως στους 4-10°C
|
2-3 ώρες με ανάδευση (~120 σ.α.λ.) σε θερμοκρασία δωματίου ή ολονυχτίως στους 4-10°C
|
4 ώρες με ανάδευση (~120 σ.α.λ.) σε θερμοκρασία δωματίου ή τουλάχιστον ολονυχτίως χωρίς ανάδευση στους 4-10°C
|
Τουλάχιστον 2 ώρες με ανάδευση (~120 σ.α.λ.) σε θερμοκρασία δωματίου
|
|
Μέτρηση OD
|
570 nm (550 - 590 nm)
χωρίς φίλτρο αναφοράς
|
570 nm (550-590 nm)
χωρίς φίλτρο αναφοράς
|
570 nm (540 - 600 nm)
χωρίς φίλτρο αναφοράς
|
570 nm (540 - 600 nm)
χωρίς φίλτρο αναφοράς
|
|
Ποιοτικός έλεγχος ιστού
|
Αγωγή με 100 μl Triton X-1 000,3 % κ.ό.
12,2 min ≤ ET50 ≤ 37,5 λεπτά
|
Αγωγή με 100 μl Triton X-1 000,3 % κ.ό.
12,2 min ≤ ET50 ≤ 37,5 λεπτά
|
Αγωγή 30 λεπτών με SDS (50 μl)
1,0 mg/ml ≤ IC50 ≤ 3,5 mg/ml
|
Αγωγή 30 λεπτών με SDS (50 μl)
1,0 mg/ml ≤ IC50 ≤ 3,2 mg/ml
|
|
Κριτήρια αποδοχής
|
|
1.
|
Η μέση OD των πανομοιότυπων δειγμάτων ιστού που υποβλήθηκαν σε αγωγή με τον αρνητικό μάρτυρα θα πρέπει να είναι > 0,8 και < 2,5
|
|
2.
|
Η μέση βιωσιμότητα των πανομοιότυπων δειγμάτων ιστού που εκτέθηκαν επί 30 λεπτά στον θετικό μάρτυρα, εκφραζόμενη ως ποσοστό (%) του αρνητικού μάρτυρα, θα πρέπει να είναι < 50 %
|
|
3.
|
Η διαφορά βιωσιμότητας μεταξύ δύο πανομοιότυπων δειγμάτων ιστού δεν θα πρέπει να υπερβαίνει το 20 %.
|
|
|
1.
|
Η μέση OD των πανομοιότυπων δειγμάτων ιστού που υποβλήθηκαν σε αγωγή με τον αρνητικό μάρτυρα θα πρέπει να είναι > 0,8 και < 2,5
|
|
2.
|
Η μέση βιωσιμότητα των πανομοιότυπων δειγμάτων ιστού που εκτέθηκαν επί 6 ώρες στον θετικό μάρτυρα, εκφραζόμενη ως ποσοστό (%) του αρνητικού μάρτυρα, θα πρέπει να είναι < 50 %
|
|
3.
|
Η διαφορά βιωσιμότητας μεταξύ δύο πανομοιότυπων δειγμάτων ιστού δεν θα πρέπει να υπερβαίνει το 20 %.
|
|
|
1.
|
Η μέση OD των πανομοιότυπων δειγμάτων ιστού που υποβλήθηκαν σε αγωγή με τον αρνητικό μάρτυρα θα πρέπει να είναι > 1,0 και ≤ 2,5
|
|
2.
|
Η μέση βιωσιμότητα των πανομοιότυπων δειγμάτων ιστού που εκτέθηκαν επί 30 λεπτά στον θετικό μάρτυρα, εκφραζόμενη ως ποσοστό (%) του αρνητικού μάρτυρα, θα πρέπει να είναι ≤ 30 %
|
|
3.
|
Η διαφορά βιωσιμότητας μεταξύ δύο πανομοιότυπων δειγμάτων ιστού δεν θα πρέπει να υπερβαίνει το 20 %.
|
|
|
1.
|
Η μέση OD των πανομοιότυπων δειγμάτων ιστού που υποβλήθηκαν σε αγωγή με τον αρνητικό μάρτυρα θα πρέπει να είναι > 1,0 και ≤ 2,5
|
|
2.
|
Η μέση βιωσιμότητα των πανομοιότυπων δειγμάτων ιστού που εκτέθηκαν επί 4 ώρες στον θετικό μάρτυρα, εκφραζόμενη ως ποσοστό (%) του αρνητικού μάρτυρα, θα πρέπει να είναι ≤ 20 %
|
|
3.
|
Η διαφορά βιωσιμότητας μεταξύ δύο πανομοιότυπων δειγμάτων ιστού δεν θα πρέπει να υπερβαίνει το 20 %.
|
|
Προσάρτημα 3
ΕΠΕΞΗΓΗΜΑΤΙΚΟ ΔΙΑΓΡΑΜΜΑ ΡΟΗΣ ΣΧΕΤΙΚΑ ΜΕ ΤΟΝ ΤΡΟΠΟ ΠΡΟΣΔΙΟΡΙΣΜΟΥ ΚΑΙ ΧΕΙΡΙΣΜΟΥ ΤΩΝ ΑΜΕΣΩΝ ΑΝΑΓΩΓΙΚΩΝ ΤΗΣ ΜΤΤ ΚΑΙ/H ΤΩΝ ΠΑΡΕΜΠΟΔΙΣΤΙΚΩΝ ΛΟΓΩ ΧΡΩΜΑΤΟΣ ΧΗΜΙΚΩΝ ΟΥΣΙΩΝ, ΒΑΣΕΙ ΤΗΣ SOP ΤΗΣ VRM1

Προσάρτημα 4
ΕΠΕΞΗΓΗΜΑΤΙΚΟ ΔΙΑΓΡΑΜΜΑ ΡΟΗΣ ΣΧΕΤΙΚΑ ΜΕ ΤΟΝ ΤΡΟΠΟ ΠΡΟΣΔΙΟΡΙΣΜΟΥ ΚΑΙ ΧΕΙΡΙΣΜΟΥ ΤΩΝ ΑΜΕΣΩΝ ΑΝΑΓΩΓΙΚΩΝ ΤΗΣ ΜΤΤ ΚΑΙ/H ΤΩΝ ΠΑΡΕΜΠΟΔΙΣΤΙΚΩΝ ΛΟΓΩ ΧΡΩΜΑΤΟΣ ΧΗΜΙΚΩΝ ΟΥΣΙΩΝ, ΒΑΣΕΙ ΤΗΣ SOP ΤΗΣ VRM2

Προσάρτημα 5
ΒΑΣΙΚΕΣ ΠΑΡΑΜΕΤΡΟΙ ΚΑΙ ΚΡΙΤΗΡΙΑ ΑΠΟΔΟΧΗΣ ΤΗΣ ΚΑΤΑΛΛΗΛΟΤΗΤΑΣ ΣΥΣΤΗΜΑΤΟΣ HPLC/UPLC-ΦΑΣΜΑΤΟΦΩΤΟΜΕΤΡΙΑΣ ΓΙΑ ΜΕΤΡΗΣΗ ΤΗΣ ΦΟΡΜΑΖΑΝΗΣ MTT ΠΟΥ ΕΚΧΥΛΙΖΕΤΑΙ ΑΠΟ ΙΣΤΙΚΑ ΜΟΡΦΩΜΑΤΑ RHE
|
Παράμετρος
|
Πρωτόκολλο από την καθοδήγηση της FDA (36)(38)
|
Κριτήρια αποδοχής
|
|
Επιλεκτικότητα
|
Ανάλυση ισοπροπανόλης, ζωντανού τυφλού δείγματος (εκχύλισμα ισοπροπανόλης από ζωντανούς ιστούς RhCE χωρίς καμία αγωγή), αδρανοποιημένου τυφλού δείγματος (εκχύλισμα ισοπροπανόλης από αδρανοποιημένα ιστικά μορφώματα RhCE χωρίς καμία αγωγή) και χρωστικής (π.χ. κυανό του μεθυλενίου)
|
εμβαδόνπαρεμβολής ≤ 20 % του εμβαδούLLOQ
(87)
|
|
Ακρίβεια
|
Μάρτυρες ποιοτικού ελέγχου (φορμαζάνη MTT στα 1,6 μg/ml, 16 μg/ml και 160 μg/ml) σε ισοπροπανόλη (n=5)
|
CV ≤ 15 % ή ≤ 20 % για το LLOQ
|
|
Ορθότητα
|
Μάρτυρες ποιοτικού ελέγχου σε ισοπροπανόλη (n=5)
|
%Dev ≤ 15 % ή ≤ 20 % για το LLOQ
|
|
Φαινόμενο μήτρας
|
Μάρτυρες ποιοτικού ελέγχου σε ζωντανό τυφλό δείγμα (n=5)
|
85 % ≤ φαινόμενο μήτρας % ≤ 115 %
|
|
Μεταφορά υλικού
|
Ανάλυση ισοπροπανόλης μετά από πρότυπο ULOQ (88)
|
εμβαδόνπαρεμβολής ≤ 20 % του εμβαδούLLOQ
|
|
Αναπαραγωγιμότητα (εντός ημέρας)
|
3 ανεξάρτητες καμπύλες βαθμονόμησης (με βάση 6 διαδοχικές αραιώσεις φορμαζάνης MTT 1:3 σε ισοπροπανόλη, ξεκινώντας από το ULOQ, δηλαδή 200 μg/ml),
Μάρτυρες ποιοτικού ελέγχου σε ισοπροπανόλη (n=5)
|
Καμπύλες βαθμονόμησης: %Dev ≤ 15 % ή ≤ 20 % για το LLOQ
Μάρτυρες ποιοτικού ελέγχου: %Dev ≤ 15 % και CV ≤ 15 %
|
|
Αναπαραγωγιμότητα (μεταξύ ημερών)
|
Ημέρα 1: 1 καμπύλη βαθμονόμησης και μάρτυρες ποιοτικού ελέγχου σε ισοπροπανόλη (n=3)
Ημέρα 2: 1 καμπύλη βαθμονόμησης και μάρτυρες ποιοτικού ελέγχου σε ισοπροπανόλη (n=3)
Ημέρα 3: 1 καμπύλη βαθμονόμησης και μάρτυρες ποιοτικού ελέγχου σε ισοπροπανόλη (n=3)
|
|
Βραχυχρόνια σταθερότητα της φορμαζάνης MTT σε εκχύλισμα ιστών RhCE
|
Μάρτυρες ποιοτικού ελέγχου σε ζωντανό τυφλό δείγμα (n=3) αναλυόμενοι την ημέρα της παρασκευής και μετά από 24 ώρες φύλαξης σε θερμοκρασία δωματίου
|
%Dev ≤ 15 %
|
|
Μακροχρόνια σταθερότητα της φορμαζάνης MTT σε εκχύλισμα ιστών RhCE, εφόσον απαιτείται
|
Μάρτυρες ποιοτικού ελέγχου σε ζωντανό τυφλό δείγμα (n=3) αναλυόμενοι την ημέρα της παρασκευής και μετά από αρκετές ημέρες φύλαξης στους -20°C
|
%Dev ≤ 15 %
|
B.70
IN VITRO ΔΟΚΙΜΑΣΙΕΣ ΑΝΑΣΥΝΔΥΑΣΜΕΝΟΥ ΑΝΘΡΩΠΙΝΟΥ ΥΠΟΔΟΧΕΑ ΟΙΣΤΡΟΓΟΝΩΝ ΓΙΑ ΤΗΝ ΑΝΙΧΝΕΥΣΗ ΧΗΜΙΚΩΝ ΟΥΣΙΩΝ ΜΕ ΣΥΓΓΕΝΕΙΑ ΔΕΣΜΕΥΣΗΣ ER
ΓΕΝΙΚΗ ΕΙΣΑΓΩΓΗ
Κατευθυντήρια γραμμή δοκιμών του ΟΟΣΑ με βάση τις επιδόσεις
|
1.
|
Η παρούσα μέθοδος δοκιμών είναι ισοδύναμη με την κατευθυντήρια γραμμή δοκιμών (TG) 493 του ΟΟΣΑ (2015). Η TG 493 είναι μια κατευθυντήρια γραμμή δοκιμών που βασίζεται στις επιδόσεις (PBTG), στην οποία περιγράφεται η μεθοδολογία για τις in vitro δοκιμασίες ανασυνδυασμένου ανθρώπινου υποδοχέα οιστρογόνων για την ανίχνευση συγγένειας δέσμευσης με τον υποδοχέα οιστρογόνων (δοκιμασίες δέσμευσης hrER). Περιλαμβάνει δύο μηχανιστικά και λειτουργικά παρεμφερείς δοκιμασίες για τον προσδιορισμό ουσιών που δεσμεύονται στον υποδοχέα οιστρογόνων (ERα) και αναμένεται να διευκολύνει την ανάπτυξη νέων παρεμφερών ή τροποποιημένων δοκιμασιών, σύμφωνα με τις αρχές επικύρωσης που καθορίζονται στο έγγραφο καθοδήγησης του ΟΟΣΑ για την επικύρωση και τη διεθνή αποδοχή νέων ή επικαιροποιημένων μεθόδων δοκιμών για την αξιολόγηση επικινδυνότητας (1). Οι πλήρως επικυρωμένες μέθοδοι δοκιμών αναφοράς (προσάρτημα 2 και προσάρτημα 3) που αποτελούν τη βάση για την εν λόγω PBTG είναι οι ακόλουθες:
|
—
|
η in vitro δοκιμασία δέσμευσης υποδοχέα οιστρογόνων (ER) Freyberger-Wilson (FW) με χρήση ανθρώπινου ανασυνδυασμένου ERα πλήρους μήκους (2) και
|
|
—
|
η in vitro δοκιμασία δέσμευσης υποδοχέα οιστρογόνων με χρήση ανασυνδυασμένης ανθρώπινης πρωτεΐνης περιοχής δέσμευσης προσδέματος, του Chemical Evaluation and Research Institute (CERI) (Ινστιτούτο αξιολόγησης και έρευνας χημικών ουσιών) (2).
|
Υπάρχουν διαθέσιμα πρότυπα επιδόσεων (PS) (3) που διευκολύνουν την ανάπτυξη και επικύρωση παρεμφερών μεθόδων δοκιμών για την ίδια παράμετρο επικινδυνότητας και επιτρέπουν την έγκαιρη τροποποίηση της PBTG 493, ούτως ώστε να εφικτή η προσθήκη νέων παρεμφερών δοκιμασιών στην επικαιροποιημένη PBTG. Εντούτοις, παρεμφερείς δοκιμασίες θα προστίθενται μόνο αφού τις εξετάσει ο ΟΟΣΑ και συμφωνήσει ότι πληρούνται τα πρότυπα επιδόσεων. Οι δοκιμασίες που περιλαμβάνονται στην TG 493 μπορούν να χρησιμοποιούνται αδιακρίτως για τη συμμόρφωση προς τις απαιτήσεις των χωρών μελών του ΟΟΣΑ όσον αφορά τα αποτελέσματα δοκιμών σχετικά με τη δέσμευση υποδοχέα οιστρογόνων, με παράλληλη αξιοποίηση της αμοιβαίας αποδοχής δεδομένων του ΟΟΣΑ.
|
Ιστορικό και αρχές των δοκιμασιών που περιλαμβάνονται στην παρούσα μέθοδο δοκιμών
|
2.
|
Το 1998 o ΟΟΣΑ ανέλαβε μια δράση πρώτης προτεραιότητας με σκοπό την αναθεώρηση των υφιστάμενων και την εκπόνηση νέων κατευθυντήριων γραμμών δοκιμών για τη διαλογή και τις δοκιμές δυνητικών ενδοκρινικών διαταρακτών. Το εννοιακό πλαίσιο του ΟΟΣΑ για τη διεξαγωγή δοκιμών και την αξιολόγηση δυνητικών ενδοκρινικών διαταρακτών αναθεωρήθηκε το 2012. Τα αρχικά και τα αναθεωρημένα εννοιακά πλαίσια περιλαμβάνονται ως παραρτήματα στο έγγραφο καθοδήγησης «Standardised Test Guidelines for Evaluating Chemicals for Endocrine Disruption» (Τυποποιημένες κατευθυντήριες γραμμές δοκιμών για την αξιολόγηση του δυναμικού χημικών ουσιών ως ενδοκρινικών διαταρακτών) (4). Το εννοιακό πλαίσιο περιλαμβάνει πέντε επίπεδα, καθένα εκ των οποίων αντιστοιχεί σε διαφορετικό επίπεδο βιολογικής πολυπλοκότητας. Οι δοκιμασίες δέσμευσης ER που περιγράφονται στην παρούσα μέθοδο δοκιμών κατατάσσονται στο επίπεδο 2, το οποίο περιλαμβάνει «in vitro δοκιμασίες για την παροχή δεδομένων σχετικά με επιλεγμένους ενδοκρινικούς μηχανισμούς/οδούς». Η παρούσα μέθοδος δοκιμών αφορά in vitro δοκιμασίες δέσμευσης υποδοχέα που έχουν σχεδιαστεί για τον προσδιορισμό προσδεμάτων του ανθρώπινου υποδοχέα οιστρογόνων α (ERα).
|
|
3.
|
Η καταλληλότητα της in vitro δοκιμασίας ER για τις βιολογικές λειτουργίες έχει καταδειχθεί με σαφήνεια. Οι δοκιμασίες δέσμευσης ER έχουν σχεδιαστεί για τον προσδιορισμό χημικών ουσιών που μπορούν να διαταράξουν την οιστρογονική ορμονική οδό και έχουν χρησιμοποιηθεί ευρέως κατά τις τελευταίες δύο δεκαετίες για τον χαρακτηρισμό της κατανομής των ER στους ιστούς, καθώς και για τον προσδιορισμό των αγωνιστών/ανταγωνιστών ER. Οι εν λόγω δοκιμασίες αποτυπώνουν την αλληλεπίδραση προσδέματος-υποδοχέα η οποία είναι το πρώτο στάδιο της οδού σηματοδότησης οιστρογόνων και είναι κρίσιμης σημασίας για την αναπαραγωγική λειτουργία όλων των σπονδυλωτών.
|
|
4.
|
Η αλληλεπίδραση των οιστρογόνων με τους ER μπορεί να επηρεάσει τη μεταγραφή των ελεγχόμενων από τα οιστρογόνα γονιδίων και να επαγάγει μη γονιδιωματικές επιδράσεις, με αποτέλεσμα την επαγωγή ή την αναστολή κυτταρικών διεργασιών, περιλαμβανομένων όσων είναι αναγκαίες για τον πολλαπλασιασμό των κυττάρων, τη φυσιολογική ανάπτυξη του διαμορφωμένου εμβρύου, και την αναπαραγωγική λειτουργία (5) (6) (7). Η διατάραξη των φυσιολογικών οιστρογονικών συστημάτων μπορεί να προκαλέσει δυσμενείς επιπτώσεις στη φυσιολογική ανάπτυξη (οντογένεση), την αναπαραγωγική υγεία και την ακεραιότητα του αναπαραγωγικού συστήματος. Η απρόσφορη σηματοδότηση μέσω των ER μπορεί να οδηγήσει σε επιδράσεις όπως αυξημένος κίνδυνος ορμονοεξαρτώμενου καρκίνου, δυσμενείς επιπτώσεις στη γονιμότητα και αλλοιώσεις στη διαδικασία αύξησης και ανάπτυξης του εμβρύου (8).
|
|
5.
|
Οι in vitro δοκιμασίες δέσμευσης βασίζονται στην άμεση αλληλεπίδραση μιας ουσίας με συγκεκριμένη θέση δέσμευσης προσδέματος υποδοχέα που ρυθμίζει τη γονιδιακή μεταγραφή. Το κύριο στοιχείο της δοκιμασίας δέσμευσης ανθρώπινου ανασυνδυασμένου υποδοχέα οιστρογόνων α (hrERα) μετρά την ικανότητα ενός ραδιοσημασμένου προσδέματος ([3H]17β-οιστραδιόλη) να δεσμεύεται στον ER παρουσία αυξανόμενων συγκεντρώσεων μιας υπό δοκιμή χημικής ουσίας (ανταγωνιστή). Οι υπό δοκιμή χημικές ουσίες που παρουσιάζουν υψηλή συγγένεια για τον ER ανταγωνίζονται με το ραδιοσημασμένο πρόσδεμα σε χαμηλότερη συγκέντρωση σε σύγκριση με τις χημικές ουσίες με χαμηλότερη συγγένεια για τον υποδοχέα. Η δοκιμασία αυτή αποτελείται από δύο βασικά στοιχεία: ένα πείραμα δέσμευσης κορεσμού για τον χαρακτηρισμό των παραμέτρων αλληλεπίδρασης υποδοχέα-προσδέματος και την τεκμηρίωση της ειδικότητας του ER, ακολουθούμενο από ένα πείραμα ανταγωνιστικής δέσμευσης που χαρακτηρίζει τον ανταγωνισμό μεταξύ μιας υπό δοκιμή χημικής ουσίας και ενός ραδιοσημασμένου προσδέματος ως προς τη δέσμευση στον ER.
|
|
6.
|
Μελέτες επικύρωσης των δοκιμασιών δέσμευσης CERI και FW έχουν καταδείξει την καταλληλότητα και την αξιοπιστία τους ως προς τον σκοπό για τον οποίο προορίζονται (2).
|
|
7.
|
Οι ορισμοί και οι συντομογραφίες που χρησιμοποιούνται στην παρούσα μέθοδο δοκιμών παρατίθενται στο προσάρτημα 1.
|
Πεδίο εφαρμογής και περιορισμοί που σχετίζονται με τις δοκιμασίες δέσμευσης υποδοχέα
|
8.
|
Οι δοκιμασίες αυτές προτείνονται για σκοπούς διαλογής και καθορισμού προτεραιοτήτων, αλλά μπορούν επίσης να παρέχουν πληροφορίες για ένα μοριακό εναρκτήριο συμβάν (MIE) που μπορούν να χρησιμοποιηθούν στο πλαίσιο προσέγγισης βάρους της απόδειξης. Αφορούν τη δέσμευση χημικών ουσιών στη θέση δέσμευσης προσδέματος ERα σε in vitro σύστημα. Ως εκ τούτου, τα αποτελέσματα δεν θα πρέπει να παρεκβάλλονται άμεσα στην πολύπλοκη σηματοδότηση και ρύθμιση του ακέραιου ενδοκρινικού συστήματος in vivo.
|
|
9.
|
Η δέσμευση του φυσικού προσδέματος, της 17β-οιστραδιόλης, είναι το αρχικό στάδιο της σειράς μοριακών συμβάντων που ενεργοποιεί τη μεταγραφή γονιδίων στόχων και καταλήγει εντέλει σε αλλαγές της φυσιολογίας (9). Ως εκ τούτου, η δέσμευση στην περιοχή δέσμευσης προσδέματος ERα θεωρείται ένας από τους βασικούς μηχανισμούς ενδοκρινικών διαταραχών που μεσολαβούνται από τον ER, αν και υπάρχουν και άλλοι μηχανισμοί μέσω των οποίων μπορεί να λάβει χώρα ενδοκρινική διαταραχή, συμπεριλαμβανομένων i) των αλληλεπιδράσεων με θέσεις του ERα διαφορετικές από τη θέση δέσμευσης προσδέματος, ii) των αλληλεπιδράσεων με άλλους υποδοχείς που σχετίζονται με τη σηματοδότηση οιστρογόνων, τον ERβ και τον συζευγμένο με πρωτεΐνη G υποδοχέα οιστρογόνων, άλλους υποδοχείς και ενζυμικά συστήματα εντός του ενδοκρινικού συστήματος, iii) της σύνθεσης ορμονών, iv) της μεταβολικής ενεργοποίησης και/ή της αδρανοποίησης ορμονών, v) της κατανομής ορμονών στους ιστούς στόχους, και vi) της απομάκρυνσης ορμονών από το σώμα. Καμία από τις δοκιμασίες της παρούσας μεθόδου δοκιμών δεν αφορά τους συγκεκριμένους τρόπους δράσης.
|
|
10.
|
Η παρούσα μέθοδος δοκιμών αφορά την ικανότητα των ουσιών να δεσμεύονται σε ανθρώπινο ERα και δεν παρέχει τη δυνατότητα διάκρισης μεταξύ αγωνιστών ή ανταγωνιστών του ERα. Οι δοκιμασίες δεν αφορούν ούτε περαιτέρω κατάντη συμβάντα, όπως η μεταγραφή γονιδίων, ούτε φυσιολογικές αλλαγές. Δεδομένου ότι κατά την επικύρωση χρησιμοποιήθηκαν μόνο μεμονωμένες μονοσυστατικές ουσίες, δεν έχει εξεταστεί η εφαρμοσιμότητα σε μείγματα δοκιμών. Οι δοκιμασίες είναι πάντως θεωρητικά εφαρμόσιμες στον έλεγχο πολυσυστατικών ουσιών και μειγμάτων. Πριν από τη χρήση της μεθόδου δοκιμών σε μείγμα για την παραγωγή δεδομένων για συγκεκριμένο κανονιστικό σκοπό, θα πρέπει να εξετάζεται αν –και, εάν ναι, για ποιον λόγο– μπορεί να αποδώσει αποτελέσματα κατάλληλα για τον επιδιωκόμενο σκοπό. Τέτοια εξέταση δεν χρειάζεται όταν οι κανονιστικές ρυθμίσεις επιβάλλουν τον έλεγχο του μείγματος.
|
|
11.
|
Τα ελεύθερα κυττάρων συστήματα υποδοχέα δεν διαθέτουν εγγενή μεταβολική ικανότητα και δεν επικυρώθηκαν σε συνδυασμό με μεταβολικά ενζυμικά συστήματα. Ωστόσο, η ενσωμάτωση της μεταβολικής δραστηριότητας στον σχεδιασμό μελέτης μπορεί να είναι εφικτή αλλά θα απαιτήσει περαιτέρω εργασίες επικύρωσης.
|
|
12.
|
Χημικές ουσίες που μπορούν να μετουσιώσουν την πρωτεΐνη (του υποδοχέα), όπως επιφανειοδραστικά ή χημικές ουσίες που μπορούν να μεταβάλλουν το pH του ρυθμιστικού διαλύματος της δοκιμασίας, δεν επιτρέπεται να υποβάλλονται σε δοκιμή ή επιτρέπεται να υποβάλλονται σε δοκιμή μόνο σε συγκεντρώσεις που δεν προκαλούν τέτοιες αλληλεπιδράσεις. Επιπλέον, το φάσμα συγκεντρώσεων μιας υπό δοκιμή χημικής ουσίας που μπορεί να εξεταστεί περιορίζεται από τη διαλυτότητά της στο ρυθμιστικό διάλυμα της δοκιμασίας.
|
|
13.
|
Για λόγους πληροφόρησης, στον πίνακα 1 παρατίθενται τα αποτελέσματα δοκιμών αγωνιστών για τις 24 ουσίες που υποβλήθηκαν σε δοκιμή στο πλαίσιο αμφότερων των πλήρως επικυρωμένων δοκιμασιών που περιγράφονται στην παρούσα μέθοδο δοκιμών. Εξ αυτών, οι 17 χαρακτηρίζονται ουσίες δεσμευόμενες στον ER και οι 6 χαρακτηρίζονται μη δεσμευόμενες με βάση δημοσιευμένες εργασίες, περιλαμβανομένων και in vitro δοκιμασιών για μεταγραφική ενεργοποίηση ER και/ή της μητροτροφικής δοκιμασίας (9) (10) (11) (12) (13) (14) (15). Όσον αφορά τα δεδομένα που παρουσιάζονται συνοπτικά στον πίνακα 1, υπήρξε σχεδόν 100 % συμφωνία μεταξύ των δύο δοκιμασιών σχετικά με τις ταξινομήσεις όλων των ουσιών έως 10-4M, και κάθε ουσία ταξινομήθηκε σωστά ως δεσμευόμενη ή μη δεσμευόμενη στον ER. Συμπληρωματικές πληροφορίες σχετικά με την εν λόγω ομάδα χημικών ουσιών καθώς και πρόσθετων χημικών ουσιών που υποβλήθηκαν στις δοκιμασίες δέσμευσης ER στη διάρκεια των μελετών επικύρωσης παρέχονται στα πρότυπα επιδόσεων για τη δοκιμασία δέσμευσης hrER (3), προσάρτημα 2 (πίνακες 1, 2 και 3).
Πίνακας 1
Ταξινόμηση ουσιών ως δεσμευόμενων ή μη δεσμευόμενων στον ER, όταν υποβάλλονται σε δοκιμή στις δοκιμασίες δέσμευσης hrER FW και CERI σε σύγκριση με την αναμενόμενη απόκριση
|
|
Ονομασία της ουσίας
|
Αριθ. CAS
|
Αναμενόμενη απόκριση
|
Δοκιμασία FW
|
Δοκιμασία CERI
|
Κατηγορία χημικής ουσίας MESH
|
Κατηγορία προϊόντος
|
|
|
Πεδίο τιμών συγκέντρωσης (M)
|
Ταξινόμηση
|
Πεδίο τιμών συγκέντρωσης (M)
|
Ταξινόμηση
|
|
1
|
17β-Οιστραδιόλη
|
50-28-2
|
Δεσμευόμενη
|
1×10-11 – 1×10-6
|
Δεσμευόμενη
|
1×10-11 – 1×10-6
|
Δεσμευόμενη
|
Στεροειδές
|
Φαρμακευτικό προϊόν, κτηνιατρικός παράγοντας
|
|
2
|
Νορεθυνοδρέλη
|
68-23-5
|
Δεσμευόμενη
|
3×10-9 – 30×10-4
|
Δεσμευόμενη
|
3×10-9 – 30×10-4
|
Δεσμευόμενη
|
Στεροειδές
|
Φαρμακευτικό προϊόν, κτηνιατρικός παράγοντας
|
|
3
|
Νορεθινδρόνη
|
68-22-4
|
Δεσμευόμενη
|
3×10-9 – 30×10-4
|
Δεσμευόμενη
|
3×10-9 – 30×10-4
|
Δεσμευόμενη
|
Στεροειδές
|
Φαρμακευτικό προϊόν, κτηνιατρικός παράγοντας
|
|
4
|
Φθαλικό δι-n-βουτύλιο
|
84-74-2
|
Μη δεσμευόμενη (*5)
|
1×10-10 – 1×10-4
|
Μη δεσμευόμενη (*6)
(1)
|
1×10-10 – 1×10-4
|
Μη δεσμευόμενη (*6)
(1)
|
Υδρογονάνθρακας (κυκλικός), εστέρας
|
Πλαστικοποιητής, ενδιάμεση χημική ουσία
|
|
5
|
DES
|
56-53-1
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Δεσμευόμενη
|
Υδρογονάνθρακας (κυκλικός), φαινόλη
|
Φαρμακευτικό προϊόν, κτηνιατρικός παράγοντας
|
|
6
|
17α-Αιθινυλοιστραδιόλη
|
57-63-6
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Δεσμευόμενη
|
Στεροειδές
|
Φαρμακευτικό προϊόν, κτηνιατρικός παράγοντας
|
|
7
|
meso-Εξεστρόλη
|
84-16-2
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Δεσμευόμενη
|
Υδρογονάνθρακας (κυκλικός), φαινόλη
|
Φαρμακευτικό προϊόν, κτηνιατρικός παράγοντας
|
|
8
|
Γενιστεΐνη
|
446-72-0
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Δεσμευόμενη
|
Υδρογονάνθρακας (ετεροκυκλικός), φλαβονοειδές
|
Φυσικό προϊόν
|
|
9
|
Εκουόλη
|
531-95-3
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Δεσμευόμενη
|
Μεταβολίτης φυτοοιστρογόνων
|
Φυσικό προϊόν
|
|
10
|
p-Υδροξυβενζοϊκός βουτυλεστέρας (4-υδροξυβενζοϊκό n-βουτύλιο)
|
94-26-8
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Δεσμευόμενη
|
Paraben (p-υδροξυβενζοϊκός εστέρας)
|
Συντηρητικό
|
|
11
|
Εννεϋλοφαινόλη (μείγμα)
|
84852-15-3
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Δεσμευόμενη
|
Αλκυλοφαινόλη
|
Ενδιάμεση ένωση
|
|
12
|
o,p'-DDT
|
789-02-6
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Δεσμευόμενη
|
Οργανοχλωριούχος
|
Εντομοκτόνο
|
|
13
|
Κορτικοστερόνη
|
50-22-6
|
Μη δεσμευόμενη (*5)
|
1×10-10 – 1×10-4
|
Μη δεσμευόμενη
|
1×10-10 – 1×10-4
|
Μη δεσμευόμενη
|
Στεροειδές
|
Φυσικό προϊόν
|
|
14
|
Ζεαραλενόνη
|
17924-92-4
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Δεσμευόμενη
|
Υδρογονάνθρακας (ετεροκυκλικός), λακτόνη
|
Φυσικό προϊόν
|
|
15
|
Ταμοξιφαίνη
|
10540-29-1
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Δεσμευόμενη
|
Υδρογονάνθρακας (κυκλικός)
|
Φαρμακευτικό προϊόν, κτηνιατρικός παράγοντας
|
|
16
|
5α-Διυδροτεστοστερόνη
|
521-18-6
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Δεσμευόμενη
|
Στεροειδές, μη φαινολική
|
Φυσικό προϊόν
|
|
17
|
Δισφαινόλη Α
|
80-05-7
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Δεσμευόμενη
|
Φαινόλη
|
Ενδιάμεση χημική ουσία
|
|
18
|
4-n-Επτυλοφαινόλη
|
1987-50-4
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Αμφίβολο (6)
|
1×10-10 – 1×10-3
|
Δεσμευόμενη
|
Αλκυλοφαινόλη
|
Ενδιάμεσο προϊόν
|
|
19
|
Κεπόνη (Chlordecone)
|
143-50-0
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Δεσμευόμενη
|
Υδρογονάνθρακας (αλογονωμένος)
|
Φυτοφάρμακο
|
|
20
|
Βενζο(a)ανθρακένιο
|
56-55-3
|
Μη δεσμευόμενη
|
1×10-10 – 1×10-3
|
Μη δεσμευόμενη (7)
|
1×10-10 – 1×10-3
|
Μη δεσμευόμενη (7)
|
Αρωματικός υδρογονάνθρακας
|
Ενδιάμεσο προϊόν
|
|
21
|
Εντερολακτόνη
|
78473-71-9
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Δεσμευόμενη
|
Φυτοοιστρογόνο
|
Φυσικό προϊόν
|
|
22
|
Προγεστερόνη
|
57-83-0
|
Μη δεσμευόμενη (*5)
|
1×10-10 – 1×10-4
|
Μη δεσμευόμενη
|
1×10-10 – 1×10-4
|
Μη δεσμευόμενη
|
Στεροειδές
|
Φυσικό προϊόν
|
|
23
|
Οκτυλοτριαιθοξυσιλάνιο
|
2943-75-1
|
Μη δεσμευόμενη
|
1×10-10 – 1×10-3
|
Μη δεσμευόμενη
|
1×10-10 – 1×10-3
|
Μη δεσμευόμενη
|
Σιλάνιο
|
Τροποποιητής επιφανειών
|
|
24
|
Ατραζίνη
|
1912-24-9
|
Μη δεσμευόμενη (*5)
|
1×10-10 – 1×10-4
|
Μη δεσμευόμενη
|
1×10-10 – 1×10-4
|
Μη δεσμευόμενη
|
Ετεροκυκλική ένωση,
|
Ζιζανιοκτόνο
|
|
ΣΤΟΙΧΕΙΑ ΤΗΣ ΔΟΚΙΜΑΣΙΑΣ ΔΕΣΜΕΥΣΗΣ hrER
Βασικά στοιχεία της δοκιμασίας
|
14.
|
Η παρούσα μέθοδος δοκιμών εφαρμόζεται σε δοκιμασίες που χρησιμοποιούν υποδοχέα ER και κατάλληλα ισχυρό πρόσδεμα του υποδοχέα, το οποίο μπορεί να χρησιμοποιηθεί ως δείκτης/ιχνηθέτης για τη δοκιμασία και μπορεί να εκτοπίζεται από αυξανόμενες συγκεντρώσεις μιας υπό δοκιμή χημικής ουσίας. Οι δοκιμασίες δέσμευσης περιλαμβάνουν τα ακόλουθα δύο βασικά στοιχεία: 1) δέσμευση κορεσμού και 2) ανταγωνιστική δέσμευση. Η δοκιμασία δέσμευσης κορεσμού χρησιμοποιείται για την επιβεβαίωση της ειδικότητας και της δραστικότητας των σκευασμάτων υποδοχέα, ενώ το πείραμα ανταγωνιστικής δέσμευσης χρησιμοποιείται για την αξιολόγηση της ικανότητας μιας υπό δοκιμή χημικής ουσίας να δεσμεύεται στον hrER.
|
Μάρτυρες
|
15.
|
Θα πρέπει να περιγράφεται η βάση του προτεινόμενου παράλληλου οιστρογόνου αναφοράς και των μαρτύρων. Οι παράλληλοι μάρτυρες [διαλύτης (φορέας), θετικός (ουσία δεσμευόμενη στον ER, ισχυρή και ασθενής συγγένεια), αρνητικός (μη δεσμευόμενη ουσία)], κατά περίπτωση, χρησιμεύουν ως ένδειξη της λειτουργικότητας της δοκιμασίας υπό τις συνθήκες δοκιμής και παρέχουν μια βάση για συγκρίσεις μεταξύ πειραμάτων· αποτελούν συνήθως μέρος των κριτηρίων αποδοχής για συγκεκριμένο πείραμα (1). Σε ένα τρυβλίο στη διάρκεια κάθε σειράς δοκιμών, θα πρέπει να χρησιμοποιούνται πλήρεις καμπύλες συγκέντρωσης για το οιστρογόνο αναφοράς και τους μάρτυρες (ασθενώς δεσμευόμενη και μη δεσμευόμενη ουσία). Όλα τα άλλα τρυβλία θα πρέπει να περιέχουν: 1) υψηλή (σχεδόν πλήρης εκτόπιση του ραδιοσημασμένου προσδέματος) και μέτρια (περίπου ίση με την IC50) συγκέντρωση E2 και ασθενώς δεσμευόμενης ουσίας, καθεμία εκ των οποίων εις τριπλούν, 2) μάρτυρα με διαλύτη και μη ειδική δέσμευση, καθένα εκ των οποίων εις τριπλούν.
|
Τυπικές διαδικασίες ποιοτικού ελέγχου
|
16.
|
Οι τυπικές διαδικασίες ποιοτικού ελέγχου θα πρέπει να διεκπεραιώνονται σύμφωνα με τα οριζόμενα για κάθε δοκιμασία προκειμένου να διασφαλίζεται ότι οι υποδοχείς είναι ενεργοί, οι συγκεντρώσεις των χημικών ουσιών είναι ορθές και τα όρια ανοχής παραμένουν σταθερά στη διάρκεια πολλών επαναλήψεων, διασφαλίζοντας τη διαχρονική ικανότητα παροχής των αναμενόμενων αποκρίσεων δέσμευσης ER.
|
Απόδειξη της τεχνικής ικανότητας του εργαστηρίου
|
17.
|
Πριν από τον έλεγχο άγνωστων χημικών ουσιών με οποιαδήποτε από τις δοκιμασίες της παρούσας μεθόδου δοκιμών, κάθε εργαστήριο θα πρέπει να αποδεικνύει την τεχνική ικανότητά του να διεξάγει δοκιμασίες κορεσμού για την επιβεβαίωση της ειδικότητας και της δραστικότητας του σκευάσματος ER, καθώς και δοκιμασίες ανταγωνιστικής δέσμευσης με το οιστρογόνο αναφοράς και τους μάρτυρες (ασθενώς δεσμευόμενης και μη δεσμευόμενης ουσίας). Το εργαστήριο θα πρέπει να δημιουργεί βάση ιστορικών δεδομένων με τα αποτελέσματα για το οιστρογόνο αναφοράς και τους μάρτυρες που προέκυψαν από 3-5 ανεξάρτητα πειράματα που διεξήχθησαν σε διαφορετικές ημέρες. Τα εν λόγω πειράματα θα αποτελούν τη βάση για το οιστρογόνο αναφοράς και τους ιστορικούς μάρτυρες του εργαστηρίου και θα χρησιμοποιούνται για τη μερική αξιολόγηση της αποδοχής της δοκιμασίας για μελλοντικές σειρές δοκιμών.
|
|
18.
|
Η αποκρισιμότητα του συστήματος δοκιμής θα επιβεβαιώνεται και μέσω ελέγχου των ουσιών ελέγχου ικανότητας που απαριθμούνται στον πίνακα 2. Ο κατάλογος ουσιών ελέγχου ικανότητας είναι ένα υποσύνολο των ουσιών αναφοράς που περιλαμβάνονται στα πρότυπα επιδόσεων για τις δοκιμασίες δέσμευσης ER (3). Οι ουσίες αυτές είναι διαθέσιμες στο εμπόριο, αντιπροσωπεύουν τις κατηγορίες χημικών ουσιών που συνδέονται συνήθως με δράση δέσμευσης των ER, παρουσιάζουν το κατάλληλο φάσμα ισχύος που αναμένεται για τις δεσμευόμενες στον ER ουσίες (ισχυρές έως ασθενείς) και περιλαμβάνουν μη δεσμευόμενες (αρνητικές) ουσίες. Για κάθε ουσία ελέγχου ικανότητας, οι υπό δοκιμή συγκεντρώσεις θα πρέπει να καλύπτουν το φάσμα που παρέχεται στον πίνακα 2. Θα πρέπει να διεξάγονται τουλάχιστον τρία πειράματα για κάθε ουσία και τα αποτελέσματα θα πρέπει να είναι σύμφωνα με την αναμενόμενη χημική δραστικότητα. Κάθε πείραμα θα πρέπει να διεξάγεται ανεξάρτητα (δηλ. με πρόσφατα παρασκευασμένες αραιώσεις υποδοχέα, χημικών ουσιών και αντιδραστηρίου), με τρία πανομοιότυπα δείγματα για κάθε συγκέντρωση. Η τεχνική ικανότητα αποδεικνύεται μέσω της ορθής ταξινόμησης (θετική/αρνητική) κάθε ουσίας ελέγχου ικανότητας. Οι δοκιμές ελέγχου ικανότητας θα πρέπει να εκτελούνται από κάθε τεχνικό κατά την εκμάθηση των δοκιμασιών.
Πίνακας 2
Κατάλογος μαρτύρων και ουσιών ελέγχου ικανότητας για τις δοκιμασίες ανταγωνιστικής δέσμευσης hrER
(89)
|
Αριθ.
|
Ονομασία της ουσίας
|
Αριθ. CAS (90)
|
Αναμενόμενη Απόκριση (91)
(92)
|
Εύρος συγκεντρώσεων δοκιμής (M)
|
Χημική κατηγορία MeSH (93)
|
Κατηγορία προϊόντος (94)
|
|
Μάρτυρες (οιστρογόνο αναφοράς, ασθενώς δεσμευόμενη ουσία, μη δεσμευόμενη ουσία)
|
|
1
|
17β-Οιστραδιόλη
|
50-28-2
|
Δεσμευόμενη
|
1×10-11 – 1×10-6
|
Στεροειδές
|
Φαρμακευτικό προϊόν, κτηνιατρικός παράγοντας
|
|
2
|
Νορεθυνοδρέλη (ή) Νορεθινδρόνη
|
68-23-5 (ή) 68-22-4
|
Δεσμευόμενη
|
3×10-9 – 30×10-6
|
Στεροειδές
|
Φαρμακευτικό προϊόν, κτηνιατρικός παράγοντας
|
|
3
|
Οκτυλοτριαιθοξυσιλάνιο
|
2943-75-1
|
Μη δεσμευόμενη
|
1×10-10 – 1×10-3
|
Σιλάνιο
|
Τροποποιητής επιφανειών
|
|
Ουσίες ελέγχου ικανότητας (94)
|
|
4
|
Διαιθυλοστιλβεστρόλη
|
56-53-1
|
Δεσμευόμενη
|
1×10-11 – 1×10-6
|
Υδρογονάνθρακας (κυκλικός), φαινόλη
|
Φαρμακευτικό προϊόν, κτηνιατρικός παράγοντας
|
|
5
|
17α-Αιθινυλοιστραδιόλη
|
57-63-6
|
Δεσμευόμενη
|
1×10-11 – 1×10-6
|
Στεροειδές
|
Φαρμακευτικό προϊόν, κτηνιατρικός παράγοντας
|
|
6
|
meso-Εξεστρόλη
|
84-16-2
|
Δεσμευόμενη
|
1×10-11 – 1×10-6
|
Υδρογονάνθρακας (κυκλικός), φαινόλη
|
Φαρμακευτικό προϊόν, κτηνιατρικός παράγοντας
|
|
7
|
Ταμοξιφαίνη
|
10540-29-1
|
Δεσμευόμενη
|
1×10-11 – 1×10-6
|
Υδρογονάνθρακας (κυκλικός)
|
Φαρμακευτικό προϊόν, κτηνιατρικός παράγοντας
|
|
8
|
Γενιστεΐνη
|
446-72-0
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Ετεροκυκλική ένωση, φλαβονοειδές
|
Φυσικό προϊόν
|
|
9
|
Δισφαινόλη Α
|
80-05-7
|
Δεσμευόμενη
|
1×10-10 – 1×10-3
|
Φαινόλη
|
Ενδιάμεση χημική ουσία
|
|
10
|
Ζεαραλενόνη
|
17924-92-4
|
Δεσμευόμενη
|
1×10-11 – 1×10-3
|
Ετεροκυκλική ένωση, λακτόνη
|
Φυσικό προϊόν
|
|
11
|
p-Υδροξυβενζοϊκός βουτυλεστέρας
|
94-26-8
|
Δεσμευόμενη
|
1×10-11 – 1×10-3
|
Καρβοξυλικό οξύ, φαινόλη
|
Συντηρητικό
|
|
12
|
Ατραζίνη
|
1912-24-9
|
Μη δεσμευόμενη
|
1×10-11 – 1×10-6
|
Ετεροκυκλική ένωση,
|
Ζιζανιοκτόνο
|
|
13
|
Φθαλικό δι-n-βουτύλιο (DBP) (95)
|
84-74-2
|
Μη δεσμευόμενη (96)
|
1×10-10 – 1×10-4
|
Υδρογονάνθρακας (κυκλικός), εστέρας
|
Πλαστικοποιητής, ενδιάμεση χημική ουσία
|
|
14
|
Κορτικοστερόνη
|
50-22-6
|
Μη δεσμευόμενη
|
1×10-11 – 1×10-4
|
Στεροειδές
|
Φυσικό προϊόν
|
|
Δοκιμές διαλυτότητας και προσδιορισμός εύρους συγκεντρώσεων για τις υπό δοκιμή χημικές ουσίες
|
19.
|
Θα πρέπει να διεξάγεται προκαταρκτική δοκιμή για τον προσδιορισμό του ορίου διαλυτότητας για κάθε υπό δοκιμή χημική ουσία και για τον προσδιορισμό του κατάλληλου εύρους συγκεντρώσεων προς χρήση κατά τη διεξαγωγή της δοκιμής. Το όριο διαλυτότητας κάθε υπό δοκιμή χημικής ουσίας πρέπει να προσδιορίζεται αρχικά στον διαλύτη και να επιβεβαιώνεται περαιτέρω υπό τις συνθήκες δοκιμασίας. Η τελική συγκέντρωση που υποβάλλεται σε δοκιμή στη δοκιμασία δεν θα πρέπει να υπερβαίνει το 1 mM. Οι δοκιμές προσδιορισμού εύρους περιλαμβάνουν μάρτυρα με διαλύτη και οκτώ λογαριθμικές, διαδοχικές αραιώσεις, που ξεκινούν από τη μέγιστη αποδεκτή συγκέντρωση (π.χ. 1 mM ή χαμηλότερη, με βάση το όριο διαλυτότητας), και καταγραφή της παρουσίας θολερότητας ή ιζήματος. Οι συγκεντρώσεις στο δεύτερο και το τρίτο πείραμα θα πρέπει να προσαρμόζονται κατά περίπτωση, με σκοπό τη βελτίωση του χαρακτηρισμού της καμπύλης συγκέντρωσης-απόκρισης.
|
Κριτήρια αποδοχής σειρών δοκιμών
|
20.
|
Η αποδοχή ή η απόρριψη μιας σειράς δοκιμών βασίζεται στην αξιολόγηση των αποτελεσμάτων που λαμβάνονται για το οιστρογόνο αναφοράς και τον μάρτυρα που χρησιμοποιήθηκαν για κάθε πείραμα. Πρώτον, για το τρυβλίο 1, οι πλήρεις καμπύλες συγκέντρωσης για τους μάρτυρες αναφοράς από κάθε πείραμα θα πρέπει να αντιστοιχούν στα μέτρα των επιδόσεων με τις παραμέτρους προσαρμογής της καμπύλης (π.χ. IC50 και κλίση Hill) να βασίζονται στα αποτελέσματα που έχουν αναφερθεί για τα αντίστοιχα πρωτόκολλα των δοκιμασιών CERI και FW (προσάρτημα 2 και 3), καθώς και στα ιστορικά δεδομένα για τους μάρτυρες του εργαστηρίου που διεξάγει τη δοκιμή. Όλοι οι μάρτυρες (οιστρογόνο αναφοράς, ασθενώς δεσμευόμενη ουσία, μη δεσμευόμενη ουσία) θα πρέπει να ταξινομούνται σωστά για κάθε πείραμα. Δεύτερον, πρέπει να αξιολογείται η συνέπεια των μαρτύρων όλων των επακόλουθων τρυβλίων σε σχέση με το τρυβλίο 1. Θα πρέπει να χρησιμοποιείται επαρκές εύρος συγκεντρώσεων της υπό δοκιμή χημικής ουσίας ώστε να προσδιορίζεται με σαφήνεια η μέγιστη τιμή της καμπύλης ανταγωνιστικής δέσμευσης. Η μεταβλητότητα μεταξύ των πανομοιότυπων δειγμάτων σε κάθε συγκέντρωση της υπό δοκιμή χημικής ουσίας καθώς και μεταξύ των τριών ανεξάρτητων σειρών δοκιμών θα πρέπει να είναι εντός εύλογων ορίων και να τεκμηριώνεται επιστημονικά. Η ικανότητα συνεπούς διεξαγωγής της δοκιμασίας θα πρέπει να αποδεικνύεται μέσω της ανάπτυξης και διατήρησης βάσης ιστορικών δεδομένων για το οιστρογόνο αναφοράς και τους μάρτυρες. Ως μέτρο της αναπαραγωγιμότητας εντός εργαστηρίου μπορούν να χρησιμοποιηθούν οι τυπικές αποκλίσεις ή οι συντελεστές μεταβλητότητας για τους μέσους όρους των παραμέτρων προσαρμογής των καμπυλών του οιστρογόνου αναφοράς και της ασθενώς δεσμευόμενης ουσίας-μάρτυρα από πολλαπλά πειράματα. Η επανεξέταση των αποτελεσμάτων μαρτύρων τρυβλίων κάθε σειράς δοκιμών καθώς και για κάθε υπό δοκιμή χημική ουσία θα πρέπει να πραγματοποιείται με βάση την επαγγελματική κρίση.
Επιπλέον, αναφορικά με τα κριτήρια αποδοχής, θα πρέπει να διασφαλίζεται η συμμόρφωση με τις ακόλουθες αρχές:
|
—
|
θα πρέπει να υπάρχουν επαρκή δεδομένα για την ποσοτική αξιολόγηση της δέσμευσης ER
|
|
—
|
οι συγκεντρώσεις που ελέγχονται θα πρέπει να παραμένουν εντός του φάσματος διαλυτότητας της υπό δοκιμή χημικής ουσίας.
|
|
Ανάλυση των δεδομένων
|
21.
|
Η καθορισμένη διαδικασία ανάλυσης δεδομένων για τα δεδομένα κορεσμού και ανταγωνιστικής δέσμευσης θα πρέπει να συμμορφώνεται με τις βασικές αρχές χαρακτηρισμού των αλληλεπιδράσεων υποδοχέα-προσδέματος. Τυπικά, τα δεδομένα δέσμευσης κορεσμού αναλύονται με χρήση μοντέλου μη γραμμικής παλινδρόμησης που καλύπτει τη συνολική και τη μη ειδική δέσμευση. Κατά τον προσδιορισμό των Bmax και Kd, ενδέχεται να χρειάζεται διόρθωση ως προς την εξάντληση του προσδέματος [π.χ. Swillens, 1995 (19)]. Τα δεδομένα από τις δοκιμασίες ανταγωνιστικής δέσμευσης τυπικά μετασχηματίζονται [π.χ. εκατοστιαία ειδική δέσμευση και συγκέντρωση της υπό δοκιμή χημικής ουσίας (log M)]. Οι εκτιμήσεις των τιμών λογαρίθμου (IC50) για κάθε υπό δοκιμή χημική ουσία θα πρέπει να προσδιορίζονται με χρήση λογισμικού μη γραμμικής προσαρμογής καμπύλης κατάλληλου για την προσαρμογή εξίσωσης Hill τεσσάρων παραμέτρων. Μετά την αρχική ανάλυση, θα πρέπει να εξετάζονται οι παράμετροι προσαρμογής της καμπύλης και να μελετάται ο βαθμός προσαρμογής των δεδομένων δέσμευσης στην προκύπτουσα καμπύλη ανταγωνιστικής δέσμευσης. Σε ορισμένες περιπτώσεις ενδέχεται να χρειάζεται συμπληρωματική ανάλυση προκειμένου να επιτευχθεί η βέλτιστη δυνατή προσαρμογή της καμπύλης [π.χ. περιορισμός της μέγιστης και/ή της ελάχιστης τιμής της καμπύλης, χρήση του κανόνα του 10 %, βλ. προσάρτημα 4 και παραπομπή 2 (ενότητα III.A.2)].
|
|
22.
|
Η συμμόρφωση με τα κριτήρια αποδοχής (παράγραφος 20) υποδεικνύει ότι το σύστημα δοκιμής λειτουργεί σωστά, αλλά δεν διασφαλίζει ότι οποιαδήποτε συγκεκριμένη δοκιμή θα παράξει ορθά δεδομένα. Η επανάληψη των ορθών αποτελεσμάτων της πρώτης δοκιμής αποτελεί την καλύτερη ένδειξη ότι παρήχθησαν ορθά δεδομένα.
|
Γενικά κριτήρια ερμηνείας των δεδομένων
|
23.
|
Επί του παρόντος δεν υφίσταται καθολικά αποδεκτή μέθοδος ερμηνείας των δεδομένων δέσμευσης ER. Εντούτοις, τόσο η ποιοτική (π.χ. δεσμευόμενη / μη δεσμευόμενη ουσία) όσο και η ποσοτική [π.χ. log IC50, σχετική συγγένεια δέσμευσης (RBA) κ.λπ.] αξιολόγηση της μεσολαβούμενης από τον hrER δραστικότητας θα πρέπει να βασίζονται σε εμπειρικά δεδομένα και ορθή επιστημονική κρίση.
|
Έκθεση δοκιμής
|
24.
|
Η έκθεση δοκιμής θα πρέπει να περιλαμβάνει τα ακόλουθα στοιχεία:
|
|
Δοκιμασία:
|
—
|
χρησιμοποιηθείσα δοκιμασία,
|
|
|
|
Μάρτυρας/πρότυπο αναφοράς/υπό δοκιμή χημική ουσία
|
—
|
πηγή, αριθμός παρτίδας, καταληκτική ημερομηνία χρήσης, εφόσον υπάρχει,
|
|
—
|
σταθερότητα της υπό δοκιμή χημικής ουσίας, εάν είναι γνωστή,
|
|
—
|
διαλυτότητα και σταθερότητα της υπό δοκιμή χημικής ουσίας στον διαλύτη, εάν είναι γνωστές,
|
|
—
|
μέτρηση του pH, της ωσμωμοριακότητας και του ιζήματος του θρεπτικού μέσου καλλιέργειας στο οποίο προστέθηκε η υπό δοκιμή χημική ουσία, κατά περίπτωση.
|
|
|
|
Μονοσυστατική ουσία:
|
—
|
φυσική εμφάνιση, υδατοδιαλυτότητα και πρόσθετες σχετικές φυσικοχημικές ιδιότητες,
|
|
—
|
ταυτοποίηση της χημικής ουσίας, όπως ονομασία/-ες IUPAC ή CAS, αριθμός CAS, κωδικός SMILES ή InChI, συντακτικός τύπος, καθαρότητα, χημική ταυτότητα προσμείξεων, κατά περίπτωση και εφόσον είναι πρακτικά εφικτό, κ.λπ.
|
|
|
|
Πολυσυστατική ουσία, UVCB και μείγματα:
|
—
|
περιγράφονται, στο μέτρο του δυνατού, με τη χημική ταυτότητα των συστατικών (βλ. ανωτέρω), την ποσότητα στην οποία απαντούν και τις σχετικές φυσικοχημικές τους ιδιότητες.
|
|
|
|
Διαλύτης/φορέας:
|
—
|
χαρακτηρισμός (φύση, προμηθευτής και παρτίδα),
|
|
—
|
αιτιολόγηση της επιλογής του διαλύτη/φορέα,
|
|
—
|
διαλυτότητα και σταθερότητα της υπό δοκιμή χημικής ουσίας στον διαλύτη/φορέα, εάν είναι γνωστές.
|
|
|
|
Υποδοχείς:
|
—
|
προέλευση υποδοχέων (προμηθευτής, αριθ. καταλόγου, παρτίδα, είδος υποδοχέα, παρεχόμενη από τον προμηθευτή συγκέντρωση ενεργού υποδοχέα, παρεχόμενη από τον προμηθευτή πιστοποίηση),
|
|
—
|
χαρακτηρισμός των υποδοχέων (περιλαμβανομένων των αποτελεσμάτων δέσμευσης κορεσμού): Kd, Bmax,
|
|
—
|
ραδιοσημασμένο πρόσδεμα:
|
|
—
|
προμηθευτής, αριθ. καταλόγου, παρτίδα, ειδική δραστικότητα.
|
|
|
|
Συνθήκες δοκιμής:
|
—
|
περιορισμοί διαλυτότητας υπό τις συνθήκες δοκιμασίας,
|
|
—
|
σύσταση του ρυθμιστικού διαλύματος δέσμευσης,
|
|
—
|
συγκέντρωση ιχνηθέτη (ραδιοσημασμένου προσδέματος),
|
|
—
|
συγκεντρώσεις της υπό δοκιμή χημικής ουσίας,
|
|
—
|
εκατοστιαία τιμή φορέα στην τελική δοκιμασία,
|
|
—
|
θερμοκρασία και χρόνος επώασης,
|
|
—
|
μέθοδος διαχωρισμού δεσμευμένου/ελεύθερου προσδέματος,
|
|
—
|
θετικοί και αρνητικοί μάρτυρες/ουσίες αναφοράς,
|
|
—
|
κριτήρια για την κατάταξη δοκιμών ως θετικών, αρνητικών ή αμφίβολων.
|
|
|
|
Έλεγχος αποδοχής:
|
—
|
πραγματικές τιμές IC50 και κλίσης Hill για τους παράλληλους θετικούς μάρτυρες/ουσίες αναφοράς.
|
|
|
|
Αποτελέσματα:
|
—
|
ανεπεξέργαστα δεδομένα και δεδομένα για δεσμευμένο/ελεύθερο πρόσδεμα,
|
|
—
|
έλεγχος επιβεβαίωσης μετουσίωσης, ανάλογα με την περίπτωση,
|
|
—
|
η χαμηλότερη αποτελεσματική συγκέντρωση (LEC), εάν υπάρχει,
|
|
—
|
τιμές RBA και/ή IC50, ανάλογα με την περίπτωση,
|
|
—
|
σχέση συγκέντρωσης-απόκρισης, όπου είναι δυνατόν,
|
|
—
|
στατιστικές αναλύσεις, εάν υπάρχουν, μαζί με μέτρο σφάλματος και εμπιστοσύνης (π.χ. SEM, SD, CV ή 95 % CI) και περιγραφή του τρόπου υπολογισμού των τιμών αυτών.
|
|
|
|
Εξέταση των αποτελεσμάτων:
|
—
|
εφαρμογή του κανόνα του 10 %
|
|
Συμπέρασμα
|
ΒΙΒΛΙΟΓΡΑΦΙΑ
|
(1)
|
OECD (2005). Guidance Document on the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment. Environmental, Health and Safety Publications, Series on Testing and Assessment (No 34), Organisation for Economic Cooperation and Development, Paris.
|
|
(2)
|
OECD (2015). Integrated Summary Report: Validation of Two Binding Assays Using Human Recombinant Estrogen Receptor Alpha (hrERα), Health and Safety Publications, Series on Testing and Assessment (No 226), Organisation for Economic Cooperation and Development, Paris.
|
|
(3)
|
OECD (2015). Performance Standards for Binding Assays Using Human Recombinant Estrogen Receptor Alpha (hrERα), Health and Safety Publications, Series on Testing and Assessment (No 222), Organisation for Economic Cooperation and Development, Paris.
|
|
(4)
|
OECD (2012). Guidance Document on Standardized Test Guidelines for Evaluating Chemicals for Endocrine Disruption. Environmental, Health and Safety Publications, Series on Testing and Assessment (No 150), Organisation for Economic Cooperation and Development, Paris.
|
|
(5)
|
Cavailles V. (2002). Estrogens and Receptors: an Evolving Concept, Climacteric, 5 Suppl 2: p.20-6.
|
|
(6)
|
Welboren W.J., et al. (2009). Genomic Actions of Estrogen Receptor Alpha: What are the Targets and How are they Regulated? Endocr. Relat. Cancer., 16(4): p. 1073-89.
|
|
(7)
|
Younes M. and Honma N. (2011). Estrogen Receptor Beta, Arch. Pathol. Lab. Med., 135(1): p. 63-6.
|
|
(8)
|
Diamanti-Kandarakis et al. (2009). Endocrine-Disrupting Chemicals: an Endocrine Society Sci. Statement, Endo Rev 30(4):293-342.
|
|
(9)
|
ICCVAM (2002). Background Review Document. Current Status of Test Methods for Detecting Endocrine Disruptors: In Vitro Estrogen Receptor Binding Assays. (NIH Publication No 03-4504). National Institute of Environmental Health Sciences, Research Triangle Park, NC.
|
|
(10)
|
ICCVAM (2003). ICCVAM Evaluation of In Vitro Test Methods for Detecting Potential Endocrine Disruptors: Estrogen Receptor and Androgen Receptor Binding and Transcriptional Activation Assays.
|
|
(11)
|
ICCVAM (2006). ICCVAM Evaluation of In Vitro Test Methods for Detecting Potential Endocrine Disruptors: Estrogen Receptor and Androgen Receptor Binding and Transcriptional Activation Assays.
|
|
(12)
|
Akahori Y. et al. (2008). Relationship Between the Results of In Vitro Receptor Binding Assay to Human Estrogen Receptor Alpha and In Vivo Uterotrophic Assay: Comparative Study with 65 Selected Chemicals, Toxicol. In Vitro, 22(1): 225-231.
|
|
(13)
|
OECD (2007). Additional Data Supporting the Test Guideline on the Uterotrophic Bioassay in Rodents, Environment, Health and Safety Publications, Series on Testing and Assessment (No 67), Organisation for Economic Cooperation and Development, Paris.
|
|
(14)
|
Takeyoshi, M. (2006). Draft Report of Pre-validation and Inter-laboratory Validation For Stably Transfected Transcriptional Activation (TA) Assay to Detect Estrogenic Activity - The Human Estrogen Receptor Alpha Mediated Reporter Gene Assay Using hER-HeLa-9903 Cell Line, Chemicals Evaluation and Research Institute (CERI): Japan. p. 1-188.
|
|
(15)
|
Yamasaki, K· Noda, S· Imatanaka, N· Yakabe, Y. (2004). Comparative Study of the Uterotrophic Potency of 14 Chemicals in a Uterotrophic Assay and their Receptor-Binding Affinity, Toxicol. Letters, 146: 111-120.
|
|
(16)
|
Kummer V· Maskova, J· Zraly, Z· Neca, J· Simeckova, P· Vondracek, J· Machala, M. (2008). Estrogenic Activity of Environmental Polycyclic Aromatic Hydrocarbons in Uterus of Immature Wistar Rats. Toxicol. Letters, 180: 213-221.
|
|
(17)
|
Gozgit, JM· Nestor, KM· Fasco, MJ· Pentecost, BT· Arcaro, KF. (2004). Differential Action of Polycyclic Aromatic Hydrocarbons on Endogenous Estrogen-Responsive Genes and on a Transfected Estrogen-Responsive Reporter in MCF-7 Cells. Toxicol. and Applied Pharmacol., 196: 58-67.
|
|
(18)
|
Santodonato, J. (1997). Review of the Estrogenic and Antiestrogenic Activity of Polycyclic Aromatic Hydrocarbons: Relationship to Carcinogenicity. Chemosphere, 34: 835-848.
|
|
(19)
|
Swillens S (1995). Interpretation of Binding Curves Obtained with High Receptor Concentrations: Practical Aid for Computer Analysis, Mol Pharmacol 47(6):1197-1203.
|
Προσάρτημα 1
ΟΡΙΣΜΟΙ ΚΑΙ ΣΥΝΤΟΜΟΓΡΑΦΙΕΣ
Κανόνας του 10 %: δυνατότητα αποκλεισμού, από τις αναλύσεις, εκείνων των σημείων δεδομένων στα οποία η μέση τιμή των πανομοιότυπων δειγμάτων για την εκατοστιαία ειδική δέσμευση της [3H]17β-οιστραδιόλης υπερβαίνει κατά 10 % ή περισσότερο τη μέση τιμή σε χαμηλότερη συγκέντρωση (βλ. προσάρτημα 4).
Κριτήρια αποδοχής: ελάχιστα πρότυπα για τις επιδόσεις των πειραματικών ελέγχων και των προτύπων αναφοράς. Για να θεωρηθεί ένα πείραμα έγκυρο, θα πρέπει να πληρούνται όλα τα κριτήρια αποδοχής.
Ορθότητα (συμφωνία): ο βαθμός συμφωνίας μεταξύ των αποτελεσμάτων της δοκιμασίας και των αποδεκτών τιμών αναφοράς. Αποτελεί κριτήριο επιδόσεων της δοκιμασίας και μια από τις πτυχές της καταλληλότητας. Συχνά ο όρος χρησιμοποιείται εναλλακτικά προς τη «συμφωνία» για να δηλώσει το ποσοστό ορθών αποτελεσμάτων μιας δοκιμασίας (1).
CF: (Conceptual Framework) το εννοιακό πλαίσιο του ΟΟΣΑ για τη διεξαγωγή δοκιμών και την αξιολόγηση των ενδοκρινικών διαταρακτών.
Χημικό προϊόν: μια ουσία ή ένα μείγμα.
CV: (Coefficient of variation) συντελεστής μεταβλητότητας.
E2: 17β-οιστραδιόλη
ED: ενδοκρινική διαταραχή
hERα: (Human estrogen receptor alpha) ανθρώπινος υποδοχέας οιστρογόνων α
ER: (Estrogen receptor) υποδοχέας οιστρογόνων
Οιστρογονική δραστικότητα: η ικανότητα μιας χημικής ουσίας να μιμείται την ικανότητα της 17β-οιστραδιόλης να δεσμεύεται από τους υποδοχείς οιστρογόνων. Η δέσμευση στον hERα μπορεί να ανιχνευτεί με την παρούσα μέθοδο δοκιμών.
IC50
: ήμισυ της μέγιστης αποτελεσματικής συγκέντρωσης μιας ανασταλτικής χημικής ουσίας.
ICCVAM: (Interagency Coordinating Committee on the Validation of Alternative Methods) Διυπηρεσιακή Συντονιστική Επιτροπή για την Επικύρωση Εναλλακτικών Μεθόδων (ΗΠΑ)
Διεργαστηριακή αναπαραγωγιμότητα: μέτρο του βαθμού στον οποίο διαφορετικά ειδικευμένα εργαστήρια, που χρησιμοποιούν το ίδιο πρωτόκολλο και ελέγχουν τις ίδιες ουσίες, μπορούν να παράγουν ανάλογα αποτελέσματα από ποιοτική και ποσοτική άποψη. Η διεργαστηριακή αναπαραγωγιμότητα προσδιορίζεται κατά τις διαδικασίες προεπικύρωσης και επικύρωσης και αποτελεί ένδειξη του κατά πόσον υπάρχει δυνατότητα επιτυχούς μεταφοράς μιας δοκιμής μεταξύ εργαστηρίων· καλείται επίσης αναπαραγωγιμότητα μεταξύ εργαστηρίων (1).
Ενδοεργαστηριακή αναπαραγωγιμότητα: προσδιορισμός του βαθμού στον οποίο ειδικευμένα άτομα μπορούν να επαναλάβουν με επιτυχία τα ίδια αποτελέσματα εντός του ίδιου εργαστηρίου, χρησιμοποιώντας συγκεκριμένο πρωτόκολλο σε διαφορετικές χρονικές στιγμές. Καλείται επίσης «αναπαραγωγιμότητα εντός εργαστηρίου» (1).
LEC: (Lowest Effective Concentration) η ελάχιστη συγκέντρωση της υπό δοκιμή χημικής ουσίας που επάγει απόκριση (δηλαδή η χαμηλότερη συγκέντρωση της υπό δοκιμή χημικής ουσίας στην οποία ο συντελεστής αύξησης της επαγωγής διαφέρει σε στατιστικά σημαντικό βαθμό από τον παράλληλο μάρτυρα με φορέα).
Δοκιμή παρόμοιου τύπου («me-too»): έκφραση της καθομιλουμένης που παραπέμπει σε δοκιμασία η οποία είναι δομικά και λειτουργικά ανάλογη με επικυρωμένη και εγκεκριμένη μέθοδο δοκιμών αναφοράς. Ο όρος χρησιμοποιείται εναλλακτικά προς την «παρεμφερή μέθοδο δοκιμών».
PBTG: (Performance-Based Test Guideline) κατευθυντήρια γραμμή δοκιμών με βάση τις επιδόσεις.
Πρότυπα επιδόσεων: πρότυπα που βασίζονται σε επικυρωμένη μέθοδο δοκιμών και παρέχουν τη βάση για την αξιολόγηση της συγκρισιμότητας προτεινόμενης δοκιμασίας η οποία είναι μηχανιστικά και λειτουργικά παρεμφερής. Στα πρότυπα επιδόσεων περιλαμβάνονται 1) τα βασικά στοιχεία της δοκιμασίας, 2) κατάλογος ελάχιστων ουσιών αναφοράς, οι οποίες έχουν επιλεγεί μεταξύ των χημικών ουσιών που χρησιμοποιήθηκαν για την απόδειξη των αποδεκτών επιδόσεων της επικυρωμένης μεθόδου αναφοράς, και 3) τα συγκρίσιμα επίπεδα ορθότητας και αξιοπιστίας, που βασίζονται στα επιτευχθέντα για την επικυρωμένη μέθοδο δοκιμών και τα οποία πρέπει να επιδεικνύει η προτεινόμενη δοκιμασία όταν αξιολογείται με χρήση του καταλόγου ελαχίστων ουσιών αναφοράς (1).
Ουσίες ελέγχου ικανότητας: υποσύνολο των ουσιών αναφοράς που περιλαμβάνονται στα πρότυπα επιδόσεων και οι οποίες μπορούν να χρησιμοποιούνται από τα εργαστήρια για να αποδεικνύουν την τεχνική τους ικανότητα στη διεξαγωγή τυποποιημένης δοκιμασίας. Τα κριτήρια επιλογής για τις εν λόγω ουσίες είναι συνήθως τα εξής: αντιπροσωπεύουν όλο το φάσμα αποκρίσεων, διατίθενται στο εμπόριο και συνοδεύονται από διαθέσιμα δεδομένα αναφοράς υψηλής ποιότητας.
Τεχνική ικανότητα: η αποδεδειγμένη ικανότητα ορθής διεξαγωγής δοκιμασίας, πριν από τη διεξαγωγή δοκιμών με άγνωστες ουσίες.
Οιστρογόνο αναφοράς: 17β-οιστραδιόλη (E2, CAS 50-28-2).
Μέθοδοι δοκιμών αναφοράς: οι δοκιμασίες στις οποίες βασίζεται η PBTG 493.
RBA: (Relative Binding Affinity) σχετική συγγένεια δέσμευσης. Η RBA μιας ουσίας υπολογίζεται ως ποσοστό του λογάριθμου (IC50) για την ουσία σε σχέση με τον λογάριθμο (IC50) για την 17β-οιστραδιόλη
Καταλληλότητα: περιγραφή της σχέσης μιας δοκιμασίας με την υπό μελέτη επίδραση και του κατά πόσον είναι κατάλληλη και χρήσιμη για συγκεκριμένο σκοπό. Πρόκειται για τον βαθμό στον οποίο η δοκιμασία μετρά ή προβλέπει σωστά τη βιολογική επίδραση υπό μελέτη. Η καταλληλότητα εμπεριέχει συνεκτίμηση της ορθότητας (συμφωνίας) μιας δοκιμασίας (1).
Αξιοπιστία: μέτρο του βαθμού στον οποίο μια δοκιμασία μπορεί να αναπαράγεται διαχρονικά στο ίδιο εργαστήριο και μεταξύ εργαστηρίων, όταν εφαρμόζεται με το ίδιο πρωτόκολλο. Εκτιμάται με υπολογισμό της ενδοεργαστηριακής και της διεργαστηριακής αναπαραγωγιμότητας.
SD: (Standard Deviation) τυπική απόκλιση.
Υπό δοκιμή χημική ουσία: κάθε ουσία ή μείγμα που υποβάλλεται σε δοκιμή με τη χρήση της παρούσας μεθόδου δοκιμών.
Επικυρωμένη μέθοδος δοκιμών: δοκιμασία για την οποία έχουν ολοκληρωθεί μελέτες επικύρωσης προκειμένου να προσδιοριστούν η καταλληλότητα (συμπεριλαμβανομένης της ορθότητας) και η αξιοπιστία της για συγκεκριμένο σκοπό. Είναι σημαντικό να σημειωθεί ότι οι επιδόσεις επικυρωμένης μεθόδου δοκιμών από πλευράς ορθότητας και αξιοπιστίας ενδέχεται να μην επαρκούν για να κριθεί αποδεκτή για τον προτεινόμενο σκοπό (1).
Επικύρωση: η διαδικασία διά της οποίας διακριβώνεται η αξιοπιστία και η καταλληλότητα μιας συγκεκριμένης προσέγγισης, μεθόδου, δοκιμασίας, διεργασίας ή αξιολόγησης για καθορισμένο σκοπό (1).
Προσάρτημα 2
ΟΙ IN VITRO ΔΟΚΙΜΑΣΙΕΣ ΚΟΡΕΣΜΟΥ ΚΑΙ ΑΝΤΑΓΩΝΙΣΤΙΚΗΣ ΔΕΣΜΕΥΣΗΣ ΥΠΟΔΟΧΕΑ ΟΙΣΤΡΟΓΟΝΩΝ (ERΑ) FREYBERGER-WILSON ΜΕ ΧΡΗΣΗ ΑΝΑΣΥΝΔΥΑΣΜΕΝΟΥ ER ΠΛΗΡΟΥΣ ΜΗΚΟΥΣΑ
ΑΡΧΙΚΕΣ ΕΚΤΙΜΗΣΕΙΣ ΚΑΙ ΠΕΡΙΟΡΙΣΜΟΙ (ΒΛ. ΕΠΙΣΗΣ ΓΕΝΙΚΗ ΕΙΣΑΓΩΓΗ)
|
1.
|
Στην παρούσα in vitro δοκιμασία κορεσμού και ανταγωνιστικής δέσμευσης υποδοχέα οιστρογόνων (ERα) χρησιμοποιείται ανθρώπινος υποδοχέας ERα (hrERα) πλήρους μήκους που παράγεται και απομονώνεται από κύτταρα εντόμων μολυσμένα με βακουλοϊό. Το πρωτόκολλο, που ανέπτυξαν οι Freyberger και Wilson, αποτέλεσε αντικείμενο διεθνούς μελέτης επικύρωσης πολλών εργαστηρίων (2), η οποία κατέδειξε την καταλληλότητα και την αξιοπιστία του για τον επιδιωκόμενο σκοπό της δοκιμασίας.
|
|
2.
|
Η παρούσα δοκιμασία αποτελεί διαδικασία διαλογής για τον προσδιορισμό ουσιών που μπορούν να δεσμεύονται στον hrERα πλήρους μήκους. Χρησιμοποιείται για τον προσδιορισμό της ικανότητας υπό δοκιμή χημικής ουσίας να ανταγωνίζεται την 17β-οιστραδιόλη όσον αφορά τη δέσμευση από τον hrERα. Τα ποσοτικά αποτελέσματα της δοκιμασίας είναι η IC50 (μέτρο της συγκέντρωσης της υπό δοκιμή χημικής ουσίας που απαιτείται για να εκτοπιστεί το ήμισυ της [3H]17β-οιστραδιόλης από τον hrERα) και οι σχετικές συγγένειες δέσμευσης των υπό δοκιμή χημικών ουσιών για τον hrERα σε σύγκριση με τη 17β-οιστραδιόλη. Για λόγους διαλογής των χημικών ουσιών, στα αποδεκτά ποιοτικά αποτελέσματα της δοκιμασίας περιλαμβάνεται η ταξινόμηση των υπό δοκιμή χημικών ουσιών ως δεσμευόμενων, μη δεσμευόμενων ή αμφίβολης δέσμευσης στον hrERα, με βάση τα κριτήρια που περιγράφονται για τις καμπύλες δέσμευσης.
|
|
3.
|
Στη δοκιμασία χρησιμοποιείται ραδιοσημασμένο πρόσδεμα για τον οποίο το εργαστήριο απαιτείται να διαθέτει άδεια ραδιενεργών υλικών. Για κάθε διαδικασία στο πλαίσιο της οποίας γίνεται χρήση ραδιοϊσοτόπων και επικίνδυνων χημικών ουσιών θα πρέπει να τηρούνται οι κανονισμοί και οι διαδικασίες που ορίζει η εθνική νομοθεσία.
|
|
4.
|
Πριν από τη χρήση της παρούσας δοκιμασίας για κανονιστικούς σκοπούς, θα πρέπει να μελετηθούν οι ενότητες «ΓΕΝΙΚΗ ΕΙΣΑΓΩΓΗ» και «ΣΤΟΙΧΕΙΑ ΔΟΚΙΜΑΣΙΑΣ ΔΕΣΜΕΥΣΗΣ hrER». Οι ορισμοί και οι συντομογραφίες που χρησιμοποιούνται στην παρούσα κατευθυντήρια γραμμή δοκιμών παρατίθενται στο προσάρτημα 1.
|
ΑΡΧΕΣ ΤΗΣ ΔΟΚΙΜΑΣΙΑΣ (ΒΛ. ΕΠΙΣΗΣ ΓΕΝΙΚΗ ΕΙΣΑΓΩΓΗ)
|
5.
|
Η δοκιμασία δέσμευσης hrERα μετρά την ικανότητα ενός ραδιοσημασμένου προσδέματος ([3H]17β-οιστραδιόλη) να δεσμεύεται στον ER παρουσία αυξανόμενων συγκεντρώσεων μιας υπό δοκιμή χημικής ουσίας (ανταγωνιστή). Οι υπό δοκιμή χημικές ουσίες που παρουσιάζουν υψηλή συγγένεια για τον ER ανταγωνίζονται με το ραδιοσημασμένο πρόσδεμα σε χαμηλότερη συγκέντρωση σε σύγκριση με τις χημικές ουσίες με χαμηλότερη συγγένεια για τον υποδοχέα.
|
|
6.
|
Η εν λόγω δοκιμασία αποτελείται από δύο βασικά στοιχεία: ένα πείραμα δέσμευσης κορεσμού για τον χαρακτηρισμό των παραμέτρων αλληλεπίδρασης υποδοχέα-προσδέματος, ακολουθούμενο από ένα πείραμα ανταγωνιστικής δέσμευσης που χαρακτηρίζει τον ανταγωνισμό μεταξύ μιας υπό δοκιμή χημικής ουσίας και ενός ραδιοσημασμένου προσδέματος ως προς τη δέσμευση στον ER.
|
|
7.
|
Σκοπός του πειράματος δέσμευσης κορεσμού είναι ο χαρακτηρισμός συγκεκριμένης παρτίδας υποδοχέων ως προς τη συγγένεια δέσμευσης και τον αριθμό εν είδει προετοιμασίας για τη διεξαγωγή του πειράματος ανταγωνιστικής δέσμευσης. Το πείραμα δέσμευσης κορεσμού μετρά, υπό συνθήκες ισορροπίας, τη συγγένεια καθορισμένης συγκέντρωσης του υποδοχέα οιστρογόνων σε σχέση με το φυσικό πρόσδεμά του (η οποία αντιπροσωπεύεται από τη σταθερά διάστασης Kd), και τη συγκέντρωση των ενεργών θέσεων του υποδοχέα (Bmax).
|
|
8.
|
Το πείραμα ανταγωνιστικής δέσμευσης μετρά τη συγγένεια δέσμευσης μιας ουσίας στον ER, ανταγωνιζόμενη την [3H]17β-οιστραδιόλη. Η συγγένεια προσδιορίζεται ποσοτικά βάσει της συγκέντρωσης της υπό δοκιμή χημικής ουσίας η οποία, σε συνθήκες ισορροπίας, αναστέλλει το 50 % της ειδικής δέσμευσης της [3H]17β-οιστραδιόλης (και η οποία καλείται «ανασταλτική συγκέντρωση 50 %» ή IC50). Η συγγένεια μπορεί επίσης να εκτιμηθεί με χρήση της σχετικής συγγένειας δέσμευσης (RBA, σε σχέση με την IC50 της οιστραδιόλης που μετράται χωριστά στην ίδια σειρά δοκιμών). Το πείραμα ανταγωνιστικής δέσμευσης μετρά τη δέσμευση της [3H]17β-οιστραδιόλης σε καθορισμένη συγκέντρωση παρουσία ευρέος φάσματος (οκτώ τάξεων μεγέθους) συγκεντρώσεων της υπό δοκιμή χημικής ουσίας. Στη συνέχεια, τα δεδομένα προσαρμόζονται σε μια μορφή της εξίσωσης Hill (Hill, 1910) βάσει της οποίας περιγράφεται η εκτόπιση του ραδιοσημασμένου προσδέματος από ανταγωνιστική δεσμευόμενη ουσία μίας θέσης. Ο βαθμός εκτόπισης της ραδιοσημασμένης οιστραδιόλης σε ισορροπία χρησιμοποιείται για τον χαρακτηρισμό της υπό δοκιμή χημικής ουσίας ως δεσμευόμενης, μη δεσμευόμενης ή αμφίβολης απόκρισης.
|
ΔΙΑΔΙΚΑΣΙΑ
Επίδειξη των αποδεκτών επιδόσεων πρωτεΐνης hrERα
|
9.
|
Πριν από την ένταξη των δοκιμασιών δέσμευσης κορεσμού και ανταγωνιστικής δέσμευσης στην καθημερινή πρακτική, θα πρέπει να καταδεικνύονται οι ορθές επιδόσεις κάθε νέας παρτίδας hrERα στο εργαστήριο στο οποίο θα χρησιμοποιηθεί. Για την επίδειξη των επιδόσεων θα πρέπει να χρησιμοποιείται διαδικασία δύο σταδίων. Τα στάδια αυτής είναι τα ακόλουθα:
|
—
|
Διεξαγωγή δοκιμασίας δέσμευσης κορεσμού [3H]17β-οιστραδιόλης με σκοπό να καταδειχθεί η ειδικότητα και ο κορεσμός του hrERα. Η μη γραμμική ανάλυση παλινδρόμησης των δεδομένων αυτών (π.χ. BioSoft, McPherson, 1985, Motulsky, 1995) και η επακόλουθη ανάλυση Scatchard θα πρέπει να τεκμηριώνουν τη συγγένεια δέσμευσης της [3H]17β-οιστραδιόλης με τον hrERα (Kd) και τον αριθμό των υποδοχέων (Bmax) για κάθε παρτίδα hrERα.
|
|
—
|
Διεξάγεται μια δοκιμασία ανταγωνιστικής δέσμευσης με χρήση των ουσιών μαρτύρων [οιστρογόνο αναφοράς (17β-οιστραδιόλη)], μιας ασθενώς δεσμευόμενης ουσίας (π.χ. νορεθυνοδρέλη ή νορεθινδρόνη) και μιας μη δεσμευόμενης ουσίας (οκτυλοτριαιθοξυσιλάνιο, OTES). Κάθε εργαστήριο θα πρέπει να δημιουργεί βάση ιστορικών δεδομένων για να τεκμηριώνει τη συνέπεια της τιμής IC50 και άλλων σχετικών τιμών για το οιστρογόνο αναφοράς και την ασθενώς δεσμευόμενη ουσία στα διάφορα πειράματα και τις διάφορες παρτίδες hrERα. Οι παράμετροι των καμπυλών ανταγωνιστικής δέσμευσης για τις ουσίες μάρτυρες θα πρέπει να περιλαμβάνονται εντός των ορίων του διαστήματος εμπιστοσύνης 95 % (βλ. πίνακα 1) που αναπτύχθηκαν με χρήση δεδομένων των εργαστηρίων που συμμετείχαν στη μελέτη επικύρωσης για την παρούσα δοκιμασία (2).
|
|
Πίνακας 1
Κριτήρια επιδόσεων που αναπτύχθηκαν για το οιστρογόνο αναφοράς και την ασθενώς δεσμευόμενη ουσία της δοκιμασίας δέσμευσης hrER FW
|
Ουσία
|
Παράμετρος
|
Μέσος όρος (8)
|
Τυπική απόκλιση (n)
|
Διαστήματα εμπιστοσύνης 95 % (9)
|
|
Κατώτατο όριο
|
Ανώτατο όριο
|
|
17β-Οιστραδιόλη
|
Μέγιστη απόκριση (%)
|
100,44
|
10,84 (67)
|
97,8
|
103,1
|
|
Ελάχιστη απόκριση (%)
|
0,29
|
1,25 (67)
|
-0,01
|
0,60
|
|
Κλίση Hill
|
-1,06
|
0,20 (67)
|
-1,11
|
-1,02
|
|
LogIC50 (M)
|
-8,92 (10)
|
0,18 (67)
|
-8,97
|
-8,88
|
|
Νορεθυνοδρέλη
|
Μέγιστη απόκριση (%)
|
99,42
|
8,90 (68)
|
97,27
|
101,60
|
|
Ελάχιστη απόκριση (%)
|
2,02
|
3,42 (68)
|
1,19
|
2,84
|
|
Κλίση Hill
|
-1,01
|
0,38 (68)
|
-1,10
|
-0,92
|
|
Log IC50 (M)
|
-6,39
|
0,27 (68)
|
-6,46
|
-6,33
|
|
Νορεθινδρόνη (10)
|
Μέγιστη απόκριση (%)
|
96,14
|
8,44 (27)
|
92,80
|
99,48
|
|
Ελάχιστη απόκριση (%)
|
2,38
|
5,02 (27)
|
0,40
|
4,37
|
|
Κλίση Hill
|
-1,41
|
0,32 (27)
|
-1,53
|
-1,28
|
|
LogIC50(M)
|
-5,73
|
0,27 (27)
|
-5,84
|
-5,62
|
Απόδειξη της τεχνικής ικανότητας του εργαστηρίου
|
10.
|
Βλ. παραγράφους 17 και 18, και πίνακα 2 στην ενότητα «ΣΤΟΙΧΕΙΑ ΔΟΚΙΜΑΣΙΑΣ ΔΕΣΜΕΥΣΗΣ hrER» της παρούσας μεθόδου δοκιμών. Κάθε δοκιμασία (κορεσμού και ανταγωνιστικής δέσμευσης) θα πρέπει να περιλαμβάνει τρεις ανεξάρτητες σειρές δοκιμών (με πρόσφατα παρασκευασμένες αραιώσεις του υποδοχέα, των χημικών ουσιών και των αντιδραστηρίων) σε διαφορετικές ημέρες, και κάθε σειρά δοκιμών θα πρέπει να περιλαμβάνει τρία πανομοιότυπα δείγματα.
|
Προσδιορισμός της συγκέντρωσης υποδοχέα (hrERα)
|
11.
|
Η συγκέντρωση του ενεργού υποδοχέα διαφέρει ελαφρώς ανά παρτίδα και συνθήκες φύλαξης. Για αυτόν τον λόγο, θα πρέπει να προσδιορίζεται η συγκέντρωση του ενεργού υποδοχέα κατά την παραλαβή του από τον προμηθευτή. Κατ’ αυτόν τον τρόπο θα υπολογιστεί η κατάλληλη συγκέντρωση του ενεργού υποδοχέα κατά τη χρονική στιγμή της σειράς δοκιμών.
|
|
12.
|
Υπό κατάλληλες για την ανταγωνιστική δέσμευση συνθήκες (δηλ. 1 nM [3H]-οιστραδιόλη), θα πρέπει να επωάζονται ονομαστικές συγκεντρώσεις υποδοχέα 0,25, 0,5, 0,75, και 1 nM απουσία (συνολική δέσμευση) και παρουσία (μη ειδική δέσμευση) 1 μΜ μη ραδιοσημασμένης οιστραδιόλης. Η ειδική δέσμευση, υπολογιζόμενη ως η διαφορά συνολικής και μη ειδικής δέσμευσης, χαράσσεται έναντι της ονομαστικής συγκέντρωσης υποδοχέα. Η συγκέντρωση του υποδοχέα από την οποία προκύπτουν τιμές ειδικής δέσμευσης που αντιστοιχούν στο 20 % της προστεθείσας ραδιοσήμανσης σχετίζεται με την αντίστοιχη ονομαστική συγκέντρωση υποδοχέα, και η εν λόγω συγκέντρωση υποδοχέα θα πρέπει να χρησιμοποιείται για τα πειράματα κορεσμού και ανταγωνιστικής δέσμευσης. Συχνά, μια τελική συγκέντρωση hrER ίση με 0,5 nM θα συμμορφώνεται με τη συνθήκη αυτή.
|
|
13.
|
Σε περίπτωση που αποτυγχάνει επανειλημμένα η ικανοποίηση του κριτηρίου του 20 %, θα πρέπει να ελέγχεται η οργάνωση του πειράματος για πιθανά σφάλματα. Η μη επίτευξη του κριτηρίου του 20 % μπορεί να υποδεικνύει ότι ο αριθμός των ενεργών υποδοχέων στην ανασυνδυασμένη παρτίδα είναι υπερβολικά χαμηλός, οπότε και θα πρέπει να εξετάζεται το ενδεχόμενο χρήσης άλλης παρτίδας υποδοχέων.
|
Δοκιμασία κορεσμού
|
14.
|
Θα πρέπει να αξιολογούνται εις τριπλούν οκτώ αυξανόμενες συγκεντρώσεις [3H]17β-οιστραδιόλης, υπό τις ακόλουθες τρεις συνθήκες (βλ. πίνακα 2):
|
—
|
απουσία μη ραδιοσημασμένης 17β-οιστραδιόλης και παρουσία ER. Έτσι προσδιορίζεται η συνολική δέσμευση βάσει της ραδιενέργειας στις κοιλότητες που περιέχουν μόνο [3H]17β-οιστραδιόλη,
|
|
—
|
παρουσία 1 000πλάσιας πλεονάζουσας συγκέντρωσης μη ραδιοσημασμένης 17β-οιστραδιόλης σε σχέση με τη ραδιοσημασμένη 17β-οιστραδιόλη και παρουσία ER. Στόχος είναι ο κορεσμός των ενεργών θέσεων δέσμευσης με μη ραδιοσημασμένη 17β-οιστραδιόλη και ο προσδιορισμός της μη ειδικής δέσμευσης μέσω μέτρησης της ραδιενέργειας στις κοιλότητες. Τυχόν εναπομένουσα ραδιοσημασμένη οιστραδιόλη που μπορεί να δεσμευτεί στον υποδοχέα θεωρείται ότι δεσμεύεται σε μη ειδική θέση, καθώς η μη ραδιοσημασμένη οιστραδιόλη βρίσκεται σε τόσο υψηλή συγκέντρωση ώστε θα πρέπει να έχει δεσμευτεί σε όλες τις διαθέσιμες ειδικές θέσεις του υποδοχέα,
|
|
—
|
απουσία μη ραδιοσημασμένης 17β-οιστραδιόλης και απουσία ER (προσδιορισμός της συνολικής ραδιενέργειας).
|
|
Παρασκευή διαλυμάτων [3H]17β-οιστραδιόλης και μη ραδιοσημασμένης 17β-οιστραδιόλης
|
15.
|
Παρασκευάζονται αραιώσεις [3H]17β-οιστραδιόλης με προσθήκη ρυθμιστικού διαλύματος δοκιμασίας σε αποθεματικό διάλυμα [3H]17β-οιστραδιόλης 12 nM έτσι ώστε να προκύπτουν συγκεντρώσεις που κυμαίνονται αρχικά από 0,12 nM έως 12 nM. Με την προσθήκη 40 μl από τα διαλύματα αυτά στις αντίστοιχες κοιλότητες δοκιμασίας ενός τρυβλίου μικροτιτλοδότησης 96 κοιλοτήτων (σε τελικό όγκο 160 μl), θα επιτευχθούν οι τελικές συγκεντρώσεις δοκιμασίας, που κυμαίνονται από 0,03 έως 3,0 nM. Η παρασκευή ρυθμιστικού διαλύματος δοκιμασίας, αποθεματικού διαλύματος και αραιώσεων [3H]17β-οιστραδιόλης και ο προσδιορισμός των συγκεντρώσεων περιγράφονται αναλυτικά στο πρωτόκολλο FW (2).
|
|
16.
|
Οι αραιώσεις των διαλυμάτων 17β-οιστραδιόλης με αιθανόλη θα πρέπει να παρασκευάζονται με προσθήκη ρυθμιστικού διαλύματος δοκιμασίας με σκοπό την επίτευξη οκτώ αυξανόμενων συγκεντρώσεων, που κυμαίνονται αρχικά από 0,06 μΜ έως 6 μΜ. Οι τελικές συγκεντρώσεις δοκιμασίας, από 0,03 μΜ έως 3 μΜ, λαμβάνονται με μεταφορά 80 μl των εν λόγω διαλυμάτων στις αντίστοιχες κοιλότητες δοκιμασίας τρυβλίου μικροτιτλοδότησης 96 κοιλοτήτων (σε τελικό όγκο 160 μl). Η τελική συγκέντρωση της μη ραδιοσημασμένης 17β-οιστραδιόλης στις μεμονωμένες κοιλότητες δοκιμασίας μη ειδικής δέσμευσης θα πρέπει να είναι 1 000πλάσια σε σχέση με τη συγκέντρωση ραδιοσημασμένης [3H]17β-οιστραδιόλης. Η παρασκευή των αραιώσεων μη ραδιοσημασμένης 17β-οιστραδιόλης περιγράφεται αναλυτικά στο πρωτόκολλο FW (2).
|
|
17.
|
Θα πρέπει να χρησιμοποιείται η ονομαστική συγκέντρωση υποδοχέα από την οποία προκύπτει ειδική δέσμευση 20±5 % (βλ. παραγράφους 12-13). Το διάλυμα hrERα θα πρέπει να παρασκευάζεται ακριβώς πριν τη χρήση του.
|
|
18.
|
Τα τρυβλία μικροτιτλοδότησης 96 κοιλοτήτων παρασκευάζονται όπως φαίνεται στον πίνακα 2, με 3 πανομοιότυπα δείγματα ανά συγκέντρωση. Παραδείγματα κατανομής των συγκεντρώσεων και των όγκων της [3H]17β-οιστραδιόλης, της μη ραδιοσημασμένης 17β-οιστραδιόλης, του ρυθμιστικού διαλύματος και του υποδοχέα στα τρυβλία παρέχονται στο προσάρτημα 2.2.
|
Πίνακας 2
Διάταξη τρυβλίου μικροτιτλοδότησης δοκιμασίας δέσμευσης κορεσμού
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
|
|
A
|
0,03 nM [3H] E2 + ER
|
0,06 nM [3H] E2 + ER
|
0,08 nM [3H] E2 + ER
|
0,10 nM [3H] E2 + ER
|
Συνολική δέσμευση (διαλύτης)
|
|
Β
|
0,30 nM [3H] E2 + ER
|
0,60 nM [3H] E2 + ER
|
1,0 nM [3H] E2 + ER
|
3,0 nM [3H] E2 + ER
|
|
Γ
|
|
|
|
|
|
|
Δ
|
0,03 nM [3H] E2 + ER + 0,03 μΜ E2
|
0,06 nM [3H] E2 + ER + 0,06 μΜ E2
|
0,08 nM [3H] E2 + ER + 0,08 μΜ E2
|
0,10 nM [3H] E2 + ER + 0,10 μΜ E2
|
Μη ειδική δέσμευση
|
|
E
|
0,30 nM [3H] E2 + ER + 0,30 μΜ E2
|
0,60 nM [3H] E2 + ER + 0,60 μΜ E2
|
1,0 nM [3H] E2 + ER + 1,0 μΜ E2
|
3,0 nM [3H] E2 + ER + 3,0 μΜ E
|
|
ΣΤ
|
|
|
|
|
|
|
Ζ
|
|
|
|
|
|
|
H
|
|
|
|
|
|
[3H] E2: [3H]17β-οιστραδιόλη
ER: υποδοχέας οιστρογόνων
E2: μη ραδιοσημασμένη 17β-οιστραδιόλη
|
|
19.
|
Τα τρυβλία μικροτιτλοδότησης δοκιμασίας θα πρέπει να επωάζονται σε θερμοκρασία 2° έως 8°C επί 16 έως 20 ώρες και να τοποθετούνται σε στροφέα στη διάρκεια της περιόδου επώασης.
|
Μέτρηση της δεσμευμένης σε hrERα [3H]17β-οιστραδιόλης
|
20.
|
Η δεσμευμένη στον hrERα [3H]17β-οιστραδιόλη θα πρέπει να διαχωρίζεται από την ελεύθερη [3H]17β-οιστραδιόλη με προσθήκη 80 μl μη ραδιοσημασμένου εναιωρήματος DCC σε κάθε κοιλότητα, ανάδευση των τρυβλίων μικροτιτλοδότησης επί 10 λεπτά και φυγοκέντρησή τους επί 10 λεπτά στις 2 500 σ.α.λ. περίπου. Για την ελαχιστοποίηση της διάστασης της δεσμευμένης [3H]17β-οιστραδιόλης από τον hrERα κατά τη διαδικασία αυτή, είναι εξαιρετικά σημαντικό η θερμοκρασία των ρυθμιστικών διαλυμάτων και των κοιλοτήτων δοκιμασίας να διατηρείται μεταξύ 2 και 8°C και κάθε στάδιο να διεκπεραιώνεται γρήγορα. Για την αποδοτική και ταχεία επεξεργασία των τρυβλίων, είναι απαραίτητη η ύπαρξη αναδευτήρα για τρυβλία μικροτιτλοδότησης.
|
|
21.
|
Στη συνέχεια, 50 μl υπερκείμενου υγρού που περιέχει τη δεσμευμένη στον hrERα [3H]17β-οιστραδιόλη λαμβάνονται με εξαιρετική προσοχή, προκειμένου να αποφευχθεί τυχόν μόλυνση των κοιλοτήτων από την επαφή με τον DCC, και μεταφέρονται σε δεύτερο τρυβλίο μικροτιτλοδότησης.
|
|
22.
|
Κατόπιν, σε κάθε κοιλότητα (A1-B12 και Δ1 έως E12) προστίθενται 200 μl υγρού σπινθηρισμού, το οποίο μπορεί να μετατρέπει την κινητική ενέργεια των πυρηνικών εκπομπών σε φωτεινή ενέργεια. Οι κοιλότητες Ζ1-H12 [προσδιοριζόμενες ως συνολικές διασπάσεις ανά λεπτό (dpm)] αντιπροσωπεύουν διαδοχικές αραιώσεις της [3H]17β-οιστραδιόλης (40 μl) οι οποίες θα πρέπει να παρέχονται απευθείας στο υγρό σπινθηρισμού στις κοιλότητες του τρυβλίου μέτρησης, όπως φαίνεται στον πίνακα 3, δηλαδή περιέχουν μόνο 200 μl υγρού σπινθηρισμού και την κατάλληλη αραίωση [3H]17β-οιστραδιόλης. Οι μετρήσεις αυτές δείχνουν την ποσότητα της [3H]17β-οιστραδιόλης, σε dpm, που προστέθηκε σε κάθε σύνολο κοιλοτήτων για τη συνολική δέσμευση και τη μη ειδική δέσμευση.
|
Πίνακας 3
Διάταξη τρυβλίου μικροτιτλοδότησης δοκιμασίας δέσμευσης κορεσμού, μέτρηση ραδιενέργειας
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
|
|
A
|
0,03 nM [3H] E2 + ER
|
0,06 nM [3H] E2 + ER
|
0,08 nM [3H] E2 + ER
|
0,10 nM [3 H] E2 + ER
|
Συνολική δέσμευση (διαλύτης)
|
|
Β
|
0,30 nM [3H] E2 + ER
|
0,60 nM [3H] E2 + ER
|
1,0 nM [3H] E2 + ER
|
3,0 nM [3H] E2 + ER
|
|
Γ
|
|
|
|
|
|
|
Δ
|
0,03 nM [3H] E2 + ER + 0,03 μΜ E2
|
0,06 nM [3H] E2 + ER + 0,06 μΜ E2
|
0,08 nM [3H] E2 + ER + 0,08 μΜ E2
|
0,10 nM [3H] E2 + ER + 0,10 μΜ E2
|
Μη ειδική δέσμευση
|
|
E
|
0,30 nM [3H] E2 + ER + 0,30 μΜ E2
|
0,60 nM [3H] E2 + ER + 0,60 μΜ E2
|
1,0 nM [3H] E2 + ER + 1,0 μΜ E2
|
3,0 nM [3H] E2 + ER + 3,0 μΜ E2
|
|
ΣΤ
|
|
|
|
|
|
|
Ζ
|
0,03 nM [3H] E2 (συνολικές dpm)
|
0,06 nM [3H] E2
|
0,08 nM [3H] E2
|
0,10 nM [3H] E2
|
Συνολικές dpm (*7)
|
|
H
|
0,30 nM [3H] E2
|
0,60 nM [3H] E2
|
1,0 nM [3H] E2
|
3,0 nM [3H] E2
|
|
[3H] E2: [3H]17β-οιστραδιόλη
ER: υποδοχέας οιστρογόνων
E2: μη ραδιοσημασμένη 17β-οιστραδιόλη
dpm: διασπάσεις ανά λεπτό
|
|
23.
|
Η μέτρηση θα πρέπει να ξεκινά μετά από τουλάχιστον 2 ώρες και ο χρόνος καταμέτρησης θα πρέπει να είναι 40 λεπτά ανά κοιλότητα. Για τον προσδιορισμό των dpm/κοιλότητα με διόρθωση για τη σβέση θα πρέπει να χρησιμοποιείται μετρητής σπινθηρισμού τρυβλίων μικροτιτλοδότησης. Εναλλακτικά, εάν δεν υπάρχει διαθέσιμος μετρητής σπινθηρισμού, τα δείγματα μπορούν να μετρώνται σε συμβατικό μετρητή. Στην περίπτωση αυτή μπορεί ενδεχομένως να μειωθεί ο χρόνος καταμέτρησης.
|
Δοκιμασία ανταγωνιστικής δέσμευσης
|
24.
|
Η δοκιμασία ανταγωνιστικής δέσμευσης μετρά τη δέσμευση μιας μεμονωμένης συγκέντρωσης [3H]17β-οιστραδιόλης παρουσία αυξανόμενων συγκεντρώσεων υπό δοκιμή χημικής ουσίας. Για κάθε συγκέντρωση σε μία σειρά δοκιμών θα πρέπει να χρησιμοποιούνται τρία παράλληλα πανομοιότυπα δείγματα. Επιπλέον, για κάθε υπό δοκιμή χημική ουσία θα πρέπει να εκτελούνται τρεις μη παράλληλες σειρές δοκιμών. Η δοκιμασία θα πρέπει να οργανώνεται σε ένα ή περισσότερα τρυβλία μικροτιτλοδότησης 96 κοιλοτήτων.
|
Μάρτυρες
|
25.
|
Κατά τη διεξαγωγή της δοκιμασίας, σε κάθε πείραμα θα πρέπει να περιλαμβάνεται παράλληλος διαλύτης και μάρτυρες (οιστρογόνο αναφοράς, ασθενώς δεσμευόμενη ουσία και μη δεσμευόμενη ουσία). Σε ένα τρυβλίο στη διάρκεια κάθε σειράς δοκιμών, θα πρέπει να χρησιμοποιούνται πλήρεις καμπύλες συγκέντρωσης για το οιστρογόνο αναφοράς και τους μάρτυρες (ασθενώς δεσμευόμενη και μη δεσμευόμενη ουσία). Όλα τα υπόλοιπα τρυβλία θα πρέπει να περιέχουν i) υψηλή (μέγιστη εκτόπιση) και μέτρια (περίπου ίση με την IC50) συγκέντρωση E2 και ασθενώς δεσμευόμενης ουσίας, εις τριπλούν, ii) μάρτυρα με διαλύτη και μη ειδική δέσμευση, καθένα εκ των οποίων τουλάχιστον εις τριπλούν. Οι διαδικασίες για την παρασκευή του ρυθμιστικού διαλύματος δοκιμασίας και των διαλυμάτων μαρτύρων, [3H]17β-οιστραδιόλης, hrERα και των υπό δοκιμή χημικών ουσιών περιγράφονται στην παραπομπή 2 (παράρτημα K, βλ. πρωτόκολλο δοκιμασίας FW).
|
Μάρτυρας με διαλύτη:
|
26.
|
Ο μάρτυρας με διαλύτη υποδεικνύει ότι ο διαλύτης δεν αλληλεπιδρά με το σύστημα δοκιμής και, επίσης, μετρά τη συνολική δέσμευση (TB). Ο προτιμώμενος διαλύτης είναι η αιθανόλη. Εναλλακτικά, εάν η υψηλότερη συγκέντρωση της υπό δοκιμή χημικής ουσίας δεν είναι διαλυτή στην αιθανόλη, μπορεί να χρησιμοποιείται DMSO. Η συγκέντρωση της αιθανόλης ή του DMSO, εφόσον χρησιμοποιείται, στις κοιλότητες της τελικής δοκιμασίας είναι 1,5 % και δεν μπορεί να υπερβαίνει το 2 %.
|
Μάρτυρας με ρυθμιστικό διάλυμα:
|
27.
|
Ο μάρτυρας με ρυθμιστικό διάλυμα δεν θα πρέπει να περιέχει ούτε διαλύτη ούτε υπό δοκιμή χημική ουσία, αλλά όλα τα υπόλοιπα στοιχεία της δοκιμασίας. Τα αποτελέσματα του μάρτυρα με ρυθμιστικό διάλυμα συγκρίνονται με τον μάρτυρα με διαλύτη προκειμένου να επαληθευτεί ότι ο χρησιμοποιούμενος διαλύτης δεν επηρεάζει το σύστημα δοκιμασίας.
|
Ισχυρώς δεσμευόμενη ουσία (οιστρογόνο αναφοράς)
|
28.
|
Η 17β-οιστραδιόλη (CAS 50-28-2) είναι το ενδογενές πρόσδεμα και δεσμεύεται με υψηλή συγγένεια στον ER υποτύπου α. Θα πρέπει να καταρτίζεται πρότυπη καμπύλη με χρήση 17β-οιστραδιόλης για κάθε δοκιμασία ανταγωνιστικής δέσμευσης hrERα, προκειμένου να είναι δυνατή η αξιολόγηση της μεταβλητότητας με την πάροδο του χρόνου κατά τη διεξαγωγή της δοκιμασίας στο ίδιο εργαστήριο. Θα πρέπει να παρασκευάζονται οκτώ διαλύματα μη ραδιοσημασμένης 17β-οιστραδιόλης σε αιθανόλη, με εύρος συγκεντρώσεων στις κοιλότητες δοκιμασίας 100 nM – 10 pM (-7[logM] έως -11[logM]), στα εξής διαστήματα: (-7[logM], -8[logM], -8,5[logM], -9[logM], -9,5[logM], -10[logM], -11[logM]). Η υψηλότερη συγκέντρωση μη ραδιοσημασμένης 17β-οιστραδιόλης (1 μΜ) χρησιμεύει επίσης ως δείκτης μη ειδικής δέσμευσης. Παρότι αποτελεί επίσης μέρος της πρότυπης καμπύλης, η συγκεκριμένη συγκέντρωση διακρίνεται από την ένδειξη «NSB» στον πίνακα 4.
|
Ασθενώς δεσμευόμενη ουσία
|
29.
|
Θα πρέπει να περιλαμβάνεται μια ασθενώς δεσμευόμενη ουσία [νορεθυνοδρέλη (CAS68-23-5) ή νορεθινδρόνη (CAS 68-22-4)] προκειμένου να καταδεικνύεται η ευαισθησία κάθε πειράματος και να παρέχεται η δυνατότητα αξιολόγησης της μεταβλητότητας με την πάροδο του χρόνου στο πλαίσιο διεξαγωγής της δοκιμασίας. Θα πρέπει να παρασκευάζονται οκτώ διαλύματα της ασθενώς δεσμευόμενης ουσίας σε αιθανόλη, με εύρος συγκεντρώσεων στις κοιλότητες δοκιμασίας 3 nM έως 30 μΜ (-8,5[logM] έως -4,5[logM]), στα εξής διαστήματα: -4,5[logM], -5[logM], -5,5[logM], -6[logM], -6,5[logM], -7[logM], -7,5[logM], -8,5[logM].
|
Μη δεσμευόμενη ουσία
|
30.
|
Ως αρνητικός μάρτυρας (μη δεσμευόμενη ουσία) θα πρέπει να χρησιμοποιείται το οκτυλοτριαιθοξυσιλάνιο (OTES, CAS 2 943-75-1). Αυτό διασφαλίζει ότι η δοκιμασία θα ανιχνεύσει τις υπό δοκιμή χημικές ουσίες που δεν δεσμεύονται στον hrERα. Θα πρέπει να παρασκευάζονται οκτώ διαλύματα της μη δεσμευόμενης ουσίας σε αιθανόλη, με εύρος συγκεντρώσεων στις κοιλότητες δοκιμασίας 0,1 nM έως 1 000 μΜ (-10[logM] έως -3[logM]), ανά λογαριθμικές βηματικές προσαυξήσεις. Ως εναλλακτικός μάρτυρας μη δεσμευόμενης ουσίας μπορεί να χρησιμοποιείται το φθαλικό δι-n-βουτύλιο (DBP). Η μέγιστη διαλυτότητά του έχει καταδειχθεί ότι είναι -4[logM].
|
Συγκέντρωση hrERα
|
31.
|
Θα πρέπει να χρησιμοποιείται η ποσότητα υποδοχέα από την οποία προκύπτει ειδική δέσμευση 20±5 % ραδιοσημασμένου προσδέματος 1 nM (βλ. παραγράφους 12-13 του προσαρτήματος 2). Το διάλυμα hrERα θα πρέπει να παρασκευάζεται ακριβώς πριν τη χρήση του.
|
[3H]17β-οιστραδιόλη
|
32.
|
Η συγκέντρωση της [3H]17β-οιστραδιόλης στις κοιλότητες δοκιμασίας θα πρέπει να είναι 1,0 nM.
|
Υπό δοκιμή χημικές ουσίες
|
33.
|
Καταρχάς, είναι απαραίτητο να διεξάγεται δοκιμή διαλυτότητας για τον προσδιορισμό του ορίου διαλυτότητας για κάθε υπό δοκιμή χημική ουσία και για τον προσδιορισμό του κατάλληλου εύρους συγκεντρώσεων προς χρήση κατά τη διεξαγωγή του πρωτοκόλλου δοκιμής. Το όριο διαλυτότητας κάθε υπό δοκιμή χημικής ουσίας πρέπει να προσδιορίζεται αρχικά στον διαλύτη και να επιβεβαιώνεται περαιτέρω υπό τις συνθήκες δοκιμασίας. Η τελική συγκέντρωση που υποβάλλεται σε δοκιμή στη δοκιμασία δεν θα πρέπει να υπερβαίνει το 1 mM. Οι δοκιμές προσδιορισμού εύρους περιλαμβάνουν μάρτυρα με διαλύτη και 8 λογαριθμικές, διαδοχικές αραιώσεις, που ξεκινούν από τη μέγιστη αποδεκτή συγκέντρωση (π.χ. 1 mM ή χαμηλότερη, με βάση το όριο διαλυτότητας), και καταγραφή της παρουσίας θολερότητας ή ιζήματος (βλ. επίσης παράγραφο 35). Η υπό δοκιμή χημική ουσία θα πρέπει να υποβάλλεται σε δοκιμή με χρήση 8 λογαριθμικά κατανεμημένων καμπυλών συγκέντρωσης, όπως έχουν καθοριστεί από την προηγούμενη δοκιμή προσδιορισμού εύρους συγκεντρώσεων. Οι συγκεντρώσεις στο δεύτερο και το τρίτο πείραμα θα πρέπει να προσαρμόζονται κατά περίπτωση, με σκοπό τη βελτίωση του χαρακτηρισμού της καμπύλης συγκέντρωσης-απόκρισης.
|
|
34.
|
Οι αραιώσεις της υπό δοκιμή χημικής ουσίας θα πρέπει να παρασκευάζονται στον κατάλληλο διαλύτη (βλ. παράγραφο 26 του προσαρτήματος 2). Εάν η υψηλότερη συγκέντρωση της υπό δοκιμή χημικής ουσίας δεν είναι διαλυτή ούτε σε αιθανόλη ούτε σε DMSO, και η προσθήκη περισσότερου διαλύτη θα είχε ως αποτέλεσμα την αύξηση της συγκέντρωσης του διαλύτη στον τελικό σωλήνα πάνω από το αποδεκτό όριο, επιτρέπεται η μείωση της υψηλότερης συγκέντρωσης έως την επόμενη χαμηλότερη συγκέντρωση. Σε αυτή την περίπτωση, μπορεί να προστεθεί μία επιπλέον συγκέντρωση στο χαμηλό άκρο της σειράς συγκεντρώσεων. Οι υπόλοιπες συγκεντρώσεις της σειράς θα πρέπει να παραμείνουν αμετάβλητες.
|
|
35.
|
Τα διαλύματα της υπό δοκιμή χημικής ουσίας θα πρέπει να παρακολουθούνται στενά όταν προστίθενται στην κοιλότητα δοκιμασίας, καθότι η υπό δοκιμή χημική ουσία μπορεί να σχηματίσει ίζημα κατά την προσθήκη της στην κοιλότητα δοκιμασίας. Τα δεδομένα για όλες τις κοιλότητες που περιέχουν ίζημα θα πρέπει να αποκλείονται από την προσαρμογή της καμπύλης, και θα πρέπει να καταγράφεται ο λόγος του αποκλεισμού τους.
|
|
36.
|
Εάν υπάρχουν ήδη διαθέσιμες πληροφορίες από άλλες πηγές που παρέχουν τον λογάριθμο (IC50) μιας υπό δοκιμή χημικής ουσίας, ίσως είναι σκόπιμο τα διαστήματα των αραιώσεων να διαμορφωθούν με γεωμετρικό τρόπο [δηλ. 0,5 λογαριθμικές μονάδες γύρω από τον αναμενόμενο λογάριθμο (IC50)]. Το τελικό αποτέλεσμα θα πρέπει να αντιπροσωπεύει επαρκή διασπορά συγκεντρώσεων εκατέρωθεν του λογάριθμου (IC50), περιλαμβανομένης της μέγιστης και της ελάχιστης τιμής, κατά τρόπον ώστε να είναι εφικτός ο επαρκής χαρακτηρισμός της καμπύλης δέσμευσης.
|
Οργάνωση τρυβλίων δοκιμασίας
|
37.
|
Θα πρέπει να προετοιμάζονται επισημασμένα τρυβλία μικροτιτλοδότησης για εξαπλές επωάσεις, με κωδικούς για τον μάρτυρα με διαλύτη, την υψηλότερη συγκέντρωση του οιστρογόνου αναφοράς που χρησιμεύει επίσης ως δείκτης μη ειδικής δέσμευσης (NSB), καθώς και τον μάρτυρα με ρυθμιστικό διάλυμα, και για τριπλές επωάσεις με κωδικούς για καθεμία από τις οκτώ συγκεντρώσεις του μάρτυρα μη δεσμευόμενης ουσίας (οκτυλοτριαιθοξυσιλάνιο), τις 7 χαμηλότερες συγκεντρώσεις για το οιστρογόνο αναφοράς, τα επίπεδα δόσης των οκτώ συγκεντρώσεων της ασθενώς δεσμευόμενης ουσίας, και τις 8 συγκεντρώσεις κάθε υπό δοκιμή χημικής ουσίας (TC). Ένα παράδειγμα διάταξης του διαγράμματος τρυβλίων για τις πλήρεις καμπύλες συγκέντρωσης που αφορούν το οιστρογόνο αναφοράς και τον μάρτυρα παρέχεται στον πίνακα 4 κατωτέρω. Για τις υπό δοκιμή χημικές ουσίες χρησιμοποιούνται πρόσθετα τρυβλία μικροτιτλοδότησης, τα οποία θα πρέπει να περιλαμβάνουν μάρτυρες τρυβλίων, ήτοι 1) μια υψηλή (μέγιστη εκτόπιση) και μία μέτρια (περίπου ίση με την IC50) συγκέντρωση E2 και ασθενώς δεσμευόμενης ουσίας, εις τριπλούν, και 2) μάρτυρα με διαλύτη και μη ειδική δέσμευση, καθένα εκ των οποίων εις εξαπλούν (πίνακας 5). Παράδειγμα φύλλου εργασίας διάταξης τρυβλίου μικροτιτλοδότησης δοκιμασίας ανταγωνιστικής δέσμευσης με χρήση τριών άγνωστων υπό δοκιμή χημικών ουσιών παρέχεται στο προσάρτημα 2.3. Οι συγκεντρώσεις που φαίνονται στους πίνακες 4 και 5 είναι οι τελικές συγκεντρώσεις της δοκιμασίας. Η μέγιστη συγκέντρωση για την E2 θα πρέπει να είναι 1×10-7 M, ενώ όσον αφορά την ασθενώς δεσμευόμενη ουσία θα πρέπει να χρησιμοποιείται η υψηλότερη συγκέντρωση που χρησιμοποιείται για την ασθενώς δεσμευόμενη ουσία στο τρυβλίο 1. Η συγκέντρωση IC50 θα πρέπει να καθορίζεται από το εργαστήριο βάσει της βάσης ιστορικών δεδομένων για τους μάρτυρες. Η εν λόγω τιμή αναμένεται να είναι παρεμφερής με την τιμή που παρατηρήθηκε στις μελέτες επικύρωσης (βλ. πίνακα 1).
|
Πίνακας 4
Διάταξη τρυβλίου μικροτιτλοδότησης δοκιμασίας ανταγωνιστικής δέσμευσης, πλήρεις καμπύλες συγκέντρωσης για το οιστρογόνο αναφοράς και τους μάρτυρες (τρυβλίο 1)
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
|
A
|
TB (μόνο διαλύτης)
|
TB (μόνο διαλύτης)
|
NSB
|
NSB
|
|
Β
|
E2 (1×10-7)
|
E2 (1×10-8)
|
E2 (1×10-8,5)
|
E2 (1×10-9)
|
|
Γ
|
E2 (1×10-9,5)
|
E2 (1×10-10)
|
E2 (1×10-11)
|
Τυφλό (*8)
|
|
Δ
|
NE (1×10-4,5)
|
NE (1×10-5)
|
NE (1×10-5,5)
|
NE (1×10-6)
|
|
E
|
NE (1×10-6,5)
|
NE (1×10-7)
|
NE (1×10-7,5)
|
NE (1×10-8,5)
|
|
ΣΤ
|
OTES (1×10-3)
|
OTES (1×10-4)
|
OTES (1×10-5)
|
OTES (1×10-6)
|
|
Ζ
|
OTES (1×10-7)
|
OTES (1×10-8)
|
OTES (1×10-9)
|
OTES (1×10-10)
|
|
H
|
Τυφλό (για ραδιοσήμανση) (*9)
|
Τυφλό (για ραδιοσήμανση) (*9)
|
Μάρτυρας με ρυθμιστικό διάλυμα
|
Μάρτυρας με ρυθμιστικό διάλυμα
|
|
Στο παράδειγμα, η ασθενώς δεσμευόμενη ουσία είναι η νορεθυνοδρέλη (NE)
|
Πίνακας 5
Διάταξη τρυβλίου μικροτιτλοδότησης δοκιμασίας ανταγωνιστικής δέσμευσης, πλήρεις καμπύλες συγκέντρωσης για τις υπό δοκιμή χημικές ουσίες και τους μάρτυρες τρυβλίου
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
|
A
|
TB (μόνο διαλύτης)
|
TB (μόνο διαλύτης)
|
NSB
|
NSB
|
|
Β
|
TC1 (1×10-3)
|
TC1 (1×10-4)
|
TC1 (1×10-5)
|
TC1 (1×10-6)
|
|
Γ
|
TC1 (1×10-7)
|
TC1 (1×10-8)
|
TC1 (1×10-9)
|
TC1 (1×10-10)
|
|
Δ
|
TC2 (1×10-3)
|
TC2 (1×10-4)
|
TC2 (1×10-5)
|
TC2 (1×10-6)
|
|
E
|
TC2 (1×10-7)
|
TC2 (1×10-8)
|
TC2 (1×10-9)
|
TC2 (1×10-10)
|
|
ΣΤ
|
TC3 (1×10-3)
|
TC3 (1×10-4)
|
TC3 (1×10-5)
|
TC3 (1×10-6)
|
|
Ζ
|
TC3 (1×10-7)
|
TC3 (1×10-8)
|
TC3 (1×10-9)
|
TC3 (1×10-10)
|
|
H
|
NE (IC50)
|
NE (1×10-4,5)
|
E2 (IC50)
|
E2 (1×10-7)
|
|
Στο παράδειγμα, η ασθενώς δεσμευόμενη ουσία είναι η νορεθυνοδρέλη (NE)
|
Ολοκλήρωση της δοκιμασίας ανταγωνιστικής δέσμευσης
|
38.
|
Όπως φαίνεται στον πίνακα 6, στις κοιλότητες θα πρέπει να προστεθούν 80 μl του μάρτυρα με διαλύτη, του οιστρογόνου αναφοράς, της ασθενώς δεσμευόμενης ουσίας, της μη δεσμευόμενης ουσίας και των υπό δοκιμή χημικών ουσιών που παρασκευάστηκαν σε ρυθμιστικό διάλυμα της δοκιμασίας. Στη συνέχεια, σε κάθε κοιλότητα θα πρέπει να προστεθούν 40 μl διαλύματος [3H]17β-οιστραδιόλης 4 nM. Μετά από ήπια ανάδευση επί 10 έως 15 λεπτά σε θερμοκρασία μεταξύ 2° και 8°C, θα πρέπει να προστεθούν 40 μl διαλύματος hrERα. Τα τρυβλία μικροτιτλοδότησης δοκιμασίας θα πρέπει να επωάζονται σε θερμοκρασία 2° έως 8°C επί 16 έως 20 ώρες και να τοποθετούνται σε περιστροφικό αναδευτήρα στη διάρκεια της περιόδου επώασης.
|
Πίνακας 6
Όγκος στοιχείων δοκιμασίας για τη δοκιμασία ανταγωνιστικής δέσμευσης hrER, τρυβλία μικροτιτλοδότησης
|
Όγκος (μl)
|
Συστατικό
|
|
80
|
Μη ραδιοσημασμένη 17β-οιστραδιόλη, νορεθυνοδρέλη, OTES, υπό δοκιμή χημικές ουσίες, διαλύτης ή ρυθμιστικό διάλυμα
|
|
40
|
4 nM διαλύματος [3H]17β-οιστραδιόλης
|
|
40
|
Διάλυμα hrERα, συγκέντρωση όπως έχει καθοριστεί
|
|
160
|
Συνολικός όγκος σε κάθε κοιλότητα δοκιμασίας
|
|
39.
|
Στη συνέχεια, θα πρέπει να πραγματοποιείται ποσοτικός προσδιορισμός της δεσμευμένης στον hrERα [3H]17β-οιστραδιόλης, μετά τον διαχωρισμό της δεσμευμένης στον hrERα [3H]17β-οιστραδιόλης από την ελεύθερη [3H]17β-οιστραδιόλη, διά της προσθήκης 80 μl μη ραδιοσημασμένου εναιωρήματος DCC σε κάθε κοιλότητα, όπως περιγράφεται στις παραγράφους 20-23 για τη δοκιμασία δέσμευσης κορεσμού.
|
|
40.
|
Οι κοιλότητες H1-6 [που προσδιορίζονται ως τυφλό δείγμα (για τη ραδιοσήμανση) στον πίνακα 4] αντιπροσωπεύουν τις dpm της [3H]-ραδιοσημασμένης οιστραδιόλης σε 40 μl. Η ποσότητα των 40 μl θα πρέπει να προστίθεται απευθείας στο υγρό σπινθηρισμού στις κοιλότητες H1 – H6.
|
Κριτήρια αποδοχής
Δοκιμασία δέσμευσης κορεσμού
|
41.
|
Η καμπύλη ειδικής δέσμευσης θα πρέπει να φθάνει σε ένα πλατώ όταν χρησιμοποιούνται αυξανόμενες συγκεντρώσεις [3H]17β-οιστραδιόλης, γεγονός που υποδεικνύει τον κορεσμό του hrERα με το πρόσδεμα.
|
|
42.
|
Η ειδική δέσμευση σε 1 nM [3H]17β-οιστραδιόλης θα πρέπει να βρίσκεται εντός του αποδεκτού φάσματος 15 % έως 25 % της μέσης μετρηθείσας συνολικής ραδιενέργειας που προστέθηκε σε όλες τις σειρές δοκιμών. Περιστασιακές ελαφρές αποκλίσεις εκτός του εν λόγω φάσματος είναι αποδεκτές, αλλά εάν οι σειρές δοκιμών βρίσκονται μονίμως εκτός του φάσματος ή μια συγκεκριμένη σειρά δοκιμών βρίσκεται αρκετά έξω από αυτό, η συγκέντρωση πρωτεΐνης θα πρέπει να προσαρμοστεί και η δοκιμασία κορεσμού να επαναληφθεί.
|
|
43.
|
Από τα δεδομένα θα πρέπει να προκύπτει γραμμικό διάγραμμα Scatchard.
|
|
44.
|
Η μη ειδική δέσμευση δεν θα πρέπει να είναι υπέρμετρη. Η τιμή της μη ειδικής δέσμευσης θα πρέπει να αντιστοιχεί κατά κανόνα σε <35 % της συνολικής δέσμευσης. Ωστόσο, ο λόγος μπορεί περιστασιακά να υπερβαίνει το εν λόγω όριο, όταν μετρώνται ιδιαίτερα χαμηλές dpm για τη χαμηλότερη συγκέντρωση της υπό δοκιμή ραδιοσημασμένης 17β-οιστραδιόλης.
|
Δοκιμασία ανταγωνιστικής δέσμευσης
|
45.
|
Οι αυξανόμενες συγκεντρώσεις μη ραδιοσημασμένης 17β-οιστραδιόλης θα πρέπει να εκτοπίζουν την [3H]17β-οιστραδιόλη από τον υποδοχέα κατά τρόπο που συνάδει με ανταγωνιστική δέσμευση μίας θέσης.
|
|
46.
|
Η τιμή IC50 για το οιστρογόνο αναφοράς (δηλ. τη 17β-οιστραδιόλη) θα πρέπει να είναι κατά προσέγγιση ίση με τη γραμμομοριακή συγκέντρωση της [3H]17β-οιστραδιόλης συν την Kd που προσδιορίζεται από τη δοκιμασία δέσμευσης κορεσμού.
|
|
47.
|
Η συνολική ειδική δέσμευση θα πρέπει να εμπίπτει σταθερά εντός του αποδεκτού φάσματος 20 ± 5 % όταν η μέση μετρηθείσα συγκέντρωση συνολικής ραδιενέργειας που προστέθηκε σε κάθε κοιλότητα ήταν 1 nM στη διάρκεια όλων των σειρών δοκιμών. Περιστασιακές ελαφρές αποκλίσεις εκτός του εν λόγω φάσματος είναι αποδεκτές, αλλά εάν οι σειρές δοκιμών βρίσκονται μονίμως εκτός του φάσματος ή μια συγκεκριμένη σειρά δοκιμών βρίσκεται αρκετά έξω από αυτό, η συγκέντρωση πρωτεΐνης θα πρέπει να προσαρμοστεί.
|
|
48.
|
Ο διαλύτης δεν θα πρέπει να αλλοιώνει την ευαισθησία ή την αναπαραγωγιμότητα της δοκιμασίας. Τα αποτελέσματα του μάρτυρα με διαλύτη (κοιλότητες TB) συγκρίνονται με τον μάρτυρα με ρυθμιστικό διάλυμα προκειμένου να επαληθευτεί ότι ο χρησιμοποιούμενος διαλύτης δεν επηρεάζει το σύστημα δοκιμασίας. Τα αποτελέσματα της συνολικής δέσμευσης (TB) και του μάρτυρα με ρυθμιστικό διάλυμα θα πρέπει να είναι συγκρίσιμα, εάν δεν υπάρχει επίδραση του διαλύτη στη δοκιμασία.
|
|
49.
|
Η μη δεσμευόμενη ουσία δεν θα πρέπει να εκτοπίζει ποσοστό άνω του 25 % της [3H]17β-οιστραδιόλης από τον hrERα, όταν ελέγχεται σε συγκέντρωση έως 10-3 M (OTES) ή 10-4 M (DBP).
|
|
50.
|
Για το οιστρογόνο αναφοράς και δύο ασθενώς δεσμευόμενες ουσίες (π.χ. νορεθυνοδρέλη, νορεθινδρόνη) αναπτύχθηκαν κριτήρια επιδόσεων με χρήση δεδομένων από τη μελέτη επικύρωσης της δοκιμασίας δέσμευσης hrER FW (παράρτημα N της παραπομπής 2). Παρέχονται διαστήματα εμπιστοσύνης 95 % για τη μέση τιμή (n) +/- την SD για όλες τις σειρές δοκιμών μάρτυρα σε όλα τα εργαστήρια που συμμετείχαν στη μελέτη επικύρωσης. Υπολογίστηκαν διαστήματα εμπιστοσύνης 95 % για τις παραμέτρους προσαρμογής της καμπύλης (δηλ. μέγιστη τιμή, ελάχιστη τιμή, κλίση Hill, logIC50) για το οιστρογόνο αναφοράς και τις ασθενώς δεσμευόμενες ουσίες, και για το log10RBA των ασθενώς δεσμευόμενων ουσιών σε σχέση με το οιστρογόνο αναφοράς, τα οποία παρέχονται ως κριτήρια επιδόσεων για τους θετικούς μάρτυρες. Στον πίνακα 1 φαίνονται οι αναμενόμενες κλίμακες τιμών για τις παραμέτρους προσαρμογής της καμπύλης που μπορούν να χρησιμοποιηθούν ως κριτήρια επιδόσεων. Στην πράξη, η κλίμακα τιμών της IC50 μπορεί να ποικίλλει ελαφρώς με βάση την Kd του σκευάσματος υποδοχέα και τη συγκέντρωση προσδέματος.
|
|
51.
|
Δεν αναπτύχθηκαν κριτήρια επιδόσεων για τις παραμέτρους προσαρμογής της καμπύλης για τις υπό δοκιμή χημικές ουσίες λόγω του ευρέος φάσματος των δυνητικών υπό δοκιμή χημικών ουσιών που υπάρχουν και του φάσματος των δυνητικών συγγενειών και εκβάσεων (π.χ. πλήρης καμπύλη, μερική καμπύλη, καμία προσαρμογή καμπύλης). Ωστόσο, η εξέταση των αποτελεσμάτων από κάθε σειρά δοκιμών για μια υπό δοκιμή χημική ουσία θα πρέπει να πραγματοποιείται με βάση την επαγγελματική κρίση. Θα πρέπει να χρησιμοποιείται επαρκές εύρος συγκεντρώσεων της υπό δοκιμή χημικής ουσίας ώστε να προσδιορίζεται με σαφήνεια η μέγιστη τιμή (π.χ. 90 - 100 % δέσμευσης) της καμπύλης ανταγωνιστικής δέσμευσης. Η μεταβλητότητα μεταξύ των πανομοιότυπων δειγμάτων σε κάθε συγκέντρωση της υπό δοκιμή χημικής ουσίας καθώς και μεταξύ των 3 μη παράλληλων σειρών δοκιμών θα πρέπει να είναι εντός εύλογων ορίων και να τεκμηριώνεται επιστημονικά. Οι μάρτυρες από κάθε σειρά δοκιμών για μια υπό δοκιμή χημική ουσία θα πρέπει να προσεγγίζουν τα μέτρα επιδόσεων που αναφέρονται για τη συγκεκριμένη δοκιμασία FW και πρέπει να είναι σύμφωνοι με τα ιστορικά δεδομένα για τους μάρτυρες από κάθε αντίστοιχο εργαστήριο.
|
ΑΝΑΛΥΣΗ ΤΩΝ ΔΕΔΟΜΕΝΩΝ
Δοκιμασία δέσμευσης κορεσμού
|
52.
|
Μετράται τόσο η συνολική όσο και η μη ειδική δέσμευση. Από τις εν λόγω τιμές, υπολογίζεται η ειδική δέσμευση αυξανόμενων συγκεντρώσεων [3H]17β-οιστραδιόλης υπό συνθήκες ισορροπίας, αφαιρώντας τη μη ειδική δέσμευση από τη συνολική δέσμευση. Ένα διάγραμμα της ειδικής δέσμευσης έναντι της συγκέντρωσης [3H]17β-οιστραδιόλης αναμένεται ότι θα φθάνει σε πλατώ όσον αφορά τη μέγιστη ειδική δέσμευση, το οποίο υποδεικνύει τον κορεσμό του hrERα με την [3H]17β-οιστραδιόλη. Επιπλέον, η ανάλυση των δεδομένων θα πρέπει να τεκμηριώνει τη δέσμευση της [3H]17β-οιστραδιόλης σε μία μοναδική θέση δέσμευσης υψηλής συγγένειας. Η μη ειδική, η συνολική και η ειδική δέσμευση θα πρέπει να παρουσιάζονται σε καμπύλη δέσμευσης κορεσμού. Στο πλαίσιο περαιτέρω ανάλυσης των εν λόγω δεδομένων θα πρέπει να χρησιμοποιηθεί ανάλυση μη γραμμικής παλινδρόμησης (π.χ. BioSoft, McPherson 1985, Motulsky 1995), με τελική παρουσίαση των δεδομένων υπό μορφή ανάλυσης Scatchard.
|
|
53.
|
Η ανάλυση δεδομένων θα πρέπει να προσδιορίζει τις Bmax και Kd αποκλειστικά από τα δεδομένα συνολικής δέσμευσης, βάσει της παραδοχής ότι η μη ειδική δέσμευση είναι γραμμική, εκτός εάν αιτιολογείται η χρήση διαφορετικής μεθόδου. Επιπλέον, κατά τον προσδιορισμό της βέλτιστης προσαρμογής θα πρέπει να χρησιμοποιείται ανάλυση εύρωστης παλινδρόμησης, εκτός εάν παρέχονται οι λόγοι για τη μη χρήση της. Θα πρέπει να αναφέρεται η επιλεγμένη μέθοδος για την εύρωστη παλινδρόμηση. Κατά τον προσδιορισμό των Bmax και Kd από δεδομένα δέσμευσης κορεσμού, θα πρέπει να εφαρμόζεται διόρθωση ως προς την εξάντληση του προσδέματος (π.χ. με χρήση της μεθόδου Swillens 1995).
|
Δοκιμασία ανταγωνιστικής δέσμευσης
|
54.
|
Η καμπύλη ανταγωνιστικής δέσμευσης χαράσσεται ως ειδική δέσμευση [3H]17β-οιστραδιόλης έναντι της συγκέντρωσης (μονάδες log10) του ανταγωνιστή. Η συγκέντρωση της υπό δοκιμή χημικής ουσίας που αναστέλλει το 50 % της μέγιστης ειδικής δέσμευσης [3H]17β-οιστραδιόλης είναι η τιμή IC50.
|
|
55.
|
Οι εκτιμήσεις των τιμών λογάριθμου (IC50) για τους θετικούς μάρτυρες (οιστρογόνο αναφοράς και ασθενώς δεσμευόμενη ουσία) θα πρέπει να προσδιορίζονται με χρήση λογισμικού μη γραμμικής προσαρμογής καμπύλης κατάλληλου για την προσαρμογή εξίσωσης Hill τεσσάρων παραμέτρων (π.χ. BioSoft, McPherson 1985, Motulsky 1995). Κατά την προσαρμογή των εν λόγω καμπυλών, η μέγιστη τιμή, η ελάχιστη τιμή, η κλίση και ο λογάριθμος (IC50) θα πρέπει, γενικά, να μην περιορίζονται. Κατά τον προσδιορισμό της βέλτιστης προσαρμογής, θα πρέπει να χρησιμοποιείται ανάλυση εύρωστης παλινδρόμησης, εκτός εάν παρέχονται οι λόγοι για τη μη χρήση της. Δεν θα πρέπει να εφαρμόζεται διόρθωση ως προς την εξάντληση του προσδέματος. Μετά την αρχική ανάλυση, κάθε καμπύλη δέσμευσης θα πρέπει να ελέγχεται ώστε να διασφαλίζεται η κατάλληλη προσαρμογή στο μοντέλο. Η σχετική συγγένεια δέσμευσης (RBA) για την ασθενώς δεσμευόμενη ουσία θα πρέπει να υπολογίζεται ως ποσοστό του λογάριθμου (IC50) για την ασθενώς δεσμευόμενη ουσία σε σχέση με τον λογάριθμο (IC50) για τη 17β-οιστραδιόλη. Τα αποτελέσματα από τους θετικούς μάρτυρες και τον μάρτυρα μη δεσμευόμενης ουσίας θα πρέπει να αξιολογούνται με χρήση των μέτρων των επιδόσεων δοκιμασίας των παραγράφων 45-50 του παρόντος προσαρτήματος 2.
|
|
56.
|
Τα δεδομένα για το σύνολο των υπό δοκιμή χημικών ουσιών θα πρέπει να αναλύονται με χρήση κλιμακωτής προσέγγισης ώστε να διασφαλίζεται η δέουσα ανάλυσή τους και η σωστή ταξινόμηση κάθε καμπύλης ανταγωνιστικής δέσμευσης. Συνιστάται κάθε σειρά δοκιμών για υπό δοκιμή χημική ουσία να υποβάλλεται αρχικά σε τυποποιημένη ανάλυση δεδομένων πανομοιότυπη με την ανάλυση που χρησιμοποιείται για το οιστρογόνο αναφοράς και την ασθενώς δεσμευόμενη ουσία (βλ. παράγραφο 55 ανωτέρω). Μετά την αρχική ανάλυση, θα πρέπει να γίνεται τεχνική επανεξέταση των παραμέτρων προσαρμογής της καμπύλης και να εξετάζεται οπτικά η ποιότητα της προσαρμογής των δεδομένων δέσμευσης στην προκύπτουσα καμπύλη ανταγωνιστικής δέσμευσης για κάθε σειρά δοκιμών. Εάν, κατά την τεχνική επανεξέταση, παρατηρηθεί εξαρτώμενη από τη συγκέντρωση μείωση του ποσοστού της ειδικά δεσμευμένης [3H]17β-οιστραδιόλης, χαμηλή μεταβλητότητα μεταξύ των τεχνικών πανομοιότυπων δειγμάτων σε κάθε συγκέντρωση χημικής ουσίας, και συμφωνία των παραμέτρων προσαρμογής μεταξύ των τριών σειρών δοκιμών, αυτό αποτελεί ουσιαστική ένδειξη ότι η δοκιμασία και οι αναλύσεις δεδομένων διεξήχθησαν ορθά.
|
Ερμηνεία των δεδομένων
|
57.
|
Υπό την προϋπόθεση ότι πληρούνται όλα τα κριτήρια αποδοχής, μια υπό δοκιμή χημική ουσία θεωρείται δεσμευόμενη στον hrERα εάν είναι εφικτή η προσαρμογή μιας καμπύλης δέσμευσης και το χαμηλότερο σημείο της καμπύλης απόκρισης εντός της κλίμακας των δεδομένων είναι χαμηλότερο από 50 % (σχήμα 1).
|
|
58.
|
Υπό την προϋπόθεση ότι πληρούνται όλα τα κριτήρια αποδοχής, μια υπό δοκιμή χημική ουσία θεωρείται μη δεσμευόμενη στον hrERα εάν:
|
—
|
είναι εφικτή η προσαρμογή μιας καμπύλης δέσμευσης και το χαμηλότερο σημείο της προσαρμοσμένης καμπύλης απόκρισης εντός της κλίμακας των δεδομένων υπερβαίνει το 75 %, ή
|
|
—
|
δεν είναι εφικτή η προσαρμογή καμπύλης δέσμευσης και το χαμηλότερο μη εξομαλυμένο μέσο εκατοστιαίο ποσοστό δέσμευσης μεταξύ των ομάδων συγκέντρωσης στα δεδομένα υπερβαίνει το 75 %.
|
|
|
59.
|
Οι υπό δοκιμή χημικές ουσίες θεωρούνται αμφίβολες εάν δεν πληρούται καμία από τις ανωτέρω προϋποθέσεις (π.χ. το χαμηλότερο σημείο της προσαρμοσμένης καμπύλης απόκρισης βρίσκεται μεταξύ 76 και 51 %).
|
Πίνακας 7
Κριτήρια ταξινόμησης βάσει της καμπύλης ανταγωνιστικής δέσμευσης για υπό δοκιμή χημική ουσία
|
Ταξινόμηση
|
Κριτήρια
|
|
Δεσμευόμενηα
|
Είναι εφικτή η προσαρμογή καμπύλης δέσμευσης.
Το χαμηλότερο σημείο της καμπύλης απόκρισης εντός της κλίμακας των δεδομένων είναι χαμηλότερο από 500%.
|
|
Μη δεσμευόμενηβ
|
Εάν είναι εφικτή η προσαρμογή καμπύλης δέσμευσης,
το χαμηλότερο σημείο της προσαρμοσμένης καμπύλης απόκρισης εντός της κλίμακας των δεδομένων υπερβαίνει το 75 %.
Εάν δεν είναι εφικτή η προσαρμογή καμπύλης δέσμευσης,
το χαμηλότερο μη εξομαλυμένο εκατοστιαίο ποσοστό δέσμευσης μεταξύ των ομάδων συγκέντρωσης στα δεδομένα υπερβαίνει το 75 %.
|
|
Αμφίβοληγ
|
Οποιαδήποτε ελέγξιμη σειρά δοκιμών η οποία δεν αντιστοιχεί ούτε σε δεσμευόμενη ούτε σε μη δεσμευόμενη ουσία (π.χ. το χαμηλότερο σημείο της προσαρμοσμένης καμπύλης απόκρισης βρίσκεται μεταξύ 76 και 51 %).
|
Σχήμα 1
Παραδείγματα ταξινόμησης υπό δοκιμή χημικής ουσίας με χρήση καμπύλης ανταγωνιστικής δέσμευσης

|
60.
|
Πολλές σειρές δοκιμών που διεξάγονται σε ένα εργαστήριο για υπό δοκιμή χημική ουσία συνδυάζονται διά της απόδοσης αριθμητικών τιμών σε κάθε σειρά δοκιμών και διά της εξαγωγής του μέσου όρου των σειρών δοκιμών, όπως φαίνεται στον πίνακα 8. Τα αποτελέσματα των συνδυασμένων σειρών δοκιμών σε κάθε εργαστήριο συγκρίνονται με την αναμενόμενη ταξινόμηση για κάθε υπό δοκιμή χημική ουσία.
|
Πίνακας 8
Μέθοδος ταξινόμησης υπό δοκιμή χημικής ουσίας με χρήση πολλών σειρών δοκιμών σε ένα εργαστήριο
|
Για την απόδοση τιμής σε κάθε σειρά δοκιμών:
|
|
|
Ταξινόμηση
|
Αριθμητική τιμή
|
|
Δεσμευόμενη
|
2
|
|
Αμφίβολη
|
1
|
|
Μη δεσμευόμενη
|
0
|
|
Για την ταξινόμηση του μέσου όρου αριθμητικών τιμών στις σειρές δοκιμών:
|
|
|
Ταξινόμηση
|
Αριθμητική τιμή
|
|
Δεσμευόμενη
|
Μέσος όρος ≥ 1,5
|
|
Αμφίβολη
|
0,5 ≤ Μέσος όρος < 1,5
|
|
Μη δεσμευόμενη
|
Μέσος όρος < 0,5
|
ΕΚΘΕΣΗ ΔΟΚΙΜΗΣ
|
61.
|
Βλ. παράγραφο 24 της ενότητας «ΣΤΟΙΧΕΙΑ ΔΟΚΙΜΑΣΙΑΣ ΔΕΣΜΕΥΣΗΣ hrER» της παρούσας μεθόδου δοκιμών.
|
Προσάρτημα 2.1
ΚΑΤΑΛΟΓΟΣ ΟΡΩΝ
[3H]E2: 17β-οιστραδιόλη ραδιοσημασμένη με τρίτιο
DCC: επιχρισμένος με δεξτράνη ενεργός άνθρακας
E2: μη ραδιοσημασμένη 17β-οιστραδιόλη (αδρανής)
Ρυθμιστικό διάλυμα δοκιμασίας: 10 mM Tris, 10 mg αλβουμίνης βόειου ορού /ml, 2 mM DTT, 10 % γλυκερόλης, 0,2 mM λευπεπτίνης, pH 7,5
hrERα: (human recombinant estrogen receptor alpha) ανασυνδασμένος ανθρώπινος υποδοχέας οιστρογόνων α
Πανομοιότυπο δείγμα: μία από πολλές κοιλότητες με το ίδιο περιεχόμενο στις ίδιες συγκεντρώσεις, οι οποίες υποβάλλονται ταυτόχρονα σε δοκιμή στο πλαίσιο μεμονωμένης σειράς δοκιμών. Στο παρόν πρωτόκολλο, κάθε συγκέντρωση της υπό δοκιμή χημικής ουσίας υποβάλλεται σε δοκιμή εις τριπλούν· δηλαδή υπάρχουν τρία πανομοιότυπα δείγματα που υποβάλλονται ταυτόχρονα σε δοκιμή για κάθε συγκέντρωση της υπό δοκιμή χημικής ουσίας.
Σειρά δοκιμών: πλήρης σειρά ταυτόχρονα εξεταζόμενων κοιλοτήτων δοκιμασίας τρυβλίων μικροτιτλοδότησης, που παρέχει όλες τις πληροφορίες που είναι απαραίτητες για τον χαρακτηρισμό της δέσμευσης μιας υπό δοκιμή χημικής ουσίας στον hrERα (δηλαδή συνολική [3H]17β-οιστραδιόλη που προστίθεται στην κοιλότητα δοκιμασίας, μέγιστη δέσμευση [3H]17β-οιστραδιόλης στον hrERα, μη ειδική δέσμευση, και συνολική δέσμευση σε διάφορες συγκεντρώσεις υπό δοκιμή χημικής ουσίας). Μια σειρά δοκιμών μπορεί να περιλαμβάνει ακόμη και μία μόνο κοιλότητα δοκιμασίας (πανομοιότυπο δείγμα) ανά συγκέντρωση αλλά, δεδομένου ότι στο παρόν πρωτόκολλο απαιτείται η διεξαγωγή της δοκιμασίας εις τριπλούν, μία σειρά δοκιμών περιλαμβάνει τρεις κοιλότητες δοκιμασίας ανά συγκέντρωση. Επιπλέον, στο παρόν πρωτόκολλο απαιτούνται τρεις ανεξάρτητες (δηλ. μη παράλληλες) σειρές δοκιμών ανά χημική ουσία.
Προσάρτημα 2.2
ΤΥΠΙΚΗ ΔΟΚΙΜΑΣΙΑ ΚΟΡΕΣΜΟΥ [3H]17Β-ΟΙΣΤΡΑΔΙΟΛΗΣ ΜΕ ΤΡΕΙΣ ΠΑΝΟΜΟΙΟΤΥΠΕΣ ΚΟΙΛΟΤΗΤΕΣ
|
Τυπική δοκιμασία κορεσμού [3H]-17β-οιστραδιόλης με τρεις πανομοιότυπες κοιλότητες
|
|
Θέση
|
Πανομοιότυπο δείγμα
|
Κωδικός τύπου κοιλότητας
|
Αρχική συγκέντρωση ραδιοσημασμένης E2 (nM)
|
Όγκος ραδιοσημασμένης E2 (μl)
|
Τελική συγκέντρωση ραδιοσημασμένης E2 (nM)
|
Αρχική συγκέντρωση μη ραδιοσημασμένης E2 (μΜ)
|
Όγκος μη ραδιοσημασμένης E2 (μl)
|
Τελική συγκέντρωση μη ραδιοσημασμένης E2 (μΜ)
|
Όγκος ρυθμιστικού διαλύματος (μl)
|
Όγκος υποδοχέα (μl)
|
Συνολικός όγκος στις κοιλότητες
|
|
A1
|
1
|
H
|
0,12
|
40
|
0,03
|
—
|
—
|
—
|
80
|
40
|
160
|
|
A2
|
2
|
H
|
0,12
|
40
|
0,03
|
—
|
—
|
—
|
80
|
40
|
160
|
|
A3
|
3
|
H
|
0,12
|
40
|
0,03
|
—
|
—
|
—
|
80
|
40
|
160
|
|
A4
|
1
|
H
|
0,24
|
40
|
0,06
|
—
|
—
|
—
|
80
|
40
|
160
|
|
A5
|
2
|
H
|
0,24
|
40
|
0,06
|
—
|
—
|
—
|
80
|
40
|
160
|
|
A6
|
3
|
H
|
0,24
|
40
|
0,06
|
—
|
—
|
—
|
80
|
40
|
160
|
|
A7
|
1
|
H
|
0,32
|
40
|
0,08
|
—
|
—
|
—
|
80
|
40
|
160
|
|
A8
|
2
|
H
|
0,32
|
40
|
0,08
|
—
|
—
|
—
|
80
|
40
|
160
|
|
A9
|
3
|
H
|
0,32
|
40
|
0,08
|
—
|
—
|
—
|
80
|
40
|
160
|
|
A10
|
1
|
H
|
0,40
|
40
|
0,10
|
—
|
—
|
—
|
80
|
40
|
160
|
|
A11
|
2
|
H
|
0,40
|
40
|
0,10
|
—
|
—
|
—
|
80
|
40
|
160
|
|
A12
|
3
|
H
|
0,40
|
40
|
0,10
|
—
|
—
|
—
|
80
|
40
|
160
|
|
B1
|
1
|
H
|
1,20
|
40
|
0,30
|
—
|
—
|
—
|
80
|
40
|
160
|
|
B2
|
2
|
H
|
1,20
|
40
|
0,30
|
—
|
—
|
—
|
80
|
40
|
160
|
|
B3
|
3
|
H
|
1,20
|
40
|
0,30
|
—
|
—
|
—
|
80
|
40
|
160
|
|
B4
|
1
|
H
|
2,40
|
40
|
0,60
|
—
|
—
|
—
|
80
|
40
|
160
|
|
B5
|
2
|
H
|
2,40
|
40
|
0,60
|
—
|
—
|
—
|
80
|
40
|
160
|
|
B6
|
3
|
H
|
2,40
|
40
|
0,60
|
—
|
—
|
—
|
80
|
40
|
160
|
|
B7
|
1
|
H
|
4,00
|
40
|
1,00
|
—
|
—
|
—
|
80
|
40
|
160
|
|
B8
|
2
|
H
|
4,00
|
40
|
1,00
|
—
|
—
|
—
|
80
|
40
|
160
|
|
B9
|
3
|
H
|
4,00
|
40
|
1,00
|
—
|
—
|
—
|
80
|
40
|
160
|
|
B10
|
1
|
H
|
12,00
|
40
|
3,00
|
—
|
—
|
—
|
80
|
40
|
160
|
|
B11
|
2
|
H
|
12,00
|
40
|
3,00
|
—
|
—
|
—
|
80
|
40
|
160
|
|
B12
|
3
|
H
|
12,00
|
40
|
3,00
|
—
|
—
|
—
|
80
|
40
|
160
|
|
D1
|
1
|
HC
|
0,12
|
40
|
0,03
|
0,06
|
80
|
0,03
|
—
|
40
|
160
|
|
D2
|
2
|
HC
|
0,12
|
40
|
0,03
|
0,06
|
80
|
0,03
|
—
|
40
|
160
|
|
D3
|
3
|
HC
|
0,12
|
40
|
0,03
|
0,06
|
80
|
0,03
|
—
|
40
|
160
|
|
D4
|
1
|
HC
|
0,24
|
40
|
0,06
|
0,12
|
80
|
0,06
|
—
|
40
|
160
|
|
D5
|
2
|
HC
|
0,24
|
40
|
0,06
|
0,12
|
80
|
0,06
|
—
|
40
|
160
|
|
D6
|
3
|
HC
|
0,24
|
40
|
0,06
|
0,12
|
80
|
0,06
|
—
|
40
|
160
|
|
D7
|
1
|
HC
|
0,32
|
40
|
0,08
|
0,16
|
80
|
0,08
|
—
|
40
|
160
|
|
D8
|
2
|
HC
|
0,32
|
40
|
0,08
|
0,16
|
80
|
0,08
|
—
|
40
|
160
|
|
D9
|
3
|
HC
|
0,32
|
40
|
0,08
|
0,16
|
80
|
0,08
|
—
|
40
|
160
|
|
D10
|
1
|
HC
|
0,40
|
40
|
0,10
|
0,2
|
80
|
0,1
|
—
|
40
|
160
|
|
D11
|
2
|
HC
|
0,40
|
40
|
0,10
|
0,2
|
80
|
0,1
|
—
|
40
|
160
|
|
D12
|
3
|
HC
|
0,40
|
40
|
0,10
|
0,2
|
80
|
0,1
|
—
|
40
|
160
|
|
E1
|
1
|
HC
|
1,20
|
40
|
0,30
|
0,6
|
80
|
0,3
|
—
|
40
|
160
|
|
E2
|
2
|
HC
|
1,20
|
40
|
0,30
|
0,6
|
80
|
0,3
|
—
|
40
|
160
|
|
E3
|
3
|
HC
|
1,20
|
40
|
0,30
|
0,6
|
80
|
0,3
|
—
|
40
|
160
|
|
E4
|
1
|
HC
|
2,40
|
40
|
0,60
|
1,2
|
80
|
0,6
|
—
|
40
|
160
|
|
E5
|
2
|
HC
|
2,40
|
40
|
0,60
|
1,2
|
80
|
0,6
|
—
|
40
|
160
|
|
E6
|
3
|
HC
|
2,40
|
40
|
0,60
|
1,2
|
80
|
0,6
|
—
|
40
|
160
|
|
E7
|
1
|
HC
|
4,00
|
40
|
1,00
|
2
|
80
|
1
|
—
|
40
|
160
|
|
E8
|
2
|
HC
|
4,00
|
40
|
1,00
|
2
|
80
|
1
|
—
|
40
|
160
|
|
E9
|
3
|
HC
|
4,00
|
40
|
1,00
|
2
|
80
|
1
|
—
|
40
|
160
|
|
E10
|
1
|
HC
|
12,00
|
40
|
3,00
|
6
|
80
|
3
|
—
|
40
|
160
|
|
E11
|
2
|
HC
|
12,00
|
40
|
3,00
|
6
|
80
|
3
|
—
|
40
|
160
|
|
E12
|
3
|
HC
|
12,00
|
40
|
3,00
|
6
|
80
|
3
|
—
|
40
|
160
|
|
G1
|
1
|
Ραδιοσημασμένο
|
0,12
|
40
|
0,03
|
—
|
—
|
—
|
—
|
—
|
40
|
|
G2
|
2
|
Ραδιοσημασμένο
|
0,12
|
40
|
0,03
|
—
|
—
|
—
|
—
|
—
|
40
|
|
G3
|
3
|
Ραδιοσημασμένο
|
0,12
|
40
|
0,03
|
—
|
—
|
—
|
—
|
—
|
40
|
|
G4
|
1
|
Ραδιοσημασμένο
|
0,24
|
40
|
0,06
|
—
|
—
|
—
|
—
|
—
|
40
|
|
G5
|
2
|
Ραδιοσημασμένο
|
0,24
|
40
|
0,06
|
—
|
—
|
—
|
—
|
—
|
40
|
|
G6
|
3
|
Ραδιοσημασμένο
|
0,24
|
40
|
0,06
|
—
|
—
|
—
|
—
|
—
|
40
|
|
G7
|
1
|
Ραδιοσημασμένο
|
0,32
|
40
|
0,08
|
—
|
—
|
—
|
—
|
—
|
40
|
|
G8
|
2
|
Ραδιοσημασμένο
|
0,32
|
40
|
0,08
|
—
|
—
|
—
|
—
|
—
|
40
|
|
G9
|
3
|
Ραδιοσημασμένο
|
0,32
|
40
|
0,08
|
—
|
—
|
—
|
—
|
—
|
40
|
|
G10
|
1
|
Ραδιοσημασμένο
|
0,40
|
40
|
0,10
|
—
|
—
|
—
|
—
|
—
|
40
|
|
G11
|
2
|
Ραδιοσημασμένο
|
0,40
|
40
|
0,10
|
—
|
—
|
—
|
—
|
—
|
40
|
|
G12
|
3
|
Ραδιοσημασμένο
|
0,40
|
40
|
0,10
|
—
|
—
|
—
|
—
|
—
|
40
|
|
H1
|
1
|
Ραδιοσημασμένο
|
1,20
|
40
|
0,30
|
—
|
—
|
—
|
—
|
—
|
40
|
|
H2
|
2
|
Ραδιοσημασμένο
|
1,20
|
40
|
0,30
|
—
|
—
|
—
|
—
|
—
|
40
|
|
H3
|
3
|
Ραδιοσημασμένο
|
1,20
|
40
|
0,30
|
—
|
—
|
—
|
—
|
—
|
40
|
|
H4
|
1
|
Ραδιοσημασμένο
|
2,40
|
40
|
0,60
|
—
|
—
|
—
|
—
|
—
|
40
|
|
H5
|
2
|
Ραδιοσημασμένο
|
2,40
|
40
|
0,60
|
—
|
—
|
—
|
—
|
—
|
40
|
|
H6
|
3
|
Ραδιοσημασμένο
|
2,40
|
40
|
0,60
|
—
|
—
|
—
|
—
|
—
|
40
|
|
H7
|
1
|
Ραδιοσημασμένο
|
4,00
|
40
|
1,00
|
—
|
—
|
—
|
—
|
—
|
40
|
|
H8
|
2
|
Ραδιοσημασμένο
|
4,00
|
40
|
1,00
|
—
|
—
|
—
|
—
|
—
|
40
|
|
H9
|
3
|
Ραδιοσημασμένο
|
4,00
|
40
|
1,00
|
—
|
—
|
—
|
—
|
—
|
40
|
|
H10
|
1
|
Ραδιοσημασμένο
|
12,00
|
40
|
3,00
|
—
|
—
|
—
|
—
|
—
|
40
|
|
H11
|
2
|
Ραδιοσημασμένο
|
12,00
|
40
|
3,00
|
—
|
—
|
—
|
—
|
—
|
40
|
|
H12
|
3
|
Ραδιοσημασμένο
|
12,00
|
40
|
3,00
|
—
|
—
|
—
|
—
|
—
|
40
|
|
Επισημαίνεται ότι οι «ραδιοσημασμένες» κοιλότητες είναι κενές κατά την επώαση. Τα 40 μl προστίθενται μόνο για τη μέτρηση του σπινθηρισμού.
|
Προσάρτημα 2.3
ΔΙΑΤΑΞΗ ΚΟΙΛΟΤΗΤΩΝ ΔΟΚΙΜΑΣΙΑΣ ΑΝΤΑΓΩΝΙΣΤΙΚΗΣ ΔΕΣΜΕΥΣΗΣ
|
Τρυβλίο
|
Θέση
|
Πανομοιότυπο δείγμα
|
Τύπος κοιλότητας
|
Κωδικός κοιλότητας
|
Κωδικός συγκέντρωσης
|
Αρχική συγκέντρωση ανταγωνιστή (M)
|
Αποθεματικό διάλυμα hrER (μl)
|
Όγκος ρυθμιστικού διαλύματος (μl)
|
Όγκος ιχνηθέτη (σημασμένης E2) (μL)
|
Όγκος από το τρυβλίο αραίωσης (μL)
|
Τελικός όγκος (μl)
|
Τελική συγκέντρωση ανταγωνιστή (M)
|
|
S
|
A1
|
1
|
συνολική δέσμευση
|
TB
|
TB1
|
—
|
40
|
|
40
|
80
|
160
|
—
|
|
S
|
A2
|
2
|
συνολική δέσμευση
|
TB
|
TB2
|
—
|
40
|
|
40
|
80
|
160
|
—
|
|
S
|
A3
|
3
|
συνολική δέσμευση
|
TB
|
TB3
|
—
|
40
|
|
40
|
80
|
160
|
—
|
|
S
|
A4
|
1
|
συνολική δέσμευση
|
TB
|
TB4
|
—
|
40
|
|
40
|
80
|
160
|
—
|
|
S
|
A5
|
2
|
συνολική δέσμευση
|
TB
|
TB5
|
—
|
40
|
|
40
|
80
|
160
|
—
|
|
S
|
A6
|
3
|
συνολική δέσμευση
|
TB
|
TB6
|
—
|
40
|
|
40
|
80
|
160
|
—
|
|
S
|
A7
|
1
|
μη σημασμένη E2 (υψηλό)
|
NSB
|
S0
|
2,00E-06
|
40
|
—
|
40
|
80
|
160
|
1,0E-06
|
|
S
|
A8
|
2
|
μη σημασμένη E2 (υψηλό)
|
NSB
|
S0
|
2,00E-06
|
40
|
—
|
40
|
80
|
160
|
1,0E-06
|
|
S
|
A9
|
3
|
μη σημασμένη E2 (υψηλό)
|
NSB
|
S0
|
2,00E-06
|
40
|
—
|
40
|
80
|
160
|
1,0E-06
|
|
S
|
A10
|
1
|
μη σημασμένη E2 (υψηλό)
|
NSB
|
S0
|
2,00E-06
|
40
|
—
|
40
|
80
|
160
|
1,0E-06
|
|
S
|
A11
|
2
|
μη σημασμένη E2 (υψηλό)
|
NSB
|
S0
|
2,00E-06
|
40
|
—
|
40
|
80
|
160
|
1,0E-06
|
|
S
|
A12
|
3
|
μη σημασμένη E2 (υψηλό)
|
NSB
|
S0
|
2,00E-06
|
40
|
—
|
40
|
80
|
160
|
1,0E-06
|
|
S
|
B1
|
1
|
μη ραδιοσημασμένη E2
|
S
|
S1
|
2,00E-07
|
40
|
—
|
40
|
80
|
160
|
1,0E-07
|
|
S
|
B2
|
2
|
μη ραδιοσημασμένο E2
|
S
|
S1
|
2,00E-07
|
40
|
—
|
40
|
80
|
160
|
1,0E-07
|
|
S
|
B3
|
3
|
μη ραδιοσημασμένη E2
|
S
|
S1
|
2,00E-07
|
40
|
—
|
40
|
80
|
160
|
1,0E-07
|
|
S
|
B4
|
1
|
μη ραδιοσημασμένη E2
|
S
|
S2
|
2,00E-08
|
40
|
—
|
40
|
80
|
160
|
1,0E-08
|
|
S
|
B5
|
2
|
μη ραδιοσημασμένη E2
|
S
|
S2
|
2,00E-08
|
40
|
—
|
40
|
80
|
160
|
1,0E-08
|
|
S
|
B6
|
3
|
μη ραδιοσημασμένη E2
|
S
|
S2
|
2,00E-08
|
40
|
—
|
40
|
80
|
160
|
1,0E-08
|
|
S
|
B7
|
1
|
μη ραδιοσημασμένη E2
|
S
|
S3
|
6,00E-09
|
40
|
—
|
40
|
80
|
160
|
3,0E-09
|
|
S
|
B8
|
2
|
μη ραδιοσημασμένη E2
|
S
|
S3
|
6,00E-09
|
40
|
—
|
40
|
80
|
160
|
3,0E-09
|
|
S
|
B9
|
3
|
μη ραδιοσημασμένη E2
|
S
|
S3
|
6,00E-09
|
40
|
—
|
40
|
80
|
160
|
3,0E-09
|
|
S
|
B10
|
1
|
μη ραδιοσημασμένη E2
|
S
|
S4
|
2,00E-09
|
40
|
—
|
40
|
80
|
160
|
1,0E-09
|
|
S
|
B11
|
2
|
μη ραδιοσημασμένη E2
|
S
|
S4
|
2,00E-09
|
40
|
—
|
40
|
80
|
160
|
1,0E-09
|
|
S
|
B12
|
3
|
μη ραδιοσημασμένη E2
|
S
|
S4
|
2,00E-09
|
40
|
—
|
40
|
80
|
160
|
1,0E-09
|
|
S
|
C1
|
1
|
μη ραδιοσημασμένη E2
|
S
|
S5
|
6,00E-10
|
40
|
—
|
40
|
80
|
160
|
3,0E-10
|
|
S
|
C2
|
2
|
μη ραδιοσημασμένη E2
|
S
|
S5
|
6,00E-10
|
40
|
—
|
40
|
80
|
160
|
3,0E-10
|
|
S
|
C3
|
3
|
μη ραδιοσημασμένη E2
|
S
|
S5
|
6,00E-10
|
40
|
—
|
40
|
80
|
160
|
3,0E-10
|
|
S
|
C4
|
1
|
μη ραδιοσημασμένη E2
|
S
|
S6
|
2,00E-10
|
40
|
—
|
40
|
80
|
160
|
1,0E-10
|
|
S
|
C5
|
2
|
μη ραδιοσημασμένη E2
|
S
|
S6
|
2,00E-10
|
40
|
—
|
40
|
80
|
160
|
1,0E-10
|
|
S
|
C6
|
3
|
μη ραδιοσημασμένη E2
|
S
|
S6
|
2,00E-10
|
40
|
—
|
40
|
80
|
160
|
1,0E-10
|
|
S
|
C7
|
1
|
μη ραδιοσημασμένη E2
|
S
|
S7
|
2,00E-11
|
40
|
—
|
40
|
80
|
160
|
1,0E-11
|
|
S
|
C8
|
2
|
μη ραδιοσημασμένη E2
|
S
|
S7
|
2,00E-11
|
40
|
—
|
40
|
80
|
160
|
1,0E-11
|
|
S
|
C9
|
3
|
μη ραδιοσημασμένη E2
|
S
|
S7
|
2,00E-11
|
40
|
—
|
40
|
80
|
160
|
1,0E-11
|
|
S
|
C10
|
1
|
τυφλό
|
τυφλό
|
B1
|
—
|
—
|
160
|
—
|
—
|
160
|
—
|
|
S
|
C11
|
2
|
τυφλό
|
τυφλό
|
B2
|
—
|
—
|
160
|
—
|
—
|
160
|
—
|
|
S
|
C12
|
3
|
τυφλό
|
τυφλό
|
B3
|
—
|
—
|
160
|
—
|
—
|
160
|
—
|
|
S
|
D1
|
1
|
νορεθυνοδρέλη
|
NE
|
WP1
|
6,00E-05
|
40
|
—
|
40
|
80
|
160
|
3,0E-05
|
|
S
|
D2
|
1
|
νορεθυνοδρέλη
|
NE
|
WP1
|
6,00E-05
|
40
|
—
|
40
|
80
|
160
|
3,0E-05
|
|
S
|
D3
|
1
|
νορεθυνοδρέλη
|
NE
|
WP1
|
6,00E-05
|
40
|
—
|
40
|
80
|
160
|
3,0E-05
|
|
S
|
D4
|
1
|
νορεθυνοδρέλη
|
NE
|
WP2
|
2,00E-05
|
40
|
—
|
40
|
80
|
160
|
1,0E-05
|
|
S
|
D5
|
1
|
νορεθυνοδρέλη
|
NE
|
WP2
|
2,00E-05
|
40
|
—
|
40
|
80
|
160
|
1,0E-05
|
|
S
|
D6
|
1
|
νορεθυνοδρέλη
|
NE
|
WP2
|
2,00E-05
|
40
|
—
|
40
|
80
|
160
|
1,0E-05
|
|
S
|
D7
|
1
|
νορεθυνοδρέλη
|
NE
|
WP3
|
6,00E-06
|
40
|
—
|
40
|
80
|
160
|
3,0E-06
|
|
S
|
D8
|
1
|
νορεθυνοδρέλη
|
NE
|
WP3
|
6,00E-06
|
40
|
—
|
40
|
80
|
160
|
3,0E-06
|
|
S
|
D9
|
1
|
νορεθυνοδρέλη
|
NE
|
WP3
|
6,00E-06
|
40
|
—
|
40
|
80
|
160
|
3,0E-06
|
|
S
|
D10
|
1
|
νορεθυνοδρέλη
|
NE
|
WP4
|
2,00E-06
|
40
|
—
|
40
|
80
|
160
|
1,0E-06
|
|
S
|
D11
|
1
|
νορεθυνοδρέλη
|
NE
|
WP4
|
2,00E-06
|
40
|
—
|
40
|
80
|
160
|
1,0E-06
|
|
S
|
D12
|
1
|
νορεθυνοδρέλη
|
NE
|
WP4
|
2,00E-06
|
40
|
—
|
40
|
80
|
160
|
1,0E-06
|
|
S
|
E1
|
1
|
νορεθυνοδρέλη
|
NE
|
WP
|
6,00E-07
|
40
|
|
40
|
80
|
160
|
3,0E-07
|
|
S
|
E2
|
2
|
νορεθυνοδρέλη
|
NE
|
WP
|
6,00E-07
|
40
|
|
40
|
80
|
160
|
3,0E-07
|
|
S
|
E3
|
3
|
νορεθυνοδρέλη
|
NE
|
WP
|
6,00E-07
|
40
|
|
40
|
80
|
160
|
3,0E-07
|
|
S
|
E4
|
1
|
νορεθυνοδρέλη
|
NE
|
WP
|
2,00E-07
|
40
|
|
40
|
80
|
160
|
1,0E-07
|
|
S
|
E5
|
2
|
νορεθυνοδρέλη
|
NE
|
WP
|
2,00E-07
|
40
|
|
40
|
80
|
160
|
1,0E-07
|
|
S
|
E6
|
3
|
νορεθυνοδρέλη
|
NE
|
WP
|
2,00E-07
|
40
|
|
40
|
80
|
160
|
1,0E-07
|
|
S
|
E7
|
1
|
νορεθυνοδρέλη
|
NE
|
WP
|
6,00E-08
|
40
|
—
|
40
|
80
|
160
|
3,0E-08
|
|
S
|
E8
|
2
|
νορεθυνοδρέλη
|
NE
|
WP
|
6,00E-08
|
40
|
—
|
40
|
80
|
160
|
3,0E-08
|
|
S
|
E9
|
3
|
νορεθυνοδρέλη
|
NE
|
WP
|
6,00E-08
|
40
|
—
|
40
|
80
|
160
|
3,0E-08
|
|
S
|
E10
|
1
|
νορεθυνοδρέλη
|
NE
|
WP
|
6,00E-09
|
40
|
—
|
40
|
80
|
160
|
3,0E-09
|
|
S
|
E11
|
2
|
νορεθυνοδρέλη
|
NE
|
WP
|
6,00E-09
|
40
|
—
|
40
|
80
|
160
|
3,0E-09
|
|
S
|
E12
|
3
|
νορεθυνοδρέλη
|
NE
|
WP
|
6,00E-09
|
40
|
—
|
40
|
80
|
160
|
3,0E-09
|
|
S
|
F1
|
1
|
OTES
|
N
|
OTES
|
2,00E-03
|
40
|
—
|
40
|
80
|
160
|
1,0E-03
|
|
S
|
F2
|
2
|
OTES
|
N
|
OTES
|
2,00E-03
|
40
|
—
|
40
|
80
|
160
|
1,0E-03
|
|
S
|
F3
|
3
|
OTES
|
N
|
OTES
|
2,00E-03
|
40
|
—
|
40
|
80
|
160
|
1,0E-03
|
|
S
|
F4
|
1
|
OTES
|
N
|
OTES
|
2,00E-04
|
40
|
—
|
40
|
80
|
160
|
1,0E-04
|
|
S
|
F5
|
2
|
OTES
|
N
|
OTES
|
2,00E-04
|
40
|
—
|
40
|
80
|
160
|
1,0E-04
|
|
S
|
F6
|
3
|
OTES
|
N
|
OTES
|
2,00E-04
|
40
|
—
|
40
|
80
|
160
|
1,0E-04
|
|
S
|
F7
|
1
|
OTES
|
N
|
OTES
|
2,00E-05
|
40
|
—
|
40
|
80
|
160
|
3,0E-05
|
|
S
|
F8
|
2
|
OTES
|
N
|
OTES
|
2,00E-05
|
40
|
—
|
40
|
80
|
160
|
3,0E-05
|
|
S
|
F9
|
3
|
OTES
|
N
|
OTES
|
2,00E-05
|
40
|
—
|
40
|
80
|
160
|
3,0E-05
|
|
S
|
F10
|
1
|
OTES
|
N
|
OTES
|
2,00E-06
|
40
|
—
|
40
|
80
|
160
|
1,0E-06
|
|
S
|
F11
|
2
|
OTES
|
N
|
OTES
|
2,00E-06
|
40
|
—
|
40
|
80
|
160
|
1,0E-06
|
|
S
|
F12
|
3
|
OTES
|
N
|
OTES
|
2,00E-06
|
40
|
—
|
40
|
80
|
160
|
1,0E-06
|
|
S
|
G1
|
1
|
OTES
|
N
|
OTES
|
2,00E-07
|
40
|
—
|
40
|
80
|
160
|
3,0E-07
|
|
S
|
G2
|
2
|
OTES
|
N
|
OTES
|
2,00E-07
|
40
|
—
|
40
|
80
|
160
|
3,0E-07
|
|
S
|
G3
|
3
|
OTES
|
N
|
OTES
|
2,00E-07
|
40
|
—
|
40
|
80
|
160
|
3,0E-07
|
|
S
|
G4
|
1
|
OTES
|
N
|
OTES
|
2,00E-08
|
40
|
—
|
40
|
80
|
160
|
1,0E-08
|
|
S
|
G5
|
2
|
OTES
|
N
|
OTES
|
2,00E-08
|
40
|
—
|
40
|
80
|
160
|
1,0E-08
|
|
S
|
G6
|
3
|
OTES
|
N
|
OTES
|
2,00E-08
|
40
|
—
|
40
|
80
|
160
|
1,0E-08
|
|
S
|
G7
|
1
|
OTES
|
N
|
OTES
|
2,00E-09
|
40
|
—
|
40
|
80
|
160
|
1,0E-09
|
|
S
|
G8
|
2
|
OTES
|
N
|
OTES
|
2,00E-09
|
40
|
—
|
40
|
80
|
160
|
1,0E-09
|
|
S
|
G9
|
3
|
OTES
|
N
|
OTES
|
2,00E-09
|
40
|
—
|
40
|
80
|
160
|
1,0E-09
|
|
S
|
G10
|
1
|
OTES
|
N
|
OTES
|
2,00E-10
|
40
|
—
|
40
|
—
|
160
|
1,0E-10
|
|
S
|
G11
|
2
|
OTES
|
N
|
OTES
|
2,00E-10
|
40
|
—
|
40
|
—
|
160
|
1,0E-10
|
|
S
|
G12
|
3
|
OTES
|
N
|
OTES
|
2,00E-10
|
40
|
—
|
40
|
—
|
160
|
1,0E-10
|
|
S
|
H1
|
1
|
ραδιοσημασμένο
|
H
|
H
|
—
|
—
|
—
|
40
|
—
|
40
|
—
|
|
S
|
H2
|
1
|
ραδιοσημασμένο
|
H
|
H
|
—
|
—
|
—
|
40
|
—
|
40
|
—
|
|
S
|
H3
|
1
|
ραδιοσημασμένο
|
H
|
H
|
—
|
—
|
—
|
40
|
—
|
40
|
—
|
|
S
|
H4
|
1
|
ραδιοσημασμένο
|
H
|
H
|
—
|
—
|
—
|
40
|
—
|
40
|
—
|
|
S
|
H5
|
1
|
ραδιοσημασμένο
|
H
|
H
|
—
|
—
|
—
|
40
|
—
|
40
|
—
|
|
S
|
H6
|
1
|
ραδιοσημασμένο
|
H
|
H
|
—
|
—
|
—
|
40
|
—
|
40
|
—
|
|
S
|
H7
|
1
|
ρυθμιστικό διάλυμα
|
BC
|
BC
|
—
|
40
|
80
|
40
|
—
|
160
|
—
|
|
S
|
H8
|
1
|
ρυθμιστικό διάλυμα
|
BC
|
BC
|
—
|
40
|
80
|
40
|
—
|
160
|
—
|
|
S
|
H9
|
1
|
ρυθμιστικό διάλυμα
|
BC
|
BC
|
—
|
40
|
80
|
40
|
—
|
160
|
—
|
|
S
|
H10
|
1
|
ρυθμιστικό διάλυμα
|
BC
|
BC
|
—
|
40
|
80
|
40
|
—
|
160
|
—
|
|
S
|
H11
|
1
|
ρυθμιστικό διάλυμα
|
BC
|
BC
|
—
|
40
|
80
|
40
|
—
|
160
|
—
|
|
S
|
H12
|
1
|
ρυθμιστικό διάλυμα
|
BC
|
BC
|
—
|
40
|
80
|
40
|
—
|
160
|
—
|
Επισημαίνεται ότι οι «ραδιοσημασμένες» κοιλότητες είναι κενές κατά την επώαση. Τα 40 μl προστίθενται μόνο για τη μέτρηση του σπινθηρισμού.
|
Διάταξη κοιλοτήτων δοκιμασίας ανταγωνιστικής δέσμευσης
|
|
Τρυβλίο
|
Θέση
|
Πανομοιότυπο δείγμα
|
Τύπος κοιλότητας
|
Κωδικός κοιλότητας
|
Κωδικός συγκέντρωσης
|
Αρχική συγκέντρωση ανταγωνιστή (Μ)
|
Αποθεματικό διάλυμα hrER (μL)
|
Όγκος ρυθμιστικού διαλύματος (μL)
|
Όγκος ιχνηθέτη (σημασμένης E2) (μL)
|
Όγκος από το τρυβλίο αραίωσης (μL)
|
Τελικός όγκος (μl)
|
Τελική συγκέντρωση ανταγωνιστή (Μ)
|
|
P1
|
A1
|
1
|
συνολική δέσμευση
|
TB
|
TBB1B1
|
—
|
40
|
—
|
40
|
80
|
160
|
—
|
|
P1
|
A2
|
2
|
συνολική δέσμευση
|
TB
|
TB2
|
—
|
40
|
—
|
40
|
80
|
160
|
—
|
|
P1
|
A3
|
3
|
συνολική δέσμευση
|
TB
|
TB3
|
—
|
40
|
—
|
40
|
80
|
160
|
—
|
|
P1
|
A4
|
1
|
συνολική δέσμευση
|
TB
|
TB4
|
—
|
40
|
—
|
40
|
80
|
160
|
—
|
|
P1
|
A5
|
2
|
συνολική δέσμευση
|
TB
|
TB5
|
—
|
40
|
—
|
40
|
80
|
160
|
—
|
|
P1
|
A6
|
3
|
συνολική δέσμευση
|
TB
|
TB6
|
—
|
40
|
—
|
40
|
80
|
160
|
—
|
|
P1
|
A7
|
1
|
μη σημασμένη E2 (υψηλό)
|
NSB
|
S0
|
2,00E-06
|
40
|
—
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
A8
|
2
|
μη σημασμένη E2 (υψηλό)
|
NSB
|
S0
|
2,00E-06
|
40
|
—
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
A9
|
3
|
μη σημασμένη E2 (υψηλό)
|
NSB
|
S0
|
2,00E-06
|
40
|
—
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
A10
|
1
|
μη σημασμένη E2 (υψηλό)
|
NSB
|
S0
|
2,00E-06
|
40
|
—
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
A11
|
2
|
μη σημασμένη E2 (υψηλό)
|
NSB
|
S0
|
2,00E-06
|
40
|
—
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
A12
|
3
|
μη σημασμένη E2 (υψηλό)
|
NSB
|
S0
|
2,00E-06
|
40
|
—
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
B1
|
1
|
Υπό δοκιμή ουσία 1
|
TC1
|
1
|
2,00E-03
|
40
|
0
|
40
|
80
|
160
|
1,0E-03
|
|
P1
|
B2
|
2
|
Υπό δοκιμή ουσία 1
|
TC1
|
1
|
2,00E-03
|
40
|
0
|
40
|
80
|
160
|
1,0E-03
|
|
P1
|
B3
|
3
|
Υπό δοκιμή ουσία 1
|
TC1
|
1
|
2,00E-03
|
40
|
0
|
40
|
80
|
160
|
1,0E-03
|
|
P1
|
B4
|
1
|
Υπό δοκιμή ουσία 1
|
TC1
|
2
|
2,00E-04
|
40
|
0
|
40
|
80
|
160
|
1,0E-04
|
|
P1
|
B5
|
2
|
Υπό δοκιμή ουσία 1
|
TC1
|
2
|
2,00E-04
|
40
|
0
|
40
|
80
|
160
|
1,0E-04
|
|
P1
|
B6
|
3
|
Υπό δοκιμή ουσία 1
|
TC1
|
2
|
2,00E-04
|
40
|
0
|
40
|
80
|
160
|
1,0E-04
|
|
P1
|
B7
|
1
|
Υπό δοκιμή ουσία 1
|
TC1
|
3
|
2,00E-05
|
40
|
0
|
40
|
80
|
160
|
1,0E-05
|
|
P1
|
B8
|
2
|
Υπό δοκιμή ουσία 1
|
TC1
|
3
|
2,00E-05
|
40
|
0
|
40
|
80
|
160
|
1,0E-05
|
|
P1
|
B9
|
3
|
Υπό δοκιμή ουσία 1
|
TC1
|
3
|
2,00E-05
|
40
|
0
|
40
|
80
|
160
|
1,0E-05
|
|
P1
|
B10
|
1
|
Υπό δοκιμή ουσία 1
|
TC1
|
4
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
B11
|
2
|
Υπό δοκιμή ουσία 1
|
TC1
|
4
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
B12
|
3
|
Υπό δοκιμή ουσία 1
|
TC1
|
4
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
C1
|
1
|
Υπό δοκιμή ουσία 1
|
TC1
|
5
|
2,00E-07
|
40
|
0
|
40
|
80
|
160
|
1,0E-07
|
|
P1
|
C2
|
2
|
Υπό δοκιμή ουσία 1
|
TC1
|
5
|
2,00E-07
|
40
|
0
|
40
|
80
|
160
|
1,0E-07
|
|
P1
|
C3
|
3
|
Υπό δοκιμή ουσία 1
|
TC1
|
5
|
2,00E-07
|
40
|
0
|
40
|
80
|
160
|
1,0E-07
|
|
P1
|
C4
|
1
|
Υπό δοκιμή ουσία 1
|
TC1
|
6
|
2,00E-08
|
40
|
0
|
40
|
80
|
160
|
1,0E-08
|
|
P1
|
C5
|
2
|
Υπό δοκιμή ουσία 1
|
TC1
|
6
|
2,00E-08
|
40
|
0
|
40
|
80
|
160
|
1,0E-08
|
|
P1
|
C6
|
3
|
Υπό δοκιμή ουσία 1
|
TC1
|
6
|
2,00E-08
|
40
|
0
|
40
|
80
|
160
|
1,0E-08
|
|
P1
|
C7
|
1
|
Υπό δοκιμή ουσία 1
|
TC1
|
7
|
2,00E-09
|
40
|
0
|
40
|
80
|
160
|
1,0E-09
|
|
P1
|
C8
|
2
|
Υπό δοκιμή ουσία 1
|
TC1
|
7
|
2,00E-09
|
40
|
0
|
40
|
80
|
160
|
1,0E-09
|
|
P1
|
C9
|
3
|
Υπό δοκιμή ουσία 1
|
TC1
|
7
|
2,00E-09
|
40
|
0
|
40
|
80
|
160
|
1,0E-09
|
|
P1
|
C10
|
1
|
Υπό δοκιμή ουσία 1
|
TC1
|
8
|
2,00E-10
|
40
|
0
|
40
|
80
|
160
|
1,0E-10
|
|
P1
|
C11
|
2
|
Υπό δοκιμή ουσία 1
|
TC1
|
8
|
2,00E-10
|
40
|
0
|
40
|
80
|
160
|
1,0E-10
|
|
P1
|
C12
|
3
|
Υπό δοκιμή ουσία 1
|
TC1
|
8
|
2,00E-10
|
40
|
0
|
40
|
80
|
160
|
1,0E-10
|
|
P1
|
D1
|
1
|
Υπό δοκιμή ουσία 2
|
TC2
|
1
|
2,00E-03
|
40
|
0
|
40
|
80
|
160
|
1,0E-03
|
|
P1
|
D2
|
2
|
Υπό δοκιμή ουσία 2
|
TC2
|
1
|
2,00E-03
|
40
|
0
|
40
|
80
|
160
|
1,0E-03
|
|
P1
|
D3
|
3
|
Υπό δοκιμή ουσία 2
|
TC2
|
1
|
2,00E-03
|
40
|
0
|
40
|
80
|
160
|
1,0E-03
|
|
P1
|
D4
|
1
|
Υπό δοκιμή ουσία 2
|
TC2
|
2
|
2,00E-04
|
40
|
0
|
40
|
80
|
160
|
1,0E-04
|
|
P1
|
D5
|
2
|
Υπό δοκιμή ουσία 2
|
TC2
|
2
|
2,00E-04
|
40
|
0
|
40
|
80
|
160
|
1,0E-04
|
|
P1
|
D6
|
3
|
Υπό δοκιμή ουσία 2
|
TC2
|
2
|
2,00E-04
|
40
|
0
|
40
|
80
|
160
|
1,0E-04
|
|
P1
|
D7
|
1
|
Υπό δοκιμή ουσία 2
|
TC2
|
3
|
2,00E-05
|
40
|
0
|
40
|
80
|
160
|
1,0E-05
|
|
P1
|
D8
|
2
|
Υπό δοκιμή ουσία 2
|
TC2
|
3
|
2,00E-05
|
40
|
0
|
40
|
80
|
160
|
1,0E-05
|
|
P1
|
D9
|
3
|
Υπό δοκιμή ουσία 2
|
TC2
|
3
|
2,00E-05
|
40
|
0
|
40
|
80
|
160
|
1,0E-05
|
|
P1
|
D10
|
1
|
Υπό δοκιμή ουσία 2
|
TC2
|
4
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
D11
|
2
|
Υπό δοκιμή ουσία 2
|
TC2
|
4
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
D12
|
3
|
Υπό δοκιμή ουσία 2
|
TC2
|
4
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
E1
|
1
|
Υπό δοκιμή ουσία 2
|
TC2
|
5
|
2,00E-07
|
40
|
0
|
40
|
80
|
160
|
1,0E-07
|
|
P1
|
E2
|
2
|
Υπό δοκιμή ουσία 2
|
TC2
|
5
|
2,00E-07
|
40
|
0
|
40
|
80
|
160
|
1,0E-07
|
|
P1
|
E3
|
3
|
Υπό δοκιμή ουσία 2
|
TC2
|
5
|
2,00E-07
|
40
|
0
|
40
|
80
|
160
|
1,0E-07
|
|
P1
|
E4
|
1
|
Υπό δοκιμή ουσία 2
|
TC2
|
6
|
—
|
40
|
0
|
40
|
80
|
160
|
1,0E-08
|
|
P1
|
E5
|
2
|
Υπό δοκιμή ουσία 2
|
TC2
|
6
|
—
|
40
|
0
|
40
|
80
|
160
|
1,0E-08
|
|
P1
|
E6
|
3
|
Υπό δοκιμή ουσία 2
|
TC2
|
6
|
—
|
40
|
0
|
40
|
80
|
160
|
1,0E-08
|
|
P1
|
E7
|
1
|
Υπό δοκιμή ουσία 2
|
TC2
|
7
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-09
|
|
P1
|
E8
|
2
|
Υπό δοκιμή ουσία 2
|
TC2
|
7
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-09
|
|
P1
|
E9
|
3
|
Υπό δοκιμή ουσία 2
|
TC2
|
7
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-09
|
|
P1
|
E10
|
1
|
Υπό δοκιμή ουσία 2
|
TC2
|
8
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-10
|
|
P1
|
E11
|
2
|
Υπό δοκιμή ουσία 2
|
TC2
|
8
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-10
|
|
P1
|
E12
|
3
|
Υπό δοκιμή ουσία 2
|
TC2
|
8
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-10
|
|
P1
|
F1
|
1
|
Υπό δοκιμή ουσία 3
|
TC3
|
1
|
2,00E-03
|
40
|
0
|
40
|
80
|
160
|
1,0E-03
|
|
P1
|
F2
|
2
|
Υπό δοκιμή ουσία 3
|
TC3
|
1
|
2,00E-03
|
40
|
0
|
40
|
80
|
160
|
1,0E-03
|
|
P1
|
F3
|
3
|
Υπό δοκιμή ουσία 3
|
TC3
|
1
|
2,00E-03
|
40
|
0
|
40
|
80
|
160
|
1,0E-03
|
|
P1
|
F4
|
1
|
Υπό δοκιμή ουσία 3
|
TC3
|
2
|
2,00E-04
|
40
|
0
|
40
|
80
|
160
|
1,0E-04
|
|
P1
|
F5
|
2
|
Υπό δοκιμή ουσία 3
|
TC3
|
2
|
2,00E-04
|
40
|
0
|
40
|
80
|
160
|
1,0E-04
|
|
P1
|
F6
|
3
|
Υπό δοκιμή ουσία 3
|
TC3
|
2
|
2,00E-04
|
40
|
0
|
40
|
80
|
160
|
1,0E-04
|
|
P1
|
F7
|
1
|
Υπό δοκιμή ουσία 3
|
TC3
|
3
|
2,00E-05
|
40
|
0
|
40
|
80
|
160
|
1,0E-05
|
|
P1
|
F8
|
2
|
Υπό δοκιμή ουσία 3
|
TC3
|
3
|
2,00E-05
|
40
|
0
|
40
|
80
|
160
|
1,0E-05
|
|
P1
|
F9
|
3
|
Υπό δοκιμή ουσία 3
|
TC3
|
3
|
2,00E-05
|
40
|
0
|
40
|
80
|
160
|
1,0E-05
|
|
P1
|
F10
|
1
|
Υπό δοκιμή ουσία 3
|
TC3
|
4
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
F11
|
2
|
Υπό δοκιμή ουσία 3
|
TC3
|
4
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
F12
|
3
|
Υπό δοκιμή ουσία 3
|
TC3
|
4
|
2,00E-06
|
40
|
0
|
40
|
80
|
160
|
1,0E-06
|
|
P1
|
G1
|
1
|
Υπό δοκιμή ουσία 3
|
TC3
|
5
|
2,00E-07
|
40
|
0
|
40
|
80
|
160
|
1,0E-07
|
|
P1
|
G2
|
2
|
Υπό δοκιμή ουσία 3
|
TC3
|
5
|
2,00E-07
|
40
|
0
|
40
|
80
|
160
|
1,0E-07
|
|
P1
|
G3
|
3
|
Υπό δοκιμή ουσία 3
|
TC3
|
5
|
2,00E-07
|
40
|
0
|
40
|
80
|
160
|
1,0E-07
|
|
P1
|
G4
|
1
|
Υπό δοκιμή ουσία 3
|
TC3
|
6
|
2,00E-08
|
40
|
0
|
40
|
80
|
160
|
1,0E-08
|
|
P1
|
G5
|
2
|
Υπό δοκιμή ουσία 3
|
TC3
|
6
|
2,00E-08
|
40
|
0
|
40
|
80
|
160
|
1,0E-08
|
|
P1
|
G6
|
3
|
Υπό δοκιμή ουσία 3
|
TC3
|
6
|
2,00E-08
|
40
|
0
|
40
|
80
|
160
|
1,0E-08
|
|
P1
|
G7
|
1
|
Υπό δοκιμή ουσία 3
|
TC3
|
7
|
2,00E-09
|
40
|
0
|
40
|
80
|
160
|
1,0E-09
|
|
P1
|
G8
|
2
|
Υπό δοκιμή ουσία 3
|
TC3
|
7
|
2,00E-09
|
40
|
0
|
40
|
80
|
160
|
1,0E-09
|
|
P1
|
G9
|
3
|
Υπό δοκιμή ουσία 3
|
TC3
|
7
|
2,00E-09
|
40
|
0
|
40
|
80
|
160
|
1,0E-09
|
|
P1
|
G10
|
1
|
Υπό δοκιμή ουσία 3
|
TC3
|
8
|
2,00E-10
|
40
|
0
|
40
|
80
|
160
|
1,0E-10
|
|
P1
|
G11
|
2
|
Υπό δοκιμή ουσία 3
|
TC3
|
8
|
2,00E-10
|
40
|
0
|
40
|
80
|
160
|
1,0E-10
|
|
P1
|
G12
|
3
|
Υπό δοκιμή ουσία 3
|
TC3
|
8
|
2,00E-10
|
40
|
0
|
40
|
80
|
160
|
1,0E-10
|
|
P1
|
H1
|
1
|
νορεθυνοδρέλη
|
NE
|
|
IC50
|
40
|
0
|
40
|
80
|
160
|
|
|
P1
|
H2
|
2
|
νορεθυνοδρέλη
|
NE
|
|
IC50
|
40
|
0
|
40
|
80
|
160
|
|
|
P1
|
H3
|
3
|
νορεθυνοδρέλη
|
NE
|
|
IC50
|
40
|
0
|
40
|
80
|
160
|
|
|
P1
|
H4
|
1
|
νορεθυνοδρέλη
|
NE
|
|
1,00E-4,5
|
40
|
0
|
40
|
80
|
160
|
|
|
P1
|
H5
|
2
|
νορεθυνοδρέλη
|
NE
|
|
1,00E-4,5
|
40
|
0
|
40
|
80
|
160
|
|
|
P1
|
H6
|
3
|
νορεθυνοδρέλη
|
NE
|
|
1,00E-4,5
|
40
|
0
|
40
|
80
|
160
|
|
|
P1
|
H7
|
1
|
μη ραδιοσημασμένη E2 S
|
|
|
IC50
|
40
|
0
|
40
|
80
|
160
|
|
|
P1
|
H8
|
2
|
μη ραδιοσημασμένη E2 S
|
|
|
IC50
|
40
|
0
|
40
|
80
|
160
|
|
|
P1
|
H9
|
3
|
μη ραδιοσημασμένη E2 S
|
|
|
IC50
|
40
|
0
|
40
|
80
|
160
|
|
|
P1
|
H10
|
1
|
μη ραδιοσημασμένη E2 S
|
|
|
1,00E-7
|
40
|
0
|
40
|
80
|
160
|
|
|
P1
|
H11
|
2
|
μη ραδιοσημασμένη E2 S
|
|
|
1,00E-7
|
40
|
0
|
40
|
80
|
160
|
|
|
P1
|
H12
|
3
|
μη ραδιοσημασμένη E2 S
|
|
|
1,00E-7
|
40
|
0
|
40
|
80
|
160
|
|
Προσάρτημα 3
IN VITRO ΔΟΚΙΜΑΣΙΑ ΔΕΣΜΕΥΣΗΣ ΥΠΟΔΟΧΕΑ ΟΙΣΤΡΟΓΟΝΩΝ ΜΕ ΧΡΗΣΗ ΑΝΑΣΥΝΔΥΑΣΜΕΝΗΣ ΑΝΘΡΩΠΙΝΗΣ ΠΡΩΤΕΪΝΗΣ ΠΕΡΙΟΧΗΣ ΔΕΣΜΕΥΣΗΣ ΠΡΟΣΔΕΜΑΤΟΣ ERΑ, ΤΟΥ CHEMICAL EVALUATION AND RESEARCH INSTITUTE (CERI) (ΙΝΣΤΙΤΟΥΤΟ ΑΞΙΟΛΟΓΗΣΗΣ ΚΑΙ ΕΡΕΥΝΑΣ ΧΗΜΙΚΩΝ ΟΥΣΙΩΝ)
ΑΡΧΙΚΕΣ ΕΚΤΙΜΗΣΕΙΣ ΚΑΙ ΠΕΡΙΟΡΙΣΜΟΙ (ΒΛ. ΕΠΙΣΗΣ ΓΕΝΙΚΗ ΕΙΣΑΓΩΓΗ)
|
1.
|
Η παρούσα in vitro δοκιμασία κορεσμού υποδοχέα οιστρογόνων (ERα) και ανταγωνιστικής δέσμευσης χρησιμοποιεί μια περιοχή δέσμευσης προσδέματος (ligand binding domain, LBD) του ανθρώπινου ERα (hrERα). Αυτό το πρωτεϊνικό κατασκεύασμα παρήχθη από το ιαπωνικό Ινστιτούτο Αξιολόγησης και Έρευνας Χημικών Ουσιών (CERI) ως πρωτεΐνη σύντηξης με S-τρανσφεράση της γλουταθειόνης (GST) και εκφράζεται στην E. coli. Το πρωτόκολλο CERI αποτέλεσε αντικείμενο διεθνούς μελέτης επικύρωσης πολλών εργαστηρίων (2), η οποία κατέδειξε την καταλληλότητα και την αξιοπιστία του για τον επιδιωκόμενο σκοπό της δοκιμασίας.
|
|
2.
|
Η παρούσα δοκιμασία αποτελεί διαδικασία διαλογής για τον προσδιορισμό ουσιών που μπορούν να δεσμεύονται στον hrERα. Χρησιμοποιείται για τον προσδιορισμό της ικανότητας μιας υπό δοκιμή χημικής ουσίας να ανταγωνίζεται τη 17β-οιστραδιόλη ως προς τη δέσμευση στην hrERα-LBD. Τα ποσοτικά αποτελέσματα της δοκιμασίας είναι η IC50 (μέτρο της συγκέντρωσης της υπό δοκιμή χημικής ουσίας που απαιτείται για να εκτοπιστεί το ήμισυ της [3H]17β-οιστραδιόλης από τον hrERα) και οι σχετικές συγγένειες δέσμευσης των υπό δοκιμή χημικών ουσιών για τον hrERα σε σύγκριση με τη 17β-οιστραδιόλη. Για λόγους διαλογής των χημικών ουσιών, στα αποδεκτά ποιοτικά αποτελέσματα της δοκιμασίας περιλαμβάνεται η ταξινόμηση των υπό δοκιμή χημικών ουσιών ως δεσμευόμενων, μη δεσμευόμενων ή αμφίβολης δέσμευσης στον hrERα, με βάση τα κριτήρια που περιγράφονται για τις καμπύλες δέσμευσης.
|
|
3.
|
Στη δοκιμασία χρησιμοποιείται ραδιοσημασμένο πρόσδεμα για τον οποίο το εργαστήριο απαιτείται να διαθέτει άδεια ραδιενεργών υλικών. Για κάθε διαδικασία στο πλαίσιο της οποίας γίνεται χρήση ραδιοϊσοτόπων και επικίνδυνων χημικών ουσιών θα πρέπει να τηρούνται οι κανονισμοί και οι διαδικασίες που ορίζει η εθνική νομοθεσία.
|
|
4.
|
Πριν από τη χρήση της παρούσας δοκιμασίας για κανονιστικούς σκοπούς, θα πρέπει να μελετηθούν οι ενότητες «ΓΕΝΙΚΗ ΕΙΣΑΓΩΓΗ» και «ΣΤΟΙΧΕΙΑ ΔΟΚΙΜΑΣΙΑΣ ΔΕΣΜΕΥΣΗΣ hrER». Οι ορισμοί και οι συντομογραφίες που χρησιμοποιούνται στην παρούσα κατευθυντήρια γραμμή δοκιμών παρατίθενται στο προσάρτημα 1.
|
ΑΡΧΕΣ ΤΗΣ ΔΟΚΙΜΑΣΙΑΣ (ΒΛ. ΕΠΙΣΗΣ ΓΕΝΙΚΗ ΕΙΣΑΓΩΓΗ)
|
5.
|
Η δοκιμασία δέσμευσης hrERα μετρά την ικανότητα ενός ραδιοσημασμένου προσδέματος ([3H]17β-οιστραδιόλη) να δεσμεύεται στον ER παρουσία αυξανόμενων συγκεντρώσεων μιας υπό δοκιμή χημικής ουσίας (ανταγωνιστή). Οι υπό δοκιμή χημικές ουσίες που παρουσιάζουν υψηλή συγγένεια για τον ER ανταγωνίζονται με το ραδιοσημασμένο πρόσδεμα σε χαμηλότερη συγκέντρωση σε σύγκριση με τις χημικές ουσίες με χαμηλότερη συγγένεια για τον υποδοχέα.
|
|
6.
|
Η δοκιμασία αυτή αποτελείται από δύο βασικά στοιχεία: ένα πείραμα δέσμευσης κορεσμού για τον χαρακτηρισμό των παραμέτρων αλληλεπίδρασης υποδοχέα-προσδέματος, ακολουθούμενο από ένα πείραμα ανταγωνιστικής δέσμευσης που χαρακτηρίζει τον ανταγωνισμό μεταξύ μιας υπό δοκιμή χημικής ουσίας και ενός ραδιοσημασμένου προσδέματος ως προς τη δέσμευση στον ER.
|
|
7.
|
Σκοπός του πειράματος δέσμευσης κορεσμού είναι ο χαρακτηρισμός συγκεκριμένης παρτίδας υποδοχέων ως προς τη συγγένεια δέσμευσης και τον αριθμό εν είδει προετοιμασίας για τη διεξαγωγή του πειράματος ανταγωνιστικής δέσμευσης. Το πείραμα δέσμευσης κορεσμού μετρά, υπό συνθήκες ισορροπίας, τη συγγένεια καθορισμένης συγκέντρωσης του υποδοχέα οιστρογόνων σε σχέση με το φυσικό πρόσδεμά του (η οποία αντιπροσωπεύεται από τη σταθερά διάστασης Kd), και τη συγκέντρωση των ενεργών θέσεων του υποδοχέα (Bmax).
|
|
8.
|
Το πείραμα ανταγωνιστικής δέσμευσης μετρά τη συγγένεια δέσμευσης μιας ουσίας στον ER, ως ανταγωνίστρια της [3H]17β-οιστραδιόλης. Η συγγένεια προσδιορίζεται ποσοτικά βάσει της συγκέντρωσης της υπό δοκιμή χημικής ουσίας η οποία, σε συνθήκες ισορροπίας, αναστέλλει το 50 % της ειδικής δέσμευσης της [3H]17β-οιστραδιόλης (και η οποία καλείται «ανασταλτική συγκέντρωση 50 %» ή IC50). Η συγγένεια μπορεί επίσης να εκτιμηθεί με χρήση της σχετικής συγγένειας δέσμευσης (RBA, σε σχέση με την IC50 της οιστραδιόλης που μετράται χωριστά στην ίδια σειρά δοκιμών). Το πείραμα ανταγωνιστικής δέσμευσης μετρά τη δέσμευση της [3H]17β-οιστραδιόλης σε καθορισμένη συγκέντρωση παρουσία ευρέος φάσματος (οκτώ τάξεων μεγέθους) συγκεντρώσεων της υπό δοκιμή χημικής ουσίας. Στη συνέχεια, τα δεδομένα προσαρμόζονται σε μια μορφή της εξίσωσης Hill (Hill, 1910) βάσει της οποίας περιγράφεται η εκτόπιση του ραδιοσημασμένου προσδέματος από ανταγωνιστική δεσμευόμενη ουσία μίας θέσης. Ο βαθμός εκτόπισης της ραδιοσημασμένης οιστραδιόλης σε ισορροπία χρησιμοποιείται για τον χαρακτηρισμό της υπό δοκιμή χημικής ουσίας ως δεσμευόμενης, μη δεσμευόμενης ή αμφίβολης απόκρισης.
|
ΔΙΑΔΙΚΑΣΙΑ
Επίδειξη των αποδεκτών επιδόσεων πρωτεΐνης hrERα
|
9.
|
Πριν από την ένταξη των δοκιμασιών δέσμευσης κορεσμού και ανταγωνιστικής δέσμευσης στην καθημερινή πρακτική, θα πρέπει να καταδεικνύονται οι ορθές επιδόσεις κάθε νέας παρτίδας hrERα στο εργαστήριο στο οποίο θα χρησιμοποιηθεί. Για την επίδειξη των επιδόσεων θα πρέπει να χρησιμοποιείται διαδικασία δύο σταδίων. Τα στάδια αυτής είναι τα ακόλουθα:
|
—
|
Διεξαγωγή δοκιμασίας δέσμευσης κορεσμού [3H]17β-οιστραδιόλης με σκοπό να καταδειχθεί η ειδικότητα και ο κορεσμός του hrERα. Η μη γραμμική ανάλυση παλινδρόμησης των δεδομένων αυτών (π.χ. BioSoft, McPherson 1985, Motulsky 1995) και η επακόλουθη ανάλυση Scatchard θα πρέπει να τεκμηριώνουν τη συγγένεια δέσμευσης της [3H]17β-οιστραδιόλης με τον hrERα (Kd) και τον αριθμό των υποδοχέων (Bmax) για κάθε παρτίδα hrERα.
|
|
—
|
Διεξαγωγή δοκιμασίας ανταγωνιστικής δέσμευσης με χρήση των ουσιών μαρτύρων [οιστρογόνο αναφοράς (17β-οιστραδιόλη), μια ασθενώς δεσμευόμενη ουσία (π.χ. νορεθυνοδρέλη ή νορεθινδρόνη) και μια μη δεσμευόμενη ουσία (οκτυλοτριαιθοξυσιλάνιο, OTES)]. Κάθε εργαστήριο θα πρέπει να δημιουργεί βάση ιστορικών δεδομένων για να τεκμηριώνει τη συνέπεια της τιμής IC50 και των σχετικών τιμών για το οιστρογόνο αναφοράς και την ασθενώς δεσμευόμενη ουσία στα διάφορα πειράματα και τις διάφορες παρτίδες hrERα. Επιπλέον, οι παράμετροι των καμπυλών ανταγωνιστικής δέσμευσης για τις ουσίες μάρτυρες θα πρέπει να περιλαμβάνονται εντός των ορίων του διαστήματος εμπιστοσύνης 95 % (βλ. πίνακα 1) που αναπτύχθηκαν με χρήση δεδομένων των εργαστηρίων που συμμετείχαν στη μελέτη επικύρωσης για την παρούσα δοκιμασία (2).
|
Πίνακας 1
Κριτήρια επιδόσεων που αναπτύχθηκαν για το οιστρογόνο αναφοράς και την ασθενώς δεσμευόμενη ουσία της δοκιμασίας δέσμευσης hrER CERI
|
Ουσία
|
Παράμετρος
|
Μέσος όρος (11)
|
Τυπική απόκλιση (n)
|
Διαστήματα εμπιστοσύνης 95 % (12)
|
|
Κατώτατο όριο
|
Ανώτατο όριο
|
|
17β-Οιστραδιόλη
|
Μέγιστη απόκριση
|
104,74
|
13,12 (70)
|
101,6
|
107,9
|
|
Ελάχιστη απόκριση
|
0,85
|
2,41 (70)
|
0,28
|
1,43
|
|
Κλίση Hill
|
–1,22
|
0,20 (70)
|
–1,27
|
–1,17
|
|
LogIC50
|
–8,93
|
0,23 (70)
|
–8,98
|
–8,87
|
|
Νορεθυνοδρέλη
|
Μέγιστη απόκριση
|
101,31
|
10,55 (68)
|
98,76
|
103,90
|
|
Ελάχιστη απόκριση
|
2,39
|
5,01 (68)
|
1,18
|
3,60
|
|
Κλίση Hill
|
–1,04
|
0,21 (68)
|
–1,09
|
–0,99
|
|
LogIC50
|
–6,19
|
0,40 (68)
|
–6,29
|
–6,10
|
|
Νορεθινδρόνη (13)
|
Μέγιστη απόκριση
|
92,27
|
7,79 (23)
|
88,90
|
95,63
|
|
Ελάχιστη απόκριση
|
16,52
|
10,59 (23)
|
11,94
|
21,10
|
|
Κλίση Hill
|
–1,18
|
0,32 (23)
|
–1,31
|
–1,04
|
|
LogIC50
|
–6,01
|
0,54 (23)
|
–6,25
|
–5,78
|
|
Απόδειξη της τεχνικής ικανότητας του εργαστηρίου
|
10.
|
Βλ. παραγράφους 17 και 18, και πίνακα 2 στην ενότητα «ΣΤΟΙΧΕΙΑ ΔΟΚΙΜΑΣΙΑΣ ΔΕΣΜΕΥΣΗΣ hrER» της παρούσας μεθόδου δοκιμών. Κάθε δοκιμασία (κορεσμού και ανταγωνιστικής δέσμευσης) θα πρέπει να περιλαμβάνει τρεις ανεξάρτητες σειρές δοκιμών (με πρόσφατα παρασκευασμένες αραιώσεις του υποδοχέα, των χημικών ουσιών και των αντιδραστηρίων) σε διαφορετικές ημέρες, και κάθε σειρά δοκιμών θα πρέπει να περιλαμβάνει τρία πανομοιότυπα δείγματα.
|
Προσδιορισμός της συγκέντρωσης υποδοχέα (hrERα)
|
11.
|
Η συγκέντρωση του ενεργού υποδοχέα διαφέρει ελαφρώς ανά παρτίδα και ανάλογα με τις συνθήκες φύλαξης. Για αυτόν τον λόγο, θα πρέπει να προσδιορίζεται η συγκέντρωση του ενεργού υποδοχέα κατά την παραλαβή του από τον προμηθευτή. Κατ’ αυτόν τον τρόπο θα υπολογιστεί η κατάλληλη συγκέντρωση του ενεργού υποδοχέα κατά τη χρονική στιγμή της σειράς δοκιμών.
|
|
12.
|
Υπό συνθήκες κατάλληλες για την ανταγωνιστική δέσμευση (δηλαδή 0,5 nM [3H]-οιστραδιόλης), θα πρέπει να επωάζονται ονομαστικές συγκεντρώσεις υποδοχέα 0,1, 0,2, 0,4 και 0,6 nM απουσία (συνολική δέσμευση) και παρουσία (μη ειδική δέσμευση) 1 μΜ μη ραδιοσημασμένης οιστραδιόλης. Η ειδική δέσμευση, υπολογιζόμενη ως η διαφορά μεταξύ συνολικής και μη ειδικής δέσμευσης, χαράσσεται έναντι της ονομαστικής συγκέντρωσης υποδοχέα. Η συγκέντρωση του υποδοχέα από την οποία προκύπτουν τιμές ειδικής δέσμευσης που αντιστοιχούν στο 40 % της προστεθείσας ραδιοσήμανσης σχετίζεται με την αντίστοιχη συγκέντρωση υποδοχέα, και η εν λόγω συγκέντρωση υποδοχέα θα πρέπει να χρησιμοποιείται για τα πειράματα κορεσμού και ανταγωνιστικής δέσμευσης. Συχνά, μια τελική συγκέντρωση hrER ίση με 0,2 nM θα συμμορφώνεται με τη συνθήκη αυτή.
|
|
13.
|
Σε περίπτωση που αποτυγχάνει επανειλημμένα η ικανοποίηση του κριτηρίου του 40 %, θα πρέπει να ελέγχεται η οργάνωση του πειράματος για πιθανά σφάλματα. Η μη επίτευξη του κριτηρίου του 40 % μπορεί να υποδεικνύει ότι ο αριθμός των ενεργών υποδοχέων στην ανασυνδυασμένη παρτίδα είναι υπερβολικά χαμηλός, οπότε και θα πρέπει να εξετάζεται το ενδεχόμενο χρήσης άλλης παρτίδας υποδοχέων.
|
Δοκιμασία κορεσμού
|
14.
|
Θα πρέπει να αξιολογούνται εις τριπλούν οκτώ αυξανόμενες συγκεντρώσεις [3H]17β-οιστραδιόλης, υπό τις ακόλουθες τρεις συνθήκες (βλ. πίνακα 2):
|
α)
|
απουσία μη ραδιοσημασμένης 17β-οιστραδιόλης και παρουσία ER. Έτσι προσδιορίζεται η συνολική δέσμευση βάσει της ραδιενέργειας στις κοιλότητες που περιέχουν μόνο [3H]17β-οιστραδιόλη.
|
|
β)
|
παρουσία κατά 2 000 φορές πολλαπλάσιας υπερβάλλουσας συγκέντρωσης μη ραδιοσημασμένης 17β-οιστραδιόλης σε σχέση με τη ραδιοσημασμένη 17β-οιστραδιόλη και παρουσία ER. Στόχος είναι ο κορεσμός των ενεργών θέσεων δέσμευσης με μη ραδιοσημασμένη 17β-οιστραδιόλη και ο προσδιορισμός της μη ειδικής δέσμευσης μέσω μέτρησης της ραδιενέργειας στις κοιλότητες. Τυχόν εναπομένουσα ραδιοσημασμένη οιστραδιόλη που μπορεί να δεσμευτεί στον υποδοχέα θεωρείται ότι δεσμεύεται σε μη ειδική θέση, καθώς η μη ραδιοσημασμένη οιστραδιόλη βρίσκεται σε τόσο υψηλή συγκέντρωση ώστε θα πρέπει να έχει δεσμευτεί σε όλες τις διαθέσιμες ειδικές θέσεις του υποδοχέα.
|
|
γ)
|
απουσία μη ραδιοσημασμένης 17β-οιστραδιόλης και απουσία ER (προσδιορισμός της συνολικής ραδιενέργειας).
|
Παρασκευή διαλυμάτων [3H]17β-οιστραδιόλης, μη ραδιοσημασμένης 17β-οιστραδιόλης και hrERα
|
15.
|
Θα πρέπει να παρασκευάζεται διάλυμα 40 nM [3H]17β-οιστραδιόλης από αποθεματικό διάλυμα 1 μΜ [3H]17β-οιστραδιόλης σε DMSO, με προσθήκη DMSO (για την παρασκευή 200 nM) και ρυθμιστικού διαλύματος δοκιμασίας σε θερμοκρασία δωματίου (για την παρασκευή 40 nM). Χρησιμοποιώντας αυτό το διάλυμα 40 nM παρασκευάζεται η σειρά αραιώσεων [3H]17β-οιστραδιόλης, από 0,313 nM έως 40 nM, με ρυθμιστικό διάλυμα δοκιμασίας σε θερμοκρασία δωματίου (όπως φαίνεται στη στήλη 12 του πίνακα 2). Οι τελικές συγκεντρώσεις δοκιμασίας, από 0,0313 έως 4,0 nM, λαμβάνονται με προσθήκη 10 μl από τα διαλύματα αυτά στις αντίστοιχες κοιλότητες δοκιμασίας τρυβλίου μικροτιτλοδότησης 96 κοιλοτήτων (βλ. πίνακες 2 και 3). Η παρασκευή ρυθμιστικού διαλύματος δοκιμασίας, ο υπολογισμός του αρχικού αποθεματικού διαλύματος [3H]17β-οιστραδιόλης βάσει της ειδικής δραστικότητάς του, η παρασκευή αραιώσεων και ο προσδιορισμός των συγκεντρώσεων περιγράφονται αναλυτικά στο πρωτόκολλο CERI (2).
|
|
16.
|
Οι αραιώσεις των διαλυμάτων μη ραδιοσημασμένης 17β-οιστραδιόλης θα πρέπει να παρασκευάζονται από αποθεματικό διάλυμα 17β-οιστραδιόλης 1 nM, με προσθήκη ρυθμιστικού διαλύματος δοκιμασίας με σκοπό την επίτευξη οκτώ αυξανόμενων συγκεντρώσεων, που κυμαίνονται αρχικά από 0,625 μΜ έως 80 μΜ. Οι τελικές συγκεντρώσεις δοκιμασίας, από 0,0625 έως 8 μΜ, λαμβάνονται με προσθήκη 10 μl από αυτά τα διαλύματα στις αντίστοιχες κοιλότητες δοκιμασίας τρυβλίου μικροτιτλοδότησης 96 κοιλοτήτων που προορίζονται ειδικά για τη μέτρηση της μη ειδικής δέσμευσης (βλ. πίνακες 2 και 3). Η παρασκευή των αραιώσεων μη ραδιοσημασμένης 17β-οιστραδιόλης περιγράφεται αναλυτικά στο πρωτόκολλο CERI (2).
|
|
17.
|
Θα πρέπει να χρησιμοποιείται η συγκέντρωση υποδοχέα από την οποία προκύπτει ειδική δέσμευση 40±10 % (βλ. παραγράφους 12-13). Το διάλυμα hrERα θα πρέπει να παρασκευάζεται με παγόψυχρο ρυθμιστικό διάλυμα δοκιμασίας ακριβώς πριν από τη χρήση, δηλαδή μετά την προετοιμασία όλων των κοιλοτήτων για συνολική δέσμευση, μη ειδική δέσμευση και ραδιοσημασμένο πρόσδεμα μόνο.
|
|
18.
|
Τα τρυβλία μικροτιτλοδότησης 96 κοιλοτήτων παρασκευάζονται όπως φαίνεται στον πίνακα 2, με 3 πανομοιότυπα δείγματα ανά συγκέντρωση [3H]17β-οιστραδιόλης. Η κατανομή όγκων της [3H]17β-οιστραδιόλης, της μη ραδιοσημασμένης 17β-οιστραδιόλης, του ρυθμιστικού διαλύματος και του υποδοχέα περιγράφεται στον πίνακα 3.
Πίνακας 2
Διάταξη τρυβλίου μικροτιτλοδότησης δοκιμασίας δέσμευσης κορεσμού
|
|
1 (*10)
|
2 (*10)
|
3 (*10)
|
4 (*10)
|
5 (*10)
|
6 (*10)
|
7 (*10)
|
8 (*10)
|
9 (*10)
|
10
|
11 (*11)
|
12 (*11)
|
|
Για μέτρηση της TB
|
Για μέτρηση της NSB
|
Για τον προσδιορισμό του ραδιοσημασμένου προσδέματος μόνο
|
|
Αραιώσεις μη ραδιοσημασμένης E2 για τη στήλη τρυβλίου 4-6
|
Αραιώσεις [3H]E2 για τη στήλη τρυβλίου 1-9
|
|
A
|
0,0313 nM [3H] E2+ ER
|
0,0313 nM [3H] E2+ 0,0625 μΜ E2+ ER
|
0,0313 nM
|
|
0,625 μΜ
|
0,313 nM
|
|
Β
|
0,0625 nM [3H] E2+ ER
|
0,0625 nM [3H] E2+ 0,125 μΜ E2+ ER
|
0,0625 nM
|
|
1,25 μΜ
|
0,625 nM
|
|
Γ
|
0,125 nM [3H] E2+ ER
|
0,125 nM [3H] E2+ 0,25 μΜ E2+ ER
|
0,125 nM
|
|
2,5 μΜ
|
1,25 nM
|
|
Δ
|
0,250 nM [3H] E2+ ER
|
0,250 nM [3H] E2+ 0,5 μΜ E2+ ER
|
0,250 nM
|
|
5 μΜ
|
2,5 nM
|
|
E
|
0,50 nM [ H] E2+ ER
|
0,50 nM [3H] E2+ 1 μΜ E2+ ER
|
0,50 nM
|
|
10 μΜ
|
5 nM
|
|
ΣΤ
|
1,00 nM [3H] E2+ ER
|
1,00 nM [3H] E2+ 2 μΜ E2+ ER
|
1,00 nM
|
|
20 μΜ
|
10 nM
|
|
Ζ
|
2,00 nM [3H] E2+ ER
|
2,00 nM [3H] E2+ 4 μΜ E2+ ER
|
2,00 nM
|
|
40 μΜ
|
20 nM
|
|
H
|
4,00 nM [3H] E2+ ER
|
4,00 nM [3H] E2+ 8 μΜ E2+ ER
|
4,00 nM
|
|
80 μΜ
|
40 nM
|
|
TB
|
:
|
συνολική δέσμευση
|
|
NSB
|
:
|
μη ειδική δέσμευση
|
|
[3H] E2
|
:
|
[3H]17β-οιστραδιόλη
|
|
E2
|
:
|
μη ραδιοσημασμένη 17β-οιστραδιόλη
|
|
Πίνακας 3
Όγκοι αντιδραστηρίου για το τρυβλίο μικροτιτλοδότησης κορεσμού
|
Αριθμός λωρίδας
|
1
|
2
|
3
|
4
|
5
|
6
|
7 (*12)
|
8 (*12)
|
9 (*12)
|
|
Στάδια παρασκευής
|
Κοιλότητες TB
|
Κοιλότητες NSB
|
Μόνο ραδιοσημασμένο πρόσδεμα
|
|
Όγκος στοιχείων για τις παραπάνω κοιλότητες αντίδρασης και σειρά προσθήκης
|
Ρυθμιστικό διάλυμα
|
60 μl
|
50 μl
|
90 μl
|
|
μη ραδιοσημασμένη E2 από τη λωρίδα 11 στον πίνακα 2
|
-
|
10 μl
|
-
|
|
[3H]E2 από τη λωρίδα 12 στον πίνακα 2
|
10 μl
|
10 μl
|
10 μl
|
|
hrERα
|
30 μl
|
30 μl
|
-
|
|
Συνολικός όγκος αντίδρασης
|
100 μl
|
100 μl
|
100 μl
|
|
Επώαση
|
ΜΕΤΑ ΑΠΟ ΑΝΤΙΔΡΑΣΗ ΕΠΩΑΣΗΣ 2 ΩΡΩΝ
|
Ποσοτικός προσδιορισμός της ραδιενέργειας αμέσως μετά την παρασκευή Καμία επώαση
|
|
Αγωγή με 0,4 % DCC
|
Ναι
|
Ναι
|
Όχι
|
|
Όγκος 0,4 % DCC
|
100 μl
|
100 μl
|
—
|
|
Διήθηση
|
Ναι
|
Ναι
|
Όχι
|
|
ΜΕΤΡΗΣΗ ΤΩΝ DPM
|
|
Όγκος ποσοτικού προσδιορισμού που προστέθηκε στο κοκτέιλ σπινθηρισμού
|
100 μl (*13)
|
100 μl (*13)
|
50 μl
|
|
|
19.
|
Τα τρυβλία μικροτιτλοδότησης δοκιμασίας για τον προσδιορισμό της συνολικής δέσμευσης και της μη ειδικής δέσμευσης θα πρέπει να επωάζονται σε θερμοκρασία δωματίου (22°C έως 28°C) επί δύο ώρες.
|
|
Μέτρηση της δεσμευμένης στον hrERα [3H]17β-οιστραδιόλης
|
20.
|
Μετά την περίοδο επώασης διάρκειας δύο ωρών, η δεσμευμένη στον hrERα [3H]17β-οιστραδιόλη θα πρέπει να διαχωρίζεται από την ελεύθερη [3H]17β-οιστραδιόλη διά της προσθήκης 100 μl παγόψυχρου εναιωρήματος DCC 0,4 %. Στη συνέχεια, τα τρυβλία θα πρέπει να τοποθετούνται στον πάγο επί 10 λεπτά και το μείγμα αντίδρασης και το εναιώρημα DCC θα πρέπει να διηθούνται, μέσω μεταφοράς σε φίλτρο τρυβλίων μικροτιτλοδότησης, για την αφαίρεση του DCC. Στη συνέχεια, 100 μl του διηθήματος θα πρέπει να προστίθενται στο υγρό σπινθηρισμού σε φιαλίδια LSC για τον προσδιορισμό των διασπάσεων ανά λεπτό (dpm) ανά φιαλίδιο.
|
|
21.
|
Εναλλακτικά, εάν δεν υπάρχει διαθέσιμο φίλτρο τρυβλίων μικροτιτλοδότησης, η αφαίρεση του DCC μπορεί να γίνει μέσω φυγοκέντρησης. Στη συνέχεια, 50 μl υπερκείμενου υγρού που περιέχει τη δεσμευμένη στον hrERα [3H]17β-οιστραδιόλη λαμβάνονται με εξαιρετική προσοχή, προκειμένου να αποφευχθεί τυχόν μόλυνση των κοιλοτήτων από την επαφή με τον DCC, και χρησιμοποιούνται για τη μέτρηση του σπινθηρισμού.
|
|
22.
|
Η συνθήκη «ραδιοσημασμένο πρόσδεμα μόνο» χρησιμοποιείται για τον προσδιορισμό των διασπάσεων ανά λεπτό (dpm) της [3H]17β-οιστραδιόλης που προστίθεται στις κοιλότητες δοκιμασίας. Ο ποσοτικός προσδιορισμός της ραδιενέργειας θα πρέπει να πραγματοποιείται αμέσως μετά την παρασκευή. Οι εν λόγω κοιλότητες δεν θα πρέπει να επωάζονται ούτε να υποβάλλονται σε αγωγή με το εναιώρημα DCC, αλλά το περιεχόμενό τους θα πρέπει να χορηγείται απευθείας στο υγρό σπινθηρισμού. Οι μετρήσεις αυτές δείχνουν την ποσότητα της [3H]17β-οιστραδιόλης, σε dpm, που προστέθηκε σε κάθε σύνολο κοιλοτήτων για τη συνολική δέσμευση και τη μη ειδική δέσμευση.
|
Δοκιμασία ανταγωνιστικής δέσμευσης
|
23.
|
Η δοκιμασία ανταγωνιστικής δέσμευσης μετρά τη δέσμευση μιας μεμονωμένης συγκέντρωσης [3H]17β-οιστραδιόλης παρουσία αυξανόμενων συγκεντρώσεων υπό δοκιμή χημικής ουσίας. Για κάθε συγκέντρωση σε μία σειρά δοκιμών θα πρέπει να χρησιμοποιούνται τρία παράλληλα πανομοιότυπα δείγματα. Επιπλέον, για κάθε υπό δοκιμή χημική ουσία θα πρέπει να εκτελούνται τρεις μη παράλληλες σειρές δοκιμών. Η δοκιμασία θα πρέπει να οργανώνεται σε ένα ή περισσότερα τρυβλία μικροτιτλοδότησης 96 κοιλοτήτων.
|
Μάρτυρες
|
24.
|
Κατά τη διεξαγωγή της δοκιμασίας, σε κάθε πείραμα θα πρέπει να περιλαμβάνεται παράλληλος διαλύτης και μάρτυρες (οιστρογόνο αναφοράς, ασθενώς δεσμευόμενη ουσία και μη δεσμευόμενη ουσία). Σε ένα τρυβλίο στη διάρκεια κάθε σειράς δοκιμών, θα πρέπει να χρησιμοποιούνται πλήρεις καμπύλες συγκέντρωσης για το οιστρογόνο αναφοράς και τους μάρτυρες (ασθενώς δεσμευόμενη και μη δεσμευόμενη ουσία). Όλα τα υπόλοιπα τρυβλία θα πρέπει να περιέχουν i) υψηλή (μέγιστη εκτόπιση, δηλαδή σχεδόν πλήρη εκτόπιση του ραδιοσημασμένου προσδέματος) και μέτρια (περίπου ίση με την IC50) συγκέντρωση E2 και ασθενώς δεσμευόμενης ουσίας, εις τριπλούν, ii) μάρτυρα με διαλύτη και μη ειδική δέσμευση, καθένα εκ των οποίων εις τριπλούν. Οι διαδικασίες για την παρασκευή του ρυθμιστικού διαλύματος δοκιμασίας και των διαλυμάτων [3H]17β-οιστραδιόλης, hrERα και των υπό δοκιμή χημικών ουσιών περιγράφονται αναλυτικά στο πρωτόκολλο CERI (2).
|
Μάρτυρας με διαλύτη:
|
25.
|
Ο μάρτυρας με διαλύτη δείχνει ότι ο διαλύτης δεν αλληλεπιδρά με το σύστημα δοκιμής και, επίσης, μετρά τη συνολική δέσμευση (TB). Ο προτιμώμενος διαλύτης είναι το DMSO. Εναλλακτικά, εάν η υψηλότερη συγκέντρωση της υπό δοκιμή χημικής ουσίας δεν είναι διαλυτή στο DMSO, μπορεί να χρησιμοποιείται αιθανόλη. Η συγκέντρωση του DMSO στις τελικές κοιλότητες δοκιμασίας θα πρέπει να είναι 2,05 % και μπορεί να αυξηθεί μέχρι και σε 2,5 % εάν η υπό δοκιμή χημική ουσία δεν είναι διαλυτή. Δεν θα πρέπει να χρησιμοποιούνται συγκεντρώσεις DMSO άνω του 2,5 %, λόγω του ότι οι υψηλότερες συγκεντρώσεις διαλύτη παρεμποδίζουν τη δοκιμασία. Για υπό δοκιμή χημικές ουσίες που δεν είναι διαλυτές σε DMSO, αλλά είναι διαλυτές σε αιθανόλη, μπορεί να χρησιμοποιείται στη δοκιμασία 2 % αιθανόλης κατά μέγιστο χωρίς να υπάρχει παρεμπόδιση.
|
Μάρτυρας με ρυθμιστικό διάλυμα:
|
26.
|
Ο μάρτυρας με ρυθμιστικό διάλυμα (BC) δεν θα πρέπει να περιέχει ούτε διαλύτη ούτε υπό δοκιμή χημική ουσία, αλλά όλα τα υπόλοιπα στοιχεία της δοκιμασίας. Τα αποτελέσματα του μάρτυρα με ρυθμιστικό διάλυμα συγκρίνονται με τον μάρτυρα με διαλύτη προκειμένου να επαληθευτεί ότι ο χρησιμοποιούμενος διαλύτης δεν επηρεάζει το σύστημα δοκιμασίας.
|
Ισχυρώς δεσμευόμενη ουσία (οιστρογόνο αναφοράς)
|
27.
|
Η 17β-οιστραδιόλη (CAS 50-28-2) είναι το ενδογενές πρόσδεμα και δεσμεύεται με υψηλή συγγένεια στον ER υποτύπου α. Θα πρέπει να καταρτίζεται πρότυπη καμπύλη με χρήση 17β-οιστραδιόλης για κάθε δοκιμασία ανταγωνιστικής δέσμευσης hrERα, προκειμένου να είναι δυνατή η αξιολόγηση της μεταβλητότητας με την πάροδο του χρόνου κατά τη διεξαγωγή της δοκιμασίας στο ίδιο εργαστήριο. Θα πρέπει να παρασκευάζονται οκτώ διαλύματα μη ραδιοσημασμένης 17β-οιστραδιόλης σε DMSO και ρυθμιστικό διάλυμα δοκιμασίας, με τις τελικές συγκεντρώσεις στις κοιλότητες δοκιμασίας προς χρήση για την πρότυπη καμπύλη, στα εξής διαστήματα: 10–6, 10–7, 10–8, 10–8,5, 10–9, 10–9,5, 10–10, 10–11 M. Η υψηλότερη συγκέντρωση της μη ραδιοσημασμένης 17β-οιστραδιόλης (1 μΜ) θα πρέπει να χρησιμοποιείται ως δείκτης μη ειδικής δέσμευσης. Παρότι αποτελεί επίσης μέρος της πρότυπης καμπύλης, η συγκεκριμένη συγκέντρωση διακρίνεται από την ένδειξη «NSB» στον πίνακα 4.
|
Ασθενώς δεσμευόμενη ουσία
|
28.
|
Θα πρέπει να περιλαμβάνεται μια ασθενώς δεσμευόμενη ουσία [νορεθυνοδρέλη (CAS68-23-5) ή, εναλλακτικά, νορεθινδρόνη (CAS 68-22-4)] προκειμένου να καταδεικνύεται η ευαισθησία κάθε πειράματος και να παρέχεται η δυνατότητα αξιολόγησης της μεταβλητότητας με την πάροδο του χρόνου στο πλαίσιο διεξαγωγής της δοκιμασίας. Θα πρέπει να παρασκευάζονται οκτώ διαλύματα της ασθενώς δεσμευόμενης ουσίας σε DMSO και ρυθμιστικό διάλυμα δοκιμασίας, με τις τελικές συγκεντρώσεις στις κοιλότητες δοκιμασίας ως ακολούθως: 10–4,5, 10–5,5, 10–6, 10–6,5, 10–7, 10–7,5, 10–8 και 10–9 M.
|
Μη δεσμευόμενη ουσία
|
29.
|
Ως αρνητικός μάρτυρας (μη δεσμευόμενη ουσία) θα πρέπει να χρησιμοποιείται το οκτυλοτριαιθοξυσιλάνιο (OTES, CAS 2943-75-1). Έτσι εξασφαλίζεται ότι η δοκιμασία, όπως εκτελείται, μπορεί να ανιχνεύσει τις υπό δοκιμή χημικές ουσίες που δεν δεσμεύονται στον hrERα. Θα πρέπει να παρασκευάζονται οκτώ διαλύματα της μη δεσμευόμενης ουσίας σε DMSO και ρυθμιστικό διάλυμα δοκιμασίας, με τις τελικές συγκεντρώσεις στις κοιλότητες δοκιμασίας ως ακολούθως: 10–3,10–4, 10–5, 10–6, 10–7, 10–8, 10–9, 10–10 M. Ως εναλλακτική μη δεσμευόμενη ουσία μπορεί να χρησιμοποιηθεί το φθαλικό δι-n-βουτύλιο (DBP, CAS 84-72-2), αλλά μόνο σε συγκεντρώσεις έως 10–4 M. Η μέγιστη διαλυτότητα του DBP στη δοκιμασία έχει καταδειχθεί ότι είναι 10–4 M.
|
Συγκέντρωση hrERα
|
30.
|
Θα πρέπει να χρησιμοποιείται η ποσότητα υποδοχέα από την οποία προκύπτει ειδική δέσμευση 40±10 % (βλ. παραγράφους 12-13 του προσαρτήματος 3). Το διάλυμα hrERα θα πρέπει να παρασκευάζεται μέσω αραίωσης του λειτουργικού hrERα σε παγόψυχρο ρυθμιστικό διάλυμα δοκιμασίας ακριβώς πριν τη χρήση.
|
[3H]17β-οιστραδιόλη
|
31.
|
Η τελική συγκέντρωση της [3H]17β-οιστραδιόλης στις κοιλότητες δοκιμασίας θα πρέπει να είναι 0,5 nM.
|
Υπό δοκιμή χημικές ουσίες
|
32.
|
Καταρχάς, είναι απαραίτητο να διεξάγεται δοκιμή διαλυτότητας για τον προσδιορισμό του ορίου διαλυτότητας για κάθε υπό δοκιμή χημική ουσία και για τον προσδιορισμό του κατάλληλου εύρους συγκεντρώσεων προς χρήση κατά τη διεξαγωγή του πρωτοκόλλου δοκιμής. Το όριο διαλυτότητας κάθε υπό δοκιμή χημικής ουσίας πρέπει να προσδιορίζεται αρχικά στον διαλύτη και, στη συνέχεια, να επιβεβαιώνεται περαιτέρω υπό τις συνθήκες δοκιμασίας. Η υπό δοκιμή τελική συγκέντρωση στη δοκιμασία δεν θα πρέπει να υπερβαίνει το 1 mM. Οι δοκιμές προσδιορισμού εύρους περιλαμβάνουν μάρτυρα με διαλύτη και τουλάχιστον 8 λογαριθμικές, διαδοχικές αραιώσεις, που ξεκινούν από τη μέγιστη αποδεκτή συγκέντρωση (π.χ. 1 mM ή χαμηλότερη, με βάση το όριο διαλυτότητας), και καταγραφή της παρουσίας θολερότητας ή ιζήματος (βλ. επίσης παράγραφο 35 του προσαρτήματος 3). Αφού προσδιοριστεί το εύρος συγκεντρώσεων για τις δοκιμές, θα πρέπει να ελέγχεται υπό δοκιμή χημική ουσία με χρήση 8 λογαριθμικών συγκεντρώσεων διατεταγμένων σε κατάλληλα διαστήματα, όπως έχουν καθοριστεί στην προηγούμενη δοκιμή προσδιορισμού εύρους. Οι συγκεντρώσεις που ελέγχονται στο δεύτερο και το τρίτο πείραμα θα πρέπει να προσαρμόζονται περαιτέρω κατά περίπτωση, με σκοπό τη βελτίωση του χαρακτηρισμού της καμπύλης συγκέντρωσης-απόκρισης, εφόσον απαιτείται.
|
|
33.
|
Οι αραιώσεις της υπό δοκιμή χημικής ουσίας θα πρέπει να παρασκευάζονται στον κατάλληλο διαλύτη (βλ. παράγραφο 25 του προσαρτήματος 3). Εάν η υψηλότερη συγκέντρωση της υπό δοκιμή χημικής ουσίας δεν είναι διαλυτή ούτε σε DMSO ούτε σε αιθανόλη, και η προσθήκη περισσότερου διαλύτη θα είχε ως αποτέλεσμα την αύξηση της συγκέντρωσης του διαλύτη στον τελικό σωλήνα πάνω από το αποδεκτό όριο, επιτρέπεται η μείωση της υψηλότερης συγκέντρωσης έως την επόμενη χαμηλότερη συγκέντρωση. Σε αυτή την περίπτωση, μπορεί να προστεθεί μία επιπλέον συγκέντρωση στο χαμηλό άκρο της σειράς συγκεντρώσεων. Οι υπόλοιπες συγκεντρώσεις της σειράς θα πρέπει να παραμείνουν αμετάβλητες.
|
|
34.
|
Τα διαλύματα της υπό δοκιμή χημικής ουσίας θα πρέπει να παρακολουθούνται στενά όταν προστίθενται στην κοιλότητα δοκιμασίας, καθότι η υπό δοκιμή χημική ουσία μπορεί να σχηματίσει ίζημα κατά την προσθήκη της στην κοιλότητα δοκιμασίας. Τα δεδομένα για όλες τις κοιλότητες που περιέχουν ίζημα θα πρέπει να αποκλείονται από την προσαρμογή της καμπύλης, και θα πρέπει να καταγράφεται ο λόγος του αποκλεισμού τους.
|
|
35.
|
Εάν υπάρχουν ήδη διαθέσιμες πληροφορίες από άλλες πηγές που παρέχουν τον λογάριθμο (IC50) μιας υπό δοκιμή χημικής ουσίας, ίσως είναι σκόπιμο τα διαστήματα των αραιώσεων να διαμορφωθούν με γεωμετρικό τρόπο πιο κοντά γύρω από τον αναμενόμενο λογάριθμο (IC50) (δηλ. 0,5 λογαριθμικές μονάδες). Τα τελικά αποτελέσματα θα πρέπει να εμφανίζουν επαρκή διασπορά συγκεντρώσεων εκατέρωθεν του λογάριθμου (IC50), περιλαμβανομένης της μέγιστης και της ελάχιστης τιμής, κατά τρόπον ώστε να είναι εφικτός ο επαρκής χαρακτηρισμός της καμπύλης δέσμευσης.
|
Οργάνωση τρυβλίων δοκιμασίας
|
36.
|
Θα πρέπει να προετοιμάζονται επισημασμένα τρυβλία μικροτιτλοδότησης για εξαπλές επωάσεις, για τον μάρτυρα με διαλύτη, την υψηλότερη συγκέντρωση του οιστρογόνου αναφοράς (Ε2) που χρησιμεύει επίσης ως δείκτης μη ειδικής δέσμευσης (NSB), και τον μάρτυρα με ρυθμιστικό διάλυμα, και για τριπλές επωάσεις για καθεμία από τις οκτώ συγκεντρώσεις του μάρτυρα μη δεσμευόμενης ουσίας (οκτυλοτριαιθοξυσιλάνιο), τις επτά χαμηλότερες συγκεντρώσεις για το οιστρογόνο αναφοράς (Ε2), τις οκτώ συγκεντρώσεις της ασθενώς δεσμευόμενης ουσίας (νορεθυνοδρέλη ή νορεθινδρόνη), και τις οκτώ συγκεντρώσεις κάθε υπό δοκιμή χημικής ουσίας (TC). Ένα παράδειγμα διαγράμματος διάταξης τρυβλίων για τις πλήρεις καμπύλες συγκέντρωσης που αφορούν το οιστρογόνο αναφοράς και τους μάρτυρες παρέχεται στον πίνακα 4 παρακάτω. Για τις υπό δοκιμή χημικές ουσίες χρησιμοποιούνται πρόσθετα τρυβλία μικροτιτλοδότησης, τα οποία θα πρέπει να περιλαμβάνουν μάρτυρες τρυβλίων [δηλαδή i) μια υψηλή (μέγιστη εκτόπιση) και μία μέτρια (περίπου ίση με την IC50) συγκέντρωση E2 και ασθενώς δεσμευόμενης ουσίας, εις τριπλούν, ii) μάρτυρα με διαλύτη (ως συνολική δέσμευση) και μη ειδική δέσμευση, καθένα εκ των οποίων σε έξι επαναλήψεις (πίνακας 5). Παράδειγμα φύλλου εργασίας διάταξης τρυβλίου μικροτιτλοδότησης δοκιμασίας ανταγωνιστικής δέσμευσης με χρήση τριών άγνωστων υπό δοκιμή χημικών ουσιών παρέχεται στο προσάρτημα 3.3. Οι συγκεντρώσεις που αναφέρονται στο φύλλο εργασίας καθώς και στους πίνακες 4 και 5 αφορούν τις τελικές συγκεντρώσεις που χρησιμοποιούνται σε κάθε κοιλότητα δοκιμασίας. Η μέγιστη συγκέντρωση για την E2 θα πρέπει να είναι 1×10–7 M, ενώ όσον αφορά την ασθενώς δεσμευόμενη ουσία θα πρέπει να χρησιμοποιείται η υψηλότερη συγκέντρωση που χρησιμοποιείται για την ασθενώς δεσμευόμενη ουσία στο τρυβλίο 1. Η συγκέντρωση IC50 θα πρέπει να καθορίζεται από το εργαστήριο βάσει της βάσης ιστορικών δεδομένων για τους μάρτυρες. Η τιμή αναμένεται να είναι παρεμφερής με την τιμή που παρατηρήθηκε στις μελέτες επικύρωσης (βλ. πίνακα 1).
|
Πίνακας 4
Διάταξη τρυβλίου μικροτιτλοδότησης δοκιμασίας ανταγωνιστικής δέσμευσης
(97)
(98)
, πλήρεις καμπύλες συγκέντρωσης για το οιστρογόνο αναφοράς και τους μάρτυρες (τρυβλίο 1)
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
|
Μάρτυρας με ρυθμιστικό διάλυμα και θετικός μάρτυρας (E2)
|
Ασθενώς θετική (Νορεθυνοδρέλη)
|
Αρνητικός μάρτυρας (OTES)
|
TB και NSB
|
|
A
|
Τυφλό (*14)
|
1×10–9 M
|
1×10–10 M
|
TB (μάρτυρας με διαλύτη) (2,05 % DMSO)
|
|
Β
|
E2 (1×10–11 M)
|
1×10–8 M
|
1×10–9 M
|
|
Γ
|
E2 (1×10–10 M)
|
1×10–7,5 M
|
1×10–8 M
|
NSB (10–6 M E2)
|
|
Δ
|
E2 (1×10–9,5 M)
|
1×10–7 M
|
1×10–7 M
|
|
E
|
E2 (1×10–9 M)
|
1×10–6,5 M
|
1×10–6 M
|
Μάρτυρας με ρυθμιστικό διάλυμα
|
|
ΣΤ
|
E2 (1×10–8,5 M)
|
1×10–6 M
|
1×10–5 M
|
|
Ζ
|
E2 (1×10–8 M)
|
1×10–5,5 M
|
1×10–4 M
|
Τυφλό (για ραδιοσήμανση) (*15)
|
|
H
|
E2 (1×10–7 M)
|
1×10–4,5 M
|
1×10–3 M
|
Πίνακας 5
Διάταξη τρυβλίου μικροτιτλοδότησης δοκιμασίας ανταγωνιστικής δέσμευσης, πρόσθετα τρυβλία για υπό δοκιμή χημικές (TC) και μάρτυρες τρυβλίου
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
|
|
Υπό δοκιμή χημική ουσία 1 (TC-1)
|
Υπό δοκιμή χημική ουσία 2 (TC-2)
|
Υπό δοκιμή χημική ουσία 3 (TC-3)
|
Μάρτυρες
|
|
A
|
TC-1 (1×10–10 M)
|
TC-2 (1×10–10 M)
|
TC-3 (1×10–10 M)
|
E2 (1×10–7M)
|
|
Β
|
TC-1 (1×10–9 M)
|
TC-2 (1×10–9 M)
|
TC-3 (1×10–9 M)
|
E2 (IC50)
|
|
Γ
|
TC-1 (1×10-8 M)
|
TC-2 (1×10–8 M)
|
TC-3 (1×10–8 M)
|
NE (1×10
–4,5
M)
|
|
Δ
|
TC-1 (1×10–7 M)
|
TC-2 (1×10–7 M)
|
TC-3 (1×10–7 M)
|
NE (IC50)
|
|
E
|
TC-1 (1×10–6 M)
|
TC-2 (1×10–6 M)
|
TC-3 (1×10–6 M)
|
NSB (10–6 M E2)
|
|
ΣΤ
|
TC-1 (1×10–5 M)
|
TC-2 (1×10–5 M)
|
TC-3 (1×10–5 M)
|
|
Ζ
|
TC-1 (1×10–4 M)
|
TC-2 (1×10–4 M)
|
TC-3 (1×10–4 M)
|
TB (μάρτυρας με διαλύτη)
|
|
H
|
TC-1 (1×10–3 M)
|
TC-2 (1×10–3 M)
|
TC-3 (1×10–3 M)
|
|
Στο παράδειγμα, η ασθενώς δεσμευόμενη ουσία είναι η νορεθυνοδρέλη (NE)
|
Ολοκλήρωση της δοκιμασίας ανταγωνιστικής δέσμευσης
|
37.
|
Με εξαίρεση τις κοιλότητες για τη συνολική δέσμευση και τα τυφλά (για ραδιοσήμανση), όπως φαίνεται στον πίνακα 6, θα πρέπει να τοποθετούνται 50 μl του ρυθμιστικού διαλύματος δοκιμασίας σε κάθε κοιλότητα και θα πρέπει να αναμιγνύονται με 10 μl του μάρτυρα με διαλύτη, του οιστρογόνου αναφοράς (E2), της ασθενώς δεσμευόμενης ουσίας, της μη δεσμευόμενης ουσίας και των υπό δοκιμή χημικών ουσιών, αντίστοιχα, και 10 μl διαλύματος [3H]17β-οιστραδιόλης 5 nM. Στη συνέχεια, σε κάθε τρυβλίο προστίθενται και αναμιγνύονται ήπια 30 μl παγόψυχρου διαλύματος υποδοχέα. Το διάλυμα hrERα θα πρέπει να είναι το τελευταίο αντιδραστήριο που προστίθεται. Τα τρυβλία μικροτιτλοδότησης δοκιμασίας θα πρέπει να επωάζονται σε θερμοκρασία δωματίου (22° έως 28°C) επί 2 ώρες.
Πίνακας 6
Όγκος στοιχείων δοκιμασίας για τη δοκιμασία ανταγωνιστικής δέσμευσης hrER, τρυβλία μικροτιτλοδότησης
|
Στάδια παρασκευής
|
Άλλες κοιλότητες εκτός των κοιλοτήτων TB
|
Κοιλότητες TB
|
Τυφλό (για ραδιοσήμανση)
|
|
Όγκος στοιχείων για τις παραπάνω κοιλότητες αντίδρασης και σειρά προσθήκης
|
Ρυθμιστικό διάλυμα δοκιμασίας σε θερμοκρασία δωματίου
|
50 μl
|
60 μl
|
90 μl
|
|
Μη ραδιοσημασμένη E2, ασθενώς δεσμευόμενη ουσία, μη δεσμευόμενη ουσία, διαλύτης και υπό δοκιμή χημικές ουσίες (*16)
|
10 μl
|
—
|
—
|
|
[3H]17β-οιστραδιόλη ώστε να προκύπτει τελική συγκέντρωση 0,5 nM (δηλ. 5 nM)
|
10 μl
|
10 μl
|
10 μl
|
|
συγκέντρωση hrERα όπως καθορίστηκε (βλ. παραγράφους 12-13)
|
30 μl
|
30 μl
|
—
|
|
Συνολικός όγκος σε κάθε κοιλότητα δοκιμασίας
|
100 μl
|
100 μl
|
100 μl
|
|
|
38.
|
Στη συνέχεια, θα πρέπει να πραγματοποιείται ποσοτικός προσδιορισμός της δεσμευμένης στον hrERα [3H]17β-οιστραδιόλης, μετά τον διαχωρισμό της δεσμευμένης στον hrERα [3H]17β-οιστραδιόλης από την ελεύθερη [3H]17β-οιστραδιόλη, διά της προσθήκης 100 μl παγόψυχρου εναιωρήματος DCC σε κάθε κοιλότητα, όπως περιγράφεται στις παραγράφους 21-23 του προσαρτήματος 3 για τη δοκιμασία δέσμευσης κορεσμού.
|
|
39.
|
Οι κοιλότητες G10-12 και H10-12 [που προσδιορίζονται ως «τυφλό (για ραδιοσήμανση)» στον πίνακα 4] αντιπροσωπεύουν τις dpm της [3H]-ραδιοσημασμένης οιστραδιόλης σε 10 μl. Η ποσότητα των 10 μl θα πρέπει να προστίθεται απευθείας στο υγρό σπινθηρισμού.
|
Κριτήρια αποδοχής
Δοκιμασία δέσμευσης κορεσμού
|
40.
|
Η καμπύλη ειδικής δέσμευσης θα πρέπει να φθάνει σε ένα πλατώ όταν χρησιμοποιούνται αυξανόμενες συγκεντρώσεις [3H]17β-οιστραδιόλης, γεγονός που υποδεικνύει τον κορεσμό του hrERα με το πρόσδεμα.
|
|
41.
|
Η ειδική δέσμευση σε 0,5 nM [3H]17β-οιστραδιόλης θα πρέπει να βρίσκεται εντός του αποδεκτού φάσματος 30 % έως 50 % της μέσης μετρηθείσας συνολικής ραδιενέργειας που προστέθηκε στη διάρκεια των σειρών δοκιμών. Περιστασιακές ελαφρές αποκλίσεις εκτός του εν λόγω φάσματος είναι αποδεκτές, αλλά εάν οι σειρές δοκιμών βρίσκονται μονίμως εκτός του φάσματος ή μια συγκεκριμένη σειρά δοκιμών βρίσκεται αρκετά έξω από αυτό, η συγκέντρωση πρωτεΐνης θα πρέπει να προσαρμοστεί και η δοκιμασία κορεσμού να επαναληφθεί.
|
|
42.
|
Από τα δεδομένα θα πρέπει να προκύπτει γραμμικό διάγραμμα Scatchard.
|
|
43.
|
Η μη ειδική δέσμευση δεν θα πρέπει να είναι υπέρμετρη. Η τιμή της μη ειδικής δέσμευσης θα πρέπει να αντιστοιχεί κατά κανόνα σε <35 % της συνολικής δέσμευσης. Ωστόσο, ο λόγος μπορεί περιστασιακά να υπερβαίνει το εν λόγω όριο, όταν μετρώνται ιδιαίτερα χαμηλές dpm για τη χαμηλότερη συγκέντρωση της υπό δοκιμή ραδιοσημασμένης 17β-οιστραδιόλης.
|
Δοκιμασία ανταγωνιστικής δέσμευσης
|
44.
|
Οι αυξανόμενες συγκεντρώσεις μη ραδιοσημασμένης 17β-οιστραδιόλης θα πρέπει να εκτοπίζουν την [3H]17β-οιστραδιόλη από τον υποδοχέα κατά τρόπο που συνάδει με ανταγωνιστική δέσμευση μίας θέσης.
|
|
45.
|
Η τιμή IC50 για το οιστρογόνο αναφοράς (δηλ. την 17β-οιστραδιόλη) θα πρέπει να είναι κατά προσέγγιση ίση με τη γραμμομοριακή συγκέντρωση της [3H]17β-οιστραδιόλης συν την Kd που προσδιορίζεται από τη δοκιμασία δέσμευσης κορεσμού.
|
|
46.
|
Η συνολική ειδική δέσμευση θα πρέπει να εμπίπτει σταθερά εντός του αποδεκτού φάσματος 40 ± 10 % όταν η μέση μετρηθείσα συγκέντρωση συνολικής ραδιενέργειας που προστέθηκε σε κάθε κοιλότητα ήταν 0,5 nM στη διάρκεια όλων των σειρών δοκιμών. Περιστασιακές ελαφρές αποκλίσεις εκτός του εν λόγω φάσματος είναι αποδεκτές, αλλά εάν οι σειρές δοκιμών βρίσκονται μονίμως εκτός του φάσματος ή μια συγκεκριμένη σειρά δοκιμών βρίσκεται αρκετά έξω από αυτό, η συγκέντρωση πρωτεΐνης θα πρέπει να προσαρμοστεί.
|
|
47.
|
Ο διαλύτης δεν θα πρέπει να αλλοιώνει την ευαισθησία ή την αναπαραγωγιμότητα της δοκιμασίας. Τα αποτελέσματα του μάρτυρα με διαλύτη (κοιλότητες TB) συγκρίνονται με τον μάρτυρα με ρυθμιστικό διάλυμα προκειμένου να επαληθευτεί ότι ο χρησιμοποιούμενος διαλύτης δεν επηρεάζει το σύστημα δοκιμασίας. Τα αποτελέσματα της συνολικής δέσμευσης (TB) και του μάρτυρα με ρυθμιστικό διάλυμα θα πρέπει να είναι συγκρίσιμα, εάν δεν υπάρχει επίδραση του διαλύτη στη δοκιμασία.
|
|
48.
|
Η μη δεσμευόμενη ουσία δεν θα πρέπει να εκτοπίζει ποσοστό άνω του 25 % της [3H]17β-οιστραδιόλης από τον hrERα, όταν ελέγχεται σε συγκέντρωση έως 10–3 M (OTES) ή 10–4 M (DBP).
|
|
49.
|
Για το οιστρογόνο αναφοράς και δύο ασθενώς δεσμευόμενες ουσίες (π.χ. νορεθυνοδρέλη, νορεθινδρόνη) αναπτύχθηκαν κριτήρια επιδόσεων με χρήση δεδομένων από τη μελέτη επικύρωσης της δοκιμασίας δέσμευσης hrER CERI (παράρτημα N της παραπομπής 2). Παρέχονται διαστήματα εμπιστοσύνης 95 % για τη μέση τιμή +/- SD (n) για όλες τις σειρές δοκιμών μάρτυρα στα τέσσερα εργαστήρια που συμμετείχαν στη μελέτη επικύρωσης. Υπολογίστηκαν διαστήματα εμπιστοσύνης 95 % για τις παραμέτρους προσαρμογής της καμπύλης (δηλ. μέγιστη τιμή, ελάχιστη τιμή, κλίση Hill και logIC50) για το οιστρογόνο αναφοράς και τις ασθενώς δεσμευόμενες ουσίες, και για το log10RBA των ασθενώς δεσμευόμενων ουσιών σε σχέση με το οιστρογόνο αναφοράς. Στον πίνακα 1 φαίνονται οι αναμενόμενες κλίμακες τιμών για τις παραμέτρους προσαρμογής της καμπύλης που μπορούν να χρησιμοποιηθούν ως κριτήρια επιδόσεων. Στην πράξη, η κλίμακα τιμών της IC50 μπορεί να ποικίλλει ελαφρώς με βάση την Kd του σκευάσματος υποδοχέα που προκύπτει πειραματικά και τη συγκέντρωση προσδέματος που χρησιμοποιήθηκε για τη δοκιμασία.
|
|
50.
|
Δεν αναπτύχθηκαν κριτήρια επιδόσεων για τις παραμέτρους προσαρμογής της καμπύλης για τις υπό δοκιμή χημικές ουσίες λόγω του ευρέος φάσματος των πιθανών υπό δοκιμή χημικών ουσιών και του φάσματος δυνητικών συγγενειών και εκβάσεων (π.χ. πλήρης καμπύλη, μερική καμπύλη, καμία προσαρμογή καμπύλης). Ωστόσο, η εξέταση των αποτελεσμάτων από κάθε σειρά δοκιμών για μια υπό δοκιμή χημική ουσία θα πρέπει να πραγματοποιείται με βάση την επαγγελματική κρίση. Θα πρέπει να χρησιμοποιείται επαρκές εύρος συγκεντρώσεων της υπό δοκιμή χημικής ουσίας ώστε να προσδιορίζεται με σαφήνεια η μέγιστη τιμή (π.χ. 90 - 100 % δέσμευσης) της καμπύλης ανταγωνιστικής δέσμευσης. Η μεταβλητότητα μεταξύ των πανομοιότυπων δειγμάτων σε κάθε συγκέντρωση της υπό δοκιμή χημικής ουσίας καθώς και μεταξύ των 3 μη παράλληλων σειρών δοκιμών θα πρέπει να είναι εντός εύλογων ορίων και να τεκμηριώνεται επιστημονικά. Οι μάρτυρες από κάθε σειρά δοκιμών για μια υπό δοκιμή χημική ουσία θα πρέπει να προσεγγίζουν τα μέτρα επιδόσεων που αναφέρονται για τη συγκεκριμένη δοκιμασία CERI και πρέπει να είναι σύμφωνοι με τα ιστορικά δεδομένα για τους μάρτυρες από το συγκεκριμένο εργαστήριο.
|
ΑΝΑΛΥΣΗ ΤΩΝ ΔΕΔΟΜΕΝΩΝ
Δοκιμασία δέσμευσης κορεσμού
|
51.
|
Μετράται τόσο η συνολική όσο και η μη ειδική δέσμευση. Από τις τιμές αυτές υπολογίζεται η ειδική δέσμευση αυξανόμενων συγκεντρώσεων [3H]17β-οιστραδιόλης υπό συνθήκες ισορροπίας, με αφαίρεση της μη ειδικής δέσμευσης από τη συνολική δέσμευση. Ένα διάγραμμα της ειδικής δέσμευσης έναντι της συγκέντρωσης [3H]17β-οιστραδιόλης αναμένεται ότι θα φθάνει σε πλατώ όσον αφορά τη μέγιστη ειδική δέσμευση, το οποίο υποδεικνύει τον κορεσμό του hrERα με την [3H]17β-οιστραδιόλη. Επιπλέον, η ανάλυση των δεδομένων θα πρέπει να τεκμηριώνει τη δέσμευση της [3H]17β-οιστραδιόλης σε μία μοναδική θέση δέσμευσης υψηλής συγγένειας. Η μη ειδική, η συνολική και η ειδική δέσμευση θα πρέπει να παρουσιάζονται σε καμπύλη δέσμευσης κορεσμού. Στο πλαίσιο περαιτέρω ανάλυσης των εν λόγω δεδομένων θα πρέπει να χρησιμοποιηθεί ανάλυση μη γραμμικής παλινδρόμησης (π.χ. BioSoft, McPherson, 1985, Motulsky, 1995), με τελική παρουσίαση των δεδομένων υπό μορφή ανάλυσης Scatchard.
|
|
52.
|
Η ανάλυση δεδομένων θα πρέπει να προσδιορίζει τις Bmax και Kd αποκλειστικά από τα δεδομένα συνολικής δέσμευσης, βάσει της παραδοχής ότι η μη ειδική δέσμευση είναι γραμμική, εκτός εάν αιτιολογείται η χρήση διαφορετικής μεθόδου. Επιπλέον, κατά τον προσδιορισμό της βέλτιστης προσαρμογής, θα πρέπει να χρησιμοποιείται ανάλυση εύρωστης παλινδρόμησης, εκτός εάν παρέχονται οι λόγοι για τη μη χρήση της. Θα πρέπει να αναφέρεται η επιλεγμένη μέθοδος για την εύρωστη παλινδρόμηση. Κατά τον προσδιορισμό των Bmax και Kd από δεδομένα δέσμευσης κορεσμού, θα πρέπει να εφαρμόζεται διόρθωση ως προς την εξάντληση του προσδέματος (π.χ. με χρήση της μεθόδου Swillens 1995).
|
Δοκιμασία ανταγωνιστικής δέσμευσης
|
53.
|
Η καμπύλη ανταγωνιστικής δέσμευσης χαράσσεται ως ειδική δέσμευση [3H]17β-οιστραδιόλης έναντι της συγκέντρωσης (μονάδες log10) του ανταγωνιστή. Η συγκέντρωση της υπό δοκιμή χημικής ουσίας που αναστέλλει το 50 % της μέγιστης ειδικής δέσμευσης [3H]17β-οιστραδιόλης είναι η τιμή IC50.
|
|
54.
|
Οι εκτιμήσεις των τιμών λογάριθμου (IC50) για τους θετικούς μάρτυρες (οιστρογόνο αναφοράς και ασθενώς δεσμευόμενη ουσία) θα πρέπει να προσδιορίζονται με χρήση λογισμικού μη γραμμικής προσαρμογής καμπύλης κατάλληλου για την προσαρμογή εξίσωσης Hill τεσσάρων παραμέτρων (π.χ. BioSoft, McPherson, 1985, Motulsky, 1995). Κατά την προσαρμογή των εν λόγω καμπυλών, η μέγιστη τιμή, η ελάχιστη τιμή, η κλίση και ο λογάριθμος (IC50) θα πρέπει, γενικά, να μην περιορίζονται. Κατά τον προσδιορισμό της βέλτιστης προσαρμογής, θα πρέπει να χρησιμοποιείται ανάλυση εύρωστης παλινδρόμησης, εκτός εάν παρέχονται οι λόγοι για τη μη χρήση της. Δεν θα πρέπει να εφαρμόζεται διόρθωση ως προς την εξάντληση του προσδέματος. Μετά την αρχική ανάλυση, κάθε καμπύλη δέσμευσης θα πρέπει να ελέγχεται ώστε να διασφαλίζεται η κατάλληλη προσαρμογή στο μοντέλο. Η σχετική συγγένεια δέσμευσης (RBA) για την ασθενώς δεσμευόμενη ουσία θα πρέπει να υπολογίζεται ως ποσοστό του λογάριθμου (IC50) για την ασθενώς δεσμευόμενη ουσία σε σχέση με τον λογάριθμο (IC50) για τη 17β-οιστραδιόλη. Τα αποτελέσματα από τους θετικούς μάρτυρες και τον μάρτυρα μη δεσμευόμενης ουσίας θα πρέπει να αξιολογούνται με χρήση των μέτρων των επιδόσεων δοκιμασίας των παραγράφων 44-49 του παρόντος προσαρτήματος 3.
|
|
55.
|
Τα δεδομένα για το σύνολο των υπό δοκιμή χημικών ουσιών θα πρέπει να αναλύονται με χρήση κλιμακωτής προσέγγισης ώστε να διασφαλίζεται η ορθή ανάλυσή τους και η σωστή ταξινόμηση κάθε καμπύλης ανταγωνιστικής δέσμευσης. Συνιστάται κάθε σειρά δοκιμών για υπό δοκιμή χημική ουσία να υποβάλλεται αρχικά σε τυποποιημένη ανάλυση δεδομένων πανομοιότυπη με την ανάλυση που χρησιμοποιείται για το οιστρογόνο αναφοράς και την ασθενώς δεσμευόμενη ουσία (βλ. παράγραφο 54 του παρόντος προσαρτήματος 3). Μετά την αρχική ανάλυση, θα πρέπει να γίνεται τεχνική επανεξέταση των παραμέτρων προσαρμογής της καμπύλης και να εξετάζεται οπτικά η ποιότητα της προσαρμογής των δεδομένων δέσμευσης στην προκύπτουσα καμπύλη ανταγωνιστικής δέσμευσης για κάθε σειρά δοκιμών. Εάν, κατά την τεχνική επανεξέταση, παρατηρηθεί εξαρτώμενη από τη συγκέντρωση μείωση του ποσοστού της ειδικά δεσμευμένης [3H]17β-οιστραδιόλης, χαμηλή μεταβλητότητα μεταξύ των τεχνικών πανομοιότυπων δειγμάτων σε κάθε συγκέντρωση υπό δοκιμή χημικής ουσίας, και συμφωνία των παραμέτρων προσαρμογής μεταξύ των τριών σειρών δοκιμών, αυτό αποτελεί ουσιαστική ένδειξη ότι η δοκιμασία και οι αναλύσεις δεδομένων διεξήχθησαν ορθά.
|
Ερμηνεία των δεδομένων
|
56.
|
Υπό την προϋπόθεση ότι πληρούνται όλα τα κριτήρια αποδοχής, μια υπό δοκιμή χημική ουσία θεωρείται δεσμευόμενη στον hrERα εάν είναι εφικτή η προσαρμογή μιας καμπύλης δέσμευσης και το χαμηλότερο σημείο της καμπύλης απόκρισης εντός της κλίμακας των δεδομένων είναι χαμηλότερο από 50 % (σχήμα 1).
|
|
57.
|
Υπό την προϋπόθεση ότι πληρούνται όλα τα κριτήρια αποδοχής, μια υπό δοκιμή χημική ουσία θεωρείται μη δεσμευόμενη στον hrERα εάν:
|
—
|
είναι εφικτή η προσαρμογή μιας καμπύλης δέσμευσης και το χαμηλότερο σημείο της προσαρμοσμένης καμπύλης απόκρισης εντός της κλίμακας των δεδομένων υπερβαίνει το 75 %, ή
|
|
—
|
δεν είναι εφικτή η προσαρμογή καμπύλης δέσμευσης και το χαμηλότερο μη εξομαλυμένο μέσο εκατοστιαίο ποσοστό δέσμευσης μεταξύ των ομάδων συγκέντρωσης στα δεδομένα υπερβαίνει το 75 %.
|
|
|
58.
|
Οι υπό δοκιμή χημικές ουσίες θεωρούνται αμφίβολες εάν δεν πληρούται καμία από τις ανωτέρω προϋποθέσεις (π.χ. το χαμηλότερο σημείο της προσαρμοσμένης καμπύλης απόκρισης βρίσκεται μεταξύ 76 και 51 %).
|
Πίνακας 7
Κριτήρια ταξινόμησης βάσει της καμπύλης ανταγωνιστικής δέσμευσης για υπό δοκιμή χημική ουσία
|
Ταξινόμηση
|
Κριτήρια
|
|
Δεσμευόμενηα
|
Είναι εφικτή η προσαρμογή καμπύλης δέσμευσης.
Το χαμηλότερο σημείο της καμπύλης απόκρισης εντός της κλίμακας των δεδομένων είναι χαμηλότερο από 50 %.
|
|
Μη δεσμευόμενηβ
|
Εάν είναι εφικτή η προσαρμογή καμπύλης δέσμευσης,
το χαμηλότερο σημείο της προσαρμοσμένης καμπύλης απόκρισης εντός της κλίμακας των δεδομένων υπερβαίνει το 75 %.
Εάν δεν είναι εφικτή η προσαρμογή καμπύλης δέσμευσης,
το χαμηλότερο μη εξομαλυμένο εκατοστιαίο ποσοστό δέσμευσης μεταξύ των ομάδων συγκέντρωσης στα δεδομένα υπερβαίνει το 75 %.
|
|
Αμφίβοληγ
|
Οποιαδήποτε ελέγξιμη σειρά δοκιμών η οποία δεν αντιστοιχεί ούτε σε δεσμευόμενη ούτε σε μη δεσμευόμενη ουσία
(π.χ. το χαμηλότερο σημείο της προσαρμοσμένης καμπύλης απόκρισης βρίσκεται μεταξύ 76 – 51 %).
|
Σχήμα 1
Παραδείγματα ταξινόμησης υπό δοκιμή χημικής ουσίας με χρήση καμπύλης ανταγωνιστικής δέσμευσης

|
59.
|
Πολλές σειρές δοκιμών που διεξάγονται σε ένα εργαστήριο για υπό δοκιμή χημική ουσία συνδυάζονται διά της απόδοσης αριθμητικών τιμών σε κάθε σειρά δοκιμών και διά της εξαγωγής του μέσου όρου των σειρών δοκιμών, όπως φαίνεται στον πίνακα 8. Τα αποτελέσματα των συνδυασμένων σειρών δοκιμών σε κάθε εργαστήριο συγκρίνονται με την αναμενόμενη ταξινόμηση για κάθε υπό δοκιμή χημική ουσία.
|
Πίνακας 8
Μέθοδος ταξινόμησης υπό δοκιμή χημικής ουσίας με χρήση πολλών σειρών δοκιμών σε ένα εργαστήριο
|
Για την απόδοση τιμής σε κάθε σειρά δοκιμών:
|
|
Ταξινόμηση
|
Αριθμητική τιμή
|
|
Δεσμευόμενη
|
2
|
|
Αμφίβολη
|
1
|
|
Μη δεσμευόμενη
|
0
|
|
Για την ταξινόμηση του μέσου όρου αριθμητικών τιμών στις σειρές δοκιμών:
|
|
Ταξινόμηση
|
Αριθμητική τιμή
|
|
Δεσμευόμενη
|
Μέσος όρος ≥ 1,5
|
|
Αμφίβολη
|
0,5 ≤ μέσος όρος < 1,5
|
|
Μη δεσμευόμενη
|
Μέσος όρος < 0,5
|
ΕΚΘΕΣΗ ΔΟΚΙΜΗΣ
|
60.
|
Βλ. παράγραφο 24 της ενότητας «ΣΤΟΙΧΕΙΑ ΔΟΚΙΜΑΣΙΑΣ ΔΕΣΜΕΥΣΗΣ hrER» της παρούσας μεθόδου δοκιμών.
|
Προσάρτημα 3.1
ΚΑΤΑΛΟΓΟΣ ΟΡΩΝ
[3H]E2
: 17β-οιστραδιόλη ραδιοσημασμένη με τρίτιο
DCC
: επιχρισμένος με δεξτράνη ενεργός άνθρακας
E2
: μη ραδιοσημασμένη 17β-οιστραδιόλη (αδρανής)
Ρυθμιστικό διάλυμα δοκιμασίας
: 10 mM Tris-HCl, pH 7,4, με 1 mM EDTA, 1 mM EGTA, 1 mM NaVO3, 10 % γλυκερόλη, 0,2 mM λευπεπτίνης, 1 mM διθειοθρεϊτόλης και 10 mg/ml αλβουμίνης βόειου ορού
hrERα
: ανασυνδυασμένος ανθρώπινος υποδοχέας οιστρογόνων α (περιοχή δέσμευσης προσδέματος)
Πανομοιότυπο δείγμα
: μία από πολλές κοιλότητες με το ίδιο περιεχόμενο στις ίδιες συγκεντρώσεις, οι οποίες υποβάλλονται ταυτόχρονα σε δοκιμή στο πλαίσιο μεμονωμένης σειράς δοκιμών. Στο παρόν πρωτόκολλο, κάθε συγκέντρωση της υπό δοκιμή χημικής ουσίας υποβάλλεται σε δοκιμή εις τριπλούν· δηλαδή υπάρχουν τρία πανομοιότυπα δείγματα που υποβάλλονται ταυτόχρονα σε δοκιμή για κάθε συγκέντρωση της υπό δοκιμή χημικής ουσίας.
Σειρά δοκιμών
: πλήρης σειρά ταυτόχρονα εξεταζόμενων κοιλοτήτων δοκιμασίας τρυβλίων μικροτιτλοδότησης, που παρέχει όλες τις πληροφορίες που είναι απαραίτητες για τον χαρακτηρισμό της δέσμευσης μιας υπό δοκιμή χημικής ουσίας στον hrERα (δηλαδή συνολική [3H]17β-οιστραδιόλη που προστίθεται στην κοιλότητα δοκιμασίας, μέγιστη δέσμευση [3H]17β-οιστραδιόλης στον hrERα, μη ειδική δέσμευση, και συνολική δέσμευση σε διάφορες συγκεντρώσεις υπό δοκιμή χημικής ουσίας). Μια σειρά δοκιμών μπορεί να περιλαμβάνει ακόμη και μία μόνο κοιλότητα δοκιμασίας (πανομοιότυπο δείγμα) ανά συγκέντρωση αλλά, δεδομένου ότι στο παρόν πρωτόκολλο απαιτείται η διεξαγωγή της δοκιμασίας εις τριπλούν, μία σειρά δοκιμών περιλαμβάνει τρεις κοιλότητες δοκιμασίας ανά συγκέντρωση. Επιπλέον, στο παρόν πρωτόκολλο απαιτούνται τρεις ανεξάρτητες (δηλ. μη παράλληλες) σειρές δοκιμών ανά χημική ουσία.
Προσάρτημα 3.2
ΔΙΑΤΑΞΗ ΚΟΙΛΟΤΗΤΩΝ ΔΟΚΙΜΑΣΙΑΣ ΑΝΤΑΓΩΝΙΣΤΙΚΗΣ ΔΕΣΜΕΥΣΗΣ
|
Τρυβλίο
|
Θέση
|
Πανομοιότυπο δείγμα
|
Τύπος κοιλότητας
|
Κωδικός κοιλότητας
|
Κωδικός συγκέντρωσης
|
Αρχική συγκέντρωση ανταγωνιστή (Μ)
|
Αποθεματικό διάλυμα hrER (ml)
|
Όγκος ρυθμιστικού διαλύματος (μl)
|
Όγκος ιχνηθέτη (σημασμένης E2) (μL)
|
Όγκος από το τρυβλίο αραίωσης (μL)
|
Τελικός όγκος (μl)
|
Τελική συγκέντρωση ανταγωνιστή (Μ)
|
|
S
|
A1
|
1
|
Τυφλό
|
BK
|
BK1
|
—
|
—
|
—
|
—
|
—
|
—
|
—
|
|
S
|
A2
|
2
|
Τυφλό
|
BK
|
BK2
|
—
|
—
|
—
|
—
|
—
|
—
|
—
|
|
S
|
A3
|
3
|
Τυφλό
|
BK
|
BK3
|
—
|
—
|
—
|
—
|
—
|
—
|
—
|
|
S
|
B1
|
1
|
μη ραδιοσημασμένη E2
|
S
|
S1
|
1,00E-10
|
30
|
50
|
10
|
10
|
100
|
1,0E-11
|
|
S
|
B2
|
2
|
μη ραδιοσημασμένη E2
|
S
|
S1
|
1,00E-10
|
30
|
50
|
10
|
10
|
100
|
1,0E-11
|
|
S
|
B3
|
3
|
μη ραδιοσημασμένη E2
|
S
|
S1
|
1,00E-10
|
30
|
50
|
10
|
10
|
100
|
1,0E-11
|
|
S
|
C1
|
1
|
μη ραδιοσημασμένη E2
|
S
|
S2
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
S
|
C2
|
2
|
μη ραδιοσημασμένη E2
|
S
|
S2
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
S
|
C3
|
3
|
μη ραδιοσημασμένη E2
|
S
|
S2
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
S
|
D1
|
1
|
μη ραδιοσημασμένη E2
|
S
|
S3
|
3,16E-09
|
30
|
50
|
10
|
10
|
100
|
3,2E-10
|
|
S
|
D2
|
2
|
μη ραδιοσημασμένη E2
|
S
|
S3
|
3,16E-09
|
30
|
50
|
10
|
10
|
100
|
3,2E-10
|
|
S
|
D3
|
3
|
μη ραδιοσημασμένη E2
|
S
|
S3
|
3,16E-09
|
30
|
50
|
10
|
10
|
100
|
3,2E-10
|
|
S
|
E1
|
1
|
μη ραδιοσημασμένη E2
|
S
|
S4
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
S
|
E2
|
2
|
μη ραδιοσημασμένη E2
|
S
|
S4
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
S
|
E3
|
3
|
μη ραδιοσημασμένη E2
|
S
|
S4
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
S
|
F1
|
1
|
μη ραδιοσημασμένη E2
|
S
|
S5
|
3,16E-08
|
30
|
50
|
10
|
10
|
100
|
3,2E-09
|
|
S
|
F2
|
2
|
μη ραδιοσημασμένη E2
|
S
|
S5
|
3,16E-08
|
30
|
50
|
10
|
10
|
100
|
3,2E-09
|
|
S
|
F3
|
3
|
μη ραδιοσημασμένη E2
|
S
|
S5
|
3,16E-08
|
30
|
50
|
10
|
10
|
100
|
3,2E-09
|
|
S
|
G1
|
1
|
μη ραδιοσημασμένη E2
|
S
|
S6
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
S
|
G2
|
2
|
μη ραδιοσημασμένη E2
|
S
|
S6
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
S
|
G3
|
3
|
μη ραδιοσημασμένη E2
|
S
|
S6
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
S
|
H1
|
1
|
μη ραδιοσημασμένο E2
|
S
|
S7
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
S
|
H2
|
2
|
μη ραδιοσημασμένη E2
|
S
|
S7
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
S
|
H3
|
3
|
μη ραδιοσημασμένη E2
|
S
|
S7
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
S
|
A4
|
1
|
νορεθυνοδρέλη
|
NE
|
WP1
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
S
|
A5
|
2
|
νορεθυνοδρέλη
|
NE
|
WP1
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
S
|
A6
|
3
|
νορεθυνοδρέλη
|
NE
|
WP1
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
S
|
B4
|
1
|
νορεθυνοδρέλη
|
NE
|
WP2
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
S
|
B5
|
2
|
νορεθυνοδρέλη
|
NE
|
WP2
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
S
|
B6
|
3
|
νορεθυνοδρέλη
|
NE
|
WP2
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
S
|
C4
|
1
|
νορεθυνοδρέλη
|
NE
|
WP3
|
3.16E-07
|
30
|
50
|
10
|
10
|
100
|
3,2E-08
|
|
S
|
C5
|
2
|
νορεθυνοδρέλη
|
NE
|
WP3
|
3,16E-07
|
30
|
50
|
10
|
10
|
100
|
3,2E-08
|
|
S
|
C6
|
3
|
νορεθυνοδρέλη
|
NE
|
WP3
|
3,16E-07
|
30
|
50
|
10
|
10
|
100
|
3,2E-08
|
|
S
|
D4
|
1
|
νορεθυνοδρέλη
|
NE
|
WP4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
S
|
D5
|
2
|
νορεθυνοδρέλη
|
NE
|
WP4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
S
|
D6
|
3
|
νορεθυνοδρέλη
|
NE
|
WP4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
S
|
E4
|
1
|
νορεθυνοδρέλη
|
NE
|
WP5
|
3,16E-06
|
30
|
50
|
10
|
10
|
100
|
3,2E-07
|
|
S
|
E5
|
2
|
νορεθυνοδρέλη
|
NE
|
WP5
|
3,16E-06
|
30
|
50
|
10
|
10
|
100
|
3,2E-07
|
|
S
|
E6
|
3
|
νορεθυνοδρέλη
|
NE
|
WP5
|
3,16E-06
|
30
|
50
|
10
|
10
|
100
|
3,2E-07
|
|
S
|
F4
|
1
|
νορεθυνοδρέλη
|
NE
|
WP6
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
S
|
F5
|
2
|
νορεθυνοδρέλη
|
NE
|
WP6
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
S
|
F6
|
3
|
νορεθυνοδρέλη
|
NE
|
WP6
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
S
|
G4
|
1
|
νορεθυνοδρέλη
|
NE
|
WP7
|
3,16E-05
|
30
|
50
|
10
|
10
|
100
|
3,2E-06
|
|
S
|
G5
|
2
|
νορεθυνοδρέλη
|
NE
|
WP7
|
3,16E-05
|
30
|
50
|
10
|
10
|
100
|
3,2E-06
|
|
S
|
G6
|
3
|
νορεθυνοδρέλη
|
NE
|
WP7
|
3,16E-05
|
30
|
50
|
10
|
10
|
100
|
3,2E-06
|
|
S
|
H4
|
1
|
νορεθυνοδρέλη
|
NE
|
WP8
|
3,16E-04
|
30
|
50
|
10
|
10
|
100
|
3,2E-05
|
|
S
|
H5
|
2
|
νορεθυνοδρέλη
|
NE
|
WP8
|
3,16E-04
|
30
|
50
|
10
|
10
|
100
|
3,2E-05
|
|
S
|
H6
|
3
|
νορεθυνοδρέλη
|
NE
|
WP8
|
3,16E-04
|
30
|
50
|
10
|
10
|
100
|
3,2E-05
|
|
S
|
A7
|
1
|
OTES
|
N
|
OTES1
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
S
|
A8
|
2
|
OTES
|
N
|
OTES1
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
S
|
A9
|
3
|
OTES
|
N
|
OTES1
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
S
|
B7
|
1
|
OTES
|
N
|
OTES2
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
S
|
B8
|
2
|
OTES
|
N
|
OTES2
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
S
|
B9
|
3
|
OTES
|
N
|
OTES2
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
S
|
C7
|
1
|
OTES
|
N
|
OTES3
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
S
|
C8
|
2
|
OTES
|
N
|
OTES3
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
S
|
C9
|
3
|
OTES
|
N
|
OTES3
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
S
|
D7
|
1
|
OTES
|
N
|
OTES4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
S
|
D8
|
2
|
OTES
|
N
|
OTES4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
S
|
D9
|
3
|
OTES
|
N
|
OTES4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
S
|
E7
|
1
|
OTES
|
N
|
OTES5
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
S
|
E8
|
2
|
OTES
|
N
|
OTES5
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
S
|
E9
|
3
|
OTES
|
N
|
OTES5
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
S
|
F7
|
1
|
OTES
|
N
|
OTES6
|
1,00E-04
|
30
|
50
|
10
|
10
|
100
|
1,0E-05
|
|
S
|
F8
|
2
|
OTES
|
N
|
OTES6
|
1,00E-04
|
30
|
50
|
10
|
10
|
100
|
1,0E-05
|
|
S
|
F9
|
3
|
OTES
|
N
|
OTES6
|
1,00E-04
|
30
|
50
|
10
|
10
|
100
|
1,0E-05
|
|
S
|
G7
|
1
|
OTES
|
N
|
OTES7
|
1,00E-03
|
30
|
50
|
10
|
10
|
100
|
1,0E-04
|
|
S
|
G8
|
2
|
OTES
|
N
|
OTES7
|
1,00E-03
|
30
|
50
|
10
|
10
|
100
|
1,0E-04
|
|
S
|
G9
|
3
|
OTES
|
N
|
OTES7
|
1,00E-03
|
30
|
50
|
10
|
10
|
100
|
1,0E-04
|
|
S
|
H7
|
1
|
OTES
|
N
|
OTES8DBP7
|
1,00E-02
|
30
|
50
|
10
|
10
|
100
|
1,0E-03
|
|
S
|
H8
|
2
|
OTES
|
N
|
OTES88
|
1,00E-02
|
30
|
50
|
10
|
10
|
100
|
1,0E-03
|
|
S
|
H9
|
3
|
OTES
|
N
|
OTES8
|
1,00E-02
|
30
|
50
|
10
|
10
|
100
|
1,0E-03
|
|
S
|
A10
|
1
|
συνολική δέσμευση
|
TB
|
TB1
|
—
|
30
|
60
|
10
|
—
|
100
|
—
|
|
S
|
A11
|
2
|
συνολική δέσμευση
|
TB
|
TB2
|
—
|
30
|
60
|
10
|
—
|
100
|
—
|
|
S
|
A12
|
3
|
συνολική δέσμευση
|
TB
|
TB3
|
—
|
30
|
60
|
10
|
—
|
100
|
—
|
|
S
|
B10
|
4
|
συνολική δέσμευση
|
TB
|
TB4
|
—
|
30
|
60
|
10
|
—
|
100
|
—
|
|
S
|
B11
|
5
|
συνολική δέσμευση
|
TB
|
TB5
|
—
|
30
|
60
|
10
|
—
|
100
|
—
|
|
S
|
B12
|
6
|
συνολική δέσμευση
|
TB
|
TB6
|
—
|
30
|
60
|
10
|
—
|
100
|
—
|
|
S
|
C10
|
1
|
μη ραδιοσημασμένη E2 (υψηλό)
|
NSB
|
S1
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
S
|
C11
|
2
|
μη ραδιοσημασμένη E2 (υψηλό)
|
NSB
|
S2
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
S
|
C12
|
3
|
μη ραδιοσημασμένη E2 (υψηλό)
|
NSB
|
S3
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
S
|
D10
|
4
|
μη ραδιοσημασμένη E2 (υψηλό)
|
NSB
|
S4
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
S
|
D11
|
5
|
μη ραδιοσημασμένη E2 (υψηλό)
|
NSB
|
S5
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
S
|
D12
|
6
|
μη ραδιοσημασμένη E2 (υψηλό)
|
NSB
|
S6
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
S
|
E10
|
1
|
Μάρτυρας με ρυθμιστικό διάλυμα
|
BC
|
BC1
|
—
|
—
|
100
|
—
|
—
|
100
|
—
|
|
S
|
E11
|
2
|
Μάρτυρας με ρυθμιστικό διάλυμα
|
BC
|
BC2
|
—
|
—
|
100
|
—
|
—
|
100
|
—
|
|
S
|
E12
|
3
|
Μάρτυρας με ρυθμιστικό διάλυμα
|
BC
|
BC3
|
—
|
—
|
100
|
—
|
—
|
100
|
—
|
|
S
|
F10
|
4
|
Μάρτυρας με ρυθμιστικό διάλυμα
|
BC
|
BC4
|
—
|
—
|
100
|
—
|
—
|
100
|
—
|
|
S
|
F11
|
5
|
Μάρτυρας με ρυθμιστικό διάλυμα
|
BC
|
BC5
|
—
|
—
|
100
|
—
|
—
|
100
|
—
|
|
S
|
F12
|
6
|
Μάρτυρας με ρυθμιστικό διάλυμα
|
BC
|
BC6
|
—
|
—
|
100
|
—
|
—
|
100
|
—
|
|
S
|
G10 (*17)
|
1
|
Τυφλό (για ραδιοσήμανση)
|
Ραδιοσημασμένο
|
H1
|
—
|
90
|
—
|
10
|
—
|
100
|
—
|
|
S
|
G11 (*17)
|
2
|
Τυφλό (για ραδιοσήμανση)
|
Ραδιοσημασμένο
|
H2
|
—
|
90
|
—
|
10
|
—
|
100
|
—
|
|
S
|
G12 (*17)
|
3
|
Τυφλό (για ραδιοσήμανση)
|
Ραδιοσημασμένο
|
H3
|
—
|
90
|
—
|
10
|
—
|
100
|
—
|
|
S
|
H10 (*17)
|
4
|
Τυφλό (για ραδιοσήμανση)
|
Ραδιοσημασμένο
|
H4
|
—
|
90
|
—
|
10
|
—
|
100
|
—
|
|
S
|
H11 (*17)
|
5
|
Τυφλό (για ραδιοσήμανση)
|
Ραδιοσημασμένο
|
H5
|
—
|
90
|
—
|
10
|
—
|
100
|
—
|
|
S
|
H12
|
6
|
Τυφλό (για ραδιοσήμανση)
|
Ραδιοσημασμένο
|
H6
|
—
|
90
|
—
|
10
|
—
|
100
|
—
|
|
P1
|
A1
|
1
|
Άγνωστο 1
|
U1
|
1
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
P1
|
A2
|
2
|
Άγνωστο 1
|
U1
|
1
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
P1
|
A3
|
3
|
Άγνωστο 1
|
U1
|
1
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
P1
|
B1
|
1
|
Άγνωστο 1
|
U1
|
2
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
P1
|
B2
|
2
|
Άγνωστο 1
|
U1
|
2
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
P1
|
B3
|
3
|
Άγνωστο 1
|
U1
|
2
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
P1
|
C1
|
1
|
Άγνωστο 1
|
U1
|
3
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
P1
|
C2
|
2
|
Άγνωστο 1
|
U1
|
3
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
P1
|
C3
|
3
|
Άγνωστο 1
|
U1
|
3
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
P1
|
D1
|
1
|
Άγνωστο 1
|
U1
|
4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
P1
|
D2
|
2
|
Άγνωστο 1
|
U1
|
4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
P1
|
D3
|
3
|
Άγνωστο 1
|
U1
|
4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
P1
|
E1
|
1
|
Άγνωστο 1
|
U1
|
5
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
E2
|
2
|
Άγνωστο 1
|
U1
|
5
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
E3
|
3
|
Άγνωστο 1
|
U1
|
5
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
F1
|
1
|
Άγνωστο 1
|
U1
|
6
|
1,00E-04
|
30
|
50
|
10
|
10
|
100
|
1,0E-05
|
|
P1
|
F2
|
2
|
Άγνωστο 1
|
U1
|
6
|
1,00E-04
|
30
|
50
|
10
|
10
|
100
|
1,0E-05
|
|
P1
|
F3
|
3
|
Άγνωστο 1
|
U1
|
6
|
1,00E-04
|
30
|
50
|
10
|
10
|
100
|
1,0E-05
|
|
P1
|
G1
|
1
|
Άγνωστο 1
|
U1
|
7
|
1,00E-03
|
30
|
50
|
10
|
10
|
100
|
1,0E-04
|
|
P1
|
G2
|
2
|
Άγνωστο 1
|
U1
|
7
|
1,00E-03
|
30
|
50
|
10
|
10
|
100
|
1,0E-04
|
|
P1
|
G3
|
3
|
Άγνωστο 1
|
U1
|
7
|
1,00E-03
|
30
|
50
|
10
|
10
|
100
|
1,0E-04
|
|
P1
|
H1
|
1
|
Άγνωστο 1
|
U1
|
8
|
1,00E-02
|
30
|
50
|
10
|
10
|
100
|
1,0E-03
|
|
P1
|
H2
|
2
|
Άγνωστο 1
|
U1
|
8
|
1,00E-02
|
30
|
50
|
10
|
10
|
100
|
1,0E-03
|
|
P1
|
H3
|
3
|
Άγνωστο 1
|
U1
|
8
|
1,00E-02
|
30
|
50
|
10
|
10
|
100
|
1,0E-03
|
|
P1
|
A4
|
1
|
Άγνωστο 2
|
U2
|
1
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
P1
|
A5
|
2
|
Άγνωστο 2
|
U2
|
1
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
P1
|
A6
|
3
|
Άγνωστο 2
|
U2
|
1
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
P1
|
B4
|
1
|
Άγνωστο 2
|
U2
|
2
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
P1
|
B5
|
2
|
Άγνωστο 2
|
U2
|
2
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
P1
|
B6
|
3
|
Άγνωστο 2
|
U2
|
2
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
P1
|
C4
|
1
|
Άγνωστο 2
|
U2
|
3
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
P1
|
C5
|
2
|
Άγνωστο 2
|
U2
|
3
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
P1
|
C6
|
3
|
Άγνωστο 2
|
U2
|
3
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
P1
|
D4
|
1
|
Άγνωστο 2
|
U2
|
4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
P1
|
D5
|
2
|
Άγνωστο 2
|
U2
|
4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
P1
|
D6
|
3
|
Άγνωστο 2
|
U2
|
4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
P1
|
E4
|
1
|
Άγνωστο 2
|
U2
|
5
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
E5
|
2
|
Άγνωστο 2
|
U2
|
5
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
E6
|
3
|
Άγνωστο 2
|
U2
|
5
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
F4
|
1
|
Άγνωστο 2
|
U2
|
6
|
1,00E-04
|
30
|
50
|
10
|
10
|
100
|
1,0E-05
|
|
P1
|
F5
|
2
|
Άγνωστο 2
|
U2
|
6
|
1,00E-04
|
30
|
50
|
10
|
10
|
100
|
1,0E-05
|
|
P1
|
F6
|
3
|
Άγνωστο 2
|
U2
|
6
|
1,00E-04
|
30
|
50
|
10
|
10
|
100
|
1,0E-05
|
|
P1
|
G4
|
1
|
Άγνωστο 2
|
U2
|
7
|
1,00E-03
|
30
|
50
|
10
|
10
|
100
|
1,0E-04
|
|
P1
|
G5
|
2
|
Άγνωστο 2
|
U2
|
7
|
1,00E-03
|
30
|
50
|
10
|
10
|
100
|
1,0E-04
|
|
P1
|
G6
|
3
|
Άγνωστο 2
|
U2
|
7
|
1,00E-03
|
30
|
50
|
10
|
10
|
100
|
1,0E-04
|
|
P1
|
H4
|
1
|
Άγνωστο 2
|
U2
|
8
|
1,00E-02
|
30
|
50
|
10
|
10
|
100
|
1,0E-03
|
|
P1
|
H5
|
2
|
Άγνωστο 2
|
U2
|
8
|
1,00E-02
|
30
|
50
|
10
|
10
|
100
|
1,0E-03
|
|
P1
|
H6
|
3
|
Άγνωστο 2
|
U2
|
8
|
1,00E-02
|
30
|
50
|
10
|
10
|
100
|
1,0E-03
|
|
P1
|
A7
|
1
|
Άγνωστο 3
|
U3
|
1
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
P1
|
A8
|
2
|
Άγνωστο 3
|
U3
|
1
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
P1
|
A9
|
3
|
Άγνωστο 3
|
U3
|
1
|
1,00E-09
|
30
|
50
|
10
|
10
|
100
|
1,0E-10
|
|
P1
|
B7
|
1
|
Άγνωστο 3
|
U3
|
2
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
P1
|
B8
|
2
|
Άγνωστο 3
|
U3
|
2
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
P1
|
B9
|
3
|
Άγνωστο 3
|
U3
|
2
|
1,00E-08
|
30
|
50
|
10
|
10
|
100
|
1,0E-09
|
|
P1
|
C7
|
1
|
Άγνωστο 3
|
U3
|
3
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
P1
|
C8
|
2
|
Άγνωστο 3
|
U3
|
3
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
P1
|
C9
|
3
|
Άγνωστο 3
|
U3
|
3
|
1,00E-07
|
30
|
50
|
10
|
10
|
100
|
1,0E-08
|
|
P1
|
D7
|
1
|
Άγνωστο 3
|
U3
|
4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
P1
|
D8
|
2
|
Άγνωστο 3
|
U3
|
4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
P1
|
D9
|
3
|
Άγνωστο 3
|
U3
|
4
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,0E-07
|
|
P1
|
E7
|
1
|
Άγνωστο 3
|
U3
|
5
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
E8
|
2
|
Άγνωστο 3
|
U3
|
5
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
E9
|
3
|
Άγνωστο 3
|
U3
|
5
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
F7
|
1
|
Άγνωστο 3
|
U3
|
6
|
1,00E-04
|
30
|
50
|
10
|
10
|
100
|
1,0E-05
|
|
P1
|
F8
|
2
|
Άγνωστο 3
|
U3
|
6
|
1,00E-04
|
30
|
50
|
10
|
10
|
100
|
1,0E-05
|
|
P1
|
F9
|
3
|
Άγνωστο 3
|
U3
|
6
|
1,00E-04
|
30
|
50
|
10
|
10
|
100
|
1,0E-05
|
|
P1
|
G7
|
1
|
Άγνωστο 3
|
U3
|
7
|
1,00E-03
|
30
|
50
|
10
|
10
|
100
|
1,0E-04
|
|
P1
|
G8
|
2
|
Άγνωστο 3
|
U3
|
7
|
1,00E-03
|
30
|
50
|
10
|
10
|
100
|
1,0E-04
|
|
P1
|
G9
|
3
|
Άγνωστο 3
|
U3
|
7
|
1,00E-03
|
30
|
50
|
10
|
10
|
100
|
1,0E-04
|
|
P1
|
H7
|
1
|
Άγνωστο 3
|
U3
|
8
|
1,00E-02
|
30
|
50
|
10
|
10
|
100
|
1,0E-03
|
|
P1
|
H8
|
2
|
Άγνωστο 3
|
U3
|
8
|
1,00E-02
|
30
|
50
|
10
|
10
|
100
|
1,0E-03
|
|
P1
|
H9
|
3
|
Άγνωστο 3
|
U3
|
8
|
1,00E-02
|
30
|
50
|
10
|
10
|
100
|
1,0E-03
|
|
P1
|
A10
|
1
|
Μάρτυρας Ε2 (μέγ.)
|
S
|
E2max1
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,00E-07
|
|
P1
|
A11
|
2
|
Μάρτυρας Ε2 (μέγ.)
|
S
|
E2max2
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,00E-07
|
|
P1
|
A12
|
3
|
Μάρτυρας Ε2 (μέγ.)
|
S
|
E2max3
|
1,00E-06
|
30
|
50
|
10
|
10
|
100
|
1,00E-07
|
|
P1
|
B10
|
1
|
Μάρτυρας Ε2 (IC50)
|
S
|
E2IC501
|
E2IC50x10
|
30
|
50
|
10
|
10
|
100
|
E2IC50
|
|
P1
|
B11
|
2
|
Μάρτυρας Ε2 (IC50)
|
S
|
E2IC502
|
E2IC50x10
|
30
|
50
|
10
|
10
|
100
|
E2IC50
|
|
P1
|
B12
|
3
|
Μάρτυρας Ε2 (IC50)
|
S
|
E2IC503
|
E2IC50x10
|
30
|
50
|
10
|
10
|
100
|
E2IC50
|
|
P1
|
C10
|
1
|
Μάρτυρας NE (μέγ.)
|
S
|
Nemax1
|
1,00E-3,5
|
30
|
50
|
10
|
10
|
100
|
1,00E-4,5
|
|
P1
|
C11
|
2
|
Μάρτυρας NE (μέγ.)
|
S
|
Nemax2
|
1,00E-3,5
|
30
|
50
|
10
|
10
|
100
|
1,00E-4,5
|
|
P1
|
C12
|
3
|
Μάρτυρας NE (μέγ.)
|
S
|
Nemax3
|
1,00E-3,5
|
30
|
50
|
10
|
10
|
100
|
1,00E-4,5
|
|
P1
|
D10
|
1
|
Μάρτυρας ΝΕ (IC50)
|
S
|
NEIC501
|
NEIC50 x10
|
30
|
50
|
10
|
10
|
100
|
NEIC50
|
|
P1
|
D11
|
2
|
Μάρτυρας ΝΕ (IC50)
|
S
|
NEIC502
|
NEIC50 x10
|
30
|
50
|
10
|
10
|
100
|
NEIC50
|
|
P1
|
D12
|
3
|
Μάρτυρας ΝΕ (IC50)
|
S
|
NEIC503
|
NEIC50 x10
|
30
|
50
|
10
|
10
|
100
|
NEIC50
|
|
P1
|
E10
|
1
|
μη ραδιοσημασμένη E2 (υψηλό)
|
NSB
|
S1
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
E11
|
2
|
μη ραδιοσημασμένη E2 (υψηλό)
|
NSB
|
S2
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
E12
|
3
|
μη ραδιοσημασμένη E2 (υψηλό)
|
NSB
|
S3
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
F10
|
4
|
μη ραδιοσημασμένη E2 (υψηλό)
|
NSB
|
S4
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
F11
|
5
|
μη ραδιοσημασμένη E2 (υψηλό)
|
NSB
|
S5
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
F12
|
6
|
μη ραδιοσημασμένη E2 (υψηλό)
|
NSB
|
S6
|
1,00E-05
|
30
|
50
|
10
|
10
|
100
|
1,0E-06
|
|
P1
|
G10
|
1
|
συνολική δέσμευση
|
TB
|
TB1
|
—
|
30
|
60
|
10
|
—
|
100
|
—
|
|
P1
|
G11
|
2
|
συνολική δέσμευση
|
TB
|
TB2
|
—
|
30
|
60
|
10
|
—
|
100
|
—
|
|
P1
|
G12
|
3
|
συνολική δέσμευση
|
TB
|
TB3
|
—
|
30
|
60
|
10
|
—
|
100
|
—
|
|
P1
|
H10
|
4
|
συνολική δέσμευση
|
TB
|
TB4
|
—
|
30
|
60
|
10
|
—
|
100
|
—
|
|
P1
|
H11
|
5
|
συνολική δέσμευση
|
TB
|
TB5
|
—
|
30
|
60
|
10
|
—
|
100
|
—
|
|
P1
|
H12
|
6
|
συνολική δέσμευση
|
TB
|
TB6
|
—
|
30
|
60
|
10
|
—
|
100
|
—
|
Προσάρτημα 4
ΕΚΤΙΜΗΣΕΙΣ ΓΙΑ ΤΗΝ ΑΝΑΛΥΣΗ ΔΕΔΟΜΕΝΩΝ ΑΠΟ ΤΗ ΔΟΚΙΜΑΣΙΑ ΑΝΤΑΓΩΝΙΣΤΙΚΗΣ ΔΕΣΜΕΥΣΗΣ HRER
|
1.
|
Η δοκιμασία ανταγωνιστικής δέσμευσης hrERα μετρά τη δέσμευση μιας μεμονωμένης συγκέντρωσης [3H]17β- οιστραδιόλης παρουσία αυξανόμενων συγκεντρώσεων υπό δοκιμή χημικής ουσίας. Η καμπύλη ανταγωνιστικής δέσμευσης χαράσσεται ως ειδική δέσμευση [3H]17β-οιστραδιόλης έναντι της συγκέντρωσης (μονάδες log10) του ανταγωνιστή. Η συγκέντρωση της υπό δοκιμή χημικής ουσίας που αναστέλλει το 50 % της μέγιστης ειδικής δέσμευσης [3H]17β-οιστραδιόλης είναι η IC50.
|
Ανάλυση δεδομένων για το οιστρογόνο αναφοράς και την ασθενώς δεσμευόμενη ουσία (1)
|
2.
|
Τα δεδομένα από τις σειρές δοκιμών μάρτυρα (δηλ. η εκατοστιαία ειδική δέσμευση [3H]17β-οιστραδιόλης και η λογαριθμική συγκέντρωση της υπό δοκιμή χημικής ουσίας) μετασχηματίζονται για περαιτέρω ανάλυση. Οι εκτιμήσεις των τιμών log(IC50) για τους θετικούς μάρτυρες (οιστρογόνο αναφοράς και ασθενώς δεσμευόμενη ουσία) θα πρέπει να προσδιορίζονται με χρήση λογισμικού μη γραμμικής προσαρμογής καμπύλης κατάλληλου για την προσαρμογή εξίσωσης Hill τεσσάρων παραμέτρων (π.χ. BioSoft, GraphPad Prism) (2). Κατά την προσαρμογή των καμπυλών, η μέγιστη τιμή, η ελάχιστη τιμή, η κλίση και ο λογάριθμος (IC50) μπορούν κατά κανόνα να αφεθούν χωρίς περιορισμό. Κατά τον προσδιορισμό της βέλτιστης προσαρμογής, θα πρέπει να χρησιμοποιείται ανάλυση εύρωστης παλινδρόμησης, εκτός εάν παρέχονται οι λόγοι για τη μη χρήση της. Θα πρέπει να αναφέρεται η επιλεγμένη μέθοδος για την εύρωστη παλινδρόμηση. Για τις δοκιμασίες hrER FW ή CERI δεν χρειάζεται διόρθωση ως προς την εξάντληση του προσδέματος, αλλά μπορεί να εξεταστεί ως ενδεχόμενο, εάν χρειαστεί. Μετά την αρχική ανάλυση, κάθε καμπύλη δέσμευσης θα πρέπει να ελέγχεται ώστε να διασφαλίζεται η κατάλληλη προσαρμογή στο μοντέλο. Η σχετική συγγένεια δέσμευσης (RBA) για την ασθενώς δεσμευόμενη ουσία μπορεί να υπολογιστεί ως ποσοστό του λογάριθμου (IC50) για την ασθενώς δεσμευόμενη ουσία σε σχέση με τον λογάριθμο (IC50) για τη 17β-οιστραδιόλη. Τα αποτελέσματα για τους θετικούς μάρτυρες και τον μάρτυρα μη δεσμευόμενης ουσίας θα πρέπει να αξιολογούνται με βάση τα μέτρα επιδόσεων της δοκιμασίας και τα κριτήρια αποδοχής που περιγράφονται στην παρούσα μέθοδο δοκιμών (παράγραφος 20), προσάρτημα 2 (δοκιμασία FW, παράγραφοι 41-51) και προσάρτημα 3 (δοκιμασία CERI, παράγραφοι 41-51). Παραδείγματα 3 σειρών δοκιμών για το οιστρογόνο αναφοράς και την ασθενώς δεσμευόμενη ουσία φαίνονται στο σχήμα 1.
|
Σχήμα 1
Παραδείγματα των καμπυλών ανταγωνιστικής δέσμευσης για το οιστρογόνο αναφοράς και τον μάρτυρα ασθενώς δεσμευόμενης ουσίας

Ανάλυση δεδομένων για τις υπό δοκιμή χημικές ουσίες
|
3.
|
Τα δεδομένα για το σύνολο των υπό δοκιμή χημικών ουσιών θα πρέπει να αναλύονται με χρήση κλιμακωτής προσέγγισης ώστε να διασφαλίζεται η ορθή ανάλυσή τους και η σωστή ταξινόμηση κάθε καμπύλης ανταγωνιστικής δέσμευσης. Κάθε σειρά δοκιμών για υπό δοκιμή χημική ουσία θα πρέπει να υποβάλλεται αρχικά σε τυποποιημένη ανάλυση δεδομένων πανομοιότυπη με την ανάλυση που χρησιμοποιείται για το οιστρογόνο αναφοράς και την ασθενώς δεσμευόμενη ουσία. Μετά την αρχική ανάλυση, θα πρέπει να γίνεται τεχνική επανεξέταση των παραμέτρων προσαρμογής της καμπύλης και να εξετάζεται οπτικά η ποιότητα της προσαρμογής των δεδομένων δέσμευσης στην προκύπτουσα καμπύλη ανταγωνιστικής δέσμευσης για κάθε σειρά δοκιμών. Εάν, κατά την τεχνική επανεξέταση, παρατηρηθεί εξαρτώμενη από τη συγκέντρωση μείωση του ποσοστού της ειδικά δεσμευμένης [3H]17β-οιστραδιόλης, χαμηλή μεταβλητότητα μεταξύ των τεχνικών πανομοιότυπων δειγμάτων σε κάθε συγκέντρωση χημικής ουσίας, και συμφωνία των παραμέτρων προσαρμογής μεταξύ των τριών σειρών δοκιμών, αυτό αποτελεί ουσιαστική ένδειξη ότι η δοκιμασία και οι αναλύσεις δεδομένων διεξήχθησαν ορθά. Η επανεξέταση των αποτελεσμάτων από κάθε σειρά δοκιμών για υπό δοκιμή χημική ουσία θα πρέπει να βασίζεται σε επαγγελματική κρίση, και τα δεδομένα που χρησιμοποιούνται για την ταξινόμηση κάθε υπό δοκιμή χημικής ουσίας ως δεσμευόμενη ή μη δεσμευόμενη θα πρέπει να είναι επιστημονικά τεκμηριωμένα.
|
|
4.
|
Περιστασιακά, μπορεί να υπάρχουν παραδείγματα δεδομένων που χρήζουν μεγαλύτερης προσοχής προκειμένου να αναλυθούν και να ερμηνευτούν δεόντως τα δεδομένα δέσμευσης hrER. Σε προηγούμενες μελέτες είχαν παρουσιαστεί περιπτώσεις στις οποίες η ανάλυση και η ερμηνεία των δεδομένων ανταγωνιστικής δέσμευσης υποδοχέα περιπλέκεται λόγω ανόδου της εκατοστιαίας ειδικής δέσμευσης κατά τις δοκιμές χημικών ουσιών στις υψηλότερες συγκεντρώσεις (σχήμα 2). Πρόκειται για γνωστό ζήτημα που προκύπτει όταν χρησιμοποιούνται πρωτόκολλα για μια σειρά δοκιμασιών ανταγωνιστικής δέσμευσης υποδοχέα (3). Σε αυτές τις περιπτώσεις, στις χαμηλότερες συγκεντρώσεις παρατηρείται εξαρτώμενη από τη συγκέντρωση απόκριση, αλλά καθώς η συγκέντρωση της υπό δοκιμή χημικής ουσίας προσεγγίζει το όριο διαλυτότητας, η εκτόπιση της [3H]17β-οιστραδιόλης παύει να μειώνεται. Σε αυτές τις περιπτώσεις, τα δεδομένα για τις υψηλότερες συγκεντρώσεις υποδεικνύουν ότι η δοκιμασία έχει φθάσει στο βιολογικό όριό της. Για παράδειγμα, το φαινόμενο αυτό συνδέεται πολλές φορές με τη χημική αδιαλυτότητα και κατακρήμνιση σε υψηλές συγκεντρώσεις, ή μπορεί επίσης να αντικατοπτρίζει την υπέρβαση της ικανότητας του επιχρισμένου με δεξτράνη ενεργού άνθρακα να παγιδεύει το αδέσμευτο ραδιοσημασμένο πρόσδεμα κατά τη διαδικασία διαχωρισμού στις υψηλότερες συγκεντρώσεις των χημικών ουσιών. Η συμπερίληψη αυτού του είδους των σημείων δεδομένων κατά την προσαρμογή δεδομένων ανταγωνιστικής δέσμευσης σε σιγμοειδή καμπύλη μπορεί ενίοτε να οδηγήσει σε εσφαλμένη ταξινόμηση του δυναμικού δέσμευσης μιας υπό δοκιμή χημικής ουσίας στον ER (σχήμα 2). Για την αποφυγή σφάλματος, το πρωτόκολλο για τις δοκιμασίες δέσμευσης hrER FW και CERI περιλαμβάνει τη δυνατότητα αποκλεισμού σημείων δεδομένων από τις αναλύσεις σε περιπτώσεις κατά τις οποίες ο μέσος όρος των πανομοιότυπων δειγμάτων για την εκατοστιαία ειδική δέσμευση της [3H]17β-οιστραδιόλης υπερβαίνει κατά 10 % ή περισσότερο τη μέση τιμή που παρατηρείται σε χαμηλότερη συγκέντρωση (ο λεγόμενος «κανόνας του 10 %»). Ο κανόνας αυτός μπορεί να χρησιμοποιηθεί μόνο μία φορά για μια ορισμένη καμπύλη και τα δεδομένα που απομένουν πρέπει να καλύπτουν τουλάχιστον 6 συγκεντρώσεις προκειμένου να είναι εφικτή η σωστή ταξινόμηση της καμπύλης.
|
Σχήμα 2
Παραδείγματα καμπυλών ανταγωνιστικής δέσμευσης με και χωρίς τη χρήση του κανόνα του 10 %

|
5.
|
Η ορθή χρήση του κανόνα του 10 % για τη διόρθωση τέτοιων καμπυλών θα πρέπει να εξετάζεται προσεκτικά, και συνιστάται να εφαρμόζεται μόνο σε εκείνες τις περιπτώσεις στις οποίες υπάρχουν ισχυρές ενδείξεις για ουσία δεσμευόμενη στον hrER. Κατά τη διεξαγωγή των πειραμάτων για τη μελέτη επικύρωσης της δοκιμασίας hrER FW, παρατηρήθηκε ότι ο κανόνας του 10 % είχε ενίοτε μια ακούσια και απρόβλεπτη συνέπεια. Οι χημικές ουσίες που δεν αλληλεπιδρούσαν με τον υποδοχέα (αληθείς μη δεσμευόμενες ουσίες) εμφάνιζαν συχνά μεταβλητότητα γύρω από τη δέσμευση ραδιοσημασμένου προσδέματος 100 % η οποία ήταν μεγαλύτερη από το 10 % σε όλες τις συγκεντρώσεις που υποβάλλονταν σε δοκιμή. Εάν η χαμηλότερη τιμή συνέβαινε να βρίσκεται σε χαμηλή συγκέντρωση, τα δεδομένα από όλες τις υψηλότερες συγκεντρώσεις θα μπορούσαν ενδεχομένως να αποκλειστούν από την ανάλυση εάν εφαρμοζόταν ο κανόνας του 10 %, παρότι οι συγκεντρώσεις αυτές θα ήταν χρήσιμες για τον χαρακτηρισμό της χημικής ουσίας ως μη δεσμευόμενης. Στο σχήμα 3 φαίνονται παραδείγματα στα οποία δεν αρμόζει η χρήση του κανόνα του 10 %.
|
Σχήμα 3
Παραδείγματα δεδομένων ανταγωνιστικής δέσμευσης στα οποία δεν αρμόζει η χρήση του κανόνα του 10 %
Παραπομπές
|
(1)
|
OECD (2015). Integrated Summary Report: Validation of Two Binding Assays Using Human Recombinant Estrogen Receptor Alpha (hrERα), Health and Safety Publications, Series on Testing and Assessment (No 226), Organisation for Economic Cooperation and Development, Paris.
|
|
(2)
|
Motulsky H. and Christopoulos A. (2003). The law of mass action, In Fitting Models to Biological Data Using Linear and Non-linear Regression. GraphPad Software Inc., San Diego, CA, pp 187-191. www.graphpad.com/manuals/Prism4/RegressionBook.pdf
|
|
(3)
|
Laws SC, Yavanhxay S, Cooper RL, Eldridge JC. (2006). Nature of the Binding Interaction for 50 Structurally Diverse Chemicals with Rat Estrogen Receptors. Toxicological Sci. 94(1):46-56.
|
B.71
IN VITRO ΔΟΚΙΜΑΣΙΕΣ ΕΥΑΙΣΘΗΤΟΠΟΙΗΣΗΣ ΤΟΥ ΔΕΡΜΑΤΟΣ ΠΟΥ ΑΦΟΡΟΥΝ ΤΟ ΒΑΣΙΚΟ ΣΥΜΒΑΝ ΤΗΣ ΕΝΕΡΓΟΠΟΙΗΣΗΣ ΤΩΝ ΔΕΝΔΡΙΤΙΚΩΝ ΚΥΤΤΑΡΩΝ ΣΤΗΝ ΠΟΡΕΙΑ ΔΥΣΜΕΝΟΥΣ ΕΚΒΑΣΗΣ (AOP) ΓΙΑ ΤΗΝ ΕΥΑΙΣΘΗΤΟΠΟΙΗΣΗ ΤΟΥ ΔΕΡΜΑΤΟΣ
ΓΕΝΙΚΗ ΕΙΣΑΓΩΓΗ
Μέθοδος δοκιμών που βασίζεται στο βασικό συμβάν της ενεργοποίησης των δενδριτικών κυττάρων
|
1.
|
Ευαισθητοποιητικές του δέρματος ονομάζονται οι ουσίες οι οποίες, όταν έρχονται επαφή με το δέρμα, προκαλούν αλλεργική αντίδραση όπως ορίζεται στο Παγκοσμίως Εναρμονισμένο Σύστημα των Ηνωμένων Εθνών για την Ταξινόμηση και Επισήμανση των Χημικών Ουσιών (GHS του ΟΗΕ) (1) και στον κανονισμό (ΕΕ) αριθ. 1272/2008 της Ευρωπαϊκής Ένωσης για την ταξινόμηση, την επισήμανση και τη συσκευασία των ουσιών και των μειγμάτων (CLP) (99). Υπάρχει γενική συμφωνία για τα βασικά υποκείμενα βιολογικά συμβάντα στη δερματική ευαισθητοποίηση. Οι υπάρχουσες γνώσεις σχετικά με τους χημικούς και βιολογικούς μηχανισμούς που συνδέονται με τη δερματική ευαισθητοποίηση έχουν συνοψιστεί με τη μορφή μιας πορείας δυσμενούς έκβασης (Adverse Outcome Pathway, AOP) στο πλαίσιο του προγράμματος AOP του ΟΟΣΑ (2) – από το μοριακό εναρκτήριο συμβάν μέχρι τα ενδιάμεσα συμβάντα και τη δυσμενή επίδραση, δηλαδή την αλλεργική δερματίτιδα εξ επαφής. Στη συγκεκριμένη περίπτωση, το μοριακό εναρκτήριο συμβάν (δηλ. το πρώτο βασικό συμβάν) είναι η ομοιοπολική δέσμευση ηλεκτρονιόφιλων ουσιών σε πυρηνόφιλα κέντρα των πρωτεϊνών του δέρματος. Το δεύτερο βασικό συμβάν στην εν λόγω AOP σημειώνεται στα κερατινοκύτταρα και περιλαμβάνει φλεγμονώδεις αποκρίσεις, καθώς και αλλαγές στην έκφραση γονιδίων που συνδέονται με συγκεκριμένες πορείες κυτταρικής σηματοδότησης, όπως εκείνες που εξαρτώνται από το στοιχείο απόκρισης στα αντιοξειδωτικά/ηλεκτρονιόφιλα (Antioxidant Response Element, ARE). Το τρίτο βασικό συμβάν είναι η ενεργοποίηση των δενδριτικών κυττάρων (DC), που συνήθως αξιολογείται με βάση την έκφραση ειδικών δεικτών της κυτταρικής επιφάνειας, χημειοκινών και κυτταροκινών. Το τέταρτο βασικό συμβάν είναι η ενεργοποίηση και ο πολλαπλασιασμός των κυττάρων Τ, που αξιολογείται έμμεσα με τη δοκιμασία επιχώριων λεμφαδένων σε ποντικό (LLNA) (3).
|
|
2.
|
Η παρούσα μέθοδος δοκιμών είναι ισοδύναμη με την κατευθυντήρια γραμμή δοκιμών (TG) 442E του ΟΟΣΑ (2017). Περιγράφει in vitro δοκιμασίες που αφορούν τους μηχανισμούς που περιγράφονται σε σχέση με το βασικό συμβάν για την ενεργοποίηση των δενδριτικών κυττάρων της AOP για την ευαισθητοποίηση του δέρματος (2). Η μέθοδος δοκιμών περιλαμβάνει δοκιμές που προορίζονται για την υποστήριξη της διάκρισης ανάμεσα σε ευαισθητοποιητικές και μη ευαισθητοποιητικές του δέρματος ουσίες, σύμφωνα με το GHS του ΟΗΕ και τον κανονισμό CLP.
|
|
Οι δοκιμές που περιγράφονται στην παρούσα μέθοδο δοκιμών είναι οι ακόλουθες:
|
—
|
δοκιμή ενεργοποίησης ανθρώπινης κυτταρικής σειράς (h-CLAT)
|
|
—
|
δοκιμή ενεργοποίησης κυτταρικής σειράς U937 (U-SENS™)
|
|
—
|
δοκιμασία γονιδίου αναφοράς ιντερλευκίνης 8 (δοκιμασία IL-8 Luc)
|
|
|
|
3.
|
Οι δοκιμές που περιλαμβάνονται στην παρούσα μέθοδο δοκιμών και στην αντίστοιχη TG του ΟΟΣΑ ενδέχεται να διαφέρουν ως προς τη διαδικασία που χρησιμοποιείται για την παραγωγή των δεδομένων και ως προς τις μετρούμενες ενδείξεις, αλλά μπορούν να χρησιμοποιούνται αδιακρίτως για τη συμμόρφωση προς τις εθνικές απαιτήσεις για αποτελέσματα δοκιμών σχετικά με το βασικό συμβάν για την ενεργοποίηση των δενδριτικών κυττάρων της AOP για την ευαισθητοποίηση του δέρματος, με παράλληλη αξιοποίηση της αμοιβαίας αποδοχής δεδομένων του ΟΟΣΑ.
|
Ιστορικό και αρχές των δοκιμών που περιλαμβάνονται στη μέθοδο δοκιμών με βάση το βασικό συμβάν
|
4.
|
Η αξιολόγηση της δερματικής ευαισθητοποίησης περιλαμβάνει συνήθως τη χρήση πειραματόζωων. Στις κλασικές μεθόδους στις οποίες χρησιμοποιούνται ινδικά χοιρίδια, όπως η δοκιμή Magnusson Kligman με μεγιστοποίηση σε ινδικά χοιρίδια (GPMT) και η δοκιμή Buehler (μέθοδος δοκιμών Β.6) (4), αξιολογούνται τόσο το στάδιο επαγωγής όσο και το στάδιο πρόκλησης δερματικής ευαισθητοποίησης. Οι δοκιμές σε ποντικό, η LLNA (μέθοδος δοκιμών B.42) (3) και οι δύο τροποποιήσεις της χωρίς τη χρήση ραδιενέργειας, η LLNA: DA (μέθοδος δοκιμών Β.50) (5) και η LLNA: BrdU-ELISA (μέθοδος δοκιμών Β.51) (6), αξιολογούν αποκλειστικά την επαγωγική απόκριση και έχουν επίσης κριθεί αποδεκτές, δεδομένου ότι προσφέρουν ένα πλεονέκτημα έναντι των δοκιμών σε ινδικά χοιρίδια όσον αφορά την καλή μεταχείριση των ζώων, σε συνδυασμό με την αντικειμενική μέτρηση του επαγωγικού σταδίου της δερματικής ευαισθητοποίησης.
|
|
5.
|
Πρόσφατα εγκρίθηκαν μέθοδοι δοκιμών μηχανιστικής βάσης in chemico και in vitro που αφορούν το πρώτο βασικό συμβάν [μέθοδος δοκιμών B.59, Άμεση ανάλυση πεπτιδικής δραστικότητας (7)] και το δεύτερο βασικό συμβάν [μέθοδος δοκιμών B.60, Μέθοδος δοκιμών ARE-Nrf2/λουσιφεράσης (8)] της AOP ευαισθητοποίησης του δέρματος για την υποστήριξη της αξιολόγησης του δυναμικού επικινδυνότητας των χημικών ουσιών για ευαισθητοποίηση του δέρματος.
|
|
6.
|
Οι δοκιμές που περιγράφονται στην παρούσα μέθοδο δοκιμών προσδιορίζουν ποσοτικά είτε τη μεταβολή στην έκφραση δεικτών της κυτταρικής επιφάνειας που συνδέονται με τη διεργασία ενεργοποίησης των μονοκυττάρων και των δενδριτικών κυττάρων έπειτα από έκθεση σε ευαισθητοποιητικά (π.χ. CD54, CD86) είτε τις μεταβολές στην έκφραση της IL-8, μιας κυτταροκίνης που σχετίζεται με την ενεργοποίηση των δενδριτικών κυττάρων. Έχει αναφερθεί ότι τα ευαισθητοποιητικά του δέρματος επάγουν την έκφραση δεικτών της κυτταρικής μεμβράνης, όπως οι CD40, CD54, CD80, CD83 και CD86, επιπροσθέτως προς την επαγωγή προφλεγμονωδών κυτταροκινών όπως οι IL-1β και TNF-α, και αρκετών χημειοκινών, περιλαμβανομένης της IL-8 (CXCL8) και της CCL3 (9) (10) (11) (12), που σχετίζονται με την ενεργοποίηση των δενδριτικών κυττάρων (2).
|
|
7.
|
Ωστόσο, δεδομένου ότι η ενεργοποίηση των δενδριτικών κυττάρων αντιπροσωπεύει ένα μόνο βασικό συμβάν της AOP ευαισθητοποίησης του δέρματος (2) (13), οι πληροφορίες που παράγονται από δοκιμές που μετρούν μόνο δείκτες ενεργοποίησης των δενδριτικών κυττάρων μπορεί να μην επαρκούν για την εξαγωγή συμπεράσματος σχετικά με την παρουσία ή την απουσία δυναμικού δερματικής ευαισθητοποίησης των χημικών ουσιών. Ως εκ τούτου, προτείνεται η χρήση των δεδομένων που παράγονται με τις δοκιμές της παρούσας μεθόδου δοκιμών για την υποστήριξη της διάκρισης μεταξύ ευαισθητοποιητικών (κατηγορία 1 κατά GHS του ΟΗΕ/κανονισμός CLP) και μη ευαισθητοποιητικών του δέρματος, όταν χρησιμοποιούνται στο πλαίσιο ολοκληρωμένων προσεγγίσεων για τη διεξαγωγή δοκιμών και την αξιολόγηση (IATA), σε συνδυασμό με άλλες συμπληρωματικές πληροφορίες, π.χ. που προκύπτουν από in vitro δοκιμασίες που αφορούν άλλα βασικά συμβάντα της AOP ευαισθητοποίησης του δέρματος καθώς και μεθόδους χωρίς δοκιμές, περιλαμβανομένης της σύγκρισης με χημικώς ανάλογες ουσίες (13). Παραδείγματα της χρήσης των δεδομένων που παράγονται με τις εν λόγω δοκιμές στο πλαίσιο καθορισμένων προσεγγίσεων, δηλαδή τυποποιημένων προσεγγίσεων τόσο σε σχέση με το σύνολο των χρησιμοποιούμενων πηγών πληροφοριών όσο και στο πλαίσιο της διαδικασίας που εφαρμόζεται στα δεδομένα για την πραγματοποίηση προβλέψεων, έχουν δημοσιευτεί (13) και μπορούν να χρησιμοποιηθούν ως χρήσιμα στοιχεία στο πλαίσιο της IATA.
|
|
8.
|
Οι δοκιμές που περιγράφονται στην παρούσα μέθοδο δοκιμών δεν μπορούν να χρησιμοποιηθούν καθαυτές, ούτε για την ταξινόμηση ευαισθητοποιητικών του δέρματος στις υποκατηγορίες 1A και 1B, όπως ορίζονται στο GHS του ΟΗΕ / στον κανονισμό CLP, για τις αρχές που εφαρμόζουν τις εν λόγω προαιρετικές υποκατηγορίες, ούτε για την πρόβλεψη της ισχύος δράσης κατά τη λήψη αποφάσεων αξιολόγησης της ασφάλειας. Εντούτοις, ανάλογα με το κανονιστικό πλαίσιο, τα θετικά αποτελέσματα που προκύπτουν με τις παρούσες μεθόδους μπορούν να χρησιμοποιηθούν ως έχουν για την ταξινόμηση μιας χημικής ουσίας στην κατηγορία 1 κατά GHS του ΟΗΕ / κανονισμό CLP.
|
|
9.
|
Ο όρος «υπό δοκιμή χημική ουσία» χρησιμοποιείται στην παρούσα μέθοδο δοκιμών για να δηλώσει την ύλη που υποβάλλεται στη δοκιμή (100) και δεν σχετίζεται με την εφαρμοσιμότητα των δοκιμών για τον έλεγχο μονοσυστατικών ουσιών, πολυσυστατικών ουσιών και/ή μειγμάτων. Επί του παρόντος, υπάρχουν περιορισμένες διαθέσιμες πληροφορίες σχετικά με την εφαρμοσιμότητα των δοκιμών σε πολυσυστατικές ουσίες/μείγματα (14) (15). Οι δοκιμές είναι πάντως τεχνικά εφαρμόσιμες στον έλεγχο πολυσυστατικών ουσιών και μειγμάτων. Ωστόσο, πριν από τη χρήση της παρούσας μεθόδου δοκιμών σε μείγμα για την παραγωγή δεδομένων για συγκεκριμένο κανονιστικό σκοπό, θα πρέπει να εξετάζεται αν –και, εάν ναι, για ποιον λόγο– μπορεί να αποδώσει αποτελέσματα κατάλληλα για τον επιδιωκόμενο σκοπό (101). Τέτοια εξέταση δεν χρειάζεται όταν οι κανονιστικές ρυθμίσεις επιβάλλουν τον έλεγχο του μείγματος. Επιπλέον, κατά τον έλεγχο πολυσυστατικών ουσιών ή μειγμάτων, θα πρέπει να λαμβάνεται υπόψη η πιθανή παρεμπόδιση των παρατηρούμενων αποκρίσεων από κυτταροτοξικά συστατικά.
|
ΒΙΒΛΙΟΓΡΑΦΙΑ
|
(1)
|
United Nations UN (2015). Globally Harmonized System of Classification and Labelling of Chemicals (GHS). Sixth revised edition. New York & Geneva: United Nations Publications. ISBN: 978-92-1-117006-1. Διατίθεται στον δικτυακό τόπο: https://www.unece.org/trans/danger/publi/ghs/ghs_rev06/06files_e.html.
|
|
(2)
|
OECD (2012). The Adverse Outcome Pathway for Skin Sensitisation Initiated by Covalent Binding to Proteins. Part 1: Scientific Evidence. Series on Testing and Assessment No. 168. Διατίθεται στον δικτυακό τόπο: http://www.oecd.org/officialdocuments/publicdisplaydocumentpdf/?cote=ENV/JM/MONO(2012)10/PART1&docLanguage=En.
|
|
(3)
|
Κεφάλαιο B.42 του παρόντος παραρτήματος: Δοκιμασία επιχώριων λεμφαδένων.
|
|
(4)
|
Κεφάλαιο B.6 του παρόντος παραρτήματος: Ευαισθητοποίηση του δέρματος.
|
|
(5)
|
Κεφάλαιο B.50 του παρόντος παραρτήματος: Ευαισθητοποίηση του δέρματος: Δοκιμασία επιχώριων λεμφαδένων: DA.
|
|
(6)
|
Κεφάλαιο B.51 του παρόντος παραρτήματος: Ευαισθητοποίηση του δέρματος: Δοκιμασία επιχώριων λεμφαδένων: BrdU-ELISA.
|
|
(7)
|
Κεφάλαιο B.59 του παρόντος παραρτήματος: Ευαισθητοποίηση του δέρματος in chemico: Άμεση ανάλυση πεπτιδικής δραστικότητας (DPRA).
|
|
(8)
|
Κεφάλαιο B.60 του παρόντος παραρτήματος: Ευαισθητοποίηση του δέρματος in vitro: Μέθοδος δοκιμών ARE-Nrf2/λουσιφεράσης.
|
|
(9)
|
Steinman RM. (1991). The dendritic cell system and its role in immunogenicity. Annu Rev Immunol 9:271-96.
|
|
(10)
|
Caux C, Vanbervliet B, Massacrier C, Azuma M, Okumura K, Lanier LL, and Banchereau J. (1994). B70/B7-2 is identical to CD86 and is the major functional ligand for CD28 expressed on human dendritic cells. J Exp Med 180:1841-7.
|
|
(11)
|
Aiba S, Terunuma A, Manome H, and Tagami H. (1997). Dendritic cells differently respond to haptens and irritants by their production of cytokines and expression of co-stimulatory molecules. Eur J Immunol 27:3031-8.
|
|
(12)
|
Aiba S, Manome H, Nakagawa S, Mollah ZU, Mizuashi M, Ohtani T, Yoshino Y, and Tagami. H. (2003). p38 mitogen-activated protein kinase and extracellular signal-regulated kinases play distinct roles in the activation of dendritic cells by two representative haptens, NiCl2 and DNCB. J Invest Dermatol 120:390-8.
|
|
(13)
|
OECD (2016). Series on Testing & Assessment No 256: Guidance Document On The Reporting Of Defined Approaches And Individual Information Sources To Be Used Within Integrated Approaches To Testing And Assessment (IATA) For Skin Sensitisation, Annex 1 and Annex 2. ENV/JM/HA(2016)29. Organisation for Economic Cooperation and Development, Paris. Διατίθεται στον δικτυακό τόπο: https://community.oecd.org/community/iatass.
|
|
(14)
|
Ashikaga T, Sakaguchi H, Sono S, Kosaka N, Ishikawa M, Nukada Y, Miyazawa M, Ito Y, NishiyamaN, Itagaki H. (2010). A comparative evaluation of in vitro skin sensitisation tests: the human cell-line activation test (h-CLAT) versus the local lymph node assay (LLNA). Altern. Lab. Anim. Sci. 38, 275-284.
|
|
(15)
|
Piroird, C., Ovigne, J.M., Rousset, F., Martinozzi-Teissier, S., Gomes, C., Cotovio, J., Alépée, N. (2015). The Myeloid U937 Skin Sensitization Test (U-SENS) addresses the activation of dendritic cell event in the adverse outcome pathway for skin sensitization. Toxicol. In Vitro 29, 901-916.
|
Προσάρτημα 1
ΕΥΑΙΣΘΗΤΟΠΟΙΗΣΗ ΤΟΥ ΔΕΡΜΑΤΟΣ IN VITRO: ΔΟΚΙΜΗ ΕΝΕΡΓΟΠΟΙΗΣΗΣ ΑΝΘΡΩΠΙΝΗΣ ΚΥΤΤΑΡΙΚΗΣ ΣΕΙΡΑΣ (H-CLAT)
ΑΡΧΙΚΕΣ ΕΚΤΙΜΗΣΕΙΣ ΚΑΙ ΠΕΡΙΟΡΙΣΜΟΙ
|
1.
|
Η h-CLAT χρησιμεύει στον ποσοτικό προσδιορισμό των μεταβολών στην έκφραση δεικτών της κυτταρικής επιφάνειας που συνδέονται με τη διεργασία ενεργοποίησης των μονοκυττάρων και των δενδριτικών κυττάρων (DC) (δείκτες CD86 και CD54), στην ανθρώπινη κυτταρική σειρά μονοκυτταρικής λευχαιμίας THP-1, κατόπιν έκθεσης σε ευαισθητοποιητικά (1)(2). Στη συνέχεια, τα μετρηθέντα επίπεδα έκφρασης των δεικτών CD86 και CD54 χρησιμοποιούνται για την υποστήριξη της διάκρισης μεταξύ ευαισθητοποιητικών και μη ευαισθητοποιητικών του δέρματος.
|
|
2.
|
Η h-CLAT έχει αξιολογηθεί σε μελέτη επικύρωσης του εργαστηρίου αναφοράς της Ευρωπαϊκής Ένωσης για τις εναλλακτικές μεθόδους αντί των δοκιμών σε ζώα (EURL ECVAM) και σε επακόλουθη ανεξάρτητη αξιολόγηση από ομοτίμους από τη Συμβουλευτική Επιστημονική Επιτροπή EURL ECVAM (ESAC). Αφού έλαβε υπόψη όλα τα διαθέσιμα στοιχεία και τις απόψεις των ρυθμιστικών αρχών και των ενδιαφερόμενων μερών, το EURL ECVAM (3) συνέστησε τη χρήση της h-CLAT στο πλαίσιο IATA για την υποστήριξη της διάκρισης μεταξύ ευαισθητοποιητικών και μη ευαισθητοποιητικών με σκοπό την ταξινόμηση και επισήμανση του κινδύνου. Παραδείγματα σχετικά με τη χρήση δεδομένων h-CLAT σε συνδυασμό με άλλα στοιχεία έχουν αναφερθεί στη βιβλιογραφία (4)(5)(6)(7)(8)(9)(10)(11).
|
|
3.
|
Διαπιστώθηκε ότι η h-CLAT μπορεί να εφαρμοστεί σε εργαστήρια που διαθέτουν εμπειρία στη χρήση τεχνικών κυτταροκαλλιέργειας και ανάλυσης κυτταρομετρίας ροής. Ο βαθμός αναπαραγωγιμότητας των προβλέψεων που αναμένεται να παρέχει η δοκιμή είναι της τάξης του 80 % ενδοεργαστηριακά και διεργαστηριακά (3)(12). Τα αποτελέσματα που προέκυψαν από τη μελέτη επικύρωσης (13) και άλλες δημοσιευμένες μελέτες (14) υποδεικνύουν συνολικά ότι, σε σύγκριση με τα αποτελέσματα της LLNA, η ορθότητα της διάκρισης μεταξύ ευαισθητοποιητικών (κατηγορίας 1 κατά GHS του ΟΗΕ / κανονισμό CLP) και μη ευαισθητοποιητικών του δέρματος είναι 85 % (N=142), με ευαισθησία 93 % (94/101) και ειδικότητα 66 % (27/41) [βάσει εκ νέου ανάλυσης του EURL ECVAM (12) στο πλαίσιο της οποίας ελήφθησαν υπόψη όλα τα υπάρχοντα δεδομένα και δεν ελήφθησαν υπόψη τα αρνητικά αποτελέσματα για τις χημικές ουσίες με Log Kow άνω του 3,5, όπως περιγράφεται στην παράγραφο 4]. Οι ψευδοαρνητικές προβλέψεις με την h-CLAT αφορούν πιθανότατα χημικές ουσίες που εμφανίζουν χαμηλή έως μέτρια ισχύ ευαισθητοποίησης του δέρματος (υποκατηγορία 1Β κατά GHS του ΟΗΕ / κανονισμό CLP) παρά ουσίες που εμφανίζουν υψηλή ισχύ ευαισθητοποίησης του δέρματος (υποκατηγορία 1Α κατά GHS του ΟΗΕ / κανονισμό CLP) (4)(13)(15). Συνολικά, τα στοιχεία αυτά δείχνουν τη χρησιμότητα της μεθόδου h-CLAT ως εργαλείου που συμβάλλει στον προσδιορισμό της επικινδυνότητας ως προς την ευαισθητοποίηση του δέρματος. Ωστόσο, οι τιμές ορθότητας που παρέχονται εδώ για την h-CLAT ως αυτοτελή δοκιμή είναι απλώς ενδεικτικές, δεδομένου ότι η δοκιμή θα πρέπει να εξετάζεται σε συνδυασμό με άλλες πηγές πληροφοριών στο πλαίσιο ΙΑΤΑ και σύμφωνα με τις πληροφορίες στις παραγράφους 7 και 8 της γενικής εισαγωγής. Επιπλέον, κατά την αξιολόγηση των μεθόδων δοκιμών ευαισθητοποίησης του δέρματος χωρίς χρήση ζώων, θα πρέπει να μη λησμονείται ότι η δοκιμασία LLNA, καθώς και άλλες δοκιμές σε ζώα, ενδέχεται να μην αντικατοπτρίζουν πλήρως την κατάσταση στον άνθρωπο.
|
|
4.
|
Με βάση το σύνολο των διαθέσιμων δεδομένων, η μέθοδος δοκιμών h-CLAT είναι εφαρμόσιμη σε υπό δοκιμή χημικές ουσίες που καλύπτουν ποικιλία οργανικών λειτουργικών ομάδων, μηχανισμών αντίδρασης, επιπέδων ισχύος ευαισθητοποίησης του δέρματος (όπως προσδιορίζονται σε μελέτες in vivo) και φυσικοχημικών ιδιοτήτων (3)(14)(15). Η μέθοδος δοκιμών h-CLAT είναι εφαρμόσιμη σε υπό δοκιμή χημικές ουσίες που είναι διαλυτές ή σχηματίζουν σταθερή διασπορά (δηλ. κολλοειδές ή εναιώρημα στο οποίο η υπό δοκιμή χημική ουσία δεν καθιζάνει ούτε διαχωρίζεται από τον διαλύτη/φορέα σε διαφορετικές φάσεις) σε κατάλληλο διαλύτη/φορέα (βλ. παράγραφο 14). Οι υπό δοκιμή χημικές ουσίες με Log Kow άνω του 3,5 τείνουν να δώσουν ψευδοαρνητικά αποτελέσματα (14). Ως εκ τούτου, τα αρνητικά αποτελέσματα με υπό δοκιμή χημικές ουσίες με Log Kow άνω του 3,5 δεν θα πρέπει να λαμβάνονται υπόψη. Αντιθέτως, τα θετικά αποτελέσματα που προκύπτουν με υπό δοκιμή χημικές ουσίες με Log Kow άνω του 3,5 μπορούν να χρησιμοποιούνται για την υποστήριξη του χαρακτηρισμού της υπό δοκιμή χημικής ουσίας ως ευαισθητοποιητικού. Επιπλέον, λόγω της περιορισμένης μεταβολικής ικανότητας της χρησιμοποιούμενης κυτταρικής σειράς (16) και λόγω των πειραματικών συνθηκών, τα μεταβολικά προαπτένια (δηλ. οι ουσίες που απαιτούν ενζυμική ενεργοποίηση, π.χ. μέσω των ενζύμων P450) και τα αβιοτικά προαπτένια (δηλ. οι ουσίες που ενεργοποιούνται με οξείδωση), και ιδίως όσα χαρακτηρίζονται από χαμηλή ταχύτητα οξείδωσης, μπορεί επίσης να δώσουν αρνητικά αποτελέσματα στην h-CLAT (15). Παρότι οι φθορίζουσες ουσίες μπορούν να αξιολογηθούν με την h-CLAT (17), οι ισχυρά φθορίζουσες ουσίες που εκπέμπουν στο ίδιο μήκος κύματος με την ισοθειοκυανική φλουορεσκεΐνη (FITC) ή το ιωδιούχο προπίδιο (PI) παρεμποδίζουν την κυτταρομετρική ανίχνευση ροής και, ως εκ τούτου, δεν μπορούν να αξιολογηθούν σωστά με χρήση συζευγμένων με FITC αντισωμάτων ή PI. Σε αυτή την περίπτωση, μπορούν να χρησιμοποιηθούν άλλα σημασμένα με φθοριοχρώματα αντισώματα ή άλλοι δείκτες κυτταροτοξικότητας, αντίστοιχα, εφόσον μπορεί να καταδειχθεί ότι παρέχουν ανάλογα αποτελέσματα με τα σημασμένα με FITC αντισώματα (βλ. παράγραφο 24) ή το PI (βλ. παράγραφο 18) π.χ. μέσω δοκιμών των ουσιών ελέγχου ικανότητας του προσαρτήματος 1-2. Υπό το πρίσμα των ανωτέρω, τα αρνητικά αποτελέσματα θα πρέπει να ερμηνεύονται στο πλαίσιο των αναφερόμενων περιορισμών και σε συνάρτηση με άλλες πηγές πληροφοριών στο πλαίσιο ΙΑΤΑ. Εάν υπάρχουν στοιχεία που δείχνουν ότι η μέθοδος δοκιμών h-CLAT δεν μπορεί να εφαρμοστεί σε άλλες ειδικές κατηγορίες χημικών ουσιών, η μέθοδος δεν θα πρέπει να χρησιμοποιείται για τις συγκεκριμένες κατηγορίες.
|
|
5.
|
Όπως αναφέρθηκε ανωτέρω, η μέθοδος h-CLAT υποστηρίζει τη διάκριση μεταξύ ευαισθητοποιητικών και μη ευαισθητοποιητικών του δέρματος. Ωστόσο, μπορεί ενδεχομένως να συμβάλει στην εκτίμηση της ευαισθητοποιητικής ισχύος (4)(5)(9), όταν χρησιμοποιείται σε ολοκληρωμένες προσεγγίσεις, όπως οι IATA. Απαιτούνται πάντως περισσότερες εργασίες, κατά προτίμηση με βάση δεδομένα για τον άνθρωπο, για να διαπιστωθεί ο τρόπος με τον οποίο τα αποτελέσματα της h-CLAT θα μπορούσαν ενδεχομένως να τροφοδοτήσουν την εκτίμηση της ευαισθητοποιητικής ισχύος.
|
|
6.
|
Οι ορισμοί παρατίθενται στο προσάρτημα 1.1.
|
ΑΡΧΗ ΤΗΣ ΔΟΚΙΜΗΣ
|
7.
|
Η μέθοδος h-CLAT είναι μια in vitro δοκιμασία με την οποία προσδιορίζονται ποσοτικά οι μεταβολές της έκφρασης κάποιων δεικτών της κυτταρικής επιφάνειας (CD86 και CD54) σε ανθρώπινη κυτταρική σειρά μονοκυτταρικής λευχαιμίας, στα κύτταρα THP-1, μετά από έκθεση 24 ωρών στην υπό δοκιμή χημική ουσία. Τα εν λόγω επιφανειακά μόρια αποτελούν τυπικούς δείκτες της ενεργοποίησης των μονοκυττάρων THP-1 και μπορούν να μιμούνται την ενεργοποίηση των δενδριτικών κυττάρων, η οποία διαδραματίζει κρίσιμο ρόλο στην προδιέγερση των Τ κυττάρων. Οι μεταβολές της έκφρασης επιφανειακών δεικτών μετρώνται με κυτταρομετρία ροής μετά από χρώση των κυττάρων με αντισώματα σημασμένα με φθοριοχρώματα. Ταυτόχρονα, διεξάγεται επίσης μέτρηση της κυτταροτοξικότητας προκειμένου να διαπιστωθεί εάν αυξάνεται η έκφραση των επιφανειακών δεικτών σε υποκυτταροτοξικές συγκεντρώσεις. Η σχετική ένταση φθορισμού των επιφανειακών δεικτών σε σύγκριση με τον μάρτυρα με διαλύτη/φορέα υπολογίζεται και χρησιμοποιείται στο μοντέλο πρόβλεψης (βλ. παράγραφο 26) για να υποστηριχθεί η διάκριση μεταξύ ευαισθητοποιητικών και μη ευαισθητοποιητικών ουσιών.
|
ΑΠΟΔΕΙΞΗ ΤΕΧΝΙΚΗΣ ΙΚΑΝΟΤΗΤΑΣ
|
8.
|
Πριν χρησιμοποιήσουν στην καθημερινή πρακτική τη δοκιμή που περιγράφεται στο παρόν προσάρτημα της μεθόδου δοκιμών B.71, τα εργαστήρια θα πρέπει να αποδεικνύουν την τεχνική τους ικανότητα, χρησιμοποιώντας τις 10 ουσίες ελέγχου ικανότητας που απαριθμούνται στο προσάρτημα 1.2. Επιπλέον, οι χρήστες της δοκιμής θα πρέπει να διατηρούν βάση ιστορικών δεδομένων με τα δεδομένα που προκύπτουν από τους ελέγχους δραστικότητας (βλ. παράγραφο 11) και με τους θετικούς μάρτυρες και τους μάρτυρες με διαλύτη/φορέα (βλ. παραγράφους 20-22), και θα πρέπει να χρησιμοποιούν τα εν λόγω δεδομένα για να βεβαιώνονται για τη διαχρονική αναπαραγωγιμότητα της δοκιμής στο εργαστήριό τους.
|
ΔΙΑΔΙΚΑΣΙΑ
|
9.
|
Η παρούσα δοκιμή βασίζεται στο πρωτόκολλο αριθ. 158 της υπηρεσίας βάσης δεδομένων h-CLAT για τις εναλλακτικές μεθόδους αντί των πειραμάτων σε ζώα (DB-ALM) (18), το οποίο είναι αντίστοιχο του πρωτοκόλλου που χρησιμοποήθηκε στη μελέτη επικύρωσης που συντονίστηκε από το EURL ECVAM. Συνιστάται να χρησιμοποιείται αυτό το πρωτόκολλο κατά την εφαρμογή και χρήση της μεθόδου h-CLAT στο εργαστήριο. Στις επόμενες παραγράφους περιγράφονται τα βασικά στοιχεία και διαδικασίες για τη μέθοδο h-CLAT, η οποία περιλαμβάνει δύο στάδια: δοκιμασία προσδιορισμού δόσης και μέτρηση έκφρασης CD86/CD54.
|
Προπαρασκευή των κυττάρων
|
10.
|
Για την εφαρμογή της μεθόδου h-CLAT θα πρέπει να χρησιμοποιείται η ανθρώπινη κυτταρική σειρά μονοκυτταρικής λευχαιμίας THP-1. Συνιστάται τα κύτταρα (TIB-202™) να λαμβάνονται από επαρκώς εξειδικευμένη τράπεζα κυττάρων, όπως η American Type Culture Collection.
|
|
11.
|
Τα κύτταρα THP-1 καλλιεργούνται στους 37°C και σε ατμόσφαιρα με ύγρανση και 5 % CO2 σε θρεπτικό μέσο RPMI-1640 συμπληρωμένο με 10 % βόειου εμβρυϊκού ορού (FBS), 0,05 mM 2-μερκαπτοαιθανόλης, 100 μονάδες/ml πενικιλίνης και 100 μg/ml στρεπτομυκίνης. Η χρήση πενικιλίνης και στρεπτομυκίνης στο θρεπτικό μέσο καλλιέργειας μπορεί να παραλειφθεί. Ωστόσο, σε αυτή την περίπτωση, οι χρήστες θα πρέπει να βεβαιώνονται ότι η απουσία αντιβιοτικών από το θρεπτικό μέσο καλλιέργειας δεν επηρεάζει τα αποτελέσματα, π.χ. μέσω δοκιμών των ουσιών ελέγχου ικανότητας που απαριθμούνται στο προσάρτημα 1.2. Σε κάθε περίπτωση, για τον περιορισμό του κινδύνου μόλυνσης στο ελάχιστο, θα πρέπει να ακολουθούνται οι ορθές πρακτικές καλλιέργειας κυττάρων, ανεξάρτητα από την παρουσία ή μη αντιβιοτικών στο θρεπτικό μέσο κυττάρων. Τα κύτταρα THP-1 εμβολιάζονται συνήθως κάθε 2-3 ημέρες σε πυκνότητα 0,1 έως 0,2 × 106 κύτταρα/ml. Θα πρέπει να διατηρούνται σε πυκνότητες από 0,1 έως 1,0 × 106 κύτταρα/ml. Πριν από τη χρήση τους στις δοκιμές, θα πρέπει να ελέγχεται εάν τα κύτταρα πληρούν τα κριτήρια, μέσω της διεξαγωγής ελέγχου δραστικότητας. Ο έλεγχος δραστικότητας των κυττάρων θα πρέπει να διενεργείται με χρήση των θετικών μαρτύρων 2,4-δινιτροχλωροβενζόλιο (DNCB) (αριθ. CAS 97-00-7, καθαρότητα ≥ 99 %) και θειικό νικέλιο (NiSO4) (αριθ. CAS 10101-97-0, καθαρότητα ≥ 99 %) και του αρνητικού μάρτυρα γαλακτικό οξύ (LA) (αριθ. CAS 50-21-5, ≥ καθαρότητα 85 %), δύο εβδομάδες μετά την απόψυξη. Αμφότερα τα DNCB και NiSO4 θα πρέπει να επάγουν θετική απόκριση και των δύο δεικτών κυτταρικής επιφάνειας CD86 και CD54, ενώ το LA θα πρέπει να επάγει αρνητική απόκριση και των δύο δεικτών. Για τη δοκιμασία πρέπει να χρησιμοποιούνται μόνο κύτταρα που έχουν υποβληθεί επιτυχώς στον έλεγχο δραστικότητας. Τα κύτταρα μπορούν να πολλαπλασιάζονται έως δύο μήνες μετά την απόψυξη. Ο αριθμός των ανακαλλιεργειών δεν θα πρέπει να υπερβαίνει τις 30. Ο έλεγχος δραστικότητας θα πρέπει να διενεργείται σύμφωνα με τις διαδικασίες που περιγράφονται στις παραγράφους 20-24.
|
|
12.
|
Για τη δοκιμή, κύτταρα THP-1 εμβολιάζονται σε πυκνότητα είτε 0,1 × 106 κύτταρα/ml είτε 0,2 × 106 κύτταρα/ml και προκαλλιεργούνται σε φιάλες καλλιέργειας επί 72 ώρες ή επί 48 ώρες αντίστοιχα. Είναι σημαντικό η πυκνότητα των κυττάρων στη φιάλη καλλιέργειας αμέσως μετά την περίοδο προκαλλιέργειας να είναι κατά το δυνατόν συνεπής σε κάθε πείραμα (με χρήση μίας από τις δύο συνθήκες προκαλλιέργειας που περιγράφονται ανωτέρω), διότι η πυκνότητα των κυττάρων στη φιάλη καλλιέργειας αμέσως μετά την προκαλλιέργεια μπορεί να επηρεάσει την έκφραση των CD86/CD54 που επάγεται από τα αλλεργιογόνα (19). Την ημέρα της δοκιμής, κύτταρα που έχουν συλλεχθεί από τη φιάλη καλλιέργειας επανεναιωρούνται με πρόσφατα παρασκευασμένο θρεπτικό μέσο καλλιέργειας σε πυκνότητα 2 × 106 κύτταρα/ml. Στη συνέχεια, τα κύτταρα κατανέμονται σε τρυβλίο επίπεδης βάσης 24 κοιλοτήτων (500 μl, 1 × 106 κύτταρα/κοιλότητα) ή τρυβλίο επίπεδης βάσης 96 κοιλοτήτων (80 μl, 1,6 × 105 κύτταρα/κοιλότητα).
|
Δοκιμασία προσδιορισμού δόσης
|
13.
|
Διεξάγεται δοκιμασία προσδιορισμού δόσης για τον προσδιορισμό της CV75, η οποία είναι η συγκέντρωση της υπό δοκιμή χημικής ουσίας που δίνει κυτταρική βιωσιμότητα (CV) 75 % σε σύγκριση με τον μάρτυρα με διαλύτη/φορέα. Η τιμή CV75 χρησιμοποιείται για τον προσδιορισμό της συγκέντρωσης των υπό δοκιμή χημικών ουσιών για τη μέτρηση της έκφρασης των CD86/CD54 (βλ. παραγράφους 20-24).
|
Παρασκευή των υπό δοκιμή χημικών ουσιών και των μαρτύρων
|
14.
|
Η παρασκευή των υπό δοκιμή χημικών ουσιών και των μαρτύρων γίνεται την ημέρα της δοκιμής. Για τη μέθοδο h-CLAT, οι υπό δοκιμή χημικές ουσίες διαλύονται ή διασπείρονται σταθερώς (βλ. επίσης παράγραφο 4) σε αλατούχο διάλυμα ή θρεπτικό μέσο, ως πρώτη επιλογή, ή σε διμεθυλοσουλφοξείδιο (DMSO, καθαρότητας ≥ 99 %), ως δεύτερη επιλογή σε περίπτωση που η υπό δοκιμή χημική ουσία δεν είναι διαλυτή ή δεν διασπείρεται σταθερώς στους δύο προηγούμενους διαλύτες/φορείς, σε τελικές συγκεντρώσεις 100 mg/ml (σε αλατούχο διάλυμα ή θρεπτικό μέσο) ή 500 mg/ml (σε DMSO). Μπορούν να χρησιμοποιηθούν και άλλοι διαλύτες/φορείς, πέραν των όσων περιγράφονται ανωτέρω, εφόσον η χρήση τους τεκμηριώνεται επαρκώς επιστημονικά. Θα πρέπει να λαμβάνεται υπόψη η σταθερότητα της υπό δοκιμή χημικής ουσίας στον τελικό διαλύτη/φορέα.
|
|
15.
|
Ξεκινώντας από αποθεματικά διαλύματα των υπό δοκιμή χημικών ουσιών 100 mg/ml (σε αλατούχο διάλυμα ή θρεπτικό μέσο) ή 500 mg/ml (σε DMSO), γίνονται οι εξής αραιώσεις:
|
—
|
για διαλύτη/φορέα αλατούχο διάλυμα ή θρεπτικό μέσο: παρασκευάζονται οκτώ αποθεματικά διαλύματα (οκτώ συγκεντρώσεις), με διαδοχικές αραιώσεις 2x με χρήση του αντίστοιχου διαλύτη/φορέα. Στη συνέχεια, αυτά τα αποθεματικά διαλύματα αραιώνονται περαιτέρω 50x σε θρεπτικό μέσο (διαλύματα εργασίας). Εάν η ανώτερη τελική συγκέντρωση στο τρυβλίο των 1 000 μg/ml είναι μη τοξική, η μέγιστη συγκέντρωση θα πρέπει να επαναπροσδιοριστεί με νέα δοκιμή κυτταροτοξικότητας. Η τελική συγκέντρωση στο τρυβλίο δεν θα πρέπει να υπερβαίνει τα 5 000 μg/ml για υπό δοκιμή χημικές ουσίες διαλυμένες ή σταθερώς διεσπαρμένες σε αλατούχο διάλυμα ή θρεπτικό μέσο.
|
|
—
|
για διαλύτη/φορέα DMSO: παρασκευάζονται οκτώ αποθεματικά διαλύματα (οκτώ συγκεντρώσεις), με διαδοχικές αραιώσεις 2x με χρήση του αντίστοιχου διαλύτη/φορέα. Στη συνέχεια, αυτά τα αποθεματικά διαλύματα αραιώνονται 250x σε θρεπτικό μέσο καλλιέργειας (διαλύματα εργασίας). Η τελική συγκέντρωση στο τρυβλίο δεν θα πρέπει να υπερβαίνει τα 1 000 μg/ml, ακόμη κι αν είναι μη τοξική.
|
Τα διαλύματα εργασίας χρησιμοποιούνται τελικά για την έκθεση, με προσθήκη ίσου όγκου διαλύματος εργασίας στον όγκο του εναιωρήματος κυττάρων THP-1 στο τρυβλίο (βλ. επίσης παράγραφο 17) ώστε να πραγματοποιηθεί νέα αραίωση 2x (η τελική κλίμακα συγκεντρώσεων στο τρυβλίο είναι συνήθως 7,81–1 000 μg/ml).
|
|
16.
|
Ο μάρτυρας με διαλύτη/φορέα που χρησιμοποιείται στη μέθοδο h-CLAT είναι θρεπτικό μέσο καλλιέργειας [για τις υπό δοκιμή χημικές ουσίες που διαλύονται ή διασπείρονται σταθερά (βλ. παράγραφο 4) είτε σε θρεπτικό μέσο είτε σε αλατούχο διάλυμα] ή DMSO (για υπό δοκιμή χημικές ουσίες που διαλύονται ή διασπείρονται σταθερά σε DMSO) που υποβάλλεται σε δοκιμή σε μία τελική συγκέντρωση 0,2 % στο τρυβλίο. Υποβάλλεται στην ίδια αραίωση που περιγράφεται για τα διαλύματα εργασίας στην παράγραφο 15.
|
Εφαρμογή των υπό δοκιμή χημικών ουσιών και των μαρτύρων
|
17.
|
Το θρεπτικό μέσο καλλιέργειας ή τα διαλύματα εργασίας που περιγράφονται στις παραγράφους 15 και 16 αναμιγνύονται 1:1 (κ.ό.) με τα εναιωρήματα κυττάρων που παρασκευάστηκαν στο τρυβλίο επίπεδης βάσης 24 ή 96 κοιλοτήτων (βλ. παράγραφο 12). Στη συνέχεια, τα υπό αγωγή τρυβλία επωάζονται επί 24±0,5 ώρες στους 37°C με 5 % CO2. Θα πρέπει να λαμβάνεται μέριμνα για την αποφυγή της εξάτμισης των πτητικών υπό δοκιμή χημικών ουσιών, καθώς και της διασταυρούμενης μόλυνσης των μικροκοιλοτήτων από τις υπό δοκιμή χημικές ουσίες, π.χ. με στεγανοποίηση του τρυβλίου πριν από την επώαση με τις υπό δοκιμή χημικές ουσίες (20).
|
Χρώση με ιωδιούχο προπίδιο (PI)
|
18.
|
Μετά από 24±0,5 ώρες έκθεσης, τα κύτταρα μεταφέρονται στα σωληνάρια δειγμάτων και συλλέγονται μέσω φυγοκέντρησης. Τα υπερκείμενα υγρά απορρίπτονται και τα εναπομείναντα κύτταρα εναιωρούνται εκ νέου με 200 μl (στην περίπτωση του τρυβλίου 96 κοιλοτήτων) ή 600 μl (στην περίπτωση του τρυβλίου 24 κοιλοτήτων) φωσφορικού αλατούχου ρυθμιστικού διαλύματος που περιέχει 0,1 % αλβουμίνης βόειου ορού (ρυθμιστικό διάλυμα χρώσης). 200 μl κυτταρικού εναιωρήματος μεταφέρονται σε τρυβλίο στρογγυλής βάσης 96 κοιλοτήτων (στην περίπτωση του τρυβλίου 96 κοιλοτήτων) ή σε μικροσωληνάριο (στην περίπτωση του τρυβλίου 24 κοιλοτήτων) και εκπλένονται δύο φορές με 200 μl (στην περίπτωση του τρυβλίου 96 κοιλοτήτων) ή 600 μl (στην περίπτωση του τρυβλίου 24 κοιλοτήτων) ρυθμιστικού διαλύματος χρώσης. Τέλος, τα κύτταρα εναιωρούνται εκ νέου σε ρυθμιστικό διάλυμα χρώσης (π.χ. 400 μl) και προστίθεται διάλυμα PI (π.χ. 20 μl) (για παράδειγμα, η τελική συγκέντρωση του PI είναι 0,625 μg/ml). Μπορούν να χρησιμοποιηθούν και άλλοι δείκτες κυτταροτοξικότητας, όπως 7-αμινοακτινομυκίνη D (7-AAD), κυανό του τρυπανίου ή άλλοι δείκτες, εάν μπορεί να αποδειχθεί ότι οι εναλλακτικές χρώσεις αποδίδουν παρεμφερή με το PI αποτελέσματα, για παράδειγμα μέσω δοκιμών των ουσιών ελέγχου ικανότητας του προσαρτήματος 1.2.
|
Μέτρηση κυτταροτοξικότητας μέσω κυτταρομετρίας ροής και εκτίμηση της τιμής CV75
|
19.
|
Η πρόσληψη του PI αναλύεται με χρήση κυτταρομετρίας ροής με τον δίαυλο καταγραφής FL-3. Καταγράφονται συνολικά 10 000 ζώντα κύτταρα (αρνητικά για PI). Η κυτταρική βιωσιμότητα μπορεί να υπολογίζεται με χρήση της ακόλουθης εξίσωσης από το πρόγραμμα ανάλυσης του κυτταρόμετρου. Όταν η κυτταρική βιωσιμότητα είναι χαμηλή, θα πρέπει να καταγράφονται έως 30 000 κύτταρα, περιλαμβανομένων των νεκρών κυττάρων. Εναλλακτικά, μπορούν να καταγράφονται δεδομένα επί ένα λεπτό μετά την έναρξη της ανάλυσης.

Η τιμή CV75 (βλ. παράγραφο 13), δηλαδή η συγκέντρωση από την οποία προκύπτει 75 % επιβίωση κυττάρων THP-1 (25 % κυτταροτοξικότητα), υπολογίζεται μέσω λογαριθμικής-γραμμικής παρεκβολής με χρήση της ακόλουθης εξίσωσης:

όπου:
a είναι η ελάχιστη τιμή κυτταρικής βιωσιμότητας άνω του 75 %
c είναι η μέγιστη τιμή κυτταρικής βιωσιμότητας κάτω του 75 %
b και d είναι οι συγκεντρώσεις που εμφανίζουν την τιμή κυτταρικής βιωσιμότητας a και c αντίστοιχα

Μπορούν να χρησιμοποιηθούν και άλλες προσεγγίσεις για τον υπολογισμό της τιμής CV75, εφόσον αποδεικνύεται ότι δεν έχουν επιπτώσεις στα αποτελέσματα (π.χ. μέσω δοκιμών των ουσιών ελέγχου ικανότητας).
|
Μέτρηση έκφρασης των CD86/CD54
Παρασκευή των υπό δοκιμή χημικών ουσιών και των μαρτύρων
|
20.
|
Χρησιμοποιείται ο κατάλληλος διαλύτης/φορέας (αλατούχο διάλυμα, θρεπτικό μέσο ή DMSO, βλ. παράγραφο 14) για τη διάλυση ή τη σταθερή διασπορά των υπό δοκιμή χημικών ουσιών. Οι υπό δοκιμή χημικές ουσίες αραιώνονται πρώτα στη συγκέντρωση που αντιστοιχεί στο 100πλάσιο (για αλατούχο διάλυμα ή θρεπτικό μέσο) ή το 500πλάσιο (για DMSO) της τιμής 1,2 × CV75 που προσδιορίστηκε στη δοκιμασία προσδιορισμού δόσης (βλ. παράγραφο 19). Εάν δεν είναι εφικτός ο προσδιορισμός της τιμής CV75 (εάν δηλαδή δεν παρατηρείται επαρκής κυτταροτοξικότητα στη δοκιμασία προσδιορισμού δόσης), ως αρχική συγκέντρωση θα πρέπει να χρησιμοποιείται η υψηλότερη διαλυτή ή σταθερώς διασπειρόμενη συγκέντρωση της υπό δοκιμή χημικής ουσίας που παρασκευάζεται με κάθε διαλύτη/φορέα. Επισημαίνεται ότι η τελική συγκέντρωση στο τρυβλίο δεν θα πρέπει να υπερβαίνει τα 5 000 μg/ml (σε περίπτωση αλατούχου διαλύματος ή θρεπτικού μέσου) ή τα 1 000 μg/ml (σε περίπτωση DMSO). Στη συνέχεια πραγματοποιούνται διαδοχικές αραιώσεις 1,2x με χρήση του αντίστοιχου διαλύτη/φορέα προκειμένου να σχηματιστούν τα αποθεματικά διαλύματα [οκτώ συγκεντρώσεις από 100×1,2 × CV75 έως 100×0,335 × CV75 (για αλατούχο διάλυμα ή θρεπτικό μέσο) ή από 500×1,2 × CV75 έως 500×0,335 × CV75 (για DMSO)] που θα υποβληθούν σε δοκιμή με τη μέθοδο h-CLAT (βλ. πρωτόκολλο DB-ALM αριθ. 158 για ένα παράδειγμα δοσολογικού σχήματος). Στη συνέχεια, τα αποθεματικά διαλύματα αραιώνονται περαιτέρω 50x (για αλατούχο διάλυμα ή θρεπτικό μέσο) ή 250x (για DMSO) στο θρεπτικό μέσο καλλιέργειας (διαλύματα εργασίας). Αυτά τα διαλύματα εργασίας χρησιμοποιούνται τελικά για την έκθεση με έναν περαιτέρω τελικό συντελεστή αραίωσης 2x στο τρυβλίο. Εάν τα αποτελέσματα δεν πληρούν τα κριτήρια αποδοχής που περιγράφονται στις παραγράφους 29 και 30 αναφορικά με την κυτταρική βιωσιμότητα, η δοκιμασία προσδιορισμού δόσης μπορεί να επαναληφθεί για τον προσδιορισμό της τιμής CV75 με μεγαλύτερη ακρίβεια. Επισημαίνεται ότι για τη μέτρηση της έκφρασης των CD86/CD54 μπορούν να χρησιμοποιηθούν μόνο τρυβλία 24 κοιλοτήτων.
|
|
21.
|
Ο μάρτυρας με διαλύτη/φορέα παρασκευάζεται σύμφωνα με τα όσα περιγράφονται στην παράγραφο 16. Ο θετικός μάρτυρας που χρησιμοποιείται στη μέθοδο h-CLAT είναι το DNCB (βλ. παράγραφο 11), για τον οποίο παρασκευάζονται αποθεματικά διαλύματα σε DMSO, τα οποία αραιώνονται σύμφωνα με τα όσα περιγράφονται στην παράγραφο 20. Το DNCB θα πρέπει να χρησιμοποιείται ως θετικός μάρτυρας για τη μέτρηση της έκφρασης των CD86/CD54 σε μία τελική συγκέντρωση στο τρυβλίο (συνήθως 4,0 μg/ml). Για την επίτευξη συγκέντρωσης DNCB 4,0 μg/ml στο τρυβλίο, παρασκευάζεται αποθεματικό διάλυμα DNCB 2 mg/ml σε DMSO, το οποίο αραιώνεται περαιτέρω 250x με θρεπτικό μέσο καλλιέργειας ώστε να προκύψει διάλυμα εργασίας 8 μg/ml. Εναλλακτικά, η τιμή CV75 του DNCB, η οποία προσδιορίζεται σε κάθε εγκατάσταση δοκιμών, μπορεί επίσης να χρησιμοποιηθεί ως η συγκέντρωση θετικού μάρτυρα. Μπορούν να χρησιμοποιηθούν και άλλοι κατάλληλοι θετικοί μάρτυρες, εάν υπάρχουν διαθέσιμα ιστορικά δεδομένα από τα οποία μπορούν να προκύψουν συγκρίσιμα κριτήρια αποδοχής σειρών δοκιμών. Για τους θετικούς μάρτυρες, η τελική συγκέντρωση στο τρυβλίο δεν θα πρέπει να υπερβαίνει τα 5 000 μg/ml (σε περίπτωση αλατούχου διαλύματος ή θρεπτικού μέσου) ή τα 1 000 μg/ml (σε περίπτωση DMSO). Τα κριτήρια αποδοχής σειρών δοκιμών είναι τα ίδια με τα κριτήρια που περιγράφονται για την υπό δοκιμή χημική ουσία (βλ. παράγραφο 29), με εξαίρεση το τελευταίο κριτήριο αποδοχής, δεδομένου ότι ο θετικός μάρτυρας υποβάλλεται σε δοκιμή σε μία μοναδική συγκέντρωση.
|
Εφαρμογή των υπό δοκιμή χημικών ουσιών και των μαρτύρων
|
22.
|
Για κάθε υπό δοκιμή χημική ουσία και μάρτυρα, για την επίτευξη πρόβλεψης απαιτείται η διεξαγωγή ενός πειράματος. Κάθε πείραμα περιλαμβάνει τουλάχιστον δύο ανεξάρτητες σειρές δοκιμών για τη μέτρηση της έκφρασης των CD86/CD54 (βλ. παραγράφους 26-28). Κάθε ανεξάρτητη σειρά δοκιμών διεξάγεται σε διαφορετική ημέρα, ή την ίδια ημέρα υπό την προϋπόθεση ότι για κάθε σειρά δοκιμών: α) παρασκευάζονται ανεξάρτητα πρόσφατα αποθεματικά διαλύματα και διαλύματα εργασίας της υπό δοκιμή χημικής ουσίας και διαλύματα αντισωμάτων, και β) χρησιμοποιούνται ανεξαρτήτως συλλεχθέντα κύτταρα (δηλ. τα κύτταρα συλλέγονται από διαφορετικές φιάλες καλλιέργειας)· ωστόσο, τα κύτταρα μπορούν να προέρχονται από την ίδια ανακαλλιέργεια. Οι υπό δοκιμή χημικές ουσίες και οι μάρτυρες που παρασκευάζονται ως διαλύματα εργασίας (500 μl) αναμιγνύονται με 500 μl εναιωρηθέντων κυττάρων (1x106 κύτταρα) σε αναλογία 1:1, και τα κύτταρα επωάζονται επί 24±0,5 ώρες, σύμφωνα με τα όσα περιγράφονται στις παραγράφους 20 και 21. Σε κάθε σειρά δοκιμών αρκεί μία μοναδική δοκιμή για κάθε συγκέντρωση της υπό δοκιμή χημικής ουσίας και του μάρτυρα, αφού μια πρόβλεψη λαμβάνεται από τουλάχιστον δύο ανεξάρτητες σειρές δοκιμών.
|
Χρώση και ανάλυση κυττάρων
|
23.
|
Μετά από 24±0,5 ώρες έκθεσης, τα κύτταρα μεταφέρονται από το τρυβλίο 24 κοιλοτήτων σε σωληνάρια δειγμάτων, συλλέγονται με φυγοκέντρηση και, στη συνέχεια, εκπλένονται δύο φορές με 1 ml ρυθμιστικού διαλύματος χρώσης (μπορούν να γίνουν και άλλες πλύσεις εάν χρειάζεται). Μετά την έκπλυση, τα κύτταρα παρεμποδίζονται με 600 μl παρεμποδιστικού διαλύματος [ρυθμιστικό διάλυμα χρώσης που περιέχει 0,01 % κ.ό. σφαιρίνη (κλάσμα Cohn II, III, ανθρώπινο, SIGMA, #G2388-10G ή ισοδύναμο)] και επωάζονται στους 4°C επί 15 λεπτά. Μετά την παρεμπόδιση, τα κύτταρα διαχωρίζονται σε τρία κλάσματα 180 μl σε τρυβλίο στρογγυλής βάσης 96 κοιλοτήτων ή μικροσωληνάριο.
|
|
24.
|
Μετά τη φυγοκέντρηση, πραγματοποιείται χρώση των κυττάρων με 50 μl σημασμένου με FITC αντισώματος αντι-CD86 ή αντι-CD54 ή αντισώματος ποντικού IgG1 (ισοτύπου) στους 4°C επί 30 λεπτά. Τα αντισώματα που περιγράφονται στο πρωτόκολλο h-CLAT DB-ALM αριθ. 158 (18) θα πρέπει να χρησιμοποιούνται μετά από αραίωση 3:25 κ.ό. [γιατον CD86 (BD-PharMingen, #555657, κλώνος: Fun-1)] ή 3:50 κ.ό. [για τον CD54 (DAKO, #F7143, κλώνος: 6.5B5) και το IgG1 (DAKO, #X0927)] με ρυθμιστικό διάλυμα χρώσης. Οι εν λόγω συντελεστές αραίωσης αντισωμάτων καθορίστηκαν από τους φορείς ανάπτυξης της δοκιμής ως οι συντελεστές που παρέχουν τον βέλτιστο λόγο σήματος προς θόρυβο. Με βάση την εμπειρία των φορέων ανάπτυξης της δοκιμής, η ένταση του φθορισμού των αντισωμάτων είναι συνήθως παρεμφερής μεταξύ των διαφόρων παρτίδων. Ωστόσο, οι χρήστες μπορούν να εξετάσουν το ενδεχόμενο να τιτλοδοτήσουν τα αντισώματα υπό τις συνθήκες του δικού τους εργαστηρίου προκειμένου να καθορίσουν τις βέλτιστες συγκεντρώσεις προς χρήση. Μπορούν να χρησιμοποιηθούν και άλλα σημασμένα με φθοριοχρώματα αντισώματα αντι-CD86 και/ή αντι-CD54, εφόσον μπορεί να αποδειχθεί ότι αποδίδουν ανάλογα αποτελέσματα με αυτά των συζευγμένων με FITC αντισωμάτων, για παράδειγμα, μέσω δοκιμών των ουσιών ελέγχου ικανότητας του προσαρτήματος 1.2. Πρέπει να σημειωθεί ότι η αλλαγή του κλώνου ή του προμηθευτή των αντισωμάτων, όπως περιγράφεται στο πρωτόκολλο h-CLAT DB-ALM αριθ. 158 (18), μπορεί να επηρεάσει τα αποτελέσματα. Αφού εκπλυθούν δύο φορές με 150 μl ρυθμιστικού διαλύματος χρώσης, τα κύτταρα εναιωρούνται εκ νέου σε ρυθμιστικό διάλυμα χρώσης (π.χ. 400 μl) και προστίθεται το διάλυμα PI (π.χ. 20 μl για την επίτευξη τελικής συγκέντρωσης 0,625 μg/ml) ή άλλο διάλυμα δείκτη κυτταροτοξικότητας (βλ. παράγραφος 18). Τα επίπεδα έκφρασης των CD86 και CD54 αναλύονται με χρήση κυτταρομετρίας ροής.
|
ΔΕΔΟΜΕΝΑ ΚΑΙ ΑΝΑΦΟΡΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ
Αξιολόγηση των δεδομένων
|
25.
|
Η έκφραση των CD86 και CD54 αναλύεται με κυτταρομετρία ροής με τον δίαυλο καταγραφής FL-1. Με βάση τον γεωμετρικό μέσο όρο έντασης φθορισμού (MFI), υπολογίζεται η σχετική ένταση φθορισμού (RFI) των CD86 και CD54 για τα κύτταρα θετικού μάρτυρα (ctrl) και τα υπό αγωγή με τη χημική ουσία κύτταρα σύμφωνα με την ακόλουθη εξίσωση:

Η κυτταρική βιωσιμότητα από τα κύτταρα ισοτυπικού μάρτυρα (ctrl) [που υποβάλλονται σε χρώση με αντισώματα IgG1 (ισοτύπου) ποντικού] υπολογίζεται επίσης σύμφωνα με την εξίσωση που περιγράφεται στην παράγραφο 19.
|
Μοντέλο πρόβλεψης
|
26.
|
Για τη μέτρηση της έκφρασης των CD86/CD54, κάθε υπό δοκιμή χημική ουσία ελέγχεται σε τουλάχιστον δύο ανεξάρτητες σειρές δοκιμών για να προκύψει μία συγκεκριμένη πρόβλεψη (ΘΕΤΙΚΗ ή ΑΡΝΗΤΙΚΗ). Μια πρόβλεψη h-CLAT θεωρείται ΘΕΤΙΚΗ εφόσον πληρούται τουλάχιστον μία από τις ακόλουθες προϋποθέσεις σε 2 από 2 ή τουλάχιστον σε 2 από 3 ανεξάρτητες σειρές δοκιμών, διαφορετικά η πρόβλεψη h-CLAT θεωρείται ΑΡΝΗΤΙΚΗ (σχήμα 1):
|
—
|
η RFI του CD86 είναι ίση ή μεγαλύτερη από 150 % σε οποιαδήποτε ελεγχθείσα συγκέντρωση (με κυτταρική βιωσιμότητα ≥ 50 %),
|
|
—
|
η RFI του CD54 είναι ίση ή μεγαλύτερη από 200 % σε οποιαδήποτε ελεγχθείσα συγκέντρωση (με κυτταρική βιωσιμότητα ≥ 50 %).
|
|
|
27.
|
Με βάση τα παραπάνω, εάν οι πρώτες δύο σειρές δοκιμών είναι αμφότερες θετικές για τον CD54 και/ή είναι αμφότερες θετικές για τον CD54, η πρόβλεψη h-CLAT θεωρείται ΘΕΤΙΚΗ και δεν χρειάζεται τρίτη σειρά δοκιμών. Παρομοίως, εάν οι πρώτες δύο σειρές δοκιμών είναι αρνητικές και για τους δύο δείκτες, η πρόβλεψη h-CLAT θεωρείται ΑΡΝΗΤΙΚΗ (λαμβανομένων δεόντως υπόψη των πληροφοριών στην παράγραφο 30) χωρίς να χρειάζεται τρίτη σειρά δοκιμών. Εάν, ωστόσο, οι δύο πρώτες σειρές δοκιμών δε συμφωνούν για τουλάχιστον έναν από τους δείκτες (CD54 ή CD86), τότε χρειάζεται τρίτη σειρά δοκιμών και η τελική πρόβλεψη προκύπτει κατά πλειοψηφία (2 στις 3). Από αυτή την άποψη, θα πρέπει να επισημανθεί ότι εάν διεξάγονται δύο ανεξάρτητες σειρές δοκιμών, εκ των οποίων η μία είναι θετική μόνο για τον CD86 (στο εξής αναφερόμενη ως P1) και η άλλη είναι θετική μόνο για τον CD54 (στο εξής αναφερόμενη ως P2), απαιτείται η διεξαγωγή τρίτης σειράς δοκιμών. Εάν η εν λόγω τρίτη σειρά δοκιμών είναι αρνητική και για τους δύο δείκτες (στο εξής αναφερόμενη ως N), η πρόβλεψη h-CLAT θεωρείται ΑΡΝΗΤΙΚΗ. Από την άλλη πλευρά, εάν η τρίτη σειρά δοκιμών είναι θετική για οποιονδήποτε από τους δύο δείκτες (P1 ή P2) ή και για τους δύο δείκτες (στο εξής αναφερόμενη ως P12), η πρόβλεψη h-CLAT θεωρείται ΘΕΤΙΚΗ.

Σχήμα 1: Μοντέλο πρόβλεψης που χρησιμοποιείται στη μέθοδο h-CLAT. Οι προβλέψεις βάσει της μεθόδου h-CLAT θα πρέπει να εξετάζονται στο πλαίσιο ΙΑΤΑ και σύμφωνα με τις πληροφορίες στις παραγράφους 7 και 8 της γενικής εισαγωγής.
P1: σειρά δοκιμών με θετικό μόνο τον CD86· P2: σειρά δοκιμών με θετικό μόνο τον CD54· P12: σειρά δοκιμών με θετικούς αμφότερους τους CD86 και CD54· N: σειρά δοκιμών χωρίς θετικό ούτε τον CD86 ούτε τον CD54.
* Σε αυτά τα πλαίσια παρουσιάζονται οι σχετικοί συνδυασμοί αποτελεσμάτων από τις δύο πρώτες σειρές δοκιμών, ανεξαρτήτως της σειράς με την οποία μπορεί να λαμβάνονται.
# Σε αυτά τα πλαίσια παρουσιάζονται οι σχετικοί συνδυασμοί αποτελεσμάτων από τις τρεις σειρές δοκιμών με βάση τα αποτελέσματα που ελήφθησαν από τις δύο πρώτες σειρές δοκιμών που παρουσιάζονται στο προηγούμενο πλαίσιο, χωρίς, ωστόσο, να αντικατοπτρίζουν τη σειρά με την οποία μπορεί να λαμβάνονται.
|
|
28.
|
Για τις υπό δοκιμή χημικές ουσίες για τις οποίες η πρόβλεψη είναι ΘΕΤΙΚΗ με την h-CLAT, μπορούν να προσδιορίζονται, προαιρετικά, δύο τιμές αποτελεσματικών συγκεντρώσεων (EC), η τιμή EC150 για τον CD86 και η τιμή EC200 για τον CD54, δηλ. η συγκέντρωση στην οποία οι υπό δοκιμή χημικές ουσίες επήγαγαν RFI 150 ή 200. Οι εν λόγω τιμές EC μπορούν δυνητικά να συμβάλουν στην εκτίμηση της ευαισθητοποιητικής ισχύος (9) όταν χρησιμοποιούνται σε ολοκληρωμένες προσεγγίσεις, όπως οι IATA (4) (5) (6) (7) (8). Μπορούν να υπολογιστούν βάσει των ακόλουθων εξισώσεων:
EC 150 (for CD86) = Bconc
+ [(150 - BRFI
)/ARFI - BRFI
) × (Aconc - Bconc
)]
EC 200 (for CD86) = Bconc
+ [(200 - BRFI
)/ARFI - BRFI
) × (Aconc - Bconc
)]
όπου:
Aconc είναι η χαμηλότερη συγκέντρωση σε μg/ml με RFI > 150 (CD86) ή 200 (CD54)
Bconc είναι η υψηλότερη συγκέντρωση σε μg/ml με RFI > 150 (CD86) ή 200 (CD54)
ARFI είναι η RFI στη χαμηλότερη συγκέντρωση με RFI > 150 (CD86) ή 200 (CD54)
ΒRFI είναι η RFI στην υψηλότερη συγκέντρωση με RFI < 150 (CD86) ή 200 (CD54)
Για τον υπολογισμό των τιμών των EC150 και EC200 με μεγαλύτερη ακρίβεια, ενδέχεται να απαιτείται η διεξαγωγή τριών ανεξάρτητων σειρών δοκιμών για τη μέτρηση της έκφρασης των CD86/CD54. Στη συνέχεια, οι τελικές τιμές EC150 και EC200 προσδιορίζονται ως η διάμεση τιμή των EC που υπολογίστηκαν από τις τρεις ανεξάρτητες σειρές δοκιμών. Σε περίπτωση που μόνο δύο από τις τρεις ανεξάρτητες σειρές δοκιμών πληρούν τα κριτήρια θετικότητας (βλ. παραγράφους 26-27), υιοθετείται η υψηλότερη EC150 ή EC200 από τις δύο υπολογισθείσες τιμές.
|
Κριτήρια αποδοχής
|
29.
|
Όταν χρησιμοποιείται η μέθοδος h-CLAT, θα πρέπει να πληρούνται τα ακόλουθα κριτήρια αποδοχής (22) (27).
|
—
|
Οι κυτταρικές βιωσιμότητες του θρεπτικού μέσου και των μαρτύρων με διαλύτη/φορέα θα πρέπει να υπερβαίνουν το 90 %.
|
|
—
|
Στον μάρτυρα με διαλύτη/φορέα, οι τιμές RFI αμφότερων των CD86 και CD54 δεν θα πρέπει να υπερβαίνουν τα κριτήρια χαρακτηρισμού ως θετικών (CD86 RFI ≥ 150 % και CD54 RFI ≥ 200 %). Οι τιμές RFI του μάρτυρα με διαλύτη/φορέα υπολογίζονται με χρήση του τύπου που περιγράφεται στην παράγραφο 25 [το «MFI χημικής ουσίας» θα πρέπει να αντικατασταθεί από το «MFI διαλύτη/φορέα», και το «MFI διαλύτη/φορέα» θα πρέπει να αντικατασταθεί από το «MFI μάρτυρα (θρεπτικού μέσου)»].
|
|
—
|
Για τους μάρτυρες θρεπτικού μέσου και διαλύτη/φορέα, ο λόγος MFI τόσο του CD86 όσο και του CD54 προς τον ισοτυπικό μάρτυρα θα πρέπει να είναι > 105 %.
|
|
—
|
Στον θετικό μάρτυρα (DNCB), οι τιμές RFI για τους CD86 και CD54 θα πρέπει να πληρούν τα κριτήρια θετικότητας (CD86 RFI ≥ 150 και CD54 RFI ≥ 200), και η κυτταρική βιωσιμότητα θα πρέπει να υπερβαίνει το 50 %.
|
|
—
|
Για την υπό δοκιμή χημική ουσία, η κυτταρική βιωσιμότητα θα πρέπει να υπερβαίνει το 50 % σε τουλάχιστον τέσσερις ελεγχθείσες συγκεντρώσεις σε κάθε σειρά δοκιμών.
|
|
|
30.
|
Αρνητικά αποτελέσματα είναι αποδεκτά μόνο για τις υπό δοκιμή χημικές ουσίες που παρουσιάζουν κυτταρική βιωσιμότητα κάτω από 90 % στην υψηλότερη ελεγχθείσα συγκέντρωση (δηλ. 1,2 × CV75, σύμφωνα με το σχήμα διαδοχικών αραιώσεων που περιγράφεται στην παράγραφο 20). Εάν η κυτταρική βιωσιμότητα σε 1,2 × CV75 είναι ίση ή μεγαλύτερη από 90 %, το αρνητικό αποτέλεσμα θα πρέπει να απορρίπτεται. Σε αυτή την περίπτωση, συνιστάται η βελτιστοποίηση των επιλεγμένων δόσεων μέσω επανάληψης του προσδιορισμού της CV75. Θα πρέπει να επισημανθεί ότι όταν ως μέγιστη συγκέντρωση δοκιμής μιας υπό δοκιμή χημικής ουσίας χρησιμοποιούνται τα 5 000 μg/ml σε αλατούχο διάλυμα (ή σε θρεπτικό μέσο ή άλλους διαλύτες/φορείς), τα 1 000 μg/ml σε DMSO ή η υψηλότερη διαλυτή συγκέντρωση, ένα αρνητικό αποτέλεσμα είναι αποδεκτό ακόμη κι αν η κυτταρική βιωσιμότητα υπερβαίνει το 90 %.
|
Έκθεση δοκιμής
|
31.
|
Στην έκθεση δοκιμής θα πρέπει να περιλαμβάνονται τα ακόλουθα στοιχεία.
|
Υπό δοκιμή χημική ουσία
|
Μονοσυστατική ουσία
|
ταυτοποίηση της χημικής ουσίας, όπως ονομασία/-ες IUPAC ή CAS, αριθμός/-οί CAS, κωδικός SMILES ή InChI, συντακτικός τύπος και/ή άλλα αναγνωριστικά στοιχεία,
|
|
φυσική εμφάνιση, Log Kow, υδατοδιαλυτότητα, διαλυτότητα σε DMSO, μοριακό βάρος και πρόσθετες σχετικές φυσικοχημικές ιδιότητες, εφόσον είναι διαθέσιμα,
|
|
καθαρότητα, χημική ταυτότητα των προσμείξεων, κατά περίπτωση και στο μέτρο του δυνατού, κ.λπ.,
|
|
κατεργασία πριν από τη δοκιμή, εάν ισχύει (π.χ. θέρμανση, λειοτρίβηση),
|
|
ελεγχθείσα συγκέντρωση/-εις,
|
|
συνθήκες φύλαξης και σταθερότητα, εφόσον είναι διαθέσιμα,
|
|
αιτιολόγηση της επιλογής του διαλύτη/φορέα για κάθε υπό δοκιμή χημική ουσία.
|
|
|
Πολυσυστατική ουσία, UVCB και μείγμα
|
χαρακτηρισμός, στο μέτρο του δυνατού, π.χ. χημική ταυτότητα (βλ. ανωτέρω), καθαρότητα, ποσότητα και σχετικές φυσικοχημικές ιδιότητες (βλ. ανωτέρω) των συστατικών, εφόσον είναι διαθέσιμα,
|
|
φυσική εμφάνιση, υδατοδιαλυτότητα, διαλυτότητα σε DMSO και πρόσθετες σχετικές φυσικοχημικές ιδιότητες, εφόσον είναι διαθέσιμα,
|
|
μοριακό βάρος ή φαινόμενο μοριακό βάρος στην περίπτωση των μειγμάτων/πολυμερών γνωστής σύνθεσης ή άλλες πληροφορίες που έχουν σημασία για τη διεξαγωγή της μελέτης,
|
|
κατεργασία πριν από τη δοκιμή, εάν ισχύει (π.χ. θέρμανση, λειοτρίβηση),
|
|
ελεγχθείσα συγκέντρωση/-εις,
|
|
συνθήκες φύλαξης και σταθερότητα, εφόσον είναι διαθέσιμα,
|
|
αιτιολόγηση της επιλογής του διαλύτη/φορέα για κάθε υπό δοκιμή χημική ουσία.
|
|
|
|
Έλεγχοι
|
Θετικός μάρτυρας
|
ταυτοποίηση της χημικής ουσίας, όπως ονομασία/-ες IUPAC ή CAS, αριθμός/-οί CAS, κωδικός SMILES ή InChI, συντακτικός τύπος και/ή άλλα αναγνωριστικά στοιχεία,
|
|
φυσική εμφάνιση, Log Kow, υδατοδιαλυτότητα, διαλυτότητα σε DMSO, μοριακό βάρος και πρόσθετες σχετικές φυσικοχημικές ιδιότητες, στο μέτρο του δυνατού και ανάλογα με την περίπτωση,
|
|
καθαρότητα, χημική ταυτότητα των προσμείξεων, κατά περίπτωση και στο μέτρο του δυνατού, κ.λπ.,
|
|
κατεργασία πριν από τη δοκιμή, εάν ισχύει (π.χ. θέρμανση, λειοτρίβηση),
|
|
ελεγχθείσα συγκέντρωση/-εις,
|
|
συνθήκες φύλαξης και σταθερότητα, εφόσον είναι διαθέσιμα,
|
|
παραπομπή σε ιστορικά αποτελέσματα θετικών μαρτύρων που καταδεικνύουν την εφαρμογή κατάλληλων κριτηρίων αποδοχής των μετρήσεων, εάν ισχύει.
|
|
|
|
Αρνητικός μάρτυρας και μάρτυρας με διαλύτη/φορέα
|
ταυτοποίηση της χημικής ουσίας, όπως ονομασία/-ες IUPAC ή CAS, αριθμός/-οί CAS, κωδικός SMILES ή InChI, συντακτικός τύπος και/ή άλλα αναγνωριστικά στοιχεία,
|
|
καθαρότητα, χημική ταυτότητα των προσμείξεων, κατά περίπτωση και στο μέτρο του δυνατού, κ.λπ.,
|
|
φυσική εμφάνιση, μοριακό βάρος, καθώς και πρόσθετες σχετικές φυσικοχημικές ιδιότητες, σε περίπτωση χρήσης άλλου διαλύτη/φορέα εκτός εκείνων που αναφέρονται στην κατευθυντήρια γραμμή δοκιμών και εφόσον είναι διαθέσιμα,
|
|
συνθήκες φύλαξης και σταθερότητα, εφόσον είναι διαθέσιμα,
|
|
αιτιολόγηση της επιλογής του διαλύτη/φορέα για κάθε υπό δοκιμή χημική ουσία.
|
|
|
Συνθήκες δοκιμής
|
όνομα και διεύθυνση του χορηγού, της εγκατάστασης δοκιμών και του διευθυντή της μελέτης,
|
|
περιγραφή της χρησιμοποιηθείσας δοκιμής,
|
|
κυτταρική σειρά που χρησιμοποιήθηκε, συνθήκες φύλαξης και προέλευσή της (π.χ. εγκατάσταση προέλευσης),
|
|
χρησιμοποιηθείσα μέθοδος κυτταρομετρίας ροής (π.χ. μοντέλο), περιλαμβανομένων των χρησιμοποιηθέντων οργάνων, σφαιρίνης, αντισωμάτων και δεικτών κυτταροτοξικότητας,
|
|
η διαδικασία που χρησιμοποιήθηκε για να αποδειχθεί η τεχνική ικανότητα του εργαστηρίου να διεξάγει τη δοκιμή μέσω δοκιμών των ουσιών ελέγχου ικανότητας, και η διαδικασία που χρησιμοποιήθηκε για να αποδειχθεί η διαχρονική αναπαραγωγιμότητα της διεξαγωγής της δοκιμής, π.χ. ιστορικά δεδομένα για μάρτυρες και/ή ιστορικά δεδομένα ελέγχων δραστικότητας.
|
|
|
Κριτήρια αποδοχής της δοκιμής
|
κυτταρική βιωσιμότητα, τιμές MFI και RFI που ελήφθησαν με τον μάρτυρα με διαλύτη/φορέα σε σύγκριση με τα αποδεκτά πεδία τιμών,
|
|
κυτταρική βιωσιμότητα και τιμές RFI που ελήφθησαν με τον θετικό μάρτυρα σε σύγκριση με τα αποδεκτά πεδία τιμών,
|
|
κυτταρική βιωσιμότητα όλων των ελεγχθεισών συγκεντρώσεων της υπό δοκιμή χημικής ουσίας.
|
|
|
Διαδικασία δοκιμής
|
αριθμός σειρών δοκιμών που χρησιμοποιήθηκαν,
|
|
συγκεντρώσεις της υπό δοκιμή χημικής ουσίας, χρόνος εφαρμογής και έκθεσης που χρησιμοποιήθηκε (εάν διαφέρει από τον συνιστώμενο),
|
|
περιγραφή των χρησιμοποιούμενων κριτηρίων αξιολόγησης και λήψης αποφάσεων,
|
|
περιγραφή τυχόν τροποποιήσεων της διαδικασίας δοκιμής.
|
|
|
Αποτελέσματα
|
δεδομένα υπό μορφή πίνακα, περιλαμβανομένης της CV75 (κατά περίπτωση), των επιμέρους γεωμετρικών τιμών MFI, RFI, των τιμών κυτταρικής βιωσιμότητας, των τιμών EC150/EC200 (κατά περίπτωση) που υπολογίστηκαν για την υπό δοκιμή χημική ουσία και για τον θετικό μάρτυρα σε κάθε σειρά δοκιμών, και ένδειξη της κατάταξης της υπό δοκιμή χημικής ουσίας σύμφωνα με το μοντέλο πρόβλεψης,
|
|
περιγραφή κάθε άλλης σχετικής παρατήρησης, κατά περίπτωση.
|
|
|
Εξέταση των αποτελεσμάτων
|
εξέταση των αποτελεσμάτων που προέκυψαν με τη μέθοδο δοκιμών h-CLAT,
|
|
εξέταση των αποτελεσμάτων δοκιμής στο πλαίσιο της IATA, εάν υπάρχουν σχετικές πληροφορίες.
|
|
|
ΒΙΒΛΙΟΓΡΑΦΙΑ
|
(1)
|
Ashikaga T, Yoshida Y, Hirota M, Yoneyama K, Itagaki H, Sakaguchi H, Miyazawa M, Ito Y, Suzuki H, Toyoda H. (2006). Development of an in vitro skin sensitization test using human cell lines: The human Cell Line Activation Test (h-CLAT) I. Optimization of the h-CLAT protocol. Toxicol. In Vitro 20, 767-773.
|
|
(2)
|
Miyazawa M, Ito Y, Yoshida Y, Sakaguchi H, Suzuki H. (2007). Phenotypic alterations and cytokine production in THP-1 cells in response to allergens. Toxicol. In Vitro 21, 428-437.
|
|
(3)
|
EC EURL-ECVAM (2013). Recommendation on the human Cell Line Activation Test (h-CLAT) for skin sensitisation testing. Διαθέσιμο στη διεύθυνση: https://eurl-ecvam.jrc.ec.europa.eu/eurl-ecvam-recommendations
|
|
(4)
|
Takenouchi O, Fukui S, Okamoto K, Kurotani S, Imai N, Fujishiro M, Kyotani D, Kato Y, Kasahara T, Fujita M, Toyoda A, Sekiya D, Watanabe S, Seto H, Hirota M, Ashikaga T, Miyazawa M. (2015). Test battery with the human cell line activation test, direct peptide reactivity assay and DEREK based on a 139 chemical data set for predicting skin sensitizing potential and potency of chemicals. J Appl Toxicol. 35, 1318-1332.
|
|
(5)
|
Hirota M, Fukui S, Okamoto K, Kurotani S, Imai N, Fujishiro M, Kyotani D, Kato Y, Kasahara T, Fujita M, Toyoda A, Sekiya D, Watanabe S, Seto H, Takenouchi O, Ashikaga T, Miyazawa M. (2015). Evaluation of combinations of in vitro sensitization test descriptors for the artificial neural network-based risk assessment model of skin sensitization. J Appl Toxicol. 35, 1333-1347.
|
|
(6)
|
Bauch C, Kolle SN, Ramirez T, Fabian E, Mehling A, Teubner W, van Ravenzwaay B, Landsiedel R. (2012). Putting the parts together: combining in vitro methods to test for skin sensitizing potencials. Regul Toxicol Parmacol. 63, 489-504.
|
|
(7)
|
Van der Veen JW, Rorije E, Emter R, Natch A, van Loveren H, Ezendam J. (2014). Evaluating the performance of integrated approaches for hazard identification of skin sensitizing chemicals. Regul Toxicol Pharmacol. 69, 371-379.
|
|
(8)
|
Urbisch D, Mehling A, Guth K, Ramirez T, Honarvar N, Kolle S, Landsiedel R, Jaworska J, Kern PS, Gerberick F, Natsch A, Emter R, Ashikaga T, Miyazawa M, Sakaguchi H. (2015). Assessing skin sensitization hazard in mice and men using non-animal test methods. Regul Toxicol Parmacol. 71, 337-351.
|
|
(9)
|
Jaworska JS, Natsch A, Ryan C, Strickland J, Ashikaga T, Miyazawa M. (2015). Bayesian integrated testing strategy (ITS) for skin sensitization potency assessment: a decision support system for quantitative weight of evidence and adaptive testing strategy. Arch Toxicol. 89, 2355-2383.
|
|
(10)
|
Strickland J, Zang Q, Kleinstreuer N, Paris M, Lehmann DM, Choksi N, Matheson J, Jacobs A, Lowit A, Allen D, Casey W. (2016). Integrated decision strategies for skin sensitization hazard. J Appl Toxicol. DOI 10.1002/jat.3281.
|
|
(11)
|
Nukada Y, Ashikaga T, Miyazawa M, Hirota M, Sakaguchi H, Sasa H, Nishiyama N. (2012). Prediction of skin sensitization potency of chemicals by human Cell Line Activation Test (h-CLAT) and an attempt at classifying skin sensitization potency. Toxicol. In Vitro 26, 1150-60.
|
|
(12)
|
EC EURL ECVAM (2015). Re-analysis of the within and between laboratory reproducibility of the human Cell Line Activation Test (h-CLAT). Διαθέσιμο στη διεύθυνση: https://eurl-ecvam.jrc.ec.europa.eu/eurl-ecvam-recommendations/eurl-ecvam-recommendation-on-the-human-cell-line-activation-test-h-clat-for-skin-sensitisation-testing
|
|
(13)
|
EC EURL ECVAM (2012). human Cell Line Activation Test (h-CLAT) Validation Study Report Accessible at: https://eurl-ecvam.jrc.ec.europa.eu/eurl-ecvam-recommendations
|
|
(14)
|
Takenouchi O, Miyazawa M, Saito K, Ashikaga T, Sakaguchi H. (2013). Predictive performance of the human Cell Line Activation Test (h-CLAT) for lipophilic with high octanol-water partition coefficients. J. Toxicol. Sci. 38, 599-609.
|
|
(15)
|
Ashikaga T, Sakaguchi H, Sono S, Kosaka N, Ishikawa M, Nukada Y, Miyazawa M, Ito Y, NishiyamaN, Itagaki H. (2010). A comparative evaluation of in vitro skin sensitisation tests: the human cell-line activation test (h-CLAT) versus the local lymph node assay (LLNA). Altern. Lab. Anim. Sci. 38, 275-284.
|
|
(16)
|
Fabian E., Vogel D., Blatz V., Ramirez T., Kolle S., Eltze T., van Ravenzwaay B., Oesch F., Landsiedel R. (2013). Xenobiotic metabolizin enzyme activities in cells used for testing skin sensitization in vitro. Arch Toxicol 87, 1683-1969.
|
|
(17)
|
Okamoto K, Kato Y, Kosaka N, Mizuno M, Inaba H, Sono S, Ashikaga T, Nakamura T, Okamoto Y, Sakaguchi H, Kishi M, Kuwahara H, Ohno Y. (2010). The Japanese ring study of a human Cell Line Activation Test (h-CLAT) for predicting skin sensitization potential (6th report): A study for evaluating oxidative hair dye sensitization potential using h-CLAT. AATEX 15, 81-88.
|
|
(18)
|
DB-ALM (INVITTOX) (2014). Protocol 158: human Cell Line Activation Test (h-CLAT), 23pp. Διαθέσιμο στη διεύθυνση: http://ecvam-dbalm.jrc.ec.europa.eu/
|
|
(19)
|
Mizuno M, Yoshida M, Kodama T, Kosaka N, Okamato K, Sono S, Yamada T, Hasegawa S, Ashikaga T, Kuwahara H, Sakaguchi H, Sato J, Ota N, Okamoto Y, Ohno Y. (2008). Effects of pre-culture conditions on the human Cell Line Activation Test (h-CLAT) results; Results of the 4th Japanese inter-laboratory study. AATEX 13, 70-82.
|
|
(20)
|
Sono S, Mizuno M, Kosaka N, Okamoto K, Kato Y, Inaba H, , Nakamura T, Kishi M, Kuwahara H, Sakaguchi H, Okamoto Y, Ashikaga T, Ohno Y. (2010). The Japanese ring study of a human Cell Line Activation Test (h-CLAT) for predicting skin sensitization potential (7th report): Evaluation of volatile, poorly soluble fragrance materials. AATEX 15, 89-96.
|
|
(21)
|
OECD (2005). Guidance Document No 34 on The Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment. OECD Series on Testing and Assessment. Organization for Economic Cooperation and Development, Paris, France, 2005, 96 pp.
|
|
(22)
|
OECD (2012). The Adverse Outcome Pathway for Skin Sensitisation Initiated by Covalent Binding to Proteins. Μέρος 1: Series on Testing and Assessment No. Series on Testing and Assessment No 168. Διατίθεται στον δικτυακό τόπο: http://www.oecd.org/officialdocuments/publicdisplaydocumentpdf/?cote=ENV/JM/ MONO(2012)10/PART1&docLanguage=En
|
|
(23)
|
United Nations UN (2013). Globally Harmonized System of Classification and Labelling of Chemicals (GHS). Fifth revised edition. New York & Geneva: United Nations Publications. ISBN: 978-92-1-117006-1. Διατίθεται στον δικτυακό τόπο: http://www.unece.org/trans/danger/publi/ghs/ghs_rev05/05files_e.html
|
|
(24)
|
ECETOC (2003). Contact sensitization: Classification according to potency. European Centre for Ecotoxicology & Toxicology of Chemicals (Technical Report No 87).
|
|
(25)
|
Ashikaga T, Sakaguchi H, Okamoto K, Mizuno M, Sato J, Yamada T, Yoshida M, Ota N, Hasegawa S, Kodama T, Okamoto Y, Kuwahara H, Kosaka N, Sono S, Ohno Y. (2008). Assessment of the human Cell Line Activation Test (h-CLAT) for Skin Sensitization; Results of the First Japanese Inter-laboratory Study. AATEX 13, 27-35.
|
Προσάρτημα 1.1
ΟΡΙΣΜΟΙ
Ορθότητα
: ο βαθμός συμφωνίας μεταξύ των αποτελεσμάτων της δοκιμής και των αποδεκτών τιμών αναφοράς. Αποτελεί κριτήριο επιδόσεων της δοκιμής και μια από τις πτυχές της καταλληλότητας. Συχνά ο όρος χρησιμοποιείται εναλλακτικά προς τη «συμφωνία» για να δηλώσει το ποσοστό ορθών αποτελεσμάτων μιας δοκιμής (21).
AOP (Adverse Outcome Pathway)
: πορεία δυσμενούς έκβασης: αλληλουχία συμβάντων, από τη χημική δομή της στοχευόμενης χημικής ουσίας ή ομάδας ομοειδών χημικών ουσιών και το μοριακό εναρκτήριο συμβάν μέχρι την εξεταζόμενη έκβαση in vivo (22).
Χημικό προϊόν
: μια ουσία ή ένα μείγμα.
CV75
: η εκτιμώμενη συγκέντρωση που παρουσιάζει κυτταρική βιωσιμότητα 75 %.
EC150
: οι συγκεντρώσεις που παρουσιάζουν την τιμή RFI 150 για την έκφραση του CD86
EC200
: οι συγκεντρώσεις που παρουσιάζουν την τιμή RFI 200 για την έκφραση του CD54
Κυτταρομετρία ροής
: κυτταρομετρική τεχνική κατά την οποία κύτταρα εναιωρημένα εντός υγρού διασχίζουν ένα-ένα την εστία μιας φωτεινής δέσμης διέγερσης, η οποία σκεδάζεται με τρόπους χαρακτηριστικούς των κυττάρων και των συστατικών τους· τα κύτταρα σημαίνονται συχνά με φθορίζοντες δείκτες οι οποίοι πρώτα απορροφούν και κατόπιν επανεκπέμπουν το φως σε διαφορετική συχνότητα.
Επικινδυνότητα
: εγγενής ιδιότητα ενός παράγοντα ή μιας κατάστασης που μπορεί να έχει δυσμενείς επιδράσεις όταν ένας οργανισμός, ένα σύστημα ή ένας (υπο)πληθυσμός εκτίθεται στον παράγοντα.
IATA (Integrated Approach to Testing and Assessment)
: ολοκληρωμένη προσέγγιση για τη διεξαγωγή δοκιμών και την αξιολόγηση: δομημένη προσέγγιση που χρησιμοποιείται για τον προσδιορισμό της επικινδυνότητας (δυναμικό), τον χαρακτηρισμό της επικινδυνότητας (ισχύς) και/ή την εκτίμηση της ασφάλειας (δυναμικό/ισχύς και έκθεση) μιας χημικής ουσίας ή ομάδας χημικών ουσιών, στην οποία ενσωματώνονται και σταθμίζονται στρατηγικά όλα τα σχετικά δεδομένα, με σκοπό την τροφοδότηση κανονιστικών αποφάσεων σχετικά με τη δυνητική επικινδυνότητα και/ή τον κίνδυνο και/ή την ανάγκη για περαιτέρω στοχευμένες και, ως εκ τούτου, ελάχιστες δοκιμές.
Μάρτυρας θρεπτικού μέσου
: πανομοιότυπο δείγμα που περιέχει όλα τα στοιχεία ενός συστήματος δοκιμής και δεν υποβάλλεται σε αγωγή. Το δείγμα αυτό υποβάλλεται σε δοκιμή μαζί με τα δείγματα που έχουν υποβληθεί σε αγωγή με την υπό δοκιμή χημική ουσία και με άλλα δείγματα μάρτυρες, ούτως ώστε να διαπιστώνεται αν ο διαλύτης/φορέας αλληλεπιδρά με το σύστημα δοκιμής.
Μείγμα
: ένα μείγμα ή διάλυμα που αποτελείται από δύο ή περισσότερες ουσίες.
Μονοσυστατική ουσία
: ουσία που ορίζεται από την ποσοτική της σύνθεση και της οποίας ένα κύριο συστατικό περιέχεται σε ποσοστό τουλάχιστον 80 % κ.β.
Πολυσυστατική ουσία
: ουσία που ορίζεται από την ποσοτική της σύνθεση και της οποίας περισσότερα από ένα κύρια συστατικά περιέχονται σε συγκέντρωση ≥ 10 % κ.β. και < 80 % κ.β. Οι πολυσυστατικές ουσίες είναι προϊόντα μεταποιητικών διεργασιών. Η διαφορά μεταξύ μείγματος και πολυσυστατικής ουσίας είναι ότι το μείγμα λαμβάνεται με ανάμειξη δύο ή περισσότερων ουσιών, χωρίς χημική αντίδραση. Οι πολυσυστατικές ουσίες είναι προϊόντα χημικών αντιδράσεων.
Θετικός μάρτυρας
: πανομοιότυπο δείγμα που περιέχει όλα τα στοιχεία ενός συστήματος δοκιμής και υποβάλλεται σε αγωγή με ουσία που είναι γνωστό ότι προκαλεί θετική απόκριση. Για να διασφαλίζεται η δυνατότητα αξιολόγησης της μεταβλητότητας της απόκρισης του θετικού μάρτυρα σε συνάρτηση με τον χρόνο, το μέγεθος της θετικής απόκρισης δεν θα πρέπει να είναι υπερβολικό.
Αβιοτικά προαπτένια
: χημικές ουσίες που καθίστανται ευαισθητοποιητικές μέσω αβιοτικού μετασχηματισμού.
Μεταβολικά προαπτένια
: χημικές ουσίες που χρειάζονται ενζυμική ενεργοποίηση για να εκδηλώσουν το δυναμικό δερματικής ευαισθητοποίησής τους.
Σχετική ένταση φθορισμού (RFI)
: οι σχετικές τιμές του γεωμετρικού μέσου όρου έντασης φθορισμού (MFI) σε κύτταρα που υποβάλλονται σε αγωγή σε με υπό δοκιμή χημική ουσία σε σύγκριση με την MFI σε κύτταρα που υποβάλλονται σε αγωγή με διαλύτη/φορέα.
Καταλληλότητα
: περιγραφή της σχέσης της δοκιμής με την υπό μελέτη επίδραση και του κατά πόσον αυτή είναι αρμόζουσα και χρήσιμη για συγκεκριμένο σκοπό. Πρόκειται για τον βαθμό στον οποίο η δοκιμή μετρά ή προβλέπει σωστά τη βιολογική επίδραση υπό μελέτη. Η καταλληλότητα εμπεριέχει συνεκτίμηση της ορθότητας (συμφωνίας) της δοκιμής (21).
Αξιοπιστία
: μέτρο του βαθμού στον οποίο μια δοκιμή μπορεί να αναπαράγεται διαχρονικά στο ίδιο εργαστήριο και μεταξύ εργαστηρίων, όταν εφαρμόζεται με το ίδιο πρωτόκολλο. Εκτιμάται με υπολογισμό της ενδοεργαστηριακής και της διεργαστηριακής αναπαραγωγιμότητας, καθώς και της ενδοεργαστηριακής επαναληψιμότητας (21).
Σειρά δοκιμών
: η σειρά περιλαμβάνει μία ή περισσότερες υπό δοκιμή χημικές ουσίες που υποβάλλονται σε δοκιμή ταυτόχρονα με μάρτυρα με διαλύτη/φορέα και θετικό μάρτυρα.
Ευαισθησία
: το ποσοστό του συνόλου των θετικών/δραστικών χημικών ουσιών που ταξινομείται σωστά με τη δοκιμή. Αποτελεί μέτρο ορθότητας των δοκιμών με τις οποίες λαμβάνονται κατηγορηματικά αποτελέσματα, και είναι σημαντικό κριτήριο αξιολόγησης της καταλληλότητας των δοκιμών (21).
Ρυθμιστικό διάλυμα χρώσης
: αλατούχο ρυθμιστικό διάλυμα φωσφορικών ιόντων που περιέχει 0,1 % αλβουμίνη βόειου ορού.
Μάρτυρας με διαλύτη/φορέα
: δείγμα που δεν υποβάλλεται σε αγωγή και περιέχει όλα τα στοιχεία ενός συστήματος δοκιμής, εκτός της υπό δοκιμή χημικής ουσίας, αλλά περιλαμβανομένου του διαλύτη/φορέα που χρησιμοποιείται. Χρησιμοποιείται για τον προσδιορισμό της βασικής απόκρισης των δειγμάτων που υποβάλλονται σε αγωγή με την υπό δοκιμή χημική ουσία διαλυμένη ή σταθερώς διεσπαρμένη στον ίδιο διαλύτη/φορέα. Όταν το εν λόγω δείγμα υποβάλλεται σε δοκιμή με παράλληλο μάρτυρα θρεπτικού μέσου, καταδεικνύει επίσης αν ο διαλύτης/φορέας αλληλεπιδρά με το σύστημα δοκιμής.
Ειδικότητα
: το ποσοστό του συνόλου των αρνητικών/αδρανών χημικών ουσιών που ταξινομείται σωστά με τη δοκιμή. Αποτελεί μέτρο ορθότητας των δοκιμών με τις οποίες λαμβάνονται κατηγορηματικά αποτελέσματα, και είναι σημαντικό κριτήριο αξιολόγησης της καταλληλότητας των δοκιμών (21).
Ουσία
: ένα χημικό στοιχείο και οι ενώσεις του σε φυσική κατάσταση ή όπως λαμβάνονται με οποιαδήποτε παραγωγική διεργασία, στα οποία συμπεριλαμβάνονται όλα τα πρόσθετα που απαιτούνται για να διατηρείται η σταθερότητά του, καθώς και τυχόν προσμείξεις που προκύπτουν από τη χρησιμοποιούμενη διεργασία, αλλά από τα οποία εξαιρούνται οι διαλύτες που είναι δυνατόν να διαχωριστούν χωρίς να επηρεαστεί η σταθερότητα της ουσίας ούτε να μεταβληθεί η σύνθεσή της.
Υπό δοκιμή χημική ουσία
: κάθε ουσία ή μείγμα που υποβάλλεται σε δοκιμή με χρήση της παρούσας μεθόδου.
Παγκοσμίως Εναρμονισμένο Σύστημα Ταξινόμησης και Επισήμανσης των Χημικών Προϊόντων των Ηνωμένων Εθνών (United Nations Globally Harmonized System of Classification and Labelling of Chemicals) (GHS του ΟΗΕ)
: σύστημα που προτείνει την ταξινόμηση των χημικών προϊόντων (ουσιών και μειγμάτων) με βάση τυποποιημένα είδη και βαθμούς φυσικής επικινδυνότητας και επικινδυνότητας για την υγεία και το περιβάλλον και καλύπτει τα αντίστοιχα στοιχεία γνωστοποίησης, όπως εικονογράμματα, προειδοποιητικές λέξεις, δηλώσεις επικινδυνότητας, δηλώσεις προφύλαξης και δελτία δεδομένων ασφαλείας, με τα οποία γνωστοποιούνται πληροφορίες σχετικά με τις δυσμενείς επιδράσεις με σκοπό την προστασία των ανθρώπων (εργοδοτών, εργαζομένων, μεταφορέων, καταναλωτών και διασωστών) και του περιβάλλοντος (23).
UVCB
: ουσίες άγνωστης ή ασταθούς σύνθεσης, πολύπλοκα προϊόντα αντιδράσεων ή βιολογικά υλικά.
Έγκυρη δοκιμή
: δοκιμή που θεωρείται επαρκούς καταλληλότητας και αξιοπιστίας για συγκεκριμένο σκοπό και βασίζεται σε επιστημονικά τεκμηριωμένες αρχές. Μια δοκιμή δεν είναι ποτέ έγκυρη με την απόλυτη σημασία του όρου, αλλά μόνο σε σχέση με καθορισμένο σκοπό (21).
Προσάρτημα 1.2
ΟΥΣΙΕΣ ΕΛΕΓΧΟΥ ΙΚΑΝΟΤΗΤΑΣ
Πριν εντάξουν στην καθημερινή πρακτική τη δοκιμή που περιγράφεται στο παρόν προσάρτημα της μεθόδου δοκιμών Β.71, τα εργαστήρια θα πρέπει να αποδεικνύουν την τεχνική τους ικανότητα επιτυγχάνοντας σωστά την αναμενόμενη πρόβλεψη βάσει της μεθόδου h-CLAT για τις 10 συνιστώμενες ουσίες του πίνακα 1, καθώς και τιμές CV75, EC150 και EC200 εντός του αντίστοιχου εύρους τιμών αναφοράς για τουλάχιστον 8 από τις 10 ουσίες ελέγχου ικανότητας. Αυτές οι ουσίες ελέγχου ικανότητας επιλέχθηκαν ως αντιπροσωπευτικές του φάσματος αποκρίσεων από τις πηγές κινδύνου δερματικής ευαισθητοποίησης. Άλλα κριτήρια επιλογής ήταν ότι οι ουσίες θα πρέπει να είναι εμπορικά διαθέσιμες, και ότι θα πρέπει να υπάρχουν διαθέσιμα in vivo δεδομένα αναφοράς υψηλής ποιότητας καθώς και in vitro δεδομένα υψηλής ποιότητας που προκύπτουν με τη μέθοδο h-CLAT. Επίσης, για τη μέθοδο h-CLAT υπάρχουν διαθέσιμα δημοσιευμένα δεδομένα αναφοράς (3) (14).
Πίνακας 1
Συνιστώμενες ουσίες για την απόδειξη τεχνικής ικανότητας όσον αφορά τη μέθοδο h-CLAT
|
Ουσίες ελέγχου ικανότητας
|
Αριθμός CAS
|
Φυσική κατάσταση
|
Πρόβλεψη in vivo
(102)
|
CV75 Πεδίο τιμών αναφοράς σε μg/ml (103)
|
Αποτελέσματα h-CLAT για τον CD86 (πεδίο τιμών αναφοράς EC150 σε μg/ml) (103)
|
Αποτελέσματα h-CLAT για τον CD54 (πεδίο τιμών αναφοράς EC200 σε μg/ml) (103)
|
|
2,4-Δινιτροχλωροβενζόλιο
|
97-00-7
|
Στερεό
|
Ευαισθητοποιητικό (εξαιρετικά ισχυρό)
|
2-12
|
Θετικό (0,5-10)
|
Θετικό (0,5-15)
|
|
4-Φαινυλενοδιαμίνη
|
106-50-3
|
Στερεό
|
Ευαισθητοποιητικό (ισχυρό)
|
5-95
|
Θετικό (<40)
|
Αρνητικό (>1,5) (104)
|
|
Θειικό νικέλιο
|
10101-97-0
|
Στερεό
|
Ευαισθητοποιητικό (μετρίως ισχυρό)
|
30-500
|
Θετικό (<100)
|
Θετικό (10-100)
|
|
2-Μερκαπτοβενζοθειαζόλιο
|
149-30-4
|
Στερεό
|
Ευαισθητοποιητικό (μετρίως ισχυρό)
|
30-400
|
Αρνητικό (>10) (104)
|
Θετικό (10-140)
|
|
R(+)-Λεμονένιο
|
5989-27-5
|
Υγρό
|
Ευαισθητοποιητικό (ασθενές)
|
>20
|
Αρνητικό (>5) (104)
|
Θετικό (<250)
|
|
Ιμιδαζολιδινυλουρία
|
39236-46-9
|
Στερεό
|
Ευαισθητοποιητικό (ασθενές)
|
25-100
|
Θετικό (20-90)
|
Θετικό (20-75)
|
|
Ισοπροπανόλη
|
67-63-0
|
Υγρό
|
Μη ευαισθητοποιητικό
|
>5 000
|
Αρνητικό (>5 000 )
|
Αρνητικό (>5 000 )
|
|
Γλυκερίνη
|
56-81-5
|
Υγρό
|
Μη ευαισθητοποιητικό
|
>5 000
|
Αρνητικό (>5 000 )
|
Αρνητικό (>5 000 )
|
|
Γαλακτικό οξύ
|
50-21-5
|
Υγρό
|
Μη ευαισθητοποιητικό
|
1500-5 000
|
Αρνητικό (>5 000 )
|
Αρνητικό (>5 000 )
|
|
4-Αμινοβενζοϊκό οξύ
|
150-13-0
|
Στερεό
|
Μη ευαισθητοποιητικό
|
>1 000
|
Αρνητικό (>1 000 )
|
Αρνητικό (>1 000 )
|
|
Συντομογραφίες: Αριθμός CAS = αριθμός μητρώου της υπηρεσίας Chemical Abstract Service
|
Προσάρτημα 2
ΕΥΑΙΣΘΗΤΟΠΟΙΗΣΗ ΤΟΥ ΔΕΡΜΑΤΟΣ IN VITRO: ΔΟΚΙΜΗ ΕΝΕΡΓΟΠΟΙΗΣΗΣ ΚΥΤΤΑΡΙΚΗΣ ΣΕΙΡΑΣ U937 (U-SENS™)
ΑΡΧΙΚΕΣ ΕΚΤΙΜΗΣΕΙΣ ΚΑΙ ΠΕΡΙΟΡΙΣΜΟΙ
|
1.
|
Η δοκιμή U-SENS™ χρησιμεύει στον ποσοτικό προσδιορισμό των μεταβολών στην έκφραση ενός δείκτη της κυτταρικής επιφάνειας που συνδέεται με τη διεργασία ενεργοποίησης των μονοκυττάρων και των δενδριτικών κυττάρων (DC) (τον δείκτη CD86), στην ανθρώπινη κυτταρική σειρά ιστιοκυτταρικού λεμφώματος, κατόπιν έκθεσης σε ευαισθητοποιητικά (1). Στη συνέχεια, τα μετρηθέντα επίπεδα έκφρασης του δείκτη CD86 στην κυτταρική σειρά U937 χρησιμοποιούνται για την υποστήριξη της διάκρισης μεταξύ ευαισθητοποιητικών και μη ευαισθητοποιητικών του δέρματος.
|
|
2.
|
Η δοκιμή U-SENS™ έχει αξιολογηθεί στο πλαίσιο μελέτης επικύρωσης (2) που συντόνισε η L’Oreal, και υποβλήθηκε σε επακόλουθη αξιολόγηση από ομοτίμους από τη Συμβουλευτική Επιστημονική Επιτροπή (ESAC) του εργαστηρίου αναφοράς της Ευρωπαϊκής Ένωσης για τις εναλλακτικές μεθόδους αντί των δοκιμών σε ζώα (EURL ECVAM) (3). Αφού έλαβε υπόψη όλα τα διαθέσιμα στοιχεία και τις απόψεις των ρυθμιστικών αρχών και των ενδιαφερόμενων μερών, το EURL ECVAM (4) συνέστησε τη χρήση της U-SENS™ στο πλαίσιο IATA για την υποστήριξη της διάκρισης μεταξύ ευαισθητοποιητικών και μη ευαισθητοποιητικών με σκοπό την ταξινόμηση και επισήμανση της επικινδυνότητας. Στο έγγραφο καθοδήγησης για την αναφορά των δομημένων προσεγγίσεων αναφορικά με την ολοκλήρωση δεδομένων και τις επιμέρους πηγές πληροφοριών των IATA για την ευαισθητοποίηση του δέρματος, ο ΟΟΣΑ εξετάζει σειρά περιπτωσιολογικών μελετών που περιγράφουν διάφορες στρατηγικές δοκιμών και μοντέλων πρόβλεψης. Μία από τις διαφορετικές καθορισμένες προσεγγίσεις βασίζεται στη δοκιμασία U-SENS (5). Παραδείγματα της χρήσης των δεδομένων της U-SENS™ σε συνδυασμό με άλλες πληροφορίες, περιλαμβανομένων των ιστορικών δεδομένων και των υπαρχόντων έγκυρων δεδομένων για τον άνθρωπο (6), έχουν επίσης αναφερθεί σε άλλες δημοσιευμένες εργασίες (4) (5) (7).
|
|
3.
|
Διαπιστώθηκε ότι η δοκιμή U-SENS™ μπορεί να εφαρμοστεί σε εργαστήρια που διαθέτουν εμπειρία στη χρήση τεχνικών κυτταροκαλλιέργειας και ανάλυσης κυτταρομετρίας ροής. Ο βαθμός αναπαραγωγιμότητας των προβλέψεων που αναμένεται να παρέχει η δοκιμή είναι της τάξης του 90 % και του 84 % ενδοεργαστηριακά και διεργαστηριακά, αντίστοιχα (8). Τα αποτελέσματα που προέκυψαν από τη μελέτη επικύρωσης (8) και άλλες δημοσιευμένες μελέτες (1) υποδεικνύουν συνολικά ότι, σε σύγκριση με τα αποτελέσματα της LLNA, η ορθότητα της διάκρισης μεταξύ ευαισθητοποιητικών (κατηγορία 1 κατά GHS του ΟΗΕ / κανονισμό CLP) και μη ευαισθητοποιητικών του δέρματος είναι 86 % (N=166), με ευαισθησία 91 % (118/129) και ειδικότητα 65 % (24/37). Σε σύγκριση με τα αποτελέσματα για τον άνθρωπο, η ορθότητα της διάκρισης μεταξύ ευαισθητοποιητικών (κατηγορία 1 κατά GHS του ΟΗΕ / κανονισμό CLP) και μη ευαισθητοποιητικών του δέρματος είναι 77 % (N=101), με ευαισθησία 100 % (58/58) και ειδικότητα 47 % (20/43). Οι ψευδοαρνητικές προβλέψεις με την U-SENS™ σε σύγκριση με την LLNA είναι πιθανότερο να προκύπτουν με χημικές ουσίες που εμφανίζουν χαμηλή έως μέτρια ισχύ ευαισθητοποίησης του δέρματος (υποκατηγορία 1Β κατά GHS του ΟΗΕ / κανονισμό CLP) παρά με χημικές ουσίες που εμφανίζουν υψηλή ισχύ ευαισθητοποίησης του δέρματος (υποκατηγορία 1Α κατά GHS του ΟΗΕ / κανονισμό CLP) (1) (8) (9). Συνολικά, τα στοιχεία αυτά δείχνουν τη χρησιμότητα της δοκιμής U-SENS™ ως εργαλείου που συμβάλλει στον προσδιορισμό της επικινδυνότητας ευαισθητοποίησης του δέρματος. Ωστόσο, οι τιμές ορθότητας που παρέχονται εδώ για την U-SENS™ ως αυτοτελή δοκιμή είναι απλώς ενδεικτικές, δεδομένου ότι η δοκιμή θα πρέπει να εξετάζεται σε συνδυασμό με άλλες πηγές πληροφοριών στο πλαίσιο ΙΑΤΑ και σύμφωνα με τις πληροφορίες στις παραγράφους 7 και 8 της γενικής εισαγωγής. Επιπλέον, κατά την αξιολόγηση των μεθόδων δοκιμών ευαισθητοποίησης του δέρματος χωρίς χρήση ζώων, θα πρέπει να μη λησμονείται ότι η δοκιμασία LLNA, καθώς και άλλες δοκιμές σε ζώα, ενδέχεται να μην αντικατοπτρίζουν πλήρως την κατάσταση στον άνθρωπο.
|
|
4.
|
Βάσει των επί του παρόντος διαθέσιμων δεδομένων, διαπιστώθηκε ότι η δοκιμή U-SENS™ μπορεί να εφαρμόζεται σε υπό δοκιμή χημικές ουσίες (περιλαμβανομένων των συστατικών καλλυντικών προϊόντων, π.χ. συντηρητικών, επιφανειοδραστικών, δραστικών ουσιών, χρωστικών) που καλύπτουν ποικιλία οργανικών λειτουργικών ομάδων, φυσικοχημικών ιδιοτήτων, επιπέδων ισχύος ευαισθητοποίησης του δέρματος (όπως καθορίζονται στις in vivo μελέτες) καθώς και το φάσμα μηχανισμών αντίδρασης που είναι γνωστό ότι συνδέονται με την ευαισθητοποίηση του δέρματος (δηλ. δέκτης Michael, σχηματισμός βάσης Schiff, παράγοντας μεταφοράς ακυλίου, πυρηνόφιλη διμοριακή υποκατάσταση [SN2], ή πυρηνόφιλη αρωματική υποκατάσταση [SNAr]) (1) (8) (9) (10). Η δοκιμή U-SENS™ είναι εφαρμόσιμη σε υπό δοκιμή χημικές ουσίες που είναι διαλυτές ή σχηματίζουν σταθερή διασπορά (δηλ. κολλοειδές ή εναιώρημα στο οποίο η υπό δοκιμή χημική ουσία δεν καθιζάνει ούτε διαχωρίζεται από τον διαλύτη/φορέα σε διαφορετικές φάσεις) σε κατάλληλο διαλύτη/φορέα (βλ. παράγραφο 13). Οι χημικές ουσίες του συνόλου δεδομένων που είχαν χαρακτηριστεί αβιοτικά προαπτένια (δηλαδή ουσίες που ενεργοποιούνται με οξείδωση) ή μεταβολικά προαπτένια (δηλαδή ουσίες που χρειάζονται ενζυμική ενεργοποίηση, π.χ. μέσω των ενζύμων P450) προβλέφθηκαν σωστά με τη δοκιμή U-SENS™ (1) (10). Ουσίες που προκαλούν ρήξη της μεμβράνης μπορούν να οδηγήσουν σε ψευδοθετικά αποτελέσματα λόγω μη ειδικής αύξησης της έκφρασης τουCD86, καθώς 3 από τα 7 ψευδοθετικά αποτελέσματα σε σχέση με την in vivo ταξινόμηση αναφοράς αφορούσαν επιφανειοδραστικές ουσίες (1). Δεδομένων των παραπάνω, τα θετικά αποτελέσματα με επιφανειοδραστικές ουσίες θα πρέπει να εξετάζονται με επιφύλαξη, ενώ τα αρνητικά αποτελέσματα με τέτοιες ουσίες μπορούν να χρησιμοποιούνται για την υποστήριξη του χαρακτηρισμού της υπό δοκιμή χημικής ουσίας ως μη ευαισθητοποιητικής. Παρότι οι φθορίζουσες ουσίες μπορούν να αξιολογηθούν με την U-SENS™ (1), οι ισχυρά φθορίζουσες ουσίες που εκπέμπουν στο ίδιο μήκος κύματος με την ισοθειοκυανική φλουορεσκεΐνη (FITC) ή το ιωδιούχο προπίδιο (PI) παρεμποδίζουν την ανίχνευση με κυτταρομετρία ροής και, ως εκ τούτου, δεν μπορούν να αξιολογηθούν σωστά με χρήση συζευγμένων με FITC αντισωμάτων (δυνητικά ψευδοαρνητικά) ή PI (μη μετρήσιμη βιωσιμότητα). Σε αυτή την περίπτωση, μπορούν να χρησιμοποιηθούν άλλα σημασμένα με φθοριοχρώματα αντισώματα ή άλλοι δείκτες κυτταροτοξικότητας, αντίστοιχα, εφόσον μπορεί να καταδειχθεί ότι παρέχουν ανάλογα αποτελέσματα με τα σημασμένα με FITC αντισώματα ή το PI (βλ. παράγραφο 18), π.χ. μέσω δοκιμών των ουσιών ελέγχου ικανότητας του προσαρτήματος 2.2. Υπό το πρίσμα των ανωτέρω, τα θετικά αποτελέσματα με επιφανειοδραστικές ουσίες και τα αρνητικά αποτελέσματα με ισχυρά φθορίζουσες ουσίες θα πρέπει να ερμηνεύονται στο πλαίσιο των αναφερόμενων περιορισμών και σε συνάρτηση με άλλες πηγές πληροφοριών στο πλαίσιο ΙΑΤΑ. Εάν υπάρχουν στοιχεία που δείχνουν ότι η δοκιμή U-SENS™ δεν μπορεί να εφαρμοστεί σε άλλες ειδικές κατηγορίες υπό δοκιμή χημικών ουσιών, η δοκιμή δεν θα πρέπει να χρησιμοποιείται για τις συγκεκριμένες κατηγορίες.
|
|
5.
|
Όπως αναφέρθηκε ανωτέρω, η μέθοδος U-SENS™ υποστηρίζει τη διάκριση μεταξύ ευαισθητοποιητικών και μη ευαισθητοποιητικών του δέρματος. Ωστόσο, μπορεί ενδεχομένως να συμβάλει στην εκτίμηση της ευαισθητοποιητικής ισχύος, όταν χρησιμοποιείται σε ολοκληρωμένες προσεγγίσεις, όπως οι IATA. Απαιτούνται πάντως περισσότερες εργασίες, κατά προτίμηση με βάση δεδομένα για τον άνθρωπο, για να διαπιστωθεί ο τρόπος με τον οποίο τα αποτελέσματα της U-SENS™ θα μπορούσαν ενδεχομένως να τροφοδοτήσουν την εκτίμηση της ευαισθητοποιητικής ισχύος.
|
|
6.
|
Οι ορισμοί παρατίθενται στο προσάρτημα 2.1.
|
ΑΡΧΗ ΤΗΣ ΔΟΚΙΜΗΣ
|
7.
|
Η δοκιμή U-SENS™ είναι μια in vitro δοκιμασία με την οποία προσδιορίζονται ποσοτικά οι μεταβολές της έκφρασης του δείκτη κυτταρικής επιφάνειας CD86 σε ανθρώπινη κυτταρική σειρά ιστιοκυτταρικού λεμφώματος, στα κύτταρα U937, μετά από έκθεση 45±3 ωρών στην υπό δοκιμή χημική ουσία. Ο επιφανειακός δείκτης CD86 αποτελεί τυπικό δείκτη ενεργοποίησης των U937. Ο δείκτης CD86 είναι γνωστό ότι αποτελεί συνδιεγερτικό μόριο που μπορεί να μιμείται τη μονοκυτταρική ενεργοποίηση, η οποία παίζει κρίσιμο ρόλο στην προδιέγερση των Τ κυττάρων. Οι μεταβολές της έκφρασης του δείκτη κυτταρικής επιφάνειας CD86 μετρώνται με κυτταρομετρία ροής μετά από χρώση των κυττάρων συνήθως με αντισώματα σημασμένα με ισοθειοκυανική φλουορεσκεΐνη (FITC). Ταυτόχρονα, διεξάγεται επίσης μέτρηση της κυτταροτοξικότητας (π.χ. με χρήση PI) προκειμένου να διαπιστωθεί εάν αυξάνεται η έκφραση του δείκτη κυτταρικής επιφάνειας CD86 σε υποκυτταροτοξικές συγκεντρώσεις. Ο δείκτης διέγερσης (S.I.) του δείκτη κυτταρικής επιφάνειας CD86 υπολογίζεται σε σύγκριση με τον μάρτυρα με διαλύτη/φορέα και χρησιμοποιείται στο μοντέλο πρόβλεψης (βλ. παράγραφο 19) για να υποστηριχθεί η διάκριση μεταξύ ευαισθητοποιητικών και μη ευαισθητοποιητικών ουσιών.
|
ΑΠΟΔΕΙΞΗ ΤΕΧΝΙΚΗΣ ΙΚΑΝΟΤΗΤΑΣ
|
8.
|
Πριν χρησιμοποιήσουν στην καθημερινή πρακτική τη δοκιμή που περιγράφεται στο παρόν προσάρτημα της μεθόδου δοκιμών B.71, τα εργαστήρια θα πρέπει να αποδεικνύουν την τεχνική τους ικανότητα, χρησιμοποιώντας τις 10 ουσίες ελέγχου ικανότητας του προσαρτήματος 2.2 σύμφωνα με τις ορθές πρακτικές in vitro μεθόδων (11). Επιπλέον, οι χρήστες της δοκιμής θα πρέπει να διατηρούν βάση ιστορικών δεδομένων με τα δεδομένα που προκύπτουν από τους ελέγχους δραστικότητας (βλ. παράγραφο 11) και με τους θετικούς μάρτυρες και τους μάρτυρες με διαλύτη/φορέα (βλ. παραγράφους 15-16), και θα πρέπει να χρησιμοποιούν τα εν λόγω δεδομένα για να βεβαιώνονται για τη διαχρονική αναπαραγωγιμότητα της δοκιμής στο εργαστήριό τους.
|
ΔΙΑΔΙΚΑΣΙΑ
|
9.
|
Η παρούσα δοκιμή βασίζεται στο πρωτόκολλο αριθ. 183 της υπηρεσίας βάσης δεδομένων U-SENS™ για τις εναλλακτικές μεθόδους αντί των πειραμάτων σε ζώα (DB-ALM) (12). Κατά την καθιέρωση και τη χρήση της δοκιμής U-SENS™ στο εργαστήριο, θα πρέπει να χρησιμοποιούνται οι τυποποιημένες διαδικασίες λειτουργίας (SOP). Μπορεί να χρησιμοποιείται αυτοματοποιημένο σύστημα για τη διεξαγωγή της U-SENS™, εφόσον μπορεί να αποδειχθεί ότι παράγει ανάλογα αποτελέσματα, για παράδειγμα μέσω δοκιμών των ουσιών ελέγχου ικανότητας του προσαρτήματος 2.2. Στις επόμενες παραγράφους περιγράφονται τα βασικά στοιχεία και διαδικασίες για τη δοκιμή U-SENS™.
|
Προπαρασκευή των κυττάρων
|
10.
|
Για τη διεξαγωγή της δοκιμής U-SENS™ θα πρέπει να χρησιμοποιείται η ανθρώπινη κυτταρική σειρά ιστιοκυτταρικού λεμφώματος U937 (13). Τα κύτταρα (κλώνος CRL1593.2) θα πρέπει να λαμβάνονται από επαρκώς εξειδικευμένη τράπεζα κυττάρων, όπως η American Type Culture Collection.
|
|
11.
|
Τα κύτταρα U937 καλλιεργούνται στους 37°C και σε ατμόσφαιρα με ύγρανση και 5 % CO2 σε θρεπτικό μέσο RPMI-1 640, συμπληρωμένο με 10 % ορού εμβρύων μόσχων (FCS), 2 mM L-γλουταμίνης, 100 μονάδες/ml πενικιλίνης και 100 μg/ml στρεπτομυκίνης (πλήρες θρεπτικό μέσο). Τα κύτταρα U937 ανακαλλιεργούνται συνήθως κάθε 2-3 ημέρες σε πυκνότητα 1,5 έως 3 × 105 κύτταρα/ml αντίστοιχα. Η κυτταρική πυκνότητα δεν θα πρέπει να υπερβαίνει τα 2 × 106 κύτταρα/ml και η κυτταρική βιωσιμότητα που μετράται με αποκλεισμό της χρωστικής Trypan Blue θα πρέπει να είναι ≥ 90 % (δεν θα πρέπει να εφαρμόζεται κατά την πρώτη ανακαλλιέργεια μετά την απόψυξη). Πριν από τη χρήση τους στη δοκιμή, θα πρέπει να ελέγχεται εάν κάθε παρτίδα κυττάρων, FCS ή αντισωμάτων πληροί τα κριτήρια μέσω της διεξαγωγής ελέγχου δραστικότητας. Ο έλεγχος δραστικότητας των κυττάρων θα πρέπει να διενεργείται με χρήση του θετικού μάρτυρα, του πικρυλοσουλφονικού οξέος (2,4,6-τρινιτροβενζολοσουλφονικό οξύ: TNBS) (αριθ. CAS 2 508-19-2, καθαρότητα ≥ 99 %) και του αρνητικού μάρτυρα γαλακτικό οξύ (LA) (αριθ. CAS 50-21-5, καθαρότητα ≥ 85 %), τουλάχιστον μία φορά την εβδομάδα μετά την απόψυξη. Για τον έλεγχο δραστικότητας, θα πρέπει να υποβάλλονται σε δοκιμή έξι τελικές συγκεντρώσεις για καθέναν από τους 2 μάρτυρες (TNBS: 1, 12,5, 25, 50, 75, 100 μg/ml και LA: 1, 10, 20, 50, 100, 200 μg/ml). Το TNBS διαλυμένο σε πλήρες θρεπτικό μέσο θα πρέπει να δίνει θετική απόκριση του CD86 σχετιζόμενη με τη συγκέντρωση (π.χ. όταν μια θετική συγκέντρωση, CD86 S.I. ≥ 150, ακολουθείται από συγκέντρωση με αυξανόμενο S.I του CD86), και το LA διαλυμένο σε πλήρες θρεπτικό μέσο θα πρέπει να δίνει αρνητική απόκριση του CD86 (βλ. παράγραφο 21). Για τη δοκιμασία πρέπει να χρησιμοποιείται μόνο η παρτίδα κυττάρων που έχει υποβληθεί επιτυχώς 2 φορές στον έλεγχο δραστικότητας. Τα κύτταρα μπορούν να πολλαπλασιάζονται έως επτά εβδομάδες μετά την απόψυξη. Ο αριθμός των ανακαλλιεργειών δεν θα πρέπει να υπερβαίνει τις 21. Ο έλεγχος δραστικότητας θα πρέπει να διενεργείται σύμφωνα με τις διαδικασίες που περιγράφονται στις παραγράφους 18-22.
|
|
12.
|
Όσον αφορά τη δοκιμή, τα κύτταρα U937 εμβολιάζονται σε πυκνότητα είτε 3 × 105 κύτταρα/ml είτε 6 × 105 κύτταρα/ml, και προκαλλιεργούνται σε φιάλες καλλιέργειας επί 2 ημέρες ή επί 1 ημέρα αντίστοιχα. Μπορούν να εφαρμοστούν και συνθήκες προκαλλιέργειας διαφορετικές από εκείνες που περιγράφονται ανωτέρω, εφόσον αυτό τεκμηριώνεται επαρκώς επιστημονικά και εφόσον μπορεί να αποδειχθεί ότι αποδίδουν ανάλογα αποτελέσματα, για παράδειγμα μέσω δοκιμών των ουσιών ελέγχου ικανότητας του προσαρτήματος 2.2. Την ημέρα της δοκιμής, κύτταρα που έχουν συλλεχθεί από την φιάλη καλλιέργειας εναιωρούνται εκ νέου με πρόσφατα παρασκευασθέν θρεπτικό μέσο καλλιέργειας σε πυκνότητα 5 × 105 κύτταρα/ml. Στη συνέχεια, τα κύτταρα κατανέμονται σε τρυβλίο επίπεδης βάσης 96 κοιλοτήτων με 100 μl (τελική κυτταρική πυκνότητα 0,5 × 105 κύτταρα/κοιλότητα).
|
Προετοιμασία των υπό δοκιμή χημικών ουσιών και των μαρτύρων
|
13.
|
Πριν από τη δοκιμή διεξάγεται αξιολόγηση της διαλυτότητας. Για αυτόν τον σκοπό, οι υπό δοκιμή χημικές ουσίες διαλύονται ή διασπείρονται σταθερώς σε συγκέντρωση 50 mg/ml σε πλήρες θρεπτικό μέσο, ως πρώτη επιλογή, ή σε διμεθυλοσουλφοξείδιο (DMSO, καθαρότητα ≥ 99 %), ως δεύτερη επιλογή διαλύτη/φορέα εάν η υπό δοκιμή χημική ουσία δεν είναι διαλυτή στον διαλύτη/φορέα πλήρους θρεπτικού μέσου. Για τη δοκιμή, η υπό δοκιμή χημική ουσία διαλύεται σε τελική συγκέντρωση 0,4 mg/ml σε πλήρες θρεπτικό μέσο, εφόσον είναι διαλυτή στον συγκεκριμένο διαλύτη/φορέα. Εάν η χημική ουσία είναι διαλυτή μόνο σε DMSO, διαλύεται σε συγκέντρωση 50 mg/ml. Μπορούν να χρησιμοποιηθούν και άλλοι διαλύτες/φορείς, πέραν των όσων περιγράφονται ανωτέρω, εφόσον η χρήση τους τεκμηριώνεται επαρκώς επιστημονικά. Θα πρέπει να λαμβάνεται υπόψη η σταθερότητα της υπό δοκιμή χημικής ουσίας στον τελικό διαλύτη/φορέα.
|
|
14.
|
Η προετοιμασία των υπό δοκιμή χημικών ουσιών και των μαρτύρων γίνεται την ημέρα της δοκιμής. Λόγω του ότι δεν διεξάγεται δοκιμασία προσδιορισμού δόσης, για την πρώτη σειρά δοκιμών θα πρέπει να υποβάλλονται σε δοκιμή 6 τελικές συγκεντρώσεις (1, 10, 20, 50, 100 και 200 μg/ml) στον αντίστοιχο διαλύτη/φορέα, είτε σε πλήρες θρεπτικό μέσο είτε σε DMSO 0,4 % σε θρεπτικό μέσο. Για τις επόμενες σειρές δοκιμών, ξεκινώντας από τα 0,4 mg/ml σε πλήρες θρεπτικό μέσο ή τα 50 mg/ml σε DMSO, παρασκευάζονται διαλύματα των υπό δοκιμή χημικών ουσιών, τουλάχιστον 4 διαλύματα εργασίας (δηλ. τουλάχιστον 4 συγκεντρώσεις), με χρήση του αντίστοιχου διαλύτη/φορέα. Τα διαλύματα εργασίας χρησιμοποιούνται τελικώς για την αγωγή, με προσθήκη ίσου όγκου εναιωρήματος κυττάρων U937 (βλ. παράγραφο 11 ανωτέρω) στον όγκο του διαλύματος εργασίας στο τρυβλίο ώστε να πραγματοποιηθεί νέα αραίωση 2x (12). Οι συγκεντρώσεις (τουλάχιστον 4 συγκεντρώσεις) για κάθε επόμενη σειρά δοκιμών επιλέγονται με βάση τα επιμέρους αποτελέσματα όλων των προηγούμενων σειρών δοκιμών (8). Οι χρησιμοποιήσιμες τελικές συγκεντρώσεις είναι 1, 2, 3, 4, 5, 7.5, 10, 12.5, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 120, 140, 160, 180 και 200 μg/ml. Η μέγιστη τελική συγκέντρωση είναι 200 μg/ml. Στην περίπτωση που παρατηρηθεί θετική τιμή του CD86 στο 1 μg/ml, αξιολογείται συγκέντρωση 0,1 μg/ml προκειμένου να προσδιοριστεί η συγκέντρωση της υπό δοκιμή χημικής ουσίας που δεν επάγει CD86 άνω του θετικού ορίου. Για κάθε σειρά δοκιμών, υπολογίζεται η EC150 (συγκέντρωση στην οποία μια υπό δοκιμή χημική ουσία φθάνει το θετικό όριο CD86του 150 %, βλ. παράγραφο 19), εφόσον παρατηρηθεί θετική απόκριση του CD86 που σχετίζεται με τη συγκέντρωση. Σε περίπτωση που η υπό δοκιμή χημική ουσία επάγει θετική απόκριση του CD86 που δεν σχετίζεται με τη συγκέντρωση, μπορεί να μην είναι σκόπιμο να υπολογίζεται η EC150, όπως περιγράφεται στο πρωτόκολλο U-SENS™ DB-ALM αριθ. 183 (12). Για κάθε σειρά δοκιμών, υπολογίζεται η CV70 (συγκέντρωση στην οποία μια χημική ουσία φθάνει το όριο κυτταροτοξικότητας του 70 %, βλ. παράγραφο 19), όποτε αυτό είναι εφικτό (12). Για τη διερεύνηση της επίδρασης της απόκρισης βάσει συγκέντρωσης λόγω αύξησης του CD86, οποιεσδήποτε από τις κατάλληλες συγκεντρώσεις θα πρέπει να επιλέγονται έτσι ώστε να είναι ομοιόμορφα κατανεμημένες μεταξύ της EC150 (ή της υψηλότερης αρνητικής μη κυτταροτοξικής συγκέντρωσης του CD86) και της CV70 (ή της υψηλότερης επιτρεπόμενης συγκέντρωσης, δηλαδή 200 μg/ml). Θα πρέπει να υποβάλλονται σε δοκιμή τουλάχιστον 4 συγκεντρώσεις ανά σειρά δοκιμών, με τουλάχιστον 2 εξ αυτών να είναι κοινές με την προηγούμενη σειρά/-ές δοκιμών, για λόγους σύγκρισης.
|
|
15.
|
Ο διαλύτης/φορέας που χρησιμοποιείται στη δοκιμή U-SENS™ είναι πλήρες θρεπτικό μέσο (για υπό δοκιμή χημικές ουσίες που διαλύονται ή διασπείρονται σταθερώς σε πλήρες θρεπτικό μέσο) (βλ. παράγραφο 4) ή DMSO 0,4 % σε πλήρες θρεπτικό μέσο (για υπό δοκιμή χημικές ουσίες που διαλύονται ή διασπείρονται σταθερώς σε DMSO).
|
|
16.
|
Ο θετικός μάρτυρας που χρησιμοποιείται στη δοκιμή U-SENS™ είναι TNBS (βλ. παράγραφο 11), παρασκευαζόμενο σε πλήρες θρεπτικό μέσο. Το TNBS θα πρέπει να χρησιμοποιείται ως θετικός μάρτυρας για τη μέτρηση της έκφρασης του CD86 σε μία τελική συγκέντρωση στο τρυβλίο (50 μg/ml) που δίδει κυτταρική βιωσιμότητα > 70 %. Για την επίτευξη συγκέντρωσης TNBS 50 μg/ml στο τρυβλίο, παρασκευάζεται αποθεματικό διάλυμα TNBS 1 M (δηλ. 293 mg/ml) σε πλήρες θρεπτικό μέσο, το οποίο αραιώνεται περαιτέρω 2 930x με πλήρες θρεπτικό μέσο ώστε να προκύψει διάλυμα εργασίας 100 μg/ml. Ως αρνητικός μάρτυρας θα πρέπει να χρησιμοποιείται γαλακτικό οξύ (LA, CAS 50-21-5) σε 200 μg/ml διαλυμένο σε πλήρες θρεπτικό μέσο (από αποθεματικό διάλυμα 0,4 mg/ml). Σε κάθε τρυβλίο κάθε σειράς δοκιμών, παρασκευάζονται τρία πανομοιότυπα δείγματα μάρτυρα πλήρους θρεπτικού μέσου χωρίς αγωγή, μάρτυρα με διαλύτη/φορέα και αρνητικών και θετικών μαρτύρων (12). Μπορούν να χρησιμοποιηθούν και άλλοι κατάλληλοι θετικοί μάρτυρες, εάν υπάρχουν διαθέσιμα ιστορικά δεδομένα από τα οποία μπορούν να προκύψουν συγκρίσιμα κριτήρια αποδοχής σειρών δοκιμών. Τα κριτήρια αποδοχής σειρών δοκιμών είναι τα ίδια με εκείνα που περιγράφονται για την υπό δοκιμή χημική ουσία (βλ. παράγραφο 12).
|
Εφαρμογή των υπό δοκιμή χημικών ουσιών και των μαρτύρων
|
17.
|
Ο μάρτυρας με διαλύτη/φορέα ή τα διαλύματα εργασίας που περιγράφονται στις παραγράφους 14-16 αναμιγνύονται 1:1 (κ.ό.) με τα εναιωρήματα κυττάρων που παρασκευάστηκαν στο τρυβλίο επίπεδης βάσης 96 κοιλοτήτων (βλ. παράγραφο 12). Στη συνέχεια, τα υπό αγωγή τρυβλία επωάζονται επί 45±3 ώρες στους 37°C με 5 % CO2. Πριν από την επώαση, τα τρυβλία καλύπτονται με ημιπερατή μεμβράνη ώστε να αποφεύγεται η εξάτμιση των πτητικών υπό δοκιμή χημικών ουσιών και η διασταυρούμενη μόλυνση μεταξύ των κυττάρων που υποβάλλονται σε αγωγή με τις υπό δοκιμή χημικές ουσίες (12).
|
Χρώση των κυττάρων
|
18.
|
Μετά από 45±3 ώρες έκθεσης, τα κύτταρα μεταφέρονται στο τρυβλίο μικροτιτλοδότησης σχήματος V και συλλέγονται μέσω φυγοκέντρησης. Η παρεμπόδιση λόγω διαλυτότητας ορίζεται ως παρουσία κρυστάλλων ή σταγόνων ορατών στο μικροσκόπιο μετά την πάροδο 45 ± 3 ωρών από την αγωγή (πριν από τη χρώση των κυττάρων). Τα υπερκείμενα υγρά απορρίπτονται και τα εναπομείναντα κύτταρα εκπλένονται μία φορά με 100 μl παγόψυχρου αλατούχου ρυθμιστικού διαλύματος φωσφορικών (PBS) που περιέχει 5 % ορού εμβρύων μόσχων (ρυθμιστικό διάλυμα χρώσης). Μετά τη φυγοκέντρηση, τα κύτταρα εναιωρούνται εκ νέου με 100 μl ρυθμιστικού διαλύματος χρώσης και υποβάλλονται σε χρώση με 5 μl (π.χ. 0,25 μg) σημασμένων με FITC αντισωμάτων αντι-CD86 ή αντισωμάτων IgG1 (ισοτύπου) ποντικού σε θερμοκρασία 4°C επί 30 λεπτά, προστατευμένα από το φως. Θα πρέπει να χρησιμοποιούνται τα αντισώματα που περιγράφονται στο πρωτόκολλο U-SENS™ DB-ALM αριθ. 183 (12) (για τον CD86: BD-PharMingen #5556 57, κλώνος: Fun-1 ή Caltag/Invitrogen # MHCD8601, κλώνος: BU63, και για το IgG1: BD-PharMingen #5557 48, ή Caltag/Invitrogen # GM4992). Με βάση την εμπειρία των φορέων ανάπτυξης της δοκιμής, η ένταση του φθορισμού των αντισωμάτων είναι συνήθως παρεμφερής μεταξύ των διαφόρων παρτίδων. Για τη δοκιμασία μπορεί να χρησιμοποιηθεί άλλος κλώνος ή προμηθευτής των αντισωμάτων που υποβλήθηκαν επιτυχώς στον έλεγχο δραστικότητας (βλ. παράγραφο 11). Ωστόσο, οι χρήστες μπορούν να εξετάσουν το ενδεχόμενο να τιτλοδοτήσουν τα αντισώματα υπό τις συνθήκες του δικού τους εργαστηρίου προκειμένου να καθορίσουν τη βέλτιστη συγκέντρωση προς χρήση. Μπορεί να χρησιμοποιηθεί και άλλο σύστημα ανίχνευσης, π.χ. σημασμένα με φθοριοχρώματα αντισώματα αντι-CD86, εφόσον μπορεί να αποδειχθεί ότι αποδίδει ανάλογα αποτελέσματα με αυτά των συζευγμένων με FITC αντισωμάτων, για παράδειγμα, μέσω δοκιμών των ουσιώνελέγχου ικανότητας του προσαρτήματος 2.2. Μετά από έκπλυση δύο φορές με 100 μl ρυθμιστικού διαλύματος και μία φορά με 100 μl παγόψυχρου PBS, τα κύτταρα εναιωρούνται εκ νέου σε παγόψυχρο PBS (π.χ. 125 μl για δείγματα που αναλύονται με μη αυτόματο τρόπο, σωληνάριο προς σωληνάριο, ή 50 μl όταν χρησιμοποιείται τρυβλίο αυτόματης δειγματοληψίας) και προστίθεται διάλυμα PI (τελική συγκέντρωση 3 μg/ml). Μπορούν να χρησιμοποιηθούν και άλλοι δείκτες κυτταροτοξικότητας, όπως 7-αμινοακτινομυκίνη D (7-AAD) ή Trypan Blue, εάν μπορεί να αποδειχθεί ότι οι εναλλακτικές χρώσεις αποδίδουν αποτελέσματα παρεμφερή με το PI, για παράδειγμα μέσω δοκιμών των ουσιών ελέγχου ικανότητας του προσαρτήματος 2.2.
|
Ανάλυση κυτταρομετρίας ροής
|
19.
|
Το επίπεδο έκφρασης του CD86 και η κυτταρική βιωσιμότητα αναλύονται με χρήση κυτταρομετρίας ροής. Τα κύτταρα αναπαρίστανται σε στικτόγραμμα μεγέθους (FSC) και κοκκίωσης (SSC) ρυθμισμένου σε λογαριθμική κλίμακα προκειμένου να προσδιοριστεί με σαφήνεια ο πληθυσμός σε ένα πρώτο παράθυρο επιλογής R1 και να εξαλειφθούν τα κατάλοιπα κυττάρων. Για κάθε κοιλότητα καταγράφεται συνολικός στόχος 10 000 κυττάρων στο παράθυρο επιλογής R1. Τα κύτταρα από το ίδιο παράθυρο επιλογής R1 αναπαρίστανται σε στικτόγραμμα FL3 ή FL4 / SSC. Τα βιώσιμα κύτταρα ανιχνεύονται με την τοποθέτηση δεύτερου παραθύρου επιλογής R2 για την επιλογή του πληθυσμού των αρνητικών στο ιωδιούχο προπίδιο κυττάρων (δίαυλος FL3 ή FL4). Η κυτταρική βιωσιμότητα μπορεί να υπολογίζεται με χρήση της ακόλουθης εξίσωσης από το πρόγραμμα ανάλυσης του κυτταρόμετρου. Όταν η κυτταρική βιωσιμότητα είναι χαμηλή, μπορούν να καταγράφονται έως 20 000 κύτταρα, περιλαμβανομένων των νεκρών κυττάρων. Εναλλακτικά, μπορούν να καταγράφονται δεδομένα επί ένα λεπτό μετά την έναρξη της ανάλυσης.

Στη συνέχεια, μετράται το ποσοστό των θετικών στο FL1 κυττάρων μεταξύ των εν λόγω βιώσιμων κυττάρων που επιλέγονται στο παράθυρο επιλογής R2 (εντός του R1). Η έκφραση κυτταρικής επιφάνειας του CD86 αναλύεται σε στικτόγραμμα FL1 / SSC με επιλογή των βιώσιμων κυττάρων (R2).
Για τις κοιλότητες πλήρους θρεπτικού μέσου/IgG1, ο δείκτης ανάλυσης ορίζεται κοντά στον βασικό πληθυσμό ούτως ώστε οι μάρτυρες με πλήρες θρεπτικό μέσο να έχουν IgG1 εντός της ζώνης στόχου 0,6 έως 0,9 %.
Η παρεμπόδιση λόγω χρώματος ορίζεται ως μετατόπιση του στικτογράμματος της σημασμένης με FITC IgG1 (S.I. γεωμετρικού μέσου IgG1 FL1 ≥ 150 %).
Ο δείκτης διέγερσης (S.I.) του CD86 για τα κύτταρα μάρτυρες (χωρίς αγωγή ή σε DMSO 0,4 %) και τα υποβληθέντα σε αγωγή κύτταρα υπολογίζεται σύμφωνα με την ακόλουθη εξίσωση:.

% των κυττάρων μάρτυρα χωρίς αγωγή IgG1+: αναφέρεται ως ποσοστό των θετικών στο FL1 κυττάρων IgG1 που ορίζεται με τον δείκτη ανάλυσης (αποδεκτό εύρος ≥ 0,6 % και < 1,5 %, βλ. παράγραφο 22) μεταξύ των βιώσιμων κυττάρων χωρίς αγωγή.
% των κυττάρων μάρτυρα / κυττάρων χωρίς αγωγή IgG1+/CD86+: αναφέρεται ως ποσοστό των θετικών στο FL1 κυττάρων IgG1/CD86 που μετρώνται χωρίς μετακίνηση του δείκτη ανάλυσης μεταξύ των βιώσιμων κυττάρων μάρτυρα / κυττάρων χωρίς αγωγή.
|
ΔΕΔΟΜΕΝΑ ΚΑΙ ΑΝΑΦΟΡΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ
Αξιολόγηση των δεδομένων
|
20.
|
Στη δοκιμή U-SENS™ υπολογίζονται οι ακόλουθες παράμετροι: Η τιμή CV70, δηλαδή η συγκέντρωση που δίνει 70 % επιβίωση των κυττάρων U937 (30 % κυτταροτοξικότητα), και η τιμή EC150, δηλαδή η συγκέντρωση στην οποία οι υπό δοκιμή χημικές ουσίες επάγουν δείκτη διέγερσης (S.I.) CD86 150 %.
Η CV70 υπολογίζεται με λογαριθμική-γραμμική παρεκβολή με χρήση της ακόλουθης εξίσωσης:
CV70 = C1 + [(V1 - 70) / (V1 – V2) * (C2 – C1)]
όπου:
V1 είναι η ελάχιστη τιμή κυτταρικής βιωσιμότητας άνω του 70 %
V2 είναι η μέγιστη τιμή κυτταρικής βιωσιμότητας κάτω του 70 %
C1 και C2 είναι οι συγκεντρώσεις που εμφανίζουν την τιμή κυτταρικής βιωσιμότητας V1 και V2 αντίστοιχα

Μπορούν να χρησιμοποιηθούν και άλλες προσεγγίσεις για τον υπολογισμό της τιμής CV70, εφόσον αποδεικνύεται ότι δεν έχουν επιπτώσεις στα αποτελέσματα (π.χ. μέσω δοκιμών των ουσιών ελέγχου ικανότητας).
Η EC150 υπολογίζεται με λογαριθμική-γραμμική παρεκβολή με χρήση της ακόλουθης εξίσωσης:
EC150 = C1 + [(150 – S.I.1) / (S.I.2 – S.I.1) * (C2 – C1)]
Όπου:
C1 είναι η υψηλότερη συγκέντρωση σε μg/ml με S.I. του CD86 < 150 % (S.I. 1)
C2 είναι η χαμηλότερη συγκέντρωση σε μg/ml με S.I. του CD86 ≥ 150 % (S.I. 2)

Οι τιμές EC150 και CV70 υπολογίζονται
|
—
|
για κάθε σειρά δοκιμών: οι επιμέρους τιμές EC150 και CV70 χρησιμοποιούνται ως εργαλεία για τη διερεύνηση της επίδρασης της απόκρισης βάσει συγκέντρωσης από την αύξηση του CD86 (βλ. παράγραφο 14),
|
|
—
|
με βάση τις μέσες βιωσιμότητες, προσδιορίζεται η συνολική CV70 (12),
|
|
—
|
με βάση τον μέσο S.I. των τιμών CD86, προσδιορίζεται η συνολική EC150 για την υπό δοκιμή χημική ουσία που έχει προβλεφθεί ως ΘΕΤΙΚΗ με τη δοκιμή U-SENS™ (βλ. παράγραφο 21) (12).
|
|
Μοντέλο πρόβλεψης
|
21.
|
Για τη μέτρηση της έκφρασης του CD86, κάθε υπό δοκιμή χημική ουσία ελέγχεται σε τουλάχιστον τέσσερις συγκεντρώσεις και σε τουλάχιστον δύο ανεξάρτητες σειρές δοκιμών (που διεξάγονται σε διαφορετική ημέρα) για την πραγματοποίηση μιας μεμονωμένης πρόβλεψης (ΑΡΝΗΤΙΚΗ ή ΘΕΤΙΚΗ).
|
—
|
Το επιμέρους συμπέρασμα μιας σειράς δοκιμών U-SENS™ θεωρείται αρνητικό (στο εξής αναφέρεται ως Α), εάν ο S.I. του CD86 είναι μικρότερος από 150 % σε όλες τις μη κυτταροτοξικές συγκεντρώσεις (κυτταρική βιωσιμότητα ≥ 70 %) και εάν δεν παρατηρείται καμία παρεμπόδιση (κυτταροτοξικότητα, διαλυτότητα: βλ. παράγραφο 18, ή χρώμα: βλ. παράγραφο 19, ανεξάρτητα από τις μη κυτταροτοξικές συγκεντρώσεις στις οποίες ανιχνεύεται η παρεμπόδιση). Σε όλες τις υπόλοιπες περιπτώσεις: ο S.I. του CD86 είναι ίσος ή μεγαλύτερος από 150 % και/ή παρατηρούνται παρεμποδίσεις, το επιμέρους συμπέρασμα μιας σειράς δοκιμών U-SENS™ θεωρείται θετικό (στο εξής αναφέρεται ως Θ).
|
|
—
|
Μια πρόβλεψη U-SENS™ θεωρείται ΑΡΝΗΤΙΚΗ εάν είναι αρνητικές (Α) τουλάχιστον δύο ανεξάρτητες σειρές δοκιμών (σχήμα 1). Εάν οι δύο πρώτες σειρές δοκιμών είναι και οι δύο αρνητικές (Α), η πρόβλεψη U-SENS™ θεωρείται ΑΡΝΗΤΙΚΗ και δεν χρειάζεται τρίτη σειρά δοκιμών.
|
|
—
|
Μια πρόβλεψη U-SENS™ θεωρείται ΘΕΤΙΚΗ εάν είναι θετικές (Θ) τουλάχιστον δύο ανεξάρτητες σειρές δοκιμών (σχήμα 1). Εάν οι δύο πρώτες σειρές δοκιμών είναι και οι δύο θετικές (Θ), η πρόβλεψη U-SENS™ θεωρείται ΘΕΤΙΚΗ και δεν χρειάζεται τρίτη σειρά δοκιμών.
|
|
—
|
Λόγω του ότι δεν διεξάγεται δοκιμασία προσδιορισμού δόσης, υπάρχει μία εξαίρεση σε περίπτωση που, στην πρώτη σειρά δοκιμών, ο S.I. του CD86 είναι ίσος ή μεγαλύτερος από 150 % μόνο στην υψηλότερη μη κυτταροτοξική συγκέντρωση. Τότε, η σειρά δοκιμών θεωρείται ΜΗ ΚΑΤΑΛΗΚΤΙΚΗ (ΜΚ), και θα πρέπει να υποβάλλονται σε δοκιμή πρόσθετες συγκεντρώσεις (μεταξύ της υψηλότερης μη κυτταροτοξικής συγκέντρωσης και της χαμηλότερης κυτταροτοξικής συγκέντρωσης - βλ. παράγραφο 20). Σε περίπτωση που μια σειρά δοκιμών χαρακτηριστεί ΜΚ, θα πρέπει να διεξάγονται τουλάχιστον 2 πρόσθετες σειρές δοκιμών, και μία τέταρτη σε περίπτωση που οι σειρές 2 και 3 δεν συμφωνούν (Α και/ή Θ, ανεξαρτήτως) (σχήμα 1). Οι επακόλουθες σειρές δοκιμών θα θεωρούνται θετικές ακόμη και εάν μία μόνο μη κυτταροτοξική συγκέντρωση δίδει CD86 ίσο ή άνω του 150 %, δεδομένου ότι η τιμή της συγκέντρωσης έχει προσαρμοστεί για τη συγκεκριμένη υπό δοκιμή χημική ουσία. Η τελική συγκέντρωση θα βασίζεται στο αποτέλεσμα των τριών ή τεσσάρων επιμέρους σειρών δοκιμών κατά πλειοψηφία (δηλ. 2 από 3 ή 2 από 4) (σχήμα 1).
|
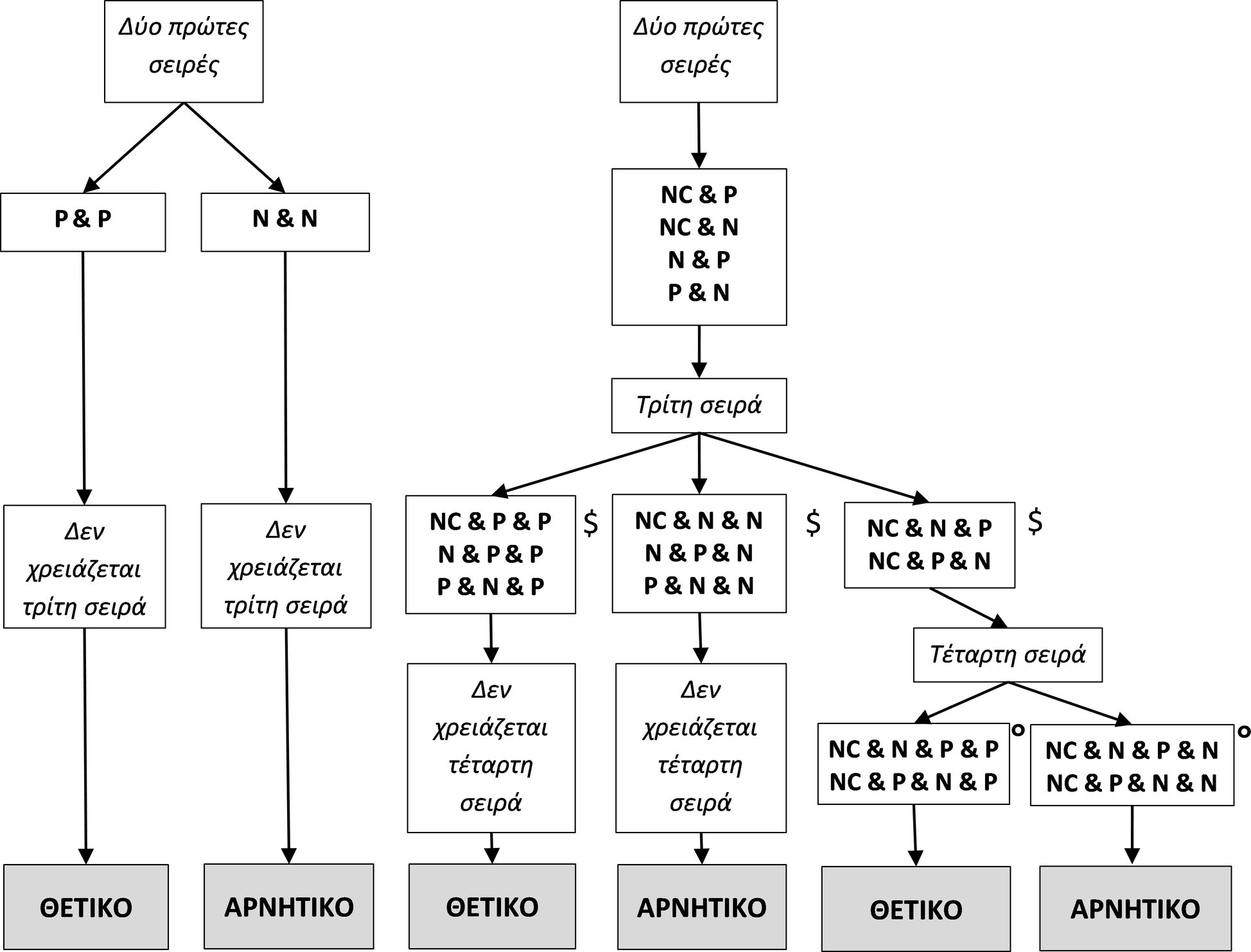
Σχήμα 1: Το μοντέλο πρόβλεψης που χρησιμοποιείται στη δοκιμή U-SENS™. Οι προβλέψεις βάσει δοκιμής U-SENS™ θα πρέπει να εξετάζονται στο πλαίσιο ΙΑΤΑ και σύμφωνα με τις πληροφορίες στην παράγραφο 4 και στις παραγράφους 7, 8 και 9 της γενικής εισαγωγής.
Ν: δοκιμασία στην οποία δεν παρατηρείται θετικό CD86 ή παρεμπόδιση.
P: δοκιμασία στην οποία παρατηρείται θετικό CD86 και/ή παρεμπόδιση.
NC: μη καταληκτική. Η πρώτη μη καταληκτική σειρά δοκιμών όταν το CD86 είναι θετικό μόνο στην υψηλότερη μη κυτταροτοξική συγκέντρωση.
#: εάν χαρακτηριστεί «μη καταληκτική» μόνο η πρώτη σειρά δοκιμών τότε αυτομάτως επιβάλλεται η διεξαγωγή τρίτης σειράς δοκιμών προκειμένου να επιτευχθεί πλειοψηφική αναλογία θετικών (P) ή αρνητικών (N) συμπερασμάτων σε τουλάχιστον 2 από 3 ανεξάρτητες σειρές δοκιμών.
$: στα πλαίσια αυτά παρουσιάζονται οι σχετικοί συνδυασμοί αποτελεσμάτων από τις τρεις σειρές δοκιμών με βάση τα αποτελέσματα που ελήφθησαν από τις δύο πρώτες σειρές δοκιμών που παρουσιάζονται στο προηγούμενο πλαίσιο.
o: στα πλαίσια αυτά παρουσιάζονται οι σχετικοί συνδυασμοί αποτελεσμάτων από τις τέσσερις σειρές δοκιμών με βάση τα αποτελέσματα που ελήφθησαν από τις τρεις πρώτες σειρές δοκιμών που παρουσιάζονται στο προηγούμενο πλαίσιο.
|
Κριτήρια αποδοχής
|
22.
|
Όταν χρησιμοποιείται η δοκιμή U-SENS™, θα πρέπει να πληρούνται τα ακόλουθα κριτήρια αποδοχής (12).
|
—
|
Στο τέλος της περιόδου έκθεσης 45±3 ωρών, η μέση βιωσιμότητα των εις τριπλούν επιστρωμένων κυττάρων U937 χωρίς αγωγή θα πρέπει να είναι > 90 %, χωρίς να παρατηρείται ολίσθηση της έκφρασης CD86. Η βασική έκφραση του CD86 στα κύτταρα U937 χωρίς αγωγή θα πρέπει να είναι ≥ 2 % και ≤ 25 %.
|
|
—
|
Όταν ως διαλύτης χρησιμοποιείται DMSO, η εγκυρότητα του μάρτυρα με φορέα DMSO εκτιμάται μέσω υπολογισμού τιμής S.I. για το DMSO σε σύγκριση με τα κύτταρα χωρίς αγωγή, και η μέση βιωσιμότητα των επιστρωμένων εις τριπλούν κυττάρων πρέπει να είναι > 90 %. Ο μάρτυρας με φορέα DMSO είναι έγκυρος εάν η μέση τιμή S.I. του CD86 εις τριπλούν είναι μικρότερη από το 250 % της μέσης τιμής S.I. του CD86 εις τριπλούν των κυττάρων U937 χωρίς αγωγή.
|
|
—
|
Οι σειρές δοκιμών θεωρούνται έγκυρες εάν τουλάχιστον δύο από τρεις τιμές IgG1 κυττάρων U937 χωρίς αγωγή είναι ≥ 0,6 % και < 1,5 %.
|
|
—
|
Ο παράλληλος αρνητικός μάρτυρας (γαλακτικό οξύ) θεωρείται έγκυρος εάν τουλάχιστον δύο από τα τρία πανομοιότυπα δείγματα είναι αρνητικά (S.I. CD86 < 150 %) και χωρίς κυτταροτοξικότητα (κυτταρική βιωσιμότητα ≥ 70 %).
|
|
—
|
Ο θετικός μάρτυρας (TNBS) θεωρείται έγκυρος εάν τουλάχιστον δύο από τα τρία πανομοιότυπα δείγματα είναι θετικά (S.I. CD86 < 150 %) και χωρίς κυτταροτοξικότητα (κυτταρική βιωσιμότητα ≥ 70 %).
|
|
Έκθεση δοκιμής
|
23.
|
Στην έκθεση δοκιμής θα πρέπει να περιλαμβάνονται τα ακόλουθα στοιχεία.
|
Υπό δοκιμή χημική ουσία
Μονοσυστατική ουσία
|
ταυτοποίηση της χημικής ουσίας, όπως ονομασία/-ες IUPAC ή CAS, αριθμός/-οί CAS, κωδικός SMILES ή InChI, συντακτικός τύπος και/ή άλλα αναγνωριστικά στοιχεία,
|
|
φυσική εμφάνιση, διαλυτότητα πλήρους θρεπτικού μέσου, διαλυτότητα σε DMSO, μοριακό βάρος και πρόσθετες σχετικές φυσικοχημικές ιδιότητες, εφόσον είναι διαθέσιμα,
|
|
καθαρότητα, χημική ταυτότητα των προσμείξεων, κατά περίπτωση και στο μέτρο του δυνατού, κ.λπ.,
|
|
κατεργασία πριν από τη δοκιμή, εάν ισχύει (π.χ. θέρμανση, λειοτρίβηση),
|
|
ελεγχθείσα συγκέντρωση/-εις,
|
|
συνθήκες φύλαξης και σταθερότητα, εφόσον είναι διαθέσιμα,
|
|
αιτιολόγηση της επιλογής του διαλύτη/φορέα για κάθε υπό δοκιμή χημική ουσία.
|
Πολυσυστατική ουσία, UVCB και μείγμα:
|
χαρακτηρισμός, στο μέτρο του δυνατού, π.χ. χημική ταυτότητα (βλ. ανωτέρω), καθαρότητα, ποσότητα και σχετικές φυσικοχημικές ιδιότητες (βλ. ανωτέρω) των συστατικών, εφόσον είναι διαθέσιμα,
|
|
φυσική εμφάνιση, διαλυτότητα πλήρους θρεπτικού μέσου, διαλυτότητα σε DMSO και πρόσθετες σχετικές φυσικοχημικές ιδιότητες, εφόσον είναι διαθέσιμα,
|
|
μοριακό βάρος ή φαινόμενο μοριακό βάρος στην περίπτωση των μειγμάτων/πολυμερών γνωστής σύνθεσης ή άλλες πληροφορίες που έχουν σημασία για τη διεξαγωγή της μελέτης,
|
|
κατεργασία πριν από τη δοκιμή, εάν ισχύει (π.χ. θέρμανση, λειοτρίβηση),
|
|
ελεγχθείσα συγκέντρωση/-εις,
|
|
συνθήκες φύλαξης και σταθερότητα, εφόσον είναι διαθέσιμα,
|
|
αιτιολόγηση της επιλογής του διαλύτη/φορέα για κάθε υπό δοκιμή χημική ουσία.
|
|
|
Μάρτυρες
Θετικός μάρτυρας
|
ταυτοποίηση της χημικής ουσίας, όπως ονομασία/-ες IUPAC ή CAS, αριθμός/-οί CAS, κωδικός SMILES ή InChI, συντακτικός τύπος και/ή άλλα αναγνωριστικά στοιχεία,
|
|
φυσική εμφάνιση, διαλυτότητα σε DMSO, μοριακό βάρος και πρόσθετες σχετικές φυσικοχημικές ιδιότητες, στο μέτρο του δυνατού και ανάλογα με την περίπτωση,
|
|
καθαρότητα, χημική ταυτότητα των προσμείξεων, κατά περίπτωση και στο μέτρο του δυνατού, κ.λπ.,
|
|
κατεργασία πριν από τη δοκιμή, εάν ισχύει (π.χ. θέρμανση, λειοτρίβηση),
|
|
ελεγχθείσα συγκέντρωση/-εις,
|
|
συνθήκες φύλαξης και σταθερότητα, εφόσον είναι διαθέσιμα,
|
|
παραπομπή σε ιστορικά αποτελέσματα θετικών μαρτύρων που καταδεικνύουν την εφαρμογή κατάλληλων κριτηρίων αποδοχής των μετρήσεων, εάν ισχύει.
|
Αρνητικός μάρτυρας και μάρτυρας με διαλύτη/φορέα
|
ταυτοποίηση της χημικής ουσίας, όπως ονομασία/-ες IUPAC ή CAS, αριθμός/-οί CAS, κωδικός SMILES ή InChI, συντακτικός τύπος και/ή άλλα αναγνωριστικά στοιχεία,
|
|
καθαρότητα, χημική ταυτότητα των προσμείξεων, κατά περίπτωση και στο μέτρο του δυνατού, κ.λπ.,
|
|
φυσική εμφάνιση, μοριακό βάρος, καθώς και πρόσθετες σχετικές φυσικοχημικές ιδιότητες, σε περίπτωση χρήσης άλλου διαλύτη/φορέα εκτός εκείνων που αναφέρονται στην κατευθυντήρια γραμμή δοκιμών και εφόσον είναι διαθέσιμα,
|
|
συνθήκες φύλαξης και σταθερότητα, εφόσον είναι διαθέσιμα,
|
|
αιτιολόγηση της επιλογής του διαλύτη/φορέα για κάθε υπό δοκιμή χημική ουσία.
|
|
|
Συνθήκες δοκιμής
|
όνομα και διεύθυνση του χορηγού, της εγκατάστασης δοκιμών και του διευθυντή της μελέτης,
|
|
περιγραφή της χρησιμοποιούμενης δοκιμής,
|
|
κυτταρική σειρά που χρησιμοποιήθηκε, συνθήκες φύλαξης και προέλευσή της (π.χ. εγκατάσταση προέλευσης),
|
|
χρησιμοποιηθείσα μέθοδος κυτταρομετρίας ροής (π.χ. μοντέλο), περιλαμβανομένων των χρησιμοποιηθέντων οργάνων, αντισωμάτων και δεικτών κυτταροτοξικότητας,
|
|
η διαδικασία που χρησιμοποιήθηκε για να αποδειχθεί η τεχνική ικανότητα του εργαστηρίου να διεξάγει τη δοκιμή μέσω δοκιμών των ουσιών ελέγχου ικανότητας, και η διαδικασία που χρησιμοποιήθηκε για να αποδειχθεί η διαχρονική αναπαραγωγιμότητα της διεξαγωγής της δοκιμής, π.χ. ιστορικά δεδομένα για μάρτυρες και/ή ιστορικά δεδομένα ελέγχων δραστικότητας.
|
|
|
Κριτήρια αποδοχής της δοκιμής
|
κυτταρική βιωσιμότητα και τιμές S.I. CD86 που ελήφθησαν με τον μάρτυρα με διαλύτη/φορέα σε σύγκριση με τα αποδεκτά πεδία τιμών,
|
|
κυτταρική βιωσιμότητα και τιμές S.I. που ελήφθησαν με τον θετικό μάρτυρα σε σύγκριση με τα αποδεκτά πεδία τιμών,
|
|
κυτταρική βιωσιμότητα όλων των ελεγχθεισών συγκεντρώσεων της υπό δοκιμή χημικής ουσίας.
|
|
|
Διαδικασία δοκιμής
|
αριθμός σειρών δοκιμών που χρησιμοποιήθηκαν,
|
|
συγκεντρώσεις της υπό δοκιμή χημικής ουσίας, χρόνος εφαρμογής και έκθεσης που χρησιμοποιήθηκε (εάν διαφέρει από τον συνιστώμενο),
|
|
περιγραφή των χρησιμοποιούμενων κριτηρίων αξιολόγησης και λήψης αποφάσεων,
|
|
περιγραφή τυχόν τροποποιήσεων της διαδικασίας δοκιμής.
|
|
|
Αποτελέσματα
|
δεδομένα υπό μορφή πίνακα, περιλαμβανομένης της CV70 (κατά περίπτωση), του S.I., των τιμών κυτταρικής βιωσιμότητας, των τιμών EC150 (κατά περίπτωση) που υπολογίστηκαν για την υπό δοκιμή χημική ουσία και για τον θετικό μάρτυρα σε κάθε σειρά δοκιμών, και ένδειξη της κατάταξης της υπό δοκιμή χημικής ουσία σύμφωνα με το μοντέλο πρόβλεψης,
|
|
περιγραφή κάθε άλλης σχετικής παρατήρησης, κατά περίπτωση.
|
|
|
Εξέταση των αποτελεσμάτων
|
εξέταση των αποτελεσμάτων που προέκυψαν με τη δοκιμή U-SENS™,
|
|
εξέταση των αποτελεσμάτων δοκιμής στο πλαίσιο της IATA, εάν υπάρχουν σχετικές πληροφορίες.
|
|
Συμπεράσματα
|
ΒΙΒΛΙΟΓΡΑΦΙΑ
|
(1)
|
Piroird, C., Ovigne, J.M., Rousset, F., Martinozzi-Teissier, S., Gomes, C., Cotovio, J., Alépée, N. (2015). The Myeloid U937 Skin Sensitization Test (U-SENS) addresses the activation of dendritic cell event in the adverse outcome pathway for skin sensitization. Toxicol. In Vitro 29, 901-916.
|
|
(2)
|
EURL ECVAM (2017). The U-SENS™ test method Validation Study Report. Διαθέσιμο στη διεύθυνση: http://ihcp.jrc.ec.europa.eu/our_labs/eurl-ecvam/eurl-ecvam-recommendations
|
|
(3)
|
EC EURL ECVAM (2016). ESAC Opinion No 2016-03 on the L'Oréal-coordinated study on the transferability and reliability of the U-SENS™ test method for skin sensitisation testing. EUR 28 178 EL· doi 10.2 787/8157 37. Διατίθεται στον δικτυακό τόπο: [http://publications.jrc.ec.europa.eu/repository/handle/JRC103705].
|
|
(4)
|
EC EURL ECVAM (2017). EURL ECVAM Recommendation on the use of non-animal approaches for skin sensitisation testing. EUR 28 553 EL· doi 10.2 760/5889 55. Διατίθεται στον δικτυακό τόπο: https://ec.europa.eu/jrc/en/publication/eur-scientific-and-technical-research-reports/eurl-ecvam-recommendation-use-non-animal-approaches-skin-sensitisation-testing.
|
|
(5)
|
Steiling, W. (2016). Safety Evaluation of Cosmetic Ingredients Regarding their Skin Sensitization Potential. doi:10.3390/cosmetics3020014.Cosmetics 3, 14.
|
|
(6)
|
OECD (2016). Guidance Document on The Reporting of Defined Approaches and Individual Information Sources to be Used Within Integrated Approaches to Testing and Assessment (IATA) For Skin Sensitisation, Series on Testing & Assessment No 256, ENV/JM/MONO(2016)29. Organisation for Economic Cooperation and Development, Paris. Διατίθεται στον δικτυακό τόπο: [http://www.oecd.org/env/ehs/testing/series-testing-assessment-publications-number.htm.
|
|
(7)
|
Urbisch, D., Mehling, A., Guth, K., Ramirez, T., Honarvar, N., Kolle, S., Landsiedel, R., Jaworska, J., Kern, P.S., Gerberick, F., Natsch, A., Emter, R., Ashikaga, T., Miyazawa, M., Sakaguchi, H. (2015). Assessing skin sensitization hazard in mice and men using non-animal test methods. Regul. Toxicol. Pharmacol. 71, 337-351.
|
|
(8)
|
Alépée, N., Piroird, C., Aujoulat, M., Dreyfuss, S., Hoffmann, S., Hohenstein, A., Meloni, M., Nardelli, L., Gerbeix, C., Cotovio, J. (2015). Prospective multicentre study of the U-SENS test method for skin sensitization testing. Toxicol In Vitro 30, 373-382.
|
|
(9)
|
Reisinger, K., Hoffmann, S., Alépée, N., Ashikaga, T., Barroso, J., Elcombe, C., Gellatly, N., Galbiati, V., Gibbs, S., Groux, H., Hibatallah, J., Keller, D., Kern, P., Klaric, M., Kolle, S., Kuehnl, J., Lambrechts, N., Lindstedt, M., Millet, M., Martinozzi-Teissier, S., Natsch, A., Petersohn, D., Pike, I., Sakaguchi, H., Schepky, A., Tailhardat, M., Templier, M., van Vliet, E., Maxwell, G. (2014). Systematic evaluation of non-animal test methods for skin sensitisation safety assessment. Toxicol. In Vitro 29, 259-270.
|
|
(10)
|
Fabian, E., Vogel, D., Blatz, V., Ramirez, T., Kolle, S., Eltze, T., van Ravenzwaay, B., Oesch, F., Landsiedel, R. (2013). Xenobiotic metabolizin enzyme activities in cells used for testing skin sensitization in vitro. Arch. Toxicol. 87, 1 683-1 696.
|
|
(11)
|
OECD. (2018). Draft Guidance document: Good In Vitro Method Practices (GIVIMP) for the Development and Implementation of In Vitro Methods for Regulatory Use in Human Safety Assessment. Organisation for Economic Cooperation and Development, Paris. Διατίθεται στον δικτυακό τόπο: http://www.oecd.org/env/ehs/testing/OECD Final Draft GIVIMP.pdf.
|
|
(12)
|
DB-ALM (2016). Protocol no 183: Myeloid U937 Skin Sensitization Test (U-SENS™), 33pp. Διαθέσιμο στη διεύθυνση: .[http://ecvam-dbalm.jrc.ec.europa.eu/]
|
|
(13)
|
Sundström, C., Nilsson, K. (1976). Establishment and characterization of a human histiocytic lymphoma cell line (U-937). Int. J. Cancer 17, 565-577.
|
|
(14)
|
OECD (2005). Series on Testing and Assessment No. 34: Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment. Organisation for Economic Cooperation and Development, Paris. Διατίθεται στον δικτυακό τόπο: http://www.oecd.org/env/ehs/testing/series-testing-assessment-publications-number.htm.
|
|
(15)
|
United Nations UN (2015). Globally Harmonized System of Classification and Labelling of Chemicals (GHS). ST/SG/AC.10/30/Rev.6, Sixth Revised Edition, New York & Geneva: United Nations Publications. Διατίθεται στον δικτυακό τόπο: http://www.unece.org/fileadmin/DAM/trans/danger/publi/ghs/ghs_rev06/English/ST-SG-AC10-30-Rev6e.pdf.
|
|
(16)
|
OECD (2012). Series on Testing and Assessment No 168: The Adverse Outcome Pathway for Skin Sensitisation Initiated by Covalent Binding to Proteins. Μέρος 1: Series on Testing and Assessment No. Organisation for Economic Cooperation and Development, Paris. Διατίθεται στον δικτυακό τόπο: http://www.oecd.org/env/ehs/testing/series-testing-assessment-publications-number.htm.
|
|
(17)
|
ECETOC (2003). Technical Report No 87: Contact sensitization: Classification according to potency. European Centre for Ecotoxicology & Toxicology of Chemicals, Brussels. Διατίθεται στον δικτυακό τόπο: https://ftp.cdc.gov/pub/Documents/OEL/06.%20Dotson/References/ECETOC_2003-TR87.pdf.
|
Προσάρτημα 2.1
ΟΡΙΣΜΟΙ
Ορθότητα
: ο βαθμός συμφωνίας μεταξύ των αποτελεσμάτων της δοκιμής και των αποδεκτών τιμών αναφοράς. Αποτελεί κριτήριο επιδόσεων της δοκιμής και μια από τις πτυχές της καταλληλότητας. Συχνά ο όρος χρησιμοποιείται εναλλακτικά προς τη «συμφωνία» για να δηλώσει το ποσοστό ορθών αποτελεσμάτων μιας δοκιμής (14).
AOP (Adverse Outcome Pathway)
: πορεία δυσμενούς έκβασης αλληλουχία συμβάντων, από τη χημική δομή της στοχευόμενης χημικής ουσίας ή ομάδας ομοειδών χημικών ουσιών και το μοριακό εναρκτήριο συμβάν μέχρι την εξεταζόμενη έκβαση in vivo (15).
Απόκριση συγκέντρωσης CD86
: η απόκριση εξαρτάται από τη συγκέντρωση (απόκριση συγκέντρωσης) όταν μια θετική συγκέντρωση (S.I. CD86 ≥ 150) ακολουθείται από συγκέντρωση με αυξανόμενο S.I. CD86.
Χημικό προϊόν
: μια ουσία ή ένα μείγμα.
CV70
: η εκτιμώμενη συγκέντρωση που παρουσιάζει κυτταρική βιωσιμότητα 70 %.
Ολίσθηση
: ολίσθηση υφίσταται όταν i) η διορθωμένη τιμή %CD86+ του πανομοιότυπου δείγματος 3 του μάρτυρα χωρίς αγωγή είναι μικρότερη από το 50 % του μέσου όρου της διορθωμένης τιμής %CD86+ των πανομοιότυπων δειγμάτων 1 και 2 του μάρτυρα χωρίς αγωγή, και όταν ii) η διορθωμένη τιμή %CD86+ του πανομοιότυπου δείγματος 3 του αρνητικού μάρτυρα είναι μικρότερη από το 50 % του μέσου όρου της διορθωμένης τιμής %CD86+ των πανομοιότυπων δειγμάτων 1 και 2 του αρνητικού μάρτυρα.
EC150
: οι εκτιμώμενες συγκεντρώσεις που εμφανίζουν S.I. 150 % της έκφρασης του CD86.
Κυτταρομετρία ροής
: κυτταρομετρική τεχνική κατά την οποία κύτταρα εναιωρημένα εντός υγρού διασχίζουν ένα-ένα την εστία μιας φωτεινής δέσμης διέγερσης, η οποία σκεδάζεται με τρόπους χαρακτηριστικούς των κυττάρων και των συστατικών τους· τα κύτταρα σημαίνονται συχνά με φθορίζοντες δείκτες οι οποίοι πρώτα απορροφούν και κατόπιν επανεκπέμπουν το φως σε διαφορετική συχνότητα.
Επικινδυνότητα
: εγγενής ιδιότητα ενός παράγοντα ή μιας κατάστασης που μπορεί να έχει δυσμενείς επιδράσεις όταν ένας οργανισμός, ένα σύστημα ή ένας (υπο)πληθυσμός εκτίθεται στον παράγοντα.
IATA (Integrated Approach to Testing and Assessment)
: ολοκληρωμένη προσέγγιση για τη διεξαγωγή δοκιμών και την αξιολόγηση δομημένη προσέγγιση που χρησιμοποιείται για τον προσδιορισμό της επικινδυνότητας (δυναμικό), τον χαρακτηρισμό της επικινδυνότητας (ισχύς) και/ή την εκτίμηση της ασφάλειας (δυναμικό/ισχύς και έκθεση) μιας χημικής ουσίας ή ομάδας χημικών ουσιών, στην οποία ενσωματώνονται και σταθμίζονται στρατηγικά όλα τα σχετικά δεδομένα, με σκοπό την τροφοδότηση κανονιστικών αποφάσεων σχετικά με τη δυνητική επικινδυνότητα και/ή τον κίνδυνο και/ή την ανάγκη για περαιτέρω στοχευμένες και, ως εκ τούτου, ελάχιστες δοκιμές.
Μείγμα
: ένα μείγμα ή διάλυμα που αποτελείται από δύο ή περισσότερες ουσίες.
Μονοσυστατική ουσία
: ουσία που ορίζεται από την ποσοτική της σύνθεση και της οποίας ένα κύριο συστατικό περιέχεται σε ποσοστό τουλάχιστον 80 % κ.β.
Πολυσυστατική ουσία
: ουσία που ορίζεται από την ποσοτική της σύνθεση και της οποίας περισσότερα από ένα κύρια συστατικά περιέχονται σε συγκέντρωση ≥ 10 % κ.β. και < 80 % κ.β. Οι πολυσυστατικές ουσίες είναι προϊόντα μεταποιητικών διεργασιών. Η διαφορά μεταξύ μείγματος και πολυσυστατικής ουσίας είναι ότι το μείγμα λαμβάνεται με ανάμειξη δύο ή περισσότερων ουσιών, χωρίς χημική αντίδραση. Οι πολυσυστατικές ουσίες είναι προϊόντα χημικών αντιδράσεων.
Θετικός μάρτυρας
: πανομοιότυπο δείγμα που περιέχει όλα τα στοιχεία ενός συστήματος δοκιμής και υποβάλλεται σε αγωγή με ουσία που είναι γνωστό ότι προκαλεί θετική απόκριση. Για να διασφαλίζεται η δυνατότητα αξιολόγησης της μεταβλητότητας της απόκρισης του θετικού μάρτυρα σε συνάρτηση με τον χρόνο, το μέγεθος της θετικής απόκρισης δεν θα πρέπει να είναι υπερβολικό.
Αβιοτικά προαπτένια
: χημικές ουσίες που καθίστανται ευαισθητοποιητικές μέσω αβιοτικού μετασχηματισμού, π.χ. μέσω οξείδωσης.
Μεταβολικά προαπτένια
: χημικές ουσίες που χρειάζονται ενζυμική ενεργοποίηση για να εκδηλώσουν το δυναμικό δερματικής ευαισθητοποίησής τους.
Καταλληλότητα
: περιγραφή της σχέσης της δοκιμής με την υπό μελέτη επίδραση και του κατά πόσον αυτή έχει σημασία και είναι χρήσιμη για συγκεκριμένο σκοπό. Πρόκειται για τον βαθμό στον οποίο η δοκιμή μετρά ή προβλέπει σωστά τη βιολογική επίδραση υπό μελέτη. Η καταλληλότητα εμπεριέχει συνεκτίμηση της ορθότητας (συμφωνίας) της δοκιμής (14).
Αξιοπιστία
: μέτρο του βαθμού στον οποίο μια δοκιμή μπορεί να αναπαράγεται διαχρονικά στο ίδιο εργαστήριο και μεταξύ εργαστηρίων, όταν εφαρμόζεται με το ίδιο πρωτόκολλο. Εκτιμάται με υπολογισμό της ενδοεργαστηριακής και της διεργαστηριακής αναπαραγωγιμότητας, καθώς και της ενδοεργαστηριακής επαναληψιμότητας (14).
Σειρά δοκιμών
: μια σειρά περιλαμβάνει μία ή περισσότερες υπό δοκιμή χημικές ουσίες που υποβάλλονται σε δοκιμή ταυτόχρονα με μάρτυρα με διαλύτη/φορέα και με θετικό μάρτυρα.
Ευαισθησία
: το ποσοστό του συνόλου των θετικών/δραστικών χημικών ουσιών που ταξινομείται σωστά με τη δοκιμή. Αποτελεί μέτρο ορθότητας των δοκιμών με τις οποίες λαμβάνονται κατηγορηματικά αποτελέσματα, και είναι σημαντικό κριτήριο αξιολόγησης της καταλληλότητας των δοκιμών (14).
S.I.
: δείκτης διέγερσης. Οι σχετικές τιμές του γεωμετρικού μέσου όρου έντασης φθορισμού σε κύτταρα που υποβάλλονται σε αγωγή με υπό δοκιμή χημική ουσία σε σύγκριση με κύτταρα που υποβάλλονται σε αγωγή με διαλύτη/φορέα.
Μάρτυρας με διαλύτη/φορέα
: δείγμα που δεν υποβάλλεται σε αγωγή και περιέχει όλα τα στοιχεία ενός συστήματος δοκιμής, εκτός της υπό δοκιμή χημικής ουσίας, αλλά περιλαμβανομένου του διαλύτη/φορέα που χρησιμοποιείται. Χρησιμοποιείται για τον προσδιορισμό της βασικής απόκρισης των δειγμάτων που υποβάλλονται σε αγωγή με την υπό δοκιμή χημική ουσία διαλυμένη ή σταθερώς διεσπαρμένη στον ίδιο διαλύτη/φορέα. Όταν το εν λόγω δείγμα υποβάλλεται σε δοκιμή με παράλληλο μάρτυρα θρεπτικού μέσου, καταδεικνύει επίσης αν ο διαλύτης/φορέας αλληλεπιδρά με το σύστημα δοκιμής.
Ειδικότητα
: το ποσοστό του συνόλου των αρνητικών/αδρανών χημικών ουσιών που ταξινομείται σωστά με τη δοκιμή. Αποτελεί μέτρο ορθότητας της δοκιμής με την οποία λαμβάνονται κατηγορηματικά αποτελέσματα, καθώς και σημαντικό κριτήριο αξιολόγησης της καταλληλότητας της δοκιμής (14).
Ρυθμιστικό διάλυμα χρώσης
: αλατούχο ρυθμιστικό διάλυμα φωσφορικών ιόντων που περιέχει 5 % ορού εμβρύων μόσχων.
Ουσία
: ένα χημικό στοιχείο και οι ενώσεις του σε φυσική κατάσταση ή όπως λαμβάνονται με οποιαδήποτε παραγωγική διεργασία, στα οποία συμπεριλαμβάνονται όλα τα πρόσθετα που απαιτούνται για να διατηρείται η σταθερότητά του, καθώς και τυχόν προσμείξεις που προκύπτουν από τη χρησιμοποιούμενη διεργασία, αλλά από τα οποία εξαιρούνται οι διαλύτες που είναι δυνατόν να διαχωριστούν χωρίς να επηρεαστεί η σταθερότητα της ουσίας ούτε να μεταβληθεί η σύνθεσή της.
Υπό δοκιμή χημική ουσία
: κάθε ουσία ή μείγμα που υποβάλλεται σε δοκιμή με χρήση της παρούσας δοκιμής.
Παγκοσμίως Εναρμονισμένο Σύστημα Ταξινόμησης και Επισήμανσης των Χημικών Προϊόντων των Ηνωμένων Εθνών (United Nations Globally Harmonized System of Classification and Labelling of Chemicals) (GHS του ΟΗΕ)
: σύστημα που προτείνει την ταξινόμηση των χημικών προϊόντων (ουσιών και μειγμάτων) με βάση τυποποιημένα είδη και βαθμούς φυσικής επικινδυνότητας και επικινδυνότητας για την υγεία και το περιβάλλον και καλύπτει τα αντίστοιχα στοιχεία γνωστοποίησης, όπως εικονογράμματα, προειδοποιητικές λέξεις, δηλώσεις επικινδυνότητας, δηλώσεις προφύλαξης και δελτία δεδομένων ασφαλείας, με τα οποία γνωστοποιούνται πληροφορίες σχετικά με τις δυσμενείς επιδράσεις με σκοπό την προστασία των ανθρώπων (εργοδοτών, εργαζομένων, μεταφορέων, καταναλωτών και διασωστών) και του περιβάλλοντος (16).
UVCB
: ουσίες άγνωστης ή ασταθούς σύνθεσης, πολύπλοκα προϊόντα αντιδράσεων ή βιολογικά υλικά.
Έγκυρη δοκιμή
: δοκιμή που θεωρείται επαρκούς καταλληλότητας και αξιοπιστίας για συγκεκριμένο σκοπό και βασίζεται σε επιστημονικά τεκμηριωμένες αρχές. Μια δοκιμή δεν είναι ποτέ έγκυρη με την απόλυτη σημασία του όρου, αλλά μόνο σε σχέση με καθορισμένο σκοπό (14).
Προσάρτημα 2.2
ΟΥΣΙΕΣ ΕΛΕΓΧΟΥ ΙΚΑΝΟΤΗΤΑΣ
Πριν εντάξουν στην καθημερινή πρακτική τη δοκιμή που περιγράφεται στο παρόν προσάρτημα της μεθόδου δοκιμών Β.71, τα εργαστήρια θα πρέπει να αποδεικνύουν την τεχνική τους ικανότητα επιτυγχάνοντας σωστά την αναμενόμενη πρόβλεψη βάσει της δοκιμής U-SENS™ για τις 10 συνιστώμενες ουσίες στον πίνακα 1, καθώς και τιμές CV70 και EC150 εντός του αντίστοιχου εύρους τιμών αναφοράς για 8 τουλάχιστον από τις 10 ουσίες ελέγχου ικανότητας. Αυτές οι ουσίες ελέγχου ικανότητας επιλέχθηκαν ως αντιπροσωπευτικές του φάσματος αποκρίσεων από τις πηγές κινδύνου δερματικής ευαισθητοποίησης. Άλλα κριτήρια επιλογής ήταν ότι οι ουσίες θα πρέπει να είναι διαθέσιμες στο εμπόριο και ότι θα πρέπει να υπάρχουν διαθέσιμα in vivo δεδομένα αναφοράς υψηλής ποιότητας καθώς και in vitro δεδομένα υψηλής ποιότητας που προκύπτουν με τη δοκιμή U-SENS™. Επίσης, για τη δοκιμή U-SENS™ υπάρχουν διαθέσιμα δημοσιευμένα δεδομένα αναφοράς (1) (8).
Πίνακας 1
Συνιστώμενες ουσίες για την απόδειξη τεχνικής ικανότητας όσον αφορά τη δοκιμή U-SENS™
|
Ουσίες ελέγχου ικανότητας
|
Αριθμός CAS
|
Φυσική κατάσταση
|
Πρόβλεψη in vivo (105)
|
U-SENS Διαλύτης/φορέας
|
U-SENS Πεδίο τιμών αναφοράς CV70 σε μg/ml (106)
|
U-SENS Πεδίο τιμών αναφοράς EC150 σε μg/ml (106)
|
|
4-Φαινυλενοδιαμίνη
|
106-50-3
|
Στερεό
|
Ευαισθητοποιητικό (ισχυρό)
|
Πλήρες θρεπτικό μέσο (107)
|
<30
|
Θετικό (≤10)
|
|
Πικρυλοσουλφονικό οξύ
|
2508-19-2
|
Υγρό
|
Ευαισθητοποιητικό (ισχυρό)
|
Πλήρες θρεπτικό μέσο
|
>50
|
Θετικό (≤50)
|
|
Μηλεϊνικό διαιθύλιο
|
141-05-9.
|
Υγρό
|
Ευαισθητοποιητικό (μετρίως ισχυρό)
|
DMSO
|
10-100
|
Θετικό (≤20)
|
|
Ρεσορκινόλη
|
108-46-3
|
Στερεό
|
Ευαισθητοποιητικό (μετρίως ισχυρό)
|
Πλήρες θρεπτικό μέσο
|
>100
|
Θετικό (≤50)
|
|
Κινναμωμική αλκοόλη
|
104-54-1
|
Στερεό
|
Ευαισθητοποιητικό (ασθενές)
|
DMSO
|
>100
|
Θετικό (10-100)
|
|
4-Αλλυλανισόλη
|
140-67-0
|
Υγρό
|
Ευαισθητοποιητικό (ασθενές)
|
DMSO
|
>100
|
Θετικό (<200)
|
|
Σακχαρίνη
|
81-07-2
|
Στερεό
|
Μη ευαισθητοποιητικό
|
DMSO
|
>200
|
Αρνητικό (>200)
|
|
Γλυκερίνη
|
56-81-5
|
Υγρό
|
Μη ευαισθητοποιητικό
|
Πλήρες θρεπτικό μέσο
|
>200
|
Αρνητικό (>200)
|
|
Γαλακτικό οξύ
|
50-21-5
|
Υγρό
|
Μη ευαισθητοποιητικό
|
Πλήρες θρεπτικό μέσο
|
>200
|
Αρνητικό (>200)
|
|
Σαλικυλικό οξύ
|
69-72-7
|
Στερεό
|
Μη ευαισθητοποιητικό
|
DMSO
|
>200
|
Αρνητικό (>200)
|
|
Συντομογραφίες: Αριθμός CAS = αριθμός μητρώου της υπηρεσίας Chemical Abstract Service
|
Προσάρτημα 3
IN VITRO ΕΥΑΙΣΘΗΤΟΠΟΙΗΣΗ ΤΟΥ ΔΕΡΜΑΤΟΣ: ΔΟΚΙΜΑΣΙΑ IL-8 LUC
ΑΡΧΙΚΕΣ ΕΚΤΙΜΗΣΕΙΣ ΚΑΙ ΠΕΡΙΟΡΙΣΜΟΙ
|
1.
|
Σε αντίθεση με τις δοκιμασίες που αναλύουν την έκφραση δεικτών κυτταρικής επιφάνειας, η δοκιμασία IL8-Luc προσδιορίζει ποσοτικά τις αλλαγές στην έκφραση της IL-8, μιας κυτταροκίνης που συνδέεται με την ενεργοποίηση των δενδριτικών κυττάρων (DC). Στην κυτταρική σειρά έκφρασης γονιδίου αναφοράς IL-8 που προέκυψε από την THP-1 (THP-G8, που δημιουργήθηκε από την ανθρώπινη κυτταρική σειρά οξείας μονοκυτταρικής λευχαιμίας THP-1), η έκφραση της IL-8 μετράται μετά από έκθεση σε ευαισθητοποιητικές ουσίες (1). Στη συνέχεια, η έκφραση της λουσιφεράσης χρησιμοποιείται για την υποστήριξη της διάκρισης μεταξύ ευαισθητοποιητικών και μη ευαισθητοποιητικών του δέρματος.
|
|
2.
|
Η δοκιμασία IL-8 Luc έχει αξιολογηθεί στο πλαίσιο μελέτης επικύρωσης (2) που διεξήγαγε το Ιαπωνικό Κέντρο για την Επικύρωση Εναλλακτικών Μεθόδων (JaCVAM), το ιαπωνικό Υπουργείο Οικονομίας, Εμπορίου και Βιομηχανίας (METI), και η Ιαπωνική Εταιρεία Εναλλακτικών Μεθόδων προς τα Πειράματα σε Ζώα (JSAAE), και η οποία υποβλήθηκε στη συνέχεια σε ανεξάρτητη αξιολόγηση από ομοτίμους (3) υπό την αιγίδα του JaCVAM και του ιαπωνικού Υπουργείου Υγείας, Εργασίας και Κοινωνικής Πρόνοιας (MHLW), με την υποστήριξη της Διεθνούς Συνεργασίας για τις Εναλλακτικές Μεθόδους Δοκιμών (ICATM). Λαμβανομένου υπόψη του συνόλου των διαθέσιμων στοιχείων και των απόψεων των ρυθμιστικών αρχών και των ενδιαφερόμενων μερών, η δοκιμασία IL-8 Luc θεωρείται χρήσιμη στο πλαίσιο IATA για τη διάκριση μεταξύ ευαισθητοποιητικών και μη ευαισθητοποιητικών ουσιών με σκοπό την ταξινόμηση και επισήμανση επικινδυνότητας. Παραδείγματα σχετικά με τη χρήση δεδομένων δοκιμασίας IL-8 Luc σε συνδυασμό με άλλα στοιχεία έχουν αναφερθεί στη βιβλιογραφία (4) (5) (6).
|
|
3.
|
Η δοκιμασία IL-8 Luc αποδείχθηκε ότι μπορεί να εφαρμοστεί σε εργαστήρια που διαθέτουν εμπειρία στην κυτταροκαλλιέργεια και τη μέτρηση λουσιφεράσης. Η αναπαραγωγιμότητα εντός και μεταξύ των εργαστηρίων ήταν 87,7 % και 87,5 %, αντίστοιχα (2). Τα δεδομένα που προέκυψαν από τη μελέτη επικύρωσης (2) και άλλες δημοσιευμένες εργασίες (1) (6) δείχνουν ότι, σε σύγκριση με την LLNA, με τη δοκιμασία IL-8 Luc 118 από τις 143 χημικές ουσίες κρίθηκαν θετικές ή αρνητικές ενώ για 25 χημικές ουσίες η δοκιμή δεν ήταν καταληκτική, και η ορθότητα της δοκιμασίας IL-8 Luc όσον αφορά τη διάκριση μεταξύ ευαισθητοποιητικών (κατηγορία 1 κατά GHS του ΟΗΕ / κανονισμό CLP) και μη ευαισθητοποιητικών του δέρματος ουσιών (καμία κατηγορία κατά GHS του ΟΗΕ / κανονισμό CLP) είναι 86 % (101/118), με ευαισθησία 96 % (92/96) και ειδικότητα 41 % (9/22). Με εξαίρεση τις ουσίες που δεν εμπίπτουν στο πεδίο εφαρμογής όπως περιγράφεται κατωτέρω (παράγραφος 5), με τη δοκιμασία IL-8 Luc 113 από τις 136 χημικές ουσίες κρίθηκαν θετικές ή αρνητικές ενώ για 23 χημικές ουσίες η δοκιμή δεν ήταν καταληκτική, και η ορθότητα της δοκιμασίας IL-8 Luc είναι 89 % (101/113), με ευαισθησία 96 % (92/96) και ειδικότητα 53 % (9/17). Με χρήση δεδομένων για τον άνθρωπο από τους Urbisch et al. (7), με τη δοκιμασία IL-8 Luc 76 από τις 90 χημικές ουσίες κρίθηκαν θετικές ή αρνητικές ενώ για 14 χημικές ουσίες η δοκιμή δεν ήταν καταληκτική, και η ορθότητα της δοκιμασίας είναι 80 % (61/76), η ευαισθησία 93 % (54/58) και η ειδικότητα 39 % (7/18). Με εξαίρεση τις ουσίες που δεν εμπίπτουν στο πεδίο εφαρμογής της, με τη δοκιμασία IL-8 Luc 71 από τις 84 χημικές ουσίες κρίθηκαν θετικές ή αρνητικές ενώ για 13 χημικές ουσίες η δοκιμή δεν ήταν καταληκτική, και η ορθότητα της δοκιμασίας είναι 86 % (61/71) με ευαισθησία 93 % (54/58) και ειδικότητα 54 % (7/13). Οι ψευδοαρνητικές προβλέψεις με τη δοκιμασία IL-8 Luc αφορούν πιθανότατα χημικές ουσίες που εμφανίζουν χαμηλή έως μέτρια ισχύ ευαισθητοποίησης του δέρματος (υποκατηγορία 1Β κατά GHS του ΟΗΕ / κανονισμό CLP) παρά ουσίες με υψηλή ισχύ (υποκατηγορία 1Α κατά GHS του ΟΗΕ / κανονισμό CLP) (6). Συνολικά, τα στοιχεία υποστηρίζουν τον ρόλο της δοκιμασίας IL-8 Luc στον προσδιορισμό της επικινδυνότητας ευαισθητοποίησης του δέρματος. Οι τιμές ορθότητας που παρέχονται για τη δοκιμασία IL-8 Luc ως αυτοτελή δοκιμή είναι απλώς ενδεικτικές, δεδομένου ότι η δοκιμή θα πρέπει να εξετάζεται σε συνδυασμό με άλλες πηγές πληροφοριών στο πλαίσιο ΙΑΤΑ και σύμφωνα με τις πληροφορίες στις παραγράφους 7 και 8 της γενικής εισαγωγής. Επιπλέον, κατά την αξιολόγηση των δοκιμών ευαισθητοποίησης του δέρματος χωρίς χρήση ζώων, θα πρέπει να μη λησμονείται ότι η δοκιμασία LLNA, καθώς και άλλες δοκιμές σε ζώα, ενδέχεται να μην αντικατοπτρίζουν πλήρως την κατάσταση στον άνθρωπο.
|
|
4.
|
Με βάση το σύνολο των διαθέσιμων δεδομένων, η δοκιμασία IL-8 Luc είναι εφαρμόσιμη σε υπό δοκιμή χημικές ουσίες που καλύπτουν ποικιλία οργανικών λειτουργικών ομάδων, μηχανισμών αντίδρασης, επιπέδων ισχύος ευαισθητοποίησης του δέρματος (όπως προσδιορίζονται σε μελέτες in vivo) και φυσικοχημικών ιδιοτήτων (2) (6).
|
|
5.
|
Παρότι στη δοκιμασία IL-8 Luc χρησιμοποιείται ως διαλύτης το X-VIVOTM 15, με τη δοκιμασία IL-8 Luc αξιολογήθηκαν σωστά χημικές ουσίες με Log Kow >3,5 καθώς και χημικές ουσίες με διαλυτότητα γύρω στα 100 μg/ml, όπως υπολογίστηκε με το EPI SuiteTM, ενώ οι επιδόσεις της όσον αφορά την ανίχνευση ευαισθητοποιητικών ουσιών με χαμηλή υδατοδιαλυτότητα είναι καλύτερες σε σχέση με τις αντίστοιχες της δοκιμασίας IL-8 Luc με χρήση διμεθυλοσουλφοξειδίου (DMSO) ως διαλύτη (2). Ωστόσο, αρνητικά αποτελέσματα για υπό δοκιμή χημικές ουσίες που δεν διαλύονται σε 20 mg/ml ενδέχεται να έχουν ως αποτέλεσμα ψευδοαρνητικά αποτελέσματα, λόγω της μη διαλυτότητάς τους στο X-VIVOTM 15. Ως εκ τούτου, τα αρνητικά αποτελέσματα για τις εν λόγω χημικές ουσίες δεν θα πρέπει να λαμβάνονται υπόψη. Στη μελέτη επικύρωσης διαπιστώθηκε υψηλό ποσοστό ψευδοαρνητικών αποτελεσμάτων για τους ανυδρίτες. Επιπλέον, λόγω της περιορισμένης μεταβολικής ικανότητας της κυτταρικής σειράς (8) και των πειραματικών συνθηκών, τα μεταβολικά προαπτένια (ουσίες που χρειάζονται μεταβολική ενεργοποίηση) και τα αβιοτικά προαπτένια (ουσίες που ενεργοποιούνται με οξείδωση από τον αέρα) ενδέχεται να δώσουν αρνητικά αποτελέσματα στη δοκιμασία. Ωστόσο, αν και τα αρνητικά αποτελέσματα για τα μεταβολικά/αβιοτικά προαπτένια για τα οποία υπάρχουν οι σχετικές υπόνοιες θα πρέπει να ερμηνεύονται με επιφύλαξη, με τη δοκιμασία IL-8 Luc κρίθηκαν σωστά 11 από 11 αβιοτικά προαπτένια, 6/6 μεταβολικά προαπτένια, και 6/8 αβιοτικά/μεταβολικά προαπτένια στο σύνολο δεδομένων της δοκιμασίας IL-8 Luc (2). Με βάση την πρόσφατη ολοκληρωμένη επισκόπηση τριών δοκιμών χωρίς χρήση ζώων (της DPRA, της KeratinoSens™ και της h-CLAT) ως προς την ικανότητά τους να ανιχνεύουν τα αβιοτικά και μεταβολικά προαπτένια (9), και βάσει του γεγονότος ότι τα κύτταρα THP-G8 που χρησιμοποιούνται στη δοκιμασία IL-8 Luc αποτελούν κυτταρική σειρά που προκύπτει από την THP-1 που χρησιμοποιείται στην h-CLAT, η δοκιμασία IL-8 Luc μπορεί επίσης να συμβάλει, σε συνδυασμό με άλλες δοκιμές, στην ενίσχυση της ευαισθησίας των δοκιμών χωρίς χρήση ζώων όσον αφορά την ανίχνευση των αβιοτικών και μεταβολικών προαπτενίων. Οι επιφανειοδραστικές ουσίες που έχουν δοκιμαστεί μέχρι σήμερα έδωσαν (ψευδο)θετικά αποτελέσματα, ανεξάρτητα από το είδος τους (π.χ. κατιονικές, ανιονικές ή μη ιονικές). Τέλος, οι χημικές ουσίες που παρεμποδίζουν τη λουσιφεράση μπορεί να προκαλέσουν σύγχυση ως προς τη δράση/μέτρησή της, προκαλώντας είτε φαινομενική αναστολή είτε αυξημένη φωταύγεια (10). Για παράδειγμα, έχει αναφερθεί ότι συγκεντρώσεις φυτοοιστρογόνων ανώτερες του 1 μΜ παρεμπόδιζαν τα σήματα φωταύγειας σε άλλες δοκιμασίες με λουσιφεράση ως γονίδιο αναφοράς, λόγω υπερενεργοποίησης του γονιδίου αναφοράς. Κατά συνέπεια, θα πρέπει να εξετάζεται με προσοχή η έκφραση της λουσιφεράσης σε υψηλές συγκεντρώσεις φυτοοιστρογόνων ή ενώσεων για τις οποίες υπάρχουν υπόνοιες ότι προκαλούν ενεργοποίηση του γονιδίου αναφοράς της λουσιφεράσης ανάλογη με εκείνη που οφείλεται στα φυτοοιστρογόνα (11). Με βάση τα παραπάνω, τα επιφανειοδραστικά, οι ανυδρίτες και οι χημικές ουσίες που παρεμποδίζουν τη λουσιφεράση δεν εμπίπτουν στο πεδίο εφαρμογής της παρούσας δοκιμασίας. Εάν υπάρχουν στοιχεία που δείχνουν ότι η δοκιμασία IL-8 Luc δεν μπορεί να εφαρμοστεί σε άλλες ειδικές κατηγορίες υπό δοκιμή χημικών ουσιών, η δοκιμή δεν θα πρέπει να χρησιμοποιείται για τις συγκεκριμένες κατηγορίες.
|
|
6.
|
Όπως αναφέρθηκε ανωτέρω, η μέθοδος IL-8 Luc υποστηρίζει τη διάκριση μεταξύ ευαισθητοποιητικών και μη ευαισθητοποιητικών του δέρματος. Για να προσδιοριστεί το κατά πόσον τα αποτελέσματα της IL-8 Luc μπορούν να συμβάλουν στην εκτίμηση της ισχύος, όταν αυτή πραγματοποιείται σε συνδυασμό με άλλες πηγές πληροφοριών, απαιτούνται περαιτέρω εργασίες, κατά προτίμηση με βάση δεδομένα για τον άνθρωπο.
|
|
7.
|
Οι ορισμοί παρατίθενται στο προσάρτημα 3.1.
|
ΑΡΧΗ ΤΗΣ ΔΟΚΙΜΗΣ
|
8.
|
Στη δοκιμασία IL-8 Luc γίνεται χρήση ανθρώπινης κυτταρικής σειράς μονοκυτταρικής λευχαιμίας, της THP-1, η οποία ελήφθη από τη συλλογή American Type Culture Collection (Manassas, VA, ΗΠΑ). Με χρήση της εν λόγω κυτταρικής σειράς, το τμήμα δερματολογίας της ιατρικής σχολής του πανεπιστημίου του Tohoku δημιούργησε μια κυτταρική σειρά γονιδίου αναφοράς IL-8 προερχόμενη από την THP-1, την THP-G8, η οποία φέρει τα γονίδια σταθερής λουσιφεράσης πορτοκαλί χρώματος (SLO) και σταθερής λουσιφεράσης κόκκινου χρώματος (SLR) υπό τον έλεγχο των υποκινητών της IL-8 και της αφυδρογονάσης της 3-φωσφορικής γλυκεραλδεΰδης (GAPDH) αντίστοιχα (1). Αυτό επιτρέπει τον ποσοτικό προσδιορισμό της επαγωγής του γονιδίου λουσιφεράσης μέσω ανίχνευσης της φωταύγειας από καθιερωμένα φωταυγή υποστρώματα λουσιφεράσης ως δείκτη της δραστικότητας της IL-8 και της GAPDH στα κύτταρα μετά από έκθεση σε ευαισθητοποιητικές χημικές ουσίες.
|
|
9.
|
Το σύστημα δοκιμασίας δύο χρωμάτων περιλαμβάνει λουσιφεράση που εκπέμπει πορτοκαλί χρώμα (SLO, λmax = 580 nm) (12) για τη γονιδιακή έκφραση του υποκινητή IL-8, και λουσιφεράση που εκπέμπει κόκκινο χρώμα (SLR, λmax = 630 nm) (13) για τη γονιδιακή έκφραση του υποκινητή εσωτερικού μάρτυρα, GAPDH. Οι δύο λουσιφεράσες εκπέμπουν διαφορετικά χρώματα όταν αντιδρούν με την d-λουσιφερίνη της πυγολαμπίδας και η φωταύγειά τους μετράται ταυτόχρονα σε αντίδραση ενός σταδίου, μέσω διαχωρισμού του φωτός που εκπέμπεται από το μείγμα της δοκιμασίας με χρήση οπτικού φίλτρου (14) (προσάρτημα 3.2).
|
|
10.
|
Τα κύτταρα THP-G8 υποβάλλονται σε αγωγή με την υπό δοκιμή χημική ουσία επί 16 ώρες και, στη συνέχεια, μετράται η δραστικότητα της λουσιφεράσης SLO (SLO-LA) που αντικατοπτρίζει τη δραστικότητα του υποκινητή IL-8 και η δραστικότητα της λουσιφεράσης SLR (SLR-LA) που αντικατοπτρίζει τη δραστικότητα του υποκινητή GAPDH. Προκειμένου να διευκολυνθεί η κατανόηση των συντομογραφιών, τα SLO-LA και SLR-LA αναφέρονται ως IL8LA και GAPLA αντίστοιχα. Στον πίνακα 1 παρέχεται περιγραφή των όρων που σχετίζονται με τη δραστικότητα της λουσιφεράσης στη δοκιμασία IL-8 Luc. Οι μετρηθείσες τιμές χρησιμοποιούνται για τον υπολογισμό της κανονικοποιημένης IL8LA (nIL8LA), η οποία αντιστοιχεί στον λόγο IL8LA προς GAPLA· της επαγωγής της nIL8LA (Ind-IL8LA), η οποία αντιστοιχεί στον λόγο των αριθμητικών μέσων όρων των εις τετραπλούν μετρηθεισών τιμών της nIL8LA των κυττάρων THP-G8 που υποβλήθηκαν σε αγωγή με υπό δοκιμή χημική ουσία προς τις τιμές της nIL8LA των κυττάρων THP-G8 χωρίς αγωγή· και της αναστολής της GAPLA (Inh-GAPLA), η οποία αντιστοιχεί στον λόγο των αριθμητικών μέσων όρων των εις τετραπλούν μετρηθεισών τιμών της GAPLA των κυττάρων THP-G8 που υποβλήθηκαν σε αγωγή με υπό δοκιμή χημική ουσία προς τις τιμές της GAPLA των κυττάρων THP-G8 χωρίς αγωγή, η οποία χρησιμοποιείται ως δείκτης κυτταροτοξικότητας.
Πίνακας 1
Περιγραφή των όρων που σχετίζονται με τη δράση της λουσιφεράσης στη δοκιμασία IL-8 Luc
|
Συντομογραφίες
|
Ορισμός
|
|
GAPLA
|
δραστικότητα της λουσιφεράσης SLR που αντικατοπτρίζει τη δραστικότητα του υποκινητή GAPDH
|
|
IL8LA
|
δραστικότητα της λουσιφεράσης SLO που αντικατοπτρίζει τη δραστικότητα του υποκινητή IL-8
|
|
nIL8LA
|
IL8LA / GAPLA
|
|
Ind-IL8LA
|
nIL8LA των κυττάρων THP-G8 που υποβάλλονται σε αγωγή με χημικές ουσίες / nIL8LA κυττάρων χωρίς αγωγή
|
|
Inh-GAPLA
|
GAPLA των κυττάρων THP-G8 που υποβάλλονται σε αγωγή με χημικές ουσίες / GAPLA κυττάρων χωρίς αγωγή
|
|
CV05
|
η χαμηλότερη συγκέντρωση της χημικής ουσίας στην οποία η Inh-GAPLA καθίσταται < 0,05.
|
|
|
11.
|
Υπάρχουν διαθέσιμα πρότυπα επιδόσεων (PS) (15) που διευκολύνουν την επικύρωση των τροποποιημένων in vitro δοκιμών λουσιφεράσης IL-8 που είναι παρεμφερείς με τη δοκιμασία IL-8 Luc και επιτρέπουν την έγκαιρη τροποποίηση της κατευθυντήριας γραμμής δοκιμών 442E του ΟΟΣΑ, ούτως ώστε να τις συμπεριλάβει. Η αμοιβαία αποδοχή δεδομένων (Mutual Acceptance of Data/MAD) του ΟΟΣΑ είναι διασφαλισμένη μόνο για δοκιμές που έχουν επικυρωθεί σύμφωνα με τα πρότυπα επιδόσεων, εφόσον αυτές έχουν κριθεί από τον ΟΟΣΑ και έχουν περιληφθεί στην κατευθυντήρια γραμμή δοκιμών 442Ε (16).
|
ΑΠΟΔΕΙΞΗ ΤΕΧΝΙΚΗΣ ΙΚΑΝΟΤΗΤΑΣ
|
12.
|
Πριν χρησιμοποιήσουν στην καθημερινή πρακτική τη δοκιμή που περιγράφεται στο παρόν προσάρτημα της μεθόδου δοκιμών B.71, τα εργαστήρια θα πρέπει να αποδεικνύουν την τεχνική τους ικανότητα, χρησιμοποιώντας τις 10 ουσίες ελέγχου ικανότητας του προσαρτήματος 3.3 σύμφωνα με τις ορθές πρακτικές in vitro μεθόδων (17). Επιπλέον, οι χρήστες της δοκιμής θα πρέπει να διατηρούν βάση ιστορικών δεδομένων με τα δεδομένα που προκύπτουν από τους ελέγχους δραστικότητας (βλ. παράγραφο 15) και με τους θετικούς μάρτυρες και τους μάρτυρες με διαλύτη/φορέα (βλ. παραγράφους 21-24), και θα πρέπει να χρησιμοποιούν τα εν λόγω δεδομένα για να βεβαιώνονται για τη διαχρονική αναπαραγωγιμότητα της δοκιμής στο εργαστήριό τους.
|
ΔΙΑΔΙΚΑΣΙΑ
|
13.
|
Υπάρχει διαθέσιμη τυποποιημένη διαδικασία λειτουργίας (SOP) για τη δοκιμασία IL-8 Luc, η οποία θα πρέπει να χρησιμοποιείται κατά τη διεξαγωγή της (18). Τα εργαστήρια που επιθυμούν να διεξάγουν τη δοκιμή μπορούν ναπρομηθευτούν την ανασυνδυασμένη κυτταρική σειρά THP-G8 από την GPC Lab. Co. Ltd., Tottori, Ιαπωνία, κατόπιν υπογραφής συμφωνίας μεταφοράς υλικού (ΣΜΥ) σύμφωνα με τις προϋποθέσεις του υποδείγματος του ΟΟΣΑ. Στις επόμενες παραγράφους περιγράφονται τα βασικά στοιχεία και διαδικασίες της δοκιμασίας.
|
Προπαρασκευή των κυττάρων
|
14.
|
Για τη διεξαγωγή της δοκιμασίας IL-8 Luc θα πρέπει να χρησιμοποιείται η κυτταρική σειρά THP-G8 από την GPC Lab. Co. Ltd., Tottori, Ιαπωνία (βλ. παραγράφους 8 και 13). Κατά την παραλαβή, τα κύτταρα πολλαπλασιάζονται (2 έως 4 ανακαλλιέργειες) και φυλάσσονται στην κατάψυξη ως ομοιογενές απόθεμα. Τα κύτταρα του αποθέματος αυτού μπορούν να πολλαπλασιάζονται μέχρι και επί 12 ανακαλλιέργειες ή επί 6 εβδομάδες. Το θρεπτικό μέσο που χρησιμοποιείται για τον πολλαπλασιασμό είναι το RPMI-1 640 που περιέχει 10 % βόειου εμβρυϊκού ορού (FBS), αντιβιοτικό/αντιμυκητιακό διάλυμα (100 U/ml πενικιλίνης G, 100 μg/ml στρεπτομυκίνης και 0,25 μg/ml αμφοτερικίνης B σε αλατούχο διάλυμα 0,85 %) (π.χ. GIBCO αρ. κατ. 15 240-062), 0,15 μg/ml πουρομυκίνης (π.χ. CAS:58-58-2) και 300 μg/ml G418 (π.χ. CAS:108 321-42-2).
|
|
15.
|
Πριν από τη χρήση τους στη δοκιμή, θα πρέπει να ελέγχεται εάν τα κύτταρα πληρούν τα κριτήρια μέσω της διεξαγωγής ελέγχου δραστικότητας. Ο εν λόγω έλεγχος θα πρέπει να διεξάγεται 1-2 εβδομάδες ή 2-4 ανακαλλιέργειες μετά την απόψυξη, με χρήση του θετικού μάρτυρα 1-βρωμομεθυλο-4-νιτροβενζόλιο (4-NBB) (CAS:100-11-8, καθαρότητα ≥ 99 %) και του αρνητικού μάρτυρα γαλακτικό οξύ (LA) (CAS:50-21-5, καθαρότητα ≥ 85 %). Το 4-NBB θα πρέπει να επάγει θετική απόκριση στην Ind-IL8LA (≥1,4), ενώ το LA θα πρέπει να επάγει αρνητική απόκριση στην Ind-IL8LA (<1,4). Για τη δοκιμασία χρησιμοποιούνται μόνο τα κύτταρα που έχουν υποβληθεί επιτυχώς στον έλεγχο δραστικότητας. Ο έλεγχος θα πρέπει να διενεργείται σύμφωνα με τις διαδικασίες που περιγράφονται στις παραγράφους 22-24.
|
|
16.
|
Για τη δοκιμή, τα κύτταρα THP-G8 εμβολιάζονται σε πυκνότητα 2 έως 5 × 105 κύτταρα/ml και προκαλλιεργούνται σε φιάλες καλλιέργειας επί 48 έως 96 ώρες. Την ημέρα διεξαγωγής της δοκιμής, τα κύτταρα που συλλέγονται από τη φιάλη καλλιέργειας εκπλένονται με RPMI-1 640 που περιέχει 10 % FBS χωρίς αντιβιοτικά και, στη συνέχεια, επανεναιωρούνται με RPMI-1 640 που περιέχει 10 % FBS χωρίς αντιβιοτικά σε πυκνότητα 1 × 106 κύτταρα/ml. Στη συνέχεια, τα κύτταρα κατανέμονται σε μαύρο τρυβλίο επίπεδης βάσης 96 κοιλοτήτων (π.χ. Costar αρ. κατ. 3603) με 50 μl (5 × 104 κύτταρα/κοιλότητα).
|
Παρασκευή των υπό δοκιμή χημικών ουσιών και των μαρτύρων
|
17.
|
Η παρασκευή των υπό δοκιμή χημικών ουσιών και των μαρτύρων γίνεται την ημέρα της δοκιμής. Για τη δοκιμασία IL-8 Luc, οι υπό δοκιμή χημικές ουσίες διαλύονται σε X-VIVOTM 15, ένα θρεπτικό μέσο του εμπορίου χωρίς ορό (Lonza, 04-418Q), σε τελική συγκέντρωση 20 mg/ml. Προστίθεται X-VIVOTM 15 σε 20 mg της υπό δοκιμή χημικής ουσίας (ανεξάρτητα από τη διαλυτότητα της χημικής ουσίας) σε σωληνάριο μικροφυγοκέντρησης και συμπληρώνεται μέχρι όγκου 1 ml και, στη συνέχεια, το διάλυμα περιδινείται έντονα και ανακινείται σε περιστρεφόμενο αναδευτήρα σε μέγιστη ταχύτητα 8 σ.α.λ. επί 30 λεπτά σε θερμοκρασία περιβάλλοντος 20oC περίπου. Επιπλέον, σε περίπτωση στερεών χημικών ουσιών που εξακολουθούν να μη διαλύονται, το σωληνάριο υποβάλλεται σε υπερήχηση μέχρις ότου η χημική ουσία διαλυθεί πλήρως ή διασπαρεί σταθερά. Για υπό δοκιμή χημικές ουσίες που είναι διαλυτές σε X-VIVOTM 15, το διάλυμα αραιώνεται 5 φορές με X-VIVOTM 15 και χρησιμοποιείται ως αποθεματικό διάλυμα X-VIVOTM 15 της υπό δοκιμή χημικής ουσίας (4 mg/ml). Για υπό δοκιμή χημικές ουσίες που δεν είναι διαλυτές σε X-VIVOTM 15, το μείγμα περιστρέφεται εκ νέου επί τουλάχιστον 30 λεπτά, και, στη συνέχεια, φυγοκεντρείται στις 15000 σ.α.λ. (≈20000g) επί 5 λεπτά· το προκύπτον υπερκείμενο υγρό χρησιμοποιείται ως αποθεματικό διάλυμα X-VIVOTM 15 της υπό δοκιμή χημικής ουσίας. Η χρήση άλλων διαλυτών, όπως DMSO, νερού, ή του θρεπτικού μέσου καλλιέργειας, θα πρέπει να τεκμηριώνεται επιστημονικά. Η αναλυτική διαδικασία για τη διάλυση χημικών ουσιών φαίνεται στο προσάρτημα 3.5. Τα διαλύματα X-VIVOTM 15 που περιγράφονται στις παραγράφους 18-23 αναμιγνύονται 1:1 (κ.ό.) με τα εναιωρήματα κυττάρων που παρασκευάστηκαν στο μαύρο τρυβλίο επίπεδης βάσης 96 κοιλοτήτων (βλ. παράγραφο 16).
|
|
18.
|
Ο σκοπός της πρώτης σειράς δοκιμών είναι ο προσδιορισμός της κυτταροτοξικής συγκέντρωσης και η εξέταση της ισχύος δερματικής ευαισθητοποίησης των χημικών ουσιών. Με χρήση X-VIVOTM 15, πραγματοποιούνται διαδοχικές αραιώσεις των αποθεματικών διαλυμάτων X-VIVOTM 15 των υπό δοκιμή χημικών ουσιών με συντελεστή αραίωσης 2 (βλ. προσάρτημα 3.5) και με χρήση τρυβλίου δοκιμασίας 96 κοιλοτήτων (π.χ. Costar αρ. κατ. EW-01729-03). Στη συνέχεια, προστίθενται 50 μl/κοιλότητα αραιωμένου διαλύματος σε 50 μl του εναιωρήματος κυττάρων σε μαύρο τρυβλίο επίπεδης βάσης 96 κοιλοτήτων. Έτσι, για υπό δοκιμή χημικές ουσίες που είναι διαλυτές σε X-VIVOTM 15, οι τελικές συγκεντρώσεις των υπό δοκιμή χημικών ουσιών κυμαίνονται από 0,002 έως 2 mg/ml (προσάρτημα 3.5). Για υπό δοκιμή ουσίες που δεν είναι διαλυτές σε X-VIVOTM 15 στα 20 mg/ml, ορίζονται μόνο συντελεστές αραίωσης από 2 έως 210, παρότι οι πραγματικές τελικές συγκεντρώσεις των υπό δοκιμή χημικών ουσιών παραμένουν αμφίβολες και εξαρτώνται από τη συγκέντρωση κορεσμού των υπό δοκιμή χημικών ουσιών στο αποθεματικό διάλυμα X-VIVOTM 15.
|
|
19.
|
Σε επακόλουθες σειρές δοκιμών (δεύτερο, τρίτο και τέταρτο πανομοιότυπο δείγμα), το αποθεματικό διάλυμα X-VIVOTM 15 παρασκευάζεται σε συγκέντρωση 4 φορές υψηλότερη από τη συγκέντρωση κυτταρικής βιωσιμότητας 05 (CV05, η χαμηλότερη συγκέντρωση στην οποία η Inh-GAPLA καθίσταται < 0,05) στο πρώτο πείραμα. Εάν η Inh-GAPLA δεν μειωθεί κάτω από 0,05 στην υψηλότερη συγκέντρωση κατά την πρώτη σειρά δοκιμών, το αποθεματικό διάλυμα X-VIVOTM 15 παρασκευάζεται στην υψηλότερη συγκέντρωση της πρώτης σειράς δοκιμών. Η συγκέντρωση της CV05 υπολογίζεται διαιρώντας τη συγκέντρωση του αποθεματικού διαλύματος στην πρώτη σειρά δοκιμών με συντελεστή αραίωσης για την CV05 (X) [συντελεστής αραίωσης CV05 (X)· ο συντελεστής αραίωσης που απαιτείται για την αραίωση του αποθεματικού διαλύματος στην CV05] (βλ. προσάρτημα 3.5). Για τις υπό δοκιμή χημικές ουσίες που δεν είναι διαλυτές σε X-VIVO σε 20 mg/ml, η CV05 προσδιορίζεται βάσει της συγκέντρωσης του αποθεματικού διαλύματος × 1/X. Για τις σειρές δοκιμών 2 έως 4, παρασκευάζεται δεύτερο αποθεματικό διάλυμα ως 4 × CV05 (προσάρτημα 3.5).
|
|
20.
|
Παρασκευάζονται διαδοχικές αραιώσεις των δεύτερων αποθεματικών διαλυμάτων X-VIVOTM 15 με συντελεστή αραίωσης 1,5, με χρήση τρυβλίου δοκιμασίας 96 κοιλοτήτων. Στη συνέχεια, προστίθενται 50 μl/κοιλότητα αραιωμένου διαλύματος σε 50 μl του εναιωρήματος κυττάρων στο μαύρο τρυβλίο επίπεδης βάσης 96 κοιλοτήτων. Κάθε συγκέντρωση κάθε υπό δοκιμή χημικής ουσίας θα πρέπει να υποβάλλεται σε δοκιμή σε 4 κοιλότητες. Στη συνέχεια, τα μείγματα αναμιγνύονται σε αναδευτήρα τρυβλίων και επωάζονται επί 16 ώρες στους 37oC και με 5 % CO2 και, κατόπιν, μετράται η δράση της λουσιφεράσης σύμφωνα με τα όσα ορίζονται κατωτέρω.
|
|
21.
|
Ο μάρτυρας με διαλύτη είναι το μείγμα 50 μl/κοιλότητα X-VIVOTM 15 και 50 μl/κοιλότητα εναιωρήματος κυττάρων σε RPMI-1640 που περιέχει 10 % FBS.
|
|
22.
|
Ο συνιστώμενος θετικός μάρτυρας είναι το 4-NBB. Παρασκευάζονται 20 mg 4-NBB σε σωληνάριο μικροφυγοκέντρησης των 1,5 ml, στο οποίο προστίθεται έως 1 ml X-VIVOTM 15. Το σωληνάριο περιδινείται έντονα και ανακινείται σε περιστροφικό αναδευτήρα σε μέγιστη ταχύτητα 8 σ.α.λ. επί τουλάχιστον 30 λεπτά. Μετά από φυγοκέντρηση σε 20000g επί 5 λεπτά, το υπερκείμενο υγρό αραιώνεται κατά 4 φορές με X-VIVOTM 15, και 500 μl του αραιωμένου υπερκείμενου υγρού μεταφέρονται σε κοιλότητα τρυβλίου 96 κοιλοτήτων. Το αραιωμένο υπερκείμενο υγρό αραιώνεται περαιτέρω με X-VIVOTM 15 κατά 2 και 4 φορές, και 50 μl του διαλύματος προστίθενται σε 50 μl εναιωρήματος κυττάρων THP-G8 στις κοιλότητες μαύρου τρυβλίου 96 κοιλοτήτων με επίπεδη βάση (προσάρτημα 3.6). Κάθε συγκέντρωση του θετικού μάρτυρα θα πρέπει να υποβάλλεται σε δοκιμή σε 4 κοιλότητες. Το τρυβλίο αναδεύεται σε αναδευτήρα τρυβλίων και επωάζεται σε επωαστήρα CO2 επί 16 ώρες (37oC, 5 % CO2) και, στη συνέχεια, μετράται η δράση της λουσιφεράσης σύμφωνα με τα όσα ορίζονται στην παράγραφο 29.
|
|
23.
|
Ο συνιστώμενος αρνητικός μάρτυρας είναι το LA. Παρασκευάζονται 20 mg LA σε σωληνάριο μικροφυγοκέντρησης των 1,5 ml, στο οποίο προστίθεται έως 1 ml X-VIVOTM 15 (20 mg/ml). 20 mg/ml διαλύματος LA αραιώνονται κατά 5 φορές με X-VIVOTM 15 (4 mg/ml) και 500 μl από αυτό το διάλυμα 4 mg/ml μεταφέρονται σε κοιλότητα τρυβλίου 96 κοιλοτήτων. Αυτό το διάλυμα αραιώνεται κατά 2 φορές με X-VIVOTM 15 και, στη συνέχεια, αραιώνεται και πάλι κατά 2 φορές για να προκύψουν διαλύματα 2 mg/ml και 1 mg/ml. 50 μl από αυτά τα 3 διαλύματα και τον μάρτυρα με φορέα (X-VIVOTM 15) προστίθενται σε 50 μl εναιωρήματος κυττάρων THP-G8 στις κοιλότητες μαύρου τρυβλίου 96 κοιλοτήτων με επίπεδη βάση. Κάθε συγκέντρωση του αρνητικού μάρτυρα υποβάλλεται σε δοκιμή σε 4 κοιλότητες. Το τρυβλίο αναδεύεται σε αναδευτήρα τρυβλίων και επωάζεται σε επωαστήρα CO2 επί 16 ώρες (37oC, 5 % CO2) και, στη συνέχεια, μετράται η δραστικότητα της λουσιφεράσης σύμφωνα με τα όσα ορίζονται στην παράγραφο 29.
|
|
24.
|
Μπορούν να χρησιμοποιηθούν και άλλοι κατάλληλοι θετικοί ή αρνητικοί μάρτυρες, εάν υπάρχουν διαθέσιμα ιστορικά δεδομένα από τα οποία μπορούν να προκύψουν συγκρίσιμα κριτήρια αποδοχής σειρών δοκιμών.
|
|
25.
|
Θα πρέπει να λαμβάνεται μέριμνα για την αποφυγή της εξάτμισης των πτητικών υπό δοκιμή χημικών ουσιών, καθώς και της διασταυρούμενης μόλυνσης των μικροκοιλοτήτων από τις υπό δοκιμή χημικές ουσίες, π.χ. με στεγανοποίηση του τρυβλίου πριν από την επώαση με τις υπό δοκιμή χημικές ουσίες.
|
|
26.
|
Για να προκύψει θετική ή αρνητική πρόβλεψη, απαιτείται η διεξαγωγή 2 έως 4 σειρών δοκιμών με τις υπό δοκιμή χημικές ουσίες και τον μάρτυρα με διαλύτη (βλ. πίνακα 2). Κάθε σειρά δοκιμών πραγματοποιείται διαφορετική ημέρα με πρόσφατο αποθεματικό διάλυμα υπό δοκιμή χημικών ουσιών σε X-VIVOTM 15 και με κύτταρα που έχουν συλλεγεί ανεξάρτητα. Τα κύτταρα μπορούν να προέρχονται από την ίδια ανακαλλιέργεια.
|
Μετρήσεις της δραστικότητας λουσιφεράσης
|
27.
|
Η φωταύγεια μετράται με χρήση λουμινόμετρου τρυβλίων μικροτιτλοδότησης 96 κοιλοτήτων εξοπλισμένου με οπτικά φίλτρα, π.χ. Phelios (ATTO, Tokyo, Ιαπωνία), Tristan 941 (Berthold, Bad Wildbad, Γερμανία) και η σειρά ARVO (PerkinElmer, Waltham, MA, ΗΠΑ). Το λουμινόμετρο πρέπει να βαθμονομείται για κάθε δοκιμή προκειμένου να διασφαλίζεται η αναπαραγωγιμότητα (19). Για την εν λόγω βαθμονόμηση διατίθενται ανασυνδυασμένες λουσιφεράσες που εκπέμπουν πορτοκαλί και κόκκινο χρώμα.
|
|
28.
|
100 μl προθερμασμένου αντιδραστηρίου δοκιμασίας Tripluc® Luciferase (Tripluc) μεταφέρονται σε κάθε κοιλότητα του τρυβλίου που περιέχει το εναιώρημα κυττάρων που υποβάλλεται σε αγωγή με ή χωρίς τη χημική ουσία. Το τρυβλίο ανακινείται επί 10 λεπτά σε θερμοκρασία περιβάλλοντος περίπου 20oC. Το τρυβλίο τοποθετείται στο λουμινόμετρο για να μετρηθεί η δραστικότητα της λουσιφεράσης. Μετράται η βιοφωταύγεια επί 3 δευτερόλεπτα, τόσο απουσία (F0) όσο και παρουσία (F1) του οπτικού φίλτρου. Η χρήση εναλλακτικών συνθηκών θα πρέπει να τεκμηριώνεται επιστημονικά, π.χ. ανάλογα με το μοντέλο του χρησιμοποιούμενου λουμινόμετρου.
|
|
29.
|
Οι παράμετροι για κάθε συγκέντρωση υπολογίζονται βάσει των μετρούμενων τιμών, π.χ. των IL8LA, GAPLA, nIL8LA, Ind-IL8LA, Inh-GAPLA, του μέσου όρου ±SD της IL8LA, του μέσου όρου ±SD της GAPLA, του μέσου όρου ±SD της nIL8LA, του μέσου όρου ±SD της Ind-IL8LA, του μέσου όρου ±SD της Inh-GAPLA, του διαστήματος εμπιστοσύνης σε επίπεδο 95 % της Ind-IL8LA. Οι ορισμοί των παραμέτρων που χρησιμοποιούνται στην παρούσα παράγραφο παρέχονται στα προσαρτήματα 3.1 και 3.4.
|
|
30.
|
Πριν από τη μέτρηση, η διάκριση των χρωμάτων στο πλαίσιο δοκιμασιών με γονίδια αναφοράς πολλών χρωμάτων πραγματοποιείται συνήθως με χρήση συσκευών ανίχνευσης (λουμινόμετρο και συσκευή ανάγνωσης τρυβλίων) που διαθέτουν οπτικά φίλτρα, όπως φίλτρα αποκοπής (υψιπερατά ή χαμηλοπερατά) ή φίλτρα ζώνης διέλευσης. Πριν από τη δοκιμή, οι συντελεστές περατότητας των φίλτρων για κάθε χρώμα σήματος βιοφωταύγειας θα πρέπει να βαθμονομούνται, σύμφωνα με το προσάρτημα 3.2.
|
ΔΕΔΟΜΕΝΑ ΚΑΙ ΑΝΑΦΟΡΑ ΑΠΟΤΕΛΕΣΜΑΤΩΝ
Αξιολόγηση των δεδομένων
|
31.
|
Βάσει των κριτηρίων για τη λήψη απόφασης περί θετικής/αρνητικής πρόβλεψης, σε κάθε σειρά δοκιμών απαιτείται:
|
—
|
μια δοκιμασία πρόβλεψης IL-8 Luc να κρίνεται θετική εάν η υπό δοκιμή χημική ουσία έχει Ind-IL8LA ≥ 1,4 και το κατώτερο όριο του διαστήματος εμπιστοσύνης 95 % της Ind-IL8LA είναι ≥ 1,0
|
|
—
|
μια δοκιμασία πρόβλεψης IL-8 Luc να κρίνεται αρνητική εάν η υπό δοκιμή χημική ουσία έχει Ind-IL8LA < 1,4 και/ή το κατώτερο όριο του διαστήματος εμπιστοσύνης 95 % της Ind-IL8LA είναι < 1,0.
|
|
Μοντέλο πρόβλεψης
|
32.
|
Οι υπό δοκιμή χημικές ουσίες από τις οποίες προκύπτουν δύο θετικά αποτελέσματα από την 1η, 2η, 3η ή 4η σειρά δοκιμών χαρακτηρίζονται θετικές, ενώ εκείνες από τις οποίες προκύπτουν τρία αρνητικά αποτελέσματα από την 1η, 2η, 3η ή 4η σειρά δοκιμών χαρακτηρίζονται υποτιθέμενες αρνητικές (πίνακας 2). Μεταξύ των υποτιθέμενων αρνητικών χημικών ουσιών, οι χημικές ουσίες που διαλύονται σε 20 mg/ml X-VIVOTM 15 κρίνονται αρνητικές, ενώ οι χημικές ουσίες που δεν διαλύονται σε 20 mg/ml X-VIVOTM 15 δεν θα πρέπει να λαμβάνονται υπόψη (σχήμα 1).
Πίνακας 2
Κριτήρια για τον προσδιορισμό των θετικών και των υποτιθέμενων αρνητικών χημικών ουσιών
|
1η σειρά δοκιμών
|
2η σειρά δοκιμών
|
3η σειρά δοκιμών
|
4η σειρά δοκιμών
|
Τελική πρόβλεψη
|
|
Θετική
|
Θετική
|
–
|
–
|
Θετική
|
|
Αρνητική
|
Θετική
|
–
|
Θετική
|
|
Αρνητική
|
Θετική
|
Θετική
|
|
Αρνητική
|
Υποτιθέμενη αρνητική
|
|
Αρνητική
|
Θετική
|
Θετική
|
–
|
Θετική
|
|
Αρνητική
|
Θετική
|
Θετική
|
|
Αρνητική
|
Υποτιθέμενη αρνητική
|
|
Αρνητική
|
Θετική
|
Θετική
|
Θετική
|
|
Αρνητική
|
Υποτιθέμενη αρνητική
|
|
Αρνητική
|
–
|
Υποτιθέμενη αρνητική
|
|
Σχήμα 1
Μοντέλο πρόβλεψης για την τελική κρίση

Κριτήρια αποδοχής
|
33.
|
Όταν χρησιμοποιείται η δοκιμασία IL-8 Luc θα πρέπει να πληρούνται τα ακόλουθα κριτήρια αποδοχής:
|
—
|
Η Ind-IL8LA θα πρέπει να υπερβαίνει το 5,0 σε μία τουλάχιστον συγκέντρωση του θετικού μάρτυρα 4-NBB σε κάθε σειρά δοκιμών.
|
|
—
|
Η Ind-IL8LA θα πρέπει να είναι χαμηλότερη από 1,4 σε όλες τις συγκεντρώσεις του αρνητικού μάρτυρα, του γαλακτικού οξέος, σε κάθε σειρά δοκιμών.
|
|
—
|
Δεδομένα από τρυβλία για τα οποία η GAPLA κοιλοτήτων μάρτυρα με κύτταρα και Tripluc αλλά χωρίς χημικές ουσίες είναι μικρότερη από 5 φορές την αντίστοιχη GAPLA κοιλότητας που περιέχει μόνο θρεπτικό μέσο δοκιμής (50 μl/κοιλότητα RPMI-1640 που περιέχει 10 % FBS και 50 μl/κοιλότητα X-VIVOTM 15) θα πρέπει να απορρίπτονται.
|
|
—
|
Δεδομένα από τρυβλία για τα οποία η Inh-GAPLA όλων των συγκεντρώσεων των υπό δοκιμή χημικών ουσιών ή των χημικών ουσιών μάρτυρα είναι μικρότερη από 0,05 θα πρέπει να απορρίπτονται. Σε αυτήν την περίπτωση, η πρώτη δοκιμή θα πρέπει να επαναλαμβάνεται, ώστε η υψηλότερη τελική συγκέντρωση της επαναλαμβανόμενης δοκιμής να είναι η χαμηλότερη τελική συγκέντρωση της προηγούμενης δοκιμής.
|
|
Έκθεση δοκιμής
|
34.
|
Η έκθεση δοκιμής θα πρέπει να περιλαμβάνει τα ακόλουθα στοιχεία:
|
Υπό δοκιμή χημικές ουσίες
Μονοσυστατική ουσία:
|
ταυτοποίηση της χημικής ουσίας, όπως ονομασία/-ες IUPAC ή CAS, αριθμός/-οί CAS, κωδικός SMILES ή InChI, συντακτικός τύπος και/ή άλλα αναγνωριστικά στοιχεία,
|
|
φυσική εμφάνιση, υδατοδιαλυτότητα, μοριακό βάρος και πρόσθετες σχετικές φυσικοχημικές ιδιότητες, εφόσον είναι διαθέσιμα,
|
|
καθαρότητα, χημική ταυτότητα των προσμείξεων, κατά περίπτωση και στο μέτρο του δυνατού, κ.λπ.,
|
|
κατεργασία πριν από τη δοκιμή, εάν ισχύει (π.χ. θέρμανση, λειοτρίβηση),
|
|
διαλυτότητα στο X-VIVOTM 15. Για τις χημικές ουσίες που δεν είναι διαλυτές στο X-VIVOTM 15, κατά πόσον παρατηρείται σχηματισμός ιζήματος ή επίπλευση μετά τη φυγοκέντρηση,
|
|
ελεγχθείσα συγκέντρωση/-εις,
|
|
συνθήκες φύλαξης και σταθερότητα, εφόσον είναι διαθέσιμα,
|
|
αιτιολόγηση της επιλογής του διαλύτη/φορέα για κάθε υπό δοκιμή χημική ουσία, εάν δεν έχει χρησιμοποιηθεί X-VIVOTM 15.
|
Πολυσυστατική ουσία, UVCB και μείγμα:
|
χαρακτηρισμός, στο μέτρο του δυνατού, π.χ. χημική ταυτότητα (βλ. ανωτέρω), καθαρότητα, ποσότητα και σχετικές φυσικοχημικές ιδιότητες (βλ. ανωτέρω) των συστατικών, εφόσον είναι διαθέσιμα,
|
|
φυσική εμφάνιση, υδατοδιαλυτότητα και πρόσθετες σχετικές φυσικοχημικές ιδιότητες, εφόσον είναι διαθέσιμα,
|
|
μοριακό βάρος ή φαινόμενο μοριακό βάρος στην περίπτωση των μειγμάτων/πολυμερών γνωστής σύνθεσης ή άλλες πληροφορίες που έχουν σημασία για τη διεξαγωγή της μελέτης,
|
|
κατεργασία πριν από τη δοκιμή, εάν ισχύει (π.χ. θέρμανση, λειοτρίβηση),
|
|
διαλυτότητα στο X-VIVOTM 15. Για τις χημικές ουσίες που δεν είναι διαλυτές στο X-VIVOTM 15, κατά πόσον παρατηρείται σχηματισμός ιζήματος ή επίπλευση μετά τη φυγοκέντρηση,
|
|
ελεγχθείσα συγκέντρωση/-εις,
|
|
Συνθήκες φύλαξης και σταθερότητα, εφόσον είναι διαθέσιμα.
|
|
αιτιολόγηση της επιλογής του διαλύτη/φορέα για κάθε υπό δοκιμή χημική ουσία, εάν δεν έχει χρησιμοποιηθεί X-VIVOTM 15.
|
|
|
Μάρτυρες
Θετικός μάρτυρας:
|
ταυτοποίηση της χημικής ουσίας, όπως ονομασία/-ες IUPAC ή CAS, αριθμός/-οί CAS, κωδικός SMILES ή InChI, συντακτικός τύπος και/ή άλλα αναγνωριστικά στοιχεία,
|
|
φυσική εμφάνιση, υδατοδιαλυτότητα, μοριακό βάρος και πρόσθετες σχετικές φυσικοχημικές ιδιότητες, στο μέτρο του δυνατού και ανάλογα με την περίπτωση,
|
|
καθαρότητα, χημική ταυτότητα των προσμείξεων, κατά περίπτωση και στο μέτρο του δυνατού, κ.λπ.,
|
|
κατεργασία πριν από τη δοκιμή, εάν ισχύει (π.χ. θέρμανση, λειοτρίβηση),
|
|
ελεγχθείσα συγκέντρωση/-εις,
|
|
συνθήκες φύλαξης και σταθερότητα, εφόσον είναι διαθέσιμα,
|
|
παραπομπή σε ιστορικά αποτελέσματα θετικών μαρτύρων που καταδεικνύουν την εφαρμογή κατάλληλων κριτηρίων αποδοχής, εάν ισχύει.
|
Αρνητικός μάρτυρας:
|
ταυτοποίηση της χημικής ουσίας, όπως ονομασία/-ες IUPAC ή CAS, αριθμός/-οί CAS και/ή άλλα αναγνωριστικά στοιχεία,
|
|
καθαρότητα, χημική ταυτότητα των προσμείξεων, κατά περίπτωση και στο μέτρο του δυνατού, κ.λπ.,
|
|
φυσική εμφάνιση, μοριακό βάρος, καθώς και πρόσθετες σχετικές φυσικοχημικές ιδιότητες, σε περίπτωση χρήσης άλλων αρνητικών μαρτύρων εκτός εκείνων που αναφέρονται στην κατευθυντήρια γραμμή δοκιμών και εφόσον είναι διαθέσιμες,
|
|
συνθήκες φύλαξης και σταθερότητα, εφόσον είναι διαθέσιμα,
|
|
αιτιολόγηση της επιλογής του διαλύτη για κάθε υπό δοκιμή χημική ουσία.
|
|
|
Συνθήκες δοκιμής
|
όνομα και διεύθυνση του χορηγού, της εγκατάστασης δοκιμών και του διευθυντή της μελέτης,
|
|
περιγραφή της χρησιμοποιούμενης δοκιμής,
|
|
κυτταρική σειρά που χρησιμοποιήθηκε, συνθήκες φύλαξης και προέλευσή της (π.χ. εγκατάσταση προέλευσης),
|
|
αριθμός παρτίδας και προέλευση του FBS, όνομα προμηθευτή, αριθμός παρτίδας μαύρου τρυβλίου με επίπεδη βάση 96 κοιλοτήτων, και αριθμός παρτίδας αντιδραστηρίου Tripluc,
|
|
αριθμός ανακαλλιεργειών και πυκνότητα κυττάρων που χρησιμοποιήθηκαν για τη δοκιμή,
|
|
μέθοδος καταμέτρησης κυττάρων που χρησιμοποιήθηκε για τον εμβολιασμό πριν από τη δοκιμή και τα μέτρα που εφαρμόστηκαν για να εξασφαλιστεί ομοιογενής κατανομή του αριθμού κυττάρων,
|
|
χρησιμοποιούμενο λουμινόμετρο (π.χ. μοντέλο), με τις ρυθμίσεις του οργάνου, χρησιμοποιούμενο υπόστρωμα λουσιφεράσης και απόδειξη της ενδεδειγμένης ποιότητας των μετρήσεων φωταύγειας με βάση τη δοκιμή ποιοτικού ελέγχου που περιγράφεται στο προσάρτημα 3.2,
|
|
διαδικασία που χρησιμοποιήθηκε για την απόδειξη της τεχνικής ικανότητας του εργαστηρίου όσον αφορά την εφαρμογή της δοκιμής (π.χ. με δοκιμές των ουσιών ελέγχου ικανότητας) ή για την απόδειξη της διαχρονικής αναπαραγωγιμότητας των επιδόσεων της δοκιμής.
|
|
|
Διαδικασία δοκιμής
|
αριθμός πανομοιότυπων δειγμάτων και σειρών δοκιμών που διεξήχθησαν,
|
|
συγκεντρώσεις της υπό δοκιμή χημικής ουσίας, διαδικασία εφαρμογής και χρόνος έκθεσης (εάν διαφέρουν από τα συνιστώμενα),
|
|
περιγραφή των χρησιμοποιούμενων κριτηρίων αξιολόγησης και λήψης αποφάσεων,
|
|
περιγραφή των χρησιμοποιούμενων κριτηρίων αποδοχής της μελέτης,
|
|
περιγραφή τυχόν τροποποιήσεων της διαδικασίας δοκιμής.
|
|
|
Αποτελέσματα
|
μετρήσεις της IL8LA και της GAPLA,
|
|
υπολογισμοί για τις nIL8LA, Ind-IL8LA, και Inh-GAPLA,
|
|
το διάστημα εμπιστοσύνης 95 % της Ind-IL8LA,
|
|
γραφική παράσταση των καμπυλών δόσης-απόκρισης για την επαγωγή δραστικότητας λουσιφεράσης και τη βιωσιμότητα των κυττάρων,
|
|
περιγραφή κάθε άλλης σχετικής παρατήρησης, κατά περίπτωση.
|
|
|
Εξέταση των αποτελεσμάτων
|
εξέταση των αποτελεσμάτων της δοκιμασίας IL-8 Luc,
|
|
εξέταση των αποτελεσμάτων δοκιμασίας στο πλαίσιο IATA, εάν υπάρχουν σχετικές πληροφορίες.
|
|
Συμπέρασμα
|
ΒΙΒΛΙΟΓΡΑΦΙΑ
|
(1)
|
Takahashi T, Kimura Y, Saito R, Nakajima Y, Ohmiya Y, Yamasaki K, and Aiba S. (2011). An in vitro test to screen skin sensitizers using a stable THP-1-derived IL-8 reporter cell line, THP-G8. Toxicol Sci 124:359-69.
|
|
(2)
|
OECD (2017). Validation report for the international validation study on the IL-8 Luc assay as a test evaluating the skin sensitizing potential of chemicals conducted by the IL-8 Luc Assay. Series on Testing and Assessment No 267, ENV/JM/MONO(2017)19. Organisation for Economic Cooperation and Development, Paris. Διατίθεται στον δικτυακό τόπο: http://www.oecd.org/env/ehs/testing/series-testing-assessment-publications-number.htm.
|
|
(3)
|
OECD (2017). Report of the Peer Review Panel for the IL-8 Luciferase (IL-8 Luc) Assay for in vitro skin sensitisation. Series on Testing and Assessment No 258, ENV/JM/MONO(2017)20. Organisation for Economic Cooperation and Development, Paris. Διατίθεται στον δικτυακό τόπο: http://www.oecd.org/env/ehs/testing/series-testing-assessment-publications-number.htm.
|
|
(4)
|
OECD (2016) Guidance Document On The Reporting Of Defined Approaches And Individual Information Sources To Be Used Within Integrated Approaches To Testing And Assessment (IATA) For Skin Sensitisation, Series on Testing & Assessment No 256, ENV/JM/MONO(2016)29. Organisation for Economic Cooperation and Development, Paris. Διατίθεται στον δικτυακό τόπο: http://www.oecd.org/env/ehs/testing/series-testing-assessment-publications-number.htm.
|
|
(5)
|
van der Veen JW, Rorije E, Emter R, Natsch A, van Loveren H, and Ezendam J. (2014). Evaluating the performance of integrated approaches for hazard identification of skin sensitizing chemicals. Regul Toxicol Pharmacol 69:371-9.
|
|
(6)
|
Kimura Y, Fujimura C, Ito Y, Takahashi T, Nakajima Y, Ohmiya Y, and Aiba S. (2015). Optimization of the IL-8 Luc assay as an in vitro test for skin sensitization. Toxicol In Vitro 29:1816-30.
|
|
(7)
|
Urbisch D, Mehling A, Guth K, Ramirez T, Honarvar N, Kolle S, Landsiedel R, Jaworska J, Kern PS, Gerberick F, et al. (2015). Assessing skin sensitization hazard in mice and men using non-animal test methods. Regul Toxicol Pharmacol 71:337-51.
|
|
(8)
|
Ashikaga T, Sakaguchi H, Sono S, Kosaka N, Ishikawa M, Nukada Y, Miyazawa M, Ito Y, Nishiyama N, and Itagaki H. (2010). A comparative evaluation of in vitro skin sensitisation tests: the human cell-line activation test (h-CLAT) versus the local lymph node assay (LLNA). Alternatives to laboratory animals: ATLA 38:275-84.
|
|
(9)
|
Patlewicz G, Casati S, Basketter DA, Asturiol D, Roberts DW, Lepoittevin J-P, Worth A and Aschberger K (2016) Can currently available non-animal methods detect pre and pro haptens relevant for skin sensitisation? Regul Toxicol Pharmacol, 82:147-155.
|
|
(10)
|
Thorne N, Inglese J, and Auld DS. (2010). Illuminating insights into firefly luciferase and other bioluminescent reporters used in chemical biology. Chem Biol 17:646-57.
|
|
(11)
|
OECD (2016). Test No 455: Performance-Based Test Guideline for Stably Transfected Transactivation In Vitro Assays to Detect Estrogen Receptor Agonists and Antagonists, OECD Publishing, Paris. http://dx.doi.org/10.1787/9789264265295-en.
|
|
(12)
|
Viviani V, Uchida A, Suenaga N, Ryufuku M, and Ohmiya Y. (2001). Thr226 is a key residue for bioluminescence spectra determination in beetle luciferases. Biochem Biophys Res Commun 280:1286-91.
|
|
(13)
|
Viviani VR, Bechara EJ, and Ohmiya Y. (1999). Cloning, sequence analysis, and expression of active Phrixothrix railroad-worms luciferases: relationship between bioluminescence spectra and primary structures. Biochemistry 38:8271-9.
|
|
(14)
|
Nakajima Y, Kimura T, Sugata K, Enomoto T, Asakawa A, Kubota H, Ikeda M, and Ohmiya Y. (2005). Multicolor luciferase assay system: one-step monitoring of multiple gene expressions with a single substrate. Biotechniques 38:891-4.
|
|
(15)
|
OECD (2017). To be published - Performance Standards for the assessment of proposed similar or modified in vitro skin sensitisation IL-8 luc test methods. OECD Environment, Health and Safety Publications, Series on Testing and Assessment. OECD, Paris, France
|
|
(16)
|
OECD (2005). Guidance Document the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment. OECD Environment, Health and Safety publications, OECD Series on Testing and Assessment No 34. OECD, Paris, France.
|
|
(17)
|
OECD (2018). Draft Guidance document: Good In Vitro Method Practices (GIVIMP) for the Development and Implementation of In Vitro Methods for Regulatory Use in Human Safety Assessment. Organisation for Economic Cooperation and Development, Paris. Διατίθεται στον δικτυακό τόπο: http://www.oecd.org/env/ehs/testing/OECD Final Draft GIVIMP.pdf.
|
|
(18)
|
JaCVAM (2016). IL-8 Luc assay protocol, Διαθέσιμο στη διεύθυνση http://www.jacvam.jp/en_effort/effort02.html.
|
|
(19)
|
Niwa K, Ichino Y, Kumata S, Nakajima Y, Hiraishi Y, Kato D, Viviani VR, and Ohmiya Y. (2010). Quantum yields and kinetics of the firefly bioluminescence reaction of beetle luciferases. Photochem Photobiol 86:1046-9.
|
|
(20)
|
OECD (2012). The Adverse Outcome Pathway for Skin Sensitisation Initiated by Covalent Binding to Proteins, Part 1: Series on Testing and Assessment No. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No 168. OECD, Paris, France.
|
|
(21)
|
United Nations (2015). Globally Harmonized System of Classification and Labelling of Chemicals (GHS). Sixth revised edition. New York & Geneva: United Nations Publications. ISBN: 978-92-1-117006-1. Διαθέσιμο στη διεύθυνση: http://www.unece.org/trans/danger/publi/ghs/ghs_rev05/05files_e.html.
|
Προσάρτημα 3.1
ΟΡΙΣΜΟΙ
Ορθότητα
: ο βαθμός συμφωνίας μεταξύ των αποτελεσμάτων της δοκιμής και των αποδεκτών τιμών αναφοράς. Αποτελεί κριτήριο επιδόσεων της δοκιμής και μια από τις πτυχές της καταλληλότητας. Συχνά ο όρος χρησιμοποιείται εναλλακτικά προς τη «συμφωνία» για να δηλώσει το ποσοστό ορθών αποτελεσμάτων μιας δοκιμής (16).
AOP (Adverse Outcome Pathway)
: πορεία δυσμενούς έκβασης: αλληλουχία συμβάντων, από τη χημική δομή της στοχευόμενης χημικής ουσίας ή ομάδας ομοειδών χημικών ουσιών και το μοριακό εναρκτήριο συμβάν μέχρι την εξεταζόμενη έκβαση in vivo (20).
Χημικό προϊόν
: μια ουσία ή ένα μείγμα.
CV05
: κυτταρική βιωσιμότητα 05, δηλ. η ελάχιστη συγκέντρωση στην οποία οι χημικές ουσίες εμφανίζουν Inh-GAPLA κάτω του 0,05.
FInSLO-LA
: συντομογραφία που χρησιμοποιήθηκε στην έκθεση επικύρωσης και σε προηγούμενες δημοσιεύσεις σχετικά με τη δοκιμασία IL-8 Luc, η οποία αναφέρεται στην Ind-IL8LA. Για τον ορισμό, βλ. Ind-IL8LA.
GAPLA
: η δράση της σταθερής λουσιφεράσης κόκκινου χρώματος (SLR) (λmax = 630 nm), η οποία ρυθμίζεται από τον υποκινητή GAPDH και αντιπροσωπεύει την κυτταρική βιωσιμότητα και τον αριθμό των βιώσιμων κυττάρων.
Επικινδυνότητα
: εγγενής ιδιότητα ενός παράγοντα ή μιας κατάστασης που μπορεί να έχει δυσμενείς επιδράσεις όταν ένας οργανισμός, ένα σύστημα ή ένας (υπο)πληθυσμός εκτίθεται στον παράγοντα.
IATA (Integrated Approach to Testing and Assessment)
: ολοκληρωμένη προσέγγιση για τη διεξαγωγή δοκιμών και την αξιολόγηση: δομημένη προσέγγιση που χρησιμοποιείται για τον προσδιορισμό της επικινδυνότητας (δυναμικό), τον χαρακτηρισμό της επικινδυνότητας (ισχύς) και/ή την εκτίμηση της ασφάλειας (δυναμικό/ισχύς και έκθεση) μιας χημικής ουσίας ή ομάδας χημικών ουσιών, στην οποία ενσωματώνονται και σταθμίζονται στρατηγικά όλα τα σχετικά δεδομένα, με σκοπό την τροφοδότηση κανονιστικών αποφάσεων σχετικά με τη δυνητική επικινδυνότητα και/ή τον κίνδυνο και/ή την ανάγκη για περαιτέρω στοχευμένες και, ως εκ τούτου, ελάχιστες δοκιμές.
II-SLR-LA
: συντομογραφία που χρησιμοποιήθηκε στην έκθεση επικύρωσης και σε προηγούμενες δημοσιεύσεις σχετικά με τη δοκιμασία IL-8 Luc, η οποία αναφέρεται στην Inh-GAPLA. Για τον ορισμό, βλ. Inh-GAPLA.
IL-8 (ιντερλευκίνη 8)
: κυτταροκίνη που προέρχεται από ενδοθηλιακά κύτταρα, ινοβλάστες, κερατινοκύτταρα, μακροφάγα και μονοκύτταρα και η οποία επάγει χημειοταξία των ουδετερόφιλων και των T λεμφοκυττάρων.
IL8LA
: η δραστικότητα της σταθερής λουσιφεράσης πορτοκαλί χρώματος (SLO) (λmax = 580 nm), η οποία ρυθμίζεται από τον υποκινητή IL-8.
Ind-IL8LA
: βαθμός επαγωγής της nIL8LA. Λαμβάνεται με διαίρεση της nIL8LA των κυττάρων THP-G8 που υποβάλλονται σε αγωγή με χημικές ουσίες διά της αντίστοιχης μη διεγερμένων κυττάρων THP-G8 και αντιπροσωπεύει την επαγωγή της δραστικότητας του υποκινητή IL-8 από τις χημικές ουσίες.
Inh-GAPLA
: αναστολή της GAPLA. Λαμβάνεται με διαίρεση της GAPLA των κυττάρων THP-G8 που υποβάλλεται σε αγωγή με χημικές ουσίες διά της GAPLA κυττάρων THP-G8 χωρίς αγωγή και αντιπροσωπεύει την κυτταροτοξικότητα των χημικών ουσιών.
Όριο ελάχιστης επαγωγής (MIT)
: η χαμηλότερη συγκέντρωση στην οποία μια χημική ουσία πληροί τα κριτήρια ώστε να χαρακτηριστεί θετική.
Μείγμα
: ένα μείγμα ή διάλυμα που αποτελείται από δύο ή περισσότερες ουσίες.
Μονοσυστατική ουσία
: ουσία που ορίζεται από την ποσοτική της σύνθεση και της οποίας ένα κύριο συστατικό περιέχεται σε ποσοστό τουλάχιστον 80 % κ.β.
Πολυσυστατική ουσία
: ουσία που ορίζεται από την ποσοτική της σύνθεση και της οποίας περισσότερα από ένα κύρια συστατικά περιέχονται σε συγκέντρωση ≥ 10 % κ.β. και < 80 % κ.β. Οι πολυσυστατικές ουσίες είναι προϊόντα μεταποιητικών διεργασιών. Η διαφορά μεταξύ μείγματος και πολυσυστατικής ουσίας είναι ότι το μείγμα λαμβάνεται με ανάμειξη δύο ή περισσότερων ουσιών, χωρίς χημική αντίδραση. Οι πολυσυστατικές ουσίες είναι προϊόντα χημικών αντιδράσεων.
nIL8LA
: η δραστικότητα της λουσιφεράσης SLO που αντικατοπτρίζει τη δραστικότητα του υποκινητή IL-8 (IL8LA), κανονικοποιημένη ως προς τη δραστικότητα της λουσιφεράσης SLR που αντικατοπτρίζει τη δραστικότητα του υποκινητή GAPDH (GAPLA). Αντιπροσωπεύει τη δραστικότητα του υποκινητή IL-8, αφού ληφθεί υπόψη η κυτταρική βιωσιμότητα ή ο αριθμός των κυττάρων.
nSLO-LA
: συντομογραφία που χρησιμοποιήθηκε στην έκθεση επικύρωσης και σε προηγούμενες δημοσιεύσεις σχετικά με τη δοκιμασία IL-8 Luc, η οποία αναφέρεται στην nIL8LA. Για τον ορισμό, βλ. nIL8LA.
Θετικός μάρτυρας
: πανομοιότυπο δείγμα που περιέχει όλα τα στοιχεία ενός συστήματος δοκιμής και υποβάλλεται σε αγωγή με ουσία που είναι γνωστό ότι προκαλεί θετική απόκριση. Για να διασφαλίζεται η δυνατότητα αξιολόγησης της μεταβλητότητας της απόκρισης του θετικού μάρτυρα σε συνάρτηση με τον χρόνο, το μέγεθος της θετικής απόκρισης δεν θα πρέπει να είναι υπερβολικό.
Αβιοτικά προαπτένια
: χημικές ουσίες που καθίστανται ευαισθητοποιητικές μέσω αβιοτικού μετασχηματισμού.
Μεταβολικά προαπτένια
: χημικές ουσίες που χρειάζονται ενζυμική ενεργοποίηση για να εκδηλώσουν το δυναμικό δερματικής ευαισθητοποίησής τους.
Καταλληλότητα
: περιγραφή της σχέσης της δοκιμής με την υπό μελέτη επίδραση και του κατά πόσον αυτή είναι αρμόζουσα και χρήσιμη για συγκεκριμένο σκοπό. Πρόκειται για τον βαθμό στον οποίο η δοκιμή μετρά ή προβλέπει σωστά τη βιολογική επίδραση υπό μελέτη. Η καταλληλότητα εμπεριέχει συνεκτίμηση της ορθότητας (συμφωνίας) της δοκιμής (16).
Αξιοπιστία
: μέτρο του βαθμού στον οποίο μια δοκιμή μπορεί να αναπαράγεται διαχρονικά στο ίδιο εργαστήριο και μεταξύ εργαστηρίων, όταν εφαρμόζεται με το ίδιο πρωτόκολλο. Εκτιμάται με υπολογισμό της ενδοεργαστηριακής και της διεργαστηριακής αναπαραγωγιμότητας, καθώς και της ενδοεργαστηριακής επαναληψιμότητας (16).
Σειρά δοκιμών
: μια σειρά περιλαμβάνει μία ή περισσότερες υπό δοκιμή χημικές ουσίες που υποβάλλονται σε δοκιμή ταυτόχρονα με μάρτυρα με διαλύτη/φορέα και με θετικό μάρτυρα.
Ευαισθησία
: το ποσοστό του συνόλου των θετικών/δραστικών χημικών ουσιών που ταξινομείται σωστά με τη δοκιμή. Αποτελεί μέτρο ορθότητας των δοκιμών με τις οποίες λαμβάνονται κατηγορηματικά αποτελέσματα, και είναι σημαντικό κριτήριο αξιολόγησης της καταλληλότητας των δοκιμών (16).
SLO-LA
: συντομογραφία που χρησιμοποιήθηκε στην έκθεση επικύρωσης και σε προηγούμενες δημοσιεύσεις σχετικά με τη δοκιμασία IL-8 Luc, η οποία αναφέρεται στην IL8LA. Για τον ορισμό, βλ. IL8LA.
SLR-LA
: συντομογραφία που χρησιμοποιήθηκε στην έκθεση επικύρωσης και σε προηγούμενες δημοσιεύσεις σχετικά με τη δοκιμασία IL-8 Luc, η οποία αναφέρεται στην GAPLA. Για τον ορισμό, βλ. GAPLA.
Μάρτυρας με διαλύτη/φορέα
: δείγμα που δεν υποβάλλεται σε αγωγή και περιέχει όλα τα στοιχεία ενός συστήματος δοκιμής, εκτός της υπό δοκιμή χημικής ουσίας, αλλά περιλαμβανομένου του διαλύτη/φορέα που χρησιμοποιείται. Χρησιμοποιείται για τον προσδιορισμό της βασικής απόκρισης των δειγμάτων που υποβάλλονται σε αγωγή με την υπό δοκιμή χημική ουσία διαλυμένη ή σταθερώς διεσπαρμένη στον ίδιο διαλύτη/φορέα. Όταν το εν λόγω δείγμα υποβάλλεται σε δοκιμή με παράλληλο μάρτυρα θρεπτικού μέσου, καταδεικνύει επίσης αν ο διαλύτης/φορέας αλληλεπιδρά με το σύστημα δοκιμής.
Ειδικότητα
: το ποσοστό του συνόλου των αρνητικών/αδρανών χημικών ουσιών που ταξινομείται σωστά με τη δοκιμή. Αποτελεί μέτρο ορθότητας των δοκιμών με τις οποίες λαμβάνονται κατηγορηματικά αποτελέσματα, και είναι σημαντικό κριτήριο αξιολόγησης της καταλληλότητας των δοκιμών (16).
Ουσία
: ένα χημικό στοιχείο και οι ενώσεις του σε φυσική κατάσταση ή όπως λαμβάνονται με οποιαδήποτε παραγωγική διεργασία, στα οποία συμπεριλαμβάνονται όλα τα πρόσθετα που απαιτούνται για να διατηρείται η σταθερότητά του, καθώς και τυχόν προσμείξεις που προκύπτουν από τη χρησιμοποιούμενη διεργασία, αλλά από τα οποία εξαιρούνται οι διαλύτες που είναι δυνατόν να διαχωριστούν χωρίς να επηρεαστεί η σταθερότητα της ουσίας ούτε να μεταβληθεί η σύνθεσή της.
Επιφανειοδραστική ουσία
: ονομάζεται επίσης τασιενεργή ουσία και είναι ουσία, όπως τα απορρυπαντικά, που μπορεί να μειώσει την επιφανειακή τάση ενός υγρού και, ως εκ τούτου, του επιτρέπει να σχηματίζει αφρό ή να διεισδύει σε στερεά· είναι επίσης γνωστή ως διαβρεκτικό μέσο (TG437).
Υπό δοκιμή χημική ουσία
: κάθε ουσία ή μείγμα που υποβάλλεται σε δοκιμή με χρήση της παρούσας μεθόδου.
THP-G8
: κυτταρική σειρά με γονίδιο αναφοράς IL-8, που χρησιμοποιείται στη δοκιμασία IL-8 Luc. Η ανθρώπινη, παρόμοια με μακροφάγα κυτταρική σειρά THP-1 διαμολύνθηκε με τα γονίδια λουσιφεράσης SLO και SLR υπό τον έλεγχο των υποκινητών IL-8 και GAPDH αντίστοιχα.
Παγκοσμίως Εναρμονισμένο Σύστημα Ταξινόμησης και Επισήμανσης των Χημικών Προϊόντων των Ηνωμένων Εθνών (United Nations Globally Harmonized System of Classification and Labelling of Chemicals) (GHS του ΟΗΕ)
: σύστημα που προτείνει την ταξινόμηση των χημικών προϊόντων (ουσιών και μειγμάτων) με βάση τυποποιημένα είδη και βαθμούς φυσικής επικινδυνότητας και επικινδυνότητας για την υγεία και το περιβάλλον και καλύπτει τα αντίστοιχα στοιχεία γνωστοποίησης, όπως εικονογράμματα, προειδοποιητικές λέξεις, δηλώσεις επικινδυνότητας, δηλώσεις προφύλαξης και δελτία δεδομένων ασφαλείας, με τα οποία γνωστοποιούνται πληροφορίες σχετικά με τις δυσμενείς επιδράσεις με σκοπό την προστασία των ανθρώπων (εργοδοτών, εργαζομένων, μεταφορέων, καταναλωτών και διασωστών) και του περιβάλλοντος (21).
UVCB
: ουσίες άγνωστης ή ασταθούς σύνθεσης, πολύπλοκα προϊόντα αντιδράσεων ή βιολογικά υλικά.
Έγκυρη μέθοδος δοκιμών
: δοκιμή που θεωρείται επαρκούς καταλληλότητας και αξιοπιστίας για συγκεκριμένο σκοπό και βασίζεται σε επιστημονικά τεκμηριωμένες αρχές. Μια δοκιμή δεν είναι ποτέ έγκυρη με την απόλυτη σημασία του όρου, αλλά μόνο σε σχέση με καθορισμένο σκοπό.
Προσάρτημα 3.2
ΑΡΧΗ ΜΕΤΡΗΣΗΣ ΤΗΣ ΔΡΑΣΗΣ ΤΗΣ ΛΟΥΣΙΦΕΡΑΣΗΣ ΚΑΙ ΠΡΟΣΔΙΟΡΙΣΜΟΥ ΤΩΝ ΣΥΝΤΕΛΕΣΤΩΝ ΠΕΡΑΤΟΤΗΤΑΣ ΟΠΤΙΚΟΥ ΦΙΛΤΡΟΥ ΓΙΑ ΤΙΣ SLO ΚΑΙ SLR
Το σύστημα δοκιμασίας πολλαπλών γονιδίων αναφοράς Tripluc μπορεί να χρησιμοποιηθεί με λουμινόμετρο τύπου τρυβλίων μικροτιτλοδότησης με σύστημα ανίχνευσης πολλών χρωμάτων, το οποίο μπορεί να διαθέτει οπτικό φίλτρο [π.χ. Phelios AB-2350 (ATTO), ARVO (PerkinElmer), Tristar LB941 (Berthold)]. Το οπτικό φίλτρο που χρησιμοποιείται στη μέτρηση είναι υψιπερατό ή χαμηλοπερατό φίλτρο 600–620 nm, ή φίλτρο ζώνης διέλευσης 600–700 nm.
Μέτρηση λουσιφερασών δύο χρωμάτων με οπτικό φίλτρο.
Στο παρόν παράδειγμα χρησιμοποιείται το Phelios AB-2350 (ATTO). Το λουμινόμετρο αυτό είναι εξοπλισμένο με υψιπερατό φίλτρο 600 nm (R60 HOYA Co., LP 600 nm, φίλτρο 1) για τον διαχωρισμό της φωταύγειας της SLO (λmax = 580 nm) και της SLR (λmax = 630 nm).
Για τον προσδιορισμό των συντελεστών περατότητας πρώτα του LP 600 nm, με χρήση κεκαθαρμένων ενζύμων λουσιφεράσης SLO και SLR: i) μετράται η ένταση βιοφωταύγειας των SLO και SLR χωρίς φίλτρο (F0), ii) μετράται η ένταση βιοφωταύγειας SLO και SLR που διήλθε μέσω LP 600 nm (φίλτρο 1) και iii) υπολογίζονται οι παρακάτω συντελεστές περατότητας του LP 600 nm για τις SLO και SLR.
|
Συντελεστές περατότητας
|
Συντομογραφία
|
Ορισμός
|
|
SLO
|
Συντελεστές περατότητας φίλτρου 1
|
κΟR60
|
Ο συντελεστής περατότητας του φίλτρου για την SLO
|
|
SLR
|
Συντελεστές περατότητας φίλτρου 1
|
κRR60
|
Ο συντελεστής περατότητας του φίλτρου για την SLR
|
Όταν οι τιμές έντασης των SLO και SLR σε δείγμα δοκιμής ορίζονται ως O και R, αντίστοιχα, i) η ένταση του φωτός χωρίς φίλτρο (όλο το οπτικό φάσμα) F0 και ii) η ένταση του φωτός που διέρχεται διαμέσου του LP 600 nm (φίλτρο 1) F1 περιγράφονται σύμφωνα με τους ακόλουθους τύπους.
F0=O+R
F1=κΟR60 x O + κRR60 x R
Οι τύποι αυτοί μπορούν να αναδιατυπωθούν ως εξής:

Στη συνέχεια, χρησιμοποιώντας τους υπολογισθέντες συντελεστές περατότητας (κΟR60 και κRR60) και τις μετρηθείσες F0 και F1, μπορούν να υπολογιστούν οι τιμές των O και R ως εξής:

Υλικά και μέθοδοι για τον προσδιορισμό του συντελεστή περατότητας
|
1)
|
Αντιδραστήρια
Μεμονωμένα κεκαθαρμένα ένζυμα λουσιφεράσης:
|
Λυοφιλιωμένο κεκαθαρμένο ένζυμο SLO
|
|
Λυοφιλιωμένο κεκαθαρμένο ένζυμο SLR
|
|
(τα οποία, για την εργασία επικύρωσης, ελήφθησαν από την GPC Lab. Co. Ltd., Tottori, Ιαπωνία με την κυτταρική σειρά THP-G8)
|
Αντιδραστήριο δοκιμασίας:
|
αντιδραστήριο δοκιμασίας λουσιφεράσης Tripluc® (για παράδειγμα από TOYOBO, αρ. κατ. MRA-301)
|
Θρεπτικό μέσο: για τη δοκιμασία λουσιφεράσης (30 ml, φυλασσόμενα σε 2 – 8°C)
|
|
Αντιδραστήριο
|
Συγκέντρωση
|
Τελική συγκέντρωση στο θρεπτικό μέσο
|
Απαιτούμενη ποσότητα
|
|
RPMI-1640
|
—
|
—
|
27 ml
|
|
FBS
|
—
|
10 %
|
3 ml
|
|
2)
|
Παρασκευή διαλύματος ενζύμου
Διαλύετε λυοφιλιωμένο κεκαθαρμένο ένζυμο λουσιφεράσης σε σωληνάριο προσθέτοντας 200 μl Tris/HCl ή Hepes/HCl 10 ~ 100 mM (pH 7,5 ~ 8,0), συμπληρωμένο με γλυκερίνη 10 % κ.ό., και διαιρείτε το διάλυμα ενζύμου σε κλάσματα 10 μl σε αναλώσιμα σωληνάρια 1,5 ml, τα οποία φυλάσσονται σε καταψύκτη στους -80°C. Το κατεψυγμένο διάλυμα ενζύμου μπορεί να χρησιμοποιείται μέχρι και για 6 μήνες. Κατά τη χρήση, προσθέτετε 1 ml θρεπτικού μέσου για τη δοκιμασία λουσιφεράσης (RPMI-1640 με 10 % FBS) σε κάθε σωληνάριο που περιέχει τα διαλύματα ενζύμου (αραιωμένο διάλυμα ενζύμου) και τα διατηρείτε σε πάγο ώστε να μην αδρανοποιηθούν.
|
|
3)
|
Μέτρηση της βιοφωταύγειας
Αποψύχετε αντιδραστήριο δοκιμασίας Tripluc® Luciferase (Tripluc) και το διατηρείτε σε θερμοκρασία δωματίου είτε σε υδατόλουτρο είτε σε θερμοκρασία αέρα περιβάλλοντος. Θέστε σε λειτουργία το λουμινόμετρο 30 λεπτά προτού ξεκινήσετε τη μέτρηση ώστε να σταθεροποιηθεί ο φωτοπολλαπλασιαστής. Μεταφέρετε 100 μl του αραιωμένου διαλύματος ενζύμου σε μαύρο τρυβλίο 96 κοιλοτήτων (επίπεδης βάσης) (το δείγμα αναφοράς SLO στις #B1, #B2, #B3, και το δείγμα αναφοράς SLR στις #D1, #D2, #D3). Στη συνέχεια, με χρήση πολυκάναλης πιπέτας μεταφέρετε 100 μl προθερμασμένου Tripluc σε κάθε κοιλότητα του τρυβλίου που περιέχει το αραιωμένο διάλυμα ενζύμου. Ανακινήστε το τρυβλίο επί 10 λεπτά σε θερμοκρασία δωματίου (περίπου 25°C) χρησιμοποιώντας αναδευτήρα τρυβλίων. Αφαιρέστε τις φυσαλίδες από τα διαλύματα σε κοιλότητες, εάν εμφανιστούν. Τοποθετήστε το τρυβλίο στο λουμινόμετρο για να μετρήσετε τη δράση της λουσιφεράσης. Μετράται η βιοφωταύγεια επί 3 δευτερόλεπτα, τόσο απουσία (F0) όσο και παρουσία (F1) του οπτικού φίλτρου.
Ο συντελεστής περατότητας του οπτικού φίλτρου υπολογίζεται ως εξής:
συντελεστής περατότητας (SLO (κΟR60))= (#B1 της F1 + #B2 της F1 + #B3 της F1) / (#B1 της F0 + #B2 της F0 + #B3 της F0)
συντελεστής περατότητας (SLR (κRR60))= (#D1 της F1 + #D2 της F1 + #D3 της F1) / (#D1 της F0 + #D2 της F0 + #D3 της F0)
Οι υπολογισθέντες συντελεστές περατότητας χρησιμοποιούνται για όλες τις μετρήσεις που πραγματοποιούνται με χρήση του ίδιου λουμινόμετρου.
|
Ποιοτικός έλεγχος του εξοπλισμού
Θα πρέπει να χρησιμοποιούνται οι διαδικασίες που περιγράφονται στο πρωτόκολλο IL-8 Luc (18).
Προσάρτημα 3.3
ΟΥΣΙΕΣ ΕΛΕΓΧΟΥ ΙΚΑΝΟΤΗΤΑΣ
Πριν εντάξουν στην καθημερινή πρακτική τη δοκιμή που περιγράφεται στο παρόν προσάρτημα της μεθόδου δοκιμών Β.71, τα εργαστήρια θα πρέπει να αποδεικνύουν την τεχνική τους ικανότητα επιτυγχάνοντας την αναμενόμενη πρόβλεψη βάσει της δοκιμασίας IL-8 Luc για τις 9 συνιστώμενες ουσίες στον πίνακα 1, καθώς και τιμές εντός του αντίστοιχου εύρους τιμών αναφοράς για τουλάχιστον 8 από τις 9 ουσίες ελέγχου ικανότητας (που έχουν επιλεγεί έτσι ώστε να αντιπροσωπεύουν το φάσμα αποκρίσεων για τις πηγές κινδύνου ευαισθητοποίησης του δέρματος). Άλλα κριτήρια επιλογής ήταν ότι οι ουσίες θα πρέπει να είναι διαθέσιμες στο εμπόριο και ότι θα πρέπει να υπάρχουν διαθέσιμα in vivo δεδομένα αναφοράς υψηλής ποιότητας καθώς και in vitro δεδομένα υψηλής ποιότητας που προκύπτουν με τη δοκιμασία IL-8 Luc. Επίσης, για τη δοκιμασία IL-8 Luc υπάρχουν διαθέσιμα δημοσιευμένα δεδομένα αναφοράς (6) (1).
Πίνακας 1
Συνιστώμενες ουσίες για την απόδειξη τεχνικής ικανότητας στη δοκιμασία IL-8 Luc
|
Ουσίες ελέγχου ικανότητας
|
Αριθ. CAS
|
Κατάσταση
|
Διαλυτότητα σε X-VIVO 15 στα 20 mg/ml
|
Πρόβλεψη in vivo
(108)
|
Πρόβλεψη IL-8 Luc (109)
|
Εύρος αναφοράς (μg/ml) (110)
|
|
|
CV05 (111)
|
IL-8 Luc MIT (112)
|
|
2,4-Δινιτροχλωροβενζόλιο
|
97-00-7
|
Στερεό
|
Μη διαλυτή
|
Ευαισθητοποιητικό (εξαιρετικά ισχυρό)
|
Θετική
|
2,3-3,9
|
0,5-2,3
|
|
Φορμαλδεΰδη
|
50-00-0
|
Υγρό
|
Διαλυτή
|
Ευαισθητοποιητικό (ισχυρό)
|
Θετική
|
9-30
|
4-9
|
|
2-Μερκαπτοβενζοθειαζόλιο
|
149-30-4.
|
Στερεό
|
Μη διαλυτή
|
Ευαισθητοποιητικό (μετρίως ισχυρό)
|
Θετική
|
250-290
|
60-250
|
|
Αιθυλενοδιαμίνη
|
107-15-3
|
Υγρό
|
Διαλυτή
|
Ευαισθητοποιητικό (μετρίως ισχυρό)
|
Θετική
|
500-700
|
0,1-0,4
|
|
Διμεθακρυλικός εστέρας της αιθυλενογλυκόλης
|
97-90-5.
|
Υγρό
|
Μη διαλυτή
|
Ευαισθητοποιητικό (ασθενές)
|
Θετική
|
>2000
|
0,04-0,1
|
|
4-Αλλυλανισόλη (εστραγκόλη)
|
140-67-0
|
Υγρό
|
Μη διαλυτή
|
Ευαισθητοποιητικό (ασθενές)
|
Θετική
|
>2000
|
0,01-0,07
|
|
Θειική στρεπτομυκίνη
|
3810-74-0
|
Στερεό
|
Διαλυτή
|
Μη ευαισθητοποιητικό
|
Αρνητική
|
>2000
|
>2000
|
|
Γλυκερίνη
|
56-81-5
|
Υγρό
|
Διαλυτή
|
Μη ευαισθητοποιητικό
|
Αρνητική
|
>2000
|
>2000
|
|
Ισοπροπανόλη
|
67-63-0
|
Υγρό
|
Διαλυτή
|
Μη ευαισθητοποιητικό
|
Αρνητική
|
>2000
|
>2000
|
|
Συντομογραφίες: Αριθ. CAS = αριθμός μητρώου της υπηρεσίας Chemical Abstract Service
|
Προσάρτημα 3.4
ΔΕΙΚΤΕΣ ΚΑΙ ΚΡΙΤΗΡΙΑ ΚΡΙΣΗΣ
nIL8LA (nSLO-LA)
Μετράται η j-οστή επανάληψη (j = 1-4) της i-οστής συγκέντρωσης (i = 0-11) για τις IL8LA (SLO-LA) και GAPLA (SLR-LA) αντίστοιχα. Η κανονικοποιημένη IL8LA, καλούμενη nIL8LA (nSLO-LA), ορίζεται ως εξής:
nIL8LAij = IL8LAij/GAPLAij
Αυτή είναι η βασική μονάδα μέτρησης στην παρούσα δοκιμασία.
Ind-IL8LA (FInSLO-LA)
Το κύριο μέτρο στην παρούσα δοκιμασία είναι η πολλαπλάσια αύξηση της μέσης nIL8LA (nSLO-LA) για την επανάληψη στην i-οστή συγκέντρωση σε σύγκριση με την αντίστοιχη στη συγκέντρωση 0, Ind-IL8LA. Αυτή η αναλογία αποτυπώνεται με τον ακόλουθο τύπο:

Το κύριο εργαστήριο πρότεινε να αντιστοιχεί τιμή 1,4 σε θετικό αποτέλεσμα για την υπό δοκιμή χημική ουσία. Η εν λόγω τιμή προέκυψε βάσει έρευνας στα ιστορικά δεδομένα του κύριου εργαστηρίου. Στη συνέχεια, η ομάδα διαχείρισης δεδομένων χρησιμοποίησε την εν λόγω τιμή σε όλες τις φάσεις της μελέτης επικύρωσης. Το κύριο αποτέλεσμα, η Ind-IL8LA, είναι ο λόγος 2 αριθμητικών μέσων όρων, όπως φαίνεται στην εξίσωση.
Διάστημα εμπιστοσύνης 95 % (95 % CI)
Για να καταδειχθεί η ακρίβεια αυτού του μέτρου κύριου αποτελέσματος, μπορεί να εκτιμηθεί το διάστημα εμπιστοσύνης 95 % (95 % CI) με βάση τον λόγο. Το κατώτερο όριο του 95 % CI ≥ 1 υποδεικνύει ότι η nIL8LA με την i-οστή συγκέντρωση είναι σημαντικά υψηλότερη από την αντίστοιχη με τον μάρτυρα με διαλύτη. Το 95 % CI μπορεί να εκτιμηθεί με διάφορους τρόπους. Στη μελέτη αυτή χρησιμοποιήσαμε τη μέθοδο που είναι γνωστή ως θεώρημα του Fieller. Το διάστημα εμπιστοσύνης 95 % βάσει του θεωρήματος λαμβάνεται σύμφωνα με τον ακόλουθο τύπο:

όπου



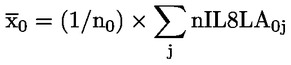




t0,975(ν) είναι το εκατοστημόριο 97,5 της κεντρικής κατανομής t με τον βαθμό ελευθερίας ν, όπου
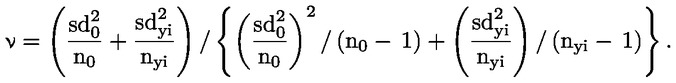
Inh-GAPLA (II-SLR-LA)
Η Inh-GAPLA είναι ο λόγος της μέσης GAPLA (SLR-LA) για την επανάληψη της i-οστής συγκέντρωσης σε σύγκριση με την αντίστοιχη για τον μάρτυρα με διαλύτη, και αποτυπώνεται με την ακόλουθη εξίσωση

Δεδομένου ότι GAPLA είναι ο παρονομαστής της nIL8LA, μια εξαιρετικά μικρή τιμή προκαλεί μεγάλη μεταβολή της nIL8LA. Ως εκ τούτου, οι τιμές Ind-IL8LA με εξαιρετικά μικρή τιμή Inh-GAPLA (κάτω από 0,05) μπορεί να θεωρηθούν ότι αντιπροσωπεύουν ανεπαρκή βαθμό ακρίβειας.
Προσάρτημα 3.5
ΤΟ ΣΧΗΜΑ ΤΩΝ ΜΕΘΟΔΩΝ ΓΙΑ ΤΗ ΔΙΑΛΥΣΗ ΧΗΜΙΚΩΝ ΟΥΣΙΩΝ ΓΙΑ ΤΗ ΔΟΚΙΜΑΣΙΑ IL-8 LUC
|
α)
|
Για χημικές ουσίες που διαλύονται σε X-VIVOTM 15 στα 20 mg/ml

|
|
β)
|
Για χημικές ουσίες που δεν διαλύονται σε X-VIVOTM 15 στα 20 mg/ml
|
Προσάρτημα 3.6
ΤΟ ΣΧΗΜΑ ΤΗΣ ΜΕΘΟΔΟΥ ΓΙΑ ΤΗ ΔΙΑΛΥΣΗ 4-NBB ΓΙΑ ΤΟΝ ΘΕΤΙΚΟ ΜΑΡΤΥΡΑ ΤΗΣ ΔΟΚΙΜΑΣΙΑΣ IL-8 LUC

» |



































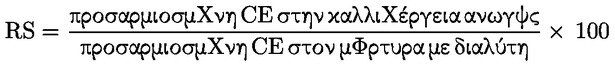










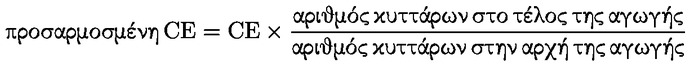


 εάν η οπτική πυκνότητα της υπό δοκιμή χημικής ουσίας στα 570±20 nm, μετά την αφαίρεση της οπτικής πυκνότητας για την ισοπροπανόλη ή το νερό, είναι > 0,08 (που αντιστοιχεί στο 5 % περίπου της μέσης οπτικής πυκνότητας του αρνητικού μάρτυρα), θα πρέπει να χρησιμοποιηθούν ζωντανοί προσαρμοσμένοι μάρτυρες
εάν η οπτική πυκνότητα της υπό δοκιμή χημικής ουσίας στα 570±20 nm, μετά την αφαίρεση της οπτικής πυκνότητας για την ισοπροπανόλη ή το νερό, είναι > 0,08 (που αντιστοιχεί στο 5 % περίπου της μέσης οπτικής πυκνότητας του αρνητικού μάρτυρα), θα πρέπει να χρησιμοποιηθούν ζωντανοί προσαρμοσμένοι μάρτυρες εάν η οπτική πυκνότητα της υπό δοκιμή χημικής ουσίας στα 570±20 nm, μετά την αφαίρεση της οπτικής πυκνότητας για την ισοπροπανόλη ή το νερό, είναι > 0,08 (που αντιστοιχεί στο 5 % περίπου της μέσης οπτικής πυκνότητας του αρνητικού μάρτυρα), θα πρέπει να χρησιμοποιηθούν ζωντανοί προσαρμοσμένοι μάρτυρες
εάν η οπτική πυκνότητα της υπό δοκιμή χημικής ουσίας στα 570±20 nm, μετά την αφαίρεση της οπτικής πυκνότητας για την ισοπροπανόλη ή το νερό, είναι > 0,08 (που αντιστοιχεί στο 5 % περίπου της μέσης οπτικής πυκνότητας του αρνητικού μάρτυρα), θα πρέπει να χρησιμοποιηθούν ζωντανοί προσαρμοσμένοι μάρτυρες εάν η υπό δοκιμή χημική ουσία είναι έγχρωμη, πρέπει να χρησιμοποιηθούν ζωντανοί προσαρμοσμένοι μάρτυρες
εάν η υπό δοκιμή χημική ουσία είναι έγχρωμη, πρέπει να χρησιμοποιηθούν ζωντανοί προσαρμοσμένοι μάρτυρες εάν η υπό δοκιμή χημική ουσία είναι έγχρωμη, πρέπει να χρησιμοποιηθούν ζωντανοί προσαρμοσμένοι μάρτυρες
εάν η υπό δοκιμή χημική ουσία είναι έγχρωμη, πρέπει να χρησιμοποιηθούν ζωντανοί προσαρμοσμένοι μάρτυρες εάν το διάλυμα αποκτήσει κυανό/ιώδες χρώμα, θα πρέπει να χρησιμοποιηθούν αδρανοποιημένοι με κατάψυξη προσαρμοσμένοι μάρτυρες
εάν το διάλυμα αποκτήσει κυανό/ιώδες χρώμα, θα πρέπει να χρησιμοποιηθούν αδρανοποιημένοι με κατάψυξη προσαρμοσμένοι μάρτυρες εάν το διάλυμα αποκτήσει κυανό/ιώδες χρώμα, θα πρέπει να χρησιμοποιηθούν αδρανοποιημένοι με κατάψυξη προσαρμοσμένοι μάρτυρες
εάν το διάλυμα αποκτήσει κυανό/ιώδες χρώμα, θα πρέπει να χρησιμοποιηθούν αδρανοποιημένοι με κατάψυξη προσαρμοσμένοι μάρτυρες εάν το διάλυμα αποκτήσει κυανό/ιώδες χρώμα, θα πρέπει να χρησιμοποιηθούν αδρανοποιημένοι σε νερό προσαρμοσμένοι μάρτυρες
εάν το διάλυμα αποκτήσει κυανό/ιώδες χρώμα, θα πρέπει να χρησιμοποιηθούν αδρανοποιημένοι σε νερό προσαρμοσμένοι μάρτυρες εάν το διάλυμα αποκτήσει κυανό/ιώδες χρώμα, θα πρέπει να χρησιμοποιηθούν αδρανοποιημένοι σε νερό προσαρμοσμένοι μάρτυρες
εάν το διάλυμα αποκτήσει κυανό/ιώδες χρώμα, θα πρέπει να χρησιμοποιηθούν αδρανοποιημένοι σε νερό προσαρμοσμένοι μάρτυρες