ΠΑΡΑΡΤΗΜΑ III
ΚΟΙΝΟΠΟΙΗΣΗ ΣΟΒΑΡΩΝ ΑΝΕΠΙΘΥΜΗΤΩΝ ΑΝΤΙΔΡΑΣΕΩΝ


|
25.10.2006 |
EL |
Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης |
L 294/32 |
ΟΔΗΓΊΑ 2006/86/ΕΚ ΤΗΣ ΕΠΙΤΡΟΠΉΣ
της 24ης Οκτωβρίου 2006
για την εφαρμογή της οδηγίας 2004/23/ΕΚ του Ευρωπαϊκού Κοινοβουλίου και του Συμβουλίου όσον αφορά τις απαιτήσεις ιχνηλασιμότητας, την κοινοποίηση σοβαρών ανεπιθύμητων αντιδράσεων και συμβάντων, καθώς και ορισμένες τεχνικές απαιτήσεις για την κωδικοποίηση, την επεξεργασία, τη συντήρηση, την αποθήκευση και τη διανομή ανθρώπινων ιστών και κυττάρων
(Κείμενο που παρουσιάζει ενδιαφέρον για τον ΕΟΧ)
Η ΕΠΙΤΡΟΠΗ ΤΩΝ ΕΥΡΩΠΑΪΚΩΝ ΚΟΙΝΟΤΗΤΩΝ,
Έχοντας υπόψη:
τη συνθήκη για την ίδρυση της Ευρωπαϊκής Κοινότητας,
την οδηγία 2004/23/ΕΚ του Ευρωπαϊκού Κοινοβουλίου και του Συμβουλίου, της 31ης Μαρτίου 2004, για τη θέσπιση προτύπων ποιότητας και ασφάλειας για τη δωρεά, την προμήθεια, τον έλεγχο, την επεξεργασία, τη συντήρηση, την αποθήκευση και τη διανομή ανθρώπινων ιστών και κυττάρων (1), και ιδίως το άρθρο 8, το άρθρο 11 παράγραφος 4 και το άρθρο 28 στοιχεία α), γ), ζ) και η),
Εκτιμώντας τα ακόλουθα:
|
(1) |
Η οδηγία 2004/23/ΕΚ θεσπίζει πρότυπα ποιότητας και ασφάλειας για τη δωρεά, την προμήθεια, τον έλεγχο, την επεξεργασία, τη συντήρηση, την αποθήκευση και τη διανομή ανθρώπινων ιστών και κυττάρων που προορίζονται για εφαρμογές στον άνθρωπο, και επεξεργασμένων προϊόντων που προέρχονται από ανθρώπινους ιστούς και κύτταρα και προορίζονται για εφαρμογές στον άνθρωπο, προκειμένου να εξασφαλίζεται υψηλού επιπέδου προστασία της ανθρώπινης υγείας. |
|
(2) |
Με σκοπό την πρόληψη της μετάδοσης ασθενειών από ανθρώπινους ιστούς και κύτταρα που προορίζονται για εφαρμογές στον άνθρωπο και την εξασφάλιση ισοδύναμου επιπέδου ποιότητας και ασφάλειας, η οδηγία 2004/23/ΕΚ προβλέπει τη θέσπιση ειδικών τεχνικών απαιτήσεων για κάθε ένα από τα στάδια της διαδικασίας εφαρμογής ανθρώπινων ιστών και κυττάρων, συμπεριλαμβανομένων προτύπων και προδιαγραφών σχετικά με σύστημα ποιότητας για ιδρύματα ιστών. |
|
(3) |
Θα πρέπει να θεσπιστούν στα κράτη μέλη διαδικασίες διαπίστευσης, ορισμού, έγκρισης ή αδειοδότησης των ιδρυμάτων ιστών και για τις μεθόδους παρασκευής στα ιδρύματα ιστών σύμφωνα με την οδηγία 2004/23/ΕΚ, ώστε να εξασφαλίζεται υψηλό επίπεδο προστασίας της ανθρώπινης υγείας. Είναι απαραίτητο να καθοριστούν οι τεχνικές απαιτήσεις των διαδικασιών αυτών. |
|
(4) |
Οι απαιτήσεις για τη διαπίστευση, τον ορισμό, την έγκριση ή την αδειοδότηση ιδρυμάτων ιστών πρέπει να καλύπτουν την οργάνωση και διοίκηση, το προσωπικό, τον εξοπλισμό και τα υλικά, τα μέσα/τις εγκαταστάσεις, την τεκμηρίωση και τα αρχεία και τον έλεγχο της ποιότητας. Τα διαπιστευμένα, ορισμένα, εγκεκριμένα ή αδειοδοτημένα ιδρύματα ιστών πρέπει να πληρούν επιπλέον απαιτήσεις για τις συγκεκριμένες δραστηριότητες που πραγματοποιούν. |
|
(5) |
Η ποιότητα του αέρα κατά την επεξεργασία των κυττάρων και των ιστών αποτελεί καίριο παράγοντα, ο οποίος μπορεί να επηρεάσει τον κίνδυνο μόλυνσης του ιστού ή του κυττάρου. Γενικά απαιτείται ποιότητα αέρα με αριθμό σωματιδίων και μικροβιακών αποικιών ισοδύναμο με την κατηγορία A, όπως ορίζεται στον ευρωπαϊκό οδηγό ορθής παρασκευαστικής πρακτικής, παράρτημα 1, και στην οδηγία 2003/94/ΕΚ της Επιτροπής (2). Ωστόσο, σε ορισμένες περιπτώσεις, δεν επιβάλλεται ποιότητα αέρα με αριθμό σωματιδίων και μικροβιακών αποικιών ισοδύναμο με το πρότυπο κατηγορίας A. Στις περιπτώσεις αυτές πρέπει να αποδεικνύεται και να τεκμηριώνεται ότι το περιβάλλον που έχει επιλεγεί εξασφαλίζει την ποιότητα και ασφάλεια που απαιτείται για το συγκεκριμένο είδος ιστών και κυττάρων ή τη συγκεκριμένη διαδικασία ή εφαρμογή στον άνθρωπο. |
|
(6) |
Το πεδίο αναφοράς της παρούσας οδηγίας πρέπει να περιλαμβάνει την ποιότητα και την ασφάλεια των ανθρώπινων ιστών και κυττάρων κατά την κωδικοποίηση, την επεξεργασία, τη συντήρηση, την αποθήκευση και τη διανομή τους στο κέντρο υγειονομικής περίθαλψης όπου θα εφαρμοστούν στο ανθρώπινο σώμα. Ωστόσο, δεν θα πρέπει να επεκταθεί στις εφαρμογές των εν λόγω ιστών και κυττάρων στον άνθρωπο (όπως μεταμοσχευτική χειρουργική, διαπότιση, σπερματέγχυση ή εμβρυομεταφορά). Οι διατάξεις της παρούσας οδηγίας σχετικά με την ιχνηλασιμότητα και την κοινοποίηση σοβαρών ανεπιθύμητων αντιδράσεων και συμβάντων ισχύουν επίσης για τη δωρεά, την προμήθεια και τον έλεγχο ανθρώπινων ιστών και κυττάρων που ρυθμίζονται από την οδηγία 2006/17/ΕΚ της Επιτροπής (3). |
|
(7) |
Η χρήση ιστών και κυττάρων για εφαρμογές στον άνθρωπο συνεπάγεται κίνδυνο μετάδοσης ασθενειών και άλλες πιθανές παρενέργειες στους λήπτες. Για την παρακολούθηση και τη μείωση των παρενεργειών αυτών, πρέπει να καθοριστούν ειδικές απαιτήσεις περί ιχνηλασιμότητας και κοινοτική διαδικασία για την κοινοποίηση των σοβαρών ανεπιθύμητων αντιδράσεων και συμβάντων. |
|
(8) |
Οι εικαζόμενες σοβαρές ανεπιθύμητες αντιδράσεις, στο δότη ή στο λήπτη, και τα σοβαρά ανεπιθύμητα συμβάντα από τη δωρεά ως τη διανομή ιστών και κυττάρων, τα οποία μπορούν να επηρεάσουν την ποιότητα και την ασφάλεια των ιστών και των κυττάρων και τα οποία μπορούν να αποδοθούν στην προμήθεια (συμπεριλαμβανομένης της αξιολόγησης και επιλογής του δότη), τον έλεγχο, την επεξεργασία, τη συντήρηση, την αποθήκευση και τη διανομή ανθρώπινων ιστών και κυττάρων πρέπει να κοινοποιούνται αμέσως στην αρμόδια αρχή. |
|
(9) |
Σοβαρές ανεπιθύμητες αντιδράσεις μπορεί να παρουσιαστούν κατά ή μετά την προμήθεια από ζώντες δότες ή κατά ή μετά την εφαρμογή στον άνθρωπο. Αυτές πρέπει να δηλώνονται στο συνεργαζόμενο ίδρυμα ιστών για να διερευνούνται και να κοινοποιούνται στην αρμόδια αρχή. Αυτό δεν πρέπει να εμποδίζει τον οργανισμό προμήθειας ή τον οργανισμό που είναι αρμόδιος για την εφαρμογή στον άνθρωπο να τις κοινοποιεί απευθείας στην αρμόδια αρχή, εφόσον το επιθυμεί. Η παρούσα οδηγία πρέπει να ορίζει τα ελάχιστα στοιχεία που χρειάζονται για την κοινοποίηση στην αρμόδια αρχή, με την επιφύλαξη της δυνατότητας των κρατών μελών να διατηρούν ή να θεσπίζουν πιο αυστηρά και προστατευτικά μέτρα στην επικράτειά τους, τα οποία συμμορφώνονται με τις απαιτήσεις της συνθήκης. |
|
(10) |
Προκειμένου να ελαχιστοποιούνται οι δαπάνες επικοινωνίας, να αποφεύγονται επικαλύψεις και να αυξάνεται η διοικητική αποτελεσματικότητα, πρέπει να χρησιμοποιούνται σύγχρονες τεχνολογίες και λύσεις ηλεκτρονικής διακυβέρνησης για την εκτέλεση των ενεργειών που αφορούν τη διαβίβαση και την επεξεργασία των πληροφοριών. Οι τεχνολογίες αυτές πρέπει να βασίζονται σε τυποποιημένο μορφότυπο ανταλλαγών που χρησιμοποιεί σύστημα κατάλληλο για τη διαχείριση των στοιχείων αναφοράς. |
|
(11) |
Για να διευκολύνεται η ιχνηλασιμότητα και οι πληροφορίες σχετικά με τα κύρια χαρακτηριστικά και τις ιδιότητες των ιστών και των κυττάρων είναι απαραίτητο να καθοριστούν τα βασικά στοιχεία που θα περιλαμβάνονται σε έναν ενιαίο ευρωπαϊκό κωδικό. |
|
(12) |
Η παρούσα οδηγία σέβεται τα θεμελιώδη δικαιώματα και τηρεί τις αρχές που αναγνωρίζονται ιδίως από το Χάρτη Θεμελιωδών Δικαιωμάτων της Ευρωπαϊκής Ένωσης. |
|
(13) |
Τα μέτρα που προβλέπονται στην παρούσα οδηγία είναι σύμφωνα με τη γνώμη της επιτροπής που συστάθηκε με το άρθρο 29 της οδηγίας 2004/23/EK, |
ΕΞΕΔΩΣΕ ΤΗΝ ΠΑΡΟΥΣΑ ΟΔΗΓΙΑ:
Άρθρο 1
Πεδίο εφαρμογής
1. Η παρούσα οδηγία εφαρμόζεται στην κωδικοποίηση, την επεξεργασία, τη συντήρηση, την αποθήκευση και τη διανομή:
|
α) |
ανθρώπινων ιστών και κυττάρων που προορίζονται για εφαρμογές στον άνθρωπο και |
|
β) |
επεξεργασμένων προϊόντων προερχόμενων από ανθρώπινους ιστούς και κύτταρα προοριζόμενων για εφαρμογές στον άνθρωπο, εάν τα προϊόντα αυτά δεν καλύπτονται από άλλες οδηγίες. |
2. Οι διατάξεις των άρθρων 5 έως 9 της παρούσας οδηγίας, σχετικά με την ιχνηλασιμότητα και την κοινοποίηση σοβαρών ανεπιθύμητων αντιδράσεων και συμβάντων ισχύουν επίσης για τη δωρεά, την προμήθεια και τον έλεγχο ανθρώπινων ιστών και κυττάρων.
Άρθρο 2
Ορισμοί
Για τους σκοπούς της παρούσας οδηγίας νοούνται ως:
|
α) |
«αναπαραγωγικά κύτταρα»: όλοι οι ιστοί και τα κύτταρα που προορίζονται να χρησιμοποιηθούν για σκοπούς υποβοηθούμενης αναπαραγωγής· |
|
β) |
«δωρεά από σύντροφο»: δωρεά αναπαραγωγικών κυττάρων μεταξύ άνδρα και γυναίκας που δηλώνουν ότι έχουν σεξουαλική σχέση· |
|
γ) |
«σύστημα ποιότητας»: η οργανωτική δομή, οι καθορισμένες αρμοδιότητες, οι διαδικασίες και οι πόροι για την εφαρμογή της διαχείρισης ποιότητας, που περιλαμβάνει όλες τις δραστηριότητες οι οποίες συμβάλλουν στην ποιότητα, άμεσα ή έμμεσα· |
|
δ) |
«διαχείριση ποιότητας»: οι συντονισμένες ενέργειες για τη διεύθυνση και τον έλεγχο ενός οργανισμού όσον αφορά την ποιότητα· |
|
ε) |
«τυποποιημένες διαδικασίες λειτουργίας (ΤΔΛ)»: γραπτές οδηγίες που περιγράφουν τα στάδια μιας συγκεκριμένης διαδικασίας, συμπεριλαμβανομένων των υλικών και των μεθόδων που χρησιμοποιούνται και του αναμενόμενου τελικού προϊόντος· |
|
στ) |
«επικύρωση» (ή «διαπίστευση» στην περίπτωση εξοπλισμού ή περιβάλλοντος): κατάρτιση τεκμηριωμένων στοιχείων που παρέχουν υψηλό επίπεδο εξασφάλισης ότι μια συγκεκριμένη διαδικασία, ένας συγκεκριμένος εξοπλισμός ή ένα συγκεκριμένο περιβάλλον παράγουν με συνέπεια προϊόν που ικανοποιεί τις προκαθορισμένες προδιαγραφές και ενδείξεις ποιότητας· μια διαδικασία επικυρώνεται για την αξιολόγηση των επιδόσεων ενός συστήματος σε σχέση με την αποτελεσματικότητά του βάσει της προβλεπόμενης χρήσης του· |
|
ζ) |
«ιχνηλασιμότητα»: δυνατότητα εντοπισμού και ταυτοποίησης του ιστού/κυττάρου κατά τη διάρκεια οποιουδήποτε σταδίου της προμήθειας, της επεξεργασίας, του ελέγχου, της αποθήκευσης και της διανομής του, είτε προς το λήπτη είτε για διάθεση, ή γενικότερα δυνατότητα ταυτοποίησης του δωρητή και του ιδρύματος ιστών, ή της εγκατάστασης παρασκευής που παραλαμβάνει, επεξεργάζεται ή αποθηκεύει τους ιστούς/τα κύτταρα, και δυνατότητα ταυτοποίησης του (των) λήπτη(-ών) στην (στις) ιατρική(-ές) εγκατάσταση(-εις) που εφαρμόζει(-ουν) τον ιστό/τα κύτταρα στον (στους) λήπτη(-ες)· η ιχνηλασιμότητα καλύπτει επίσης τη δυνατότητα εντοπισμού και ταυτοποίησης όλων των σχετικών δεδομένων που αφορούν τα προϊόντα και τα υλικά που έρχονται σε επαφή με τους εν λόγω ιστούς/τα κύτταρα· |
|
η) |
«κρίσιμος»: μπορεί να έχει επιπτώσεις στην ποιότητα ή/και την ασφάλεια των ιστών και των κυττάρων ή να έχει έρθει σε επαφή με αυτά· |
|
θ) |
«οργανισμός προμήθειας»: ίδρυμα υγειονομικής περίθαλψης ή νοσοκομειακή μονάδα ή άλλος φορέας που αναλαμβάνει δραστηριότητες προμήθειας ανθρώπινων ιστών και κυττάρων και που ενδεχομένως δεν είναι διαπιστευμένο, δεν έχει οριστεί ή δεν έχει λάβει έγκριση ή άδεια ως ίδρυμα ιστών· |
|
ι) |
«οργανισμός αρμόδιος για εφαρμογές στον άνθρωπο»: ίδρυμα υγειονομικής περίθαλψης ή νοσοκομειακή μονάδα ή άλλος φορέας που πραγματοποιεί εφαρμογές ιστών και κυττάρων στον άνθρωπο. |
Άρθρο 3
Απαιτήσεις για τη διαπίστευση, τον ορισμό, την έγκριση ή την αδειοδότηση ιδρυμάτων ιστών
Τα ιδρύματα ιστών πρέπει να συμμορφώνονται με τις απαιτήσεις του παραρτήματος I.
Άρθρο 4
Απαιτήσεις για τη διαπίστευση, τον ορισμό, την έγκριση ή την αδειοδότηση μεθόδων παρασκευής ιστών και κυττάρων
Οι μέθοδοι παρασκευής στα ιδρύματα ιστών πρέπει να συμμορφώνονται με τις απαιτήσεις του παραρτήματος II.
Άρθρο 5
Κοινοποίηση σοβαρών ανεπιθύμητων αντιδράσεων
1. Τα κράτη μέλη διασφαλίζουν ότι:
|
α) |
οι οργανισμοί προμήθειας εφαρμόζουν διαδικασίες για τη τήρηση αρχείων των ιστών και των κυττάρων που προμηθεύουν και για την άμεση κοινοποίηση στα ιδρύματα ιστών τυχόν σοβαρών ανεπιθύμητων αντιδράσεων στο ζώντα δότη, οι οποίες μπορεί να επηρεάσουν την ποιότητα και την ασφάλεια των ιστών και των κυττάρων· |
|
β) |
οι οργανισμοί που είναι αρμόδιοι για εφαρμογές ιστών και κυττάρων στον άνθρωπο εφαρμόζουν διαδικασίες για την τήρηση αρχείων των ιστών και των κυττάρων που εφαρμόζουν και για την άμεση κοινοποίηση στα ιδρύματα ιστών τυχόν σοβαρών ανεπιθύμητων αντιδράσεων που παρατηρούνται κατά ή μετά την κλινική εφαρμογή, οι οποίες μπορεί να συνδέονται με την ποιότητα και την ασφάλεια των ιστών και των κυττάρων· |
|
γ) |
τα ιδρύματα ιστών που διανέμουν ιστούς και κύτταρα για εφαρμογές στον άνθρωπο υποδεικνύουν στον αρμόδιο οργανισμό για εφαρμογές ιστών και κυττάρων στον άνθρωπο τον τρόπο κοινοποίησης των σοβαρών ανεπιθύμητων αντιδράσεων που αναφέρονται στο στοιχείο β). |
2. Τα κράτη μέλη εξασφαλίζουν ότι τα ιδρύματα ιστών:
|
α) |
εφαρμόζουν διαδικασίες για την άμεση κοινοποίηση στην αρμόδια αρχή όλων των συναφών πληροφοριών που διαθέτουν σχετικά με εικαζόμενες σοβαρές ανεπιθύμητες αντιδράσεις που αναφέρονται στην παράγραφο 1 στοιχεία α) και β)· |
|
β) |
εφαρμόζουν διαδικασίες για την άμεση κοινοποίηση στην αρμόδια αρχή των συμπερασμάτων της έρευνας για την ανάλυση των αιτίων και των αποτελεσμάτων. |
3. Τα κράτη μέλη εξασφαλίζουν ότι:
|
α) |
ο υπεύθυνος που αναφέρεται στο άρθρο 17 της οδηγίας 2004/23/ΕΚ κοινοποιεί στην αρμόδια αρχή τις πληροφορίες που περιλαμβάνονται στην κοινοποίηση στο μέρος A του παραρτήματος ΙΙΙ· |
|
β) |
τα ιδρύματα ιστών κοινοποιούν στην αρμόδια αρχή τα μέτρα που λαμβάνουν σε σχέση με άλλους ενεχόμενους ιστούς και κύτταρα που έχουν διανεμηθεί για εφαρμογές στον άνθρωπο· |
|
γ) |
τα ιδρύματα ιστών κοινοποιούν στην αρμόδια αρχή τα συμπεράσματα της έρευνας, παρέχοντας τουλάχιστον τα στοιχεία που αναφέρονται στο μέρος Β του παραρτήματος III. |
Άρθρο 6
Κοινοποίηση σοβαρών ανεπιθύμητων συμβάντων
1. Τα κράτη μέλη διασφαλίζουν ότι:
|
α) |
οι οργανισμοί προμήθειας και τα ιδρύματα ιστών εφαρμόζουν διαδικασίες για την τήρηση αρχείου και για την άμεση κοινοποίηση στα ιδρύματα ιστών τυχόν σοβαρών ανεπιθύμητων συμβάντων κατά τη διάρκεια της προμήθειας, που ενδέχεται να επηρεάσουν την ποιότητα ή/και την ασφάλεια των ανθρώπινων ιστών και κυττάρων· |
|
β) |
οι οργανισμοί που είναι αρμόδιοι για εφαρμογές ιστών και κυττάρων στον άνθρωπο εφαρμόζουν διαδικασίες για την άμεση κοινοποίηση στα ιδρύματα ιστών τυχόν σοβαρών ανεπιθύμητων συμβάντων που μπορεί να επηρεάσουν την ποιότητα και την ασφάλεια των ιστών και των κυττάρων· |
|
γ) |
τα ιδρύματα ιστών υποδεικνύουν στον αρμόδιο οργανισμό για εφαρμογές στον άνθρωπο με ποιο τρόπο πρέπει να τους κοινοποιεί σοβαρά ανεπιθύμητα συμβάντα που μπορεί να επηρεάσουν την ποιότητα και την ασφάλεια των ιστών και των κυττάρων. |
2. Στην περίπτωση της υποβοηθούμενης αναπαραγωγής, κάθε είδους λανθασμένη ταυτοποίηση ή σύγχυση γαμέτη ή εμβρύου θα θεωρείται σοβαρό ανεπιθύμητο συμβάν. Όλα τα πρόσωπα ή οι οργανισμοί προμήθειας ή οι οργανισμοί που είναι υπεύθυνοι για την εφαρμογή στον άνθρωπο, οι οποίοι πραγματοποιούν υποβοηθούμενη αναπαραγωγή, δηλώνουν τα συμβάντα αυτά στα ιδρύματα που προμηθεύουν τους ιστούς για να τα διερευνήσουν και να τα κοινοποιήσουν στην αρμόδια αρχή.
3. Τα κράτη μέλη εξασφαλίζουν ότι τα ιδρύματα ιστών:
|
α) |
εφαρμόζουν διαδικασίες για την άμεση κοινοποίηση στην αρμόδια αρχή όλων των συναφών πληροφοριών που διαθέτουν σχετικά με εικαζόμενα σοβαρά ανεπιθύμητα συμβάντα που αναφέρονται στην παράγραφο 1 στοιχεία α) και β)· |
|
β) |
εφαρμόζουν διαδικασίες για την άμεση κοινοποίηση στην αρμόδια αρχή των συμπερασμάτων της έρευνας για την ανάλυση των αιτίων και των αποτελεσμάτων. |
4. Τα κράτη μέλη διασφαλίζουν ότι:
|
α) |
ο υπεύθυνος που αναφέρεται στο άρθρο 17 της οδηγίας 2004/23/ΕΚ κοινοποιεί στην αρμόδια αρχή τις πληροφορίες που περιλαμβάνονται στην κοινοποίηση στο μέρος A του παραρτήματος IV· |
|
β) |
τα ιδρύματα ιστών αξιολογούν τα σοβαρά ανεπιθύμητα συμβάντα για να εντοπίζουν στη ροή της διαδικασίας αίτια που μπορούν να προληφθούν· |
|
γ) |
τα ιδρύματα ιστών κοινοποιούν στην αρμόδια αρχή τα συμπεράσματα της έρευνας, παρέχοντας τουλάχιστον τα στοιχεία που αναφέρονται στο μέρος Β του παραρτήματος IV. |
Άρθρο 7
Ετήσιες εκθέσεις
1. Τα κράτη μέλη υποβάλλουν στην Επιτροπή ετήσια έκθεση, έως τις 30 Ιουνίου του επόμενου έτους, σχετικά με τις κοινοποιήσεις σοβαρών ανεπιθύμητων αντιδράσεων και συμβάντων που έλαβε η αρμόδια αρχή. Η Επιτροπή υποβάλλει στις αρμόδιες αρχές των κρατών μελών περίληψη των εκθέσεων που λαμβάνει. Η αρμόδια αρχή καθιστά την εν λόγω έκθεση διαθέσιμη στα ιδρύματα ιστών.
2. Η διαβίβαση δεδομένων γίνεται σύμφωνα με τις προδιαγραφές για το μορφότυπο ανταλλαγής δεδομένων που καθορίζεται στο παράρτημα V μέρη A και B, και παρέχονται όλες οι απαραίτητες πληροφορίες για την ταυτοποίηση του αποστολέα και τη διατήρηση των στοιχείων αναφοράς του.
Άρθρο 8
Ανταλλαγή πληροφοριών μεταξύ αρμόδιων αρχών και Επιτροπής
Τα κράτη μέλη διασφαλίζουν ότι οι αρμόδιες αρχές τους κοινοποιούν στις άλλες αρμόδιες αρχές και στην Επιτροπή τις κατάλληλες πληροφορίες σε σχέση με σοβαρές ανεπιθύμητες αντιδράσεις και συμβάντα, ώστε να εξασφαλίζεται η λήψη επαρκών μέτρων.
Άρθρο 9
Ιχνηλασιμότητα
1. Τα ιδρύματα ιστών διαθέτουν αποτελεσματικά και ακριβή συστήματα για τη μοναδική ταυτοποίηση και επισήμανση των κυττάρων/ιστών που λαμβάνουν και διανέμουν.
2. Τα ιδρύματα ιστών και οι οργανισμοί που είναι αρμόδιοι για την εφαρμογή στον άνθρωπο διατηρούν τα δεδομένα που καθορίζονται στο παράρτημα VI για τουλάχιστον 30 έτη, σε κατάλληλο και αναγνώσιμο μέσο αποθήκευσης.
Άρθρο 10
Ευρωπαϊκό σύστημα κωδικοποίησης
1. Ένας μοναδικός ευρωπαϊκός κωδικός ταυτοποίησης χορηγείται σε όλο το δωρηθέν υλικό στο ίδρυμα ιστών, ο οποίος εξασφαλίζει την ορθή ταυτοποίηση του δότη και την ιχνηλασιμότητα όλου του δωρηθέντος υλικού και παρέχει πληροφορίες για τα κύρια χαρακτηριστικά και τις κύριες ιδιότητες των ιστών και των κυττάρων. Ο κωδικός αυτός περιλαμβάνει τουλάχιστον τις πληροφορίες που αναφέρονται στο παράρτημα VII.
2. Η παράγραφος 1 δεν ισχύει για τη δωρεά αναπαραγωγικών κυττάρων από το σύντροφο.
Άρθρο 11
Μεταφορά στο εθνικό δίκαιο
1. Τα κράτη μέλη θέτουν σε ισχύ τις αναγκαίες νομοθετικές, κανονιστικές και διοικητικές διατάξεις προκειμένου να συμμορφωθούν με την παρούσα οδηγία το αργότερο έως την 1η Σεπτεμβρίου 2007. Κοινοποιούν αμέσως στην Επιτροπή το κείμενο των εν λόγω διατάξεων καθώς και έναν πίνακα αντιστοιχίας μεταξύ αυτών των διατάξεων και των διατάξεων της παρούσας οδηγίας.
Τα κράτη μέλη θέτουν σε ισχύ τις αναγκαίες νομοθετικές, κανονιστικές και διοικητικές διατάξεις για να συμμορφωθούν με το άρθρο 10 της παρούσας οδηγίας έως την 1η Σεπτεμβρίου 2008.
Οι διατάξεις αυτές, όταν θεσπίζονται από τα κράτη μέλη, περιέχουν αναφορά στην παρούσα οδηγία ή συνοδεύονται από παρόμοια αναφορά κατά την επίσημη δημοσίευσή τους. Οι λεπτομερείς διατάξεις για την αναφορά αυτή καθορίζονται από τα κράτη μέλη.
2. Τα κράτη μέλη ανακοινώνουν στην Επιτροπή το κείμενο των ουσιωδών διατάξεων εσωτερικού δικαίου τις οποίες θεσπίζουν στον τομέα που διέπεται από την παρούσα οδηγία.
Άρθρο 12
Έναρξη ισχύος
Η παρούσα οδηγία αρχίζει να ισχύει την εικοστή ημέρα από τη δημοσίευσή της στην Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης.
Άρθρο 13
Αποδέκτες
Η παρούσα οδηγία απευθύνεται στα κράτη μέλη.
Βρυξέλλες, 24 Οκτωβρίου 2006.
Για την Επιτροπή
Μάρκος ΚΥΠΡΙΑΝΟΫ
Μέλος της Επιτροπής
(1) ΕΕ L 102 της 7.4.2004, σ. 48.
(2) http://pharmacos.eudra.org/F2/eudralex/vol-4/home.htm και ΕΕ L 262 της 14.10.2003, σ. 22.
(3) ΕΕ L 38 της 9.2.2006, σ. 40.
ΠΑΡΑΡΤΗΜΑ I
Απαιτήσεις για τη διαπίστευση, τον ορισμό, την έγκριση ή την αδειοδότηση ιδρυμάτων ιστών σύμφωνα με το άρθρο 3
Α. ΟΡΓΑΝΩΣΗ ΚΑΙ ΔΙΑΧΕΙΡΙΣΗ
|
1. |
Πρέπει να ορίζεται υπεύθυνος ο οποίος διαθέτει τα προσόντα και αναλαμβάνει τις ευθύνες που προβλέπονται στο άρθρο 17 της οδηγίας 2004/23/ΕΚ. |
|
2. |
Τα ιδρύματα ιστών πρέπει να διαθέτουν οργανωτική δομή και διαδικασίες λειτουργίας κατάλληλες για τη διεξαγωγή των δραστηριοτήτων για τις οποίες ζητείται διαπίστευση/ορισμός/έγκριση ή αδειοδότηση· πρέπει να υπάρχει οργανόγραμμα το οποίο να καθορίζει σαφώς τους υπεύθυνους για τις κοινοποιήσεις. |
|
3. |
Κάθε ίδρυμα ιστών πρέπει να έχει πρόσβαση σε εντεταλμένο ιατρό ο οποίος θα παρέχει συμβουλές και θα επιβλέπει τις ιατρικές δραστηριότητες του ιδρύματος, όπως την επιλογή δωρητών, την ανασκόπηση των κλινικών αποτελεσμάτων των ιστών και κυττάρων που εφαρμόζονται ή την ενδεχόμενη επικοινωνία με κλινικούς χρήστες. |
|
4. |
Πρέπει να εφαρμόζεται τεκμηριωμένο σύστημα διαχείρισης ποιότητας στις δραστηριότητες για τις οποίες ζητείται διαπίστευση/ορισμός/έγκριση ή αδειοδότηση, σύμφωνα με τα πρότυπα που ορίζονται στην παρούσα οδηγία. |
|
5. |
Πρέπει να διασφαλίζεται ότι οι κίνδυνοι που ενέχει η χρήση και ο χειρισμός βιολογικών υλικών αναγνωρίζονται και ελαχιστοποιούνται, εξασφαλίζοντας ταυτόχρονα επαρκή ποιότητα και ασφάλεια για το σκοπό που προορίζονται οι ιστοί και τα κύτταρα. Οι κίνδυνοι περιλαμβάνουν εκείνους που συνδέονται ειδικότερα με τις διαδικασίες, το περιβάλλον και την κατάσταση της υγείας του προσωπικού του κάθε ιδρύματος ιστών. |
|
6. |
Οι συμφωνίες μεταξύ ιδρυμάτων ιστών και τρίτων πρέπει να συμμορφώνονται με το άρθρο 24 της οδηγίας 2004/23/ΕΚ. Οι συμφωνίες με τρίτους πρέπει να καθορίζουν τους όρους της σχέσης και τις αρμοδιότητες καθώς και τα πρωτόκολλα που ακολουθούνται για να επιτευχθούν οι απαιτούμενες προδιαγραφές απόδοσης. |
|
7. |
Πρέπει να εφαρμόζεται τεκμηριωμένο σύστημα, υπό την επίβλεψη του υπευθύνου, το οποίο να επικυρώνει ότι οι ιστοί ή/και τα κύτταρα πληρούν τις κατάλληλες προδιαγραφές ασφάλειας και ποιότητας για τη χρησιμοποίηση και τη διανομή τους. |
|
8. |
Σε περίπτωση παύσης των δραστηριοτήτων, οι συμφωνίες που έχουν συναφθεί και οι διαδικασίες που έχουν θεσπισθεί σύμφωνα με το άρθρο 21 παράγραφος 5 της οδηγίας 2004/23/ΕΚ θα περιλαμβάνουν τα δεδομένα περί ιχνηλασιμότητας και υλικό σχετικά με την ποιότητα και την ασφάλεια των κυττάρων και των ιστών. |
|
9. |
Πρέπει να εφαρμόζεται τεκμηριωμένο σύστημα που να εξασφαλίζει την ταυτοποίηση κάθε μονάδας ιστού ή κυττάρων σε όλα τα στάδια των δραστηριοτήτων για τις οποίες ζητείται διαπίστευση/ορισμός/έγκριση ή αδειοδότηση. |
B. ΠΡΟΣΩΠΙΚΟ
|
1. |
Τα ιδρύματα ιστών πρέπει να είναι επαρκώς επανδρωμένα με προσωπικό που διαθέτει τα κατάλληλα προσόντα για την εκτέλεση των καθηκόντων του. Η επάρκεια προσόντων του προσωπικού πρέπει να αξιολογείται σε ενδεδειγμένα διαστήματα που καθορίζονται στο σύστημα ποιότητας. |
|
2. |
Όλο το προσωπικό πρέπει να διαθέτει σαφή, τεκμηριωμένη και ενημερωμένη περιγραφή καθηκόντων. Τα καθήκοντα, οι αρμοδιότητες και οι ευθύνες τους πρέπει να τεκμηριώνονται σαφώς και να είναι απόλυτα κατανοητά(-ές). |
|
3. |
Πρέπει να παρέχεται στο προσωπικό η αρχική/βασική κατάρτιση, επανακατάρτιση, εάν χρειάζεται, όταν αλλάζουν οι διαδικασίες ή εξελίσσονται οι επιστημονικές γνώσεις, και επαρκείς ευκαιρίες για σχετική επαγγελματική εξέλιξη. Το πρόγραμμα κατάρτισης πρέπει να εξασφαλίζει και να τεκμηριώνει ότι κάθε άτομο:
|
Γ. ΕΞΟΠΛΙΣΜΟΣ ΚΑΙ ΥΛΙΚΑ
|
1. |
Όλος ο εξοπλισμός και τα υλικά πρέπει να σχεδιάζονται και να συντηρούνται κατά τρόπο ώστε να εξυπηρετούν το σκοπό για τον οποίο προορίζονται και πρέπει να ελαχιστοποιούν οποιοδήποτε κίνδυνο για τους λήπτες ή/και το προσωπικό. |
|
2. |
Όλος ο κρίσιμος εξοπλισμός και τα τεχνικά όργανα πρέπει να προσδιορίζονται και να επικυρώνονται, να επιθεωρούνται τακτικά και να συντηρούνται προληπτικά σύμφωνα με τις οδηγίες του κατασκευαστή. Ο εξοπλισμός ή τα υλικά που επηρεάζουν κρίσιμες παραμέτρους για την επεξεργασία ή την αποθήκευση (π.χ. θερμοκρασία, πίεση, αριθμός σωματιδίων, επίπεδα μικροβιακής μόλυνσης) πρέπει να προσδιορίζονται και να υποβάλλονται σε κατάλληλη παρακολούθηση, προειδοποιήσεις, σήμανση συναγερμού και διορθωτικές ενέργειες, εάν χρειάζεται, ώστε να εντοπίζονται δυσλειτουργίες και ελαττώματα και να εξασφαλίζεται ότι οι κρίσιμες παράμετροι παραμένουν διαρκώς εντός αποδεκτών ορίων. Όλος ο εξοπλισμός που επιτελεί κρίσιμες λειτουργίες μέτρησης πρέπει να βαθμονομείται σε σχέση με προσδιορίσιμο πρότυπο, εάν υπάρχει. |
|
3. |
Ο νέος και ο επισκευασμένος εξοπλισμός πρέπει να ελέγχεται κατά την εγκατάσταση και να επικυρώνεται πριν από τη χρήση. Τα αποτελέσματα των ελέγχων πρέπει να τεκμηριώνονται. |
|
4. |
Η συντήρηση, το σέρβις, ο καθαρισμός, η απολύμανση και η υγιεινή όλου του κρίσιμου εξοπλισμού πρέπει να γίνονται τακτικά και να καταγράφονται αναλόγως. |
|
5. |
Πρέπει να υπάρχουν διαδικασίες λειτουργίας για όλο τον κρίσιμο εξοπλισμό, οι οποίες να αναφέρουν λεπτομερώς τα μέτρα που λαμβάνονται σε περίπτωση δυσλειτουργίας ή βλάβης. |
|
6. |
Οι διαδικασίες για τις δραστηριότητες για τις οποίες ζητείται διαπίστευση/ορισμός/έγκριση ή αδειοδότηση, πρέπει να αναφέρουν αναλυτικά τις προδιαγραφές για όλα τα κρίσιμα υλικά και αντιδραστήρια. Πρέπει να καθορίζονται, ιδίως, οι προδιαγραφές για τα πρόσθετα (π.χ. διαλύματα) και τα υλικά συσκευασίας. Τα κρίσιμα αντιδραστήρια και υλικά πρέπει να πληρούν τις τεκμηριωμένες απαιτήσεις και προδιαγραφές και, ανάλογα με την περίπτωση, τις απαιτήσεις της οδηγίας 93/42/ΕΟΚ του Συμβουλίου, της 14ης Ιουνίου 1993, περί των ιατροτεχνολογικών προϊόντων (1) και της οδηγίας 98/79/ΕΚ του Ευρωπαϊκού Κοινοβουλίου και του Συμβουλίου, της 27ης Οκτωβρίου 1998, για τα ιατροτεχνολογικά βοηθήματα που χρησιμοποιούνται στη διάγνωση in vitro (2). |
Δ. ΜΕΣΑ/ΕΓΚΑΤΑΣΤΑΣΕΙΣ
|
1. |
Τα ιδρύματα ιστών πρέπει να διαθέτουν τα κατάλληλα μέσα για τη διεξαγωγή των δραστηριοτήτων για τις οποίες ζητείται διαπίστευση/ορισμός/έγκριση ή αδειοδότηση, σύμφωνα με τα πρότυπα που ορίζονται στην παρούσα οδηγία. |
|
2. |
Στην περίπτωση που οι δραστηριότητες αυτές περιλαμβάνουν την επεξεργασία ιστών και κυττάρων ενώ εκτίθενται στο περιβάλλον, η επεξεργασία πρέπει να λαμβάνει χώρα σε περιβάλλον με καθορισμένη ποιότητα και καθαρότητα αέρα έτσι ώστε ο κίνδυνος μόλυνσης, συμπεριλαμβανομένης της διασταυρούμενης μόλυνσης των δωρεών, να είναι μειωμένος στο ελάχιστο. Η αποτελεσματικότητα των μέτρων αυτών πρέπει να επικυρώνεται και να παρακολουθείται. |
|
3. |
Με την επιφύλαξη όσων ορίζονται στο σημείο 4, όταν οι ιστοί ή τα κύτταρα εκτίθενται στο περιβάλλον κατά τη διάρκεια της επεξεργασίας, χωρίς να ακολουθεί διαδικασία μικροβιακής αδρανοποίησης, απαιτείται ποιότητα αέρα με αριθμό σωματιδίων και μικροβιακών αποικιών ισοδύναμο με την κατηγορία A σύμφωνα με τον ισχύοντα ευρωπαϊκό οδηγό ορθής παρασκευαστικής πρακτικής [European Guide to Good Manufacturing Practice (GMP)], παράρτημα 1 και την οδηγία 2003/94/ΕΚ με κατάλληλο περιβάλλοντα χώρο για την επεξεργασία των σχετικών ιστών/κυττάρων που είναι τουλάχιστον ισοδύναμο με την κατηγορία Δ του GMP όσον αφορά τον αριθμό των σωματιδίων και των μικροβίων. |
|
4. |
Λιγότερο αυστηρό περιβάλλον από αυτό που καθορίζεται στο σημείο 3 δύναται να γίνει αποδεκτό όταν:
|
|
5. |
Στο σημείο 4 στοιχεία α), β), γ) και δ), το περιβάλλον πρέπει να καθορισθεί. Πρέπει να αποδειχθεί και να τεκμηριωθεί ότι το επιλεγέν περιβάλλον επιτυγχάνει την απαιτούμενη ποιότητα και ασφάλεια, τουλάχιστον σε σχέση με τον επιδιωκόμενο στόχο, τον τρόπο εφαρμογής και την ανοσολογική κατάσταση του λήπτη. Σε κάθε σχετικό τμήμα του ιδρύματος ιστών πρέπει να παρέχονται τα κατάλληλα ενδύματα καθώς και ο κατάλληλος εξοπλισμός προσωπικής προστασίας και υγιεινής μαζί με γραπτές οδηγίες υγιεινής και ένδυσης. |
|
6. |
Όταν οι δραστηριότητες για τις οποίες ζητείται διαπίστευση/ορισμός/έγκριση ή αδειοδότηση περιλαμβάνουν την αποθήκευση ιστών και κυττάρων, πρέπει να ορίζονται οι συνθήκες αποθήκευσης που είναι αναγκαίες για τη διατήρηση των απαιτούμενων ιδιοτήτων των ιστών και των κυττάρων, συμπεριλαμβανομένων συναφών παραμέτρων, όπως η θερμοκρασία, η υγρασία ή η ποιότητα του αέρα. |
|
7. |
Κρίσιμες παράμετροι (π.χ. θερμοκρασία, υγρασία, ποιότητα αέρα) πρέπει να ελέγχονται, να παρακολουθούνται και να καταγράφονται ώστε να αποδεικνύεται η συμμόρφωση με τις προδιαγραφείσες συνθήκες αποθήκευσης. |
|
8. |
Πρέπει να παρέχονται χώροι αποθήκευσης που να ξεχωρίζουν και να διαχωρίζουν με σαφήνεια τους ιστούς και τα κύτταρα που δεν έχουν ακόμα χρησιμοποιηθεί/κρατούνται σε «καραντίνα» από τους ιστούς και τα κύτταρα που έχουν χρησιμοποιηθεί, καθώς και από τους ιστούς και τα κύτταρα που έχουν απορριφθεί, έτσι ώστε να προλαμβάνεται τυχόν σύγχυση και διασταυρούμενη μόλυνση. Στους χώρους αποθήκευσης καραντίνας και χρησιμοποίησης πρέπει να διατίθενται φυσικά διαχωρισμένοι χώροι ή εξοπλισμός αποθήκευσης ή ασφαλής διαχωρισμός εντός του εξοπλισμού για την τοποθέτηση ορισμένων ιστών και κυττάρων που έχουν συλλεγεί σύμφωνα με ειδικά κριτήρια. |
|
9. |
Το ίδρυμα ιστών πρέπει να διαθέτει γραπτές πολιτικές και διαδικασίες ελεγχόμενης πρόσβασης, καθαρισμού και συντήρησης, διάθεσης αποβλήτων και εκ νέου παροχής υπηρεσιών σε επείγουσες περιπτώσεις. |
Ε. ΤΕΚΜΗΡΙΩΣΗ ΚΑΙ ΑΡΧΕΙΑ
|
1. |
Πρέπει να υπάρχει σύστημα βάσει του οποίου να εξασφαλίζεται σαφώς καθορισμένη και αποτελεσματική τεκμηρίωση, ορθά αρχεία και μητρώα καθώς και εγκεκριμένες τυποποιημένες διαδικασίες λειτουργίας (ΤΔΛ) αναφορικά με τις δραστηριότητες για τις οποίες ζητείται διαπίστευση/ορισμός/έγκριση ή αδειοδότηση. Τα έγγραφα πρέπει να εξετάζονται τακτικά και να είναι σύμφωνα με τα πρότυπα που ορίζονται στην παρούσα οδηγία. Το σύστημα πρέπει να εξασφαλίζει ότι οι εργασίες που διεξάγονται είναι τυποποιημένες και ότι όλα τα στάδια είναι ανιχνεύσιμα· δηλαδή η κωδικοποίηση, η επιλεξιμότητα του δότη, η προμήθεια, η επεξεργασία, η συντήρηση, η αποθήκευση, η μεταφορά, η διανομή και η διάθεση, συμπεριλαμβανομένων παραμέτρων που αφορούν τον έλεγχο της ποιότητας και τη διασφάλιση της ποιότητας. |
|
2. |
Για κάθε κρίσιμη δραστηριότητα, πρέπει να προσδιορίζονται με σχετική τεκμηρίωση τα υλικά και ο εξοπλισμός που χρησιμοποιήθηκαν καθώς και το προσωπικό που ενεπλάκη. |
|
3. |
Όλες οι τροποποιήσεις εγγράφων στα ιδρύματα ιστών πρέπει να εξετάζονται, να χρονολογούνται, να εγκρίνονται, να τεκμηριώνονται και να εκτελούνται ταχέως από εξουσιοδοτημένο προσωπικό. |
|
4. |
Πρέπει να υπάρχει διαδικασία ελέγχου των εγγράφων η οποία να καθιστά δυνατή την παρακολούθηση του ιστορικού των εγγράφων και των τροποποιήσεων και να εξασφαλίζει ότι χρησιμοποιούνται μόνον ισχύουσες εκδοχές εγγράφων. |
|
5. |
Πρέπει να αποδεικνύεται ότι τα αρχεία είναι αξιόπιστα και ότι αντικατοπτρίζουν ορθά τα αποτελέσματα. |
|
6. |
Τα αρχεία πρέπει να είναι ευανάγνωστα και ανεξίτηλα και μπορούν να είναι χειρόγραφα ή να μεταφέρονται σε άλλο επικυρωμένο σύστημα, όπως υπολογιστές ή μικροφίλμ. |
|
7. |
Με την επιφύλαξη των διατάξεων του άρθρου 9 παράγραφος 2, όλα τα αρχεία, συμπεριλαμβανομένων των μη επεξεργασμένων δεδομένων, που είναι κρίσιμα για την ασφάλεια και την ποιότητα των ιστών και των κυττάρων, πρέπει να τηρούνται με τέτοιο τρόπο ώστε να εξασφαλίζεται η πρόσβαση στα δεδομένα αυτά για τουλάχιστον 10 έτη μετά την ημερομηνία λήξης, την κλινική χρήση ή τη διάθεση. |
|
8. |
Τα αρχεία πρέπει να πληρούν τις απαιτήσεις εμπιστευτικότητας που ορίζονται στο άρθρο 14 της οδηγίας 2004/23/ΕΚ. Η πρόσβαση στα μητρώα και τα δεδομένα πρέπει να δίδεται μόνον σε άτομα που έχουν εξουσιοδοτηθεί από τον υπεύθυνο καθώς και στην αρμόδια αρχή για σκοπούς επιθεώρησης και εφαρμογής μέτρων ελέγχου. |
ΣΤ. ΕΛΕΓΧΟΣ ΠΟΙΟΤΗΤΑΣ
|
1. |
Πρέπει να υπάρχει σύστημα ελέγχου των δραστηριοτήτων για τις οποίες ζητείται διαπίστευση/ορισμός/έγκριση ή αδειοδότηση. Ο έλεγχος πρέπει να διεξάγεται κατά αμερόληπτο τρόπο από εκπαιδευμένα και ικανά άτομα, τουλάχιστον ανά διετία, με στόχο την επαλήθευση της τήρησης των εγκεκριμένων πρωτοκόλλων και κανονιστικών απαιτήσεων. Τα ευρήματα και οι διορθωτικές ενέργειες πρέπει να τεκμηριώνονται. |
|
2. |
Ενδεχόμενες αποκλίσεις από τα απαιτούμενα πρότυπα ποιότητας και ασφάλειας πρέπει να οδηγούν σε τεκμηριωμένες έρευνες, συμπεριλαμβανομένων των αποφάσεων για πιθανές ενέργειες διορθωτικού και προληπτικού χαρακτήρα. Το μέλλον των μη συμμορφούμενων ιστών και κυττάρων πρέπει να αποφασίζεται σύμφωνα με γραπτές διαδικασίες υπό την επιτήρηση του υπευθύνου και να καταγράφεται. Όλοι οι εν λόγω ιστοί και τα κύτταρα πρέπει να ταυτοποιούνται και να τεκμηριώνονται. |
|
3. |
Οι διορθωτικές ενέργειες πρέπει να τεκμηριώνονται, να ξεκινούν και να ολοκληρώνονται έγκαιρα και αποτελεσματικά. Μετά την εφαρμογή τους, οι ενέργειες προληπτικού και διορθωτικού χαρακτήρα πρέπει να αξιολογούνται αναφορικά με την αποτελεσματικότητά τους. |
|
4. |
Το ίδρυμα ιστών πρέπει να εφαρμόζει διαδικασίες εξέτασης της αποτελεσματικότητας του συστήματος διαχείρισης ποιότητας έτσι ώστε να εξασφαλίζεται συνεχής και συστηματική βελτίωση. |
(1) ΕΕ L 169 της 12.7.1993, σ. 1. Οδηγία όπως τροποποιήθηκε τελευταία με τον κανονισμό (ΕΚ) αριθ. 1882/2003 του Ευρωπαϊκού Κοινοβουλίου και του Συμβουλίου (ΕΕ L 284 της 31.10.2003, σ. 1).
(2) ΕΕ L 331 της 7.12.1998, σ. 1. Οδηγία όπως τροποποιήθηκε με τον κανονισμό (ΕΚ) αριθ. 1882/2003.
ΠΑΡΑΡΤΗΜΑ ΙΙ
Απαιτήσεις για την έγκριση των διαδικασιών παρασκευής ιστών και κυττάρων σε ιδρύματα ιστών σύμφωνα με το άρθρο 4
Η αρμόδια αρχή εγκρίνει τη διαδικασία παρασκευής ιστών και κυττάρων κατόπιν αξιολόγησης των κριτηρίων επιλογής του δότη και των διαδικασιών προμήθειας, των πρωτοκόλλων για κάθε στάδιο της διαδικασίας, των κριτηρίων διαχείρισης της ποιότητας και των τελικών ποσοτικών και ποιοτικών κριτηρίων για ιστούς και κύτταρα. Η αξιολόγηση αυτή πρέπει να είναι σύμφωνη τουλάχιστον με τις απαιτήσεις που καθορίζονται στο παρόν παράρτημα.
Α. ΠΑΡΑΛΑΒΗ ΣΤΟ ΙΔΡΥΜΑ ΙΣΤΩΝ
Κατά την παραλαβή των προμηθευθέντων ιστών και κυττάρων στο ίδρυμα ιστών, οι ιστοί και τα κύτταρα πρέπει να συνάδουν με τις απαιτήσεις που ορίζονται στην οδηγία 2006/17/ΕΚ.
Β. ΕΠΕΞΕΡΓΑΣΙΑ
Όταν οι δραστηριότητες για τις οποίες ζητείται διαπίστευση/ορισμός/έγκριση ή αδειοδότηση περιλαμβάνουν την επεξεργασία ιστών και κυττάρων, οι διαδικασίες του ιδρύματος ιστών πρέπει να είναι σύμφωνες με τα ακόλουθα κριτήρια:
|
1. |
Οι κρίσιμες διαδικασίες επεξεργασίας πρέπει να είναι επικυρωμένες και δεν πρέπει να καθιστούν τους ιστούς ή τα κύτταρα κλινικά αναποτελεσματικά ή επιβλαβή για το λήπτη. Η εν λόγω επικύρωση πρέπει να βασίζεται σε μελέτες που πραγματοποιεί το ίδιο το ίδρυμα ή σε δεδομένα δημοσιευμένων μελετών ή, όσον αφορά καθιερωμένες διαδικασίες επεξεργασίας, σε αναδρομική αξιολόγηση των κλινικών αποτελεσμάτων ιστών που έχει διαθέσει το ίδρυμα. |
|
2. |
Πρέπει να αποδεικνύεται ότι η επικυρωμένη επεξεργασία είναι δυνατόν να διεξαχθεί αποτελεσματικά και με συνέπεια από το προσωπικό στο περιβάλλον του ιδρύματος ιστών. |
|
3. |
Οι διαδικασίες πρέπει να τεκμηριώνονται σε ΤΔΛ, οι οποίες πρέπει να είναι σύμφωνες με την επικυρωμένη μέθοδο και τα πρότυπα που θεσπίζονται στην παρούσα οδηγία, σύμφωνα με το παράρτημα Ι Ε σημεία 1 έως 4. |
|
4. |
Πρέπει να εξασφαλίζεται ότι όλες οι διαδικασίες λαμβάνουν χώρα σύμφωνα με τις εγκεκριμένες ΤΔΛ. |
|
5. |
Όταν εφαρμόζεται διαδικασία μικροβιακής αδρανοποίησης στους ιστούς ή τα κύτταρα, πρέπει να διευκρινίζεται, να τεκμηριώνεται και να επικυρώνεται. |
|
6. |
Πριν από την πραγματοποίηση οιασδήποτε σημαντικής αλλαγής στην επεξεργασία, η τροποποιηθείσα διαδικασία πρέπει να επικυρώνεται και να τεκμηριώνεται. |
|
7. |
Οι διαδικασίες επεξεργασίας πρέπει να αξιολογούνται τακτικά και αυστηρά ώστε να εξασφαλίζεται ότι συνεχίζουν να επιτυγχάνουν τα σκοπούμενα αποτελέσματα. |
|
8. |
Οι διαδικασίες απόρριψης ιστών και κυττάρων πρέπει να προλαμβάνουν τη μόλυνση άλλων δωρεών και προϊόντων, του περιβάλλοντος επεξεργασίας και του προσωπικού. Οι διαδικασίες αυτές πρέπει να είναι σύμφωνες με την εθνική νομοθεσία. |
Γ. ΑΠΟΘΗΚΕΥΣΗ ΚΑΙ ΧΡΗΣΙΜΟΠΟΙΗΣΗ ΠΡΟΪΟΝΤΩΝ
Όταν οι δραστηριότητες για τις οποίες ζητείται διαπίστευση/ορισμός/έγκριση ή αδειοδότηση περιλαμβάνουν την αποθήκευση και διάθεση ιστών και κυττάρων, οι διαδικασίες του εγκεκριμένου ιδρύματος ιστών πρέπει να είναι σύμφωνες με τα ακόλουθα κριτήρια:
|
1. |
Ο ανώτατος χρόνος αποθήκευσης πρέπει να προσδιορίζεται για κάθε είδος συνθήκης αποθήκευσης. Η επιλεγείσα περίοδος πρέπει, μεταξύ άλλων, να αντανακλά τυχόν επιδείνωση των απαιτούμενων ιδιοτήτων των ιστών και των κυττάρων. |
|
2. |
Πρέπει να υπάρχει σύστημα καταλόγου απογραφής των ιστών ή/και κυττάρων ώστε να εξασφαλίζεται ότι η χρησιμοποίησή τους δεν είναι δυνατή έως ότου πληρωθούν όλες οι απαιτήσεις που προβλέπονται στην παρούσα οδηγία. Πρέπει να υπάρχει τυποποιημένη διαδικασία λειτουργίας που να περιγράφει λεπτομερώς τις συνθήκες, αρμοδιότητες και διαδικασίες διάθεσης ιστών και κυττάρων προς διανομή. |
|
3. |
Τα κατάλληλα προς διάθεση προϊόντα πρέπει να διαχωρίζονται με σαφήνεια από τα μη διατιθέμενα (σε καραντίνα) και τα απορριφθέντα προϊόντα μέσω συστήματος ταυτοποίησης ιστών και κυττάρων σε κάθε στάδιο επεξεργασίας στο ίδρυμα ιστών. |
|
4. |
Τα αρχεία πρέπει να αποδεικνύουν ότι, πριν από τη διάθεση των ιστών και των κυττάρων, πληρούνται όλες οι ενδεδειγμένες προδιαγραφές, ιδιαίτερα ότι όλα τα ισχύοντα έντυπα δήλωσης, τα σχετικά ιατρικά αρχεία, τα αρχεία επεξεργασίας και τα αποτελέσματα δοκιμών έχουν επαληθευθεί στο πλαίσιο γραπτής διαδικασίας από άτομο εξουσιοδοτημένο για το έργο αυτό από τον υπεύθυνο σύμφωνα με το άρθρο 17 της οδηγίας 2004/23/ΕΚ. Στην περίπτωση που χρησιμοποιείται υπολογιστής για τη διάθεση αποτελεσμάτων του εργαστηρίου, η διαδρομή ελέγχου πρέπει να δείχνει ποιο άτομο ήταν υπεύθυνο για τη διάθεση των αποτελεσμάτων. |
|
5. |
Στην περίπτωση που εισαχθούν νέα κριτήρια επιλογής δότη ή ελέγχων ή οιοδήποτε σημαντικά τροποποιηθέν στάδιο επεξεργασίας που ενισχύει την ασφάλεια ή την ποιότητα, πρέπει να πραγματοποιείται τεκμηριωμένη αξιολόγηση κινδύνου η οποία πρέπει να εγκρίνεται από τον υπεύθυνο σύμφωνα με το άρθρο 17 της οδηγίας 2004/23/ΕΚ προκειμένου να προσδιορισθεί η πορεία όλων των αποθηκευμένων ιστών και κυττάρων. |
Δ. ΔΙΑΝΟΜΗ ΚΑΙ ΑΝΑΚΛΗΣΗ
Όταν οι δραστηριότητες για τις οποίες ζητείται διαπίστευση/ορισμός/έγκριση ή αδειοδότηση περιλαμβάνουν τη διανομή ιστών και κυττάρων, οι διαδικασίες του εγκριθέντος ιδρύματος ιστών πρέπει να είναι σύμφωνες με τα ακόλουθα κριτήρια:
|
1. |
Πρέπει να καθορίζονται οι κρίσιμες παράμετροι που αφορούν τις συνθήκες μεταφοράς, όπως η θερμοκρασία και τα χρονικά όρια, έτσι ώστε να διατηρούνται οι απαιτούμενες ιδιότητες των ιστών και των κυττάρων. |
|
2. |
Ο περιέκτης/η συσκευασία πρέπει να είναι ασφαλής και να εξασφαλίζει ότι οι ιστοί και τα κύτταρα διατηρούνται υπό τις καθορισμένες συνθήκες. Όλοι οι περιέκτες και όλες οι συσκευασίες πρέπει να επικυρώνονται ως κατάλληλοι(-ες) για τη σκοπούμενη χρήση. |
|
3. |
Όταν η διανομή έχει ανατεθεί σε τρίτο, πρέπει να υπάρχει τεκμηριωμένη σύμβαση για να εξασφαλίζεται η τήρηση των απαιτούμενων συνθηκών. |
|
4. |
Στο ίδρυμα ιστών πρέπει να υπάρχει εξουσιοδοτημένο προσωπικό που θα αξιολογεί τις ανάγκες ανάκλησης και θα δρομολογεί και θα συντονίζει τις απαραίτητες ενέργειες. |
|
5. |
Πρέπει να εφαρμόζεται αποτελεσματική διαδικασία ανάκλησης, συμπεριλαμβανομένης της περιγραφής των αρμοδιοτήτων και δράσεων που πρέπει να αναληφθούν. Σε αυτές πρέπει να περιλαμβάνεται η κοινοποίηση στην αρμόδια αρχή. |
|
6. |
Οι ενέργειες πρέπει να αναλαμβάνονται εντός προκαθορισμένων χρονικών ορίων και να περιλαμβάνουν τον εντοπισμό όλων των σχετικών ιστών και κυττάρων και, κατά περίπτωση, ιχνηλάτηση. Στόχος της διερεύνησης είναι ο εντοπισμός δότη που μπορεί να έχει συμβάλει στην πρόκληση της αντίδρασης στο λήπτη και η ανάκληση των ιστών και κυττάρων που είναι διαθέσιμα από τον ίδιο δότη, καθώς και η ενημέρωση των παραληπτών και αποδεκτών των ιστών και των κυττάρων που έχουν συλλεγεί από τον ίδιο δότη σε περίπτωση που θα μπορούσαν να έχουν τεθεί σε κίνδυνο. |
|
7. |
Πρέπει να προβλέπονται διαδικασίες για τη διεκπεραίωση αιτήσεων για ιστούς και κύτταρα. Οι κανόνες που διέπουν την εκχώρηση ιστών και κυττάρων σε ορισμένους ασθενείς ή ιδρύματα υγειονομικής περίθαλψης πρέπει να είναι τεκμηριωμένοι και να κοινοποιούνται στα μέρη αυτά κατόπιν σχετικής αίτησης. |
|
8. |
Πρέπει να υπάρχει τεκμηριωμένο σύστημα για τη διαχείριση των προϊόντων που έχουν επιστραφεί, συμπεριλαμβανομένων, κατά περίπτωση, των κριτηρίων αποδοχής τους στον κατάλογο απογραφής. |
Ε. ΤΕΛΙΚΗ ΕΠΙΣΗΜΑΝΣΗ ΓΙΑ ΤΗ ΔΙΑΝΟΜΗ
|
1. |
Στο αρχικό περιέκτη ιστών/κυττάρων πρέπει να αναγράφονται οι ακόλουθες πληροφορίες:
Αν κάποια από τις πληροφορίες των στοιχείων δ) έως ε) δεν μπορεί να περιληφθεί στην επισήμανση του αρχικού περιέκτη, πρέπει να παρασχεθεί σε ξεχωριστό φύλλο που θα συνοδεύει τον αρχικό περιέκτη. Το φύλλο αυτό πρέπει να είναι συσκευασμένο μαζί με τον αρχικό περιέκτη κατά τρόπο που να εξασφαλίζει ότι θα παραμένουν μαζί. |
|
2. |
Οι ακόλουθες πληροφορίες πρέπει να παρέχονται είτε στην επισήμανση είτε σε συνοδευτικό έγγραφο:
|
ΣΤ. ΕΞΩΤΕΡΙΚΗ ΕΠΙΣΗΜΑΝΣΗ ΤΟΥ ΠΕΡΙΕΚΤΗ ΑΠΟΣΤΟΛΗΣ
Για τη μεταφορά, ο αρχικός περιέκτης πρέπει να τοποθετείται σε περιέκτη μεταφοράς ο οποίος πρέπει να φέρει επισήμανση με τις ακόλουθες πληροφορίες τουλάχιστον:
|
α) |
στοιχεία ταυτοποίησης του αρχικού ιδρύματος ιστών, συμπεριλαμβανομένης της διεύθυνσης και του αριθμού τηλεφώνου του· |
|
β) |
στοιχεία ταυτοποίησης του οργανισμού προορισμού που είναι υπεύθυνος για την ανθρώπινη εφαρμογή, συμπεριλαμβανομένης της διεύθυνσης και του αριθμού τηλεφώνου του· |
|
γ) |
δήλωση για το ότι η συσκευασία περιέχει ανθρώπινους ιστούς/κύτταρα καθώς και την επισήμανση «ΕΥΘΡΑΥΣΤΟ»· |
|
δ) |
στην περίπτωση που για τη λειτουργία του μοσχεύματος απαιτούνται ζώντα κύτταρα, όπως γαμέτες, βλαστικά κύτταρα και έμβρυα, πρέπει να προστίθενται τα ακόλουθα: «ΝΑ ΜΗΝ ΑΚΤΙΝΟΒΟΛΗΘΕΙ»· |
|
ε) |
συνιστώμενες συνθήκες μεταφοράς (π.χ. διατήρηση στη σωστή θερμοκρασία, σε όρθια θέση κ.λπ.)· |
|
στ) |
οδηγίες ασφάλειας/μέθοδος διατήρησης στη σωστή θερμοκρασία (όπου χρειάζεται). |
ΠΑΡΑΡΤΗΜΑ III
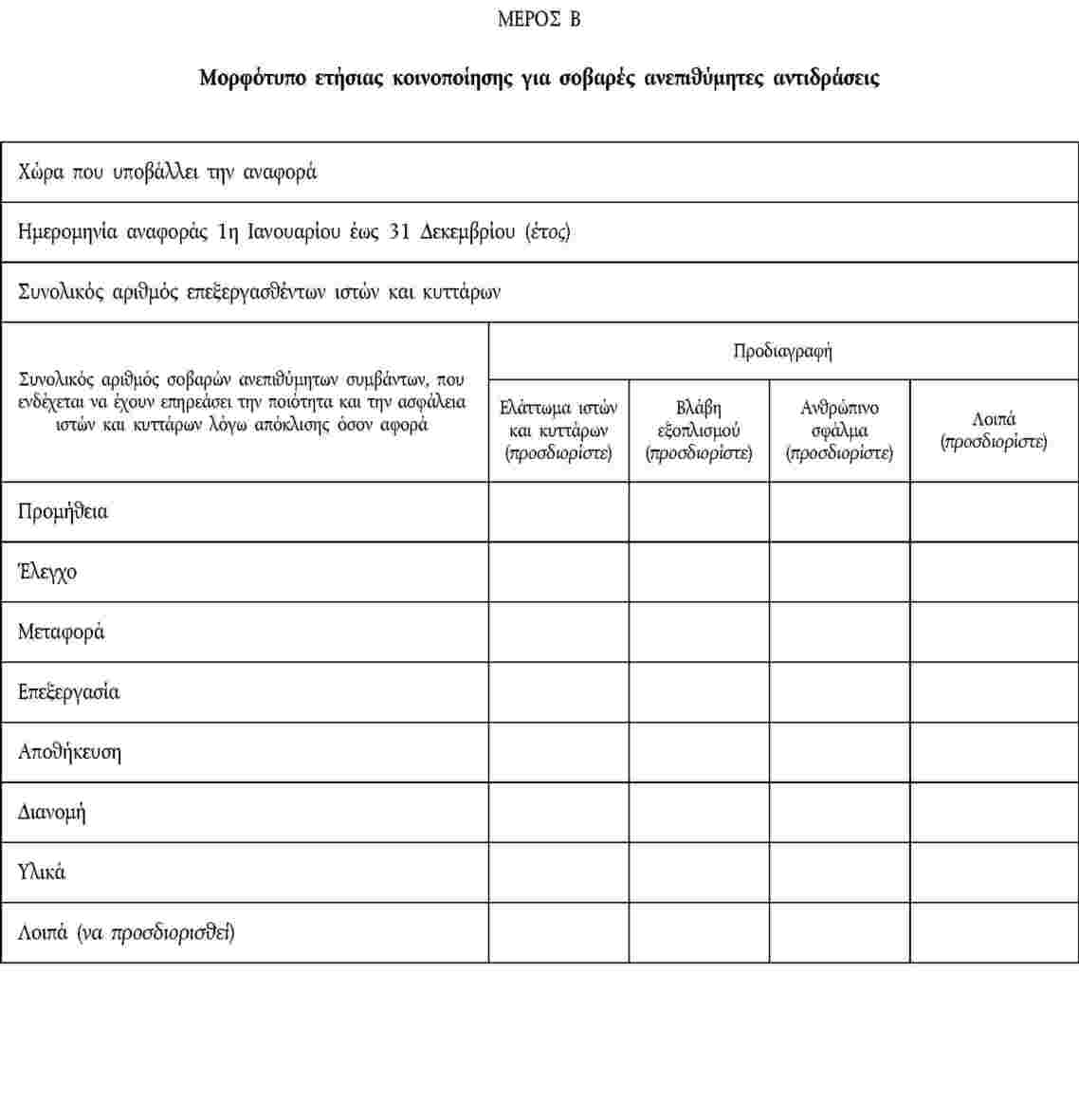
ΚΟΙΝΟΠΟΙΗΣΗ ΣΟΒΑΡΩΝ ΑΝΕΠΙΘΥΜΗΤΩΝ ΑΝΤΙΔΡΑΣΕΩΝ


ΠΑΡΑΡΤΗΜΑ IV
ΚΟΙΝΟΠΟΙΗΣΗ ΣΟΒΑΡΩΝ ΑΝΕΠΙΘΥΜΗΤΩΝ ΣΥΜΒΑΝΤΩΝ

ΠΑΡΑΡΤΗΜΑ V
ΜΟΡΦΟΤΥΠΟ ΕΤΗΣΙΑΣ ΚΟΙΝΟΠΟΙΗΣΗΣ

ΠΑΡΑΡΤΗΜΑ VI
Πληροφορίες σχετικά με το ελάχιστο σύνολο δεδομένων που πρέπει να τηρούνται αναφορικά με το δότη/λήπτη σύμφωνα με το άρθρο 9
Α. ΑΠΟ ΤΑ ΙΔΡΥΜΑΤΑ ΙΣΤΩΝ
Στοιχεία ταυτότητας δότη.
Στοιχεία ταυτοποίησης της δωρεάς, που περιλαμβάνουν τουλάχιστον τα ακόλουθα:
|
— |
στοιχεία ταυτοποίησης του οργανισμού προμήθειας ή του ιδρύματος ιστών, |
|
— |
μοναδικό αριθμό ταυτοποίησης δωρεάς, |
|
— |
ημερομηνία προμήθειας, |
|
— |
τόπο προμήθειας, |
|
— |
είδος της δωρεάς (π.χ. ενός ή πολλών ιστών· αυτόλογη ή αλλογενής· από ζώντα ή νεκρό). |
Στοιχεία ταυτοποίησης προϊόντος, που περιλαμβάνουν τουλάχιστον τα ακόλουθα:
|
— |
στοιχεία ταυτοποίησης του ιδρύματος ιστών, |
|
— |
είδος του προϊόντος των ιστών και κυττάρων (βασική ονοματολογία), |
|
— |
αριθμό της ομάδας παρτίδων (εάν υπάρχει), |
|
— |
αριθμό της υποπαρτίδας (εάν υπάρχει), |
|
— |
ημερομηνία λήξης, |
|
— |
κατάσταση των ιστών/κυττάρων (καραντίνα, κατάλληλα προς χρήση κ.λπ.), |
|
— |
περιγραφή και προέλευση των προϊόντων, των εφαρμοζόμενων σταδίων επεξεργασίας, των υλικών και πρόσθετων που έρχονται σε επαφή με τους ιστούς και τα κύτταρα και επηρεάζουν την ποιότητα ή/και την ασφάλεια, |
|
— |
στοιχεία ταυτοποίησης της εγκατάστασης που εκδίδει την τελική επισήμανση. |
Στοιχεία ταυτοποίησης της εφαρμογής στον άνθρωπο, που περιλαμβάνουν τουλάχιστον τα ακόλουθα:
|
— |
ημερομηνία διανομής/διάθεσης, |
|
— |
στοιχεία ταυτοποίησης του ιατρού ή του τελικού χρήστη/εγκατάστασης. |
Β. ΑΠΟ ΤΟΥΣ ΟΡΓΑΝΙΣΜΟΥΣ ΠΟΥ ΕΙΝΑΙ ΥΠΕΥΘΥΝΟΙ ΓΙΑ ΤΗΝ ΑΝΘΡΩΠΙΝΗ ΕΦΑΡΜΟΓΗ
|
α) |
Στοιχεία ταυτοποίησης του προμηθευτή ιδρύματος ιστών. |
|
β) |
Στοιχεία ταυτοποίησης του ιατρού ή του τελικού χρήστη/εγκατάστασης. |
|
γ) |
Είδος ιστών και κυττάρων. |
|
δ) |
Ταυτοποίηση του προϊόντος. |
|
ε) |
Στοιχεία ταυτοποίησης του λήπτη. |
|
στ) |
Ημερομηνία αίτησης. |
ΠΑΡΑΡΤΗΜΑ VII
Πληροφορίες που περιλαμβάνονται στο ευρωπαϊκό σύστημα κωδικοποίησης
|
α) |
Στοιχεία ταυτοποίησης της δωρεάς:
|
|
β) |
Ταυτοποίηση του προϊόντος:
|