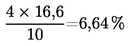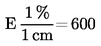EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 32009R0152
Commission Regulation (EC) No 152/2009 of 27 January 2009 laying down the methods of sampling and analysis for the official control of feed (Text with EEA relevance)
Κανονισμός (ΕΚ) αριθ. 152/2009 της Επιτροπής, της 27ης Ιανουαρίου 2009 , για τον καθορισμό μεθόδων δειγματοληψίας και ανάλυσης για τον επίσημο έλεγχο των ζωοτροφών (Κείμενο που παρουσιάζει ενδιαφέρον για τον ΕΟΧ)
Κανονισμός (ΕΚ) αριθ. 152/2009 της Επιτροπής, της 27ης Ιανουαρίου 2009 , για τον καθορισμό μεθόδων δειγματοληψίας και ανάλυσης για τον επίσημο έλεγχο των ζωοτροφών (Κείμενο που παρουσιάζει ενδιαφέρον για τον ΕΟΧ)
OJ L 54, 26.2.2009, p. 1–130
(BG, ES, CS, DA, DE, ET, EL, EN, FR, IT, LV, LT, HU, MT, NL, PL, PT, RO, SK, SL, FI, SV)
Special edition in Croatian: Chapter 03 Volume 006 P. 3 - 132
 In force: This act has been changed. Current consolidated version: 04/04/2024
In force: This act has been changed. Current consolidated version: 04/04/2024
|
26.2.2009 |
EL |
Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης |
L 54/1 |
ΚΑΝΟΝΙΣΜΌΣ (ΕΚ) αριθ. 152/2009 ΤΗΣ ΕΠΙΤΡΟΠΉΣ
της 27ης Ιανουαρίου 2009
για τον καθορισμό μεθόδων δειγματοληψίας και ανάλυσης για τον επίσημο έλεγχο των ζωοτροφών
(Κείμενο που παρουσιάζει ενδιαφέρον για τον ΕΟΧ)
Η ΕΠΙΤΡΟΠΗ ΤΩΝ ΕΥΡΩΠΑΪΚΩΝ ΚΟΙΝΟΤΗΤΩΝ,
Έχοντας υπόψη:
τη συνθήκη για την ίδρυση της Ευρωπαϊκής Κοινότητας,
τον κανονισμό (ΕΚ) αριθ. 882/2004 του Ευρωπαϊκού Κοινοβουλίου και του Συμβουλίου, της 29ης Απριλίου 2004, για τη διενέργεια επισήμων ελέγχων της συμμόρφωσης προς τη νομοθεσία περί ζωοτροφών και τροφίμων και προς τους κανόνες για την υγεία και την καλή διαβίωση των ζώων (1), και ιδίως το άρθρο 11 παράγραφος 4 στοιχεία α), β) και γ),
Εκτιμώντας τα ακόλουθα:
|
(1) |
Οι ακόλουθες πράξεις θεσπίστηκαν για την υλοποίηση της οδηγίας 70/373/ΕΟΚ και παραμένουν σε ισχύ σύμφωνα με το άρθρο 61 παράγραφος 2 του κανονισμού (ΕΚ) αριθ. 882/2004:
|
|
(2) |
Δεδομένου ότι η οδηγία 70/373/ΕΟΚ αντικαταστάθηκε από τον κανονισμό (ΕΚ) αριθ. 882/2004, κρίνεται σκόπιμο να αντικατασταθούν οι πράξεις υλοποίησης της εν λόγω οδηγίας από έναν ενιαίο κανονισμό. Ταυτόχρονα, οι μέθοδοι πρέπει να προσαρμοστούν στην πρόοδο της επιστημονικής και τεχνολογικής γνώσης. Οι μέθοδοι που δεν είναι πλέον έγκυρες για το σκοπό τον οποίο προορίζονται πρέπει να καταργηθούν. Προβλέπεται η ενημέρωση των διατάξεων δειγματοληψίας εν ευθέτω χρόνο προκειμένου να ληφθούν υπόψη οι πρόσφατες εξελίξεις στον τρόπο παραγωγής, αποθήκευσης, μεταφοράς και διάθεσης των ζωοτροφών στην αγορά. Εντούτοις, κρίνεται σκόπιμο να διατηρηθούν προς το παρόν οι υφιστάμενες διατάξεις περί δειγματοληψίας. |
|
(3) |
Συνεπώς, οι οδηγίες 71/250/ΕΟΚ, 71/393/ΕΟΚ, 72/199/ΕΟΚ, 73/46/ΕΟΚ, 76/371/ΕΟΚ, 76/372/ΕΟΚ, 78/633/ΕΟΚ, 81/715/ΕΟΚ, 84/425/ΕΟΚ, 86/174/ΕΟΚ, 93/70/ΕΟΚ, 93/117/ΕΚ, 98/64/ΕΚ, 1999/27/ΕΚ, 1999/76/ΕΚ, 2000/45/ΕΚ, 2002/70/ΕΚ και 2003/126/ΕΚ πρέπει να καταργηθούν. |
|
(4) |
Τα μέτρα που προβλέπονται στον παρόντα κανονισμό είναι σύμφωνα με τη γνώμη της μόνιμης επιτροπής για την τροφική αλυσίδα και την υγεία των ζώων, |
ΕΞΕΔΩΣΕ ΤΟΝ ΠΑΡΟΝΤΑ ΚΑΝΟΝΙΣΜΟ:
Άρθρο 1
Η δειγματοληψία για τον επίσημο έλεγχο των ζωοτροφών, όσον αφορά τον καθορισμό των συστατικών, των πρόσθετων υλών και των ανεπιθύμητων ουσιών, με εξαίρεση τα υπολείμματα φυτοφαρμάκων και μικροοργανισμών, διενεργείται σύμφωνα με τις μεθόδους που καθορίζονται στο παράρτημα I.
Άρθρο 2
Η προετοιμασία δειγμάτων για ανάλυση και η έκφραση των αποτελεσμάτων διενεργούνται σύμφωνα με τις μεθόδους που καθορίζονται στο παράρτημα II.
Άρθρο 3
Η ανάλυση για τον επίσημο έλεγχο των ζωοτροφών διενεργείται εφαρμόζοντας τις μεθόδους που αναφέρονται στο παράρτημα III (Μέθοδοι ανάλυσης για τον έλεγχο της σύστασης των πρώτων υλών ζωοτροφών και των σύνθετων ζωοτροφών), στο παράρτημα IV (Μέθοδοι ανάλυσης για τον έλεγχο της περιεκτικότητας ζωοτροφών σε εγκεκριμένες πρόσθετες ύλες), στο παράρτημα V (Μέθοδοι ανάλυσης για τον έλεγχο των ανεπιθύμητων ουσιών στις ζωοτροφές) και στο παράρτημα VI (Μέθοδοι ανάλυσης για τον προσδιορισμό των συστατικών ζωικής προέλευσης για τον επίσημο έλεγχο των ζωοτροφών).
Άρθρο 4
Η ενεργειακή αξία των σύνθετων ζωοτροφών για πουλερικά υπολογίζεται σύμφωνα με το παράρτημα VII.
Άρθρο 5
Οι μέθοδοι ανάλυσης για τον έλεγχο της παράνομης περιεκτικότητας ζωοτροφών σε μη εγκεκριμένες πλέον πρόσθετες ύλες οι οποίες περιέχονται στο παράρτημα VIII χρησιμοποιούνται για λόγους επιβεβαίωσης.
Άρθρο 6
Οι οδηγίες 71/250/ΕΟΚ, 71/393/ΕΟΚ, 72/199/ΕΟΚ, 73/46/ΕΟΚ, 76/371/ΕΟΚ, 76/372/ΕΟΚ, 78/633/ΕΟΚ, 81/715/ΕΟΚ, 84/425/ΕΟΚ, 86/174/ΕΟΚ, 93/70/ΕΟΚ, 93/117/ΕΚ, 98/64/ΕΚ, 1999/27/ΕΚ, 1999/76/ΕΚ, 2000/45/ΕΚ, 2002/70/ΕΚ και 2003/126/ΕΚ καταργούνται.
Οι αναφορές στις καταργούμενες οδηγίες νοούνται ως αναφορές στην παρούσα οδηγία και διαβάζονται σύμφωνα με τους πίνακες αντιστοιχίας του παραρτήματος IX.
Άρθρο 7
Ο παρών κανονισμός αρχίζει να ισχύει την εικοστή ημέρα από τη δημοσίευσή του στην Επίσημη Εφημερίδα της Ευρωπαϊκής Ένωσης.
Εφαρμόζεται από τις 26 Αυγούστου 2009.
Ο παρών κανονισμός είναι δεσμευτικός ως προς όλα τα μέρη του και ισχύει άμεσα σε κάθε κράτος μέλος.
Βρυξέλλες, 27 Ιανουαρίου 2009.
Για την Επιτροπή
Ανδρούλλα ΒΑΣΙΛΕΙΟΥ
Μέλος της Επιτροπής
(1) ΕΕ L 165 της 30.4.2004, σ. 1· διορθώθηκε στην ΕΕ L 191 της 28.5.2004, σ. 1.
(2) ΕΕ L 155 της 12.7.1971, σ. 13.
(3) ΕΕ L 279 της 20.12.1971, σ. 7.
(4) ΕΕ L 123 της 29.5.1972, σ. 6.
(5) ΕΕ L 83 της 30.3.1973, σ. 21.
(6) ΕΕ L 102 της 15.4.1976, σ. 1.
(7) ΕΕ L 102 της 15.4.1976, σ. 8.
(8) ΕΕ L 206 της 29.7.1978, σ. 43.
(9) ΕΕ L 257 της 10.9.1981, σ. 38.
(10) ΕΕ L 238 της 6.9.1984, σ. 34.
(11) ΕΕ L 130 της 16.5.1986, σ. 53.
(12) ΕΕ L 234 της 17.9.1993, σ. 17.
(13) ΕΕ L 329 της 30.12.1993, σ. 54.
(14) ΕΕ L 257 της 19.9.1998, σ. 14.
(15) ΕΕ L 118 της 6.5.1999, σ. 36.
(16) ΕΕ L 207 της 6.8.1999, σ. 13.
(17) ΕΕ L 174 της 13.7.2000, σ. 32.
(18) ΕΕ L 209 της 6.8.2002, σ. 15.
(19) ΕΕ L 339 της 24.12.2003, σ. 78.
ΠΑΡΑΡΤΗΜΑ I
ΜΕΘΟΔΟΙ ΔΕΙΓΜΑΤΟΛΗΨΙΑΣ
1. ΑΝΤΙΚΕΙΜΕΝΟ ΚΑΙ ΠΕΔΙΟ ΕΦΑΡΜΟΓΗΣ
Τα δείγματα τα οποία προορίζονται για τους επισήμους ελέγχους των ζωοτροφών λαμβάνονται σύμφωνα με τις μεθόδους που υποδεικνύονται παρακάτω. Τα δείγματα που αποκτήθηκαν με τον τρόπο αυτόν θεωρούνται ως αντιπροσωπευτικά των παρτίδων.
2. ΠΡΟΣΩΠΙΚΟ ΔΕΙΓΜΑΤΟΛΗΨΙΑΣ
Η δειγματοληψία γίνεται από πρόσωπα εξουσιοδοτημένα για το σκοπό αυτό από τα κράτη μέλη.
3. ΟΡΙΣΜΟΙ
Παρτίδα: Ποσότητα προϊόντων τα οποία αποτελούν μία ενότητα και τα οποία θεωρείται ότι έχουν ομοιόμορφα χαρακτηριστικά.
Στοιχειώδες δείγμα: Ποσότητα λαμβανομένη σε ένα σημείο της παρτίδας.
Ολικό δείγμα: Σύνολο στοιχειωδών δειγμάτων τα οποία λαμβάνονται από την ίδια παρτίδα.
Μειωμένο δείγμα: Αντιπροσωπευτικό τμήμα του ολικού δείγματος, το οποίο λαμβάνεται με μείωση αυτού.
Τελικό δείγμα: Τμήμα του μειωμένου δείγματος ή του ολικού δείγματος το οποίο έχει γίνει ομοιογενές.
4. ΟΡΓΑΝΑ
|
4.1. |
Οι συσκευές οι οποίες προορίζονται για τη δειγματοληψία πρέπει να κατασκευάζονται από υλικά τα οποία δεν μολύνουν τα προς δειγματοληψία προϊόντα. Οι συσκευές αυτές είναι δυνατόν να έχουν την έγκριση των κρατών μελών. |
4.2. Προτεινόμενες συσκευές για τη δειγματοληψία των στερεών ζωοτροφών
4.2.1. Δειγματοληψία διά χειρός
|
4.2.1.1. |
Σπάτουλα με πλατύ πυθμένα και κάθετα χείλη. |
|
4.2.1.2. |
Δειγματολήπτης με μακρύ αυλό ή χωρισμένος σε διαμερίσματα. Οι διαστάσεις του δειγματολήπτη πρέπει να έχουν προσαρμοσθεί ανάλογα με τα χαρακτηριστικά της παρτίδας (βάθος δοχείου, διαστάσεις σάκου κ.λπ.) και το μέγεθος των τεμαχιδίων που συνιστούν τη ζωοτροφή. |
4.2.2. Μηχανική δειγματοληψία
Για τη δειγματοληψία των κινουμένων ζωοτροφών δύνανται να χρησιμοποιηθούν εγκεκριμένες μηχανικές συσκευές.
4.2.3. Διαχωριστής
Συσκευές που προορίζονται για τη διαίρεση του δείγματος σε ίσα περίπου τμήματα μπορούν να χρησιμοποιηθούν για τα στοιχειώδη δείγματα καθώς και για την παρασκευή των μειωμένων και τελικών δειγμάτων.
5. ΠΟΣΟΤΙΚΕΣ ΑΠΑΙΤΗΣΕΙΣ
|
5.A. |
Για τους ελέγχους των ουσιών ή των προϊόντων που κατανέμονται ομοιόμορφα μέσα στις ζωοτροφές |
|
|
5.A.1. |
Παρτίδα Το μέγεθος της παρτίδας πρέπει να είναι τέτοιο ώστε να είναι εφικτή η δειγματοληψία από όλα τα τμήματα που την αποτελούν. |
|
|
5.A.2. |
Στοιχειώδη δείγματα |
|
|
5.A.2.1. |
Μη συσκευασμένες ζωοτροφές (χύμα): |
Ελάχιστος αριθμός στοιχειωδών δειγμάτων: |
|
5.A.2.1.1. |
παρτίδες που δεν υπερβαίνουν τους 2,5 τόνους |
7 |
|
5.A.2.1.2. |
παρτίδες άνω των 2,5 τόνων |
√ το γινόμενο του αριθμού των τόνων που αποτελούν την παρτίδα επί 20 (1) περιορίζεται σε ένα μέγιστο 40 στοιχειωδών δειγμάτων |
|
5.A.2.2. |
Συσκευασμένες ζωοτροφές: |
Ελάχιστος αριθμός συσκευασιών για δειγματοληψία (2): |
|
5.A.2.2.1. |
συσκευασίες με περιεχόμενο ανώτερο του ενός χιλιογράμμου: |
|
|
5.A.2.2.1.1. |
παρτίδες αποτελούμενες από 1 μέχρι 4 συσκευασίες |
όλες οι συσκευασίες |
|
5.A.2.2.1.2. |
παρτίδες αποτελούμενες από 5 μέχρι 16 συσκευασίες |
4 |
|
5.A.2.2.1.3. |
παρτίδες αποτελούμενες από περισσότερες των 16 συσκευασιών |
√ ο αριθμός των συσκευασιών που αποτελούν την παρτίδα (1) περιορίζεται σε ένα μέγιστο 20 συσκευασιών |
|
5.A.2.2.2. |
συσκευασίες των οποίων το περιεχόμενο δεν υπερβαίνει το ένα χιλιόγραμμο |
4 |
|
5.A.2.3. |
Υγρές ή ημίρρευστες ζωοτροφές: |
Ελάχιστος αριθμός δοχείων για δειγματοληψία (2): |
|
5.A.2.3.1. |
δοχεία με περιεχόμενο ανώτερο του ενός λίτρου: |
|
|
5.A.2.3.1.1. |
παρτίδες αποτελούμενες από 1 μέχρι 4 δοχεία |
όλα τα δοχεία |
|
5.A.2.3.1.2. |
παρτίδες αποτελούμενες από 5 μέχρι 16 δοχεία |
4 |
|
5.A.2.3.1.3. |
παρτίδες αποτελούμενες από περισσότερα των 16 δοχείων |
√ ο αριθμός των δοχείων που αποτελούν την παρτίδα (1), έως 20 δοχεία κατ’ ανώτατο όριο |
|
5.A.2.3.2. |
δοχεία των οποίων το περιεχόμενο δεν υπερβαίνει το ένα λίτρο |
4 |
|
5.A.2.4. |
Πλάκες ανόργανων αλάτων και ζωοτροφών οι οποίες προορίζονται για να λείχονται από τα ζώα |
Ελάχιστος αριθμός πλακών για δειγματοληψία (2): μία πλάκα για κάθε μερίδα 25 μονάδων, με ανώτατο όριο 4 πλάκες |
|
5.A.3. |
Ολικό δείγμα Απαιτείται μόνο ένα ολικό δείγμα κατά παρτίδα. Το σύνολο της ποσότητας των στοιχειωδών δειγμάτων που προορίζονται για να σχηματίζουν το ολικό δείγμα δεν πρέπει να είναι μικρότερη από τις παρακάτω ποσότητες: |
|
|
5.A.3.1. |
Μη συσκευασμένες ζωοτροφές |
4 χιλιόγραμμα |
|
5.A.3.2. |
Συσκευασμένες ζωοτροφές: |
|
|
5.A.3.2.1. |
συσκευασίες με περιεχόμενο ανώτερο του 1 χιλιογράμμου |
4 χιλιόγραμμα |
|
5.A.3.2.2. |
συσκευασίες με περιεχόμενο που δεν υπερβαίνει το 1 χιλιόγραμμο |
το βάρος του περιεχομένου 4 αρχικών συσκευασιών |
|
5.A.3.3. |
Υγρές ή ημίρρευστες ζωοτροφές: |
|
|
5.A.3.3.1. |
δοχεία με περιεχόμενο άνω του ενός λίτρου |
4 λίτρα |
|
5.A.3.3.2. |
δοχεία με περιεχόμενο που δεν υπερβαίνει το ένα λίτρο |
όγκος του περιεχομένου 4 αρχικών δοχείων |
|
5.A.3.4. |
Πλάκες ανόργανων αλάτων και ζωοτροφών που προορίζονται για να λείχονται από τα ζώα: |
|
|
5.A.3.4.1. |
των οποίων το μοναδιαίο βάρος είναι ανώτερο του ενός χιλιογράμμου |
4 χιλιόγραμμα |
|
5.A.3.4.2. |
των οποίων το μοναδιαίο βάρος δεν υπερβαίνει το ένα χιλιόγραμμο |
το βάρος 4 αρχικών πλακών |
|
5.A.4. |
Τελικά δείγματα Από το ολικό δείγμα, εφόσον είναι αναγκαίο μετά από τη μείωση, θα δημιουργηθούν τα τελικά δείγματα. Απαιτείται η ανάλυση ενός τουλάχιστον τελικού δείγματος. Η ποσότητα του τελικού δείγματος που προορίζεται για ανάλυση δεν μπορεί να είναι μικρότερη από τις παρακάτω ποσότητες: |
|
|
|
Στερεές ζωοτροφές |
500 γραμμάρια |
|
|
Υγρές ή ημίρρευστες ζωοτροφές |
500 χιλιοστόλιτρα |
|
5.B. |
Για τους ελέγχους των ανεπιθύμητων ουσιών ή προϊόντων που είναι πιθανόν να κατανέμονται ανομοιόμορφα στις ζωοτροφές όπως οι αφλατοξίνες, η ερυσιβώδης σίκαλη, ο ρίκινος ο κοινός, οι σπόροι του κροτάλου στις πρώτες ύλες ζωοτροφών (3). |
|
|
5.B.1. |
Παρτίδα: βλέπε 5.A.1. |
|
|
5.B.2. |
Στοιχειώδη δείγματα |
|
|
5.B.2.1. |
Μη συσκευασμένες ζωοτροφές: βλέπε 5.A.2.1. |
|
|
5.B.2.2. |
Συσκευασμένες ζωοτροφές: |
Ελάχιστος αριθμός συσκευασιών για δειγματοληψία: |
|
5.B.2.2.1. |
παρτίδες αποτελούμενες από 1 μέχρι 4 συσκευασίες |
όλες οι συσκευασίες |
|
5.B.2.2.2. |
παρτίδες αποτελούμενες από 5 μέχρι 16 συσκευασίες |
4 |
|
5.B.2.2.3. |
παρτίδες αποτελούμενες από περισσότερες των 16 συσκευασιών |
√ ο αριθμός των συσκευασιών που αποτελούν την παρτίδα (1), με ανώτατο όριο 40 συσκευασίες |
|
5.B.3. |
Ολικά δείγματα Ο αριθμός των ολικών δειγμάτων θα ποικίλλει ανάλογα με το μέγεθος της παρτίδας. Ο ελάχιστος αριθμός των ολικών δειγμάτων ανά παρτίδα δίδεται παρακάτω. Το συνολικό βάρος των στοιχειωδών δειγμάτων που προορίζονται για το σχηματισμό κάθε ολικού δείγματος δεν μπορεί να είναι μικρότερο από 4 χιλιόγραμμα. |
|
|
5.B.3.1. |
Μη συσκευασμένες ζωοτροφές |
|
|
|
Βάρος παρτίδας σε τόνους: |
Ελάχιστος αριθμός ολικών δειγμάτων ανά παρτίδα: |
|
|
μέχρι 1 |
1 |
|
|
περισσότεροι του ενός και μέχρι 10 |
2 |
|
|
περισσότεροι των 10 και μέχρι 40 |
3 |
|
|
περισσότεροι των 40 |
4 |
|
5.B.3.2. |
Συσκευασμένες ζωοτροφές |
|
|
|
Αριθμός συσκευασιών οι οποίες αποτελούν την παρτίδα: |
Ελάχιστος αριθμός ολικών δειγμάτων ανά παρτίδα: |
|
|
από 1 μέχρι 16 |
1 |
|
|
από 17 μέχρι 200 |
2 |
|
|
από 201 μέχρι 800 |
3 |
|
|
άνω των 800 |
4 |
|
5.B.4. |
Τελικά δείγματα Από κάθε ολικό δείγμα κατόπιν μείωσης θα δημιουργηθούν τα τελικά δείγματα. Απαιτείται η ανάλυση ενός τουλάχιστον τελικού δείγματος ανά ολικό δείγμα. Το βάρος του τελικού δείγματος που προορίζεται για ανάλυση δεν μπορεί να είναι μικρότερο από 500 γραμμάρια. |
|
6. ΟΔΗΓΙΕΣ ΠΟΥ ΑΦΟΡΟΥΝ ΤΗ ΛΗΨΗ, ΤΗΝ ΠΑΡΑΣΚΕΥΗ ΚΑΙ ΤΗ ΣΥΣΚΕΥΑΣΙΑ ΤΩΝ ΔΕΙΓΜΑΤΩΝ
6.1. Γενικά
Τα δείγματα πρέπει να λαμβάνονται και να παρασκευάζονται όσο το δυνατόν ταχύτερα, λαμβανομένων υπόψη των απαραίτητων προφυλάξεων για την αποφυγή αλλοίωσης ή μόλυνσης του προϊόντος. Τα εργαλεία καθώς και οι επιφάνειες και τα δοχεία στα οποία θα τοποθετηθούν τα δείγματα πρέπει να είναι καθαρά και ξηρά.
6.2. Στοιχειώδη δείγματα
6.2.A. Προοριζόμενα για τους ελέγχους των ουσιών ή των προϊόντων τα οποία κατανέμονται ομοιόμορφα στις ζωοτροφές
Τα στοιχειώδη δείγματα πρέπει να λαμβάνονται «τυχαία» από το σύνολο της παρτίδας και πρέπει να είναι ισοδύναμων περίπου μεγεθών.
6.2.A.1.
Η παρτίδα διαιρείται συμβολικά σε ίσα περίπου τμήματα. Επιλέγεται τυχαία ένας αριθμός τμημάτων ο οποίος ανταποκρίνεται στον αριθμό των στοιχειωδών δειγμάτων που απαιτείται σύμφωνα με το σημείο 5.Α.2 και λαμβάνεται τουλάχιστον ένα δείγμα από καθένα από τα τμήματα αυτά.
Ενδεχομένως γίνεται δειγματοληψία κατά τη μετακίνηση της παρτίδας (φόρτωση ή εκφόρτωση).
6.2.A.2.
Αφού επιλεγεί ο απαιτούμενος αριθμός συσκευασιών σύμφωνα με το σημείο 5.Α.2, λαμβάνεται δείγμα από το περιεχόμενο κάθε συσκευασίας με δειγματολήπτη ή σπάτουλα. Εάν απαιτείται, τα δείγματα λαμβάνονται μετά τη χωριστή εκκένωση των συσκευασιών. Εάν είναι αναγκαίο, τα συσσωματώματα θραύονται χωριστά για κάθε ολικό δείγμα (αφού διαχωρισθούν ενδεχομένως από τη μάζα, ενσωματώνονται πάλι στο σύνολο).
6.2.A.3.
Αφού επιλεγεί ο απαιτούμενος αριθμός δοχείων σύμφωνα με το σημείο 5.Α.2, το περιεχόμενο ομογενοποιείται κατά το δυνατόν και λαμβάνεται μία ποσότητα από κάθε δοχείο.
Τα στοιχειώδη δείγματα δύνανται να ληφθούν κατά τη μετάγγιση του προϊόντος.
6.2.A.4.
Αφού επιλεγεί ο απαιτούμενος αριθμός δοχείων σύμφωνα με το σημείο 5.Α.2, τα δείγματα λαμβάνονται από διάφορα επίπεδα.
Τα δείγματα δύνανται να ληφθούν επίσης κατά τη μετάγγιση του προϊόντος αφού απομακρυνθεί το πρώτο μέρος.
Στις δύο περιπτώσεις, ο ολικός όγκος των δειγμάτων δεν πρέπει να είναι κατώτερος των 10 λίτρων.
6.2.A.5.
Αφού επιλεγεί ο απαιτούμενος αριθμός πλακών σύμφωνα με το σημείο 5.Α.2, λαμβάνεται ως δείγμα ένα τμήμα από κάθε πλάκα.
6.2.B. Προοριζόμενα για τον έλεγχο των ανεπιθύμητων ουσιών ή προϊόντων που είναι πιθανόν να κατανέμονται ανομοιόμορφα στις ζωοτροφές όπως οι αφλατοξίνες, η ερυσιβώδης σίκαλη, ο ρίκινος ο κοινός και οι σπόροι του κροτάλου στις πρώτες ύλες ζωοτροφών
Η παρτίδα διαιρείται συμβολικά σε έναν αριθμό τμημάτων περίπου ίσων ο οποίος αντιστοιχεί σε εκείνον των ολικών δειγμάτων που αναφέρονται στο σημείο 5.Β.3. Όταν ο αριθμός αυτός είναι ανώτερος του ένα, ο ολικός αριθμός των στοιχειωδών δειγμάτων που προβλέπονται στο σημείο 5.Β.2 κατανέμεται κατά τρόπο περίπου ίσο στα διάφορα τμήματα. Λαμβάνονται κατόπιν δείγματα ίσου περίπου μεγέθους (4), έτσι ώστε η συνολική ποσότητα των δειγμάτων από κάθε τμήμα να μην είναι κατώτερη της ελάχιστης ποσότητας των 4 χιλιογράμμων που απαιτείται για κάθε ολικό δείγμα. Τα στοιχειώδη δείγματα που προέρχονται από διάφορα τμήματα δεν πρέπει να αθροίζονται.
6.3. Παρασκευή των ολικών δειγμάτων
6.3.A. Προοριζόμενα για τους ελέγχους των ουσιών ή προϊόντων που κατανέμονται ομοιόμορφα στις ζωοτροφές
Τα στοιχειώδη δείγματα αναμειγνύονται για να σχηματίσουν ένα μόνο ολικό δείγμα.
6.3.B. Προοριζόμενα για τους ελέγχους των ανεπιθύμητων ουσιών ή προϊόντων που είναι πιθανόν να κατανέμονται ανομοιόμορφα στις ζωοτροφές όπως οι αφλατοξίνες, η ερυσιβώδης σίκαλη, ο ρίκινος ο κοινός και οι σπόροι του κροτάλου στις πρώτες ύλες ζωοτροφών
Τα στοιχειώδη δείγματα από κάθε τμήμα της παρτίδας αναμειγνύονται και σχηματίζεται ο αριθμός των ολικών δειγμάτων που προβλέπεται στο σημείο 5.Β.3, μεριμνώντας να είναι εμφανής η προέλευση κάθε δείγματος.
6.4. Παρασκευή των τελικών δειγμάτων
Το υλικό κάθε ολικού δείγματος αναμειγνύεται με προσοχή ώστε να ληφθεί ομογενοποιημένο δείγμα (5). Αν είναι αναγκαίο, το ολικό δείγμα μειώνεται για το σκοπό αυτόν μέχρι 2 χιλιόγραμμα ή 2 λίτρα τουλάχιστον (μειωμένο δείγμα) είτε με μηχανικό ή αυτόματο διαχωριστή είτε με τη μέθοδο των τετάρτων.
Παρασκευάζονται κατόπιν τουλάχιστον τρία τελικά δείγματα της ίδιας περίπου ποσότητας και τα οποία ανταποκρίνονται στις ποσοτικές απαιτήσεις που αναφέρονται στα σημεία 5.Α.4 ή 5.Β.4. Κάθε δείγμα τοποθετείται σε κατάλληλο δοχείο. Λαμβάνονται όλες οι απαραίτητες προφυλάξεις για να αποφευχθεί κάθε μεταβολή της σύνθεσης του δείγματος ή κάθε μόλυνση ή αλλοίωση δυναμένη να επέλθει κατά τη μεταφορά ή την εναποθήκευση.
6.5. Συσκευασία των τελικών δειγμάτων
Τα δοχεία ή οι συσκευασίες σφραγίζονται και επικολλάται ετικέτα (η ετικέτα πρέπει να είναι ενσωματωμένη στο σφράγισμα), έτσι ώστε το άνοιγμά τους να είναι αδύνατο χωρίς να καταστραφεί το σφράγισμα.
7. ΠΡΑΚΤΙΚΟ ΔΕΙΓΜΑΤΟΛΗΨΙΑΣ
Για κάθε λήψη δειγμάτων συντάσσεται πρακτικό δειγματοληψίας το οποίο επιτρέπει την αδιαμφισβήτητη αναγνώριση της παρτίδας από την οποία έγινε η δειγματοληψία.
8. ΠΡΟΟΡΙΣΜΟΣ ΔΕΙΓΜΑΤΩΝ
Για κάθε ολικό δείγμα πρέπει να αποστέλλεται, το ταχύτερο δυνατόν, στο εξουσιοδοτημένο για τη διενέργεια αναλύσεων εργαστήριο, ένα τουλάχιστον τελικό δείγμα με τις απαραίτητες για την ανάλυση πληροφορίες.
(1) Όταν ο αριθμός που προκύπτει είναι κλασματικός, στρογγυλοποιείται στον αμέσως επόμενο ακέραιο.
(2) Για τις συσκευασίες ή τα δοχεία των οποίων το περιεχόμενο δεν υπερβαίνει το ένα χλγρ. ή το ένα λίτρο καθώς και για τις πλάκες που προορίζονται για να λείχονται από τα ζώα και των οποίων το μοναδιαίο βάρος δεν υπερβαίνει το ένα χιλιόγραμμο, το περιεχόμενο μιας αρχικής συσκευασίας ή ενός αρχικού δοχείου ή μία πλάκα αποτελεί ένα στοιχειώδες δείγμα.
(3) Οι μέθοδοι που προβλέπονται στο σημείο 5.Α εφαρμόζονται για τον έλεγχο των αφλατοξινών, της ερυσιβώδους σίκαλης, του ρίκινου του κοινού και των σπόρων του κροτάλου στις πλήρεις και στις συμπληρωματικές ζωοτροφές.
(4) Στην περίπτωση των συσκευασμένων ζωοτροφών, λαμβάνεται ένα τμήμα του περιεχομένου των προς δειγματοληψία συσκευασιών με δειγματολήπτη ή σπάτουλα, ενδεχομένως αφού έχουν εκκενωθεί χωριστά οι συσκευασίες.
(5) Εάν είναι αναγκαίο, τα συσσωματώματα θραύονται χωριστά για κάθε ολικό δείγμα (αφού διαχωρισθούν ενδεχομένως από τη μάζα, ενσωματώνονται πάλι στο σύνολο).
ΠΑΡΑΡΤΗΜΑ II
ΓΕΝΙΚΕΣ ΔΙΑΤΑΞΕΙΣ ΠΕΡΙ ΤΩΝ ΜΕΘΟΔΩΝ ΑΝΑΛΥΣΗΣ ΤΩΝ ΖΩΟΤΡΟΦΩΝ
A. ΠΑΡΑΣΚΕΥΗ ΤΩΝ ΔΕΙΓΜΑΤΩΝ ΠΡΟΣ ΑΝΑΛΥΣΗ
1. Αντικείμενο
Οι τρόποι που περιγράφονται κατωτέρω αφορούν την παρασκευή προς ανάλυση των τελικών δειγμάτων, τα οποία έχουν διαβιβαστεί στο εργαστήριο ελέγχου, αφού προηγουμένως έχουν ληφθεί σύμφωνα με τις διατάξεις του παραρτήματος I.
Η παρασκευή των εν λόγω δειγμάτων πρέπει να εξασφαλίζει ότι τα δοκίμια, που προβλέπονται στις μεθόδους ανάλυσης, είναι ομοιογενή και αντιπροσωπευτικά των τελικών δειγμάτων.
2. Προφυλάξεις που πρέπει να λαμβάνονται
Η διαδικασία παρασκευής των δειγμάτων που ακολουθείται εξαρτάται από τις μεθόδους ανάλυσης που χρησιμοποιούνται. Επομένως, είναι ιδιαίτερα σημαντικό να εξασφαλιστεί ότι η διαδικασία παρασκευής των δειγμάτων που ακολουθείται είναι κατάλληλη για τη μέθοδο ανάλυσης που χρησιμοποιείται.
Όλες οι εργασίες επιτελούνται κατά τρόπο που αποφεύγεται, κατά το δυνατόν, τυχόν μόλυνση του δείγματος ή αλλαγή της σύστασής του.
Οι κονιοποιήσεις, μείξεις και τα κοσκινίσματα πραγματοποιούνται όσο το δυνατόν ταχύτερα, εκθέτοντας ελάχιστα το δείγμα στον αέρα και στο φως. Δεν πρέπει να χρησιμοποιούνται μύλοι και τριβεία που ενδέχεται να προκαλέσουν σημαντική θέρμανση του δείγματος.
Η διά χειρός κονιοποίηση συνιστάται για τις τροφές οι οποίες είναι ιδιαίτερα ευαίσθητες στη θερμότητα. Επίσης, εξασφαλίζεται ότι οι ίδιες οι συσκευές δεν αποτελούν πηγή μόλυνσης με ιχνοστοιχεία.
Αν το δείγμα δεν είναι δυνατόν να παρασκευασθεί χωρίς αισθητή μεταβολή της περιεκτικότητάς του σε υγρασία, προσδιορίζεται η εν λόγω περιεκτικότητα προ και μετά την παρασκευή, με τη μέθοδο που καθορίζεται στο μέρος Α του παραρτήματος III.
3. Διαδικασία
Γίνεται καταμερισμός του δείγματος σε κατάλληλα μερικά δείγματα για ανάλυση και αναφορά, χρησιμοποιώντας κατάλληλες τεχνικές διαχωρισμού όπως εναλλασσόμενο φτυάρισμα, σταθερή ή περιστροφική ανάμειξη. Η κωνικοποίηση και η μέθοδος των τετάρτων δεν συνιστώνται επειδή μπορεί να προκύψουν μερικά δείγματα με υψηλό σφάλμα διαχωρισμού. Το δείγμα φυλάσσεται για αναφορά σε κατάλληλο δοχείο, καθαρό και ξηρό, εφοδιασμένο με ερμητικό κλείσιμο, και μερικά δείγματα τουλάχιστον 100 g προετοιμάζονται για ανάλυση όπως περιγράφεται κατωτέρω.
3.1. Ζωοτροφές δυνάμενες να αλεσθούν στην κατάσταση που βρίσκονται
Εκτός ειδικής ένδειξης των μεθόδων ανάλυσης, το σύνολο του δείγματος διέρχεται διά μέσου κοσκίνου με τετράγωνες βροχίδες, πλευράς 1 mm (συμφώνως προς τη σύσταση ISO R565), αφού έχει κονιοποιηθεί, αν υπάρχει ανάγκη. Αποφεύγεται κάθε περιττή κονιοποίηση.
Το κοσκινισμένο δείγμα αναμειγνύεται και τοποθετείται σε κατάλληλο δοχείο, καθαρό και ξηρό, εφοδιασμένο με ερμητικό κλείσιμο. Αμέσως πριν πραγματοποιηθεί η λήψη του δοκιμίου, το δείγμα αναμειγνύεται εκ νέου.
3.2. Ζωοτροφές δυνάμενες να αλεσθούν μετά την ξήρανση
Εκτός ειδικής ένδειξης των μεθόδων ανάλυσης, ξηραίνεται το δείγμα έως ότου η περιεκτικότητα σε υγρασία κατέλθει σε 8-12 %, εφαρμόζοντας τη διαδικασία προκαταρτικής ξήρανσης, η οποία αναφέρεται στην παράγραφο 4.3 της μεθόδου προσδιορισμού της υγρασίας, που μνημονεύεται στο μέρος A του παραρτήματος III). Για τη συνέχεια των εργασιών ακολουθείται η παράγραφος 3.1.
3.3. Ρευστές ή ημίρρευστες ζωοτροφές
Το δείγμα τοποθετείται σε κατάλληλο δοχείο, καθαρό και ξηρό, εφοδιασμένο με ερμητικό κλείσιμο. Αμέσως πριν πραγματοποιηθεί η λήψη του δοκιμίου, το δείγμα αναμειγνύεται πολύ καλά.
3.4. Λοιπές ζωοτροφές
Αν το δείγμα δεν δύναται να παρασκευασθεί σύμφωνα με τους τρόπους που περιγράφονται ανωτέρω, τότε εφαρμόζεται κάθε άλλη κατάλληλη μέθοδος παρασκευής, που επιτρέπει τα δοκίμια να είναι ομοιογενή και αντιπροσωπευτικά των τελικών δειγμάτων.
4. Διατήρηση των δειγμάτων
Τα δείγματα διατηρούνται σε θερμοκρασία, η οποία δεν δύναται να μεταβάλλει τη σύστασή τους. Για τα δείγματα που προορίζονται για ανάλυση βιταμινών ή ουσιών ιδιαίτερα ευαίσθητων στο φως, χρησιμοποιούνται γυάλινα δοχεία χρώματος καστανού.
B. ΔΙΑΤΑΞΕΙΣ ΠΟΥ ΑΦΟΡΟΥΝ ΤΑ ΑΝΤΙΔΡΑΣΤΗΡΙΑ ΚΑΙ ΤΙΣ ΣΥΣΚΕΥΕΣ ΠΟΥ ΧΡΗΣΙΜΟΠΟΙΟΥΝΤΑΙ ΣΤΙΣ ΜΕΘΟΔΟΥΣ ΑΝΑΛΥΣΗΣ
|
1. |
Εκτός ειδικής ένδειξης των μεθόδων ανάλυσης, όλα τα αντιδραστήρια πρέπει να είναι ποιότητας «pro analysis» (p.a.) Για την ανάλυση των ιχνοστοιχείων, η καθαρότητα των αντιδραστηρίων πρέπει να ελέγχεται με τυφλό πείραμα. Σύμφωνα με το λαμβανόμενο αποτέλεσμα, μπορεί να απαιτείται συμπληρωματικός καθαρισμός. |
|
2. |
Οι εργασίες διάλυσης, αραίωσης, έκπλυσης ή πλύσης, που μνημονεύονται στις μεθόδους ανάλυσης χωρίς να αναφέρεται η φύση του διαλύτη ή αραιωτικού, σημαίνει ότι πρέπει να πραγματοποιούνται με νερό. Κατά γενικό κανόνα, το νερό πρέπει να είναι αφαλατωμένο ή απεσταγμένο. Σε ειδικές περιπτώσεις, που επισημαίνονται στις μεθόδους ανάλυσης, το νερό πρέπει να υποβάλλεται σε ειδικές μεθόδους καθαρισμού. |
|
3. |
Λαμβανομένου υπόψη του συνήθους εξοπλισμού των εργαστηρίων ελέγχου, στις μεθόδους ανάλυσης μνημονεύονται μόνο τα ειδικά όργανα και οι ειδικές συσκευές ή τα όργανα και οι συσκευές που πρέπει να εκπληρούν ειδικούς όρους. Ο εξοπλισμός αυτός πρέπει να καθαρίζεται καλά, ιδιαίτερα για τους προσδιορισμούς πολύ μικρών ποσοτήτων ουσιών. |
Γ. ΕΦΑΡΜΟΓΗ ΤΩΝ ΜΕΘΟΔΩΝ ΑΝΑΛΥΣΗΣ ΚΑΙ ΕΚΦΡΑΣΗ ΤΩΝ ΑΠΟΤΕΛΕΣΜΑΤΩΝ
1. Διαδικασία εκχύλισης
Υπάρχουν διάφορες μέθοδοι που καθορίζουν μια συγκεκριμένη διαδικασία εκχύλισης. Κατά κανόνα, μπορούν να εφαρμοστούν και άλλες διαδικασίες εκχύλισης από τη διαδικασία που μνημονεύεται στη μέθοδο, με την προϋπόθεση ότι έχει αποδειχθεί πως η διαδικασία εκχύλισης που χρησιμοποιείται έχει ισοδύναμη απόδοση εκχύλισης στην υπό ανάλυση μήτρα με τη διαδικασία που μνημονεύεται στη μέθοδο.
2. Διαδικασία καθαρισμού
Υπάρχουν διάφορες μέθοδοι που καθορίζουν μια συγκεκριμένη διαδικασία καθαρισμού. Κατά κανόνα, μπορούν να εφαρμοστούν και άλλες διαδικασίες καθαρισμού από τη διαδικασία που μνημονεύεται στη μέθοδο, με την προϋπόθεση ότι έχει αποδειχθεί πως η διαδικασία καθαρισμού που χρησιμοποιείται οδηγεί σε ισοδύναμα αποτελέσματα ανάλυσης στην υπό ανάλυση μήτρα με τη διαδικασία που μνημονεύεται στη μέθοδο.
3. Αναφορά στη μέθοδο ανάλυσης που χρησιμοποιείται
Εν γένει, καθορίζεται μία μόνο μέθοδος για τον προσδιορισμό κάθε ουσίας στις ζωοτροφές. Όταν παρέχονται περισσότερες της μιας μέθοδοι, η εφαρμοζόμενη από το εργαστήριο ελέγχου μέθοδος πρέπει να αναφέρεται στο δελτίο ανάλυσης.
4. Αριθμός προσδιορισμών
Το αποτέλεσμα που εμφαίνεται στο δελτίο ανάλυσης αποτελεί τη μέση τιμή που λαμβάνεται τουλάχιστον από δύο προσδιορισμούς, που διενεργούνται σε ξεχωριστά δοκίμια και των οποίων η επαναληψιμότητα είναι ικανοποιητική.
Ωστόσο, στην περίπτωση ανάλυσης ανεπιθύμητων ουσιών, αν το αποτέλεσμα του πρώτου προσδιορισμού είναι κατά πολύ (> 50 %) μικρότερο από την προς έλεγχο προδιαγραφή, δεν απαιτούνται πρόσθετοι προσδιορισμοί, με την προϋπόθεση ότι εφαρμόζονται οι κατάλληλες διαδικασίες ποιότητας.
Στην περίπτωση ελέγχου του δηλωμένου περιεχομένου μιας ουσίας ή ενός συστατικού, αν το αποτέλεσμα του πρώτου προσδιορισμού επιβεβαιώνει το δηλωμένο περιεχόμενο, δηλαδή αν το αποτέλεσμα της ανάλυσης εμπίπτει στο αποδεκτό εύρος απόκλισης του δηλωμένου περιεχομένου, δεν απαιτούνται πρόσθετοι προσδιορισμοί, με την προϋπόθεση ότι εφαρμόζονται οι κατάλληλες διαδικασίες ποιότητας.
Σε ορισμένες περιπτώσεις, αυτό το αποδεκτό εύρος απόκλισης ορίζεται από τη νομοθεσία, όπως η οδηγία 79/373/ΕΟΚ του Συμβουλίου (1).
5. Αναφορά του αποτελέσματος της ανάλυσης
Το εν λόγω αποτέλεσμα πρέπει να εκφράζεται σύμφωνα με τις ενδείξεις που παρέχονται στη μέθοδο ανάλυσης, με κατάλληλο αριθμό σημαντικών ψηφίων, και να έχει διορθωθεί, εφόσον είναι ανάγκη, συναρτήσει της περιεκτικότητας του τελικού δείγματος σε υγρασία, προ της παρασκευής.
6. Αβεβαιότητα μέτρησης και ποσοστό ανάκτησης στην περίπτωση ανάλυσης ανεπιθύμητων ουσιών
Όσον αφορά τις ανεπιθύμητες ουσίες, κατά την έννοια της οδηγίας 2002/32/ΕΚ, συμπεριλαμβανομένων των διοξινών και των παρόμοιων με τις διοξίνες PCB, ένα προϊόν που προορίζεται για ζωοτροφή θεωρείται ότι δεν συμμορφώνεται με το καθορισμένο μέγιστο περιεχόμενο, αν το αποτέλεσμα της ανάλυσης θεωρείται ότι υπερβαίνει το μέγιστο περιεχόμενο λαμβάνοντας υπόψη τη διευρυμένη αβεβαιότητα μέτρησης και τη διόρθωση για την ανάκτηση. Η συγκέντρωση που προκύπτει από την ανάλυση, μετά τη διόρθωση για την ανάκτηση και την αφαίρεση της διευρυμένης αβεβαιότητας μέτρησης, χρησιμοποιείται για την αξιολόγηση της συμμόρφωσης. Αυτή η διαδικασία εφαρμόζεται μόνο στις περιπτώσεις όπου η μέθοδος ανάλυσης επιτρέπει την εκτίμηση της αβεβαιότητας μέτρησης και της διόρθωσης για την ανάκτηση (π.χ. δεν είναι εφικτή στην περίπτωση μικροσκοπικής ανάλυσης).
Το αποτέλεσμα της ανάλυσης αναφέρεται ως εξής (στο βαθμό που η χρησιμοποιούμενη μέθοδος ανάλυσης επιτρέπει την εκτίμηση της αβεβαιότητας των μετρήσεων και του ποσοστού ανάκτησης):
|
α) |
διόρθωση για ανάκτηση, με αναφορά στο ποσοστό ανάκτησης. Η διόρθωση για ανάκτηση δεν είναι απαραίτητη αν το ποσοστό ανάκτησης κυμαίνεται μεταξύ 90-110 %· |
|
β) |
ως «x +/- U», όπου x είναι το αποτέλεσμα της ανάλυσης και U είναι η διευρυμένη αβεβαιότητα μέτρησης, χρησιμοποιώντας έναν συντελεστή κάλυψης 2 που παρέχει ποσοστό εμπιστοσύνης περίπου 95 %. |
Ωστόσο, αν το αποτέλεσμα της ανάλυσης είναι κατά πολύ (> 50 %) μικρότερο από την προς έλεγχο προδιαγραφή, και με την προϋπόθεση ότι εφαρμόζονται οι κατάλληλες διαδικασίες ποιότητας και η ανάλυση χρησιμοποιείται μόνο με σκοπό τον έλεγχο της συμμόρφωσης προς τις νομικές διατάξεις, το αποτέλεσμα της ανάλυσης μπορεί να αναφερθεί χωρίς διόρθωση για ανάκτηση, ενώ, σε αυτές τις περιπτώσεις, η αναφορά στο ποσοστό ανάκτησης και στην αβεβαιότητα της μέτρησης μπορεί να παραλείπεται.
ΠΑΡΑΡΤΗΜΑ III
ΜΕΘΟΔΟΙ ΑΝΑΛΥΣΗΣ ΓΙΑ ΤΟΝ ΕΛΕΓΧΟ ΤΗΣ ΣΥΣΤΑΣΗΣ ΤΩΝ ΠΡΩΤΩΝ ΥΛΩΝ ΖΩΟΤΡΟΦΩΝ ΚΑΙ ΤΩΝ ΣΥΝΘΕΤΩΝ ΖΩΟΤΡΟΦΩΝ
A. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΥΓΡΑΣΙΑΣ
1. Αντικείμενο και πεδίο εφαρμογής
Η μέθοδος επιτρέπει τον προσδιορισμό της περιεκτικότητας των ζωοτροφών σε υγρασία. Στην περίπτωση ζωοτροφών που περιέχουν πτητικές ουσίες, όπως οργανικά οξέα, πρέπει να σημειωθεί ότι μαζί με την περιεκτικότητα της υγρασίας προσδιορίζεται και μια σημαντική ποσότητα πτητικών ουσιών.
Η μέθοδος δεν αφορά την ανάλυση των γαλακτοκομικών προϊόντων ως πρώτων υλών ζωοτροφών, την ανάλυση των μεταλλικών ουσιών και των μειγμάτων, τα οποία αποτελούνται κυρίως από μεταλλικές ουσίες, την ανάλυση ζωικών και φυτικών λιπών και ελαίων, καθώς και την ανάλυση των ελαιούχων σπόρων και καρπών.
2. Αρχή
Το δείγμα ξηραίνεται υπό καθορισμένες συνθήκες οι οποίες διαφέρουν αναλόγως της φύσης της ζωοτροφής. Η απώλεια βάρους προσδιορίζεται με ζύγιση. Είναι απαραίτητο να διενεργείται προκαταρκτική ξήρανση, όταν πρόκειται για στερεά ζωοτροφή η οποία έχει υψηλή περιεκτικότητα σε υγρασία.
3. Όργανα
|
3.1. |
Τριβείο αποτελούμενο από υλικό το οποίο δεν απορροφά υγρασία, είναι εύκολο στον καθαρισμό του, επιτρέπει ταχεία και ομοιόμορφη τριβή χωρίς να προκαλεί την παραγωγή αξιόλογης θερμότητας, δεν επιτρέπει κατά το δυνατόν την επαφή με τον εξωτερικό αέρα και ανταποκρίνεται στις απαιτήσεις οι οποίες επισημαίνονται στις παραγράφους 4.1.1 και 4.1.2 (π.χ. σφυριά ή μικροτριβεία ψυχόμενα με νερό, κωνικοί λυόμενοι μύλοι, τριβεία βραδείας κίνησης ή οδοντωτών δίσκων). |
|
3.2. |
Αναλυτικός ζυγός ακριβείας 1 mg. |
|
3.3. |
Στεγνά μεταλλικά δοχεία από ανοξείδωτο μέταλλο ή από γυαλί, εφοδιασμένα με κάλυμμα το οποίο εξασφαλίζει αεροστεγές κλείσιμο. Ωφέλιμη επιφάνεια που επιτρέπει την κατανομή της ποσότητας του δείγματος σε αναλογία 0,3 g ανά cm2 περίπου. |
|
3.4. |
Ισοθερμικός κλίβανος αποξήρανσης (± 2 oC) ηλεκτρικής θέρμανσης που εξασφαλίζει ταχεία ρύθμιση της θερμοκρασίας και επαρκώς αεριζόμενος (1). |
|
3.5. |
Ρυθμιζόμενος ηλεκτρικός κλίβανος κενού με ελαιοαντλία και με μηχανισμό εισαγωγής ξηρού και θερμού αέρα ή αφυδατικού μέσου (π.χ. οξειδίου του ασβεστίου). |
|
3.6. |
Αποξηραντήρας με παχειά διάτρητη μεταλλική πλάκα ή πλάκα από πορσελάνη που περιέχει δραστικό αφυδατικό μέσο. |
4. Διαδικασία
|
Σημείωση: |
Οι εργασίες που περιγράφονται στο παρόν μέρος πρέπει να διενεργούνται αμέσως μετά το άνοιγμα των συσκευασιών τα οποία περιέχουν τα δείγματα. Οι αναλύσεις πρέπει να διενεργούνται τουλάχιστον εις διπλούν. |
4.1. Προετοιμασία
4.1.1.
Λαμβάνεται ποσότητα δείγματος τουλάχιστον 50 g. Αν είναι απαραίτητο κονιοποιείται ή συνθλίβεται κατά τον ενδεδειγμένο τρόπο προς αποφυγή κάθε μεταβολής της περιεκτικότητας σε υγρασία (βλέπε παράγραφο 6).
4.1.2.
Λαμβάνεται ποσότητα τουλάχιστον 50 g δείγματος. Αλέθεται κατά τρόπο ώστε τα μόρια αυτού να διέρχονται τουλάχιστον κατά 50 % διά μέσου κοσκίνου των 0,5 mm και να μη συγκρατείται σε κόσκινο με στρογγυλά ανοίγματα 1 mm περισσότερο του 10 % του απορρίμματος.
4.1.3.
Λαμβάνεται και ζυγίζεται ποσότητα δείγματος 25 g περίπου με προσέγγιση 10 mg, προστίθεται η ενδεδειγμένη ποσότητα άνυδρου άμμου η οποία έχει ζυγισθεί με προσέγγιση 10 mg και αναμειγνύεται μέχρι την επίτευξη ενός ομοιογενούς προϊόντος.
4.2. Αποξήρανση
4.2.1.
Λαμβάνεται το απόβαρο του δοχείου (3.3) με το κάλυμμά του, με προσέγγιση 1 mg. Ζυγίζεται ποσότητα 5 g περίπου δείγματος, με προσέγγιση 1 mg μέσα στο δοχείο του οποίου το απόβαρο έχει ληφθεί και κατανέμεται ομοιόμορφα. Τοποθετείται το δοχείο χωρίς το κάλυμμά του μέσα στον κλίβανο αποξήρανσης ο οποίος έχει προηγουμένως θερμανθεί σε 103 oC. Προς αποφυγή μεγάλης πτώσης της θερμοκρασίας του κλιβάνου αποξήρανσης το δοχείο εισάγεται το ταχύτερο δυνατόν. Αφήνεται να ξηρανθεί επί τέσσερις ώρες από τη στιγμή κατά την οποία η θερμοκρασία του κλιβάνου αποξήρανσης έχει επανέλθει στους 103 oC. Επανατοποθετείται το κάλυμμα στο δοχείο, το δοχείο εξάγεται από τον κλίβανο αποξήρανσης, αφήνεται να ψυχθεί επί 30 έως 45 πρώτα λεπτά εντός του αποξηραντήρα (3.6) και ζυγίζεται με προσέγγιση 1 mg περίπου.
Στην περίπτωση κατά την οποία οι ζωοτροφές συνίστανται ουσιωδώς σε λιπαρές ύλες διενεργείται συμπληρωματική ξήρανση 30 λεπτών μέσα στον κλίβανο αποξήρανσης στους 130 oC. H διαφορά μεταξύ των δύο ζυγίσεων δεν πρέπει να υπερβαίνει το 0,1 % της υγρασίας.
4.2.2.
Λαμβάνεται το απόβαρο του δοχείου (3.3) με το κάλυμμά του, με προσέγγιση 0,5 mg. Ζυγίζεται ποσότητα 5 g περίπου κονιοποιημένου δείγματος, με προσέγγιση 1mg, μέσα στο δοχείο του οποίου το απόβαρο έχει ληφθεί και κατανέμεται ομοιόμορφα. Το δοχείο τοποθετείται χωρίς το κάλυμμά του μέσα στον κλίβανο αποξήρανσης ο οποίος έχει προηγουμένως θερμανθεί στους 130 oC. Προς αποφυγή μεγάλης πτώσης της θερμοκρασίας του κλιβάνου αποξήρανσης, το δοχείο εισάγεται το ταχύτερο δυνατόν. Αφήνεται να ξηρανθεί επί δύο ώρες από τη στιγμή κατά την οποία η θερμοκρασία του κλιβάνου αποξήρανσης έχει επανέλθει στους 130 oC. Επανατοποθετείται το κάλυμμα στο δοχείο, το δοχείο εξάγεται από τον κλίβανο αποξήρανσης, αφήνεται να ψυχθεί επί 30 έως 45 λεπτά εντός του αποξηραντήρα (3.6) και ζυγίζεται με προσέγγιση 1 mg περίπου.
|
4.2.3. |
Σύνθετες ζωοτροφές που περιέχουν περισσότερο του 4 % σακχαρόζη ή λακτόζη: πρώτες ύλες ζωοτροφών όπως χαρούπια, αφυδατωμένα προϊόντα σιτηρών, φύτρα βύνης, λοβοί τεύτλων, διαλυτοί ιχθείς και ζάχαρη. Σύνθετες ζωοτροφές που περιέχουν πάνω από 25 % μεταλλικά άλατα περιλαμβανομένου του νερού κρυσταλλοποίησης. Λαμβάνεται το απόβαρο του δοχείου (3.3) με το κάλυμμά του, με προσέγγιση 0,5 mg. Ζυγίζεται ποσότητα 5 g περίπου δείγματος, με προσέγγιση 1 mg, εντός του δοχείου του οποίου το απόβαρο έχει ληφθεί και κατανέμεται ομοιόμορφα. Το δοχείο τοποθετείται χωρίς το κάλυμμά του μέσα στον κλίβανο (3.5), ο οποίος έχει προηγουμένως θερμανθεί σε θερμοκρασία από 80 oC μέχρι 85 oC. Προς αποφυγή μεγάλης πτώσης της θερμοκρασίας του κλιβάνου το δοχείο εισάγεται το ταχύτερο δυνατόν. Επιφέρεται πίεση 100 Torr και αφήνεται να ξηρανθεί στην πίεση αυτή επί τέσσερις ώρες, είτε σε ξηρό και θερμό ρεύμα αέρος, είτε με τη χρήση αφυδατικού μέσου (300 g περίπου για 20 δείγματα). Στην τελευταία περίπτωση διακόπτεται η σύνδεση με την αντλία κενού όταν επιτευχθεί η ως άνω πίεση. Η διάρκεια ξήρανσης μετράται από τη στιγμή κατά την οποία η θερμοκρασία του κλιβάνου έχει επανέλθει στους 80 oC έως 85 oC. Ο κλίβανος επαναφέρεται στη συνέχεια με προσοχή σε ατμοσφαιρική πίεση. Ο κλίβανος ανοίγεται, καλύπτεται αμέσως το δοχείο με το κάλυμμά του, εξάγεται το δοχείο από τον κλίβανο, αφήνεται να ψυχθεί επί 30 έως 45 λεπτά εντός του αποξηραντήρα (3.6.) και ζυγίζεται με προσέγγιση 1 mg. Διενεργείται συμπληρωματική ξήρανση 30 λεπτών μέσα στον κλίβανο κενού σε θερμοκρασία 80 oC έως 85 oC και ζυγίζεται εκ νέου. Η διαφορά μεταξύ των δύο ζυγίσεων δεν πρέπει να υπερβαίνει το 0,1 % της υγρασίας. |
4.3. Προκαταρκτική ξήρανση
4.3.1.
Οι στερεές ζωοτροφές των οποίων η περιεκτικότητα σε υγρασία είναι υψηλή και η κονιοποίηση καθίσταται δύσκολη πρέπει να υφίστανται προκαταρκτική ξήρανση ως ακολούθως:
Ζυγίζεται ποσότητα 50 g μη κονιοποιημένου δείγματος με προσέγγιση 10 mg (εφόσον είναι απαραίτητο, μπορεί να διενεργηθεί χονδρική σύνθλιψη στην περίπτωση συμπιεσμένων ή συσσωματωμένων τροφών) εντός κατάλληλου δοχείου (π.χ. πλάκα αλουμινίου των 20 × 12 cm με τοιχώματα 0,5 cm). Αφήνεται να ξηρανθεί μέσα στον κλίβανο αποξήρανσης σε θερμοκρασία 60 oC έως 70 oC μέχρις ότου η περιεκτικότητα σε υγρασία κατέλθει σε τιμή κυμαινομένη μεταξύ 8 % και 12 %. Εξάγεται από τον κλίβανο αποξήρανσης, αφήνεται να ψυχθεί χωρίς κάλυμμα μέσα στο εργαστήριο επί μία ώρα και ζυγίζεται με προσέγγιση 10 mg. Στη συνέχεια, κονιοποιείται αμέσως όπως υποδεικνύεται στην παράγραφο 4.1.1 και διενεργείται η ξήρανση όπως υποδεικνύεται στις παραγράφους 4.2.1 ή 4.2.3, ανάλογα με τη φύση της ζωοτροφής.
4.3.2.
Οι καρποί οι οποίοι έχουν ποσοστό υγρασίας ανώτερο του 17 % πρέπει να υφίστανται προκαταρκτική ξήρανση ως εξής:
Ζυγίζεται ποσότητα 50 g μη αλεσμένου σπόρου με προσέγγιση 10 mg μέσα σε κατάλληλο δοχείο (π.χ. πλάκα αλουμινίου των 20 × 12 cm με τοιχώματα 0,5 cm). Αφήνεται να ξηρανθεί μέσα σε κλίβανο αποξήρανσης επί 5 έως 7 λεπτά σε θερμοκρασία 130 oC. Εξάγεται από τον κλίβανο αποξήρανσης, αφήνεται να ψυχθεί χωρίς κάλυμμα μέσα στο εργαστήριο επί δύο ώρες και ζυγίζεται με προσέγγιση 10 mg. Στη συνέχεια, αλέθεται αμέσως όπως υποδεικνύεται στην παράγραφο 4.1.2 και διενεργείται η ξήρανση όπως υποδεικνύεται στην παράγραφο 4.2.2.
5. Υπολογισμός των αποτελεσμάτων
Η περιεκτικότητα σε υγρασία (X) ως ποσοστό επί τοις εκατό του δείγματος υπολογίζεται με τους ακόλουθους τύπους:
5.1. Αποξήρανση χωρίς προκαταρκτική ξήρανση

όπου:
|
m |
= |
αρχικό βάρος, σε γραμμάρια, της ποσότητας του δείγματος, |
|
m0 |
= |
βάρος, σε γραμμάρια, της ξηρανθείσας ποσότητας του δείγματος. |
5.2. Αποξήρανση με προκαταρτική ξήρανση

όπου:
|
m |
= |
αρχικό βάρος σε γραμμάρια της ποσότητας του δείγματος, |
|
m1 |
= |
βάρος σε γραμμάρια της ποσότητας του δείγματος κατόπιν προκαταρκτικής ξήρανσης, |
|
m2 |
= |
βάρος σε γραμμάρια της ποσότητας του δείγματος κατόπιν κονιοποίησης ή άλεσης, |
|
m0 |
= |
βάρος σε γραμμάρια της ξηρανθείσας ποσότητας του δείγματος. |
5.3. Επαναληψιμότητα
Η διαφορά μεταξύ των αποτελεσμάτων των δύο παράλληλαπαράλληλα διενεργούμενων προσδιορισμών επί του ίδιου δείγματος δεν πρέπει να υπερβαίνει το 0,2 % της απόλυτης τιμής της υγρασίας.
6. Παρατήρηση
Αν η κονιοποίηση αποδεικνύεται απαραίτητη και αν προκύπτει ότι αυτό εξασκεί κάποια μεταβολή της περιεκτικότητας σε υγρασία του προϊόντος, τα αποτελέσματα της ανάλυσης, τα οποία αναφέρονται στα συστατικά της ζωοτροφής, πρέπει να προσαρμόζονται ανάλογα με την περιεκτικότητα σε υγρασία του αρχικού δείγματος.
B. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΗΣ ΠΕΡΙΕΚΤΙΚΟΤΗΤΑΣ ΣΕ ΥΓΡΑΣΙΑ ΤΩΝ ΖΩΙΚΩΝ ΚΑΙ ΦΥΤΙΚΩΝ ΛΙΠΩΝ ΚΑΙ ΕΛΑΙΩΝ
1. Αντικείμενο και τομέας εφαρμογής
Η μέθοδος επιτρέπει τον προσδιορισμό της περιεκτικότητας σε υγρασία (νερό και άλλες πτητικές ουσίες) των ζωικών και φυτικών λιπών και ελαίων.
2. Αρχή
Το δείγμα ξηραίνεται σε 103 oC μέχρι σταθερού βάρους (η απώλεια του βάρους μεταξύ δύο διαδοχικών ζυγισμάτων πρέπει να είναι ίση ή κατώτερη του 1 mg). Η απώλεια βάρους προσδιορίζεται με ζύγιση.
3. Όργανα
|
3.1. |
Υποδοχέας (κάψα) επίπεδου πυθμένα από ανοξείδωτο υλικό, διαμέτρου 8 έως 9 cm και ύψους περίπου 3 cm. |
|
3.2. |
Θερμόμετρο με ενισχυμένο βολβό και θάλαμο διαστολής στο άνω άκρο, διαβαθμισμένο μεταξύ 80 oC περίπου έως 110 oC τουλάχιστον και μήκους 10 cm περίπου. |
|
3.3. |
Αμμόλουτρο ή θερμαινόμενη ηλεκτρική πλάκα. |
|
3.4. |
Ξηραντήρας που περιέχει δραστικό αφυδατικό μέσο. |
|
3.5. |
Αναλυτικός ζυγός. |
4. Διαδικασία
Ζυγίζεται ποσότητα 20 g περίπου, με προσέγγιση 1 mg, του ομογενοποιημένου δείγματος εντός του ξηρού υποδοχέα (3.1), του οποίου έχει ληφθεί το απόβαρο και ο οποίος περιέχει το θερμόμετρο (3.2). Θερμαίνεται επί του αμμόλουτρου ή επί της θερμαινομένης πλάκας (3.3), ανακινώντας σταθερά με το θερμόμετρο έτσι ώστε η θερμοκρασία να ανέλθει στους 90 oC εντός 7 περίπου λεπτών.
Μειώνεται η θερμότητα, ανάλογα με τη συχνότητα ανόδου των φυσαλλίδων από τον πυθμένα του υποδοχέα. Η θερμοκρασία δεν πρέπει να υπερβεί τους 105 oC. Συνεχίζεται η ανακίνηση αποξύνοντας τον πυθμένα του υποδοχέα μέχρι να παύσουν να δημιουργούνται φυσαλίδες.
Για να εξασφαλισθεί η πλήρης απομάκρυνση της υγρασίας, επαναλαμβάνεται πολλές φορές η θέρμανση στους 103 oC ± 2 oC, με ψύξη στους 93 oC μεταξύ των διαδοχικών θερμάνσεων. Ακολούθως αφήνεται να ψυχθεί εντός του ξηραντήρα (3.4) μέχρι θερμοκρασίας δωματίου και ζυγίζεται. Επαναλαμβάνεται η εργασία αυτή μέχρις ότου η απώλεια βάρους μεταξύ δύο διαδοχικών ζυγίσεων να μην υπερβαίνει τα 2 mg.
|
Σημείωση: |
Αύξηση του βάρους του δείγματος κατόπιν επανειλημμένων θερμάνσεων δείχνει οξείδωση του λίπους. Στην περίπτωση αυτή το αποτέλεσμα υπολογίζεται από τη ζύγιση η οποία διενεργείται αμέσως πριν αρχίσει να αυξάνεται το βάρος. |
5. Υπολογισμός των αποτελεσμάτων
Η επί τοις εκατό περιεκτικότητα σε υγρασία του δείγματος (X) δίδεται από τον τύπο:

όπου:
|
m |
= |
βάρος, σε γραμμάρια, της ποσότητος του δείγματος, |
|
m1 |
= |
βάρος, σε γραμμάρια, του υποδοχέα και του περιεχομένου του πριν από τη θέρμανση, |
|
m2 |
= |
βάρος, σε γραμμάρια, του υποδοχέα και του περιεχομένου μετά τη θέρμανση. |
Αποτελέσματα μικρότερα του 0,05 % πρέπει να καταχωρούνται με την ένδειξη «μικρότερα του 0,05 %».
Επαναληψιμότητα
Η διαφορά της υγρασίας μεταξύ των αποτελεσμάτων δύο παράλληλων προσδιορισμών που έγιναν στο ίδιο δείγμα δεν πρέπει να υπερβαίνει το 0,05 % σε απόλυτη τιμή.
Γ. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΗΣ ΠΕΡΙΕΚΤΙΚΟΤΗΤΑΣ ΣΕ ΟΛΙΚΕΣ ΑΖΩΤΟΥΧΕΣ ΟΥΣΙΕΣ
1. Αντικείμενο και πεδίο εφαρμογής
Η μέθοδος επιτρέπει τον προσδιορισμό της περιεκτικότητας των ζωοτροφών σε ολικές αζωτούχες ουσίες βάσει της περιεκτικότητας σε άζωτο, όπως αυτή προσδιορίζεται με τη μέθοδο Kjeldahl.
2. Αρχή
Το δείγμα ανοργανοποιείται με θειικό οξύ παρουσία καταλύτη. Το όξινο διάλυμα καθίσταται αλκαλικό με διάλυμα υδροξειδίου του νατρίου. Η αμμωνία αποστάζεται και συλλέγεται μέσα σε καθορισμένη ποσότητα θειικού οξέος, η περίσσεια του οποίου ογκομετρείται με διάλυμα υδροξειδίου του νατρίου.
Εναλλακτικά, η αμμωνία που εκλύεται αποστάζεται σε περίσσεια διαλύματος βορικού οξέος και, στη συνέχεια, ογκομετρείται με διάλυμα υδροχλωρικού οξέος ή θειικού οξέος.
3. Αντιδραστήρια
|
3.1. |
Θειικό κάλιο. |
|
3.2. |
Καταλύτης: οξείδιο του (δισθενούς) χαλκού (CuO) ή θειικός χαλκός πεντάκις (δισθενής) ένυδρος CuSO4-5H2O. |
|
3.3. |
Ψευδάργυρος υπό μορφή κόκκων. |
|
3.4. |
Θειικό οξύ, πυκνότητας ρ20 = 1,84 g/ml. |
|
3.5. |
Θειικό οξύ, πρότυπο ογκομετρικό διάλυμα, c(H2SO4) = 0,25 mol/l. |
|
3.6. |
Θειικό οξύ, πρότυπο ογκομετρικό διάλυμα, c(H2SO4) = 0,10 mol/l. |
|
3.7. |
Θειικό οξύ, πρότυπο ογκομετρικό διάλυμα, c(H2SO4) = 0,05 mol/l. |
|
3.8. |
Δείκτης ερυθρό του μεθυλίου· διαλύονται 300 mg ερυθρού του μεθυλίου σε 100 ml αιθανόλης, σ = 95-96 % (v/v). |
|
3.9. |
Διάλυμα υδροξειδίου του νατρίου (μπορεί να χρησιμοποιηθεί διάλυμα του εμπορίου για τεχνικές χρήσεις) β = 40 g/100 ml (m/v: 40 %). |
|
3.10. |
Υδροξείδιο του νατρίου, πρότυπο ογκομετρικό διάλυμα c(NaOH) = 0,25 mol/l. |
|
3.11. |
Υδροξείδιο του νατρίου, πρότυπο ογκομετρικό διάλυμα c(NaOH) = 0,10 mol/l. |
|
3.12. |
Ελαφρόπετρα υπό μορφή κόκκων, η οποία έχει πλυθεί σε υδροχλωρικό οξύ και υποβληθεί σε ανάφλεξη. |
|
3.13. |
Ακετανιλίδιο (σ.τ. = 114 oC, περιεκτικότητα αζώτου = 10,36 %). |
|
3.14. |
Σακχαρόζη (ελεύθερη αζώτου). |
|
3.15. |
Βορικό οξύ (H3BO3). |
|
3.16. |
Δείκτης ερυθρό του μεθυλίου· διαλύονται 100 mg ερυθρού του μεθυλίου σε 100 ml αιθανόλης ή μεθανόλης. |
|
3.17. |
Διάλυμα πράσινου της βρωμοκρεζόλης: διαλύονται 100 mg πράσινου της βρωμοκρεζόλης σε 100 ml αιθανόλης ή μεθανόλης. |
|
3.18. |
Διάλυμα βορικού οξέος (συγκέντρωσης 10 g/l έως 40 g/l ανάλογα με τα όργανα που χρησιμοποιούνται) Όταν εφαρμόζεται η χρωματομετρική μέθοδος ανίχνευσης μέχρι το τέλος της αντίδρασης, οι δείκτες ερυθρό του μεθυλίου και πράσινο της βρωμοκρεζόλης πρέπει να προστίθενται στα διαλύματα βορικού οξέος. Αν παρασκευάζεται 1 λίτρο διαλύματος βορικού οξέος, πριν ρυθμιστεί ο όγκος του, πρέπει να προστεθούν 7 ml διαλύματος ερυθρού του μεθυλίου (3.16) και 10 ml διαλύματος πράσινου της βρωμοκρεζόλης (3.17). Ανάλογα με την ποσότητα του νερού που χρησιμοποιείται, το pH του διαλύματος βορικού οξέος μπορεί να διαφέρει από παρτίδα σε παρτίδα. Συχνά απαιτείται μια ρύθμιση με την προσθήκη μικρής ποσότητας αλκάλεως για να προκύψει ένα θετικό τυφλό δείγμα.
|
|
3.19. |
Υδροχλωρικό οξύ, πρότυπο διάλυμα, c(HCl) = 0,10 mol/l.
|
4. Όργανα
Συσκευή κατάλληλη για ανοργανοποίηση, απόσταξη και ογκομέτρηση σύμφωνα με τη μέθοδο Kjeldahl.
5. Διαδικασία
5.1. Ανοργανοποίηση
Ζυγίζουμε 1 g του δείγματος με ακρίβεια 0,001 g και το εισάγουμε στη φιάλη της συσκευής ανοργανοποίησης. Προσθέτουμε 15 g θειικού καλίου (3.1), την ενδεδειγμένη ποσότητα καταλύτου (3.2) (0,3 έως 0,4 g CuO ή 0,9 έως 1,2 g CuSO4-5H2O), 25 ml θειικού οξέος (3.4) και, αν χρειάζεται, μερικούς κόκκους ελαφρόπετρας (3.12) και αναμειγνύουμε.
Θερμαίνουμε τη φιάλη μετρίως στην αρχή, ανακινώντας από καιρού σε καιρό εάν είναι απαραίτητο, μέχρις ότου απανθρακωθεί η μάζα και εξαφανισθεί ο αφρός· εν συνεχεία θερμαίνουμε περισσότερο μέχρις ότου το υγρό αρχίσει να βράζει σταθερά. Η θέρμανση είναι επαρκής όταν οι ατμοί του ζέοντος οξέος υγροποιούνται πάνω στα τοιχώματα της φιάλης. Πρέπει να αποφεύγεται η υπερθέρμανση των πλευρικών τοιχωμάτων καθώς και η προσκόλληση οργανικών σωματιδίων επ’ αυτών.
Όταν το διάλυμα καταστεί διαυγές και αποκτήσει ανοικτό πράσινο χρώμα, αφήνεται να βράσει επί δύο ακόμη ώρες και εν συνεχεία αφήνεται να ψυχθεί.
5.2. Απόσταξη
Προσθέτουμε με προσοχή ικανή ποσότητα νερού ώστε τα θειικά άλατα να διαλυθούν πλήρως. Αφήνουμε το διάλυμα να ψυχθεί και προσθέτουμε εν συνεχεία μερικούς κόκκους ψευδαργύρου (3.3), αν απαιτείται. Συνεχίζουμε σύμφωνα με την παράγραφο 5.2.1 ή 5.2.2.
5.2.1.
Εισάγουμε στη φιάλη συλλογής της αποστακτικής συσκευής 25 ml (με ακρίβεια μετρημένα) θειικού οξέος (3.5) ή (3.7) ανάλογα με την κατ’ εκτίμηση αναμενόμενη περιεκτικότητα σε άζωτο. Προσθέτουμε μερικές σταγόνες ερυθρού του μεθυλίου (3.8).
Συνδέουμε τη φιάλη ανοργανοποίησης με τον συμπυκνωτή της αποστακτικής συσκευής και βυθίζουμε το άκρο του συμπυκνωτή στο υγρό της φιάλης συλλογής μέχρι βάθους 1 cm τουλάχιστον (βλέπε παρατήρηση 8.3). Προσθέτουμε βραδέως 100 ml διαλύματος υδροξειδίου του νατρίου (3.9) στη φιάλη ανοργανοποίησης προσέχοντας ώστε να μη σημειωθεί απώλεια αμμωνίας (βλέπε παρατήρηση 8.1). Θερμαίνουμε τη φιάλη μέχρι την απόσταξη όλης της αμμωνίας.
5.2.2.
Στις περιπτώσεις όπου η ογκομέτρηση της περιεκτικότητας του αποστάγματος σε αμμωνία εκτελείται χειρωνακτικά, εφαρμόζεται η διαδικασία που αναφέρεται παρακάτω. Στις περιπτώσεις όπου η μονάδα απόσταξης είναι πλήρως αυτοματοποιημένη έτσι ώστε να συμπεριλαμβάνει την ογκομέτρηση της περιεκτικότητας του αποστάγματος σε αμμωνία, ακολουθούμε τις οδηγίες του κατασκευαστή σχετικά με τη λειτουργία της μονάδας απόσταξης.
Τοποθετούμε μια φιάλη συλλογής που περιέχει 25 ml έως 30 ml διαλύματος βορικού οξέος (3.18) κάτω από το στόμιο εκροής του συμπυκνωτή με τέτοιο τρόπο ώστε ο σωλήνας διανομής να βρίσκεται κάτω από την επιφάνεια της περίσσειας του διαλύματος βορικού οξέος. Ρυθμίζουμε τη μονάδα απόσταξης έτσι ώστε να παρέχει 50 ml διαλύματος υδροξειδίου του νατρίου (3.9). Χρησιμοποιούμε τη μονάδα απόσταξης σύμφωνα με τις οδηγίες του κατασκευαστή και αποστάζουμε την αμμωνία που εκλύεται με την προσθήκη του διαλύματος υδροξειδίου του νατρίου. Συλλέγουμε το απόσταγμα από το διάλυμα βορικού οξέος. Η ποσότητα του αποστάγματος (χρόνος απόσταξης με ατμό) εξαρτάται από την ποσότητα του αζώτου που περιέχεται στο δείγμα. Ακολουθούμε τις οδηγίες του κατασκευαστή.
|
Σημείωση: |
Σε μια ημιαυτόματη μονάδα απόσταξης, η προσθήκη περίσσειας υδροξειδίου του νατρίου και η απόσταξη με ατμό εκτελούνται αυτόματα. |
5.3. Ογκομέτρηση
Σύμφωνα με την παράγραφο 5.3.1 ή 5.3.2.
5.3.1.
Ογκομετρείται η περίσσεια θειικού οξέος στη φιάλη συλλογής με διάλυμα υδροξειδίου του νατρίου (3.10 ή 3.11) αναλόγως της συγκέντρωσης του χρησιμοποιηθέντος θειικού οξέος μέχρι το τέλος της αντίδρασης.
5.3.2.
Ογκομετρείται το περιεχόμενο της φιάλης συλλογής με το πρότυπο ογκομετρικό διάλυμα υδροχλωρικού οξέος (3.19) ή με το πρότυπο ογκομετρικό διάλυμα θειικού οξέος (3.6), χρησιμοποιώντας προχοΐδα και διαβάζοντας την ένδειξη για την ποσότητα του ογκομετρικού διαλύματος που χρησιμοποιήθηκε.
Όταν εφαρμόζεται η χρωματομετρική μέθοδος ανίχνευσης μέχρι το τέλος της αντίδρασης, ως τέλος της αντίδρασης θεωρείται το πρώτο ίχνος ρόδινου χρώματος στο περιεχόμενο. Η ένδειξη της προχοΐδας εκτιμάται με προσέγγιση 0,05 ml. Ένας μαγνητικός δίσκος ανάδευσης με φωτεινή ένδειξη ή φωτομετρικός ανιχνευτής μπορεί να βοηθήσει στην ανίχνευση του τέλους της αντίδρασης.
Αυτή η διαδικασία μπορεί να γίνει αυτόματα χρησιμοποιώντας μια αποστακτική συσκευή ατμού με αυτόματη ογκομέτρηση.
Ακολουθούνται οι οδηγίες του κατασκευαστή σχετικά με τη λειτουργία της ειδικής αποστακτικής συσκευής ή αποστακτικής συσκευής/τιτλοδότη.
|
Σημείωση: |
Όταν χρησιμοποιείται αυτόματο σύστημα ογκομέτρησης, η ογκομέτρηση ξεκινά αμέσως μετά την έναρξη της απόσταξης και χρησιμοποιείται διάλυμα βορικού οξέος συγκέντρωσης 1 % (3.18). Στις περιπτώσεις όπου χρησιμοποιείται πλήρως αυτοματοποιημένη μονάδα απόσταξης, η αυτόματη ογκομέτρηση της αμμωνίας μπορεί επίσης να πραγματοποιηθεί με ανίχνευση του τέλους της αντίδρασης, χρησιμοποιώντας ένα ποτενσιομετρικό σύστημα πεχαμέτρησης. Σε αυτή την περίπτωση χρησιμοποιείται ένας αυτόματος τιτλοδότης, με πεχάμετρο. Το πεχάμετρο πρέπει να βαθμονομηθεί σωστά, στο εύρος pH 4 έως 7, ακολουθώντας τις συνήθεις εργαστηριακές διαδικασίες βαθμονόμησης πεχάμετρου. Το τέλος της αντίδρασης ογκομέτρησης με βάση το pH είναι η τιμή pH 4,6 δηλαδή η κορυφή στην καμπύλη ογκομέτρησης (σημείο καμπής). |
5.4. Τυφλό πείραμα
Για να επιβεβαιωθεί ότι τα αντιδραστήρια είναι ελεύθερα αζώτου, πραγματοποιούμε τυφλό πείραμα (ανοργανοποίηση, απόσταξη και ογκομέτρηση) χρησιμοποιώντας 1 g σακχαρόζης (3.14) αντί του δείγματος.
6. Υπολογισμός των αποτελεσμάτων
Οι υπολογισμοί εκτελούνται σύμφωνα με την παράγραφο 6.1. ή 6.2.
6.1. Υπολογισμός για την ογκομέτρηση σύμφωνα με την παράγραφο 5.3.1
Η περιεκτικότητα σε ολικές αζωτούχες ουσίες, ως κλάσμα βάρους, υπολογίζεται βάσει του τύπου:

όπου:
|
Vo |
= |
είναι ο όγκος (σε ml) του NaOH (3.10 ή 3.11) που χρησιμοποιήθηκε κατά το τυφλό πείραμα, |
|
V1 |
= |
είναι ο όγκος (σε ml) του NaOH (3.10 ή 3.11) που χρησιμοποιήθηκε για την ογκομέτρηση του δείγματος, |
|
c |
= |
είναι η συγκέντρωση (σε mol/l) του NaOH (3.10 ή 3.11), |
|
m |
= |
είναι το βάρος του δείγματος (σε g). |
6.2. Υπολογισμός για την ογκομέτρηση σύμφωνα με την παράγραφο 5.3.2
6.2.1.
Η περιεκτικότητα σε ολικές αζωτούχες ουσίες, ως κλάσμα βάρους, υπολογίζεται βάσει του τύπου:

όπου:
|
m |
= |
είναι το βάρος της παρτίδας δοκιμής (σε g), |
|
c |
= |
είναι η συγκέντρωση (σε mol/l) του πρότυπου ογκομετρικού διαλύματος υδροχλωρικού οξέος (3.19), |
|
V0 |
= |
είναι ο όγκος (σε ml) του υδροχλωρικού οξέος που χρησιμοποιήθηκε κατά το τυφλό πείραμα, |
|
V1 |
= |
είναι ο όγκος (σε ml) του υδροχλωρικού οξέος που χρησιμοποιήθηκε για την παρτίδα δοκιμής. |
6.2.2.
Η περιεκτικότητα σε ολικές αζωτούχες ουσίες, ως κλάσμα βάρους, υπολογίζεται βάσει του τύπου:

όπου:
|
m |
= |
είναι το βάρος της παρτίδας δοκιμής (σε g), |
|
c |
= |
είναι η συγκέντρωση (σε mol/l) του πρότυπο διαλύματος θειικού οξέος (3.6), |
|
V0 |
= |
είναι ο όγκος (σε ml) του θειικού οξέος (3.6) που χρησιμοποιήθηκε κατά το τυφλό πείραμα, |
|
V1 |
= |
είναι ο όγκος (σε ml) του θειικού οξέος (3.6) που χρησιμοποιήθηκε για την παρτίδα δοκιμής. |
7. Επαλήθευση της μεθόδου
7.1. Επαναληψιμότητα
Η διαφορά μεταξύ των αποτελεσμάτων δύο παράλληλα διενεργούμενων προσδιορισμών επί του ίδιου δείγματος δεν πρέπει να υπερβαίνει:
|
— |
το 0,2 % σε απόλυτη τιμή, για επίπεδα αζωτούχων ουσιών μικρότερα από 20 %, |
|
— |
το 1,0 % σε σχέση με την υψηλότερη τιμή, για επίπεδα από 20 % έως 40 %, και |
|
— |
το 0,4 % σε απόλυτη τιμή, για επίπεδα μεγαλύτερα από 40 %. |
7.2. Ακρίβεια της μεθόδου
Η ανάλυση (ανοργανοποίηση, απόσταξη και ογκομέτρηση) διεξάγεται επί 1,5 έως 2,0 g ακετανιλιδίου (3.13) παρουσία 1 g σακχαρόζης (3.14). Για 1 g ακετανιλιδίου απαιτούνται 14,80 ml θειικού οξέος (3.5). Η ανάκτηση πρέπει να είναι τουλάχιστον 99 %.
8. Παρατηρήσεις
|
8.1. |
Η συσκευή μπορεί να είναι χειροκίνητη, ημιαυτόματη ή αυτόματη. Αν η συσκευή είναι τέτοια ώστε μεταξύ ανοργανοποίησης και απόσταξης να χρειασθεί να γίνει μεταφορά, χρειάζεται προσοχή ώστε κατά τη μεταφορά αυτή να μη σημειωθούν απώλειες. Αν η φιάλη της αποστακτικής συσκευής δεν διαθέτει σταγονομετρικό χωνί, προσθέτουμε το υδροξείδιο του νατρίου αμέσως πριν από τη σύνδεση της φιάλης στο συμπυκνωτή, ρίχνοντας το υγρό σιγά-σιγά. |
|
8.2. |
Εάν το προκύπτον από την ανοργανοποίηση υγρό πήγνυται, προβαίνουμε σε νέο προσδιορισμό χρησιμοποιώντας μεγαλύτερη ποσότητα θειικού οξέος (3.4) από την ανωτέρω οριζόμενη. |
|
8.3. |
Για προϊόντα χαμηλής περιεκτικότητας σε άζωτο, ο όγκος του θειικού οξέος (3.7) που εισάγεται στη φιάλη συλλογής μπορεί να μειωθεί, αν χρειασθεί, σε 10 ή 15 ml και να συμπληρωθεί με νερό μέχρι τα 25 ml. |
|
8.4. |
Για συνήθεις αναλύσεις, μπορούν να εφαρμοστούν εναλλακτικές μέθοδοι αναλύσης για τον προσδιορισμό των ολικών αζωτούχων ουσιών, αλλά η μέθοδος Kjeldahl που περιγράφεται στο παρόν μέρος Γ είναι η μέθοδος αναφοράς. Η ισοδυναμία των αποτελεσμάτων που προκύπτουν με την εναλλακτική μέθοδο (π.χ. DUMAS) σε σύγκριση με τη μέθοδο αναφοράς πρέπει να αποδεικνύεται για κάθε επιμέρους μήτρα. Καθώς τα αποτελέσματα που προκύπτουν με μια εναλλακτική μέθοδο, ακόμα και μετά την επαλήθευση της ισοδυναμίας της μεθόδου, μπορεί να αποκλίνουν ελαφρώς από τα αποτελέσματα που προκύπτουν με τη μέθοδο αναφοράς, είναι απαραίτητο να αναφέρεται στην αναλυτική έκθεση η μέθοδος ανάλυσης που χρησιμοποιήθηκε για τον προσδιορισμό των ολικών αζωτούχων ουσιών. |
Δ. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΗΣ ΟΥΡΙΑΣ
1. Αντικείμενο και πεδίο εφαρμογής
Η μέθοδος επιτρέπει τον προσδιορισμό της περιεκτικότητας των ζωοτροφών σε ουρία.
2. Αρχή
Το δείγμα φέρεται εν αιωρήσει σε νερό παρουσία ενός βοηθητικού της στράγγισης παράγοντα. Το αιώρημα διηθείται. Η περιεκτικότητα σε ουρία του διηθήματος προσδιορίζεται μετά από προσθήκη 4-διμεθυλαμινοβενζαλδεΰδης (4-DMAB) και μέτρηση της οπτικής πυκνότητας σε μήκος κύματος 420 nm.
3. Αντιδραστήρια
|
3.1. |
Διάλυμα 4-διμεθυλαμινοβενζαλδεΰδης: διαλύονται 1,6 g 4-DMAB σε 100 ml αιθανόλης 96 % και προστίθενται 10 ml υδροχλωρικού οξέος (ρ201,19 g/ml). Αυτό το αντιδραστήριο διατηρείται κατ’ ανώτατο όριο δύο εβδομάδες. |
|
3.2. |
Διάλυμα Carrez I: Διαλύονται σε νερό 21,9 g οξεικού ψευδαργύρου Zn(CH3COO)2 2H2O και 3 g κρυσταλλικού οξεικού οξέος. Φέρεται στα 100 ml με νερό. |
|
3.3. |
Διάλυμα Carrez II: διαλύονται σε νερό 10,6 g σιδηροκυανιούχου καλίου, K4 Fe (CN)6 3H2O. Φέρεται στα 100 ml με νερό. |
|
3.4. |
Ενεργός άνθραξ, μη προσροφών την ουρία (ελέγξιμο). |
|
3.5. |
Διάλυμα 0,1 % (βάρος/όγκο) ουρίας. |
4. Όργανα
|
4.1. |
Αναμείκτης (παλινδρομητής): περίπου 35 έως 40 στροφές ανά λεπτό. |
|
4.2. |
Δοκιμαστικοί σωλήνες: 160 × 16 mm με εσμυρισμένα πώματα. |
|
4.3. |
Φασματοφωτόμετρο. |
5. Διαδικασία
5.1. Ανάλυση του δείγματος
Ζυγίστε, με ακρίβεια 1 mg, 2 g δείγματος και τοποθετήστε τα μαζί με 1 g ενεργού άνθρακα (3.4) σε ογκομετρική φιάλη των 500 ml. Προσθέστε 400 ml νερό και 5 ml από το διάλυμα Carrez I (3.2), αναμείξτε επί περίπου 30 δευτερόλεπτα και προσθέστε 5 ml από το διάλυμα Carrez II (3.3). Αναμείξτε επί 30 λεπτά στον παλινδρομητή. Συμπληρώστε μέχρι της χαραγής με νερό, ανακινήστε και διηθήστε.
Λάβετε 5 ml από το διαυγές και άχρουν διήθημα, φέρτε τα εντός των δοκιμαστικών σωλήνων με εσμυρισμένα πώματα, προσθέστε 5 ml διαλύματος 4-DMAB (3.1) και αναμείξτε. Τοποθετήστε τους σωλήνες μέσα σε υδατόλουτρο σε 20 oC (+/- 4 oC). Έπειτα από 15 λεπτά, μετρήστε την οπτική πυκνότητα του διαλύματος του δείγματος στο φασματοφωτόμετρο στα 420 nm σε σύγκριση με τυφλό πείραμα.
5.2. Πρότυπη καμπύλη
Λάβετε όγκους 1, 2, 4, 5 και 10 ml από το διάλυμα ουρίας (3.5), φέρτε τους σε ογκομετρικές φιάλες των 100 ml και συμπληρώστε μέχρι τη χαραγή με νερό. Λάβετε 5 ml από κάθε διάλυμα, προσθέστε από 5 ml διαλύματος 4-DMAB (3.1), ομογενοποιήστε και μετρήστε την οπτική πυκνότητα όπως υποδεικνύεται ανωτέρω σε σύγκριση με διάλυμα μάρτυρα που περιέχει 5 ml 4-DMAB και 5 ml νερό, απαλλαγμένο ουρίας. Χαράξτε την πρότυπη καμπύλη.
6. Υπολογισμός των αποτελεσμάτων
Με την πρότυπη καμπύλη υπολογίστε την ποσότητα της ουρίας δείγματος που χρησιμοποιήθηκε.
Εκφράστε το αποτέλεσμα επί τοις εκατό του δείγματος.
7. Παρατηρήσεις
|
7.1. |
Για περιεκτικότητες σε ουρία ανώτερες από 3 % μειώστε την ποσότητα δοκιμής σε 1 g ή αραιώστε το αρχικό διάλυμα για να μην έχετε περισσότερο από 50 mg ουρίας στα 500 ml. |
|
7.2. |
Για χαμηλές περιεκτικότητες σε ουρία, αυξήστε την ποσότητα δοκιμής, αρκεί το διήθημα να παραμείνει διαυγές και άχρουν. |
|
7.3. |
Αν το δείγμα περιέχει απλά αζωτούχα παράγωγα, όπως αμινοξέα, η μέτρηση της οπτικής πυκνότητας ενδείκνυται να πραγματοποιηθεί στα 435 nm. |
E. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΩΝ ΠΤΗΤΙΚΩΝ ΑΖΩΤΟΥΧΩΝ ΒΑΣΕΩΝ
I. ΜΕ ΜΙΚΡΟΔΙΑΧΥΣΗ
1. Αντικείμενο και πεδίο εφαρμογής
Η μέθοδος επιτρέπει τον προσδιορισμό της περιεκτικότητας σε πτητικές αζωτούχες βάσεις, εκπεφρασμένης σε αμμωνία.
2. Αρχή
Το δείγμα εκχυλίζεται με νερό και το διάλυμα διαυγάζεται και διηθείται. Οι πτητικές αζωτούχες βάσεις αντικαθίστανται με μικροδιάχυση με τη χρήση διαλύματος ανθρακικού καλίου, συλλέγονται σε διάλυμα βορικού οξέος και τιτλοδοτούνται με θειικό οξύ.
3. Αντιδραστήρια
|
3.1. |
Διάλυμα τριχλωροξεικού οξέος 20 % (βάρος/όγκο). |
|
3.2. |
Δείκτης: Διαλύονται 33 mg πρασίνου της βρωμοκρεζόλης και 65 mg ερυθρού του μεθυλίου εντός 100 ml αιθανόλης 95-96 % (κατ’ όγκο). |
|
3.3. |
Διάλυμα βορικού οξέος: Εντός ογκομετρικής φιάλης ενός λίτρου, διαλύονται 10 g βορικού οξέος σε 200 ml αιθανόλης 95-96 % (κατ’ όγκο) και 700 ml νερού. Προστίθενται 10 ml δείκτη (3.2). Αναμειγνύονται και ρυθμίζεται, εφόσον είναι απαραίτητο, ο χρωματισμός του διαλύματος σε ανοικτό ερυθρό με προσθήκη διαλύματος υδροξειδίου του νατρίου. Ένα (1) ml του διαλύματος αυτού επιτρέπει τη δέσμευση κατ’ ανώτατο όριο 300 μg NH3. |
|
3.4. |
Κεκορεσμένο διάλυμα ανθρακικού καλίου: Ποσότητα 100 g ανθρακικού καλίου διαλύεται εντός 100 ml ζέοντος νερού. Αφήνεται να ψυχθεί και διηθείται. |
|
3.5. |
Θειικό οξύ 0,01 mol/litre. |
4. Όργανα
|
4.1. |
Αναμείκτης (παλινδρομητής): 35 έως 40 περίπου στροφές ανά λεπτό. |
|
4.2. |
Κύτταρα Conway (βλέπε σχήμα), από γυαλί ή πλαστικό. |
|
4.3. |
Μικροπροχοΐδες, διαβαθμισμένες σε 1/100 ml. |
5. Διαδικασία
Ζυγίζεται ποσότητα 10 g δείγματος, με προσέγγιση 1 ml και εισάγεται με 100 ml νερού εντός ογκομετρικής φιάλης των 200 ml. Αναμειγνύεται ή αναδεύεται στον αναμείκτη επί 30 λεπτά. Προστίθενται 50 ml διαλύματος τριχλωροξεικού οξέος (3.1), συμπληρώνεται ο όγκος με νερό, ανακινείται έντονα και διηθείται μέσω πτυχωτού ηθμού.
Μέσω του σιφωνίου εισάγεται 1 ml διαλύματος βορικού οξέος (3.3) εντός του κεντρικού τμήματος του κυττάρου Conway και 1 ml του διηθήματος του δείγματος εντός της στεφάνης του κυττάρου. Καλύπτεται μερικώς με τη βοήθεια του λιπανθέντος καλύμματος. Αφήνεται να πέσει ταχέως εντός του δακτύλου 1 ml κεκορεσμένου διαλύματος ανθρακικού καλίου (3.4) και κλείεται το κάλυμμα αεροστεγώς. Το κύτταρο ταράσσεται με προσοχή κατά οριζόντια περιστροφική κίνηση για την εξασφάλιση της ανάμειξης των δύο αντιδραστηρίων. Αφήνεται προς επώαση επί τουλάχιστον τέσσερις ώρες σε θερμοκρασία δωματίου ή επί μία ώρα σε 40 oC.
Τιτλοδοτούνται οι πτητικές βάσεις εντός του διαλύματος βορικού οξέος με θειικό οξύ (3.5) χρησιμοποιώντας μικροπροχοΐδα (4.3).
Διενεργείται τυφλό πείραμα εφαρμόζοντας τον ίδιο τρόπο εργασίας χωρίς το προς ανάλυση δείγμα.
6. Υπολογισμός των αποτελεσμάτων
Ένα (1) ml H2SO40,01 mol/litre αντιστοιχεί εις 0,34 mg αμμωνίας.
Το αποτέλεσμα εκφράζεται επί τοις εκατό του δείγματος.
Επαναληψιμότητα
Η διαφορά μεταξύ των αποτελεσμάτων των δύο παράλληλα διενεργουμένων προσδιορισμών επί του ίδιου δείγματος δεν πρέπει να υπερβαίνει το:
|
— |
10 % σε σχετική τιμή για περιεκτικότητα σε αμμωνία μικρότερη του 1,0 %, |
|
— |
0,1 % σε απόλυτο τιμή για περιεκτικότητα σε αμμωνία ίση ή υψηλότερη του 1,0 %. |
7. Παρατήρηση
Αν η περιεκτικότητα του δείγματος σε αμμωνία είναι υψηλότερη του 0,6 % αραιώνεται το αρχικό διήθημα.
ΚΥΤΤΑΡΟ CONWAY
Κλίμακα 1/1

II. ΜΕ ΑΠΟΣΤΑΞΗ
1. Αντικείμενο και πεδίο εφαρμογής
Η μέθοδος επιτρέπει τον προσδιορισμό της περιεκτικότητας σε πτητικές αζωτούχες βάσεις, εκπεφρασμένες σε αμμωνία, των ιχθυαλεύρων τα οποία πρακτικώς δεν περιέχουν ουρία. Αύτη δεν είναι εφαρμόσιμη για περιεκτικότητες σε αμμωνία μικρότερες των 0,25 %.
2. Αρχή
Το δείγμα εκχυλίζεται με νερό και το διάλυμα διαυγάζεται και διηθείται. Οι πτητικές αζωτούχες βάσεις αντικαθίστανται στο σημείο ζέσεως με την προσθήκη οξειδίου του μαγνησίου και συλλέγονται εντός καθορισμένης ποσότητας θειικού οξέος, η περίσσεια του οποίου επανατιτλοδοτείται με διάλυμα υδροξειδίου του νατρίου.
3. Αντιδραστήρια
|
3.1. |
Διάλυμα τριχλωροξεικού οξέος 20 % (βάρος/όγκο). |
|
3.2. |
Οξείδιο του μαγνησίου. |
|
3.3. |
Αντιαφριτικό γαλάκτωμα (για παράδειγμα σιλικόνη). |
|
3.4. |
Θειικό οξύ 0,05 mol/litre. |
|
3.5. |
Διάλυμα υδροξειδίου του νατρίου 0,1 mol/litre. |
|
3.6. |
Διάλυμα 0,3 % ερυθρού του μεθυλίου εντός αιθανόλης 95-96 % (κατ’ όγκο). |
4. Όργανα
|
4.1. |
Αναμείκτης (παλινδρομητής): 35 έως 40 περίπου στροφές ανά λεπτό. |
|
4.2. |
Συσκευή απόσταξης τύπου Kjeldahl. |
5. Διαδικασία
Ζυγίζεται ποσότητα 10 g δείγματος με προσέγγιση 1 mg και εισάγεται με 100 ml νερού εντός ογκομετρικής φιάλης των 200 ml. Αναμειγνύεται ή αναδεύεται στον αναμείκτη επί 30 λεπτά, προστίθενται 50 ml διαλύματος τριχλωροξεικού οξέος, συμπληρώνεται ο όγκος με νερό, ανακινείται έντονα και διηθείται μέσω πτυχωτού ηθμού.
Λαμβάνεται ποσότητα διαυγούς διηθήματος αναλόγως της υποτιθεμένης περιεκτικότητας σε πτητικές αζωτούχες βάσεις (γενικά ενδείκνυται 100 ml). Αραιώνεται στα 200 ml και προστίθενται 2 g οξειδίου του μαγνησίου (3.2) και ορισμένες σταγόνες αντιαφρώδους γαλακτώματος (3.3). Το διάλυμα πρέπει να είναι αλκαλικό σε χάρτη ηλιοτροπίου, διαφορετικά προστίθεται μια ποσότητα οξειδίου του μαγνησίου (3.2). Η διαδικασία συνεχίζεται σύμφωνα με τις παραγράφους 5.2 και 5.3 της μεθόδου ανάλυσης για τον προσδιορισμό της περιεκτικότητας σε ολικές αζωτούχες ουσίες (μέρος Γ του παρόντος παραρτήματος).
Διενεργείται τυφλό πείραμα εφαρμόζοντας τον ίδιο τρόπο εργασίας χωρίς το προς ανάλυση δείγμα.
6. Υπολογισμός των αποτελεσμάτων
1 ml H2SO40,05 mol/litre αντιστοιχεί σε 1,7 mg αμμωνίας.
Το αποτέλεσμα εκφράζεται επί τοις εκατό του δείγματος.
Επαναληψιμότητα
Η διαφορά μεταξύ των αποτελεσμάτων των δύο παράλληλα διενεργουμένων προσδιορισμών επί του ίδιου δείγματος δεν πρέπει να υπερβαίνει, σε σχετική τιμή, το 10 % της αμμωνίας.
ΣΤ. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΑΜΙΝΟΞΕΩΝ (ΕΚΤΟΣ ΤΗΣ ΘΡΥΠΤΟΦΑΝΗΣ)
1. Σκοπός και πεδίο εφαρμογής
Η μέθοδος επιτρέπει τον προσδιορισμό των ελεύθερων (συνθετικών και φυσικών) και ολικών (ενωμένων σε πεπτίδια και ελεύθερων) αμινοξέων στις ζωοτροφές με αναλυτή αμινοξέων. Μπορεί να εφαρμοστεί στα ακόλουθα αμινοξέα: κυστ(ε)ίνη, μεθειονίνη, λυσίνη, θρεονίνη, αλανίνη, αργινίνη, ασπαραγινικό οξύ, γλουταμινικό οξύ, γλυκίνη, ιστιδίνη, ισολευκίνη, λευκίνη, φαινυλαλανίνη, προλίνη, σερίνη, τυροσίνη και βαλίνη.
Η μέθοδος δεν κάνει διάκριση μεταξύ των αλάτων των αμινοξέων ούτε και μπορεί να επιτύχει διαφοροποίηση μεταξύ των μορφών D και L των αμινοξέων. Δεν είναι κατάλληλη για τον προσδιορισμό της θρυπτοφάνης και των υδροξυλιωμένων παραγώγων των αμινοξέων.
2. Αρχή
2.1. Ελεύθερα αμινοξέα
Τα προστιθέμενα ελεύθερα αμινοξέα εκχυλίζονται με τη βοήθεια αραιού υδροχλωρικού οξέος. Τα συνεκχυλιζόμενα αζωτούχα μακρομόρια καθιζάνουν με σουλφοσαλικυλικό οξύ και απομακρύνονται με διήθηση. Το pH του διηθήματος ρυθμίζεται στο 2,20. Τα αμινοξέα διαχωρίζονται με χρωματογραφία ιοντοανταλλαγής και προσδιορίζονται με αντίδραση με νινυδρίνη και φωτομετρική ανίχνευση στα 570 nm.
2.2. Ολικά αμινοξέα
Ο τρόπος εργασίας εξαρτάται από τα εξεταζόμενα αμινοξέα. Η κυστ(ε)ίνη και η μεθειονίνη πρέπει να οξειδώνονται προς κυστεϊνικό οξύ και σουλφόνη μεθειονίνης πριν από την υδρόλυση. Η τυροσίνη πρέπει να προσδιορίζεται σε υδρόλυμα μη οξειδωμένων δειγμάτων. Όλα τα υπόλοιπα αμινοξέα που αναφέρονται στο σημείο 1 μπορούν να προσδιορίζονται είτε σε οξειδωμένο είτε σε μη οξειδωμένο δείγμα.
Η οξείδωση πραγματοποιείται στους 0 oC με μείγμα υπερμυρμηκικού οξέος και φαινόλης. Η περίσσεια του οξειδωτικού αντιδραστηρίου αποσυντίθεται με διθειώδες νάτριο. Το δείγμα, οξειδωμένο ή μη, υδρολύεται με υδροχλωρικό οξύ (3.20) επί 23 ώρες. Το pH του υδρολύματος ρυθμίζεται στο 2,20. Τα αμινοξέα διαχωρίζονται με χρωματογραφία ιοντοανταλλαγής και προσδιορίζονται με αντίδραση με νινυδρίνη και φωτομετρική ανίχνευση στα 570 nm (440 nm στην περίπτωση της προλίνης).
3. Αντιδραστήρια
Χρησιμοποιείται δισαπεσταγμένο νερό ή νερό ισοδύναμης καθαρότητας (αγωγιμότητα < 10 μS).
|
3.1. |
Υπεροξείδιο του υδρογόνου, w (w/w) = 30 %. |
|
3.2. |
Μυρμηκικό οξύ, w (w/w) = 98-100 %. |
|
3.3. |
Φαινόλη. |
|
3.4. |
Διθειώδες νάτριο. |
|
3.5. |
Υδροξείδιο του νατρίου. |
|
3.6. |
Διένυδρο 5-σουλφοσαλικυλικό οξύ. |
|
3.7. |
Υδροχλωρικό οξύ, πυκνότητας περίπου 1,18 g/ml. |
|
3.8. |
Διένυδρο κιτρικό νάτριο. |
|
3.9. |
2,2'-θειοδιαιθανόλη (θειοδιγλυκόλη). |
|
3.10. |
Χλωριούχο νάτριο. |
|
3.11. |
Νινυδρίνη. |
|
3.12. |
Πετρελαϊκός αιθέρας, περιοχή ζέσεως 40-60 oC. |
|
3.13. |
Νορλευκίνη, ή άλλη ένωση κατάλληλη για χρήση ως εσωτερικό πρότυπο. |
|
3.14. |
Αέριο άζωτο (< 10 ppm οξυγόνο). |
|
3.15. |
1-οκτανόλη. |
|
3.16. |
Αμινοξέα. |
|
3.16.1. |
Οι τυπικές ουσίες που αναφέρονται στην παράγραφο 1. Καθαρές ενώσεις που δεν περιέχουν νερό κρυσταλλοποίησης. Ξηραίνονται υπό κενό υπεράνω P2O5 ή H2SO4 για 1 εβδομάδα πριν από τη χρήση. |
|
3.16.2. |
Κυστεϊνικό οξύ. |
|
3.16.3. |
Σουλφόνη μεθειονίνης. |
|
3.17. |
Διάλυμα υδροξειδίου του νατρίου, c = 7,5 mol/l: Διαλύονται 300 g NaOH (3.5) σε νερό και το διάλυμα συμπληρώνεται μέχρις όγκου 1 λίτρου με νερό. |
|
3.18. |
Διάλυμα υδροξειδίου του νατρίου, c = 1 mol/l: Διαλύονται 40 g NaOH (3.5) σε νερό και το διάλυμα συμπληρώνεται μέχρις όγκου 1 λίτρου με νερό. |
|
3.19. |
Διάλυμα μυρμηκικού οξέος-φαινόλης: Αναμειγνύονται 889 g μυρμηκικού οξέος (3.2) με 111 g νερού και προστίθενται 4,73 g φαινόλης (3.3). |
|
3.20. |
Μείγμα υδρόλυσης, c = 6 mol HCl/l που περιέχει 1 g φαινόλης/l: Προστίθεται 1 g φαινόλης (3.3) σε 492 ml HCl (3.7) και το διάλυμα συμπληρώνεται μέχρις όγκου 1 λίτρου με νερό. |
|
3.21. |
Μείγμα εκχύλισης, c = 0,1 mol HCl/l που περιέχει 2 % θειοδιγλυκόλη: λαμβάνονται 8,2 ml HCl (3.7), αραιώνονται με περίπου 900 ml νερού, προστίθενται 20 ml θειοδιγλυκόλης (3.9) και το διάλυμα συμπληρώνεται μέχρις όγκου 1 λίτρου με νερό, (τα 3.7 και 3.9 δεν πρέπει να αναμειγνύονται απευθείας). |
|
3.22. |
5-σουλφοσαλικυλικό οξύ ß = 6 %: Διαλύονται 60 g 5-σουλφοσαλικυλικού οξέος (3.6) σε νερό και το διάλυμα συμπληρώνεται μέχρις όγκου 1 λίτρου με νερό. |
|
3.23. |
Μείγμα οξείδωσης (υπερμυρμηκικό οξύ-φαινόλη): Αναμειγνύονται 0,5 ml υπεροξειδίου του υδρογόνου (3.1) με 4,5 ml διαλύματος μυρμηκικού οξέος-φαινόλης (3.19) σε ένα μικρό γυάλινο ποτήρι ζέσεως. Αφήνεται προς επώαση στους 20-30 oC για 1 ώρα για να σχηματιστεί το υπερμυρμηκικό οξύ, και στη συνέχεια ψύχεται σε λουτρό νερού/πάγου (15 λεπτά) πριν προστεθεί στο δείγμα. Προσοχή: αποφύγετε την επαφή με το δέρμα και φοράτε προστατευτικά ρούχα. |
|
3.24. |
Διάλυμα κιτρικού άλατος, c = 0,2 mol Na+/l, pH 2,20: Διαλύονται 19,61 g κιτρικού νατρίου (3.8), 5 ml θειογλυκόλης (3.9), 1 g φαινόλης (3.3) και 16,50 ml HCl (3.7) σε περίπου 800 ml νερό. Το pH ρυθμίζεται στο 2,20. Το διάλυμα συμπληρώνεται μέχρις όγκου 1 λίτρου με νερό. |
|
3.25. |
Ρυθμιστικό διάλυμα έκλουσης, το οποίο παρασκευάζεται ανάλογα με τις συνθήκες του αναλυτή που χρησιμοποιείται (4.9). |
|
3.26. |
Αντιδραστήριο νινυδρίνης, το οποίο παρασκευάζεται ανάλογα με τις συνθήκες του αναλυτή που χρησιμοποιείται (4.9). |
|
3.27. |
Πρότυπα διαλύματα αμινοξέων. Τα εν λόγω διαλύματα πρέπει να αποθηκεύονται σε θερμοκρασία κάτω των 5 oC. |
|
3.27.1. |
Αρχικό πρότυπο διάλυμα αμινοξέων (3.16.1). c = 2,5 μmol/ml για κάθε αμινοξύ. Διατίθεται στο εμπόριο. |
|
3.27.2. |
Αρχικό πρότυπο διάλυμα κυστεϊνικού οξέως και σουλφόνης μεθειονίνης, c = 1,25 μmol/ml. Διαλύονται 0,2115 g κυστεϊνικού οξέως (3.16.2) και 0,2265 g σουλφόνης μεθειονίνης (3.16.3) σε διάλυμα κιτρικού οξέος (3.24) σε μια ογκομετρική φιάλη 1 l και το διάλυμα συμπληρώνεται μέχρις όγκου 1 λίτρου με διάλυμα κιτρικού οξέος. Αποθηκεύεται σε θερμοκρασία κάτω των 5 oC για 12 μήνες το πολύ. Το εν λόγω διάλυμα δεν χρησιμοποιείται αν το αρχικό πρότυπο διάλυμα (3.27.1) περιέχει κυστεϊνικό οξύ και σουλφόνη μεθειονίνης. |
|
3.27.3. |
Αρχικό πρότυπο διάλυμα του εσωτερικού προτύπου π.χ. νορλευκίνη, c = 20 μmol/ml. Διαλύονται 0,6560 g νορλευκίνης (3.13) σε διάλυμα κιτρικού οξέος (3.24) σε μια ογκομετρική φιάλη και το διάλυμα συμπληρώνεται μέχρις όγκου 250 ml με ρυθμιστικό διάλυμα κιτρικού οξέος. Αποθηκεύεται σε θερμοκρασία κάτω των 5 oC για 6 μήνες το πολύ. |
|
3.27.4. |
Διάλυμα βαθμονόμησης πρότυπων αμινοξέων για χρήση με υδρολύματα, c = 5 nmol/50 μl κυστεϊνικού οξέως και σουλφόνης μεθειονίνης και c = 10 nmol/50 μl για τα υπόλοιπα αμινοξέα. Διαλύονται 2,2 g χλωριούχου νατρίου (3.10) σε γυάλινο ποτήρι ζέσεως 100 ml με 30 ml διαλύματος κιτρικού οξέως (3.24). Προστίθενται 4,00 ml αρχικού πρότυπου διαλύματος αμινοξέων (3.27.1), 4,00 ml αρχικού πρότυπου διαλύματος κυστεϊνικού οξέως και σουλφόνης μεθειονίνης (3.27.2) και 0,50 ml αρχικού πρότυπου διαλύματος εσωτερικού προτύπου (3.27.3), αν χρησιμοποιούνται. Το pH ρυθμίζεται στο 2,20 με υδροξείδιο του νατρίου (3.18). Μεταγγίζεται ποσοτικά σε ογκομετρική φιάλη 50 ml. Το διάλυμα συμπληρώνεται μέχρι τη χαραγή της φιάλης με διάλυμα κιτρικού οξέος (3.24) και αναμειγνύεται. Αποθηκεύεται σε θερμοκρασία κάτω των 5 oC για 3 μήνες το πολύ. Βλέπε επίσης παρατηρήσεις 9.1 |
|
3.27.5. |
Διάλυμα βαθμονόμησης πρότυπων αμινοξέων για χρήση με υδρολύματα το οποίο παρασκευάζεται σύμφωνα με την παράγραφο 5.3.3.1 και για χρήση με εκχυλίσματα (5.2). Το διάλυμα βαθμονόμησης παρασκευάζεται σύμφωνα με την παράγραφο 3.27.4 αλλά παραλείποντας το χλωριούχο νάτριο. Αποθηκεύεται σε θερμοκρασία κάτω των 5 oC για 3 μήνες το πολύ. |
4. Όργανα
|
4.1. |
Σφαιρική φιάλη 100 ή 250 ml που φέρει κάθετο ψυκτήρα. |
|
4.2. |
Φιάλη από βοροπυριτικό γυαλί 100 ml με βιδωτό πώμα με επένδυση από καουτσούκ/τεφλόν (π.χ. Duran, Schott) για χρήση σε ξηραντήρα. |
|
4.3. |
Ξηραντήρας με δυναμικό αερισμό και ρυθμιστή θερμοκρασίας ακρίβειας υψηλότερης από ±2 oC. |
|
4.4. |
pH-μετρο (με ακρίβεια τριών δεκαδικών ψηφίων). |
|
4.5. |
Φίλτρο μεμβράνης (0,22 μm). |
|
4.6. |
Μηχανή φυγοκέντρησης. |
|
4.7. |
Περιστροφικός εξατμιστής κενού. |
|
4.8. |
Μηχανικό τάρακτρο (σέικερ) ή μαγνητικός αναδευτήρας. |
|
4.9. |
Αναλυτής αμινοξέων ή εξοπλισμός HPLC με ιοντοανταλλακτική στήλη, συσκευή για νινυδρίνη, παραγώγιση μετά τη στήλη και φωτομετρικό ανιχνευτή. Πραγματοποιείται πλήρωση της στήλης με θειούχες ρητίνες πολυστυρένιου, κατάλληλες για το διαχωρισμό των αμινοξέων μεταξύ τους και για το διαχωρισμό από άλλα υλικά θετικά στη νινυδρίνη. Η ροή μέσα στους κλάδους με το ρυθμιστικό διάλυμα και τη νινυδρίνη εξασφαλίζεται με αντλίες σταθερότητας ροής ±0,5 % κατά την περίοδο που καλύπτει τόσο την εκτέλεση της πρότυπης βαθμονόμησης όσο και την ανάλυση του δείγματος. Με ορισμένους αναλυτές αμινοξέων είναι δυνατόν να χρησιμοποιηθούν διαδικασίες υδρόλυσης όπου το υδρόλυμα έχει συγκέντρωση νατρίου c = 0,8 mol/l και περιέχει όλο το μυρμηκικό οξύ που απομένει μετά το στάδιο της οξείδωσης. Άλλοι πάλι δεν εξασφαλίζουν τον ικανοποιητικό διαχωρισμό ορισμένων αμινοξέων αν το υδρόλυμα περιέχει περίσσεια μυρμηκικού οξέος ή/και έχει υψηλές συγκεντρώσεις ιόντων νατρίου. Σε αυτή την περίπτωση, μειώνεται ο όγκος των οξέων με εξάτμιση σε περίπου 5 ml μετά την υδρόλυση και πριν από τη ρύθμιση του pH. Η εξάτμιση πρέπει να εκτελείται υπό κενό και σε ανώτατη θερμοκρασία 40 oC. |
5. Διαδικασία
5.1. Παρασκευή δειγμάτων
Το δείγμα αλέθεται ώστε να διέρχεται από κόσκινο με διάμετρο οπών 0,5 mm. Δείγματα με υψηλή υγρασία πρέπει είτε να ξηραίνονται με αέρα σε θερμοκρασία μη υπερβαίνουσα τους 50 oC ή να ξηραίνονται με ψύξη πριν από την άλεση. Δείγματα με υψηλή περιεκτικότητα σε λίπος πρέπει να εκχυλίζονται με πετρελαϊκό αιθέρα (3.12) πριν από την άλεση.
5.2. Προσδιορισμός ελεύθερων αμινοξέων σε ζωοτροφές και προμείγματα
Σε κωνική φιάλη ζυγίζεται με προσέγγιση 0,2 mg κατάλληλη ποσότητα (1-5 g) του παρασκευασθέντος δείγματος (5.1). Προστίθενται 100,0 ml μείγματος εκχύλισης (3.21). Το σύνολο ανακινείται ή αναμειγνύεται επί 60 λεπτά χρησιμοποιώντας μηχανικό τάρακτρο ή μαγνητικό αναδευτήρα (4.8). Το ίζημα αφήνεται να κατακαθίσει και 10,0 ml του υπερκείμενου διαλύματος μεταφέρονται με σιφώνιο σε ποτήρι ζέσεως 100 ml.
Προστίθενται 5,0 ml διαλύματος σουλφοσαλικυλικού οξέος (3.22), αναδεύοντας με τη βοήθεια μαγνητικού αναδευτήρα για 5 λεπτά. Το υπερκείμενο διάλυμα υποβάλλεται σε διήθηση ή φυγοκέντρηση για την απομάκρυνση τυχόν ιζήματος. Τοποθετούνται 10,0 ml του διαλύματος που προκύπτει σε ποτήρι ζέσεως 100 ml και ρυθμίζεται το pH στο 2,20 χρησιμοποιώντας διάλυμα υδροξειδίου του νατρίου (3.18). Το διάλυμα μεταφέρεται σε ογκομετρική φιάλη κατάλληλου όγκου χρησιμοποιώντας διάλυμα κιτρικού οξέος (3.24), και το διάλυμα συμπληρώνεται μέχρι τη χαραγή της φιάλης με διάλυμα κιτρικού οξέος (3.24).
Αν χρησιμοποιείται εσωτερικό πρότυπο, προστίθεται 1,00 ml εσωτερικού προτύπου (3.27.3) ανά 100 ml τελικού διαλύματος και το διάλυμα συμπληρώνεται μέχρι τη χαραγή με διάλυμα κιτρικού οξέος (3.24).
Ακολουθεί χρωματογράφηση σύμφωνα με την παράγραφο 5.4.
Εάν τα εκχυλίσματα δεν εξεταστούν την ίδια ημέρα, πρέπει να φυλαχθούν σε θερμοκρασία κάτω των 5 oC.
5.3. Προσδιορισμός των συνολικών αμινοξέων
5.3.1.
Ζυγίζονται με προσέγγιση 0,2 mg από 0,1 έως 1 g του παρασκευασθέντος δείγματος (5.1) σε:
|
— |
σφαιρική φιάλη 100 ml (4.1) για ανοικτή υδρόλυση (5.3.2.3), ή |
|
— |
σφαιρική φιάλη 250 ml (4.1) αν απαιτείται χαμηλή συγκέντρωση νατρίου (5.3.3.1), ή |
|
— |
φιάλη 100 ml με βιδωτό πώμα (4.2), για κλειστή υδρόλυση (5.3.2.4). |
Η ζυγισθείσα ποσότητα δείγματος πρέπει να έχει περιεκτικότητα σε άζωτο περίπου 10 mg και περιεκτικότητα σε υγρασία όχι μεγαλύτερη των 100 mg.
Η φιάλη ψύχεται μέσα σε λουτρό νερού-πάγου στους 0 oC, προστίθενται 5 ml μείγματος οξείδωσης (3.23) και αναμειγνύεται χρησιμοποιώντας γυάλινη σπαθίδα με κυρτή άκρη. Η φιάλη μαζί με τη σπαθίδα σφραγίζεται με αεροστεγή μεμβράνη. Τα λουτρό νερού/πάγου που περιέχει τη σφραγισμένη φιάλη τοποθετείται σε ψυγείο στους 0 oC και αφήνεται για 16 ώρες. Μετά τις 16 ώρες, η φιάλη εξάγεται από το ψυγείο και η περίσσεια του οξειδωτικού αντιδραστηρίου αποσυντίθεται προσθέτοντας 0,84 g διθειώδους νατρίου (3.4).
Ακολουθείται η διαδικασία της παραγράφου 5.3.2.1.
5.3.2.
5.3.2.1.
Στο οξειδωμένο δείγμα που παρασκευάστηκε σύμφωνα με την παράγραφο 5.3.1 προστίθενται 25 ml μείγματος υδρόλυσης (3.20), φροντίζοντας να εκπλυθούν τυχόν κατάλοιπα δείγματος που παραμένουν στα τοιχώματα του δοχείου και στη σπαθίδα.
Ανάλογα με τη διαδικασία υδρόλυσης που χρησιμοποιείται, ακολουθείται η διαδικασία της παραγράφου 5.3.2.3 ή 5.3.2.4.
5.3.2.2.
Ζυγίζονται, είτε σε μια σφαιρική φιάλη 100 ml ή 250 ml (4.1) είτε σε μια φιάλη 100 ml με βιδωτό πώμα (4.2), με προσέγγιση 0,2 mg, από 0,1 έως 1 g του δείγματος που παρασκευάστηκε (5.1). Η ζυγισθείσα ποσότητα δείγματος πρέπει να έχει περιεκτικότητα σε άζωτο περίπου 10 mg. Προστίθενται προσεκτικά 25 ml μείγματος υδρόλυσης (3.20) και αναμειγνύονται με το δείγμα. Ακολουθείται η διαδικασία της παραγράφου 5.3.2.3 ή 5.3.2.4.
5.3.2.3.
Προστίθενται 3 γυάλινες σφαίρες στο μείγμα της φιάλης (το οποίο παρασκευάστηκε σύμφωνα με την παράγραφο 5.3.2.1 ή 5.3.2.2) και θερμαίνεται στο σημείο βρασμού με συνεχή παραγωγή φυσαλίδων υπό αναρροή για 23 ώρες. Όταν ολοκληρωθεί η υδρόλυση, ο ψυκτήρας εκπλύνεται με 5 ml διαλύματος κιτρικού οξέος (3.24). Η φιάλη αποσυνδέεται και ψύχεται σε λουτρό πάγου.
Ακολουθείται η διαδικασία της παραγράφου 5.3.3.
5.3.2.4.
Η φιάλη με το μείγμα που παρασκευάστηκε σύμφωνα με την παράγραφο 5.3.2.1 ή 5.3.2.2 τοποθετείται σε ξηραντήρα (4.3) στους 110 oC. Κατά την πρώτη ώρα της ξήρανσης, για να αποφευχθεί η υπερβολική αύξηση της πίεσης (λόγω της έκλυσης αέριων ουσιών) και τυχόν έκρηξη, το βιδωτό πώμα τοποθετείται πάνω στο στόμιο του δοχείου. Η φιάλη δεν πρέπει να σφραγισθεί με το βιδωτό πώμα. Μετά από μία ώρα, η φιάλη σφραγίζεται με το πώμα και αφήνεται στον ξηραντήρα (4.3) για 23 ώρες. Όταν ολοκληρωθεί η υδρόλυση, η φιάλη εξάγεται από τον ξηραντήρα, ξεβιδώνεται προσεκτικά το πώμα και η φιάλη τοποθετείται σε λουτρό νερού/πάγου. Αφήνεται να ψυχθεί.
Ανάλογα με τη διαδικασία που χρησιμοποιείται για τη ρύθμιση του pH (5.3.3), το περιεχόμενο της φιάλης μεταγγίζεται ποσοτικά σε ένα ποτήρι ζέσεως 250 ml ή μια σφαιρική φιάλη 250 ml, χρησιμοποιώντας διάλυμα κιτρικού οξέος (3.24).
Ακολουθείται η διαδικασία της παραγράφου 5.3.3.
5.3.3.
Ανάλογα με την ανοχή του αναλυτή αμινοξέων στο νάτριο (4.9), για τη ρύθμιση του pH ακολουθείται η διαδικασία της παραγράφου 5.3.3.1 ή 5.3.3.2.
5.3.3.1.
Κρίνεται σκόπιμο να χρησιμοποιηθεί αρχικό πρότυπο διάλυμα του εσωτερικού προτύπου (3.27.3), όταν χρησιμοποιούνται αναλυτές αμινοξέων που απαιτούν χαμηλή συγκέντρωση νατρίου (εφόσον πρέπει να μειωθεί ο όγκος του όξινου διαλύματος).
Σε αυτή την περίπτωση προστίθενται 2,00 ml αρχικού πρότυπου διαλύματος του εσωτερικού προτύπου (3.27.3) στο υδρόλυμα πριν από την εξάτμιση.
Προστίθενται 2 σταγόνες 1-οκτανόλης (3.15) στο υδρόλυμα το οποίο παρασκευάστηκε σύμφωνα με την παράγραφο 5.3.2.3 ή 5.3.2.4.
Χρησιμοποιώντας έναν περιστροφικό εξατμιστή κενού (4.7), ο όγκος μειώνεται σε 5-10 ml, υπό κενό, στους 40 oC. Αν ο όγκος μειωθεί κατά λάθος κάτω των 5 ml, το υδρόλυμα πρέπει να απορριφθεί και η ανάλυση να γίνει από την αρχή.
Το pH ρυθμίζεται στο 2,20 με διάλυμα υδροξειδίου του νατρίου (3.18) και ακολουθείται η διαδικασία της παραγράφου 5.3.4.
5.3.3.2.
Λαμβάνονται τα υδρολύματα που παρασκευάστηκαν σύμφωνα με την παράγραφο 5.3.2.3 ή 5.3.2.4 και υποβάλλονται σε μερική εξουδετέρωση, προσθέτοντας προσεκτικά και με ταυτόχρονη ανάδευση 17 ml διαλύματος υδροξειδίου του νατρίου (3.17), διατηρώντας τη θερμοκρασία κάτω από τους 40 oC.
Το pH ρυθμίζεται στο 2,20 σε θερμοκρασία δωματίου, χρησιμοποιώντας διάλυμα υδροξειδίου του νατρίου (3.17) και, τέλος, διάλυμα υδροξειδίου του νατρίου (3.18). Ακολουθείται η διαδικασία της παραγράφου 5.3.4.
5.3.4.
Το υδρόλυμα με το ρυθμισμένο pH (5.3.3.1 ή 5.3.3.2) μεταγγίζεται ποσοτικά με διάλυμα κιτρικού οξέος (3.24) σε ογκομετρική φιάλη 200 ml και το διάλυμα συμπληρώνεται μέχρι τη χαραγή με διάλυμα κιτρικού οξέος (3.24).
Αν δεν έχει χρησιμοποιηθεί ήδη εσωτερικό πρότυπο, προστίθενται 2,00 ml εσωτερικού προτύπου (3.27.3) και το διάλυμα συμπληρώνεται μέχρι τη χαραγή με διάλυμα κιτρικού οξέος (3.24). Το διάλυμα αναμειγνύεται πολύ καλά.
Ακολουθεί χρωματογράφηση σύμφωνα με την παράγραφο 5.4.
Εάν τα εκχυλίσματα δεν εξεταστούν την ίδια ημέρα, πρέπει να φυλαχθούν σε θερμοκρασία κάτω των 5 oC.
5.4. Χρωματογράφηση
Πριν από τη χρωματογράφηση, το εκχύλισμα (5.2) ή το υδρόλυμα (5.3.4) ρυθμίζεται σε θερμοκρασία δωματίου. Το μείγμα αναμειγνύεται καλά και διηθείται κατάλληλη ποσότητα με φίλτρο μεμβράνης 0,22 μm (4.5). Το διαυγές διάλυμα που προκύπτει υποβάλλεται σε χρωματογράφηση ιοντοανταλλαγής, χρησιμοποιώντας αναλυτή αμινοξέων (4.9).
Η έγχυση μπορεί να εκτελεστεί διά χειρός ή αυτόματα. Είναι σημαντικό να προστεθεί η ίδια ποσότητα διαλύματος ±0,5 % στη στήλη για την ανάλυση των προτύπων και των δειγμάτων, εκτός αν χρησιμοποιείται εσωτερικό πρότυπο, και οι αναλογίες νατρίου/αμινοξέα στα πρότυπα διαλύματα και στα διαλύματα δείγματος να είναι παρόμοιες, όσο αυτό είναι πρακτικά δυνατόν.
Σε γενικές γραμμές, η συχνότητα των κύκλων βαθμονόμησης εξαρτάται από τη σταθερότητα του αντιδραστηρίου νινυδρίνης και από το αναλυτικό σύστημα. Το πρότυπο ή το δείγμα αραιώνεται με διάλυμα κιτρικού οξέος (3.24), προκειμένου η περιοχή μεγίστων του προτύπου να αντιστοιχεί σε 30-200 % της περιοχής μεγίστων των αμινοξέων του δείγματος.
Η χρωματογράφηση αμινοξέων διαφοροποιείται ελαφρώς ανάλογα με τον τύπο του αναλυτή και τη ρητίνη που χρησιμοποιείται. Το επιλεγμένο σύστημα πρέπει να είναι σε θέση να διαχωρίζει τα αμινοξέα μεταξύ τους, καθώς και από άλλα υλικά θετικά στη νινυδρίνη. Εντός του εύρους λειτουργίας του χρωματογραφικού συστήματος πρέπει να εμφανιστεί μια γραμμική απόκριση στις μεταβολές των ποσοτήτων των αμινοξέων που προστίθενται στη στήλη.
Κατά τη χρωματογράφηση, η αναλογία ύψους ελαχίστων/μεγίστων που αναφέρεται παρακάτω ισχύει όταν αναλύεται ένα ισομοριακό διάλυμα (των υπό προσδιορισμό αμινοξέων). Το εν λόγω ισομοριακό διάλυμα πρέπει να περιέχει τουλάχιστον 30 % της μέγιστης ποσότητας κάθε αμινοξέως που μπορεί να μετρηθεί με ακρίβεια με το σύστημα του αναλυτή αμινοξέων (4.9).
Για τον διαχωρισμό θρεονίνης-σερίνης, η αναλογία ύψους ελαχίστων/μεγίστων του κατώτερου από τα δύο αλληλεπικαλυπτόμενα αμινοξέα στο χρωματογράφημα δεν πρέπει να υπερβαίνει το 2:10 (αν προσδιορίζονται μόνο κυστ(ε)ίνη, μεθειονίνη, θρεονίνη και λυσίνη, ο ανεπαρκής διαχωρισμός από τα γειτονικά μέγιστα θα επηρεάσει αρνητικά τον προσδιορισμό). Για όλα τα υπόλοιπα αμινοξέα, ο διαχωρισμός πρέπει να είναι καλύτερος από 1:10.
Το σύστημα πρέπει να εξασφαλίζει τον διαχωρισμό της λυσίνης από «τεχνητά σφάλματα λυσίνης» και από την ορνιθίνη.
6. Υπολογισμός αποτελεσμάτων
Το εμβαδόν των κορυφών του δείγματος και του προτύπου μετράται για κάθε επιμέρους αμινοξύ και η ποσότητα (X), σε g αμινοξέως ανά kg δείγματος, υπολογίζεται με τον τύπου.

Αν χρησιμοποιείται εσωτερικό πρότυπο, ο τύπος πολλαπλασιάζεται επί: 
|
A |
= |
εμβαδόν κορυφής, υδρόλυμα ή εκχύλισμα |
|
B |
= |
εμβαδόν κορυφής, εσωτερικό πρότυπο |
|
C |
= |
εμβαδόν κορυφής, εσωτερικό πρότυπο σε υδρόλυμα ή εκχύλισμα |
|
D |
= |
εμβαδόν κορυφής, εσωτερικό πρότυπο, πρότυπο διάλυμα βαθμονόμησης |
|
M |
= |
μοριακό βάρος του υπό προσδιορισμό αμινοξέως |
|
c |
= |
συγκέντρωση προτύπου σε μmol/ml |
|
m |
= |
βάρος δείγματος (g) (διορθωμένο στο αρχικό βάρος αν είναι αποξηραμένο ή απολιπωμένο) |
|
V |
= |
ml συνολικού υδρολύματος (5.3.4) ή ml του υπολογιζόμενου συνολικού όγκου αραίωσης του εκχυλίσματος (6.1) |
Η κυστίνη και η κυστεΐνη προσδιορίζονται και οι δύο ως κυστεϊνικό οξύ σε υδρολύματα οξειδωμένου δείγματος, υπολογίζονται όμως ως κυστίνη (C6H12N2O4S2, M 240,30 g/mol) χρησιμοποιώντας την τιμή M 120,15 g/mol (= 0,5 × 240,30 g/mol).
Η μεθειονίνη προσδιορίζεται ως σουλφόνη μεθειονίνης σε υδρολύματα οξειδωμένου δείγματος, υπολογίζεται όμως ως μεθειονίνη χρησιμοποιώντας την τιμή M = 149,21 g/mol για τη μεθειονίνη.
Η προστιθέμενη ελεύθερη μεθειονίνη προσδιορίζεται έπειτα από εκχύλιση ως μεθειονίνη. Για τον υπολογισμό, χρησιμοποιείται η ίδια τιμή M.
|
6.1. |
Ο ολικός μετά την αραίωση όγκος των εκχυλισμάτων (F) για τον προσδιορισμό των ελεύθερων αμινοξέων (5.2) υπολογίζεται ως εξής: 
|
7. Αξιολόγηση της μεθόδου
Η μέθοδος δοκιμάστηκε σε διεθνή διεργαστηριακή σύγκριση που έγινε το 1990 χρησιμοποιώντας τέσσερις διαφορετικές ζωοτροφές (αναμεμειγμένη ζωοτροφή χοίρων, φύραμα πουλερικών, συμπύκνωμα πρωτεΐνης, προμείγματα). Τα αποτελέσματα, μετά την αφαίρεση των εκτός κλίμακας αποκλίσεων, της μέσης και της σταθερής απόκλισης δίδονται στους πίνακες που ακολουθούν:
Μέσοι όροι σε g/kg
|
Υλικό αναφοράς |
Αμινοξύ |
||||||
|
Θρεονίνη |
Κυστ(ε)ίνη |
Μεθειονίνη |
Λυσίνη |
||||
|
Αναμεμειγμένη ζωοτροφή χοίρων |
6,94 n = 15 |
3,01 n = 17 |
3,27 n = 17 |
9,55 n = 13 |
|||
|
Φύραμα πουλερικών |
9,31 n = 16 |
3,92 n = 18 |
5,08 n = 18 |
13,93 n = 16 |
|||
|
Συμπύκνωμα πρωτεΐνης |
22,32 n = 16 |
5,06 n = 17 |
12,01 n = 17 |
47,74 n = 15 |
|||
|
Πρόμειγμα |
58,42 n= 16 |
— |
90,21 n = 16 |
98,03 n = 16 |
|||
|
|||||||
7.1. Επαναληψιμότητα
Τιμές επαναληψιμότητας για τα εξετασθέντα αμινοξέα. Η επαναληψιμότητα εκφραζόμενη ως «τυπική απόκλιση εντός εργαστηρίου» της προαναφερθείσας διεργαστηριακής σύγκρισης, εμφαίνεται στους ακόλουθους πίνακες:
Τυπική απόκλιση εντός εργαστηρίου (Sr) σε g/kg
|
Υλικό αναφοράς |
Αμινοξύ |
||||||
|
Θρεονίνη |
Κυστ(ε)ίνη |
Μεθειονίνη |
Λυσίνη |
||||
|
Αναμεμειγμένη ζωοτροφή χοίρων |
0,13 n = 15 |
0,10 n = 17 |
0,11 n = 17 |
0,26 n = 13 |
|||
|
Φύραμα πουλερικών |
0,20 n = 16 |
0,11 n = 18 |
0,16 n = 18 |
0,28 n = 16 |
|||
|
Συμπύκνωμα πρωτεΐνης |
0,48 n = 16 |
0,13 n = 17 |
0,27 n = 17 |
0,99 n = 15 |
|||
|
Πρόμειγμα |
1,30 n= 16 |
— |
2,19 n = 16 |
2,06 n = 16 |
|||
|
|||||||
Συντελεστής διακύμανσης ( %) για την τυπική απόκλιση εντός εργαστηρίου (Sr)
|
Υλικό αναφοράς |
Αμινοξύ |
||||||
|
Θρεονίνη |
Κυστ(ε)ίνη |
Μεθειονίνη |
Λυσίνη |
||||
|
Αναμεμειγμένη ζωοτροφή χοίρων |
1,9 n = 15 |
3,3 n = 17 |
3,4 n = 17 |
2,8 n = 13 |
|||
|
Φύραμα πουλερικών |
2,1 n = 16 |
2,8 n = 18 |
3,1 n = 18 |
2,1 n = 16 |
|||
|
Συμπύκνωμα πρωτεΐνης |
2,7 n = 16 |
2,6 n = 17 |
2,2 n = 17 |
2,4 n = 15 |
|||
|
Πρόμειγμα |
2,2 n = 16 |
— |
2,4 n = 16 |
2,1 n = 16 |
|||
|
|||||||
7.2. Αναπαραγωγιμότητα
Τα σχετικά αποτελέσματα για την τυπική απόκλιση μεταξύ εργαστηρίων για τη διεργαστηριακή σύγκριση που αναφέρθηκε παραπάνω, εμφαίνονται στον ακόλουθο πίνακα:
Τυπική απόκλιση μεταξύ εργαστηρίων (SR) σε g/kg
|
Υλικό αναφοράς |
Αμινοξύ |
||||||
|
Θρεονίνη |
Κυστ(ε)ίνη |
Μεθειονίνη |
Λυσίνη |
||||
|
Αναμεμειγμένη ζωοτροφή χοίρων |
0,28 n = 15 |
0,30 n = 17 |
0,23 n = 17 |
0,30 n = 13 |
|||
|
Φύραμα πουλερικών |
0,48 n = 16 |
0,34 n = 18 |
0,55 n = 18 |
0,75 n = 16 |
|||
|
Συμπύκνωμα πρωτεΐνης |
0,85 n = 16 |
0,62 n = 17 |
1,57 n = 17 |
1,24 n = 15 |
|||
|
Πρόμειγμα |
2,49 n = 16 |
— |
6,20 n = 16 |
6,62 n = 16 |
|||
|
|||||||
Συντελεστής διακύμανσης ( %) για την τυπική απόκλιση μεταξύ εργαστηρίων (SR)
|
Υλικό αναφοράς |
Αμινοξύ |
||||||
|
Θρεονίνη |
Κυστ(ε)ίνη |
Μεθειονίνη |
Λυσίνη |
||||
|
Αναμεμειγμένη ζωοτροφή χοίρων |
4,1 n = 15 |
9,9 n = 17 |
7,0 n = 17 |
3,2 n = 13 |
|||
|
Φύραμα πουλερικών |
5,2 n = 16 |
8,8 n = 18 |
10,9 n = 18 |
5,4 n = 16 |
|||
|
Συμπύκνωμα πρωτεΐνης |
3,8 n = 16 |
12,3 n = 17 |
13,0 n = 17 |
3,0 n = 15 |
|||
|
Πρόμειγμα |
4,3 n = 16 |
— |
6,9 n = 16 |
6,7 n = 16 |
|||
|
|||||||
8. Χρήση υλικών αναφοράς
Η σωστή εφαρμογή της μεθόδου ελέγχεται πραγματοποιώντας επανειλημμένες μετρήσεις των πιστοποιημένων υλικών αναφοράς που είναι διαθέσιμα. Συνιστάται η διακρίβωση με πιστοποιημένο διάλυμα διακριβώσεων αμινοξέων.
9. Παρατηρήσεις
|
9.1. |
Λόγω διαφορών μεταξύ αναλυτών αμινοξέων, ως κατευθυντήρια οδός πρέπει να χρησιμοποιούνται οι τελικές συγκεντρώσεις των διαλυμάτων διακρίβωσης των αμινοξέων (βλέπε παραγράφους 3.27.4 και 3.27.5) και του υδρολύματος (βλέπε παράγραφο 5.3.4). Το πεδίο της γραμμικής ανταπόκρισης της συσκευής, πρέπει να ελεγχθεί για όλα τα αμινοξέα. Το πρότυπο διάλυμα διαλύεται με ρυθμιστικό διάλυμα κιτρικού άλατος προκειμένου να παρουσιασθούν οι περιοχές αιχμής στο μέσο του πεδίου. |
|
9.2. |
Όταν για την ανάλυση των προϊόντων υδρόλυσης χρησιμοποιείται εξοπλισμός υγρής χρωματογραφίας υψηλής απόδοσης, οι πειραματικές συνθήκες πρέπει να βελτιστοποιούνται σύμφωνα με τις οδηγίες του κατασκευαστή. |
|
9.3. |
Με την εφαρμογή της μεθόδου σε ζωοτροφές που περιέχουν περισσότερο από 1 % χλωρίδιο (συμπυκνώματα, ανόργανες ζωοτροφές, συμπληρωματικές ζωοτροφές) θα μπορούσε να υπάρξει εκτίμηση κατώτερη της κανονικής όσον αφορά τη μεθειονίνη και πρέπει να υπάρξει ειδική αγωγή. |
Ζ. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΘΡΥΠΤΟΦΑΝΗΣ
1. Σκοπός και πεδίο εφαρμογής
Η μέθοδος επιτρέπει τον προσδιορισμό της συνολικής και της ελεύθερης θρυπτοφάνης σε ζωοτροφές. Δεν γίνεται διάκριση μεταξύ D- και L-μορφών.
2. Αρχή
Για τον προσδιορισμό της συνολικής θρυπτοφάνης, το δείγμα υδρολύεται υπό αλκαλικές συνθήκες με κορεσμένο διάλυμα υδροξειδίου του βαρίου και θερμαίνεται στους 110 oC για 20 ώρες. Μετά την υδρόλυση, προστίθεται εσωτερικό πρότυπο.
Για τον προσδιορισμό της ελεύθερης θρυπτοφάνης, το δείγμα εκχυλίζεται υπό ήπιες όξινες συνθήκες παρουσία εσωτερικού προτύπου.
Η θρυπτοφάνη και το εσωτερικό πρότυπο στο υδρόλυμα ή στο εκχύλισμα προσδιορίζονται μέσω HPLC με ανίχνευση φθορισμού.
3. Αντιδραστήρια
|
3.1. |
Πρέπει να χρησιμοποιείται δισαπεσταγμένο νερό ή νερό ισοδύναμης καθαρότητας (αγωγιμότητα < 10 μS/cm). |
|
3.2. |
Πρότυπη ουσία: θρυπτοφάνη (καθαρότητα/περιεκτικότητα ≥ 99 %) ξηρανθείσα υπό κενό υπεράνω πεντοξειδίου του φωσφόρου. |
|
3.3. |
Ουσία εσωτερικού προτύπου: α-μεθυλο-θρυπτοφάνη (καθαρότητα/περιεκτικότητα ≥ 99 %), ξηρανθείσα υπό κενό υπεράνω πεντοξειδίου του φωσφόρου. |
|
3.4. |
Οκταένυδρο υδροξείδιο του βαρίου [πρέπει να λαμβάνεται πρόνοια ώστε το Ba(OH)2 .8 H2O να μην εκτίθεται υπερβολικά στον αέρα για την αποφυγή σχηματισμού BaCO3, πράγμα το οποίο μπορεί να προκαλέσει προβλήματα στον προσδιορισμό] (βλέπε παρατήρηση 9.3). |
|
3.5. |
Υδροξείδιο του νατρίου. |
|
3.6. |
Ορθοφωσφορικό οξύ, w (w/w) = 85 %. |
|
3.7. |
Υδροχλωρικό οξύ, ρ201,19 g/ml. |
|
3.8. |
Μεθανόλη, καθαρότητας ισοδύναμης HPLC. |
|
3.9. |
Πετρελαϊκός αιθέρας, περιοχή ζέσεως 40-60 oC. |
|
3.10. |
Διάλυμα υδροξειδίου του νατρίου, c = 1 mol/l: 40,0 g NaOH (3.5) διαλύονται σε νερό και το διάλυμα συμπληρώνεται μέχρις όγκου 1 λίτρου με νερό (3.1). |
|
3.11. |
Υδροχλωρικό οξύ, c = 6 mol/l: Λαμβάνονται 492 ml HCl (3.7) και συμπληρώνονται μέχρις όγκου 1 λίτρου με νερό. |
|
3.12. |
Υδροχλωρικό οξύ, c = 1 mol/l: Λαμβάνονται 82 ml HCl (3.7) και συμπληρώνονται μέχρις όγκου 1 λίτρου με νερό. |
|
3.13. |
Υδροχλωρικό οξύ, c= 0,1 mol/l: Λαμβάνονται 8,2 ml HCl (3.7) και συμπληρώνονται μέχρις όγκου 1 λίτρου με νερό. |
|
3.14. |
Ορθοφωσφορικό οξύ, c = 0,5 mol/l: Λαμβάνονται 34 ml ορθοφωσφορικού οξέος (3.6) και συμπληρώνονται μέχρις όγκου 1 λίτρου με νερό (3.1). |
|
3.15. |
Πυκνό διάλυμα θρυπτοφάνης (3.2), c = 2,50 μmol/ml: Σε ογκομετρική φιάλη 500 ml διαλύονται 0,2553 g θρυπτοφάνης (3.2) σε υδροχλωρικό οξύ (3.13) και συμπληρώνονται μέχρι τη χαραγή με υδροχλωρικό οξύ (3.13). Το διάλυμα αποθηκεύεται στους - 18 oC για τέσσερις εβδομάδες το πολύ. |
|
3.16. |
Πυκνό διάλυμα εσωτερικού προτύπου, c = 2,50 μmol/ml: Σε ογκομετρική φιάλη 500 ml διαλύονται 0,2728 g α-μεθυλο-θρυπτοφάνης (3.3) σε υδροχλωρικό οξύ (3.13) και το διάλυμα συμπληρώνεται μέχρι τη χαραγή με υδροχλωρικό οξύ (3.13). Αποθηκεύεται στους - 18 oC για τέσσερις εβδομάδες το πολύ. |
|
3.17. |
Πρότυπο διάλυμα βαθμονόμησης θρυπτοφάνης και εσωτερικού προτύπου: Λαμβάνονται 2,00 ml πυκνού διαλύματος θρυπτοφάνης (3.15), και 2,00 ml πυκνού διαλύματος εσωτερικού προτύπου (α-μεθυλο-θρυπτοφάνη) (3.16). Αραιώνονται με νερό (3.1) και μεθανόλη (3.8) μέχρι περίπου τον ίδιο όγκο και την ίδια περίπου συγκέντρωση μεθανόλης (10-30 %) όπως και το τελικό υδρόλυμα. Το διάλυμα αυτό πρέπει να παρασκευάζεται λίγο πριν από τη χρήση του. Κατά τη διάρκεια της παρασκευής, προστατεύεται από το άμεσο ηλιακό φως. |
|
3.18. |
Οξικό οξύ |
|
3.19. |
1,1,1-τριχλωρο-2-μεθυλο-2-προπανόλη. |
|
3.20. |
Αιθανολαμίνη w (w/w) > 98 %. |
|
3.21. |
Διάλυμα 1 g 1,1,1-τριχλωρο-2-μεθυλο-2-προπανόλης (3.19) σε 100 ml μεθανόλης (3.8). |
|
3.22. |
Κινητή φάση για HPLC: 3,00 g οξικό οξύ (3.18) + 900 ml νερό (3.1) +50,0 ml διάλυμα (3.21) 1,1,1-τριχλωρο-2-μεθυλο-2-προπανόλης (3.19) σε μεθανόλη (3.8) (1g/100ml). Το pH ρυθμίζεται στο 5,00 με αιθανολαμίνη (3.20). Συμπληρώνεται μέχρι τα 1 000 ml με νερό (3.1). |
4. Όργανα
|
4.1. |
Εξοπλισμός HPLC με φασματοφθορισμομετρικό ανιχνευτή. |
|
4.2. |
Υγρή χρωματογραφική στήλη, 125 mm × 4 mm, C18, 3 μm πλήρωση, ή ισοδύναμη. |
|
4.3. |
pH-μετρο. |
|
4.4. |
Φιάλη πολυπροπυλενίου, χωρητικότητας 125 ml, ευρύλαιμη και με βιδωτό πώμα. |
|
4.5. |
Φίλτρο μεμβράνης, 0,45 μm. |
|
4.6. |
Αυτόκλειστο, 110 (± 2) oC, 1,4 (±0,1) bar. |
|
4.7. |
Μηχανικό τάρακτρο (σέικερ) ή μαγνητικός αναδευτήρας. |
|
4.8. |
Αναμείκτης vortex. |
5. Διαδικασία
5.1. Παρασκευή δειγμάτων
Το δείγμα αλέθεται ώστε να διέρχεται από κόσκινο με διάμετρο οπών 0,5 mm. Δείγματα με υψηλή υγρασία πρέπει είτε να ξηραίνονται με αέρα σε θερμοκρασία μη υπερβαίνουσα τους 50 oC ή να ξηραίνονται με ψύξη πριν από την άλεση. Δείγματα με υψηλή περιεκτικότητα σε λίπος πρέπει να εκχυλίζονται με πετρελαϊκό αιθέρα (3.9) πριν από την άλεση.
5.2. Προσδιορισμός ελεύθερης θρυπτοφάνης (εκχύλισμα)
Σε κωνική φιάλη, ζυγίζεται με προσέγγιση 1 mg κατάλληλη ποσότητα (1-5 g) του παρασκευασθέντος δείγματος (5.1). Προστίθενται 100,0 ml υδροχλωρικό οξύ, (3.13) και 5,00 ml πυκνό διάλυμα εσωτερικού προτύπου (3.16). Το σύνολο ανακινείται ή αναμειγνύεται επί 60 min χρησιμοποιώντας μηχανικό τάρακτρο ή μαγνητικό αναδευτήρα (4.7). Το ίζημα αφήνεται να κατακαθίσει και 10,0 ml του υπερκείμενου διαλύματος μεταφέρονται με σιφώνιο σε ποτήρι ζέσεως. Προστίθενται 5 ml ορθο-φωσφορικού οξέος (3.14). Το pH ρυθμίζεται στο 3 χρησιμοποιώντας υδροξείδιο του νατρίου (3.10). Προστίθεται ικανή ποσότητα μεθανόλης (3.8) ώστε να ληφθεί συγκέντρωση μεταξύ 10 και 30 % μεθανόλης στον τελικό όγκο. Το διάλυμα μεταφέρεται σε ογκομετρική φιάλη καταλλήλου όγκου και αραιώνεται με νερό στον όγκο που απαιτείται για τη χρωματογραφία [περίπου ο ίδιος όγκος με το πρότυπο διάλυμα βαθμονόμησης (3.17)].
Μερικά ml του διαλύματος διηθούνται μέσω φίλτρου μεμβράνης 0,45 μm (4.5) πριν εγχυθούν στη στήλη HPLC. Ακολουθεί χρωματογράφηση σύμφωνα με την παράγραφο 5.4.
Το πρότυπο διάλυμα και τα εκχυλίσματα προστατεύονται από το άμεσο ηλιακό φως. Εάν δεν είναι δυνατή η ανάλυση των εκχυλισμάτων την ίδια ημέρα, τα εκχυλίσματα μπορούν να φυλαχθούν στους 5 oC για τρεις ημέρες το πολύ.
5.3. Προσδιορισμός της συνολικής θρυπτοφάνης (υδρόλυμα)
Στην πολυπροπυλενική φιάλη (4.4) ζυγίζονται με προσέγγιση 0,2 mg από 0,1 έως 1 g του παρασκευασθέντος δείγματος (5.1). Η ζυγισθείσα ποσότητα δείγματος πρέπει να έχει περιεκτικότητα σε άζωτο περίπου 10 mg. Προστίθενται 8,4 g οκταένυδρο υδροξείδιο του βαρίου (3.4) και 10 ml νερό. Το σύνολο αναμειγνύεται σε αναμείκτη vortex (4.8) ή μαγνητικό αναδευτήρα (4.7). Ο επικαλυμμένος με τεφλόν μαγνήτης αφήνεται στο μείγμα. Τα τοιχώματα του δοχείου εκπλύνονται προς τα κάτω με 4 ml νερό. Τοποθετείται το βιδωτό πώμα και η φιάλη κλείνεται χαλαρά. Μεταφέρεται σε αυτόκλειστο (4.6) με βραστό νερό και ατμό για 30-60 λεπτά. Το αυτόκλειστο κλείνεται και ακολουθεί θέρμανση στους 110 (± 2) oC για 20 ώρες.
Πριν ανοιχθεί το αυτόκλειστο, η θερμοκρασία μειώνεται λίγο κάτω από τους 100 oC. Για την αποφυγή κρυστάλλωσης του Ba(OH)2 .8 H2O, προστίθενται στο θερμό μείγμα 30 ml νερό με θερμοκρασία δωματίου. Το σύνολο ανακινείται ή αναδεύεται ήπια. Προστίθενται 2,00 ml πυκνό διάλυμα εσωτερικού προτύπου (α-μεθυλο-θρυπτοφάνης) (3.16). Τα δοχεία ψύχονται σε λουτρό νερού/πάγου για 15 λεπτά.
Στη συνέχεια προστίθενται 5 ml ορθοφωσφορικού οξέος (3.14). Το δοχείο διατηρείται στο λουτρό ψύξης και εξουδετερώνεται με HCl (3.11) με ταυτόχρονη ανάδευση και το pH ρυθμίζεται στο 3,0 με HCl (3.12). Προστίθεται ικανή ποσότητα μεθανόλης ώστε να ληφθεί συγκέντρωση μεταξύ 10 και 30 % μεθανόλης στον τελικό όγκο. Κατάλληλη ποσότητα μεταφέρεται σε ογκομετρική φιάλη και αραιώνεται με νερό στον καθορισμένο όγκο που απαιτείται για τη χρωματογραφία (π.χ. 100 ml). Η προσθήκη μεθανόλης δεν πρέπει να προκαλεί καθίζηση.
Μερικά ml του διαλύματος διηθούνται μέσω φίλτρου μεμβράνης 0,45 μm (4.5) πριν εγχυθούν στη στήλη HPLC. Ακολουθεί χρωματογράφηση σύμφωνα με την παράγραφο 5.4.
Το πρότυπο διάλυμα και τα υδρολύματα προστατεύονται από το άμεσο ηλιακό φως. Εάν δεν είναι εφικτή η ανάλυση των υδρολυμάτων την ίδια ημέρα, τότε αυτά μπορούν να φυλαχθούν στους 5 oC για τρεις ημέρες το πολύ.
5.4. Προσδιορισμός με HPLC
Για ισοκρατική έκλουση κατάλληλες είναι οι ακόλουθες συνθήκες. Μπορούν να χρησιμοποιηθούν και άλλες συνθήκες, υπό την προϋπόθεση ότι παρέχουν ισοδύναμα αποτελέσματα (βλέπε επίσης τις παρατηρήσεις 9.1 και 9.2):
|
Υγρή χρωματογραφική στήλη (4.2): |
125 mm × 4 mm, C18, 3 μm πλήρωση, ή ισοδύναμη |
|
Θερμοκρασία στήλης: |
θερμοκρασία δωματίου |
|
Κινητή φάση (3.22): |
3,00 g οξικό οξύ (3.18) + 900 ml νερό (3.1) +50,0 ml διάλυμα (3.21) 1,1,1-τριχλωρο-2- μεθυλο-2-προπανόλης (3.19) σε μεθανόλη (3.8) (1g/100ml). Το pH ρυθμίζεται στο 5,00 με αιθανολαμίνη (3.20). Συμπληρώνεται μέχρι τα 1 000 ml με νερό (3.1) |
|
Ρυθμός ροής: |
1 ml/min |
|
Συνολικός χρόνος ροής: |
περίπου 34 min |
|
Μήκος κύματος ανίχνευσης: |
διέγερση: 280 nm, εκπομπή: 356 nm. |
|
Όγκος έγχυσης |
20 µl |
6. Υπολογισμός αποτελεσμάτων
Η ποσότητα της θρυπτοφάνης (X), σε g ανά 100 g δείγματος, υπολογίζεται ως εξής.
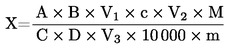
|
A |
= |
εμβαδόν κορυφής εσωτερικού προτύπου, πρότυπο διάλυμα βαθμονόμησης (3.17) |
|
B |
= |
εμβαδόν κορυφής θρυπτοφάνης, εκχύλισμα (5.2) ή υδρόλυμα (5.3) |
|
V1 |
= |
όγκος σε ml (2 ml) πυκνού διαλύματος θρυπτοφάνης (3.15) που προστίθεται στο διάλυμα βαθμονόμησης (3.17) |
|
c |
= |
συγκέντρωση σε μmol/ml = 2,50 πυκνού διαλύματος θρυπτοφάνης (3.15) που προστίθεται στο διάλυμα βαθμονόμησης (3.17) |
|
V2 |
= |
όγκος σε ml του πυκνού διαλύματος εσωτερικού προτύπου (3.16) που προστίθεται στην εκχύλιση (5.2) = 5,00 ml ή στο υδρόλυμα (5.3) = 2,00 ml |
|
C |
= |
εμβαδόν κορυφής εσωτερικού προτύπου, εκχύλισμα (5.2) ή υδρόλυμα (5.3) |
|
D |
= |
εμβαδόν κορυφής θρυπτοφάνης, πρότυπο διάλυμα βαθμονόμησης (3.17) |
|
V3 |
= |
όγκος σε ml (= 2,00 ml) πυκνού διαλύματος εσωτερικού προτύπου (3.16) που προστίθεται στο πρότυπο διάλυμα βαθμονόμησης (3.17) |
|
m |
= |
βάρος δείγματος σε g (διορθωμένο στο αρχικό βάρος εφόσον έχει ξηρανθεί ή/και απολιπανθεί) |
|
M |
= |
μοριακό βάρος θρυπτοφάνης (= 204,23 g/mol) |
7. Επαναληψιμότητα
Η διαφορά μεταξύ των αποτελεσμάτων δύο παράλληλα διενεργούμενων προσδιορισμών που γίνονται στο ίδιο δείγμα δεν πρέπει να υπερβαίνει το 10 % σε σχέση με την υψηλότερη τιμή.
8. Αποτελέσματα διεργαστηριακής μελέτης
Πραγματοποιήθηκε διεργαστηριακή κοινοτική μελέτη (4η διασύγκριση) στην οποία τρία δείγματα αναλύθηκαν από μέχρι δώδεκα εργαστήρια για την πιστοποίηση της μεθόδου υδρόλυσης. Σε κάθε δείγμα πραγματοποιήθηκαν πέντε επαναληπτικές αναλύσεις. Τα αποτελέσματα δίνονται στον ακόλουθο πίνακα:
|
|
Δείγμα 1 Ζωοτροφή χοίρων |
Δείγμα 2 Ζωοτροφή χοίρων με συμπλήρωμα L-θρυπτοφάνης |
Δείγμα 3 Συμπύκνωμα ζωοτροφής για χοίρους |
|
L |
12 |
12 |
12 |
|
n |
50 |
55 |
50 |
|
Μέσος όρος [g/kg] |
2,42 |
3,40 |
4,22 |
|
sr [g/kg] |
0,05 |
0,05 |
0,08 |
|
r [g/kg] |
0,14 |
0,14 |
0,22 |
|
CVr [%] |
1,9 |
1,6 |
1,9 |
|
SR [g/kg] |
0,15 |
0,20 |
0,09 |
|
R [g/kg] |
0,42 |
0,56 |
0,25 |
|
CVR [%] |
6,3 |
6,0 |
2,2 |
|
L |
= |
αριθμός υποβληθέντων εργαστηριακών αποτελεσμάτων |
|
n |
= |
αριθμός μεμονωμένων αποτελεσμάτων που διατηρούνται απαλείφοντας τις ακραίες τιμές (προσδιορίζονται με τη δοκιμή ακραίων τιμών Cochran, Dixon) |
|
sr |
= |
τυπική απόκλιση επαναληψιμότητας |
|
SR |
= |
τυπική απόκλιση αναπαραγωγιμότητας |
|
r |
= |
επαναληψιμότητα |
|
R |
= |
αναπαραγωγιμότητα |
|
CVr |
= |
συντελεστής διακύμανσης επαναληψιμότητας, % |
|
CVR |
= |
συντελεστής διακύμανσης αναπαραγωγιμότητας, % |
Πραγματοποιήθηκε μια άλλη κοινοτική μελέτη (3η διασύγκριση) στην οποία δύο δείγματα αναλύθηκαν από μέχρι δεκατρία εργαστήρια για την πιστοποίηση της μεθόδου υδρόλυσης. Σε κάθε δείγμα πραγματοποιήθηκαν πέντε επαναληπτικές αναλύσεις. Τα αποτελέσματα δίνονται στον ακόλουθο πίνακα:
|
|
Δείγμα 4 Μείγμα σίτου και σόγιας |
Δείγμα 5 Μείγμα σίτου και σόγιας (= δείγμα 4) με προσθήκη θρυπτοφάνης (0,457g/kg) |
|
L |
12 |
12 |
|
n |
55 |
60 |
|
Μέσος όρος [g/kg] |
0,391 |
0,931 |
|
sr [g/kg] |
0,005 |
0,012 |
|
r [g/kg] |
0,014 |
0,034 |
|
CVr [%] |
1,34 |
1,34 |
|
SR [g/kg] |
0,018 |
0,048 |
|
R [g/kg] |
0,050 |
0,134 |
|
CVR [%] |
4,71 |
5,11 |
|
L |
= |
αριθμός υποβληθέντων εργαστηριακών αποτελεσμάτων |
|
n |
= |
αριθμός μεμονωμένων αποτελεσμάτων που διατηρούνται απαλείφοντας τις ακραίες τιμές (προσδιορίζονται με τη δοκιμή ακραίων τιμών Cochran, Dixon) |
|
sr |
= |
τυπική απόκλιση επαναληψιμότητας |
|
SR |
= |
τυπική απόκλιση αναπαραγωγιμότητας |
|
r |
= |
επαναληψιμότητα |
|
R |
= |
αναπαραγωγιμότητα |
|
CVr |
= |
συντελεστής διακύμανσης επαναληψιμότητας, % |
|
CVR |
= |
συντελεστής διακύμανσης αναπαραγωγιμότητας, % |
Πραγματοποιήθηκε μια άλλη κοινοτική μελέτη διασύγκρισης στην οποία αναλύθηκαν τέσσερα δείγματα από μέχρι επτά εργαστήρια με σκοπό την πιστοποίηση θρυπτοφάνης για υδρόλυση. Τα αποτελέσματα δίνονται κατωτέρω. Σε κάθε δείγμα έγιναν πέντε επαναληπτικές αναλύσεις.
|
|
Δείγμα 1 Αναμεμειγμένη ζωοτροφή χοίρων (CRM 117) |
Δείγμα 2 Ιχθυάλευρο με χαμηλά λιπαρά (CRM 118) |
Δείγμα 3 Σογιάλευρο (CRM 119) |
Δείγμα 4 Αποβουτυρωμένο γάλα σε σκόνη (CRM 120) |
|
L |
7 |
7 |
7 |
7 |
|
n |
25 |
30 |
30 |
30 |
|
Μέσος όρος [g/kg] |
2,064 |
8,801 |
6,882 |
5,236 |
|
sr [g/kg] |
0,021 |
0,101 |
0,089 |
0,040 |
|
r [g/kg] |
0,059 |
0,283 |
0,249 |
0,112 |
|
CVr [%] |
1,04 |
1,15 |
1,30 |
0,76 |
|
SR [g/kg] |
0,031 |
0,413 |
0,283 |
0,221 |
|
R [g/kg] |
0,087 |
1,156 |
0,792 |
0,619 |
|
CVR [%] |
1,48 |
4,69 |
4,11 |
4,22 |
|
L |
= |
αριθμός υποβληθέντων εργαστηριακών αποτελεσμάτων |
|
n |
= |
αριθμός μεμονωμένων αποτελεσμάτων που διατηρούνται απαλείφοντας τις ακραίες τιμές (προσδιορίζονται με τη δοκιμή ακραίων τιμών Cochran, Dixon) |
|
SR |
= |
τυπική απόκλιση επαναληψιμότητας |
|
sR |
= |
τυπική απόκλιση αναπαραγωγιμότητας |
|
r |
= |
επαναληψιμότητα |
|
R |
= |
αναπαραγωγιμότητα |
|
CVr |
= |
συντελεστής διακύμανσης επαναληψιμότητας, % |
|
CVR |
= |
συντελεστής διακύμανσης αναπαραγωγιμότητας, % |
9. Παρατηρήσεις
|
9.1. |
Με ειδικές χρωματογραφικές συνθήκες μπορεί να επιτευχθεί καλύτερος διαχωρισμός μεταξύ θρυπτοφάνης και α-μεθυλο-θρυπτοφάνης. Ισοκρατική έκλουση που ακολουθείται από καθαρισμό της διαβαθμισμένης στήλης:
|
||||||||||||||||||||||||||||||||||||||||||||
|
9.2. |
Η χρωματογραφία διαφοροποιείται ανάλογα με τον τύπο HPLC και το χρησιμοποιούμενο υλικό πλήρωσης στήλης. Το επιλεγόμενο σύστημα πρέπει να μπορεί να επιτυγχάνει διαχωρισμό βασικής γραμμής μεταξύ θρυπτοφάνης και εσωτερικού προτύπου. Περαιτέρω, παίζει σημαντικό ρόλο τα προϊόντα αποδόμησης να διαχωρίζονται σωστά από τη θρυπτοφάνη και το εσωτερικό πρότυπο. Πρέπει να χρησιμοποιούνται υδρολύματα χωρίς εσωτερικό πρότυπο για να ελέγχεται η βασική γραμμή υπό το εσωτερικό πρότυπο για προσμείξεις. Παίζει σημαντικό ρόλο ο χρόνος λειτουργίας να είναι αρκετά μεγάλος για την έκλουση όλων των προϊόντων αποδόμησης, διαφορετικά στις επόμενες χρωματογραφικές δοκιμές μπορεί να παρεισφρύσουν όψιμες κορυφές έκλουσης. Στην περιοχή εργασίας, το χρωματογραφικό σύστημα πρέπει να παρέχει γραμμική απόκριση. Η γραμμική απόκριση πρέπει να μετριέται με σταθερή (την κανονική) συγκέντρωση του εσωτερικού προτύπου και ποικίλες συγκεντρώσεις θρυπτοφάνης. Έχει σημασία το μέγεθος των κορυφών και της θρυπτοφάνης και του εσωτερικού προτύπου να είναι στα πλαίσια της γραμμικής περιοχής του συστήματος HPLC/φθορισμού. Εάν η (οι) κορυφή(-ές) ή της θρυπτοφάνης ή/και του εσωτερικού προτύπου είναι πολύ μικρή ή πολύ υψηλή, η ανάλυση πρέπει να επαναλαμβάνεται με άλλο μέγεθος δείγματος ή/και τελικό όγκο. |
|
9.3. |
Υδροξείδιο του βαρίου
Με το χρόνο, το υδροξείδιο του βαρίου είναι πολύ δύσκολο να διαλυθεί. Το γεγονός αυτό συνεπάγεται μη διαυγές διάλυμα για τον προσδιορισμό HPLC, πράγμα το οποίο μπορεί να δώσει χαμηλές τιμές για τη θρυπτοφάνη. |
H. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΩΝ ΑΚΑΤΕΡΓΑΣΤΩΝ ΕΛΑΙΩΝ ΚΑΙ ΛΙΠΩΝ
1. Αντικείμενο και πεδίο εφαρμογής
Η παρούσα μέθοδος αποσκοπεί στον προσδιορισμό της περιεκτικότητας σε ακατέργαστα έλαια και λίπη των ζωοτροφών. Δεν καλύπτει την ανάλυση των ελαιούχων σπόρων και καρπών.
Η εφαρμογή μιας εκ των δύο κατωτέρω περιγραφόμενων διαδικασιών εξαρτάται από τη φύση και τη σύνθεση της ζωοτροφής και το σκοπό για τον οποίο πραγματοποιείται η ανάλυση.
1.1. Διαδικασία Α — Μέσες εκχυλιζόμενες ακατέργαστες λιπαρές ουσίες
Εφαρμόζεται σε απλά υλικά φυτικής προέλευσης, με εξαίρεση εκείνα που εντάσσονται στο πεδίο εφαρμογής της διαδικασίας B.
1.2. Διαδικασία B — Ολικά ακατέργαστα έλαια και λίπη
Εφαρμόζεται σε απλά υλικά ζωικής προέλευσης, και σε όλες τις σύνθετες τροφές. Εφαρμόζεται σε όλα εκείνα τα υλικά από τα οποία δεν είναι δυνατόν να εκχυλίζονται πλήρως έλαια και λιπαρές ουσίες χωρίς προκαταρκτική υδρόλυση, π.χ. γλουτένες, ζύμη, πρωτεΐνες γεωμήλων, και προϊόντα που υποβάλλονται σε εξώθηση, νιφαδοποίηση και εν θερμώ κατεργασία.
1.3. Ερμηνεία των αποτελεσμάτων
Σε κάθε περίπτωση κατά την οποία επιτυγχάνονται υψηλότερα αποτελέσματα με την εφαρμογή της διαδικασίας Β έναντι αυτών της διαδικασίας Α, ως ορθή τιμή γίνεται δεκτή η επιτυγχανόμενη διά της διαδικασίας Β.
2. Αρχή
2.1. Διαδικασία A
Το δείγμα υδρολύεται με αιθέρα. Το διαλυτικό μέσο απομακρύνεται με απόσταξη και το υπόλειμμα ξηραίνεται και ζυγίζεται.
2.2. Διαδικασία B
Γίνεται επεξεργασία του δείγματος με υδροχλωρικό οξύ υπό θέρμανση. Το μείγμα ψύχεται και φιλτράρεται. Το υπόλειμμα ξεπλένεται και ξηραίνεται και προσδιορίζεται σύμφωνα με τη μέθοδο A.
3. Αντιδραστήρια
|
3.1. |
Αιθέρας, περιοχή ζέσεως: 40 μέχρι 60 oC. Ο δείκτης του βρωμίου πρέπει να είναι κατώτερος από 1 και το υπόλειμμα της εξάτμισης κατώτερο από 2 mg/100 ml. |
|
3.2. |
Άνυδρο θειικό νάτριο. |
|
3.3. |
Υδροχλωρικό οξύ, c = 3 mol/l. |
|
3.4. |
Επιβοηθητικό διήθησης, π.χ. γη διατόμων, Hyflo-supercel. |
4. Όργανα
|
4.1. |
Συσκευή εκχύλισης. Εάν η συσκευή είναι εφοδιασμένη με σιφώνιο (συσκευή Soxhlet), η παροχή αναρροής ρυθμίζεται προς επίτευξη 10 στροφών τουλάχιστον ανά ώρα. Εφόσον χρησιμοποιείται συσκευή άνευ σιφωνίων, η παροχή του αναρρεούμενου υγρού πρέπει να είναι 10 ml περίπου ανά λεπτό. |
|
4.2. |
Φυσίγγια εκχύλισης, ελεύθερα διαλυτών στον αιθέρα ουσιών των οποίων το πορώδες ανταποκρίνεται στις απαιτήσεις της παραγράφου 4.1. |
|
4.3. |
Ξηραντήρας, είτε κενού σε 75 oC ± 3 oC, είτε με ατμοσφαιρική πίεση σε 100 ± 3 oC. |
5. Διαδικασία
5.1. Διαδικασία A (βλέπε παράγραφο 8.1)
Ζυγίζονται 5 g δείγματος, με προσέγγιση 1 mg, εισάγονται εντός φυσιγγίου εκχύλισης (4.2) και καλύπτονται με βαμβακερό πώμα απαλλαγμένου λιπαρών ουσιών.
Τοποθετείται το φυσίγγιο εντός συσκευής εκχύλισης (4.1) και εκχυλίζεται επί 6 ώρες με αιθέρα (3.1). Συλλέγεται το εκχύλισμα εντός ξηράς φιάλης (2), εφοδιασμένης με μερικά τεμάχια κίσσηρης, της οποίας έχει ληφθεί το απόβαρο.
Απομακρύνεται το διαλυτικό μέσο με απόσταξη. Ξηραίνεται το υπόλειμμα επί μιάμιση ώρα τοποθετώντας τη φιάλη εντός ξηραντήρα (4.3). Ψύχεται εντός αποξηραντήρος και ζυγίζεται. Διενεργείται εκ νέου ξήρανση για 30 λεπτά προς επιβεβαίωση ότι το βάρος της λιπαράς ύλης παραμένει σταθερό (η απώλεια του βάρους μεταξύ δύο διαδοχικών ζυγισμάτων πρέπει να είναι κατώτερη του 1 mg).
5.2. Διαδικασία B
Ζυγίζονται 2,5 g δείγματος με προσέγγιση 1 ml (βλέπε παρατήρηση 8.2) και εισάγονται εντός γυάλινου ποτηριού ζέσεως των 400 ml ή εντός κωνικής φιάλης των 300 ml και προστίθενται 100 ml υδροχλωρικού οξέος 3M (3.3) και μερικά τεμάχια κίσσηρης. Καλύπτεται το γυάλινο ποτήρι ζέσεως με γυαλί ωρολογίου ή εφοδιάζεται η κωνική φιάλη με κάθετο ψυκτήρα. Το μείγμα φέρεται σε ήπιο βρασμό με τη χρήση χαμηλής φλόγας ή θερμαντικής πλάκας και διατηρείται εκεί για μία ώρα. Αποφεύγεται η προσκόλληση του προϊόντος επί των πλευρών του δοχείου.
Ψύχεται και προστίθεται ποσότητα επιβοηθητικού διήθησης (3.4), επαρκής προς αποφυγή κάθε απωλείας λιπαρής ύλης κατά τη διάρκεια της διήθησης. Διηθείται με διπλό υγρό διηθητικό χάρτη ελεύθερου λιπαρών υλών. Εκπλύνεται το υπόλειμμα με ψυχρό νερό μέχρι την ουδετεροποίηση του διηθήματος. Η παρουσία αυτών υποδεικνύει ότι το δείγμα πρέπει να εκχυλιστεί με αιθέρα, κατά τη διαδικασία Α, πριν από την υδρόλυση.
Τοποθετείται ο διπλός διηθητικός χάρτης ο οποίος περιέχει το υπόλειμμα σε γυαλί ωρολογίου και ξηραίνεται επί μιάμιση ώρα εντός κλιβάνου αποξήρανσης (4.3) σε θερμοκρασία 100 ± 3 oC.
Εισάγεται ο διπλός διηθητικός χάρτης και το ξηρό υπόλειμμα εντός φυσιγγίου εκχύλισης (4.2) και καλύπτεται με βαμβακερό πώμα απαλλαγμένου λιπαρών ουσιών (4.1). Τοποθετείται το φυσίγγιο εντός συσκευής εκχύλισης και ακολουθείται ο τρόπος εργασίας όπως υποδεικνύεται στην παράγραφο 5.1, δεύτερη και τρίτη υποπαράγραφος.
6. Διατύπωση των αποτελεσμάτων
Το αποτέλεσμα του ζυγίσματος εκφράζεται σε ποσοστό επί τοις εκατό του δείγματος.
7. Επαναληψιμότητα
Η διαφορά μεταξύ των αποτελεσμάτων δύο παράλληλαπαράλληλα διενεργούμενων προσδιορισμών, επί του ίδιου δείγματος, από τον ίδιο αναλυτή, δεν πρέπει να υπερβαίνει:
|
— |
το 0,2 %, σε απόλυτη τιμή για περιεκτικότητες σε ακατέργαστα έλαια και λίπη μικρότερες του 5 %, |
|
— |
το 4,0 %, του μεγαλύτερου αποτελέσματος για περιεκτικότητα από 5 έως 10 %, |
|
— |
το 0,4 %, σε απόλυτη τιμή, για περιεκτικότητες μεγαλύτερες του 10 %. |
8. Παρατηρήσεις
|
8.1. |
Για τα προϊόντα με υψηλή περιεκτικότητα λιπαρών ουσιών, δύσκολα κονιοποιούμενα ή μη κατάλληλα για λήψη μειωμένης και ομοιογενούς ποσότητας. Ζυγίζονται 20 g δείγματος με προσέγγιση 1 mg και αναμειγνύονται με ποσότητα 10 g ή περισσότερων άνυδρου θειικού νατρίου (3.2). Διενεργείται εκχύλιση με αιθέρα (3.1) όπως υποδεικνύεται στην παράγραφο 5.1. Το επιτευχθέν εκχύλισμα συμπληρώνεται έως 500 ml με αιθέρα (3.1) και αναμειγνύεται. Εισάγονται 50 ml του διαλύματος σε μικρή ξηρή φιάλη εφοδιασμένη με μερικά τεμάχια κίσσηρης της οποίας έχει ληφθεί το απόβαρο. Απομακρύνεται το διαλυτικό μέσο με απόσταξη, ξηραίνεται και ακολουθείται ο τρόπος εργασίας όπως υποδεικνύεται στην παράγραφο 5.1 τελευταία υποπαράγραφος. Απομακρύνεται το διαλυτικό μέσο του υπολείμματος της εκχύλισης, το οποίο βρίσκεται εντός του φυσιγγίου, κονιοποιείται το υπόλοιπο σε κόκκους 1 mm, τοποθετείται εκ νέου εντός φυσιγγίου (άνευ προσθήκης θειικού νατρίου) και ακολουθείται ο τρόπος εργασίας όπως υποδεικνύεται στην παράγραφο 5.1 δεύτερη και τρίτη υποπαράγραφος. Η περιεκτικότητα σε ακατέργαστες λιπαρές ύλες σε ποσοστό επί τοις εκατό του δείγματος εκφράζεται με τον τύπο: (10m1 + m2) × 5 όπου:
|
|
8.2. |
Η ποσότητα του δείγματος των χαμηλής περιεκτικότητας σε λιπαρές ύλες προϊόντων μπορεί να ανέρχεται σε 5 g. |
|
8.3. |
Τροφές ζώων συντροφιάς υψηλής περιεκτικότητας σε νερό πρέπει να αναμειγνύονται με άνυδρο θειικό νάτριο πριν από την υδρόλυση και την εκχύλιση σύμφωνα με τη διαδικασία B. |
|
8.4. |
Στην παράγραφο 5.2, ενδέχεται να είναι αποτελεσματικότερη η χρήση θερμού νερού, αντί του ψυχρού, για την έκπλυση του υπολείμματος μετά τη διήθηση. |
|
8.5. |
Ο χρόνος ξήρανσης της μιάμισης ώρας είναι πιθανόν να πρέπει να παραταθεί για ορισμένες ζωοτροφές. Πρέπει να αποφεύγεται η υπερβολική ξήρανση, καθώς οδηγεί σε χαμηλές τιμές αποτελεσμάτων. Μπορεί επίσης να χρησιμοποιηθεί φούρνος μικροκυμάτων. |
|
8.6. |
Αν η περιεκτικότητα σε ακατέργαστα έλαια και λίπη υπερβαίνει το 15 %, συνιστάται, πριν από την υδρόλυση και εκχύλιση της διαδικασίας Β, η προεκχύλιση σύμφωνα με τη διαδικασία Α. Αυτό εξαρτάται σε κάποιο βαθμό από τη φύση της ζωοτροφής και τη φύση των ελαίων/λιπών που περιέχονται στις ζωοτροφές. |
Θ. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΙΝΩΔΩΝ ΟΥΣΙΩΝ
1. Αντικείμενο και τομέας εφαρμογής
Η μέθοδος επιτρέπει τον προσδιορισμό των εντός των ζωοτροφών οργανικών υλών, των ελεύθερων λιπών και αδιάλυτων σε όξινα ή αλκαλικά μέσα, που συμβατικά ονομάζονται ινώδεις ουσίες.
2. Αρχή
Το δείγμα, ενδεχομένως απολιπανθέν, υποβάλλεται σε κατεργασία διαδοχικά με ζέοντα διαλύματα θειικού οξέος και υδροξειδίου του νατρίου καθορισμένης συγκέντρωσης. Το υπόλειμμα διαχωρίζεται με διήθηση σε ηθμό από συντετηγμένο γυαλί αμιάντου, εκπλύνεται, ξηραίνεται, ζυγίζεται και αποτεφρώνεται σε θερμοκρασιακό εύρος 475 έως 500 oC. Η απώλεια βάρους που προκύπτει από την αποτέφρωση αντιστοιχεί στις ινώδεις ουσίες του δείγματος.
3. Αντιδραστήρια
|
3.1. |
Θειικό οξύ, c = 0,13 mol/l. |
|
3.2. |
Αντιαφριτικό γαλάκτωμα (π.χ. n-οκτανόλη). |
|
3.3. |
Διηθητικό μέσο (Celite 545 ή ισοδύναμο), θερμαινόμενο στους 500 oC για τέσσερις ώρες (8.6). |
|
3.4. |
Καθαρή ακετόνη. |
|
3.5. |
Πετρελαϊκός αιθέρας, περιοχή ζέσεως 40 έως 60 oC. |
|
3.6. |
Υδροχλωρικό οξύ, c = 0,5 mol/l. |
|
3.7. |
Διάλυμα υδροξειδίου του καλίου, c = 0,23 mol/l. |
4. Όργανα
|
4.1. |
Θερμαντική μονάδα για την ανοργανοποίηση με θειικό οξύ και διάλυμα υδροξειδίου του νατρίου, η οποία διαθέτει στήριγμα για το γυάλινο χωνευτήριο (4.2) και σωλήνα εκροής με στρόφιγγα στην έξοδο των υγρών και κενού, ενδεχομένως με συμπιεσμένο αέρα. Κάθε μέρα, πριν από τη χρήση, η μονάδα προθερμαίνεται με βραστό νερό για πέντε λεπτά. |
|
4.2. |
Γυάλινο χωνευτήριο με διηθητική πλάκα από συντηγμένο γυαλί με πόρους μεγέθους 40-90 μm. Πριν από την πρώτη χρήση, θερμαίνεται στους 500 oC για λίγα λεπτά και αφήνεται να ψυχθεί (8.6). |
|
4.3. |
Κύλινδρος χωρητικότητας τουλάχιστον 270 ml με κάθετο ψυκτήρα, κατάλληλος για βρασμό. |
|
4.4. |
Κλίβανος αποξήρανσης με θερμοστάτη. |
|
4.5. |
Ηλεκτρικός κλίβανος με θερμοστάτη. |
|
4.6. |
Μονάδα εκχύλισης που αποτελείται από πλάκα στήριξης για το γυάλινο χωνευτήριο (4.2.) και από σωλήνα εκροής με στρόφιγγα στην έξοδο κενού και υγρών. |
|
4.7. |
Συνδετικοί δακτύλιοι για τη συναρμολόγηση της θερμαντικής μονάδας (4.1), του χωνευτηρίου (4.2) και του κυλίνδρου (4.3), καθώς και για τη σύνδεση της μονάδας εκχύλισης εν ψυχρώ (4.6) και του χωνευτηρίου. |
5. Διαδικασία
Ζυγίζεται 1 g του παρασκευασθέντος δείγματος με προσέγγιση 1 mg και τοποθετείται μέσα στο χωνευτήριο (4.2), (βλέπε παρατηρήσεις 8.1, 8.2 και 8.3). Προστίθεται 1 g διηθητικού μέσου (3.3).
Συναρμολογείται η θερμαντική μονάδα (4.1) και το γυάλινο χωνευτήριο (4.2), στη συνέχεια ο κύλινδρος (4.3) συνδέεται με το χωνευτήριο. Προστίθενται 150 ml του ζέοντος θειικού οξέος (3.1) στο συναρμολογημένο κύλινδρο και χωνευτήριο και, αν χρειάζεται, προστίθενται λίγες σταγόνες αντιαφριτικού γαλακτώματος (3.2).
Το υγρό θερμαίνεται μέχρι του σημείου βρασμού εντός 5 ± 2 λεπτών και υποβάλλεται σε έντονο βρασμό για ακριβώς 30 λεπτά.
Ανοίγεται η στρόφιγγα του σωλήνα εκροής (4.1) και, υπό κενό, διηθείται το θειικό οξύ μέσω του γυάλινου χωνευτηρίου. Τα κατάλοιπα εκπλένονται τρεις φορές με 30 ml ζέοντος νερού κάθε φορά, φροντίζοντας για την ξηρή διήθηση των καταλοίπων μετά από κάθε έκπλυση.
Κλείνεται η στρόφιγγα εκροής και μεταγγίζονται 150 ml ζέοντος διαλύματος υδροξειδίου του καλίου (3.7) στο συναρμολογημένο κύλινδρο και χωνευτήριο. Προστίθενται λίγες σταγόνες αντιαφριτικού γαλακτώματος (3.2). Το υγρό θερμαίνεται μέχρι του σημείου βρασμού εντός 5 ± 2 λεπτών και υποβάλλεται σε έντονο βρασμό για ακριβώς 30 λεπτά. Ακολουθεί διήθηση και επαναλαμβάνεται η διαδικασία έκπλυσης που χρησιμοποιείται στη διαδικασία του θειικού οξέος.
Μετά την τελική έκπλυση και ξήρανση, αποσυνδέεται το χωνευτήριο και το περιεχόμενό του και επανασυνδέεται στη μονάδα εκχύλισης εν ψυχρώ (4.6). Τα κατάλοιπα εκπλένονται, υπό κενό, μέσα στο χωνευτήριο τρεις φορές με 25 ml ακετόνης κάθε φορά (3.4), φροντίζοντας για την ξηρή διήθηση των καταλοίπων μετά από κάθε έκπλυση.
Το χωνευτήριο ξηραίνεται στον κλίβανο αποξήρανσης στους 130 oC μέχρι να σταθεροποιηθεί το βάρος του. Μετά από κάθε ξήρανση, αφήνεται να ψυχθεί μέσα στον ξηραντήρα και ζυγίζεται ταχέως. Το χωνευτήριο τοποθετείται μέσα στον ηλεκτρικό κλίβανο και αποτεφρώνεται μέχρι να σταθεροποιηθεί το βάρος του (η απώλεια βάρους μεταξύ δύο διαδοχικών μετρήσεων πρέπει να είναι μικρότερη ή ίση των 2 mg) στους 475 oC έως 500 oC για τουλάχιστον 30 λεπτά.
Μετά από κάθε θέρμανση, αφήνεται να ψυχθεί πρώτα μέσα στον κλίβανο και μετά μέσα στον ξηραντήρα πριν από το ζύγισμα.
Διενεργείται ένα τυφλό πείραμα χωρίς το δείγμα. Η απώλεια βάρους κατά την αποτέφρωση δεν πρέπει να υπερβαίνει τα 4 mg.
6. Υπολογισμός των αποτελεσμάτων
Η περιεκτικότητα σε ινώδεις ουσίες σε ποσοστό επί τοις εκατό του δείγματος δίδεται από τον τύπο:
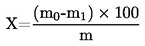
όπου:
|
m |
= |
βάρος δείγματος σε g, |
|
m0 |
= |
απώλεια βάρους κατά την αποτέφρωση, κατά τη διάρκεια του προσδιορισμού, σε g, |
|
m1 |
= |
απώλεια βάρους κατά την αποτέφρωση, κατά τη διάρκεια του τυφλού πειράματος, σε g. |
7. Επαναληψιμότητα
Η διαφορά μεταξύ δύο παράλληλα διενεργούμενων προσδιορισμών που έγιναν στο ίδιο δείγμα δεν πρέπει να υπερβαίνει το:
|
— |
0,6 % σε απόλυτη τιμή, για περιεκτικότητα σε ινώδεις ουσίες μικρότερη του 10 %, |
|
— |
6 % σε σχετική τιμή, για περιεκτικότητα σε ινώδεις ουσίες ίση ή υψηλότερη του 10 %. |
8. Παρατηρήσεις
|
8.1. |
Οι ζωοτροφές που περιέχουν περισσότερο του 10 % λιπαρές ουσίες πρέπει να απολιπαίνονται πριν από την ανάλυση με πετρελαϊκό αιθέρα (3.5). Το χωνευτήριο (4.2) με το περιεχόμενό του συνδέεται με τη μονάδα εκχύλισης εν ψυχρώ (4.6). Υπό κενό, τα κατάλοιπα εκπλένονται τρεις φορές με 30 ml πετρελαϊκού αιθέρα κάθε φορά, φροντίζοντας για την ξήρανση των καταλοίπων. Το χωνευτήριο και το περιεχόμενό του συνδέεται με τη θερμαντική μονάδα (4.1) και ακολουθείται η διαδικασία που περιγράφεται στην παράγραφο 5. |
|
8.2. |
Οι ζωοτροφές που περιέχουν λίπη τα οποία δεν μπορούν να προκύψουν με απευθείας εκχύλιση με πετρελαϊκό αιθέρα (3.5) πρέπει να απολιπαίνονται όπως υποδεικνύεται στην παράγραφο 8.1 και να απολιπαίνονται εκ νέου μετά το βρασμό με οξύ. Μετά το βρασμό με οξύ και την έκπλυση, το χωνευτήριο και το περιεχόμενό του συνδέεται με τη μονάδα εκχύλισης εν ψυχρώ (4.6) και εκπλένεται τρεις φορές με 30 ml ακετόνης κάθε φορά, και στη συνέχεια τρεις φορές με 30 ml πετρελαϊκού αιθέρα κάθε φορά. Το προϊόν διηθείται υπό κενό μέχρις ότου αποξηρανθεί και η ανάλυση συνεχίζεται όπως υποδεικνύεται στην παράγραφο 5, ξεκινώντας με την κατεργασία με υδροξείδιο του καλίου. |
|
8.3. |
Αν η ζωοτροφή περιέχει πάνω από 5 % ανθρακικά άλατα καλίου, το χωνευτήριο (4.2) με το ζυγισμένο δείγμα συνδέεται με τη θερμαντική μονάδα (4.1). Το δείγμα επλένεται τρεις φορές με 30 ml υδροχλωρικού οξέος κάθε φορά (3.6). Μετά από κάθε προσθήκη οξέος, το δείγμα αφήνεται για ένα λεπτό περίπου πριν από τη διήθηση. Το δείγμα εκπλένεται μία φορά με 30 ml νερού και η διαδικασία συνεχίζεται όπως υποδεικνύεται στην παράγραφο 5. |
|
8.4. |
Αν χρησιμοποιείται συσκευή με τη μορφή βάσης (περισσότερα από ένα χωνευτήρια προσαρτημένα στην ίδια θερμαντική μονάδα), δεν επιτρέπεται η διενέργεια δύο μεμονωμένων προσδιορισμών στο ίδιο δείγμα ανάλυσης στην ίδια σειρά. |
|
8.5. |
Αν, μετά το βρασμό, η διήθηση των όξινων και βασικών διαλυμάτων είναι δυσχερής, διοχετεύεται συμπιεσμένος αέρας μέσω του σωλήνα εκροής της θερμαντικής μονάδας και στη συνέχεια συνεχίζεται η διήθηση. |
|
8.6. |
Η θερμοκρασία αποτέφρωσης δεν πρέπει να υπερβαίνει τους 500 oC, προκειμένου να παρατείνεται η διάρκεια ζωής του γυάλινου χωνευτηρίου. Χρειάζεται προσοχή ώστε να αποφεύγεται η υπερβολική θερμική καταπόνηση στη διάρκεια των κύκλων θέρμανσης και ψύξης. |
Ι. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΣΑΚΧΑΡΩΝ
1. Αντικείμενο και πεδίο εφαρμογής
Η μέθοδος επιτρέπει τον προσδιορισμό των αναγόντων σακχάρων και των ολικών σακχάρων έπειτα από ιμβερτοποίηση, εκφρασμένων σε γλυκόζη ή, κατά περίπτωση, σε σακχαρόζη, με συντελεστή μετατροπής 0,95. Εφαρμόζεται στις σύνθετες ζωοτροφές. Ιδιαίτερες διαδικασίες προβλέπονται για άλλες ζωοτροφές. Σε μερικές περιπτώσεις χρειάζεται να προσδιορισθεί ξεχωριστά η λακτόζη και να λαμβάνεται υπόψη στον υπολογισμό των αποτελεσμάτων.
2. Αρχή
Τα σάκχαρα διαλύονται σε αραιή αιθανόλη- το διάλυμα αποστραγγίζεται με τη βοήθεια των αντιδραστηρίων Carrez I και II. Έπειτα από απομάκρυνση της αιθανόλης, οι προσδιορισμοί πραγματοποιούνται πριν και μετά από ιμβερτοποίηση, κατά τη μέθοδο Luff-Schoorl.
3. Αντιδραστήρια
|
3.1. |
Διάλυμα αιθανόλης 40 % (κατ’ όγκο) πυκνότητας: 0,948 g/ml σε θερμοκρασία 20 oC και στο σημείο αλλαγής της φαινολοφθαλεΐνης. |
|
3.2. |
Διάλυμα Carrez I: Διαλύστε σε νερό 21,9 g οξικού ψευδαργύρου Zn (CH3COO)2 2H2O και 3 g κρυσταλλικού οξικού οξέος. Συμπληρώστε στα 100 ml με νερό. |
|
3.3. |
Διάλυμα Carrez II: Διαλύστε σε νερό 10,6 g σιδηροκυανιούχου καλίου K4Fe (CN)6 3H2O. Συμπληρώστε στα 100 ml με νερό. |
|
3.4. |
Διάλυμα 0,1 % (βάρος/όγκο) πορτοκαλόχρου του μεθυλίου. |
|
3.5. |
Υδροχλωρικό οξύ 4 mol/l. |
|
3.6. |
Υδροχλωρικό οξύ 0,1 mol/l. |
|
3.7. |
Διάλυμα υδροξειδίου του νατρίου 0,1 mol/l. |
|
3.8. |
Αντιδραστήριο κατά Luff-Schoorl: Ανακινώντας προσεκτικά, μεταγγίστε το διάλυμα του κιτρικού οξέος (3.8.2) στο διάλυμα ανθρακικού νατρίου (3.8.3). Κατόπιν προσθέστε το διάλυμα του θειικού χαλκού (3.8.1) και συμπληρώστε στο 1 l με νερό. Αφήστε σε ηρεμία μία νύχτα και διηθήστε. Ελέγξτε τη συγκέντρωση του ληφθέντος αντιδραστηρίου (Cu 0,05 mol/l, Na2 CO3 1 mol/l), βλέπε (5.4) τελευταία παράγραφο. Το pH του διαλύματος πρέπει να είναι 9,4 περίπου. |
|
3.8.1. |
Διάλυμα θειικού χαλκού: Διαλύστε 25 g θειικού χαλκού, Cu SO4 5H2O, ελεύθερου σιδήρου, σε 100 ml νερό. |
|
3.8.2. |
Διάλυμα κιτρικού οξέος: Διαλύστε 50 g κιτρικού οξέος, C6H8O7 H2O σε 50 ml νερό. |
|
3.8.3. |
Διάλυμα ανθρακικού νατρίου: Διαλύστε 143,8 g άνυδρου ανθρακικού νατρίου σε 300 ml περίπου θερμού νερού. Αφήστε να ψυχθεί. |
|
3.9. |
Διάλυμα θειοθειικού νατρίου 0,1 mol/l. |
|
3.10. |
Διάλυμα αμύλου: Προσθέστε μείγμα 5 g διαλυτού αμύλου και 30 ml νερού σε 1 l ζέοντος νερού: Ζέετε επί 3 λεπτά, αφήνετε προς ψύξη και, ενδεχομένως, προσθέτετε 10 mg ιωδιούχο υδράργυρο ως συντηρητικό. |
|
3.11. |
Θειικό οξύ 3 mol/l. |
|
3.12. |
Διάλυμα 30 % (κ.ο.) ιωδιούχου καλίου. |
|
3.13. |
Τεμάχια ελαφρόπετρας κατεργασμένα με βρασμό μέσα σε υδροχλωρικό οξύ, πλυμένα με νερό και στεγνωμένα. |
|
3.14. |
Ισοπεντανόλη. |
4. Όργανα
Αναμείκτης (παλινδρομητής): περίπου 35 έως 40 παλινδρομήσεις στο λεπτό.
5. Διαδικασία
5.1. Εκχύλιση δείγματος
Ζυγίστε 2,5 g δείγματος, με προσέγγιση 1 mg, και τοποθετήστε τα μέσα σε ογκομετρική φιάλη των 250 ml. Προσθέστε 200 ml αιθανόλης (3.1) και αναμείξτε επί μία ώρα στον παλινδρομητή. Προσθέστε 5 ml διαλύματος Carrez I (3.2) και ανακινήστε επί περίπου 30 δευτερόλεπτα. Προσθέστε κατόπιν 5 ml διαλύματος Carrez II (3.3) και ανακινήστε πάλι επί ένα λεπτό. Συμπληρώστε μέχρι τη χαραγή με αιθανόλη (3.1), ομογενοποιήστε και διηθήστε. Αφαιρέστε 200 ml από το διήθημα και εξατμίστε περίπου στο μισό όγκο, προκειμένου να απομακρυνθεί το μεγαλύτερο μέρος της αιθανόλης. Μεταφέρτε ποσοτικά το υπόλειμμα της εξάτμισης με τη βοήθεια θερμού νερού, σε ογκομετρική φιάλη των 200 ml, ψύξτε, γεμίστε με νερό μέχρι τη χαραγή, ομογενοποιήστε και διηθήστε αν χρειάζεται. Το διάλυμα αυτό θα χρησιμοποιηθεί για τον προσδιορισμό των αναγόντων σακχάρων και, έπειτα από ιμβερτοποίηση, τον προσδιορισμό των ολικών σακχάρων.
5.2. Προσδιορισμός των αναγόντων σακχάρων
Αφαιρέστε με σιφώνιο μία ποσότητα από το διάλυμα που δεν υπερβαίνει τα 25 ml και περιέχει λιγότερο από 60 mg ανάγοντα σάκχαρα, εκφρασμένα σε γλυκόζη. Αν χρειάζεται, συμπληρώστε στα 25 ml με νερό απεσταγμένο και προσδιορίστε την περιεκτικότητα σε ανάγοντα σάκχαρα κατά Luff-Schoorl. Το αποτέλεσμα εκφράζεται σε γλυκόζη επί τοις εκατό.
5.3. Προσδιορισμός των ολικών σακχάρων μετά από ιμβερτοποίηση
Αφαιρέστε με σιφώνιο 50 ml διαλύματος και τοποθετήστε τα σε ογκομετρική φιάλη των 100 ml. Προσθέστε μερικές σταγόνες διαλύματος πορτοκαλόχρου του μεθυλίου (3.4) κατόπιν, προσεκτικά και ανακινώντας, υδροχλωρικό οξύ (3.5) μέχρι σαφούς αλλαγής στο κόκκινο. Προσθέστε 15 ml υδροχλωρικού οξέος (3.6), βυθίστε την φιάλη σε εντόνως ζέον υδατόλουτρο και αφήστε την εκεί επί 30 λεπτά. Ψύξτε ταχέως στους 20 oC περίπου και προσθέστε 15 ml διαλύματος υδροξειδίου του νατρίου (3.7). Συμπληρώστε στα 100 ml με νερό και ομογενοποιήστε. Αφαιρέστε μια ποσότητα που δεν υπερβαίνει τα 25 ml και περιέχει λιγότερο από 60 mg ανάγοντα σάκχαρα, εκφρασμένα σε γλυκόζη. Αν χρειάζεται, συμπληρώστε στα 25 ml με νερό απεσταγμένο και προσδιορίστε την περιεκτικότητα σε ανάγοντα σάκχαρα κατά Luff-Schoorl. Το αποτέλεσμα εκφράζεται ως ποσοστό γλυκόζης ή, όπου χρειάζεται, σε σακχαρόζη κατόπιν πολλαπλασιασμού με τον συντελεστή 0,95.
5.4. Ογκομέτρηση κατά Luff-Schoorl
Αφαιρέστε με σιφώνιο 25 ml αντιδραστηρίου κατά Luff-Schoorl (3.8) και τοποθετήστε τα σε κωνική φιάλη των 300 ml. Προσθέστε 25 ml, επακριβώς μετρηθέντα, του στραγγισμένου διαλύματος των σακχάρων. Προσθέστε δύο τεμάχια ελαφρόπετρας (3.13), θερμάνατε, ανακινώντας με το χέρι, επάνω από ελεύθερη φλόγα μέσου ύψους και φέρτε το υγρό σε βρασμό σε δύο λεπτά περίπου. Τοποθετήστε αμέσως την κωνική φιάλη πάνω σε μεταλλικό πλέγμα εφοδιασμένο με οθόνη αμιάντου και οπή διαμέτρου περίπου 6 cm, κάτω από την οποία έχει αναφθεί φλόγα. Η φλόγα είναι ρυθμισμένη κατά τρόπο ώστε μόνο ο πυθμένας της φιάλης να θερμαίνεται. Προσαρμόστε κατόπιν έναν ψυκτήρα επαναφοράς στην κωνική φιάλη. Από τη στιγμή αυτή ζέει επί 10 λεπτά ακριβώς. Ψύξτε αμέσως σε ψυχρό νερό και, μετά από 5 λεπτά περίπου, ογκομετρήστε ως ακολούθως:
Προσθέστε 10 ml διαλύματος ιωδιούχου καλίου (3.12) και, αμέσως μετά και με προσοχή (λόγω κινδύνου σχηματισμού μεγάλης ποσότητας αφρού), 25 ml θειικού οξέος (3.11). Ογκομετρήστε κατόπιν με το διάλυμα θειοκυανιούχου νατρίου (3.9) μέχρι να εμφανισθεί ελαφρώς κιτρίνη χροιά, προσθέστε τον δείκτη αμύλου (3.10) και ολοκληρώστε την ογκομέτρηση.
Πραγματοποιήστε την ίδια ογκομέτρηση σε ένα μείγμα επακριβώς μετρηθέν από 25 ml αντιδραστηρίου κατά Luff-Schoorl (3.8) και 25 ml νερού, αφού προσθέσετε 10 ml διαλύματος ιωδιούχου καλίου (3.12) και 25 ml θειικού οξέος (3.11), χωρίς να φέρετε σε βρασμό.
6. Υπολογισμός αποτελεσμάτων
Υπολογίσατε με τη βοήθεια του πίνακα την ποσότητα της γλυκόζης σε mg που αντιστοιχεί στη διαφορά μεταξύ των τιμών των δύο ογκομετρήσεων, εκφρασμένων σε ml θειοθειικού νατρίου 0,1 mol/litre. Εκφράστε το αποτέλεσμα ως ποσοστό επί τοις εκατό του δείγματος.
7. Ιδιαίτεροι τρόποι εργασίας
|
7.1. |
Για ζωοτροφές πολύ πλούσιες σε μελάσσα και άλλες μη ιδιαίτερης ομοιογένειας, ζυγίστε 20 g και τοποθετήστε τα σε ογκομετρική φιάλη του 1 l με 500 ml νερό. Αναμείξτε επί μία ώρα στον παλινδρομητή. Αποστραγγίστε με τη βοήθεια των αντιδραστηρίων Carrez I (3.2) και II (3.3) όπως περιγράφεται στην παράγραφο 5.1 χρησιμοποιώντας όμως μια ποσότητα 4 φορές υψηλότερη για κάθε αντιδραστήριο. Συμπληρώστε μέχρι τη χαραγή με αιθανόλη (κατ’ όγκο). Ομογενοποιήστε και διηθήστε. Απομακρύντε την αιθανόλη όπως περιγράφεται στην παράγραφο 5.1. Επί απουσίας δεξτρινοποιημένου αμύλου, συμπληρώστε μέχρι τη χαραγή με απεσταγμένο νερό. |
|
7.2. |
Για τις μελάσσες και τις πρώτες ύλες ζωοτροφών οι οποίες είναι πλούσιες σε σάκχαρα και πρακτικά απαλλαγμένες αμύλου (χαρούπια, ξηρά υπολείμματα τεύτλων κ.ά.) ζυγίστε 5 g, τοποθετήστε τα σε ογκομετρική φιάλη των 250 ml, προσθέστε 200 ml νερού απεσταγμένου και αναμείξτε επί μία ώρα ή περισσότερο, αν χρειάζεται, στον παλινδρομητή. Αποστραγγίστε κατόπιν με τη βοήθεια των αντιδραστηρίων Carrez I (3.2) και II (3.3) όπως περιγράφεται στην παράγραφο 5.1. Συμπληρώστε μέχρι τη χαραγή με ψυχρό νερό, ομογενοποιήστε και διηθήστε. Για τον προσδιορισμό των ολικών σακχάρων ακολουθήστε τη διαδικασία που περιγράφεται στην παράγραφο 5.3. |
8. Παρατηρήσεις
|
8.1. |
Συνιστάται να προστεθεί περίπου 1 ml ισοπεντανόλης (3.14) (χωρίς να ληφθεί υπόψη ο όγκος), πριν το βρασμό με το αντιδραστήριο Luff-Schoorl, προκειμένου να αποφευχθεί ο σχηματισμός αφρού. |
|
8.2. |
Η διαφορά μεταξύ της περιεκτικότητας σε ολικά σάκχαρα μετά την ιμβερτοποίηση, εκφρασμένα σε γλυκόζη, και της περιεκτικότητας σε ανάγοντα σάκχαρα, εκφρασμένα σε γλυκόζη, πολλαπλασιασμένη επί 0,95, δίνει την περιεκτικότητα σε σακχαρόζη επί τοις εκατό. |
|
8.3. |
Για τον προσδιορισμό της περιεκτικότητας σε ανάγοντα σάκχαρα, με εξαίρεση τη λακτόζη, δύο μέθοδοι μπορούν να χρησιμοποιηθούν: |
|
8.3.1. |
Για έναν κατά προσέγγιση υπολογισμό, πολλαπλασιάζουμε επί 0,675 την περιεκτικότητα σε λακτόζη προσδιορισμένη με ξεχωριστό προσδιορισμό και αφαιρούμε το αποτέλεσμα από την περιεκτικότητα σε ανάγοντα σάκχαρα. |
|
8.3.2. |
Για έναν ακριβή υπολογισμό των αναγόντων σακχάρων, με εξαίρεση τη λακτόζη, είναι απαραίτητο να ξεκινήσουμε από την ίδια ποσότητα δοκιμής για τους δύο τελικούς προσδιορισμούς. Η μία από τις αναλύσεις πραγματοποιείται επί ενός τμήματος του διαλύματος που λαμβάνεται σύμφωνα με την παράγραφο 5.1, η άλλη επί ενός τμήματος του διαλύματος που λαμβάνεται κατά τον προσδιορισμό της λακτόζης σύμφωνα με τη μέθοδο που προβλέπεται για το σκοπό αυτό (έπειτα από ζύμωση των άλλων ειδών σακχάρων και αποστράγγιση). Και στις δύο περιπτώσεις, η ποσότητα του υπάρχοντος σακχάρου προσδιορίζεται σύμφωνα με την μέθοδο Luff-Schoorl και υπολογίζεται σε mg γλυκόζης. Οι δύο τιμές αφαιρούνται η μία από την άλλη και η διαφορά εκφράζεται σε ποσοστό επί τοις εκατό του δείγματος. Παράδειγμα Οι δύο ληφθέντες όγκοι αντιστοιχούν για κάθε προσδιορισμό, σε ποσότητα δοκιμής 250 mg. Στην πρώτη περίπτωση, καταναλώνονται 17 ml διαλύματος θειοθειικού νατρίου 0,1 mol/litre πράγμα που αντιστοιχεί σε 44,2 mg γλυκόζης, στη δεύτερη περίπτωση 11 ml, πράγμα που αντιστοιχεί σε 27,6 mg γλυκόζης. Η διαφορά συνίσταται σε 16,6 mg γλυκόζης. Η περιεκτικότητα σε ανάγοντα σάκχαρα (με εξαίρεση τη λακτόζη), υπολογισμένη σε γλυκόζη, είναι επομένως:
|
Πίνακας τιμών για 25 ml αντιδραστηρίου κατά Luff Schoorl
ml Na2 S2 O30,1 mol/litre, δύο λεπτά θέρμανση, 10 λεπτά βρασμός
|
Na2 S2 O3 0,1 mol/litre |
Γλυκόζη, φρουκτόζη ιμβερτοποιημένα σάκχαρα C6 H12 O6 |
Λακτόζη C12 H22 O11 |
Μαλτόζη C12 H22 O11 |
Na2 S2 O3 0,1 mol/litre |
|||
|
ml |
mg |
διαφορά |
mg |
διαφορά |
mg |
διαφορά |
ml |
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 |
2,4 4,8 7,2 9,7 12,2 14,7 17,2 19,8 22,4 25,0 27,6 30,3 33,0 35,7 38,5 41,3 44,2 47,1 50,0 53,0 56,0 59,1 62,2 |
2,4 2,4 2,5 2,5 2,5 2,5 2,6 2,6 2,6 2,6 2,7 2,7 2,7 2,8 2,8 2,9 2,9 2,9 3,0 3,0 3,1 3,1 |
3,6 7,3 11,0 14,7 18,4 22,1 25,8 29,5 33,2 37,0 40,8 44,6 48,4 52,2 56,0 59,9 63,8 67,7 71,7 75,7 79,8 83,9 88,0 |
3,7 3,7 3,7 3,7 3,7 3,7 3,7 3,7 3,8 3,8 3,8 3,8 3,8 3,8 3,9 3,9 3,9 4,0 4,0 4,1 4,1 4,1 |
3,9 7,8 11,7 15,6 19,6 23,5 27,5 31,5 35,5 39,5 43,5 47,5 51,6 55,7 59,8 63,9 68,0 72,2 76,5 80,9 85,4 90,0 94,6 |
3,9 3,9 3,9 4,0 3,9 4,0 4,0 4,0 4,0 4,0 4,0 4,1 4,1 4,1 4,1 4,1 4,2 4,3 4,4 4,5 4,6 4,6 |
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 |
ΙΑ. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΛΑΚΤΟΖΗΣ
1. Αντικείμενο και πεδίο εφαρμογής
Η μέθοδος επιτρέπει τον προσδιορισμό της περιεκτικότητας σε λακτόζη ζωοτροφών που περιέχουν περισσότερο από 0,5 % λακτόζης.
2. Αρχή
Τα σάκχαρα διαλύονται σε νερό. Το διάλυμα υποβάλλεται σε ζύμωση με μύκητες Saccharomyces cerevisiae οι οποίοι αφήνουν τη λακτόζη απρόσβλητη. Έπειτα από αποστράγγιση και διήθηση, η περιεκτικότητα σε λακτόζη του διηθήματος προσδιορίζεται με τη μέθοδο Luff-Schoorl.
3. Αντιδραστήρια
|
3.1. |
Αιώρημα μυκήτων Saccharomyces cerevisiae: δημιουργήστε εναιώρημα 25 g νωπής μαγιάς σε 100 ml νερού. Το εναιώρημα διατηρείται το πολύ μία εβδομάδα σε ψυγείο. |
|
3.2. |
Διάλυμα Carrez I: Διαλύστε στο νερό 21,9 g οξικού ψευδαργύρου Zn (CH3 COO)2 2H2O και 3 g κρυσταλλικού οξικού οξέος. Συμπληρώστε στα 100 ml με νερό. |
|
3.3. |
Διάλυμα Carrez II: Διαλύστε στο νερό 10,6 g σιδηροκυανιούχου καλίου K4Fe (CN)6 3H2O. Συμπληρώστε στα 100 ml με νερό. |
|
3.4. |
Αντιδραστήριο κατά Luff-Schoorl: Ανακινώντας προσεκτικά, μεταγγίστε το διάλυμα του κιτρικού οξέος (3.4.2) στο διάλυμα του ανθρακικού νατρίου (3.4.3). Προσθέστε στη συνέχεια το διάλυμα του θειικού χαλκού (3.4.1) και συμπληρώστε στο 1 l με νερό. Αφήστε σε ηρεμία μια νύκτα και διηθήστε. Ελέγξτε την καυστικότητα του ληφθέντος διαλύματος (Cu 0,05 mol/litre· Na2 CO3 1 mol/litre). Το pH του διαλύματος πρέπει να είναι 9,4 περίπου. |
|
3.4.1. |
Διάλυμα θειικού χαλκού: Διαλύστε 25 g θειικού χαλκού Cu SO4 5H2O, ελεύθερου σιδήρου, σε 100 ml νερό. |
|
3.4.2. |
Διάλυμα κιτρικού οξέος: Διαλύστε 50 g κιτρικού οξέος C6H8O7 H2O σε 50 ml νερού. |
|
3.4.3. |
Διάλυμα ανθρακικού νατρίου: Διαλύστε 143,8 g άνυδρου ανθρακικού νατρίου σε 300 ml περίπου θερμού νερού. Αφήστε να ψυχθεί. |
|
3.5. |
Κόκκοι ελαφρόπετρας κατεργασμένοι με βρασμό σε υδροχλωρικό οξύ, πλυμένοι και ξηραμένοι. |
|
3.6. |
Διάλυμα 30 % (βάρος/όγκο) ιωδιούχου καλίου. |
|
3.7. |
Θειικό οξύ 3 mol/litre. |
|
3.8. |
Διάλυμα θειοθειικού νατρίου 0,1 mol/litre. |
|
3.9. |
Διάλυμα αμύλου: Προσθέστε ένα μείγμα από 5 g διαλυτού αμύλου και 30 ml νερού σε 1 l ζέοντος νερού. Ζέει επί 3 λεπτά, αφήνεται να ψυχθεί και, ενδεχομένως, προστίθενται 10 mg ιωδιούχου υδραργύρου ως συντηρητικού. |
4. Όργανα
Υδατόλουτρο εφοδιασμένο με θερμοστάτη ρυθμισμένο στους 38 έως 40 oC.
5. Διαδικασία
Ζυγίστε 1 g δείγματος με προσέγγιση 1 mg και τοποθετήστε αυτή την ποσότητα δείγματος σε ογκομετρική φιάλη των 100 ml, προσθέστε 25 έως 30 ml νερού. Τοποθετήστε τη φιάλη επί τριάντα λεπτά σε ζέον υδρόλουτρο και ψύξτε κατόπιν στους 35 oC περίπου. Προσθέστε 5 ml εναιωρήματος μαγιάς (3.1) και ομογενοποιήστε. Αφήστε τη φιάλη σε ηρεμία επί δύο ώρες μέσα σε υδατόλουτρο σε θερμοκρασία 38 έως 40 o C. Ψύξτε κατόπιν μέχρι 20 oC περίπου.
Προσθέστε 2,5 ml διαλύματος Carrez I (3.2) και ανακινήστε επί τριάντα δευτερόλεπτα, προσθέστε κατόπιν 2,5 ml διαλύματος Carrez II (3.3) και ανακινήστε εκ νέου, επί τριάντα δευτερόλεπτα. Συμπληρώστε στα 100 ml με νερό, αναμείξτε και διηθήστε. Αφαιρέστε με σιφώνιο μία ποσότητα διηθήματος όχι μεγαλύτερη από 25 ml η οποία περιέχει κατά προτίμηση 40 έως 80 mg λακτόζης και τοποθετήστε την σε κωνική φιάλη των 300 ml. Αν χρειάζεται, συμπληρώστε στα 25 ml με νερό.
Προβείτε κατά τον ίδιο τρόπο σε τυφλό πείραμα με 5 ml εναιωρήματος μαγιάς (3.1). Προσδιορίστε την περιεκτικότητα σε λακτόζη κατά Luff-Schoorl ως ακολούθως: Προσθέστε 25 ml ακριβώς αντιδραστηρίου κατά Luff-Schoorl (3.4) και δύο τεμάχια ελαφρόπετρας (3.5). Θερμάνατε ανακινώντας με το χέρι, πάνω από ελεύθερη φλόγα μέσου ύψους και φέρτε το υγρό σε βρασμό εντός δύο λεπτών περίπου. Τοποθετήστε αμέσως την κωνική φιάλη πάνω σε μεταλλικό πλέγμα εφοδιασμένο με οθόνη αμιάντου και οπή διαμέτρου περίπου 6 cm, κάτω από το οποίο έχει αναφθεί προηγουμένως φλόγα. Η φλόγα ρυθμίζεται έτσι ώστε να θερμαίνεται μόνο ο πυθμένας της φιάλης. Προσαρμόστε κατόπιν έναν ψυκτήρα επαναφοράς στην κωνική φιάλη. Από το σημείο αυτό ζέετε επί 10 λεπτά ακριβώς. Ψύξτε αμέσως σε ψυχρό νερό και μετά από 5 λεπτά περίπου, τιτλοδοτήστε ως ακολούθως:
Προσθέστε 10 ml διαλύματος ιωδιούχου καλίου (3.6) και, αμέσως μετά και με προσοχή (λόγω κινδύνου σχηματισμού μεγάλης ποσότητας αφρού), 25 ml θειικού οξέος (3.7). Τιτλοδοτήστε κατόπιν με το διάλυμα του θειοθειικού νατρίου (3.8) μέχρι να εμφανιστεί ελαφρώς κίτρινος χρωματισμός, προσθέστε τον δείκτη αμύλου (3.9) και ολοκληρώστε την τιτλοδότηση.
Πραγματοποιήστε την ίδια τιτλοδότηση σε επακριβώς μετρηθέν μείγμα από 25 ml αντιδραστηρίου κατά Luff-Schoorl (3.4) και 25 ml νερού, αφού έχετε προσθέσει 10 ml διαλύματος ιωδιούχου καλίου (3.6) και 25 ml θειικού οξέος (3.7), χωρίς να φέρετε σε βρασμό.
6. Υπολογισμός αποτελεσμάτων
Υπολογίστε με τη βοήθεια του πίνακα την ποσότητα της λακτόζης σε mg που αντιστοιχεί στη διαφορά μεταξύ των αποτελεσμάτων των δύο τιτλοδοτήσεων, εκφράστε σε ml θειοθειικού νατρίου 0,1 mol/litre.
Εκφράστε το αποτέλεσμα της άνυδρης λακτόζης σε ποσοστό επί τοις εκατό του δείγματος.
7. Παρατήρηση
Για τα προϊόντα που περιέχουν περισσότερο από 40 % ζυμώσιμα σάκχαρα χρησιμοποιήστε περισσότερο από 5 ml εναιωρήματος μαγιάς (3.1).
Πίνακας τιμών για 25 ml αντιδραστηρίου κατά Luff-Schoorl
ml Na2 S2 O30,1 mol/litre, δύο λεπτά θέρμανση, δέκα λεπτά βρασμός
|
Na2 S2 O3 0,1 mol/litre |
Γλυκόζη, φρουκτόζη ιμβερτοποιημένα σάκχαρα C6 H12 O6 |
Λακτόζη C12 H22 O11 |
Μαλτόζη C12 H22 O11 |
Na2 S2 O3 0,1 mol/litre |
|||
|
ml |
mg |
διαφορά |
mg |
διαφορά |
mg |
διαφορά |
ml |
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 |
2,4 4,8 7,2 9,7 12,2 14,7 17,2 19,8 22,4 25,0 27,6 30,3 33,0 35,7 38,5 41,3 44,2 47,1 50,0 53,0 56,0 59,1 62,2 |
2,4 2,4 2,5 2,5 2,5 2,5 2,6 2,6 2,6 2,6 2,7 2,7 2,7 2,8 2,8 2,9 2,9 2,9 3,0 3,0 3,1 3,1 |
3,6 7,3 11,0 14,7 18,4 22,1 25,8 29,5 33,2 37,0 40,8 44,6 48,4 52,2 56,0 59,9 63,8 67,7 71,7 75,7 79,8 83,9 88,0 |
3,7 3,7 3,7 3,7 3,7 3,7 3,7 3,7 3,8 3,8 3,8 3,8 3,8 3,8 3,9 3,9 3,9 4,0 4,0 4,1 4,1 4,1 |
3,9 7,8 11,7 15,6 19,6 23,5 27,5 31,5 35,5 39,5 43,5 47,5 51,6 55,7 59,8 63,9 68,0 72,2 76,5 80,9 85,4 90,0 94,6 |
3,9 3,9 3,9 4,0 3,9 4,0 4,0 4,0 4,0 4,0 4,0 4,1 4,1 4,1 4,1 4,1 4,2 4,3 4,4 4,5 4,6 4,6 |
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 |
ΙΒ. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΑΜΥΛΟΥ
ΠΟΛΩΣΙΜΕΤΡΙΚΗ ΜΕΘΟΔΟΣ
1. Αντικείμενο και πεδίο εφαρμογής
Η παρούσα μέθοδος επιτρέπει τον προσδιορισμό της περιεκτικότητας σε άμυλο και σε προϊόντα διάσπασης των υψηλών μοριακών βαρών αμύλου των ζωοτροφών με στόχο τον έλεγχο συμμόρφωσης προς τη δηλούμενη ενεργειακή αξία (βλέπε διατάξεις του παραρτήματος VII) και προς την οδηγία 96/25/ΕΚ του Συμβουλίου (3).
2. Αρχή
Η μέθοδος περιλαμβάνει δύο προσδιορισμούς. Κατά τον πρώτο, το δείγμα υφίσταται επεξεργασία με αραιωμένο υδροχλωρικό οξύ. Ύστερα από διαύγαση και διήθηση, μετριέται η οπτική στροφική ικανότητα του διαλύματος με πολωσιμετρία.
Κατά τον δεύτερο, το δείγμα εκχυλίζεται με αιθανόλη 40 %. Κατόπιν οξύνισης του διηθήματος με τη χρήση υδροχλωρικού οξέος, διαύγασης και διήθησης, μετριέται η οπτική στροφική ικανότητα υπό τις ίδιες συνθήκες όπως και στον πρώτο προσδιορισμό.
Η διαφορά μεταξύ των δύο μετρήσεων πολλαπλασιαζόμενη επί έναν γνωστό συντελεστή δίδει την περιεκτικότητα του δείγματος σε άμυλο.
3. Αντιδραστήρια
|
3.1. |
Υδροχλωρικό οξύ, διάλυμα 25 % (κ.β.) πυκνότητα: 1,126 g/ml. |
|
3.2. |
Υδροχλωρικό οξύ, διάλυμα 1,13 % (κ.ό.) Η συμπύκνωση πρέπει να ελέγχεται με ογκομετρική τιτλοδότηση, με τη χρήση διαλύματος υδροξειδίου του νατρίου 0,1 Ν παρουσία ερυθρού του μεθυλίου 0,1 % (κ.ό.) σε αιθανόλη 94 % (κατ’ όγκο). Για την εξουδετέρωση των 10 ml, απαιτούνται 30,94 ml NaOH συγκέντρωσης 0,1 mol/litre. |
|
3.3. |
Διάλυμα Carrez I: διαλύονται σε νερό 21,9 g οξεικού ψευδαργύρου Zn(CH3COO)2 2H2O και 3 g άνυδρου οξεικού οξέος. Συμπληρώνεται με νερό έως 100 ml. |
|
3.4. |
Διάλυμα Carrez II: διαλύονται σε νερό 10,6 g σιδηροκυανιούχου καλίου K4Fe(CN)6 3H2O. Συμπληρώνεται με νερό έως 100 ml. |
|
3.5. |
Αιθανόλη 40 % (ο/ο), πυκνότητα: 0,948 g/ml στους 20 oC. |
4. Όργανα
|
4.1. |
Κωνική φιάλη (Erlenmeyer) 250 ml με σύνηθες εσμυρισμένο πώμα συνδεδεμένη με κάθετο ψυκτήρα. |
|
4.2. |
Πολωσίμετρο ή σακχαρόμετρο. |
5. Διαδικασία
5.1. Προετοιμασία του δείγματος
Κονιοποιείται το δείγμα έτσι ώστε να διέρχεται όλη η ποσότητα αυτού διά μέσου κοσκίνου στρογγυλών οπών διαμέτρου 0,5 mm.
5.2. Προσδιορισμός της συνολικής οπτικής στροφικής ικανότητος (Ρ ή S) (βλέπε παρατήρηση 7.1)
Ζυγίζονται 2,5 g κονιοποιημένου δείγματος με προσέγγιση 1 mg και εισάγονται εντός ογκομετρικής φιάλης των 100 ml. Προστίθενται 25 ml υδροχλωρικού οξέος (3.2), ανακινούνται προς επίτευξη καλής κατανομής της ποσότητας του δείγματος και προστίθενται εκ νέου άλλα 25 ml υδροχλωρικού οξέος (3.2). Η φιάλη εμβαπτίζεται εντός ζέοντος υδρόλουτρου και κατά τη διάρκεια των πρώτων επομένων 3 λεπτών ανακινείται έντονα και σταθερά προς αποφυγή σχηματισμού συσσωματώσεων. Η ποσότητα του νερού στο υδρόλουτρο πρέπει να είναι επαρκής για να επιτρέπει τη διατήρηση του λουτρού στο σημείο βρασμού κατά το χρονικό διάστημα της παραμονής της φιάλης εντός αυτού. Η φιάλη δεν πρέπει να εξέρχεται του λουτρού κατά τη διάρκεια της ανακίνησης. Μετά πάροδο 15 λεπτών ακριβώς εξάγεται η φιάλη από το λουτρό, προστίθενται 30 ml ψυχρού νερού και ψύχεται αμέσως σε 20 oC.
Προστίθενται 5 ml διαλύματος Carrez Ι (3.3) και ανακινείται επί 30 δευτερόλεπτα περίπου. Προστίθενται ακολούθως 5 ml διαλύματος Carrez ΙΙ (3.4) και ανακινείται εκ νέου επί 30 δευτερόλεπτα περίπου. Συμπληρώνεται ο όγκος της φιάλης με νερό, ομοιογενοποιείται και διηθείται. Εάν το διήθημα δεν είναι πλήρως διαυγές (σπάνια περίπτωση), ο προσδιορισμός επαναλαμβάνεται με τη χρησιμοποίηση μεγαλυτέρων ποσοτήτων διαλυμάτων Carrez Ι και ΙΙ, επί παραδείγματι 10 ml.
Μετριέται ακολούθως η οπτική στροφική ικανότητα του διαλύματος εντός σωλήνα 200 mm με πολωσίμετρο ή σακχαρόμετρο.
5.3. Προσδιορισμός της οπτικής στροφικής ικανότητος (Ρ ή S) των διαλυτών προσμίξεων σε αιθανόλη 40 %
Ζυγίζονται 5 g δείγματος με προσέγγιση 1 mg, εισάγονται εντός ογκομετρικής φιάλης των 100 ml και προστίθενται 80 ml περίπου αιθανόλης (3.5) (βλέπε παρατήρηση 7.2). Αφήνεται η φιάλη σε ηρεμία επί 1 ώρα σε θερμοκρασία δωματίου. Κατά τη διάρκεια του χρονικού αυτού διαστήματος ανακινείται έντονα έξι φορές κατά τέτοιο τρόπο ώστε η ποσότητα του δείγματος να αναμιχθεί καλά με την αιθανόλη. Συμπληρώνεται ακολούθως ο όγκος με αιθανόλη (3.5), ομοιογενοποιείται και διηθείται.
Εισάγονται με σιφώνιο 50 ml του διηθήματος (αντιστοιχούν σε 2,5 g δείγματος) εντός της κωνικής φιάλης των 250 ml, προστίθενται 2,1ml υδροχλωρικού οξέος (3.1) και ανακινείται έντονα. Προσαρμόζεται κάθετος ψυκτήρας στην κωνική φιάλη η οποία βυθίζεται εντός ζέοντος υδρόλουτρου. Μετά 15 λεπτά ακριβώς εξάγεται η κωνική φιάλη από το υδρόλουτρο, μεταγγίζεται το περιεχόμενο αυτής εντός ογκομετρικής φιάλης των 100 ml εκπλύνοντας με ελαφρώς ψυχρό νερό και ψύχεται μέχρι 20 oC.
Διαυγάζεται ακολούθως με τη χρήση των διαλυμάτων Carrez Ι (3.3) και ΙΙ (3.4), συμπληρώνεται ο όγκος με νερό, ομοιογενοποιείται, διηθείται και μετριέται η οπτική στροφική ικανότητα όπως υποδεικνύεται στην παράγραφο 5.2, δεύτερη και τρίτη υποπαράγραφος.
6. Υπολογισμός των αποτελεσμάτων
Η επί τοις εκατό περιεκτικότητα του δείγματος σε άμυλο υπολογίζεται ως ακολούθως:
6.1. Μετρήσεις διενεργούμενες με πολωσίμετρο

|
P |
= |
συνολική στροφική ικανότητα σε μοίρες |
||||||||||||||
|
P' |
= |
οπτική στροφική ικανότητα σε μοίρες των ουσιών που διαλύονται σε αιθανόλη 40 % (κατ’ όγκο) |
||||||||||||||
|
|
= |
η ειδική οπτική στροφική ικανότητα καθαρού αμύλου. Οι συμβατικώς D αποδεκτές τιμέςτου συντελεστή αυτού είναι οι κάτωθι:
|
6.2. Μετρήσεις διενεργούμενες με σακχαρόμετρο

|
S |
= |
συνολική οπτική στροφική ικανότητα σε σακχαρομετρικούς βαθμούς |
|
S' |
= |
οπτική στροφική ικανότητα σε σακχαρομετρικούς βαθμούς των ουσιών που διαλύονται, σε αιθανόλη 40 % (ο/ο) |
|
N |
= |
βάρος σε g σακχαρόζης εντός 100 ml νερού που παρέχουν οπτική στροφική ικανότητα 100 σακχαρομετρικών βαθμών εντός σωλήνος 200 mm 16,29 g για γαλλικά σακχαρόμετρα 26,00 g για γερμανικά σακχαρόμετρα 20,00 g για μεικτά σακχαρόμετρα |
|
|
= |
ειδική οπτική στροφική ικανότητα καθαρού αμύλου (βλέπε 6.1) |
6.3. Επαναληψιμότητα
Η διαφορά των αποτελεσμάτων των δύο παράλληλα διενεργουμένων προσδιορισμών του ίδιου δείγματος δεν πρέπει να υπερβαίνει το 0,4 σε απόλυτη τιμή για περιεκτικότητα αμύλου μικρότερη του 40 % και 1 % σε σχετική τιμή για περιεκτικότητα αμύλου ίση ή μεγαλύτερη του 40 %.
7. Παρατηρήσεις
|
7.1. |
Εάν το δείγμα περιέχει ανθρακικά άλατα πλέον του 6 % εκφρασμένα σε ανθρακικά άλατα ασβεστίου, πρέπει αυτά να εξουδετερωθούν με τη χρήση της απαιτουμένης ακριβούς ποσότητας αραιωμένου θειικού οξέος, πριν από τον προσδιορισμό της συνολικής οπτικής στροφικής ικανότητας. |
|
7.2. |
Στην περίπτωση προϊόντων με υψηλή περιεκτικότητα σε λακτόζη, όπως η σκόνη ορρού γάλακτος ή το αποβουτυρωμένο γάλα, διενεργούνται τα ακόλουθα, κατόπιν προσθήκης 80 ml αιθανόλης (3.5). Προσαρμόζεται κάθετος ψυκτήρας στη φιάλη, εμβαπτίζεται η φιάλη σε υδρόλουτρο 50 oC επί 30 λεπτά. Αφήνεται ακολούθως να ψυχθεί και συνεχίζεται η ανάλυση όπως υποδεικνύεται ανωτέρω στην παράγραφο 5.3. |
|
7.3. |
Οι ακόλουθες πρώτες ύλες ζωοτροφών, σε περίπτωση παρουσίας τους σε σημαντική ποσότητα στις ζωοτροφές, είναι γνωστό ότι προκαλούν παράσιτα κατά τον προσδιορισμό της περιεκτικότητας σε άμυλο με την πολωσιμετρική μέθοδο και, ως εκ τούτου, ενδέχεται να προκύψουν εσφαλμένα αποτελέσματα:
|
ΙΓ. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΑΚΑΤΕΡΓΑΣΤΗΣ ΤΕΦΡΑΣ
1. Αντικείμενο και πεδίο εφαρμογής
Η μέθοδος επιτρέπει τον προσδιορισμό της περιεκτικότητας των ζωοτροφών σε ακατέργαστη τέφρα.
2. Αρχή
Το δείγμα αποτεφρώνεται στους 550o C. Το υπόλειμμα ζυγίζεται.
3. Αντιδραστήρια
Διάλυμα 20 % (κ.β.) νιτρικού αμμωνίου.
4. Όργανα
|
4.1. |
Θερμαντική πλάκα. |
|
4.2. |
Ηλεκτρική κάμινος με θερμοστάτη. |
|
4.3. |
Κάψες αποτέφρωσης από πυρίτιο, πορσελάνη ή πλατίνα, παραλληλεπίπεδες (περίπου 60 × 40 × 25 mm) ή στρογγυλές (διαμέτρου: 60 έως 75 mm, ύψους: 20 έως 40 mm). |
5. Διαδικασία
Ζυγίζονται 5 g περίπου δείγματος με προσέγγιση 1 mg (2,5 g για προϊόντα που έχουν τάση διόγκωσης) εντός κάψας αποτέφρωσης πριν από τη θέρμανση στους 550 oC, την ψύξη και προζύγισμά της. Τοποθετείται η κάψα επί θερμαντικής πλάκας και θερμαίνεται προοδευτικά μέχρι την ανθρακοποίηση της ύλης. Ακολουθεί αποτέφρωση σύμφωνα με τις παραγράφους 5.1. ή 5.2.
|
5.1. |
Εισάγεται η κάψα εντός της ηλεκτρικής καμίνου ρυθμισμένης στους 550 oC. Διατηρείται στη θερμοκρασία αυτή μέχρι τη λήψη λευκής, ανοικτού γκρίζου ή ροδόχρου τέφρας, καταφανώς απαλλαγμένης από ανθρακώδη σωματίδια. Η κάψα φέρεται εντός ξηραντήρα, αφήνεται να ψυχθεί και ζυγίζεται αμέσως. |
|
5.2. |
Εισάγεται η κάψα εντός της ηλεκτρικής καμίνου ρυθμισμένης στους 550 oC. Αποτεφρώνεται για 3 ώρες. Η κάψα φέρεται εντός ξηραντήρα, αφήνεται να ψυχθεί και ζυγίζεται αμέσως. Αποτεφρώνεται εκ νέου για 30 λεπτά ώστε να εξασφαλιστεί ότι το βάρος της τέφρας παραμένει σταθερό (η απώλεια βάρους μεταξύ δύο διαδοχικών ζυγισμάτων πρέπει να είναι μικρότερη ή ίση από 1 mg). |
6. Υπολογισμός των αποτελεσμάτων
Υπολογίζεται το βάρος του υπολείμματος με αφαίρεση του απόβαρου.
Το αποτέλεσμα εκφράζεται σε ποσοστό επί τοις εκατό του δείγματος.
7. Παρατηρήσεις
|
7.1. |
Η τέφρα των υλών που αποτεφρώνονται δύσκολα πρέπει να υπόκειται σε πρώτη αποτέφρωση επί τρεις ώρες τουλάχιστον, να ψύχεται και να προστίθενται σε αυτήν μερικές σταγόνες διαλύματος 20 % νιτρικού αμμωνίου ή νερού (προσεκτικά, προς αποφυγή διασποράς ή συγκόλλησης των σωματιδίων της τέφρας). Συνεχίζεται η αποτέφρωση κατόπιν ξήρανσης σε κλίβανο. Επαναλαμβάνεται ενδεχομένως η εργασία μέχρι την πλήρη αποτέφρωση. |
|
7.2. |
Για ύλες ανθεκτικές στην κατεργασία η οποία υποδεικνύεται στην παράγραφο 7.1, διενεργούνται τα κάτωθι: κατόπιν αποτέφρωσης επί τρεις ώρες παραλαμβάνεται η τέφρα με θερμό νερό και διηθείται με μικρό ηθμό ελεύθερου τέφρας. Αποτεφρώνεται ο ηθμός και το περιεχόμενο αυτού εντός της αρχικής κάψας. Το διήθημα φέρεται εντός της ψυχθείσας κάψας, εξατμίζεται μέχρι ξηρού, αποτεφρώνεται και ζυγίζεται. |
|
7.3. |
Στην περίπτωση των ελαίων και των λιπών, ζυγίζεται με ακρίβεια ποσότητα δείγματος 25 g εντός κάψας ενδεδειγμένης χωρητικότητας. Ανθρακοποιείται με ανάφλεξη της ύλης μέσω ταινίας διηθητικού χάρτου ελεύθερου τέφρας. Μετά από την καύση, υγραίνεται με τη μικρότερη απαραίτητη ποσότητα νερού. Ξηραίνεται και αποτεφρώνεται όπως υποδεικνύεται στην παράγραφο 5. |
ΙΔ. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΕΦΡΑΣ ΑΔΙΑΛΥΤΗΣ ΣΤΟ ΥΔΡΟΧΛΩΡΙΚΟ ΟΞΥ
1. Αντικείμενο και πεδίο εφαρμογής
Η μέθοδος επιτρέπει τον προσδιορισμό σε ανόργανες ύλες, αδιάλυτες στο υδροχλωρικό οξύ, των ζωοτροφών. Δύο μέθοδοι προβλέπονται ανάλογα με τη φύση του δείγματος.
|
1.1. |
Μέθοδος Α: εφαρμόσιμη στις απλές οργανικές ζωοτροφές και στις περισσότερες από τις σύνθετες ζωοτροφές. |
|
1.2. |
Μέθοδος Β: εφαρμόσιμη στις ανόργανες ενώσεις και μείγματα καθώς και στις σύνθετες ζωοτροφές των οποίων η περιεκτικότητα σε αδιάλυτα στο υδροχλωρικό οξύ, προσδιοριζόμενη κατά την μέθοδο Α, είναι ανώτερη από 1 %. |
2. Αρχή
|
2.1. |
Μέθοδος A: το δείγμα απανθρακώνεται, γίνεται κατεργασία της τέφρας, εν βρασμώ με υδροχλωρικό οξύ και το αδιάλυτο υπόλειμμα διηθείται και ζυγίζεται. |
|
2.2. |
Μέθοδος B: γίνεται κατεργασία του δείγματος με υδροχλωρικό οξύ. Το διάλυμα διηθείται, το υπόλειμμα απανθρακώνεται και γίνεται κατεργασία της λαμβανομένης τέφρας όπως στη μέθοδο Α. |
3. Αντιδραστήρια
|
3.1. |
Υδροχλωρικό οξύ 3 mol/litre. |
|
3.2. |
Διάλυμα 20 % (κατ’ όγκο) τριχλωροξικού οξέος. |
|
3.3. |
Διάλυμα 1 % (κατ’ όγκο) τριχλωροξικού οξέος. |
4. Όργανα
|
4.1. |
Θερμαινόμενη πλάκα. |
|
4.2. |
Φούρνος με σπείρωμα ηλεκτρικό και θερμοστάτη. |
|
4.3. |
Κάψες αποτέφρωσης από πυρίτιο, πορσελάνη ή πλατίνα παραλληλεπίπεδες (περίπου 60 × 40 × 25 mm) ή κυκλικές (διαμέτρου: 60 έως 75 mm, ύψους: 20 έως 40 mm). |
5. Διαδικασία
5.1. Μέθοδος A
Αποτεφρώστε την ποσότητα δοκιμής σύμφωνα με τη διαδικασία που περιγράφεται για τον προσδιορισμό της ακατέργαστης τέφρας. Επίσης μπορείτε να χρησιμοποιήσετε την τέφρα που πήρατε από αυτόν τον προσδιορισμό.
Τοποθετήστε την τέφρα μέσα σε ποτήρι των 250 έως 400 ml με τη βοήθεια 75 ml υδροχλωρικού οξέος (3.1). Φέρτε προσεκτικά το υγρό σε ήπιο βρασμό και διατηρήστε τον επί 15 λεπτά. Διηθήστε το θερμό διάλυμα πάνω σε διηθητικό χαρτί απαλλαγμένο από τέφρα και πλύντε το υπόλειμμα με θερμό νερό μέχρι την εξαφάνιση της όξινης αντίδρασης. Ξηράνατε τον ηθμό που περιέχει το υπόλειμμα και αποτεφρώστε σε προζυγισμένη κάψα σε θερμοκρασία 550 oC τουλάχιστον και 700 oC κατ’ ανώτατο όριο. Αφήστε προς ψύξη σε ξηραντήρα και ζυγίστε.
5.2. Μέθοδος B
Ζυγίστε, με προσέγγιση 1 mg, 5g δείγματος και τοποθετήστε τα σε ποτήρι των 250 έως 400 ml. Προσθέστε διαδοχικά 25 ml υδροχλωρικού οξέος (3.1), αναμείξτε και περιμένετε να τελειώσει ο αναβρασμός. Προσθέστε ακόμη 50 ml υδροχλωρικού οξέος (3.1). Περιμένετε το τέλος μιας ενδεχόμενης έκλυσης αερίου, τοποθετήστε εν συνεχεία το ποτήρι μέσα σε ζέον υδατόλουτρο και διατηρήστε το εκεί επί 30 λεπτά ή περισσότερο, αν χρειάζεται, προκειμένου να υδρολυθεί πλήρως το άμυλο που ενδεχομένως υπάρχει. Διηθήστε εν θερμώ επί ηθμού απαλλαγμένου τέφρας και πλύντε τον ηθμό με τη βοήθεια 50 ml θερμού νερού (βλέπε παρατήρηση στην παράγραφο 7). Τοποθετήστε τον ηθμό που περιέχει το υπόλειμμα μέσα σε κάψα αποτέφρωσης, ξηράνατε και αποτεφρώστε σε θερμοκρασία 550 oC τουλάχιστον και 700 oC κατ’ ανώτατο όριο. Τοποθετήστε εν συνεχεία την τέφρα σε ποτήρι των 250 έως 400 ml με τη βοήθεια 75 ml υδροχλωρικού οξέος (3.1)· ακολουθήστε τα υποδεικνυόμενα στην παράγραφο 5.1, δεύτερο εδάφιο.
6. Υπολογισμός των αποτελεσμάτων
Υπολογίστε το βάρος του υπολείμματος αφαιρώντας το απόβαρο. Εκφράστε το αποτέλεσμα σε ποσοστό επί τοις εκατό του δείγματος.
7. Παρατήρηση
Εάν η διήθηση αποδεικνύεται δύσκολη, επαναλάβετε τον προσδιορισμό αντικαθιστώντας τα 50 ml υδροχλωρικού οξέος (3.1) με 50 ml τριχλωροξικού οξέος 20 % (3.2) και εκπλένοντας τον ηθμό με τη βοήθεια θερμού διαλύματος τριχλωροξικού οξέος 1 % (3.3).
ΙΕ. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΑΝΘΡΑΚΙΚΩΝ ΑΛΑΤΩΝ
1. Αντικείμενο και πεδίο εφαρμογής
Η μέθοδος επιτρέπει τον προσδιορισμό των ανθρακικών αλάτων, συμβατικώς εκπεφρασμένων σε ανθρακικό ασβέστιο, που υπάρχουν στις περισσότερες ζωοτροφές.
Ωστόσο, σε ορισμένες περιπτώσεις (ανθρακικός σίδηρος, για παράδειγμα), πρέπει να χρησιμοποιείται ιδιαίτερη μέθοδος.
2. Αρχή
Τα ανθρακικά άλατα διασπώνται με υδροχλωρικό οξύ. Το απελευθερούμενο διοξείδιο του άνθρακος συλλέγεται εντός βαθμονομημένου σωλήνα και ο όγκος του συγκρίνεται με αυτόν που εκλύεται με τις ίδιες συνθήκες από γνωστή ποσότητα ανθρακικού ασβεστίου.
3. Αντιδραστήρια
|
3.1. |
Υδροχλωρικό οξύ, πυκνότητα 1,10 g/ml. |
|
3.2. |
Ανθρακικό ασβέστιο. |
|
3.3. |
Θειικό οξύ, 0,05 mol/litre περίπου, κεχρωσμένο με ερυθρούν του μεθυλίου. |
4. Όργανα
Συσκευή Scheibler-Dietrich (βλέπε σχήμα) ή ισοδύναμη συσκευή.
5. Διαδικασία
Αναλόγως της περιεκτικότητας του δείγματος σε ανθρακικά άλατα, ζυγίζεται ποσότητα δείγματος όπως υποδεικνύεται κατωτέρω:
|
— |
0,5 g για προϊόντα που περιέχουν 50 έως 100 % ανθρακικά άλατα, εκπεφρασμένα σε ανθρακικό ασβέστιο. |
|
— |
1 g για προϊόντα που περιέχουν 10 έως 50 % ανθρακικά άλατα, εκπεφρασμένα σε ανθρακικό ασβέστιο. |
|
— |
2 g έως 3 g για τα υπόλοιπα προϊόντα. |
Εισάγεται η ποσότητα του δείγματος εντός της ειδικής φιάλης (4) της συσκευής, εφοδιασμένης με μικρό σωλήνα από άθραυστη ύλη που περιέχει 10 ml υδροχλωρικού οξέος (3.1) και συνδέεται με τη συσκευή. Ο κρουνός τριπλής κατεύθυνσης (5) στρέφεται κατά τρόπον ώστε ο σωλήνας (1) να επικοινωνεί με το εξωτερικό περιβάλλον. Με τη χρήση του κινητού σωλήνα (2) ο οποίος είναι πληρωμένος με κεχρωσμένο θειικό οξύ (3.3) και συνδεδεμένος με το βαθμονομημένο σωλήνα (1), το επίπεδο του υγρού φέρεται στη διαβάθμιση μηδέν. Ο κρουνός (5) στρέφεται έτσι ώστε να φέρει σε επικοινωνία τους σωλήνες (1) και (2) και ελέγχεται το επίπεδο μηδέν.
Αφήνεται το υδροχλωρικό οξύ (3.1) να ρεύσει αργά επί της ποσότητας του δείγματος με κλίση της φιάλης (4), εξισορροπείται η πίεση με κλίση του σωλήνα (2). Ανακινείται η φιάλη (4) μέχρι την πλήρη παύση της έκλυσης διοξειδίου του άνθρακος.
Αποκαθίσταται η πίεση μέσω της επαναφοράς του υγρού στο ίδιο ύψος εντός των σωλήνων (1) και (2). Αναγιγνώσκεται η ένδειξη αφού περάσουν μερικά λεπτά, οπότε ο όγκος του αερίου καθίσταται σταθερός.
Υπό αυτές τις συνθήκες διενεργείται πείραμα αναφοράς επί 0,5 g ανθρακικού ασβεστίου (3.2).
6. Υπολογισμός των αποτελεσμάτων
Η περιεκτικότηταανθρακικών αλάτων, εκπεφρασμένων σε ανθρακικό ασβέστιο υπολογίζεται με τον τύπο:

όπου:
|
X |
= |
% (w/w) ανθρακικών αλάτων στο δείγμα, εκπεφρασμένων σε ανθρακικό ασβέστιο |
|
V |
= |
ml CO2 απελευθερωμένων από τη ποσότητα του δείγματος. |
|
V1 |
= |
ml CO2 απελευθερωμένων υπό 0,5 g CaCO3. |
|
m |
= |
βάρος της ποσότητας του δείγματος σε γραμμάρια. |
7. Παρατηρήσεις
|
7.1. |
Όταν η ποσότητα του δείγματος υπερβαίνει τα 2 g, εισάγονται προηγουμένως εντός της φιάλης (4) 15 ml απεσταγμένου νερού και αναμειγνύεται πριν από την έναρξη του πειράματος. Για το πείραμα αναφοράς χρησιμοποιείται ο ίδιος όγκος νερού. |
|
7.2. |
Αν χρησιμοποιείται συσκευή διαφορετικού όγκου από εκείνη των Scheibler-Dietrich, η λαμβανόμενη ποσότητα δείγματος και ουσίας αναφοράς πρέπει να προσαρμόζεται όπως και ο υπολογισμός των αποτελεσμάτων.
|
ΙΣΤ. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΟΛΙΚΟΥ ΦΩΣΦΟΡΙΚΟΥ
ΦΩΤΟΜΕΤΡΙΚΗ ΜΕΘΟΔΟΣ
1. Αντικείμενο και πεδίο εφαρμογής
Η μέθοδος επιτρέπει τον προσδιορισμό της περιεκτικότητας των ζωοτροφών σε ολικό φώσφορο. Ενδείκνυται ιδιαιτέρως για την ανάλυση προϊόντων πτωχών σε φώσφορο. Σε ορισμένες περιπτώσεις (προϊόντα πλούσια σε φώσφορο) μπορεί να εφαρμοσθεί μέθοδος σταθμικής ανάλυσης.
2. Αρχή
Το δείγμα μεταλλοποιείται, είτε διά της ξηράς οδού (ξηρής καύσης) (στην περίπτωση των οργανικών τροφών), είτε διά της υγράς οδού (στην περίπτωση των μεταλλικών ενώσεων και των ρευστών τροφών) και φέρεται σε όξινο διάλυμα. Το διάλυμα υποβάλλεται σε κατεργασία με μολυβδοβαναδικό αντιδραστήριο. Η οπτική πυκνότητα του κίτρινου διαλύματος που σχηματίζεται μετράται με φασματοφωτόμετρο σε 430 nm.
3. Αντιδραστήρια
|
3.1. |
Ανθρακικό ασβέστιο. |
|
3.2. |
Υδροχλωρικό οξύ, ρ20 = 1,10 g/ml (περίπου 6 mol/litre). |
|
3.3. |
Νιτρικό οξύ, ρ20 = 1,045 g/ml. |
|
3.4. |
Νιτρικό οξύ, ρ20 = 1,38 έως 1,42 g/ml. |
|
3.5. |
Θειικό οξύ, ρ20 = 1,84 g/ml. |
|
3.6. |
Μολυβδοβαναδικό αντιδραστήριο: Αναμειγνύονται 200 ml διαλύματος επταμολυβδαινικού αμμωνίου (3.6.1), 200 ml διαλύματος μονοβαναδικού αμμωνίου (3.6.2) και 134 ml νιτρικού οξέος (3.4) εντός ογκομετρικής φιάλης ενός λίτρου. Ο όγκος συμπληρώνεται με νερό. |
|
3.6.1. |
Διάλυμα επταμολυβδαινικού αμμωνίου: Σε θερμό νερό διαλύονται 100 g επταμολυβδαινικού αμμωνίου (NH4) 6Mo7O24.4H2O. Προστίθενται 10 ml αμμωνίας (πυκνότητας 0,91 g/ml) και ο όγκος συμπληρώνεται με νερό μέχρι ενός λίτρου. |
|
3.6.2. |
Διάλυμα μονοβαναδικού αμμωνίου: Διαλύονται εντός 400 ml θερμού νερού 2,35 g μονοβαναδικού αμμωνίου NH4VO3. Προστίθενται βραδέως και με ανακίνηση 20 ml αραιού νιτρικού οξέος [7 ml HNO3 (3.4) + 13 ml H2O] και ο όγκος συμπληρώνεται με νερό μέχρι ενός λίτρου. |
|
3.7. |
Πρότυπο διάλυμα ενός (1) mg φωσφόρου ανά ml: Διαλύεται εντός νερού ποσότητα 4,387 g δισοξίνου φωσφορικού καλίου KH2PO4. Ο όγκος συμπληρώνεται με νερό μέχρι ενός λίτρου. |
4. Όργανα
|
4.1. |
Χωνευτήρια αποτέφρωσης από πυρίτιο, πορσελάνη ή πλατίνα. |
|
4.2. |
Ηλεκτρική κάμινος με διαμερίσματα εφοδιασμένη με θερμοστάτη ρυθμισμένο στους 550 oC. |
|
4.3. |
Φιάλη Kjeldahl των 250 ml. |
|
4.4. |
Ογκομετρικές φιάλες και σιφώνια ακριβείας. |
|
4.5. |
Φασματοφωτόμετρο. |
|
4.6. |
Δοκιμαστικοί σωλήνες διαμέτρου 16 mm περίπου με σμυριδωμένα στόμια διαμέτρου 14,5 mm. Χωρητικότητα 25 έως 30 ml. |
5. Διαδικασία
5.1. Παρασκευή του διαλύματος
Ανάλογα με τη φύση του δείγματος, παρασκευάζεται διάλυμα όπως υποδεικνύεται στην παράγραφο 5.1.1 ή 5.1.2.
5.1.1.
Ζυγίζεται ένα 1 g ή περισσότερο δείγματος με προσέγγιση 1 mg. Η ποσότητα του δείγματος εισάγεται εντός φιάλης Kjeldahl, προστίθεται ποσότητα 20 ml θειικού οξέος (3.5), ανακινείται προς πλήρη διαποτισμό των υλών με το οξύ και προς αποφυγή επικάθισης αυτών των υλών επί των πλευρών της φιάλης, θερμαίνεται και διατηρείται επί 10 λεπτά σε κατάσταση βρασμού. Αφήνεται να ψυχθεί ελαφρώς, προστίθενται 2 ml νιτρικού οξέος (3.4), θερμαίνεται ηπίως, αφήνεται να ψυχθεί ελαφρώς, προστίθεται εκ νέου λίγο νιτρικό οξύ (3.4) και θερμαίνεται μέχρι βρασμού. Επαναλαμβάνονται οι ίδιες ενέργειες μέχρι την επίτευξη αχρώμου διαλύματος. Ψύχεται, προστίθεται λίγο νερό, μεταγγίζεται το υγρό εντός ογκομετρικής φιάλης των 500 ml, εκπλύνοντας τη φιάλη Kjeldahlμε θερμού νερού. Αφήνεται να ψυχθεί, συμπληρώνεται ο όγκος με νερό, ομοιογενοποιείται και διηθείται.
5.1.2.
Ζυγίζονται 2,5 g περίπου δείγματος, με προσέγγιση 1 mg, εντός χωνευτηρίου αποτέφρωσης. Η ποσότητα του δείγματος αναμειγνύεται μέχρι την πλήρη ανάμειξη ενός 1 g ανθρακικού ασβεστίου (3.1.). Ασβεστοποιείται εντός της καμίνου στους 550 oC μέχρι την επίτευξη λευκής ή φαιάς τέφρας (μικρή ποσότητα άνθρακος δεν εμπνέει ανησυχία). Μεταγγίζεται η τέφρα εντός γυάλινου ποτηριού ζέσεως των 250 ml. Προστίθενται 20 ml νερού και υδροχλωρικό οξύ (3.2) μέχρι την παύση του αφρισμού. Προστίθενται ακολούθως άλλα 10 ml υδροχλωρικού οξέος (3.2). Φέρεται το γυάλινο ποτήρι ζέσεως σε αμμόλουτρο και εξατμίζεται μέχρι ξήρανσης προς αδιαλυτοποίηση του χαλαζία. Επαναδιαλύεται το υπόλειμμα με 10 ml νιτρικού οξέος (3.3) και βράζεται επί του αμμόλουτρου ή της θερμαινόμενης πλάκας επί 5 λεπτά, χωρίς εξάτμιση μέχρι την ξήρανση. Μεταγγίζεται το υγρό εντός ογκομετρικής φιάλης των 500 ml, εκπλύνοντας το γυάλινο ποτήρι ζέσεως πολλές φορές με θερμό νερό. Αφήνεται να ψυχθεί, ο όγκος συμπληρώνεται με νερό, ομοιογενοποιείται και διηθείται.
5.2. Ανάπτυξη του χρωματισμού και μέτρηση της οπτικής πυκνότητος
Μέρος της ποσότητας του διηθήματος που προέκυψε βάσει της παραγράφου 5.1.1 ή 5.1.2 αραιώνεται προς επίτευξη συγκέντρωσης φωσφόρου μέχρι 40 mg/ml κατ’ ανώτατο όριο. Εισάγονται 10 ml του διαλύματος εντός δοκιμαστικού σωλήνα (4.6) και προστίθενται 10 ml του μολυβδοβαναδικού αντιδραστηρίου (3.6). Ομοιογενοποιείται και αφήνεται σε ηρεμία επί 10 λεπτά σε θερμοκρασία τουλάχιστον 20 oC. Η οπτική πυκνότητα μετράται με το φασματοφωτόμετρο σε 430 mm μέσω σύγκρισης με το διάλυμα που προκύπτει διά της προσθήκης 10 ml μολυβδοβαναδικού αντιδραστηρίου (3.6) σε 10 ml νερού.
5.3. Καμπύλη βαθμονόμησης
Βάσει του πρότυπου διαλύματος (3.7) παρασκευάζονται διαλύματα που περιέχουν αντιστοίχως 5, 10, 20, 30 και 40 μg φωσφόρου ανά ml. Λαμβάνονται 10 ml από κάθε ένα εκ των διαλυμάτων αυτών στα οποία προστίθενται 10 ml μολυβδοβαναδικού αντιδραστηρίου (3.6). Ομοιογενοποιούνται και αφήνονται σε ηρεμία επί 10 λεπτά σε θερμοκρασία τουλάχιστον 20 oC. Μετράται η οπτική πυκνότητα υπό τις συνθήκες που καθορίζονται στην παράγραφο 5.2. Η καμπύλη βαθμονόμησης διαμορφώνεται χαράσσοντας τη γραμμή των σημείων τομής των τιμών οπτικής πυκνότητας και των αντίστοιχων ποσοτήτων φωσφόρου. Για συγκεντρώσεις που κυμαίνονται μεταξύ 0 και 40 μg/ml η καμπύλη είναι γραμμική.
6. Υπολογισμός των αποτελεσμάτων
Προσδιορίζεται η ποσότητα φωσφόρου εντός της ποσότητας δείγματος μέσω αναφοράς στην καμπύλη βαθμονόμησης.
Το αποτέλεσμα εκφράζεται επί τοις εκατό του δείγματος.
Επαναληψιμότητα
Η διαφορά μεταξύ των αποτελεσμάτων των δύο παράλληλα πραγματοποιούμενων προσδιορισμών επί του ίδιου δείγματος δεν πρέπει να υπερβαίνει το:
|
— |
3 % σε σχετική τιμή για περιεκτικότητες σε φώσφορο μικρότερες του 5 %, |
|
— |
0,15 % σε απόλυτη τιμή για περιεκτικότητες σε φώσφορο ίσες ή μεγαλύτερες του 5 %. |
ΙΖ. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΧΛΩΡΙΟΥ ΤΩΝ ΧΛΩΡΙΟΥΧΩΝ
1. Αντικείμενο και πεδίο εφαρμογής
Η μέθοδος επιτρέπει τον προσδιορισμό του χλωρίου των χλωριούχων των διαλυτών στο νερό, συμβατικά εκπεφρασμένου σε χλωριούχο νάτριο. Είναι εφαρμόσιμη σε όλες τις ζωοτροφές.
2. Αρχή
Τα χλωριούχα διαλύονται στο νερό. Εάν το προϊόν περιέχει οργανικές ουσίες προβείτε σε αποστράγγιση. Το διάλυμα οξυνίζεται ελαφρά με νιτρικό οξύ και τα χλωριούχα καταβυθίζονται ως χλωριούχος άργυρος με τη βοήθεια διαλύματος νιτρικού αργύρου. Η περίσσεια νιτρικού αργύρου ογκομετρείται με ένα διάλυμα θειοκυανιούχου αμμωνίου, κατά τη μέθοδο Volhard.
3. Αντιδραστήρια
|
3.1. |
Διάλυμα θειοκυανιούχου αμμωνίου 0,1 mol/litre. |
|
3.2. |
Διάλυμα νιτρικού αργύρου 0,1 mol/litre. |
|
3.3. |
Κεκορεσμένο διάλυμα θειικού σιδηροαμμωνίου (NH4)Fe(SO4)2. |
|
3.4. |
Νιτρικό οξύ, πυκνότητα: 1,38 g/ml. |
|
3.5. |
Διαιθυλικός αιθέρας. |
|
3.6. |
Ακετόνη. |
|
3.7. |
Διάλυμα Carrez I: διαλύστε στο νερό 21,9 g οξικού ψευδαργύρου, Zn (CH3COO)2·2H2O και 3 g κρυσταλλικού οξικού οξέος. Συμπληρώστε στα 100 ml με νερό. |
|
3.8. |
Διάλυμα Carrez II: διαλύστε στο νερό 10,6 g σιδηροκυανιούχο κάλιο K4Fe(CN)6·3H2O. Συμπληρώστε στα 100 ml με νερό. |
|
3.9. |
Ενεργός άνθρακας, απαλλαγμένος χλωριούχων και μη επιδεκτικός προσρόφησης χλωριούχων. |
4. Όργανα
Αναμείκτης (παλινδρομητής): περίπου 35 έως 40 αναστροφές ανά λεπτό.
5. Διαδικασία
5.1. Ετοιμασία του διαλύματος
Ανάλογα με τη φύση του δείγματος, ετοιμάστε ένα διάλυμα όπως υποδεικνύεται στην παράγραφο 5.1.1, 5.1.2 ή 5.1.3.
Πραγματοποιήστε παράλληλα τυφλό πείραμα απαλλαγμένο από το προς ανάλυση δείγμα.
5.1.1.
Ζυγίστε, με ακρίβεια 1 mg, μια ποσότητα δοκιμής (όχι μεγαλύτερη των 10 g), που να μην περιέχει περισσότερο από 3 g χλωρίου σε μορφή χλωριούχων και τοποθετήστε την σε μια ογκομετρική φιάλη των 500 ml με 400 ml νερού θερμοκρασίας 20 oC περίπου. Αναμείξτε επί 30 λεπτά στον παλινδρομητή, συμπληρώστε μέχρι τη χαραγή, ομογενοποιήστε και διηθήστε.
5.1.2.
Ζυγίστε, με ακρίβεια 1 mg, 5 g περίπου δείγματος και τοποθετήστε τα μαζί με 1 g ενεργού άνθρακα σε ογκομετρική φιάλη των 500 ml. Προσθέστε 400 ml νερού θερμοκρασίας 20 oC περίπου και 5 ml διαλύματος Carrez I (3.7), ανακινήστε και προσθέστε κατόπιν 5 ml διαλύματος Carrez II (3.8). Αναμείξτε επί 30 λεπτά στον παλινδρομητή, συμπληρώστε μέχρι τη χαραγή, ομογενοποιήστε και διηθήστε.
5.1.3.
Ετοιμάστε το διάλυμα όπως υποδεικνύεται στην 5.1.2 αλλά μην διηθείτε. Αφήστε προς καταστάλαξη (εάν είναι απαραίτητο, φυγοκεντρήστε), παραλάβατε 100 ml από το υγρό που επιπλέει και εισαγάγετέ τα σε ογκομετρική φιάλη των 200 ml. Αναμείξτε με ακετόνη (3.6) και συμπληρώστε μέχρι τη χαραγή με τον διαλύτη αυτόν, ομογενοποιήστε και διηθήστε.
5.2. Ογκομέτρηση
Εισαγάγετε με προχοΐδα μέσα σε κωνική φιάλη 25 έως 100 ml από το διήθημα (ανάλογα με την αναμενόμενη περιεκτικότητα σε χλώριο) που πάρθηκε κατά τις παραγράφους 5.1.1, 5.1.2 ή 5.1.3. Η ποσότητα αυτή δεν πρέπει να περιέχει περισσότερο από 150 mg χλωρίου (Cl). Αραιώστε, αν είναι απαραίτητο, στα 50 ml τουλάχιστον με νερό, προσθέστε 5 ml νιτρικού οξέος (3.4), 20 ml κεκορεσμένου διαλύματος θειϊκού σιδηροαμμωνίου (3.3) και 2 σταγόνες διαλύματος θειοκυανιούχου αμμωνίου (3.1), με προχοΐδα γεμάτη μέχρι τη χαραγή μηδέν. Μεταφέρτε εν συνεχεία με προχοΐδα το διάλυμα νιτρικού αργύρου (3.2) έτσι ώστε να δημιουργηθεί περίσσεια των 5 ml. Προσθέστε 5 ml διαιθυλικού αιθέρα (3.5) και ανακινήστε δυνατά ώστε το ίζημα να συσσωματωθεί. Ογκομετρήστε την περίσσεια του νιτρικού αργύρου με το διάλυμα του θειοκυανιούχου αμμωνίου (3.1) μέχρις ότου η αλλαγή του χρώματος στο ερυθροκαστανό επιμένει επί ένα λεπτό.
6. Υπολογισμός των αποτελεσμάτων
Η ποσότητα του χλωρίου (X), εκφρασμένη σε χλωριούχο νάτριο επί τοις εκατό, δίδεται από τον ακόλουθο τύπο:
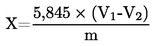
όπου:
|
V1 |
= |
ml διαλύματος νιτρικού αργύρου 0,1 mol/l που προστέθηκαν |
|
V2 |
= |
ml διαλύματος θειοκυανιούχου αμμωνίου 0,1 mol/l που χρησιμοποιήθηκαν κατά την ογκομέτρηση |
|
m |
= |
βάρος του δείγματος. |
Εάν το τυφλό πείραμα υποδεικνύει κατανάλωση διαλύματος νιτρικού αργύρου 0,1 mol/l, αφαιρέστε αυτόν τον όγκο από τον όγκο (V1 - V2).
7. Παρατηρήσεις
|
7.1. |
Η ογκομέτρηση μπορεί επίσης να γίνει ποτενσιομετρικώς. |
|
7.2. |
Για προϊόντα πολύ πλούσια σε λιπαρές ύλες, προχωρήστε σε προηγούμενη απολίπανση με διαιθυλικό αιθέρα ή πετρελαϊκό αιθέρα. |
|
7.3. |
Για ιχθυάλευρα, η ογκομέτρηση μπορεί να πραγματοποιηθεί με τη μέθοδο Mohr. |
(1) Για την ξήρανση των σιτηρών καθώς και των αλεύρων, χονδραλεύρων και σιμιγδαλιών, ο κλίβανος αποξήρανσης πρέπει να έχει θερμική απόδοση τέτοια ώστε ρυθμιζόμενος εκ των προτέρων στη θερμοκρασία των 131 oC, να δύναται να επανακτήσει τη θερμοκρασία αυτή νωρίτερα των 45 πρώτων λεπτών κατόπιν της τοποθέτησης σε αυτόν του μεγαλύτερου δυνατού αριθμού των δειγμάτων για ταυτόχρονο ξήρανση. Ο αερισμός του κλιβάνου αποξήρανσης πρέπει να είναι τέτοιος ώστε όλα μαζί τα δείγματα μαλακού σίτου, που είναι δυνατόν να χωρέσουν, ξηραινόμενα επί δύο ώρες να δίδουν αποτελέσματα τα οποία να παρουσιάζουν διαφορά κατώτερη του 0,15 % σε σχέση με τα αποτελέσματα που επιτυγχάνονται μετά από τετράωρη ξήρανση.
(2) Όταν η λιπαρή ύλη πρέπει να αποτελέσει αντικείμενο μεταγενέστερων ποιοτικών εξετάσεων, τα τεμάχια κίσσηρης αντικαθίστανται από γυάλινες χάντρες.
ΠΑΡΑΡΤΗΜΑ IV
ΜΕΘΟΔΟΙ ΑΝΑΛΥΣΗΣ ΓΙΑ ΤΟΝ ΕΛΕΓΧΟ ΤΗΣ ΠΕΡΙΕΚΤΙΚΟΤΗΤΑΣ ΤΩΝ ΖΩΟΤΡΟΦΩΝ ΣΕ ΕΓΚΕΚΡΙΜΕΝΕΣ ΠΡΟΣΘΕΤΕΣ ΥΛΕΣ
A. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΗΣ ΒΙΤΑΜΙΝΗΣ Α
1. Σκοπός και πεδίο εφαρμογής
Η παρούσα μέθοδος αποσκοπεί στον προσδιορισμό της βιταμίνης Α (ρετινόλη) σε ζωοτροφές και προμείγματα. Στον όρο βιταμίνη Α περιλαμβάνονται η ολο-trans-ρετινόλη και τα cis-ισομερή της που προσδιορίζονται με την παρούσα μέθοδο. Η περιεκτικότητα σε βιταμίνη Α εκφράζεται σε διεθνείς μονάδες (IU) ανά kg. Μία IU αντιστοιχεί στη δράση 0,300 μg αλκοολικής ολο-trans-βιταμίνης Α ή 0,344 μg οξικής ολο-trans-βιταμίνης Α ή 0,550 μg παλμιτικής ολο-trans-βιταμίνης Α.
Το όριο προσδιορισμού είναι 2 000 IU βιταμίνης A/kg.
2. Αρχή
Το δείγμα υδρολύεται με αιθανολικό διάλυμα υδροξειδίου του καλίου και η βιταμίνη Α εκχυλίζεται με πετρελαϊκό αιθέρα. Ο διαλύτης απομακρύνεται με εξάτμιση και το υπόλειμμα διαλύεται σε μεθανόλη και, εφόσον είναι αναγκαίο, αραιώνεται μέχρι την απαιτούμενη συγκέντρωση. Η συγκέντρωση της βιταμίνης Α προσδιορίζεται με υγρή χρωματογραφία ανάστροφης φάσης υψηλής απόδοσης (RP-HPLC) χρησιμοποιώντας ανιχνευτή UV ή φθορισμού. Οι χρωματογραφικές παράμετροι επιλέγονται έτσι ώστε να μη γίνεται διαχωρισμός μεταξύ της αλκοολικής ολο-trans- βιταμίνης Α και των cis ισομερών της.
3. Αντιδραστήρια
|
3.1. |
Αιθανόλη, σ = 96 % |
|
3.2. |
Πετρελαϊκός αιθέρας, περιοχή ζέσεως 40 oC-60 oC |
|
3.3. |
Μεθανόλη |
|
3.4. |
Διάλυμα υδροξειδίου του καλίου, c = 50 g/100 ml |
|
3.5. |
Διάλυμα ασκορβικού νατρίου, c = 10 g/100 ml (βλέπε παρατήρηση 7.7) |
|
3.6. |
Θειούχο νάτριο, Na2S·× H2O (x = 7-9) |
|
3.6.1. |
Διάλυμα θειούχου νατρίου, c = 0,5 mol/l σε γλυκερόλη, ß = 120 g/l (για x = 9) (βλέπε παρατήρηση 7.8) |
|
3.7. |
Διάλυμα φαινολοφθαλεΐνης, c = 2 g/100 ml σε αιθανόλη (3.1) |
|
3.8. |
2-προπανόλη |
|
3.9. |
Κινητή φάση για HPLC: μείγμα μεθανόλης (3.3) και νερού, π.χ. 980 + 20 (v + v). Η ακριβής σχέση καθορίζεται από τα χαρακτηριστικά της χρησιμοποιούμενης στήλης. |
|
3.10. |
Άζωτο, απαλλαγμένο οξυγόνου |
|
3.11. |
Οξική ολο-trans-βιταμίνη Α, εξαιρετικά καθαρή, πιστοποιημένης δραστικότητας, π.χ. 2,80 × 106 IU/g |
|
3.11.1. |
Αρχικό διάλυμα οξικής ολο-trans-βιταμίνης Α: Σε ογκομετρική φιάλη 100 ml ζυγίζονται με προσέγγιση 0,1 mg, 50 mg οξικής βιταμίνης Α (3.11). Διαλύονται σε 2-προπανόλη (3.8) και συμπληρώνονται μέχρι τη χαραγή με τον ίδιο διαλύτη. Η ονομαστική συγκέντρωση του εν λόγω διαλύματος είναι 1 400 IU βιταμίνης Α ανά ml. Η ακριβής συγκέντρωση πρέπει να προσδιορίζεται σύμφωνα με την παράγραφο 5.6.3.1. |
|
3.12. |
Παλμιτική ολο-trans-βιταμίνη Α, εξαιρετικά καθαρή, πιστοποιημένης δραστικότητας, π.χ. 1,80 × 106 IU/g |
|
3.12.1. |
Αρχικό διάλυμα παλμιτικής ολο-trans-βιταμίνης Α: Σε ογκομετρική φιάλη 100 ml ζυγίζονται με προσέγγιση 0,1 mg, 80 mg παλμιτικής βιταμίνης Α (3.12). Διαλύονται σε 2-προπανόλη (3.8) και συμπληρώνονται μέχρι τη χαραγή με τον ίδιο διαλύτη. Η ονομαστική συγκέντρωση του εν λόγω διαλύματος είναι 1 400 IU βιταμίνης Α ανά ml. Η ακριβής συγκέντρωση πρέπει να προσδιορίζεται σύμφωνα με την παράγραφο 5.6.3.2. |
|
3.13. |
2,6-δι-tert-βουτυλο-4-μεθυλοφαινόλη (BHT) (βλέπε παρατήρηση 7.5) |
4. Όργανα
|
4.1. |
Περιστροφικός εξατμιστήρας κενού |
|
4.2. |
Αδιαφανή γυάλινα σκεύη |
|
4.2.1. |
Κωνικές ή σφαιρικές φιάλες με επίπεδο πυθμένα των 500 ml, με εσμυρισμένη υποδοχή |
|
4.2.2. |
Ογκομετρικές στενόλαιμες φιάλες με εσμυρισμένα πώματα των 10, 25, 100 και 500 ml |
|
4.2.3. |
Κωνικές διαχωριστικές χοάνες των 1 000 ml, με εσμυρισμένα πώματα |
|
4.2.4. |
Απιοειδείς φιάλες των 250 ml, με εσμυρισμένες υποδοχές |
|
4.3. |
Συμπυκνωτής Allihn, με χιτώνιο μήκους 300 mm, με εσμυρισμένη ένωση, με προσαρμογέα για σωλήνα παροχής αερίου |
|
4.4. |
Πτυχωτός ηθμός για διαχωρισμό φάσεων, διαμέτρου 185 mm (π.χ. Schleicher & Schuell 597 HY 1/2) |
|
4.5. |
Εξοπλισμός HPLC με σύστημα έγχυσης |
|
4.5.1. |
Στήλη υγρής χρωματογραφίας, 250 mm × 4 mm, C18, 5 ή 10 μm με πλήρωση 5 ή 10 μm, ή ισοδύναμη (κριτήριο απόδοσης: μία μόνον κορυφή για όλα τα ισομερή ρετινόλης υπό τις συνθήκες HPLC) |
|
4.5.2. |
Ανιχνευτής UV ή φθορισμού, με μεταβαλλόμενο μήκος κύματος |
|
4.6. |
Φασματοφωτόμετρο με κυψελίδες χαλαζία των 10 mm |
|
4.7. |
Υδρόλουτρο με μαγνητικό αναδευτήρα |
|
4.8. |
Συσκευή εκχύλισης (βλέπε σχήμα 1) αποτελούμενη από: |
|
4.8.1. |
Γυάλινο κύλινδρο χωρητικότητας 1 l με εσμυρισμένο λαιμό και πώμα |
|
4.8.2. |
Εσμυρισμένο γυάλινο ένθεμα εφοδιασμένο με πλευρικό βραχίονα και προσαρμόσιμο σωλήνα διερχόμενο από το κέντρο. Το κάτω άκρο του προσαρμόσιμου σωλήνα πρέπει να έχει σχήμα U ενώ στο άλλο άκρο πρέπει να υπάρχει ακροφύσιο έτσι ώστε η πάνω υγρή στιβάδα στον κύλινδρο να μπορεί να μεταφέρεται σε διαχωριστική χοάνη. |
5. Διαδικασία
|
Σημείωση: |
Η βιταμίνη Α είναι ευαίσθητη στο υπεριώδες φως και στην οξείδωση. Όλες οι εργασίες πρέπει να γίνονται απουσία φωτός (χρησιμοποιώντας αδιαφανή γυάλινα σκεύη ή σκεύη προστατευόμενα με φύλλο αλουμινίου) και οξυγόνου (πλήρωση με άζωτο). Κατά τη διάρκεια της εκχύλισης ο αέρας πρέπει να αντικαθίσταται από άζωτο (αποφεύγεται η υπερβολική πίεση χαλαρώνοντας από καιρού σε καιρό το πώμα). |
5.1. Παρασκευή του δείγματος
Το δείγμα αλέθεται έτσι ώστε να διέρχεται από κόσκινο με διάμετρο οπών 1 mm, προσέχοντας να μην παράγεται θερμότητα. Η άλεση πρέπει να γίνεται αμέσως πριν από τη ζύγιση και τη σαπωνοποίηση, αλλιώς μπορεί να υπάρξουν απώλειες βιταμίνης A.
5.2. Σαπωνοποίηση
Ανάλογα με την περιεκτικότητα σε βιταμίνη Α, ζυγίζονται σε κωνική ή σφαιρική φιάλη με επίπεδο πυθμένα των 500 ml (4.2.1), 2 g έως 25 g του δείγματος με προσέγγιση 1 mg. Προστίθενται διαδοχικά υπό ανακίνηση 130 ml αιθανόλης (3.1), περίπου 100 mg BHT (3.13), 2 ml διαλύματος ασκορβικού νατρίου (3.5) και 2 ml διαλύματος θειούχου νατρίου (3.6). Στη φιάλη προσαρμόζεται συμπυκνωτήρας (4.3) και η φιάλη βυθίζεται σε υδρόλουτρο με μαγνητικό αναδευτήρα (4.7). Θερμαίνεται μέχρι βρασμού και το διάλυμα αφήνεται υπό αναρροή για 5 λεπτά. Κατόπιν προστίθενται 25 ml διαλύματος υδροξειδίου του καλίου (3.4) μέσω του συμπυκνωτήρα (4.3) και το διάλυμα αφήνεται υπό αναρροή για 25 λεπτά ακόμη, με ανάδευση υπό ελαφρύ ρεύμα αζώτου. Ο συμπυκνωτήρας στη συνέχεια εκπλένεται με 20 ml νερό περίπου και το περιεχόμενο της φιάλης ψύχεται σε θερμοκρασία δωματίου.
5.3. Εκχύλιση
Το σαπωνοποιημένο διάλυμα μεταγγίζεται ποσοτικά, εκπλένοντάς το με νερό συνολικού όγκου 250 ml, σε διαχωριστική χοάνη των 1 000 ml (4.2.3) ή σε συσκευή εκχύλισης (4.8). Η φιάλη σαπωνοποίησης εκπλένεται διαδοχικά με 25 ml αιθανόλης (3.1) και 100 ml πετρελαϊκού αιθέρα (3.2) και τα εκπλύματα μεταφέρονται στη διαχωριστική χοάνη ή στη συσκευή εκχύλισης. Η αναλογία νερού-αιθανόλης στα συνενωμένα διαλύματα πρέπει να είναι περίπου 2:1. Το σύνολο ανακινείται έντονα επί 2 λεπτά και αφήνεται να ηρεμήσει για άλλα 2 λεπτά.
5.3.1.
Μετά το διαχωρισμό των στιβάδων (βλέπε παρατήρηση παράγραφο 7.3), η στιβάδα του πετρελαϊκού αιθέρα μεταφέρεται σε άλλη διαχωριστική χοάνη (4.2.3). Η εκχύλιση αυτή επαναλαμβάνεται δύο φορές, με 100 ml πετρελαϊκού αιθέρα (3.2) και δύο φορές με 50 ml πετρελαϊκού αιθέρα (3.2).
Τα συνενωμένα εκχυλίσματα πλένονται στη διαχωριστική χοάνη δύο φορές με ήπια περιδίνιση (για την αποφυγή σχηματισμού γαλακτωμάτων) με 100 ml νερό κάθε φορά και κατόπιν με επανειλημμένη ανακίνηση με περαιτέρω ποσότητες νερού των 100 ml μέχρις ότου το νερό να παραμένει άχρωμο σε προσθήκη διαλύματος φαινολοφθαλεΐνης (3.7) (τέσσερις φορές πλύσιμο συνήθως αρκεί). Το πλυμένο εκχύλισμα διηθείται μέσω ξηρού πτυχωτού ηθμού για διαχωρισμό φάσεων (4.4) για την απομάκρυνση τυχόν εναιωρούμενου νερού σε ογκομετρική φιάλη των 500 ml (4.2.2). Η διαχωριστική χοάνη και ο ηθμός εκπλύνονται με 50 ml πετρελαϊκού αιθέρα (3.2), το διάλυμα συμπληρώνεται μέχρι τη χαραγή με πετρελαϊκό αιθέρα (3.2) και αναμειγνύεται καλά.
5.3.2.
Μετά το διαχωρισμό των στιβάδων (βλέπε παρατήρηση 7.3), το πώμα του γυάλινου κυλίνδρου (4.8.1) αντικαθίσταται με το εσμυρισμένο ένθεμα (4.8.2) και το σχήματος U κάτω άκρο του προσαρμοζόμενου σωλήνα φέρεται σε τέτοια θέση ώστε να είναι ίσα-ίσα πάνω από το επίπεδο της διαχωριστικής επιφάνειας. Με εφαρμογή πίεσης από γραμμή αζώτου στον πλευρικό βραχίονα, η πάνω στιβάδα του πετρελαϊκού αιθέρα μεταφέρεται σε διαχωριστική χοάνη των 1 000 ml (4.2.3). Στον γυάλινο κύλινδρο προστίθενται 100 ml πετρελαϊκού αιθέρα (3.2), ο κύλινδρος πωματίζεται και ανακινείται καλά. Οι στιβάδες αφήνονται να διαχωριστούν και η πάνω στιβάδα μεταφέρεται όπως πριν στη διαχωριστική χοάνη. Η διαδικασία εκχύλισης επαναλαμβάνεται με 100 ml ακόμη πετρελαϊκού αιθέρα (3.2), στη συνέχεια δύο φορές με 50 ml κάθε φορά πετρελαϊκού αιθέρα (3.2) και οι στιβάδες του πετρελαϊκού αιθέρα προστίθενται στη διαχωριστική χοάνη.
Τα συνενωμένα πετρελαϊκά εκχυλίσματα πλένονται όπως περιγράφεται στην παράγραφο 5.3.1 και ακολουθείται η περιγραφόμενη εκεί διαδικασία.
5.4. Παρασκευή του δείγματος για την HPLC
Σε απιοειδή φιάλη 250 ml (4.2.4) μεταφέρεται με πιπέτα (σιφώνιο) κατάλληλη ποσότητα του διαλύματος πετρελαϊκού αιθέρα (από τις παραγράφους 5.3.1 ή 5.3.2). Ο διαλύτης εξατμίζεται σχεδόν μέχρι ξηρού σε περιστροφικό εξατμιστήρα (4.1) με ελαττωμένη πίεση και θερμοκρασία λουτρού μη υπερβαίνουσα τους 40 oC. Αποκαθίσταται η ατμοσφαιρική πίεση με εισαγωγή αζώτου (3.10) και η φιάλη απομακρύνεται από τον περιστροφικό εξατμιστήρα. Ο παραμένων διαλύτης απομακρύνεται με ρεύμα αζώτου (3.10) και το υπόλειμμα διαλύεται αμέσως σε γνωστό όγκο (10-100 ml) μεθανόλης (3.3) (η συγκέντρωση της βιταμίνης Α πρέπει να είναι της τάξεως των 5 IU/ml έως 30 IU/ml).
5.5. Προσδιορισμός με HPLC
Η βιταμίνη Α διαχωρίζεται σε στήλη ανάστροφης φάσης C18 (4.5.1) και μετράται η συγκέντρωση με τη βοήθεια ανιχνευτή UV (325 nm) ή φθορισμού (διέγερση: 325 nm, εκπομπή: 475 nm) (4.5.2).
Εγχύεται κατάλληλη ποσότητα (π.χ. 20 μl) του μεθανολικού διαλύματος που λαμβάνεται στην παράγραφο 5.4 και εκλούζεται με την κινητή φάση (3.9). Υπολογίζεται το μέσο ύψος κορυφής (εμβαδόν) ορισμένων εγχύσεων του ίδιου δείγματος και τα μέσα ύψη κορυφών (εμβαδά) ορισμένων εγχύσεων των διαλυμάτων βαθμονόμησης (5.6.2).
Για την HPLC πρέπει να χρησιμοποιούνται οι κατωτέρω συνθήκες. Μπορούν να χρησιμοποιηθούν όμως και άλλες συνθήκες υπό την προϋπόθεση ότι παρέχουν ισοδύναμα αποτελέσματα.
|
Υγρή χρωματογραφική στήλη (4.5.1): |
250 mm × 4 mm, C18, 5 ή 10 μm πλήρωση, ή ισοδύναμη |
|
Κινητή φάση (3.9): |
Μείγμα μεθανόλης (3.3) και νερού π.χ. 980 + 20 (v + v). |
|
Ρυθμός ροής: |
1-2 ml/min |
|
Ανιχνευτής (4.5.2): |
Ανιχνευτής UV (325 nm) ή φθορισμού (διέγερση: 325 nm/εκπομπή: 475 nm) |
5.6. Βαθμονόμηση
5.6.1.
Σε κωνική ή σφαιρική φιάλη με επίπεδο πυθμένα των 500 ml μεταφέρονται με σιφώνιο 20 ml του αρχικού διαλύματος οξικής βιταμίνης Α (3.11.1) ή 20 ml του αρχικού διαλύματος παλμιτικής βιταμίνης Α (3.12.1) και υδρολύονται όπως περιγράφεται στο σημείο 5.2, αλλά χωρίς προσθήκη BHT. Ακολουθεί εκχύλιση με πετρελαϊκό αιθέρα (3.2) σύμφωνα με την παράγραφο 5.3 και συμπληρώνουμε μέχρι τη χαραγή των 500 ml με πετρελαϊκό αιθέρα (3.2). 100 ml του εκχυλίσματος αυτού εξατμίζονται στον περιστροφικό εξατμιστήρα (βλέπε 5.4) σχεδόν μέχρι ξηρού, ο εναπομένων διαλύτης απομακρύνεται με ρεύμα αζώτου (3.10) και το υπόλειμμα αναδιαλύεται σε 10,0 ml μεθανόλης (3.3). Η ονομαστική συγκέντρωση αυτού του διαλύματος είναι 560 IU βιταμίνης Α ανά ml. Η ακριβής συγκέντρωση πρέπει να προσδιοριστεί σύμφωνα με την παράγραφο 5.6.3.3. Το πρότυπο διάλυμα εργασίας πρέπει να παρασκευάζεται λίγο πριν από τη χρήση του.
2,0 ml του προτύπου αυτού διαλύματος εργασίας μεταφέρονται με σιφώνιο σε ογκομετρική φιάλη των 20 ml, συμπληρώνονται μέχρι τη χαραγή με μεθανόλη (3.3) και το σύνολο αναμειγνύεται. Η ονομαστική συγκέντρωση αυτού του αραιωμένου πρότυπου διαλύματος εργασίας είναι 56 IU βιταμίνης Α ανά ml.
5.6.2.
1,0, 2,0, 5,0 και 10,0 ml του αραιωμένου πρότυπου διαλύματος εργασίας μεταφέρονται σε μια σειρά ογκομετρικών φιαλών των 20 ml, συμπληρώνονται μέχρι τη χαραγή με μεθανόλη (3.3) και αναμειγνύονται. Οι ονομαστικές συγκεντρώσεις των διαλυμάτων αυτών είναι 2,8, 5,6, 14,0 και 28,0 IU βιταμίνης Α ανά ml.
20 μl κάθε διαλύματος βαθμονόμησης εγχύονται κατ’ επανάληψη και προσδιορίζονται τα μέσα ύψη (εμβαδά) των κορυφών. Χρησιμοποιώντας τα μέσα ύψη (εμβαδά) των κορυφών, χαράσσεται καμπύλη βαθμονόμησης λαμβάνοντας υπόψη τα αποτελέσματα του ελέγχου με UV (5.6.3.3).
5.6.3.
5.6.3.1.
Σε ογκομετρική φιάλη των 50 ml (4.2.2) μεταφέρονται με σιφώνιο 2,0 ml του αρχικού διαλύματος οξικής βιταμίνης Α (3.11.1) και συμπληρώνονται μέχρι τη χαραγή με 2-προπανόλη (3.8). Η ονομαστική συγκέντρωση αυτού του διαλύματος είναι 56 IU βιταμίνης Α ανά ml. 3,0 ml του αραιωμένου αυτού διαλύματος οξικής βιταμίνης Α μεταφέρονται με σιφώνιο σε ογκομετρική φιάλη των 25 ml και συμπληρώνονται μέχρι τη χαραγή με 2-προπανόλη (3.8). Η ονομαστική συγκέντρωση αυτού του διαλύματος είναι 6,72 IU βιταμίνης Α ανά ml. Μετριέται το φάσμα UV αυτού του διαλύματος σε σχέση με την 2-προπανόλη (3.8) στο φασματοφωτόμετρο (4.6) μεταξύ 300 nm και 400 nm. Η μέγιστη απόσβεση πρέπει να είναι μεταξύ 325 nm και 327 nm.
Υπολογισμός της συγκέντρωσης βιταμίνης Α:
IU βιταμίνη A/ml = E326 × 19,0
( για οξική βιταμίνη A = 1 530 στα 326 nm σε 2-προπανόλη)
για οξική βιταμίνη A = 1 530 στα 326 nm σε 2-προπανόλη)
5.6.3.2.
Σε ογκομετρική φιάλη των 50 ml (4.2.2) μεταφέρονται με σιφώνιο 2,0 ml του αρχικού διαλύματος παλμιτικής βιταμίνης Α (3.12.1) και συμπληρώνονται μέχρι τη χαραγή με 2-προπανόλη (3.8). Η ονομαστική συγκέντρωση αυτού του διαλύματος είναι 56 IU βιταμίνης Α ανά ml. 3,0 ml του αραιωμένου αυτού διαλύματος παλμιτικής βιταμίνης Α μεταφέρονται με σιφώνιο σε ογκομετρική φιάλη των 25 ml και συμπληρώνονται μέχρι τη χαραγή με 2-προπανόλη (3.8). Η ονομαστική συγκέντρωση αυτού του διαλύματος είναι 6,72 IU βιταμίνης Α ανά ml. Μετριέται το UV φάσμα αυτού του διαλύματος έναντι 2-προπανόλης (3.8) στο φασματοφωτόμετρο (4.6) μεταξύ 300 nm και 400 nm. Το μέγιστο της απόσβεσης πρέπει να είναι μεταξύ 325 nm και 327 nm.
Υπολογισμός της συγκέντρωσης βιταμίνης Α:
IU βιταμίνη A/ml = E326 × 19,0
( για παλμιτική βιταμίνη A=957 στα 326nm σε 2-προπανόλη)
για παλμιτική βιταμίνη A=957 στα 326nm σε 2-προπανόλη)
5.6.3.3.
Σε ογκομετρική φιάλη των 50 ml (4.2.2) μεταφέρονται με σιφώνιο 3,0 ml του παρασκευασμένου σύμφωνα με την παράγραφο 5.6.1 μη αραιωμένου πρότυπου διαλύματος εργασίας βιταμίνης Α (3.12.1) και συμπληρώνονται μέχρι τη χαραγή με 2-προπανόλη (3.8). 5,0 ml του εν λόγω διαλύματος μεταφέρονται με σιφώνιο σε ογκομετρική φιάλη των 25 ml και συμπληρώνονται μέχρι τη χαραγή με 2-προπανόλη (3.8). Η ονομαστική συγκέντρωση αυτού του διαλύματος είναι 6,72 IU βιταμίνης Α ανά ml. Μετριέται το UV φάσμα αυτού του διαλύματος έναντι 2-προπανόλης (3.8) στο φασματοφωτόμετρο (4.6) μεταξύ 300 nm και 400 nm. Το μέγιστο της απόσβεσης πρέπει να είναι μεταξύ 325 nm και 327 nm.
Υπολογισμός της συγκέντρωσης βιταμίνης Α:
IU βιταμίνη A/ml = E325 × 18,3
( για αλκοολική βιταμίνη A = 1 821 στα 325nm σε 2-προπανόλη)
για αλκοολική βιταμίνη A = 1 821 στα 325nm σε 2-προπανόλη)
6. Υπολογισμός των αποτελεσμάτων
Από το μέσο ύψος (εμβαδόν) των κορυφών της βιταμίνης Α του δείγματος προσδιορίζεται η συγκέντρωση του διαλύματος σε IU/ml με αναφορά στην καμπύλη βαθμονόμησης (5.6.2).
Η συγκέντρωση της βιταμίνης Α σε IU/kg του δείγματος δίνεται από τον ακόλουθο τύπο:
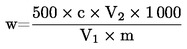 [UI/kg]
[UI/kg]
στον οποίο:
|
c |
= |
συγκέντρωση βιταμίνης Α στο δείγμα (5.4) σε IU/ml |
|
V1 |
= |
όγκος του δείγματος (5.4) σε ml |
|
V2 |
= |
όγκος της ποσότητας που λαμβάνεται στην παράγραφο 5.4 σε ml |
|
m |
= |
βάρος της προς δοκιμή ποσότητας σε g |
7. Παρατηρήσεις
|
7.1. |
Σε δείγματα με χαμηλή συγκέντρωση βιταμίνης Α, για τον προσδιορισμό με HPLC ενδέχεται να προσφέρεται περισσότερο η συνένωση των πετρελαϊκών εκχυλισμάτων δύο σαπωνοποιήσεων (ζυγισθείσα ποσότητα: 25 g) σε ένα δείγμα. |
|
7.2. |
Το βάρος του δείγματος που λαμβάνεται για την ανάλυση δεν πρέπει να περιέχει περισσότερο από 2 g λίπους. |
|
7.3. |
Εάν δεν επέλθει διαχωρισμός φάσεων, προστίθενται 10 ml περίπου αιθανόλης (3.1) για διάσπαση του γαλακτώματος. |
|
7.4. |
Με μουρουνέλαιο και άλλα καθαρά λίπη, ο χρόνος σαπωνοποίησης πρέπει να παρατείνεται στα 45-60 λεπτά. |
|
7.5. |
Αντί ΒΗΤ, μπορεί να χρησιμοποιηθεί υδροκινόνη. |
|
7.6. |
Χρησιμοποιώντας στήλη κανονικής φάσης ο διαχωρισμός των ισομερών ρετινόλης είναι εφικτός. Σε αυτή την περίπτωση όμως πρέπει να αθροίζονται τα ύψη (εμβαδά) όλων των κορυφών των ισομερών cis και trans για τους υπολογισμούς. |
|
7.7. |
Αντί διαλύματος ασκορβικού νατρίου, μπορούν να χρησιμοποιηθούν περίπου 150 mg ασκορβικού οξέος. |
|
7.8. |
Αντί διαλύματος θειούχου νατρίου, μπορούν να χρησιμοποιηθούν περίπου 50 mg EDTA. |
|
7.9. |
Σε περιπτώσεις ανάλυσης της βιταμίνης A σε υποκατάστατα γάλακτος, πρέπει να αποδίδεται ιδιαίτερη προσοχή στις εξής διεργασίες:
Προκειμένου να ελεγχθεί ότι η εφαρμοζόμενη μέθοδος ανάλυσης αποδίδει αξιόπιστα αποτελέσματα στο συγκεκριμένο πλαίσιο (υποκατάστατο γάλακτος), πρέπει να εφαρμοστεί δοκιμή ανάκτησης σε ένα πρόσθετο δείγμα δοκιμής. Αν το ποσοστό ανάκτησης είναι μικρότερο από 80 %, το αποτέλεσμα της ανάλυσης πρέπει να υποβληθεί σε διόρθωση για ανάκτηση. |
8. Επαναληψιμότητα
Η διαφορά μεταξύ των αποτελεσμάτων δύο παράλληλα πραγματοποιούμενων προσδιορισμών στο ίδιο δείγμα δεν πρέπει να υπερβαίνει το 15 % σε σχέση με το υψηλότερο αποτέλεσμα.
9. Αποτελέσματα διεργαστηριακής μελέτης (1)
|
|
Πρόμειγμα |
Πρόμειγμα ζωοτροφής |
Συμπύκνωμα ανόργανων υλικών |
Πρωτεϊνούχος ζωοτροφή |
Ζωοτροφή για χοιρίδια |
|
L |
13 |
12 |
13 |
12 |
13 |
|
n |
48 |
45 |
47 |
46 |
49 |
|
Μέσος όρος [IU/kg] |
17,02 × 106 |
1,21 × 106 |
537 100 |
151 800 |
18 070 |
|
Sr [IU/kg] |
0,51 × 106 |
0,039 × 106 |
22 080 |
12 280 |
682 |
|
r [IU/kg] |
1,43 × 106 |
0,109 × 106 |
61 824 |
34 384 |
1 910 |
|
CVr [%] |
3,0 |
3,5 |
4,1 |
8,1 |
3,8 |
|
SR [IU/kg] |
1,36 × 106 |
0,069 × 106 |
46 300 |
23 060 |
3 614 |
|
R [IU/kg] |
3,81 × 106 |
0,193 × 106 |
129 640 |
64 568 |
10 119 |
|
CVR [%] |
8,0 |
6,2 |
8,6 |
15 |
20 |
|
L |
= |
αριθμός εργαστηρίων |
|
n |
= |
αριθμός μεμονωμένων τιμών |
|
Sr |
= |
τυπική απόκλιση επαναληψιμότητας |
|
SR |
= |
τυπική απόκλιση αναπαραγωγιμότητας |
|
r |
= |
επαναληψιμότητα |
|
R |
= |
αναπαραγωγιμότητα |
|
CVr |
= |
συντελεστής διακύμανσης επαναληψιμότητας |
|
CVR |
= |
συντελεστής διακύμανσης αναπαραγωγιμότητας |
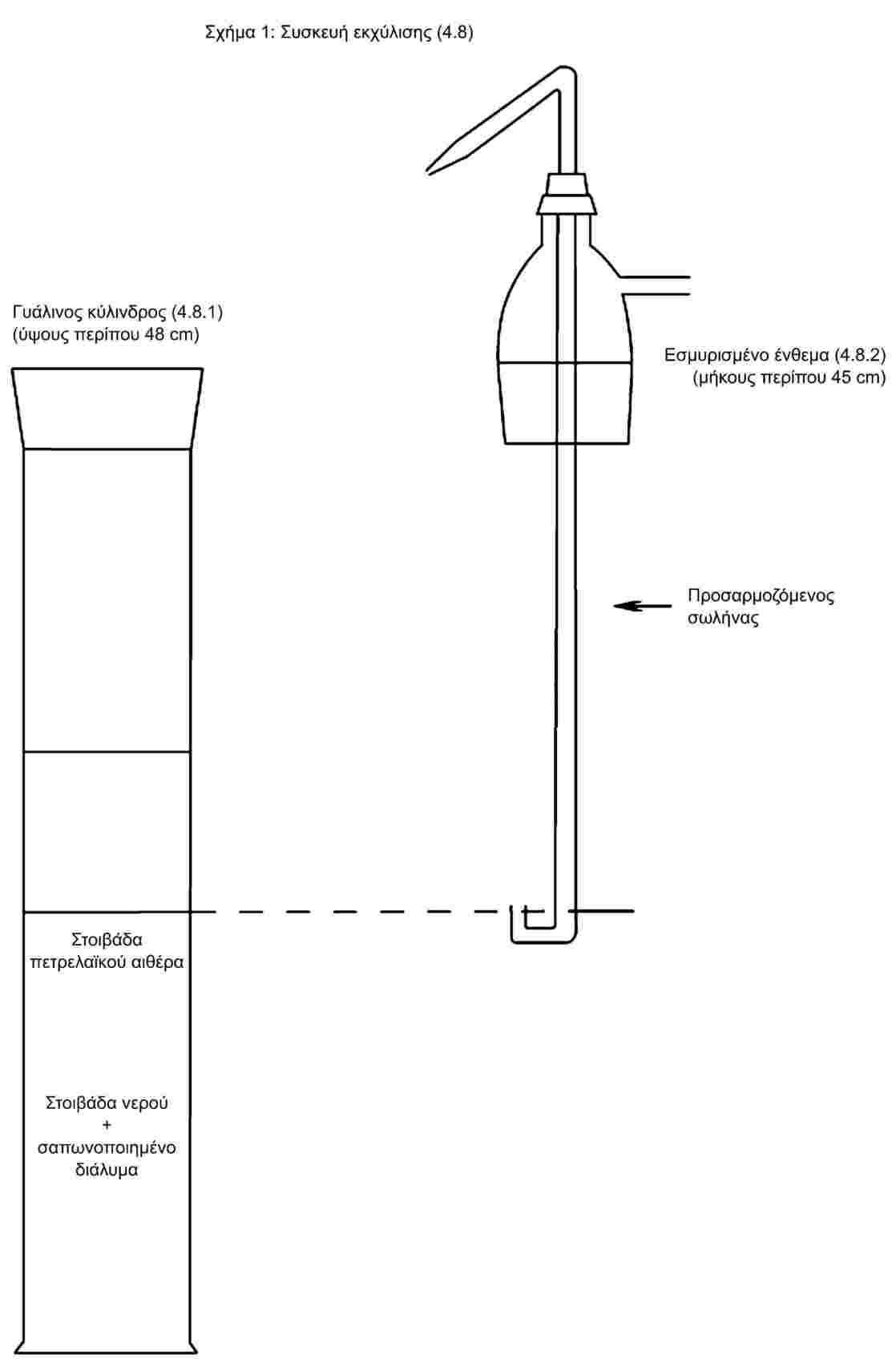
B. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΗΣ ΒΙΤΑΜΙΝΗΣ Ε
1. Σκοπός και πεδίο εφαρμογής
Η παρούσα μέθοδος επιτρέπει τον προσδιορισμό της βιταμίνης Ε σε ζωοτροφές και προμείγματα. Η περιεκτικότητα σε βιταμίνη Ε εκφράζεται σε mg οξικής DL-α-τοκοφερόλης ανά kg. 1 mg οξικής DL-α-τοκοφερόλης αντιστοιχεί σε 0,91 mg DL-α-τοκοφερόλης (βιταμίνη E).
Το όριο προσδιορισμού είναι 2 mg βιταμίνης E/kg. Αυτό το όριο προσδιορισμού είναι επιτεύξιμο μόνο με ανιχνευτή φθορισμού. Με ανιχνευτή UV, το όριο προσδιορισμού είναι 10 mg/kg.
2. Αρχή
Το δείγμα υδρολύεται με αιθανολικό διάλυμα υδροξειδίου του καλίου και η βιταμίνη Ε εκχυλίζεται με πετρελαϊκό αιθέρα. Ο διαλύτης απομακρύνεται με εξάτμιση και το υπόλειμμα διαλύεται σε μεθανόλη και, εφόσον είναι αναγκαίο, αραιώνεται μέχρι την απαιτούμενη συγκέντρωση. Η συγκέντρωση της βιταμίνης Ε προσδιορίζεται με υγρή χρωματογραφία ανάστροφης φάσης υψηλής απόδοσης (RP-HPLC) χρησιμοποιώντας ανιχνευτή UV ή φθορισμού.
3. Αντιδραστήρια
|
3.1. |
Αιθανόλη, σ = 96 % |
|
3.2. |
Πετρελαϊκός αιθέρας, περιοχή ζέσεως 40 oC-60 oC |
|
3.3. |
Μεθανόλη |
|
3.4. |
Διάλυμα υδροξειδίου του καλίου, c = 50 g/100 ml |
|
3.5. |
Διάλυμα ασκορβικού νατρίου, c = 10 g/100 ml (βλέπε παρατήρηση 7.7) |
|
3.6. |
Θειούχο νάτριο, Na2S· × H2O (x = 7-9) |
|
3.6.1. |
Διάλυμα θειούχου νατρίου, c = 0,5 mol/l σε γλυκερόλη, β = 120 g/l (για x = 9) (βλέπε παρατήρηση 7.8) |
|
3.7. |
Διάλυμα φαινολοφθαλεΐνης c = 2 g/100 ml σε αιθανόλη (3.1) |
|
3.8. |
Κινητή φάση για HPLC: μείγμα μεθανόλης (3.3) και νερού, π.χ. 980 + 20 (v + v). Η ακριβής σχέση καθορίζεται από τα χαρακτηριστικά της χρησιμοποιούμενης στήλης. |
|
3.9. |
Άζωτο, απαλλαγμένο οξυγόνου |
|
3.10. |
Οξική DL-α-τοκοφερεόλη, εξαιρετικά καθαρή, πιστοποιημένης δραστικότητας |
|
3.10.1. |
Αρχικό διάλυμα οξικής DL-α-τοκοφερύλης: Σε ογκομετρική φιάλη των 100 ml ζυγίζονται με προσέγγιση 0,1 mg, 100 mg οξικής DL-α-τοκοφερόλης (3.10). Διαλύονται σε αιθανόλη (3.1) και το διάλυμα συμπληρώνεται μέχρι τη χαραγή με τον ίδιο διαλύτη. 1 ml αυτού του διαλύματος περιέχει 1 mg οξικής DL-α-τοκοφερόλης (για τον έλεγχο UV βλέπε παράγραφο 5.6.1.3, για τη σταθεροποίηση βλέπε παρατήρηση 7.4). |
|
3.11. |
DL-α-τοκοφερόλη, εξαιρετικής καθαρότητας, πιστοποιημένης δραστικότητας |
|
3.11.1. |
Αρχικό διάλυμα DL-α-τοκοφερόλης: Σε ογκομετρική φιάλη των 100 ml ζυγίζονται με προσέγγιση 0,1 mg, 100 mg DL-α-τοκοφερόλης (3.11). Διαλύονται σε αιθανόλη (3.1) και το διάλυμα συμπληρώνεται μέχρι τη χαραγή με τον ίδιο διαλύτη. 1 ml αυτού του διαλύματος περιέχει 1 mg DL-α-τοκοφερόλης (για τον έλεγχο UV βλέπε παράγραφο 5.6.2.3, για τη σταθεροποίηση βλέπε παρατήρηση 7.4). |
|
3.12. |
2,6 δι-tert-βουτυλο-4-μεθυλοφαινόλη (BHT) (βλέπε παρατήρηση 7.5). |
4. Όργανα
|
4.1. |
Περιστρεφόμενος εξατμιστήρας υμενίου |
|
4.2. |
Αδιαφανή γυάλινα σκεύη |
|
4.2.1. |
Κωνικές ή σφαιρικές φιάλες με επίπεδο πυθμένα των 500 ml, με εσμυρισμένη υποδοχή |
|
4.2.2. |
Ογκομετρικές φιάλες με εσμυρισμένα πώματα των 10, 25, 100 και 500 ml |
|
4.2.3. |
Κωνικές διαχωριστικές χοάνες των 1 000 ml, με εσμυρισμένα πώματα |
|
4.2.4. |
Απιοειδείς φιάλες των 250 ml, με εσμυρισμένες υποδοχές |
|
4.3. |
Συμπυκνωτής Αllihn, με χιτώνιο μήκους 300 mm, με εσμυρισμένη ένωση, με προσαρμογέα για σωλήνα παροχής αερίου |
|
4.4. |
Πτυχωτός ηθμός για διαχωρισμό φάσεων, διαμέτρου 185 mm (π.χ. Schleicher & Schuell 597 HY 1/2) |
|
4.5. |
Εξοπλισμός HPLC με σύστημα έγχυσης |
|
4.5.1. |
Στήλη υγρής χρωματογραφίας, 250 mm × 4 mm, C18, με πλήρωση 5 ή 10 μm, ή ισοδύναμη |
|
4.5.2. |
Ανιχνευτής UV ή φθορισμού, με μεταβαλλόμενο μήκος κύματος |
|
4.6. |
Φασματοφωτόμετρο με κυψελίδες χαλαζία των 10 mm |
|
4.7. |
Υδρόλουτρο με μαγνητικό αναδευτήρα |
|
4.8. |
Συσκευή εκχύλισης (βλέπε σχήμα 1) αποτελούμενη από: |
|
4.8.1. |
Γυάλινο κύλινδρο χωρητικότητας 1 l με εσμυρισμένο λαιμό και πώμα |
|
4.8.2. |
Εσμυρισμένο γυάλινο ένθεμα εφοδιασμένο με πλευρικό βραχίονα και προσαρμόσιμο σωλήνα διερχόμενο από το κέντρο. Το κάτω άκρο του προσαρμόσιμου σωλήνα πρέπει να έχει σχήμα U ενώ στο άλλο άκρο πρέπει να υπάρχει ακροφύσιο έτσι ώστε η πάνω υγρή στιβάδα στον κύλινδρο να μπορεί να μεταφέρεται σε διαχωριστική χοάνη. |
5. Διαδικασία
|
Σημείωση: |
Η βιταμίνη Ε είναι ευαίσθητη στο υπεριώδες φως και στην οξείδωση. Όλες οι εργασίες πρέπει να γίνονται απουσία φωτός (χρησιμοποιώντας αδιαφανή γυάλινα σκεύη ή σκεύη προστατευόμενα με φύλλο αλουμινίου) και οξυγόνου (πλήρωση με άζωτο). Κατά τη διάρκεια της εκχύλισης ο αέρας πρέπει να αντικαθίσταται από άζωτο (αποφεύγεται η υπερβολική πίεση χαλαρώνοντας από καιρού σε καιρό το πώμα). |
5.1. Παρασκευή του δείγματος
Το δείγμα αλέθεται έτσι ώστε να διέρχεται από κόσκινο με διάμετρο οπών 1 mm, προσέχοντας να μην παράγεται θερμότητα. Η άλεση πρέπει να γίνεται αμέσως πριν από τη ζύγιση και τη σαπωνοποίηση, αλλιώς μπορεί να υπάρξουν απώλειες βιταμίνης E.
5.2. Σαπωνοποίηση
Ανάλογα με την περιεκτικότητα σε βιταμίνη Ε, ζυγίζονται σε κωνική ή σφαιρική φιάλη με επίπεδο πυθμένα των 500 ml (4.2.1), 2 g έως 25 g του δείγματος με προσέγγιση 0,01 g. Προστίθενται διαδοχικά υπό ανακίνηση 130 ml αιθανόλης (3.1), περίπου 100 mg ΒΗΤ (3.12), 2 ml διαλύματος ασκορβικού νατρίου (3.5) και 2 ml διαλύματος θειούχου νατρίου (3.6). Στη φιάλη προσαρμόζεται συμπυκνωτήρας (4.3) και η φιάλη βυθίζεται σε υδρόλουτρο με μαγνητικό αναδευτήρα (4.7). Θερμαίνεται μέχρι βρασμού και το διάλυμα αφήνεται υπό αναρροή για 5 λεπτά. Κατόπιν προστίθενται 25 ml διαλύματος υδροξειδίου του καλίου (3.4) μέσω του συμπυκνωτήρα (4.3) και το διάλυμα αφήνεται υπό αναρροή για 25 λεπτά ακόμη, με ανάδευση υπό ελαφρύ ρεύμα αζώτου. Ο συμπυκνωτήρας στη συνέχεια εκπλένεται με 20 ml νερό περίπου και το περιεχόμενο της φιάλης ψύχεται σε θερμοκρασία δωματίου.
5.3. Εκχύλιση
Το σαπωνοποιημένο διάλυμα μεταγγίζεται ποσοτικά, εκπλένοντάς το με νερό συνολικού όγκου 250 ml, σε διαχωριστική χοάνη των 1 000 ml (4.2.3) ή σε συσκευή εκχύλισης (4.8). Η φιάλη σαπωνοποίησης εκπλένεται διαδοχικά με 25 ml αιθανόλης (3.1) και 100 ml πετρελαϊκού αιθέρα (3.2) και τα εκπλύματα μεταφέρονται στη διαχωριστική χοάνη ή στη συσκευή εκχύλισης. Η αναλογία νερού-αιθανόλης στα συνενωμένα διαλύματα πρέπει να είναι περίπου 2:1. Το σύνολο ανακινείται έντονα επί 2 λεπτά και αφήνεται να ηρεμήσει για άλλα 2 λεπτά.
5.3.1.
Μετά το διαχωρισμό των στιβάδων (βλέπε παρατήρηση στην παράγραφο 7.3), η στιβάδα του πετρελαϊκού αιθέρα μεταφέρεται σε άλλη διαχωριστική χοάνη (4.2.3). Η εκχύλιση αυτή επαναλαμβάνεται δύο φορές, με 100 ml πετρελαϊκού αιθέρα (3.2) και δύο φορές με 50 ml πετρελαϊκού αιθέρα (3.2).
Τα συνενωμένα εκχυλίσματα πλένονται στη διαχωριστική χοάνη δύο φορές με ήπια περιδίνιση (για την αποφυγή σχηματισμού γαλακτωμάτων) με 100 ml νερό κάθε φορά και κατόπιν με επανειλημμένη ανακίνηση με περαιτέρω ποσότητες νερού των 100 ml μέχρις ότου το νερό να παραμένει άχρωμο σε προσθήκη διαλύματος φαινολοφθαλεΐνης (3.7) (τέσσερις φορές πλύσιμο συνήθως αρκεί). Το πλυμένο εκχύλισμα διηθείται μέσω ξηρού πτυχωτού ηθμού για διαχωρισμό φάσεων (4.4) για την απομάκρυνση τυχόν εναιωρούμενου νερού σε ογκομετρική φιάλη των 500 ml (4.2.2). Η διαχωριστική χοάνη και ο ηθμός εκπλύνονται με 50 ml πετρελαϊκού αιθέρα (3.2), το διάλυμα συμπληρώνεται μέχρι τη χαραγή με πετρελαϊκό αιθέρα (3.2) και αναμειγνύεται καλά.
5.3.2.
Μετά το διαχωρισμό των στιβάδων (βλέπε παρατήρηση 7.3), το πώμα του γυάλινου κυλίνδρου (4.8.1) αντικαθίσταται με το εσμυρισμένο ένθεμα (4.8.2) και το σχήματος U κάτω άκρο του προσαρμοζόμενου σωλήνα φέρεται σε τέτοια θέση ώστε να είναι ίσα-ίσα πάνω από το επίπεδο της διαχωριστικής επιφάνειας. Με εφαρμογή πίεσης από γραμμή αζώτου στον πλευρικό βραχίονα, η πάνω στιβάδα του πετρελαϊκού αιθέρα μεταφέρεται σε διαχωριστική χοάνη των 1 000 ml (4.2.3). Στον γυάλινο κύλινδρο προστίθενται 100 ml πετρελαϊκού αιθέρα (3.2), ο κύλινδρος πωματίζεται και ανακινείται καλά. Οι στιβάδες αφήνονται να διαχωριστούν και η πάνω στιβάδα μεταφέρεται όπως πριν στη διαχωριστική χοάνη. Η διαδικασία εκχύλισης επαναλαμβάνεται με 100 ml ακόμη πετρελαϊκού αιθέρα (3.2), στη συνέχεια δύο φορές με 50 ml κάθε φορά πετρελαϊκού αιθέρα (3.2) και οι στιβάδες του πετρελαϊκού αιθέρα προστίθενται στη διαχωριστική χοάνη.
Τα συνενωμένα πετρελαϊκά εκχυλίσματα πλένονται όπως περιγράφεται στην παράγραφο 5.3.1 και ακολουθείται η περιγραφόμενη εκεί διαδικασία.
5.4. Παρασκευή του δείγματος για την HPLC
Σε απιοειδή φιάλη 250 ml (4.2.4) μεταφέρεται με πιπέτα (σιφώνιο) κατάλληλη ποσότητα του διαλύματος πετρελαϊκού αιθέρα (από την παράγραφο 5.3.1 ή 5.3.2). Ο διαλύτης εξατμίζεται σχεδόν μέχρι ξηρού σε περιστροφικό εξατμιστήρα (4.1) με ελαττωμένη πίεση και θερμοκρασία λουτρού μη υπερβαίνουσα τους 40 oC. Αποκαθίσταται η ατμοσφαιρική πίεση με εισαγωγή αζώτου (3.9) και η φιάλη απομακρύνεται από τον περιστροφικό εξατμιστήρα. Ο παραμένων διαλύτης απομακρύνεται με ρεύμα αζώτου (3.9) και το υπόλειμμα διαλύεται αμέσως σε γνωστό όγκο (10-100 ml) μεθανόλης (3.3) (η συγκέντρωση της DL-α-τοκοφερόλης πρέπει να είναι της τάξεως των 5 IU/ml έως 30 μg/ml).
5.5. Προσδιορισμός με HPLC
Η βιταμίνη Ε διαχωρίζεται σε στήλη ανάστροφης φάσης C18 (4.5.1) και μετράται η συγκέντρωση με τη βοήθεια ανιχνευτή φθορισμού (διέγερση: 295 nm, εκπομπή: 330 nm) ή UV (292 nm) (4.5.2).
Εγχύεται κατάλληλη ποσότητα (π.χ. 20 μl) του μεθανολικού διαλύματος που λαμβάνεται στην παράγραφο 5.4 και εκλούζεται με την κινητή φάση (3.8). Υπολογίζεται το μέσο ύψος κορυφής (εμβαδόν) ορισμένων εγχύσεων του ίδιου δείγματος και τα μέσα ύψη κορυφών (εμβαδά) ορισμένων εγχύσεων των διαλυμάτων βαθμονόμησης (5.6.2).
Για την HPLC πρέπει να χρησιμοποιούνται οι κατωτέρω συνθήκες. Μπορούν να χρησιμοποιηθούν όμως και άλλες συνθήκες υπό την προϋπόθεση ότι παρέχουν ισοδύναμα αποτελέσματα.
|
Υγρή χρωματογραφική στήλη (4.5.1): |
250 mm × 4 mm, C18, 5 ή 10 μm πλήρωση ή ισοδύναμη |
|
Κινητή φάση (3.8): |
Μείγμα μεθανόλης (3.3) και νερού π.χ. 980 + 20 (v + v). |
|
Ρυθμός ροής: |
1-2 ml/min |
|
Ανιχνευτής (4.5.2) |
Ανιχνευτής φθορισμού (διέγερση: 295 nm/εκπομπή: 330 nm) ή ανιχνευτής UV (292 nm) |
5.6. Βαθμονόμηση (οξική DL-α-τοκοφερόλη ή DL-α-τοκοφερόλη)
5.6.1.
5.6.1.1.
Σε κωνική ή σφαιρική φιάλη με επίπεδο πυθμένα των 500 ml (4.2.1) μεταφέρονται με σιφώνιο 25 ml του αρχικού διαλύματος οξικής DL-ατοκοφερόλης (3.10.1) και υδρολύεται όπως περιγράφεται στην παράγραφο 5.2. Ακολουθεί εκχύλιση με πετρελαϊκό αιθέρα (3.2) σύμφωνα με την παράγραφο 5.3 και συμπληρώνουμε μέχρι τη χαραγή των 500 ml με πετρελαϊκό αιθέρα. 25 ml του εκχυλίσματος αυτού εξατμίζονται στον περιστροφικό εξατμιστήρα (βλέπε παράγραφο 5.4) σχεδόν μέχρι ξηρού, ο εναπομένων διαλύτης απομακρύνεται με ρεύμα αζώτου (3.9) και το υπόλειμμα αναδιαλύεται σε 25,0 ml μεθανόλης (3.3). Η ονομαστική συγκέντρωση αυτού του διαλύματος είναι 45,5 μg οξικής DL-α-τοκοφερόλης ανά ml. Το πρότυπο διάλυμα εργασίας πρέπει να παρασκευάζεται λίγο πριν από τη χρήση του.
5.6.1.2.
1,0, 2,0, 4,0 και 10,0 ml του πρότυπου διαλύματος εργασίας μεταφέρονται σε μια σειρά ογκομετρικών φιαλών των 20 ml, συμπληρώνονται μέχρι τη χαραγή με μεθανόλη (3.3) και αναμειγνύονται. Οι ονομαστικές περιεκτικότητες των διαλυμάτων αυτών είναι 2,5, 5,0, 10,0 και 25,0 μg/ml σε οξική DL-α-τοκοφερόλη, δηλαδή 2,28, 4,55, 9,10 και 22,8 μg/ml DLα-τοκοφερόλη.
20 μl κάθε διαλύματος βαθμονόμησης εγχύονται κατ’ επανάληψη και προσδιορίζονται τα μέσα ύψη (εμβαδά) των κορυφών. Χρησιμοποιώντας τα μέσα ύψη (εμβαδά) των κορυφών, χαράσσεται καμπύλη βαθμονόμησης.
5.6.1.3.
5,0 ml του αρχικού διαλύματος οξικής DL-α-τοκοφερόλης (3.10.1) αραιώνονται στα 25,0 ml με αιθανόλη και μετράται το υπεριώδες φάσμα του διαλύματος αυτού σε σχέση με την αιθανόλη (3.1) στο φασματοφωτόμετρο (4.6) μεταξύ 250 nm και 320 nm.
Το μέγιστο της απορρόφησης πρέπει να είναι στα 284 nm:
 = 43,6 στα 284 nm σε αιθανόλη
= 43,6 στα 284 nm σε αιθανόλη
Στην αραίωση αυτή πρέπει να ληφθεί τιμή απόσβεσης 0,84 έως 0,88.
5.6.2.
5.6.2.1.
Σε ογκομετρική φιάλη 50 ml μεταφέρονται με σιφώνιο 2 ml του αρχικού διαλύματος DL-α-τοκοφερόλης (3.11.1), διαλύονται σε μεθανόλη (3.3) και το διάλυμα συμπληρώνεται μέχρι τη χαραγή με μεθανόλη. Η ονομαστική συγκέντρωση αυτού του διαλύματος είναι 40 μg DL-α-τοκοφερόλης ανά ml, ισοδύναμη με 44,0 μg οξικής DL-α-τοκοφερόλης ανά ml. Το πρότυπο διάλυμα εργασίας πρέπει να παρασκευάζεται λίγο πριν από τη χρήση του.
5.6.2.2.
1,0, 2,0, 4,0 και 10,0 ml του πρότυπου διαλύματος εργασίας μεταφέρονται σε μια σειρά ογκομετρικών φιαλών των 20 ml, συμπληρώνονται μέχρι τη χαραγή με μεθανόλη (3.3) και αναμειγνύονται. Οι ονομαστικές περιεκτικότητες των διαλυμάτων αυτών είναι 2,0, 4,0, 8,0 και 20,0 μg/ml σε DL-α-τοκοφερόλη, δηλαδή 2,20, 4,40, 8,79 και 22,0 μg/ml σε οξική DL-α-τοκοφερόλη.
20 μl κάθε διαλύματος βαθμονόμησης εγχύονται κατ’ επανάληψη και προσδιορίζονται τα μέσα ύψη (εμβαδά) των κορυφών. Χρησιμοποιώντας τα μέσα ύψη (εμβαδά) των κορυφών, χαράσσεται καμπύλη βαθμονόμησης.
5.6.2.3.
2,0 ml του αρχικού διαλύματος DL-α-τοκοφερόλης (3.11.1) αραιώνονται στα 25,0 ml με αιθανόλη και μετράται το υπεριώδες φάσμα του διαλύματος αυτού σε σχέση με αιθανόλη (3.1) στο φασματοφωτόμετρο (4.6) μεταξύ 250 nm και 320 nm. Το μέγιστο της απορρόφησης πρέπει να είναι στα 292 nm:
 = 75,8 στα 292 nm σε αιθανόλη
= 75,8 στα 292 nm σε αιθανόλη
Στην αραίωση αυτή πρέπει να λαμβάνεται τιμή απόσβεσης 0,6.
6. Υπολογισμός των αποτελεσμάτων
Από το μέσο ύψος (εμβαδόν) των κορυφών της βιταμίνης Ε του δείγματος προσδιορίζεται η συγκέντρωση του δείγματος σε μg/ml (ως οξική DL-α-τοκοφερόλη) με αναφορά στην καμπύλη βαθμονόμησης (5.6.1.2 ή 5.6.2.2).
Η συγκέντρωση w της βιταμίνης Ε σε mg/kg του δείγματος δίνεται από τον ακόλουθο τύπο:
 [mg/kg]
[mg/kg]
στον οποίο:
|
c |
= |
συγκέντρωση βιταμίνης Ε (με τη μορφή οξικής α-τοκοφερόλης) στο δείγμα (5.4) σε μg/ml |
|
V1 |
= |
όγκος του δείγματος (5.4) σε ml |
|
V2 |
= |
όγκος της ποσότητας που λαμβάνεται στην παράγραφο 5.4 σε ml |
|
m |
= |
βάρος της προς δοκιμή ποσότητας σε g |
7. Παρατηρήσεις
|
7.1. |
Σε δείγματα με χαμηλή συγκέντρωση βιταμίνης Ε, για τον προσδιορισμό με HPLC ενδέχεται να προσφέρεται περισσότερο η συνένωση των πετρελαϊκών εκχυλισμάτων δύο σαπωνοποιήσεων (ζυγισθείσα ποσότητα: 25 g) σε ένα δείγμα. |
|
7.2. |
Το βάρος του δείγματος που λαμβάνεται για την ανάλυση δεν πρέπει να περιέχει περισσότερο από 2 g λίπους. |
|
7.3. |
Εάν δεν επέλθει διαχωρισμός φάσεων, προστίθενται 10 ml περίπου αιθανόλης (3.1) για διάσπαση του γαλακτώματος. |
|
7.4. |
Μετά την φασματοφωτομετρική μέτρηση του διαλύματος της οξικής DL-α-τοκοφερόλης ή DL-α-τοκοφερόλης σύμφωνα με τις παραγράφους 5.6.1.3 ή 5.6.2.3 αντιστοίχως, προστίθενται περίπου 10 mg ΒΗΤ (3.12) στο διάλυμα (3.10.1 ή 3.10.2) και το διάλυμα διατηρείται σε ψυγείο (μέγιστος χρόνος αποθήκευσης τέσσερις εβδομάδες). |
|
7.5. |
Αντί ΒΗΤ, μπορεί να χρησιμοποιηθεί υδροκινόνη. |
|
7.6. |
Χρησιμοποιώντας στήλη κανονικής φάσης είναι εφικτός ο διαχωρισμός μεταξύ α-, β-, γ- και δ-τοκοφερόλης. |
|
7.7. |
Αντί διαλύματος ασκορβικού νατρίου, μπορούν να χρησιμοποιηθούν περίπου 150 mg ασκορβικού οξέος. |
|
7.8. |
Αντί διαλύματος θειούχου νατρίου, μπορούν να χρησιμοποιηθούν περίπου 50 mg EDTA. |
|
7.9. |
Η οξική βιταμίνη E υδρολύεται πολύ γρήγορα υπό αλκαλικές συνθήκες και επομένως είναι πολύ ευαίσθητη στην οξείδωση, ιδιαίτερα παρουσία ιχνοστοιχείων όπως ο σίδηρος ή ο χαλκός. Στην περίπτωση προσδιορισμού βιταμίνης E σε προμείγματα, σε περιεκτικότητα μεγαλύτερη από 5 000 mg/kg, μπορεί να προκύψει αποδόμηση της βιταμίνης E. Συνεπώς, για επιβεβαίωση, συνιστάται μια μέθοδος HPLC η οποία περιλαμβάνει ενζυματική χώνευση της σχηματιζόμενης βιταμίνης E χωρίς το βήμα της αλκαλικής σαπωνοποίησης. |
8. Επαναληψιμότητα
Η διαφορά μεταξύ των αποτελεσμάτων δύο παράλληλα πραγματοποιούμενων προσδιορισμών στο ίδιο δείγμα δεν πρέπει να υπερβαίνει το 15 % σε σχέση με το υψηλότερο αποτέλεσμα.
9. Αποτελέσματα διεργαστηριακής μελέτης (2)
|
|
Πρόμειγμα |
Πρόμειγμα ζωοτροφής |
Συμπύκνωμα ανόργανων υλικών |
Πρωτεϊνούχος ζωοτροφή |
Ζωοτροφή για χοιρίδια |
|
L |
12 |
12 |
12 |
12 |
12 |
|
n |
48 |
48 |
48 |
48 |
48 |
|
Μέσος όρος [mg/kg] |
17 380 |
1 187 |
926 |
315 |
61,3 |
|
Sr [mg/kg] |
384 |
45,3 |
25,2 |
13,0 |
2,3 |
|
r [mg/kg] |
1 075 |
126,8 |
70,6 |
36,4 |
6,4 |
|
CVr [%] |
2,2 |
3,8 |
2,7 |
4,1 |
3,8 |
|
SR mg/kg] |
830 |
65,0 |
55,5 |
18,9 |
7,8 |
|
R [mg/kg] |
2 324 |
182,0 |
155,4 |
52,9 |
21,8 |
|
CVR [%] |
4,8 |
5,5 |
6,0 |
6,0 |
12,7 |
|
L |
= |
αριθμός εργαστηρίων |
|
n |
= |
αριθμός μεμονωμένων τιμών |
|
sr |
= |
τυπική απόκλιση επαναληψιμότητας |
|
sR |
= |
τυπική απόκλιση αναπαραγωγιμότητας |
|
r |
= |
επαναληψιμότητα |
|
R |
= |
αναπαραγωγιμότητα |
|
CVr |
= |
συντελεστής διακύμανσης επαναληψιμότητας |
|
CVR |
= |
συντελεστής διακύμανσης αναπαραγωγιμότητας. |

Γ. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΩΝ ΙΧΝΟΣΤΟΙΧΕΙΩΝ ΣΙΔΗΡΟΥ, ΧΑΛΚΟΥ, ΜΑΓΓΑΝΙΟΥ ΚΑΙ ΨΕΥΔΑΡΓΥΡΟΥ
1. Σκοπός και πεδίο εφαρμογής
Η μέθοδος επιτρέπει τον προσδιορισμό των ιχνοστοιχείων σιδήρου, χαλκού, μαγγανίου και ψευδαργύρου στις ζωοτροφές. Τα όρια προσδιορισμού είναι:
|
— |
σίδηρος (Fe): 20 mg/kg |
|
— |
χαλκός (Cu): 10 mg/kg |
|
— |
μαγγάνιο (Mn): 20 mg/kg |
|
— |
ψευδάργυρος (Zn): 20 mg/kg |
2. Βασική αρχή
Το δείγμα διαλύεται σε υδροχλωρικό οξύ μετά την καταστροφή της οργανικής ύλης, αν υπάρχει. Τα στοιχεία σίδηρος, χαλκός, μαγγάνιο και ψευδάργυρος προσδιορίζονται, μετά από κατάλληλη αραίωση, με φασματοσκοπία ατομικής απορρόφησης.
3. Αντιδραστήρια
Εισαγωγικές παρατηρήσεις
Για την παρασκευή των αντιδραστηρίων και των αναλυτικών διαλυμάτων χρησιμοποιείται νερό απαλλαγμένο από τα κατιόντα που πρόκειται να προσδιορισθούν, που λαμβάνεται είτε με διπλή απόσταξη νερού σε αποστακτήρα από βοριοπυριτική ύαλο ή από χαλαζία είτε με διπλή επεξεργασία με ρητίνες ανταλλαγής ιόντων.
Τα αντιδραστήρια πρέπει να είναι τουλάχιστον αναλυτικής ποιότητος. Η καθαρότητα από τα στοιχεία που πρόκειται να προσδιορισθούν πρέπει να ελέγχεται με τυφλό πείραμα. Αν απαιτείται, τα αντιδραστήρια πρέπει να καθαρίζονται επιπλέον.
Σε αντικατάσταση των πρότυπων διαλυμάτων που περιγράφονται κατωτέρω, πρότυπα διαλύματα του εμπορίου μπορεί να χρησιμοποιηθούν με την προϋπόθεση ότι είναι εγγυημένα και έχουν ελεγχθεί πριν από τη χρήση.
|
3.1. |
Υδροχλωρικό οξύ (d:1,19 g/ml). |
|
3.2. |
Υδροχλωρικό οξύ (6 mol/litre). |
|
3.3. |
Υδροχλωρικό οξύ (0,5 mol/litre). |
|
3.4. |
Υδροφθορικό οξύ 38 μέχρι 40 % (κατ’ όγκο) που έχει περιεκτικότητα σιδήρου λιγότερο από 1 mg Fe/lt και ίζημα μετά από εξάτμιση, λιγότερο από 10 mg (ως θειικό άλας)/lit. |
|
3.5. |
Θειικό οξύ (d: 1,84 g/ml). |
|
3.6. |
Υπεροξείδιο του υδρογόνου (περίπου 100 όγκοι οξυγόνου 30 % κατά βάρος). |
|
3.7. |
Πρότυπο διάλυμα σιδήρου (1 000 μg Fe/ml) που παρασκευάζεται ως εξής ή ισοδύναμο διάλυμα διαθέσιμο στο εμπόριο: διαλύεται 1 gr σύρματος σιδήρουσε 200 ml υδροχλωρικού οξέος 6 mol/litre (3.2), προστίθενται 16 ml υπεροξειδίου του υδρογόνου (3.6) και συμπληρώνεται με νερό μέχρι όγκο ενός λίτρου. |
|
3.7.1. |
Πρότυπο διάλυμα εργασίας σιδήρου (100 μg Fe/ml) που παρασκευάζεται με αραίωση ενός μέρους του πρότυπου διαλύματος (3.7) με 9 μέρη νερό. |
|
3.8. |
Πρότυπο διάλυμα χαλκού (1 000 μg Cu/ml) που παρασκευάζεται ως εξής ή ισοδύναμο διάλυμα διαθέσιμο στο εμπόριο:
|
|
3.8.1. |
Πρότυπο διάλυμα εργασίας χαλκού (10 μg Cu/ml) παρασκευάζεται με αραίωση ενός μέρους του πρότυπου διαλύματος (3.8) με 9 μέρη νερό και συνέχεια με αραίωση ενός μέρους του προκύπτοντος διαλύματος με 9 μέρη νερό. |
|
3.9. |
Πρότυπο διάλυμα μαγγανίου (1 000 μg Mn/ml) που παρασκευάζεται ως εξής ή ισοδύναμο διάλυμα διαθέσιμο στο εμπόριο:
|
|
3.9.1. |
Πρότυπο διάλυμα εργασίας μαγγανίου (10 μg Mn/ml) που παρασκευάζεται με αραίωση ενός μέρους του πρότυπου διαλύματος (3.9) με 9 μέρη νερό και συνέχεια με αραίωση ενός μέρους του προκύπτοντος διαλύματος με 9 μέρη νερό. |
|
3.10. |
Πρότυπο διάλυμα ψευδαργύρου (1 000 μg Zn/ml) που παρασκευάζεται ως εξής ή ισοδύναμο διάλυμα διαθέσιμο στο εμπόριο:
|
|
3.10.1. |
Πρότυπο διάλυμα εργασίας ψευδαργύρου (10 μg Zn/ml) που παρασκευάζεται με αραίωση ενός μέρους του πρότυπου διαλύματος (3.10) με 9 μέρη νερό και συνέχεια με αραίωση ενός μέρους του προκύπτοντος διαλύματος με 9 μέρη νερό. |
|
3.11. |
Διάλυμα χλωριούχου λανθανίου που παρασκευάζεται ως εξής: διαλύονται 12 g οξειδίου του λανθανίου σε 150 ml νερό, προστίθενται 100 ml υδροχλωρικού οξέος 6 mol/litre (3.2) και συμπληρώνεται με νερό μέχρι όγκο ενός λίτρου. |
4. Όργανα
|
4.1. |
Φούρνος με διαφράγματα με ρυθμιζόμενη θερμοκρασία και καταγραφικό. |
|
4.2. |
Τα γυάλινα σκεύη πρέπει να είναι από ανθεκτικό πυριτικό βόριο. Συνιστάται η χρησιμοποίηση συσκευών αποκλειστικά για προσδιορισμούς ιχνοστοιχείων. |
|
4.3. |
Φασματοφωτόμετρο ατομικής απορρόφησης ανταποκρινόμενο στις απαιτήσεις της μεθόδου όσον αφορά την ευαισθησία και την ακρίβεια στο απαιτούμενο εύρος της περιοχής μετρήσεων. |
5. Μέθοδος (3)
5.1. Δείγματα που περιέχουν οργανική ύλη
5.1.1. (4)
|
5.1.1.1. |
Τοποθετούνται 5 ως 10 g του δείγματος ζυγισμένα με προσέγγιση 0,2 mg σε ένα χωνευτήρι από χαλαζία ή πλατίνα (βλέπε σημείωση β), ξηραίνονται σε φούρνο σε 105 oC και τοποθετείται το χωνευτήρι σε κρύο φούρνο με διαφράγματα (4.1). Κλείεται ο φούρνος [βλέπε σημείωση γ)] και προοδευτικά αυξάνεται η θερμοκρασία στους 450 μέχρι 475 oC μέσα σε 90 λεπτά περίπου. Διατηρείται αυτή η θερμοκρασία για 4 ως 16 ώρες (π.χ. κατά τη διάρκεια της νύχτας) ώστε να απομακρυνθεί η ανθρακώδης ύλη και στη συνέχεια ανοίγεται ο φούρνος και αφήνεται να κρυώσει (βλέπε σημείωση δ). Η τέφρα υγραίνεται με νερό και μεταφέρεται σε ποτήρι ζέσεως των 250 ml. Ξεπλένεται το χωνευτήρι με περίπου 5 ml συνολικά υδροχλωρικού οξέος (3.1) και στη συνέχεια προστίθεται το διάλυμα αυτό αργά και προσεκτικά στο δοχείο. (Πιθανόν να υπάρξει μια ισχυρή αντίδραση οφειλόμενη στο σχηματισμό CO2). Προστίθεται υδροχλωρικό οξύ (3.1) κατά σταγόνες ανακατεύοντας ταυτόχρονα το περιεχόμενο του δοχείου, μέχρι να σταματήσει τελείως ο αναβρασμός. Εξατμίζεται μέχρι ξηρού, ανακατεύοντας κατά διαστήματα με γυάλινη ράβδο. Στη συνέχεια προστίθενται 15 ml υδροχλωρικού οξέος 6 mol/litre (3.2) στο υπόλειμμα και κατόπιν περίπου 120 ml νερό. Αναδεύεται με τη βοήθεια της γυάλινης ράβδου, η οποία πρέπει να μείνει μέσα στο δοχείο και καλύπτεται το δοχείο με ύαλο ωρολογίου. Αυξάνεται σιγά-σιγά η θερμοκρασία στο σημείο βρασμού και διατηρείται στο σημείο αυτό μέχρις ότου δεν φαίνεται να διαλύεται άλλη στάχτη. Διηθείται με διηθητικό χαρτί καθαρό από στάχτες και συλλέγεται το διήθημα σε μία ογκομετρική φιάλη των 250 ml. Πλένεται το δοχείο και το φίλτρο με 5 ml ζεστού υδροχλωρικού οξέος 6 mol/litre (3.2) και δύο φορές με βραστό νερό. Συμπληρώνεται η ογκομετρική φιάλη με νερό μέχρι τα 250 ml (συγκέντρωση HCl περίπου 0,5 mol/litre). |
|
5.1.1.2. |
Αν το υπόλειμμα στο φίλτρο εμφανίζεται μαύρο (κάρβουνο) τοποθετείται πάλι στο φούρνο και αποτεφρώνεται στους 450 ως 475 oC. Αυτή η αποτέφρωση, που απαιτεί μόνο λίγες ώρες (περίπου τρεις ως πέντε ώρες), ολοκληρώνεται όταν η στάχτη εμφανίζεται άσπρη ή σχεδόν άσπρη. Διαλύεται το υπόλειμμα με περίπου 2 ml υδροχλωρικού οξέος (3.1), εξατμίζεται μέχρι του ξηρού και προστίθενται 5 ml υδροχλωρικού οξέως 6 mol/litre (3.2). Θερμαίνεται, διηθείται το διάλυμα μέσα στην ογκομετρική φιάλη και συμπληρώνεται με νερό μέχρι τα 250 ml (συγκέντρωση HCl περίπου 0,5 mol/litre. Σημειώσεις:
|
5.1.2.
5.1.2.1.
Για καθένα από τα στοιχεία που πρόκειται να προσδιορισθούν, παρασκευάζεται από τα πρότυπα διαλύματα εργασίας που δόθηκαν στις παραγράφους 3.71, 3.8.1, 3.9.1 και 3.10.1 μια σειρά από διαλύματα βαθμονόμησης, έτσι ώστε κάθε διάλυμα βαθμονόμησης να έχει συγκέντρωση HCl περίπου 0,5 mol/litre και (στις περιπτώσεις σιδήρου, μαγγανίου και ψευδαργύρου) συγκέντρωση χλωριούχου λανθανίου ισοδύναμη με 0,1 % La (βάρος/όγκο).
Οι συγκεντρώσεις των ιχνοστοιχείων που διαλέχτηκαν πρέπει να βρίσκονται μέσα στα όρια ευαισθησίας του φασματοφωτόμετρου που χρησιμοποιήθηκε. Οι παρακάτω πίνακες δείχνουν, ως παράδειγμα, τις συνθέσεις του τυπικού εύρους των διαλυμάτων βαθμονόμησης. Εντούτοις, ανάλογα με τον τύπο και την ευαισθησία του φασματοφωτόμετρου που χρησιμοποιείται, μπορεί να είναι απαραίτητη η επιλογή άλλων συγκεντρώσεων.
Σίδηρος
|
μg Fe/ml |
0 |
0,5 |
1 |
2 |
3 |
4 |
5 |
|
ml πρότυπου διαλύματος εργασίας (3.7.1) (1 ml = 100 μg Fe) |
0 |
0,5 |
1 |
2 |
3 |
4 |
5 |
|
ml HCl (3.2) |
7 |
7 |
7 |
7 |
7 |
7 |
7 |
|
+ 10 ml διαλύματος χλωριούχου λανθανίου (3.11) και συμπληρώνεται με νερό μέχρι όγκο 100 ml |
|||||||
Χαλκός
|
μg Cu/ml |
0 |
0,1 |
0,2 |
0,4 |
0,6 |
0,8 |
1,0 |
|
ml πρότυπου διαλύματος εργασίας (3.8.1) (1 ml = 10 μg Cu) |
0 |
1 |
2 |
4 |
6 |
8 |
10 |
|
ml HCl (3.2) |
8 |
8 |
8 |
8 |
8 |
8 |
8 |
Μαγγάνιο
|
μg Mn/ml |
0 |
0,1 |
0,2 |
0,4 |
0,6 |
0,8 |
1,0 |
|
ml πρότυπου διαλύματος εργασίας (3.9.1) (1 ml = 10 μg Mn) |
0 |
1 |
2 |
4 |
6 |
8 |
10 |
|
ml HCl (3.2) |
7 |
7 |
7 |
7 |
7 |
7 |
7 |
|
+ 10 ml διαλύματος χλωριούχου λανθανίου (3.11) και συμπληρώνεται με νερό μέχρι όγκο 100 ml |
|||||||
Ψευδάργυρος
|
μg Zn/ml |
0 |
0,05 |
0,1 |
0,2 |
0,4 |
0,6 |
0,8 |
|
ml πρότυπου διαλύματος εργασίας (3.10.1) (1 ml = 10 μg Zn) |
0 |
0,5 |
1 |
2 |
4 |
6 |
8 |
|
ml HCl (3.2) |
7 |
7 |
7 |
7 |
7 |
7 |
7 |
|
+ 10 ml διαλύματος χλωριούχου λανθανίου (3.11) και συμπληρώνεται με νερό μέχρι όγκο 100 ml |
|||||||
5.1.2.2.
Για τον προσδιορισμό του χαλκού, το διάλυμα που παρασκευάστηκε από την παράγραφο 5.1.1 μπορεί γενικά να χρησιμοποιηθεί άμεσα. Αν απαιτείται να προσαρμοσθεί η συγκέντρωσή του μέσα στα όρια των διαλυμάτων βαθμονόμησης, μπορεί ένα μέρος του διαλύματος να μεταφερθεί με πιπέτα σε μια ογκομετρική φιάλη των 100 ml και να συμπληρωθεί με 0,5 mol/litre υδροχλωρικό οξύ (3.3) μέχρι ο όγκος να φτάσει τα 100 ml.
Για τον προσδιορισμό του σιδήρου, μαγγανίου και ψευδαργύρου μεταφέρεται με πιπέτα ένα μέρος του διαλύματος που παρασκευάστηκε από την παράγραφο 5.1.1 μέσα σε ογκομετρική φιάλη των 100 ml, προστίθενται 10 ml διαλύματος χλωριούχου λανθανίου (3.11) και συμπληρώνεται μέχρι τη χαραγή με υδροχλωρικό οξύ 0,5 mol/litre (3.3) (βλέπε επίσης παράγραφο 8 «Παρατήρηση»).
5.1.2.3.
Το τυφλό πείραμα πρέπει να περιλαμβάνει όλα τα προβλεπόμενα στάδια της διαδικασίας, παραλειπομένου του υλικού του δείγματος. Το διάλυμα βαθμονόμησης «0» δεν πρέπει να χρησιμοποιηθεί ως «τυφλό πείραμα».
5.1.2.4.
Μετράται η ατομική απορρόφηση των διαλυμάτων βαθμονόμησης και του διαλύματος που πρόκειται να αναλυθεί χρησιμοποιώντας μια οξειδωτική φλόγα αέρα-ακετυλενίου στα ακόλουθα μήκη κύματος:
|
|
Fe: 248,3 nm |
|
|
Cu: 324,8 nm |
|
|
Mn: 279,5 nm |
|
|
Zn: 213,8 nm |
Κάθε μέτρηση γίνεται τέσσερις φορές.
5.2. Ανόργανα υλικά
Αν το δείγμα δεν περιέχει οργανική ύλη, δεν είναι απαραίτητη προηγούμενη αποτέφρωση. Ακολουθείται η διαδικασία που περιγράφεται στην παράγραφο 5.1.1.1 αρχίζοντας από τη δεύτερη υποπαράγραφο. Η εξάτμιση με υδροφθορικό οξύ μπορεί να παραλειφθεί.
6. Υπολογισμός των αποτελεσμάτων
Χρησιμοποιώντας μια καμπύλη βαθμονόμησης, υπολογίζεται η συγκέντρωση του ιχνοστοιχείου στο δείγμα που αναλύεται και το αποτέλεσμα εκφράζεται σε mg ιχνοστοιχείου ανά kg δείγματος (ppm).
7. Επαναληψιμότητα
Η διαφορά ανάμεσα στα αποτελέσματα δύο παράλληλα πραγματοποιούμενων προσδιορισμών, που εκτελέστηκαν στο ίδιο δείγμα από τον ίδιο αναλυτή, δεν πρέπει να υπερβαίνει:
|
— |
τα 5 mg/kg, κατ’ απόλυτη τιμή, για περιεκτικότητες ιχνοστοιχείου μέχρι 50 mg/kg, |
|
— |
το 10 % του μεγαλύτερου αποτελέσματος για περιεκτικότητες ιχνοστοιχείου από 50 και μέχρι 100 mg/kg, |
|
— |
τα 10 mg/kg, με απόλυτη τιμή για περιεκτικότητες ιχνοστοιχείου 100 και μέχρι 200 mg/kg, |
|
— |
το 5 % του μεγαλύτερου αποτελέσματος για περιεκτικότητες ιχνοστοιχείου ανώτερες από 200 mg/kg. |
8. Παρατήρηση
Η παρουσία μεγάλων ποσοτήτων φωσφορικών αλάτων μπορεί να προκαλέσει παρεμβολές στον προσδιορισμό του σιδήρου, μαγγανίου και ψευδαργύρου. Αυτή η παρεμβολή πρέπει να διορθωθεί με την προσθήκη διαλύματος χλωριούχου λανθανίου (3.11). Αν όμως στο δείγμα ο λόγος βάρους Ca + Mg/P είναι > 2, η προσθήκη του διαλύματος χλωριούχου λανθανίου (3.11) στο διάλυμα που θα αναλυθεί και στα διαλύματα βαθμονόμησης μπορεί να παραλειφθεί.
Δ. ΠΟΣΟΤΙΚΟΣ ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΗΣ ΑΛΟΦΟΥΓΙΝΟΝΗΣ
Υδροβρωμική DL-trans-7-βρωμο-6-χλωρο-3-[3-υδροξυ-2-πιπεριδυλ)-ακετονυλο]-κιναζολινόνη-4-(3Η)
1. Αντικείμενο και πεδίο εφαρμογής
Η παρούσα μέθοδος προορίζεται για τον ποσοτικό προσδιορισμό της αλοφουγινόνης στις ζωοτροφές. Η ευαισθησία της μεθόδου είναι 1 mg/kg.
2. Αρχή
Μετά από κατεργασία του δείγματος με θερμό νερό, η αλοφουγινόνη εκχυλίζεται ως ελεύθερη βάση σε οξικό αιθυλεστέρα και, κατόπιν, κατανέμεται ως υδροχλωρικό άλας σε υδατικό διάλυμα οξέος. Το εκχύλισμα υποβάλλεται σε καθαρισμό με χρωματογραφία ιονανταλλαγής. Η περιεκτικότητα σε αλοφουγινόνη προσδιορίζεται με υγρή χρωματογραφία υψηλής απόδοσης (HPLC), ανεστραμμένης φάσης, με τη βοήθεια ανιχνευτή υπεριώδους ακτινοβολίας.
3. Αντιδραστήρια
|
3.1. |
Ακετονιτρίλιο, καθαρότητας ισοδύναμης με HPLC |
|
3.2. |
Ρητίνη Amberlite XAD-2 |
|
3.3. |
Οξικό αμμώνιο |
|
3.4. |
Οξικός αιθυλεστέρας |
|
3.5. |
Κρυσταλλικό οξικό οξύ |
|
3.6. |
Αλοφουγινόνη, πρότυπη ουσία (υδροβρωμική DL-trans-7-βρωμο-6-χλωρο-3-[3-υδροξυ-2-πιπεριδυλ) ακετονυλο]-κιναζολινόνη-4-(3Η), Ε 764) |
|
3.6.1. |
Σε ογκομετρική φιάλη των 500 ml ζυγίζονται, με ακρίβεια 0,1 mg, 50 mg αλοφουγινόνης (3.6) και διαλύονται σε ρυθμιστικό διάλυμα οξικού αμμωνίου (3.18). Ο όγκος συμπληρώνεται μέχρι τη χαραγή με το ίδιο ρυθμιστικό διάλυμα και ακολουθεί ανάμειξη. Το διάλυμα αυτό διατηρείται σταθερό επί τρεις εβδομάδες στους 5 oC, εφόσον φυλάσσεται στο σκοτάδι. |
|
3.6.2. |
Σε σειρά ογκομετρικών φιαλών των 100 ml, μεταφέρονται 1,0, 2,0, 3,0, 4,0 και 6,0 ml από το αρχικό πρότυπο διάλυμα (3.6.1). Ο όγκος συμπληρώνεται μέχρι τη χαραγή με το διάλυμα της κινούμενης φάσης (3.21) και ακολουθεί ανάμειξη. Τα διαλύματα αυτά, που πρέπει να παρασκευάζονται πριν από κάθε χρήση, έχουν συγκέντρωση αλοφουγινόνης 1,0, 2,0, 3,0, 4,0 και 6,0 μg/ml αντίστοιχα. |
|
3.7. |
Υδροχλωρικό οξύ (ρ20 περίπου 1,16 g/ml). |
|
3.8. |
Μεθανόλη |
|
3.9. |
Νιτρικός άργυρος |
|
3.10. |
Ασκορβικό νάτριο |
|
3.11. |
Ανθρακικό νάτριο |
|
3.12. |
Χλωριούχο νάτριο |
|
3.13. |
EDTA (δινάτριο άλας του αιθυλενοδιαμινοτετραοξικού οξέος) |
|
3.14. |
Νερό καθαρότητας ισοδύναμης με HPLC |
|
3.15. |
Διάλυμα ανθρακικού νατρίου, c = 10 g/100 ml |
|
3.16. |
Διάλυμα ανθρακικού νατρίου κορεσμένο σε χλωριούχο νάτριο, c = 5 g/100 ml Διαλύονται σε νερό 50 g ανθρακικού νατρίου (3.11). Το διάλυμα αραιώνεται μέχρι το 1 λίτρο και προστίθεται χλωριούχο νάτριο (3.12) μέχρι κορεσμού. |
|
3.17. |
Υδροχλωρικό οξύ περίπου 0,1 mol/l 10 ml HCl (3.7) αραιώνονται με νερό μέχρι το 1 λίτρο. |
|
3.18. |
Ρυθμιστικό διάλυμα οξικού αμμωνίου περίπου 0,25 mol/l Διαλύονται σε νερό (3.14) 19,3 gr οξικού αμμωνίου (3.3) και 30 ml οξικού οξέος (3.5) και το διάλυμα αραιώνεται μέχρι το 1 λίτρο. |
|
3.19. |
Προετοιμασία της ρητίνης Amberlite XAD-2 Κατάλληλη ποσότητα ρητίνης Amberlite (3.2) εκπλύνεται με νερό μέχρι να απομακρυνθούν τελείως τα χλωριόντα, πράγμα που αποδεικνύεται με τη διεξαγωγή δοκιμής νιτρικού αργύρου (3.20) στην απορριπτόμενη υδατική φάση. Στη συνέχεια, η ρητίνη εκπλύνεται με 50 ml μεθανόλης (3.8), απορρίπτεται η μεθανόλη και η ρητίνη φυλάσσεται σε ανανεωμένη μεθανόλη. |
|
3.20. |
Διάλυμα νιτρικού αργύρου περίπου 0,1 mol/l Διαλύονται 0,17 gr νιτρικού αργύρου (3.9) σε 10 ml νερού. |
|
3.21. |
Κινούμενη φάση για τη χρωματογραφία HPLC Αναμειγνύονται 500 ml ακετονιτριλίου (3.1) με 300 ml ρυθμιστικού διαλύματος οξικού αμμωνίου (3.18) και 1 200 ml νερού (3.14). Ρυθμίζεται το pH στην τιμή 4,3 με τη βοήθεια οξικού οξέος (3.5). Το διάλυμα διηθείται με ηθμό των 0,22 μm (4.8) και κατόπιν υποβάλλεται σε απαερίωση (παραδείγματος χάρη, με έκθεση σε υπερήχους επί δέκα λεπτά). Το διάλυμα αυτό διατηρείται σταθερό επί ένα μήνα, εφόσον φυλάσσεται στο σκοτάδι σε κλειστό δοχείο. |
4. Όργανα
|
4.1. |
Λουτρό υπερήχων |
|
4.2. |
Περιστρεφόμενος εξατμιστής υμενίου |
|
4.3. |
Φυγόκεντρος |
|
4.4. |
Εξοπλισμός HPLC με ανιχνευτή υπεριώδους ακτινοβολίας μεταβλητού μήκους κύματος ή ανιχνευτή συστοιχίας διόδων λυχνιών |
|
4.4.1. |
Στήλη υγρής χρωματογραφίας διαστάσεων 300 mm × 4 mm, με πληρωτικό υλικό C18 πάχους 10 μm ή ισοδύναμη |
|
4.5. |
Γυάλινη στήλη (διαστάσεων 300 mm × 10 mm) εφοδιασμένη με ηθμό από συντετηγμένο γυαλί και στρόφιγγα |
|
4.6. |
Ηθμοί από υαλοβάμβακα, διαμέτρου 150 mm |
|
4.7. |
Διηθητικές μεμβράνες των 0,45 μm |
|
4.8. |
Διηθητικές μεμβράνες των 0,22 μm |
5. Διαδικασία
|
Σημείωση: |
Η αλοφουγινόνη ως ελεύθερη βάση είναι ασταθής σε αλκαλικά διαλύματα και διαλύματα οξικού αιθυλεστέρα. Δεν πρέπει να παραμένει μέσα σε οξικό αιθυλεστέρα περισσότερο από 30 λεπτά. |
5.1. Γενικά
|
5.1.1. |
Πρέπει να αναλυθεί τυφλό δείγμα ζωοτροφής για να διαπιστωθεί ότι δεν υπάρχει σ’ αυτό αλοφουγινόνη ή παρεμποδίζουσες ουσίες. |
|
5.1.2. |
Για να εξακριβωθεί ο βαθμός ανάκτησης, πρέπει να αναληφθεί τυφλό δείγμα ζωοτροφής, το οποίο θα έχει εμπλουτισθεί με ποσότητα αλοφουγινόνης όμοια με αυτήν που υπάρχει στο προς ανάλυση δείγμα. Για τον εμπλουτισμό σε επίπεδο 3 mg/Kg προστίθενται 300 μl από το αρχικό πρότυπο διάλυμα (3.6.1) σε 10 gr τυφλού δείγματος ζωοτροφής και αφού αναμειχθεί αφήνεται δέκα λεπτά πριν από το επόμενο στάδιο της εκχύλισης (5.2).
|
5.2. Εκχύλιση
Σε σωλήνα φυγοκέντρου των 200 ml, ζυγίζονται 10 gr του παρασκευασθέντος δείγματος με ακρίβεια 0,1 gr και προστίθενται 0,5 gr ασκορβικού νατρίου (3.10), 0,5 gr EDTA (3.13) και 20 ml νερού. Το σύνολο αναμειγνύεται και ο σωλήνας τοποθετείται επί 5 λεπτά σε υδατόλουτρο (80 oC). Αφού ψυχθεί μέχρι τη θερμοκρασία περιβάλλοντος, προστίθενται 20 ml διαλύματος ανθρακικού νατρίου (3.15) και ακολουθεί ανάμειξη. Προστίθενται αμέσως 100 ml οξικού αιθυλεστέρα (3.4) και το σύνολο αναδεύεται ζωηρά επί 15 δευτερόλεπτα με το χέρι. Στη συνέχεια ο σωλήνας τοποθετείται επί τρία λεπτά στο λουτρό υπερήχων (4.1) και χαλαρώνεται το πώμα. Ακολουθεί φυγοκέντρηση επί δύο λεπτά. Η στιβάδα του οξικού αιθυλεστέρα αποχύνεται, μέσω ηθμού από υαλοβάμβακα (4.6), μέσα σε διαχωριστική χοάνη των 500 ml. Επαναλαμβάνεται η εκχύλιση του δείγματος με νέα ποσότητα 100 ml οξικού αιθυλεστέρα. Τα εκχυλίσματα ενώνονται, εκπλύνονται επί ένα λεπτό με 50 ml διαλύματος ανθρακικού νατρίου κορεσμένου με χλωριούχο νάτριο (3.16) και η υδατική στιβάδα απορρίπτεται.
Η οργανική στιβάδα υποβάλλεται σε εκχύλιση επί ένα λεπτό με 50 ml υδροχλωρικού οξέος (3.17). Η υποκείμενη στιβάδα του οξέος συλλέγεται γρήγορα σε διαχωριστική χοάνη των 250 ml. Επαναλαμβάνεται η εκχύλιση της οργανικής στιβάδας επί 1,5 λεπτό με νέα ποσότητα 50 ml υδροχλωρικού οξέος και τα δύο εκχυλίσματα ενώνονται. Εκπλύνονται με περιδίνηση επί δέκα δευτερόλεπτα περίπου με 10 ml οξικού αιθυλεστέρα (3.4).
Η υδάτινη στιβάδα μεταγγίζεται ποσοτικά σε σφαιρική φιάλη των 250 ml, ενώ η οργανική στιβάδα απορρίπτεται. Η εναπομένουσα ποσότητα οξικού αιθυλεστέρα εξατμίζεται πλήρως από το διάλυμα του οξέος σε περιστρεφόμενο εξατμιστή υμενίου (4.2). Η θερμοκρασία του υδατόλουτρου δεν πρέπει να υπερβαίνει τους 40 oC. Αν η συσκευή βρίσκεται υπό κενό περίπου 25 mbar και θερμαίνεται σε υδατόλουτρο θερμοκρασίας 38 oC, όλη η εναπομένουσα ποσότητα οξικού αιθυλεστέρα απομακρύνεται σε πέντε λεπτά.
5.3. Καθαρισμός
5.3.1.
Παρασκευάζεται μία στήλη XAD-2 για κάθε εκχύλισμα δείγματος. Με τη βοήθεια μεθανόλης (3.8) φέρονται σε γυάλινη στήλη (4.5) 10 gr έτοιμης προς χρήση Amberlite (3.9). Στην άνω επιφάνεια της ρητίνης τοποθετείται μικρό βύσμα από υαλοβάμβακα. Η μεθανόλη απορροφάται από τη στήλη και η ρητίνη εκπλύνεται με 100 ml νερού, μέχρι το υγρό να φθάσει στην άνω επιφάνεια της ρητίνης, οπότε διακόπτεται η ροή. Πριν χρησιμοποιηθεί, η στήλη αφήνεται σε ηρεμία επί δέκα λεπτά για να αποκατασταθεί ισορροπία. Η στήλη δεν πρέπει ποτέ να αφήνεται να ξηρανθεί.
5.3.2.
Το εκχύλισμα (5.2) μεταγγίζεται ποσοτικά στο άνω μέρος της έτοιμης προς χρήση στήλης Amberlite (5.3.1) και ακολουθεί έκλουση με απόρριψη του εκλούσματος. Η ταχύτητα έκλουσης δεν πρέπει να υπερβαίνει τα 20 ml/min. Η σφαιρική φιάλη εκπλύνεται με 20 ml υδροχλωρικού οξέος (3.17) και το έκπλυμα αυτό χρησιμοποιείται για την έκπλυση της ρητινικής στήλης. Στα τυχόν υπολείμματα διαλύματος του οξέος διοχετεύεται ρεύμα αέρος. Τα υγρά της έκπλυσης απορρίπτονται. Προστίθενται στη στήλη 100 ml μεθανόλης (3.8) και αφήνονται να εκρεύσουν 5-10 ml και το έκλουσμα συλλέγεται σε σφαιρική φιάλη των 250 ml. Η εναπομένουσα μεθανόλη αφήνεται σε ηρεμία επί δέκα λεπτά για να αποκατασταθεί ισορροπία με τη ρητίνη και συνεχίζεται η έκλουση με ταχύτητα όχι μεγαλύτερη από 20 ml/min, ενώ το έκλουσμα συλλέγεται στην ίδια σφαιρική φιάλη. Η μεθανόλη εξατμίζεται σε περιστρεφόμενο εξατμιστή υμενίου (4.2), θερμαινόμενο σε υδατόλουτρο του οποίου η θερμοκρασία δεν πρέπει να υπερβαίνει τους 40 oC. Το υπόλειμμα μεταφέρεται ποσοτικά σε ογκομετρική φιάλη των 10 ml με τη βοήθεια του διαλύματος της κινούμενης φάσης (3.21). Ο όγκος συμπληρώνεται μέχρι τη χαραγή με την κινούμενη φάση και το σύνολο αναμειγνύεται. Μια ορισμένη ποσότητα διηθείται διαμέσου διηθητικής μεμβράνης (4.7). Το διάλυμα αυτό φυλάσσεται για τον χρωματογραφικό προσδιορισμό με χρωματογραφία HPLC (5.4).
5.4. Ποσοτικός προσδιορισμός με χρωματογραφία HPLC
5.4.1.
Οι ακόλουθες συνθήκες δίδονται μόνο ως οδηγός. Άλλες συνθήκες μπορούν να χρησιμοποιηθούν, υπό την προϋπόθεση να δίδουν ισοδύναμα αποτελέσματα.
Στήλη αναλυτικής χρωματογραφίας (4.4.1)
Κινούμενη φάση (3.21)
Ταχύτητα ροής: 1,5 έως 2 ml/min.
Μήκος κύματος ανιχνευτή: 243 nm
Όγκος εισαγόμενου δείγματος: 40 έως 100 μl.
Ελέγχεται η σταθερότητα του χρωματογραφικού συστήματος με επανειλημμένη εισαγωγή του διαλύματος αναφοράς (3.6.2) που περιέχει 3,0 μg/ml, μέχρι να επιτευχθούν σταθερά ύψη κορυφών ή εμβαδά και σταθεροί χρόνοι κατακράτησης.
5.4.2.
Κάθε διάλυμα αναφοράς (3.6.2) εισάγεται πολλές φορές στη στήλη και μετρώνται τα ύψη (ή τα εμβαδά) των κορυφών που αντιστοιχούν σε κάθε συγκέντρωση. Σχεδιάζεται καμπύλη αναφοράς με τεταγμένη τις μέσες τιμές των υψών ή των εμβαδών των κορυφών που λαμβάνονται για διαλύματα αναφοράς και τετμημένη τις αντίστοιχες συγκεντρώσεις σε μg/ml.
5.4.3.
Το εκχύλισμα του δείγματος (5.3.2), σε όγκο ίσο με εκείνου που έχει χρησιμοποιηθεί για τα διαλύματα αναφοράς, εισάγεται πολλές φορές στη στήλη και υπολογίζεται η μέση τιμή των υψών ή των εμβαδών των κορυφών που αντιστοιχούν στην αλοφουγινόνη.
6. Έκφραση των αποτελεσμάτων
Από τις μέσες τιμές των υψών (εμβαδών) των κορυφών που αντιστοιχούν στην αλοφουγινόνη του διαλύματος του δείγματος προσδιορίζεται η συγκέντρωσή του σε/ml με τη βοήθεια της καμπύλης αναφοράς (5.4.2).
Η περιεκτικότητα του δείγματος σε αλοφουγινόνη κατά βάρος (mg/kg) παρέχεται από τον τύπο:

όπου:
|
c |
= |
συγκέντρωση αλοφουγινόνης στο διάλυμα δείγματος σε μg/ml, |
|
m |
= |
βάρος του δείγματος δοκιμής σε γραμμάρια. |
7. Επικύρωση των αποτελεσμάτων
7.1. Ταυτότητα
Η ταυτότητα της ελεγχόμενης ουσίας μπορεί να επιβεβαιωθεί με συγχρωματογράφηση ή με ανιχνευτή συστοιχίας διόδων λυχνιών, με τον οποίο συγκρίνονται τα φάσματα του εκχυλίσματος του δείγματος και του διαλύματος αναφοράς (3.6.2) με συγκέντρωση 6,0 μg/ml.
7.1.1.
Το εκχύλισμα δείγματος εμπλουτίζεται με την προσθήκη κατάλληλης ποσότητας διαλύματος αναφοράς (3.6.2). Η ποσότητα της προστιθέμενης αλοφουγινόνης πρέπει να είναι παραπλήσια με την υπολογισθείσα ποσότητα της ουσίας στο εκχύλισμα του δείγματος.
Πρέπει να προκύψει ενίσχυση μόνο του ύψους της κορυφής που αντιστοιχεί στην αλοφουγινόνη, αφού ληφθεί υπόψη και το ποσό που προστέθηκε και η αραίωση του εκχυλίσματος. Το εύρος της κορυφής στο ήμισυ του μέγιστου ύψους της δεν πρέπει να διαφέρει περισσότερο από ± 10 % του αρχικού εύρους.
7.1.2.
Τα αποτελέσματα αξιολογούνται με τα ακόλουθα κριτήρια:
|
α) |
το μήκος κύματος στο οποίο παρατηρείται η μέγιστη απορρόφηση στα φάσματα του δείγματος και του προτύπου, καταγραφόμενα στο μέγιστο ύψος των κορυφών στο χρωματογράφημα, πρέπει να είναι τα ίδια, εντός ορίων που καθορίζονται από τη διαχωριστική ικανότητα του ανιχνευτή. Για την ανίχνευση σε συστοιχία διόδων λυχνιών, το όριο αυτό είναι συνήθως ± 2 nm· |
|
β) |
σε μήκος κύματος μεταξύ 225 και 300 nm, τα φάσματα που αντιστοιχούν στο δείγμα και στο πρότυπο διάλυμα, καταγραφόμενα στο μέγιστο ύψος των κορυφών στο χρωματογράφημα, δεν πρέπει να διαφέρουν για εκείνα τα μέρη του φάσματος που περικλείονται μεταξύ 10 % και 100 % της σχετικής απορρόφησης. Το κριτήριο αυτό πληρούται όταν παρατηρούνται οι ίδιες μέγιστες τιμές και σε κανένα σημείο παρατήρησης η απόκλιση μεταξύ των δύο φασμάτων δεν υπερβαίνει το 15 % της απορρόφησης της πρότυπης ελεγχόμενης ουσίας· |
|
γ) |
σε μήκος κύματος μεταξύ 225 και 300 nm, τα φάσματα στο ανερχόμενο τμήμα στο μέγιστο ύψος και στο κατερχόμενο τμήμα των κορυφών που παράγονται από το εκχύλισμα του δείγματος δεν πρέπει να διαφέρουν μεταξύ τους για εκείνα τα μέρη του φάσματος που περικλείονται μεταξύ 10 % και 100 % της σχετικής απορρόφησης. Το κριτήριο αυτό πληρούται όταν παρατηρούνται οι ίδιες μέγιστες τιμές και όταν σε κανένα σημείο παρατήρησης η απόκλιση μεταξύ των φασμάτων δεν υπερβαίνει το 15 % της απορρόφησης του φάσματος στο μέγιστο ύψος των κορυφών. |
Εάν ένα από τα κριτήρια αυτά δεν πληρούται, η παρουσία της ελεγχόμενης ουσίας δεν θεωρείται επιβεβαιωμένη.
7.2. Επαναληψιμότητα
Η διαφορά μεταξύ των αποτελεσμάτων δύο παράλληλα διενεργούμενων ποσοτικών προσδιορισμών στο ίδιο δείγμα δεν πρέπει να υπερβαίνει τα 0,5 mg/kg, για περιεκτικότητα σε αλοφουγινόνη 3mg/kg.
7.3. Ανάκτηση
Για το εμπλουτισμένο τυφλό δείγμα, ο βαθμός ανάκτησης πρέπει να είναι τουλάχιστον 80 %.
8. Αποτελέσματα συλλογικής μελέτης
Εκπονήθηκε συλλογική μελέτη (5), κατά την οποία υποβλήθηκαν σε ανάλυση τρία δείγματα σε οκτώ εργαστήρια.
Αποτελέσματα
|
|
Δείγμα A (τυφλό) Κατά την παραλαβή |
Δείγμα B (Σιμιγδάλια) |
Δείγμα Γ (Σύμπηκτα) |
||
|
|
|
Κατά την παραλαβή |
Μετά από δύο μήνες |
Κατά την παραλαβή |
Μετά από δύο μήνες |
|
Μέσος όρος [mg/kg] |
ΔΑ |
2,80 |
2,42 |
2,89 |
2,45 |
|
SR [mg/kg] |
— |
0,45 |
0,43 |
0,40 |
0,42 |
|
CVR [%] |
— |
16 |
18 |
14 |
17 |
|
Ανάκτ. [%] |
|
86 |
74 |
88 |
75 |
|
ΔΑ |
= |
δεν ανιχνεύθηκε |
|
SR |
= |
τυπική απόκλιση αναπαραγωγιμότητας |
|
CVR |
= |
συντελεστής διακύμανσης αναπαραγωγιμότητας (%) |
|
Rec |
= |
ανάκτηση (%). |
E. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΗΣ ΡΟΒΕΝΙΔΙΝΗΣ
Υδροχλωρική 1,3-δις[(4-χλωροβενζυλιδενο)αμινο] γουανιδίνη
1. Αντικείμενο και πεδίο εφαρμογής
Η μέθοδος επιτρέπει τον προσδιορισμό της ροβενιδίνης στις ζωοτροφές. Η ευαισθησία της μεθόδου είναι 5 mg/kg.
2. Αρχή
Το δείγμα εκχυλίζεται με οξινισμένη μεθανόλη. Το εκχύλισμα ξηραίνεται και μέρος αυτού υποβάλλεται σε καθαρισμό πάνω σε στήλη οξειδίου του αργιλίου. Η ροβενιδίνη εκλούεται από τη στήλη με μεθανόλη και φέρεται στον κατάλληλο όγκο με κινητή φάση. Η περιεκτικότητα σε ροβενιδίνη προσδιορίζεται με υψηλής απόδοσης υγρή χρωματογραφία (HPLC) ανάστροφης φάσης με τη βοήθεια ανιχνευτού υπεριώδους ακτινοβολίας.
3. Αντιδραστήρια
|
3.1. |
Μεθανόλη |
|
3.2. |
Οξινισμένη μεθανόλη
Εντός βαθμονομημένης φιάλης των 500 ml εισάγονται 4,0 ml υδροχλωρικού οξέος (ρ20 = 1,18 g/ml), προστίθεται μεθανόλη (3.1) μέχρι τη χαραγή και το περιεχόμενο αναμειγνύεται. Το διάλυμα αυτό πρέπει να παρασκευασθεί λίγο πριν χρησιμοποιηθεί. |
|
3.3. |
Ακετονιτρίλιο καθαρότητας ισοδύναμης με HPLC |
|
3.4. |
Μοριακό κόσκινο
Σφαιρίδια τύπου 3Α, 8 έως 12 βρόχων (διάμετρος σφαιριδίων 1,6-2,5 mm, κρυσταλλικό πυριτικό αργίλιο, διάμετρος πόρων 0,3 nm). |
|
3.5. |
Οξείδιο του αργιλίου: όξινο, βαθμού ενεργότητας Ι για χρωματογραφία στήλης
Εισάγουμε 100 g οξειδίου του αργιλίου σε κατάλληλο δοχείο και προσθέτουμε 2,0 ml νερού. Πωματίζουμε και ανακινούμε επαρκώς επί 20 λεπτά. Φυλάσσουμε το διάλυμα σε καλά πωματισμένο δοχείο. |
|
3.6. |
Διάλυμα δισόξινου φωσφορικού καλίου, c = 0,025 mol/l
Διαλύουμε σε νερό (καθαρότητας HPLC) 3,40 g δισόξινου φωσφορικού καλίου εντός βαθμονομημένης φιάλης των 1 000 ml, συμπληρώνουμε μέχρι τη χαραγή και αναμειγνύουμε. |
|
3.7. |
Διάλυμα μονόξινου φωσφορικού νατρίου, c = 0,025 mol/l
Διαλύουμε σε νερό (καθαρότητας HPLC) 3,55 g άνυδρου (ή 4,45 g δις ένυδρου ή 8,95 g δωδεκάκις ένυδρου) μονόξινου φωσφορικού νατρίου εντός βαθμονομημένης φιάλης του 1 λίτρου, συμπληρώνουμε μέχρι τη χαραγή και αναμειγνύουμε. |
|
3.8. |
Κινητή φάση HPLC
Αναμειγνύουμε τα ακόλουθα αντιδραστήρια:
Το διάλυμα διηθείται μέσω διηθητικής μεμβράνης πάχους 0,22 μm (4.6) και απομακρύνονται τα αέρια (π.χ. με έκθεση σε υπερήχους επί 10 λεπτά). |
|
3.9. |
Πρότυπη ουσία
Καθαρή ροβενιδίνη: υδροχλωρική 1,3-δις [4-χλωροβενζυλιδενο)αμινο]γουανιδίνη. |
|
3.9.1. |
Ζυγίζουμε 30 mg της πρότυπης ουσίας (3.9) με ακρίβεια 0,1 mg. Διαλύουμε σε οξινισμένη μεθανόλη (3.2) εντός βαθμονομημένης φιάλης των 100 ml, συμπληρώνουμε μέχρι τη χαραγή με τον ίδιο διαλύτη και αναμειγνύουμε. Περιτυλίγουμε τη φιάλη με αλουμινόχαρτο και τη φυλάσσουμε σε σκοτεινό μέρος. |
|
3.9.2. |
Μεταφέρουμε 10,0 ml του αρχικού πρότυπου διαλύματος (3.9.1) εντός βαθμονομημένης φιάλης των 250 ml, συμπληρώνουμε μέχρι τη χαραγή με την κινητή φάση (3.8) και αναμειγνύουμε. Περιτυλίσσουμε τη φιάλη με αλουμινόχαρτο και τη φυλάσσουμε σε σκοτεινό μέρος. |
|
3.9.3. |
Μεταφέρουμε 5,0 ml 10,0 ml, 15,0 ml, 20,0 ml και 25,0 ml του ενδιάμεσου πρότυπου διαλύματος (3.9.2) σε βαθμονομημένες φιάλες των 50 ml. Συμπληρώνουμε μέχρι τη χαραγή με την κινητή φάση (3.8) και αναμειγνύουμε. Η συγκέντρωση των διαλυμάτων αυτών σε ροβενιδίνη είναι αντιστοίχως 1,2, 2,4, 3,6, 4,8 και 6,0 μg/ml. Τα διαλύματα αυτά πρέπει να παρασκευάζονται λίγο πριν χρησιμοποιηθούν. |
|
3.10. |
Νερό καθαρότητας ισοδύναμης με HPLC |
4. Όργανα
|
4.1. |
Υάλινη στήλη
Υάλινη στήλη φαιοκίτρινου χρώματος (όπως το χρώμα του ηλέκτρου), εφοδιασμένη με στρόφιγγα και με δεξαμενή χωρητικότητας 150 ml περίπου, εσωτερικής διαμέτρου 10-15 mm και μήκους 250 mm. |
|
4.2. |
Μηχανικό τάρακτρο (σέικερ) ή μαγνητικός αναδευτήρας. |
|
4.3. |
Περιστρεφόμενος εξατμιστήρας υμενίου. |
|
4.4. |
Συσκευή HPLC με ανιχνευτή υπεριώδους ακτινοβολίας μεταβλητού μήκους κύματος ή με αντιστοιχία διόδιων ως ανιχνευτή η οποία να λειτουργεί στην περιοχή 250-400 nm. |
|
4.4.1. |
Στήλη υγρής χρωματογραφίας διαστάσεων 300 mm × 4 mm, με πληρωτικό υλικό C18 πάχους 10 μm ή ισοδύναμη |
|
4.5. |
Διηθητικός χάρτης από ίνες υάλου (Whatman GF/A ή άλλου ισοδύναμου τύπου) |
|
4.6. |
Διηθητικές μεμβράνες πάχους 0,22 μm |
|
4.7. |
Διηθητικές μεμβράνες πάχους 0,45 μm |
5. Διαδικασία
|
Σημείωση: |
Η ροβενιδίνη παρουσιάζει ευαισθησία στο φως και γι’ αυτό πρέπει σε όλες τις ενέργειες να χρησιμοποιούνται υάλινα σκεύη φαιοκίτρινου χρώματος. |
5.1. Γενικά
|
5.1.1. |
Πρέπει να αναλυθεί τυφλό δείγμα ζωοτροφής για να διαπιστωθεί ότι δεν υπάρχει σε αυτό ούτε ροβενιδίνη ούτε άλλες παρεμποδίζουσες ουσίες. |
|
5.1.2. |
Για να εξακριβωθεί ο βαθμός ανάκτησης, πρέπει να αναλυθεί τυφλό δείγμα ζωοτροφής (5.1.1) το οποίο θα έχει προηγουμένως εμπλουτιστεί με ποσότητα ροβονιδίνης παραπλήσια εκείνης του δείγματος. Για εμπλουτισμό μέχρι 60 mg/kg, μεταφέρουμε 3,0 ml του αρχικού πρότυπου διαλύματος (3.9.1) σε κωνική φιάλη των 250 ml. Εξατμίζουμε το διάλυμα υπό ρεύμα αζώτου μέχρις ότου απομείνουν περί τα 0,5 ml. Προσθέτουμε 15 g του τυφλού δείγματος, αναμειγνύουμε και αναμένουμε επί 10 λεπτά πριν προχωρήσουμε στην εκχύλιση (5.2).
|
5.2. Εκχύλιση
Ζυγίζονται περί τα 15 g που παρασκευασθέντος δείγματος με προσέγγιση 0,01 g, εισάγονται σε κωνική φιάλη των 250 ml όπου και προστίθενται 100,0 ml οξινισμένης μεθανόλης (3.2). Πωματίζεται η φιάλη και ανακινείται επί μία ώρα με τον αναδευτήρα (4.2). Το διάλυμα διηθείται μέσω διηθητικού χάρτη από ίνες υάλου (4.5) και το διήθημα συλλέγεται σε κωνική φιάλη των 150 ml. Προστίθενται 7,5 g από μοριακό κόσκινο (3.4), πωματίζεται η φιάλη και ανακινείται το περιεχόμενο επί 5 λεπτά. Το παρασκεύασμα διηθείται μέσω διηθητικού χάρτη από υάλινες ίνες και το λαμβανόμενο διάλυμα φυλάσσεται για το στάδιο διαχωρισμού (5.3).
5.3. Καθαρισμός
5.3.1.
Μικρό βύσμα υαλοβάμβακος τοποθετείται στο κάτω μέρος μιας υάλινης στήλης (4.1) και συμπιέζεται με τη βοήθεια υάλινης ράβδου. Ζυγίζονται 11,0 g του παρασκευασθέντος οξειδίου του αργιλίου (3.5) και μεταφέρονται στη στήλη. Λαμβάνεται φροντίδα ώστε κατά το στάδιο αυτό η έκθεση στον ατμοσφαιρικό αέρα να περιορισθεί στο ελάχιστο. Χτυπάμε ελαφρά τη στήλη από το κάτω μέρος της ώστε να κατακαθίσει το οξείδιο του αργιλίου.
5.3.2.
Με ένα σιφώνιο εισάγονται στη στήλη 5,0 ml από το εκχύλισμα που ελήφθη κατά το στάδιο 5.2. Φέρεται στο άκρο του σιφωνίου πλησίον του τοιχώματος της στήλης και το διάλυμα αφήνεται να απορροφηθεί από το οξείδιο του αργιλίου. Εκλούεται η ροβενιδίνη από τη στήλη με 100 ml μεθανόλης (3.1) σε ρυθμό ροής 2-3 ml/min και συλλέγεται το υγρό της έκλουσης σε σφαιρική φιάλη των 250 ml. Το διάλυμα μεθανόλης εξατμίζεται μέχρι πλήρους ξήρανσης σε θερμοκρασία 40 oC και υπό ελαττωμένη πίεση με τη βοήθεια περιστροφικού εξατμιστήρα υμενίου (4.3). Το υπόλειμμα διαλύεται εκ νέου σε 3-4 ml κινητής φάσης (3.8) και μεταφέρεται ποσοτικά σε βαθμονομημένη φιάλη των 10 ml. Η φιάλη εκπλύνεται επανειλημμένως με 1-2 ml κινητής φάσης κάθε φορά και τα υπολείμματα των εκπλύσεων μεταφέρονται στη βαθμονομημένη φιάλη. Προστίθεται ο ίδιος διαλύτης στη βαθμονομημένη φιάλη μέχρι τη χαραγή και το περιεχόμενο της φιάλης αναμειγνύεται. Μέρος του τελευταίου αυτού διαλύματος διηθείται μέσω μεμβράνης των 0,45 μm (4.7) και φυλάσσεται για τον προσδιορισμό με χρωματογραφία HPLC (5.4).
5.4. Προσδιορισμός με χρωματογραφία HPLC
5.4.1.
Οι ακόλουθες πειραματικές συνθήκες είναι απλώς ενδεικτικές- ισοδύναμα αποτελέσματα μπορούν να προκύψουν και υπό άλλες συνθήκες:
Στήλη υγρής χρωματογραφίας (4.4.1),
Κινητή φάση HPLC (3.8),
Ρυθμός ροής: 1,5 έως 2 ml/min,
Μήκος κύματος ανίχνευσης: 317 nm,
Όγκος εισαγόμενου δείγματος: 20 έως 50 μl.
Ελέγχεται η σταθερότητα της χρωματογραφικής διάταξης με επανειλημμένη εισαγωγή του διαλύματος αναφοράς (3.9.3) συγκέντρωσης 3,6 μg/ml έως ότου επιτευχθούν σταθερά ύψη κορυφών ή εμβαδά και σταθεροί χρόνοι κατακράτησης.
5.4.2.
Εισάγεται κατ’ επανάληψη καθένα από τα διαλύματα αναφοράς (3.9.3) και μετρούνται τα ύψη των κορυφών (εμβαδά) για κάθε συγκέντρωση. Χαράσσεται η καμπύλη αναφοράς με τεταγμένες τις μέσες τιμές του ύψους των κορυφών ή τις μέσες τιμές των εμβαδών και με τετμημένες τις αντίστοιχες συγκεντρώσεις σε μg ανά ml.
5.4.3.
Εισάγεται κατ’ επανάληψη στη στήλη το εκχύλισμα του δείγματος (5.3.2) σε όγκο ίσο με εκείνον που χρησιμοποιήθηκε για τα διαλύματα αναφοράς και προσδιορίζεται το μέσο ύψος κορυφής (εμβαδόν) των κορυφών που αντιστοιχούν στη ροβενιδίνη.
6. Υπολογισμός των αποτελεσμάτων
Προσδιορίζεται η συγκέντρωση του διαλύματος του δείγματος σε μg/ml με βάση το μέσο ύψος (εμβαδόν) των κορυφών της ροβενιδίνης του διαλύματος του δείγματος με τη βοήθεια της καμπύλης αναφοράς (5.4.2).
Η περιεκτικότητα του δείγματος σε ροβενιδίνη κατά βάρος (mg/kg) υπολογίζεται με βάση τον ακόλουθο τύπο:

όπου:
|
c |
= |
συγκέντρωση της ροβενιδίνης στο διάλυμα του δείγματος, σε μg/ml, |
|
m |
= |
βάρος του δείγματος δοκιμής σε γραμμάρια. |
7. Επικύρωση των αποτελεσμάτων
7.1. Ταυτότητα της ανιχνευόμενης ουσίας
Η ταυτότητα της ανιχνευόμενης ουσίας μπορεί να επιβεβαιωθεί με συγχρωματογραφία ή με τη χρήση συστοιχίας διόδων ως ανιχνευτή με τον οποίο γίνεται σύγκριση των φασμάτων του εκχυλίσματος του δείγματος και του διαλύματος αναφοράς (3.9.3) συγκέντρωσης 6,0 μg/ml.
7.1.1.
Εκχύλισμα του δείγματος εμπλουτίζεται με προσθήκη κατάλληλης ποσότητας του διαλύματος αναφοράς (3.9.3). Η ποσότητα της προστιθέμενης ροβενιδίνης πρέπει να είναι παραπλήσια προς την κατ’ εκτίμηση υπολογιζόμενη ποσότητα ροβενιδίνης στο εκχύλισμα του δείγματος.
Αν συνεκτιμηθούν τόσο η ποσότητα που προστέθηκε όσο και η αραίωση του εκχυλίσματος, πρέπει να σημειωθεί ενίσχυση μόνον της κορυφής που αντιστοιχεί στη ροβενιδίνη. Το εύρος της κορυφής στο ήμισυ περίπου του μεγίστου ύψους αυτής πρέπει να κυμαίνεται κατά 10 % περίπου σε σχέση με το αρχικό εύρος.
7.1.2.
Τα αποτελέσματα αξιολογούνται με βάση τα ακόλουθα κριτήρια:
|
α) |
Τα μήκη κύματος στα οποία παρατηρείται η μέγιστη απορρόφηση στο φάσμα του δείγματος και στο φάσμα του προτύπου και τα οποία αντιστοιχούν στο μέγιστο ύψος των κορυφών στο χρωματογράφημα πρέπει να είναι τα ίδια, με μια διαφορά της οποίας τα όρια καθορίζονται από τη διαχωριστική ικανότητα της ανιχνευτικής διάταξης. Για ανίχνευση με συστοιχία διόδων, το περιθώριο αυτό είναι ± 2 nm. |
|
β) |
Μεταξύ 250 και 400 nm, τα φάσματα του δείγματος και του προτύπου, καταγραφόμενα στο μέγιστο ύψος των κορυφών στο χρωματογράφημα, δεν πρέπει να διαφέρουν για τα τμήματα εκείνα του φάσματος που περικλείονται μεταξύ 10 και 100 % της σχετικής απορρόφησης. Το κριτήριο αυτό πληρούται όταν παρατηρούνται οι ίδιες μέγιστες τιμές και σε κανένα σημείο η απόκλιση μεταξύ των δύο φασμάτων δεν υπερβαίνει το 15 % της απορρόφησης της πρότυπης ανιχνευόμενης ουσίας. |
|
γ) |
Μεταξύ 250 και 400 nm, τα φάσματα στο ανερχόμενο τμήμα, στο μέγιστο ύψος και στο κατερχόμενο τμήμα της κορυφής του εκχυλίσματος του δείγματος δεν πρέπει να διαφέρουν το ένα από το άλλο για τα τμήματα εκείνα του φάσματος που περικλείονται μεταξύ 10 % και 100 % της σχετικής απορρόφησης. Το κριτήριο αυτό πληρούται όταν παρατηρούνται οι ίδιες μέγιστες τιμές και σε κανένα σημείο η απόκλιση μεταξύ των φασμάτων δεν υπερβαίνει το 15 % της απορρόφησης του φάσματος στο μέγιστο ύψος. |
Εάν έστω και ένα από τα ανωτέρω κριτήρια δεν πληρούται, τότε η παρουσία της ανιχνευόμενης ουσίας δεν θεωρείται επιβεβαιωθείσα.
7.2. Επαναληψιμότητα
Η διαφορά μεταξύ των αποτελεσμάτων δύο παράλληλα διενεργούμενων ποσοτικών προσδιορισμών επί του ιδίου δείγματος δεν πρέπει να υπερβαίνει το 10 % του αποτελέσματος με την υψηλότερη τιμή, για περιεκτικότητα σε ροβενιδίνη μεγαλύτερη από 15 mg/kg.
7.3. Ανάκτηση
Για ένα εμπλουτισμένο τυφλό δείγμα, η ανάκτηση πρέπει να είναι τουλάχιστον 85 %.
8. Αποτελέσματα διεργαστηριακής μελέτης
Διοργανώθηκε από την Κοινότητα η πραγματοποίηση διεργαστηριακής μελέτης κατά την οποία αναλύθηκαν 4 δείγματα ζωοτροφών για πουλερικά και κουνέλια, υπό τη μορφή αλεύρων ή μορφή συμπήκτων. Οι αναλύσεις πραγματοποιήθηκαν σε 12 εργαστήρια και κάθε δείγμα αναλύθηκε δύο φορές. Τα αποτελέσματα των αναλύσεων είναι τα ακόλουθα:
|
|
Ζωοτροφές για πουλερικά |
Ζωοτροφές για κουνέλια |
||
|
|
Άλευρα |
Σύμπηκτα |
Άλευρα |
Σύμπηκτα |
|
Μέσος όρος [mg/kg] |
27,00 |
27,99 |
43,6 |
40,1 |
|
sr [mg/kg] |
1,46 |
1,26 |
1,44 |
1,66 |
|
CVr [%] |
5,4 |
4,5 |
3,3 |
4,1 |
|
SR [mg/kg] |
4,36 |
3,36 |
4,61 |
3,91 |
|
CVR [%] |
16,1 |
12,0 |
10,6 |
9,7 |
|
Ανάκτηση [%] |
90,0 |
93,3 |
87,2 |
80,2 |
|
sr |
= |
τυπική απόκλιση επαναληψιμότητας |
|
CVr |
= |
συντελεστής μεταβολής της επαναληψιμότητας, % |
|
SR |
= |
τυπική απόκλιση αναπαραγωγιμότητας |
|
CVR |
= |
συντελεστής μεταβολής της αναπαραγωγικότητας, %. |
ΣΤ. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ DICLAZURIL
(+)-4-χλωροφαινυλο[2,6-διχλωρο-4-(2,3,4,5-τετραϋδρο-3,5-διοξο-1,2,4-τριαζιν-2-υλο) φαινυλ]ακετονιτρίλιο
1. Σκοπός και πεδίο εφαρμογής
Η μέθοδος επιτρέπει τον προσδιορισμό του diclazuril σε ζωοτροφές και προμείγματα. Το όριο ανίχνευσης είναι 0,1 mg/kg, το όριο προσδιορισμού είναι 0,5 mg/kg.
2. Αρχή
Μετά από προσθήκη εσωτερικού προτύπου, το δείγμα εκχυλίζεται με οξινισμένη μεθανόλη. Στις ζωοτροφές, κατάλληλη ποσότητα του εκχυλίσματος καθαρίζεται σε φυσίγγιο εκχύλισης στερεάς φάσης C18. Το diclazuril εκλούεται από το φυσίγγιο με μείγμα οξινισμένης μεθανόλης και νερού. Έπειτα από εξάτμιση, το υπόλειμμα διαλύεται σε DMF/νερό. Στα προμείγματα, το εκχύλισμα εξατμίζεται και το υπόλειμμα διαλύεται σε DMF/νερό. Η περιεκτικότητα σε diclazuril προσδιορίζεται με υγρή χρωματογραφία υψηλής απόδοσης (HPLC) ανάστροφης φάσης τριών διαλυμάτων βαθμωτής έκλουσης με χρήση ανιχνευτή UV.
3. Αντιδραστήρια
|
3.1. |
Νερό καθαρότητας ισοδύναμης με HPLC |
|
3.2. |
Οξικό αμμώνιο |
|
3.3. |
Όξινο θειικό τετραβουτυλαμμώνιο (TBHS) |
|
3.4. |
Ακετονιτρίλιο καθαρότητας ισοδύναμης με HPLC |
|
3.5. |
Μεθανόλη καθαρότητας ισοδύναμης με HPLC |
|
3.6. |
Ν, Ν-διμεθυλοφορμαμίδιο (DMF) |
|
3.7. |
Υδροχλωρικό οξύ, ρ20 = 1,19 g/ml |
|
3.8. |
Πρότυπη ουσία: diclazuril ΙΙ-24: (+)-4-χλωροφαινυλο[2,6-διχλωρο-4-(2,3,4,5τετραϋδρο-3,5-διοξο-1,2,4-τριαζιν-2-υλο) φαινυλ] ακετονιτρίλιο εγγυημένης καθαρότητας, E771. |
|
3.8.1. |
Σε ογκομετρική φιάλη των 50 ml ζυγίζονται με ακρίβεια 0,1 mg, 25 mg πρότυπης ουσίας diclazuril (3.8). Διαλύονται σε DMF (3.6), συμπληρώνονται μέχρι τη χαραγή με DMF (3.6) και αναμειγνύονται. Η φιάλη περιτυλίσσεται με φύλλο αλουμινίου ή χρησιμοποιείται σκουρόχρωμη φιάλη και φυλάσσεται στο ψυγείο. Σε θερμοκρασία ≤ 4o C το διάλυμα είναι σταθερό για ένα μήνα. |
|
3.8.2. |
5,00 ml του αρχικού πρότυπου διαλύματος (3.8.1.) μεταφέρονται σε ογκομετρική φιάλη των 50 ml, το διάλυμα συμπληρώνεται μέχρι τη χαραγή με DMF (3.6) και αναμειγνύεται. Η φιάλη περιτυλίσσεται με φύλλο αλουμινίου ή χρησιμοποιείται σκουρόχρωμη φιάλη και φυλάσσεται στο ψυγείο. Σε θερμοκρασία ≤ 4o C το διάλυμα είναι σταθερό για, ενα μήνα. |
|
3.9. |
Ουσία εσωτερικού προτύπου: 2,6 διχλωρο-α-(4-χλωροφαινυλο)-4-(4,5 διυδρο-3,5-διοξο-1,2,4-τριαζιν-2(3Η)-υλο)α-μεθυλοβενζολο-ακετονιτρίλιο |
|
3.9.1. |
Σε ογκομετρική φιάλη των 50 ml ζυγίζονται με ακρίβεια 0,1 mg, 25 mg ουσίας εσωτερικού προτύπου (3.9). Διαλύονται σε DMF (3.6), συμπληρώνονται μέχρι τη χαραγή με DMF (3.6) και αναμειγνύονται. Η φιάλη περιτυλίσσεται με φύλλο αλουμινίου ή χρησιμοποιείται σκουρόχρωμη φιάλη και φυλάσσεται στο ψυγείο. Σε θερμοκρασία ≤ 4o C το διάλυμα είναι σταθερό για ένα μήνα. |
|
3.9.2. |
5,00 ml του αρχικού διαλύματος εσωτερικού προτύπου (3.9.1.) μεταφέρονται σε ογκομετρική φιάλη των 50 ml, το διάλυμα συμπληρώνεται μέχρι τη χαραγή με DMF (3.6) και αναμειγνύεται. Η φιάλη περιτυλίσσεται με φύλλο αλουμινίου ή χρησιμοποιείται σκουρόχρωμη φιάλη και φυλάσσεται στο ψυγείο. Σε θερμοκρασία ≤ 4o C το διάλυμα είναι σταθερό για ένα μήνα. |
|
3.9.3. |
Δ (p = ονομαστική περιεκτικότητα diclazuril στο πρόμειγμα σε mg/kg) Σε ογκομετρική φιάλη των 100 ml ζυγίζονται με ακρίβεια 0,1 mg ρ/10 mg της ουσίας εσωτερικού προτύπου, διαλύονται σε DMF (3.6) σε λουτρό υπερήχων (4.6), το διάλυμα συμπληρώνεται μέχρι τη χαραγή με DMF και αναμειγνύεται. Η φιάλη περιτυλίσσεται με φύλλο αλουμινίου ή χρησιμοποιείται σκουρόχρωμη φιάλη και φυλάσσεται στο ψυγείο. Σε θερμοκρασία ≤ 4o C το διάλυμα είναι σταθερό για ένα μήνα. |
|
3.10. |
Διάλυμα βαθμονόμησης, 2 μg/ml. 2,00 ml πρότυπου διαλύματος diclazuril (3.8.2) και 2,00 ml διαλύματος εσωτερικού προτύπου (3.9.2) μεταφέρονται με σιφώνιο σε ογκομετρική φιάλη των 50 ml. Προστίθενται 16 ml DMF (3.6), το διάλυμα συμπληρώνεται μέχρι τη χαραγή με νερό και αναμειγνύεται. Το διάλυμα αυτό πρέπει να παρασκευάζεται λίγο πριν να χρησιμοποιηθεί. |
|
3.11. |
Στήλη εκχύλισης στερεάς φάσης C18, π.χ. Bond Elut, μέγεθος: 1 cc, προσροφητικό βάρος: 100 mg. |
|
3.12. |
Διαλύτης εκχύλισης: οξινισμένη μεθανόλη. 5,0 ml υδροχλωρικού οξέος (3.7) φέρονται με σιφώνιο σε 1 000 ml μεθανόλης (3.5), και αναμειγνύονται. |
|
3.13. |
Κινητή φάση για HPLC |
|
3.13.1. |
Υγρό έκλουσης A: διάλυμα οξικού αμμωνίου-όξινου θειικού τετραβουτυλαμμωνίου. 5 g οξικού αμμωνίου (3.2) και 3,4 g TBHS (3.3) διαλύονται σε 1 000 ml νερού (3.1) και αναμειγνύονται. |
|
3.13.2. |
Υγρό έκλουσης Β: ακετονιτρίλιο (3.4). |
|
3.13.3. |
Υγρό έκλουσης Γ: μεθανόλη (3.5). |
4. Όργανα
|
4.1. |
Συσκευή μηχανικής ανακίνησης |
|
4.2. |
Εξοπλισμός HPLC με σύστημα τριών διαλυτών βαθμωτής έκλουσης |
|
4.2.1. |
Στήλη υγρής χρωματογραφίας, Hypersil ODS, 3 μm, 100 mm × 4,6 mm ή ισοδύναμη |
|
4.2.2. |
Ανιχνευτής UV με δυνατότητα ρύθμισης σε διάφορα μήκη κύματος ή με διάταξη διόδων |
|
4.3. |
Περιστροφικός εξατμιστήρας υμενίου |
|
4.4. |
Φίλτρο μεμβράνης, 0,45 μm |
|
4.5. |
Πολλαπλή κενού (vacuum manifold) |
|
4.6. |
Λουτρό υπερήχων. |
5. Διαδικασία
5.1. Γενικά
5.1.1.
Πρέπει να διενεργείται ανάλυση τυφλού ώστε να ελέγχεται ότι δεν υπάρχει ούτε diclazuril ούτε κάποια άλλη παρεμποδίζουσα ουσία. Το τυφλό δείγμα πρέπει να είναι παρόμοιου τύπου με εκείνον του δείγματος και δεν πρέπει να ανιχνεύονται σε αυτό diclazuril ή άλλες παρεμποδίζουσες ουσίες.
5.1.2.
Πρέπει να πραγματοποιείται δοκιμή ανάκτησης υποβάλλοντας σε ανάλυση τυφλό δείγμα εμπλουτισμένο με προσθήκη μιας ποσότητας diclazuril, παρόμοιας με εκείνη που υπάρχει στο δείγμα. Για εμπλουτισμό μέχρι 1 mg/kg, 0,1 ml του αρχικού πρότυπου διαλύματος (3.8.1) προστίθενται σε 50 g του τυφλού, αναμειγνύονται επισταμένως και αφήνονται για 10 λεπτά αναμειγνύοντας πάλι μερικές φορές πριν προχωρήσουμε στο στάδιο της εκχύλισης (5.2.)
Εναλλακτικά, εφόσον δεν υπάρχει διαθέσιμο τυφλό παρόμοιου τύπου με το δείγμα (βλέπε 5.1.1), η δοκιμή ανάκτησης μπορεί να γίνει μέσω της μεθόδου προσθήκης προτύπου. Στην περίπτωση αυτή, το προς ανάλυση δείγμα εμπλουτίζεται με ποσότητα diclazuril παρόμοια με εκείνη που υπάρχει ήδη στο δείγμα. Το δείγμα αυτό αναλύεται παράλληλα με το μη εμπλουτισμένο δείγμα και η ανάκτηση μπορεί να υπολογιστεί με αφαίρεση.
5.2. Εκχύλιση
5.2.1.
Ζυγίζονται με ακρίβεια 0,01 g περίπου 50 g του δείγματος. Μεταφέρονται σε κωνική φιάλη των 500 ml, προστίθενται 1,00 ml διαλύματος εσωτερικού προτύπου (3.9.2) και 200 ml διαλύτη εκχύλισης (3.12) και η φιάλη πωματίζεται. Το μείγμα ανακινείται σε συσκευή μηχανικής ανακίνησης (4.1) καθ’ όλη τη διάρκεια της νύκτας. Αφήνεται σε ηρεμία για 10 λεπτά. Ποσότητα 20 ml του υπερκείμενου υγρού μεταφέρεται σε κατάλληλο γυάλινο δοχείο και αραιώνεται με 20 ml νερό. Το διάλυμα αυτό μεταφέρεται σε φυσίγγιο εκχύλισης (3.11), και διέρχεται με εφαρμογή κενού (4.5). Η στήλη (3.11) εκπλένεται με 25 ml μείγματος διαλύτη εκχύλισης (3.12) και νερού, 65 + 35 (V + V). Τα συλλεγόμενα κλάσματα απορρίπτονται και οι απομένουσες ουσίες εκλούονται με 25 ml μείγματος διαλύτη εκχύλισης (3.12) και νερού, 80 + 20 (V + V). Το κλάσμα αυτό εξατμίζεται μέχρι ξηρού σχεδόν με τη βοήθεια του περιστροφικού εξατμιστήρα (4.3) στους 60 oC. Το υπόλειμμα διαλύεται σε 1,0 ml DMF (3.6), προστίθεται 1,5 ml νερό (3.1) και αναμειγνύονται. Ακολουθεί διήθηση μέσω μεμβράνης (4.4) και κατόπιν ο προσδιορισμός με HPLC (5.3).
5.2.2.
Ζυγίζεται με ακρίβεια 0,001 g περίπου 1 g του δείγματος. Μεταφέρεται σε κωνική φιάλη των 500 ml, προστίθεται 1,00 ml διαλύματος εσωτερικού προτύπου (3.9.3), 200 ml διαλύτη εκχύλισης (3.12) και η φιάλη πωματίζεται. Το μείγμα ανακινείται σε συσκευή μηχανικής ανακίνησης (4.1) καθ’ όλη τη διάρκεια της νύκτας. Αφήνεται να κατακαθίσει για 10 λεπτά. Ποσότητα 10 000/p ml (p = ονομαστική περιεκτικότητα του diclazuril στο πρόμειγμα σε mg/kg) του υπερκειμένου υγρού μεταφέρεται σε φιάλη στρογγυλού πυθμένα με κατάλληλο μέγεθος. Το διάλυμα εξατμίζεται μέχρι ξηρού υπό ελαττωμένη πίεση στους 60 oC με τη βοήθεια περιστροφικού εξατμιστήρα (4.3). Το υπόλειμμα αναδιαλύεται σε 10,0 ml DMF (3.6), προστίθενται 15,0 ml νερό (3.1) και αναμειγνύονται. Ακολουθεί ο προσδιορισμός με HPLC (5.3).
5.3. Προσδιορισμός με HPLC
5.3.1.
Παρακάτω, δίδονται ενδεικτικά ορισμένες κατάλληλες συνθήκες. Μπορούν να χρησιμοποιηθούν και διαφορετικές συνθήκες εφόσον παρέχουν ισοδύναμα αποτελέσματα.
|
Στήλη υγρής χρωματογραφίας (4.2.1.): |
100 mm × 4,6 mm, Hypersil ODS, 3 μm ή ισοδύναμη |
|
||||||
|
Κινητή φάση: |
Υγρό έκλουσης A (3.13.1): |
υδατικό διάλυμα οξικού αμμωνίου και όξινου θειικού τετραβουτυλαμμωνίου |
||||||
|
|
Υγρό έκλουσης B (3.13.2): |
ακενονιτρίλιο |
||||||
|
|
Υγρό έκλουσης C (3.13.3): |
μεθανόλη |
||||||
|
Φάση έκλουσης: |
Πλήρωση με B για 10 λεπτά. |
|||||||
|
Ρυθμός ροής: |
1,5-2 ml/min |
|
||||||
|
Όγκος έγχυσης: |
20 μl |
|
||||||
|
Μήκος κύματος ανίχνευσης: |
280 nm |
|
||||||
Ελέγχεται η σταθερότητα του χρωματογραφικού συστήματος, εγχύοντας κατ’ επανάληψη το διάλυμα βαθμονόμησης (3.10) που περιέχει 2 μg/ml, μέχρι να σταθεροποιηθούν τα ύψη των κορυφών και οι χρόνοι κατακράτησης.
5.3.2.
Εγχύονται κατ’ επανάληψη 20 μl του διαλύματος βαθμονόμησης (3.10) και προσδιορίζεται το μέσο ύψος (εμβαδόν) των κορυφών του diclazuril και του εσωτερικού προτύπου.
5.3.3.
Εγχύονται κατ’ επανάληψη 20 μl του διαλύματος δείγματος (5.2.1 ή 5.2.2) και προσδιορίζεται το μέσο ύψος (εμβαδόν) των κορυφών του diclazuril και του εσωτερικού προτύπου.
6. Υπολογισμός των αποτελεσμάτων
6.1. Ζωοτροφές
Η περιεκτικότητα του δείγματος σε diclazuril w (mg/kg) δίδεται από τον ακόλουθο τύπο:
 [mg/kg]
[mg/kg]
όπου:
|
hd, s |
= |
ύψος (εμβαδόν) κορυφής του diclazuril στο διάλυμα δείγματος (5.2.1) |
|
hi, s |
= |
ύψος (εμβαδόν) κορυφής του εσωτερικού προτύπου στο διάλυμα δείγματος (5.2.1) |
|
hd, c |
= |
ύψος (εμβαδόν) κορυφής του diclazuril στο διάλυμα βαθμονόμησης (3.10) |
|
hi, c |
= |
ύψος (εμβαδόν) κορυφής του εσωτερικού προτύπου στο διάλυμα βαθμονόμησης (3.10) |
|
cd, c |
= |
συγκέντρωση του diclazuril στο διάλυμα βαθμονόμησης σε μg/ml (3.10) |
|
m |
= |
βάρος του προς δοκιμή δείγματος σε g. |
|
V |
= |
όγκος του εκχυλίσματος δείγματος σύμφωνα με την παράγραφο 5.2.1 (δηλαδή 2,5 ml) |
6.2. Προμείγματα
Η περιεκτικότητα του δείγματος σε diclazuril κατά βάρος (mg/kg) δίδεται από τον ακόλουθο τύπο:
 [mg/kg]
[mg/kg]
όπου:
|
hd, c |
= |
ύψος (εμβαδόν) κορυφής του diclazuril στο διάλυμα βαθμονόμησης (3.10) |
|
hi, c |
= |
ύψος (εμβαδόν) κορυφής του εσωτερικού προτύπου στο διάλυμα βαθμονόμησης (3.10) |
|
hd, s |
= |
ύψος (εμβαδόν) κορυφής του diclazuril στο διάλυμα δείγματος (5.2.2) |
|
hi, s |
= |
ύψος (εμβαδόν) κορυφής του εσωτερικού προτύπου στο διάλυμα δείγματος (5.2.2) |
|
cd, c |
= |
συγκέντρωση του diclazuril στο διάλυμα βαθμονόμησης σε μg/ml (3.10) |
|
m |
= |
βάρος του προς δοκιμή δείγματος σε g. |
|
V |
= |
όγκος του εκχυλίσματος δείγματος σύμφωνα με την παράγραφο 5.2.2 (δηλαδή 25 ml) |
|
p |
= |
ονομαστική συγκέντρωση του diclazuril σε mg/kg στο πρόμειγμα |
7. Επικύρωση των αποτελεσμάτων
7.1. Ταυτότητα
Η ταυτότητα της αναλυόμενης ουσίας μπορεί να ελεγχθεί με συγχρωματογραφία ή με τη βοήθεια ανιχνευτή διόδων με τον οποίο συγκρίνονται τα φάσματα του εκχυλίσματος (5.2.1 ή 5.2.2) και του διαλύματος βαθμονόμησης (3.10).
7.1.1.
Εκχύλισμα δείγματος (5.2.1 ή 5.2.2) εμπλουτίζεται με προσθήκη κατάλληλης ποσότητας διαλύματος βαθμονόμησης (3.10). Η ποσότητα του προστιθέμενου diclazuril πρέπει να είναι παρόμοια με την ποσότητα του diclazuril που βρίσκεται στο εκχύλισμα.
Λαμβάνοντας υπόψη τόσο την προστιθέμενη ποσότητα όσο και την αραίωση του εκχυλίσματος, μόνον το ύψος της κορυφής του diclazuril και της κορυφής του εσωτερικού προτύπου πρέπει να βρίσκεται αυξημένο. Το πλάτος της κορυφής, στα μισά του ύψους, δεν πρέπει να αποκλίνει περισσότερο από ± 10 % του αρχικού πλάτους της κορυφής του diclazuril ή της κορυφής του εσωτερικού προτύπου του μη εμπλουτισμένου εκχυλίσματος δείγματος.
7.1.2.
Τα αποτελέσματα αξιολογούνται με τα ακόλουθα κριτήρια:
|
α) |
Το μήκος κύματος της μέγιστης απορρόφησης των φασμάτων του δείγματος και του προτύπου, που καταγράφονται στο υψηλότερο σημείο της κορυφής στο χρωματογράφημα, πρέπει να είναι ίδια στα πλαίσια των περιθωρίων που δικαιολογούνται από την αναλυτική ισχύ του συστήματος ανίχνευσης. Το περιθώριο αυτό στην ανίχνευση με διάταξη διόδων είναι συνήθως ± 2 nm. |
|
β) |
Μεταξύ 230 και 320 nm, τα φάσματα του δείγματος και του προτύπου που καταγράφονται στο υψηλότερο σημείο της κορυφής του χρωματογραφήματος, δεν πρέπει να διαφέρουν στα μέρη εκείνα του φάσματος που είναι στην περιοχή του 10-100 % της σχετικής απορρόφησης. Το κριτήριο αυτό εκπληρώνεται όταν εμφανίζονται τα ίδια μέγιστα και σε κανένα υπό παρατήρηση σημείο η απόκλιση μεταξύ των δύο φασμάτων δεν υπερβαίνει το 15 % της απορρόφησης της πρότυπης αναλυόμενης ουσίας. |
|
γ) |
Μεταξύ 230 και 320 nm, τα φάσματα του ανερχόμενου τμήματος, του υψηλότερου σημείου και του κατερχόμενου τμήματος της κορυφής του εκχυλίσματος του δείγματος δεν πρέπει να διαφέρουν μεταξύ τους στα μέρη εκείνα του φάσματος που είναι στην περιοχή του 10-100 % της σχετικής πυκνότητας. Το κριτήριο αυτό εκπληρώνεται όταν εμφανίζονται τα ίδια μέγιστα και όταν σε όλα τα υπό παρατήρηση σημεία η απόκλιση μεταξύ των φασμάτων δεν υπερβαίνει το 15 % της απορρόφησης του φάσματος του υψηλότερου σημείου της κορυφής. |
Εφόσον ένα από αυτά τα κριτήρια δεν εκπληρώνεται, δεν θεωρείται επιβεβαιωμένη η παρουσία της αναλυόμενης ουσίας.
7.2. Επαναληψιμότητα
Η διαφορά μεταξύ των αποτελεσμάτων δύο παράλληλα διενεργούμενων προσδιορισμών στο ίδιο δείγμα δεν πρέπει να υπερβαίνει:
|
— |
το 30 % σε σχέση με την υψηλότερη τιμή για περιεκτικότητες σε diclazuril από 0,5 mg/kg έως 2,5 mg/kg, |
|
— |
τα 0,75 mg/kg για περιεκτικότητες σε diclazuril μεταξύ 2,5 mg/kg και 5 mg/kg, |
|
— |
το 15 % σε σχέση με την υψηλότερη τιμή για περιεκτικότητες σε diclazuril άνω των 5 mg/kg. |
7.3. Ανάκτηση
Σε εμπλουτισμένο (τυφλό) δείγμα, η ανάκτηση πρέπει να είναι τουλάχιστον 80 %.
8. Αποτελέσματα διεργαστηριακής μελέτης
Πραγματοποιήθηκε διεργαστηριακή μελέτη στην οποία αναλύθηκαν 5 δείγματα από 11 εργαστήρια. Τα δείγματα αυτά συνίσταντο σε δύο προμείγματα: το ένα αναμείχθηκε με οργανικό υλικό (Ο 100) και το άλλο με ανόργανο υλικό (Α 100). Η θεωρητική περιεκτικότητα είναι 100 mg diclazuril ανά kg. Οι τρεις μεικτές πτηνοτροφές παρασκευάστηκαν από τρεις διαφορετικούς παραγωγούς (NL) (L1/Ζ1/Κ1). Η θεωρητική περιεκτικότητα είναι 1 mg diclazuril ανά kg. Οι οδηγίες προς τα εργαστήρια ήταν να αναλύσουν κάθε δείγμα μια φορά ή εις διπλούν. (Για περισσότερες λεπτομέρειες σχετικά με αυτή τη διεργαστηριακή μελέτη βλέπε Journal of AOAC International, τόμος 77, αριθ. 6, 1994, σ. 1359-1361). Τα αποτελέσματα δίδονται στον ακόλουθο πίνακα.
|
|
Δείγμα 1 A 100 |
Δείγμα 2 O 100 |
Δείγμα 3 L1 |
Δείγμα 4 Z1 |
Δείγμα 5 K1 |
|
L |
11 |
11 |
11 |
11 |
6 |
|
n |
19 |
18 |
19 |
19 |
12 |
|
Μέσος όρος |
100,8 |
103,5 |
0,89 |
1,15 |
0,89 |
|
Sr (mg/kg) |
5,88 |
7,64 |
0,15 |
0,02 |
0,03 |
|
CVr (%) |
5,83 |
7,38 |
17,32 |
1,92 |
3,34 |
|
SR (mg/kg) |
7,59 |
7,64 |
0,17 |
0,11 |
0,12 |
|
CVR (%) |
7,53 |
7,38 |
18,61 |
9,67 |
13,65 |
|
Ονομαστική περιεκτικότητα (mg/kg) |
100 |
100 |
1 |
1 |
1 |
|
L |
= |
αριθμός εργαστηρίων |
|
n |
= |
αριθμός μεμονωμένων τιμών |
|
Sr |
= |
τυπική απόκλιση επαναληψιμότητας |
|
CVr |
= |
συντελεστής διακύμανσης επαναληψιμότητας |
|
SR |
= |
τυπική απόκλιση αναπαραγωγιμότητας |
|
CVR |
= |
συντελεστής διακύμανσης αναπαραγωγιμότητας. |
9. Παρατηρήσεις
Η απόκριση του diclazuril πρέπει να έχει καταδειχθεί προηγουμένως ότι είναι γραμμική στην περιοχή των μετρούμενων συγκεντρώσεων.
Ζ. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΑΛΑΤΟΣ ΤΟΥ LASALOCID ΜΕ ΝΑΤΡΙΟ
Άλας με νάτριο πολυαιθέρα μονοκαρβονικού οξέος παραγόμενου από τον Streptomyces lasaliensis
1. Σκοπός και πεδίο εφαρμογής
Η παρούσα μέθοδος επιτρέπει τον προσδιορισμό του άλατος του lasalocid με νάτριο σε ζωοτροφές και προμείγματα. Το όριο ανίχνευσης είναι 5 mg/kg, το όριο προσδιορισμού είναι 10 mg/kg.
2. Βασική αρχή της μεθόδου
Το άλας του lasalocid με νάτριο εκχυλίζεται από το δείγμα σε οξυνισμένη μεθανόλη και προσδιορίζεται με υγρή χρωματογραφία υψηλής απόδοσης (HPLC) ανεστραμμένης φάσης με χρήση φασματοφθορισμομετρικού ανιχνευτή.
3. Αντιδραστήρια
|
3.1. |
Δισόξινο φωσφορικό κάλιο (KH2PO4) |
|
3.2. |
Ορθοφωσφορικό οξύ, w (w/w) = 85 % |
|
3.3. |
Διάλυμα ορθοφωσφορικού οξέος, c = 20 % Διαλύονται 23,5 ml ορθοφωσφορικού οξέος (3.2) σε 100 ml με νερό. |
|
3.4. |
6-μεθυλο-2-επτυλαμίνη (1,5-διμεθυλεξυλαμίνη), w (w/w) = 99 % |
|
3.5. |
Μεθανόλη καθαρότητας ισοδύναμης με HPLC |
|
3.6. |
Υδροχλωρικό οξύ, πυκνότητα = 1,19 g/ml |
|
3.7. |
Ρυθμιστικό διάλυμα φωσφορικών αλάτων, c = 0,01 mol/l Διαλύονται 1,36 g KH2PO4 (3.1) σε 500 ml νερού (3.11), προστίθενται 3,5 ml ορθοφωσφορικού οξέος (3.2) και 10,0 ml 6-μεθυλο-2-επτυλαμίνης (3.4). Ρυθμίζεται το pH σε 4,0 με διάλυμα ορθοφωσφορικού οξέος (3.3) και ο όγκος συμπληρώνεται μέχρι τα 1 000 με νερό (3.11). |
|
3.8. |
Οξυνισμένη μεθανόλη 5,0 ml υδροχλωρικού οξέος (3.6) μεταγγίζονται σε ογκομετρική φιάλη των 1 000 ml, ο όγκος συμπληρώνεται μέχρι τη χαραγή με μεθανόλη (3.5) και το σύνολο ανακινείται. Το διάλυμα παρασκευάζεται για άμεση χρήση. |
|
3.9. |
Κινητή φάση για την HPLC, ρυθμιστικό διάλυμα φωσφορικών αλάτων-διάλυμα μεθανόλης σε αναλογία 5 + 95 (V + V) Αναμειγνύονται 5 ml ρυθμιστικού διαλύματος φωσφορικών αλάτων (3.7) με 95 ml μεθανόλης (3.5). |
|
3.10. |
Πρότυπη ουσία άλατος lasalocid με νάτριο εγγυημένης καθαρότητας, C34H53O8Na (άλας με νάτριο πολυαιθέρα μονοκαρβονικού οξέος παραγόμενου από τον Streptomyces lasaliensis), E763 |
|
3.10.1. |
Σε ογκομετρική σφαιρική φιάλη των 100 ml ζυγίζονται, με ακρίβεια 0,1 mg, 50 mg άλατος lasalocid με νάτριο (3.10), διαλύονται σε οξυνισμένη μεθανόλη (3.8), ο όγκος συμπληρώνεται μέχρι τη χαραγή με τον ίδιο διαλύτη και το σύνολο ανακινείται. Το διάλυμα παρασκευάζεται για άμεση χρήση. |
|
3.10.2. |
Σε ογκομετρική φιάλη των 100 ml φέρονται με σιφώνιο 10,0 ml του αρχικού πρότυπου διαλύματος (3.10.1) και ο όγκος συμπληρώνεται μέχρι τη χαραγή με οξυνισμένη μεθανόλη (3.8) και το σύνολο ανακινείται. Το διάλυμα παρασκευάζεται για άμεση χρήση. |
|
3.10.3. |
1,0, 2,0, 4,0, 5,0 και 10,0 ml του ενδιαμέσου πρότυπου διαλύματος (3.10.2) μεταγγίζονται σε μια σειρά ογκομετρικών φιαλών των 50 ml. Ο όγκος συμπληρώνεται μέχρι τη χαραγή με οξυνισμένη μεθανόλη (3.8) και οι φιάλες ανακινούνται. Τα διαλύματα αυτά αντιστοιχούν σε 1,0, 2,0, 4,0, 5,0 και 10,0 μg/ml άλατος lasalocid με νάτριο αντιστοίχως. Το διάλυμα παρασκευάζεται για άμεση χρήση. |
|
3.11. |
Νερό καθαρότητας ισοδύναμης με HPLC |
4. Εργαστηριακά σκεύη ή όργανα
|
4.1. |
Λουτρό υπερήχων (ή ανακινούμενο υδατόλουτρο) με ελεγχόμενη θερμοκρασία |
|
4.2. |
Διηθητικές μεμβράνες, 0,45 μm |
|
4.3. |
Εξοπλισμός HPLC με σύστημα έγχυσης, κατάλληλο για έγχυση όγκων 20 μl. |
|
4.3.1. |
Στήλη υγρής χρωματογραφίας διαστάσεων 125 mm × 4 mm, υλικό πλήρωσης ανεστραμμένης φάσης C18, 5 μm ή ισοδύναμη |
|
4.3.2. |
Φασματοφθορισμόμετρο με δυνατότητα ρύθμισης σε διάφορα μήκη κύματος διέγερσης και εκπομπής |
5. Διαδικασία
5.1. Γενικά
5.1.1.
Για την εκτέλεση της δοκιμής ανάκτησης (5.1.2), πρέπει να διενεργείται ανάλυση τυφλού ώστε να ελέγχεται ότι δεν υπάρχει ούτε άλας του lasalocid με νάτριο ούτε κάποια άλλη παρεμποδιστική ουσία. Το τυφλό δείγμα πρέπει να είναι παρόμοιου τύπου με εκείνο του δείγματος και δεν πρέπει να ανιχνεύονται σε αυτό άλας του lasalocid με νάτριο ή άλλες παρεμποδιστικές ουσίες.
5.1.2.
Πρέπει να πραγματοποιείται δοκιμή ανάκτησης υποβάλλοντας σε ανάλυση τυφλό δείγμα εμπλουτισμένο με προσθήκη ποσότητας άλατος του lasalocid με νάτριο, παρόμοιας με εκείνη που υπάρχει στο δείγμα. Για εμπλουτισμό μέχρι 100 mg/kg, 10,0 ml του αρχικού πρότυπου διαλύματος (3.10.1) μεταγγίζονται σε κωνική φιάλη των 250 ml και το διάλυμα εξατμίζεται μέχρις όγκου περίπου 0,5 ml. Προστίθενται 50 g του τυφλού, αναμειγνύονται επιμελώς και αφήνονται για 10 λεπτά αναμειγνύοντας πάλι μερικές φορές πριν προχωρήσουμε στο στάδιο της εκχύλισης (5.2).
Εναλλακτικά, εφόσον δεν υπάρχει διαθέσιμο τυφλό παρόμοιου τύπου με το δείγμα (βλ. 5.1.1), η δοκιμή ανάκτησης μπορεί να γίνει μέσω της μεθόδου προσθήκης προτύπου. Στην περίπτωση αυτή, το προς ανάλυση δείγμα εμπλουτίζεται με ποσότητα άλατος του lasalocid με νάτριο παρόμοια με εκείνη που υπάρχει ήδη στο δείγμα. Το δείγμα αυτό αναλύεται παράλληλα με το μη εμπλουτισμένο δείγμα και η ανάκτηση μπορεί να υπολογιστεί με αφαίρεση.
5.2. Εκχύλιση
5.2.1.
Σε κωνική φιάλη των 250 ml με πώμα ζυγίζονται, με ακρίβεια 0,01 g, 5 έως 10 g του δείγματος. Προστίθενται με σιφώνιο 100,0 ml οξυνισμένης μεθανόλης (3.8). Τοποθετείται χαλαρά το πώμα και ακολουθεί περιδίνηση μέχρι να επιτευχθεί διασπορά. Η φιάλη τοποθετείται στο λουτρό υπερήχων (4.1) και αφήνεται για 20 λεπτά στους 40 oC, στη συνέχεια απομακρύνεται από το λουτρό και ψύχεται σε θερμοκρασία δωματίου. Το διάλυμα αφήνεται σε ηρεμία επί μία ώρα μέχρι να καθιζάνουν οι αιωρούμενες ύλες, στη συνέχεια καθορισμένη ποσότητα του διαλύματος διηθείται μέσω διηθητικής μεμβράνης 0,45 μm (4.2) σε κατάλληλο δοχείο. Ακολουθεί προσδιορισμός με HPLC (5.3).
5.2.2.
Σε κωνική φιάλη των 250 ml ζυγίζονται, με ακρίβεια 0,001 g, 2 g του μη αλεσμένου προμείγματος. Προστίθενται 100,0 ml οξυνισμένης μεθανόλης (3.8) και ακολουθεί περιδίνηση μέχρι να επιτευχθεί διασπορά. Η φιάλη με το περιεχόμενό της τοποθετείται στο λουτρό υπερήχων (4.1) και αφήνεται για 20 λεπτά σε θερμοκρασία περίπου 40 oC, στη συνέχεια απομακρύνεται από το λουτρό και ψύχεται σε θερμοκρασία δωματίου. Ο όγκος αραιώνεται μέχρι τη χαραγή με οξυνισμένη μεθανόλη (3.8) και αναμειγνύεται επιμελώς. Το διάλυμα αφήνεται σε ηρεμία επί μία ώρα μέχρι να καθιζάνουν οι αιωρούμενες ύλες, στη συνέχεια καθορισμένη ποσότητα του διαλύματος διηθείται μέσω διηθητικής μεμβράνης 0,45 μm (4.2). Κατάλληλος όγκος του διαυγούς διηθήματος αραιώνεται με οξυνισμένη μεθανόλη (3.8) για να ληφθεί το τελικό διάλυμα της δοκιμής που περιέχει περίπου 4 μg/ml άλατος lasalocid με νάτριο. Ακολουθεί προσδιορισμός με HPLC (5.3).
5.3. Προσδιορισμός με HPLC
5.3.1.
Παρακάτω, δίδονται ενδεικτικά ορισμένες κατάλληλες συνθήκες· μπορούν να χρησιμοποιηθούν και διαφορετικές συνθήκες εφόσον παρέχουν ισοδύναμα αποτελέσματα:
|
Στήλη υγρής χρωματογραφίας (4.3.1): |
125 mm × 4 mm, υλικό πλήρωσης ανεστραμμένης φάσης C18, 5 μm ή ισοδύναμη |
|
Κινητή φάση (3.9): |
Μείγμα ρυθμιστικού διαλύματος φωσφορικών αλάτων (3.7) και μεθανόλης (3.5), 5+95 (V+V) |
|
Ρυθμός ροής: |
1,2 ml/min |
|
Μήκη κύματος ανίχνευσης: |
|
|
Διέγερσης: |
310 nm |
|
Εκπομπής: |
419 nm |
|
Όγκος έγχυσης: |
20 μl |
Ελέγχεται η σταθερότητα του χρωματογραφικού συστήματος, εγχέοντας κατ’ επανάληψη το διάλυμα αναφοράς (3.10.3) που περιέχει 4,0 μg/ml, μέχρι να σταθεροποιηθούν τα ύψη των κορυφών και οι χρόνοι κατακράτησης.
5.3.2.
Κάθε διάλυμα αναφοράς (3.10.3) εγχέεται κατ’ επανάληψη και προσδιορίζεται το μέσο ύψος (εμβαδόν) της κορυφής που αντιστοιχεί σε κάθε συγκέντρωση. Χαράσσεται καμπύλη αναφοράς χρησιμοποιώντας ως τεταγμένες τα μέσα ύψη (εμβαδά) των κορυφών των διαλυμάτων αναφοράς και ως τετμημένες τις αντίστοιχες συγκεντρώσεις σε μg/ml.
5.3.3.
Εγχέεται κατ’ επανάληψη το εκχύλισμα του δείγματος που προέκυψε στην παράγραφο 5.2.1 ή 5.2.2 χρησιμοποιώντας τον ίδιο όγκο με εκείνο των διαλυμάτων αναφοράς και προσδιορίζεται το μέσο ύψος (εμβαδόν) των κορυφών του άλατος lasalocid με νάτριο.
6. Υπολογισμός των αποτελεσμάτων
Η περιεκτικότητα στο διάλυμα του δείγματος σε μg/ml προσδιορίζεται από το μέσο ύψος (εμβαδόν) των κορυφών τον άλατος lasalocid με νάτριο του διαλύματος του δείγματος βάσει της καμπύλης αναφοράς ή βαθμονόμησης (5.3.3).
6.1. Ζωοτροφές
Η περιεκτικότητα του δείγματος σε άλας lasalocid με νάτριο κατά βάρος (mg/kg) δίδεται από τον ακόλουθο τύπο:
 [mg/kg]
[mg/kg]
όπου:
|
c |
= |
συγκέντρωση του άλατος lasalocid με νάτριο στο δείγμα (5.2.1) σε μg/ml |
|
V1 |
= |
όγκος εκχυλίσματος του δείγματος σύμφωνα με την παράγραφο 5.2.1 σε ml (δηλαδή 100) |
|
m |
= |
βάρος του δείγματος δοκιμής σε g |
6.2. Προμείγματα
Η περιεκτικότητα του δείγματος σε άλας lasalocid με νάτριο κατά βάρος (mg/kg) δίδεται από τον ακόλουθο τύπο:
 [mg/kg]
[mg/kg]
όπου:
|
c |
= |
συγκέντρωση του άλατος lasalocid με νάτριο στο δείγμα (5.2.2) σε μg/ml |
|
V2 |
= |
όγκος εκχυλίσματος του δείγματος σύμφωνα με την παράγραφο 5.2.2 σε ml (δηλαδή 250) |
|
f |
= |
συντελεστής αραίωσης σύμφωνα με την παράγραφο 5.2.2 |
|
m |
= |
βάρος του δείγματος δοκιμής σε g |
7. Επικύρωση των αποτελεσμάτων
7.1. Ταυτότητα
Οι φασματοφθορισμομετρικές μέθοδοι είναι λιγότερο εκτεθειμένες σε παρεμβολές σε σύγκριση με αυτές που χρησιμοποιούν ανιχνευτή υπεριώδους. Η ταυτότητα της αναλυόμενης ουσίας μπορεί να ελεγχθεί με συγχρωματογραφία.
7.1.1.
Εκχύλισμα δείγματος (5.2.1 ή 5.2.2) εμπλουτίζεται με προσθήκη κατάλληλης ποσότητας διαλύματος αναφοράς (3.10.3). Η ποσότητα του προστιθέμενου άλατος lasalocid με νάτριο πρέπει να είναι παρόμοια με την ποσότητα του άλατος lasalocid με νάτριο που βρίσκεται στο εκχύλισμα. Αυξάνεται μόνο το ύψος της κορυφής του άλατος lasalocid με νάτριο αφού ληφθεί υπόψη η ποσότητα άλατος lasalocid με νάτριο που προστέθηκε και ηαραίωση του εκχυλίσματος. Το πλάτος της κορυφής, στα μισά του ύψους, δεν πρέπει να αποκλίνει περισσότερο από ± 10 % του αρχικού πλάτους της κορυφής του άλατος lasalocid με νάτριο του μη εμπλουτισμένου εκχυλίσματος.
7.2. Ενδοεργαστηριακή επαναληψιμότητα
Η διαφορά μεταξύ των αποτελεσμάτων δύο παράλληλα διενεργούμενων προσδιορισμών στο ίδιο δείγμα δεν πρέπει να υπερβαίνει:
|
— |
το 15 % σε σχέση με την υψηλότερη τιμή για περιεκτικότητες σε άλας lasalocid με νάτριο από 30 mg/kg έως 100 mg/kg, |
|
— |
τα 15 mg/kg για περιεκτικότητες σε άλας lasalocid με νάτριο μεταξύ 100 mg/kg και 200 mg/kg, |
|
— |
7,5 % σε σχέση με την υψηλότερη τιμή για περιεκτικότητες σε άλας lasalocid με νάτριο άνω των 200 mg/kg. |
7.3. Ανάκτηση
Για το εμπλουτισμένο (τυφλό) δείγμα, η ανάκτηση πρέπει να είναι τουλάχιστον 80 %. Για τα εμπλουτισμένα δείγματα προμειγμάτων, η ανάκτηση πρέπει να είναι τουλάχιστον 90 %.
8. Αποτελέσματα διεργαστηριακής μελέτης
Πραγματοποιήθηκε διεργαστηριακή (6) μελέτη στην οποία αναλύθηκαν 2 προμείγματα (δείγματα 1 και 2) και 5 ζωοτροφές (δείγματα 3 έως 7) από δώδεκα εργαστήρια. Η ανάλυση του κάθε δείγματος έγινε εις διπλούν. Τα αποτελέσματα δίδονται στον ακόλουθο πίνακα:
|
|
Δείγμα 1 Πρόμειγμα για κοτόπουλα |
Δείγμα 2 Πρόμειγμα για γαλοπούλες |
Δείγμα 3 Σύμπηκτα για γαλοπούλες |
Δείγμα 4 Θρύμματα για κοτόπουλα |
Δείγμα 5 Ζωοτροφή για γαλοπούλες |
Δείγμα 6 Ζωοτροφή για πουλερικά A |
Δείγμα 7 Ζωοτροφή για πουλερικά B |
|
L |
12 |
12 |
12 |
12 |
12 |
12 |
12 |
|
n |
23 |
23 |
23 |
23 |
23 |
23 |
23 |
|
Μέσος όρος [mg/kg] |
5 050 |
16 200 |
76,5 |
78,4 |
92,9 |
48,3 |
32,6 |
|
sr [mg/kg] |
107 |
408 |
1,71 |
2,23 |
2,27 |
1,93 |
1,75 |
|
CVr [%] |
2,12 |
2,52 |
2,24 |
2,84 |
2,44 |
4,00 |
5,37 |
|
sR [mg/kg] |
286 |
883 |
3,85 |
7,32 |
5,29 |
3,47 |
3,49 |
|
CVR [%] |
5,66 |
5,45 |
5,03 |
9,34 |
5,69 |
7,18 |
10,70 |
|
Ονομαστική περιεκτικότητα [mg/kg] |
5 000 (7) |
16 000 (7) |
80 (7) |
105 (7) |
120 (7) |
50 (8) |
35 (8) |
|
L |
= |
αριθμός εργαστηρίων |
|
n |
= |
αριθμός μεμονωμένων τιμών |
|
sr |
= |
τυπική απόκλιση ενδοεργαστηριακής επαναληψιμότητας |
|
sR |
= |
τυπική απόκλιση διεργαστηριακής επαναληψιμότητας |
|
CVr |
= |
συντελεστής διακύμανσης ενδοεργαστηριακής επαναληψιμότητας, % |
|
CVR |
= |
συντελεστής διακύμανσης διεργαστηριακής επαναληψιμότητας, %. |
(1) Πραγματοποιήθηκε από την ομάδα εργασίας για τις ζωοτροφές του Verband Deutscher Landwirtschaftlicher Untersuchungs- und Forschungsanstalten (VDLUFA).
(2) Πραγματοποιήθηκε από την ομάδα εργασίας για τις ζωοτροφές του Verband Deutscher Landwirtschaftlicher Untersuchungs- und Forschungsanstalten (VDLUFA).
(3) Μπορούν να χρησιμοποιηθούν άλλες μέθοδοι χώνευσης, εφόσον έχει αποδειχθεί ότι έχουν παρόμοια αποτελέσματα (όπως χώνευση υπό πίεση μικροκυμάτων).
(4) Ο πράσινος σανός (φρέσκος ή αποξηραμένος) ενδέχεται να περιέχει μεγάλες ποσότητες φυτικού διοξειδίου του πυριτίου, το οποίον μπορεί να συγκρατεί ιχνοστοιχεία και πρέπει να απομακρυνθεί. Για δείγματα προερχόμενα από τέτοιες ζωοτροφές πρέπει συνεπώς να ακολουθηθεί η επόμενη τροποποιημένη μέθοδος. Εκτελείται η εργασία της παραγράφου 5.1.1.1 μέχρι το στάδιο της διήθησης. Πλένεται το διηθητικό χαρτί που περιέχει το αδιάλυτο κατακράτημα, δύο φορές με βραστό νερό και τοποθετείται σε χωνευτήρι από χαλαζία ή πλατίνα. Αποτεφρώνεται μέσα στο φούρνο με διαφράγματα (4.1) σε θερμοκρασία χαμηλότερη από 550 oC μέχρις ότου όλη η ανθρακώδης ύλη εξαφανισθεί τελείως. Αφήνεται να κρυώσει, προστίθενται μερικές σταγόνες νερού, μετά 10 ως 15 ml υδροφθορικού οξέος (3.4) και εξατμίζεται μέχρι ξηρού στους 150 oC περίπου. Αν παραμείνει ποσότητα διοξείδιο του πυριτίου στο υπόλειμμα, ξαναδιαλύεται σε μερικά ml υδροφθορικού οξέος (3.4) και εξατμίζεται μέχρι ξηρού. Προστίθενται πέντε σταγόνες θειικού οξέος (3.5) και θερμαίνεται μέχρι να σταματήσει η παραγωγή άσπρου καπνού. Μετά την προσθήκη 5 ml υδροχλωρικού οξέος 6 mol/litre (3.2) και περίπου 30 ml νερού, θερμαίνεται, διηθείται το διάλυμα μέσα σε ογκομετρική φιάλη των 250 ml και συμπληρώνεται ο όγκος των 250 ml με νερό (η συγκέντρωση του HCl είναι περίπου 0,5 mol/l). Στη συνέχεια ακολουθείται η διαδικασία από την παράγραφο 5.1.2.
(5) The Analyst 108, 1983, σσ. 1 252 έως 1 256.
(6) Analyst, 1995, 120, 2 175-2 180.
(7) Περιεκτικότητα δηλωμένη από τον κατασκευαστή.
(8) Ζωοτροφή που παρασκευάστηκε στο εργαστήριο.
ΠΑΡΑΡΤΗΜΑ V
ΜΕΘΟΔΟΙ ΑΝΑΛΥΣΗΣ ΓΙΑ ΤΟΝ ΕΛΕΓΧΟ ΤΩΝ ΑΝΕΠΙΘΥΜΗΤΩΝ ΟΥΣΙΩΝ ΣΤΙΣ ΖΩΟΤΡΟΦΕΣ
A. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΗΣ ΕΛΕΥΘΕΡΗΣ ΚΑΙ ΣΥΝΟΛΙΚΗΣ ΓΚΟΣΣΥΠΟΛΗΣ
1. Αντικείμενο και πεδίο εφαρμογής
Η μέθοδος επιτρέπει τον προσδιορισμό της ελεύθερης γκοσσυπόλης, της συνολικής γκοσσυπόλης και των χημικών σχετιζομένων ουσιών εντός σπόρων, αλεύρων και πλακούντων βάμβακος καθώς και εντός σύνθετων τροφών οι οποίες περιέχουν αυτές τις πρώτες ύλες ζωοτροφών. Το κατώτερο όριο προσδιορισμού της ελεύθερης γκοσσυπόλης, της συνολικής γκοσσυπόλης και των χημικών σχετιζομένων ουσιών είναι 20 mg/kg.
2. Αρχή
Η γκοσσυπόλη εκχυλίζεται παρουσία 3 αμινο 1 προπανόλης, είτε με μείγμα ισοπροπανόλης και εξανίου για τον προσδιορισμό της ελεύθερης γκοσσυπόλης, είτε με διμεθυλοφορμαμίδη για τον προσδιορισμό της συνολικής γκοσσυπόλης. Η γκοσσυπόλη μετατρέπεται διά της ανιλίνης σε γκοσσυπόλη-διανιλίνη, της οποίας η οπτική πυκνότητα μετριέται στα 440 nm.
3. Αντιδραστήρια
|
3.1. |
Μείγμα ισοπροπανόλης-εξανίου: Αναμειγνύονται 60 μέρη κατ’ όγκο ισοπροπανόλης σε 40 μέρη κατ’ όγκο κανονικού εξανίου. |
|
3.2. |
Διαλυτικό μέσον Α: Εντός ογκομετρικής φιάλης του ενός λίτρου τίθενται 500 ml περίπου του μείγματος ισοπροπανόλης-εξανίου (3.1), 2 ml 3-αμινο-1-προπανόλης, 8 ml άνυδρου οξεικού οξέος και 50 ml νερού. Συμπληρώνεται ο όγκος με μείγμα ισοπροπανόλης-εξανίου (3.1). Το αντιδραστήριο αυτό παραμένει σταθερό επί μία εβδομάδα. |
|
3.3. |
Διαλυτικό μέσο Β: Τίθενται με σιφώνιο εντός ογκομετρικής φιάλης των 100 ml, 2 ml 3-αμινο-1-προπανόλης και 10 ml άνυδρου οξεικού οξέος. Ψύχεται σε θερμοκρασία περιβάλλοντος και συμπληρώνεται ο όγκος με Ν, Ν-διμεθυλοφρομαμίδης. Το εν λόγω αντιδραστήριο παραμένει σταθερό για μία εβδομάδα. |
|
3.4. |
Ανιλίνη: Αν η οπτική πυκνότητα του τυφλού πειράματος υπερβαίνει την τιμή 0,022, η ανιλίνη αποστάζεται επί κόνεως ψευδαργύρου με απόρριψη των πρώτων και τελευταίων 10 % μερών του αποστάγματος. Εντός πωματισμένης φαιάς φιάλης και εντός ψυγείου, το αντιδραστήριο αυτό διατηρείται επί πολλούς μήνες. |
|
3.5. |
Πρότυπο διάλυμα γκοσσυπόλης Α: Τίθενται εντός ογκομετρικής φιάλης των 250 ml, 27,9 mg οξεικής γκοσσυπόλης. Διαλύεται και ο όγκος συμπληρώνεται με το διαλυτικό μέσο Α (3.2). Εισάγονται με σιφώνιο 50 ml του εν λόγω διαλύματος εντός ογκομετρικής φιάλης των 250 ml και συμπληρώνεται ο όγκος με το διαλυτικό μέσο Α. Η συμπύκνωση της γκοσσυπόλης του διαλύματος είναι 0,02 mg/ml. Αφήνεται εν ηρεμία επί μία ώρα σε θερμοκρασία περιβάλλοντος πριν από τη χρήση. |
|
3.6. |
Πρότυπο διάλυμα γκοσσυπόλης Β: Τίθενται εντός ογκομετρικής φιάλης των 50 ml, 27,9 mg οξεικής γκοσσυπόλης. Διαλύεται και συμπληρώνεται ο όγκος με το διαλυτικό μέσο Β (3.3). Η συμπύκνωση της γκοσσυπόλης του εν λόγω διαλύματος είναι 0,5 mg/ml. Τα πρότυπα διαλύματα γκοσσυπόλης Α και Β παραμένουν σταθερά επί 24 ώρες εφόσον διατηρούνται μακριά από το φως. |
4. Όργανα
|
4.1. |
Αναμείκτης (παλινδρομητής): 35 περίπου στροφών ανά λεπτό. |
|
4.2. |
Φασματοφωτόμετρο |
5. Διαδικασία
5.1. Ποσότητα δείγματος
Η ποσότητα δείγματος εξαρτάται από την εκτιμώμενη περιεκτικότητα του δείγματος σε γκοσσυπόλη. Είναι προτιμότερο η εργασία να εκτελείται επί μικρής ποσότητας δείγματος και επί σχετικώς μεγάλου μέρους της ποσότητας του διηθήματoς, ώστε να επιτυγχάνεται επαρκής ποσότητα γκοσσυπόλης για τη διενέργεια επακριβούς φωτομετρικής μέτρησης. Για τον προσδιορισμό της ελεύθερης γκοσσυπόλης εντός των σπόρων βάμβακος, των αλεύρων βάμβακος και των βαμβακοπλακούντων, η ποσότητα του δείγματος δεν πρέπει να υπερβαίνει το ένα γραμμάριο· για σύνθετες τροφές είναι δυνατόν να ανέρχεται έως 5 γραμμάρια. Μέρος της ποσότητος του διηθήματος 10 ml είναι επαρκές για τις περισσότερες περιπτώσεις. Αυτό πρέπει να περιέχει 50 έως 100 μg γκοσσυπόλης. Για τον προσδιορισμό της συνολικής γκοσσυπόλης, η ποσότητα του δείγματος πρέπει να κυμαίνεται μεταξύ 0,5 έως 5 γραμμάρια, ώστε μέρος της ποσότητος του διηθήματος 2 ml να περιέχει 40 έως 200 μg γκοσσυπόλης.
Η ανάλυση πρέπει να διενεργείται σε θερμοκρασία περιβάλλοντος 20 oC περίπου.
5.2. Προσδιορισμός ελεύθερης γκοσσυπόλης
Η ποσότητα του δείγματος εισάγεται εντός φιάλης χαμηλού περιλαιμίου των 250 ml, της οποίας ο πυθμένας είναι καλυμμένος με υαλόσκονη. Μέσω του σιφωνίου προστίθενται 50 ml διαλυτικού μέσου Α (3.2), πωματίζεται η φιάλη και αναμειγνύονται επί μία ώρα εντός του αναμείκτη. Διηθείται μέσω ξηρού φίλτρου και συλλέγεται το διήθημα εντός μικράς φιάλης χαμηλού περιλαιμίου. Κατά τη διάρκεια της διήθησης το χωνί καλύπτεται με γυαλί ωρολογίου.
Εισάγονται διά του σιφωνίου εντός δύο ογκομετρικών φιαλών των 25 ml (Α και Β) αντιστοίχως όμοια μέρη των ποσοτήτων του διηθήματος τα οποία περιέχουν 50 έως 100 μg γκοσσυπόλης. Συμπληρώνεται ο όγκος, εφόσον χρειάζεται, μέχρι 10 ml με διαλυτικό μέσο Α (3.2). Ακολούθως, το περιεχόμενο της φιάλης (Α) συμπληρώνεται με μείγμα ισοπροπανόλης-εξανίου (3.1). Το διάλυμα αυτό θα χρησιμοποιηθεί ως διάλυμα αναφοράς για τη μέτρηση του διαλύματος του δείγματος.
Εισάγονται με σιφώνιο 10 ml του διαλυτικού μέσου Α (3.2) εντός των δύο άλλων ογκομετρικών φιαλών 25 ml (Γ και Δ) αντιστοίχως. Συμπληρώνεται ο όγκος του περιεχομένου της φιάλης (Γ) με μείγμα ισοπροπανόλης-εξανίου (3.1). Το διάλυμα αυτό θα χρησιμοποιηθεί ως διάλυμα αναφοράς για τη μέτρηση του διαλύματος του τυφλού πειράματος.
Σε κάθε φιάλη (Δ) και (Β) προστίθενται 2 ml ανιλίνης (3.4). Θερμαίνονται επί 30 λεπτά επί ζέοντος υδρολούτρου για την ανάπτυξη του χρωματισμού. Ψύχονται σε θερμοκρασία δωματίου, συμπληρώνονται οι όγκοι με μείγμα ισοπροπανόλης-εξανίου (3.1), ομοιογενοποιούνται και αφήνονται σε ηρεμία επί μία ώρα.
Προσδιορίζεται η οπτική πυκνότητα του διαλύματος του τυφλού πειράματος (Δ) μέσω σύγκρισης με το διάλυμα αναφοράς (Γ) και η οπτική πυκνότητα του διαλύματος του δείγματος (Β) μέσω σύγκρισης με το διάλυμα αναφοράς (Α) στο φασματοφωτόμετρο σε 440 nm, εντός γυάλινων κυψελίδων 1 cm.
Η οπτική πυκνότητα του διαλύματος του τυφλού πειράματος αφαιρείται από εκείνη του διαλύματος του δείγματος (= διορθωμένη οπτική πυκνότητα). Από την τιμή αυτή υπολογίζεται η περιεκτικότητα της ελεύθερης γκοσσυπόλης, όπως υποδεικνύεται στην παράγραφο 6.
5.3. Προσδιορισμός της συνολικής γκοσσυπόλης
Εισάγεται ποσότητα δείγματος που περιέχει 1 έως 5 mg γκοσσυπόλης εντός ογκομετρικής φιάλης των 50 ml και προστίθενται 10 ml διαλυτικού μέσου Β (3.3). Προετοιμάζεται συγχρόνως ένα τυφλό πείραμα με την εισαγωγή 10 ml διαλυτικού μέσου Β (3.3) εντός άλλης ογκομετρικής φιάλης των 50 ml. Οι δύο φιάλες θερμαίνονται επί 30 λεπτά εντός ζέοντος υδρόλουτρου. Ψύχονται σε θερμοκρασία δωματίου και το περιεχόμενο κάθε φιάλης συμπληρώνεται μέχρι να γεμίσει με μείγμα ισοπροπανίου-εξανίου (3.1). Ομοιογενοποιείται και αφήνεται εν ηρεμία για χρονικό διάστημα 10 έως 15 λεπτών, ακουλούθως διηθείται και συλλέγεται το διήθημα εντός φιάλης χαμηλού περιλαιμίου.
Τίθενται 2 ml του διηθήματος σε κάθε ογκομετρική φιάλη των 25 ml και 2 ml του διηθήματος του τυφλού πειράματος εντός δύο άλλων φιαλών των 25 ml. Λαμβάνεται μία φιάλη από κάθε σειρά και τα αντίστοιχα περιεχόμενα συμπληρώνονται μέχρι τα 25 ml με μείγμα ισοπροπανόλης-εξανίου (3.1). Τα εν λόγω διαλύματα θα χρησιμοποιηθούν ως διαλύματα αναφοράς.
Προστίθενται 2 ml ανιλίνης (3.4) εντός δύο άλλων φιαλών. Θερμαίνονται επί 30 λεπτά επί ζέοντος υδρόλουτρου για την ανάπτυξη του χρωματισμού. Ψύχονται σε θερμοκρασία δωματίου, συμπληρώνονται μέχρι 25 ml με το μείγμα ισοπροπανόλης-εξανίου (3.1), ομοιογενοποιούνται και αφήνονται σε ηρεμία επί 1 ώρα.
Προσδιορίζεται η οπτική πυκνότητα, όπως υποδεικνύεται στην παράγραφο 5.2 για την ελεύθερη γκοσσυπόλη. Από την τιμή υπολογίζεται η περιεκτικότητα της συνολικής γκοσσυπόλης, όπως υποδεικνύεται στην παράγραφο 6.
6. Υπολογισμός των αποτελεσμάτων
Ο υπολογισμός των αποτελεσμάτων μπορεί να διενεργηθεί είτε μέσω της ειδικής οπτικής πυκνότητας (6.1), είτε με αναφορά στην καμπύλη βαθμονόμησης (6.2).
6.1. Με την ειδική οπτική πυκνότητα
Οι τύποι για τον υπολογισμό της ειδικής οπτικής πυκνότητας, βάσει των συνθηκών που περιγράφονται, είναι οι ακόλουθοι:
|
Ελεύθερη γκοσσυπόλη: |
|
|
Συνολική γκοσσυπόλη: |
|
Η περιεκτικότητα σε ελεύθερη και συνολική γκοσσυπόλη του δείγματος δίδεται από τον ακόλουθο τύπο:

όπου:
|
E |
= |
διορθωμένη οπτική πυκνότητα, προσδιοριζόμενη σύμφωνα με την παράγραφο 5.2, |
|
p |
= |
ποσότητα δείγματος σε γραμμάρια, |
|
a |
= |
μέρος ποσότητας του διηθήματος σε ml. |
6.2. Με αναφορά στην καμπύλη βαθμονόμησης
6.2.1.
Προετοιμάζονται 2 σειρές από 5 ογκομετρικές φιάλες των 25 ml. Εισάγονται με σιφώνιο εντός των φιαλών κάθε σειράς όγκοι 2,0-4,0-6,0-8,0 και 10,0 ml του πρότυπου διαλύματος γκοσσυπόλης A (3,5). Οι όγκοι συμπληρώνονται έως 10 ml με διαλυτικό μέσο A (3.2). Κάθε σειρά συμπληρώνεται με μάρτυρα ο οποίος αποτελείται από μια ογκομετρική φιάλη των 25 ml που περιέχει μόνο 10 ml διαλυτικού μέσου A (3.2) (τυφλό πείραμα).
Οι όγκοι των φιαλών της πρώτης σειράς συμπληρώνονται μέχρι τα 25 ml (συμπεριλαμβανομένου του μάρτυρα) με το μείγμα ισοπροπανόλης-εξανίου (3.1) (σειρά αναφοράς).
Προστίθενται 2 ml ανιλίνης (3.4) εντός κάθε φιάλης της δεύτερης σειράς (συμπεριλαμβανομένου του μάρτυρα). Θερμαίνονται επί 30 λεπτά επί ζέοντος υδρόλουτρου για την ανάπτυξη χρωματισμού. Ψύχονται σε θερμοκρασία δωματίου, οι όγκοι συμπληρώνονται με το μείγμα ισοπροπανόλης-εξανίου (3.1), ομοιογενοποιούνται και αφήνονται σε ηρεμία επί μία ώρα (πρότυπη σειρά).
Με βάση τις συνθήκες που ορίζονται στην παράγραφο 5.2 προσδιορίζεται η οπτική πυκνότητα των διαλυμάτων της πρότυπης σειράς μέσω σύγκρισης με τα αντίστοιχα διαλύματα της σειράς αναφοράς. Η καμπύλη βαθμονόμησης αποτυπώνεται τοποθετώντας τις τιμές των οπτικών πυκνοτήτων έναντι των ποσοτήτων της γκοσσυπόλης (σε μg).
6.2.2.
Προετοιμάζονται έξι (6) ογκομετρικές φιάλες των 50 ml. Εισάγονται εντός της πρώτης φιάλης 10 ml διαλυτικού μέσου B (3.3) και εντός των υπολοίπων 2,0-4,0-6,0-8,0, και 10,0 ml πρότυπου διαλύματος γκοσσυπόλης B (3.6) αντιστοίχως. Το περιεχόμενο της κάθε φιάλης συμπληρώνεται με 10 ml διαλυτικού μέσου B (3.3). Θερμαίνονται επί 30 λεπτά επί ζέοντος υδρόλουτρου. Ψύχονται σε θερμοκρασία δωματίου, οι όγκοι συμπληρώνονται με μείγμα ισοπροπανόλης-εξανίου (3.1) και ομοιογενοποιούνται.
Εισάγονται 2,0 ml των διαλυμάτων αυτών εντός δύο σειρών έξι 6 ογκομετρικών φιαλών των 25 ml αντιστοίχως. Συμπληρώνεται έως 25 ml το περιεχόμενο των φιαλών της πρώτης σειράς με μείγμα ισοπροπανόλης-εξανίου (3.1) (σειρά αναφοράς).
Προστίθενται 2 ml ανιλίνης (3.4) σε κάθε φιάλη της δεύτερης σειράς. Θερμαίνονται επί 30 λεπτά επί ζέοντος υδρόλουτρου. Ψύχονται σε θερμοκρασία δωματίου, οι όγκοι συμπληρώνονται με μείγμα ισοπροπανόλης-εξανίου (3.1), ομοιογενοποιούνται και αφήνονται σε ηρεμία επί μία ώρα (πρότυπη σειρά).
Με βάση τις υποδεικνυόμενες συνθήκες στην παράγραφο 5.2 προσδιορίζεται η οπτική πυκνότητα των διαλυμάτων της πρότυπης σειράς μέσω σύγκρισης με τα αντίστοιχα διαλύματα της σειράς αναφοράς. Η καμπύλη βαθμονόμησης αποτυπώνεται τοποθετώντας τις τιμές των οπτικών πυκνοτήτων έναντι των ποσοτήτων της γκοσσυπόλης (σε μg).
6.3. Επαναληψιμότητα
Η διαφορά μεταξύ των αποτελεσμάτων των δύο παράλληλα διενεργουμένων προσδιορισμών επί του ίδιου δείγματος δεν πρέπει να υπερβαίνει:
|
— |
το 15 % σε σχετική τιμή, για τις περιεκτικότητες σε γκοσσυπόλη μικρότερες των 500 ppm, |
|
— |
τα 75ppm σε απόλυτη τιμή, για περιεκτικότητες μεταξύ 500 και 750 ppm, |
|
— |
το 10 % σε σχετική τιμή, για περιεκτικότητες ανώτερες των 750 ppm. |
B. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΩΝ ΕΠΙΠΕΔΩΝ ΤΩΝ ΔΙΟΞΙΝΩΝ (PCDD/PCDF) ΚΑΙ ΤΩΝ ΠΑΡΟΜΟΙΩΝ ΜΕ ΤΙΣ ΔΙΟΞΙΝΕΣ PCB
I. ΜΕΘΟΔΟΙ ΔΕΙΓΜΑΤΟΛΗΨΙΑΣ ΚΑΙ ΕΡΜΗΝΕΙΑ ΤΩΝ ΑΠΟΤΕΛΕΣΜΑΤΩΝ ΑΝΑΛΥΣΗΣ
1. Σκοπός και πεδίο εφαρμογής
Τα δείγματα που προορίζονται για τον επίσημο έλεγχο των επιπέδων των διοξινών [πολυχλωριωμένων διβενζο-παρα-διοξινών (PCDD) και πολυχλωριωμένων διβενζοφουρανίων (PCDF)] και των παρόμοιων με τις διοξίνες πολυχλωριωμένων διφαινυλίων (PCB) (1) στις ζωοτροφές, λαμβάνονται σύμφωνα με τις μεθόδους που περιγράφονται στο παράρτημα I. Πρέπει να εφαρμόζονται οι ποσοτικές απαιτήσεις σε σχέση με τον έλεγχο των ουσιών ή των προϊόντων που κατανέμονται ομοιόμορφα μέσα στις ζωοτροφές, όπως ορίζεται στο σημείο 5.A του παραρτήματος I. Τα συνολικά δείγματα που αποκτήθηκαν με τον τρόπο αυτό θεωρούνται ως αντιπροσωπευτικά των παρτίδων ή υποπαρτίδων από τις οποίες λαμβάνονται. Η συμμόρφωση με τα ανώτατα επίπεδα που καθορίζονται στη οδηγία 2002/32/ΕΚ του Ευρωπαϊκού Κοινοβουλίου και του Συμβουλίου (2) προσδιορίζεται με βάση τα επίπεδα που διαπιστώνονται στα εργαστηριακά δείγματα.
2. Συμμόρφωση της παρτίδας ή της υποπαρτίδας με τις προδιαγραφές
Η παρτίδα γίνεται δεκτή εάν το αποτέλεσμα μίας μόνο ανάλυσης δεν υπερβαίνει το αντίστοιχο μέγιστο επίπεδο διοξινών και το σύνολο των διοξινών και των παρόμοιων με τις διοξίνες PCB που ορίζονται στην οδηγία 2002/32/ΕΚ λαμβανομένης υπόψη της αβεβαιότητας της μέτρησης.
Η παρτίδα δεν συμμορφώνεται με το μέγιστο όριο που ορίζεται στην οδηγία 2002/32/ΕΚ, εάν το αποτέλεσμα της ανάλυσης για το ανώτατο όριο συγκέντρωσης (3), που επιβεβαιώνεται από δεύτερη ανάλυση (4), υπερβαίνει το μέγιστο επίπεδο πέραν κάθε λογικής αμφιβολίας, λαμβανομένης υπόψη της αβεβαιότητας της μέτρησης.
Η αβεβαιότητα της μέτρησης μπορεί να ληφθεί υπόψη σύμφωνα με μία από τις ακόλουθες προσεγγίσεις:
|
— |
με υπολογισμό της διευρυμένης αβεβαιότητας, χρησιμοποιώντας συντελεστή κάλυψης 2 που δίνει επίπεδο εμπιστοσύνης περίπου 95 %. Μια παρτίδα ή υποπαρτίδα δεν συμμορφώνεται με τις προδιαγραφές εάν η τιμή που μετρήθηκε μείον U είναι μεγαλύτερη του καθορισμένου επιτρεπόμενου ορίου. Σε περίπτωση ξεχωριστού προσδιορισμού των διοξινών και των παρόμοιων με τις διοξίνες PCB, το άθροισμα των εκτιμήσεων της διευρυμένης αβεβαιότητας των ξεχωριστών αναλυτικών αποτελεσμάτων των διοξινών και των παρόμοιων με τις διοξίνες PCB πρέπει να χρησιμοποιηθεί για το σύνολο των διοξινών και των παρόμοιων με τις διοξίνες PCB, |
|
— |
καθορίζοντας το όριο απόφασης (CCα) σύμφωνα με την απόφαση 2002/657/ΕΚ της Επιτροπής (5) (σημείο 3.1.2.5 του παραρτήματος — Ουσίες για τις οποίες έχει καθοριστεί επιτρεπόμενο όριο). Μια παρτίδα ή υποπαρτίδα δεν συμμορφώνεται με τις προδιαγραφές εάν η τιμή που μετρήθηκε είναι ίση ή μεγαλύτερη του CCα. |
Οι παρόντες ερμηνευτικοί κανόνες ισχύουν για τα αποτελέσματα των αναλύσεων που προκύπτουν από δείγμα που λαμβάνεται για επίσημο έλεγχο. Δεν επηρεάζουν το δικαίωμα των κρατών μελών να εφαρμόσουν εθνικές νομοθετικές διατάξεις σε αναλύσεις για λόγους δικαιώματος προσφυγής ή διαιτησίας.
II. ΠΡΟΕΤΟΙΜΑΣΙΑ ΤΟΥ ΔΕΙΓΜΑΤΟΣ ΚΑΙ ΑΠΑΙΤΗΣΕΙΣ ΓΙΑ ΤΙΣ ΜΕΘΟΔΟΥΣ ΑΝΑΛΥΣΗΣ ΠΟΥ ΧΡΗΣΙΜΟΠΟΙΟΥΝΤΑΙ ΚΑΤΑ ΤΟΝ ΕΠΙΣΗΜΟ ΕΛΕΓΧΟ ΤΩΝ ΕΠΙΠΕΔΩΝ ΤΩΝ ΔΙΟΞΙΝΩΝ (PCDD/PCDF) ΚΑΙ ΤΩΝ ΠΑΡΟΜΟΙΩΝ ΜΕ ΤΙΣ ΔΙΟΞΙΝΕΣ PCB
1. Στόχος και πεδίο εφαρμογής
Οι απαιτήσεις αυτές πρέπει να εφαρμόζονται όταν αναλύονται πρώτες ύλες και ζωοτροφές για τον προσδιορισμό διοξινών [πολυχλωριωμένες διβενζο-παρα-διοξίνες (PCDD) και πολυχλωριωμένα διβενζοφουράνια (PCDF)] και παρόμοιων με τις διοξίνες πολυχλωριωμένων διφαινυλίων (PCB).
Ο έλεγχος για την παρουσία διοξινών στις ζωοτροφές μπορεί να διεξαχθεί βάσει στρατηγικής που θα περιλαμβάνει μια μέθοδο μαζικής εξέτασης προκειμένου να επιλεγούν εκείνα τα δείγματα με επίπεδα διοξινών και παρόμοιων με τις διοξίνες PCB που είναι λιγότερο από 25 % κάτω από το επίπεδο που ενδιαφέρει ή υπερβαίνει το επίπεδο που ενδιαφέρει. Η συγκέντρωση διοξινών στα δείγματα εκείνα με σημαντικά επίπεδα πρέπει να προσδιοριστεί/επιβεβαιωθεί με μέθοδο επιβεβαίωσης.
Οι μέθοδοι μαζικής εξέτασης είναι μέθοδοι που χρησιμοποιούνται για την ανίχνευση της παρουσίας διοξινών και παρόμοιων με διοξίνες PCB στο επίπεδο που ενδιαφέρει. Οι μέθοδοι αυτές έχουν την ικανότητα επεξεργασίας μεγάλων ποσοτήτων δειγμάτων και χρησιμοποιούνται για τη διύλιση μεγάλου αριθμού δειγμάτων για πιθανά θετικά. Έχουν σχεδιαστεί ειδικά για την αποφυγή ψευδώς αρνητικών.
Οι μέθοδοι επιβεβαίωσης είναι μέθοδοι που παρέχουν πλήρεις ή συμπληρωματικές πληροφορίες που δίνουν τη δυνατότητα οι διοξίνες και τα παρόμοια με διοξίνες PCB να προσδιοριστούν και να ποσοτικοποιηθούν σαφώς στο επίπεδο που ενδιαφέρει.
2. Ιστορικό
Επειδή τα περιβαλλοντικά και βιολογικά δείγματα (συμπεριλαμβανομένων των δειγμάτων πρώτων υλών/ζωοτροφών) γενικά περιέχουν σύνθετα μείγματα διαφόρων ομοειδών ουσιών της ομάδας των διοξινών, αναπτύχθηκε η έννοια των συντελεστών τοξικής ισοδυναμίας (TEF) ώστε να διευκολυνθεί η αξιολόγηση του κινδύνου. Αυτοί οι TEF δημιουργήθηκαν για να εκφράσουν τις συγκεντρώσεις των μειγμάτων των 2,3,7,8-υποκατεστημένων PCDD και PCDF και, πρόσφατα, ορισμένων μη-ορθο και μονο-ορθο υποκατεστημένων από χλώριο PCB με δραστικότητα παρόμοια με αυτήν των διοξινών σε τοξικά ισοδύναμα (TEQ) 2,3,7,8-TCDD. Οι συγκεντρώσεις των μεμονωμένων ουσιών σε κάποιο δεδομένο δείγμα πολλαπλασιάζονται με τον αντίστοιχο TEF τους και στη συνέχεια αθροίζονται για να εξαχθεί η συνολική συγκέντρωση των παρόμοιων με τις διοξίνες ενώσεων εκφρασμένη σε TEQ.
Για τους σκοπούς του παρόντος κανονισμού, το αποδεκτό ειδικό όριο ποσοτικού προσδιορισμού μιας μεμονωμένης ομοειδούς ουσίας είναι η συγκέντρωση μιας αναλυτικώς προσδιοριζόμενης ουσίας στο εκχύλισμα ενός δείγματος το οποίο παράγει απόκριση του οργάνου σε δύο διαφορετικά ιόντα που πρόκειται να ελεγχθούν με λόγο S/N (σήμα/θόρυβος) 3:1, για το λιγότερο ευαίσθητο σήμα, και πλήρωση των βασικών απαιτήσεων όπως, για παράδειγμα, του χρόνου κατακράτησηςκαι της αναλογίας ισοτόπων σύμφωνα με διαδικασία προσδιορισμού όπως περιγράφεται στη μέθοδο 1613 της EPA, αναθεώρηση B.
3. Οι απαιτήσεις διασφάλισης ποιότητας που πρέπει να τηρούνται για την προετοιμασία του δείγματος
Ισχύουν οι γενικές διατάξεις σχετικά με την προετοιμασία των δειγμάτων για ανάλυση όπως καθορίζονται στο παράρτημα II.
Επιπλέον, πρέπει να τηρούνται οι ακόλουθες απαιτήσεις:
|
— |
τα δείγματα πρέπει να αποθηκεύονται και να μεταφέρονται σε δοχεία από γυαλί, αλουμίνιο, πολυπροπυλένιο ή πολυαιθυλένιο. Πρέπει να αφαιρούνται τα ίχνη σκόνης χαρτιού από τον περιέκτη του δείγματος. Τα γυάλινα σκεύη πρέπει να ξεπλένονται με διαλύτες που έχουν προηγουμένως ελεγχθεί για την παρουσία διοξινών, |
|
— |
εκτέλεση ανάλυσης τυφλού με την πραγματοποίηση του συνόλου της αναλυτικής διαδικασίας παραλείποντας μόνο το δείγμα, |
|
— |
το βάρος του δείγματος που χρησιμοποιείται για την εκχύλιση πρέπει να είναι αρκετό για να πληροί τις απαιτήσεις όσον αφορά την ευαισθησία. |
4. Απαιτήσεις για τα εργαστήρια
|
— |
Τα εργαστήρια αποδεικνύουν την απόδοση μιας μεθόδου στο εύρος της ανοχής, π.χ. 0,5 φορές, 1 και 2 φορές το επίπεδο που ενδιαφέρει με έναν αποδεκτό συντελεστή μεταβλητότητας για επαναλαμβανόμενες αναλύσεις. Για τα λεπτομερή στοιχεία των κριτηρίων αποδοχής, βλ. παράγραφο 5. |
|
— |
Το όριο του ποσοτικού προσδιορισμού για μια μέθοδο επιβεβαίωσης πρέπει να είναι στο εύρος του ενός πέμπτου περίπου του επιπέδου που ενδιαφέρει, ώστε να διασφαλίζεται ότι οι αποδεκτοί συντελεστές μεταβλητότητας πληρούνται στο εύρος του επιπέδου που ενδιαφέρει. |
|
— |
Οι τακτικές τυφλές δοκιμές και πειράματα εμπλουτισμού των δειγμάτων ή η ανάλυση των δειγμάτων ελέγχου (κατά προτίμηση, εφόσον είναι διαθέσιμο, πιστοποιημένου υλικού αναφοράς) πρέπει να εκτελούνται ως μέτρα εσωτερικής διασφάλισης της ποιότητας. |
|
— |
Η επιτυχής συμμετοχή σε διεργαστηριακές μελέτες που αξιολογούν την επάρκεια των εργαστηρίων είναι ο καλύτερος τρόπος απόδειξης της αρμοδιότητας για ειδικές αναλύσεις. Ωστόσο, η επιτυχής συμμετοχή σε διεργαστηριακές μελέτες όσον αφορά π.χ. δείγματα εδάφους ή αποχετεύσεων δεν αποδεικνύει κατ’ ανάγκη την αρμοδιότητα και στον τομέα των δειγμάτων των τροφίμων ή των ζωοτροφών που παρουσιάζουν χαμηλότερα επίπεδα μόλυνσης. Συνεπώς, η συνεχής συμμετοχή σε διεργαστηριακές μελέτες για τον προσδιορισμό των διοξινών και των παρόμοιων με τις διοξίνες PCB στις αντίστοιχες μήτρες ζωοτροφών/τροφίμων είναι υποχρεωτική. |
|
— |
Τη διαπίστευση στα εργαστήρια πρέπει να χορηγήσει αναγνωρισμένος οργανισμός που λειτουργεί σύμφωνα με τον οδηγό ISO 58, ώστε να εξασφαλίζεται ότι τα εργαστήρια εφαρμόζουν μεθόδους διασφάλισης της ποιότητας. Η διαπίστευση των εργαστηρίων πρέπει να πραγματοποιηθεί σύμφωνα με το πρότυπο ISO/IEC/17025:1999. |
5. Απαιτήσεις για τις αναλυτικές διαδικασίες για τις διοξίνες και τα παρόμοια με διοξίνες PCB
Βασικές απαιτήσεις για την αποδοχή των διαδικασιών ανάλυσης:
|
— |
Υψηλή ευαισθησία και χαμηλά όρια ανίχνευσης. Όσον αφορά τα PCDD και τα PCDF, οι ανιχνεύσιμες ποσότητες πρέπει να είναι της τάξης των πικογραμμαρίων TEQ (10-12 g) εξαιτίας της εξαιρετικής τοξικότητας ορισμένων από τις ενώσεις αυτές. Γνωρίζουμε ότι τα PCB εμφανίζονται σε υψηλότερα επίπεδα από ό,τι τα PCDD και τα PCDF. Για τα περισσότερα ομοειδή PCB, η ευαισθησία στο φάσμα των νανογραμμαρίων (10-9 g) είναι ήδη επαρκής. Ωστόσο, για τη μέτρηση των πιο τοξικών παρόμοιων με διοξίνες ομοειδών PCB (ιδίως των μη-ορθο υποκατεστημένων ομοειδών) πρέπει να επιτυγχάνεται η ίδια ευαισθησία όπως και για τα PCDD και τα PCDF. |
|
— |
Υψηλή εκλεκτικότητα (ειδικότητα). Τα PCDD, τα PCDF και τα παρόμοια με τις διοξίνες PCB πρέπει να διακρίνονται από τις άλλες ενώσεις, που εξάγονται επίσης και πιθανώς παρεμποδίζουν τις ενώσεις που είναι παρούσες σε συγκεντρώσεις έως και ορισμένες τάξεις μεγέθους υψηλότερες από εκείνες των αναλυτέων ουσιών που ενδιαφέρουν. Για τις μεθόδους αέριας χρωματογραφίας/φασματομετρίας μάζας (GC/MS) είναι αναγκαία μια διαφοροποίηση μεταξύ των διαφόρων ομοειδών, όπως μεταξύ των τοξικών (π.χ. των δεκαεπτά 2,3,7,8-υποκατεστημένων PCDD και PCDF και των παρόμοιων με τις διοξίνες PCB) και των άλλων ομοειδών. Οι βιολογικές δοκιμασίες πρέπει να είναι σε θέση να προσδιορίζουν τις τιμές TEQ επιλεκτικά ως το άθροισμα των PCDD, των PCDF και των παρόμοιων με τις διοξίνες PCB. |
|
— |
Υψηλή ορθότητα (αληθότητα και ακρίβεια). Ο προσδιορισμός πρέπει να παρέχει έγκυρη και αξιόπιστη εκτίμηση της αληθούς συγκέντρωσης σε ένα δείγμα. Η υψηλή ορθότητα (ορθότητα της μέτρησης: η εγγύτητα της συμφωνίας μεταξύ του αποτελέσματος της μέτρησης με την αληθή ή αποδοθείσα τιμή του μετρητέου) είναι αναγκαία για να αποφευχθεί η απόρριψη του αποτελέσματος της ανάλυσης του δείγματος με βάση την κακή αξιοπιστία της εκτίμησης του TEQ. Η ορθότητα εκφράζεται ως αληθότητα (διαφορά μεταξύ της μέσης τιμής που μετρήθηκε για μια αναλυτέα ουσία σε ένα πιστοποιημένο υλικό και της πιστοποιημένης τιμή της, εκφρασμένη ως ποσοστό της τιμής αυτής) και ακρίβεια (RSDR, σχετική τυπική απόκλιση που υπολογίζεται από τα αποτελέσματα τα οποία προκύπτουν υπό συνθήκες αναπαραγωγιμότητας). |
Οι μέθοδοι μαζικής εξέτασης μπορούν να περιλαμβάνουν βιολογικές δοκιμασίες και μεθόδους GC/MS· οι μέθοδοι επιβεβαίωσης είναι μέθοδοι υψηλής ανάλυσης αέριας χρωματογραφίας/φασματομετρίας μάζας υψηλής ανάλυσης (HRGC/HRMS).
Τα ακόλουθα κριτήρια πρέπει να τηρούνται στη συνολική τιμή TEQ:
|
|
Μέθοδοι μαζικής εξέτασης |
Μέθοδοι επιβεβαίωσης |
|
Ψευδώς αρνητικό ποσοστό |
< 1 % |
|
|
Αληθότητα |
|
20 % έως + 20 % |
|
Ακρίβεια RSDR |
< 30 % |
< 15 % |
6. Ειδικές απαιτήσεις για μεθόδους GC/MS που πρέπει να τηρούνται για τη μαζική εξέταση ή για λόγους επιβεβαίωσης
|
— |
Η προσθήκη εσωτερικών προτύπων PCDD/F υποκατάστασης με χλώριο στις θέσεις 2, 3, 7, 8 με ισοτοπική επισήμανση 13C και των εσωτερικών προτύπων των παρόμοιων με τις διοξίνες PCB με ισοτοπική επισήμανση 13C πρέπει να πραγματοποιηθεί πολύ νωρίς, στην αρχή της μεθόδου ανάλυσης, δηλαδή πριν από την εκχύλιση, προκειμένου να επικυρωθεί η αναλυτική διαδικασία. Πρέπει να προστεθεί τουλάχιστον μία ομοειδής ουσία για καθεμία από τις ομόλογες ομάδες PCDD/F των τετρα- έως οκτα-χλωριωμένων ομόλογων ομάδων και τουλάχιστον μία ομοειδής ουσία και για καθεμία από τις ομόλογες ομάδες των παρόμοιων με τις διοξίνες PCB (εναλλακτικά, τουλάχιστον μία ομοειδής ουσία για κάθε φασματομετρικά επιλεγμένη συνάρτηση καταγραφής ιόντων που χρησιμοποιείται για την παρακολούθηση των PCDD/F και των παρόμοιων με τις διοξίνες PCBs). Υπάρχει σαφής προτίμηση, ιδίως στην περίπτωση των μεθόδων επιβεβαίωσης, στη χρησιμοποίηση του συνόλου των 17 εσωτερικών προτύπων PCDD/F υποκατάστασης με χλώριο στις θέσεις 2,3,7,8 με ισοτοπική επισήμανση 13C και του συνόλου των 12 εσωτερικών προτύπων των παρόμοιων με τις διοξίνες PCB με ισοτοπική επισήμανση 13C. |
|
— |
Πρέπει επίσης να προσδιοριστούν οι σχετικοί συντελεστές απόκρισης για εκείνες τις ομοειδείς ουσίες για τις οποίες δεν προστίθεται κανένα ανάλογο με ισοτοπική επισήμανση 13C με τη χρησιμοποίηση των κατάλληλων διαλυμάτων βαθμονόμησης. |
|
— |
Για τα τρόφιμα φυτικής προέλευσης και τα τρόφιμα ζωικής προέλευσης που περιέχουν λιγότερο από 10 % λίπος, η προσθήκη των εσωτερικών προτύπων είναι υποχρεωτική πριν από την εκχύλιση. Για τα τρόφιμα ζωικής προέλευσης που περιέχουν περισσότερο από 10 % λίπος, τα εσωτερικά πρότυπα μπορούν να προστεθούν είτε πριν από την εκχύλιση είτε μετά την εκχύλιση του λίπους. Πραγματοποιείται κατάλληλη επικύρωση της αποτελεσματικότητας της εκχύλισης, ανάλογα με το στάδιο στο οποίο εισάγονται εσωτερικά πρότυπα και ανάλογα με το αν τα αποτελέσματα αναφέρονται με βάση το προϊόν ή το λίπος. |
|
— |
Πριν από την ανάλυση GC/MS, πρέπει να προστεθούν ένα ή δύο πρότυπο(-α) ανάκτησης (υποκατάστατο). |
|
— |
Ο έλεγχος ανάκτησης είναι αναγκαίος. Για τις μεθόδους επιβεβαίωσης, οι ανακτήσεις των μεμονωμένων εσωτερικών προτύπων πρέπει να κυμαίνονται στο εύρος του 60 έως 120 %. Χαμηλότερες ή υψηλότερες ανακτήσεις για μεμονωμένες ομοειδείς ουσίες, ιδίως ορισμένων επτα- και οκτα-χλωριωμένων διβενζοδιοξινών και διβενζοφουρανίων, είναι αποδεκτές υπό τον όρο ότι η συμβολή τους στην τιμή TEQ δεν υπερβαίνει το 10 % της συνολικής τιμής TEQ (με βάση το άθροισμα PCDD/F και παρόμοιων με τις διοξίνες PCB). Για τις μεθόδους μαζικής εξέτασης, οι ανακτήσεις πρέπει να κυμαίνονται στο εύρος του 30 έως 140 %. |
|
— |
Πρέπει να πραγματοποιείται διαχωρισμός των διοξινών από τις παρεμβαλλόμενες χλωριωμένες ενώσεις, όπως τα μη παρόμοια με τις διοξίνες PCB και οι χλωριωμένοι διφαινυλικοί αιθέρες με τις κατάλληλες χρωματογραφικές τεχνικές (κατά προτίμηση με στήλη florisil, αλουμίνας ή/και άνθρακα). |
|
— |
Ο διαχωρισμός των ισομερών με αέρια χρωματογραφία πρέπει να είναι επαρκής (< 25 % κορυφή με κορυφή μεταξύ 1,2,3,4,7,8-HxCDF και 1,2,3,6,7,8-HxCDF). |
|
— |
Ο προσδιορισμός πρέπει να πραγματοποιηθεί σύμφωνα με τη μέθοδο της EPA 1613 αναθεώρηση B: «Tetra- through octa-chlorinated dioxins and furans by isotope dilution HRGC/HRMS» ή άλλη με ισοδύναμα κριτήρια απόδοσης. |
|
— |
Η διαφορά μεταξύ του ανώτατου επιπέδου και του κατώτατου επιπέδου συγκέντρωσης δεν πρέπει να υπερβαίνει το 20 % για τις ζωοτροφές με μόλυνση διοξίνης στο εύρος του μέγιστου επιπέδου ή πάνω από αυτό. Για τις ζωοτροφές με επίπεδα μόλυνσης πολύ κάτω από το μέγιστο επίπεδο, η διαφορά μπορεί να ανέρχεται στο εύρος του 25 έως 40 %. |
7. Ειδικές μέθοδοι ανάλυσης
7.1. Εισαγωγή
Μπορούν να διεξαχθούν διάφορες αναλυτικές προσεγγίσεις με τη χρησιμοποίηση μιας μεθόδου μαζικής εξέτασης: μια προσέγγιση αμιγώς μαζικής εξέτασης και μια ποσοτική προσέγγιση.
Η απόκριση των δειγμάτων συγκρίνεται με αυτήν ενός δείγματος αναφοράς στο επίπεδο που ενδιαφέρει. Τα δείγματα με απόκριση μικρότερη από την αναφορά θεωρούνται αρνητικά, ενώ εκείνα με υψηλότερη απόκριση ύποπτα για θετικά. Οι απαιτήσεις:
|
— |
Σε κάθε σειρά δοκιμών πρέπει να συμπεριληφθεί ένα τυφλό δείγμα και ένα δείγμα αναφοράς, που εκχυλίζονται και δοκιμάζονται ταυτόχρονα υπό τις ίδιες συνθήκες. Το δείγμα αναφοράς πρέπει να παρουσιάζει μια σαφώς υψηλότερη απόκριση σε σύγκριση με το τυφλό. |
|
— |
Πρόσθετα δείγματα αναφοράς 0,5 φορές και 2 φορές το επίπεδο που ενδιαφέρει πρέπει να συμπεριληφθούν ώστε να καταδειχτεί η ορθή απόδοση της δοκιμασίας στο φάσμα που ενδιαφέρει για τον έλεγχο του επιπέδου που ενδιαφέρει. |
|
— |
Κατά τη δοκιμή άλλων υποστρωμάτων, πρέπει να καταδειχτεί η καταλληλότητα του δείγματος/των δειγμάτων αναφοράς, κατά προτίμηση με τη συμπερίληψη δειγμάτων που φαίνεται από τις μεθόδους HRGC/HRMS να περιέχουν ένα επίπεδο TEQ παρόμοιο με αυτό του δείγματος αναφοράς ή αλλιώς ενός τυφλού εμπλουτισμένου στο επίπεδο αυτό. |
|
— |
Καθώς δεν μπορούν να χρησιμοποιηθούν εσωτερικά πρότυπα σε βιολογικές δοκιμασίες, οι δοκιμές επαναληψιμότητας είναι πολύ σημαντικές προκειμένου να αποκτηθούν πληροφορίες σχετικά με την τυπική απόκλιση στα πλαίσια μια σειράς δοκιμών. Ο συντελεστής μεταβλητότητας πρέπει να είναι κάτω από 30 %. |
|
— |
Για τις βιολογικές δοκιμασίες πρέπει να οριστούν οι ενώσεις-στόχοι, οι πιθανές παρεμποδίσεις και τα μέγιστα ανεκτά επίπεδα τυφλού. |
Η ποσοτική προσέγγιση απαιτεί πρότυπη σειρά διάλυσης, διπλό ή τριπλό καθάρισμα και μέτρηση, καθώς και ελέγχους τυφλού και ανάκτησης. Το αποτέλεσμα μπορεί να εκφράζεται σε TEQ, υποθέτοντας ότι οι ενώσεις που είναι υπεύθυνες για το σήμα αντιστοιχούν στην αρχή των TEQ. Αυτό μπορεί να πραγματοποιηθεί με τη χρησιμοποίηση TCDD (ή ενός τυποποιημένου μείγματος διοξίνης/φουρανίου/παρόμοιου με τις διοξίνες PCB) για τη δημιουργία μιας καμπύλης βαθμονόμησης για τον υπολογισμό του επιπέδου TEQ στο εκχύλισμα και, συνεπώς, στο δείγμα. Αυτό στη συνέχεια διορθώνεται για το επίπεδο TEQ που υπολογίζεται για ένα τυφλό δείγμα (ώστε να λαμβάνει υπόψη ακαθαρσίες από διαλύτες και χημικά που χρησιμοποιήθηκαν), και για την ανάκτηση (που υπολογίζεται από το επίπεδο TEQ σε δείγμα ελέγχου ποιότητας γύρω από το επίπεδο που ενδιαφέρει). Είναι αναγκαίο να σημειωθεί ότι τμήμα της εμφανούς απώλειας ανάκτησης μπορεί να οφείλεται σε επιδράσεις υποστρώματος ή/και σε διαφορές μεταξύ των τιμών TEF στις βιολογικές δοκιμασίες και των επίσημων τιμών TEF που όρισε η ΠΟΥ.
7.2. Απαιτήσεις για τις μεθόδους ανάλυσης που χρησιμοποιούνται για διαλογή
|
— |
Οι μέθοδοι ανάλυσης GC/MS και οι βιολογικές δοκιμασίες μπορούν να χρησιμοποιηθούν για διαλογή. Για τις μεθόδους GC/MS πρέπει να χρησιμοποιηθούν οι απαιτήσεις όπως ορίζονται στο σημείο 6. Ειδικές απαιτήσεις για τις βιολογικές δοκιμασίες με βάση κύτταρα (cell based bioassays) ορίζονται στην παράγραφο 7.3 του παρόντος παραρτήματος και για τις βιολογικές δοκιμασίες με βάση προσυσκευασμένα αντιδραστήρια (kit-based bioassays) στην παράγραφο 7.4 του παρόντος παραρτήματος. |
|
— |
Στοιχεία για τον αριθμό των ψευδώς θετικών και ψευδώς αρνητικών αποτελεσμάτων ενός μεγάλου αριθμού δειγμάτων κάτω και πάνω από το μέγιστο επίπεδο ή το επίπεδο δράσης είναι αναγκαία σε σύγκριση με την περιεκτικότητα σε TEQ όπως προσδιορίζεται με μια επιβεβαιωτική μέθοδο ανάλυσης. Τα πραγματικά ψευδώς αρνητικά ποσοστά πρέπει να είναι κάτω από 1 %. Το ποσοστό των ψευδώς θετικών δειγμάτων πρέπει να είναι αρκετά χαμηλό ώστε η χρήση της μεθόδου διαλογής να είναι πλεονεκτική. |
|
— |
Τα θετικά αποτελέσματα πρέπει πάντα να επιβεβαιώνονται με επιβεβαιωτική μέθοδο ανάλυσης (HRGC/HRMS). Επιπλέον, τα δείγματα από ένα ευρύ φάσμα TEQ πρέπει να επιβεβαιώνονται με μεθόδους HRGC/HRMS (περίπου 2-10 % των αρνητικών δειγμάτων). Πρέπει να παρέχονται ο πληροφορίες σχετικά με την αντιστοιχία μεταξύ βιολογικής δοκιμασίας και αποτελεσμάτων HRGC/HRMS. |
7.3. Ειδικές απαιτήσεις για βιολογικές δοκιμασίες με βάση κύτταρα
|
— |
Κατά την εκτέλεση μιας βιολογικής δοκιμασίας, κάθε δοκιμασία απαιτεί μια σειρά συγκέντρωσης αναφοράς του TCDD ή του μείγματος διοξίνης/φουρανίου (καμπύλη απόκρισης πλήρους δόσης με R2 > 0,95). Ωστόσο, για την ανίχνευση μπορεί να χρησιμοποιηθεί μια εκτεταμένη καμπύλη χαμηλού επιπέδου για την ανάλυση δειγμάτων χαμηλού επιπέδου. |
|
— |
Μια συγκέντρωση αναφοράς TCDD (περίπου 3 φορές το όριο ποσοτικού προσδιορισμού) σε ένα δελτίο ποιοτικού ελέγχου πρέπει να χρησιμοποιηθεί για το αποτέλεσμα της βιολογικής δοκιμασίας για μια σταθερή περίοδο. Μια εναλλακτική λύση θα ήταν η σχετική απόκριση ενός δείγματος αναφοράς σε σύγκριση με τη γραμμή βαθμονόμησης TCDD, καθώς η απόκριση των κυττάρων μπορεί να εξαρτάται από πολλούς παράγοντες. |
|
— |
Πρέπει να καταγράφονται και να ελέγχονται διαγράμματα ποιοτικού ελέγχου (ΠΕ) για κάθε είδος υλικού αναφοράς ώστε να διασφαλίζεται ότι το αποτέλεσμα είναι σύμφωνο με τις δηλωμένες κατευθυντήριες γραμμές. |
|
— |
Ιδιαίτερα για τους ποσοτικούς υπολογισμούς, η επαγωγή της αραίωσης δείγματος που χρησιμοποιήθηκε πρέπει να είναι εντός του γραμμικού τμήματος της καμπύλης απόκρισης. Δείγματα πάνω από αυτό το γραμμικό τμήμα της καμπύλης απόκρισης πρέπει να αραιώνονται και να δοκιμάζονται εκ νέου. Συνεπώς, συνιστάται να δοκιμάζονται τουλάχιστον τρεις ή περισσότερες αραιώσεις ταυτόχρονα. |
|
— |
Η ποσοστιαία τυπική απόκλιση δεν πρέπει να είναι άνω του 15 % σε ένα τριπλό προσδιορισμό για κάθε αραίωση δείγματος και όχι πάνω από 30 % μεταξύ τριών ανεξάρτητων πειραμάτων. |
|
— |
Το όριο της ανίχνευσης μπορεί να καθοριστεί έως 3 φορές την τυπική απόκλιση του τυφλού του διαλύτη ή την απόκριση υποβάθρου σήματος. Μια άλλη προσέγγιση είναι η εφαρμογή μιας απόκρισης που είναι άνω του υποβάθρου (συντελεστής επαγωγής 5 φορές το τυφλό του διαλύτη) που υπολογίζεται από την καμπύλη βαθμονόμησης της ημέρας. Το όριο του ποσοτικού προσδιορισμού μπορεί να καθοριστεί ως το πενταπλάσιο ή το εξαπλάσιο της τυπικής απόκλισης του τυφλού του διαλύτη ή της απόκρισης υποβάθρου ή ως η απόκριση που είναι σαφώς πάνω από το υπόβαθρο (συντελεστής επαγωγής 10 φορές το τυφλό του διαλύτη) που υπολογίζεται από την καμπύλη βαθμονόμησης της ημέρας. |
7.4. Ειδικές απαιτήσεις για βιολογικές δοκιμασίες με βάση συσκευασίες
|
— |
Πρέπει να εξασφαλιστεί ότι οι βιολογικές δοκιμασίες με βάση συσκευασίες έχουν επαρκή ευαισθησία και αξιοπιστία ώστε να εφαρμοστούν σε τρόφιμα. |
|
— |
Για την προετοιμασία των δειγμάτων και των αναλύσεων πρέπει να τηρούνται οι οδηγίες του κατασκευαστή. |
|
— |
Οι συσκευασίες δοκιμών (test kits) δεν πρέπει να χρησιμοποιούνται μετά την ημερομηνία λήξης τους. |
|
— |
Δεν πρέπει να χρησιμοποιούνται υλικά ή συστατικά που προβλέπονται για χρήση με άλλες συσκευασίες. |
|
— |
Οι συσκευασίες δοκιμών πρέπει να διατηρούνται εντός του καθορισμένου εύρους τιμών θερμοκρασίας αποθήκευσης και να χρησιμοποιούνται στην καθορισμένη θερμοκρασία λειτουργίας. |
|
— |
Το όριο ανίχνευσης για τις ανοσολογικές δοκιμασίες προκύπτει από την άθροιση της μέσης τιμής και μιας τιμής ίσης κατά 3 φορές την τυπική απόκλιση, με βάση δέκα επαναληπτικές αναλύσεις του τυφλού, διαιρούμενης με την τιμή της κλίσης της γραμμικής εξίσωσης παλινδρόμησης. |
|
— |
Για τις δοκιμές στο εργαστήριο πρέπει να χρησιμοποιούνται πρότυπα αναφοράς ώστε να διασφαλίζεται ότι η απόκριση στο πρότυπο κυμαίνεται εντός αποδεκτού εύρους. |
8. Υποβολή έκθεσης των αποτελεσμάτων
Εφόσον το επιτρέπει η χρησιμοποιούμενη διαδικασία ανάλυσης, τα αποτελέσματα της ανάλυσης πρέπει να περιέχουν τα επίπεδα των επιμέρους PCDD/F και ομοειδών PCB και τα αποτελέσματα της ανάλυσης να υποβάλλονται ως κατώτατο όριο συγκέντρωσης, ανώτατο όριο συγκέντρωσης και μέσο όριο συγκέντρωσης προκειμένου να περιλαμβάνουν ένα μέγιστο σύνολο πληροφοριών κατά την υποβολή της έκθεσης των αποτελεσμάτων και να διευκολύνουν έτσι την ερμηνεία των αποτελεσμάτων σύμφωνα με τις ειδικές απαιτήσεις.
Η έκθεση πρέπει επίσης να περιλαμβάνει την περιεκτικότητα λιπιδίων του δείγματος καθώς και τη μέθοδο που χρησιμοποιήθηκε για την εκχύλιση λιπιδίων.
Οι ανακτήσεις των μεμονωμένων εσωτερικών προτύπων πρέπει να καθίστανται διαθέσιμες κατόπιν σχετικής αίτησης στην περίπτωση που βρίσκονται εκτός του εύρους που αναφέρεται στην παράγραφο 6, στην περίπτωση που υπερβαίνεται το μέγιστο επίπεδο, καθώς και στις άλλες περιπτώσεις.
Η αβεβαιότητα της μέτρησης πρέπει επίσης να αναφέρεται επειδή η παράμετρος αυτή πρέπει να λαμβάνεται υπόψη όταν πρέπει να προσδιοριστεί εάν ένα δείγμα είναι ή όχι συμβατό. Τα αποτελέσματα της ανάλυσης πρέπει να αναφέρονται ως «x +/- U», όπου x είναι το αποτέλεσμα της ανάλυσης και U είναι η διευρυμένη αβεβαιότητα της μέτρησης, χρησιμοποιώντας συντελεστή κάλυψης 2, ο οποίος δίνει επίπεδο εμπιστοσύνης περίπου 95 %. Σε περίπτωση ξεχωριστού προσδιορισμού των διοξινών και των παρόμοιων με τις διοξίνες PCB, το σύνολο της εκτίμησης της διευρυμένης αβεβαιότητας των ξεχωριστών αναλυτικών αποτελεσμάτων των διοξινών και των παρόμοιων με τις διοξίνες PCB πρέπει να χρησιμοποιηθεί για το σύνολο των διοξινών και των παρόμοιων με τις διοξίνες PCB.
Εάν ληφθεί υπόψη η αβεβαιότητα της μέτρησης μέσω του CCα (όπως περιγράφεται στο σημείο I.2 του παρόντος μέρους Β), η παράμετρος αυτή πρέπει να αναφέρεται.
(1) Πίνακας TEF (= συντελεστές τοξικής ισοδυναμίας) για διοξίνες φουράνια και παρόμοια με διοξίνες PCB:
|
Ομοειδής ουσία |
Τιμή TEF |
Ομοειδής ουσία |
Τιμή TEF |
|
Διβενζο-παρα-διοξίνες («PCDDs») |
|
«Παρόμοιαι με διοξίνες» PCBs: |
|
|
2,3,7,8-TCDD |
1 |
|
|
|
1,2,3,7,8-PeCDD |
1 |
Μη-ορθο PCBs |
|
|
1,2,3,4,7,8-HxCDD |
0,1 |
PCB 77 |
0,0001 |
|
1,2,3,6,7,8-HxCDD |
0,1 |
PCB 81 |
0,0001 |
|
1,2,3,7,8,9-HxCDD |
0,1 |
PCB 126 |
0,1 |
|
1,2,3,4,6,7,8-HpCDD |
0,01 |
PCB 169 |
0,01 |
|
OCDD |
0,0001 |
Μονο-ορθο PCBs |
|
|
|
|
PCB 105 |
0,0001 |
|
Διβενζοφουράνια («PCDFs») |
|
PCB 114 |
0,0005 |
|
2,3,7,8-TCDF |
0,1 |
PCB 118 |
0,0001 |
|
1,2,3,7,8-PeCDF |
0,05 |
PCB 123 |
0,0001 |
|
2,3,4,7,8-PeCDF |
0,5 |
PCB 156 |
0,0005 |
|
1,2,3,4,7,8-HxCDF |
0,1 |
PCB 157 |
0,0005 |
|
1,2,3,6,7,8-HxCDF |
0,1 |
PCB 167 |
0,00001 |
|
1,2,3,7,8,9-HxCDF |
0,1 |
PCB 189 |
0,0001 |
|
2,3,4,6,7,8-HxCDF |
0,1 |
|
|
|
1,2,3,4,6,7,8-HpCDF |
0,01 |
|
|
|
1,2,3,4,7,8,9-HpCDF |
0,01 |
|
|
|
OCDF |
0,0001 |
|
|
|
Συντμήσεις: «T» = τετρα· «P» = πεντα· «Hx» = εξα· «Hp» = επτα· «O» = οκτα· «CDD» = χλωροδιβενζοδιοξίνη· «CDF» = χλωροδιβενζοφουράνιο· «CB» = χλωροδιφαινύλιο. |
|||
(2) ΕΕ L 140 της 30.5.2002, σ. 10.
(3) Η έννοια του «ανώτατου ορίου συγκέντρωσης» απαιτεί τη χρησιμοποίηση του ορίου του ποσοτικού προσδιορισμού για τη συμβολή κάθε μη ποσοτικά προσδιορισμένης ομοειδούς ουσίας ισοδύναμης τοξικότητας (TEQ).
Η έννοια του «κατώτατου ορίου συγκέντρωσης» απαιτεί τη χρησιμοποίηση του μηδέν για τη συμβολή κάθε μη ποσοτικά προσδιορισμένης ομοειδούς ουσίας στο TEQ.
Η έννοια του «μέσου ορίου συγκέντρωσης» απαιτεί τη χρησιμοποίηση του μισού του ορίου του ποσοτικού προσδιορισμού για τον υπολογισμό της συμβολής κάθε μη ποσοτικά προσδιορισμένης ομοειδούς ουσίας στο TEQ.
(4) Η δεύτερη ανάλυση είναι απαραίτητη για να αποκλειστεί η πιθανότητα εσωτερικής διασταυρούμενης μόλυνσης ή τυχαία ανάμειξη δειγμάτων. Η πρώτη ανάλυση, στην οποία λαμβάνεται υπόψη η αβεβαιότητα της μέτρησης, χρησιμοποιείται για την επαλήθευση της συμμόρφωσης.
Στην περίπτωση που η ανάλυση πραγματοποιείται στο πλαίσιο συμβάντος μόλυνσης από διοξίνη, η επιβεβαίωση με δεύτερη ανάλυση μπορεί να παραληφθεί όταν τα δείγματα που επελέγησαν για ανάλυση συνδέονται βάσει ιχνηλασιμότητας με το εν λόγω συμβάν.
ΠΑΡΑΡΤΗΜΑ VI
ΜΕΘΟΔΟΙ ΑΝΑΛΥΣΗΣ ΓΙΑ ΤΟΝ ΠΡΟΣΔΙΟΡΙΣΜΟ ΤΩΝ ΣΥΣΤΑΤΙΚΩΝ ΖΩΙΚΗΣ ΠΡΟΕΛΕΥΣΗΣ ΓΙΑ ΤΟΝ ΕΠΙΣΗΜΟ ΕΛΕΓΧΟ ΤΩΝ ΖΩΟΤΡΟΦΩΝ
Όροι για τη μικροσκοπική ανίχνευση, την ταυτοποίηση ή τον κατ’ εκτίμηση προσδιορισμό των συστατικών ζωικής προέλευσης στις ζωοτροφές
1. Στόχος και πεδίο εφαρμογής
Οι όροι αυτοί πρέπει να εφαρμόζονται όταν η ανίχνευση συστατικών ζωικής προέλευσης (τα οποία ορίζονται ως προϊόντα της μεταποίησης σφαγίων ή τμημάτων σφαγίων θηλαστικών, πουλερικών ή ψαριών) στις ζωοτροφές πραγματοποιείται με μικροσκοπική εξέταση στο πλαίσιο του προγράμματος συντονισμένων επιθεωρήσεων στον τομέα της διατροφής των ζώων σύμφωνα με τον κανονισμό (ΕΚ) αριθ. 882/2004 του Ευρωπαϊκού Κοινοβουλίου και του Συμβουλίου (1). Με την προϋπόθεση ότι οι μέθοδοι του παρόντος παραρτήματος θα χρησιμοποιούνται σε όλες τις επίσημες δοκιμές, μπορεί επίσης να πραγματοποιείται και μια δεύτερη δοκιμή με τη χρήση παραλλαγμένων ή εναλλακτικών μεθόδων προκειμένου να βελτιώνεται η ανίχνευση ορισμένων ειδών συστατικών ζωικής προέλευσης ή να διευκρινίζεται καλύτερα η προέλευση των εν λόγω συστατικών. Επιπλέον, όταν εξετάζονται ορισμένα ειδικά συστατικά ζωικής προέλευσης όπως το πλάσμα ή οστά σε λίπος μπορεί να χρησιμοποιείται ένα παραλλαγμένο πρωτόκολλο (βλ. επίσης σημείο 9), με την προϋπόθεση ότι οι αναλύσεις αυτές θα πραγματοποιούνται επιπροσθέτως προς τις αναλύσεις που προβλέπονται στο πρόγραμμα συντονισμένων επιθεωρήσεων.
2. Ευαισθησία
Σε συνάρτηση με τη φύση των συστατικών ζωικής προέλευσης, είναι εφικτή η ανίχνευση πολύ μικρών ποσοτήτων τους (< 0,1 %) στις ζωοτροφές.
3. Αρχή
Για την ταυτοποίηση χρησιμοποιείται ένα αντιπροσωπευτικό δείγμα το οποίο έχει ληφθεί σύμφωνα με τα προβλεπόμενα στο παράρτημα I, και το οποίο έχει προετοιμαστεί καταλλήλως. Το ακόλουθο πρωτόκολλο είναι κατάλληλο για τις ζωοτροφές με χαμηλή περιεκτικότητα σε υγρασία. Οι τροφές με υγρασία μεγαλύτερη από 14 % πρέπει να ξηραίνονται (να συμπυκνώνονται) πριν χρησιμοποιηθούν. Ορισμένες ειδικές ζωοτροφές ή υλικά ζωοτροφών (π.χ. λίπη, έλαια) απαιτούν ιδιαίτερη επεξεργασία (βλ. παράγραφο 9). Τα συστατικά ζωικής προέλευσης ταυτοποιούνται με βάση τυπικά χαρακτηριστικά, τα οποία είναι ταυτοποιήσιμα με χρήση μικροσκοπίου (ήτοι μυϊκές ίνες και άλλα σωματίδια κρέατος, χόνδροι, οστά, κέρατα, τρίχες, χνούδι, αίμα, πτερά, κελύφη αυγών, ψαροκόκαλα, λέπια). Η ταυτοποίηση πρέπει να πραγματοποιείται τόσο στο κοσκινισμένο τμήμα (6.1) όσο και στο συμπυκνωμένο ίζημα (6.2) του δείγματος.
4. Αντιδραστήρια
4.1. Παράγοντας ενσωμάτωσης
|
4.1.1. |
Ένυδρη χλωράλη (υδατικό διάλυμα, 60 % βάρος/όγκο) |
|
4.1.2. |
Αλισίβα (NaOH 2,5 % βάρος/όγκο ή KOH 2,5 % βάρος/όγκο) για τα κοσκινισμένα τμήματα |
|
4.1.3. |
Παραφινέλαιο ή γλυκερόλη (ιξώδες: 68-81) για μικροσκοπικές παρατηρήσεις στο ίζημα |
4.2. Παράγοντες έκπλυσης
|
4.2.1. |
Αλκοόλη, 96 % |
|
4.2.2. |
Ακετόνη |
4.3. Παράγοντας συμπύκνωσης
|
4.3.1. |
Τετραχλωροαιθυλένιο (πυκνότητα 1,62) |
4.4. Αντιδραστήρια χρώσης
|
4.4.1. |
Διάλυμα ιωδίου/ιωδιούχου καλίου (διαλύονται 2 g ιωδιούχου καλίου σε 100 ml νερού και προστίθεται 1 g ιωδίου με συχνή ανακίνηση) |
|
4.4.2. |
Ερυθρό της αλιζαρίνης (αραιώνονται 2,5 ml υδροχλωρικού οξέος 1M σε 100 ml νερού και στο διάλυμα προστίθενται 200 mg ερυθρού της αλιζαρίνης) |
|
4.4.3. |
Αντιδραστήριο κυστίνης (2 g οξικού μολύβδου, 10 g NaOH/100 ml H2O) |
|
4.4.4. |
Διάλυμα ιωδίου/ιωδιούχου καλίου (σε διάλυμα αιθανόλης 70 %) |
4.5. Αντιδραστήριο λεύκανσης
|
4.5.1 |
Εμπορικό διάλυμα υποχλωριώδους νατρίου (9,6 % ενεργό χλώριο) |
5. Εξοπλισμός και όργανα
|
5.1. |
Αναλυτικός ζυγός (ακρίβεια 0,01 g εκτός από το συμπυκνωμένο ίζημα: 0,001 g) |
|
5.2. |
Υλικό άλεσης (μύλος άλεσης ή γουδί ειδικά για ζωοτροφές που περιέχουν > 15 % λίπος σε ανάλυση). |
|
5.3. |
Κόσκινο με τετράγωνα διάκενα των οποίων το άνοιγμα είναι 0,50 mm το μέγιστο |
|
5.4. |
Διαχωριστική χοάνη ή ποτήρι ζέσεως με κωνικό πυθμένα |
|
5.5. |
Διόφθαλμο μικροσκόπιο (μεγέθυνση τουλάχιστον 40 φορές) |
|
5.6. |
Απλό μικροσκόπιο (μεγέθυνση τουλάχιστον 400 φορές), εκπεμπομένου ή πολωμένου φωτός |
|
5.7. |
Συνήθη γυάλινα εργαστηριακά σκεύη Όλος ο εξοπλισμός πρέπει να καθαρίζεται εξονυχιστικά. Οι διαχωριστικές χοάνες και τα γυάλινα σκεύη πρέπει να πλένονται σε πλυντήριο. Τα κόσκινα πρέπει να καθαρίζονται με βούρτσα με σκληρές τρίχες. |
6. Διαδικασία
Οι ζωοτροφές υπό μορφή σφαιριδίων πρέπει να προκοσκινίζονται εάν και τα δύο τμήματα αναλύονται ως ξεχωριστό δείγμα.
Υποβάλλονται σε επεξεργασία τουλάχιστον 50 g του δείγματος (προσεκτική άλεση με τη χρήση του κατάλληλου εξοπλισμού άλεσης (5.2), εφόσον παρίσταται ανάγκη, προκειμένου να επιτευχθεί κατάλληλη δομή). Από το αλεσμένο υλικό λαμβάνονται κατόπιν δύο αντιπροσωπευτικά μέρη, ένα (τουλάχιστον 5 g) για το κοσκινισμένο μέρος (6.1) και ένα (τουλάχιστον 5 g) για το συμπυκνωμένο ίζημα (6.2). Ο χρωματισμός με αντιδραστήρια χρώσης (6.3) μπορεί επιπροσθέτως να χρησιμοποιηθεί για την ταυτοποίηση.
Προκειμένου να προσδιοριστεί η φύση των ζωικών πρωτεϊνών και η προέλευση των σωματιδίων, μπορεί να χρησιμοποιείται ένα σύστημα για την υποστήριξη της λήψης απόφασης, όπως το ARIES, καθώς και να γίνεται τεκμηρίωση των δειγμάτων αναφοράς.
6.1. Ταυτοποίηση των συστατικών ζωικής προέλευσης στα κοσκινισμένα τμήματα
Τουλάχιστον 5 g του δείγματος κοσκινίζονται (5.3) σε δύο τμήματα
Το(-α) κοσκινισμένο(-α) τμήμα(-τα) με τα μεγάλα σωματίδια (ή ένα αντιπροσωπευτικό μέρος του τμήματος) απλώνεται σε κατάλληλο υπόστρωμα ούτως ώστε να σχηματιστεί ένα λεπτό στρώμα και να αποτελεί αντικείμενο συστηματικής παρατήρησης με διόφθαλμο μικροσκόπιο (5.5) σε διάφορες μεγεθύνσεις για να ανιχνευθούν τα συστατικά ζωικής προέλευσης.
Προετοιμάζονται πλάκες με το(-α) κοσκινισμένο(-α) τμήμα(-τα) με τα μικρά σωματίδια, οι οποίες αποτελούν αντικείμενο συστηματικής παρατήρησης με χρήση απλού μικροσκοπίου (5.6) σε διάφορες μεγεθύνσεις για την ανίχνευση των συστατικών ζωικής προέλευσης.
6.2. Ταυτοποίηση των συστατικών ζωικής προέλευσης στο συμπυκνωμένο ίζημα
Τουλάχιστον 5 g (ακρίβεια 0,01 g) του δείγματος μεταφέρονται σε διαχωριστική χοάνη ή σε ποτήρι ζέσεως με κωνικό πυθμένα και υποβάλλονται σε επεξεργασία με 50 ml τουλάχιστον τετραχλωροαιθυλενίου (4.3.1). Το μείγμα υποβάλλεται σε επανειλημμένη ανακίνηση/ανάδευση.
|
— |
Αν χρησιμοποιείται κλειστή διαχωριστική χοάνη, το μείγμα αφήνεται σε ηρεμία επί επαρκές χρονικό διάστημα (τουλάχιστον τρία λεπτά) πριν διαχωριστεί το ίζημα. Η ανακίνηση επαναλαμβάνεται και το μείγμα αφήνεται και πάλι σε ηρεμία για τουλάχιστον τρία λεπτά. Το ίζημα διαχωρίζεται ξανά. |
|
— |
Αν χρησιμοποιείται ανοικτό ποτήρι ζέσεως, το μείγμα αφήνεται σε ηρεμία για τουλάχιστον πέντε λεπτά πριν διαχωριστεί το ίζημα. |
Το συνολικό ίζημα ξηραίνεται και κατόπιν ζυγίζεται (ακρίβεια 0,001 g). Η ζύγιση είναι απαραίτητη μόνον εφόσον απαιτείται εκτίμηση. Αν το ίζημα αποτελείται από πολλά μεγάλα σωματίδια, μπορεί να κοσκινιστεί (5.3) σε δύο τμήματα. Το αποξηραμένο ίζημα εξετάζεται με διόφθαλμο μικροσκόπιο (5.5) και με απλό μικροσκόπιο (5.6) για να διαπιστωθεί η ύπαρξη οστικών συστατικών.
6.3. Χρήση παραγόντων ενσωμάτωσης και αντιδραστηρίων χρώσης
Η μικροσκοπική ταυτοποίηση των συστατικών ζωικής προέλευσης μπορεί να διευκολυνθεί με τη χρήση ειδικών παραγόντων ενσωμάτωσης και αντιδραστηρίων χρώσης
Ένυδρη χλωράλη (4.1.1): Με προσεκτική θέρμανση, η δομή των κυττάρων γίνεται πιο ευδιάκριτη επειδή οι κόκκοι του αμύλου ζελατινοποιούνται και απομακρύνονται οι ανεπιθύμητες προσμίξεις των κυττάρων.
Αλισίβα (4.1.2): είτε το υδροξείδιο του νατρίου είτε το υδροξείδιο του καλίου καθαρίζει το υλικό της ζωοτροφής, βοηθώντας στην ανίχνευση μυϊκών ινών, τριχών και άλλων δομών από κερατίνη.
Παραφινέλαιο και γλυκερόλη (4.1.3): Η ανίχνευση των οστικών συστατικών είναι εφικτή μέσα σε αυτόν τον παράγοντα ενσωμάτωσης επειδή τα περισσότερα χαρακτηριστικά κενά παραμένουν γεμάτα με αέρα και εμφανίζονται ως μαύρες τρύπες διαστάσεων 5-15 μm.
Διάλυμα ιωδίου/ιωδιούχου καλίου (4.4.1): Χρησιμοποιείται για την ανίχνευση του αμύλου (κυανό-ιώδες χρώμα) και πρωτεϊνών (κίτρινο-πορτοκαλί χρώμα). Τα διαλύματα μπορούν να αραιωθούν αν χρειάζεται.
Ερυθρό της αλιζαρίνης (4.4.2): Χρώση με ερυθρό/ρόδινο χρώμα οστών, ψαροκόκκαλων και λεπιών. Πριν από την ξήρανση του ιζήματος (βλ. παράγραφο 6.2), το συνολικό ίζημα μεταφέρεται σε γυάλινο δοκιμαστικό σωλήνα και εκπλύνεται δύο φορές με περίπου 5 ml αλκοόλης (4.2.1) (κάθε φορά χρησιμοποιείται αναμείκτης vortex, ο διαλύτης αφήνεται να κατακαθίσει για περίπου ένα λεπτό και εγχύεται). Πριν από τη χρήση του αντιδραστηρίου χρώσης, το ίζημα υποβάλλεται σε λεύκανση προσθέτοντας τουλάχιστον 1 ml διαλύματος υποχλωριώδους νατρίου (4.5.1). Η αντίδραση αφήνεται να εξελιχθεί για 10 λεπτά. Ο σωλήνας γεμίζεται με νερό, το ίζημα αφήνεται να κατακαθίσει για 2-3 λεπτά, και εγχύεται το νερό μαζί με τα αιωρούμενα σωματίδια. Το ίζημα εκπλύνεται δύο φορές ακόμα με περίπου 10 ml νερού (κάθε φορά χρησιμοποιείται αναμείκτης vortex, το νερό αφήνεται να κατακαθίσει και εγχύεται). Προστίθενται 2-10 ή περισσότερες σταγόνες (εξαρτάται από την ποσότητα των καταλοίπων) διαλύματος ερυθρού της αλιζαρίνης. Το μείγμα ανακινείται και η αντίδραση αφήνεται να εξελιχθεί για λίγα δευτερόλεπτα. Το έγχρωμο ίζημα εκπλύνεται δύο φορές με περίπου 5 ml αλκοόλης (4.2.1) και στη συνέχεια μία φορά με ακετόνη (4.2.2) (κάθε φορά χρησιμοποιείται αναμείκτης vortex, ο διαλύτης αφήνεται να κατακαθίσει για περίπου ένα λεπτό και εγχύεται). Το ίζημα είναι έτοιμο για ξήρανση.
Αντιδραστήριο κυστίνης (4.4.3): Με προσεκτική θέρμανση, τα συστατικά που περιέχουν κυστίνη (τρίχες, πτερά, κλπ.) χρωματίζονται καστανά-μαύρα.
6.4. Εξέταση ζωοτροφών που πιθανόν περιέχουν ιχθυάλευρο
Τουλάχιστον μία πλάκα πρέπει να εξετάζεται από το λεπτοκοσκινισμένο μέρος και από το λεπτό τμήμα του ιζήματος με απλό μικροσκόπιο (βλ. παραγράφους 6.1 και 6.2).
Όταν η ετικέτα αναγράφει ότι τα συστατικά περιλαμβάνουν ιχθυάλευρο ή αν υπάρχει υποψία παρουσίας ιχθυάλευρου ή αν αυτό έχει ανιχνευθεί στην αρχική εξέταση, πρέπει να εξετάζονται τουλάχιστον δύο ακόμη πλάκες του ψιλοκοσκινισμένου τμήματος από το αρχικό δείγμα καθώς και ολόκληρο το ίζημα.
7. Υπολογισμός και εκτίμηση
Τα κράτη μέλη εξασφαλίζουν ότι όταν πραγματοποιείται επίσημη ανάλυση προκειμένου να εκτιμηθεί η ποσότητα (και όχι απλώς η παρουσία) των συστατικών ζωικής προέλευσης ακολουθούνται οι διαδικασίες που περιγράφονται στην παρούσα παράγραφο.
Ο υπολογισμός μπορεί να πραγματοποιηθεί μόνο σε περίπτωση που τα συστατικά ζωικής προέλευσης περιλαμβάνουν θραύσματα οστών.
Τα θραύσματα οστών χερσαίων θερμόαιμων ζωικών ειδών (όπως θηλαστικά και πτηνά) μπορούν να διακριθούν από τα διάφορα είδη ψαροκόκαλων στη μικροσκοπική πλάκα χάρη στα χαρακτηριστικά τους κενά. Η αναλογία συστατικών ζωικής προέλευσης στο δείγμα του υλικού εκτιμάται λαμβάνοντας υπόψη:
|
— |
την εκτιμώμενη αναλογία (βάρος %) υπολειμμάτων οστών στο συμπυκνωμένο ίζημα και |
|
— |
την αναλογία (βάρος %) οστών στα συστατικά ζωικής προέλευσης. |
Η εκτίμηση πρέπει να βασίζεται σε τουλάχιστον τρεις (εφόσον αυτό είναι εφικτό) πλάκες και τουλάχιστον πέντε οπτικά πεδία για κάθε πλάκα. Στην περίπτωση μειγμάτων ζωοτροφών, το συμπυκνωμένο ίζημα περιλαμβάνει, κατά κανόνα, όχι μόνο θραύσματα οστών ζώων της ξηράς και ψαροκόκαλων, αλλά και άλλα σωματίδια υψηλού ειδικού βάρους, όπως ανόργανες ουσίες, άμμος, θραύσματα ξυλωδών φυτών κ.λπ.
7.1. Κατ’ εκτίμηση προσδιορισμός του ποσοστού θραυσμάτων οστών
% θραυσμάτων οστών ζώων της ξηράς = (S × c)/W
% θραυσμάτων ψαροκόκαλων και λεπιών = (S × d)/W
|
[S = |
βάρος ιζήματος (mg), c = διορθωτικός συντελεστής (%) για τον κατ’ εκτίμηση προσδιορισμό της αναλογίας οστών ζώων της ξηράς στο ίζημα, d = διορθωτικός συντελεστής (%) για τον κατ’ εκτίμηση προσδιορισμό της αναλογίας θραυσμάτων ψαροκόκαλων και λεπιών στο ίζημα, W = βάρος του υλικού του δείγματος για την καθίζηση (mg)]. |
7.2. Κατ’ εκτίμηση προσδιορισμός του ποσοστού συστατικών ζωικής προέλευσης
Η αναλογία οστών στα ζωικά προϊόντα μπορεί να κυμαίνεται σε μεγάλο βαθμό. (Το ποσοστό οστών στην περίπτωση οστεαλεύρων είναι της τάξεως του 50-60 % και στην περίπτωση κρεαταλεύρων της τάξεως του 20-30 %· σε περίπτωση ιχθυάλευρων, η αναλογία των τμημάτων ψαροκόκαλων και λεπιών κυμαίνεται ανάλογα με την κατηγορία και την καταγωγή του ιχθυάλευρου: συνήθως είναι της τάξεως του 10-20 %).
Σε περίπτωση που είναι γνωστό το είδος του ζωικού αλεύρου που υπάρχει στο δείγμα, είναι εφικτός ο κατ’ εκτίμηση προσδιορισμός της περιεκτικότητας:
Κατ’ εκτίμηση περιεκτικότητα σε συστατικά προϊόντων ζώων της ξηράς (%) = (S × c)/(W × f) × 100
Κατ’ εκτίμηση περιεκτικότητα σε συστατικά προϊόντων ψαριών (%) = (S × d)/(W × f) × 100
|
[S = |
βάρος ιζήματος (mg), c = διορθωτικός συντελεστής (%) για τον κατ’ εκτίμηση προσδιορισμό της αναλογίας οστών ζώων της ξηράς στο ίζημα, d = διορθωτικός συντελεστής (%) για τον κατ’ εκτίμηση προσδιορισμό της αναλογίας θραυσμάτων ψαροκόκαλων και λεπιών στο ίζημα, f = διορθωτικός συντελεστής για την αναλογία οστών στα συστατικά ζωικής προέλευσης του υπό εξέταση δείγματος, W = βάρος του υλικού του δείγματος για την καθίζηση (mg)]. |
8. Παρουσίαση των πορισμάτων της εξέτασης
Η έκθεση πρέπει να περιλαμβάνει τουλάχιστον πληροφορίες σχετικά με την παρουσία συστατικών που προέρχονται από ζώα της ξηράς και από ιχθυάλευρα. Οι διάφορες περιπτώσεις πρέπει να αναφέρονται με τον ακόλουθο τρόπο:
|
8.1. |
Όσον αφορά την παρουσία συστατικών που προέρχονται από ζώα της ξηράς:
|
|
8.2. |
και όσον αφορά την παρουσία ιχθυάλευρου:
Σε περίπτωση που διαπιστώθηκε η παρουσία συστατικών που προέρχονται από ιχθυάλευρο ή από ζώα της ξηράς, το πόρισμα της εξέτασης μπορεί, εφόσον απαιτείται, να αναφέρει και εκτίμηση του ποσού των συστατικών που ανιχνεύθηκαν (x %, < 0,1 %, 0,1-0,5 %, 0,5-5 % ή > 5 %), να διευκρινίζει το είδος του ζώου της ξηράς, εφόσον είναι εφικτό, καθώς και τα συστατικά ζωικής προέλευσης που εντοπίστηκαν (μυϊκές ίνες, χόνδροι, οστά, κέρατα, τρίχες, χνούδι, πτερά, αίμα, κελύφη αυγών, ψαροκόκαλα, λέπια). Για τις περιπτώσεις που γίνεται εκτίμηση των ποσοτήτων των συστατικών ζωικής προέλευσης, πρέπει να αναφέρεται ο χρησιμοποιούμενος διορθωτικός συντελεστής f. Για τις περιπτώσεις που ταυτοποιούνται συστατικά οστών από ζώα της ξηράς, η έκθεση πρέπει να περιλαμβάνει την ακόλουθη επιπρόσθετη φράση: «Δεν μπορεί να αποκλειστεί το ενδεχόμενο τα ως άνω συστατικά να προέρχονται από θηλαστικά». Η πρόσθετη αυτή αυτή φράση δεν είναι απαραίτητη σε περιπτώσεις θραυσμάτων οστών ζώων της ξηράς, όταν έχει διευκρινιστεί ότι πρόκειται για θραύσματα οστών πουλερικών ή θηλαστικών. |
9. Προαιρετικό πρωτόκολλο για την ανάλυση λιπών ή ελαίων
Το ακόλουθο πρωτόκολλο μπορεί να χρησιμοποιείται για την ανάλυση των λιπών ή ελαίων:
|
— |
Αν το λίπος είναι στερεό, θερμαίνεται π.χ. σε φούρνο μικροκυμάτων μέχρις ότου υγροποιηθεί. |
|
— |
Με τη χρήση σιφωνίου, μεταφέρονται 40 ml λίπους από τον πυθμένα του δείγματος σε σωλήνα φυγοκέντρησης. |
|
— |
Πραγματοποιείται φυγοκέντρηση επί 10 λεπτά σε 4 000 rpm. |
|
— |
Αν το λίπος είναι στερεό μετά τη φυγοκέντρηση, θερμαίνεται ακόμη μια φορά σε φούρνο μέχρις ότου υγροποιηθεί. Επαναλαμβάνεται η φυγοκέντρηση επί 5 λεπτά σε 4 000 rpm. |
|
— |
Χρησιμοποιώντας ένα μικρό κουτάλι ή μια σπάτουλα, το ήμισυ των προσμείξεων του υπερκείμενου του ιζήματος διαλύματος μεταφέρεται σε ένα μικρό τρυβλίο Petri ή σε μια αντικειμενοφόρο πλάκα για μικροσκοπική ταυτοποίηση πιθανού περιεχομένου συστατικών ζωικής προέλευσης (ίνες κρέατος, πτερά, θραύσματα οστών κ.λπ.). Ως παράγοντας ενσωμάτωσης για τη μικροσκοπική εξέταση συνιστάται να χρησιμοποιείται παραφινέλαιο ή γλυκερόλη. |
|
— |
Οι προσμείξεις που εναπομένουν χρησιμοποιούνται για ιζηματοποίηση, όπως περιγράφεται στην παράγραφο 6.2. |
(1) ΕΕ L 165 της 30.4.2004, σ. 1· διορθώθηκε στην ΕΕ L 191 της 28.5.2004, σ. 1.
ΠΑΡΑΡΤΗΜΑ VII
ΜΕΘΟΔΟΣ ΥΠΟΛΟΓΙΣΜΟΥ ΤΗΣ ΕΝΕΡΓΕΙΑΚΗΣ ΑΞΙΑΣ ΤΩΝ ΣΥΝΘΕΤΩΝ ΤΡΟΦΩΝ ΠΟΥ ΠΡΟΟΡΙΖΟΝΤΑΙ ΓΙΑ ΤΑ ΠΟΥΛΕΡΙΚΑ
1. Μέθοδος υπολογισμού και έκφραση της ενεργειακής αξίας
Η ενεργειακή αξία των συνθέτων τροφών που προορίζονται για πουλερικά υπολογίζεται σύμφωνα με τον κατωτέρω τύπο, βάσει των ποσοστών ορισμένων αναλυτικών συστατικών των τροφών· η αξία αυτή εκφράζεται σε megajoules (MJ), μεταβολίσιμης ενέργειας (ΜΕ), διορθωμένης για το άζωτο, ανά χιλιόγραμμο σύνθετης τροφής ως έχει:
MJ/kg ME = 0,1551 × % ακατέργαστης πρωτεΐνης +0,3431 × % ακατέργαστες λιπαρές ουσίες +0,1669 × % άμυλο +0,1301 × % ολικά ζάχαρα (εκφρασμένα σε ζαχαρόζη).
2. Όρια ανοχής που εφαρμόζονται στις δηλωθείσες αξίες
Εάν, μετά από τους επισήμους ελέγχους διαπιστώνεται διαφορά μεταξύ του αποτελέσματος του ελέγχου και της ενεργειακής αξίας που έχει δηλωθεί, η οποία συνιστά αύξηση ή μείωση της ενεργειακής αξίας της τροφής, εφαρμόζεται ανοχή της μεταβολίσιμης ενέργειας κατά 0,4 MJ/kg ΜΕ τουλάχιστον.
3. Έκφραση του αποτελέσματος
Το αποτέλεσμα που λαμβάνεται από την εφαρμογή του ανωτέρω τύπου δηλώνεται με προσέγγιση ενός δεκαδικού ψηφίου.
4. Τρόποι δειγματοληψίας και εφαρμοζόμενες μέθοδοι ανάλυσης
Η δειγματοληψία της σύνθετης τροφής και οι περιεκτικότητες σε αναλυτικά συστατικά που δηλώνονται στη μέθοδο υπολογισμού πραγματοποιούνται αντίστοιχα ανάλογα με τις κοινοτικές μεθόδους δειγματοληψίας και ανάλυσης για τον επίσημο έλεγχο των ζωοτροφών.
Εφαρμόζεται:
|
— |
για την περιεκτικότητα σε ακατέργαστες λιπαρές ουσίες: η διαδικασία B της μεθόδου για τον προσδιορισμό των ακατέργαστων ελαίων και λιπών, όπως ορίζεται στο μέρος H του παραρτήματος III, |
|
— |
για τις περιεκτικότητες σε άμυλο: η διαθλασματική μέθοδος, όπως ορίζεται στο μέρος ΙΒ του παραρτήματος III. |
ΠΑΡΑΡΤΗΜΑ VIII
ΜΕΘΟΔΟΙ ΑΝΑΛΥΣΗΣ ΓΙΑ ΤΟΝ ΕΛΕΓΧΟ ΤΗΣ ΠΑΡΑΝΟΜΗΣ ΠΕΡΙΕΚΤΙΚΟΤΗΤΑΣ ΤΩΝ ΖΩΟΤΡΟΦΩΝ ΣΕ ΜΗ ΕΓΚΕΚΡΙΜΕΝΕΣ ΠΛΕΟΝ ΠΡΟΣΘΕΤΕΣ ΥΛΕΣ
Σημαντική σημείωση:Είναι δυνατή η χρήση πιο ευαίσθητων μεθόδων ανάλυσης από τις μεθόδους που αναφέρονται στο παρόν παράρτημα για την ανίχνευση της παράνομης περιεκτικότητας των ζωοτροφών σε μη εγκεκριμένες πλέον πρόσθετες ύλες.Οι μέθοδοι ανάλυσης που αναφέρονται στο παρόν παράρτημα χρησιμοποιούνται για λόγους επιβεβαίωσης.
A. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΗΣ ΟΥΣΙΑΣ ΜΕΘΥΛ-ΜΠΕΝΖΟΚΟΥΕΙΤ
7-βενζυλοξη-6-βουτυλ-3-μεθοξυκαρβονυλ-4-κινολόνη
1. Αντικείμενο και πεδίο εφαρμογής
Η μέθοδος επιτρέπει τον προσδιορισμό της ουσίας μεθυλ-μπενζοκουέιτ στις ζωοτροφές. Η ευαισθησία της μεθόδου είναι 1 mg/kg.
2. Αρχή
Η ουσία μεθυλ-μπενζοκουέιτ λαμβάνεται από το δείγμα με εκχύλιση με μεθανολικό διάλυμα μεθανοσουλφονικού οξέος. Το εκχύλισμα υποβάλλεται σε καθαρισμό με διχλωρομεθάνιο διά ιοντοεναλλακτικής χρωματογραφίας και εν συνεχεία πάλι με διχλωρομεθάνιο. Η περιεκτικότητα σε μεθυλ-μπενζοκουέιτ προσδιορίζεται με υψηλής απόδοσης υγρή χρωματογραφία (HPLC) ανάστροφης φάσης με τη βοήθεια ανιχνευτή υπεριώδους ακτινοβολίας.
3. Αντιδραστήρια
|
3.1. |
Διχλωρομεθάνιο |
|
3.2. |
Μεθανόλη καθαρότητας ισοδύναμης με HPLC |
|
3.3. |
Κινητή φάση HPLC Μείγμα μεθανόλης (3.2) και νερού (καθαρότητας ισοδύναμης με HPLC) 75 + 25 (v+v). Το διάλυμα διηθείται με φίλτρο πάχους 0,22 μm (4.5) και αφαιρούνται τα αέρια (π.χ. μέσω έκθεσης σε υπερήχους επί 10 λεπτά). |
|
3.4. |
Διάλυμα μεθανοσουλφονικού οξέος, c = 2 % Διαλύονται 20,0 ml μεθανοσουλφονικού οξέος σε 1 000 ml μεθανόλης (3.2). |
|
3.5. |
Διάλυμα υδροχλωρικού οξέος, c = 10 % Διαλύονται 100 ml υδροχλωρικού οξέος (ρ201,18 g/ml) σε 1 000 ml νερού. |
|
3.6. |
Ιοντοεναλλακτική ρητίνη κατιόντων Amberlite CG-120 (Na), 100-200 mesh Η ρητίνη υποβάλλεται σε προκαταρκτική επεξεργασία. Αναμειγνύονται 100 γραμμάρια ρητίνης με 500 ml διαλύματος υδροχλωρικού οξέος (3.5) και θερμαίνονται μέχρι βρασμού πάνω σε θερμαινόμενη πλάκα υπό συνεχή ανάδευση. Αφήνεται το διάλυμα να κρυώσει και αποχύνεται το οξύ. Διηθούμε μέσω διηθητικού χάρτη υπό κενό. Εκπλύνουμε τη ρητίνη δύο φορές με 500 ml νερού κάθε φορά και εν συνεχεία με 250 ml μεθανόλης (3.2). Εκπλύνουμε τη ρητίνη μια ακόμη φορά με 250 ml μεθανόλης και ξηραίνουμε με αέρα που διέρχεται μέσω του στερεού υπολείμματος της διήθησης. Η αποξηραμένη ρητίνη φυλάσσεται σε πωματισμένη φιάλη. |
|
3.7. |
Πρότυπη ουσία: καθαρή μεθυλ-μπενζοκουέιτ (7-βενζυλοξη-6-βουτυλ-3-μεθοξυκαρβονυλ-4-κινολόνη) |
|
3.7.1. |
Ζυγίζουμε 50 mg της πρότυπης ουσίας (3.7) με ακρίβεια 0,1 mg, διαλύουμε σε διάλυμα μεθανοσουλφονικού οξέος (3.4) σε βαθμονομημένη φιάλη των 100 ml, συμπληρώνουμε μέχρι τη χαραγή και αναμειγνύουμε. |
|
3.7.2. |
Μεταφέρουμε 5,0 ml του αρχικού πρότυπου διαλύματος μεθυλ-μπενζοκουέιτ (3.7.1) σε βαθμονομημένη φιάλη των 50 ml, συμπληρώνουμε με μεθανόλη (3.2) μέχρι τη χαραγή και αναμειγνύουμε. |
|
3.7.3. |
Μεταφέρουμε 1,0 ml, 2,0 ml, 3,0 ml, 4,0 ml και 5,0 ml του ενδιάμεσου πρότυπου διαλύματος μεθυλ-μπενζοκουέιτ (3.7.2) σε βαθμολογημένες φιάλες των 25 ml. Συμπληρώνουμε με την κινητή φάση (3.3) μέχρι τη χαραγή και αναμειγνύουμε. Η συγκέντρωση των διαλυμάτων αυτών σε μεθυλ-μπενζοκουέιτ είναι αντιστοίχως 2,0 μg/ml, 4,0 μg/ml, 6,0 μg/ml, 8,0 μg/ml και 10,0 μg/ml. Τα διαλύματα αυτά πρέπει να παρασκευάζονται λίγο πριν χρησιμοποιηθούν. |
4. Όργανα
|
4.1. |
Αναδευτήρας εργαστηρίου |
|
4.2. |
Περιστρεφόμενος εξατμιστήρας υμενίου |
|
4.3. |
Υάλινη στήλη (250 mm × 15 mm), εφοδιασμένη με στρόφιγγα και με δεξαμενή χωρητικότητας 200 ml περίπου |
|
4.4. |
Συσκευή HPLC με ανιχνευτή υπεριώδους ακτινοβολίας μεταβλητού μήκους κύματος ή με συστοιχία διόδων ως ανιχνευτή |
|
4.4.1. |
Στήλη υγρής χρωματογραφίας διαστάσεων 300 mm × 4 mm, με πληρωτικό υλικό C18 πάχους 10 μm ή ισοδύναμη |
|
4.5. |
Διηθητικές μεμβράνες, 0,22 μm |
|
4.6. |
Διηθητικές μεμβράνες, 0,45 μm |
5. Διαδικασία
5.1. Γενικά
|
5.1.1. |
Πρέπει να αναλυθεί τυφλό δείγμα ζωοτροφής για να διαπιστωθεί ότι δεν υπάρχει σε αυτό ούτε η ουσία μεθυλ-μπενζοκουέιτ ούτε άλλες παρεμποδίζουσες ουσίες. |
|
5.1.2. |
Για να εξακριβωθεί ο βαθμός ανάκτησης, πρέπει να αναλυθεί τυφλό δείγμα ζωοτροφής το οποίο θα έχει εμπλουτιστεί με προσθήκη ποσότητας μεθυλ-μπενζοκουέιτ παραπλήσιας εκείνης του δείγματος. Για εμπλουτισμό μέχρι 15 mg/kg, προσθέτουμε 600 μl του αρχικού πρότυπου διαλύματος (3.7.1) σε 20 g του τυφλού δείγματος ζωοτροφής, αναμειγνύουμε και περιμένουμε επί 10 λεπτά πριν προχωρήσουμε στο στάδιο της εκχύλισης (5.2). Σημείωση: Για τους σκοπούς της μεθόδου, το τυφλό δείγμα ζωοτροφής πρέπει να είναι παρόμοιου τύπου προς εκείνον του δείγματος και κατά την ανάλυση δεν πρέπει να ανιχνεύεται μεθυλ-μπενζοκουέιτ. |
5.2. Εκχύλιση
Ζυγίζονται περί τα 20 g του παρασκευασθέντος δείγματος με ακρίβεια 0,01 g και εισάγονται σε κωνική φιάλη των 250 ml. Προστίθενται 100,0 ml του διαλύματος μεθανοσουλφονικού οξέος (3.4) και ακολουθεί μηχανική ανατάραξη (4.1) επί 30 λεπτά. Το διάλυμα διηθείται μέσω διηθητικού χάρτη και το διήθημα φυλάσσεται για το στάδιο διαχωρισμού υγρού-υγρού (5.3).
5.3. Διαχωρισμός υγρού-υγρού
Εντός διαχωριστικής χοάνης των 500 ml όπου περιέχονται 100 ml διαλύματος υδροχλωρικού οξέος (3.5), εισάγονται 25,0 ml του διηθήματος που ελήφθη κατά το στάδιο (5.2). Προστίθενται στη χοάνη 100 ml διχλωρομεθανίου (3.1) και ακολουθεί ανατάραξη επί 1 λεπτό. Αφήνεται να επέλθει διαχωρισμός των στοιβάδων και αποχύνεται η υποκείμενη στοιβάδα (διχλωρομεθάνιο) εντός σφαιρικής φιάλης με σφαιρικό πυθμένα και όγκου 500 ml. Επαναλαμβάνεται η εκχύλιση της υδατικής φάσης με δύο ακόμη ποσότητες διχλωρομεθανίου των 40 ml και τα εκχυλίσματα εισάγονται στη σφαιρική φιάλη μαζί με το πρώτο εκχύλισμα. Το εκχύλισμα του διχλωρομεθανίου αφήνεται να εξατμισθεί μέχρι πλήρους ξηράνσης στον περιστροφικό εξατμιστήρα (4.2), σε θερμοκρασία 40 oC και υπό ελαττωμένη πίεση. Το υπόλειμμα διαλύεται σε 20-25 ml μεθανόλης (3.2), πωματίζεται η φιάλη και φυλάσσεται το σύνολο του εκχυλίσματος για το στάδιο της ιοντοεναλλακτικής χρωματογραφίας (5.4).
5.4. Ιοντοεναλλακτική χρωματογραφία
5.4.1.
Τοποθετείται βύσμα από υαλοβάμβακα στο κάτω μέρος μιας υάλινης στήλης (4.3). Παρασκευάζεται μείγμα 5,0 g της προεπεξεργασμένης ρητίνης ανταλλαγής κατιόντων (3.6) με 50 ml υδροχλωρικού οξέος (3.5), εισάγεται στη γυάλινη στήλη και αφήνεται να ηρεμήσει. Απορρίπτεται το πλεονάζον οξύ μέχρις ότου η στάθμη του φθάσει ακριβώς πάνω από την επιφάνεια της ρητίνης και η στήλη εκπλύνεται με νερό μέχρι την ουδετέρη αντίδραση του εκρέοντος υγρού με το χάρτη του ηλιοτροπίου. Εισάγονται πάνω στη στήλη 50 ml μεθανόλης (3.2) και αφήνονται να φθάσουν μέχρι την επιφάνεια της ρητίνης.
5.4.2.
Με ένα σιφώνιο εισάγεται προσεκτικά πάνω στη στήλη το εκχύλισμα που ελήφθη κατά το στάδιο (5.3). Εκπλύνεται η σφαιρική φιάλη με δύο ποσότητες μεθανόλης (3.2) των 5-10 ml και τα υπολείμματα της έκπλυσης μεταφέρονται στη στήλη. Αφήνεται το εκχύλισμα να ρεύσει μέχρι την επιφάνεια της ρητίνης και εκπλύνεται η στήλη με 50 ml μεθανόλης κατά τρόπον ώστε ο ρυθμός της ροής να μην υπερβαίνει τα 5 ml ανά min Το εκρέον υγρό απορρίπτεται. Εκλούεται η μεθυλ-μπενζοκουέιτ από τη στήλη με 150 ml διαλύματος μεθανοσουλφονικού οξέος (3.4) και το υγρό της έκλουσης συλλέγεται από τη στήλη μέσα σε κωνική φιάλη των 250 ml.
5.5. Διαχωρισμός υγρού-υγρού
Εισάγεται το υγρό της έκλουσης το οποίο ελήφθη κατά το στάδιο (5.4.2) εντός διαχωριστικής χοάνης του 1 λίτρου. Εκπλύνεται η κωνική φιάλη με 5-10 ml μεθανόλης (3.2) και τα υπολείμματα της έκλουσης αναμειγνύονται με το περιεχόμενο της διαχωριστικής χοάνης. Προστίθενται 300 ml διαλύματος υδροχλωρικού οξέος (3.5) και 130 ml διχλωρομεθανίου (3.1). Ακολουθεί ανατάραξη επί 1 λεπτό και αφήνεται να επέλθει διαχωρισμός των φάσεων. Αποχύνεται η κατώτερη στοιβάδα (διχλωρομεθάνιο) εντός σφαιρικής φιάλης με σφαιρικό πυθμένα και όγκου 500 ml. Επαναλαμβάνεται η εκχύλιση της υδατικής φάσης με δύο επιπλέον ποσότητες διχλωρομεθανίου των 70 ml και τα εκχυλίσματα εισάγονται μαζί με το πρώτο στη σφαιρική φιάλη.
Αφήνεται να εξατμιστεί το εκχύλισμα του διχλωρομεθανίου μέχρι πλήρους ξηράνσης στον περιστροφικό εξατμιστήρα (4.2) σε θερμοκρασία 40 oC και υπό ελαττωμένη πίεση. Διαλύεται το υπόλειμμα της φιάλης με περίπου 5 ml μεθανόλης (3.2) και το διάλυμα μεταφέρεται προσεκτικά σε βαθμονομημένη φιάλη των 10 ml. Εκπλύνεται η σφαιρική φιάλη με δύο ακόμη ποσότητες μεθανόλης 1-2 ml και τα υπολείμματα της έκπλυσης μεταφέρονται στη βαθμονομημένη φιάλη. Προστίθεται μεθανόλη μέχρι τη χαραγή και ακολουθεί ανάμειξη. Μέρος του εν λόγω υγρού διηθείται μέσω διηθητικής μεμβράνης (4.6). Το εν λόγω διάλυμα φυλάσσεται για τον προσδιορισμό με χρωματογραφία HPLC (5.6).
5.6. Προσδιορισμός με χρωματογραφία HPLC
5.6.1.
Οι ακόλουθες πειραματικές συνθήκες είναι απλώς ενδεικτικές- ισοδύναμα αποτελέσματα μπορούν να προκύψουν και υπό άλλες συνθήκες:
|
— |
Στήλη υγρής χρωματογραφίας (4.4.1), |
|
— |
Κινητή φάση HPLC: Μείγμα μεθανόλης-νερού (3.3), |
|
— |
Ρυθμός ροής: 1-1,5 ml/min, |
|
— |
Μήκος κύματος ανίχνευσης: 265 nm, |
|
— |
Όγκος εισαγόμενου δείγματος: 20-50 μl. |
Ελέγχεται η σταθερότητα της χρωματογραφικής διάταξης με επανειλημμένη εισαγωγή του διαλύματος αναφοράς (3.7.3) συγκέντρωσης 4,0 μg/ml έως ότου επιτευχθούν σταθερά ύψη κορυφών ή εμβαδά και σταθεροί χρόνοι κατακράτησης.
5.6.2.
Εισάγονται κατ’ επανάληψη καθένα από τα διαλύματα αναφοράς (3.7.3) και μετρούνται τα ύψη των κορυφών (εμβαδά) για κάθε συγκέντρωση. Χαράσσεται η καμπύλη αναφοράς με τεταγμένες τις μέσες τιμές του ύψους των κορυφών ή τις μέσες τιμές των εμβαδών και με τετμημένες τις αντίστοιχες συγκεντρώσεις σε μg/ml.
5.6.3.
Εισάγεται κατ’ επανάληψη στη στήλη το εκχύλισμα του δείγματος (5.5) σε όγκο ίσο με εκείνον που χρησιμοποιήθηκε για τα διαλύματα αναφοράς και προσδιορίζεται το μέσο ύψος κορυφής (εμβαδόν) των κορυφών που αντιστοιχούν στην ουσία μεθυλ-μπενζοκουέιτ.
6. Υπολογισμός των αποτελεσμάτων
Προσδιορίζεται η συγκέντρωση του διαλύματος του δείγματος σε μg/ml με βάση το μέσο ύψος (εμβαδόν) των κορυφών της μεθυλ-μπενζοκουέιτ του διαλύματος του δείγματος με τη βοήθεια της καμπύλης αναφοράς (5.6.2).
Η περιεκτικότητα του δείγματος σε μεθυλ-μπενζοκουέιτ w (mg/kg) υπολογίζεται με βάση τον ακόλουθο τύπο:

όπου:
|
c |
= |
η συγκέντρωση της μεθυλ-μπενζοκουέιτ στο διάλυμα του δείγματος, σε μg/ml και |
|
m |
= |
το βάρος του δείγματος δοκιμής, σε γραμμάρια. |
7. Επικύρωση των αποτελεσμάτων
7.1. Ταυτότητα της ανιχνευόμενης ουσίας
Η ταυτότητα της ανιχνευόμενης ουσίας μπορεί να επιβεβαιωθεί με συγχρωματογραφία ή με τη χρήση συστοιχίας διόδων ως ανιχνευτή με τον οποίο γίνεται σύγκριση των φασμάτων του εκχυλίσματος του δείγματος και του διαλύματος αναφοράς (3.7.3) συγκέντρωσης 10 μg/ml.
7.1.1.
Εκχύλισμα του δείγματος εμπλουτίζεται με την προσθήκη κατάλληλης ποσότητας του ενδιάμεσου πρότυπου διαλύματος (3.7.2). Η ποσότητα της προστιθέμενης μεθυλ-μπενζοκουέιτ πρέπει να είναι παραπλήσια προς την κατ’ εκτίμηση υπολογιζόμενη ποσότητα μεθυλ-μπενζοκουέιτ στο εκχύλισμα του δείγματος.
Αν συνεκτιμηθούν τόσο η ποσότητα που προστέθηκε όσο και η αραίωση του εκχυλίσματος, πρέπει να σημειωθεί ενίσχυση μόνον της κορυφής που αντιστοιχεί στην ουσία μεθυλ-μπενζοκουέιτ. Το εύρος της κορυφής στο ήμισυ περίπου του μεγίστου ύψους αυτής δεν πρέπει να αποκλίνει περισσότερο από 10 % περίπου σε σχέση με το αρχικό εύρος.
7.1.2.
Τα αποτελέσματα αξιολογούνται με βάση τα ακόλουθα κριτήρια:
|
α) |
Τα μήκη κύματος στα οποία παρατηρείται η μέγιστη απορρόφηση στο φάσμα του δείγματος και στο φάσμα του προτύπου και τα οποία αντιστοιχούν στο μέγιστο ύψος των κορυφών στο χρωματογράφημα, πρέπει να είναι τα ίδια, με μια διαφορά της οποίας τα όρια καθορίζονται από τη διαχωριστική ικανότητα της ανιχνευτικής διάταξης. Για ανίχνευση με συστοιχία διόδων, το περιθώριο αυτό είναι ± 2 nm. |
|
β) |
Μεταξύ 220 και 350 nm, τα φάσματα του δείγματος και του προτύπου, καταγραφόμενα στο μέγιστο ύψος των κορυφών στο χρωματογράφημα, δεν πρέπει να διαφέρουν για τα τμήματα εκείνα του φάσματος που περικλείονται μεταξύ 10 % και 100 % της σχετικής απορρόφησης. Το κριτήριο αυτό πληρούται όταν παρατηρούνται οι ίδιες μέγιστες τιμές και σε κανένα σημείο η απόκλιση μεταξύ των δύο φασμάτων δεν υπερβαίνει το 15 % απορρόφησης της πρότυπης ανιχνευόμενης ουσίας. |
|
γ) |
Μεταξύ 220 και 350 nm νανομέτρων, τα φάσματα στο ανερχόμενο τμήμα, στο μέγιστο ύψος και στο κατερχόμενο τμήμα της κορυφής του εκχυλίσματος του δείγματος δεν πρέπει να διαφέρουν το ένα από το άλλο για τα τμήματα εκείνα του φάσματος που περικλείονται μεταξύ 10 % και 100 % της σχετικής απορρόφησης. Το κριτήριο αυτό πληρούται όταν παρατηρούνται οι ίδιες μέγιστες τιμές και σε κανένα σημείο η απόκλιση μεταξύ των φασμάτων δεν υπερβαίνει το 15 % της απορρόφησης του φάσματος στο μέγιστο ύψος . |
Εάν έστω και ένα από τα ανωτέρω κριτήρια δεν πληρούται, τότε η παρουσία της ανιχνευόμενης ουσίας δεν θεωρείται επιβεβαιωθείσα.
7.2. Επαναληψιμότητα
Η διαφορά μεταξύ των αποτελεσμάτων δύο παράλληλα διενεργούμενων ποσοτικών προσδιορισμών επί του ίδιου δείγματος δεν πρέπει να υπερβαίνει το 10 % του αποτελέσματος με την υψηλότερη τιμή για περιεκτικότητα της μεθυλ-μπενζοκουέιτ μεταξύ 4 και 20 mg/kg.
7.3. Ανάκτηση
Για ένα εμπλουτισμένο τυφλό δείγμα, η ανάκτηση πρέπει να είναι τουλάχιστον 90 %.
8. Αποτελέσματα συλλογικής μελέτης
Αναλύθηκαν πέντε δείγματα σε δέκα εργαστήρια και κάθε δείγμα αναλύθηκε δύο φορές.
|
|
Τυφλό |
Άλευρο 1 |
Σύμπηκτο 1 |
Άλευρο 2 |
Σύμπηκτο 2 |
|
Μέσος όρος [mg/kg] |
ΔΑ |
4,50 |
4,50 |
8,90 |
8,70 |
|
sr [mg/kg] |
— |
0,30 |
0,20 |
0,60 |
0,50 |
|
CVr [%] |
— |
6,70 |
4,40 |
6,70 |
5,70 |
|
sR [mg/kg] |
— |
0,40 |
0,50 |
0,90 |
1,00 |
|
CVR [%] |
— |
8,90 |
11,10 |
10,10 |
11,50 |
|
Ανάκτηση [%] |
— |
92,00 |
93,00 |
92,00 |
89,00 |
|
ΔΑ |
= |
δεν ανιχνεύθηκε |
|
sr |
= |
τυπική απόκλιση επαναληψιμότητας |
|
CVr |
= |
συντελεστής μεταβολής της επαναληψιμότητας, % |
|
sR |
= |
τυπική απόκλιση αναπαραγωγιμότητας |
|
CVR |
= |
συντελεστής μεταβολής της αναπαραγωγιμότητας, %. |
B. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΟΛΑΚΙΝΔΟΞΗΣ
2-[N-2'-(υδροξυαιθυλο)καρβαμοϋλο]- 3-μεθυλοκινοξαλίνης -N1,N4- διοξείδιο
1. Σκοπός και πεδίο εφαρμογής
Η παρούσα μέθοδος επιτρέπει τον ποσοτικό προσδιορισμό της ολακινδόξης (olaquindox) στις ζωοτροφές. Το κατώτερο όριο προσδιορισμού είναι 5mg/kg.
2. Αρχή
Το δείγμα εκχυλίζεται με μείγμα νερού-μεθανόλης. Η περιεκτικότητα σε ολακινδόξη προσδιορίζεται με τη μέθοδο της υγρής χρωματογραφίας υψηλής απόδοσης (HPLC) ανάστροφης φάσης χρησιμοποιώντας ανιχνευτή UV.
3. Αντιδραστήρια
|
3.1. |
Μεθανόλη |
|
3.2. |
Μεθανόλη, καθαρότητας ισοδύναμης με HPLC |
|
3.3. |
Νερό, καθαρότητας ισοδύναμης με HPLC |
|
3.4. |
Κινητή φάση για HPLC Μείγμα νερού (3.3)-μεθανόλης (3.2), 900 + 100 (V + V) |
|
3.5. |
Πρότυπη ουσία: καθαρή ολακινδόξη [2-/(N-2'-(υδροξυαίθυλο)καρβαμοϋλο] - 3-μεθυλοκινοξαλίνης-N1,N4- διοξίδιο, E 851 |
|
3.5.1. |
Σε ογκομετρική φιάλη των 200 ml ζυγίζονται με ακρίβεια 0,1mg, 50 mg ολακινδόξης (3.5) και προστίθενται 190 ml περίπου νερό. Κατόπιν, η φιάλη τοποθετείται για 20 λεπτά σε λουτρό υπερήχων (4.1). Μετά το λουτρό, το διάλυμα φέρεται σε θερμοκρασία δωματίου, συμπληρώνεται μέχρι τη χαραγή με νερό και ανακινείται για να αναμειχθεί. Η φιάλη τυλίγεται με ένα φύλλο αλουμινίου και φυλάσσεται σε ψυγείο. Να παρασκευάζεται φρέσκο κάθε μήνα. |
|
3.5.2. |
Σε ογκομετρική φιάλη των 100ml μεταφέρονται 10,0 ml του αρχικού πρότυπου διαλύματος (3.5.1), το διάλυμα συμπληρώνεται μέχρι τη χαραγή με την κινητή φάση (3.4) και ανακινείται για να αναμειχθεί καλά. Η φιάλη τυλίγεται με ένα φύλλο αλουμινίου και φυλάσσεται σε ψυγείο. Να παρασκευάζεται φρέσκο κάθε μέρα. |
|
3.5.3. |
Σε μία σειρά από ογκομετρικές φιάλες των 50 ml, μεταγγίζονται 1,0, 2,0, 5,0, 10,0, 15,0 και 20,0 ml του ενδιάμεσου πρότυπου διαλύματος (3.5.2). Τα διαλύματα συμπληρώνονται μέχρι τη χαραγή με την κινητή φάση (3.4), ανακινούνται και στη συνέχεια οι φιάλες τυλίγονται με ένα φύλλο αλουμινίου. Τα διαλύματα αυτά αντιστοιχούν σε 0,5, 1,0, 2,5, 5,0, 7,5 και 10,0 μg ολακινδόξης ανά ml. Κάθε μέρα πρέπει να παρασκευάζονται φρέσκα διαλύματα. |
4. Όργανα
|
4.1. |
Λουτρό υπερήχων |
|
4.2. |
Μηχανικός αναδευτήρας |
|
4.3. |
Εξοπλισμός για HPLC με ανιχνευτή υπεριώδους μεταβλητού μήκους κύματος ή με ανιχνευτή διόδων |
|
4.3.1. |
Στήλη υγρής χρωματογραφίας, 250 mm × 4 mm, πληρωτικό υλικό C18, 10 μm ή ισοδύναμη με αυτήν στήλη |
|
4.4. |
Φίλτρα μεμβράνης 0,45 μm |
5. Διαδικασία
|
Σημείωση: |
Η ολακινδόξη παρουσιάζει ευαισθησία στο φως, γι’ αυτό όλες οι εργασίες πρέπει να εκτελούνται με χαμηλό φωτισμό ή να χρησιμοποιούνται κιτρινωπά γυάλινα σκεύη. |
5.1. Γενικά
|
5.1.1. |
Καταρχάς, πρέπει να υποβάλλεται σε ανάλυση ένα τυφλό δείγμα για να επιβεβαιώνεται ότι αυτό είναι απαλλαγμένο από ολακινδόξη ή άλλες παρεμβαίνουσες προσμίξεις. |
|
5.1.2. |
Πρέπει να εκτελείται δοκιμή ανάκτησης υποβάλλοντας σε ανάλυση το τυφλό το οποίο εμπλουτίστηκε με ολακινδόξη, παρόμοια με εκείνη του δείγματος. Για να επιτευχθεί εμπλουτισμός της τάξης των 50 mg/kg, σε κωνική φιάλη των 250 ml μεταφέρονται 10,0 ml του αρχικού προτύπου διαλύματος (3.5.1) και το διάλυμα εξατμίζεται μέχρις όγκου περίπου 0,5 ml. Προστίθενται 50 g του τυφλού, η φιάλη ανακινείται επισταμένως και αφήνεται σε ηρεμία για 10 λεπτά, ανακινώντας την και πάλι μερικές φορές πριν να προχωρήσουμε στο στάδιο της εκχύλισης (5.2).
|
5.2. Εκχύλιση
Ζυγίζονται, με ακρίβεια 0,01 g περίπου 50 g του δείγματος. Η ποσότητα αυτή του δείγματος μεταφέρεται σε κωνική φιάλη των 1 000 ml, προστίθενται 100 ml μεθανόλης (3.1) και η φιάλη τοποθετείται για 5 λεπτά στο λουτρό υπερήχων (4.1). Προστίθενται 410 ml νερού και η φιάλη αφήνεται στο λουτρό υπερήχων για 15 λεπτά ακόμη. Η φιάλη απομακρύνεται από το λουτρό υπερήχων, το περιεχόμενο αναταράσσεται για 30 λεπτά στον αναδευτήρα (4.2) και διηθείται με πτυχωτό ηθμό. Μεταφέρονται 10 ml του διηθήματος σε μια βαθμονομημένη φιάλη των 20 ml, συμπληρώνεται με νερό και αναμειγνύεται. Φιλτράρεται ένα κλάσμα μέσω φίλτρου μεμβράνης (4.4) (βλ. παρατήρηση στην παράγραφο 9). Συνεχίζεται ο προσδιορισμός στην HPLC (5.3).
5.3. Προσδιορισμός HPLC
5.3.1.
Για την εκτέλεση του προσδιορισμού συνιστάται η χρήση των παρακάτω συνθηκών, χωρίς να αποκλείεται η χρήση και άλλων συνθηκών υπό την προϋπόθεση ότι λαμβάνονται ισοδύναμα αποτελέσματα.
|
Αναλυτική στήλη (4.3.1) |
|
|
Κινητή φάση (3.4): |
μείγμα νερού (3.3) — μεθανόλης (3.2.), 900 + 100 (V + V) |
|
Ρυθμός ροής: |
1,5-2 ml/min |
|
Μήκος κύματος ανίχνευσης: |
380 nm |
|
Όγκος έγχυσης: |
20 μl-100 μl |
Ελέγχεται η σταθερότητα του χρωματογραφικού συστήματος, εγχύοντας επανειλημμένως το διάλυμα αναφοράς (3.5.3) που περιέχει 2,5 μg/ml, μέχρι να επιτευχθούν σταθερά ύψη κορυφών και χρόνοι κατακράτησης.
5.3.2.
Κάθε διάλυμα αναφοράς (3.5.3) εγχύεται επανειλημμένως και προσδιορίζεται για κάθε συγκέντρωση το μέσο ύψος (εμβαδόν) των κορυφών. Η καμπύλη αναφοράς χαράσσεται θέτοντας τα μέσα ύψη (εμβαδά) των κορυφών των διαλυμάτων αναφοράς στον άξονα των τεταγμένων και τις αντίστοιχες συγκεντρώσεις σε μg/ml στον άξονα των τετμημένων.
5.3.3.
Χρησιμοποιώντας τον ίδιο όγκο με εκείνο που χρησιμοποιείται και στην περίπτωση των διαλυμάτων αναφοράς, το δείγμα-διάλυμα (5.2) εγχύεται επανειλημμένως και προσδιορίζεται το μέσο ύψος (εμβαδόν) των κορυφών της ολακινδόξης.
6. Υπολογισμός των αποτελεσμάτων
Η περιεκτικότητα σε ολακινδόξη του υπό μορφή διαλύματος δείγματος προσδιορίζεται σε μg/ml από το μέσο ύψος (εμβαδόν) των κορυφών της ολακινδόξης του εν λόγω δείγματος, με τη βοήθεια της καμπύλης αναφοράς (5.3.2).
Η περιεκτικότητα w του δείγματος σε ολακινδόξη σε mg/kg υπολογίζεται με τον ακόλουθο τύπο:
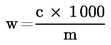
όπου:
|
c |
= |
η συγκέντρωση της ολακινδόξης στο δείγμα διάλυμα (5.2) σε μg/ml |
|
m |
= |
το βάρος του δείγματος δοκιμής σε g (5.2) |
7. Επικύρωση των αποτελεσμάτων
7.1. Ταυτότητα
Η ταυτότητα της αναλυόμενης ουσίας μπορεί να επιβεβαιωθεί με συγχρωματογραφία ή χρησιμοποιώντας ανιχνευτή διόδων με τον οποίο συγκρίνονται τα φάσματα του διαλύματος του δείγματος (5.2) και του διαλύματος αναφοράς (3.5.3) που περιέχει 5,0 μg/ml.
7.1.1.
Δείγμα-διάλυμα (5.2) εμπλουτίζεται προσθέτοντας κατάλληλη ποσότητα διαλύματος αναφοράς (3.5.3). Η ποσότητα της προστιθέμενης ολακινδόξης πρέπει να είναι παρόμοια με την ποσότητα της ολακινδόξης που υπάρχει στο δείγμα (5.2).
Πρέπει να εμφανίζεται ενίσχυση μόνο της κορυφής που αντιστοιχεί στην ολακινδόξη ανάλογα τόσο με την προστεθείσα ποσότητα όσο και με την αραίωση του διαλύματος. Το εύρος της κορυφής, στο ήμισυ του ύψους της, πρέπει να κυμαίνεται στο ± 10 % του αρχικού εύρους της κορυφής της ολακινδόξης του μη εμπλουτισμένου δείγματος.
7.1.2.
Τα αποτελέσματα αξιολογούνται σύμφωνα με τα ακόλουθα κριτήρια:
|
α) |
το μήκος κύματος της μέγιστης απορρόφησης του δείγματος και των πρότυπων φασμάτων, που αντιστοιχεί στο ανώτατο σημείο της κορυφής στο χρωματογράφημα, πρέπει να είναι το ίδιο και να κυμαίνεται σε όρια που καθορίζονται από την αναλυτική ισχύ του συστήματος ανίχνευσης. Για ανίχνευση με διόδους, τα όρια αυτά είναι συνήθως ± 2 nm· |
|
β) |
μεταξύ 200 και 400 nm, το δείγμα και τα πρότυπα φάσματα που αντιστοιχούν στο ανώτατο σημείο της κορυφής του χρωματογραφήματος, δεν πρέπει να διαφέρουν για τα μέρη εκείνα του φάσματος που εμπίπτουν στην περιοχή του 10-100 % σχετικής απορρόφησης. Το κριτήριο αυτό θεωρείται ότι πληρούται όταν τα εμφανιζόμενα μέγιστα είναι τα ίδια και σε κανένα από τα παρατηρούμενα σημεία η απόκλιση μεταξύ των δύο φασμάτων δεν υπερβαίνει το 15 % της απορρόφησης της πρότυπης αναλυόμενης ουσίας· |
|
γ) |
μεταξύ 220 και 400 nm, τα φάσματα της ανωφέρειας, του ανώτατου σημείου και της κατωφέρειας της κορυφής που δίνει το δείγμα-διάλυμα δεν πρέπει να διαφέρουν μεταξύ τους στα σημεία εκείνα του φάσματος που εμπίπτουν στην περιοχή του 10-100 % σχετικής απορρόφησης. Το κριτήριο αυτό θεωρείται ότι πληρούται όταν τα εμφανιζόμενα μέγιστα είναι τα ίδια και όταν σε όλα τα παρατηρούμενα σημεία η απόκλιση μεταξύ των φασμάτων δεν υπερβαίνει το 15 % της απορρόφησης του φάσματος του ανώτατου σημείου της κορυφής. |
Εφόσον ένα οποιοδήποτε από τα παραπάνω κριτήρια δεν πληρούνται, τότε δεν μπορεί θεωρηθεί ότι βεβαιώθηκε η παρουσία της αναλυόμενης ουσίας.
7.2. Επαναληψιμότητα
Η διαφορά μεταξύ των αποτελεσμάτων δύο παράλληλα διενεργούμενων προσδιορισμών στο ίδιο δείγμα δεν πρέπει να υπερβαίνει το 15 % σε σχέση με την υψηλότερη τιμή για συγκεντρώσεις ολακινδόξης μεταξύ 10 και 200 mg/kg.
7.3. Ανάκτηση
Σε ένα εμπλουτισμένο τυφλό δείγμα, η ανάκτηση πρέπει να είναι τουλάχιστον 90 %.
8. Αποτελέσματα διεργαστηριακής μελέτης
Πραγματοποιήθηκε διεργαστηριακή μελέτη σε επίπεδο Ευρωπαϊκής Κοινότητας στην οποία 4 δείγματα χοιροτροφής, συμπεριλαμβανομένου και ενός τυφλού, αναλύθηκαν σε 13 εργαστήρια. Τα αποτελέσματα δίδονται κατωτέρω:
|
|
Δείγμα 1 |
Δείγμα 2 |
Δείγμα 3 |
Δείγμα 4 |
|
L |
13 |
10 |
11 |
11 |
|
n |
40 |
40 |
44 |
44 |
|
Μέσος όρος [mg/kg] |
— |
14,6 |
48,0 |
95,4 |
|
Sr [mg/kg] |
— |
0,82 |
2,05 |
6,36 |
|
SR [mg/kg] |
— |
1,62 |
4,28 |
8,42 |
|
CVr [%] |
— |
5,6 |
4,3 |
6,7 |
|
CVR [%] |
— |
11,1 |
8,9 |
8,8 |
|
Ονομαστική περιεκτικότητα |
|
|
|
|
|
[mg/kg] |
— |
15 |
50 |
100 |
|
Ανάκτηση % |
— |
97,3 |
96,0 |
95,4 |
|
L |
= |
αριθμός εργαστηρίων |
|
n |
= |
αριθμός μεμονωμένων τιμών |
|
Sr |
= |
τυπική απόκλιση επαναληψιμότητας |
|
SR |
= |
τυπική απόκλιση αναπαραγωγιμότητας |
|
CVr |
= |
συντελεστής διακύμανσης επαναληψιμότητας |
|
CVR |
= |
συντελεστής διακύμανσης αναπαραγωγιμότητας. |
9. Παρατήρηση
Αν και η μέθοδος δεν έχει αξιολογηθεί για τροφές που περιέχουν περισσότερο από 100 mg/kg ολακινδόξης, είναι δυνατόν να επιτευχθούν ικανοποιητικά αποτελέσματα παίρνοντας μικρότερη ποσότητα δείγματος ή/και αραιώνοντας το εκχύλισμα (5.2) ώστε να επιτευχθούν συγκεντρώσεις μέσα στα όρια της καμπύλης αναφοράς (5.3.2).
Γ. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΟΥ ΑΜΠΡΟΛΙΟΥ
Υδροχλωρικό άλας του χλωριούχου 1-[(4-αμινο-2-προπυλοπυρυριμιδιν-5-υλο)μεθυλο]- 2-μεθυλο-πυριδινίου
1. Σκοπός και πεδίο εφαρμογής
Η παρούσα μέθοδος επιτρέπει τον προσδιορισμό του αμπρολίου σε ζωοτροφές και προμείγματα. Το όριο ανίχνευσης είναι 1 mg/kg, το όριο προσδιορισμού είναι 5 mg/kg.
2. Αρχή
Το δείγμα εκχυλίζεται με μείγμα μεθανόλης-νερού. Έπειτα από αραίωση με την κινητή φάση και διήθηση μέσω φίλτρου μεμβράνης, η περιεκτικότητα σε αμπρόλιο προσδιορίζεται με κατιοανταλλακτική υγρή χρωματογραφία υψηλής απόδοσης (HPLC) με χρήση ανιχνευτή υπεριώδους.
3. Αντιδραστήρια
|
3.1. |
Μεθανόλη |
|
3.2. |
Ακετονιτρίλιο καθαρότητας ισοδύναμης με HPLC |
|
3.3. |
Νερό καθαρότητας ισοδύναμης με HPLC |
|
3.4. |
Διάλυμα δισόξινου φωσφορικού νατρίου, c = 0,1 mol/l 13,80 g μονοένυδρου δισόξινου φωσφορικού νατρίου διαλύονται σε νερό (3.3) σε ογκομετρική φιάλη των 1 000 ml, το διάλυμα συμπληρώνεται με νερό (3.3) μέχρι τη χαραγή και ανακινείται. |
|
3.5. |
Διάλυμα υπερχλωρικού νατρίου, c = 1,6 mol/l 224,74 g μονοένυδρου υπερχλωρικού νατρίου διαλύονται σε νερό (3.3) σε ογκομετρική φιάλη των 1 000 ml, το διάλυμα συμπληρώνεται μέχρι τη χαραγή με νερό (3.3) και ανακινείται. |
|
3.6. |
Κινητή φάση για την HPLC (βλ. παρατήρηση στην παράγραφο 9.1) Μείγμα ακετονιτριλίου (3.2), διαλύματος δισόξινου φωσφορικού νατρίου (3.4) και διαλύματος υπερχλωρικού νατρίου (3.5), 450 + 450 + 100 (v+v+v). Πριν από τη χρήση, διηθείται διαμέσου διηθητικής μεμβράνης πάχους 0,22 μm (4.3) και το διάλυμα απαεριώνεται [π.χ. σε λουτρό υπερήχων (4.4) για 15 λεπτά τουλάχιστον]. |
|
3.7. |
Πρότυπη ουσία: καθαρό αμπρόλιο, υδροχλωρικό άλας χλωριούχου 1-[(4-αμινο-2-προπυλοπυριμιδιν-5-υλο)μεθυλο]-2-μεθυλο-πυριδινίου, Ε 750 (βλ. παράγραφο 9.2) |
|
3.7.1. |
Σε ογκομετρική σφαιρική φιάλη των 100 ml, ζυγίζονται με ακρίβεια 0,1 mg, 50 mg αμπρολίου (3.7), διαλύονται σέ 80 ml μεθανόλης (3.1) και η φιάλη τοποθετείται για 10 λεπτά σε λουτρό υπερήχων (4.4). Στη συνέχεια, το διάλυμα φέρεται σε θερμοκρασία δωματίου, συμπληρώνεται μέχρι τη χαραγή με νερό και ανακινείται. Σε θερμοκρασία ≤ 4 oC το διάλυμα είναι σταθερό για ένα μήνα. |
|
3.7.2. |
5,0 ml του αρχικού πρότυπου διαλύματος (3.7.1) παραλαμβάνονται με σιφώνιο και φέρονται σε ογκομετρική φιάλη των 50 ml, το διάλυμα συμπληρώνεται μέχρι τη χαραγή με τον διαλύτη εκχύλισης (3.8) και ανακινείται. Σε θερμοκρασία ≤ 4 oC το διάλυμα είναι σταθερό για ένα μήνα. |
|
3.7.3. |
0,5, 1,0 και 2,0 ml του ενδιαμέσου πρότυπου διαλύματος (3.7.2) μεταφέρονται σε μια σειρά ογκομετρικών φιαλών των 50 ml. Συμπληρώνονται μέχρι τη χαραγή με την κινητή φάση (3.6) και ανακινούνται. Τα διαλύματα αυτά αντιστοιχούν σε 0,5, 1,0 και 2,0 μg αμπρολίου ανά ml αντιστοίχως. Τα διαλύματα αυτά πρέπει να ετοιμάζονται λίγο πριν να χρησιμοποιηθούν. |
|
3.8. |
Διαλύτης εκχύλισης Μείγμα μεθανόλης (3.1)-νερού 2+1 (v+v) |
4. Όργανα
|
4.1. |
Εξοπλισμός HPLC με σύστημα έγχυσης, κατάλληλο για έγχυση όγκων 100 μl |
|
4.1.1. |
Στήλη υγρής χρωματογραφίας 125 mm × 4 mm, κατιοανταλλακτικό υλικό πλήρωσης Nucleosil 10 SA, 5 ή 10 μm, ή ισοδύναμη |
|
4.1.2. |
Ανιχνευτής UV με δυνατότητα ρύθμισης σε διάφορα μήκη κύματος ή με διάταξη διόδων |
|
4.2. |
Φίλτρο μεμβράνης, υλικό PTFE, 0,45 μm |
|
4.3. |
Φίλτρο μεμβράνης, 0,22 μm |
|
4.4. |
Λουτρό υπερήχων |
|
4.5. |
Συσκευή μηχανικής ανακίνησης ή μαγνητικός αναδευτήρας |
5. Διαδικασία
5.1. Γενικά
5.1.1.
Για την εκτέλεση της δοκιμής ανάκτησης (5.1.2), πρέπει να διενεργείται ανάλυση τυφλού ώστε να ελέγχεται ότι δεν υπάρχει ούτε αμπρόλιο ούτε κάποια άλλη παρεμποδίζουσα ουσία. Το τυφλό δείγμα πρέπει να είναι παρόμοιου τύπου με εκείνον του δείγματος και δεν πρέπει να ανιχνεύονται σε αυτό αμπρόλιο ή άλλες παρεμποδίζουσες ουσίες.
5.1.2
Πρέπει να πραγματοποιείται δοκιμή ανάκτησης υποβάλλοντας σε ανάλυση τυφλό δείγμα εμπλουτισμένο με προσθήκη ποσότητας αμπρολίου, παρόμοιας με εκείνη που υπάρχει στο δείγμα. Για εμπλουτισμό μέχρι 100 mg/kg, 10,0 ml του αρχικού πρότυπου διαλύματος (3.7.1) μεταφέρονται σε κωνική φιάλη των 250 ml και το διάλυμα εξατμίζεται μέχρις όγκου περίπου 0,5 ml. Προστίθενται 50 g του τυφλού, αναμειγνύονται επισταμένως και αφήνονται για 10 λεπτά αναμειγνύοντας πάλι μερικές φορές πριν προχωρήσουμε στο στάδιο της εκχύλισης (5.2).
Εναλλακτικά, εφόσον δεν υπάρχει διαθέσιμο τυφλό παρόμοιου τύπου με το δείγμα (βλ. παράγραφο 5.1.1), δοκιμή ανάκτησης μπορεί να γίνει μέσω της μεθόδου προσθήκης προτύπου. Στην περίπτωση αυτή, το προς ανάλυση δείγμα εμπλουτίζεται με ποσότητα αμπρολίου παρόμοια με εκείνη που υπάρχει ήδη στο δείγμα. Το δείγμα αυτό αναλύεται παράλληλα με το μη εμπλουτισμένο δείγμα και η ανάκτηση μπορεί να υπολογιστεί με αφαίρεση.
5.2. Εκχύλιση
5.2.1.
Σε κωνική φιάλη των 500 ml, ζυγίζονται με ακρίβεια 0,01 g, 5-40 g του δείγματος ανάλογα με την περιεκτικότητα σε αμπρόλιο και προστίθενται 200 ml διαλύτη εκχύλισης (3.8). Η φιάλη τοποθετείται στο λουτρό υπερήχων (4.4) και αφήνεται για 15 λεπτά. Η φιάλη απομακρύνεται από το λουτρό και ανακινείται για 1 ώρα στο μηχανικό τάρακτρο ή αναδεύεται με μαγνητικό αναδευτήρα (4.5). Κατάλληλη ποσότητα του εκχυλίσματος αραιώνεται με την κινητή φάση (3.6) μέχρι περιεκτικότητας σε αμπρόλιο 0,5-2 μg/ml και αναμειγνύεται (9.3). 5-10 ml του αραιωμένου αυτού διαλύματος διηθούνται μέσω μεμβράνης (4.2). Ακολουθεί προσδιορισμός με HPLC (5.3).
5.2.2.
Σε κωνική φιάλη των 500 ml ζυγίζονται με ακρίβεια 0,001 g, 1-4 g του προμείγματος ανάλογα με την περιεκτικότητα σε αμπρόλιο και προστίθενται 200 ml διαλύτη εκχύλισης (3.8). Η φιάλη τοποθετείται σε λουτρό υπερήχων (4.4) και αφήνεται για 15 λεπτά. Η φιάλη απομακρύνεται από το λουτρό και ανακινείται για 1 ώρα στο μηχανικό τάρακτρο ή αναδεύεται με μαγνητικό αναδευτήρα (4.5). Κατάλληλη ποσότητα του εκχυλίσματος αραιώνεται με την κινητή φάση (3.6) μέχρι περιεκτικότητας σε αμπρόλιο 0,5-2 μg/ml και αναμειγνύεται. 5-10 ml του αραιωμένου αυτού διαλύματος διηθούνται μέσω μεμβράνης (4.2). Ακολουθεί προσδιορισμός με HPLC (5.3).
5.3. Προσδιορισμός με HPLC
5.3.1.
Παρακάτω δίδονται ενδεικτικά ορισμένες κατάλληλες συνθήκες. Μπορούν να χρησιμοποιηθούν και διαφορετικές συνθήκες εφόσον παρέχουν ισοδύναμα αποτελέσματα.
|
Υγρή χρωματογραφική |
|
|
στήλη (4.1.1): |
125 mm × 4 mm, κατιοανταλλακτικό υλικό πλήρωσης Nucleosil 10 SA, 5 ή 10 μm ή ισοδύναμη |
|
Κινητή φάση (3.6): |
Μείγμα ακετονιτριλίου (3.2), διαλύματος δισόξινου φωσφορικού νατρίου (3.4) και διαλύματος υπερχλωρικού νατρίου (3.5) 450+450+100 (v+v+v). |
|
Ρυθμός ροής: |
0,7-1 ml/min |
|
Μήκος κύματος ανίχνευσης: |
264 nm |
|
Όγκος έγχυσης: |
100 μl |
Ελέγχεται η σταθερότητα του χρωματογραφικού συστήματος, εγχύοντας κατ’ επανάληψη το διάλυμα βαθμονόμησης (3.7.3) που περιέχει 1,0 μg/ml, μέχρι να σταθεροποιηθούν τα ύψη των κορυφών και οι χρόνοι κατακράτησης.
5.3.2.
Κάθε διάλυμα βαθμονόμησης ή αναφοράς (3.7.3) εγχύεται κατ’ επανάληψη και προσδιορίζεται το μέσο ύψος (εμβαδόν) της κορυφής κάθε συγκέντρωσης. Χαράσσεται καμπύλη αναφοράς χρησιμοποιώντας ως τεταγμένες τα μέσα ύψη (εμβαδά) των κορυφών των διαλυμάτων βαθμονόμησης και ως τετμημένες τις αντίστοιχες συγκεντρώσεις σε μg/ml.
5.3.3.
Εγχύεται κατ’ επανάληψη το εκχύλισμα του δείγματος (5.2) χρησιμοποιώντας τον ίδιο όγκο με εκείνο των διαλυμάτων βαθμονόμησης και προσδιορίζεται το μέσο ύψος (εμβαδόν) των κορυφών του αμπρολίου.
6. Υπολογισμός των αποτελεσμάτων
Από το μέσο ύψος (εμβαδόν) των κορυφών του αμπρολίου του διαλύματος του δείγματος προσδιορίζεται η περιεκτικότητα στο διάλυμα του δείγματος σε μg/ml βάσει της καμπύλης αναφοράς (5.3.2).
Η συγκέντρωση κατά βάρος σε mg/kg του αμπρολίου στο δείγμα δίδεται από τον ακόλουθο τύπο:
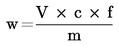 [mg/kg]
[mg/kg]
όπου:
|
V |
= |
όγκος του διαλύτη εκχύλισης (3.8) σε ml σύμφωνα με το 5.2 (δηλαδή 200 ml) |
|
c |
= |
συγκέντρωση αμπρολίου στο εκχύλισμα δείγματος (5.2) σε μg/ml |
|
f |
= |
συντελεστής αραίωσης σύμφωνα με το 5.2 |
|
m |
= |
βάρος του δείγματος δοκιμής σε g. |
7. Επικύρωση των αποτελεσμάτων
7.1. Ταυτότητα
Η ταυτότητα της αναλυόμενης ουσίας μπορεί να ελεγχθεί με συγχρωματογραφία ή με τη βοήθεια ανιχνευτή διόδων με τον οποίο συγκρίνονται τα φάσματα του εκχυλίσματος (5.2) και του διαλύματος βαθμονόμησης (3.7.3) που περιέχει 2,0 μg/ml.
7.1.1.
Εκχύλισμα δείγματος (5.2) εμπλουτίζεται με προσθήκη κατάλληλης ποσότητας διαλύματος βαθμονόμησης (3.7.3). Η ποσότητα του προστιθέμενου αμπρολίου πρέπει να είναι παρόμοια με την ποσότητα του αμπρολίου που βρίσκεται στο εκχύλισμα.
Λαμβάνοντας υπόψη τόσο την προστιθέμενη ποσότητα όσο και την αραίωση του εκχυλίσματος, μόνον το ύψος της κορυφής του αμπρολίου πρέπει να βρίσκεται αυξημένο. Το πλάτος της κορυφής, στα μισά του ύψους, δεν πρέπει να αποκλίνει περισσότερο από ± 10 % του αρχικού πλάτους της κορυφής του αμπρολίου του μη εμπλουτισμένου εκχυλίσματος.
7.1.2.
Τα αποτελέσματα αξιολογούνται με τα ακόλουθα κριτήρια:
|
α) |
Το μήκος κύματος της μέγιστης απορρόφησης των φασμάτων του δείγματος και του προτύπου, που καταγράφονται στο υψηλότερο σημείο της κορυφής στο χρωματογράφημα, πρέπει να είναι στο πλαίσιο των περιθωρίων που δικαιολογούνται από την αναλυτική ικανότητα του συστήματος ανίχνευσης. Το περιθώριο αυτό στην ανίχνευση με διάταξη διόδων είναι συνήθως ± 2 nm. |
|
β) |
Μεταξύ 210 και 320 nm, τα φάσματα του δείγματος και του προτύπου που καταγράφονται στο υψηλότερο σημείο της κορυφής του χρωματογραφήματος, δεν πρέπει να διαφέρουν στα μέρη εκείνα του φάσματος που είναι στην περιοχή του 10-100 % της σχετικής απορρόφησης. Το κριτήριο αυτό εκπληρώνεται όταν εμφανίζονται τα ίδια μέγιστα και σε κανένα υπό παρατήρηση σημείο η απόκλιση μεταξύ των δύο φασμάτων δεν υπερβαίνει το 15 % της απορρόφησης της πρότυπης αναλυόμενης ουσίας. |
|
γ) |
Μεταξύ 210 και 320 nm, τα φάσματα του ανερχόμενου τμήματος, του υψηλότερου σημείου και του κατερχόμενου τμήματος της κορυφής του εκχυλίσματος του δείγματος δεν πρέπει να διαφέρουν μεταξύ τους στα μέρη εκείνα του φάσματος που είναι στην περιοχή του 10-100 % της σχετικής πυκνότητας. Το κριτήριο αυτό εκπληρώνεται όταν εμφανίζονται τα ίδια μέγιστα και όταν σε όλα τα υπό παρατήρηση σημεία η απόκλιση μεταξύ των φασμάτων δεν υπερβαίνει το 15 % της απορρόφησης του φάσματος του υψηλότερου σημείου της κορυφής. |
Εφόσον ένα από αυτά τα κριτήρια δεν εκπληρώνεται, δεν θεωρείται επιβεβαιωμένη η παρουσία της αναλυόμενης ουσίας.
7.2. Επαναληψιμότητα
Η διαφορά μεταξύ των αποτελεσμάτων δύο παράλληλων προσδιορισμών που πραγματοποιούνται στο ίδιο δείγμα δεν πρέπει να υπερβαίνει
|
— |
το 15 % σε σχέση με την υψηλότερη τιμή για περιεκτικότητες σε αμπρόλιο από 25 mg/kg έως 500 mg/kg, |
|
— |
τα 75 mg/kg για περιεκτικότητες σε αμπρόλιο μεταξύ 500 mg/kg και 1 000 mg/kg, |
|
— |
το 7,5 % σε σχέση με την υψηλότερη τιμή για περιεκτικότητες σε αμπρόλιο άνω των 1 000 mg/kg. |
7.3. Ανάκτηση
Σε εμπλουτισμένο (τυφλό) δείγμα, η ανάκτηση πρέπει να είναι τουλάχιστον 90 %.
8. Αποτελέσματα διεργαστηριακής μελέτης
Πραγματοποιήθηκε διεργαστηριακή μελέτη στην οποία αναλύθηκαν τρεις πτηνοτροφές (δείγμα 1-3), μια ανόργανη (δείγμα 4) και ένα πρόμειγμα (δείγμα 5). Τα αποτελέσματα δίδονται στον ακόλουθο πίνακα
|
|
Δείγμα 1 (τυφλό) |
Δείγμα 2 |
Δείγμα 3 |
Δείγμα 4 |
Δείγμα 5 |
|
L |
14 |
14 |
14 |
14 |
15 |
|
n |
56 |
56 |
56 |
56 |
60 |
|
Μέσος όρος [mg/kg] |
— |
45,5 |
188 |
5 129 |
25 140 |
|
sr [mg/kg] |
— |
2,26 |
3,57 |
178 |
550 |
|
CVr [%] |
— |
4,95 |
1,90 |
3,46 |
2,20 |
|
sR [mg/kg] |
— |
2,95 |
11,8 |
266 |
760 |
|
CVR [%] |
— |
6,47 |
6,27 |
5,19 |
3,00 |
|
Ονομαστική περιεκτικότητα [mg/kg] |
— |
50 |
200 |
5 000 |
25 000 |
|
L |
= |
αριθμός εργαστηρίων |
|
n |
= |
αριθμός μεμονωμένων τιμών |
|
sr |
= |
τυπική απόκλιση επαναληψιμότητας |
|
CVr |
= |
συντελεστής διακύμανσης επαναληψιμότητας |
|
sR |
= |
τυπική απόκλιση αναπαραγωγιμότητας |
|
CVR |
= |
συντελεστής διακύμανσης αναπαραγωγιμότητας. |
9. Παρατηρήσεις
|
9.1. |
Εάν το δείγμα περιέχει θειαμίνη, η κορυφή της θειαμίνης στο χρωματογράφημα εμφανίζεται λίγο πριν από την κορυφή του αμπρολίου. Σύμφωνα με την παρούσα μέθοδο, το αμπρόλιο και η θειαμίνη πρέπει να διαχωρίζονται. Εάν το αμπρόλιο και η θειαμίνη δεν διαχωρίζονται από τη στήλη (4.1.1) που χρησιμοποιείται στην παρούσα μέθοδο, ένα μέρος του ακετονιτριλίου της κινητής φάσης (3.6) μέχρι 50 % πρέπει να αντικαθίσταται από μεθανόλη. |
|
9.2. |
Σύμφωνα με τη Βρετανική Φαρμακοποιία, το φάσμα διαλύματος αμπρολίου (c = 0,02 mol/l) σε υδροχλωρικό οξύ (c = 0,1 mol/l) εμφανίζει μέγιστα στα 246 nm και 262 nm. H απορρόφηση ανέρχεται σε 0,84 στα 246 nm και 0,80 στα 262 nm. |
|
9.3. |
Το εκχύλισμα πρέπει να αραιώνεται πάντοτε με την κινητή φάση διότι διαφορετικά ο χρόνος κατακράτησης της κορυφής του αμπρολίου μπορεί να μετατοπιστεί σημαντικά λόγω μεταβολών της ιονικής ισχύος. |
Δ. ΠΡΟΣΔΙΟΡΙΣΜΟΣ ΤΗΣ ΚΑΡΒΑΔΟΞΗΣ
Μέθυλο 3-(2-κινοξαλινυλομεθυλενο)καρβαζικό N 1 ,N 4 -διοξείδιο
1. Σκοπός και πεδίο εφαρμογής
Η παρούσα μέθοδος επιτρέπει τον προσδιορισμό της καρβαδόξης σε ζωοτροφές, προμείγματα και παρασκευάσματα. Το όριο ανίχνευσης είναι 1 mg/kg, το όριο προσδιορισμού είναι 5 mg/kg.
2. Αρχή
Το δείγμα αναμειγνύεται με νερό και εκχυλίζεται με μεθανόλη-ακετονιτρίλιο. Στις ζωοτροφές, κατάλληλη ποσότητα του διηθημένου εκχυλίσματος υποβάλλεται σε καθαρισμό σε στήλη οξειδίου του αργιλίου. Στα προμείγματα και παρασκευάσματα, ποσότητα του διηθημένου εκχυλίσματος αραιώνεται σε κατάλληλη συγκέντρωση με νερό, μεθανόλη και ακετονιτρίλιο. Η περιεκτικότητα της καρβαδόξης προσδιορίζεται με υγρή χρωματογραφία υψηλής απόδοσης (HPLC) ανάστροφης φάσης με χρήση ανιχνευτή UV.
3. Αντιδραστήρια
|
3.1. |
Μεθανόλη |
|
3.2. |
Ακετονιτρίλιο καθαρότητας ισοδύναμης με HPLC |
|
3.3. |
Οξικό οξύ, w = 100 % |
|
3.4. |
Οξείδιο αργιλίου: ουδέτερο, βαθμός δραστικότητας I |
|
3.5. |
Μεθανόλη-ακετονιτρίλιο 1 + 1 (v + v) 500 ml μεθανόλης (3.1) αναμειγνύονται με 500 ml ακετονιτριλίου (3.2). |
|
3.6. |
Οξικό οξύ, σ = 10 % 10 ml οξικού οξέος (3.3) αραιώνονται μέχρι τα 100 ml με νερό. |
|
3.7. |
Οξικό νάτριο |
|
3.8. |
Νερό καθαρότητας ισοδύναμης με HPLC |
|
3.9. |
Οξικό ρυθμιστικό διάλυμα, c = 0,01 mol/l, pH = 6,0 0,82 g οξικού νατρίου (3.7) διαλύονται σε 700 ml νερό (3.8) και ρυθμίζεται το pH στο 6,0 με οξικό οξύ (3.6). Το διάλυμα μεταφέρεται σε ογκομετρική φιάλη των 1 000 ml, συμπληρώνεται μέχρι τη χαραγή με νερό (3.8) και αναμειγνύεται. |
|
3.10. |
Κινητή φάση για HPLC 825 ml οξικού ρυθμιστικού διαλύματος (3.9) αναμειγνύονται με 175 ml ακετονιτριλίου (3.2). Ακολουθεί διήθηση μέσω φίλτρου 0,22 μm (4.5) και απαερίωση του διαλύματος (π.χ. με υπερήχους για 10 λεπτά). |
|
3.11. |
Πρότυπη ουσία Καθαρή καρβαδόξη: Μεθυλο 3-(2-κινοξαλινυλομεθυλενο)καρβαζικό N1,N4-διοξείδιο, E 850 |
|
3.11.1. |
Σε ογκομετρική φιάλη των 250 ml ζυγίζονται με ακρίβεια 0,1 mg, 25 mg πρότυπης ουσίας καρβαδόξης (3.11). Διαλύονται σε μεθανόλη-ακετονιτρίλιο (3.5) με εφαρμογή υπερήχων (4.7). Μετά τους υπερήχους, το διάλυμα φέρεται σε θερμοκρασία δωματίου, συμπληρώνεται μέχρι τη χαραγή με μεθανόλη-ακετονιτρίλιο (3.5) και αναμειγνύεται. Η φιάλη περιτυλίσσεται με φύλλο αλουμινίου ή χρησιμοποιείται σκουρόχρωμη φιάλη και φυλάσσεται στο ψυγείο. Το διάλυμα αυτό είναι σταθερό για ένα μήνα σε θερμοκρασία ≤ 4 oC. |
|
3.11.2. |
2,0, 5,0, 10,0, και 20,0 ml του αρχικού πρότυπου διαλύματος (3.11.1) μεταφέρονται σε μια σειρά ογκομετρικών φιαλών των 100 ml. Προστίθενται 30 ml νερό, συμπληρώνονται μέχρι τη χαραγή με μεθανόλη-ακετονιτρίλιο (3.5) και αναμειγνύονται. Οι φιάλες περιτυλίσσονται με φύλλο αλουμινίου. Τα διαλύματα αυτά αντιστοιχούν σε 2,0, 5,0, 10,0 και 20,0 μg/ml καρβαδόξης αντίστοιχα. Τα διαλύματα βαθμονόμησης πρέπει να ετοιμάζονται λίγο πριν να χρησιμοποιηθούν.
|
|
3.12. |
Μείγμα νερού-[μεθανόλης-ακετονιτριλίου] (3.5), 300 + 700 (v + v) 300 ml νερό αναμειγνύονται με 700 ml του μείγματος μεθανόλης-ακετονιτριλίου (3.5). |
4. Όργανα
|
4.1. |
Συσκευή μηχανικής ανακίνησης ή μαγνητικός αναδευτήρας |
|
4.2. |
Ηθμός υαλοϊνών (Whatman GF/Α ή ισοδύναμος) |
|
4.3. |
Γυάλινη στήλη (μήκος 300 έως 400 mm, εσωτερική διάμετρος περίπου 10 mm) με εσμυρισμένη απόληξη σύνδεσης και βαλβίδα εξαγωγής.
|
|
4.4. |
Εξοπλισμός HPLC με σύστημα έγχυσης, κατάλληλο για έγχυση όγκων 20 μl |
|
4.4.1. |
Στήλη υγρής χρωματογραφίας: 300 mm × 4 mm, C18, 10 μm ή ισοδύναμη. |
|
4.4.2. |
Ανιχνευτής UV με δυνατότητα ρύθμισης σε διάφορα μήκη κύματος ή με διάταξη διόδων κατάλληλος για περιοχή μηκών κύματος 225 έως 400 nm. |
|
4.5. |
Φίλτρο μεμβράνης, 0,22 μm. |
|
4.6. |
Φίλτρο μεμβράνης, 0,45 μm. |
|
4.7. |
Λουτρό υπερήχων. |
5. Διαδικασία
|
Σημείωση: |
Η καρβαδόξη είναι ευαίσθητη στο φως. Όλες οι εργασίες πρέπει να γίνονται σε ημίφως ή να χρησιμοποιούνται υάλινα σκεύη σκουρόχρωμα ή τυλιγμένα με φύλλο αλουμινίου. |
5.1. Γενικά
5.1.1.
Για την εκτέλεση της δοκιμής ανάκτησης (5.1.2), πρέπει να διενεργείται ανάλυση τυφλού ώστε να ελέγχεται ότι δεν υπάρχει ούτε καρβαδόξη ούτε κάποια άλλη παρεμποδίζουσα ουσία. Το τυφλό δείγμα πρέπει να είναι παρόμοιου τύπου με εκείνον του δείγματος και δεν πρέπει να ανιχνεύονται σε αυτό καρβαδόξη ή άλλες παρεμποδίζουσες ουσίες.
5.1.2.
Πρέπει να πραγματοποιείται δοκιμή ανάκτησης υποβάλλοντας σε ανάλυση τυφλό δείγμα (5.1.1) εμπλουτισμένο με προσθήκη ποσότητας καρβαδόξης, παρόμοιας με εκείνη που υπάρχει στο δείγμα. Για εμπλουτισμό 50 mg/kg, 5,0 ml του αρχικού πρότυπου διαλύματος (3.11.1) μεταφέρονται σε κωνική φιάλη των 200 ml και το διάλυμα εξατμίζεται μέχρις όγκου περίπου 0,5 ml σε ρεύμα αζώτου. Προστίθενται 10 g του τυφλού, αναμειγνύονται και περιμένουμε για 10 λεπτά πριν προχωρήσουμε στο στάδιο της εκχύλισης (5.2).
Εναλλακτικά, εφόσον δεν υπάρχει διαθέσιμο τυφλό παρόμοιου τύπου με το δείγμα (βλ. παράγραφο 5.1.1), δοκιμή ανάκτησης μπορεί να γίνει μέσω της μεθόδου προσθήκης προτύπου. Στην περίπτωση αυτή, το προς ανάλυση δείγμα εμπλουτίζεται με ποσότητα καρβαδόξης παρόμοια με εκείνη που υπάρχει ήδη στο δείγμα. Το δείγμα αυτό αναλύεται παράλληλα με το μη εμπλουτισμένο δείγμα και η ανάκτηση μπορεί να υπολογιστεί με αφαίρεση.
5.2. Εκχύλιση
5.2.1.
Ζυγίζονται με προσέγγιση 0,01 g, 10 g του δείγματος και μεταφέρονται σε κωνική φιάλη των 200 ml. Προστίθενται 15,0 ml νερό, αναμειγνύονται και αφήνονται σε ηρεμία για 5 λεπτά. Προστίθενται 35,0 ml μεθανόλης-ακετονιτριλίου (3.5), η φιάλη πωματίζεται και ανακινείται για 30 λεπτά σε συσκευή μηχανικής ανακίνησης ή αναδεύεται με μαγνητικό αναδευτήρα. Το διάλυμα διηθείται μέσω ηθμού υαλοϊνών (4.2). Το εν λόγω διάλυμα κρατιέται για το στάδιο καθαρισμού (5.3).
5.2.2.
Ζυγίζεται με ακρίβεια 0,001 g, 1 g του μη αλεσμένου δείγματος και μεταφέρεται σε κωνική φιάλη των 200 ml. Προστίθενται 15,0 ml νερό, αναμειγνύονται και αφήνονται σε ηρεμία για 5 λεπτά. Προστίθενται 35,0 ml μεθανόλης-ακετονιτριλίου (3.5), η φιάλη πωματίζεται και ανακινείται για 30 λεπτά σε συσκευή μηχανικής ανακίνησης ή αναδεύεται με μαγνητικό αναδευτήρα (4.1). Το διάλυμα διηθείται μέσω ηθμού υαλοϊνών (4.2).
Κατάλληλη ποσότητα διηθήματος μεταφέρεται με σιφώνιο σε ογκομετρική φιάλη των 50 ml. Προστίθενται 15,0 ml νερό, συμπληρώνονται μέχρι τη χαραγή με μεθανόλη-ακετονιτρίλιο (3.5) και αναμειγνύονται. Η συγκέντρωση της καρβαδόξης στο τελικό διάλυμα πρέπει να είναι περίπου 10 μg/ml. Κατάλληλη ποσότητα διηθείται μέσω φίλτρου 0,45 μm (4.6).
Ακολουθεί προσδιορισμός με HPLC (5.4).
5.2.3.
Ζυγίζονται με ακρίβεια 0,001 g, 0,2 g του μη αλεσμένου δείγματος και μεταφέρονται σε κωνική φιάλη των 250 ml. Προστίθενται 45,0 ml νερό, αναμειγνύονται και αφήνονται σε ηρεμία για 5 λεπτά. Προστίθενται 105,0 ml μεθανόλης-ακετονιτριλίου (3.5), η φιάλη πωματίζεται και το περιεχόμενο ομοιογενοποιείται. Το δείγμα υποβάλλεται για 15 λεπτά σε επεξεργασία με υπερήχους (4.7) και ακολουθεί ανακίνηση ή ανάδευση για 15 λεπτά (4.1). Το διάλυμα διηθείται μέσω ηθμού υαλοϊνών (4.2).
Κατάλληλη ποσότητα του διηθήματος αραιώνεται με μείγμα νερού-μεθανόλης ακετονιτριλίου (3.12) μέχρι τελικής συγκέντρωσης καρβαδόξης 10-15 μg/ml (για παρασκεύασμα 10 %, ο συντελεστής αραίωσης είναι 10). Κατάλληλη ποσότητα διηθείται μέσω φίλτρου 0,45 μm (4.6).
Ακολουθεί ο προσδιορισμός με HPLC (5.4).
5.3. Καθαρισμός
5.3.1.
Ζυγίζονται 4 g οξειδίου του αργιλίου (3.4) και μεταφέρονται στη γυάλινη στήλη (4.3).
5.3.2.
15 ml του διηθημένου εκχυλίσματος (5.2.1) μεταγγίζονται στη στήλη του οξειδίου του αργιλίου και τα πρώτα 2 ml του εκλούσματος απορρίπτονται. Τα επόμενα 5 ml συλλέγονται και κατάλληλη ποσότητα διηθείται διαμέσου φίλτρου 0,45 μm (4.6).
Ακολουθεί ο προσδιορισμός με HPLC (5.4).
5.4. Προσδιορισμός με HPLC
5.4.1.
Παρακάτω, δίδονται ενδεικτικά ορισμένες κατάλληλες συνθήκες. Μπορούν να χρησιμοποιηθούν και διαφορετικές συνθήκες εφόσον παρέχουν ισοδύναμα αποτελέσματα:
|
Υγρή χρωματογραφική |
|
|
στήλη (4.4.1): |
300 mm × 4 mm, C18, 10 μm πλήρωση ή ισοδύναμη |
|
Κινητή φάση (3.10): |
Μείγμα οξικού ρυθμιστικού διαλύματος (3.9) και ακετονιτριλίου (3.2), 825 + 175 (v+v) |
|
Ρυθμός ροής: |
1,5-2 ml/min |
|
Μήκος κύματος ανίχνευσης: |
365 nm |
|
Όγκος έγχυσης: |
20 μl |
Ελέγχεται η σταθερότητα του χρωματογραφικού συστήματος, εγχύοντας κατ’ επανάληψη το διάλυμα βαθμονόμησης (3.11.2) που περιέχει 5,0 μg/ml, μέχρι να σταθεροποιηθούν τα ύψη των κορυφών και οι χρόνοι κατακράτησης.
5.4.2.
Κάθε διάλυμα βαθμονόμησης (3.11.2) εγχύεται κατ’ επανάληψη και μετρώνται τα ύψη (εμβαδά) των κορυφών για κάθε συγκέντρωση. Χαράσσεται καμπύλη αναφοράς χρησιμοποιώντας ως τεταγμένες τα μέσα ύψη (εμβαδά) των κορυφών των διαλυμάτων βαθμονόμησης και ως τετμημένες τις αντίστοιχες συγκεντρώσεις σε μg/ml.
5.4.3.
Εγχύεται κατ’ επανάληψη το εκχύλισμα δείγματος [(5.3.2) για ζωοτροφές, (5.2.2) για προμείγματα και (5.2.3) για παρασκευάσματα] και προσδιορίζεται το μέσο ύψος (εμβαδόν) των κορυφών της καρβαδόξης.
6. Υπολογισμός των αποτελεσμάτων
Από το μέσο ύψος (εμβαδόν) των κορυφών της καρβαδόξης του διαλύματος του δείγματος προσδιορίζεται η περιεκτικότητα καρβαδόξης στο διάλυμα του δείγματος σε μg/ml βάσει της καμπύλης αναφοράς (5.4.2).
6.1. Ζωοτροφές
Η περιεκτικότητα κατά βάρος (mg/kg) της καρβαδόξης στο δείγμα δίδεται από τον ακόλουθο τύπο:
 [mg/kg]
[mg/kg]
όπου:
|
c |
= |
συγκέντρωση της καρβαδόξης στο εκχύλισμα δείγματος (5.3.2.) σε μg/ml, |
|
V1 |
= |
όγκος εκχύλισης ml (δηλαδή 50), |
|
m |
= |
βάρος της προς δοκιμή ποσότητας σε g. |
6.2. Προμείγματα και παρασκευάσματα
Η περιεκτικότητα κατά βάρος (mg/kg) της καρβαδόξης στο δείγμα δίδεται από τον ακόλουθο τύπο:
 [mg/kg]
[mg/kg]
όπου:
|
c |
= |
συγκέντρωση της καρβαδόξης στο εκχύλισμα δείγματος (5.2.2. ή 5.2.3.) σε μg/ml, |
|
V2 |
= |
όγκος εκχύλισης σε ml (δηλαδή 50 για προμείγματα, 150 για παρασκευάσματα), |
|
f |
= |
συντελεστής αραίωσης σύμφωνα με το 5.2.2 (προμείγματα) ή 5.2.3. (παρασκευάσματα), |
|
m |
= |
βάρος της προς δοκιμή ποσότητας σε g. |
7. Επικύρωση των αποτελεσμάτων
7.1. Ταυτότητα
Η ταυτότητα της αναλυόμενης ουσίας μπορεί να ελεγχθεί με συγχρωματογραφία ή με τη βοήθεια ανιχνευτή διόδων με τον οποίο συγκρίνονται τα φάσματα του εκχυλίσματος δείγματος και του διαλύματος βαθμονόμησης (3.11.2) που περιέχει 10,0 μg/ml.
7.1.1.
Εκχύλισμα δείγματος εμπλουτίζεται με προσθήκη κατάλληλης ποσότητας διαλύματος βαθμονόμησης (3.11.2). Η ποσότητα της προστιθέμενης καρβαδόξης πρέπει να είναι παρόμοια με την εκτιμώμενη ποσότητα καρβαδόξης στο εκχύλισμα.
Λαμβάνοντας υπόψη τόσο την προστιθέμενη ποσότητα όσο και την αραίωση του εκχυλίσματος, μόνον το ύψος της κορυφής της καρβαδόξης πρέπει να βρίσκεται αυξημένο. Το πλάτος της κορυφής, στα μισά του ύψους, δεν πρέπει να παρεκλίνει περισσότερο από 10 % του αρχικού πλάτους.
7.1.2.
Τα αποτελέσματα αξιολογούνται με τα ακόλουθα κριτήρια:
|
α) |
Το μήκος κύματος της μέγιστης απορρόφησης των φασμάτων του δείγματος και του προτύπου, που καταγράφονται στο υψηλότερο σημείο της κορυφής στο χρωματογράφημα, πρέπει να είναι στο πλαίσιο των περιθωρίων που δικαιολογούνται από την αναλυτική ικανότητα του συστήματος ανίχνευσης. Το περιθώριο αυτό στην ανίχνευση με διάταξη διόδων είναι συνήθως + 2 nm· |
|
β) |
Μεταξύ 225 και 400 nm, τα φάσματα του δείγματος και του προτύπου που καταγράφονται στο υψηλότερο σημείο της κορυφής του χρωματογραφήματος, δεν πρέπει να διαφέρουν στα μέρη εκείνα του φάσματος που είναι στην περιοχή του 10-100 % της σχετικής απορρόφησης. Το κριτήριο αυτό εκπληρώνεται όταν εμφανίζονται τα ίδια μέγιστα και σε κανένα υπό παρατήρηση σημείο η απόκλιση μεταξύ των δύο φασμάτων δεν υπερβαίνει το 15 % της απορρόφησης της πρότυπης αναλυόμενης ουσίας· |
|
γ) |
Μεταξύ 225 και 400 nm, τα φάσματα του ανερχόμενου τμήματος, του υψηλότερου σημείου και του κατερχόμενου τμήματος της κορυφής του εκχυλίσματος του δείγματος δεν πρέπει να διαφέρουν μεταξύ τους στα μέρη εκείνα του φάσματος που είναι στην περιοχή του 10-100 % της σχετικής πυκνότητας. Το κριτήριο αυτό εκπληρώνεται όταν εμφανίζονται τα ίδια μέγιστα και όταν σε όλα τα υπό παρατήρηση σημεία η απόκλιση μεταξύ των φασμάτων δεν υπερβαίνει το 15 % της απορρόφησης του φάσματος του υψηλότερου σημείου της κορυφής. |
Εφόσον ένα από αυτά τα κριτήρια δεν εκπληρώνεται, δεν θεωρείται επιβεβαιωμένη η παρουσία της αναλυόμενης ουσίας.
7.2. Επαναληψιμότητα
Για περιεκτικότητες 10 mg/kg και άνω, η διαφορά μεταξύ των αποτελεσμάτων δύο παράλληλα διενεργούμενων προσδιορισμών στο ίδιο δείγμα δεν πρέπει να υπερβαίνει το 15 % σε σχέση με την υψηλότερη τιμή.
7.3. Ανάκτηση
Σε εμπλουτισμένο (τυφλό) δείγμα, η ανάκτηση πρέπει να είναι τουλάχιστον 90 %.
8. Αποτελέσματα διεργαστηριακής μελέτης
Πραγματοποιήθηκε διεργαστηριακή μελέτη στην οποία αναλύθηκαν 6 ζωοτροφές, 4 προμείγματα και 3 παρασκευάσματα από 8 εργαστήρια. Σε κάθε δείγμα έγιναν δύο αναλύσεις (Για περισσότερες λεπτομέρειες σχετικά με τη διεργαστηριακή μελέτη, βλ. The Journal of AOAC, τόμος 71, 1988, σ. 484-490). Τα αποτελέσματα (με εξαίρεση τα εκτός ορίων εκτρεπόμενα) εμφαίνονται κατωτέρω:
Πίνακας 1
Αποτελέσματα της διεργαστηριακής μελέτης για ζωοτροφές
|
|
Δείγμα 1 |
Δείγμα 2 |
Δείγμα 3 |
Δείγμα 4 |
Δείγμα 5 |
Δείγμα 6 |
|
L |
8 |
8 |
8 |
8 |
8 |
8 |
|
n |
15 |
14 |
15 |
15 |
15 |
15 |
|
Μέσος όρος (mg/kg) |
50,0 |
47,6 |
48,2 |
49,7 |
46,9 |
49,7 |
|
Sr (mg/kg) |
2,90 |
2,69 |
1,38 |
1,55 |
1,52 |
2,12 |
|
CVr (%) |
5,8 |
5,6 |
2,9 |
3,1 |
3,2 |
4,3 |
|
SR (mg/kg) |
3,92 |
4,13 |
2,23 |
2,58 |
2,26 |
2,44 |
|
CVR (%) |
7,8 |
8,7 |
4,6 |
5,2 |
4,8 |
4,9 |
|
Ονομαστική περιεκτικότητα (mg/kg) |
50,0 |
50,0 |
50,0 |
50,0 |
50,0 |
50,0 |
Πίνακας 2
Αποτελέσματα της διεργαστηριακής μελέτης για προμείγματα και παρασκευάσματα
|
|
Προμείγματα |
Παρασκευάσματα |
|||||
|
A |
B |
C |
D |
A |
B |
C |
|
|
L |
7 |
7 |
7 |
7 |
8 |
8 |
8 |
|
n |
14 |
14 |
14 |
14 |
16 |
16 |
16 |
|
Μέσος όρος (g/kg) |
8,89 |
9,29 |
9,21 |
8,76 |
94,6 |
98,1 |
104 |
|
Sr (g/kg) |
0,37 |
0,28 |
0,28 |
0,44 |
4,1 |
5,1 |
7,7 |
|
CVr (%) |
4,2 |
3,0 |
3,0 |
5,0 |
4,3 |
5,2 |
7,4 |
|
SR (g/kg) |
0,37 |
0,28 |
0,40 |
0,55 |
5,4 |
6,4 |
7,7 |
|
CVR (%) |
4,2 |
3,0 |
4,3 |
6,3 |
5,7 |
6,5 |
7,4 |
|
Ονομαστική περιεκτικότητα (g/kg) |
10,0 |
10,0 |
10,0 |
10,0 |
100 |
100 |
100 |
|
L |
= |
αριθμός εργαστηρίων |
|
n |
= |
αριθμός μεμονωμένων τιμών |
|
Sr |
= |
τυπική απόκλιση επαναληψιμότητας |
|
CVr |
= |
συντελεστής διακύμανσης επαναληψιμότητας |
|
SR |
= |
απόκλιση αναπαραγωγικότητας |
|
CVR |
= |
συντελεστής διακύμανσης αναπαραγωγιμότητας. |
ΠΑΡΑΡΤΗΜΑ IX
ΠΙΝΑΚΕΣ ΑΝΤΙΣΤΟΙΧΙΑΣ ΠΟΥ ΑΝΑΦΕΡΟΝΤΑΙ ΣΤΟ ΑΡΘΡΟ 6
1. Οδηγία 71/250/ΕΟΚ
|
Οδηγία 71/250/ΕΟΚ |
Παρών κανονισμός |
|
Άρθρο 1 πρώτο εδάφιο |
Άρθρο 3 |
|
Άρθρο 1 δεύτερο εδάφιο |
Άρθρο 2 |
|
Άρθρο 2 |
— |
|
Άρθρο 3 |
— |
|
Παράρτημα, μέρος 1 |
Παράρτημα II |
|
Παράρτημα, μέρος 2 |
— |
|
Παράρτημα, μέρος 3 |
— |
|
Παράρτημα, μέρος 4 |
Παράρτημα III, μέρος ΙΕ |
|
Παράρτημα, μέρος 5 |
Παράρτημα III, μέρος ΙΓ |
|
Παράρτημα, μέρος 6 |
Παράρτημα III, μέρος ΙΔ |
|
Παράρτημα, μέρος 7 |
Παράρτημα III, μέρος ΙΖ |
|
Παράρτημα, μέρος 9 |
Παράρτημα III, μέρος ΙΑ |
|
Παράρτημα, μέρος 10 |
— |
|
Παράρτημα, μέρος 11 |
— |
|
Παράρτημα, μέρος 12 |
Παράρτημα III, μέρος Ι |
|
Παράρτημα, μέρος 14 |
Παράρτημα III, μέρος Δ |
|
Παράρτημα, μέρος 16 |
— |
2. Οδηγία 71/393/ΕΟΚ
|
Οδηγία 71/393/ΕΟΚ |
Παρών κανονισμός |
|
Άρθρο 1 |
Άρθρο 3 |
|
Άρθρο 2 |
— |
|
Άρθρο 3 |
— |
|
Παράρτημα, μέρος I |
Παράρτημα III, μέρος A |
|
Παράρτημα, μέρος II |
Παράρτημα III, μέρος Ε |
|
Παράρτημα, μέρος III |
Παράρτημα III, μέρος ΙΣΤ |
|
Παράρτημα, μέρος IV |
Παράρτημα III, μέρος H |
3. Οδηγία 72/199/ΕΟΚ
|
Οδηγία 72/199/ΕΟΚ |
Παρών κανονισμός |
|
Άρθρο 1 |
Άρθρο 3 |
|
Άρθρο 2 |
— |
|
Άρθρο 3 |
— |
|
Άρθρο 4 |
— |
|
Παράρτημα I, μέρος 1 |
Παράρτημα III, μέρος ΙΒ |
|
Παράρτημα I, μέρος 2 |
Παράρτημα III, μέρος Γ |
|
Παράρτημα I, μέρος 3 |
— |
|
Παράρτημα I, μέρος 4 |
— |
|
Παράρτημα I, μέρος 5 |
Παράρτημα V, μέρος A |
|
Παράρτημα II |
— |
4. Οδηγία 73/46/ΕΟΚ
|
Οδηγία 73/46/ΕΟΚ |
Παρών κανονισμός |
|
Άρθρο 1 |
Άρθρο 3 |
|
Άρθρο 3 |
— |
|
Άρθρο 4 |
— |
|
Παράρτημα I, μέρος 1 |
Παράρτημα III, μέρος B |
|
Παράρτημα I, μέρος 2 |
— |
|
Παράρτημα I, μέρος 3 |
Παράρτημα III, μέρος Θ |
5. Οδηγία 76/371/ΕΟΚ
|
Οδηγία 76/371/ΕΟΚ |
Παρών κανονισμός |
|
Άρθρο 1 |
Άρθρο 1 |
|
Άρθρο 2 |
— |
|
Άρθρο 3 |
— |
|
Παράρτημα |
Παράρτημα I |
6. Οδηγία 76/372/ΕΟΚ
|
Οδηγία 76/372/ΕΟΚ |
Παρών κανονισμός |
|
Άρθρο 1 |
— |
|
Άρθρο 2 |
— |
|
Άρθρο 3 |
— |
|
Παράρτημα |
— |
7. Οδηγία 78/633/ΕΟΚ
|
Οδηγία 78/633/ΕΟΚ |
Παρών κανονισμός |
|
Άρθρο 1 |
Άρθρο 3 |
|
Άρθρο 2 |
— |
|
Άρθρο 3 |
— |
|
Παράρτημα, μέρος 1 |
— |
|
Παράρτημα, μέρος 2 |
— |
|
Παράρτημα, μέρος 3 |
Παράρτημα IV, μέρος Γ |
8. Οδηγία 81/715/ΕΟΚ
|
Οδηγία 81/715/ΕΟΚ |
Παρών κανονισμός |
|
Άρθρο 1 |
— |
|
Άρθρο 2 |
— |
|
Άρθρο 3 |
— |
|
Παράρτημα |
— |
9. Οδηγία 84/425/ΕΟΚ
|
Οδηγία 84/425/ΕΟΚ |
Παρών κανονισμός |
|
Άρθρο 1 |
— |
|
Άρθρο 2 |
— |
|
Άρθρο 3 |
— |
|
Παράρτημα |
— |
10. Οδηγία 86/174/ΕΟΚ
|
Οδηγία 86/174/ΕΟΚ |
Παρών κανονισμός |
|
Άρθρο 1 |
Άρθρο 4 |
|
Άρθρο 2 |
— |
|
Άρθρο 3 |
— |
|
Παράρτημα |
Παράρτημα VII |
11. Οδηγία 93/70/ΕΟΚ
|
Οδηγία 93/70/ΕΟΚ |
Παρών κανονισμός |
|
Άρθρο 1 |
Άρθρο 3 |
|
Άρθρο 2 |
— |
|
Άρθρο 3 |
— |
|
Παράρτημα |
Παράρτημα IV, μέρος Δ |
12. Οδηγία 93/117/ΕΚ
|
Οδηγία 93/117/ΕΚ |
Παρών κανονισμός |
|
Άρθρο 1 |
Άρθρα 3 και 5 |
|
Άρθρο 2 |
— |
|
Άρθρο 3 |
— |
|
Παράρτημα, μέρος 1 |
Παράρτημα IV, μέρος E |
|
Παράρτημα, μέρος 2 |
Παράρτημα VIII, μέρος A |
13. Οδηγία 98/64/ΕΚ
|
Οδηγία 98/64/ΕΚ |
Παρών κανονισμός |
|
Άρθρο 1 |
Άρθρα 3 και 5 |
|
Άρθρο 2 |
— |
|
Άρθρο 3 |
— |
|
Άρθρο 4 |
— |
|
Παράρτημα, μέρος A |
Παράρτημα III, μέρος ΣΤ |
|
Παράρτημα, μέρος Γ |
Παράρτημα VIII, μέρος B |
14. Οδηγία 1999/27/ΕΚ
|
Οδηγία 1999/27/ΕΚ |
Παρών κανονισμός |
|
Άρθρο 1 |
Άρθρα 3 και 5 |
|
Άρθρο 2 |
— |
|
Άρθρο 3 |
— |
|
Άρθρο 4 |
— |
|
Άρθρο 5 |
— |
|
Άρθρο 6 |
— |
|
Άρθρο 7 |
— |
|
Παράρτημα, μέρος A |
Παράρτημα VIII, μέρος Γ |
|
Παράρτημα, μέρος B |
Παράρτημα IV, μέρος ΣΤ |
|
Παράρτημα, μέρος Γ |
Παράρτημα VIII, μέρος Δ |
15. Οδηγία 1999/76/ΕΚ
|
Οδηγία 1999/76/ΕΚ |
Παρών κανονισμός |
|
Άρθρο 1 |
Άρθρο 3 |
|
Άρθρο 2 |
— |
|
Άρθρο 3 |
— |
|
Άρθρο 4 |
— |
|
Παράρτημα |
Παράρτημα IV, μέρος Ζ |
16. Οδηγία 2000/45/ΕΚ
|
Οδηγία 2000/45/ΕΚ |
Παρών κανονισμός |
|
Άρθρο 1 |
Άρθρο 3 |
|
Άρθρο 2 |
— |
|
Άρθρο 3 |
— |
|
Άρθρο 4 |
— |
|
Παράρτημα, μέρος A |
Παράρτημα IV, μέρος A |
|
Παράρτημα, μέρος B |
Παράρτημα IV, μέρος B |
|
Παράρτημα, μέρος Γ |
Παράρτημα III, μέρος Ζ |
17. Οδηγία 2002/70/ΕΚ
|
Οδηγία 2002/70/ΕΚ |
Παρών κανονισμός |
|
Άρθρο 1 |
Άρθρο 1 |
|
Άρθρο 2 |
Άρθρα 2 και 3 |
|
Άρθρο 3 |
— |
|
Άρθρο 4 |
— |
|
Άρθρο 5 |
— |
|
Παράρτημα I |
Παράρτημα I και παράρτημα V μέρος B (I) |
|
Παράρτημα II |
Παράρτημα II και παράρτημα V μέρος B (II) |
18. Οδηγία 2003/126/ΕΚ
|
Οδηγία 2003/126/ΕΚ |
Παρών κανονισμός |
|
Άρθρο 1 |
Άρθρο 3 |
|
Άρθρο 2 |
— |
|
Άρθρο 3 |
— |
|
Άρθρο 4 |
— |
|
Άρθρο 5 |
— |
|
Άρθρο 6 |
— |
|
Παράρτημα |
Παράρτημα VI |