ISSN 1977-0642
Amtsblatt
der Europäischen Union
L 110

Ausgabe in deutscher Sprache
Rechtsvorschriften
61. Jahrgang
30. April 2018
|
ISSN 1977-0642 |
||
|
Amtsblatt der Europäischen Union |
L 110 |
|

|
||
|
Ausgabe in deutscher Sprache |
Rechtsvorschriften |
61. Jahrgang |
|
|
|
Berichtigungen |
|
|
|
* |
|
|
|
|
|
(1) Text von Bedeutung für den EWR. |
|
DE |
Bei Rechtsakten, deren Titel in magerer Schrift gedruckt sind, handelt es sich um Rechtsakte der laufenden Verwaltung im Bereich der Agrarpolitik, die normalerweise nur eine begrenzte Geltungsdauer haben. Rechtsakte, deren Titel in fetter Schrift gedruckt sind und denen ein Sternchen vorangestellt ist, sind sonstige Rechtsakte. |
II Rechtsakte ohne Gesetzescharakter
VERORDNUNGEN
|
30.4.2018 |
DE |
Amtsblatt der Europäischen Union |
L 110/1 |
DURCHFÜHRUNGSVERORDNUNG (EU) 2018/659 DER KOMMISSION
vom 12. April 2018
über die Bestimmungen für den Eingang lebender Equiden sowie von Sperma, Eizellen und Embryonen von Equiden in die Union
(Text von Bedeutung für den EWR)
DIE EUROPÄISCHE KOMMISSION —
gestützt auf den Vertrag über die Arbeitsweise der Europäischen Union,
gestützt auf die Richtlinie 91/496/EWG des Rates vom 15. Juli 1991 zur Festlegung von Grundregeln für die Veterinärkontrollen von aus Drittländern in die Gemeinschaft eingeführten Tieren und zur Änderung der Richtlinien 89/662/EWG, 90/425/EWG und 90/675/EWG (1), insbesondere auf Artikel 3 Absatz 2 und Artikel 9 Absatz 1 Buchstabe c,
gestützt auf die Richtlinie 92/65/EWG des Rates vom 13. Juli 1992 über die tierseuchenrechtlichen Bedingungen für den Handel mit Tieren, Samen, Eizellen und Embryonen in der Gemeinschaft sowie für ihre Einfuhr in die Gemeinschaft, soweit sie diesbezüglich nicht den spezifischen Gemeinschaftsregelungen nach Anhang A Abschnitt I der Richtlinie 90/425/EWG unterliegen (2), insbesondere auf Artikel 17 Absatz 3,
gestützt auf die Richtlinie 2009/156/EG des Rates vom 30. November 2009 zur Festlegung der tierseuchenrechtlichen Vorschriften für das Verbringen von Equiden und für ihre Einfuhr aus Drittländern (3), insbesondere auf Artikel 2 Buchstabe i, Artikel 12 Absätze 1, 4 und 5, Artikel 13 Absatz 2 sowie die Artikel 15, 16, 17 und 19,
in Erwägung nachstehender Gründe:
|
(1) |
In der Richtlinie 2009/156/EG sind die tiergesundheitlichen Bedingungen für die Einfuhr von Equiden in die Union festgelegt. Gemäß dieser Richtlinie sind zur Einfuhr in die Union nur Equiden zugelassen, die aus Drittländern oder Teilen von Drittländern stammen, die in einer gemäß der genannten Richtlinie erstellten Liste von Drittländern aufgeführt sind, und für die außerdem eine Gesundheitsbescheinigung mitgeführt wird, die einem ebenfalls gemäß der genannten Richtlinie erstellten Muster entspricht. In der Gesundheitsbescheinigung muss bestätigt werden, dass die Equiden die gemäß der genannten Richtlinie in der entsprechenden Gesundheitsbescheinigung festgelegten Gesundheitsbedingungen erfüllen. |
|
(2) |
Die Liste der Drittländer, aus denen die Mitgliedstaaten die Einfuhr von lebenden Equiden sowie von Equidensperma, -eizellen und -embryonen zulassen, und die Regionalisierung einiger dieser Drittländer sollten sich nach dem Tiergesundheitsstatus in diesen Drittländern richten und auf der Liste von Drittländern und Teilen des Hoheitsgebiets von Drittländern in der Entscheidung 2004/211/EG der Kommission (4) beruhen. |
|
(3) |
In Übereinstimmung mit Artikel 12 Absatz 2 Buchstabe a der Richtlinie 2009/156/EG sollte den in der vorliegenden Verordnung festgelegten Tiergesundheitsanforderungen eine Risikobewertung zugrunde liegen. Das Prinzip der Einteilung der Länder nach gemeinsamen Risiken in Gesundheitszonen, wie es in Artikel 12 Absatz 4 der Richtlinie 2009/156/EG festgelegt wird, hat sich bewährt. Da der Begriff „Zonen“ jedoch einen gewissen Gebietszusammenhang suggeriert und bestimmte Risiken derselben Art auch in entfernteren Gebieten auftreten können, sollten die Länder spezifischen „Statusgruppen“ zugeordnet werden. |
|
(4) |
Die Richtlinie 92/65/EWG enthält die tiergesundheitlichen Bedingungen für die Einfuhr von Sperma, Eizellen und Embryonen von Equiden in die Union. Gemäß dieser Richtlinie sind zur Einfuhr in die Union nur Waren zugelassen, die aus Drittländern oder Teilen von Drittländern stammen, die in einer gemäß der genannten Richtlinie erstellten Liste von Drittländern aufgeführt sind, und für die außerdem eine Gesundheitsbescheinigung mitgeführt wird, die einem ebenfalls gemäß der genannten Richtlinie erstellten Muster entspricht. In der Bescheinigung muss bestätigt werden, dass die Waren aus zugelassenen Besamungsstationen und Samendepots oder zugelassenen Entnahme- und Erzeugungseinheiten stammen, die Garantien bieten, die den Garantien in Anhang D Kapitel I der genannten Richtlinie mindestens gleichwertig sind. |
|
(5) |
Mit der Richtlinie 92/65/EWG, geändert durch die Richtlinie 2008/73/EG des Rates (5), wurde ein vereinfachtes Verfahren für das Auflisten von Besamungsstationen und Samendepots sowie Embryo-Entnahmeeinheiten und Embryo-Erzeugungseinheiten in Drittländern eingeführt, die zur Einfuhr der Waren in die Union zugelassen sind. Die Listen sind auf der Website der Kommission verfügbar (6). |
|
(6) |
Anhang D der Richtlinie 92/65/EWG enthält bestimmte Anforderungen an Sperma, Eizellen und Embryonen von Equiden und regelt Zulassung, Überwachung und Betrieb von Besamungsstationen, Samendepots, Embryo-Entnahmeeinheiten und Embryo-Erzeugungseinheiten; außerdem werden detaillierte Bedingungen für den Gesundheitszustand der Spendertiere festgelegt. Daher sollten Muster für Gesundheitsbescheinigungen für die Einfuhr von Sperma, Eizellen und Embryonen von Equiden in die Union festgelegt werden. |
|
(7) |
Außerdem sollte die Einfuhr in die Union bereits vorhandener Warenbestände geregelt werden, die den Bestimmungen der Richtlinie 92/65/EWG entsprechen und vor Inkrafttreten der mit der Verordnung (EU) Nr. 176/2010 der Kommission (7) eingeführten Änderungen angelegt wurden. Daher ist es erforderlich, separate Mustergesundheitsbescheinigungen für die Einfuhr von Sendungen mit Sperma, Eizellen und Embryonen von Equiden festzulegen, die vor dem 1. September 2010 gemäß Anhang D der Richtlinie 92/65/EWG entnommen bzw. gewonnen, aufbereitet und gelagert wurden. |
|
(8) |
Wegen der Langzeitlagerfähigkeit solcher Waren ist es derzeit nicht möglich, ein Datum für die Erschöpfung der Lagerbestände anzugeben. Daher kann auch keine Frist für das Auslaufen der Verwendung dieser Mustergesundheitsbescheinigungen für die Lagerbestände festgelegt werden. |
|
(9) |
Um die vollständige Rückverfolgbarkeit der Waren zu gewährleisten, sollte die vorliegende Verordnung Mustergesundheitsbescheinigungen für die Einfuhr von Equidensperma in die Union enthalten, das in zugelassenen Besamungsstationen entnommen und aus einem zugelassenen Samendepot versandt wird, unabhängig davon, ob Letzteres zu einer Besamungsstation gehört, die unter einer anderen Zulassungsnummer zugelassen ist. |
|
(10) |
Zudem ist es angezeigt, dass aus der Schweiz in die Union eingeführten Warensendungen Gesundheitsbescheinigungen beigefügt werden, die den Mustern entsprechen, die für den Handel mit Sperma, Eizellen und Embryos von Equiden innerhalb der Union verwendet werden und im Beschluss 2010/470/EU der Kommission (8) festgelegt sind, mit den entsprechenden Änderungen gemäß Anhang 11 Anlage 2 Kapitel IX Abschnitt B Nummern 8 und 9 des Abkommens zwischen der Europäischen Gemeinschaft und der Schweizerischen Eidgenossenschaft über den Handel mit landwirtschaftlichen Erzeugnissen, das durch den Beschluss 2002/309/EG, Euratom des Rates und der Kommission (9) genehmigt wurde. |
|
(11) |
Für Sendungen von Sperma, Eizellen und Embryonen von Equiden, die aus Kanada in die Union versendet werden, sind Gesundheitsbescheinigungen zulässig, die gemäß dem Abkommen zwischen der Europäischen Gemeinschaft und der Regierung Kanadas über gesundheitspolizeiliche Maßnahmen zum Schutz der Gesundheit von Mensch und Tier im Handel mit lebenden Tieren und Tierprodukten (10), genehmigt durch den Beschluss 1999/201/EG des Rates (11), festgelegt wurden. |
|
(12) |
Für Sendungen von Equidensperma, -eizellen und -embryonen, die aus Neuseeland in die Union versandt werden, sind Gesundheitsbescheinigungen zulässig, die gemäß dem Abkommen zwischen der Europäischen Gemeinschaft und Neuseeland über veterinärhygienische Maßnahmen im Handel mit lebenden Tieren und tierischen Erzeugnissen (12), genehmigt durch den Beschluss 97/132/EG des Rates (13), festgelegt wurden. |
|
(13) |
Zur Vereinfachung der Rechtsvorschriften der Union sollten die Anforderungen an die Tiergesundheit und die Ausstellung von Bescheinigungen für den Eingang in die Union von Sendungen von Equiden sowie von Equidensperma, -eizellen und -embryonen in einer einzigen Verordnung zusammengefasst werden; diese Verordnung sollte auch die Liste der Drittländer und der Teile des Hoheitsgebiets von Drittländern enthalten, aus denen die Mitgliedstaaten den Eingang solcher Sendungen zulassen müssen. |
|
(14) |
Um den bescheinigten Gesundheitszustand von Equiden während ihrer Verbringung aus dem ausführenden Drittland in die Union zu wahren, sollten Tiergesundheitsanforderungen an die Beförderung von Equiden festgelegt werden. |
|
(15) |
Die Qualität von Gesundheitsuntersuchungen und die Dokumentation von Impfungen sollten geregelt werden. Ebenfalls geregelt werden sollte, dass die Untersuchungsergebnisse dann vom Referenzlaboratorium der Europäischen Union für Krankheiten von Equiden mit Ausnahme der Afrikanischen Pferdepest, das gemäß der Verordnung (EG) Nr. 180/2008 der Kommission (14) benannt wurde, bestätigt werden, wenn die Ergebnisse bei der risikobasierten Probenahme bei Equiden gemäß der Entscheidung 97/794/EG der Kommission (15) von den Ergebnissen abweichen, die das Versanddrittland bescheinigt hat. |
|
(16) |
Die Tests für die Diagnose der Equinen Viralen Arteritis sowie die Kategorien von männlichen Equiden, für die die entsprechenden Untersuchungsbedingungen gelten, sollten auf der Grundlage der Empfehlungen des Wissenschaftlichen Veterinärausschusses (16) gemäß der Entscheidung 95/329/EG der Kommission (17) und den aktuellsten Empfehlungen in Kapitel 12.9 des Gesundheitskodex für Landtiere der Weltorganisation für Tiergesundheit (OIE) in der Ausgabe von 2016 (18) festgelegt werden. |
|
(17) |
Für die Durchfuhr lebender Equiden durch die Union von einem Drittland oder einem Teil des Hoheitsgebiets eines Drittlands in ein anderes Drittland oder in einen anderen Teil des Hoheitsgebiets desselben Drittlands sollte eine eigene Mustergesundheitsbescheinigung festgelegt werden. |
|
(18) |
Es sollten besondere zusätzliche Bestimmungen über die Verwendung des mit den Entscheidungen 2003/24/EG (19) und 2004/292/EG (20) der Kommission eingeführten integrierten EDV-Systems für das Veterinärwesen (TRACES) ab der gemäß der Entscheidung 2009/821/EG der Kommission (21) zugelassenen und für Veterinärkontrollen zuständigen Eingangsgrenzkontrollstelle bis zum Ort des Ausgangs aus der Union festgelegt werden, damit die Kontrollen durchgeführt werden können, mit denen sichergestellt wird, dass die Mitgliedstaaten die Bestimmungen über die zeitweilige Zulassung registrierter Pferde, die Wiedereinfuhr registrierter Pferde nach vorübergehender Ausfuhr, die Durchfuhr von Equiden und die Umwandlung einer zeitweiligen Zulassung registrierter Pferde in eine endgültige Zulassung einheitlich anwenden. |
|
(19) |
Im Interesse der Kohärenz und Vereinfachung der Rechtsvorschriften der Union sollte das Format der Mustergesundheitsbescheinigungen für den Eingang in die Union von Equiden und von Equidensperma, -eizellen und -embryonen nach dem Vorbild der Standardmuster der Veterinärbescheinigungen in Anhang I der Entscheidung 2007/240/EG der Kommission (22) festgelegt werden. |
|
(20) |
Es sollten gemäß Artikel 19 Buchstabe c der Richtlinie 2009/156/EG die Voraussetzungen für die Umwandlung einer zeitweiligen in einen endgültige Zulassung festgelegt werden, zusammen mit Bestimmungen für die erforderlichen Angaben in TRACES und den Austausch des Gemeinsamen Veterinärdokuments für die Einfuhr (GVDE) gemäß Anhang I der Verordnung (EG) Nr. 282/2004 der Kommission (23). |
|
(21) |
Für die Wiedereinfuhr registrierter Pferde nach vorübergehender Ausfuhr in Drittländer zur Teilnahme an Rennen, Turnieren oder kulturellen Veranstaltungen sollten in einem Anhang zur vorliegenden Verordnung besondere Tiergesundheitsbedingungen und die entsprechenden Musterbescheinigungen festgelegt werden. |
|
(22) |
Aus der Entscheidung 93/444/EWG der Kommission (24) geht hervor, was unter „Ort des Verbringens“ bzw. Ausgangsort zu verstehen ist, und sie bestimmt unter anderem, dass für Tiere, die in ein Drittland ausgeführt werden sollen, auf ihrem Weg zu diesem Ort eine Gesundheitsbescheinigung mitgeführt wird, die mindestens für den Handel mit Schlachttieren der betreffenden Tierart gilt. Ferner wird dort bestimmt, dass die zuständige Behörde am Versandort den Ausgangsort von der beabsichtigten Verbringung unterrichtet. Es muss geklärt werden, dass der Ausgangsort zum Zwecke der Rückverfolgbarkeit eine Grenzkontrollstelle sein sollte und dass als Gesundheitsbescheinigung gemäß Artikel 2 Absatz 1 der Entscheidung 93/444/EWG auch im Falle registrierter Pferde, die zur vorübergehenden Ausfuhr bestimmt sind, die Gesundheitsbescheinigung gemäß Anhang III der Richtlinie 2009/156/EG dienen sollte. |
|
(23) |
Im Interesse der Rechtssicherheit sollten die Entscheidungen 92/260/EWG (25), 93/195/EWG (26), 93/196/EWG (27), 93/197/EWG (28), 94/699/EG (29), 95/329/EG, 2003/13/EG (30), 2004/177/EG (31), 2004/211/EG, 2010/57/EU (32) der Kommission und der Beschluss 2010/471/EU der Kommission (33) aufgehoben werden. |
|
(24) |
Um Marktbeteiligten die Möglichkeit zu geben, sich an die neuen Regeln der vorliegenden Verordnung anzupassen, sollte ein Übergangszeitraum vorgesehen werden, in dem die Mitgliedstaaten den Eingang in die Union von Equiden sowie von Equidensperma, -eizellen und -embryonen, die den Bedingungen in den vor Geltungsbeginn der vorliegenden Verordnung gültigen Mustergesundheitsbescheinigungen entsprechen, zulassen müssen. |
|
(25) |
Die in dieser Verordnung vorgesehenen Maßnahmen entsprechen der Stellungnahme des Ständigen Ausschusses für Pflanzen, Tiere, Lebensmittel und Futtermittel — |
HAT FOLGENDE VERORDNUNG ERLASSEN:
ABSCHNITT 1
Gegenstand, Anwendungsbereich und Begriffsbestimmungen
Artikel 1
Gegenstand und Anwendungsbereich
Diese Verordnung enthält die Liste der Drittländer und der Teile des Hoheitsgebiets von Drittländern, aus denen die Einfuhr von Sendungen von Equiden und von Equidensperma, -eizellen und -embryonen in die Union zugelassen ist.
Zudem legt sie die Anforderungen an die Tiergesundheit und die Ausstellung von Veterinärbescheinigungen für solche Sendungen fest.
Artikel 2
Begriffsbestimmungen
Für die Zwecke dieser Verordnung bezeichnet der Ausdruck:
|
die amtliche Anerkennung eines Teils des Hoheitsgebiets eines Drittlandes mit genauer geografischer Abgrenzung, in dem eine Teilpopulation von Equiden mit einem bestimmten Gesundheitsstatus in Bezug auf eine oder mehrere spezifische Seuchen lebt, die geeigneten Maßnahmen zur Überwachung, Seuchenbekämpfung und zum Schutz vor biologischen Gefahren unterliegt; |
||||||||||
|
jedes Dokument, das verwendet wird, um die Identität eines Equiden zu belegen und das mindestens folgende Angaben enthält:
|
||||||||||
|
ein Tier der Art Equus caballus, das gemäß der Richtlinie 90/427/EWG des Rates (35) registriert ist und dessen Identität mithilfe eines Identifizierungsdokuments festgestellt werden kann, das ausgestellt wurde von
|
||||||||||
|
das Verbringen von Equiden sowie von Sperma, Eizellen und Embryonen von Equiden in eines der in Anhang I der Richtlinie 97/78/EG des Rates (36) aufgeführten Gebiete; |
||||||||||
|
die zeitweilige Zulassung, die Wiedereinfuhr nach vorübergehender Ausfuhr, Einfuhren und Durchfuhr; |
||||||||||
|
den Status eines aus einem Drittland stammenden registrierten Pferdes, das für einen Zeitraum von weniger als 90 Tagen in das Hoheitsgebiet der Union verbracht wird; |
||||||||||
|
die Verbringung eines registrierten Pferdes für einen Zeitraum von weniger als 90 Tagen aus der Union; |
||||||||||
|
die Verbringung eines registrierten Pferdes aus einem Drittland nach vorübergehender Ausfuhr aus der Union zurück in die Union; |
||||||||||
|
die Verbringung einer Sendung von Equiden oder von Equidensperma, -eizellen oder -embryonen in die Union für einen unbefristeten Zeitraum; |
||||||||||
|
die Verbringung einer Sendung von Equiden durch das Gebiet der Union auf der Straße, der Schiene oder dem Wasser aus einem Drittland in ein anderes Drittland oder von einem Teil des Hoheitsgebiets eines Drittlandes in einen anderen Teil des Hoheitsgebiets desselben Drittlands; |
||||||||||
|
jede Kontrollstelle gemäß Artikel 2 Absatz 2 Buchstabe f der Richtlinie 91/496/EWG und Artikel 2 Absatz 2 Buchstabe g der Richtlinie 97/78/EG, die gemäß der Entscheidung 2009/821/EG für die betreffende Ware zugelassen ist; |
||||||||||
|
entweder registrierte Equiden, Schlachtequiden und/oder Zucht- und Nutzequiden gemäß Artikel 2 der Richtlinie 2009/156/EG sowie registrierte Pferde; |
||||||||||
|
die haploiden Stadien der Oogenese mit Oozyten zweiter Ordnung und Eizellen; |
||||||||||
|
alle natürlichen oder juristischen Personen, für die eine oder mehrere der Bestimmungen in dieser Verordnung gelten und die für Equiden oder Equiden-Zuchtmaterial verantwortlich sind; |
||||||||||
|
die befristete Absonderung von Equiden von anderen Tieren, um die Übertragung bestimmter Krankheitserreger durch direkten oder indirekten Kontakt zu verhindern; die Equiden stehen während dieser Zeit unter Beobachtung und werden gegebenenfalls unter der Aufsicht der Veterinärbehörde untersucht und behandelt; |
||||||||||
|
die Isolierung von Equiden in Räumlichkeiten, für die besondere Biosicherheitsvorschriften gelten und die von der Veterinärbehörde kontrolliert werden; |
||||||||||
|
die Quarantäne von Equiden
|
||||||||||
|
die Quarantäne von Equiden in einem geschlossenen Gebäude, für das Folgendes gilt:
|
||||||||||
|
das mit den Entscheidungen 2003/24/EG und 2004/292/EG eingeführte integrierte EDV-System für das Veterinärwesen. |
ABSCHNITT 2
Verzeichnis der Drittländer und der Teile von Drittländern für den Eingang von Equiden und Equidensperma, -eizellen und -embryonen in die Union
Artikel 3
Verzeichnis der Drittländer und der Teile des Hoheitsgebiets von Drittländern, aus denen der Eingang von Equiden in die Union zugelassen ist
(1) Die Mitgliedstaaten erlauben die folgenden Arten des Eingangs in die Union von Sendungen von Equiden aus den Drittländern oder — wenn die Union eine Regionalisierung anwendet — den Teilen des Hoheitsgebiets von Drittländern, die in den Spalten 2 und 4 der Tabelle in Anhang I aufgeführt sind, wobei sie die Angaben in diesem Anhang berücksichtigen:
|
a) |
zeitweilige Zulassung registrierter Pferde gemäß Spalte 6 der Tabelle in Anhang I, für die jeweils eine individuelle Gesundheitsbescheinigung nach dem Muster der Gesundheitsbescheinigung in Anhang II Teil 1 Abschnitt A mitgeführt wird; |
|
b) |
Durchfuhr von Equiden gemäß Spalte 15 der Tabelle in Anhang I, für die jeweils eine individuelle Gesundheitsbescheinigung nach dem Muster der Gesundheitsbescheinigung in Anhang II Teil 1 Abschnitt B mitgeführt wird; |
|
c) |
Wiedereinfuhr von registrierten Renn-, Turnier- und für kulturelle Veranstaltungen bestimmten Pferden nach vorübergehender Ausfuhr gemäß Spalte 7 der Tabelle in Anhang I, für die jeweils eine individuelle Gesundheitsbescheinigung nach dem entsprechenden Muster der Gesundheitsbescheinigung in Anhang II Teil 2 Abschnitt A bzw. B mitgeführt wird; |
|
d) |
Einfuhr registrierter Pferde gemäß Spalte 8 der Tabelle in Anhang I, für die jeweils eine individuelle Gesundheitsbescheinigung nach dem Muster der Gesundheitsbescheinigung in Anhang II Teil 3 Abschnitt A mitgeführt wird; |
|
e) |
Einfuhr einer Sendung von Schlachtequiden gemäß Spalte 9 der Tabelle in Anhang I, für die eine Gesundheitsbescheinigung nach dem Muster der Gesundheitsbescheinigung in Anhang II Teil 3 Abschnitt B mitgeführt wird; |
|
f) |
Einfuhr von registrierten Equiden und Zucht- und Nutzequiden gemäß Spalte 10 der Tabelle in Anhang I, für die jeweils eine individuelle Gesundheitsbescheinigung nach dem Muster der Gesundheitsbescheinigung in Anhang II Teil 3 Abschnitt A mitgeführt wird. |
(2) Die zuständige Behörde des Versanddrittlands wendet die Maßnahmen an, die erforderlich sind, um den besonderen Bedingungen oder Fristen zu entsprechen, die für dieses Land in Spalte 16 der Tabelle in Anhang I angegeben sind.
Artikel 4
Drittländer und Teile des Hoheitsgebiets von Drittländern, aus denen der Eingang von Equidensperma in die Union zugelassen ist
Die Mitgliedstaaten erlauben den Eingang in die Union von Sendungen von Equidensperma gemäß den Angaben in den Spalten 11, 12 und 13 der Tabelle in Anhang I aus den Drittländern oder — wenn die Union eine Regionalisierung anwendet — den Teilen des Hoheitsgebiets von Drittländern, die in den Spalten 2 und 4 dieser Tabelle aufgeführt sind, sofern die Sendung den folgenden Bedingungen genügt:
|
a) |
Sie wird aus einer Besamungsstation oder einem Samendepot gemäß Artikel 17 Absatz 3 Buchstabe b der Richtlinie 92/65/EWG versendet; |
|
b) |
mit ihr wird eine Gesundheitsbescheinigung nach dem entsprechenden Muster der Gesundheitsbescheinigung in Anhang III Teil 1 mitgeführt. |
Artikel 5
Drittländer und Teile des Hoheitsgebiets von Drittländern, aus denen der Eingang von Equideneizellen und -embryonen in die Union zugelassen ist
Die Mitgliedstaaten erlauben den Eingang in die Union von Sendungen von Equideneizellen und -embryonen gemäß den Angaben in Spalte 14 der Tabelle in Anhang I aus den Drittländern oder — wenn die Union eine Regionalisierung anwendet — den Teilen des Hoheitsgebiets von Drittländern, die in den Spalten 2 und 4 dieser Tabelle aufgeführt sind, sofern die Sendung den folgenden Bedingungen genügt:
|
a) |
Sie wird von einer Embryo-Entnahmeeinheit oder Embryo-Erzeugungseinheit gemäß Artikel 17 Absatz 3 Buchstabe b der Richtlinie 92/65/EWG versendet; |
|
b) |
mit ihr wird eine Gesundheitsbescheinigung nach dem entsprechenden Muster der Gesundheitsbescheinigung in Anhang III Teil 2 mitgeführt. |
ABSCHNITT 3
Allgemeine Anforderungen für den Eingang von Sendungen von Equiden sowie von Equidensperma, -eizellen und -embryonen in die Union
Artikel 6
Bescheinigungen
(1) Die in den Artikeln 3, 4 und 5 genannten Gesundheitsbescheinigungen werden nach folgenden Anweisungen erstellt und ausgegeben:
|
a) |
den entsprechenden ergänzenden Garantien oder Bedingungen gemäß Anhang I Spalte 16; |
|
b) |
den Erläuterungen in Anhang II Teil 4 bzw. Anhang III Teil 3. |
(2) Die Bestimmungen in Absatz 1 schließen nicht aus, dass Bescheinigungen auf elektronischem Weg oder mithilfe anderer vereinbarter Systeme erstellt werden, sobald dafür auf Unionsebene harmonisierte Verfahren festgelegt worden sind.
Artikel 7
Gültigkeitsdauer von Gesundheitsbescheinigungen
(1) Der für eine für den Eingang in die Union bestimmte Sendung von Equiden oder von Equidensperma, -eizellen oder -embryonen verantwortliche Unternehmer gewährleistet, dass die Sendung spätestens 10 Tage nach dem Datum, an dem im Versanddrittland die Bescheinigung dafür ausgestellt wurde, an einer anerkannten Grenzkontrollstelle vorgeführt wird, die für die betreffende Sendung zugelassen ist.
(2) Werden Equiden auf dem Seeweg befördert, verlängert sich die 10-Tages-Frist gemäß Absatz 1 um die Dauer der Seereise.
ABSCHNITT 4
Transportbestimmungen für den Eingang von Equiden in die Union
Artikel 8
Allgemeine Tiergesundheitsanforderungen
(1) Der für eine für den Eingang in die Union bestimmte Sendung von Equiden verantwortliche Unternehmer gewährleistet, dass beim Transport dieser Equiden folgende Bedingungen erfüllt sind:
|
a) |
Die Equiden werden in einem Transportmittel befördert, in dem sich nur Equiden befinden, die für die Union bestimmt sind oder mit denen stattdessen eine für die Durchfuhr erforderliche Gesundheitsbescheinigung mitgeführt wird; |
|
b) |
die Equiden werden in einem Transportmittel befördert, in dem sich nur Equiden mit demselben bescheinigten Gesundheitsstatus befinden, es sei denn, es wird eine Ausnahme gemäß den besonderen Tiergesundheitsanforderungen in Anhang II Teil 1 Abschnitte A und B und in Anhang II Teil 3 Abschnitt A gewährt; |
|
c) |
die Equiden werden nur in einem Drittland oder dem Teil des Hoheitsgebiets eines Drittlands, das für mindestens eine Eingangsart von mindestens einer Equidenkategorie zugelassen ist, auf der Straße oder der Schiene befördert oder zu Fuß verbracht. |
(2) Der für eine für den Eingang in die Union bestimmte Sendung von Equiden verantwortliche Unternehmer gewährleistet, dass
|
a) |
die für den Transport der Equiden genutzten Kisten, Container, Boxen oder Flugboxen und die Transportmittel oder die Abteile in dem Transportmittel vor der Verladung der Tiere mit einem im Versandland amtlich anerkannten Desinfektionsmittel gereinigt und desinfiziert werden; |
|
b) |
die Straßen- oder Bahntransportmittel so gedacht und beschaffen sind und so benutzt werden, dass während der geplanten Fahrt Exkremente, Urin oder Futter nicht nach außen gelangen können; |
|
c) |
beim Auftreten einer der folgenden Krankheiten Maßnahmen zum Schutz der Tiere vor Insektenvektoren ergriffen werden:
Im Falle der in Ziffer i genannten Krankheiten müssen zum Schutz vor Vektoren u. a. die Kisten, Container, Boxen oder Flugboxen mit Netzen verhängt werden und die Transportabteile werden künstlich belüftet und bleiben außer zum Be- und Entladen der Tiere oder zur Versorgung der Tiere geschlossen. |
(3) Der für eine für den Eingang in die Union bestimmte Sendung von Equiden verantwortliche Unternehmer gewährleistet, dass diese Equiden während der Reise nur in einem Drittland oder einem Teil des Hoheitsgebiets eines Drittlands entladen werden, das/der gemäß Anhang I für den Eingang von Equiden in die Union zugelassen ist.
Artikel 9
Besondere Tiergesundheitsanforderungen für den Lufttransport
(1) Der für eine für den Eingang in die Union auf dem Luftweg bestimmte Sendung von Equiden verantwortliche Unternehmer gewährleistet, dass
|
a) |
die Kisten, Container oder Boxen und die Umgebungsluft in dem Transportabteil unmittelbar nach dem Schließen der Verladeklappen des Flugzeugs mit einem geeigneten Insektenabwehrmittel in Kombination mit einem Insektizid besprüht werden; |
|
b) |
der Kapitän/die Kapitänin des Flugzeugs die Erklärung gemäß Anhang V Teil 1 ausfüllt und unterzeichnet. |
(2) Abweichend von Artikel 8 Absatz 3 können die Mitgliedstaaten auf Antrag des für die Sendung verantwortlichen Unternehmers die direkte Umladung von einem Flugzeug in ein anderes Flugzeug in einem nicht in Anhang I aufgeführten Drittland zulassen, sofern folgende Bedingungen erfüllt sind:
|
a) |
Die Umladung findet unter direkter Aufsicht eines amtlichen Tierarztes oder des zuständigen Zollbediensteten auf demselben Flughafen und im Bereich derselben Zollstelle statt; |
|
b) |
während der Umladung sind die Equiden vor Insekten geschützt, die Vektoren für auf Equiden übertragbare Krankheiten sind; |
|
c) |
die Equiden kommen nicht mit Equiden mit einem anderen Gesundheitsstatus in Kontakt; |
|
d) |
die Maßnahmen gemäß Absatz 1 Buchstaben a und b finden auch auf das für den Weiterflug genutzte Flugzeug Anwendung; |
|
e) |
die Einhaltung der Bestimmungen gemäß Absatz 1 Buchstabe a und den Buchstaben a, b und c dieses Absatzes wird vom amtlichen Tierarzt oder dem zuständigen Zollbediensteten in dem Umladungsmanifest gemäß dem Muster in Anhang V Teil 3 bescheinigt. |
Artikel 10
Besondere Tiergesundheitsanforderungen für den Seetransport
(1) Der für eine für den Eingang in die Union auf dem Seeweg bestimmte Sendung von Equiden verantwortliche Unternehmer gewährleistet, dass
|
a) |
das Schiff planmäßig auf direktem Weg in einen Hafen in der Union anlegt, ohne in einen Hafen in einem nicht in Anhang I aufgeführten Drittland oder Teil des Hoheitsgebiets eines Drittlandes einzulaufen; |
|
b) |
die Kisten, Container oder Boxen und die Umgebungsluft in dem Transportabteil unmittelbar nach dem Schließen des Abteils mit einem geeigneten Insektenabwehrmittel in Kombination mit einem Insektizid besprüht werden; |
|
c) |
der Kapitän/die Kapitänin des Schiffes die Erklärung gemäß Anhang V Teil 2 ausfüllt und unterzeichnet. |
(2) Abweichend von Absatz 1 Buchstabe a können die Mitgliedstaaten die direkte Umladung von einem Schiff auf ein anderes Schiff in einem nicht in Anhang I aufgeführten Drittland zulassen, sofern
|
a) |
die Umladung unter direkter Aufsicht eines amtlichen Tierarztes oder des zuständigen Zollbediensteten in demselben Hafen und im Bereich derselben Zollstelle stattfindet; |
|
b) |
die Equiden während der Umladung vor Insekten geschützt sind, die Vektoren für auf Equiden übertragbare Krankheiten sind; |
|
c) |
die Equiden nicht mit Equiden mit einem anderen Gesundheitsstatus in Kontakt kommen; |
|
d) |
die Einhaltung der Bestimmungen gemäß Absatz 1 Buchstabe b und den Buchstaben a, b und c dieses Absatzes wird vom amtlichen Tierarzt oder dem zuständigen Zollbediensteten in dem Umladungsmanifest gemäß dem Muster in Anhang V Teil 3 bescheinigt. |
ABSCHNITT 5
Allgemeine Anforderungen an die Untersuchung und Impfung von Equiden, die für den Eingang in die Union bestimmt sind sowie von Spender-Equiden, deren Sperma, Eizellen oder Embryonen für den Eingang in die Union bestimmt sind
Artikel 11
Allgemeine Anforderungen an die Laboruntersuchungen für die Bescheinigung von für den Eingang in die Union bestimmten Sendungen von Equiden oder Equidensperma, -eizellen oder -embryonen
(1) Die zuständige Behörde in dem Drittland, aus dem für den Eingang in die Union bestimmte Equiden oder Equidensperma, -eizellen oder -embryonen versendet werden, gewährleistet, dass die Laboruntersuchungen, die in den Gesundheitsbescheinigungen gemäß den Anhängen II und III zum Nachweis von Rotz, Beschälseuche, Infektiöser Anämie der Einhufer, Venezolanischer Pferdeenzephalomyelitis, Östlicher und Westlicher Pferdeenzephalomyelitis, Japanischer Enzephalitis, West-Nil-Fieber, Stomatitis vesicularis, Equiner Viraler Arteritis und Ansteckender Metritis des Pferdes vorgesehen sind, mindestens den Anforderungen an Sensitivität und Sensibilität für die betreffende Krankheit genügen, die im entsprechenden Kapitel von Abschnitt 2.5 des Handbuchs mit Normenempfehlungen zu Diagnosemethoden und Vakzinen für Landtiere der Weltorganisation für Tiergesundheit (OIE) in der aktuellen Ausgabe festgelegt sind.
(2) Die zuständige Behörde in dem Drittland, aus dem Equiden in die Union versendet werden, gewährleistet, dass die Laboruntersuchungen, die in den Gesundheitsbescheinigungen gemäß Anhang II zum Nachweis der Afrikanischen Pferdepest vorgesehen sind, gemäß Anhang IV der Richtlinie 2009/156/EG durchgeführt werden.
(3) Die zuständige Behörde in dem Drittland, aus dem Equiden oder Equidensperma, -eizellen oder -embryonen in die Union versendet werden, gewährleistet die Einhaltung folgender Anforderungen:
|
a) |
die Untersuchungen gemäß den Absätzen 1 und 2 werden in einem Labor durchgeführt, das von der zuständigen Behörde im Versanddrittland anerkannt ist; |
|
b) |
die Angaben zur Probenahme und die Ergebnisse der Untersuchungen werden vorschriftsmäßig in die der Sendung entsprechende Gesundheitsbescheinigung gemäß den Anhängen II oder III eingetragen und stimmen mit dem Laborbericht überein, der dem bescheinigenden amtlichen Tierarzt zur Verfügung gestellt wird. |
Artikel 12
Untersuchung bei Eintreffen in der Union
(1) Wenn eine im Eingangsmitgliedstaat oder in dessen Namen durchgeführte Untersuchung einer gemäß Artikel 4 der Entscheidung 97/794/EG entnommenen Probe nicht das Ergebnis einer Laboruntersuchung bestätigt, das in der Gesundheitsbescheinigung gemäß den Anhängen II oder III der vorliegenden Verordnung eingetragen ist, die mit einer in der Union ankommenden Sendung von Equiden oder Equidensperma, -eizellen oder -embryonen mitgeführt wird, stellt die zuständige Behörde dieses Eingangsmitgliedstaats sicher, dass die Untersuchung in dem gemäß Artikel 4 Absatz 1 der Verordnung (EG) Nr. 882/2004 des Europäischen Parlaments und des Rates (38) für diese Krankheit benannten nationalen Referenzlaboratorium wiederholt wird.
(2) Führen die in Absatz 1 vorgesehenen Maßnahmen bei den gemäß Artikel 4 der Entscheidung 97/794/EG durchgeführten Prüfungen der Einhaltung der Vorschriften nicht zu einem schlüssigen Ergebnis, stellt die in Absatz 1 genannte zuständige Behörde sicher, dass die in diesem Absatz genannte Probe eindeutig untersucht wird, und zwar
|
a) |
auf Afrikanische Pferdepest in dem gemäß der Richtlinie 92/35/EWG des Rates (39) benannten Referenzlaboratorium der Europäischen Union für die Pferdepest; |
|
b) |
auf die in Artikel 11 Absatz 1 genannten Krankheiten in dem gemäß der Verordnung (EG) Nr. 180/2008 benannten Referenzlaboratorium der Europäischen Union für Krankheiten von Equiden mit Ausnahme der Pferdepest. |
Artikel 13
Verabreichung von Impfstoffen und Aufzeichnung der Impfungen
(1) Die zuständige Behörde des Drittlands, aus dem für die Union bestimmte Equiden oder Equidensperma, -eizellen oder -embryonen versendet werden, stellt sicher, dass alle in den Bescheinigungen gemäß den Anhängen II oder III angegebenen Impfungen folgende Bedingungen erfüllen:
|
a) |
Die Impfung wird in Übereinstimmung mit den Herstellerangaben oder den nationalen Rechtsvorschriften (ausschlaggebend sind die strengeren Bestimmungen) durchgeführt; |
|
b) |
die Impfung wird mit einem zugelassenen Impfstoff durchgeführt, der mindestens den Anforderungen an Sicherheit, Sterilität und Wirksamkeit genügt, die im Handbuch mit Normenempfehlungen zu Diagnosemethoden und Vakzinen für Landtiere der Weltorganisation für Tiergesundheit (OIE) in der aktuellen Ausgabe für den betreffenden Impfstoff festgelegt sind. |
(2) Wenn die zuständige Behörde des Drittlands bescheinigt, dass ein positiver Laborbefund bei einer serologischen Untersuchung auf Afrikanische Pferdepest im Zusammenhang mit einer früheren Impfung steht, ist die Impfung in dem mit dem Equiden mitgeführten Identifizierungsdokument festzuhalten, falls ein solches Dokument zur Verfügung steht.
Artikel 14
Anforderungen in Bezug auf die Equine Virale Arteritis
(1) Außer den in Anhang IV Nummer 1 genannten müssen alle für den Eingang in die Union bestimmten unkastrierten männlichen Equiden auf Equine Virale Arteritis untersucht werden, um sich zu vergewissern, dass ihr Sperma frei von dem Virus ist.
(2) Die Impfung gegen Equine Virale Arteritis und die Untersuchung gemäß Anhang IV Nummer 1 Buchstabe a werden unter amtstierärztlicher Aufsicht durchgeführt.
(3) Eine Impfung gegen die Equine Virale Arteritis ist gültig, wenn in einem den Equiden begleitenden Dokument ein ununterbrochener Impfzyklus mit einer Erstimpfung gemäß einem der in Anhang IV Nummer 1 Buchstabe a beschriebenen Impfprotokolle und regelmäßigen Auffrischungsimpfungen, die nach den Herstellerempfehlungen und in jedem Fall in Abständen von höchstens 12 Monaten erfolgt sind, nachgewiesen wird.
ABSCHNITT 6
Identifizierung von Equiden, die für den Eingang in die Union bestimmt sind
Artikel 15
Identifizierung von Equiden, die für den Eingang in die Union bestimmt sind
(1) Für den Eingang in die Union bestimmte Equiden werden individuell so identifiziert, dass zwischen dem Tier und dem bescheinigten Gesundheitszustand eine eindeutige Entsprechung besteht.
Diese Identifizierung muss
|
a) |
entweder den Bestimmungen gemäß Artikel 14 der Durchführungsverordnung (EU) 2015/262 entsprechen oder |
|
b) |
mindestens die Angaben gemäß Anhang I Teil 1 Abschnitt I Teil A Nummern 1, 2, 3 und 6 bis 10 und Anhang I Teil 1 Abschnitt I Teil B Nummern 12 bis 18 der genannten Verordnung umfassen. |
(2) Zur Einfuhr in die Union bestimmte Schlachtequiden werden einzeln mit einem elektronischen Transponder oder einer Ohrmarke gekennzeichnet; die zugehörige Nummer wird in die beim Transport der Tiere mitgeführte Gesundheitsbescheinigung eingetragen.
(3) Auf dem linken Vorderhuf von zur Einfuhr in die Union bestimmten Schlachtequiden wird gut lesbar und unauslöschlich ein „S“ eingebrannt, das mindestens halb so hoch ist wie die Hufwand, wenn einer der folgenden Fälle zutrifft:
|
a) |
Die Tiere sind abweichend von Absatz 2 mit einer anderen Methode individuell gekennzeichnet, die im Gesundheitszeugnis angegeben ist; in diesem Fall sind die Tiere in Übereinstimmung mit Artikel 21 Buchstabe a in den Bestimmungsschlachthof zu versenden; |
|
b) |
die Tiere sollen in Übereinstimmung mit Artikel 21 Buchstabe b in den Bestimmungsschlachthof versendet werden. |
ABSCHNITT 7
Allgemeine Anforderungen an die Tiergesundheit und die Ausstellung von Bescheinigungen für den Eingang von Equidensendungen in die Union
Artikel 16
Maßnahmen der zuständigen Behörden zur Gewährleistung der Rückverfolgbarkeit eines zeitweilig zugelassenen registrierten Pferdes
(1) Wenn die Einhaltung der Eingangsbedingungen feststeht, unternimmt die zuständige Behörde an der Eingangsgrenzkontrollstelle folgende Schritte:
|
a) |
Sie behält eine Kopie der Gesundheitsbescheinigung gemäß Artikel 3 Absatz 1 Buchstabe a; |
|
b) |
sie teilt über TRACES der betreffenden zuständigen Behörde bzw. der Ausgangsgrenzkontrollstelle den Eingang eines vorübergehend zugelassenen registrierten Pferdes mit, und zwar
|
|
c) |
sie händigt dem Unternehmer, der in Feld I.7 des GVDE gemäß Absatz 1 Buchstabe b als „für die Sendung verantwortlicher Unternehmer“ eingetragen ist, mindestens eine Ausfertigung des GVDE aus. |
(2) Wenn ein registriertes Pferd während seiner zeitweiligen Zulassung von einem Mitgliedstaat in einen anderen verbracht werden soll, unternimmt die zuständige Behörde am Versandort folgende Schritte:
|
a) |
Sofern die Tiergesundheitsbedingungen gemäß den Artikeln 4 und 5 der Richtlinie 2009/156/EG erfüllt sind, stellt sie entweder für ein einzelnes registriertes Pferd oder für eine Sendung registrierter Pferde desselben Ursprungs und mit derselben Bestimmung eine Gesundheitsbescheinigung gemäß Anhang III der Richtlinie 2009/156/EG aus und vermerkt in Feld I.6 dieser Bescheinigung für jedes zeitweilig zugelassene Pferd aus dieser Sendung die Bezugsnummer der Gesundheitsbescheinigung gemäß Artikel 3 Absatz 1 Buchstabe a und des GVDE gemäß Absatz 1 Buchstabe b Ziffer i; |
|
b) |
sie teilt der zuständigen Behörde am Bestimmungsort über TRACES die Verbringung eines registrierten Pferdes in diesen Mitgliedstaat mit und bittet darum, das Eintreffen zu überprüfen und das Ergebnis in einem zusätzlichen Teil III des GVDE gemäß Absatz 1 Buchstabe b Ziffer i zu vermerken; |
|
c) |
sie händigt dem in Feld I.7 des GVDE gemäß Absatz 1 Buchstabe b Ziffer i eingetragenen Unternehmer eine neue Druckfassung des GVDE aus, in der der gemäß Buchstabe b dieses Absatzes hinzugefügte Teil III erscheint; |
|
d) |
sie entwertet jede Druckfassung des GVDE, die dem Unternehmer gemäß Absatz 1 Buchstabe c oder — bei einer zuvor erfolgten Verbringung in einen anderen Mitgliedstaat — gemäß Buchstabe c dieses Absatzes ausgehändigt worden ist oder zieht diese aus dem Verkehr. |
(3) Die in Absatz 1 Buchstabe b Ziffer i und Absatz 2 Buchstabe b genannte zuständige Behörde des Bestimmungsorts bestätigt über TRACES das Eintreffen des registrierten Pferdes und dokumentiert in Teil III des GVDE die durchgeführten Kontrollen.
(4) Bei Ablauf der zeitweiligen Zulassung unternimmt die zuständige Behörde gemäß Absatz 1 Buchstabe b Ziffer i bzw. iii, die über das zeitweilig zugelassene registrierte Pferd für das Ursprungsdrittland oder ein anderes Drittland die Bescheinigung ausstellt, folgende Schritte:
|
a) |
Sie teilt über TRACES der Ausgangsgrenzkontrollstelle mit, dass das zeitweilig zugelassene registrierte Pferd die Union verlassen hat, indem sie einen zusätzlichen Teil III des GVDE gemäß Absatz 1 Buchstabe b Ziffer i ausfüllt; |
|
b) |
sie händigt dem in Feld I.7 des GVDE gemäß Absatz 1 Buchstabe b Ziffer i eingetragenen Unternehmer eine neue Druckfassung des GVDE aus, in der der gemäß Buchstabe a dieses Absatzes hinzugefügte Teil III erscheint; |
|
c) |
wenn die Ausgangsgrenzkontrollstelle in einem anderen Mitgliedstaat liegt,
|
(5) Die Ausgangsgrenzkontrollstelle gemäß Absatz 4 Buchstabe a dokumentiert die Beendigung der zeitweiligen Zulassung des registrierten Pferdes durch einen entsprechenden Eintrag in Teil III des GVDE.
(6) Wenn die zeitweilige Zulassung eines registrierten Pferdes nicht gemäß Absatz 5 innerhalb eines Zeitraums von höchstens 90 Tagen nach dem Datum der Ausgabe des GVDE gemäß Absatz 1 Buchstabe b Ziffer i beendet wurde, geht über TRACES automatisch eine Warnung an die Eingangsgrenzkontrollstelle und die in diesem Artikel genannten zuständigen Behörden, damit diese zuständigen Behörden den Status des registrierten Pferds klären können.
Artikel 17
Pflichten des Unternehmers in Bezug auf zeitweilig zugelassene registrierte Pferde
(1) Der für ein zeitweilig in die Union zugelassenes registriertes Pferd verantwortliche Unternehmer, der in Feld I.7 des GVDE gemäß Artikel 16 Absatz 1 Buchstabe b Ziffer i eingetragen ist, gewährleistet die Erfüllung der folgenden Bedingungen:
|
a) |
Mit dem registrierten Pferd werden zu jedem Zeitpunkt seiner zeitweiligen Zulassung das Original der Gesundheitsbescheinigung gemäß Artikel 3 Absatz 1 Buchstabe a und das von der Grenzkontrollstelle beim Eingang in die Union ausgestellte GVDE mitgeführt; |
|
b) |
das registrierte Pferd verbleibt in dem entsprechenden Mitgliedstaat und auf dem Gelände gemäß der Erklärung, die der Gesundheitsbescheinigung gemäß Artikel 3 Absatz 1 Buchstabe a beigefügt ist; |
|
c) |
wenn das registrierte Pferd in einen anderen Mitgliedstaat verbracht werden soll, sind eine Gesundheitsbescheinigung gemäß Anhang III der Richtlinie 2009/156/EG und das von der zuständigen Behörde gemäß Artikel 16 Absatz 2 ausgehändigte geänderte GVDE mitzuführen; |
|
d) |
jede frühere Druckfassung des GVDE ist der zuständigen Behörde zurückzugeben, damit sie entwertet oder aus dem Verkehr gezogen werden kann; |
|
e) |
das registrierte Pferd verlässt die Union spätestens 89 Tage nach dem auf dem entsprechenden GVDE eingetragenen Datum des Eingangs in die Union über eine in der Gesundheitsbescheinigung gemäß Artikel 3 Absatz 1 Buchstabe a angegebene Grenzkontrollstelle. |
(2) Der in Absatz 1 genannte Unternehmer bleibt für die Dauer der zeitweiligen Zulassung in die Union für die Verbringung des registrierten Pferds verantwortlich; insbesondere informiert er
|
a) |
die zuständige Behörde gemäß Artikel 16 Absatz 1 Buchstabe b Ziffern i und iii über jede Änderung der in der Erklärung zu der Gesundheitsbescheinigung gemäß Artikel 3 Absatz 1 Buchstabe a angegebenen Verbringungen; |
|
b) |
die Ausgangsgrenzkontrollstelle über das Datum, an dem das zeitweilig zugelassene registrierte Pferd die Union verlassen soll; |
|
c) |
die für den Haltungsbetrieb verantwortliche zuständige Behörde gemäß Artikel 16 Absatz 1 Buchstabe b Ziffern i und iii über den Tod oder Verlust des registrierten Pferds oder über jeden Notfall, beispielsweise betreffend den Gesundheitszustand, der eine tierärztliche Behandlung über die 89 Tage der zeitweiligen Zulassung hinaus erfordert. |
Artikel 18
Wiedereinfuhr zeitweilig in die Union zugelassener registrierter Pferde nach vorübergehender Ausfuhr
(1) Zeitweilig in die Union zugelassene registrierte Pferde können nach vorübergehender Ausfuhr in ein Drittland oder einen Teil des Hoheitsgebiets eines Drittlandes wieder eingeführt werden, wenn dieses Land bzw. dieser Teil für die Wiedereinfuhr registrierter Pferde zur Teilnahme an bestimmten Rennen, Turnieren oder kulturellen Veranstaltungen zugelassen ist, wofür gemäß Artikel 20 Absatz 3 Mustergesundheitsbescheinigungen für die Wiedereinfuhr in die Union festgelegt sind, und sofern die Wiedereinfuhr in die Union in einem Zeitraum von weniger als 90 Tagen nach dem Datum der Ausgabe des GVDE gemäß Artikel 16 Absatz 1 Buchstabe b Ziffer i stattfindet.
(2) Damit ein registriertes Pferd gemäß Absatz 1 wieder eingeführt werden kann, unternimmt die zuständige Behörde gemäß Artikel 16 Absatz 1 Buchstabe b Ziffern i und iii, die die Bescheinigung für die vorübergehende Ausfuhr ausgibt, folgende Schritte:
|
a) |
Sie ergreift die in Artikel 16 Absatz 4 Buchstaben a, b und gegebenenfalls c vorgesehenen Maßnahmen; |
|
b) |
sie informiert die für die Wiedereinfuhr vorgesehene Grenzkontrollstelle über TRACES, indem sie Teil III des GVDE ausfüllt; |
|
c) |
sie händigt dem in Feld I.7 des GVDE gemäß Artikel 16 Absatz 1 Buchstabe b Ziffer i eingetragenen Unternehmer eine neue Druckfassung des GVDE aus, in der der gemäß Buchstabe b dieses Absatzes hinzugefügte Teil III erscheint; |
|
d) |
sie entwertet jede Druckfassung des GVDE, die gemäß Artikel 16 Absatz 1 Buchstabe c oder — bei einer zuvor erfolgten Verbringung in einen anderen Mitgliedstaat — gemäß Artikel 16 Absatz 2 Buchstabe c ausgehändigt worden ist oder sie zieht diese aus dem Verkehr. |
(3) Die Grenzkontrollstelle für die Wiedereinfuhr
|
a) |
behält das Original der Gesundheitsbescheinigung gemäß Artikel 3 Absatz 1 Buchstabe c; |
|
b) |
teilt über TRACES folgenden Stellen die Wiedereinfuhr des registrierten Pferdes mit:
|
|
c) |
bittet die zuständige Behörde des Bestimmungsorts, das Eintreffen des registrierten Pferds zu überprüfen und dessen Eintreffen ggf. in Feld I.6 des GVDE gemäß Buchstabe d zu bestätigen; |
|
d) |
händigt dem Unternehmer eine Druckfassung eines neuen GVDE aus, in dem in Feld II.1 die Bezugsnummer des vorigen GVDE eingetragen ist, das gemäß Artikel 16 Absatz 1 Buchstabe c oder — bei einer zuvor erfolgten Verbringung in einen anderen Mitgliedstaat — gemäß Artikel 16 Absatz 2 Buchstabe c ausgehändigt worden war, und in dem Feld II.14 innerhalb der in dem GVDE gemäß Artikel 16 Absatz 1 Buchstabe b Ziffer i eingetragenen Frist für das Verlassen der Union ausgefüllt wurde; |
|
e) |
entwertet jede Druckfassung des GVDE, die dem Unternehmer gemäß Artikel 16 Absatz 1 Buchstabe c oder — bei einer zuvor erfolgten Verbringung in einen anderen Mitgliedstaat — gemäß Artikel 16 Absatz 2 Buchstabe c ausgehändigt worden ist oder zieht diese aus dem Verkehr. |
(4) Nach der Wiedereinfuhr eines zeitweilig zugelassenen registrierten Pferds nach vorübergehender Ausfuhr gemäß Absatz 1 gelten die Bestimmungen gemäß Artikel 16 für den Zeitraum, der nach dem Datum der Ausgabe des GVDE gemäß Artikel 16 Absatz 1 Buchstabe b Ziffer i bis zum Ablauf der 90 Tage verbleibt.
Artikel 19
Umwandlung einer zeitweiligen Zulassung in eine endgültige Zulassung und Tod oder Verlust eines registrierten Pferds
(1) Wenn der in Feld I.7 des GVDE gemäß Artikel 16 Absatz 1 Buchstabe b Ziffer i eingetragene Unternehmer bei der zuständigen Behörde gemäß Artikel 16 Absatz 1 Buchstabe b Ziffer i bzw. iii oder Artikel 16 Absatz 2 Buchstabe b einen Antrag auf Umwandlung einer zeitweiligen Zulassung eines registrierten Pferds in eine endgültige Zulassung stellt, kann ein Mitgliedstaat eine solche Umwandlung genehmigen, sofern
|
a) |
Einfuhren registrierter Pferde aus dem betreffenden Drittland oder Teil des Hoheitsgebiets des Drittlands gemäß Anhang I zulässig sind; |
|
b) |
die für den zeitweiligen Aufenthaltsort verantwortliche zuständige Behörde folgende Bedingungen erfüllt:
|
(2) Die zuständige Behörde gemäß Absatz 1 oder eine für diese Aufgabe vom Mitgliedstaat benannte Grenzkontrollstelle
|
a) |
beenden die zeitweilige Zulassung in TRACES, indem sie „Umwandlung in eine endgültige Zulassung“ in Teil III des GVDE auswählen, das dem Unternehmer ausgehändigt wird entweder gemäß Artikel 16 Absatz 1 Buchstabe c, Artikel 16 Absatz 2 Buchstabe c bei einer zuvor erfolgten Verbringung in einen anderen Mitgliedstaat oder Artikel 18 Absatz 3 Buchstabe c bei einer zuvor erfolgten Wiedereinfuhr nach vorübergehender Ausfuhr; |
|
b) |
händigen dem in Feld I.7 des GVDE gemäß Artikel 16 Absatz 1 Buchstabe b Ziffer i eingetragenen Unternehmer eine neue Druckfassung des GVDE gemäß Buchstabe a oder ein neues GVDE aus, in dem in Feld I.21 „Für den Binnenmarkt“ ausgewählt ist; |
|
c) |
entwerten jede Druckfassung des GVDE, die dem Unternehmer gemäß Artikel 16 Absatz 1 Buchstabe c, Artikel 16 Absatz 2 Buchstabe c bei einer zuvor erfolgten Verbringung in einen anderen Mitgliedstaat oder Artikel 18 Absatz 3 Buchstabe c bei einer zuvor erfolgten Wiedereinfuhr nach vorübergehender Ausfuhr ausgehändigt worden ist oder ziehen diese aus dem Verkehr; |
|
d) |
entwerten das Original der Gesundheitsbescheinigung gemäß Artikel 3 Absatz 1 Buchstabe a oder ziehen dieses aus dem Verkehr. |
(3) Während der Umwandlung trifft der für das registrierte Pferd verantwortliche Unternehmer, der in Feld I.7 des gemäß Artikel 16 Absatz 1 Buchstabe b Ziffer i oder Artikel 18 Absatz 3 Buchstabe b ausgestellten GVDE eingetragen ist, folgende Maßnahmen:
|
a) |
Er sorgt dafür, dass regelmäßige Kontrollen durch einen Tierarzt stattfinden und aufgezeichnet werden, bei denen das registrierte Pferd auf klinische Anzeichen möglicher ansteckender Krankheiten untersucht wird; |
|
b) |
er führt Aufzeichnungen über Verbringungen des registrierten Pferds und über die Zu- und Abgänge von Equiden in dem Haltungsbetrieb, in dem es steht; |
|
c) |
er wickelt die Zollverfahren gemäß Artikel 15 der Durchführungsverordnung (EU) 2015/262 ab; |
|
d) |
er stellt einen Antrag gemäß Artikel 15 Absatz 1 der Durchführungsverordnung (EU) 2015/262 auf Ausstellung eines Identifizierungsdokuments oder die Anpassung eines existierenden Identifizierungsdokuments. |
(4) Bei Tod oder Verlust eines zeitweilig in die Union zugelassenen registrierten Pferds unternimmt die zuständige Behörde an dem Ort, an dem das Tier verendet ist oder verloren ging, folgende Schritte, in enger Zusammenarbeit mit einer Grenzkontrollstelle, falls vom betreffenden Mitgliedstaat verlangt:
|
a) |
Sie beendet die zeitweilige Zulassung in TRACES, indem sie „Tod/Verlust“ in Teil III des GVDE gemäß Artikel 16 Absatz 1 Buchstabe b Ziffer i bzw. Artikel 18 Absatz 3 Buchstabe b auswählt; |
|
b) |
sie entwertet jede Druckfassung des GVDE, die dem Unternehmer gemäß Artikel 16 Absatz 1 Buchstabe c, Artikel 16 Absatz 2 Buchstabe c bei einer zuvor erfolgten Verbringung in einen anderen Mitgliedstaat oder Artikel 18 Absatz 3 Buchstabe c bei einer zuvor erfolgten Wiedereinfuhr nach vorübergehender Ausfuhr ausgehändigt worden ist oder zieht diese aus dem Verkehr. |
Artikel 20
Besondere Tiergesundheitsbedingungen bei der Wiedereinfuhr registrierter Pferde nach vorübergehender Ausfuhr zur Teilnahme an Rennen, Turnieren oder kulturellen Veranstaltungen
(1) Die Mitgliedstaaten genehmigen unter folgenden Bedingungen die Wiedereinfuhr registrierter Pferde:
|
a) |
Das registrierte Pferd hat höchstens 30 Tage außerhalb der Union verbracht, es sei denn, die Bestimmungen in Absatz 3 finden Anwendung; |
|
b) |
das registrierte Pferd wurde weder in einem Drittland oder einem Teil des Hoheitsgebiets eines Drittlands gehalten, das nicht derselben Statusgruppe angehört wie das Drittland oder der Teil des Hoheitsgebiets des Drittlands, in dem die Gesundheitsbescheinigung gemäß Anhang II Teil 2 Abschnitt A vom amtlichen Tierarzt unterzeichnet wurde, noch wurde es auf dem Landweg dort durchgeführt; |
|
c) |
auf Verlangen der Grenzkontrollstelle für die Wiedereinfuhr in die Union wird die vom amtlichen Tierarzt im Ursprungsmitgliedstaat unterzeichnete Gesundheitsbescheinigung für die vorübergehende Ausfuhr oder eine beglaubigte Kopie dieser Bescheinigung vorgelegt. |
(2) Die zuständige Behörde, die eine Bescheinigung zur vorübergehenden Ausfuhr eines registrierten Pferds in ein Drittland ausgibt, stellt sicher, dass gemäß Artikel 2 Absatz 1 der Entscheidung 93/444/EWG mit dem registrierten Pferd bis zum Ausgangsort in einem anderen Mitgliedstaat eine Gesundheitsbescheinigung gemäß Anhang III der Richtlinie 2009/156/EG mitgeführt wird.
(3) Für registrierte Pferde, die an bestimmten Rennen, Turnieren oder kulturellen Veranstaltungen teilnehmen und nach einer mehr als 30-tägigen vorübergehenden Ausfuhr wieder eingeführt werden, gelten bestimmte Anforderungen an die Tiergesundheit, die in den entsprechenden Mustergesundheitsbescheinigungen gemäß Anhang II Teil 2 Abschnitt B für die jeweilige Veranstaltung festgelegt sind.
(4) Der für die Sendung verantwortliche Unternehmer, der in Feld I.7 des GVDE eingetragen ist, stellt sicher, dass das registrierte Pferd während der vorübergehenden Ausfuhr weder in einem Drittland oder einem Teil des Hoheitsgebiets eines Drittlands gehalten wurde, das nicht derselben Statusgruppe angehört wie das Drittland oder der Teil des Hoheitsgebiets des Drittlands, in dem die Gesundheitsbescheinigung gemäß Anhang II Teil 2 Abschnitt A vom amtlichen Tierarzt unterzeichnet wurde, noch auf dem Landweg dort durchgeführt wurde.
Artikel 21
Besondere Tiergesundheitsbedingungen für Einfuhren von Schlachtequiden
Der für eine Sendung von Schlachtequiden verantwortliche Unternehmer, der in Feld I.7 des GVDE gemäß Artikel 16 Absatz 1 Buchstabe b Ziffer i eingetragen ist, stellt sicher, dass die Tiere nach den Kontrollen an der Grenzkontrollstelle für den Eingang in die Union
|
a) |
entweder auf direktem Weg, unverzüglich und ohne Kontakt zu Equiden mit einem anderen Gesundheitsstatus zum Bestimmungsschlachthof befördert und innerhalb von 72 Stunden nach Eintreffen im Schlachthof geschlachtet werden oder |
|
b) |
einen einzigen zugelassenen Markt oder eine einzige zugelassene Sammelstelle gemäß Artikel 7 Absatz 1 der Richtlinie 2009/156/EG passieren, wie in der Gesundheitsbescheinigung gemäß Artikel 3 Absatz 1 Buchstabe e der vorliegenden Verordnung angegeben, von wo aus sie gemäß den nationalen Vorschriften zur Gewährleistung der Rückverfolgbarkeit auf direktem Weg und ohne mit Equiden mit einem anderen Gesundheitsstatus in Kontakt zu kommen zur Schlachtung in einen Schlachthof verbracht werden, und zwar so schnell wie möglich, spätestens aber fünf Arbeitstage nach Eintreffen in der Union. |
ABSCHNITT 8
Übergangs- und Schlussbestimmungen
Artikel 22
Übergangsbestimmungen
Für eine Übergangszeit bis zum 31. Dezember 2018 erlauben die Mitgliedstaaten den Eingang in die Union von Sendungen von Equiden sowie von Equidensperma, -eizellen und -embryonen, für die Gesundheitsbescheinigungen gemäß den vor dem Geltungsbeginn der vorliegenden Verordnung gemäß dem zweiten Unterabsatz von Artikel 24 gültigen Mustergesundheitsbescheinigungen mitgeführt werden.
Artikel 23
Aufhebung
Die Entscheidungen 92/260/EWG, 93/195/EWG, 93/196/EWG, 93/197/EWG, 94/699/EG, 95/329/EG, 2003/13/EG, 2004/177/EG, 2004/211/EG, 2010/57/EU und der Beschluss 2010/471/EU werden aufgehoben.
Bezugnahmen auf diese Entscheidungen bzw. Beschlüsse gelten als Bezugnahme auf die vorliegende Verordnung.
Artikel 24
Inkrafttreten und Anwendbarkeit
Diese Verordnung tritt am zwanzigsten Tag nach ihrer Veröffentlichung im Amtsblatt der Europäischen Union in Kraft.
Sie gilt ab dem 1. Oktober 2018.
Artikel 16 Absatz 1 Buchstabe b Ziffer iii, Artikel 16 Absatz 2 Buchstaben b, c und d, Artikel 16 Absatz 3, Artikel 16 Absatz 4 Buchstaben a und b sowie Artikel 16 Absatz 5 und Artikel 17 Absatz 1 Buchstabe d gelten jedoch ab dem 14. Dezember 2019.
Diese Verordnung ist in allen ihren Teilen verbindlich und gilt unmittelbar in jedem Mitgliedstaat.
Brüssel, den 12. April 2018
Für die Kommission
Der Präsident
Jean-Claude JUNCKER
(1) ABl. L 268 vom 24.9.1991, S. 56.
(2) ABl. L 268 vom 14.9.1992, S. 54.
(3) ABl. L 192 vom 23.7.2010, S. 1.
(4) Entscheidung 2004/211/EG der Kommission vom 6. Januar 2004 zur Erstellung der Liste von Drittländern und Teilen von Drittländern, aus denen die Mitgliedstaaten die Einfuhr von lebenden Equiden sowie von Equidensperma, -eizellen und -embryonen zulassen, und zur Änderung der Entscheidungen 93/195/EWG und 94/63/EG (ABl. L 73 vom 11.3.2004, S. 1).
(5) Richtlinie 2008/73/EG des Rates vom 15. Juli 2008 zur Vereinfachung der Verfahren für das Auflisten und die Veröffentlichung von Informationen im Veterinär- und Tierzuchtbereich und zur Änderung der Richtlinien 64/432/EWG, 77/504/EWG, 88/407/EWG, 88/661/EWG, 89/361/EWG, 89/556/EWG, 90/426/EWG, 90/427/EWG, 90/428/EWG, 90/429/EWG, 90/539/EWG, 91/68/EWG, 91/496/EWG, 92/35/EWG, 92/65/EWG, 92/66/EWG, 92/119/EWG, 94/28/EG, 2000/75/EG, der Entscheidung 2000/258/EG sowie der Richtlinien 2001/89/EG, 2002/60/EG und 2005/94/EG (ABl. L 219 vom 14.8.2008, S. 40).
(6) http://ec.europa.eu/food/animals/semen/equine_en.
(7) Verordnung (EU) Nr. 176/2010 der Kommission vom 2. März 2010 zur Änderung des Anhangs D der Richtlinie 92/65/EWG des Rates bezüglich Besamungsstationen und Samendepots, Embryo-Entnahmeeinheiten und Embryo-Erzeugungseinheiten, hinsichtlich der Anforderungen an Spenderpferde, Spenderschafe und Spenderziegen sowie der Bedingungen für den Umgang mit Sperma, Eizellen und Embryonen der betreffenden Tierarten (ABl. L 52 vom 3.3.2010, S. 14).
(8) Beschluss 2010/470/EU der Kommission vom 26. August 2010 mit Muster-Veterinärbescheinigungen für den Handel innerhalb der Union mit Samen, Eizellen und Embryonen von Pferden, Schafen und Ziegen sowie mit Eizellen und Embryonen von Schweinen (ABl. L 228 vom 31.8.2010, S. 15).
(9) Beschluss 2002/309/EG, Euratom des Rates und — bezüglich des Abkommens über die wissenschaftliche und technische Zusammenarbeit — der Kommission vom 4. April 2002 über den Abschluss von sieben Abkommen mit der Schweizerischen Eidgenossenschaft (ABl. L 114 vom 30.4.2002, S. 1).
(10) ABl. L 71 vom 18.3.1999, S. 3.
(11) Beschluss 1999/201/EG des Rates vom 14. Dezember 1998 über den Abschluss des Abkommens zwischen der Europäischen Gemeinschaft und der Regierung Kanadas über gesundheitspolizeiliche Maßnahmen zum Schutz der Gesundheit von Mensch und Tier im Handel mit lebenden Tieren und Tierprodukten (ABl. L 71 vom 18.3.1999, S. 1).
(12) ABl. L 57 vom 26.2.1997, S. 5.
(13) Beschluss 97/132/EG des Rates vom 17. Dezember 1996 über den Abschluss des Abkommens zwischen der Europäischen Gemeinschaft und Neuseeland über veterinärhygienische Maßnahmen im Handel mit lebenden Tieren und tierischen Erzeugnissen (ABl. L 57 vom 26.2.1997, S. 4).
(14) Verordnung (EG) Nr. 180/2008 der Kommission vom 28. Februar 2008 über das Gemeinschaftsreferenzlaboratorium für Krankheiten von Equiden mit Ausnahme der Pferdepest und zur Änderung des Anhangs VII der Verordnung (EG) Nr. 882/2004 des Europäischen Parlaments und des Rates (ABl. L 56 vom 29.2.2008, S. 4).
(15) Entscheidung 97/794/EG der Kommission vom 12. November 1997 mit Durchführungsbestimmungen zur Richtlinie 91/496/EWG des Rates hinsichtlich der Veterinärkontrollen für aus Drittländern einzuführende lebende Tiere (ABl. L 323 vom 26.11.1997, S. 31).
(16) Report of the Scientific Veterinary Committee on Equine Viral Arteritis, 12. Dezember 1994, VI/4994/94 — Rev. 4.
(17) Entscheidung 95/329/EG der Kommission vom 25. Juli 1995 zur Festlegung der Kategorien von Hengsten, auf die die Bedingungen gemäß Artikel 15 Buchstabe b) Ziffer ii) der Richtlinie 90/426/EWG des Rates bezüglich der Virusarteriitis anzuwenden sind (ABl. L 191 vom 12.8.1995, S. 36).
(18) http://www.oie.int/index.php?id=169&L=0&htmfile=chapitre_eav.htm.
(19) Entscheidung 2003/24/EG der Kommission vom 30. Dezember 2002 über die Entwicklung eines integrierten EDV-Systems für das Veterinärswesen (ABl. L 8 vom 14.1.2003, S. 44).
(20) Entscheidung 2004/292/EG der Kommission vom 30. März 2004 zur Einführung des TRACES-Systems und zur Änderung der Entscheidung 92/486/EWG (ABl. L 94 vom 31.3.2004, S. 63).
(21) Entscheidung 2009/821/EG der Kommission vom 28. September 2009 zur Aufstellung eines Verzeichnisses zugelassener Grenzkontrollstellen, zur Festlegung bestimmter Vorschriften für die von Veterinärsachverständigen der Kommission durchgeführten Inspektionen und zur Definition der Veterinäreinheiten in TRACES (ABl. L 296 vom 12.11.2009, S. 1).
(22) Entscheidung 2007/240/EG der Kommission vom 16. April 2007 zur Festlegung neuer Veterinärbescheinigungen für die Einfuhr von lebenden Tieren, Sperma, Embryonen, Eizellen und Erzeugnissen tierischen Ursprungs in die Gemeinschaft im Rahmen der Entscheidungen 79/542/EWG, 92/260/EWG, 93/195/EWG, 93/196/EWG, 93/197/EWG, 95/328/EG, 96/333/EG, 96/539/EG, 96/540/EG, 2000/572/EG, 2000/585/EG, 2000/666/EG, 2002/613/EG, 2003/56/EG, 2003/779/EG, 2003/804/EG, 2003/858/EG, 2003/863/EG, 2003/881/EG, 2004/407/EG, 2004/438/EG, 2004/595/EG, 2004/639/EG und 2006/168/EG (ABl. L 104 vom 21.4.2007, S. 37).
(23) Verordnung (EG) Nr. 282/2004 der Kommission vom 18. Februar 2004 zur Festlegung eines Dokuments für die Zollanmeldung und Veterinärkontrolle von aus Drittländern in die Gemeinschaft eingeführten Tieren (ABl. L 49 vom 19.2.2004, S. 11).
(24) Entscheidung 93/444/EWG der Kommission vom 2. Juli 1993 mit Durchführungsvorschriften zur Regelung des innergemeinschaftlichen Handels mit bestimmten lebenden Tieren und Erzeugnissen, die zur Ausfuhr nach Drittländern bestimmt sind (ABl. L 208 vom 19.8.1993, S. 34).
(25) Entscheidung 92/260/EWG der Kommission vom 10. April 1992 über die tierseuchenrechtlichen Bedingungen und die Beurkundung für die zeitweilige Zulassung registrierter Pferde (ABl. L 130 vom 15.5.1992, S. 67).
(26) Entscheidung 93/195/EWG der Kommission vom 2. Februar 1993 über die tierseuchenrechtlichen Bedingungen und die Beurkundung für die Wiedereinfuhr von registrierten Renn-, Turnier- und für kulturelle Veranstaltungen bestimmten Pferden nach vorübergehender Ausfuhr (ABl. L 86 vom 6.4.1993, S. 1).
(27) Entscheidung 93/196/EWG der Kommission vom 5. Februar 1993 über die tierseuchenrechtlichen Bedingungen und die Beurkundung für die Einfuhr von Schlachtequiden (ABl. L 86 vom 6.4.1993, S. 7).
(28) Entscheidung 93/197/EWG der Kommission vom 5. Februar 1993 über die tierseuchenrechtlichen Bedingungen und die Beurkundung für die Einfuhr von registrierten Equiden sowie Zucht- und Nutzequiden (ABl. L 86 vom 6.4.1993, S. 16).
(29) Entscheidung 94/699/EG der Kommission vom 19. Oktober 1994 zur Einschränkung der Nämlichkeitskontrollen und der Beschau bei der zeitweiligen Zulassung bestimmter registrierter Equiden aus Schweden, Norwegen und Finnland und zur Aufhebung der Entscheidung 93/321/EWG (ABl. L 280 vom 29.10.1994, S. 88).
(30) Entscheidung 2003/13/EG der Kommission vom 10. Januar 2003 über die zeitweilige Zulassung registrierter Pferde, die 2003 an der Testprüfung für die Olympischen Spiele in Griechenland teilnehmen (ABl. L 7 vom 11.1.2003, S. 86).
(31) Entscheidung 2004/177/EG der Kommission vom 20. Februar 2004 über die zeitweilige Verbringung registrierter Pferde, die 2004 an den Olympischen Spielen oder den Paralympischen Spielen in Griechenland teilnehmen (ABl. L 55 vom 24.2.2004, S. 64).
(32) Beschluss 2010/57/EU der Kommission vom 3. Februar 2010 zur Festlegung von Gesundheitsgarantien für die Durchfuhr von Equiden durch die in Anhang I der Richtlinie 97/78/EG des Rates aufgeführten Gebiete (ABl. L 32 vom 4.2.2010, S. 9).
(33) Beschluss 2010/471/EU der Kommission vom 26. August 2010 über die Einfuhr von Samen, Eizellen und Embryonen von Equiden in die Union bezüglich der Listen der Besamungsstationen, Samendepots, Embryo-Entnahmeeinheiten und Embryo-Erzeugungseinheiten sowie bezüglich der Bescheinigungsanforderungen (ABl. L 228 vom 31.8.2010, S. 52).
(34) Durchführungsverordnung (EU) 2015/262 der Kommission vom 17. Februar 2015 zur Festlegung von Vorschriften gemäß den Richtlinien 90/427/EWG und 2009/156/EG des Rates in Bezug auf die Methoden zur Identifizierung von Equiden (Equidenpass-Verordnung) (ABl. L 59 vom 3.3.2015, S. 1).
(35) Richtlinie 90/427/EWG des Rates vom 26. Juni 1990 zur Festlegung der tierzüchterischen und genealogischen Vorschriften für den innergemeinschaftlichen Handel mit Equiden (ABl. L 224 vom 18.8.1990, S. 55).
(36) Richtlinie 97/78/EG des Rates vom 18. Dezember 1997 zur Festlegung von Grundregeln für die Veterinärkontrollen von aus Drittländern in die Gemeinschaft eingeführten Erzeugnissen (ABl. L 24 vom 30.1.1998, S. 9).
(37) https://ec.europa.eu/food/sites/food/files/animals/docs/ad_control-measures_bt_guidance_vpe_7068_2012.pdf.
(38) Verordnung (EG) Nr. 882/2004 des Europäischen Parlaments und des Rates vom 29. April 2004 über amtliche Kontrollen zur Überprüfung der Einhaltung des Lebensmittel- und Futtermittelrechts sowie der Bestimmungen über Tiergesundheit und Tierschutz (ABl. L 165 vom 30.4.2004, S. 1).
(39) Richtlinie 92/35/EWG des Rates vom 29. April 1992 zur Festlegung von Kontrollregeln und Maßnahmen zur Bekämpfung der Pferdepest (ABl. L 157 vom 10.6.1992, S. 19).
ANHANG I
LISTE VON DRITTLÄNDERN (1) UND TEILEN DES HOHEITSGEBIETS VON DRITTLÄNDERN (2) FÜR DIE EINFUHR VON EQUIDENSENDUNGEN SOWIE VON EQUIDENSPERMA, -EIZELLEN UND -EMBRYONEN IN DIE UNION
|
ISO-Code |
Drittland |
Code des Teils des Hoheitsgebiets des Drittlands |
Abgrenzung des Teils des Hoheitsgebiets des Drittlands |
SG |
ZZ |
WE |
Einfuhr |
Einfuhr |
Durchfuhr |
Besondere Bedingungen |
|||||
|
RP |
RP |
RP |
SE |
RE + ZNE |
SPERMA |
EI/EM |
Equiden |
|
|||||||
|
RP |
RE |
ZNE |
|
|
|
||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
AE |
Vereinigte Arabische Emirate |
AE-0 |
Gesamtes Hoheitsgebiet |
E |
X |
X |
X |
— |
— |
X |
— |
— |
X |
X |
|
|
AR |
Argentinien |
AR-0 |
Gesamtes Hoheitsgebiet |
D |
X |
X |
X |
X |
X |
X |
X |
X |
X |
X |
|
|
AU |
Australien |
AU-0 |
Gesamtes Hoheitsgebiet |
A |
X |
X |
X |
X |
X |
X |
X |
X |
X |
X |
|
|
BB |
Barbados |
BB-0 |
Gesamtes Hoheitsgebiet |
D |
X |
X |
X |
— |
— |
X |
— |
— |
— |
X |
|
|
BH |
Bahrain |
BH-0 |
Gesamtes Hoheitsgebiet |
E |
X |
X |
X |
— |
— |
— |
— |
— |
— |
X |
|
|
BM |
Bermuda |
BM-0 |
Gesamtes Hoheitsgebiet |
D |
X |
X |
X |
— |
— |
X |
— |
— |
— |
X |
|
|
BO |
Bolivien |
BO-0 |
Gesamtes Hoheitsgebiet |
D |
X |
X |
X |
— |
— |
X |
— |
— |
— |
X |
|
|
BR |
Brasilien |
BR-0 |
Gesamtes Hoheitsgebiet |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
BR-1 |
Die Bundesstaaten Rio Grande do Sul, Santa Catarina, Mato Grosso do Sul, Distrito Federal und Rio de Janeiro |
D |
X |
X |
X |
— |
— |
X |
— |
— |
— |
X |
|
||
|
BY |
Belarus |
BY-0 |
Gesamtes Hoheitsgebiet |
B |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
|
CA |
Kanada |
CA-0 |
Gesamtes Hoheitsgebiet |
C |
X |
X |
X |
X |
X |
X |
X |
X |
X |
X |
|
|
CH |
Schweiz (1) |
CH-0 |
Gesamtes Hoheitsgebiet |
A |
X |
X |
X |
X |
X |
X |
X |
X |
X |
X |
|
|
CL |
Chile |
CL-0 |
Gesamtes Hoheitsgebiet |
D |
X |
X |
X |
X |
X |
— |
— |
— |
— |
X |
|
|
CN |
China |
CN-0 |
Gesamtes Hoheitsgebiet |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
CN-1 |
Die von Equidenkrankheiten freie Zone in der Stadt Conghua, Unterprovinzstadt Guangzhou, Provinz Guangdong, einschl. der Straße, die vom und zum Flughafen Guangzhou und Hongkong führt und auf der die Biosicherheit gewährleistet ist (Details siehe Kasten 1) |
G |
X |
X |
X |
— |
— |
— |
— |
— |
— |
X |
|
||
|
CN-2 |
Austragungsort der Global Champions Tour auf der EXPO 2010 Parkplatz 15 sowie die Zufahrt von dort zum internationalen Flughafen Shanghai Pudong im Norden des Gebiets Pudong New und im östlichen Teil des Minhang-Bezirks der Großstadtregion Shanghai (Details siehe Kasten 1) |
G |
— |
X |
— |
— |
— |
— |
— |
— |
— |
|
Nur bei Bescheinigung gemäß Anhang II Teil 2 Abschnitt B Kapitel 1 |
||
|
CR |
Costa Rica |
CR-0 |
Gesamtes Hoheitsgebiet |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
CR-1 |
Stadtgebiet von San José |
D |
— |
X |
— |
— |
— |
— |
— |
— |
— |
|
|
||
|
CU |
Kuba |
CU-0 |
Gesamtes Hoheitsgebiet |
D |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
DZ |
Algerien |
DZ-0 |
Gesamtes Hoheitsgebiet |
E |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
|
EG |
Ägypten |
EG-0 |
Gesamtes Hoheitsgebiet |
|
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
EG-1 |
Von Equidenkrankheiten freie Zone rund um die Tierklinik der Ägyptischen Streitkräfte an der El-Nasr Road, gegenüber dem Al Ahly Club, Kairo, und Schnellstraße zum Cairo International Airport (Details siehe Kasten 2) |
E |
X |
— |
X |
— |
— |
— |
— |
— |
— |
X |
|
||
|
FK |
Falklandinseln |
FK-0 |
Gesamtes Hoheitsgebiet |
A |
X |
X |
X |
— |
X |
|
|
|
|
X |
|
|
GL |
Grönland |
GL-0 |
Gesamtes Hoheitsgebiet |
A |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
|
HK |
Hongkong |
HK-0 |
Gesamtes Hoheitsgebiet |
G |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
IL |
Israel (3) |
IL-0 |
Gesamtes Hoheitsgebiet |
E |
X |
X |
X |
X |
X |
X |
X |
|
|
X |
|
|
IS |
Island (5) |
IS-0 |
Gesamtes Hoheitsgebiet |
A |
X |
X |
X |
X |
X |
X |
X |
X |
|
X |
|
|
JM |
Jamaika |
JM-0 |
Gesamtes Hoheitsgebiet |
D |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
JO |
Jordanien |
JO-0 |
Gesamtes Hoheitsgebiet |
E |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
JP |
Japan |
JP-0 |
Gesamtes Hoheitsgebiet |
G |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
KG |
Kirgisistan |
KG-0 |
Gesamtes Hoheitsgebiet |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
KG-1 |
Region Issyk-Kul |
B |
— |
— |
X |
— |
— |
|
— |
— |
— |
X |
|
||
|
KR |
Republik Korea |
KR-0 |
Gesamtes Hoheitsgebiet |
G |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
KW |
Kuwait |
KW-0 |
Gesamtes Hoheitsgebiet |
E |
X |
X |
X |
— |
— |
— |
— |
— |
— |
X |
|
|
LB |
Libanon |
LB-0 |
Gesamtes Hoheitsgebiet |
E |
X |
X |
X |
— |
— |
— |
— |
— |
— |
X |
|
|
MA |
Marokko |
MA-0 |
Gesamtes Hoheitsgebiet |
E |
X |
X |
X |
X |
X |
X |
X |
X |
|
X |
|
|
ME |
Montenegro |
ME-0 |
Gesamtes Hoheitsgebiet |
B |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
|
MK |
Ehemalige jugoslawische Republik Mazedonien (4) |
MK-0 |
Gesamtes Hoheitsgebiet |
B |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
|
MO |
Macao |
MO-0 |
Gesamtes Hoheitsgebiet |
G |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
MY |
Malaysia |
MY-0 |
Gesamtes Hoheitsgebiet |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
MY-1 |
Halbinsel |
G |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
||
|
MU |
Mauritius |
MU-0 |
Gesamtes Hoheitsgebiet |
E |
— |
— |
X |
— |
— |
— |
— |
— |
— |
X |
|
|
MX |
Mexiko |
MX-0 |
Gesamtes Hoheitsgebiet |
C |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
|
|
MX-1 |
Großstadtregion Mexiko-Stadt |
C |
|
X |
|
|
|
|
|
|
|
|
Nur bei Bescheinigung gemäß Anhang II Teil 2 Abschnitt B Kapitel 1 |
|
NO |
Norwegen (5) |
NO-1 |
Gesamtes Hoheitsgebiet |
A |
X |
X |
X |
X |
X |
X |
X |
X |
X |
X |
|
|
NZ |
Neuseeland |
NZ-0 |
Gesamtes Hoheitsgebiet |
A |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
|
OM |
Oman |
OM-0 |
Gesamtes Hoheitsgebiet |
E |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
PE |
Peru |
PE-0 |
Gesamtes Hoheitsgebiet |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
PE-1 |
Region Lima |
D |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
||
|
PM |
St Pierre & Miquelon |
PM-0 |
Gesamtes Hoheitsgebiet |
A |
— |
— |
X |
— |
X |
|
|
|
|
X |
|
|
PY |
Paraguay |
PY-0 |
Gesamtes Hoheitsgebiet |
D |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
|
QA |
Katar |
QA-0 |
Gesamtes Hoheitsgebiet |
E |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
RS |
Serbien (6) |
RS-0 |
Gesamtes Hoheitsgebiet |
B |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
|
RU |
Russland |
RU-0 |
Gesamtes Hoheitsgebiet |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
RU-1 |
Oblaste Kaliningrad, Archangelsk, Wologda, Murmansk, Leningrad, Nowgorod, Pskow, Brjansk, Wladimir, Iwanowo, Twer, Kaluga, Kostroma, Moskau, Orjol, Rjasan, Smolensk, Tula, Jaroslawl, Nischni Nowgorod, Kirow, Belgorod, Woronesch, Kursk, Lipezk, Tambow, Astrachan, Wolgograd, Pensa, Saratow, Uljanowsk, Rostow, Orenburg, Perm und Kurgan |
B |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
||
|
RU-2 |
Regionen Stavropol und Krasnodar |
B |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
||
|
RU-3 |
Republiken Karelien, Mari El, Mordowien, Tschuwaschien, Kalmyckien, Tatarstan, Dagestan, Kabardino-Balkarien, Nordossetien, Inguschetien und Karatschajewo-Tscherkessien |
B |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
||
|
SA |
Saudi-Arabien |
SA-0 |
Gesamtes Hoheitsgebiet |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
SA-1 |
Gesamtes Hoheitsgebiet, ausgenommen SA-2 |
E |
X |
X |
X |
— |
— |
X |
— |
— |
— |
X |
|
||
|
SA-2 |
Schutz- und Überwachungszonen in den Provinzen Jizan, Asir und Najran gemäß Kasten 3 |
— |
— |
— |
— |
|
|
— |
|
|
|
|
|
||
|
SG |
Singapur |
SG-0 |
Gesamtes Hoheitsgebiet |
G |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
TH |
Thailand |
TH-0 |
Gesamtes Hoheitsgebiet |
G |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
TN |
Tunesien |
TN-0 |
Gesamtes Hoheitsgebiet |
E |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
|
TR |
Türkei |
TR-0 |
Gesamtes Hoheitsgebiet |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
TR-1 |
Provinzen Ankara, Edirne, Istanbul, Izmir, Kırklareli und Tekirdağ |
E |
— |
— |
— |
— |
— |
|
— |
— |
— |
— |
|
||
|
UA |
Ukraine |
UA-0 |
Gesamtes Hoheitsgebiet |
B |
X |
X |
X |
X |
X |
X |
X |
X |
|
X |
|
|
US |
Vereinigte Staaten von Amerika |
US-0 |
Gesamtes Hoheitsgebiet |
C |
X |
X |
X |
X |
X |
X |
X |
X |
X |
X |
|
|
UY |
Uruguay |
UY-0 |
Gesamtes Hoheitsgebiet |
D |
X |
X |
X |
X |
X |
X |
X |
X |
|
X |
|
|
ZA |
Südafrika |
ZA-0 |
Gesamtes Hoheitsgebiet |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
ZA-1 |
Stadtgebiet von Kapstadt (Details siehe Kasten 4) |
F |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
Entscheidung 2008/698/EG der Kommission |
||
LEGENDE ZU ANHANG I:
|
Tier/Erzeugnis |
Kategorien/Bedingungen |
|
RP |
Registrierte Pferde im Sinne von Artikel 2 Buchstabe c der vorliegenden Verordnung. |
|
SE |
Schlachtequiden im Sinne von Artikel 2 Buchstabe d der Richtlinie 2009/156/EG. |
|
RE |
Registrierte Equiden im Sinne von Artikel 2 Buchstabe c der Richtlinie 2009/156/EG. |
|
ZNE |
Zucht- und Nutzequiden im Sinne von Artikel 2 Buchstabe e der Richtlinie 2009/156/EG. |
|
SPERMA |
Equidensperma, nach Maßgabe von Artikel 17 Absatz 2 Buchstabe b Ziffer ii der Richtlinie 92/65/EWG gewonnen. |
|
EI/EM |
Equideneizellen und -embryonen, nach Maßgabe von Artikel 17 Absatz 2 Buchstabe b Ziffer ii der Richtlinie 92/65/EWG entnommen oder erzeugt. |
|
Spalten |
Information/Beschreibung der Ware |
Erforderliche Gesundheitsbescheinigung |
|
1-4 |
Gebietsabgrenzung |
entfällt |
|
5 |
Statusgruppe |
entfällt |
|
6 |
Zeitweilige Zulassung registrierter Pferde |
Anhang II Teil 1 Abschnitt A |
|
7 |
Wiedereinfuhr registrierter Pferde nach vorübergehender Ausfuhr für Rennen, Turniere und kulturelle Veranstaltungen |
Anhang II Teil 2 Abschnitt A Anhang II Teil 2 Abschnitt B Kapitel 1 Anhang II Teil 2 Abschnitt B Kapitel 2 |
|
8 |
Einfuhr registrierter Pferde |
Anhang II Teil 3 Abschnitt A |
|
9 |
Einfuhr von Schlachtequiden |
Anhang II Teil 3 Abschnitt B |
|
10 |
Einfuhr von registrierten Equiden sowie Zucht- und Nutzequiden |
Anhang II Teil 3 Abschnitt A |
|
11 |
Einfuhr von Sperma registrierter Pferde |
Anhang III Teil 1 Abschnitt A Anhang III Teil 1 Abschnitt B Anhang III Teil 1 Abschnitt C Anhang III Teil 1 Abschnitt D |
|
12 |
Einfuhr von Sperma registrierter Equiden |
Anhang III Teil 1 Abschnitt A Anhang III Teil 1 Abschnitt B Anhang III Teil 1 Abschnitt C Anhang III Teil 1 Abschnitt D |
|
13 |
Einfuhr von Sperma von Zucht- und Nutzequiden |
Anhang III Teil 1 Abschnitt A Anhang III Teil 1 Abschnitt B Anhang III Teil 1 Abschnitt C Anhang III Teil 1 Abschnitt D |
|
14 |
Einfuhr von Equideneizellen und -embryonen |
Anhang III Teil 2 Abschnitt A Anhang III Teil 2 Abschnitt B |
|
15 |
Equiden auf der Durchfuhr |
Anhang II Teil 1 Abschnitt B |
|
16 |
Verweis auf besondere Bedingungen/zusätzliche Garantien |
entfällt |
Felder
|
X |
Eingang erlaubt |
|
— |
Eingang verboten |
Statusgruppen
|
Statusgruppe |
Besondere Tiergesundheitsgarantien, die für den Eingang von Equiden in die Union erforderlich sind |
|
A |
Ansteckende Blutarmut der Einhufer, Equine Virale Arteritis |
|
B |
Ansteckende Blutarmut der Einhufer, Equine Virale Arteritis, Rotz, Beschälseuche |
|
C |
Ansteckende Blutarmut der Einhufer, Equine Virale Arteritis, Östliche und Westliche Pferdeenzephalomyelitis, Stomatitis vesicularis |
|
D |
Ansteckende Blutarmut der Einhufer, Equine Virale Arteritis, Rotz, Beschälseuche, Östliche und Westliche Pferdeenzephalomyelitis, Venezolanische Pferdeenzephalomyelitis, Stomatitis vesicularis |
|
E |
Ansteckende Blutarmut der Einhufer, Equine Virale Arteritis, Rotz, Beschälseuche, Afrikanische Pferdepest |
|
F |
Ansteckende Blutarmut der Einhufer, Beschälseuche, Afrikanische Pferdepest |
|
G |
Ansteckende Blutarmut der Einhufer, Equine Virale Arteritis, Rotz, Beschälseuche, Japanische Enzephalitis |
|
KASTEN 1 |
||||||||||||||||||||||||||||||||||||
|
CN |
China |
CN-1 |
Die spezifische von Equidenkrankheiten freie Zone in der Provinz Guangdong mit folgender Abgrenzung:
|
|||||||||||||||||||||||||||||||||
|
CN |
China |
CN-2 |
Abgrenzung der Zone in der Großstadtregion Shanghai:
|
|||||||||||||||||||||||||||||||||
|
KASTEN 2 |
|||||||
|
EG |
Ägypten |
EG-1 |
Von Equidenkrankheiten freie Zone (EDFZ) von etwa 0,1 km2 rund um die Tierklinik der Ägyptischen Streitkräfte an der El-Nasr Road, gegenüber dem Al Ahly Club, am östlichen Stadtrand von Kairo (geografische Koordinaten: 30°04′19,6″N 31°21′16,5″E) und der 10 km lange Abschnitt der El-Nasr Road und der Airport Road zum Cairo International Airport.
|
||||
|
KASTEN 3 |
|||||||||||||||||||||
|
SA |
Saudi-Arabien |
SA-1 |
Zugelassene Quarantänestationen:
|
||||||||||||||||||
|
|
|
SA-2 |
Abgrenzung der gemäß Artikel 5 Absatz 2 Unterabsatz 2 Buchstaben a und b der Richtlinie 2009/156/EG eingerichteten Schutz- und Überwachungs-/Kontrollzonen:
|
||||||||||||||||||
|
KASTEN 4 |
|||||||||||||||||
|
ZA |
Südafrika |
ZA-1 |
Zugelassene Quarantänestationen:
|
||||||||||||||
(1) Unbeschadet besonderer Bescheinigungsvorschriften gemäß dem Beschluss 2002/309/EG, Euratom des Rates und der Kommission.
(2) Falls eine amtliche Regionalisierung gemäß Artikel 13 Absatz 2 Buchstabe a der Richtlinie 2009/156/EG festgelegt ist.
(3) Im Folgenden wird darunter das Gebiet des Staates Israel mit Ausnahme der seit Juni 1967 unter israelischer Verwaltung stehenden Gebiete (namentlich die Golanhöhen, der Gazastreifen, Ostjerusalem und das restliche Westjordanland) verstanden.
(4) Ehemalige jugoslawische Republik Mazedonien — die endgültige Benennung dieses Landes wird nach Abschluss der laufenden Verhandlungen innerhalb der Vereinten Nationen festgelegt.
(5) Unbeschadet besonderer Bescheinigungsvorschriften gemäß Artikel 17 des Abkommen über den Europäischen Wirtschaftsraum (ABl. L 1 vom 3.1.1994, S. 3).
(6) Ohne das Kosovo im Sinne der Resolution 1244 des VN-Sicherheitsrates vom 10. Juni 1999.
ANHANG II
MUSTERGESUNDHEITSBESCHEINIGUNGEN UND MUSTERERKLÄRUNGEN FÜR DEN EINGANG VON LEBENDEN EQUIDEN IN DIE UNION
TEIL 1
Zeitweilige Zulassung und Durchfuhr
Abschnitt A
Muster der Gesundheitsbescheinigung und der Erklärung für die zeitweilige Zulassung registrierter Pferde in die Union für einen Zeitraum von weniger als 90 Tagen
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
Abschnitt B
Muster der Gesundheitsbescheinigung und der Erklärung für die Durchfuhr von lebenden Equiden durch die Union aus einem Drittland oder einem Teil des Hoheitsgebiets eines Drittlands in ein anderes Drittland oder einen anderen Teil des Hoheitsgebiets desselben Drittlands
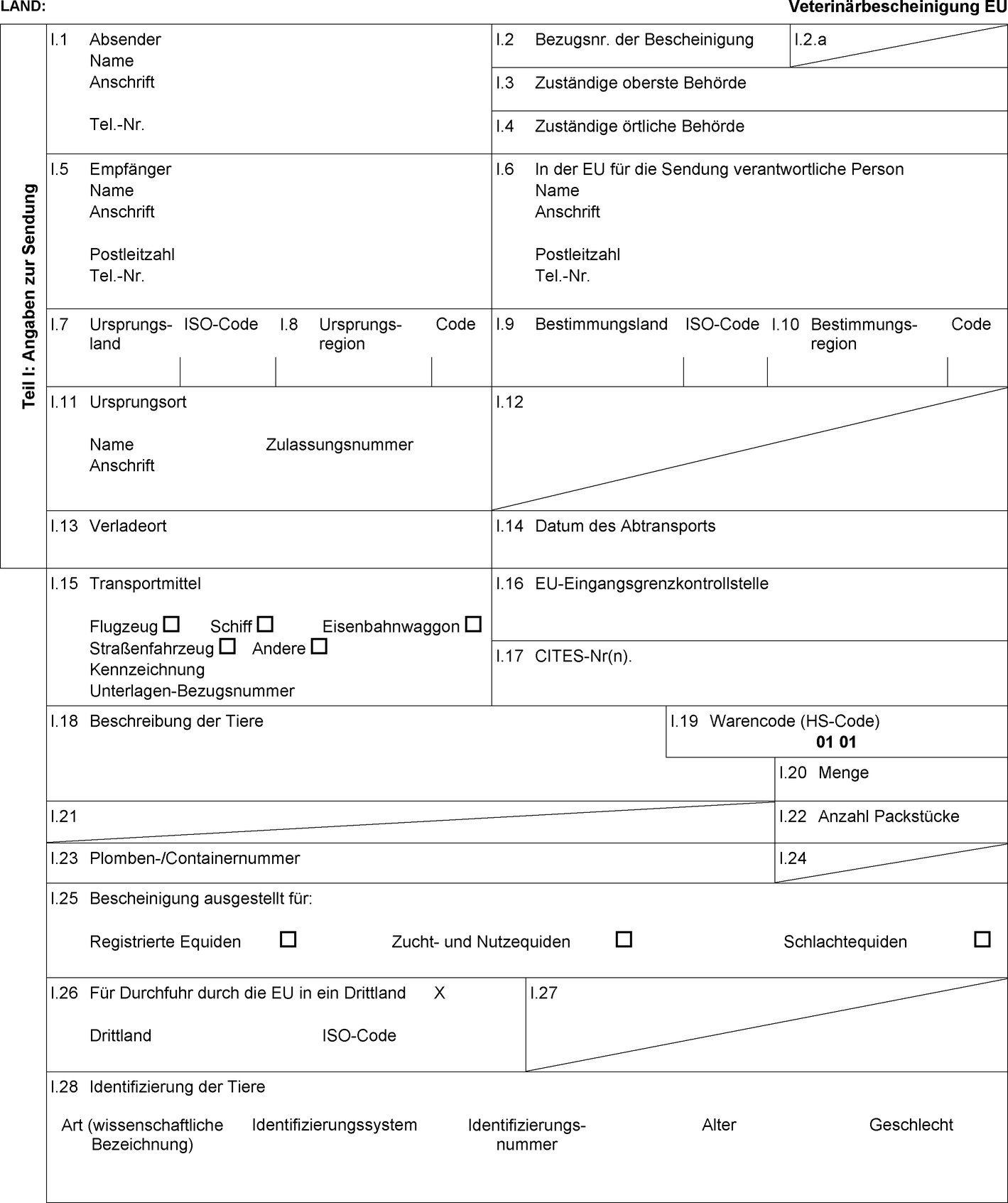 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
TEIL 2
Wiedereinfuhr nach vorübergehender Ausfuhr
Abschnitt A
Muster der Gesundheitsbescheinigung und der Erklärung für die Wiedereinfuhr registrierter Pferde in die Union nach vorübergehender Ausfuhr für weniger als 30 Tage für Rennen, Turniere und kulturelle Veranstaltungen
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
Abschnitt B
Muster der Gesundheitsbescheinigungen und der Erklärungen für die Wiedereinfuhr registrierter Pferde in die Union nach vorübergehender Ausfuhr für bestimmte Turniere oder Rennen
Muster der Gesundheitsbescheinigung und der Erklärung für die Wiedereinfuhr registrierter Turnierpferde in die Union nach vorübergehender Ausfuhr für weniger als 90 Tage zur Teilnahme an unter der Schirmherrschaft der Internationalen Reiterlichen Vereinigung veranstalteten Pferdesportveranstaltungen
(Probeveranstaltung in Vorbereitung auf die Olympischen Spiele, Olympische Spiele, Paralympische Spiele, Weltreiterspiele, Asienspiele, Amerikaspiele, Endurance World Cup in den Vereinigten Arabischen Emiraten)
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
Muster der Gesundheitsbescheinigung und der Erklärung für die Wiedereinfuhr in die Union von registrierten Rennpferden nach vorübergehender Ausfuhr für weniger als 90 Tage zur Teilnahme an bestimmten Rennveranstaltungen in Australien, Kanada, den Vereinigten Staaten von Amerika, Hongkong, Japan, Singapur, den Vereinigten Arabischen Emiraten oder Katar
(Internationale Gruppen-/Klassenrennen, Japan Cup, Melbourne Cup, Racing World Cup in Dubai, Hongkong International Races)
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
TEIL 3
Einfuhr
Abschnitt A
Muster der Gesundheitsbescheinigungen und der Erklärung für die Einfuhr in die Union eines einzelnen registrierten Pferdes, eines registrierten Equiden oder eines Zucht- und Nutzequiden
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
Abschnitt B
Muster der Gesundheitsbescheinigung und der Erklärung für die Einfuhr von Sendungen von Hausequiden zur Schlachtung in die Union
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
TEIL 4
Erläuterungen zu der Bescheinigung
 Text von Bild
Text von Bild
ANHANG III
MUSTERGESUNDHEITSBESCHEINIGUNGEN FÜR DEN EINGANG VON EQUIDENSPERMA, -EIZELLEN UND -EMBRYONEN IN DIE UNION
TEIL 1
Mustergesundheitsbescheinigung für die Einfuhr von Sperma
Abschnitt A
MUSTER 1 — Mustergesundheitsbescheinigung für die Einfuhr von Sendungen mit Sperma von Equiden, das nach dem 30. September 2014 gemäß der Richtlinie 92/65/EWG entnommen und von einer zugelassenen Besamungsstation versendet wurde, aus der das Sperma stammt
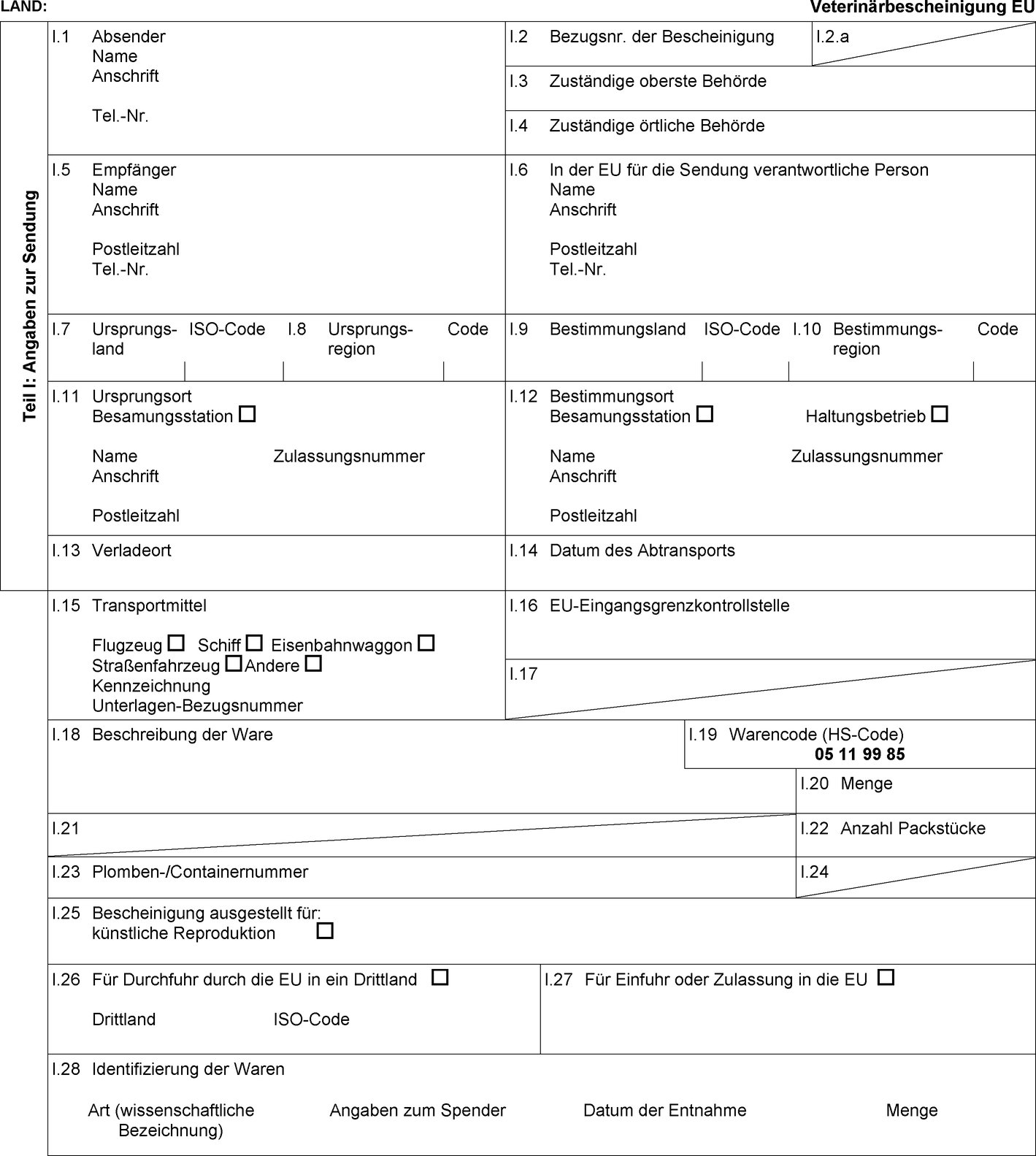 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
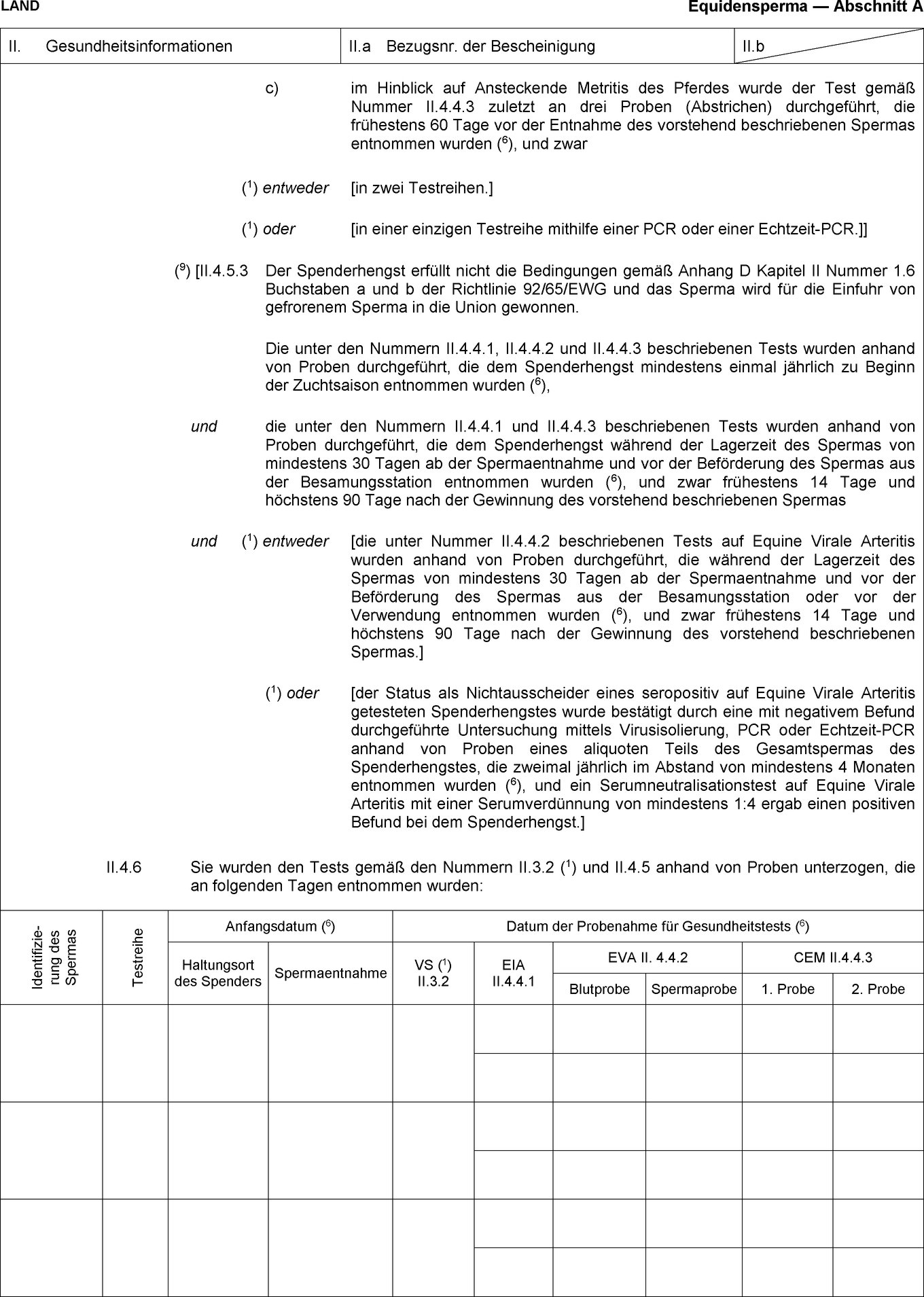 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
Abschnitt B
MUSTER 2 — Mustergesundheitsbescheinigung für die Einfuhr von Sendungen mit Beständen von Equidensperma, das nach dem 31. August 2010 und vor dem 1. Oktober 2014 gemäß der Richtlinie 92/65/EWG entnommen, aufbereitet und gelagert und nach dem 31. August 2010 von einer zugelassenen Besamungsstation versendet wurde, aus der das Sperma stammt
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
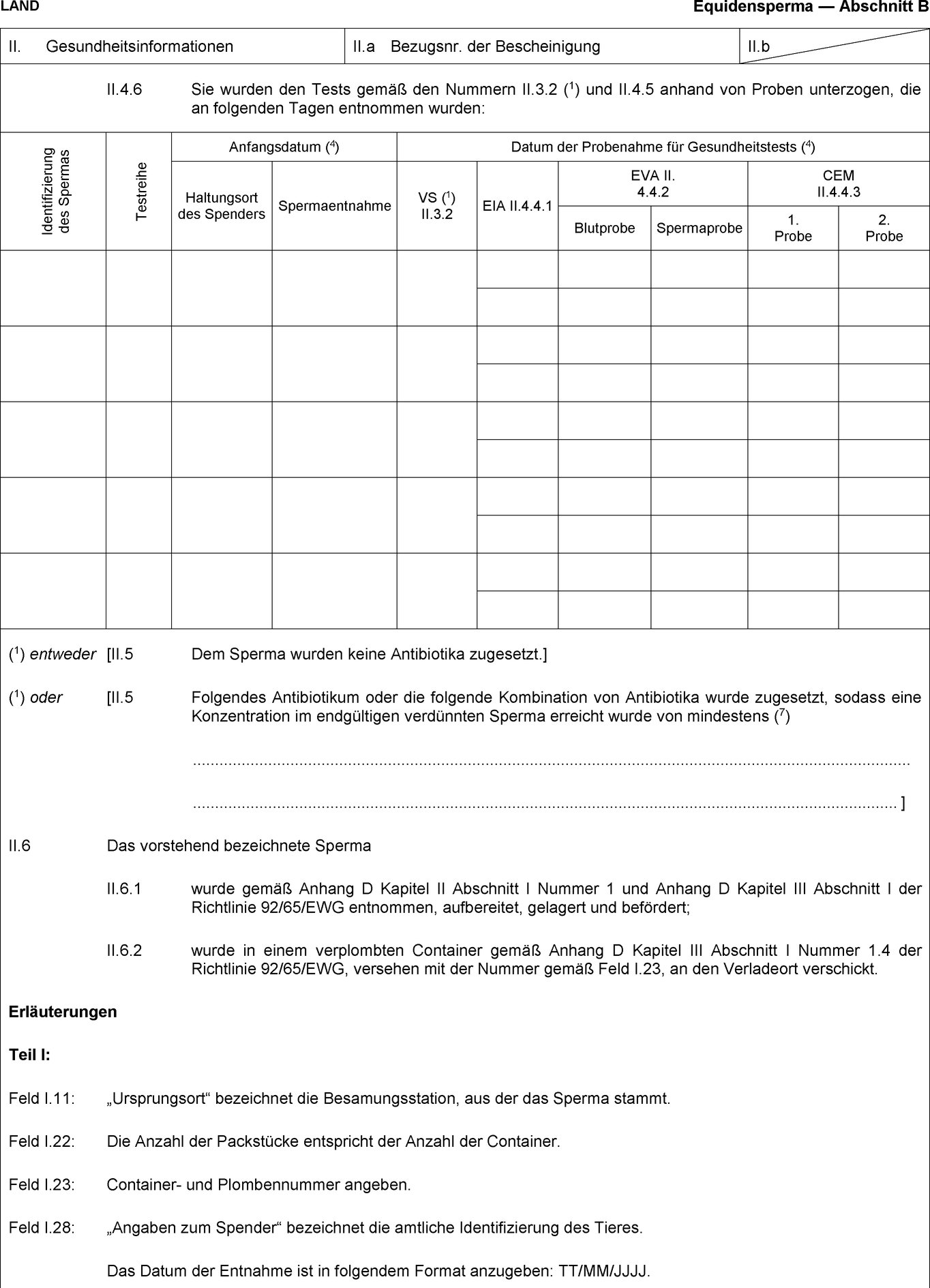 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
Abschnitt C
MUSTER 3 — Mustergesundheitsbescheinigung für die Einfuhr von Sendungen mit Beständen von Equidensperma, das vor dem 1. September 2010 gemäß der Richtlinie 92/65/EWG entnommen, aufbereitet und gelagert und nach dem 31. August 2010 von einer zugelassenen Besamungsstation versendet wurde, aus der das Sperma stammt
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
Abschnitt D
MUSTER 4 — Mustergesundheitsbescheinigung für die Einfuhr von Sendungen mit Equidensperma, das gemäß der Richtlinie 92/65/EWG nach dem 30. September 2014 entnommen, aufbereitet und gelagert wurde, sowie von Sendungen mit Beständen von Equidensperma, das gemäß der Richtlinie 92/65/EWG nach dem 31. August 2010 und vor dem 1. Oktober 2014 oder vor dem 1. September 2010 entnommen, aufbereitet und gelagert und nach dem 31. August 2010 aus einem zugelassenen Samendepot versendet wurde
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
TEIL 2
Mustergesundheitsbescheinigung für die Einfuhr von Eizellen und Embryonen
Abschnitt A
MUSTER 1 — Mustergesundheitsbescheinigung für die Einfuhr von Sendungen mit Eizellen und Embryonen von Equiden, die gemäß der Richtlinie 92/65/EWG nach dem 30. September 2014 entnommen oder erzeugt und von einer zugelassenen Embryo-Entnahmeeinheit oder Embryo-Erzeugungseinheit versendet wurden, aus der die Eizellen oder Embryonen stammen
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
Abschnitt B
MUSTER 2 — Mustergesundheitsbescheinigung für die Einfuhr von Sendungen mit Beständen von Equiden-Eizellen und -Embryonen, die nach dem 31. August 2010 und vor dem 1. Oktober 2014 gemäß der Richtlinie 92/65/EWG entnommen, aufbereitet und gelagert und nach dem 31. August 2010 von einer zugelassenen Embryo-Entnahmeeinheit oder Embryo-Erzeugungseinheit versendet wurden, aus der die Eizellen oder Embryonen stammen
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
 Text von Bild
Text von Bild
TEIL 3
Erläuterungen zu der Bescheinigung
 Text von Bild
Text von Bild
ANHANG IV
KATEGORIEN MÄNNLICHER EQUIDEN, AUF DIE DIE BEDINGUNGEN GEMÄẞ ARTIKEL 15 BUCHSTABE b ZIFFER ii DER RICHTLINIE 2009/156/EG BEZÜGLICH DER EQUINEN VIRALEN ARTERITIS ANZUWENDEN SIND
|
1. |
Die Anforderung bezüglich der Equinen Viralen Arteritis gemäß Artikel 15 Buchstabe b Ziffer ii der Richtlinie 2009/156/EG gilt für unkastrierte männliche Equiden mit Ausnahme von
|
|
2. |
Der Test muss unter amtstierärztlicher Aufsicht durchgeführt und bescheinigt und das Ergebnis und die Impfung müssen unter amtstierärztlicher Aufsicht bescheinigt werden. Die Impfung ist gemäß den Herstellerangaben in regelmäßigen Abständen zu wiederholen. Die Chargennummern des zugelassenen Impfstoffs, genaue Angaben zur Impfung und Auffrischungsimpfung und die Ergebnisse der serologischen Tests und der Erreger-Identifizierungstests sind — falls vorhanden im Identifizierungsdokument (Pass) — zu dokumentieren und müssen zu Bescheinigungszwecken zur Verfügung stehen. |
|
3. |
Testpaarung gemäß Artikel 12.9.2 Nummer 4 Buchstabe a des Gesundheitskodex für Landtiere der Weltorganisation für Tiergesundheit (OIE) gilt als gleichwertig zu dem Virusisolationstest gemäß Nummer 1 Buchstabe a Ziffer i, um das Nichtvorhandensein des Virus der Equinen Viralen Arteritis im Sperma nachzuweisen. |
ANHANG V
MUSTERERKLÄRUNGEN
TEIL 1
Erklärung des Flugkapitäns/der Flugkapitänin des Flugzeugs
 Text von Bild
Text von Bild
TEIL 2
Erklärung des Schiffskapitäns/der Schiffskapitänin
 Text von Bild
Text von Bild
TEIL 3
Muster eines Manifests für die Umladung
 Text von Bild
Text von Bild
|
30.4.2018 |
DE |
Amtsblatt der Europäischen Union |
L 110/122 |
DURCHFÜHRUNGSVERORDNUNG (EU) 2018/660 DER KOMMISSION
vom 26. April 2018
zur Erneuerung der Genehmigung des Wirkstoffs Bentazon gemäß der Verordnung (EG) Nr. 1107/2009 des Europäischen Parlaments und des Rates über das Inverkehrbringen von Pflanzenschutzmitteln und zur Änderung des Anhangs der Durchführungsverordnung (EU) Nr. 540/2011 der Kommission
(Text von Bedeutung für den EWR)
DIE EUROPÄISCHE KOMMISSION —
gestützt auf den Vertrag über die Arbeitsweise der Europäischen Union,
gestützt auf die Verordnung (EG) Nr. 1107/2009 des Europäischen Parlaments und des Rates vom 21. Oktober 2009 über das Inverkehrbringen von Pflanzenschutzmitteln und zur Aufhebung der Richtlinien 79/117/EWG und 91/414/EWG des Rates (1), insbesondere auf Artikel 20 Absatz 1,
in Erwägung nachstehender Gründe:
|
(1) |
Mit der Richtlinie 2000/68/EG der Kommission (2) wurde der Wirkstoff Bentazon in Anhang I der Richtlinie 91/414/EWG des Rates (3) aufgenommen. |
|
(2) |
In Anhang I der Richtlinie 91/414/EWG aufgenommene Wirkstoffe gelten als gemäß der Verordnung (EG) Nr. 1107/2009 genehmigt und sind in Teil A des Anhangs der Durchführungsverordnung (EU) Nr. 540/2011 der Kommission (4) aufgeführt. |
|
(3) |
Die Genehmigung des Wirkstoffs Bentazon gemäß Teil A des Anhangs der Durchführungsverordnung (EU) Nr. 540/2011 der Kommission läuft am 30. Juni 2018 aus. |
|
(4) |
Es wurde ein Antrag auf erneute Aufnahme von Bentazon in Anhang I der Richtlinie 91/414/EWG des Rates gemäß Artikel 4 der Verordnung (EU) Nr. 1141/2010 der Kommission (5) innerhalb der in diesem Artikel festgesetzten Frist gestellt. |
|
(5) |
Die Antragsteller haben die gemäß Artikel 9 der Verordnung (EU) Nr. 1141/2010 erforderlichen ergänzenden Unterlagen vorgelegt. Der Bericht erstattende Mitgliedstaat hat den Antrag für vollständig befunden. |
|
(6) |
Der Bericht erstattende Mitgliedstaat hat in Absprache mit dem mitberichterstattenden Mitgliedstaat einen Bewertungsbericht im Hinblick auf die Erneuerung erstellt und ihn am 8. Januar 2014 der Europäischen Behörde für Lebensmittelsicherheit (im Folgenden die „Behörde“) und der Kommission vorgelegt. |
|
(7) |
Die Behörde hat den Bewertungsbericht im Hinblick auf die erneute Aufnahme den Antragstellern und den Mitgliedstaaten zur Stellungnahme vorgelegt und die eingegangenen Stellungnahmen an die Kommission weitergeleitet. Sie hat außerdem die Kurzfassung der ergänzenden Unterlagen der Öffentlichkeit zugänglich gemacht. |
|
(8) |
Am 20. April 2015 hat die Behörde der Kommission ihre Schlussfolgerung (6) dazu übermittelt, ob angenommen werden kann, dass Bentazon die Genehmigungskriterien gemäß Artikel 4 der Verordnung (EG) Nr. 1107/2009 erfüllt. Die Kommission hat am 8. Oktober 2015 dem Ständigen Ausschuss für Pflanzen, Tiere, Lebensmittel und Futtermittel den Entwurf des Überprüfungsberichts für Bentazon vorgelegt. |
|
(9) |
Die Antragsteller erhielten Gelegenheit, zu diesem Entwurf des Überprüfungsberichts Stellung zu nehmen. |
|
(10) |
In Bezug auf einen oder mehrere repräsentative Verwendungszwecke mindestens eines Pflanzenschutzmittels, das Bentazon enthält, wurde festgestellt, dass die Genehmigungskriterien gemäß Artikel 4 der Verordnung (EG) Nr. 1107/2009 erfüllt sind. Die Genehmigung für Bentazon sollte daher erneuert werden. |
|
(11) |
Dennoch haben mehrere Mitgliedstaaten im Rahmen ihrer nationalen Grundwasserüberwachungsprogramme Bentazon im Grundwasser festgestellt, und die EFSA gab an, dass für bestimmte Verwendungszwecke und bei empfindlichen Böden eine Grundwasserverschmutzung nicht ausgeschlossen werden kann. |
|
(12) |
Angesichts der Ergebnisse nationaler Grundwasserüberwachungsprogramme sowie im Hinblick auf die notwendige Gewährleistung eines Sicherheits- und Schutzniveaus, das mit dem hohen Schutzniveau übereinstimmt, das innerhalb der Union erreicht werden soll, ist es angemessen, die Erneuerung der Genehmigung von Bentazon für einen Zeitraum von sieben Jahren festzulegen, wodurch eine vorrangige Neubewertung von Bentazon gegenüber anderen Wirkstoffen sichergestellt ist, sodass auch die aktualisierten Ergebnisse der nationalen Grundwasserüberwachungsprogramme berücksichtigt werden können. |
|
(13) |
Die Risikobewertung zur Erneuerung der Genehmigung von Bentazon stützt sich auf eine begrenzte Zahl repräsentativer Verwendungszwecke, wodurch jedoch nicht die Verwendungszwecke beschränkt werden, für bentazonhaltige Pflanzenschutzmittel zugelassen werden dürfen. Die Beschränkung auf Anwendungen als Herbizid sollte daher aufgehoben werden. |
|
(14) |
Gemäß Artikel 14 Absatz 1 der Verordnung (EG) Nr. 1107/2009 in Verbindung mit deren Artikel 6 und angesichts des derzeitigen wissenschaftlichen und technischen Kenntnisstands sind jedoch bestimmte Auflagen und Einschränkungen notwendig. Es ist insbesondere angezeigt, zusätzliche bestätigende Informationen anzufordern. |
|
(15) |
Der Anhang der Durchführungsverordnung (EU) Nr. 540/2011 sollte entsprechend geändert werden. |
|
(16) |
Mit der Durchführungsverordnung (EU) 2017/841 der Kommission (7) wurde die Laufzeit der Genehmigung von Bentazon bis zum 30. Juni 2018 verlängert, damit der Erneuerungsprozess vor dem Auslaufen der Genehmigung des Wirkstoffs abgeschlossen werden kann. Da jedoch bereits vor Ablauf dieser Laufzeit ein Beschluss über die Erneuerung getroffen wurde, sollte die vorliegende Verordnung ab dem 1. Juni 2018 gelten. |
|
(17) |
Die in der vorliegenden Verordnung vorgesehenen Maßnahmen entsprechen der Stellungnahme des Ständigen Ausschusses für Pflanzen, Tiere, Lebensmittel und Futtermittel — |
HAT FOLGENDE VERORDNUNG ERLASSEN:
Artikel 1
Erneuerung der Genehmigung des Wirkstoffs
Die Genehmigung des Wirkstoffs Bentazon wird gemäß Anhang I erneuert.
Artikel 2
Änderung der Durchführungsverordnung (EU) Nr. 540/2011
Der Anhang der Durchführungsverordnung (EU) Nr. 540/2011 wird gemäß Anhang II der vorliegenden Verordnung geändert.
Artikel 3
Inkrafttreten und Geltungsbeginn
Diese Verordnung tritt am zwanzigsten Tag nach ihrer Veröffentlichung im Amtsblatt der Europäischen Union in Kraft.
Sie gilt ab dem 1. Juni 2018.
Diese Verordnung ist in allen ihren Teilen verbindlich und gilt unmittelbar in jedem Mitgliedstaat.
Brüssel, den 26. April 2018
Für die Kommission
Der Präsident
Jean-Claude JUNCKER
(1) ABl. L 309 vom 24.11.2009, S. 1.
(2) Richtlinie 2000/68/EG der Kommission vom 23. Oktober 2000 zur Aufnahme des Wirkstoffs Bentazon in Anhang I der Richtlinie 91/414/EWG des Rates über das Inverkehrbringen von Pflanzenschutzmitteln (ABl. L 276 vom 28.10.2000, S. 41).
(3) Richtlinie 91/414/EWG des Rates vom 15. Juli 1991 über das Inverkehrbringen von Pflanzenschutzmitteln (ABl. L 230 vom 19.8.1991, S. 1).
(4) Durchführungsverordnung (EU) Nr. 540/2011 der Kommission vom 25. Mai 2011 zur Durchführung der Verordnung (EG) Nr. 1107/2009 des Europäischen Parlaments und des Rates hinsichtlich der Liste zugelassener Wirkstoffe (ABl. L 153 vom 11.6.2011, S. 1).
(5) Verordnung (EU) Nr. 1141/2010 der Kommission vom 7. Dezember 2010 zur Festlegung des Verfahrens für die erneute Aufnahme einer zweiten Gruppe von Wirkstoffen in Anhang I der Richtlinie 91/414/EWG des Rates und zur Erstellung der Liste dieser Wirkstoffe (ABl. L 322 vom 8.12.2010, S. 10).
(6) EFSA Journal 2015;13(4):4077, 153 S. doi:10.2903/j.efsa.2015.4077.
(7) Durchführungsverordnung (EU) 2017/841 der Kommission vom 17. Mai 2017 zur Änderung der Durchführungsverordnung (EU) Nr. 540/2011 hinsichtlich der Verlängerung der Laufzeit der Genehmigung für die Wirkstoffe Alpha-Cypermethrin, Ampelomyces quisqualis Stamm: AQ 10, Benalaxyl, Bentazon, Bifenazat, Bromoxynil, Carfentrazon-ethyl, Chlorpropham, Cyazofamid, Desmedipham, Diquat, DPX KE 459 (Flupyrsulfuron-methyl), Etoxazol, Famoxadon, Fenamidon, Flumioxazin, Foramsulfuron, Gliocladium catenulatum Stamm: J1446, Imazamox, Imazosulfuron, Isoxaflutol, Laminarin, Metalaxyl-M, Methoxyfenozid, Milbemectin, Oxasulfuron, Pendimethalin, Phenmedipham, Pymetrozin, S-Metolachlor und Trifloxystrobin (ABl. L 125 vom 18.5.2017, S. 12).
ANHANG I
|
Gebräuchliche Bezeichnung, Kennnummern |
IUPAC-Bezeichnung |
Reinheit (1) |
Datum der Genehmigung |
Befristung der Genehmigung |
Besondere Bestimmungen |
||||||||
|
Bentazon CAS-Nr. 25057-89-0 CIPAC-Nr. 366 |
3-Isopropyl-1H-2,1,3-benzothiadiazin-4(3H)-on-2,2-dioxid |
≥ 960 g/kg 1,2-Dichlorethan < 3 mg/kg |
1. Juni 2018 |
31. Mai 2025 |
Bei der Anwendung der einheitlichen Grundsätze gemäß Artikel 29 Absatz 6 der Verordnung (EG) Nr. 1107/2009 sind die Schlussfolgerungen des Überprüfungsberichts über Bentazon und insbesondere dessen Anlagen I und II zu berücksichtigen. Bei ihrer Gesamtbewertung achten die Mitgliedstaaten insbesondere auf Folgendes:
Die Anwendungsbedingungen umfassen gegebenenfalls Maßnahmen zur Risikobegrenzung. Der Antragsteller übermittelt der Kommission, den Mitgliedstaaten und der Behörde bis 1. Februar 2019 bestätigende Informationen bezüglich Tests der Stufen 2/3 zur Untersuchung potenzieller endokrin vermittelter Wirkungsweisen von Bentazon, wie sie gegenwärtig das Rahmenkonzept („Conceptual Framework“) der OECD vorsieht. |
(1) Weitere Einzelheiten hinsichtlich der Identität und Spezifikation des Wirkstoffs sind dem Beurteilungsbericht zu entnehmen.
ANHANG II
Der Anhang der Durchführungsverordnung (EU) Nr. 540/2011 wird wie folgt geändert:
|
(1) |
In Teil A wird Eintrag Nr. 11 zu Bentazon gestrichen. |
|
(2) |
In Teil B wird folgender Eintrag eingefügt:
|
(1) Weitere Einzelheiten hinsichtlich der Identität und Spezifikation des Wirkstoffs sind dem Beurteilungsbericht zu entnehmen.
BESCHLÜSSE
|
30.4.2018 |
DE |
Amtsblatt der Europäischen Union |
L 110/127 |
DURCHFÜHRUNGSBESCHLUSS (EU) 2018/661 DER KOMMISSION
vom 26. April 2018
zur Änderung des Durchführungsbeschlusses (EU) 2015/750 zur Harmonisierung des Frequenzbands 1 452-1 492 MHz für terrestrische Systeme, die elektronische Kommunikationsdienste in der Union erbringen können, im Hinblick auf seine Ausweitung auf die harmonisierten Frequenzbänder 1 427-1 452 MHz und 1 492-1 517 MHz
(Bekannt gegeben unter Aktenzeichen C(2018) 2286)
(Text von Bedeutung für den EWR)
DIE EUROPÄISCHE KOMMISSION —
gestützt auf den Vertrag über die Arbeitsweise der Europäischen Union,
gestützt auf die Entscheidung Nr. 676/2002/EG des Europäischen Parlaments und des Rates vom 7. März 2002 über einen Rechtsrahmen für die Funkfrequenzpolitik in der Europäischen Gemeinschaft (Frequenzentscheidung) (1), insbesondere auf Artikel 4 Absatz 3,
in Erwägung nachstehender Gründe:
|
(1) |
Durch den Beschluss Nr. 243/2012/EU des Europäischen Parlaments und des Rates (2) wurde ein Mehrjahresprogramm für die Funkfrequenzpolitik (RSPP) aufgestellt; es enthält das Ziel, bis 2015 auf der Grundlage der Bestandsaufnahme der Frequenznutzung mindestens 1 200 MHz (einschließlich bereits genutzter Frequenzen) an für drahtlose Breitbanddienste geeigneten Frequenzen in der Union bereitzustellen. |
|
(2) |
In ihrer Stellungnahme (3) vom 20. Februar 2013 zu den strategischen Herausforderungen, vor denen Europa angesichts der steigenden Nachfrage nach Frequenzen für drahtlose Breitbanddienste steht, empfahl die Gruppe für Frequenzpolitik (RSPG) zu prüfen, ob das Frequenzband 1 427-1 452 MHz nach 2015 für die drahtlose Breitbandnutzung als Erweiterung des Frequenzbands 1 452-1 492 MHz zugewiesen werden sollte. Ferner betonte die Gruppe für Frequenzpolitik in ihrer Stellungnahme die Probleme bei einer möglichen Zuweisung der Frequenzbänder 1 427-1 452 MHz und 1 492-1 518 MHz für drahtlose Breitbanddienste, die durch die bestehende militärische Nutzung und durch ortsfeste terrestrische drahtlose Dienste verursacht werden. Sie schlug sodann vor, das Frequenzband 1 492-1 518 MHz in Abhängigkeit vom Ausgang der Weltfunkkonferenz 2015 (WRC-15) weiterhin in Betracht zu ziehen. |
|
(3) |
Auf der WRC-15 wurden die Frequenzbänder 1 427-1 452 MHz und 1 492-1 518 MHz weltweit für den Mobilfunk nach der Norm International Mobile Telecommunications (IMT) ausgewiesen. In der Region 1 der Internationalen Fernmeldeunion (ITU), zu der die Europäische Union gehört, sind diese Frequenzbänder oder Teile davon auf gemeinsamer primärer Basis für den Mobilfunkdienst (mit Ausnahme des mobilen Flugfunkdienstes) und den festen Funkdienst sowie für den Weltraumfernwirkfunkdienst Erde-Weltraum zugewiesen worden. Darüber hinaus haben einige Mitgliedstaaten das Frequenzband 1 452-1 518 MHz für die Programmproduktion und Sonderveranstaltungen (Programme Making and Special Events, PMSE) zugewiesen. |
|
(4) |
Am 15. März 2017 erteilte die Kommission der Europäischen Konferenz der Verwaltungen für Post und Telekommunikation (CEPT) gemäß Artikel 4 Absatz 2 der Frequenzentscheidung ein Mandat zur Ausarbeitung harmonisierter technischer Bedingungen für zusätzliche Frequenzbänder im Frequenzbereich von 1,5 GHz, nämlich für die Frequenzbänder 1 427-1 452 MHz und 1 492-1 518 MHz, um deren Nutzung für terrestrische drahtlose breitbandige elektronische Kommunikationsdienste in der Union zu fördern. |
|
(5) |
Am 16. November 2017 legte die CEPT aufgrund dieses Mandats ihren Bericht 65 (4) vor, in dem sie harmonisierte technische Bedingungen für den Nur-Downlink-Betrieb drahtloser breitbandiger elektronischer Kommunikationsdienste in den Frequenzbändern 1 427-1 452 MHz und 1 492-1 517 MHz unter Berücksichtigung dessen vorschlägt, dass das Frequenzband 1 452-1 492 MHz gemäß dem Durchführungsbeschluss (EU) 2015/750 der Kommission (5) bereits unionsweit unter harmonisierten technischen Bedingungen für terrestrische Systeme, die elektronische Kommunikationsdienste erbringen können, zugewiesen ist. |
|
(6) |
Eine unionsweite Zuweisung der Frequenzbänder 1 427-1 452 MHz und 1 492-1 517 MHz für den Nur-Downlink-Betrieb drahtloser breitbandiger elektronischer Kommunikationsdienste dürfte durch das Hinzufügen von 50 MHz an zusätzlichen Frequenzen zur Erreichung des im Programm für die Funkfrequenzpolitik (RSPP) vorgesehenen Frequenzziels beitragen. Eine Nur-Downlink-Nutzung ist wichtig für die Bewältigung der Asymmetrie des Datenverkehrs, denn sie erhöht die Downlink-Kapazitäten drahtloser Breitbandsysteme — auch für die Bereitstellung von 5G-Diensten. |
|
(7) |
Im Einklang mit den Empfehlungen des CEPT-Berichts 65 sollte den Mitgliedstaaten eine gewisse nationale Flexibilität eingeräumt werden, damit sie Teile der Frequenzbänder 1 427-1 452 MHz und 1 492-1 517 MHz nutzen können, um internationalen Militärabkommen (6) nachzukommen oder — zeitlich begrenzt — einem besonderen nationalen Bedarf für den weiteren Betrieb ortsfester terrestrischer drahtloser Dienste Rechnung zu tragen. In dieser Hinsicht wird in dem Bericht betont, dass eine gemeinsame Nutzung der Frequenzen durch Mobilfunkdienste und ortsfeste Funkdienste nicht möglich ist. Der Prozess der Neuordnung dieser Frequenzbänder auf nationaler Ebene, um sie entsprechend der nationalen Nachfrage nach Nur-Downlink-Frequenzen für drahtlose breitbandige elektronische Kommunikationsdienste zur Verfügung zu stellen, ist folglich ein komplexer Prozess, der einen angemessenen Zeitrahmen braucht. |
|
(8) |
Bei der Ausübung der nationalen Flexibilität sollten die Mitgliedstaaten bevorzugt auf die Verfügbarkeit aneinander angrenzender Frequenzen für den Nur-Downlink-Betrieb drahtloser breitbandiger elektronischer Kommunikationsdienste — auch im Frequenzband 1 452-1 492 MHz — achten, um größere Kanalbandbreiten für 5G-Dienste, Größenvorteile bei Geräten/Ausrüstungen, die Koexistenz mit Diensten in benachbarten Frequenzbändern und die Frequenzkoordinierung zu erleichtern. |
|
(9) |
Unbeschadet ihres Rechts, die Frequenznutzung gemäß Artikel 1 Absatz 4 der Frequenzentscheidung für die Zwecke der öffentlichen Ordnung und Sicherheit und der Verteidigung zu organisieren, sollten die Mitgliedstaaten die Frequenzbänder 1 427-1 452 MHz und 1 492-1 517 MHz soweit möglich für den Nur-Downlink-Betrieb drahtloser breitbandiger elektronischer Kommunikationsdienste zuweisen. |
|
(10) |
Der Nur-Downlink-Betrieb drahtloser breitbandiger elektronischer Kommunikationsdienste sollte im gesamten Frequenzband 1 427-1 517 MHz auf der Grundlage einer einheitlich harmonisierten Kanalanordnung und minimaler (d. h. möglichst wenig einschränkender) gemeinsamer technischer Bedingungen erfolgen, um den Binnenmarkt zu fördern, schädliche funktechnische Störungen zu mindern und die Frequenzkoordinierung sicherzustellen. |
|
(11) |
Die im CEPT-Bericht 65 vorgesehenen technischen Bedingungen und Regelungen sehen auch die Koexistenz drahtloser Breitbanddienste mit Diensten in benachbarten Frequenzbändern vor. |
|
(12) |
Insbesondere die technischen Bedingungen und Regelungen, wie z. B. Leistungsgrenzwerte für unerwünschte Aussendungen, gewährleisten bei der drahtlosen Breitbandnutzung im Frequenzband 1 427-1 517 MHz einen angemessenen Schutz von Funkastronomiediensten und passiven Satelliten-Erkundungsdiensten im Frequenzband 1 400-1 427 MHz und von Satellitenmobilfunkdiensten im Frequenzband 1 518-1 559 MHz. Weitere Maßnahmen können auf nationaler Ebene erforderlich sein, um die Koexistenz mit Funkdiensten in den benachbarten Frequenzbändern 1 400-1 427 MHz und 1 518-1 559 MHz zu verbessern, z. B. in der Umgebung von Flughäfen, Seehäfen und Bodenstationen, die für den Empfang von per Satellit weitergeleiteten Such- und Rettungssignalen genutzt werden. Darüber hinaus sind im Einklang mit den Zielen und Anforderungen der Richtlinie 2014/53/EU des Europäischen Parlaments und des Rates (7) Verbesserungen bei der Empfangsleistung von Mobilfunk-Bodenstationen erforderlich. |
|
(13) |
Angesichts der mangelnden Nutzung von Teilen des Frequenzbands 1 452-1 492 MHz für terrestrische Rundfunksysteme sollten die bestehenden regulatorischen Beschränkungen in Bezug auf die Koexistenz mit diesen Diensten in diesem Band aufgehoben werden, um den Nur-Downlink-Betrieb drahtloser breitbandiger elektronischer Kommunikationsdienste zu ermöglichen. |
|
(14) |
Damit die in diesem Beschluss festgelegten Parameter umgesetzt werden können und der Nur-Downlink-Betrieb drahtloser breitbandiger elektronischer Kommunikationsdienste in den Frequenzbändern 1 427-1 452 MHz und 1 492-1 517 MHz erweitert werden kann, könnte es erforderlich sein, grenzüberschreitende Frequenzkoordinierungsvereinbarungen zwischen Verwaltungen zu schließen, um schädliche funktechnische Störungen zu vermeiden und die Effizienz der Frequenznutzung zu erhöhen. Grenzüberschreitende Frequenzkoordinierungsvereinbarungen in Bezug auf aeronautische Telemetrie-Dienste sollten zwischen den betreffenden CEPT-Verwaltungen auf bilateraler oder multilateraler Basis getroffen werden. |
|
(15) |
Die Mitgliedstaaten sollten sich bei der Durchführung dieses Beschlusses von dem obersten Ziel leiten lassen, die volle Nutzung des gesamten Frequenzbands 1 427–1 517 MHz — oder bei mangelnder nationaler Nachfrage dessen teilweise Nutzung — für den Nur-Downlink-Betrieb drahtloser breitbandiger elektronischer Kommunikationsdienste zu ermöglichen, um so weit wie möglich zur Erreichung des im RSPP vorgesehenen Frequenzziels beizutragen. |
|
(16) |
Die Mitgliedstaaten sollten der Kommission über die Durchführung dieses Beschlusses und die Nutzung des Frequenzbands Bericht erstatten, um eine Beurteilung seiner Auswirkungen auf Unionsebene sowie nötigenfalls eine rechtzeitige Überprüfung dieses Beschlusses zu erleichtern. Insbesondere die Begründungen für die Ausübung der nationalen Flexibilität bei der Bereitstellung von Frequenzen im Frequenzband 1 427-1 452 MHz oder im Frequenzband 1 492-1 517 MHz sollten alle zwei Jahre geprüft werden. Darüber hinaus sollten die Mitgliedstaaten alle zwei Jahre über ihre nationalen Maßnahmen zur Verbesserung der Koexistenz mit den Funkastronomiediensten und passiven Satelliten-Erkundungsdiensten im Frequenzband 1 400-1 427 MHz und den Satellitenmobilfunkdiensten im Frequenzband 1 518-1 559 MHz berichten. |
|
(17) |
Die in diesem Beschluss vorgesehenen Maßnahmen entsprechen der Stellungnahme des Funkfrequenzausschusses — |
HAT FOLGENDEN BESCHLUSS ERLASSEN:
Artikel 1
Der Durchführungsbeschluss (EU) 2015/750 wird wie folgt geändert:
|
(1) |
Der Titel erhält folgende Fassung: „Durchführungsbeschluss der Kommission (EU) 2015/750 vom 8. Mai 2015 zur Harmonisierung des Frequenzbands 1 427-1 517 MHz für terrestrische Systeme, die elektronische Kommunikationsdienste in der Union erbringen können“. |
|
(2) |
Artikel 1 erhält folgende Fassung: „Artikel 1 Dieser Beschluss dient der Harmonisierung der Bedingungen für die Verfügbarkeit und die effiziente Nutzung des Frequenzbands 1 427-1 517 MHz für terrestrische Systeme, die elektronische Kommunikationsdienste in der Union erbringen können.“ |
|
(3) |
Artikel 2 Absatz 2 erhält folgende Fassung: „(2) Spätestens zum 1. Oktober 2018 sorgen die Mitgliedstaaten in Übereinstimmung mit den Parametern im Anhang für die nicht ausschließliche Zuweisung und Bereitstellung der Frequenzbänder 1 427-1 452 MHz und 1 492-1 517 MHz oder eines Teils davon für terrestrische Systeme, die drahtlose breitbandige elektronische Kommunikationsdienste erbringen können.“ |
|
(4) |
Artikel 2 Absatz 3 erhält folgende Fassung: „(3) Wenn sie gemäß Absatz 2 nur einen Teil des Frequenzbands 1 427-1 452 MHz oder des Frequenzbands 1 492-1 517 MHz zuweisen und bereitstellen,
|
|
(5) |
Dem Artikel 2 wird folgender Absatz 4 angefügt: „(4) Die Mitgliedstaaten stellen sicher, dass die in diesem Artikel genannten terrestrischen Systeme einen angemessenen Schutz der Systeme in benachbarten Frequenzbändern gewährleisten.“ |
|
(6) |
Dem Artikel 2 wird folgender Absatz 5 angefügt: „(5) Die Mitgliedstaaten fördern grenzübergreifende Koordinierungsvereinbarungen, um unter Berücksichtigung bestehender Regulierungsverfahren und Rechte sowie einschlägiger internationaler Vereinbarungen den Betrieb der in den Absätzen 1, 2 und 3 genannten Systeme zu ermöglichen.“ |
|
(7) |
Der folgende Artikel 2a wird eingefügt: „Artikel 2a Die Mitgliedstaaten überprüfen alle zwei Jahre die Anwendung des Artikels 2, um eine größtmögliche Verfügbarkeit des Frequenzbands 1 427-1 517 MHz für drahtlose breitbandige elektronische Kommunikationsdienste zu gewährleisten.“ |
|
(8) |
Artikel 4 erhält folgende Fassung: „Artikel 4 Die Mitgliedstaaten beobachten die Nutzung des Frequenzbands 1 427-1 517 MHz und berichten der Kommission auf Anfrage oder auf eigene Initiative über ihre Erkenntnisse, um nötigenfalls eine rechtzeitige Überprüfung dieses Beschlusses zu ermöglichen.“ |
|
(9) |
Der folgende Artikel 4a wird eingefügt: „Artikel 4a Die Mitgliedstaaten berichten der Kommission spätestens am 1. November 2018 über die Anwendung dieses Beschlusses und insbesondere über den Umfang der Verfügbarkeit der Frequenzbänder 1 427-1 452 MHz und 1 492-1 517 MHz.“ |
|
(10) |
Der Anhang des Durchführungsbeschlusses (EU) 2015/750 erhält die Fassung des Anhangs des vorliegenden Beschlusses. |
Artikel 2
Dieser Beschluss ist an die Mitgliedstaaten gerichtet.
Brüssel, den 26. April 2018
Für die Kommission
Mariya GABRIEL
Mitglied der Kommission
(1) ABl. L 108 vom 24.4.2002, S. 1.
(2) Beschluss Nr. 243/2012/EU des Europäischen Parlaments und des Rates vom 14. März 2012 über ein Mehrjahresprogramm für die Funkfrequenzpolitik (ABl. L 81 vom 21.3.2012, S. 7).
(3) Dok. RSPG 13-521 Rev. 1 final.
(4) CEPT-Bericht 65, angenommen am 17. November 2017, berichtigt am 2. März 2018.
(5) Durchführungsbeschluss der Kommission (EU) 2015/750 vom 8. Mai 2015 zur Harmonisierung des Frequenzbands 1 452-1 492 MHz für terrestrische Systeme, die elektronische Kommunikationsdienste in der Union erbringen können (ABl. L 119 vom 12.5.2015, S. 27).
(6) Die Frequenzbänder 1 427-1 452 MHz und 1 492-1 518 MHz werden nach der 2014 geschlossenen NATO-Vereinbarung über die gemeinsame zivile und militärische Nutzung von Frequenzen (NFJA) für Systeme der Land- und Seestreitkräfte genutzt. In Nummer 14 der Vereinbarung heißt es dazu: „(…) Wenn die Nutzung von Funkfrequenzbändern von der NATO und den NATO-Mitgliedern für militärische Zwecke harmonisiert wurde, schließt dies eine Nutzung für zivile Anwendungen nicht aus.“
(7) Richtlinie 2014/53/EU des Europäischen Parlaments und des Rates vom 16. April 2014 über die Harmonisierung der Rechtsvorschriften der Mitgliedstaaten über die Bereitstellung von Funkanlagen auf dem Markt und zur Aufhebung der Richtlinie 1999/5/EG (ABl. L 153 vom 22.5.2014, S. 62).
ANHANG
ANHANG
PARAMETER GEMÄẞ ARTIKEL 2 ABSATZ 1 UND ARTIKEL 2 ABSATZ 2
A. ALLGEMEINE PARAMETER
|
1. |
Der Betriebsmodus im Frequenzband 1 427-1 517 MHz ist auf Aussendungen der Basisstation (‚nur Downlink‘) beschränkt. |
|
2. |
Blockgrößen im Frequenzband 1 427-1 517 MHz werden in Vielfachen von 5 MHz zugeteilt. Die untere Frequenzgrenze eines zugeteilten Blocks wird ausgerichtet an dem oder hat den Abstand eines Vielfachen von 5 MHz von dem unteren Bandrand von 1 427 MHz. |
|
3. |
Die Aussendungen der Basisstation müssen den in diesem Anhang festgelegten technischen Bedingungen (Frequenzblock-Entkopplungsmasken) entsprechen. |
B. TECHNISCHE BEDINGUNGEN FÜR BASISSTATIONEN — FREQUENZBLOCK-ENTKOPPLUNGSMASKE
Die folgenden technischen Parameter für Basisstationen werden als Frequenzblock-Entkopplungsmaske (Block Edge Mask, BEM) bezeichnet und verwendet, um die Koexistenz benachbarter Netze bei Fehlen bilateraler oder multilateraler Vereinbarungen zwischen den Betreibern solcher benachbarten Netze zu gewährleisten. Weniger strenge Parameter können angewandt werden, sofern sie zwischen den betreffenden Betreibern oder Verwaltungen vereinbart worden sind und soweit diese Parameter die für den Schutz anderer Dienste oder Anwendungen auch in benachbarten Frequenzbändern oder aufgrund grenzübergreifender Verpflichtungen geltenden technischen Bedingungen erfüllen.
Die BEM ist eine Sendefrequenzmaske, die frequenzabhängig und auf den Rand eines Frequenzblocks bezogen ist, für den einem Betreiber entsprechende Nutzungsrechte erteilt wurden. Sie besteht aus blockinternen und Außerblock-Leistungsgrenzwerten. Der blockinterne Leistungsgrenzwert gilt für einen Block, der einem Betreiber gehört. Die Außerblock-Leistungsgrenzwerte gelten für Frequenzen, die für WBB-ECS innerhalb des Frequenzbands 1 427-1 517 MHz genutzt werden und außerhalb von Blöcken liegen, die einem Betreiber zugeteilt sind. Sie sind in Tabelle 2 angegeben. Die Außerband-Leistungsgrenzwerte gelten für Frequenzen, die außerhalb des Teils des Frequenzbands 1 427-1 517 MHz liegen, der auf nationaler Ebene für WBB-ECS genutzt wird.
Darüber hinaus werden Koexistenz-Leistungsgrenzen für drahtlose breitbandige elektronische Kommunikationsdienste (wireless broadband electronic communications services, WBB-ECS) im Frequenzband 1 427-1 517 MHz festgelegt, um die Kompatibilität zwischen diesen Diensten und anderen Funkdiensten oder -anwendungen zu gewährleisten, auch wenn ein Teil des Frequenzbands 1 427-1 452 MHz und das Frequenzband 1 492-1 517 MHz nicht für WBB-ECS zugewiesen ist. Die Koexistenz-Leistungsgrenzwerte in Bezug auf Dienste oder Anwendungen in den benachbarten Frequenzbändern (d. h. außerhalb der für WBB-ECS genutzten Frequenzen) sind in den Tabellen 3, 4 und 5 angegeben und decken auch die nationale Flexibilität bei der Zuteilung von Frequenzen für WBB-ECS im Frequenzband 1 427-1 517 MHz gemäß diesem Beschluss ab.
Um die Koexistenz mit Diensten und Anwendungen in den benachbarten Bändern zu gewährleisten, können auf nationaler Ebene zusätzliche technische Maßnahmen oder Verfahrensmaßnahmen (1) oder beides Anwendung finden.
Anforderungen für blockinterne Aussendungen
Für Basisstationen wird für die blockinterne äquivalente isotrope Strahlungsleistung (EIRP) kein Grenzwert verbindlich vorgeschrieben, außer für den Frequenzblock 1 512-1 517 MHz, für den ein solcher Grenzwert in Tabelle 1 angegeben ist. Für andere Frequenzblöcke als den Frequenzblock 1 512-1 517 MHz können die Mitgliedstaaten einen EIRP-Grenzwert von höchstens 68 dBm/5 MHz festsetzen, der für bestimmte Anwendungsfälle angehoben werden kann, z. B. für die aggregierte Frequenznutzung im Frequenzband 1 427-1 512 MHz und für Frequenzen in niedrigeren Frequenzbändern.
Tabelle 1
Maximale blockinterne EIRP pro Zelle (2) für WBB-ECS-Basisstationen im Frequenzband 1 512 -1 517 MHz
|
Frequenzblock |
Maximale blockinterne EIRP |
Messbandbreite |
|
1 512 -1 517 MHz |
58 dBm |
5 MHz |
Erläuterung zu Tabelle 1
Diese Anforderungen sollen die Kompatibilität zwischen WBB-ECS, die im Frequenzblock 1 512-1 517 MHz betrieben werden, und Satellitenmobilfunkdiensten, die im Frequenzband 1 518-1 525 MHz betrieben werden, gewährleisten.
Anforderungen für Außerblockaussendungen
Tabelle 2
BEM für Außerblock-EIRP-Grenzwerte pro Antenne für Basisstationen im Frequenzband 1 427 -1 517 MHz
|
Frequenzbereich Außerblockaussendungen |
Maximale mittlere Außerblock-EIRP |
Messbandbreite |
|
– 10 bis – 5 MHz vom unteren Blockrand |
11 dBm |
5 MHz |
|
– 5 bis 0 MHz vom unteren Blockrand |
16,3 dBm |
5 MHz |
|
0 bis + 5 MHz vom oberen Blockrand |
16,3 dBm |
5 MHz |
|
+ 5 bis + 10 MHz vom oberen Blockrand |
11 dBm |
5 MHz |
|
Frequenzen mit einem Abstand von mehr als 10 MHz vom unteren oder oberen Blockrand im Frequenzband 1 427 -1 517 MHz |
9 dBm |
5 MHz |
Koexistenzanforderungen für benachbarte Frequenzbänder
Tabelle 3
Leistungsgrenzwerte für unerwünschte Aussendungen im Frequenzband 1 400 -1 427 MHz für Basisstationen, die im Frequenzband 1 427 -1 452 MHz betrieben werden
|
Frequenzbereich Außerbandaussendungen |
Maximale unerwünschte Sendeleistung (3) |
Messbandbreite |
|
1 400 -1 427 MHz |
– 72 dBm |
27 MHz |
Erläuterung zu Tabelle 3
Diese Anforderung soll den Schutz von Funkastronomiediensten und passiven Satelliten-Erkundungsdiensten im passiven Frequenzband 1 400-1 427 MHz vor WBB-ECS gewährleisten, die im Frequenzband 1 427-1 452 MHz betrieben werden, auch wenn nur ein Teil dieses Frequenzbands für WBB-ECS zugeteilt ist. Weitere nationale Maßnahmen können erforderlich sein, um Funkastronomie-Beobachtungsdienste im passiven Frequenzband 1 400-1 427 MHz besser vor WBB-ECS zu schützen.
Tabelle 4
Grenzwerte für die Außerband-EIRP pro Zelle (4) im Frequenzbereich 1 518 -1 559 MHz für Basisstationen, die im Frequenzband 1 492 -1 517 MHz betrieben werden
|
Frequenzbereich Außerbandaussendungen |
Maximale Außerband-EIRP |
Messbandbreite |
|
1 518 -1 520 MHz |
– 0,8 dBm |
1 MHz |
|
1 520 -1 559 MHz |
– 30 dBm |
1 MHz |
Erläuterung zu Tabelle 4
Diese Anforderungen sollen einen angemessenen Schutz von Satellitenmobilfunkdiensten, die im Frequenzband 1 518-1 559 MHz insbesondere in Seehäfen, Flughäfen und Such- und Rettungsbodenstationen des Satellitenmobilfunkdienstes betrieben werden, vor WBB-ECS gewährleisten, die im Frequenzband 1 492-1 517 MHz betrieben werden, auch wenn nur ein Teil dieses Frequenzbands für WBB-ECS zugeteilt ist. Weitere nationale Maßnahmen können erforderlich sein, um Satellitenmobilfunkdienste im Frequenzband 1 518-1 559 MHz besser zu schützen.
Tabelle 5
Grenzwerte für die Außerband-EIRP pro Zelle unter 1 452 MHz und über 1 492 MHz für Basisstationen, die im Frequenzband 1 452 -1 492 MHz betrieben werden
|
Frequenzbereich Außerbandaussendungen |
Maximale mittlere Außerband-EIRP |
Messbandbreite |
|
unter 1 449 MHz |
– 20 dBm |
1 MHz |
|
1 449 -1 452 MHz |
14 dBm |
3 MHz |
|
1 492 -1 495 MHz |
14 dBm |
3 MHz |
|
über 1 495 MHz |
– 20 dBm |
1 MHz |
Erläuterung zu Tabelle 5
Diese Anforderungen gelten, wenn unterhalb von 1 452 MHz und/oder oberhalb von 1 492 MHz keine WBB-ECS betrieben werden. Sie sollen die Kompatibilität von WBB-ECS im Frequenzband 1 452-1 492 MHz mit koordinierten ortsfesten Funkstrecken, Mobilfunkdiensten und aeronautischen Telemetriediensten, die auf Bodenstationen beschränkt sind, in benachbarten Frequenzbändern unter 1 452 MHz oder über 1 492 MHz gewährleisten.
Die in Tabelle 5 für Frequenzen unter 1 452 MHz angegebenen Grenzwerte gelten nicht, wenn WBB-ECS in den Blöcken unmittelbar unter 1 452 MHz betrieben werden. Die in Tabelle 5 für Frequenzen über 1 492 MHz angegebenen Grenzwerte gelten nicht, wenn WBB-ECS in den Blöcken unmittelbar über 1 492 MHz betrieben werden. Die in den Tabellen 3 und 4 festgelegten Außerband-Anforderungen und die in Tabelle 2 festgelegten Außerblock-Anforderungen bleiben hiervon unberührt.
(1) Beispielsweise eine oder mehrere der folgenden Möglichkeiten: Koordinierung der Frequenzplanung, Standortkoordinierung, strengere bandinterne Leistungsgrenzwerte für Basisstationen, strengere Außerband-Grenzwerte für die äquivalente isotrope Strahlungsleistung der Basisstationen als in Tabelle 5.
(2) An einem Standort mit mehreren Sektoren entspricht der Wert „pro Zelle“ dem eines der Sektoren.
(3) Unter unerwünschter Sendeleistung ist hier der am Antennenanschluss gemessene Leistungswert zu verstehen.
(4) An einem Standort mit mehreren Sektoren entspricht der Wert „pro Zelle“ dem eines der Sektoren.
|
30.4.2018 |
DE |
Amtsblatt der Europäischen Union |
L 110/134 |
DURCHFÜHRUNGSBESCHLUSS (EU) 2018/662 DER KOMMISSION
vom 27. April 2018
zur Benennung des Referenzlabors der Europäischen Union für die Aviäre Influenza und die Newcastle-Krankheit und zur Änderung des Anhangs VII der Richtlinie 2005/94/EG des Rates
(Bekannt gegeben unter Aktenzeichen C(2018) 2459)
(Text von Bedeutung für den EWR)
DIE EUROPÄISCHE KOMMISSION —
gestützt auf den Vertrag über die Arbeitsweise der Europäischen Union,
gestützt auf die Richtlinie 92/66/EWG des Rates vom 14. Juli 1992 mit Gemeinschaftsmaßnahmen zur Bekämpfung der Newcastle-Krankheit (1), insbesondere auf Artikel 15 Absatz 1,
gestützt auf die Richtlinie 2005/94/EG des Rates vom 20. Dezember 2005 mit Gemeinschaftsmaßnahmen zur Bekämpfung der Aviären Influenza und zur Aufhebung der Richtlinie 92/40/EWG (2), insbesondere auf Artikel 63 Absatz 2,
in Erwägung nachstehender Gründe:
|
(1) |
In der Richtlinie 92/66/EWG (*1) sind die Mindestbekämpfungsmaßnahmen festgelegt, die im Fall eines Ausbruchs der Newcastle-Krankheit bei Geflügel, Brieftauben und sonstigen in Gefangenschaft gehaltenen Vögeln ergriffen werden müssen. Artikel 15 dieser Richtlinie sieht die Benennung eines Referenzlabors der Europäischen Union für die Newcastle-Krankheit vor, das die in diesem Artikel genannten Befugnisse und Aufgaben wahrnehmen soll. |
|
(2) |
In der Richtlinie 2005/94/EG des Rates sind bestimmte Vorbeugungsmaßnahmen hinsichtlich der Überwachung und Früherkennung der Aviären Influenza sowie Mindestbekämpfungsmaßnahmen festgelegt, die bei Ausbruch der Aviären Influenza bei Geflügel oder anderen in Gefangenschaft gehaltenen Vögeln durchzuführen sind. Artikel 51 Absatz 1 dieser Richtlinie legt fest, dass das in Anhang VII Nummer 1 beschriebene Labor Referenzlabor der Europäischen Union für Aviäre Influenza ist und die in Anhang VII Nummer 2 festgelegten Funktionen und Aufgaben übernimmt. |
|
(3) |
Infolge der Mitteilung des Vereinigten Königreichs gemäß Artikel 50 des Vertrags über die Europäische Union müssen die Referenzlabore der Europäischen Union für die Aviäre Influenza und die Newcastle-Krankheit, die in den Richtlinien 92/66/EWG bzw. 2005/94/EG benannt sind, ihre Funktionen und Aufgaben als Referenzlabore der Europäischen Union für diese beiden Krankheiten aufgeben. |
|
(4) |
Da die Aviäre Influenza und die Newcastle-Krankheit einander hinsichtlich der Symptome, der Diagnoseverfahren sowie des erforderlichen Fachwissens und der erforderlichen Ausrüstung stark ähneln, ist es angezeigt, ein einziges Referenzlabor der Europäischen Union für beide Krankheiten zu benennen. |
|
(5) |
Um eine Unterbrechung der Tätigkeit des Referenzlabors der Europäischen Union für die Aviäre Influenza und die Newcastle-Krankheit zu vermeiden und dem neu benannten Referenzlabor ausreichend Zeit einzuräumen, um seine Arbeit in vollem Umfang aufzunehmen, sollten die in diesem Beschluss vorgesehenen Maßnahmen ab dem 1. Januar 2019 gelten. |
|
(6) |
Die Kommission hat in enger Zusammenarbeit mit den Mitgliedstaaten ein Verfahren zur Auswahl und Benennung des Referenzlabors der Europäischen Union für die Aviäre Influenza und die Newcastle-Krankheit durchgeführt, bei dem Kriterien der technischen und wissenschaftlichen Kompetenz des Labors und die Kompetenz seines Personals berücksichtigt wurden. |
|
(7) |
Das in dem Auswahlverfahren ausgewählte Labor, das Istituto Zooprofilattico Sperimentale delle Venezie (IZSVe), Legnaro, Italien, sollte mit Wirkung vom 1. Januar 2019 auf unbestimmte Zeit als Referenzlabor der Europäischen Union für die Aviäre Influenza und die Newcastle-Krankheit benannt werden. |
|
(8) |
Die in diesem Durchführungsbeschluss vorgesehenen Maßnahmen entsprechen der Stellungnahme des Ständigen Ausschusses für Pflanzen, Tiere, Lebensmittel und Futtermittel — |
HAT FOLGENDEN BESCHLUSS ERLASSEN:
Artikel 1
Das Istituto Zooprofilattico Sperimentale delle Venezie (IZSVe), Legnaro, Italien, wird auf unbestimmte Zeit als Referenzlabor der Europäischen Union für die Aviäre Influenza und die Newcastle-Krankheit benannt.
Artikel 2
Anhang VII Nummer 1 der Richtlinie 2005/94/EG erhält folgende Fassung:
|
„1. |
Folgendes Labor ist das Referenzlabor der Europäischen Union für Aviäre Influenza: Istituto Zooprofilattico Sperimentale delle Venezie (IZSVe), Legnaro, Italien.“ |
Artikel 3
Dieser Beschluss gilt ab dem 1. Januar 2019.
Artikel 4
Dieser Beschluss ist an die Mitgliedstaaten gerichtet.
Brüssel, den 27. April 2018
Für die Kommission
Vytenis ANDRIUKAITIS
Mitglied der Kommission
(1) ABl. L 260 vom 5.9.1992, S. 1.
(2) ABl. L 10 vom 14.1.2006, S. 16.
(*1) Die Richtlinie 92/66/EWG des Rates wird gegenwärtig an den AEUV und die Verordnung (EU) 2017/625 des Europäischen Parlaments und des Rates (ABl. L 95 vom 7.4.2017, S. 1) über amtliche Kontrollen angepasst.
|
30.4.2018 |
DE |
Amtsblatt der Europäischen Union |
L 110/136 |
DURCHFÜHRUNGSBESCHLUSS (EU) 2018/663 DER KOMMISSION
vom 27. April 2018
betreffend bestimmte vorläufige Maßnahmen zum Schutz vor der Afrikanischen Schweinepest in Ungarn
(Bekannt gegeben unter Aktenzeichen C(2018) 2690)
(Nur der ungarische Text ist verbindlich)
(Text von Bedeutung für den EWR)
DIE EUROPÄISCHE KOMMISSION —
gestützt auf den Vertrag über die Arbeitsweise der Europäischen Union,
gestützt auf die Richtlinie 89/662/EWG des Rates vom 11. Dezember 1989 zur Regelung der veterinärrechtlichen Kontrollen im innergemeinschaftlichen Handel im Hinblick auf den gemeinsamen Binnenmarkt (1), insbesondere auf Artikel 9 Absatz 3,
gestützt auf die Richtlinie 90/425/EWG des Rates vom 26. Juni 1990 zur Regelung der veterinärrechtlichen und tierzüchterischen Kontrollen im innergemeinschaftlichen Handel mit lebenden Tieren und Erzeugnissen im Hinblick auf den Binnenmarkt (2), insbesondere auf Artikel 10 Absatz 3,
in Erwägung nachstehender Gründe:
|
(1) |
Die Afrikanische Schweinepest ist eine ansteckende Viruserkrankung, die Haus- und Wildschweinpopulationen befällt; sie kann die Rentabilität der Schweinehaltung stark beeinträchtigen und damit zu Störungen im Handel innerhalb der Union sowie bei der Ausfuhr in Drittländer führen. |
|
(2) |
Bei einem Fall der Afrikanischen Schweinepest bei Wildschweinen besteht die Gefahr, dass der Erreger auf andere Wildschweinpopulationen und auf Schweinehaltungsbetriebe übergreift. In der Folge kann er über den Handel mit lebenden Schweinen oder aus ihnen gewonnenen Erzeugnissen aus einem Mitgliedstaat in andere Mitgliedstaaten und in Drittländer eingeschleppt werden. |
|
(3) |
Mit der Richtlinie 2002/60/EG des Rates (3) wurden die Mindestvorschriften der Union für die Bekämpfung der Afrikanischen Schweinepest festgelegt. Insbesondere müssen gemäß Artikel 15 der Richtlinie 2002/60/EG nach der Bestätigung eines Falls oder mehrerer Fälle der Afrikanischen Schweinepest bei Wildschweinen bestimmte Maßnahmen ergriffen werden. |
|
(4) |
Ungarn hat die Kommission über die derzeitige Lage hinsichtlich der Afrikanischen Schweinepest auf seinem Hoheitsgebiet unterrichtet und gemäß Artikel 15 der Richtlinie 2002/60/EG eine Reihe von Maßnahmen ergriffen, einschließlich der Abgrenzung eines Seuchengebiets, in dem die Maßnahmen gemäß Artikel 15 der genannten Richtlinie durchgeführt werden, um eine Ausbreitung dieser Seuche zu verhindern. |
|
(5) |
Um unnötige Störungen des Handels innerhalb der Union zu verhindern und von Drittländern auferlegte ungerechtfertigte Hemmnisse für den Handel zu vermeiden, muss das Seuchengebiet in Bezug auf die Afrikanische Schweinepest in Ungarn in Zusammenarbeit mit diesem Mitgliedstaat auf Unionsebene abgegrenzt werden. |
|
(6) |
Daher sollte bis zur Sitzung des Ständigen Ausschusses für Pflanzen, Tiere, Lebensmittel und Futtermittel das Seuchengebiet in Ungarn im Anhang dieses Beschlusses aufgeführt und die Dauer dieser Regionalisierung festgelegt werden. |
|
(7) |
Dieser Beschluss ist auf der nächsten Sitzung des Ständigen Ausschusses für Pflanzen, Tiere, Lebensmittel und Futtermittel zu überprüfen — |
HAT FOLGENDEN BESCHLUSS ERLASSEN:
Artikel 1
Ungarn stellt sicher, dass das von Ungarn abgegrenzte Seuchengebiet, in dem die Maßnahmen gemäß Artikel 15 der Richtlinie 2002/60/EG gelten, mindestens die im Anhang dieses Beschlusses aufgeführten Gebiete umfasst.
Artikel 2
Dieser Beschluss gilt bis zum 30. Juni 2018.
Artikel 3
Dieser Beschluss ist an Ungarn gerichtet.
Brüssel, den 27. April 2018
Für die Kommission
Vytenis ANDRIUKAITIS
Mitglied der Kommission
(1) ABl. L 395 vom 30.12.1989, S. 13.
(2) ABl. L 224 vom 18.8.1990, S. 29.
(3) Richtlinie 2002/60/EG des Rates vom 27. Juni 2002 zur Festlegung von besonderen Vorschriften für die Bekämpfung der Afrikanischen Schweinepest sowie zur Änderung der Richtlinie 92/119/EWG hinsichtlich der Teschener Krankheit und der Afrikanischen Schweinepest (ABl. L 192 vom 20.7.2002, S. 27).
ANHANG
|
Als Seuchengebiet in Ungarn gemäß Artikel 1 ausgewiesenes Gebiet |
Gültig bis |
|
Territory of the county of Heves located north of the motorway E 71 |
30. Juni 2018 |
|
30.4.2018 |
DE |
Amtsblatt der Europäischen Union |
L 110/139 |
BESCHLUSS (EU) 2018/664 DER PLENARSITZUNG DES EINHEITLICHEN ABWICKLUNGSAUSSCHUSSES
vom 23. März 2017
über die Entlastung für die Ausführung des Haushaltsplans und über den Rechnungsabschluss des einheitlichen Abwicklungsausschusses (SRB) für das Haushaltsjahr 2015 (SRB/PS/2017/02)
DIE PLENARSITZUNG DES EINHEITLICHEN ABWICKLUNGSAUSSCHUSSES —
gestützt auf Artikel 50 Absatz 1 Buchstabe b und Artikel 63 Absatz 8 der Verordnung (EU) Nr. 806/2014 des Europäischen Parlaments und des Rates vom 15. Juli 2014 zur Festlegung einheitlicher Vorschriften und eines einheitlichen Verfahrens für die Abwicklung von Kreditinstituten und bestimmten Wertpapierfirmen im Rahmen eines einheitlichen Abwicklungsmechanismus und eines einheitlichen Abwicklungsfonds sowie zur Änderung der Verordnung (EU) Nr. 1093/2010 (1),
gestützt auf die Artikel 103, 104 und 105 der Finanzregelung des einheitlichen Abwicklungsausschusses, wie durch Beschluss der Plenarsitzung vom 25. März 2015 (SRB/PS/2015/05) angenommen und durch Beschluss der Plenarsitzung vom 16. März 2016 (SRB/PS/2016/13) geändert,
gestützt auf den Beschluss der Plenarsitzung vom 6. Januar 2017 zur Festlegung des Verfahrens für die Plenarsitzung zur Entlastung des Vorsitzenden des einheitlichen Abwicklungsausschusses bezüglich der Ausführung des Haushaltsplans des Ausschusses (SRB/PS/2017/01),
gestützt auf die im Rahmen seiner Sitzung vom 28. Juni 2016 genehmigte endgültige Jahresrechnung des einheitlichen Abwicklungsausschusses für das Haushaltsjahr 2015,
gestützt auf den im Rahmen seiner Sitzung vom 28. Juni 2016 genehmigten Jährlichen Tätigkeitsbericht des einheitlichen Abwicklungsausschusses für das Haushaltsjahr 2015,
gestützt auf den Jahresbericht des Rechnungshofs, der die Erklärung über die Zuverlässigkeit der Rechnungsführung sowie die Rechtmäßigkeit und Ordnungsmäßigkeit der zugrunde liegenden Vorgänge und die Wirtschaftlichkeit der Haushaltsführung für das Haushaltsjahr 2015 enthält, zusammen mit den Antworten des einheitlichen Abwicklungsausschusses,
gestützt auf den gemäß Artikel 92 Absatz 4 der Verordnung (EU) Nr. 806/2014 erstellten Bericht des Rechnungshofs über alle Eventualverbindlichkeiten (für den einheitlichen Abwicklungsausschuss, den Rat, die Kommission oder sonstige), die daraus resultieren, dass der einheitliche Abwicklungsausschuss, der Rat und die Kommission ihre Aufgaben nach dieser Verordnung wahrnehmen, zusammen mit den Antworten des einheitlichen Abwicklungsausschusses, des Rates und der Kommission —
HAT BESCHLOSSEN:
|
1. |
der Vorsitzenden des einheitlichen Abwicklungsausschusses Entlastung für die Ausführung des Haushaltsplans des SRB für das Haushaltsjahr 2015 zu erteilen; |
|
2. |
den Rechnungsabschluss des einheitlichen Abwicklungsausschusses für das Haushaltsjahr 2015 zu genehmigen; |
|
3. |
seine Bemerkungen in nachstehendem Antrag niederzulegen; |
|
4. |
die Vorsitzende des einheitlichen Abwicklungsausschusses zu beauftragen, diesen Beschluss dem Rat, der Kommission und dem Rechnungshof zu übermitteln und seine Veröffentlichung im Amtsblatt der Europäischen Union und auf der Website des SRB zu veranlassen. |
Geschehen zu Brüssel am 23. März 2017.
Für die Plenarsitzung des Ausschusses
Mitglied der SRB-Plenarsitzung
Frank ELDERSON
(1) ABl. L 225 vom 30.7.2014, S. 1.
|
30.4.2018 |
DE |
Amtsblatt der Europäischen Union |
L 110/140 |
BESCHLUSS (EU) 2018/665 DER PLENARSITZUNG DES EINHEITLICHEN ABWICKLUNGSAUSSCHUSSES
vom 15. März 2018
über die Entlastung für die Ausführung des Haushaltsplans und über den Rechnungsabschluss des einheitlichen Abwicklungsausschusses (SRB) für das Haushaltsjahr 2016 (SRB/PS/2018/02)
DIE PLENARSITZUNG DES EINHEITLICHEN ABWICKLUNGSAUSSCHUSSES —
gestützt auf Artikel 50 Absatz 1 Buchstabe b und Artikel 63 Absatz 8 der Verordnung (EU) Nr. 806/2014 des Europäischen Parlaments und des Rates vom 15. Juli 2014 zur Festlegung einheitlicher Vorschriften und eines einheitlichen Verfahrens für die Abwicklung von Kreditinstituten und bestimmten Wertpapierfirmen im Rahmen eines einheitlichen Abwicklungsmechanismus und eines einheitlichen Abwicklungsfonds sowie zur Änderung der Verordnung (EU) Nr. 1093/2010 (1),
gestützt auf die Artikel 103, 104 und 105 der Finanzregelung des SRB,
gestützt auf die im Rahmen seiner Sitzung vom 22. Juni 2017 genehmigte endgültige Jahresrechnung des SRB für das Haushaltsjahr 2016,
gestützt auf den im Rahmen seiner Sitzung vom 22. Juni 2017 genehmigten Jährlichen Tätigkeitsbericht des SRB für das Haushaltsjahr 2016,
gestützt auf den Jahresbericht des Rechnungshofs, der die Erklärung über die Zuverlässigkeit der Rechnungsführung sowie die Rechtmäßigkeit und Ordnungsmäßigkeit der zugrunde liegenden Vorgänge und die Wirtschaftlichkeit der Haushaltsführung für das Haushaltsjahr 2016 enthält, zusammen mit den Antworten des SRB,
gestützt auf den gemäß Artikel 92 Absatz 4 der Verordnung (EU) Nr. 806/2014 erstellten Bericht des Rechnungshofs für das Haushaltsjahr 2016 über alle Eventualverbindlichkeiten (für den Ausschuss, den Rat, die Kommission oder sonstige), die daraus resultieren, dass der Ausschuss, der Rat und die Kommission ihre Aufgaben nach dieser Verordnung wahrnehmen, zusammen mit den Antworten des SRB, des Rates und der Kommission —
HAT BESCHLOSSEN:
|
1. |
der Vorsitzenden des SRB Entlastung für die Ausführung des Haushaltsplans des SRB für das Haushaltsjahr 2016 zu erteilen; |
|
2. |
den Rechnungsabschluss des SRB für das Haushaltsjahr 2016 zu genehmigen; |
|
3. |
seine Bemerkungen in nachstehendem Antrag niederzulegen; |
|
4. |
die Vorsitzende des einheitlichen Abwicklungsausschusses zu beauftragen, diesen Beschluss dem Rat, der Kommission und dem Rechnungshof zu übermitteln und seine Veröffentlichung im Amtsblatt der Europäischen Union und auf der Website des SRB zu veranlassen. |
Geschehen zu Brüssel am 15. März 2018.
Für die Plenarsitzung des Ausschusses
Mitglied der SRB-Plenarsitzung
Tuija TAOS
(1) ABl. L 225 vom 30.7.2014, S. 1.
Berichtigungen
|
30.4.2018 |
DE |
Amtsblatt der Europäischen Union |
L 110/141 |
Berichtigung der Richtlinie (EU) 2016/798 des Europäischen Parlaments und des Rates vom 11. Mai 2016 über Eisenbahnsicherheit
( Amtsblatt der Europäischen Union L 138 vom 26. Mai 2016 )
Seite 111, Artikel 3 Nummer 23:
Anstatt:
|
„23. |
‚Absender‘ ein Unternehmen, das Güter entweder für sich selbst oder für einen Dritten befördert;“ |
muss es heißen:
|
„23. |
‚Absender‘ ein Unternehmen, das Güter entweder für sich selbst oder für einen Dritten versendet;“ |