ISSN 1725-2539
doi:10.3000/17252539.L_2010.052.deu
Amtsblatt
der Europäischen Union
L 52

Ausgabe in deutscher Sprache
Rechtsvorschriften
53. Jahrgang
3. März 2010
|
ISSN 1725-2539 doi:10.3000/17252539.L_2010.052.deu |
||
|
Amtsblatt der Europäischen Union |
L 52 |
|

|
||
|
Ausgabe in deutscher Sprache |
Rechtsvorschriften |
53. Jahrgang |
|
|
|
|
|
(1) Text von Bedeutung für den EWR |
|
DE |
Bei Rechtsakten, deren Titel in magerer Schrift gedruckt sind, handelt es sich um Rechtsakte der laufenden Verwaltung im Bereich der Agrarpolitik, die normalerweise nur eine begrenzte Geltungsdauer haben. Rechtsakte, deren Titel in fetter Schrift gedruckt sind und denen ein Sternchen vorangestellt ist, sind sonstige Rechtsakte. |
II Rechtsakte ohne Gesetzescharakter
VERORDNUNGEN
|
3.3.2010 |
DE |
Amtsblatt der Europäischen Union |
L 52/1 |
VERORDNUNG (EU) Nr. 175/2010 DER KOMMISSION
vom 2. März 2010
zur Durchführung der Richtlinie 2006/88/EG des Rates hinsichtlich Maßnahmen zur Überwachung der erhöhten Mortalität bei Austern der Art Crassostrea gigas im Zusammenhang mit der Entdeckung des Ostreiden Herpesvirus 1 μvar (OsHV-1 μvar)
(Text von Bedeutung für den EWR)
DIE EUROPÄISCHE KOMMISSION —
gestützt auf den Vertrag über die Arbeitsweise der Europäischen Union,
gestützt auf die Richtlinie 2006/88/EG des Rates vom 24. Oktober 2006 mit Gesundheits- und Hygienevorschriften für Tiere in Aquakultur und Aquakulturerzeugnisse und zur Verhütung und Bekämpfung bestimmter Wassertierkrankheiten (1), insbesondere auf Artikel 41 Absatz 3 und Artikel 61 Absatz 3,
in Erwägung nachstehender Gründe:
|
(1) |
In der Richtlinie 2006/88/EG sind Tiergesundheitsvorschriften für das Inverkehrbringen von Tieren aus Aquakultur und ihrer Erzeugnisse festgelegt. Ferner umfasst sie Mindestpräventivmaßnahmen für den Fall des Verdachts auf bestimmte Wassertierkrankheiten oder des Ausbruchs einer Seuche. |
|
(2) |
Nach Artikel 41 der Richtlinie müssen die Mitgliedstaaten alle erforderlichen Vorkehrungen treffen, um neu auftretende Krankheiten unter Kontrolle zu bringen und die Übertragung von Erregern zu verhindern. Im Falle einer neu auftretenden Krankheit unterrichtet der betreffende Mitgliedstaat die Kommission, die anderen Mitgliedstaaten und die EFTA-Staaten unverzüglich davon, wenn die Untersuchungsergebnisse für andere Mitgliedstaaten von epidemiologischer Bedeutung sind. |
|
(3) |
In mehreren Gebieten in Frankreich und Irland wurde im Spätfrühling und Sommer 2008 eine erhöhte Mortalität bei Austern der Art Crassostrea gigas („Pazifische Auster“) festgestellt. Sie konnte auf eine Kombination von negativen Umweltfaktoren und dem Vorkommen von Bakterien der Gattung Vibrio und des Ostreiden Herpesvirus 1 (OsHV-1) einschließlich eines neu beschriebenen Genotyps dieses Virus, OsHV-1 μvar, zurückgeführt werden. |
|
(4) |
Die französischen Behörden informierten die Kommission, die Mitgliedstaaten und die EFTA-Staaten über diese Situation und über die im August 2008 getroffenen Maßnahmen. Im September 2008 wurde der Ständige Ausschuss für die Lebensmittelkette und Tiergesundheit mit dieser Angelegenheit befasst. |
|
(5) |
Im Frühjahr 2009 wurde in Frankreich, Irland und auf den Kanalinseln erneut eine erhöhte Mortalität festgestellt, die auf dieselbe Kombination von Faktoren zurückzuführen war. Die Ursache dieser Mortalität ist zwar nach wie vor ungeklärt, doch legen die 2009 in Irland und im Vereinigten Königreich durchgeführten epidemiologischen Untersuchungen nahe, dass das Virus OsHV-1 μvar dabei eine maßgebliche Rolle spielt. |
|
(6) |
Die zuständigen Behörden dieser Mitgliedstaaten und der Kanalinseln unterrichteten die Kommission über die Situation und die entsprechenden Maßnahmen und der Ständige Ausschuss für die Lebensmittelkette und Tiergesundheit wurde mehrmals mit dieser Angelegenheit befasst. |
|
(7) |
Die Sperrmaßnahmen, die die zuständigen Behörden dieser Mitgliedstaaten und der Kanalinseln zur Bekämpfung dieser neu auftretenden Krankheit getroffen haben, umfassten in erster Linie die Beschränkung der Verbringung Pazifischer Austern aus den Gebieten mit erhöhter Mortalität. |
|
(8) |
Da die neu auftretende Krankheit 2009 wieder auftrat und möglicherweise auch im Frühjahr und Sommer 2010 auftreten wird und eine weitere Ausbreitung drohen könnte, müssen aufgrund der Erfahrung die Maßnahmen der betroffenen Mitgliedstaaten verlängert werden. |
|
(9) |
Um einheitliche Bedingungen für die Durchführung der Richtlinie 2006/88/EG hinsichtlich neu auftretender Krankheiten zu gewährleisten und sicherzustellen, dass die Maßnahmen ausreichend Schutz vor einer weiteren Ausbreitung bieten, gleichzeitig jedoch der Verbringung Pazifischer Austern keine unnötigen Beschränkungen aufzuerlegen, sind die Maßnahmen in Bezug auf diese neu auftretende Krankheit auf Ebene der Europäischen Union zu koordinieren. |
|
(10) |
Werden die zuständigen Behörden über eine erhöhte Mortalität bei Pazifischen Austern unterrichtet, so sollten Proben genommen und Untersuchungen durchgeführt werden, um das Vorkommen von OsHV-1 μvar zu bestätigen oder auszuschließen. |
|
(11) |
Wird das Vorkommen des Genotyps OsHV-1 μvar des Virus bestätigt, so sollten die Mitgliedstaaten Seuchenbekämpfungsmaßnahmen einschließlich der Einrichtung eines Sperrgebiets treffen. Bei der Festlegung des Sperrgebiets sind bestimmte in dieser Verordnung festgelegte Faktoren zu berücksichtigen. Die Seuchenbekämpfungsmaßnahmen sollten aufrechterhalten werden, bis bei Kontrollen keine erhöhte Mortalität mehr festgestellt wird. |
|
(12) |
Die Verbringung Pazifischer Austern aus den Sperrgebieten sollte eingeschränkt werden, um die Gefahr der Ausbreitung der Krankheit zu mindern. Wo die Gefahr einer Verbreitung der Krankheit gering ist, sollten jedoch Ausnahmen vorgesehen werden. Diese Ausnahmen betreffen die Verbringung Pazifischer Austern, die für Zucht- oder Umsetzungsgebiete in einem anderen Sperrgebiet oder für den menschlichen Verzehr bestimmt sind. Um die Rückverfolgbarkeit von Sendungen von für Zucht- oder Umsetzungsgebiete bestimmten Pazifischen Austern sicherzustellen, sollten sie von einer Tiergesundheitsbescheinigung begleitet werden. Beim Ausfüllen der Bescheinigung sind die Erläuterungen in Anhang V der Verordnung (EG) Nr. 1251/2008 der Kommission vom 12. Dezember 2008 zur Durchführung der Richtlinie 2006/88/EG des Rates hinsichtlich der Bedingungen und Bescheinigungsvorschriften für das Inverkehrbringen und die Einfuhr in die Gemeinschaft von Tieren in Aquakultur und Aquakulturerzeugnissen sowie zur Festlegung einer Liste von Überträgerarten (2) zu berücksichtigen. |
|
(13) |
Um weitere Erkenntnisse zur Verbreitung dieser neu auftretenden Krankheit in der Union und insbesondere in noch nicht betroffenen Mitgliedstaaten und Kompartimenten zu gewinnen und um zu gewährleisten, dass das Vorkommen von OsHV-1 μvar möglichst frühzeitig erkannt wird, können die Mitgliedstaaten Programme zur gezielten Probenahme und Untersuchung im Hinblick auf die frühzeitige Entdeckung von OsHV-1 μvar einrichten. Für Pazifische Austern, die aus Gebieten stammen, die im Jahr 2009 gemäß nationalen Vorschriften oder im Jahr 2010 gemäß dieser Verordnung Gegenstand von Sperrmaßnahmen waren, sollten zusätzliche Gesundheitsvorschriften gelten, sofern sie zur Zucht oder Umsetzung in Mitgliedstaaten oder Kompartimente eingeführt werden, für die ein solches Programm gilt, solange OsHV-1 μvar in diesem Mitgliedstaat oder Kompartiment nicht vorkommt. |
|
(14) |
Damit gewährleistet ist, dass die in verschiedenen Mitgliedstaaten im Rahmen von Programmen mit gezielter Probenahme und Untersuchung zur frühzeitigen Entdeckung von OsHV-1 μvar gesammelten Daten vergleichbar sind, sollten bestimmte Anforderungen im Hinblick auf den Inhalt dieser Programme festgelegt werden. |
|
(15) |
Die frühzeitige Verfügbarkeit zuverlässiger Informationen über die Lage im Hinblick auf die Entdeckung von OsHV-1 μvar in den Mitgliedstaaten ist ein wesentliches Element für die Gewährleistung einer angemessenen Bekämpfung der neu auftretenden Krankheit. Zu diesem Zweck sollten die Mitgliedstaaten die Kommission und die anderen Mitgliedstaaten unverzüglich über das erste bestätigte Auftreten des Virus OsHV-1 μvar in ihrem Hoheitsgebiet im Jahr 2010 informieren. |
|
(16) |
Ferner sind die gemäß Artikel 10 der Entscheidung 2009/177/EG der Kommission vom 31. Oktober 2008 zur Durchführung der Richtlinie 2006/88/EG des Rates in Bezug auf Überwachungs- und Tilgungsprogramme sowie auf den Seuchenfreiheitsstatus von Mitgliedstaaten, Zonen und Kompartimenten (3) erstellten Informations-Websites zu nutzen. |
|
(17) |
Um die Transparenz der einschlägigen Informationen über die neu auftretende Krankheit und den raschen Zugang zu diesen Informationen zu gewährleisten, sollten die Mitgliedstaaten der Kommission und den anderen Mitgliedstaaten Angaben zu Sperrgebieten, zu Gebieten, die früher Gegenstand von Sperrmaßnahmen waren, in denen OsHV-1 μvar jedoch nachweislich nicht vorkommt, sowie zu ihren Programmen zur frühzeitigen Entdeckung von OsHV-1 μvar bereitstellen. |
|
(18) |
Da noch immer große Unsicherheit im Hinblick auf die neu auftretende Krankheit besteht, sollten die in dieser Verordnung vorgesehenen Maßnahmen bis Ende Dezember 2010 gelten. |
|
(19) |
Die in dieser Verordnung vorgesehenen Maßnahmen entsprechen der Stellungnahme des Ständigen Ausschusses für die Lebensmittelkette und Tiergesundheit — |
HAT FOLGENDE VERORDNUNG ERLASSEN:
Artikel 1
Begriffsbestimmung
Für die Zwecke dieser Verordnung bezeichnet OsHV-1 μvar einen Genotyp des Virus Ostreides Herpesvirus 1 (OsHV-1), der auf der Grundlage der Daten einer Teilsequenz definiert ist, die eine systematische Löschung von 12 Basenpaaren im ORF 4 des Genoms im Vergleich zu OsHV-1 zeigen (GenBank # AY509253).
Artikel 2
Probenahme, Durchführung von Untersuchungen und Einrichtung von Sperrgebieten
(1) Wird eine erhöhte Mortalität bei Austern der Art Crassostrea gigas („Pazifische Auster“) festgestellt, so geht die zuständige Behörde wie folgt vor:
|
a) |
Sie nimmt Proben gemäß Anhang I Teil A; |
|
b) |
sie führt Untersuchungen gemäß den diagnostischen Methoden in Anhang I Teil B im Hinblick auf das Vorkommen von OsHV-1 μvar durch. |
(2) Bestätigen die in Absatz 1 Buchstabe b genannten Untersuchungen das Vorkommen von OsHV-1 μvar, so richtet die zuständige Behörde ein Sperrgebiet ein. Das Gebiet wird nach einer Einzelfallprüfung festgelegt, bei der die in Anhang I Teil C aufgeführten Faktoren berücksichtigt werden, die das Risiko einer Ausbreitung der Krankheit beeinflussen.
(3) Die Mitgliedstaaten unterrichten die Kommission und die anderen Mitgliedstaaten unverzüglich über die Einrichtung des ersten Sperrgebiets in ihrem Hoheitsgebiet im Jahr 2010.
Artikel 3
Bedingungen für das Inverkehrbringen von Austern der Art Crassostrea gigas aus den in Artikel 2 genannten Sperrgebieten
(1) Pazifische Austern, die aus gemäß Artikel 2 Absatz 2 eingerichteten Sperrgebieten stammen, werden nicht aus diesen Gebieten verbracht.
(2) Abweichend von Absatz 1 dürfen Sendungen von Pazifischen Austern aus einem Sperrgebiet verbracht werden, wenn
|
a) |
sie für ein anderes Sperrgebiet gemäß Artikel 2 Absatz 2 bestimmt sind; |
|
b) |
sie aus einem Teil des Sperrgebiets einschließlich Zuchtbetrieben stammen, in dem/denen die Mortalität nicht erhöht ist und
|
|
c) |
sie vor dem Verzehr durch Menschen zur weiteren Verarbeitung in Reinigungszentren, Versandzentren oder Verarbeitungsbetrieben bestimmt sind, die über eine von der zuständigen Behörde validierte Abwasseraufbereitungsanlage verfügen, die
|
|
d) |
sie für den menschlichen Verzehr bestimmt sind und zu diesem Zweck gemäß der Verordnung (EG) Nr. 853/2004 des Europäischen Parlaments und des Rates (4) verpackt und gekennzeichnet wurden und wenn sie
|
|
e) |
diese Sendungen oder die darin enthaltenen Erzeugnisse für den menschlichen Verzehr bestimmt sind, sofern sie in Einzelhandelspackungen verpackt sind, die den einschlägigen Vorschriften der Verordnung (EG) Nr. 853/2004 entsprechen. |
(3) Die in Absatz 2 Buchstaben a und b genannten für Zucht- oder Umsetzungsgebiete bestimmten Sendungen werden von einer Tiergesundheitsbescheinigung gemäß dem Muster in Anhang II dieser Verordnung und den Erläuterungen in Anhang V der Verordnung (EG) Nr. 1251/2008 begleitet.
Artikel 4
Aufhebung der in den Artikeln 2 und 3 vorgesehenen Maßnahmen
Die zuständige Behörde kann die Seuchenbekämpfungsmaßnahmen im Zusammenhang mit den gemäß Artikel 2 Absatz 2 eingerichteten Sperrgebieten und den in Artikel 3 vorgesehenen Beschränkungen des Inverkehrbringens im Anschluss an zwei innerhalb von 15 Tagen aufeinanderfolgende Inspektionen aufheben, wenn diese Inspektionen beweisen, dass die Mortalität nicht mehr erhöht ist.
Artikel 5
Bedingungen für das Inverkehrbringen von Austern der Art Crassostrea gigas aus einem Kompartiment, das bereits Gegenstand von Seuchenbekämpfungsmaßnahmen aufgrund einer erhöhten Mortalität bei Austern der Art Crassostrea gigas im Zusammenhang mit OsHV-1 μvar war
(1) Pazifische Austern aus einem Kompartiment, das entweder 2009 oder 2010 bereits Gegenstand von Sperrmaßnahmen aufgrund einer erhöhten Mortalität bei Pazifischen Austern im Zusammenhang mit OsHV-1 μvar war,
|
a) |
werden von einer Tiergesundheitsbescheinigung gemäß dem Muster in Anhang II dieser Verordnung und den Erläuterungen in Anhang V der Verordnung (EG) der Kommission Nr. 1251/2008 begleitet, sofern die Tiere
|
|
b) |
müssen aus einem Kompartiment stammen, in dem durch Probenahmen und Untersuchungen gemäß Anhang I Teil A nachgewiesen wurde, dass OsHV-1 μvar nicht vorkommt; und |
|
c) |
müssen den Tiergesundheitsvorschriften gemäß der unter Buchstabe a genannten Musterbescheinigung entsprechen. |
(2) Das in Absatz 1 Buchstabe a Ziffer i genannte Programm zur frühzeitigen Feststellung von OsHV-1 μvar erfüllt folgende Anforderungen:
|
a) |
Das Programm wird dem Ständigen Ausschuss für die Lebensmittelkette und Tiergesundheit gemeldet. |
|
b) |
Diese Meldung erfolgt in Übereinstimmung mit den Ziffern 1, 5.1, 5.2, 5.3, 5.5, 5.9, 6 und 7 des Musterformulars in Anhang II der Entscheidung 2009/177/EG. |
|
c) |
Das Programm muss Folgendes umfassen:
|
(3) Absatz 1 gilt eine Woche nach dem Datum der Sitzung des Ständigen Ausschusses für die Lebensmittelkette und Tiergesundheit, in der das in Absatz 1 Buchstabe a Ziffer i genannte Programm gemeldet wurde.
Artikel 6
Informations-Website
(1) Die Mitgliedstaaten legen der Kommission und den anderen Mitgliedstaaten Folgendes vor:
|
a) |
eine Liste der Sperrgebiete und der Faktoren, die bei der Einrichtung dieser Gebiete berücksichtigt wurden, einschließlich einer Beschreibung der geografischen Grenzen des jeweiligen gemäß Artikel 2 Absatz 2 festgelegten Gebietes; |
|
b) |
eine Liste der Kompartimente (einschließlich einer Beschreibung der geografischen Grenzen des jeweiligen Gebietes),
|
|
c) |
die Meldungen der in Artikel 5 Absatz 2 genannten Programme einschließlich einer Beschreibung der geografischen Grenzen des jeweiligen Gebietes. |
(2) Die in Absatz 1 genannten Angaben werden laufend aktualisiert und auf der gemäß Artikel 10 der Entscheidung 2009/177/EG eingerichteten Informations-Website bereitgestellt.
Artikel 7
Berichterstattung
Die Mitgliedstaaten legen der Kommission bis spätestens 1. Oktober 2010 einen Bericht über die gemäß Artikel 5 Absatz 2 gemeldeten Programme vor.
Für den Bericht ist das Musterformular in Anhang VI der Entscheidung 2009/177/EG zu verwenden.
Artikel 8
Inkrafttreten und Geltungsdauer
Diese Verordnung tritt am dritten Tag nach ihrer Veröffentlichung im Amtsblatt der Europäischen Union in Kraft.
Sie gilt vom 15. März 2010 bis zum 31. Dezember 2010.
Diese Verordnung ist in allen ihren Teilen verbindlich und gilt unmittelbar in jedem Mitgliedstaat.
Geschehen zu Brüssel am 2. März 2010.
Für die Kommission
Der Präsident
José Manuel BARROSO
(1) ABl. L 328 vom 24.11.2006, S. 14.
(2) ABl. L 337 vom 16.12.2008, S. 41.
(3) ABl. L 63 vom 7.3.2009, S. 15.
(4) ABl. L 139 vom 30.4.2004, S. 55.
ANHANG I
TEIL A
Probenahme
1. Probenahme gemäß Artikel 2
Die in Artikel 2 vorgesehenen Proben bestehen aus mindestens 12 einzelnen Austern der Art Crassostrea gigas. Für die Proben sind geschwächte, offenstehende oder soeben verendete Tiere (ohne Anzeichen der Zersetzung) aus dem Kompartiment mit erhöhter Mortalität auszuwählen.
2. Probenahme gemäß Artikel 3 Absatz 2 Buchstabe b und Artikel 5 Absatz 1 Buchstabe b und Absatz 2
|
a) |
Probenahmen gemäß Artikel 3 Absatz 2 Buchstabe b umfassen
Es sind anteilmäßig Proben von allen Teilen der Sendung auszuwählen. Sind geschwächte, offenstehende oder soeben verendete Tiere (ohne Anzeichen der Zersetzung) vorhanden, so sind hauptsächlich solche Tiere auszuwählen. |
|
b) |
Probenahmen gemäß Artikel 5 Absatz 2 umfassen mindestens 150 Einzeltiere der Art Crassostrea gigas pro Entnahmestelle. Es sind Proben aus allen Zuchtbetrieben oder Weichtierzuchtgebieten in dem Mitgliedstaat oder Kompartiment zu nehmen, das Gegenstand des Programms ist. Probenahmen gemäß Artikel 5 Absatz 1 Buchstabe b umfassen mindestens 150 Einzeltiere der Art Crassostrea gigas pro Kompartiment. Bei der Auswahl dieser Tiere werden folgende Kriterien berücksichtigt:
|
|
c) |
Die Proben gemäß Artikel 5 Absatz 2 werden in der Jahreszeit entnommen, in der das Vorkommen von OsHV-1 μvar im jeweiligen Mitgliedstaat oder Kompartiment bekanntermaßen seinen Höhepunkt erreicht. Liegen keine derartigen Angaben vor, so werden die Proben unmittelbar nach dem Zeitraum entnommen, in dem die Wassertemperatur 16 °C übersteigt, bzw. zu der Jahreszeit, in der die Temperatur normalerweise ihren jährlichen Höchststand erreicht. |
|
d) |
Die Proben gemäß Artikel 5 Absatz 1 Buchstabe b werden vorzugsweise in der in Buchstabe c genannten Jahreszeit entnommen. Werden Proben außerhalb dieser Jahreszeit entnommen, so müssen die entnommenen Austern während eines für die Feststellung von OsHV-1 μvar ausreichenden Zeitraums unter Bedingungen gehalten werden, die den in Buchstabe c beschriebenen entsprechen, bevor Untersuchungen durchgeführt werden. |
TEIL B
Diagnostische Methoden zur Feststellung von OsHV-1 μvar
1. Anwendungsbereich
Nachstehend ist eine diagnostische Standardmethode beschrieben, die zur Feststellung von OsHV-1 μvar und zum Nachweis einer Polymerase-Kettenreaktion (im Folgenden „PCR“) anzuwenden ist. Sie ermöglicht eine Unterscheidung zwischen OsHV-1 und OsHV-1 μvar.
Um optimale Reaktionsbedingungen zu schaffen und Anpassungen an die Ausrüstung und die Bedingungen in ihren eigenen Einrichtungen vorzunehmen, dürfen die Laboratorien die in diesem Anhang beschriebenen Methoden gegebenenfalls ändern, sofern eine entsprechende Sensitivität und Spezifität nachgewiesen werden kann.
2. Begriffsbestimmung
OsHV-1 μvar ist in Artikel 1 dieser Verordnung definiert.
3. Ausrüstung und Umgebungsbedingungen
Für die Diagnose von OsHV-1 μvar und den Nachweis einer PCR ist die für den PCR-Nachweis übliche Ausrüstung unter denselben Umgebungsbedingungen zu verwenden, also:
|
— |
ein geschlossener Abzug mit einem System zur Erzeugung von UV-Strahlen zur Beseitigung möglicher Kontaminationen bei der Zubereitung des PCR-Gemisches; |
|
— |
zwei vollständige Pipettensets (2 μl, 20 μl, 200 μl und 1 000 μl), eines für die DNA-Extraktion und eines für die Zubereitung des PCR-Gemisches; |
|
— |
drei verschiedene Pipetten: eine Pipette (2 μl) für die Einbringung der Proben in das PCR-Gemisch, eine Pipette (20 μl) für die EtBr-Aufnahme und eine Pipette (20 μl) für die Beladung des Agarose-Gels mit PCR-Produkten; |
|
— |
Filterpipettenspitzen (2 μl, 20 μl, 200 μl und 1 000 μl) für die DNA-Extraktion, die Zubereitung des PCR-Gemisches und die Einbringung der Proben; |
|
— |
Pipettenspitzen (20 μl) für die Aufnahme von EtBr und für die Beladung des Agarose-Gels mit Amplifikationsprodukten; |
|
— |
ein Thermocycler für die Amplifikation; |
|
— |
ein horizontales Elektrophoresesystem für die Elektrophorese von PCR-Produkten; |
|
— |
ein UV-Tisch zur Beobachtung der PCR-Produkte nach der Agarose-Gel-Elektrophorese; |
|
— |
ein System, das Bilder des Gels liefert. |
Der Manipulator muss während aller unten beschriebenen Schritte einen Laborkittel und Handschuhe tragen. Der Laborkittel und die Handschuhe sind vorzugsweise nach jedem Hauptschritt (DNA-Extraktion, Zubereitung des PCR-Gemisches, Einbringung der Probe, Amplifikation und Beladung des Gels) zu wechseln.
Es wird empfohlen, die einzelnen Schritte in unterschiedlichen Räumen durchzuführen. Insbesondere sollten die Amplifikation und die Beladung des Gels/Elektrophorese in einem anderen Raum stattfinden als die DNA-Extraktion, die Zubereitung des PCR-Gemisches und die Verteilung der DNA.
4. Verfahren
4.1 Zubereitung der Proben
Lebende oder soeben verendete Austern (ohne Anzeichen der Zersetzung), die zuvor eingefroren werden können, werden für die DNA-Extraktion aufbereitet.
Die Proben werden je nach ihrer Größe unterschiedlich behandelt:
|
a) |
Bei Larven werden Sammelproben von 50 mg ganzer Tiere (einschließlich Schalen) mit 200 μl destilliertem Wasser zermahlen und bei 1 000 g 1 Minute lang zentrifugiert. |
|
b) |
Bei Jungmuscheln, die kleiner als 6 mm sind, werden Sammelproben von 300 mg ganzer Tiere (einschließlich Schalen) mit 1 200 μl destilliertem Wasser zermahlen und bei 1 000 g 1 Minute lang zentrifugiert. |
|
c) |
Bei Jungmuscheln, die zwischen 6 und 15 mm groß sind, werden alle Weichteile jedes Tieres einzeln zermahlen. |
|
d) |
Bei Tieren, die größer als 15 mm sind, werden Teile der Kiemen und des Mantels isoliert. |
Die DNA-Extraktion erfolgt mithilfe des QIAamp® DNA Mini Kits (QIAGEN) nach dem Protokoll für Gewebeproben.
Die weitere Zubereitung der Probe erfolgt in der folgenden Reihenfolge:
|
1. |
100 μl der in den Buchstaben a und b genannten Aufschwemmungsproben oder 10 bis 50 mg der in den Buchstaben c und d genannten Gewebeproben in ein 1,5-ml-Mikrozentrifugengefäß geben und 180 μl Gewebelysepuffer hinzufügen. |
|
2. |
20 μl Proteinase-K hinzufügen, (auf einem Vortex) kräftig mischen und bei 56 °C inkubieren, bis das Gewebe vollständig lysiert ist (über Nacht). Während der Inkubation die Probe mehrmals gründlich (auf einem Vortex) mischen, um die Probe zu dispergieren. Das 1,5-ml-Mikrozentrifugengefäß kurz zentrifugieren, um Tropfen vom Deckelinneren zu entfernen. |
|
3. |
200 μl Lysepuffer zu der Probe geben, 15 Sekunden lang auf einem Vortex kräftig mischen und die Probe 10 Minuten lang bei 70 °C inkubieren. Das 1,5-ml-Mikrozentrifugengefäß kurz zentrifugieren, um Tropfen vom Deckelinneren zu entfernen. |
|
4. |
200 μl Ethanol (96–100 %) zur Probe geben und 15 Sekunden lang auf einem Vortex mischen. Das 1,5-ml-Mikrozentrifugengefäß kurz zentrifugieren, um Tropfen vom Deckelinneren zu entfernen. |
|
5. |
Die Mischung aus Schritt 4 vorsichtig — ohne den oberen Rand zu benetzen — auf die QIAamp-Spinsäule (in einem 2-ml-Collection-Tube) geben. Das Gefäß verschließen und 1 Minute lang bei 10 000 min-1 zentrifugieren. Anschließend die QIAamp-Spinsäule in ein sauberes 2-ml-Collection-Tube (im Kit enthalten) setzen und das benutzte Gefäß mitsamt Filtrat entsorgen. |
|
6. |
Die QIAamp-Spinsäule vorsichtig öffnen und 500 μl Waschpuffer 1 hinzugeben, ohne den oberen Rand zu benetzen. Das Gefäß verschließen und 1 Minute lang bei 10 000 min-1 zentrifugieren. Anschließend die QIAamp-Spinsäule in ein sauberes 2-ml-Collection-Tube (im Kit enthalten) setzen und das benutzte Collection Tube mitsamt Filtrat entsorgen. |
|
7. |
Die QIAamp-Spinsäule vorsichtig öffnen und 500 μl Waschpuffer 2 hinzugeben, ohne den oberen Rand zu benetzen. Das Gefäß verschließen und 3 Minuten lang bei maximaler Drehzahl (14 000 min-1) zentrifugieren. |
|
8. |
(Optional:) Anschließend die QIAamp-Spinsäule in ein neues 2-ml-Collection-Tube (nicht im Kit enthalten) setzen und das benutzte Collection Tube mitsamt Filtrat entsorgen. 1 Minute lang bei maximaler Geschwindigkeit (14 000 min-1) zentrifugieren. |
|
9. |
Anschließend die QIAamp-Spinsäule in ein sauberes 1,5-ml-Mikrozentrifugengefäß (nicht im Kit enthalten) setzen und das Collection Tube mitsamt Filtrat entsorgen. Die QIAamp-Spinsäule vorsichtig öffnen und 100 μl destilliertes Wasser auf die Säule geben. 5 Minuten lang bei Raumtemperatur inkubieren und die Spinsäule anschließend 1 Minute lang bei 10 000 min-1 zentrifugieren. |
|
10. |
Qualität und Effizienz der Extraktion prüfen (beispielsweise durch OD-Messung (260 nm) mit einem Spektrophotometer oder nach der Elektrophorese in Agarose-Gel). |
|
11. |
Proben soweit verdünnen, dass die endgültige DNA-Konzentration 50-100 ng/μl beträgt. |
|
12. |
DNA-Lösungen bis zur Durchführung von PCR-Analysen bei 4 °C aufbewahren. |
Für die DNA-Extraktion können auch andere im Handel erhältliche Kits verwendet werden, sofern sie nachweislich ähnliche Ergebnisse erzielen.
4.2 Polymerase-Kettenreaktion (PCR)
4.2.1 Reagenzien
|
— |
10x-Puffer (mit Taq-DNA-Polymerase geliefert), |
|
— |
MgCl2 (DNA-Polymerase) (25 mM), |
|
— |
Taq-DNA-Polymerase (Goldstar, Eurogentec) 5 U/μl, |
|
— |
dNTP (dATP, dCTP, dGTP, dTTT) Master Mix (20 mM), vor Verwendung zehnfach verdünnen (auf 2 mM), |
|
— |
dH2O (destilliertes H2O ohne DNA und RNA). |
4.2.2 Primer
Die nachstehenden Primer (1) sind zu verwenden:
|
|
CF (10 μM), |
|
|
CR (10 μM). |
4.2.3 PCR-Gemisch
Das PCR-Gemisch für jedes Gefäß besteht aus:
|
|
Volumen je Gefäß |
Endgültige Konzentration |
|
Puffer (10x) |
5 μl |
1x |
|
MgCl2 (25 mM) |
5 μl |
2,5 mM |
|
dNTP (2 mM) |
5 μl |
0,2 mM |
|
CF (10 μM) |
1 μl |
0,2 μM |
|
CR (10 μM) |
1 μl |
0,2 μM |
|
Taq-Polymerase (5 U/μl) |
0,5 μl |
2,5 U |
|
dH2O |
31,5 μl |
|
|
— |
49 μl dieses PCR-Gemisches in jedes PCR-Gefäß füllen; |
|
— |
jedem Gefäß 1 μl extrahierter DNA (50-100 ng/μl) hinzufügen. |
4.2.4 Kontrollen
Es werden zwei Arten von Kontrollen verwendet:
|
— |
Negativkontrollen bestehen aus dH2O (1 μl auf 49 μl PCR-Gemisch). Sie sollen potenzielle reaktive Kontaminationen des Arbeitsumfelds aufzeigen. Eine Negativkontrolle sollte nach jeweils zehn Proben oder nach jeder Probenserie durchgeführt werden. |
|
— |
Positivkontrollen bestehen aus Plasmid-DNA, die die Zielgenomregion CF-CR von OsHV-1 enthält. Sie sollen die Effizienz der PCR-Reaktion prüfen. Eine Positivkontrolle sollte nach jeder PCR-Analyse durchgeführt werden. Positivkontrollen sind beim Gemeinschaftlichen Referenzlaboratorium verfügbar. |
4.2.5 Amplifikation
Amplifikationszyklen werden in einem Thermocycler durchgeführt.
|
— |
Anfängliche Denaturierung: 2 Minuten bei 94 °C, |
|
— |
Amplifikation: 35 Zyklen (1 Minute bei 94 °C, 1 Minute bei 50 °C und 1 Minute bei 72 °C), |
|
— |
abschließende Elongation: 5 Minuten bei 72 °C. |
4.3 Elektrophorese
4.3.1 Reagenzien
|
— |
50x-TAE-Puffer (kann direkt gebrauchsfertig gekauft werden):
|
|
— |
Agarose-Gel 2,5 % in 1x-TAE-Puffer Ethidiumbromid (0,5 μg/ml), nach Abkühlen des Gels hinzugefügt; |
|
— |
Beladung mit blauem Farbstoff:
|
|
— |
Molekulargewichtsmarker: SmartLadder SF (Eurogentec): ein gebrauchsfertiger Molekulargewichtsmarker mit neun regelmäßigen Banden von 100 bis 1 000 bp. |
4.3.2 Herstellung von Agarose-Gel
|
1. |
2,5 g Agarose abwiegen, 100 ml 1x-TAE-Puffer hinzufügen und erhitzen, bis die Mischung schmilzt. |
|
2. |
Nach Abkühlen der Lösung Ethidiumbromid hinzufügen (5 μl für 100 ml Agarose-Gel) und die Lösung in eine spezifische Form mit Kämmen füllen (um Probetaschen zu bilden). |
|
3. |
Wenn das Gel polymerisiert ist, werden die Kämme entfernt; das Gel wird in ein horizontales Elektrophoresesystem gefüllt, das so viel 1x-TAE-Puffer enthält, dass das Agarose-Gel vollständig bedeckt ist. |
|
4. |
10 μl PCR-Produkte werden mit 2 μl blauem Farbstoff (6x) vermischt und in die Probetaschen gefüllt. |
|
5. |
Eine Probetasche ist für den Molekulargewichtsmarker bestimmt (5 μl). |
|
6. |
Je nach Menge und Konzentration des Gels wird eine elektrische Spannung zwischen 50 und 150 Volt zwischen 30 Minuten und 1 Stunde angelegt. |
|
7. |
Das Gel wird unter UV-Licht beobachtet. |
4.4 Auswertung
Kommt in einer Probe OsHV-1 μvar vor, so ist das daran zu erkennen, dass sich auf 2,5 %igem Agarose-Gel eine Bande der entsprechenden Größe (157 bp anstatt 173 bp bei OsHV-1) bildet und alle Negativkontrollen negativ sowie alle Positivkontrollen positiv sind.
TEIL C
Festlegung des Sperrgebiets
Folgende Faktoren, die die Risiken der Ausbreitung der Krankheit beeinflussen, sind bei der Festlegung eines Sperrgebiets gemäß Artikel 2 Absatz 2 zu berücksichtigen:
|
a) |
Anzahl, Rate und Verteilung der Mollusken im befallenen Zuchtbetrieb oder Weichtierzuchtgebiet, |
|
b) |
Abstand und Dichte benachbarter Zuchtbetriebe oder Weichtierzuchtgebiete, |
|
c) |
Nähe zu Verarbeitungsbetrieben, Kontaktbetrieben oder Kontakt-Weichtierzuchtgebieten, |
|
d) |
Arten im Zuchtbetrieb oder Weichtierzuchtgebiet, |
|
e) |
Bewirtschaftungsmethoden im betroffenen Zuchtbetrieb oder Weichtierzuchtgebiet und in den benachbarten Zuchtbetrieben oder Weichtierzuchtgebieten und |
|
f) |
hydrodynamische Bedingungen und andere epizootiologisch bedeutsame Faktoren. |
(1) Diese Primer oder deren Beschreibungen können beim Gemeinschaftlichen Referenzlaboratorium für Muschelkrankheiten (LGP-Ifremer, av. de Mus de Loup, 17390 La Tremblade, Frankreich) angefordert werden.
ANHANG II
Muster einer Tiergesundheitsbescheinigung für das Inverkehrbringen von für Zucht- und Umsetzungsgebiete bestimmten Austern der Art Crassostrea gigas
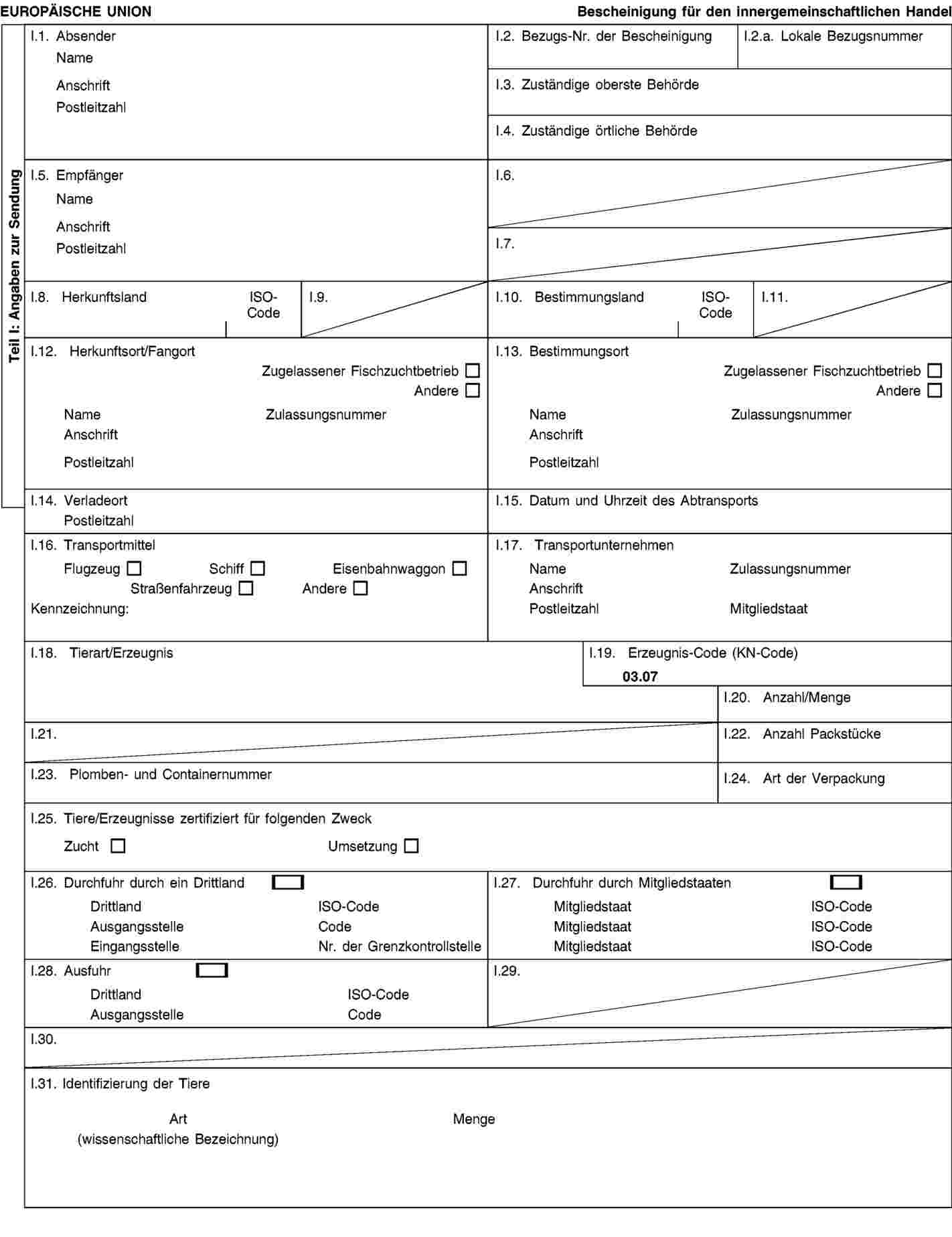


|
3.3.2010 |
DE |
Amtsblatt der Europäischen Union |
L 52/14 |
VERORDNUNG (EU) Nr. 176/2010 DER KOMMISSION
vom 2. März 2010
zur Änderung des Anhangs D der Richtlinie 92/65/EWG des Rates bezüglich Besamungsstationen und Samendepots, Embryo-Entnahmeeinheiten und Embryo-Erzeugungseinheiten, hinsichtlich der Anforderungen an Spenderpferde, Spenderschafe und Spenderziegen sowie der Bedingungen für den Umgang mit Sperma, Eizellen und Embryonen der betreffenden Tierarten
(Text von Bedeutung für den EWR)
DIE EUROPÄISCHE KOMMISSION —
gestützt auf den Vertrag über die Arbeitsweise der Europäischen Union,
gestützt auf die Richtlinie 92/65/EWG des Rates vom 13. Juli 1992 über die tierseuchenrechtlichen Bedingungen für den Handel mit Tieren, Samen, Eizellen und Embryonen in der Gemeinschaft sowie für ihre Einfuhr in die Gemeinschaft, soweit sie diesbezüglich nicht den spezifischen Gemeinschaftsregelungen nach Anhang A Abschnitt I der Richtlinie 90/425/EWG unterliegen (1), insbesondere auf Artikel 22 Unterabsatz 1,
in Erwägung nachstehender Gründe:
|
(1) |
In der Richtlinie 92/65/EWG sind die Tiergesundheitsvorschriften für den Handel mit Tieren, Samen, Eizellen und Embryonen in der EU sowie für ihre Einfuhr in die EU festgelegt, soweit für sie nicht die Tiergesundheitsvorschriften der einzelnen in der Richtlinie genannten EU-Rechtsakte gelten. |
|
(2) |
In der Richtlinie sind auch die Bedingungen für die Zulassung und Überwachung der Stationen für die Gewinnung des Samens von Pferden, Schafen und Ziegen (Besamungsstationen) festgelegt. |
|
(3) |
In einigen Besamungsstationen wird der von den betreffenden Arten gewonnene Samen lediglich gelagert. Daher ist es angebracht, besondere Bedingungen für die Zulassung und Überwachung solcher Stationen festzulegen. |
|
(4) |
Die Richtlinie 88/407/EWG des Rates vom 14. Juni 1988 zur Festlegung der tierseuchenrechtlichen Anforderungen an den innergemeinschaftlichen Handelsverkehr mit Samen von Rindern und an dessen Einfuhr (2) enthält eine Definition des Begriffs des Samendepots. Im Interesse eines einheitlichen Unionsrechts sollten Stationen zur Lagerung des Samens von Tieren, für die die vorliegende Verordnung gilt, als „Samendepots“ im Sinne der genannten Definition bezeichnet werden. |
|
(5) |
Außerdem sind in der Richtlinie 88/407/EWG Bedingungen für die Zulassung und Überwachung von Samendepots für Rindersamen festgelegt. Diese Bedingungen sollten als Leitlinie für die Bedingungen dienen, die in der vorliegenden Verordnung für die Zulassung und Überwachung von Samendepots für Pferde, Schafe und Ziegen festgelegt werden. Anhang D Kapitel I Abschnitte I und II der Richtlinie 92/65/EWG sollte entsprechend geändert werden. |
|
(6) |
Gemäß der Richtlinie 92/65/EWG in der durch die Richtlinie 2008/73/EG (3) geänderten Fassung werden Eizellen und Embryonen von Schafen, Ziegen, Pferden und Schweinen von einer Entnahmeeinheit entnommen oder von einer Erzeugungseinheit erzeugt, die die zuständige Behörde zugelassen hat. |
|
(7) |
Es ist daher notwendig, in Anhang D der Richtlinie 92/65/EWG die Bedingungen für die Zulassung solcher Einheiten festzulegen. Der Gesundheitskodex für Landtiere der Weltorganisation für Tiergesundheit (OIE), 18. Ausgabe 2009 (nachstehend „Kodex“), enthält die aktuellen technischen internationalen Normen für die Entnahme und Aufbereitung von Embryonen. Die Kapitel 4.7, 4.8 und 4.9 des Kodex enthalten Empfehlungen für Entnahme und Aufbereitung in vivo gewonnener Embryonen, Entnahme und Aufbereitung in vitro erzeugter Embryonen bzw. für Entnahme und Aufbereitung mikromanipulierter Embryonen. Diese Empfehlungen sollten in Anhang D Kapitel III der Richtlinie 92/65/EWG entsprechend berücksichtigt werden. Daher sollten die betreffenden Passagen entsprechend geändert werden. |
|
(8) |
Die International Embryo Transfer Society (IETS) ist ein internationaler Verband mit einem Fachforum, der u. a. die wissenschaftliche Seite der Embryonenerzeugung fördert und die Standardisierung des Umgangs mit Embryonen und der betreffenden Aufzeichnungsverfahren international koordiniert. Die IETS hat in mehrjähriger Arbeit praktische und wissenschaftlich gestützte Protokolle ausgearbeitet, mit denen das Risiko einer Krankheitsübertragung beim Embryonentransfer vom Spendertier zum Empfängertier vermieden werden soll. Diese Protokolle basieren weitgehend auf den Hygieneverfahren zum Umgang mit Embryonen, die in der 3. Ausgabe des IETS-Handbuchs dargelegt sind und auch im Kodex erscheinen. Die von der IETS empfohlenen Verfahren zum Umgang mit Embryonen können bei bestimmten Krankheiten herkömmliche Vorbeugungsmaßnahmen ersetzen, so etwa Diagnosetests an Spendertieren; bei traditionellen Maßnahmen sollten die empfohlenen Verfahren jedoch nur zu deren Verstärkung und Ergänzung dienen. |
|
(9) |
In der Richtlinie 92/65/EWG ist auch festgelegt, dass der Samen von Pferden, Schafen und Ziegen Tieren entnommen worden sein muss, die den Bedingungen von Anhang D Kapitel II der genannten Richtlinie entsprechen. Diese Bedingungen sollten in Bezug auf Spenderhengste und Spenderböcke unter Berücksichtigung der internationalen Normen überprüft werden, die in Kapitel 4.5 des Kodex festgelegt sind. Anhang D Kapitel II Abschnitte A und B sollte entsprechend geändert werden. |
|
(10) |
Bei der Anwendung dieser Verordnung sollten im Hinblick auf Spenderschafe und Spenderziegen folgende Rechtsakte berücksichtigt werden: Verordnung (EG) Nr. 999/2001 des Europäischen Parlaments und des Rates vom 22. Mai 2001 mit Vorschriften zur Verhütung, Kontrolle und Tilgung bestimmter transmissibler spongiformer Enzephalopathien (4), Verordnung (EG) Nr. 546/2006 der Kommission vom 31. März 2006 zur Durchführung der Verordnung (EG) Nr. 999/2001 des Europäischen Parlaments und des Rates hinsichtlich nationaler Programme zur Bekämpfung der Traberkrankheit und zusätzlicher Garantien sowie zur Befreiung von bestimmten Anforderungen von Entscheidung 2003/100/EG und zur Aufhebung der Verordnung (EG) Nr. 1874/2003 (5), Verordnung (EG) Nr. 1266/2007 der Kommission vom 26. Oktober 2007 mit Durchführungsvorschriften zur Richtlinie 2000/75/EG des Rates hinsichtlich der Bekämpfung, Überwachung und Beobachtung der Blauzungenkrankheit sowie der Beschränkungen, die für Verbringungen bestimmter Tiere von für die Blauzungenkrankheit empfänglichen Arten gelten (6). |
|
(11) |
Bei der Anwendung dieser Verordnung sollte im Hinblick auf die Verwendung von Antibiotika im Samen oder in den bei Entnahme, Einfrieren und Lagerung von Embryonen verwendeten Medien die Richtlinie 2001/82/EG des Europäischen Parlaments und des Rates vom 6. November 2001 zur Schaffung eines Gemeinschaftskodexes für Tierarzneimittel (7) berücksichtigt werden. |
|
(12) |
Bei der Anwendung dieser Verordnung sollte im Hinblick auf Spendersauen die Entscheidung 2008/185/EG der Kommission vom 21. Februar 2008 zur Festlegung zusätzlicher Garantien für den innergemeinschaftlichen Handel mit Schweinen hinsichtlich der Aujeszky-Krankheit und der Kriterien für die Informationsübermittlung (8) berücksichtigt werden. |
|
(13) |
Gemäß der Richtlinie 92/65/EWG dürfen nur Samen, Eizellen und Embryonen in den Handel kommen, die bestimmte Bedingungen gemäß der genannten Richtlinie erfüllen. Insbesondere sieht diese vor, dass für die Samengewinnung nur Hengste in Frage kommen, die bestimmten Tests unterzogen wurden, u. a. Tests auf infektiöse Anämie der Einhufer und kontagiöse equine Metritis. Die Richtlinie 92/65/EWG besagt ferner, dass Eizellen und Embryonen nur denjenigen weiblichen Spendertieren entnommen werden dürfen, die bestimmte Bedingungen erfüllen. Derzeit gibt es jedoch keine Anforderung, weibliche Spendertiere auf infektiöse Anämie der Einhufer bzw. auf kontagiöse equine Metritis zu untersuchen. Wissenschaftlich ist nicht belegt, dass eine Behandlung von Embryonen die Risiken aufgrund des Transfers eines Embryos ausschließen kann, der einem infizierten Spendertier entnommen wurde; daher sollten die Tiergesundheitsanforderungen, die für den Handel mit Eizellen und Embryonen von Pferden gelten, ausgeweitet werden und Tests auf infektiöse Anämie der Einhufer und kontagiöse equine Metritis bei weiblichen Spendertieren einschließen. Folglich sollte Anhang D Kapitel II Abschnitt C entsprechend geändert werden. |
|
(14) |
Anhang D der Richtlinie 92/65/EWG sollte daher entsprechend geändert werden. |
|
(15) |
Die in dieser Verordnung vorgesehenen Maßnahmen entsprechen der Stellungnahme des Ständigen Ausschusses für die Lebensmittelkette und Tiergesundheit — |
HAT FOLGENDE VERORDNUNG ERLASSEN:
Artikel 1
Anhang D der Richtlinie 92/65/EWG wird gemäß dem Anhang der vorliegenden Verordnung geändert.
Artikel 2
Diese Verordnung tritt am zwanzigsten Tag nach ihrer Veröffentlichung im Amtsblatt der Europäischen Union in Kraft.
Sie gilt ab dem 1. September 2010.
Diese Verordnung ist in allen ihren Teilen verbindlich und gilt unmittelbar in jedem Mitgliedstaat.
Brüssel, den 2. März 2010
Für die Kommission
Der Präsident
José Manuel BARROSO
(1) ABl. L 268 vom 14.9.1992, S. 54.
(2) ABl. L 194 vom 22.7.1988, S. 10.
(3) ABl. L 219 vom 14.8.2008, S. 40.
(4) ABl. L 147 vom 31.5.2001, S. 1.
(5) ABl. L 94 vom 1.4.2006, S. 28.
(6) ABl. L 283 vom 27.10.2007, S. 37.
(7) ABl. L 311 vom 28.11.2001, S. 1.
(8) ABl. L 59 vom 4.3.2008, S. 19.
ANHANG
Anhang D der Richtlinie 92/65/EWG erhält folgende Fassung:
„ANHANG D
KAPITEL I
Bedingungen für Besamungsstationen, Samendepots, Embryo-Entnahmeeinheiten und Embryo-Erzeugungseinheiten
I. Bedingungen für die Zulassung von Besamungsstationen und Samendepots
1. Um zugelassen zu werden und die Veterinärkontrollnummer gemäß Artikel 11 Absatz 4 zu erhalten, muss eine Besamungsstation folgende Bedingungen erfüllen:
|
1.1 |
sie wird ständig von einem Stationstierarzt überwacht, den die zuständige Behörde dazu ermächtigt hat; |
|
1.2 |
sie umfasst zumindest Folgendes:
|
|
1.3 |
ihre Bauweise gewährleistet, dass ein Kontakt zu Viehbeständen außerhalb der Station ausgeschlossen ist; |
|
1.4 |
ihre Bauweise gewährleistet, dass die gesamte Station, außer den Büroräumen und im Fall von Equiden außer dem Auslaufbereich, leicht gereinigt und desinfiziert werden kann. |
2. Um zugelassen zu werden, muss ein Samendepot folgende Bedingungen erfüllen:
|
a) |
Für jede der Tierarten, deren Samen im Depot gelagert wird, muss eine eindeutige Veterinärkontrollnummer gemäß Artikel 11 Absatz 4 erteilt werden, wenn die Lagerung nicht auf den Samen einer einzelnen Art beschränkt ist, der in gemäß dieser Richtlinie zugelassenen Besamungsstationen gewonnen wird, bzw. wenn im Depot Embryonen im Einklang mit dieser Richtlinie gelagert werden; |
|
b) |
sie wird ständig von einem Stationstierarzt überwacht, den die zuständige Behörde dazu ermächtigt hat; |
|
c) |
sie verfügt über einen Samenlagerraum, der mit den erforderlichen Einrichtungen zur Lagerung des Samens und/oder der Embryonen ausgestattet und so ausgelegt ist, dass diese Erzeugnisse und Einrichtungen vor ungünstigen Witterungs- und Umweltbedingungen geschützt sind; |
|
d) |
ihre Bauweise gewährleistet, dass ein Kontakt zu Viehbeständen außerhalb der Station oder zu sonstigen Tieren ausgeschlossen ist; |
|
e) |
ihre Bauweise gewährleistet, dass das gesamte Depot, außer den Büroräumen und im Fall von Equiden außer dem Auslaufbereich, leicht gereinigt und desinfiziert werden kann; |
|
f) |
ihre Bauweise gewährleistet, dass der Zutritt Unbefugter ausgeschlossen wird. |
II. Bedingungen für die Überwachung von Besamungsstationen und Samendepots
1. Besamungsstationen erfüllen folgende Bedingungen:
|
1.1 |
Sie müssen dahin gehend überwacht werden, dass
|
|
1.2 |
sie müssen dahin gehend überwacht werden, dass
|
|
1.3 |
sie werden im Fall von Tieren mit saisonalem Reproduktionszyklus während der Decksaison mindestens einmal jährlich und im Fall der saisonunabhängigen Reproduktion zweimal jährlich von einem amtlichen Tierarzt kontrolliert, der sich — erforderlichenfalls anhand von Unterlagen, Standardbetriebsverfahren und internen Prüfungen — vergewissert, dass die Zulassungs- und Überwachungsbedingungen eingehalten werden. |
2. Samendepots erfüllen folgende Bedingungen:
|
2.1 |
Sie müssen überwacht werden, damit sichergestellt ist, dass
|
|
2.2 |
sie werden dahin gehend überwacht, dass
|
|
2.3 |
abweichend von Nummer 2.2 Buchstabe a wird die Lagerung von Embryonen in zugelassenen Samendepots genehmigt, sofern die Embryonen die Anforderungen dieser Richtlinie erfüllen und in separaten Lagerbehältern gelagert werden; |
|
2.4 |
sie werden mindestens zweimal pro Kalenderjahr von einem amtlichen Tierarzt kontrolliert, der sich — erforderlichenfalls anhand von Aufzeichnungen, Standardbetriebsverfahren und internen Prüfungen — vergewissert, dass die Zulassungs- und Überwachungsbedingungen eingehalten werden. |
III. Bedingungen für die Zulassung und Überwachung von Embryo-Entnahmeeinheiten und Embryo-Erzeugungseinheiten
1. Um zugelassen zu werden, muss eine Embryo-Entnahmeeinheit folgende Bedingungen erfüllen:
|
1.1 |
Entnahme, Aufbereitung und Lagerung von Embryonen sind von einem für die Einheit verantwortlichen Tierarzt oder unter seiner Verantwortung von einem oder mehreren Technikern vorzunehmen, die hierzu befähigt sind und vom Tierarzt der Einheit in Hygieneverfahren, Hygienetechnik sowie den Grundsätzen und Verfahren der Seuchenbekämpfung ausgebildet wurden; |
|
1.2 |
der Tierarzt der Einheit ist für jede Tätigkeit der Einheit verantwortlich, unter anderem für
|
|
1.3 |
die Einheit wird von einem amtlichen Tierarzt überwacht, der sie mindestens einmal pro Kalenderjahr kontrolliert und der sich — erforderlichenfalls anhand von Aufzeichnungen, Standardbetriebsverfahren und internen Prüfungen — vergewissert, dass sowohl die Hygienebedingungen bei Gewinnung, Aufbereitung und Lagerung von Embryonen als auch die Zulassungs- und Überwachungsbedingungen eingehalten werden; |
|
1.4 |
die Einheit verfügt über ein stationäres oder mobiles Labor, in dem Embryonen untersucht, aufbereitet und verpackt werden können; das Labor umfasst mindestens eine Arbeitsplatte, ein optisches bzw. Stereomikroskop und erforderlichenfalls eine kryotechnische Ausrüstung; |
|
1.5 |
im Fall eines stationären Labors umfasst dieses Folgendes:
|
|
1.6 |
Im Fall eines mobilen Labors
|
|
1.7 |
Aufbau und Auslegung der Gebäude und Labors sowie die Arbeitsverfahren der Einheit gewährleisten, dass eine Kreuzkontamination der Embryonen verhindert wird; |
|
1.8 |
die Einheit verfügt über Lagereinrichtungen,
|
|
1.9 |
Die zuständige Behörde kann die Lagerung von Samen in Lagereinrichtungen gemäß Nummer 1.8 genehmigen, wenn der Samen
|
2. Um zugelassen zu werden, muss eine Embryo-Erzeugungseinheit folgende Bedingungen erfüllen:
|
2.1 |
Die Mitglieder der Einheit wurden in Seuchenbekämpfung und einschlägigen Labortechniken, insbesondere in Verfahren für steriles Arbeiten, angemessen geschult; |
|
2.2 |
die Einheit verfügt über ein stationäres Labor, das
|
|
2.3 |
werden Eizellen und sonstige Gewebe aus einem Schlachthof bezogen, so muss dieser angemessen ausgerüstet sein, damit eine hygienisch einwandfreie und sichere Entnahme und Beförderung der Eierstöcke und sonstigen Gewebe zum Aufbereitungslabor gewährleistet ist. |
KAPITEL II
Anforderungen an Spendertiere
I. Anforderungen an Spenderhengste
1. Um zur Samengewinnung eingesetzt zu werden, muss ein Spenderhengst nachstehende, vom Stationstierarzt überprüfte Bedingungen erfüllen:
|
1.1 |
Er darf bei der Einstallung in die Besamungsstation und am Tag der Samengewinnung keine klinischen Anzeichen einer Infektionskrankheit aufweisen; |
|
1.2 |
er stammt aus dem Gebiet oder — im Falle der Regionalisierung — aus einem Teil des Gebiets eines Mitgliedstaats oder eines Drittlands und aus einem tierärztlich überwachten Betrieb, das bzw. der der Richtlinie 90/426/EWG genügt; |
|
1.3 |
er wurde in den letzten 30 Tagen vor der Samengewinnung in Betrieben gehalten, in denen während dieser Zeit keine Equiden klinische Anzeichen der infektiösen Arteriitis der Pferde oder der kontagiösen equinen Metritis aufwies; |
|
1.4 |
er darf in den letzten 30 Tagen vor der ersten Samengewinnung und während des Gewinnungszeitraums nicht im Natursprung eingesetzt werden; |
|
1.5 |
er wurde nachstehenden Tests unterzogen, die ein von der zuständigen Behörde amtlich anerkanntes Labor gemäß dem Programm unter Nummer 1.6 durchgeführt und bescheinigt hat:
|
|
1.6 |
er wurde einer der folgenden Testreihen unterzogen:
|
|
1.7 |
bringt einer der unter Nummer 1.5 vorgesehenen Tests ein positives Ergebnis, so wird der Spenderhengst abgesondert und der seit dem Datum des letzten negativen Tests gewonnene Samen darf nicht für den Handel freigegeben werden, außer — in Bezug auf die infektiöse Arteriitis der Pferde — dem Samen aus jedem Ejakulat, das mittels Virusisolierung auf die infektiöse Arteriitis der Pferde unterzogen wurde, wobei das Ergebnis negativ war; Samen, der von allen anderen Hengsten der Besamungsstation seit dem Datum der letzten Entnahme einer Probe gewonnen wurde, die im Test gemäß Nummer 1.5 ein negatives Ergebnis lieferte, wird getrennt gelagert und darf nicht für den Handel freigegeben werden, bis der Gesundheitsstatus der Besamungsstation wiederhergestellt ist und der gelagerte Samen den entsprechenden amtlichen Untersuchungen unterzogen wurde, mit denen das Vorhandensein von Erregern der unter Nummer 1.5 genannten Krankheiten im Samen ausgeschlossen werden kann; |
|
1.8 |
Samen, der von Hengsten in einer Besamungsstation gewonnen wurde, die einer Sperrmaßnahme gemäß Artikel 4 oder 5 der Richtlinie 90/426/EWG unterliegt, wird getrennt gelagert und darf nicht für den Handel freigegeben werden, bis der amtliche Tierarzt den Gesundheitsstatus der Besamungsstation gemäß der Richtlinie 90/426/EWG wiederhergestellt hat und der gelagerte Samen den entsprechenden amtlichen Untersuchungen unterzogen wurde, mit denen das Vorhandensein der Erreger der Krankheiten gemäß Anhang A der Richtlinie 90/426/EWG ausgeschlossen werden kann; |
II. Anforderungen an Spenderschafböcke- und Spenderziegenböcke
1. Alle in eine Besamungsstation eingestallten Schafe und Ziegen erfüllen folgende Anforderungen:
|
1.1 |
Sie waren mindestens 28 Tage lang in eigens von der zuständigen Behörde zugelassenen Räumen unter Quarantäne gestellt, in denen sich nur Tiere mit zumindest demselben Gesundheitsstatus befinden (‚Quarantäneeinrichtung‘); |
|
1.2 |
vor ihrer Einstallung in die Quarantäneeinrichtung gehörten sie zu einem amtlich als brucellosefrei anerkannten Schaf- oder Ziegenhaltungsbetrieb gemäß Artikel 2 der Richtlinie 91/68/EWG des Rates vom 28. Januar 1991 zur Regelung tierseuchenrechtlicher Fragen beim innergemeinschaftlichen Handelsverkehr mit Schafen und Ziegen, und sie wurden zuvor nicht in einem Betrieb mit einem hinsichtlich Brucellose niedrigeren Gesundheitsstatus gehalten; |
|
1.3 |
Sie stammen aus einem Betrieb, in dem sie in den letzten 60 Tagen vor ihrer Einstallung in die Quarantäneeinrichtung einem serologischen Test auf die infektiöse Epididymitis des Schafbocks (Brucella ovis) gemäß Anhang D der Richtlinie 91/68/EWG oder einem anderen Test mit nachweislich vergleichbarer Empfindlichkeit und Spezifität unterzogen wurden; |
|
1.4 |
sie wurden — mit Ausnahme des Tests auf enzootische Zitterkrankheit gemäß Buchstabe c Ziffer ii — den nachstehenden Tests unterzogen, die an einer in den letzten 28 Tagen vor Beginn der Quarantäne gemäß Nummer 1.1 genommenen Blutprobe durchgeführt wurden und jeweils ein negatives Ergebnis lieferten:
die zuständige Behörde kann genehmigen, dass die hier beschriebenen Tests an Proben durchgeführt werden, die in der Quarantäneeinrichtung entnommen wurden. In diesem Fall darf die Quarantäne gemäß Nummer 1.1 nicht vor dem Tag der Probenahme beginnen. Fällt jedoch einer der hier genannten Tests positiv aus, so wird das betreffende Tier unverzüglich aus der Quarantäneeinrichtung ausgestallt. Bei Gruppenquarantäne darf die Quarantänegemäß Nummer 1.1 für die verbliebenen Tiere erst nach Ausstallung des positiven Tieres beginnen; |
|
1.5 |
Sie wurden den nachstehenden Tests unterzogen, die an Proben durchgeführt wurden, die während der Quarantäne gemäß Nummer 1.1 und mindestens 21 Tage nach Einstallung in die Quarantäneeinrichtung entnommen wurden, und ein negatives Ergebnis lieferten:
|
|
1.6 |
sie wurden den Tests auf enzootische Zitterkrankheit gemäß Nummer 1.4 Buchstabe c Ziffern i und ii unterzogen, die an Blutproben vorgenommen wurden, die während der Quarantäne gemäß Nummer 1.1 und mindestens 21 Tage nach Einstallung in die Quarantäneeinrichtung entnommen wurden; ein (seronegatives oder seropositives) Tier darf nur dann in die Besamungsstation eingestallt werden, wenn es bei den Tieren, die vor dem Tag der Einstallung in die Quarantäneeinrichtung serologisch negativ reagiert haben, nicht zur Serokonversion kommt; Kommt es zur Serokonversion, so sind alle weiterhin seronegativen Tiere über längere Zeit in Quarantäne zu halten, d. h. bis in der Gruppe nach dem Datum der Serokonversion drei Wochen lang keine Serokonversion auftritt; seropositive Tiere dürfen in die Besamungsstation eingestallt werden, wenn ein Test gemäß Nummer 1.4 Buchstabe c Ziffer i ein negatives Ergebnis liefert. |
2. Tiere dürfen nur mit ausdrücklicher Genehmigung des Stationstierarztes in die Besamungsstation eingestallt werden. Jede Einstallung und Ausstallung wird aufgezeichnet.
3. Die Tiere dürfen am Tag ihrer Einstallung in die Besamungsstation keine klinischen Anzeichen einer Krankheit aufweisen.
Unbeschadet der Nummer 4 stammen alle Tiere aus einer Quarantäneeinrichtung, die am Tag der Versendung der Tiere zur Besamungsstation folgende Bedingungen erfüllt:
|
a) |
Sie liegt in einem Gebiet, in dem im Umkreis von 10 km in den letzten 30 Tagen kein Ausbruch von Maul- und Klauenseuche zu verzeichnen war; |
|
b) |
sie war in den letzten drei Monaten frei von Maul- und Klauenseuche und Brucellose; |
|
c) |
sie war in den letzten 30 Tagen frei von anzeigepflichtigen Krankheiten im Sinne von Artikel 2 Buchstabe b Nummer 6 der Richtlinie 91/68/EWG. |
4. Sofern die Bedingungen gemäß Nummer 3 erfüllt sind und die Routineuntersuchungen gemäß Nummer 5 in den vergangenen zwölf Monaten vor der Verbringung durchgeführt wurden, können Tiere von einer zugelassenen Besamungsstation in eine andere zugelassene Besamungsstation mit gleichem Gesundheitsstatus verbracht werden, ohne unter Quarantäne gestellt oder getestet zu werden, sofern die Beförderung auf direktem Weg erfolgt. Die betreffenden Tiere dürfen weder direkt noch indirekt mit Klauentieren mit niedrigerem Gesundheitsstatus in Berührung kommen, und die Transportmittel müssen vor Gebrauch desinfiziert werden. Wird ein Tier aus einer Besamungsstation in eine Besamungsstation in einem anderen Mitgliedstaat verbracht, so wird diese Verbringung gemäß Richtlinie 91/68/EWG durchgeführt.
5. Alle Schafe und Ziegen in einer zugelassenen Besamungsstation werden mindestens einmal pro Kalenderjahr folgenden Tests unterzogen werden, wobei die Ergebnisse negativ sind:
|
a) |
einem serologischen Test auf Brucellose (Brucella melitensis) gemäß Anhang C der Richtlinie 91/68/EWG, |
|
b) |
einem serologischen Test zum auf die infektiöse Epididymitis des Schafbocks (Brucella ovis) gemäß Anhang D der Richtlinie 91/68/EWG oder einem anderen Test mit nachweislich gleichwertiger Empfindlichkeit und Spezifität, |
|
c) |
dem Antikörpertest zum Nachweis der enzootischen Zitterkrankheit gemäß Nummer 1.4 Buchstabe c Ziffer ii, und zwar ausschließlich bei seronegativen Tieren. |
6. Alle in diesem Abschnitt genannten Tests werden von einem zugelassenen Labor durchgeführt.
7. Liefert einer der Tests gemäß Nummer 5 ein positives Ergebnis, so wird das Tier abgesondert und der seit dem letzten Test mit negativem Ergebnis entnommene Samen darf nicht für den Handel freigegeben werden;
Ein Tier gemäß Absatz 1 wird aus der Station ausgestallt, außer bei der enzootischen Zitterkrankheit; in diesem Fall wird das Tier einem Test gemäß Nummer 1.4 Buchstabe c Ziffer i unterzogen, wobei das Ergebnis negativ sein muss;
Samen, der von allen anderen Tieren der Besamungsstation seit dem Datum der letzten Entnahme einer Probe gewonnen wurde, die in einem der Tests gemäß Nummer 5 ein negatives Ergebnis lieferte, wird getrennt gelagert und darf nicht für den Handel freigegeben werden, bis der Gesundheitsstatus der Besamungsstation wiederhergestellt ist und der gelagerte Samen den entsprechenden amtlichen Untersuchungen unterzogen wurde, mit denen das Vorhandensein von Erregern der unter Nummer 5 genannten Krankheiten im Samen ausgeschlossen werden kann.
8. Der Samen wird Tieren entnommen, die folgende Anforderungen erfüllen:
|
a) |
Sie wurden am Tag der Samengewinnung für frei von klinischen Anzeichen einer Krankheit befunden; |
|
b) |
sie wurden in den letzten zwölf Monaten vor der Samengewinnung
|
|
c) |
im Fall von Frischsamen wurden sie zumindest in den letzten 30 Tagen vor der Samengewinnung ununterbrochen in einer zugelassenen Besamungsstation gehalten; |
|
d) |
sie entsprechen den Artikeln 4, 5 und 6 der Richtlinie 91/68/EWG; |
|
e) |
befanden sie sich in Betrieben gemäß Artikel 11 Absatz 2 erster Gedankenstrich, so wurden sie in den letzten 30 Tagen vor dem Datum der Samengewinnung folgenden Tests unterzogen, wobei das Ergebnis jeweils negativ war:
|
|
f) |
sie dürfen zumindest in den letzten 30 Tagen vor dem Datum der ersten Samengewinnung und zwischen dem Datum der ersten Probenahme gemäß den Nummern 1.5 und 1.6 oder gemäß Buchstabe e und dem Ende des Gewinnungszeitraums nicht im Natursprung eingesetzt werden. |
9. Samen, der von Spenderschafböcken bzw. Spenderziegenböcken einer Besamungsstation oder eines Betriebs gemäß Artikel 11 Absatz 2 erster Gedankenstrich gewonnen wurde, die/der aus tiergesundheitlichen Gründen einer Sperrmaßnahme gemäß Artikel 4 der Richtlinie 91/68/EWG unterliegt, wird getrennt gelagert und darf nicht für den Handel freigegeben werden, bis der amtliche Tierarzt den Gesundheitsstatus der Besamungsstation oder des Betriebs gemäß der Richtlinie 91/68/EWG wiederhergestellt hat und der gelagerte Samen den entsprechenden amtlichen Untersuchungen unterzogen wurde, mit denen das Vorhandensein von Erregern der in Anhang B Nummer I der Richtlinie 91/68/EWG genannten Krankheiten ausgeschlossen werden kann.
KAPITEL III
Anforderungen an Samen, Eizellen und Embryonen
I. Bedingungen für Gewinnung, Aufbereitung, Konservierung, Lagerung und Transport von Samen
|
1.1 |
Falls unbeschadet der Richtlinie 2001/82/EG des Europäischen Parlaments und des Rates (2) Antibiotika oder eine Antibiotika-Mischung zugesetzt werden, deren bakterizide Aktivität je ml Samen derjenigen der nachstehenden Mischungen zumindest gleichwertig ist, werden die zugesetzten Antibiotika und ihre Konzentration in der Gesundheitsbescheinigung gemäß Artikel 11 Absatz 2 vierter Gedankenstrich angegeben: Gentamicin (250 μg), Tylosin (50 μg), Lincomycin-Spectinomycin (150/300 μg); Penicillin (500 IE), Streptomycin (500 μg), Lincomycin-Spectinomycin (150/300 μg); oder Amikacin (75 μg), Divekacin (25 μg). |
|
1.2 |
Alle Instrumente, die bei Gewinnung, Aufbereitung, Konservierung oder Einfrieren von Samen zum Einsatz kommen, werden vor Gebrauch entweder desinfiziert oder sterilisiert, oder es werden Einweg-Materialien verwendet. |
|
1.3 |
Gefrorener Samen wird
|
|
1.4 |
Samen, der für den Handel freigegeben werden soll,
|
II. Anforderungen an Eizellen und Embryonen
1. Gewinnung und Aufbereitung in vivo gewonnener Embryonen
In vivo gewonnene Embryonen gelten als Ergebnis einer künstlichen Besamung mit Samen, der die Anforderungen dieser Richtlinie erfüllt, und werden gemäß nachstehenden Bestimmungen gewonnen, aufbereitet und konserviert:
|
1.1 |
Die Embryonen werden durch eine zugelassene Embryo-Entnahmeeinheit entnommen und aufbereitet, ohne mit Chargen von Embryonen in Berührung zu kommen, die nicht dieser Richtlinie entsprechen; |
|
1.2 |
die Embryonen werden an einem Ort gewonnen, der getrennt ist von anderen Teilen des Betriebsgeländes oder Betriebs, in denen Embryonen gewonnen werden; dieser Ort muss in gutem Zustand und so konstruiert sein, dass er sich wirksam und leicht reinigen und desinfizieren lässt; |
|
1.3 |
die Embryonen werden entweder in einem stationären oder in einem mobilen Labor aufbereitet (untersucht, gewaschen, behandelt und in gekennzeichnete und sterile Pailletten, Ampullen oder sonstige Packungseinheiten verpackt), das sich im Hinblick auf empfängliche Tierarten in einem Gebiet befindet, in dem in den letzten 30 Tagen im Umkreis von 10 Kilometern kein Ausbruch von Maul- und Klauenseuche zu verzeichnen war; |
|
1.4 |
alle Geräte für Gewinnung, Handhabung, Waschen, Einfrieren und Lagerung der Embryonen sind Einweggeräte oder werden vor Gebrauch gemäß dem IETS-Handbuch (3) sterilisiert oder ordnungsgemäß gereinigt und desinfiziert; |
|
1.5 |
biologische Erzeugnisse tierischen Ursprungs, die in Medien und Lösungen für Gewinnung, Aufbereitung, Waschen oder Lagerung von Embryonen verwendet werden, sind frei von pathogenen Mikroorganismen; für Gewinnung, Einfrieren und Lagerung von Embryonen verwendete Medien und Lösungen werden nach zugelassenen Verfahren gemäß dem IETS-Handbuch sterilisiert und so gehandhabt, dass die Sterilität erhalten bleibt; den Medien für Gewinnung, Aufbereitung, Waschen und Lagerung dürfen gegebenenfalls gemäß dem IETS-Handbuch Antibiotika zugesetzt werden; |
|
1.6 |
kryogene Stoffe, die zur Samenkonservierung oder Samenlagerung dienen, wurden vorher nicht für andere Erzeugnisse tierischen Ursprungs eingesetzt; |
|
1.7 |
jede Paillette, Ampulle oder sonstige Packungseinheit mit Embryonen wird mit Etiketten nach dem standardisierten System gemäß dem IETS-Handbuch deutlich gekennzeichnet; |
|
1.8 |
die Embryonen werden gemäß dem IETS-Handbuch gewaschen, und ihre Zona pellucida muss vor und unmittelbar nach dem Waschen unbeschädigt sein; das Standardwaschverfahren wird dahin gehend abgeändert, dass zusätzliche Waschgänge mit dem Enzym Trypsin gemäß dem IETS-Handbuch vorgenommen werden, wenn die Inaktivierung oder Beseitigung bestimmter Viren erforderlich ist; |
|
1.9 |
Embryonen verschiedener Spendertiere dürfen nicht zusammen gewaschen werden; |
|
1.10 |
Die Zona pellucida jedes Embryos wird auf der gesamten Oberfläche mit mindestens 40 facher Vergrößerung untersucht und als unbeschädigt und frei von anhaftendem Material bescheinigt; |
|
1.11 |
Embryonen einer Charge, die die Untersuchung gemäß Nummer 1.11 erfolgreich absolviert hat, werden in eine sterile Paillette, Ampulle oder anderen Packungseinheit gegeben, die gemäß Nummer 1.7 gekennzeichnet wurde und unverzüglich verplombt wird; |
|
1.12 |
jeder Embryo wird gegebenenfalls so bald wie möglich eingefroren und an einem Ort gelagert, den der Tierarzt der Einheit beaufsichtigt; |
|
1.13 |
jede Embryo-Entnahmeeinheit legt Standardproben nicht lebensfähiger Embryonen oder Eizellen sowie der Spül- oder Waschflüssigkeiten, die sich aus ihrer Tätigkeit ergeben, gemäß dem IETS-Handbuch zur amtlichen Überprüfung auf bakterielle und virale Kontamination vor; |
|
1.14 |
jede Embryo-Entnahmeeinheit bewahrt für eine Dauer von zwei Jahren, nachdem die Embryonen für den Handel oder die Einfuhr freigegeben wurden, Aufzeichnungen über ihre Tätigkeit zur Embryonenentnahme, und zwar mit folgenden Angaben:
|
2. Gewinnung und Aufbereitung von Eizellen, Eierstöcken und anderen Geweben zur In-vitro-Erzeugung von Embryonen
Die Anforderungen gemäß den Nummern 1.1 bis 1.14 gelten entsprechend auch für die Gewinnung und Aufbereitung von Eizellen, Eierstöcken und anderen Geweben zur Verwendung in der In-vitro-Befruchtung und/oder In-vitro-Kultur. Zusätzlich gilt Folgendes:
|
2.1 |
Die zuständige Behörde muss über den/die Herkunftsbetrieb(e) der Spendertiere informiert und dafür zuständig sein; |
|
2.2 |
Werden Eierstöcke und andere Gewebe in einem Schlachthof entweder Einzeltieren oder mehreren Spendertieren (‚Sammelentnahme‘) entnommen, so ist der Schlachthof gemäß der Verordnung (EG) Nr. 854/2004 des Europäischen Parlaments und des Rates vom 29. April 2004 mit besonderen Verfahrensvorschriften für die amtliche Überwachung von zum menschlichen Verzehr bestimmten Erzeugnissen tierischen Ursprungs (4) amtlich zugelassen und untersteht der Aufsicht eines Tierarztes, dessen Aufgabe es ist sicherzustellen, dass Schlachttier- und Fleischuntersuchungen an potenziellen Spendertieren durchgeführt werden, und zu bescheinigen, dass diese frei von Anzeichen der einschlägigen, auf Tiere übertragbaren Infektionskrankheiten sind; der Schlachthof liegt in der Mitte eines Gebiets, um die im Umkreis von 10 km in den letzten 30 Tagen kein Ausbruch von Maul- und Klauenseuche zu verzeichnen war; |
|
2.3 |
Chargen von Eierstöcken dürfen nicht in das Aufbereitungslabor gebracht werden, bevor die Fleischuntersuchung an den Spendertieren abgeschlossen ist; |
|
2.4 |
Ausrüstung für die Entfernung und den Transport von Eierstöcken und anderem Gewebe ist vor der Verwendung zu reinigen und zu desinfizieren oder sterilisieren sowie ausschließlich für diese Zwecke zu verwenden. |
3. Aufbereitung in vitro erzeugter Embryonen
Die Anforderungen gemäß den Nummern 1.1 bis 1.14 gelten entsprechend auch für die Aufbereitung in vitro erzeugter Embryonen. Zusätzlich gilt Folgendes:
|
3.1 |
In vitro erzeugte Embryonen gelten als Ergebnis einer In-vitro-Befruchtung mit Samen, der die Anforderungen dieser Richtlinie erfüllt; |
|
3.2 |
nach der In-vitro-Kultur, aber vor Einfrieren, Lagerung und Beförderung der Embryonen werden diese gewaschen und gemäß den Nummern 1.8, 1.10 und 1.11 behandelt; |
|
3.3 |
Embryonen verschiedener Spendertiere (bei Entnahme von Einzeltieren) bzw. Embryonen verschiedener Chargen (bei Sammelentnahme) werden nicht zusammen gewaschen; |
|
3.4 |
Embryonen verschiedener Spendertiere (bei Entnahme von Einzeltieren) bzw. Embryonen verschiedener Chargen (bei Sammelentnahme) dürfen nicht in derselben Paillette, Ampulle oder sonstigen Packungseinheit gelagert werden. |
4. Aufbereitung mikromanipulierter Embryonen
Vor jeder Mikromanipulation, bei der die Integrität der Zona pellucida verletzt wird, werden alle Embryonen oder Eizellen nach den Hygienevorschriften der Nummern 1, 2 und 3 entnommen und aufbereitet. Zusätzlich gilt Folgendes:
|
4.1 |
Bei der Embryo-Mikromanipulation mit Penetration der Zona pellucida kommen geeignete Laboreinrichtungen zum Einsatz, die unter der Aufsicht eines zugelassenen Team-Tierarztes stehen; |
|
4.2 |
jede Embryo-Entnahmeeinheit führt Aufzeichnungen über ihre Tätigkeit gemäß Nummer 1.14, einschließlich Angaben zu Mikromanipulationstechniken an den Embryonen, die eine Penetration der Zona pellucida umfassen; werden Embryonen durch In-vitro-Befruchtung erzeugt, so kann die Kennzeichnung der Embryonen anhand der Charge erfolgen, muss jedoch Angaben über Datum und Ort der Entnahme der Eierstöcke und/oder Eizellen umfassen; darüber hinaus muss sich der Herkunftsbetrieb der Spendertiere identifizieren lassen. |
5. Lagerung von Embryonen
|
5.1 |
Jede Embryo-Entnahmeeinheit- und Embryo-Erzeugungseinheit stellt sicher, dass die Embryonen bei geeigneter Temperatur in Lagereinrichtungen im Sinne von Kapitel I Abschnitt III Nummer 1.8 gelagert werden; |
|
5.2 |
gefrorene Embryonen werden vor dem Versand ab dem Datum der Entnahme bzw. Erzeugung mindestens 30 Tage lang unter zugelassenen Bedingungen gelagert. |
6. Beförderung von Embryonen
|
6.1 |
Embryonen, die für den Handel freigegeben werden sollen, werden in Behältern in den Bestimmungsmitgliedstaat befördert, die vor Gebrauch gereinigt und desinfiziert oder sterilisiert wurden oder Einwegbehälter sind, und die vor dem Versand aus den zugelassenen Lagereinrichtungen verplombt und nummeriert wurden; |
|
6.2 |
die Pailletten, Ampullen oder sonstigen Packungseinheiten werden so gekennzeichnet, dass die Nummer auf den Pailletten, Ampullen oder sonstigen Packungseinheiten mit der Nummer auf der Gesundheitsbescheinigung gemäß Artikel 11 Absatz 3 dritter Gedankenstrich übereinstimmt und dem Behälter entspricht, in dem sie gelagert und befördert werden. |
KAPITEL IV
Anforderungen an weibliche Spendertiere
1. Embryonen und Eizellen dürfen weiblichen Spendertieren nur dann entnommen werden, wenn diese und die Betriebe, aus denen sie stammen, nach Feststellung des amtlichen Tierarztes in Bezug auf die jeweiligen Tierarten den einschlägigen Richtlinien über den Handel mit lebenden Zucht- und Nutztieren innerhalb der Union genügen.
2. Zusätzlich zu den Anforderungen der Richtlinie 64/432/EWG müssen Spendersauen — außer bei in vivo erzeugten Embryonen, die einer Trypsin-Behandlung zu unterziehen sind — den Anforderungen gemäß Artikel 9 oder 10 der genannten Richtlinie in Bezug auf die Aujeszky-Krankheit entsprechen.
3. Für Spenderzibben gilt die Richtlinie 91/68/EWG.
4. Zusätzlich zu den Anforderungen der Richtlinie 90/426/EWG gilt für Spenderstuten Folgendes:
|
4.1 |
Sie dürfen mindestens 30 Tage vor dem Datum der Entnahme von Eizellen oder Embryonen sowie zwischen dem Datum der ersten Probenahme gemäß den Nummern 4.2 und 4.3 und dem Datum der Entnahme der Eizellen bzw. Embryonen nicht im Natursprung eingesetzt werden; |
|
4.2 |
sie werden einem Agargel-Immundiffusionstest (Coggins-Test) oder einem ELISA auf infektiöse Anämie der Einhufer anhand von Blutproben unterzogen, die erstmals in den letzten 30 Tagen vor der ersten Entnahme von Eizellen oder Embryonen und danach während des Entnahmezeitraums alle 90 Tage entnommen wird; |
|
4.3 |
sie werden einem Test auf kontagiöse equine Metritis durch Isolierung des Erregers Taylorella equigenitalis unterzogen, und zwar anhand von Proben, die von den Schleimhäuten der Fossa clitoridis und des Sinus clitoridis in zwei aufeinanderfolgenden Östrusperioden entnommen werden, sowie anhand einer zusätzlichen Kulturprobe, die an der Zervikalschleimhaut während einer Östrusperiode entnommen wird, wobei bei allen das Ergebnis nach Kultivierung zwischen 7 und 14 Tagen negativ sein muss.“ |
(1) ABl. L 224 vom 18.8.1990, S. 62.
(2) ABl. L 311 vom 28.11.2001. S. 1.
(3) ‚Manual of the International Embryo Transfer Society — A procedural guide and general information for the use of embryo transfer technology emphasising sanitary procedures‘, veröffentlicht von der International Embryo Transfer Society, 1111 North Dunlap Avenue, Savoy, Illinois 61874, USA (http://www.iets.org/).
|
3.3.2010 |
DE |
Amtsblatt der Europäischen Union |
L 52/28 |
VERORDNUNG (EU) Nr. 177/2010 DER KOMMISSION
vom 2. März 2010
zur Änderung der Verordnung (EWG) Nr. 2454/93 mit Durchführungsvorschriften zu der Verordnung (EWG) Nr. 2913/92 des Rates zur Festlegung des Zollkodex der Gemeinschaften
DIE EUROPÄISCHE KOMMISSION —
gestützt auf den Vertrag über die Arbeitsweise der Europäischen Union,
gestützt auf die Verordnung (EWG) Nr. 2913/92 des Rates vom 12. Oktober 1992 zur Festlegung des Zollkodex der Gemeinschaften (1), insbesondere auf Artikel 247,
in Erwägung nachstehender Gründe:
|
(1) |
Aus Gründen der Klarheit sollte die Struktur des Artikel 313 der Verordnung (EWG) Nr. 2454/93 (2), in dem festgelegt ist, unter welchen Umständen Waren als Waren mit Gemeinschaftscharakter gelten, geändert werden. |
|
(2) |
Zur Errichtung eines europäischen Seeverkehrsraums ohne Grenzen im Sinne der Mitteilung und des Aktionsplans der Kommission zur Errichtung eines europäischen Seeverkehrsraums ohne Grenzen (3) sollten die Aufgaben der Wirtschaftsbeteiligten und der Zollverwaltungen im Zusammenhang mit Waren, die auf dem Seeweg zwischen Häfen im Zollgebiet der Gemeinschaft befördert werden, vereinfacht werden. |
|
(3) |
Insbesondere sollte ein Verfahren für die Zulassung zur Einrichtung eines Linienverkehrs und für die Registrierung der Schiffe vorgesehen werden; dabei sollte von dem elektronischen Informations- und Kommunikationssystem für die Ausstellung von AEO-Zertifikaten gemäß Artikel 14x der Verordnung (EWG) Nr. 2454/93 Gebrauch gemacht werden. |
|
(4) |
Um die Verwendung von Papierdokumenten zu verringern, sollte der in Artikel 324e der Verordnung (EWG) Nr. 2454/93 genannte Ausdruck des im Wege des elektronischen Datenaustauschs übermittelten Manifests nicht vorgelegt werden müssen, wenn die Zollbehörden an das elektronische Informations- und Kommunikationssystem, in dem das Datenaustauschmanifest registriert ist, angeschlossen sind. |
|
(5) |
Artikel 324c Absatz 1 sollte geändert werden, damit er den korrekten Verweis auf die Sicherheitsmaßnahmen im Hinblick auf die Stempel enthält. Der falsche Verweis auf Anhang 37c der Verordnung (EWG) Nr. 2454/93 in den Bemerkungen zu den einzelnen Daten der Versandanmeldung in Anhang 37a der Verordnung (EWG) Nr. 2454/93 in der Fassung der Verordnung (EG) Nr. 1192/2008 (4) sollte geändert werden. |
|
(6) |
Die Verordnung (EWG) Nr. 2454/93 sollte daher entsprechend geändert werden. |
|
(7) |
Im Interesse der berechtigten Erwartungen der Wirtschaftsbeteiligten sollte eine vor dem Zeitpunkt der Anwendung dieser Verordnung erteilte Zulassung zur Einrichtung eines Linienverkehrs als im Einklang mit dieser Verordnung erteilte Zulassung gelten. Um sicherzustellen, dass alle Zulassungen in demselben elektronischen System verfügbar sind, sollten frühere Zulassungen in dem elektronischen Informations- und Kommunikationssystem für die Ausstellung von AEO-Zertifikaten gespeichert werden. |
|
(8) |
Mitgliedstaaten und Zollbehörden sollte ausreichend Zeit eingeräumt werden, ein voll funktionierendes elektronisches Informations- und Kommunikationssystem einzurichten. |
|
(9) |
Da die Vorschriften über die Bemerkungen zu den einzelnen Daten der Versandanmeldung in Anhang 37a der Verordnung (EWG) Nr. 2454/93 in der Fassung der Verordnung (EG) Nr. 1192/2008 ab 1. Juli 2008 anwendbar sind, sollten die Änderungen dieser Vorschriften ebenfalls ab diesem Zeitpunkt anwendbar sein. |
|
(10) |
Die in dieser Verordnung vorgesehenen Maßnahmen entsprechen der Stellungnahme des Ausschusses für den Zollkodex — |
HAT FOLGENDE VERORDNUNG ERLASSEN:
Artikel 1
Die Verordnung (EWG) Nr. 2454/93 wird wie folgt geändert:
|
1. |
Artikel 313 erhält folgende Fassung: „Artikel 313 (1) Unbeschadet Artikel 180 des Zollkodex und der in Absatz 2 des vorliegenden Artikels aufgeführten Ausnahmen gelten alle im Zollgebiet der Gemeinschaft befindlichen Waren als Gemeinschaftswaren, es sei denn, es wird der Nachweis erbracht, dass sie nicht Gemeinschaftscharakter besitzen. (2) Folgende Waren gelten nicht als Gemeinschaftswaren, es sei denn, der Nachweis für ihren Gemeinschaftscharakter wird nach den Artikeln 314 bis 323 dieser Verordnung ordnungsgemäß erbracht:
(3) Abweichend von Absatz 2 Buchstabe a gelten in das Zollgebiet der Gemeinschaft verbrachte Waren als Gemeinschaftswaren, wenn sie:
|
|
2. |
Artikel 313a und 313b erhalten folgende Fassung: „Artikel 313a Unter Linienverkehr ist ein Seeverkehrsdienst zu verstehen, in dem die Schiffe Waren nur zwischen Häfen im Zollgebiet der Gemeinschaft befördern und ihre Herkunfts- und Bestimmungshäfen oder gegebenenfalls Zwischenhäfen nicht außerhalb des Zollgebiets der Gemeinschaft oder in einer Freizone des Kontrolltyps I im Sinne von Artikel 799 in einem Hafen im Zollgebiet der Gemeinschaft liegen dürfen. Artikel 313b (1) Einer Schifffahrtsgesellschaft kann auf Antrag bei den Zollbehörden des Mitgliedstaats, in dessen Hoheitsgebiet sie niedergelassen ist oder andernfalls ein Regionalbüro unterhält, die Zulassung zur Einrichtung eines Linienverkehrs erteilt werden, sofern die Voraussetzungen dieses Artikels und des Artikels 313c erfüllt sind. (2) Die Zulassung wird nur Schifffahrtsgesellschaften erteilt, die
(3) Im Antrag auf Zulassung zur Einrichtung eines Linienverkehrs sind die von diesem Verkehr betroffenen Mitgliedstaaten anzugeben. Die Zollbehörden des Mitgliedstaats, in dem der Antrag gestellt wurde (nachfolgend: ‚bewilligende Zollbehörden‘), benachrichtigen die Zollbehörden der anderen von dem Verkehr betroffenen Mitgliedstaaten (nachfolgend: ‚korrespondierende Zollbehörden‘) mittels des in Artikel 14x genannten elektronischen Informations- und Kommunikationssystems. Unbeschadet Absatz 4 können die korrespondierenden Zollbehörden innerhalb von 45 Tagen nach Eingang einer solchen Benachrichtigung den Antrag aus dem Grund ablehnen, dass die Voraussetzung in Absatz 2 Buchstabe b nicht erfüllt ist und die Ablehnung mittels des in Artikel 14x genannten Informations- und Kommunikationssystems mitteilen. Die korrespondierenden Zollbehörden geben die Gründe der Ablehnung sowie die die Zuwiderhandlungen betreffenden Rechtsvorschriften an. In diesem Fall erteilt die bewilligende Zollbehörde die Zulassung nicht und unterrichtet den Antragsteller über die Ablehnung und deren Gründe. In Ermangelung einer Antwort oder Ablehnung seitens der korrespondierenden Zollbehörden erteilt die bewilligende Zollbehörde nach Prüfung, ob die Voraussetzungen für die Zulassung erfüllt sind, die Zulassung, die von den anderen von dem Verkehr betroffenen Mitgliedstaaten anerkannt wird. Die Zulassung wird in dem in Artikel 14x genannten Informations- und Kommunikationssystem registriert und den korrespondierenden Zollbehörden wird durch dieses Informations- und Kommunikationssystem mitgeteilt, dass die Zulassung erteilt wurde. (4) Ist die Schifffahrtsgesellschaft Inhaber eines AEO-Zertifikats nach Artikel 14a Absatz 1 Buchstabe a oder c, so gelten die in Absatz 2 Buchstaben a und b genannten Anforderungen im Sinne von Absatz 3 als erfüllt.“ |
|
3. |
Die folgenden Artikel 313c bis 313f werden eingefügt: „Artikel 313c (1) Eine Schifffahrtsgesellschaft, der gemäß Artikel 313b die Zulassung zur Einrichtung eines Linienverkehrs erteilt wurde, setzt die Zulassung für zu diesem Zweck registrierte Schiffe ein. (2) Die Schifffahrtsgesellschaft unterrichtet die bewilligende Zollbehörde über alle Umstände, die nach Erteilung der Zulassung eingetreten sind und sich auf deren Aufrechterhaltung oder Inhalt auswirken können. Wird die Zulassung seitens der bewilligenden Zollbehörde oder auf Antrag der Schifffahrtsgesellschaft widerrufen, so teilt die bewilligende Zollbehörde den korrespondierenden Zollbehörden den Widerruf mittels des in Artikel 14x genannten Informations- und Kommunikationssystems mit. (3) Wird die Zulassung dahingehend geändert, dass sie auch für Mitgliedstaaten gilt, die in der ersten oder einer früheren Zulassung nicht genannt wurden, so kommt das Verfahren des Artikels 313b Absatz 3 zur Anwendung. Artikel 313b Absatz 4 gilt sinngemäß. Artikel 313d (1) Eine Schifffahrtsgesellschaft, der die Zulassung zur Einrichtung eines Linienverkehrs erteilt wurde, übermittelt der bewilligenden Zollbehörde folgende Angaben:
(2) Die bewilligende Zollbehörde registriert die gemäß Absatz 1 übermittelten Angaben innerhalb eines Arbeitstags in dem in Artikel 14x genannten Informations- und Kommunikationssystem; sie sind den Zollbehörden, die in im Zollgebiet der Gemeinschaft gelegenen Häfen tätig sind, zugänglich. Die Registrierung wird am ersten Arbeitstag nach der Registrierung wirksam. Artikel 313e Ist ein für einen Linienverkehr registriertes Schiff infolge höherer Gewalt oder eines unvorhergesehenen Ereignisses gezwungen, eine Umladung auf hoher See vorzunehmen oder vorübergehend in einem Hafen anzulegen, der nicht Teil des Linienverkehrs ist, was Häfen eines Drittlands oder Freizonen des Kontrolltyps I in einem im Zollgebiet der Gemeinschaft gelegenen Hafen einschließt, so benachrichtigt die Schifffahrtsgesellschaft unverzüglich die Zollbehörden der nächsten Gemeinschaftsanlaufhäfen einschließlich der an der planmäßigen Strecke gelegenen Häfen. In solchen Häfen geladene oder entladene Waren gelten nicht als Gemeinschaftswaren. Artikel 313f (1) Die Zollbehörden können von der Schifffahrtsgesellschaft einen Nachweis über die Einhaltung der Vorschriften der Artikel 313b bis 313e verlangen. (2) Stellen die Zollbehörden fest, dass die in Absatz 1 genannten Vorschriften von der Schifffahrtsgesellschaft nicht eingehalten wurden, so benachrichtigen sie mittels des in Artikel 14x genannten Informations- und Kommunikationssystems unverzüglich alle von dem Linienverkehr betroffenen Zollbehörden, damit diese die erforderlichen Maßnahmen ergreifen können.“ |
|
4. |
Artikel 324c Absatz 1 Unterabsatz 2 erhält folgende Fassung: „Anhang 37d Abschnitt 27 gilt sinngemäß.“ |
|
5. |
Artikel 324e Absatz 4 Buchstaben c und d erhalten folgende Fassung:
|
|
6. |
Anhang 37a Titel II Abschnitt B „Bemerkungen zu den einzelnen Daten der Versandanmeldung“ Datengruppe „PACKSTÜCKE“ wird wie folgt geändert:
|
||||||||||||||||
Artikel 2
Eine vor dem in Artikel 3 Absatz 2 dieser Verordnung genannten Zeitpunkt der Anwendung erteilte Zulassung zur Einrichtung eines Linienverkehrs gilt als im Einklang mit der Verordnung (EWG) Nr. 2454/93 in der durch diese Verordnung geänderten Fassung erteilte Zulassung.
Die bewilligende Zollbehörde speichert eine solche Zulassung innerhalb eines Monats ab dem in Artikel 3 Absatz 2 dieser Verordnung genannten Zeitpunkt der Anwendung dieser Verordnung in dem in Artikel 14x der Verordnung (EWG) Nr. 2454/93 genannten elektronischen Informations- und Kommunikationssystem.
Artikel 3
Diese Verordnung tritt am siebten Tag nach ihrer Veröffentlichung im Amtsblatt der Europäischen Union in Kraft.
Artikel 1 Nummern 2 und 3 gelten ab dem 1. Januar 2012.
Artikel 1 Nummern 4 und 6 gelten ab dem 1. Juli 2008.
Diese Verordnung ist in allen ihren Teilen verbindlich und gilt unmittelbar in jedem Mitgliedstaat.
Brüssel, den 2. März 2010
Für die Kommission
Der Präsident
José Manuel BARROSO
(1) ABl. L 302 vom 19.10.1992, S. 1.
(2) ABl. L 253 vom 11.10.1993, S. 1.
(3) KOM(2009) 10 endgültig.
(4) ABl. L 329 vom 6.12.2008, S. 1.
|
3.3.2010 |
DE |
Amtsblatt der Europäischen Union |
L 52/32 |
VERORDNUNG (EU) Nr. 178/2010 DER KOMMISSION
vom 2. März 2010
zur Änderung der Verordnung (EG) Nr. 401/2006 hinsichtlich Erdnüssen, sonstigen Ölsaaten, Nüssen, Aprikosenkernen, Süßholz und pflanzlichem Öl
(Text von Bedeutung für den EWR)
DIE EUROPÄISCHE KOMMISSION —
gestützt auf den Vertrag über die Arbeitsweise der Europäischen Union,
gestützt auf die Verordnung (EG) Nr. 882/2004 des Europäischen Parlaments und des Rates vom 29. April 2004 über amtliche Kontrollen zur Überprüfung der Einhaltung des Lebensmittel- und Futtermittelrechts sowie der Bestimmungen über Tiergesundheit und Tierschutz (1), insbesondere auf Artikel 11 Absatz 4,
in Erwägung nachstehender Gründe:
|
(1) |
Die Verordnung (EG) Nr. 1881/2006 der Kommission vom 19. Dezember 2006 zur Festsetzung der Höchstgehalte für bestimmte Kontaminanten in Lebensmitteln (2) sieht Höchstgehalte für bestimmte Mykotoxine in bestimmten Lebensmitteln vor. |
|
(2) |
Die Probenahme spielt eine entscheidende Rolle, was die Genauigkeit der Bestimmung des Gehalts an Mykotoxinen anbelangt, die in einer Partie sehr heterogen verteilt sind. Daher ist es notwendig, allgemeine Kriterien festzulegen, die die Probenahmeverfahren erfüllen sollten. |
|
(3) |
In der Verordnung (EG) Nr. 401/2006 der Kommission vom 23. Februar 2006 zur Festlegung der Probenahmeverfahren und Analysemethoden für die amtliche Kontrolle des Mykotoxingehalts von Lebensmitteln (3) sind die Kriterien für die Probenahme und die Kontrolle des Mykotoxingehalts festgelegt. |
|
(4) |
Es ist erforderlich, einige Bestimmungen über die Probenahme zur Kontrolle auf Aflatoxine in bestimmten Lebensmitteln zu ändern, damit Entwicklungen im Codex Alimentarius sowie vor kurzem festgelegten Höchstgehalten für Mykotoxine in neuen Lebensmittelkategorien Rechnung getragen werden kann. |
|
(5) |
Im Codex Alimentarius wurde ein neuer Probenahmeplan für Erdnüsse, Mandeln, Haselnüsse und Pistazien zur weiteren Verarbeitung sowie ein neuer Probenahmeplan für verzehrfertige Mandeln, Haselnüsse und Pistazien festgelegt (4). |
|
(6) |
Zur leichteren Durchsetzung der Höchstgehalte für Aflatoxine sollten die Probenahmebestimmungen gemäß dem Codex Alimentarius für Erdnüsse, Mandeln, Haselnüsse und Pistazien zur weiteren Verarbeitung auch auf sonstige Nüsse zur weiteren Verarbeitung und die Probenahmebestimmungen gemäß dem Codex für verzehrfertige Mandeln, Haselnüsse und Pistazien auf sonstige verzehrfertige Nüsse und Erdnüsse angewandt werden. Das Probenahmeverfahren für Nüsse sollte auch für Aprikosenkerne gelten. Daher sollte Anhang I Teil D der Verordnung (EG) Nr. 401/2006 entsprechend geändert werden, sodass er nur das Probenahmeverfahren für getrocknete Feigen umfasst, das unverändert bleiben sollte, und das neue Probenahmeverfahren für Erdnüsse, sonstige Ölsaaten, Aprikosenkerne, Nüsse sollte in einem getrennten Teil des Anhangs festgelegt werden. |
|
(7) |
Für Aflatoxine in anderen Ölsaaten als Erdnüssen (5) und für Ochratoxin A in Gewürzen, Süßholzwurzel und Süßholzauszug (6) wurden Höchstgehalte festgelegt. Für diese neuen Lebensmittelkategorien sollten besondere Probenahmebestimmungen festgelegt werden und es sollte gegebenenfalls auf geltende Bestimmungen Bezug genommen werden. |
|
(8) |
Bei der Beprobung von pflanzlichen Ölen zur Kontrolle auf Mykotoxine sind Besonderheiten zu beachten und daher sollten besondere Probenahmeregeln festgelegt werden. |
|
(9) |
Die in dieser Verordnung vorgesehenen Maßnahmen entsprechen der Stellungnahme des Ständigen Ausschusses für die Lebensmittelkette und Tiergesundheit — |
HAT FOLGENDE VERORDNUNG ERLASSEN:
Artikel 1
Anhang I der Verordnung (EG) Nr. 401/2006 wird wie folgt geändert:
|
1. |
Teil D wird durch den Wortlaut des Anhangs I der vorliegenden Verordnung ersetzt. |
|
2. |
In Teil E erhält der erste Satz folgende Fassung: „Dieses Probenahmeverfahren ist bei der amtlichen Kontrolle der Höchstgehalte an Ochratoxin A, Aflatoxin B1 und Gesamtaflatoxinen in Gewürzen anzuwenden.“ |
|
3. |
Teil G wird durch den Wortlaut des Anhangs II der vorliegenden Verordnung ersetzt. |
|
4. |
Ein Teil K gemäß Anhang III der vorliegenden Verordnung wird angefügt. |
Artikel 2
Diese Verordnung tritt am zehnten Tag nach ihrer Veröffentlichung im Amtsblatt der Europäischen Union in Kraft.
Sie gilt ab dem Datum des Inkrafttretens.
Diese Verordnung ist in allen ihren Teilen verbindlich und gilt unmittelbar in jedem Mitgliedstaat.
Brüssel, den 2. März 2010
Für die Kommission
Der Präsident
José Manuel BARROSO
(1) ABl. L 165 vom 30.4.2004, S. 1.
(2) ABl. L 364 vom 20.12.2006, S. 5.
(3) ABl. L 70 vom 9.3.2006, S. 12.
(4) Allgemeiner Codex-Standard für Kontaminanten und Toxine in Lebensmitteln (CODEX STAN 193-1995) http://www.codexalimentarius.net/download/standards/17/CXS_193e.pdf
(5) Verordnung (EU) Nr. 165/2010 der Kommission vom 26. Frebruar 2010 zur Änderung der Verordnung (EG) Nr. 1881/2006 zur Festsetzung der Höchstgehalte für bestimmte Kontaminanten in Lebensmitteln hinsichtlich Aflatoxinen (ABl. L 50 vom 27.2.2010, S. 8).
(6) Verordnung (EU) Nr. 105/2010 der Kommission vom 5. Februar 2010 zur Änderung der Verordnung (EG) Nr. 1881/2006 zur Festsetzung der Höchstgehalte für bestimmte Kontaminanten in Lebensmitteln hinsichtlich Ochratoxin A (ABl. L 35 vom 6.2.2010, S. 7).
ANHANG I
„D.1. Probenahmeverfahren für getrocknete feigen
Dieses Probenahmeverfahren ist bei der amtlichen Kontrolle der Höchstgehalte an Aflatoxin B1 und Gesamtaflatoxinen in getrockneten Feigen anzuwenden.
D.1.1. Gewicht der Einzelprobe
Das Gewicht der Einzelprobe beträgt rund 300 g, soweit in diesem Teil D.1 des Anhangs I nicht anders definiert.
Bei Partien in Einzelhandelspackungen hängt das Gewicht der Einzelprobe vom Gewicht der Einzelhandelspackung ab.
Bei Einzelhandelspackungen mit mehr als 300 g Inhalt führt dies zu Sammelproben von über 30 kg. Wiegt eine Einzelhandelspackung wesentlich mehr als 300 g, werden 300 g aus jeder einzelnen Einzelhandelspackung als Einzelprobe entnommen. Dies kann bei der Probenahme oder im Labor erfolgen. In Fällen, in denen ein derartiges Probenahmeverfahren zu unannehmbaren Folgen für den Handel führen würde, weil die Partie beschädigt wird (wegen der Verpackungsart, der Transportweise usw.), können andere Probenahmeverfahren angewandt werden. Dies ist beispielsweise der Fall bei wertvollen Erzeugnissen, die in Einzelhandelspackungen von 500 g oder 1 kg vermarktet werden. In einem solchen Fall kann die Sammelprobe durch Zusammenfassung einer Anzahl Einzelproben gebildet werden, die geringer ist als die in den Tabellen 1, 2 und 3 angegebene Anzahl; dabei muss das Gewicht der Sammelprobe dem in den Tabellen 1, 2 und 3 angegebenen Gewicht entsprechen.
Wiegt die Einzelhandelspackung weniger als 300 g und ist der Unterschied nicht sehr groß, ist eine Einzelhandelspackung als eine Einzelprobe anzusehen, was zu einer Sammelprobe von weniger als 30 kg führt. Wiegt die Einzelhandelspackung wesentlich weniger als 300 g, besteht eine Einzelprobe aus zwei oder mehr Einzelhandelspackungen, wobei das Gewicht soweit wie möglich an 300 g anzunähern ist.
D.1.2. Allgemeiner Überblick über das Probenahmeverfahren für getrocknete Feigen
Tabelle 1
Unterteilung von Partien in Teilpartien nach Erzeugnis und Partiegewicht
|
Ware |
Partiegewicht (t) |
Gewicht oder Anzahl der Teilpartien |
Anzahl der Einzelproben |
Sammelprobe Gewicht (kg) |
|
Getrocknete Feigen |
≥ 15 |
15-30 t |
100 |
30 |
|
< 15 |
— |
10-100 (1) |
≤ 30 |
D.1.3. Probenahmeverfahren für getrocknete Feigen (Partien ≥ 15 Tonnen)
|
— |
Unter der Bedingung, dass die Teilpartie physisch getrennt werden kann, ist jede Partie gemäß Tabelle 1 in Teilpartien aufzuteilen. Da das Gewicht der Partie nicht immer ein exaktes Vielfaches des Gewichts der Teilpartien ist, darf das Gewicht der Teilpartie das genannte Gewicht um höchstens 20 % überschreiten. |
|
— |
Jede Teilpartie ist getrennt zu beproben. |
|
— |
Anzahl der Einzelproben: 100. |
|
— |
Gewicht der Sammelprobe = 30 kg; diese wird gemischt und vor der Mahlung in drei gleiche Laborproben von je 10 kg aufgeteilt (diese Aufteilung in drei Laborproben ist nicht notwendig bei getrockneten Feigen, die weiter sortiert oder anderweitig behandelt werden, und wenn Geräte zur Verfügung stehen, mit denen eine 30-kg-Probe homogenisiert werden kann). |
|
— |
Jede Laborprobe von 10 kg muss gemäß Anhang II einzeln fein vermahlen und gründlich gemischt werden, damit eine vollständige Homogenisierung erreicht wird. |
|
— |
Ist es nicht möglich, das vorstehend beschriebene Probenahmeverfahren anzuwenden, da sich aus einer Beschädigung der Partie unannehmbare Folgen für den Handel ergeben würden (wegen der Verpackungsart, der Transportweise usw.), so kann ein alternatives Probenahmeverfahren angewendet werden, sofern dieses so repräsentativ wie möglich ist und umfassend beschrieben und dokumentiert wird. |
D.1.4. Probenahmeverfahren für getrocknete Feigen (Partien < 15 Tonnen)
Die Anzahl der zu entnehmenden Einzelproben hängt vom Gewicht der Partie ab, wobei mindestens 10 und höchstens 100 Proben zu entnehmen sind.
Anhand von Tabelle 2 kann die Anzahl der zu entnehmenden Einzelproben und die nachfolgende Aufteilung der Sammelprobe ermittelt werden.
Tabelle 2
Anzahl der Einzelproben in Abhängigkeit vom Gewicht der Partie und der Anzahl der Teile der Sammelprobe
|
Partiegewicht (t) |
Anzahl der Einzelproben |
Gewicht der Sammelprobe (kg) (bei Einzelhandelspackungen kann das Gewicht der Sammelprobe abweichen — s. D.1.1) |
Anzahl der Laborproben aus der Sammelprobe |
|
≤ 0,1 |
10 |
3 |
1 (keine Teilung) |
|
> 0,1 – ≤ 0,2 |
15 |
4,5 |
1 (keine Teilung) |
|
> 0,2 – ≤ 0,5 |
20 |
6 |
1 (keine Teilung) |
|
> 0,5 – ≤ 1,0 |
30 |
9 (– < 12 kg) |
1 (keine Teilung) |
|
> 1,0 – ≤ 2,0 |
40 |
12 |
2 |
|
> 2,0 – ≤ 5,0 |
60 |
18 (– < 24 kg) |
2 |
|
> 5,0 – ≤ 10,0 |
80 |
24 |
3 |
|
> 10,0 – ≤ 15,0 |
100 |
30 |
3 |
|
— |
Gewicht der Sammelprobe ≤ 30 kg; diese wird gemischt und vor der Mahlung in zwei oder drei gleiche Laborproben von je ≤ 10 kg aufgeteilt (diese Aufteilung in zwei oder drei Laborproben ist nicht notwendig bei getrockneten Feigen, die weiter sortiert oder anderweitig behandelt werden, und wenn Geräte zur Verfügung stehen, mit denen eine Probe von bis zu 30 kg homogenisiert werden kann). Wiegt die Sammelprobe weniger als 30 kg, muss sie folgendermaßen in Laborproben unterteilt werden:
|
|
— |
Jede Laborprobe muss gemäß Anhang II einzeln fein vermahlen und gründlich gemischt werden, damit eine vollständige Homogenisierung erreicht wird. |
|
— |
Ist es nicht möglich, das vorstehend beschriebene Probenahmeverfahren anzuwenden, da sich aus einer Beschädigung der Partie unannehmbare Folgen für den Handel ergeben würden (wegen der Verpackungsart, der Transportweise usw.), so kann ein alternatives Probenahmeverfahren angewendet werden, sofern dieses so repräsentativ wie möglich ist und umfassend beschrieben und dokumentiert wird. |
D.1.5. Probenahmeverfahren bei Verarbeitungserzeugnissen und zusammengesetzten Lebensmitteln
D.1.5.1.
|
— |
Anzahl der Einzelproben: 100; bei Partien unter 50 Tonnen sollten (abhängig vom Partiegewicht, siehe Tabelle 3) 10 bis 100 Einzelproben entnommen werden. Tabelle 3 Anzahl der Einzelproben in Abhängigkeit vom Gewicht der Partie
|
|
— |
Eine Einzelprobe sollte etwa 100 g wiegen. Bei Partien in Einzelhandelspackungen hängt das Gewicht der Einzelprobe vom Gewicht der Einzelhandelspackung ab. |
|
— |
Gewicht der Sammelprobe = 1-10 kg, ausreichend gemischt. |
D.1.5.2.
Probenahmeverfahren und Akzeptanz wie bei getrockneten Feigen (D.1.3 und D.1.4).
D.1.6. Probenahme im Einzelhandel
Die Probenahme von Lebensmitteln auf der Einzelhandelsebene sollte, soweit dies möglich ist, nach den in diesem Teil von Anhang I beschriebenen Bestimmungen durchgeführt werden.
In Fällen, in denen dies nicht möglich ist, können andere geeignete Probenahmeverfahren auf der Einzelhandelsebene angewandt werden, sofern die nach diesen Verfahren entnommene Sammelprobe ausreichend repräsentativ für die beprobten Partien ist und ausführlich beschrieben und dokumentiert wird. In jedem Fall muss die Sammelprobe mindestens 1 kg wiegen (2).
D.1.7. Spezifisches Probenahmeverfahren für getrocknete Feigen und Verarbeitungserzeugnisse, die in Vakuumpackungen gehandelt werden
D.1.7.1.
Bei Partien größer gleich 15 Tonnen sind mindestens 50 Einzelproben zu entnehmen, die eine Sammelprobe von 30 kg ergeben; bei Partien kleiner als 15 Tonnen sind 50 % der in Tabelle 2 genannten Anzahl an Einzelproben zu entnehmen, was zu einer Sammelprobe führt, deren Gewicht dem Gewicht der beprobten Partie entspricht (s. Tabelle 2).
D.1.7.2.
Bei Partien größer gleich 50 Tonnen sind mindestens 25 Einzelproben zu entnehmen, was eine Sammelprobe von 10 kg ergibt, und bei Partien kleiner als 50 Tonnen sind 25 % der in Tabelle 3 genannten Anzahl an Einzelproben zu entnehmen, deren Gewicht dem Gewicht der beprobten Partie entspricht (s. Tabelle 3).
D.1.8. Akzeptanz einer Partie oder Teilpartie
Bei getrockneten Feigen, die einer Sortierung oder anderen Behandlung unterzogen wurden:
|
— |
Akzeptanz, wenn die Sammelprobe oder der Durchschnitt der Laborproben den Höchstgehalt nicht überschreitet, wobei die Berichtigung um die Wiederfindungsrate und die Messunsicherheit berücksichtigt wird; |
|
— |
Zurückweisung, wenn die Sammelprobe oder der Durchschnitt der Laborproben den Höchstgehalt zweifelsfrei überschreitet, wobei die Berichtigung um die Wiederfindungsrate und die Messunsicherheit berücksichtigt wird. |
Bei zum unmittelbaren Verzehr bestimmten getrockneten Feigen:
|
— |
Akzeptanz, wenn keine Laborprobe den Höchstgehalt überschreitet, wobei die Berichtigung um die Wiederfindungsrate und die Messunsicherheit berücksichtigt wird; |
|
— |
Zurückweisung, wenn eine Laborprobe oder mehrere Laborproben den Höchstgehalt zweifelsfrei überschreitet/überschreiten, wobei die Berichtigung um die Wiederfindungsrate und die Messunsicherheit berücksichtigt wird. |
In Fällen, in denen die Sammelprobe höchstens 12 kg wiegt:
|
— |
Akzeptanz, wenn die Laborprobe den Höchstgehalt nicht überschreitet, wobei die Berichtigung um die Wiederfindungsrate und die Messunsicherheit berücksichtigt wird; |
|
— |
Zurückweisung, wenn die Laborprobe den Höchstgehalt zweifelsfrei überschreitet, wobei die Berichtigung um die Wiederfindungsrate und die Messunsicherheit berücksichtigt wird. |
D.2. Probenahmeverfahren für erdnüsse, sonstige ölsaaten, aprikosenkerne und nüsse
Dieses Probenahmeverfahren ist bei der amtlichen Kontrolle der Höchstgehalte an Aflatoxin B1 und Gesamtaflatoxinen in Erdnüssen, sonstigen Ölsaaten, Aprikosenkernen und Nüssen anzuwenden.
D.2.1. Gewicht der Einzelprobe
Das Gewicht der Einzelprobe beträgt rund 200 g, soweit in diesem Teil D.2 des Anhangs I nicht anders definiert.
Bei Partien in Einzelhandelspackungen hängt das Gewicht der Einzelprobe vom Gewicht der Einzelhandelspackung ab.
Bei Einzelhandelspackungen mit mehr als 200 g Inhalt führt dies zu Sammelproben von über 20 kg. Wiegt eine Einzelhandelspackung wesentlich mehr als 200 g, werden 200 g aus jeder einzelnen Einzelhandelspackung als Einzelprobe entnommen. Dies kann bei der Probenahme oder im Labor erfolgen. In Fällen, in denen ein derartiges Probenahmeverfahren zu unannehmbaren Folgen für den Handel führen würde, weil die Partie beschädigt wird (wegen der Verpackungsart, der Transportweise usw.), können andere Probenahmeverfahren angewandt werden. Dies ist beispielsweise der Fall bei wertvollen Erzeugnissen, die in Einzelhandelspackungen von 500 g oder 1 kg vermarktet werden. In einem solchen Fall kann die Sammelprobe durch Zusammenfassung einer Anzahl Einzelproben gebildet werden, die geringer ist als die in den Tabellen 1, 2 und 3 angegebene Anzahl; dabei muss das Gewicht der Sammelprobe dem in den Tabellen 1, 2 und 3 angegebenen Gewicht entsprechen.
Wiegt die Einzelhandelspackung weniger als 200 g und ist der Unterschied nicht sehr groß, ist eine Einzelhandelspackung als eine Einzelprobe anzusehen, was zu einer Sammelprobe von weniger als 20 kg führt. Wiegt die Einzelhandelspackung wesentlich weniger als 200 g, besteht eine Einzelprobe aus zwei oder mehr Einzelhandelspackungen, wobei das Gewicht soweit wie möglich an 200 g anzunähern ist.
D.2.2. Allgemeiner Überblick über das Probenahmeverfahren für Erdnüsse, sonstige Ölsaaten, Aprikosenkerne und Nüsse
Tabelle 1
Unterteilung von Partien in Teilpartien nach Erzeugnis und Partiegewicht
|
Ware |
Partiegewicht (t) |
Gewicht oder Anzahl der Teilpartien |
Anzahl der Einzelproben |
Sammelprobe Gewicht (kg) |
|
Erdnüsse, sonstige Ölsaaten, Aprikosenkerne und Nüsse |
≥ 500 |
100 t |
100 |
20 |
|
> 125 und < 500 |
5 Teilpartien |
100 |
20 |
|
|
≥ 15 und ≤ 125 |
25 t |
100 |
20 |
|
|
< 15 |
— |
10-100 (3) |
≤ 20 |
D.2.3. Probenahmeverfahren für Erdnüsse, sonstige Ölsaaten, Aprikosenkerne und Nüsse (Partien ≥ 15 Tonnen)
|
— |
Unter der Bedingung, dass die Teilpartie physisch getrennt werden kann, ist jede Partie gemäß Tabelle 1 in Teilpartien aufzuteilen. Da das Gewicht der Partie nicht immer ein exaktes Vielfaches des Gewichts der Teilpartien ist, darf das Gewicht der Teilpartie das genannte Gewicht um höchstens 20 % überschreiten. |
|
— |
Jede Teilpartie ist getrennt zu beproben. |
|
— |
Anzahl der Einzelproben: 100. |
|
— |
Gewicht der Sammelprobe = 20 kg; diese wird gemischt und vor der Mahlung in zwei gleiche Laborproben von je 10 kg aufgeteilt (diese Aufteilung in drei Laborproben ist nicht notwendig bei Erdnüssen und Nüssen, die weiter sortiert oder anderweitig behandelt werden, und wenn Geräte zur Verfügung stehen, mit denen eine 30-kg-Probe homogenisiert werden kann). |
|
— |
Jede Laborprobe von 10 kg muss gemäß Anhang II einzeln fein vermahlen und gründlich gemischt werden, damit eine vollständige Homogenisierung erreicht wird. |
|
— |
Ist es nicht möglich, das vorstehend beschriebene Probenahmeverfahren anzuwenden, da sich aus einer Beschädigung der Partie unannehmbare Folgen für den Handel ergeben würden (wegen der Verpackungsart, der Transportweise usw.), so kann ein alternatives Probenahmeverfahren angewendet werden, sofern dieses so repräsentativ wie möglich ist und umfassend beschrieben und dokumentiert wird. |
D.2.4. Probenahmeverfahren für Erdnüsse, sonstige Ölsaaten, Aprikosenkerne und Nüsse (Partien < 15 Tonnen)
Die Anzahl der zu entnehmenden Einzelproben hängt vom Gewicht der Partie ab, wobei mindestens 10 und höchstens 100 Proben zu entnehmen sind.
Anhand von Tabelle 2 kann die Anzahl der zu entnehmenden Einzelproben und die nachfolgende Aufteilung der Sammelprobe ermittelt werden.
Tabelle 2
Anzahl der Einzelproben in Abhängigkeit vom Gewicht der Partie und der Anzahl der Teile der Sammelprobe
|
Partiegewicht (t) |
Anzahl der Einzelproben |
Gewicht der Sammelprobe (kg) (bei Einzelhandelspackungen kann das Gewicht der Sammelprobe abweichen — s. D.2.1) |
Anzahl der Laborproben aus der Sammelprobe |
|
≤ 0,1 |
10 |
2 |
1 (keine Teilung) |
|
> 0,1 – ≤ 0,2 |
15 |
3 |
1 (keine Teilung) |
|
> 0,2 – ≤ 0,5 |
20 |
4 |
1 (keine Teilung) |
|
> 0,5 – ≤ 1,0 |
30 |
6 |
1 (keine Teilung) |
|
> 1,0 – ≤ 2,0 |
40 |
8 (– < 12 kg) |
1 (keine Teilung) |
|
> 2,0 – ≤ 5,0 |
60 |
12 |
2 |
|
> 5,0 – ≤ 10,0 |
80 |
16 |
2 |
|
> 10,0 – ≤ 15,0 |
100 |
20 |
2 |
|
— |
Gewicht der Sammelprobe ≤ 20 kg; diese wird gemischt und erforderlichenfalls vor der Mahlung in zwei gleiche Laborproben von je ≤ 10 kg aufgeteilt (diese Aufteilung in zwei Laborproben ist nicht notwendig bei Erdnüssen, sonstigen Ölsaaten, Aprikosenkernen und Nüssen, die weiter sortiert oder anderweitig behandelt werden, und wenn Geräte zur Verfügung stehen, mit denen eine Probe von bis zu 20 kg homogenisiert werden kann). Wiegt die Sammelprobe weniger als 20 kg, muss sie folgendermaßen in Laborproben unterteilt werden:
|
|
— |
Jede Laborprobe muss gemäß Anhang II einzeln fein vermahlen und gründlich gemischt werden, damit eine vollständige Homogenisierung erreicht wird. |
|
— |
Ist es nicht möglich, das vorstehend beschriebene Probenahmeverfahren anzuwenden, da sich aus einer Beschädigung der Partie unannehmbare Folgen für den Handel ergeben würden (wegen der Verpackungsart, der Transportweise usw.), so kann ein alternatives Probenahmeverfahren angewendet werden, sofern dieses so repräsentativ wie möglich ist und umfassend beschrieben und dokumentiert wird. |
D.2.5. Probenahmeverfahren bei Verarbeitungserzeugnissen, ausgenommen pflanzliches Öl, und zusammengesetzten Lebensmitteln
D.2.5.1.
|
— |
Anzahl der Einzelproben: 100; bei Partien unter 50 Tonnen sollten (abhängig vom Partiegewicht, siehe Tabelle 3) 10 bis 100 Einzelproben entnommen werden. Tabelle 3 Anzahl der Einzelproben in Abhängigkeit vom Gewicht der Partie
|
|
— |
Eine Einzelprobe sollte etwa 100 g wiegen. Bei Partien in Einzelhandelspackungen hängt das Gewicht der Einzelprobe vom Gewicht der Einzelhandelspackung ab. |
|
— |
Gewicht der Sammelprobe = 1-10 kg, ausreichend gemischt. |
D.2.5.2.
Probenahmeverfahren und Akzeptanz wie bei Erdnüssen, sonstigen Ölsaaten, Aprikosenkernen und Nüssen (D.2.3 und D.2.4).
D.2.6. Probenahme im Einzelhandel
Die Probenahme von Lebensmitteln auf der Einzelhandelsebene sollte, soweit dies möglich ist, nach den in diesem Teil von Anhang I beschriebenen Bestimmungen durchgeführt werden.
In Fällen, in denen dies nicht möglich ist, können andere geeignete Probenahmeverfahren angewandt werden, sofern die nach diesen Verfahren entnommene Sammelprobe ausreichend repräsentativ für die beprobten Partien ist und ausführlich beschrieben und dokumentiert wird. In jedem Fall muss die Sammelprobe mindestens 1 kg wiegen (2).
D.2.7. Spezifisches Probenahmeverfahren für Erdnüsse, sonstige Ölsaaten, Aprikosenkerne, Nüsse und Verarbeitungserzeugnisse, die in Vakuumverpackungen gehandelt werden
D.2.7.1.
Bei Partien größer gleich 15 Tonnen sind mindestens 50 Einzelproben zu entnehmen, die eine Sammelprobe von 20 kg ergeben; bei Partien kleiner als 15 Tonnen sind 50 % der in Tabelle 2 genannten Anzahl an Einzelproben zu entnehmen, was zu einer Sammelprobe führt, deren Gewicht dem Gewicht der beprobten Partie entspricht (s. Tabelle 2).
D.2.7.2.
Bei Partien größer gleich 15 Tonnen sind mindestens 25 Einzelproben zu entnehmen, was eine Sammelprobe von 20 kg ergibt, und bei Partien kleiner als 15 Tonnen sind 25 % der in Tabelle 2 genannten Anzahl an Einzelproben zu entnehmen, was zu einer Sammelprobe führt, deren Gewicht dem Gewicht der beprobten Partie entspricht (s. Tabelle 2).
D.2.7.3.
Bei Partien größer gleich 50 Tonnen sind mindestens 25 Einzelproben zu entnehmen, was eine Sammelprobe von 10 kg ergibt, und bei Partien kleiner als 50 Tonnen sind 25 % der in Tabelle 3 genannten Anzahl an Einzelproben zu entnehmen, deren Gewicht dem Gewicht der beprobten Partie entspricht (s. Tabelle 3).
D.2.8. Akzeptanz einer Partie oder Teilpartie
Bei Erdnüssen, sonstigen Ölsaaten, Aprikosenkernen und Nüssen, die einer Sortierung oder anderen Behandlung unterzogen wurden:
|
— |
Akzeptanz, wenn die Sammelprobe oder der Durchschnitt der Laborproben den Höchstgehalt nicht überschreitet, wobei die Berichtigung um die Wiederfindungsrate und die Messunsicherheit berücksichtigt wird; |
|
— |
Zurückweisung, wenn die Sammelprobe oder der Durchschnitt der Laborproben den Höchstgehalt zweifelsfrei überschreitet, wobei die Berichtigung um die Wiederfindungsrate und die Messunsicherheit berücksichtigt wird. |
Bei zum unmittelbaren Verzehr bestimmten Erdnüssen, sonstigen Ölsaaten, Aprikosenkernen und Nüssen:
|
— |
Akzeptanz, wenn keine Laborprobe den Höchstgehalt überschreitet, wobei die Berichtigung um die Wiederfindungsrate und die Messunsicherheit berücksichtigt wird; |
|
— |
Zurückweisung, wenn eine Laborprobe oder beide Laborproben den Höchstgehalt zweifelsfrei überschreitet/überschreiten, wobei die Berichtigung um die Wiederfindungsrate und die Messunsicherheit berücksichtigt wird. |
In Fällen, in denen die Sammelprobe höchstens 12 kg wiegt:
|
— |
Akzeptanz, wenn die Laborprobe den Höchstgehalt nicht überschreitet, wobei die Berichtigung um die Wiederfindungsrate und die Messunsicherheit berücksichtigt wird; |
|
— |
Zurückweisung, wenn die Laborprobe den Höchstgehalt zweifelsfrei überschreitet, wobei die Berichtigung um die Wiederfindungsrate und die Messunsicherheit berücksichtigt wird. |
(1) Abhängig vom Partiegewicht — vgl. Tabelle 2 dieses Teils D.1 dieses Anhangs.
(2) Ist die zu beprobende Portion so klein, dass es nicht möglich ist, eine Sammelprobe von 1 kg zu erhalten, kann die Sammelprobe auch weniger als 1 kg wiegen.“
(3) Abhängig vom Partiegewicht — vgl. Tabelle 2 dieses Teils D.2. dieses Anhangs.
ANHANG II
„G. PROBENAHMEVERFAHREN FÜR KAFFEE, KAFFEEERZEUGNISSE, SÜSSHOLZWURZEL UND SÜSSHOLZAUSZUG
Dieses Probenahmeverfahren ist bei der amtlichen Kontrolle der Höchstgehalte an Ochratoxin A in gerösteten Kaffeebohnen, gemahlenem geröstetem Kaffee; löslichem Kaffee; Süßholzwurzel und Süßholzauszug anzuwenden.
G.1. Gewicht der Einzelprobe
Das Gewicht der Einzelprobe beträgt rund 100 g, soweit im vorliegenden Teil G von Anhang I nicht anders definiert.
Bei Partien in Einzelhandelspackungen hängt das Gewicht der Einzelprobe vom Gewicht der Einzelhandelspackung ab.
Bei Einzelhandelspackungen mit mehr als 100 g Inhalt führt dies zu Sammelproben von über 10 kg. Wiegt eine Einzelhandelspackung wesentlich mehr als 100 g, werden 100 g aus jeder einzelnen Einzelhandelspackung als Einzelprobe entnommen. Dies kann bei der Probenahme oder im Labor erfolgen. In Fällen, in denen ein derartiges Probenahmeverfahren zu unannehmbaren Folgen für den Handel führen würde, weil die Partie beschädigt wird (wegen der Verpackungsart, der Transportweise usw.), können andere Probenahmeverfahren angewandt werden. Dies ist beispielsweise der Fall bei einem wertvollen Erzeugnis, das in Einzelhandelspackungen von 500 g oder 1 kg vermarktet wird. In einem solchen Fall kann die Sammelprobe durch Zusammenfassung einer Anzahl Einzelproben gebildet werden, die geringer ist als die in den Tabellen 1 und 2 angegebene Anzahl; dabei muss das Gewicht der Sammelprobe dem in den Tabellen 1 und 2 angegebenen Gewicht entsprechen.
Wiegt die Einzelhandelspackung weniger als 100 g und ist der Unterschied nicht sehr groß, ist eine Einzelhandelspackung als eine Einzelprobe anzusehen, was zu einer Sammelprobe von weniger als 10 kg führt. Wiegt die Einzelhandelspackung wesentlich weniger als 100 g, besteht eine Einzelprobe aus zwei oder mehr Einzelhandelspackungen, wobei das Gewicht soweit wie möglich an 100 g anzunähern ist.
G.2. Allgemeine Übersicht über das Probenahmeverfahren für gerösteten Kaffee, gemahlenen gerösteten Kaffee, löslichen Kaffee, Süßholzwurzel und Süßholzauszug
Tabelle 1
Unterteilung von Partien in Teilpartien nach Erzeugnis und Partiegewicht
|
Ware |
Partiegewicht (t) |
Gewicht oder Anzahl der Teilpartien |
Anzahl der Einzelproben |
Sammelprobe Gewicht (kg) |
|
Geröstete Kaffeebohnen, gemahlener gerösteter Kaffee, löslicher Kaffee, Süßholzwurzel und Süßholzauszug |
≥ 15 |
15-30 t |
100 |
10 |
|
< 15 |
— |
10-100 (1) |
1-10 |
G.3. Probenahmeverfahren für geröstete Kaffeebohnen, gemahlenen gerösteten Kaffee, löslichen Kaffee, Süßholzwurzel und Süßholzauszug (Partien ≥ 15 Tonnen)
|
— |
Unter der Bedingung, dass die Teilpartie physisch getrennt werden kann, ist jede Partie gemäß Tabelle 1 in Teilpartien aufzuteilen. Da das Gewicht der Partie nicht immer ein genaues Vielfaches des Gewichts der Teilpartien ist, darf das Gewicht der Teilpartie von dem angegebenen Gewicht um höchstens 20 % abweichen. |
|
— |
Jede Teilpartie ist getrennt zu beproben. |
|
— |
Anzahl der Einzelproben: 100. |
|
— |
Gewicht der Sammelprobe = 10 kg. |
|
— |
Ist es nicht möglich, das vorstehend beschriebene Probenahmeverfahren anzuwenden, da sich aus einer Beschädigung der Partie unannehmbare Folgen für den Handel ergeben würden (wegen der Verpackungsart, der Transportweise usw.), so kann ein alternatives Probenahmeverfahren angewendet werden, sofern dieses so repräsentativ wie möglich ist und umfassend beschrieben und dokumentiert wird. |
G.4. Probenahmeverfahren für geröstete Kaffeebohnen, gemahlenen gerösteten Kaffee, löslichen Kaffee, Süßholzwurzel und Süßholzauszug (Partien < 15 Tonnen)
Für Partien gerösteter Kaffeebohnen, gemahlenen gerösteten Kaffees, löslichen Kaffees, Süßholzwurzel und Süßholzauszug unter 15 Tonnen muss ein Probenahmeverfahren angewendet werden, das — je nach Gewicht der Partie — aus 10 bis 100 Einzelproben besteht, die eine Sammelprobe mit einem Gewicht zwischen 1 und 10 kg ergeben.
Anhand der nachstehenden Tabelle kann die Anzahl der zu entnehmenden Einzelproben ermittelt werden.
Tabelle 2
Anzahl der Einzelproben in Abhängigkeit vom Gewicht der Partie gerösteter Kaffeebohnen, gemahlenen gerösteten Kaffees, löslichen Kaffees, Süßholzwurzel und Süßholzauszug
|
Partiegewicht (t) |
Anzahl der Einzelproben |
Sammelprobe Gewicht (kg) |
|
≤ 0,1 |
10 |
1 |
|
> 0,1 – ≤ 0,2 |
15 |
1,5 |
|
> 0,2 – ≤ 0,5 |
20 |
2 |
|
> 0,5 – ≤ 1,0 |
30 |
3 |
|
> 1,0 – ≤ 2,0 |
40 |
4 |
|
> 2,0 – ≤ 5,0 |
60 |
6 |
|
> 5,0 – ≤ 10,0 |
80 |
8 |
|
> 10,0 – ≤ 15,0 |
100 |
10 |
G.5. Probenahmeverfahren für geröstete Kaffeebohnen, gemahlenen gerösteten Kaffee, löslichen Kaffee, Süßholzwurzel und Süßholzauszug, die in Vakuumverpackungen gehandelt werden
Bei Partien größer gleich 15 Tonnen sind mindestens 25 Einzelproben zu entnehmen, was eine Sammelprobe von 10 kg ergibt, und bei Partien kleiner als 15 Tonnen sind 25 % der in Tabelle 2 genannten Anzahl an Einzelproben zu entnehmen, deren Gewicht dem Gewicht der beprobten Partie entspricht (s. Tabelle 2).
G.6. Probenahme im Einzelhandel
Die Probenahme von Lebensmitteln auf der Einzelhandelsebene sollte, soweit dies möglich ist, nach den in diesem Teil von Anhang I beschriebenen Bestimmungen durchgeführt werden.
Ist dies nicht möglich, kann auch ein alternatives Probenahmeverfahren auf der Einzelhandelsebene angewandt werden, sofern die Sammelprobe ausreichend repräsentativ für die beprobte Partie ist und ausführlich beschrieben und dokumentiert wird. In jedem Fall muss die Sammelprobe mindestens 1 kg wiegen (2).
G.7. Akzeptanz einer Partie oder Teilpartie
|
— |
Akzeptanz, wenn die Laborprobe den Höchstgehalt nicht überschreitet, wobei die Berichtigung um die Wiederfindungsrate und die Messunsicherheit berücksichtigt wird; |
|
— |
Zurückweisung, wenn die Laborprobe den Höchstgehalt zweifelsfrei überschreitet, wobei die Berichtigung um die Wiederfindungsrate und die Messunsicherheit berücksichtigt wird. |
(1) Abhängig vom Partiegewicht — vgl. Tabelle 2 dieses Teils dieses Anhangs.
(2) Ist die zu beprobende Portion so klein, dass es nicht möglich ist, eine Sammelprobe von 1 kg zu erhalten, kann die Sammelprobe auch weniger als 1 kg wiegen.“
ANHANG III
„K. PROBENAHMEVERFAHREN FÜR PFLANZLICHE ÖLE
Dieses Probenahmeverfahren ist bei der amtlichen Kontrolle der Höchstgehalte an Mykotoxinen, insbesondere Aflatoxin B1, Gesamtaflatoxinen und Zearalenon in pflanzlichen Ölen anzuwenden.
K.1 Probenahmeverfahren für pflanzliche Öle
|
— |
Das Gewicht der Einzelprobe beträgt mindestens etwa 100 g (ml) (je nach Art der Sendung, z. B. sind bei nicht abgefülltem pflanzlichem Öl mindestens drei Einzelproben von etwa 350 ml zu entnehmen), was eine Sammelprobe von mindestens 1 kg (l) ergibt. |
|
— |
Die Mindestanzahl der Einzelproben, die der Partie zu entnehmen sind, ist in Tabelle 1 aufgeführt. Die Partie ist unmittelbar vor der Probenahme so weit möglich entweder manuell oder mechanisch gründlich zu vermischen. In diesem Fall kann in einer bestimmten Partie von einer homogenen Verteilung des Aflatoxins ausgegangen werden, daher reicht es aus, drei Einzelproben aus einer Partie zu entnehmen, die die Sammelprobe bilden. Tabelle 1 Mindestanzahl an Einzelproben, die der Partie zu entnehmen sind
Tabelle 2 Unterteilung von Partien in Teilpartien nach Partiegewicht
|
K.2 Probenahmeverfahren für pflanzliche Öle auf der Einzelhandelsebene
Die Probenahme von Lebensmitteln auf der Einzelhandelsebene sollte, soweit dies möglich ist, nach den in diesem Teil von Anhang I beschriebenen Bestimmungen durchgeführt werden.
In Fällen, in denen dies nicht möglich ist, können andere geeignete Probenahmeverfahren angewandt werden, sofern die nach diesen Verfahren entnommene Sammelprobe ausreichend repräsentativ für die beprobten Partien ist und ausführlich beschrieben und dokumentiert wird. In jedem Fall muss die Sammelprobe mindestens 1 kg wiegen (2).
K.3 Akzeptanz einer Partie oder Teilpartie
|
— |
Akzeptanz, wenn die Laborprobe den Höchstgehalt nicht überschreitet, wobei die Berichtigung um die Wiederfindungsrate und die Messunsicherheit berücksichtigt wird; |
|
— |
Zurückweisung, wenn die Laborprobe den Höchstgehalt zweifelsfrei überschreitet, wobei die Berichtigung um die Wiederfindungsrate und die Messunsicherheit berücksichtigt wird. |
(1) Sofern die Teilpartie physisch getrennt werden kann, sind große Sendungen/Partien nicht abgefüllten pflanzlichen Öls in Teilpartien gemäß Tabelle 2 dieses Teils zu unterteilen.
(2) Ist die zu beprobende Portion so klein, dass es nicht möglich ist, eine Sammelprobe von 1 kg zu erhalten, kann die Sammelprobe auch weniger als 1 kg wiegen.“
|
3.3.2010 |
DE |
Amtsblatt der Europäischen Union |
L 52/44 |
VERORDNUNG (EU) Nr. 179/2010 DER KOMMISSION
vom 2. März 2010
zur Festlegung pauschaler Einfuhrwerte für die Bestimmung der für bestimmtes Obst und Gemüse geltenden Einfuhrpreise
DIE EUROPÄISCHE KOMMISSION —
gestützt auf den Vertrag über die Arbeitsweise der Europäischen Union,
gestützt auf die Verordnung (EG) Nr. 1234/2007 des Rates vom 22. Oktober 2007 über eine gemeinsame Organisation der Agrarmärkte und mit Sondervorschriften für bestimmte landwirtschaftliche Erzeugnisse (Verordnung über die einheitliche GMO) (1),
gestützt auf die Verordnung (EG) Nr. 1580/2007 der Kommission vom 21. Dezember 2007 mit Durchführungsbestimmungen zu den Verordnungen (EG) Nr. 2200/96, (EG) Nr. 2201/96 und (EG) Nr. 1182/2007 des Rates im Sektor Obst und Gemüse (2), insbesondere auf Artikel 138 Absatz 1,
in Erwägung nachstehenden Grundes:
Die in Anwendung der Ergebnisse der multilateralen Handelsverhandlungen der Uruguay-Runde von der Kommission festzulegenden, zur Bestimmung der pauschalen Einfuhrwerte zu berücksichtigenden Kriterien sind in der Verordnung (EG) Nr. 1580/2007 für die in ihrem Anhang XV Teil A aufgeführten Erzeugnisse und Zeiträume festgelegt —
HAT FOLGENDE VERORDNUNG ERLASSEN:
Artikel 1
Die in Artikel 138 der Verordnung (EG) Nr. 1580/2007 genannten pauschalen Einfuhrwerte sind in der Tabelle im Anhang zur vorliegenden Verordnung festgesetzt.
Artikel 2
Diese Verordnung tritt am 3. März 2010 in Kraft.
Diese Verordnung ist in allen ihren Teilen verbindlich und gilt unmittelbar in jedem Mitgliedstaat.
Brüssel, den 2. März 2010
Für die Kommission, im Namen des Präsidenten,
Jean-Luc DEMARTY
Generaldirektor für Landwirtschaft und ländliche Entwicklung
(1) ABl. L 299 vom 16.11.2007, S. 1.
(2) ABl. L 350 vom 31.12.2007, S. 1.
ANHANG
Pauschale Einfuhrwerte für die Bestimmung der für bestimmtes Obst und Gemüse geltenden Einfuhrpreise
|
(EUR/100 kg) |
||
|
KN-Code |
Drittland-Code (1) |
Pauschaler Einfuhrwert |
|
0702 00 00 |
JO |
67,6 |
|
MA |
113,6 |
|
|
TN |
130,0 |
|
|
TR |
116,9 |
|
|
ZZ |
107,0 |
|
|
0707 00 05 |
EG |
211,5 |
|
JO |
145,3 |
|
|
MK |
147,9 |
|
|
TR |
148,5 |
|
|
ZZ |
163,3 |
|
|
0709 90 70 |
MA |
132,4 |
|
TR |
89,4 |
|
|
ZZ |
110,9 |
|
|
0709 90 80 |
EG |
43,6 |
|
ZZ |
43,6 |
|
|
0805 10 20 |
CL |
52,4 |
|
EG |
45,1 |
|
|
IL |
56,5 |
|
|
MA |
46,5 |
|
|
TN |
46,6 |
|
|
TR |
58,8 |
|
|
ZZ |
51,0 |
|
|
0805 50 10 |
EG |
76,3 |
|
IL |
76,3 |
|
|
MA |
68,6 |
|
|
TR |
70,3 |
|
|
ZZ |
72,9 |
|
|
0808 10 80 |
CA |
76,4 |
|
CN |
70,6 |
|
|
MK |
24,7 |
|
|
US |
99,2 |
|
|
ZZ |
67,7 |
|
|
0808 20 50 |
AR |
78,5 |
|
CL |
200,0 |
|
|
CN |
54,8 |
|
|
US |
92,4 |
|
|
ZA |
91,9 |
|
|
ZZ |
103,5 |
|
(1) Nomenklatur der Länder gemäß der Verordnung (EG) Nr. 1833/2006 der Kommission (ABl. L 354 vom 14.12.2006, S. 19). Der Code „ZZ“ steht für „Andere Ursprünge“.
|
3.3.2010 |
DE |
Amtsblatt der Europäischen Union |
L 52/46 |
VERORDNUNG (EU) Nr. 180/2010 DER KOMMISSION
vom 2. März 2010
zur Änderung der mit der Verordnung (EG) Nr. 877/2009 festgesetzten repräsentativen Preise und zusätzlichen Einfuhrzölle für bestimmte Erzeugnisse des Zuckersektors im Wirtschaftsjahr 2009/10
DIE EUROPÄISCHE KOMMISSION —
gestützt auf den Vertrag über die Arbeitsweise der Europäischen Union,
gestützt auf die Verordnung (EG) Nr. 1234/2007 des Rates vom 22. Oktober 2007 über eine gemeinsame Organisation der Agrarmärkte und mit Sondervorschriften für bestimmte landwirtschaftliche Erzeugnisse (Verordnung über die einheitliche GMO) (1),
gestützt auf die Verordnung (EG) Nr. 951/2006 der Kommission vom 30. Juni 2006 mit Durchführungsbestimmungen zur Verordnung (EG) Nr. 318/2006 des Rates für den Zuckerhandel mit Drittländern (2), insbesondere auf Artikel 36 Absatz 2 Unterabsatz 2 zweiter Satz,
in Erwägung nachstehender Gründe:
|
(1) |
Die bei der Einfuhr von Weißzucker, Rohzucker und bestimmten Sirupen geltenden repräsentativen Preise und zusätzlichen Einfuhrzölle für das Wirtschaftsjahr 2009/10 sind mit der Verordnung (EG) Nr. 877/2009 der Kommission (3) festgesetzt worden. Diese Preise und Zölle wurden zuletzt durch die Verordnung (EU) Nr. 160/2010 der Kommission (4) geändert. |
|
(2) |
Die der Kommission derzeit vorliegenden Angaben führen zu einer Änderung der genannten Beträge gemäß den in der Verordnung (EG) Nr. 951/2006 vorgesehenen Regeln und Modalitäten — |
HAT FOLGENDE VERORDNUNG ERLASSEN:
Artikel 1
Die mit der Verordnung (EG) Nr. 951/2006 für das Wirtschaftsjahr 2009/10 festgesetzten repräsentativen Preise und zusätzlichen Zölle bei der Einfuhr der Erzeugnisse des Artikels 36 der Verordnung (EG) Nr. 877/2009 werden geändert und sind im Anhang der vorliegenden Verordnung aufgeführt.
Artikel 2
Diese Verordnung tritt am 3. März 2010 in Kraft.
Diese Verordnung ist in allen ihren Teilen verbindlich und gilt unmittelbar in jedem Mitgliedstaat.
Brüssel, den 2. März 2010
Für die Kommission, im Namen des Präsidenten,
Jean-Luc DEMARTY
Generaldirektor für Landwirtschaft und ländliche Entwicklung
(1) ABl. L 299 vom 16.11.2007, S. 1.
(2) ABl. L 178 vom 1.7.2006, S. 24.
(3) ABl. L 253 vom 25.9.2009, S. 3.
(4) ABl. L 49 vom 26.2.2010, S. 18.
ANHANG
Geänderte Beträge der ab dem 3. März 2010 geltenden repräsentativen Preise und zusätzlichen Einfuhrzölle für Weißzucker, Rohzucker und die Erzeugnisse des KN-Codes 1702 90 95
|
(EUR) |
||
|
KN-Code |
Repräsentativer Preis je 100 kg Eigengewicht des Erzeugnisses |
Zusätzlicher Zoll je 100 kg Eigengewicht des Erzeugnisses |
|
1701 11 10 (1) |
40,51 |
0,00 |
|
1701 11 90 (1) |
40,51 |
2,75 |
|
1701 12 10 (1) |
40,51 |
0,00 |
|
1701 12 90 (1) |
40,51 |
2,45 |
|
1701 91 00 (2) |
47,12 |
3,33 |
|
1701 99 10 (2) |
47,12 |
0,20 |
|
1701 99 90 (2) |
47,12 |
0,20 |
|
1702 90 95 (3) |
0,47 |
0,23 |
(1) Festsetzung für die Standardqualität gemäß Anhang IV Abschnitt III der Verordnung (EG) Nr. 1234/2007.
(2) Festsetzung für die Standardqualität gemäß Anhang IV Abschnitt II der Verordnung (EG) Nr. 1234/2007.
(3) Festsetzung pro 1 % Saccharosegehalt.
|
3.3.2010 |
DE |
Amtsblatt der Europäischen Union |
L 52/48 |
VERORDNUNG (EU) Nr. 181/2010 DER KOMMISSION
vom 2. März 2010
über die Erteilung von Lizenzen für die Einfuhr von Knoblauch im Teilzeitraum vom 1. Juni 2010 bis 31. August 2010
DIE EUROPÄISCHE KOMMISSION —
gestützt auf den Vertrag über die Arbeitsweise der Europäischen Union,
gestützt auf die Verordnung (EG) Nr. 1234/2007 des Rates vom 22. Oktober 2007 über eine gemeinsame Organisation der Agrarmärkte und mit Sondervorschriften für bestimmte landwirtschaftliche Erzeugnisse (Verordnung über die einheitliche GMO) (1),
gestützt auf die Verordnung (EG) Nr. 1301/2006 der Kommission vom 31. August 2006 mit gemeinsamen Regeln für die Verwaltung von Einfuhrzollkontingenten für landwirtschaftliche Erzeugnisse im Rahmen einer Einfuhrlizenzregelung (2), insbesondere auf Artikel 7 Absatz 2,
in Erwägung nachstehender Gründe:
|
(1) |
Die Verordnung (EG) Nr. 341/2007 der Kommission (3) sieht die Eröffnung und Verwaltung von Zollkontingenten sowie die Einführung einer Einfuhrlizenz- und Ursprungsbescheinigungsregelung für aus Drittländern eingeführten Knoblauch und bestimmte andere landwirtschaftliche Erzeugnisse vor. |
|
(2) |
Die Mengen, für die die traditionellen und die neuen Einführer in den ersten fünf Arbeitstagen nach dem fünfzehnten Tag des Monats Februar 2010 gemäß Artikel 10 Absatz 1 der Verordnung (EG) Nr. 341/2007 „A-Lizenzen“ beantragt haben, überschreiten die verfügbaren Mengen für Erzeugnisse mit Ursprung in China und allen Drittländern außer China. |
|
(3) |
Daher ist gemäß Artikel 7 Absatz 2 der Verordnung (EG) Nr. 1301/2006 festzulegen, in welchem Umfang den der Kommission bis Ende Februar 2010 übermittelten Anträgen auf A-Lizenzen gemäß Artikel 12 der Verordnung (EG) Nr. 341/2007 stattgegeben werden kann — |
HAT FOLGENDE VERORDNUNG ERLASSEN:
Artikel 1
Die in den ersten fünf Arbeitstagen nach dem fünfzehnten Tag des Monats Februar 2010 gemäß Artikel 10 Absatz 1 der Verordnung (EG) Nr. 341/2007 gestellten und der Kommission spätestens bis Ende Februar 2010 übermittelten Anträge auf Erteilung von „A-Einfuhrlizenzen“ werden nach Maßgabe der Prozentsätze der beantragten Mengen gemäß dem Anhang der vorliegenden Verordnung erteilt.
Artikel 2
Diese Verordnung tritt am Tag ihrer Veröffentlichung im Amtsblatt der Europäischen Union in Kraft.
Diese Verordnung ist in allen ihren Teilen verbindlich und gilt unmittelbar in jedem Mitgliedstaat.
Brüssel, den 2. März 2010
Für die Kommission, im Namen des Präsidenten,
Jean-Luc DEMARTY
Generaldirektor für Landwirtschaft und ländliche Entwicklung
(1) ABl. L 299 vom 16.11.2007, S. 1.
(2) ABl. L 238 vom 1.9.2006, S. 13.
(3) ABl. L 90 vom 30.3.2007, S. 12.
ANHANG
|
Ursprung |
Laufende Nummer |
Zuteilungskoeffizient |
|||
|
Argentinien |
|||||
|
09.4104 |
X |
|||
|
09.4099 |
X |
|||
|
China |
|||||
|
09.4105 |
17,875957 % |
|||
|
09.4100 |
0,387100 % |
|||
|
Andere Drittländer |
|||||
|
09.4106 |
100 % |
|||
|
09.4102 |
31,057336 % |
|||
|
|||||
BESCHLÜSSE
|
3.3.2010 |
DE |
Amtsblatt der Europäischen Union |
L 52/50 |
BESCHLUSS DES RATES
vom 25. Februar 2010
zur Einsetzung des Ständigen Ausschusses für die operative Zusammenarbeit im Bereich der inneren Sicherheit
(2010/131/EU)
DER RAT DER EUROPÄISCHEN UNION —
gestützt auf den Vertrag über die Arbeitsweise der Europäischen Union, insbesondere auf Artikel 240 Absatz 3,
in Erwägung nachstehender Gründe:
|
(1) |
In Artikel 71 des Vertrags über die Arbeitsweise der Europäischen Union ist vorgesehen, dass im Rat ein ständiger Ausschuss eingesetzt wird, um sicherzustellen, dass innerhalb der Union die operative Zusammenarbeit im Bereich der inneren Sicherheit gefördert und verstärkt wird. |
|
(2) |
Daher sollte ein Beschluss über die Einsetzung dieses Ausschusses erlassen und dessen Aufgaben festgelegt werden — |
HAT FOLGENDEN BESCHLUSS ERLASSEN:
Artikel 1
Im Rat wird der Ständige Ausschuss für die operative Zusammenarbeit im Bereich der inneren Sicherheit (nachstehend „Ständiger Ausschuss“ genannt) nach Artikel 71 des Vertrags eingesetzt.
Artikel 2
Der Ständige Ausschuss erleichtert und verstärkt die Koordinierung der operativen Maßnahmen der für den Bereich der inneren Sicherheit zuständigen Behörden der Mitgliedstaaten.
Artikel 3
(1) Der Ständige Ausschuss erleichtert und gewährleistet unbeschadet der Mandate der in Artikel 5 genannten Einrichtungen eine wirksame operative Zusammenarbeit und Koordinierung nach Maßgabe des Titels V des Dritten Teils des Vertrags auch in den Bereichen, die von der Zusammenarbeit der Zollbehörden abgedeckt werden oder in die Zuständigkeit der für die Kontrolle und den Schutz der Außengrenzen verantwortlichen Behörden fallen. Er ist gegebenenfalls auch für die justizielle Zusammenarbeit in Strafsachen zuständig, die für die operative Zusammenarbeit im Bereich der inneren Sicherheit von Relevanz sind.
(2) Der Ständige Ausschuss nimmt ferner eine Bewertung der allgemeinen Ausrichtung und der Effizienz der operativen Zusammenarbeit vor; er stellt etwaige Mängel oder Versäumnisse fest, und spricht gegebenenfalls geeignete konkrete Empfehlungen aus, um sie zu beheben.
(3) Der Ständige Ausschuss unterstützt den Rat gemäß Artikel 222 des Vertrags.
Artikel 4
(1) Der Ständige Ausschuss beteiligt sich nicht an der Durchführung von Operationen; für diese sind weiterhin die Mitgliedstaaten zuständig.
(2) Der Ständige Ausschuss beteiligt sich nicht an der Ausarbeitung von Rechtsetzungsakten.
Artikel 5
(1) Gegebenenfalls werden Vertreter von Eurojust, Europol, der Europäischen Agentur für die operative Zusammenarbeit an den Außengrenzen der Mitgliedstaaten der Europäischen Union (Frontex) und anderen einschlägigen Einrichtungen ersucht, als Beobachter an den Sitzungen des Ständigen Ausschusses teilzunehmen.
(2) Der Ständige Ausschuss trägt zur Wahrung der Kohärenz des Handelns dieser Einrichtungen bei.
Artikel 6
(1) Der Ständige Ausschuss legt dem Rat in regelmäßigen Abständen einen Bericht über seine Tätigkeiten vor.
(2) Der Rat hält das Europäische Parlament und die nationalen Parlamente über die Beratungen des Ständigen Ausschusses auf dem Laufenden.
Artikel 7
Dieser Beschluss tritt am Tag seiner Annahme in Kraft.
Er wird im Amtsblatt der Europäischen Union veröffentlicht.
Geschehen zu Brüssel am 25. Februar 2010.
Im Namen des Rates
Der Präsident
A. PÉREZ RUBALCABA
|
3.3.2010 |
DE |
Amtsblatt der Europäischen Union |
L 52/51 |
BESCHLUSS DER KOMMISSION
vom 2. März 2010
zur grundsätzlichen Anerkennung der Vollständigkeit der Unterlagen, die zur eingehenden Prüfung im Hinblick auf eine etwaige Aufnahme von Trichoderma asperellum (Stamm T34) und Isopyrazam in Anhang I der Richtlinie 91/414/EWG des Rates eingereicht wurden
(Bekannt gegeben unter Aktenzeichen K(2010) 1099)
(Text von Bedeutung für den EWR)
(2010/132/EU)
DIE EUROPÄISCHE KOMMISSION —
gestützt auf den Vertrag über die Arbeitsweise der Europäischen Union,
gestützt auf die Richtlinie 91/414/EWG des Rates vom 15. Juli 1991 über das Inverkehrbringen von Pflanzenschutzmitteln (1), insbesondere auf Artikel 6 Absatz 3,
in Erwägung nachstehender Gründe:
|
(1) |
Die Richtlinie 91/414/EWG sieht die Aufstellung einer gemeinschaftlichen Liste der Wirkstoffe vor, die als Inhaltsstoffe von Pflanzenschutzmitteln zugelassen sind. |
|
(2) |
Am 22. April 2009 hat Biocontrol Technologies S.L. den Behörden des Vereinigten Königreichs Unterlagen über den Wirkstoff Trichoderma asperellum (Stamm T34) mit einem Antrag auf Aufnahme in Anhang I der Richtlinie 91/414/EWG übermittelt. Am 25. November 2008 hat Syngenta Crop Protection AG den Behörden des Vereinigten Königreichs Unterlagen über den Wirkstoff Isopyrazam mit einem Antrag auf Aufnahme in Anhang I der Richtlinie 91/414/EWG übermittelt. |
|
(3) |
Die Behörden des Vereinigten Königreichs haben der Kommission mitgeteilt, eine erste Prüfung habe ergeben, dass die Unterlagen über die betreffenden Wirkstoffe offensichtlich die gemäß Anhang II der Richtlinie 91/414/EWG erforderlichen Angaben und Informationen enthalten. Außerdem erfüllen die Unterlagen die Anforderungen an die Angaben und Informationen gemäß Anhang III der Richtlinie 91/414/EWG in Bezug auf ein Pflanzenschutzmittel, das den betreffenden Wirkstoff enthält. Die Unterlagen wurden anschließend gemäß Artikel 6 Absatz 2 der Richtlinie 91/414/EWG von den jeweiligen Antragstellern an die Kommission und die übrigen Mitgliedstaaten übermittelt und wurden an den Ständigen Ausschuss für die Lebensmittelkette und Tiergesundheit weitergeleitet. |
|
(4) |
Mit diesem Beschluss soll auf Ebene der Europäischen Union formell festgestellt werden, dass die Unterlagen grundsätzlich den Anforderungen in Bezug auf Angaben und Informationen gemäß Anhang II und — bei mindestens einem Pflanzenschutzmittel mit dem betreffenden Wirkstoff — den Anforderungen gemäß Anhang III der Richtlinie 91/414/EWG entsprechen. |
|
(5) |
Die in diesem Beschluss vorgesehenen Maßnahmen entsprechen der Stellungnahme des Ständigen Ausschusses für die Lebensmittelkette und Tiergesundheit — |
HAT FOLGENDEN BESCHLUSS ERLASSEN:
Artikel 1
Die Unterlagen für die im Anhang dieses Beschlusses genannten Wirkstoffe, die bei der Kommission und den Mitgliedstaaten im Hinblick auf die Aufnahme dieser Stoffe in Anhang I der Richtlinie 91/414/EWG eingereicht wurden, erfüllen grundsätzlich die Anforderungen an die Angaben und Informationen gemäß Anhang II der genannten Richtlinie.
In Bezug auf ein Pflanzenschutzmittel, das den betreffenden Wirkstoff enthält, erfüllen die Unterlagen unter Berücksichtigung der vorgesehenen Anwendungszwecke zudem die Anforderungen gemäß Anhang III der genannten Richtlinie.
Artikel 2
Der berichterstattende Mitgliedstaat unterzieht die Unterlagen einer eingehenden Prüfung und übermittelt der Kommission so bald wie möglich, spätestens jedoch innerhalb eines Jahres ab dem Datum der Veröffentlichung dieses Beschlusses im Amtsblatt der Europäischen Union, die Schlussfolgerungen der Prüfung, zusammen mit einer Empfehlung zur Aufnahme bzw. Nichtaufnahme des Wirkstoffs gemäß Artikel 1 in Anhang I der Richtlinie 91/414/EWG sowie zu etwaigen Bedingungen für die Aufnahme.
Artikel 3
Dieser Beschluss ist an die Mitgliedstaaten gerichtet.
Brüssel, den 2. März 2010
Für die Kommission
John DALLI
Mitglied der Kommission
(1) ABl. L 230 vom 19.8.1991, S. 1.
ANHANG
VON DEM BESCHLUSS BETROFFENE WIRKSTOFFE
|
Nr. |
Gebräuchliche Bezeichnung, CIPAC-Nummer |
Antragsteller |
Datum des Antrags |
Berichterstattender Mitgliedstaat |
|
1 |
Trichoderma asperellum (Stamm T34) CIPAC-Nr.: Entfällt |
Biocontrol Technologies S.L. |
22.4.2009 |
Vereinigtes Königreich |
|
2 |
Isopyrazam CIPAC-Nr.: Syn-isomer: 683777-13-1 Anti-isomer: 683777-14-2 |
Syngenta Crop Protection (AG) |
25.11.2008 |
Vereinigtes Königreich |
EMPFEHLUNGEN
|
3.3.2010 |
DE |
Amtsblatt der Europäischen Union |
L 52/53 |
EMPFEHLUNG DER KOMMISSION
vom 2. März 2010
zur Prävention und Reduzierung von Ethylcarbamat in Steinobstbränden und Steinobsttrestern und zur Überwachung des Ethylcarbamatgehalts in diesen Getränken
(Text von Bedeutung für den EWR)
(2010/133/EU)
DIE EUROPÄISCHE KOMMISSION —
gestützt auf den Vertrag zur Arbeitsweise der Europäischen Union, insbesondere auf Artikel 292,
in Erwägung nachstehender Gründe:
|
(1) |
Das Wissenschaftliche Gremium für Kontaminanten in der Lebensmittelkette bei der Europäischen Behörde für Lebensmittelsicherheit (EFSA) nahm am 20. September 2007 ein wissenschaftliches Gutachten zu Ethylcarbamat und Blausäure in Lebensmitteln und Getränken an (1). In diesem Gutachten leitete das Gremium für verschiedene Lebensmittel- und Getränkeverbrauchsszenarien „Margins of Exposure“ (MOE) für Ethylcarbamat ab. Aufgrund der MOE-Werte kam das Gremium zu dem Schluss, dass Ethylcarbamat in alkoholischen Getränken gesundheitlich bedenklich ist, insbesondere was Steinobstbrände betrifft, und empfahl, Maßnahmen zu treffen, um die Konzentration von Ethylcarbamat in diesen Getränken zu senken. Da Blausäure eine wichtige Vorstufe bei der Bildung von Ethylcarbamat in Steinobstbränden und Steinobsttrestern ist, schloss das Gremium, dass ein Schwerpunkt der Maßnahmen auf Blausäure und andere Vorstufen von Ethylcarbamat gelegt werden sollte, um die Bildung von Ethylcarbamat während der Haltbarkeitsdauer dieser Produkte zu verhindern. |
|
(2) |
Der maximale Blausäuregehalt in Steinobstbränden und Steinobsttrestern wurde in der Verordnung (EG) Nr. 110/2008 des Europäischen Parlaments und des Rates vom 15. Januar 2008 zur Begriffsbestimmung, Bezeichnung, Aufmachung und Etikettierung von Spirituosen sowie zum Schutz geografischer Angaben für Spirituosen und zur Aufhebung der Verordnung (EWG) Nr. 1576/89 (2) festgelegt. Diese Verordnung sieht vor, dass der maximale Blausäuregehalt bei Steinobstbränden und Steinobsttrestern 7 g/hl r. A. (70 mg/l) nicht überschreiten darf. |
|
(3) |
Zur Umsetzung der EFSA-Empfehlungen wird ein „Verhaltenskodex zur Prävention und Reduzierung des Ethylcarbamatgehalts in Steinobstbränden und Steinobsttrestern“ als geeignetes Mittel angesehen. Der Kodex empfiehlt bewährte Herstellungsverfahren (GMP), deren Einsatz nachweislich zu einem geringeren Ethylcarbamatgehalt führen kann. Das Ziel eines Ethylcarbamatgehalts von 1 mg/l in trinkfertigen Spirituosen ist realistisch und kann bei der Anwendung bewährter Verfahren erreicht werden. |
|
(4) |
Während eines Zeitraums von drei Jahren sollte der Ethylcarbamatgehalt in Steinobstbränden und Steinobsttrestern überwacht werden; die Ergebnisse sollten genutzt werden, um die Auswirkungen des Verhaltenskodex drei Jahre nach seiner Umsetzung zu bewerten. Weiterhin sollte die Möglichkeit der Festlegung eines Höchstgehalts bewertet werden — |
HAT DIE FOLGENDE EMPFEHLUNG ERLASSEN:
Es wird empfohlen, dass die Mitgliedstaaten
|
1. |
die erforderlichen Maßnahmen ergreifen, damit der „Verhaltenskodex zur Prävention und Reduzierung des Ethylcarbamatgehalts in Steinobstbränden und Steinobsttrestern“, wie im Anhang dieser Empfehlung beschrieben, von allen umgesetzt wird, die an Herstellung, Verpackung, Transport und Lagerung von Steinobstbränden und Steinobsttrestern beteiligt sind; |
|
2. |
sicherstellen, dass angemessene Maßnahmen ergriffen werden, um einen möglichst geringen Ethylcarbamatgehalt in Steinobstbränden und Steinobsttrestern zu erreichen, wobei als Zielwert 1 mg/l angestrebt wird; |
|
3. |
den Ethylcarbamatgehalt in Steinobstbränden und Steinobsttrestern 2010, 2011 und 2012 überwachen, um die Auswirkungen des Verhaltenskodexes zu bewerten, der im Anhang zu dieser Empfehlung enthalten ist; |
|
4. |
jeweils am 1. Juni jedes Jahres die Überwachungsdaten des vorangegangenen Jahres der EFSA zusammen mit den von der EFSA geforderten Angaben und in dem verlangten Format übermitteln; |
|
5. |
im Rahmen des Überwachungsprogramms die Probenahmeverfahren befolgen, die im Teil B des Anhangs zur Verordnung (EG) Nr. 333/2007 der Kommission vom 28. März 2007 zur Festlegung der Probenahmeverfahren und Analysemethoden für die amtliche Kontrolle des Gehalts an Blei, Cadmium, Quecksilber, anorganischem Zinn, 3-MCPD und Benzo(a)pyren in Lebensmitteln (3) dargelegt werden; |
|
6. |
Ethylcarbamatanalysen entsprechend den Kriterien ausführen, die in Anhang III der Verordnung (EG) Nr. 882/2004 des Europäischen Parlaments und des Rates vom 29. April 2004 über amtliche Kontrollen zur Überprüfung der Einhaltung des Lebensmittel- und Futtermittelrechts sowie der Bestimmungen über Tiergesundheit und Tierschutz (4) unter den Punkten 1 und 2 aufgeführt werden. |
Brüssel, den 2. März 2010
Für die Kommission
John DALLI
Mitglied der Kommission
(1) Ethylcarbamat und Blausäure in Lebensmitteln und Getränken — Wissenschaftliches Gutachten des Gremiums für Kontaminanten, abgegeben auf Ersuchen der Kommission, The EFSA Journal (2007) Nr. 551, S. 1. http://www.efsa.europa.eu/en/scdocs/doc/Contam_ej551_ethyl_carbamate_en_rev.1,3.pdf
(2) ABl. L 39 vom 13.2.2008, S. 16.
(3) ABl. L 88 vom 29.3.2007, S. 29.
(4) ABl. L 165 vom 3.4.2004, S. 1.
ANHANG
Verhaltenskodex zur Prävention und Reduzierung des Ethylcarbamatgehalts in Steinobstbränden und Steinobsttrestern
EINLEITUNG
|
1. |
Ethylcarbamat ist eine Verbindung, die von Natur aus in fermentierten Lebensmitteln und alkoholischen Getränken wie Brot, Jogurt, Sojasoße, Wein, Bier und vor allem in hauptsächlich aus Kirschen, Pflaumen, Mirabellen und Aprikosen hergestellten Steinobstbränden und Steinobsttrestern vorkommt. |
|
2. |
Ethylcarbamat kann aus verschiedenen Substanzen entstehen, die in Lebensmitteln und Getränken enthalten sind, wie Hydrogencyanid (oder Blausäure), Harnstoff, Citrullin und andere N-Carbamoyl-Verbindungen. Wahrscheinlich ist Cyanat in den meisten Fällen die letzte Vorstufe und reagiert mit Ethanol zu Ethylcarbamat. |
|
3. |
In Steinobstdestillaten (Steinobstbränden und Steinobsttrestern) kann Ethylcarbamat aus Blausäureglykosiden entstehen, die natürlicher Bestandteil der Steine sind. Beim Einmaischen der Früchte können die Kerne zerbrechen und Blausäureglykoside aus den Steinen mit den Enzymen der Obstmaische in Kontakt kommen. Die Blausäureglykoside werden dann zu Blausäure/Cyaniden abgebaut. Bei einer längeren Lagerung der fermentierten Maische können auch intakte Steine Blausäure abgeben. Während des Destillationsvorgangs kann sich die Blausäure in allen Fraktionen anreichern. Unter Lichteinfluss wird Cyanid zu Cyanat oxidiert, das mit Ethanol zu Ethylcarbamat reagiert. Wenn die Reaktion einmal ausgelöst wurde, kann sie nicht mehr gestoppt werden. |
|
4. |
Eine starke Reduzierung des Ethylcarbamatgehalts kann auf zwei unterschiedliche Weisen erreicht werden. Erstens ist es möglich, die Konzentration der wichtigsten Vorläufersubstanzen zu verringern. Zweitens lässt sich die Reaktionsneigung dieser Substanzen zur Bildung von Cyanat abzuschwächen. Die zentralen Einflussfaktoren sind dabei die Konzentration der Vorstufen (wie Blausäure und Cyanide) und die Lagerbedingungen, wie Lichtexposition und Temperatur. |
|
5. |
Auch wenn noch keine enge Korrelation zwischen dem Gehalt von Blausäure und Ethylcarbamat hergestellt werden konnte, führen offensichtlich unter bestimmten Bedingungen hohe Konzentrationen von Blausäure zu einem höheren Ethylcarbamatgehalt. Ein möglicher Anstieg der Ethylcarbamatbildung wurde mit einem Blausäuregehalt im endgültigen Destillat von 1 mg/l oder mehr in Verbindung gebracht (1), (2). |
|
6. |
Teil I enthält Einzelheiten zum Herstellungsprozess, Teil II spezielle Empfehlungen auf der Grundlage bewährter Herstellungsverfahren (GMP). |
I. BESCHREIBUNG DES HERSTELLUNGSPROZESSES
|
7. |
Der Herstellungsprozess von Obstbränden und Obsttrestern umfasst das Einmaischen und die Fermentierung der gesamten Frucht sowie die anschließende Destillation. Der Prozess läuft typischerweise folgendermaßen ab:
|
|
8. |
Während der Destillation verdampft der Vorlauf als Erstes. Er ist in der Regel am lösungsmittel- oder lackähnlichen Geruch zu erkennen. Diese Faktion ist im Allgemeinen nicht für den Verbrauch geeignet und sollte entsorgt werden. |
|
9. |
In der Mitte des Destillationsprozesses (Mittellauf oder „Herzstück“) wird der in allen Spirituosen hauptsächlich enthaltene Ethylalkohol (Ethanol) abgeschieden. Dieser Teil des Destillationsvorgangs, in dem der Anteil an anderen flüchtigen Verbindungen als Ethanol am geringsten ist und in dem die reinsten Obstaromen vorkommen, wird immer aufgefangen. |
|
10. |
Der Nachlauf der Destillation enthält Essigsäure und Fuselöle, die sich häufig durch unangenehme Gerüche (Essig und Pflanzen) auszeichnen. Er wird ebenfalls entfernt, kann aber erneut destilliert werden, da er immer noch Ethanol enthält. |
II. EMPFOHLENE VERFAHREN AUF DER GRUNDLAGE BEWÄHRTER HERSTELLUNGSVERFAHREN (GMP)
Rohstoffe und Vorbereitung der Obstmaische
|
11. |
Die Auswahl der Rohstoffe und die Vorbereitung der Obstmaische sollten darauf ausgerichtet sein, die Freisetzung von Blausäure zu verhindern. |
|
12. |
Das Steinobst sollte von hoher Qualität und weder mechanisch beschädigt noch mikrobiologisch verdorben sein. |
|
13. |
Die Früchte sollten vorzugsweise entsteint werden. |
|
14. |
Wenn die Früchte nicht entsteint werden, sollten sie behutsam zerquetscht werden, um das Beschädigen der Steine zu vermeiden. |
Fermentierung
|
15. |
Den eingemaischten Früchten sollten ausgewählte Hefestämme für die Alkoholherstellung entsprechend den Anweisungen für die Verwendung hinzugefügt werden. |
|
16. |
Die eingemaischten fermentierten Früchte sollten unter Einsatz hoher Hygienestandards behandelt werden; die Lichtexposition sollte minimiert werden. Die fermentierte Obstmaische sollte vor der Destillierung möglichst kurz gelagert werden, da bei längerer Lagerung der Maische die Blausäure auch aus intakten Steinen austreten kann. |
Destillationsanlagen
|
17. |
Die Destillationsanlagen und der Destillationsprozess müssen so ausgelegt sein, dass keine Blausäure in das Destillat gelangt. |
|
18. |
Die Destillationsanlagen sollten mit automatischen Spülvorrichtungen und Kupferkatalysatoren ausgestattet sein. Die automatischen Spülvorrichtungen sorgen dafür, dass der Destillierapparat sauber bleibt, während die Kupferkatalysatoren die Blausäure binden, bevor sie in das Destillat übergeht. |
|
19. |
Automatische Spülvorrichtungen sind bei einer diskontinuierlichen Destillation nicht erforderlich. Die Destillationsanlage sollte nach festgelegten Verfahren systematisch und gründlich gereinigt werden. |
|
20. |
In bestimmten Fällen — wenn keine Kupferkatalysatoren oder andere spezielle Cyanidabscheider verwendet werden — können Kupferverbindungen der fermentierten Obstmaische vor der Destillierung hinzugefügt werden. Die Aufgabe der Kupferverbindungen besteht in der Bindung der Blausäure. Kupferverbindungen sind in Fachgeschäften erhältlich und sollten sehr vorsichtig entsprechend der Gebrauchsanweisung eingesetzt werden. |
Destillationsvorgang
|
21. |
Steine, die sich in der fermentierten Maische abgelagert haben, sollten nicht in die Destillationsanlage gepumpt werden. |
|
22. |
Die Destillation sollte so ausgeführt werden, dass der Alkohol langsam verdampft (z. B. durch die Verwendung von Dampf als Heizquelle anstelle einer direkten Flamme). |
|
23. |
Die erste Fraktion des Destillats, der Vorlauf, sollte sorgfältig abgeschieden werden. |
|
24. |
Der Mittellauf (das „Herzstück“), sollte aufgefangen und dunkel gelagert werden. Wenn der Alkoholgehalt 50 % Vol. im Sammelgefäß erreicht, sollte auf den Nachlauf umgeschaltet werden, damit Ethylcarbamat, das sich eventuell gebildet hat, mit dem Nachlauf abgeschieden wird. |
|
25. |
Der abgetrennte Nachlauf, der möglicherweise Ethylcarbamat enthält, sollte aufgefangen werden; wenn er für eine erneute Destillation verwendet wird, sollte er separat destilliert werden. |
Überprüfung des Destillats, erneute Destillation und Lagerung
Blausäure
|
26. |
Die Destillate sollten regelmäßig auf ihren Blausäuregehalt überprüft werden. Die Bestimmung sollte mithilfe geeigneter Tests erfolgen, d. h. entweder mit Schnelltests zur Bestimmung des Blausäuregehalts oder alternativ durch ein Speziallabor. |
|
27. |
Übersteigt die Konzentration von Blausäure im Destillat 1 mg/l, empfiehlt sich ggf. eine erneute Destillation mit Katalysatoren oder Kupferverbindungen (vgl. Punkte 18 und 20). |
|
28. |
Destillate, die einen Blausäuregehalt von annähernd 1 mg/l aufweisen, sollten idealerweise ebenfalls erneut destilliert werden, oder, wenn dies nicht möglich ist, in lichtundurchlässigen Flaschen oder Umkartons und so kurz wie möglich gelagert werden, um die Bildung von Ethylcarbamat während der Lagerung zu verhindern. |
Ethylcarbamat
|
29. |
Eine Untersuchung auf Ethylcarbamat wird für Destillate empfohlen, in denen die Verbindung bereits entstanden sein könnte (z. B. in Destillaten mit unbekanntem Herstellungsablauf, erhöhtem Cyanidgehalt und bei Lagerung bei Licht). Der Ethylcarbamatgehalt kann nur durch ein Speziallabor getestet werden. |
|
30. |
Wenn das Destillat einen Ethylcarbamatgehalt aufweist, der das angestrebte Niveau von 1 mg/l übersteigt, sollte das Destillat ggf. erneut destilliert werden. |
(1) Christoph, N., Bauer-Christoph, C., Maßnahmen zur Reduzierung des Ethylcarbamatgehaltes bei der Herstellung von Steinobstbränden (I), Kleinbrennerei 11, 1998; S. 9-13.
(2) Christoph, N., Bauer-Christoph, C., Maßnahmen zur Reduzierung des Ethylcarbamatgehaltes bei der Herstellung von Steinobstbränden (II), Kleinbrennerei 1, 1999; S. 5-13.