ISSN 1725-2539
Amtsblatt
der Europäischen Union
L 333

Ausgabe in deutscher Sprache
Rechtsvorschriften
51. Jahrgang
11. Dezember 2008
|
ISSN 1725-2539 |
||
|
Amtsblatt der Europäischen Union |
L 333 |
|

|
||
|
Ausgabe in deutscher Sprache |
Rechtsvorschriften |
51. Jahrgang |
|
Inhalt |
|
I Veröffentlichungsbedürftige Rechtsakte, die in Anwendung des EG-Vertrags/Euratom-Vertrags erlassen wurden |
Seite |
|
|
|
VERORDNUNGEN |
|
|
|
|
||
|
|
* |
|
|
|
II Nicht veröffentlichungsbedürftige Rechtsakte, die in Anwendung des EG-Vertrags/Euratom-Vertrags erlassen wurden |
|
|
|
|
ENTSCHEIDUNGEN UND BESCHLÜSSE |
|
|
|
|
Kommission |
|
|
|
|
2008/932/EG |
|
|
|
* |
||
|
|
|
2008/933/EG |
|
|
|
* |
Entscheidung der Kommission vom 4. Dezember 2008 über die Zulassung des Inverkehrbringens von Erzeugnissen, die genetisch veränderte Sojabohnen der Sorte MON89788 (MON-89788-1) enthalten, aus ihnen bestehen oder aus ihnen gewonnen werden, gemäß der Verordnung (EG) Nr. 1829/2003 des Europäischen Parlaments und des Rates (Bekannt gegeben unter Aktenzeichen K(2008) 7517) ( 1 ) |
|
|
|
|
2008/934/EG |
|
|
|
* |
Entscheidung der Kommission vom 5. Dezember 2008 über die Nichtaufnahme bestimmter Wirkstoffe in Anhang I der Richtlinie 91/414/EWG des Rates und die Rücknahme der Zulassungen für Pflanzenschutzmittel mit diesen Wirkstoffen (Bekannt gegeben unter Aktenzeichen K(2008) 7637) ( 1 ) |
|
|
|
|
2008/935/EG |
|
|
|
* |
|
|
|
Berichtigungen |
|
|
|
* |
|
|
|
||
|
|
* |
|
|
|
|
|
(1) Text von Bedeutung für den EWR |
|
DE |
Bei Rechtsakten, deren Titel in magerer Schrift gedruckt sind, handelt es sich um Rechtsakte der laufenden Verwaltung im Bereich der Agrarpolitik, die normalerweise nur eine begrenzte Geltungsdauer haben. Rechtsakte, deren Titel in fetter Schrift gedruckt sind und denen ein Sternchen vorangestellt ist, sind sonstige Rechtsakte. |
I Veröffentlichungsbedürftige Rechtsakte, die in Anwendung des EG-Vertrags/Euratom-Vertrags erlassen wurden
VERORDNUNGEN
|
11.12.2008 |
DE |
Amtsblatt der Europäischen Union |
L 333/1 |
VERORDNUNG (EG) Nr. 1228/2008 DER KOMMISSION
vom 10. Dezember 2008
zur Festlegung pauschaler Einfuhrwerte für die Bestimmung der für bestimmtes Obst und Gemüse geltenden Einfuhrpreise
DIE KOMMISSION DER EUROPÄISCHEN GEMEINSCHAFTEN —
gestützt auf den Vertrag zur Gründung der Europäischen Gemeinschaft,
gestützt auf die Verordnung (EG) Nr. 1234/2007 des Rates vom 22. Oktober 2007 über eine gemeinsame Organisation der Agrarmärkte und mit Sondervorschriften für bestimmte landwirtschaftliche Erzeugnisse (Verordnung über die einheitliche GMO) (1),
gestützt auf die Verordnung (EG) Nr. 1580/2007 der Kommission vom 21. Dezember 2007 mit Durchführungsbestimmungen zu den Verordnungen (EG) Nr. 2200/96, (EG) Nr. 2201/96 und (EG) Nr. 1182/2007 des Rates im Sektor Obst und Gemüse (2), insbesondere auf Artikel 138 Absatz 1,
in Erwägung nachstehenden Grundes:
Die in Anwendung der Ergebnisse der multilateralen Handelsverhandlungen der Uruguay-Runde von der Kommission festzulegenden, zur Bestimmung der pauschalen Einfuhrwerte zu berücksichtigenden Kriterien sind in der Verordnung (EG) Nr. 1580/2007 für die in ihrem Anhang XV Teil A aufgeführten Erzeugnisse und Zeiträume festgelegt —
HAT FOLGENDE VERORDNUNG ERLASSEN:
Artikel 1
Die in Artikel 138 der Verordnung (EG) Nr. 1580/2007 genannten pauschalen Einfuhrwerte sind in der Tabelle im Anhang zur vorliegenden Verordnung festgesetzt.
Artikel 2
Diese Verordnung tritt am 11. Dezember 2008 in Kraft.
Diese Verordnung ist in allen ihren Teilen verbindlich und gilt unmittelbar in jedem Mitgliedstaat.
Brüssel, den 10. Dezember 2008
Für die Kommission
Jean-Luc DEMARTY
Generaldirektor für Landwirtschaft und ländliche Entwicklung
(1) ABl. L 299 vom 16.11.2007, S. 1.
(2) ABl. L 350 vom 31.12.2007, S. 1.
ANHANG
Pauschale Einfuhrwerte für die Bestimmung der für bestimmtes Obst und Gemüse geltenden Einfuhrpreise
|
(EUR/100 kg) |
||
|
KN-Code |
Drittland-Code (1) |
Pauschaler Einfuhrwert |
|
0702 00 00 |
MA |
81,5 |
|
TR |
75,2 |
|
|
ZZ |
78,4 |
|
|
0707 00 05 |
JO |
167,2 |
|
MA |
56,7 |
|
|
TR |
84,0 |
|
|
ZZ |
102,6 |
|
|
0709 90 70 |
MA |
128,5 |
|
TR |
133,8 |
|
|
ZZ |
131,2 |
|
|
0805 10 20 |
AR |
18,1 |
|
BR |
44,6 |
|
|
CL |
36,4 |
|
|
EG |
30,5 |
|
|
MA |
76,3 |
|
|
TR |
62,7 |
|
|
ZA |
43,2 |
|
|
ZW |
43,9 |
|
|
ZZ |
44,5 |
|
|
0805 20 10 |
MA |
72,3 |
|
TR |
73,0 |
|
|
ZZ |
72,7 |
|
|
0805 20 30, 0805 20 50, 0805 20 70, 0805 20 90 |
CN |
52,4 |
|
HR |
54,6 |
|
|
IL |
71,9 |
|
|
TR |
57,3 |
|
|
ZZ |
59,1 |
|
|
0805 50 10 |
MA |
59,0 |
|
TR |
64,6 |
|
|
ZZ |
61,8 |
|
|
0808 10 80 |
CA |
89,2 |
|
CL |
43,7 |
|
|
CN |
71,7 |
|
|
MK |
34,8 |
|
|
US |
106,7 |
|
|
ZA |
123,2 |
|
|
ZZ |
78,2 |
|
|
0808 20 50 |
CN |
56,2 |
|
TR |
97,0 |
|
|
US |
133,9 |
|
|
ZZ |
95,7 |
|
(1) Nomenklatur der Länder gemäß der Verordnung (EG) Nr. 1833/2006 der Kommission (ABl. L 354 vom 14.12.2006, S. 19). Der Code „ZZ“ steht für „Andere Ursprünge“.
|
11.12.2008 |
DE |
Amtsblatt der Europäischen Union |
L 333/3 |
VERORDNUNG (EG) Nr. 1229/2008 DER KOMMISSION
vom 10. Dezember 2008
zur Eintragung bestimmter Bezeichnungen in das Verzeichnis der geschützten Ursprungsbezeichnungen und der geschützten geografischen Angaben (San Simón da Costa (g.U.), Ail blanc de Lomagne (g.g.A.), Steirischer Kren (g.g.A.))
DIE KOMMISSION DER EUROPÄISCHEN GEMEINSCHAFTEN —
gestützt auf den Vertrag zur Gründung der Europäischen Gemeinschaft,
gestützt auf die Verordnung (EG) Nr. 510/2006 des Rates vom 20. März 2006 zum Schutz von geografischen Angaben und Ursprungsbezeichnungen für Agrarerzeugnisse und Lebensmittel (1), insbesondere auf Artikel 7 Absatz 4 Unterabsatz 1,
in Erwägung nachstehender Gründe:
|
(1) |
Der Antrag Spaniens auf Eintragung der Bezeichnung „San Simón da Costa“, der Antrag Frankreichs auf Eintragung der Bezeichnung „Ail blanc de Lomagne“ und der Antrag Österreichs auf Eintragung der Bezeichnung „Steirischer Kren“ wurden gemäß Artikel 6 Absatz 2 Unterabsatz 1 der Verordnung (EG) Nr. 510/2006 und in Anwendung des Artikels 17 Absatz 2 der genannten Verordnung im Amtsblatt der Europäischen Union (2) veröffentlicht. |
|
(2) |
Da bei der Kommission kein Einspruch gemäß Artikel 7 der Verordnung (EG) Nr. 510/2006 eingegangen ist, sollten diese Bezeichnungen eingetragen werden — |
HAT FOLGENDE VERORDNUNG ERLASSEN:
Artikel 1
Die im Anhang dieser Verordnung genannten Bezeichnungen werden eingetragen.
Artikel 2
Diese Verordnung tritt am zwanzigsten Tag nach ihrer Veröffentlichung im Amtsblatt der Europäischen Union in Kraft.
Diese Verordnung ist in allen ihren Teilen verbindlich und gilt unmittelbar in jedem Mitgliedstaat.
Brüssel, den 10. Dezember 2008
Für die Kommission
Mariann FISCHER BOEL
Mitglied der Kommission
(1) ABl. L 93 vom 31.3.2006, S. 12.
(2) ABl. C 85 vom 4.4.2008, S. 13 (San Simón da Costa), ABl. C 87 vom 8.4.2008, S. 8 (Ail blanc de Lomagne), ABl. C 91 vom 12.4.2008, S. 26 (Steirischer Kren).
ANHANG
Für den menschlichen Verzehr bestimmte landwirtschaftliche Erzeugnisse gemäß Anhang I des Vertrags:
Klasse 1.3. Käse
SPANIEN
San Simón da Costa (g.U.)
Klasse 1.6. Obst, Gemüse und Getreide, frisch oder verarbeitet
FRANKREICH
Ail blanc de Lomagne (g.g.A.)
ÖSTERREICH
Steirischer Kren (g.g.A.)
II Nicht veröffentlichungsbedürftige Rechtsakte, die in Anwendung des EG-Vertrags/Euratom-Vertrags erlassen wurden
ENTSCHEIDUNGEN UND BESCHLÜSSE
Kommission
|
11.12.2008 |
DE |
Amtsblatt der Europäischen Union |
L 333/5 |
ENTSCHEIDUNG DER KOMMISSION
vom 2. Dezember 2008
zur Anwendung von Artikel 8 der Richtlinie 98/79/EG des Europäischen Parlaments und des Rates
(Bekannt gegeben unter Aktenzeichen K(2008) 7378)
(Nur der portugiesische Text ist verbindlich)
(2008/932/EG)
DIE KOMMISSION DER EUROPÄISCHEN GEMEINSCHAFTEN —
gestützt auf den Vertrag zur Gründung der Europäischen Gemeinschaft,
gestützt auf die Richtlinie 98/79/EG des Europäischen Parlaments und des Rates vom 27. Oktober 1998 über In-vitro-Diagnostika (1), insbesondere auf Artikel 8,
in Erwägung nachstehender Gründe:
|
(1) |
Die portugiesische Behörde für Medizinprodukte INFARMED hat mit Schreiben vom 29. Juli 2005 (2) der italienischen Firma Medical Biological Service S.R.L („MBS“) die Vermarktung ihres In-vitro-HIV-Diagnostik-Testkits „HIV 1&2 Ab“ („der HIV-Test“) verboten. INFARMED verpflichtete außerdem das portugiesische Vertriebs-unternehmen Prestifarma Lda. zum Rückruf des Produkts im Namen von MBS. |
|
(2) |
Mit Schreiben vom 1. September 2005 (3) teilte INFARMED diese Maßnahmen gemäß Artikel 13 der Richtlinie 98/79/EG mit. Zur Begründung seiner Maßnahme verwies Portugal auf den Gesundheitsüberwachungsbericht „NCAR DE-2005-07-30“ des deutschen Paul-Ehrlich-Instituts (PEI-Fall Nr. PEI0026/05). In einem nachfolgenden Schriftwechsel wurde klargestellt, dass die Nummer des NCAR-Berichts falsch angegeben worden war, dass die korrekte Nummer DE-2005-07-07-30 lautet und dass dieser Bericht mit dem NCAR-Bericht DE-2005-07-27-30 identisch ist. |
|
(3) |
Der NCAR-Bericht DE-2005-07-07-30 stellt fest, dass der HIV-Test kurz nach einer HIV-Infektion zur Entdeckung der Infektion 10—18 Tage länger als vergleichbare Tests braucht (geringe Sensitivität für frühe Serokonversion). Aus demselben Grund hatte die Slowakische Medizinische Hochschule in ihrem Prüfbericht vom 28. Oktober 2004 (4) der slowakischen notifizierten Stelle EVPÚ empfohlen, keine Bescheinigung für den HIV-Test auszustellen. Der Test entsprach somit nicht dem „allgemein anerkannten Stand der Technik“ im Sinne von Anhang I (Grundlegende Anforderungen) Abschnitt A.2 der Richtlinie 98/79/EG und von Abschnitt 3.1.8 Satz 3 der Gemeinsamen Technischen Spezifikationen für In-vitro-Diagnostika im Anhang der Entscheidung 2002/364/EG der Kommission (5). |
|
(4) |
Wie das Paul-Ehrlich-Institut in seinem Schreiben an das deutsche Bundesgesundheitsministerium vom 12. Dezember 2005 (6) feststellt, belegen die vom Hersteller zur Verfügung gestellten Unterlagen überdies, dass der HIV-Test nicht wie laut Abschnitt 3.1.8 Satz 1 der Gemeinsamen Technischen Spezifikationen erforderlich alle echt positiven Proben entdeckte. Entgegen Abschnitt 3.1.5 der Gemeinsamen Technischen Spezifikationen wurde dieses Versagen vom Hersteller oder seiner notifizierten Stelle niemals aufgeklärt. Der HIV-Test erfüllt daher nicht Abschnitt 3.1.8 Satz 1 und Abschnitt 3.1.5 der Gemeinsamen Technischen Spezifikationen. |
|
(5) |
Nachdem MBS den NCAR-Bericht DE-2005-07-07-30 zur Kenntnis genommen hatte, modifizierte das Unternehmen den HIV-Test. Jedoch wurde, wie das Paul-Ehrlich-Institut später in einem Bericht vom 23. August 2007 (7) feststellte, die Sensitivität des HIV-Tests für frühe Serokonversion durch die Modifizierung nicht verbessert. Laut der Aussage auf Seite 10 dieses Berichts versagt auch der modifizierte Test bei der Erkennung echt positiver Proben, deren Befund bereits durch die Westernblot- oder Immunoblot-Methode bestätigt wurde. |
|
(6) |
Die Kommission konsultierte die Mitgliedstaaten mit Schreiben vom 22. März 2007 (D(2007)7800), die beteiligten notifizierten Stellen und Institute mit Schreiben vom 21. März 2007 (D(2007)7817) und MBS mit Schreiben vom 11. Juni 2007 (D(2007)16597). Sie hörte außerdem verschiedentlich Experten auf dem Gebiet der In-vitro-Diagnostika, unter anderem auf einer Sitzung am 31. Januar 2008. |
|
(7) |
In Artikel 13 der Richtlinie 98/79/EG (Besondere Gesundheitsüberwachungsmaßnahmen) sind die Bedingungen weiter gefasst als in Artikel 8 (Schutzklausel) derselben Richtlinie. Artikel 13 der Richtlinie 98/79/EG erfordert bei der handelnden Behörde nicht dasselbe Maß an Gewissheit im Hinblick auf das Vorliegen eines Risikos. |
|
(8) |
Die Auswertung der ursprünglichen Mitteilung und der späteren Schreiben von INFARMED sowie die Anhörung der betroffenen Parteien haben bestätigt, dass das zu prüfende Produkt bei korrekter Wartung und bestimmungsgemäßer Verwendung die Gesundheit und/oder die Sicherheit von Patienten, Nutzern oder anderen Personen im Sinne von Artikel 8 der Richtlinie 98/79/EG beeinträchtigen kann, da es nicht dem „allgemein anerkannten Stand der Technik“ entspricht und somit eine grundlegende Anforderung nicht erfüllt. |
|
(9) |
Da der Test langsamer und weniger zuverlässig als andere Diagnostika ist, entdeckt er weniger HIV-Infektionen als die anderen Diagnostika und verzögert möglicherweise den Beginn einer geeigneten Antiretrovirentherapie. Der Test könnte auch zu einem erhöhten Risiko unentdeckter HIV-Infektionen bei Blutspendern beitragen. Er beeinträchtigt die Gesundheit auch insofern, als durch die verspätete und unzuverlässige Entdeckung von HIV-Infektionen das Risiko einer Übertragung auf dritte Personen, zum Beispiel durch Geschlechtsverkehr, steigen kann. |
|
(10) |
Laut dem Europäischen Gerichtshof (8) ist die im Einklang mit Artikel 8 Absatz 2 der Richtlinie 98/79/EG geäußerte Ansicht der Kommission für den Mitgliedstaat, der Maßnahmen getroffen hat, bindend. Dementsprechend ist dieser Rechtsakt als Entscheidung einzustufen — |
HAT FOLGENDE ENTSCHEIDUNG ERLASSEN:
Artikel 1
Die Maßnahmen, die die portugiesische Behörde INFARMED gegen die Vermarktung des von der italienischen Firma Medical Biological Services S.R.L hergestellten In-vitro-Diagnostikums „HIV 1&2 Ab“ mit Schreiben vom 29. Juli 2005 (DGREE/VPS/086/05 — Fall Nummer 9.5.1.-329/2005) getroffenen hat, sind gerechtfertigt.
Artikel 2
Diese Entscheidung ist an die Portugiesische Republik gerichtet.
Brüssel, den 2. Dezember 2008
Für die Kommission
Günter VERHEUGEN
Vizepräsident
(1) ABl. L 331 vom 7.12.1998, S. 1.
(2) DGREE/VPS/086/05 — Fall Nummer 9.5.1.-329/2005.
(3) DGREE/VPS/094/05.
(4) Prüfbericht Nr. E-650/04 208600.
(5) ABl. L 131 vom 16.5.2002, S. 17.
(6) Bezugsnummer: A2.
(7) Die österreichischen Behörden hatten das Paul-Ehrlich-Institut um die Erstellung dieses Berichts ersucht, nachdem sie den modifizierten Test auf dem Weg von MBS zur österreichischen Firma DIALAB GmbH beschlagnahmt hatten, die beabsichtigte, den Test unter ihrem eigenen Namen zu vermarkten.
(8) Vgl. analog das Urteil des Gerichtshofs (Erste Kammer) vom 14. Juni 2007, Rechtssache C-6/05, Slg. 2007, S. I-4557 Randnummern 58, 59.
|
11.12.2008 |
DE |
Amtsblatt der Europäischen Union |
L 333/7 |
ENTSCHEIDUNG DER KOMMISSION
vom 4. Dezember 2008
über die Zulassung des Inverkehrbringens von Erzeugnissen, die genetisch veränderte Sojabohnen der Sorte MON89788 (MON-89788-1) enthalten, aus ihnen bestehen oder aus ihnen gewonnen werden, gemäß der Verordnung (EG) Nr. 1829/2003 des Europäischen Parlaments und des Rates
(Bekannt gegeben unter Aktenzeichen K(2008) 7517)
(Nur der französische und der niederländische Text sind verbindlich)
(Text von Bedeutung für den EWR)
(2008/933/EG)
DIE KOMMISSION DER EUROPÄISCHEN GEMEINSCHAFTEN —
gestützt auf den Vertrag zur Gründung der Europäischen Gemeinschaft,
gestützt auf die Verordnung (EG) Nr. 1829/2003 des Europäischen Parlaments und des Rates vom 22. September 2003 über genetisch veränderte Lebensmittel und Futtermittel (1), insbesondere auf Artikel 7 Absatz 3 und Artikel 19 Absatz 3,
in Erwägung nachstehender Gründe:
|
(1) |
Am 31. Oktober 2006 stellte das Unternehmen Monsanto Europe S.A. bei der zuständigen Behörde der Niederlande gemäß den Artikeln 5 und 17 der Verordnung (EG) Nr. 1829/2003 einen Antrag (im Folgenden „Antrag“) auf das Inverkehrbringen von Lebensmitteln, Lebensmittelzutaten und Futtermitteln, die Sojabohnen der Sorte MON89788 enthalten, aus ihnen bestehen oder aus ihnen gewonnen werden. |
|
(2) |
Der Antrag betrifft außerdem das Inverkehrbringen anderer Erzeugnisse, die Sojabohnen der Sorte MON89788 enthalten oder aus ihnen bestehen, zu den gleichen Verwendungszwecken wie bei jeder anderen Sojabohnensorte außer zum Anbau. Daher enthält der Antrag gemäß Artikel 5 Absatz 5 und Artikel 17 Absatz 5 der Verordnung (EG) Nr. 1829/2003 die Daten und Angaben, die gemäß den Anhängen III und IV der Richtlinie 2001/18/EG des Europäischen Parlaments und des Rates vom 12. März 2001 über die absichtliche Freisetzung genetisch veränderter Organismen in die Umwelt und zur Aufhebung der Richtlinie 90/220/EWG des Rates (2) erforderlich sind, sowie Informationen und Schlussfolgerungen zu der nach den Grundsätzen in Anhang II der Richtlinie 2001/18/EG durchgeführten Risikobewertung. |
|
(3) |
Am 11. Juli 2008 gab die Europäische Behörde für Lebensmittelsicherheit (EFSA) gemäß den Artikeln 6 und 18 der Verordnung (EG) Nr. 1829/2003 eine befürwortende Stellungnahme ab und kam zu dem Schluss, es sei unwahrscheinlich, dass das Inverkehrbringen der im Antrag beschriebenen Erzeugnisse, die Sojabohnen der Sorte MON89788 enthalten, aus ihnen bestehen oder aus ihnen gewonnen werden (im Folgenden „Erzeugnisse“), im Rahmen der vorgesehenen Verwendungszwecke schädliche Auswirkungen auf die Gesundheit von Mensch oder Tier oder auf die Umwelt habe (3). In ihrer Stellungnahme hat die EFSA alle spezifischen Fragen und Bedenken der Mitgliedstaaten berücksichtigt, die im Rahmen der Konsultation der zuständigen nationalen Behörden gemäß Artikel 6 Absatz 4 und Artikel 18 Absatz 4 der genannten Verordnung vorgebracht wurden. |
|
(4) |
Die EFSA kam in ihrer Stellungnahme ferner zu dem Schluss, dass der Umweltüberwachungsplan, der aus einem allgemeinen, vom Antragsteller vorgelegten Überwachungsplan besteht, der vorgesehenen Verwendung der Erzeugnisse entspricht. |
|
(5) |
In Anbetracht dieser Erwägungen sollten die Erzeugnisse zugelassen werden. |
|
(6) |
Jedem genetisch veränderten Organismus (GVO) sollte gemäß der Verordnung (EG) Nr. 65/2004 der Kommission vom 14. Januar 2004 über ein System für die Entwicklung und Zuweisung spezifischer Erkennungsmarker für genetisch veränderte Organismen (4) ein spezifischer Erkennungsmarker zugewiesen werden. |
|
(7) |
Nach der Stellungnahme der EFSA scheinen keine über die in Artikel 13 Absatz 1 und Artikel 25 Absatz 2 der Verordnung (EG) Nr. 1829/2003 hinausgehenden spezifischen Kennzeichnungsanforderungen an Lebensmittel, Lebensmittelzutaten und Futtermittel, die Sojabohnen der Sorte MON89788 enthalten, aus ihnen bestehen oder aus ihnen gewonnen werden, erforderlich zu sein. Um jedoch sicherzustellen, dass die Erzeugnisse nur im Rahmen der mit dieser Entscheidung erteilten Zulassung verwendet werden, sollte die Kennzeichnung von Futtermitteln sowie von anderen Erzeugnissen als Lebensmittel und Futtermittel, die den GVO enthalten oder aus diesem bestehen und für die die Zulassung beantragt wird, auch einen klaren Hinweis darauf enthalten, dass die betreffenden Erzeugnisse nicht zum Anbau verwendet werden dürfen. |
|
(8) |
Laut der Stellungnahme der EFSA sind außerdem keine spezifischen Bedingungen oder Einschränkungen für das Inverkehrbringen und/oder die Verwendung und Handhabung, einschließlich Bestimmungen für die marktbegleitende Beobachtung, sowie keine spezifischen Bedingungen zum Schutz besonderer Ökosysteme/der Umwelt und/oder geografischer Gebiete gemäß Artikel 6 Absatz 5 Buchstabe e und Artikel 18 Absatz 5 Buchstabe e der Verordnung (EG) Nr. 1829/2003 gerechtfertigt. |
|
(9) |
Alle relevanten Informationen über die Zulassung der Erzeugnisse sollten gemäß der Verordnung (EG) Nr. 1829/2003 in das Gemeinschaftsregister genetisch veränderter Lebensmittel und Futtermittel aufgenommen werden. |
|
(10) |
Artikel 4 Absatz 6 der Verordnung (EG) Nr. 1830/2003 des Europäischen Parlaments und des Rates vom 22. September 2003 über die Rückverfolgbarkeit und Kennzeichnung von genetisch veränderten Organismen und über die Rückverfolgbarkeit von aus genetisch veränderten Organismen hergestellten Lebensmitteln und Futtermitteln sowie zur Änderung der Richtlinie 2001/18/EG (5) legt die Anforderungen an die Kennzeichnung von Erzeugnissen fest, die aus GVO bestehen oder GVO enthalten. |
|
(11) |
Diese Entscheidung ist gemäß Artikel 9 Absatz 1 und Artikel 15 Absatz 2 Buchstabe c der Verordnung (EG) Nr. 1946/2003 des Europäischen Parlaments und des Rates vom 15. Juli 2003 über grenzüberschreitende Verbringungen genetisch veränderter Organismen (6) über die Informationsstelle für biologische Sicherheit den Vertragsparteien des Protokolls von Cartagena über die biologische Sicherheit zum Übereinkommen über die biologische Vielfalt zu melden. |
|
(12) |
Der Antragsteller wurde zu den in der vorliegenden Entscheidung vorgesehenen Maßnahmen konsultiert. |
|
(13) |
Der Ständige Ausschuss für die Lebensmittelkette und Tiergesundheit hat innerhalb der von seinem Vorsitz gesetzten Frist keine Stellungnahme abgegeben. |
|
(14) |
Auf seiner Tagung vom 19. November 2008 konnte der Rat keine Entscheidung durch qualifizierte Mehrheit für oder gegen den Vorschlag fällen. Der Rat erklärte, dass diese Angelegenheit für ihn abgeschlossen sei. Es obliegt nun der Kommission, diese Maßnahmen zu erlassen — |
HAT FOLGENDE ENTSCHEIDUNG ERLASSEN:
Artikel 1
Genetisch veränderter Organismus und spezifischer Erkennungsmarker
Der im Anhang dieser Entscheidung unter Buchstabe b bezeichneten genetisch veränderten Sojabohnensorte (Glycine max) MON89788 wird gemäß der Verordnung (EG) Nr. 65/2004 der spezifische Erkennungsmarker MON-89788-1 zugewiesen.
Artikel 2
Zulassung
Folgende Erzeugnisse werden für die Zwecke des Artikels 4 Absatz 2 und des Artikels 16 Absatz 2 der Verordnung (EG) Nr. 1829/2003 gemäß den in dieser Entscheidung genannten Bedingungen zugelassen:
|
a) |
Lebensmittel und Lebensmittelzutaten, die Sojabohnen der Sorte MON-89788-1 enthalten, aus ihnen bestehen oder aus ihnen gewonnen werden; |
|
b) |
Futtermittel, die Sojabohnen der Sorte MON-89788-1 enthalten, aus ihnen bestehen oder aus ihnen gewonnen werden; |
|
c) |
andere Erzeugnisse als Lebensmittel und Futtermittel, die Sojabohnen der Sorte MON-89788-1 enthalten oder aus ihnen bestehen, zu den gleichen Verwendungszwecken wie bei jeder anderen Sojabohnensorte außer zum Anbau. |
Artikel 3
Kennzeichnung
(1) Für die Zwecke der Kennzeichnungsanforderungen gemäß Artikel 13 Absatz 1 und Artikel 25 Absatz 2 der Verordnung (EG) Nr. 1829/2003 sowie gemäß Artikel 4 Absatz 6 der Verordnung (EG) Nr. 1830/2003 wird als „Bezeichnung des Organismus“„Sojabohnen“ festgelegt.
(2) Der Hinweis „nicht zum Anbau“ muss auf dem Etikett und in den Begleitpapieren der in Artikel 2 Buchstaben b und c genannten Erzeugnisse, die Sojabohnen der Sorte MON-89788-1 enthalten oder aus ihnen bestehen, erscheinen.
Artikel 4
Überwachung der Auswirkungen auf die Umwelt
(1) Der Zulassungsinhaber stellt sicher, dass der Plan zur Überwachung der Umweltauswirkungen gemäß Buchstabe h des Anhangs aufgestellt und umgesetzt wird.
(2) Der Zulassungsinhaber legt der Kommission Jahresberichte über die Durchführung und die Ergebnisse der im Überwachungsplan festgelegten Tätigkeiten vor.
Artikel 5
Gemeinschaftsregister
Die im Anhang der vorliegenden Entscheidung genannten Informationen werden gemäß Artikel 28 der Verordnung (EG) Nr. 1829/2003 in das Gemeinschaftsregister genetisch veränderter Lebensmittel und Futtermittel aufgenommen.
Artikel 6
Zulassungsinhaber
Zulassungsinhaber ist Monsanto Europe S.A., Belgien, im Namen der Monsanto Company, Vereinigte Staaten von Amerika.
Artikel 7
Geltungsdauer
Diese Entscheidung gilt 10 Jahre ab dem Datum ihrer Bekanntgabe.
Artikel 8
Adressat
Diese Entscheidung ist gerichtet an Monsanto Europe S.A., Avenue de Tervuren 270-272, B-1150 Brüssel, Belgien.
Brüssel, den 4. Dezember 2008
Für die Kommission
Androulla VASSILIOU
Mitglied der Kommission
(1) ABl. L 268 vom 18.10.2003, S. 1.
(2) ABl. L 106 vom 17.4.2001, S. 1.
(3) http://www.efsa.europa.eu/EFSA/efsa_locale-1178620753816_1178620787358.htm
(4) ABl. L 10 vom 16.1.2004, S. 5.
(5) ABl. L 268 vom 18.10.2003, S. 24.
(6) ABl. L 287 vom 5.11.2003, S. 1.
ANHANG
a) Antragsteller und Zulassungsinhaber:
|
Name |
: |
Monsanto Europe S.A. |
|
Anschrift |
: |
Avenue de Tervuren 270-272, B-1150 Brüssel, Belgien |
im Namen der Monsanto Company, 800 N. Lindbergh Boulevard, St. Louis, Missouri 63167, USA
b) Bezeichnung und Spezifikation der Erzeugnisse:
|
1. |
Lebensmittel und Lebensmittelzutaten, die Sojabohnen der Sorte MON-89788-1 enthalten, aus ihnen bestehen oder aus ihnen gewonnen werden; |
|
2. |
Futtermittel, die Sojabohnen der Sorte MON-89788-1 enthalten, aus ihnen bestehen oder aus ihnen gewonnen werden; |
|
3. |
andere Erzeugnisse als Lebensmittel und Futtermittel, die Sojabohnen der Sorte MON-89788-1 enthalten oder aus ihnen bestehen, zu den gleichen Verwendungszwecken wie bei jeder anderen Sojabohnensorte außer zum Anbau. |
Die im Antrag beschriebene genetisch veränderte Sojabohnensorte MON-89788-1 exprimiert das Protein CP4 EPSPS, das Toleranz gegenüber dem Herbizid Glyphosat verleiht.
c) Kennzeichnung:
|
1. |
Für die Zwecke der spezifischen Kennzeichnungsanforderungen gemäß Artikel 13 Absatz 1 und Artikel 25 Absatz 2 der Verordnung (EG) Nr. 1829/2003 sowie gemäß Artikel 4 Absatz 6 der Verordnung (EG) Nr. 1830/2003 wird als „Bezeichnung des Organismus“„Sojabohnen“ festgelegt. |
|
2. |
Der Hinweis „nicht zum Anbau“ muss auf dem Etikett und in den Begleitpapieren der in Artikel 2 Buchstaben b und c dieser Entscheidung genannten Erzeugnisse, die Sojabohnen der Sorte MON-89788-1 enthalten oder aus ihnen bestehen, erscheinen. |
d) Nachweisverfahren:
|
— |
Quantitative ereignisspezifische Methode auf Basis der Polymerase-Kettenreaktion in Echtzeit für die Sojabohnensorte MON-89788-1; |
|
— |
Validiert durch das gemäß der Verordnung (EG) Nr. 1829/2003 benannte gemeinschaftliche Referenzlabor, Validierung veröffentlicht unter http://gmo-crl.jrc.ec.europa.eu/statusofdoss.htm |
|
— |
Referenzmaterial: AOCS 0906-A und AOCS 0906-B, abrufbar bei der American Oil Chemists Society (AOCS) unter http://www.aocs.org/tech/crm/soybean.cfm |
e) Spezifischer Erkennungsmarker:
MON-89788-1
f) Informationen gemäß Anhang II des Protokolls von Cartagena über die biologische Sicherheit zum Übereinkommen über die biologische Vielfalt:
Informationsstelle für biologische Sicherheit, Eintragskennung: siehe [zu ergänzen bei Bekanntgabe]
g) Bedingungen oder Einschränkungen für das Inverkehrbringen, die Verwendung oder die Handhabung der Erzeugnisse:
nicht erforderlich
h) Überwachungsplan:
Plan zur Überwachung der Umweltauswirkungen gemäß Anhang VII der Richtlinie 2001/18/EG
[Link: im Internet veröffentlichter Plan]
i) Anforderungen an die Überwachung nach Inverkehrbringen bei Verwendung der Lebensmittel zum menschlichen Verzehr:
nicht erforderlich
Hinweis: Die Links zu einschlägigen Dokumenten müssen möglicherweise von Zeit zu Zeit angepasst werden. Diese Änderungen werden mit der Aktualisierung des Gemeinschaftsregisters genetisch veränderter Lebensmittel und Futtermittel veröffentlicht.
|
11.12.2008 |
DE |
Amtsblatt der Europäischen Union |
L 333/11 |
ENTSCHEIDUNG DER KOMMISSION
vom 5. Dezember 2008
über die Nichtaufnahme bestimmter Wirkstoffe in Anhang I der Richtlinie 91/414/EWG des Rates und die Rücknahme der Zulassungen für Pflanzenschutzmittel mit diesen Wirkstoffen
(Bekannt gegeben unter Aktenzeichen K(2008) 7637)
(Text von Bedeutung für den EWR)
(2008/934/EG)
DIE KOMMISSION DER EUROPÄISCHEN GEMEINSCHAFTEN —
gestützt auf den Vertrag zur Gründung der Europäischen Gemeinschaft,
gestützt auf die Richtlinie 91/414/EWG des Rates vom 15. Juli 1991 über das Inverkehrbringen von Pflanzenschutzmitteln (1), insbesondere auf Artikel 8 Absatz 2 Unterabsatz 4,
in Erwägung nachstehender Gründe:
|
(1) |
Gemäß Artikel 8 Absatz 2 der Richtlinie 91/414/EWG kann ein Mitgliedstaat während eines Zeitraums von zwölf Jahren ab der Bekanntgabe der genannten Richtlinie zulassen, dass Pflanzenschutzmittel in Verkehr gebracht werden, die nicht in Anhang I der genannten Richtlinie aufgeführte Wirkstoffe enthalten und zwei Jahre nach dem Zeitpunkt der Bekanntgabe der Richtlinie bereits im Handel sind; diese Stoffe werden nach und nach im Rahmen eines Arbeitsprogramms geprüft. |
|
(2) |
Die Kommissionsverordnungen (EG) Nr. 451/2000 (2) und (EG) Nr. 1490/2002 (3) enthalten die Durchführungsbestimmungen für die dritte Stufe des Arbeitsprogramms gemäß Artikel 8 Absatz 2 der Richtlinie 91/414/EWG sowie eine Liste der Wirkstoffe, die im Hinblick auf ihre mögliche Aufnahme in Anhang I der Richtlinie 91/414/EWG bewertet werden sollen. Diese Liste umfasst die im Anhang der vorliegenden Entscheidung aufgeführten Wirkstoffe. |
|
(3) |
Innerhalb von zwei Monaten nach Erhalt des Entwurfs eines Bewertungsberichts nahmen die betreffenden Antragsteller von sich aus gemäß Artikel 11e der Verordnung (EG) Nr. 1490/2002 ihren Antrag auf Aufnahme dieser Wirkstoffe zurück. |
|
(4) |
Die Kommission hat die Entwürfe der Bewertungsberichte, die Empfehlungen der berichterstattenden Mitgliedstaaten sowie die Kommentare der übrigen Mitgliedstaaten geprüft und ist zu dem Schluss gelangt, dass die Artikel 11b und 11f keine Anwendung finden. Somit gilt Artikel 11e. |
|
(5) |
Die im Anhang der vorliegenden Entscheidung aufgeführten Wirkstoffe sollten daher nicht in Anhang I der Richtlinie 91/414/EWG aufgenommen werden. |
|
(6) |
Da die Nichtaufnahme dieser Wirkstoffe nicht auf dem Vorliegen eindeutiger Hinweise auf Schädlichkeit nach Anhang VI der Verordnung (EG) Nr. 1490/2002 basiert, sollten die Mitgliedstaaten die Möglichkeit haben, die Zulassungen gemäß Artikel 12 Absatz 3 der Verordnung (EG) Nr. 1490/2002 bis zum 31. Dezember 2010 aufrechtzuerhalten. |
|
(7) |
Hat ein Mitgliedstaat eine Frist für die Beseitigung, die Lagerung, das Inverkehrbringen und die Verwendung vorhandener Lagervorräte von Pflanzenschutzmitteln mit den genannten Wirkstoffen eingeräumt, so sollte diese höchstens zwölf Monate betragen, damit die Lagervorräte noch in einer weiteren Vegetationsperiode verwendet werden können. |
|
(8) |
Diese Entscheidung steht der Einreichung eines neuen Antrags gemäß Artikel 6 Absatz 2 der Richtlinie 91/414/EWG und gemäß der Verordnung (EG) Nr. 33/2008 der Kommission vom 17. Januar 2008 mit Durchführungsbestimmungen zur Richtlinie 91/414/EWG des Rates in Bezug auf ein reguläres und ein beschleunigtes Verfahren für die Bewertung von Wirkstoffen im Rahmen des in Artikel 8 Absatz 2 dieser Richtlinie genannten Arbeitsprogramms, die nicht in Anhang I dieser Richtlinie aufgenommen wurden (4), nach dem beschleunigten Verfahren gemäß den Artikeln 13 bis 22 der genannten Verordnung nicht entgegen. |
|
(9) |
Dieses Verfahren ermöglicht es Antragstellern, deren Wirkstoff aufgrund ihrer Rücknahme des Antrags nicht aufgenommen wurde, einen neuen Antrag zu stellen und dabei nur die zusätzlichen Daten vorzulegen, die notwendig sind, um auf die spezifischen Aspekte einzugehen, die zu der Entscheidung über die Nichtaufnahme geführt haben. Der Antragsteller hat den Entwurf eines Bewertungsberichts, in dem diese Informationen aufgeführt werden, erhalten. |
|
(10) |
Die in dieser Entscheidung vorgesehenen Maßnahmen entsprechen der Stellungnahme des Ständigen Ausschusses für die Lebensmittelkette und Tiergesundheit — |
HAT FOLGENDE ENTSCHEIDUNG ERLASSEN:
Artikel 1
Die im Anhang der vorliegenden Entscheidung aufgeführten Stoffe werden nicht als Wirkstoffe in Anhang I der Richtlinie 91/414/EWG aufgenommen.
Artikel 2
Die Mitgliedstaaten nehmen die Zulassungen für Pflanzenschutzmittel, die einen oder mehrere der im Anhang aufgeführten Stoffe enthalten, bis spätestens 31. Dezember 2010 zurück.
Artikel 3
Jede von den Mitgliedstaaten gemäß Artikel 4 Absatz 6 der Richtlinie 91/414/EWG eingeräumte Frist endet spätestens am 31. Dezember 2011.
Artikel 4
Diese Entscheidung ist an die Mitgliedstaaten gerichtet.
Brüssel, den 5. Dezember 2008
Für die Kommission
Androulla VASSILIOU
Mitglied der Kommission
(1) ABl. L 230 vom 19.8.1991, S. 1.
(2) ABl. L 55 vom 29.2.2000, S. 25.
(3) ABl. L 224 vom 21.8.2002, S. 23.
(4) ABl. L 15 vom 18.1.2008, S. 5.
ANHANG
Liste der Wirkstoffe gemäß Artikel 1
|
Wirkstoff |
Übermittlung des Entwurfs eines Bewertungsberichts an den Antragsteller am |
|
Acetochlor |
14. Dezember 2005 |
|
Acrinathrin |
8. Oktober 2007 |
|
Asulam |
28. Juli 2006 |
|
Bitertanol |
23. März 2006 |
|
Bupirimat |
7. August 2007 |
|
Carbetamid |
31. August 2006 |
|
Carboxin |
28. Juli 2006 |
|
Chlorpikrin |
19. April 2006 |
|
Clethodim |
19. April 2006 |
|
Cycloxydim |
28. Februar 2007 |
|
Cyproconazol |
15. September 2006 |
|
Dazomet |
8. Oktober 2007 |
|
Diclofop-methyl |
10. September 2007 |
|
Diethofencarb |
24. Oktober 2007 |
|
Dithianon |
5. Februar 2007 |
|
Dodin |
29. März 2007 |
|
Ethalfluralin |
4. Oktober 2007 |
|
Etridiazol |
7. August 2007 |
|
Fenazaquin |
23. Juni 2006 |
|
Fenbuconazol |
12. Mai 2006 |
|
Fenbutatinoxid |
20. April 2007 |
|
Fenoxycarb |
4. Oktober 2007 |
|
Fluazifop-P |
10. September 2007 |
|
Flufenoxuron |
8. November 2007 |
|
Fluometuron |
31. August 2007 |
|
Fluquinconazol |
22. Dezember 2005 |
|
Flurochloridon |
27. Oktober 2006 |
|
Flutriafol |
9. November 2006 |
|
Guazatin |
8. November 2007 |
|
Hexythiazox |
18. Mai 2006 |
|
Hymexazol |
8. Oktober 2007 |
|
Isoxaben |
9. November 2006 |
|
Metaldehyd |
1. September 2006 |
|
Metosulam |
8. Oktober 2007 |
|
Myclobutanil |
29. März 2006 |
|
Oryzalin |
4. Oktober 2007 |
|
Oxyfluorfen |
4. Oktober 2007 |
|
Paclobutrazol |
7. Dezember 2006 |
|
Pencycuron |
1. Juni 2006 |
|
Prochloraz |
18. Juni 2007 |
|
Propargit |
8. Oktober 2007 |
|
Pyridaben |
7. August 2007 |
|
Quinmerac |
6. Juli 2007 |
|
Sintofen |
8. November 2007 |
|
Tau-Fluvalinat |
18. Juni 2007 |
|
Tebufenozid |
9. Juni 2006 |
|
Tefluthrin |
4. Mai 2007 |
|
Terbuthylazin |
8. Oktober 2007 |
|
Thiobencarb |
21. Juli 2006 |
|
11.12.2008 |
DE |
Amtsblatt der Europäischen Union |
L 333/15 |
ENTSCHEIDUNG DER KOMMISSION
vom 5. Dezember 2008
über eine Finanzhilfe der Gemeinschaft für die Gemeinsame Forschungsstelle der Kommission in Belgien und Italien für bestimmte Tätigkeiten, die gemäß der Verordnung (EG) Nr. 882/2004 des Europäischen Parlaments und des Rates im Jahr 2009 durchgeführt werden
(Bekannt gegeben unter Aktenzeichen K(2008) 7702)
(Nur der französische, der italienische und der niederländische Text sind verbindlich)
(2008/935/EG)
DIE KOMMISSION DER EUROPÄISCHEN GEMEINSCHAFTEN —
gestützt auf den Vertrag zur Gründung der Europäischen Gemeinschaft,
gestützt auf die Verordnung (EG) Nr. 882/2004 des Europäischen Parlaments und des Rates vom 29. April 2004 über amtliche Kontrollen zur Überprüfung der Einhaltung des Lebensmittel- und Futtermittelrechts sowie der Bestimmungen über Tiergesundheit und Tierschutz (1), insbesondere auf Artikel 32 Absatz 7,
in Erwägung nachstehender Gründe:
|
(1) |
Den gemeinschaftlichen Referenzlaboratorien im Bereich der Lebensmittel- und Futtermittelkontrolle kann gemäß Artikel 28 der Entscheidung 90/424/EWG des Rates vom 26. Juni 1990 über bestimmte Ausgaben im Veterinärbereich (2) eine Finanzhilfe der Gemeinschaft gewährt werden. |
|
(2) |
Die Gemeinsame Forschungsstelle der Europäischen Kommission in Ispra, Italien, ist in Anhang VII der Verordnung (EG) Nr. 882/2004 als gemeinschaftliches Referenzlaboratorium für Stoffe, die dazu bestimmt sind, mit Lebensmitteln in Berührung zu kommen, und für gentechnisch veränderte Organismen aufgeführt. Die Gemeinsame Forschungsstelle der Europäischen Kommission in Geel, Belgien, ist in Anhang VII der Verordnung (EG) Nr. 882/2004 als gemeinschaftliches Referenzlaboratorium für Schwermetalle in Futtermitteln und Lebensmitteln, für Mykotoxine und für polyzyklische aromatische Kohlenwasserstoffe (PAK) aufgeführt. |
|
(3) |
Die Gemeinsame Forschungsstelle und die Generaldirektion Gesundheit und Verbraucher sind Dienste der Kommission, und ihre Beziehung zueinander wird in einer jährlichen Verwaltungsvereinbarung festgelegt, die von einem Arbeitsprogramm und einem Haushalt flankiert wird. |
|
(4) |
Die Arbeitsprogramme und entsprechenden Haushaltsvoranschläge der gemeinschaftlichen Referenzlaboratorien innerhalb der Gemeinsamen Forschungsstelle für das Jahr 2009 sind bewertet worden. |
|
(5) |
Dementsprechend sollte eine Finanzhilfe der Gemeinschaft für bestimmte Tätigkeiten der Gemeinsamen Forschungsstelle der Europäischen Kommission in Geel, Belgien, und Ispra, Italien, gemäß der Verordnung (EG) Nr. 882/2004 gewährt werden. Die Finanzhilfe der Gemeinschaft sollte 100 % der beihilfefähigen Kosten im Einklang mit der Verordnung (EG) Nr. 1754/2006 der Kommission (3) betragen. |
|
(6) |
Gemäß Artikel 3 Absatz 2 Buchstabe a der Verordnung (EG) Nr. 1290/2005 des Rates vom 21. Juni 2005 über die Finanzierung der gemeinsamen Agrarpolitik (4) werden Programme zur Tilgung und Überwachung von Tierseuchen (Veterinärmaßnahmen) aus dem Europäischen Garantiefonds für die Landwirtschaft (EGFL) finanziert. Außerdem werden gemäß Artikel 13 Absatz 2 der genannten Verordnung in hinreichend begründeten Ausnahmefällen für Maßnahmen und Programme, die unter die Entscheidung 90/424/EWG fallen, die Ausgaben für Verwaltung und Personal, die den Mitgliedstaaten und den Begünstigten der Unterstützung aus dem EGFL entstehen, vom EGFL getragen. Zum Zweck der Finanzkontrolle finden die Artikel 9, 36 und 37 der Verordnung (EG) Nr. 1290/2005 Anwendung. |
|
(7) |
Die in dieser Entscheidung vorgesehenen Maßnahmen entsprechen der Stellungnahme des Ständigen Ausschusses für die Lebensmittelkette und Tiergesundheit — |
HAT FOLGENDE ENTSCHEIDUNG ERLASSEN:
Artikel 1
Für folgende Tätigkeiten der Gemeinsamen Forschungsstelle der Europäischen Kommission in Ispra, Italien („das Laboratorium“), die gemäß Artikel 32 Absatz 1 der Verordnung (EG) Nr. 882/2004 durchgeführt werden, sowie für die Organisation von Workshops im Zusammenhang mit diesen Tätigkeiten im Zeitraum vom 1. Januar bis zum 31. Dezember 2009 wird eine Finanzhilfe der Gemeinschaft gewährt:
|
1. |
Tätigkeiten im Zusammenhang mit Stoffen, die dazu bestimmt sind, mit Lebensmitteln in Berührung zu kommen; diese Finanzhilfe beträgt höchstens 180 003 EUR; |
|
2. |
Organisation von Workshops, die die unter Nummer 1 genannten Tätigkeiten betreffen, durch dieses Laboratorium; diese Finanzhilfe beträgt höchstens 75 947 EUR; |
|
3. |
Tätigkeiten im Zusammenhang mit GVO; diese Finanzhilfe beträgt höchstens 13 388 EUR; |
|
4. |
Organisation von Workshops, die die unter Nummer 3 genannten Tätigkeiten betreffen, durch dieses Laboratorium; diese Finanzhilfe beträgt höchstens 61 440 EUR. |
Artikel 2
Für folgende Tätigkeiten der Gemeinsamen Forschungsstelle der Europäischen Kommission in Geel, Belgien („das Laboratorium“), die gemäß Artikel 32 Absatz 1 der Verordnung (EG) Nr. 882/2004 durchgeführt werden, sowie für die Organisation von Workshops im Zusammenhang mit diesen Tätigkeiten im Zeitraum vom 1. Januar bis zum 31. Dezember 2009 wird eine Finanzhilfe der Gemeinschaft gewährt:
|
1. |
Tätigkeiten im Zusammenhang mit Schwermetallen in Futtermitteln und Lebensmitteln; diese Finanzhilfe beträgt höchstens 250 000 EUR; |
|
2. |
Organisation von Workshops, die die unter Nummer 1 genannten Tätigkeiten betreffen, durch dieses Laboratorium; diese Finanzhilfe beträgt höchstens 25 000 EUR; |
|
3. |
Tätigkeiten im Zusammenhang mit Mykotoxinen; diese Finanzhilfe beträgt höchstens 230 000 EUR; |
|
4. |
Organisation von Workshops, die die unter Nummer 3 genannten Tätigkeiten betreffen, durch dieses Laboratorium; diese Finanzhilfe beträgt höchstens 22 000 EUR; |
|
5. |
Tätigkeiten im Zusammenhang mit polyzyklischen aromatischen Kohlenwasserstoffen (PAK); diese Finanzhilfe beträgt höchstens 232 000 EUR; |
|
6. |
Organisation von Workshops, die die unter Nummer 5 genannten Tätigkeiten betreffen, durch dieses Laboratorium; diese Finanzhilfe beträgt höchstens 22 000 EUR. |
Artikel 3
Die in den Artikeln 1 und 2 genannte Finanzhilfe der Gemeinschaft beläuft sich auf 100 % der beihilfefähigen Kosten im Einklang mit der Verordnung (EG) Nr. 1754/2006.
Artikel 4
Diese Entscheidung ist gerichtet an:
|
— |
für Stoffe, die dazu bestimmt sind, mit Lebensmitteln in Berührung zu kommen: Gemeinsame Forschungsstelle, Institut für Gesundheit und Verbraucherschutz, Referat: Physikalische und chemische Schadeinwirkungen, TP 260, Via E. Fermi 1, 21020 Ispra (Italien); |
|
— |
für gentechnisch veränderte Organismen: Gemeinsame Forschungsstelle, Institut für Gesundheit und Verbraucherschutz, Referat: Biotechnologie und GVO, Via E. Fermi 1, 21020 Ispra (Italien); |
|
— |
für Schwermetalle: Gemeinsame Forschungsstelle, Retieseweg 111, 2440 Geel (Belgien); |
|
— |
für Mykotoxine: Gemeinsame Forschungsstelle, Retieseweg 111, 2440 Geel (Belgien); |
|
— |
für PAK: Gemeinsame Forschungsstelle, Retieseweg 111, 2440 Geel (Belgien). |
Brüssel, den 5. Dezember 2008
Für die Kommission
Androulla VASSILIOU
Mitglied der Kommission
(1) ABl. L 165 vom 30.4.2004, S. 1. Berichtigte Fassung im ABl. L 191 vom 28.5.2004, S. 1.
(2) ABl. L 224 vom 18.8.1990, S. 19.
(3) ABl. L 331 vom 29.11.2006, S. 8.
(4) ABl. L 209 vom 11.8.2005, S. 1.
Berichtigungen
|
11.12.2008 |
DE |
Amtsblatt der Europäischen Union |
L 333/17 |
Berichtigung der Verordnung (EG) Nr. 1896/2006 des Europäischen Parlaments und des Rates vom 12. Dezember 2006 zur Einführung eines Europäischen Mahnverfahrens
( Amtsblatt der Europäischen Union L 399 vom 30. Dezember 2006 )
Seite 11 bis 32 — die Anhänge I bis VII erhalten folgende Fassung:
ANHANG I





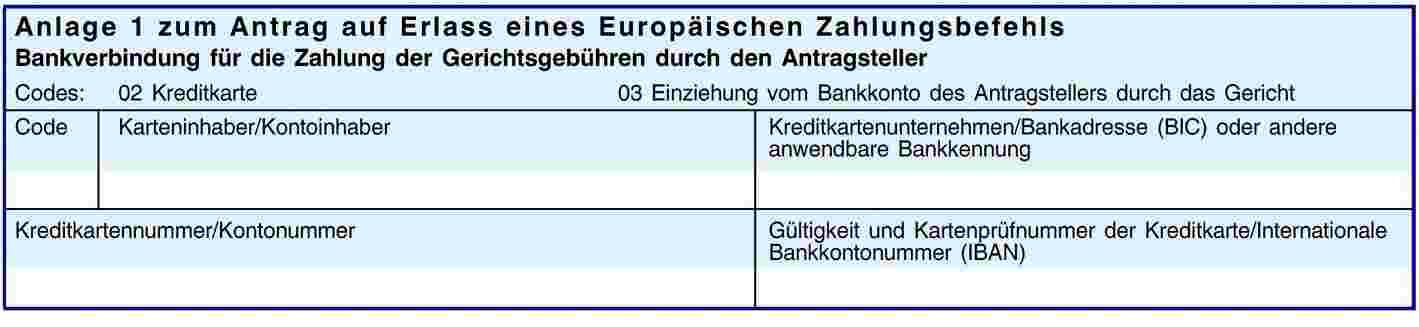



ANHANG II


ANHANG III


ANHANG IV


ANHANG V
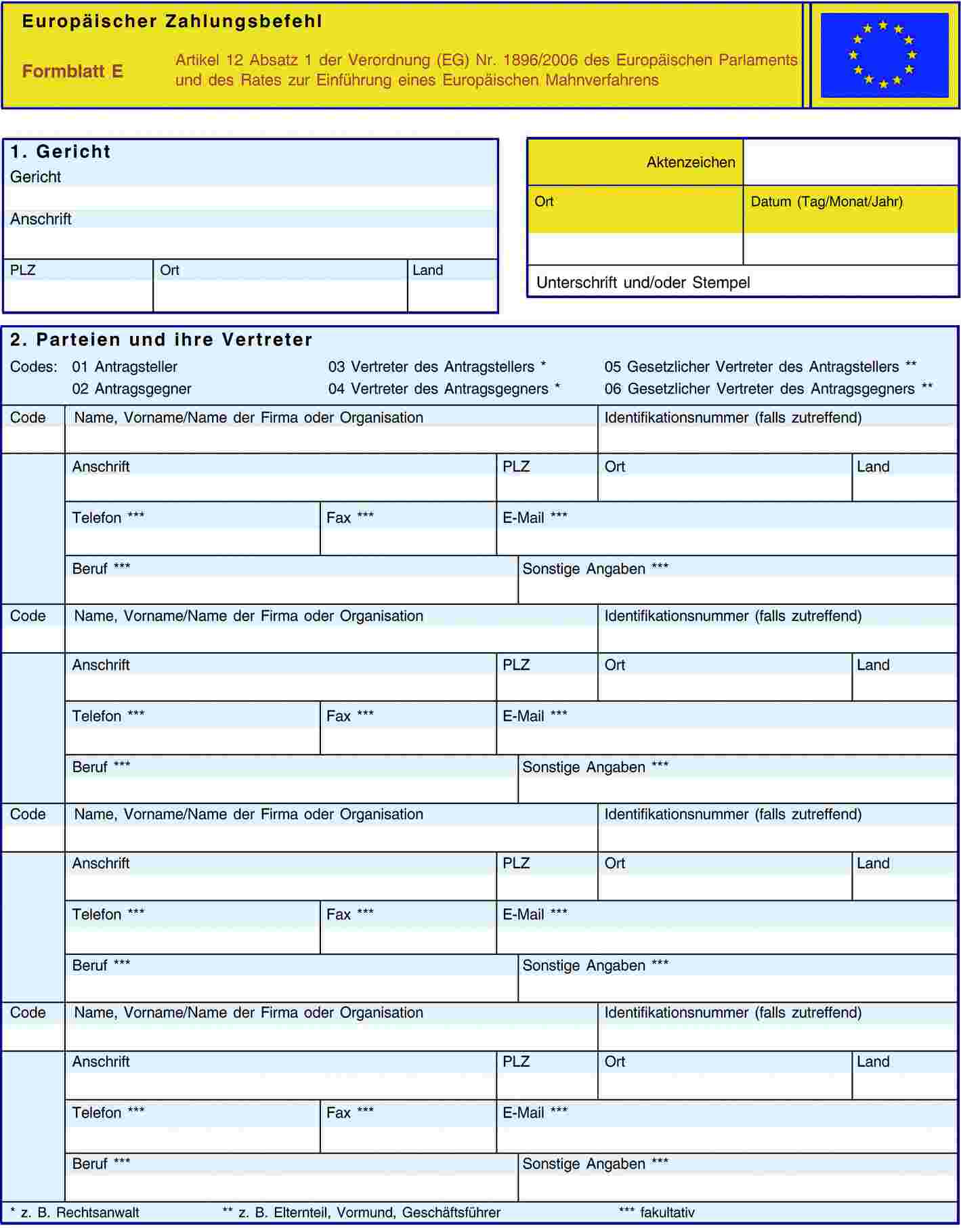


ANHANG VI
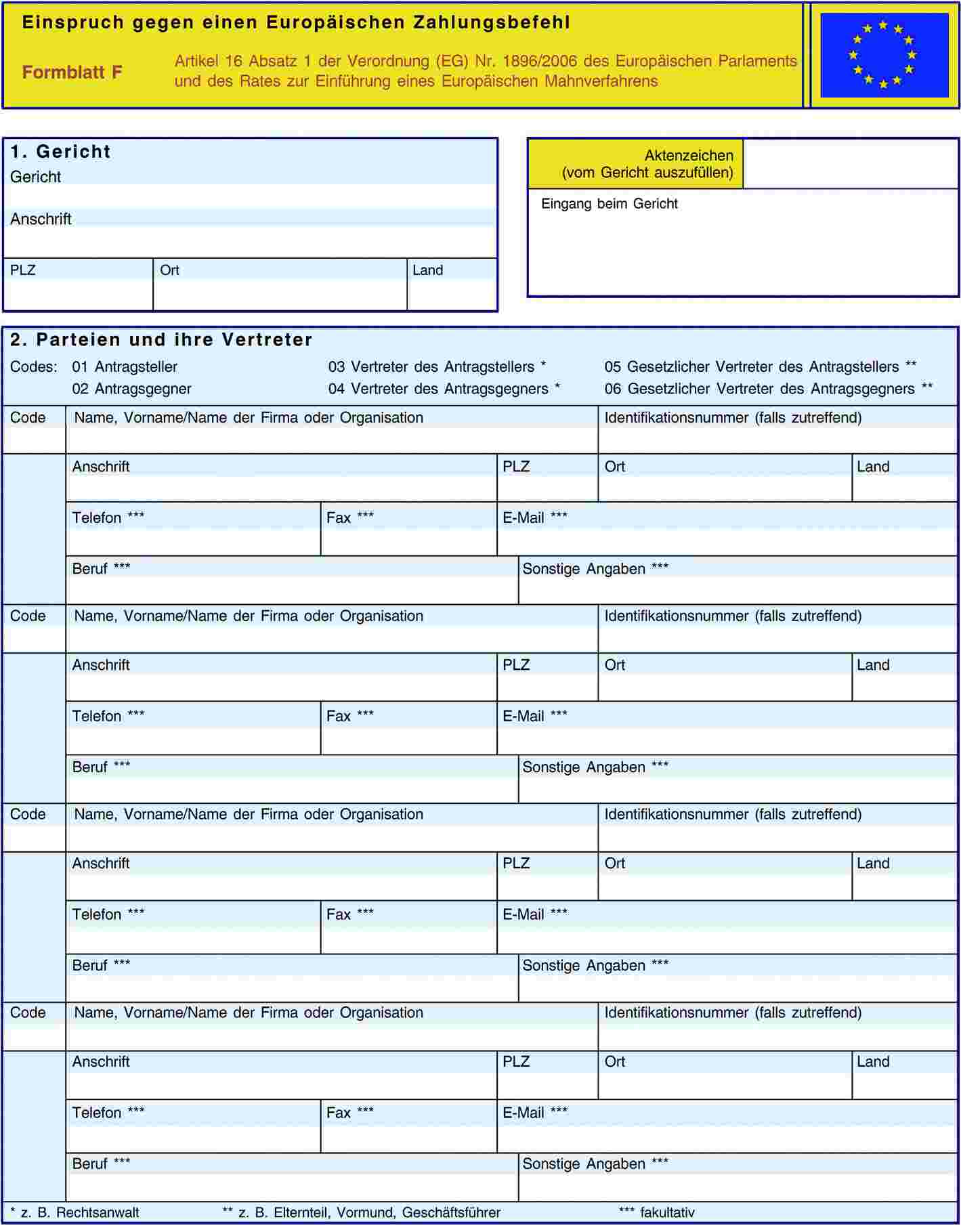
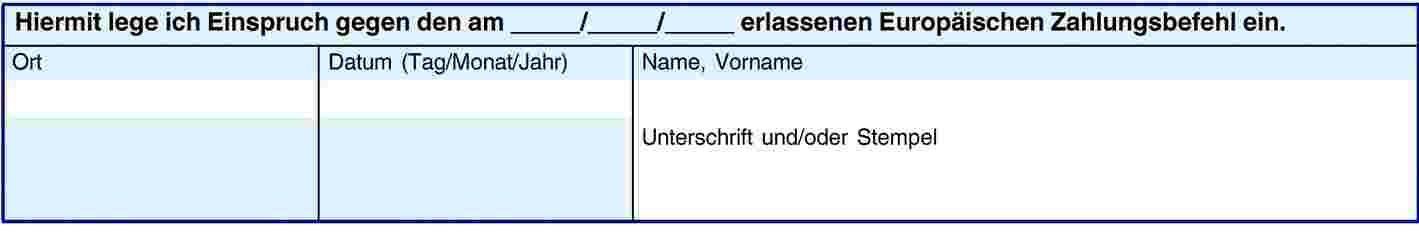
ANHANG VII


|
11.12.2008 |
DE |
Amtsblatt der Europäischen Union |
L 333/s3 |
HINWEIS FÜR DEN LESER
Nach entsprechendem Beschluss der Organe entfällt künftig der Hinweis auf die letzte Änderung der zitierten Rechtsakte.
Sofern nicht anders angegeben, beziehen sich in den hier veröffentlichten Texten Verweise auf Rechtsakte auf die jeweils geltende Fassung der Rechtsakte.