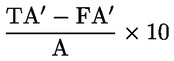ANHANG
Der Anhang der Verordnung (EG) Nr. 2870/2000 wird wie folgt geändert:
|
1. |
Das Inhaltsverzeichnis wird wie folgt geändert:
|
|
2. |
In Kapitel III wird der folgende Teil angefügt: „III.3. BESTIMMUNG FLÜCHTIGER SÄURE IN SPIRITUOSEN 1. Anwendungsbereich Die Methode wurde durch einen Ringversuch für Rum, Brandy, Obstbrände und Obsttrester bei Konzentrationen von 30 mg/l bis 641 mg/l validiert. 2. Normen ISO 3696:1987 Wasser für Analysezwecke — Spezifikationen und Testverfahren. 3. Definitionen 3.1. Die flüchtige Säure wird berechnet durch Subtraktion der nichtflüchtigen Säure von der Gesamtsäure. 3.2. Die Gesamtsäure entspricht der Summe der titrierbaren Säuren. 3.3. Der Gehalt an nichtflüchtigen Säuren entspricht dem Säuregehalt des Verdampfungsrückstands der Spirituose. 4. Prinzip Gesamtsäure und nichtflüchtige Säure werden durch Titration oder Potentiometrie bestimmt. 5. Reagenzien und Material Falls nichts anderes angegeben ist, sind für die Analyse nur Reagenzien von anerkannter Analysequalität und Wasser, das mindestens der Kategorie 3 gemäß den Begriffsbestimmungen nach ISO 3696:1987 entspricht, zu verwenden. 5.1. Natriumhydroxidlösung (NaOH), 0,01 M. 5.2. Mischindikatorlösung:
6. Gerät und Ausrüstung Indirekte Laborapparatur, Volumenmessgeräte aus Glas der Kategorie A und Folgendes:
7. Probenahmen und Proben Die Proben werden vor der Analyse bei Raumtemperatur gelagert. 8. Verfahren 8.1. Gesamtsäure 8.1.1. Vorbereitung der Probe Falls erforderlich, wird die Spirituose zur Beseitigung des Kohlendioxids mindestens zwei Minuten lang unter Vakuum gerührt, oder das Kohlendioxid wird durch Ultraschallbestrahlung entfernt. 8.1.2. Titration 25 ml der Spirituose in einen 500-ml-Erlenmeyerkolben pipettieren. Etwa 200 ml abgekühltes, abgekochtes destilliertes Wasser (täglich frisch zubereitet) sowie 2 bis 6 Tropfen der Mischindikatorlösung (5.2) zugeben. Mit der 0,01 M Natriumhydroxidlösung (5.1) bis zum Farbumschlag von Gelb-Grün nach Violett bei farblosen Spirituosen bzw. von Gelb-Braun zu Rot-Braun bei braunen Spirituosen titrieren. Es kann ebenfalls eine potentiometrische Titration bei pH 7,5 vorgenommen werden. Das Volumen in ml an Natronlauge 0,01 M, das hinzugefügt wurde, wird als n1 bezeichnet. 8.1.3. Berechnung Die Gesamtsäure (TA), ausgedrückt in Milliäquivalenten je Liter Spirituose, entspricht 0,4 × n1. Die Gesamtsäure (TA′), ausgedrückt in mg Essigsäure je Liter Spirituose, entspricht 24 × n1. 8.2. Gebundene Säure 8.2.1. Vorbereitung der Probe 25 ml der Spirituose zur Trockne eindampfen:
8.2.2. Titration Den Verdampfungsrückstand in abgekühltem, abgekochtem destilliertem Wasser (täglich frisch zubereitet) auflösen und auf etwa 100 ml auffüllen; 2 bis 6 Tropfen der Mischindikatorlösung (5.2) zugeben. Mit der 0,01 M Natriumhydroxidlösung (5.1) titrieren. Es kann ebenfalls eine potentiometrische Titration bei pH 7,5 vorgenommen werden. Das Volumen in ml an Natronlauge 0,01 M, das hinzugefügt wurde, wird als n2 bezeichnet. 8.2.3. Berechnung Die nichtflüchtige Säure (FA), ausgedrückt in Milliäquivalenten je Liter Spirituose, entspricht 0,4 × n2. Die nichtflüchtige Säure (FA), ausgedrückt in mg Essigsäure je Liter Spirituose, entspricht 24 × n2. 9. Berechnung des Gehalts an flüchtigen Säuren 9.1. Angabe in Milliäquivalenten je Liter:
Der Gehalt an flüchtigen Säuren, VA, in Milliäquivalenten je Liter entspricht: TA – FA 9.2. Angabe in mg Essigsäure je Liter:
Flüchtige Säure, VA, in mg Essigsäure je Liter entspricht: TA′ – FA′ 9.3. Angabe in g Essigsäure je hl reiner Alkohol 100 Vol.- %: Dabei entspricht A dem volumetrischen Alkoholgehalt der Spirituose. 10. Leistungsmerkmale der Methode (Präzision) 10.1. Statistische Ergebnisse des Ringversuchs Bei einem internationalen Ringversuch ergaben sich nach einem international abgestimmten Verfahren [1] [2] folgende Daten:
Art der Proben:
|
|
3. |
Das folgende Kapitel VIII wird eingefügt: „VIII. GESAMTZUCKER 1. Anwendungsbereich Die HPLC–RI-Methode eignet sich für die Bestimmung der Gesamtzucker (ausgedrückt als Invertzucker) in Spirituosen, mit Ausnahme von Likören, die Ei und Milcherzeugnisse enthalten. Die Methode wurde in einem Ringversuch für Pastis, Ouzo, Kirschlikör, Crème de (gefolgt vom Namen einer Frucht oder des verwendeten Rohstoffs) und Crème de cassis bei Konzentrationen von 10,86 g/l bis 509,7 g/l validiert. Die Linearität der Empfindlichkeit des Messgeräts war jedoch für den Konzentrationsbereich von 2,5 g/l bis 20,0 g/l nachgewiesen. Diese Methode eignet sich nicht zur Bestimmung geringer Zuckerkonzentrationen. 2. Normen ISO 3696:1987 Wasser für Analysezwecke — Spezifikationen und Testverfahren 3. Prinzip Hochleistungsflüssigkeitschromatografische Untersuchungen von Zuckerlösungen zur Bestimmung ihrer Konzentrationen an Glucose, Fructose, Saccharose, Maltose und Lactose. Bei dieser Methode wird als stationäre Phase ein Alkylamin und für die Detektion ein Brechungsindexdetektor (RI) verwendet. Es handelt sich um ein Beispiel. Als stationäre Phase könnten auch Anionenaustauscherharze verwendet werden. 4. Reagenzien und Material 4.1. Glucose (CAS 50-99-7), Reinheit mindestens 99 %. 4.2. Fructose (CAS 57-48-7), Reinheit mindestens 99 %. 4.3. Saccharose (CAS 57-50-1), Reinheit mindestens 99 %. 4.4. Lactose (CAS 5965-66-2), Reinheit mindestens 99 %. 4.5. Maltose-Monohydrat (CAS 6363-53-7), Reinheit mindestens 99 %. 4.6. Reines Acetonitril (CAS 75-05-8) für HPLC-Analyse. 4.7. Destilliertes oder entmineralisiertes Wasser, vorzugsweise mikrofiltriert. 4.8. Lösungsmittel (Beispiel) Das Elutionsmittel besteht aus
Vor Verwendung 5 bis 10 Min. im schwachen Heliumstrom entgasen. Wenn das verwendete Wasser nicht mikrofiltriert wurde, sollte das Lösungsmittel mit einem Filter für organische Lösungsmittel mit einer Maschenweite von höchstens 0,45 μm filtriert werden. 4.9. Reines Ethanol (CAS 64-17-5) 4.10. Ethanollösung (Volumenkonzentration = 5 %) 4.11. Ansetzen der Standard-Stammlösung (20 g/l) Von jedem der zu analysierenden Zucker (4.1 bis 4.5) 2 g abwiegen und verlustfrei in einen 100-ml-Messkolben überführen. (Hinweis: 2,11 g Maltose-Monohydrat entsprechen 2 g Maltose.) Mit der Ethanollösung 5 Vol.- % (4.10) auf 100 ml auffüllen, schütteln und bei etwa + 4 °C lagern. Die Standard-Stammlösung einmal wöchentlich neu anzusetzen. 4.12. Ansetzen von Standard-Arbeitslösungen (2,5, 5,0, 7,5, 10,0 und 20,0 g/l) Die Stammlösung, 20 g/l, (4.11) mit der 5 Vol.- % Ethanollösung (4.10) zu fünf Standardarbeitslösungen verdünnen: 2,5, 5,0, 7,5, 10,0 und 20,0 g/l. Durch ein Filter mit einer Maschenweite von höchstens 0,45 μm (5.3.) filtrieren. 5. Gerät und Ausrüstung 5.1. HPLC-System, das eine Basislinien-Auflösung aller Zucker erreichen kann 5.1.1. Hochleistungsflüssigkeitschromatograf mit einem 6-Wege-Injektionsventil mit 10-μl-Dosierungsschleife oder einer anderen Dosierungsvorrichtung, automatisch oder manuell, für die zuverlässige Injektion von Mikrovolumina 5.1.2. Pumpsystem zur Erzielung und Aufrechterhaltung einer konstanten oder programmierten Durchflussmenge mit hoher Genauigkeit 5.1.3. Differentialrefraktometer 5.1.4. Computergestützter Integrator oder Schreiber, dessen Leistungsfähigkeit mit den übrigen Geräten kompatibel ist 5.1.5. Vorsäule Es wird empfohlen, die Analysesäule mit einer geeigneten Vorsäule zu verbinden. 5.1.6. Säule (Beispiel)
5.1.7. Chromatografiebedingungen (Beispiel)
Um sicherzustellen, dass der Detektor vollkommen stabil ist, sollte er einige Stunden vor Verwendung eingeschaltet werden. Die Referenzzelle muss mit dem Elutionsmittel gefüllt sein. 5.2. Analysenwaage, Genauigkeit 0,1 mg 5.3. Mikromembran-Filtervorrichtung (0,45 μm) für kleine Volumina 6. Lagerung der Proben Die Proben sollten nach Erhalt bis zur Analyse bei Raumtemperatur aufbewahrt werden. 7. Verfahren 7.1. TEIL A: Vorbereitung der Probe 7.1.1. Die Probe schütteln. 7.1.2. Die Probe durch ein Filter mit einer Maschenweite von höchstens 0,45 μm (5.3) filtrieren. 7.2. TEIL B: HPLC 7.2.1. Bestimmung 10 μl der Standardlösungen (4.12) und der Proben (7.1.2) injizieren. Die Analyse unter geeigneten Chromatografiebedingungen, z. B. wie oben beschrieben, durchführen. 7.2.2. Sollte ein Peak einer Probe eine größere Fläche (oder Höhe) aufweisen als der entsprechende Peak der Standardlösung mit der höchsten Konzentration, ist die Probe mit destilliertem Wasser zu verdünnen und erneut zu analysieren. 8. Berechnung Die Chromatogramme der Standardlösung und der Spirituose sind zu vergleichen. Die Peaks sind nach ihren Retentionszeiten zu identifizieren. Ihre Flächen (oder Höhen) messen und die Konzentrationen nach der Methode des externen Standards berechnen. Dabei sind etwaige Verdünnungen der Probe zu berücksichtigen. Das Endergebnis ist die Summe von Saccharose, Maltose, Lactose, Glucose und Fructose, ausgedrückt als Invertzucker in g/l. Invertzucker wird berechnet als Summe der vorhandenen Monosaccharide und reduzierenden Disaccharide zuzüglich der aus der vorhandenen Saccharose errechneten stöchiometrischen Menge Glucose und Fructose.
9. Leistungsmerkmale der Methode (Präzision) 9.1. Statistische Ergebnisse des Ringversuchs Bei einem internationalen Ringversuch ergaben sich nach einem international abgestimmten Verfahren [1] [2] folgende Daten:
Tabelle 1 Fructose, Glucose, Maltose
Tabelle 2 Saccharose
Tabelle 3 Gesamtzucker (Hinweis: Diese Daten wurden für Gesamtzucker berechnet, nicht für Invertzucker gemäß der Definition unter Nummer 8.)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
4. |
Das folgende Kapitel X wird angefügt: „X. BESTIMMUNG DER FOLGENDEN AUS HOLZ AUSTRETENDEN VERBINDUNGEN IN SPIRITUOSEN DURCH HOCHLEISTUNGSFLÜSSIGKEITSCHROMATOGRAFIE (HPLC): FURFURAL, HYDROXYMETHYL-5-FURFURAL, METHYL-5-FURFURAL, VANILLIN, SYRINGALDEHYD, CONIFERALDEHYD, SINAPALDEHYD, GALLUSSÄURE, ELLAGSÄURE, VANILLINSÄURE, SYRINGASÄURE UND SCOPOLETIN 1. Anwendungsbereich Die Methode dient der Bestimmung von Furfural, Hydroxymethyl-5-furfural, Methyl-5-furfural, Vanillin, Syringaldehyd, Coniferaldehyd, Sinapaldehyd, Gallussäure, Ellagsäure, Vanillinsäure, Syringasäure und Scopoletin durch Hochleistungsflüssigkeitschromatografie. 2. Normen Von der Generalversammlung der Internationalen Organisation für Rebe und Wein (OIV) anerkannte und unter OIV-MA-BS-16: R2009 veröffentlichte Analysemethode. 3. Prinzip Bestimmung durch Hochleistungsflüssigkeitschromatografie (HPLC) mit Detektion durch UV-Spektrophotometrie in mehreren Wellenlängen und durch Spektrofluorimetrie. 4. Reagenzien Die Reagenzien müssen Analysequalität haben. Das verwendete Wasser muss destilliertes Wasser oder von mindestens gleichwertiger Reinheit sein. Es wird empfohlen, mikrofiltriertes Wasser mit einer Resistivität von 18,2 M Ω.cm zu verwenden. 4.1. Alkohol 96 Vol.- % 4.2. Methanol in HPLC-Qualität (Lösungsmittel B) 4.3. Essigsäure 0,5 % (Lösungsmittel A) 4.4. Mobile Phasen: (nur als Beispiel) Lösungsmittel A (0,5 %ige Essigsäure) und Lösungsmittel B (reines Methanol) über eine Membran filtern (Maschenweite 0,45 μm). Falls erforderlich in Ultraschallwanne entgasen. 4.5. Standardmaterial, mindestens 99 % rein: Furfural, Hydroxymethyl-5-furfural, Methyl-5-furfural, Vanillin, Syringaldehyd, Coniferaldehyd, Sinapaldehyd, Gallussäure, Ellagsäure, Vanillinsäure, Syringasäure und Scopoletin 4.6. Standardlösung: Das Standardmaterial wird in einer wässrigen Alkohollösung zu 50 Vol.- % gelöst. Die Konzentration in der Standardlösung beträgt: Furfural: 5 mg/l; Hydroxymethyl-5-furfural: 10 mg/l; Methyl-5-furfural: 2 mg/l; Vanillin: 5 mg/l; Syringaldehyd: 10 mg/l; Coniferaldehyd: 5 mg/l; Sinapaldehyd: 5 mg/l; Gallussäure: 10 mg/l; Ellagsäure: 10 mg/l; Vanillinsäure: 5 mg/l; Syringasäure: 5 mg/l; Scopoletin: 0,5 mg/l. 5. Geräte Übliche Laborgeräte sowie 5.1. Hochleistungsflüssigkeitschromatograf, der mit Binärgradient betrieben werden kann und folgende Ausstattung aufweist:
5.2. Spritzen für HPLC 5.3. Membranfilter für kleine Mengen 5.4. Rechner oder Schreiber, dessen Leistung mit den Geräten kompatibel ist. Er muss vor allen Dingen mehrere Erfassungskanäle aufweisen. 6. Verfahren 6.1. Vorbereitung der einzuspritzenden Lösung Die Standardlösung und die Spirituose werden, falls erforderlich, über eine Membran gefiltert, deren Maschenweite höchstens 0,45 μm beträgt. 6.2. Parameter für die Chromatografie: Die Analyse bei Raumtemperatur mit der unter 5.1 genannten Ausrüstung durchführen, dabei die mobilen Phasen (4.4) mit einem Durchsatz von etwa 0,6 ml pro Minute nach folgendem Programm verwenden (nur als Beispiel): Zeit: 0 min 50 min 70 min 90 min Lösungsmittel A (Wasser-Säure): 100 % 60 % 100 % 100 % Lösungsmittel B: (Methanol): 0 % 40 % 0 % 0 % Zur Vermeidung von Co-Elutionen ist dieser Gradient in einigen Fällen jedoch zu ändern. 6.3. Bestimmung 6.3.1. Das Standardmaterial getrennt, dann gemischt injizieren. Die Betriebsparameter so anpassen, dass der Auflösungsfaktor der Peaks bei allen Verbindungen mindestens gleich 1 ist. 6.3.2. Die wie in 6.1 vorbereitete Probe injizieren. 6.3.3. Die Fläche der Peaks der Standardlösung und der Spirituose messen und die Konzentration berechnen. 7. Darstellung der Ergebnisse Die Konzentration jedes Bestandteils wird in mg/l ausgedrückt. 8. Leistungsmerkmale der Methode (Präzision) Die folgenden Angaben stammen aus einer internationalen Studie aus dem Jahr 2009 zur Leistungsfähigkeit der Methode, wobei die Studie gemäß den international anerkannten Verfahren für unterschiedliche Spirituosen durchgeführt wurde [1], [2]. 8.1. Furfural
8.2. Hydroxymethyl-5-furfural
8.3. Methyl-5-furfural
8.4. Vanillin
8.5. Syringaldehyd
8.6. Coniferaldehyd
8.7. Sinapaldehyd
8.8. Gallussäure
8.9. Ellagsäure
8.10. Vanillinsäure
8.11. Syringasäure
8.12. Scopoletin
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(*) Splitwert
(**) Splitwert“