ISSN 1977-0634
Den Europæiske Unions
Tidende
L 71

Dansk udgave
Retsforskrifter
66. årgang
9. marts 2023
|
ISSN 1977-0634 |
||
|
Den Europæiske Unions Tidende |
L 71 |
|

|
||
|
Dansk udgave |
Retsforskrifter |
66. årgang |
|
|
|
Berigtigelser |
|
|
|
* |
||
|
|
* |
||
|
|
* |
||
|
|
* |
|
|
|
|
|
(1) EØS-relevant tekst. |
|
DA |
De akter, hvis titel er trykt med magre typer, er løbende retsakter inden for rammerne af landbrugspolitikken og har normalt en begrænset gyldighedsperiode. Titlen på alle øvrige akter er trykt med fede typer efter en asterisk. |
II Ikke-lovgivningsmæssige retsakter
FORORDNINGER
|
9.3.2023 |
DA |
Den Europæiske Unions Tidende |
L 71/1 |
KOMMISSIONENS DELEGEREDE FORORDNING (EU) 2023/511
af 24. november 2022
om supplerende regler til Europa-Parlamentets og Rådets forordning (EU) nr. 575/2013 for så vidt angår reguleringsmæssige tekniske standarder for beregning af risikovægtede værdier af eksponeringer for institutter for kollektiv investering efter mandatmetoden
(EØS-relevant tekst)
EUROPA-KOMMISSIONEN HAR —
under henvisning til traktaten om Den Europæiske Unions funktionsmåde,
under henvisning til Europa-Parlamentets og Rådets forordning (EU) nr. 575/2013 af 26. juni 2013 om tilsynsmæssige krav til kreditinstitutter og investeringsselskaber og om ændring af forordning (EU) nr. 648/2012 (1), særlig 132a, stk. 4, tredje afsnit, og
ud fra følgende betragtninger:
|
(1) |
For at undgå unødige variationer i kapitalkravene på tværs af institutter og for at gøre den mandatbaserede metode operationel i situationer, hvor der ikke foreligger tilstrækkelige oplysninger, er det nødvendigt at præcisere metoden til beregning af den risikovægtede værdi af eksponeringer for et institut for kollektiv investering (CIU) efter mandatmetoden i de tilfælde, hvor manglende input ikke gør det muligt at beregne den risikovægtede værdi af eksponeringer. |
|
(2) |
Hvis en CIU indgår derivattransaktioner, og de underliggende værdier af derivaterne eller den underliggende risiko ved derivaternes positioner er ukendte, kan genanskaffelsesomkostningerne for positionerne ikke bestemmes af institutterne, og deres eksponeringsværdi kan derfor heller ikke bestemmes. I så fald bør institutterne basere deres beregninger på den notionelle værdi af et derivats position, som normalt ville være kendt og ville være den bedste indikator for positionens størrelse, og dermed give en approksimation til eksponeringsværdien. |
|
(3) |
Hvis CIU'ens mandat ikke udelukker indgåelse af derivater, men ikke indeholder tilstrækkelige oplysninger til at fastslå, om en underliggende værdi udgør en balanceført eller ikkebalanceført eksponering, kan det ikke udelukkes, at der er tale om en sådan eksponering. Det er derfor nødvendigt at medtage denne eksponering i beregningen af den risikovægtede værdi af CIU'ens eksponeringer. |
|
(4) |
Hvis mandatet ikke giver tilstrækkelige oplysninger om eksponeringsværdien af en sådan position, kan det ikke udelukkes, at eksponeringsværdien er derivatpositionens fulde notionelle værdi. |
|
(5) |
Hvis mandatet ikke specificerer derivatpositionens notionelle værdi, bør denne værdi for at sikre en tilstrækkelig forsigtig tilgang udledes af den maksimale notionelle værdi af derivater, der er tilladt i henhold til mandatet. |
|
(6) |
Hvis genanskaffelsesomkostningerne eller den potentielle fremtidige eksponering med henblik på beregning af den eksponeringsværdi, der er forbundet med modpartskreditrisiko, er ukendte, bør institutterne basere deres beregninger på summen af de notionelle værdier af transaktionerne i nettinggruppen, hvilket ville være det bedste tilgængelige konservative skøn med hensyn til at gøre det muligt at anvende mandatmetoden. |
|
(7) |
Der er tilfælde, hvor det ikke er muligt for institutterne at fastslå de relevante nettinggrupper for en bestemt type derivat i CIU'en, da der ikke foreligger oplysninger om modparterne eller om, hvorvidt transaktionerne er omfattet af et retsgyldigt bilateralt nettingsystem som omhandlet i artikel 272, nr. 4), i forordning (EU) nr. 575/2013. I sådanne tilfælde bør institutterne antage, at der hverken findes nettingvirkninger eller modpartsdiversificering for den pågældende type derivat. Institutterne bør derfor antage, at CIU'en har indgået et enkelt derivat med den maksimale notionelle værdi, som mandatet tillader for den pågældende type derivat. |
|
(8) |
Denne forordning er baseret på de udkast til reguleringsmæssige tekniske standarder, som Den Europæiske Banktilsynsmyndighed har forelagt Kommissionen. |
|
(9) |
Den Europæiske Banktilsynsmyndighed har afholdt åbne offentlige høringer om udkastet til reguleringsmæssige tekniske standarder, som ligger til grund for denne forordning, analyseret de potentielle omkostninger og fordele samt anmodet om rådgivning fra interessentgruppen for banker, der er nedsat i henhold til artikel 37 i Europa-Parlamentets og Rådets forordning (EU) nr. 1093/2010 (2) — |
VEDTAGET DENNE FORORDNING:
Artikel 1
Bestemmelse af eksponeringsværdien af en CIU's derivatpositioner, hvis den underliggende værdi er ukendt, jf. artikel 132a, stk. 2, i forordning (EU) nr. 575/2013
1. Ved anvendelse af mandatmetoden i overensstemmelse med artikel 132a, stk. 2, i forordning (EU) nr. 575/2013, hvor CIU'ens mandat ikke udelukker, at den underliggende værd af i en CIU's derivatposition udgør en balanceført eller ikkebalanceført eksponering, men eksponeringsværdien eller, i tilfælde af ikkebalanceførte eksponeringer, den relevante procentdel i henhold til artikel 111 i forordning (EU) nr. 575/2013 er ukendt, anvender institutterne den fulde notionelle værdi af derivatpositionen som eksponeringsværdien til beregning af de risikovægtede værdi af eksponeringer.
2. Med henblik på at bestemme eksponeringsværdien som omhandlet i stk. 1 anvender institutterne, hvis den notionelle værdi af derivatpositionerne er ukendt, et konservativt skøn baseret på den maksimale notionelle værdi af de derivater, der i henhold til en CIU's mandat er tilladt som eksponeringsværdi.
Artikel 2
Beregning af eksponeringsværdierne for modpartskreditrisikoen for en nettinggruppe af en CIU's derivatpositioner
1. Ved beregning af eksponeringsværdien for en nettinggruppe for modpartskreditrisiko i overensstemmelse med de metoder, der er beskrevet i del 3, afsnit II, kapitel 6, afdeling 3, 4 eller 5, alt efter hvad der er relevant, i forordning (EU) nr. 575/2013, anvender institutterne følgende:
|
a) |
Hvis instituttet ikke er i stand til at beregne genanskaffelsesomkostningerne for nettinggruppen i overensstemmelse med den relevante metode, på grund af manglende input, anvender instituttet summen af de notionelle beløb for alle derivater i nettinggruppen som genanskaffelsesomkostning. |
|
b) |
Hvis instituttet ikke er i stand til at beregne den potentielle fremtidige eksponering for nettinggruppen i overensstemmelse med den relevante metode, på grund af manglende input, anvender instituttet i stedet 0,15 gange summen af de notionelle beløb for alle derivater i nettinggruppen. |
2. Ved beregning af eksponeringsværdien for modpartskreditrisiko i overensstemmelse med stk. 1 anvender institutterne, hvis den notionelle værdi af derivatpositionerne i nettinggruppen er ukendt, et konservativt skøn baseret på den maksimale notionelle værdi af de derivater, der i henhold til en CIU's mandat er tilladt, til at bestemme eksponeringsværdien af den pågældende nettinggruppe.
3. Hvis det med henblik på stk. 1 og 2 ikke er muligt for institutterne at fastslå de relevante nettinggrupper for en bestemt type derivat i CIU'en, antager de, at CIU'en har indgået et enkelt derivat med den maksimale notionelle værdi, som mandatet tillader for den pågældende type derivat.
Artikel 3
Ikrafttræden
Denne forordning træder i kraft på tyvendedagen efter offentliggørelsen i Den Europæiske Unions Tidende.
Denne forordning er bindende i alle enkeltheder og gælder umiddelbart i hver medlemsstat.
Udfærdiget i Bruxelles, den 24. november 2022.
På Kommissionens vegne
Ursula VON DER LEYEN
Formand
(1) EUT L 176 af 27.6.2013, s. 1.
(2) Europa-Parlamentets og Rådets forordning (EU) nr. 1093/2010 af 24. november 2010 om oprettelse af en europæisk tilsynsmyndighed (Den Europæiske Banktilsynsmyndighed), om ændring af afgørelse nr. 716/2009/EF og om ophævelse af Kommissionens afgørelse 2009/78/EF (EUT L 331 af 15.12.2010, s. 12).
|
9.3.2023 |
DA |
Den Europæiske Unions Tidende |
L 71/4 |
KOMMISSIONENS GENNEMFØRELSESFORORDNING (EU) 2023/512
af 2. marts 2023
om godkendelse af en væsentlig ændring af varespecifikationen for en betegnelse, der er opført i registret over beskyttede oprindelsesbetegnelser og beskyttede geografiske betegnelser (»Aceto Balsamico di Modena« (BGB))
EUROPA-KOMMISSIONEN HAR —
under henvisning til traktaten om Den Europæiske Unions funktionsmåde,
under henvisning til Europa-Parlamentets og Rådets forordning (EU) nr. 1151/2012 af 21. november 2012 om kvalitetsordninger for landbrugsprodukter og fødevarer (1), særlig artikel 52, stk. 3, litra b), og
ud fra følgende betragtninger:
|
(1) |
I henhold til artikel 50, stk. 2, litra a), i forordning (EU) nr. 1151/2012 blev Italiens ansøgning om godkendelse af en væsentlig ændring af varespecifikationen for den beskyttede geografiske betegnelse »Aceto Balsamico« offentliggjort i Den Europæiske Unions Tidende (2). |
|
(2) |
Kommissionen modtog den 31. august 2021 tre meddelelser om indsigelse samt en begrundet indsigelse fra Tyskland. Tyskland indgav den 11. oktober 2021 to andre begrundede indsigelser. Kommissionen modtog den 16. september 2021 den fjerde meddelelse om indsigelse fra den indsigende part i Tyrkiet. Den tilhørende begrundede indsigelse blev indgivet den 16. november 2021. |
|
(3) |
Efter at have undersøgt de begrundede indsigelser og fastslået, at de kunne antages, opfordrede Kommissionen i overensstemmelse med artikel 51, stk. 3, i forordning (EU) nr. 1151/2012 ved brev af 10. december 2021 både Italien og Tyskland og Italien og den indsigende part fra Tyrkiet til at indlede passende konsultationer med henblik på at nå til enighed. |
|
(4) |
Tyskland meddelte den 4. marts 2021 Kommissionen, at en af indsigelserne var blevet trukket tilbage, men opretholdt af to andre indsigende parter fra Tyskland. |
|
(5) |
Konsultationerne mellem på den ene side Italien og Tyskland og på den anden Italien og den indsigende part fra Tyrkiet blev afsluttet, uden at der blev opnået enighed. Kommissionen bør derfor træffe afgørelse om registreringen i overensstemmelse med proceduren i artikel 52, stk. 3, litra b), i forordning (EU) nr. 1151/2012 under hensyntagen til resultaterne af disse konsultationer. |
|
(6) |
De indsigende parter mente, at ændringerne til varespecifikationen ville medføre manglende overholdelse af de betingelser, der er fastsat i artikel 5, stk. 2, i forordning (EU) nr. 1151/2012, navnlig med hensyn til at bryde sammenhængen mellem produktet og det geografiske område. Med henblik herpå blev der sat spørgsmålstegn ved påståede ændringer af de organoleptiske egenskaber ved »Aceto Balsamico di Modena«, ændringen af det minimale totale syreindhold for det lagrede produkt og en korrektionsprocedure for mulige afvigelser fra parametrene. Disse ændringer blev også anfægtet som en forringelse af kvaliteten af »Aceto Balsamico di Modena« og manglende overholdelse af de krav, der er fastsat for vineddike i henhold til punkt 17 i del II i bilag VII til Europa-Parlamentets og Rådets forordning (EU) nr. 1308/2013 (3) om en fælles markedsordning for landbrugsprodukter (syre på mindst 60 g pr. liter = mindst 6 %). |
|
(7) |
Desuden hævdede de indsigende parter, at mindstekravene for varespecifikations indhold ikke var overholdt, for så vidt angår artikel 7, stk. 1, litra g), i forordning (EU) nr. 1151/2012, vedrørende fjernelsen af angivelsen af kontrolorganet for »Aceto Balsamico di Modena«. |
|
(8) |
Endvidere hævdede de indsigende parter, at det gældende beskyttelses omfang er blevet uretmæssigt forlænget, og registreringen af ændringerne dermed ville kunne skade eksisterende betegnelser, varemærker eller produkter, herunder balsamisk vineddike af anden oprindelse. Denne indsigelse vedrører især den påståede medtagelse af forpligtelsen om aftapning inden for det afgrænsede område, en supplerende regel om beholdernes form og indførelsen af isotopforhold. Som følge heraf hævder de indsigende parter, at de planlagte ændringer angiveligt skader de interesser, som de virksomheder, der aftapper »Aceto Balsamico di Modena«, og tyske producenter af anden vineddike har. |
|
(9) |
Endelig hævder de indsigende parter, at en nyligt indført reduktion af minimalt syreindhold kan føre til forveksling af »Aceto Balsamico di Modena« (BGB) og »Aceto Balsamico Tradizionale di Modena« (BOB). |
|
(10) |
Kommissionen har vurderet argumenterne i Tysklands og Tyrkiets begrundede indsigelser i lyset af bestemmelserne i forordning (EU) nr. 1151/2012 under hensyntagen til resultaterne af de relevante høringer mellem ansøgeren og de indsigende parter, og den har konkluderet, at ændringen af varespecifikationen for den beskyttede geografiske betegnelse »Aceto Balsamico« bør godkendes. |
|
(11) |
Italien hævdede, at de indsigende parter ikke havde påvist deres legitime interesse ved at indgive en indsigelse som omhandlet i artikel 51, stk. 1, i forordning (EU) nr. 1151/2012, da de indsigende parter gjorde indsigelse mod de ændringer, der enten ikke var blevet anmoder om, eller som ikke medførte handelsmæssige og/eller markedsmæssige hindringer. I forbindelse med den anvendte procedure for ansøgninger om væsentlige ændringer af varespecifikationen kan enhver fysisk eller juridisk person, der har en legitim interesse, gøre indsigelse mod den indgivne ændringsansøgning. I det nuværende tilfælde betragtedes risikoen for at skade den indsigende parts interesse hverken som helt usandsynligt eller hypotetisk, og det blev derfor konkluderet, at de indsigende parter påviste legitim interesse ved at gøre indsigelse. |
|
(12) |
Analysen af de forbehold, som de indsigende parter havde indgivet, afslørede, at nogle af indsigelserne blev indgivet med hensyn til elementer i varespecifikationen, der faktisk ikke var ændret som følge af de foreliggende ændringer, men bestod af mere redaktionelle ændringer. Disse redaktionelle ændringer havde til formål at bringe enhedsdokumentet i overensstemmelse med artikel 8, stk. 1, litra c), i forordning (EU) nr. 1151/2012 og bedre afspejle betingelserne i varespecifikationen for »Aceto Balsamico di Modena« (BGB). Dette vedrører især de påståede ændringer til de organoleptiske egenskaber og vedrørende anvendelsen af tilsætningsstoffer og anvendelsen af plastemballage samt den påståede forpligtelse om aftapning inden for det afgrænsede område. Disse regler er ikke blevet ændret, mens den omformulering, der fremkommer i enhedsdokumentet og kan være blevet opfattet som ændringer til varespecifikationen faktisk er en følge af en berigtigelse af uoverensstemmelser mellem varespecifikationen og sammenfatningen af varespecifikationen, der blev offentliggjort i Den Europæiske Unions Tidende (4). Kommissionens vurdering af ændringsansøgningen for »Aceto Balsamico di Modena« (BGB) har haft fokus på de væsentlige ændringer, der er ansøgt om. |
|
(13) |
Ændringerne vedrørende minimumssyreindhold for »invecchiato« (lagret) type fra 6 % til 5,5 % eller tilladt korrektionsprocedure for mulige afvigelser kan ikke betragtes som havende en negativ indvirkning på produktets tilknytning til dets geografiske område. Grundene til disse ændringer er blevet forklaret og behørigt begrundet i offentliggørelsen af ansøgningen, mens det er tydeligt, at disse ændringers art og omfang ikke ændrer de vigtigste egenskaber ved »Aceto Balsamico di Modena« (BGB) og derfor ikke får tilknytningen til at forsvinde. |
|
(14) |
Endvidere kan ligheden i syreniveauet ikke skabe nogen forveksling mellem »Aceto Balsamico di Modena« (BGB) og »Aceto Balsamico Tradizionale di Modena« (BOB) eller føre til antydning af sidstnævnte. Selv om visse produkter under begge betegnelser deler visse egenskaber som f.eks. syreniveauet, fremstilles de af forskellige råmaterialer og følger forskellige produktionsmetoder og forbliver dermed adskilt. |
|
(15) |
Endelig defineres »Aceto Balsamico di Modena« (BGB) ikke som vineddike og er dermed ikke underlagt de regler, som gælder for vineddike, især med hensyn til minimumssyreindholdet. |
|
(16) |
For så vidt angår indsigelserne vedrørende udvidelsen af udbuddet af flaskestørrelse kan ændringen ikke betragtes som indførelse af nogen begrænsninger for de erhvervsdrivende, der er involveret i emballering af »Aceto Balsamico di Modena«. At tillade supplerende beholderkapacitet som f.eks. 0,100 l, 0,150 l, 0,200 l eller 1,5 l kan tværtimod betragtes som liberalising af aftapningsbetingelserne. En mulig indvirkning af den øgede konkurrence, der kan være affødt af markedsføringen af »Aceto Balsamico di Modena« i et større udbud af flaskestørrelser, ville være i overensstemmelse med de grundlæggende principper i EU's konkurrencepolitik og bør ikke betragtes som skadelig for omdømmet for »Aceto Balsamico di Modena« (BGB). |
|
(17) |
Formålet med egenskaberne ved beholderne med en kapacitet på mindre end 0,250 liter, der indgår i enhedsdokumentets afsnit 3.5, er at sikre en minimumsstandard for ensartetheden blandt flaskerne, hvori produktet sælges. Denne emballeringsregel er hverken omfattet af varebeskrivelsen eller er tilknyttet varespecifikationen i det afsnit i enhedsdokumentet, der vedrører dette. Den kan derfor ikke betragtes som et væsentligt element ved præsentationen af produktet. Da disse krav kun fastsættes for nye beholdere med en kapacitet på mindre end 0,250 liter, hvilket ikke var tilladt før den foreliggende ændring, vil den ændring, der er gjort indsigelse mod, ikke have nogen negativ indvirkning på de investeringer i beholdere, som de virksomheder, der aftapper »Aceto Balsamico di Modena«, allerede har foretaget, og derfor vil det ikke medføre et økonomisk tab for disse. |
|
(18) |
Der er ikke blevet anført oplysninger om kontrolorganet direkte i enhedsdokumentet, da det ikke kræves der i overensstemmelse med bilag I til Kommissionens gennemførelsesforordning (EU) nr. 668/2014 (5). Denne oplysning er dog medtaget i varespecifikationen som fastsat i artikel 7, stk. 1, litra g), i forordning (EU) nr. 1151/2012. |
|
(19) |
Med henvisning til de indsigende parters indsigelser mod den påkrævede overensstemmelse med isotopforholdet er sådanne forhold indført for bedre at kunne spore mulig forfalskning af vineddike og forbedre kontrolordningen for »Aceto Balsamico di Modena«. Kontrol af isotopforholdet gennemføres under alle omstændigheder på fremstillingsstadiet og berører derfor kun producenter af »Aceto Balsamico di Modena«. |
|
(20) |
Den ændring af varespecifikationen, der er offentliggjort i Den Europæiske Unions Tidende, og som vedrører betegnelsen »Aceto Balsamico di Modena« (BGB), bør godkendes. |
|
(21) |
Foranstaltningerne i denne forordning er i overensstemmelse med udtalelse fra Komitéen for Kvalitetspolitikken for Landbrugsprodukter — |
VEDTAGET DENNE FORORDNING:
Artikel 1
Den ændring af varespecifikationen, der er offentliggjort i Den Europæiske Unions Tidende, og som vedrører betegnelsen »Aceto Balsamico di Modena« (BGB), godkendes.
Artikel 2
Denne forordning træder i kraft på tyvendedagen efter offentliggørelsen i Den Europæiske Unions Tidende.
Denne forordning er bindende i alle enkeltheder og gælder umiddelbart i hver medlemsstat.
Udfærdiget i Bruxelles, den 2. marts 2023.
På Kommissionens vegne
Ursula VON DER LEYEN
Formand
(1) EUT L 343 af 14.12.2012, s. 1.
(2) EUT C 231 af 16.6.2021, s. 11.
(3) Europa-Parlamentets og Rådets forordning (EU) nr. 1308/2013 af 17. december 2013 om en fælles markedsordning for landbrugsprodukter og om ophævelse af Rådets forordning (EØF) nr. 922/72, (EØF) nr. 234/79, (EF) nr. 1037/2001 og (EF) nr. 1234/2007 (EUT L 347 af 20.12.2013, s. 671).
(4) EUT C 152 af 6.7.2007, s. 18 og Kommissionens forordning (EF) nr. 583/2009 af 3. juli 2009 om registrering af en betegnelse i registret over beskyttede oprindelsesbetegnelser og beskyttede geografiske betegnelser (Aceto Balsamico di Modena (BGB)) (EUT L 175 af 4.7.2009, s. 7).
(5) Kommissionens gennemførelsesforordning (EU) nr. 668/2014 af 13. juni 2014 om fastlæggelse af regler for anvendelsen af Europa-Parlamentets og Rådets forordning (EU) nr. 1151/2012 om kvalitetsordninger for landbrugsprodukter og fødevarer (EUT L 179 af 19.6.2014, s. 36).
|
9.3.2023 |
DA |
Den Europæiske Unions Tidende |
L 71/8 |
KOMMISSIONENS GENNEMFØRELSESFORORDNING (EU) 2023/513
af 8. marts 2023
om ændring af bilag XV og XIX til gennemførelsesforordning (EU) 2021/404 for så vidt angår listen over tredjelande, territorier eller zoner deri, hvorfra det er tilladt at indføre kødprodukter af hovdyr, fjerkræ og fjervildt samt æg og ægprodukter til Unionen
(EØS-relevant tekst)
EUROPA-KOMMISSIONEN HAR —
under henvisning til traktaten om Den Europæiske Unions funktionsmåde,
under henvisning til Europa-Parlamentets og Rådets forordning (EU) 2016/429 af 9. marts 2016 om overførbare dyresygdomme og om ændring og ophævelse af visse retsakter på området for dyresundhed (»dyresundhedsloven«) (1), særlig artikel 230, stk. 1, og
ud fra følgende betragtninger:
|
(1) |
Ved forordning (EU) 2016/429 er der bl.a. fastsat dyresundhedsmæssige krav vedrørende indførsel til Unionen af sendinger af dyr, avlsmateriale og animalske produkter, og forordningen anvendes fra den 21. april 2021. Et af disse dyresundhedsmæssige krav er, at de pågældende sendinger skal komme fra et tredjeland eller territorium eller en zone eller et kompartment deri, der er listeopført i overensstemmelse med nævnte forordnings artikel 230, stk. 1. |
|
(2) |
Kommissionens delegerede forordning (EU) 2020/692 (2) supplerer forordning (EU) 2016/429 for så vidt angår de dyresundhedsmæssige krav vedrørende indførsel til Unionen af sendinger af visse arter og kategorier af dyr, avlsmateriale og animalske produkter fra tredjelande, territorier eller zoner eller kompartmenter deri. Delegeret forordning (EU) 2020/692 foreskriver, at sendinger af dyr, avlsmateriale og animalske produkter, der er omfattet af nævnte forordning, kun må indføres til Unionen, hvis de kommer fra et tredjeland eller territorium eller en zone eller et kompartment deri, der er listeopført for de bestemte arter og kategorier af dyr, avlsmateriale og animalske produkter i overensstemmelse med de dyresundhedsmæssige krav, der er fastsat i nævnte delegerede forordning. |
|
(3) |
Ved Kommissionens gennemførelsesforordning (EU) 2021/404 (3) er der fastlagt lister over tredjelande, territorier eller zoner eller kompartmenter deri, hvorfra det er tilladt at indføre de arter og kategorier af dyr, avlsmateriale og animalske produkter, der er omfattet af delegeret forordning (EU) 2020/692, til Unionen. Listerne og visse generelle regler vedrørende disse er indeholdt i nævnte gennemførelsesforordning bilag I-XXII. |
|
(4) |
Bilag XV, del 1, til gennemførelsesforordning (EU) 2021/404 indeholder listen over tredjelande eller territorier eller zoner deri, hvorfra det er tilladt at indføre kødprodukter af hovdyr, fjerkræ og fjervildt til Unionen. Bilag XIX, del 1, til gennemførelsesforordning (EU) 2021/404 indeholder listen over tredjelande eller territorier eller zoner deri, hvorfra det er tilladt at indføre æg og ægprodukter til Unionen. |
|
(5) |
Moldova har indgivet en ansøgning til Kommissionen om tilladelse til indførsel til Unionen af sendinger af kødprodukter af andet fjerkræ end strudsefugle og æg og har givet garantier med hensyn til det pågældende tredjelands overholdelse af kravene om anmeldelse af og rapportering om de listeopførte sygdomme, der er omhandlet i bilag I til delegeret forordning (EU) 2020/692, der er relevante for fjerkræ, og garantier med hensyn til tredjelandets overholdelse af Unionens relevante dyresundhedskrav eller tilsvarende krav. Under hensyntagen til sundhedssituationen for fjerkræ i Moldova bør dette tredjeland derfor opføres på listerne i bilag XV, del 1, og i bilag XIX, del 1, til gennemførelsesforordning (EU) 2021/404 for så vidt angår kødprodukter af andet fjerkræ end strudsefugle og æg. |
|
(6) |
Bilag XV og XIX til gennemførelsesforordning (EU) 2021/404 bør derfor ændres. |
|
(7) |
Foranstaltningerne i denne forordning er i overensstemmelse med udtalelse fra Den Stående Komité for Planter, Dyr, Fødevarer og Foder — |
VEDTAGET DENNE FORORDNING:
Artikel 1
Bilag XV og XIX til gennemførelsesforordning (EU) 2021/404 ændres som anført i bilaget til nærværende forordning.
Artikel 2
Denne forordning træder i kraft på tyvendedagen efter offentliggørelsen i Den Europæiske Unions Tidende.
Denne forordning er bindende i alle enkeltheder og gælder umiddelbart i hver medlemsstat.
Udfærdiget i Bruxelles, den 8. marts 2023.
På Kommissionens vegne
Ursula VON DER LEYEN
Formand
(1) EUT L 84 af 31.3.2016, s. 1.
(2) Kommissionens delegerede forordning (EU) 2020/692 af 30. januar 2020 om supplerende regler til Europa-Parlamentets og Rådets forordning (EU) 2016/429 for så vidt angår regler vedrørende indførsel til Unionen og flytning og håndtering efter indførsel af sendinger af visse dyr, visse typer avlsmateriale og visse animalske produkter (EUT L 174 af 3.6.2020, s. 379).
(3) Kommissionens gennemførelsesforordning (EU) 2021/404 af 24. marts 2021 om fastlæggelse af lister over tredjelande, territorier eller zoner deri, hvorfra det er tilladt at indføre dyr, avlsmateriale og animalske produkter til Unionen, jf. Europa-Parlamentets og Rådets forordning (EU) 2016/429 (EUT L 114 af 31.3.2021, s. 1).
BILAG
I bilag XV og XIX til gennemførelsesforordning (EU) 2021/404 foretages følgende ændringer:
|
1) |
I bilag XV, del 1, indsættes følgende oplysninger om Moldova mellem oplysningerne om Marokko og oplysningerne om Montenegro:
|
|
2) |
I bilag XIX, del 1, affattes oplysningerne vedrørende Moldova således:
|
|
9.3.2023 |
DA |
Den Europæiske Unions Tidende |
L 71/11 |
KOMMISSIONENS GENNEMFØRELSESFORORDNING (EU) 2023/514
af 8. marts 2023
om ændring af gennemførelsesforordning (EU) 2021/405 for så vidt angår højt forarbejdede produkter, listen over tredjelande med en godkendt kontrolplan, og Moldovas opførelse på listen over tredjelande, hvorfra det er tilladt at indføre sendinger af æg, der er bestemt til markedsføring som klasse A-æg til Unionen
(EØS-relevant tekst)
EUROPA-KOMMISSIONEN HAR —
under henvisning til traktaten om Den Europæiske Unions funktionsmåde,
under henvisning til Europa-Parlamentets og Rådets forordning (EU) 2017/625 af 15. marts 2017 om offentlig kontrol og andre officielle aktiviteter med henblik på at sikre anvendelsen af fødevare- og foderlovgivningen og reglerne for dyresundhed og dyrevelfærd, plantesundhed og plantebeskyttelsesmidler, om ændring af Europa-Parlamentets og Rådets forordning (EF) nr. 999/2001, (EF) nr. 396/2005, (EF) nr. 1069/2009, (EF) nr. 1107/2009, (EU) nr. 1151/2012, (EU) nr. 652/2014, (EU) 2016/429 og (EU) 2016/2031, Rådets forordning (EF) nr. 1/2005 og (EF) nr. 1099/2009 samt Rådets direktiv 98/58/EF, 1999/74/EF, 2007/43/EF, 2008/119/EF og 2008/120/EF og om ophævelse af Europa-Parlamentets og Rådets forordning (EF) nr. 854/2004 og (EF) nr. 882/2004, Rådets direktiv 89/608/EØF, 89/662/EØF, 90/425/EØF, 91/496/EØF, 96/23/EF, 96/93/EF og 97/78/EF og Rådets afgørelse 92/438/EØF (forordningen om offentlig kontrol) (1), særlig artikel 127, stk. 2, og
ud fra følgende betragtninger:
|
(1) |
Kommissionens delegerede forordning (EU) 2022/2292 (2) supplerer forordning (EU) 2017/625 og har til formål at sikre, at sendinger af dyr bestemt til fødevareproduktion og visse varer til konsum fra tredjelande eller regioner heri opfylder visse EU-fødevaresikkerhedskrav eller krav, der er anerkendt som værende mindst ækvivalente hermed. Nævnte forordning omhandler navnlig identifikation af dyr og varer til konsum, for hvilke det er et krav, at de skal komme fra et tredjeland eller en region heri, der optræder på listen omhandlet i artikel 126, stk. 2, litra a), i forordning (EU) 2017/625. |
|
(2) |
Artikel 7 i delegeret forordning (EU) 2022/2292 foreskriver, at visse sendinger af dyr bestemt til fødevareproduktion, animalske produkter og sammensatte produkter udelukkende må indføres til Unionen fra et tredjeland, der er opført på listen over tredjelande, som er godkendt til indførsel til Unionen af sådanne sendinger til konsum. |
|
(3) |
Ved Kommissionens gennemførelsesforordning (EU) 2021/405 (3) fastsættes der lister over tredjelande eller regioner heri, hvorfra indførsel til Unionen af sendinger af visse højt forarbejdede produkter til konsum er tilladt. |
|
(4) |
Siden en nylig ændring (4) af Europa-Parlamentets og Rådets forordning (EF) nr. 853/2004 (5) omfatter højt forarbejdede produkter også fedtderivater og fødevarearomaer, der er godkendt i henhold til Europa-Parlamentets og Rådets forordning (EF) nr. 1334/2008 (6), der er genstand for behandlinger, der udelukker enhver risiko for folke- eller dyresundheden. Gennemførelsesforordning (EU) 2021/405 bør ændres for at være i overensstemmelse med denne ændring. |
|
(5) |
Aserbajdsjan har forelagt en kontrolplan, der omfatter rogn og kaviar. Denne plan giver tilstrækkelige garantier og bør derfor godkendes. |
|
(6) |
Libanon har forelagt en kontrolplan, der omfatter honning. Denne plan giver tilstrækkelige garantier og bør derfor godkendes. |
|
(7) |
Isle of Man er opført i tabellen i bilag –I til gennemførelsesforordning (EU) 2021/405 med henblik på eksport til Unionen af fåre- og gedekød. Isle of Man har imidlertid meddelt Kommissionen, at virksomheden ikke længere er interesseret i at eksportere gedekød til Unionen. Oplysningerne vedrørende Isle of Man og fåre- og gedekød i nævnte tabel i bilag –I til gennemførelsesforordning (EU) 2021/405 bør derfor kun omfatte fårekød. |
|
(8) |
Japan er opført i tabellen i bilag –I til gennemførelsesforordning (EU) 2021/405 med henblik på eksport til Unionen af svinekød. Japan har imidlertid meddelt Kommissionen, at landet ikke længere er interesseret i at forelægge en kontrolplan for svinekød, men har til hensigt kun at anvende svinekød med oprindelse i enten medlemsstater eller tredjelande, hvorfra det er tilladt at indføre sådanne produkter til Unionen. Oplysningerne vedrørende Japan for svinekød bør derfor tilpasses i overensstemmelse hermed i bilag –I til gennemførelsesforordning (EU) 2021/405. |
|
(9) |
Det Forenede Kongerige er opført i tabellen i bilag I til gennemførelsesforordning (EU) 2021/405 med henblik på eksport til Unionen af kaninkød. Det Forenede Kongerige har imidlertid meddelt Kommissionen, at landet ikke længere er interesseret i at forelægge en kontrolplan for kaninkød, men har til hensigt kun at anvende kaninkød med oprindelse i enten medlemsstater eller tredjelande, hvorfra det er tilladt at indføre sådanne produkter til Unionen. Oplysningerne vedrørende Det Forenede Kongerige for kaninkød bør derfor tilpasses i overensstemmelse hermed i bilag –I til gennemførelsesforordning (EU) 2021/405. |
|
(10) |
Thailand har ikke forelagt Kommissionen en kontrolplan for mælk. Thailand har imidlertid givet garantier for, at der kun anvendes mælk fra enten medlemsstater eller tredjelande, hvorfra det er tilladt at indføre mælk til Unionen. Landet har også meddelt Kommissionen, at denne slags mælk, der skal eksporteres til Unionen, ikke vil være begrænset til sammensatte produkter, der indeholder forarbejdede mejeriprodukter. Oplysningerne vedrørende Thailand for mælk bør derfor tilpasses i overensstemmelse hermed i bilag –I til gennemførelsesforordning (EU) 2021/405. |
|
(11) |
USA har forelagt en kontrolplan, der omfatter naturtarme. Denne plan giver tilstrækkelige garantier og bør derfor godkendes. |
|
(12) |
Rwanda er i øjeblikket opført i tabellen i bilag I til gennemførelsesforordning (EU) 2021/405 for honning, og Colombia og Syrien er opført på listen for naturtarme. Da disse tredjelande ikke har forelagt Kommissionen planer for de respektive produkter, bør disse rækker udgå af tabellen i bilaget. |
|
(13) |
Moldova har forelagt et salmonellabekæmpelsesprogram for flokke af æglæggende høner for at få tilladelse til indførsel til Unionen af klasse A-æg, jf. artikel 7 i gennemførelsesforordning (EU) 2021/405. Dette kontrolprogram blev vurderet med tilfredshed af Kommissionen. Overholdelsen af kravene vedrørende salmonellabekæmpelse i henhold til artikel 10, stk. 6, i Europa-Parlamentets og Rådets forordning (EF) nr. 2160/2003 (7) blev kontrolleret to gange under den audit, som Kommissionen gennemførte i april 2022 (8). Moldova bør derfor få tilladelse til at indføre klasse A-æg til Unionen. |
|
(14) |
Gennemførelsesforordning (EU) 2021/405 bør derfor ændres. |
|
(15) |
Foranstaltningerne i denne forordning er i overensstemmelse med udtalelse fra Den Stående Komité for Planter, Dyr, Fødevarer og Foder — |
VEDTAGET DENNE FORORDNING:
Artikel 1
Ændring af gennemførelsesforordning (EU) 2021/405
I gennemførelsesforordning (EU) 2021/405 foretages følgende ændringer:
|
1) |
Artikel 22, indledningen, affattes således: »Sendinger af højt forarbejdede produkter som beskrevet i afsnit XVI i bilag III til forordning (EF) nr. 853/2004 til konsum må kun indføres til Unionen, hvis de kommer fra følgende tredjelande eller regioner heri:«. |
|
2) |
Bilag –I erstattes af teksten i bilag I til nærværende forordning. |
|
3) |
Bilag IV erstattes af teksten i bilag II til nærværende forordning. |
Artikel 2
Ikrafttræden og anvendelse
Denne forordning træder i kraft på tyvendedagen efter offentliggørelsen i Den Europæiske Unions Tidende.
Denne forordning er bindende i alle enkeltheder og gælder umiddelbart i hver medlemsstat.
Udfærdiget i Bruxelles, den 8. marts 2023.
På Kommissionens vegne
Ursula VON DER LEYEN
Formand
(1) EUT L 95 af 7.4.2017, s. 1.
(2) Kommissionens delegerede forordning (EU) 2022/2292 af 6. september 2022 om supplerende regler til Europa-Parlamentets og Rådets forordning (EU) 2017/625 for så vidt angår krav vedrørende indførsel til Unionen af sendinger af dyr bestemt til fødevareproduktion og visse varer til konsum (EUT L 304 af 24.11.2022, s. 1).
(3) Kommissionens gennemførelsesforordning (EU) 2021/405 af 24. marts 2021 om fastlæggelse af lister over tredjelande og regioner heri, hvorfra det er tilladt at indføre visse dyr og varer til konsum til Den Europæiske Union, jf. Europa-Parlamentets og Rådets forordning (EU) 2017/625 (EUT L 114 af 31.3.2021, s. 118).
(4) Kommissionens delegerede forordning (EU) 2022/2258 af 9. september 2022 om ændring og berigtigelse af bilag III til Europa-Parlamentets og Rådets forordning (EF) nr. 853/2004 om særlige hygiejnekrav vedrørende animalske fødevarer for så vidt angår fiskevarer, æg og visse højt forarbejdede produkter og om ændring af Kommissionens delegerede forordning (EU) 2019/624 for så vidt angår visse toskallede bløddyr (EUT L 299 af 18.11.2022, s. 5).
(5) Europa-Parlamentets og Rådets forordning (EF) nr. 853/2004 af 29. april 2004 om særlige hygiejnebestemmelser for animalske fødevarer (EUT L 139 af 30.4.2004, s. 55).
(6) Europa-Parlamentets og Rådets forordning (EF) nr. 1334/2008 af 16. december 2008 om aromaer og visse fødevareingredienser med aromagivende egenskaber til anvendelse i og på fødevarer og om ændring af Rådets forordning (EØF) nr. 1601/91, forordning (EF) nr. 2232/96, forordning (EF) nr. 110/2008 og direktiv 2000/13/EF (EUT L 354 af 31.12.2008, s. 34).
(7) Europa-Parlamentets og Rådets forordning (EF) nr. 2160/2003 af 17. november 2003 om bekæmpelse af salmonella og andre bestemte fødevarebårne zoonotiske agenser (EUT L 325 af 12.12.2003, s. 1).
(8) GD (SANTE) 2021-7268 — endelig rapport findes på https://ec.europa.eu/food/audits-analysis/audit-report/details/4533
BILAG I
Bilag –I til gennemførelsesforordning (EU) 2021/405 affattes således:
»BILAG –I
Liste over tredjelande eller regioner heri med godkendte kontrolplaner for visse dyr bestemt til fødevareproduktion og animalske produkter til konsum som omhandlet i artikel 2a, artikel 3, artikel 6, stk. 1, artikel 7, stk. 1, artikel 10, stk. 2, artikel 11, 15, 16 og 21 og artikel 25, litra a) og c)
|
Landets ISO-kode |
Tredjelande (1) eller region(er) heri |
Kvæg |
Får/geder |
Svin |
Dyr af hestefamilien |
Fjerkræ |
Akvakultur (17) |
Mælk |
Æg |
Kanin |
Vildtlevende vildt |
Opdrættet vildt |
Honning |
Naturtarme |
|
AD |
Andorra |
X |
X |
Δ |
X |
|
P |
|
|
|
|
|
X |
|
|
AE |
De Forenede Arabiske Emirater |
|
|
|
|
|
Δ P |
X (2) O |
O |
|
|
|
X (3) |
|
|
AL |
Albanien |
|
X |
|
|
|
X (14) P |
O |
X |
|
|
|
|
X |
|
AM |
Armenien |
|
|
|
|
|
X (14) P |
O |
O |
|
|
|
X |
|
|
AR |
Argentina |
X |
X |
|
X |
X |
X (14) P |
X |
X |
X |
X |
X |
X |
X |
|
AU |
Australien |
X |
X |
|
X |
|
X M |
X |
X |
|
X |
X |
X |
X |
|
AZE |
Aserbajdsjan |
|
|
|
|
|
X (16) P |
|
|
|
|
|
|
|
|
BA |
Bosnien-Hercegovina |
X |
X |
X |
|
X |
X (14) P |
X |
X |
|
|
|
X |
|
|
BD |
Bangladesh |
|
|
|
|
|
X P |
O |
O |
|
|
|
|
|
|
BF |
Burkina Faso |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
BJ |
Benin |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
BN |
Brunei |
|
|
|
|
|
X (15) P |
O |
O |
|
|
|
|
|
|
BR |
Brasilien |
X |
|
|
X |
X |
X P |
O |
O |
|
|
|
X |
X |
|
BW |
Botswana |
X |
|
|
|
|
P |
|
|
|
|
|
|
|
|
BY |
Belarus |
|
|
|
X (8) |
|
X (14) P |
X |
X |
|
|
|
X |
X |
|
BZ |
Belize |
|
|
|
|
|
X (15) P |
O |
O |
|
|
|
|
|
|
CA |
Canada |
X |
X |
X |
X |
X |
X M |
X |
X |
X |
X |
X |
X |
|
|
CH |
Schweiz (7) |
X |
X |
X |
X |
X |
X (14) M |
X |
X |
X |
X |
X |
X |
X |
|
CL |
Chile |
X |
X 5 |
X |
|
X |
X (14) M |
X |
O |
|
X |
|
X |
X |
|
CM |
Cameroun |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
CN |
Kina |
|
|
|
|
X |
X P |
O |
X |
X |
|
|
X |
X |
|
CO |
Colombia |
|
|
|
|
|
X P |
X |
Δ |
|
|
|
|
|
|
CR |
Costa Rica |
|
|
|
|
|
X P |
O |
O |
|
|
|
|
|
|
CU |
Cuba |
|
|
|
|
|
X (15) P |
O |
O |
|
|
|
X |
|
|
DO |
Den Dominikanske Republik |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
EC |
Ecuador |
|
|
|
|
|
X P |
O |
O |
|
|
|
|
|
|
EG |
Egypten |
|
|
|
|
|
|
|
|
|
|
|
|
X |
|
ET |
Etiopien |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
FK |
Falklandsøerne |
X |
X (5) |
|
|
|
X (14) P |
O |
O |
|
|
|
|
|
|
FO |
Færøerne Færøerne |
|
|
|
|
|
X (14) P |
O |
O |
|
|
|
|
|
|
GB |
Det Forenede Kongerige (6) |
X |
X |
X |
X |
X |
X (14) Δ M |
X |
X |
Δ |
X |
X |
X |
X |
|
GE |
Georgien |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
GG |
Guernsey |
|
|
|
|
|
O M |
X |
O |
|
|
|
|
|
|
GL |
Grønland |
|
X (5) |
|
|
|
M |
|
|
|
|
X |
|
|
|
GT |
Guatemala |
|
|
|
|
|
X (15) P |
O |
O |
|
|
|
X |
|
|
HK |
Hongkong |
|
|
|
|
|
Δ P |
|
Δ |
|
|
|
|
|
|
HN |
Honduras |
|
|
|
|
|
X P |
O |
O |
|
|
|
|
|
|
ID |
Indonesien |
|
|
|
|
|
X P |
O |
O |
|
|
|
|
|
|
IL |
Israel (4) |
|
|
|
|
X |
X (14) P |
X |
X |
|
|
|
X |
|
|
IM |
Isle of Man |
X |
X (5) |
X |
|
|
X (14) M |
X |
O |
|
|
|
X |
|
|
IN |
Indien |
|
|
|
|
O |
X P |
O |
X |
|
|
|
X |
X |
|
IR |
Iran |
|
|
|
|
|
X (15) X (16) P |
O |
O |
|
|
|
|
X |
|
JE |
Jersey |
X |
|
|
|
|
M |
X |
O |
|
|
|
|
|
|
JM |
Jamaica |
|
|
|
|
|
M |
|
|
|
|
|
X |
|
|
JP |
Japan |
X |
|
Δ |
|
X |
X (14) M |
X |
X |
|
|
|
Δ |
X |
|
KE |
Kenya |
|
|
|
|
|
X (14) P |
O |
O |
|
|
|
|
|
|
KR |
Sydkorea |
|
|
|
|
X |
X M |
O |
O |
|
|
|
Δ |
|
|
LB |
Libanon |
|
|
|
|
|
|
|
|
|
|
|
X |
X |
|
LK |
Sri Lanka |
|
|
|
|
|
X P |
O |
O |
|
|
|
|
|
|
MA |
Marokko |
|
|
|
|
X |
X (14) Δ M |
O |
O |
|
|
|
|
X |
|
MD |
Moldova |
|
|
|
|
X |
X (14) P |
X |
X |
|
|
|
X |
|
|
ME |
Montenegro |
X |
X (5) |
X |
|
X |
X (14) P |
X |
X |
|
|
|
X |
|
|
MG |
Madagaskar |
|
|
|
|
|
X P |
O |
O |
|
|
|
X |
|
|
MK |
Nordmakedonien |
X |
X |
X |
|
X |
X (14) P |
X |
X |
|
X |
|
X |
|
|
MM |
Myanmar/Burma |
|
|
|
|
|
X P |
O |
O |
|
|
|
X |
|
|
MN |
Mongoliet |
|
|
|
|
|
|
|
|
|
|
|
|
X |
|
MU |
Mauritius |
|
|
|
|
|
X (14) P |
O |
O |
|
|
|
Δ |
|
|
MX |
Mexico |
|
|
Δ |
|
|
X P |
O |
X |
|
|
|
X |
|
|
MY |
Malaysia |
|
|
|
|
Δ |
X P |
O |
O |
|
|
|
|
|
|
MZ |
Mozambique |
|
|
|
|
|
X (15) P |
O |
O |
|
|
|
|
|
|
NA |
Namibia |
X |
X (5) |
|
|
|
P |
|
|
|
X |
|
|
|
|
NC |
Ny Kaledonien |
|
|
|
|
|
X (15) P |
O |
O |
|
|
X |
X |
|
|
NG |
Nigeria |
|
|
|
|
|
X (15) P |
O |
O |
|
|
|
|
|
|
NI |
Nicaragua |
|
|
|
|
|
X (15) P |
O |
O |
|
|
|
X |
|
|
NZ |
New Zealand |
X |
X |
O |
X |
O |
X (14) M |
X |
O |
O |
X |
X |
X |
X |
|
PA |
Panama |
|
|
|
|
|
X P |
O |
O |
|
|
|
|
|
|
PE |
Peru |
|
|
|
|
|
X M |
O |
O |
|
|
|
|
|
|
PH |
Filippinerne |
|
|
|
|
|
X P |
O |
O |
|
|
|
|
|
|
PK |
Pakistan |
|
|
|
|
|
|
|
|
|
|
|
|
X |
|
PM |
Saint-Pierre og Miquelon |
|
|
|
|
X |
P |
|
|
|
|
|
|
|
|
PN |
Pitcairn |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
PY |
Paraguay |
X |
|
|
|
|
P |
|
|
|
|
|
|
X |
|
RS |
Serbien |
X |
X |
X |
X (8) |
X |
X (14) P |
X |
X |
X |
X |
|
X |
X |
|
RU |
Rusland |
X |
X |
X |
|
X |
O P |
X |
X |
|
|
X (9) |
X |
X |
|
RW |
Rwanda |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SA |
Saudi-Arabien |
|
|
|
|
|
X P |
O |
O |
|
|
|
|
|
|
SG |
Singapore |
Δ |
Δ |
Δ |
X (10) |
Δ |
X (14) P |
Δ |
Δ |
|
X (10) |
X (10) |
|
|
|
SM |
San Marino |
X |
|
Δ |
|
|
O P |
X |
O |
|
|
|
X |
|
|
SV |
El Salvador |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
SY |
Syrien |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SZ |
Eswatini |
X |
|
|
|
|
P |
|
|
|
|
|
|
|
|
TG |
Togo |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
TH |
Thailand |
O |
|
O |
|
X |
X M |
Δ |
Δ |
|
|
|
X |
|
|
TN |
Tunesien |
|
|
|
|
|
X (14) M |
O |
O |
|
|
|
|
X |
|
TR |
Tyrkiet |
|
|
|
|
X |
X (14) M |
X |
X |
|
|
|
X |
X |
|
TW |
Taiwan |
|
|
|
|
|
X P |
O |
X |
|
|
|
X |
|
|
TZ |
Tanzania |
|
|
|
|
|
X (15) P |
O |
O |
|
|
|
X |
|
|
UA |
Ukraine |
X |
|
X |
|
X |
X (14) M |
X |
X |
X |
|
|
X |
X |
|
UG |
Uganda |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
US |
USA |
X |
X (11) |
X |
|
X |
X M |
X |
X |
X |
X |
X |
X |
X |
|
UY |
Uruguay |
X |
X |
|
X |
|
X (14) M |
X |
O |
|
X |
|
X |
X |
|
UZ |
Usbekistan |
|
|
|
|
|
|
|
|
|
|
|
|
X |
|
VE |
Venezuela |
|
|
|
|
|
X (15) P |
O |
O |
|
|
|
|
|
|
VN |
Vietnam |
|
|
|
|
|
X M |
O |
O |
|
|
|
X |
|
|
WF |
Wallis og Futuna |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
XK |
Kosovo (12) |
|
|
|
|
Δ |
|
|
|
|
|
|
|
|
|
ZA |
Sydafrika |
|
|
|
|
|
P |
|
|
|
X |
X (13) |
|
|
|
ZM |
Zambia |
|
|
|
|
|
|
|
|
|
|
|
X |
|
(1) Liste over tredjelande og territorier (ikke begrænset til tredjelande, som anerkendes af Unionen).
(2) Kun kamelmælk.
(3) Kun regionen Ras al Khaimah.
(4) I det følgende forstået som Staten Israel bortset fra territorierne under israelsk administration siden den 5. juni 1967, nærmere betegnet Golanhøjderne, Gazastriben, Østjerusalem og resten af Vestbredden.
(5) Kun fårearter.
(6) I overensstemmelse med aftalen om Det Forenede Kongerige Storbritannien og Nordirlands udtræden af Den Europæiske Union og Det Europæiske Atomenergifællesskab, særlig artikel 5, stk. 4, i protokollen om Irland/Nordirland sammenholdt med bilag 2 til samme protokol, omfatter henvisninger til Det Forenede Kongerige i dette bilag ikke Nordirland.
(7) I overensstemmelse med aftalen af 21. juni 1999 mellem Det Europæiske Fællesskab og Det Schweiziske Forbund om handel med landbrugsprodukter (EFT L 114 af 30.4.2002, s. 132).
(8) Eksport til Unionen af levende dyr af hestefamilien til slagtning (kun dyr bestemt til fødevareproduktion).
(9) Kun rensdyr.
(10) Kun for sendinger af fersk kød med oprindelse i New Zealand, som er bestemt til Unionen, og som aflæsses, med eller uden oplagring, i Singapore og genpålæsses på en godkendt virksomhed under transit gennem Singapore.
(11) Kun gedearter.
(12) Denne betegnelse indebærer ingen stillingtagen til Kosovos status, og den er i overensstemmelse med UNSCR 1244/1999 og ICJ's udtalelse om Kosovos uafhængighedserklæring.
(13) Kun strudsefugle.
(14) Kun fisk.
(15) Kun krebsdyr.
(16) Kun rogn og kaviar.
(17) Akvakultur omfatter fisk, herunder ål, og produkter af fisk (såsom rogn og kaviar) samt krebsdyr. De tredjelande eller regioner heri, der er opført på listen i bilag VIII for levende, kølede, frosne eller forarbejdede toskallede bløddyr, pighuder, sækdyr og havsnegle, er mærket med »M« i denne kolonne.«
BILAG II
Bilag IV til gennemførelsesforordning (EU) 2021/405 affattes således:
(1) I overensstemmelse med aftalen af 21. juni 1999 mellem Det Europæiske Fællesskab og Det Schweiziske Forbund om handel med landbrugsprodukter (EFT L 114 af 30.4.2002, s. 132).
(2) I overensstemmelse med aftalen om Det Forenede Kongerige Storbritannien og Nordirlands udtræden af Den Europæiske Union og Det Europæiske Atomenergifællesskab, særlig artikel 5, stk. 4, i protokollen om Irland/Nordirland sammenholdt med bilag 2 til samme protokol, omfatter henvisninger til Det Forenede Kongerige i dette bilag ikke Nordirland.«
|
9.3.2023 |
DA |
Den Europæiske Unions Tidende |
L 71/22 |
KOMMISSIONENS GENNEMFØRELSESFORORDNING (EU) 2023/515
af 8. marts 2023
om fornyelse af godkendelsen af aktivstoffet abamectin, jf. Europa-Parlamentets og Rådets forordning (EF) nr. 1107/2009, og om ændring af Kommissionens gennemførelsesforordning (EU) nr. 540/2011
(EØS-relevant tekst)
EUROPA-KOMMISSIONEN HAR —
under henvisning til traktaten om Den Europæiske Unions funktionsmåde,
under henvisning til Europa-Parlamentets og Rådets forordning (EF) nr. 1107/2009 af 21. oktober 2009 om markedsføring af plantebeskyttelsesmidler og om ophævelse af Rådets direktiv 79/117/EØF og 91/414/EØF (1), særlig artikel 20, stk. 1, og
ud fra følgende betragtninger:
|
(1) |
Abamectin blev ved Kommissionens direktiv 2008/107/EF (2) opført som et aktivstof i bilag I til Rådets direktiv 91/414/EØF (3). |
|
(2) |
Aktivstoffer, der er opført i bilag I til direktiv 91/414/EØF, betragtes som godkendt i henhold til forordning (EF) nr. 1107/2009 og er opført i del A i bilaget til Kommissionens gennemførelsesforordning (EU) nr. 540/2011 (4). |
|
(3) |
Godkendelsen af aktivstoffet abamectin, jf. del A i bilaget til gennemførelsesforordning (EU) nr. 540/2011, udløber den 30. april 2023. |
|
(4) |
Der blev i overensstemmelse med artikel 1 i Kommissionens gennemførelsesforordning (EU) nr. 844/2012 (5) indgivet en ansøgning om fornyelse af godkendelsen af aktivstoffet abamectin til Østrig som rapporterende medlemsstat og Malta som medrapporterende medlemsstat inden for den tidsfrist, der er fastsat i nævnte artikel. |
|
(5) |
Ansøgeren fremlagde de supplerende dossierer for den rapporterende medlemsstat, den medrapporterende medlemsstat, Kommissionen og Den Europæiske Fødevaresikkerhedsautoritet (»autoriteten«) i overensstemmelse med artikel 6 i gennemførelsesforordning (EU) nr. 844/2012. Den rapporterende medlemsstat fandt, at ansøgningen var fuldstændig. |
|
(6) |
Den rapporterende medlemsstat udarbejdede et udkast til vurderingsrapport vedrørende fornyelse i samråd med den medrapporterende medlemsstat og forelagde den for autoriteten og Kommissionen den 17. april 2019. I sit udkast til vurderingsrapport vedrørende fornyelse foreslog den rapporterende medlemsstat at forny godkendelsen af abamectin. |
|
(7) |
Autoriteten fremsendte udkastet til vurderingsrapport vedrørende fornyelse til ansøgeren og medlemsstaterne, således at de kunne fremsætte bemærkninger hertil, og videresendte de modtagne bemærkninger til Kommissionen. Autoriteten gjorde også det supplerende sammenfattende dossier tilgængeligt for offentligheden. |
|
(8) |
Den 15. juli 2020 meddelte autoriteten Kommissionen sin konklusion (6) om, hvorvidt abamectin kan forventes at opfylde godkendelseskriterierne i artikel 4 i forordning (EF) nr. 1107/2009. Autoriteten konstaterede en række spørgsmål, der ikke kunne færdigbehandles. Der blev navnlig konstateret risici for så vidt angår fugle, pattedyr, vandorganismer og jordlevende makroorganismer. |
|
(9) |
Den 1. februar 2022 sendte Kommissionen et mandat til autoriteten med en anmodning om at gennemgå eksponerings- og risikovurderingerne for fugle, pattedyr, vandorganismer og jordlevende makroorganismer. Autoriteten sendte sin opdaterede konklusion til Kommissionen den 27. juli 2022 (7). I sin opdaterede konklusion bekræftede autoriteten de risici, der blev konstateret i den foregående vurdering. |
|
(10) |
Kommissionen forelagde en rapport vedrørende fornyelse samt udkastet til forordning om abamectin for Den Stående Komité for Planter, Dyr, Fødevarer og Foder den 25. marts 2021 og reviderede versioner af de to dokumenter den 8. december 2022 for at tage hensyn til udfaldet af autoritetens opdaterede konklusion. |
|
(11) |
Kommissionen opfordrede ansøgeren til at fremsætte sine bemærkninger til autoritetens konklusion og, i henhold til artikel 14, stk. 1, tredje afsnit, i gennemførelsesforordning (EU) nr. 844/2012, sine bemærkninger til rapporten vedrørende fornyelse. Ansøgeren fremsatte sine bemærkninger til begge udgaver af rapporten vedrørende fornyelse, og de er blevet nøje gennemgået. |
|
(12) |
Det er med hensyn til ét eller flere repræsentative anvendelsesformål for mindst ét plantebeskyttelsesmiddel, der indeholder abamectin, blevet fastslået, at godkendelseskriterierne i artikel 4 i forordning (EF) nr. 1107/2009 er opfyldt. |
|
(13) |
Risikovurderingen for fornyelse af godkendelsen af aktivstoffet abamectin er baseret på repræsentative anvendelsesformål som insekticid og acaricid i beskyttede afgrøder. Skønt det i lyset af denne risikovurdering ikke er nødvendigt fortsat at begrænse anvendelsen til anvendelse som insekticid og acaricid er det dog nødvendigt, i overensstemmelse med artikel 14, stk. 1, i forordning (EF) nr. 1107/2009 sammenholdt med samme forordnings artikel 6 og på grundlag af den foreliggende videnskabelige og tekniske viden, at fastsætte visse betingelser og begrænsninger. Det er navnlig relevant at begrænse brugen af plantebeskyttelsesprodukter, der indeholder abamectin, til anvendelsesformål, hvor der kan ske kontrolleret udveksling af materiale og energi med omgivelserne, for således at undgå frigivelse af plantebeskyttelsesprodukter til miljøet og imødegå den høje risiko, der er identificeret for vandorganismer og vilde landlevende organismer uden for målgruppen. I overensstemmelse hermed kan anvendelsesformål i permanente væksthuse godkendes. |
|
(14) |
Gennemførelsesforordning (EU) nr. 540/2011 bør derfor ændres. |
|
(15) |
Godkendelsesperioden for abamectin blev ved Kommissionens gennemførelsesforordning (EU) 2022/378 (8) forlænget til den 30. april 2023 for at gøre det muligt at afslutte fornyelsesprocessen, inden godkendelsen af aktivstoffet udløber. Eftersom der er truffet afgørelse om fornyelse forud for denne forlængede udløbsdato, og eftersom den nuværende godkendelse af abamectin udløber den 30. april 2023, bør nærværende forordning træde i kraft hurtigst muligt og finde anvendelse fra før nævnte dato. |
|
(16) |
Foranstaltningerne i denne forordning er i overensstemmelse med udtalelse fra Den Stående Komité for Planter, Dyr, Fødevarer og Foder — |
VEDTAGET DENNE FORORDNING:
Artikel 1
Fornyelse af godkendelsen af aktivstoffet
Godkendelsen af aktivstoffet abamectin, som opført i bilag I, forlænges på de betingelser, der er fastsat i samme bilag.
Artikel 2
Ændringer af gennemførelsesforordning (EU) nr. 540/2011
Bilaget til gennemførelsesforordning (EU) nr. 540/2011 ændres som angivet i bilag II til nærværende forordning.
Artikel 3
Ikrafttræden og anvendelsesdato
Denne forordning træder i kraft på tredjedagen efter offentliggørelsen i Den Europæiske Unions Tidende.
Den anvendes fra den 1. april 2023.
Denne forordning er bindende i alle enkeltheder og gælder umiddelbart i hver medlemsstat.
Udfærdiget i Bruxelles, den 8. marts 2023.
På Kommissionens vegne
Ursula VON DER LEYEN
Formand
(1) EUT L 309 af 24.11.2009, s. 1.
(2) Kommissionens direktiv 2008/107/EF af 25. november 2008 om ændring af Rådets direktiv 91/414/EØF for at optage abamectin, epoxiconazol, fenpropimorph, fenpyroximat og tralkoxydim som aktivstoffer (EUT L 316 af 26.11.2008, s. 4).
(3) Rådets direktiv 91/414/EØF af 15. juli 1991 om markedsføring af plantebeskyttelsesmidler (EFT L 230 af 19.8.1991, s. 1).
(4) Kommissionens gennemførelsesforordning (EU) nr. 540/2011 af 25. maj 2011 om gennemførelse af Europa-Parlamentets og Rådets forordning (EF) nr. 1107/2009 for så vidt angår listen over godkendte aktivstoffer (EUT L 153 af 11.6.2011, s. 1).
(5) Kommissionens gennemførelsesforordning (EU) nr. 844/2012 af 18. september 2012 om fastsættelse af de fornødne bestemmelser til gennemførelse af fornyelsesproceduren for aktivstoffer, jf. Europa-Parlamentets og Rådets forordning (EF) nr. 1107/2009 om markedsføring af plantebeskyttelsesmidler (EUT L 252 af 19.9.2012, s. 26).
(6) EFSA Journal 2020;18(8):6227. Foreligger online: www.efsa.europa.eu.
(7) EFSA Journal 2022;20(8):7544. Foreligger online: www.efsa.europa.eu.
(8) Kommissionens gennemførelsesforordning (EU) 2022/378 af 4. marts 2022 om ændring af gennemførelsesforordning (EU) nr. 540/2011 for så vidt angår godkendelsesperioderne for aktivstofferne abamectin, Bacillus subtilis (Cohn 1872) stamme QST 713, Bacillus thuringiensis subsp. aizawai stamme ABTS-1857 og GC-91, Bacillus thuringiensis subsp. israeliensis (serotype H-14) stamme AM65-52, Bacillus thuringiensis subsp. kurstaki stamme ABTS 351, PB 54, SA 11, SA12 og EG 2348, Beauveria bassiana stamme ATCC 74040 og GHA, clodinafop, Cydia pomonella Granulovirus (CpGV), cyprodinil, dichlorprop-P, fenpyroximat, fosetyl, malathion, mepanipyrim, metconazol, metrafenon, pirimicarb, Pseudomonas chlororaphis stamme MA342, pyrimethanil, Pythium oligandrum M1, rimsulfuron, spinosad, Trichoderma asperellum (tidligere »T. harzianum«) stamme ICC012, T25 og TV1, Trichoderma atroviride (tidligere »T. harzianum«) stamme T11, Trichoderma gamsii (tidligere »T. viride«) stamme ICC080, Trichoderma harzianum stamme T-22 og ITEM 908, triclopyr, trinexapac, triticonazol og ziram (EUT L 72 af 7.3.2022, s. 2).
BILAG I
|
Almindeligt anvendt navn, identifikations-nr. |
IUPAC-navn |
Renhed (1) |
Godkendelsesdato |
Udløbsdato for stoffets godkendelse |
Særlige bestemmelser |
||||
|
Abamectin CAS-nr. 71751-41-2 Avermectin B1a CAS-nr. 65195-55-3 Avermectin B1b CAS-nr. 65195-56-4 Abamectin CIPAC-nr. 495 |
Avermectin B1a (10E,14E,16E)-(1R,4S,5′S,6S,6′R,8R,12S,13S,20R,21R,24S)-6′-[(S)-sec-butyl]-21,24-dihydroxy-5′,11,13,22-tetramethyl-2-oxo-(3,7,19-trioxatetracyclo[15.6.1.14,8020,24]pentacosa-10,14,16,22-tetraen)-6-spiro-2′-(5′,6′-dihydro-2′H-pyran)-12-yl 2,6-dideoxy-4-O-(2,6-dideoxy-3-O-methyl-α-L-arabino-hexopyranosyl)-3-O-methyl-α-L-arabino-hexopyranosid Avermectin B1b (10E,14E,16E)-(1R,4S,5′S,6S,6′R,8R,12S,13S,20R,21R,24S)-21,24-dihydroxy-6′-isopropyl-5′,11,13,22-tetramethyl-2-oxo-(3,7,19-trioxatetracyclo[15.6.1.14,8020,24]pentacosa-10,14,16,22-tetraen)-6-spiro-2′-(5′,6′-dihydro-2′H-pyran)-12-yl 2,6-dideoxy-4-O-(2,6-dideoxy-3-O-methyl-α-L-arabino-hexopyranosyl)-3-O-methyl-α-L-arabino-hexopyranosid |
≥ 850 g/kg abamectin (summen af avermectin B1a og avermectin B1b), min. 800 g/kg avermectin B1a og max. 200 g/kg avermectin B1b |
1. april 2023 |
31. marts 2038 |
Kun godkendt til anvendelsesformål, hvor kontrolleret udveksling af materiale og energi til omgivelserne kan forebygge frigivelse af plantebeskyttelsesprodukter til miljøet, navnlig anvendelsesformål i permanente væksthuse. Med henblik på gennemførelsen af de i artikel 29, stk. 6, i forordning (EF) nr. 1107/2009 nævnte ensartede principper skal der tages hensyn til konklusionerne i vurderingsrapporten vedrørende fornyelse af godkendelsen af abamectin, navnlig tillæg I og II. Ved denne samlede vurdering skal medlemsstaterne være særlig opmærksomme på:
|
(1) Yderligere oplysninger om aktivstoffets identitet og specifikation fremgår af vurderingsrapporten vedrørende fornyelse.
BILAG II
I bilaget til gennemførelsesforordning (EU) nr. 540/2011 foretages følgende ændringer:
|
1) |
I del A udgår nr. 210 om abamectin. |
|
2) |
I del B indsættes følgende:
|
(1) Yderligere oplysninger om aktivstoffets identitet og specifikation fremgår af vurderingsrapporten vedrørende fornyelse.
|
9.3.2023 |
DA |
Den Europæiske Unions Tidende |
L 71/27 |
KOMMISSIONENS GENNEMFØRELSESFORORDNING (EU) 2023/516
af 8. marts 2023
om ændring af gennemførelsesforordning (EU) 2020/2236 for så vidt angår standarddyresundhedscertifikatet til brug ved indførsel til Unionen af sendinger af akvatiske dyr bestemt til visse akvakulturvirksomheder, udsætning i naturen eller andre formål, bortset fra direkte konsum
(EØS-relevant tekst)
EUROPA-KOMMISSIONEN HAR —
under henvisning til traktaten om Den Europæiske Unions funktionsmåde,
under henvisning til Europa-Parlamentets og Rådets forordning (EU) 2016/429 af 9. marts 2016 om overførbare dyresygdomme og om ændring og ophævelse af visse retsakter på området for dyresundhed (»dyresundhedsloven«) (1), særlig artikel 238, stk. 3, litra a) og c),
under henvisning til Europa-Parlamentets og Rådets forordning (EU) 2017/625 af 15. marts 2017 om offentlig kontrol og andre officielle aktiviteter med henblik på at sikre anvendelsen af fødevare- og foderlovgivningen og reglerne for dyresundhed og dyrevelfærd, plantesundhed og plantebeskyttelsesmidler, om ændring af Europa-Parlamentets og Rådets forordning (EF) nr. 999/2001, (EF) nr. 396/2005, (EF) nr. 1069/2009, (EF) nr. 1107/2009, (EU) nr. 1151/2012, (EU) nr. 652/2014, (EU) 2016/429 og (EU) 2016/2031, Rådets forordning (EF) nr. 1/2005 og (EF) nr. 1099/2009 samt Rådets direktiv 98/58/EF, 1999/74/EF, 2007/43/EF, 2008/119/EF og 2008/120/EF og om ophævelse af Europa-Parlamentets og Rådets forordning (EF) nr. 854/2004 og (EF) nr. 882/2004, Rådets direktiv 89/608/EØF, 89/662/EØF, 90/425/EØF, 91/496/EØF, 96/23/EF, 96/93/EF og 97/78/EF og Rådets afgørelse 92/438/EØF (forordningen om offentlig kontrol) (2), særlig artikel 90, og
ud fra følgende betragtninger:
|
(1) |
Ved Kommissionens gennemførelsesforordning (EU) 2020/2236 (3) er der fastsat standarddyresundhedscertifikater til brug ved indførsel til Unionen og flytning inden for Unionen af sendinger af akvatiske dyr og af visse animalske produkter af akvatiske dyr. |
|
(2) |
Navnlig er der i bilag II til gennemførelsesforordning (EU) 2020/2236 fastsat et standarddyresundhedscertifikat til brug ved indførsel til Unionen af sendinger akvatiske dyr bestemt til visse akvakulturvirksomheder, udsætning i naturen eller andre formål, bortset fra direkte konsum (model »AQUA-ENTRY-ESTAB/RELEASE/OTHER«). Artikel 166 i Kommissionens delegerede forordning (EU) 2020/692 (4) blev for nylig ændret ved delegeret forordning (EU) 2023/119 (5) for at gøre det muligt for fagfolk med ekspertise i akvatiske dyrs sundhed at foretage kliniske inspektioner af sendinger af akvatiske dyr forud for eksport til Unionen, hvis de er bemyndiget hertil i henhold til lovgivningen i det eksporterende tredjeland eller territorium. Disse nye krav vedrørende indførsel til Unionen af de sådanne sendinger bør afspejles i punkt II.3.2 i nævnte standarddyresundhedscertifikat. Bilag II til gennemførelsesforordning (EU) 2020/2236 bør derfor ændres. |
|
(3) |
For at undgå handelsforstyrrelser for så vidt angår indførsel til Unionen af sendinger af akvatiske dyr bestemt til visse akvakulturvirksomheder, udsætning i naturen eller andre formål, bortset fra direkte konsum, bør anvendelsen af dyresundhedscertifikater udstedt i overensstemmelse med gennemførelsesforordning (EU) 2020/2236, som den var gældende før ændringerne ved nærværende gennemførelsesforordning, fortsat være tilladt i en overgangsperiode på visse betingelser. |
|
(4) |
Da gennemførelsesforordning (EU) 2020/2236 anvendes fra den 21. april 2021, bør de ændringer, der vil skulle foretages i gennemførelsesforordning (EU) 2020/2236 ved nærværende forordning, af hensyn til retssikkerheden og for at lette handelen, træde i kraft hurtigst muligt. |
|
(5) |
Foranstaltningerne i denne forordning er i overensstemmelse med udtalelse fra Den Stående Komité for Planter, Dyr, Fødevarer og Foder — |
VEDTAGET DENNE FORORDNING:
Artikel 1
Bilag II til gennemførelsesforordning (EU) 2020/2236 ændres som angivet i bilaget til nærværende forordning.
Artikel 2
I en overgangsperiode indtil den 15. december 2023 er det fortsat tilladt at indføre sendinger af akvatiske dyr bestemt til visse akvakulturvirksomheder, udsætning i naturen eller andre formål, bortset fra direkte konsum, der ledsages af det dyresundhedscertifikat, der er udstedt i overensstemmelse med modellen i bilag II til gennemførelsesforordning (EU) 2020/2236, som var gældende før ændringerne af nævnte gennemførelsesforordning ved nærværende gennemførelsesforordning, forudsat at certifikatet er udstedt senest den 15. september 2023.
Artikel 3
Denne forordning træder i kraft dagen efter offentliggørelsen i Den Europæiske Unions Tidende.
Denne forordning er bindende i alle enkeltheder og gælder umiddelbart i hver medlemsstat.
Udfærdiget i Bruxelles, den 8. marts 2023.
På Kommissionens vegne
Ursula VON DER LEYEN
Formand
(1) EUT L 84 af 31.3.2016, s. 1.
(2) EUT L 95 af 7.4.2017, s. 1.
(3) Kommissionens gennemførelsesforordning (EU) 2020/2236 af 16. december 2020 om regler for anvendelsen af Europa-Parlamentets og Rådets forordning (EU) 2016/429 og (EU) 2017/625 for så vidt angår standarddyresundhedscertifikater til brug ved indførsel til Unionen og flytning inden for Unionen af sendinger af akvatiske dyr og af visse animalske produkter af akvatiske dyr samt officiel certificering vedrørende sådanne certifikater og om ophævelse af forordning (EF) nr. 1251/2008 (EUT L 442 af 30.12.2020, s. 410).
(4) Kommissionens delegerede forordning (EU) 2020/692 af 30. januar 2020 om supplerende regler til Europa-Parlamentets og Rådets forordning (EU) 2016/429 for så vidt angår regler vedrørende indførsel til Unionen og flytning og håndtering efter indførsel af sendinger af visse dyr, visse typer avlsmateriale og visse animalske produkter (EUT L 174 af 3.6.2020, s. 379).
(5) Kommissionens delegerede forordning (EU) 2023/119 af 9. november 2022 om ændring af delegeret forordning (EU) 2020/692 om supplerende regler til Europa-Parlamentets og Rådets forordning (EU) 2016/429 for så vidt angår regler vedrørende indførsel til Unionen og flytning og håndtering efter indførsel af sendinger af visse dyr, visse typer avlsmateriale og visse animalske produkter (EUT L 16 af 18.1.2023, s. 5).
BILAG
Bilag II til gennemførelsesforordning (EU) 2020/2236 affattes således:
»BILAG II
Bilag II indeholder følgende standarddyresundhedscertifikat:
Model
|
AQUA-ENTRY-ESTAB/RELEASE/OTHER |
Standarddyresundhedscertifikat til brug ved indførsel til Unionen af akvatiske dyr bestemt til visse akvakulturvirksomheder, udsætning i naturen eller andre formål, bortset fra direkte konsum |
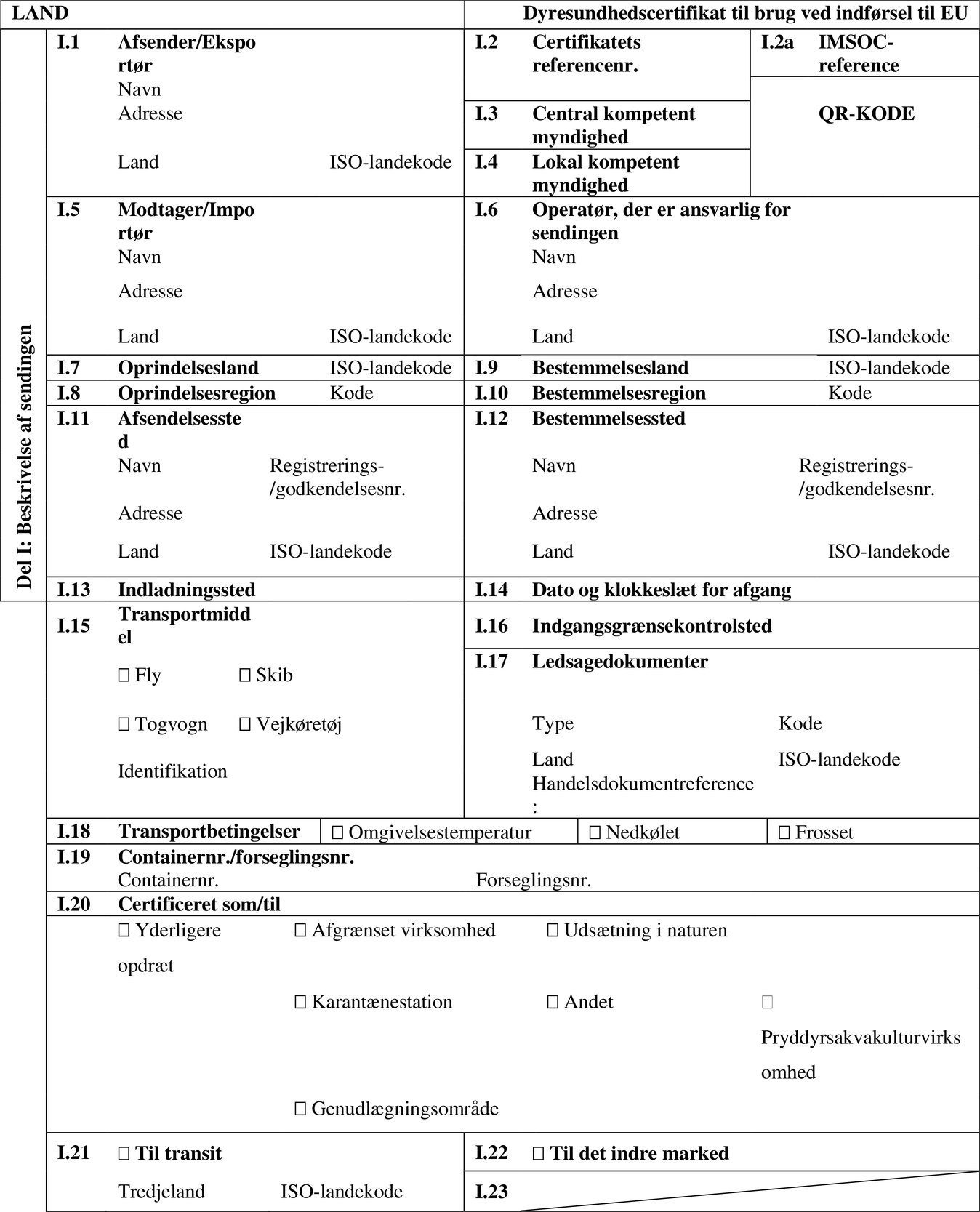
STANDARDDYRESUNDHEDSCERTIFIKAT TIL BRUG VED INDFØRSEL TIL UNIONEN AF AKVATISKE DYR BESTEMT TIL VISSE AKVAKULTURVIRKSOMHEDER, UDSÆTNING I NATUREN ELLER ANDRE FORMÅL, BORTSET FRA DIREKTE KONSUM (MODEL »AQUA-ENTRY-ESTAB/RELEASE/OTHER«)






Berigtigelser
|
9.3.2023 |
DA |
Den Europæiske Unions Tidende |
L 71/37 |
Berigtigelse til Europa-Parlamentets og Rådets forordning (EU) 2022/123 af 25. januar 2022 om styrkelse af Det Europæiske Lægemiddelagenturs rolle i forbindelse med kriseberedskab og krisestyring med hensyn til lægemidler og medicinsk udstyr
( Den Europæiske Unions Tidende L 20 af 31. januar 2022 )
|
1. |
Side 11, artikel 1, litra a): |
I stedet for:
|
»a) |
forberedelse på, forebyggelse, koordinering og håndtering af virkningerne af folkesundhedsmæssige krisesituationer for lægemidler og for medicinsk udstyr og virkningerne af større hændelser for medicinske lægemidler og for medicinsk udstyr på EU-plan« |
læses:
|
»a) |
forberedelse på, forebyggelse, koordinering og håndtering af virkningerne af folkesundhedsmæssige krisesituationer for lægemidler og for medicinsk udstyr og virkningerne af større hændelser for lægemidler på EU-plan« |
|
2. |
Side 14, artikel 4, stk. 2: |
I stedet for:
»2. For at lette den monitorering, der er omhandlet i stk. 1, indberetter de nationale kompetente lægemiddelmyndigheder rettidigt via de centrale kontaktpunkter, jf. artikel 3, stk. 6, eller den platform, der er omhandlet i artikel 13 (»ESMP«), når denne er fuldt funktionsdygtig, til agenturet […].«
læses:
»2. For at lette den monitorering, der er omhandlet i stk. 1, indberetter de nationale kompetente lægemiddelmyndigheder rettidigt via de centrale kontaktpunkter, jf. artikel 3, stk. 6, andet afsnit, eller den platform, der er omhandlet i artikel 13 (»ESMP«), når denne er fuldt funktionsdygtig, til agenturet […].«
|
3. |
Side 16, artikel 8, stk. 1: |
I stedet for:
»1. I hele den periode, som en folkesundhedsmæssige krisesituation eller anerkendelsen af en større hændelse som omhandlet i artikel 4, stk. 3, varer, og indtil det er blevet bekræftet, at den større hændelse er blevet tilstrækkeligt håndteret i henhold til artikel 4, stk. 4, rapporterer Styringsgruppen vedrørende Mangel på Lægemidler regelmæssigt om resultaterne af den i artikel 7 omhandlede monitorering til Kommissionen og de i artikel 3, stk. 6, omhandlede centrale kontaktpunkter, og påpeger navnlig enhver faktisk eller potentiel mangel på lægemidler, der er opført på listen over kritiske lægemidler, eller enhver hændelse, der kan forventes at føre til en større hændelse.«
læses:
»1. I hele den periode, som en folkesundhedsmæssige krisesituation eller anerkendelsen af en større hændelse som omhandlet i artikel 4, stk. 3, varer, og indtil det er blevet bekræftet, at den større hændelse er blevet tilstrækkeligt håndteret i henhold til artikel 4, stk. 4, rapporterer Styringsgruppen vedrørende Mangel på Lægemidler regelmæssigt om resultaterne af den i artikel 7 omhandlede monitorering til Kommissionen og de i artikel 3, stk. 6, andet afsnit, omhandlede centrale kontaktpunkter, og påpeger navnlig enhver faktisk eller potentiel mangel på lægemidler, der er opført på listen over kritiske lægemidler, eller enhver hændelse, der kan forventes at føre til en større hændelse.«
|
4. |
Side 16, artikel 8, stk. 2, indledningen: |
I stedet for:
»2. Hvis Kommissionen eller én eller flere centrale kontaktpunkter, der er omhandlet i artikel 3, stk. 6 anmoder herom, fremlægger Styringsgruppen vedrørende Mangel på Lægemidler aggregerede data og efterspørgselsprognoser for at underbygge sine konstateringer og konklusioner. I den forbindelse skal Styringsgruppen vedrørende Mangel på Lægemidler: […]«
læses:
»2. Hvis Kommissionen eller én eller flere centrale kontaktpunkter, der er omhandlet i artikel 3, stk. 6, andet afsnit, anmoder herom, fremlægger Styringsgruppen vedrørende Mangel på Lægemidler aggregerede data og efterspørgselsprognoser for at underbygge sine konstateringer og konklusioner. I den forbindelse skal Styringsgruppen vedrørende Mangel på Lægemidler: […]«
|
5. |
Side 18, artikel 9, stk. 2, litra d): |
I stedet for:
|
»d) |
anmode om oplysninger om lægemidler på listerne over kritiske lægemidler fra de centrale kontaktpunkter, der er omhandlet i artikel 3, stk. 6, på grundlag af det sæt af oplysninger, der er omhandlet i artikel 6, stk. 4, og fastsætte en frist for indgivelsen af disse oplysninger, hvis oplysningerne ikke er tilgængelige på ESMP.« |
læses:
|
»d) |
anmode om oplysninger om lægemidler på listerne over kritiske lægemidler fra de centrale kontaktpunkter, der er omhandlet i artikel 3, stk. 6, andet afsnit, på grundlag af det sæt af oplysninger, der er omhandlet i artikel 6, stk. 4, og fastsætte en frist for indgivelsen af disse oplysninger, hvis oplysningerne ikke er tilgængelige på ESMP.« |
|
6. |
Side 18, artikel 10, stk. 2, andet afsnit: |
I stedet for:
»De indehavere af markedsføringstilladelser, der er omhandlet i nærværende stykkes første afsnit, fremsender de oplysninger, der er anmodet om, inden for den frist, der er fastsat af agenturet, gennem de centrale kontaktpunkter, der er omhandlet i artikel 9, stk. 2, litra b), ved hjælp af de monitorerings- og rapporteringsmetoder og -systemer, der er fastlagt i henhold til henholdsvis litra b) og c) i artikel 9, stk. 1. Disse indehavere af markedsføringstilladelser foretager ajourføringer, når det er nødvendigt.«
læses:
»De indehavere af markedsføringstilladelser, der er omhandlet i nærværende stykkes første afsnit, fremsender de oplysninger, der er anmodet om, inden for den frist, der er fastsat af agenturet, gennem de centrale kontaktpunkter, der er omhandlet i artikel 9, stk. 2, litra a), ved hjælp af de monitorerings- og rapporteringsmetoder og -systemer, der er fastlagt i henhold til henholdsvis litra b) og c) i artikel 9, stk. 1. Disse indehavere af markedsføringstilladelser foretager ajourføringer, når det er nødvendigt.«
|
7. |
Side 19, artikel 11, stk. 1, litra a): |
I stedet for:
|
»a) |
indgive det sæt af oplysninger, der er omhandlet i artikel 6, stk. 4, herunder foreliggende og anslåede data om omfanget af efterspørgslen og efterspørgselsprognoser, gennem det centrale kontaktpunkt, der er omhandlet i artikel 3, stk. 6, og ved hjælp af de rapporteringsmetoder og systemer, der er fastlagt i henhold til henholdsvis litra b) og c) i artikel 9, stk. 1« |
læses:
|
»a) |
indgive det sæt af oplysninger, der er omhandlet i artikel 9, stk. 2, litra d), herunder foreliggende og anslåede data om omfanget af efterspørgslen og efterspørgselsprognoser, gennem det centrale kontaktpunkt, der er omhandlet i artikel 3, stk. 6, andet afsnit, ved hjælp af de rapporteringsmetoder og systemer, der er fastlagt i henhold til henholdsvis litra b) og c) i artikel 9, stk. 1« |
|
8. |
Side 20, artikel 11, stk. 3: |
I stedet for:
»3. Hvis medlemsstaterne er i besiddelse af eventuelle oplysninger ud over de oplysninger, der skal fremlægges i overensstemmelse med denne artikels stk. 1 og 2, om omfanget af salget og mængden af recepter for lægemidler, som dokumenterer en faktisk eller potentiel mangel på et lægemiddel, der er opført på listerne over kritiske lægemidler, herunder data omhandlet i artikel 23a, stk. 3, i direktiv 2001/83/EF, giver de straks Styringsgruppen vedrørende Mangel på Lægemidler disse oplysninger gennem deres respektive centrale kontaktpunkter, jf. denne forordnings artikel 3, stk. 6.«
læses:
»3. Hvis medlemsstaterne er i besiddelse af eventuelle oplysninger ud over de oplysninger, der skal fremlægges i overensstemmelse med denne artikels stk. 1 og 2, om omfanget af salget og mængden af recepter for lægemidler, som dokumenterer en faktisk eller potentiel mangel på et lægemiddel, der er opført på listerne over kritiske lægemidler, herunder data omhandlet i artikel 23a, stk. 3, i direktiv 2001/83/EF, giver de straks Styringsgruppen vedrørende Mangel på Lægemidler disse oplysninger gennem deres respektive centrale kontaktpunkter, jf. denne forordnings artikel 3, stk. 6, andet afsnit.«
|
9. |
Side 21, artikel 13, stk. 3, litra b): |
I stedet for:
|
»b) |
anvender medlemsstaterne ESMP til at indberette oplysninger om lægemidler på listerne over kritiske lægemidler til agenturet via de centrale kontaktpunkter, der er omhandlet i artikel 9, stk. 1, litra d), i overensstemmelse med artikel 9 og 11.« |
læses:
|
»b) |
anvender medlemsstaterne ESMP til at indberette oplysninger om lægemidler på listerne over kritiske lægemidler til agenturet via de centrale kontaktpunkter, der er omhandlet i artikel 3, stk. 6, andet afsnit, i overensstemmelse med artikel 9 og 11.« |
|
10. |
Side 21, artikel 13, stk. 4, litra b): |
I stedet for:
|
»b) |
anvender medlemsstaterne ESMP til via de centrale kontaktpunkter, der er omhandlet i artikel 9, stk. 1, litra e), at indberette til agenturet om mangel på lægemidler, der kan forventes at føre til en folkesundhedsmæssig krisesituation eller større hændelse, jf. artikel 4, stk. 2.« |
læses:
|
»b) |
anvender medlemsstaterne ESMP til via de centrale kontaktpunkter, der er omhandlet i artikel 3, stk. 6, andet afsnit, at indberette til agenturet om mangel på lægemidler, der kan forventes at føre til en folkesundhedsmæssig krisesituation eller større hændelse, jf. artikel 4, stk. 2.« |
|
11. |
Side 28, artikel 22, stk. 2: |
I stedet for:
»2. Med henblik på artikel 25, stk. 2, vedtager og offentliggør Styringsgruppen vedrørende Mangel på Medicinsk Udstyr det sæt af oplysninger, der er omhandlet i artikel 25, stk. 2, litra b) og c), og som er nødvendige for at monitorere forsyning af og efterspørgsel efter medicinsk udstyr, der er opført på listen over kritisk medicinsk udstyr til folkesundhedsmæssige krisesituationer, og underretter den arbejdsgruppe, der er omhandlet i artikel 21, stk. 5, om dette sæt af oplysninger.«
læses:
»2. Med henblik på artikel 25, stk. 2, vedtager og offentliggør Styringsgruppen vedrørende Mangel på Medicinsk Udstyr det sæt af oplysninger, der er omhandlet i artikel 25, stk. 2, litra c) og d), og som er nødvendige for at monitorere forsyning af og efterspørgsel efter medicinsk udstyr, der er opført på listen over kritisk medicinsk udstyr til folkesundhedsmæssige krisesituationer, og underretter den arbejdsgruppe, der er omhandlet i artikel 21, stk. 5, om dette sæt af oplysninger.«
|
12. |
Side 28, artikel 24, stk. 1: |
I stedet for:
»1. I hele periode, som den folkesundhedsmæssige krisesituation varer, rapporterer Styringsgruppen vedrørende Mangel på Medicinsk Udstyr regelmæssigt om resultaterne af den monitorering, der er omhandlet i artikel 23, til Kommissionen og det i artikel 25, stk. 2, litra a), omhandlede centrale kontaktpunkt, og påpeger navnlig enhver faktisk eller potentiel mangel på medicinsk udstyr, der er opført på listen over kritisk medicinsk udstyr til folkesundhedsmæssige krisesituationer.«
læses:
»1. I hele periode, som den folkesundhedsmæssige krisesituation varer, rapporterer Styringsgruppen vedrørende Mangel på Medicinsk Udstyr regelmæssigt om resultaterne af den monitorering, der er omhandlet i artikel 23, til Kommissionen og det i artikel 21, stk. 5, andet afsnit, omhandlede centrale kontaktpunkt, og påpeger navnlig enhver faktisk eller potentiel mangel på medicinsk udstyr, der er opført på listen over kritisk medicinsk udstyr til folkesundhedsmæssige krisesituationer.«
|
13. |
Side 29, artikel 24, stk. 5: |
I stedet for:
»5. Hvis Kommissionen anmoder herom, kan Styringsgruppen vedrørende Mangel på Medicinsk Udstyr koordinere foranstaltninger, der træffes af de nationale kompetente myndigheder for medicinsk udstyr, producenter af medicinsk udstyr, bemyndigede organer og andre enheder, alt efter hvad der er relevant, med henblik på at forebygge eller afbøde faktisk eller potentiel mangel på medicinsk udstyr i forbindelse med en folkesundhedsmæssig krisesituation eller en større hændelse.«
læses:
»5. Hvis Kommissionen anmoder herom, kan Styringsgruppen vedrørende Mangel på Medicinsk Udstyr koordinere foranstaltninger, der træffes af de nationale kompetente myndigheder for medicinsk udstyr, producenter af medicinsk udstyr, bemyndigede organer og andre enheder, alt efter hvad der er relevant, med henblik på at forebygge eller afbøde faktisk eller potentiel mangel på medicinsk udstyr i forbindelse med en folkesundhedsmæssig krisesituation.«
|
14. |
Side 31, artikel 27, stk. 1, litra a): |
I stedet for:
|
»a) |
indgive det sæt af oplysninger, der er omhandlet i artikel 22, stk. 2, herunder tilgængelige oplysninger om behovene vedrørende medicinsk udstyr, der er opført på listen over kritisk medicinsk udstyr til folkesundhedsmæssige krisesituationer, og foreliggende og anslåede data om omfanget af efterspørgslen efter og efterspørgselsprognoser for dette medicinske udstyr, gennem det respektive centrale kontaktpunkt, der er omhandlet i artikel 25, stk. 2, litra a), og ved hjælp af de monitorerings- og rapporteringsmetoder og -systemer, der er fastlagt i henhold til artikel 25, stk. 1, litra b)« |
læses:
|
»a) |
indgive det sæt af oplysninger, der er omhandlet i artikel 25, stk. 2, litra d), herunder tilgængelige oplysninger om behovene vedrørende medicinsk udstyr, der er opført på listen over kritisk medicinsk udstyr til folkesundhedsmæssige krisesituationer, og foreliggende og anslåede data om omfanget af efterspørgslen efter og efterspørgselsprognoser for dette medicinske udstyr, gennem det respektive centrale kontaktpunkt, der er omhandlet i artikel 21, stk. 5, andet afsnit, ved hjælp af de monitorerings- og rapporteringsmetoder og -systemer, der er fastlagt i henhold til artikel 25, stk. 1, litra b)«. |
|
15. |
Side 32, artikel 27, stk. 3: |
I stedet for:
»3. Hvis medlemsstaterne er i besiddelse af eventuelle oplysninger ud over de oplysninger, der skal fremlægges i overensstemmelse med denne artikels stk. 1 og 2, og som dokumenterer en faktisk eller potentiel mangel på medicinsk udstyr, giver de straks disse oplysninger til Styringsgruppen vedrørende Mangel på Medicinsk Udstyr gennem deres respektive centrale kontaktpunkter, jf. artikel 25, stk. 2, litra a).«
læses:
»3. Hvis medlemsstaterne er i besiddelse af eventuelle oplysninger ud over de oplysninger, der skal fremlægges i overensstemmelse med denne artikels stk. 1 og 2, og som dokumenterer en faktisk eller potentiel mangel på medicinsk udstyr, giver de straks disse oplysninger til Styringsgruppen vedrørende Mangel på Medicinsk Udstyr gennem deres respektive centrale kontaktpunkter, jf. artikel 21, stk. 5, andet afsnit.«
|
16. |
Side 32, artikel 27, stk. 4, litra b): |
I stedet for:
|
»b) |
tage hensyn til eventuelle anbefalinger som omhandlet i artikel 24, stk. 3, og eventuelle retningslinjer som omhandlet i artikel 28, litra b), og koordinere deres tiltag i forbindelse med eventuelle tiltag på EU-plan i henhold til artikel 12, litra a)« |
læses:
|
»b) |
tage hensyn til eventuelle anbefalinger som omhandlet i artikel 24, stk. 3, og eventuelle retningslinjer som omhandlet i artikel 28, litra b), og koordinere deres tiltag i forbindelse med eventuelle tiltag på EU-plan i henhold til artikel 28, litra a)«. |
|
9.3.2023 |
DA |
Den Europæiske Unions Tidende |
L 71/42 |
Berigtigelse til Rådets forordning (EU) 2023/194 af 30. januar 2023 om fastsættelse for 2023 af fiskerimuligheder for visse fiskebestande gældende for EU-farvande og for EU-fiskerfartøjer i visse andre farvande og om fastsættelse af sådanne fiskerimuligheder for visse dybhavsbestande for 2023 og 2024
( Den Europæiske Unions Tidende L 28 af 31. januar 2023 )
Side 33, afsnit II, kapitel III, afdeling 11, artikel 48:
I stedet for:
»Artikel 48
Forbud mod målrettet fiskeri efter dybhavshajer
Målrettet fiskeri efter følgende dybhavshajer i SIOFA-aftaleområdet er forbudt:
|
a) |
portugisisk fløjlshaj (Centroscymnus coelolepis) |
|
b) |
næbhaj (Deania calcea) |
|
c) |
ru pighaj (Centrophorus granulosus) |
|
d) |
chokoladehaj (Dalatias licha) |
|
e) |
Bachs kattehaj (Bythaelurus bachi) |
|
f) |
mørkmundet havmus (Chimaera buccanigella) |
|
g) |
Didiers havmus (Chimaera didierae) |
|
h) |
sømandens havmus (Chimaera willwatchi) |
|
i) |
langsnudet fløjlshaj (Centroscymnus crepidater) |
|
j) |
Plunkets fløjlshaj (Centroscymnus plunketi) |
|
k) |
fløjlshaj (Scymnodon squamulosus) |
|
l) |
hvidkindet lanternehaj (Etmopterus alphus) |
|
m) |
smalmavet kattehaj (Apristurus indicus) |
|
n) |
smalnæset havmus (Harriotta raleighana) |
|
o) |
smalhovedet kattehaj (Bythaelurus tenuicephalus) |
|
p) |
kravehaj (Chlamydoselachus anguineus) |
|
q) |
storøjet seksgællet haj (Hexanchus nakamurai) |
|
r) |
glat lanternehaj (Etmopterus pusillus) |
|
s) |
antarktisk havkal (Somniosus antarcticus) |
|
t) |
troldhaj (Mitsukurina owstoni).« |
læses:
»Artikel 48
Forbud mod målrettet fiskeri efter dybhavshajer
Målrettet fiskeri efter følgende dybhavshajer i SIOFA-aftaleområdet er forbudt:
|
a) |
portugisisk fløjlshaj (Centroscymnus coelolepis) |
|
b) |
næbhaj (Deania calcea) |
|
c) |
ru pighaj (Centrophorus granulosus) |
|
d) |
chokoladehaj (Dalatias licha) |
|
e) |
Bachs rødhaj (Bythaelurus bachi) |
|
f) |
sortmundet havmus (Chimaera buccanigella ) |
|
g) |
Didiers havmus (Chimaera didierae) |
|
h) |
sømandshavmus (Chimaera willwatchi) |
|
i) |
langsnudet fløjlshaj (Centroscymnus crepidater) |
|
j) |
Plunkets fløjlshaj (Centroscymnus plunketi) |
|
k) |
fløjlshaj (Scymnodon squamulosus) |
|
l) |
hvidkindet lanternehaj (Etmopterus alphus) |
|
m) |
småbuget kattehaj (Apristurus indicus) |
|
n) |
smalnæset havmus (Harriotta raleighana) |
|
o) |
smalhovedet rødhaj (Bythaelurus tenuicephalus) |
|
p) |
kravehaj (Chlamydoselachus anguineus) |
|
q) |
storøjet seksgællet haj (Hexanchus nakamurai) |
|
r) |
glat lanternehaj (Etmopterus pusillus) |
|
s) |
sydlig havkal (Somniosus antarcticus) |
|
t) |
troldhaj (Mitsukurina owstoni).« |
|
9.3.2023 |
DA |
Den Europæiske Unions Tidende |
L 71/44 |
Berigtigelse til Rådets forordning (EU) 2022/2576 af 19. december 2022 om styrkelse af solidariteten gennem bedre koordinering af indkøb af gas, pålidelige prisbenchmarks og udveksling af gas på tværs af grænserne
( Den Europæiske Unions Tidende L 335 af 29. december 2022 )
|
1. |
Side 10, betragtning 66: |
I stedet for:
|
»(66) |
For hver medlemsstat bør der fastsættes en maksimumsgrænse for de kritiske gasmængder, der er nødvendige for at opretholde elforsyningssikkerheden, således at unødvendige eller urimelige solidaritetsanmodninger eller unødige begrænsninger for solidaritet til en medlemsstat i nød undgås. Den metode, der anvendes i vinterprognosen fra det europæiske net af transmissionssystemoperatører for elektricitet (ENTSO-E), danner grundlag for indkredsningen af den kritiske gasmængde til elforsyningssikkerheden og for fastsættelsen af sådanne grænser. De kritiske gasmængder for elforsyningssikkerheden, som ENTSO-E har beregnet, afspejler de gasmængder, der er absolut nødvendige for at sikre tilstrækkelig elektricitet på paneuropæisk plan under anvendelse af alle markedsressourcer, idet gassen altid anses for at være sidst i rangfølgen. ENTSO-E-metoden er baseret på et stort udsnit af de værst tænkelige klimascenarier og scenarier med tvungne afbrydelser. Det forhold, at ENTSO-E-metoden ikke tager hensyn til al kraftvarmeproduktion, forhindrer ikke medlemsstaterne i at betragte beskyttede kunders fjernvarmeinstallationer som beskyttede i henhold til definitionen i forordning (EU) 2017/1938. For medlemsstater, hvis elproduktion er fuldstændig afhængig af LNG-leverancer uden betydelig lagerkapacitet, bør de kritiske gasmængder for elforsyningssikkerheden tilpasses i overensstemmelse hermed. Den kritiske gasmængde for elforsyningssikkerheden kan være lavere end det historiske gasniveau, der forbruges til elproduktion, da tilstrækkelig elektricitet kan leveres på andre måder, herunder ved at levere forsyninger mellem medlemsstaterne.« |
læses:
|
»(66) |
For hver medlemsstat bør der fastsættes en maksimumsgrænse for de kritiske gasmængder, der er nødvendige med henblik på at opretholde elforsyningssikkerheden, således at unødvendige eller urimelige solidaritetsanmodninger eller unødige begrænsninger for solidaritet til en medlemsstat i nød undgås. Den metode, der anvendes i vinterprognosen fra det europæiske net af transmissionssystemoperatører for elektricitet (ENTSO-E), danner grundlag for indkredsningen af den kritiske gasmængde med henblik på elforsyningssikkerhed og for fastsættelsen af sådanne grænser. De kritiske gasmængder med henblik på elforsyningssikkerhed, som ENTSO-E har beregnet, afspejler de gasmængder, der er absolut nødvendige for at sikre tilstrækkelig elektricitet på paneuropæisk plan under anvendelse af alle markedsressourcer, idet gassen altid anses for at være sidst i rangfølgen. ENTSO-E-metoden er baseret på et stort udsnit af de værst tænkelige klimascenarier og scenarier med tvungne afbrydelser. Det forhold, at ENTSO-E-metoden ikke tager hensyn til al kraftvarmeproduktion, forhindrer ikke medlemsstaterne i at betragte beskyttede kunders fjernvarmeinstallationer som beskyttede i henhold til definitionen i forordning (EU) 2017/1938. For medlemsstater, hvis elproduktion er fuldstændig afhængig af LNG-leverancer uden betydelig lagerkapacitet, bør de kritiske gasmængder med henblik på elforsyningssikkerhed tilpasses i overensstemmelse hermed. Den kritiske gasmængde med henblik på elforsyningssikkerhed kan være lavere end det historiske gasniveau, der forbruges til elproduktion, da tilstrækkelig elektricitet kan leveres på andre måder, herunder ved at levere forsyninger mellem medlemsstaterne.« |
|
2. |
Side 11, betragtning 67, tredje punktum: |
I stedet for:
»Den kritiske gasmængde for elforsyningssikkerheden omfatter pr. definition al den gas, der er nødvendig for at sikre en stabil elforsyning, og omfatter derfor den elektricitet, der er nødvendig for at producere og transportere gas, samt vigtige sektorer med kritisk infrastruktur og anlæg, der er afgørende for, at militæret, de nationale sikkerhedstjenester og de humanitære bistandstjenester kan fungere.«
læses:
»Den kritiske gasmængde med henblik på elforsyningssikkerhed omfatter pr. definition al den gas, der er nødvendig for at sikre en stabil elforsyning, og omfatter derfor den elektricitet, der er nødvendig for at producere og transportere gas, samt vigtige sektorer med kritisk infrastruktur og anlæg, der er afgørende for, at militæret, de nationale sikkerhedstjenester og de humanitære bistandstjenester kan fungere.«
|
3. |
Side 16, artikel 2, nr. 14): |
I stedet for:
»14) »kritisk gasmængde til elforsyningssikkerhed«: det maksimale gasforbrug, der er nødvendigt i elsektoren for at …«
læses:
»14) »kritisk gasmængde med henblik på elforsyningssikkerhed«: det maksimale gasforbrug, der er nødvendigt i elsektoren for at …«.
|
4. |
Side 28, artikel 23, titlen: |
I stedet for:
»Udvidelse af solidaritetsbeskyttelsen til de gasmængder, der er kritiske for elforsyningssikkerheden«
læses:
»Udvidelse af solidaritetsbeskyttelsen til de kritiske gasmængder med henblik på elforsyningssikkerhed«
|
5. |
Side 28, artikel 23, stk. 1, litra b), første punktum: |
I stedet for:
|
»b) |
den gasmængde, der er kritisk for elforsyningssikkerheden, på trods af anvendelsen af den foranstaltning, der …« |
læses:
|
»b) |
den kritiske gasmængde med henblik på elforsyningssikkerhed på trods af anvendelsen af den foranstaltning, der …«. |
|
6. |
Side 28, artikel 23, stk. 2, litra b): |
I stedet for:
|
»b) |
forsyninger af de gasmængder, der er kritiske for elforsyningssikkerheden« |
læses:
|
»b) |
forsyninger af de kritiske gasmængder med henblik på elforsyningssikkerhed« |
|
7. |
Side 28, artikel 23, stk. 3, første punktum: |
I stedet for:
»3. De gasmængder, der er kritiske for elforsyningssikkerheden, jf. stk. 1, litra b), og …«
læses:
»3. De kritiske gasmængder med henblik på elforsyningssikkerhed, jf. stk. 1, litra b), og …«
|
8. |
Side 33, bilag I, punkt a), indledningen: |
I stedet for:
|
»a) |
Maksimale kritiske gasmængder med henblik på elforsyningssikkerheden, jf. artikel 23, …« |
læses:
|
»a) |
Maksimale kritiske gasmængder med henblik på elforsyningssikkerhed, jf. artikel 23, …« |
|
9. |
Side 34, bilag I, punkt b), indledningen: |
I stedet for:
|
»b) |
Maksimale kritiske gasmængder med henblik på elforsyningssikkerheden, jf. artikel 23, …« |
læses:
|
»b) |
Maksimale kritiske gasmængder med henblik på elforsyningssikkerhed, jf. artikel 23, …«. |
|
9.3.2023 |
DA |
Den Europæiske Unions Tidende |
L 71/47 |
Berigtigelse til Rådets gennemførelsesforordning (EU) 2023/419 af 24. februar 2023 om gennemførelse af artikel 8a i forordning (EF) nr. 765/2006 om restriktive foranstaltninger på baggrund af situationen i Belarus og Belarus' involvering i den russiske aggression mod Ukraine
( Den Europæiske Unions Tidende L 61 af 27. februar 2023 )
Side 22, bilaget, indledningen:
I stedet for:
»I bilag I til forordning (EF) nr. 765/2006 foretages følgende ændringer:
|
1) |
I tabel »A. Fysiske personer, jf. artikel 2, stk. 1« affattes punkt 10, 17, 20, 22, 35, 39, 41, 42, 64, 65, 71, 73, 75, 78, 85, 87, 89, 90, 123, 125 og 179 således:« |
læses:
»I bilag I til forordning (EF) nr. 765/2006 foretages følgende ændringer:
|
1) |
I tabel »A. Fysiske personer, jf. artikel 2, stk. 1« affattes punkt 10, 17, 20, 22, 35, 39, 41, 42, 64, 65, 71, 73, 75, 78, 85, 87, 89, 90, 104, 123, 125, 129, 131, 179 og 195 således:«. |