ISSN 1977-0634
Den Europæiske Unions
Tidende
L 331

Dansk udgave
Retsforskrifter
57. årgang
18. november 2014
|
ISSN 1977-0634 |
||
|
Den Europæiske Unions Tidende |
L 331 |
|

|
||
|
Dansk udgave |
Retsforskrifter |
57. årgang |
|
|
|
Berigtigelser |
|
|
|
* |
||
|
|
* |
|
|
|
|
|
(1) EØS-relevant tekst |
|
DA |
De akter, hvis titel er trykt med magre typer, er løbende retsakter inden for rammerne af landbrugspolitikken og har normalt en begrænset gyldighedsperiode. Titlen på alle øvrige akter er trykt med fede typer efter en asterisk. |
II Ikke-lovgivningsmæssige retsakter
FORORDNINGER
|
18.11.2014 |
DA |
Den Europæiske Unions Tidende |
L 331/1 |
RÅDETS GENNEMFØRELSESFORORDNING (EU) Nr. 1225/2014
af 17. november 2014
om gennemførelse af forordning (EU) nr. 269/2014 om restriktive foranstaltninger over for tiltag, der underminerer eller truer Ukraines territoriale integritet, suverænitet og uafhængighed
RÅDET FOR DEN EUROPÆISKE UNION HAR —
under henvisning til traktaten om Den Europæiske Unions funktionsmåde,
under henvisning til Rådets forordning (EU) nr. 269/2014 af 17. marts 2014 om restriktive foranstaltninger over for tiltag, der underminerer eller truer Ukraines territoriale integritet, suverænitet og uafhængighed (1), særlig artikel 14, stk. 1, og
ud fra følgende betragtninger:
|
(1) |
Rådet vedtog den 17. marts 2014 forordning (EU) nr. 269/2014. |
|
(2) |
Oplysningerne om en person, der er opført på listen i henhold til forordning (EU) nr. 269/2014, bør ændres. |
|
(3) |
Bilag I til forordning (EU) nr. 269/2014 bør derfor ændres i overensstemmelse hermed — |
VEDTAGET DENNE FORORDNING:
Artikel 1
Bilag I til forordning (EU) nr. 269/2014 ændres herved som anført i bilaget til nærværende forordning.
Artikel 2
Denne forordning træder i kraft dagen efter offentliggørelsen i Den Europæiske Unions Tidende.
Denne forordning er bindende i alle enkeltheder og gælder umiddelbart i hver medlemsstat.
Udfærdiget i Bruxelles, den 17. november 2014.
På Rådets vegne
F. MOGHERINI
Formand
(1) EUT L 78 af 17.3.2014, s. 6.
BILAG
Oplysningerne om følgende person i bilag I til forordning (EU) nr. 269/2014 affattes således:
|
|
Navn |
Identificerende oplysninger |
Begrundelse |
Dato for opførelse på listen |
|
|
Vladimir Volfovich ZHIRINOVSKY Владимир Вольфович Жириновский |
Født den 25.4.1946 i Almaty (tidligere også benævnt Alma-Ata), Kasakhstan. |
Medlem af Statsdumaens Råd, leder af LDPR-partiet. Han støttede aktivt anvendelsen af russiske væbnede styrker i Ukraine og annekteringen af Krim. Han har aktivt opfordret til opsplitning af Ukraine. Han underskrev, på vegne af LDPR-partiet, en aftale med den såkaldte »Folkerepublik Donetsk« |
12.9.2014 |
|
18.11.2014 |
DA |
Den Europæiske Unions Tidende |
L 331/3 |
KOMMISSIONENS FORORDNING (EU) Nr. 1226/2014
af 17. november 2014
om godkendelse af en sundhedsanprisning af fødevarer, der henviser til en reduceret risiko for sygdom
(EØS-relevant tekst)
EUROPA-KOMMISSIONEN HAR —
under henvisning til traktaten om Den Europæiske Unions funktionsmåde,
under henvisning til Europa-Parlamentets og Rådets forordning (EF) nr. 1924/2006 af 20. december 2006 om ernærings- og sundhedsanprisninger af fødevarer (1), særlig artikel 17, stk. 3, og
ud fra følgende betragtninger:
|
(1) |
I henhold til forordning (EF) nr. 1924/2006 er sundhedsanprisninger af fødevarer forbudt, medmindre de er godkendt af Kommissionen i overensstemmelse med samme forordning og opført på en liste over tilladte anprisninger. |
|
(2) |
Forordning (EF) nr. 1924/2006 foreskriver ligeledes, at lederne af fødevarevirksomheder kan sende ansøgninger om godkendelse af sundhedsanprisninger til en medlemsstats nationale kompetente myndighed. Den nationale kompetente myndighed skal videresende gyldige ansøgninger til Den Europæiske Fødevaresikkerhedsautoritet (EFSA), i det følgende benævnt »autoriteten«. |
|
(3) |
Efter at have modtaget en ansøgning skal autoriteten straks underrette de øvrige medlemsstater og Kommissionen herom og desuden afgive udtalelse om den pågældende sundhedsanprisning. |
|
(4) |
Kommissionen skal træffe beslutning vedrørende eventuel godkendelse af sundhedsanprisninger under hensyntagen til autoritetens udtalelse. |
|
(5) |
Som opfølgning på en ansøgning, som Lactalis B&C indgav i henhold til artikel 14, stk. 1, litra a), i forordning (EF) nr. 1924/2006, skulle autoriteten afgive udtalelse om en sundhedsanprisning vedrørende »smørbare fedtstoffer med lavt fedtindhold, lavt indhold af transfedtsyrer og højt indhold af umættede fedtsyrer og omega-3-fedtsyrer« og reduktion af indholdet af LDL-kolesterol (spørgsmål nr. EFSA-Q-2009-00458) (2). Den af ansøgeren foreslåede anprisning havde følgende ordlyd: »Udskiftning af et fedtstof, der er rigt på mættede fedtsyrer/transfedtsyrer, med et fedtstof, der er rigt på umættede fedtsyrer, hjælper til at reducere LDL-kolesterolet. LDL-kolesterol er en risikofaktor i forhold til hjerte-kar-sygdomme«. |
|
(6) |
På grundlag af de fremlagte oplysninger konkluderede autoriteten i sin udtalelse, som Kommissionen og medlemsstaterne modtog den 25. maj 2011, at der var fastslået en årsagssammenhæng mellem indtag af blandinger af mættede fedtsyrer (SFA) via kosten og en stigning i blodets indhold af LDL-kolesterol, og at udskiftning — gram for gram — af en blanding af SFA med cis-enkeltumættede fedtsyrer og/eller cis-flerumættede fedtsyrer i fødevarer eller kost reducerer indholdet af LDL-kolesterol. En sundhedsanprisning, der er i overensstemmelse med denne konklusion, bør følgelig anses for at opfylde kravene i forordning (EF) nr. 1924/2006 og bør optages på EU-listen over tilladte anprisninger. Autoriteten vurderede, at den kliniske interventionsundersøgelse, som ansøgeren havde angivet som værende omfattet af ejendomsrettigheder, ikke var nødvendig for at kunne nå frem til en konklusion. Det vurderes følgelig, at betingelsen i artikel 21, stk. 1, litra c), i forordning (EF) nr. 1924/2006 ikke er opfyldt, og anmodningen om ejendomsretlig beskyttelse bør derfor ikke efterkommes. |
|
(7) |
Autoriteten konkluderer i sin udtalelse, at betydelige mængder af mættede fedtsyrer skal erstattes — gram for gram — af enkeltumættede og/eller flerumættede fedtsyrer i fødevarer eller diæter, for at anprisningen skal kunne anvendes. For at sikre, at en fødevare indeholder betydelige mængder af enkeltumættede og/eller flerumættede fedtsyrer, bør anvendelsen af anprisningen derfor begrænses til fedtstoffer og olier, ligesom der bør fastsættes anvendelsesbetingelser som i ernæringsanprisningen »HØJT INDHOLD AF UMÆTTET FEDT« som fastsat i bilaget til forordning (EF) nr. 1924/2006. |
|
(8) |
Artikel 16, stk. 4, i forordning (EF) nr. 1924/2006 foreskriver, at en positiv udtalelse, hvorefter en sundhedsanprisning kan godkendes, skal indeholde bestemte oplysninger. Disse oplysninger bør således angives i bilaget til nærværende forordning for den anprisning, der godkendes, og de bør alt efter tilfældet omfatte en ændret formulering af anprisningen, særlige betingelser for anvendelsen af anprisningen og, hvor det er relevant, betingelser eller begrænsninger for anvendelsen af fødevaren og/eller supplerende erklæringer eller advarsler, i overensstemmelse med forordning (EF) nr. 1924/2006 og i tråd med autoritetens udtalelser. |
|
(9) |
Et af målene med forordning (EF) nr. 1924/2006 er at sikre, at sundhedsanprisninger er sandfærdige, klare, pålidelige og anvendelige for forbrugeren, og i den forbindelse at formuleringen og præsentationen af sundhedsanprisninger tages i betragtning. Anprisninger, der i kraft af deres formulering har samme betydning for forbrugerne som en godkendt sundhedsanprisning, idet de viser den samme sammenhæng mellem en fødevarekategori, en fødevare eller en af dens bestanddele og sundhed, bør derfor også være omfattet af de i bilaget til nærværende forordning angivne anvendelsesbetingelser. |
|
(10) |
De bemærkninger fra ansøgerne og medlemmer af offentligheden, som Kommissionen har modtaget i overensstemmelse med artikel 16, stk. 6, i forordning (EF) nr. 1924/2006, er taget i betragtning ved fastsættelsen af foranstaltningerne i nærværende forordning. |
|
(11) |
Foranstaltningerne i denne forordning er i overensstemmelse med udtalelse fra Den Stående Komité for Fødevarekæden og Dyresundhed — |
VEDTAGET DENNE FORORDNING:
Artikel 1
1. Fødevarer, der markedsføres i Unionen, kan gøres til genstand for sundhedsanprisningen i bilaget til denne forordning i overensstemmelse med de i samme bilag fastsatte betingelser.
2. Den i stk. 1 omhandlede sundhedsanprisning optages på den i artikel 14, stk. 1, i forordning (EF) nr. 1924/2006 omhandlede EU-liste over tilladte anprisninger.
Artikel 2
Denne forordning træder i kraft på tyvendedagen efter offentliggørelsen i Den Europæiske Unions Tidende.
Denne forordning er bindende i alle enkeltheder og gælder umiddelbart i hver medlemsstat.
Udfærdiget i Bruxelles, den 17. november 2014.
På Kommissionens vegne
Jean-Claude JUNCKER
Formand
(1) EUT L 404 af 30.12.2006, s. 9.
(2) EFSA Journal 2011;9(5):2168.
BILAG
Tilladt sundhedsanprisning
|
Ansøgning — relevante bestemmelser i forordning (EF) nr. 1924/2006 |
Ansøger — adresse |
Næringsstof, andet stof, fødevare eller fødevarekategori |
Anprisning |
Betingelser for anvendelsen af anprisningen |
Betingelser og/eller begrænsninger for anvendelsen af fødevaren og/eller supplerende erklæringer eller advarsler |
EFSA-udtalelse |
|
Sundhedsanprisning i henhold til artikel 14, stk. 1, litra a), der henviser til en reduceret risiko for sygdom |
Lactalis B&C, ZA Les Placis, 35230 Bourgbarré, Frankrig |
Enkeltumættede og/eller flerumættede fedtsyrer |
Udskiftning af mættede fedtstoffer i kosten med umættede fedtstoffer har vist sig at sænke/reducere kolesterolindholdet i blodet. Et højt kolesteroltal er en risikofaktor i forhold til udvikling af koronar hjertesygdom |
Anprisningen må kun anvendes for fødevarer med et højt indhold af umættede fedtsyrer i henhold til det, der er angivet under anprisningen HØJT INDHOLD AF UMÆTTET FEDT på listen i bilaget til forordning (EF) nr. 1924/2006. |
Anprisningen må kun anvendes for fedtstoffer og olier. |
Q-2009-00458 |
|
18.11.2014 |
DA |
Den Europæiske Unions Tidende |
L 331/6 |
KOMMISSIONENS GENNEMFØRELSESFORORDNING (EU) Nr. 1227/2014
af 17. november 2014
om fastlæggelse af en tilpasningssats for direkte betalinger som fastsat i Rådets forordning (EF) nr. 73/2009 for kalenderåret 2014 og om ophævelse af Kommissionens gennemførelsesforordning (EU) nr. 879/2014
EUROPA-KOMMISSIONEN HAR —
under henvisning til traktaten om Den Europæiske Unions funktionsmåde,
under henvisning til Europa-Parlamentets og Rådets forordning (EU) nr. 1306/2013 af 17. december 2013 om finansiering, forvaltning og overvågning af den fælles landbrugspolitik og om ophævelse af Rådets forordning (EØF) nr. 352/78, (EF) nr. 165/94, (EF) nr. 2799/98, (EF) nr. 814/2000, (EF) nr. 1290/2005 og (EF) nr. 485/2008 (1), særlig artikel 26, stk. 4,
efter høring af Komitéen for Landbrugsfondene, og
ud fra følgende betragtninger:
|
(1) |
Kommissionen vedtog den 21. marts 2014 et forslag til Europa-Parlamentets og Rådets forordning om fastsættelse af en tilpasningssats for direkte betalinger, som fastsat i forordning (EF) nr. 73/2009, for kalenderåret 2014 (2). Denne tilpasningssats var ikke blevet fastsat af Europa-Parlamentet og Rådet senest den 30. juni 2014. I henhold til artikel 26, stk. 3, i forordning (EU) nr. 1306/2013 har Kommissionen derfor fastsat tilpasningssatsen i Kommissionens gennemførelsesforordning (EU) nr. 879/2014 (3). |
|
(2) |
Prognoserne for direkte betalinger og markedsrelaterede udgifter i Kommissionens ændringsskrivelse nr. 1 til budgetforslaget for 2015 viser, at der er behov for at tilpasse den sats for finansiel disciplin, der blev taget højde for i budgetforslaget for 2015. Ved udarbejdelsen af ændringsskrivelsen blev der fastsat et beløb på 433 mio. EUR for finansiel disciplin til den reserve til kriser i landbrugssektoren, der er omhandlet i artikel 25 i forordning (EU) nr. 1306/2013. For at tage hensyn til disse nye oplysninger bør Kommissionen ændre den tilpasningssats, som er fastsat i gennemførelsesforordning (EU) nr. 879/2014. |
|
(3) |
Som hovedregel modtager de landbrugere, der indgiver en støtteansøgning om direkte betalinger for et kalenderår (N), betaling inden for en fastsat betalingsperiode i regnskabsåret (N + 1). Medlemsstaterne har dog, inden for visse grænser, mulighed for at foretage sene betalinger til landbrugerne uden for betalingsperioden og uden tidsbegrænsninger. Sådanne sene betalinger kan foretages i et senere regnskabsår. Når mekanismen for finansiel disciplin anvendes i et givet kalenderår, bør tilpasningssatsen ikke anvendes på betalinger, der er indgivet ansøgning om i andre kalenderår end det år, den pågældende finansielle disciplin finder anvendelse. For at sikre ligebehandling af landbrugerne bør det derfor fastsættes, at tilpasningssatsen kun anvendes på betalinger, der er indgivet ansøgning om i det kalenderår, hvor den finansielle disciplin finder anvendelse, uanset tidspunktet for betalingen til landbrugerne. |
|
(4) |
I henhold til artikel 8, stk. 1, i Europa-Parlamentets og Rådets forordning (EU) nr. 1307/2013 (4) finder den tilpasningssats, der er fastsat i henhold til artikel 26 i forordning (EU) nr. 1306/2013, kun anvendelse på direkte betalinger på over 2 000 EUR, som bevilges til landbrugere i det pågældende kalenderår. Artikel 8, stk. 2, i forordning (EU) nr. 1307/2013 fastsætter endvidere, at som følge af den gradvise indførelse af direkte betalinger finder tilpasningssatsen først anvendelse på Bulgarien og Rumænien fra den 1. januar 2016 og på Kroatien fra den 1. januar 2022. Den tilpasningssats, der fastsættes ved denne forordning, bør derfor ikke finde anvendelse på betalinger til landbrugere i disse medlemsstater. |
|
(5) |
For at sikre at den ændrede tilpasningssats finder anvendelse fra den dato, hvor betalingerne til landbrugerne i henhold til forordning (EU) nr. 1306/2013 skal påbegyndes, bør denne forordning anvendes fra den 1. december 2014. |
|
(6) |
Der bør tages hensyn til den ændrede tilpasningssats ved beregningen af alle betalinger, der tildeles en landbruger på grundlag af en ansøgning, der er indgivet for kalenderåret 2014. Af klarhedshensyn bør gennemførelsesforordning (EU) nr. 879/2014 derfor ophæves — |
VEDTAGET DENNE FORORDNING:
Artikel 1
1. Med henblik på anvendelsen af den justering, der er omhandlet i artikel 25 og 26 i forordning (EU) nr. 1306/2013, og i henhold til artikel 8, stk. 1, i forordning (EU) nr. 1307/2013, nedsættes de i artikel 2, litra d), i Rådets forordning (EF) nr. 73/2009 (5) nævnte betalinger på over 2 000 EUR, der skal foretages til en landbruger i forbindelse med en støtteansøgning, der er indgivet for kalenderåret 2014, med 1,302214 %.
2. Tilpasningssatsen i henhold til stk. 1 finder ikke anvendelse på Bulgarien, Kroatien og Rumænien.
Artikel 2
Gennemførelsesforordning (EU) nr. 879/2014 ophæves.
Artikel 3
Denne forordning træder i kraft på syvendedagen efter offentliggørelsen i Den Europæiske Unions Tidende.
Den anvendes fra den 1. december 2014.
Denne forordning er bindende i alle enkeltheder og gælder umiddelbart i hver medlemsstat.
Udfærdiget i Bruxelles, den 17. november 2014.
På Kommissionens vegne
Jean-Claude JUNCKER
Formand
(1) EUT L 347 af 20.12.2013, s. 549.
(2) COM(2014)175.
(3) Kommissionens gennemførelsesforordning (EU) nr. 879/2014 af 12. august 2014 om fastlæggelse af en tilpasningssats for direkte betalinger som fastsat i Rådets forordning (EF) nr. 73/2009 for så vidt angår kalenderåret 2014 (EUT L 240 af 13.8.2014, s. 20).
(4) Europa-Parlamentets og Rådets forordning (EU) nr. 1307/2013 af 17. december 2013 om fastsættelse af regler for direkte betalinger til landbrugere under støtteordninger inden for rammerne af den fælles landsbrugspolitik og om ophævelse af Rådets forordning (EF) nr. 637/2008 og Rådets forordning (EF) nr. 73/2009 (EUT L 347 af 20.12.2013, s. 608).
(5) Rådets forordning (EF) nr. 73/2009 af 19. januar 2009 om fælles regler for den fælles landbrugspolitiks ordninger for direkte støtte til landbrugere og om fastlæggelse af visse støtteordninger for landbrugere, om ændring af forordning (EF) nr. 1290/2005, (EF) nr. 247/2006, (EF) nr. 378/2007 og om ophævelse af forordning (EF) nr. 1782/2003 (EUT L 30 af 31.1.2009, s. 16).
|
18.11.2014 |
DA |
Den Europæiske Unions Tidende |
L 331/8 |
KOMMISSIONENS FORORDNING (EU) Nr. 1228/2014
af 17. november 2014
om henholdsvis godkendelse og afvisning af visse sundhedsanprisninger af fødevarer, der henviser til en reduceret risiko for sygdom
(EØS-relevant tekst)
EUROPA-KOMMISSIONEN HAR —
under henvisning til traktaten om Den Europæiske Unions funktionsmåde,
under henvisning til Europa-Parlamentets og Rådets forordning (EF) nr. 1924/2006 af 20. december 2006 om ernærings- og sundhedsanprisninger af fødevarer (1), særlig artikel 17, stk. 3, og
ud fra følgende betragtninger:
|
(1) |
I henhold til forordning (EF) nr. 1924/2006 er sundhedsanprisninger af fødevarer forbudt, medmindre de er godkendt af Kommissionen i overensstemmelse med samme forordning og opført på en liste over tilladte anprisninger. |
|
(2) |
Forordning (EF) nr. 1924/2006 foreskriver ligeledes, at lederne af fødevarevirksomheder kan sende ansøgninger om godkendelse af sundhedsanprisninger til en medlemsstats nationale kompetente myndighed. Den nationale kompetente myndighed skal videresende gyldige ansøgninger til Den Europæiske Fødevaresikkerhedsautoritet (EFSA), i det følgende benævnt »autoriteten«. |
|
(3) |
Efter at have modtaget en ansøgning skal autoriteten straks underrette de øvrige medlemsstater og Kommissionen herom og desuden afgive udtalelse om den pågældende sundhedsanprisning. |
|
(4) |
Kommissionen skal træffe beslutning vedrørende eventuel godkendelse af sundhedsanprisninger under hensyntagen til autoritetens udtalelse. |
|
(5) |
Som opfølgning på en ansøgning, som Abtei Pharma Vertriebs GmbH indgav i henhold til artikel 14, stk. 1, litra a), i forordning (EF) nr. 1924/2006, skulle autoriteten afgive udtalelse om en sundhedsanprisning vedrørende tyggetabletter indeholdende calcium og vitamin D3 og tab af knoglemasse (spørgsmål nr. EFSA-Q-2008-721) (2). Den af ansøgeren foreslåede anprisning havde følgende ordlyd: »Tyggetabletter med calcium og vitamin D forbedrer knogletætheden hos kvinder på 50 år og derover. Tyggetabletter kan således reducere risikoen for knoglebrud som følge af osteoporose«. |
|
(6) |
På grundlag af de fremlagte oplysninger konkluderede autoriteten i sin udtalelse, som Kommissionen og medlemsstaterne modtog den 7. august 2009, at der var fastslået en årsagssammenhæng mellem indtag af calcium, enten alene eller i kombination med vitamin D, og reduceret tab af knoglemineraltæthed (BMD) hos kvinder i den postmenopausale alder. Reduktion af tabet af BMD kan bidrage til at mindske risikoen for knoglebrud. To sundhedsanprisninger, der er i overensstemmelse med denne konklusion, bør følgelig anses for at opfylde kravene i forordning (EF) nr. 1924/2006 og bør optages på EU-listen over tilladte anprisninger. Autoriteten konkluderede imidlertid, at de fremlagte oplysninger var utilstrækkelige som grundlag for at fastsætte anvendelsesbetingelser for anprisningerne. Kommissionen henvendte sig efterfølgende endnu en gang til autoriteten for at indhente yderligere rådgivning med henblik på at gøre det muligt for de ansvarlige for risikostyringen at fastsætte passende anvendelsesbetingelser for de pågældende sundhedsanprisninger. Autoriteten konkluderede i sin udtalelse, som Kommissionen og medlemsstaterne modtog den 17. maj 2010 (spørgsmål nr. EFSA-Q-2009-00940) (3), at det er nødvendigt at indtage mindst 1 200 mg calcium fra alle kilder eller mindst 1 200 mg calcium og 800 IU (20 μg) vitamin D fra alle kilder om dagen for at opnå den anpriste virkning. |
|
(7) |
For så vidt angår anvendelse af sundhedsanprisningen udelukkende for calcium bør der — for at sikre, at en fødevare indeholder en betydelig mængde calcium — fastsættes anvendelsesbetingelser, i henhold til hvilke anprisningen kun må anvendes for fødevarer, der indeholder mindst 400 mg calcium pr. kvantificeret portion. |
|
(8) |
I betragtning af, hvor stort et indtag af vitamin D der er nødvendigt for at opnå den anpriste virkning (20 μg), når sundhedsanprisningen anvendes for kombinationen af calcium og vitamin D, bør anvendelsen af anprisningen begrænses til kosttilskud. For at sikre, at et kosttilskud ville indeholde en betydelig mængde calcium og vitamin D i forbindelse med denne anprisning, bør der fastsættes anvendelsesbetingelser, i henhold til hvilke anprisningen kun må anvendes for kosttilskud, der indeholder mindst 400 mg calcium og 15 μg vitamin D pr. daglig dosis. |
|
(9) |
Som opfølgning på en ansøgning, som DSM Nutritional Products Europe AG indgav i henhold til artikel 14, stk. 1, litra a), i forordning (EF) nr. 1924/2006, skulle autoriteten afgive udtalelse om en sundhedsanprisning vedrørende virkningerne af vitamin D og risikoen for at falde blandt mænd og kvinder i alderen 60 år og derover (spørgsmål nr. EFSA-Q-2010-01233) (4). Den af ansøgeren foreslåede anprisning havde følgende ordlyd: »Vitamin D mindsker risikoen for at falde. At falde er en risikofaktor i forhold til knoglebrud«. |
|
(10) |
På grundlag af de fremlagte oplysninger konkluderede autoriteten i sin udtalelse, som Kommissionen og medlemsstaterne modtog den 30. september 2011, at der var fastslået en årsagssammenhæng mellem indtag af vitamin D og mindskelse af risikoen for at falde, som er forbundet med balancebesvær og muskelsvaghed. Mindskelse af risikoen for at falde blandt mænd og kvinder i alderen 60 år og derover influerer positivt på menneskers sundhed, ved at risikoen for knoglebrud mindskes. En sundhedsanprisning, der er i overensstemmelse med denne konklusion, bør følgelig anses for at opfylde kravene i forordning (EF) nr. 1924/2006 og bør optages på EU-listen over tilladte anprisninger. |
|
(11) |
I sin udtalelse konkluderede autoriteten også, at det er nødvendigt at indtage 800 IU (20 μg) vitamin D fra alle kilder om dagen for at opnå den anpriste virkning. I betragtning af, hvor stort et indtag af vitamin D der er nødvendigt for at opnå den anpriste virkning (20 μg), bør anvendelsen af anprisningen begrænses til kosttilskud. For at sikre, at et kosttilskud ville indeholde en betydelig mængde vitamin D i forbindelse med denne anprisning, bør der fastsættes anvendelsesbetingelser, i henhold til hvilke anprisningen kun må anvendes for kosttilskud, der indeholder mindst 15 μg vitamin D pr. daglig dosis. |
|
(12) |
Artikel 16, stk. 4, i forordning (EF) nr. 1924/2006 foreskriver, at en positiv udtalelse, hvorefter en sundhedsanprisning kan godkendes, skal indeholde bestemte oplysninger. Disse oplysninger bør således angives i bilag I til nærværende forordning for de anprisninger, der godkendes, og de bør alt efter tilfældet omfatte en ændret formulering af anprisningen, særlige betingelser for anvendelsen af anprisningen og, hvor det er relevant, betingelser eller begrænsninger for anvendelsen af fødevaren og/eller supplerende erklæringer eller advarsler, i overensstemmelse med forordning (EF) nr. 1924/2006 og i tråd med autoritetens udtalelser. |
|
(13) |
Et af målene med forordning (EF) nr. 1924/2006 er at sikre, at sundhedsanprisninger er sandfærdige, klare, pålidelige og anvendelige for forbrugeren, og i den forbindelse at formuleringen og præsentationen af sundhedsanprisninger tages i betragtning. Anprisninger, der i kraft af deres formulering har samme betydning for forbrugerne som en godkendt sundhedsanprisning, idet de viser den samme sammenhæng mellem en fødevarekategori, en fødevare eller en af dens bestanddele og sundhed, bør derfor også være omfattet af de i bilag I til nærværende forordning angivne anvendelsesbetingelser. |
|
(14) |
Som opfølgning på en ansøgning, som GP International Holding B.V. indgav i henhold til artikel 14, stk. 1, litra a), i forordning (EF) nr. 1924/2006, skulle autoriteten afgive udtalelse om en sundhedsanprisning vedrørende glucosaminhydrochlorid og langsommere degenerering af brusk (spørgsmål nr. EFSA-Q-2009-00412) (5). Den af ansøgeren foreslåede anprisning havde følgende ordlyd: »Forsinker/begrænser nedbrydningen af brusk i bevægeapparatet og mindsker derved risikoen for slidgigt«. |
|
(15) |
På grundlag af de fremlagte oplysninger konkluderede autoriteten i sin udtalelse, som Kommissionen og medlemsstaterne modtog den 29. oktober 2009, at der ikke var fastslået en årsagssammenhæng mellem indtag af glucosaminhydrochlorid og den anpriste virkning. Eftersom anprisningen således ikke opfylder kravene i forordning (EF) nr. 1924/2006, bør den ikke godkendes. |
|
(16) |
Som opfølgning på en ansøgning, som European Natural Soyfood Manufacturers Association (ENSA), European Vegetable Protein Federation (EUVEPRO) og Soya Protein Association (SPA) indgav i henhold til artikel 14, stk. 1, litra a), i forordning (EF) nr. 1924/2006, skulle autoriteten afgive udtalelse om en sundhedsanprisning vedrørende virkningerne af isoleret sojaprotein på reduktion af blodets indhold af LDL-kolesterol (spørgsmål nr. EFSA-Q-2011-00784) (6). Den af ansøgeren foreslåede anprisning havde følgende ordlyd: »Den proteinrige sojabønnebestanddel har vist sig at sænke/reducere kolesterolindholdet i blodet; risikoen for (koronar) hjertesygdom kan reduceres, når kolesterolindholdet i blodet sænkes«. |
|
(17) |
På grundlag af de fremlagte oplysninger konkluderede autoriteten i sin udtalelse, som Kommissionen og medlemsstaterne modtog den 2. februar 2012, at der ikke var fastslået en årsagssammenhæng mellem indtag af isoleret sojaprotein, som defineret af ansøgeren, og den anpriste virkning. Eftersom anprisningen således ikke opfylder kravene i forordning (EF) nr. 1924/2006, bør den ikke godkendes. |
|
(18) |
Som opfølgning på en ansøgning, som Health Concern B.V. indgav i henhold til artikel 14, stk. 1, litra a), i forordning (EF) nr. 1924/2006, skulle autoriteten afgive udtalelse om en sundhedsanprisning vedrørende en kombination af plantesteroler og Cholesternorm®mix og reduktion af blodets indhold af LDL-kolesterol (spørgsmål nr. EFSA-Q-2009-00237, EFSA-Q-2011-01114) (7). Den af ansøgeren foreslåede anprisning havde følgende ordlyd: »Sænker aktivt kolesterolniveauet«. |
|
(19) |
På grundlag af de fremlagte oplysninger konkluderede autoriteten i sin udtalelse, som Kommissionen og medlemsstaterne modtog den 17. juli 2012, at der ikke var fastslået en årsagssammenhæng mellem indtag af en kombination af plantesteroler og Cholesternorm®mix og den anpriste virkning under de påtænkte anvendelsesbetingelser. Eftersom anprisningen således ikke opfylder kravene i forordning (EF) nr. 1924/2006, bør den ikke godkendes. |
|
(20) |
Som opfølgning på en ansøgning, som Minami Nutrition Health BVBA indgav i henhold til artikel 14, stk. 1, litra a), i forordning (EF) nr. 1924/2006, skulle autoriteten afgive udtalelse om en sundhedsanprisning vedrørende virkningerne af eicosapentaensyre (EPA) og reduktion af forholdet mellem arachidonsyre (AA) og EPA i blodet hos børn med ADHD (Attention Deficit Hyperactivity Disorder) (spørgsmål nr. EFSA-Q-2012-00573) (8). Den af ansøgeren foreslåede anprisning havde følgende ordlyd: »EPA har vist sig at reducere forholdet mellem AA og EPA i blodet. Et højt AA/EPA-niveau er en risikofaktor i forhold til udvikling af opmærksomhedsforstyrrelser hos børn med ADHD-lignende symptomer. Disse børn er også kendetegnet ved mindre hyperaktivitet og/eller samtidig oppositionel adfærd«. |
|
(21) |
På grundlag af de fremlagte oplysninger konkluderede autoriteten i sin udtalelse, som Kommissionen og medlemsstaterne modtog den 8. april 2013, at målgruppen for anprisningen er en sygdomsramt befolkningsgruppe (dvs. børn med ADHD), og at den anpriste virkning vedrører behandling af en sygdom. |
|
(22) |
Forordning (EF) nr. 1924/2006 supplerer de generelle principper i Europa-Parlamentets og Rådets direktiv 2000/13/EF af 20. marts 2000 om indbyrdes tilnærmelse af medlemsstaternes lovgivning om mærkning af og præsentationsmåder for levnedsmidler samt om reklame for sådanne levnedsmidler (9). I henhold til artikel 2, stk. 1, litra b), i direktiv 2000/13/EF må mærkningen ikke tillægge en fødevare egenskaber vedrørende forebyggelse, behandling eller helbredelse af en menneskelig sygdom eller give indtryk af sådanne egenskaber. Eftersom det således er forbudt at tillægge fødevarer medicinske egenskaber, bør anprisningen vedrørende virkningerne af eicosapentaensyre (EPA) på reduktion af forholdet mellem AA og EPA i blodet hos børn med ADHD ikke godkendes. |
|
(23) |
Som opfølgning på en ansøgning, som McNeil Nutritionals og Raisio Nutrition Ltd. indgav i henhold til artikel 14, stk. 1, litra a), i forordning (EF) nr. 1924/2006, skulle autoriteten afgive udtalelse om en sundhedsanprisning vedrørende indtag af 2 g plantestanoler (som plantestanolestere) om dagen som del af en kost med et lavt indhold af mættet fedt og en dobbelt så stor reduktion af blodets indhold af LDL-kolesterol som ved indtagelse af en kost med et lavt indhold af mættet fedt alene (spørgsmål nr. EFSA-Q-2012-00915) (10). Den af ansøgeren foreslåede anprisning havde følgende ordlyd: »Indtag af 2 g plantestanoler (som plantestanolestere) om dagen som del af en kost med et lavt indhold af mættet fedt nedbringer LDL-kolesterolet dobbelt så meget som indtagelse af en kost med et lavt indhold af mættet fedt alene. Et højt kolesteroltal er en risikofaktor i forhold til udvikling af koronar hjertesygdom«. |
|
(24) |
På grundlag af de fremlagte oplysninger konkluderede autoriteten i sin udtalelse, som Kommissionen og medlemsstaterne modtog den 8. april 2013, at den af ansøgeren fremlagte dokumentation ikke gør det muligt at fastslå, at indtag af 2 g plantestanoler (som plantestanolestere) om dagen som del af en kost med et lavt indhold af mættet fedt nedbringer indholdet af LDL-kolesterol dobbelt så meget som indtagelse af en kost med et lavt indhold af mættet fedt alene. Eftersom anprisningen således ikke opfylder kravene i forordning (EF) nr. 1924/2006, bør den ikke godkendes. |
|
(25) |
De bemærkninger fra ansøgerne og medlemmer af offentligheden, som Kommissionen har modtaget i overensstemmelse med artikel 16, stk. 6, i forordning (EF) nr. 1924/2006, er taget i betragtning ved fastsættelsen af foranstaltningerne i nærværende forordning. |
|
(26) |
Tilsætning af stoffer til eller anvendelse af stoffer i fødevarer er underkastet særlige EU-retsforskrifter og national lovgivning, og det samme gælder klassificeringen af produkter som fødevarer eller lægemidler. En afgørelse vedrørende en sundhedsanprisning i henhold til forordning (EF) nr. 1924/2006, såsom optagelse på listen over tilladte anprisninger som omhandlet i samme forordnings artikel 14, stk. 1, er ikke at betragte som en tilladelse til markedsføring af det stof, anprisningen vedrører, som en beslutning om, hvorvidt stoffet kan anvendes i fødevarer, eller som klassificering af et bestemt produkt som fødevare. |
|
(27) |
Foranstaltningerne i denne forordning er i overensstemmelse med udtalelse fra Den Stående Komité for Fødevarekæden og Dyresundhed — |
VEDTAGET DENNE FORORDNING:
Artikel 1
1. Fødevarer, der markedsføres i Unionen, kan gøres til genstand for sundhedsanprisningerne i bilag I til denne forordning i overensstemmelse med de i samme bilag fastsatte betingelser.
2. De i stk. 1 omhandlede sundhedsanprisninger optages på den i artikel 14, stk. 1, i forordning (EF) nr. 1924/2006 omhandlede EU-liste over tilladte anprisninger.
Artikel 2
De i bilag II til nærværende forordning angivne sundhedsanprisninger optages ikke på den i artikel 14, stk. 1, i forordning (EF) nr. 1924/2006 omhandlede EU-liste over tilladte anprisninger.
Artikel 3
Denne forordning træder i kraft på tyvendedagen efter offentliggørelsen i Den Europæiske Unions Tidende.
Denne forordning er bindende i alle enkeltheder og gælder umiddelbart i hver medlemsstat.
Udfærdiget i Bruxelles, den 17. november 2014.
På Kommissionens vegne
Jean-Claude JUNCKER
Formand
(1) EUT L 404 af 30.12.2006, s. 9.
(2) EFSA Journal (2009) 1180, s. 1-13.
(3) EFSA Journal (2010);8(5):1609.
(4) EFSA Journal (2011);9(9):2382.
(5) EFSA Journal 2009;7(10):1358.
(6) EFSA Journal 2012;10(2):2555.
(7) EFSA Journal 2012;10(7):2810.
(8) EFSA Journal 2013;11(4):3161.
(9) EFT L 109 af 6.5.2000, s. 29.
(10) EFSA Journal 2013;11(4):3160.
BILAG I
Tilladte sundhedsanprisninger
|
Ansøgning — relevante bestemmelser i forordning (EF) nr. 1924/2006 |
Ansøger — adresse |
Næringsstof, andet stof, fødevare eller fødevarekategori |
Anprisning |
Betingelser for anvendelsen af anprisningen |
Betingelser og/eller begrænsninger for anvendelsen af fødevaren og/eller supplerende erklæringer eller advarsler |
EFSA-udtalelse |
|
Sundhedsanprisning i henhold til artikel 14, stk. 1, litra a), der henviser til en reduceret risiko for sygdom |
Abtei Pharma Vertriebs GmbH, Abtei 1, 37696, Marienműnster, Tyskland |
Calcium |
Calcium hjælper til at begrænse tabet af knoglemineral hos kvinder i den postmenopausale alder. Lav knoglemineraltæthed er en risikofaktor i forhold til knoglebrud som følge af osteoporose |
Anprisningen må kun anvendes for fødevarer, der indeholder mindst 400 mg calcium pr. kvantificeret portion. Forbrugerne informeres om, at anprisningen specifikt henvender sig til kvinder i alderen 50 år og derover, og at den gavnlige effekt opnås ved et dagligt indtag på mindst 1 200 mg calcium fra alle kilder |
For så vidt angår fødevarer med tilsat calcium må anprisningen kun anvendes for fødevarer, der har kvinder i alderen 50 år og derover som målgruppe |
Q-2008-721 Q-2009-00940 |
|
Sundhedsanprisning i henhold til artikel 14, stk. 1, litra a), der henviser til en reduceret risiko for sygdom |
Abtei Pharma Vertriebs GmbH, Abtei 1, 37696, Marienműnster, Tyskland |
Calcium og vitamin D |
Calcium og vitamin D hjælper til at begrænse tabet af knoglemineral hos kvinder i den postmenopausale alder. Lav knoglemineraltæthed er en risikofaktor i forhold til knoglebrud som følge af osteoporose |
Anprisningen må kun anvendes for kosttilskud, der indeholder mindst 400 mg calcium og 15 μg vitamin D pr. daglig dosis. Forbrugerne informeres om, at anprisningen specifikt henvender sig til kvinder i alderen 50 år og derover, og at den gavnlige effekt opnås ved et dagligt indtag på mindst 1 200 mg calcium og 20 μg vitamin D fra alle kilder |
For så vidt angår kosttilskud med tilsat calcium og/eller vitamin D må anprisningen kun anvendes for kosttilskud, der har kvinder i alderen 50 år og derover som målgruppe |
Q-2008-721 Q-2009-00940 |
|
Sundhedsanprisning i henhold til artikel 14, stk. 1, litra a), der henviser til en reduceret risiko for sygdom |
DSM Nutritional Products Europe AG, P.O. Box 2676, 4002 Basel, Schweiz |
Vitamin D |
Vitamin D hjælper til at reducere risikoen for at falde, som er forbundet med balancebesvær og muskelsvaghed. At falde er en risikofaktor i forhold til knoglebrud hos mænd og kvinder i alderen 60 år og derover |
Anprisningen må kun anvendes for kosttilskud, der indeholder mindst 15 μg vitamin D pr. daglig dosis. Forbrugerne informeres om, at den gavnlige effekt opnås ved et dagligt indtag på 20 μg vitamin D fra alle kilder |
For så vidt angår kosttilskud med tilsat vitamin D må anprisningen kun anvendes for kosttilskud, der har mænd og kvinder i alderen 60 år og derover som målgruppe |
Q-2010-01233 |
BILAG II
Afviste sundhedsanprisninger
|
Ansøgning — relevante bestemmelser i forordning (EF) nr. 1924/2006 |
Næringsstof, andet stof, fødevare eller fødevarekategori |
Anprisning |
EFSA-udtalelse |
|
Sundhedsanprisning i henhold til artikel 14, stk. 1, litra a), der henviser til en reduceret risiko for sygdom |
Glucosaminhydrochlorid |
Forsinker/begrænser nedbrydningen af brusk i bevægeapparatet og mindsker derved risikoen for slidgigt |
Q-2009-00412 |
|
Sundhedsanprisning i henhold til artikel 14, stk. 1, litra a), der henviser til en reduceret risiko for sygdom |
Isoleret sojaprotein |
Den proteinrige sojabønnebestanddel har vist sig at sænke/reducere kolesterolindholdet i blodet; risikoen for (koronar) hjertesygdom kan reduceres, når kolesterolindholdet i blodet sænkes |
Q-2011-00784 |
|
Sundhedsanprisning i henhold til artikel 14, stk. 1, litra a), der henviser til en reduceret risiko for sygdom |
Plantesteroler i kombination med Cholesternorm®mix |
Sænker aktivt kolesterolniveauet |
Q-2009-00237 Q-2011-01114 |
|
Sundhedsanprisning i henhold til artikel 14, stk. 1, litra a), der henviser til en reduceret risiko for sygdom |
Eicosapentaensyre (EPA) |
EPA har vist sig at reducere forholdet mellem AA og EPA i blodet. Et højt AA/EPA-niveau er en risikofaktor i forhold til udvikling af opmærksomhedsforstyrrelser hos børn med ADHD-lignende symptomer. Disse børn er også kendetegnet ved mindre hyperaktivitet og/eller samtidig oppositionel adfærd |
Q-2012-00573 |
|
Sundhedsanprisning i henhold til artikel 14, stk. 1, litra a), der henviser til en reduceret risiko for sygdom |
Plantestanoler (som plantestanolestere) |
Indtag af 2 g plantestanoler (som plantestanolestere) om dagen som del af en kost med et lavt indhold af mættet fedt nedbringer LDL-kolesterolet dobbelt så meget som indtagelse af en kost med et lavt indhold af mættet fedt alene. Et højt kolesteroltal er en risikofaktor i forhold til udvikling af koronar hjertesygdom |
Q-2012-00915 |
|
18.11.2014 |
DA |
Den Europæiske Unions Tidende |
L 331/14 |
KOMMISSIONENS FORORDNING (EU) Nr. 1229/2014
af 17. november 2014
om afvisning af visse andre sundhedsanprisninger af fødevarer end dem, der henviser til en reduceret risiko for sygdom og til børns udvikling og sundhed
(EØS-relevant tekst)
EUROPA-KOMMISSIONEN HAR —
under henvisning til traktaten om Den Europæiske Unions funktionsmåde,
under henvisning til Europa-Parlamentets og Rådets forordning (EF) nr. 1924/2006 af 20. december 2006 om ernærings- og sundhedsanprisninger af fødevarer (1), særlig artikel 18, stk. 5, og
ud fra følgende betragtninger:
|
(1) |
I henhold til forordning (EF) nr. 1924/2006 er sundhedsanprisninger af fødevarer forbudt, medmindre de er godkendt af Kommissionen i overensstemmelse med samme forordning og opført på en liste over tilladte anprisninger. |
|
(2) |
Forordning (EF) nr. 1924/2006 foreskriver ligeledes, at lederne af fødevarevirksomheder kan sende ansøgninger om godkendelse af sundhedsanprisninger til en medlemsstats nationale kompetente myndighed. Den nationale kompetente myndighed skal videresende gyldige ansøgninger til Den Europæiske Fødevaresikkerhedsautoritet (EFSA), i det følgende benævnt »autoriteten«, med henblik på en videnskabelig vurdering samt til Kommissionen og medlemsstaterne til orientering. |
|
(3) |
Autoriteten skal afgive udtalelse om den pågældende sundhedsanprisning. |
|
(4) |
Kommissionen skal træffe beslutning vedrørende eventuel godkendelse af sundhedsanprisninger under hensyntagen til autoritetens udtalelse. |
|
(5) |
Som opfølgning på en ansøgning, som Italsur s.r.l. indgav i henhold til artikel 13, stk. 5, i forordning (EF) nr. 1924/2006, skulle autoriteten afgive udtalelse om en sundhedsanprisning vedrørende virkningerne af en kombination af »Black Tuscany«-kål, »trefarvet« sølvbede, »tofarvet« spinat og »blu savoy«-kål og beskyttelse af fedtstoffer i blodet mod skader på grund af iltning (spørgsmål nr. EFSA-Q-2013-00574) (2). Den af ansøgeren foreslåede anprisning havde følgende ordlyd: »bidrager til at beskytte fedtstoffer i blodet mod skader på grund af iltning«. |
|
(6) |
Den 30. oktober 2013 modtog Kommissionen og medlemsstaterne den videnskabelige udtalelse fra autoriteten, som konkluderede, at der ikke på grundlag af de fremlagte oplysninger var fastslået en årsagssammenhæng mellem indtagelse af en kombination af »Black Tuscany«-kål, »trefarvet« sølvbede, »tofarvet« spinat og »blu savoy«-kål og den anpriste virkning. Eftersom anprisningen således ikke opfylder kravene i forordning (EF) nr. 1924/2006, bør den ikke godkendes. |
|
(7) |
Som opfølgning på en ansøgning, som Italsur s.r.l. indgav i henhold til artikel 13, stk. 5, i forordning (EF) nr. 1924/2006, skulle autoriteten afgive udtalelse om en sundhedsanprisning vedrørende virkningerne af en kombination af rød spinat, grøn spinat, rød cikorie, grøn cikorie, grøn bladbede, rød bladbede, rød sølvbede, gylden sølvbede og hvid sølvbede og beskyttelse af fedtstoffer i blodet mod skader på grund af iltning (spørgsmål nr. EFSA-Q-2013-00575) (3). Den af ansøgeren foreslåede anprisning havde følgende ordlyd: »bidrager til at beskytte fedtstoffer i blodet mod skader på grund af iltning«. |
|
(8) |
Den 30. oktober 2013 modtog Kommissionen og medlemsstaterne den videnskabelige udtalelse fra autoriteten, som konkluderede, at der ikke på grundlag af de fremlagte oplysninger var fastslået en årsagssammenhæng mellem indtagelse af en kombination af rød spinat, grøn spinat, rød cikorie, grøn cikorie, grøn bladbede, rød bladbede, rød sølvbede, gylden sølvbede og hvid sølvbede og den anpriste virkning. Eftersom anprisningen således ikke opfylder kravene i forordning (EF) nr. 1924/2006, bør den ikke godkendes. |
|
(9) |
Som opfølgning på en ansøgning, som Italsur s.r.l. indgav i henhold til artikel 13, stk. 5, i forordning (EF) nr. 1924/2006, skulle autoriteten afgive udtalelse om en sundhedsanprisning vedrørende virkningerne af en kombination af »Black Tuscany«-kål, »trefarvet« sølvbede, »tofarvet« spinat og »blu savoy«-kål og vedligeholdelse af normale koncentrationer af LDL-kolesterol i blodet (spørgsmål nr. EFSA-Q-2013-00576) (4). Den af ansøgeren foreslåede anprisning havde følgende ordlyd: »vedligeholder et normalt kolesterolniveau i blodet«. |
|
(10) |
Den 30. oktober 2013 modtog Kommissionen og medlemsstaterne den videnskabelige udtalelse fra autoriteten, som konkluderede, at der ikke på grundlag af de fremlagte oplysninger var fastslået en årsagssammenhæng mellem indtagelse af en kombination af »Black Tuscany«-kål, »trefarvet« sølvbede, »tofarvet« spinat og »blu savoy«-kål og den anpriste virkning. Eftersom anprisningen således ikke opfylder kravene i forordning (EF) nr. 1924/2006, bør den ikke godkendes. |
|
(11) |
Som opfølgning på en ansøgning, som Italsur s.r.l. indgav i henhold til artikel 13, stk. 5, i forordning (EF) nr. 1924/2006, skulle autoriteten afgive udtalelse om en sundhedsanprisning vedrørende virkningerne af en kombination af rød spinat, grøn spinat, rød cikorie, grøn cikorie, grøn bladbede, rød bladbede, rød sølvbede, gylden sølvbede og hvid sølvbede og vedligeholdelse af normale koncentrationer af LDL-kolesterol i blodet (spørgsmål nr. EFSA-Q-2013-00579) (5). Den af ansøgeren foreslåede anprisning havde følgende ordlyd: »vedligeholder et normalt kolesterolniveau i blodet«. |
|
(12) |
Den 30. oktober 2013 modtog Kommissionen og medlemsstaterne den videnskabelige udtalelse fra autoriteten, som konkluderede, at der ikke på grundlag af de fremlagte oplysninger var fastslået en årsagssammenhæng mellem indtagelse af en kombination af rød spinat, grøn spinat, rød cikorie, grøn cikorie, grøn bladbede, rød bladbede, rød sølvbede, gylden sølvbede og hvid sølvbede og den anpriste virkning. Eftersom anprisningen således ikke opfylder kravene i forordning (EF) nr. 1924/2006, bør den ikke godkendes. |
|
(13) |
Som opfølgning på en ansøgning, som Omikron Italia S.r.l. indgav i henhold til artikel 13, stk. 5, i forordning (EF) nr. 1924/2006, skulle autoriteten afgive udtalelse om en sundhedsanprisning vedrørende virkningerne af en kombination af diosmin, troxerutin og hesperidin og vedligeholdelse af normal vene-kapillær-permeabilitet (spørgsmål nr. EFSA-Q-2013-00353) (6). Den af ansøgeren foreslåede anprisning havde følgende ordlyd: »flavonoidblandingen indeholdende 300 mg diosmin, 300 mg troxerutin og 100 mg hesperidin er et nyttigt hjælpestof til vedligeholdelse af fysiologisk vene-kapillær-permeabilitet«. |
|
(14) |
Den 13. januar 2014 modtog Kommissionen og medlemsstaterne den videnskabelige udtalelse fra autoriteten, som konkluderede, at der ikke på grundlag af de fremlagte oplysninger var fastslået en årsagssammenhæng mellem indtag af en kombination af diosmin, troxerutin og hesperidin og den anpriste virkning. Eftersom anprisningen således ikke opfylder kravene i forordning (EF) nr. 1924/2006, bør den ikke godkendes. |
|
(15) |
Som opfølgning på en ansøgning, som Omikron Italia S.r.l. indgav i henhold til artikel 13, stk. 5, i forordning (EF) nr. 1924/2006, skulle autoriteten afgive udtalelse om en sundhedsanprisning vedrørende virkningerne af en kombination af diosmin, troxerutin og hesperidin og vedligeholdelse af normal venetonicitet (spørgsmål nr. EFSA-Q-2013-00354) (7). Den af ansøgeren foreslåede anprisning havde følgende ordlyd: »flavonoidblandingen indeholdende 300 mg diosmin, 300 mg troxerutin og 100 mg hesperidin er et nyttigt hjælpestof til vedligeholdelse af fysiologisk venetonicitet«. |
|
(16) |
Den 13. januar 2014 modtog Kommissionen og medlemsstaterne den videnskabelige udtalelse fra autoriteten, som konkluderede, at der ikke på grundlag af de fremlagte oplysninger var fastslået en årsagssammenhæng mellem indtag af en kombination af diosmin, troxerutin og hesperidin og den anpriste virkning. Eftersom anprisningen således ikke opfylder kravene i forordning (EF) nr. 1924/2006, bør den ikke godkendes. |
|
(17) |
Som opfølgning på en ansøgning, som Italsur s.r.l. indgav i henhold til artikel 13, stk. 5, i forordning (EF) nr. 1924/2006, skulle autoriteten afgive udtalelse om en sundhedsanprisning vedrørende virkningerne af bygsuppen »Orzotto« og beskyttelse af fedtstoffer i blodet mod skader på grund af iltning (spørgsmål nr. EFSA-Q-2013-00578) (8). Den af ansøgeren foreslåede anprisning havde følgende ordlyd: »bidrager til at beskytte fedtstoffer i blodet mod skader på grund af iltning«. |
|
(18) |
Den 10. januar 2014 modtog Kommissionen og medlemsstaterne den videnskabelige udtalelse fra autoriteten, som konkluderede, at der ikke på grundlag af de fremlagte oplysninger var fastslået en årsagssammenhæng mellem indtagelse af bygsuppen »Orzotto« og den anpriste virkning. Eftersom anprisningen således ikke opfylder kravene i forordning (EF) nr. 1924/2006, bør den ikke godkendes. |
|
(19) |
Foranstaltningerne i denne forordning er i overensstemmelse med udtalelse fra Den Stående Komité for Fødevarekæden og Dyresundhed — |
VEDTAGET DENNE FORORDNING:
Artikel 1
De i bilaget til nærværende forordning angivne sundhedsanprisninger optages ikke på den i artikel 13, stk. 3, i forordning (EF) nr. 1924/2006 omhandlede EU-liste over tilladte anprisninger.
Artikel 2
Denne forordning træder i kraft på tyvendedagen efter offentliggørelsen i Den Europæiske Unions Tidende.
Denne forordning er bindende i alle enkeltheder og gælder umiddelbart i hver medlemsstat.
Udfærdiget i Bruxelles, den 17. november 2014.
På Kommissionens vegne
Jean-Claude JUNCKER
Formand
(1) EUT L 404 af 30.12.2006, s. 9.
(2) The EFSA Journal 2013;11(10):3413.
(3) The EFSA Journal 2013;11(10):3414.
(4) The EFSA Journal 2013;11(10):3415.
(5) The EFSA Journal 2013;11(10):3416.
(6) The EFSA Journal 2014;12(1):3511.
(7) The EFSA Journal 2014;12(1):3512.
(8) The EFSA Journal 2014;12(1):3519.
BILAG
Afviste sundhedsanprisninger
|
Ansøgning — relevante bestemmelser i forordning (EF) nr. 1924/2006 |
Næringsstof, andet stof, fødevare eller fødevarekategori |
Anprisning |
EFSA-udtalelse |
|
Sundhedsanprisning i henhold til artikel 13, stk. 5, baseret på senere udviklet videnskabelig evidens og/eller ledsaget af anmodning om beskyttelse af data, som er omfattet af ejendomsrettigheder |
En kombination af »Black Tuscany«-kål, »trefarvet« sølvbede, »tofarvet« spinat og »blu savoy«-kål |
Bidrager til at beskytte fedtstoffer i blodet mod skader på grund af iltning |
Q-2013-00574 |
|
Sundhedsanprisning i henhold til artikel 13, stk. 5, baseret på senere udviklet videnskabelig evidens og/eller ledsaget af anmodning om beskyttelse af data, som er omfattet af ejendomsrettigheder |
En kombination af rød spinat, grøn spinat, rød cikorie, grøn cikorie, grøn bladbede, rød bladbede, rød sølvbede, gylden sølvbede og hvid sølvbede |
Bidrager til at beskytte fedtstoffer i blodet mod skader på grund af iltning |
Q-2013-00575 |
|
Sundhedsanprisning i henhold til artikel 13, stk. 5, baseret på senere udviklet videnskabelig evidens og/eller ledsaget af anmodning om beskyttelse af data, som er omfattet af ejendomsrettigheder |
En kombination af »Black Tuscany«-kål, »trefarvet« sølvbede, »tofarvet« spinat og »blu savoy«-kål |
Vedligeholder et normalt kolesterolniveau i blodet |
Q-2013-00576 |
|
Sundhedsanprisning i henhold til artikel 13, stk. 5, baseret på senere udviklet videnskabelig evidens og/eller ledsaget af anmodning om beskyttelse af data, som er omfattet af ejendomsrettigheder |
En kombination af rød spinat, grøn spinat, rød cikorie, grøn cikorie, grøn bladbede, rød bladbede, rød sølvbede, gylden sølvbede og hvid sølvbede |
Vedligeholder et normalt kolesterolniveau i blodet |
Q-2013-00579 |
|
Sundhedsanprisning i henhold til artikel 13, stk. 5, baseret på senere udviklet videnskabelig evidens og/eller ledsaget af anmodning om beskyttelse af data, som er omfattet af ejendomsrettigheder |
En kombination af diosmin, troxerutin og hesperidin |
Flavonoidblandingen indeholdende 300 mg diosmin, 300 mg troxerutin og 100 mg hesperidin er et nyttigt hjælpestof til vedligeholdelse af fysiologisk vene-kapillær-permeabilitet |
Q-2013-00353 |
|
Sundhedsanprisning i henhold til artikel 13, stk. 5, baseret på senere udviklet videnskabelig evidens og/eller ledsaget af anmodning om beskyttelse af data, som er omfattet af ejendomsrettigheder |
En kombination af diosmin, troxerutin og hesperidin |
Flavonoidblandingen indeholdende 300 mg diosmin, 300 mg troxerutin og 100 mg hesperidin er et nyttigt hjælpestof til vedligeholdelse af fysiologisk venetonicitet |
Q-2013-00354 |
|
Sundhedsanprisning i henhold til artikel 13, stk. 5, baseret på senere udviklet videnskabelig evidens og/eller ledsaget af anmodning om beskyttelse af data, som er omfattet af ejendomsrettigheder |
Bygsuppen »Orzotto« |
Bidrager til at beskytte fedtstoffer i blodet mod skader på grund af iltning |
Q-2013-00578 |
|
18.11.2014 |
DA |
Den Europæiske Unions Tidende |
L 331/18 |
KOMMISSIONENS GENNEMFØRELSESFORORDNING (EU) Nr. 1230/2014
af 17. november 2014
om godkendelse af kobberbilysinat som tilsætningsstof til foder til alle dyrearter
(EØS-relevant tekst)
EUROPA-KOMMISSIONEN HAR —
under henvisning til traktaten om Den Europæiske Unions funktionsmåde,
under henvisning til Europa-Parlamentets og Rådets forordning (EF) nr. 1831/2003 af 22. september 2003 om fodertilsætningsstoffer (1), særlig artikel 9, stk. 2, og
ud fra følgende betragtninger:
|
(1) |
Forordning (EF) nr. 1831/2003 indeholder bestemmelser om godkendelse af fodertilsætningsstoffer og om grundlaget og procedurerne for udstedelse af en sådan godkendelse. |
|
(2) |
Der er i overensstemmelse med artikel 7 i forordning (EF) nr. 1831/2003 indgivet en ansøgning om godkendelse af kobberbilysinat. Ansøgningen var vedlagt de oplysninger og dokumenter, der kræves i henhold til artikel 7, stk. 3, i forordning (EF) nr. 1831/2003. |
|
(3) |
Ansøgningen vedrører godkendelse i tilsætningsstofkategorien »tilsætningsstoffer med ernæringsmæssige egenskaber« af kobberbilysinat som tilsætningsstof til foder til alle dyrearter. |
|
(4) |
Den Europæiske Fødevaresikkerhedsautoritet (»autoriteten«) konkluderede i sin udtalelse af 3. juli 2014 (2), at kobberbilysinat under de foreslåede betingelser for anvendelse ikke har skadelige virkninger på dyrs eller menneskers sundhed eller på miljøet, og at stoffet kan betragtes som en effektiv kobberkilde for alle dyrearter. Autoriteten mener ikke, at der er behov for særlige krav om overvågning efter markedsføringen. Autoriteten har ligeledes gennemgået den rapport om metoden til analyse af fodertilsætningsstoffet i foder, der blev forelagt af det i henhold til forordning (EF) nr. 1831/2003 oprettede referencelaboratorium. |
|
(5) |
Vurderingen af kobberbilysinat viser, at betingelserne for godkendelse, jf. artikel 5 i forordning (EF) nr. 1831/2003, er opfyldt. Derfor bør anvendelsen af stoffet godkendes som anført i bilaget til nærværende forordning. |
|
(6) |
Foranstaltningerne i denne forordning er i overensstemmelse med udtalelse fra Den Stående Komité for Planter, Dyr, Fødevarer og Foder — |
VEDTAGET DENNE FORORDNING:
Artikel 1
Det i bilaget opførte stof, der tilhører tilsætningsstofkategorien »tilsætningsstoffer med ernæringsmæssige egenskaber« og den funktionelle gruppe »forbindelser af sporstoffer«, tillades anvendt som fodertilsætningsstof på de betingelser, der er fastsat i bilaget.
Artikel 2
Denne forordning træder i kraft på tyvendedagen efter offentliggørelsen i Den Europæiske Unions Tidende.
Denne forordning er bindende i alle enkeltheder og gælder umiddelbart i hver medlemsstat.
Udfærdiget i Bruxelles, den 17. november 2014.
På Kommissionens vegne
Jean-Claude JUNCKER
Formand
(1) EUT L 268 af 18.10.2003, s. 29.
(2) EFSA Journal 2014; 12(7):3796.
BILAG
|
Tilsætningsstoffets identifikationsnummer |
Navn på indehaveren af godkendelsen |
Tilsætningsstof |
Sammensætning, kemisk betegnelse, beskrivelse, analysemetode |
Dyreart eller -kategori |
Maksimumsalder |
Minimumsindhold |
Maksimumsindhold |
Andre bestemmelser |
Godkendelse gyldig til |
||||||||||||||||||||||||||||
|
Indhold af grundstoffet (Cu) i mg/kg fuldfoder med et vandindhold på 12 % |
|||||||||||||||||||||||||||||||||||||
|
Kategori: tilsætningsstoffer med ernæringsmæssige egenskaber. Funktionel gruppe: forbindelser af sporstoffer |
|||||||||||||||||||||||||||||||||||||
|
3b411 |
— |
Kobberbilysinat |
Tilsætningsstoffets karakteristika Pulver eller granulat med et indhold af kobber på ≥ 14,5 % og af lysin på ≥ 84,0 %. Aktivstoffets karakteristika Kobberchelat af L-lysinat-HCl Kemisk formel: Cu(C6H13N2O2)2 × 2HCl CAS-nummer: 53383-24-7 Analysemetoder (1) Til kvantificering af lysinindholdet i fodertilsætningsstoffet:
Til kvantificering af det samlede indhold af kobber i tilsætningsstoffet og forblandingerne:
Til kvantificering af det samlede indhold af kobber i foder og foderblandinger:
|
Alle dyrearter |
— |
— |
Kvæg:
Får: 15 (i alt) Smågrise op til 12 uger: 170 (i alt) Krebsdyr: 50 (i alt) Andre dyr: 25 (i alt) |
|
8. december 2024 |
||||||||||||||||||||||||||||
(1) Nærmere oplysninger om analysemetoderne findes på referencelaboratoriets hjemmeside: https://ec.europa.eu/jrc/en/eurl/feed-additives/evaluation-reports.
|
18.11.2014 |
DA |
Den Europæiske Unions Tidende |
L 331/22 |
KOMMISSIONENS GENNEMFØRELSESFORORDNING (EU) Nr. 1231/2014
af 17. november 2014
om faste importværdier med henblik på fastsættelse af indgangsprisen for visse frugter og grøntsager
EUROPA-KOMMISSIONEN HAR —
under henvisning til traktaten om Den Europæiske Unions funktionsmåde,
under henvisning til Europa-Parlamentets og Rådets forordning (EU) nr. 1308/2013 af 17. december 2013 om en fælles markedsordning for landbrugsprodukter og om ophævelse af Rådets forordning (EØF) nr. 922/72, (EØF) nr. 234/79, (EF) nr. 1037/2001 og (EF) nr. 1234/2007 (fusionsmarkedsordningen) (1),
under henvisning til Kommissionens gennemførelsesforordning (EU) nr. 543/2011 af 7. juni 2011 om gennemførelsesbestemmelser til Rådets forordning (EF) nr. 1234/2007 for så vidt angår frugt og grøntsager og forarbejdede frugter og grøntsager (2), særlig artikel 136, stk. 1, og
ud fra følgende betragtninger:
|
(1) |
Ved gennemførelsesforordning (EU) nr. 543/2011 fastsættes der på basis af resultatet af de multilaterale handelsforhandlinger under Uruguayrunden kriterier for Kommissionens fastsættelse af faste importværdier for tredjelande for de produkter og perioder, der er anført i del A i bilag XVI til nævnte forordning. |
|
(2) |
Der beregnes hver arbejdsdag en fast importværdi i henhold til artikel 136, stk. 1, i gennemførelsesforordning (EU) nr. 543/2011 under hensyntagen til varierende daglige data. Derfor bør nærværende forordning træde i kraft på dagen for offentliggørelsen i Den Europæiske Unions Tidende — |
VEDTAGET DENNE FORORDNING:
Artikel 1
De faste importværdier som omhandlet i artikel 136 i gennemførelsesforordning (EU) nr. 543/2011 fastsættes i bilaget til nærværende forordning.
Artikel 2
Denne forordning træder i kraft på dagen for offentliggørelsen i Den Europæiske Unions Tidende.
Denne forordning er bindende i alle enkeltheder og gælder umiddelbart i hver medlemsstat.
Udfærdiget i Bruxelles, den 17. november 2014.
På Kommissionens vegne
For formanden
Jerzy PLEWA
Generaldirektør for landbrug og udvikling af landdistrikter
(1) EUT L 347 af 20.12.2013, s. 671.
(2) EUT L 157 af 15.6.2011, s. 1.
BILAG
Faste importværdier med henblik på fastsættelse af indgangsprisen for visse frugter og grøntsager
|
(EUR/100 kg) |
||
|
KN-kode |
Tredjelandskode (1) |
Fast importværdi |
|
0702 00 00 |
AL |
94,9 |
|
MA |
77,1 |
|
|
MK |
78,8 |
|
|
ZZ |
83,6 |
|
|
0707 00 05 |
AL |
67,4 |
|
JO |
194,1 |
|
|
TR |
128,5 |
|
|
ZZ |
130,0 |
|
|
0709 93 10 |
AL |
65,0 |
|
MA |
52,3 |
|
|
TR |
125,4 |
|
|
ZZ |
80,9 |
|
|
0805 20 10 |
MA |
130,6 |
|
ZZ |
130,6 |
|
|
0805 20 30, 0805 20 50, 0805 20 70, 0805 20 90 |
TR |
74,4 |
|
ZZ |
74,4 |
|
|
0805 50 10 |
TR |
78,7 |
|
ZZ |
78,7 |
|
|
0806 10 10 |
BR |
293,5 |
|
LB |
337,2 |
|
|
PE |
282,9 |
|
|
TR |
149,1 |
|
|
US |
303,0 |
|
|
ZZ |
273,1 |
|
|
0808 10 80 |
BR |
54,0 |
|
CA |
135,3 |
|
|
CL |
80,6 |
|
|
MD |
29,7 |
|
|
NZ |
144,2 |
|
|
US |
102,4 |
|
|
ZA |
108,6 |
|
|
ZZ |
93,5 |
|
|
0808 30 90 |
CN |
75,6 |
|
ZZ |
75,6 |
|
(1) Landefortegnelse fastsat ved Kommissionens forordning EU) nr. 1106/2012 af 27. november 2012 om gennemførelse af Europa-Parlamentets og Rådets forordning (EF) nr. 471/2009 om fællesskabsstatistikker over varehandelen med tredjelande for så vidt angår ajourføring af den statistiske lande- og områdefortegnelse (EUT L 328 af 28.11.2012, s. 7). Koden »ZZ« = »anden oprindelse«.
AFGØRELSER
|
18.11.2014 |
DA |
Den Europæiske Unions Tidende |
L 331/24 |
RÅDETS AFGØRELSE 2014/800/FUSP
af 17. november 2014
om iværksættelse af Den Europæiske Unions rådgivende mission om civil ukrainsk sikkerhedssektorreform (EUAM Ukraine) og om ændring af afgørelse 2014/486/FUSP
RÅDET FOR DEN EUROPÆISKE UNION HAR —
under henvisning til traktaten om Den Europæiske Union, særlig artikel 28, artikel 42, stk. 4, og artikel 43, stk. 2,
under henvisning til Rådets afgørelse 2014/486/FUSP af 22. juli 2014 om Den Europæiske Unions rådgivende mission om civil ukrainsk sikkerhedssektorreform (EUAM Ukraine) (1), særlig artikel 4,
under henvisning til forslag fra Unionens højtstående repræsentant for udenrigsanliggender og sikkerhedspolitik, og
ud fra følgende betragtninger:
|
(1) |
Den 22. juli 2014 vedtog Rådet afgørelse 2014/486/FUSP. |
|
(2) |
Den 20. oktober 2014 godkendte Rådet operationsplanen for EUAM Ukraine. |
|
(3) |
Efter henstilling fra den øverstbefalende for den civile operation og efter at EUAM Ukraine har nået sin indledende operative kapacitet, bør EUAM Ukraine iværksættes den 1. december 2014. |
|
(4) |
Afgørelse 2014/486/FUSP fastsatte det finansielle referencegrundlag til 2 680 000 EUR for perioden frem til den 30. november 2014. Der bør fastsættes et nyt finansielt referencegrundlag for en periode på 12 måneder fra den 1. december 2014. Afgørelse 2014/486/FUSP bør derfor ændres. |
|
(5) |
EUAM Ukraine vil blive gennemført under forhold, som muligvis vil blive forværret og kunne hindre opnåelsen af målene for Unionens optræden udadtil, jf. artikel 21 i traktaten — |
VEDTAGET DENNE AFGØRELSE:
Artikel 1
Den Europæiske Unions rådgivende mission om civil ukrainsk sikkerhedssektorreform (EUAM Ukraine) iværksættes den 1. december 2014.
Artikel 2
Den øverstbefalende for den civile operation EUAM Ukraine bemyndiges herved med øjeblikkelig virkning til at indlede gennemførelsen af operationen.
Artikel 3
Artikel 14, stk. 1, i afgørelse 2014/486/FUSP affattes således:
»1. Det finansielle referencegrundlag, der er beregnet til dækning af udgifterne i forbindelse med EUAM Ukraine indtil den 30. november 2014, udgør 2 680 000 EUR. Det finansielle referencegrundlag, der er beregnet til dækning af udgifterne i forbindelse med EUAM Ukraine for perioden fra den 1. december 2014 til den 30. november 2015, udgør 13 100 000 EUR. Det finansielle referencegrundlag for de efterfølgende perioder fastsættes af Rådet.«
Artikel 4
Denne afgørelse træder i kraft på dagen for vedtagelsen.
Udfærdiget i Bruxelles, den 17. november 2014.
På Rådets vegne
F. MOGHERINI
Formand
(1) EUT L 217 af 23.7.2014, s. 42.
|
18.11.2014 |
DA |
Den Europæiske Unions Tidende |
L 331/26 |
RÅDETS AFGØRELSE 2014/801/FUSP
af 17. november 2014
om ændring af afgørelse 2014/145/FUSP om restriktive foranstaltninger over for tiltag, der underminerer eller truer Ukraines territoriale integritet, suverænitet og uafhængighed
RÅDET FOR DEN EUROPÆISKE UNION HAR —
under henvisning til traktaten om Den Europæiske Union, særlig artikel 29, og
ud fra følgende betragtninger:
|
(1) |
Rådet vedtog den 17. marts 2014 afgørelse 2014/145/FUSP (1). |
|
(2) |
Oplysningerne vedrørende en person, der er opført på listen i henhold til afgørelse 2014/145/FUSP, bør ændres. |
|
(3) |
Bilaget til afgørelse 2014/145/FUSP bør derfor ændres i overensstemmelse hermed — |
VEDTAGET DENNE AFGØRELSE:
Artikel 1
Bilaget til afgørelse 2014/145/FUSP ændres herved som anført i bilaget til nærværende afgørelse.
Artikel 2
Denne afgørelse træder i kraft dagen efter offentliggørelsen i Den Europæiske Unions Tidende.
Udfærdiget i Bruxelles, den 17. november 2014.
På Rådets vegne
F. MOGHERINI
Formand
(1) Rådets afgørelse 2014/145/FUSP af 17. marts 2014 om restriktive foranstaltninger over for tiltag, der underminerer eller truer Ukraines territoriale integritet, suverænitet og uafhængighed (EUT L 78 af 17.3.2014, s. 16).
BILAG
Oplysningerne om følgende person i bilaget til afgørelse 2014/145/FUSP affattes således:
|
|
Navn |
Identificerende oplysninger |
Begrundelse |
Dato for opførelse på listen |
|
|
Vladimir Volfovich ZHIRINOVSKY Владимир Вольфович Жириновский |
Født den 25.4.1946 i Almaty (tidligere også benævnt Alma-Ata), Kasakhstan. |
Medlem af Statsdumaens Råd, leder af LDPR-partiet. Han støttede aktivt anvendelsen af russiske væbnede styrker i Ukraine og annekteringen af Krim. Han har aktivt opfordret til opsplitning af Ukraine. Han underskrev, på vegne af LDPR-partiet, en aftale med den såkaldte »Folkerepublik Donetsk« |
12.9.2014 |
|
18.11.2014 |
DA |
Den Europæiske Unions Tidende |
L 331/28 |
KOMMISSIONENS GENNEMFØRELSESAFGØRELSE
af 14. november 2014
om ændring af afgørelse 2010/470/EU og 2010/472/EU for så vidt angår de dyresundhedsmæssige betingelser vedrørende scrapie i forbindelse med handel inden for Unionen med embryoner fra får og geder og import til Unionen heraf
(meddelt under nummer C(2014) 8389)
(EØS-relevant tekst)
(2014/802/EU)
EUROPA-KOMMISSIONEN HAR —
under henvisning til traktaten om Den Europæiske Unions funktionsmåde,
under henvisning til Rådets direktiv 92/65/EØF af 13. juli 1992 om dyresundhedsmæssige betingelser for samhandel med og indførsel til Fællesskabet af dyr samt sæd, æg og embryoner, der for så vidt angår disse betingelser ikke er underlagt specifikke fællesskabsbetingelser som omhandlet i bilag A, del I, til direktiv 90/425/EØF (1), særlig artikel 11, stk. 3, tredje led, artikel 17, stk. 2, litra b), artikel 18, stk. 1, første led, og artikel 19, hovedet, og litra b), og
ud fra følgende betragtninger:
|
(1) |
Del A i bilag IV til Kommissionens afgørelse 2010/470/EU (2) indeholder standardsundhedscertifikatet til brug ved handel inden for EU med sendinger af æg og embryoner fra får og geder, der er opsamlet eller produceret efter den 31. august 2010. |
|
(2) |
Del 2 i bilag IV til Kommissionens afgørelse 2010/472/EU (3) indeholder standardsundhedscertifikatet til brug ved import til EU af sendinger af æg og embryoner fra får og geder. |
|
(3) |
Ved Europa-Parlamentets og Rådets forordning (EF) nr. 999/2001 (4) er der fastsat regler for forebyggelse af, kontrol med og udryddelse af transmissible spongiforme encephalopatier (TSE) hos kvæg, får og geder. I kapitel A i bilag VIII til samme forordning er der fastsat betingelser for samhandelen inden for Unionen med levende dyr, sæd og embryoner. I bilag IX til samme forordning er der endvidere fastsat betingelser for import til Unionen af levende dyr, embryoner, æg og animalske produkter fra tredjelande. |
|
(4) |
På grundlag af ny videnskabelig dokumentation blev forordning (EF) nr. 999/2001 ændret ved Kommissionens forordning (EU) nr. 630/2013 (5). Ændringerne vedrørende scrapie blev ved Kommissionens gennemførelsesafgørelse 2013/470/EU (6) afspejlet i standardsundhedscertifikatet til brug ved handel inden for EU med sendinger af æg og embryoner fra får og geder indeholdt i del A i bilag IV til afgørelse 2010/470/EU og standardsundhedscertifikatet til brug ved import til EU af sendinger af æg og embryoner fra får og geder indeholdt i del 2 i bilag IV til afgørelse 2010/472/EU med en overgangsperiode, som udløber den 31. december 2014. |
|
(5) |
I overensstemmelse med en videnskabelig udtalelse om risikoen for overførsel af klassisk scrapie i forbindelse med overførsel af in vivo-producerede embryoner hos får, som Den Europæiske Fødevaresikkerhedsautoritet (EFSA) vedtog den 24. januar 2013, og hvori det konkluderedes, at risikoen for overførsel af klassisk scrapie ved implantation af homozygote eller heterozygote ARR-embryoner fra får kan betragtes som ubetydelig, forudsat at OIE's anbefalinger og procedurer vedrørende embryooverførsel følges, blev de relevante bestemmelser i forordning (EF) nr. 999/2001 ændret ved Kommissionens forordning (EU) nr. 1148/2014 (7). |
|
(6) |
Standardsundhedscertifikatet til brug ved handel inden for Unionen med sendinger af æg og embryoner fra får og geder, der er fastsat i del A i bilag IV til afgørelse 2010/470/EU, og standardsundhedscertifikatet til brug ved import til Unionen af sendinger af æg og embryoner fra får og geder, der er fastsat i del 2 i bilag IV til afgørelse 2010/472/EU, bør derfor ændres for at afspejle de krav, der er fastsat i forordning (EF) nr. 999/2001, som ændret ved forordning (EU) nr. 1148/2014. |
|
(7) |
Endvidere er der i standardsundhedscertifikatet til brug ved handel inden for Unionen med sendinger af æg og embryoner fra får og geder, der er fastsat i del A i bilag IV til afgørelse 2010/470/EU, visse henvisninger til forordning (EF) nr. 999/2001, som bør ændres for at fjerne enhver tvivl. |
|
(8) |
Desuden kræves der i standardsundhedscertifikatet til brug ved import til Unionen af sendinger af æg og embryoner fra får og geder, der er fastsat i del 2 i bilag IV til afgørelse 2010/472/EU, en mere præcis formulering for at gøre det helt klart, at prøverne vedrørende epizootisk hæmorragi (EHD) gælder hundonordyrene af fåre- og gedearter. |
|
(9) |
Afgørelse 2010/470/EU og 2010/472/EU bør derfor ændres i overensstemmelse hermed. |
|
(10) |
Foranstaltningerne i denne afgørelse er i overensstemmelse med udtalelse fra Den Stående Komité for Fødevarekæden og Dyresundhed — |
VEDTAGET DENNE AFGØRELSE:
Artikel 1
Bilag IV til afgørelse 2010/470/EU ændres som angivet i bilag I til nærværende afgørelse.
Artikel 2
Bilag IV til afgørelse 2010/472/EU ændres som angivet i bilag II til nærværende afgørelse.
Artikel 3
Denne afgørelse anvendes fra den 1. januar 2015.
Artikel 4
Denne afgørelse er rettet til medlemsstaterne.
Udfærdiget i Bruxelles, den 14. november 2014.
På Kommissionens vegne
Vytenis ANDRIUKAITIS
Medlem af Kommissionen
(1) EFT L 268 af 14.9.1992, s. 54.
(2) Kommissionens afgørelse 2010/470/EU af 26. august 2010 om standardsundhedscertifikater til brug ved handel inden for Den Europæiske Union med sæd, æg og embryoner fra dyr af heste-, fåre- og gedearter samt med æg og embryoner fra svin (EUT L 228 af 31.8.2010, s. 15).
(3) Kommissionens afgørelse 2010/472/EU af 26. august 2010 om import til Unionen af sæd, æg og embryoner fra fåre- og gedearter (EUT L 228 af 31.8.2010, s. 74).
(4) Europa-Parlamentets og Rådets forordning (EF) nr. 999/2001 af 22. maj 2001 om fastsættelse af regler for forebyggelse af, kontrol med og udryddelse af visse transmissible spongiforme encephalopatier (EFT L 147 af 31.5.2001, s. 1).
(5) Kommissionens forordning (EU) nr. 630/2013 af 28. juni 2013 om ændring af bilagene til Europa-Parlamentets og Rådets forordning (EF) nr. 999/2001 om fastsættelse af regler for forebyggelse af, kontrol med og udryddelse af visse transmissible spongiforme encephalopatier (EUT L 179 af 29.6.2013, s. 60).
(6) Kommissionens gennemførelsesafgørelse 2013/470/EU af 20. september 2013 om ændring af afgørelse 2010/470/EU og 2010/472/EU for så vidt angår dyresundhedskravene vedrørende scrapie i forbindelse med handel inden for Unionen med sæd, æg og embryoner fra får og geder og import til Unionen heraf (EUT L 252 af 24.9.2013, s. 32).
(7) Kommissionens forordning (EU) nr. 1148/2014 af 28. oktober 2014 om ændring af bilag II, VII, VIII, IX og X til Europa-Parlamentets og Rådets forordning (EF) nr. 999/2001 om fastsættelse af regler for forebyggelse af, kontrol med og udryddelse af visse transmissible spongiforme encephalopatier (EUT L 308 af 29.10.2014, s. 66).
BILAG I
I bilag IV til afgørelse 2010/470/EU affattes del A således:
»DEL A
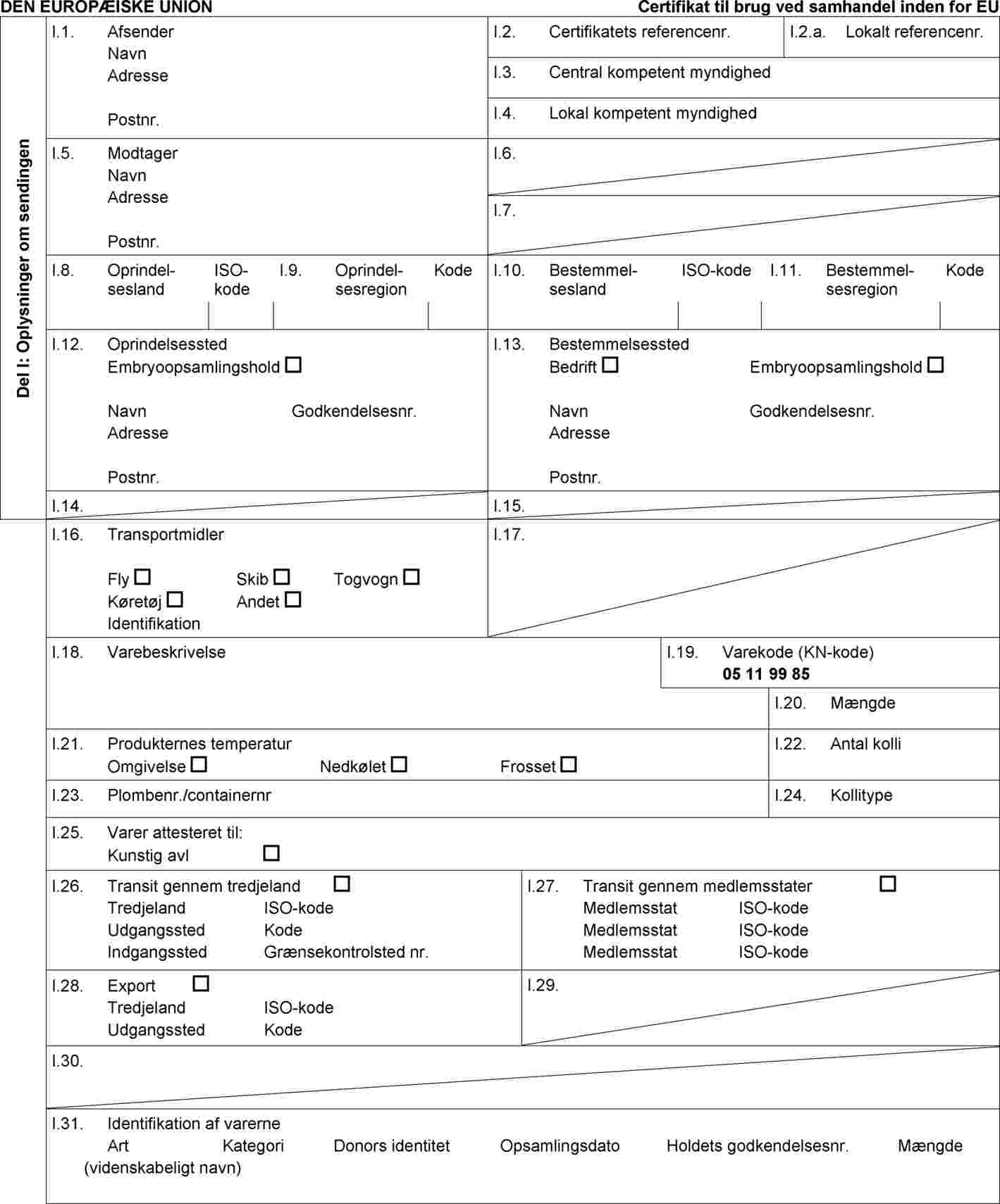
Standardsundhedscertifikat IVA til brug ved handel inden for EU med sendinger af æg og embryoner fra får og geder, der er opsamlet eller produceret efter den 31. august 2010 i overensstemmelse med Rådets direktiv 92/65/EØF og afsendt af et godkendt embryoopsamlings- eller embryoproduktionshold, som æggene eller embryonerne stammer fra

 «
«
BILAG II
I bilag IV til afgørelse 2010/472/EU affattes del 2 således:
»DEL 2
Standardsundhedscertifikat til brug ved import af sendinger af æg og embryoner fra dyr af fåre- og gedearter




 «
«
RETSAKTER VEDTAGET AF ORGANER OPRETTET VED INTERNATIONALE AFTALER
|
18.11.2014 |
DA |
Den Europæiske Unions Tidende |
L 331/38 |
AFGØRELSE Nr. 1/2014 VEDTAGET AF DET BLANDEDE UDVALG EU-SCHWEIZ
af 10. oktober 2014
om fastlæggelse af de tilfælde, der fritages for kravet om at videregive de oplysninger, som er omhandlet i artikel 3, stk. 3, første afsnit, i bilag I til aftalen mellem Det Europæiske Fællesskab og Det Schweiziske Forbund af 25. juni 2009 om forenkling af kontrol og formaliteter under godstransport og om toldsikkerhedsforanstaltninger
(2014/803/EU)
DET BLANDEDE UDVALG HAR —
under henvisning til aftalen mellem Det Europæiske Fællesskab og Det Schweiziske Forbund af 25. juni 2009 om forenkling af kontrol og formaliteter under godstransport og om toldsikkerhedsforanstaltninger (»aftalen«), særlig artikel 21, stk. 3, sammenholdt med bilag I, artikel 3, stk. 3, andet afsnit, og
ud fra følgende betragtninger:
|
(1) |
Aftalen går ud på at opretholde forenklingen af kontrol og formaliteter i forbindelse med godstransport på tværs af landegrænser og den frie samhandel mellem de kontraherende parter, samtidig med at en høj grad af sikkerhed garanteres i forsyningskæden. |
|
(2) |
De kontraherende parter har forpligtet sig til at sikre ækvivalensen mellem sikkerhedsniveauerne på deres respektive områder ved hjælp af foranstaltninger, der bygger på de lovregler, der gælder i Den Europæiske Union. |
|
(3) |
Når varer forlader en kontraherende parts toldområde med et tredjeland som bestemmelsessted og i transit via den anden kontraherende parts toldområde, videregiver den første kontraherende parts kompetente myndighed sikkerhedsoplysningerne i den indgivne summariske udgangsangivelse til den anden kontraherende parts kompetente myndighed. |
|
(4) |
Det blandede udvalg kan fastlægge de tilfælde, hvor denne videregivelse af oplysninger ikke er nødvendig, for så vidt dette ikke udgør en risiko for det i aftalen garanterede sikkerhedsniveau. |
|
(5) |
Den Europæiske Unions medlemsstater og Det Schweiziske Forbund er kontraherende parter i Chicagokonventionen angående international civil luftfart; i medfør af denne konventions bilag 17 underkaster luftfartsforetagender hele fragten en sikkerhedskontrol, inden den lastes om bord på et luftfartøj, for at beskytte den internationale luftfart mod ulovlige indgreb. |
|
(6) |
Det Europæiske Fællesskab og Det Schweiziske Forbund er omfattet af den lufttransportaftale, som er indgået den 21. juni 1999, og som bl.a. regulerer security og sikkerhed inden for luftfarten — |
VEDTAGET DENNE AFGØRELSE:
Artikel 1
For vareeksport som omhandlet i artikel 3, stk. 3, første afsnit, i aftalens bilag I er en videregivelse af oplysninger ikke nødvendig, såfremt:
|
a) |
varerne transporteres af et luftfartsforetagende, der varetager transporten ud af de kontraherende parters toldområde |
|
b) |
udførslen af varerne fra den anden kontraherende parts toldsted foretages ad luftvejen |
|
c) |
en summarisk udgangsangivelse eller en angivelse til eksporttoldstedet, der opfylder de fastsatte betingelserne for denne summariske angivelse, er forelagt det kompetente toldsted på det sted, hvorfra varerne eksporteres |
|
d) |
transportforetagendet, når varerne ankommer til den anden kontraherende parts udgangstoldsted, på anmodning fra det pågældende toldsted stiller en kopi af EU-eksportledsage-dokumentet eller et lignende dokument, der er udstedt af de schweiziske toldmyndigheder, og som indeholder sikkerhedsdata, for de eksporterede varer til rådighed for toldstedet. |
Artikel 2
Denne afgørelse træder i kraft dagen efter vedtagelsen.
Udfærdiget i Vacallo, den 10. oktober 2014.
På Det Blandede Udvalg EU-Schweiz' Vegne
Michaela SCHÄRER-RICKENBACHER
Formand
Berigtigelser
|
18.11.2014 |
DA |
Den Europæiske Unions Tidende |
L 331/40 |
Berigtigelse til Europa-Parlamentets og Rådets forordning (EU) nr. 1169/2011 af 25. oktober 2011 om fødevareinformation til forbrugerne, om ændring af Europa-Parlamentets og Rådets forordning (EF) nr. 1924/2006 og (EF) nr. 1925/2006 og om ophævelse af Kommissionens direktiv 87/250/EØF, Rådets direktiv 90/496/EØF, Kommissionens direktiv 1999/10/EF, Europa-Parlamentets og Rådets direktiv 2000/13/EF, Kommissionens direktiv 2002/67/EF og 2008/5/EF og Kommissionens forordning (EF) nr. 608/2004
( Den Europæiske Unions Tidende L 304 af 22. november 2011 )
Side 34, artikel 30, stk. 1, litra b:
I stedet for:
»mængden af fedt, mættede fedtsyrer, kulhydrater, sukkerarter, protein og salt.«
læses:
»mængden af fedt, mættede fedtsyrer, kulhydrat, sukkerarter, protein og salt.«
Side 48, bilag VI, del A, punkt 1:
I stedet for:
»Varebetegnelsen for fødevaren skal omfatte eller ledsages af oplysninger om fødevarens fysiske tilstand eller den særlige behandling, som fødevaren har undergået (f.eks. i pulverform, gennedfrosset, frysetørret, hurtigfrosset, optøet, koncentreret, røget) …«
læses:
»Varebetegnelsen for fødevaren skal omfatte eller ledsages af oplysninger om fødevarens fysiske tilstand eller den særlige behandling, som fødevaren har undergået (f.eks. i pulverform, gennedfrosset, frysetørret, dybfrosset, optøet, koncentreret, røget) …«.
Side 54, bilag VII, del C, tiende kategori:
I stedet for:
»Konsistensmiddel
Kompleksdannere«
læses:
»Konsistensmiddel
Stabilisator«
Side 57, bilag X, punkt 1, litra a), første og andet led:
I stedet for:
|
»— |
»Mindst holdbar til …«, når datoen angiver dagen |
|
— |
»Mindst holdbar til og med …« i andre tilfælde.« |
læses:
|
»— |
»Bedst før …«, når datoen angiver dagen |
|
— |
»Bedst før udgangen af …« i andre tilfælde.« |
Side 61, bilag XIII, del A, punkt 1:
I stedet for:
»Vitaminer og mineraler, som kan deklareres, og deres ernæringsmæssige referenceværdier«
læses:
»Vitaminer og mineraler, som kan deklareres, og deres næringsstofreferenceværdier (NRV)«
Side 61, bilag XIII, del A, punkt 2, første led:
I stedet for:
»15 % af de ernæringsmæssige referenceværdier angivet i punkt 1, pr. 100 g eller 100 ml for andre varer end drikkevarer«
læses:
»15 % af de næringsstofreferenceværdier angivet i punkt 1, pr. 100 g eller 100 ml for andre varer end drikkevarer«
Side 61, bilag XIII, del A, punkt 2, andet led (som berigtiget i EFT L 247 af 13.9.2012, s. 17):
I stedet for:
»7,5 % af de ernæringsmæssige referenceværdier angivet i punkt 1, pr. 100 ml for drikkevarer eller«
læses:
»7,5 % af de næringsstofreferenceværdier angivet i punkt 1, pr. 100 ml for drikkevarer eller«
Side 61, bilag XIII, del A, punkt 2, tredje led:
I stedet for:
»15 % af de ernæringsmæssige referenceværdier angivet i punkt 1 pr. portion, hvis pakken kun indeholder én enkelt portion.«
læses:
»15 % af de næringsstofreferenceværdier angivet i punkt 1 pr. portion, hvis pakken kun indeholder én enkelt portion.«
|
18.11.2014 |
DA |
Den Europæiske Unions Tidende |
L 331/41 |
Berigtigelse til Rådets afgørelse 2014/252/EU af 14. april 2014 om indgåelse af aftalen mellem Den Europæiske Union og Republikken Tyrkiet om tilbagetagelse af personer, der er bosiddende uden tilladelse
( Den Europæiske Unions Tidende L 134 af 7. maj 2014 )
Side 1, betragtning 3:
I stedet for:
|
»(3) |
I medfør af artikel 1 og 2 i protokol (nr. 21) om Det Forenede Kongeriges og Irlands stilling for så vidt angår området med frihed, sikkerhed og retfærdighed, der er knyttet som bilag til traktaten om Den Europæiske Union og til traktaten om Den Europæiske Unions funktionsmåde, og med forbehold af artikel 4 i samme protokol, deltager Det Forenede Kongerige ikke i vedtagelsen af denne afgørelse som ikke er bindende for og ikke finder anvendelse i Det Forenede Kongerige.« |
læses:
|
»(3) |
I medfør af artikel 3 i protokol nr. 21 om Det Forenede Kongeriges og Irlands stilling for så vidt angår området med frihed, sikkerhed og retfærdighed, der er knyttet som bilag til traktaten om Den Europæiske Union og til traktaten om Den Europæiske Unions funktionsmåde, har Det Forenede Kongerige ved skrivelse af 21. september 2012 meddelt, at det ønsker at deltage i vedtagelsen og anvendelsen af denne afgørelse.« |