ISSN 1977-0871
Den Europæiske Unions
Tidende
C 305

Dansk udgave
Meddelelser og oplysninger
61. årgang
30. august 2018
|
ISSN 1977-0871 |
||
|
Den Europæiske Unions Tidende |
C 305 |
|

|
||
|
Dansk udgave |
Meddelelser og oplysninger |
61. årgang |
|
Indhold |
Side |
|
|
|
II Meddelelser |
|
|
|
MEDDELELSER FRA DEN EUROPÆISKE UNIONS INSTITUTIONER, ORGANER, KONTORER OG AGENTURER |
|
|
|
Europa-Kommissionen |
|
|
2018/C 305/01 |
Beslutning om ikke at gøre indsigelse mod en anmeldt fusion (Sag M.8970 — Sumitomo/Parkwind/Northwester2) ( 1 ) |
|
|
V Øvrige meddelelser |
|
|
|
ADMINISTRATIVE PROCEDURER |
|
|
|
Det Europæiske Personaleudvælgelseskontor (EPSO) |
|
|
2018/C 305/13 |
||
|
|
PROCEDURER VEDRØRENDE GENNEMFØRELSEN AF KONKURRENCEPOLITIKKEN |
|
|
|
Europa-Kommissionen |
|
|
2018/C 305/14 |
Anmeldelse af en planlagt fusion (Sag M.9072 — KKR/Altice/SFR Filiale) — Behandles eventuelt efter den forenklede procedure ( 1 ) |
|
|
|
|
|
(1) EØS-relevant tekst. |
|
DA |
|
II Meddelelser
MEDDELELSER FRA DEN EUROPÆISKE UNIONS INSTITUTIONER, ORGANER, KONTORER OG AGENTURER
Europa-Kommissionen
|
30.8.2018 |
DA |
Den Europæiske Unions Tidende |
C 305/1 |
Beslutning om ikke at gøre indsigelse mod en anmeldt fusion
(Sag M.8970 — Sumitomo/Parkwind/Northwester2)
(EØS-relevant tekst)
(2018/C 305/01)
Den 30. juli 2018 besluttede Kommissionen ikke at gøre indsigelse mod ovennævnte anmeldte fusion og erklære den forenelig med det indre marked. Beslutningen er truffet efter artikel 6, stk. 1, litra b), i Rådets forordning (EF) nr. 139/2004 (1). Beslutningens fulde ordlyd foreligger kun på engelsk og vil blive offentliggjort, efter at eventuelle forretningshemmeligheder er udeladt. Den vil kunne ses:
|
— |
under fusioner på Kommissionens websted for konkurrence (http://ec.europa.eu/competition/mergers/cases/). Dette websted giver forskellige muligheder for at finde de konkrete fusionsbeslutninger, idet de er opstillet efter bl.a. virksomhedens navn, sagsnummer, dato og sektor |
|
— |
i elektronisk form på EUR-Lex-webstedet (http://eur-lex.europa.eu/homepage.html?locale=da) under dokumentnummer 32018M8970. EUR-Lex giver onlineadgang til EU-retten. |
IV Oplysninger
OPLYSNINGER FRA DEN EUROPÆISKE UNIONS INSTITUTIONER, ORGANER, KONTORER OG AGENTURER
Europa-Kommissionen
|
30.8.2018 |
DA |
Den Europæiske Unions Tidende |
C 305/2 |
Euroens vekselkurs (1)
29. august 2018
(2018/C 305/03)
1 euro =
|
|
Valuta |
Kurs |
|
USD |
amerikanske dollar |
1,1660 |
|
JPY |
japanske yen |
129,73 |
|
DKK |
danske kroner |
7,4571 |
|
GBP |
pund sterling |
0,90500 |
|
SEK |
svenske kroner |
10,6923 |
|
CHF |
schweiziske franc |
1,1385 |
|
ISK |
islandske kroner |
124,90 |
|
NOK |
norske kroner |
9,7475 |
|
BGN |
bulgarske lev |
1,9558 |
|
CZK |
tjekkiske koruna |
25,745 |
|
HUF |
ungarske forint |
324,63 |
|
PLN |
polske zloty |
4,2838 |
|
RON |
rumænske leu |
4,6417 |
|
TRY |
tyrkiske lira |
7,5236 |
|
AUD |
australske dollar |
1,5989 |
|
CAD |
canadiske dollar |
1,5093 |
|
HKD |
hongkongske dollar |
9,1524 |
|
NZD |
newzealandske dollar |
1,7413 |
|
SGD |
singaporeanske dollar |
1,5941 |
|
KRW |
sydkoreanske won |
1 299,27 |
|
ZAR |
sydafrikanske rand |
16,8176 |
|
CNY |
kinesiske renminbi yuan |
7,9626 |
|
HRK |
kroatiske kuna |
7,4370 |
|
IDR |
indonesiske rupiah |
17 087,73 |
|
MYR |
malaysiske ringgit |
4,8076 |
|
PHP |
filippinske pesos |
62,375 |
|
RUB |
russiske rubler |
79,4075 |
|
THB |
thailandske bath |
38,140 |
|
BRL |
brasilianske real |
4,8451 |
|
MXN |
mexicanske pesos |
22,3252 |
|
INR |
indiske rupee |
82,3405 |
(1) Kilde: Referencekurs offentliggjort af Den Europæiske Centralbank.
|
30.8.2018 |
DA |
Den Europæiske Unions Tidende |
C 305/3 |
Forklarende bemærkninger til Den Europæiske Unions kombinerede nomenklatur
(2018/C 305/04)
I medfør af artikel 9, stk. 1, litra a), i Rådets forordning (EØF) nr. 2658/87 (1)foretages følgende ændringer i de forklarende bemærkninger til Den Europæiske Unions kombinerede nomenklatur (2):
På side 379
|
9401 |
Siddemøbler (undtagen varer henhørende under pos. 9402), herunder sovesofaer og lign., samt dele dertil |
Følgende tekst tilføjes efter den eksisterende tekst:
»I denne position finder alle henvisninger til bambus udelukkende anvendelse på vegetabilske materialer henhørende under pos. 1401. På den anden side finder alle henvisninger til træ eller træagtig i denne position også anvendelse på bambusplader henhørende under pos. 4412. (Se også bestemmelse 1 b) og bestemmelse 6 til kapitel 44).«
|
9403 |
Andre møbler og dele dertil |
Følgende tekst tilføjes efter det eksisterende afsnit:
»De forklarende bemærkninger til pos. 9401 om henvisningerne til »bambus« og »træ eller træagtig« anvendes med de fornødne tillempninger.«
(1) Rådets forordning (EØF) nr. 2658/87 af 23. juli 1987 om told- og statistiknomenklaturen og den fælles toldtarif (EFT L 256 af 7.9.1987, s. 1).
|
30.8.2018 |
DA |
Den Europæiske Unions Tidende |
C 305/4 |
Forklarende bemærkninger til Den Europæiske Unions kombinerede nomenklatur
(2018/C 305/05)
I medfør af artikel 9, stk. 1, litra a), i Rådets forordning (EØF) nr. 2658/87 (1) foretages følgende ændring i de forklarende bemærkninger til Den Europæiske Unions kombinerede nomenklatur (2):
På side 379
|
9403 |
Andre møbler og dele dertil |
Følgende tekst tilføjes efter den eksisterende tekst:
»Denne position omfatter ikke »informationsskilte« såsom »gadetavler/street boards« og »roll-up-bannere/roll-ups«.
De skal tariferes under andre positioner i den kombinerede nomenklatur, hvor de er specifikt nævnt (for eksempel skrive- og tegnetavler, der svarer til varer henhørende under position 9610) eller efter materialets beskaffenhed:
|
a) |
under en position, der specifikt dækker disse varer (f.eks. tariferes plader af uægte metal, som svarer til varer henhørende under pos. 8310, under denne position), eller |
|
b) |
under en position, der dækker forskellige varer af dette materiale (f.eks. position 3926 eller 7616). |
Eksempel på en gadetavle, der skal tariferes under pos. 9610:

Gadetavle.
Eksempel på en gadetavle, der skal tariferes under pos. 8310:
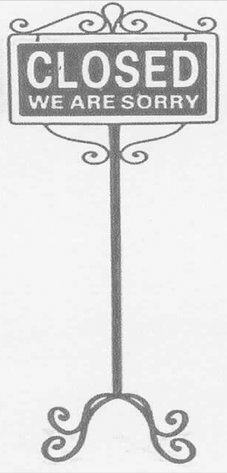
Gadetavle, der udelukkende består af uædle metaller.
Eksempler på »informationsskilte«, der skal tariferes efter materialets beskaffenhed under en position, der dækker forskellige varer af dette materiale:
|
|
|
|
En nedre del bestående af hård plast, en øvre del bestående af en aluminiumsramme med en plastplade i midten, hvis overflade på begge sider er dækket af gennemsigtig PVC-folie. |
En nedre del og ramme bestående af aluminium med gummipåsætninger samt gennemsigtig PVC-folie, der dækker et ark papir. |
|
Pos. 7616 (aluminiumsrammen er karaktergivende for varen). |
Pos. 7616 (aluminiumsrammen er karaktergivende for varen). |
|
|
|
|
En plastplade, der er fastgjort på fem plaststænger af omtrent samme længde, som alle kan vippes i forskellige retninger. Fire af disse stænger har en plastkrog på enden, og på den femte er der fastgjort en plastkapsel. |
|
|
Pos. 3926 (varen er fremstillet udelukkende af plast).« |
|
(1) Rådets forordning (EØF) nr. 2658/87 af 23. juli 1987 om told- og statistiknomenklaturen og den fælles toldtarif (EFT L 256 af 7.9.1987, s. 1).
|
30.8.2018 |
DA |
Den Europæiske Unions Tidende |
C 305/6 |
Ny national side af euromønter bestemt til at blive sat i omløb
(2018/C 305/06)

National side af den nye 2-euroerindringsmønt bestemt til at blive sat i omløb, udstedt af Luxembourg
Euromønter, som er bestemt til at blive sat i omløb, har status som lovligt betalingsmiddel i hele euroområdet. For at informere den brede offentlighed og alle, der professionelt beskæftiger sig med mønter, offentliggør Kommissionen alle de nye euromønters design (1). I overensstemmelse med Rådets konklusioner af 10. februar 2009 (2) kan medlemsstaterne i euroområdet og lande, som har indgået monetære aftaler med Den Europæiske Union om udstedelse af euromønter, på visse betingelser udstede et vist antal euroerindringsmønter bestemt til at blive sat i omløb. Der må således kun anvendes 2-euromønter. Disse mønter skal have samme tekniske karakteristika som de normale 2-euromønter, men bærer på den nationale side et særligt motiv af stor symbolsk betydning i national eller europæisk henseende.
Udstedende stat : Luxembourg
Anledning til erindringsmønten : 175-årsdagen for Storhertug Guillaume I's død
Beskrivelse af designet : I højre side af er afbildet Hans Kongelige Højhed Storhertug Henri, der kigger til venstre, og på venstre side er afbildet Hans Kongelige Højhed Storhertug Guillaume I. Mellem de to portrætter ses vertikalt årstallene »1772-1843« samt navnet »Guillaume I«. Nederst bærer mønten påskriften »LUXEMBOURG« og årstallet »2018«.
På møntens ydre ring ses EU-flagets tolv stjerner.
Antal udstedte mønter :
500 000Udstedelsesdato : September 2018
(1) Jf. EFT C 373 af 28.12.2001, s. 1, hvor man kan se de nationale sider af alle de mønter, der blev udstedt i 2002.
(2) Jf. konklusionerne fra Rådets møde (økonomi og finans) den 10. februar 2009 og Kommissionens henstilling af 19. december 2008 om fælles retningslinjer for de nationale sider og udstedelsen af euromønter, som er bestemt til at sættes i omløb (EUT L 9 af 14.1.2009, s. 52).
Den Europæiske Tilsynsførende for Databeskyttelse
|
30.8.2018 |
DA |
Den Europæiske Unions Tidende |
C 305/7 |
Resumé af udtalelse om forslaget til omarbejdning af direktivet om videreanvendelse af den offentlige sektors informationer (PSI)
(Udtalelsen findes i sin helhed på engelsk, fransk og tysk på den tilsynsførendes websted www.edps.europa.eu)
(2018/C 305/07)
Direktivet om den offentlige sektors informationer (PSI) har til formål at lette videreanvendelse af den offentlige sektors informationer i hele EU ved at harmonisere de grundlæggende betingelser, der gør PSI tilgængelige for videreanvendere, og i hele EU at styrke udviklingen af produkter og tjenester baseret på PSI og undgå konkurrencefordrejninger.
De nye bestemmelser omfatter udvidelsen af direktivets anvendelsesområde til dokumenter, som indehaves af offentlige virksomheder inden for vand- og energiforsyning, transport samt posttjenester. Endvidere finder det anvendelse på dokumenter, som indehaves af offentlige virksomheder, der handler som operatører af offentlige tjenester, så længe sådanne dokumenter er produceret som led i leveringen af tjenesteydelser af almen interesse. Forslagets anvendelsesområde vil endvidere også blive udvidet til at omfatte specifikke forskningsdata såsom resultaterne af videnskabelige processer.
Udtalelsen har fokus på specifikke anbefalinger for bedre at præcisere PSI-direktivets forhold til og sammenhæng med undtagelserne i den generelle forordning om databeskyttelse og på henvisningen til gældende databeskyttelseslovgivning. Endvidere indeholder den yderligere anbefalinger vedrørende anonymisering i forhold til omkostninger og databeskyttelse, også med fokus på en konsekvensanalyse vedrørende databeskyttelse under hensyntagen til en »acceptabel videreanvendelsespolitik«.
Med denne udtalelse om videreanvendelse af PSI bygger den tilsynsførende videre på det arbejde, der allerede er udført vedrørende »Good Big Data« (»EU's værdibaserede dataudveksling«), og navnlig på udtalelser og formelle bemærkninger, som den tilsynsførende tidligere har afgivet, i overensstemmelse med vores praksis med hensyn til tilsynssager. Endvidere peger vi på de spørgsmål, hvor der er behov for harmonisering på EU-plan, for at omarbejdningen af PSI-direktivet kan høste de forventede fordele.
I forbindelse med forslagets artikel 1, stk. 2, litra g), ønsker den tilsynsførende en bedre præcisering af PSI-direktivets forhold til og sammenhæng med den generelle forordning om databeskyttelse og har fremsat et formuleringsforslag.
Endvidere foreslår den tilsynsførende, at den specifikke bestemmelse, der på nuværende tidspunkt er indeholdt i artikel 1, stk. 4, i direktiv 2013/37/EU, genindføres i de vigtigste bestemmelser i direktivet, og at det klart anføres i forslaget, at definitionen af »personoplysninger« i artikel 4, stk. 1, i den generelle forordning om databeskyttelse finder anvendelse. Den tilsynsførende anbefaler ligeledes, at der tilføjes en henvisning til den tilsynsmyndighed, der er oprettet ved artikel 51 i den generelle forordning om databeskyttelse, i forslagets artikel 4, stk. 4.
Den tilsynsførende anbefaler endvidere at præcisere anvendelsen af anonymisering ved at indføje en henvisning til »anonyme oplysninger« i lovteksten og udvide rækken af enheder, der har ret til at medtage omkostninger ved anonymisering blandt de omkostninger, der kan opkræves hos videreanvendere.
Som en sidste anbefaling foreslår den tilsynsførende, at der fastsættes konsekvensanalyser vedrørende databeskyttelse for specifikke sektorer, der håndterer følsomme oplysninger, såsom sundhedssektoren, som licensgiveren bør basere sin beslutning på, og derfor tage hensyn til betingelserne for videreanvendelse.
1. INDLEDNING OG BAGGRUND
|
1. |
Den 25. april 2018 vedtog Kommissionen et forslag til direktiv om ændring af direktiv 2013/37/EU (efter en revision af direktiv 2003/98/EF) om videreanvendelse af den offentlige sektors informationer (PSI) (herefter »forslaget«). Forslaget er en del af »datapakken fra 2018«, som også omfatter andre vigtige dokumenter: i) en meddelelse fra Kommissionen med titlen »Om et fælles europæisk dataområde« (herefter »meddelelsen«), ii) retningslinjer for udveksling af data med den private sektor, i form af et arbejdsdokument fra Kommissionens tjenestegrene (herefter »retningslinjerne«), og iii) en evaluering af PSI-direktivet. |
|
2. |
Formålet med forslaget er at opdatere og ændre den eksisterende tekst i direktiv 2013/37/EU og direktiv 2003/98/EF om videreanvendelse af den offentlige sektors informationer (PSI-direktivet). |
|
3. |
Revisionen af direktivet er én af de tre »foranstaltninger«, der er foreslået af Kommissionen med henblik på et fælles dataområde i EU (jf. den »overordnede« meddelelse fra Kommissionen COM(2018) 232, som følge heraf »meddelelsen«), sammen med retningslinjerne for udveksling af data med den private sektor […] og opdateringen af anbefalingen om adgang til og bevaring af videnskabelig information […]. |
|
4. |
Sigtet med Europa-Kommissionens forslag om at ændre PSI-direktivet er at lette videreanvendelse af den offentlige sektors informationer, f.eks. juridiske oplysninger, trafikdata, meteorologiske, økonomiske og finansielle data, i hele EU ved at harmonisere de grundlæggende betingelser, der gør PSI tilgængelige for videreanvendere, og i hele EU at styrke udviklingen af produkter og tjenester baseret på PSI og undgå konkurrencefordrejninger. |
|
5. |
Det overordnede formål med forslaget er navnlig at være i overensstemmelse med målene i strategien for det digitale indre marked. Forslaget har til formål at øge virkningen af direktivet ved at styrke specifikke bestemmelser og ændre dem i overensstemmelse hermed med henblik på at øge mængden af den offentlige sektors data, der er til rådighed til videreanvendelse. Specifikt har initiativet også til formål at styrke små og mellemstore virksomheders position på datamarkedet ved at sikre en mere fair konkurrence og lettere adgang til markeder samt øge grænseoverskridende innovation. |
|
6. |
Relevante nye bestemmelser i direktivet omfatter udvidelsen af dets anvendelsesområde til dokumenter, som indehaves af offentlige virksomheder inden for vand- og energiforsyning, transport samt posttjenester. Endvidere finder det anvendelse på dokumenter, som indehaves af offentlige virksomheder, der handler som operatører af offentlige tjenester, så længe sådanne dokumenter er produceret som led i leveringen af tjenesteydelser af almen interesse. Forslagets anvendelsesområde vil endvidere blive udvidet til at omfatte specifikke forskningsdata såsom resultaterne af videnskabelige processer (dvs. eksperimenter og undersøgelser). I praksis »(…) fastsætter (forslaget) horisontale rammer, som giver en minimumsharmonisering af betingelserne for videreanvendelse på tværs af domæner og sektorer.« (1) |
|
7. |
Den tilsynsførende noterer sig med tilfredshed, at omarbejdningen af PSI-direktivet ifølge Europa-Kommissionen har til formål at fremme videreanvendelse af den offentlige sektors informationer ved, som det fremgår af meddelelsen, at »mindske hindringerne for markedsadgang, navnlig for små og mellemstore virksomheder […], minimere risikoen for overdrevne first-mover fordele, som store virksomheder har fordel af og dermed begrænse antallet af potentielle genbrugere af de pågældende data […], [øge] forretningsmuligheder ved at fremme offentliggørelsen af dynamiske data og udbredelsen af applikationsprogrammeringsgrænseflader (API'er).« (2) |
|
8. |
PSI-direktivet er en del af EU's vision om at fremme »Good Big Data«. Den offentlige sektors informationer er en vigtig kilde til »råmaterialet« til big data i forbindelse med digitale indre marked. Intelligent brug af data, herunder behandlingen heraf via kunstig intelligens, kan have en transformerende virkning på alle økonomiske sektorer. |
|
9. |
Allerede i september 2016 fremlagde den tilsynsførende med sin udtalelse om effektiv håndhævelse af grundlæggende rettigheder i en tid med big data, Opinion on coherent enforcement of fundamental rights in the age of big data (3) en strategi med henblik på at udforme et cyberspace i EU baseret på EU's værdier og pegede på problemstillinger såsom koncentration af markeds- og informationsstyrke og et svagt marked for teknologier til beskyttelse af privatlivet som foranstaltninger til at minimere behandling af personoplysninger, uden at det går ud over et produkts eller en tjenestes funktionalitet (med inspiration fra princippet om indbygget privatlivsbeskyttelse (4) og privatlivsbeskyttelse som standard). |
|
10. |
Den tilsynsførende vil endvidere gerne minde om relevansen for databeskyttelse af de »nøgleprincipper«, der ifølge Europa-Kommissionen bør overholdes i forbindelse med videreanvendelse af data, dvs. i) minimeret datalåsning og sikring af uhindret konkurrence, ii) transparens og samfundsmæssig deltagelse med hensyn til formålet med videreanvendelsen over for borgerne/de registrerede samt gennemsigtighed og klar formålsdefinition mellem licensgiveren og licenshaverne, iii) konsekvensanalyse vedrørende databeskyttelse og passende databeskyttelsesgarantier for videreanvendelse (ifølge et »gør ikke skade«-princip — ud fra et databeskyttelsessynspunkt). |
|
11. |
Mens den tilsynsførende er blevet hørt uformelt af Europa-Kommissionen, er den tilsynsførende ikke blevet hørt formelt som krævet i artikel 28, stk. 2, i forordning (EF) nr. 45/2001. Udtalelsen er derfor baseret på samme forordnings artikel 41, stk. 2. Den tilsynsførende anbefaler, at der henvises til denne udtalelse i det vedtagne instruments præambel. |
7. KONKLUSION
Derfor anbefaler den tilsynsførende:
|
— |
at ændre forslagets artikel 1, stk. 2, litra g), og fastlægge en specifik ordlyd vedrørende forskellen mellem »dokumenter« og »dele af dokumenter«, som PSI-direktivet ikke finder anvendelse på af databeskyttelseshensyn |
|
— |
at tilføje en henvisning til den tilsynsmyndighed, der er oprettet ved artikel 51 i den generelle forordning om databeskyttelse, i forslagets artikel 4, stk. 4, med henblik på yderligere at styrke forbindelsen mellem videreanvendelsen af den offentlige sektors informationer og beskyttelsen af personoplysninger |
|
— |
at genindføre den specifikke bestemmelse om gældende databeskyttelseslovgivning, der på nuværende tidspunkt er indeholdt i artikel 1, stk. 4, i direktiv 2013/37/EU, i forslagets dispositive del (herunder den nødvendige opdatering af henvisninger til de gældende retsakter) |
|
— |
yderligere at præcisere anvendelsen af anonymisering i forbindelse med videreanvendelse af den offentlige sektors informationer ved at indføje en henvisning til »anonyme oplysninger« i lovteksten og udvide rækken af enheder, der har ret til at medtage omkostninger ved anonymisering blandt de omkostninger, der kan opkræves hos videreanvendere |
|
— |
klart at anføre i forslaget, at definitionen af »personoplysninger« i artikel 4, stk. 1, i den generelle forordning om databeskyttelse finder anvendelse |
|
— |
at muliggøre og indføre konsekvensanalyser vedrørende databeskyttelse for specifikke sektorer, der håndterer følsomme oplysninger, såsom sundhedssektoren, som licensgiveren bør basere sin beslutning på, og derfor tage hensyn til betingelserne for videreanvendelse |
|
— |
Som en sidste bemærkning understreger den tilsynsførende i forbindelse med disse anbefalinger relevansen for databeskyttelse af følgende »nøgleprincipper«, der ifølge Kommissionen bør overholdes i forbindelse med videreanvendelse af data, dvs.:
|
Udfærdiget i Bruxelles, den 10. juli 2018.
Giovanni BUTTARELLI
Den Europæiske Tilsynsførende for Databeskyttelse
(1) Begrundelsen til forslaget til Europa-Parlamentets og Rådets direktiv om videreanvendelse af den offentlige sektors informationer (omarbejdning), s. 3.
(2) Meddelelse fra Kommissionen til Europa-Parlamentet, Rådet, Det Europæiske Økonomiske og Sociale Udvalg og Regionsudvalget, Meddelelse »Om et fælles europæisk dataområde«, s. 5.
(3) https://edps.europa.eu/sites/edp/files/publication/16-09-23_bigdata_opinion_en.pdf, om videreanvendelse s. 9.
(4) Den Europæiske Tilsynsførende for Databeskyttelses udtalelse 05/2018 — Foreløbig udtalelse om indbygget privatlivsbeskyttelse.
OPLYSNINGER FRA MEDLEMSSTATERNE
|
30.8.2018 |
DA |
Den Europæiske Unions Tidende |
C 305/10 |
Bekendtgørelse fra Kommissionen i henhold til artikel 16, stk. 4, i Europa-Parlamentets og Rådets forordning (EF) nr. 1008/2008 om fælles regler for driften af lufttrafiktjenester i Fællesskabet
Indførelse af forpligtelse til offentlig tjeneste vedrørende ruteflyvning
(EØS-relevant tekst)
(2018/C 305/08)
|
Medlemsstat |
Portugal |
||||||
|
Rute |
Bragança - Vila Real – Viseu – Cascais – Portimão – Cascais – Viseu – Vila Real - Bragança |
||||||
|
Dato, hvor forpligtelsen til offentlig tjeneste træder i kraft |
Fra 23. december 2018 |
||||||
|
Adresse, hvor teksten og eventuelle relevante oplysninger og/eller eventuel relevant dokumentation vedrørende forpligtelserne til offentlig tjeneste kan rekvireres |
Alle dokumenter kan rekvireres på webstedet: http://www.saphety.com Yderligere oplysninger fås ved henvendelse til:
|
|
30.8.2018 |
DA |
Den Europæiske Unions Tidende |
C 305/11 |
Bekendtgørelse fra Kommissionen i henhold til artikel 16, stk. 4, i Europa-Parlamentets og Rådets forordning (EF) nr. 1008/2008 om fælles regler for driften af lufttrafiktjenester i Fællesskabet
Ændring af forpligtelse til offentlig tjeneste vedrørende ruteflyvning
(EØS-relevant tekst)
(2018/C 305/09)
|
Medlemsstat |
Det Forenede Kongerige |
|||||||||||
|
Rute |
Oban-Coll Oban-Colonsay Oban-Tiree Coll-Tiree |
|||||||||||
|
Oprindelig dato, hvor forpligtelsen til offentlig tjeneste trådte i kraft |
Den 2. marts 2007 |
|||||||||||
|
Dato for ændringernes ikrafttræden |
Den 16. maj 2019 |
|||||||||||
|
Adresse, hvor teksten og eventuelle relevante oplysninger og/eller eventuel relevant dokumentation vedrørende forpligtelserne til offentlig tjeneste kan rekvireres |
Alle dokumenter kan rekvireres på webstedet: http://www.publiccontractsscotland.gov.uk Yderligere oplysninger fås ved henvendelse til:
|
|
30.8.2018 |
DA |
Den Europæiske Unions Tidende |
C 305/12 |
Bekendtgørelse fra Kommissionen i henhold til artikel 17, stk. 5, i Europa-Parlamentets og Rådets forordning (EF) nr. 1008/2008 om fælles regler for driften af lufttrafiktjenester i Fællesskabet
Udbud vedrørende ruteflyvning med forpligtelse til offentlig tjeneste
(EØS-relevant tekst)
(2018/C 305/10)
|
Medlemsstat |
Det Forenede Kongerige |
|||||||||||
|
Rute |
Oban-Coll Oban-Colonsay Oban-Tiree Coll-Tiree |
|||||||||||
|
Kontraktens løbetid |
Fra den 16. maj 2019 til den 15. maj 2022 |
|||||||||||
|
Frist for indgivelse af ansøgninger og bud |
19. november 2018 |
|||||||||||
|
Adresse, hvor udbudsteksten og eventuelle relevante oplysninger og/eller eventuel relevant dokumentation vedrørende det offentlige udbud og forpligtelsen til offentlig tjeneste kan rekvireres |
Alle dokumenter kan rekvireres på webstedet: http://www.publiccontractsscotland.gov.uk Yderligere oplysninger fås ved henvendelse til:
|
OPLYSNINGER VEDRØRENDE DET EUROPÆISKE ØKONOMISKE SAMARBEJDSOMRÅDE
Det Stående Udvalg for EFTA-staterne
|
30.8.2018 |
DA |
Den Europæiske Unions Tidende |
C 305/13 |
Farlige stoffer — liste over afgørelser om godkendelse, der er truffet af EØS/EFTA-staterne i henhold til artikel 64, stk. 8, i forordning (EF) nr. 1907/2006 (REACH) i anden halvdel af 2017
(2018/C 305/11)
Underudvalg I for frie varebevægelser
Til Det Blandede EØS-Udvalgs underretning
Under henvisning til Det Blandede EØS-Udvalgs afgørelse nr. 25/2008 af 14. marts 2008 opfordres Det Blandede EØS-Udvalg til på sit møde den 27. april 2018 at notere sig følgende lister over afgørelser om godkendelse truffet i perioden 1. juli-31. december 2017 på grundlag af artikel 64, stk. 8, i forordning (EF) nr. 1907/2006 (REACH):
BILAG
Liste over afgørelser om godkendelse
I perioden 1. juli-31. december 2017 er der i EØS/EFTA-staterne truffet følgende afgørelser om godkendelse i henhold til artikel 64, stk. 8, i forordning (EF) nr. 1907/2006 (REACH):
|
Stof |
Afgørelse truffet af Kommissionen i medfør af artikel 64, stk. 8, i forordning (EF) nr. 1907/2006 |
Land |
Dato for afgørelsen |
|
Ammoniumdichromat |
C(2017) 3237 |
Island |
7.7.2017 |
|
Natriumdichromat |
C(2017) 3453 |
Island |
7.7.2017 |
|
Natriumdichromat |
C(2017) 3764 |
Island |
7.7.2017 |
|
Natriumdichromat |
C(2017) 3765 |
Island |
7.7.2017 |
|
Natriumdichromat |
C(2017) 3801 |
Island |
7.7.2017 |
|
Natriumdichromat |
C(2017) 3806 |
Island |
7.7.2017 |
|
Natriumdichromat |
C(2017) 3816 |
Island |
7.7.2017 |
|
1,2-dichlorethan |
C(2017) 3821 |
Island |
7.7.2017 |
|
Kaliumdichromat |
C(2017) 3910 |
Island |
7.7.2017 |
|
Chromtrioxid og dichromtris(chromat) |
C(2017) 5001 |
Island |
5.10.2017 |
|
Chromtrioxid og dichromtris(chromat) |
C(2017) 5001 |
Liechtenstein |
4.9.2017 |
|
Chromtrioxid og dichromtris(chromat) |
C(2017) 5001 |
Norge |
18.8.2017 |
|
Bis(2-methoxyethyl)ether (diglym) |
C(2017) 5025 |
Island |
5.10.2017 |
|
Bis(2-methoxyethyl)ether (diglym) |
C(2017) 5025 |
Liechtenstein |
4.9.2017 |
|
Bis(2-methoxyethyl)ether (diglym) |
C(2017) 5025 |
Norge |
18.8.2017 |
|
Blychromat |
C(2017) 5012 |
Island |
5.10.2017 |
|
Blychromat |
C(2017) 5012 |
Liechtenstein |
4.9.2017 |
|
Blychromat |
C(2017) 5012 |
Norge |
18.8.2017 |
|
Chromtrioxid |
C(2017) 5880 |
Island |
5.10.2017 |
|
Chromtrioxid |
C(2017) 5880 |
Liechtenstein |
20.9.2017. |
|
Chromtrioxid |
C(2017) 5880 |
Norge |
25.9.2017 |
|
Chromtrioxid |
C(2017) 6727 |
Island |
9.11.2017 |
|
Chromtrioxid |
C(2017) 6727 |
Liechtenstein |
25.10.2017 |
|
Chromtrioxid |
C(2017) 6727 |
Norge |
8.11.2017 |
|
30.8.2018 |
DA |
Den Europæiske Unions Tidende |
C 305/15 |
Medicinske specialiteter — liste over markedsføringstilladelser udstedt af EØS-EFTA-staterne i anden halvdel af 2017
(2018/C 305/12)
Underudvalg I for frie varebevægelser
Til Det Blandede EØS-Udvalgs underretning
Under henvisning til afgørelse truffet af Det Blandede EØS-udvalg nr. 74/1999 af 28. maj 1999 opfordres Det Blandede EØS-udvalg til på sit møde den 23. marts 2018 at notere sig følgende lister over markedsføringstilladelser for medicinske specialiteter udstedt i perioden 1. juli-31. december 2017:
|
Bilag I |
Liste over nye markedsføringstilladelser |
|
Bilag II |
Liste over fornyede markedsføringstilladelser |
|
Bilag III |
Liste over udvidede markedsføringstilladelser |
|
Bilag IV |
Liste over tilbagetrukne markedsføringstilladelser |
|
Bilag V |
Liste over suspenderede markedsføringstilladelser |
BILAG I
Liste over nye markedsføringstilladelser
Følgende markedsføringstilladelser er blevet udstedt i EØS-EFTA-staterne i perioden 1. juli-31. december 2017:
|
EU-nummer |
Produkt |
Land |
Udstedelsesdato |
|
EU/1/02/226 |
InductOs |
Island |
18.8.2017 |
|
EU/1/15/999 |
Zykadia (switch to non-conditional) |
Liechtenstein |
31.8.2017 |
|
EU/1/16/1138 |
Venclyxto |
Liechtenstein |
31.12.2017 |
|
EU/1/16/1155 |
Kyntheum |
Island |
16.8.2017 |
|
EU/1/16/1155 |
Kyntheum |
Liechtenstein |
31.8.2017 |
|
EU/1/16/1155 |
Kyntheum |
Norge |
14.8.2017 |
|
EU/1/17/1179 |
Veltassa |
Island |
11.8.2017 |
|
EU/1/17/1179 |
Veltassa |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1179 |
Veltassa |
Norge |
9.8.2017 |
|
EU/1/17/1181 |
Spherox |
Island |
24.7.2017 |
|
EU/1/17/1181 |
Spherox |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1181 |
Spherox |
Norge |
13.9.2017 |
|
EU/1/17/1184 |
Riximyo |
Island |
11.7.2017 |
|
EU/1/17/1185 |
Rixathon |
Island |
11.7.2017 |
|
EU/1/17/1191 |
Dinutuximab beta Apeiron |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1194 |
Febuxostat Mylan |
Island |
11.7.2017 |
|
EU/1/17/1195 |
Erelzi |
Island |
14.7.2017 |
|
EU/1/17/1195 |
Erelzi |
Norge |
7.7.2017 |
|
EU/1/17/1196 |
Kevzara |
Island |
14.7.2017 |
|
EU/1/17/1196 |
Kevzara |
Norge |
5.7.2017 |
|
EU/1/17/1197 |
Oxervate |
Island |
24.7.2017 |
|
EU/1/17/1197 |
OXERVATE |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1197 |
OXERVATE |
Norge |
17.7.2017 |
|
EU/1/17/1199 |
Cuprior |
Island |
13.9.2017 |
|
EU/1/17/1199 |
Cuprior |
Liechtenstein |
31.10.2017 |
|
EU/1/17/1199 |
Cuprior |
Norge |
13.9.2017 |
|
EU/1/17/1200 |
Besponsa |
Island |
24.7.2017 |
|
EU/1/17/1200 |
Besponsa |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1200 |
Besponsa |
Norge |
13.7.2017 |
|
EU/1/17/1201 |
Skilarence |
Island |
14.7.2017 |
|
EU/1/17/1201 |
Skilarence |
Norge |
7.7.2017 |
|
EU/1/17/1202 |
Ucedane |
Island |
12.7.2017 |
|
EU/1/17/1202 |
Ucedane |
Norge |
5.7.2017 |
|
EU/1/17/1203 |
Insulin lispro Sanofi |
Island |
11.8.2017 |
|
EU/1/17/1203 |
Insulin Lispro Sanofi |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1203 |
Insulin lispro Sanofi |
Norge |
18.8.2017 |
|
EU/1/17/1205 |
Blitzima |
Island |
9.8.2017 |
|
EU/1/17/1205 |
Blitzima |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1205 |
Blitzima |
Norge |
1.8.2017 |
|
EU/1/17/1206 |
Tuxella |
Island |
9.8.2017 |
|
EU/1/17/1206 |
Tuxella |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1206 |
Tuxella |
Norge |
1.8.2017 |
|
EU/1/17/1207 |
Ritemvia |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1207 |
Ritemvia |
Island |
10.8.2017 |
|
EU/1/17/1207 |
Ritemvia |
Norge |
1.8.2017 |
|
EU/1/17/1208 |
Trimbow |
Island |
11.8.2017 |
|
EU/1/17/1208 |
Trimbow |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1208 |
Trimbow |
Norge |
9.8.2017 |
|
EU/1/17/1209 |
Reagila |
Island |
9.8.2017 |
|
EU/1/17/1209 |
Reagila |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1209 |
Reaglia |
Norge |
9.8.2017 |
|
EU/1/17/1210 |
Efavirenz/Emtricitabin/Tenofovirdisproksil Zentiva |
Norge |
8.8.2017 |
|
EU/1/17/1210 |
Efavirenz/Emtricitabine/Tenofovir disoproxil Zentiva |
Island |
10.8.2017 |
|
EU/1/17/1210 |
Efavirenz/Emtricitabine/Tenofovir disoproxil Zentiva |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1211 |
Entecavir Accord |
Island |
5.10.2017 |
|
EU/1/17/1211 |
Entecavir Accord |
Liechtenstein |
31.10.2017 |
|
EU/1/17/1211 |
Entecavir Accord |
Norge |
20.10.2017 |
|
EU/1/17/1212 |
Mavenclad |
Island |
13.9.2017 |
|
EU/1/17/1212 |
MAVENCLAD |
Norge |
30.8.2017 |
|
EU/1/17/1212 |
MAVENCLAD |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1213 |
Maviret |
Island |
17.8.2017 |
|
EU/1/17/1213 |
Maviret |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1213 |
Maviret |
Norge |
7.8.2017 |
|
EU/1/17/1214 |
Bavencio |
Island |
4.10.2017 |
|
EU/1/17/1214 |
Bavencio |
Liechtenstein |
31.10.2017 |
|
EU/1/17/1214 |
Bavencio |
Norge |
25.9.2017 |
|
EU/1/17/1215 |
Fotivda |
Island |
13.9.2017 |
|
EU/1/17/1215 |
Fotivda |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1215 |
Fotivda |
Norge |
31.8.2017 |
|
EU/1/17/1216 |
Imraldi |
Island |
12.9.2017 |
|
EU/1/17/1216 |
Imraldi |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1216 |
Imraldi |
Norge |
11.9.2017 |
|
EU/1/17/1217 |
Nitisinone MendeliKABS |
Island |
19.9.2017 |
|
EU/1/17/1217 |
Nitisinone MendeliKABS |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1217 |
Nitisinone MendeliKABS |
Norge |
1.9.2017 |
|
EU/1/17/1218 |
Rydapt |
Island |
4.10.2017 |
|
EU/1/17/1218 |
Rydapt |
Liechtenstein |
31.10.2017 |
|
EU/1/17/1218 |
Rydapt |
Norge |
25.9.2017 |
|
EU/1/17/1220 |
Tecentriq |
Liechtenstein |
31.10.2017 |
|
EU/1/17/1220 |
Tecentriq |
Norge |
27.9.2017 |
|
EU/1/17/1220 |
Tecentriq |
Island |
5.10.2017 |
|
EU/1/17/1221 |
Kisqali |
Island |
12.9.2017 |
|
EU/1/17/1221 |
Kisqali |
Norge |
30.8.2017 |
|
EU/1/17/1221 |
Kisqali |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1222 |
Efavirenz/Emtricitabine/Tenofovir disoproxil Mylan |
Island |
8.11.2017 |
|
EU/1/17/1222 |
Efavirenz/Emtricitabine/Tenofovir disoproxil Mylan |
Liechtenstein |
31.10.2017 |
|
EU/1/17/1222 |
Efavirenz/Emtricitabine/Tenofovir disoproxil Mylan |
Norge |
27.9.2017 |
|
EU/1/17/1223 |
Vosevi |
Island |
16.8.2017 |
|
EU/1/17/1223 |
Vosevi |
Liechtenstein |
31.8.2017 |
|
EU/1/17/1223 |
Vosevi |
Norge |
8.8.2017 |
|
EU/1/17/1224 |
Xermelo |
Island |
4.10.2017 |
|
EU/1/17/1224 |
Xermelo |
Liechtenstein |
31.10.2017 |
|
EU/1/17/1224 |
Xermelo |
Norge |
3.10.2017 |
|
EU/1/17/1225 |
Symtuza |
Island |
5.10.2017 |
|
EU/1/17/1225 |
Symtuza |
Liechtenstein |
31.10.2017 |
|
EU/1/17/1225 |
Symtuza |
Norge |
11.10.2017 |
|
EU/1/17/1226 |
Lutathera |
Island |
10.10.2017 |
|
EU/1/17/1226 |
Lutathera |
Liechtenstein |
31.10.2017 |
|
EU/1/17/1226 |
Lutathera |
Norge |
3.10.2017 |
|
EU/1/17/1227 |
Entecavir Mylan |
Island |
4.10.2017 |
|
EU/1/17/1227 |
Entecavir Mylan |
Liechtenstein |
31.10.2017 |
|
EU/1/17/1227 |
Entecavir Mylan |
Norge |
27.9.2017 |
|
EU/1/17/1228 |
Tookad |
Island |
29.11.2017 |
|
EU/1/17/1228 |
TOOKAD |
Liechtenstein |
31.12.2017 |
|
EU/1/17/1228 |
TOOKAD |
Norge |
22.11.2017 |
|
EU/1/17/1229 |
Dupixent |
Island |
10.10.2017 |
|
EU/1/17/1229 |
Dupixent |
Liechtenstein |
31.10.2017 |
|
EU/1/17/1229 |
Dupixent |
Norge |
10.10.2017 |
|
EU/1/17/1230 |
Lacosamide Accord |
Island |
5.10.2017 |
|
EU/1/17/1230 |
Lacosamide Accord |
Liechtenstein |
31.10.2017 |
|
EU/1/17/1230 |
Lacosamide Accord |
Norge |
27.9.2017 |
|
EU/1/17/1232 |
Miglustat Gen.Orph |
Island |
30.11.2017 |
|
EU/1/17/1232 |
Miglustat Gen.Orph |
Liechtenstein |
31.12.2017 |
|
EU/1/17/1232 |
Miglustat Gen.Orph |
Norge |
27.11.2017 |
|
EU/1/17/1233 |
Zubsolv |
Island |
29.11.2017 |
|
EU/1/17/1233 |
Zubsolv |
Liechtenstein |
31.12.2017 |
|
EU/1/17/1233 |
Zubsolv |
Norge |
22.11.2017 |
|
EU/1/17/1234 |
Tremfya |
Island |
4.12.2017 |
|
EU/1/17/1235 |
Zejula |
Island |
4.12.2017 |
|
EU/1/17/1235 |
Zejula |
Liechtenstein |
31.12.2017 |
|
EU/1/17/1235 |
Zejula |
Norge |
27.11.2017 |
|
EU/1/17/1236 |
Trelegy Ellipta |
Island |
30.11.2017 |
|
EU/1/17/1236 |
Trelegy Ellipta |
Liechtenstein |
31.12.2017 |
|
EU/1/17/1236 |
Trelegy Ellipta |
Norge |
22.11.2017 |
|
EU/1/17/1237 |
Elebrato Ellipta |
Island |
30.11.2017 |
|
EU/1/17/1237 |
Elebrato Ellipta |
Liechtenstein |
31.12.2017 |
|
EU/1/17/1237 |
Elebrato Ellipta |
Norge |
27.11.2017 |
|
EU/1/17/1238 |
Nyxoid |
Island |
29.11.2017 |
|
EU/1/17/1238 |
Nyxoid |
Liechtenstein |
31.12.2017 |
|
EU/1/17/1238 |
Nyxoid |
Norge |
27.11.2017 |
|
EU/1/17/1239 |
VeraSeal |
Island |
30.11.2017 |
|
EU/1/17/1239 |
VeraSeal |
Liechtenstein |
31.12.2017 |
|
EU/1/17/1239 |
VeraSeal |
Norge |
1.12.2017 |
|
EU/1/17/1240 |
Cyltezo |
Island |
29.11.2017 |
|
EU/1/17/1240 |
Cyltezo |
Liechtenstein |
31.12.2017 |
|
EU/1/17/1240 |
Cyltezo |
Norge |
1.12.2017 |
|
EU/1/17/1241 |
Ontruzant |
Island |
30.11.2017 |
|
EU/1/17/1241 |
Ontruzant |
Liechtenstein |
31.12.2017 |
|
EU/1/17/1241 |
Ontruzant |
Norge |
27.11.2017 |
|
EU/1/17/1242 |
Ritonavir Mylan |
Island |
29.11.2017 |
|
EU/1/17/1242 |
Ritonavir Mylan |
Liechtenstein |
31.12.2017 |
|
EU/1/17/1242 |
Ritonavir Mylan |
Norge |
22.11.2017 |
|
EU/1/17/1243 |
Imatinib Teva B.V. |
Island |
30.11.2017 |
|
EU/1/17/1243 |
Imatinib Teva B.V. |
Liechtenstein |
31.12.2017 |
|
EU/1/17/1243 |
Imatinib Teva B.V. |
Norge |
22.11.2017 |
|
EU/1/17/1244 |
Tacforius |
Liechtenstein |
31.12.2017 |
|
EU/2/16/197 |
CLYNAV |
Island |
13.7.2017 |
|
EU/2/16/197 |
CLYNAV |
Liechtenstein |
31.8.2017 |
|
EU/2/16/197 |
CLYNAV |
Norge |
18.7.2017 |
|
EU/2/17/211 |
Prevomax |
Island |
13.7.2017 |
|
EU/2/17/211 |
Prevomax |
Norge |
6.7.2017 |
|
EU/2/17/212 |
Exzolt |
Island |
30.8.2017 |
|
EU/2/17/212 |
Exzolt |
Liechtenstein |
31.10.2017 |
|
EU/2/17/212 |
Exzolt |
Norge |
15.9.2017 |
|
EU/2/17/213 |
Innovax-ND-IBD |
Island |
11.9.2017 |
|
EU/2/17/213 |
Innovax-ND-IBD |
Norge |
18.9.2017 |
|
EU/2/17/214 |
VEPURED |
Island |
12.9.2017 |
|
EU/2/17/214 |
VEPURED |
Norge |
15.9.2017 |
|
EU/2/17/215 |
Suvaxyn PRRS MLV |
Island |
11.9.2017 |
|
EU/2/17/215 |
Suvaxyn PRRS MLV |
Liechtenstein |
31.10.2017 |
|
EU/2/17/215 |
Suvaxyn PRRS MLV |
Norge |
18.9.2017 |
|
EU/2/17/217 |
Nobivac LeuFel |
Island |
9.11.2017 |
|
EU/2/17/217 |
Nobivac LeuFel |
Liechtenstein |
31.12.2017 |
|
EU/2/17/217 |
Nobivac LeuFel |
Norge |
14.11.2017 |
|
EU/2/17/218 |
Bovilis Blue-8 |
Island |
1.12.2017 |
|
EU/2/17/218 |
Bovilis Blue-8 |
Liechtenstein |
31.12.2017 |
|
EU/2/17/218 |
Bovilis Blue-8 |
Norge |
19.12.2017 |
BILAG II
Liste over fornyede markedsføringstilladelser
Følgende markedsføringstilladelser er blevet fornyet i EØS-EFTA-staterne i perioden 1. juli-31. december 2017:
|
EU-nummer |
Produkt |
Land |
Udstedelsesdato |
|
EU/1/07/401 |
alli |
Island |
14.7.2017 |
|
EU/1/07/401 |
alli |
Liechtenstein |
31.8.2017 |
|
EU/1/07/401 |
alli |
Norge |
5.7.2017 |
|
EU/1/07/402 |
Increlex |
Island |
12.7.2017 |
|
EU/1/07/402 |
INCRELEX |
Norge |
5.7.2017 |
|
EU/1/07/403 |
Atriance |
Island |
11.7.2017 |
|
EU/1/07/416 |
Ecalta |
Island |
13.9.2017 |
|
EU/1/07/416 |
Ecalta |
Liechtenstein |
31.10.2017 |
|
EU/1/07/416 |
Ecalta |
Norge |
22.9.2017 |
|
EU/1/07/421 |
Glubrava |
Island |
30.11.2017 |
|
EU/1/07/421 |
Glubrava |
Liechtenstein |
31.12.2017 |
|
EU/1/07/421 |
Glubrava |
Norge |
22.11.2017 |
|
EU/1/07/424 |
Torisel |
Island |
24.7.2017 |
|
EU/1/07/424 |
Torisel |
Liechtenstein |
31.8.2017 |
|
EU/1/07/424 |
Torisel |
Norge |
1.8.2017 |
|
EU/1/08/446 |
Privigen |
Island |
4.12.2017 |
|
EU/1/08/446 |
Privigen |
Liechtenstein |
31.12.2017 |
|
EU/1/08/446 |
Privigen |
Norge |
5.12.2017 |
|
EU/1/08/453 |
Prepandrix |
Island |
4.12.2017 |
|
EU/1/08/453 |
Prepandrix |
Liechtenstein |
31.12.2017 |
|
EU/1/08/453 |
Prepandrix |
Norge |
5.12.2017 |
|
EU/1/12/784 |
Cuprymina |
Island |
11.8.2017 |
|
EU/1/12/784 |
Cuprymina |
Liechtenstein |
31.8.2017 |
|
EU/1/12/784 |
Cuprymina |
Norge |
9.8.2017 |
|
EU/1/12/787 |
Revestive |
Island |
13.7.2017 |
|
EU/1/12/787 |
Revestive |
Norge |
5.7.2017 |
|
EU/1/12/788 |
Seebri Breezhaler |
Island |
11.8.2017 |
|
EU/1/12/788 |
Seebri Breezhaler |
Liechtenstein |
31.8.2017 |
|
EU/1/12/788 |
Seebri Breezhaler |
Norge |
9.8.2017 |
|
EU/1/12/789 |
Enurev Breezhaler |
Island |
24.7.2017 |
|
EU/1/12/789 |
Enurev Breezhaler |
Liechtenstein |
31.8.2017 |
|
EU/1/12/789 |
Enurev Breezhaler |
Norge |
9.8.2017 |
|
EU/1/12/790 |
Tovanor Breezhaler |
Island |
14.8.2017 |
|
EU/1/12/790 |
Tovanor Breezhaler |
Liechtenstein |
31.8.2017 |
|
EU/1/12/790 |
Tovanor Breezhaler |
Norge |
9.8.2017 |
|
EU/1/12/794 |
Adcetris |
Island |
4.12.2017 |
|
EU/1/12/794 |
ADCETRIS |
Liechtenstein |
31.12.2017 |
|
EU/1/12/794 |
ADCETRIS |
Norge |
27.11.2017 |
|
EU/1/12/795 |
Forxiga |
Island |
13.9.2017 |
|
EU/1/12/795 |
Forxiga |
Liechtenstein |
31.10.2017 |
|
EU/1/12/795 |
Forxiga |
Norge |
27.9.2017 |
|
EU/1/12/796 |
Picato |
Island |
24.7.2017 |
|
EU/1/12/796 |
Picato |
Liechtenstein |
31.8.2017 |
|
EU/1/12/796 |
Picato |
Norge |
8.8.2017 |
|
EU/1/12/797 |
Eylea |
Island |
10.8.2017 |
|
EU/1/12/797 |
Eylea |
Liechtenstein |
31.8.2017 |
|
EU/1/12/797 |
Eylea |
Norge |
18.8.2017 |
|
EU/1/12/798 |
Ibandronic acid Accord |
Island |
6.10.2017 |
|
EU/1/12/798 |
Ibandronic acid Accord |
Liechtenstein |
31.10.2017 |
|
EU/1/12/798 |
Ibandronic acid Accord |
Norge |
27.9.2017 |
|
EU/1/12/799 |
Memantine Merz |
Island |
24.7.2017 |
|
EU/1/12/799 |
Memantine Merz |
Liechtenstein |
31.8.2017 |
|
EU/1/12/799 |
Memantine Merz |
Norge |
9.8.2017 |
|
EU/1/12/800 |
Zoledronic Acid Hospira |
Island |
11.9.2017 |
|
EU/1/12/800 |
Zoledronic acid Hospira |
Liechtenstein |
31.8.2017 |
|
EU/1/12/800 |
Zoledronsyre Hospira |
Norge |
4.9.2017 |
|
EU/1/12/801 |
Constella |
Island |
14.9.2017 |
|
EU/1/12/801 |
Constella |
Liechtenstein |
31.10.2017 |
|
EU/1/12/801 |
Constella |
Norge |
22.9.2017 |
|
EU/1/12/802 |
Capecitabine medac |
Island |
12.7.2017 |
|
EU/1/12/803 |
NexoBrid |
Island |
30.11.2017 |
|
EU/1/12/803 |
NexoBrid |
Liechtenstein |
31.12.2017 |
|
EU/1/12/803 |
NexoBrid |
Norge |
11.12.2017 |
|
EU/1/12/805 |
AMYViD |
Island |
9.10.2017 |
|
EU/1/12/805 |
Amyvid |
Liechtenstein |
31.10.2017 |
|
EU/1/12/805 |
Amyvid |
Norge |
3.10.2017 |
|
EU/1/12/806 |
Ryzodeg |
Island |
4.10.2017 |
|
EU/1/12/806 |
Ryzodeg |
Liechtenstein |
31.10.2017 |
|
EU/1/12/806 |
Ryzodeg |
Norge |
10.10.2017 |
|
EU/1/12/807 |
Tresiba |
Island |
9.10.2017 |
|
EU/1/12/807 |
Tresiba |
Liechtenstein |
31.10.2017 |
|
EU/1/12/807 |
Tresiba |
Norge |
10.10.2017 |
|
EU/1/12/808 |
Imatinib Teva |
Island |
9.10.2017 |
|
EU/1/12/808 |
Imatinib Teva |
Liechtenstein |
31.10.2017 |
|
EU/1/12/808 |
Imatinib Teva |
Norge |
27.9.2017 |
|
EU/1/12/809 |
Betmiga |
Island |
6.10.2017 |
|
EU/1/12/809 |
Betmiga |
Liechtenstein |
31.10.2017 |
|
EU/1/12/809 |
Betmiga |
Norge |
3.10.2017 |
|
EU/1/12/811 |
Lyxumia |
Island |
6.10.2017 |
|
EU/1/12/811 |
Lyxumia |
Liechtenstein |
31.10.2017 |
|
EU/1/12/811 |
Lyxumia |
Norge |
9.10.2017 |
|
EU/1/12/812 |
Bexsero |
Island |
9.10.2017 |
|
EU/1/12/812 |
Bexsero |
Liechtenstein |
31.10.2017 |
|
EU/1/12/812 |
Bexsero |
Norge |
3.10.2017 |
|
EU/1/12/814 |
Zaltrap |
Island |
9.10.2017 |
|
EU/1/12/814 |
ZALTRAP |
Liechtenstein |
31.10.2017 |
|
EU/1/12/814 |
ZALTRAP |
Norge |
27.9.2017 |
|
EU/1/12/815 |
Selincro |
Island |
30.11.2017 |
|
EU/1/12/815 |
Selincro |
Liechtenstein |
31.12.2017 |
|
EU/1/12/815 |
Selincro |
Norge |
1.12.2017 |
|
EU/1/13/813 |
Perjeta |
Island |
19.12.2017 |
|
EU/1/13/813 |
Perjeta |
Liechtenstein |
31.12.2017 |
|
EU/1/13/817 |
Actelsar HCT |
Liechtenstein |
31.12.2017 |
|
EU/1/13/819 |
JETREA |
Island |
15.12.2017 |
|
EU/1/13/819 |
JETREA |
Liechtenstein |
31.12.2017 |
|
EU/1/13/819 |
JETREA |
Norge |
19.12.2017 |
|
EU/1/13/902 |
Translarna |
Island |
12.7.2017 |
|
EU/1/13/902 |
Translarna |
Norge |
5.7.2017 |
|
EU/1/14/987 |
Holoclar |
Island |
19.12.2017 |
|
EU/1/16/1094 |
Ninlaro |
Island |
6.10.2017 |
|
EU/1/16/1094 |
Ninlaro |
Liechtenstein |
31.10.2017 |
|
EU/1/16/1094 |
Ninlaro |
Norge |
26.9.2017 |
|
EU/1/16/1121 |
Zalmoxis |
Island |
24.7.2017 |
|
EU/1/16/1121 |
Zalmoxis |
Liechtenstein |
31.8.2017 |
|
EU/1/16/1121 |
Zalmoxis |
Norge |
4.8.2017 |
|
EU/1/16/1138 |
Venclyxto |
Island |
6.11.2017 |
|
EU/1/16/1138 |
Venclyxto |
Norge |
14.11.2017 |
|
EU/1/16/1139 |
Ocaliva |
Island |
8.12.2017 |
|
EU/1/16/1139 |
OCALIVA |
Liechtenstein |
31.12.2017 |
|
EU/1/16/1139 |
OCALIVA |
Norge |
18.12.2017 |
|
EU/1/16/1143 |
Lartruvo |
Island |
6.10.2017 |
|
EU/1/16/1143 |
Lartruvo |
Liechtenstein |
31.10.2017 |
|
EU/1/16/1143 |
Lartruvo |
Norge |
27.9.2017 |
|
EU/1/16/1169 |
Alecensa |
Island |
8.12.2017 |
|
EU/1/16/1169 |
Alecensa |
Liechtenstein |
31.12.2017 |
|
EU/1/16/1169 |
Alecensa |
Norge |
15.12.2017 |
|
EU/1/43/890 |
Cometriq |
Norge |
3.8.2017 |
|
EU/2/12/142 |
Cardalis |
Island |
4.7.2017 |
|
EU/2/12/144 |
Contacera |
Island |
5.12.2017 |
|
EU/2/12/144 |
Contacera |
Liechtenstein |
31.12.2017 |
|
EU/2/12/144 |
Contacera |
Norge |
15.12.2017 |
|
EU/2/12/145 |
Kexxtone |
Liechtenstein |
31.12.2017 |
|
EU/2/12/145 |
Kexxtone |
Norge |
28.12.2017 |
|
EU/2/12/147 |
Pexion |
Island |
5.12.2017 |
|
EU/2/12/147 |
Pexion |
Liechtenstein |
31.12.2017 |
|
EU/2/12/147 |
Pexion |
Norge |
6.12.2017 |
BILAG III
Liste over udvidede markedsføringstilladelser
Følgende markedsføringstilladelser er blevet udvidet i EØS-EFTA-staterne i perioden 1. juli-31. december 2017:
|
EU-nummer |
Produkt |
Land |
Udstedelsesdato |
|
EU/1/01/177/002 |
SonoVue |
Norge |
4.9.2017 |
|
EU/1/03/256/022 |
Humira |
Island |
19.12.2017 |
|
EU/1/03/256/022 |
Humira |
Norge |
10.11.2017 |
|
EU/1/04/292/013-015 |
Mimpara |
Island |
15.9.2017 |
|
EU/1/04/292/013-015 |
Mimpara |
Norge |
28.8.2017 |
|
EU/1/06/356/020-022 |
Exjade |
Norge |
28.11.2017 |
|
EU/1/06/356/020-022 |
Exjade |
Island |
1.12.2017 |
|
EU/1/07/418/011-013 |
Celsentri |
Norge |
3.8.2017 |
|
EU/1/07/418/011-013 |
Celsentri |
Island |
13.7.2017 |
|
EU/1/07/422/015 |
Tasigna |
Island |
4.12.2017 |
|
EU/1/07/422/015 |
Tasigna |
Norge |
28.11.2017 |
|
EU/1/07/436/006 |
Isentress |
Island |
9.8.2017 |
|
EU/1/07/436/006 |
Isentress |
Norge |
7.8.2017 |
|
EU/1/08/481/004-005 |
Kuvan |
Island |
10.8.2017 |
|
EU/1/08/481/004-005 |
Kuvan |
Norge |
13.7.2017 |
|
EU/1/09/522/003 |
ellaOne |
Island |
1.12.2017 |
|
EU/1/09/522/003 |
ellaOne |
Norge |
10.11.2017 |
|
EU/1/09/531/022-033 |
Instanyl |
Island |
6.11.2017 |
|
EU/1/09/539/005-006 |
Samsca |
Island |
5.10.2017 |
|
EU/1/09/539/005-006 |
Samsca |
Norge |
18.9.2017 |
|
EU/1/10/618 |
Prolia |
Norge |
27.9.2017 |
|
EU/1/11/703 |
Xgeva |
Norge |
27.9.2017 |
|
EU/1/12/753/018-019 |
Signifor |
Island |
4.10.2017 |
|
EU/1/12/753/018-019 |
Signifor |
Norge |
18.9.2017 |
|
EU/1/12/787/003 |
Revestive |
Norge |
5.7.2017 |
|
EU/1/12/787/003 |
Revestive |
Island |
13.7.2017 |
|
EU/1/13/846/002-003 |
Xtandi |
Norge |
3.10.2017 |
|
EU/1/13/846/002-003 |
Xtandi |
Island |
6.10.2017 |
|
EU/1/13/860/003 |
Nexium Control |
Island |
11.7.2017 |
|
EU/1/13/860/003 |
Nexium Control |
Norge |
5.7.2017 |
|
EU/1/15/1070/002 |
Oncaspar |
Island |
19.12.2017 |
BILAG IV
Liste over tilbagetrukne markedsføringstilladelser
Følgende markedsføringstilladelser er blevet trukket tilbage i EØS-EFTA-staterne i perioden 1. juli-31. december 2017:
|
EU-nummer |
Produkt |
Land |
Tilbagetrækningsdato |
|
EU/1/00/167 |
Prevenar |
Liechtenstein |
31.12.2017 |
|
EU/1/00/167 |
Prevenar |
Norge |
11.12.2017 |
|
EU/1/00/167 |
Prevenar |
Island |
1.12.2017 |
|
EU/1/07/394 |
Optaflu |
Norge |
18.10.2017 |
|
EU/1/07/398 |
Optimark |
Island |
10.10.2017 |
|
EU/1/09/561 |
Clopidogrel Teva Pharma |
Island |
11.7.2017 |
|
EU/1/11/674 |
Repso |
Liechtenstein |
31.8.2017 |
|
EU/1/11/674 |
Repso |
Norge |
8.8.2017 |
|
EU/1/11/674 |
Repso |
Island |
10.8.2017 |
|
EU/1/13/868 |
EVARREST |
Liechtenstein |
31.12.2017 |
|
EU/1/13/868 |
EVARREST |
Norge |
28.11.2017 |
|
EU/1/13/868 |
EVARREST |
Island |
4.12.2017 |
|
EU/1/14/976 |
Zontivity |
Liechtenstein |
31.8.2017 |
|
EU/1/15/996 |
Ristempa |
Liechtenstein |
31.10.2017 |
|
EU/1/15/996 |
Ristempa |
Norge |
9.10.2017 |
|
EU/1/15/996 |
Ristempa |
Island |
9.10.2017 |
|
EU/1/16/1113 |
Enzepi |
Island |
11.8.2017 |
|
EU/1/16/1113 |
Enzepi |
Liechtenstein |
31.8.2017 |
|
EU/1/16/1113 |
Enzepi |
Norge |
8.8.2017 |
BILAG V
Liste over suspenderede markedsføringstilladelser
Følgende markedsføringstilladelser er blevet suspenderet i EØS-EFTA-staterne i perioden 1. juli-31. december 2017:
|
EU-nummer |
Produkt |
Land |
Suspensionsdato |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V Øvrige meddelelser
ADMINISTRATIVE PROCEDURER
Det Europæiske Personaleudvælgelseskontor (EPSO)
|
30.8.2018 |
DA |
Den Europæiske Unions Tidende |
C 305/34 |
MEDDELELSE OM ALMINDELIG UDVÆLGELSESPRØVE
(2018/C 305/13)
Det Europæiske Personaleudvælgelseskontor (EPSO) afholder en almindelig udvælgelsesprøve
|
|
EPSO/AST-SC/07/18 — BEVÆBNEDE SIKKERHEDS- OG BESKYTTELSESMEDARBEJDERE (SC 1/SC 2) |
Meddelelsen om udvælgelsesprøve er offentliggjort på 24 sprog i Den Europæiske Unions Tidende C 305 A af 30. august 2018.
Yderligere oplysninger findes på EPSO's hjemmeside: https://epso.europa.eu/.
PROCEDURER VEDRØRENDE GENNEMFØRELSEN AF KONKURRENCEPOLITIKKEN
Europa-Kommissionen
|
30.8.2018 |
DA |
Den Europæiske Unions Tidende |
C 305/35 |
Anmeldelse af en planlagt fusion
(Sag M.9072 — KKR/Altice/SFR Filiale)
Behandles eventuelt efter den forenklede procedure
(EØS-relevant tekst)
(2018/C 305/14)
1.
Den 24. august 2018 modtog Kommissionen i overensstemmelse med artikel 4 i Rådets forordning (EF) nr. 139/2004 (1) anmeldelse af en planlagt fusion.Anmeldelsen vedrører virksomhederne:
|
— |
KKR & Co. Inc. (»KKR«, USA) |
|
— |
Altice France S.A. (»Altice«, Frankrig), der tilhører Altice-koncernen |
|
— |
SFR Filiale SAS (»SFR Filiale«), der kontrolleres af Altice. |
KKR og Altice erhverver fælles kontrol, jf. fusionsforordningens artikel 3, stk. 1, litra b), over hele SFR Filiale.
Den planlagte fusion gennemføres gennem opkøb af aktier.
2.
De deltagende virksomheder er aktive på følgende områder:— KKR: investeringsselskab, der tilbyder kapitalforvaltningstjenester og kapitalmarkedsløsninger
— Altice: tjenester inden for telekommunikation, indhold, medier, underholdning og reklame
— SFR Filiale: sendemastdelen af Altices datterselskab i Frankrig, SFR S.A.
3.
Efter en foreløbig gennemgang af sagen finder Kommissionen, at den anmeldte fusion muligvis er omfattet af fusionsforordningen. Den har dog endnu ikke taget endelig stilling hertil.Det bemærkes, at denne sag eventuelt vil blive behandlet efter den forenklede procedure i overensstemmelse med Kommissionens meddelelse om en forenklet procedure for behandling af bestemte fusioner efter Rådets forordning (EF) nr. 139/2004 (2).
4.
Kommissionen opfordrer hermed alle interesserede tredjeparter til at fremsætte eventuelle bemærkninger til den planlagte fusion.Alle bemærkninger skal være Kommissionen i hænde senest 10 dage efter offentliggørelsen af denne meddelelse. Angiv altid referencen:
M.9072 — KKR/Altice/SFR Filiale.
Bemærkningerne kan sendes til Kommissionen pr. e-mail, fax eller brev. Benyt venligst følgende kontaktoplysninger:
|
E-mail: COMP-MERGER-REGISTRY@ec.europa.eu |
|
Fax +32 22964301 |
|
Postadresse: |
|
Europa-Kommissionen |
|
Generaldirektoratet for Konkurrence |
|
Registreringskontoret for fusioner |
|
1049 Bruxelles/Brussel |
|
BELGIEN |
(1) EUT L 24 af 29.1.2004, s. 1 (»fusionsforordningen«).