BILAG III
KLARGØRING AF PRØVER OG KRAV TIL ANALYSEMETODER, DER ANVENDES VED KONTROL AF INDHOLDET AF DIOXINER (PCDD'ER/PCDF'ER) OG DIOXINLIGNENDE PCB'ER I VISSE FØDEVARER
1. ANVENDELSESOMRÅDE
Kravene i dette bilag anvendes, når fødevarer analyseres med henblik på offentlig kontrol af indholdet af 2,3,7,8-substituerede polychlorerede dibenzo-p-dioxiner og polychlorerede dibenzofuraner (PCDD'er/PCDF'er) og dioxinlignende polychlorerede biphenyler (dioxinlignende PCB'er) og i forbindelse med klargøring af prøver og krav til analyser til andre forskriftsmæssige formål, herunder kontrol udført af ledere af fødevarevirksomheder med henblik på at sikre overholdelse af bestemmelserne i artikel 4 i forordning (EF) nr. 852/2004.
Indholdet af PCDD'er/PCDF'er og dioxinlignende PCB'er i fødevarer kan overvåges ved to forskellige slags analysemetoder:
a) Screeningsmetoder
Målet med screeningsmetoder er at udvælge de stikprøver med indhold af PCDD'er/PCDF'er og dioxinlignende PCB'er, der overskrider grænse- eller indgrebsværdierne. Screeningsmetoder skal sikre omkostningseffektivitet og høj produktivitet med hensyn til antallet af screenede prøver, hvilket forbedrer mulighederne for at opdage nye hændelser, hvor høj eksponering kan føre til sundhedsrisici for forbrugerne. De anvendes for at undgå falsk overensstemmende resultater. De kan omfatte biologiske analysemetoder og GC/MS-metoder.
Screeningsmetoder sammenligner analyseresultatet med en afskæringsværdi ved at give et ja/nej-svar vedrørende mulig overskridelse af grænse- eller indgrebsværdien. Koncentrationen af PCDD'er/PCDF'er og summen af PCDD'er/PCDF'er og dioxinlignende PCB'er i prøver, der mistænkes for at være ikke-overensstemmende med grænseværdien, skal bestemmes/bekræftes ved en verifikationsmetode.
Screeningsmetoder kan desuden give en indikation af indholdet af PCDD'er/PCDF'er og dioxinlignende PCB'er i prøven. I tilfælde, hvor der anvendes bioanalytiske screeningsmetoder, udtrykkes resultatet som bioanalytiske ækvivalenter (BEQ), hvorimod det i tilfælde, hvor der anvendes fysisk-kemiske GC/MS-metoder, udtrykkes som toksicitetsækvivalenter (TEQ). De resultater af screeningsmetoder, der udtrykkes numerisk, egner sig som dokumentation for overensstemmelse eller mistænkt ikke-overensstemmelse eller overskridelse af indgrebsværdier og giver en indikation af værdiintervallet, i tilfælde af at prøverne følges op af verifikationsmetoder. De er ikke egnet i tilfælde, hvor formålet er f.eks. at evaluere baggrundsniveauer, vurdere indtaget, følge udviklingen i niveauer over tid eller at revurdere indgrebs- og grænseværdier.
b) Verifikationsmetoder
Verifikationsmetoder gør det muligt at give en entydig identifikation og kvantificering af PCDD'er/PCDF'er og dioxinlignende PCB'er i prøver og at tilvejebringe fuldstændige oplysninger om kongenere. Af den grund gør disse metoder det muligt at kontrollere grænse- og indgrebsværdier, herunder at bekræfte resultater opnået med screeningsmetoder. Endvidere kan resultater anvendes til andre formål som f.eks. til at bestemme lave baggrundsniveauer i forbindelse med overvågningen af fødevarer, følge udviklingen i niveauer over tid, vurdere befolkningens eksponering og til at opbygge en database til brug for en eventuel revurdering af indgrebs- og grænseværdier. De er også vigtige redskaber til at klarlægge kongenermønstre med henblik på at identificere kilden til en eventuel forurening. Sådanne metoder omfatter anvendelse af GC-HRMS. GC/MS-MS kan også anvendes til at bekræfte, om grænseværdierne er blevet overholdt eller ej.
2. BAGGRUND
Til beregning af koncentrationer af TEQ'er ganges koncentrationerne af de enkelte stoffer i en given prøve med deres respektive TEF, der er fastsat af Verdenssundhedsorganisationen, og som er anført i tillægget til dette bilag, og summen heraf giver den samlede koncentration af dioxinlignende forbindelser udtrykt i TEQ.
Screenings- og verifikationsmetoder må kun anvendes til kontrol af en bestemt matrix, hvis metoderne er tilstrækkeligt følsomme til på pålidelig vis at påvise forekomst ved grænse- eller indgrebsværdien.
3. KVALITETSSIKRINGSKRAV
|
— |
Der skal træffes foranstaltninger for at undgå krydskontaminering i alle faser af prøveudtagnings- og analyseproceduren. |
|
— |
Prøverne skal opbevares og transporteres i beholdere af glas, aluminium, polypropylen eller polyethylen, som egner sig til opbevaring, uden at mængden af PCDD'er/PCDF'er og dioxinlignende PCB'er i prøverne påvirkes. Spor af papirstøv fjernes fra prøvebeholderen. |
|
— |
Opbevaring og transport af fødevareprøven skal foregå, så den ikke forringes. |
|
— |
Alle laboratorieprøver finmales og blandes grundigt, hvis det er relevant, efter en metode, for hvilken det er godtgjort, at den resulterer i fuldstændig homogenisering (f.eks. så prøven kan sigtes gennem en 1 mm-sigte); prøverne tørres før formalingen, hvis vandindholdet er for højt. |
|
— |
Det er altid vigtigt at kontrollere, at reagenser, glasudstyr og andet udstyr ikke påvirker TEQ- eller BEQ-baserede resultater. |
|
— |
Der foretages en blindprøveanalyse ved at gennemføre hele analyseproceduren, blot med udeladelse af prøven. |
|
— |
For så vidt angår bioanalytiske metoder er det meget vigtigt at kontrollere, at alt glasudstyr og alle opløsningsmidler, der anvendes til analyser, er fri for forbindelser, der interfererer med påvisningen af målforbindelser i måleområdet. Glasudstyr skylles med opløsningsmidler og/eller opvarmes til temperaturer, der er tilstrækkeligt høje til at fjerne spor af PCDD'er/PCDF'er, dioxinlignende forbindelser og interfererende forbindelser fra udstyrets overflader. |
|
— |
Den prøvemængde, der anvendes til ekstraktionen, skal være tilstrækkelig til, at kravene vedrørende et tilstrækkelig lavt måleområde, herunder koncentrationer af grænse- eller indgrebsværdier, er opfyldt. |
|
— |
De specifikke procedurer for klargøring af prøver, som anvendes for de pågældende produkter, skal være i overensstemmelse med internationalt anerkendte retningslinjer. |
|
— |
Når det drejer sig om fisk, fjernes skindet, da grænseværdien gælder for muskelkød uden skind. Det er imidlertid nødvendigt, at alle rester af muskelkød og fedtvæv på indersiden af skindet omhyggeligt skrabes fuldstændig af skindet, og at disse rester indgår i den prøve, der skal analyseres. |
4. KRAV TIL LABORATORIER
|
— |
I henhold til forordning (EF) nr. 882/2004 skal laboratorier være akkrediteret af et anerkendt organ, der fungerer i overensstemmelse med ISO-vejledning 58, så det sikres, at de anvender analysekvalitetssikring. Laboratorier akkrediteres i overensstemmelse med EN ISO/IEC 17025-standarden. Principperne som beskrevet i »Technical Guidelines for the estimation of measurement uncertainty and limits of quantification for PCDD/F and PCB analysis« skal følges, hvis det er relevant (1). |
|
— |
Laboratoriets præstationer dokumenteres ved løbende, vellykket deltagelse i laboratoriesammenligninger vedrørende bestemmelse af PCDD'er/PCDF'er og dioxinlignende PCB'er i de relevante fødevarematrixer og koncentrationsområder. |
|
— |
Laboratorier, der anvender screeningsmetoder til rutinemæssig kontrol af prøver, skal etablere et tæt samarbejde med laboratorier, der anvender verifikationsmetoden — både i forbindelse med kvalitetskontrol og til at bekræfte analyseresultater for mistænkte prøver. |
5. GRUNDLÆGGENDE KRAV TIL PROCEDURER FOR ANALYSE AF DIOXINER (PCDD'ER/PCDF'ER) OG DIOXINLIGNENDE PCB'ER
5.1. Lavt måleområde og bestemmelsesgrænser
|
— |
For PCDD'er/PCDF'er skal de påviselige mængder befinde sig i det øvre femtogram-interval (10- 15g) på grund af visse af disse forbindelsers ekstremt høje toksicitet. For de fleste PCB-kongenere er det tilstrækkeligt med en bestemmelsesgrænse i nanogram-intervallet (10- 9g). Til måling af de mere toksiske dioxinlignende PCB-kongenere (især non-ortho-substituerede kongenere) skal den nedre del af måleområdet dog ligge i den nedre del af pikogram-intervallet (10- 12g). |
5.2. Høj selektivitet (specificitet)
|
— |
PCDD'er/PCDF'er og dioxinlignende PCB'er skal kunne skelnes fra en lang række andre ledsagestoffer, der er fremkommet ved ekstraktionen, og som muligvis er interfererende forbindelser i koncentrationer, der er op til mange gange højere end analyttens. For gaskromatografi/massespektrometri (GC/MS)-metoders vedkommende skal der kunne skelnes mellem forskellige kongenere, f.eks. mellem toksiske kongenere (f.eks. de sytten 2,3,7,8-substituerede PCDD'er/PCDF'er og tolv dioxinlignende PCB'er) og andre kongenere. |
|
— |
Bioanalytiske metoder skal kunne påvise målforbindelserne som summen af PCDD'er/PCDF'er og/eller dioxinlignende PCB'er. Ved oprensningen af prøver skal det tilstræbes at fjerne forbindelser, der giver falsk ikke-overensstemmende resultater, og forbindelser, der kan svække responset og give falsk overensstemmende resultater. |
5.3. Høj nøjagtighed (korrekthed og præcision, tilsyneladende bioassay-genfinding)
|
— |
For så vidt angår GC/MS-metoder skal bestemmelsen give et pålideligt skøn over den korrekte koncentration i en prøve. Høj nøjagtighed (målingens nøjagtighed: graden af overensstemmelse mellem måleresultatet og den målte genstands sande eller tillagte værdi) er nødvendig for at undgå, at et resultat af en analyse afvises på grundlag af lav pålidelighed af det bestemte TEQ-niveau. Nøjagtighed udtrykkes som korrekthed (forskellen mellem den målte middelværdi for en analyt i et certificeret materiale og dens certificerede værdi, udtrykt i procent af den certificerede værdi) og præcision (RSDR, relativ standardafvigelse beregnet ud fra resultater, der er fremkommet under reproducerbarhedsforhold). |
|
— |
For bioanalytiske metoder bestemmes den tilsyneladende bioassay-genfinding. |
5.4. Validering inden for grænseværdiintervallet og kvalitetskontrol generelt
|
— |
Laboratorierne skal dokumentere en metodes ydeevne inden for grænseværdiintervallet, f.eks. 0,5, 1 og 2 gange grænseværdien med en acceptabel variationskoefficient for gentagne analyser, som led i valideringsproceduren og/eller i forbindelse med rutinemæssige analyser. |
|
— |
Som interne kvalitetskontrolforanstaltninger skal der regelmæssigt gennemføres blindprøvekontrol og spikingforsøg eller analyse af kontrolprøver (om muligt med certificeret referencemateriale). Kvalitetskontrolkort til blindprøvekontrol, spikingforsøg eller analyser af kontrolprøver registreres og kontrolleres for at sikre, at den analytiske ydeevne er i overensstemmelse med gældende krav. |
5.5. Bestemmelsesgrænse
|
— |
For så vidt angår bioanalytiske screeningsmetoder er fastlæggelse af bestemmelsesgrænsen (LOQ) ikke et ufravigeligt krav, men det skal godtgøres, at metoden gør det muligt at skelne blindprøveværdien fra afskæringsværdien. I forbindelse med fastlæggelsen af et BEQ-niveau fastsættes et rapporteringsniveau med henblik på håndtering af prøver, som giver et respons under dette niveau. Det skal dokumenteres, at rapporteringsniveauet adskiller sig fra procedureblindprøver med som minimum en faktor tre, med et respons under måleområdet. Det skal derfor beregnes ud fra prøver med et indhold af målforbindelserne omkring det krævede minimumsniveau og ikke ud fra et bestemt signal-støj-forhold eller en assay-blindprøve. |
|
— |
Bestemmelsesgrænsen (LOQ) for en verifikationsmetode skal være på ca. en femtedel af grænseværdien. |
5.6. Analysekriterier
|
— |
For at sikre pålidelige resultater af verifikationsmetoder eller screeningsmetoder skal følgende kriterier være opfyldt inden for grænseværdien for henholdsvis TEQ- eller BEQ-værdien, bestemt enten som samlet TEQ/samlet BEQ (som summen af PCDD'er/PCDF'er og dioxinlignende PCB'er) eller separat for henholdsvis PCDD'er/PCDF'er og dioxinlignende PCB'er. |
|
|
Screening efter bioanalytiske eller fysisk-kemiske metoder |
Verifikationsmetoder |
|
Andel af falsk overensstemmende (*1) |
< 5 % |
|
|
Korrekthed |
|
– 20 % to + 20 % |
|
Repeterbarhed (RSDr) |
< 20 % |
|
|
Intermediær præcision (RSDR) |
< 25 % |
< 15 % |
5.7. Specifikke krav til screeningsmetoder
|
— |
Både GC/MS-metoder og bioanalytiske metoder kan anvendes til screening. For GC/MS-metoder anvendes kravene i punkt 6. Der er fastsat specifikke krav til cellebaserede bioanalytiske metoder i punkt 7. |
|
— |
Laboratorier, der anvender screeningsmetoder til rutinemæssig kontrol af prøver, skal etablere et tæt samarbejde med laboratorier, der anvender verifikationsmetoden. |
|
— |
Screeningsmetodens ydeevne skal efterprøves i forbindelse med rutinemæssige analyser, ved analysekvalitetskontrol og ved løbende metodevalidering. Der skal opereres med et fast program for kontrol af overensstemmende resultater. |
|
— |
Kontrol af eventuel hæmning af celleresponset og cytotoxicitet. 20 % af prøveekstrakterne måles i forbindelse med rutinemæssig screening med og uden TCDD tilsat i overensstemmelse med grænse- eller indgrebsværdien med henblik på at kontrollere, om responset måske hæmmes af interfererende stoffer i prøveekstraktet. Den målte koncentration af den spikede prøve sammenholdes med summen af koncentrationen af det ikke-spikede ekstrakt og spikingkoncentrationen. Hvis denne målte koncentration er over 25 % mindre end den beregnede (sum-)koncentration, er dette en indikation af mulig signalhæmning, og den pågældende prøve skal underkastes en verifikationsanalyse. Resultaterne registreres i kvalitetskontrolkort. |
|
— |
Kvalitetskontrol af overensstemmende prøver. Ca. 2 % til 10 % af de overensstemmende prøver, afhængigt af prøvematrix og laboratoriets erfaring, skal bekræftes. |
|
— |
Bestemmelse af andelen af falsk overensstemmende resultater fra kvalitetskontroldata. Andelen af falsk overensstemmende resultater fra screening af prøver, der ligger under og over grænse- eller indgrebsværdierne, skal bestemmes. Den faktiske andel af falsk overensstemmende resultater skal ligge under 5 %. Når der foreligger mindst 20 bekræftede resultater pr. matrix/matrixgruppe fra kvalitetskontrollen af overensstemmende prøver, drages konklusionerne vedrørende andelen af falsk overensstemmende resultater på grundlag af denne database. Resultaterne fra prøver, der er analyseret i ringtest eller i forbindelse med forureningshændelser, og som dækker et koncentrationsområde på op til f.eks. 2 gange grænseværdien, kan også tælles med i de mindst 20 resultater, der skal lægges til grund for evalueringen af andelen af falsk overensstemmende resultater. Prøverne skal dække de mest almindelige kongenermønstre og repræsentere forskellige kilder. Selv om screeningsassays fortrinsvis skal have til formål at påvise prøver, for hvilke indgrebsværdien er overskredet, er kriteriet for bestemmelse af andelen af falsk overensstemmende resultater grænseværdien, under hensyntagen til måleusikkerheden ved verifikationsmetoden. |
|
— |
Eventuelle ikke-overensstemmende resultater fra screeninger skal altid verificeres ved en fuldstændig ny analyse af den originale prøve ved en verifikationsmetode. Disse prøver kan også anvendes til at evaluere andelen af falsk ikke-overensstemmende resultater. For screeningsmetoder er andelen af falsk ikke-overensstemmende resultater andelen af resultater, for hvilke det ved hjælp af verifikationsanalyse er bekræftet, at de opfylder kravene (dvs. er overensstemmende), efter at prøven i en tidligere screening har været mistænkt for at være ikke-overensstemmende. Vurderingen af screeningsmetodens hensigtsmæssighed skal dog baseres på sammenholdelse af antallet af falsk ikke-overensstemmende prøver med det samlede antal kontrollerede prøver. Denne andel skal være tilstrækkeligt lille til, at screening med fordel kan anvendes. |
|
— |
Bioanalytiske metoder skal, i det mindste under valideringsbetingelser, give en brugbar indikation af TEQ-niveauet, beregnet og udtrykt som BEQ. |
|
— |
Også for bioanalytiske metoder, der gennemføres under repeterbarhedsbetingelser, er den interne RSDr typisk lavere end reproducerbarheden RSDR. |
6. SPECIFIKKE KRAV, SOM GC-MS-METODER SKAL OPFYLDE MED HENBLIK PÅ SCREENING ELLER VERIFIKATION
6.1. Acceptable differencer mellem de øvre og de nedre WHO-TEQ-niveauer
|
— |
For at bekræfte, at grænseværdierne eller om nødvendigt, indgrebsværdierne overskrides, må differencen mellem den øvre og den nedre koncentration ikke overstige 20 %. |
6.2. Genfindingskontrol
|
— |
For at validere analyseproceduren tilsættes 13C-mærkede 2,3,7,8-chlorsubstituerede PCDD'er/PCDF'er og 13C-mærkede dioxinlignende PCB'er som intern standard helt fra begyndelsen af analysen, f.eks. inden ekstraktion. Der tilsættes mindst én kongener for hver af de tetra- til octa-chlorerede homologe grupper af PCDD'er/PCDF'er og mindst én kongener for hver af de homologe grupper af dioxinlignende PCB'er (alternativt tilsættes mindst én kongener for hver massespektrometrisk udvalgt ionregistreringsfunktion, der anvendes til overvågning af PCDD'er/PCDF'er og dioxinlignende PCB'er). For så vidt angår verifikationsmetoder anvendes alle 17 13C-mærkede 2,3,7,8-substituerede PCDD'er/PCDF'er og alle 12 13C-mærkede dioxinlignende PCB'er som intern standard. |
|
— |
Der bestemmes også relative responsfaktorer for de kongenere, som der ikke tilsættes en 13C-mærket analog for, ved hjælp af relevante kalibreringsopløsninger. |
|
— |
For vegetabilske fødevarer og animalske fødevarer, der indeholder under 10 % fedt, er det obligatorisk at tilsætte interne standarder inden ekstraktionen. For animalske fødevarer, der indeholder over 10 % fedt, kan de interne standarder tilsættes enten før eller efter fedtekstraktionen. Der foretages en hensigtsmæssig validering af ekstraktionseffektiviteten, afhængigt af det trin, hvor de interne standarder tilsættes, og af, om resultaterne er produktbaserede eller fedtbaserede. |
|
— |
Inden GC/MS-analyse tilsættes en eller to genfindingsstandarder (surrogat). |
|
— |
Det er nødvendigt med genfindingskontrol. Niveauet for genfinding af de enkelte interne standarder ved verifikationsmetoder skal ligge på mellem 60 og 120 %. Lavere eller højere genfinding for enkeltkongenere, navnlig for visse hepta- og octa-chlorerede dibenzo-p-dioxiner og dibenzofuraner, kan accepteres, på betingelse af at deres bidrag til TEQ-værdien ikke udgør mere end 10 % af den samlede TEQ-værdi (baseret på summen af PCDD'er/PCDF'er og dioxinlignende PCB'er). Niveauet for genfinding ved GC-MS-screeningsmetoder skal ligge på mellem 30 og 140 %. |
6.3. Fjernelse af interfererende stoffer
|
— |
PCDD'er/PCDF'er skal separeres fra interfererende chlorerede forbindelser som f.eks. ikke-dioxinlignende PCB'er og chlorerede diphenylethere ved hjælp af egnede kromatografiske metoder (helst med florisil-, alumina- og/eller carbonkolonne). |
|
— |
Det er tilstrækkeligt med gaskromatografisk separation af isomerer (< 25 % målt mellem toppene for 1,2,3,4,7,8-HxCDF og 1,2,3,6,7,8-HxCDF). |
6.4. Kalibrering med standardkurve
|
— |
Kalibreringskurveintervallet skal dække de relevante grænse- eller indgrebsværdiintervaller. |
6.5. Specifikke kriterier for verifikationsmetoder
|
— |
For så vidt angår GC/HRMS:
|
|
— |
For så vidt angår GC/MS-MS:
|
7. SPECIFIKKE KRAV TIL BIOANALYTISKE METODER
Bioanalytiske metoder er metoder, der er baseret på anvendelse af biologiske principper, såsom cellebaserede assays, receptorassays eller immunassays. Dette punkt indeholder krav til bioanalytiske metoder generelt.
Med en screeningsmetode klassificeres en prøve principielt som overensstemmende eller som mistænkt for at være ikke-overensstemmende. I det øjemed sammenholdes det beregnede BEQ-niveau med afskæringsværdien (jf. punkt 7.3). Prøver, der giver resultater under afskæringsværdien, erklæres for overensstemmende, mens prøver, der ligger på eller over afskæringsværdien, erklæres for værende mistænkt for at være ikke-overensstemmende og nødvendiggør analyse efter en verifikationsmetode. I praksis kan et BEQ-niveau på to tredjedele af grænseværdien være en afskæringsværdi, hvis der sikres en andel af falsk overensstemmende resultater på under 5 % og en acceptabel andel af falsk ikke-overensstemmende resultater. Med særskilte grænseværdier for henholdsvis PCDD'er/PCDF'er og for summen af PCDD'er/PCDF'er og dioxinlignende PCB'er er passende bioassay-afskæringsværdier for PCDD'er/PCDF'er en forudsætning for at kunne kontrollere prøvernes overensstemmelse uden fraktionering. Til kontrol af prøver, for hvilke indgrebsværdierne er overskredet, vil en passende procentdel af den pågældende indgrebsværdi være en egnet afskæringsværdi.
Hvis der fastsættes et vejledende niveau udtrykt i BEQ, skal resultaterne af prøven angives i måleområdet og over rapporteringsgrænsen (jf. punkt 7.1.1 og 7.1.6).
7.1. Evaluering af testresponset
7.1.1. Generelle krav
|
— |
Ved beregning af koncentrationerne ud fra en TCDD-kalibreringskurve vil værdierne i den øverste del af kurven vise en stor spredning (en høj variationskoefficient (CV)). Måleområdet er det område, hvor CV er under 15 %. Den nedre del af måleområdet (rapporteringsniveauet) skal endvidere sættes væsentligt højere (som minimum med en faktor tre) end procedureblindprøverne. Den øvre del af måleområdet er normalt repræsenteret ved EC70-værdien (70 % af den højeste effektive koncentration), men er lavere, hvis CV ligger over 15 % inden for dette interval. Måleområdet skal fastsættes i forbindelse med validering. Afskæringsværdierne (jf. punkt 7.3) skal ligge klart inden for måleområdet. |
|
— |
Standardopløsninger og prøveekstrakter testes tre eller mindst to gange. Ved dobbeltbestemmelse skal en standardopløsning eller et kontrolekstrakt, der testes i fire til seks huller fordelt over hele pladen, give et respons eller en koncentration (kun muligt i måleområdet) baseret på en CV på < 15 %. |
7.1.2. Kalibrering
7.1.2.1. Kalibrering med standardkurve
|
— |
Indholdet i prøver kan anslås ved at sammenholde testresponset med en kalibreringskurve for TCDD (eller PCB 126 eller en standardblanding af PCDD/PCDF/dioxinlignende PCB) med henblik på at beregne BEQ-niveauet i ekstraktet og efterfølgende i prøven. |
|
— |
Kalibreringskurver skal indbefatte otte til 12 koncentrationer (som minimum dobbeltbestemmelser), idet der skal være tilstrækkeligt med koncentrationer i den nederste del af kurven (måleområdet). Der lægges særlig vægt på kvaliteten af kurvetilpasningen i måleområdet. R2-værdien er som sådan af begrænset eller slet ingen værdi som grundlag for en goodness-of-fit-vurdering ved ikke-lineær regression. Der opnås et bedre fit ved at minimere forskellen mellem beregnede og observerede niveauer i kurvens måleområde (f.eks. ved at minimere summen af kvadrerede residualer). |
|
— |
Det anslåede indhold i prøveekstraktet korrigeres efterfølgende for det BEQ-niveau, der er beregnet for en matrix/opløsningsmiddel-blindprøve (for at tage urenheder fra de anvendte opløsningsmidler og kemikalier i betragtning), og den tilsyneladende genfinding (som beregnes ud fra BEQ-niveauet i passende referenceprøver med repræsentative kongenermønstre omkring grænse- eller indgrebsværdien). Til korrektion for genfinding skal den tilsyneladende genfinding altid ligge inden for det krævede interval (jf. punkt 7.1.4.). Referenceprøver, der anvendes til korrektion for genfinding, skal opfylde kravene i punkt 7.2. |
7.1.2.2. Kalibrering med referenceprøver
Alternativt kan der anvendes en kalibreringskurve fremstillet på grundlag af mindst fire referenceprøver (jf. punkt 7.2): 1 matrixblindprøve plus 3 referenceprøver på 0,5, 1,0 og 2,0 gange grænse- eller indgrebsværdien), hvorved behovet for at korrigere for blindprøve og genfinding bortfalder, hvis referenceprøvernes matrix svarer til de ukendte prøvers matrix. I dette tilfælde kan det testrespons, som svarer til to tredjedele af grænseværdien (jf. punkt 7.3), beregnes direkte ud fra disse prøver og anvendes som afskæringsværdi. Til kontrol af prøver, for hvilke indgrebsværdierne er overskredet, vil en passende procentdel af disse indgrebsværdier være en egnet afskæringsværdi.
7.1.3. Separat bestemmelse af henholdsvis PCDD'er/PCDF'er og dioxinlignende PCB'er
Ekstrakter kan opdeles i fraktioner indeholdende henholdsvis PCDD'er/PCDF'er og dioxinlignende PCB'er, således at TEQ-niveauet (i BEQ) kan angives særskilt for henholdsvis PCDD'er/PCDF'er og dioxinlignende PCB'er. Der anvendes fortrinsvis en PCB 126-standardkalibreringskurve til at evaluere resultaterne for den fraktion, der indeholder dioxinlignende PCB'er.
7.1.4. Tilsyneladende bioassay-genfinding
Den »tilsyneladende bioassay-genfinding« beregnes ud fra passende referenceprøver med repræsentative kongenermønstre omkring grænse- eller indgrebsværdien og udtrykkes som procent af BEQ-niveauet i forhold til TEQ-niveauet. Forskellene mellem TEF- og REP-faktorer for dioxinlignende PCB'er kan, afhængigt af hvilken type assay og TEF'er (2) der anvendes, resultere i lave tilsyneladende genfindingsprocenter for dioxinlignende PCB'er i forhold til PCDD'er/PCDF'er. Hvis PCDD'er/PCDF'er og dioxinlignende PCB'er bestemmes separat, er den tilsyneladende bioassay-genfinding derfor 20-60 % for dioxinlignende PCB'er og 50-130 % for PCDD'er/PCDF'er (disse intervaller gælder for TCDD-kalibreringskurven). Eftersom dioxinlignende PCB'ers bidrag til summen af PCDD'er/PCDF'er og dioxinlignende PCB'er kan variere afhængigt af forskellige matrixer og prøver, afspejler den tilsyneladende bioassay-genfinding for sumparameteren disse intervaller og skal være på 30-130 %.
7.1.5. Kontrol af genfinding efter oprensning
Tabet af forbindelser under oprensningen kontrolleres i forbindelse med validering. En blindprøve tilsat en blanding af de forskellige kongenere underkastes oprensning (mindst n = 3), og genfinding og variabilitet kontrolleres efter en verifikationsmetode. Genfindingen skal være på mellem 60 og 120 %, især for kongenere, der bidrager med over 10 % af TEQ-niveauet i forskellige blandinger.
7.1.6. Rapporteringsgrænse
Ved indberetning af BEQ-niveauer fastlægges der en rapporteringsgrænse ud fra relevante matrixprøver med typiske kongenermønstre, men ikke ud fra standardernes kalibreringskurve, idet præcisionen i den nederste del af kurven er lav. Der tages hensyn til virkningerne af ekstraktion og oprensning. Rapporteringsgrænsen sættes væsentligt højere (som minimum med en faktor tre) end procedureblindprøverne.
7.2. Anvendelse af referenceprøver
|
— |
Referenceprøver skal repræsentere prøvematrix, kongenermønstre og koncentrationsområder for PCDD'er/PCDF'er og dioxinlignende PCB'er omkring grænse- og indgrebsværdien. |
|
— |
Hver analyserække skal omfatte en procedureblindprøve, eller hellere en matrixblindprøve, og en referenceprøve inden for grænse- eller indgrebsværdien. Disse prøver ekstraheres og analyseres samtidig under identiske betingelser. Referenceprøven skal udvise en klart kraftigere reaktion end blindprøven, så der er sikkerhed for testens egnethed. Prøverne kan anvendes til korrektion for blindprøve og genfinding. |
|
— |
Referenceprøver, der udvælges til korrektion for genfinding, skal være repræsentative for de klargjorte prøver, hvilket betyder, at bestemte kongenermønstre ikke må føre til, at niveauerne vurderes for lavt. |
|
— |
Der kan inkluderes ekstra referenceprøver på f.eks. 0,5 og 2 gange grænse- eller indgrebsværdien for at vise analysemetodens ydeevne inden for det interval, der er relevant for kontrollen af grænse- eller indgrebsværdien. Kombineret kan disse prøver anvendes til beregning af BEQ-niveauerne i de klargjorte prøver (jf. punkt 7.1.2.2). |
7.3. Fastlæggelse af afskæringsværdier
Relationen mellem bioanalytiske resultater i BEQ og resultater fra verifikationsmetoder i TEQ fastlægges (f.eks. ved hjælp af matrixtilpassede kalibreringsforsøg med referenceprøver tilsat 0, 0,5, 1 og 2 gange grænseværdien, med seks gentagelser på hvert niveau (n = 24)). Korrektionsfaktorer (blindprøve og genfinding) kan beregnes skønsmæssigt ud fra dette forhold, men skal efterprøves i hver enkelt analyserække, ved at der inkluderes procedure/matrix-blindprøver og genfindingsprøver (jf. punkt 7.2).
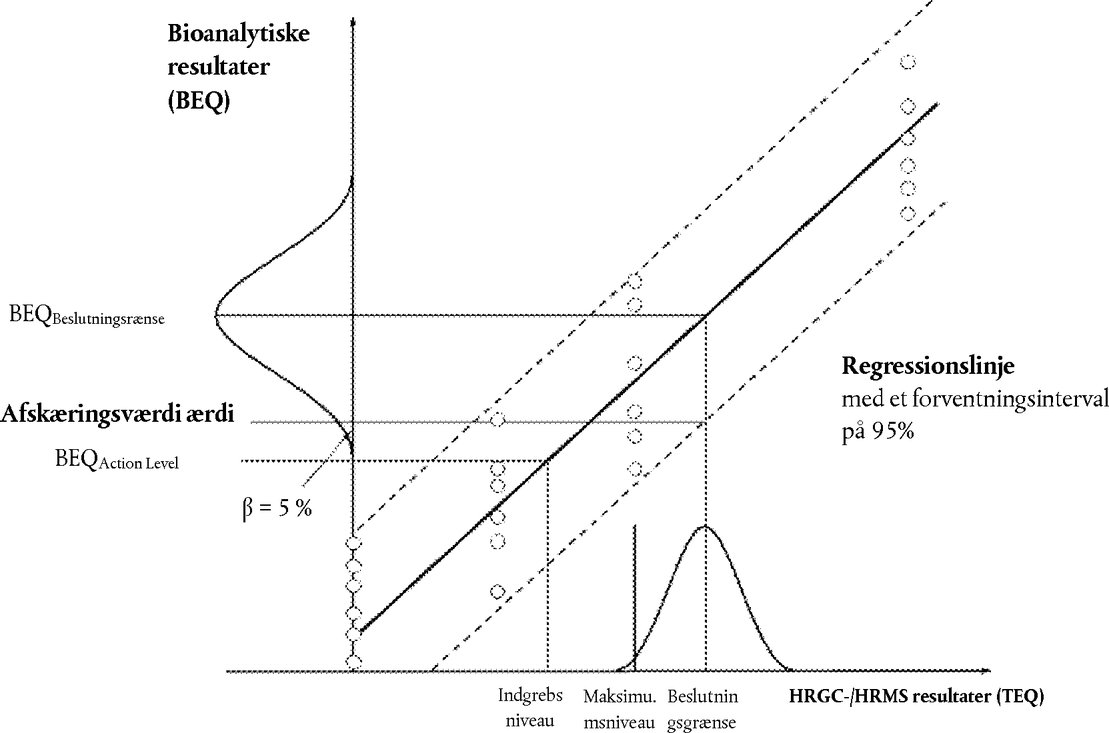
Der fastlægges afskæringsværdier for at kunne afgøre, om en prøve overholder de fastsatte grænseværdier, eller for, hvor det er relevant, at kunne kontrollere indgrebsværdierne i forhold til de relevante grænse- eller indgrebsværdier, der er fastsat for enten PCDD'er/PCDF'er og dioxinlignende PCB'er hver for sig eller for summen af PCDD'er/PCDF'er og dioxinlignende PCB'er. De repræsenteres ved det nedre endepunkt i fordelingen af bioanalytiske resultater (korrigeret for blindprøve og genfinding), som svarer til verifikationsmetodens beslutningsgrænse, med et konfidensniveau på 95 %, hvilket indebærer en falsk-overensstemmende andel på < 5 %, og en RSDR på < 25 %. Verifikationsmetodens beslutningsgrænse er grænseværdien, under hensyntagen til den ekspanderede måleusikkerhed.
I praksis kan afskæringsværdien (i BEQ) beregnes i overensstemmelse med følgende (jf. figur 1):
7.3.1. Anvendelse af det nedre bånd i forventningsintervallet på 95 % ved verifikationsmetodens beslutningsgrænse
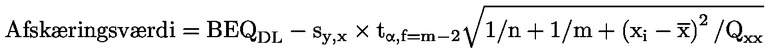
hvor:
|
BEQDL |
er den BEQ, der svarer til verifikationsmetodens beslutningsgrænse, som er grænseværdien under hensyntagen til den ekspanderede måleusikkerhed |
|
sy,x |
er den residuale standardafvigelse |
|
t α,f = m-2 |
er student-faktoren (α = 5 %, f = frihedsgrader, enkeltsidet) |
|
m |
er det samlede antal kalibreringspunkter (indeks j) |
|
n |
er antallet af gentagelser på hvert niveau |
|
xi |
prøvekoncentration (i TEQ) for kalibreringspunktet I bestemt ved en verifikationsmetode |
|
|
er middelværdien af koncentrationerne (i TEQ) af samtlige kalibreringsprøver |
 er kvadratsum-parameteren
er kvadratsum-parameteren
|
i |
= |
indeks for kalibreringspunktet i. |
7.3.2. Beregning ud fra bioanalytiske resultater (korrigeret for blindprøve og genfinding) fra flere analyser af prøver (n≥ 6) forurenet i koncentrationer ved verifikationsmetodens beslutningsgrænse som det nedre endepunkt i fordelingen af data ved den tilsvarende BEQ-middelværdi:
Afskæringsværdi = BEQDL – 1,64 × SDR
hvor
|
SDR |
er standardafvigelse for resultaterne af bioassay ved BEQDL, målt under interne reproducerbarhedsbetingelser. |
7.3.3. Beregning som middelværdi af bioanalytiske resultater (i BEQ, korrigeret for blindprøve og genfinding) fra flere analyser af prøver (n≥ 6) forurenet i koncentrationer på to tredjedele af grænse- eller indgrebsværdien. Dette er baseret på den observation, at dette niveau vil ligge på omkring den afskæringsværdi, der er fastlagt i overensstemmelse med punkt 7.3.1 eller 7.3.2
Beregning af afskæringsværdier med et konfidensniveau på 95 %, hvilket indebærer en falsk overensstemmende-andel på < 5 %, og en RSDR på < 25 %:
|
1. |
fra det nedre bånd i forventningsintervallet på 95 % ved verifikationsmetodens beslutningsgrænse |
|
2. |
fra flere analyser af prøver (n≥ 6) forurenet i koncentrationer ved verifikationsmetodens beslutningsgrænse som det nedre endepunkt i fordelingen af data (i figuren repræsenteret ved en klokkelignende kurve) ved den tilsvarende BEQ-middelværdi: |
Figur 1
7.3.4. Begrænsninger for afskæringsværdier
BEQ-baserede afskæringsværdier beregnet ud fra RSDR, som er tilvejebragt i forbindelse med validering med et begrænset antal prøver med forskellige matrix/kongenermønstre, kan være højere end de TEQ-baserede grænse- eller indgrebsværdier, fordi der opnås en højere præcision end den, der kan opnås i rutinemæssige analyser, når et ukendt spektrum af mulige kongenermønstre skal kontrolleres. I sådanne tilfælde beregnes afskæringsværdierne med udgangspunkt i en RSDR på 25 % eller, hvis det er muligt, to tredjedele af grænse- eller indgrebsværdien.
7.4. Karakteristika for metodens ydeevne
|
— |
Da interne standarder ikke kan anvendes i bioanalytiske metoder, skal der gennemføres repeterbarhedstests for at tilvejebringe oplysninger om standardafvigelsen inden for og mellem de enkelte testrækker. Repeterbarheden skal være på under 20 %, mens den interne reproducerbarhed skal ligge på under 25 %. Til grund lægges de beregnede niveauer i BEQ efter korrektion for blindprøve og genfinding. |
|
— |
Det dokumenteres som led i valideringsprocessen, at testen kan skelne mellem en blindprøve og et indhold på afskæringsværdien, således at det er muligt at identificere prøver over den tilsvarende afskæringsværdi (jf. punkt 7.1.2). |
|
— |
Målforbindelser, mulige interferenser og højeste tolererede værdier for blindprøver skal fastlægges. |
|
— |
Standardafvigelsen i responset eller i den koncentration, der beregnes ud fra responset (kun muligt i måleområdet), ved tredobbelt bestemmelse af et prøveekstrakt må ikke være over 15 %. |
|
— |
De ukorrigerede resultater af referenceprøven/prøverne udtrykt i BEQ (blindprøve og grænse- og indgrebsværdi) bruges til at evaluere den bioanalytiske metodes ydeevne over et konstant tidsrum. |
|
— |
Kvalitetskontrolkort for procedureblindprøver og for hver enkelt type referenceprøve registreres og kontrolleres med henblik på at sikre, at den analytiske ydeevne er i overensstemmelse med gældende krav, især for procedureblindprøverne for så vidt angår den påkrævede minimumsdifference i forhold til den nedre del af måleområdet og for referenceprøverne med hensyn til den interne reproducerbarhed. Procedureblindprøver skal holdes under streng kontrol for at undgå falsk overensstemmende resultater ved fratrækning af værdierne. |
|
— |
Resultaterne fra verifikationsmetoderne af mistænkte prøver samt 2-10 % af de overensstemmende prøver (mindst 20 prøver pr. matrix) skal indsamles og lægges til grund for en evaluering af screeningsmetodens ydeevne og relationen mellem BEQ og TEQ. Denne database kan anvendes til revurdering af de afskæringsværdier, der finder anvendelse på rutinemæssige prøver til de validerede matrixer. |
|
— |
En metodes gode ydeevne kan også dokumenteres ved deltagelse i ringtest. Resultaterne fra prøver, der er analyseret i ringtest og dækker et koncentrationsområde på op til f.eks. 2 gange grænseværdien, kan også inkluderes i evalueringen af andelen af falsk overensstemmende resultater, såfremt laboratoriet kan dokumentere gode præstationer. Prøverne skal dække de mest almindelige kongenermønstre og repræsentere forskellige kilder. |
|
— |
I forbindelse med hændelser kan afskæringsværdierne revurderes på baggrund af de specifikke matrix- og kongenermønstre, der observeres under denne enkelte hændelse. |
8. INDBERETNING AF RESULTATER
Verifikationsmetoder
|
— |
Analyseresultaterne skal omfatte værdierne for de enkelte PCDD/PCDF- og dioxinlignende PCB-kongenere, og TEQ-værdier angives som nedre koncentrationer, øvre koncentrationer og middelkoncentrationer, med henblik på at sikre, at indberetningen af resultater omfatter så mange oplysninger som muligt, så resultaterne kan fortolkes i overensstemmelse med specifikke krav. |
|
— |
Rapporten skal også omfatte oplysninger om den metode, der er anvendt til ekstraktion af PCDD'er/PCDF'er, dioxinlignende PCB'er og fedtstoffer. Prøvens fedtindhold bestemmes og indberettes for fødevarematrixer med grænseværdier udtrykt i forhold til fedtmængden og en forventet fedtkoncentration i størrelsesordenen 0-2 % (i overensstemmelse med gældende lovgivning). For andre prøver er det valgfrit at bestemme fedtindholdet. |
|
— |
Tallene for genfinding af de enkelte interne standarder skal stilles til rådighed, hvis genfindingen ligger uden for det interval, der er angivet i punkt 6.2, hvis grænseværdierne er overskredet (i dette tilfælde genfindingen for en af to analyser), og i øvrige tilfælde efter anmodning. |
|
— |
Da der skal tages hensyn til den ekspanderede måleusikkerhed, når det afgøres, om en prøve er overensstemmende, skal denne parameter ligeledes være tilgængelig. Analyseresultaterne indberettes derfor som x +/- U, hvor x er analyseresultatet og U er den ekspanderede måleusikkerhed, idet der anvendes en dækningsfaktor på 2, hvilket giver et konfidensniveau på ca. 95 %. Hvis PCDD'er/PCDF'er og dioxinlignende PCB'er bestemmes separat, anvendes summen af den anslåede ekspanderede usikkerhed for de separate analyseresultater vedrørende PCDD'er/PCDF'er og dioxinlignende PCB'er for summen af PCDD'er/PCDF'er og dioxinlignende PCB'er. |
|
— |
Resultaterne skal angives i samme enheder og med samme antal betydende cifre som de grænseværdier, der er fastsat i forordning (EF) nr. 1881/2006. |
Bioanalytiske screeningsmetoder
|
— |
Resultatet af screeningen udtrykkes som værende »overensstemmende« eller som »mistænkt for at være ikke-overensstemmende« (»mistænkt«). |
|
— |
Derudover kan et resultat for PCDD'er/PCDF'er og/eller dioxinlignende PCB'er udtrykt i bioanalytiske ækvivalenter (BEQ) (ikke TEQ) oplyses (jf. punkt 1). Prøver, der giver et respons under rapporteringsgrænsen, udtrykkes som værende under rapporteringsgrænsen. Prøver, der giver et respons over måleområdet, indberettes som prøver, der overskrider måleområdet, og den værdi, der svarer til den øvre del af måleområdet, angives i BEQ. |
|
— |
Rapporten skal for hver enkelt type prøvematrix give oplysninger om grænse- eller indgrebsværdien, som vurderingen er baseret på. |
|
— |
Rapporten skal indeholde oplysninger om, hvilken type test der er anvendt, det grundlæggende prøvningsprincip og den anvendte kalibreringsmåde. |
|
— |
Rapporten skal også omfatte oplysninger om den metode, der er anvendt til ekstraktion af PCDD'er/PCDF'er, dioxinlignende PCB'er og fedtstoffer. Prøvens fedtindhold bestemmes og indberettes for fødevarematrixer med grænseværdier udtrykt i forhold til fedtmængden og en forventet fedtkoncentration i størrelsesordenen 0-2 % (i overensstemmelse med gældende lovgivning). For andre prøver er det valgfrit at bestemme fedtindholdet. |
|
— |
I tilfælde, hvor prøver mistænkes for at være ikke-overensstemmende, skal rapporten indeholde en bemærkning om den foranstaltning, der skal træffes. Koncentrationen af PCDD'er/PCDF'er og summen af PCDD'er/PCDF'er og dioxinlignende PCB'er i prøver med forhøjet indhold skal bestemmes/bekræftes ved en verifikationsmetode. |
|
— |
Ikke-overensstemmende resultater indberettes kun på grundlag af verifikationsanalyse. |
Fysisk-kemiske screeningsmetoder
|
— |
Resultatet af screeningen udtrykkes som værende »overensstemmende« eller som »mistænkt for at være ikke-overensstemmende« (»mistænkt«). |
|
— |
Rapporten skal for hver enkelt type prøvematrix give oplysninger om grænse- eller indgrebsværdien, som vurderingen er baseret på. |
|
— |
Der kan desuden gives værdier for de enkelte PCDD/PCDF- og/eller dioxinlignende PCB-kongenere og TEQ-værdier, der indberettes som nedre koncentrationer, øvre koncentrationer og middelkoncentrationer. Resultaterne angives i samme enheder og med (mindst) samme antal betydende cifre som de grænseværdier, der er fastsat i forordning (EF) nr. 1881/2006. |
|
— |
Tallene for genfinding af de enkelte interne standarder skal stilles til rådighed, hvis genfindingen ligger uden for det interval, der er angivet i punkt 6,2, og i øvrige tilfælde efter anmodning. |
|
— |
Den anvendte GC-MS-metode skal være nævnt i rapporten. |
|
— |
Rapporten skal også omfatte oplysninger om den metode, der er anvendt til ekstraktion af PCDD'er/PCDF'er, dioxinlignende PCB'er og fedtstoffer. Prøvens fedtindhold bestemmes og indberettes for fødevarematrixer med grænseværdier udtrykt i forhold til fedtmængden og en forventet fedtkoncentration i størrelsesordenen 0-2 % (i overensstemmelse med gældende lovgivning). For andre prøver er det valgfrit at bestemme fedtindholdet. |
|
— |
I tilfælde, hvor prøver mistænkes for at være ikke-overensstemmende, skal rapporten indeholde en bemærkning om den foranstaltning, der skal træffes. Koncentrationen af PCDD'er/PCDF'er og summen af PCDD'er/PCDF'er og dioxinlignende PCB'er i prøver med forhøjet indhold skal bestemmes/bekræftes ved en verifikationsmetode. |
|
— |
Ikke-overensstemmelse kan kun bestemmes på grundlag af verifikationsanalyse. |
(1) Guidance Document on Measurement Uncertainty for Laboratories performing PCDD/F and PCB Analysis using Isotope Dilution Mass Spectrometry [link til websted], Guidance Document on the Estimation of LOD and LOQ for Measurements in the Field of Contaminants in Feed and Food [link to website].
(*1) I forhold til grænseværdierne
(2) Gældende krav er baseret på TEF'erne, som er offentliggjort i: M. Van den Berg et al., Toxicol Sci 93 (2), 223-241 (2006).
Tillæg
WHO-TEF til vurdering af risikoen for mennesker baseret på konklusionerne fra Verdenssundhedsorganisationens (WHO) ekspertmøde i Genève i juni 2005 om det internationale program for sikkerhed i forbindelse med kemikalier (IPCS) (1)
|
Kongener |
TEF-værdi |
Kongener |
TEF-værdi |
||
|
Dibenzo-p-dioxiner (»PCDD'er«) |
»Dioxinlignende« PCB'er: Non-ortho-PCB'er + mono-ortho-PCB'er |
||||
|
2,3,7,8-TCDD |
1 |
|
|
||
|
1,2,3,7,8-PeCDD |
1 |
Non-ortho-PCB'er |
|
||
|
1,2,3,4,7,8-HxCDD |
0,1 |
PCB 77 |
0,0001 |
||
|
1,2,3,6,7,8-HxCDD |
0,1 |
PCB 81 |
0,0003 |
||
|
1,2,3,7,8,9-HxCDD |
0,1 |
PCB 126 |
0,1 |
||
|
1,2,3,4,6,7,8-HpCDD |
0,01 |
PCB 169 |
0,03 |
||
|
OCDD |
0,0003 |
|
|
||
|
Dibenzofuraner (»PCDF'er«) |
Mono-ortho-PCB'er |
||||
|
2,3,7,8-TCDF |
0,1 |
PCB 105 |
0,00003 |
||
|
1,2,3,7,8-PeCDF |
0,03 |
PCB 114 |
0,00003 |
||
|
2,3,4,7,8-PeCDF |
0,3 |
PCB 118 |
0,00003 |
||
|
1,2,3,4,7,8-HxCDF |
0,1 |
PCB 123 |
0,00003 |
||
|
1,2,3,6,7,8-HxCDF |
0,1 |
PCB 156 |
0,00003 |
||
|
1,2,3,7,8,9-HxCDF |
0,1 |
PCB 157 |
0,00003 |
||
|
2,3,4,6,7,8-HxCDF |
0,1 |
PCB 167 |
0,00003 |
||
|
1,2,3,4,6,7,8-HpCDF |
0,01 |
PCB 189 |
0,00003 |
||
|
1,2,3,4,7,8,9-HpCDF |
0,01 |
|
|
||
|
OCDF |
0,0003 |
|
|
||
|
|||||
(1) Martin van den Berg et al., The 2005 World Health Organization Re-evaluation of Human and Mammalian Toxic Equivalency Factors for Dioxins and Dioxin-like Compounds. Toxicological Sciences 93(2), 223–241 (2006).