
|
22.12.2005 |
DA |
Den Europæiske Unions Tidende |
L 338/27 |
KOMMISSIONENS FORORDNING (EF) Nr. 2074/2005
af 5. december 2005
om gennemførelsesbestemmelser vedrørende visse produkter i henhold til Europa-Parlamentets og Rådets forordning (EF) nr. 853/2004 og vedrørende offentlig kontrol i henhold til Europa-Parlamentets og Rådets forordning (EF) nr. 854/2004 og (EF) nr. 882/2004, om fravigelse fra Europa-Parlamentets og Rådets forordning (EF) nr. 852/2004 og om ændring af forordning (EF) nr. 853/2004 og (EF) nr. 854/2004
(EØS-relevant tekst)
KOMMISSIONEN FOR DE EUROPÆISKE FÆLLESSKABER HAR —
under henvisning til traktaten om oprettelse af Det Europæiske Fællesskab,
under henvisning til Europa-Parlamentets og Rådets forordning (EF) nr. 852/2004 af 29. april 2004 om fødevarehygiejne (1), særlig artikel 13, stk. 2,
under henvisning til Europa-Parlamentets og Rådets forordning (EF) nr. 853/2004 af 29. april 2004 om særlige hygiejnebestemmelser for animalske fødevarer (2), særlig artikel 9, 10 og 11,
under henvisning til Europa-Parlamentets og Rådets forordning (EF) nr. 854/2004 af 29. april 2004 om særlige bestemmelser for tilrettelæggelsen af den offentlige kontrol af animalske produkter til konsum (3), særlig artikel 16, 17 og 18,
under henvisning til Europa-Parlamentets og Rådets forordning (EF) nr. 882/2004 af 29. april 2004 om offentlig kontrol med henblik på verifikation af, at foderstof- og fødevarelovgivningen samt dyresundheds- og dyrevelfærdsbestemmelserne overholdes (4), særlig artikel 63, og
ud fra følgende betragtninger:
|
(1) |
I forordning (EF) nr. 853/2004 er der fastsat særlige krav vedrørende hygiejnebestemmelser for animalske fødevarer. Det er nødvendigt at fastsætte visse gennemførelsesbestemmelser vedrørende kød, levende toskallede bløddyr, fiskevarer, mælk, æg, frølår og snegle samt forarbejdede produkter heraf. |
|
(2) |
I forordning (EF) nr. 854/2004 er der fastsat særlige bestemmelser for tilrettelæggelsen af den offentlige kontrol af animalske produkter til konsum. Det er nødvendigt, at visse bestemmelser udbygges, og at der fastsættes yderligere krav. |
|
(3) |
Ved forordning (EF) nr. 882/2004 er der fastsat harmoniserede fællesskabsrammer med generelle bestemmelser for tilrettelæggelsen af offentlig kontrol. Det er nødvendigt, at visse bestemmelser udbygges, og at der fastsættes yderligere krav. |
|
(4) |
Ved Kommissionens beslutning 20XX/../EF (5) ophæves visse beslutninger om gennemførelsesbestemmelser, som var foreskrevet i de direktiver, der blev ophævet ved Europa-Parlamentets og Rådets direktiv 2004/41/EF af 21. april 2004 om ophævelse af visse direktiver om levnedsmiddelhygiejne og sundhedsbetingelser for produktion og afsætning af visse animalske produkter til konsum og om ændring af Rådets direktiv 89/662/EØF og 92/118/EØF og Rådets afgørelse 95/408/EF (6). Visse dele af de pågældende beslutninger bør derfor bibeholdes i denne forordning. |
|
(5) |
I henhold til forordning (EF) nr. 852/2004 skal virksomhedslederne føre og opbevare journaler og på begæring stille de relevante oplysninger i sådanne journaler til rådighed for den kompetente myndighed og den fødevarevirksomhed, der modtager produkterne. |
|
(6) |
I henhold til forordning (EF) nr. 853/2004 skal ledere af slagterier desuden anmode om, modtage, kontrollere og skride ind på grundlag af oplysninger om fødevarekæden med hensyn til alle dyr, bortset fra vildtlevende vildt, der er sendt eller er bestemt til at blive sendt til slagteriet. Desuden bør vedkommende sikre sig, at informationen om fødevarekæden omfatter alle oplysninger, der kræves i henhold til forordning (EF) nr. 853/2004. |
|
(7) |
Informationen om fødevarekæden udgør en hjælp for slagterilederen til at tilrettelægge slagtearbejdet og for embedsdyrlægen til at afgøre, hvilke inspektionsprocedurer der er behov for. Informationen om fødevarekæden bør analyseres af embedsdyrlægen og anvendes som en integreret del af inspektionsprocedurerne. |
|
(8) |
Eksisterende systemer for informationsstrømme bør anvendes i så høj grad som muligt og tilpasses, så de bringes i overensstemmelse med de krav til information om fødevarekæden, der er fastsat i forordning (EF) nr. 854/2004. |
|
(9) |
For at forbedre praksis med hensyn til dyrehold på bedrifterne og i overensstemmelse med forordning (EF) nr. 854/2004 bør embedsdyrlægen registrere og om nødvendigt underrette fødevarevirksomhedslederen på oprindelsesbedriften og den eller de dyrlæger, der er tilknyttet oprindelsesbedriften, eller kompetente myndigheder, der er involveret, om sygdomme eller tilstande, der er konstateret på slagteriet vedrørende enkeltdyr eller besætningen/flokken, og som kan have uheldige følger for menneskers eller dyrs sundhed eller true dyrenes velfærd. |
|
(10) |
I forordning (EF) nr. 853/2004 og (EF) nr. 854/2004 er der fastsat krav til parasitkontrol af fiskevarer på land og om bord på fartøjer. Det er op til fødevarevirksomhedslederne at foretage deres egen kontrol i alle led i fremstillingen af fiskevarer i overensstemmelse med bestemmelserne i afsnit VIII, kapitel V, punkt D, i bilag III til forordning (EF) nr. 853/2004, så fisk, der er tydeligt forurenede med parasitter, fjernes og ikke frigives til konsum. Ved vedtagelsen af nærmere bestemmelser om visuel undersøgelse er der behov for, at begrebet »synlige parasitter« og »visuel undersøgelse« defineres, og for at det fastlægges, hvilke typer observationer der skal foretages og hvor ofte. |
|
(11) |
Ved de kontrolforanstaltninger, der er fastsat i forordning (EF) nr. 853/2004 for at undgå markedsføring af fiskevarer, der er uegnede til konsum, kan anvendes visse kemiske kontrolforanstaltninger, herunder kontrol af TVB-N (Total Volatile Basic Nitrogen). Det er nødvendigt at fastsætte de grænseværdier, der skal overholdes med hensyn til TVB-N for visse artskategorier, samt de analysemetoder, der skal anvendes. Videnskabeligt anerkendte analysemetoder til rutinemæssig kontrol af TVB-N bør fortsat anvendes, men der bør fastsættes en referencemetode, som anvendes, dersom der er tvivl om resultaterne, eller disse bestrides. |
|
(12) |
Grænseværdierne for paralytisk skaldyrsgift (PSP), amnesifremkaldende skaldyrsgift (ASP) og lipofile toksiner er fastsat i forordning (EF) nr. 853/2004. Bioassay-metoden er referencemetoden til at påvise bestemte toksiner og forhindre, at giftige skaldyr høstes. Grænseværdier og analysemetoder bør harmoniseres og gennemføres af medlemsstaterne for at beskytte menneskers sundhed. Som supplement til biologiske analysemetoder bør alternative påvisningsmetoder, f.eks. kemiske metoder og in vitro-assays, tillades, hvis det godtgøres, at de valgte metoder er mindst lige så effektive som den biologiske metode, og at anvendelsen af dem giver et tilsvarende folkesundhedsbeskyttelsesniveau. De foreslåede grænseværdier for lipofile toksiner er baseret på foreløbige data og bør revurderes, når der foreligger ny videnskabelig dokumentation. Som følge af manglende referencemateriale og anvendelse alene af andre test end bioassays svarer folkesundhedsbeskyttelsesniveauet vedrørende alle de nævnte toksiner for tiden ikke til det, som biologiske test kunne give. Der bør fastsættes bestemmelser med henblik på udskiftning af biologiske test så hurtigt som muligt. |
|
(13) |
Maskinsepareret kød, der er fremstillet ved anvendelse af teknikker, som ikke ændrer strukturen af de knogler, der anvendes ved fremstillingen deraf, bør behandles anderledes end maskinsepareret kød, der er fremstillet ved anvendelse af teknikker, som ændrer knoglernes struktur. |
|
(14) |
Det bør tillades at anvende maskinsepareret kød, der er fremstillet ved anvendelse af førstnævnte teknikker på nærmere bestemte betingelser, og som har en nærmere bestemt sammensætning, i tilberedt kød, som tydeligvis ikke er bestemt til konsum uden forudgående varmebehandling. Betingelserne vedrører især calciumindholdet i det maskinseparerede kød i overensstemmelse med artikel 11, stk. 2, i forordning (EF) nr. 853/2004. Det maksimumscalciumindhold, der fastsættes i nærværende forordning, bør justeres, når der foreligger nærmere oplysninger om variationer ved anvendelse af forskellige typer råvarer. |
|
(15) |
I henhold til artikel 31, stk. 2, litra f), i forordning (EF) nr. 882/2004 skal medlemsstaterne føre ajourførte lister over godkendte/autoriserede virksomheder. Der bør fastsættes fælles regler for, hvordan de relevante oplysninger fremlægges for de øvrige medlemsstater og for offentligheden. |
|
(16) |
I afsnit XI i bilag III til forordning (EF) nr. 853/2004 er der fastsat krav vedrørende tilberedning af frølår og snegle til konsum. Der bør derudover fastsættes krav, herunder modeller til sundhedscertifikater, vedrørende import fra tredjelande af frølår og snegle til konsum. |
|
(17) |
I afsnit XIV og XV i bilag III til forordning (EF) nr. 853/2004 er der fastsat bestemmelser om fremstilling og markedsføring af gelatine og kollagen til konsum. Der bør derudover fastsættes krav, herunder modeller til sundhedscertifikater, vedrørende import fra tredjelande af gelatine og kollagen og råvarer til fremstilling af gelatine og kollagen til konsum. |
|
(18) |
Der er behov for fleksibilitet, så fødevarer med traditionelle karakteristika fortsat kan fremstilles. Medlemsstaterne har allerede givet dispensationer for en lang række af sådanne fødevarer i medfør af den lovgivning, der var i kraft før den 1. januar 2006. Fødevarevirksomhedsledere bør uden afbrydelse kunne fortsætte med at anvende gældende praksis efter den dato. I forordning (EF) nr. 852/2004, (EF) nr. 853/2004 og (EF) nr. 854/2004 er der fastlagt en procedure, der tillader medlems- staterne at udvise fleksibilitet. I de fleste tilfælde, hvor der allerede er givet dispensation, er der imidlertid blot tale om en videreførelse af gældende praksis, så det kunne være en unødvendig og uforholdsmæssig stor byrde for medlemsstaterne at anvende en fuldstændig meddelelsesprocedure, herunder en komplet risikoanalyse. Som en undtagelse fra strukturkravene i forordning (EF) nr. 852/2004 og under hensyntagen til fødevaresundhedsmålene bør det derfor defineres, hvad »fødevarer med traditionelle karakteristika« er, og det bør fastsættes, hvilke generelle betingelser der gælder for sådanne fødevarer. |
|
(19) |
Da forordning (EF) nr. 853/2004 og (EF) nr. 854/2004 blev vedtaget før udvidelsen den 1. maj 2004, indeholder de ikke en henvisning til de nye medlemsstater. De pågældende medlemsstaters ISO-koder og forkortelserne af Det Europæiske Fællesskab på deres eget sprog bør derfor indsættes i de relevante bestemmelser i de pågældende forordninger. |
|
(20) |
I afsnit I i bilag III til forordning (EF) nr. 853/2004 er der fastsat bestemmelser om fremstilling og markedsføring af kød af tamhovdyr. Kapitel IV, punkt 8, i nævnte afsnit indeholder en undtagelse fra kravet om fuldstændig afhudning af slagtekroppen og de øvrige dele af kroppen, der er bestemt til konsum. Der bør fastsættes en bestemmelse, der udvider undtagelsen til at omfatte fødder af voksne kreaturer, forudsat at de opfylder samme betingelser som dem, der gælder for kalvefødder. |
|
(21) |
Visse former for praksis kan vildlede forbrugeren hvad angår bestemte produkters sammensætning. Især for ikke at skuffe forbrugernes forventninger bør det forbydes at sælge fjerkrækød, der er behandlet med vandbindingsmidler, som fersk kød. |
|
(22) |
Den Europæiske Fødevaresikkerhedsautoritets udtalelse af 30. august 2004 viste, at fiskevarer fra Gempylidae-familien, navnlig Ruvettus pretiosus og Lepidocybium flavobrunneum, kan have negative virkninger for mave-tarm-kanalen, hvis de indtages på bestemte vilkår. Fiskevarer af den nævnte familie bør derfor underkastes markedsføringsbetingelser. |
|
(23) |
I afsnit IX i bilag III til forordning (EF) nr. 853/2004 er der fastsat særlige hygiejnebestemmelser for rå mælk og mejeriprodukter. I henhold til kapitel I, del II, litra B, punkt 1, litra e), må pattedypningsmidler kun anvendes, hvis de er godkendt af den kompetente myndighed. Der er imidlertid ikke fastlagt en nærmere godkendelsesordning i nævnte del. For at sikre, at medlemsstaterne anvender en harmoniseret fremgangmåde, er det derfor nødvendigt at gøre godkendelsesprocedurerne klarere. |
|
(24) |
I henhold til forordning (EF) nr. 853/2004 skal fødevarevirksomhedslederne sikre, at de varmebehandlinger, der anvendes til forarbejdning af rå mælk og mejeriprodukter, er i overensstemmelse med en internationalt anerkendt norm. Som følge af den særlige karakter af visse varmebehandlinger, der anvendes i denne sektor, og deres betydning for fødevaresikkerheden og dyresundheden bør der imidlertid gives klarere retningslinjer herom til fødevarevirksomhedslederne. |
|
(25) |
Ved forordning (EF) nr. 853/2004 blev der indført en ny definition, der skulle omfatte produkter af æg, som — efter at skallen er fjernet — endnu ikke er blevet forarbejdet. Det er derfor nødvendigt at gøre bestemmelserne om de pågældende produkter klarere og ændre afsnit X, kapitel II, i bilag III til forordning (EF) nr. 853/2004 i overensstemmelse hermed. |
|
(26) |
I afsnit XIV i bilag III til forordning (EF) nr. 853/2004 er der fastsat særlige hygiejnebestemmelser for gelatine. Bestemmelserne omfatter krav til typen af råvarer, der kan anvendes til at fremstille gelatine, og til transport og opbevaring af råvarer. Det er ligeledes fastsat, hvilke specifikationer der gælder for fremstilling af gelatine. Der bør imidlertid også fastsættes bestemmelser om mærkning af gelatine. |
|
(27) |
Den videnskabelige udvikling har ført til, at ISO 16649-3 er fastlagt som referencemetode til analyse af E. coli i toskallede bløddyr. Denne referencemetode er allerede fastlagt for levende toskallede bløddyr fra A-områder, jf. Kommissionens forordning (EF) nr. 2073/2005 om mikrobiologiske kriterier for fødevarer (7). ISO 16649-3 bør derfor også anføres om MPN-referencemetoden (Most Probable Number) til analyse af E. coli i toskallede bløddyr fra B‐ og C-områder. Det bør kun tillades at anvende alternative metoder, hvis de betragtes som ligestillede med referencemetoden. |
|
(28) |
Forordning (EF) nr. 853/2004 og (EF) nr. 854/2004 bør derfor ændres i overensstemmelse hermed. |
|
(29) |
Foranstaltningerne i denne forordning er i overensstemmelse med udtalelse fra Den Stående Komité for Fødevarekæden og Dyresundhed — |
UDSTEDT FØLGENDE FORORDNING:
Artikel 1
Gennemførelsesbestemmelser til forordning (EF) nr. 853/2004 og (EF) nr. 854/2004 om krav vedrørende information om fødevarekæden
I bilag I til nærværende forordning fastsættes krav vedrørende information om fødevarekæden, jf. afsnit III i bilag II til forordning (EF) nr. 853/2004 og afsnit I, kapitel II, punkt A, i bilag I til forordning (EF) nr. 854/2004.
Artikel 2
Gennemførelsesbestemmelser til forordning (EF) nr. 853/2004 og (EF) nr. 854/2004 om krav vedrørende fiskevarer
I bilag II til nærværende forordning fastsættes krav vedrørende fiskevarer, jf. artikel 11, nr. 9), i forordning (EF) nr. 853/2004 og artikel 18, nr. 14) og 15), i forordning (EF) nr. 854/2004.
Artikel 3
Gennemførelsesbestemmelser til forordning (EF) nr. 853/2004 og (EF) nr. 854/2004 om anerkendte analysemetoder for marine biotoksiner
I bilag III til nærværende forordning fastsættes de anerkendte analysemetoder til påvisning af marine biotoksiner, jf. artikel 11, nr. 4), i forordning (EF) nr. 853/2004 og artikel 18, nr. 13), litra a), i forordning (EF) nr. 854/2004.
Artikel 4
Gennemførelsesbestemmelser til forordning (EF) nr. 853/2004 om calciumindholdet i maskinsepareret kød
I bilag IV til nærværende forordning fastsættes calciumindholdet i maskinsepareret kød, jf. artikel 11, nr. 2), i forordning (EF) nr. 853/2004.
Artikel 5
Gennemførelsesbestemmelser til forordning (EF) nr. 882/2004 om lister over virksomheder
I bilag V til nærværende forordning fastsættes krav vedrørende listerne over virksomheder, jf. artikel 31, stk. 2, litra f), i forordning (EF) nr. 882/2004.
Artikel 6
Gennemførelsesbestemmelser til forordning (EF) nr. 853/2004 om modeller til sundhedscertifikater for frølår, snegle, gelatine og kollagen
I bilag VI til nærværende forordning fastsættes modellerne til sundhedscertifikater ved import af frølår, snegle, gelatine og kollagen, jf. artikel 6, stk. 1, litra d), i forordning (EF) nr. 853/2004, og af råvarer til fremstilling af gelatine og kollagen.
Artikel 7
Fravigelse fra forordning (EF) nr. 852/2004 for så vidt angår fødevarer med traditionelle karakteristika
1. I denne forordning forstås ved »fødevarer med traditionelle karakteristika« fødevarer, der i den medlemsstat, hvor de traditionelt fremstilles, er:
|
a) |
historisk anerkendte som traditionelle produkter eller |
|
b) |
fremstillet i henhold til en lovbestemt eller registreret teknisk reference til den traditionelle proces eller i henhold til traditionelle produktionsmetoder eller |
|
c) |
beskyttet som en traditionel fødevare af fællesskabsbestemmelser eller en national, regional eller lokal lov. |
2. Medlemsstaterne kan give virksomheder, der fremstiller fødevarer med traditionelle karakteristika, individuelle eller generelle dispensationer fra de krav, der er fastsat i:
|
a) |
kapitel II, punkt 1, i bilag II til forordning (EF) nr. 852/2004 for så vidt angår de steder, hvor de pågældende produkter eksponeres for et miljø, der til en vis grad er nødvendigt for, at deres karakteristika kan udvikle sig. Sådanne steder kan bl.a. omfatte vægge, lofter og døre, der ikke er glatte, vandtætte, ikke-absorberende eller af et korrosionsbestandigt materiale, og naturlige, geologiske vægge, lofter og gulve |
|
b) |
kapitel II, punkt 1, litra f), og kapitel V, punkt 1, i bilag II til forordning (EF) nr. 852/2004 for så vidt angår den type materialer, som de redskaber og det udstyr, der anvendes specifikt til at tilberede, emballere og indpakke de pågældende produkter, er lavet af. Rengørings- og desinficeringsforanstaltningerne vedrørende steder som omhandlet i litra a) og den hyppighed, hvormed de gennemføres, tilpasses den pågældende aktivitet for at tage hensyn til den særlige flora, der er forbundet med stedet. Redskaberne og udstyret omhandlet i litra b) skal konstant have en tilfredsstillende hygiejnestandard og skal regelmæssigt rengøres og desinficeres. |
3. Medlemsstater, der giver dispensationer, jf. stk. 2, giver Kommissionen og de øvrige medlemsstater meddelelse herom senest 12 måneder efter, at de individuelle eller generelle dispensationer er givet. Meddelelsen skal indeholde:
|
a) |
en kort beskrivelse af de ændrede krav |
|
b) |
en beskrivelse af de pågældende fødevarer og virksomheder |
|
c) |
alle andre relevante oplysninger. |
Artikel 8
Ændringer af forordning (EF) nr. 853/2004
Bilag II og III til forordning (EF) nr. 853/2004 ændres som angivet i bilag VII til nærværende forordning.
Artikel 9
Ændringer af forordning (EF) nr. 854/2004
Bilag I, II og III til forordning (EF) nr. 854/2004 ændres som angivet i bilag VIII til nærværende forordning.
Artikel 10
Ikrafttrædelse og anvendelse
Denne forordning træder i kraft på tyvendedagen efter offentliggørelsen i Den Europæiske Unions Tidende.
Den anvendes fra den 1. januar 2006; dog anvendes kapitel II og III i bilag V fra den 1. januar 2007.
Denne forordning er bindende i alle enkeltheder og gælder umiddelbart i hver medlemsstat.
Udfærdiget i Bruxelles, den 5. december 2005.
På Kommissionens vegne
Markos KYPRIANOU
Medlem af Kommissionen
(1) EUT L 134 af 30.4.2004, s. 1. Berigtiget i EUT L 226 af 25.6.2004, s. 3.
(2) EUT L 139 af 30.4.2004, s. 55. Berigtiget i EUT L 226 af 25.6.2004, s. 22.
(3) EUT L 139 af 30.4.2004, s. 206. Berigtiget i EUT L 226 af 25.6.2004, s. 83.
(4) EUT L 165 af 30.4.2004, s. 1. Berigtiget i EUT L 191 af 28.5.2004, s. 1.
(5) Endnu ikke offentliggjort i EUT.
(6) EUT L 157 af 30.4.2004, s. 33. Berigtiget i EUT L 195 af 2.6.2004, s. 12.
(7) Se side 1 i denne EUT.
BILAG I
INFORMATION OM FØDEVAREKÆDEN
AFSNIT I
FORPLIGTELSER, DER PÅHVILER FØDEVAREVIRKSOMHEDSLEDERE
Fødevarevirksomhedsledere, som opdrætter dyr, der sendes til slagtning, sikrer, at fødevarekædeoplysningerne, jf. forordning (EF) nr. 853/2004, indgår på relevant vis i dokumentationen om de afsendte dyr, således at den pågældende slagterileder har adgang til dem.
AFSNIT II
FORPLIGTELSER, DER PÅHVILER DE KOMPETENTE MYNDIGHEDER
KAPITEL I
BESTEMMELSER OM INFORMATION OM FØDEVAREKÆDEN
|
1. |
Den kompetente myndighed på afsendelsesstedet underretter den fødevarevirksomhedsleder, der foretager afsendelsen, om, hvilke elementer af fødevarekædeoplysningerne der mindst skal gives til slagteriet i henhold til afsnit III i bilag II til forordning (EF) nr. 853/2004. |
|
2. |
Den kompetente myndighed på slagtestedet kontrollerer, at:
|
|
3. |
Hvis dyrene afsendes til slagtning i en anden medlemsstat, samarbejder de kompetente myndigheder på afsendelsesstedet og slagtestedet for at sikre, at oplysningerne fra den fødevarevirksomhedsleder, der foretager afsendelsen, er let tilgængelige for den slagterileder, der modtager dem. |
KAPITEL II
TILBAGEMELDING TIL OPRINDELSESBEDRIFTEN
|
1. |
Embedsdyrlægen kan anvende modellen i tillæg I til meddelelse af de relevante inspektionsresultater, til bedriften i den samme medlemsstat, hvor dyrene blev opdrættet før slagtningen,, jf. afsnit II, kapitel I, i bilag I til forordning (EF) nr. 854/2004. |
|
2. |
Den kompetente myndighed er ansvarlig for at meddele de relevante inspektionsresultater, når dyrene er opdrættet på en bedrift i en anden medlemsstat, og den pågældende myndighed skal anvende modellen i tillægget på såvel afsendelseslandets som modtagerlandets sprog. |
Tillæg til bilag I
MODEL
|
1. |
Oplysninger til identifikation |
||
|
|
1.1. |
Oprindelsesbedrift (f.eks. ejer eller bestyrer) |
|
|
|
|
navn/nummer |
|
|
|
|
fulde adresse |
|
|
|
|
tlf. |
|
|
|
1.2. |
Identifikationsnumre (vedlæg særskilt liste) |
|
|
|
|
antal dyr i alt (pr. art) |
|
|
|
|
eventuelle identifikationsproblemer |
|
|
|
1.3. |
Identifikation af besætning/flok/bur (hvis relevant) |
|
|
|
1.4. |
Dyreart |
|
|
|
1.5. |
Sundhedscertifikatets referencenummer |
|
|
2. |
Resultater af undersøgelse før slagtning |
||
|
|
2.1. |
Velfærd |
|
|
|
|
antal problematiske dyr |
|
|
|
|
type/klasse/alder |
|
|
|
|
observationer (f.eks. halebidning) |
|
|
|
2.2. |
Dyr blev leveret snavsede |
|
|
|
2.3. |
Kliniske fund (sygdom) |
|
|
|
|
antal problematiske dyr |
|
|
|
|
type/klasse/alder |
|
|
|
|
observationer |
|
|
|
|
inspektionsdato |
|
|
|
2.4. |
Laboratorieresultater (1) |
|
|
3. |
Resultater af undersøgelse efter slagtning |
||
|
|
3.1. |
(Makroskopiske) fund |
|
|
|
|
antal problematiske dyr |
|
|
|
|
type/klasse/alder |
|
|
|
|
organ eller sted på dyret/dyrene |
|
|
|
|
slagtedato |
|
|
|
3.2. |
Sygdom (der kan anvendes koder (2) |
|
|
|
|
antal problematiske dyr |
|
|
|
|
type/klasse/alder |
|
|
|
|
organ eller sted på dyret/dyrene |
|
|
|
|
slagtekrop helt eller delvis kasseret (oplys årsag) |
|
|
|
|
slagtedato |
|
|
|
3.3. |
Laboratorieresultater (3) |
|
|
|
3.4. |
Andre resultater (f.eks. parasitter og fremmedlegemer) |
|
|
|
3.5. |
Velfærdsrelaterede fund (f.eks. benbrud) |
|
|
4. |
Supplerende oplysninger |
||
|
5. |
Kontaktoplysninger |
||
|
|
5.1. |
Slagteri (autorisationsnummer) |
|
|
|
|
navn |
|
|
|
|
fulde adresse |
|
|
|
|
tlf. |
|
|
|
5.2. |
Evt. e-mail-adresse |
|
|
6. |
Embedsdyrlæge (blokbogstaver) |
||
|
|
|
underskrift og stempel |
|
|
7. |
Dato |
||
|
8. |
Antal sider, der er vedlagt dette skema: |
||
(1) Mikrobiologiske, kemiske, serologiske osv. (vedlæg resultaterne).
(2) De kompetente myndigheder kan anføre følgende koder: »A« for sygdomme på OIE's liste, »B100« og »B200« for velfærdsproblemer (afsnit I, kapitel II, litra C, i bilag I til forordning (EF) nr. 854/2004) og »C100« til »C290« for beslutninger vedrørende kød (afsnit II, kapitel V, punkt 1, litra a) til u), i bilag I til forordning (EF) nr. 854/2004). Kodesystemet kan om nødvendigt omfatte yderligere underinddelinger (f.eks. »C141« for en mild generaliseret sygdom og »C142« for en mere alvorlig sygdom). Hvis der anvendes koder, skal de være umiddelbart tilgængelige for fødevarevirksomhedslederen sammen med en passende betydningsforklaring.
(3) Mikrobiologiske, kemiske, serologiske osv. (vedlæg resultaterne).
BILAG II
FISKEVARER
AFSNIT I
FORPLIGTELSER, DER PÅHVILER FØDEVAREVIRKSOMHEDSLEDERE
I dette afsnit fastsættes nærmere bestemmelser om visuel undersøgelse af fiskevarer for parasitter.
KAPITEL I
DEFINITIONER
|
1. |
Ved »synlig parasit« forstås en parasit eller en gruppe af parasitter, der har en størrelse, farve eller konsistens, der klart kan skelnes fra fiskevæv. |
|
2. |
Ved »visuel undersøgelse« forstås ikke-destruktiv undersøgelse af fisk eller fiskevarer udført med eller uden optiske forstørrelsesmidler og under gode belysningsforhold for det menneskelige øje, herunder om nødvendigt gennemlysning. |
|
3. |
Ved »gennemlysning« forstås, for så vidt angår fladfisk og fiskefileter, det at holde fisk op foran et lys i et lysdæmpet lokale med henblik på at påvise parasitter. |
KAPITEL II
VISUEL UNDERSØGELSE
|
1. |
Der foretages visuel undersøgelse af et repræsentativt antal prøver. De personer, der er ansvarlige for virksomhederne på land, og de kvalificerede personer på fabriksfartøjerne træffer afgørelse om omfanget og hyppigheden af undersøgelsen ud fra fiskevarernes art, deres geografiske oprindelse og deres anvendelse. Virksomhedens kvalificerede personale foretager under produktionen visuel undersøgelse af de rensede fisk i bughulen og på lever og rogn bestemt til konsum. Afhængigt af rensningsmetoden foretages den visuelle undersøgelse:
|
|
2. |
Den visuelle undersøgelse af fiskefileter eller -skiver foretages af kvalificerede personer ved afpudsningen og efter filetering eller udskæring. Når det ikke er muligt at foretage en individuel undersøgelse på grund af fileternes størrelse eller fileteringsmetoden, opstilles der en prøveudtagningsplan, som stilles til rådighed for den kompetente myndighed, jf. afsnit VIII, kapitel II, punkt 4, i bilag III til forordning (EF) nr. 853/2004. Når gennemlysning af fileter er nødvendig ud fra et teknisk synspunkt, skal dette indgå i prøveudtagningsplanen. |
AFSNIT II
FORPLIGTELSER, DER PÅHVILER DE KOMPETENTE MYNDIGHEDER
KAPITEL I
GRÆNSEVÆRDIER FOR TVB-N (TOTAL VOLATILE BASIC NITROGEN) FOR VISSE KATEGORIER AF FISKEVARER OG DE ANALYSEMETODER, DER SKAL ANVENDES
|
1. |
Uforarbejdede fiskevarer af de i kapitel II anførte artskategorier anses for uegnede til konsum, når en kemisk kontrol — efter at der ved den organoleptiske bedømmelse er rejst tvivl om deres friskhed — viser, at følgende grænseværdier for TVB-N (Total Volatile Basic Nitrogen) er overskredet:
Referencemetoden ved kontrol af grænseværdien for TVB-N omfatter destillation af et proteinfrit perchlorsyreekstrakt som beskrevet i kapitel III. |
|
2. |
Destillation, jf. punkt 1, foretages ved hjælp af et apparat, der fungerer som vist på figuren i kapitel IV. |
|
3. |
Følgende rutinemetoder kan anvendes til at kontrollere grænseværdien for TVB-N:
|
|
4. |
Prøven skal bestå af ca. 100 gram fiskekød, der er udtaget mindst tre forskellige steder og blandet i en kødhakkemaskine. Medlemsstaterne skal anbefale, at de officielle laboratorier rutinemæssigt anvender den nævnte referencemetode. Hvis resultaterne af en analyse udført efter en af rutinemetoderne er usikre eller bestrides, må alene referencemetoden anvendes til verifikation af resultaterne. |
KAPITEL II
ARTSKATEGORIER, FOR HVILKE DER ER FASTSAT GRÆNSEVÆRDIER FOR TVB-N
|
1. |
Sebastes spp., Helicolenus dactylopterus, Sebastichthys capensis |
|
2. |
Arter tilhørende familien Pleuronectidae (med undtagelse af helleflynder: Hippoglossus spp.) |
|
3. |
Salmo salar, arter tilhørende familien Merlucciidae, arter tilhørende familien Gadidae. |
KAPITEL III
BESTEMMELSE AF KONCENTRATIONEN AF TVB-N I FISK OG FISKEVARER
Referenceprocedure
1. Formål og anvendelsesområde
Der beskrives en referencemetode til at identificere nitrogenkoncentrationen af TVB-N i fisk og fiskevarer. Metoden kan anvendes for TVB-N-koncentrationer fra 5 mg pr. 100 g til i hvert fald 100 mg pr. 100 g.
2. Definition
Ved »TVB-N-koncentration« forstås nitrogenindholdet af flygtige nitrogenbaser bestemt ved den beskrevne metode.
Koncentrationen udtrykkes i mg pr. 100 g.
3. Kort beskrivelse
De flygtige nitrogenbaser ekstraheres af en prøve ved hjælp af 0,6 mol perchlorsyreopløsning. Ekstraktet gøres basisk og underkastes dampdestillation, idet de flygtige basebestanddele absorberes i en syreopløsning. TVB-N-koncentrationen bestemmes ved titrering af de absorberede baser.
4. Kemikalier
Medmindre andet er angivet, skal der anvendes analyserene kemikalier. Vandet skal enten være destilleret eller demineraliseret og have mindst tilsvarende renhed. Medmindre andet er angivet, forstås ved »opløsning« en vandig opløsning, f.eks.:
|
a) |
perchlorsyreopløsning = 6 g pr. 100 ml |
|
b) |
natriumhydroxidopløsning = 20 g pr. 100 ml |
|
c) |
standardsaltsyreopløsning 0,05 mol/l (0,05 N)
|
|
d) |
borsyreopløsning = 3 g pr. 100 ml |
|
e) |
silikonebaseret skumdæmpningsmiddel |
|
f) |
phenolphtaleinopløsning = 1 g pr. 100 ml 95 % ethanol |
|
g) |
indikatoropløsning (Tashiro blandet indikator) 2 g methylrødt og 1 g methylenblåt opløses i 1 000 ml 95 % ethanol. |
5. Udstyr
|
a) |
En kødhakkemaskine, hvormed der kan fremstilles tilstrækkeligt homogent finthakket fiskekød. |
|
b) |
En højhastighedsblender med et omdrejningstal på mellem 8 000 og 45 000 omdrejninger pr. minut. |
|
c) |
Foldefilter, diameter 150 mm, til hurtigfiltrering. |
|
d) |
5 ml burette med 0,01 ml-inddeling. |
|
e) |
Apparatur til dampdestillation. Apparaturet skal kunne indstilles til forskellige dampmængder og producere en konstant mængde damp i et vist tidsrum. Det skal være sådan indrettet, at de frie baser, der dannes, når analysen gøres basisk, ikke kan slippe bort. |
6. Udførelse
Advarsel: Når der arbejdes med perchlorsyre, som er stærkt ætsende, skal der udvises den nødvendige forsigtighed og træffes passende sikkerhedsforanstaltninger. Prøverne bør — hvis det overhovedet er muligt — forberedes som beskrevet nedenfor snarest muligt efter ankomsten til laboratoriet.
|
a) |
Analyseprøven hakkes omhyggeligt i en kødhakkemaskine som beskrevet i punkt 5, litra a). 10 g ± 0,1 g af den hakkede prøve afvejes nøjagtigt i en egnet beholder. Dette blandes med 90,0 ml perchlorsyreopløsning som nævnt i punkt 4, litra a); der homogeniseres i to minutter i en blender som beskrevet i punkt 5, litra b), og filtreres. Det herved fremkomme ekstrakt kan opbevares i mindst syv dage ved en temperatur på ca. 2-6 oC. |
|
b) |
50,0 ml af ekstraktet, jf. litra a), anbringes i et dampdestillationsapparatur som beskrevet i punkt 5, litra e). Med henblik på en senere kontrol af, at ekstraktet er blevet alkalisk, tilsættes nogle dråber phenolphtalein som beskrevet i punkt 4, litra f). Efter tilsætning af nogle få dråber silikonebaseret skumdæmpningsmiddel tilsættes der 6,5 ml natriumhydroxidopløsning som beskrevet i punkt 4, litra b), til ekstraktet, og dampdestillationen påbegyndes straks. Dampdestillationen reguleres således, at der produceres ca. 100 ml destillat inden for ti minutter. Destillationsafgangsrøret udmunder under væskeoverfladen i et forlag med 100 ml borsyreopløsning som beskrevet i punkt 4, litra d), hvortil der er tilsat 3-5 dråber indikatoropløsning som beskrevet i punkt 4, litra g). Efter nøjagtigt 10 minutter afsluttes destillationen. Destillationsafgangsrøret tages op af forlaget og skylles med vand. Indholdet af flygtige baser i forlagsopløsningen bestemmes ved titrering med standardsaltsyreopløsning som beskrevet i punkt 4, litra c). Endepunktet bør ligge ved et pH på 5,0 ± 0,1. |
|
c) |
Der skal foretages dobbeltbestemmelse. Metoden er korrekt udført, hvis forskellen mellem de to bestemmelser ikke er større end 2 mg pr. 100 g. |
|
d) |
Der udføres en blindprøve efter samme fremgangsmåde som i litra b). I stedet for ekstraktet anvendes en 50,0 ml perchlorsyreopløsning som beskrevet i punkt 4, litra a). |
7. Beregning af TVB-N
Efter titrering af forlagsopløsningen med saltsyre som beskrevet i punkt 4, litra c), beregnes TVB-N-koncentrationen således:

V1 = ml 0,01 mol saltsyreopløsning for prøven
V0 = ml 0,01 mol saltsyreopløsning for blindprøven
M = prøvens vægt i g.
Bemærkninger
|
1. |
Der skal foretages dobbeltbestemmelse. Metoden er korrekt udført, hvis forskellen mellem de to bestemmelser ikke er større end 2 mg pr. 100 g. |
|
2. |
Udstyret kontrolleres ved at destillere en NH4Cl-opløsning svarende til 50 mg TVB-N pr. 100 g. |
|
3. |
Standardafvigelse for reproducerbarhed Sr = 1,20 mg pr. 100 g. Standardafvigelse for sammenlignelighed SR = 2,50 mg pr. 100 g. |
KAPITEL IV
TVB-N-APPARATUR TIL DAMPDESTILLATION

BILAG III
ANERKENDTE ANALYSEMETODER TIL PÅVISNING AF MARINE BIOTOKSINER
De kompetente myndigheder og, når det er relevant, fødevarevirksomhedslederne skal anvende nedenstående analysemetoder til at kontrollere overholdelsen af de grænseværdier, der er fastsat i afsnit VII, kapitel V, punkt 2, i bilag III til forordning (EF) nr. 853/2004.
I henhold til artikel 7, stk. 2 og 3, i Rådets direktiv 86/609/EØF (1) skal elementer til erstatning, forbedring og reducering tages i betragtning, når der anvendes biologiske metoder.
KAPITEL I
METODE TIL PÅVISNING AF PARALYTISK SKALDYRSGIFT (PSP)
|
1. |
Indholdet af paralytisk skaldyrsgift (PSP) i bløddyrs spiselige dele (hele kroppen eller enhver spiselig del heraf) skal påvises i overensstemmelse med den biologiske analysemetode eller en anden internationalt anerkendt metode. Den biologiske analysemetode kan om fornødent kombineres med en anden metode til påvisning af saxitoksin og analoge stoffer, som der foreligger standarder for. |
|
2. |
Hvis resultaterne bestrides, er referencemetoden den biologiske metode. |
KAPITEL II
METODE TIL PÅVISNING AF AMNESIFREMKALDENDE SKALDYRSGIFT (ASP)
Det samlede indhold af amnesifremkaldende skaldyrsgift (ASP) i bløddyrs spiselige dele (hele kroppen eller enhver spiselig del heraf) skal påvises ved anvendelse af højtryksvæskechromatografi (HPLC) eller anden anerkendt metode.
Hvis resultaterne bestrides, er referencemetoden HPLC-metoden.
KAPITEL III
METODER TIL PÅVISNING AF LIPOFILE TOKSINER
A. Biologiske metoder
|
1. |
Til påvisning af de marine toksiner, der er omhandlet i afsnit VII, kapitel V, punkt 2, litra c), d) og e), i bilag III til forordning (EF) nr. 853/2004, kan der anvendes procedurer med en række bioassays med mus, som er forskellige med hensyn til analyseprøve (hepatopancreas eller hele kroppen) og med hensyn til de opløsningsmidler, der anvendes til ekstraktion og oprensning. Følsomhed og selektivitet afhænger af, hvilket opløsningsmiddel der vælges til ekstraktion og oprensning, og dette bør tages i betragtning, når det afgøres, hvilken metode der skal anvendes, så alle toksinerne bliver omfattet. |
|
2. |
Et enkelt bioassay med mus med acetoneekstraktion kan anvendes til at påvise okadainsyre, dinophysistoksiner, pectenotoksiner og yessotoksiner. Et sådant assay kan om fornødent suppleres med væske-væske-deling med ethylacetat/vand eller dichlormethan/vand for at fjerne eventuelle interferenser. Til påvisning af azaspiracider på den foreskrevne grænseværdi ved hjælp af denne procedure skal hele kroppen anvendes som analyseprøve. |
|
3. |
Der anvendes tre mus til hver test. Hvis to ud af tre mus dør, inden for 24 timer efter at de alle har fået injiceret et ekstrakt svarende til 5 g hepatopancreas eller 25 g af hele kroppen, anses det for en positiv indikation af, at en eller flere af de toksiner, der er omhandlet i afsnit VII, kapitel V, punkt 2, litra c), d) og e), i bilag III til forordning (EF) nr. 853/2004, forekommer i mængder, der overstiger de fastsatte grænseværdier. |
|
4. |
Bioassay med mus med acetoneekstraktion fulgt af væske-væske-deling med diethylether kan anvendes til at påvise okadainsyre, dinophysistoksiner, pectenotoksiner og azaspiracider, men det kan ikke anvendes til at påvise yessotoksiner, da der kan forekomme tab af disse toksiner ved delingen. Der anvendes tre mus til hver test. Hvis to ud af tre mus dør, inden for 24 timer efter at de alle har fået injiceret et ekstrakt svarende til 5 g hepatopancreas eller 25 g af hele kroppen, anses det for en positiv indikation af, at okadainsyre, dinophysistoksiner, pectenotoksiner og azaspiracider forekommer i mængder, der overstiger de grænseværdier, der er fastsat i afsnit VII, kapitel V, punkt 2, litra c) og e), i bilag III til forordning (EF) nr. 853/2004. |
|
5. |
Bioassay med rotter kan anvendes til at påvise okadainsyre, dinophysistoksiner og azaspiracider. Der anvendes tre rotter til hver test. Hvis mindst en ud af tre rotter pr. forsøg reagerer med diarré, anses det for en positiv indikation af, at okadainsyre, dinophysistoksiner og azaspiracider forekommer i mængder, der overstiger de grænser, der er fastsat i afsnit VII, kapitel V, punkt 2, litra c) og e), i bilag III til forordning (EF) nr. 853/2004. |
B. Alternative påvisningsmetoder
|
1. |
En række metoder, f.eks. højtryksvæskechromatografi (HPLC) med fluorimetrisk påvisning og væskechromatografi (LC), massespektrometri (MS), immunassays og funktionelle assays, såsom fosfatase-inhiberingsassay, anvendes som alternative eller supplerende metoder til den biologiske analysemetode, forudsat at de enten alene eller kombineret kan påvise mindst følgende analoge stoffer, at de ikke er mindre effektive end biologiske metoder, og at anvendelsen af dem giver et tilsvarende folkesundhedsbeskyttelsesniveau:
|
|
2. |
Hvis der opdages nye analoge stoffer af betydning for folkesundheden, bør de også være omfattet af analysen. Der skal foreligge standarder, inden det er muligt at foretage kemiske analyser. Samlet toksicitet beregnes ved anvendelse af konverteringsfaktorer på basis af toksicitetsoplysningerne for hvert toksin. |
|
3. |
Metodernes præstationsegenskaber fastlægges efter validering ifølge en internationalt anerkendt protokol. |
|
4. |
Biologiske metoder erstattes af alternative påvisningsmetoder, så snart referencematerialer til påvisning af toksinerne foreskrevet i afsnit VI, kapitel V, i bilag III til forordning (EF) nr. 853/2004 er umiddelbart tilgængelige, metoderne er blevet valideret, og dette kapitel er blevet ændret i overensstemmelse hermed. |
(1) EFT L 358 af 18.12.1986, s. 1.
BILAG IV
CALCIUMINDHOLD I MASKINSEPARERET KØD
Der gælder følgende for calciumindholdet i maskinsepareret kød, jf. forordning (EF) nr. 853/2004:
|
1. |
Det må ikke overstige 0,1 % (= 100 mg/100 g eller 1 000 ppm) af ferskvaren. |
|
2. |
Det skal bestemmes ved anvendelse af en standardiseret international metode. |
BILAG V
LISTER OVER GODKENDTE/AUTORISEREDE FØDEVAREVIRKSOMHEDER
KAPITEL I
ADGANG TIL LISTER OVER GODKENDTE/AUTORISEREDE GODKENDTE FØDEVAREVIRKSOMHEDER
Som en hjælp til, at medlemsstaterne kan give de øvrige medlemsstater og offentligheden adgang til ajourførte lister over godkendte/autoriserede fødevarevirksomheder, opretter Kommissionen et websted, hvor alle medlemsstater får lagt et link til deres respektive nationale websteder.
KAPITEL II
DE NATIONALE WEBSTEDERS UDFORMNING
A. Masterliste
|
1. |
De enkelte medlemsstater meddeler Kommissionen en internetadresse på ét nationalt websted, der indeholder masterlisten over lister over godkendte/autoriserede fødevarevirksomheder, der fremstiller animalske produkter som defineret i punkt 8.1 i bilag I til forordning (EF) nr. 853/2004. |
|
2. |
Masterlisten, jf. punkt 1, skal bestå af én side og være udfyldt på et eller flere officielle EU-sprog. |
B. Struktur
|
1. |
Webstedet med masterlisten udarbejdes af den kompetente myndighed eller, hvis det er relevant, en af de kompetente myndigheder, der er omhandlet i artikel 4 i forordning (EF) nr. 882/2004. |
|
2. |
Masterlisten skal indeholde links til:
|
KAPITEL III
LAYOUT OG KODER FOR LISTER OVER GODKENDTE/AUTORISEREDE FØDEVAREVIRKSOMHEDER
Layout, herunder relevante oplysninger og koder, fastlægges med henblik på at sikre, at oplysningerne om godkendte/autoriserede fødevarevirksomheder er bredt tilgængelige, og at listerne er let læselige.
KAPITEL IV
TEKNISKE SPECIFIKATIONER
De opgaver og aktiviteter, der er omhandlet i kapitel II og III, udføres i overensstemmelse med de tekniske specifikationer, som Kommissionen har offentliggjort.
BILAG VI
MODELLER TIL SUNDHEDSCERTIFIKATER VED IMPORT AF FRØLÅR, SNEGLE, GELATINE OG KOLLAGEN
AFSNIT I
FRØLÅR OG SNEGLE
Sundhedscertifikater, jf. artikel 6, stk. 1, litra d), i forordning (EF) nr. 853/2004, til anvendelse ved import af frølår og snegle skal være i overensstemmelse med de modeller, der er fastlagt i henholdsvis del A og del B i tillæg I til dette bilag.
AFSNIT II
GELATINE
Sundhedscertifikater, jf. artikel 6, stk. 1, litra d), i forordning (EF) nr. 853/2004, til anvendelse ved import af gelatine og råvarer til fremstilling af gelatine skal være i overensstemmelse med de modeller, der er fastlagt i henholdsvis del A og del B i tillæg II til dette bilag, medmindre andet er fastsat i andre særlige fællesskabsbestemmelser, først og fremmest — men ikke udelukkende — om transmissible spongiforme encephalopatier og hormoner.
AFSNIT III
KOLLAGEN
Sundhedscertifikater, jf. artikel 6, stk. 1, litra d), i forordning (EF) nr. 853/2004, til anvendelse ved import af kollagen og råvarer til fremstilling af kollagen skal være i overensstemmelse med de modeller, der er fastlagt i henholdsvis del A og del B i tillæg III til dette bilag, medmindre andet er fastsat i andre særlige fællesskabsbestemmelser, først og fremmest — men ikke udelukkende — om transmissible spongiforme encephalopatier og hormoner.
Tillæg I til bilag VI
Del A
MODEL TIL SUNDHEDSCERTIFIKAT VED IMPORT AF KØLEDE, FROSNE ELLER TILBEREDTE FRØLÅR TIL KONSUM


Del B
MODEL TIL SUNDHEDSCERTIFIKAT VED IMPORT AF KOGTE, TILBEREDTE ELLER KONSERVEREDE SNEGLE, OGSÅ UDEN HUS, TIL KONSUM


Tillæg II til bilag VI
DEL A
MODEL TIL SUNDHEDSCERTIFIKAT VED IMPORT AF GELATINE TIL KONSUM


Del B
MODEL TIL SUNDHEDSCERTIFIKAT VED IMPORT AF RÅVARER TIL FREMSTILLING AF GELATINE TIL KONSUM
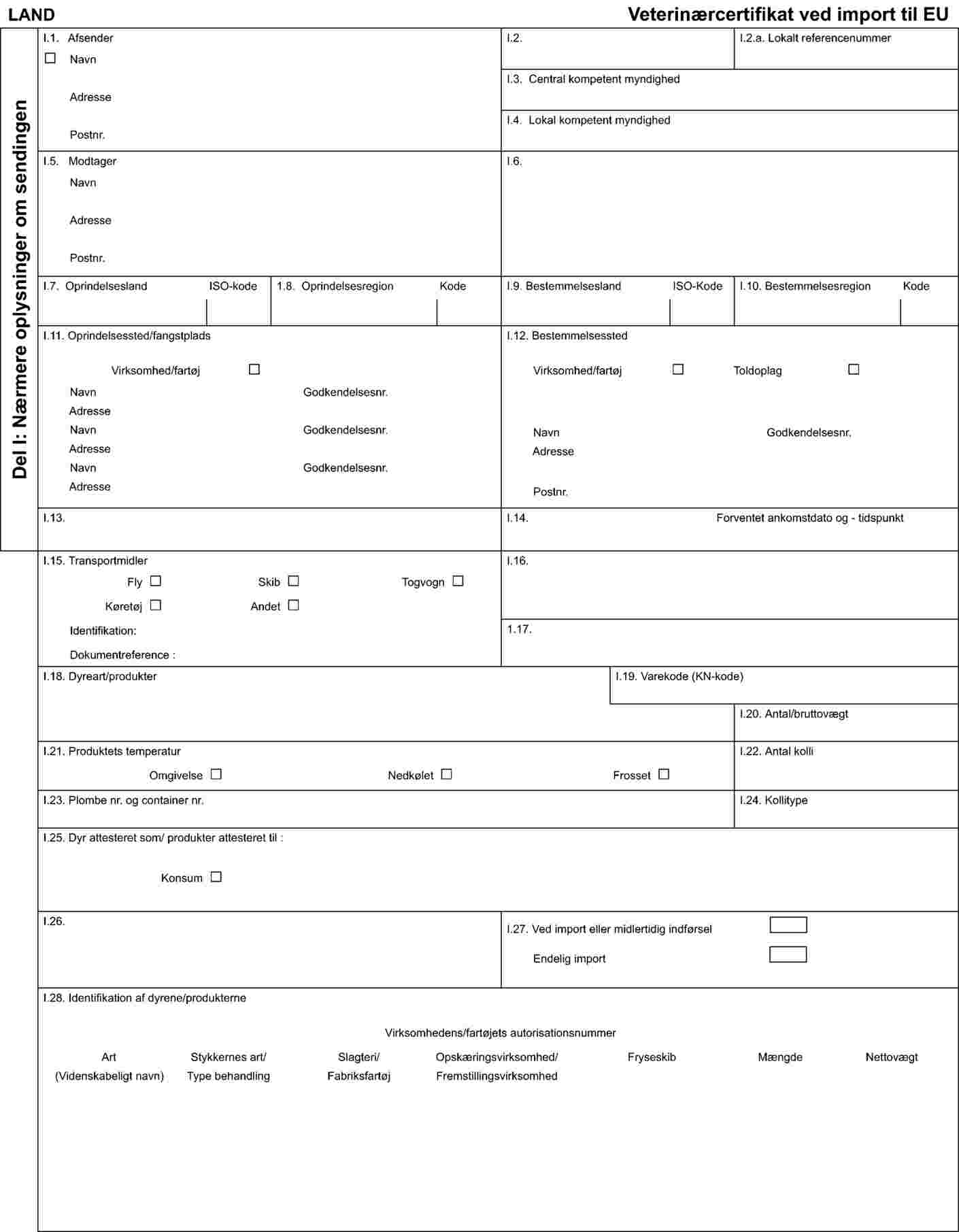

Tillæg III til bilag VI
Del A
MODEL TIL SUNDHEDSCERTIFIKAT VED IMPORT AF KOLLAGEN TIL KONSUM


Del B
MODEL TIL SUNDHEDSCERTIFIKAT VED IMPORT AF RÅVARER TIL FREMSTILLING AF KOLLAGEN TIL KONSUM


BILAG VII
ÆNDRINGER AF FORORDNING (EF) Nr. 853/2004
I bilag II og III til forordning (EF) nr. 853/2004 foretages følgende ændringer:
|
1) |
Bilag II, afsnit I, punkt B, ændres således:
|
|
2) |
Bilag III ændres således:
|
(1) EFT L 123 af 24.4.1998, s. 1.
BILAG VIII
ÆNDRINGER AF FORORDNING (EF) Nr. 854/2004
I bilag I, II og III til forordning (EF) nr. 854/2004 foretages følgende ændringer:
|
1) |
Bilag I, afsnit I, kapitel III, punkt 3, ændres således:
|
|
2) |
Kapitel II, litra A, punkt 4 og 5, i bilag II affattes således:
|
|
3) |
Kapitel II, litra G, punkt 1, i bilag III affattes således:
|