EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 32015R1013
Commission Implementing Regulation (EU) 2015/1013 of 25 June 2015 laying down rules in respect of Regulation (EC) No 273/2004 of the European Parliament and of the Council on drug precursors and of Council Regulation (EC) No 111/2005 laying down rules for the monitoring of trade between the Union and third countries in drug precursors (Text with EEA relevance)
Kommissionens gennemførelsesforordning (EU) 2015/1013 af 25. juni 2015 om regler vedrørende Europa-Parlamentets og Rådets forordning (EF) nr. 273/2004 om narkotikaprækursorer og vedrørende Rådets forordning (EF) nr. 111/2005 om regler for overvågning af handel med narkotikaprækursorer mellem Unionen og tredjelande (EØS-relevant tekst)
Kommissionens gennemførelsesforordning (EU) 2015/1013 af 25. juni 2015 om regler vedrørende Europa-Parlamentets og Rådets forordning (EF) nr. 273/2004 om narkotikaprækursorer og vedrørende Rådets forordning (EF) nr. 111/2005 om regler for overvågning af handel med narkotikaprækursorer mellem Unionen og tredjelande (EØS-relevant tekst)
OJ L 162, 27.6.2015, p. 33–64
(BG, ES, CS, DA, DE, ET, EL, EN, FR, HR, IT, LV, LT, HU, MT, NL, PL, PT, RO, SK, SL, FI, SV)
 In force
In force
|
27.6.2015 |
DA |
Den Europæiske Unions Tidende |
L 162/33 |
KOMMISSIONENS GENNEMFØRELSESFORORDNING (EU) 2015/1013
af 25. juni 2015
om regler vedrørende Europa-Parlamentets og Rådets forordning (EF) nr. 273/2004 om narkotikaprækursorer og vedrørende Rådets forordning (EF) nr. 111/2005 om regler for overvågning af handel med narkotikaprækursorer mellem Unionen og tredjelande
(EØS-relevant tekst)
EUROPA-KOMMISSIONEN HAR —
under henvisning til traktaten om Den Europæiske Unions funktionsmåde,
under henvisning til Europa-Parlamentets og Rådets forordning (EF) nr. 273/2004 af 11. februar 2004 om narkotikaprækursorer (1), særlig artikel 14,
under henvisning til Rådets forordning (EF) nr. 111/2005 af 22. december 2004 om regler for overvågning af handel med narkotikaprækursorer mellem Unionen og tredjelande (2), særlig artikel 6, stk. 3, artikel 9, stk. 2, tredje afsnit, og artikel 28, og
ud fra følgende betragtninger:
|
(1) |
Kommissionens forordning (EF) nr. 1277/2005 (3) fastlægger gennemførelsesbestemmelser til forordning (EF) nr. 273/2004 og forordning (EF) nr. 111/2005 om narkotikaprækursorer. Både forordning (EF) nr. 273/2004 og forordning (EF) nr. 111/2005 er blevet ændret efter vedtagelsen af forordning (EF) nr. 1277/2005 med henblik på at indarbejde beføjelser til at vedtage delegerede retsakter og gennemførelsesbestemmelser, jf. traktatens artikel 290 og 291. Der bør derfor vedtages nye regler i overensstemmelse med de nye beføjelser. |
|
(2) |
Selv om forordning (EF) nr. 273/2004 vedrører handel inden for EU, og forordning (EF) nr. 111/2005 vedrører handel mellem EU og tredjelande, er mange af bestemmelserne fælles for begge forordninger. For at sikre sammenhæng er det berettiget at vedtage én gennemførelsesretsakt, som dækker begge forordninger. |
|
(3) |
Af hensyn til retssikkerheden og en sammenhængende håndhævelse af bestemmelserne i denne forordning er det nødvendigt at definere »forretningslokaler«. |
|
(4) |
De gældende bestemmelser vedrørende procedurereglerne for udstedelse af licenser, proceduren og formatet for indgivelse af oplysninger krævet med henblik på overvågning af handel, og formatet og håndteringen af eksport- og importtilladelser har vist sig at være effektive og bør derfor i alt væsentligt fortsat finde anvendelse i kraft af denne forordning. |
|
(5) |
Procedurereglerne for udstedelse af registrering til erhvervsdrivende og brugere, som fastlagt i forordning (EF) nr. 273/2004 og forordning (EF) nr. 111/2005, bør afspejle procedurereglerne for udstedelse af licenser. |
|
(6) |
For at sikre kvaliteten og sammenhængen af de oplysninger, der lægges ind i den europæiske database over narkotikaprækursorer, og undgå gentagelser bør hver medlemsstat oprette ét kontaktpunkt, der overfører oplysningerne til databasen. Oplysningerne bør meddeles hurtigst muligt. Oplysninger om en licens eller en registrering bør omfatte de elementer, der er nødvendige for at identificere den erhvervsdrivende eller den bruger, der er indehaver af licensen eller registreringen, samt det eller de omfattede stoffer. Adgangen til oplysningerne bør begrænses til det minimum, der er nødvendigt for, at de offentlige myndigheder kan varetage deres opgaver. |
|
(7) |
Overgangsbestemmelser bør tillade anvendelse af papirformularer, der er udstedt før denne forordnings ikrafttræden i overensstemmelse med tidligere bestemmelser, indtil beholdningen af papirformularerne er udtømt. |
|
(8) |
Foranstaltningerne i denne forordning er i overensstemmelse med udtalelse fra Udvalget for Narkotikaprækursorer — |
VEDTAGET DENNE FORORDNING:
Artikel 1
Genstand
Denne forordning fastsætter ensartede procedureregler til gennemførelsen af forordning (EF) nr. 273/2004 og forordning (EF) nr. 111/2005 for så vidt angår udstedelse af licens til og registrering af erhvervsdrivende og brugere og opførelse af dem i den europæiske database over narkotikaprækursorer, de erhvervsdrivendes indberetning af oplysninger krævet med henblik på overvågning af handel og tilladelse til eksport og import af narkotikaprækursorer.
Artikel 2
Definitioner
I denne forordning forstås ved »forretningslokaler« bygninger samt tilhørende jord på de enkelte lokaliteter, hvor en erhvervsdrivende er etableret.
Artikel 3
Procedure for udstedelse af licenser
1. En erhvervsdrivende eller en bruger skal forelægge den kompetente myndighed en ansøgning om udstedelse af en licens, jf. artikel 3, stk. 2, i forordning (EF) nr. 273/2004 eller artikel 6, stk. 1, i forordning (EF) nr. 111/2005, elektronisk eller på papir som foreskrevet af den pågældende medlemsstat.
En ansøgning anses for at være fyldestgørende, når den indeholder alle de oplysninger, der er nævnt i artikel 3, stk. 2, litra b), i Kommissionens delegerede forordning (EU) 2015/1011 (4).
2. Ved vurderingen af en ansøgning om udstedelse af en licens kan den kompetente myndighed også tage hensyn til resultaterne af tidligere vurderinger eller kontroller af den ansøgende erhvervsdrivende, der har status som en autoriseret økonomisk operatør (AEO), jf. artikel 5a i Rådets forordning (EØF) nr. 2913/92 (5), i det omfang de er relevante for undersøgelsen af betingelserne for udstedelse af en licens.
Som en undtagelse fra nærværende forordnings artikel 3, stk. 1, kan den kompetente myndighed give tilladelse til, at erhvervsdrivende, der har status som en AEO, ikke indgiver alle de oplysninger, der er nævnt i 3, stk. 2, litra b), i delegeret forordning (EU) 2015/1011, når de indgiver en ansøgning.
3. Den kompetente myndighed vurderer først, om en ansøgning er fyldestgørende.
Hvis en ansøgning ikke anses for at være fyldestgørende, meddeler den kompetente myndighed ansøgeren dette og opfordrer ansøgeren til at indgive manglende eller relevante yderligere oplysninger.
Hvis en ansøgning anses for at være fyldestgørende, bekræfter den kompetente myndighed over for ansøgeren modtagelse af en fyldestgørende ansøgning.
4. Den kompetente myndighed træffer afgørelse om udstedelse af en licens senest 60 arbejdsdage efter modtagelsen af en fyldestgørende ansøgning i tilfælde af en ny licens og senest 30 arbejdsdage i tilfælde af fornyelse af en licens.
5. Enhver afgørelse om ikke at udstede en licens skal begrundes og meddeles ansøgeren elektronisk eller på papir.
6. Licensen kan gælde for de transaktioner, der er omhandlet i forordning (EF) nr. 273/2004 og forordning (EF) nr. 111/2005.
Artikel 4
Licensens anvendelsesområde
Den kompetente myndighed kan udstede en licens:
|
a) |
der omfatter alle registrerede stoffer og alle transaktioner pr. forretningslokale, eller |
|
b) |
der omfatter alle registrerede stoffer og alle transaktioner pr. medlemsstat. |
Artikel 5
Licensens format
En licens som omhandlet i artikel 3, stk. 2, i forordning (EF) nr. 273/2004 eller artikel 6, stk. 1, i forordning (EF) nr. 111/2005 skal udstedes i det format, der er angivet i bilag I til nærværende forordning.
Artikel 6
Senere ændringer
Hvis oplysningerne i en ansøgning om licens, bortset fra de oplysninger, der er nævnt i artikel 3, stk. 9, i delegeret forordning (EU) 2015/1011, ændres efter udstedelsen af licensen, skal licensindehaveren underrette den kompetente myndighed elektronisk eller på papir senest 10 arbejdsdage efter ændringen.
Hvis betingelserne i artikel 3 i delegeret forordning (EU) 2015/1011 fortsat er opfyldt efter ændringen, og de oplysninger, der skal ændres, fremgår af ansøgningen, ændrer den kompetente myndighed licensen i overensstemmelse hermed.
Artikel 7
Gyldighed, suspension og tilbagekaldelse af licenser
1. Når en licens' gyldighed er udløbet, eller når en licens er blevet tilbagekaldt, returnerer licensindehaveren en licens, der ikke længere er gyldig, til den kompetente myndighed senest 10 dage efter datoen for gyldighedens udløb eller tilbagekaldelsesdatoen.
2. Når en kompetent myndighed beslutter at suspendere eller tilbagekalde en licens, meddeles beslutningen licensindehaveren elektronisk eller på papir med en begrundelse for suspensionen eller tilbagekaldelsen.
Artikel 8
Særlige licenser
Denne forordnings artikel 3-7 finder ikke anvendelse på de særlige licenser, der er omhandlet i artikel 3, stk. 2, i forordning (EF) nr. 273/2004.
Artikel 9
Registreringsprocedure
1. Artikel 3, 4, 6 og 7 finder anvendelse på den procedure for registrering, der er omhandlet i artikel 3, stk. 6, i forordning (EF) nr. 273/2004 og i artikel 7, stk. 1, i forordning (EF) nr. 111/2005.
2. En registrering som omhandlet i artikel 3, stk. 6, i forordning (EF) nr. 273/2004 eller artikel 7, stk. 1, i forordning (EF) nr. 111/2005 skal udstedes i det format, der er angivet i bilag II.
3. Uanset stk. 2 kan den kompetente myndighed udstede registrering på en formular, som er trykt før denne forordnings ikrafttrædelsesdato, og som overholder nationale regler, der var gældende før denne forordnings ikrafttrædelse, indtil beholdningerne er udtømt.
4. Artikel 1, 2 og 3 finder ikke anvendelse på de særlige registreringer, der er omhandlet i artikel 3, stk. 6, i forordning (EF) nr. 273/2004.
Artikel 10
Oplysninger krævet med henblik på overvågning af handel
1. De erhvervsdrivende skal forelægge de oplysninger, der er nævnt i artikel 8, stk. 2, i forordning (EF) nr. 273/2004, elektronisk eller på papir som foreskrevet af den pågældende medlemsstat inden den 15. februar i hvert kalenderår for de registrerede stoffer i kategori 1 og 2 i bilag I til nævnte forordning.
2. De erhvervsdrivende skal forelægge de oplysninger, der er nævnt i artikel 9, stk. 2, i forordning (EF) nr. 111/2005, elektronisk eller på papir som fastsat af den pågældende medlemsstat inden den 15. februar hvert kalenderår.
3. De erhvervsdrivende skal forelægge de i stk. 1 og 2 årlige rapporter, selv om der ikke er foretaget transaktioner i et givent år.
Artikel 11
Eksport- og importtilladelser
1. De eksport- og importtilladelser, der er omhandlet i artikel 28 i forordning (EF) nr. 111/2005, udformes som vist i henholdsvis bilag III eller IV til nærværende forordning.
Uanset første afsnit kan rubrikken for tilladelsens nummer have et andet format i tilfælde, hvor eksport- eller importtilladelsen udstedes elektronisk.
2. Eksporttilladelsen udfærdiges i fire eksemplarer, der nummereres 1 til 4. Eksemplar nr. 1 opbevares af den myndighed, som udsteder tilladelsen. Eksemplar nr. 2 og 3 ledsager det registrerede stof og fremlægges for det toldsted, hvor eksporttoldangivelsen indgives, og derefter for den kompetente myndighed ved udgangsstedet fra Unionens toldområde. Den kompetente myndighed ved udgangsstedet returnerer eksemplar nr. 2 til den udstedende myndighed. Eksemplar nr. 3 ledsager de registrerede stoffer ind til importlandets kompetente myndighed. Eksportøren beholder eksemplar nr. 4.
3. Importtilladelsen udfærdiges i fire eksemplarer, der nummereres 1 til 4. Eksemplar nr. 1 opbevares af den myndighed, som udsteder tilladelsen. Den udstedende myndighed sender eksemplar nr. 2 til den kompetente myndighed i eksportlandet. Eksemplar nr. 3 ledsager det registrerede stof fra indgangsstedet til Unionens toldområde ind til importørens forretningslokaler, og importøren sender dette eksemplar til den udstedende myndighed. Importøren beholder eksemplar nr. 4.
4. En eksport- eller importtilladelse må ikke omfatte mere end to registrerede stoffer.
5. En tilladelse udstedes på et eller flere af Unionens officielle sprog. Medmindre den udstedes elektronisk, skal den være i A4-format og forsynet med guillocheret bundtryk, som gør al forfalskning ved hjælp af mekaniske eller kemiske midler synlig.
6. En medlemsstat kan trykke formularerne til tilladelse selv eller overlade trykningen til trykkerier, som den har godkendt. I sidstnævnte tilfælde skal hver formular til tilladelse være forsynet med en bemærkning om godkendelse og skal være påtrykt trykkeriets navn og adresse eller et kendetegn, som gør det muligt at identificere dette.
7. Uanset stk. 1-6 kan en medlemsstat udstede en eksport- eller importtilladelse på en formular, som er trykt før denne forordnings ikrafttrædelsesdato, og som overholder Kommissionens forordning (EF) nr. 1277/2005, indtil beholdningerne er udtømt.
8. Eksemplar nr. 1, 2 og 4 af den formular, der er vist i bilag III, anvendes til eksporttilladelser, som meddeles ved forenklet procedure. Eksemplar nr. 1 opbevares af den myndighed, som udsteder tilladelsen. Eksportøren beholder eksemplar nr. 2 og eksemplar nr. 4. Eksportøren skal på bagsiden af eksemplar nr. 2 angive nærmere enkeltheder vedrørende eksporttransaktionen, særlig mængden af det registrerede stof, som eksporteres, og den resterende mængde. Eksemplar nr. 2 forelægges det toldsted, hvor toldangivelsen blev indgivet. Nævnte toldsted bekræfter oplysningerne og tilbageleverer eksemplar nr. 2 til eksportøren.
9. Den erhvervsdrivende anfører tilladelsens nummer og ordene »forenklet procedure for meddelelse af eksporttilladelse« på toldangivelsen for hver eksporttransaktion. Hvis udgangstoldstedet ikke er udgangsstedet fra Unionens toldområde, skal oplysningerne figurere på de dokumenter, der ledsager eksportforsendelsen.
10. Eksportøren returnerer eksemplar nr. 2 til den udstedende myndighed senest 10 arbejdsdage efter udløbet af gyldigheden af en eksporttilladelse, der er meddelt ved forenklet procedure.
Artikel 12
Opførelse af erhvervsdrivende og brugere i den europæiske database over narkotikaprækursorer
1. Med henblik på opførelse i den europæiske database over narkotikaprækursorer af erhvervsdrivende og brugere, der har fået en licens eller registrering i henhold til artikel 3, stk. 7, i forordning (EF) nr. 273/2004, udpeger hver medlemsstat ét kontaktpunkt og meddeler kontaktoplysningerne til Kommissionen.
2. Det ansvarlige kontaktpunkt videregiver elektronisk de relevante oplysninger, senest 30 arbejdsdage efter at den har udstedt licensen eller registreringen. Hvis den pågældende erhvervsdrivende eller bruger meddeler ændringer i de relevante oplysninger til den kompetente myndighed, eller hvis en licens eller registrering suspenderes eller tilbagekaldes, skal det ansvarlige kontaktpunkt ajourføre oplysningerne, senest 30 arbejdsdage efter at den har accepteret ændringerne eller har suspenderet eller tilbagekaldt licensen eller registreringen.
3. Kommissionen sikrer:
|
a) |
at den elektroniske overførsel af oplysninger er sikker |
|
b) |
at databasen er begrænset og kun tilgængelig for de medarbejdere, der er udpeget af medlemsstaterne, og de embedsmænd i Kommissionen, der er ansvarlige for den europæiske database. |
4. Kommissionen og de kompetente myndigheder træffer alle nødvendige foranstaltninger for at sikre, at de i databasen opførte oplysninger om erhvervsdrivende og brugere kun anvendes med henblik på de officielle opgaver, der varetages af de udpegede medarbejdere og Kommissionens embedsmænd.
5. Oplysninger om erhvervsdrivende og brugere skal omfatte det fulde navn, adressen, licensens eller registreringens nummer og gyldighedsstatus samt navnet på og KN-koden for de registrerede stoffer, der er omfattet af henholdsvis licensen eller registreringen,
6. Kommissionen stiller oplysninger om licenser og registreringer, de er udløbet eller er blevet tilbagekaldt, til rådighed i databasen i mindst tre år efter udløbsdatoen eller tilbagekaldelsesdatoen.
Artikel 13
Ikrafttrædelse og anvendelse
Denne forordning træder i kraft på tredjedagen efter offentliggørelsen i Den Europæiske Unions Tidende.
Denne forordning er bindende i alle enkeltheder og gælder umiddelbart i hver medlemsstat.
Udfærdiget i Bruxelles, den 25. juni 2015.
På Kommissionens vegne
Jean-Claude JUNCKER
Formand
(1) EUT L 47 af 18.2.2004, s. 1.
(2) EUT L 22 af 26.1.2005, s. 1.
(3) Kommissionens forordning (EF) nr. 1277/2005 af 27. juli 2005 om gennemførelsesbestemmelser til Europa-Parlamentets og Rådets forordning (EF) nr. 273/2004 om narkotikaprækursorer og til Rådets forordning (EF) nr. 111/2005 om regler for overvågning af handel med narkotikaprækursorer mellem Fællesskabet og tredjelande (EUT L 202 af 3.8.2005, s. 7).
(4) Kommissionens delegerede forordning (EU) 2015/1011 af 24. april 2015 om supplerende bestemmelser til Europa-Parlamentets og Rådets forordning (EF) nr. 273/2004 om narkotikaprækursorer og Rådets forordning (EF) nr. 111/2004 om regler for overvågning af handel med narkotikaprækursorer mellem Unionen og tredjelande og om ophævelse af Kommissionens forordning (EF) nr. 1277/2005 (se side 12 i denne EUT).
(5) Rådets forordning (EØF) nr. 2913/92 af 12. oktober 1992 om indførelse af en EF-toldkodeks (EFT L 302 af 19.10.1992, s. 1).
BILAG I

Noter
|
1. |
Modellens layout er ikke obligatorisk. |
|
2. |
Modellens løbenumre og tekst skal følges. Rubrikkerne med tekst i fed skrift skal udfyldes. |
|
3. |
Enkeltheder vedrørende rubrikkerne:
|
|
4. |
Medlemsstaterne kan tilføje rubrikker til nationale formål. Sådanne rubrikker eller linjer forsynes med løbenummer og et stort bogstav (f.eks. 4A). |
5. Beskyttelse af personoplysninger
Når Europa-Kommissionen behandler personoplysninger i dette dokument, finder Europa-Parlamentets og Rådets forordning (EF) nr. 45/2001 om beskyttelse af fysiske personer i forbindelse med behandling af personoplysninger i fællesskabsinstitutionerne og -organerne og om fri udveksling af sådanne oplysninger anvendelse.
Når en medlemsstats kompetente myndighed behandler personoplysninger i dette dokument, finder de nationale bestemmelser om gennemførelse af direktiv 95/46/EF anvendelse.
Formålet med behandlingen af personoplysninger er overvågning af handelen med narkotikaprækursorer i Unionen i overensstemmelse med forordning (EF) nr. 273/2004, som ændret ved forordning (EU) nr. 1258/2013, og mellem Unionen og tredjelande i overensstemmelse med forordning (EF) nr. 111/2005, som ændret ved forordning (EU) nr. 1259/2013.
Den registeransvarlige i forbindelse med behandlingen af oplysningerne er den nationale kompetente myndighed, hvor dette dokument er indgivet. Listen over de kompetente myndigheder offentliggøres på Kommissionens websted:
http://ec.europa.eu/taxation_customs/resources/documents/customs/customs_controls/drugs_precursors/legislation/national_competent_authorities.pdf
I overensstemmelse med artikel 17 i forordning (EF) nr. 111/2005 om regler for overvågning af handel med narkotikaprækursorer mellem Unionen og tredjelande, med forbehold af gældende bestemmelser om databeskyttelse i Unionen og med henblik på kontrol og overvågning af visse stoffer, der hyppigt anvendes til ulovlig fremstilling af narkotika eller psykotrope stoffer, kan Kommissionen og medlemsstaternes kompetente myndigheder udveksle personoplysninger og oplysninger i dette dokument med de relevante myndigheder i tredjelande.
Den registrerede har ret til adgang til de personoplysninger vedrørende den pågældende, der behandles, og om nødvendigt til at berigtige, slette eller blokere personoplysninger i henhold til forordning (EF) nr. 45/2001 eller de nationale love til gennemførelse af direktiv 95/46/EF.
Alle anmodninger om udøvelse af retten til adgang, berigtigelse, sletning eller blokering fremsendes til og behandles af de kompetente myndigheder, som nærværende dokument er indgivet til.
Retsgrundlaget for behandling af personoplysninger er artikel 33 i forordning (EF) nr. 111/2005 og artikel 13b i forordning (EF) nr. 273/2004.
Personoplysninger i nærværende dokument må ikke opbevares i et længere tidsrum end det, der er nødvendigt af hensyn til de formål, hvortil de indsamles.
I tilfælde af konflikt kan klager indgives til den relevante nationale databeskyttelsesmyndighed. Kontaktoplysninger for de nationale databeskyttelsesmyndigheder findes på Europa-Kommissionens websted under Generaldirektorat for Retlige Anliggender: (http://ec.europa.eu/justice/data-protection/bodies/authorities/eu/index_en.htm#h2-1)
Vedrører klagen Europa-Kommissionens behandling af personoplysninger, skal den indgives til Den Europæiske Tilsynsførende for Databeskyttelse: (http://www.edps.europa.eu/EDPSWEB/)
BILAG II

Noter
|
1. |
Modellens layout er ikke obligatorisk. |
|
2. |
Modellens løbenumre og tekst skal følges. Rubrikkerne med tekst i fed skrift skal udfyldes. |
|
3. |
Enkeltheder vedrørende rubrikkerne:
|
|
4. |
Medlemsstaterne kan tilføje rubrikker til nationale formål. Sådanne rubrikker eller linjer forsynes med løbenummer og et stort bogstav (f.eks. 4A). |
5. Beskyttelse af personoplysninger
Når Europa-Kommissionen behandler personoplysninger i dette dokument, finder Europa-Parlamentets og Rådets forordning (EF) nr. 45/2001 om beskyttelse af fysiske personer i forbindelse med behandling af personoplysninger i fællesskabsinstitutionerne og -organerne og om fri udveksling af sådanne oplysninger anvendelse.
Når en medlemsstats kompetente myndighed behandler personoplysninger i dette dokument, finder de nationale bestemmelser om gennemførelse af direktiv 95/46/EF anvendelse.
Formålet med behandlingen af personoplysninger er overvågning af handelen med narkotikaprækursorer i Unionen i overensstemmelse med forordning (EF) nr. 273/2004, som ændret ved forordning (EU) nr. 1258/2013, og mellem Unionen og tredjelande i overensstemmelse med forordning (EF) nr. 111/2005, som ændret ved forordning (EU) nr. 1259/2013.
Den registeransvarlige i forbindelse med behandlingen af oplysningerne er den nationale kompetente myndighed, hvor dette dokument er indgivet. Listen over de kompetente myndigheder offentliggøres på Kommissionens websted:
http://ec.europa.eu/taxation_customs/resources/documents/customs/customs_controls/drugs_precursors/legislation/national_competent_authorities.pdf
I overensstemmelse med artikel 17 i forordning (EF) nr. 111/2005 om regler for overvågning af handel med narkotikaprækursorer mellem Unionen og tredjelande, med forbehold af gældende bestemmelser om databeskyttelse i Unionen og med henblik på kontrol og overvågning af visse stoffer, der hyppigt anvendes til ulovlig fremstilling af narkotika eller psykotrope stoffer, kan Kommissionen og medlemsstaternes kompetente myndigheder udveksle personoplysninger og oplysninger i dette dokument med de relevante myndigheder i tredjelande.
Den registrerede har ret til adgang til de personoplysninger vedrørende den pågældende, der behandles, og om nødvendigt til at berigtige, slette eller blokere personoplysninger i henhold til forordning (EF) nr. 45/2001 eller de nationale love til gennemførelse af direktiv 95/46/EF.
Alle anmodninger om udøvelse af retten til adgang, berigtigelse, sletning eller blokering fremsendes til og behandles af de kompetente myndigheder, som nærværende dokument er indgivet til.
Retsgrundlaget for behandling af personoplysninger er artikel 33 i forordning (EF) nr. 111/2005 og artikel 13b i forordning (EF) nr. 273/2004.
Personoplysninger i nærværende dokument må ikke opbevares i et længere tidsrum end det, der er nødvendigt af hensyn til de formål, hvortil de indsamles.
I tilfælde af konflikt kan klager indgives til den relevante nationale databeskyttelsesmyndighed. Kontaktoplysninger for de nationale databeskyttelsesmyndigheder findes på Europa-Kommissionens websted under Generaldirektorat for Retlige Anliggender: (http://ec.europa.eu/justice/data-protection/bodies/authorities/eu/index_en.htm#h2-1)
Vedrører klagen Europa-Kommissionens behandling af personoplysninger, skal den indgives til Den Europæiske Tilsynsførende for Databeskyttelse: (http://www.edps.europa.eu/EDPSWEB/)
BILAG III





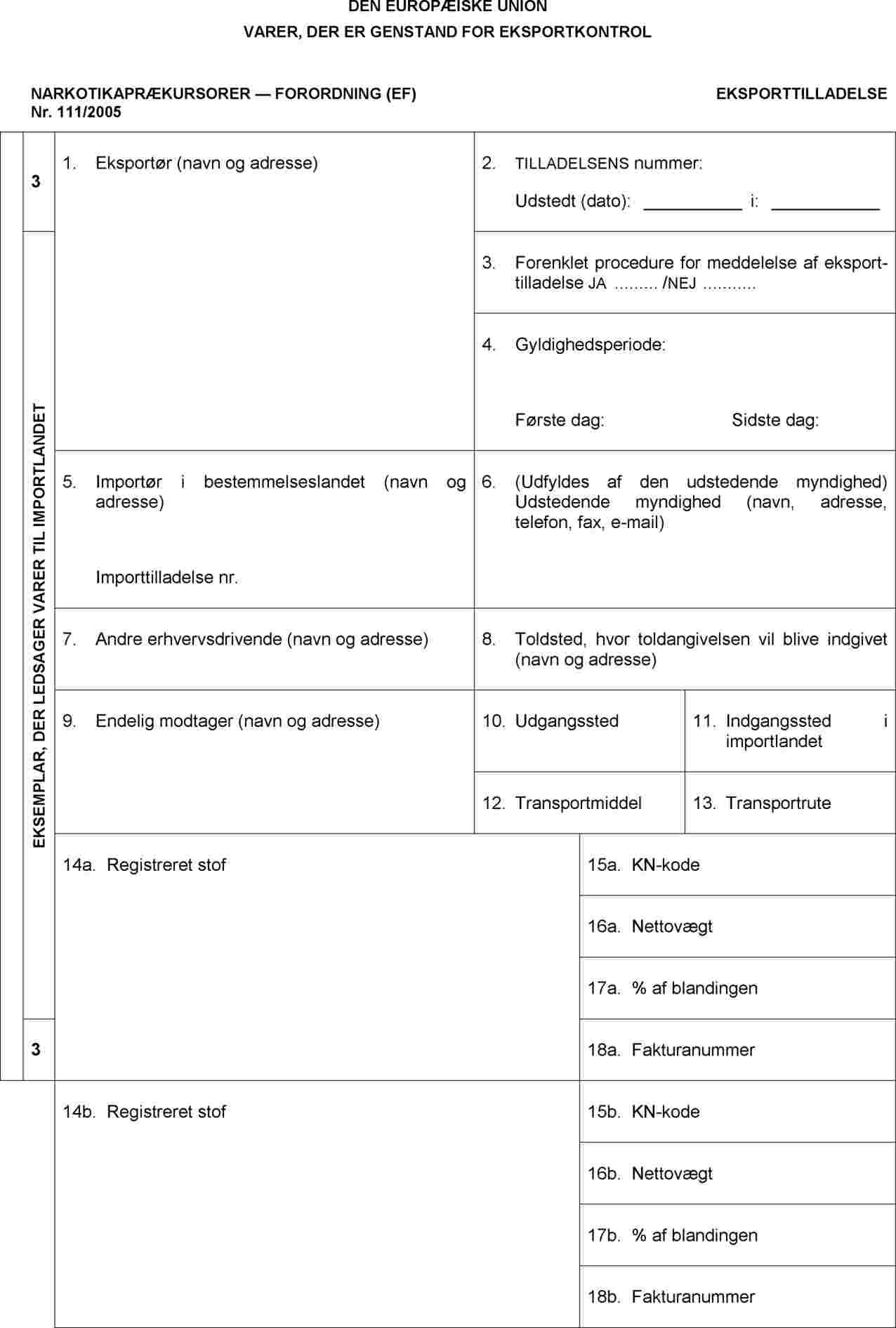



Noter
I.
|
1. |
Tilladelsen udfærdiges på et af Unionens officielle sprog. Hvis den udfærdiges i hånden, skal det gøres med blæk og blokbogstaver. |
|
2. |
Rubrik 1, 3, 5, 7 og 9 til 19 skal udfyldes af ansøgeren på tidspunktet for ansøgningen; oplysninger i rubrik 7, 8 og 10 til13 og 18 kan dog afgives på et senere tidspunkt, hvis de ikke kendes på tidspunktet for ansøgningen. I dette tilfælde skal rubrik 18 udfyldes, senest når eksportangivelsen indgives, og de supplerende oplysninger i rubrik 7, 8, 10 til 13 skal afgives til toldvæsenet eller en anden myndighed ved udgangsstedet fra Unionens toldområde senest inden varernes fysiske afsendelse. |
|
3. |
Rubrik 1, 5, 7 og 9: Angiv fulde navne og adresser (telefon, fax og e-mail) |
|
4. |
Rubrik 5: Angiv referencenummeret for tredjelandsimportørens importtilladelsesdokumentation (f.eks. et »letter of no objection« (stiltiende accept), importbevilling eller anden erklæring fra bestemmelseslandet). |
|
5. |
Rubrik 7: Angiv fulde navn og adresse (telefon, fax og e-mail) for alle andre erhvervsdrivende, som er involveret i eksporttransaktionen, såsom transportvirksomheder, formidlere, speditører. |
|
6. |
Rubrik 9: Angiv fulde navn og adresse (telefon, fax og e-mail) for den person eller det selskab, som varerne leveres til i bestemmelseslandet (som ikke nødvendigvis er den endelige bruger). |
|
7. |
Rubrik 10: Angiv navn på medlemsstat, havn, lufthavn eller grænseovergangssted. |
|
8. |
Rubrik 11: Angiv navn på land, havn, lufthavn eller grænseovergangssted. |
|
9. |
Rubrik 12: Beskriv, hvilket transportmiddel der skal benyttes (f.eks. lastbil, skib, fly, tog osv.). Det er ikke påkrævet at udfylde denne rubrik, når det drejer sig om en eksporttilladelse, som omfatter flere eksporttransaktioner. |
|
10. |
Rubrik 13: Beskriv transportruten så detaljeret som muligt. |
|
11. |
Rubrik 14a, 14b: Angiv navnet på det registrerede stof som anført i bilaget til forordning (EF) nr. 111/2005, handelsnavnet på lægemidlet i kategori 4, antallet af enheder i forsendelsen, antallet af tabletter/ampuller i hver enhed, indholdet af det registrerede stof i én enhed (pr. tablet/ampul) eller i forbindelse med en blanding eller et naturprodukt, navnet og den ottecifrede KN-kode samt handelsnavnet. |
|
12. |
Rubrik 15a, 15b: Angiv den ottecifrede KN-kode for det registrerede stof som anført i bilaget til forordning (EF) nr. 111/2005. |
|
13. |
Rubrik 16a, 16b: Angiv for kategori 4 den samlede nettovægt af det registrerede stof i forsendelsen af lægemidler. |
|
14. |
Rubrik 19:
|
II. (Forenklet procedure for meddelelse af eksporttilladelse)
|
1. |
Det er ikke påkrævet at udfylde rubrik 7, 8, 10 til 13 og 18 i forbindelse med en forenklet procedure for meddelelse af eksporttilladelse. |
|
2. |
På bagsiden af eksemplar nr. 2 skal rubrik 24 til 27 udfyldes for hver eksporttransaktion. |
|
3. |
Rubrik 23: Angiv den tilladte maksimumsmængde og nettovægt. Angiv for kategori 4 den samlede nettovægt af det registrerede stof i forsendelsen af lægemidler. Kolonne 24: Angiv den disponible mængde i felt 1 og delmængden til eksport i felt 2. Angiv for kategori 4 den samlede nettovægt af det registrerede stof i forsendelsen af lægemidler. Kolonne 25: Angiv delmængden til eksport med bogstaver. Rubrik 26: Toldangivelsens referencenummer og dato. |
Beskyttelse af personoplysninger
Når Europa-Kommissionen behandler personoplysninger i dette dokument, finder Europa-Parlamentets og Rådets forordning (EF) nr. 45/2001 om beskyttelse af fysiske personer i forbindelse med behandling af personoplysninger i fællesskabsinstitutionerne og -organerne og om fri udveksling af sådanne oplysninger anvendelse.
Når en medlemsstats kompetente myndighed behandler personoplysninger i dette dokument, finder de nationale bestemmelser om gennemførelse af direktiv 95/46/EF anvendelse.
Formålet med behandlingen af personoplysninger er overvågning af handelen med narkotikaprækursorer i Unionen i overensstemmelse med forordning (EF) nr. 273/2004, som ændret ved forordning (EU) nr. 1258/2013, og mellem Unionen og tredjelande i overensstemmelse med forordning (EF) nr. 111/2005, som ændret ved forordning (EU) nr. 1259/2013.
Den registeransvarlige i forbindelse med behandlingen af oplysningerne er den nationale kompetente myndighed, hvor dette dokument er indgivet. Listen over de kompetente myndigheder offentliggøres på Kommissionens websted:
http://ec.europa.eu/taxation_customs/resources/documents/customs/customs_controls/drugs_precursors/legislation/national_competent_authorities.pdf
I overensstemmelse med artikel 17 i forordning (EF) nr. 111/2005 om regler for overvågning af handel med narkotikaprækursorer mellem Unionen og tredjelande, med forbehold af gældende bestemmelser om databeskyttelse i Unionen og med henblik på kontrol og overvågning af visse stoffer, der hyppigt anvendes til ulovlig fremstilling af narkotika eller psykotrope stoffer, kan Kommissionen og medlemsstaternes kompetente myndigheder udveksle personoplysninger og oplysninger i dette dokument med de relevante myndigheder i tredjelande.
Den registrerede har ret til adgang til de personoplysninger vedrørende den pågældende, der behandles, og om nødvendigt til at berigtige, slette eller blokere personoplysninger i henhold til forordning (EF) nr. 45/2001 eller de nationale love til gennemførelse af direktiv 95/46/EF.
Alle anmodninger om udøvelse af retten til adgang, berigtigelse, sletning eller blokering fremsendes til og behandles af de kompetente myndigheder, som nærværende dokument er indgivet til.
Retsgrundlaget for behandling af personoplysninger er artikel 33 i forordning (EF) nr. 111/2005 og artikel 13b i forordning (EF) nr. 273/2004.
Personoplysninger i nærværende dokument må ikke opbevares i et længere tidsrum end det, der er nødvendigt af hensyn til de formål, hvortil de indsamles.
I tilfælde af konflikt kan klager indgives til den relevante nationale databeskyttelsesmyndighed. Kontaktoplysninger for de nationale databeskyttelsesmyndigheder findes på Europa-Kommissionens websted under Generaldirektorat for Retlige Anliggender: (http://ec.europa.eu/justice/data-protection/bodies/authorities/eu/index_en.htm#h2-1)
Vedrører klagen Europa-Kommissionens behandling af personoplysninger, skal den indgives til Den Europæiske Tilsynsførende for Databeskyttelse: (http://www.edps.europa.eu/EDPSWEB/)
BILAG IV




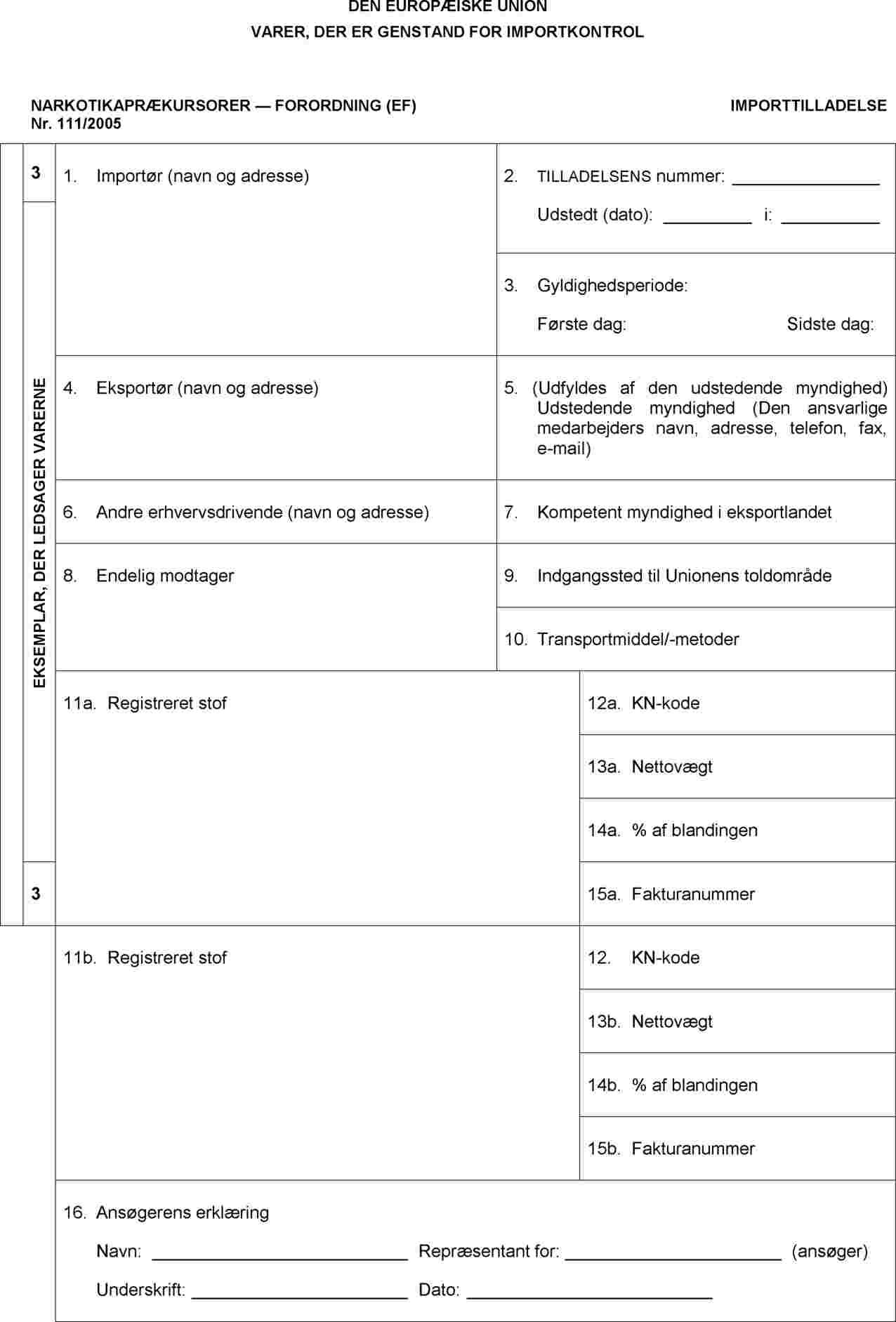

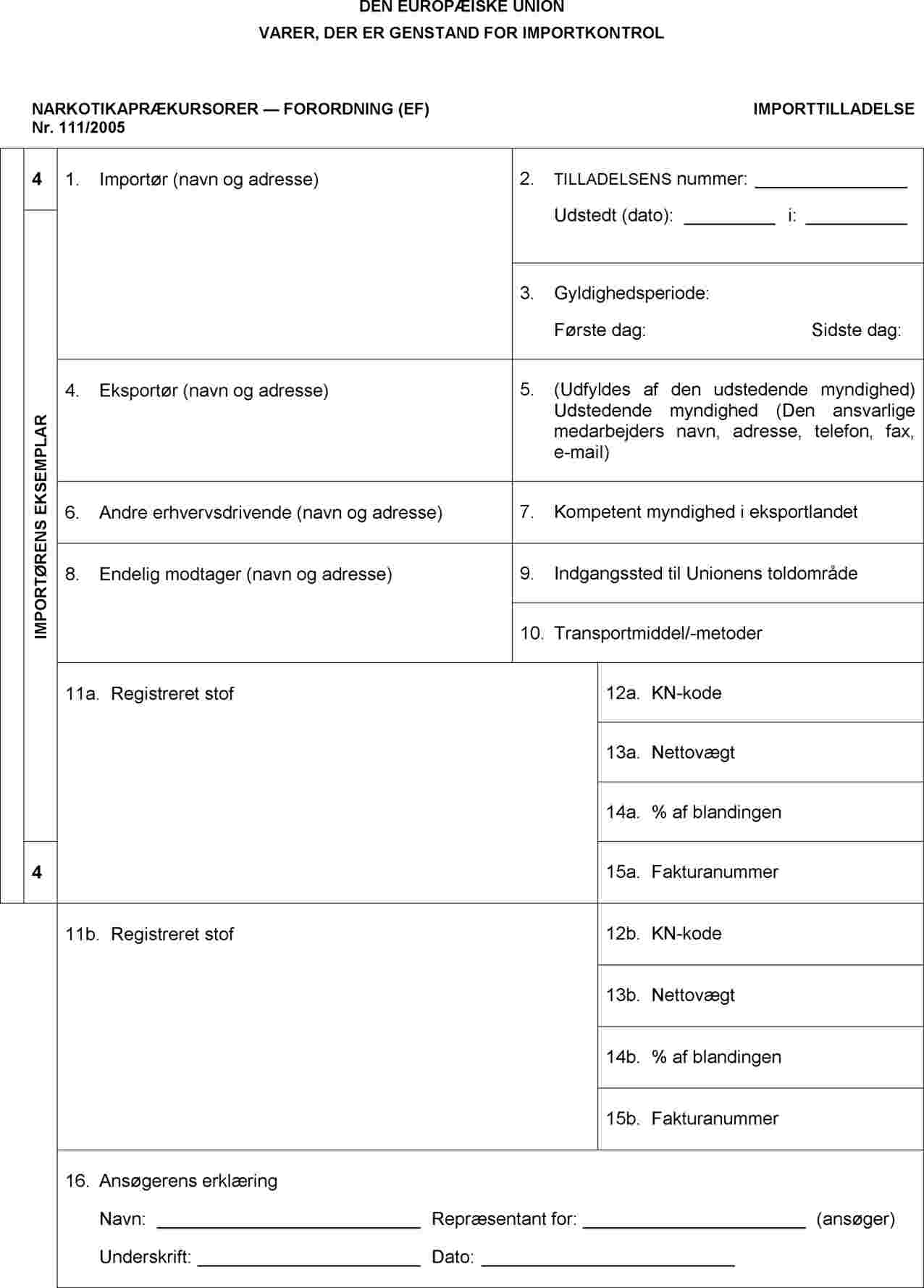

Noter
|
1. |
Tilladelsen udfærdiges på et af Unionens officielle sprog. Hvis den udfærdiges i hånden, skal det gøres med blæk og blokbogstaver. |
|
2. |
Rubrik 1, 4, 6, 8 og 11 til 16 skal udfyldes af ansøgeren på tidspunktet for ansøgningen; oplysninger i rubrik 7, 9 og 10 til13 og 15 kan dog afgives på et senere tidspunkt. I sådanne tilfælde skal oplysningerne suppleres, senest når varerne indføres i Unionens toldområde. |
|
3. |
Rubrik 1, 4: Angiv fulde navne og adresser (telefon, fax og e-mail) |
|
4. |
Rubrik 6: Angiv fulde navn og adresse (telefon, fax og e-mail) for alle andre erhvervsdrivende, som er involveret i importtransaktionen, såsom transportvirksomheder, formidlere, speditører. |
|
5. |
Rubrik 8: Angiv den endelige modtagers fulde navn og adresse. Den endelige modtager kan være den samme som importøren. |
|
6. |
Rubrik 7: Angiv navn og adresse (telefon, fax, e-mail) på myndigheden i tredjelandet. |
|
7. |
Rubrik 9: Angiv navn på medlemsstat, havn, lufthavn eller grænseovergangssted. |
|
8. |
Rubrik 10: Beskriv, hvilket transportmiddel der skal benyttes (f.eks. lastbil, skib, fly, tog osv.). |
|
9. |
Rubrik 11a, 11b: Angiv navnet på det registrerede stof som anført i bilaget til forordning (EF) nr. 111/2005, handelsnavnet på lægemidlet i kategori 4, antallet af enheder i forsendelsen, antallet af tabletter/ampuller i hver enhed, indholdet af det registrerede stof i én enhed (pr. tablet/ampul) eller i forbindelse med en blanding eller et naturprodukt, navnet og den ottecifrede KN-kode samt handelsnavnet. |
|
10. |
Rubrik 11a, 11b: Giv en præcis beskrivelse af emballage og stoffer (f.eks. 2 beholdere à 5 liter hver). Hvis det drejer sig om en blanding, et naturprodukt eller tilberedninger, angives det pågældende handelsnavn. |
|
11. |
Rubrik 12a, 12b: Angiv den ottecifrede KN-kode for det registrerede stof som anført i bilaget til forordning (EF) nr. 111/2005. Rubrik 13 a, 13b: Angiv for kategori 4 den samlede nettovægt af det registrerede stof i forsendelsen af lægemidler. |
|
12. |
Rubrik 16:
|
13. Beskyttelse af personoplysninger
Når Europa-Kommissionen behandler personoplysninger i dette dokument, finder Europa-Parlamentets og Rådets forordning (EF) nr. 45/2001 om beskyttelse af fysiske personer i forbindelse med behandling af personoplysninger i fællesskabsinstitutionerne og -organerne og om fri udveksling af sådanne oplysninger anvendelse.
Når en medlemsstats kompetente myndighed behandler personoplysninger i dette dokument, finder de nationale bestemmelser om gennemførelse af direktiv 95/46/EF anvendelse.
Formålet med behandlingen af personoplysninger er overvågning af handelen med narkotikaprækursorer i Unionen i overensstemmelse med forordning (EF) nr. 273/2004, som ændret ved forordning (EU) nr. 1258/2013, og mellem Unionen og tredjelande i overensstemmelse med forordning (EF) nr. 111/2005, som ændret ved forordning (EU) nr. 1259/2013.
Den registeransvarlige i forbindelse med behandlingen af oplysningerne er den nationale kompetente myndighed, hvor dette dokument er indgivet. Listen over de kompetente myndigheder offentliggøres på Kommissionens websted:
http://ec.europa.eu/taxation_customs/resources/documents/customs/customs_controls/drugs_precursors/legislation/national_competent_authorities.pdf
I overensstemmelse med artikel 17 i forordning (EF) nr. 111/2005 om regler for overvågning af handel med narkotikaprækursorer mellem Unionen og tredjelande, med forbehold af gældende bestemmelser om databeskyttelse i Unionen og med henblik på kontrol og overvågning af visse stoffer, der hyppigt anvendes til ulovlig fremstilling af narkotika eller psykotrope stoffer, kan Kommissionen og medlemsstaternes kompetente myndigheder udveksle personoplysninger og oplysninger i dette dokument med de relevante myndigheder i tredjelande.
Den registrerede har ret til adgang til de personoplysninger vedrørende den pågældende, der behandles, og om nødvendigt til at berigtige, slette eller blokere personoplysninger i henhold til forordning (EF) nr. 45/2001 eller de nationale love til gennemførelse af direktiv 95/46/EF.
Alle anmodninger om udøvelse af retten til adgang, berigtigelse, sletning eller blokering fremsendes til og behandles af de kompetente myndigheder, som nærværende dokument er indgivet til.
Retsgrundlaget for behandling af personoplysninger er artikel 33 i forordning (EF) nr. 111/2005 og artikel 13b i forordning (EF) nr. 273/2004.
Personoplysninger i nærværende dokument må ikke opbevares i et længere tidsrum end det, der er nødvendigt af hensyn til de formål, hvortil de indsamles.
I tilfælde af konflikt kan klager indgives til den relevante nationale databeskyttelsesmyndighed. Kontaktoplysninger for de nationale databeskyttelsesmyndigheder findes på Europa-Kommissionens websted under Generaldirektorat for Retlige Anliggender: (http://ec.europa.eu/justice/data-protection/bodies/authorities/eu/index_en.htm#h2-1)
Vedrører klagen Europa-Kommissionens behandling af personoplysninger, skal den indgives til Den Europæiske Tilsynsførende for Databeskyttelse: (http://www.edps.europa.eu/EDPSWEB/)

