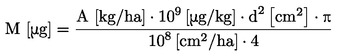|
6)
|
Doplňují se následující kapitoly C.31 až C.46: „C.31. ZKOUŠKA SUCHOZEMSKÝCH ROSTLIN: ZKOUŠKA VZCHÁZIVOSTI OSIVA A RŮSTU SEMENÁČKŮ
ÚVOD
|
1.
|
Tato zkušební metoda je rovnocenná Pokynu OECD pro zkoušení 208 (2006). Zkušební metody se pravidelně přezkoumávají s ohledem na vědecký pokrok a aplikovatelnost pro zákonné použití. Tato aktualizovaná zkušební metoda je určena pro hodnocení potenciálních účinků chemických látek na vzcházivost osiva a růst semenáčků. Jako taková nepokrývá chronické účinky nebo účinky na reprodukci (tj. množství semen, tvorba květů, zrání plodů). Je třeba brát v úvahu podmínky expozice a vlastnosti chemické látky určené ke zkoušení, aby se zajistilo, že budou použity příslušné zkušební metody (např. při zkoušení kovů/kovových sloučenin je třeba počítat s efekty pH a s tím spojených protiiontů) (1). Tato zkušební metoda se netýká rostlin vystavených parám chemických látek. Zkušební metoda je vhodná pro zkoušení obecných chemických látek, biocidů a přípravků na ochranu plodin (rovněž známých jako přípravky na ochranu rostlin nebo pesticidy). Metoda byla vyvinuta na základě stávajících metod (2, 3, 4, 5, 6, 7). Rovněž byly zohledněny další dokumenty vztahující se ke zkoušení rostlin (8, 9, 10). Použité definice jsou uvedeny v dodatku 1.
|
PODSTATA ZKOUŠKY
|
2.
|
Zkouška hodnotí účinky na vzcházivost osiva a rané fáze růstu vyšších rostlin po expozici zkoušené chemické látce v půdě (nebo jiné vhodné půdní matrici). Semena se umístí do půdy vystavené působení zkoušené chemické látky a účinky se vyhodnotí obvykle 14 až 21 dnů poté, co vzejde 50 % osiva v kontrolní skupině. Cílovými ukazateli jsou vizuální hodnocení vzcházivosti osiva, hmotnost suchých výhonků (alternativně hmotnost čerstvých výhonků) a v určitých případech výška výhonků a rovněž hodnocení viditelných škodlivých účinků na různé části rostlin. Tato měření a pozorování se porovnají s neexponovanými kontrolními rostlinami.
|
|
3.
|
V závislosti na očekávaném způsobu expozice se zkoušená chemická látka buď zapracuje do půdy (nebo případně do umělé půdní matrice) nebo se aplikuje na povrch půdy, což správně představuje potenciální způsob expozice chemické látce. Zapracování do půdy se provede zpracováním půdy v objemu. Po aplikaci se půda přemístí do květináčů a semena daného rostlinného druhu se vysejí do půdy. Povrchová aplikace se provádí na půdu v květináčích, do které již byla vsazena semena. Zkoušené jednotky (kontrolní a exponované půdy se semeny) se pak umístí do prostoru s vhodnými podmínkami pro podporu klíčení/růstu rostlin.
|
|
4.
|
Zkoušku lze provádět tak, aby se stanovila křivka dávka-odezva nebo pro jednotlivou koncentraci/dávku jako limitní zkoušku podle účelu studie. Jestliže výsledky ze zkoušky s jednou koncentrací/dávkou překročí určitou úroveň toxicity (např. jsou-li pozorovány účinky vyšší než x %), provede se orientační zkouška pro stanovení horní a dolní meze toxicity; následuje zkouška s několika koncentracemi/dávkami pro stanovení křivky dávka-odezva. Použije se příslušná metoda statistické analýzy pro získání účinné koncentrace ECx nebo účinné dávky ERx vyvolávající účinek (např. EC25, ER25, EC50, ER50) pro nejcitlivější významný(é) parametr(y). Při této zkoušce je možno rovněž vypočítat koncentraci bez pozorovaných účinků (NOEC) a nejnižší koncentraci s pozorovaným účinkem (LOEC).
|
INFORMACE O ZKOUŠENÉ CHEMICKÉ LÁTCE
|
5.
|
Následující informace jsou užitečné pro identifikaci očekávaného způsobu expozice chemické látce a pro uspořádání zkoušky: strukturní vzorec, čistota, rozpustnost ve vodě, rozpustnost v organických rozpouštědlech, rozdělovací koeficient 1-oktanol/voda, sorpční chování půdy, tlak par, stabilita chemické látky ve vodě a na světle a biologická rozložitelnost.
|
PLATNOST ZKOUŠKY
|
6.
|
Aby byla zkouška uznána za platnou, musí být v kontrolních vzorcích splněna následující kritéria platnosti:
|
—
|
vzcházivost osiva je alespoň 70 %,
|
|
—
|
semenáčky nevykazují žádné viditelné fytotoxické účinky (např. chloróza, nekróza, vadnutí, deformace listů a stonků) a rostliny vykazují pouze normální odchylky v růstu a morfologii pro příslušný druh,
|
|
—
|
střední hodnota přežití vzešlých kontrolních semenáčků je alespoň 90 % po dobu trvání studie,
|
|
—
|
podmínky prostředí pro příslušný druh jsou identické a růstová média obsahují stejné množství půdní matrice, podpůrných médií nebo substrátu ze stejného zdroje.
|
|
REFERENČNÍ CHEMICKÁ LÁTKA
|
7.
|
Referenční chemická látka se může zkoušet v pravidelných intervalech pro ověření, zda se účinnost zkoušky a odezva příslušných zkoušených rostlin a zkušebních podmínek v průběhu zkoušky významně nezměnily. Alternativně je možné použít dřívější měření biomasy nebo růstu kontrolních vzorků pro vyhodnocení fungování zkušebního systému v příslušných laboratořích a výsledky mohou sloužit jako měřítko kontroly kvality pro danou laboratoř.
|
POPIS METODY
Přírodní půda – umělý substrát
|
8.
|
Rostliny se mohou pěstovat v květináčích v půdě písčitohlinité, hlinitopísčité nebo písčitojílovitohlinité obsahující až 1,5 % organického uhlíku (přibližně 3 % organické hmoty). Rovněž se dá použít běžně prodávaný substrát nebo syntetická půdní směs, která obsahuje do 1,5 % organického uhlíku. Jílovité půdy by se neměly používat, jestliže je o zkoušené chemické látce známo, že vykazuje vysokou afinitu k jílu. Půda z pole se musí prosít na velikost částic 2 mm, aby se homogenizovala a odstranily se hrubé částice. V závěrečné zprávě se musí uvést typ a textura půdy, procentuální zastoupení organického uhlíku, pH a obsah solí měřením elektrické vodivosti konečné připravené půdy. Půda by měla být klasifikována podle standardního klasifikačního systému (11). Půdu je možné pasterizovat nebo tepelně ošetřit, aby se snížil účinek půdních patogenů.
|
|
9.
|
Přírodní půda může komplikovat interpretaci výsledků a zvýšit variabilitu způsobenou měnícími se fyzikálně/chemickými vlastnostmi a mikrobiálními populacemi. Tyto proměnné zase mění schopnost zadržovat vlhkost, kapacitu vázat chemické látky, provzdušňování a obsah živin a stopových prvků. Kromě kolísání těchto fyzikálních faktorů se budou rovněž vyskytovat odchylky v chemických vlastnostech, jako je pH a oxidačně-redukční potenciál, což může ovlivnit biologickou dostupnost zkoušené chemické látky (12, 13, 14).
|
|
10.
|
Umělé substráty se obvykle nepoužívají ke zkoušení přípravků na ochranu rostlin, lze je ale použít ke zkoušení běžných chemických látek nebo v případech, kdy je žádoucí minimalizovat variabilitu přírodních půd a zlepšit srovnatelnost výsledků zkoušek. Použité substráty by měly být složeny z inertních materiálů, které minimalizují interakce se zkoušenou chemickou látkou, nosným rozpouštědlem nebo s oběma. Jako vhodné inertní materiály se ukázaly křemenný písek vypraný kyselinou, minerální vlna a skleněné kuličky (např. o průměru 0,35 až 0,85 mm), které minimálně absorbují zkoušenou chemickou látku (15) a tím zajišťují, že chemická látka bude v maximální míře k dispozici pro sazenice příjmem kořeny. Nevhodnými substráty jsou vermikulit, perlit nebo jiné vysoce absorpční materiály. Rostlinám je třeba pro jejich růst poskytnout živiny, aby se předešlo strádání rostlin kvůli nedostatku živin, a tam, kde je to možné, je třeba stav vyhodnotit chemickou analýzou nebo vizuálním posouzením kontrolních rostlin.
|
Kritéria pro výběr zkušebního druhu
|
11.
|
Spektrum vybraných druhů by mělo být rozumně široké, např. s ohledem na taxonomickou rozmanitost v rostlinné říši, distribuci druhů, jejich hojnost, druhově specifické charakteristiky životního cyklu a oblast přírodního výskytu, aby bylo možno stanovit rozsah odezvy (8, 10, 16, 17, 18, 19, 20). Při výběru je třeba brát v úvahu následující charakteristiky možných zkušebních druhů:
|
—
|
druhy mají jednotná semena, která jsou přímo dostupná ze spolehlivých standardních zdrojů semen a která zajišťují konzistentní, spolehlivé a rovnoměrné klíčení, a rovněž jednotný růst semenáčků,
|
|
—
|
rostlina je vhodná pro zkoušení v laboratoři a může poskytnout spolehlivé a reprodukovatelné výsledky v rámci jedné zkušební laboratoře i mezi zkušebními laboratořemi navzájem,
|
|
—
|
citlivost zkoušených druhů by měla být konzistentní s odezvami rostlin v přírodním prostředí vystaveným účinku chemické látky,
|
|
—
|
byly použity v určitém rozsahu v dřívějších zkouškách toxicity a jejich použití, například při biologických zkouškách herbicidů, screeningu těžkých kovů, zátěžových testech vztahujících se ke slanosti nebo obsahu minerálů nebo alelopatických studiích, ukazuje citlivost na širokou škálu stresových faktorů,
|
|
—
|
jsou kompatibilní s růstovými podmínkami zkušební metody,
|
|
—
|
splňují kritéria platnosti zkoušky.
|
Některé v minulosti nejčastěji používané zkušební druhy jsou uvedeny v dodatku 2 a možné neplodinové druhy v dodatku 3.
|
|
12.
|
Počet druhů určených ke zkoušení závisí na příslušných právních požadavcích, proto není v této zkušební metodě specifikován.
|
Aplikace zkoušené chemické látky
|
13.
|
Chemická látka se aplikuje ve vhodném nosiči (např. voda, aceton, etanol, polyethylenglykol, arabská guma, písek). Zkoušeny mohou být rovněž směsi (upravené produkty nebo přípravky) obsahující účinné složky a různé pomocné látky.
|
Zapracování do půdy/umělého substrátu
|
14.
|
Chemické látky rozpustné ve vodě nebo suspendované ve vodě se mohou rozmíchat ve vodě a roztok se pak promíchá s půdou ve vhodném mísícím zařízení. Tento typ zkoušky může být vhodný, jestliže k expozici chemické látce dochází prostřednictvím půdy nebo vody v půdních pórech a jestliže je cílem sledovat příjem kořeny. Přidáním zkoušené chemické látky by neměla být překročena retenční vodní kapacita půdy. Objem přidané vody by měl být stejný pro každou zkušební koncentraci, ale měl by být omezen, aby se zabránilo hromadění shluků v půdě.
|
|
15.
|
Chemické látky s nízkou rozpustností ve vodě se rozpustí ve vhodném těkavém rozpouštědle (např. aceton, ethanol) a promíchají s pískem. Rozpouštědlo se pak odstraní z písku pomocí proudu vzduchu za stálého promíchávání písku. Takto zpracovaný písek se pak promíchá s experimentální půdou. Připraví se druhý kontrolní vzorek, ve kterém bude pouze písek a rozpouštědlo. Do vzorků o všech expozičních úrovních a do druhého kontrolního vzorku se přidají stejná množství písku se zamíchaným a s odstraněným rozpouštědlem. V případě pevných, nerozpustných zkoušených chemických látek se suchá půda a chemická látka promíchají ve vhodném míchacím zařízení. Půda se pak přidá do květináčů a ihned se zasejí semena.
|
|
16.
|
Je-li namísto půdy použit umělý substrát, chemické látky rozpustné ve vodě se mohou rozpustit v živném roztoku bezprostředně před začátkem zkoušky. Chemické látky, které jsou nerozpustné ve vodě, ale které se dají ve vodě suspendovat použitím nosného rozpouštědla, se přidají s nosičem do živného roztoku. Ve vodě nerozpustné chemické látky, pro které není k dispozici žádný netoxický nosič rozpustný ve vodě, se rozpustí ve vhodném těkavém rozpouštědle. Roztok se promíchá s pískem nebo skleněnými kuličkami a odpaří v rotační vakuové odparce, přičemž vznikne jednotný povlak chemické látky na písku nebo kuličkách. Zvážený podíl kuliček se extrahuje stejným organickým rozpouštědlem a chemická látka se stanoví před naplněním květináčů.
|
Povrchová aplikace
|
17.
|
V případě přípravků na ochranu rostlin se pro aplikaci zkoušené chemické látky často používá postřik povrchu půdy zkoušeným roztokem. Veškeré zařízení použité při provádění zkoušek, včetně vybavení použitého k přípravě a dávkování zkoušené chemické látky, by mělo mít takovou konstrukci a kapacitu, aby zkoušky zahrnující toto zařízení mohly být provedeny přesně a poskytly reprodukovatelné pokrytí. Pokrytí by mělo být jednotné po celém půdním povrchu. Pozornost je třeba věnovat tomu, aby se předešlo možnosti, že by chemická látka byla adsorbována nebo reagovala s vybavením (např. s plastovými trubkami a lipofilními chemikáliemi nebo ocelovými částmi a elementy). Zkoušená chemická látka se nastříkne na půdní povrch, čímž se simuluje typický postřik aplikovaný v nádržích. Obecně by objemy postřiku měly být v rozmezí normální zemědělské praxe a objemů (množství vody atd. je třeba uvést v závěrečné zprávě). Typ trysky se zvolí tak, aby umožnil jednotné pokrytí půdního povrchu. Jestliže se používají rozpouštědla a nosiče, připraví se druhá skupina kontrolních rostlin, na kterou se aplikuje pouze rozpouštědlo/nosič. To není nezbytné u přípravků na ochranu rostlin, u nichž se testuje složení.
|
Ověření koncentrace/dávky zkoušené chemické látky
|
18.
|
Koncentrace/aplikační dávky se musí ověřit vhodnou analytickou metodou. U rozpustných chemických látek se ověření všech zkušebních koncentrací/dávek může provést analýzou nejvyšší koncentrace zkoušeného roztoku použitého při zkoušce; zaznamená se následné zředění a použití kalibrovaných pomůcek (např. kalibrovaného analytického laboratorního skladu, kalibrovaného vybavení pro aplikaci postřiku). V případě nerozpustných chemikálií musí být spolu s ověřením materiálu složek uvedeny hmotnosti zkoušené chemické látky přidané do půdy. Jestliže je nutné prokázat homogenitu, může být nutné provést analýzu půdy.
|
POSTUP
Uspořádání zkoušky
|
19.
|
Semena stejného druhu se vysejí do květináčů. Počet semen vysetých v květináči závisí na druhu, velikosti květináče a době trvání zkoušky. Počet rostlin v květináči by měl poskytovat adekvátní podmínky růstu a předejít přeplnění během trvání zkoušky. Maximální hustota rostlin je okolo 3–10 semen na 100 cm2 v závislosti na velikosti semen. Například se doporučuje jedna až dvě rostliny kukuřice, sóji, rajčete, okurky nebo cukrové řepy v 15cm květináči; tři rostliny řepky nebo hrachu v 15cm květináči; a 5 až 10 cibulových, pšeničných nebo jiných malých semen v 15cm květináči. Počet semen a paralelních květináčů (paralelní vzorek je definován jako květináč, proto rostliny ve stejném květináči nejsou považovány za paralelní vzorek) by měl být dostatečný pro optimální statistickou analýzu (21). Je třeba poznamenat, že variabilita bude větší u zkušebních druhů s velkými semeny, kterých se dává méně na květináč (opakování) ve srovnání se zkušebním druhem s malými semeny, jichž je možné použít větší počet na jeden květináč. Vysetím stejného počtu semen do každého květináče lze tuto variabilitu minimalizovat.
|
|
20.
|
Kontrolní skupiny se používají, aby bylo jisté, že pozorované účinky jsou spojeny pouze s expozicí zkoušené chemické látce, nebo je lze této expozici přisoudit. Příslušná kontrolní skupina by měla být v každém ohledu identická se zkoušenou skupinou s výjimkou expozice zkoušené chemické látce. Během dané zkoušky by všechny zkušební rostliny, včetně kontrolních, měly být ze stejného zdroje. Aby se zabránilo systematickým chybám, je vyžadováno náhodné přiřazení zkušebních a kontrolních květináčů.
|
|
21.
|
Semena pokrytá insekticidy nebo fungicidy (tzv. ‚oblečená‘ semena) se musí vyloučit. Avšak některé regulační orgány použití určitých nesystemických kontaktních fungicidů (např. kaptan, thiram) povolují (22). Jestliže je obava z patogenů vnesených semeny, mohou se semena nechat krátce nasáknout ve slabém 5 % roztoku chlornanu, pak důkladně opláchnout pod tekoucí vodou a osušit. Není povoleno žádné léčivé ošetření jiným přípravkem na ochranu rostlin.
|
Zkušební podmínky
|
22.
|
Zkušební podmínky by měly napodobit podmínky nezbytné pro normální růst zkoušených druhů a odrůd (v dodatku 4 jsou uvedeny příklady zkušebních podmínek). Vyvíjející se rostliny je třeba udržovat v podmínkách správné zahradnické praxe v řízeném prostředí komor, fytotronů nebo skleníků. Při použití růstových zařízení tato praxe obvykle zahrnuje regulaci a dostatečně časté (např. jednou za den) zaznamenávání teploty, vlhkosti, koncentrace oxidu uhličitého, světelných podmínek (intenzity, vlnové délky, fotosynteticky aktivního záření), doby osvětlení, prostředků zavlažování atd.; tím se zajistí dobrý růst rostlin, což se posuzuje pomocí kontrolních rostlin zvoleného druhu. Teplota ve skleníku by se měla regulovat pomocí systémů ventilace, vytápění anebo chlazení. Pro zkoušení ve sklenících jsou obecně doporučeny následující podmínky:
|
—
|
teplota: 22 °C ± 10 °C,
|
|
—
|
relativní vlhkost: 70 % ± 25 %,
|
|
—
|
fotoperioda: minimálně 16 hodin osvětlení,
|
|
—
|
intenzita záření dopadajícího na povrch (ozářenost): 350 ± 50 μE · m– 2 · s– 1. Dodatečné osvětlení může být nezbytné, jestliže se intenzita sníží pod 200 μE · m– 2 · s– 1, vlnová délka 400–700 nm s výjimkou určitých druhů, jejichž požadavky na osvětlení jsou menší.
|
V průběhu studie se podmínky prostředí monitorují a zaznamenávají. Rostliny se pěstují v neporézních plastových nebo glazovaných květináčích s táckem nebo miskou pod nimi. Květináče se mohou pravidelně přemísťovat, aby se minimalizovala variabilita v růstu rostlin (v důsledku rozdílů ve zkušebních podmínkách v růstovém zařízení). Květináče musí být dostatečně velké, aby umožnily normální růst.
|
|
23.
|
Půdní živiny je možné dodávat podle potřeby pro zachování dobré vitality rostlin. Potřeba a načasování dodatečných živin se mohou určit pozorováním kontrolních rostlin. Doporučuje se spodní zavlažování zkušebních květináčů (např. použitím knotů ze skelných vláken). Počáteční vrchní zavlažení se však může použít pro stimulaci klíčení semen; při aplikaci zkoušené chemické látky na půdní povrch se takto usnadní její průnik do půdy.
|
|
24.
|
Specifické růstové podmínky by měly být vhodné pro zkušební druh a zkoušenou chemickou látku, které jsou předmětem zkoumání. Kontrolní a exponované rostliny se musí držet za stejných podmínek okolního prostředí; je však třeba přijmout adekvátní opatření, aby se zabránilo křížné expozici zkoušené chemické látce (např. těkavé látce) mezi různými exponovanými a kontrolními vzorky.
|
Zkoušení jediné koncentrace/dávky
|
25.
|
Pro stanovení vhodné koncentrace/dávky chemické látky při provádění zkoušky (provokační/mezní) s jedinou koncentrací nebo dávkou je třeba zvážit řadu faktorů. U běžných chemikálií k takovým faktorům patří fyzikální a chemické vlastnosti chemické látky, u přípravků na ochranu rostlin je třeba brát v úvahu fyzikální a chemické vlastnosti a způsob použití zkoušené chemické látky, její maximální koncentraci nebo aplikační dávku, počet aplikací za sezónu anebo stálost zkoušené látky. Pro stanovení, zda běžná chemikálie vykazuje fytotoxické vlastnosti, může být vhodné provést zkoušku při maximální dávce 1 000 mg/kg suché půdy.
|
Orientační zkouška
|
26.
|
Podle potřeby je možné provádět orientační zkoušku pro určení rozsahu koncentrací/dávek, které mají být zkoušeny v hlavní studii zjišťující vztah dávka-odezva. Při orientační zkoušce by zkušební koncentrace/dávky měly být zvoleny s velkými intervaly (např. 0,1, 1,0, 10, 100 a 1 000 mg/kg suché půdy). U přípravků na ochranu rostlin mohou koncentrace/dávky vycházet z doporučených nebo maximálních hodnot koncentrací nebo aplikačních dávek, např. 1/100, 1/10, 1/1 doporučené/maximální koncentrace nebo aplikační dávky.
|
Zkouška s několika koncentracemi/dávkami
|
27.
|
Účelem zkoušky s několika koncentracemi/dávkami je určit vztah dávka-odezva a stanovit hodnotu ECx nebo ERx pro vzcházivost, biomasu anebo viditelné účinky ve srovnání s neexponovanými kontrolními vzorky podle požadavků regulačních orgánů.
|
|
28.
|
Počet a rozložení koncentrací nebo dávek by mělo být dostatečné, aby poskytly spolehlivý vztah dávka-odezva a regresní rovnici a umožnily odhad ECx. nebo ERx. Zvolené koncentrace/dávky by měly zahrnovat hodnoty ECx nebo ERx, které mají být stanoveny. Například, jestliže je požadována hodnota EC50, bude žádoucí provést zkoušku při dávkách vyvolávajících 20–80 % účinek. Doporučený počet zkoušených koncentrací/dávek, kterými se toho dosáhne, je alespoň pět v geometrické posloupnosti plus neexponovaný kontrolní vzorek, rozložených s faktorem nepřekračujícím tři. Pro každou exponovanou a kontrolní skupinu by počet opakování měl být alespoň čtyři a celkový počet semen alespoň 20. Pro zvýšení statistické síly zkoušky může být zapotřebí více opakování s určitými rostlinami vykazujícími nízkou rychlost klíčení nebo proměnné růstové průběhy. Jestliže se použije větší počet zkušebních koncentrací/dávek, může se počet opakování snížit. Jestliže je třeba odhadnout hodnotu NOEC, může být potřeba více opakování pro dosažení požadované statistické síly (23).
|
Pozorování
|
29.
|
Během doby pozorování, tj. 14 až 21 dní poté, co vzešlo 50 % kontrolních rostlin (rovněž případně kontrolních vzorků s rozpouštědly), jsou rostliny často pozorovány (alespoň jednou za týden a, je-li to možné, denně) z hlediska vzcházivosti a viditelné fytotoxicity a mortality. Na konci zkoušky se zaznamená změřený procentní podíl vzcházivosti a biomasy přeživších rostlin a rovněž viditelné škodlivé účinky na různých částech rostlin. Škodlivými účinky jsou abnormální vzhled vzešlých semenáčků, zakrslý růst, chloróza, odbarvení, odumření a účinky na vývoj rostlin. Konečnou biomasu lze měřit prostřednictvím konečné průměrné hmotnosti suchých výhonků přeživších rostlin, kdy se požnou výhonky při povrchu půdy a usuší do konstantní hmotnosti při 60 °C. Alternativně se může konečná biomasa měřit prostřednictvím hmotnosti čerstvých výhonků. Výška výhonku může představovat další cílový ukazatel, jestliže je požadován regulačními orgány. Pro vyhodnocení pozorovatelných toxických účinků je třeba použít jednotný systém vyhodnocování viditelného poškození. Příklady provádění kvalitativního a kvantitativního vizuálního hodnocení jsou uvedeny v odkazech (23, 24).
|
ÚDAJE A PŘEDKLÁDÁNÍ ZPRÁV
Statistická analýza
Zkouška s jedinou koncentrací/dávkou
|
30.
|
Údaje pro každý druh rostlin se analyzují použitím vhodné statistické metody (21). V závěrečné zprávě by se měla uvést úroveň účinku při zkušební koncentraci/dávce nebo nedosažení daného účinku při zkušební koncentraci/dávce (např. < x % účinek pozorovaný při koncentraci nebo dávce y).
|
Zkouška s několika koncentracemi/dávkami
|
31.
|
Vztah dávka-odezva se stanoví ve formě regresní rovnice. Je možné použít rozdílné modely: například pro odhad hodnoty ECx nebo ERx (např. EC25, ER25, EC50, ER50) a jejího intervalu spolehlivosti pro vzcházivost v binárním tvaru mohou být vhodné metody logitová, probitová, Weibullova, Spearman-Karberova, upravená Spearman-Karberova atp. Pro růst semenáčků – tj. jejich hmotnost a výšku jako průběžné ukazatele – se mohou hodnoty ECx nebo ERx a jejich intervaly spolehlivosti odhadnout použitím vhodné regresní analýzy (např. Bruce-Versteegova nelineární regresní analýza (25)). Tam, kde je to možné, by hodnota R2 měla být 0,7 nebo vyšší pro většinu citlivých druhů a použité zkušební koncentrace/dávky by měly zahrnovat 20 % až 80 % účinky. Jestliže má být odhadnuta hodnota NOEC, dává se přednost použití silných statistických testů zvolených na základě rozdělení dat (21, 26).
|
Závěrečná zpráva
|
32.
|
Závěrečná zpráva by měla obsahovat výsledky studií a rovněž podrobný popis zkušebních podmínek, důkladnou diskusi výsledků, analýzu dat a závěry získané na základě analýz. Rovněž by měl být obsažen tabelární souhrn a abstrakt výsledků. Závěrečná zpráva musí zahrnovat následující:
|
|
Zkoušená chemická látka:
|
—
|
identifikační údaje chemické látky, relevantní vlastnosti zkoušené chemické látky (např. log Pow, rozpustnost ve vodě, tlak par a informace o osudu a chování v životním prostředí, jsou-li k dispozici);
|
|
—
|
podrobnosti o přípravě zkušebního roztoku a ověření zkušebních koncentrací, jak je specifikováno v odstavci 18.
|
|
|
|
Zkušební druh:
|
—
|
podrobnosti o zkušebním organismu: druh/odrůda, čeledi rostliny, vědecký a obecný název, zdroj a historie semen co nejpodrobnější (tj. jméno dodavatele, procentuální klíčivost, třída velikosti semen, číslo várky nebo dávky, rok setí nebo sezóna pěstování shromážděných vzorků, datum hodnocení klíčení), životaschopnost atd.,
|
|
—
|
počet zkoušených jedno- a dvouděložných druhů,
|
|
—
|
odůvodnění výběru druhu,
|
|
—
|
popis skladování, zpracování a udržování semen.
|
|
|
|
Zkušební podmínky:
|
—
|
zkušební zařízení (např. růstová komora, fytotron a skleník),
|
|
—
|
popis zkušebního systému (např. rozměry květináčů, materiál květináčů a množství půdy),
|
|
—
|
charakteristiky půdy (textura nebo typ půdy: distribuce půdních částic a klasifikace, fyzikální a chemické vlastnosti, včetně podílu organické hmoty, podílu organického uhlíku a pH),
|
|
—
|
příprava půdy/substrátu (např. půda, umělá půda, písek a jiné) před zkouškou,
|
|
—
|
popis živného média, jestliže se používá,
|
|
—
|
aplikace zkoušené chemické látky: popis metody aplikace, popis vybavení, stupně a objemy expozice včetně ověření chemické látky, popis kalibrační metody a popis podmínek během aplikace,
|
|
—
|
podmínky růstu: ozářenost (např. PAR (parabolický hliníkový reflektor), fotosynteticky aktivní záření), fotoperioda, maximální/minimální teplota, harmonogram a způsob zavlažování, hnojení,
|
|
—
|
počet semen v květináči, počet rostlin na dávku, počet opakování (květináčů) na stupeň expozice,
|
|
—
|
typ a počet kontrolních vzorků (negativní anebo pozitivní kontrolní vzorky, kontrolní vzorky s rozpouštědlem, jestliže se použije),
|
|
|
|
Výsledky:
|
—
|
tabulka všech cílových ukazatelů pro každé opakování, zkušební koncentrace/dávka a druh,
|
|
—
|
počet a procentuální vzcházivost ve srovnání s kontrolními vzorky,
|
|
—
|
měření biomasy (hmotnost suchých výhonků nebo čerstvých výhonků) rostlin vyjádřená jako procentuální podíl kontrolního vzorku,
|
|
—
|
výška výhonků rostlin jako procentuální podíl kontrolního vzorku, jestliže se měří,
|
|
—
|
procentuální podíl viditelně poškozených rostlin a kvalitativní a kvantitativní popis viditelného poškození (chloróza, nekróza, vadnutí, deformace listů a stonků, jakýkoli nedostatečný účinek) zkoušenou chemickou látkou ve srovnání s kontrolními rostlinami,
|
|
—
|
popis stupnice hodnocení použité k posouzení viditelného poškození, jestliže se vizuální hodnocení provádí,
|
|
—
|
u studií s jedinou dávkou je třeba uvést procentuální podíl poškození,
|
|
—
|
hodnoty ECx nebo ERx (např. EC50, ER50, EC25, ER25) a příslušné intervaly spolehlivosti. Když se provádí regresní analýza, uvede se standardní odchylka pro regresní rovnici a standardní odchylka pro jednotlivý odhadnutý parametr (např. směrnice, úsek),
|
|
—
|
hodnoty NOEC (a LOEC), jestliže byly vypočítány,
|
|
—
|
popis použitých statistických postupů a předpokladů,
|
|
—
|
grafické zobrazení těchto dat a vztah dávka-odezva zkoušeného druhu.
|
|
Odchylky od postupů popsaných v této zkušební metodě a jakékoli neobvyklé skutečnosti během zkoušky.
|
LITERATURA
|
1)
|
Schrader G., Metge K., and Bahadir M. (1998). Importance of salt ions in ecotoxicological tests with soil arthropods. Applied Soil Ecology, 7, 189-193.
|
|
2)
|
International Organisation of Standards. (1993). ISO 11269-1. Soil Quality -- Determination of the Effects of Pollutants on Soil Flora – Part 1: Method for the Measurement of Inhibition of Root Growth.
|
|
3)
|
International Organisation of Standards. (1995). ISO 11269-2. Soil Quality -- Determination of the Effects of Pollutants on Soil Flora – Part 2: Effects of Chemicals on the Emergence and Growth of Higher Plants.
|
|
4)
|
American Standard for Testing Material (ASTM). (2002). E 1963-98. Standard Guide for Conducting Terrestrial Plant Toxicity Tests.
|
|
5)
|
U.S. EPA. (1982). FIFRA, 40CFR, Part 158.540. Subdivision J, Parts 122-1 and 123-1.
|
|
6)
|
US EPA. (1996). OPPTS Harmonized Test Guidelines, Series 850. Ecological Effects Test Guidelines:
|
—
|
850.4000: Background – Non-target Plant Testing;
|
|
—
|
850.4025: Target Area Phytotoxicity;
|
|
—
|
850.4100: Terrestrial Plant Toxicity, Tier I (Seedling Emergence);
|
|
—
|
850.4200: Seed Germination/Root Elongation Toxicity Test;
|
|
—
|
850.4225: Seedling Emergence, Tier II;
|
|
—
|
850.4230: Early Seedling Growth Toxicity Test.
|
|
|
7)
|
AFNOR, X31-201. (1982). Essai d'inhibition de la germination de semences par une substance. AFNOR X31-203/ISO 11269-1. (1993) Determination des effets des polluants sur la flore du sol: Méthode de mesurage de l'inhibition de la croissance des racines.
|
|
8)
|
Boutin, C., Freemark, K.E. and Keddy, C.J. (1993). Proposed guidelines for registration of chemical pesticides: Non-target plant testing and evaluation. Technical Report Series No.145. Canadian Wildlife Service (Headquarters), Environment Canada, Hull, Québec, Canada.
|
|
9)
|
Forster, R., Heimbach, U., Kula, C., and Zwerger, P. (1997). Effects of Plant Protection Products on Non-Target Organisms – A contribution to the Discussion of Risk Assessment and Risk Mitigation for Terrestrial Non-Target Organisms (Flora and Fauna). Nachrichtenbl. Deut. Pflanzenschutzd. No 48.
|
|
10)
|
Hale, B., Hall, J.C., Solomon, K., and Stephenson, G. (1994). A Critical Review of the Proposed Guidelines for Registration of Chemical Pesticides; Non-Target Plant Testing and Evaluation, Centre for Toxicology, University of Guelph, Ontario Canada.
|
|
11)
|
Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sc. Soc. Amer. Proc. 26:305 (1962).
|
|
12)
|
Audus, L.J. (1964). Herbicide behaviour in the soil. In: Audus, L.J. ed. The Physiology and biochemistry of Herbicides, London, New York, Academic Press, NY, Chapter 5, pp. 163-206.
|
|
13)
|
Beall, M.L., Jr. and Nash, R.G. (1969). Crop seedling uptake of DDT, dieldrin, endrin, and heptachlor from soil, J. Agro. 61:571-575.
|
|
14)
|
Beetsman, G.D., Kenney, D.R. and Chesters, G. (1969). Dieldrin uptake by corn as affected by soil properties, J. Agro. 61:247-250.
|
|
15)
|
U.S. Food and Drug Administration (FDA). (1987). Environmental Assessment Technical Handbook. Environmental Assessment Technical Assistance Document 4.07, Seedling Growth, 14 pp., FDA, Washington, DC.
|
|
16)
|
McKelvey, R.A., Wright, J.P., Honegger, J.L. and Warren, L.W. (2002). A Comparison of Crop and Non-crop Plants as Sensitive Indicator Species for Regulatory Testing. Pest Management Science vol. 58:1161-1174
|
|
17)
|
Boutin, C.; Elmegaard, N. and Kjær, C. (2004). Toxicity testing of fifteen non-crop plant species with six herbicides in a greenhouse experiment: Implications for risk assessment. Ecotoxicology vol. 13(4): 349-369.
|
|
18)
|
Boutin, C., and Rogers, C.A. (2000). Patterns of sensitivity of plant species to various herbicides – An analysis with two databases. Ecotoxicology vol.9(4):255-271.
|
|
19)
|
Boutin, C. and Harper, J.L. (1991). A comparative study of the population dynamics of five species of Veronica in natural habitats. J. Ecol. 9:155-271.
|
|
20)
|
Boutin, C., Lee, H.-B., Peart, T.E., Batchelor, S.P. and Maguire, R.J.. (2000). Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Envir. Toxicol. Chem. 19 (10): 2532-2541.
|
|
21)
|
OECD (2006). Draft Guidance Document, Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Series on Testing and Assessment No 54, Organisation for Economic Co-operation and Development, Paris.
|
|
22)
|
Hatzios, K.K. and Penner, D. (1985). Interactions of herbicides with other agrochemicals in higher plants. Rev. Weed Sci. 1:1-63.
|
|
23)
|
Hamill, P.B., Marriage, P.B. and G. Friesen. (1977). A method for assessing herbicide performance in small plot experiments. Weed Science 25:386-389.
|
|
24)
|
Frans, R.E. and Talbert, R.E. (1992). Design of field experiments and the measurement and analysis of plant response. In: B. Truelove (Ed.) Research Methods in Weed Science, 2nd ed. Southern weed Science Society, Auburn, 15-23.
|
|
25)
|
Bruce, R.D. and Versteeg, D. J.(1992). A Statistical Procedure for Modelling Continuous Toxicity Data. Environmental Toxicology and Chemistry 11, 1485-1492.
|
|
26)
|
Kapitola C.33 této přílohy: Zkouška toxicity pro reprodukci žížal (Eisenia fetida/Eisenia andrei).
|
Dodatek 1
Definice
|
|
Účinná složka (ú.s.) (nebo účinná látka (ú.l.)) je látka určená k vyvolání specifického biologického účinku (např. hubení hmyzu, likvidace nákazy rostlin, hubení plevele na ošetřených plochách), rovněž je známá jako technická účinná složka, účinná látka.
|
|
|
Chemická látka je látka nebo směs.
|
|
|
Přípravky na ochranu plodin (CPP) nebo přípravky na ochranu rostlin (PPP) nebo pesticidy jsou látky se specifickou biologickou aktivitou záměrně používané k ochraně plodin před škůdci (např. plísňové choroby, hmyz a konkurenční rostliny).
|
|
|
ECx – účinná koncentrace s x % účinkem nebo ERx – účinná dávka s x % účinkem je koncentrace nebo dávka, jejímž výsledkem je nežádoucí změna u x % ve zkoušeném cílovém ukazateli v porovnání s kontrolou (např. 25 % nebo 50 % snížení vzcházivosti osiva, hmotnosti výhonku či konečného počtu přítomných rostlin nebo nárůst viditelného poškození by představovaly EC25/ER25 nebo EC50/ER50).
|
|
|
Vzklíčení je objevení se koleoptile nebo děložního lístku nad půdním povrchem.
|
|
|
Přípravek je komerčně upravený výrobek obsahující účinnou látku (účinnou složku), rovněž znám jako konečný přípravek (8) nebo typický výrobek pro konečné použití (TEP).
|
|
|
Nejnižší koncentrace s pozorovaným účinkem (LOEC) je nejnižší koncentrace zkoušené chemické látky, u níž byl účinek pozorován. Při této zkoušce vykazuje koncentrace odpovídající LOEC statisticky významný účinek (p < 0,05) během dané expoziční doby ve srovnání s kontrolou a je vyšší než hodnota NOEC.
|
|
|
Necílové rostliny: Rostliny, které jsou mimo cílovou pěstební plochu. U přípravků na ochranu rostlin to obvykle znamená rostliny mimo plochu, na které se provádí expozice.
|
|
|
Koncentrace bez pozorovaných účinků (NOEC) je nejvyšší koncentrace zkoušené chemické látky, při které nebyl pozorován žádný účinek. Při této zkoušce nevykazuje koncentrace odpovídající NOEC žádný statisticky významný účinek (p < 0,05) během dané expoziční doby ve srovnání s kontrolou.
|
|
|
Fytotoxicita: Škodlivé odchylky (zjištěné měřením a vizuálním hodnocením) od normálního vzhledu a růstu rostlin v odezvě na danou chemickou látku.
|
|
|
Opakování je experimentální jednotka, která představuje kontrolní skupinu anebo exponovanou skupinu. V těchto studiích je jako opakování definován květináč.
|
|
|
Vizuální hodnocení: Hodnocení viditelného poškození na základě pozorování postoje rostlin, jejich vitality, znetvoření, chlorózy, nekrózy a celkového vzhledu ve srovnání s kontrolní skupinou.
|
|
|
Zkoušená chemická látka: Jakákoli látka nebo směs zkoušená touto metodou.
|
Dodatek 2
Seznam druhů v minulosti použitých při zkoušení rostlin
|
Čeleď
|
Druh
|
Obecné názvy
|
|
DICOTYLEDONAE
|
|
Apiaceae (Umbelliferae)
|
Daucus carota
|
mrkev obecná
|
|
Asteraceae (Compositae)
|
Helianthus annuus
|
slunečnice roční
|
|
Asteraceae (Compositae)
|
Lactuca sativa
|
salát hlávkový
|
|
Brassicaceae (Cruciferae)
|
Sinapis alba
|
hořčice setá
|
|
Brassicaceae (Cruciferae)
|
Brassica campestris var. chinensis
|
brukev zelí (čínské)
|
|
Brassicaceae (Cruciferae)
|
Brassica napus
|
brukev řepka (olejka)
|
|
Brassicaceae (Cruciferae)
|
Brassica oleracea var. capitata
|
brukev zelná (hlávkové zelí)
|
|
Brassicaceae (Cruciferae)
|
Brassica rapa
|
brukev řepák (vodnice)
|
|
Brassicaceae (Cruciferae)
|
Lepidium sativum
|
řeřicha setá
|
|
Brassicaceae (Cruciferae)
|
Raphanus sativus
|
ředkev setá
|
|
Chenopodiaceae
|
Beta vulgaris
|
řepa obecná
|
|
Cucurbitaceae
|
Cucumis sativus
|
okurka setá
|
|
Fabaceae (Leguminosae)
|
Glycine max (G. soja)
|
Sója luštinatá
|
|
Fabaceae (Leguminosae)
|
Phaseolus aureus
|
fazol zlatý (mungo)
|
|
Fabaceae (Leguminosae)
|
Phaseolus vulgaris
|
fazol obecný
|
|
Fabaceae (Leguminosae)
|
Pisum sativum
|
hrách setý
|
|
Fabaceae (Leguminosae)
|
Trigonella foenum- graecum
|
pískavice řecké seno
|
|
Fabaceae (Leguminosae)
|
Lotus corniculatus
|
štírovník růžkatý
|
|
Fabaceae (Leguminosae)
|
Trifolium pratense
|
jetel luční
|
|
Fabaceae (Leguminosae)
|
Vicia sativa
|
vikev setá
|
|
Linaceae
|
Linum usitatissimum
|
len setý
|
|
Polygonaceae
|
Fagopyrum esculentum
|
pohanka obecná
|
|
Solanaceae
|
Solanum lycopersicum
|
rajče jedlé
|
|
MONOCOTYLEDONAE
|
|
Liliaceae (Amarylladaceae)
|
Allium cepa
|
cibule kuchyňská
|
|
Poaceae (Gramineae)
|
Avena sativa
|
oves setý
|
|
Poaceae (Gramineae)
|
Hordeum vulgare
|
ječmen setý
|
|
Poaceae (Gramineae)
|
Lolium perenne
|
jílek vytrvalý
|
|
Poaceae (Gramineae)
|
Oryza sativa
|
rýže setá
|
|
Poaceae (Gramineae)
|
Secale cereale
|
žito seté
|
|
Poaceae (Gramineae)
|
Sorghum bicolor
|
čirok obecný
|
|
Poaceae (Gramineae)
|
Triticum aestivum
|
pšenice setá
|
|
Poaceae (Gramineae)
|
Zea mays
|
kukuřice setá
|
Dodatek 3
Seznam potenciálních neplodinových druhů
Potenciální druhy pro zkoušení toxicity na rostlinách podle OECD.
Poznámka: Následující tabulka poskytuje informace o 52 neplodinových druzích (odkazy jsou uvedeny v závorkách u každé položky). Uvedené vzcházivosti pocházejí z publikované literatury a slouží pouze jako obecné vodítko. Individuální zkušenost se může lišit v závislosti na zdroji semen a dalších faktorech.
|
ČELEĎ Botanický název druhu
(český obecný název)
|
Délka života (9) a přirozené prostředí
|
Hmotnost semene
(mg)
|
Fotoperioda pro klíčení nebo růst (10)
|
Hloubka setí
(mm) (11)
|
Doba do vzklíčení
(dny) (12)
|
Speciální zpracování (13)
|
Zkouška toxicity (14)
|
Dodavatelé semen (15)
|
Další odkazy (16)
|
|
APIACEAE
Torilis japónica
(tařice skalní)
|
А, В narušené oblasti, živé ploty, pastviny (16, 19)
|
1,7–1,9 (14, 19)
|
L = D (14)
|
0
(1, 19)
|
5 (50 %) (19)
|
studená stratifikace (7, 14, 18, 19) zrání může být nezbytné (19) klíčení tlumeno tmou (1, 19) žádné speciální zpracování (5)
|
POST (5)
|
|
|
|
ASTERACEAE
Bellis perennis
(sedmikráska chudobka)
|
Ρ
louky, orná pole, trávníky (16, 19)
|
0,09–0,17 (4, 19)
|
L = D (14)
|
0
(4)
|
3 (50 %) (19)
11 (100 %) (18)
|
klíčení neovlivněno ozářeností (18, 19) žádné speciální zpracování (4, 14)
|
POST (4)
|
A, D, F
|
7
|
|
Centaurea cyanus
(chrpa modrá)
|
A
pole, okraje silnic, otevřená stanoviště (16)
|
4,1–4,9 (4, 14)
|
L = D (14)
|
0–3 (2, 4, 14)
|
14–21 (100 %) (14)
|
žádné speciální zpracování (2, 4)
|
POST (2,4)
|
A, D, E, F
|
7
|
|
Centaurea nigra
(chrpa černá)
|
Ρ
pole, okraje silnic, otevřená stanoviště (16, 19)
|
2,4–2,6 (14, 19)
|
L = D (14)
|
0 (19)
|
3 (50 %) (19)
4 (97 %) (18)
|
zrání může být nezbytné (18, 19) klíčení tlumeno tmou (19) žádné speciální zpracování (5, 14, 26)
|
POST (5, 22, 26)
|
A
|
|
|
Inula helenium
(oman pravý)
|
Ρ
vlhká, narušená místa
(16)
|
1–1,3 (4, 14, 29)
|
|
0
(4, 29)
|
|
žádné speciální zpracování (4)
|
POST (4)
|
A, F
|
|
|
Leontodon hispidus
(máchelka srstnatá, pampeliška)
|
Ρ
pole, okraje silnic, narušené oblasti (16, 19)
|
0,85–1,2 (14, 19)
|
L = D (14)
|
0 (19)
|
4 (50 %) (19)
7 (80 %) (18)
|
klíčení tlumeno tmou (17, 18, 19) žádné speciální zpracování (5, 23)
|
POST (5, 22, 23)
|
|
|
|
Rudbeckia hirta
(třapatka srstnatá)
|
Β, Ρ narušené
(16)
|
0,3 (4, 14)
|
L = D (14)
|
0
(4, 33)
|
< 10 (100 %) (33)
|
žádné speciální zpracování
(4, 14, 33)
|
POST (4, 33)
|
C, D, E, F
|
|
|
Solidago canadensis
(zlatobýl kanadský)
|
Ρ
pastviny, otevřená stanoviště (16)
|
0,06–0,08 (4, 14)
|
L = D (11)
|
0
(4)
|
14–21
(11)
|
smíchat se stelným podílem písku a nasáknout v 500 ppm GA 24 hod. (11) žádné speciální zpracování (4)
|
POST (4)
|
E, F
|
|
|
Xanthium pensylvanicum
(řepeň pensylvánská)
|
A
pole, otevřená stanoviště (16)
|
25–61 (14, 29)
|
|
0(1)
5(29)
|
|
klíčení může být tlumeno tmou (1 ), nasáknout v teplé vodě 12 hod. (29)
|
PRE & POST (31)
|
A
|
|
|
Xanthium spinosum
(řepeň trnitá)
|
A
otevřená stanoviště (16)
|
200 (14)
|
L = D (14)
L > D (6)
|
10
(6)
|
|
skarifikace (14) žádné speciální zpracování (6)
|
PRE & POST (6)
|
A
|
|
|
Xanthium strumarium
(řepeň italská)
|
A
pole, otevřená stanoviště (16)
|
67,4 (14)
|
L = D (14)
|
10–20 (6, 21)
|
|
žádné speciální zpracování
(6, 14, 21)
|
PRE & POST (6, 21, 28, 31)
|
A
|
|
|
BRASSICACEAE
Cardamine pratensis
(řeřišnice luční)
|
Ρ
pole, okraje silnic, trávníky (16, 19)
|
0,6 (14, 19)
|
L = D (14)
|
0 (19)
|
5 (50 %) (19)
15 (98 %) (18)
|
klíčení tlumeno tmou (18, 19) žádné speciální zpracování (5, 14, 22)
|
POST (5, 22)
|
F
|
|
|
CARYOPHYLLACEAE
Lychnis flos-cuculi
(kohoutek luční)
|
Ρ
(16)
|
0,21 (14)
|
L = D (14)
|
|
< 14 (100 %) (14, 25)
|
zrání může být nezbytné (18) žádné speciální zpracování (5, 14, 15, 22-26)
|
POST (5, 15, 22-26)
|
F
|
|
|
CHENOPODIACEAE
Chenopodium album
(merlík bílý)
|
A
okraje polí, narušené oblasti (16, 19)
|
0,7–1,5 (14, 19, 34)
|
L = D (14)
|
0
(1, 19)
|
2 (50 %) (19)
|
zpracování se liší v závislosti na barvě semen (19) suché skladování v době klidu (19) klíčení tlumeno tmou (1, 18, 19) studená stratifikace (18) žádné speciální zpracování (14, 34)
|
PRE & POST (28, 31, 34)
|
A
|
32
|
|
CLUSIACEAE
Hypericum perforatum
(třezalka tečkovaná)
|
Ρ
pole, orná půda, otevřená stanoviště (16, 19)
|
0,1–0,23
(14, 19)
|
L= D
(14)
|
0
(1, 19)
|
3 (19)
11 (90 %) (18)
|
klíčení tlumeno tmou (1, 18, 19)
žádné speciální zpracování (5, 14, 15, 25, 27)
|
POST
(5, 15, 25, 27)
|
A, E, F
|
|
|
CONVOLVULACEAE
Ipomoea hederacea
(povijnice břečťanovitá, svlačec)
|
A
okraje silnic, otevřená stanoviště, obilná pole (16)
|
28,2
(14)
|
L > D
(6, 10)
|
10–20
(6, 10, 21)
|
4 (100 %)
(10)
|
klíčení neovlivněno ozářeností (1)
žádné speciální zpracování (6, 21)
|
PRE & POST
(6, 12, 21, 28)
|
A
|
|
|
CYPERACEAE
Cyperus rotundus
(šáchor hlíznatý)
|
Ρ
orná půda, pastviny, okraje silnic (16, 30)
|
0,2
(14)
|
L= D
(14)
|
0 (1)
10–20 (6, 10)
|
12 (91 %)
(10)
|
klíčení tlumeno tmou (1)
žádné speciální zpracování (6, 10, 14)
|
PRE & POST
(6, 28, 31)
|
B
|
7
|
|
FABACEAE
Lotus corniculatus
(štírovník růžkatý)
|
Ρ
zatravněné plochy, okraje silnic, otevřená stanoviště (16, 19)
|
1–1,67
(14, 19)
|
L = D (14)
|
|
1 (50 %)
(19)
|
skarifikace (14, 19)
klíčení neovlivněno ozářeností (18, 19) žádné speciální zpracování (23, 25)
|
POST
(5, 23, 25)
|
A, D, E, F
|
|
|
Senna obtusifolia
(kasie tora)
|
A
vlhké lesy (16)
|
23–28
(9)
|
L = D (14)
L > D (9)
|
10–20
(6, 9)
|
|
nasáknutí semen ve vodě 24 hodin (9)
skarifikace (14) životaschopnost semen se liší v závislosti na barvě (1) žádné speciální zpracování (6)
|
POST
(6, 9)
|
A
|
|
|
Sesbania exaltata
(sesbánie bylinná)
|
A
naplavená půda (16)
|
11–13
(9, 14)
|
L > D (9)
|
10–20
(9, 21)
|
|
nasáknutí semen ve vodě 24 hodin (9)
klíčení neovlivněno ozářeností (1) žádné speciální zpracování (21)
|
PRE & POST
(9, 21, 28, 31)
|
A
|
|
|
Trifolium pratense
(jetel luční)
|
Ρ
pole, okraje silnic, orná půda (16, 19)
|
1,4–1,7
(14, 19)
|
L = D (14)
|
|
1 (50 %)
(19)
|
skarifikace (14, 18)
může vyžadovat zrání (19) klíčení neovlivněno ozářeností (1, 19) žádné speciální zpracování (5)
|
POST
(5)
|
A, E, F
|
|
|
LAMIACEAE
Leonurus cardiaca
(buřina srdečník)
|
Ρ
otevřená stanoviště (16)
|
0,75–1,0
(4, 14)
|
L = D (14)
|
0
(4)
|
|
žádné speciální zpracování
(4, 14)
|
POST
(4)
|
F
|
|
|
Mentha spicata
(máta klasnatá)
|
Ρ
vlhké plochy (16)
|
2,21
(4)
|
|
0
(4)
|
|
žádné speciální zpracování
(4)
|
POST
(4)
|
F
|
|
|
Nepeta cataria
(šanta kočičí)
|
Ρ
narušené oblasti (16)
|
0,54
(4, 14)
|
L = D (14)
|
0
(4)
|
|
žádné speciální zpracování
(2, 4, 14)
|
POST
(2, 4)
|
F
|
|
|
Prunella vulgaris
(černohlávek obecný)
|
Ρ
orná pole, zatravněné plochy, narušené oblasti (16, 19)
|
0,58–1,2
(4, 14, 19)
|
L = D (14)
|
0
(4, 19)
|
5 (50 %) (19)
7 (91 %) (18)
|
klíčení tlumeno tmou (18, 19)
intenzivnější klíčení s většími semeny (1 ), žádné speciální zpracování (4, 14, 22)
|
POST
(4, 22)
|
A, F
|
|
|
Stachys officinalis
(bukvice lékařská, čistec)
|
Ρ
louky, okraje polí (19)
|
14–18
(14, 19)
|
L = D (14)
|
|
7 (50 %)
(19)
|
žádné speciální zpracování
(5, 14, 22)
|
POST
(5, 22)
|
F
|
|
|
MALVACEAE
Abutilón theophrasti
(mračňák Theophrastův)
|
A
pole, otevřená stanoviště (16)
|
8,8
(14)
|
L = D (14)
|
10–20
(6, 10, 21)
|
4 (84 %)
(10)
|
skarifikace (14)
žádné speciální zpracování (5, 10, 21)
|
PRE & POST
(6, 22, 28, 31)
|
A, F
|
|
|
Sida spinosa
(vlákeň ostnitá)
|
A
pole, okraje silnic (16)
|
3,8
(14)
|
L = D (14)
|
10–20
(6, 21)
|
|
skarifikace (14)
klíčení neovlivněno ozářeností (1) žádné speciální zpracování (6, 21)
|
PRE & POST
(6, 21, 28, 31)
|
A, F
|
|
|
PAPAVERACEAE
Papaver rhoeas
(mák vlčí)
|
A
pole, orná půda, narušené oblasti (16, 19)
|
0,1–0,3
(4, 14, 19, 29)
|
L = D (14)
|
0
(4, 29)
|
4 (50 %)
(19)
|
studená stratifikace a skarifikace (1, 19, 32)
žádné speciální zpracování (4, 14, 29)
|
POST
(4)
|
A, D, E, F, G
|
|
|
POACEAE
Agrostis tenuis
(psineček obecný)
|
trávníky, pastviny (16)
|
0,07 (14)
|
L > D (Ю)
|
20 (10)
|
10 (62 %) (10)
|
klíčení tlumeno tmou (1, 17-19) žádné speciální zpracování (10)
|
POST (10)
|
A, E
|
|
|
Alopecurus myosuroides
(psárka polní)
|
A
pole, otevřená stanoviště (16)
|
0,9–1,6
(29, 34)
|
L = D (14)
|
2
(29)
|
< 24 (30 %) (34)
|
skarifikace (14) ošetřit 101 mg/l KNO3 (14) teplá stratifikace (1) klíčení tlumeno tmou (1) žádné speciální zpracování (34)
|
PRE & POST
(28, 34)
|
A
|
32
|
|
Avena fatua
(oves hluchý)
|
A
obdělávané plochy, otevřená stanoviště (16)
|
7–37,5 (14, 30)
|
L = D (14)
L > D (6)
|
10–20 (6, 10)
|
3 (70 %) (18)
|
skarifikace (7, 32) tma potlačuje klíčení (1)
studená stratifikace (1, 18) žádné speciální zpracování (6, 10, 14)
|
PRE & POST (6, 10, 28, 31)
|
A
|
|
|
Bromus tectorum
(sveřep střešní)
|
A
pole, okraje silnic, orná půda (16)
|
0,45–2,28 (14, 29)
|
L = D (14)
|
3 (29)
|
|
období zrání (1, 7, 32) klíčení tlumeno světlem (1), žádné speciální zpracování (14)
|
PRE & POST (28, 31)
|
A
|
|
|
Cynosurus cristatus
(poháňka hřebenitá)
|
P
pole, okraje silnic, otevřená stanoviště (16, 19)
|
0,5–0,7 (14, 19, 29)
|
L = D (14)
|
0 (29)
|
3 (50 %) (19)
|
klíčení neovlivněno ozářeností (19) žádné speciální zpracování (14, 29)
|
POST (5)
|
A
|
|
|
Digitaria sanguinalis
(rosička krvavá)
|
A
pole, trávník, otevřená stanoviště (16)
|
0,52–0,6 (14, 30)
|
L = D (14)
|
10–20 (21)
|
7 (75 %)
14 (94 %) (7)
|
skarifikace, studená stratifikace, a zrání (1, 7, 14, 32) ošetřit 101 mg/l KNO3 (14) klíčení tlumeno tmou (1), žádné speciální zpracování (21)
|
PRE & POST (18, 25, 31)
|
A
|
|
|
Echinochloa crusgalli
(ježatka kuří noha)
|
A
(16)
|
1,5 (14)
|
L = D (14)
L > D (3)
|
10–20 (7, 21)
|
|
skarifikace (7, 32) klíčení neovlivněno ozářeností (1), žádné speciální zpracování (3, 14, 21)
|
PRE & POST (3, 21, 28, 31)
|
A
|
|
|
Elymus canadensis
(pýrovník kanadský)
|
P
pobřeží, narušené oblasti (16)
|
4–5 (14, 30)
|
L = D (11)
|
1
(11)
|
14–28
(11)
|
žádné speciální zpracování
(2, 11)
|
POST (2)
|
C, D, E
|
|
|
Festuca pratensis
(kostřava luční)
|
P
pole, vlhké plochy (16, 19)
|
1,53–2,2 (16, 19)
|
L = D (14)
L > D (10)
|
20 (10)
|
9 (74 %) (10)
2 (50 %) (19)
|
žádné speciální zpracování
(10, 19)
|
POST (10)
|
A
|
7
|
|
Hordeum pusillum
(ječmen malý)
|
A
pastviny, okraje silnic, otevřená stanoviště (16)
|
3,28 (14)
|
|
|
|
teplá stratifikace (1) klíčení neovlivněno ozářeností (1)
|
PRE (31)
|
|
7
|
|
Phieum pratense
(bojínek luční)
|
P
pastviny, orná pole, narušená místa (16, 19)
|
0,45 (14, 19)
|
L > D (10, 14)
|
0–10 (10, 19)
|
2 (74 %) (10)
8 (50 %) (19)
|
klíčení tlumeno tmou (19) klíčení neovlivněno ozářeností (17) žádné speciální zpracování (10, 14, 17, 19)
|
POST (10)
|
A, E
|
|
|
POLYGONACEAE
Polygonum convolvulus
(opletka svlačcovitá)
|
A
otevřená stanoviště, okraje silnic (16)
|
5–8 (4, 14, 29)
|
L = D (20)
|
0–2 (4, 29)
|
|
studená stratifikace 4–8 týdnů (1, 2, 4, 20, 29) klíčení neovlivněno ozářeností (1)
|
PRE & POST 1, 2, 20, 28, 31
|
A
|
32
|
|
Polygonum lapathifolium
(rdesno blešník)
|
A
vlhká půda (16)
|
1,8–2,5 (14)
|
L > D (6)
|
|
5 (94 %) (18)
|
klíčení neovlivněno ozářeností (1) klíčení tlumeno tmou (18) studená stratifikace (1) žádné speciální zpracování (5)
|
PRE & POST (6)
|
A, E
|
|
|
Polygonum pennsylvanicum
(rdesno pensylvánské)
|
A
pole, otevřená stanoviště (16)
|
3,6–7 (14, 29)
|
|
2 (29)
|
|
studená stratifikace 4 týdny při 0–5 °C (1, 29) klíčení tlumeno tmou (1)
|
PRE (31)
|
A, E
|
|
|
Polygonum periscaria
(rdesno červivec)
|
A
narušené oblasti, orná půda (16, 19)
|
2,1–2,3 (14, 19)
|
L > D (13)
|
0 (19)
|
< 14 (13)
2 (50 %) (19)
|
skarifikace, studená stratifikace, GA zpracování (14) studená stratifikace, zrání (17-19) klíčení tlumeno tmou (19) žádné speciální zpracování (13)
|
POST (13)
|
A
|
32
|
|
Rumex crispus
(šťovík kadeřavý)
|
P
orná pole, okraje silnic, otevřené plochy (16, 19)
|
1,3–1,5 (4, 14, 19)
|
L = D (14, 33)
|
0
(4, 19, 33)
|
3 (50 %) (19)
6 (100 %) (33)
|
klíčení tlumeno tmou (18, 19) zrání může být nezbytné (18) žádné speciální zpracování (4, 14, 33)
|
POST (4, 33)
|
A, E
|
32
|
|
PRIMULACEAE
Anagallis arvensis
(drchnička rolní)
|
A
orná pole, otevřené plochy, narušená místa (16, 19)
|
0,4–0,5 (4, 14, 19)
|
L = D (14)
|
|
1 (50 %) (19)
|
studená stratifikace, GA zpracování (1,14, 18, 19, 32) klíčení vyžaduje světlo (1), žádné speciální zpracování (2, 4)
|
POST (2,4)
|
A, F
|
|
|
RANUNCULACEAE
Ranunculus acris
(pryskyřičník prudký)
|
Ρ
orná pole, okraje silnic, otevřené plochy (16, 19)
|
1,5–2 (14, 19, 29)
|
L = D (14)
|
1
(29)
|
41–56 (19, 29)
|
žádné speciální zpracování
(5, 14, 22, 24 -26)
|
POST (5, 22, 24-26)
|
|
32
|
|
ROSACEAE
Geum urbanum
(kuklík městský)
|
Ρ
živý plot, vlhké plochy
(16, 19)
|
0,8–1,5 (14, 19)
|
L = D (14)
|
0 (19)
|
5 (50 %) (19)
16 (79 %) (18)
|
klíčení tlumeno tmou (18, 19) teplá stratifikace (1) žádné speciální zpracování (5, 14, 22, 25, 26)
|
POST (5, 22, 25, 26)
|
A
|
|
|
RUBIACEAE
Galium aparine
(svízel přítula)
|
A
orná pole, vlhké plochy, narušené oblasti (16, 19)
|
7–9 (14, 19)
|
L = D (14)
|
|
5 (50 %) (19)
6 (100 %) (18)
|
studená stratifikace (1, 18, 19) klíčení neovlivněno ozářeností (18, 19) klíčení tlumeno světlem (1) žádné speciální zpracování (6, 14)
|
PRE & POST (6, 28)
|
A
|
32
|
|
Galium mollugo
(svízel povázka)
|
Ρ
ohrady s živým plotem, otevřené plochy (8)
|
7
(29)
|
L = D (14)
|
2
(29)
|
|
žádné speciální zpracování
(5, 14, 22, 24, 26, 29)
|
POST (5, 22, 24, 26)
|
A
|
|
|
SCROPHULARIACEAE
Digitalis purpurea
(náprstník červený)
|
Β, Ρ živý plot, otevřené plochy (16, 19)
|
0,1–0,6 (4, 14, 19)
|
L = D (14)
|
0
(4, 19)
|
6 (50 %) (19)
8 (99 %) (18)
|
klíčení tlumeno tmou (1, 17-19) žádné speciální zpracování (4, 22-26)
|
POST (4, 22–26)
|
D, G, F
|
|
|
Veronica persica
(rozrazil perský)
|
A
orná pole, otevřené plochy, narušené oblasti(16, 19)
|
0,5–0,6 (14, 19)
|
L = D (14)
|
0 (19)
|
3 (19)
5 (96 %) (18)
|
klíčení tlumeno tmou (18, 19) studená stratifikace (18) žádné speciální zpracování (14)
|
PRE & POST (28)
|
A
|
32
|
Uvádění dodavatelé semen
|
ID dodavatele
|
Informace o dodavateli
|
|
A
|
|
Herbiseed
|
|
New Farm, Mire Lane, West End, Twyford RG10 0NJ ENGLAND +44 (0) 1189 349 464
|
|
www.herbiseed.com
|
|
|
B
|
|
Tropilab Inc.
|
|
8240 Ulmerton Road, Largo, FL 33771-3948 USA
|
|
(727) 344 – 4050
|
|
www.tropilab.com
|
|
|
C
|
|
Pterophylla – Native Plants & Seeds
|
|
#316 Regional Road 60, RR#1, Walsingham, ON N0E 1X0 CANADA (519) 586 – 3985
|
|
|
D
|
|
Applewood Seed Co.
|
|
5380 Vivian St., Arvada, CO 80002 USA (303) 431 – 7333
|
|
www.applewoodseed.com
|
|
|
E
|
|
Ernst Conservation Seeds
|
|
9006 Mercer Pike, Meadville, PA 16335 USA
|
|
(800) 873 – 3321
|
|
www.ernstseed.com
|
|
|
F
|
|
Chiltern Seeds
|
|
Bortree Stile, Ulverston, Cumbria LA12 7PB ENGLAND
|
|
+44 1229 581137
|
|
www.chiltemseeds.co.uk
|
|
|
G
|
|
Thompson & Morgan
|
|
P.O. Box 1051, Fort Erie, ON L2A 6C7 CANADA (800) 274 – 7333
|
|
www.thompson-morgan.com
|
|
LITERATURA
|
1)
|
Baskin, C.C. & Baskin, J.M. 1998. Seeds. Academic Press, Toronto.
|
|
2)
|
Blackburn, L.G. & Boutin, C. 2003. Subtle effects of herbicide use in the context of genetically modified crops: a case study with glyphosate (Round-Up®). Ecotoxicology, 12:271-285.
|
|
3)
|
Boutin, C., Lee, H-B., Peart, T., Batchelor, P.S., & Maguire, R.J. 2000. Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Environmental Toxicology & Chemistry, 19(10):2532-2541.
|
|
4)
|
Boutin, C., Elmegaard, N., & Kjaer, C. 2004. Toxicity testing of fifteen non-crop plant species with six herbicides in a greenhouse experiment: implications for risk assessment. Ecotoxicology, 13:349-369.
|
|
5)
|
Breeze, V., Thomas, G., & Butler, R. 1992. Use of a model and toxicity data to predict the risks to some wild plant species from drift of four herbicides. Annals of Applied Biology, 121:669-677.
|
|
6)
|
Brown, R.A., & Farmer, D. 1991. Track-sprayer and glasshouse techniques for terrestrial plant bioassays with pesticides. In: Plants for toxicity assessment: 2nd volume. ASTM STP 1115, J.W. Gorsuch, W.R. Lower, W.Wang, & M.A. Lewis, eds. American Society for Testing & Materials, Philadelphia. pp 197 – 208.
|
|
7)
|
Buhler, D.D. & Hoffman, M.L. 1999. Anderson's guide to practical methods of propagating weeds and other plants. Weed Science Society of America, Lawrence, K.
|
|
8)
|
Clapham, A.R., Tutin, T.G., & Warburg, E.F. 1981. Excursion flora of the British Isles, 3rd ed. Cambridge University Press, Cambridge.
|
|
9)
|
Clay, P.A. & Griffin, J.L. 2000. Weed seed production and seedling emergence response to late-season glyphosate applications. Weed Science, 48:481-486.
|
|
10)
|
Cole, J.F.H. & Canning, L. 1993. Rationale for the choice of species in the regulatory testing of the effects of pesticides on terrestrial non-target plants. BCPC – Weeds. pp. 151 – 156.
|
|
11)
|
Fiely, M. (Ernst Conservation Seeds). 2004. Personal communication. (www.ernstseed.com)
|
|
12)
|
Fletcher, J.S., Johnson, F.L., & McFarlane, J.C. 1990. Influence of greenhouse versus field testing and taxonomic differences on plant sensitivity to chemical treatment. Environmental Toxicology & Chemistry, 9:769-776.
|
|
13)
|
Fletcher, J.S., Pfleeger, T.G., Ratsch, H.C., & Hayes, R. 1996. Potential impact of low levels of chlorsulfuron and other herbicides on growth and yield of nontarget plants. Environmental Toxicology & Chemistry, 15(7):1189-1196.
|
|
14)
|
Flynn, S., Turner, R.M., and Dickie, J.B. 2004. Seed Information Database (release 6.0, Oct 2004) Royal Botanic Gardens, Kew (www.rbgkew.org.uk/data/sid).
|
|
15)
|
Franzaring, J., Kempenaar, C., & van der Eerden, L.J.M. 2001. Effects of vapours of chlorpropham and ethofumesate on wild plant species. Environmental Pollution, 114:21-28.
|
|
16)
|
Gleason, H.A. & Cronquist, A. 1991. Manual of vascular plants of northeastern United States and adjacent Canada, 2nd ed. New York Botanical Garden, Bronx, NY.
|
|
17)
|
Grime, J.P. 1981. The role of seed dormancy in vegetation dynamics. Annals of Applied Biology, 98:555-558.
|
|
18)
|
Grime, J.P., Mason, G., Curtis, A.V., Rodman, J., Band, S.R., Mowforth, M.A.G., Neal, A.M., & Shaw, S. 1981. A comparative study of germination characteristics in a local flora. Journal of Ecology, 69:1017-1059.
|
|
19)
|
Grime, J.P., Hodgson, J.G., & Hunt, R. 1988. Comparative plant ecology: a functional approach to common British species. Unwin Hyman Ltd., London.
|
|
20)
|
Kjaer, C. 1994. Sublethal effects of chlorsulfuron on black bindweed (Polygonum convolvulus L.). Weed Research, 34:453-459.
|
|
21)
|
Klingaman, T.E., King, C.A., & Oliver, L.R. 1992. Effect of application rate, weed species, and weed stage of growth on imazethapyr activity. Weed Science, 40:227-232.
|
|
22)
|
Marrs, R.H., Williams, C.T., Frost, A.J., & Plant, R.A. 1989. Assessment of the effects of herbicide spray drift on a range of plant species of conservation interest. Environmental Pollution, 59:71-86.
|
|
23)
|
Marrs, R.H., Frost, A.J., & Plant, R.A. 1991. Effects of herbicide spray drift on selected species of nature conservation interest: the effects of plant age and surrounding vegetation structure. Environmental Pollution, 69:223-235.
|
|
24)
|
Marrs, R.H., Frost, A.J., & Plant, R.A. 1991. Effects of mecoprop drift on some plant species of conservation interest when grown in standardized mixtures in microcosms. Environmental Pollution, 73:25-42.
|
|
25)
|
Marrs, R.H., Frost, A.J., Plant, R.A., & Lunnis, P. 1993. Determination of buffer zones to protect seedlings of non-target plants from the effects of glyphosate spray drift. Agriculture, Ecosystems, & Environment, 45:283-293.
|
|
26)
|
Marrs, R.H. & Frost, A.J. 1997. A microcosm approach to detection of the effects of herbicide spray drift in plant communities. Journal of Environmental Management, 50:369-388.
|
|
27)
|
Marshall, E.J.P. & Bernie, J.E. 1985. Herbicide effects on field margin flora. BCPC – Weeds. pp. 1021-1028.
|
|
28)
|
McKelvey, R.A., Wright, J.P., & Honegger, J.L. 2002. A comparison of crop and non-crop plants as sensitive species for regulatory testing. Pest Management Science, 58:1161-1174.
|
|
29)
|
Morton, S. (Herbiseed). 2004. Personal communication. (http://www.herbiseed.com)
|
|
30)
|
USDA, NRCS. 2004. The Plants Database, version 3.5. (http://plants.usda.gov). National Plant Data Centre, Baton Rouge, LA 70874-4490 USA.
|
|
31)
|
USEPA. 1999. One-Liner Database. [U.S. E.P.A./Office of Pesticide Programs/Environmental Fate and Effects Division/Environmental Epidemiology Branch].
|
|
32)
|
Webster, R.H. 1979. Technical Report No. 56: Growing weeds from seeds and other propagules for experimental purposes. Agricultural Research Council Weed Research Organization, Oxford.
|
|
33)
|
White, A. L. & Boutin, C. (National Wildlife Research Centre, Environment Canada). 2004. Personal communication.
|
|
34)
|
Zwerger, P. & Pestemer, W. 2000. Testing the phytotoxic effects of herbicides on higher terrestrial non-target plants using a plant life-cycle test. Z. PflKrankh. PflSchutz, Sonderh., 17:711-718.
|
Dodatek 4
Příklady vhodných podmínek pro růst určitých druhů plodin
Následující podmínky byly shledány vhodnými pro 10 druhů plodin a mohou se použít jako vodítko rovněž při zkouškách v růstových komorách s určitými dalšími druhy:
|
|
Koncentrace oxidu uhličitého: 350 ± 50 ppm
|
|
|
Relativní vlhkost: 70 ± 5 % během období světa a 90 ± 5 % během období tmy
|
|
|
Teplota: 25 ± 3 °C během dne, 20 ± 3 °C během noci
|
|
|
Fotoperioda: 16 hodin světla/8 hodin tma, předpokládá se průměrná vlnová délka 400 až 700 nm
|
|
|
Světlo: svítivost 350 ± 50 μE/m2/s měřená na vrchu klenby.
|
Plodinové druhy:
|
—
|
rajče jedlé (Solanum lycopersicum),
|
|
—
|
okurka setá (Cucumis sativus),
|
|
—
|
salát hlávkový (Lactuca sativa),
|
|
—
|
sója luštinatá (Glycine max),
|
|
—
|
hlávkové zelí (Brassica oleracea var. capitata),
|
|
—
|
mrkev obecná (Daucus carota),
|
|
—
|
oves setý (Avena sativa),
|
|
—
|
jílek vytrvalý (Lolium perenne),
|
|
—
|
kukuřice setá (Zea mays),
|
|
—
|
cibule kuchyňská (Allium cepa).
|
C.32. ZKOUŠKA TOXICITY PRO REPRODUKCI ROUPICOVITÝCH
ÚVOD
|
1.
|
Tato zkušební metoda je rovnocenná Pokynu OECD pro zkoušení 220 (2004). Je určena pro použití v hodnocení účinků chemických látek na reprodukční schopnost roupice bělavé, Enchytraeus albidus Henle 1873, v půdě. V zásadě vychází z metody vyvinuté v německém spolkovém úřadu pro ochranu životního prostředí (Umweltbundesamt) (1), která byla podrobena okružnímu testu (2). Byly rovněž brány v úvahu další metody zkoušení toxicity chemických látek na roupicovité a žížaly (3, 4, 5, 6, 7, 8).
|
VÝCHOZÍ ÚVAHY
|
2.
|
V půdě žijící kroužkovci rodu roupice (Enchytraeus) jsou ekologicky vhodným druhem pro ekotoxikologické zkoušky. I když se roupicovití často vyskytují v půdách, kde žijí žížaly, rovněž je pravda, že se často nalézají v hojném množství i tam, kde žížaly nejsou. Roupicovití se dají použít v laboratorních zkouškách, stejně jako v poloterénních a terénních studiích. Z praktického hlediska je řada druhů Enchytraeus vhodných vzhledem k snadné manipulaci a snadnému chovu a jejich generační perioda je významně kratší než u žížal. Doba trvání zkoušky toxicity pro reprodukci s roupicovitými je proto pouze 4–6 týdnů, zatímco u žížal hnojních (Eisenia fetida) je to 8 týdnů.
|
|
3.
|
Základní informace o ekologii a ekotoxikologii roupicovitých v suchozemském životním prostředí lze nalézt v literatuře (9, 10, 11, 12).
|
PODSTATA ZKOUŠKY
|
4.
|
Dospělí roupicovití červi jsou vystaveni celé řadě koncentrací zkoušené chemické látky zamíchané do umělé půdy. Zkoušku je možné rozdělit na dva kroky: a) v případě, že nejsou k dispozici dostatečné informace, orientační zkoušku pro nalezení rozmezí dávek, ve které je hlavním cílovým ukazatelem mortalita hodnocená po dvou týdnech expozice, a b) hlavní zkoušku toxicity pro reprodukci, ve které se hodnotí celkový počet mláďat zplozených rodičovskými jedinci a přežití rodičů. Doba trvání hlavní zkoušky je šest týdnů. Po prvních třech týdnech se dospělí jedinci vyjmou a zaznamenají se morfologické změny. Po dalších třech týdnech se zjistí počet potomků vylíhnutých ze zámotků vytvořených dospělými jedinci. Reprodukční schopnost živočichů vystavených zkoušené chemické látce se srovná s aktivitou kontrolní skupiny pro stanovení i) koncentrace bez pozorovaných účinků (NOEC), nebo ii) ECx (např. EC10, EC50) za použití regresního modelu pro odhad koncentrace, která způsobí x % snížení reprodukční schopnosti. Rozsah zkušebních koncentrací by měl zahrnovat ECx (např. EC10, EC50) tak, aby se pak hodnota ECx získala interpolací spíše než extrapolací.
|
INFORMACE O ZKOUŠENÉ CHEMICKÉ LÁTCE
|
5.
|
U zkoušené chemické látky by optimálně měly být známy rozpustnost ve vodě, log Kow, rozdělovací koeficient půda/voda (např. kapitola C.18 nebo C.19 této přílohy) a tlak par. Žádoucí jsou další informace o osudu zkoušené chemické látky v půdě, jako je rychlost fotolýzy a hydrolýzy.
|
|
6.
|
Tato zkušební metoda se dá použít jak pro chemické látky ve vodě rozpustné, tak i nerozpustné. Režim aplikace zkoušené chemické látky se však bude příslušně lišit. Zkušební metoda se nedá aplikovat na těkavé chemické látky, tj. látky, jejichž Henryho konstanta nebo rozdělovací koeficient vzduch/voda je větší než jedna, nebo chemické látky, jejichž tlak par je vyšší než 0,0133 Pa při 25 °C.
|
PLATNOST ZKOUŠKY
|
7.
|
Má-li být zkouška platná, musí být u kontrolních skupin splněna tato kritéria reprodukční schopnosti:
|
—
|
na konci orientační zkoušky a po prvních třech týdnech zkoušky toxicity pro reprodukci by mortalita dospělých jedinců neměla překročit 20 %,
|
|
—
|
za předpokladu, že v uspořádání zkoušky bylo použito 10 dospělých jedinců na nádobu, mělo by být na konci zkoušky zplozeno průměrně alespoň 25 mláďat na nádobu,
|
|
—
|
variační koeficient okolo střední hodnoty počtu mláďat by na konci zkoušky toxicity pro reprodukci neměl být vyšší než 50 %.
|
Tam, kde zkouška nesplní uvedená kritéria platnosti, musí být ukončena. Případné pokračování zkoušky musí být odůvodněno. Odůvodnění musí být uvedeno v závěrečné zprávě.
|
REFERENČNÍ CHEMICKÁ LÁTKA
|
8.
|
Referenční chemická látka by se měla zkoušet buď v pravidelných intervalech, nebo by případně měla být zahrnuta v každé zkoušce, aby se ověřilo, že reakce zkušebních organismů se během času významně nezměnila. Vhodnou referenční látkou je karbendazim, u kterého bylo zjištěno, že ovlivňuje přežití a reprodukci roupicovitých (13, 14), nebo je rovněž možné použít jiné chemické látky, u nichž jsou dobře známé údaje týkající se toxicity. Přípravek karbendazim známý pod obchodním názvem Derosal™, který dodává firma AgrEvo (Frankfurt, Německo) a který obsahuje 360 g/l (32,18 %) účinné složky, byl použit v okružním testu (2). Hodnota EC50 pro reprodukci stanovená okružním testem byla v rozsahu 1,2 ± 0,8 mg účinné složky na kg sušiny (2). Jestliže se do zkušební série zahrne pozitivní kontrolní látka, použije se jedna koncentrace a počet opakování by měl být stejný jako u kontrolních vzorků. V případě karbendazimu se doporučuje zkoušení 1,2 mg ú.s./kg hmotnosti sušiny (zkoušeno jako kapalný přípravek).
|
POPIS ZKOUŠKY
Vybavení
|
9.
|
Zkušební nádoby by měly být vyrobeny ze skla nebo jiného chemicky inertního materiálu. Vhodné jsou skleněné nádoby (např. o objemu 0,20–0,25 litru; průměr: ≈ 6 cm). Nádoby by měly mít průhledná víka (např. skleněná nebo polyethylenová), která jsou navržena tak, aby snižovala odpařování vody a současně umožňovala výměnu plynů mezi půdou a atmosférou. Víka by měla být průhledná, aby umožňovala průchod světla.
|
|
10.
|
Je požadováno běžné laboratorní vybavení, zejména následující:
|
—
|
adekvátní zařízení pro regulaci teploty,
|
|
—
|
adekvátní zařízení pro regulaci vlhkosti (není podstatné, jestliže exponované nádoby mají víka),
|
|
—
|
inkubátor nebo malá místnost s klimatizací,
|
|
—
|
pinzeta, háčky nebo smyčky,
|
|
Příprava umělé půdy
|
11.
|
V této zkoušce se používá umělá půda (5, 7) s následujícím složením (vztaženo na hmotnost sušiny, sušeno do konstantní hmotnosti při 105 °C):
|
—
|
10 % sfagnové rašeliny sušené na vzduchu a jemně mleté (přijatelná je velikost částic 2 ± 1 mm); před použitím ve zkoušce se doporučuje prověřit, zda je půda připravená s čerstvou várkou rašeliny vhodná pro kultivaci roupic,
|
|
—
|
20 % kaolinitického jílu (obsah kaolinitu pokud možno vyšší než 30 %);
|
|
—
|
přibližně 0,3 až 1,0 % uhličitanu vápenatého (CaCO3, práškový, analyticky čistý) pro dosažení pH 6,0 ± 0,5; množství uhličitanu vápenatého, které je třeba doplnit, může v podstatě záviset na kvalitě/charakteru rašeliny;
|
|
—
|
přibližně 70 % na vzduchu vysušeného křemenného písku (v závislosti na potřebném množství CaCO3), převážně jemný písek s více než 50 % částic o velikosti 50 a 200 mikrometrů.
|
Před použitím půdy v hlavní zkoušce se doporučuje prokázat vhodnost umělé půdy pro kultivaci roupic a pro splnění kritérií platnosti zkoušky. Zejména se doporučuje provést takové prověření, kterým se zjistí, zda se účinnost zkoušky nesníží, jestliže se obsah organického uhlíku v umělé půdě sníží, např. snížením obsahu rašeliny na 4–5 % a odpovídajícím zvýšením obsahu písku. Takovým snížením obsahu organického uhlíku se může snížit schopnost adsorpce zkoušené chemické látky (organický uhlík) v půdě a dostupnost zkoušené chemické látky pro živočichy se může zvýšit. Bylo prokázáno, že Enchytraeus albidus může splnit kritéria platnosti pro reprodukci při testování v polních půdách s nižším obsahem organického uhlíku, např. 2,7 % (15); dle zkušeností, i když omezených, toho lze dosáhnout i v umělé půdě s 5 % obsahem rašeliny.
Poznámka: Při použití přírodní půdy v dodatečné zkoušce (např. vyššího stupně) je třeba rovněž prokázat vhodnost půdy a splnění kritérií platnosti zkoušky.
|
|
12.
|
Suché složky půdy se důkladně promísí (např. ve velké laboratorní míchačce). To by se mělo provést alespoň týden před zahájením zkoušky. Promíchaná půda by se měla skladovat dva dny, aby se dosáhlo rovnováhy a stabilizovala se kyselost. Pro stanovení pH se použije směs půdy a roztoku 1 M chloridu draselného (KCl) nebo 0,01 M chloridu vápenatého (CaCl2) v poměru 1:5 (viz (16) a dodatek 3). Jestliže je kyselost půdy vyšší než požadovaný rozsah (viz odstavec 11), nastaví se pH přidáním vhodného množství CaCO3. Jestliže je půda příliš alkalická, nastaví se pH přidáním více směsi uvedené v odstavci 11, ale s vyloučením CaCO3.
|
|
13.
|
Maximální retenční vodní kapacita (RVKmax, též WHCmax) umělé půdy se stanoví podle postupů popsaných v dodatku 2. Jeden až dva dny před začátkem zkoušky se suchá umělá půda předběžně zvlhčí přidáním dostatečného množství deionizované vody, aby se dosáhlo přibližně poloviny konečného obsahu vody, což představuje 40 až 60 % maximální retenční vodní kapacity. Na začátku zkoušky se předem zvlhčená půda rozdělí na díly odpovídající počtu zkušebních koncentrací (a referenční chemické látce, je-li použita) a kontrolních vzorků použitých při zkoušce. Obsah vlhkosti se nastaví na 40–60 % maximální RVK přidáním roztoku zkoušené chemické látky anebo přidáním destilované nebo deionizované vody (viz odstavce 19–21). Obsah vlhkosti se stanoví na začátku a na konci zkoušky (vysušením na konstantní hmotnost při 105 °C) a měl by spadat do optimálního rozsahu pro přežití živočichů. Hrubý odhad obsahu vlhkosti v půdě lze učinit tak, že mírně stisknete půdu v ruce; jestliže je obsah vlhkosti správný, měly by se mezi prsty objevit malé kapky vody.
|
Výběr a příprava zkušebních živočichů
|
14.
|
Doporučený zkušební druh je Enchytraeus albidus Henle 1837 (roupice bělavá) z čeledi Enchytraeidae (třída Oligochaeta, kmen Annelida). E. albidus je jedním z největších druhů roupicovitých, u nějž byli zaznamenáni jedinci o délce až 35 mm (17, 18). E. albidus je celosvětově rozšířen a nalézá se na mořských, sladkovodních i suchozemských stanovištích, zejména v tlející organické hmotě (chaluhy, kompost) a vzácně na lukách (9). Jeho široká ekologická tolerance a některé morfologické odchylky mohou ukazovat na existenci rozdílných poddruhů.
|
|
15.
|
E. albidus je komerčně dostupný jako krmivo pro ryby. Mělo by se ověřit, zda není kultura kontaminována jinými, obvykle menšími druhy (1, 19). Pokud se znečištění objeví, omyjí se všechny roupice vodou v Petriho misce. Velcí dospělí jedinci E. albidus se pak vyberou (použitím stereomikroskopu) pro začátek nové kultury, ostatní jedinci se vyřadí. E. albidus lze snadno chovat v široké škále organických materiálů (viz dodatek 4). Životní cyklus E. albidus je krátký, jelikož dospělosti dosáhne mezi 33 dny (při 18 °C) a 74 dny (při 12 °C) (1). Pro zkoušku se použijí pouze kultury, které byly uchovávány bez problémů v laboratoři po dobu alespoň 5 týdnů (jednu generaci).
|
|
16.
|
Ostatní druhy rodu Enchytraeus jsou rovněž vhodné, např. E. buchholzi Vejdovský 1879 nebo E. crypticus Westheide a Graefe 1992 (viz dodatek 5). Pokud se použijí jiné druhy rodu Enchytraeus, musí být jasně identifikovány a musí být logicky zdůvodněný výběr druhu.
|
|
17.
|
Při zkouškách se používají dospělí jedinci. Měli by mít vajíčka (bílé skvrny) v oblasti clitella (střední kroužkové části) a mít přibližně stejnou velikost (přibližně 1 cm na délku). Synchronizace množících se kultur není nezbytná.
|
|
18.
|
Jestliže roupicovití nejsou chováni ve stejném půdním typu a za podmínek (včetně výživy) použitých při konečné zkoušce, musí se aklimatizovat po dobu nejméně 24 hodin až tří dnů. Na počátku by se měl aklimatizovat větší počet dospělých jedinců, než bude zapotřebí pro provádění zkoušky, aby vznikla rezerva pro vyřazení poškozených nebo jinak nevyhovujících jedinců. Na konci doby aklimatizace se jako vhodní pro zkoušku vyberou pouze jedinci mající vajíčka a nevykazující žádné anomálie v chování (např. pokus o únik z půdy). Roupice se opatrně vyjmou použitím klenotnických pinzet, háčků nebo smyček a umístí do Petriho misek obsahujících malé množství čerstvé vody. Pro tento účel se přednostně použije rekonstituovaná sladká voda podle návrhu v kapitole C.20 této přílohy (Zkouška toxicity pro reprodukci druhu Daphnia magna), neboť voda deionizovaná, demineralizovaná nebo voda z vodovodu by pro roupice mohla být nebezpečná. Živočichové se prohlédnou pod stereomikroskopem a všichni, kteří neobsahují vajíčka, jsou vyřazeni. Je třeba dbát na to, aby byli vyjmuti a odstraněni všichni roztoči nebo chvostoskoci, kteří mohli infikovat kultury. Zdraví jedinci nepoužití pro zkoušku se vrátí do zásobní kultury.
|
Příprava zkušebních koncentrací
Zkoušená chemická látka rozpustná ve vodě
|
19.
|
Připraví se roztok zkoušené chemické látky v deionizované vodě v množství dostatečném pro všechna opakování jedné zkušební koncentrace. Doporučuje se použít vhodné množství vody, aby byl dosažen požadovaný obsah vlhkosti, tj. 40 až 60 % maximální RVKmax (viz odstavec 13). Před vložením do zkušební nádoby se každý roztok zkoušené chemické látky důkladně promíchá s jednou várkou předem navlhčené půdy.
|
Zkoušená chemická látka nerozpustná ve vodě
|
20.
|
V případě chemických látek nerozpustných ve vodě, ale rozpustných v organických rozpouštědlech, se může zkoušená chemická látka rozpustit v co nejmenším objemu vhodného nosiče (např. acetonu). Měla by se použít pouze těkavá rozpouštědla. Nosič se nastříkne nebo promíchá s malým množstvím, například 2,5 g, jemného křemenného písku. Nosič se odstraní odpařením v digestoři po dobu alespoň jedné hodiny. Tato směs křemenného písku a zkoušené chemické látky se přidá do navlhčené půdy a důkladně se promíchá; předem se přidá příslušné množství deionizované vody, aby bylo dosaženo požadované vlhkosti. Konečná směs se přemístí do zkušebních nádob.
|
|
21.
|
V případě chemických látek obtížně rozpustných ve vodě i v organických rozpouštědlech se ekvivalent 2,5 g jemně mletého křemenného písku na zkušební nádobu promíchá s příslušným množstvím zkoušené chemické látky, aby se získala požadovaná zkušební koncentrace. Tato směs křemenného písku a zkoušené chemické látky se přidá do navlhčené půdy a důkladně se promíchá; předem se přidá příslušné množství deionizované vody, aby se dosáhlo požadované vlhkosti. Konečná směs se rozdělí mezi zkušební nádoby. Tento postup se opakuje pro každou zkušební koncentraci a připraví se rovněž příslušné kontrolní vzorky.
|
|
22.
|
Chemické látky by se obvykle neměly zkoušet při koncentracích vyšších než 1 000 mg/kg suché hmotnosti půdy. Zkoušení při vyšších koncentracích však může být požadováno podle cílů konkrétní zkoušky.
|
ÚČINNOST ZKOUŠEK
Zkoušené a kontrolní skupiny
|
23.
|
Pro každou zkušební koncentraci se do zkušební nádoby umístí příslušné množství zkušební půdy odpovídající 20 g hmotnosti sušiny (viz odstavce 19–21). Připraví se rovněž kontrolní vzorky bez zkoušené chemické látky. Do každé nádoby se přidá krmivo podle postupů popsaných v odstavci 29. Do každé zkušební nádoby se náhodně rozmístí deset roupic. Roupice se opatrně přemístí do každé ze zkušebních nádob a položí na povrch půdy použitím například klenotnických pinzet, háčků nebo smyček. Počet opakování pro zkušební koncentrace a pro kontrolní vzorky závisí na použitém uspořádání zkoušky (viz odstavec 34). Zkušební nádoby se umístí náhodně do zkušebního inkubátoru a tyto polohy se jednou za týden náhodně obmění.
|
|
24.
|
Jestliže se pro aplikaci zkoušené chemické látky použije nosič, je třeba kromě zkoušené série provést zkoušku s jednou kontrolní sérií obsahující křemenný písek postříknutý nebo promíchaný s rozpouštědlem. Koncentrace rozpouštědla nebo dispergátoru by měla být stejná jako v případě zkušebních nádob obsahujících zkoušenou chemickou látku. V případě chemické látky vyžadující administraci ve shodě s postupy popsanými v odstavci 21 by se měla provést zkouška s kontrolní sérií obsahující další křemenný písek (2,5 g na nádobu).
|
Zkušební podmínky
|
25.
|
Zkušební teplota je 20 ± 2 °C. Aby se roupicím zabránilo uniknout z půdy, provádí se zkouška v řízených cyklech světlo-tma (výhodně 16 hodin světla a 8 hodin tmy) s intenzitou osvětlení 400 až 800 luxů v místě zkušebních nádob.
|
|
26.
|
Při prověřování vlhkosti půdy se nádoby váží na začátku zkoušky a pak jednou týdně. Ztráta hmotnosti se doplní přidáním příslušného množství deionizované vody. Je třeba poznamenat, že ztrátu vody je možné snížit tak, že se ve zkušebním inkubátoru udržuje vysoká vlhkost vzduchu (> 80 %).
|
|
27.
|
Obsah vlhkosti a pH se měří na začátku a konci jak orientační zkoušky, tak hlavní zkoušky. Měření se provádí v kontrolních a exponovaných (všechny koncentrace) vzorcích půdy připravených a udržovaných stejným způsobem jako zkušební kultury, ale neobsahujících roupice. Krmivo se přidává pouze do těchto vzorků půdy na začátku zkoušky, aby byla usnadněna mikrobiální aktivita. Množství přidaného krmiva musí být stejné, jako se přidává do zkušebních kultur. Není nezbytné do těchto nádob během zkoušky přidávat další krmivo.
|
Krmení
|
28.
|
Je možné použít krmivo schopné uchovat populaci roupicovitých. Jako vhodný krmný materiál se ukázaly ovesné vločky, přednostně před použitím ošetřené v autoklávu, aby se předešlo mikrobiální kontaminaci (zahřátí je rovněž vhodné).
|
|
29.
|
Krmivo se nejdříve podává promícháním 50 mg mletých vloček s půdou v každé nádobě před vložením roupic. Pak se krmivo dodává týdně až do 21. dne. Krmení se neprovádí 28. den neboť dospělí jedinci byli v této fázi vyjmuti a mladé roupice potřebují po tomto dni relativně málo dalšího krmiva. Krmení během zkoušky spočívá v 25 mg mletých ovesných vloček na nádobu umístěných opatrně na povrch půdy, aby se předešlo poranění živočichů. Aby se potlačil růst plísní, měly by se ovesné vločky zapracovat do půdy pokrytím malým množstvím půdy. Jestliže krmivo zůstane nesnědené, dávka se sníží.
|
Uspořádání orientační zkoušky
|
30.
|
Je-li to nezbytné, provede se orientační zkouška, například s pěti koncentracemi zkoušené chemické látky 0,1; 1,0; 10; 100 a 1 000 mg/kg (suchá hmotnost půdy). Dostatečné je jedno opakování pro každou koncentraci a kontrolu.
|
|
31.
|
Doba trvání orientační zkoušky je dva týdny. Na konci zkoušky se vyhodnotí mortalita roupic. Živočich je zaznamenán jako mrtvý, jestliže nijak nereaguje na mechanické stimuly na ventrálním konci. Pro rozhodování o rozsahu koncentrací použitých v hlavní zkoušce mohou být užitečné i další informace o mortalitě. Proto je třeba zaznamenat změny v chování dospělých jedinců (např. neschopnost zavrtat se do půdy; ležení bez pohybu proti skleněné stěně zkušební nádoby) a v morfologii (např. přítomnost otevřených ran) spolu s přítomností jakýchkoli mláďat. Mláďata je možné identifikovat použitím barvící metody popsané v dodatku 6.
|
|
32.
|
Hodnotu LC50 je možné přibližně stanovit výpočtem geometrického průměru z dat mortality. Při určování rozsahu koncentrací pro hlavní zkoušku se předpokládá, že účinky na reprodukci jsou nižší než LC50 s faktorem až 10. Jedná se však o empirický vztah a v každém specifickém případě může být tato hodnota jiná. Další pozorování prováděná během orientační zkoušky, jako je výskyt mláďat, mohou pomoci v přesnějším určení rozsahu koncentrací zkoušené chemické látky, který má být použit v hlavní zkoušce.
|
|
33.
|
Pro přesné stanovení LC50 se doporučuje provádět zkoušku s použitím alespoň čtyř opakování pro každou koncentraci zkoušené chemické látky a adekvátní počet koncentrací, aby bylo dosaženo alespoň čtyř statisticky významně rozdílných středních hodnot odezvy při těchto koncentracích. Podobný počet koncentrací a opakování se použije pro kontrolní vzorky, když se používají.
|
Uspořádání hlavní zkoušky toxicity pro reprodukci
|
34.
|
Jsou navržena tři uspořádání na základě doporučení plynoucích z okružního testu (2)
|
—
|
Při stanovení NOEC by se mělo zkoušet alespoň pět koncentrací tvořících geometrickou posloupnost. Doporučují se čtyři opakování pro každou zkoušenou koncentraci plus osm kontrolních vzorků. Koncentrace by měly být rozloženy tak, že interval mezi nimi nepřekročí faktor 1,8.
|
|
—
|
Při stanovení ECx (např. EC10, EC50) je třeba zkoušet alespoň pět koncentrací a rozsah koncentrací by měl zahrnovat ECx, aby bylo možno hodnotu ECx interpolovat, a nebylo nutno extrapolovat. Doporučuje se použít alespoň čtyři opakování pro každou zkušební koncentraci a čtyři kontrolní opakování. Faktor pro interval se může měnit, tj. faktor může být nižší nebo roven 1,8 v očekávaném rozsahu účinku a větší než 1,8 při vyšších nebo nižších koncentracích.
|
|
—
|
Kombinovaný přístup umožňuje stanovení jak NOEC, tak ECx. Použije se osm koncentrací testované chemické látky v geometrické posloupnosti. Doporučena jsou čtyři opakování pro každou koncentraci plus osm kontrol. Koncentrace by měly být rozloženy tak, že faktor pro interval dávek nepřekračuje 1,8.
|
|
|
35.
|
Na zkušební nádobu se použije deset dospělých jedinců (viz odstavec 23). Krmivo se přidá do zkušebních nádob na začátku zkoušky a pak jednou za týden (viz odstavec 29) až do 21. dne (včetně). 21. dne se vzorky půdy opatrně ručně prozkoumají; pozorují se a spočítají žijící dospělí jedinci; zaznamenají se změny v chování (např. neschopnost zavrtat se do půdy; ležení bez pohybu u skleněné stěny zkušební nádoby) a v morfologii (např. otevřené rány). Všichni dospělí jedinci se pak vyjmou ze zkušebních nádob a ze zkušební půdy. Zkušební půdy obsahující jakékoli zplozené zámotky se inkubují po další tři týdny za stejných zkušebních podmínek s tou výjimkou, že krmení se provádí pouze v 35. den (tj. 25 mg mletých ovesných vloček na nádobu).
|
|
36.
|
Po šesti týdnech se spočítají nově vylíhlí jedinci. Doporučuje se metoda využívající barvení bengálskou červení (viz dodatek 6), ačkoli se jako vhodné ukázaly i jiné techniky používající mokrou (ale ne horkou) extrakci a flotaci (viz dodatek 6) (4, 10, 11, 20). Barvení bengálskou červení se doporučuje, protože mokrá extrakce z půdního substrátu může být brzděna turbiditou způsobenou suspendovanými jílovými částicemi.
|
Limitní zkouška
|
37.
|
Jestliže při nejvyšší koncentraci v orientační zkoušce (tj. 1 000 mg/kg) nejsou pozorovány žádné účinky, může se zkouška toxicity pro reprodukci provést jako limitní zkouška použitím koncentrace 1 000 mg/kg, aby se prokázalo, že hodnota NOEC pro reprodukci je vyšší než tato hodnota.
|
Souhrn a harmonogram zkoušky
|
38.
|
Jednotlivé kroky zkoušky je možné shrnout následovně:
|
Čas
|
Orientační zkouška
|
Hlavní zkouška
|
|
Den – 7 nebo dříve
|
|
—
|
Připraví se umělá půda (smísením suchých složek)
|
|
|
—
|
Připraví se umělá půda (smísením suchých složek)
|
|
|
Den – 5
|
|
—
|
Zjistí se pH umělé půdy
|
|
|
—
|
Zjistí se pH umělé půdy
|
|
|
Den – 5 až – 3
|
|
—
|
Vytřídí se roupice pro aklimatizaci
|
|
|
—
|
Vytřídí se roupice pro aklimatizaci
|
|
|
Den – 3 až 0
|
|
—
|
Roupice se aklimatizují alespoň 24 hodin
|
|
|
—
|
Roupice se aklimatizují alespoň 24 hodin
|
|
|
Den – 1
|
|
—
|
Umělá půda se zvlhčí a rozdělí do várek
|
|
|
—
|
Umělá půda se zvlhčí a rozdělí do várek
|
|
|
Den 0
|
|
—
|
Připraví se zásobní roztoky
|
|
—
|
Aplikuje se zkoušená chemická látka
|
|
—
|
Odváží se zkušební substrát do zkušebních nádob
|
|
—
|
Změří se pH a obsah vlhkosti půdy
|
|
|
—
|
Připraví se zásobní roztoky
|
|
—
|
Aplikuje se zkoušená chemická látka
|
|
—
|
Odváží se zkušební substrát do zkušebních nádob
|
|
—
|
Změří se pH a obsah vlhkosti půdy
|
|
|
Den 7
|
|
—
|
Zjistí se obsah vlhkosti půdy
|
|
|
—
|
Zjistí se obsah vlhkosti půdy
|
|
|
Den 14
|
|
—
|
Stanoví se mortalita dospělých jedinců
|
|
—
|
Odhadne se počet mláďat
|
|
—
|
Změří se pH a obsah vlhkosti půdy
|
|
|
—
|
Zjistí se obsah vlhkosti půdy
|
|
|
Den 21
|
|
|
—
|
Pozoruje se chování dospělých jedinců
|
|
—
|
Vyjmou se dospělí jedinci
|
|
—
|
Stanoví se mortalita dospělých jedinců
|
|
—
|
Zjistí se obsah vlhkosti půdy
|
|
|
Den 28
|
|
|
—
|
Zjistí se obsah vlhkosti půdy
|
|
|
Den 35
|
|
|
—
|
Zjistí se obsah vlhkosti půdy
|
|
|
Den 42
|
|
|
—
|
Spočítají se mladí jedinci
|
|
—
|
Změří se pH a obsah vlhkosti půdy
|
|
|
ÚDAJE A PŘEDKLÁDÁNÍ ZPRÁV
Zpracování výsledků
|
39.
|
Ačkoli je přehled statistických metod uveden v dodatku 7, neexistují u této zkušební metody žádné závazné pokyny pro statistickou analýzu výsledků zkoušky.
|
|
40.
|
Při orientační zkoušce je hlavním cílovým ukazatelem mortalita. Změny v chování (např. neschopnost zavrtat se do půdy; ležení bez pohybu proti skleněné stěně zkušební nádoby) a v morfologii (např. přítomnost otevřených ran) dospělých jedinců by však rovněž měly být zaznamenány spolu s přítomností jakýchkoli mláďat. Pro stanovení LC50 se obvykle užívá probitová analýza (21) nebo logistická regrese. Avšak v případech, kdy tato metoda analýzy není vhodná (např. jsou-li k dispozici méně než tři koncentrace s usmrcením pouze části zkušební skupiny), je možné použít alternativní metody. Mezi takové metody můžeme počítat klouzavé průměry (22), upravenou Spearman-Karberovu metodu (23) nebo jednoduchou interpolaci (např. geometrický průměr LC0 a LC100 vypočítaný jako druhá odmocnina ze součinu LC0 a LC100).
|
|
41.
|
V hlavní zkoušce je cílovým ukazatelem plodnost (tj. počet zplozených mláďat). Avšak stejně jako v orientační zkoušce musí být i v závěrečné zprávě uvedeny všechny ostatní škodlivé účinky. Statistická analýza vyžaduje výpočet aritmetického průměru a směrodatné odchylky účinku na reprodukci u exponovaných a kontrolních souborů.
|
|
42.
|
Jestliže byla provedena analýza rozptylu, mohou se směrodatná odchylka s a stupně volnosti df nahradit odhadnutým sloučeným rozptylem získaným z ANOVA a jeho stupni volnosti – za předpokladu, že rozptyl nezávisí na koncentraci. V tomto případě se použijí hodnoty jednotlivých rozptylů kontrolních a exponovaných souborů. Tyto hodnoty se obvykle vypočítají pomocí běžně dostupného statistického softwaru použitím výsledků pro jednu nádobu jako opakování. Jestliže se sloučení dat pro negativní a kontrolní vzorky s rozpouštědly ukáže jako rozumnější než statistické testování vůči jedné z variant, pak je třeba provést test, který prokáže, zda je mezi nimi významný rozdíl (vhodné statistické metody jsou uvedeny v odstavci 45 a dodatku 7).
|
|
43.
|
Další statistické testy a závěry závisejí na tom, zda mají opakované hodnoty normální rozdělení a zda je jejich rozptyl homogenní.
|
Odhad NOEC
|
44.
|
Přednost by se měla dávat aplikaci výkonných testů. Měly by se použít informace, např. z předchozích zkušeností s okružním testem nebo jiné údaje z minulosti, o tom, zda data mají přibližně normální distribuci. Ještě důležitější je homogenita rozptylu (homoskedasticita). Zkušenost ukazuje, že rozptyl se často zvyšuje s rostoucí střední hodnotou. V těchto případech je možno homoskedasticity dosáhnout transformací dat. Avšak taková transformace by měla být založena spíše na zkušenostech s předchozími daty než na datech právě zkoumaných. S homogenními daty se provádějí vícenásobné t-testy, jako je Williamsův test (α = 0,05, jednostranný) (24, 25) nebo v určitých případech Dunnettův test (26, 27). Nutno poznamenat, že v případě nerovnoměrného opakování musí být tabulkové t-hodnoty korigovány podle návrhu Dunnetta a Williamse. Někdy v důsledku velké odchylky nerostou/neklesají odezvy pravidelně. V případě takto velké odchylky od monotónnosti je vhodnější Dunnettův test. Jestliže existují odchylky od homoskedasticity, může být rozumné zkoumat možné účinky na hodnoty rozptylu blíže, aby se rozhodlo, zda může být aplikován t-test, aniž by se podstatně snížila vypovídací schopnost testu (28). Alternativně může být aplikován vícenásobný U-test, např. Bonferroniho-U-test podle Holma (29), nebo když tato data vykazují heteroskedasticitu, ale jinak jsou konzistentní se základním monotónním vztahem dávka-odezva, jiný neparametrický test [např. Jonckheere-Terpstrův (30, 31) nebo Shirleyův (32, 33)], a byla by mu obecně dávána přednost před t-testy s nerovností rozptylů (viz rovněž schéma v dodatku 7).
|
|
45.
|
Jestliže byla provedena limitní zkouška a podmínky pro použití parametrických testů jsou splněny (normálnost, homogenita), je možné použít párový Studentův t-test, v opačném případě pak neparametrický Mann-Whitneyův U-test (29).
|
Odhad ECx
|
46.
|
Při výpočtu jakékoli hodnoty ECx se pro regresní analýzu (lineární nebo nelineární) použijí střední hodnoty pro jednu expozici poté, co byla získána příslušná funkce dávka-odezva. Pro růst roupic jako kontinuální odezvu mohou být hodnoty ECx odhadnuty použitím vhodné regresní analýzy (35). Mezi vhodné funkce pro binární data (mortalita/přežití a počet zplozených potomků) patří normální sigmoidní, logistická nebo Weibullova funkce obsahující dva až čtyři parametry, z nichž některé mohou rovněž modelovat hormetické odezvy. Jestliže funkce dávka-odezva vyhovují lineární regresní analýze, tomu odpovídající r2 (koeficient determinace) a/nebo směrnice by měly být stanoveny prostřednictvím regresní analýzy před odhadem ECx, a to dosazením hodnoty odpovídající x % střední hodnoty kontroly do rovnice zjištěné regresní analýzou. Meze 95 % intervalu spolehlivosti se vypočítají podle Fiellera (citován ve Finney (21)) nebo jinými vhodnými moderními metodami.
|
|
47.
|
Alternativně se odpověď modeluje jako procentní část modelového parametru, který je interpretován jako střední hodnota odpovědi kontroly. V těchto případech je často možné výsledky snadno proložit normální (logistickou, Weibullovou) sigmoidní křivkou za použití probitového regresního postupu (21). V těchto případech musejí být váhové funkce nastaveny pro metrické odezvy, jak uvádí Christensen (36). Avšak jestliže byla pozorována hormeze, měla by se probitová analýza nahradit čtyřparametrickou logistickou nebo Weibullovou funkcí za použití nelineární regrese (36). Jestliže není možné data proložit vhodnou funkcí dávka-odezva, je možné použít alternativní metody pro odhad hodnoty ECx a jejího intervalu spolehlivosti, jako je metoda klouzavých průměrů podle Thompsona (22) a očištěná Spearman-Karberova metoda (23).
|
ZÁVĚREČNÁ ZPRÁVA
|
48.
|
Závěrečná zpráva musí obsahovat následující informace:
|
|
Zkoušená chemická látka:
|
—
|
fyzikální povaha a tam, kde je to podstatné, fyzikálně-chemické vlastnosti (např. rozpustnost ve vodě, tlak par),
|
|
—
|
chemická identifikace zkoušené chemické látky podle nomenklatury IUPAC, číslo CAS, šarže, dávka, strukturní vzorec a čistota,
|
|
—
|
datum konce použitelnosti vzorku.
|
|
|
|
Zkušební druh:
|
—
|
použití zkušební živočichové: druh, vědecký název, zdroj organismů a podmínky chovu.
|
|
|
|
Zkušební podmínky:
|
—
|
složky umělé půdy a její příprava,
|
|
—
|
metoda aplikace zkoušené chemické látky,
|
|
—
|
popis zkušebních podmínek, včetně teploty, obsahu vlhkosti, pH atd.,
|
|
—
|
úplný popis experimentálního uspořádání a postupů.
|
|
|
|
Výsledky zkoušky:
|
—
|
mortalita dospělých roupic po dvou týdnech a počet mláďat na konci orientační zkoušky,
|
|
—
|
mortalita dospělých roupic po třech týdnech expozice a úplný záznam mláďat na konci hlavní zkoušky,
|
|
—
|
jakékoli pozorované fyzikální nebo patologické symptomy a změny chování zkušebních organismů,
|
|
—
|
hodnoty LC50, NOEC anebo ECx (např. EC50, EC10) pro reprodukci, jestliže některé z nich jsou použitelné pro intervaly spolehlivosti, a graf proložené modelové křivky použité při jeho výpočtu, všechny informace a pozorování užitečné pro interpretaci výsledků.
|
|
Odchylky od postupů popsaných v této zkušební metodě a jakékoli neběžné jevy, které se vyskytly během zkoušky.
|
LITERATURA
|
1)
|
Römbke, J. (1989). Entwicklung eines Reproduktionstests an Bodenorganismen – Enchytraeen. Abschlußbericht des Battelle-Instituts e.V. Frankfurt für das Umweltbundesamt (Berlin), FE-Vorhaben 106 03 051/01.
|
|
2)
|
Römbke, J. and Moser, T. (1999). Organisation and Performance of an International Ringtest for the Validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, 150 + 223 pp.
|
|
3)
|
Westheide, W. and Bethge-Beilfuss, D. (1991). The sublethal enchytraeid test system: guidelines and some results, In: Modern Ecology: Basic and Applied Aspects. Ed. by Esser, G. and Overdieck, D. pp 497-508. Elsevier, Amsterdam.
|
|
4)
|
Dirven-Van Breemen, E., Baerselmann, R. and Notenboom, J. (1994). Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) in Bodemecotoxicologisch Onderzoek. RIVM Rapport Nr. 719102025. 46 pp.
|
|
5)
|
Kapitola C.8 této přílohy, Zkouška akutní toxicity pro žížaly.
|
|
6)
|
ISO (International Organization for Standardization) (1993). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 1: Determination of acute toxicity using Artificial Soil substrate, No. 11268-1. ISO, Geneve.
|
|
7)
|
ISO (International Organization for Standardization) (1996). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Geneve.
|
|
8)
|
Rundgren, S. and A.K. Augustsson (1998). Test on the enchytraeid Cognettia sphagnetorum (Vejdovsky 1877). In: Løkke, H. and C.A.M. Van Gestel, Handbook of soil invertebrate toxicity tests. John Wiley and Sons, Chichester, 73-94.
|
|
9)
|
Kasprzak, K. (1982). Review of enchytraeid community structure and function in agricultural ecosystems. Pedobiologia 23, 217-232.
|
|
10)
|
Römbke, J. (1995). Enchytraeen (Oligochaeta) als Bioindikator, UWSF – Z. Umweltchem. Ökotox. 7, 246-249.
|
|
11)
|
Dunger, W. and Fiedler, H.J. (1997). Methoden der Bodenbiologie. G. Fischer Verlag, Stuttgart, New York.
|
|
12)
|
Didden, W.A.M. (1993). Ecology of terrestrial Enchytraeidae. Pedobiologia 37, 2-29.
|
|
13)
|
Becker, H. (1991). Bodenorganismen – Prüfungskategorien der Forschung. UWSF – Z. Umweltchem. Ökotox. 3, 19-24.
|
|
14)
|
Römbke, J. and Federschmidt, A. (1995). Effects of the fungicide Carbendazim on Enchytraeidae in laboratory and field tests, Newsletter on Enchytraeidae 4, 79-96.
|
|
15)
|
Römbke, J., Riepert, F. & Achazi R. (2000): Enchytraeen als Testorganismen. In: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. & Eisentraeger, A. (eds.). Spektrum Verl., Heidelberg. 59-81.
|
|
16)
|
ISO (International Organization for Standardization) (1994). Soil Quality – Determination of pH, No. 10390. ISO, Geneve.
|
|
17)
|
Bell, A.W. (1958). The anatomy of Enchytraeus albidus, with a key to the species of the genus Enchytraeus. Ann. Mus. Novitat. 1902, 1-13.
|
|
18)
|
Nielsen, C.O. and Christensen, B. (1959). The Enchytraeidae, critical revision and taxonomy of European species. Natura Jutlandica 8-9, 1-160.
|
|
19)
|
Bouguenec, V. and Giani, N. (1987). Deux nouvelles especes d'Enchytraeus (Oligochaeta, Enchytraeidae) et rediscription d'E. bigeminus. Remarques sur le genre Enchytraeus. Ann. Limnol. 23, 9-22.
|
|
20)
|
Korinkova, J. and Sigmund, J. (1968). The colouring of bottom-fauna samples before sorting, Věstník Československé společnosti zoologické 32, 300-305.
|
|
21)
|
Finney, D.J. (1971). Probit Analysis (3rd ed.), pp. 19-76. Cambridge Univ. Press.
|
|
22)
|
Finney, D.J. (1978). Statistical Method in Biological Assay. – Charles Griffin & Company Ltd, London.
|
|
23)
|
Hamilton, M.A., R.C. Russo and R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714-719; Correction Environ. Sci. Technol. 12(1998), 417.
|
|
24)
|
Williams, D.A., (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
|
|
25)
|
Williams, D.A., (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519-531.
|
|
26)
|
Dunnett, C.W., (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
|
|
27)
|
Dunnett, C.W., (1964) New tables for multiple comparisons with a control. Biometrics 20, 482-491.
|
|
28)
|
Hoeven, N. van der, (1998). Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7: 355-361.
|
|
29)
|
Holm, S., (1979): A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
|
|
30)
|
Jonckheere, A. R. (1954); A Distribution-free k-Sample Test Against Ordered Alternatives, Biometrika 41, 133-145.
|
|
31)
|
Terpstra, T. J. (1952); The Asymptotic Normality and Consistency of Kendall's Test Against Trend, When Ties are Present in One Ranking, Indagationes Math. 14, 327-333.
|
|
32)
|
Shirley, E. A. (1979); The comparison of treatment to control group means in toxicology studies, Applied Statistics 28, 144-151.
|
|
33)
|
Williams, D.A. (1986); A Note on Shirley's Nonparametric Test for Comparing Several Dose Levels with a Zero-Dose Control, Biometrics 42, 183-186.
|
|
34)
|
Sokal, R.R. and F.J. Rohlf. (1981). Biometry. The Principle and practice of statistics in biological research. 2nd edition. W.H. Freeman and Company. New York.
|
|
35)
|
Christensen, E.R., (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18, 213-221.
|
|
36)
|
Van Ewijk, P.H. and J.A. Hoekstra. (1993). Calculation of the EC50 and its confidence interval when sub-toxic stimulus is present. Ecotox, Environ. Safety. 25, 25-32.
|
Dodatek 1
Definice
Pro účel této zkušební metody jsou platné následující definice:
|
|
Chemická látka je látka nebo směs.
|
|
|
ECx
(účinná koncentrace s x % účinkem) je koncentrace, která vyvolá x % účinek u zkušebních organismů během dané expoziční doby ve srovnání s kontrolou. Při této zkoušce jsou koncentrace vyvolávající účinek vyjádřeny jako hmotnost zkoušené chemické látky na hmotnost sušiny zkušební půdy.
|
|
|
LC0
(koncentrace bez letálního účinku) je koncentrace zkoušené chemické látky, která neusmrtí žádné exponované zkušební organismy během daného časového období. Při této zkoušce je LC0 vyjádřena jako hmotnost zkoušené chemické látky na hmotnost sušiny zkušební půdy.
|
|
|
LC50
(medián letální koncentrace) je koncentrace zkoušené chemické látky, která zahubí 50 % exponovaných zkušebních organismů během daného časového období. Při této zkoušce je LC50 vyjádřena jako hmotnost zkoušené chemické látky na hmotnost sušiny zkušební půdy.
|
|
|
LC100
(letální koncentrace) je koncentrace zkoušené chemické látky, která zahubí 100 % exponovaných zkušebních organismů během daného časového období. Při této zkoušce je LC100 vyjádřena jako hmotnost zkoušené chemické látky na hmotnost sušiny zkušební půdy.
|
|
|
Nejnižší koncentrace s pozorovaným účinkem (LOEC) je nejnižší koncentrace zkoušené chemické látky, která má statisticky významný účinek (p < 0,05). Při této zkoušce je LOEC vyjádřena jako hmotnost zkoušené chemické látky na hmotnost sušiny zkušební půdy. Všechny zkušební koncentrace vyšší než LOEC by obvykle měly vykazovat účinek, který je statisticky rozdílný od kontroly. Jakékoli odchylky z výše uvedeného v identifikaci LOEC musejí být zdůvodněny v závěrečné zprávě.
|
|
|
Koncentrace bez pozorovaných účinků (NOEC) je nejvyšší koncentrace zkoušené chemické látky bezprostředně nižší než LOEC, při které není pozorován žádný účinek. Při této zkoušce nemá koncentrace odpovídající NOEC žádný statisticky významný účinek (p < 0,05) během dané expoziční doby ve srovnání s kontrolou.
|
|
|
Rychlost reprodukce je střední hodnota počtu mladých roupic zplozených daným počtem dospělých jedinců během zkušebního období.
|
|
|
Zkoušená chemická látka je jakákoli látka nebo směs zkoušená použitím této zkušební metody.
|
Dodatek 2
Stanovení maximální retenční vodní kapacity
Stanovení retenční vodní kapacity umělé půdy
Následující metoda byla shledána vhodnou. Je popsána v příloze C normy ISO DIS 11268-2.
Odeberte stanovené množství (např. 5 g) zkušebního půdního substrátu použitím vhodného nástroje na odběr vzorku (spirálový trubkový vzorkovač atd.). Dno trubky se pokryje kusem filtračního papíru, trubka se naplní vodou a umístí na stojan ve vodní lázni. Trubka se postupně ponořuje, až je vodní hladina nad povrchem půdy. Pak se ponechá ve vodě přibližně tři hodiny. Jelikož ne všechna voda absorbovaná půdními kapilárami může být zadržena, měl by se vzorek půdy ponechat okapat dvě hodiny tak, že se trubka umístí na lůžko z velmi mokrého, jemně mletého křemenného písku v uzavřené nádobě (aby se zabránilo vysušení). Vzorek se pak zváží a vysuší do konstantní hmotnosti při 105 °C. Retenční vodní kapacita (RVK) se pak vypočítá podle následujícího vzorce:
Kde:
|
S
|
=
|
vodou nasycený substrát + hmotnost trubky + hmotnost filtračního papíru
|
|
T
|
=
|
tára (hmotnost trubky + hmotnost filtračního papíru)
|
|
D
|
=
|
hmotnost sušiny substrátu
|
LITERATURA:
ISO (International Organization for Standardization) (1996). Soil Quality -Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Geneve.
Dodatek 3
Stanovení pH půdy
Následující metoda stanovení pH vzorku půdy vychází z popisu v ISO 10390 (Kvalita půdy – Stanovení pH).
Definované množství půdy se vysuší při laboratorní teplotě po dobu alespoň 12 hodin. Suspenze půdy (obsahující alespoň 5 gramů půdy) se pak doplní do 5násobného objemu buď 1 M analyticky čistého chloridu draselného (KCl) nebo 0,01 M roztoku analyticky čistého chloridu vápenatého (CaCl2). Suspenze se pak důkladně třepe 5 minut. Po protřepání se suspenze ponechá usadit alespoň 2 hodiny, ale ne déle než 24 hodin. pH kapalné fáze se pak změří použitím pH-metru kalibrovaného před každým měřením pomocí vhodné řady roztoků pufrů (např. pH 4,0 a 7,0).
LITERATURA:
ISO (International Organization for Standardization) (1994). Soil Quality – Determination of pH, No. 10390. ISO, Geneve.
Dodatek 4
Kultivační podmínky Enchytraeus sp.
Roupicovití druhu Enchytraeus albidus (stejně jako jiné druhy Enchytraeus) mohou být kultivováni ve velkých plastových krabicích (např. 30 × 60 × 10 cm) naplněných 1:1 směsí umělé půdy a přírodní nekontaminované zahradní půdy. Nesmí se používat kompostovaný materiál, protože by mohl obsahovat toxické chemické látky, jakými jsou těžké kovy. Fauna se musí z půdy před použitím odstranit (např. hlubokozmrazením). Je rovněž možné použít substrát obsahující pouze umělou půdu, ale rychlost reprodukce může být nižší než v případě promíchaného půdního substrátu. Substrát použitý pro kultivaci by měl mít pH 6,0 ± 0,5.
Kultura se udržuje v temnu při teplotě 15 až 20 °C ± 2 °C. Teplota nesmí překročit 23 °C. Půda se musí udržovat vlhká, ale ne mokrá. Správný obsah vlhkosti půdy je indikován malými kapkami vody, které se objeví mezi prsty po lehkém stisknutí půdy. Je třeba zabránit vytvoření anaerobních podmínek tak, že zajistíme, aby kryty kontejnerů s kulturou umožňovaly dostatečnou výměnu plynů s atmosférou. Každý týden se půda musí opatrně rozrušit, aby bylo umožněno provzdušňování.
Roupice je možné krmit ovesnými vločkami. Ovesné vločky se uchovávají v utěsněných nádobách a před použitím by se měly zpracovat v autoklávu nebo zahřát, aby se zabránilo infikování moučnými roztoči (např. Glyzyphagus sp., Astigmata, Acarina) nebo dravými roztoči (např. Hypoaspis (Cosmolaelaps) miles, Gamasida, Acarina). Po zahřátí se krmivo umele, aby se dalo snadno rozsypat na půdní povrch. Občas se mohou ovesné vločky obohatit přidáním vitamínů, mléka a oleje z tresčích jater. Dalšími vhodnými krmnými zdroji jsou pekařské droždí a rybí krmivo ‚Tetramin‘.
Krmení se provádí přibližně dvakrát týdně. Vhodné množství ovesných vloček se rozsype na půdní povrch nebo opatrně zamíchá do substrátu při rozrušování půdy pro možné provzdušnění. Absolutní množství dodaného krmiva závisí na počtu roupic přítomných v substrátu. Jako vodítko, že množství krmiva je třeba zvýšit, může sloužit pozorování, že je všechno spotřebováno během jednoho dne od přidání. Naopak jestliže krmivo ještě zůstává na povrchu v čase druhého krmení (po týdnu), je třeba dávku snížit. Krmivo kontaminované plísněmi se musí odstranit a nahradit. Po třech měsících se červi přemístí do čerstvě připraveného substrátu.
Kultivační podmínky se považují za vyhovující, jestliže roupice: a) se nepokoušejí opustit půdní substrát, b) se pohybují rychle půdou, c) vykazují lesklý vnější povrch bez ulpívajících půdních částic, d) jejich zbarvení je více méně bělavé, e) vykazují rozmanitost rozmezí stáří v kulturách a f) kontinuálně se reprodukují.
Dodatek 5
Účinnost zkoušky s jinými druhy Enchytraeus
Výběr druhu
Je možné použít jiné druhy než E. albidus, ale postup zkoušky a kritéria platnosti se musí příslušně upravit. Mnoho druhů Enchytraeus je snadno k dispozici a mohou se vyhovujícím způsobem udržovat v laboratoři, proto je nejdůležitějším kritériem pro výběr druhu jiného než E. albidus ekologická významnost a srovnatelná citlivost. Pro výměnu druhů mohou rovněž existovat formální důvody. Například v zemích, kde se E. albidus nevyskytuje a není možné ho dovézt (např. z důvodů karanténních omezení), bude nezbytné použít jiný druh Enchytraeus.
Příklady vhodných alternativních druhů
|
—
|
Enchytraeus crypticus (Westheide a Graefe 1992): V nedávné době byl tento druh často používán v ekotoxikologických studiích z důvodu jednoduchosti jeho chovu a zkoušení. Tento druh je však malý a to činí nakládání s ním obtížnější ve srovnání s E. albidus (zejména ve stádiích před použitím barvící metody). U E. crypticus nebyl s určitostí zjištěn jeho výskyt na polích, který byl popsán pouze u kultur žížal. Jeho ekologické požadavky proto nejsou známé.
|
|
—
|
Enchytraeus buchholzi (Vejdovský 1879): Tento název pravděpodobně zahrnuje skupinu úzce příbuzných druhů, které se dají morfologicky obtížně rozlišit. Jeho použití pro zkoušení se nedoporučuje, dokud nebude možné jedince použité ve zkoušce identifikovat s jednotlivými druhy. E. buchholzi se obvykle nalézá na loukách a narušených místech, jako jsou okraje silnic.
|
|
—
|
Enchytraeus luxuriosus: Tento druh byl původně znám jako E. ‚minutus‘, ale nedávno byl popsán (1). Poprvé ho nalezl U. Graefe (Hamburk) na louce blízko St. Peter-Ording (Šlesvicko-Holštýnsko, Německo). E. luxuriosus má přibližně poloviční velikost ve srovnání s E. albidus, je ale větší než ostatní druhy zde probírané; to ho činí dobrou alternativou za E. albidus.
|
|
—
|
Enchytraeus bulbosus (Nielsen a Christensen 1963): Až doposud byl výskyt tohoto druhu popsán v německých a španělských minerálních půdách, kde je běžný, ale obvykle ne příliš hojný. Ve srovnání s ostatními malými druhy tohoto rodu se dá relativně snadno identifikovat. Nic není známo o jeho chování při laboratorních zkouškách nebo o jeho citlivosti na chemické látky. Bylo však zjištěno, že se dá snadno kultivovat (E. Belotti, soukromé sdělení).
|
Podmínky chovu
Všechny výše zmíněné druhy Enchytraeus mohou být kultivovány ve stejných substrátech jako E. albidus. Jejich menší velikost znamená, že kultivační nádoby mohou být menší a že při použití stejného krmiva se dávkování musí nastavit. Životní cyklus těchto druhů je kratší než u E. albidus a krmení se provádí častěji.
Zkušební podmínky
Zkušební podmínky jsou obecně stejné jako u E. albidus, s výjimkou, že:
|
—
|
velikost zkušební nádoby může (ale nemusí) být menší,
|
|
—
|
trvání zkoušky toxicity pro reprodukci může (ale nemusí) být kratší, tj. čtyři namísto šesti týdnů, avšak doba trvání orientační zkoušky by se neměla měnit,
|
|
—
|
s ohledem na malou velikost mláďat roupic se pro počítání důrazně doporučuje použití barvící metody,
|
|
—
|
kritérium platnosti vztahující se k ‚počtu mláďat na zkušební nádobu v kontrolním vzorku‘ se mění na ‚50‘.
|
LITERATURA
|
1)
|
Schmelz, R.M. and Collado, R. (1999). Enchytraeus luxuriosus sp.nov., a new terrestrial oligochaete species (Enchytraeidae, Clitellata, Annelida). Carolinea 57, 93-100.
|
Dodatek 6
Podrobný popis extrakčních technik
Barvení bengálskou červení
Tato metoda, původně vyvinutá v limnické ekologii (1), byla poprvé navržena W. de Coenem (Univerzita v Ghentu, Belgie) pro počítání mláďat při zkoušce toxicity pro reprodukci roupicovitých. Nezávisle vyvinul upravenou verzi (bengálská červeň smíchaná s formaldehydem místo s ethanolem) RIVM Bilthoven (2, 3).
Na konci hlavní zkoušky (tj. po šesti týdnech) se půda ze zkušebních nádob přemístí do mělké misky. Vhodné pro tento účel jsou třeba nádoby z bella-plastu nebo fotografické misky s žebrovaným dnem; fotomiska je vhodná, protože ‚žebra‘ omezují pohyb roupic v rámci pole pozorování. Mláďata jsou fixována etanolem (přibližně 5 ml na opakování). Do nádoby se pak přilije voda, až vznikne vrstva vysoká 1 až 2 cm. Přidá se několik kapek (200 až 300 μl) bengálské červeně (1 % roztok v ethanolu) (alternativně lze použít 0,5 % eozinové barvivo) a obě složky se opatrně promíchají. Po 12 hodinách by se roupice měly zbarvit do červena a bude možné je snadno spočítat, protože budou ležet na povrchu substrátu. Alternativně lze směs substrát/alkohol přecedit přes síto (velikost ok 0,250 mm) a pak roupice spočítat. Při použití tohoto postupu se kaolinit, rašelina a část písku vymyje a roupice zbarvené do červena bude možné snadno rozlišit a spočítat. Použití osvětlených čoček (velikost čočky alespoň 100 × 75 mm s příčným zvětšením 2 až 3) rovněž usnadní počítání.
Barvící technika zkracuje dobu počítání na několik minut na nádobu a zhruba řečeno je možné, aby jeden pracovník vyhodnotil všechny nádoby z jedné zkoušky maximálně za dva dny.
Mokrá extrakce
Mokrou extrakci je třeba začít ihned po ukončení zkoušky. Půda z každé zkušební nádoby se umístí do plastových sít s velikostí ok přibližně 1 mm. Síta se pak zavěsí do plastových mís, aniž by se dotýkala dna. Mísy se opatrně naplní vodou, až jsou vzorky v sítech úplně ponořeny. Aby byla zajištěna rychlost regenerace přítomných roupic vyšší než 90 %, musí se extrakce provádět 3 dny při 20 ± 2 °C. Na konci extrakce se síta vyjmou a voda (až na malé množství) se pomalu dekantuje; přitom se dbá na to, aby se nerozvířil sediment na dně misek. Plastové mísy se pak mírně protřepou, aby se sediment suspendoval v překrývající vodě. Voda se přelije do Petriho misek a po usazení půdních částic mohou být roupicovití identifikováni, vyjmuti a spočítáni použitím stereomikroskopu a měkké ocelové pinzety.
Flotace
Metoda založená na flotaci byla popsána v článku R. Kupermana (4). Obsahy zkušebních nádob se fixují ethanolem a půda se zaplaví přípravkem Ludox (AM-30 koloidní oxid křemičitý, 30 hm. % suspenze ve vodě) do výšky 10 až 15 mm nad povrch půdy. Po důkladném promíchání půdy s flotačním činidlem po dobu 2–3 minut se mohou mláďata roupic plovoucí na povrchu snadno spočítat.
LITERATURA
|
1)
|
Kořínková, J. and Sigmund, J. (1968). The colouring of bottom-fauna samples before sorting, Věstník Československé společnosti zoologické 32, 300-305.
|
|
2)
|
Dirven-Van Breemen, E., Baerselmann, R. and Notenboom, J. (1994). Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) in Bodemecotoxicologisch Onderzoek. RIVM Rapport Nr. 719102025. 46 pp.
|
|
3)
|
Posthuma, L., Baerselmann, R., Van Veen, R.P.M. and Dirven-Van Breemen, E.M. (1997). Single and joint toxic effects of copper and zinc on reproduction of Enchytraeus crypticus in relation to sorption of metals in soils. Ecotox. Envir. Safety 38, 108-121.
|
|
4)
|
Phillips, C.T., Checkai, R.T. and Kuperman, R.G. (1998). An alternative to the O'Connor Method for Extracting Enchytraeids from Soil. SETAC 19th Annual Meeting, Charlotte, USA. Abstract Book No. PMP069, p. 157.
|
Dodatek 7
Schéma statistického vyhodnocení dat (stanovení NOEC)
C.33. ZKOUŠKA TOXICITY PRO REPRODUKCI ŽÍŽAL (EISENIA FETIDA/EISENIA ANDREI)
ÚVOD
|
1.
|
Tato zkušební metoda je rovnocenná Pokynu OECD pro zkoušení 222 (2004). Je určena k použití pro zhodnocení účinků chemických látek v půdě na reprodukční schopnost (a další subletální cílové ukazatele) žížal druhu Eisenia fetida (Savigny 1826) nebo Eisenia andrei (Andre 1963) (1, 2). Zkouška byla testována v okružním testu (3). Existuje zkušební metoda pro zkoušku akutní toxicity pro žížaly (4). Byla publikována řada dalších mezinárodních a vnitrostátních pokynů pro zkoušky akutní a chronické toxicity (5, 6, 7, 8).
|
|
2.
|
Druhy Eisenia fetida / Eisenia andrei se považují za jedny z představitelů půdní fauny, a zejména žížal. Podkladové informace o ekologii žížal a jejich použití v ekotoxikologických zkouškách jsou k dispozici (7, 9, 10, 11, 12).
|
PODSTATA ZKOUŠKY
|
3.
|
Dospělé žížaly jsou vystaveny rozmezí koncentrací zkoušené chemické látky, která se buď přimíchá do půdy, nebo se v případě pesticidů aplikuje do půdy nebo na půdu postupy odpovídajícími způsobu použití chemické látky. Metoda aplikace je specifická pro daný účel zkoušky. Rozmezí zkušebních koncentrací se vybere tak, aby zahrnovalo koncentrace, které pravděpodobně povedou k subletálním a letálním účinkům během období osmi týdnů. Po 4 týdnech expozice se stanoví mortalita a účinky na růst dospělých žížal. Dospělí jedinci se poté z půdy odstraní a po dalších 4 týdnech se zhodnotí účinky na reprodukci spočítáním potomků přítomných v půdě. Reprodukční schopnost žížal vystavených zkoušené chemické látce se porovná s hodnotou kontrol(y), aby se stanovila i) koncentrace bez pozorovaných účinků (NOEC) a/nebo ii) ECx (např. EC10, EC50) pomocí regresního modelu k odhadnutí koncentrace, která by způsobila x % snížení reprodukční schopnosti. Hodnota ECx by se měla nacházet mezi zkušebními koncentracemi (např. EC10, EC50), aby hodnota ECx vycházela spíše z interpolace než extrapolace (definice viz dodatek 1).
|
INFORMACE O ZKOUŠENÉ CHEMICKÉ LÁTCE
|
4.
|
Aby bylo možno navrhnout vhodné zkušební postupy, měly by být k dispozici tyto informace o zkoušené chemické látce:
|
—
|
pokud možno informace o osudu a chování v životním prostředí (např. rychlost fotolýzy a rychlost hydrolýzy, pokud jsou relevantní pro způsoby aplikace).
|
|
|
5.
|
Tato zkušební metoda je použitelná pro všechny chemické látky bez ohledu na jejich rozpustnost ve vodě. Není použitelná pro těkavé chemické látky, které jsou zde definovány jako chemické látky, u nichž je hodnota Henryho konstanty nebo rozdělovacího koeficientu vzduch/voda větší než jedna, ani pro chemické látky s tlakem par přesahujícím 0,0133 Pa při teplotě 25 °C.
|
|
6.
|
V této zkušební metodě není zohledněn možný rozklad zkoušené chemické látky v průběhu zkoušky. Tudíž nelze předpokládat, že se expoziční koncentrace udrží na počátečních hodnotách po celou dobu zkoušky. V takovém případě se doporučuje provést na začátku a na konci zkoušky chemickou analýzu zkoušené chemické látky.
|
REFERENČNÍ CHEMICKÁ LÁTKA
|
7.
|
Musí se stanovit NOEC a/nebo ECx referenční chemické látky, aby se zajistilo, že jsou laboratorní zkušební podmínky přiměřené, a aby se ověřilo, zda se odezva zkušebních organismů v průběhu času statisticky nemění. Doporučuje se zkoušet referenční chemickou látku nejméně jednou ročně nebo – pokud se zkoušení provádí s menší četností – souběžně se stanovováním toxicity zkoušené látky. Vhodnými referenčními chemickými látkami, u nichž se prokázalo, že ovlivňují reprodukci, jsou karbendazim nebo benomyl (3). Významné účinky by měly být pozorovány v rozmezí a) 1 až 5 mg účinné složky (ú.s.) / kg sušiny nebo b) 250–500 g/ha nebo 25–50 mg/m2. Pokud je do série zkoušení zařazena pozitivní kontrola, měla by se použít jedna koncentrace a počet opakování by měl být stejný jako u kontrol.
|
PLATNOST ZKOUŠKY
|
8.
|
Aby se výsledek zkoušky mohl považovat za platný, měly by kontroly splňovat tato kritéria:
|
—
|
v každém opakování (obsahujícím 10 dospělých jedinců) se do konce zkoušky vyprodukuje ≥ 30 nedospělých jedinců,
|
|
—
|
variační koeficient reprodukce je ≤ 30 %,
|
|
—
|
mortalita dospělých jedinců během prvních 4 týdnů zkoušky je ≤10 %.
|
Pokud zkouška nesplní výše uvedená kritéria platnosti, měla by se ukončit. Případné pokračování ve zkoušce je nutné zdůvodnit. Odůvodnění by mělo být obsaženo v závěrečné zprávě.
|
POPIS ZKOUŠKY
Vybavení
|
9.
|
Měly by se použít zkušební nádoby ze skla nebo jiného chemicky inertního materiálu o objemu jeden až dva litry. Nádoby by měly mít průřez přibližně 200 cm2, aby se dosáhlo přibližně 5–6 cm hloubky vlhkého substrátu, když se přidá 500 až 600 g suché hmotnosti substrátu. Víko nádoby by mělo umožňovat výměnu plynů mezi substrátem a atmosférou a přístup světla (např. prostřednictvím děrovaného průhledného víka) a zároveň zabraňovat žížalám v úniku. Pokud množství použitého zkušebního substrátu výrazně převyšuje 500 až 600 g na zkušební nádobu, měl by se úměrně zvýšit počet žížal.
|
|
10.
|
Pro zkoušku je třeba normální laboratorní vybavení, konkrétně:
|
—
|
náležité vybavení pro regulaci teploty,
|
|
—
|
náležité vybavení pro regulaci vlhkosti (není nezbytné, pokud mají expoziční nádoby víka),
|
|
—
|
inkubátor nebo malá místnost s klimatizací,
|
|
—
|
pinzety, háčky nebo očka,
|
|
Příprava umělé půdy
|
11.
|
V této zkoušce se používá umělá půda (5, 7) následujícího složení (vychází se ze suchých hmotností získaných vysušením na konstantní hmotnost při teplotě 105 °C):
|
—
|
10 % sfagnové rašeliny (o hodnotě pH co nejvíce se blížící 5,5 až 6,0, bez viditelných zbytků rostlin, jemně mleté, vysušené na měřený obsah vlhkosti),
|
|
—
|
20 % kaolinitického jílu (obsah kaolinitu pokud možno více než 30 %),
|
|
—
|
0,3 až 1,0 % uhličitanu vápenatého (CaCO3, práškový, p.a.) k získání počátečního pH o hodnotě 6,0 ± 0,5,
|
|
—
|
70 % na vzduchu vysušeného křemenného písku (v závislosti na potřebném množství CaCO3), převážně jemný písek s více než 50 % částic o velikosti 50 až 200 mikrometrů.
|
Poznámka 1: Požadované množství CaCO3 bude záviset na složkách půdního substrátu včetně potravy a mělo by se stanovit pomocí měření dílčích půdních vzorků bezprostředně před zkouškou. Hodnota pH se měří ve smíšeném vzorku v 1 M roztoku chloridu draselného (KCl) nebo 0,01 M roztoku chloridu vápenatého (CaCl2) (13).
Poznámka 2: Obsah organického uhlíku v umělé půdě lze snížit, např. snížením obsahu rašeliny na 4–5 % a odpovídajícím zvýšením obsahu písku. Takovým snížením obsahu organického uhlíku lze snížit možnost adsorpce zkoušené chemické látky na půdu (organický uhlík) a zvýšit dostupnost zkoušené chemické látky pro žížaly. Bylo prokázáno, že Eisenia fetida může splnit kritéria platnosti pro reprodukci při testování v polních půdách s nižším obsahem organického uhlíku (např. 2,7 %) (14), a dle zkušeností toho lze dosáhnout i v umělé půdě s 5 % obsahem rašeliny. Proto není pro splnění kritérií platnosti zkoušky nutné před použitím takové půdy v hlavní zkoušce prokázat vhodnost umělé půdy, pokud nebyl obsah rašeliny snížen více, než je uvedeno výše.
Poznámka 3: Při použití přírodní půdy v dalších zkouškách (např. vyššího stupně) by se měla rovněž prokázat vhodnost půdy a splnění kritérií platnosti zkoušky.
|
|
12.
|
Suché složky půdy se důkladně promísí (např. ve velké laboratorní míchačce) v dobře větraném prostoru. Před zahájením zkoušky se suchá umělá půda zvlhčí přidáním dostatečného množství deionizované vody, aby se dosáhlo přibližně poloviny konečného obsahu vody, který činí 40 % až 60 % maximální retenční vodní kapacity (což odpovídá 50 ± 10 % vlhkosti sušiny). Vznikne substrát, který neobsahuje žádnou stojatou vodu a při stisknutí v dlani neuvolňuje vodu. Maximální retenční vodní kapacita (RVKmax) umělé půdy se stanoví v souladu s postupy popsanými v dodatku 2, normě ISO 11274 (15) nebo rovnocenné normě EU.
|
|
13.
|
Pokud se zkoušená chemická látka aplikuje na povrch půdy nebo se vmíchává do půdy bez vody, je možné přidat konečné množství vody do umělé půdy při její přípravě. Pokud se zkoušená chemická látka do půdy vmíchává s určitým množstvím vody, je možné doplňující objem vody přidat společně se zkoušenou chemickou látkou (viz odstavec 19).
|
|
14.
|
Obsah vlhkosti v půdě se stanoví na začátku a na konci zkoušky podle normy ISO 11465 (16) nebo rovnocenné normy EU a hodnota pH se stanoví podle dodatku 3 nebo normy ISO 10390 (13) nebo rovnocenné normy EU. Tato stanovení by se měla provádět ve vzorku kontrolní půdy a ve vzorcích půdy s každou zkušební koncentrací. Pokud se zkouší kyselé nebo zásadité chemické látky, nemělo by se pH půdy upravovat. Obsah vlhkosti by se měl v průběhu zkoušky kontrolovat pravidelným vážením nádob (viz odstavec 26 a 30).
|
Výběr a příprava zkušebních živočichů
|
15.
|
V této zkoušce se používá druh Eisenia fetida nebo Eisenia andrei (1, 2). K zahájení zkoušky jsou potřeba dospělé žížaly ve stáří dvou měsíců až jednoho roku a s opaskem. Žížaly by se měly vybrat ze synchronizované kultury s relativně homogenní věkovou strukturou (dodatek 4). Stáří jedinců ve zkušební skupině by se nemělo lišit o více než 4 týdny.
|
|
16.
|
Vybrané žížaly by se měly aklimatizovat alespoň po dobu jednoho dne v umělém půdním substrátu takového typu, který se použije ve zkoušce. Během tohoto období by se měly žížaly krmit stejnou potravou, jaká se bude používat ve zkoušce (viz odstavce 31 až 33).
|
|
17.
|
Na začátku zkoušky by se měly individuálně zvážit skupiny po 10 žížalách a náhodně přiřadit do zkušebních nádob. Před vážením se žížaly omyjí (deionizovanou vodou) a přebytečná voda se odstraní krátkým umístěním žížal na filtrační papír. Mokrá hmotnost jednotlivých žížal by se měla pohybovat mezi 250 a 600 mg.
|
Příprava zkušebních koncentrací
|
18.
|
Lze použít dvě metody aplikace zkoušené chemické látky: zamíchání zkoušené chemické látky do půdy (viz odstavce 19–21) nebo její aplikace na povrch půdy (viz odstavce 22–24). Výběr vhodné metody závisí na účelu zkoušky. Obecně se doporučuje zamíchání zkoušené chemické látky do půdy. Nicméně mohou být vyžadovány i aplikační postupy, které odpovídají běžné zemědělské praxi (např. nastříkání kapalné formy nebo použití speciálních forem pesticidů, jako jsou granule nebo moření semen). Rozpouštědla použitá k ošetření půdy zkoušenou chemickou látkou by se měla zvolit na základě jejich nízké toxicity pro žížaly a v uspořádání zkoušky musí být zahrnuta příslušná kontrola s rozpouštědlem (viz odstavec 27).
|
Zamíchání zkoušené chemické látky do půdy
Zkoušená chemická látka rozpustná ve vodě
|
19.
|
Bezprostředně před zahájením zkoušky se připraví roztok zkoušené chemické látky v deionizované vodě v množství dostačujícím pro všechna opakování jedné koncentrace. K usnadnění přípravy zkušebního roztoku může být nutné pomocné rozpouštědlo. Je praktické připravit si množství roztoku potřebné k dosažení konečného obsahu vlhkosti (40 až 60 % maximální retenční vodní kapacity). Před umístěním do zkušební nádoby se roztok důkladně smíchá s půdním substrátem.
|
Zkoušená chemická látka nerozpustná ve vodě
|
20.
|
Zkoušená chemická látka se rozpustí v malém objemu vhodného organického rozpouštědla (např. acetonu) a poté se nastříká na malé množství jemného křemenného písku nebo se s ním smísí. Poté se rozpouštědlo odstraní odpařováním v digestoři po dobu alespoň několika minut. Ošetřený písek se poté důkladně smísí s předem zvlhčenou umělou půdou. Následně se přidá a vmíchá deionizovaná voda (požadované množství), aby se dosáhlo konečného obsahu vlhkosti 40 až 60 % maximální retenční vodní kapacity. Poté je půda připravena k umístění do zkušebních nádob. Je třeba postupovat opatrně, neboť některá rozpouštědla mohou být pro žížaly toxická.
|
Zkoušená chemická látka nerozpustná ve vodě a organických rozpouštědlech
|
21.
|
Připraví se směs obsahující 10 g jemně mletého průmyslového křemenného písku s množstvím zkoušené chemické látky nutným k dosažení zkušební koncentrace v půdě. Směs se poté důkladně promísí s předem zvlhčenou umělou půdou. Následně se přidá a vmíchá deionizovaná voda v množství potřebném k dosažení konečného obsahu vlhkosti 40 až 60 % maximální retenční vodní kapacity. Pak je půda připravena k umístění do zkušebních nádob.
|
Aplikace zkoušené chemické látky na povrch půdy
|
22.
|
Půda se ošetří po přidání žížal. Zkušební nádoby se nejprve naplní zvlhčeným půdním substrátem a zvážené žížaly se umístí na povrch. Zdravé žížaly se obvykle okamžitě zavrtají do substrátu, tudíž všichni jedinci, kteří na povrchu zůstanou po 15 minutách, se považují za poškozené a musí se nahradit. Pokud se nějaké žížaly nahrazují, měli by se noví jedinci a nahrazovaní jedinci zvážit, aby byla na začátku zkoušky známa celková živá hmotnost exponované skupiny žížal a celková hmotnost nádoby se žížalami.
|
|
23.
|
Aplikuje se zkoušená chemická látka. Neměla by se do půdy přidávat dříve než za půl hodiny po umístění žížal (nebo pokud se žížaly nacházejí na povrchu půdy), aby se zabránilo přímé expozici zkoušené chemické látce kontaktem s kůží. Pokud je zkoušená chemická látka pesticid, může být vhodné aplikovat ji na povrch půdy postřikem. Zkoušená chemická látka by se měla aplikovat na povrch půdy co nejrovnoměrněji pomocí vhodného laboratorního nástroje na postřik, aby se simulovala aplikace postřikem na poli. Před aplikací by se mělo víko zkušební nádoby sejmout a nahradit vložkou, která chrání stěny nádoby před postřikem. Vložka může být vyrobena ze zkušební nádoby s odstraněným dnem. Aplikace by se měla provádět při teplotě pohybující se v rozmezí 20 ± 2 °C a u vodných roztoků, emulzí nebo disperzí při aplikační dávce vody v rozmezí 600 a 800 μl/m2. Dávka by se měla ověřit pomocí vhodné kalibrační techniky. Speciální formy, jako jsou granule nebo moření semen, by se měly aplikovat způsobem odpovídajícím zemědělskému použití.
|
|
24.
|
Zkušební nádoby by se měly nechat nezakryté po dobu jedné hodiny, aby se mohl případný těkavý roztok spojený s aplikací zkoušené chemické látky vypařit. Je třeba zajistit, aby během této doby neunikla ze zkušebních nádob žádná žížala.
|
POSTUP
Zkušební skupiny a kontroly
|
25.
|
Doporučuje se nasazovat 10 žížal na 500–600 g suché hmotnosti umělé půdy (tj. 50–60 g půdy na jednu žížalu). Pokud se použije větší množství půdy, například při zkouškách pesticidů se speciálním způsobem aplikace, jako je moření semen, měl by se udržet příděl 50–60 g půdy na jednu žížalu zvýšením počtu žížal. Pro každou kontrolní nádobu a nádobu s ošetřenou půdou se připraví deset žížal. Žížaly se omyjí vodou, otřou a poté se na krátkou dobu umístí na savý papír, aby se odvedla přebytečná voda.
|
|
26.
|
Aby při rozdělování žížal do zkušebních nádob nedošlo k systematickým chybám, měla by se stanovit homogenita populace individuálním zvážením 20 žížal vybraných náhodně z populace, ze které budou pocházet žížaly použité k provedení zkoušky. Po zajištění homogenity se vyberou skupiny žížal, zváží se a randomizací (tj. náhodně) se přidělí do jednotlivých zkušebních nádob. Po přidání pokusných žížal by se měla zvážit hmotnost každé zkušební nádoby, aby se získala hodnota počáteční hmotnosti, kterou lze použít jako výchozí bod pro sledování obsahu vlhkosti v půdě v průběhu zkoušky, jak je popsáno v odstavci 30. Zkušební nádoby se poté zakryjí způsobem popsaným v odstavci 9 a umístí se do zkušební komory.
|
|
27.
|
Pro každou z metod aplikace zkoušené chemické látky popsaných v odstavci 18 až 24 se připraví odpovídající kontroly. Při přípravě kontrol se dodržují příslušné popsané postupy, pouze se nepřidá zkoušená chemická látka. V odpovídajících případech se tedy aplikují organická rozpouštědla, křemenný písek či jiné nosiče i na kontroly v koncentracích/množstvích odpovídajících těm, které byly použity k ošetření půdy. Pokud se ke zkoušené chemické látce přidává rozpouštědlo nebo jiný nosič, měla by se rovněž připravit a otestovat další kontrola bez nosiče či zkoušené chemické látky, aby se zajistilo, že nosič nemá na žádný vliv výsledek.
|
Zkušební podmínky
|
28.
|
Zkušební teplota je 20 ± 2 °C. Zkouška se provádí při řízených cyklech osvětlení-tmy (pokud možno 16 hodin světlo a 8 hodin tma) s intenzitou osvětlení v místě se zkušebními nádobami o hodnotě 400 až 800 luxů.
|
|
29.
|
Zkušební nádoby se během zkoušky neprovzdušňují, ale konstrukce vík zkušebních nádob by měla umožňovat výměnu plynů a zároveň omezovat vypařování vlhkosti (viz odstavec 9).
|
|
30.
|
Obsah vody v půdním substrátu ve zkušebních nádobách se během zkoušky udržuje a sleduje opakovaným pravidelným vážením zkušebních nádob (bez vík). Vodní ztráty se doplní dle potřeby deionizovanou vodou. Obsah vody by se neměl lišit o více než 10 % od hodnoty na začátku zkoušky.
|
Krmení
|
31.
|
Za přijatelnou se považuje jakákoli potrava o takové kvalitě, která je prokazatelně vhodná alespoň k udržení hmotnosti žížal během zkoušky. Zkušenosti ukázaly, že vhodnou potravou jsou ovesné vločky a kravský či koňský hnůj. Je třeba provádět kontroly zajišťující, že krávy či koně, od kterých se hnůj získává, nejsou léčeni či ošetřováni chemickými látkami, například látkami podporujícími růst, nematocidy či podobnými veterinárními přípravky, které by mohly žížaly během zkoušky nepříznivě ovlivnit. Doporučuje se používat osobně odebraný kravský hnůj, neboť zkušenosti ukázaly, že komerčně dostupný kravský hnůj používaný jako zahradní hnojivo může mít na žížaly nežádoucí účinky. Hnůj by se měl před použitím nechat vyschnout na vzduchu, jemně rozemlít a pasterizovat.
|
|
32.
|
Každá čerstvá dávka potravy by se měla před použitím ve zkoušce podat netestované kultuře žížal, aby se ověřilo, že je vhodné kvality. Růst a tvorba zámotků by se neměla snížit v porovnání s žížalami chovanými v substrátu, který neobsahuje novou dávku potravy (podmínky popsané ve zkušební metodě C.8(4)).
|
|
33.
|
Potrava se poprvé podá jeden den po přidání žížal a aplikaci zkoušené chemické látky do půdy. Přibližně 5 g potravy se rozptýlí na povrch půdy v každé nádobě a zvlhčí se deionizovanou vodou (asi 5 až 6 ml na jednu nádobu). Poté se potrava podává jednou týdně během 4týdenního zkušebního období. Pokud není veškerá potrava zkonzumována, měla by se její porce zmenšit, aby nedošlo k růstu hub nebo zplesnivění. 28. den zkoušky se z půdy odeberou dospělí jedinci. Poté se do každé zkušební nádoby přidá dalších 5 g potravy. Během zbývajících 4 týdnů zkoušky se již neprovádí žádné další krmení.
|
Výběr zkušebních koncentrací
|
34.
|
Při výběru vhodných zkušebních koncentrací by měly pomoci předchozí znalosti toxicity zkoušené chemické látky, např. ze zkoušky akutní toxicity (4) a/nebo z orientačních studií. Pokud je to nutné, provede se orientační zkouška, např. s pěti zkušebními koncentracemi 0,1, 1,0, 10, 100 a 1 000 mg/kg (suché hmotnosti půdy). Jedno opakování pro každé ošetření zkoušenou látkou a kontrolu je dostačující. Orientační zkouška trvá dva týdny a na jejím konci se vyhodnotí mortalita.
|
Experimentální uspořádání
|
35.
|
I když pro tuto zkoušku nelze předepsat jednoduchou souhrnnou statistiku, umožňuje tato metoda stanovení hodnoty NOEC a ECx. Hodnota NOEC bude pravděpodobně vyžadována regulačními orgány v dohledné budoucnosti. V důsledku statistických a ekologických úvah může v blízké budoucnosti dojít k více rozšířenému používání hodnoty ECx Proto jsou navržena tři uspořádání, a to na základě doporučení vycházejících z okružního testu zkušební metody reprodukce roupic (17).
|
|
36.
|
Při volbě rozsahu koncentrací by měly být zohledněny tyto zásady:
|
—
|
Ke stanovení hodnoty NOEC by se mělo testovat alespoň pět/dvanáct koncentrací v geometrických posloupnostech. Doporučuje se použít čtyři opakování pro každé ošetření zkoušenou látkou a osm kontrol. Při odstupňování koncentrací by se měl použít faktor, který nepřevyšuje 2,0.
|
|
—
|
Ke stanovení hodnoty ECx (např. EC10, EC50) se doporučuje použít dostačující počet koncentrací, aby vedl k alespoň čtyřem statisticky významným různým průměrným odezvám při těchto koncentracích. Doporučuje se použít alespoň dvě opakování pro každou zkušební koncentraci a šest kontrolních opakování. Koeficient odstupňování koncentrací se může měnit, tj. faktor může být ≤ 1,8 v očekávaném rozsahu účinku a > 1,8 při vyšších nebo nižších koncentracích.
|
|
—
|
Stanovit jak hodnotu NOEC, tak ECx umožňuje kombinovaný přístup. Mělo by se použít osm zkušebních koncentrací v geometrické posloupnosti. Doporučuje se použít čtyři opakování pro každou zkušební koncentraci a osm kontrol. Při odstupňování koncentrací by se měl použít faktor nepřevyšující 1,8.
|
|
Délka zkoušky a měření
|
37.
|
28. den se provede pozorování živých dospělých žížal a spočítají se. Rovněž se zaznamená jakékoli neobvyklé chování (např. neschopnost zavrtat se do půdy; nehybně ležící jedinci) a morfologické změny (např. otevřené rány). Všechny dospělé žížaly se poté odeberou ze zkušebních nádob a zváží se. Vyhledávání dospělých jedinců může usnadnit přemístění půdy se žížalami na čistý tác před hodnocením. Žížaly odebrané z půdy by se měly před vážením omýt (deionizovanou vodou) a přebytečná voda odstranit krátkým umístěním žížal na filtrační papír. Všechny žížaly, které v tuto dobu nebudou nalezeny, se zaznamenají jako uhynulé, neboť se předpokládá, že takové žížaly uhynuly a rozložily se ještě před hodnocením.
|
|
38.
|
Pokud se půda přemisťovala z nádob, vrátí se zpět (bez dospělých žížal, ale se zámotky, které vytvořily). Poté se půda inkubuje po další čtyři týdny za stejných zkušebních podmínek s jedinou výjimkou, že krmení proběhne pouze jednou, na začátku této fáze zkoušky (viz odstavec 33).
|
|
39.
|
Na konci druhého 4týdenního období se pomocí postupů popsaných v dodatku 5 určí počet nedospělých jedinců, kteří se vylíhli ze zámotků ve zkušební půdě, a počet zámotků. Během celého období zkoušky by se měly rovněž zaznamenávat všechny známky poranění či poškození žížal.
|
Limitní zkouška
|
40.
|
Pokud při nejvyšší koncentraci v orientační zkoušce (tj. 1 000 mg/kg) nejsou pozorovány žádné účinky, provede se zkouška reprodukce jako limitní zkouška s použitím zkušební koncentrace 1 000 mg/kg. Limitní zkouška umožní prokázat, že hodnota NOEC pro reprodukci je větší než limitní koncentrace, a zároveň se minimalizuje počet žížal použitých ve zkoušce. Mělo by se použít osm opakování jak pro půdu ošetřenou zkoušenou chemickou látkou, tak pro kontrolu.
|
ÚDAJE A PŘEDKLÁDÁNÍ ZPRÁV
Zpracování výsledků
|
41.
|
Přestože v dodatku 6 je uveden přehled statistických metod, nejsou u této zkušební metody uvedeny žádné závazné pokyny pro statistickou analýzu výsledků zkoušky.
|
|
42.
|
Základním cílovým ukazatelem je mortalita. Měly by se však zaznamenat také změny chování (např. neschopnost zavrtat se do půdy; nehybně ležící jedinci nalepení na skleněnou stěnu nádoby) a morfologické změny (např. otevřené rány) dospělých žížal a rovněž přítomnost nedospělých jedinců. Ke stanovení hodnoty LC50 se obvykle používá probitová analýza (18) nebo logistická regrese. Nicméně v případech, kdy je tato metoda analýzy nevhodná (např. jsou k dispozici méně než tři koncentrace s usmrcením pouze části skupiny), lze použít alternativní metody. Mezi tyto metody by mohly patřit klouzavé průměry (19), upravená Spearman-Karberova metoda (20) nebo jednoduchá interpolace (např. geometrický průměr LC0 a LC100 vypočítaný jako druhá odmocnina součinu LC0 a LC100).
|
|
43.
|
Dalším cílovým ukazatelem je plodnost (např. počet vyprodukovaných nedospělých jedinců). V závěrečné zprávě by se však měly zaznamenat i všechny ostatní známky poškození, stejně jako u orientační zkoušky. V rámci statistické analýzy se spočítá aritmetický průměr

a směrodatná odchylka u každého ošetření zkoušenou látkou a každé kontroly. |
|
44.
|
Pokud byla provedena analýza rozptylu, je možné nahradit směrodatnou odchylku s a stupně volnosti df odhadem sdruženého rozptylu získaným z ANOVA a jeho stupni volnosti – za předpokladu, že rozptyl nezávisí na koncentraci. V takovém případě použijte jednotlivé rozptyly kontrol a ošetření. Tyto hodnoty se obvykle spočítají pomocí běžně dostupného statistického softwaru, přičemž výsledky pro jednotlivé nádoby se považují za opakování. Pokud se sdružení dat pro negativní kontrolu a kontrolu s rozpouštědlem jeví jako rozumnější než testování oproti jedné z nich, mělo by se otestovat, zda se významně neliší (k určení vhodného testu nahlédněte do odstavce 47 a dodatku 6).
|
|
45.
|
Další statistické testy a závěry závisí na tom, zda mají hodnoty opakování normální rozdělení a jsou homogenní, co se týká jejich rozptylu.
|
Odhad hodnoty NOEC
|
46.
|
Mělo by se upřednostnit použití výkonných testů. Je třeba použít informace např. z předchozích zkušeností s okružním testováním či jiná historická data ke zjištění, zda mají data přibližně normální distribuci. Ještě důležitější je homogenita rozptylu (homoskedasticita). Zkušenosti ukazují, že rozptyl se často zvětšuje s rostoucí střední hodnotou. V těchto případech je možno homoskedasticity dosáhnout transformací dat. Taková transformace by však měla vycházet spíše ze zkušeností s historickými daty než ze zkoumaných dat. U homogenních dat by se měly provést mnohonásobné t-testy, jako je Williamsův test (α = 0,05, jednostranný) (21, 22) nebo v určitých případech Dunnettův test (23, 24). Je třeba upozornit, že v případě nerovného počtu opakování se musí tabulkové t-hodnoty korigovat způsobem navrženým Dunnettem a Williamsem. Odezvy někdy v důsledku velkého rozptylu nevzrůstají/neklesají pravidelně. V případě silné odchylky od monotónnosti je vhodnější Dunnetův test. Existují-li odchylky od homoskedasticity, může být rozumné důkladněji prozkoumat možný dopad na rozptyly, aby bylo možno rozhodnout, zda lze t-testy použít, aniž by se podstatně snížila vypovídací schopnost testu (25). Jinak lze použít mnohonásobný U-test, např. Bonferroniho U-test podle Holma (26), nebo pokud tato data vykazují heteroskedasticitu, avšak jinak jsou v souladu se základním monotónním vztahem mezi dávkou a odezvou, lze použít jiný neparametrický test (např. Jonckheere-Terpstrův (27)(28) nebo Shirleyův (29) (30)) a obecně by se v takovém případě upřednostňoval před t-testy upravené pro nerovnost rozptylů. (viz také schéma v dodatku 6).
|
|
47.
|
Pokud byla provedena limitní zkouška a jsou splněny nezbytné předpoklady pro použití parametrických testů (normálnost, homogenita), lze použít párový Studentův t-test, v opačném případě pak neparametrický Mann-Whitneyův U-test (31).
|
Odhad hodnoty ECx
|
48.
|
Pro výpočet hodnoty ECx se poté, co byla získána vhodná funkce závislosti odezvy na dávce, použijí k regresní analýze střední hodnoty pro každé ošetření zkoušenou látkou (lineární nebo nelineární). Pro růst žížal jakožto spojitou proměnnou odezvy lze hodnoty ECx odhadnout pomocí vhodné regresní analýzy. Mezi funkce vhodné pro binární data (mortalita/přežití) a počet vyprodukovaných potomků patří normální sigmoidní, logistická nebo Weibullova funkce obsahující dva nebo čtyři parametry, z nichž některé mohou modelovat rovněž hormetické odezvy. Pokud byla funkce závislosti odezvy na dávce proložena pomocí lineární regresní analýzy, měl by se před odhadnutím hodnoty ECx pomocí regresní analýzy zjistit významný r2 (koeficient determinace) a/nebo směrnice vložením hodnoty odpovídající x % střední hodnoty kontroly do rovnice zjištěné při regresní analýze. 95 % intervaly spolehlivosti se vypočítají podle Fiellera (citováno v práci Finneye (18)) nebo jinými vhodnými moderními metodami.
|
|
49.
|
Jinou možností je modelovat účinek jako procento nebo podíl modelového parametru, který je interpretován jako průměrný účinek u kontroly. V těchto případech lze výsledky snadno proložit normální (logistickou, Weibullovu) sigmoidní křivkou pomocí probitové regrese (18). V těchto případech je nutné upravit váženou funkci pro metrické odezvy, jak uvádí Christensen (33). Pokud však byla pozorována hormeze, měla by se probitová analýza nahradit čtyřparametrickou logistickou nebo Weibullovou funkcí proloženou pomocí nelineární regrese (34). Pokud data nelze proložit vhodnou funkcí závislosti odezvy na dávce, je možné použít k odhadu hodnoty ECx a jejích mezí spolehlivosti jiné metody, např. klouzavé průměry dle Thompsona (19) a upravený Spearman-Kärberův postup (20).
|
ZÁVĚREČNÁ ZPRÁVA
|
50.
|
Závěrečná zpráva musí obsahovat tyto údaje:
|
|
Zkoušená chemická látka:
|
—
|
úplný popis zkoušené chemické látky, šarže, dávka a číslo CAS, čistota,
|
|
—
|
vlastnosti zkoušené chemické látky (např. log Kow, rozpustnost ve vodě, tlak par, Henryho konstanta (H) a informace o jejím osudu a chování).
|
|
|
|
Zkušební organismy:
|
—
|
použité zkušební organismy: druh, vědecký název, zdroj organismů a podmínky chovu,
|
|
—
|
věk, rozmezí velikosti (hmotnosti) zkušebních organismů.
|
|
|
|
Zkušební podmínky
|
—
|
podrobné údaje o přípravě zkušební půdy,
|
|
—
|
maximální retenční vodní kapacita půdy,
|
|
—
|
popis techniky použité k aplikaci zkoušené chemické látky do půdy,
|
|
—
|
podrobné údaje o pomocných chemických látkách použitých k aplikaci zkoušené chemické látky,
|
|
—
|
kalibrační údaje o zařízení použitém k postřiku, je-li to vhodné,
|
|
—
|
popis experimentálního uspořádání a postupu,
|
|
—
|
velikost zkušebních nádob a objem zkušební půdy,
|
|
—
|
zkušební podmínky: intenzita osvětlení, doba trvání cyklů světla-tmy, teplota,
|
|
—
|
popis krmného režimu, typ a množství potravy použité ve zkoušce, data krmení,
|
|
—
|
pH půdy a obsah vody v půdě na začátku a na konci zkoušky.
|
|
|
|
Výsledky zkoušky:
|
—
|
mortalita dospělých jedinců ( %) v každé zkušební nádobě na konci prvních 4 týdnů zkoušky,
|
|
—
|
celková hmotnost dospělých jedinců na začátku zkoušky v každé zkušební nádobě,
|
|
—
|
změny tělesné hmotnosti živých dospělých jedinců ( % původní hmotnosti) v každé zkušební nádobě po prvních čtyřech týdnech zkoušky,
|
|
—
|
počet nedospělých jedinců vyprodukovaných v každé zkušební nádobě na konci zkoušky,
|
|
—
|
popis zjevných patologických příznaků či zřetelných změn chování,
|
|
—
|
výsledky získané s referenční zkoušenou chemickou látkou,
|
|
—
|
hodnoty LC50, NOEC a/nebo ECx (např. EC50, EC10) pro reprodukci, pokud jsou některé z nich vhodné, s intervaly spolehlivosti a grafem příslušného modelu použitého pro jejich výpočet, všechny informace a pozorování užitečné pro interpretaci výsledků,
|
|
—
|
graf vztahu mezi dávkou a odezvou,
|
|
—
|
výsledky pro každou zkušební nádobu.
|
|
Odchylky od postupů popsaných v této zkušební metodě a jakékoli neobvyklé jevy, které se vyskytly během zkoušky.
|
LITERATURA
|
1)
|
Jaenicke, J. (1982). 'Eisenia foetida' is two biological species. Megadrilogica 4, 6-8.
|
|
2)
|
Oien, N. and J. Stenerson (1984). Esterases of earthworm – III. Electrophoresis reveals that Eisenia foetida (Savigny) is two species. Comp. Biochem. Physiol. 78c (2), 277 – 282.
|
|
3)
|
Kula, C. (1996). Development of a test method on sublethal effects of pesticides on the earthworm species Eisenia fetida/Eisenia andrei – comparison of two ringtests. In: Riepert, F., Kula, C. (1996): Development of laboratory methods for testing effects of chemicals and pesticides on collembola and earthworms. Mitt. Biol. Bundesamst. f. Land- Forstwirtsch. Berlin-Dahlem, 320, p. 50-82.
|
|
4)
|
Kapitola C.8 této přílohy, Zkouška akutní toxicity pro žížaly.
|
|
5)
|
ISO (International Organization for Standardization) (1996). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No.11268-2. ISO, Geneve.
|
|
6)
|
ISO (International Organization for Standardization) (1993). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 1: Determination of acute toxicity using artificial soil substrate, No.11268-1. ISO, Geneve.
|
|
7)
|
SETAC (1998). Advances in Earthworm Ecotoxicology. Sheppard, S.C., Bembridge, J.D., Holmstrup, M., and L. Posthuma, (eds). SETAC Press, 456 pp.
|
|
8)
|
EPA (1996). Ecological effects test guidelines. Earthworm Subchronic Toxicity Test (850.62.00). United States Environmental Protection Agency. Office of Prevention, Pesticides and Toxic Substances. EPA712-C-96-167, April 1996.
|
|
9)
|
Bouché, M.B. (1972). Lombriciens de France, Ecologie et systématique. Publication de l'Institut National de la Recherche Agronomique.
|
|
10)
|
Edwards, C.A. (1983). Development of a standardized laboratory method for assessing the toxicity of chemical substances to earthworms. Report EUR 8714 EN, Commission of European Communities.
|
|
11)
|
Greig-Smith, P.W., H. Becker, P.J. Edwards and F. Heimbach (eds.) (1992). Ecotoxicology of Earthworms. Intercept.
|
|
12)
|
Edwards, C.A. and J. P. Bohlen, (1996). Biology and ecology of Earthworms, 3rd Edition. Chapman and Hall, London.
|
|
13)
|
(ISO (International Organization for Standardization) (1994). Soil Quality – Determination of pH, No. 10390. ISO, Geneve.
|
|
14)
|
Hund-Rinke, K, Römbke, J., Riepert, F. & Achazi R. (2000): Beurteilung der Lebensraumfunktion von Böden mit Hilfe von Regenwurmtests. In: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. & Eisentraeger, A. (eds.). Spektrum Verl., Heidelberg. 59-81.
|
|
15)
|
ISO (International Organization for Standardization) (1992). Soil Quality –Determination of water retention characteristics –Laboratory methods, No. 11274. ISO, Geneve.
|
|
16)
|
ISO (International Organization for Standardization) (1993). Soil Quality –Determination of dry matter and water content on a mass basis – Gravimetric method, No. 11465. ISO, Geneve.
|
|
17)
|
Römbke, J. and Th. Moser (1999). Organisation and Performance of an International Ringtest for the validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, 150+ 223 pp.
|
|
18)
|
Finney, D.J. (1971). Probit Analysis (3rd ed.), pp. 19-76. Cambridge Univ. Press.
|
|
19)
|
Finney, D.J. (1978). Statistical Method in Biological Assay. – Charles Griffin & Company Ltd, London.
|
|
20)
|
Hamilton, M.A., R.C. Russo and R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Microbiol. Tecn. Technol. 11(7), 714-719; Correction Environ. Tecn. Technol. 12(1998), 417.
|
|
21)
|
Williams, D.A., (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
|
|
22)
|
Williams, D.A., (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519-531.
|
|
23)
|
Dunnett, C.W., (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
|
|
24)
|
Dunnett, C.W., (1964) New tables for multiple comparisons with a control. Biometrics 20, 482-491.
|
|
25)
|
Hoeven, N. van der, (1998). Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7: 355-361.
|
|
26)
|
Holm, S., (1979): A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
|
|
27)
|
Jonckheere, A. R. (1954); A Distribution-free k-Sample Test Against Ordered Alternatives, Biometrika 41, 133-145.
|
|
28)
|
Terpstra, T. J. (1952); The Asymptotic Normality and Consistency of Kendall's Test Against Trend, When Ties are Present in One Ranking, Indagationes Math. 14, 327-333.
|
|
29)
|
Shirley, E. A. (1979); The comparison of treatment to control group means in toxicology studies, Applied Statistics 28, 144-151.
|
|
30)
|
Williams, D.A. (1986); A Note on Shirley's Nonparametric Test for Comparing Several Dose Levels with a Zero-Dose Control, Biometrics 42, 183-186.
|
|
31)
|
Sokal, R.R. and F.J. Rohlf. (1981). Biometry. The Principle and practice of statistics in biological research. 2nd edition. W.H. Freeman and Company. New York.
|
|
32)
|
Bruce R.D. and Versteeg D.J. (1992) A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry 11:1485-1494.
|
|
33)
|
Christensen, E.R., (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18, 213-221.
|
|
34)
|
Van Ewijk, P.H. and J.A. Hoekstra. (1993). Calculation of the EC50 and its confidence interval when sub-toxic stimulus is present. Ecotox, Environ. Safety. 25, 25-32.
|
Dodatek 1
Definice
V rámci této zkušební metody se používají následující definice:
|
|
Chemická látka je látka nebo směs.
|
|
|
ECx
(účinná koncentrace s x % účinkem) je koncentrace, která má x % účinek na zkušební organismus během daného období expozice v porovnání s kontrolou. Například EC50 je koncentrace, u níž se odhaduje, že povede k účinku na testovaný cílový ukazatel u 50 % exponované populace během definovaného období expozice. V této zkoušce jsou účinné koncentrace vyjádřeny jako hmotnost zkoušené chemické látky na suchou hmotnost zkušební půdy nebo jako hmotnost zkoušené chemické látky na jednotku plochy půdy.
|
|
|
LC0
(koncentrace bez letálního účinku) je koncentrace zkoušené chemické látky, která neusmrtí žádný z exponovaných zkušebních organismů během daného období. V této zkoušce je LC0 vyjádřena jako hmotnost zkoušené chemické látky na suchou hmotnost zkušební půdy.
|
|
|
LC50
(medián letální koncentrace) je koncentrace zkoušené chemické látky, která usmrtí 50 % exponovaných zkušebních organismů během daného období. V této zkoušce je LC50 vyjádřena jako hmotnost zkoušené chemické látky na suchou hmotnost zkušební půdy nebo jako hmotnost zkoušené chemické látky na jednotku plochy půdy.
|
|
|
LC100
(letální koncentrace) je koncentrace zkoušené chemické látky, která usmrtí 100 % exponovaných zkušebních organismů během daného období. V této zkoušce je LC100 vyjádřena jako hmotnost zkoušené chemické látky na suchou hmotnost zkušební půdy.
|
|
|
Nejnižší koncentrace s pozorovaným účinkem (LOEC) je nejnižší koncentrace zkoušené chemické látky, který má statisticky významný účinek (p < 0,05). V této zkoušce je LOEC vyjádřena jako hmotnost zkoušené chemické látky na suchou hmotnost zkušební půdy nebo jako hmotnost zkoušené chemické látky na jednotku plochy půdy. Všechny zkušební koncentrace vyšší než LOEC by měly obvykle vykazovat účinek, který je statisticky odlišný od kontroly. Jakékoli odchylky od výše uvedeného musí být zdůvodněny v závěrečné zprávě.
|
|
|
Koncentrace bez pozorovaných účinků (NOEC) je nejvyšší koncentrace zkoušené chemické látky hned pod LOEC, při níž nejsou pozorovány žádné účinky. V této zkoušce nemá koncentrace odpovídající NOEC žádný statisticky významný účinek (p < 0,05) během daného období expozice v porovnání s kontrolou.
|
|
|
Míra reprodukce: Průměrný počet nedospělých jedinců vyprodukovaných na počet dospělých jedinců během období zkoušky.
|
|
|
Zkoušená chemická látka je jakákoli látka nebo směs zkoušená pomocí této zkušební metody.
|
Dodatek 2
Stanovení maximální retenční vodní kapacity půdy
Zjistilo se, že vhodnou metodou pro stanovení maximální retenční vodní kapacity je následující metoda. Je popsána v příloze C normy ISO DIS 11268-2 (1).
Odeberte stanovené množství (např. 5 g) zkušebního půdního substrátu pomocí vhodného nástroje na odběr vzorků (spirálový trubkový vzorkovač atd.). Zakryjte spodek trubky kouskem filtračního papíru, naplňte ji vodou a poté ji umístěte na stojan ve vodní lázni. Trubka by se měla postupně nořit pod hladinu, až se hladina vody dostane nad povrch půdy. Poté by se měla nechat ve vodě asi tři hodiny. Protože půda nemůže udržet veškerou vodu absorbovanou půdními kapilárami, je třeba nechat půdní vzorek po dobu dvou hodin odkapat umístěním trubky na vrstvu velmi vlhkého jemně mletého křemenného písku v zakryté nádobě (aby se zabránilo vysychání). Poté by se měl vzorek zvážit, vysušit na konstantní hmotnost při teplotě 105 °C. Retenční vodní kapacita (RVK) se poté vypočítá takto:
Kde:
|
S
|
=
|
vodou nasycený substrát + hmotnost trubky + hmotnost filtračního papíru
|
|
T
|
=
|
tára (hmotnost trubky + hmotnost filtračního papíru)
|
|
D
|
=
|
hmotnost suchého substrátu
|
LITERATURA:
|
1)
|
ISO (International Organization for Standardisation ) (1996). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No.11268-2. ISO, Geneve.
|
Dodatek 3
Stanovení pH půdy
Následující metoda stanovení pH půdy vychází z popisu uvedeného v normě ISO DIS 10390: Kvalita půdy – Stanovení pH (1).
Definované množství půdy se nechá schnout při pokojové teplotě po dobu alespoň 12 hodin. Poté se připraví suspenze půdy (obsahující alespoň 5 gramů půdy) buď v 1 M roztoku chloridu draselného p.a. (KCl), nebo v 0,01 M roztoku chloridu vápenatého p.a. (CaCl2) o objemu rovnajícímu se pětinásobku objemu půdy. Poté se suspenze důkladně protřepe po dobu pěti minut a nechá se usadit alespoň 2 hodiny, avšak ne déle než 24 hodin. Následně se změří pH kapalné fáze pomocí pH-metru, který se před každým měřením kalibruje pomocí vhodné sady roztoků pufru (např. o pH 4,0 a 7,0).
LITERATURA:
|
1)
|
ISO (International Organization for Standardization) (1994). Soil Quality – Determination of pH, No. 10390. ISO, Geneve.
|
Dodatek 4
Kultivace žížal druhu Eisenia fetida/Eisenia andrei
Chov by se měl provádět pokud možno v klimatizované komoře při teplotě 20 °C ± 2 °C. Při této teplotě a dostatečném přísunu potravy žížaly dospějí po asi 2 až 3 měsících.
Oba druhy mohou být kultivovány v celé řadě zvířecích exkrementů. Doporučeným chovným médiem je směs koňského nebo kravského hnoje a rašeliny v poměru 50:50. Je třeba provádět kontroly zajišťující, že krávy či koně, od kterých se hnůj získává, nejsou léčeni či ošetřováni chemickými látkami, například látkami podporujícími růst, nematocidy či podobnými veterinárními přípravky, které by mohly žížaly během zkoušky nepříznivě ovlivnit. Doporučuje se používat osobně odebraný hnůj z ‚biologického‘ zdroje, neboť zkušenosti ukázaly, že komerčně dostupný hnůj používaný jako zahradní hnojivo může mít na žížaly nežádoucí účinky. Médium by mělo mít hodnotu pH přibližně 6 až 7 (upraví se uhličitanem vápenatým), nízkou iontovou vodivost (méně než 6 mS/cm nebo 0,5 % koncentrace solí) a nemělo by být příliš kontaminováno amoniakem nebo zvířecí močí. Substrát by měl být vlhký, ale ne příliš mokrý. Vhodnými chovnými nádobami jsou nádoby o objemu 10 až 50 litrů.
Pro získání žížal standardního stáří a velikosti (hmotnosti) je nejlepší založit kulturu pomocí zámotků. Jakmile je kultura založena, udržuje se umístěním dospělých žížal do chovné nádoby s čerstvým substrátem na dobu 14 až 28 dnů, aby mohly vyprodukovat další zámotky. Poté se dospělí jedinci odeberou a nedospělí jedinci vylíhlí ze zámotků se použijí jako základ další kultury. Žížaly se kontinuálně krmí zvířecími exkrementy a občas se přenesou do čerstvého substrátu. Zkušenosti ukázaly, že vhodnou potravou je na vzduchu vysušený jemně mletý kravský či koňský hnůj nebo ovesné vločky. Je třeba zajistit, že krávy či koně, od kterých se hnůj získává, nejsou léčeni či ošetřováni chemickými látkami, například látkami podporujícími růst, které by mohly žížaly během dlouhodobé kultivace nepříznivě ovlivnit. Žížaly vylíhlé ze zámotků se použijí ke zkoušce, když dosáhnou stáří 2 až 12 měsíců a považují se za dospělé jedince.
Žížaly lze považovat za zdravé, pokud se pohybují substrátem, nesnaží se substrát opustit a průběžně se množí. Vyčerpání substrátu se projeví tím, že se žížaly velmi pomalu pohybují a mají žlutý zadní konec. V takovém případě se doporučuje zajistit čerstvý substrát a/nebo snížit hustotu jedinců v půdě.
Dodatek 5
Techniky pro počítání nedospělých jedinců vylíhlých ze zámotků
Ruční vybírání žížal z půdního substrátu je velmi časově náročné. Proto se doporučují dvě alternativní metody:
|
a)
|
Zkušební nádoby se umístí do vodní lázně, nejprve při teplotě 40 °C, která se postupně zvýší na 60 °C. Po uběhnutí asi 20 minut by se měli nedospělí jedinci objevit na povrchu půdy, odkud je lze snadno odebrat a spočítat.
|
|
b)
|
Zkušební půdu lze promýt přes síto pomocí metody vyvinuté van Gestelem et al. (1) za předpokladu, že rašelina a hnůj nebo ovesné vločky přidané do půdy byly pomlety na jemný prášek. Dvě síta o velikosti ok 0,5 mm (průměr 30 cm) se umístí na sebe. Obsah zkušební nádoby se promyje skrz síta silným proudem vodovodní vody, což zanechá mladé žížaly a zámotky převážně na horním sítě. Je třeba poznamenat, že během tohoto postupu by se měl celý povrch horního síta udržovat vlhký, aby se juvenilní jedinci vznášeli na vrstvičce vody a nemohli prolézt oky v sítu. Nejlepších výsledků se dosáhne při použití sprchové hlavice.
|
Jakmile se půdní substrát promyje skrz síto, je možné nedospělé jedince a zámotky z horního síta vypláchnout do misky. Obsah misky se poté nechá stát, aby prázdné zámotky vyplavaly na povrch vody a plné zámotky a mladé žížaly klesly ke dnu. Stojící vodu je možné následně slít a mladé žížaly a zámotky přemístit do Petriho misky naplněné malým množstvím vody. Poté je možné žížaly odebrat ke spočítání pomocí jehly nebo pinzety.
Zkušenosti ukázaly, že metoda a) se více hodí k odebrání nedospělých jedinců, kteří by mohli při promytí projít i skrze síto o velikosti ok 0,5 mm.
Vždy by se měla stanovit účinnost metody použité k odběru žížal (a případně zámotků) z půdního substrátu. Pokud se k odběru nedospělých jedinců použije ruční technika třídění, doporučuje se provést celý postup na všech vzorcích dvakrát.
LITERATURA:
|
1)
|
Van Gestel, C.A.M., W.A. van Dis, E.M. van Breemen, P.M. Sparenburg (1988). Comparison of two methods determining the viability of cocoons produced in earthworm toxicity experiments. Pedobiologia 32:367-371.
|
Dodatek 6
Přehled statistického vyhodnocení dat (stanovení NOEC)
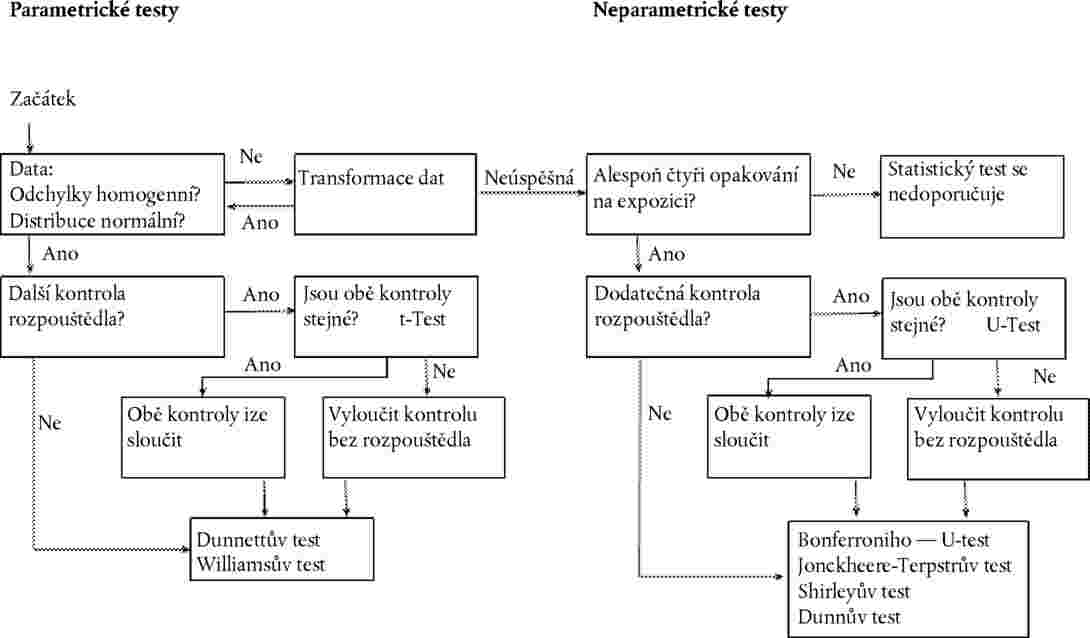
C.34. STANOVENÍ INHIBICE AKTIVITY ANAEROBNÍCH BAKTERIÍ – SNÍŽENÍ PRODUKCE PLYNŮ Z ANAEROBNĚ ROZKLÁDAJÍCÍHO (ČISTÍRENSKÉHO) KALU
ÚVOD
|
1.
|
Tato zkušební metoda je rovnocenná Pokynu OECD pro zkoušení 224 (2007). Chemické látky uvolněné do vodného prostředí procházejí aerobními i anaerobními zónami, ve kterých se mohou rozkládat a/nebo inhibovat bakteriální aktivitu. V některých případech mohou zůstat v anaerobních zónách v netknuté podobě po desetiletí i déle. První fáze čištění odpadních vod – primární usazení – je aerobní v supernatantní tekutině a anaerobní v subnatantním kalu. Následuje sekundární fáze v aerobní zóně provzdušňovací nádrže s aktivovaným kalem a v anaerobní zóně v subnatantním kalu v sekundární usazovací nádrži. Kal z obou těchto fází se obvykle zpracovává anaerobně, přičemž vzniká methan a oxid uhličitý, které se obvykle používají k výrobě elektřiny. Chemické látky, které se v širším prostředí dostanou do sedimentů v zátokách, ústích řek a moři, v těchto zónách pravděpodobně zůstanou trvale, pokud nejsou biologicky rozložitelné. Díky svým fyzikálním vlastnostem, jako je nízká rozpustnost ve vodě, vysoká adsorpce na suspendované pevné částice a rovněž nemožnost rozložit je biologicky aerobním způsobem, se určité chemické látky dostanou do těchto zón přednostně ve větším množství.
|
|
2.
|
Zatímco je žádoucí, aby byly chemické látky uvolňované do životního prostředí biologicky rozložitelné jak za aerobních, tak anaerobních podmínek, je nezbytné, aby tyto chemické látky neinhibovaly aktivitu mikroorganismů v žádné z těchto zón. Ve Spojeném království se vyskytlo několik případů úplné inhibice produkce methanu způsobené například pentachlorfenolem v průmyslových odpadech, což mělo za následek velmi nákladný transport inhibovaného kalu z vyhnívacích nádrží na ‚bezpečná‘ místa a dovoz zdravého rozkládajícího kalu ze sousedních zařízení. Došlo však také k mnoha případům méně závažného narušení rozkládání několika dalšími chemickými látkami, mezi něž patřily halogenované alifatické uhlovodíky (chemické čištění oděvů) a detergenty, což vedlo k významnému zhoršení účinnosti vyhnívací nádrže.
|
|
3.
|
Inhibicí bakteriální aktivity (respirace aktivovaného kalu) se zabývá pouze jediná zkušební metoda – C.11 (1), která posuzuje účinek zkoušených chemických látek na rychlost spotřeby kyslíku v přítomnosti substrátu. Tato metoda se obecně používá k časnému zjištění možných škodlivých účinků chemických látek na aerobní čištění odpadních vod a rovněž ke zjištění neinhibičních koncentrací zkoušených chemických látek pro použití v různých zkouškách biologické rozložitelnosti. Zkušební metoda C.43 (2) nabízí omezenou možnost stanovení toxicity zkoušené chemické látky pro produkci plynů anaerobním kalem. Používá kal naředěný na jednu desetinu své normální koncentrace pevných částic, aby bylo možno stanovit procento biologického rozkladu s požadovanou přesností. Protože naředěný kal by mohl být citlivější na inhibiční chemické látky, rozhodla se pracovní skupina pro normy ISO vypracovat metodu využívající neředěný kal. Byly přezkoumány nejméně tři texty (z Dánska, Německa a Spojeného království) a nakonec byly vypracovány dvě normy ISO, z nichž jedna používá neředěný kal – ISO 13 641-1 (3) a druhá používá stokrát ředěný kal – ISO 13 641-2 (4), který představuje bahna a sedimenty s málo početnými bakteriálními populacemi. Obě metody byly podrobeny okružnímu testu (5). 1. část byla potvrzena jako přijatelná norma, avšak na 2. část panovaly rozdílné názory. Spojené království zastávalo názor, že tato metoda vyžaduje další výzkum, neboť významné procento účastníků hlásilo velmi malou nebo žádnou produkci plynů, částečně i proto, že procento prostoru pro plyny bylo příliš vysoké (75 %) pro dosažení optimální citlivosti.
|
|
4.
|
Dřívější práce provedená ve Spojeném království (6)(7) popisovala manometrickou metodu používající jako substrát neředěný rozkládající kal a nezpracovaný čistírenský kal v 500ml baňkách. Zařízení bylo neskladné a zápach nezpracovaného kalu byl velmi nepříjemný. Později Wilson et al. (10) úspěšně použil kompaktnější a praktičtější zařízení Sheltona a Tiedjeho (8), jak ho vyvinuli Battersby a Wilson (9). Kawaraha et al. (11) připravil v laboratoři úspěšně standardnější kaly pro použití při zkouškách anaerobní biologické rozložitelnosti a inhibice u řady chemických látek. Nezpracovaný kal jako substrát byl rovněž nahrazen a zkouška se provádí buď se stokrát zředěným anaerobním kalem, nebo s bahny, sedimenty atd. o nízké bakteriální aktivitě.
|
|
5.
|
Tato metoda může přinést informace, které jsou užitečné při předpovídání pravděpodobného účinku zkoušené chemické látky na produkci plynu v anaerobních vyhnívacích nádržích. Nicméně pouze delší zkoušky lépe simulující vyhnívací nádrže v provozu mohou ukázat, zda může dojít k adaptaci mikroorganismů na zkoušenou chemickou látku, nebo zda se chemické látky, které se budou pravděpodobně absorbovat a adsorbovat na kal, mohou nahromadit až do toxické koncentrace během delšího období, než které umožňuje tato zkouška.
|
PODSTATA ZKOUŠKY
|
6.
|
Alikvoty směsi anaerobně rozkládajícího kalu (celková koncentrace pevných částic 20 g/l až 40 g/l ) a rozložitelný roztok substrátu se inkubují v uzavřených nádobách samostatně a paralelně také s řadou koncentrací zkoušené chemické látky po dobu až 3 dnů. Množství vyprodukovaného plynu (methan a oxid uhličitý) se určuje podle zvýšení tlaku (Pa) v nádobách. Procento inhibice produkce plynů způsobené různými koncentracemi zkoušené chemické látky se vypočítá z množství plynu vyprodukovaného v příslušné zkušební a kontrolní nádobě. Hodnota EC50 a další účinné koncentrace se vypočítají z grafů závislosti procentuální inhibice na koncentraci zkoušené chemické látky nebo, obvykleji, na logaritmu její koncentrace.
|
INFORMACE O ZKOUŠENÉ CHEMICKÉ LÁTCE
|
7.
|
Zkoušené chemické látky by se měly obvykle použít v nejčistší snadno dostupné formě, neboť nečistoty v některých chemických látkách, např. chlorfenoly, mohou být mnohem toxičtější než zkoušená chemická látka sama. Je však třeba zvážit potřebu zkoušet chemické látky v té formě, ve které jsou komerčně produkovány/vyráběny. Použití komerčně upravovaných přípravků se běžně nedoporučuje, avšak u špatně rozpustných zkoušených chemických látek může být použití upravovaných přípravků vhodné. Mezi vlastnosti zkoušené chemické látky, které by měly být známy, patří rozpustnost ve vodě a některých organických rozpouštědlech, tlak par, adsorpční koeficient, hydrolýza a biologická rozložitelnost za anaerobních podmínek.
|
POUŽITELNOST ZKUŠEBNÍ METODY
|
8.
|
Tuto zkoušku lze použít u chemických látek, které jsou rozpustné nebo nerozpustné ve vodě, včetně těkavých chemických látek. Při práci s materiály o nízké rozpustnosti ve vodě (viz odkaz (12)) a vysoké těkavosti je však zapotřebí zvláštní opatrnosti. Rovněž lze použít inokula z jiných anaerobních míst, např. bahna, nasycené půdy, sedimenty. Anaerobní bakteriální systémy, které byly v minulosti vystaveny toxickým chemickým látkám, se mohou adaptovat tak, aby si udržely svou aktivitu v přítomnosti xenobiotických chemických látek. Inokula z adaptovaných bakteriálních systémů mohou vykazovat vyšší snášenlivost vůči zkoušeným chemickým látkám v porovnání s inokuly získanými z neadaptovaných systémů.
|
REFERENČNÍ CHEMICKÉ LÁTKY
|
9.
|
Ke kontrole celého postupu se jako součást normální zkoušky souběžně provede ve vhodných nádobách zkouška s referenční chemickou látkou. Ukázalo se, že 3,5-dichlorfenol je stálý inhibitor anaerobní produkce plynů a rovněž spotřeby kyslíku aktivovaným kalem a jiných biochemických reakcí. Zjistilo se, že ještě větší inhibici produkce methanu než 3,5-dichlorfenol způsobují dvě další chemické látky, a sice methylen-dithiokyanát a pentachlorfenol, avšak výsledky s těmito látkami nebyly validovány. Pentachlorfenol se nedoporučuje, neboť není snadno dostupný v čisté formě.
|
REPRODUKOVATELNOST VÝSLEDKŮ
|
10.
|
V mezinárodním okružním testu (5) byly výsledky hodnot EC50 pro 3,5-dichlorfenol a 2-bromethansulfonovou kyselinu reprodukovatelné mezi 10 zúčastněnými laboratořemi pouze uspokojivě. (Rozpětí pro první látku bylo 32 až 502 mg/l a pro druhou 220–2 190 mg/l.)
|
Počet laboratoří
|
v mg/l
|
v mg/g kalu
|
|
střední hodnota
|
SD
|
var. koef. (%)
|
střední hodnota
|
SD
|
var. koef. (%)
|
|
|
3,5-dichlorfenol
|
|
10
|
153
|
158
|
103
|
5
|
4,6
|
92
|
|
|
2-bromethansulfonová kyselina
|
|
10
|
1 058
|
896
|
85
|
34
|
26
|
76
|
|
EC50 z okružního testu pro neředěný kal
|
11.
|
Vysoké variační koeficienty mezi laboratořemi do velké míry odrážejí rozdíly v citlivosti kalových mikroorganismů způsobené tím, zda tyto mikroorganismy byly, nebo nebyly v minulosti vystaveny zkoušené chemické látce nebo jiným chemicky příbuzným látkám. Přesnost, s jakou byla stanovena hodnota EC50 na základě koncentrace kalu, byla sotva lepší než ‚volumetrická‘ hodnota (mg/l). Tři laboratoře, které uváděly přesnost hodnot EC50 pro 3,5-dichlorfenol, vykazovaly mnohem nižší variační koeficienty (22, 9 a 18 % pro EC50 mg/g), než byly variační koeficienty středních hodnot všech deseti laboratoří. Jednotlivé střední hodnoty činily u těchto laboratoří 3,1, 3,2 a 2,8 mg/g. Nižší, přijatelné variační koeficienty v rámci jednotlivých laboratoří v porovnání s mnohem vyššími koeficienty mezi laboratorními hodnotami, a sice 9–22 % srov. 92 %, naznačují, že se jednotlivé kaly významně liší svými vlastnostmi.
|
POPIS METODY
Přístroje a pomůcky
|
12.
|
Je zapotřebí obvyklé laboratorní vybavení a tyto pomůcky:
|
a)
|
Inkubátor – s ochranou proti jiskření a s řízenou teplotou v rozmezí 35 °C ± 2 °C;
|
|
b)
|
Tlakuvzdorné skleněné zkušební nádoby vhodné nominální velikosti (17), každá vybavená plynotěsným potaženým septem, které je schopno vydržet tlak přibližně 2 bary nebo 2 × 105 Pa (pro potah použijte např. PTFE = polytetrafluorethen, teflon). Doporučují se skleněné lahve na sérum o nominálním objemu 125 ml se skutečným objemem přibližně 160 ml, uzavřené septem (18) a tvarovaným hliníkovým uzávěrem, avšak je možné úspěšně použít i lahve o celkovém objemu 0,1 až 1 litr;
|
|
c)
|
Přesný tlakoměr
(19)
a nástavec s jehlou;
Celková produkce plynů (methanu a oxidu uhličitého) naměřená pomocí tlakoměru upraveného tak, aby umožňoval měření a ventilaci vyprodukovaného plynu. Příkladem vhodného přístroje je ruční přesný tlakoměr připojený na injekční jehlu. Trojcestný plynotěsný ventil usnadňuje uvolnění nadměrného tlaku (dodatek 1). Je třeba udržet vnitřní objem trubice pro přenos tlaku a ventilu co možná nejnižší, aby byly chyby vzniklé zanedbáním objemu zařízení nevýznamné;
|
|
d)
|
Izolované nádoby pro transport rozkládajícího kalu;
|
|
e)
|
Trojcestné tlakové ventily;
|
|
f)
|
Síto s oky o rozměru 1 mm2;
|
|
g)
|
Nádrž pro rozkládající kal, skleněná láhev nebo láhev z polyethylenu o vysoké hustotě, s objemem asi 5 litrů, vybavená míchadlem a zařízením pro průchod proudu plynného dusíku (viz odstavec 13) skrz prostor nad kapalinou;
|
|
h)
|
membránové filtry (0,2 μm) pro sterilizaci substrátu;
|
|
i)
|
mikrostříkačky pro plynotěsné připojení tlakového snímače (viz odstavec 12 c)) k prostoru nad kapalinou v lahvi (viz odstavec 12 b)) a rovněž pro přidání nerozpustných tekutých zkoušených materiálů do lahví;
|
|
j)
|
rukavicový box, volitelný, avšak doporučuje se, s lehkým přetlakem dusíku.
|
|
Činidla
|
13.
|
Používají se pouze chemická činidla o čistotě p.a. V celé zkoušce by se měl používat plynný dusík o vysoké čistotě s obsahem kyslíku méně než 5 μl/l.
|
Voda
|
14.
|
Je-li v jakékoli fázi zapotřebí provést ředění, použijte odvzdušněnou deionizovanou vodu. Analytické kontroly této vody nejsou nutné, ale zajistěte pravidelnou údržbu deionizačního přístroje. Deionizovanou vodu použijte také k přípravě zásobních roztoků. Před přidáním anaerobního inokula k jakémukoli roztoku či naředěnému zkoušenému materiálu se ujistěte, že neobsahují kyslík. Provedete to buď probubláváním plynného dusíku skrz vodu používanou k ředění (nebo skrz ředěné roztoky) po dobu 1 hodiny před přidáním inokula, nebo zahřátím vody používané k ředění k bodu varu a vychlazením na pokojovou teplotu v atmosféře bez kyslíku.
|
Rozkládající kal
|
15.
|
Odeberte aktivně rozkládající kal z vyhnívací nádrže v čistírně odpadních vod nebo z laboratorní vyhnívací nádrže, která čistí kal pocházející převážně z domácích odpadních vod. Praktické informace týkající se kalu z laboratorní vyhnívací nádrže naleznete jinde (11). Pokud zamýšlíte použít adaptované inokulum, je možné zvážit použití rozkládajícího kalu z čistírny průmyslových odpadních vod. K odběru kalu použijte lahve se širokým hrdlem vyrobené z polyethylenu o vysoké hustotě nebo podobného materiálu, který se může roztáhnout. Naplňte vzorkovací lahve do výšky asi 1 cm od hrdla, pevně je uzavřete, nejlépe pojistným ventilem (odstavec 12 e)), a umístěte je do izolovaných nádob (odstavec 12 d)), aby se minimalizoval teplotní šok, dokud se nepřemístí do inkubátoru s teplotou udržovanou na 35 °C ± 2 °C. Při otvírání lahví dbejte na to, abyste uvolnili přetlak plynu buď opatrným povolením uzávěru, nebo pomocí trojcestného tlakového ventilu (odstavec 12 e)). Nejlepší je použít kal do několika hodin od odběru, jinak ho uchovávejte při teplotě 35 °C ± 2 °C pod ochrannou vrstvou dusíku po dobu až 3 dnů, kdy obvykle dochází k malé ztrátě aktivity.
Varování – rozkládající kal produkuje hořlavé plyny, které představují riziko požáru a výbuchu: rovněž obsahuje potenciálně patogenní organismy, proto při manipulaci s kalem dodržujte vhodná bezpečnostní opatření. Z bezpečnostních důvodů nepoužívejte pro odběr kalu skleněné nádoby.
|
Inokulum
|
16.
|
Bezprostředně před použitím kal opatrně zamíchejte a nechte ho protéci skrz síto s oky o velikosti 1 mm2 (odstavec 12 f)) do vhodné lahve (odstavec 12 g)) skrz prostor, kterým prochází proud dusíku. Dejte stranou vzorek pro měření koncentrace celkových suchých pevných částic (viz např. norma ISO 11 923 (13) nebo odpovídající norma EU). Obecně používejte neředěný kal. Koncentrace pevných částic se obvykle pohybuje mezi 2 % a 4 % (hmotnost/objem). Zkontrolujte hodnotu pH kalu, a pokud je to nutné, upravte ji na 7 ± 0,5.
|
Zkušební substrát
|
17.
|
Rozpusťte 10 g živné půdy (např. Oxoid), 10 g kvasničného extraktu a 10 g D-glukózy v deionizované vodě a nařeďte na objem 100 ml. Sterilizujte pomocí filtrace přes membránový filtr s velikostí pórů 0,2 μm (odstavec 12(h)) a ihned použijte nebo uchovávejte při teplotě 4 °C maximálně 1 den.
|
Zkoušená chemická látka
|
18.
|
Připravte si samostatný zásobní roztok každé zkoušené chemické látky rozpustné ve vodě, který bude obsahovat například 10 g/l chemické látky ve vodě zbavené kyslíku (odstavec 14). Použijte vhodné objemy těchto zásobních roztoků k přípravě reakčních směsí obsahujících odstupňované koncentrace. Alternativně si připravte ředicí řadu každého zásobního roztoku tak, aby byl objem přidávaný do každé zkušební nádoby stejný pro každou požadovanou konečnou koncentraci. Hodnota pH zásobních roztoků by se měla v případě potřeby upravit na 7 ± 0,2.
|
|
19.
|
U zkoušených chemických látek, které nejsou dostatečně rozpustné ve vodě, nahlédněte do normy ISO 10 634 (12) nebo odpovídající normy EU. Je-li třeba použít organické rozpouštědlo, vyhněte se rozpouštědlům, jako je chloroform a tetrachlormethan, o nichž je známo, že silně inhibují produkci methanu. Ve vhodném těkavém rozpouštědle, například acetonu či diethyletheru, připravte roztok chemické látky nerozpustné ve vodě o příslušné koncentraci. Požadované objemy roztoku rozpouštědla přidejte do prázdných zkušebních nádob (odstavec 12 b)) a před přidáním kalu nechte rozpouštědlo odpařit. Pro jiné způsoby ošetření použijte normu ISO 10 634 (12) nebo odpovídající normu EU, avšak mějte na paměti, že surfaktanty používané k výrobě emulzí mohou působit inhibičně na anaerobní produkci plynů. Pokud se domníváte, že přítomnost organických rozpouštědel a emulzifikátorů vede k nahodilým chybám, měla by se zkoušená chemická látka přidat přímo do zkušební směsi jako prášek nebo tekutina. Těkavé chemické látky a kapalné zkoušené chemické látky nerozpustné ve vodě je možné vstříknout do inokulovaných sérových lahví pomocí mikrostříkaček (odstavec 12(i)).
|
|
20.
|
Přidejte zkoušené chemické látky do lahví v takových množstvích, abyste získali geometrickou posloupnost koncentrací, např. 500 mg/l, 250 mg/l, 125 mg/l, 62,5 mg/l, 31,2 mg/l a 15,6 mg/l. Není-li znám rozsah toxicity u podobných chemických látek, proveďte nejprve předběžnou orientační zkoušku k nalezení vhodného rozmezí koncentrací, při níž použijete koncentrace 1 000 mg/l, 100 mg/l a 10 mg/l.
|
Referenční chemická látka
|
21.
|
Připravte vodný roztok 3,5-dichlorfenolu (10 g/l) postupným přidáváním minimálního množství 5 mol/l roztoku hydroxidu sodného k pevné látce za neustálého třepání, dokud se látka nerozpustí. Poté roztok doplňte ředicí vodou zbavenou kyslíku (odstavec 14) na požadovaný objem; rozpouštění můžete usnadnit pomocí ultrazvukové lázně. Je možné použít jiné referenční chemické látky, pokud u nich bylo zjištěno průměrné rozmezí hodnot EC50 v alespoň třech zkouškách s různými inokuly (z různých zdrojů nebo různých časů odběru).
|
RUŠIVÉ VLIVY / CHYBY
|
22.
|
Některé složky kalu by mohly pravděpodobně reagovat s potenciálními inhibitory, a činit je tak nedostupnými pro mikroorganismy, což by vedlo k nízké nebo žádné inhibici. Také pokud již kal obsahuje chemickou látku, která působí inhibičně, došlo by k chybným výsledkům, pokud by se tato chemická látka podrobila zkoušce. Kromě těchto možností byla identifikována řada faktorů, které mohou vést k chybným výsledkům. Tyto faktory jsou uvedeny v dodatku 3 spolu s metodami pro vyloučení či alespoň snížení chyb.
|
POSTUP ZKOUŠKY
|
23.
|
Počet potřebných opakování závisí na požadovaném stupni přesnosti ukazatelů inhibice. Pokud si uzávěry lahví uchovají dostatečnou plynotěsnost po celou dobu zkoušky, založte pouze jednu sadu (alespoň tři lahve) zkušebních lahví pro každou požadovanou koncentraci. Stejně tak založte jednu sadu lahví s referenční chemickou látkou a jednu sadu kontrol. Pokud jsou však uzávěry lahví spolehlivé jen při jednom nebo při několika málo propíchnutích, založte sadu (např. tří lahví) zkušebních lahví pro každý interval (t), pro který jsou požadovány výsledky, pro všechny koncentrace zkoušené chemické látky, jež se mají testovat. Stejně tak založte sady lahví ‚t‘ pro referenční chemickou látku a pro kontroly.
|
|
24.
|
Doporučuje se použít rukavicový box (odstavec 12 j)). Nejméně 30 minut před zahájením zkoušky spusťte proudění plynného dusíku skrz rukavicový box obsahující veškeré nezbytné pomůcky. Ujistěte se, že teplota kalu se během manipulace s lahvemi a uzavírání lahví pohybuje v rozmezí 35 °C ± 2 °C.
|
Předběžná zkouška
|
25.
|
Není-li aktivita kalu známa, doporučuje se provést předběžnou zkoušku. Připravte kontroly obsahující pevné částice v koncentraci například 10 g/l, 20 g/l a 40 g/l a substrát, avšak nepřidávejte do nich žádnou zkoušenou chemickou látku. Rovněž použijte různé objemy reakční směsi, abyste získali tři nebo čtyři různé poměry objemu prostoru nad kapalinou k objemu kapaliny v lahvi. Z výsledků objemů plynů vyprodukovaných při různých časových intervalech zvolte nejvhodnější podmínky, které umožní dvě měření denně a vedou k produkci významného objemu plynu a rovněž umožní každodenní uvolnění tlaku při optimální citlivosti (20) bez nebezpečí výbuchu.
|
Přidání zkoušených chemických látek
|
26.
|
Ve vodě rozpustné zkoušené chemické látky přidejte do prázdných zkušebních nádob (odstavec 12 b)) ve formě vodných roztoků (odstavec 18). Pro každou koncentraci z daného rozmezí použijte sadu alespoň tří lahví (odstavec 20). V případě nerozpustných a špatně rozpustných zkoušených chemických látek vstříkněte roztoky těchto látek v organických rozpouštědlech pomocí mikrostříkačky do prázdných nádob, abyste získali sady opakování pro každou z pěti koncentrací zkoušené chemické látky. Rozpouštědlo odpařte vedením proudu plynného dusíku po povrchu roztoků ve zkušebních lahvích. Nerozpustné pevné chemické látky můžete přidat do zkušebních nádob také přímo jako odvážená množství pevné látky.
|
|
27.
|
Pokud se nerozpustné a ve vodě špatně rozpustné tekuté zkoušené chemické látky nepřidávají pomocí rozpouštědla, přidejte je do zkušebních nádob přímo pomocí mikrostříkačky po přidání inokula a zkušebního substrátu (viz odstavec 30). Stejným způsobem lze přidat těkavé zkoušené chemické látky.
|
Přidání inokula a substrátu
|
28.
|
Míchejte vhodný objem procezeného rozkládajícího kalu (viz odstavec 16) v 5litrové lahvi (odstavec 12 g)) za současného proudění plynného dusíku prostorem nad kapalinou v lahvi. Promývejte zkušební lahve obsahující vodný roztok zkoušené chemické látky nebo roztok zkoušené chemické látky s odpařeným rozpouštědlem proudem plynného dusíku po dobu asi dvou minut, abyste odstranili vzduch. Rozdělte alikvotní díly, např. objemy 100 ml, dobře promíchaného kalu do zkušebních nádob pomocí pipety s dlouhou špičkou nebo odměrného válce. Je nezbytné naplnit pipetu přesným objemem požadovaného kalu v jediném kroku, protože pevné částice kalu se snadno usazují. Pokud naberete více, vyprázdněte pipetu a začněte znovu.
|
|
29.
|
Poté za stálého promývání dusíkem přidejte dostatečné množství roztoku substrátu (odstavec 17), abyste dosáhli koncentrace 2 g/l jak živné půdy, tak kvasničného extraktu a D-glukózy ve směsi. Níže je uveden příklad pro zkušební sady.
|
Konečná hmotnostní koncentrace zkoušené chemické látky ve zkušebních lahvích
(mg/l)
|
Objem zkoušené chemické látky
(ml)
|
Činidla a média
(ml)
|
|
Zásobní roztok a)10 g/lodst. 18
|
Zásobní roztok b)1 g/lodst. 18
|
Ředicí voda
odst. 14
|
Inokulum
odst. 16
|
Substrát
odst. 17
|
|
0
|
—
|
0
|
1,0
|
100
|
2
|
|
1
|
—
|
0,1
|
0,9
|
100
|
2
|
|
3,3
|
—
|
0,33
|
0,67
|
100
|
2
|
|
10
|
0,1
|
—
|
0,9
|
100
|
2
|
|
33
|
0,33
|
—
|
0,67
|
100
|
2
|
|
100
|
1,0
|
—
|
0
|
100
|
2
|
|
Celkový objem lahve = 160 ml. Objem kapaliny = 103 ml
Objem plynu = 57 ml nebo 35,6 % celkového objemu.
|
|
|
30.
|
Obdobně dostatečně promyjte plynným dusíkem prázdné zkušební nádoby pro manipulaci s těkavou nebo nerozpustnou tekutou zkoušenou chemickou látkou (viz odstavec 27).
|
Kontroly a referenční chemická látka
|
31.
|
Připravte sady lahví alespoň po třech kusech, které obsahují pouze kal a substrát a budou sloužit jako kontroly. Připravte další lahve pro opakování obsahující kal a substrát a dostatečné množství zásobního roztoku referenční chemické látky 3,5-dichlorfenolu (odstavec 21) vedoucí k výsledné koncentraci 150 mg/l. Tato koncentrace by měla inhibovat produkci plynů asi o 50 %. Alternativně vytvořte řadu koncentrací referenční chemické látky. Kromě toho připravte navíc čtyři lahve na měření pH, které obsahují kal, vodu zbavenou kyslíku a substrát. Do dvou lahví přidejte zkoušenou chemickou látku v nejvyšší zkoušené koncentraci a do zbývajících dvou lahví vodu zbavenou kyslíku.
|
|
32.
|
Ujistěte se, že všechny lahve – se zkoušenou a referenční chemickou látkou a kontroly – obsahují stejný objem (VR) kapaliny. Pokud je to třeba, doplňte na požadovaný objem deionizovanou vodou zbavenou kyslíku (odstavec 14). Objem prostoru nad kapalinou v lahvi by se měl nacházet v rozmezí 10 % až 40 % objemu lahve, přičemž skutečný objem se vybere na základě údajů získaných při předběžné zkoušce. Po přidání všech složek do lahví odstraňte jehlu přivádějící plyn a uzavřete každou z lahví pryžovou zátkou a hliníkovou zátkou (odstavec 12 b)), přičemž zátku navlhčete kapkou deionizované vody pro usnadnění jejího zavedení. Promíchejte obsah každé lahve protřepáním.
|
Inkubace lahví
|
33.
|
Přemístěte lahve do inkubátoru s termostatem, pokud možno vybaveného třepačkou, s teplotou udržovanou na hodnotě 35 °C ± 2 °C. Lahve se inkubují ve tmě. Po uplynutí asi 1 hodiny vyrovnejte tlak v lahvích na atmosférický tlak zavedením injekční jehly připojené k tlakoměru (odstavec 12 c)) skrz zátku každé lahve, otevřete ventil a počkejte, dokud hodnota tlaku naměřená tlakoměrem neklesne na nulu. Nakonec ventil zavřete. Jehla by se měla zavádět pod úhlem 45°, aby se zabránilo úniku plynu z lahví. Pokud se lahve inkubují bez třepačky, protřepejte je manuálně dvakrát denně každý den během celého inkubačního období, aby systém dosáhl rovnováhy. Lahve inkubujte a obraťte je dnem vzhůru, aby se zabránilo úniku plynu skrz septum. Obrácení však není vhodné v případě nerozpustných zkoušených chemických látek, které mohou přilnout ke dnu lahve.
|
Měření tlaku
|
34.
|
Když lahve dosáhnou teploty 35 °C ± 2 °C, změřte a zaznamenejte pH obsahu dvou ze čtyř lahví připravených pro tento účel a obsah zlikvidujte. Zbývající lahve dále inkubujte ve tmě. Během následujících 48 až 72 hodin měřte a zaznamenávejte tlak v lahvích dvakrát denně, a sice zavedením jehly tlakoměru skrz zátku do každé lahve (postupně). Jehlu mezi jednotlivými měřeními osušte. Při měření udržujte všechny části lahve při inkubační teplotě a proveďte měření co možná nejrychleji. Nechte hodnotu tlaku zobrazenou na tlakoměru, aby se ustálila, a zaznamenejte ji. Poté otevřete ventil pro ventilaci, a když tlak klesne na nulu, zavřete ho. Ve zkoušce pokračujte obvykle po dobu 48 hodin od doby prvního vyrovnání tlaku, která se označuje jako ‚čas 0‘. Počet měření a ventilací by se měl u těkavých chemických látek omezit na jedno (na konci inkubace) či dvě, aby se minimalizovaly ztráty zkoušené chemické látky (10).
|
|
35.
|
Pokud se na tlakoměru zobrazí záporná hodnota tlaku, ventil neotvírejte. Někdy se v injekční jehle a trubici nahromadí vlhkost, o čemž svědčí malá záporná hodnota tlaku zobrazená na tlakoměru. V takovém případě jehlu odstraňte, protřepejte trubici, osušte papírovou utěrkou a připojte novou jehlu.
|
Měření pH
|
36.
|
Po posledním měření tlaku změřte a zaznamenejte pH obsahu každé lahve.
|
ÚDAJE A PŘEDKLÁDÁNÍ ZPRÁV
Vyjádření výsledků
|
37.
|
Vypočítejte součet a průměr zaznamenaných tlaků v každém časovém intervalu pro každou sadu opakování (lahví) a vypočítejte střední kumulativní úhrnný tlak plynu pro každý časový interval pro každou sadu opakování. Střední kumulativní produkci plynu (Pa) v kontrolních, zkušebních a referenčních lahvích vyneste do grafu jako funkci času. V lineární části vynesené křivky zvolte čas, obvykle 48 hodin, a vypočítejte procento inhibice (I) pro každou koncentraci z rovnice [1]:
|
I = (1 – Pt/PC) × 100
|
[1],
|
kde
|
I
|
=
|
procento inhibice v %;
|
|
Pt
|
=
|
tlak plynu vyprodukovaného zkoušeným materiálem ve vybranou dobu v Pascalech (Pa);
|
|
Pt
|
=
|
tlak plynu vyprodukovaného kontrolou ve stejnou dobu v Pascalech (Pa);
|
Je vhodné sestrojit oba grafy, tj. vynést inhibici (I) jako funkci koncentrace a rovněž logaritmu koncentrace, aby bylo možné zvolit křivku, která se více blíží linearitě. Z křivky, která se více blíží linearitě, stanovte hodnotu EC50 (mg/l) vizuálně nebo regresní analýzou. Pro účely srovnání může být užitečnější vyjádřit koncentraci chemické látky v mg chemické látky na g celkové suché hmotnosti pevných částic. K získání této koncentrace vydělte objemovou koncentraci (mg/l) chemické látky objemovou koncentrací pevných částic kalu (g/l) (odstavec 16).
|
|
38.
|
Vypočítejte buď procento inhibice dosažené použitím jediné koncentrace referenční chemické látky, nebo EC50, pokud byl zkoumán dostatečný počet koncentrací.
|
|
39.
|
Přepočítejte střední tlak plynu vyprodukovaného v kontrole Pc (Pa) na objem pomocí vztahu ke kalibrační křivce tlakoměru (dodatek 2) a z této hodnoty vypočítejte výtěžek plynu, vyjádřený jako objem vyprodukovaný za 48 hodin ze 100 ml neředěného kalu při koncentraci pevných částic 2 % (20 g/l) až 4 % (40 g/l).
|
Kritéria platnosti
|
40.
|
Výsledky z mezilaboratorního hodnocení ISO (5) ukázaly, že referenční chemická látka (3,5-dichlorfenol) způsobila 50 % inhibici produkce plynu v rozmezí koncentrací od 32 mg/l do 510 mg/l, se střední hodnotou 153 mg/l (odstavec 10). Tento interval je tak velký, že pevné meze inhibice nelze spolehlivě nastavit jako kritéria platnosti. Mělo by to být možné, pokud další vývoj povede k produkci více konzistentních inokul. Hodnoty objemu plynu vyprodukovaného v kontrolních lahvích za 48 hodin se pohybovaly od 21 ml/g sušiny kalu do 149 ml/g (střední hodnota 72 ml/g). Mezi objemem vyprodukovaného plynu a odpovídající hodnotou EC50 nebyl žádný zjevný vztah. Konečná hodnota pH se pohybovala mezi 6,1 a 7,5.
|
|
41.
|
Zkouška se považuje za platnou, když se v referenční kontrole obsahující 150 mg/l 3,5-dichlorfenolu dosáhne inhibice vyšší než 20 %, ve slepé kontrole se vyprodukuje více než 50 ml plynu na g sušiny a hodnota pH se na konci zkoušky pohybuje v rozmezí od 6,2 do 7,5.
|
Závěrečná zpráva
|
42.
|
Závěrečná zpráva musí obsahovat tyto údaje:
|
|
Zkoušená chemická látka
|
—
|
obecný název, chemický název, číslo CAS, strukturní vzorec a relevantní fyzikálně-chemické vlastnosti,
|
|
—
|
čistota zkoušené látky (obsah nečistot).
|
|
|
|
Zkušební podmínky
|
—
|
objemy kapaliny ve zkušebních nádobách a prostoru nad ní,
|
|
—
|
popis zkušebních nádob a měření plynu (např. typ tlakoměru),
|
|
—
|
aplikace zkoušené chemické látky a referenční chemické látky na zkušební systém, použité zkušební koncentrace a použití jakýchkoli rozpouštědel,
|
|
—
|
podrobné údaje o použitém inokulu: jméno čistírny odpadních vod, popis zdroje čištěné odpadní vody (např. provozní teplota, doba retence kalu, převážně domácí odpadní vody nebo průmyslový odpad atd.), koncentrace pevných částic, produkce plynů v anaerobní vyhnívací nádrži, předchozí expozice či možná předběžná adaptace na toxické chemické látky nebo místo odběru bahna, sedimentu atd.,
|
|
—
|
inkubační teplota a rozmezí,
|
|
|
|
Výsledky
|
—
|
hodnoty pH na konci zkoušky,
|
|
—
|
všechna data naměřená v nádobách se zkoušenou chemickou látkou, referenční chemickou látkou a slepou kontrolou, podle potřeby (např. tlak v Pa nebo milibarech) v tabulkové formě,
|
|
—
|
procento inhibice v lahvích se zkoušenou a referenční chemickou látkou a křivky závislosti inhibice na koncentraci,
|
|
—
|
vypočítané hodnoty EC50 vyjádřené v mg/l a mg/g,
|
|
—
|
produkce plynu na jeden gram kalu za 48 hodin,
|
|
—
|
odůvodnění případného odmítnutí výsledků zkoušky,
|
|
—
|
diskuze výsledků, včetně jakýchkoli odchylek od postupů této zkušební metody a diskuze jakýchkoli odchylek ve výsledcích zkoušky způsobených rušivými vlivy a chybami od toho, co by se očekávalo,
|
|
—
|
rovněž uveďte, zda bylo cílem zkoušky měřit toxicitu vůči předem exponovaným, nebo předem neexponovaným mikroorganismům.
|
|
|
LITERATURA
|
1)
|
Kapitola C.11 této přílohy: Zkouška inhibice respirace aktivovaného kalu.
|
|
2)
|
Kapitola C.43 této přílohy: Anaerobní biologická rozložitelnost organických sloučenin ve vyhnilém kalu: metoda měřením produkce plynů.
|
|
3)
|
International Organisation for Standardisation (2003) ISO 13 641-1 Water Quality – Determination of inhibition of gas production of anaerobic bacteria – Part 1: General Test.
|
|
4)
|
International Organisation for Standardisation (2003) ISO 13 641-2 Water Quality – Determination of inhibition of gas production of anaerobic bacteria – Part 2: Test for low biomass concentrations.
|
|
5)
|
ISO (2000) Ring test of ISO 13 641-1 and ISO 13 641-2. Determination of inhibition of activity of anaerobic bacteria. BL 6958/A. Evans MR, Painter HA. Brixham Environmental Laboratory, AstraZeneca UK Ltd., Brixham, TQ5 8BA UK.
|
|
6)
|
Swanwick JD, Foulkes M (1971). Inhibition of anaerobic digestion of sewage sludge by chlorinated hydrocarbons. Wat. Control Fed. Control, 70, 58-70.
|
|
7)
|
HMSO (1986) Determination of the inhibitory effects of chemicals and waste waters on the anaerobic digestion of sewage sludge. ISBN 0 117519 43 X, In: Methods for the Examination of Waters and Associated Materials UK.
|
|
8)
|
Shelton DR, Tiedje JM (1984). General method for determining anaerobic biodegradation potential. Environ. Env. Microbiol. 47, 850-857.
|
|
9)
|
Battersby NS and Wilson V (1988). Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic compounds under methanogenic conditions. Chemosphere 17, 2441-2460.
|
|
10)
|
Wilson V, Painter HA and Battersby NS (1992). A screening method for assessing the inhibition of the anaerobic gas production from sewage sludge. Ind. Int. Symp. on Ecotoxicology. Ecotoxicological Relevance of Test Methods, GSF Forschungzentrum, Neuherberg, Germany (1990). Eds. Steinberg C and Kettrup A, pp 117-132 (1992).
|
|
11)
|
Kawahara K, Yakabe Y, Chida T, and Kida K (1999). Evaluation of laboratory-made sludge for an anaerobic biodegradability test and its use for assessment of 13 chemicals. Chemosphere, 39 (12), 2007-2018.
|
|
12)
|
International Organization for Standardization (1995) ISO 10 634 Water Quality – Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium.
|
|
13)
|
International Organization for Standardization (1997) ISO 11 923 Water Quality – Determination of suspended solids by filtration through glass-fibre filters.
|
Dodatek 1
Příklad přístroje k měření produkce bioplynu pomocí tlaku plynu

Poznámky:
|
1
|
–
|
Tlakoměr
|
|
2
|
–
|
Trojcestný plynotěsný ventil
|
|
3
|
–
|
Injekční jehla
|
|
4
|
–
|
Plynotěsný uzávěr (krimpované víčko a septum)
|
|
5
|
–
|
Prostor nad kapalinou v lahvi
|
|
6
|
–
|
Inokulum rozkládajícího kalu
|
Zkušební nádoby v prostředí o teplotě 35 °C ± 2 °C
Dodatek 2
Převod hodnot naměřených tlakoměrem
Hodnoty naměřené tlakoměrem lze převést na objemy plynu pomocí standardní křivky a z nich lze vypočítat objem plynu vyprodukovaný na jeden gram suchého kalu za 48 hodin. Tento index aktivity se používá jako jedno z kritérií pro hodnocení platnosti výsledků zkoušky. Kalibrační křivka se získá vstříknutím známých objemů plynu při teplotě 35 °C ± 2 °C do sérových lahví obsahujících objem vody odpovídající objemu reakční směsi VR.
|
—
|
Rozdělte alikvotní díly vody o objemu VR ml udržované při teplotě 35 °C ± 2 °C do pěti sérových lahví. Lahve uzavřete a umístěte je do vodní lázně o teplotě 35 °C ± 2 °C a nechte 1 hodinu, aby systém dosáhl rovnováhy.
|
|
—
|
Zapněte tlakoměr, počkejte, až se ustálí a nastavte ho na nulu.
|
|
—
|
Zaveďte injekční jehlu skrz uzávěr jedné z lahví, otevřete ventil, počkejte, dokud se na tlakoměru neobjeví nula, a potom ventil zavřete.
|
|
—
|
Zopakujte tento postup se zbývajícími lahvemi.
|
|
—
|
Vstříkněte do každé lahve 1 ml vzduchu při teplotě 35 °C ± 2 °C. Zaveďte jehlu (tlakoměru) skrz uzávěr jedné z lahví a počkejte, dokud se naměřená hodnota tlaku neustálí. Tlak zaznamenejte, otevřete ventil, počkejte, dokud se na tlakoměru nezobrazí nula, a potom ventil zavřete.
|
|
—
|
Zopakujte tento postup se zbývajícími lahvemi.
|
|
—
|
Zopakujte celý postup se 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml, a 50 ml vzduchu.
|
|
—
|
Vyneste do grafu převodní křivku tlaku (Pa) jako funkci vstříknutého objemu plynu (ml). Odezva přístroje je lineární v rozmezí 0 Pa až 70 000 Pa a 0 ml až 50 ml vyprodukovaného plynu.
|
Dodatek 3
Zjištěné faktory, které mohou vést k chybným výsledkům
a) Kvalita uzávěrů lahví
Existují různé druhy komerčně dostupných sept pro sérové lahve. Mnoho z nich, včetně sept z butylové pryže, ztrácí těsnost při propíchnutí jehlou za podmínek této zkoušky. Někdy tlak po propíchnutí septa injekční jehlou klesá velmi pomalu. Doporučuje se používat plynotěsná septa, aby se zamezilo únikům plynu (odstavec 12 b)).
b) Vlhkost v injekční jehle
Někdy se v injekční jehle a trubici nahromadí vlhkost, o čemž svědčí malá záporná hodnota tlaku zobrazená na tlakoměru. K nápravě této situace jehlu odstraňte, protřepejte trubici, osušte papírovou utěrkou a připojte novou jehlu (odstavce 12 c) a 35).
c) Kontaminace kyslíkem
Anaerobní metody vykazující chybu v důsledku kontaminace kyslíkem, který může způsobit nižší produkci plynu. V této metodě by se měla tato možnost minimalizovat použitím přísně anaerobních technik, včetně použití rukavicového boxu.
d) Hrubé částice substrátu v kalu
Anaerobní produkce plynu a citlivost kalu jsou ovlivněny substráty, které jsou do zkušebních lahví přeneseny spolu s inokulem. Rozkládající kal z domácích anaerobních vyhnívacích nádrží často ještě obsahuje rozeznatelný materiál, jako jsou vlasy a celulózové rostlinné zbytky, který znesnadňuje odběr reprezentativních vzorků. Procezením lze hrubý nerozpustný materiál z kalu odstranit, a zvýšit tak pravděpodobnost odběru reprezentativních vzorků (odstavec 16).
e) Těkavé zkoušené chemické látky
Těkavé zkoušené chemické látky se budou uvolňovat do prostoru nad kapalinou ve zkušebních lahvích. Tato skutečnost může vést ke ztrátě části zkoušeného materiálu ze systému během ventilace po měřeních tlaku a k získání falešně vysokých hodnot EC50. Tuto chybu lze snížit volbou vhodného poměru objemu prostoru nad kapalinou vůči objemu kapaliny a neprováděním ventilace po měřeních tlaku (10).
f) Nelinearita produkce plynu
Pokud graf střední kumulativní produkce plynu jako funkce doby inkubace nemá přibližně lineární průběh v intervalu 48 hodin, může se přesnost zkoušky snížit. Odstranění tohoto nedostatku lze docílit použitím rozkládajícího kalu z jiného zdroje a/nebo přidáním zvýšené koncentrace zkušebního substrátu – živné půdy, kvasničného extraktu a glukózy (odstavec 29).
Dodatek 4
Použití na environmentální vzorky s nízkou koncentrací biomasy – anaerobní bahna, sedimenty atd.
ÚVOD
A.1 Obecně platí, že specifická mikrobiální aktivita (objem plynu vyprodukovaného na gram sušiny) přirozeně se vyskytujících anaerobních bahen, sedimentů, půd atd. je mnohem nižší než aktivita anaerobního kalu získaného z odpadních vod. Proto je třeba změnit některé experimentální podmínky, pokud se mají měřit inhibiční účinky chemických látek na tyto méně aktivní vzorky. U těchto méně aktivních vzorků jsou možné dva obecné způsoby provedení zkoušky:
|
a)
|
provést modifikovanou předběžnou zkoušku (odstavec 25) s neředěným vzorkem bahna, půdy atd. při teplotě 35 °C ± 2 °C nebo při teplotě místa odběru vzorku, chceme-li dosáhnout přesnější simulace (stejně jako v části 1 normy ISO 13 641);
|
|
b)
|
nebo provést zkoušku s ředěným vzorkem (1:100) kalu z vyhnívací nádrže za účelem simulace nízké aktivity očekávané u vzorku prostředí, avšak při teplotě udržované na 35 °C ± 2 °C (stejně jako v části 2 normy ISO 13 641).
|
A.2 Možnost a) lze provést podle zde popsané metody (odpovídající části 1 normy ISO 13 641), avšak je třeba provést předběžnou zkoušku (odstavec 25) ke zjištění optimálních podmínek, pokud již nejsou známy z předchozích zkoušek. Vzorek bahna nebo sedimentu by se měl důkladně promíchat, např. v míchačce, a je-li to nutné, naředit malým množstvím odvzdušněné vody (odstavec 14), aby byl dostatečně tekutý pro přenos pipetou s dlouhou špičkou nebo odměrným válcem. Pokud se má za to, že ve vzorku mohou chybět živiny, je možné vzorek bahna odstředit (za anaerobních podmínek) a resuspendovat v minerálním médiu obsahujícím kvasničný extrakt (A.11).
A.3 Možnost b). Tato možnost přiměřeně napodobuje nízkou aktivitu environmentálních vzorků, avšak chybí při ní vysoká koncentrace suspendovaných pevných částic přítomných v těchto vzorcích. Úloha těchto pevných částic při inhibici není známa, avšak je možné, že by reakce mezi zkoušenými chemickými látkami a složkami bahna a rovněž adsorpce zkoušených chemických látek na pevné částice mohly vést ke snížení toxicity zkoušené chemické látky.
A.4 Teplota je dalším důležitým faktorem: k dosažení přesné simulace by se měly zkoušky provádět při teplotě místa odběru vzorku, protože je známo, že různé skupiny bakteriálních společenstev produkujících methan jsou aktivní při různých teplotních rozmezích, a sice termofilové při teplotě ~30–35 °C, mezofilové při 20–25 °C, a psychrofilové při < 20 °C, což může vést k různým inhibičním vzorcům.
A.5 Doba trvání. V obecné zkoušce, části 1, používající neředěný kal, byla produkce plynu za 2–4 dny vždy dostatečná, zatímco v části 2 se stokrát ředěným kalem bylo za toto období v okružním testu vyprodukováno nedostatečné či žádné množství plynu. Madsen et al. (1996) při popisu této druhé zkoušky uvádí, že je třeba vyčkat alespoň 7 dní.
Zkouška při nízké koncentraci biomasy (možnost b)
Měly by se provést následující změny a úpravy, které přidávají či nahrazují některé stávající odstavce a pododstavce hlavního textu.
A.6 V odstavci 6 se doplňuje: Podstata zkoušky;
‚Tato technika se může použít s anaerobním kalem naředěným 1:100, částečně proto, aby se simulovala nízká aktivita bahen a sedimentů. Inkubační teplota může být buď 35 °C, nebo odpovídat teplotě místa, z něhož byl vzorek odebrán. Protože bakteriální aktivita je mnohem nižší než v neředěném kalu, měla by se inkubační doba prodloužit alespoň na 7 dní.‘
A.7 V odstavci 12 a) se doplňuje:
‚inkubátor by měl být schopen provozu při teplotách klesajících až k 15 °C.‘
A.8 Za odstavec 13 se přidává další činidlo:
‚kyselina fosforečná (H3PO4), 85 % (hmot.) vodný roztok.‘
A.9 Na konec odstavce 16 se doplňuje:
‚Ve zkoušce použijte konečnou koncentraci 0,20 ± 0,05 g/l celkové sušiny.‘
A.10 Odstavec 17 Zkušební substrát:
Tento substrát se nepoužívá, nýbrž se nahrazuje kvasničným extraktem (viz odstavce 17, A.11, A.12. A.13).
A.11 K naředění anaerobního kalu je třeba minerální médium obsahující stopové prvky a pro usnadnění se k tomuto médiu přidá organický substrát, jímž je kvasničný extrakt.
Za odstavec 17 se vkládá nový odstavec, který zní
|
‚a)
|
Zkušební minerální médium s kvasničným extraktem.
|
Připraví se z 10násobně koncentrovaného zkušebního média (odstavec 17 b); A.12) s roztokem stopových prvků (odstavec 17 c); A.13). Použijte čerstvě dodaný nonahydrát sulfidu sodného (odstavec 17 b); A.12) nebo ho před použitím namočte a vysušte, aby bylo zajištěno, že má dostatečnou redukční kapacitu. Pokud se zkouška provádí bez použití rukavicového boxu (odstavec 12 j)), měla by se koncentrace sulfidu sodného v zásobním roztoku zvýšit na 2 g/l (z 1 g/l). Sulfid sodný lze rovněž z vhodného zásobního roztoku přidat skrz septum uzavřených zkušebních lahví (neboť tento postup snižuje riziko oxidace) k dosažení konečné koncentrace 0,2 g/l. Alternativně je možné použít citrát titanitý (odstavec 17 b)). Přidejte ho skrz septum uzavřených zkušebních lahví, abyste získali koncentraci 0,8 mmol/l až 1,0 mmol/l. Citrát titanitý je vysoce účinné redukční činidlo o nízké toxicitě, které se připravuje tímto způsobem: Rozpusťte 2,94 g citrátu sodného dihydrátu v 50 ml ředicí vody zbavené kyslíku (odstavec 14) (vznikne roztok 200 mmol/l) a přidejte 5 ml roztoku chloridu titanitého (15 g/100 ml vody). Roztok pomocí uhličitanu sodného neutralizujte na pH 7 ± 0,5 a přelijte do vhodné sérové lahve pod proudem plynného dusíku. Koncentrace citrátu titanitého v tomto zásobním roztoku je 164 mmol/l. Zkušební médium ihned použijte, nebo ho uchovávejte při teplotě 4 °C maximálně po dobu 1 dne.
|
A.12
|
b)
|
Desetinásobně koncentrované zkušební médium připravené z těchto látek:
|
bezvodý dihydrogenfosforečnan draselný (KH2PO4)
|
2,7 g
|
|
hydrogenfosforečnan sodný (Na2HPO4)
|
4,4 g
|
|
(nebo 11,2 g dodekahydrátu)
chlorid amonný (NH4Cl)
|
5,3 g
|
|
dihydrát chloridu vápenatého (CaCl2 · 2H2O)
|
0,75 g
|
|
hexahydrát chloridu manganatého (MgCl2 · 6H2O)
|
1,0 g
|
|
tetrahydrát chloridu železnatého (FeCl2 · 4H2O)
|
0,2 g
|
|
resazurin (redoxní indikátor)
|
0,01 g
|
|
nonahydrát sulfidu sodného (Na2S · 9H2O)
|
1,0 g
|
|
(nebo citrát titanitý) konečná koncentrace
|
0,8 mmol/l až 1,0 mmol/l
|
|
roztok stopových prvků (viz odstavec 17 c); A.13)
|
10,0 ml
|
|
kvasničný extrakt
|
100 g
|
|
Rozpusťte v ředicí vodě (odstavec 14) a doplňte na objem:
|
1 000 ml
|
|
|
A.13
|
c)
|
Roztok stopových prvků připravený z těchto látek:
|
tetrahydrát chloridu manganatého (MnCl2 · 4H2O)
|
0,5 g
|
|
kyselina orthoboritá (H3BO3)
|
0,05 g
|
|
chlorid zinečnatý (ZnCl2)
|
0,05 g
|
|
chlorid měďnatý (CuCl2)
|
0,03 g
|
|
dihydrát molybdenanu sodného (Na2MoO4 · 2H2O)
|
0,01 g
|
|
hexahydrát chloridu kobaltnatého (CoCl2 · 6H2O)
|
1,0 g
|
|
hexahydrát chloridu nikelnatého (NiCl2 · 6H2O)
|
0,1 g
|
|
seleničitan sodný (Na2SeO3)
|
0,05 g
|
|
Rozpusťte v ředicí vodě (odstavec 14) a doplňte na objem:
|
1 000 ml‘
|
|
A.14 Odstavec 25: Předběžná zkouška
Je nezbytné provést předběžnou zkoušku způsobem popsaným v odstavci 24 s tím rozdílem, že koncentrace pevných částic v kalu by měla být stokrát nižší, to jest 0,1 g/l, 0,2 g/l a 0,4 g/l. Inkubace by měla trvat alespoň 7 dní.
Poznámka: V okružním testu (5) byl objem prostoru nad kapalinou příliš vysoký, činil 75 % celkového objemu; měl by se pohybovat v doporučeném rozmezí 10 %–40 %. Příslušným kritériem je skutečnost, že objem vyprodukovaného plynu při přibližně 80 % inhibici by měl být měřitelný s přijatelnou přesností (např. ± 5 % až ± 10 %).
A.15 Odstavce 26 až 30: Přidání zkoušené chemické látky, inokula a substrátu.
Přidání se provede stejným způsobem, jaký je popsán v těchto odstavcích, avšak roztok substrátu (odstavec 17) se nahradí zkušebním médiem s kvasničným extraktem (A.11).
Rovněž konečná koncentrace pevných částic v kalu se sníží z 2 g/l–4 g/l na 0,2 ± 0,05 g/l (A.9). V tabulce A.1 jsou uvedeny dva příklady přidání složek do zkušební směsi. Tato tabulka nahrazuje tabulku v odstavci 29.
A.16 Odstavec 33: Inkubace lahví
Protože se očekává snížená rychlost produkce plynu, provádí se inkubace po dobu alespoň 7 dní.
A.17 Odstavec 34: Měření tlaku
Pokud je třeba zjistit objem plynné fáze, použije se pro měření tlaku v prostoru nad kapalinou v lahvích stejný postup, jaký je popsaný v odstavci 34. Pokud se mají měřit celková množství CO2 a CH4, sníží se pH kapalné fáze na cca pH 2 vstříknutím H3PO4 do každé příslušné lahve a tlak se změří po 30 minutách třepání při zkušební teplotě. Více informací o kvalitě inokula však lze získat měřením tlaku v každé lahvi před okyselením a po něm. Pokud je například rychlost produkce CO2 mnohem vyšší než rychlost produkce methanu, může být citlivost fermentačních baktérií pozměněna a/nebo budou zkoušenou chemickou látkou přednostně ovlivněny methanogenní baktérie.
A.18 Odstavec 36; měření pH
Pokud se má použít H3PO4, bude třeba připravit několik dalších lahví, do nichž se nepřidá žádná H3PO4, zejména pro měření pH.
LITERATURA:
Madsen, T, Rasmussen, HB; and Nilsson, L (1996), Methods for screening anaerobic biodegradability and toxicity of organic chemicals. Project No.336, Water Quality Institute, Danish Environment Protection Agency, Copenhagen.
Tabulka A.1
Příklady uspořádání zkušebních sad ve zkoušce
|
Složky reakční směsi
|
Příklad 1
|
Příklad 2
|
Normální pořadí přidání
|
|
Koncentrace připraveného inokula (g/l)
|
0,42
|
2,1
|
—
|
|
Objem přidaného inokula (ml)
|
45
|
9
|
4
|
|
Koncentrace inokula ve zkušebních lahvích (g/l)
|
0,20
|
0,20
|
—
|
|
Objem přidaného zkušebního média (ml)
|
9
|
9
|
2
|
|
Objem přidané ředicí vody (ml)
|
36
|
72
|
3
|
|
Koncentrace kvasničného extraktu ve zkušebních lahvích (g/l)
|
9,7
|
9,7
|
—
|
|
Objem zásobního roztoku zkoušené chemické látky (ml)
|
3
|
3
|
1
|
|
Celkový objem kapaliny (ml)
|
93
|
93
|
—
|
Dodatek 5
Definice
Pro účely této zkušební metody se použijí tyto definice:
|
|
Chemickou látkou se rozumí látka nebo směs.
|
|
|
Zkoušenou chemickou látkou se rozumí jakákoli látka nebo směs zkoušená pomocí této zkušební metody.
|
C.35. ZKOUŠKA TOXICITY PRO ROD LUMBRICULUS V SYSTÉMU SEDIMENT-VODA ZA POUŽITÍ SEDIMENTU SE ZNÁMÝM PŘÍDAVKEM ZKOUŠENÉ CHEMICKÉ LÁTKY
ÚVOD
|
1.
|
Tato zkušební metoda je rovnocenná Pokynu OECD pro zkoušení 225 (2007). Endobentické organismy živící se sedimentem podléhají potenciálně vysoké expozici chemickým látkám vázaným na sediment, a proto je třeba jim věnovat přednostní pozornost, např. (1, 2, 3). Mezi těmito organismy živícími se sedimentem hrají vodní máloštětinatci (Oligochaeta) důležitou roli v sedimentech vodních systémů. Bioturbací sedimentu a tím, že slouží jako kořist, mohou mít tito živočichové velký vliv na biologickou dostupnost těchto chemických látek pro ostatní organismy, např. bentivorní ryby. Na rozdíl od epibentických organismů se endobentičtí vodní máloštětinatci (např. Lumbriculus variegatus) zavrtávají do sedimentu a požívají částice sedimentu, které se nacházejí pod povrchem sedimentu. Tím je zajištěna expozice zkušebních organismů zkoušené chemické látce všemi možnými cestami příjmu (např. kontaktem s kontaminovanými částicemi sedimentu a jejich požitím, ale také prostřednictvím kapilární vody a vody nad sedimentem).
|
|
2.
|
Tato zkušební metoda je určena k zhodnocení účinků dlouhodobé expozice endobentického máloštětinatce žížalice pestré (Lumbriculus variegatus; Müller) chemickým látkám vázaným na sediment. Vychází ze stávajících závěrečných zpráv zkoušek toxicity sedimentu a bioakumulace, např. (3, 4, 5, 6, 7, 8, 9, 10). Metoda je popsána pro statické zkušební podmínky. Scénář expozice užitý při této zkušební metodě spočívá v přidání známého množství zkoušené chemické látky do sedimentu (spiking). Použití sedimentu se známým přídavkem chemické látky (spiked sediment) má simulovat sediment kontaminovaný zkoušenou chemickou látkou.
|
|
3.
|
Chemické látky, které je třeba testovat z hlediska organismů žijících v sedimentu, v této složce obvykle přetrvávají po dlouhá časová období. Organismy žijící v sedimentu mohou být chemické látce vystaveny několika cestami. Relativní význam jednotlivých cest, jimiž dochází k expozici, a doba nezbytná k tomu, aby každá z nich přispěla k celkovým toxickým účinkům, závisí na fyzikálně chemických vlastnostech dotčené chemické látky a jejím konečném osudu v daném organismu. V případě silně adsorbujících chemických látek (např. log Kow > 5) nebo chemických látek s kovalentní vazbou na sediment může být významnou cestou expozice požití kontaminované potravy. Aby nedošlo k podcenění toxicity takových chemických látek, přidá se potrava nezbytná pro reprodukci a růst zkušebních organismů do sedimentu před aplikací zkoušené chemické látky (11). Popisovaná zkušební metoda je dostatečně podrobná, aby bylo možné zkoušku provést, a zároveň umožňuje přizpůsobení experimentálního uspořádání podmínkám v příslušné laboratoři a rozličným vlastnostem zkoušených chemických látek.
|
|
4.
|
Zkušební metoda má za cíl stanovit účinky zkoušené chemické látky na reprodukci a biomasu zkušebních organismů. Měřenými biologickými parametry jsou celkový počet přeživších jedinců a biomasa (hmotnost sušiny) na konci expozice. Tyto údaje se analyzují buď pomocí regresního modelu, který slouží k odhadnutí koncentrace, jež by vyvolala x % účinek (např. EC50, EC25 a EC10), nebo použitím testování statistické hypotézy ke stanovení koncentrace bez pozorovaných účinků (NOEC) a nejnižší koncentrace s pozorovaným účinkem (LOEC).
|
|
5.
|
Kapitola C.27 této přílohy ‚Zkouška toxicity pro chironomidy v systému sediment-voda za použití sedimentu se známým přídavkem zkoušené chemické látky‘ (6) poskytuje mnoho podstatných a užitečných podrobných údajů pro provádění zde uváděné zkušební metody toxicity sedimentu. Tento dokument tedy sloužil jako základ, na němž se vypracovaly úpravy pro provádění zkoušek toxicity sedimentu s Lumbriculus variegatus. Další dokumenty, na něž se odkazuje, zahrnují např. Standardní příručku ASTM pro stanovení bioakumulace kontaminujících látek vázaných na sediment bentickými bezobratlými (3), Metody Agentury pro ochranu životního prostředí USA pro měření toxicity a bioakumulace kontaminujících látek vázaných na sediment sladkovodními bezobratlými (7) a Standardní příručku ASTM pro sběr, uchovávání, charakterizaci sedimentů pro toxikologické zkoušky a manipulaci s nimi a výběr vzorkovačů používaných pro sběr bentických bezobratlých (12). Dalšími důležitými zdroji informací pro vypracování tohoto dokumentu byly praktické zkušenosti získané během okružního testování této zkušební metody ((13), zpráva o okružním testu).
|
NEZBYTNÉ A POMOCNÉ INFORMACE PRO PROVEDENÍ ZKOUŠKY
|
6.
|
Před zahájením studie je třeba získat informace o zkoušené chemické látce, jako jsou bezpečnostní opatření, správné podmínky uchovávání a analytické metody. Pokyny pro zkoušení chemických látek s fyzikálně chemickými vlastnostmi, které činí jejich zkoušení obtížné, jsou uvedeny v literatuře (14).
|
|
7.
|
Před provedením zkoušky je třeba mít o zkoušené chemické látce k dispozici tyto informace:
|
—
|
obecný název, chemický název (nejlépe název IUPAC), strukturní vzorec, číslo CAS, čistotu,
|
|
|
8.
|
Dále je před zahájením zkoušky užitečné znát tyto doplňující informace:
|
—
|
rozdělovací koeficient oktanol-voda, Kow,
|
|
—
|
rozdělovací koeficient organický uhlík-voda, vyjádřený jako Koc,
|
|
—
|
fototransformaci ve vodě,
|
|
—
|
biologickou rozložitelnost,
|
|
|
9.
|
Před zahájením zkoušky by se měly získat informace o určitých vlastnostech sedimentu, který se bude používat (7). Podrobnosti naleznete v odstavcích 22 až 25.
|
PODSTATA ZKOUŠKY
|
10.
|
Zkušební organismy v podobném fyziologickém stavu (synchronizované způsobem popsaným v dodatku 5) jsou vystaveny řadě toxických koncentrací látky aplikované na sediment v systému sediment-voda. Jako médium by se měl použít umělý sediment a rekonstituovaná voda. Zkušební nádoby bez přídavku zkoušené chemické látky slouží jako kontroly. Zkoušená chemická látka se do sedimentu přidá hromadně pro každou úroveň koncentrace, aby se minimalizovala variabilita mezi opakováními při každé úrovni koncentrace, a následně se do zkušebních nádob, ve kterých byly ekvilibrovány koncentrace ve vodě a sedimentu, přidají zkušební organismy (viz odstavec 29). Zkušební organismy se vystaví systému sediment-voda na dobu 28 dnů. Vzhledem k nízkému obsahu živin v umělém sedimentu by se měl sediment doplnit zdrojem potravy (viz odstavce 22 až 23 a dodatek 4), aby se zajistilo, že organismy porostou a budou se množit za kontrolovaných podmínek. Tímto způsobem je zajištěno, že jsou organismy vystaveny chemické látce prostřednictvím vody, sedimentu a rovněž potravy.
|
|
11.
|
Upřednostňovaným cílovým ukazatelem tohoto typu studie je ECx (např. EC50, EC25 a EC10; účinná koncentrace ovlivňující x % zkušebních organismů) pro reprodukci a biomasu v porovnání s kontrolou. Je však třeba poznamenat, že vezme-li se v úvahu vysoká nejistota nízké ECx (např. EC10, EC25) s extrémně vysokými 95 % intervaly spolehlivosti (např. (15)) a statistická síla vypočítaná během testování hypotézy, považuje se za nejprůkaznější cílový ukazatel hodnota EC50. Kromě toho je možné vypočítat koncentraci bez pozorovaných účinků (NOEC) a nejnižší koncentraci s pozorovaným účinkem (LOEC) pro biomasu a reprodukci, pokud uspořádání zkoušky a data tyto výpočty podporují (viz odstavce 34 až 38). Uspořádání zkoušky je závislé na účelu studie – odvození ECx nebo NOEC.
|
REFERENČNÍ ZKOUŠKY
|
12.
|
Očekává se, že chování kontrolních organismů dostatečně prokáže schopnost laboratoře provést danou zkoušku, a pokud jsou k dispozici historická data, opakovatelnost zkoušky. Kromě toho je možné provádět v pravidelných intervalech referenční zkoušky toxicity s použitím referenční toxické látky ke stanovení citlivosti zkušebních organismů. 96hodinové referenční zkoušky toxicity pouze ve vodě mohou dostatečně ukázat citlivost a stav zkušebních živočichů (4, 7). V dodatku 6 a ve zprávě o okružním testu zkušební metody jsou uvedeny informace o toxicitě pentachlorfenolu (PCP) v úplných zkouškách (28denní expozice sedimentu se známým přídavkem chemické látky) (13). Akutní toxicita PCP pouze ve vodě je popsána např. v (16). Tyto informace je možné použít k porovnání citlivosti zkušebních organismů v referenčních zkouškách s PCP jako referenční toxickou látkou. Jako referenční toxické látky pro zkoušky s L. variegatus byly doporučeny chlorid draselný (KCl) nebo síran měďnatý (CuSO4) (4, 7). Stanovení kritérií kvality vycházejících z údajů o toxicitě KCl je dosud obtížné vzhledem k nedostatku publikovaných údajů o L. variegatus. Informace o toxicitě mědi pro L. variegatus jsou uvedeny v (17) až (21).
|
PLATNOST ZKOUŠKY
|
13.
|
Má-li být zkouška platná, měly by být splněny tyto požadavky:
|
—
|
Okružní test (13) ukázal, že u druhu Lumbriculus variegatus by se měl průměrný počet živých jedinců v každém opakování v kontrolách zvýšit alespoň 1,8krát do konce expozice v porovnání s počtem jedinců v každém opakování na začátku expozice.
|
|
—
|
pH vody nad sedimentem by se mělo nacházet v rozmezí 6 až 9 po celou dobu zkoušky.
|
|
—
|
Koncentrace kyslíku ve vodě nad sedimentem by v průběhu zkoušky neměla být nižší než 30 % hodnoty nasycení vzduchem (air saturation value, ASV) při zkušební teplotě.
|
|
POPIS ZKUŠEBNÍ METODY
Zkušební systém
|
14.
|
Doporučují se statické systémy bez výměny vody nad sedimentem. Pokud je poměr sedimentu k vodě (viz odstavec 15) vhodný, postačí obvykle mírné provzdušňování k udržení kvality vody na přijatelné úrovni pro zkušební organismy (např. maximalizujte hladinu rozpuštěného kyslíku, minimalizujte hromadění výměšků). Semistatické nebo průtokové systémy s občasnou nebo kontinuální výměnou vody nad sedimentem by se měly používat pouze ve výjimečných případech, neboť se předpokládá, že pravidelná výměna vody nad sedimentem ovlivní chemickou rovnováhu (např. dojde ke ztrátám zkoušené chemické látky ze zkušebního systému).
|
Zkušební nádoby a přístroje
|
15.
|
Expozice by se měla provádět ve skleněných kádinkách o objemu např. 250 ml a průměru 6 cm. Lze použít i jiné skleněné nádoby, ale měly by zaručit odpovídající hloubku vody nad sedimentem a sedimentu. Do každé nádoby se přidá přibližně 1,5–3cm vrstva uměle vytvořeného sedimentu. Poměr hloubky vrstvy sedimentu k hloubce vody nad sedimentem by měl být 1:4. Nádoby by měly mít vhodný objem pro příslušnou násadu, tj. počet zkušebních organismů přidaných na jednotku hmotnosti sedimentu (viz rovněž odstavec 39).
|
|
16.
|
Zkušební nádoby a další přístroje, které přichází do styku se zkoušenou chemickou látkou, by měly být celé zhotoveny ze skla nebo z jiného chemicky inertního materiálu. U všech částí zařízení je třeba se vyhnout použití materiálů, které se mohou rozpouštět, absorbovat zkoušenou chemickou látku nebo vyluhovat jiné chemické látky a mají nepříznivý účinek na zkušební živočichy. Zařízení, které přijde do kontaktu se zkušebním médiem, by mělo být vyrobeno z polytetrafluorethylenu (PTFE; teflon), nerezové oceli a/nebo skla. U organických chemických látek, které mohou adsorbovat na sklo, může být nutné použít silanizované sklo. V takových případech se musí zařízení po použití zlikvidovat.
|
Zkušební druh
|
17.
|
Zkušebním druhem používaným v tomto typu studie je sladkovodní máloštětinatec Lumbriculus variegatus (Müller). Tento druh toleruje širokou škálu typů sedimentu a je široce používán při zkouškách toxicity sedimentu a bioakumulace (např. 3, 5, 7, 9, 13, 15, 16, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35). V závěrečné zprávě by se měl uvést původ zkušebních živočichů, potvrzení identity druhu (např. (36)) a rovněž podmínky kultivace. Identifikace druhu se nevyžaduje před každou zkouškou, pokud organismy pocházejí z vlastní kultury.
|
Kultivace zkušebních organismů
|
18.
|
Aby se zajistil dostatečný počet jedinců pro provádění zkoušek toxicity sedimentů, je užitečné udržovat stálou laboratorní kulturu zkušebních organismů. Pokyny ohledně metod laboratorní kultivace Lumbriculus variegatus a zdroje startovacích kultur jsou uvedeny v dodatku 5. Podrobnosti o kultivaci tohoto druhu naleznete v literatuře (3, 7, 27).
|
|
19.
|
Důrazně se doporučuje založení kultur jediného druhu, aby se zajistilo, že se zkoušky provádějí s živočichy stejného druhu. Ujistěte se, že kultury, a zejména organismy používané ve zkouškách netrpí žádnými viditelnými nemocemi a abnormalitami.
|
Voda
|
20.
|
Jako vodu nad sedimentem se ve zkouškách doporučuje použít vodu rekonstituovanou podle metody C.1 této přílohy (37). Lze ji také použít pro laboratorní kultury zkušebních organismů (příprava viz dodatek 2). Je-li to nutné, může se použít přírodní voda. Vybraná voda musí mít takovou kvalitu, která umožní růst a reprodukci zkušebních druhů po dobu aklimatizace a v průběhu fází zkoušky, aniž by vykazovaly abnormální vzhled nebo chování. Bylo prokázáno, že Lumbriculus variegatus v tomto typu vody přežije, roste a množí se (30), a je zajištěna maximální standardizace zkušebních a kultivačních podmínek. Pokud se použije rekonstituovaná voda, mělo by se uvést její složení a voda by se měla před použitím charakterizovat alespoň uvedením pH, obsahu kyslíku a tvrdosti (vyjádřené jako mg CaCO3/l). Analýza vody na mikropolutanty provedená před použitím může poskytnout užitečné informace (viz např. dodatek 3).
|
|
21.
|
pH vody nad sedimentem by se mělo pohybovat mezi 6,0 a 9,0 (viz odstavec 13). Pokud se očekává zvýšená tvorba amoniaku, považuje se za užitečné udržovat hodnotu pH v rozmezí 6,0 až 8,0. Pro zkoušky např. slabých organických kyselin se doporučuje upravit pH pufrováním vody používané ve zkoušce, jak popisuje např. (16). Celková tvrdost přírodní vody používané ve zkoušce by se měla pohybovat mezi 90 a 300 mg CaCO3 na litr. V dodatku 3 jsou shrnuta další kritéria pro přijatelnou ředicí vodu dle Pokynu OECD č. 210 (38).
|
Sediment
|
22.
|
Protože nekontaminované přírodní sedimenty z určitého zdroje nemusí být k dispozici po celý rok a původní organismy a rovněž přítomnost mikropolutantů mohou ovlivnit zkoušku, měl by se raději použít uměle vytvořený sediment (rovněž nazývaný rekonstituovaný, artificiální či syntetický sediment). Použití uměle vytvořeného sedimentu minimalizuje variabilitu zkušebních podmínek a rovněž kontaminaci původní faunou. Níže uvedený uměle vytvořený sediment vychází z umělého sedimentu dle (6), (39) a (40). Doporučuje se použít ho v tomto typu zkoušky (6, 10, 30, 41, 42, 43):
|
a)
|
4–5 % (hmotnost sušiny) sfagnové rašeliny; je důležité použít rašelinu v práškové formě, stupeň rozkladu: ‚střední‘, jemně mletou (velikost částic ≤ 0,5 mm) a sušenou pouze na vzduchu;
|
|
b)
|
20 ± 1 % (hmotnost sušiny) kaolinitického jílu (pokud možno s více než 30 % kaolinitu);
|
|
c)
|
75–76 % (hmotnost sušiny) křemenného písku (jemný písek, velikost zrn: ≤ 2 mm, ale > 50 % částic musí být v rozpětí 50–200 μm);
|
|
d)
|
Deionizovaná voda, 30–50 % hmotnosti sušiny sedimentu, navíc k suchým složkám sedimentu;
|
|
e)
|
Přidá se chemicky čistý uhličitan vápenatý (CaCO3) pro úpravu pH konečné směsi sedimentu;
|
|
f)
|
Celkový obsah organického uhlíku (TOC) v konečné směsi by měl činit 2 % (± 0,5 %) hmotnosti sušiny sedimentu a je třeba jej upravit použitím vhodného množství rašeliny a písku v souladu s písm. a) a c);
|
|
g)
|
Potrava, např. sušený drcený list kopřivy (Urtica sp., v souladu s lékárenskými normami, pro lidskou spotřebu) nebo směs listu Urtica sp. v prášku s alfa-celulózou (1:1) v množství 0,4–0,5 % suché hmotnosti sedimentu, navíc k suchým složkám sedimentu; podrobnosti viz dodatek 4.
|
|
|
23.
|
Rašelina, kaolinitický jíl, potrava a písek by měly pocházet ze známého zdroje. Jako doplněk k položce g) uvádí kapitola C.27 této přílohy (6) alternativní rostlinné materiály, které lze použít jako zdroj výživy: dehydratované listy morušovníku bílého (Morus alba), jetele plazivého (Trifolium repens), špenátu setého (Spinacia oleracea) nebo obilovin.
|
|
24.
|
Vybraný zdroj potravy by se měl přidat do sedimentu před přidáním zkoušené chemické látky nebo během něj. Vybraný zdroj potravy by měl umožňovat alespoň přijatelnou reprodukci v kontrolách. Užitečné informace by mohla poskytnout analýza umělého sedimentu nebo jeho složek na mikropolutanty před použitím. Příklad přípravy uměle vytvořeného sedimentu je popsán v dodatku 4. Přijatelné je i smíchání suchých složek, pokud se prokáže, že po přidání vody nad sedimentem nedochází k separaci složek sedimentu (např. vyplavování částic rašeliny) a že rašelina nebo sediment jsou dostatečně kondicionovány (viz také odstavec 25 a dodatek 4). Umělý sediment by se měl charakterizovat alespoň uvedením původu složek, distribuce velikosti zrn (procento písku, naplavenin a jílu), celkového obsahu organického uhlíku (TOC), obsahu vody a pH. Měření oxidačně-redukčního potenciálu je volitelné.
|
|
25.
|
Je-li to nutné, např. pro specifické zkušební účely, mohou jako zkušební a/nebo kultivační sediment sloužit také přírodní sedimenty z neznečištěných míst (3). Pokud se však použije přírodní sediment, měl by se charakterizovat alespoň uvedením původu (místa odběru), pH a obsahu amoniaku v kapilární vodě, celkového obsahu organického uhlíku (TOC) a obsahu dusíku, distribuce velikosti částic (procento písku, naplavenin a jílu) a procentuálního obsahu vody (7) a měl by být prostý jakékoli kontaminace a jiných organismů, které by mohly se zkušebními organismy soutěžit nebo je lovit. Měření oxidačně-redukčního potenciálu a kationtové výměnné kapacity je volitelné. Doporučuje se také přírodní sediment před přidáním známého množství zkoušené chemické látky kondicionovat po dobu sedmi dnů za stejných podmínek, které převládají v následující zkoušce. Na konci tohoto období kondicionování by se měla voda nad sedimentem odstranit a zlikvidovat.
|
|
26.
|
Používaný sediment musí mít takovou kvalitu, která umožní přežití a reprodukci kontrolních organismů po celou dobu expozice, aniž by vykazovaly abnormální vzhled nebo chování. Kontrolní jedinci by se měli zavrtat do země a měli by požírat sediment. Reprodukce v kontrolách by měla dosáhnout alespoň hodnoty uvedené v kritériu platnosti popsaném v odstavci 13. Měla by se zaznamenat přítomnost nebo nepřítomnost pelet trusu na povrchu sedimentu, které svědčí o tom, že organismy požírají sediment. Tato informace může být užitečná při interpretaci výsledků zkoušky s ohledem na cesty expozice. Další informace o požírání sedimentu lze získat pomocí metod popsaných v (24), (25), (44) a (45), které specifikují požírání sedimentu nebo výběr částic u zkušebních organismů.
|
|
27.
|
Postupy manipulace s přírodními sedimenty před použitím v laboratoři jsou popsány v (3), (7) a (12). Příprava a uchovávání umělého sedimentu, který se doporučuje používat ve zkoušce s Lumbriculus, jsou popsány v dodatku 4.
|
Aplikace zkoušené chemické látky
|
28.
|
Zkoušená chemická látka se přidá do sedimentu ve známém množství. Protože se předpokládá, že většina zkoušených chemických látek bude mít nízkou rozpustnost ve vodě, měly by se rozpustit v co nejmenším objemu vhodného organického rozpouštědla (např. aceton, n-hexan, cyklohexan), čímž se vytvoří zásobní roztok. Zásobní roztok by se měl naředit stejným rozpouštědlem k získání zkušebních roztoků. Hlavním kritériem pro výběr vhodného solubilizačního činidla by měla být toxicita a těkavost rozpouštědla a rozpustnost zkoušené chemické látky ve zvoleném rozpouštědle. Pro každou úroveň koncentrace by se měl použít stejný objem odpovídajícího roztoku. Zkoušená chemická látka by se měla do sedimentu přidat pro každou úroveň koncentrace hromadně, aby se minimalizovala variabilita mezi opakováními příslušné koncentrace zkoušené chemické látky. Každý ze zkušebních roztoků se poté smísí s křemenným pískem, jak je popsáno v odstavci 22 (např. 10 g křemenného písku na zkušební nádobu). Zjistilo se, že k úplnému nasáknutí křemenného písku postačuje objem 0,20–0,25 ml na gram písku. Poté se musí rozpouštědlo nechat do sucha odpařit. Aby se minimalizovaly ztráty zkoušené chemické látky souběžným odpařováním (např. v závislosti na tlaku par chemické látky), měl by se písek pokrytý chemickou látkou použít ihned po usušení. Suchý písek se smísí s vhodným množstvím uměle vytvořeného sedimentu o odpovídající úrovni koncentrace. Při přípravě sedimentu je nutno zohlednit písek pocházející ze směsi písku se zkoušenou chemickou látkou (tj. při přípravě sedimentu by se mělo použít menší množství písku). Hlavní výhodou tohoto postupu je fakt, že se do sedimentu nezanese prakticky žádné rozpouštědlo (7). Další možností, jak zkoušenou chemickou látku přidat do sedimentu, např. v případě terénního sedimentu, je přidat zkoušenou chemickou látku do suché a jemně namleté části sedimentu způsobem popsaným výše pro křemenný písek, nebo zamíchat zkoušenou chemickou látku do vlhkého sedimentu a následně nechat odpařit použité solubilizační činidlo. Je třeba dbát na to, aby zkoušená chemická látka přidaná do sedimentu byla v sedimentu důkladně a rovnoměrně rozložena. Je-li třeba, je možné analyzovat dílčí vzorky pro potvrzení konečné koncentrace látky v sedimentu a stanovení stupně homogenity. Rovněž může být užitečné analyzovat dílčí vzorky zkušebních roztoků pro potvrzení konečných koncentrací látky v sedimentu. Protože se k nanesení zkoušené chemické látky na křemenný písek používá rozpouštědlo, měla by se zavést kontrola s rozpouštědlem, která se připraví se stejným množstvím rozpouštědla jako zkušební sedimenty. Měla by se uvést metoda použitá pro přidání zkoušené chemické látky a důvody pro výběr jiného konkrétního postupu přidání, než jaký je uveden výše. Metodu přidání lze upravit pro fyzikálně-chemické vlastnosti zkoušené chemické látky, např. aby se zabránilo ztrátám z důvodu odpařování (těkání) během přidávání látky nebo ekvilibrace. Další pokyny pro postupy přidávání zkoušené chemické látky jsou uvedeny v Environment Canada (1995) (46).
|
|
29.
|
Jakmile se připraví sediment se známým přídavkem zkoušené chemické látky, rozdělí se do zkušebních nádob pro jednotlivá opakování a přelije zkušební vodou, je vhodné nechat proběhnout rozdělení zkoušené chemické látky ze sedimentu do vodné fáze (např. 3, 7, 9). To by se mělo provádět pokud možno za stejných podmínek z hlediska teploty a provzdušňování, jaké se používají při zkoušce. Vhodná doba pro ustavení rovnováhy je specifická pro konkrétní sediment a chemickou látku a může se pohybovat v řádu hodin až dní, zřídka až několika týdnů (4–5 týdnů) (např. 27, 47). V této zkoušce se nečeká na dosažení rovnováhy, ale doporučuje se doba ekvilibrace 48 hodin až 7 dní. Tím se minimalizuje doba pro rozklad zkoušené chemické látky. V závislosti na účelu studie, např. pokud se mají napodobit environmentální podmínky, je možné nechat sediment s přidanou látkou stabilizovat po delší dobu.
|
|
30.
|
Na konci období ekvilibrace by se měly odebrat vzorky alespoň vody nad sedimentem a sedimentu alespoň u nejvyšší koncentrace a nižší koncentrace pro analýzu koncentrace zkoušené chemické látky. Tato analytická stanovení zkoušené chemické látky by měla umožnit výpočet hmotnostní bilance a vyjádření výsledků na základě naměřených počátečních koncentrací. Odběr vzorků obecně narušuje nebo ničí systém sediment-voda. Proto obvykle není možné použít stejná opakování pro odběr vzorku sedimentu a živočichů. Je třeba připravit doplňující ‚analytické‘ nádoby vhodných rozměrů, které se ošetří stejným způsobem (včetně přítomnosti zkušebních organismů), avšak nepoužijí se pro biologická pozorování. Rozměry nádob by se měly zvolit tak, aby zajišťovaly požadovaný počet vzorků pro danou analytickou metodu. Podrobnosti o odběru vzorků jsou uvedeny v odstavci 53.
|
PROVEDENÍ ZKOUŠKY
Předběžná zkouška
|
31.
|
Pokud nejsou k dispozici žádné informace o toxicitě zkoušené chemické látky pro Lumbriculus variegatus, může být užitečné provést předběžný experiment ke stanovení rozmezí koncentrací, které se budou testovat v hlavní zkoušce, a k optimalizaci zkušebních podmínek v hlavní zkoušce. K tomuto účelu se použije řada široce odstupňovaných koncentrací zkoušené chemické látky. Žížalice se vystaví každé koncentraci zkoušené chemické látky po dobu (např. 28 dní, jako v konečné zkoušce), která umožňuje odhadnout vhodné zkušební koncentrace. Opakování nejsou třeba. Během předběžné zkoušky by se mělo pozorovat a zaznamenávat chování zkušebních živočichů, například vyhýbání se sedimentu, které by mohlo být způsobeno zkoušenou chemickou látkou a/nebo sedimentem. V předběžné zkoušce by se neměly testovat koncentrace vyšší než 1 000 mg/kg hmotnosti sušiny sedimentu.
|
Hlavní zkouška
|
32.
|
V hlavní zkoušce by se mělo použít alespoň pět koncentrací, které se zvolí např. na základě výsledku předběžné orientační zkoušky (odstavec 31) a způsobem popsaným v odstavcích 35, 36, 37 a 38.
|
|
33.
|
Kromě zkušebních sad se zkoušce podrobí i kontrola (co se týká opakování, viz odstavce 36, 37 a 38) obsahující všechny složky vyjma zkoušené chemické látky. Pokud se k aplikaci zkoušené chemické látky použije solubilizační činidlo, nemělo by mít žádný významný vliv na zkušební organismy, což se zjistí pomocí doplňující kontroly obsahující pouze rozpouštědlo.
|
Uspořádání zkoušky
|
34.
|
Uspořádáním zkoušky se rozumí výběr počtu zkušebních koncentrací a jejich odstupňování, počet nádob pro každou koncentraci a počet červů v každé nádrži. Uspořádání pro odhad ECx, odhad NOEC a pro provedení limitní zkoušky jsou popsána v odstavcích 35, 36, 37 a 38.
|
|
35.
|
Koncentrace použité ve zkoušce by měly pokrývat účinnou koncentraci (např. EC50 EC25, EC10) a rozsah koncentrací, při nichž dochází k účinku zkoušené chemické látky, který je předmětem zájmu. Je třeba vyhnout se extrapolaci koncentrací mnohem nižších, než je nejnižší koncentrace ovlivňující zkušební organismy, nebo nad nejvyšší testovanou koncentrací. Pokud se – ve výjimečných případech – taková extrapolace provede, je třeba v závěrečné zprávě uvést úplné vysvětlení.
|
|
36.
|
Pokud se má odhadnout hodnota ECx, je třeba testovat alespoň pět koncentrací a minimálně tři opakování pro každou koncentraci. Doporučuje se šest opakování pro kontrolu, nebo kontrolu s rozpouštědlem (pokud se používá), aby se zlepšil odhad variability kontroly. V každém případě je vhodné, aby se použily dostatečné zkušební koncentrace umožňující dobrý odhad modelu. Koeficient rozložení koncentrací by neměl být větší než dvě (výjimku lze učinit v případě, kdy má křivka závislosti odezvy na koncentraci malý sklon). Počet opakování při každé expozici lze snížit, pokud se zvýší počet zkušebních koncentrací s odezvami v rozmezí 5–95 %. Zvýšení počtu opakování nebo zmenšení intervalů zkušebních koncentrací obvykle vede k zmenšení intervalu spolehlivosti zkoušky.
|
|
37.
|
Pokud se mají odhadnout hodnoty LOEC/NOEC, mělo by se použít alespoň pět zkušebních koncentrací s alespoň čtyřmi opakováními (pro kontrolu nebo, pokud se používá, kontrolu s rozpouštědlem se doporučuje šest opakování, aby se zlepšil odhad variability kontroly) a koeficient rozložení by neměl být větší než dvě. V dodatku 6 je uvedeno několik informací o statistické síle zjištěné během testování hypotézy v okružním testu této zkušební metody.
|
|
38.
|
Pokud se neočekávají žádné účinky až do koncentrace 1 000 mg/kg suché hmotnosti sedimentu (např. na základě výsledků předběžné orientační zkoušky) nebo pokud bude testování při jediné koncentraci dostačující pro potvrzení hodnoty NOEC, která je předmětem zájmu, lze provést limitní zkoušku. Ve druhém zmiňovaném případě by mělo být v závěrečné zprávě uvedeno podrobné odůvodnění pro výběr limitní koncentrace. Účelem limitní zkoušky je provést zkoušku při dostatečně vysoké koncentraci umožňující osobám s rozhodovací pravomocí vyloučit možné toxické účinky chemické látky a limit je stanoven v takové koncentraci, jejíž výskyt se v žádném případě nepředpokládá. Doporučená koncentrace je 1 000 mg/kg (hmotnosti sušiny). Obvykle je pro expozici i kontroly zapotřebí alespoň šest opakování. V dodatku 6 je uvedeno několik informací o statistické síle zjištěné během testování hypotézy v okružním testu této zkušební metody.
|
Podmínky expozice
Zkušební organismy
|
39.
|
Zkouška se provádí s alespoň 10 jedinci v každém opakování použitém pro stanovení biologických parametrů. Tento počet jedinců odpovídá přibližně 50–100 mg mokré biomasy. Za předpokladu obsahu sušiny 17,1 % (48) to vede k přibližně 9–17 mg suché biomasy v každé nádobě. Agentura pro ochranu životního prostředí USA (2000 (7)) doporučuje použít násadu nepřevyšující poměr 1:50 (suchá biomasa: TOC). V případě uměle vytvořeného sedimentu popsaného v odstavci 22 to odpovídá přibližně 43 g sedimentu (hmotnosti sušiny) na 10 jedinců při obsahu TOC 2,0 % suchého sedimentu. V případě, že se použije více než 10 jedinců na nádobu, by se mělo podle toho upravit množství sedimentu a vody nad sedimentem.
|
|
40.
|
Organismy použité ve zkoušce by měly všechny pocházet ze stejného zdroje a mělo by se jednat o živočichy v podobném fyziologickém stavu (viz dodatek 5). Měli by se vybrat jedinci podobné velikosti (viz odstavec 39). Doporučuje se zvážit před zkouškou dílčí vzorek sady či zásoby zkušebních organismů s cílem odhadnout střední hmotnost.
|
|
41.
|
Jedinci, kteří se použijí ve zkoušce, se vyjmou z kultury (podrobnosti viz dodatek 5). Velcí (dospělí) jedinci, kteří nevykazují známky nedávné fisiparie, se přenesou do skleněných misek (např. Petriho misek) s čistou vodou. Poté se synchronizují způsobem popsaným dodatku 5. Po období regenerace, které trvá 10 až 14 dní, by se měli ve zkoušce použít neporušení, úplní jedinci podobné velikosti, kteří po jemném mechanickém stimulu aktivně plavou nebo se plazí. Pokud se zkušební podmínky liší od podmínek kultivace (např. teplotou, světelným režimem a vodou nad sedimentem), měla by být k adaptaci organismů na zkušební podmínky dostačující aklimatizační fáze v délce např. 24 h při teplotě, světelném režimu a s použitím stejné vody nad sedimentem jako ve zkoušce. Adaptovaní máloštětinatci by se měli náhodně přiřadit do zkušebních nádob.
|
Krmení
|
42.
|
Protože se potrava přidává do sedimentu před aplikací zkoušené chemické látky (nebo během ní), zkušební organismy se již v průběhu zkoušky dále nepřikrmují.
|
Světlo a teplota
|
43.
|
Fotoperioda při kultivaci a během zkoušky je obvykle 16 hodin (3), (7). Intenzita osvětlení by se měla udržovat nízká (např. 100–500 lx), aby se imitovaly přirozené podmínky na povrchu sedimentu, a měla by se měřit alespoň jednou během období expozice. Teplota by se měla udržovat na 20 ± 2 °C po celou dobu zkoušky. V jednom daném dni měření by rozdíl teplot mezi zkušebními nádobami neměl být vyšší než ± 1 °C. Zkušební nádoby by se měly umístit do zkušebního inkubátoru nebo do prostoru, kde se zkouška provádí, náhodným způsobem, např. aby se minimalizovalo zkreslení reprodukce v důsledku umístění nádob.
|
Provzdušňování
|
44.
|
Voda nad sedimentem ve zkušebních nádobách by se měla jemně provzdušňovat (např. 2–4 bubliny za sekundu) pomocí Pasteurovy pipety umístěné přibližně 2 cm nad povrchem sedimentu, aby se minimalizovala perturbace sedimentu. Je třeba dbát na to, aby koncentrace rozpuštěného kyslíku neklesla pod 30 % hodnoty nasycení vzduchem (ASV). Dodávka vzduchu by měla být regulovaná, a je-li to nezbytné, upravována alespoň jednou denně během pracovních dnů.
|
Měření kvality vody
|
45.
|
Ve vodě nad sedimentem by se měly měřit tyto parametry kvality vody:
|
Teplota:
|
alespoň v jedné zkušební nádobě každé úrovně koncentrace a jedné zkušební nádobě kontrol jednou týdně a na začátku a na konci období expozice. Pokud je to možné, lze jako doplňující údaj zaznamenávat teplotu okolního média (vzduch v okolním prostředí nebo vodní lázeň), např. v hodinových intervalech;
|
|
Obsah rozpuštěného kyslíku:
|
alespoň v jedné zkušební nádobě každé úrovně koncentrace a jedné zkušební nádobě kontrol jednou týdně a na začátku a na konci období expozice; vyjádřen v mg/l a % ASV (hodnota nasycení vzduchem);
|
|
Dodávka vzduchu:
|
měla by se kontrolovat alespoň jednou denně v pracovních dnech a v případě potřeby upravit;
|
|
pH:
|
alespoň v jedné zkušební nádobě každé úrovně koncentrace a jedné zkušební nádobě kontrol jednou týdně a na začátku a na konci období expozice;
|
|
Celková tvrdost vody:
|
alespoň v jednom opakování kontrol a v jedné zkušební nádobě s nejvyšší koncentrací na začátku a na konci období expozice; vyjádřená v mg/ml CaCO3;
|
|
Celkový obsah amoniaku:
|
alespoň v jednom opakování kontrol a v jedné zkušební nádobě každé úrovně koncentrace na začátku období expozice a poté 3 × týdně; vyjádřen v mg/l NH4
+ nebo NH3 nebo celkového amonného dusíku.
|
Pokud měření parametrů kvality vody vyžaduje odebrání významných vzorků vody z nádob, může být vhodné použít samostatné nádoby pro měření kvality vody, aby se neměnil poměr objemu vody vůči sedimentu.
|
Biologická pozorování
|
46.
|
Během expozice by se měly ve zkušebních nádobách zrakem vyhodnotit jakékoli změny v chování zkušebních organismů (např. vyhýbání se sedimentu, pelety trusu viditelné na povrchu sedimentu) v porovnání s kontrolami. Pozorování by se měla zaznamenat.
|
|
47.
|
Na konci zkoušky se prohlédne každé opakování (doplňující nádoby určené k chemickým analýzám lze z této prohlídky vyloučit). Měla by se použít vhodná metoda pro získání všech jedinců ze zkušební nádoby. Je třeba dbát na to, aby se při odběru žádný jedinec neporanil. Jednou z možných metod je prosít žížalice ze sedimentu. Lze k tomu použít síto z nerezové oceli o vhodné velikosti ok. Většina vody nad sedimentem se opatrně slije a zbývající sediment a voda se protřepou, aby vznikla řídká kaše, kterou lze přecedit přes síto. Při použití síta s otvory o průměru 500 μm projde většina částic sedimentu sítem velmi rychle, nicméně cezení je třeba provést rychle, aby žížalice nezalezly do síta či neprolezly sítem. Použití 250μm síta zabrání žížalicím zalézt do síta nebo jím prolézt, nicméně je třeba dbát na to, aby na sítu zůstalo co nejméně částic sedimentu. Procezenou řídkou kaši z nádoby každého opakování je možné procedit znovu, aby se zajistilo, že se zachytí všechny žížalice. Alternativním způsobem by mohlo být zahřátí sedimentu umístěním zkušebních nádob do vodní lázně o teplotě 50–60 °C. Žížalice vylezou ze sedimentu a je možné je sebrat z povrchu sedimentu pomocí pipety se širokým ústím protažené plamenem. Dalším alternativním způsobem by mohlo být vytvoření řídké kaše sedimentu a nalití této kaše do mělké misky vhodné velikosti. Z tenké vrstvy řídké kaše lze zkušební organismy snadno vybrat pomocí ocelové jehly nebo hodinářské pinzety (použít raději jako vidličku než kleště, aby nedošlo k jejich poranění) a přemístit je do čisté vody. Žížalice se po vybrání z řídké kaše sedimentu promyjí zkušebním médiem a spočítají.
|
|
48.
|
Bez ohledu na použitý způsob by laboratoře měly prokázat, že jejich zaměstnanci jsou schopni získat v průměru nejméně 90 % organismů z celého sedimentu. Například je možné přidat do kontrolního sedimentu nebo zkušebních sedimentů určitý počet zkušebních organismů a za 1 h stanovit počet jedinců, které personál ze sedimentu získá (7).
|
|
49.
|
Měl by se zaznamenat a vyhodnotit celkový počet živých a mrtvých jedinců v každém opakování. Za mrtvé se považují tyto skupiny organismů:
|
a)
|
nevykazující žádnou reakci na jemný mechanický stimul;
|
|
b)
|
vykazující známky rozkladu (v kombinaci s písmenem a));
|
Živé organismy lze navíc zařadit do jedné ze tří skupin:
|
a)
|
velcí úplní jedinci (dospělí) bez regenerovaných částí těla;
|
|
b)
|
úplní jedinci s regenerovanými, světle zbarvenými částmi těla (tj. s novou zadní částí, novou přední částí nebo s novou zadní i přední částí);
|
|
c)
|
neúplní jedinci (tj. jedinci, kteří se nedávno rozdělili, a dosud jim nezregenerovaly části těla).
|
Tato dodatečná pozorování nejsou povinná, ale lze je použít pro doplňující interpretaci biologických výsledků (například vysoký počet jedinců zařazených o skupiny c může naznačovat opoždění reprodukce nebo regenerace při dané expozici). Dále, pokud jsou zpozorovány nějaké rozdíly ve vzhledu (např. léze pokožky, edematózní části těla) mezi exponovanými a kontrolními jedinci, měly by se zaznamenat.
|
|
50.
|
Ihned po spočítání/vyhodnocení se živí jedinci nalezení v každém opakování přenesou do suchých, předem zvážených a označených misek vah (jedna pro každé opakování) a usmrtí pomocí kapky ethanolu na každou misku. Misky vah se poté umístí do sušicí trouby s teplotou nastavenou na 100 ± 5 °C, aby přes noc vyschly, a poté se nechají zchladnout v desikátoru, následně se zváží a stanoví se hmotnost sušiny jedince (nejlépe v g, s přesností alespoň na 4 desetinná místa).
|
|
51.
|
Kromě celkové hmotnosti sušiny je možné stanovit hmotnost sušiny bez anorganických částic způsobem popsaným v (49), aby se zohlednily anorganické složky pocházející z požitého sedimentu přítomného v trávicím traktu organismů.
|
|
52.
|
Biomasa se stanoví jako celková biomasa v každém opakování včetně dospělých a mladých jedinců. Mrtví jedinci by se při stanovování biomasy v každém opakování neměli brát v úvahu.
|
Ověření koncentrací zkoušené chemické látky
Odběr vzorků
|
53.
|
Pro chemickou analýzu zkoušené chemické látky by se měly odebrat vzorky alespoň u nejvyšší koncentrace a nižší koncentrace, alespoň na konci fáze ustavování rovnováhy (před přidáním zkušebních organismů) a na konci zkoušky. Pro analýzu by se měl odebrat nejméně vzorek celkového sedimentu a vody nad sedimentem. V každý odběrový den by se měly odebrat alespoň dva vzorky pro každý substrát a expozici. Jeden z těchto dvou vzorků lze uchovat jako rezervu (která se bude analyzovat např. v případě, že výsledek první analýzy se bude nacházet mimo rozmezí nominální koncentrace ± 20 %). V případě specifických chemických vlastností, např. očekává-li se rychlý rozklad zkoušené chemické látky, lze analytický harmonogram upravit (např. častější odběr vzorků, analýza více úrovní koncentrací) na základě odborného posouzení. Vzorky pak je možné odebírat i průběžně (např. sedmý den po zahájení expozice).
|
|
54.
|
Vzorek vody nad sedimentem by se měl odebrat opatrným odlitím nebo vypuštěním vody, aby se minimalizovala perturbace sedimentu. Měl by se zaznamenat objem vzorků.
|
|
55.
|
Poté, co byla voda nad sedimentem odstraněna, by se sediment měl homogenizovat a přemístit do vhodné nádoby. Zaznamená se hmotnost vzorku vlhkého sedimentu.
|
|
56.
|
Pokud se navíc vyžaduje analýza zkoušené chemické látky v kapilární vodě, měly by se homogenizované a zvážené vzorky sedimentu odstředit, aby se získala kapilární voda. Například je možné přibližně 200 ml vlhkého sedimentu naplnit do 250ml centrifugačních kádinek. Poté by se měly vzorky odstředit bez filtrace, aby se izolovala kapilární voda, např. při 10 000 ± 600 × g po dobu 30–60 minut při teplotě nepřesahující teplotu použitou ve zkoušce. Po odstředění se supernatant slije nebo odpipetuje, přičemž je třeba dát pozor, aby se do něj nedostaly částice sedimentu, a objem se zaznamená. Zaznamená se hmotnost zbylé pelety sedimentu. Pokud se v každém odběrovém dni stanoví hmotnost sušiny sedimentu, může to usnadnit odhad hmotnostní bilance či výtěžku zkoušené chemické látky v systému voda-sediment. V některých případech nemusí být možné provést analýzu koncentrací v kapilární vodě, protože vzorek je příliš malý.
|
|
57.
|
Není-li možné provést okamžitou analýzu, měly by se všechny vzorky uchovávat vhodným způsobem, např. za podmínek uchovávání doporučených pro minimalizaci rozkladu příslušné zkoušené chemické látky (např. vzorky odebrané z prostředí se obvykle uchovávají ve tmě při teplotě – 18 °C). Obstarejte si informace o správných podmínkách uchovávání příslušné zkoušené chemické látky, např. o délce a teplotě uchovávání, extrakčních postupech atd., ještě před zahájením studie.
|
Analytická metoda
|
58.
|
Vzhledem k tomu, že celý postup je určen hlavně správností, přesností a citlivostí analytické metody použité pro analýzu zkoušené chemické látky, je třeba experimentálně kontrolovat, že přesnost a reprodukovatelnost chemické analýzy a rovněž výtěžek zkoušené chemické látky jak z vody, tak ze vzorků sedimentu jsou pro danou analytickou metodu dostatečné alespoň při nejnižší a nejvyšší zkušební koncentraci. Rovněž si ověřte, že zkoušená látka není v kontrolních nádobách detekovatelná v koncentracích vyšších, než je mez kvantifikace. V případě potřeby upravte nominální koncentrace s ohledem na výtěžky ze vzorků sedimentu s přidanou chemickou látkou sloužících ke kontrole kvality (např. když výtěžky leží mimo rozmezí 80–120 % přidaného množství). Se všemi vzorky během zkoušky nakládejte tak, aby se minimalizovala kontaminace a ztráty (např. v důsledku adsorpce zkoušené chemické látky zařízením pro odběr vzorků).
|
|
59.
|
Výtěžek zkoušené chemické látky, mez kvantifikace a mez detekce v sedimentu a vodě by se měly zaznamenat a uvést v závěrečné zprávě.
|
ÚDAJE A PŘEDKLÁDÁNÍ ZPRÁV
Zpracování výsledků
|
60.
|
Hlavní povinné proměnné odezvy ve zkoušce, které se mají statisticky vyhodnotit, jsou biomasa a celkový počet jedinců v každém opakování. Případně je možné rovněž vyhodnotit reprodukci (zvýšení počtu červů) a růst (jako přírůstek suché biomasy). V takovém případě je třeba získat odhad hmotnosti sušiny organismů na začátku expozice např. měřením hmotnosti sušiny v reprezentativním dílčím vzorku skupiny synchronizovaných jedinců, kteří se mají použít ve zkoušce.
|
|
61.
|
Přestože mortalita není cílovým ukazatelem této zkoušky, měly by se údaje o mortalitě vyhodnotit v co největší možné míře. Pro odhad mortality by se měli mezi mrtvé jedince započítat jedinci, kteří nereagují na jemný mechanický stimul nebo vykazují známky rozkladu, a rovněž chybějící jedinci. Údaje o mortalitě by se měly přinejmenším zaznamenat a vzít v úvahu při interpretaci výsledků zkoušky.
|
|
62.
|
Účinné koncentrace by se měly vyjádřit v mg/kg hmotnosti sušiny sedimentu. Pokud výtěžek zkoušené chemické látky naměřený v sedimentu nebo v sedimentu a vodě nad sedimentem na začátku expozice leží v rozmezí 80 až 120 % nominálních koncentrací, je možné vyjádřit účinné koncentrace (ECx, NOEC, LOEC) na základě nominálních koncentrací. Pokud se výtěžek od nominálních koncentrací odchyluje o více než ± 20 % nominálních koncentrací, měly by účinné koncentrace (ECx, NOEC, LOEC) vycházet z koncentrací naměřených na začátku expozice, např. se zohledněním hmotnostní bilance zkoušené chemické látky ve zkušebním systému (viz odstavec 30). V takových případech je možné získat další informace z analýzy zásobního a/nebo aplikačního roztoku, aby se potvrdilo, že byly zkušební sedimenty připraveny správně.
|
ECx
|
63.
|
Hodnoty ECx pro parametry popisované v odstavci 60 se vypočítají pomocí vhodných statistických metod (např. probitové analýzy, logistické nebo Weibullovy funkce, upravené Spearman-Karberovy metody nebo jednoduché interpolace). Pokyny k statistickému vyhodnocení jsou uvedeny v literatuře (15) a (50). Hodnota ECx se získá vložením hodnoty odpovídající x % kontrolního průměru do nalezené rovnice. Pro výpočet hodnoty EC50 či jakékoli jiné ECx je třeba podrobit průměry pro každou expozici (

) regresní analýze. |
NOEC/LOEC
|
64.
|
Pokud je statistická analýza určena ke stanovení hodnoty NOEC/LOEC, jsou zapotřebí statistiky pro každou nádobu (jednotlivé nádoby se považují za opakování). Je třeba použít vhodné statistické metody. Obecně se porovnávají nežádoucí účinky zkoušené položky s kontrolou pomocí testování jednostranné hypotézy při p ≤ 0,05. V následujících odstavcích jsou uvedeny příklady. Pokyny k výběru vhodných statistických metod jsou uvedeny v literatuře (15) a (50).
|
|
65.
|
Normální rozdělení dat lze testovat např. pomocí Kolmogorov-Smirnovova testu dobré shody (goodness-of-fit), testu poměru rozpětí k směrodatné odchylce (R/s test) nebo Shapiro-Wilkova testu (dvoustranný, p ≤ 0,05). Cochranův test, Levenův test nebo Bartlettův test (dvoustranný, p ≤ 0,05) lze použít k testování homogenity rozptylu. Jsou-li splněny nezbytné předpoklady pro použití parametrických testů (normalita, homogenita rozptylu), je možné provést jednostupňovou analýzu rozptylu (ANOVA) a následné testy vícenásobného porovnávání. Párová porovnávání (např. Dunnettův t-test) nebo testy sestupného trendu (např. Williamsův test) lze použít k výpočtu, zda jsou mezi kontrolami a různými koncentracemi zkoušené položky významné rozdíly (p ≤ 0,05). Jinak by se ke stanovení hodnoty NOEC a LOEC měly použít neparametrické metody (např. Bonferroniho U-test podle Holma nebo Jonckheere-Terpstrův test trendu).
|
Limitní zkouška
|
66.
|
Pokud byla provedena limitní zkouška (pouze porovnání kontroly a jedné expozice) a jsou splněny nezbytné předpoklady pro použití parametrických testů (normalita, homogenita), lze metrické proměnné (celkový počet jedinců a biomasu vyjádřenou jako hmotnost sušiny zkušebních organismů) vyhodnotit Studentovým testem (t-test). Pokud tyto požadavky splněny nejsou, lze použít t-test upravený pro nerovnost rozptylů (Welchův t-test) nebo neparametrický test, jako je například Mann-Whitneyův U-test. V dodatku 6 je uvedeno několik informací o statistické síle zjištěné během testování hypotézy v okružním testu této metody.
|
|
67.
|
Pro stanovení významných rozdílů mezi kontrolami (kontrola a kontrola s rozpouštědlem), lze testovat opakování každé kontroly způsobem popsaným pro limitní zkoušku. Pokud se v těchto testech nezjistí významné rozdíly, lze všechna opakování kontroly a kontroly s rozpouštědlem sloučit. Jinak by se měly všechny expozice porovnávat s kontrolou s rozpouštědlem.
|
Interpretace výsledků
|
68.
|
Výsledky je třeba interpretovat opatrně, pokud došlo k odchylkám od této zkušební metody a v případě, kdy se naměřené koncentrace zkušebních koncentrací nacházejí blízko meze detekce použité analytické metody. Všechny odchylky od této zkušební metody se musí zaznamenat.
|
Závěrečná zpráva
|
69.
|
Závěrečná zpráva by měla obsahovat minimálně tyto informace:
|
—
|
Zkoušená chemická látka:
|
—
|
chemické identifikační údaje (obecný název, chemický název, strukturní vzorec, číslo CAS atd.) včetně čistoty a analytické metody použité ke kvantifikaci zkoušené chemické látky; zdroj zkoušené chemické látky, identita a koncentrace jakéhokoli použitého rozpouštědla,
|
|
—
|
jakékoli dostupné informace o fyzikální povaze a fyzikálně-chemických vlastnostech získané před zahájením zkoušky (např rozpustnost ve vodě, tlak par, rozdělovací koeficient v půdě (nebo v sedimentu, je-li k dispozici), log Kow, stálost ve vodě atd.).
|
|
|
—
|
Zkušební druh:
|
—
|
vědecký název, zdroj, případné předběžné ošetření, aklimatizace, kultivační podmínky atd.
|
|
|
—
|
Zkušební podmínky:
|
—
|
použitý zkušební postup (např. statický, semistatický nebo průtokový),
|
|
—
|
uspořádání zkoušky (např. počet, materiál a velikost zkušebních komor, objem vody v nádobě, hmotnost a objem sedimentu v nádobě, (u semistatických a průtokových postupů: frekvence výměny objemu vody), jakékoli provzdušňování použité před zkouškou a během ní, počet opakování, počet jedinců v každém opakování na začátku expozice, počet zkušebních koncentrací, délka úpravy, doba dosažení rovnováhy a expozice, frekvence odběru vzorků),
|
|
—
|
hloubka sedimentu a vody nad sedimentem,
|
|
—
|
metoda předběžného ošetření zkoušené chemické látky a přidání/aplikace látky do sedimentu,
|
|
—
|
nominální zkušební koncentrace, podrobnosti o odběrech vzorků pro chemickou analýzu a analytické metody, pomocí nichž byly stanoveny koncentrace zkoušené chemické látky,
|
|
—
|
charakteristiky sedimentu, jak jsou popsány v odstavcích 24–25 a jakákoli další provedená měření; příprava uměle vytvořeného sedimentu,
|
|
—
|
příprava zkušební vody (pokud se používá rekonstituovaná voda) a její charakteristiky (koncentrace kyslíku, pH, vodivost, tvrdost a jakákoli další provedená měření) před zahájením zkoušky,
|
|
—
|
podrobné informace o krmení včetně typu krmiva, přípravy, množství a režimu krmení,
|
|
—
|
intenzita osvětlení a fotoperioda(y),
|
|
—
|
metody použité ke stanovení všech biologických parametrů (např. odběr vzorků, pozorování, vážení zkušebních organismů) a všech abiotických parametrů (např. parametry kvality vody a sedimentu),
|
|
—
|
objemy a/nebo hmotnosti všech vzorků pro chemickou analýzu,
|
|
—
|
podrobné informace o expozici všech vzorků pro chemickou analýzu, včetně podrobností o přípravě, uchovávání, postupech přidání zkoušené chemické látky, extrakci a analytických postupech (a přesnosti), pokud jde o zkoušenou chemickou látku a její výtěžky.
|
|
|
—
|
Výsledky:
|
—
|
kvalita vody ve zkušebních nádobách (pH, teplota, koncentrace rozpuštěného kyslíku, tvrdost, koncentrace amoniaku a jakákoli další provedená měření),
|
|
—
|
celkový obsah organického uhlíku (TOC), poměr hmotnosti sušiny k mokré hmotnosti, pH sedimentu a jakákoli další provedená měření,
|
|
—
|
celkový počet a – pokud se stanovuje – také počet úplných a neúplných jedinců v každé zkušební komoře na konci zkoušky,
|
|
—
|
hmotnost sušiny zkušebních organismů v každé zkušební komoře na konci zkoušky, a měří-li se, také hmotnost sušiny dílčího vzorku organismů na začátku zkoušky,
|
|
—
|
jakékoli zpozorované abnormální chování v porovnání s kontrolami (např. vyhýbání se sedimentu, přítomnost nebo nepřítomnost pelet trusu),
|
|
—
|
jakákoli pozorovaná mortalita,
|
|
—
|
odhady cílových ukazatelů toxicity (např. ECx, NOEC a/nebo LOEC) a statistické metody použité k jejich stanovení,
|
|
—
|
nominální zkušební koncentrace, naměřené zkušební koncentrace a výsledky všech analýz pro stanovení koncentrace zkoušené chemické látky ve zkušebních nádobách,
|
|
—
|
jakékoli odchylky od kritérií platnosti.
|
|
|
—
|
Vyhodnocení výsledků:
|
—
|
soulad výsledků s kritérii platnosti uvedenými v odstavci 13,
|
|
—
|
diskuse o výsledcích včetně případného vlivu na výsledek zkoušky v důsledku odchylek od této zkušební metody.
|
|
|
LITERATURA
|
1)
|
EC (2003). Technical Guidance Document in support of Commission Directive 93/67/EEC on Risk Assessment for new notified substances, Commission Regulation (EC) No 1488/94 on Risk Assessment for existing substances and Directive 98/8/EC of the European Parliament and of the Council concerning the placing of biocidal products on the market; Part I – IV. Office for Official Publications of the EC (European Commission), Luxembourg.
|
|
2)
|
OECD (1992a). Report of the OECD workshop on effects assessment of chemicals in sediment. OECD Monographs No. 60. Organisation for Economic Co-operation and Development (OECD), Paris.
|
|
3)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
4)
|
ASTM International (2002). Standard Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, E1706-00. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
5)
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. and Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269-279.
|
|
6)
|
Kapitola C.27 této přílohy, ‚Zkouška toxicity pro chironomidy v systému sediment-voda za použití sedimentu se známým přídavkem zkoušené chemické látky‘.
|
|
7)
|
US EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
8)
|
Environment Canada (1997). Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius). Biological Test Method. Report SPE 1/RM/32. December 1997.
|
|
9)
|
Hill, I.R., Matthiessen, P., Heimbach, F. (eds), 1993, Guidance document on Sediment Toxicity Tests and Bioassays for freshwater and Marine Environments, From the SETAC-Europe Workshop On Sediment Toxicity Assessment, 8-10 November 1993, Renesse (NL).
|
|
10)
|
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Edited by M. Streloke and H.Köpp. Berlin 1995.
|
|
11)
|
Riedhammer C. & B. Schwarz-Schulz (2001). The Newly Proposed EU Risk Assessment Concept for the Sediment Compartment. J. Soils Sediments 1(2), 105-110.
|
|
12)
|
ASTM International (2004). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing and for selection of samplers used to collect benthic invertebrates. American Society for Testing and Materials, E 1391-03.
|
|
13)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
|
|
14)
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
15)
|
Environment Canada (2003). Guidance Document on Statistical Methods for Environmental Toxicity Tests; fifth draft, March 2003; Report EPS 1/RM/___
|
|
16)
|
Nikkilä A., Halme A., Kukkonen J.V.K. (2003). Toxicokinetics, toxicity and lethal body residues of two chlorophenols in the oligochaete worm, Lumbriculus variegatus, in different sediments. Chemosphere 51: 35-46.
|
|
17)
|
Baily H.C., & Liu D.H.W. (1980). Lumbriculus variegatus, a Benthic Oligochaete, as a Bioassay Organism. p. 205-215. In J.C. Eaton, P.R. Parrish, and A.C. Hendricks (eds). Aquatic Toxicology, ASTM STP 707. American Society for Testing and Materials.
|
|
18)
|
Chapman K. K., Benton M. J., Brinkhurst R. O. & Scheuerman P. R. (1999). Use of the aquatic oligochaetes Lumbriculus variegatus and Tubifex tubifex for assessing the toxicity of copper and cadmium in a spiked-artificial-sediment toxicity test. Environmental Toxicology. 14(2): 271-278.
|
|
19)
|
Meyer J.S., Boese C.J. & Collyard S.A. (2002). Whole-body accumulation of copper predicts acute toxicity to an aquatic oligochaete (Lumbriculus variegatus) as pH and calcium are varied. Comp. Biochem. Physiol. Part C 133:99-109.
|
|
20)
|
Schubauer-Berigan M.K., Dierkes J.R., Monson P.D. & Ankley G.T. (1993). pH-dependent toxicity of cadmium, copper, nickel, lead and zinc to Ceriodaphnia dubia, Pimephales promelas, Hyalella azteca and Lumbriculus variegatus. Environ. Toxciol. Chem. 12(7):1261-1266.
|
|
21)
|
West, C.W., V.R. Mattson, E.N. Leonard, G.L. Phipps & G.T. Ankley (1993). Comparison of the relative sensitivity of three benthic invertebrates to copper-contaminated sediments from the Keweenaw Waterway. Hydrobiol. 262:57-63.
|
|
22)
|
Ingersoll, C.G., Ankley, G.T., Benoit D.A., Brunson, E.L., Burton, G.A., Dwyer, F.J., Hoke, R.A., Landrum, P. F., Norberg-King, T. J. and Winger, P.V. (1995). Toxicity and bioaccumulation of sediment-associated contaminants using freshwater invertebrates: A review of methods and applications. Environ. Toxicol. Chem. 14, 1885-1894.
|
|
23)
|
Kukkonen, J. and Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457-1468.
|
|
24)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998a). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196-2202.
|
|
25)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998b). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183-194.
|
|
26)
|
Landrum, P.F., Gedeon, M.L., Burton, G.A., Greenberg. M.S., & Rowland, C.D. (2002). Biological Responses of Lumbriculus variegatus Exposed to Fluoranthene-Spiked Sediment. Arch. Environ. Contam. Toxicol. 42: 292-302.
|
|
27)
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191-201.
|
|
28)
|
Ingersoll, C.G., Brunson, E.L., Wang N., Dwyer, F.J., Ankley, G.T., Mount D.R., Huckins J., Petty. J. and Landrum, P. F. (2003). Uptake and depuration of non-ionic organic contaminants from sediment by the oligochaete, Lumbriculus variegatus. Environmental Toxicology and Chemistry 22, 872-885.
|
|
29)
|
Rodriguez, P. & Reynoldson, T.B. (1999). Laboratory methods and criteria for sediment bioassessment. In: A. Mudroch, J.M. Azcue & P. Mudroch (eds.): Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
|
|
30)
|
Liebig, M., Egeler, Ph. Oehlmann, J., & Knacker, Th. (2005). Bioaccumulation of14C-17α-ethinylestradiol by the oligochaete Lumbriculus variegatus in artificial sediment. Chemosphere 59, 271-280.
|
|
31)
|
Brust, K., O. Licht, V. Hultsch, D. Jungmann & R. Nagel (2001). Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Environ. Toxicol. Chemistry, Vol. 20, pp. 2000–2007.
|
|
32)
|
Oetken, M., K.-U. Ludwichowski & R. Nagel (2000). Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG-AltstoffV. By order of the Federal Environmental Agency (Umweltbundesamt Berlin), FKZ 360 12 001, March 2000.
|
|
33)
|
Leppänen M.T. & Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503-1508.
|
|
34)
|
Dermott R. & Munawar M. (1992). A simple and sensitive assay for evaluation of sediment toxicity using Lumbriculus variegatus (Müller). Hydrobiologia 235/236: 407-414.
|
|
35)
|
Drewes C.D. & Fourtner C.R. (1990). Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Develop. Biol. 138: 94-103.
|
|
36)
|
Brinkhurst, R.O. (1971). A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. No. 22.
|
|
37)
|
Kapitola C.1 této přílohy, Zkouška akutní toxicity pro ryby.
|
|
38)
|
OECD (1992c). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Paris.
|
|
39)
|
Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G. & Nagel, R. (1997). Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere 35, 835-852.
|
|
40)
|
Meller, M., P. Egeler, J. Roembke, H. Schallnass, R. Nagel and B. Streit. (1998). Short-term Toxicity of Lindane, Hexachlorobenzene and Copper Sulphate on Tubificid Sludgeworms (Oligochaeta) in Artificial Media. Ecotox. and Environ. Safety, 39, 10-20.
|
|
41)
|
Egeler, Ph., Römbke, J., Knacker, Th., Franke, C. & Studinger, G. (1999). Workshop on ‚Bioaccumulation: Sediment test using benthic oligochaetes‘, 26.-27.04.1999, Hochheim/Main, Germany. Report on the R+D-project No. 298 67 419, Umweltbundesamt, Berlin.
|
|
42)
|
Suedel, B.C. and Rodgers, J.H. (1993). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13, 1163-1175.
|
|
43)
|
Naylor, C. and C. Rodrigues. (1995). Development of a test method for Chironomus riparius using a formulated sediment. Chemosphere 31: 3291-3303.
|
|
44)
|
Kaster, J.L., Klump, J.V., Meyer, J., Krezoski, J. & Smith, M.E. (1984). Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia 11, 181-184.
|
|
45)
|
Martinez-Madrid, M., Rodriguez, P., Perez-Iglesias, J.I. & Navarro, E. (1999). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology 8, 111-124.
|
|
46)
|
Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
|
|
47)
|
Landrum, P.F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Technol. 23, 588-595.
|
|
48)
|
Brooke, L.T., Ankley, G.T., Call, D.J. & Cook, P.M. (1996). Gut content and clearance for three species of freshwater invertebrates. Environ. Toxicol. Chem. 15, 223-228.
|
|
49)
|
Mount, D.R., Dawson, T.D. & Burkhard, L.P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Environ. Toxicol. Chem. 18, 1244-1249.
|
|
50)
|
OECD 2006. Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. OECD Series on Testing and Assessment No. 54, OECD, Paris, France.
|
|
51)
|
Liebig M., Meller M. & Egeler P. (2004). Sedimenttoxizitätstests mit aquatischen Oligochaeten – Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Proceedings 5/2004: Statusseminar Sedimentkontakttests. March 24-25, 2004. BfG (Bundesanstalt für Gewässerkunde), Koblenz, Germany. pp. 107-119.
|
Další literatura o statistických postupech:
Dunnett,C.W. (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
Dunnett,C.W. (1964). New tables for multiple comparisons with a control. Biometrics 20, 482-491.
Finney, D.J. (1971). Probit Analysis (3rd ed.), pp. 19-76. Cambridge Univ. Press.
Finney, D.J. (1978). Statistical Method in Biological Assay. Charles Griffin & Company Ltd, London.
Hamilton, M.A., R.C. Russo and R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714-719; Correction: Environ. Sci. Technol. 12 (1998), 417.
Holm, S. (1979). A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
Sokal, R.R. and F.J. Rohlf. (1981) Biometry. The principles and practice of statistics in biological research. 2nd edition. W.H. Freeman and Company. New York.
Miller, R.G., Jr. (1986). Beyond ANOVA, basics of applied statistics. John Wiley & Sons. New York.
Shapiro S.S. & Wilk M.B (1965). An analysis of variance test for normality (complete samples). Biometrika 52: 591-611.
Williams, D.A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
Williams, D.A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519-531.
Dodatek 1
Definice
Pro účely této zkušební metody se použijí tyto definice:
|
|
Chemickou látkou se rozumí látka nebo směs.
|
|
|
Období stabilizace se používá k ustálení mikrobiální složky sedimentu a k odstranění např. amoniaku pocházejícího ze složek sedimentu. Probíhá před přidáním zkoušené chemické látky do sedimentu. Po uplynutí období stabilizace se voda nad sedimentem obvykle zlikviduje.
|
|
|
ECx
je koncentrace zkoušené chemické látky v sedimentu, která vede k x % (např. 50 %) účinku na biologický parametr během stanoveného období expozice.
|
|
|
Období dosahování rovnováhy (ekvilibrace) slouží k tomu, aby se zkoušená chemická látka mohla rozdělit mezi pevnou fázi, kapilární vodu a vodu nad sedimentem. Probíhá po přidání zkoušené chemické látky do sedimentu a před přidáním zkušebních organismů.
|
|
|
Fáze expozice je doba, během níž jsou zkušební organismy vystaveny zkoušené chemické látce.
|
|
|
Uměle vytvořený sediment neboli rekonstituovaný, umělý či syntetický sediment je směs materiálů použitá k napodobení fyzických složek přírodního sedimentu.
|
|
|
Nejnižší koncentrace s pozorovaným účinkem (LOEC) je nejnižší zkušební koncentrace zkoušené chemické látky, při níž je pozorován významný toxický účinek zkoušené látky ve srovnání s kontrolou (při p ≤ 0,05). Všechny zkušební koncentrace vyšší než LOEC však musí mít stejný nebo větší účinek, než je účinek pozorovaný při koncentraci LOEC. Nelze-li tyto dvě podmínky splnit, musí být podrobně vysvětleno, jak byla zvolena hodnota LOEC (a tedy i NOEC).
|
|
|
Koncentrace bez pozorovaných účinků (NOEC) je zkušební koncentrace bezprostředně nižší než LOEC, která při srovnání s kontrolou nemá pro danou dobu expozice statisticky významný účinek (při p ≤ 0,05).
|
|
|
Rozdělovací koeficient oktanol-voda (Kow; někdy se vyjadřuje jako Pow) je poměr rozpustnosti chemické látky v n-oktanolu a vodě v rovnovážném stavu a vyjadřuje lipofilitu chemické látky (kapitola A.24 této přílohy). Hodnota Kow nebo logaritmus Kow (log Kow) se používá jako ukazatel možné bioakumulace dané chemické látky vodními organismy.
|
|
|
Rozdělovací koeficient organický uhlík/voda (Koc) je rovnovážný poměr mezi koncentrací chemické látky v/na frakci organického uhlíku v sedimentu a koncentrací chemické látky ve vodě.
|
|
|
Voda nad sedimentem je voda nacházející se nad sedimentem ve zkušební nádobě.
|
|
|
Kapilární voda nebo intersticiální voda je voda zaplňující prostor mezi částicemi sedimentu či půdy.
|
|
|
Sediment se známým přídavkem chemické látky (spiked sediment) je sediment, do něhož byla přidána zkoušená chemická látka.
|
|
|
Zkoušenou chemickou látkou se rozumí jakákoli látka nebo směs zkoušená pomocí této zkušební metody.
|
Dodatek 2
SLOŽENÍ DOPORUČENÉ REKONSTITUOVANÉ VODY
(převzato z kapitoly C.1 této přílohy (1))
|
a)
|
Roztok chloridu vápenatého dihydrátu
Rozpusťte 11,76 g CaCl2 · 2H2O v deionizované vodě a doplňte na objem 1 l deionizovanou vodou.
|
|
b)
|
Roztok síranu hořečnatého heptahydrátu
Rozpusťte 4,93 g MgSO4 · 7H2O v deionizované vodě a doplňte na objem 1 l deionizovanou vodou.
|
|
c)
|
Roztok hydrogenuhličitanu sodného
Rozpusťte 2,59 g NaHCO3 v deionizované vodě a doplňte na objem 1 l deionizovanou vodou.
|
|
d)
|
Roztok chloridu draselného
Rozpusťte 0,23 g KCl v deionizované vodě a doplňte na objem 1 l deionizovanou vodou.
|
Všechny chemikálie musí být čistoty p.a.
Vodivost destilované nebo deionizované vody by neměla přesahovat 10 μScm– 1.
Smísí se 25 ml od každého roztoku a) až d) a celkový objem se doplní na 1 l deionizovanou vodou. Celkové množství iontů vápníku a hořčíku v těchto roztocích činí 2,5 mmol/l.
Poměr iontů Ca:Mg je 4:1 a iontů Na:K je 10:1. Kyselinová neutralizační kapacita KS4.3 tohoto roztoku je 0,8 mmol/l.
Provzdušňujte ředicí vodu, dokud nebude saturována kyslíkem, a poté ji před použitím skladujte přibližně dva dny bez dalšího provzdušňování.
LITERATURA
|
(1)
|
Kapitola C.1 této přílohy, Zkouška akutní toxicity pro ryby.
|
Dodatek 3
Fyzikálně-chemické parametry přijatelné ředicí vody
|
Složka
|
Koncentrace
|
|
Pevné částice
|
< 20 mg/l
|
|
Celkový obsah organického uhlíku
|
< 2 μg/l
|
|
Neionizovaný amoniak
|
< 1 μg/l
|
|
Zbytkový chlor
|
< 10 μg/l
|
|
Celkové organofosforové pesticidy
|
< 50 ng/l
|
|
Celkové organochlorové pesticidy a polychlorované bifenyly
|
< 50 ng/l
|
|
Celkový organický chlor
|
< 25 ng/l
|
|
(převzato z OECD (1992) (1))
|
LITERATURA
|
1)
|
OECD (1992). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Paris.
|
Dodatek 4
Doporučený umělý sediment – pokyny k přípravě a uchovávání
Složky sedimentu
|
Složka
|
Vlastnosti
|
% hmotnosti sušiny sedimentu
|
|
Rašelina
|
Sfagnová rašelina, stupeň rozkladu: ‚střední‘, vysušená na vzduchu, bez viditelných zbytků rostlin, jemně mletá (velikost částic ≤ 0,5 mm)
|
5 ± 0,5
|
|
Křemenný písek
|
Velikost zrn: ≤ 2 mm, ale > 50 % částic by se mělo nacházet v rozmezí 50–200 μm
|
75–76
|
|
Kaolinitický jíl
|
Obsah kaolinitu ≥ 30 %
|
20 ± 1
|
|
Zdroj potravy
|
Např. list kopřivy v prášku (Folia urticae), listy Urtica dioica (kopřiva dvoudomá), jemně mleté (velikost částic ≤ 0,5 mm), v souladu s lékárenskými normami, pro lidskou spotřebu; jako přídavek k suchému sedimentu
|
0,4–0,5 %
|
|
Organický uhlík
|
Upraven přidáním rašeliny a písku
|
2 ± 0,5
|
|
Uhličitan vápenatý
|
CaCO3, v práškové formě, chemicky čistý, jako přídavek k suchému sedimentu
|
0,05–1
|
|
Deionizovaná voda
|
Vodivost ≤ 10 μS/cm, jako přídavek k suchému sedimentu
|
30–50
|
Poznámka: Očekávají-li se zvýšené koncentrace amoniaku, např. je-li známo, že zkoušená chemická látka inhibuje nitrifikaci, může být vhodné nahradit 50 % kopřivového prášku bohatého na dusík celulózou (např. práškem α-celulózy, chemicky čistým, s velikostí částic ≤ 0,5 mm; (1) (2)).
Příprava
Rašelina se usuší na vzduchu a rozemele na jemný prášek. Pomocí vysoce výkonného homogenizačního zařízení se připraví suspenze požadovaného množství rašelinného prášku v deionizované vodě. pH této suspenze se upraví na 5,5 ± 0,5 pomocí CaCO3. Suspenze se stabilizuje po dobu nejméně dvou dní za mírného promíchávání při 20 ± 2 °C za účelem ustálení pH a vytvoření stabilní mikrobiální složky. Poté se opět změří pH, které by mělo být 6,0 ± 0,5. Pak se suspenze rašeliny smísí s ostatními složkami (písek a kaolinitický jíl) a s deionizovanou vodou s cílem získat homogenní sediment s obsahem vody v rozmezí 30–50 procent sušiny sedimentu. Znovu se změří pH konečné směsi a v případě nutnosti se opět upraví pomocí CaCO3 na hodnotu 6,5 až 7,5. Pokud se však očekává vznik amoniaku, může být vhodné udržovat pH sedimentu pod hodnotou 7,0 (např. v rozmezí 6,0–6,5). Odeberou se vzorky sedimentu pro stanovení obsahu sušiny a obsahu organického uhlíku. Pokud se předpokládá vznik amoniaku, je možné uměle vytvořený sediment stabilizovat po dobu sedmi dnů za stejných podmínek, jaké převažují v následující zkoušce (např. poměr sediment-voda 1:4, výška vrstvy sedimentu stejná jako ve zkušebních nádobách) před přidáním zkoušené chemické látky, tj. sediment by se měl přelít vodou, která by se měla provzdušňovat. Na konci tohoto období stabilizace by se měla voda nad sedimentem odstranit a zlikvidovat. Poté se do sedimentu vmíchá křemenný písek s přidanou zkoušenou chemickou látkou pro každou úroveň expozice, sediment se rozdělí do zkušebních nádob jednotlivých opakování a přelije se zkušební vodou. Poté se nádoby inkubují za stejných podmínek, jaké budou převládat v následující zkoušce. V tomto okamžiku začíná období dosahování rovnováhy. Voda nad sedimentem by se měla provzdušňovat.
Vybraný zdroj potravy by se měl přidat do sedimentu před přidáním zkoušené chemické látky nebo během něj. Je možné smíchat ho na počátku se suspenzí rašeliny (viz výše). Nicméně je třeba předejít nadměrnému rozkladu zdroje potravy před přidáním zkušebních organismů – např. v případě dlouhého období dosažení rovnováhy – udržováním co možná nejkratší doby od přidání potravy do začátku expozice. Aby se zajistilo, že potrava rovněž obsahuje zkoušenou chemickou látku, měl by se zdroj potravy smísit se sedimentem nejpozději v den přidání zkoušené chemické látky do sedimentu.
Skladování
Suché složky pro přípravu umělého sedimentu lze skladovat na suchém a chladném místě při pokojové teplotě. Připravený sediment s přidanou zkoušenou chemickou látkou by se měl okamžitě použít ve zkoušce. Vzorky sedimentu s přidanou zkoušenou chemickou látkou lze uchovávat za podmínek doporučených pro konkrétní zkoušenou chemickou látku až do provedení analýzy.
LITERATURA
|
1)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
|
|
2)
|
Liebig M., Meller M. & Egeler P. (2004). Sedimenttoxizitätstests mit aquatischen Oligochaeten – Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Proceedings 5/2004: Statusseminar Sedimentkontakttests. March 24-25, 2004. BfG (Bundesanstalt für Gewässerkunde), Koblenz, Germany. pp. 107-119.
|
Dodatek 5
Metody kultivace Lumbriculus variegatus
Druh Lumbriculus variegatus (MÜLLER), čeleď Lumbriculidae (žížalicovití), třída Oligochaeta (máloštětinatci) žije ve sladkovodních sedimentech a je široce používán v ekotoxikologických zkouškách. Lze jej snadno kultivovat v laboratorních podmínkách. V následujícím textu je uveden přehled kultivačních metod.
Metody kultivace
Kultivační podmínky Lumbriculus variegatus jsou podrobně uvedeny v Phipps et al. (1993) (1), Brunson et al. (1998) (2), ASTM (2000) (3), U.S. EPA (2000) (4). Níže je uveden krátký souhrn těchto podmínek. Hlavní výhodou L. variegatus je jeho rychlá reprodukce vedoucí k rychlému nárůstu biomasy v populacích kultivovaných v laboratoři (např. (1), (3), (4), (5)).
Zkušební organismy lze kultivovat ve velkých akváriích (57–80 l) při teplotě 23 °C s fotoperiodou 16 h světlo:8 hodin tma (100–1 000 lx) s použitím každodenně obměňované přírodní vody (45–50 l na akvárium). Substrát se připraví nastříháním nebělených utěrek z hnědého papíru na proužky, které lze několik sekund mixovat s kultivační vodou, aby vznikly malé kousky papírového substrátu. Tento substrát lze poté rovnou použít v kultivačních akváriích pro Lumbriculus, jejichž dno se substrátem pokryje, nebo jej lze uchovávat zmrazený v deionizované vodě pro pozdější použití. Nový substrát v nádrži obvykle vydrží přibližně dva měsíce.
Každá kultura se zahajuje na počtu 500–1 000 jedinců a krmí se 10 ml suspenze obsahující 6 g krmiva pro mladé lososovité ryby třikrát týdně za obnovovacích nebo průtokových podmínek. Statické nebo semistatické kultury by měly dostat méně potravy, aby se zabránilo růstu bakterií a hub.
Za těchto podmínek se počet jedinců v kultuře obvykle zdvojnásobí za přibližně 10 až 14 dnů.
Jinak lze Lumbriculus variegatus rovněž kultivovat v systému složeném z vrstvy křemenného písku, jaký se používá pro umělý sediment, (hloubka 1–2 cm) a rekonstituované vody. Jako kultivační nádoby lze použít nádoby ze skla nebo nerezové oceli o výšce 12 až 20 cm. Voda nad sedimentem by se měla jemně provzdušňovat (např. 2 bubliny za sekundu) pomocí Pasteurovy pipety umístěné přibližně 2 cm nad povrchem sedimentu. Aby se zabránilo hromadění např. amoniaku, měla by se voda nad sedimentem měnit pomocí průtokového systému nebo alespoň jednou týdně ručně. Máloštětinatce lze chovat při pokojové teplotě s fotoperiodou 16 hodin světla (o intenzitě 100–1 000 lx) a 8 hodin tmy. V semistatické kultuře (výměna vody jednou týdně) se krmí krmivem TetraMin dvakrát týdně (např. 0,6–0,8 mg na jeden cm2 povrchu sedimentu), které lze aplikovat jako suspenzi 50 mg TetraMin na jeden ml deionizované vody.
Lumbriculus variegatus lze z kultur odebrat např. přenesením substrátu v síti s malými oky nebo přenesením organismů pomocí skleněné pipety s širokou špičkou (přibližně o průměru 5 mm) protažené plamenem do zvláštní kádinky. Pokud se do této kádinky přenese zároveň i nějaký substrát, nechá se kádinka obsahující zkušební organismy a substrát přes noc za průtokových podmínek, čímž se z ní substrát odstraní, zatímco organismy zůstanou na dně nádoby. Poté je lze přenést do nově připravených kultivačních nádrží nebo dále zpracovat pro účely zkoušky, jak je popsáno v (3) a (4) nebo v následujícím textu.
Při použití L. variegatus ve zkouškách sedimentu je nutné velmi kriticky pohlížet na jeho způsob rozmnožování (architomie čili morfalaxe, např. (6)). Toto nepohlavní rozmnožování vede ke vzniku dvou fragmentů, které po určitou dobu nepřijímají potravu, dokud nedojde k regeneraci hlavové nebo ocasní části (např. (7), (8)). To znamená, že k expozici L. variegatus požíráním kontaminovaného sedimentu nedochází kontinuálně.
Proto by se měla provést synchronizace, aby se minimalizovalo nekontrolované rozmnožování a regenerace a následná vysoká variabilita výsledků zkoušky. K této variabilitě může dojít, když jsou někteří jedinci, kteří se rozdělili, a proto po určité časové období nepřijímají potravu, méně vystaveni zkoušené chemické látce než jedinci, u nichž během zkoušky nedošlo k dělení (9), (10), (11). 10 až 14 dní po začátku expozice by se měly organismy uměle fragmentovat (synchronizace). K synchronizaci by se měli vybrat velcí (dospělí) jedinci, kteří pokud možno nevykazují známky nedávné morfalaxe. Tyto jedince je možné umístit na skleněné sklíčko do kapky kultivační vody a poté přeříznout ve střední části těla skalpelem. Je třeba dbát na to, aby zadní konce měly přibližně stejnou délku. Zadní konce se nechají zregenerovat v kultivační nádobě obsahující stejný substrát, který byl použit ke kultivaci, a rekonstituovanou vodu a pak je zahájena expozice. Známkou toho, že došlo k regeneraci nových hlavových částí, je, když se synchronizovaní jedinci zavrtávají do substrátu (přítomnost regenerovaných hlavových částí lze potvrdit prohlédnutím reprezentativního dílčího vzorku pod binokulárním mikroskopem). Očekává se, že se zkušební organismy poté nacházejí v podobném fyziologickém stavu. To znamená, že pokud během zkoušky dojde k rozmnožování synchronizovaných jedinců morfalaxí, očekává se, že budou prakticky všichni živočichové vystaveni sedimentu s přidanou zkoušenou chemickou látkou stejně. Krmení synchronizovaných jedinců by se mělo provést, jakmile se začnou zavrtávat do substrátu, nebo 7 dnů po přeříznutí. Režim krmení by měl být zhruba stejný jako u běžných kultur, ale je vhodné krmit synchronizované jedince stejným zdrojem potravy, jaký se použije ve zkoušce. Zkušební organismy by se měly udržovat při zkušební teplotě 20 ± 2 °C. Po regeneraci by se měli ke zkoušce použít neporušení úplní jedinci, kteří na jemný mechanický stimul reagují aktivním plaváním nebo plazením. Je třeba zabránit poranění nebo oddělení části těla živočichů, např. používáním pipet s otavenými hranami nebo zubních háčků z nerezové oceli při manipulaci s nimi.
Zdroje startovacích kultur Lumbriculus variegatus (adresy v USA převzaty z (4))
|
Evropa
|
|
ECT Oekotoxikologie GmbH
|
|
Böttgerstr. 2-14
|
|
D-65439 Flörsheim/Main
|
|
Německo
|
|
|
Bayer Crop Science AG
|
|
Development – Ecotoxicology
|
|
Alfred-Nobel-Str. 50
|
|
D-40789 Monheim
|
|
Německo
|
|
|
|
|
|
University of Joensuu
|
|
Laboratory of Aquatic Toxicology
|
|
Dept. of Biology
|
|
Yliopistokatu 7, P.O. Box 111
|
|
FIN-80101 Joensuu
|
|
Finsko
|
|
|
Dresden University of Technology
|
|
Institut für Hydrobiologie
|
|
Fakultät für Forst-, Geo- und Hydrowissenschaften
|
|
Mommsenstr. 13
|
|
D-01062 Dresden
|
|
Německo
|
|
|
|
|
|
C.N.R.- I.R.S.A.
|
|
Italian National Research Council
|
|
Water Research Institute
|
|
Via del Mulino 19
|
|
I-20047 Brugherio (MB)
|
|
Itálie
|
|
|
|
|
|
|
U.S.A.
|
|
U.S. Environmental Protection Agency
|
|
Mid-Continent Ecological Division
|
|
6201 Congdon Boulevard
|
|
Duluth, MN 55804
|
|
|
Michigan State University
|
|
Department of Fisheries and Wildlife
|
|
No. 13 Natural Resources Building
|
|
East Lansing, MI 48824-1222
|
|
|
|
|
|
U.S. Environmental Protection Agency
|
|
Environmental Monitoring System Laboratory
|
|
26 W. Martin Luther Dr.
|
|
Cincinnati, OH 45244
|
|
|
Wright State University
|
|
Institute for Environmental Quality
|
|
Dayton, OH 45435
|
|
|
|
|
|
Columbia Environmental Research Center
|
|
U.S. Geological Survey
|
|
4200 New Haven Road
|
|
Columbia, MO 65201
|
|
|
Great Lakes Environmental Research
|
|
Laboratory, NOAA
|
|
2205 Commonwealth Boulevard
|
|
Ann Arbor, MI 48105-1593
|
|
LITERATURA
|
1)
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. and Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269-279.
|
|
2)
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191-201.
|
|
3)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
4)
|
US EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
5)
|
Kukkonen, J. and Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457-1468.
|
|
6)
|
Drewes C.D. & Fourtner C.R. (1990). Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Develop. Biol. 138: 94-103.
|
|
7)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998a). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196-2202.
|
|
8)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998b). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183-194.
|
|
9)
|
Brust, K., O. Licht, V. Hultsch, D. Jungmann & R. Nagel (2001). Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Environ. Toxicol. Chemistry, Vol. 20, pp. 2000–2007.
|
|
10)
|
Oetken, M., K.-U. Ludwichowski & R. Nagel (2000). Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG-AltstoffV. By order of the Federal Environmental Agency (Umweltbundesamt Berlin), FKZ 360 12 001, March 2000.
|
|
11)
|
Leppänen M.T. & Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503-1508.
|
Dodatek 6
Souhrn výsledků okružního testu
‚Zkouška toxicity sedimentu s Lumbriculus variegatus‘
Tabulka 1
Výsledky jednotlivých sérií okružního testu: Průměrný počet jedinců v kontrolách a kontrolách s rozpouštědlem na konci testu; SD = směrodatná odchylka; CV = variační koeficient.
|
|
průměrný počet jedinců v kontrolách
|
SD
|
CV (%)
|
n
|
průměrný počet jedinců v kontrolách s rozpouštědlem
|
SD
|
CV (%)
|
n
|
|
|
32,3
|
7,37
|
22,80
|
3
|
39,0
|
3,61
|
9,25
|
3
|
|
|
40,8
|
6,55
|
16,05
|
6
|
36,0
|
5,29
|
14,70
|
3
|
|
|
41,5
|
3,54
|
8,52
|
2
|
38,5
|
7,05
|
18,31
|
4
|
|
|
16,3
|
5,99
|
36,67
|
6
|
30,8
|
6,70
|
21,80
|
4
|
|
|
24,3
|
10,69
|
43,94
|
3
|
26,3
|
3,06
|
11,60
|
3
|
|
|
28,5
|
8,29
|
29,08
|
4
|
30,7
|
1,15
|
3,77
|
3
|
|
|
28,3
|
3,72
|
13,14
|
6
|
28,8
|
2,56
|
8,89
|
6
|
|
|
25,3
|
5,51
|
21,74
|
3
|
27,7
|
1,53
|
5,52
|
3
|
|
|
23,8
|
2,99
|
12,57
|
4
|
21,3
|
1,71
|
8,04
|
4
|
|
|
36,8
|
8,80
|
23,88
|
6
|
35,0
|
4,20
|
11,99
|
6
|
|
|
33,0
|
3,58
|
10,84
|
6
|
33,5
|
1,73
|
5,17
|
4
|
|
|
20,7
|
2,73
|
13,22
|
6
|
15,0
|
6,68
|
44,56
|
4
|
|
|
42,0
|
7,07
|
16,84
|
6
|
43,7
|
0,58
|
1,32
|
3
|
|
|
18,2
|
3,60
|
19,82
|
6
|
21,7
|
4,04
|
18,65
|
3
|
|
|
32,0
|
3,95
|
12,34
|
6
|
31,3
|
4,79
|
15,32
|
4
|
|
mezilabo-ratorní průměr
|
29,59
|
|
20,10
|
|
30,61
|
|
13,26
|
|
|
SD
|
8,32
|
|
10,03
|
|
7,57
|
|
10,48
|
|
|
n
|
15
|
|
|
|
15
|
|
|
|
|
min
|
16,3
|
|
|
|
15,0
|
|
|
|
|
max
|
42,0
|
|
|
|
43,7
|
|
|
|
|
CV (%)
|
28,1
|
|
|
|
24,7
|
|
|
|
Tabulka 2
Výsledky jednotlivých sérií okružního testu: Průměrná celková hmotnost sušiny organismů na opakování v kontrolách a kontrolách s rozpouštědlem na konci testu; SD = směrodatná odchylka; CV = variační koeficient.
|
|
celková hmotnost sušiny organismů na opakování (kontroly)
|
SD
|
CV (%)
|
n
|
celková hmotnost sušiny organismů na opakování (kontroly s rozpouštědlem)
|
SD
|
CV (%)
|
n
|
|
|
24,72
|
6,31
|
25,51
|
3
|
27,35
|
4,08
|
14,93
|
3
|
|
|
30,17
|
2,04
|
6,75
|
6
|
33,83
|
10,40
|
30,73
|
3
|
|
|
23,65
|
3,61
|
15,25
|
2
|
28,78
|
4,68
|
16,28
|
4
|
|
|
12,92
|
6,83
|
52,91
|
6
|
24,90
|
6,84
|
27,47
|
4
|
|
|
21,31
|
4,17
|
19,57
|
3
|
25,87
|
5,30
|
20,49
|
3
|
|
|
22,99
|
4,86
|
21,16
|
4
|
24,64
|
5,09
|
20,67
|
3
|
|
|
18,91
|
1,91
|
10,09
|
6
|
19,89
|
1,77
|
8,89
|
6
|
|
|
24,13
|
1,63
|
6,75
|
3
|
25,83
|
2,17
|
8,41
|
3
|
|
|
22,15
|
3,18
|
14,34
|
4
|
22,80
|
2,60
|
11,40
|
4
|
|
|
35,20
|
8,12
|
23,07
|
6
|
31,42
|
8,45
|
26,90
|
6
|
|
|
41,28
|
5,79
|
14,02
|
6
|
41,42
|
4,37
|
10,55
|
4
|
|
|
15,17
|
5,78
|
38,09
|
6
|
10,50
|
3,42
|
32,53
|
4
|
|
|
35,69
|
8,55
|
23,94
|
6
|
38,22
|
1,23
|
3,21
|
3
|
|
|
19,57
|
5,21
|
26,65
|
6
|
28,58
|
6,23
|
21,81
|
3
|
|
|
29,40
|
2,16
|
7,34
|
6
|
31,15
|
2,70
|
8,67
|
4
|
|
mezilabo-ratorní průměr
|
25,15
|
|
20,36
|
|
27,68
|
|
17,53
|
|
|
SD
|
7,87
|
|
12,56
|
|
7,41
|
|
9,10
|
|
|
n
|
15
|
|
|
|
15
|
|
|
|
|
min
|
12,9
|
|
|
|
10,5
|
|
|
|
|
max
|
41,3
|
|
|
|
41,4
|
|
|
|
|
CV (%)
|
31,3
|
|
|
|
26,8
|
|
|
|
Tabulka 3
Toxicita PCP: Souhrn cílových ukazatelů v okružním testu; mezilaboratorní průměry pro EC50, NOEC a LOEC; SD = směrodatná odchylka; CV = variační koeficient.
|
biologický parametr
|
|
mezilaboratorní průměr (mg/kg)
|
min
|
max
|
mezilabora-torní faktor
|
SD
|
CV (%)
|
geometr. průměr (mg/kg)
|
|
celkový počet jedinců
|
EC50
|
23,0
|
4,0
|
37,9
|
9,4
|
10,7
|
46,3
|
19,9
|
|
NOEC
|
9,9
|
2,1
|
22,7
|
10,7
|
7,2
|
72,3
|
7,6
|
|
LOEC
|
27,9
|
4,7
|
66,7
|
14,2
|
19,4
|
69,4
|
20,9
|
|
MDD (%)
|
22,5
|
7,1
|
39,1
|
|
|
|
|
|
celková hmotnost sušiny organismů
|
EC50
|
20,4
|
7,3
|
39,9
|
5,5
|
9,1
|
44,5
|
18,2
|
|
NOEC
|
9,3
|
2,1
|
20,0
|
9,4
|
6,6
|
70,4
|
7,4
|
|
LOEC
|
25,7
|
2,1
|
50,0
|
23,5
|
16,8
|
65,5
|
19,4
|
|
MDD (%)
|
24,8
|
10,9
|
44,7
|
|
|
|
|
|
mortalita/přežití
|
LC50
|
25,3
|
6,5
|
37,2
|
5,7
|
9,4
|
37,4
|
23,1
|
|
NOEC
|
16,5
|
2,1
|
40,0
|
18,8
|
10,3
|
62,4
|
12,8
|
|
LOEC
|
39,1
|
4,7
|
66,7
|
14,2
|
18,1
|
46,2
|
32,6
|
|
reprodukce (zvýšení počtu jedinců na opakování)
|
EC50
|
20,0
|
6,7
|
28,9
|
4,3
|
7,6
|
37,9
|
18,3
|
|
NOEC
|
7,9
|
2,1
|
20,0
|
9,4
|
5,2
|
66,0
|
6,4
|
|
LOEC
|
22,5
|
2,1
|
50,0
|
23,5
|
15,4
|
68,6
|
16,0
|
|
MDD (%)
|
29,7
|
13,9
|
47,9
|
|
|
|
|
|
růst (zvýšení biomasy na opakování)
|
EC50
|
15,3
|
5,7
|
29,9
|
5,2
|
7,1
|
46,5
|
13,7
|
|
NOEC
|
8,7
|
2,1
|
20,0
|
9,4
|
6,0
|
68,1
|
6,9
|
|
LOEC
|
24,0
|
2,1
|
50,0
|
23,5
|
15,7
|
65,5
|
17,3
|
|
MDD (%)
|
32,2
|
13,6
|
65,2
|
|
|
|
|
|
MDD (minimum detectable difference): minimální detekovatelný rozdíl kontrolních hodnot během testování hypotézy; použit jako měřítko statistické síly
|
LITERATURA
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
C.36. DRAVÍ ROZTOČI (HYPOASPIS (GEOLAELAPS) ACULEIFER): ZKOUŠKA TOXICITY PRO REPRODUKCI V PŮDĚ
ÚVOD
|
1.
|
Tato zkušební metoda je rovnocenná Pokynu OECD pro zkoušení 226 (2008). Je určena k použití při hodnocení účinků chemických látek v půdě na reprodukční schopnost druhu půdního roztoče Hypoaspis (Geolaelaps) aculeifer Canestrini (infratřída Acari: čeleď Laelapidae), což umožňuje odhadnout inhibici specifické rychlosti růstu populace (1,2). Reprodukční schopnost zde znamená počet mláďat na konci zkušebního období. H. aculeifer představuje další trofickou úroveň k druhu, pro nějž jsou zkušební metody již dostupné. Zkouška toxicity pro reprodukci bez rozlišování a kvantifikace různých stupňů reprodukčního cyklu je považována za adekvátní pro účel této zkušební metody. V případě chemických látek s jiným expozičním scénářem než prostřednictvím půdy mohou být vhodné jiné přístupy (3).
|
|
2.
|
Hypoaspis (Geolaelaps) aculeifer je považován za vhodného zástupce půdní fauny, a dravých roztočů zejména. Je celosvětově rozšířený (5) a dá se snadno shromáždit a chovat v laboratoři. Souhrn biologie H. aculeifer je uveden v dodatku 7. Podrobné informace o ekologii druhu roztoče a použití v ekotoxikologické zkoušce jsou dostupné v literatuře (4, 5, 6, 7, 8, 9, 10, 11, 12).
|
PODSTATA ZKOUŠKY
|
3.
|
Dospělé samičky se vystaví rozpětí koncentrací zkoušené chemické látky vmíchané do půdy. Zkouška se zahájí s 10 dospělými samičkami na nádobu k opakování. Samečci se při zkoušce nevkládají, protože zkušenost ukázala, že samičky se páří okamžitě nebo krátce po vylíhnutí ze stupně deutonymfy, jestliže jsou samečci přítomni. Kromě toho by vložení samečků prodloužilo zkoušku tak, že by bylo nezbytné náročně rozlišovat stupně stáří. Páření jako takové tedy není součástí zkoušky. Samičky se vkládají do zkoušky 28–35 dní po začátku období kladení vajíček v synchronizaci (viz dodatek 4), jelikož o samičkách je pak možné usuzovat, že se již spářily a že již prošly stupněm před kladením vajíček. Při 20 °C zkouška končí 14. den od vložení samiček (den 0), což umožňuje, aby první kontrolní potomci dosáhli stupně deutonymfy (viz dodatek 4). Jako hlavní měřená proměnná se stanoví počet mláďat na zkušební nádoby a navíc počet přeživších samiček. Reprodukční schopnost roztočů vystavených zkoušené chemické látce se srovná se schopností kontrolní skupiny a stanoví se ECx (např. EC10, EC50) nebo koncentrace bez pozorovaných účinků (NOEC) (definice – viz dodatek 1) v závislosti na experimentálním uspořádání (viz odstavec 29). Přehled časového sledu zkoušky je uveden v dodatku 8.
|
INFORMACE O ZKOUŠENÉ CHEMICKÉ LÁTCE
|
4.
|
Především by měly být známy rozpustnost ve vodě, log Kow, rozdělovací koeficient půda/ voda a tlak par zkoušené chemické látky. Žádoucí jsou také další informace o osudu zkoušené chemické látky v půdě, jako jsou rychlosti biotického a abiotického rozkladu.
|
|
5.
|
Tato zkušební metoda se dá použít pro chemické látky ve vodě rozpustné nebo nerozpustné. Režim aplikace zkoušené chemické látky se však bude příslušně lišit. Zkušební metoda se nedá použít pro těkavé chemické látky, tj. látky, jejichž Henryho konstanta nebo rozdělovací koeficient vzduch-voda je větší než jedna, nebo chemické látky, jejichž tlak par překročí 0,0133 Pa při 25 °C.
|
PLATNOST ZKOUŠKY
|
6.
|
Následující kritéria je třeba splnit v neexponovaných kontrolních vzorcích, aby výsledek zkoušky bylo možno považovat za platný:
|
—
|
střední mortalita dospělých samiček by na konci zkoušky neměla překročit 20 %,
|
|
—
|
střední počet mláďat na opakování (s 10 vloženými dospělými samičkami) by na konci zkoušky měl být alespoň 50,
|
|
—
|
variační koeficient vypočítaný pro počet mláďat roztočů na opakování by na konci hlavní zkoušky neměl být vyšší než 30 %.
|
|
REFERENČNÍ CHEMICKÁ LÁTKA
|
7.
|
Je třeba stanovit ECx anebo NOEC referenční chemické látky, aby se získala záruka, že laboratorní zkušební podmínky jsou vyhovující, a aby se ověřilo, že odezva zkušebních organismů se časem nemění. Dimethoát (CAS 60-51-5) je vhodná referenční chemická látka, u níž bylo zjištěno ovlivnění velikosti populace (4). Kyselinu boritou (CAS 10043-35-3) je možno použít jako alternativní referenční chemickou látku. S touto látkou bylo však získáno méně zkušeností. Existují dvě možná uspořádání:
|
—
|
Referenční chemická látka se může zkoušet paralelně se stanovením toxicity každé zkoušené chemické látky při jedné koncentraci, kterou je třeba předem prokázat ve studii dávka-odezva, jejímž výsledkem je účinek > 50 % snížení počtu potomků. V tomto případě by počet opakování měl být stejný jako v kontrolních vzorcích (viz odstavec 29).
|
|
—
|
Druhou možností je, že se referenční chemická látka zkouší 1–2krát ročně zkouškou dávka-odezva. V závislosti na vybraném uspořádání se počet koncentrací a opakování a koeficient rozložení liší (viz odstavec 29), ale mělo by se dosáhnout odezvy 10– 90 % účinku (koeficient rozložení 1,8). Hodnota EC50 pro dimethoát stanovená na základě počtu mláďat by měla být v rozmezí 3,0 až 7,0 mg účinné látky/kg půdy (sušina). Na základě výsledků doposud získaných s kyselinou boritou by hodnota EC50 založená na počtu mláďat měla být v rozmezí 100 až 500 mg/kg půdy (sušina).
|
|
POPIS ZKOUŠKY
Zkušební nádoby a vybavení
|
8.
|
Měly by se používat zkušební nádoby o průměru 3–5 cm (výška půdy ≥ 1,5 cm), vyrobené ze skla nebo jiného chemicky inertního materiálu a vybavené těsně přiléhajícím víčkem. Přednost se dává šroubovacím víčkům a v tom případě by nádoby mohly být provzdušňovány dvakrát týdně. Alternativně je možné použít kryty, které dovolují přímou výměnu plynů mezi substrátem a atmosférou (např. gáza). Jelikož je během zkoušky třeba udržovat obsah vlhkosti dostatečně vysoký, je zásadně třeba kontrolovat hmotnost každé experimentální nádoby během zkoušky a podle potřeby doplnit vodu. To může být zvlášť důležité, jestliže nejsou k dispozici šroubovací víčka. Jestliže se použijí neprůhledné zkušební nádoby, kryt by měl být vyroben z materiálu, který umožňuje přístup světla (např. děrované průhledné víčko) a zároveň brání roztočům v úniku. Velikost a typ zkušební nádoby závisí na extrakční metodě (podrobnosti – viz dodatek 5). Jestliže se tepelná extrakce aplikuje přímo na zkušební nádobu, pak je možné přidat na dno síto o vhodné velikosti ok (utěsněné až do extrakce); hloubka půdy by měla být dostatečná, aby byl zajištěn gradient teploty a vlhkosti.
|
|
9.
|
Je třeba použít standardní laboratorní vybavení, zejména následující:
|
—
|
přednostně skleněné nádoby se šroubovacími víčky,
|
|
—
|
štětce pro přemístění roztočů,
|
|
—
|
odpovídající vybavení pro regulaci teploty,
|
|
—
|
odpovídající vybavení pro regulaci vlhkosti vzduchu (není nezbytné, jestliže expoziční nádoby jsou kryty víčky),
|
|
—
|
inkubátor nebo malá místnost s řízenou teplotou,
|
|
—
|
zařízení pro extrakci (viz dodatek 5) (13),
|
|
—
|
horní osvětlovací panel s řízenou intenzitou světla,
|
|
—
|
sklenice pro shromáždění extrahovaných (vyjmutých) roztočů.
|
|
Příprava umělé půdy
|
10.
|
Při této zkoušce se používá umělá půda. Umělá půda se skládá z následujících složek (všechny hodnoty jsou vztaženy na hmotnost sušiny):
|
—
|
5 % sfagnové rašeliny, přijatelná je na vzduchu sušená a jemně mletá (velikost částic 2 ± 1 mm),
|
|
—
|
20 % kaolinitického jílu (obsah kaolinitu přednostně vyšší než 30 %),
|
|
—
|
přibližně 74 % na vzduchu sušeného průmyslového písku (v závislosti na potřebném množství CaCO3); převážně jemný písek s více než 50 % částic mezi 50 a 200 mikrometry. Přesné množství písku závisí na množství CaCO3 (viz níže), společně by měly tvořit 75 %.
|
|
—
|
< 1,0 % uhličitanu vápenatého (CaCO3, práškový, analyticky čistý) k dosažení pH 6,0 ± 0,5; množství přidaného uhličitanu vápenatého může v zásadě záviset na kvalitě/ charakteru rašeliny (viz poznámka 1).
|
Poznámka 1: Požadované množství CaCO3 bude záviset na složkách půdního substrátu a mělo by se stanovit měřením pH dílčích vzorků půdy bezprostředně před zkouškou (14).
Poznámka 2: Obsah rašeliny v umělé půdě se odchyluje od jiných zkušebních metod na půdních organismech, kde se ve většině případů používá 10 % rašeliny (např. (15)). Avšak podle EPPO (16) neobsahuje typická zemědělská půda více než 5 % organické hmoty, a snížení obsahu rašeliny se tak odráží ve snížené možnosti přírodní půdy sorbovat zkoušenou chemickou látku na organický uhlík.
Poznámka 3: Jestliže je to potřeba, např. pro specifické zkušební účely, mohou jako zkušební anebo kultivační substrát rovněž sloužit přírodní půdy z nekontaminovaných míst. Avšak jestliže se přírodní půda použije, měla by být charakterizována alespoň původem (místem odběru), pH, texturou (rozložení velikosti částic) a obsahem organické hmoty. Jestliže jsou dostupné, je třeba uvést typ a název půdy podle klasifikace půd; půda by neměla být ničím kontaminována. V případě, že zkoušená chemická látka je kov nebo organo-kovová sloučenina, je třeba rovněž stanovit kapacitu výměny kationtů (CEC) přírodní půdy. Zvláštní pozornost je třeba věnovat splnění kritérií platnosti, jelikož podrobné informace o přírodních půdách jsou obvykle vzácné.
|
|
11.
|
Suché složky půdy se důkladně promíchají (např. ve velké laboratorní míchačce). Pro stanovení pH se použije směs půdy a 1 M roztoku chloridu draselného (KCl) nebo 0,01 M chloridu vápenatého (CaCl2) v poměru 1:5 (viz (14) a dodatek 3). Jestliže je půda kyselejší, nežli je požadované rozpětí (viz odstavec 10), může se upravit přidáním vhodného množství CaCO3. Jestliže je půda příliš alkalická, upraví se přidáním více směsi zahrnující první tři složky popsané v odstavci 10, ale s vyloučením CaCO3.
|
|
12.
|
Maximální retenční vodní kapacita (RVKmax) umělé půdy se stanoví ve shodě s postupy popsanými v dodatku 2. Dva až sedm dní před zahájením zkoušky se suchá umělá půda zvlhčí přidáním dostatečného množství destilované nebo deionizované vody, aby se dosáhlo přibližně poloviny konečného obsahu vody, který je 40 až 60 % RVKmax. Obsah vlhkosti se nastaví na 40–60 % RVKmax přidáním roztoku zkoušené chemické látky a/nebo přidáním destilované nebo deionizované vody (viz odstavce 16–18). Dodatečná hrubá kontrola obsahu vlhkosti v půdě se provede mírným stisknutím půdy v ruce; jestliže je obsah vlhkosti správný, objeví se mezi prsty malé kapky vody.
|
|
13.
|
Obsah vlhkosti půdy se stanoví na začátku a na konci zkoušky sušením na konstantní hmotnost při 105 °C ve shodě s ISO 11465 (17); pH půdy se stanoví ve shodě s dodatkem 3 nebo ISO 10390 (14). Tato měření je třeba provádět na dodatečných vzorcích bez roztočů, jak z kontrolní půdy, tak z půdy o každé zkoušené koncentraci. Hodnota pH půdy by se neměla upravovat, jestliže se zkoušejí kyselé nebo bazické chemické látky. Obsah vlhkosti je třeba sledovat během zkoušky pravidelným vážením nádob (viz odstavce 20 a 24).
|
Výběr a příprava zkušebních živočichů
|
14.
|
Druh použitý ve zkoušce je Hypoaspis (Geolaelaps) aculeifer (Canestrini, 1883). Pro zahájení zkoušky jsou vyžadovány dospělé samičky roztočů získané ze synchronizované skupiny. Roztoči se vkládají asi 7–14 dní po dosažení dospělosti, 28–35 dní po zahájení kladení vajíček v synchronizaci (viz odstavec 3 a dodatek 4). Je třeba zaznamenat zdroj roztočů nebo dodavatele a udržování laboratorní kultury. Jestliže se laboratorní kultura udržuje, doporučuje se, aby identita druhu byla potvrzena alespoň jednou ročně. Identifikační list je uveden v dodatku 6.
|
Příprava zkušebních koncentrací
|
15.
|
Zkoušená chemická látka se zamíchá do půdy. Organická rozpouštědla použitá při zapracování zkoušené chemické látky do exponované půdy je třeba volit s ohledem na jejich nízkou toxicitu pro roztoče a v uspořádání zkoušky musí být zahrnuta kontrola s rozpouštědlem (viz odstavec 29).
|
Zkoušená chemická látka rozpustná ve vodě
|
16.
|
Připraví se roztok zkoušené chemické látky v deionizované vodě v množství dostatečném pro všechna opakování jedné zkušební koncentrace. Doporučuje se použít vhodné množství vody, aby byl získán požadovaný obsah vlhkosti, tj. 40–60 % RVKmax (viz odstavec 12). Každý roztok zkoušené chemické látky se důkladně promíchá s jednou várkou zvlhčené půdy, která se pak vloží do zkušební nádoby.
|
Zkoušená chemická látka nerozpustná ve vodě
|
17.
|
V případě chemických látek nerozpustných ve vodě, ale rozpustných v organických rozpouštědlech se zkoušená chemická látka může rozpustit v co nejmenším objemu vhodného nosiče (např. acetonu). Měla by se použít pouze těkavá rozpouštědla. Při použití takových nosičů by všechny zkušební koncentrace a kontrolní vzorky měly obsahovat stejné minimální množství nosiče. Nosič se nastříkne na malé množství, například 10 g, jemného křemenného písku, nebo se s ním smíchá. Celkový obsah písku v substrátu by měl být korigován na toto množství. Nosič se odstraní odpařením v digestoři po dobu alespoň jedné hodiny. Tato směs křemenného písku a zkoušené chemické látky se přidá do zvlhčené půdy a důkladně s ní promíchá, přičemž se přidá vhodné množství deionizované vody, aby se dosáhlo požadované vlhkosti. Konečná směs se vkládá do zkušebních nádob. Uvědomte si, že některá rozpouštědla mohou být toxická pro roztoče. Proto se doporučuje použít kontrolní vzorek s přidanou vodou bez nosiče, jestliže toxicita rozpouštědla pro roztoče není známá. Jestliže je dostatečně prokázáno, že rozpouštědlo (v koncentracích, které mají být aplikovány) nemá žádné účinky, lze kontrolní vzorek s vodou vynechat.
|
Zkoušené chemické látky špatně rozpustné ve vodě i organických rozpouštědlech
|
18.
|
V případě chemických látek, které jsou špatně rozpustné ve vodě a v organických rozpouštědlech, se ekvivalentní množství 2,5 g jemně mletého křemenného písku na zkušební nádobu (například 10 g jemného křemenného písku na čtyři opakování) smíchá s příslušným množstvím zkoušené chemické látky, aby se získala požadovaná zkušební koncentrace. Celkový obsah písku v substrátu je pak třeba korigovat na toto množství. Tato směs křemenného písku a zkoušené chemické látky se přidá do zvlhčené půdy a důkladně promíchá; přidá se vhodné množství deionizované vody, aby se získal požadovaný obsah vlhkosti. Konečná směs se rozdělí mezi zkušební nádoby. Postup se opakuje pro každou zkušební koncentraci a připraví se rovněž příslušné kontrolní vzorky.
|
POSTUP
Zkušební skupiny a kontroly
|
19.
|
Pro každou kontrolní a exponovanou nádobu se doporučuje deset dospělých samiček na 20 g sušiny umělé půdy. Zkušební organismy je třeba vložit během dvou hodin po přípravě konečného zkušebního substrátu (tj. po aplikaci zkoušené látky). Ve zvláštních případech (např. když je stárnutí považováno za určující faktor) je možné čas mezi přípravou konečného zkušebního substrátu a přidáním roztočů prodloužit (podrobnosti takového stárnutí viz (18)). Avšak v takových případech musí být uvedeno vědecké odůvodnění.
|
|
20.
|
Po přidání roztočů do půdy se jim dodá krmivo a změří se počáteční hmotnost každé zkušební nádoby, která se použije jako reference při sledování obsahu vlhkosti v půdě během zkoušky, jak je popsáno v odstavci 24. Zkušební nádoby se pak zakryjí, jak je popsáno v odstavci 8, a umístí se do zkušební komory.
|
|
21.
|
Pro každou z metod aplikace zkoušené chemické látky popsaných v odstavcích 15 až 18 se připraví příslušné kontrolní nádoby. Je třeba dodržovat popsané příslušné postupy přípravy kontrol s výjimkou, že není přidána zkoušená chemická látka. Tam, kde je to potřebné, se tak do kontrolních vzorků přidají organická rozpouštědla, křemenný písek nebo jiné nosiče v koncentracích/množstvích jako u exponovaných nádob. Tam, kde se pro přidání zkoušené chemické látky použije rozpouštědlo nebo jiný nosič, by se rovněž měla připravit dodatečná kontrola bez nosiče nebo zkoušené chemické látky a zkoušet v případě, že toxicita rozpouštědla není známá (viz odstavec 17).
|
Zkušební podmínky
|
22.
|
Zkušební teplota by měla být 20 ± 2 °C. Teplota by se měla zaznamenávat alespoň jednou za den a podle potřeby upravit. Zkouška se provádí za podmínek řízených cyklů světlo-tma (přednostně 16 hodin světla a 8 hodin tmy) s osvětlením 400 až 800 luxů v blízkosti zkušebních nádob. Z důvodů srovnatelnosti jsou tyto podmínky stejné jako u jiných ekotoxikologických zkoušek půdy (např. (15)).
|
|
23.
|
Výměnu plynů je třeba zajistit provzdušňováním zkušebních nádob alespoň dvakrát za týden v případě, že se používají šroubovací víka. Jestliže se používají kryty z gázy, je třeba věnovat zvláštní pozornost udržování obsahu vlhkosti v půdě (viz odstavce 8 a 24).
|
|
24.
|
Obsah vody v půdním substrátu ve zkušebních nádobách se během zkoušky udržuje vážením a podle potřeby pravidelným přidáváním vody do zkušebních nádob (např. jednou za týden). Ztráty se doplňují podle potřeby deionizovanou vodou. Obsah vlhkosti by se během zkoušky neměl od počáteční hodnoty lišit o více než 10 %.
|
Krmení
|
25.
|
Ukázalo se, že vhodným zdrojem krmiva jsou sýrohubi zhoubní (Tyrophagus putrescentiae (Schrank, 1781)). Vhodní mohou být rovněž malí chvostoskoci (např. mláďata Folsomia candida Willem, 1902 nebo Onychiurus fimatus (19, 20), roupice (např. Enchytraeus crypticus Westheide a Graefe, 1992) nebo hlístice (např. Turbatrix silusiae de Man, 1913)) (21). Doporučuje se krmivo před použitím ve zkoušce kontrolovat. Druh a množství krmiva by měly zaručit adekvátní počet mláďat, aby byla splněna kritéria platnosti (odstavec 6). Při výběru kořisti je třeba brát v úvahu režim působení zkoušené látky (např. akaricid může být pro potravinové roztoče rovněž toxický, viz odstavec 26).
|
|
26.
|
Krmivo se dodává ad libitum (tj. pokaždé malé množství (špička špachtle)). Pro tento účel je rovněž možné použít odsávač se slabým sáním, jak je navrženo ve zkoušce s chvostoskoky, nebo jemný štěteček. Postačující obvykle bude podávat krmivo na začátku zkoušky a dvakrát až třikrát týdně. Jestliže se ukáže, že zkoušená látka je pro organismy sloužící jako krmivo toxická, je třeba zvážit zvýšenou rychlost krmení anebo alternativní zdroj krmiva.
|
Výběr zkoušených koncentrací
|
27.
|
Předchozí znalost toxicity zkoušené chemické látky by měla pomoci při výběru vhodných zkušebních koncentrací, např. z orientačních studií. V případě potřeby se provede orientační zkouška s pěti koncentracemi zkoušené chemické látky v rozpětí 0,1–1 000 mg/kg sušiny půdy, s alespoň jedním opakováním pro exponované a kontrolní nádoby. Orientační zkouška trvá 14 dní; pak se stanoví mortalita dospělých roztočů a počet mláďat. Rozpětí koncentrací se v hlavní zkoušce přednostně zvolí tak, aby zahrnovalo koncentrace, při nichž je počet mláďat ovlivněn, zatímco přežití mateřské generace ovlivněno není. To však nemusí být možné v případě chemických látek, které mají smrtelné a téměř smrtelné účinky při skoro podobných koncentracích. Účinná koncentrace (např. EC50 EC25, EC10) a rozpětí koncentrací, ve kterém je účinek zkoušené chemické látky předmětem zájmu, by měly být zahrnuty mezi koncentracemi použitými ve zkoušce. Extrapolace hluboko pod nejnižší koncentraci ovlivňující zkušební organismy nebo vysoko nad nejvyšší zkoušenou koncentraci by se měla provádět pouze ve výjimečných případech a v takovém případě je třeba uvést úplné vysvětlení v závěrečné zprávě.
|
Uspořádání experimentu
Zkoušky dávka-odezva
|
28.
|
Jsou navrženy tři uspořádání zkoušky na základě doporučení vyplývajících z jiného okružního testu (zkouška toxicity pro reprodukci s roupicovitými (22)). Všeobecná vhodnost všech těchto návrhů byla potvrzena závěry validace u H. aculeifer.
|
|
29.
|
Při určování rozpětí koncentrací je třeba brát v úvahu následující:
|
—
|
Pro stanovení ECx (např. EC10, EC50) je třeba zkoušet dvanáct koncentrací. Doporučují se alespoň dvě opakování pro každou zkoušenou koncentraci a šest kontrolních opakování. Koeficient rozložení koncentrací se může lišit, tj. být menší nebo rovný 1,8 v rozmezí očekávaného účinku a vyšší než 1,8 při vyšších a nižších koncentracích.
|
|
—
|
Pro stanovení NOEC je třeba zkoušet alespoň pět koncentrací v geometrické posloupnosti. Doporučují se čtyři opakování pro každou zkoušenou koncentraci plus osm kontrolních vzorků. Koncentrace by měly být rozloženy s faktorem nepřekračujícím 2,0.
|
|
—
|
Kombinovaný přístup umožňuje stanovení jak NOEC, tak ECx. Použije se osm exponovaných koncentrací v geometrické řadě. Doporučují se čtyři opakování pro každou exponovanou koncentraci plus osm pro kontrolní vzorky. Koncentrace by měly být rozloženy s faktorem nepřekračujícím 1,8.
|
|
Limitní zkouška
|
30.
|
Jestliže v orientační zkoušce nejsou pozorovány žádné účinky při nejvyšší koncentraci (tj. 1 000 mg/kg sušiny půdy), může být hlavní zkouška toxicity pro reprodukci provedena jako limitní zkouška s použitím zkoušené koncentrace 1 000 mg/kg sušiny půdy. Limitní zkouška poskytne možnost prokázat, že hodnota NOEC nebo EC10 u reprodukce je větší než mezní koncentrace, přičemž je minimalizován počet roztočů použitých při zkoušce. Použije se osm opakování jak pro exponovanou půdu, tak pro kontrolu.
|
Doba trvání zkoušky a měření
|
31.
|
Všechny pozorované rozdíly mezi chováním a morfologií roztočů v kontrolních a exponovaných nádobách je třeba zaznamenat.
|
|
32.
|
V den 14 se přeživší roztoči vyjmou z půdy pomocí tepelné/světelné extrakce nebo jiné vhodné metody (viz dodatek 5). Odděleně se spočítá počet mláďat (tj. larvy, protonymfy a deutonymfy) a dospělých jedinců. Všichni dospělí roztoči v tuto chvíli nenalezení se zaznamenají jako mrtví, přičemž se předpokládá, že takoví roztoči uhynuli a rozložili se před vyhodnocením. Účinnost extrakce se musí potvrdit jednou nebo dvakrát ročně na kontrolních vzorcích se známými počty dospělých a mláďat. Účinnost by měla být vyšší než 90 % v průměru kombinovaném pro všechna vývojová stádia (viz dodatek 5). Počty dospělých a mláďat se pro účinnost neupravují.
|
ÚDAJE A PŘEDKLÁDÁNÍ ZPRÁV
Zpracování výsledků
|
33.
|
Informace o statistických metodách, které je možné použít pro analyzování výsledků zkoušek, jsou uvedeny v odstavcích 36 až 41. Kromě toho je třeba brát v úvahu dokument OECD č. 54 ‚Současné přístupy ve statistické analýze údajů o ekotoxicitě: Pokyny pro aplikaci‘ (Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application) (31).
|
|
34.
|
Hlavní cílovým ukazatelem je reprodukční schopnost, v tomto případě počet zplozených mláďat na zkušební nádobu určenou k opakování (s vloženými 10 dospělými samičkami). Pro statistickou analýzu je třeba spočítat u exponovaných a kontrolních nádob aritmetický průměr (X) a rozptyl (s2) reprodukční schopnosti. X a s2 se použijí pro postupy ANOVA, jako je např. Studentův t-test, Dunnettův test nebo Williamsův test a rovněž pro výpočet 95 % intervalů spolehlivosti.
Poznámka: Tento hlavní cílový ukazatel je rovnocenný plodnosti měřené jako počet živých mláďat zplozených během zkoušky dělený počtem rodičovských samiček vložených na začátku zkoušky.
|
|
35.
|
Počet přeživších samiček v neexponovaných kontrolních vzorcích je hlavním kritériem platnosti a musí být dokumentován. Stejně jako při orientační zkoušce je třeba i v závěrečné zprávě z hlavního testu zaznamenat další škodlivé znaky.
|
ECx
|
36.
|
Hodnoty ECx, včetně s nimi spojené dolní a horní 95 % meze spolehlivosti pro parametr popsaný v odstavci 34, se vypočítají použitím vhodných statistických metod (např. probitové analýzy, logistické nebo Weibullovy funkce, upravené Spearman-Karberovy metody nebo jednoduché interpolace). ECx se získá dosazením hodnot odpovídajících x % kontrolního průměru do nalezené rovnice. Pro výpočet EC50 nebo jakékoli jiné ECx je třeba průměry pro exponované vzorky (X) podrobit regresní analýze.
|
NOEC/LOEC
|
37.
|
Jestliže se při statistické analýze očekává stanovení NOEC/LOEC, je nezbytné zpracovat statistiku na nádobu (jednotlivé nádoby se považují za opakování). Je třeba použít vhodné statistické metody (podle dokumentu OECD č. 54 – Současné přístupy ve statistické analýze údajů o ekotoxicitě: Pokyny pro aplikaci). Obecně se nepříznivé účinky zkoušené látky ve srovnání s kontrolou zkoumají použitím jednostranného (menšího) testu hypotézy pro p ≤ 0,05. Příklady jsou uvedeny v následujících odstavcích.
|
|
38.
|
Normální rozložení dat lze testovat použitím např. Kolmogorov-Smirnovova testu dobré shody, testu poměru rozpětí ke směrodatné odchylce (R/s-test) nebo Shapiro-Wilkova testu (dvoustranný, p ≤ 0,05). Cochranův test, Levenův test nebo Bartlettův test (dvoustranný, p ≤ 0,05) lze použít k testování homogenity rozptylu. Jestliže jsou splněny předpoklady pro použití parametrických testů (normalita, homogenita rozptylu), lze provést jednostupňovou analýzu rozptylu (ANOVA) a následné testy vícenásobného porovnávání. Vícenásobná porovnání (např. Dunnettův t-test) nebo testy sestupného trendu (např. Williamsův test v případě monotónního vztahu dávka-odezva) se mohou použít pro výpočet, zda existují významné rozdíly (p ≤ 0,05) mezi kontrolními vzorky a různými koncentracemi zkoušené látky (výběr doporučené zkoušky podle dokumentu č. 54 OECD – Současné přístupy ve statistické analýze údajů o ekotoxicitě: Pokyny pro aplikaci). Jinak je třeba pro stanovení NOEC a LOEC použít neparametrické metody (např. Bonferroniho U-test podle Holma nebo Jonckheere-Terpstrův test trendu).
|
Limitní zkouška
|
39.
|
Jestliže byla provedena limitní zkouška (pouze srovnání kontrolního a jednoho exponovaného vzorku) a jsou splněny předpoklady pro použití parametrických testů (normalita, homogenita), mohou být metrické proměnné vyhodnoceny použitím Studentova testu (t-test). Jestliže tyto požadavky nejsou splněny, je možné použít t-test upravený pro nerovnost rozptylů (Welchův t-test) nebo neparametrický test, jako je Mann-Whitneyův U-test.
|
|
40.
|
Pro stanovení významných rozdílů mezi kontrolami (kontrolní vzorek a kontrolní vzorek s rozpouštědlem) je možné zkoušet opakování každého kontrolního vzorku, jak je popsáno pro limitní zkoušku. Jestliže se těmito zkouškami nezjistí významné rozdíly, je možné všechna opakování kontrol a kontrol s rozpouštědlem sloučit. Jinak by se všechny exponované nádoby měly srovnávat s kontrolou s rozpouštědlem.
|
Závěrečná zpráva
|
41.
|
Závěrečná zpráva by měla obsahovat alespoň následující informace:
|
—
|
Zkoušená chemická látka
|
—
|
identita zkoušené chemické látky, název, šarže, dávka a číslo CAS, čistota,
|
|
—
|
fyzikálně-chemické vlastnosti zkoušené chemické látky (např. log Kow, rozpustnost ve vodě, tlak par, Henryho konstanta (H) a informace o osudu zkoušené chemické látky v půdě).
|
|
|
—
|
Zkušební organismy
|
—
|
identifikace a dodavatel zkušebních organismů, popis kultivačních podmínek,
|
|
—
|
věkové rozpětí zkušebních organismů.
|
|
|
—
|
Zkušební podmínky
|
—
|
popis experimentálního uspořádání a postupu,
|
|
—
|
podrobnosti přípravy zkušební půdy; podrobná specifikace, jestliže se používá přírodní půda (původ, historie, rozložení velikosti částic, pH, obsah organické hmoty a klasifikace půdy, jestliže je dostupná),
|
|
—
|
maximální retenční vodní kapacita půdy,
|
|
—
|
popis techniky použité pro aplikaci zkoušené chemické látky do půdy,
|
|
—
|
podrobnosti o pomocných chemikáliích použitých pro aplikaci zkoušené chemické látky,
|
|
—
|
velikost zkušebních nádob a hmotnost sušiny zkušební půdy na nádobu,
|
|
—
|
zkušební podmínky: intenzita světla, trvání cyklů světlo-tma, teplota,
|
|
—
|
popis režimu krmení, typ a množství krmiva použitého ve zkoušce, datum krmení,
|
|
—
|
pH a obsah vody v půdě na začátku a během zkoušky (kontrolní vzorek a všechny exponované vzorky),
|
|
—
|
podrobný popis extrakční metody a účinnost extrakce.
|
|
|
—
|
Výsledky zkoušky
|
—
|
počet mláďat stanovený v každé zkušební nádobě na konci zkoušky,
|
|
—
|
počet dospělých samiček a mortalita dospělých jedinců ( %) v každé zkušební nádobě na konci zkoušky,
|
|
—
|
popis zjevných symptomů nebo výrazných změn v chování,
|
|
—
|
výsledky získané s referenční zkoušenou chemickou látkou,
|
|
—
|
souhrn statistického zpracování (ECx anebo NOEC ), včetně 95 % mezí spolehlivosti, a popis metody výpočtu,
|
|
—
|
graf vztahu koncentrace-odezva,
|
|
—
|
odchylky od postupů popsaných v této zkušební metodě a jakékoli neobvyklé jevy během zkoušky.
|
|
|
LITERATURA
|
1)
|
Casanueva, M.E. (1993). Phylogenetic studies of the free-living and arthropod associated Laelapidae (Acari: Mesostigmata). Gayana Zool. 57, 21-46.
|
|
2)
|
Tenorio, J. M. (1982). Hypoaspidinae (Acari: Gamasida: Laelapidae) of the Hawaiian Islands. Pacific Insects 24, 259-274.
|
|
3)
|
Bakker, F.M., Feije, R., Grove, A. J., Hoogendorn, G., Jacobs, G., Loose, E.D. and van Stratum, P. (2003). A laboratory test protocol to evaluate effects of plant protection products on mortality and reproduction of the predatory mite Hypoaspis aculeifer Canestrini (Acari: Laelapidae) in standard soil. JSS – Journal of Soils and Sediments 3, 73-77.
|
|
4)
|
Karg, W. (1993). Die freilebenden Gamasina (Gamasides), Raubmilben. 2nd edition In: Dahl, F. (Hrsg.): Die Tierwelt Deutschlands 59. Teil, G. Fischer, Jena, 523 pp.
|
|
5)
|
Ruf, A. (1991). Do females eat males?: Laboratory studies on the population development of Hypoaspis aculeifer (Acari: Parasitiformes). In: F. Dusbabek & V. Bukva (eds.): Modern Acarology. Academia Prague & SPD Academic Publishing bv, The Hague, Vol. 2, 487-492.
|
|
6)
|
Ruf, A. (1995). Sex ratio and clutch size control in the soil inhabiting predatory mite Hypoaspis aculeifer (Canestrini 1883) (Mesostigmata, Dermanyssidae). Proc. 2nd Symp. EURAAC: p 241-249.
|
|
7)
|
Ruf, A. (1996). Life-history patterns in soil-inhabiting mesostigmatid mites. Proc. IXth Internat. Congr. Acarol. 1994, Columbus, Ohio: p 621-628.
|
|
8)
|
Krogh, P.H. and Axelsen, J.A. (1998). Test on the predatory mite Hypoaspis aculeifer preying on the collembolan Folsomia fimetaria. In: Lokke, H. and van Gestel, C.A.M.: Handbook of soil invertebrate toxicity tests. John Wiley Sons, Chichester, p 239-251.
|
|
9)
|
Løkke, H., Janssen, C.R., Lanno, R.P., Römbke, J., Rundgren, S. and Van Straalen, N.M. (2002). Soil Toxicity Tests – Invertebrates. In: Test Methods to Determine Hazards of Sparingly Soluble Metal Compounds in Soils. Fairbrother, A., Glazebrook, P.W., Van Straalen, N.M. and Tarazona, J.V. (eds.). SETAC Press, Pensacola, USA. 128 pp.
|
|
10)
|
Schlosser, H.-J. and Riepert, F. (1991/92). Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilben (Gamasina). Teil 1: Biologie der Bodenraubmilbe Hypoaspis aculeifer Canestrini, 1883 (Gamasina) unter Laborbedingungen. Zool. Beiträge, 34, 395-433.
|
|
11)
|
Schlosser, H.-J. and Riepert, F. (1992). Entwicklung eines Prüfverfahrens für Chemikalien an Boden-raubmilben (Gamasina). Teil 2: Erste Ergebnisse mit Lindan und Kaliumdichromat in subletaler Dosierung. Zool. Beitr. N.F. 34, 413-433.
|
|
12)
|
Heckmann, L.-H., Maraldo, K. and Krogh, P. H. (2005). Life stage specific impact of dimethoate on the predatory mite Hypoaspis aculeifer Canestrini (Gamasida: Laelapidae). Environmental Science & Technology 39, 7154-7157.
|
|
13)
|
Petersen, H. (1978). Some properties of two high-gradient extractors for soil microarthropods, and an attempt to evaluate their extraction efficiency. Natura Jutlandica 20, 95-122.
|
|
14)
|
ISO (International Organization for Standardization) (1994). Soil Quality – Determination of pH, No. 10390. ISO, Geneve.
|
|
15)
|
Kapitola C.8 této přílohy – Zkouška toxicity pro reprodukci žížal.
|
|
16)
|
EPPO (2003): EPPO Standards. Environmental risk assessment scheme for plant protection products. Chapter 8. Soil Organisms and Functions. Bull. OEPP/EPPO Bull. 33, 195-209.
|
|
17)
|
ISO (International Organization for Standardization) (1993). Soil Quality –Determination of dry matter and water content on a mass basis – Gravimetric method, No. 11465. ISO, Geneve.
|
|
18)
|
Fairbrother, A., Glazebrock, P.W., Van Straalen, N.M. and Tarazona, J.V. 2002. Test methods to determine hazards of sparingly soluble metal compounds in soils. SETAC Press, Pensacola, FL, USA.
|
|
19)
|
Chi, H. 1981. Die Vermehrungsrate von Hypoaspis aculeifer Canestrini (Acarina, Laelapidae) bei Ernährung mit Onychiurus fimatus Gisin (Collenbola). Ges.allg..angew. Ent. 3:122-125.
|
|
20)
|
Schlosser, H.J., und Riepert, F. 1992. Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilden (Gamasina). Zool.Beitr. N.F. 34(3):395-433.
|
|
21)
|
Heckmann, L.-H., Ruf, A., Nienstedt, K. M. and Krogh, P. H. 2007. Reproductive performance of the generalist predator Hypoaspis aculeifer (Acari: Gamasida) when foraging on different invertebrate prey. Applied Soil Ecology 36, 130-135.
|
|
22)
|
Kapitola C.32 této přílohy – Zkouška toxicity pro reprodukci roupicovitých.
|
|
23)
|
ISO (International Organization for Standardization) (1994). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Geneve.
|
|
24)
|
Southwood, T.R.E. (1991). Ecological methods. With particular reference to the study of insect populations. (2nd ed.). Chapman & Hall, London, 524 pp.
|
|
25)
|
Dunger, W. and Fiedler, H.J. (1997). Methoden der Bodenbiologie (2nd ed.). G. Fischer, Jena, 539 pp.
|
|
26)
|
Lesna, I. and Sabelis, M.W. (1999). Diet-dependent female choice for males with ‚good genes‘ in a soil predatory mite. Nature 401, 581-583.
|
|
27)
|
Ruf, A. (1989). Die Bedeutung von Arrhenotokie und Kannibalismus für die Populationsentwicklung von Hypoaspis aculeifer (Canestrini 1883) (Acari, Gamasina). Mitt. Deut. Ges. Allg. Angew. Ent. 7, 103-107.
|
|
28)
|
Ruf, A. (1993). Die morphologische Variabilität und Fortpflanzungsbiologie der Raubmilbe Hypoaspis aculeifer (Canestrini 1883) (Mesostigmata, Dermanyssidae). Dissertation, Universität Bremen.
|
|
29)
|
Ignatowicz, S. (1974). Observations on the biology and development of Hypoaspis aculeifer Canestrini, 1885 (Acarina, Gamasides). Zoologica Poloniae 24, 11-59.
|
|
30)
|
Kevan, D.K. McE. and Sharma, G.D. (1964). Observations on the biology of Hypoaspis aculeifer (Canestrini, 1884), apparently new to North America (Acarina: Mesostigmata: Laelaptidae). Acarologia 6, 647-658.
|
|
31)
|
OECD (2006c). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD environmental Health and Safety Publications Series on Testing and Assessment No.54. ENV/JM/MONO(2006)18.
|
Dodatek 1
Definice
V této zkušební metodě se používají následující definice (v této zkoušce jsou všechny účinné koncentrace vyjádřeny jako hmotnost zkoušené chemické látky na hmotnost sušiny zkušební půdy):
|
|
Chemická látka je látka nebo směs.
|
|
|
Koncentrace bez pozorovaných účinků (NOEC) je koncentrace zkoušené chemické látky, při které není pozorován žádný účinek. V této zkoušce koncentrace odpovídající NOEC nemá statisticky významný účinek (p < 0,05) během dané expoziční doby ve srovnání s kontrolou.
|
|
|
Nejnižší koncentrace s pozorovaným účinkem (LOEC) je nejnižší koncentrace zkoušené chemické látky, která má statisticky významný účinek (p < 0,05) během dané expoziční doby ve srovnání s kontrolou.
|
|
|
ECx (účinná koncentrace pro x % účinek) je koncentrace, která má x % účinek na zkušební organismy během dané expoziční doby ve srovnání s kontrolou. Například EC50 je koncentrace, u níž se odhadne, že způsobí zkoumaný účinek u cílového ukazatele u 50 % vystavené populace během definované expoziční doby.
|
|
|
Zkoušená chemická látka je jakákoli látka nebo směs zkoušená použitím této zkušební metody.
|
Dodatek 2
Stanovení maximální retenční vodní kapacity půdy
Následující metoda stanovení maximální retenční vodní kapacity půdy je považována za vhodnou. Je popsána v příloze C ISO DIS 11268-2 (Kvalita půdy – Účinky znečišťujících látek na žížaly (Eisenia fetida). Část 2: Stanovení účinků na reprodukci (23)).
Shromáždí se definované množství (např. 5 g) zkušebního půdního substrátu použitím vhodného nástroje na odběr vzorků (spirálový trubkový vzorkovač atd.). Dno trubky se zakryje kusem filtračního papíru, trubka se naplní vodou a umístí na stojan ve vodní lázni. Trubka se postupně ponořuje, až je vodní hladina nad povrchem půdy. Pak se ponechá ve vodě přibližně tři hodiny. Jelikož ne všechna voda absorbovaná půdními kapilárami může být zadržena, měl by se vzorek půdy ponechat okapat dvě hodiny tak, že se trubka umístí na lůžko z velmi mokrého, jemně mletého křemenného písku v uzavřené nádobě (aby se zabránilo vysušení). Vzorek se pak zváží a vysuší do konstantní hmotnosti při 105 °C. Retenční vodní kapacita (RVK) se pak vypočítá podle následujícího vzorce:
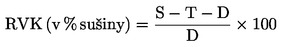
Kde:
S= vodou nasycený substrát + hmotnost trubky + hmotnost filtračního papíru
T= tára (hmotnost trubky + hmotnost filtračního papíru)
D= hmotnost sušiny substrátu
Dodatek 3
Stanovení pH půdy
Následující metoda stanovení pH půdy vychází z popisu uvedeného v ISO DIS 10390: Kvalita půdy – Stanovení pH (16).
Definované množství půdy se suší při laboratorní teplotě po dobu alespoň 12 hodin. Suspenze půdy (obsahující alespoň 5 gramů půdy) se pak doplní do 5násobného objemu buď 1 M roztoku analyticky čistého chloridu draselného (KCl) nebo 0,01 M roztoku analyticky čistého chloridu vápenatého (CaCl2). Suspenze se pak důkladně protřepává po dobu 5 minut. Po protřepání se suspenze ponechá usadit alespoň 2 hodiny, ale ne déle než 24 hodin. Pak se změří pH kapalné fáze použitím pH-metru kalibrovaného před každým měřením pomocí vhodné řady pufračních roztoků (např. pH 4,0 a 7,0).
Dodatek 4
Chov dravých roztočů druhu Hypoaspis (Geolaelaps ) aculeifer, potravinoví roztoči a synchronizace kultury
Chov druhu Hypoaspis (Geolaelaps) aculeifer:
Kultury mohou být udržovány v plastových nádobách nebo sklenicích naplněných směsí pálené sádry a mletého dřevěného uhlí (9:1). Sádru je možné udržovat vlhkou přidáním několika kapek destilované nebo deionizované vody podle potřeby. Teplota chovu je optimálně mezi 20 ± 2 °C, režim světlo/tma není pro tento druh důležitý. Kořistí mohou být roztoči druhu Typrophagus putrescentiae nebo Caloglyphus (s potravinovými roztoči se musí zacházet opatrně, neboť by u člověka mohli způsobit alergickou reakci), ale hlístice, roupicovití a chvostoskoci jsou rovněž vhodní jako kořist. Jejich zdroj je třeba zaznamenat. Vývoj populace může být zahájen s jednou samičkou, protože samečci se vyvíjejí z neoplodněných vajíček. Generace se široce překrývají. Samička může žít alespoň 100 dní a může během svého života naklást přibližně 100 vajíček. Maximální rychlost kladení vajíček je mezi 10 a 40 dny (po dosažení dospělosti) a představuje 2,2 vajíčka na samičku a den. Doba vývoje od vajíčka k dospělé samičce je přibližně 20 dní při 20 °C. Předem je třeba udržovat a přechovávat více než jednu kulturu.
Chov druhu Typrophagus putrescentiae:
Roztoči jsou přechováváni ve skleněné nádobě naplněné jemným práškem z pivovarských kvasnic, která je umístěna v plastovém kbelíku naplněném roztokem KNO3, aby se zabránilo jejich úniku. Potravinoví roztoči se umístí na povrch tohoto prášku. Pak se pečlivě použitím špachtle promíchají s práškem (který se musí měnit dvakrát týdně).
Synchronizace kultury:
Jedinci, kteří se použijí při zkoušce, by měli být podobně staří (cca 7 dní po dosažení stupně dospělosti). Při chovné teplotě 20 °C se toho dosáhne takto:
Samičky se přemístí do čisté chovné nádoby a přidá se dostatek krmiva
|
—
|
Dva až tři dny se samičky ponechají pro nakladení vajíček, pak se vyjmou.
|
|
—
|
Dospělé samičky se odeberou pro zkoušku mezi 28. a 35. dnem od začátku jejich umístění do čistých chovných nádob.
|
Dospělé samičky lze snadno odlišit od samečků a jiných vývojových stupňů díky jejich větší velikosti, vykrmenému tvaru a hnědému hřbetnímu štítu (samečci jsou útlejší a placatí), nedospělé mají bílou až krémovou barvu. Vývoj roztočů pokračuje přibližně podle modelu popsaného níže při 20 °C (obrázek): vajíčko 5 dní, larva 2 dny, protonymfa 5 dní, deutonymfa 7 dní, období před kladením vajíček u samiček 2 dny. Pak jsou roztoči dospělí.
Obrázek
Vývoj roztočů druhu Hypoaspis (Geolaelaps) aculeifer při 20 °C. (odebrání = samičky použité pro zkoušku)

Dospělí zkušební živočichové se odeberou ze synchronizované kultury a vloží do zkušebních nádob mezi 28. a 35. dnem poté, co rodičovské samičky zahájily kladení vajíček (tj. 7–14 dní po dosažení dospělosti). Tím se zaručí, že zkušební samičky již prošly obdobím před kladením vajíček a spářily se se samečky, kteří jsou rovněž přítomni v kultivační nádobě. Pozorováním kultur v laboratoři se zjistilo, že samičky se páří okamžitě nebo krátce po dosažení dospělosti, jestliže jsou samečci přítomni (Ruf, Vaninnen, osobní sdělení). Období sedmi dní je zvoleno, aby se usnadnila integrace do laboratorních podmínek a byl poskytnut čas pro vyrovnání individuální vývojové variability mezi roztoči. Kladení vajíček by mělo být zahájeno alespoň se stejným počtem samiček, jaký bude nakonec potřebný při zkoušce. Jestliže je například při zkoušce potřeba 400 samiček, musí být alespoň 400 samičkám umožněno naklást vajíčka během dvou až tří dní. Alespoň 1 200 vajíček by měl být startovní bod pro synchronizovanou populaci (poměr pohlaví cca 0,5; mortalita cca 0,2). Aby se předešlo kanibalismu, je vhodnější nedržet v jedné nádobě více než 20–30 samiček kladoucích vajíčka.
Dodatek 5
Extrakční metody
Pro mikročlenovce je tepelná extrakce vhodnou metodou vyjmutí zkušebních jedinců z půdy/substrátu (viz obrázek níže). Metoda je založena na aktivitě organismů, takže pouze pohybliví jedinci budou mít šanci být zaznamenáni. Podstatou tepelné extrakce je vytvořit pro organismy ve vzorku postupně horší a horší podmínky, až pak opustí substrát a spadnou do fixační kapaliny (např. ethanolu). Klíčovými body jsou trvání extrakce a gradient zhoršování podmínek pro organismy, od dobrých přes středně dobré až po špatné. Extrakce pro ekotoxikologické zkoušky musí být co možná nejkratší, protože jakýkoli populační růst během doby extrakce by zkreslil výsledky. Na druhé straně musí být podmínky teploty a vlhkosti ve vzorku vždy v rozmezí, které umožňuje pohyb roztočů. Zahřívání vzorku půdy vede k vysušování substrátu. Jestliže je vysychání příliš rychlé, někteří roztoči by sami mohli vyschnout dříve, než by se jim podařilo uniknout.
Proto je navržen následující postup (24, 25):
|
|
Přístroj: Tullgrenova nálevka nebo srovnatelné metody, např. McFadyenova (vrchní zahřívání, vzorek je vkládán přes nálevku).
|
|
|
Režim zahřívání: 25 °C po dobu 12 h, 35 °C po dobu 12 h, 45 °C po dobu 24 hodin (celkem 48 h). Teplota se musí měřit v substrátu.
|
|
|
Fixační kapalina: 70 % ethanol.
|
|
|
Podrobnosti: Ze skleněné lahvičky použité pro zkoušku se sundá víčko a okolo hrdla se ováže kus síťoviny nebo tkaniny. Tkanina by měla mít velikost ok 1,0 až 1,5 mm. Tkanina se připevní gumičkou. Lahvička se opatrně otočí dnem vzhůru a umístí do extrakčního zařízení. Tkanina brání, aby substrát vypadával do fixační kapaliny, ale umožňuje roztočům opustit vzorek. Když jsou všechny lahvičky vloženy, spustí se režim zahřívání. Extrakce se ukončí po 48 hodinách. Fixační lahvičky se vyjmou a roztoči se spočítají pomocí mikroskopu s malým zvětšením.
|
Účinnost extrakce vybranou metodou se musí prověřovat jednou nebo dvakrát ročně za použití nádob obsahujících známý počet mláďat a dospělých roztočů držených v neexponovaném zkušebním substrátu. Účinnost by měla být ≥ 90 % v průměru kombinovaném pro všechna vývojová stadia.
Extrakční zařízení Tullgrenova typu

Jak se připraví zkušební ampulka po skončení zkoušky před extrakcí.

Dodatek 6
Identifikace Hypoaspis (Geolaelaps ) aculeifer
|
Podtřída/řád/podřád:
|
|
Čeleď:
|
|
Rod/podrod/druh:
|
|
Acari/Parasitiformes/Gamasida
|
|
Laelapidae
|
|
Hypoaspis (Geolaelaps) aculeifer
|
|
Autor a datum:
|
F. Faraji, Ph.D. (MITOX), 23. ledna 2007
|
|
Použitá literatura:
|
Karg, W. (1993). Die freilebenden Gamasina (Gamasides), Raubmilben. Tierwelt Deutschlands 59, 2. upravené vydání: 1-523.
Hughes, A.M. (1976). The mites of stored food a houses. Ministry of Agriculture, Fisheries a Food, Technical Bulletin 9: 400pp.
Krantz, G.W. (1978). A manual of Acarology. Oregon State University Book Stores, Inc., 509 pp.
|
|
Plánovaně řízené charakteristiky:
|
Tectum se zaobleným pilovitým okrajem; hypostomální rýhy s více než 6 zoubky; kaudální dorsální sety Z4 nepříliš dlouhé; dorsální sety štětinovité; normální štít genitálií, nepříliš zvětšený a nedosahující k análnímu štítu; zadní polovina dorsálního štítu bez nepárových set; nohy II a IV s několika silnými makrosetami; dorsální seta Z5 asi dvakrát delší než J5; pevný článek chelicer s 12–14 zoubky a pohyblivý článek s 2 zoubky; délka idiosomy 520–685 μm.
Roztoči Hypoaspis
miles se rovněž používají při biologické kontrole a mohou se splést s H. aculeifer. Hlavní rozdíl je:
H. miles náleží k podrodu Cosmolaelaps a mají nožovité dorsální sety, zatímco H. aculeifer náleží k podrodu Geolaelaps a mají štětinovité dorsální sety.
|
Dodatek 7
Základní informace o biologii roztočů Hypoaspis (Geolaelaps) aculeifer
Roztoči Hypoaspis aculeifer náleží do čeledi Lealapidae, řádu Acari (roztoči), třídy Arachnida, kmenu Arthropoda. Žijí ve všech druzích půdy a živí se jinými roztoči, hlísticemi, roupicovitými a chvostoskoky (26). V případě nedostatku potravy se uchylují ke kanibalismu (27). Těla dravých roztočů se člení na idiosomu a gnathosomu. Jasné dělení idiosomy na prosomu (hlavohruď) a opistosomu (zadeček) nemají. Gnathosoma (hlavový štít) nese orgány pro příjem potravy, jako jsou palpy (makadla) a chelicery (klepítka). Chelicery jsou tříčlánkové a opatřené zoubky různého tvaru. Kromě požírání používají samečci své chelicery zejména k přenosu spermatofor na samičky. Dorsální štít kryje téměř celou idiosomu. Velkou část idiosomy samičky zabírají rozmnožovací orgány, které jsou zvláště výrazné krátce před kladením vajíček. Na ventrální straně lze nalézt dva štíty, hrudní a genitální štít. Všechny nohy jsou vybaveny chlupy a trny. Chlupy se používají jako opora při zavrtávání do půdy nebo při pohybu na jejím povrchu. První pár nohou se používá hlavně jako tykadla. Druhý pár nohou se používá nejen k pohybu, ale rovněž k sevření kořisti. Trny čtvrtého páru nohou mohou sloužit k obraně a také k pohybu (28). Samečci jsou dlouzí 0,55–0,65 mm a váží 10–15 μg. Samičky jsou dlouhé 0,8–0,9 mm a váží 50–60 μg (8, 28) (obrázek 1).
Obr. 1
Samička, sameček, protonymfa a larva H. aculeifer.

Při 23 °C dosahují roztoči sexuální zralosti po 16 dnech (samičky) a 18 dnech (samečci) (6). Samičky přenášejí spermie pomocí solenostomu, odkud se pak přemístí do vaječníku. Spermie ve vaječníku dospějí a ukládají se. K oplodnění dochází pouze po dozrání spermií ve vaječníku. Oplodněná nebo neoplodněná vajíčka samičky kladou ve shlucích nebo odděleně, především do puklin nebo děr. Spářené samičky mohou plodit mláďata obou pohlaví, zatímco z vajíček nespářených samiček se vylíhnou pouze mláďata samečků. Během vývoje k dospělosti procházejí roztoči čtyřmi vývojovými fázemi (vajíčko–larva, larva–protonymfa, protonymfa–deutonymfa, deutonymfa–dospělý jedinec).
Vajíčka jsou mléčně bílá, sklovitá, eliptická a přibližně 0,37 mm dlouhá s pevným pláštěm. Podle (8) jsou larvy 0,42 až 0,45 mm veliké. Mají pouze tři páry nohou. V oblasti hlavy jsou vyvinuty palpy a chelicery. Chelicery opatřené několika malými zoubky slouží k vyklubání z vajíčka. Po prvním svlékání, 1–2 dny po vylíhnutí, se vyvinou protonymfy. Ty jsou rovněž bílé, o velikosti 0,45–0,62 mm (8) a mají čtyři páry nohou. Chelicery jsou kompletně vybaveny zoubky. Počínaje tímto stadiem začínají roztoči shánět potravu. Z tohoto důvodu je kutikula kořisti proražena chelicerami a do jejího těla je vypuštěn sekret pro mimostřevní trávení. Roztoč pak nasaje potravu ve formě kaše. Chelicery mohou rovněž sloužit k vytrhnutí větších částí z hrudek potravy (28). Po dalším svlékání se vyvinou deutonymfy. Ty jsou velké 0,60–0,80 mm (8) a mají žlutou až světle hnědou barvu. Počínaje tímto stadiem vývoje se dělí na samičky a samečky. Po další ekdyzi, během níž jsou živočichové neaktivní a vytváří se jim hnědý štít (po cca 14 dnech), jsou roztoči dospělí (28, 29, 30). Při teplotě 25 °C žijí 48 až 100 dní (27).
Dodatek 8
Souhrn a harmonogram hlavních činností, které je třeba podniknout k provedení zkoušky s roztoči Hypoaspis
|
Doba (dny)
začátek zkoušky = den 0
|
Činnost/úkol
|
|
Den – 35
až – 28
|
Samičky se přemístí ze zásobní kultury do čistých nádob pro zahájení synchronizace
Po 2 dnech: samičky se vyjmou
Dvakrát až třikrát za týden: dodá se dostatek krmiva
|
|
Den – 5 (± 2)
|
Příprava umělé půdy
|
|
Den – 4 (± 2)
|
Stanovení RVK umělé půdy
Vysušení přes noc
Následující den: vzorky se zváží a vypočítá se RVK
|
|
Den – 4 (± 2)
|
Zvlhčí se umělá půda, aby se dosáhlo 20–30 % RVK
|
|
Den 0
|
Zahájení zkoušky: do umělé půdy se přidá zkoušená chemická látka
Do každého opakování se vloží 10 samiček
Každé opakování se zváží
Příprava abiotických kontrolních vzorků pro obsah vlhkosti a pH, 2 opakování pro každou expozici
Přes noc se vysuší vlhké kontrolní vzorky
Následující den: zváží se vlhké kontrolní vzorky
Následující den: změří se pH vysušených abiotických kontrolních vzorků
|
|
Den 3, 6, 9, 12 (přibl.)
|
Do každého opakování se dodá dostatečné množství kořisti
Každé opakování se zváží a nakonec se doplní odpařená voda
|
|
Den 14
|
Ukončení zkoušky, připraví se extrakce se všemi opakováními plus kontrolní vzorky účinnosti extrakce
Přes noc se vysuší voda z kontrolních vzorků
Následující den: zjistí se obsah vody v kontrolních vzorcích
Následující den: změří se pH sušených kontrolních vzorků
|
|
Den 16
|
Ukončení extrakce
|
|
Den 16 +
|
Zaznamená se počet dospělých jedinců a mláďat v extrahovaném materiálu
Výsledky se zpracují do vzorových tabulek
Zkušební postup se uvede v listech závěrečné zprávy
|
C.37. 21DENNÍ ZKOUŠKA NA RYBÁCH: KRÁTKODOBÝ SCREENING ESTROGENNÍ A ANDROGENNÍ AKTIVITY A INHIBICE AROMATÁZY
ÚVOD
|
1.
|
Tato zkušební metoda je rovnocenná Pokynu OECD pro zkoušení (TG) 230 (2009). Potřeba vyvinout a validovat zkoušku na rybách, která umožní zjistit určité chemické látky ovlivňující funkce endokrinního systému, pramení z obavy, že přítomnost chemických látek v životním prostředí může vyvolávat nepříznivé účinky na lidi i volně žijící zvířata, způsobené interakcí těchto chemických látek s endokrinním systémem. Organizace OECD v roce 1998 zahájila činnost s vysokou prioritou zaměřenou na revizi stávajících pokynů a vypracování nových pokynů pro zjišťování a zkoušení látek, které mohou narušovat činnost endokrinních žláz. Součástí této činnosti bylo vypracování zkušebních metod pro zjišťování chemických látek ovlivňujících endokrinní systém druhů ryb. Tato 21denní screeningová zkouška endokrinního působení na ryby prošla rozsáhlým validačním programem, který sestával z mezilaboratorních studií s vybranými chemickými látkami a jehož cílem bylo prokázat relevanci a spolehlivost této zkoušky pro zjišťování chemických látek způsobujících narušení endokrinního systému a inhibici aromatázy (1)(2)(3)(4)(5) u tří zkoumaných druhů ryb (jeleček velkohlavý, halančík japonský a danio pruhované). Zjistit androgenní aktivitu lze u jelečka velkohlavého a halančíka japonského, u dania pruhovaného to však možné není. Zjištění antiandrogenních chemických látek tato zkušební metoda neumožňuje. Validační studie byly podrobeny odborné revizi, kterou provedla komise složená z odborníků jmenovaných národními koordinátory programu zkušebních pokynů OECD (6). Tato zkouška není určena k identifikaci konkrétních mechanismů poškození hormonálního systému, protože pokusná zvířata mají intaktní hypothalamo-hypofýzo-gonadální (HPG) osu, která může reagovat na chemické látky, jež mají vliv na HPG osu na různých úrovních. Krátkodobá zkouška působení na reprodukci ryb (OECD TG 229) zahrnuje plodnost a případně histopatologii gonád u jelečka velkohlavého a rovněž všechny vlastnosti, které sleduje tato zkušební metoda. Pokyn OECD TG 229 umožňuje screening chemických látek, které ovlivňují reprodukci prostřednictvím různých mechanismů, včetně působení na endokrinní systém. Před volbou nejvhodnější zkušební metody je třeba to vzít v úvahu.
|
|
2.
|
Tato zkušební metoda popisuje screeningovou zkoušku in vivo, kdy jsou pohlavně zralí rybí samečkové a třoucí se samičky drženi pohromadě a po určitou omezenou část svého životního cyklu (21 dnů) jsou vystaveni působení chemické látky. Po ukončení 21denní doby expozice – v závislosti na použitém druhu – se u samečků a samiček změří jeden nebo dva biomarkerové ukazatele jakožto indikátory estrogenní či androgenní aktivity zkoušené chemické látky nebo jejího působení jako inhibitoru aromatázy; těmito ukazateli jsou vitelogenin a druhotné pohlavní znaky. Vitelogenin se měří u jelečka velkohlavého, halančíka japonského a dania pruhovaného, zatímco druhotné pohlavní znaky se měří pouze u jelečka velkohlavého a halančíka japonského.
|
|
3.
|
Tato biologická zkouška slouží jako screeningová zkouška pro určité typy působení na endokrinní systém a na její provádění je třeba pohlížet v kontextu ‚Koncepčního rámce OECD pro zkoušky a posuzování chemických látek narušujících činnost endokrinních žláz‘ (28).
|
VÝCHOZÍ ÚVAHY A OMEZENÍ
|
4.
|
Vitelogenin (VTG) obvykle vzniká v játrech samiček vejcorodých obratlovců v reakci na endogenní estrogen v krevním oběhu. Je to prekurzor žloutkových proteinů a poté, co vznikne v játrech, putuje krevním řečištěm do vaječníku, kde je spotřebováván a modifikován vyvíjejícími se jikrami. V plazmě nedospělých rybích samiček a samečků vitelogenin téměř není možné detekovat, protože v krevním oběhu nemají dostatek estrogenu. Játra jsou však schopna vitelogenin syntetizovat a vylučovat jej v reakci na stimulaci exogenním estrogenem.
|
|
5.
|
Měření vitelogeninu slouží k zjištění chemických látek s různými mechanismy estrogenního působení. Zjistit přítomnost estrogenních chemických látek je možné pomocí měření indukce vitelogeninu u samečků ryb, které bylo obsáhle zdokumentováno v recenzované vědecké literatuře (např. (7)). Indukce vitelogeninu byla rovněž prokázána na základě expozice aromatizovatelným androgenům (8)(9). Pokles úrovně estrogenu v krevním oběhu u samiček, například prostřednictvím inhibice aromatázy, která endogenní androgen přeměňuje v přírodní estrogen 17-beta-estradiol, způsobuje snížení hladiny vitelogeninu, což se použije ke zjištění chemických látek s vlastnostmi způsobujícími inhibici aromatázy (10)(11). Biologický význam odezvy v podobě produkce vitelogeninu po inhibici estrogenu/aromatázy byl potvrzen a široce zdokumentován. Je však možné, že tvorba VTG u samiček může být ovlivněna také obecnou toxicitou a toxickými účinky jiného než endokrinního charakteru, např. toxickými účinky na játra.
|
|
6.
|
Podařilo se úspěšně vyvinout několik metod měření, následně standardizovaných pro rutinní používání. Jedná se například o metody enzymové imunosorpční analýzy (ELISA) specifické pro jednotlivé druhy, kdy se pro stanovení hladiny vzniklého vitelogeninu v malých vzorcích krve nebo jater odebraných z jednotlivých ryb používá imunochemie (12)(13)(14)(15)(16)(17)(18). Pro měření VTG se odebírají vzorky krve jelečka velkohlavého, krve nebo homogenátu hlavy/ocasu dania pruhovaného a jater halančíka japonského. U halančíka japonského existuje dobrá korelace mezi VTG měřeným z krve a z jater (19). Doporučené postupy pro odběr vzorků pro účely analýzy vitelogeninu jsou uvedeny v dodatku 6. Soupravy pro měření vitelogeninu jsou široce dostupné; takovéto soupravy by měly být založeny na validované metodě zkoušky ELISA specifické pro jednotlivé druhy.
|
|
7.
|
Druhotné pohlavní znaky samečků ryb určitých druhů jsou zvenku viditelné, kvantifikovatelné a odrážejí hladiny endogenních androgenů. Je tomu tak v případě jelečka velkohlavého a halančíka japonského, avšak nikoli u dania pruhovaného, které kvantifikovatelné druhotné pohlavní znaky nemá. U samiček se zachovává schopnost vyvinout samčí druhotné pohlavní znaky, jsou-li exponovány androgenním chemickým látkám ve vodě. Ve vědecké literatuře je k dispozici několik studií, které dokumentují tento typ reakce u jelečka velkohlavého (20) a halančíka japonského (21). Snížený výskyt druhotných pohlavních znaků u samečků by vzhledem k nízké statistické průkaznosti měl být interpretován s opatrností a měl by být založen na odborném posouzení a na závažnosti důkazů. Pro použití dania pruhovaného v této zkoušce existují omezení v důsledku neexistence kvantifikovatelných druhotných pohlavních znaků, které by reagovaly na chemické látky s androgenním působením.
|
|
8.
|
U jelečka velkohlavého je hlavním indikátorem expozice exogennímu androgenu počet pářicích hrbolků, které se nacházejí na tlamě samičky. U halančíka japonského představuje hlavní marker exogenní expozice androgenním chemickým látkám počet bradavkovitých výběžků u samiček. Doporučené postupy, kterými je třeba se řídit při hodnocení pohlavních znaků, jsou pro jelečka velkohlavého uvedeny v dodatku 5A a pro halančíka japonského v dodatku 5B.
|
|
9.
|
Definice použité v této zkušební metodě jsou uvedeny v dodatku 1.
|
PODSTATA ZKOUŠKY
|
10.
|
Při zkoušce jsou ve zkušebních nádržích společně exponováni samečci a samičky ryb v reprodukčním stavu. Jejich dospělost a reprodukční stav umožňují jasné rozlišení pohlaví, a tím i analýzu jednotlivých ukazatelů v závislosti na pohlaví, a zajišťuje jejich citlivost vůči exogenním chemickým látkám. Při ukončení zkoušky se pohlaví ověří makroskopickým vyšetřením gonád po ventrálním otevření břicha nůžkami. Přehled příslušných podmínek pro provedení biologické zkoušky je uveden v dodatku 2. Zkouška obvykle začíná se vzorky ryb odebranými z populace, která je schopna tření; zestárlé ryby by se používat neměly. Pokyny ohledně stáří ryb a jejich reprodukčního stavu jsou uvedeny v oddíle ‚Výběr ryb‘. Ve zkoušce se použijí tři expoziční koncentrace chemické látky a kontrola s vodou, a je-li to nezbytné, kontrola s rozpouštědlem. U halančíka japonského a dania pruhovaného se použijí dvě nádrže či opakování pro každou expozici (přičemž každá nádrž obsahuje 5 samečků a 5 samiček), zatímco u jelečka velkohlavého se použijí čtyři nádrže či opakování pro každou expozici (přičemž každá nádrž obsahuje 2 samečky a 4 samičky). Účelem je zohlednit teritoriální chování samečků jelečka velkohlavého a současně zachovat dostatečnou průkaznost zkoušky. Expozice trvá 21 dnů a v den 21 expozice se u ryb odeberou vzorky.
|
|
11.
|
Při odběru vzorků v den 21 se všechny ryby humánně usmrtí. U jelečka velkohlavého a halančíka japonského se změří druhotné pohlavní znaky (viz dodatek 5A a dodatek 5B); u dania pruhovaného a jelečka velkohlavého se odeberou vzorky krve pro stanovení vitelogeninu, alternativně lze pro stanovení vitelogeninu u dania pruhovaného odebrat hlavu/ocas (dodatek 6); u halančíka japonského se pro analýzu VTG odeberou játra (dodatek 6).
|
KRITÉRIA PŘIJATELNOSTI ZKOUŠKY
|
12.
|
Aby byly výsledky zkoušky přijatelné, musí být splněny tyto podmínky:
|
—
|
mortalita v kontrolách s vodou (nebo s rozpouštědlem) na konci doby expozice by neměla být větší než 10 %,
|
|
—
|
koncentrace rozpuštěného kyslíku by měla dosahovat alespoň 60 % hodnoty nasycení vzduchem (ASV) po celou dobu expozice,
|
|
—
|
teplota vody ve zkušebních nádržích by se v kterémkoli čase během doby expozice neměla lišit o více než ± 1,5 °C a měla by být udržována v rozpětí 2 °C v teplotních rozmezích stanovených pro jednotlivé zkušební druhy (dodatek 2),
|
|
—
|
měly by být k dispozici důkazy pro prokázání toho, že koncentrace zkoušené chemické látky v roztoku byly uspokojivě udržovány v rozmezí ± 20 % od středních naměřených hodnot.
|
|
POPIS METODY
Přístroje a pomůcky
|
13.
|
Normální laboratorní vybavení a zejména:
|
b)
|
vybavení pro stanovení tvrdosti a alkality vody;
|
|
c)
|
vhodné zařízení pro regulaci teploty a pro její pokud možno nepřetržité sledování;
|
|
d)
|
nádrže z chemicky inertního materiálu o vhodném objemu vzhledem k doporučené velikosti násady a hustotě obsádky (viz dodatek 2);
|
|
e)
|
třecí podklad pro jelečka velkohlavého a danio pruhované, potřebné podrobnosti jsou uvedeny v dodatku 4;
|
|
f)
|
dostatečně přesné váhy (tj. vážící s přesností na ± 0,5 mg).
|
|
Voda
|
14.
|
Jako zkušební voda může být použita jakákoli voda, v níž zkušební druh dlouhodobě přežívá a roste. Po celou dobu zkoušky by měla mít stejnou kvalitu. Hodnota pH by měla být v rozmezí 6,5 až 8,5, avšak během zkoušky by se pH nemělo lišit o více než ± 0,5. S cílem zajistit, aby ředicí voda neměla nadměrný vliv na výsledek zkoušky (například v důsledku tvorby komplexů zkoušené chemické látky), by v určitých intervalech měly být odebírány vzorky k analýze. Je-li kvalita ředicí vody relativně stálá, mělo by se např. každé tři měsíce provádět stanovení těžkých kovů (např. Cu, Pb, Zn, Hg, Cd a Ni), hlavních aniontů a kationtů (např. Ca2+, Mg2+, Na+, K+, Cl– a SO4
2–), pesticidů (např. celkový obsah organických fosforových a chlorových pesticidů) a celkového obsahu organického uhlíku a suspendovaných látek. Je-li prokázáno, že kvalita vody je konstantní po dobu alespoň jednoho roku, mohou být stanovení méně častá a intervaly lze prodloužit (např. každých šest měsíců). Některé chemické charakteristiky přijatelné ředicí vody jsou uvedeny v dodatku 3.
|
Zkušební roztoky
|
15.
|
Zkušební roztoky o zvolených koncentracích se připraví ředěním zásobního roztoku. Zásobní roztok se připraví přednostně jednoduchým mechanickým mícháním nebo protřepáváním zkoušené chemické látky v ředicí vodě (např. mechanickým mícháním nebo pomocí ultrazvuku). Pro dosažení vhodné koncentrace zásobního roztoku mohou být použity syticí kolony. Použití nosného rozpouštědla se nedoporučuje. Pokud je však rozpouštědlo nezbytné, měla by být souběžně nasazena kontrola s rozpouštědlem při stejné koncentraci rozpouštědla jako při expozicích chemické látce. U chemických látek, jejichž zkoušení je obtížné, může být rozpouštědlo technicky nejlepším řešením; měl by být konzultován dokument OECD ke zkoušení toxicity obtížných látek a směsí ve vodním prostředí (22). Volba rozpouštědla se řídí chemickými vlastnostmi dané chemické látky. Dokument OECD doporučuje maximální koncentraci 100 μl/l, což by mělo být dodrženo. Nedávno provedený přezkum (23) však poukázal na další problémy při používání rozpouštědel ke zkoušení působení na endokrinní systém. Proto se doporučuje, aby byla koncentrace rozpouštědla – je-li nezbytné – snížena na co nejnižší úroveň, kdykoli je to technicky proveditelné (v závislosti na fyzikálně-chemických vlastnostech zkoušené chemické látky).
|
|
16.
|
Použije se průtokový zkušební systém. Takový systém nepřetržitě dávkuje a ředí zásobní roztok zkoušené látky (např. pomocí dávkovacího čerpadla, zařízení pro proporcionální ředění či syticího systému), aby byla zajištěna série koncentrací ve zkušebních komorách. Průtok zásobních roztoků a ředicí vody by měl být během zkoušky kontrolován v určitých intervalech, nejlépe denně, a neměl by se v průběhu zkoušky měnit o více než 10 %. Je třeba zajistit, aby se nepoužívaly trubky z plastů nízké kvality nebo jiných materiálů, jež mohou obsahovat biologicky aktivní chemické látky. Při výběru materiálu pro průtokový systém by měla být vzata v úvahu možná adsorpce zkoušené chemické látky na tento materiál.
|
Chov ryb
|
17.
|
Zkušební ryby by měly pocházet z laboratorní populace, přednostně z jednoho chovu, která byla alespoň dva týdny před zkouškou udržována v podmínkách kvality vody a osvětlení podobných podmínkám použitým ve zkoušce. Je důležité, aby velikost násady a hustota obsádky (viz definice v dodatku 1) vyhovovaly použitému testovacímu druhu (viz dodatek 2).
|
|
18.
|
Po 48hodinové aklimatizaci se zaznamená mortalita a uplatní se tato kritéria:
|
—
|
mortalita vyšší než 10 % populace za sedm dnů: vyměnit celou obsádku,
|
|
—
|
mortalita od 5 % do 10 % populace: aklimatizace dalších sedm dnů; je-li mortalita během následujících sedmi dnů vyšší než 5 %, vymění se celá obsádka,
|
|
—
|
mortalita nižší než 5 % populace za sedm dnů: obsádka se přijme.
|
|
|
19.
|
Během aklimatizačního období, v předexpozičním období nebo během expozice nesmí být u ryb léčeny žádné nemoci.
|
Předexpozice a výběr ryb
|
20.
|
Doporučuje se jednotýdenní předexpoziční období, kdy jsou ryby umístěny do podobných nádrží jako při skutečné zkoušce. V průběhu chovu a ve fázi expozice se rybám podává strava ad libitum. Fáze expozice začíná s pohlavně dimorfními dospělými rybami z laboratorní dodávky reprodukčně zralých zvířat (např. s jasně viditelnými druhotnými pohlavními znaky, pokud jde o jelečka velkohlavého a halančíka japonského), kteří se aktivně třou. Jako obecné vodítko lze uvést, že jelečci velkohlaví by měli být ve věku přibližně 20 (± 2) týdnů za předpokladu, že byli po celou délku svého života chováni při teplotě 25 ± 2 °C (nelze to však posuzovat odděleně od pozorování skutečného reprodukčního stavu dané skupiny ryb). Halančíci japonští by měli být přibližně ve věku 16 (± 2) týdnů za předpokladu, že byli po celou dobu svého života chováni při teplotě 25 ± 2 °C. Dania pruhovaná by měla být přibližně ve věku 16 (± 2) týdnů za předpokladu, že po celou dobu svého života byla chována při teplotě 26 ± 2 °C.
|
USPOŘÁDÁNÍ ZKOUŠKY
|
21.
|
Použijí se tři koncentrace zkoušené chemické látky, jedna kontrola (s vodou) a v případě potřeby jedna kontrola s rozpouštědlem. Údaje lze analyzovat, aby se určily statisticky významné rozdíly mezi reakcí na expozici a reakcí kontrolní skupiny. Tyto analýzy ukážou, zda je nezbytné chemickou látku dále dlouhodoběji testovat na nepříznivé účinky (totiž na přežití, rozvoj, růst a reprodukci) a nepoužívat ji při posuzování rizik (24).
|
|
22.
|
U dania pruhovaného a halančíka japonského se v den 21 experimentu odebere vzorek samečků a samiček pro každou úroveň expozice (5 samečků a 5 samiček z každé ze dvou duplikátních nádrží) a z kontroly (kontrol) za účelem změření vitelogeninu a popřípadě druhotných pohlavních znaků. U jelečka velkohlavého se v den 21 expozice odebere vzorek samečků a samiček (2 samečci a 4 samičky z každé ze čtyř duplikátních nádrží) a z kontroly (kontrol) za účelem změření vitelogeninu a druhotných pohlavních znaků.
|
Výběr zkušebních koncentrací
|
23.
|
Pro účely této zkoušky by nejvyšší zkušební koncentrace měla být stanovena na úrovni maximální tolerované koncentrace (MTC) určené na základě zkoušky ke zjištění rozsahu či jiných údajů o toxicitě, na úrovni 10 mg/l nebo na úrovni maximální rozpustnosti ve vodě, podle toho, která z hodnot je nejnižší. Maximální tolerovaná koncentrace je definována jako nejvyšší zkušební koncentrace chemické látky, která vede k nižší než 10 % mortalitě. Použití tohoto přístupu předpokládá, že existují empirické údaje o akutní toxicitě nebo jiné údaje o toxicitě, z nichž je možné maximální tolerovanou koncentraci odhadnout. Odhad maximální tolerované koncentrace může být nepřesný a obvykle je nezbytný odborný úsudek.
|
|
24.
|
Vyžadují se tři zkušební koncentrace odstupňované podle konstantního faktoru, který nepřekračuje 10, a kontrola s ředicí vodou (a v případě potřeby kontrola s rozpouštědlem). Doporučené rozmezí faktorů odstupňování je mezi 3,2 a 10.
|
POSTUP
Výběr a vážení zkušebních ryb
|
25.
|
Je důležité minimalizovat rozdíly v hmotnostech ryb na začátku zkoušky. Vhodná rozpětí velikostí ryb různých druhů doporučených pro tuto zkoušku jsou uvedena v dodatku 2. Rozpětí individuálních hmotností samečků a samiček na začátku zkoušky by pro celou násadu ryb použitých ve zkoušce mělo být pokud možno ± 20 % aritmetického průměru hmotností stejného pohlaví. Aby bylo možné odhadnout střední hodnotu hmotnosti, doporučuje se před zkouškou zvážit dílčí vzorek rybí populace.
|
Podmínky expozice
Doba trvání
|
26.
|
Doba trvání zkoušky je 21 dnů po předexpozičním období. Doporučené předexpoziční období je jeden týden.
|
Krmení
|
27.
|
Ryby by měly být krmeny ad libitum dostatečným množstvím vhodného krmiva (dodatek 2), aby si udržely tělesnou kondici. Je třeba dbát na to, aby nedošlo k růstu mikroorganismů a k zakalení vody. Obecně lze říci, že denní množství krmiva by mělo být rozděleno na dva nebo tři stejné díly a podáváno několikrát za den s odstupem alespoň tří hodin mezi dvěma krmeními. Podávání v jedné větší porci je přijatelné zejména o víkendech. 12 hodin před odběrem vzorků / pitvou se ryby přestanou krmit.
|
|
28.
|
Rybí potrava by měla být vyhodnocena z hlediska přítomnosti kontaminantů, např. organochlorových pesticidů, polycyklických aromatických uhlovodíků (PAH) a polychlorovaných bifenylů (PCB). Měla by být vyloučena potrava se zvýšenou hladinou fytoestrogenů, která by zpochybnila reakci na známého agonistu estrogenu (např. 17-beta-estradiol) při zkoušce.
|
|
29.
|
Nespotřebovaná potrava a výkaly se ze zkušebních nádrží odstraňují alespoň dvakrát týdně, např. opatrným odsátím ze dna jednotlivých nádrží pomocí odsávačky.
|
Světlo a teplota
|
30.
|
Fotoperioda a teplota vody by měly vyhovovat zkušebním druhům (viz dodatek 2).
|
Četnost analytických stanovení a měření
|
31.
|
Před započetím předexpoziční doby je třeba zajistit řádné fungování systému dávkování chemických látek. Měly by se stanovit všechny analytické metody, které budou zapotřebí, včetně dostatečných znalostí o stálosti chemických látek ve zkušebním systému. Během zkoušky se koncentrace zkoušené látky stanovují v pravidelných intervalech následujícím způsobem: průtok zásobních roztoků toxické látky a ředicí vody se během zkoušky kontroluje nejlépe denně, avšak minimálně dvakrát týdně, a neměl by se v průběhu zkoušky měnit o více než 10 %. Doporučuje se na počátku zkoušky a poté v týdenních intervalech měřit skutečné koncentrace zkoušené chemické látky ve všech nádržích.
|
|
32.
|
Doporučuje se zakládat výsledky na naměřených koncentracích. Udržela-li se však koncentrace zkoušené chemické látky v roztoku během celé zkoušky uspokojivě v rozmezí ± 20 % jmenovité koncentrace, lze výsledky zakládat na jmenovitých nebo změřených hodnotách.
|
|
33.
|
Může být nezbytné vzorky filtrovat (např. přes filtr s průměrem pórů 0,45 μm) nebo je odstředit. Bude-li toho zapotřebí, doporučuje se odstřeďování. Neadsorbuje-li se zkoušená látka na filtry, je filtrace přijatelná.
|
|
34.
|
V průběhu zkoušky se alespoň jednou týdně v každé zkušební nádrži měří množství rozpuštěného kyslíku, teplota a pH. Nejméně jednou týdně se měří celková tvrdost a alkalita vody v kontrolních nádržích a v jedné nádrži s nejvyšší koncentrací. Teplota se měří pokud možno nepřetržitě alespoň v jedné zkušební nádrži.
|
Pozorování
|
35.
|
V celém průběhu zkoušky nebo při jejím ukončení se posuzuje počet obecných reakcí (např. přežití) a základních biologických reakcí (např. hladiny vitelogeninu). Měření a hodnocení těchto ukazatelů a jejich využití jsou popsány níže.
|
Přežití
|
36.
|
Ryby se v průběhu zkoušky prohlížejí denně, každý úhyn se zaznamená a uhynulé ryby se co nejdříve odstraní. Uhynulé ryby v kontrolních ani v exponovaných nádržích se nenahrazují. Makroskopickým hodnocením gonád se určí pohlaví ryb, které uhynuly v průběhu zkoušky.
|
Chování a vzhled
|
37.
|
Jakékoli neobvyklé chování (v porovnání s kontrolními skupinami) se zaznamená. Může se jednat o příznaky obecné toxicity včetně hyperventilace, nekoordinovaného plavání, ztráty rovnováhy a netypické nečinnosti nebo netypického příjmu potravy. Zaznamenají se rovněž vnější abnormality (např. krvácení, ztráta zbarvení). Takovéto příznaky toxicity by měly být při interpretaci údajů pečlivě zváženy, neboť mohou ukazovat na koncentrace, při kterých biologické markery endokrinní aktivity nejsou spolehlivé. Pozorované změny chování mohou rovněž poskytnout užitečné kvalitativní informace, které se mohou stát podnětem pro možné budoucí požadavky na zkoušky s rybami. Například u jelečka velkohlavého byla pozorována teritoriální agresivita u normálních samečků nebo maskulinizovaných samiček exponovaných androgenním látkám; u dania pruhovaného se v důsledku expozice estrogenním nebo antiandrogenním látkám omezí nebo utlumí typické chování při páření a tření.
|
|
38.
|
Některé vzhledové charakteristiky (především zbarvení) se během manipulace mohou rychle měnit, a proto je důležité provádět kvalitativní pozorování ještě před odstraněním ryb ze zkušebního systému. Dosavadní zkušenosti s jelečkem velkohlavým naznačují, že některé chemické látky s endokrinním působením mohou zpočátku vyvolat změny těchto vnějších znaků: zbarvení těla (světlé nebo tmavé), forma zbarvení (přítomnost svislých pruhů) a tvar těla (hlavy a hrudní oblasti). Proto by pozorování fyzického vzhledu ryb měla být prováděna jak v průběhu zkoušky, tak na konci studie.
|
Humánní usmrcení ryb
|
39.
|
V den 21, tj. při ukončení expozice, se ryby usmrtí přiměřeným množstvím trikainu (trikain methan sulfonát, Metacain, MS-222 (číslo CAS 886-86-2)), pufrovaného na koncentraci 100–500 mg/l roztokem NaHCO3 (hydrogenuhličitan sodný, číslo CAS 144-55-8) v koncentraci 300 mg/l, aby se snížilo podráždění sliznice; poté se odeberou vzorky krve nebo tkání za účelem stanovení vitelogeninu, jak je vysvětleno v části týkající se vitelogeninu.
|
Pozorování druhotných pohlavních znaků
|
40.
|
Některé chemické látky s endokrinním působením mohou vyvolat změny v druhotných pohlavních znacích specifických pro jednotlivé druhy (např. počet pářicích hrbolků u samečků jelečka velkohlavého a bradavkovitých výběžků u samečků halančíka japonského). Chemické látky s určitými účinky pak mohou způsobit abnormální výskyt druhotných pohlavních znaků u zvířat opačného pohlaví; např. agonisté androgenního receptoru, jako je trenbolon, methyltestosteron a dihydrotestosteron, mohou způsobit, že se u samiček jelečka vyvinou výrazné pářicí hrbolky nebo že se u samiček halančíka japonského vyvinou bradavkovité výběžky (11)(20)(21). Bylo také zaznamenáno, že agonisté receptoru estrogenu mohou způsobit snížení počtu pářicích hrbolků a velikost dorzálních týlních polštářků u dospělých samečků (25)(26). Takováto obecná morfologická pozorování mohou poskytnout užitečné kvalitativní a kvantitativní informace, které se mohou stát podnětem pro možné budoucí požadavky na zkoušky s rybami. Počet a velikost pářicích hrbolků u jelečka velkohlavého a bradavkovitých výběžků u halančíka japonského lze kvantifikovat buď přímo, anebo pomocí uchovávaných vzorků, což je praktičtější. Doporučené postupy pro hodnocení druhotných pohlavních znaků u jelečka velkohlavého jsou k dispozici v dodatku 5A a u halančíka japonského v dodatku 5B.
|
Vitelogenin (VTG)
|
41.
|
Pomocí heparinizované mikrohematokritové kapiláry nebo alternativně srdeční punkcí pomocí injekční stříkačky se odebere krev z ocasní tepny/žíly. V závislosti na velikosti ryb se objem krve, který lze odebrat, zpravidla nachází v rozmezí 5–60 μl u jednoho jelečka velkohlavého a 5–15 μl u jednoho dania pruhovaného. Odstředěním se z krve oddělí plazma a uskladní se s inhibitory proteázy při teplotě – 80 °C do doby, než je analyzována na vitelogenin. Alternativně lze jako zdroj tkáně pro stanovení vitelogeninu u halančíka japonského použít játra a u dania pruhovaného homogenát hlavy/ocasu (dodatek 6). Měření VTG by mělo být založeno na validované homologované metodě ELISA s použitím homologovaného standardu VTG a homologovaných protilátek. Doporučuje se použít metodu schopnou odhalit tak nízké hladiny VTG, jako je několik málo ng na ml plazmy (nebo ng na mg tkáně, což je základní hladina u neexponovaných samečků ryb).
|
|
42.
|
Kontrola kvality analýzy vitelogeninu bude provedena za použití standardů, provedením slepých zkoušek a analýzou alespoň dvou duplikátních vzorků. U každé metody ELISA by měla být provedena zkouška na vliv matrice (účinek ředění vzorku) s cílem určit minimální faktor ředění vzorku. Každá destička pro analýzu metodou ELISA, která se používá pro zkoušky VTG, by měla zahrnovat tyto vzorky pro kontrolu kvality: alespoň 6 kalibračních standardů pokrývajících rozmezí očekávaných koncentrací vitelogeninu a alespoň jednu slepou zkoušku nespecifické vazby (analyzované na dvou duplikátních vzorcích). Absorbance při těchto slepých zkouškách by neměla přesahovat 5 % maximální absorbance kalibrovaných standardů. Analyzovat se budou alespoň dva alikvotní vzorky (duplikátní jamky) každého ředění. Duplikátní jamky, které se liší o více než 20 %, by měly být analyzovány znovu.
|
|
43.
|
Korelační koeficient (R2) u kalibračních křivek by měl být větší než 0,99. Vysoká korelace však nepostačuje k tomu, aby zaručila odpovídající prognózu koncentrace ve všech rozmezích. Kromě dostatečně vysoké korelace u kalibrační křivky by koncentrace všech standardů vypočtené z kalibrační křivky měly ležet mezi 70 a 120 % jejich jmenovité koncentrace. Pokud se jmenovité koncentrace od kalibrační regresní křivky odchylují (např. při nízkých koncentracích), může být pro adekvátní vyjádření údajů o absorbanci nezbytné rozdělit kalibrační křivku na nízké a vysoké rozpětí nebo použít nelineární model. Je-li křivka rozdělena, oba segmenty křivky by měly mít R2 > 0,99.
|
|
44.
|
Mez detekce (LOD) je definována jako koncentrace nejnižšího analytického standardu a mez stanovitelnosti (LOQ) je definována jako koncentrace nejnižšího analytického standardu vynásobená nejnižším faktorem ředění.
|
|
45.
|
Každý den, kdy se provádějí zkoušky vitelogeninu, se analyzuje obohacený vzorek vytvořený pomocí referenčního standardu pro opakovatelnost (dodatek 7). Poměr mezi očekávanou koncentrací a naměřenou koncentrací se zaznamená spolu s výsledky všech souborů zkoušek provedených v týž den.
|
ÚDAJE A JEJICH PŘEDKLÁDÁNÍ
Hodnocení reakcí biologických markerů pomocí analýzy rozptylu (ANOVA)
|
46.
|
Pro zjištění potenciálního endokrinního působení chemické látky se pomocí analýzy rozptylu (ANOVA) porovnávají reakce mezi exponovanými a kontrolními skupinami. Je-li nasazena kontrola s rozpouštědlem, provede se pro každý ukazatel vhodné statistické porovnání mezi kontrolami s ředicí vodou a kontrolami s rozpouštědlem. Návod k tomu, jak při následné statistické analýze zacházet s údaji o kontrolách s ředicí vodou a kontrolách s rozpouštědlem, lze najít v dokumentu OECD, 2006c (27). Veškeré údaje o biologických reakcích se analyzují a zaznamenají se za každé pohlaví zvlášť. Nejsou-li splněny předpoklady pro použití parametrických metod kvůli nenormálnímu rozdělení (např. Shapirův-Wilkův test) nebo heterogennímu rozptylu (Bartlettův test nebo Lewenův test), měla by být před provedením ANOVA zvážena transformace údajů za účelem homogenizace rozptylů nebo by měla být provedena vážená ANOVA. V případě nemonotónní závislosti dávka-odezva lze použit Dunnettův test (parametrický) vícenásobných párových porovnávání nebo Mannův-Whitneyův test s Bonferroniho korekcí (neparametrický). Je-li závislost dávka-odezva přibližně monotónní, lze použít jiné statistické testy (např. Jonckheerův-Terpstrův test nebo Williamsův test). V dodatku 8 je uvedeno statistické schéma, které může pomoci při rozhodování o tom, jaký statistický test je nejvhodnější použít. Další informace lze získat rovněž v dokumentu OECD o současných přístupech ke statistické analýze údajů o ekotoxicitě (27).
|
Zpráva o výsledcích zkoušky
|
47.
|
Údaje o studii by měly zahrnovat:
|
|
Zkušební zařízení:
|
—
|
odpovědní pracovníci a jejich odpovědnost v rámci studie,
|
|
—
|
každá laboratoř by měla prokázat svoji způsobilost testováním škály reprezentativních chemických látek.
|
|
|
|
Zkoušená látka:
|
—
|
charakterizace zkoušených chemických látek,
|
|
—
|
fyzikální povaha a relevantní fyzikálně-chemické vlastnosti,
|
|
—
|
metoda a frekvence přípravy zkušebních koncentrací,
|
|
—
|
informace o stabilitě a biologické rozložitelnosti.
|
|
|
|
Rozpouštědlo:
|
—
|
charakterizace rozpouštědla (povaha, použitá koncentrace),
|
|
—
|
zdůvodnění výběru rozpouštědla (není-li použita voda).
|
|
|
|
Pokusná zvířata:
|
—
|
dodavatel a konkrétní zařízení dodavatele,
|
|
—
|
věk ryb na počátku zkoušky a reprodukční stav/stav z hlediska tření,
|
|
—
|
podrobnosti o postupu aklimatizace ryb,
|
|
—
|
tělesná hmotnost ryb na počátku expozice (z dílčího vzorku rybí populace).
|
|
|
|
Zkušební podmínky:
|
—
|
použitý zkušební postup (druh zkoušky, velikost nasazení, hustota obsádky atd.),
|
|
—
|
metoda přípravy zásobních roztoků a průtok,
|
|
—
|
jmenovité zkušební koncentrace, týdně naměřené koncentrace zkušebních roztoků a použitá analytická metoda, střední hodnoty koncentrací naměřených ve zkušebních nádržích a směrodatné odchylky a důkazy toho, že naměřené hodnoty odpovídají koncentracím zkoušené chemické látky v pravém roztoku,
|
|
—
|
charakteristiky ředicí vody (včetně pH, tvrdosti, alkality, teploty, koncentrace rozpuštěného kyslíku, koncentrace zbytkového chloru, celkového obsahu organického uhlíku, obsahu suspendovaných látek a výsledků jakýchkoli jiných provedených měření),
|
|
—
|
kvalita vody ve zkušebních nádržích: pH, tvrdost, teplota a koncentrace rozpuštěného kyslíku,
|
|
—
|
podrobné informace o krmení (např. druh krmiva/krmiv, původ, podávané množství a frekvence krmení), a jsou-li k dispozici, analýzy na přítomnost příslušných kontaminujících látek (např. polychlorovaných bifenylů, polyaromatických uhlovodíků a organochlorových pesticidů).
|
|
|
|
Výsledky
|
—
|
důkazy o tom, že kontrolní skupiny vyhověly kritériím přijatelnosti zkoušky,
|
|
—
|
údaje o mortalitě pro každou zkušební koncentraci a kontrolní skupinu,
|
|
—
|
použité metody statistické analýzy, zpracování údajů a zdůvodnění použitých metod,
|
|
—
|
údaje o biologických pozorováních celkové morfologie včetně druhotných pohlavních znaků a vitelogeninu,
|
|
—
|
výsledky analýz údajů, přednostně ve formě tabulek a grafů,
|
|
—
|
výskyt jakýchkoli neobvyklých reakcí ryb a viditelné účinky vyvolané zkoušenou chemickou látkou.
|
|
|
POKYNY K INTERPRETACI A PŘIJETÍ VÝSLEDKŮ
|
48.
|
Tento oddíl obsahuje některé aspekty, které je třeba vzít v úvahu při interpretaci výsledků zkoušky pro různé měřené ukazatele. K výsledkům zkoušky je třeba přistupovat s opatrností, pokud se zdá, že zkoušená chemická látka způsobuje zjevnou toxicitu nebo ovlivňuje celkový stav zkušebního zvířete.
|
|
49.
|
Při stanovování rozmezí zkušebních koncentrací by se mělo dbát na to, aby nebyla překročena maximální tolerovaná koncentrace a byla tak umožněna smysluplná interpretace údajů. Je důležité, aby existovala alespoň jedna koncentrace, při které se neprojevují žádné příznaky toxických účinků. Příznaky onemocnění a příznaky toxických účinků se pečlivě posoudí a zaznamenají. Je například možné, že tvorba VTG u samiček může být ovlivněna také obecnou toxicitou a toxickými účinky jiného než endokrinního charakteru, např. toxickými účinky na játra. Interpretace účinků však může být podpořena na jiných úrovních expozice, které nejsou zkresleny systémovou toxicitou.
|
|
50.
|
Existuje několik aspektů, které je třeba zvážit pro přijetí výsledků zkoušky. Obecně vzato by hladiny VTG v kontrolních skupinách samečků a samiček měly být odlišné – u jelečka velkohlavého a dania pruhovaného by se měly lišit přibližně o tři řády a u halančíka japonského přibližně o jeden řád. Příklady rozmezí hodnot zjištěných v kontrolních a exponovaných skupinách jsou dostupné ve validačních zprávách (1)(2)(3)(4). Vysoké hodnoty VTG u samečků v kontrolních skupinách by mohly zpochybnit citlivost zkoušky a její schopnost odhalit slabé agonisty estrogenu. Nízké hodnoty VTG u samiček v kontrolních skupinách by mohly zpochybnit citlivost zkoušky a její schopnost detekovat inhibitory aromatázy a antagonisty estrogenu. Při vypracování tohoto návodu byly použity validační studie.
|
|
51.
|
Pokud laboratoř dříve tuto zkoušku neprováděla nebo došlo k podstatným změnám (např. změna rybího kmene nebo dodavatele), lze doporučit provedení studie odborné způsobilosti. Doporučuje se použít k tomuto účelu chemické látky pokrývající širší spektrum účinků nebo dopadů na několik ukazatelů zkoušky. V praxi se doporučuje, aby každá laboratoř shromáždila své vlastní historické kontrolní údaje pro samečky a samičky v kontrolních skupinách a pro pozitivní kontrolu estrogenního působení chemické látky (např. 17-beta-estradiolu při koncentraci 100 ng/l nebo dobře známého slabého agonisty), jež vede ke zvýšené hodnotě VTG u samečků ryb, pozitivní kontrolu inhibice aromatázy chemické látky (např. fadrozolu nebo prochlorazu při koncentraci 300 μg/l), jež vede ke zvýšené hodnotě VTG u samiček ryb, a pozitivní kontrolu androgenního působení chemické látky (např. 17-beta-trenbolonu při koncentraci 5 μg/l), jež vede k indukci druhotných pohlavních znaků u samiček jelečka velkohlavého a halančíka japonského. Pro zajištění způsobilosti laboratoře lze všechny tyto údaje porovnat s dostupnými údaji (1)(2)(3).
|
|
52.
|
Obecně lze říci, že měření vitelogeninu se považuje za pozitivní, dojde-li v porovnání s kontrolní skupinou ke statisticky významnému nárůstu VTG u samečků (p < 0,05) nebo ke statisticky významnému poklesu u samiček (p < 0,05) alespoň při nejvyšší koncentraci zkoušené látky a za nepřítomnosti příznaků obecné toxicity. Pozitivní výsledek se dále podpoří prokázáním biologicky možné závislosti mezi dávkou a odezvou. Jak bylo uvedeno výše, pokles hodnoty vitelogeninu nemusí být zcela endokrinního původu; avšak pozitivní výsledek by měl být obecně interpretován jako důkaz endokrinního působení in vivo a měl by být obvykle podnětem ke krokům za účelem dalšího vyjasnění.
|
LITERATURA
|
1)
|
OECD (2006a) Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1A). OECD Environmental Health and Safety Publications Series on Testing and Assessment No. 60, ENV/JM/MONO(2006)27.
|
|
2)
|
OECD (2006b) Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1B). OECD Environmental Health and Safety Publications Series on Testing and Assessment No. 61, ENV/JM/MONO(2006)29.
|
|
3)
|
OECD (2007) Final report of the Validation of the 21-day Fish Screening Assay for the Detection of Endocrine Active Substances. Phase 2: Testing Negative Substances. OECD Environmental Health and Safety Publications Series on Testing and Assessment No. 78, ENV/JM/MONO(2007)25.
|
|
4)
|
Owens, J. W. (2007) Phase 3 report of the validation of the OECD Fish Screening Assay. CEFIC LRI Project, Endocrine. http://www.cefic-lri.org/index.php?page=projects (accessed 18/09/08).
|
|
5)
|
US EPA (2007) Validation of the Fish Short-Term Reproduction Assay: Integrated Summary Report. Unpublished report dated 15 December 2007. US Environmental Protection Agency, Washington, DC, pp. 104.
|
|
6)
|
OECD (2008) Report of the Validation Peer Review for the 21-Day Fish Endocrine Screening Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. OECD Environmental Health and Safety Publications Series on Testing and Assessment No. 94, ENV/JM/MONO(2008)21.
|
|
7)
|
Sumpter and Jobling (1995) Vitellogenesis as a biomarker for estrogenic contamination of the aquatic environment. Environmental Health Perspectives;103 Suppl 7:173-8 Review.
|
|
8)
|
Pawlowski, S., Sauer, A., Shears, J. A., Tyler, C. R., Braunbeck, T. (2004) Androgenic and estrogenic effects of the synthetic androgen 17alpha-methyltestosterone on sexual development and reproductive performance in the fathead minnow (Pimephales promelas) determined using the gonadal recrudescence assay. Aquatic Toxicology; 68(3), pp. 277–91.
|
|
9)
|
Andersen, L., Goto-Kazato, R., Trant, J. M., Nash, J. P., Korsgaard, B., Bjerregaard, P. (2006) Short-term exposure to low concentrations of the synthetic androgen methyltestosterone affects vitellogenin and steroid levels in adult male zebrafish (Danio rerio). Aquatic Toxicology; 76(3-4), pp. 343–52.
|
|
10)
|
Ankley, G. T., Kahl, M. D., Jensen, K. M., Hornung, M. W., Korte, J. J., Makynen, E. A., Leino, R. L. (2002) Evaluation of the aromatase inhibitor fadrozole in a short-term reproduction assay with the fathead minnow (Pimephales promelas). Toxicological Sciences;67(1), pp. 121–30.
|
|
11)
|
Panter, G. H., Hutchinson, T. H., Hurd, K. S., Sherren, A., Stanley, R. D., Tyler, C. R. (2004) Successful detection of (anti-)androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development. Aquatic Toxicology; 70(1), pp. 11–21.
|
|
12)
|
Parks, L. G., Cheek, A. O., Denslow, N. D., Heppell, S. A., McLachlan, J. A., LeBlanc, G. A., Sullivan, C. V. (1999) Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds. Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology; 123(2), pp. 113–25.
|
|
13)
|
Panter, G. H., Tyler, C. R., Maddix, S., Campbell, P. M., Hutchinson, T. H., Länge, R., Lye, C., Sumpter, J. P. (1999) Application of an ELISA to quantify vitellogenin concentrations in fathead minnows (Pimephales promelas) exposed to endocrine disrupting chemicals. CEFIC-EMSG research report reference AQ001. CEFIC, Brussels, Belgium.
|
|
14)
|
Fenske, M., van Aerle, R. B., Brack, S. C., Tyler, C. R., Segner, H. (2001) Development and validation of a homologous zebrafish (Danio rerio Hamilton-Buchanan) vitellogenin enzyme-linked immunosorbent assay (ELISA) and its application for studies on estrogenic chemicals. Comp. Biochem. Phys. C 129 (3), pp. 217–232.
|
|
15)
|
Holbech, H., Andersen, L., Petersen, G. I., Korsgaard, B., Pedersen, K. L., Bjerregaard, P. (2001) Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio). Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology; 130, pp. 119–131.
|
|
16)
|
Rose, J., Holbech, H., Lindholst, C., Noerum, U., Povlsen, A., Korsgaard, B., Bjerregaard, P. (2002) Vitellogenin induction by 17ß-estradiol and 17ß-ethinylestradiol in male zebrafish (Danio rerio). Comp. Biochem. Physiol. C. 131, pp. 531–539.
|
|
17)
|
Brion, F., Nilsen, B. M., Eidem, J. K., Goksoyr, A., Porcher, J. M. Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio). Environmental Toxicology and Chemistry; vol. 21, pp. 1699–1708.
|
|
18)
|
Yokota, H., Morita, H., Nakano, N., Kang, I. J., Tadokoro, H., Oshima, Y., Honjo, T., Kobayashi, K. (2001) Development of an ELISA for determination of the hepatic vitellogenin in Medaka (Oryzias latipes). Jpn J Environ Toxicol 4, pp. 87–98.
|
|
19)
|
Tatarazako, N., Koshio, M., Hori, H., Morita, M. and Iguchi, T. (2004) Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the Medaka. Journal of Health Science 50, pp. 301–308.
|
|
20)
|
Ankley, G. T., Jensen, K. M., Makynen, E. A., Kahl, M. D., Korte, J. J., Homung, M. W., Henry, T. R., Denny, J. S., Leino, R. L., Wilson, V. S., Cardon, M. C., Hartig, P. C., Gray, L. E. (2003) Effects of the androgenic growth promoter 17-beta-trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environmental Toxicology and Chemistry; 22(6), pp. 1350–60.
|
|
21)
|
Seki, M., Yokota, H., Matsubara, H., Maeda, M., Tadokoro, H., Kobayashi, K. (2004) Fish full life-cycle testing for androgen methyltestosterone on medaka (Oryzias latipes). Environmental Toxicology and Chemistry; 23(3), pp. 774–81.
|
|
22)
|
OECD (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 23. Paris.
|
|
23)
|
Hutchinson, T. H., Shillabeer, N., Winter, M. J., Pickford, D. B. (2006a) Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Review. Aquatic Toxicology, 76, pp. 69–92.
|
|
24)
|
Hutchinson, T. H., Ankley, G. T., Segner, H., Tyler, C. R. (2006b) Screening and testing for endocrine disruption in fish-biomarkers as ‚signposts,‘ not ‚traffic lights,‘ in risk assessment. Environmental Health Perspectives; 114 Suppl 1, pp. 106–14.
|
|
25)
|
Miles-Richardson, S. R., Kramer, V. J., Fitzgerald, S. D., Render, J. A., Yamini, B., Barbee, S. J., Giesy, J. P. (1999) Effects of waterborne exposure to 17B-estradiol on secondary sex characteristics and gonads of the fathead minnow (Pimephales promelas). Aquat. Toxicol. 47, pp. 129–145.
|
|
26)
|
Martinovic, D., Blake, L. S., Durhan, E. J., Greene, K. J., Kahl, M. D., Jensen, K. M., Makynen, E. A., Villeneuve, D. L. and Ankley, G. T. (2008) Characterization of reproductive toxicity of vinclozolin in the fathead minnow and co-treatment with an androgen to confirm an anti-androgenic mode of action. Environ. Toxicol. Chem. 27, pp. 478–488.
|
|
27)
|
OECD (2006c). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD environmental Health and Safety Publications Series on Testing and Assessment No. 54. ENV/JM/MONO(2006)18.
|
|
28)
|
OECD (2012) OECD Conceptual Framework for Testing and Assessment of Endocrine Disrupters (revised). Annex I to Draft Guidance Document on Standardised Test Guidelines for Evaluating Chemicals for Endocrine Disruption. Series on Testing and Assessment No. 150. ENV/JM/MONO(2012)22.
|
Dodatek 1
Zkratky a definice
Chemická látka
: látka nebo směs.
CV
: variační koeficient.
ELISA
: enzymová imunosorpční analýza.
Velikost násady
: živá hmotnost ryb na jednotku objemu vody.
Hustota obsádky
: počet ryb na jednotku objemu vody.
VTG (Vitelogenin)
: fosfolipoglykoprotein, prekurzor proteinů vaječného žloutku, který se obvykle vyskytuje u sexuálně aktivních samiček všech vejcorodých druhů.
Osa HPG
: hypothalamo-hypofýzo-gonadální osa.
MTC
: maximální tolerovaná koncentrace; představuje přibližně 10 % mediánu letální koncentrace (LC50).
Zkoušená látka
: jakákoli látka nebo směs zkoušená pomocí této zkušební metody.
Dodatek 2
Experimentální podmínky pro screeningovou zkoušku endokrinního působení na rybách
|
|
Jeleček velkohlavý
(Pimephales promelas)
|
Halančík japonský
(Oryzias latipes)
|
Danio pruhované
(Danio rerio)
|
|
|
průtoková
|
průtoková
|
průtoková
|
|
|
25 ± 2 °C
|
25 ± 2 °C
|
26 ± 2 °C
|
|
|
Fluorescenční zářivky (širokospektrální)
|
Fluorescenční zářivky (širokospektrální)
|
Fluorescenční zářivky (širokospektrální)
|
|
|
10–20 μE/m2/s, 540–1 000 luxů nebo 50–100 ft-c (okolní laboratorní hodnoty)
|
10–20 μE/m2/s, 540–1 000 luxů nebo 50–100 ft-c (okolní laboratorní hodnoty)
|
10–20 μE/m2/s, 540–1 000 luxů nebo 50–100 ft-c (okolní laboratorní hodnoty)
|
|
6.
|
Fotoperioda (přechody ve formě svítání/stmívání jsou volitelné, nejsou však považovány za nezbytné)
|
|
16 h světlo, 8 h tma
|
12–16 h světlo, 12–8 h tma
|
12–16 h světlo, 12–8 h tma
|
|
|
< 5 g na l
|
< 5 g na l
|
< 5 g na l
|
|
8.
|
Velikost zkušební komory
|
|
10 l (minimálně)
|
2 l (minimálně)
|
5 l (minimálně)
|
|
9.
|
Objem zkušebního roztoku
|
|
8 l (minimálně)
|
1,5 l (minimálně)
|
4 l (minimálně)
|
|
10.
|
Výměny objemu zkušebního roztoku
|
|
Nejméně 6krát denně
|
Nejméně 5krát denně
|
Nejméně 5krát denně
|
|
11.
|
Stáří zkušebních organismů
|
|
Viz odstavec 20
|
Viz odstavec 20
|
Viz odstavec 20
|
|
12.
|
Přibližná živá hmotnost dospělých ryb (v g)
|
|
Samičky: 1,5 ± 20 %
Samečci: 2,5 ± 20 %
|
Samičky: 0,35 ± 20 %
Samečci: 0,35 ± 20 %
|
Samičky: 0,65 ± 20 %
Samečci: 0,4 ± 20 %
|
|
13.
|
Počet ryb v každé zkušební nádrži
|
|
6 (2 samečci a 4 samičky)
|
10 (5 samečků a 5 samiček)
|
10 (5 samečků a 5 samiček)
|
|
|
= 3 (plus příslušné kontrolní skupiny)
|
= 3 (plus příslušné kontrolní skupiny)
|
= 3 (plus příslušné kontrolní skupiny)
|
|
15.
|
Počet nádrží pro každou expozici
|
|
minimálně 4
|
minimálně 2
|
minimálně 2
|
|
16.
|
Počet ryb pro každou zkušební koncentraci
|
|
16 dospělých samiček a 8 samečků (4 samičky a 2 samečci v každé duplikátní nádrži)
|
10 dospělých samiček a 10 samečků (5 samiček a 5 samečků v každé duplikátní nádrži)
|
10 dospělých samiček a 10 samečků (5 samiček a 5 samečků v každé duplikátní nádrži)
|
|
|
Živé nebo zmrazené dospělé nebo larvy (nauplia) žábronožky solné dvakrát nebo třikrát denně (ad libitum), komerčně dostupná potrava nebo kombinace výše uvedeného
|
Larvy (nauplia) žábronožky solné dvakrát nebo třikrát denně (ad libitum), komerčně dostupná potrava nebo kombinace výše uvedeného
|
Larvy (nauplia) žábronožky solné dvakrát nebo třikrát denně (ad libitum), komerčně dostupná potrava nebo kombinace výše uvedeného
|
|
|
Žádné, dokud koncentrace rozpuštěného kyslíku neklesne pod 60 % nasycení vzduchem
|
Žádné, dokud koncentrace rozpuštěného kyslíku neklesne pod 60 % nasycení vzduchem
|
Žádné, dokud koncentrace rozpuštěného kyslíku neklesne pod 60 % nasycení vzduchem
|
|
|
Čistá povrchová, studniční nebo rekonstituovaná voda nebo odchlorovaná vodovodní voda
|
Čistá povrchová, studniční nebo rekonstituovaná voda nebo odchlorovaná vodovodní voda
|
Čistá povrchová, studniční nebo rekonstituovaná voda nebo odchlorovaná vodovodní voda
|
|
|
doporučeno 7 dnů
|
doporučeno 7 dnů
|
doporučeno 7 dnů
|
|
21.
|
Trvání expozice chemické látce
|
|
21 dnů
|
21 dnů
|
21 dnů
|
|
|
přežití
chování
druhotné pohlavní znaky
VTG
|
přežití
chování
druhotné pohlavní znaky
VTG
|
přežití
chování
VTG
|
|
|
Obsah rozpuštěného kyslíku > 60 % nasycení; střední teplota 25 ± 2 °C; 90 % přežití ryb v kontrolních skupinách; naměřené zkušební koncentrace v rozmezí 20 % středních naměřených hodnot pro každou úroveň expozice.
|
Obsah rozpuštěného kyslíku > 60 % nasycení; střední teplota 24 ± 2 °C; 90 % přežití ryb v kontrolních skupinách; naměřené zkušební koncentrace v rozmezí 20 % středních naměřených hodnot pro každou úroveň expozice.
|
Obsah rozpuštěného kyslíku > 60 % nasycení; střední teplota 26 ± 2 °C; 90 % přežití ryb v kontrolních skupinách; naměřené zkušební koncentrace v rozmezí 20 % středních naměřených hodnot pro každou úroveň expozice.
|
Dodatek 3
Některé chemické charakteristiky přijatelné ředicí vody
|
Složka
|
Koncentrace
|
|
Pevné částice
|
< 20 mg/l
|
|
Celkový obsah organického uhlíku
|
< 2 mg/l
|
|
Neionizovaný amoniak
|
< 1 μg/l
|
|
Zbytkový chlor
|
< 10 μg/l
|
|
Celkový obsah organofosforových pesticidů
|
< 50 ng/l
|
|
Celkový obsah organochlorových pesticidů a polychlorovaných bifenylů
|
< 50 ng/l
|
|
Celkový obsah organického chloru
|
< 25 ng/l
|
Dodatek 4A
Třecí podklad pro danio pruhované
Vytírací rošt
: celoskleněná miska na nástroje, např. o rozměrech (d × š × v) 22 × 15 × 5,5 cm, pokrytá snímatelnou drátěnou mřížkou z nerezové oceli (šířka otvorů 2 mm). Mřížka by měla pokrývat misku na nástroje v místech pod úrovní okraje.

Na mřížku se připevní třecí podklad. Měl by vytvořit strukturu, do které budou ryby vplouvat. Vhodné jsou například umělé akvarijní rostliny vyrobené ze zeleného plastového materiálu (poznámka: je třeba vzít v potaz možnou adsorpci zkoušené chemické látky na plastový materiál). Plastový materiál se dostatečně dlouho proplachuje v dostatečném objemu horké vody, aby se zajistilo, že se do zkušební vody nedostanou žádné chemické látky. Při použití skleněných materiálů je třeba zajistit, aby se ryby při prudkých pohybech neporanily a netísnily.
Vzdálenost mezi roštem a skleněnými tabulemi by měla být alespoň 3 cm, aby se zajistilo, že ke tření nebude docházet mimo rošt. Jikry vytřené do roštu propadávají mřížkou a 45–60 minut od začátku osvětlení je lze odebírat. Průsvitné jikry nejsou přilnavé a lze je snadno spočítat pomocí bočního světla. Při použití pěti samiček v každé nádrži se počet jiker do 20 za den považuje za nízký, do 100 za den za středně vysoký a více než 100 jiker za den za vysoký. Třecí rošt se odstraní, odeberou se jikry a třecí rošt se poté opět vsadí do zkušební nádrže, a to co nejpozději večer nebo velmi časně zrána. Doba do opětovného vsazení by neměla překročit jednu hodinu, protože jinak může pod vlivem třecího podkladu dojít k individuálnímu páření a tření v neobvyklé době. Pokud situace vyžaduje pozdější vsazení třecího roštu, mělo by se tak stát alespoň 9 hodin po začátku osvětlení. V tuto pozdní denní dobu již tření vyvoláno nebývá.
Dodatek 4B
Třecí podklad pro jelečka velkohlavého
Do jedné zkušební komory se umístí dvě nebo tři kombinované třecí roury a plastové/keramické/skleněné rošty nebo rošty z nerezové oceli (např. šedý žlábek polokruhového tvaru o délce 80 mm uložený na podložce se zvednutými okraji o délce 130 mm) (viz obrázek). Bylo prokázáno, že pro třecí podklad jsou vhodné starší roury z PVC nebo keramiky (Thorpe a kol., 2007).
Roury se doporučuje obrousit, aby se zlepšila přilnavost. Rošt by rovněž měl být odstíněn, aby se rybám zabránilo v přístupu k vypadlým jikrám, pokud u použitého třecího podkladu nebylo prokázáno, že na něm jikry dobře ulpívají.

Účelem základny je pojmout veškeré jikry, které neulpěly na povrchu roury a které by tak spadly na dno nádrže (nebo jikry, které jsou kladeny přímo na plochou plastovou základnu). Všechny třecí podklady by se před použitím měly nejméně 12 hodin proplachovat v ředicí vodě.
ODKAZY
Thorpe, K. L., Benstead, R., Hutchinson, T. H., Tylerm, C. R. (2007) An optimised experimental test procedure for measuring chemical effects on reproduction in the fathead minnow, Pimephales promelas. Aquatic Toxicology, 81, pp. 90–98.
Dodatek 5A
Posuzování druhotných pohlavních znaků u jelečka velkohlavého za účelem zjištění určitých chemických látek s endokrinním působením
Přehled
Mezi potenciálně důležité charakteristiky tělesného vzhledu dospělých jelečků velkohlavých při zkouškách endokrinních disruptorů patří zbarvení těla (tj. světlé/tmavé), forma zbarvení (tj. přítomnost či nepřítomnost svislých pruhů), tvar těla (tj. tvar hlavy a hrudní oblasti, rozšíření břicha) a druhotné pohlavní znaky specifické pro tento druh (tj. počet a velikost pářicích hrbolků, velikost dorzálního polštářku a kladélka).
Pářicí hrbolky se nacházejí na hlavě (dorzální polštářek) reprodukčně aktivních jelečků velkohlavých a obvykle jsou uspořádány symetricky po obou stranách (Jensen a kol., 2001). U samiček v kontrolních skupinách a u nedospělých samečků a samiček nebyl vývoj hrbolků zaznamenán (Jensen a kol., 2001). Samečci mohou mít až osm jednotlivých hrbolků kolem očí a mezi nosními dírkami. Nejvíce hrbolků největší velikosti se nachází ve dvou souběžných řadách bezprostředně pod nosními dírkami a nad tlamou. Ryby často mají také skupiny hrbolků pod dolní čelistí. Ty, které jsou nejblíže k tlamě, se zpravidla vyskytují v jednom páru, zatímco více ventrálně se mohou nacházet i po čtyřech. Skutečný počet hrbolků je zřídka větší než 30 (v rozmezí 18–28; Jensen a kol., 2001). Nejvíce hrbolků má podobu jednotlivých, zaoblených struktur, jejichž výška se přibližně rovná jejich poloměru. Většina reprodukčně aktivních samečků má rovněž alespoň některé hrbolky zvětšené a vystouplé do té míry, že je nelze odlišit jako jednotlivé struktury.
Některé druhy chemických látek narušujících činnost endokrinních žláz mohou způsobit abnormální výskyt určitých druhotných pohlavních znaků u opačného pohlaví. Například agonisté androgenního receptoru, jako je 17-beta-methyltestosteron nebo 17-beta-trenbolon, mohou způsobit, že se pářicí hrbolky vyvinou u samiček jelečka velkohlavého (Smith, 1974; Ankley a kol., 2001; 2003), a agonisté estrogenního receptoru mohou způsobit snížení počtu nebo velikosti pářicích hrbolků u samečků (Miles-Richardson a kol., 1999; Harries a kol., 2000).
Následuje popis, jak charakterizovat pářicí hrbolky u jelečka velkohlavého, založený na postupech používaných v laboratoři americké Agentury na ochranu životního prostředí (EPA) v Duluthu ve státě Minnesota. Specifické produkty a/nebo vybavení lze nahradit srovnatelnými materiály, které jsou k dispozici.
Prohlídka se nejlépe provádí pomocí lupy s osvětlením nebo pomocí preparačního mikroskopu s osvětlením a s objektivem 3X. Ryby se prohlížejí z dorzálního směru a anteriorní stranou dopředu (hlavou k pozorovateli).
|
a)
|
Ryba se vloží do malé Petriho misky (např. o průměru 100 mm), anteriorní stranou dopředu a ventrální stranou dolů. Hledáček se zaostří tak, aby bylo možné identifikovat hrbolky. Ryba se jemně a pomalu obrací z boku na bok, aby bylo možné identifikovat oblasti s hrbolky. Hrbolky se spočítají a zaznamená se jejich hodnocení.
|
|
b)
|
Pozorování se opakuje na ventrálním povrchu hlavy tak, že se ryba položí na Petriho misku dorzálně, anteriorní stranou dopředu.
|
|
c)
|
Pozorování by u každé ryby měla být dokončena do 2 min.
|
Počítání hrbolků a jejich klasifikace
Bylo zjištěno šest specifických oblastí pro posuzování přítomnosti a vývoje hrbolků u dospělých jelečků velkohlavých. Ke zmapování umístění a množství přítomných hrbolků byla vytvořena šablona (viz konec tohoto dodatku). U každého organismu se zaznamená počet hrbolků a jejich velikost pak lze kvantitativně seřadit takto: 0 – nevyskytují se, 1 – přítomné, 2 – zvětšené a 3 – výrazně zvětšené (obrázek 1).
Stupeň 0 – žádné hrbolky se nevyskytují. Stupněm 1 (přítomné) se označí všechny hrbolky s jedním vrcholem, jejichž výška se přibližně rovná jejich poloměru (průměru). Stupeň 2 (zvětšené) se projevuje tkání v hvězdicovitém tvaru, který má obvykle velkou radiální základnu s rýhami nebo brázdami směřujícími od středu. Horní část hrbolku je často spíše rozeklaná, ale může být i poněkud zaoblená. Při stupni 3 (výrazně zvětšené) jsou hrbolky obvykle poměrně velké a zaoblené, s málo rozlišenou strukturou. Někdy se hrbolky mohou vyskytovat společně a vytvářet jednolitou strukturu v určité oblasti nebo v několika oblastech najednou (B, C a D, jak jsou popsány níže). Zbarvení a tvar jsou podobné jako u stupně 2, ale někdy je obtížné je navzájem rozlišit. Použití tohoto klasifikačního systému zpravidla vede k celkovému hodnocení hrbolků nižšímu než 50 u normálních samečků v kontrolních skupinách, kteří mají 18–20 hrbolků (Jensen a kol., 2001).
Obrázek 1

Skutečný počet hrbolků u některých ryb může být v konkrétní oblasti klasifikace větší, než je počet políček v šabloně (dodatek A). Nastane-li tento případ, lze vpravo nebo vlevo od daného políčka vepsat další klasifikační čísla. Šablona proto nemusí vykazovat symetrii. Další způsob zmapování hrbolků, které jsou párové nebo spojené vertikálně podél horizontální roviny tlamy, lze provést tak, že se do jednoho políčka uvedou klasifikační body dvou hrbolků.
Oblasti mapování:
A– hrbolky nacházející se kolem oka. Mapují se od dorzálních po ventrální kolem anteriorního okraje oka. U dospělých samečků v kontrolních skupinách jsou obvykle početné, u samiček v kontrolních skupinách se nevyskytují, zpravidla jsou párové (po jednom u každého oka), u samiček exponovaných androgenům může být pouze jeden.
B– hrbolky nacházející se mezi nosními dírkami (póry senzorických kanálků). U samečků v kontrolní skupině jsou obvykle párové a vyššího stupně (2 – zvětšené nebo 3 – výrazně zvětšené). U samiček v kontrolní skupině se nevyskytují, do určité míry se mohou vyskytnout a vyvinout u samiček exponovaných androgenům.
C– hrbolky nacházející se bezprostředně anteriorně před nosními dírkami, souběžně s tlamou. U zralých samečků v kontrolních skupinách jsou zpravidla zvětšené nebo výrazně zvětšené. U méně vyvinutých samečků nebo u samiček exponovaných androgenům bývají stupně 1 (přítomné) nebo zvětšené.
D– hrbolky nacházející se souběžně s linií tlamy. Zpravidla jsou klasifikovány u samečků v kontrolních skupinách. U samiček z kontrolních skupin se nevyskytují, ale bývají přítomné u samiček exponovaných androgenům.
E– hrbolky nacházející se na dolní čelisti, poblíž tlamy; obvykle jsou malé a většinou párové. U samečků v kontrolních skupinách nebo u exponovaných samečků bývají různé, stejně tak u exponovaných samiček.
F– hrbolky nacházející se ventrálně k poloze E. Obvykle jsou malé a párové. Bývají přítomné u samečků v kontrolní skupině a samiček exponovaných androgenům.
ODKAZY
|
1)
|
Ankley, G. T., Jensen, K. M., Kahl, M. D., Korte, J. J., Makynen, M. E. (2001) Description and evaluation of a short-term reproduction test with the fathead minnow (Pimephales promelas). Environ Toxicol Chem 20, pp. 1276–1290.
|
|
2)
|
Ankley, G. T., Jensen, K. M., Makynen, E. A., Kahl, M. D., Korte, J. J., Hornung, M. W., Henry, T. R., Denny, J. S., Leino, R. L., Wilson, V. S., Cardon, M. C., Hartig, P. C., Gray, E. L. (2003) Effects of the androgenic growth promoter 17-β trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environ Toxicol Chem 22, pp. 1350–1360.
|
|
3)
|
Harries, J. E., Runnalls, T., Hill, E., Harris, C. A., Maddix, S., Sumpter, J. P., Tyler, C. R. (2000) Development of a reproductive performance test for endocrine disrupting chemicals using pair-breeding fathead minnows (Pimephales promelas). Environ Sci Technol 34, pp. 3003–3011.
|
|
4)
|
Jensen, K. M., Korte, J. J., Kahl, M. D., Pasha, M. S., Ankley, G. T. (2001) Aspects of basic reproductive biology and endocrinology in the fathead minnow (Pimephales promelas). Comp Biochem Physiol C 128, pp. 127–141.
|
|
5)
|
Kahl, M. D., Jensen, K. M., Korte, J. J., Ankley, G. T. (2001) Effects of handling on endocrinology and reproductive performance of the fathead minnow. J Fish Biol 59, pp. 515–523.
|
|
6)
|
Miles-Richardson, S. R., Kramer, V. J., Fitzgerald, S. D., Render, J. A., Yamini, B., Barbee, S. J., Giesy, J. P. (1999) Effects of waterborne exposure of 17-estradiol on secondary sex characteristics and gonads of fathead minnows (Pimephales promelas). Aquat Toxicol 47, pp. 129–145.
|
|
7)
|
Smith, R. J. F. (1974) Effects of 17-methyltestosterone on the dorsal pad and tubercles of fathead minnows (Pimephales promelas). Can J Zool 52, pp. 1031–1038.
|
|
Šablona pro pářicí hrbolky
|
Číselná klasifikace
|
|
Identifikační číslo
|
1 – přítomné
|
|
Datum
|
2 – zvětšené
|
|
Celkové hodnocení
|
3 – výrazně zvětšené
|
|
|
C
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
|
|
D
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
Dodatek 5B
Posuzování druhotných pohlavních znaků u halančíka japonského za účelem zjištění určitých chemických látek s endokrinním působením
Následuje popis měření bradavkovitých výběžků (21), které jsou druhotným pohlavním znakem u halančíka japonského (Oryzias latipes).
|
1)
|
Po vyříznutí jater (dodatek 6) se mrtvé tělo vloží do kónické zkumavky, která obsahuje asi 10 ml 10 % neutrálního pufrovaného formalínu (hlavou nahoru, ocasem dolů). Fixuje-li se gonáda v jiném roztoku než v 10 % neutrálním pufrovaném formalínu, provede se příčný řez skalpelem přes celé mrtvé tělo mezi anteriorní oblastí řitní ploutve a řitním otvorem, přičemž je nutno dbát na to, aby nedošlo k poškození vývodu pohlavních žláz a samotné gonády (obrázek 3). Kraniální část rybího těla se vloží do fixačního roztoku, aby se zachovala gonáda, a ocasní část rybího těla do 10 % neutrálního pufrovaného formalínu, jak bylo popsáno výše.
|
|
2)
|
Po uložení rybího těla do 10 % neutrálního pufrovaného formalínu se anteriorní oblast řitní ploutve uchopí pinzetou a stiskne se asi na 30 vteřin tak, aby řitní ploutev zůstala otevřená. Při uchopení řitní ploutve pinzetou se opatrně uchopí několik ploutevních paprsků v anteriorní oblasti tak, aby se nepoškrábaly bradavkovité výběžky.
|
|
3)
|
Poté, co řitní ploutev zůstala asi po 30 vteřin otevřená, se rybí tělo uloží do 10 % neutrálního pufrovaného formalínu při pokojové teplotě až do změření bradavkovitých výběžků (měření se provádí po fixaci trvající alespoň 24 hodin).
|
Měření
|
1)
|
Po fixaci rybího těla v 10 % neutrálním pufrovaném formalínu po dobu alespoň 24 hodin se mrtvé tělo ryby vyjme z kónické zkumavky a formalín se otře do filtračního papíru (nebo papírového ubrousku).
|
|
2)
|
Ryba se položí břichem nahoru. Poté se malými preparačními nůžkami opatrně odstřihne řitní ploutev (upřednostňuje se řitní ploutev odstřihnout s malým množstvím interneurálních trnů (pterygioforů).
|
|
3)
|
Anteriorní oblast oddělené řitní ploutve se uchopí pinzetou a položí na skleněné podložní sklíčko spolu s několika kapkami vody. Poté se řitní ploutev překryje krycím sklíčkem. Je třeba dát pozor, aby se při uchopení řitní ploutve pinzetou nepoškrábaly bradavkovité výběžky.
|
|
4)
|
Pod biologickým mikroskopem (vzpřímený mikroskop nebo inverzní mikroskop) se pomocí počítadla stanoví počet článků s bradavkovitými výběžky. Bradavkovité výběžky se započítají, pokud je na posteriorním okraji článku viditelná malá formace výběžků. Počet článků s bradavkovitými výběžky na každé řitní ploutvi se zaznamená v pracovním listu (např. první ploutevní paprsek: 0, druhý ploutevní paprsek: 10, třetí ploutevní paprsek: 12 atd.) a součet těchto čísel u jednotlivých ryb se zanese do excelové tabulky. V případě potřeby se řitní ploutev vyfotografuje a počet článků s bradavkovitými výběžky se spočítá na fotografii.
|
|
5)
|
Po ukončení měření se řitní ploutev vloží do kónické zkumavky popsané v bodě 1) a uskladní se.
|
Obrázek 1.
Schéma znázorňující rozdíl mezi pohlavími v tvaru a velikosti řitní ploutve – A sameček, B samička. Oka, T. B. (1931) On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2, pp. 209–218.

Obrázek 2.
A – výběžky na článcích paprsků řitní ploutve. J. P. – článek, A. S. – osová vzdálenost, P. – výběžek. B – distální konec ploutvového paprsku. Na hrotu paprsku se nacházejí actinotrichia (Act.). Oka, T. B. (1931) On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2, pp. 209–218.

Obrázek 3.
Fotografie rybího těla, na které je znázorněno místo řezu při fixaci gonád ve fixačním roztoku, nejedná-li se o 10 % neutrální pufrovaný formalín. V takovém případě se zbývající část těla pomocí břitvy odřízne mezi anteriorní oblastí řitní ploutve a řitním otvorem (červená čára), hlavová část rybího těla se uloží do fixačního roztoku pro gonády a ocasní část se uloží do 10 % neutrálního pufrovaného formalínu.
Dodatek 6
Doporučené postupy pro odběr vzorků za účelem analýzy vitelogeninu
Je třeba dbát na to, aby nedošlo ke vzájemné kontaminaci mezi vzorky VTG samečků a samiček.
Postup 1A: Jeleček velkohlavý, odběr krve z ocasní žíly/tepny
Po anestetizaci se skalpelem částečně oddělí ocasní stopka a heparinizovanou mikrohematokritovou kapilárou se odebere krev z ocasní žíly/tepny. Po odebrání krve se rychle izoluje plazma, a to odstředěním po dobu 3 minut při zrychlení 15 000 g (nebo alternativně po dobu 10 minut při zrychlení 15 000 g a při teplotě 4 °C). Je-li to požadováno, lze po odstředění stanovit procento hematokritu. Část plazmy se poté přenese z mikrohematokritové kapiláry a uloží se do odstředivkové zkumavky s 0,13 jednotkami aprotininu (inhibitor proteázy) při teplotě – 80 °C do doby, než bude možné provést stanovení vitelogeninu. Podle velikosti jelečka velkohlavého (závisející na pohlaví) se objem plazmy, kterou lze odebrat, zpravidla nachází v rozmezí od 5 do 60 mikrolitrů z každé ryby (Jensen a kol., 2001).
Postup 1B: Jeleček velkohlavý, odběr krve ze srdce
Alternativně lze krev odebrat také srdeční punkcí pomocí heparinizované injekční stříkačky (1 000 jednotek heparinu na ml). Krev se přenese do Eppendorfových zkumavek (uložených na ledu) a poté odstředí (po dobu 5 minut při zrychlení 7 000 g a pokojové teplotě). Plazma se přenese do čistých Eppendorfových zkumavek (v poměrných částech, pokud je to s ohledem na objem plazmy proveditelné), urychleně se zmrazí při teplotě – 80 °C a takto se ponechá až do analýzy (Panter a kol., 1998).
Postup 2A: Halančík japonský, vyříznutí jater
Vyjmutí testované ryby ze zkušební komory
|
1)
|
Testovaná ryba se pomocí malého čeřenu vyjme ze zkušební komory. Je třeba dát pozor a neupustit testovanou rybu do jiné zkušební komory.
|
|
2)
|
V zásadě by se testované ryby měly vyjímat v tomto pořadí: kontrolní skupina, kontrola s rozpouštědlem (existuje-li), skupina s nejnižší koncentrací, skupina se střední koncentrací, skupina s nejvyšší koncentrací a pozitivní kontrola. Všichni samečkové se ze zkušební komory vyjmou dříve než zbývající samičky.
|
|
3)
|
Pohlaví každé testované ryby se zjistí na základě vnějších druhotných pohlavních znaků (např. tvaru řitní ploutve).
|
|
4)
|
Zkušební ryby se umístí do přepravní nádrže a dopraví se na pracoviště, kde se provádí vyříznutí jater. Etikety ze zkušební komory a přepravní nádrže se zkontrolují kvůli přesnosti a pro ověření, zda se počet ryb, jež byly vyjmuty ze zkušební komory, a počet ryb, které ve zkušební komoře zůstávají, shodují s očekáváním.
|
|
5)
|
Nelze-li pohlaví ryb zjistit podle jejich vnějšího vzhledu, vyjmou se ze zkušební komory všechny ryby. V takovém případě se pohlaví zjistí vyšetřením gonád nebo druhotných pohlavních znaků pod stereoskopickým mikroskopem.
|
Vyříznutí jater
|
1)
|
Zkušební ryba se pomocí malého čeřenu přenese z nádrže pro přepravu do anestetického roztoku.
|
|
2)
|
Po anestetizaci se ryba přenese pinzetou na filtrační papír (nebo na papírový ubrousek). Ryba se uchopí pinzetou za hlavu z obou stran, aby nedošlo k porušení ocasu.
|
|
3)
|
Voda na povrchu těla ryby se otře filtračním papírem (nebo papírovým ubrouskem).
|
|
4)
|
Ryba se položí břichem nahoru. Poté se pomocí preparačních nůžek provede malý příčný řez v polovině vzdálenosti mezi ventrální hřbetní oblastí a střední břišní oblastí.
|
|
5)
|
Do tohoto malého řezu se vloží preparační nůžky a rozstřihne se břicho podél střední linie břicha od bodu ležícího kaudálně od žaberního krytu až po kraniální stranu řitního otvoru. Je třeba dát pozor, aby preparační nůžky nepronikly příliš hluboko a aby nedošlo k poškození jater a gonád.
|
|
6)
|
Následující kroky se provedou pod stereoskopickým mikroskopem.
|
|
7)
|
Testovací ryba se položí břichem nahoru na papírový ubrousek (použít lze rovněž skleněnou Petriho misku nebo podložní sklíčko mikroskopu).
|
|
8)
|
Stěny břišní dutiny se roztáhnou jemnou pinzetou a odkryjí se tak vnitřní orgány. V případě potřeby je rovněž přijatelné odkrýt vnitřní orgány tak, že se odstraní jedna strana stěny břišní dutiny.
|
|
9)
|
Pomocí druhé jemné pinzety se odhalí přirostlá část jater a žlučový měchýř. Poté se uchopí žlučovod a odřízne se žlučový měchýř. Je třeba dbát na to, aby se žlučový měchýř neprotrhl.
|
|
10)
|
Stejným způsobem se uchopí jícen a od jater se odřízne gastrointestinální trakt. Je třeba dát pozor, aby obsah trávicí soustavy nevytekl. Kaudální část gastrointestinálního traktu se odřízne od řitního otvoru a gastrointestinální trakt se vyjme z břišní dutiny.
|
|
11)
|
Od periferie jater se ořízne tuková hmota a jiné tkáně. Je třeba dát pozor, aby se játra nepoškrábala.
|
|
12)
|
Oblast jaterního portálu se uchopí jemnou pinzetou a játra se vyjmou z břišní dutiny.
|
|
13)
|
Játra se umístí na podložní sklíčko. V případě potřeby se pomocí jemné pinzety z povrchu jater odstraní veškerý zbývající tuk a vnější tkáně (např. břišní výstelka).
|
|
14)
|
Na elektronických analytických vahách se změří hmotnost jater s mikrozkumavkou o objemu 1,5 ml jako vahou obalu. Hodnota se zaznamená v pracovním listu (s přesností na 0,1 mg). Na etiketě mikrozkumavky se ověří identifikační údaje.
|
|
15)
|
Mikrozkumavka s játry se zazátkuje. Skladuje se v chladicím (nebo mrazicím) stojánku.
|
|
16)
|
Po odříznutí jedněch jater se preparační nástroje vyčistí nebo nahradí čistými.
|
|
17)
|
Výše popsaným způsobem se vyjmou játra u všech ryb v přepravní nádrži.
|
|
18)
|
Po vyříznutí jater ze všech ryb v přepravní nádrži (tj. všech samečků nebo samiček ze zkušební komory) se všechny vzorky jater umístí do stojánku na zkumavky s etiketou kvůli identifikaci a uskladní se v mrazničce. Jsou-li játra krátce po vyříznutí dodána k předběžné úpravě, vzorky se na další pracoviště přenesou v chladicím (nebo mrazicím) stojánku.
|
Po odnětí jater je mrtvé tělo ryby k dispozici pro měření druhotných pohlavních znaků.
Vzorek
Pokud se vzorky jater odebrané u testovacích ryb krátce po vyříznutí nepoužijí pro předběžnou úpravu, skladují se při teplotě ≤ – 70 °C.
Obrázek 1.
Nůžkami se vede řez těsně před prsními ploutvemi.

Obrázek 2.
Pomocí nůžek se rozstřihne střední linie břicha až k bodu, který se nachází přibližně 2 mm kraniálně od řitního otvoru.

Obrázek 3.
Pinzetou se rozevřou břišní stěny, aby se odkryla játra a další vnitřní orgány. (Alternativně lze břišní stěny laterálně přišpendlit.) Šipka označuje játra.
Obrázek 4.
Játra se pomocí pinzety vypreparují a vyříznou.

Obrázek 5.
Pinzetou se jemně odtáhnou střeva.

Obrázek 6.
Oba konce střev a veškeré střevní okruží se oddělí nůžkami.
Obrázek 7 (samička).
U samiček je postup stejný.

Obrázek 8.
Dokončený postup.

Postup 2B: Halančík japonský (Oryzias latipes), předúprava jater pro analýzu vitelogeninu
Ze soupravy pro analýzu ELISA se vezme lahev s homogenizačním pufrem a ochladí se v ledové tříšti (teplota roztoku ≤ 4 °C). Je-li použit homogenizační pufr ze systému ELISA EnBio, roztok se rozmrazí při pokojové teplotě a poté se lahev ochladí v ledové tříšti.
Objem pufru pro homogenizaci jater se vypočítá na základě jejich hmotnosti (pro přípravu homogenátu se přidá 50 μl homogenizačního pufru na mg hmotnosti jater). Například je-li hmotnost jater 4,5 mg, objem pufru pro homogenizaci jater je 225 μl. Připraví se seznam objemů homogenizačního pufru pro všechna játra.
Příprava jater pro předúpravu
|
1)
|
Mikrozkumavka o objemu 1,5 ml obsahující játra se vyjme z mrazničky těsně před předúpravou.
|
|
2)
|
Předúprava samčích jater by se měla provádět dříve než předúprava samičích jater, aby se předešlo kontaminaci vitelogeninem. U zkušebních skupin by se kromě toho předúprava měla provádět v tomto pořadí: kontrolní skupina, kontrola s rozpouštědlem (existuje-li), skupina s nejnižší koncentrací, skupina se střední koncentrací, skupina s nejvyšší koncentrací a pozitivní kontrola.
|
|
3)
|
Počet mikrozkumavek o objemu 1,5 ml obsahujících vzorky jater, které se vyjmou z mrazničky v daný čas, by neměl být větší než počet zkumavek, které lze současně odstředit.
|
|
4)
|
Mikrozkumavky o objemu 1,5 ml s jaterními vzorky se uspořádají na mrazicím stojánku podle pořadových čísel (játra není třeba rozmrazovat).
|
Provedení předúpravy
1. Přidání homogenizačního pufru
|
1)
|
Kontrolou seznamu se zjistí, jaký objem homogenizačního pufru má být přidán pro daný konkrétní vzorek jater, a mikropipeta (rozmezí objemů 100–1 000 μl) se nastaví na příslušný objem. Na mikropipetu se nasadí čistý hrot.
|
|
2)
|
Z lahve s činidlem se nabere homogenizační pufr a přidá se do zkumavky o objemu 1,5 ml obsahující játra.
|
|
3)
|
Podle výše uvedeného postupu se homogenizační pufr přidá do všech mikrozkumavek o objemu 1,5 ml obsahujících játra. Hrot mikropipety není třeba měnit za nový. Je-li hrot kontaminován nebo existuje-li podezření, že je kontaminován, musí se vyměnit.
|
2. Homogenizace jater
|
1)
|
Vezme se nový homogenizační tlouček pro homogenizátor pro mikrozkumavky.
|
|
2)
|
Tlouček se vloží do mikrozkumavky o objemu 1,5 ml. Homogenizátor se uchopí tak, aby tlačil na játra mezi povrchem tloučku a vnitřní stěnou mikrozkumavky o objemu 1,5 ml.
|
|
3)
|
Homogenizátor pro mikrozkumavky se ponechá v činnosti 10–20 sekund. Mikrozkumavka o objemu 1,5 ml se během této činnosti chladí ledovou tříští.
|
|
4)
|
Tlouček se vyjme z mikrozkumavky o objemu 1,5 ml a ponechá se asi na 10 sekund v nečinnosti. Poté se provede vizuální kontrola stavu suspenze.
|
|
5)
|
Jsou-li v suspenzi patrné kousky jater, kroky 3) a 4) se opakují, aby se připravil uspokojivý homogenát jater.
|
|
6)
|
Suspendovaný homogenát jater se chladí v chladicím stojánku až do odstřeďování.
|
|
7)
|
Pro každý homogenát se tlouček vymění za nový.
|
|
8)
|
Podle výše popsaného postupu se všechna játra homogenizují za pomoci homogenizačního pufru.
|
3. Odstředění suspendovaného homogenátu jater
|
1)
|
Ověří se, že teplota v komoře chlazené odstředivky není vyšší než 5 °C.
|
|
2)
|
Mikrozkumavky o objemu 1,5 ml obsahující suspendovaný homogenát jater se vloží do chlazené odstředivky (v případě potřeby se provede vyvážení).
|
|
3)
|
Suspendovaný homogenát jater se 10 minut odstřeďuje při zrychlení 13 000 g a při teplotě ≤ 5 °C. Je-li však supernatant dostatečně oddělený, lze sílu a dobu odstředění upravit podle potřeby.
|
|
4)
|
Po odstředění se zkontroluje, zda je supernatant náležitě oddělený (na povrchu: tuk, uprostřed: supernatant, spodní vrstva: jaterní tkáň). Není-li odstředění dostatečné, suspenze se odstředí znovu za stejných podmínek.
|
|
5)
|
Všechny vzorky se vyjmou z chlazené odstředivky a uspořádají se na mrazicím stojánku podle pořadových čísel vzorků. Je třeba dát pozor, aby oddělené vrstvy po odstředění opět nesuspendovaly.
|
4. Odběr supernatantu
|
1)
|
Do stojánku na zkumavky se vloží čtyři mikrozkumavky o objemu 0,5 ml pro uchovávání supernatantu.
|
|
2)
|
Pomocí mikropipety se z každého supernatantu (odděleného jako prostřední vrstva) odebere 30 μl a vloží se do jedné mikrozkumavky o objemu 0,5 ml. Je třeba dát pozor, aby nebyl odebrán tuk z povrchu nebo jaterní tkáň ze spodní vrstvy.
|
|
3)
|
Stejným způsobem se supernatant odebere a vloží do dalších dvou mikrozkumavek o objemu 0,5 ml.
|
|
4)
|
Pomocí mikropipety se odebere zbytek supernatantu (nejméně 100 μl, je-li to proveditelné). Tento supernatant se poté vloží do zbývající mikrozkumavky o objemu 0,5 ml. Je třeba dát pozor, aby nebyl odebrán tuk z povrchu nebo jaterní tkáň ze spodní vrstvy.
|
|
5)
|
Mikrozkumavka o objemu 0,5 ml se uzavře zátkou a objem supernatantu se zapíše na etiketu. Poté se mikrozkumavky ihned ochladí v mrazicím stojánku.
|
|
6)
|
Pro každý supernatant se použije nový hrot mikropipety. Ulpí-li na hrotu větší množství tuku, je třeba ho ihned nahradit novým hrotem, aby nedošlo ke kontaminaci jaterního extraktu tukem.
|
|
7)
|
Podle postupu popsaného výše se všechen odstředěný supernatant vloží do čtyř mikrozkumavek o objemu 0,5 ml.
|
|
8)
|
Po vložení supernatantu do mikrozkumavek o objemu 0,5 ml se všechny mikrozkumavky s identifikačními etiketami uloží do stojánku na zkumavky a ihned poté se zmrazí v mrazničce. Měří-li se koncentrace VTG okamžitě po předúpravě, zkumavka o objemu 0,5 ml (obsahující 30 μl supernatantu) se uchová v chladu ve stojánku na zkumavky a přenese se na pracoviště, kde se provádí analýza ELISA. V takovém případě se ostatní mikrozkumavky vloží do stojánků na zkumavky a zmrazí se v mrazničce.
|
|
9)
|
Po odběru supernatantu se reziduum vhodným způsobem odstraní.
|
Skladování vzorku
Mikrozkumavky o objemu 0,5 ml obsahující supernatant homogenátu jater se skladují při teplotě ≤ – 70 °C do doby, než jsou použity pro analýzu ELISA.
Postup 3A: Danio pruhované, odběr krve z ocasní žíly/tepny
Ihned po anestetizaci se příčně oddělí ocasní stopka a z ocasní tepny/žíly se odebere krev pomocí heparinizované mikrohematokritové kapiláry. Objemy krve se nacházejí v rozmezí od 5 do 15 μl v závislosti od velikosti ryby. Do mikrokapiláry se přidá stejný objem pufru s aprotininem (6 μg aprotininu na ml fosfátového pufru (PBS)) a plazma se od krve oddělí odstředěním (po dobu 5 minut při zrychlení 600 g). Plazma se shromáždí do zkušebních zkumavek a uskladní se při teplotě – 20 °C do doby, než se analyzuje na vitelogenin nebo na jiné proteiny, jež jsou předmětem zájmu.
Postup 3B: Danio pruhované, odběr krve srdeční punkcí
Aby nedošlo ke koagulaci krve a rozložení proteinu, vzorky se odebírají ve fosfátovém pufru (PBS) obsahujícím heparin (1 000 jednotek/ml) a inhibitor proteázy aprotinin (2 TIU/ml). Jako složky pro přípravu tohoto pufru se doporučuje použít heparin, amonnou sůl a lyofilizovaný aprotinin. Odběr krve se doporučuje provést injekční stříkačkou (o objemu 1 ml) s fixovanou tenkou jehlou (např. značky Braun Omnikan-F). Injekční stříkačka se předem naplní pufrem (přibližně 100 μl) tak, aby malé objemy krve z každé ryby byly plně eluovány. Vzorky krve se odeberou srdeční punkcí. Ryba se nejprve anestetizuje roztokem MS-222 (v koncentraci 100 mg/l). Správný režim anestezie umožní uživateli rozeznat srdeční tep dania pruhovaného. Při provádění srdeční punkce se píst injekční stříkačky udržuje pod slabým tlakem. Množství krve, která lze odebrat, se nacházejí v rozmezí 20–40 mikrolitrů. Po srdeční punkci se směs krve/pufru vloží do zkušební zkumavky. Plazma se oddělí od krve odstředěním (po dobu 20 minut při 5 000 g) a uskladní se při teplotě – 80 °C do doby, než bude použita pro analýzu.
Postup 3C: Standardní operační postup: danio pruhované, homogenizace hlavy a ocasu
|
1)
|
Ryba se anestetizuje a usmrtí v souladu s popisem zkoušky.
|
|
2)
|
Odřízne se hlava a ocas, jak znázorňuje obrázek 1.
|
Pozor: veškeré preparační nástroje a pracovní stůl je třeba mezi zpracováním každé jednotlivé ryby řádně omýt a vyčistit (např. 96 % ethanolem), aby se zabránilo ‚znečištění vitelogeninem‘ v důsledku přenosu ze samiček nebo ze samečků, u kterých byly vyvolány účinky, na samečky, u kterých účinky vyvolány nebyly.
Obrázek 1
|
1)
|
Stanoví se společná hmotnost hlavy a ocasu každé ryby se zaokrouhlením na mg.
|
|
2)
|
Po zvážení se části vloží do vhodných zkumavek (např. Eppendorfovy zkumavky o objemu 1,5 ml) a zmrazí se při teplotě – 80 °C až do homogenizace nebo se přímo homogenizují na ledu pomocí dvou plastových paliček. (Lze užít i jiných metod, jsou-li prováděny na ledu a je-li výsledkem homogenní hmota.) Důležité: Zkumavky je třeba řádně očíslovat, aby bylo možné hlavu a ocas z určité ryby porovnat s příslušným řezem těla, který se použije pro histologii gonád.
|
|
3)
|
Když je dosaženo homogenní hmoty, přidá se homogenizační pufr (22) chlazený na ledu v množství čtyřnásobně větším než hmotnost tkáně. Pokračuje se v práci s paličkami, dokud směs není homogenní. Důležitá poznámka: na každou rybu se použijí nové paličky.
|
|
4)
|
Vzorky se uloží na led až do odstřeďování při teplotě 4 °C po dobu 30 minut při zrychlení 50 000 g.
|
|
5)
|
Pomocí pipety se části supernatantu o objemu 20 μl přenesou do nejméně dvou zkumavek tak, že se špička pipety ponoří pod tukovou vrstvu na hladině a opatrně se nasaje supernatant bez frakcí tuku nebo sedimentu.
|
|
6)
|
Zkumavky se uskladní při teplotě – 80 °C až do použití.
|
Dodatek 7
Vzorky obohacené vitelogeninem a referenční standard pro opakovatelnost
Každý den provádění zkoušek na vitelogenin se analyzuje obohacený vzorek vytvořený pomocí referenčního standardu pro opakovatelnost. Pro přípravu referenčního standardu pro opakovatelnost se použije vitelogenin z jiné šarže, než jaká byla použita pro přípravu kalibračních standardů pro zkoušku, která se nyní provádí.
Obohacený vzorek se připraví tak, že se známé množství standardu přidá do vzorku plazmy samečků z kontrolní skupiny. Vzorek se obohatí tak, aby se dosáhlo koncentrace vitelogeninu 10krát až 100krát vyšší než očekávaná koncentrace vitelogeninu u samečků ryb z kontrolní skupiny. Vzorek plazmy samečků z kontrolní skupiny, který se obohacuje, může pocházet z jedné ryby nebo to může být směsný vzorek z několika ryb.
Dílčí vzorek neobohacené plazmy samečků z kontrolní skupiny se bude analyzovat alespoň ve dvou duplikátních jamkách. Rovněž obohacený vzorek se bude analyzovat alespoň ve dvou duplikátních jamkách. Za účelem stanovení očekávané koncentrace se střední hodnota množství vitelogeninu z obou neobohacených vzorků plazmy samečků z kontrolní skupiny přičte k vypočtenému množství vitelogeninu přidaného za účelem obohacení vzorků. Poměr mezi touto očekávanou koncentrací a naměřenou koncentrací se zaznamená spolu s výsledky všech souborů zkoušek provedených v týž den.
Dodatek 8
Schéma rozhodování pro statistickou analýzu

C.38. ZKOUŠKA METAMORFÓZY OBOJŽIVELNÍKŮ
ÚVOD
|
1.
|
Tato zkušební metoda je rovnocenná Pokynu OECD pro zkoušení č. 231 (2009). Potřeba vyvinout a ověřit zkoušku schopnou zjistit chemické látky působící v systému štítné žlázy druhů obratlovců vyplývá z obavy, že úrovně chemických látek v životním prostředí mohou mít nepříznivé účinky na lidi i volně žijící živočichy. V roce 1998 zahájila OECD činnost s vysokou prioritou, a sice revizi stávajících pokynů pro zkoušení a vývoj nových pokynů pro zkoušení určených ke screeningu a zkouškám potenciálních endokrinních disruptorů. Součástí této činnosti bylo vyvinout Pokyn pro zkoušení určený pro screening chemických látek působících na systém štítné žlázy druhů obratlovců. Bylo navrženo rozšíření Studie orální toxicity u hlodavců s opakovaným podáváním dávky v 28denním cyklu (kapitola B.7 této přílohy) a Zkouška metamorfózy obojživelníků (AMA). Rozšířená zkušební metoda B.7 prošla validací a revidovaná zkušební metoda byla vydána. Zkouška metamorfózy obojživelníků (AMA) prošla rozsáhlým validačním programem, který zahrnoval vnitrolaboratotní i mezilaboratorní studie prokazující vhodnost a spolehlivost této zkoušky (1)(2). Následně byla validace zkoušky podrobena hloubkovému hodnocení, které provedla komise složená z nezávislých odborníků (3). Tato zkušební metoda je výsledkem zkušeností získaných v průběhu validačních studií se zjišťováním chemických látek ovlivňujících činnost štítné žlázy a práce provedené jinde v členských zemích OECD.
|
PODSTATA ZKOUŠKY
|
2.
|
Zkouška metamorfózy obojživelníků (AMA) je screeningová zkouška sloužící k empirickému zjištění chemických látek, které mohou narušovat normální funkci osy hypotalamus-hypofýza-štítná žláza (HPT). Zkouška metamorfózy obojživelníků představuje zobecněný model obratlovců do té míry, do jaké je založena na zachovaných strukturách a funkcích osy hypotalamus-hypofýza-štítná žláza (HPT). Je to důležitá zkouška, protože metamorfóza obojživelníků je dobře popsaný proces závislý na funkci štítné žlázy, který reaguje na chemické látky působící v ose hypotalamus-hypofýza-štítná žláza, a je to jediná stávající zkouška, která zjišťuje činnost štítné žlázy u živočichů procházejících morfologickým vývojem.
|
|
3.
|
Celkové experimentální uspořádání zahrnuje expozici pulců Xenopus laevis ve stadiu 51 nejméně třem různým koncentracím zkoušené chemické látky a kontrolní experiment s ředicí vodou po dobu 21 dnů. Každá zkušební expozice má čtyři opakování. Hustota larev na začátku zkoušky je 20 pulců v každé zkušební nádrži pro každou exponovanou skupinu. Sledovanými ukazateli jsou délka zadní končetiny, délka těla od tlamy po kloaku (SVL), stadium vývoje, hmotnost ve vlhkém stavu, histologie štítné žlázy a každodenní pozorování mortality.
|
POPIS METODY
Zkušební druh
|
4.
|
Xenopus laevis se běžně kultivuje v laboratořích celého světa a lze jej jednoduše získat prostřednictvím komerčních dodavatelů. Reprodukci u tohoto druhu lze snadno vyvolat po celý rok dodáním lidského choriového gonadotropinu (hCG) a výsledné larvy lze běžně odchovat do zvolených stadií vývoje ve velkých počtech, což umožňuje používat protokoly o zkoušce specifické pro každé stadium. Upřednostňuje se, aby larvy použité ve zkoušce pocházely od domácích dospělých jedinců. Jako alternativu, i když se tento postup neupřednostňuje, lze do laboratoře provádějící zkoušku dodat vajíčka nebo embrya a nechat je aklimatizovat; dodávka vývojových stadií larvy pro použití ve zkoušce je nepřijatelná.
|
Vybavení a potřeby
|
5.
|
Pro provedení této zkoušky je potřebné toto vybavení a tyto potřeby:
|
a)
|
systém expozice (viz popis níže);
|
|
b)
|
akvária skleněná nebo z nerezové oceli (viz popis níže);
|
|
d)
|
zařízení řídící teplotu (např. ohřívače nebo chladiče (nastavitelné na 22° ± 1 °C));
|
|
f)
|
binokulární preparační mikroskop;
|
|
g)
|
digitální fotoaparát s rozlišením minimálně 4 megapixelů a s mikro funkcí;
|
|
h)
|
počítačový software pro digitalizací snímků;
|
|
i)
|
Petriho miska (např. 100 × 15 mm) nebo průhledná plastová komora srovnatelné velikosti;
|
|
j)
|
analytické váhy s přesností měření na tři desetinná místa (v mg);
|
|
m)
|
luxmetr (měřič intenzity osvětlení) s přesností měření na jednotky luxů;
|
|
n)
|
různé laboratorní sklo a nástroje;
|
|
o)
|
nastavitelné pipety (10 až 5 000 μl) nebo sada pipet odpovídajících velikostí;
|
|
p)
|
zkoušená chemická látka v množství dostatečném pro provedení zkoušky, pokud možno z jedné šarže;
|
|
q)
|
analytické pomůcky vhodné pro zkoušenou chemickou látku nebo smluvně zajištěné analytické služby.
|
|
Chemická testovatelnost
|
6.
|
Zkouška metamorfózy obojživelníků je založena na protokolu expozice ve vodním prostředí, přičemž zkoušená chemická látka se do zkušebních komor zavádí průtokovým systémem. Průtokové metody však představují omezení, pokud jde o typy chemických látek, které lze zkoušet, vyplývající z fyzikálně-chemických vlastností dané chemické látky. Před použitím tohoto protokolu by proto měly být získány základní informace o chemické látce, které jsou důležité pro určení testovatelnosti, a mělo by se nahlédnout do Metodického dokumentu OECD ke zkouškám toxicity složitých látek a směsí pro vodní organismy (4). To, že daná chemická látka může být obtížně testovatelná ve vodním prostředí, naznačují mimo jiné tyto vlastnosti: vysoký rozdělovací koeficient oktanol/voda (log Kow), vysoká těkavost, citlivost k hydrolýze a citlivost k fotolýze v podmínkách okolního laboratorního osvětlení. Pro stanovení toho, zda je látka testovatelná, mají význam i další faktory, které by měly být určeny v každém jednotlivém případě. Jestliže danou chemickou látku není možné úspěšně zkoušet v průtokovém zkušebním systému, lze použít statický systém s obnovováním média. Pokud zkoušené chemické látce nevyhovuje žádný z obou uvedených systémů, obvyklým postupem je, nezkoušet ji podle tohoto protokolu.
|
Systém expozice
|
7.
|
Upřednostňuje se pokud možno průtokový ředicí systém před statickým systémem s obnovováním média. Pokud fyzikální a/nebo chemické vlastnosti jakékoli zkoušené chemické látky nejsou vhodné pro použití průtokového ředicího systému, může být použit alternativní systém expozice (např. statický systém s obnovováním média). Složky systému, které přicházejí do styku s vodou, by měly být vyrobeny ze skla, nerezové oceli a/nebo polytetrafluorethylenu (PTFE). Mohou však být využity i vhodné plasty, pokud nezpochybní studii. Jako expoziční nádrže by měla sloužit akvária ze skla nebo nerezové oceli vybavená trubicovými stavoznaky, které pomáhají udržovat přibližný objem nádržky mezi 4,0 a 10,0 l a minimální hloubku vody 10 až 15 cm. Systém by měl být schopen podporovat všechny zkušební koncentrace a kontrolní měření, se čtyřmi opakováními při každé expozici. Průtoková rychlost by měla být u všech nádob stejná a neměnná, jednak kvůli zachování biologických podmínek, jednak kvůli expozici chemické látce (např. 25 ml/min). Expoziční nádrže by k určité pozici v systému expozice měly být přiřazeny náhodně, aby se snížily potenciální poziční vlivy, včetně mírných rozdílů v teplotě, intenzitě osvětlení apod. Mělo by být použito fluoroscenční osvětlení zajišťující fotoperiodu 12 hodin světla: 12 hodin tmy při intenzitě osvětlení mezi 600 a 2 000 luxy (lumen/m2) na povrchu vody. Teplotu vody je třeba udržovat na 22° ± 1 °C, hodnotu pH mezi 6,5 a 8,5 a koncentraci rozpuštěného kyslíku (DO) > 3,5 mg/l (> 40 % nasycení vzduchem) v každé zkušební nádrži. Teplota vody, hodnota pH a rozpuštěný kyslík by měly být měřeny minimálně jednou za týden; alespoň v jedné zkušební nádobě by se teplota měla pokud možno měřit průběžně. Podmínky, za kterých by tento protokol měl být prováděn, jsou nastíněny v dodatku 1. Pro další informace o nastavení průtokových systémů expozice a/nebo statických systémů s obnovováním média se odkazuje na publikaci Standard Guide for Conducting Acute Toxicity Tests on Test Materials with Fishes, Macroinvertebrates, and Amphibians (5), vydanou Americkou společností pro zkoušení a materiály (ASTM), a obecné toxikologické zkoušky ve vodním prostředí.
|
Kvalita vody
|
8.
|
Použít lze jakoukoli vodu, která je místně dostupná (např. pramenitou vodu nebo vodu z kohoutku filtrovanou přes aktivní uhlí) a umožňuje normální růst a vývoj pulců X. laevis. Jelikož kvalita místní vody se může v různých oblastech podstatně lišit, je třeba provést analýzu kvality vody, zejména pokud nejsou dostupné historické údaje o používání této vody pro chov druhu Xenopus. Zvláštní pozornost je třeba věnovat tomu, aby voda neobsahovala měď, chlor a chloraminy, které všechny jsou pro žáby a pulce toxické. Dále se doporučuje analyzovat vodu na koncentraci fluoridů, chloristanů a chlorečnanů (vedlejší produkty dezinfekce pitné vody) v pozadí, neboť všechny tyto anionty jsou substráty transportního systému jódu ze štítné žlázy a zvýšená úroveň každého z těchto aniontů může zkreslit výsledek studie. Analýzu je třeba provést před zahájením zkoušení a zkušební voda by obvykle neměla tyto anionty obsahovat.
|
Koncentrace jódu ve zkušební vodě
|
9.
|
K tomu, aby mohla štítná žláza syntetizovat thyroidální hormony, musí mít larvy k dispozici dostatek jodidu podávaného současně vodou i potravou. V současnosti neexistují žádné empiricky podložené pokyny ohledně minimální koncentrace jodidu. Dostupnost jodidu však může ovlivnit schopnost tyreoidálního systému reagovat na činitele ovlivňující činnost štítné žlázy, a jak známo, moduluje bazální aktivitu štítné žlázy, což je aspekt, který zasluhuje pozornost při interpretaci výsledků provedené histopatologie štítné žlázy. Proto je třeba zaznamenávat koncentrace jodidu ve zkušební vodě. Na základě dostupných údajů validačních studií bylo prokázáno, že se tento protokol dobře osvědčil při koncentraci jodidu (I), která se ve zkušební vodě pohybovala mezi 0,5 a 10 μg/l. Optimální hodnota minimální koncentrace jodidu ve zkušební vodě by měla činit 0,5 μg/l. Pokud je zkušební voda rekonstituována z deionizované vody, měl by se přidat jód v minimální koncentraci 0,5 μg/l. Jakékoli další doplnění jódu nebo jeho solí do zkušební vody je třeba uvést ve zprávě.
|
Chov zvířat
Péče o dospělé jedince a množení
|
10.
|
Péče o dospělé jedince a množení se provádí v souladu se standardními pokyny a čtenář se odkazuje na standardní příručku pro provádění zkoušky teratogeneze embryí žab (FETAX) (6), kde získá podrobnější informace. Tyto standardní pokyny poskytují příklad vhodných metod péče a množení, avšak jejich striktní dodržování se nevyžaduje. Množení se provádí tak, že se párům (3–5) dospělých samiček a samečků vstřikuje lidský choriogonadotropin (hCG). Samičkám ve vzorku se vstříkne přibližně 800–1 000 IU a samečkům 600–800 IU hCG rozpuštěných v 0,6–0,9 % solném roztoku. Chovné páry jsou drženy ve velkých nádržích, v klidu a ve statických podmínkách, aby se podpořil amplexus. Na dně každé množicí nádrže by mělo být nepravé dno z nerezové oceli nebo plastového pletiva, které umožní propadnutí shluků vajíček na dno nádrže. Žáby, kterým se vstříkne hCG pozdě odpoledne, obvykle nakladou většinu vajíček do druhého dne dopoledne. Po uvolnění a oplodnění dostatečného množství vajíček by dospělí jedinci měli být z množicích nádrží odstraněni.
|
Péče o larvy a jejich výběr
|
11.
|
Po odstranění dospělých jedinců z množicích nádrží se odeberou vajíčka a zhodnotí se jejich životaschopnost na reprezentativním podsouboru embryí ze všech chovných nádrží. Nejlepší jednotlivé snůšky (pro vyhodnocení kvality tření se doporučují 2 až 3 snůšky) by měly být ponechány na základě životaschopnosti embryí a přítomnosti dostatečného počtu (minimálně 1 500) embryí. Všechny organismy použité ve studii by měly pocházet z jednoho tření (tj. snůšky by se neměly mísit navzájem). Embrya se přenesou na velkou plochou pánev nebo mísu a všechna očividně mrtvá nebo nenormální vajíčka (viz definice v (5)) se pipetou nebo kapátkem odstraní. Zdravá embrya z každé ze tří snůšek se přenesou do tří oddělených líhní. Po čtyřech dnech od umístění do líhní se vybere nejlepší snůška na základě životaschopnosti a úspěšného vylíhnutí a larvy se přemístí do vhodného počtu chovných nádrží s teplotou vody 22° ± 1 °C. Kromě toho se některé další larvy přemístí do samostatných nádrží jako rezerva pro případ, že během prvního týdne dojde v chovných nádržích k úhynu. Tento postup zachovává jednotnou hustotu organismů, a snižuje tak vývojové rozdíly v rámci kohorty jedné snůšky. Všechny chovné nádrže je třeba denně čistit odsátím. V rámci prevence se upřednostňují vinylové nebo nitrilové rukavice před latexovými. Uhynulé jedince je třeba během prvního týdne každodenně odstraňovat a nahrazovat larvami z rezervy, aby byla zachována hustota organismů. Krmit je třeba minimálně dvakrát za den.
|
|
12.
|
V adaptační fázi se pulci aklimatizují na podmínky skutečné expoziční fáze, včetně typu potravy, teploty, cyklu světlo – tma a kultivačního média. Proto se doporučuje, aby během adaptační fáze a expoziční fáze byla použita stejná kultivační/ředicí voda. Pokud je pro uchovávání pulců během adaptační fáze používán statický kultivační systém, je třeba kultivační médium zcela vyměnit nejméně dvakrát týdně. V adaptační fázi je nutné předejít nakupením vyvolaným vysokou hustotou larev, protože takové vlivy by mohly znatelně ovlivnit vývoj pulců v následné experimentální fázi. Hustota chovu by neměla být větší než přibližně čtyři pulci na litr kultivačního média (ve statickém systému expozice) nebo 10 pulců na litr kultivačního média (např. s průtokem 50 ml/min v adaptačním nebo kultivačním systému). Za těchto podmínek by se pulci ze stadia 45/46 do stadia 51 měli vyvinout do dvanácti dnů. Reprezentativní pulce z této kmenové populace je třeba denně kontrolovat z hlediska jejich vývojové fáze, aby bylo možno odhadnout vhodný čas pro zahájení expozice. Je nutné dbát na minimalizaci stresu a traumat u pulců, zejména během přemisťování, čištění akvárií a manipulace s larvami. Je třeba se vyvarovat stresových podmínek/činností, jakými jsou hlasitý a/nebo nepřetržitý hluk, klepání na akvária, vibrace v akváriích, nadměrná aktivita v laboratoři a rychlé změny ve složkách životního prostředí (dostupnost světla, teplota, pH, rozpuštěný kyslík, rychlosti průtoku vody apod.). Pokud se pulci nevyvinou do stadia 51 během 17 dní po oplodnění, za potenciální důvod této skutečnosti je třeba považovat nadměrný stres.
|
Kultivace larev a jejich krmení
|
13.
|
Pulci se v době před expozicí (po stadiu 45/46 podle Nieuwkoopa a Fabera (NF) (8)) a během celé 21denní zkoušky krmí např. komerčně dostupným krmivem pro pulce používaným ve validačních studiích (viz též dodatek 1) nebo jinou stravou, u níž bylo prokázáno, že umožňuje stejnou účinnost zkoušky metamorfózy obojživelníků. Krmný režim v období před expozicí je třeba pečlivě upravit tak, aby splňoval požadavky vyvíjejících se pulců. To znamená, že nově vylíhnutým pulcům by měly být podávány malé porce potravy několikrát (minimálně dvakrát) za den. Je třeba zamezit přebytku potravy, aby i) byla zachována kvalita vody a ii) se zabránilo zanesení žaberních filtrů částicemi potravy a zbytky. Pokud jde o krmivo pro pulce používané ve validačních studiích, spolu s růstem pulců je nutno zvyšovat denní porce potravy až na přibližně 30 mg na jedince a den krátce před začátkem zkoušky. Jak ukázaly validační studie, toto krmivo dostupné na trhu podporuje řádný růst a vývoj pulců X. laevis; jedná se o jemné částice, které zůstávají suspendované ve vodním sloupci po dlouhé časové období a lze je spláchnout proudem vody. Celkové denní množství potravy je proto třeba rozdělit do menších porcí a podávat minimálně dvakrát denně. Krmný režim pro toto krmivo je nastíněn v tabulce 1. Krmné dávky je třeba zaznamenávat. Může být podáváno v suchém stavu nebo jako zásobní roztok připravený v ředicí vodě. Tento zásobní roztok je nutno připravovat obden čerstvý, a není-li použit, musí se uchovávat při teplotě 4 °C.
Tabulka 1.
Krmný režim s komerčně dostupným krmivem pro pulce, které bylo použito ve validačních studiích pro pulce X. laevis v životní části zkoušky metamorfózyobojživelníků v průtokových podmínkách.
|
Den studie
|
Přísun potravy (mg potravy na jedince a den)
|
|
0–4
|
30
|
|
5–7
|
40
|
|
8–10
|
50
|
|
11–14
|
70
|
|
15–21
|
80
|
|
Analytická chemie
|
14.
|
Před provedením studie je třeba vyhodnotit stabilitu zkoušené chemické látky na základě existujících informací o její rozpustnosti, rozložitelnosti a těkavosti. Na začátku zkoušky (den 0) a poté jednou týdně po dobu zkoušky je třeba z každé nádrže (opakování) při každé koncentraci odebrat vzorky zkušebních roztoků pro analytickou chemickou analýzu, tedy minimálně čtyři vzorky. Analýzu každé zkušební koncentrace se doporučuje provést rovněž během přípravy systému, před zahájením zkoušky, aby se ověřila účinnost systému. Dále se doporučuje analyzovat zásobní roztoky při jejich výměně, zejména pokud objem zásobního roztoku neposkytuje dostatečné množství chemické látky, aby pokrylo období běžných odběrů vzorků. V případě chemických látek, které při některých nebo všech koncentracích používaných při zkoušce není možné zjistit, je třeba měřit zásobní roztoky a zaznamenávat průtoky v rámci systému, aby bylo možno vypočítat nominální koncentrace.
|
Dávkování chemické látky
|
15.
|
Zkoušenou chemickou látku je možné zavést do systému různým způsobem, v závislosti na jejích fyzikálně-chemických vlastnostech. Chemické látky rozpustné ve vodě mohou být rozpuštěny v přiměřeném množství zkušební vody v koncentraci, která umožňuje dávkování v cílové zkušební koncentraci v průtokovém systému. Chemické látky, které jsou kapalné při pokojové teplotě a těžko rozpustné ve vodě, mohou být zavedeny pomocí metod sycení kapaliny kapalinou. Chemické látky, které jsou pevné při pokojové teplotě a jsou těžko rozpustné ve vodě, mohou být zavedeny pomocí syticích kolon ze skelné vaty (7). Upřednostňuje se použití zkušebního systému bez nosičů, avšak různé zkoušené chemické látky budou mít rozličné fyzikálně-chemické vlastnosti, které mohou vyžadovat různé přístupy při přípravě vody pro expozici chemické látce. Upřednostňuje se obejít se bez rozpouštědel nebo nosičů, protože: i) určitá rozpouštědla sama o sobě mohou způsobit toxicitu a/nebo vyvolat nežádoucí či neočekávané endokrinologické reakce, ii) zkoušené chemické látky v množstvích přesahujících jejich rozpustnost ve vodě (což může často nastat při použití rozpouštědel) mohou vést k nepřesnému určení účinných koncentrací a iii) použití rozpouštědel při déle trvajících zkouškách může vést k významnému rozvoji ‚biofilmů‘ spojených s činností mikrobů. V případě chemických látek, jejichž zkoušení je obtížné, lze použít rozpouštědlo jako poslední řešení, a určení, jaká metoda je nejvhodnější, by mělo vycházet z Metodického dokumentu OECD ke zkouškám toxicity složitých látek a směsí pro vodní organismy (4). Volba rozpouštědla se bude řídit chemickými vlastnostmi dané chemické látky. Bylo zjištěno, že v případech zkoušení toxicity ve vodním prostředí účinně působí rozpouštědla jako aceton, ethanol, methanol, dimethylformamid a triethylenglykol. V případě, že je použito nosné rozpouštědlo, musí být koncentrace rozpouštědla nižší než stálá koncentrace bez pozorovaných účinků (NOEC); pokyny OECD doporučují maximálně 100 μl/l; nedávný přezkum doporučuje používat koncentrace rozpouštědla pouze 20 μl/l ředicí vody (12). Jsou-li použita jako nosiče rozpouštědla, je nutné vyhodnotit kontrolní měření nejen při použití vhodného rozpouštědla, ale i v pro případ, kdy se rozpouštědlo nepoužije (čistá voda). Pokud není možné dodat chemickou látku s vodou, buď kvůli fyzikálně-chemickým vlastnostem (nízká rozpustnost), nebo z důvodu omezené dostupnosti chemické látky, je možné zvážit její podání prostřednictvím potravy. Byla provedena předběžná práce týkající se expozic ve stravě, avšak expozice touto cestou se běžně nepoužívá. Volbu metody je nutné zdokumentovat a analyticky ověřit.
|
Výběr zkušebních koncentrací
Stanovení nejvyšší zkušební koncentrace
|
16.
|
Pro účely této zkoušky by měla být nejvyšší zkušební koncentrace rovna mezi rozpustnosti zkoušené chemické látky; v případě akutně toxické chemické látky maximální tolerované koncentraci (MTC); nebo 100 mg/l podle toho, která z těchto hodnot je nejnižší.
|
|
17.
|
Maximální tolerovaná koncentrace je definována jako nejvyšší zkušební koncentrace chemické látky, která vede k nižší akutní mortalitě než 10 %. Použití tohoto přístupu předpokládá, že existují empirické údaje o akutní mortalitě, z nichž je možné maximální tolerovanou koncentraci odhadnout. Odhad maximální tolerované koncentrace může být nepřesný a obvykle se požaduje nějaký odborný posudek. I když technicky nejspolehlivější metodou pro odhad maximální tolerované koncentrace je použití regresních modelů, užitečnou aproximaci maximální tolerované koncentrace lze odvodit z existujících údajů o akutní toxicitě pomocí 1/3 akutní hodnoty LC50. Údaje o akutní toxicitě pro testovaný druh však mohou chybět. Pokud údaje o akutní toxicitě pro konkrétní druh nejsou k dispozici, lze provést 96hodinovou zkoušku LC50 s pulci, kteří jsou reprezentativním (tj. ve stejném stadiu) vzorkem pulců ze zkoušky metamorfózy obojživelníků. Volitelně, jsou-li dostupné údaje týkající se jiných druhů vodních živočichů (např. studie LC50 na rybách nebo na jiných druzích obojživelníků), je možné pravděpodobnou maximální tolerovanou koncentraci odhadnout mezidruhovou extrapolací na základě odborného posudku.
|
|
18.
|
Alternativně, pokud chemická látka není akutně toxická a je rozpustná v koncentraci vyšší než 100 mg/l, měla by být za nejvyšší zkoušenou koncentraci (HTC) považována hodnota 100 mg/l, neboť tato koncentrace se obvykle považuje za ‚prakticky netoxickou‘.
|
|
19.
|
Ačkoli statické metody s obnovováním média nejsou doporučeným postupem, mohou být použity, pokud průtokové metody nepostačují k dosažení maximální tolerované koncentrace. Použijí-li se statické metody s obnovováním média, je třeba zdokumentovat stabilitu koncentrace zkoušené chemické látky, která by měla zůstat v mezích kritérií provedení zkoušky. Médium se doporučuje obnovovat každých 24 hodin. Obnovení po více než 72 hodinách je nepřijatelné. Kromě toho je třeba vždy, bezprostředně před každým obnovením, změřit parametry kvality vody (např. rozpuštěný kyslík, teplotu, pH atd.).
|
Rozpětí zkušebních koncentrací
|
20.
|
Požadovány jsou minimálně tři zkušební koncentrace a kontrola s čistou vodou (a v případě nutnosti kontrola s vehikulem). Mezi nejvyšší a nejnižší zkušební koncentrací by měl rozdíl minimálně jednoho řádu. Maximální odstupňování dávek je o 0,1 a minimální odstupňování je o 0,33.
|
POSTUP
Zahájení a provádění zkoušky
Den 0
|
21.
|
Expozice by měla být zahájena, jakmile dostatečný počet pulců v předexpoziční kmenové populaci, kteří jsou ve věku 17 dnů po oplodnění nebo mladší, dosáhne vývojového stadia 51 podle Nieuwkoopa a Fabera (8). Pro výběr zkušebních zvířat je třeba zdravé a normálně vyhlížející pulce z kmenové populace shromáždit do jediné nádoby s přiměřeným množství ředicí vody. Pro určení stadia vývoje je třeba pulce jednotlivě vyjmout ze sběrné nádrže síťkou nebo odfiltrováním a přemístit do průhledné měřicí komory (např. Petriho misky o průměru 100 mm) s ředicí vodou. Při určování stadia se doporučuje pokud možno nepoužívat anestezii, avšak pulce je možné jednotlivě znecitlivět roztokem trikain–methan–sulfonátu v koncentraci 100 mg/l (např. MS-222), před manipulací vhodně pufrovaným hydrouhličitanem sodným. Použije-li se tento postup, měla by být metodika pro vhodné použití k anestezii, např. MS-222, získána z laboratoří, které s ní mají zkušenosti, a popsána ve zprávě o výsledcích zkoušky. Se zvířaty je třeba při tomto přemístění zacházet opatrně, aby se minimalizoval manipulační stres a předešlo jakémukoli poranění.
|
|
22.
|
Stadium vývoje zvířat se určí pomocí binokulárního preparačního mikroskopu. Aby se snížila konečná variabilita v rámci jednoho vývojového stadia, je důležité určení stadia provést co nejpřesněji. Podle Nieuwkoopa a Fabera (8) je hlavním vývojovým znakem při výběru organismů ve stadiu 51 morfologie zadní končetiny. Morfologické znaky zadních končetin je třeba zkoumat pod mikroskopem. Pro získání komplexních informací o určení stadií u pulců je třeba si pročíst celý návod Nieuwkoopa a Fabera (8), avšak stadium vývoje lze spolehlivě určit pomocí výrazných morfologických znaků. Pro zjednodušení a standardizaci procesu určení stadií během celé studie pomocí identifikace těchto výrazných morfologických znaků spojených s jednotlivými stadii za předpokladu, že vývoj je normální, je možné použít následující tabulku.
Tabulka 2.
Výrazné morfologické znaky pro určení stadií vývoje podle Neuwkoopa a Fabera.
|
Výrazné morfologické znaky
|
Stadium vývoje
|
|
51
|
52
|
53
|
54
|
55
|
56
|
57
|
58
|
59
|
60
|
61
|
62
|
63
|
64
|
65
|
66
|
|
Zadní končetina
|
X
|
X
|
X
|
X
|
X
|
X
|
X
|
|
|
|
|
|
|
|
|
|
|
Přední končetina
|
|
|
|
|
|
X
|
X
|
X
|
X
|
X
|
|
|
|
|
|
|
|
Kraniofaciální struktura
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
X
|
|
|
|
|
Morfologie čichového nervu
|
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
|
|
|
|
Délka ocasu
|
|
|
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
X
|
|
|
23.
|
Pro zahájení zkoušky by všichni pulci měli být ve stadiu 51. Nejvýraznějším morfologickým znakem pro určení stadia je v tomto stadiu morfologie zadní končetiny, což je zobrazeno na obrázku 1.
Obrázek 1.
Morfologie zadní končetiny ve stadiu 51 pulce X. laevis.
|
|
24.
|
Kromě výběru podle stadia vývoje je volitelně možné použít výběr podle velikosti zkušebních zvířat. Za tímto účelem je třeba změřit délku celého těla (nikoli délku těla od tlamy po kloaku (SVL)) v den 0 z dílčího vzorku přibližně 20 pulců ve stadiu 51 podle Nieuwkoopa a Fabera. Po výpočtu střední délky celého těla pro tuto skupinu pulců je možné stanovit minimální a maximální meze délky celého těla zkušebních zvířat tak, že se povolí rozpětí střední hodnoty ± 3 mm (střední hodnota délky celého těla u pulců ve stadiu 51 je mezi 24,0 a 28,1 mm). Hlavním parametrem při určování připravenosti každého zkušebního zvířete je však stanovení stadia vývoje. Pulce, kteří vykazují viditelné malformace nebo poranění, je třeba ze zkoušky vyloučit.
|
|
25.
|
Pulci, kteří splňují výše popsaná kritéria stadia, jsou uchováváni v nádržce s čistou kultivační vodou, dokud postup určení stadia není dokončen. Jakmile se určení stadia dokončí, larvy se náhodně rozdělí do expozičních nádrží tak, aby každá nádrž obsahovala 20 larev. Každá expoziční nádrž se pak zkontroluje, zda neobsahuje zvířata s abnormálním vzhledem (např. poraněním, nestandardním plaváním atd.). Pulci, kteří vypadají zjevně nezdravě, by měli být z expozičních nádrží odstraněni a nahrazeni larvami nově vybranými ze sběrné nádrže.
|
Poznámky
|
26.
|
Podrobnější informace ohledně postupů ukončení zkoušky a výběru pulců viz Metodický dokument OECD pro histologii štítné žlázy u obojživelníků (OECD Guidance Document on Amphibian Thyroid Histology (9)).
|
Měření v den 7.
|
27.
|
V den 7 se z každé zkušební nádrže (opakování) vyjme pět náhodně zvolených pulců. Použitý postup náhodného výběru by každému organismu ve zkoušce měl poskytnout stejnou pravděpodobnost, že bude vybrán. Toho lze dosáhnout použitím jakékoli metody náhodného výběru, avšak vyžaduje se, aby každý pulec byl očištěn. Pulci, kteří nebyli vybráni, se vrátí do své původní nádrže a pulci, kteří vybráni byli, se humánně usmrtí v roztoku o koncentraci 150 až 200 mg/l, např. MS-222, vhodně pufrovaném hydrouhličitanem sodným tak, aby bylo dosaženo pH 7,0. Utracení pulci se opláchnou ve vodě a osuší, poté se stanoví jejich tělesná hmotnost se zaokrouhlením na miligramy. U každého pulce se stanoví (pomocí binokulárního preparačního mikroskopu) délka zadní končetiny, délka těla od tlamy po kloaku a stadium vývoje.
|
Měření v den 21. (při ukončení zkoušky)
|
28.
|
Při ukončení zkoušky (den 21) se zbývající pulci vyjmou ze zkušebních nádrží a humánně usmrtí v roztoku o koncentraci 150 až 200 mg/l, např. MS-222, vhodně pufrovaném hydrouhličitanem sodným, jak uvedeno výše. Pulci se opláchnou ve vodě a osuší, poté se stanoví jejich tělesná hmotnost se zaokrouhlením na miligramy. U každého pulce se změří stadium vývoje, délka těla od tlamy po kloaku a délka zadní končetiny.
|
|
29.
|
Všechny larvy se na 48 až 72 hodin ponoří do Davidsonova fixačního média buď jako vzorky celého těla, nebo jako tkáňové vzorky odříznuté hlavy se spodní čelistí pro histologická vyšetření. Pro histopatologii by z každé nádrže (opakování) mělo být odebráno celkem pět pulců. Jelikož výška folikulární buňky závisí na stadiu vývoje (10), nejvhodnější metodou pro odběr vzorků pro účely histologických analýz je použít pokud možno jedince ve stejném stadiu. Aby bylo možno vybrat jedince ve stejném stadiu, je třeba před výběrem a následným zpracováním za účelem sběru a uchování údajů provést u všech larev určení stadia vývoje. Je to nezbytné, protože běžná odchylka ve vývoji bude mít za následek rozdílnou distribuci stadií v každé nádrži (opakování).
|
|
30.
|
Pulce vybrané pro histopatologii (n = 5 z každé nádrže k opakování) je třeba pokud možno porovnávat se střední hodnotou stadia kontrolních vzorků (ze spojených replik/opakování). Pokud existují nádrže (opakování) s více než pěti larvami v odpovídajícím stadiu, náhodně se vybere pět larev.
|
|
31.
|
Pokud existují nádrže (opakování) s méně než pěti larvami v odpovídajícím stadiu, je třeba odebrat vzorek náhodně vybraných jedinců v nejbližším nižším nebo vyšším stadiu vývoje tak, aby celková velikost vzorku dosáhla pěti larev pro každé opakování. Rozhodnutí, zda odebrat tyto další larvy v nejbližším vyšším, anebo nejbližším nižším stadiu vývoje, by mělo být učiněno na základě celkového hodnocení distribuce stadií v rámci kontroly a v rámci expozic chemické látce. Tzn. je-li expozice dané chemické látce spojena se zpomalením vývoje, pak by vzorek dalších larev měl být odebrán v nejbližším nižším stadiu. A naopak, je-li expozice dané chemické látce spojena s urychlením vývoje, pak by vzorek dalších larev měl být odebrán v nejbližším vyšším stadiu.
|
|
32.
|
V případech s prudkými změnami vývoje pulců v důsledku expozice určité zkoušené chemické látce může dojít k tomu, že distribuce stadií ve skupinách exponovaných chemické látce se nebude překrývat s vypočtenou mediánovou hodnotou stadia vývoje kontrolní skupiny. Pouze v těchto případech by postup výběru měl být pozměněn tak, že se použije stadium odlišné od mediánové hodnoty stadia kontroly, aby se dosáhlo odběru vzorků larev odpovídajícího stadia pro histopatologii štítné žlázy. Dále, pokud stadia nejsou stanovena (tj. nejsou synchronizovaná), mělo by pro histologickou analýzu být náhodně vybráno 5 pulců z každého opakování. Důvody, proč byly do vzorku zařazeny jakékoli larvy, které nejsou ve stadiu stejném jako mediánová hodnota stadia vývoje kontroly, je třeba uvést ve zprávě.
|
Určení biologických ukazatelů
|
33.
|
Během expoziční fáze, která trvá 21 dnů, se měření hlavních ukazatelů provádí v den 7 a 21, avšak zkušební zvířata je nezbytné pozorovat každodenně. V tabulce 3 je uveden přehled měřených ukazatelů a časů příslušných pozorování. Podrobnější informace o technických postupech pro měření hlavních ukazatelů a histologická vyšetření obsahuje Metodický dokument OECD (9).
Tabulka 3.
Časy pozorování hlavních ukazatelů při zkoušce metamorfózy obojživelníků.
|
Hlavní ukazatele
|
Denně
|
Den 7
|
Den 21
|
|
|
ߦ
|
|
|
|
|
|
ߦ
|
ߦ
|
|
|
|
ߦ
|
ߦ
|
|
—
|
Délka těla od tlamy po kloaku
|
|
|
ߦ
|
ߦ
|
|
—
|
Tělesná hmotnost ve vlhkém stavu
|
|
|
ߦ
|
ߦ
|
|
—
|
Histologie štítné žlázy
|
|
|
|
ߦ
|
|
Hlavní ukazatele
|
34.
|
Stadium vývoje, délka zadní končetiny, délka těla od tlamy po kloaku a hmotnost ve vlhkém stavu jsou hlavními sledovanými ukazateli při zkoušce metamorfózy obojživelníků a o každém z nich je v krátkosti pojednáno níže. Další technické informace o sběru těchto údajů lze najít v referenčních dokumentech, a to včetně postupů pro počítačovou analýzu, které se doporučuje používat.
|
Stadium vývoje
|
35.
|
Stadium vývoje pulců X. laevis se určí podle kritérií Nieuwkoopa a Fabera (8) pro určování stadií. Údaje o stadiu vývoje se obvykle používají k určení, zda je vývoj zrychlený, asynchronní, opožděný nebo není ovlivněn. Urychlení nebo opoždění vývoje se určuje srovnáním mediánové hodnoty stadia dosažené v kontrolní skupině a mediánové hodnoty stadia v exponovaných skupinách. Asynchronní vývoj se zaznamená, jestliže zkoumané tkáně nevykazují malformace nebo abnormality, ale je porušeno relativní načasování morfogeneze nebo vývoje různých tkání jednotlivých pulců.
|
Délka zadní končetiny
|
36.
|
Diferenciace a růst zadních končetin jsou řízeny hormony štítné žlázy a jsou to důležité vývojové znaky, které již byly používány při určování stadia vývoje. Vývoj zadní končetiny je při určení stadia vývoje používán kvalitativně, avšak zde je posuzován jako kvantitativní ukazatel. Proto se měří délka zadní končetiny jako ukazatel, který má odhalit účinky na osu štítné žlázy (obrázek 2). Kvůli jednotnosti se délka zadní končetiny měří na levé zadní končetině. Délka zadní končetiny se hodnotí v den 7 i v den 21 zkoušky. V den 7 je měření délky zadní končetiny jednoduché, jak je znázorněno na obrázku 2. Avšak v den 21 je měření délky zadní končetiny složitější vzhledem k záhybům na končetině. Měření délky zadní končetiny v den 21 by proto mělo začínat od bočního svalstva a sledovat střední linii končetiny přes jakékoli úhlové odchylky. Změny v délce zadní končetiny v den 7, i kdyby nebyly zjevné v den 21, se přesto považují za významné z hlediska potenciálního tyreoidálního působení. Měření délky se provádí z digitálních fotografií pomocí softwaru pro analýzu obrázků, jak je popsáno v Metodickém dokumentu OECD pro histologii štítné žlázy u obojživelníků (9).
|
Tělesná délka a hmotnost ve vlhkém stavu
|
37.
|
Určení délky těla od tlamy po kloaku (SVL) (obrázek 2) a hmotnosti ve vlhkém stavu se uvádí v protokolu o zkoušce, aby bylo možno zhodnotit možné účinky zkoušené chemické látky na tempo růstu pulců ve srovnání s kontrolní skupinou, a tyto hodnoty jsou užitečné při zjišťování obecné toxicity zkoušené chemické látky. Jelikož odstranění ulpělé vody při určování hmotnosti může u pulců vyvolat stresové podmínky a způsobit poškození kůže, provádějí se tato měření v den 7 na pulcích z dílčího vzorku a na všech ostatních pulcích až při ukončení zkoušky (den 21). Kvůli jednotnosti při měření použijte jako kaudální hranici okraj kloakálního otvoru ve směru k hlavě.
|
|
38.
|
Délka těla od tlamy po kloaku (SVL) se používá k hodnocení růstu pulců, jak je znázorněno na obrázku 2.
Obrázek 2.
(A) Typy měření tělesné délky a (B) měření délky zadní končetiny u pulců X. laevis (1).
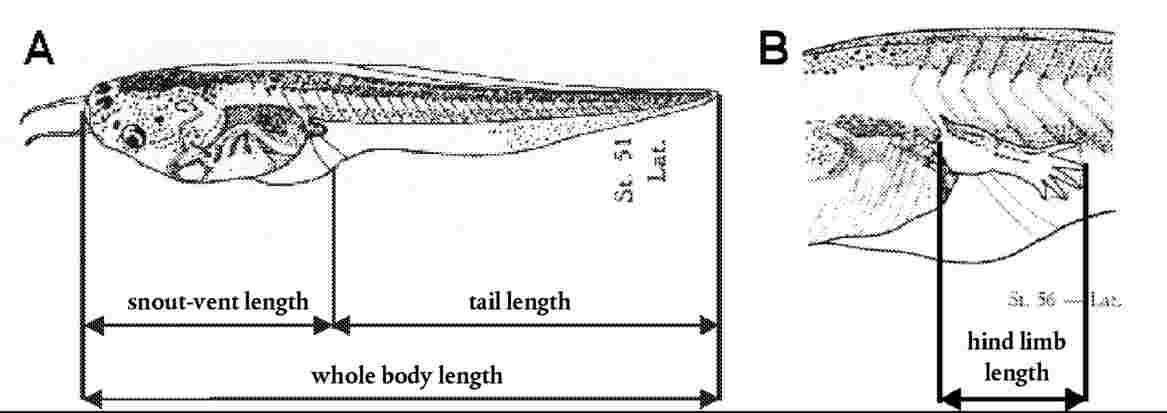
|
Histologie štítné žlázy
|
39.
|
Stadium vývoje a délka zadní končetiny jsou sice důležitými ukazateli pro hodnocení změn v průběhu metamorfózy, avšak opožděný vývoj nelze sám o sobě považovat za diagnostický indikátor antityreoidálního působení. Některé změny mohou být pozorovatelné pouze prostřednictvím běžné histopatologické analýzy. Diagnostickými kritérii jsou mimo jiné hypertrofie/atrofie štítné žlázy, hypertrofie folikulárních buněk, hyperplazie folikulárních buněk a dále pak i jiná kvalitativní kritéria: oblast folikulární dutiny, kvalita koloidu a výška/tvar folikulárních buněk. Ve zprávě je třeba uvést stupeň závažnosti (4 stupně). Informace k získávání a zpracování vzorků pro histologickou analýzu a pro provádění histologických analýz tkáňových vzorků jsou dostupné v literatuře ‚Amphibian Metamorphosis Assay: Part 1 – Technical guidance for morphologic sampling and histological preparation‘ a ‚Amphibian Metamorphosis Assay: Part 2 – Approach to reading studies, diagnostic criteria, severity grading and atlas‘ (9). Laboratoře, které provádějí tuto zkoušku poprvé, by se před provedením histologické analýzy a hodnocení štítné žlázy měly obrátit o radu za účelem školení na zkušené patology. Při zjevných a významných změnách v hlavních ukazatelích nasvědčujících zrychlenému nebo asynchronnímu vývoji nemusí být histopatologická analýza štítné žlázy nezbytná. Avšak nepřítomnost zjevných morfologických změn nebo poznatky o opožděném vývoji vyžadují histologickou analýzu.
|
Mortalita
|
40.
|
Všechny zkušební nádrže je třeba denně kontrolovat, zda neobsahují mrtvé pulce, a zaznamenávat počty v každé nádrži. U každého pozorování mortality by mělo být uvedeno datum, koncentrace a číslo nádrže. Mrtvé jedince ihned po jejich zpozorování je třeba ze zkušební nádrže odstranit. Míra mortality vyšší než 10 % může ukazovat na nevhodné zkušební podmínky nebo na toxické účinky zkoušené chemické látky.
|
Další pozorování
|
41.
|
Případy nestandardního chování a makroskopicky viditelných malformací a lézí by měly být zaznamenány. U každého pozorování nestandardního chování, makroskopických malformací nebo lézí se uvede datum, koncentrace a číslo nádrže. Pro standardní chování je typické, že pulci při ponoření do vodního sloupce mají ocas zvednutý výše, než je hlava, pravidelně rytmicky mrskají ocasní ploutví, pravidelně vyplouvají k hladině, zavírají žábry a reagují na podnět. Nestandardní chování by zahrnovalo například plavání na hladině, ležení na dně nádrže, obrácené nebo nepravidelné plavání, nepravidelné vyplouvání k hladině a nereagování na podnět. Kromě toho by měly být zaznamenány značné rozdíly ve spotřebě potravy mezi expozicemi. Závažné malformace a léze mohou zahrnovat morfologické abnormality (např. deformace končetin), léze s krvácením, bakteriální a plísňové infekce aj. Tato stanovení jsou kvalitativní, měla by být považována za rovnocenná klinickým příznakům onemocnění/stresu a porovnána s kontrolními zvířaty. Pokud výskyt nebo míra výskytu v exponovaných nádržích je větší než v kontrolních, pak tento výskyt nebo míru výskytu je třeba považovat za důkaz zjevné toxicity.
|
ÚDAJE A JEJICH PŘEDKLÁDÁNÍ
Sběr údajů
|
42.
|
Veškeré údaje by měly být shromažďovány pomocí elektronických nebo ručních systémů, které jsou v souladu se zásadami správné laboratorní praxe (SLP). Údaje o studii by měly zahrnovat:
|
|
Zkoušená chemická látka:
|
—
|
charakterizace zkoušené chemické látky: fyzikálně-chemické vlastnosti, údaje o stabilitě a biologické rozložitelnosti,
|
|
—
|
chemické informace a údaje: metoda a frekvence přípravy roztoků. Informace o zkoušené chemické látce zahrnují skutečné a jmenovité koncentrace zkoušené chemické látky a v některých případech, je-li to vhodné, i dalších (non-parent) chemických látek. Měření zkoušených chemických látek může být nezbytné provádět jak u zásobních roztoků, tak i u zkušebních roztoků,
|
|
—
|
rozpouštědlo (pokud není použita voda): zdůvodnění výběru rozpouštědla a charakterizace rozpouštědla (povaha, použitá koncentrace).
|
|
|
|
Zkušební podmínky:
|
—
|
provozní záznamy: sem patří pozorování týkající se fungování zkušebního systému a podpůrného prostředí a infrastruktury. Záznamy obvykle obsahují: teplotu okolí, zkušební teplotu, fotoperiodu, stav kritických složek systému expozice (např. čerpadel, počítačů cyklů, tlaky), průtoky, úrovně vody, výměny zásobních lahví a záznamy o krmení. Obecné parametry kvality vody zahrnují: pH, rozpuštěný kyslík, vodivost, celkový jód, zásaditost a tvrdost,
|
|
—
|
odchylky od zkušební metody: zde je třeba uvést jakékoli údaje o odchylkách nebo slovní popis odchylek od zkušební metody.
|
|
|
|
Výsledky:
|
—
|
biologická pozorování a údaje: zahrnují každodenní pozorování mortality, spotřeby potravy, nestandardního plavání, letargie, ztráty rovnováhy, malformací, lézí atd. Pozorování a údaje shromážděné v předem stanovených intervalech obsahují: stadium vývoje, délku zadní končetiny, délku těla od tlamy po kloaku a hmotnost ve vlhkém stavu,
|
|
—
|
použití metod statistické analýzy a jejich zdůvodnění; výsledky statistické analýzy pokud možno ve formě tabulky,
|
|
—
|
histologické údaje: zahrnují slovní popisy, stupeň závažnosti a míry výskytu konkrétních pozorování, která jsou podrobně uvedena v pokynech pro histopatologii,
|
|
—
|
pozorování ad hoc: tato pozorování by měla zahrnovat slovní popisy o studii, které nespadají do dříve popsaných kategorií.
|
|
|
Předkládání údajů
|
43.
|
Dodatek 2 obsahuje tabulky pro každodenní sběr údajů, které mohou být použity jako vodítko pro zápis naměřených údajů a pro výpočty souhrnných statistických údajů. Poskytnuty jsou také vykazovací tabulky, vhodné pro sdělování souhrnných údajů o ukazatelích. Vykazovací tabulky pro histologická hodnocení obsahuje dodatek 2.
|
Kritéria provedení zkoušky a přijatelnost/validita zkoušky
|
44.
|
Obecně platí, že větší odchylky od zkušební metody povedou k údajům, které jsou z hlediska interpretace nebo vykazování nepřijatelné. Proto byla vypracována následující kritéria, uvedená v tabulce 4, jako vodítko pro určení kvality provedené zkoušky celkového stavu kontrolních organismů.
Tabulka 4.
Kritéria pro provedení zkoušky metamorfózy obojživelníků.
|
Kritérium
|
Přijatelné meze
|
|
Zkušební koncentrace
|
Udržována na ≤ 20 % variačního koeficientu (variabilita naměřené zkušební koncentrace) po celých 21 dnů zkoušky
|
|
Mortalita v kontrolních skupinách
|
≤ 10 % – mortalita v kterémkoli opakování by v kontrolních skupinách neměla být větší než 2 jedinci
|
|
Minimální medián stadia vývoje kontrolních skupin na konci zkoušky
|
57
|
|
Rozpětí stadií vývoje v kontrolní skupině
|
10. a 90. percentil distribuce stadií vývoje by se neměl lišit o více než 4 stadia
|
|
Rozpuštěný kyslík
|
≥ 40 % nasycení vzduchem (23)
|
|
pH
|
Hodnota pH by měla být udržována mezi 6,5–8,5. Rozdíly mezi opakováními/expozicemi by neměly být větší než 0,5
|
|
Teplota vody
|
22° ± 1 °C – rozdíly mezi opakováními/expozicemi by neměly být větší než 0,5 °C
|
|
Zkušební koncentrace bez zjevné toxicity
|
≥ 2
|
|
Výsledky při opakováních
|
≤ 2 opakování po celou dobu zkoušky mohou být zpochybněna
|
|
Zvláštní podmínky pro použití rozpouštědla
|
Je-li použito nosné rozpouštědlo, měla by být použita kontrolní skupina s rozpouštědlem a kontrolní skupina s čistou vodou a výsledky by měly být zaznamenány
|
|
Statisticky významné rozdíly mezi kontrolní skupinou s rozpouštědlem a kontrolní skupinou s vodou se posuzují zvlášť. Více informací viz níže
|
|
Zvláštní podmínky pro statický systém s obnovováním média
|
Reprezentativní chemické analýzy před a po obnovení média by měly být zaznamenány
|
|
Úrovně amoniaku by měly být měřeny bezprostředně před obnovením média
|
|
Všechny parametry kvality vody uvedené v tabulce 1 dodatku 1 by měly být měřeny bezprostředně před obnovením média
|
|
Období mezi obnoveními by nemělo být delší než 72 hodin
|
|
Vhodný krmný plán (50 % denní dávky potravy tvoří komerčně dostupné krmivo pro pulce)
|
|
Validita zkoušky
|
45.
|
Aby bylo možné považovat zkoušku za přijatelnou/platnou, musí být splněny tyto požadavky:
|
|
Experiment při zkoušce, která z hlediska činnosti štítné žlázy byla shledána jako negativní, je považován za platný za těchto podmínek:
|
1)
|
Při každé dané expozici (včetně kontrolních skupin) nesmí mortalita přesáhnout 10 %. Při každém daném opakování nesmí mortalita postihnout více než tři pulce, jinak je toto opakování považováno za zpochybněné.
|
|
2)
|
Alespoň dvě úrovně expozice se všemi čtyřmi nezpochybněnými opakováními musí být dostupné pro analýzu.
|
|
3)
|
Alespoň dvě úrovně expozice bez zjevné toxicity musí dostupné pro analýzu.
|
|
|
|
Platný experiment při zkoušce, která z hlediska činnosti štítné žlázy byla shledána jako pozitivní:
|
1)
|
Může dojít k mortalitě nejvýše u dvou pulců/opakování v kontrolní skupině.
|
|
|
Rozhodovací logika pro provádění zkoušky metamorfózy obojživelníků
|
46.
|
Pro zkoušku metamorfózy obojživelníků byla vypracována rozhodovací logika s cílem poskytnout logickou pomoc při provádění a interpretaci výsledků této biologické zkoušky (viz vývojový diagram na obrázku 3). Logika rozhodování v podstatě spočívá ve vážení ukazatelů, přičemž pokročilý vývoj, asynchronní vývoj a histopatologie štítné žlázy jsou považovány za závažné, a opožděný vývoj, délka těla od tlamy po kloaku a tělesná hmotnost ve vlhkém stavu, tj. parametry, které potenciálně mohou být ovlivněny obecnou toxicitou, jsou považovány za méně závažné.
Obrázek 3.
Rozhodovací logika pro provádění zkoušky metamorfózy obojživelníků.

|
Urychlený vývoj (určený pomocí stadia vývoje, délky od tlamy po kloaku a délky zadní končetiny)
|
47.
|
Je známo, že urychlený vývoj nastává pouze v důsledku účinků, které souvisí s hormonem štítné žlázy. Může se jednat o účinky na periferních tkáních, jako je přímá interakce s receptorem tyreoidálních hormonů (např. T4), nebo účinky, které mění hladiny cirkulujících hormonů štítné žlázy. V každém z těchto případů je to považováno za dostatečný důkaz toho, že chemická látka ovlivňuje činnost štítné žlázy. Urychlený vývoj se hodnotí jedním ze dvou způsobů. Zaprvé lze hodnotit obecné stadium vývoje pomocí standardizované metody podrobně popsané ve studii Nieuwkoopa a Fabera (8). Zadruhé lze kvantifikovat specifické morfologické rysy, jako je délka zadní končetiny, v den 7 a 21, což pozitivně souvisí s agonistickými účinky na receptor tyreoidálních hormonů. Pokud se vyskytnou statisticky významné pokroky ve vývoji nebo v délce zadních končetin, pak ze zkoušky vyplývá, že chemická látka ovlivňuje činnost štítné žlázy.
|
|
48.
|
Hodnocení pokusných organismů na přítomnost zrychleného vývoje v porovnání s kontrolní populací bude vycházet z výsledků statistických analýz zaměřených na tyto čtyři ukazatele:
|
—
|
délka zadní končetiny (normalizovaná podle délky od tlamy po kloaku) v den 7 studie,
|
|
—
|
délka zadní končetiny (normalizovaná podle délky od tlamy po kloaku) v den 21 studie,
|
|
—
|
stadium vývoje v den 7 studie,
|
|
—
|
stadium vývoje v den 21 studie.
|
|
|
49.
|
Statistické analýzy délky zadní končetiny je třeba provádět na základě měření délky levé zadní končetiny. Délka zadní končetiny se normalizuje stanovením poměru mezi délkou zadní končetiny a délkou těla od tlamy po kloaku jedince. Střední hodnoty z těchto normalizovaných hodnot u každé úrovně expozice se poté porovnají. Zrychlení vývoje je pak indikováno významným zvýšením (normalizované) střední hodnoty délky zadní končetiny ve skupině exponované chemické látce v porovnání s kontrolní skupinou v den 7 studie a/nebo v den 21 studie (viz dodatek 3).
|
|
50.
|
Statistické analýzy stadia vývoje je třeba provádět na základě určení vývojových stadií podle morfologických kritérií popsaných Nieuwkoopem a Faberem (8). Zrychlení vývoje je indikováno, pokud se multikvantovou analýzou zjistí významné zvýšení hodnot stadií vývoje ve skupině exponované chemické látce v porovnání s kontrolní skupinou v den 7 studie a/nebo v den 21 studie.
|
|
51.
|
Významný účinek na kterýkoli ze čtyř výše uvedených ukazatelů je v této zkušební metodě pro zkoušku metamorfózy obojživelníků považován za dostatečný pro potvrzení urychleného vývoje. To znamená, že významné účinky na délku zadní končetiny v určitém čase nevyžadují potvrzení významnými účinky na délku zadní končetiny v alternativním časovém bodu ani významnými účinky na stadium vývoje v tomto určitém čase. A naopak, významné účinky na stadium vývoje v určitém čase nevyžadují potvrzení významnými účinky na stadium vývoje v alternativním časovém bodu ani významnými účinky na délku zadní končetiny v tomto určitém čase. Váha důkazů pro urychlený vývoj nicméně vzroste, jsou-li zjištěny významné účinky na více než jeden ukazatel.
|
Asynchronní vývoj (určený pomocí kritérií stadia vývoje)
|
52.
|
Pro asynchronní vývoj je typické narušení relativního načasování morfogeneze nebo vývoj různých tkání u jednotlivých pulců. Není-li možné jasně stanovit stadium vývoje organismu pomocí souboru morfologických ukazatelů, které jsou pro kterékoli dané stadium typické, ukazuje to na to, že tkáně se v průběhu metamorfózy vyvíjejí asynchronně. Asynchronní vývoj je jedním z indikátorů činnosti štítné žlázy. Jedinými známými druhy působení, jež způsobují asynchronní vývoj, jsou buď účinky chemických látek na periferní působení hormonu štítné žlázy a/nebo metabolismus hormonu štítné žlázy ve vyvíjejících se tkáních, např. který lze pozorovat u inhibitorů deiodinasy.
|
|
53.
|
Hodnocení pokusných zvířat na přítomnost asynchronního vývoje v porovnání s kontrolní populací bude založeno na makroskopickém morfologickém posouzení pokusných zvířat v den 7 studie a v den 21 studie.
|
|
54.
|
Popis normálního vývoje Xenopus laevis u Nieuwkoopa a Fabera (8) poskytuje rámec pro identifikaci postupu normální přestavby tkání. Termínem ‚asynchronní vývoj‘ se označují zvláště ty odchylky v makroskopickém morfologickém vývoji pulců, které znemožňují s konečnou platností určit stadium vývoje podle kritérií Nieuwkoopa a Fabera (8), jelikož klíčové morfologické znaky vykazují význačné rysy různých stadií.
|
|
55.
|
Jak vyplývá z pojmu ‚asynchronní vývoj‘, měly by být zohledněny pouze případy vykazující odchylky v průběhu přestavby určitých tkání v porovnání s průběhem přestavby jiných tkání. U některých klasických fenotypů dochází k pozdnímu vývinu nebo nevyvinutí předních končetin, a to i přes normální nebo pokročilý vývoj zadních končetin a ocasních tkání, nebo k předčasné resorpci žaber v porovnání se stadiem morfogeneze zadních končetin a resorpce ocasu. U pokusného organismu se zaznamená, že vykazuje asynchronní vývoj, pokud nemůže být přiřazen ke stadiu, protože nesplňuje většinu kritérií vývojových znaků pro dané stadium podle Nieuwkoopa a Fabera (8), nebo pokud dojde k extrémnímu zpoždění nebo urychlení jednoho nebo více klíčových rysů (např. ocas je zcela resorbován, avšak přední končetiny se nevyvinuly). Toto posouzení se provádí kvalitativně a měl by se vyšetřit celý soubor vývojových znaků uváděných Nieuwkoopem a Faberem (8). Není však nutné zaznamenávat stav vývoje různých vývojových znaků pozorovaných zvířat. Zvířata, o nichž se zaznamená, že vykazují asynchronní vývoj, se nezařadí do stadia vývoje podle Nieuwkoopa a Fabera (8).
|
|
56.
|
Rozhodujícím kritériem pro určení případů abnormálního morfologického vývoje jako ‚asynchronního vývoje‘ je tedy to, že je narušeno relativní načasování přestavby tkání a morfogeneze tkání, zatímco morfologie dotčených tkání není zjevně abnormální. Příkladem pro ilustraci této interpretace makroskopických morfologických abnormalit je to, že zaostalá morfogeneze zadních končetin v porovnání s vývojem jiných tkání bude splňovat kritérium ‚asynchronního vývoje‘, naproti tomu případy vykazující chybějící zadní končetiny, jejich abnormální počet (např. ektrodaktylie, polydaktylie) nebo jiné zjevné malformace končetin by za ‚asynchronní vývoj‘ považovány být neměly.
|
|
57.
|
V této souvislosti by hlavní morfologické znaky, které je třeba hodnotit z hlediska jejich koordinovaného morfologického pokroku, měly zahrnovat morfogenezi zadních končetin, morfogenezi předních končetin, vývin předních končetin, stadium resorpce ocasu (zejména resorpce konce ocasu) a morfologii hlavy (např. velikost žaber a stadium resorpce žaber, morfologii dolní čelisti, protruzi Meckelovy chrupavky).
|
|
58.
|
V závislosti na způsobu chemického působení se mohou vyskytnout různé makroskopické morfologické fenotypy. U některých klasických fenotypů dochází k pozdnímu vývinu nebo nevyvinutí předních končetin, a to i přes normální nebo pokročilý vývoj zadních končetin a ocasních tkání, k předčasné resorpci žaber v porovnání s přetvořením zadních končetin a ocasu.
|
Histopatologie
|
59.
|
Pokud chemická látka nezpůsobuje zjevnou toxicitu a neurychluje vývoj nebo nezpůsobuje asynchronní vývoj, pak se histopatologie štítné žlázy hodnotí podle příslušného Metodického dokumentu OECD (9). Zaostávání ve vývoji v nepřítomnosti toxicity je silným indikátorem antityreoidálního působení, avšak analýza stadií vývoje je méně citlivá a méně diagnosticky významná než histopatologická analýza štítné žlázy. Proto je v tomto případě nezbytné provádět histopatologické analýzy štítné žlázy. Účinky na histologii štítné žlázy byly prokázány v nepřítomnosti vývojových účinků. Dojde-li ke změnám v tyreoidální histopatologii, je chemická látka považována za ovlivňující činnost štítné žlázy. Pokud na štítných žlázách není zpozorován opožděný vývoj nebo histologické léze, má se za to, že chemická látka neovlivňuje činnost štítné žlázy. Zdůvodnění toto rozhodnutí je takové, že štítná žláza je ovlivňována hormonem TSH a jakákoli chemická látka, která dostatečně změní cirkulující tyreoidální hormon tak, že se změní sekrece TSH, povede k histopatologickým změnám na štítné žláze. Cirkulaci tyreoidálních hormonů mohou změnit různé způsoby a mechanismy působení. Hladina tyreoidálních hormonů tedy sice je indikativní pro účinek související se štítnou žlázou, avšak nepostačuje pro určení, který způsob nebo mechanismus působení s touto reakcí souvisí.
|
|
60.
|
Z hlediska základních statistických metod není tento ukazatel vhodný, a proto určení účinku souvisejícího s expozicí chemické látce musí být provedeno prostřednictvím znaleckého posudku patologa.
|
Opožděný vývoj (určený pomocí stadia vývoje, délky zadních končetin, tělesné hmotnosti, délky od tlamy po kloaku)
|
61.
|
K opožděnému vývoji může dojít působením antityreoidálních mechanismů a prostřednictvím nepřímé toxicity. Mírná zpoždění ve vývoji spolu se zjevnými znaky toxicity pravděpodobně ukazují na nespecifikovaný toxický účinek. Hodnocení netyreoidální toxicity je podstatným prvkem zkoušky, který má snížit pravděpodobnost chybných pozitivních výsledků. Nadměrná mortalita očividně znamená, že působí jiné toxické mechanismy. Podobně i mírné zpomalení růstu, určené podle hmotnosti ve vlhkém stavu a/nebo podle délky těla od tlamy po kloaku, rovněž naznačuje netyreoidální toxicitu. Zjevný rychlejší růst je obvykle zaznamenán v případě chemických látek, které negativně ovlivňují normální růst. Z přítomnosti větších zvířat tedy nutně nevyplývá netyreoidální toxicita. Při určování tyreoidální toxicity by se však nikdy nemělo vycházet pouze z růstu. Růst spolu se stadiem vývoje a histopatologií štítné žlázy by měl být spíše používán k určení tyreoidálního působení. Při určování zjevné toxicity by měly být posuzovány i jiné ukazatele včetně edémů, krvácejících lézí, letargie, snížené spotřeby potravy, chybného/změněného plavání atd. Pokud všechny zkušební koncentrace vykazují zjevnou toxicitu, měla by zkoušená chemická látka před stanovením, zda potenciálně ovlivňuje či neovlivňuje činnost štítné žlázy, být přehodnocena na nižší zkušební koncentrace.
|
|
62.
|
Statisticky významná zpoždění ve vývoji a zároveň nepřítomnost jiných příznaků zjevné toxicity ukazují na to, že chemická látka ovlivňuje činnost štítné žlázy (je antagonistická). V nepřítomnosti statisticky silných odezev může být tento výsledek podpořen výsledky histopatologie štítné žlázy.
|
Statistické analýzy
|
63.
|
Statistická analýza údajů by se pokud možno měla řídit postupy, které jsou popsány v dokumentu Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application (11). Pro všechny spojité kvantitativní ukazatele (délka zadních končetin, délka těla od tlamy po kloaku, hmotnost ve vlhkém stavu), které odpovídají monotónní závislosti dávka-odezva, by se ke stanovení významného účinku expozice měl použít test sestupného trendu Jonckheere-Terpstry.
|
|
64.
|
Pro kontinuální ukazatele, které nejsou v souladu s monotónní závislostí dávka-odezva, by údaje měly být posouzeny z hlediska normality rozdělení (pokud možno Shapiro-Wilkovým nebo Anderson-Darlingovým testem) a homogenity rozptylu (pokud možno Levenovým testem). Oba testy se provádějí na základě reziduálních hodnot získaných z jednostranné analýzy rozptylu (ANOVA). Místo těchto formálních testů na normalitu rozdělení a homogenitu rozptylu lze použit odborný posudek, ovšem formální testy se upřednostňují. Pokud je zjištěno nenormální rozdělení nebo heterogenní rozptyl, je třeba usilovat o normalizační transformaci ke stabilizaci rozptylu. Jsou-li údaje (případně i po transformaci) rozděleny normálně s homogenním rozptylem, stanoví se významný účinek expozice Dunnettovým testem. Jsou-li údaje (případně po transformaci) rozděleny normálně s heterogenním rozptylem, stanoví se významný účinek expozice Tamhaneovým-Dunnettovým testem nebo testem T3 nebo Mannovým-Whitneyovým-Wilcoxonovým U-testem. Pokud není možné nalézt normalizační transformaci, stanoví se významný účinek expozice Mannovým-Whitneyovým-Wilcoxonovým U-testem s Bonferroni-Holmovou korekcí hodnot p. Dunnettův test se použije nezávisle na jakémkoli F-testu ANOVA a Mannův-Whitneyův test se provede nezávisle na jakémkoli celkovém Kruskallově-Wallisově testu.
|
|
65.
|
Významná mortalita se nepředpokládá, ale měla by být posouzena pomocí Cochranova-Armitageova testu sestupného trendu, pokud údaje odpovídají monotónní závislosti dávka-odezva, a pokud neodpovídají, pomocí Fisherova exaktního testu s Bonferroni-Holmovou korekcí.
|
|
66.
|
Významný účinek expozice pro stadium vývoje se stanoví pomocí Jonckheerova-Terpstrova testu sestupného trendu aplikovaného na mediánové hodnoty opakování. Alternativně a přednostně by pro stanovení účinku od 20. do 80. percentilu měl být použit Jonckheerův multikvantový test, jelikož zohledňuje změny v profilu distribuce.
|
|
67.
|
Vhodnou jednotkou analýzy je opakování, takže údaje sestávají z mediánových hodnot opakování, použije-li se Jonckheerův-Terpstrův test nebo Mannův-Whitneyův U-test, nebo ze středních hodnot opakování, použije-li se Dunnettův test. Monotónnost závislosti dávka-odezva lze posoudit vizuálně na základě středních či mediánových hodnot opakování a expozic nebo na základě formálních testů, jak byly popsány dříve (11). Při méně než pěti opakováních při každé expozici nebo kontrole by měly být použity exaktní permutační verze Jonckheerova-Terpstrova testu a Mannova-Whitneyova testu, jsou-li dostupné. Statistický význam všech uvedených testů se posoudí při hladině významnosti 0,05.
|
|
68.
|
Na obrázku 4 je vývojový diagram pro provádění statistických testů kontinuálních údajů.
Obrázek 4.
Vývojový diagram pro statistické metody zpracování údajů o kontinuální odezvě.
|
Úvahy o analýze zvláštních dat
Použití zpochybněných úrovní expozice
|
69.
|
Při určování toho, zda opakování nebo celá expozice vykazují zjevnou toxicitu a měly by být z analýzy vyřazeny, se zvažuje několik faktorů. Zjevná toxicita je definována jako > 2 úhyny v každém opakování, které lze vysvětlit pouze toxicitou, a nikoli technickou chybou. Jiné příznaky zjevné toxicity zahrnují krvácení, nestandardní chování, nestandardní plavání, anorexii a jakékoli jiné klinické příznaky choroby. Při subletálních příznacích toxicity mohou být nezbytná kvalitativní hodnocení, která by měla být vždy prováděna ve srovnání s kontrolní skupinou v čisté vodě.
|
Kontroly s rozpouštědlem
|
70.
|
Použití rozpouštědla by mělo být zvažováno pouze jako poslední možnost, když byly uváženy všechny ostatní možnosti dávkování chemické látky. Je-li použito rozpouštědlo, měla by být souběžně provedena u kontrolní skupiny zkouška s čistou vodou. Při ukončení zkoušky je třeba provést hodnocení případných účinků rozpouštědla. To se provede pomocí statistického srovnání kontrolní skupiny s rozpouštědlem a kontrolní skupiny s čistou vodou. Nejdůležitějšími ukazateli, které je třeba při této analýze posoudit, jsou stadium vývoje, délka těla od tlamy po kloaku a hmotnost ve vlhkém stavu, jelikož tyto ukazatele mohou být ovlivněny netyreoidální toxicitou. Jsou-li zaznamenány statisticky významné rozdíly v těchto ukazatelích mezi kontrolní skupinou s čistou vodou a kontrolní skupinou s rozpouštědlem, stanovte ukazatele studie pro měření odezev pomocí kontrolní skupiny s čistou vodou. Pokud neexistují žádné statisticky významné rozdíly mezi kontrolní skupinou s čistou vodou a kontrolní skupinou s rozpouštědlem pro všechny měřené proměnné odezvy, stanovte ukazatele studie pro měření odezev pomocí sloučené kontrolní skupiny s ředicí vodou a kontrolní skupiny s rozpouštědlem.
|
Exponované skupiny dosahující vývojového stadia 60 a vyšších
|
71.
|
Po stadiu 60 dochází u pulců ke snížení velikosti a hmotnosti v důsledku resorpce tkání a snížení absolutního obsahu vody. Měření hmotnosti ve vlhkém stavu a délky těla od tlamy po kloaku tak nemohou být vhodně použita při statistických analýzách tempa růstu. Údaje o hmotnosti ve vlhkém stavu a délce organismů > NF60 by proto měly být omezeny a nelze je použít při analýzách středních nebo mediánových hodnot duplikátních vzorků. Tyto růstové parametry lze analyzovat dvěma různými metodami.
|
|
72.
|
Jedna metoda spočívá v tom, že pro statistické analýzy hmotnosti ve vlhkém stavu a/nebo délky těla od tlamy po kloaku se posoudí pouze pulci ve stadiu vývoje, které je nižší nebo rovno stadiu 60. Má se za to, že tato metoda poskytuje dostatečně průkazné údaje o závažnosti možných růstových účinků, pokud se z analýzy vyloučí pouze malá část (≤ 20 %) pokusných organismů. Pokud stadium vývoje vyšší než stadium 60 vykazuje vyšší počet pulců (≥ 20 %) při jedné nebo více nominálních koncentracích, pak by měla být u všech pulců provedena dvoufaktorová hierarchická analýza rozptylu (ANOVA), což umožní posoudit růstové účinky vyvolané expozicí chemické látce při zohlednění účinku pozdního stadia vývoje na růst. Pokyny týkající se dvoufaktorové analýzy ANOVA hmotnosti a délky obsahuje dodatek 3.
|
LITERATURA
|
1)
|
OECD (2004) Report of the Validation of the Amphibian Metamorphosis Assay for the detection of thyroid active substances: Phase 1 – Optimisation of the Test Protocol. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 77, Paris.
|
|
2)
|
OECD (2007) Final Report of the Validation of the Amphibian Metamorphosis Assay: Phase 2 – Multi-chemical Interlaboratory Study. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 76, Paris.
|
|
3)
|
OECD (2008) Report of the Validation Peer Review for the Amphibian Metamorphosis Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 92, Paris.
|
|
4)
|
OECD (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 23, Paris.
|
|
5)
|
ASTM (2002) Standard Guide for Conducting Acute Toxicity Tests on Test Materials with Fishes, Macroinvertebrates, and Amphibians. American Society for Testing and Materials, ASTM E729-96(2002), Philadelpia, PA.
|
|
6)
|
ASTM (2004) Standard Guide for Conducting the Frog Embryo Teratogenesis Assay – Xenopus (FETAX). E 1439-98.
|
|
7)
|
Kahl, M. D., Russom, C. L., DeFoe, D. L. & Hammermeister, D. E. (1999) Saturation units for use in aquatic bioassays. Chemosphere 39, pp. 539–551.
|
|
8)
|
Nieuwkoop, P. D. & Faber, J. (1994) Normal Table of Xenopus laevis. Garland Publishing, New York.
|
|
9)
|
OECD (2007) Guidance Document on Amphibian Thyroid Histology. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 82. Paris.
|
|
10)
|
Dodd, M. H. I. & Dodd, J. M. (1976) Physiology of Amphibia. Lofts, B. (ed.), Academic Press, New York, pp. 467–599.
|
|
11)
|
OECD (2006) Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 54, Paris.
|
|
12)
|
Hutchinson, T. H., Shillabeer, N., Winter, M. J., Pickford, D. B. (2006) Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Review. Aquatic Toxicology, 76; pp. 69–92.
|
Dodatek 1
Tabulka 1
Experimentální podmínky pro 21denní zkoušku metamorfózy obojživelníků
|
Pokusné zvíře
|
Larvy Xenopus laevis
|
|
Výchozí stadium larev
|
Stadium 51 podle Nieuwkoopa a Fabera
|
|
Doba expozice
|
21 dnů
|
|
Kritéria pro výběr larev
|
Stadium vývoje a celková délka (volitelné)
|
|
Zkušební koncentrace
|
Minimálně 3 koncentrace přibližně v rozmezí jednoho řádu
|
|
Režim expozice
|
Průtokový (upřednostňuje se) a/nebo statický s obnovováním média
|
|
Průtok zkušebního systému
|
25 ml/min (výměna celého objemu přibližně každých 2,7 h)
|
|
Hlavní ukazatele / dny určování
|
Mortalita
|
Denně
|
|
Stadium vývoje
|
D 7 a 21
|
|
Délka zadních končetin
|
D 7 a 21
|
|
Délka těla od tlamy po kloaku
|
D 7 a 21
|
|
Tělesná hmotnost ve vlhkém stavu
|
D 7 a 21
|
|
Histologie štítné žlázy
|
D 21
|
|
Ředicí voda / laboratorní kontrola
|
Dechlorovaná vodovodní voda (filtrovaná přes aktivní uhlí) nebo rovnocenný laboratorní zdroj
|
|
Hustota larev
|
20 larev / zkušební nádoba (5 / l)
|
|
Zkušební roztok / zkušební nádoba
|
4–10 l (minimální obsah vody 10–15 cm) / zkušební nádoba skleněná nebo z nerezové oceli (např. 22,5 cm × 14 cm × 16,5 cm)
|
|
Opakování
|
4 zkušební nádoby k opakování / zkušební koncentrace a kontrola
|
|
Přijatelná mortalita v kontrolních skupinách
|
≤ 10 % v každé zkušební nádobě k opakování
|
|
Fixace štítné žlázy
|
Počet fixovaných
|
Všichni pulci (zpočátku se hodnotí 5/opakování)
|
|
Oblast
|
Hlava nebo celé tělo
|
|
Fixační kapalina
|
Davidsonovo fixační médium
|
|
Krmení
|
Potrava
|
Sera Micron® nebo rovnocenné
|
|
Množství/frekvence
|
Režim krmení při použití Sera Micron® viz tabulka 1
|
|
Osvětlení
|
Fotoperioda
|
12 h světla: 12 h tmy
|
|
Intenzita
|
600 až 2 000 luxů (měřeno na povrchu vody)
|
|
Teplota vody
|
22° ± 1 °C
|
|
pH
|
6,5 – 8,5
|
|
Koncentrace rozpuštěného kyslíku (DO)
|
> 3,5 mg/l (> 40 % nasycení vzduchem)
|
|
Rozvrh odběru vzorků pro analytickou chemii
|
Jednou/týden (4 případy odběru vzorků / zkouška)
|
Dodatek 2
Vykazovací tabulka pro naměřené údaje a souhrnné údaje
Tabulka 1
Chemické informace o hlavní zkoušce
|
Chemické informace
|
|
|
Uveďte zkoušenou chemickou látku, jednotky koncentrace a expozice
|
|
|
Zkoušená chemická látka:
|
|
|
|
|
Jednotky koncentrace
|
|
|
|
|
Expozice 1
|
|
|
|
|
Expozice 2
|
|
|
|
|
Expozice 3
|
|
|
|
|
Expozice 4
|
|
|
|
|
|
|
|
|
|
Datum (den 0):
|
|
Uveďte datum (mm/dd/rr)
|
|
|
Datum (den 7):
|
|
Uveďte datum (mm/dd/rr)
|
|
|
Datum (den 21):
|
|
Uveďte datum (mm/dd/rr)
|
Tabulka 2:
Formuláře pro sběr údajů naměřených v den 7 a 21
|
DEN X
DATUM 00/00/00
|
|
|
Koncentrace
|
Číslo expozice
|
Číslo opakování
|
Číslo jedince
|
Identifikátor jedince
|
Stadium vývoje
|
Délka těla od tlamy po kloaku (mm)
|
Délka zadní končetiny (mm)
|
Hmotnost celého organismu ve vlhkém stavu (mg)
|
|
ŘADA
|
CONC
|
EXP#
|
REP
|
IND
|
ID#
|
STAGE
|
BL
|
HLL
|
WEIGHT
|
|
1
|
0,00
|
1
|
|
|
|
|
|
|
|
|
2
|
0,00
|
1
|
|
|
|
|
|
|
|
|
3
|
0,00
|
1
|
|
|
|
|
|
|
|
|
4
|
0,00
|
1
|
|
|
|
|
|
|
|
|
5
|
0,00
|
1
|
|
|
|
|
|
|
|
|
6
|
0,00
|
1
|
|
|
|
|
|
|
|
|
7
|
0,00
|
1
|
|
|
|
|
|
|
|
|
8
|
0,00
|
1
|
|
|
|
|
|
|
|
|
9
|
0,00
|
1
|
|
|
|
|
|
|
|
|
10
|
0,00
|
1
|
|
|
|
|
|
|
|
|
11
|
0,00
|
1
|
|
|
|
|
|
|
|
|
12
|
0,00
|
1
|
|
|
|
|
|
|
|
|
13
|
0,00
|
1
|
|
|
|
|
|
|
|
|
14
|
0,00
|
1
|
|
|
|
|
|
|
|
|
15
|
0,00
|
1
|
|
|
|
|
|
|
|
|
16
|
0,00
|
1
|
|
|
|
|
|
|
|
|
17
|
0,00
|
1
|
|
|
|
|
|
|
|
|
18
|
0,00
|
1
|
|
|
|
|
|
|
|
|
19
|
0,00
|
1
|
|
|
|
|
|
|
|
|
20
|
0,00
|
1
|
|
|
|
|
|
|
|
|
21
|
0,00
|
2
|
|
|
|
|
|
|
|
|
22
|
0,00
|
2
|
|
|
|
|
|
|
|
|
23
|
0,00
|
2
|
|
|
|
|
|
|
|
|
24
|
0,00
|
2
|
|
|
|
|
|
|
|
|
25
|
0,00
|
2
|
|
|
|
|
|
|
|
|
26
|
0,00
|
2
|
|
|
|
|
|
|
|
|
27
|
0,00
|
2
|
|
|
|
|
|
|
|
|
28
|
0,00
|
2
|
|
|
|
|
|
|
|
|
29
|
0,00
|
2
|
|
|
|
|
|
|
|
|
30
|
0,00
|
2
|
|
|
|
|
|
|
|
|
31
|
0,00
|
2
|
|
|
|
|
|
|
|
|
32
|
0,00
|
2
|
|
|
|
|
|
|
|
|
33
|
0,00
|
2
|
|
|
|
|
|
|
|
|
34
|
0,00
|
2
|
|
|
|
|
|
|
|
|
35
|
0,00
|
2
|
|
|
|
|
|
|
|
|
36
|
0,00
|
2
|
|
|
|
|
|
|
|
|
37
|
0,00
|
2
|
|
|
|
|
|
|
|
|
38
|
0,00
|
2
|
|
|
|
|
|
|
|
|
39
|
0,00
|
2
|
|
|
|
|
|
|
|
|
40
|
0,00
|
2
|
|
|
|
|
|
|
|
|
41
|
0,00
|
3
|
|
|
|
|
|
|
|
|
42
|
0,00
|
3
|
|
|
|
|
|
|
|
|
43
|
0,00
|
3
|
|
|
|
|
|
|
|
|
44
|
0,00
|
3
|
|
|
|
|
|
|
|
|
45
|
0,00
|
3
|
|
|
|
|
|
|
|
|
46
|
0,00
|
3
|
|
|
|
|
|
|
|
|
47
|
0,00
|
3
|
|
|
|
|
|
|
|
|
48
|
0,00
|
3
|
|
|
|
|
|
|
|
|
49
|
0,00
|
3
|
|
|
|
|
|
|
|
|
50
|
0,00
|
3
|
|
|
|
|
|
|
|
|
51
|
0,00
|
3
|
|
|
|
|
|
|
|
|
52
|
0,00
|
3
|
|
|
|
|
|
|
|
|
53
|
0,00
|
3
|
|
|
|
|
|
|
|
|
54
|
0,00
|
3
|
|
|
|
|
|
|
|
|
55
|
0,00
|
3
|
|
|
|
|
|
|
|
|
56
|
0,00
|
3
|
|
|
|
|
|
|
|
|
57
|
0,00
|
3
|
|
|
|
|
|
|
|
|
58
|
0,00
|
3
|
|
|
|
|
|
|
|
|
59
|
0,00
|
3
|
|
|
|
|
|
|
|
|
60
|
0,00
|
3
|
|
|
|
|
|
|
|
|
61
|
0,00
|
4
|
|
|
|
|
|
|
|
|
62
|
0,00
|
4
|
|
|
|
|
|
|
|
|
63
|
0,00
|
4
|
|
|
|
|
|
|
|
|
64
|
0,00
|
4
|
|
|
|
|
|
|
|
|
65
|
0,00
|
4
|
|
|
|
|
|
|
|
|
66
|
0,00
|
4
|
|
|
|
|
|
|
|
|
67
|
0,00
|
4
|
|
|
|
|
|
|
|
|
68
|
0,00
|
4
|
|
|
|
|
|
|
|
|
69
|
0,00
|
4
|
|
|
|
|
|
|
|
|
70
|
0,00
|
4
|
|
|
|
|
|
|
|
|
71
|
0,00
|
4
|
|
|
|
|
|
|
|
|
72
|
0,00
|
4
|
|
|
|
|
|
|
|
|
73
|
0,00
|
4
|
|
|
|
|
|
|
|
|
74
|
0,00
|
4
|
|
|
|
|
|
|
|
|
75
|
0,00
|
4
|
|
|
|
|
|
|
|
|
76
|
0,00
|
4
|
|
|
|
|
|
|
|
|
77
|
0,00
|
4
|
|
|
|
|
|
|
|
|
78
|
0,00
|
4
|
|
|
|
|
|
|
|
|
79
|
0,00
|
4
|
|
|
|
|
|
|
|
|
80
|
0,00
|
4
|
|
|
|
|
|
|
|
Tabulka 3
Vypočtené souhrnné údaje k ukazatelům ze dne 7 a 21
|
|
|
Stadium vývoje
|
Délka těla od tlamy po kloaku (mm)
|
Délka zadní končetiny (mm)
|
Hmotnost (mg)
|
|
EXP
|
REP
|
MIN
|
MEDI
|
MAX
|
STŘED
|
SD
|
STŘED
|
SD
|
STŘED
|
SD
|
|
1
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
Poznámka: Výpočty v buňkách jsou propojeny s údaji zadanými v tabulce 2.
SD = směrodatná odchylka
|
Tabulka 4
Údaje o denní mortalitě
|
Den zkoušky
|
Datum
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
|
0
|
00/00/00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Počet opakování
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Počet expozic
|
0
|
|
|
|
0
|
|
|
|
0
|
|
|
|
0
|
|
|
|
|
Poznámka: Výpočty v buňkách jsou propojeny s údaji zadanými v tabulce 1.
|
Tabulka 5
Kritéria pro kvalitu vody
Expoziční systém (průtokový / statický s obnovováním média):
Teplota:
Intenzita světla:
Cyklus světlo-tma:
Potrava:
Množství krmiva:
pH vody:
Koncentrace jódu ve zkušební vodě:
Tabulka 6
Souhrn údajů o chemickém vyšetření
|
Chemický název
|
|
Číslo CAS:
|
|
Den zkoušky
|
Datum
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
|
0
|
00/00/00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Poznámka: Výpočty v buňkách jsou propojeny s údaji zadanými v tabulce 1.
|
Tabulka 7
Vykazovací tabulky pro hlavní histopatologická kritéria
|
Datum:
|
Chemická látka:
|
|
|
Patolog:
|
|
|
Hypertrofie štítné žlázy
|
Atrofie štírné žlázy
|
Hypertrofie folikulárních buněk
|
Hyperplazie folikulárních buněk
|
|
Hypertrofie štítné žlázy
|
Atrofie štítné žlázy
|
Hypertrofie folikulárních buněk
|
Hyperplazie folikulárních buněk
|
|
ID kontrolního zvířete – opakování 1
|
|
|
|
|
|
ID exponovaného zvířete – opakování 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID kontrolního zvířete – opakování 2
|
|
|
|
|
|
ID exponovaného zvířete – opakování 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Celkem:
|
|
|
|
|
Celkem:
|
|
|
|
|
|
|
Hypertrofie štítné žlázy
|
Atrofie štítné žlázy
|
Hypertrofie folikulárních buněk
|
Hyperplazie folikulárních buněk
|
|
|
Hypertrofie štítné žlázy
|
Atrofie štítné žlázy
|
Hypertrofie folikulárních buněk
|
Hyperplazie folikulárních buněk
|
|
ID exponovaného zvířete – opakování 1
|
|
|
|
|
|
ID exponovaného zvířete – opakování 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID exponovaného zvířete – opakování 2
|
|
|
|
|
|
ID exponovaného zvířete – opakování 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Celkem:
|
|
|
|
|
Celkem
|
|
|
|
|
Tabulka 8
Další histopatologická kritéria
|
Datum:
|
Chemická látka:
|
|
|
Patolog:
|
|
|
|
|
|
|
|
|
Zvětšení oblasti folikulárních dutin
|
Zmenšení oblasti folikulárních dutin
|
Zvětšení oblasti folikulárních dutin
|
Zmenšení oblasti folikulárních dutin
|
|
ID kontrolního zvířete – opakování 1
|
|
|
|
ID exponovaného zvířete – opakování 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID kontrolního zvířete – opakování 2
|
|
|
|
ID exponovaného zvířete – opakování 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Celkem:
|
|
|
Celkem:
|
|
|
|
|
Zvětšení oblasti folikulárních buněk
|
Zmenšení oblasti folikulárních buněk
|
|
|
Zvětšení oblasti folikulárních buněk
|
Zmenšení oblasti folikulárních buněk
|
|
ID exponovaného zvířete – opakování 1
|
|
|
|
ID exponovaného zvířete – opakování 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID exponovaného zvířete – opakování 2
|
|
|
|
ID exponovaného zvířete – opakování 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Celkem:
|
|
|
Celkem:
|
|
|
Tabulka 9
Slovní popis histopatologických nálezů
|
Datum:
|
|
Chemická látka:
|
|
Patolog:
|
|
|
Slovní popis
|
|
ID kontrolního zvířete – opakování 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID kontrolního zvířete – opakování 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID exponovaného zvířete – opakování 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID exponovaného zvířete – opakování 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID exponovaného zvířete – opakování 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID exponovaného zvířete – opakování 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID exponovaného zvířete – opakování 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID exponovaného zvířete – opakování 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tabulka 10
Šablona souhrnné vykazovací tabulky za den × (7 nebo 21) zkoušky metamorfózy obojživelníků
|
|
|
Kontrola
|
Dávka 1
|
Dávka 2
|
Dávka 3
|
|
Ukazatel
|
REP
|
Střed
|
SD
|
CV
|
N
|
Střed
|
SD
|
CV
|
N
|
ph
|
Střed
|
SD
|
CV
|
N
|
ph
|
Střed
|
SD
|
CV
|
N
|
ph
|
|
Délka zadní končetiny
(mm)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Střed:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Délka těla od tlamy po kloaku
(mm)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Střed:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tělesná hmotnost za vlhka
(mg)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Střed:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tabulka 11
Šablona souhrnné vykazovací tabulky údajů o stadiu vývoje za den × (7 nebo 21) zkoušky metamorfózy obojživelníků
|
|
|
Kontrola
|
Dávka 1
|
Dávka 2
|
Dávka 3
|
|
|
REP
|
Medián
|
Min
|
Max
|
N
|
Medián
|
Min
|
Max
|
N
|
ph
|
Medián
|
Min
|
Max
|
N
|
ph
|
Medián
|
Min
|
Max
|
Medián
|
ph
|
|
Stadium vývoje
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Střed:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Dodatek 3
Alternativní analýza hmotnosti a délky v případě pozdních stadií vývoje zahrnujících více než 20 % pulců při jedné nebo více koncentracích
Pokud stadium vývoje vyšší než stadium 60 vykazuje vyšší počet pulců (≥ 20 %) při jedné nebo více nominálních koncentracích, pak by měla být u všech pulců provedena dvoufaktorová hierarchická analýza rozptylu (ANOVA), což umožní posoudit růstové účinky vyvolané expozicí chemické látce při zohlednění účinku pozdního stadia vývoje na růst.
Navrhuje se použít všechny údaje, avšak zohlednit účinek pozdního stadia vývoje. Toho lze dosáhnout dvoufaktorovou hierarchickou analýzou rozptylu ANOVA. Definujte pozdní stadium =„Ano“ pro pulce, je-li jeho stadium vývoje 61 nebo vyšší. Jinak definujte pozdní stadium = „Ne“. Poté lze provést dvoufaktorovou hierarchickou analýzu rozptylu ANOVA s koncentrací a pozdním stadiem a jejich interakcí, přičemž opakování(koncentrace) je účinek náhodného faktoru a pulec(opakování) je účinek jiného náhodného faktoru. Tím se i nadále opakování považuje za jednotku analýzy a přináší v zásadě stejné výsledky jako vážená analýza středních hodnot opakování*pozdní stadium, která se váží počtem pulců v každé střední hodnotě. Pokud tyto údaje porušují požadavky ANOVA na normalitu rozdělení nebo homogenitu rozptylu, pak pro odstranění této námitky lze provést transformaci normalizovaného pořadí.
Kromě běžných ANOVA F-testů pro účinky koncentrace, pozdní stadium a jejich interakci je možné F-test interakce ‚rozdělit‘ na dva doplňkové ANOVA F-testy, z nichž jeden se použije na střední hodnoty odezvy při všech koncentracích pro pozdní stadium = „Ne“ a druhý na střední hodnoty odezev při všech koncentracích pro pozdní stadium = „Ano“. Další porovnání středních hodnot expozic oproti kontrole se provede na každé úrovni pozdního stadia. Pokud existují důkazy o nemonotónní závislosti dávka-odezva na úrovni proměnné ‚pozdní stadium‘, lze provést analýzu trendů pomocí vhodných kontrastů nebo lze provést jednoduchá párová srovnání. Bonferroni-Holmova korekce hodnot p se provede pouze tehdy, jestliže příslušný dílčí F-test není významný. To lze provést v rámci systému statistické analýzy (SAS) a pravděpodobně i jiných sad statistického softwaru. Komplikace mohou vzniknout, pokud při některých koncentracích neexistují žádní pulci v pozdním stadiu, avšak tyto situace lze jednoduchým způsobem řešit.
Dodatek 4
Definice
Chemická látka
: látka nebo směs
Zkoušená chemická látka
: jakákoli látka nebo směs zkoušená touto zkušební metodou
C.39. ZKOUŠKA TOXICITY PRO REPRODUKCI CHVOSTOSKOKŮ V PŮDĚ
ÚVOD
|
1.
|
Tato zkušební metoda je rovnocenná Pokynu OECD pro zkoušení č. 232 (2009). Tato zkušební metoda je určena pro posouzení účinků chemických látek na reprodukční schopnost chvostoskoků v půdě. Je založena na stávajících postupech (1)(2). Partenogenetický Folsomia candida a pohlavně se rozmnožující Folsomia fimetaria jsou dva z nejdostupnějších druhů chvostoskoků, lze je kultivovat a jsou komerčně dostupné. Je-li nutné posoudit specifická prostředí, kde se uvedené dva druhy nevyskytují, lze tento postup rozšířit i na jiné druhy chvostoskoků, pokud jsou schopny splnit kritéria platnosti zkoušky.
|
|
2.
|
Chvostoskoci žijící v půdě jsou ekologicky důležité druhy pro ekotoxikologické zkoušení. Chvostoskoci jsou šestinohý hmyz s exoskeletem vysoce propustným pro vzduch a vodu a představují druh členovců s odlišnou cestou expozice a odlišnou mírou expozice, než mají žížaly a roupice.
|
|
3.
|
Hustota populací chvostoskoků obvykle dosahuje 105 m– 2 ve vrstvách půdy a spadaného listí v mnoha terestrických ekosystémech (3)(4). Dospělí jedinci obvykle měří 0,5–5 mm, jejich příspěvek k celkové živočišné biomase v půdě a k půdní respiraci je nízký, odhaduje se mezi 1 % a 5 % (5). Nejdůležitější úlohu proto mohou sehrávat jako potenciální činitelé regulačních procesů díky tomu, že jsou mikrobivorní a likvidují mikrofaunu. Chvostoskoci slouží jako kořist mnohým endogeickým a epigeickým bezobratlým, jako jsou roztoči, stonožky, pavouci, střevlíkovití a drapčíci. Přispívají k rozkladným procesům v kyselých půdách, kde jsou vedle roupic možná nejdůležitějšími půdními bezobratlými, neboť žížaly a mnohonožky se tam obvykle nevyskytují.
|
|
4.
|
F. fimetaria je celosvětově rozšířen a běžně se vyskytuje v některých typech půdy od písčitých až po hlinité a od mulových po humusové půdy. Je to bezoký chvostoskok, bez pigmentu. Zaznamenán byl v zemědělských půdách celé Evropy (6). Je omnivorní, živí se mimo jiné houbovými vlákny, bakteriemi, prvoky a zbytky. Prostřednictvím příjmu potravy interaguje s infekcemi působenými patogenními plísněmi rostlin (7) a může ovlivňovat mykorhizu, stejně jako je to známo o F. candida. Rozmnožuje se jako většina druhů chvostoskoků pohlavně, přičemž pro oplodnění vajíček je nezbytná stálá přítomnost samečků.
|
|
5.
|
F. candida je rovněž celosvětové rozšířen. Ve většině přírodních půd není běžný, ale často se ve velmi hojných počtech vyskytuje na místech bohatých na humus. Je to bezoký chvostoskok, bez pigmentu. Má dobře vyvinutou furcu (skákací orgán), je běhavý a je-li vyrušen, rychle skáče. Z ekologického hlediska plní druh F. candida podobnou úlohu jako F. fimetaria, ale obývá organicky bohatší půdy. Rozmnožuje se partenogenezí. Samečci se mohou vyskytovat v počtu menším než 1 z tisíce.
|
PODSTATA ZKOUŠKY
|
6.
|
Synchronizovaní dospělí (F. fimetaria) nebo nedospělí (F. candida) chvostoskoci se exponují různým koncentracím zkoušené chemické látky smíchané s upravenou umělou půdou (8) s 5 % obsahem organických látek (nebo alternativní půdou). Scénář zkoušky lze rozdělit do dvou kroků:
|
—
|
Test pro stanovení rozmezí dávek, v případě, že nejsou dostupné dostatečné údaje o toxicitě, kde hlavními ukazateli jsou mortalita a reprodukce, které se vyhodnotí po 2 týdnech pro F. fimetaria a po 3 týdnech pro F. candida.
|
|
—
|
Hlavní zkouška toxicity pro reprodukci, při níž se posoudí celkový počet nedospělých potomků pocházejících z dospělých organismů a přežití dospělých organismů. Hlavní zkouška trvá 3 týdny pro F. fimetaria nebo 4 týdny pro F. candida.
|
Toxický účinek zkoušené chemické látky na mortalitu a schopnost reprodukce dospělých chvostoskoků se vyjadřuje jako LCx a ECx, přičemž údaje se zanášejí do vhodného modelu nelineární regresí s cílem odhadnout koncentraci, která by způsobila mortalitu nebo snížení reprodukční schopnosti ve výši x %, nebo alternativně jako hodnota NOEC/LOEC (9).
|
INFORMACE O ZKOUŠENÉ LÁTCE
|
7.
|
Měly by být pokud možno známy fyzické vlastnosti, rozpustnost ve vodě, log Kow, rozdělovací koeficient půda-voda a tlak par zkoušené chemické látky. Žádoucí jsou i další informace o osudu zkoušené chemické látky v půdě, jako např. míra fotolýzy a hydrolýzy a biotický rozklad. Je třeba zdokumentovat chemickou identifikaci zkoušené chemické látky podle nomenklatury IUPAC, číslo CAS, sadu, šarži, strukturní vzorec a čistotu, jsou-li dostupné.
|
|
8.
|
Tuto zkušební metodu lze použít pro chemické látky rozpustné nebo nerozpustné ve vodě. Způsob aplikace zkoušené chemické látky se však bude odpovídajícím způsobem lišit. Tuto zkušební metodu nelze použít pro těkavé chemické látky, tj. chemické látky, u nichž Henryho konstanta nebo rozdělovací koeficient vzduch-voda je větší než jedna, nebo chemické látky, u nichž tlak par je vyšší než 0,0133 Pa při 25 °C.
|
VALIDITA ZKOUŠKY
|
9.
|
Aby mohly být výsledky zkoušky uznány za platné, měla by být v neexponovaných kontrolních skupinách splněna tato kritéria:
|
—
|
střední mortalita dospělých jedinců na konci zkoušky by neměla přesahovat 20 %;
|
|
—
|
střední počet nedospělých jedinců na konci zkoušky by měl být minimálně 100 v každé nádobě;
|
|
—
|
variační koeficient vypočtený pro počet nedospělých jedinců na konci hlavní zkoušky by měl být menší než 30 %.
|
|
REFERENČNÍ CHEMICKÁ LÁTKA
|
10.
|
Referenční chemická látka by měla být zkoušena při její koncentraci EC50 pro zvolený druh zkušební půdy buď v pravidelných intervalech, nebo se může zařadit do každého provedení zkoušky, s cílem ověřit, že reakce pokusných organismů ve zkušebním systému jsou v mezích normy. Vhodnou referenční chemickou látkou je kyselina boritá, která by měla snížit reprodukci o 50 % (10)(11) při dávce přibližně 100 mg/kg půdy v suchém stavu pro oba druhy.
|
POPIS ZKOUŠKY
Zkušební nádoby a zařízení
|
11.
|
Jako zkušební nádoby je vhodné použít nádoby schopné pojmout 30 g vlhké půdy. Měly by být buď skleněné, nebo z inertního plastu (netoxického). Pokud se však expozice zkoušené chemické látce v důsledku sorpce snižuje, plastové nádoby by používány být neměly. Zkušební nádoby by měly mít průřezovou plochu umožňující dosáhnout v nich skutečné hloubky půdy 2–4 cm. Nádoby by měly mít víčka (např. skleněná nebo polyethylenová), konstruovaná tak, aby se snížilo vypařování vody a současně byla umožněna výměna plynů mezi půdou a ovzduším. Nádoba by měla být alespoň částečně průhledná, aby propouštěla světlo.
|
|
12.
|
Vyžaduje se běžné laboratorní zařízení, a sice:
|
—
|
pH-metr, měřič osvětlení,
|
|
—
|
odpovídající zařízení pro řízení teploty,
|
|
—
|
odpovídající zařízení pro řízení vlhkosti vzduchu (není nutné, pokud jsou expoziční nádoby zakryty víčkem),
|
|
—
|
inkubátor nebo malá místnost s řízenou teplotou,
|
|
—
|
pinzeta nebo odsávačka s nízkým výkonem.
|
|
Příprava zkušební půdy
|
13.
|
Používá se upravená umělá půda (8) s obsahem organických látek 5 %. Alternativně lze použít přírodní půdu, jelikož umělá půda se nepodobá přírodním půdám. Doporučuje se toto složení umělé půdy (na základě hmotností v suchém stavu, složky vysušené na konstantní hmotnost při 105 °C):
|
—
|
5 % sfagnové rašeliny, vysušené vzduchem a jemně rozemleté (přijatelná je velikost částic 2 ± 1 mm),
|
|
—
|
20 % kaolinitického jílu (obsah kaolinitu pokud možno vyšší než 30 %),
|
|
—
|
asi 74 % průmyslového písku, vysušeného vzduchem (k dosažení potřebného množství CaCO3), pokud možno jemného písku s více než 50 % částic mezi 50 a 200 mikrony. Přesné množství písku závisí na množství CaCO3 (viz níže), celkem by mělo tvořit do 75 %,
|
|
—
|
1,0 % uhličitanu vápenatého (CaCO3, práškového, čistoty p.a.) pro získání pH 6,0 ± 0,5; množství uhličitanu vápenatého, které se má přidat, může záviset především na kvalitě/povaze rašeliny (viz poznámka 1).
|
Poznámka 1: Požadované množství CaCO3 bude záviset na složkách půdního substrátu a mělo by být stanoveno změřením pH dílčích vzorků preinkubované vlhké půdy bezprostředně před zkouškou.
Poznámka 2: Doporučuje se změřit pH a volitelně poměr C/N, kationtovou výměnnou kapacitu (CEC) a obsah organických látek v půdě, což umožní její pozdější normalizaci a lepší interpretaci výsledků.
Poznámka 3: V případě potřeby, například pro specifické zkušební účely, mohou jako zkušební a/nebo kultivační substrát posloužit přírodní půdy z neznečištěných lokalit. Avšak je-li použita přírodní půda, je nutno ji charakterizovat přinejmenším z hlediska jejího původu (místa odběru), pH, půdní struktury (distribuce velikosti částic), CEC (kationtové výměnné kapacity) a obsahu organických látek a neměla by být nijak kontaminovaná. U přírodní půdy se doporučuje před použitím půdy v hlavní zkoušce prokázat její vhodnost pro tuto zkoušku a pro dosažení kritérií platnosti zkoušky.
|
|
14.
|
Suché složky půdy se důkladně promíchají (např. ve velké laboratorní míchačce). V souladu s postupy popsanými v dodatku 5 se určí maximální vodní kapacita (RVK) umělé půdy. Vlhkost zkušební půdy by měla být optimalizována tak, aby se dosáhlo volné pórovitě struktury půdy umožňující vstup chvostoskoků do pórů. Je to obvykle mezi 40–60 % maximální RVK.
|
|
15.
|
Suchá umělá půda se předem zvlhčí přidáním dostatečného množství deionizované vody, aby bylo dosaženo přibližně poloviny konečného obsahu vody 2–7 dní před začátkem zkoušky, s cílem vyrovnat/stabilizovat kyselost. Pro určení pH se použije směs půdy a roztoku 1 M chloridu draselného (KCl) nebo 0,01 M chloridu vápenatého (CaCl2) v poměru 1:5 (podle dodatku 6). Je-li půda kyselejší než požadované rozmezí, lze ji upravit přidáním vhodného množství CaCO3. Je-li půda příliš alkalická, lze ji upravit přidáním anorganické kyseliny neškodné pro chvostoskoky.
|
|
16.
|
Navlhčená půda se rozdělí na části odpovídající počtu zkušebních koncentrací (a případně referenční chemické látky) a kontrol, které budou při zkoušce použity. Přidají se zkoušené chemické látky a obsah vody se reguluje podle odstavce 24.
|
Výběr a příprava pokusných organismů
|
17.
|
Doporučeným druhem je F. candida, jelikož při okružním testu zkušební metody (11) tento druh splnil kritéria platnosti pro přežití častěji než F. fimetaria. Je-li použit alternativní druh, měl by splňovat kritéria platnosti uvedená v odstavci 9. Na začátku zkoušky by organismy měly být dobře vykrmeny a ve věku 23–26 dnů pro F. fimetaria a 9–12 dnů pro F. candida. Do každého opakování by mělo být zařazeno 10 samečků a 10 samiček F. fimetaria, v případě F. candida se použije 10 samiček (viz dodatek 2 a dodatek 3). Z misek se náhodně vyjmou synchronizovaní chvostoskoci a u každé sady zařazené do jednotlivých opakování se zkontroluje zdravotní a fyzický stav chvostoskoků. Každá skupina složená z 10/20 jedinců se vloží do náhodně zvolené zkušební nádoby; u F. fimetaria se vyberou velké samičky, aby se zajistilo náležité odlišení od samečků.
|
Příprava zkušebních koncentrací
|
18.
|
Zkoušenou chemickou látku je možné aplikovat čtyřmi způsoby: 1) smísit zkoušenou chemickou látku s půdou, přičemž nosičem bude voda, 2) smísit zkoušenou chemickou látku s půdou, přičemž nosičem bude organické rozpouštědlo, 3) smísit zkoušenou chemickou látku s půdou, přičemž nosičem bude písek, nebo 4) aplikovat zkoušenou chemickou látku na povrch půdy. Výběr vhodné metody závisí na charakteristice chemické látky a na účelu zkoušky. Obecně se doporučuje smísení zkoušené chemické látky s půdou. Mohou být však vyžadovány aplikační postupy, které odpovídají praktickému využití zkoušené chemické látky (např. nastříkání látky v kapalném stavu nebo použití zvláštních pesticidních přípravků, např. v granulích nebo jako mořená semena). Půda se exponuje před umístěním chvostoskoků, kromě případů, kdy se zkoušená chemická látka nanáší na povrch půdy a chvostoskoky je třeba vložit do půdy ještě předtím.
|
Zkoušená chemická látka rozpustná ve vodě
|
19.
|
Připraví se roztok zkoušené chemické látky v deionizované vodě v množství dostatečném pro všechna opakování s jednou zkušební koncentrací. Každý roztok zkoušené chemické látky se před zavedením do zkušební nádoby pečlivě smísí s jednou sadou navlhčené půdy.
|
Zkoušená chemická látka nerozpustná ve vodě
|
20.
|
V případě chemických látek nerozpustných ve vodě, ale rozpustných v organických rozpouštědlech lze chemickou látku rozpustit v co nejmenším objemu příslušného rozpouštědla (např. acetonu), které ještě zajišťuje řádné smísení chemické látky s půdou a její smísení s částí požadovaného křemenného písku. Je třeba používat pouze těkavá rozpouštědla. Použije-li se organické rozpouštědlo, všechny zkušební koncentrace a doplňková negativní kontrola rozpouštědla by měly obsahovat stejné minimální množství rozpouštědla. Aplikační nádoby by měly být ponechány po určitou dobu neuzavřeny, aby se umožnilo vypaření rozpouštědla použitého k aplikaci zkoušené chemické látky, a musí se zajistit, aby v této době nedošlo k rozptylu toxické chemické látky.
|
Zkušební chemická látka špatně rozpustná ve vodě a organických rozpouštědlech
|
21.
|
V případě chemických látek, které jsou špatně rozpustné ve vodě a organických rozpouštědlech, se křemenný písek, který by měl být součástí celkového písku přidaného do půdy, smísí s množstvím zkoušené chemické látky, aby se dosáhlo žádoucí zkušební koncentrace. Tato směs křemenného písku a zkoušené chemické látky se přidá do navlhčené půdy a důkladně se promísí s příslušným množstvím deionizované vody, aby bylo dosaženo požadované vlhkosti. Konečná směs se rozdělí do zkušebních nádob. Tento postup se opakuje pro každou zkušební koncentraci a připraví se rovněž příslušná kontrola.
|
Aplikace zkoušené chemické látky na povrch půdy
|
22.
|
Je-li zkoušenou chemickou látkou pesticid, může být vhodné jej aplikovat na povrch půdy nástřikem. Půda se exponuje poté, co jsou do ní umístěni chvostoskoci. Zkušební nádoby se nejdříve naplní navlhčeným půdním substrátem, vloží se organismy a zkušební nádržky se poté zváží. Aby se zabránilo přímé expozici organismů zkoušené chemické látce přímým kontaktem, aplikuje se zkoušená chemická látka nejdříve půl hodiny po zavedení chvostoskoků. Zkoušená chemická látka by se měla aplikovat na povrch půdy pokud možno rovnoměrně rozprašovačem a za použití laboratorních vah, s cílem simulovat aplikaci postřikem na poli. Aplikace by měla být provedena v teplotním rozmezí ± 2 °C a v případě vodních roztoků, emulzí nebo disperzí s dávkováním vody podle doporučení obsažených v posouzení rizik. Dávkování je třeba ověřit pomocí vhodné kalibrační techniky. Zvláštní formy jako granule nebo mořená semena lze aplikovat způsobem odpovídajícím jejich použití v zemědělství. Potrava se podává po nástřiku.
|
POSTUP
Zkušební podmínky
|
23.
|
Střední zkušební teplota by měla být 20 ± 1 °C s teplotním rozmezím 20 ± 2 °C. Zkouška se provádí v řízených cyklech světlo-tma (pokud možno 12 hodin světla a 12 hodin tmy) s osvětlením 400 až 800 luxů v oblasti zkušebních nádob.
|
|
24.
|
Aby bylo možné kontrolovat vlhkost půdy, nádobky se začátku, uprostřed a na konci zkoušky zváží. Ztráta hmotnosti > 2 % se nahradí přidáním deionizované vody. Je třeba podotknout, že ztrátu hmotnosti vody lze snížit udržováním vysoké vlhkosti vzduchu (> 80 %) ve zkušebním inkubátoru.
|
|
25.
|
Na začátku a na konci zkoušky ke stanovení rozsahu i hlavní zkoušky je třeba změřit pH. Měření se provede také v jednom dodatečném kontrolním vzorku a jednom dodatečném vzorku s upravenou půdou (pro každou koncentraci), připravených a uchovávaných stejným způsobem jako zkušební kultury, avšak bez přítomnosti chvostoskoků.
|
Zkušební postup a měření
|
26.
|
Pro každou koncentraci se do zkušební nádoby vloží množství zkušební půdy odpovídající 30 g čerstvé hmotnosti. Připraví se rovněž kontrolní vzorky bez zkoušené chemické látky. Aplikuje-li se zkoušená chemická látka pomocí vehikula, je třeba kromě zkušebních sérií provést také jednu řadu kontrol pouze s vehikulem. Koncentrace rozpouštědla nebo dispergátoru má být stejná jako jejich koncentrace použitá ve zkušebních nádobách se zkoušenou chemickou látkou.
|
|
27.
|
Jednotliví chvostoskoci se pečlivě přemístí do každé zkušební nádoby (do zkušebních nádob se přidělí náhodným výběrem) a umístí se na povrch půdy. Pro účinné přemístění organismů lze použít odsávačku s nízkým výkonem. Počet opakování pro zkušební koncentrace a kontroly závisí na použitém uspořádání zkoušky. Zkušební nádoby se do zkušebního inkubátoru umístí náhodně a jejich poloha se každý týden náhodně mění.
|
|
28.
|
Pro zkoušku s F. fimetaria by mělo být použito 20 dospělých jedinců, 10 samečků a 10 samiček ve věku 23–26 dnů v každé zkušební nádobě. V den 21 se chvostoskoci vyjmou z půdy a spočítají se. U F. fimetaria se pohlaví rozliší podle velikosti v synchronizované sadě chvostoskoků, která je ve zkoušce použita. Samičky jsou výrazně větší než samečci (viz dodatek 3).
|
|
29.
|
Pro zkoušku s F. candida by mělo být použito 10 nedospělých jedinců ve věku 9–12 dnů v každé zkušební nádobě. V den 28 se chvostoskoci vyjmou z půdy a spočítají se.
|
|
30.
|
Jako vhodný zdroj potravy se na začátku zkoušky a poté po přibližně dvou týdnech do každé nádoby přidá dostatečné množství, např. 2–10 mg, granulovaných sušených pekařských kvasnic, komerčně dostupných pro použití v domácnostech.
|
|
31.
|
Na konci zkoušky se vyhodnotí mortalita a reprodukce. Chvostoskoci se po 3 týdnech (F. fimetaria) nebo po 4 týdnech (F. candida) vyjmou ze zkušební půdy (viz dodatek 4) a spočítají se (12). Nejsou-li v extraktu nalezeni chvostoskoci, považují se za mrtvé. Metodu extrakce a počítání je třeba validovat. Validací se ověřuje účinnost extrakce nedospělých jedinců větší než 95 %, např. vložením jejich známého počtu do půdy.
|
|
32.
|
Praktické shrnutí a časový rozvrh zkušebního postupu jsou popsány v dodatku 2.
|
Uspořádání zkoušky
Zkouška pro stanovení rozmezí dávek
|
33.
|
Je-li to nezbytné, provede se zkouška pro stanovení rozmezí dávek například s pěti koncentracemi zkoušené chemické látky ve výši 0,1, 1,0, 10, 100 a 1 000 mg/kg suché hmotnosti půdy a s dvěma opakováními každé expozice a kontroly. Při rozhodování o rozmezí koncentrací, které ve zkoušce ke stanovení rozsahu mají být použity, mohou být užitečné i další informace o mortalitě nebo reprodukci chvostoskoků, získané při zkouškách s obdobnými chemickými látkami nebo z literatury.
|
|
34.
|
Zkouška pro stanovení rozmezí dávek trvá pro F. fimetaria 2 týdny a pro F. candida 3 týdny, aby bylo zajištěno vylíhnutí jedné generace nedospělých jedinců. Na konci zkoušky se vyhodnotí mortalita a reprodukce chvostoskoků. Počet dospělých a výskyt nedospělých jedinců je třeba zaznamenat.
|
Hlavní zkouška
|
35.
|
K určení ECx (např. EC10, EC50) by mělo být zkoušeno dvanáct koncentrací. Doporučují se alespoň dvě opakování expozice každé zkušební koncentraci a šest opakování kontroly. Faktor odstupňování koncentrací může být různý v závislosti na vztahu mezi dávkou a odezvou.
|
|
36.
|
K určení NOEC/LOEC je třeba zkoušet alespoň pět koncentrací v geometrické řadě. Doporučují se čtyři opakování expozice v každé zkušební koncentraci a osm kontrolních skupin. Koncentrace by měly být odstupňovány podle faktoru, který nebude vyšší než 1,8.
|
|
37.
|
K určení NOEC/LOEC i ECx se dospěje kombinovanou metodou. Při této kombinované metodě je třeba použít osm expozičních koncentrací v geometrické řadě. Doporučují se čtyři opakování každé expozice a osm kontrolních skupin. Koncentrace by měly být odstupňovány podle faktoru, který nebude vyšší než 1,8.
|
|
38.
|
Nejsou-li při zkoušce ke stanovení rozsahu zaznamenány žádné účinky při nejvyšší koncentraci (tj. 1 000 mg/kg), je možné zkoušku toxicity pro reprodukci provést jako limitní zkoušku s použitím zkušební koncentrace 1 000 mg/kg a kontroly. Limitní zkouška umožní prokázat, že při limitní koncentraci neexistuje žádný statisticky významný účinek. Mělo by se provést osm opakování s exponovanou půdou a osm s kontrolou.
|
ÚDAJE A JEJICH PŘEDKLÁDÁNÍ
Zpracování výsledků
|
39.
|
Hlavním ukazatelem je reprodukční schopnost (např. počet nedospělých jedinců vylíhnutých v jedné zkušební nádobce). Při statistické analýze, provedené např. pomocí postupů analýzy rozptylu (ANOVA), se expozice porovnají Studentovým t-testem, Dunnettovým testem nebo Williamsovým testem. Pro střední hodnoty jednotlivých koncentrací se vypočtou 95 % intervaly spolehlivosti.
|
|
40.
|
Počet přeživších dospělých jedinců v neexponovaných kontrolních skupinách je důležitým kritériem platnosti zkoušky a je třeba jej zdokumentovat. Stejně jako při zkoušce pro stanovení rozsahu dávek je třeba také v závěrečné zprávě uvést i všechny ostatní škodlivé příznaky.
|
LCx a ECx
|
41.
|
Hodnoty ECx včetně s nimi souvisejících nižších a vyšších hladin 95 % intervalu spolehlivosti tohoto parametru se vypočítají vhodnou statistickou metodou (např. pomocí logistické neboli Weibullovy funkce, zkrácenou Spearman-Karberovou metodou nebo prostou interpolací). ECx získáme tak, že se do příslušné rovnice vloží hodnoty odpovídající x % střední hodnoty kontrolní skupiny. Pro výpočet EC50 nebo kterékoli jiné hodnoty ECx se úplný soubor údajů podrobí regresní analýze. LC50 se obvykle odhadne pomocí probitové analýzy nebo obdobné analýzy, která zohlední binomicky rozdělené údaje o mortalitě.
|
NOEC/LOEC
|
42.
|
Má-li statistická analýza určit NOEC/LOEC, jsou k tomu nezbytné statistické údaje o každé nádobě (jednotlivé nádoby se považují za opakování). Měly by být použity vhodné statistické metody podle dokumentu OECD č. 54 o současných přístupech ke statistické analýze dat týkajících se ekotoxicity: pokyny pro aplikaci (9). Nepříznivé účinky zkoušené chemické látky v porovnání s kontrolou se zpravidla zkoumají jednostranným testováním hypotéz při p ≤ 0,05.
|
|
43.
|
Normalitu rozdělení a homogenitu rozptylu lze prověřit vhodným statistickým testem, např. Shapiro-Wilkovým testem, případně Leveneovým testem (p ≤ 0,05). Je možné provést jednocestnou analýzu rozptylu (ANOVA) a následné mnohonásobné srovnávací testy. Pro výpočet, zda existují významné rozdíly (p ≤ 0,05) mezi kontrolními skupinami a různými koncentracemi zkoušené chemické látky, je možné použít mnohonásobné srovnávání (např. Dunnettův test) nebo testy sestupného trendu (např. Williamsův test) (výběr doporučeného testu se provede podle dokumentu OECD č. 54 (9)). Nebo lze k určení NOEC a LOEC použít neparametrické metody (např. Bonferroniho U-test podle Holma nebo zkouška trendu Jonckheere-Terpstra).
|
Limitní zkouška
|
44.
|
Byla-li provedena limitní zkouška (porovnání kontrolní skupiny a pouze jedné exponované skupiny) a jsou-li splněny podmínky pro parametrické zkušební postupy (normalita rozdělení, homogenita rozptylu), je možné hodnotit spojité proměnné pomocí Studentova testu (t-testu). Pokud tyto požadavky splněny nejsou, lze použít t-test nestejných rozptylů (Welchův t-test) nebo neparametrický test, např. Mannův-Whitneyův U-test.
|
|
45.
|
Pro určení významných rozdílů mezi kontrolními skupinami (kontrolní a kontrolní s rozpouštědlem) je možné každou kontrolní skupinu podrobit opakovaným zkouškám, jak bylo popsáno u limitní zkoušky. Pokud tyto zkoušky neodhalí významné rozdíly, údaje ze všech opakování s kontrolou a kontrolou s rozpouštědlem je možné sloučit. V opačném případě by všechny expozice měly být porovnány s kontrolou s rozpouštědlem.
|
Závěrečná zpráva
|
46.
|
Závěrečná zpráva by měla obsahovat minimálně tyto údaje:
|
|
Zkoušená látka
|
—
|
identifikace zkoušené chemické látky, sada, šarže a číslo CAS, čistota,
|
|
—
|
fyzikálně-chemické vlastnosti zkoušené chemické látky (např. log Kow, rozpustnost ve vodě, tlak par, Henryho konstanta (H) a pokud možno informace o osudu zkoušené chemické látky v půdě), jsou-li dostupné,
|
|
—
|
složení zkoušené chemické látky, a pokud se nejedná o čistou chemickou látku, je třeba uvést příměsi.
|
|
|
|
Pokusné organismy
|
—
|
identifikace druhů a dodavatele pokusných organismů, popis podmínek chovu a věkové rozpětí pokusných organismů.
|
|
|
|
Zkušební podmínky
|
—
|
popis uspořádání zkoušky a jejích postupů,
|
|
—
|
podrobnosti o přípravě zkušební půdy; byla-li použita přírodní půda, její podrobná specifikace (původ, historie, distribuce velikosti částic, pH, obsah organických látek),
|
|
—
|
retenční vodní kapacita půdy,
|
|
—
|
popis techniky použité při aplikaci zkoušené chemické látky na půdu,
|
|
—
|
zkušební podmínky: intenzita osvětlení, doba trvání cyklů světlo-tma, teplota,
|
|
—
|
popis režimu krmení, typ a množství krmiva použitého při zkoušce, data krmení,
|
|
—
|
pH půdy a obsah vody v půdě na začátku a na konci zkoušky (pro kontrolní skupinu a každou expozici),
|
|
—
|
podrobný popis metody extrakce a účinnost extrakce.
|
|
|
|
Výsledky zkoušek
|
—
|
počet nedospělých jedinců zjištěných v každé zkušební nádobě na konci zkoušky,
|
|
—
|
počet dospělých jedinců a jejich mortalita (v %) v každé zkušební nádobě na konci zkoušky,
|
|
—
|
popis zjevných fyziologických nebo patologických symptomů nebo výrazných změn v chování,
|
|
—
|
výsledky dosažené s referenční zkoušenou chemickou látkou,
|
|
—
|
hodnoty NOEL/LOEC, LCx pro mortalitu a ECx pro reprodukci (hlavně LC50, LC10, EC50 a EC10) spolu s 95 % intervaly spolehlivosti, graf proloženého modelu použitého pro výpočet, jeho funkční rovnice a jeho parametry (viz (9)),
|
|
—
|
veškeré informace a pozorování užitečné pro interpretaci výsledků,
|
|
—
|
síla statistického testu, provádí-li se testování hypotéz (9),
|
|
—
|
odchylky od postupů popsaných v této zkušební metodě a jakékoli neobvyklé události během zkoušky,
|
|
—
|
minimální zjistitelný rozdíl NOEC, byla-li hodnota NOEC odhadnuta.
|
|
|
LITERATURA
|
1)
|
Wiles, J. A. and Krogh, P. H. (1998) Testing with the collembolans I. viridis, F. candida and F. fimetaria. In Handbook of soil invertebrate toxicity tests (ed. H Løkke and CAM Van Gestel), pp. 131–156. John Wiley & Sons, Ltd., Chichester.
|
|
2)
|
ISO (1999) Soil Quality – Effects of soil pollutants on Collembola (Folsomia candida): Method for determination of effects on reproduction. No. 11267. International Organisation for Standardisation, Geneve.
|
|
3)
|
Burges, A. and Raw, F. (Eds.) (1967) Soil Biology. Academic Press. London.
|
|
4)
|
Petersen H and Luxton M (1982) A comparative analysis of soil fauna populations and their role in decomposition processes. Oikos 39: 287–388.
|
|
5)
|
Petersen, H. (1994) A review of collembolan ecology in ecosystem context. Acta Zoologica Fennica 195: 111–118.
|
|
6)
|
Hopkin, S. P. (1997). Biology of the Springtails (Insecta: Collembola). Oxford University Press. pp. 330 (ISBN 0-19-854084-1).
|
|
7)
|
Ulber, B. (1983) Einfluss von Onychirurus fimatus Gisin (Collembola, Onychiuridae) und Folsomia fimetaria L. (Collembola, Isotomidae) auf Pythium ultimum Trow. einen Erreger des Wurzelbrandes der Zuckerrübe. In New trends in soil Biology (Lebrun Ph, André HM, De Medts A, Grégoire-Wibo, Wauthy G (Eds.), Proceedings of the VI. international colloquium on soil zoology, Louvain-la-neuve (Belgium), 30 August – 2 September 1982, I Dieu-Brichart, Ottignies-Louvain-la-Neuve, pp. 261–268.
|
|
8)
|
Kapitola C.36 této přílohy, Zkouška toxicity pro reprodukci dravých roztočů (Hypoaspis (Geolaelaps) aculeifer) v půdě.
|
|
9)
|
OECD (2006), Current approaches in the statistical analysis of ecotoxicity data: a guidance to application. OECD series on testing and assessment Number 54, ENV/JM/MONO(2006)18, OECD Paris.
|
|
10)
|
Scott-Fordsmand, J. J. and Krogh, P. H. (2005) Background report on prevalidation of an OECD springtail test guideline. Environmental Project Nr. 986. Miljøstyrelsen pp. 61. Danish Ministry for the Environment.
|
|
11)
|
Krogh, P. H., 2009. Toxicity testing with the collembolans Folsomia fimetaria and Folsomia candida and the results of a ringtest. Danish Environmental Protection Agency, Environmental Project No. 1256, pp. 66.
|
|
12)
|
Krogh, P. H., Johansen, K. and Holmstrup, M. (1998) Automatic counting of collembolans for laboratory experiments. Appl. Soil Ecol. 7, pp. 201–205.
|
|
13)
|
Fjellberg, A. (1980) Identification keys to Norwegian collembolans. Norsk Entomologisk Forening.
|
|
14)
|
Edwards, C. A. (1955) Simple techniques for rearing Collembola, Symphyla and other small soil inhabiting arthropods. In Soil Zoology (Kevan D.K. McE., Ed.). Butterworths, London, pp. 412–416.
|
|
15)
|
Goto, H. E. (1960) Simple techniques for the rearing of Collembola and a not on the use of a fungistatic substance in the cultures. Entomologists' Monthly Magazine 96: pp. 138–140.
|
Dodatek 1
Definice
Pro tuto zkušební metodu jsou použitelné následující definice (v této zkoušce se všechny koncentrace vyvolávající účinek vyjádří v hmotnosti zkoušené chemické látky vztažené na jednotku suché hmotnosti zkušební půdy).
|
|
Chemická látka: látka nebo směs.
|
|
|
NOEC (No Observed Effect Concentration) je zkratkou pro koncentraci bez pozorovaných účinků, což je koncentrace zkoušené chemické látky, při níž není pozorován žádný účinek. V této zkoušce koncentrace odpovídající hodnotě NOEC nemá pro danou expoziční dobu žádný statisticky významný účinek (na hladině spolehlivosti p < 0,05) ve srovnání s kontrolami.
|
|
|
LOEC (Lowest Observed Effect Concentration) je zkratkou pro nejnižší koncentraci s pozorovanými účinky, což je nejnižší koncentrace zkoušené chemické látky, která má pro danou expoziční dobu statisticky významný účinek (na hladině spolehlivosti p < 0,05) ve srovnání s kontrolami.
|
|
|
ECx (Effect Concentration for x % effect) je koncentrace, která pro danou expoziční dobu vyvolává x % účinek na zkušební organismy ve srovnání s kontrolami. Například EC50 je koncentrace odhadnutá pro vyvolání účinku na zkoušený ukazatel u 50 % exponované populace za stanovenou expoziční dobu.
|
|
|
Zkoušená chemická látka: jakákoli látka nebo směs zkoušená touto zkušební metodou.
|
Dodatek 2
Hlavní úkony a časový harmonogram pro provedení zkoušky s chvostoskoky
Kroky zkoušky lze shrnout takto:
|
Čas (dny)
|
Úkon
|
|
– 23 až – 26
|
Připravit synchronizovanou kulturu F. fimetaria
|
|
– 14
|
Připravit umělou půdu (smícháním suchých složek)
Zkontrolovat pH umělé půdy a odpovídajícím způsobem upravit
Změřit maximální vodní kapacitu půdy
|
|
– 9 až – 12
|
Připravit synchronizovanou kulturu F. candida
|
|
– 2 až – 7–
|
Navlhčit půdu
|
|
– 1
|
Rozdělit nedospělé jedince do sad
Připravit zásobní roztoky a smísit je se zkoušenou chemickou látkou, je-li požadován roztok
|
|
0
|
Připravit zásobní roztoky a smísit je se zkoušenou chemickou látkou, je-li požadována aplikace pevné chemické látky rozpustné ve vodě nebo povrchová aplikace
Změřit pH půdy a zvážit nádržky
Dodat potravu. Vložit chvostoskoky.
|
|
14
|
Zkouška ke stanovení rozsahu pro F. fimetaria: ukončit zkoušku, vyjmout chvostoskoky, změřit pH půdy a ztrátu vody (zvážením)
Hlavní zkoušky: změřit vlhkost, doplnit vodu a přidat 2–10 mg kvasnic
|
|
21
|
Hlavní zkouška s F. fimetaria: ukončit zkoušku, vyjmout chvostoskoky, změřit pH půdy a ztrátu vody (zvážením)
Zkouška ke stanovení rozsahu pro F. candida: ukončit zkoušku, vyjmout chvostoskoky, změřit pH půdy a ztrátu vody (zvážením)
|
|
28
|
Hlavní zkouška s F. candida: ukončit zkoušku, vyjmout chvostoskoky, změřit pH půdy a ztrátu vody (zvážením)
|
Dodatek 3
Pokyny pro odchov a synchronizaci F. fimetaria a F. candida
Časy a doby trvání uvedené v těchto pokynech je třeba pro každý konkrétní kmen chvostoskoků ověřit, aby se zajistilo, že načasování umožní získat dostatečně synchronizované nedospělé jedince. Výskyt kladení vajíček poté, co byly dospělé organismy přemístěny do čerstvého substrátu, a vylíhnutí z vajíček v zásadě určují vhodný den pro odběr vajíček a odběr synchronizovaných nedospělých chvostoskoků.
Doporučuje se mít neustále k dispozici kmenovou kulturu sestávající např. z 50 nádržek / Petriho misek. Tuto kmenovou kulturu je třeba udržovat v dobrých životních podmínkách s podáváním potravy, vody a odstraňováním zbývajících částí mrtvých těl jednou týdně. Příliš malý počet chvostoskoků v substrátu může vést k inhibici v důsledku většího růstu plísní. Je-li kmenová kultura používána k produkci vajíček příliš často, může se vyčerpat. Příznaky vyčerpání jsou mrtví dospělí jedinci a plíseň na substrátu. Zbylá vajíčka pocházející ze synchronizovaných chvostoskoků je možné použít na omlazení kultury.
V synchronizované kultuře F. fimetaria se samečci odlišují od samiček především velikostí. Samečci jsou jasně menší a pohybují se rychleji než samičky. Správný výběr pohlaví nevyžaduje velkou praxi a je možné ho potvrdit mikroskopickým ohledáním oblasti genitálií (13).
1. Odchov
1.a. Příprava kultivačního substrátu
Kultivačním substrátem je pálená sádra (síran vápenatý) s aktivovaným aktivním uhlím. To poskytuje vlhký substrát, přičemž funkcí aktivního uhlí je absorbovat odpadní plyny a exkreta (14)(15). K usnadnění pozorování chvostoskoků lze použít různé formy aktivního uhlí. Např. v případě F. candida a F. fimetaria se používá práškové aktivní uhlí (čímž se získá pálená sádra černé/šedé barvy):
Složky substrátu:
|
—
|
20 ml aktivovaného aktivního uhlí
|
|
—
|
200 ml destilované vody
|
nebo
|
—
|
50 g aktivovaného aktivního uhlí v prášku
|
|
—
|
260–300 ml destilované vody
|
Směs substrátu se před použitím nechá usadit.
1.b. Chov
Chvostoskoci jsou drženi v nádržkách, např. v Petriho miskách (90 mm × 13 mm) s dnem pokrytým 0,5 cm vrstvou substrátu složeného ze sádry a aktivního uhlí. Kultivují se při teplotě 20 ± 1 °C a cyklu 12 hodin světla a 12 hodin tmy (s osvětlením 400–800 luxů). Nádržky se udržují vždy vlhké, aby se zajistila 100 % relativní vlhkost vzduchu v nádržkách. To lze zaručit přítomností volné vody v porézní sádře, je však třeba se vyvarovat vytvoření vodní vrstvy na povrchu sádry. Ztrátě vody lze předejít zajištěním vlhkého okolního vzduchu. Z nádržek je nutné odstranit všechny mrtvé jedince, a stejně tak veškerou potravu napadenou plísní. Aby se stimulovala produkce vajíček, je nezbytné přemístit dospělé chvostoskoky do Petriho misek s nově připraveným substrátem z pálené sádry a aktivního uhlí.
1.c. Zdroj potravy
Jako jediné krmivo pro F. candida a F. fimetaria se používají sušené pekařské kvasnice v granulích. Čerstvé krmivo se podává jednou nebo dvakrát týdně, aby nedocházelo k plesnivění. Klade se v malé hromádce přímo na pálenou sádru. Hmotnost přidaných pekařských kvasnic je třeba upravit podle velikosti populace chvostoskoků, ale zpravidla postačí 2–15 mg.
2. Synchronizace
Zkouška by se měla provádět se synchronizovanými chvostoskoky, aby se dosáhlo homogenních zkušebních organismů stejného instaru a stejné velikosti. Synchronizace dále umožňuje rozlišovat mezi samečky a samičkami F. fimetaria ve věku od 3 týdnů výše na základě pohlavního dimorfismu, tj. rozdílné velikosti. Níže je uveden doporučený postup, jak získat synchronizované jedince (praktické kroky jsou volitelné):
2.a. Synchronizace
|
—
|
Připravte nádržky s 0,5 cm vrstvou substrátu složeného z pálené sádry a aktivního uhlí.
|
|
—
|
Pro kladení vajíček přemístěte 150–200 dospělých F. fimetaria a 50–100 F. candida z nejlepších 15–20 nádržek s kmenovou kulturou se substrátem starým 4–8 týdnů do nádržek a podejte jim krmivo – 15 mg pekařských kvasnic. Dbejte na to, aby se nedospělí jedinci nesmíchali s dospělými, neboť přítomnost nedospělých chvostoskoků může inhibovat produkci vajíček.
|
|
—
|
Při kultivaci udržujte teplotu 20 ± 1 °C (střední hodnota by měla být 20 °C), cyklus 12 hodin světla a 12 hodin tmy (s osvětlením 400–800 luxů). Zabezpečte přísun čerstvé potravy a nasycenost vzduchu vodou. Nedostatek potravy může vést k tomu, že chvostoskoci budou defekovat na vajíčka s následným růstem plísní na vajíčkách, nebo F. candida mohou pojídat svá vlastní vajíčka. Po 10 dnech se vajíčka pečlivě odeberou jehlou a stěrkou a přemístí na ‚vajíčkový papír‘ (malé kousky filtračního papíru namočené do suspenze pálené sádry / aktivního uhlí), který se vloží do nádržky s čerstvým substrátem ze sádry a aktivního uhlí. Do substrátu se přidá několik zrnek kvasnic, aby upoutaly pozornost nedospělých chvostoskoků a přiměly je filtrační papír opustit. Je důležité, aby filtrační papír i substrát byly vlhké, jinak vajíčka vyschnou. Alternativně mohou být dospělí jedinci po nakladení vajíček na 2 nebo 3 dny ze synchronizovaných kultivačních schránek vyjmuti.
|
|
—
|
Po 3 dnech se z většiny vajíček na filtračním papíru vylíhnou mláďata a pod filtračním papírem bude možné nalézt několik nedospělých jedinců.
|
|
—
|
Abychom získali stejně staré nedospělé chvostoskoky, filtrační papír s nevylíhnutými vajíčky se z Petriho misky pinzetou odstraní. Nedospělí chvostoskoci, nyní ve věku 0–3 dnů, v misce zůstanou a nakrmí se pekařskými kvasnicemi. Nevylíhnutá vejce se vyřadí.
|
|
—
|
Vajíčka a vylíhnutí nedospělí jedinci se kultivují stejným způsobem jako dospělí. Zejména pro F. fimetaria je třeba přijmout tato opatření: zabezpečí se dostatek čerstvé potravy, stará plesnivějící potrava se odstraní a po 1 týdnu se nedospělí jedinci, pokud je jejich hustota vyšší než 200, rozdělí do nových Petriho misek.
|
2.b. Manipulace s chvostoskoky na začátku zkoušky
|
—
|
F. candida ve věku 9–12 dnů nebo F. fimetaria ve věku 23–26 dnů se odeberou, např. odsátím, a vypustí do malé nádržky s vlhkým substrátem složeným ze sádry a aktivního uhlí a jejich fyzický stav se ověří pod binokulárním mikroskopem (zranění a poškození jedinci se vyřadí). Při všech krocích je třeba udržovat chvostoskoky ve vlhkém prostředí, např. pomocí navlhčených povrchů apod., aby se zabránilo stresu ze sucha.
|
|
—
|
Otočte nádržku dnem vzhůru a poklepejte na ni, aby se chvostoskoci přemístili do půdy. Je třeba neutralizovat statickou elektřinu, jinak by chvostoskoci mohli pouze vyletět do vzduchu nebo se přitisknout ke stěně zkušební nádržky a vyschnout. Pro neutralizaci je možné použít ionizátor nebo podložit nádržku kusem vlhké látky.
|
|
—
|
Potravu je třeba rozprostřít po celém povrchu půdy a nepodávat ji pouze v jedné hrudce.
|
|
—
|
Při přepravě a v době zkoušky by se nemělo klepat na zkušební nádržky nebo s nimi jinak rušivě manipulovat, protože to může zvýšit kompaktnost půdy a narušit interakci mezi chvostoskoky.
|
3. Alternativní druhy chvostoskoků
Pro zkoušení podle této zkušební metody je možné zvolit i jiné druhy chvostoskoků, např. Proisotoma minuta, Isotoma viridis, Isotoma anglicana, Orchesella cincta, Sinella curviseta, Paronychiurus kimi, Orthonychiurus folsomi, Mesaphorura macrochaeta. Před použitím alternativních druhů by měly být splněny určité podmínky:
|
—
|
druhy by měly být jednoznačně identifikovány,
|
|
—
|
výběr daného druhu by měl být odůvodněn,
|
|
—
|
mělo by se zajistit, aby do zkušební fáze byla zahrnuta reprodukční biologie, takže bude potenciálním cílem během expozice,
|
|
—
|
měly by být známy informace o vývoji: věk při dosažení zralosti, doba trvání vývoje vajíček a instary podléhající expozici,
|
|
—
|
zkušební substrát a podávání potravy by měly zajistit optimální podmínky pro růst a rozmnožování,
|
|
—
|
variabilita by měla být dostatečně nízká pro dosažení precizního a přesného odhadu toxicity.
|
Dodatek 4
Extrakce a počítání chvostoskoků
1. Lze použít dvě metody extrakce.
|
1.a.
|
První metoda: je možné použít řízený extraktor s teplotním gradientem, založený za zásadách stanovených MacFadyenem (1). Teplo přichází z topného článku v horní části extrakční nádrže (regulované pomocí termistoru umístěného na povrchu půdního vzorku). Teplota ochlazené kapaliny obklopující sběrnou nádobu se reguluje pomocí termistoru, který se nachází na povrchu sběrné schránky (umístěné pod půdním vzorkem). Termistory jsou připojeny k programovatelné řídící jednotce, která zvyšuje teplotu podle předem naprogramovaného rozvrhu. Chvostoskoci se odeberou do chlazené sběrné schránky (o teplotě 2 °C), na jejímž dně je vrstva pálené sádry / aktivního uhlí. Extrakce začíná při 25 °C, přičemž teplota se každých 12 hodin automaticky zvyšuje o 5 °C, a trvá celkem 48 hodin. Extrakce se ukončí po 12 hodinách při teplotě 40 °C.
|
|
1.b.
|
Druhá metoda: Po pokusné inkubační době se počet nedospělých chvostoskoků odhadne pomocí flotace. Pro tento účel se zkouška provádí v nádobách o objemu přibližně 250 ml. Na konci zkoušky se přidá asi 200 ml destilované vody. Půda se jemně zkypří jemným štětečkem, aby se chvostoskokům umožnilo vyplavat na vodní povrch. Do vody je možné přidat malé množství, asi 0,5 ml, černé fotografické barvy značky Kentmere, aby se usnadnilo počítání díky zvýšení kontrastu mezi vodou a bílými chvostoskoky. Tato barva není pro chvostoskoky toxická.
|
2. Počítání:
Určení počtu je možné provést vizuálně nebo pod světelným mikroskopem pomocí síťky umístěné pod flotační nádobou nebo tak, že se povrch každé nádoby vyfotografuje a chvostoskoci se poté spočítají na zvětšených fotografiích nebo promítaných diapozitivech. Počty lze rovněž stanovit pomocí technik digitálního zpracování obrazu (12). Všechny techniky by měly být validovány.
Dodatek 5
Určení maximální vodní kapacity půdy
Bylo zjištěno, že pro určení maximální vodní kapacity (RVK) půdy je vhodná následující metoda. Je popsána v příloze C normy ISO DIS 11268-2 (Soil Quality – Effects of pollutants on earthworms (Eisenia fetida) (Kvalita půdy – Účinky znečišťujících látek na žížaly. Část 2: Stanovení účinků na reprodukci Eisenia fetida/Eisenia andrei).
Odeberte stanovené množství (např. 5 g) zkušebního půdního substrátu pomocí vhodného zařízení pro odběr vzorků (spirálové trubice apod.). Dno trubice překryjte kouskem navlhčeného filtračního papíru a poté ji položte na podložku do vodní lázně. Trubici je třeba postupně ponořovat, dokud hladina vody nepřevýší vrchní část půdy. Poté by měla být ponechána asi na tři hodiny ve vodě. Jelikož ne všechna voda absorbovaná půdními kapilárami může být zadržena, vzorek půdy by se měl nechat schnout po dobu dvou hodin tak, že se trubice položí na lože velmi vlhkého jemně rozemletého křemenného písku umístěného v zakryté nádobě (aby se zabránilo vysychání). Vzorek, vysušený na konstantní hmotnost při teplotě 105 °C, je poté třeba zvážit. Retenční vodní kapacita (RVK) se vypočítá takto:

kde:
|
S
|
=
|
hmotnost substrátu nasyceného vodou + hmotnost trubice + hmotnost filtračního papíru
|
|
T
|
=
|
hmotnost obalu (hmotnost trubice + hmotnost filtračního papíru)
|
|
D
|
=
|
suchá hmotnost substrátu
|
Dodatek 6
Určení pH půdy
Následující metoda pro určení pH půdy je založena na popisu uvedeném v ČSN ISO 10390: Kvalita půdy – Stanovení pH.
Stanovené množství půdy se suší při pokojové teplotě alespoň 12 hodin. Suspenze půdy (obsahující alespoň 5 gramů půdy) se poté smíchá s pětinásobkem svého objemu 1 M roztoku chloridu draselného (KCl) čistoty p. a. nebo 0,01 M roztoku chloridu vápenatého (CaCl2) čistoty p. a. Suspenze se poté po dobu 5 minut důkladně protřepe a následně se nechá alespoň 2 hodiny, avšak ne déle než 24 hodin, usadit. Poté se změří pH kapalné fáze pH-metrem, který byl před každým měřením kalibrován pomocí vhodné série pufrovaných roztoků (např. pH 4,0 a 7,0).
C.40. ZKOUŠKA TOXICITY BĚHEM ŽIVOTNÍHO CYKLU CHIRONOMIDAE V SYSTÉMU SEDIMENT-VODA ZA POUŽITÍ OBOHACENÉ VODY NEBO OBOHACENÉHO SEDIMENTU
ÚVOD
|
1.
|
Tato zkušební metoda odpovídá Pokynu OECD pro zkoušení č. 233 (2010). Je určena k posouzení účinků celoživotní expozice sladkovodních pakomárů čeledi Chironomus chemickým látkám, přičemž plně pokrývá první generaci (generaci P) a ranou fázi druhé generace (generace F1). Navazuje na stávající zkušební metodu C.28 (1) používající scénář expozice obohacené vodě nebo metodu C.27 (15) používající scénář s obohaceným sedimentem. Zohledňuje stávající metody zkoušení toxicity pro druhy Chironomus riparius a Chironomus dilutus (dříve nazývaný C. tentans (2)), které byly vyvinuty v Evropě a Severní Americe (3)(4)(5)(6)(7)(8)(9) a následně ověřovány v mezilaboratorních porovnávacích zkouškách (1)(7)(10)(11)(12). Lze užít rovněž další dobře zdokumentované druhy pakomárů, jako např. Chironomus yoshimatsui (13)(14). Celková délka trvání expozice je přibližně 44 dnů pro C. riparius a C. yoshimatsui a přibližně 100 dnů pro C. dilutus.
|
|
2.
|
V této zkušební metodě jsou popsány scénáře expozice vodě i sedimentu. Výběr vhodného scénáře expozice závisí na zamýšleném použití zkoušky. Účelem scénáře expozice vodě, tj. metoda obohacení vodního sloupce, je simulovat rozprášení pesticidního postřiku a zahrnuje počáteční maximální koncentraci v povrchových vodách. Obohacení vody je užitečné také pro jiné druhy expozic (včetně úniků chemikálií), ale nikoli procesů akumulace v sedimentu, jejichž délka přesahuje trvání zkušebního období. V takovém případě a také tehdy, když se pesticidy dostávají do vodního útvaru především odplavením, může být vhodnější uspořádání s obohaceným sedimentem. Jsou-li předmětem zájmu jiné scénáře expozice, uspořádání zkoušky lze snadno upravit. Například pokud není podstatná distribuce zkoušené chemické látky mezi vodní fází a vrstvou sedimentu a adsorpce do sedimentu musí být minimalizována, lze zvážit použití náhradního umělého sedimentu (např. křemenného písku).
|
|
3.
|
Chemické látky, které je třeba testovat na organismech žijících v sedimentu, mohou v sedimentu přetrvávat po dlouhá období. Expozici organismů žijících v sedimentu lze zajistit celou řadou možných cest. Relativní význam jednotlivých cest, jimiž dochází k expozici, a doba nezbytná k tomu, aby každá z nich přispěla k celkovému toxickému účinku, jsou závislé na fyzikálně-chemických vlastnostech chemické látky. V případě silně adsorbujících chemických látek nebo chemických látek s kovalentní vazbou na sediment může být významnou cestou expozice požití kontaminované potravy. Aby nedošlo k podcenění toxicity vysoce lipofilních chemických látek, lze zvážit užití potravy přidané do sedimentu před aplikací zkoušené chemické látky (viz odstavec 31). Je tedy možné zohlednit všechny způsoby expozice a všechna životní stadia.
|
|
4.
|
Měřenými ukazateli jsou celkový počet plně vylíhlých, živých dospělců (v první a druhé generaci), rychlost vývoje (v první a druhé generaci), poměr pohlaví u plně vylíhlých, živých dospělců (v první a druhé generaci), počet šňůr vajíček na jednu samičku (pouze v první generaci) a fertilita šňůr vajíček (pouze v první generaci).
|
|
5.
|
Důrazně se doporučuje používat připravený sediment. Připravený sediment má oproti přírodním sedimentům několik výhod:
|
—
|
jeho experimentální variabilita je snížena, neboť tvoří reprodukovatelnou ‚standardizovanou matrici‘, a odpadá potřeba hledat zdroje nekontaminovaného čistého sedimentu,
|
|
—
|
zkoušky lze zahájit kdykoli, aniž by bylo nutno potýkat se se sezonními výkyvy zkušebního sedimentu, a sediment není třeba předem upravovat, aby se z něj odstranili původní živočichové,
|
|
—
|
oproti terénnímu shromažďování dostatečného množství sedimentu pro rutinní testování se sníží náklady,
|
|
—
|
připravený sediment umožňuje porovnání toxicity v různých studiích a odpovídající řazení látek (3).
|
|
|
6.
|
Použité definice jsou uvedeny v dodatku 1.
|
PODSTATA ZKOUŠKY
|
7.
|
Larvy pakomárů v prvním instaru jsou vystaveny koncentračnímu rozmezí zkoušené chemické látky v systému sediment-voda. Zkouška začíná tím, že se larvy prvního instaru (první generace) umístí do zkušebních kádinek obsahujících obohacený sediment, nebo se zkoušená chemická látka po umístění larev vmíchá do vody. Posuzuje se počet vylíhnutí, čas do vylíhnutí a poměr pohlaví plně vylíhlých, živých pakomárů. Vylíhlí dospělci se přemístí do chovných klecí, aby se usnadnilo rojení, páření a kladení vajíček. Posuzuje se počet nakladených šňůr vajíček a jejich fertilita. Z těchto šňůr vajíček se získají larvy prvního instaru druhé generace. Tyto larvy se vloží do čerstvě připravených zkušebních kádinek (postup expozice je stejný jako pro první generaci), aby bylo možné určit životaschopnost druhé generace pakomárů posouzením jejich vylíhnutí, času do vylíhnutí a poměru pohlaví plně vylíhlých, živých pakomárů (schematický přehled zkoušky toxicity během životního cyklu je uveden v dodatku 5). Všechny údaje se analyzují buď pomocí regresního modelu s cílem odhadnout koncentraci, která by způsobila x % snížení příslušných ukazatelů, nebo s využitím testování hypotéz pro stanovení koncentrace bez pozorovatelných účinků (NOEC). Posledně uvedená metoda vyžaduje srovnání odezvy exponovaných skupin s odpovídajícími odezvami kontrolních skupin pomocí statistických testů. Je třeba poznamenat, že při scénáři s obohacenou vodou by v případě rychle se rozkládajících chemických látek bylo možné pozdnější životní stadia každé generace (např. stadium kukly) vystavit výrazně nižší menší úrovni koncentrace ve vodě nad sedimentem, než tomu bylo v případě larev v prvním instaru. Pokud je to problém a je nutná srovnatelná úroveň expozice pro všechna životní stadia, je možné zvážit tyto změny ve zkušební metodě:
|
—
|
souběžná provedení s obohacením v různých životních fázích nebo
|
|
—
|
opakované obohacení zkušebního systému (nebo obnovení vody nad sedimentem) během obou fází zkoušky (první a druhá generace), přičemž intervaly obohacení (obnovení) by měly být upraveny podle charakteristik rozpadu zkoušené chemické látky.
|
Takové změny jsou proveditelné pouze při scénáři s obohacenou vodou, nikoli však při scénáři s obohaceným sedimentem.
|
INFORMACE O ZKOUŠENÉ CHEMICKÉ LÁTCE
|
8.
|
Měla by být známa rozpustnost zkoušené chemické látky ve vodě, její tlak par a log Kow, naměřená nebo vypočtená distribuce v sedimentu a stabilita ve vodě a v sedimentu. Měla by být k dispozici spolehlivá analytická metoda pro stanovení množství zkoušené chemické látky ve vodě nad sedimentem, kapilární vodě a v sedimentu, a to se známou a doloženou přesností a mezí stanovitelnosti. K užitečným informacím patří strukturní vzorec a čistota zkoušené chemické látky. Užitečný je rovněž chemický osud zkoušené chemické látky (např. zánik, abiotický a biotický rozklad atd.). Další pokyny pro zkoušení látek s fyzikálně-chemickými vlastnostmi, které činí jejich zkoušení obtížným, jsou uvedeny v seznamu literatury (16).
|
REFERENČNÍ CHEMICKÉ LÁTKY
|
9.
|
Referenční chemické látky mohou být pravidelně testovány pro ověření toho, že citlivost laboratorní populace se nezměnila. Stejně jako u dafnií je dostačující provést 48hodinovou zkoušku akutní toxicity (podle (17). Dokud však není k dispozici platná metoda OECD pro zkoušky akutní toxicity, lze zvážit provedení zkoušky chronické toxicity podle kapitoly C.28 této přílohy. Příkladem referenčních toxických látek úspěšně použitých v mezilaboratorních zkouškách a validačních studiích jsou: lindan, trifluralin, pentachlorfenol, chlorid kademnatý a chlorid draselný (1)(3)(6)(7)(18).
|
VALIDITA ZKOUŠKY
|
10.
|
Aby byla zkouška platná, musí být splněny tyto podmínky:
|
—
|
střední hodnota vylíhnutí v kontrolní zkoušce by pro obě generace na konci zkušebního období měla být alespoň 70 % (1)(7),
|
|
—
|
pro C. riparius a C. yoshimatsui by k líhnutí 85 % celkového počtu vylíhlých dospělých jedinců z kontrolní zkoušky v obou generacích mělo dojít mezi 12. a 23. dnem po zavedení larev prvního instaru do nádob; pro C. dilutus je přijatelná doba 20–65 dnů,
|
|
—
|
střední hodnota poměru pohlaví plně vylíhlých, živých dospělců (vyjádřená podílem samiček/samečků) v kontrolní zkoušce v obou generacích by měla být nejméně 0,4, ale ne větší než 0,6,
|
|
—
|
v kontrolách první generace by počet šňůr vajíček v každé chovné kleci měl být nejméně 0,6 na jednu samičku nasazenou do chovné klece,
|
|
—
|
podíl plodných šňůr vajíček v každé chovné kleci s kontrolou první generace by měl být nejméně 0,6,
|
|
—
|
na konci období expozice obou generací se v každé nádobě změří pH a koncentrace rozpuštěného kyslíku. Koncentrace rozpuštěného kyslíku by měla činit alespoň 60 % hodnoty nasycení vzduchem (ASV (24)) a pH vody nad sedimentem by se ve všech zkušebních nádobách mělo pohybovat mezi 6 a 9,
|
|
—
|
teplota vody by se neměla lišit o více než ± 1,0 °C.
|
|
POPIS METODY
Zkušební nádoby a chovné klece
|
11.
|
Larvy jsou vystaveny expozici ve skleněných 600ml kádinkách o průměru přibližně 8,5 cm (viz dodatek 5). Vhodné jsou i jiné nádoby, ale měly by zaručovat odpovídající výšku vody nad sedimentem a hloubku sedimentu. Plocha sedimentu by měla být dostatečná, aby poskytovala 2 až 3 cm2 na larvu. Poměr hloubky sedimentu k výšce vody nad sedimentem by měl být přibližně 1:4. Měly by být použity chovné klece (minimálně 30 cm ve všech třech rozměrech) s gázou (velikost ok přibližně 1 mm) pokrývající vrchní část klece a nejméně jednu stěnu klece (viz dodatek 5). Do každé klece se umístí dvoulitrová krystalizační miska obsahující zkušební vodu a sediment na kladení vajíček. Také v krystalizační misce by poměr hloubky sedimentu k výšce vody nad sedimentem měl být přibližně 1:4. Poté, co jsou z krystalizační misky odebrány šňůry vajíček, umístí se na mikrotitrační destičky s 12 jamkami (na jednu šňůru v každé jamce připadá nejméně 2,5 ml obohacené vody z krystalizační misky) a poté se destičky uzavřou víčkem, aby se zabránilo významnému odpařování. Je možné použít i jiné nádoby vhodné pro uchovávání šňůr vajíček. S výjimkou mikrotitračních destiček by všechny zkušební nádoby a další aparatura, která přichází do styku se zkušebním systémem, měly být celé zhotoveny ze skla nebo z jiného chemicky inertního materiálu (např. z teflonu).
|
Výběr druhů
|
12.
|
Při zkoušce má být přednostně užito druhu Chironomus riparius. Lze užít rovněž druh C. yoshimatsui. Vhodný je i druh C. dilutus, avšak hůře se s ním manipuluje a vyžaduje i delší trvání zkoušky. Podrobnosti o kultivačních metodách pro druh C. riparius jsou uvedeny v dodatku 2. Informace o kultivačních podmínkách jsou k dispozici také pro druhy C. dilutus (5) a C. yoshimatsui (14). Identifikace druhu by měla být před zkouškou potvrzena, ale není vyžadována před každou zkouškou, pokud organismy pocházejí z domácí kultury.
|
Sediment
|
13.
|
Doporučuje se přednostně užívat připravený sediment (nazývaný rovněž rekonstituovaný, umělý nebo syntetický sediment). Pokud se však použije přírodní sediment, je potřeba ho charakterizovat (alespoň pH a obsah organického uhlíku a doporučuje se i stanovení dalších parametrů, jako je poměr C/N a zrnitost) a měl by být prost veškerého znečištění a dalších organismů, které mohou larvám pakomárů konkurovat nebo je konzumovat. Doporučuje se také sedimenty před zkouškou po dobu sedmi dnů kondicionovat za zkušebních podmínek. Doporučuje se následující připravený sediment (1)(20)(21), popsaný v seznamu literatury (1):
|
a.
|
4–5 % (sušiny) rašeliny s pH co nejblíže 5,5 až 6,0; je důležité, aby byla ve formě prášku, jemně namletá (velikost částic ≤ 1 mm) a sušená výhradně na vzduchu;
|
|
b.
|
20 % (sušiny) kaolinitického jílu (pokud možno s více než 30 % kaolinitu);
|
|
c.
|
75–76 % (sušiny) křemenného písku (měl by převažovat jemný písek s více než 50 % částic velikosti 50 až 200 μm);
|
|
d.
|
přidá se deionizovaná voda s cílem dosáhnout 30–50 % vlhkosti v konečné směsi;
|
|
e.
|
přidá se chemicky čistý uhličitan vápenatý (CaCO3) pro úpravu pH konečné směsi sedimentu na pH 7,0 ± 0,5;
|
|
f.
|
obsah organického uhlíku v konečné směsi by měl být 2 % (± 0,5 %) a je třeba jej upravit použitím vhodného množství rašeliny a písku v souladu s písm. a) a c).
|
|
|
14.
|
Rašelina, kaolinitický jíl a písek by měly pocházet ze známého zdroje. Jednotlivé složky sedimentu by měly být kontrolovány z hlediska nepřítomnosti chemické kontaminace (např. těžké kovy, chlorované organické sloučeniny, organofosforové sloučeniny). Příklad přípravy umělého sedimentu je popsán v dodatku 3. Přijatelné je i míchání suchých složek, pokud se prokáže, že po přidání vody nad sedimentem nedochází k separaci složek sedimentu (např. vyplavování částic rašeliny) a že rašelina nebo sediment jsou dostatečně kondicionovány.
|
Voda
|
15.
|
Pro tuto zkoušku je vhodná jakákoli voda, která vyhovuje chemickým charakteristikám přípustné ředicí vody uvedeným v dodatcích 2 a 4. Jakákoli vhodná voda, přírodní voda (povrchová nebo podzemní), rekonstituovaná voda (viz dodatek 2) nebo odchlorovaná vodovodní voda je přijatelná jako kultivační a zkušební voda, pokud v ní pakomáři přežijí po dobu kultivace a zkoušení bez známek stresu. Na začátku zkoušky by se hodnota pH zkušební vody měla pohybovat mezi 6 a 9 a její celková tvrdost by neměla být vyšší než 400 mg/l CaCO3. V případě, že je podezření na interakci mezi ionty způsobujícími tvrdost vody a zkoušenou chemickou látkou, měla by být použita voda nižší tvrdosti (proto není vhodné v této situaci používat Elendtovo médium M4). V průběhu celé studie by měl být užíván stejný typ vody. Charakteristiky jakosti vody uvedené v dodatku 4 by měly být měřeny nejméně dvakrát ročně, nebo pokud existuje podezření, že mohlo dojít k podstatné změně těchto vlastností.
|
Zásobní roztoky – obohacená voda
|
16. a.
|
Zkušební koncentrace se vypočtou na základě koncentrací ve vodním sloupci, tj. vodě nad sedimentem. Zkušební roztoky zvolené koncentrace jsou obvykle připravovány ředěním zásobního roztoku. Zásobní roztoky by měly být připraveny rozpuštěním zkoušené chemické látky v ředicí vodě. V některých případech může být pro vytvoření zásobního roztoku o vhodné koncentraci nezbytné použití rozpouštědel nebo dispergátorů. Mezi vhodná rozpouštědla patří aceton, ethylenglykol-monoethylether, ethylenglykol-dimethylether, dimethylformamid a triethylenglykol. Jako dispergátor mohou být použity Cremophor RH40, Tween 80, 0,01 % methylcelulosa a HCO-40. Koncentrace solubilizačního činidla v konečném zkušebním médiu by měla být minimální (tj. ≤ 0,1 ml/l) a měla by být u všech expozic stejná. Použije-li se solubilizační činidlo, nemělo by mít významné účinky na přežití, což musí být prokázáno na kontrolní skupině vystavené rozpouštědlu ve srovnání s negativní kontrolní skupinou (vystavenou pouze vodě). Měla by však být vynaložena maximální snaha takové chemické látky nepoužívat.
|
Zásobní roztoky – obohacené sedimenty
|
16. b.
|
Obohacené sedimenty zvolené koncentrace se obvykle připraví přidáním roztoku zkoušené chemické látky přímo do sedimentu. Zásobní roztok zkoušené chemické látky rozpuštěné v deionizované vodě se smísí s připraveným sedimentem pomocí krouživé míchačky, míchačky krmiv nebo ručním smícháním. Je-li zkoušená chemická látka špatně rozpustná ve vodě, může být rozpuštěna v co nejmenším objemu vhodného organického rozpouštědla (např. hexanu, acetonu nebo chloroformu). Tento roztok se pak smísí s 10 g jemného křemičitého písku na jednu zkušební nádobu. Rozpouštědlo se nechá odpařit a mělo by být z písku zcela odstraněno; písek se pak smísí s vhodným množstvím sedimentu. K rozpuštění, dispergaci nebo emulgaci zkoušené chemické látky mohou být použita pouze činidla, která snadno vytěkají. Je třeba mít na paměti, že při přípravě sedimentu musí být brán v potaz písek ze zkoušené chemické látky a směsi písku (tzn. při přípravě sedimentu by se mělo použít menší množství písku). Je třeba dbát na to, aby zkoušená chemická látka přidaná do sedimentu byla v sedimentu důkladně a rovnoměrně rozložena. Pokud je to nutné, lze za účelem stanovení stupně homogenity analyzovat dílčí vzorky.
|
USPOŘÁDÁNÍ ZKOUŠKY
|
17.
|
Uspořádáním zkoušky se rozumí výběr počtu zkušebních koncentrací a jejich odstupňování, počet zkušebních nádob pro každou koncentraci, počet larev v nádobě, počet krystalizačních misek a chovných klecí. Uspořádání pro ECx, NOEC a limitní zkoušku jsou popsána níže.
|
Uspořádání pro regresní analýzu
|
18.
|
Zkouška by měla pokrývat účinnou koncentraci (ECx,) a rozsah koncentrací, při nichž dochází k účinku zkoušené chemické látky, který je předmětem zájmu, tak aby konečný ukazatel nebyl extrapolován mimo hranice získaných údajů. Je třeba se vyhnout extrapolaci hluboko pod nejnižší koncentrací nebo přesahující nejvyšší koncentraci. Pro výběr vhodného rozsahu zkušebních koncentrací může být užitečná předběžná zkouška ke stanovení rozsahu koncentrací podle zkušební metody C.27 nebo C.28.
|
|
19.
|
Pro stanovení ECx je požadováno nejméně pět koncentrací a osm opakování pro každou koncentraci. Pro každou koncentraci by měly být použity dvě chovné klece (A a B). Osm opakování se rozdělí do dvou skupin po čtyřech opakováních pro každou chovnou klec. Toto sloučení opakování je nezbytné vzhledem k počtu pakomárů, který je v kleci potřebný pro řádné posouzení reprodukce. Druhá generace však má opět osm opakování, jež pocházejí z exponovaných populací v chovných klecích. Faktor mezi koncentracemi nesmí být větší než 2 (výjimku lze učinit v případech, kdy má křivka závislosti odezvy na dávce malý sklon). Počet opakování při každé expozici lze snížit na šest (po třech pro každou chovnou klec), pokud se zvýší počet zkušebních koncentrací s různými odezvami. Zvýšení počtu opakování nebo zúžení rozsahu zkušebních koncentrací obvykle vede k zúžení intervalu spolehlivosti hodnoty ECx.
|
Uspořádání odhadu NOEC
|
20.
|
Pro stanovení NOEC se použije pět zkušebních koncentrací s nejméně osmi opakováními (po čtyřech pro každou chovnou klec, A a B) a faktor mezi koncentracemi by neměl být vyšší než 2. Počet opakování by měl být dostatečný, aby zajistil odpovídající statistickou významnost, s jakou má být rozeznán 20 % rozdíl oproti kontrolnímu vzorku na 5 % hladině významnosti (α = 0,05). Pro rychlost vývoje, reprodukční schopnost a fertilitu je zpravidla vhodné použít analýzu rozptylu (ANOVA) s následným Dunnettovým nebo Williamsovým testem (22)(23)(24)(25). Pro procento vylíhlých jedinců a poměr jejich pohlaví může být vhodný Cochranův-Armitageův test, Fisherův exaktní test (s Bonferroniho korekcí) nebo Mantelův-Haenszelův test.
|
Limitní zkouška
|
21.
|
Může být provedena limitní zkouška (jedna zkušební koncentrace a kontrola (kontroly)), pokud nebyly zjištěny žádné účinky až po maximální koncentraci při volitelné předběžné zkoušce ke stanovení rozsahu koncentrací. Účelem limitní zkoušky je určit, že jakékoli toxické účinky zkoušené chemické látky se vyskytují při úrovních vyšších než zkoušený koncentrační limit. Pro zkoušku s vodou se doporučuje 100 mg/l a pro zkoušku se sedimentem 1 000 mg/kg (sušiny). Obvykle je pro expozici i kontrolu zapotřebí alespoň osmi opakování. Počet opakování by měl být dostatečný, aby zajistil odpovídající statistickou významnost, s jakou má být rozeznán 20 % rozdíl oproti kontrolnímu vzorku na 5 % hladině významnosti (α = 0,05). V případě spojité proměnné (např. rychlost vývoje) je t-test vhodnou statistickou metodou, pokud údaje splňují požadavky tohoto testu (normalita rozdělení, homogenní rozptyly). Pokud tyto požadavky splněny nejsou, lze použít t-test nestejných rozptylů nebo neparametrický test, jako je například Wilcoxonův-Mannův-Whitneyův test. Pro procento vylíhlých jedinců je vhodný Fisherův exaktní test.
|
POSTUP
Podmínky expozice
Příprava systému voda-sediment (obohacení vody)
|
22. a.
|
Do každé zkušební nádoby a krystalizační misky se přidá připravený sediment (viz odstavce 13–14 a dodatek 3) tak, aby tvořil vrstvu o hloubce nejméně 1,5 cm (v krystalizační misce může být poněkud nižší), avšak nejvýše 3 cm. Přidá se voda (viz odstavec 15) tak, aby poměr hloubky vrstvy sedimentu a výšky vody nepřekročil 1:4. Po přípravě zkušebních nádob se systém sediment-voda před přidáním larev zkušebních organismů v prvním instaru první nebo druhé generace po dobu sedmi dnů mírně provzdušňuje (viz odstavec 14 a dodatek 3). Systém sediment-voda v krystalizačních miskách se během zkoušky neprovzdušňuje, neboť nemusí podporovat přežití larev (šňůry vajíček se odeberou již před vylíhnutím). Aby se zabránilo oddělení složek sedimentu a resuspenzi jemného materiálu v průběhu přidávání zkušební vody ve vodním sloupci, lze sediment přikrýt plastovým diskem, na který se voda nalije. Bezprostředně poté se disk vyjme. Mohou být vhodná i jiná zařízení.
|
Příprava systému voda-sediment (obohacený sediment)
|
22. b.
|
Obohacené sedimenty připravené podle odstavce 16.b se umístí do nádob a krystalizační misky a přidá se voda nad sediment tak, aby vznikl objemový poměr sedimentu a vody 1:4. Hloubka vrstvy sedimentu by se měla pohybovat v rozmezí od 1,5 do 3 cm (v krystalizační misce může být poněkud nižší). Aby se zabránilo oddělení složek sedimentu a resuspenzi jemného materiálu v průběhu přidávání zkušební vody ve vodním sloupci, lze sediment přikrýt plastovým diskem, na který se voda nalije, a disk se bezprostředně poté vyjme. Mohou být vhodná i jiná zařízení. Jakmile je obohacený sediment s vodou nad sedimentem připraven, je žádoucí umožnit průnik zkoušené chemické látky ze sedimentu do vodné fáze (4)(5)(7)(18). To by se mělo provádět pokud možno za stejných podmínek z hlediska teploty a provzdušňování, jaké mají být použity při zkoušce. Vhodná doba k dosažení rovnováhy je specifická pro konkrétní sediment a chemickou látku a může se pohybovat v řádu hodin až dní, zřídka až pět týdnů. Vzhledem k tomu, že taková doba by umožnila rozklad mnoha chemických látek, nečeká se na dosažení rovnováhy, ale doporučuje se vyrovnávací doba v trvání 48 hodin. Je-li však známo, že daná chemická látka má dlouhý poločas rozkladu v sedimentu (viz odstavec 8), lze dobu pro ustavení rovnováhy prodloužit. Na konci této prodloužené doby pro ustavení rovnováhy by se měla změřit koncentrace zkoušené chemické látky ve vodě nad sedimentem, v kapilární vodě a v sedimentu, a to alespoň při nejvyšší koncentraci a při jedné nižší koncentraci (viz odstavec 38). Tato analytická stanovení zkoušené chemické látky umožňují vypočítat hmotnostní bilanci a vyjádřit výsledky na základě naměřených koncentrací.
|
|
23.
|
Zkušební nádoby se přikryjí (například skleněnými destičkami). Pokud je to nutné, v průběhu studie se hladina vody doplňuje na původní objem s cílem kompenzovat odpařování vody. K tomuto účelu by měla být použita destilovaná nebo deionizovaná voda, aby se zabránilo hromadění solí. Krystalizační misky v chovných klecích se nezakrývají a mohou, ale nemusí být doplňovány, aby se nahradila ztráta vody během zkušební doby, neboť šňůry vajíček jsou ve styku s vodou pouze přibližně jeden den a misky se používají pouze během krátké fáze zkoušky.
|
Přidání zkušebních organismů
|
24.
|
Čtyři až pět dnů před přidáním larev v prvním instaru první generace by měly být z kultury odebrány shluky vajíček a měly by být umístěny do malých nádob do kultivačního média. Lze použít starší médium ze zásobní kultury nebo čerstvě připravené médium. V každém případě by mělo být do kultivačního média přidáno malé množství potravy, např. několik kapek filtrátu z jemně mleté suspenze vločkového krmiva pro ryby (viz dodatek 2). Měly by se použít pouze čerstvě nakladené shluky vajíček. Za běžných okolností se larvy začínají líhnout několik dní po nakladení vajíček (2 až 3 dny u C. riparius při 20 °C a 1 až 4 dny u C. dilutus při 23 °C a C. yoshimatsui při 25 °C) a během larválního vývoje se vystřídají čtyři instary, z nichž každý trvá 4–8 dnů. Při zkoušce se použijí larvy prvního instaru (nejvýše 48 h po vylíhnutí). Stadium instaru pakomárů lze případně zkontrolovat pomocí šířky hlavové kapsuly (7).
|
|
25.
|
Dvacet larev v prvním instaru první generace se pomocí pipety bez špičky náhodně rozdělí do jednotlivých zkušebních nádob obsahujících systém sediment-voda. Provzdušňování vody se při přidávání larev do zkušebních nádob ukončí a znovu by se mělo zahájit nejdříve po uplynutí 24 hodin od přidání larev (viz odstavec 32). Podle zvoleného uspořádání zkoušky (viz odstavce 19 a 20) je počet larev užitý na jednu koncentraci minimálně 120 pro stanovení ECx (6 opakování pro každou koncentraci) a 160 pro stanovení NOEC (8 opakování pro každou koncentraci). V uspořádání s obohaceným sedimentem expozice začíná přidáním larev.
|
Obohacení vody nad sedimentem
|
26.
|
Po 24 hodinách od přidání larev v prvním instaru první generace se zkoušená chemická látka vmísí do sloupce vody nad sedimentem a znovu se zavede mírné provzdušňování (ohledně možných změn v uspořádání zkoušky viz odstavec 7). Pod hladinou vody se pomocí pipety aplikují malé objemy roztoků zkoušené chemické látky. Voda nad sedimentem se poté opatrně promíchá, aby se sediment nerozrušil. Při uspořádání s obohacenou vodou expozice začíná obohacením vody (tj. jeden den po přidání larev).
|
Sběr vylíhlých dospělců
|
27.
|
Vylíhlí pakomáři první generace se nejméně jednou, lépe však dvakrát denně (viz odstavec 36) odebírají ze zkušebních nádob pomocí odsavače, exhaustoru nebo obdobného zařízení (viz dodatek 5). Zvláště je třeba dbát na to, aby se dospělci nepoškodili. Odebraní pakomáři ze čtyř zkušebních nádob v rámci jedné expozice se vypustí do chovné klece, ke které byli předtím přiděleni. V den prvního vylíhnutí (samečka) se do krystalizačních misek pod hladinu vody pipetou přidá malé množství zkoušené chemické látky (uspořádání s obohacenou vodou). Voda nad sedimentem se poté opatrně promíchá, aby se sediment nerozrušil. Koncentrace zkoušené chemické látky v krystalizační misce je stejná jako v expozičních nádobách, které jsou přiděleny k dané konkrétní chovné kleci. Při uspořádání s obohaceným sedimentem se krystalizační misky připraví přibližně v den 11 po zahájení expozice (tj. po zavedení larev první generace) tak, aby mohly být během asi 48 hodin před vložením prvních šňůr vajíček uvedeny do rovnováhy.
|
|
28.
|
Šňůry vajíček se odeberou z krystalizační misky v chovné kleci pomocí pinzety nebo pipety bez špičky. Každá šňůra vajíček se z krystalizační misky, z níž byla odebrána, přemístí do nádoby s kultivačním médiem (např. do jamky mikrotitrační destičky s 12 jamkami spolu s nejméně 2,5 ml média). Nádoby se šňůrami vajíček se přikryjí víčky, aby se zabránilo významnému odpařování. Šňůry vajíček se po dobu nejméně šesti dnů od jejich nakladení ponechají za účelem pozorování, aby mohly být vyhodnoceny jako plodné nebo neplodné.
Pro zahájení zkoušky s druhou generací se z každé chovné klece vyberou nejméně tři, lépe však šest plodných šňůr vajíček a spolu s určitým množstvím potravy se nechají vylíhnout. Tyto šňůry s vajíčky by měly být nakladeny ve vrcholné části kladení vajíček, k čemuž obvykle dochází kolem zkušebního dne 19 v kontrolních skupinách. V ideálním případě začne zkouška s druhou generací ve všech expozicích ve stejný den, ale v důsledku účinků té či oné chemické látky na vývoj larev to nemusí být vždy možné. V takovém případě může k vývoji při vyšších koncentracích dojít později než k nižším expozicím a kontrolám (s rozpouštědlem).
|
|
29.a.
|
Při uspořádání s obohacenou vodou se systém sediment-voda pro druhou generaci připraví tak, že se zkoušená chemická látka přimísí do vodního sloupce nad sedimentem přibližně 1 hodinu před vložením larev prvního instaru do zkušebních nádob. Pod hladinou vody se pomocí pipety aplikují malé objemy roztoku zkoušené chemické látky. Voda nad sedimentem se poté opatrně promíchá, aby se sediment nerozrušil. Po obohacení se provede mírné provzdušnění.
|
|
29.b.
|
Při uspořádání s obohaceným sedimentem se expoziční nádoby obsahující systém sediment-voda pro druhou generaci připraví stejným způsobem jako pro první generaci.
|
|
30.
|
20 larev v prvním instaru (nejvýše 48 h po vylíhnutí) druhé generace se pomocí pipety bez špičky náhodně rozdělí do jednotlivých zkušebních nádob obsahujících systém obohacený sediment-voda. Provzdušňování vody by mělo být při přidání larev prvního instaru do zkušebních nádob ukončeno a mělo by být znovu zahájeno nejdříve po uplynutí dalších 24 hodin od přidání larev. Podle zvoleného uspořádání zkoušky (viz odstavce 19 a 20) je počet larev použitý na jednu koncentraci minimálně 120 pro stanovení ECx (6 opakování pro každou koncentraci) a 160 pro stanovení NOEC (8 opakování pro každou koncentraci).
|
Potrava
|
31.
|
Larvy ve zkušebních nádobách je třeba krmit optimálně denně nebo nejméně třikrát týdně. Jako dostatečná dávka pro mladé larvy po dobu prvních 10 dnů jejich vývoje se jeví krmivo pro ryby (suspenze ve vodě nebo jemně rozmělněné krmivo, např. Tetra-Min nebo Tetra-Phyll, viz podrobnosti v dodatku 2) v množství 0,25 až 0,5 mg (0,35 až 0,5 mg pro C. yoshimatsui) na larvu za den. Starší larvy mohou potřebovat o něco větší množství potravy: po zbývající dobu zkoušky by mělo dostačovat 0,5–1,0 mg na larvu denně. Pokud v kontrolních skupinách dojde k růstu plísní nebo je u nich zjištěna mortalita, je nutné přísun potravy u všech expozic snížit a kontrolovat. Pokud není možné růst plísní zastavit, je třeba zkoušku opakovat.
Toxikologický význam expozice požitím je obecně vyšší v případě chemických látek s vysokou afinitou k organickému uhlíku nebo chemických látek s kovalentní vazbou na sediment. Při zkoušení látek s takovýmito vlastnostmi proto lze v závislosti na požadavcích regulačních orgánů dávku potravy nezbytnou pro zajištění přežití a přirozeného růstu larev přidat do připraveného sedimentu před fází stabilizace. Aby se zabránilo zhoršení kvality vody, je nutno místo krmiva pro ryby použít rostlinný materiál, například přídavek 0,5 % (sušiny) jemně mletých listů kopřivy dvoudomé (Urtica dioica), morušovníku bílého (Morus alba), jetele plazivého (Trifolium repens), špenátu setého (Spinacia oleracea) nebo jiného rostlinného materiálu (Cerophylu nebo alfa-celulózy). Přidání celé dávky zdroje organické potravy do sedimentu před obohacením není s ohledem na kvalitu vody a biologickou účinnost běžnou praxí (21) a nejedná se ani o standardizovanou metodu, avšak z nedávných studií vyplývá, že tato metoda funguje (19)(26). Dospělí pakomáři v chovné kleci obvykle krmení nepotřebují, avšak reprodukční schopnost a fertilita se posílí, pokud se vylíhlým dospělcům jako zdroj potravy nabídne vata namočená do nasyceného roztoku sacharózy (34).
|
Inkubační podmínky
|
32.
|
Voda nad sedimentem ve zkušebních nádobách se 24 hodin po přidání larev prvního instaru obou generací mírně provzdušňuje a v provzdušňování se pokračuje po celou dobu zkoušky (je třeba dbát na to, aby koncentrace rozpuštěného kyslíku neklesla pod 60 procent ASV). Provzdušňování se provádí pomocí skleněné Pasteurovy pipety, jejíž výstupní otvor je upevněn 2–3 cm nad vrstvou sedimentu a která dávkuje několik bublin/s. Při zkoušení těkavých chemických látek by se mělo zvážit neprovzdušňování systému sediment-voda, přičemž je však třeba splnit kritérium nejméně 60 % ASV (odstavec 10). Další pokyny jsou uvedeny v (16).
|
|
33.
|
Zkouška s C. riparius se provádí při konstantní teplotě 20 °C (± 2 °C). Doporučená teplota pro C. dilutus je 23 °C a pro C. yoshimatui 25 °C (± 2 °C). Fotoperioda je 16 hodin a intenzita osvětlení by měla být 500 až 1 000 luxů. Pro chovné klece je možné zařadit jednohodinovou fázi úsvitu a šera.
|
Trvání expozice
|
34.
|
Uspořádání s obohacenou vodou: Doba expozice první generace začíná v okamžiku vmísení zkoušené chemické látky do vody nad sedimentem ve zkušebních nádobách (tj. jeden den po vložení larev – pro možné změny v uspořádání expozice viz odstavec 7). Expozice druhé generace larev začíná okamžitě, neboť se vkládají do systému sediment-voda, který již byl obohacen. Maximální délka trvání expozice pro C. riparius a C. yoshimatsui je u první generace 27 dnů a u druhé generace 28 dnů (tj. larvy první generace stráví v nádobách jeden den bez expozice). Vzhledem k překrývání činí celková délka trvání zkoušky přibližně 44 dnů. Pro C. dilutus je maximální délka trvání expozice u první generace 64 dnů a u druhé generace 65 dnů. Celková délka trvání je přibližně 100 dnů.
Uspořádání s obohaceným sedimentem: expozice začíná přidáním larev a trvá maximálně 28 dnů pro obě generace C. riparius a C. yoshimatsui a maximálně 65 dnů pro obě generace C. dilutus.
|
Poznámky
Líhnutí
|
35.
|
Určí se čas potřebný pro vývoj a celkový počet plně vylíhlých, živých samečků a samiček pakomárů pro obě generace. Samečky lze snadno rozlišit podle vějířovitých tykadel a štíhlého trupu.
|
|
36.
|
Zkušební nádoby pro obě generace se kontrolují alespoň třikrát týdně s cílem vizuálně posoudit jakékoli neobvyklé chování larev (např. opouštění sedimentu, neobvyklé plavání) ve srovnání s kontrolními nádobami. Během období líhnutí, které začíná asi 12 dnů po vložení larev u C. riparius a C. yoshimatsui (a po 20 dnech u C. dilutus), se vylíhlí pakomáři počítají a rozlišují podle pohlaví alespoň jednou, lépe však dvakrát denně (brzy ráno a pozdě odpoledne). Po identifikaci se pakomáři první generace z nádob opatrně odstraní a přemístí do chovné klece. Pakomáři druhé generace se po identifikaci odstraní a usmrtí. Veškeré šňůry vajíček vložené do zkušebních nádob první generace by měly být jednotlivě odebrány a přeneseny s alespoň 2,5 ml původní vody na mikrotitrační destičky s 12 jamkami (nebo do jiných vhodných nádob), které se přikryjí víčkem s cílem zamezit významnému odpařování. Je třeba rovněž zaznamenat počet mrtvých larev a viditelných kukel, které se dosud nevylíhly. Příklady chovné klece, zkušební nádoby a exhaustoru jsou uvedeny v dodatku 5.
|
Reprodukce
|
37.
|
Účinky na reprodukci se posoudí podle počtu šňůr vajíček nakladených první generací pakomárů a podle fertility těchto šňůr vajíček. Jednou denně se šňůry vajíček odeberou z krystalizační misky, která je umístěna v každé chovné kleci. Šňůry vajíček by se měly odebrat a přenést s alespoň 2,5 ml původní vody na mikrotitrační destičku s 12 jamkami (po jedné šňůře vajíček do každé jamky) nebo do jiné vhodné nádoby, která se přikryje víčkem s cílem zamezit silnému odpařování. U každé šňůry vajíček se zdokumentují tyto charakteristiky: den nakladení, velikost (normální, tj. 1,0 ± 0,3 cm, nebo malá, obvykle ≤ 0,5 cm), struktura (normální = ve tvaru banánku se spirálovitě zatočenou nití vajíček, nebo nenormální, např. s nití vajíček, která není spirálovitě zatočená) a fertilita (plodná nebo neplodná). Po uplynutí 6 dní od nakladení šňůry vajíček se posoudí její fertilita. Šňůra vajíček se považuje za plodnou, pokud se vylíhne alespoň jedna třetina vajíček. Celkový počet samiček přidaných do chovné klece se použije k výpočtu počtu šňůr vajíček na jednu samičku a počtu plodných šňůr vajíček na jednu samičku. Je-li to nutné, lze počet vajíček ve šňůře vajíček odhadnout, aniž by došlo k jejich poškození, metodou počtu prstenců (ta je podrobně popsána v (32)(33)).
|
Analytická měření
Koncentrace zkoušené chemické látky
|
38.
|
Je třeba analyzovat alespoň vzorky vody nad sedimentem, kapilární vody a sedimentu na počátku expozice (v případě obohacení vody nejlépe hodinu po aplikaci zkoušené chemické látky) a na konci zkoušky při nejvyšší koncentraci a jedné nižší koncentraci. To platí o nádobách pro obě generace. Z krystalizačních misek v chovné kleci se analyzuje pouze voda nad sedimentem, protože právě s ní přišly šňůry vajíček do styku (při uspořádání s obohaceným sedimentem lze zvážit analytické potvrzení koncentrace v sedimentu). Další měření sedimentu, kapilární vody nebo vody nad sedimentem lze provádět během zkoušky, je-li to považováno za nezbytné. Tato stanovení koncentrace zkoušené chemické látky poskytují informace o chování/distribuci zkoušené chemické látky v systému voda-sediment. Odběr vzorků sedimentu a kapilární vody na počátku zkoušky a v jejím průběhu (viz odstavec 39) vyžaduje další zkušební nádoby k provedení analytických určení. Měření v sedimentu při uspořádání s obohacenou vodou nemusí být nutná, pokud distribuce zkoušené chemické látky mezi vodou a sedimentem byla jasně stanovena studií voda/sediment za srovnatelných podmínek (např. poměr sedimentu k vodě, typ aplikace, obsah organického uhlíku v sedimentu), nebo pokud se prokáže, že naměřené koncentrace ve vodě nad sedimentem zůstávají v rozmezí 80 až 120 % nominálních nebo naměřených počátečních koncentrací.
|
|
39.
|
Při provádění průběžných měření (např. v den 7 a/nebo den 14) a v případě, že jsou pro analýzu zapotřebí rozsáhlé vzorky, které nelze ze zkušebních nádob odebrat bez dopadu na zkušební systém, je potřeba provést analytická stanovení na vzorcích z dalších zkušebních nádob, s nimiž bylo zacházeno stejným způsobem (včetně přítomnosti zkušebních organismů), ale nebyly použity pro biologická pozorování.
|
|
40.
|
Doporučeným postupem izolace intersticiální (= kapilární) vody je odstřeďování např. při odstředivé síle 10 000 g a při 4 °C po dobu 30 minut. Pokud však filtry zkoušenou chemickou látku prokazatelně neadsorbují, je přijatelná i filtrace. V některých případech může být nemožné analýzu koncentrací v kapilární vodě provést kvůli tomu, že vzorek je příliš malý.
|
Fyzikálně-chemické parametry
|
41.
|
Hodnotu pH, rozpuštěný kyslík ve zkušební vodě a teplotu vody ve zkušebních nádobách a krystalizačních miskách je nutno měřit vhodným způsobem (viz odstavec 10). Tvrdost a obsah amoniaku by měly být měřeny v kontrolních nádobách a v jedné zkušební nádobě a krystalizační misce při nejvyšší koncentraci na počátku zkoušky a na jejím konci.
|
ÚDAJE A JEJICH PŘEDKLÁDÁNÍ
Zpracování výsledků
|
42.
|
Účelem této zkoušky toxicity během životního cyklu je stanovit účinek zkoušené chemické látky na reprodukci a na rychlost vývoje a celkový počet plně vylíhlých, živých samečků a samiček pakomárů po dobu dvou generací. Pro získání údajů o procentu vylíhlých jedinců by údaje o samečcích a samičkách měly být sloučeny. Pokud neexistují statisticky významné rozdíly v citlivosti z hlediska rychlosti vývoje jednotlivých pohlaví, lze výsledky pro samečky a pro samičky sloučit pro účely statistické analýzy.
|
|
43.
|
Koncentrace s pozorovanými účinky vyjádřené jako koncentrace ve vodě nad sedimentem (v případě obohacené vody) nebo v sedimentu (v případě obohaceného sedimentu) se obvykle vypočítají na základě koncentrací naměřených na počátku expozice (viz odstavec 38). V případě obohacené vody se proto pro každou expozici stanoví průměrná hodnota koncentrací naměřených obvykle na počátku expozice ve vodě nad sedimentem v nádobách pro obě generace a koncentrací naměřených v krystalizačních miskách. V případě obohaceného sedimentu se pro každou expozici stanoví průměrná hodnota koncentrací naměřených obvykle na počátku expozice v nádobách pro obě generace (a volitelně koncentrací naměřených v krystalizačních miskách).
|
|
44.
|
Pro výpočet bodového odhadu, tj. ECx, lze jako skutečné opakování použít statistiku na jednu nádobu a na jednu chovnou klec. Při výpočtu intervalu spolehlivosti pro každou hodnotu ECx je nutno zohlednit variabilitu mezi jednotlivými nádobami, případně prokázat, že tato variabilita je tak nízká, že ji lze ignorovat. Je-li u modelu užita metoda nejmenších čtverců, je nutné u statistik jednotlivých nádob uplatnit transformaci za účelem homogenity rozptylu. Hodnoty ECx je však třeba vypočítat až poté, co byla reakce převedena zpět na původní hodnotu (31).
|
|
45.
|
Pokud je cílem statistické analýzy stanovení hodnoty NOEC testováním hypotéz, je nutné vzít v úvahu variabilitu mezi nádobami, což zaručí užití metod analýzy rozptylu ANOVA (např. postupy Williamsova a Dunnettova testu). Williamsův test je vhodný, když se teoreticky předpokládá monotónní závislost dávka-odezva, a Dunnettův test je vhodný, pokud hypotéza monotónnosti neplatí. Případně mohou být vhodnější robustnější testy (27), jsou-li porušeny předpoklady obvykle užité při analýze ANOVA (31).
|
Procento vylíhlých jedinců
|
46.
|
Procenta vylíhlých jedinců jsou kvantifikovatelné údaje a lze je analyzovat za použití postupně klesajícího Cochranova-Armitageova testu, pokud se předpokládá monotónní závislost dávka-odezva a údaje jsou s tímto očekáváním v souladu. V opačném případě lze použít Fisherův exaktní test nebo Mantelův-Haenszelův test s Bonferroniho-Holmovou korekcí hodnot p. Pokud existují důkazy o větší variabilitě mezi opakováními ve stejné koncentraci, pak by binomické rozdělení (často uváděné jako ‚extra-binomická‘ variabilita) nasvědčovalo tomu, že je nutno použít robustní Cochranův-Armitageův test nebo Fisherův exaktní test, jak je navrhováno v položce seznamu literatury (27).
Určí se součet živých pakomárů (samečků plus samiček) vylíhlých v jedné nádobě, ne
, a ten se vydělí počtem vložených larev, na
:

kde:
|
ER
|
=
|
procento vylíhlých jedinců,
|
|
ne
|
=
|
počet živých pakomárů vylíhlých v nádobě,
|
|
na
|
=
|
počet larev nasazených do nádoby (obvykle 20).
|
Pokud je ne
větší než na
(tj. pokud bylo neúmyslně nasazeno více než předpokládaný počet larev), na
se upraví na hodnotu rovnou ne
.
|
|
47.
|
Nejvhodnějším alternativním přístupem pro rozsáhlé vzorky s extra-binomickou variabilitou je zacházet s procentem vylíhlých jedinců jako s kontinuální proměnnou a použít postupy, které jsou konzistentní s těmito údaji ER. Rozsáhlý vzorek je zde definován jako situace, při níž jak počet vylíhlých jedinců, tak počet nevylíhlých jedinců přesáhnou v jednom opakování (nádobě) hodnotu pět.
|
|
48.
|
Při použití metody ANOVA je nutno hodnoty ER nejprve transformovat druhou odmocninou funkce arcsin nebo transformací podle Tukeyho-Freemana s cílem získat přibližné normální rozdělení údajů a vyrovnat odchylky. Při použití absolutních frekvencí lze použít Cochranův-Armitageův test, Fisherův exaktní test (s Bonferroniho korekcí) nebo Mantelův-Haenszelův test. Transformace funkcí √arcsin se vypočte pomocí převrácené hodnoty sinu (sin– 1) z odmocniny ER.
|
|
49.
|
Pro získání procenta vylíhlých jedinců se hodnoty ECx vypočtou pomocí regresní analýzy (např. pomocí modelu probit, logit nebo Weibullova modelu (28)). V případě selhání regresní analýzy (např. v případě méně než dvou koncentrací s parciálními odezvami) se použijí další neparametrické metody, jako je například klouzavý průměr nebo prostá interpolace.
|
Rychlost vývoje
|
50.
|
Střední doba vývoje představuje střední časové rozpětí mezi nasazením larev (den 0 zkoušky) a vylíhnutím experimentální kohorty pakomárů (pro výpočet skutečné doby vývoje by mělo být zohledněno stáří larev v okamžiku zavedení). Rychlost vývoje (jednotka: 1/den) je převrácenou hodnotou doby vývoje a představuje tu část larválního vývoje, která se odehraje za den. Rychlost vývoje je z hlediska hodnocení těchto studií toxicity sedimentů upřednostňována před dobou vývoje vzhledem ke své nižší variabilitě, vyšší homogenitě a vyšší blízkosti normálnímu rozdělení. Mohou být tudíž použity silnější parametrické zkušební postupy pro rychlost vývoje než pro dobu vývoje. Pro rychlost vývoje jako kontinuální odezvu lze hodnoty ECx stanovit odhadem pomocí regresní analýzy (např. (29)(30)). Hodnotu NOEC pro střední rychlost vývoje lze stanovit metodami analýzy ANOVA, např. Williamsovým nebo Dunnettovým testem. Jelikož se samečci líhnou dříve než samičky, tj. mají vyšší rychlost vývoje, má smysl kromě celkové rychlosti vývoje pakomárů vypočítat i rychlost vývoje pro každé pohlaví zvlášť.
|
|
51.
|
Pro účely statistických testů se má za to, že počet pakomárů pozorovaných v den pozorování x se vylíhl uprostřed časového intervalu mezi dnem x a dnem x – l (l = délka intervalu mezi pozorováními, obvykle 1 den). Střední rychlost vývoje v nádobě (

) se vypočte podle vzorce:

kde:
|

|
:
|
střední rychlost vývoje v nádobě,
|
|
i
|
:
|
index intervalu mezi pozorováními,
|
|
m
|
:
|
počet všech intervalů mezi pozorováními,
|
|
fi
|
:
|
počet vylíhlých jedinců během daného intervalu i mezi pozorováními,
|
|
ne
|
:
|
počet vylíhlých jedinců celkem na konci pokusu (Σfi
)
|
|
xi
|
:
|
rychlost vývoje pakomárů vylíhlých v intervalu i;
|

kde:
|
dayi
|
:
|
den pozorování (ve dnech od zavedení larev),
|
|
li
|
:
|
délka intervalu i mezi pozorováními (ve dnech, obvykle 1 den).
|
|
Poměr pohlaví
|
52.
|
Poměry pohlaví jsou kvantitativní proměnné, a měly by proto být hodnoceny pomocí Fisherova exaktního testu nebo jiných vhodných metod. Poměr pohlaví u C. riparius v přírodě činí jedna, tj. samečci a samičky se vyskytují ve stejných počtech. U obou generací by s údaji o poměru pohlaví mělo být zacházeno stejným způsobem. Jelikož maximální počet pakomárů v nádobě (tj. 20) je příliš nízký pro smysluplnou statistickou analýzu, sloučí se celkový počet plně vylíhlých, živých pakomárů každého pohlaví ze všech nádob při jedné expozici. Tyto netransformované údaje se podrobí testu oproti kontrole (s rozpouštědlem) nebo oproti sloučeným kontrolním údajům v kontingenční tabulce 2 × 2.
|
Reprodukce
|
53.
|
Reprodukce, vyjádřená jako reprodukční schopnost, se vypočítá jako počet šňůr vajíček na jednu samičku. Konkrétněji se celkový počet šňůr vajíček nakladených v chovné kleci vydělí celkovým počtem živých a nepoškozených samiček nasazených do této klece. Hodnotu NOEC pro reprodukční schopnost lze stanovit metodami analýzy ANOVA, např. Williamsovým nebo Dunnettovým testem.
|
|
54.
|
Fertility šňůr vajíček se užívá ke kvantifikaci počtu plodných šňůr vajíček na jednu samičku. Konkrétněji se celkový počet plodných šňůr vajíček nakladených v chovné kleci vydělí celkovým počtem živých a nepoškozených samiček nasazených do této klece. Hodnotu NOEC pro fertilitu lze stanovit metodami analýzy ANOVA, např. Williamsovým nebo Dunnettovým testem.
|
Závěrečná zpráva
|
55.
|
Závěrečná zpráva by měla obsahovat tyto údaje:
|
|
Zkoušená chemická látka:
|
—
|
fyzikální povahu a fyzikálně-chemické vlastnosti (rozpustnost ve vodě, tlak par, log Kow, rozdělovací koeficient v půdě (případně v sedimentu), stabilita ve vodě a v sedimentu atd.),
|
|
—
|
chemické identifikační údaje (obecný název, chemický název, strukturní vzorec, číslo CAS atd.) včetně čistoty a analytické metody pro kvantitativní stanovení zkoušené chemické látky.
|
|
|
|
Testovaný druh:
|
—
|
užité zkušební organismy: druh, vědecký název, zdroj organismů a podmínky množení,
|
|
—
|
informace, jak bylo nakládáno se shluky vajíček a s larvami,
|
|
—
|
informace o nakládání s vylíhlými dospělci první generace pomocí exhaustoru atd. (viz dodatek 5),
|
|
—
|
stáří zkušebních organismů v době nasazení první a druhé generace do zkušebních nádob.
|
|
|
|
Zkušební podmínky:
|
—
|
použitý sediment, tj. přírodní nebo připravený (umělý) sediment,
|
|
—
|
u přírodního sedimentu: lokalita a popis místa odběru sedimentu, pokud možno včetně dřívější kontaminace; charakteristika sedimentu: pH, obsah organického uhlíku, poměr C/N a zrnitost (je-li to vhodné),
|
|
—
|
u připraveného sedimentu: příprava, složky a charakteristiky (obsah organického uhlíku, pH, vlhkost atd., měřeno na začátku zkoušky),
|
|
—
|
příprava zkušební vody (pokud se používá rekonstituovaná voda) a její charakteristiky (koncentrace kyslíku, pH, tvrdost atd. na začátku zkoušky),
|
|
—
|
hloubka sedimentu a výška vody nad sedimentem ve zkušebních nádobách a v krystalizačních miskách,
|
|
—
|
objem vody nad sedimentem a kapilární vody a hmotnost vlhkého sedimentu s kapilární vodou a bez ní ve zkušebních nádobách a v krystalizačních miskách,
|
|
—
|
zkušební nádoby (materiál a rozměry),
|
|
—
|
krystalizační misky (materiál a rozměry),
|
|
—
|
chovné klece (materiál a rozměry),
|
|
—
|
metoda přípravy zásobních roztoků a zkušebních koncentrací ve zkušebních nádobách a v krystalizačních miskách,
|
|
—
|
aplikace zkoušené chemické látky do zkušebních nádob a krystalizačních misek: zkušební koncentrace, počet opakování a rozpouštědla, jsou-li nutná,
|
|
—
|
inkubační podmínky ve zkušebních nádobách: teplota, cyklus a intenzita osvětlení, provzdušňování (bublin za sekundu),
|
|
—
|
inkubační podmínky v chovných klecích a v krystalizačních miskách: teplota, cyklus a intenzita osvětlení,
|
|
—
|
inkubační podmínky pro šňůry vajíček v mikrotitračních destičkách (nebo v jiných nádobách): teplota, cyklus a intenzita osvětlení,
|
|
—
|
podrobné informace o krmení včetně typu krmiva, přípravy, množství a režimu krmení.
|
|
|
|
Výsledky:
|
—
|
nominální zkušební koncentrace, naměřené zkušební koncentrace a výsledky všech analýz pro stanovení koncentrace zkoušené chemické látky ve zkušebních nádobách a v krystalizačních miskách,
|
|
—
|
kvalita vody ve zkušebních nádobách a v krystalizačních miskách, tj. pH, teplota, rozpuštěný kyslík, tvrdost a obsah amoniaku,
|
|
—
|
případné nahrazování odpařené zkušební vody ve zkušebních nádobách,
|
|
—
|
počet vylíhlých samečků a samiček pakomárů v první a druhé generaci na nádobu za den,
|
|
—
|
poměr pohlaví plně vylíhlých, živých pakomárů v první a druhé generaci při každé expozici,
|
|
—
|
počet larev první a druhé generace, z nichž se nevylíhli pakomáři, na nádobu,
|
|
—
|
procento vylíhlých jedinců na opakování a zkušební koncentraci (sloučený počet samečků a samiček pakomárů) v první a druhé generaci,
|
|
—
|
střední rychlost vývoje plně vylíhlých, živých pakomárů na opakování a aplikované množství (zvlášť pro každé pohlaví a také sloučený počet samečků a samiček pakomárů) v první a druhé generaci,
|
|
—
|
počet šňůr vajíček vložených do krystalizačních misek na chovnou klec za den,
|
|
—
|
charakteristika každé šňůry vajíček (velikost, tvar a fertilita);
|
|
—
|
reprodukční schopnost – celkový počet šňůr vajíček na celkový počet samiček nasazených do chovné klece,
|
|
—
|
fertilita – celkový počet plodných šňůr vajíček na celkový počet samiček nasazených do chovné klece,
|
|
—
|
odhady ukazatelů toxicity, např. ECx (a související intervaly spolehlivosti), NOEC a statistické metody použité k jejímu stanovení,
|
|
—
|
diskuse o výsledcích včetně případného ovlivnění výsledku zkoušky v důsledku odchylek od této zkušební metody.
|
|
|
LITERATURA
|
1)
|
Kapitola C.28 této přílohy, Test toxicity na Chironomidae v systému sediment-voda za použití obohacené vody.
|
|
2)
|
Shobanov, N. A., Kiknadze, I. I., and Butler, M. G. (1999) Palearctic and Nearctic Chironomus (Camptochironomus) tentans Fabricius are different species (Diptera: Chironomidae). Entomologica Scandinavica, 30: pp. 311–322.
|
|
3)
|
Fleming, R. et al. (1994) Sediment Toxicity Tests for Poorly Water-Soluble Substances, Final Report to the European Commission, Report No: EC 3738. August 1994. WRc, UK.
|
|
4)
|
SETAC (1993) Guidance Document on Sediment toxicity Tests and Bioassays for Freshwater and Marine Environments, From the WOSTA Workshop held in the Netherlands.
|
|
5)
|
ASTM International (2009) E1706-05E01: Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, In: Annual Book of ASTM Standards, Volume 11.06, Biological Effects and Environmental Fate; Biotechnology. ASTM International, West Conshohocken, PA.
|
|
6)
|
Environment Canada (1997) Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius), Biological Test Method, Report SPE 1/RM/32, December 1997.
|
|
7)
|
US-EPA (2000) Methods for Measuring the Toxicity and Bioaccumulation of Sediment-associated Contaminants with Freshwater Invertebrates, Second edition, EPA 600/R-99/064, March 2000, Revision to the first edition dated June 1994.
|
|
8)
|
US-EPA/OPPTS 850.1735 (1996) Whole Sediment Acute Toxicity Invertebrates.
|
|
9)
|
US-EPA/OPPTS 850.1790 (1996) Chironomid Sediment toxicity Test.
|
|
10)
|
Milani, D., Day, K.E., McLeay, D.J. and R.S. Kirby (1996) Recent intra- and inter-laboratory studies related to the development and standardisation of Environment Canada's biological test methods for measuring sediment toxicity using freshwater amphipods (Hyalella azteca) and midge larvae (Chironomus riparius), Technical Report, Environment Canada, National Water Research Institute, Burlington, Ontario, Canada.
|
|
11)
|
Norberg-King, T. J., Sibley, P. K., Burton, G. A., Ingersoll, C. G., Kemble, N. E., Ireland, S., Mount, D. R. and Rowland, C. D. (2006) Interlaboratory evaluation of Hyalella azteca and Chironomus tentans short-term and long-term sediment toxicity tests, Environ. Toxicol. Chem., 25: pp. 2662–2674.
|
|
12)
|
Taenzler, V., Bruns, E., Dorgerloh, M., Pfeifle, V. and Weltje, L. (2007) Chironomids: suitable test organisms for risk assessment investigations on the potential endocrine-disrupting properties of pesticides, Ecotoxicology, 16: pp. 221–230.
|
|
13)
|
Sugaya, Y. (1997) Intra-specific variations of the susceptibility of insecticides in Chironomus yoshimatsui, Jp. J. Sanit. Zool., 48: pp. 345–350.
|
|
14)
|
Kawai, K. (1986) Fundamental studies on chironomid allergy, I. Culture methods of some Japanese chironomids (Chironomidae, Diptera), Jp. J. Sanit. Zool., 37: pp. 47–57.
|
|
15)
|
Kapitola C.27 této přílohy, Test toxicity na Chironomidae v systému sediment-voda za použití obohaceného sedimentu.
|
|
16)
|
OECD (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Environment, Health and Safety Publications, Series on Testing and Assessment No. 23, ENV/JM/MONO(2000)6, OECD, Paris.
|
|
17)
|
Weltje, L., Rufli, H., Heimbach, F., Wheeler, J., Vervliet-Scheebaum, M. and Hamer, M. (2010) The chironomid acute toxicity test: development of a new test system, Integr. Environ. Assess. Management.
|
|
18)
|
Environment Canada (1995) Guidance Document on Measurement of Toxicity Test Precision Using Control Sediments Spiked with a Reference Toxicant, Report EPS 1/RM/30, September 1995.
|
|
19)
|
Oetken, M, Nentwig, G., Löffler, D, Ternes, T. and Oehlmann, J. (2005) Effects of pharmaceuticals on aquatic invertebrates, Part I, The antiepileptic drug carbamazepine, Arch. Environ. Contam. Toxicol., 49: pp. 353–361.
|
|
20)
|
Suedel, B. C. and Rodgers, J. H. (1994) Development of formulated reference sediments for freshwater and estuarine sediment testing, Environ. Toxicol. Chem., 13: pp. 1163–1175.
|
|
21)
|
Naylor, C. and Rodrigues, C. (1995) Development of a test method for Chironomus riparius using a formulated sediment, Chemosphere, 31: pp. 3291–3303.
|
|
22)
|
Dunnett, C. W. (1964) A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statis. Assoc., 50: pp. 1096–1121.
|
|
23)
|
Dunnett, C. W. (1964) New tables for multiple comparisons with a control, Biometrics, 20: pp. 482–491.
|
|
24)
|
Williams, D. A. (1971) A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27: pp. 103–117.
|
|
25)
|
Williams, D. A. (1972) The comparison of several dose levels with a zero dose control. Biometrics, 28: pp. 510–531.
|
|
26)
|
Jungmann, D., Bandow, C., Gildemeister, T., Nagel, R., Preuss, T. G., Ratte, H. T., Shinn, C., Weltje, L. and H. M. Maes (2009) Chronic toxicity of fenoxycarb to the midge Chironomus riparius after exposure in sediments of different composition. J Soils Sediments, 9: pp. 94–102.
|
|
27)
|
Rao, J. N. K. and Scott, A. J. (1992) A simple method for the analysis of clustered binary data. Biometrics, 48: pp. 577–585.
|
|
28)
|
Christensen, E. R. (1984) Dose-response functions in aquatic toxicity testing and the Weibull model, Water Res., 18: pp. 213–221.
|
|
29)
|
Bruce, R. D. and Versteeg, D. J. (1992) A statistical procedure for modelling continuous toxicity data, Environ. Toxicol. Chem., 11: pp. 1485–1494.
|
|
30)
|
Slob, W. (2002) Dose-response modelling of continuous endpoints. Toxicol. Sci., 66: pp. 298–312.
|
|
31)
|
OECD (2006) Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application, OECD Series on Testing and Assessment No. 54, pp. 146, ENV/JM/MONO(2006)18, OECD, Paris.
|
|
32)
|
Benoit, D. A., Sibley, P. K., Juenemann, J. L. and Ankley, G. T. (1997) Chironomus tentans life-cycle test: design and evaluation for use in assessing toxicity of contaminated sediments, Environ. Toxicol. Chem., 16: pp. 1165–1176.
|
|
33)
|
Vogt, C., Belz, D., Galluba, S., Nowak, C., Oetken, M. and Oehlmann, J. (2007) Effects of cadmium and tributyltin on development and reproduction of the non-biting midge Chironomus riparius (Diptera) – baseline experiments for future multi-generation studies, J. Environ. Sci. Health Part A, 42: pp. 1–9.
|
|
34)
|
OECD (2010) Validation report of the Chironomid full life-cycle toxicity test, Forthcoming publication in the Series on Testing and Assessment, OECD, Paris.
|
Dodatek 1
Definice
Pro účely této zkušební metody se použijí tyto definice:
|
|
Chemická látka: látka nebo směs.
|
|
|
Připravený sediment nebo rekonstituovaný, umělý nebo syntetický sediment je směs materiálů užitá k napodobení fyzických složek přírodního sedimentu.
|
|
|
Voda nad sedimentem je voda nacházející se nad sedimentem ve zkušební nádobě.
|
|
|
Intersticiální voda nebo kapilární voda je voda zaujímající prostor mezi sedimentem a částicemi půdy.
|
|
|
Obohacená voda je zkušební voda, do níž byla přidána zkoušená chemická látka.
|
|
|
Zkoušená chemická látka: jakákoli látka nebo směs zkoušená touto zkušební metodou.
|
Dodatek 2
Doporučení pro kultivaci kultury Chironomus riparius
|
1.
|
Larvy rodu Chironomus lze chovat v krystalizačních miskách nebo ve větších nádobách. Jemný křemičitý písek se rozprostře po dně nádoby v tenké vrstvě silné 5 až 10 mm. Bylo prokázáno, že substrátem vhodným jako podklad je také křemelina (např. Merck, čl. 8117; dostačující je tenčí vrstva silná jen několik málo mm). Následně se přidá několikacentimetrová vrstva vhodné vody. Objem vody by se měl podle potřeby doplňovat s cílem nahradit ztráty vzniklé odpařováním a zabránit vysychání. Vodu lze v případě potřeby vyměnit. Je třeba zajistit mírné provzdušňování. Nádoby, v nichž jsou larvy chovány, by měly být umístěny ve vhodné kleci, která zabrání úniku líhnoucích se dospělců. Tato klec by měla být dostatečně velká, aby umožňovala rojení vylíhlých dospělců, jinak by nemuselo dojít k páření (minimální rozměry jsou přibližně 30 × 30 × 30 cm).
|
|
2.
|
Klece by měly být umístěny při pokojové teplotě nebo v místnosti s konstantní teplotou 20 ± 2 °C s fotoperiodou 16 hodin světlo (intenzita osvětlení přibližně 1 000 luxů) a 8 hodin tma. Bylo zjištěno, že vzdušná vlhkost nižší než 60 % RH může bránit rozmnožování.
|
Ředicí voda
|
3.
|
Lze použít jakoukoli vhodnou přírodní nebo syntetickou vodu. Zpravidla se používá studniční voda, odchlorovaná vodovodní voda a umělá média (např. Elendtovo médium ‚M4‘ nebo ‚M7‘, viz níže). Vodu je třeba před použitím provzdušnit. Je-li to nutné, lze kultivační vodu obnovit opatrným odlitím nebo odčerpáním použité vody z kultivačních nádob tak, aby nedošlo k poškození schránek larev.
|
Krmení larev
|
4.
|
Larvy rodu Chironomus by se měly krmit vločkovým krmivem pro ryby (TetraMin®, Tetra Phyll® nebo jiná podobná značka patentovaného krmiva pro ryby) v množství přibližně 250 mg na nádobu a den. Potravu lze aplikovat v podobě suchého mletého prášku nebo v podobě suspenze ve vodě: 1,0 g vločkového krmiva se přidá do 20 ml ředicí vody a vytvoří se homogenní směs. Tento přípravek lze podávat v množství přibližně 5 ml na nádobu a den (před použitím protřepat). Starším larvám lze přidat více krmiva.
|
|
5.
|
Krmení se upraví podle kvality vody. V případě, že se kultivační médium ‚zakalí‘, je třeba krmnou dávku snížit. Přidávání potravy je nutno pečlivě sledovat. Příliš malé množství krmiva způsobí, že larvy opouštějí sediment a vznášejí se ve vodním sloupci, a naopak příliš mnoho krmiva způsobí zvýšenou mikrobiální činnost a pokles koncentrace kyslíku. Obojí může způsobit zpomalení růstu.
|
|
6.
|
Do nových kultivačních nádob mohou být přidány i buňky zelených řas (např. Scenedesmus subspicatus, Chlorella vulgaris).
|
Krmení vylíhlých dospělců
|
7.
|
Někteří experimentátoři navrhují, že jako potrava vylíhlých dospělců může sloužit vata namočená do nasyceného roztoku sacharózy.
|
Líhnutí
|
8.
|
Dospělci se začnou v chovných nádobách líhnout při teplotě 20 ± 2 °C přibližně po 13–15 dnech. Samečky lze snadno odlišit podle vějířovitých tykadel a štíhlého trupu.
|
Shluky vajíček
|
9.
|
Jakmile se v chovné kleci nacházejí dospělci, je třeba třikrát týdně kontrolovat všechny reprodukční nádoby, zda se v nich nenacházejí shluky vajíček spojené rosolovitou hmotou. Pokud se zde shluky vajíček nacházejí, je nutno je opatrně odstranit a přemístit do malé misky obsahující vzorek chovného vodního prostředí. Shluky vajíček se použijí pro založení nové kultivační nádoby (např. 2–4 shluky vajíček na nádobu) nebo pro zkoušky toxicity.
|
|
10.
|
Larvy prvního instaru by se měly vylíhnout za 2–3 dny.
|
Zakládání nových kultivačních nádob
|
11.
|
Jakmile jsou kultury založeny, mělo by být možné s kulturami larev jednou týdně nebo méně často v závislosti na zkušebních požadavcích zakládat nové nádoby a odstraňovat starší nádoby po vylíhnutí dospělců. Pomocí tohoto systému se zajistí pravidelné dodávky dospělců s minimální potřebou dohledu.
|
Příprava zkušebních roztoků ‚M4‘ a ‚M7‘
|
12.
|
Médium ‚M4‘ popsal Elendt (1990). Médium ‚M7‘ se připraví obdobně jako médium ‚M4‘ s výjimkou látek uvedených v tabulce 1, u nichž jsou koncentrace u ‚M7‘ čtyřikrát nižší než u ‚M4‘. Podle Elendta a Biase (1990) by se zkušební roztok neměl připravovat, protože pro koncentrace NaSiO3 · 5H2O, NaNO3, KH2PO4 a K2HPO4 nejsou pro přípravu zásobních roztoků vhodné.
|
Příprava média ‚M7‘
|
13.
|
Každý zásobní roztok (I) se připraví samostatně a z těchto zásobních roztoků (I) se pak připraví kombinovaný zásobní roztok (II) (viz tabulka 1). Médium ‚M7‘ se připraví přidáním 50 ml kombinovaného zásobního roztoku (II) a množství zásobního roztoku jednotlivých makroživin, které jsou uvedeny v tabulce 2, do 1 litru deionizované vody. Vitaminový zásobní roztok se připraví přidáním tří vitaminů do deionizované vody, jak je uvedeno v tabulce 3, a 0,1 ml kombinovaného vitaminového zásobního roztoku se přidá do výsledného média ‚M7‘ krátce před použitím. Vitaminový zásobní roztok se uskladňuje zmrazený v malých stejnoměrných dílech. Médium se provzdušní a stabilizuje.
|
Tabulka 1
Zásobní roztoky stopových prvků pro médium M4 a M7
|
Zásobní roztoky (I)
|
Množství (mg) doplněné na 1 litr deionizované vody
|
Kombinovaný zásobní roztok (II) se připraví smícháním následujících množství (v ml) zásobních roztoků (I) a doplněním na 1 litr deionizované vody
|
Konečné koncentrace ve zkušebním roztoku (mg/l)
|
|
M4
|
M7
|
M4
|
M7
|
|
H3BO3
(25)
|
57 190
|
1,0
|
0,25
|
2,86
|
0,715
|
|
MnCl2 · 4H2O (25)
|
7 210
|
1,0
|
0,25
|
0,361
|
0,090
|
|
LiCl (25)
|
6 120
|
1,0
|
0,25
|
0,306
|
0,077
|
|
RbCl (25)
|
1 420
|
1,0
|
0,25
|
0,071
|
0,018
|
|
SrCl2 · 6H2O (25)
|
3 040
|
1,0
|
0,25
|
0,152
|
0,038
|
|
NaBr (25)
|
320
|
1,0
|
0,25
|
0,016
|
0,004
|
|
Na2MoO4 · 2H2O (25)
|
1 260
|
1,0
|
0,25
|
0,063
|
0,016
|
|
CuCl2 · 2H2O (25)
|
335
|
1,0
|
0,25
|
0,017
|
0,004
|
|
ZnCl2
|
260
|
1,0
|
1,0
|
0,013
|
0,013
|
|
CaCl2 · 6H2O
|
200
|
1,0
|
1,0
|
0,010
|
0,010
|
|
KI
|
65
|
1,0
|
1,0
|
0,0033
|
0,0033
|
|
Na2SeO3
|
43,8
|
1,0
|
1,0
|
0,0022
|
0,0022
|
|
NH4VO3
|
11,5
|
1,0
|
1,0
|
0,00058
|
0,00058
|
|
Na2EDTA · 2H2O (25)
(26)
|
5 000
|
20,0
|
5,0
|
2,5
|
0,625
|
|
FeSO4 · 7H2O (25)
(26)
|
1 991
|
20,0
|
5,0
|
1,0
|
0,249
|
Tabulka 2
Zásobní roztoky makroživin pro médium M4 a M7
|
|
Množství doplněné na 1 litr deionizované vody
(mg)
|
Množství zásobních roztoků makroživin přidané za účelem přípravy média M4 a M7
(ml/l)
|
Konečné koncentrace ve zkušebním roztoku M4 a M7
(mg/l)
|
|
CaCl2 · 2H2O
|
293 800
|
1,0
|
293,8
|
|
MgSO4 · 7H2O
|
246 600
|
0,5
|
123,3
|
|
KCl
|
58 000
|
0,1
|
5,8
|
|
NaHCO3
|
64 800
|
1,0
|
64,8
|
|
NaSiO3 · 9H2O
|
50 000
|
0,2
|
10,0
|
|
NaNO3
|
2 740
|
0,1
|
0,274
|
|
KH2PO4
|
1 430
|
0,1
|
0,143
|
|
K2HPO4
|
1 840
|
0,1
|
0,184
|
Tabulka 3
Vitaminový zásobní roztok pro médium M4 a M7
Všechny tři vitaminové roztoky se smísí do jediného vitaminového zásobního roztoku.
|
|
Množství doplněné na 1 litr deionizované vody
(mg)
|
Množství vitaminového zásobního roztoku přidané za účelem přípravy média M4 a M7
(ml/l)
|
Konečné koncentrace ve zkušebním roztoku M4 a M7
(mg/l)
|
|
Thiaminhydrochlorid
|
750
|
0,1
|
0,075
|
|
Kyanokobalamin (B12)
|
10
|
0,1
|
0,0010
|
|
Biotin
|
7,5
|
0,1
|
0,00075
|
ODKAZY
BBA (1995), Long-term toxicity test with Chironomus riparius: Development and validation of a new test system, Edited by M. Streloke and H. Köpp. Berlin.
Elendt, B.P. (1990) Selenium deficiency in Crustacea, Protoplasma, 154: pp. 25–33.
Elendt, B. P. and Bias, W.-R. (1990) Trace nutrient deficiency in Daphnia magna cultured in standard medium for toxicity testing, Effects on the optimisation of culture conditions on life history parameters of D. magna, Water Research, 24: pp. 1157–1167.
Dodatek 3
Příprava umělého sedimentu
SLOŽENÍ SEDIMENTU
Složení připraveného sedimentu by mělo být následující:
|
Složka
|
Charakteristika
|
% sušiny sedimentu
|
|
Rašelina
|
rašeliníková (Sphagnum) rašelina s pH co nejblíže 5,5 až 6,0, bez viditelných zbytků rostlin a jemně mletá (velikost částic ≤ 1 mm) a vysušená na vzduchu
|
4–5
|
|
Křemičitý písek
|
velikost zrn: > 50 % částic musí být v rozpětí 50–200 μm
|
75–76
|
|
Kaolinitický jíl
|
obsah kaolinitu ≥ 30 %
|
20
|
|
Organický uhlík
|
upraven přidáním rašeliny a písku
|
2 (± 0,5)
|
|
Uhličitan vápenatý
|
CaCO3, práškový, chemicky čistý
|
0,05–0,1
|
|
Voda
|
vodivost ≤ 10 μS/cm
|
30–50
|
PŘÍPRAVA
Rašelina se usuší na vzduchu a rozemele se na jemný prášek. Připraví se suspenze požadovaného množství rašelinného prášku v deionizované vodě s použitím vysoce výkonného homogenizačního zařízení. pH této suspenze se pomocí CaCO3 upraví na 5,5 ± 0,5. Suspenze se po dobu nejméně dvou dnů za mírného promíchávání při 20 ± 2 °C kondicionuje za účelem stabilizace pH a vytvoření stabilní mikrobiální složky. Poté se opět změří pH, které by se mělo rovnat 6,0 ± 0,5. Následně se suspenze rašeliny smísí s ostatními složkami (písek a jíl) a s deionizovanou vodou s cílem získat homogenní sediment s obsahem vody v rozmezí 30–50 % sušiny sedimentu. Znovu se změří pH konečné směsi a v případě nutnosti se opět upraví pomocí CaCO3 na hodnotu 6,5 až 7,5. Odeberou se vzorky sedimentu pro stanovení obsahu sušiny a obsahu organického uhlíku. Před použitím pro zkoušku toxicity pro pakomáry se doporučuje připravený sediment kondicionovat po dobu 7 dnů za stejných podmínek, které budou převládat v následné zkoušce.
SKLADOVÁNÍ
Suché složky pro přípravu umělého sedimentu lze skladovat na suchém a chladném místě při pokojové teplotě. Připravený (vlhký) sediment by před použitím ve zkoušce neměl být skladován. Měl by se použít ihned po uplynutí 7denního období kondicionování, kterým končí jeho příprava.
ODKAZY
OECD (1984), Earthworm, Acute Toxicity Test, Test Guideline No. 207, Guidelines for the Testing of Chemicals, OECD, Paris.
Meller, M., Egeler, P., Roembke, J., Schallnass, H., Nagel, R. and Streit, B. (1998) Short-term toxicity of lindane, hexachlorobenzene and copper sulfate on tubificid sludgeworms (Oligochaeta) in artificial media, Ecotox. Environ. Safety, 39: pp. 10–20.
Dodatek 4
Chemické charakteristiky přípustné ředicí vody
|
SLOŽKA
|
KONCENTRACE
|
|
Pevné částice
|
< 20 mg/l
|
|
Celkový obsah organického uhlíku
|
< 2 mg/l
|
|
Neionizovaný amoniak
|
< 1 μg/l
|
|
Tvrdost vyjádřená jako obsah CaCO3
|
< 400 mg/l (27)
|
|
Zbytkový chlor
|
< 10 μg/l
|
|
Celkový obsah organofosfátových pesticidů
|
< 50 ng/l
|
|
Celkový obsah organochlorových pesticidů a polychlorovaných bifenylů
|
< 50 ng/l
|
|
Celkový obsah organických sloučenin chloru
|
< 25 ng/l
|
Dodatek 5
Pokyny pro provedení zkoušky
Příklad chovné klece:

|
A
|
:
|
gáza pokrývající vrchní část a nejméně jednu stěnu klece (velikost ok přibližně 1 mm)
|
|
B
|
:
|
otvor pro vkládání vylíhlých dospělců do chovné klece a odstraňování nakladených šňůr vajíček z krystalizačních misek (na tomto nákresu nejsou zobrazeny)
|
|
C
|
:
|
minimální velikost chovné klece: délka 30 cm, výška 30 cm a šířka 30 cm
|
Příklad zkušební nádoby:

|
A
|
:
|
Pasteurova pipeta pro provzdušňování vody nad sedimentem
|
|
B
|
:
|
skleněné víčko bránící vylíhlým pakomárům v opuštění nádoby
|
|
C
|
:
|
hladina vody
|
|
D
|
:
|
zkušební nádoba (skleněná kádinka, minimální objem 600 ml)
|
|
E
|
:
|
vrstva sedimentu
|
Příklad exhaustoru pro odchyt dospělých pakomárů (šipky znázorňují směr proudu vzduchu)
|
A
|
:
|
skleněná trubice (vnitřní průměr přibližně 5 mm) propojená se samonasávacím čerpadlem
|
|
B
|
:
|
zátka z vulkanizované pryže, jíž prochází skleněná trubice (A). Z vnitřní strany je vyústění skleněné trubice (A) obloženo určitým množstvím bavlny a gázou (velikost ok přibližně 1 mm) s cílem zamezit poškození pakomárů, když jsou vtahováni do exhaustoru
|
|
C
|
:
|
průhledná nádržka (plastová nebo skleněná, délka přibližně 15 cm) pro odchycené pakomáry
|
|
D
|
:
|
zátka z vulkanizované pryže, jíž prochází skleněná trubice (E). Pro vypuštění do chovné klece se zátka D vyjme z nádoby C
|
|
E
|
:
|
trubice (plastová nebo skleněná, vnitřní průměr přibližně 8 mm) k odběru dospělých pakomárů z nádoby
|
Schematický přehled zkoušky toxicity během životního cyklu:
|
A
|
:
|
první generace – zkušební nádoby obsahující systém sediment-voda, osm opakování, 20 larev prvního instaru v každé nádobě
|
|
B
|
:
|
čtyři zkušební nádoby pro každou chovnou klec, A a B
|
|
C
|
:
|
chovné klece (A a B) pro rojení, páření a kladení vajíček
|
|
D
|
:
|
krystalizační misky pro odkládání šňůr vajíček
|
|
E
|
:
|
mikrotitrační destičky, jedna jamka na každou šňůru vajíček
|
|
F
|
:
|
druhá generace – zkušební nádoby obsahující systém sediment-voda, osm opakování, 20 larev prvního instaru v každé nádobě
|
C.41. ZKOUŠKA POHLAVNÍHO VÝVOJE RYB
ÚVOD
|
1.
|
Tato zkušební metoda je rovnocenná Pokynu OECD pro zkoušení č. 234 (2011). Je založena na rozhodnutí přijatém v roce 1998 s cílem vyvinout nové nebo aktualizovat stávající zkušební metody pro screening a zkoušky potenciálních endokrinních disruptorů. Zkouška pohlavního vývoje ryb (FSDT) byla označena za slibnou zkušební metodu zahrnující citlivé životní stadium ryb, kdy reagují na chemické látky typu estrogenů a androgenů. V letech 2006 až 2013 byly k této zkušební metodě provedeny mezilaboratorní validační studie, při kterých byly validovány zkoušky s halančíkem japonským (Oryzias latipes), daniem pruhovaným (Danio rerio) a koljuškou tříostnou (Gasterosteus aculeatus) a částečně validována zkouška s jelečkem velkohlavým (Pimephales promelas) (41)(42)(43). Tento pokyn zahrnuje halančíka japonského, koljušku tříostnou a danio pruhované. Pokyn v zásadě navazuje na pokyn OECD TG 210 Zkouška toxicity na raných životních stadiích ryb (1), přičemž expozice pokračuje, dokud nedojde k pohlavní diferenciaci ryb, tj. přibližně 60 dní po vylíhnutí pro halančíka japonského, koljušku tříostnou a dania pruhovaného (u jiných druhů, které budou validovány v budoucnu, může být doba expozice kratší), a je doplněn o ukazatele citlivosti endokrinního systému. Zkouška FSDT hodnotí účinky chemických látek, které by mohly způsobovat poruchy endokrinního systému (např. estrogenů, androgenů a inhibitorů steroidogeneze), v raném životním stadiu a případné nepříznivé důsledky těchto chemických látek pro pohlavní vývoj. Kombinace dvou základních endokrinních ukazatelů, koncentrace vitelogeninu (VTG) a fenotypový poměr pohlaví, umožňuje při této zkoušce prokázat mechanismus působení zkoušené chemické látky. V důsledku změny ve fenotypovém poměru pohlaví, která je významná z hlediska populace, může být zkouška FSDT použita k posouzení nebezpečí a rizik. Nicméně pokud se zkouška použije k posouzení nebezpečí nebo rizik, neměla by být prováděna na koljušce, protože z dosud dostupných validačních údajů vyplývá, že u tohoto druhu nebyly změny ve fenotypovém poměru pohlaví vyvolané zkoušenými chemickými látkami obvykle pozorovány.
|
|
2.
|
Metoda je založena na expozici ryb chemickým látkám prostřednictvím vody v pohlavně labilním období, kdy lze očekávat, že ryba je vůči účinkům chemických látek způsobujících poruchy endokrinního systému, které interferují s pohlavním vývojem, nejcitlivější. Jsou měřeny dva základní ukazatele – indikátory vývojových vad souvisejících s endokrinním systémem, a to koncentrace VTG a poměry pohlaví určené histologií pohlavních žláz. Histopatologie pohlavních žláz (hodnocení a určení stadií oocytů a spermatogenetických buněk) je volitelná. Tam, kde je to možné (např. u halančíka japonského a koljušky tříostné) se navíc určí genetické pohlaví. Přítomnost markerů genetického pohlaví je značnou výhodou, neboť zvyšuje průkaznost statistických údajů o poměru pohlaví a umožňuje zjistit fenotypovou změnu pohlaví jedinců. Jinými klíčovými ukazateli, které by měly být měřeny, jsou míra vylíhnutí, přežití, délka a tělesná hmotnost. Tuto zkušební metodu by bylo možno přizpůsobit i pro jiné druhy, než které byly uvedeny výše, a to za předpokladu, že tyto jiné druhy projdou stejnou validací, jako byla validace provedená pro halančíka japonského, koljušku tříostnou a danio pruhované, kontrolní ryby budou na konci zkoušky pohlavně diferencované, úrovně VTG budou dostatečně vysoké, aby bylo možné zjistit významné změny související s chemickou látkou, a citlivost zkušebního systému byla stanovena pomocí referenčních chemických látek ovlivňujících funkci endokrinního systému ((anti)-estrogenů, (anti)-androgenů, inhibitorů aromatázy atd.). Veškeré validační zprávy odkazující na údaje zkoušky FSDT s užitím jiných druhů musí přezkoumat OECD a výsledek validace musí být shledán dostatečným.
|
Výchozí úvahy a omezení
|
3.
|
VTG obvykle vzniká v játrech samiček vejcorodých obratlovců v reakci na endogenní estrogen v krevním oběhu (2). Je to prekurzor žloutkových proteinů a poté, co vznikne v játrech, putuje krevním řečištěm do vaječníku, kde je spotřebováván a modifikován vyvíjejícími se jikrami. Syntéza VTG je velmi omezená, ale zjistitelná, u nedospělých ryb a dospělých rybích samečků, protože nemají dostatek estrogenu v krevním oběhu. Játra jsou však schopna syntetizovat a vylučovat VTG jako reakci na exogenní stimulaci estrogenem (3)(4)(5).
|
|
4.
|
Měření VTG slouží k zjištění chemických látek s estrogenními, antiestrogenními a androgenními účinky a chemických látek, jež interferují se steroidogenezí, jako například s inhibitory aromatázy. Zjišťování estrogenních chemických látek je možné pomocí měření indukce VTG u samečků ryb a bylo rozsáhle zdokumentováno v recenzované vědecké literatuře. Indukce VTG byla rovněž prokázána na základě expozice aromatizovatelným androgenům (6)(7). Pokles úrovně estrogenu v krevním oběhu u samiček, například prostřednictvím inhibice aromatázy, která endogenní androgen přeměňuje v přírodní estrogen 17-beta-estradiol, způsobuje snížení koncentrace VTG, což se používá k zjištění chemických látek s vlastnostmi způsobujícími inhibici aromatázy, nebo obecněji inhibitorů steroidogeneze (33). Biologický význam odezvy v podobě produkce VTG po inhibici estrogenu/aromatázy byl potvrzen a široce zdokumentován (8)(9). Je však možné, že tvorba VTG u samiček může být ovlivněna také obecnou toxicitou a toxickými účinky jiného než endokrinního charakteru.
|
|
5.
|
Několik metod měření bylo úspěšně vyvinuto a standardizováno pro běžné použití za účelem stanovení hladiny VTG ve vzorcích krve, jater, celého těla nebo homogenátu hlavy/ocasu. Je tomu tak v případě dania pruhovaného, koljušky tříostné a halančíka japonského a také u částečně validovaného druhu jelečka velkohlavého; k dispozici jsou metody enzymové imunosorpční analýzy (ELISA) specifické pro jednotlivé druhy, které pro stanovení hladiny VTG využívají imunochemie (5)(10)(11)(12)(13)(14)(15)(16). U halančíka japonského a dania pruhovaného je dobrá korelace mezi úrovněmi VTG měřenými z krevní plazmy, jater a vzorků homogenátů, ačkoli homogenáty často vykazují poněkud nižší hodnoty VTG než plazma (17)(18)(19). Doporučené postupy pro odběr vzorků pro účely analýzy VTG jsou uvedeny v dodatku 5.
|
|
6.
|
Změna ve fenotypovém poměru pohlaví je ukazatel, který vyjadřuje změnu pohlaví. Poměr pohlaví vyvíjejících se ryb mohou v zásadě ovlivnit estrogeny, antiestrogeny, androgeny, antiandrogeny a chemické látky inhibující steroidogenezi (20). Bylo prokázáno, že u dania pruhovaného je tato změna po expozici chemickým látkám typu estrogenů pohlaví částečně zvratná (21), zatímco změna pohlaví po expozici chemickým látkám typu androgenů je změna pohlaví trvalá (30). Pohlaví jsou definována jako samečci, samičky, intersexuálové (s oocyty i spermatogernetickými buňkami v jedné gonádě) nebo nediferencované a u jednotlivých ryb se určují histologickým vyšetřením gonád. Pokyny jsou obsaženy v dodatku 7 a v pokynu OECD k diagnostice histopatologie pohlavních žláz ryb v souvislosti s endokrinním systémem (22).
|
|
7.
|
Genetické pohlaví se vyšetřuje prostřednictvím genetických markerů, pokud existují u daných druhů ryb. U halančíka japonského lze samičí chromozomy XX nebo samčí chromozomy XY zjistit pomocí polymerázové řetězové reakce (PCR) nebo lze analyzovat geny vázané v DM doméně chromozomu Y (DMY) (DMY negativní nebo pozitivní), jak je popsáno v položkách seznamu literatury (23)(24). Pro určení genetického pohlaví u koljušky tříostné existuje ekvivalentní metoda PCR, popsaná v dodatku 10. Pokud lze genetické pohlaví v jednotlivých případech spojit s fenotypovým pohlavím, průkaznost zkoušky se zvýší, a proto by u druhů se zdokumentovanými markery genetického pohlaví mělo být genetické pohlaví určeno.
|
|
8.
|
Dva klíčové endokrinní ukazatele, VTG a poměr pohlaví, mohou v kombinaci prokázat endokrinní účinky chemické látky (tabulka 1). Poměr pohlaví je biologický marker významný z hlediska populace (25)(26) a u některých dobře definovaných účinků mohou být výsledky zkoušky FSDT, bude-li to regulační agentura považovat za vhodné, použity pro účely posouzení nebezpečí a rizik. Mechanismy účinků jsou v současnosti estrogeny, androgeny a inhibitory steroidogeneze.
Tabulka 1
Reakce endokrinních ukazatelů na různé mechanismy účinků chemických látek
↑= vzrůstající, ↓= klesající, — = nebylo zkoumáno
|
Mechanismus účinku
|
VTG ♂
|
VTG ♀
|
Poměr pohlaví
|
Odkazy
|
|
Slabý agonista estrogenu
|
↑
|
↑
|
↑ ♀ nebo ↑ nedif
|
(27)(40)
|
|
Silný agonista estrogenu
|
↑
|
↑
|
↑ ♀ nebo ↑ nedif, žádný ♂
|
(28)(40)
|
|
Antagonista estrogenu
|
—
|
—
|
↑ ♀ nebo ↑ nedif
|
(29)
|
|
Agonista androgenu
|
↓ nebo —
|
↓ nebo —
|
↑♂, žádný ♀
|
(28)(30)
|
|
Antagonista androgenu
|
—
|
—
|
↑ ♀
↑ intersex.
|
(31)
|
|
Inhibitor aromatázy
|
↓
|
↓
|
↓ ♀
|
(33)
|
|
|
9.
|
Zkouška FSDT nepokrývá reprodukční životní stadium ryb a chemické látky, u nichž existuje podezření, že ovlivňují reprodukci při nižších koncentracích, než při jakých ovlivňují pohlavní vývoj, by měly být zkoumány ve zkoušce, která zahrnuje reprodukci.
|
|
10.
|
Definice pro účely této zkušební metody jsou uvedeny v dodatku 1.
|
|
11.
|
Zkouška FSDT in vivo je určena k zjištění chemických látek s androgenními a estrogenními vlastnostmi a rovněž chemických látek s antiandrogenními, antiestrogenními vlastnostmi a vlastnostmi způsobujících inhibici steroidogeneze. Validační fáze zkoušky FSDT (fáze 1 a 2) zahrnovala estrogenní, androgenní chemické látky a inhibitory steroidogeneze. Účinky antagonistů estrogenů a antagonistů androgenů ve zkoušce FSDT lze dohledat v tabulce 1, avšak tyto účinky jsou v současnosti méně zdokumentovány.
|
PODSTATA ZKOUŠKY
|
12.
|
Při této zkoušce jsou ryby, počínaje čerstvě oplodněnými jikrami až po ryby s ukončenou diferenciací pohlaví, vystaveny nejméně třem koncentracím zkoušené chemické látky rozpuštěné ve vodě. Zkušební podmínky by měly být průtokové, pokud to není nemožné z důvodu nedostupnosti nebo povahy (tj. omezené rozpustnosti) zkoušené chemické látky. Zkouška začíná nasazením čerstvě oplodněných jiker (před rýhováním blastuly) do zkušebních komor. Obsádka komor je pro každý druh popsána v odstavci 27. U validovaných druhů ryb, halančíka japonského, koljušky tříostné a dania pruhovaného, se zkouška ukončí 60. den po vylíhnutí. Po ukončení zkoušky se všechny ryby humánně usmrtí. Z každé ryby se odebere biologický vzorek (krevní plazma, játra nebo homogenát hlavy/ocasu) pro analýzu VTG a zbytek se fixuje pro histologické hodnocení pohlavních žláz s cílem určit fenotypové pohlaví; volitelně lze provést histopatologii (např. určení stadia gonád, míru výskytu intersexuálů). U druhů s příslušnými markery (dodatky 9 a 10) se odebere biologický vzorek (řitní nebo hřbetní ploutev) pro určení genetického pohlaví.
|
|
13.
|
Přehled příslušných zkušebních podmínek specifických pro validované druhy, halančíka japonského, koljušku tříostnou a danio pruhované, je uveden v dodatku 2.
|
INFORMACE O ZKOUŠENÉ CHEMICKÉ LÁTCE
|
14.
|
Měly by být dostupné výsledky zkoušky akutní toxicity [např. zkušební metody C.14 (34) a OECD TG 210 (1)], přednostně provedené s druhy zvolenými pro tuto zkoušku. To znamená, že je známa rozpustnost zkoušené látky ve vodě a tlak jejích par a je k dispozici spolehlivá analytická metoda pro stanovení množství látky ve zkušebních komorách, a to se známou a doloženou přesností a známou mezí stanovitelnosti.
|
|
15.
|
Dalšími užitečnými informacemi jsou strukturní vzorec, čistota chemické látky, její stálost ve vodě a na světle, pKa, Pov a výsledky zkoušky snadné biologické rozložitelnosti (zkušební metoda C.4) (35).
|
Kritéria přijatelnosti zkoušky
|
16.
|
Aby byly výsledky zkoušky přijatelné, musí být splněny tyto podmínky:
|
—
|
koncentrace rozpuštěného kyslíku by po celou dobu zkoušky měla činit nejméně 60 % hodnoty nasycení vzduchem (ASV),
|
|
—
|
teplota vody ve zkušebních komorách by se v kterémkoli čase během doby expozice neměla lišit o více než ± 1,5 °C a měla by být udržována v teplotních rozmezích stanovených pro jednotlivé zkušební druhy (dodatek 2),
|
|
—
|
měla by být k dispozici validovaná metoda pro analýzu zkoušené chemické látky s mezí stanovitelnosti výrazně nižší, než je nejnižší jmenovitá koncentrace, a měly by být shromážděny důkazy potvrzující, že koncentrace zkoušené chemické látky v roztoku byly uspokojivě udržovány v rozmezí ± 20 % středních naměřených hodnot,
|
|
—
|
celková míra přežití oplodněných jiker v kontrolních skupinách a případně také v kontrolních skupinách s rozpouštědlem by měla být rovna limitům stanoveným v dodatku 2 nebo vyšší,
|
|
—
|
kritéria přijatelnosti týkající se růstu a poměru pohlaví při ukončení zkoušky jsou založena na údajích z kontrolních skupin (sloučené kontrolní skupiny s rozpouštědlem a s vodou; pokud se významně neliší, pak pouze kontroly s rozpouštědlem):
|
|
Halančík japonský
|
Danio pruhované
|
Koljuška tříostná
|
|
Růst
|
Živá hmotnost ryby (po osušení do sucha)
|
> 150 mg
|
> 75 mg
|
> 120 mg
|
|
Délka (standardní délka)
|
> 20 mm
|
>14 mm
|
>20 mm
|
|
Poměr pohlaví (% samečků nebo samiček)
|
30–70 %
|
30–70 %
|
30–70 %
|
|
|
—
|
pokud je užito rozpouštědla, nemělo by mít statisticky významný účinek na přežití a nemělo by způsobovat žádné poruchy endokrinního systému nebo mít jiné nepříznivé účinky na raná životní stadia, což bylo potvrzeno kontrolou s rozpouštědlem.
|
Je-li zjištěno nedodržení kritérií přijatelnosti zkoušky, měly by být zváženy důsledky z hlediska spolehlivosti zkušebních údajů a tyto úvahy by měly být zahrnuty do zpráv.
|
POPIS ZKUŠEBNÍ METODY
Zkušební komory
|
17.
|
Lze použít komory ze skla, nerezové oceli nebo z jiného chemicky inertního materiálu. Rozměry komor by měly být dostatečně velké, aby umožňovaly dodržení kritérií obsádky, která jsou uvedena níže. Je žádoucí, aby komory byly umístěny ve zkušebním prostoru náhodně. Pro zcela náhodné uspořádání se upřednostňuje náhodně blokové uspořádání, při kterém je každá koncentrace přítomna v každém bloku. Zkušební komory by měly být chráněny před nežádoucími rušivými vlivy.
|
Výběr druhů
|
18.
|
Doporučené druhy ryb jsou uvedeny v dodatku 2. Postupy pro zařazení nových druhů jsou uvedeny v odstavci 2.
|
Chov matečných ryb
|
19.
|
Podrobnosti o chovu matečných ryb za uspokojivých podmínek lze nalézt v dokumentu OECD TG 210 (1). Matečné ryby je třeba krmit jednou nebo dvakrát denně vhodným krmivem.
|
Chov embryí a plůdků
|
20.
|
Embrya a plůdky mohou být uvnitř hlavní nádrže nejprve exponovány v menších nádobách ze skla nebo nerezové oceli s pletivovými stěnami nebo konci, aby nádobami mohla proudit zkoušená chemická látka. Nevířivého průtoku nádobami lze dosáhnout jejich zavěšením do ramen, pomocí nichž lze pohybovat nádobami nahoru a dolů, přičemž organismy zůstanou stále ponořeny.
|
|
21.
|
Jsou-li k odchovu jiker v hlavní nádrži použity nádoby, mřížky nebo pletiva, měly by být po vylíhnutí plůdků odstraněny, pokud ovšem nemají být ponechány k zamezení úniku ryb. Je-li třeba plůdky přemístit, neměly by být vystaveny vzduchu a k jejich vyjmutí z nádob by se neměly používat síťky. Načasování přemístění se liší podle druhu a přemístění nemusí být vždy nutné.
|
Voda
|
22.
|
Pro tuto zkoušku je vhodná jakákoli voda, ve které zkušební druhy z kontrolních skupin přežívají alespoň tak, jako ve vodě popsané v dodatku 3. Po celou dobu zkoušky by měla mít stejnou kvalitu. Aby bylo zajištěno, že voda neovlivní výsledky zkoušky (například reakcí se zkoušenou chemickou látkou) nebo nebude mít nepříznivý vliv na stav matečných ryb, měly by být v pravidelných intervalech odebírány vzorky na analýzu. Je-li kvalita ředicí vody relativně stálá, měl by se měřit celkový obsah organického uhlíku, vodivost, pH a suspendované látky, například každé tři měsíce. Je-li kvalita vody problematická, měl by být stanoven obsah těžkých kovů (např. Cu, Pb, Zn, Hg, Cd, Ni), hlavních aniontů a kationtů (např. Ca2+, Mg2+, Na+, K+, Cl–, SO4
2–) a pesticidů. Podrobnosti o chemické analýze a odběru vody jsou uvedeny v odstavci 34.
|
Zkušební roztoky
|
23.
|
Je-li to proveditelné, měl by být použit průtokový systém. Pro zjištění řady koncentrací při průtokových zkouškách je nezbytný systém, který nepřetržitě dávkuje a ředí zásobní roztok zkoušené chemické látky (např. dávkovací čerpadlo, zařízení pro poměrné ředění a syticí systém). Průtok zásobních roztoků a ředicí vody by měl být při zkoušce v určitých intervalech kontrolován a v jejím průběhu by se neměl měnit o více než 10 %. Jako vhodný byl shledán průtok odpovídající výměně alespoň pětinásobku objemu nádrže za 24 hodin (1). Mělo by se dbát na to, aby nebyly použity trubky z plastu nebo jiné materiály, z nichž některé mohou obsahovat biologicky aktivní látky nebo mohou zkoušenou chemickou látku adsorbovat.
|
|
24.
|
Zásobní roztok by měl být připraven pokud možno bez použití rozpouštědel jednoduchým mechanickým mícháním zkoušené chemické látky v ředicí vodě nebo jejím protřepáváním (např. mechanickým čeřením nebo pomocí ultrazvuku). Je-li zkoušená chemická látka obtížně rozpustná ve vodě, měl by se použít postup popsaný v pokynu OECD ke zkouškám toxicity složitých látek a směsí pro vodní organismy (36). Rozpouštědla by se používat neměla, ale v některých případech mohou být pro vytvoření zásobního roztoku o vhodné koncentraci nezbytná. Příklady vhodných rozpouštědel lze nalézt v seznamu literatury (36).
|
|
25.
|
Semistatické zkušební podmínky by používány být neměly, pokud pro to nebudou naléhavé důvody související se zkoušenou chemickou látkou (např. stálost, omezená dostupnost, vysoké náklady nebo nebezpečnost). U semistatických technik mohou být použity dva různé výměnné postupy: buď se do čistých nádrží připraví nové zkušební roztoky a přežívající jikry a plůdky se do těchto nových nádrží opatrně přenesou, nebo se zkušební organismy ponechají ve zkušebních nádržích a denně se vymění určitý podíl (alespoň dvě třetiny) zkušební vody.
|
POSTUP
Podmínky expozice
Sběr jiker a délka expozice
|
26.
|
Aby nedošlo ke geneticky podmíněnému zkreslení, odeberou se jikry nejméně od třech chovných párů nebo skupin, smíchají se a pro zahájení zkoušky se náhodně vyberou. V případě koljušky tříostné je popis umělého oplodnění uveden v dodatku 11. Zkouška se zahájí co nejdříve po oplodnění jiker, embrya se ponoří do zkušebních roztoků nejlépe ještě před započetím rýhování blastuly nebo co nejdříve po tomto stadiu, avšak nejpozději 12 h po oplodnění. Zkouška by měla pokračovat až do dokončení pohlavní diferenciace v kontrolní skupině (60 dní po vylíhnutí u halančíka japonského, koljušky tříostné a dania pruhovaného).
|
Nasazování
|
27.
|
Počet oplodněných jiker na počátku zkoušky by měl být nejméně 120 pro každou koncentraci, rozdělených mezi alespoň 4 opakování (přijatelné je přidělení ke kontrolním skupinám podle druhé odmocniny). Jikry by měly být (pomocí statistických tabulek pro randomizaci) náhodně rozděleny mezi varianty expozice. Velikost násady (pro definici viz dodatek 1) by měla být tak nízká, aby bez přímého provzdušňování nádrží bylo možné udržet koncentrace rozpuštěného kyslíku alespoň na 60 % hodnoty ASV. U průtokových zkoušek se doporučuje nasazování nepřevyšující 0,5 g/l za 24 hodin a v žádném okamžiku nepřekračující 5 g/l roztoku. Nejpozději 28 dnů po oplodnění by počet ryb v jednotlivých opakováních měl být upraven tak, aby každé opakování obsahovalo pokud možno stejný počet ryb. Dojde-li v souvislosti s expozicí k úhynům, počet opakování by měl být vhodně snížen tak, aby bylo možné udržet pokud možno stejnou hustotu ryb mezi úrovněmi expozice.
|
Světlo a teplota
|
28.
|
Fotoperioda a teplota vody by měly vyhovovat zkušebním druhům (viz zkušební podmínky pro zkoušku FSDT v dodatku 2).
|
Krmení
|
29.
|
Potrava a krmení mají zásadní význam a v každém stadiu je nezbytné poskytovat vhodnou potravu v přiměřených časových intervalech a na úrovni dostatečné k podpoře normálního růstu. Krmit je třeba ad libitum, avšak zároveň minimalizovat přebytek potravy. K zajištění dostatečné rychlosti růstu by rybám měla být potrava podávána alespoň dvakrát denně (o víkendech je přijatelné jednou denně), s alespoň tříhodinovým intervalem mezi jednotlivými krmeními. Zbytky potravy a výkaly se, je-li to nutné, odstraní, aby nedošlo k hromadění odpadu. S přibývajícími zkušenostmi se potrava a režimy krmení neustále zdokonalují s cílem zlepšit schopnost přežití a optimalizovat růst. Proto by mělo být dbáno na to, aby byl navrhovaný režim schválen uznávanými odborníky. 24 hodin před ukončením zkoušky by krmení mělo být ukončeno. Příklady vhodné stravy jsou uvedeny v dodatku 2 (viz rovněž pokyn OECD pro testování ryb (39).
|
Zkušební koncentrace
|
30.
|
Zkoušené chemické látky by měly být odstupňovány tak, jak je popsáno v dodatku 4. Měly by být užity nejméně tři zkušební koncentrace při alespoň čtyřech opakováních. Při výběru rozsahu zkušebních koncentrací by měla být zohledněna křivka závislosti hodnoty LC50 na délce expozice, dostupná ve studiích akutní toxicity. Mají-li být údaje použity pro posouzení rizik, doporučuje se pět zkušebních koncentrací.
|
|
31.
|
Koncentrace látky, které jsou vyšší než 10 % hodnoty LC50 pro dospělé ryby při zkoušce akutní toxicity nebo vyšší než 10 mg/l, podle toho, co je nižší, nemusí být zkoušeny. Maximální zkušební koncentrace u životního stadia plůdků / nedospělých ryb by měla činit 10 % hodnoty LC50.
|
Kontrolní skupiny
|
32.
|
Kromě zkušebních koncentrací by měla být nasazena kontrolní skupina v ředicí vodě (≥ 4 opakování) a podle potřeby kontrolní skupina s rozpouštědlem (≥ 4 opakování). Při zkoušce by měla být užita pouze rozpouštědla, u nichž bylo šetřením prokázáno, že nemají statisticky významný vliv na ukazatele zkoušky.
|
|
33.
|
Použije-li se rozpouštědlo, neměla by jeho konečná koncentrace být větší než 0,1 ml/l (36) a ve všech zkušebních nádržích s výjimkou kontrolní skupiny s ředicí vodou by měla být stejná koncentrace. Mělo by však být vynaloženo maximální úsilí k tomu, aby se takové rozpouštědlo nepoužívalo, nebo bylo alespoň udržováno v co nejnižší koncentraci.
|
Četnost analytických stanovení a měření
|
34.
|
Před zahájením zkoušky by měla být provedena chemická analýza koncentrace zkoušené chemické látky, aby se ověřilo, že odpovídá kritériím přijatelnosti. Všechna opakování by měla být analyzována jednotlivě na začátku zkoušky a při jejím ukončení. V průběhu zkoušky by mělo být alespoň jednou týdně analyzováno jedno opakování pro každou zkušební koncentraci, přičemž opakování je třeba systematicky měnit (1,2,3,4,1,2…). Skladují-li se vzorky pro pozdější analýzu, metoda uskladnění vzorků by měla být předem validována. Vzorky by měly být filtrovány (např. přes filtr s průměrem pórů 0,45 μm) nebo odstředěny, aby se zajistilo, že stanovení budou provedena na chemické látce ve skutečném roztoku).
|
|
35.
|
V průběhu zkoušky se měří rozpuštěný kyslík, pH, celková tvrdost, vodivost, salinita (podle potřeby) a teplota. Rozpuštěný kyslík, salinita (podle potřeby) a teplota se měří týdně a pH, vodivost a tvrdost na začátku a na konci zkoušky. Teplota se měří pokud možno nepřetržitě alespoň v jedné zkušební nádrži.
|
|
36.
|
Výsledky by měly být založeny na naměřených koncentracích. Udržela-li se však koncentrace zkoušené chemické látky v roztoku během celé zkoušky v rozmezí ± 20 % nominální koncentrace, mohou být výsledky založeny buď na nominálních, nebo na naměřených hodnotách.
|
Pozorování a měření
Stadia vývoje embrya
|
37.
|
Expozice by měla být zahájena co nejdříve po oplodnění a před zahájením rýhování blastuly, avšak nejpozději 12 h po oplodnění, aby se zajistilo, že k expozici dojde během raného vývoje embrya.
|
Líhnutí a přežívání
|
38.
|
Líhnutí a přežívání se pozoruje alespoň jednou denně a zaznamenávají se počty. Uhynulá embrya, plůdky a nedospělé ryby se odstraní ihned po nalezení, neboť se mohou rychle rozkládat a činností ostatních ryb mohou být porušeny. Při odstraňování uhynulých jedinců se postupuje s mimořádnou opatrností, aby se nenarazilo do sousedních jiker/plůdků nebo aby se fyzicky nepoškodily, neboť jsou mimořádně křehké a citlivé. Kritéria uhynutí se v životních stadiích liší:
|
—
|
u jiker: zejména v raných stadiích zřetelná ztráta průsvitnosti a změna ve zbarvení vyvolaná koagulací a/nebo vysražením bílkovin, které vedou k bílému zakalení,
|
|
—
|
u plůdků a nedospělých ryb: nepohyblivost a/nebo absence dýchacích pohybů a/nebo tepu srdce a/nebo bílé neprůsvitné zbarvení centrálního nervového systému a/nebo nereagování na mechanické podněty.
|
|
Neobvyklý vzhled
|
39.
|
Zaznamenává se počet plůdků nebo ryb vykazujících neobvyklý tělesný vzhled a popíše se vzhled a povaha popisované abnormality. Je třeba si uvědomit, že neobvyklá embrya a plůdky se vyskytují přirozeně a u některých druhů jich může být v kontrolních skupinách řádově několik procent. Neobvyklí jedinci by měli být ze zkušební nádrže odstraněni pouze v případě uhynutí. Pokud však – v souladu se směrnicí Evropského parlamentu a Rady 2010/63/EU ze dne 22. září 2010 o ochraně zvířat používaných pro vědecké účely – abnormality způsobují bolest, utrpení a strach nebo trvalé poškození a je možno spolehlivě předpovědět smrt, jedinci by měli být anestetizováni a usmrceni podle popisu v odstavci 44 a pro účely analýzy údajů by s nimi mělo být zacházeno jako s uhynulými.
|
Neobvyklé chování
|
40.
|
Abnormality, např. hyperventilace, nekoordinované plavání, netypická nečinnost a netypické chování při krmení, se při zjištění zaznamenají.
|
Hmotnost
|
41.
|
Na konci zkoušky se všechny ryby, které přežily, usmrtí (anestetizují, mají-li být odebrány krevní vzorky) a stanoví se živá hmotnost jedinců (po osušení do sucha).
|
Tělesná délka
|
42.
|
Na konci zkoušky se změří délka jednotlivých ryb (standardní délka).
|
|
43.
|
Tato pozorování poskytnou některé nebo všechny následující údaje, které budou k dispozici pro podání zpráv:
|
—
|
počty zdravých ryb na konci zkoušky,
|
|
—
|
čas začátku líhnutí a konce líhnutí,
|
|
—
|
délku a hmotnost ryb, které přežily,
|
|
—
|
počty deformovaných plůdků,
|
|
—
|
počty ryb vykazujících neobvyklé chování.
|
|
Odběr vzorků ryb
|
44.
|
Při ukončení zkoušky se provede odebrání vzorků ryb. Ryby určené pro odběr vzorků se usmrtí např. pomocí MS-222 (100–500 mg na litr pufrovaného 200 mg NaHCO3 na litr) nebo FA-100 (4-allyl-2-methoxyfenol: eugenol) a jednotlivě změří a zváží za účelem stanovení hmotnosti (po osušení do sucha) nebo, má-li být odebrán krevní vzorek, anestetizují (viz odstavec 49).
|
Odběr vzorků pro analýzu VTG a určení pohlaví prostřednictvím histologického hodnocení
|
45.
|
Ze všech ryb se odeberou vzorky a připraví se na analýzu pohlaví a VTG. Všechny ryby se histologicky analyzují za účelem určení pohlaví. Pro měření VTG je přijatelné použít dílčí vzorek alespoň z 16 ryb z každého opakování. Ukáže-li se, že výsledky získané z dílčího vzorku jsou nejasné, je potřeba analyzovat na VTG více ryb.
|
|
46.
|
Postup odběru vzorků na určení VTG a pohlaví závisí na metodě analýzy VTG:
|
Metoda homogenátu hlavy/ocasu pro analýzu VTG
|
47.
|
Ryba se usmrtí. Od těla každé ryby se skalpelem oddělí hlava a ocas řezem vedeným těsně za prsními ploutvemi a těsně za hřbetní ploutví (viz obrázek 1). Hlava a ocasní část každé ryby se společně zváží a jednotlivě očíslují, zmrazí v tekutém dusíku a uskladní při teplotě – 70 °C nebo méně pro účely analýzy VTG. Tělo ryby se očísluje a fixuje ve vhodném fixačním médiu za účelem histologického hodnocení (22). Touto metodou se provede hodnocení VTG a histopatologie každého jedince a případnou změnu v hladině VTG tak lze porovnat s fenotypovým pohlavím ryb nebo (u halančíka japonského a koljušky tříostné) s genetickým pohlavím ryb. Pro další informace viz návod k homogenizaci (dodatek 5) a návod ke stanovení hladiny VTG (dodatek 6).
|
Metoda homogenátu jater pro analýzu VTG
|
48.
|
Ryba se usmrtí. Játra se vyříznou a uskladní při teplotě – 70 °C nebo nižší. Doporučené postupy pro vyříznutí jater a předúpravu vzorku lze nalézt v pokynu OECD TG 229 (37) nebo v kapitole C.37 této přílohy (38). Játra se poté jednotlivě homogenizují, jak je popsáno v pokynu OECD TG 229 nebo v kapitole C.37 této přílohy. Odebraný supernatant se použije pro měření VTG homologační technikou ELISA (viz dodatek 6 s příkladem kvantifikace u dania pruhovaného nebo pokyn OECD TG 229 (37) pro halančíka japonského). Pomocí tohoto přístupu je rovněž možné získat údaje o jednotlivých rybách týkající se jak VTG, tak histologie pohlavních žláz.
|
Metoda krevní plazmy pro analýzu VTG
|
49.
|
Z anestetizované ryby se odebere krev srdeční punkcí, z ocasní žíly nebo řezu v ocasu a odstředí se při 4 °C pro odběr plazmy. Plazma se až do použití skladuje při teplotě – 70 °C nebo nižší. Ryba se usmrtí a fixuje za účelem histologického zkoumání. Vzorky plazmy a ryby se jednotlivě očíslují, aby bylo možné porovnat hladiny VTG s pohlavím ryb.
Obrázek 1
Jak rozříznout rybu pro změření VTG v homogenátu hlavy/ocasu a histologické hodnocení střední části těla

|
Určení genetického pohlaví
|
50.
|
U druhů, které mají příslušné markery, se z jednotlivých ryb odebere biologický vzorek pro určení genetického pohlaví. U halančíka japonského se odebere řitní ploutev nebo hřbetní ploutev. Podrobný popis, včetně odběru vzorků tkání a určení pohlaví metodou PCR, je uveden v dodatku 9. Pro koljušku tříostnou je popis odběru tkání a metody PCR pro určení pohlaví uveden v dodatku 10.
|
Měření VTG
|
51.
|
Měření VTG by mělo být založeno na kvantitativní a analyticky validované metodě. Měly by být k dispozici údaje o mezilaboratorní a vnitrolaboratorní variabilitě metody, která se používá v dané laboratoři. Zdroj mezilaboratorní a vnitrolaboratorní variability je (s největší pravděpodobností) založen na různých stadiích vývoje rybí populace. Pokud jde o variabilitu měření VTG, mělo by se s velkou opatrností přistupovat k hodnotám NOEC založených na tomto ukazateli. Pro hodnocení produkce VTG u druhů ryb posuzovaných v této zkoušce jsou k dispozici různé metody. Poměrně citlivou a specifickou technikou měření je určení koncentrace proteinů pomocí enzymové imunosorpční analýzy (ELISA). Měly by být použity homologické protilátky (vytvořené proti VTG téhož druhu) a nejdůležitější homologické standardy.
|
Určení pohlaví
|
52.
|
V závislosti na postupu při odběru vzorků za účelem stanovení VTG se celé ryby nebo zbylá střední část každé ryby vloží do předem označených schránek pro zpracování a fixují se ve vhodném fixačním médiu pro histologické určení pohlaví (volitelně též pro hodnocení stadia vývoje gonád). Pokyny ohledně fixace a zalití do fixátoru obsahuje dodatek 7 a pokyn OECD k diagnostice histopatologie pohlavních žláz ryb v souvislosti s endokrinním systémem (22). Po zpracování se ryby zalijí do parafínových bloků. Jedinci by do parafínového bloku měli být uloženi podélně. Z každého jedince se odebere alespoň šest podélných řezů (o tloušťce 3–5 μm) ve frontální rovině včetně gonadální tkáně z obou gonád. Interval mezi těmito řezy by měl být přibližně 50 μm u samiček a 250 μm u samečků. Každý blok bude často obsahovat samečky i samičky (pokud se do bloku zalije více než jeden jedinec), proto by měl být interval mezi řezy z těchto bloků přibližně 50 μm, dokud se nedocílí alespoň šesti řezů gonád z každého samečka. Poté lze interval mezi řezy zvýšit přibližně na 250 μm u samiček. Řezy se obarví hematoxylinem a eosinem a zkoumají se pomocí světelné mikroskopie se zaměřením na pohlaví (samečci, samičky, intersexuálové nebo nediferencované pohlaví). Intersexualita je definována jako přítomnost více než jednoho oocytu ve varleti na šest analyzovaných řezů nebo spermatogenetických buněk (ano/ne) ve vaječnících. Histopatologie a určení stadia vaječníků a varlat jsou nepovinné, avšak je-li takové vyšetření provedeno, výsledky by měly být podrobeny statistické analýze a uvedeny ve zprávě. Je třeba poznamenat, že některé druhy ryb (např. halančík japonský a někdy danio pruhované) nemají přirozeně plně vyvinutý pár gonád a může být přítomna pouze jedna gonáda. Veškerá taková zjištění se zaznamenají.
|
|
53.
|
Určení genetického pohlaví u jedinců halančíka japonského je založeno na přítomnosti nebo nepřítomnosti genu DMY, který určuje samčí pohlaví halančíka a nachází se v chromozomu Y. Genotypové pohlaví u halančíka lze identifikovat sekvenováním genu DMY z DNA extrahované např. z řitní ploutve nebo hřbetní ploutve. Přítomnost DMY indikuje jedince XY (samečka), a to bez ohledu na fenotyp, zatímco nepřítomnost DMY indikuje jedince XX (samičku), a to bez ohledu na fenotyp (23). Návod k přípravě tkání a metodě PCR obsahuje dodatek 9. Také u jedinců koljušky tříostné se určení genetického pohlaví provede metodou PCR, která je popsána v dodatku 10.
|
|
54.
|
Zaznamená se výskyt intersexu (viz definici v dodatku 1).
|
Druhotné pohlavní znaky
|
55.
|
U druhů jako halančík japonský jsou druhotné pohlavní znaky řízeny endokrinní činností; na konci expozice by proto mělo být pokud možno provedeno pozorování fyzického vzhledu ryb. U samiček halančíka japonského je papilární útvar v posteriorní části řitní ploutve citlivý na androgeny. Kapitola C.37 této přílohy (38) obsahuje příslušné fotografie samčích druhotných pohlavních znaků a samiček vystavených působení androgenu.
|
ÚDAJE A JEJICH PŘEDKLÁDÁNÍ
Zpracování výsledků
|
56.
|
Je důležité, aby konečný ukazatel byl potvrzen validním statistickým testem jako co nejprůkaznější. Experimentální jednotkou je opakování, avšak statistické testování by mělo zohlednit variabilitu v rámci opakování. Dodatek 8 obsahuje vývojový diagram pro rozhodování, který pomůže při volbě nejvhodnějšího statistického testu na základě charakteristik údajů, jež byly při zkoušce získány. Úroveň statistické významnosti pro všechny ukazatele zahrnuté do zkoušky činí 0,05.
|
Poměr pohlaví a genetické pohlaví
|
57.
|
Je-li závislost dávka-odezva monotónní, měl by být Jonckheerovým-Terpstrovým testem (trend testem) analyzován poměr pohlaví při významném účinku expozice (přístup NOEC/LOEC). Není-li zjištěna monotónnost, měl být použit párový test. Pokud je možné dosáhnout normality rozdělení a homogenity rozptylu, použijte Dunnettův test. Při heterogenním rozptylu použijte Tamhaneův-Dunnettův test. V ostatních případech použijte exaktní Mannův-Whitneyův test s Bonferroniho-Holmovou korekcí. V dodatku 8 je uveden vývojový diagram popisující statistiky poměru pohlaví. Poměr pohlaví by měl být uveden v tabulkách jako podíl samečků, samiček, intersexuálů a nediferencovaných jedinců ± směrodatná odchylka pro každou koncentraci. Měla by být zdůrazněna statistická významnost. Příklady obsahuje validační zpráva pro fázi 2 zkoušky FSDT (42). Genetické pohlaví by mělo být uvedeno jako procentní podíl změny fenotypového pohlaví u samečků, samiček, intersexuálů a nediferencovaných jedinců.
|
Koncentrace VTG
|
58.
|
Měly by být analyzovány koncentrace VTG pro zjištění významném účinku expozice (přístup NOEC/LOEC). Před t-testem s Bonferroniho korekcí se upřednostňuje Dunnettův test. Je-li použita Bonferroniho korekce, upřednostňuje se Bonferroniho-Holmova korekce. Měl by být zohledněn logaritmický převod VTG pro dosažení normality rozdělení a homogenity rozptylu. Odpovídá-li reakce při jednotlivých koncentracích monotónní odezvě na dávku, pak se před všemi výše uvedenými upřednostňuje Jonckheerův-Terpstrův test. Použije-li se Dunnettův test, pro další pokračování není třeba provádět ANOVA F-test významnosti. Pro podrobnosti viz schéma v dodatku 8. Výsledky by měly být uvedeny v tabulkách jako střední hodnoty u samečků, samiček, intersexuálů a nediferencovaných jedinců odděleně pro každou koncentraci. Měla by být zdůrazněna statistická významnost u fenotypových samiček a fenotypových samečků. Příklady obsahuje validační zpráva pro fázi 2 zkoušky FSDT (42).
|
Zkoušená chemická látka: skutečná koncentrace
|
59.
|
Skutečné koncentrace zkoušené chemické látky v nádržích by měly být analyzovány s četností popsanou v odstavci 34. Výsledky by měly být uvedeny v tabulkách jako střední koncentrace ± směrodatná odchylka na bázi opakování a rovněž i na bázi koncentrací spolu s informací o počtu vzorků a zdůrazní se odlehlé hodnoty od střední zkušební koncentrace ± 20 %. Příklady obsahuje validační zpráva pro fázi 2 zkoušky FSDT (42).
|
Interpretace výsledků
|
60.
|
V případě, že se naměřené koncentrace zkoušené chemické látky ve zkušebních roztocích pohybují na úrovních blízkých mezi stanovitelnosti dané analytické metody, by výsledky měly být interpretovány opatrně.
|
Závěrečná zpráva
|
61.
|
Závěrečná zpráva by měla obsahovat tyto informace:
|
|
Zkoušená chemická látka
|
—
|
Příslušné fyzikálně-chemické vlastnosti a chemická identifikace včetně údajů o čistotě a metodě kvantitativního stanovení zkoušené chemické látky.
|
|
|
|
Zkušební podmínky
|
—
|
Použitý zkušební postup (např. průtokový, semistatický / s obnovováním); uspořádání zkoušky včetně zkušebních koncentrací, metoda přípravy zásobních roztoků (v příloze), četnost obnovování (je-li použito, uvede se solubilizační činidlo a jeho koncentrace),
|
|
—
|
nominální zkušební koncentrace, průměry naměřených hodnot v jednotlivých zkušebních nádržích, jejich směrodatné odchylky a metody jejich stanovení (použitá analytická metoda by měla být uvedena v příloze); důkazy o tom, že naměřené hodnoty odpovídají koncentracím zkoušené chemické látky ve skutečném roztoku,
|
|
—
|
kvalita vody ve zkušebních nádržích: pH, tvrdost, teplota a koncentrace rozpuštěného kyslíku,
|
|
—
|
podrobné informace o krmení (např. druh krmiva/krmiv, původ, podávané množství a frekvence krmení) a podle potřeby analýzy na přítomnost kontaminujících látek (např. polychlorovaných bifenylů, polyaromatických uhlovodíků a organochlorových pesticidů).
|
|
|
|
Výsledky
|
—
|
Doklady o tom, že kontrolní skupiny splnily kritéria validity: údaje o míře vylíhnutí by měly být uvedeny v tabulkách jako procentní podíl v každém opakování a pro každou koncentraci. Měly by být zdůrazněny odlehlé hodnoty od kritérií přijatelnosti (v kontrolních skupinách). Údaje o přežití by měly být uvedeny jako procentní podíl v každém opakování a pro každou koncentraci. Měly by být zdůrazněny odlehlé hodnoty od kritérií validity (v kontrolních skupinách),
|
|
—
|
jasné uvedení dosažených výsledků v jednotlivých sledovaných ukazatelích: přežití embryí a úspěšnost líhnutí; zevní odchylky; délka a hmotnost; naměřené hodnoty VTG (v ng/g homogenátu, ng/ml plazmy nebo ng/mg jater); histologie gonád, poměr pohlaví, údaje o genetickém pohlaví; výskyt jakýchkoli neobvyklých reakcí ryb a jakékoli viditelné účinky způsobené zkoušenou chemickou látkou.
|
|
|
|
62.
|
Výsledky by měly být uvedeny jako střední hodnoty ± směrodatná odchylka (SD) nebo střední směrodatná chyba (SE). Statistické údaje by měly být uvedeny minimálně jako NOEC a LOEC a intervaly spolehlivosti. Mělo by se postupovat podle vývojového diagramu pro provedení statistické analýzy (dodatek 8).
|
LITERATURA
|
1)
|
OECD (1992), Fish, Early Life Stage Toxicity Test, Test Guideline No. 210, Guidelines for the Testing of Chemicals, OECD, Paris.
|
|
2)
|
Jobling, S., Sheahan, D., Osborne, J. A., Matthiessen, P. and Sumpter, J. P. (1996) Inhibition of testicular growth in rainbow trout (Oncorhynchus mykiss) exposed to estrogenic alkylphenolic chemicals, Environmental Toxicology and Chemistry 15, pp. 194–202.
|
|
3)
|
Sumpter, J. P. and Jobling, S. (1995) Vitellogenesis As A Biomarker for Estrogenic Contamination of the Aquatic Environment, Environmental Health Perspectives 103, pp. 173–178.
|
|
4)
|
Tyler, C. R., van Aerle, R., Hutchinson, T. H., Maddix, S. and Trip, H. (1999) An in vivo testing system for endocrine disruptors in fish early life stages using induction of vitellogenin, Environmental Toxicology and Chemistry 18, pp. 337–347.
|
|
5)
|
Holbech, H., Andersen, L., Petersen, G. I., Korsgaard, B., Pedersen, K. L. and Bjerregaard, P. (2001a) Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio), Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 130, pp. 119–131.
|
|
6)
|
Andersen, L., Bjerregaard, P. and Korsgaard, B. (2003) Vitellogenin induction and brain aromatase activity in adult male and female zebrafish exposed to endocrine disrupters, Fish Physiology and Biochemistry 28, pp. 319–321.
|
|
7)
|
Orn, S., Holbech, H., Madsen, T. H., Norrgren, L. and Petersen, G. I. (2003) Gonad development and vitellogenin production in zebrafish (Danio rerio) exposed to ethinylestradiol and methyltestosterone, Aquatic Toxicology 65, pp. 397–411.
|
|
8)
|
Panter, G. H., Hutchinson, T. H., Lange, R., Lye, C. M., Sumpter, J. P., Zerulla, M. and Tyler, C. R. (2002) Utility of a juvenile fathead minnow screening assay for detecting (anti-)estrogenic substances, Environmental Toxicology and Chemistry 21, pp. 319–326.
|
|
9)
|
Sun, L. W., J. M. Zha, P. A. Spear, and Z. J. Wang (2007) Toxicity of the aromatase inhibitor letrozole to Japanese medaka (Oryzias latipes) eggs, larvae and breeding adults, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 145, pp. 533–541.
|
|
10)
|
Parks, L. G., A. O. Cheek, N. D. Denslow, S. A. Heppell, J. A. McLachlan, G. A. LeBlanc, and C. V. Sullivan (1999) Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 123, pp. 113–125.
|
|
11)
|
Brion, F., B. M. Nilsen, J. K. Eidem, A. Goksoyr, and J. M. Porcher (2002) Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio), Environmental Toxicology and Chemistry 21, pp. 1699–1708.
|
|
12)
|
Nishi, K., M. Chikae, Y. Hatano, H. Mizukami, M. Yamashita, R. Sakakibara, and E. Tamiya (2002) Development and application of a monoclonal antibody-based sandwich ELISA for quantification of Japanese medaka (Oryzias latipes) vitellogenin, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 132, pp. 161–169.
|
|
13)
|
Hahlbeck, E., I. Katsiadaki, I. Mayer, M. Adolfsson-Erici, J. James, and B. E. Bengtsson (2004) The juvenile three-spined stickleback (Gasterosteus aculeatus L.) as a model organism for endocrine disruption – II – kidney hypertrophy, vitellogenin and spiggin induction, Aquatic Toxicology 70, pp. 311–326.
|
|
14)
|
Tatarazako, N., M. Koshio, H. Hori, M. Morita, and T. Iguchi (2004) Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the medaka, Journal of Health Science 50, pp. 301–308.
|
|
15)
|
Eidem, J. K., H. Kleivdal, K. Kroll, N. Denslow, R. van Aerle, C. Tyler, G. Panter, T. Hutchinson, and A. Goksoyr (2006) Development and validation of a direct homologous quantitative sandwich ELISA for fathead minnow (Pimephales promelas) vitellogenin. Aquatic Toxicology, 78, pp. 202–206.
|
|
16)
|
Jensen, K. M. and G. T. Ankley (2006) Evaluation of a commercial kit for measuring vitellogenin in the fathead minnow (Pimephales promelas), Ecotoxicology and Environmental Safety 64, pp. 101–105.
|
|
17)
|
Holbech, H., Petersen, G. I., Norman, A., Örn, S, Norrgren, L., and Bjerregaard, P (2001b) Suitability of zebrafish as test organism for detection of endocrine disrupting chemicals. Comparison of vitellogenin in plasma and whole body homogenate from zebrafish (Danio rerio) and rainbow trout (Oncorhynchus mykiss), Nordic Council of Ministers, TemaNord 2001:597, pp. 48–51.
|
|
18)
|
Nilsen, B. M., K. Berg, J. K. Eidem, S. I. Kristiansen, F. Brion, J. M. Porcher, and A. Goksoyr (2004) Development of quantitative vitellogenin-ELISAs for fish test species used in endocrine disruptor screening, Analytical and Bioanalytical Chemistry 378, pp. 621–633.
|
|
19)
|
Orn, S., S. Yamani, and L. Norrgren (2006) Comparison of vitellogenin induction, sex ratio, and gonad morphology between zebrafish and Japanese medaka after exposure to 17 alpha-ethinylestradiol and 17 beta-trenbolone, Archives of Environmental Contamination and Toxicology 51, pp. 237–243.
|
|
20)
|
Scholz, S. and N. Kluver (2009) Effects of Endocrine Disrupters on Sexual, Gonadal Development in Fish, Sexual Development 3, pp. 136–151.
|
|
21)
|
Fenske, M., G. Maack, C. Schafers, and H. Segner (2005) An environmentally relevant concentration of estrogen induces arrest of male gonad development in zebrafish, Danio rerio, Environmental Toxicology and Chemistry 24, pp. 1088–1098.
|
|
22)
|
OECD (2010), Guidance Document on the Diagnosis of Endocrine-related Histopathology in Fish Gonads, Series on Testing and Assessment No. 123, ENV/JM/MONO(2010)14, OECD, Paris.
|
|
23)
|
Kobayashi, T., M. Matsuda, H. Kajiura-Kobayashi, A. Suzuki, N. Saito, M. Nakamoto, N. Shibata, and Y. Nagahama (2004) Two DM domain genes, DMY and DMRT1, involved in testicular differentiation and development in the medaka, Oryzias latipes, Developmental Dynamics 231, pp. 518–526.
|
|
24)
|
Shinomiya, A., H. Otake, K. Togashi, S. Hamaguchi, and M. Sakaizumi (2004) Field survey of sex-reversals in the medaka, Oryzias latipes: genotypic sexing of wild populations, Zoological Science 21, pp. 613–619.
|
|
25)
|
Kidd, K. A., P. J. Blanchfield, K. H. Mills, V. P. Palace, R. E. Evans, J. M. Lazorchak, and R. W. Flick (2007) Collapse of a fish population after exposure to a synthetic estrogen, Proceedings of the National Academy of Sciences of the United States of America 104, pp. 8897–8901.
|
|
26)
|
Palace,V. P., R. E. Evans, K. G. Wautier, K. H. Mills, P. J. Blanchfield, B. J. Park, C. L. Baron, and K. A. Kidd (2009) Interspecies differences in biochemical, histopathological, and population responses in four wild fish species exposed to ethynylestradiol added to a whole lake, Canadian Journal of Fisheries and Aquatic Sciences 66, pp. 1920–1935.
|
|
27)
|
Panter, G. H., T. H. Hutchinson, K. S. Hurd, J. Bamforth, R. D. Stanley, S. Duffell, A. Hargreaves, S. Gimeno, and C. R. Tyler (2006) Development of chronic tests for endocrine active chemicals – Part 1. An extended fish early-life stage test for oestrogenic active chemicals in the fathead minnow (Pimephales promelas), Aquatic Toxicology 77, pp. 279–290.
|
|
28)
|
Holbech, H., K. Kinnberg, G. I. Petersen, P. Jackson, K. Hylland, L. Norrgren, and P. Bjerregaard (2006) Detection of endocrine disrupters: Evaluation of a Fish Sexual Development Test (FSDT), Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 144, pp. 57–66.
|
|
29)
|
Andersen, L., K. Kinnberg, H. Holbech, B. Korsgaard, and P. Bjerregaard (2004) Evaluation of a 40 day assay for testing endocrine disrupters: Effects of an anti-estrogen and an aromatase inhibitor on sex ratio and vitellogenin concentrations in juvenile zebrafish (Danio rerio), Fish Physiology and Biochemistry 30, pp. 257–266.
|
|
30)
|
Morthorst, J. E., H. Holbech, and P. Bjerregaard (2010) Trenbolone causes irreversible masculinization of zebrafish at environmentally relevant concentrations, Aquatic Toxicology 98, pp. 336–343.
|
|
31)
|
Kiparissis,Y., T. L. Metcalfe, G.C. Balch, and C.D. Metcalf (2003) ‚Effects of the antiandrogens, vinclozolin and cyproterone acetate on gonadal development in the Japanese medaka (Oryzias latipes)‘, Aquatic Toxicology 63, pp. 391–403.
|
|
32)
|
Panter, G. H., T. H. Hutchinson, K. S. Hurd, A. Sherren, R. D. Stanley, and C. R. Tyler (2004) Successful detection of (anti-) androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development, Aquatic Toxicology 70, pp. 11–21.
|
|
33)
|
Kinnberg, K., H. Holbech, G. I. Petersen, and P. Bjerregaard (2007) Effects of the fungicide prochloraz on the sexual development of zebrafish (Danio rerio), Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 145, pp. 165–170.
|
|
34)
|
Kapitola C.14 této přílohy, Růstová zkouška na nedospělých rybách.
|
|
35)
|
Kapitola C.4 této přílohy, Stanovení snadné biologické rozložitelnosti.
|
|
36)
|
OECD (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Series on Testing and Assessment No. 23, OECD, Paris.
|
|
37)
|
OECD (2009), Fish Short Term Reproduction Assay, Test Guideline No. 229, Guidelines for the Testing of Chemicals, OECD, Paris.
|
|
38)
|
Kapitola C.37 této přílohy, 21denní zkouška na rybách: krátkodobý screening estrogenní a androgenní aktivity a inhibice aromatázy.
|
|
39)
|
OECD (2012), Fish Toxicity Testing Framework, Series on Testing and Assessment No. 171, OECD, Paris.
|
|
40)
|
Schäfers, C., Teigeler, M., Wenzel, A., Maack, G., Fenske, M., Segner, H. (2007) Concentration- and time-dependent effects of the synthetic estrogen, 17 alpha-ethinylestradiol, on reproductive capabilities of the zebrafish, Danio rerio, Journal of Toxicology and Environmental Health-Part A, 70, 9–10, pp 768–779.
|
|
41)
|
OECD (2011), Validation Report (Phase 1) for the Fish Sexual Development Test, Series on Testing and Assessment No 141, ENV/JM/MONO(2011)22, OECD, Paris.
|
|
42)
|
OECD (2011), Validation Report ( Phase 2) for the Fish Sexual Development Test, Series on Testing and Assessment No 142, ENV/JM/MONO(2011)23, OECD, Paris.
|
|
43)
|
OECD (2011), Peer Review Report of the validation of the Fish Sexual Development Test, Series on Testing and Assessment No 143, ENV/JM/MONO(2011)24, OECD, Paris.
|
Dodatek 1
Zkratky a definice
Klíčový ukazatel
: způsobuje účinek na úrovni populace
ASV
: hodnota nasycení vzduchem
Biomarker
: způsobuje účinek na úrovni jedinců
Chemická látka
: látka nebo směs
Dph
: dnů po vylíhnutí
DMY
: gen ležící v DM doméně chromozomu Y, který je nezbytný pro vývoj samečků halančíka japonského
ELISA
: enzymová imunosorpční analýza
Hmotnost ryby
: hmotnost ryby po osušení do sucha
FSDT
: zkouška pohlavního vývoje ryb
Osa HPG
: hypothalamo-hypofýzo-gonadální osa
Intersexuální ryba
: ryba s více než jedním oocytem ve varleti na 6 analyzovaných řezů nebo se spermatogenetickými buňkami ve vaječnících (ano/ne)
Velikost násady
: živá hmotnost ryb na jednotku objemu vody
MOA
: mechanismus účinku
RT-PCR
: polymerázová řetězová reakce s reverzní transkripcí
Zkoušená chemická látka
: jakákoli látka nebo směs zkoušená pomocí této zkušební metody
Nediferencovaná ryba
: ryba s gonádami, které nevykazují žádné rozpoznatelné zárodečné buňky
VTG
: vitelogenin
Dodatek 2
Experimentální podmínky pro zkoušku FSDT (sladkovodní druhy)
|
|
Halančík japonský (Oryzias latipes)
|
Danio pruhované (Danio rerio)
|
Koljuška tříostná (Gasterosteus aculeatus)
|
|
|
Průtoková nebo semistatická
|
Průtoková nebo semistatická
|
Průtoková nebo semistatická
|
|
|
25 ± 2 °C
|
27 ± 2 °C
|
20 ± 2 °C
|
|
|
Fluorescenční zářivky (širokospektrální)
|
Fluorescenční zářivky (širokospektrální)
|
Fluorescenční zářivky (širokospektrální)
|
|
|
10–20 μE/m2/s, 540–1 080 luxů nebo 50–100 ft-c (okolní laboratorní hodnoty)
|
10–20 μE/m2/s, 540–1 080 luxů nebo 50–100 ft-c (okolní laboratorní hodnoty)
|
10–20 μE/m2/s, 540–1 080 luxů nebo 50–100 ft-c (okolní laboratorní hodnoty)
|
|
|
12–16 h světlo, 8–12 h tma
|
12–16 h světlo, 8–12 h tma
|
16 h světlo, 8 h tma
|
|
7.
|
Minimální velikost nádrže
|
|
Jednotlivé nádrže by měly pojmout nejméně 7 l vody
|
Jednotlivé nádrže by měly pojmout nejméně 7 l vody
|
Jednotlivé nádrže by měly pojmout nejméně 7 l vody
|
|
8.
|
Výměny objemu zkušebního roztoku
|
|
Nejméně 5krát denně
|
Nejméně 5krát denně
|
Nejméně 5krát denně
|
|
9.
|
Stáří zkušebních organismů na začátku expozice
|
|
Čerstvě oplodněné jikry (stadium rané blastuly)
|
Čerstvě oplodněné jikry (stadium rané blastuly)
|
Čerstvě oplodněné jikry
|
|
10.
|
Počet jiker pro každou expozici
|
|
Nejméně 120
|
Nejméně 120
|
Nejméně 120
|
|
|
Nejméně 3 (plus příslušné kontrolní skupiny)
|
Nejméně 3 (plus příslušné kontrolní skupiny)
|
Nejméně 3 (plus příslušné kontrolní skupiny)
|
|
12.
|
Počet opakování pro každou expozici
|
|
Nejméně 4 (pokud není přidělení ke kontrolním skupinám podle druhé odmocniny)
|
Nejméně 4 (pokud není přidělení ke kontrolním skupinám podle druhé odmocniny)
|
Nejméně 4 (pokud není přidělení ke kontrolním skupinám podle druhé odmocniny)
|
|
|
Živé Artemia, zmrazené dospělé žábronožky solné, vločkové krmivo atd. Doporučuje se krmit dvakrát denně
|
Speciální krmivo pro mladé ryby, živé Artemia, zmrazené dospělé žábronožky solné, vločkové krmivo atd. Doporučuje se krmit dvakrát denně
|
Živé Artemia, zmrazené dospělé žábronožky solné, vločkové krmivo atd. Doporučuje se krmit dvakrát denně
|
|
|
Žádné, dokud koncentrace rozpuštěného kyslíku neklesne pod 60 % nasycení
|
Žádné, dokud koncentrace rozpuštěného kyslíku neklesne pod 60 % nasycení
|
Žádné, dokud koncentrace rozpuštěného kyslíku neklesne pod 70 % nasycení
|
|
|
Čistá povrchová, studniční nebo rekonstituovaná voda
|
Čistá povrchová, studniční nebo rekonstituovaná voda
|
Čistá povrchová, studniční nebo rekonstituovaná voda
|
|
16.
|
Trvání expozice zkoušené chemické látce
|
|
60 dnů po vylíhnutí
|
60 dnů po vylíhnutí
|
60 dnů po vylíhnutí
|
|
|
Úspěšné vylíhnutí, přežití makroskopická morfologie, VTG histologie gonád, genetické pohlaví, poměr pohlaví
|
Úspěšné vylíhnutí, přežití makroskopická morfologie, VTG histologie gonád, poměr pohlaví
|
Úspěšné vylíhnutí, přežití makroskopická morfologie, VTG histologie gonád, poměr pohlaví
|
|
18.
|
Kritéria přijatelnosti zkoušky pro sloučená opakování kontrolních skupin
|
|
Úspěšné vylíhnutí > 80 %
|
Úspěšné vylíhnutí > 80 %
|
Úspěšné vylíhnutí > 80 %
|
|
přežití po vylíhnutí ≥ 70 %
|
přežití po vylíhnutí ≥ 70 %
|
Přežití po vylíhnutí ≥ 70 %
|
|
růst (živá hmotnost ryby, po osušení do sucha) > 150 mg
|
růst (živá hmotnost ryby, po osušení do sucha) > 75 mg
|
růst (živá hmotnost ryby, po osušení do sucha) > 120 mg
|
|
délka (standardní délka) > 20 mm
|
délka (standardní délka) > 14 mm
|
délka (standardní délka) > 20 mm
|
|
poměr pohlaví (% samečků nebo samiček)
30 %–70 %
|
poměr pohlaví (% samečků nebo samiček) 30 %–70 %
|
poměr pohlaví (% samečků nebo samiček) 30 %–70 %
|
Dodatek 3
Chemické charakteristiky vhodné ředicí vody
|
SLOŽKA
|
KONCENTRACE
|
|
Pevné částice
|
< 20 mg/l
|
|
Celkový organický uhlík
|
< 2 mg/l
|
|
Volný (neiontový) amoniak
|
< 1 μg/l
|
|
Zbytkový chlor
|
< 10 μg/l
|
|
Celkový obsah organofosforových pesticidů
|
< 50 ng/l
|
|
Celkový obsah organochlorových pesticidů a polychlorovaných bifenylů
|
< 50 ng/l
|
|
Celkový obsah organických sloučenin chloru
|
< 25 ng/l
|
Dodatek 4
Ze zkušební metody C.14/Pokyny týkající se zkušebních koncentrací
|
Sloupec (počet koncentrací mezi 100 a 10, nebo mezi 10 a 1) (28)
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
|
32
|
46
|
56
|
63
|
68
|
72
|
75
|
|
10
|
22
|
32
|
40
|
46
|
52
|
56
|
|
3,2
|
10
|
18
|
25
|
32
|
37
|
42
|
|
1,0
|
4,6
|
10
|
16
|
22
|
27
|
32
|
|
|
2,2
|
5,6
|
10
|
15
|
19
|
24
|
|
|
1,0
|
3,2
|
6,3
|
10
|
14
|
18
|
|
|
|
1,8
|
4,0
|
6,8
|
10
|
13
|
|
|
|
1,0
|
2,5
|
4,6
|
7,2
|
10
|
|
|
|
|
1,6
|
3,2
|
5,2
|
7,5
|
|
|
|
|
1,0
|
2,2
|
3,7
|
5,6
|
|
|
|
|
|
1,5
|
2,7
|
4,2
|
|
|
|
|
|
1,0
|
1,9
|
3,2
|
|
|
|
|
|
|
1,4
|
2,4
|
|
|
|
|
|
|
1,0
|
1,8
|
|
|
|
|
|
|
|
1,3
|
|
|
|
|
|
|
|
1,0
|
Dodatek 5
Návod k homogenizaci hlavy a ocasu z nedospělých danií pruhovaných, jelečka velkohlavého, koljušky tříostné a halančíka japonského
Účelem tohoto oddílu je popsat postupy, které je třeba dodržet před stanovením hladiny koncentrace VTG. Lze použít jiné postupy, jež vedou ke srovnatelné kvantifikaci VTG. Namísto užití homogenátu hlavy/ocasu je možné koncentraci VTG určit z krevní plazmy nebo z jater.
Postup
|
1.
|
Ryba se anestetizuje a usmrtí v souladu s popisem zkoušky.
|
|
2.
|
Odřízne se hlava a ocas v souladu s popisem zkoušky. Důležité: Veškeré pitevní nástroje a pracovní stůl je třeba mezi zpracováním každé jednotlivé ryby řádně omýt a vyčistit (např. 96 % ethanolem), aby se zabránilo ‚znečištění VTG‘ přenosem ze samiček nebo ze samečků, u kterých byly vyvolány účinky, na samečky, u kterých účinky vyvolány nebyly.
|
|
3.
|
Společná hmotnost hlavy a ocasu každé ryby se stanoví se zaokrouhlením na mg.
|
|
4.
|
Po zvážení se části vloží do vhodných zkumavek (např. Eppendorfovy zkumavky o objemu 1,5 ml) a zmrazí se při teplotě –80 °C až do homogenizace nebo se přímo homogenizují na ledu pomocí dvou plastových paliček. (Lze užít i jiných metod, jsou-li prováděny na ledu a je-li výsledkem homogenní hmota.) Důležité:
Zkumavky je třeba řádně očíslovat, aby bylo možné hlavu a ocas z určité ryby porovnat s příslušným řezem těla, který se použije pro histologii gonád.
|
|
5.
|
Jakmile se dosáhne homogenní hmoty, přidá se ledový homogenizační pufr
(29) v množství 4–10krát větším než hmotnost tkáně (ředění se zaznamená). V práci s paličkami se pokračuje, dokud není směs homogenní. Důležitá poznámka:
Na každou rybu se použijí nové paličky.
|
|
6.
|
Vzorky se položí na led až do odstřeďování při teplotě 4 °C po dobu 30 min při zrychlení 50 000 g.
|
|
7.
|
Pomocí pipety přeneste části o velikosti 20–50 μl (množství zaznamenejte) supernatantu do nejméně dvou zkumavek tak, že špičku pipety ponoříte pod tukovou vrstvu na hladině a opatrně nasajete supernatant bez frakcí tuku nebo sedimentu.
|
|
8.
|
Zkumavky se až do použití uskladní při teplotě – 80 °C.
|
Poznámka: Homogenizační pufr by měl být použit ve stejný den, kdy byl vyroben. Během použití ho uchovávejte na ledu.
Dodatek 6
Návod ke kvantifikaci vitelogeninu z homogenátu hlavy a ocasu dania pruhovaného (Danio rerio) (upraveno z Holbech a další, 2001). lze použít jiné postupy za použití homologických protilátek a standardů
|
1.
|
Mikrotitrační destičky (certifikované, Maxisorp F96, Nunc, Roskilde Denmark) předem pokryté 5 μg/ml lipovitellinu-IgG se rozmrazí a třikrát promyjí promývacím pufrem (*).
|
|
2.
|
Očištěný standard (30) dania pruhovaného pro stanovení vitelogeninu se sériově rozředí ředicím pufrem (**) na 0,2, 0,5, 1, 2, 5, 10 a 20 ng/ml, vzorky se zředí nejméně 1/200 ředicím pufrem (s cílem zabránit matricovému efektu) a nanesou se na destičky. V opakování se použije vzorek z kontrolní skupiny. Do každé jamky se vloží 150 μl. Standardy se testují ve dvou opakováních a vzorky ve třech opakováních. Inkubují se přes noc na třepačce při teplotě 4 °C.
|
|
3.
|
Destičky se pětkrát promyjí promývacím pufrem (*).
|
|
4.
|
Křenová peroxydáza (HRP) sloučená v řetězec dextranu (např. AMDEX A/S, Denmark) a konjugované protilátky se rozředí v promývacím pufru; skutečné zředění se liší podle šarže a stáří. Do každé jamky se vloží 150 μl a destičky se 1 hodinu inkubují na třepačce při pokojové teplotě.
|
|
5.
|
Destičky se pětkrát promyjí promývacím pufrem (*) a dno jamek se důkladně vyčistí ethanolem.
|
|
6.
|
Do každé jamky se vloží 150 μl TNB plus (***). Destičku je třeba chránit před světlem pomocí staniolu a kontrolovat změnu barvy na třepačce.
|
|
7.
|
Jakmile se standardní křivka plně rozvine, činnost enzymů se zastaví přidáním 150 μl 0,2 M H2SO4 do každé jamky.
|
|
8.
|
Absorbance se měří při 450 nm (např. na analyzátoru destiček Molecular Devices Thermomax). Údaje se analyzují pomocí příslušného softwaru (např. Softmax).
|
|
(*)
|
Promývací pufr:
|
PBS-stock (****)
|
500,0
|
ml
|
|
BSA
|
5,0
|
g
|
|
Tween 20
|
5,0
|
ml
|
|
Hodnota pH se upraví na 7,3 a doplní se do 5 l deionizovanou H2O (Millipore). Skladuje se při 4 °C.
|
|
|
(**)
|
Ředicí pufr:
|
PBS-Stock(****)
|
100,0
|
ml
|
|
BSA
|
3,0
|
g
|
|
Tween 20
|
1,0
|
ml
|
|
Hodnota pH se upraví na 7,3 a doplní se do 1 l deionizované H2O (Millipore). Skladuje se při 4 °C.
|
|
|
(***)
|
TMB plus je substrát ‚k okamžitému použití‘ vyráběný společností KemEnTec (Dánsko). Je citlivý na světlo. Skladuje se při 4 °C.
|
|
(****)
|
PBS-stock
|
NaCl
|
160,0
|
g
|
|
KH2PO4
|
4,0
|
g
|
|
Na2HPO4 · 2H2O
|
26,6
|
g
|
|
KCl
|
4,0
|
g
|
|
Hodnota pH se upraví na 6,8 a doplní se do 2 l deionizované H2O (Millipore). Skladuje se při pokojové teplotě.
|
|
Dodatek 7
Návod k přípravě tkáňových řezů pro určení pohlaví a určení stadií gonád
Účelem tohoto oddílu je popsat postupy, ke kterým dochází před hodnocením histologických řezů. Mohou být použity jiné postupy, které vedou k obdobnému určení pohlaví a určení stadií gonád.
S několika málo výjimkami jsou tyto postupy obdobné pro halančíka japonského i danio pruhované.
Usmrcení, pitva a fixace tkání
Cíle:
|
1.
|
Humánní usmrcení ryby.
|
|
2.
|
Získání potřebných tělesných hmotností a měření.
|
|
3.
|
Vyhodnocení druhotných pohlavních znaků.
|
|
4.
|
Disekce tkání pro analýzu VTG.
|
Postupy:
|
1.
|
Ryba by se měla usmrtit bezprostředně před pitvou. Není-li k dispozici větší počet osob provádějících pitvu, nemělo by proto být usmrcováno více ryb současně.
|
|
2.
|
Ryba se pomocí malého podběráku vyjme z experimentální nádrže a přenese se v dopravní nádržce do pitevního prostoru.
|
|
3.
|
Vloží se do usmrcujícího roztoku. Poté, co se zastaví dýchání a ryba nereaguje na vnější podněty, z roztoku se vyjme.
|
|
5.
|
Za účelem přípravy tkání pro analýzu VTG lze rybu na korkové podložce položit na stolek pitevního mikroskopu.
|
a.
|
U dania pruhovaného se odřízne hlava těsně za prsní ploutví a ocas těsně za hřbetní ploutví.
|
|
b.
|
U halančíka japonského se opatrně otevře břicho řezem, který je veden po střední linii od hrudního pletence k bodu na kraniálním okraji řitního otvoru. Pomocí malé pinzety a malých nůžek se opatrně vyjmou játra.
|
|
|
6.
|
Vzorek pro analýzu VTG se vloží do Eppedorfových zkumavek a okamžitě zmrazí v tekutém dusíku.
|
|
7.
|
Mrtvé tělo včetně gonád se vloží do etiketou předem označené plastové kazety na tkáně, která se přenese do Davidsonova nebo Bouinova fixačního roztoku. Objem fixačního roztoku by měl být alespoň desetinásobkem odhadovaného objemu tkání. Fixační nádrž se po dobu 5 sekund jemně protřepe, aby se z kazety odstranily vzduchové bubliny.
|
|
8.
|
|
a.
|
V Davidsonově fixačním roztoku zůstanou všechny tkáně přes noc a příštího dne se přemístí do individuálních nádrží s 10 % neutrálním pufrovaným formalínem. Nádrže s kazetami se po 5 minut jemně protřepou s cílem zajistit dostatečně proniknutí formalínu do kazet.
|
|
b.
|
V Bouinově fixačním roztoku zůstanou tkáně po 24 h, poté se přenesou do 70 % ethanolu.
|
|
Zpracování tkání
Cíle:
|
1.
|
Dehydratace tkáně pro dostatečné proniknutí parafínu.
|
|
2.
|
Impregnace tkáně parafínem, aby zůstala zachována integrita tkání, a vytvoření pevného povrchu pro mikrotomii.
|
Postupy:
|
3.
|
Tkáňové kazety označené etiketou se vyjmou z formalínového/ethylenového uložení a vloží se do koše (košů) ke zpracování. Koš se vloží do tkáňového procesoru.
|
|
4.
|
Zvolí se plán zpracování.
|
|
5.
|
Poté, co tkáňový procesor dokončí cyklus zpracování, koš (koše) je možné přenést do zalévacího přístroje.
|
Zalití
Cíl:
Řádná orientace vzorku ve ztuhlém parafínu pro mikrotomii.
Postupy:
|
1.
|
Koš (koše) s kazetami se vyjme (vyjmou) z procesoru a ponoří se do přední komory termální konzoly zalévacího přístroje naplněné parafínem nebo se kazety přenesou do samostatného ohřívače parafínu.
|
|
2.
|
První kazeta, která má být zalita, se vyjme z přední komory termální konzole nebo z ohřívače parafínu. Víčko kazety se sejme a odstraní se a zkontroluje se etiketa na kazetě, zda odpovídá záznamům o zvířeti, aby se případné nesrovnalosti vyřešily ještě před zalitím.
|
|
3.
|
Vybere se zalévací forma vhodné velikosti.
|
|
4.
|
Formy se podrží pod výtokovým otvorem dávkovací konzoly a naplní se roztaveným parafínem.
|
|
5.
|
Z kazety se vyjme vzorek a vloží se do roztaveného parafínu ve formě. To se opakuje se 4–8 vzorky na každou formu s parafínem. Poloha jednotlivých ryb se vyznačí tak, že se ryba č. 1 uloží v úhlu 180 stupňů vůči rybám č. 2–4/8.
|
|
6.
|
Přidá se další parafín, aby byl vzorek zakryt.
|
|
7.
|
Forma s dnem kazety se vloží na chladicí desku kryokonzole.
|
|
8.
|
Po ztuhnutí parafínu se blok (tj. ztuhlý parafín s tkáněmi a dnem kazety) vyjme z formy.
|
Mikrotomie
Cíl:
Provedení a uložení histologických řezů za účelem zbarvení.
Postupy:
|
1.
|
Počáteční fáze mikrotomie, která se nazývá ‚odkrytí‘, se provádí takto:
|
a)
|
Parafínový blok se vloží do svorky mikrotomu.
|
|
b)
|
Svorka se posune otáčením kolečka mikrotomu a z parafínového povrchu bloku se odřezávají silné plátky, dokud nůž nedosáhne uložených tkání.
|
|
c)
|
Tloušťka řezů na mikrotomu se nastaví mezi 3–5 mikrony. Svorka se posune a z bloku se několika řezy odstraní jakékoli artefakty, jež vznikly na odříznutém povrchu tkání během hrubých řezů.
|
|
d)
|
Blok je možné vyjmout ze svorky a položit jej lícem dolů na led, aby tkáň nabobtnala.
|
|
|
2.
|
Další fází mikrotomie je provedení konečných řezů a umístění tkáně na podložní sklíčka. Tyto postupy se provádějí takto:
|
a)
|
Pokud byl blok položen na led, z ledu se sejme a znovu se vloží do svorky mikrotomu.
|
|
b)
|
Svorka se posunuje otáčením kolečka mikrotomu, přičemž tloušťka řezu je nastavena na 3–5 mikronů. Z bloku se odřezávají řezy, dokud se nezíská ‚páska‘ obsahující alespoň jeden přijatelný řez včetně gonád. (V případě potřeby je možné blok během provádění řezů ze svorky vyjmout, položit na led, aby tkáň nabobtnala, a vrátit do svorky.)
|
|
c)
|
Řezy se umístí na hladinu vody ve vodní lázni. Usiluje se o získání alespoň jednoho řezu, který nebude zvrásněný a pod nímž nebudou zachyceny žádné vzduchové bublinky.
|
|
d)
|
Podložním sklíčkem mikroskopu se podloží nejlepší řez, který se pomocí sklíčka vyjme z vody. Tento postup se označuje jako ‚umístění‘ řezu na podložní sklíčko.
|
|
e)
|
Pro soubor ryb se připraví tři řezy. Druhý a třetí řez se provedou v intervalech 50 mikronů od prvního řezu. Pokud ryba s gonádami nebyla uložena do stejné úrovně provádění řezů, je třeba provést více řezů, aby se zajistilo, že z každé ryby bude získáno alespoň šest řezů obsahujících gonády.
|
|
f)
|
Tužkou pro označování sklíček se na sklíčko zaznamená číslo bloku, z něhož byl řez pořízen.
|
|
g)
|
Sklíčko se umístí na barvicí stojan.
|
|
h)
|
Blok se vyjme ze svorky a uloží se lícem dolů k uskladnění.
|
|
Barvení vzorků, překrytí krycím sklíčkem a označování
Cíle:
|
—
|
Obarvení řezů pro histopatologické vyšetření.
|
|
—
|
Trvalé zapečetění zbarvených tkání.
|
|
—
|
Trvalá identifikace zbarvených vzorků způsobem, který umožní jejich plnou vysledovatelnost.
|
Postupy:
|
1.
|
Barvení
|
a.
|
Vzorky se přes noc před barvením vysuší na vzduchu.
|
|
b.
|
Řezy se obarví hematoxylinem-eosinem.
|
|
|
2.
|
Překrytí krycím sklíčkem
|
a.
|
Krycí sklíčka lze nasazovat ručně nebo automaticky.
|
|
b.
|
Vzorek se ponoří do xylenu nebo do přípravku TissueClear a přebytek xylenu nebo TissueClear se ze vzorku jemně sklepne.
|
|
c.
|
U konce vzorku opačného, než je zmrazený konec, nebo na krycí sklíčko se nanese přibližně 0,1 ml barvicího média.
|
|
d.
|
Krycí sklíčko se nakloní v mírném úhlu a položí na vzorek.
|
|
|
3.
|
Označování
|
a.
|
Každá etiketa na vzorku by měla obsahovat tyto informace:
|
iii.
|
Č. vzorku / č. podkladového sklíčka
|
|
iv.
|
Chemickou látku / expoziční skupinu
|
|
|
Dodatek 8
Schéma – statistické metody pro analýzu vitelogeninu

Schéma – statistické metody pro analýzu poměru pohlaví

Dodatek 9
Návod k odběru vzorků pro určení genetického pohlaví a pro určení genetického pohlaví metodou PCR
Odběr, příprava a uskladnění vzorků před určením genetického pohlaví u halančíka japonského metodou PCR (připraveno Laboratoří pro vodní organismy společnosti Bayer CropScience AG)
|
1.
|
Z každé jednotlivé ryby se jemnými nůžkami odstřihne řitní ploutev nebo hřbetní ploutev a umístí se do zkumavky obsahující 100 μl extrakčního pufru 1 (podrobnosti o přípravě pufru viz níže). Po každé jednotlivé rybě se nůžky očistí v kádince s destilovanou H2O a osuší se papírovým ubrouskem.
|
|
2.
|
Nyní se ploutvové tkáně v mikrozkumavce homogenizují teflonovou tyčinkou pro lýzu buněk. Pro každou zkumavku se použije nová tyčinka, aby se zabránilo jakékoli kontaminaci. Tyčinky se přes noc vloží do roztoku 0,5 M NaOH, po dobu 5 minut oplachují destilovanou H2O a skladují v etanolu nebo sterilizátoru po ošetření v autoklávu až do použití.
|
|
3.
|
Je také možné ploutvové tkáně skladovat bez extrakčního pufru 1 na suchém ledu a poté v mrazničce při teplotě – 80 °C, aby se zabránilo jakékoli degeneraci DNA. Extrakce však probíhá lépe, pokud se současně extrahuje DNA (manipulace viz výše; před přidáním pufru do zkumavky by vzorky po skladování při teplotě – 80 °C měly být rozmrazeny na ledu).
|
|
4.
|
Po homogenizaci se všechny zkumavky vloží do vodní lázně a nechají po 15 minut vařit při teplotě 100 °C.
|
|
5.
|
Poté se do každé zkumavky pipetou vloží 100 μl extrakčního pufru 2 (podrobnosti o přípravě pufru viz níže). Vzorky se ponechají 15 minut při pokojové teplotě za občasného jemného protřepání v ruce.
|
|
6.
|
Poté se všechny zkumavky znovu vloží do vodní lázně a nechají dalších 15 minut vařit při teplotě 100 °C.
|
|
7.
|
Až do další analýzy jsou zkumavky zmrazeny při teplotě – 20 °C.
|
Příprava pufru
Pufr PCR 1:
|
|
500 mg N-Lauroylsarcosin (např. Merck KGaA, Darmstadt, Německo)
|
|
|
doplnit destilovanou H2O do objemu 100 ml
|
Pufr PCR 2:
|
|
20 g Chelex (např. Biorad, München, Německo)
|
|
|
nechat nabobtnat ve 100 ml destilované H2O
|
Určení genetického pohlaví (metodou PCR) u halančíka japonského (připraveno Laboratoří pro vodní organismy společnosti Bayer CropScience AG a Biocentrem Univerzity ve Würzburgu)
Připravené a zmrazené zkumavky (jak je popsáno v předchozím oddíle) se rozmrazí na ledu. Poté se odstředí odstředivkou Eppendorf (30 sekund při maximální rychlosti, při pokojové teplotě). Pro PCR se použije čistý supernatant oddělený od sraženiny. Je naprosto nezbytné zabránit tomu, aby se do reakce PCR dostaly jakékoli stopy Chelexu (nacházející se ve sraženině), protože by interferoval s působením tzv. Taq-polymerázy. Supernatant se použije přímo nebo ho lze zmrazit (na teplotu – 20 °C) a znovu rozmrazit v několika cyklech bez negativního dopadu na DNA pro pozdější analýzy.
1. Příprava ‚reakční směsi‘ (25 μl na každý vzorek):
|
|
Objem
|
Konečná koncentrace
|
|
Templátová DNA
|
0,5 μl–2 μl
|
|
|
10x pufr PCR s MgCl2
|
2,5 μl
|
1x
|
|
Nukleotidy (každý z dATP, dCTP, dGTP, dTTP)
|
4 μl (5mM)
|
200 μM
|
|
Přímý primer (10 μM) (viz níže 3–5)
|
0,5 μl
|
200nM
|
|
Reverzní primer (10 μM) (viz níže 3-5)
|
0,5 μl
|
200 nM
|
|
DMSO
|
1,25 μl
|
5 %
|
|
Voda (PCR grade)
|
do 25 μl
|
|
|
Taq-E-polymeráza
|
0,3 μl
|
1,5 U
|
|
10x pufr PCR s MgCl2: 670 mM Tris/HCl (pH 8,8 při 25 °C), 160 mM (NH4)2SO4, 25 mM MgCl2, 0,1 % Tween 20
|
Pro každou reakci PCR (viz níže 3–5) je potřeba zvláštní primer jako nová kombinace ‚reakční směsi‘ a příslušného potřebného množství templátové DNA pro každý vzorek (viz výše). Příslušné objemy se pipetami přenesou do nových zkumavek. Poté se všechny zkumavky uzavřou, míchají (asi 10 sekund) a odstředí (10 sekund, při pokojové teplotě). Poté lze zahájit příslušné programy PCR. V každém programu se kromě toho použije jedna pozitivní kontrola (modelový vzorek DNA se známou aktivitou a jasnými výsledky) a jedna negativní kontrola (1 μl dest. H2O).
2. Příprava agarózového gelu (1 %) – během probíhajících programů PCR
|
—
|
Rozpusťte 3 g agarózy v 300 ml 1 × pufru TAE (1 % agarózový gel).
|
|
—
|
Tento roztok by se měl povařit v mikrovlnné troubě (asi 2–3 min).
|
|
—
|
Horký roztok přeneste do speciální odlévací schránky, která je položena na ledu.
|
|
—
|
Přibližně po 20 minutách je agarózový gel připraven k použití.
|
|
—
|
Agarózový gel skladujte v 1 × pufru TAE až do konce programů PCR.
|
3. Program PCR s aktinem
Cílem tohoto programu PCR je prokázat, že DNA ve vzorku není poškozena.
|
—
|
Speciální primer:
|
—
|
‚Mact1(horní/přímý)‘ → TTC AAC AGC CCT GCC ATG TA
|
|
—
|
‚Mact2(dolní/reverzní)‘ → GCA GCT CAT AGC TCT TCT CCA GGG AG
|
|
|
—
|
Program:
|
—
|
Cyklus (35krát):
|
Denaturace
|
→ 45 s při 95 °C
|
|
Nasedání
|
→ 45 s při 56 °C
|
|
Prodloužení
|
→ 1 min při 68 °C
|
|
|
4. Program PCR k zjištění genů X a Y
Při tomto programu se vzorky s nepoškozenou DNA použijí k zjištění genů X a Y. Samčí DNA by se měla projevit jedním dvojitým proužkem a samičí DNA jedním jednoduchým proužkem (po obarvení a gelové elektroforéze). Pro tento program by měla být zařazena jedna pozitivní kontrola pro samčí vzorek (vzorek XY) a jedna pro samičí vzorek (vzorek XX).
|
—
|
Speciální primer:
|
—
|
‚PG 17.5‘ (horní/přímý) → CCG GGT GCC CAA GTG CTC CCG CTG
|
|
—
|
‚PG 17.6‘ (dolní/reverzní) → GAT CGT CCC TCC ACA GAG AAG AGA
|
|
|
—
|
Program:
|
—
|
Cyklus (40krát):
|
Denaturace
|
→ 45 s při 95 °C
|
|
Nasedání
|
→ 45 s při 55 °C
|
|
Prodloužení
|
→ 1 min 30 s při 68 °C
|
|
|
5. Program PCR k zjištění genů Y jako ‚kontrola‘ pro program PCR k zjištění genů X a Y:
Tento program PCR ověřuje výsledky ‚programu PCR k zjištění genů X a Y‘. ‚Samčí vzorky‘ by měly vykázat jeden proužek a ‚samičí vzorky‘ by neměly vykázat žádný proužek (po obarvení a gelové elektroforéze).
|
—
|
Speciální primer:
|
—
|
‚DMTYa (horní/přímý)‘ → GGC CGG GTC CCC GGG TG
|
|
—
|
‚DMTYd (dolní/reverzní)‘ → TTT GGG TGA ACT CAC ATG G
|
|
|
—
|
Program:
|
—
|
Cyklus (40krát):
|
Denaturace
|
→ 45 s při 95 °C
|
|
Nasedání
|
→ 45 s při 56 °C
|
|
Prodloužení
|
→ 1 min při 68 °C
|
|
|
6. Barvení vzorků PCR:
Barvicí roztok:
Pomocí pipety se do každé jednotlivé zkumavky přidá 1 μl barvicího roztoku.
7. Zahájení gelové elektroforézy:
|
—
|
Připravený 1 % agarózový gel se přenese do komory pro gelovou elektroforézu naplněné 1 × pufrem TAE.
|
|
—
|
10–15 μl každého obarveného vzorku PCR se pipetou umístí do jamky v agarózovém gelu.
|
|
—
|
Do samostatné jamky se pipetou nanese také 5–15 μl velikostního markeru – 1kb žebříku (Invitrogen).
|
|
—
|
Zahájí se elektroforéza při 200 V.
|
|
—
|
Po 30–45 min se proces ukončí.
|
8. Určení pruhů:
|
—
|
Agarózový gel se omyje v destilované H2O.
|
|
—
|
Následně se agarózový gel na 15–30 min umístí do ethidiumbromidu.
|
|
—
|
Poté by měl být pořízen snímek agarózového gelu v UV transiluminátoru.
|
|
—
|
Nakonec se vzorky analyzují porovnáním s pruhem (nebo pruhy) pozitivní kontroly a s markerem (žebříkem).
|
Dodatek 10
Návod k odběru tkáňových vzorků pro určení genetického pohlaví u koljušky tříostné metodou PCR
Odběr tkáňových vzorků a extrakce DNA
DNA lze extrahovat pomocí různých komerčně dostupných činidel a ručních i automatizovaných extrakčních systémů. Níže je ve stručnosti popsán protokol používaný v laboratoři CEFAS, Weymouth, popřípadě s doplněnými alternativními postupy.
|
1.
|
Z každé jednotlivé ryby se jemnými nůžkami odstřihne malý kousek tkáně (10–20 mg) z dorzálně laterální oblasti (po odstranění hlavy a ocasu pro analýzu VTG). Tkáň se vloží do zkumavky a ta se buď umístí přímo do kapalného dusíku (pro skladování při teplotě – 80 °C), nebo se naplní 70 % ethanolem (pro přepravu a následné skladování při teplotě 4 °C). Nůžky se po každé jednotlivé rybě očistí v 70 % ethanolu a poté v destilované vodě a osuší se hedvábným papírem.
|
|
2.
|
Ethanol (je-li přítomen) se odstraní odsátím a tkáň se nechá přes noc vyluhovat s proteinázou K ve 400 μl pufru ATL (Qiagen). Poměrný podíl (200 μl) výluhu se přemístí do S-bloku s 96 jamkami (Qiagen) a DNA se extrahuje v 96jamkovém formátu za pomoci biorobota Qiagen Universal BioRobot a soupravy QIamp Investigator BioRobot kit. DNA se eluuje v 50 μl vody prosté DNázy a RNázy. Použijí-li se pro extrakci DNA tvrdé tkáně (jako je hřbetní nebo prsní ploutev), může být nezbytné homogenizovat vzorek v lýzovém pufru za pomoci homogenizátoru FastPrep® nebo rovnocenného systému pro narušení tkání.
Alternativní postup:
|
a)
|
Tkáň se nechá přes noc vyluhovat s proteinázou K ve 400 μl lýzového pufru G2 (Qiagen) a DNA se extrahuje z 200 μl výluhu za pomoci buď soupravy EZ-1 DNA easy tissue kit a biorobota EZ-1, nebo soupravy DNA easy tissue mini kit. DNA se eluuje v objemu 50 μl.
|
|
b)
|
Tkáně se zpracují pomocí činidla DNAzol. Vzorky tkání se krátce (10 minut) lýzují v 1 ml DNAzolu v mikrocentrifugační zkumavce o objemu 1,5 ml a poté se odstředí 5 minut při 13 000 ot/min, aby se odstranily veškeré pevné částice. Lýzovaný vzorek se poté přemístí do nové mikrocentrifugační zkumavky o objemu 1,5 ml, která obsahuje 500 μl 100 % ethanolu molekulární kvality, a 10 minut se odstředí při 13 000 ot/min, aby se vysrážela DNA. Ethanol se odstraní a nahradí se 400 μl 70 % ethanolu molekulární kvality, 5 minut se odstředí při 13 000 ot/min a peleta DNA se rozpustí v 50 μl vody s molekulovou kvalitou, prosté DNázy a RNázy. Opět, použijí-li se tvrdé tkáně (prsní ploutev), může být nezbytné před extrakcí DNA homogenizovat vzorek v lýzovém pufru za pomoci homogenizátoru FastPrep® nebo rovnocenného systému pro narušení tkání.
|
|
|
3.
|
DNA se skladuje až do použití při teplotě – 20 °C.
|
Důležitá poznámka: při těchto postupech se musí používat rukavice.
Analýza pomocí polymerázové řetězové reakce (PCR)
Byly provedeny amplifikace pomocí 2,5 μl extraktu DNA v 50 μl objemu do reakce za použití primerů Idh locus (popsaných v publikaci Peichel et al., 2004. Current Biology 1:1416–1424):
|
Přímý primer
|
5′ GGG ACG AGC AAG ATT TAT TGG 3′
|
|
Reverzní primer
|
5′ TAT AGT TAG CCA GGA GAT GG 3′
|
Existuje řada dodavatelů vhodných činidel pro PCR. Níže uvedená metoda se v současnosti používá v Centru pro životní prostředí, rybolov a akvakulturu (CEFAS), v laboratořích ve Weymouthu.
1. Příprava ‚reakční směsi‘ (50 μl na každý vzorek):
Pracovní roztok (‚mastermix‘) se připraví následujícím způsobem. Lze jej připravit předem a uskladnit zmrazený při teplotě – 20 °C až do použití. Mastermixu se připraví dostatečné množství i pro negativní kontrolu (použije se pouze voda jakosti pro molekulární biologii).
|
|
Objem (koncentrace zásobního roztoku) na vzorek
|
Konečná koncentrace
|
|
5x reakční pufr GoTaq®
|
10 μl
|
1x
|
|
MgCl2
|
5 μl (25 mM)
|
2,5 mM
|
|
Nukleotidy (dATP, dCTP, dGTP, dTTP)
|
0,5 μl (25 mM každý)
|
250 μM každý
|
|
Přímý primer
|
0,5 μl (0,1 nmol/μl)
|
2,0 μM
|
|
Reverzní primer
|
0,5 μl (0,1 nmol/μl)
|
2,0 μM
|
|
Voda jakosti pro molekulární biologii
|
30,75 μl
|
|
|
GoTaq polymeráza
|
0,25 μl
|
1,25 U
|
|
—
|
47,5 μl se odpipetuje do tenkostěnné zkumavky pro PCR o objemu 0,5 ml, označené etiketou.
|
|
—
|
Do vhodně označené zkumavky se přidá 2,5 μl purifikované DNA. Opakuje se pro všechny vzorky a pro negativní kontrolu.
|
|
—
|
Pokryje se 2 kapkami minerálního oleje. Alternativně lze použít termocykler s nahřátým víčkem.
|
|
—
|
Vzorky se 5 minut denaturují v termocykleru Peltier PTC-225 při teplotě 94 ± 2 °C a následuje 39 cyklů 1 minuta při teplotě 94 ± 2 °C, 1 minuta při teplotě 55 ± 2 °C, 1 minuta při teplotě 72 ± 2 °C a konečná extenze 10 minut při teplotě 72 ± 2 °C.
|
2. Příprava agarózového gelu (2 %):
Produkty PCR se tradičně zpracovávají v 20 % agarózovém gelu, který obsahuje ethidiumbromid.
Lze rovněž použít systémy kapilární elektroforézy.
|
—
|
Odváží se 2 g agarózy ve 100 ml 1 × pufru TAE
|
|
—
|
Ohřeje se v mikrovlnné troubě (asi 2–3 min), aby se agaróza rozpustila.
|
|
—
|
Přidají se 2 kapky ethidiumbromidu v konečné koncentraci 0,5 μg/ml.
|
|
—
|
Horký roztok se přenese do zařízení na odlévání gelů.
|
3. Gelová elektroforéza:
|
—
|
Agarózový gel se přemístí do elektroforézního zařízení a ponoří se do 1 × pufru TAE.
|
|
—
|
20 μl z každého vzorku se naloží do samostatných jamek a do náhradní jamky se přidá marker molekulové hmotnosti (100 bp DNA ladder, Promega).
|
|
—
|
Elektroforéza se provádí 30–45 minut při 120 V.
|
4. Vizualizace produktů amplifikace
Pokud byl do agarózového gelu přidán ethidiumbromid, jak bylo popsáno výše, produkty DNA se vizualizují pod zdrojem UV záření. Alternativně se agarózový gel obarví ponořením do zředěného roztoku ethidiumbromidu (0,5 μg na ml vody) po dobu 30 minut před vizualizací.
Dodatek 11
Postup umělého oplodnění u koljušky tříostné
Účelem tohoto oddílu je popsat postup, jak získat oplodněné jikry koljušky tříostné se zřetelem k jejich použití ve zkoušce FSDT.
Postupy
Získání spermatu od samečků
|
1.
|
Dobře vybarvený sameček z požadované populace se usmrtí.
|
|
2.
|
Z obou boků ryby se vyříznou varlata. Varlata jsou obvykle silně pigmentované struktury tyčinkovitého tvaru, které jsou snadno rozeznatelné v laterální střední linii těla. Použije se některá z následujících metod:
|
|
3.
|
Jemnými nůžkami se vede řez od kloaky v délce 1–1,5 cm jedním střihem přibližně pod úhlem 45 stupňů.
|
|
4.
|
Skalpelem se provede malý řez na boku ryby poněkud posteriorně za pánví a přímo ventrálně od laterálních destiček.
|
|
5.
|
Varlata se jemnou pinzetou vyjmou a umístí se do Petriho misky.
|
|
6.
|
Každé varle se pokryje 100 μl čerstvě připraveného Hankova konečného roztoku
(31).
|
|
7.
|
Varlata se břitvou nebo skalpelem nakrájejí na malé kostičky. Tím se uvolní sperma, které dodá Hankovu roztoku mléčný vzhled.
|
|
8.
|
Tekutina obsahující sperma se přidá do zkumavky, přičemž se dbá na to, aby při přenosu pipetou neobsahovala žádné kousky tkáně varlat.
|
|
9.
|
Do zkumavky se přidá 800 μl of Hankova konečného roztoku a dobře se promíchá.
|
|
10.
|
V případě potřeby lze samečka uchovávat fixací ve 100 % ethanolu nebo v jiném požadovaném fixativu. To je zvlášť důležité, pokud se při studii určuje parentální původ potomků.
|
Důležitá poznámka: Většinu požadovaných zásobních roztoků lze připravit předem, avšak
zásobní roztok 5
a následně
konečný roztok
by měly být
čerstvě
připraveny v den použití.
|
Zásobní roztok 1
|
|
NaCl
|
8,00 g
|
|
KCl
|
0,40 g
|
|
destilovaná voda
|
100 ml
|
|
Zásobní roztok 2
|
|
Na2HPO4 (bezvodý)
|
0,358 g
|
|
KH2PO4
|
0,60 g
|
|
destilovaná voda
|
100 ml
|
|
Zásobní roztok 3
|
|
CaCl2
|
0,72 g
|
|
destilovaná voda
|
50 ml
|
|
Zásobní roztok 4
|
|
MgSO4 · 7H2O
|
1,23 g
|
|
destilovaná voda
|
50 ml
|
|
Zásobní roztok 5 (čerstvě připravený)
|
|
NaHCO3
|
0,35 g
|
|
destilovaná voda
|
10 ml
|
Poznámka: Je-li některá z výše uvedených solí již k dispozici, avšak s odlišným obsahem vody (např. 2H2O, a nikoli bezvodá), lze ji přesto použít, ale nejprve je třeba upravit její hmotnost na základě molekulové hmotnosti).
Pro získání Hankova konečného roztoku se zkombinují v tomto pořadí:
|
zásobní roztok 1
|
1,0 ml
|
|
zásobní roztok 2
|
0,1 ml
|
|
zásobní roztok 3
|
0,1 ml
|
|
destilovaná voda
|
8,6 ml
|
|
zásobní roztok 4
|
0,1 ml
|
|
zásobní roztok 5
|
0,1 ml
|
Před použitím se dobře promíchá.
Oplodnění
|
1.
|
Z požadované populace se vyberou velké, gravidní samičky; samičky jsou připraveny k tření teprve tehdy, když jsou vidět jikry vyčnívající z kloaky. Připravené samičky zaujímají typickou polohu ‚hlavou nahoru‘.
|
|
2.
|
Prstem se jemně přejede po boku ryby směrem k ocasu, aby se napomohlo vytlačení vaku s jikrami do nové Petriho misky. Totéž se opakuje na druhém boku a ryba se vrátí do nádrže.
|
|
3.
|
Jikry lze pomocí jemného štětečku rozptýlit (vytvořit monovrstvu). Je důležité dbát na to, aby spermatu bylo vystaveno co nejvíce jiker, takže je užitečné, aby pokrývaly co největší plochu. Důležitá poznámka: Jikry se udržují vlhké tím, že se obalí navlhčeným hedvábným papírem (je důležité, aby se jikry přímo nedotýkaly vody, neboť to může způsobit předčasně ztuhnutí chorionu a zabránit oplodnění). Počet jiker, které může každá samička produkovat, se velmi liší, ale v průměru by se z jedné gravidní samičky mělo snadno získat přibližně 150 jiker.
|
|
4.
|
25 μl spermatu ve směsi s Hankovým roztokem se štětečkem rovnoměrně nanese na celý povrch jiker. Po začátku oplodnění jikry rychle (během minuty) ztuhnou a změní barvu. Je-li odhadovaný počet jiker větší než 150, postup se opakuje. Obdobně pokud jikry během minuty neztuhnou, přidá se o něco více spermatu. Důležitá poznámka: Přidání většího množství spermatu nemusí nutně zvýšit míru oplodnění.
|
|
5.
|
Jikry a roztok se spermatem by měly být ponechány pro ‚interakci‘ nejméně 15 minut a do 1,5 hodiny po oplodnění by oplodněné jikry měly být umístěny do expozičních akvárií.
|
|
6.
|
Postup se opakuje s další samičkou, dokud se neodebere požadovaný počet jiker.
|
|
7.
|
Několik jiker z poslední sady se dá stranou a zafixují se v 10 % kyselině octové.
|
Počítání jiker a jejich distribuce do zkušebních akvárií
|
1.
|
Jikry by měly být rovnoměrně distribuovány mezi všechny úrovně expozice, aby nedošlo ke genetickému zkreslení. Každá sada oplodněných jiker by pomocí tupého nástroje (tj. entomologickou pinzetou se širokým břitem nebo pomocí očkovací kličky) měla být rozdělena do stejně velikých skupin (tolika, kolik je úrovní expozice). Mají-li být čtyři opakování pro každou expozici, každé s 20 jikrami, pak se do každého expozičního akvária musí distribuovat 80 jiker. Důležitá poznámka: Pokud není jisté, že bude dosaženo 100 % míry oplodnění, může být užitečné přidat 20 % navíc (tj. 96 jiker na každou úroveň expozice).
|
|
2.
|
Vně sítě chráněné otcem jsou jikry koljušky velmi náchylné k plísňovým infekcím. V této souvislosti je velice důležité, aby byly všechny jikry během prvních 5 dnů zkoušky ošetřeny methylenovou modří. Zásobní roztok methylenové modři se připraví s koncentrací 1 mg/ml a přidá se do expozičních akvárií, aby se získala maximální konečná koncentrace 2,125 mg/l. Důležitá poznámka: Po vylíhnutí by koljušky již neměly být methylenové modři vystaveny, systém by proto ode dne 6 zkoušky neměl methylenovou modř již obsahovat.
|
|
3.
|
Jikry se denně kontrolují a veškeré uhynulé nebo neoplodněné jikry se jako takové zaznamenají. Důležitá poznámka: Jikry by až do vylíhnutí nikdy neměly opustit vodu, a to ani na sebekratší dobu.
|
C.42 BIOLOGICKÁ ROZLOŽITELNOST V MOŘSKÉ VODĚ
VŠEOBECNÝ ÚVOD
|
1.
|
Tato zkušební metoda je rovnocenná Pokynu OECD pro zkoušení č. 306 (1992). Když byly vyvíjeny původní zkušební metody, nebylo známo, do jaké míry lze výsledky screeningových zkoušek týkajících se snadné biologické rozložitelnosti za použití sladké vody, splaškových vod nebo aktivovaného odpadu jako inokula uplatnit na mořské prostředí. K této otázce byly uváděny různé výsledky (např. (1)).
|
|
2.
|
Mnohé průmyslové odpadní vody, obsahující řadu chemických látek, se dostanou do moře buď přímým vypuštěním, nebo prostřednictvím výtoků a ústí řek, v nichž je doba zdržení krátká v porovnání s obdobím potřebným pro úplné biologické rozložení mnoha chemických látek, které jsou zde přítomny. Vzhledem k rostoucímu povědomí o tom, že je třeba chránit mořské prostředí proti rostoucí zátěži, již chemické látky způsobují, a odhadnout pravděpodobnou koncentraci chemických látek v moři, byly vyvinuty zkušební metody pro zkoušky biologické rozložitelnosti v mořské vodě.
|
|
3.
|
Metody zde popsané využívají přírodní mořské vody jako vodní fáze i jako zdroje mikroorganismů. Ve snaze splnit požadavky metod pro snadnou biologickou rozložitelnost ve sladké vodě bylo zkoumáno použití vysoce filtrované a odstředěné mořské vody a rovněž užití mořských sedimentů jako inokula. Tato šetření nebyla úspěšná. Zkušebním médiem je proto přírodní mořská voda upravená tak, aby se odstranily hrubé částice.
|
|
4.
|
Aby bylo možné posoudit konečnou biologickou rozložitelnost metodou třepací lahve, musí se použít poměrně vysoké koncentrace zkoušené látky vzhledem k nízké citlivosti analytické metody rozpuštěného organického uhlíku (DOC). To na druhé straně vyžaduje, aby byly do mořské vody přidány minerální živiny (N a P), jejichž nízké koncentrace by jinak odstraňování DOC omezily. Tyto živiny je z důvodu koncentrace přidané zkoušené látky nezbytné přidat také při použití metody uzavřených lahviček.
|
|
5.
|
Tyto metody tudíž nejsou zkouškami snadné biologické rozložitelnosti, jelikož se nepřidává žádné inokulum kromě mikroorganismů, které jsou v mořské vodě již přítomny. Tyto zkoušky rovněž nesimulují mořské prostředí, protože se přidávají živiny a koncentrace zkoušených látek je mnohem vyšší, než v jaké by byly přítomny v moři. Z těchto důvodů se tyto metody navrhují v rámci nového pododdílu ‚Biologická rozložitelnost v mořské vodě‘.
|
UPLATNĚNÍ
|
6.
|
Výsledky zkoušek aplikované s ohledem na způsob použití a likvidace příslušné látky, u níž se ukáže, že se dostává do moře, dávají první představu o biologické rozložitelnosti v mořské vodě. Je-li výsledek pozitivní (odstranění DOC > 70 %; teoretická spotřeba kyslíku (TSK) > 60 %), lze učinit závěr, že existuje potenciál pro biologickou rozložitelnost v mořském prostředí. Ani negativní výsledek takový potenciál nevylučuje, naznačuje však, že je nezbytné další studium, např. s použitím co nejnižší koncentrace zkoušené látky.
|
|
7.
|
V každém případě platí, že požaduje-li se stanovení míry nebo stupně biologického rozkladu v mořské vodě v té či oné lokalitě v konkrétnějších hodnotách, budou zřejmě muset být použity jiné, složitější a propracovanější, a tudíž i nákladnější metody. Například by bylo možné provést simulační zkoušku s koncentrací zkoušené látky, která se více přibližuje pravděpodobné koncentraci v životním prostředí. Bylo by rovněž možné použít neobohacenou, neupravenou mořskou vodu ze zájmové lokality a na primární biologický rozklad by mohla navázat specifická chemická analýza. Pro úplnou biologickou rozložitelnost by byly zapotřebí látky značené 14C, aby bylo možné měřit míry vymizení rozpustného organického 14C a produkce 14CO2 v koncentracích reálných v životním prostředí.
|
VOLBA METOD
|
8.
|
Výběr metody, která má být použita, závisí na řadě faktorů; jako pomůcka při výběru poslouží následující tabulka. Látky s rozpustností ve vodě nižší, než je ekvivalent přibližně 5 mg C/l, není možné zkoušet metodou třepací lahve, avšak špatně rozpustné látky v zásadě lze testovat metodou uzavřených lahviček.
Tabulka
Výhody a nevýhody zkoušky s třepací lahví a zkoušky v uzavřených lahvičkách
|
METODA
|
VÝHODY
|
NEVÝHODY
|
|
TŘEPACÍ LAHEV
|
|
—
|
jednoduchá aparatura s výjimkou analyzátoru C
|
|
—
|
doba trvání 60 d není problémem
|
|
—
|
lze přizpůsobit pro těkavé látky
|
|
|
—
|
používá se 5–40 mg DOC/l, může být inhibující
|
|
—
|
stanovení DOC je obtížné při nízkých koncentracích v mořské vodě (vliv chloridů)
|
|
—
|
DOC v mořské vodě je někdy vysoký
|
|
|
UZAVŘENÉ LAHVIČKY
|
|
—
|
jednoduché konečné stanovení
|
|
—
|
užívá se nízkých koncentrací zkušebních látek (2 mg/l), tudíž menší pravděpodobnost inhibice
|
|
—
|
lze snadno přizpůsobit pro těkavé látky
|
|
|
—
|
může být obtížné zachovat vzduchotěsnost lahviček
|
|
—
|
růst bakterií na stěnách může vést k nesprávným hodnotám
|
|
—
|
hodnoty příjmu O2 v slepých zkouškách mohou být vysoké, zejména po 28 dnech; to lze vyřešit odstátím mořské vody
|
|
—
|
možný vliv příjmu O2 v důsledku nitrifikace
|
|
|
METODA TŘEPACÍ LAHVE
ÚVOD
|
1.
|
Tato metoda je variantou modifikované screeningové zkoušky OECD, která je popsána v kapitole C.4–B této přílohy (2), prováděnou v mořské vodě. Byla dokončena jako výsledek mezilaboratorní porovnávací zkoušky, kterou pro Evropskou komisi (EK) zorganizoval dánský Institut pro kvalitu vody (3).
|
|
2.
|
Podobně jako u doprovodné metody uzavřených lahviček pro mořské prostředí nelze výsledky této zkoušky považovat za indikátory snadné biologické rozložitelnosti, nýbrž mají být využívány výlučně pro získání informací o biologické rozložitelnosti látek v mořském prostředí.
|
PODSTATA METODY
|
3.
|
Předem určené množství zkoušené látky se rozpustí ve zkušebním médiu tak, aby se získala koncentrace 5–40 mg rozpuštěného organického uhlíku (DOC)/l. Zlepší-li se meze citlivosti analýz organického uhlíku, může být výhodné použití nižších koncentrací zkoušené látky, zejména v případě inhibujících látek. Roztok zkoušené látky ve zkušebním médiu se za protřepávání inkubuje v temnu nebo v rozptýleném světle v aerobních podmínkách při stálé teplotě (udržované v toleranci ± 2 °C), která se obvykle bude pohybovat v rozmezí 15–20 °C. V případech, kdy je cílem studie simulovat situace v životním prostředí, mohou být prováděny i zkoušky mimo toto obvyklé teplotní rozmezí. Doporučené maximální trvání zkoušky je přibližně 60 dnů. Rozklad se sleduje pomocí měření DOC (úplný rozklad) a v některých případech pomocí specifické analýzy (primární rozklad).
|
INFORMACE O ZKOUŠENÉ LÁTCE
|
4.
|
Aby bylo možné poznat, zda lze zkoušku aplikovat na konkrétní látku, musí být známy některé její vlastnosti. Musí být stanoven obsah organického uhlíku v látce, její těkavost musí být taková, aby v průběhu zkoušky nedocházelo k významným ztrátám, a její rozpustnost ve vodě by měla být větší než ekvivalent 25–40 mg C/l. Zkoušená látka by rovněž neměla významně adsorbovat na povrchu skla. Pro interpretaci získaných výsledků, zejména pokud se tyto výsledky pohybují kolem ‚ještě vyhovujících‘ hodnot, jsou vyžadovány informace o čistotě nebo relativních podílech hlavních složek zkoušené látky.
|
|
5.
|
Pro volbu vhodných zkušebních koncentrací mohou být užitečné informace o toxicitě zkoušené látky pro bakterie, například o toxicitě naměřené při krátkodobých testech rychlosti dýchání (4); tyto informace mohou být důležité pro správnou interpretaci nízkých hodnot biologického rozkladu. Takové informace však nemusí být vždy dostatečné pro interpretaci výsledků získaných ve zkoušce biologické rozložitelnosti a vhodnější je postup popsaný v odstavci 18.
|
REFERENČNÍ LÁTKY
|
6.
|
Musí být použity vhodné referenční látky, aby se prověřila mikrobiální aktivita daného vzorku mořské vody. Za tímto účelem lze použit látky jako např. benzoan sodný, octan sodný nebo anilin. Referenční látky se musí rozložit v přiměřeně krátkém časovém intervalu, jinak se doporučuje zkoušku opakovat s použitím jiného vzorku mořské vody.
|
|
7.
|
V mezilaboratorní porovnávací zkoušce EK, kdy byly vzorky mořské vody odebrány v různých lokalitách a v různých ročních obdobích (3), činila u benzoanu sodného fáze iniciace (tL) 1 až 4 dny a doba potřebná k dosažení 50 % rozkladu (t50) činila bez fáze iniciace 1 až 7 dnů. U anilinu se tL pohybovala od 0 do 10 dnů a t50 od 1 do 10 dnů.
|
REPRODUKOVATELNOST A CITLIVOST METODY
|
8.
|
Reprodukovatelnost této metody byla stanovena mezilaboratorní porovnávací zkouškou (3). Nejnižší koncentrace zkoušené látky, při níž může být tato metoda při analýze DOC použita, je značně závislá na mezi stanovitelnosti analýzy organického uhlíku (v současnosti přibližně 0,5 mg C/l) a na koncentraci rozpuštěného organického uhlíku v užité mořské vodě (obvykle v řádu 3–5 mg/l pro vodu z otevřeného moře). Koncentrace DOC v pozadí by neměla být větší než přibližně 20 % celkové koncentrace DOC po přidání zkoušené látky. Není-li to možné, může být koncentrace DOC v pozadí někdy snížena odstátím mořské vody před zkoušením. Je-li tato metoda použita pouze při specifické chemické analýze (při které se měří primární rozklad), musí experimentátor s uvedením doplňujících informací zdokumentovat, zda lze očekávat úplnou rozložitelnost. Tyto doplňující informace mohou sestávat z výsledků jiných zkoušek snadné biologické rozložitelnosti nebo vlastní biologické rozložitelnosti.
|
POPIS METODY
Přístroje a pomůcky
|
9.
|
Běžné laboratorní vybavení a dále:
|
a.
|
třepačka upravená pro umístění Erlenmeyerových baněk o objemu 0,5–2 litrů, buď s automatickou regulací teploty, nebo používaná v prostoru s konstantní teplotou 15–20 °C udržovanou s tolerancí ± 2 °C;
|
|
b.
|
Erlenmeyerovy baňky o objemu 0,5–2 litrů s úzkým hrdlem;
|
|
c.
|
membránový filtrační přístroj nebo odstředivka;
|
|
d.
|
membránové filtry, velikost pórů 0,2–0,45 μm;
|
|
f.
|
vybavení pro specifickou analýzu (volitelné).
|
|
Mořská voda
|
10.
|
Do důkladně vyčištěného zásobníku se odebere vzorek mořské vody a dopraví se do laboratoře, pokud možno během jednoho nebo dvou dnů po odběru. Během dopravy nesmí dojít k tomu, aby teplota vzorku byla výrazně vyšší než teplota, která bude použita při zkoušce. Přesně se identifikuje lokalita odběru vzorků a popíše se její stav znečištění a živin. Zejména u pobřežních vod se v této charakteristice uvede také počet kolonií heterotrofních mikroorganismů a stanovení koncentrací rozpuštěných dusičnanů, amoniaku a fosfátů.
|
|
11.
|
O samotném vzorku mořské vody se uvedou tyto informace:
|
—
|
vzhled vzorku – zakalený atd.,
|
|
—
|
zpoždění mezi odběrem a použitím ve zkoušce.
|
|
|
12.
|
Zjistí-li se, že obsah DOC ve vzorku mořské vody je příliš vysoký (odstavec 8), doporučuje se nechat mořskou vodu přibližně jeden týden před použitím odstát. To se děje za umístění v aerobních podmínkách při zkušební teplotě, v temnu nebo v rozptýleném světle. Je-li to nezbytné, aerobní podmínky se udržují jemným provzdušňováním. Během odstátí se sníží obsah snadno rozložitelného organického materiálu. Při mezilaboratorní porovnávací zkoušce (3) nebyl zjištěn žádný rozdíl mezi potenciálem rozkladu vzorků odstáté mořské vody a nově odebrané mořské vody. Před použitím se mořská voda upraví tak, aby se odstranily hrubé částice, např. filtrací přes nylonový filtr nebo přes hrubý papírový filtr (nikoli membránový nebo GF/C filtr), případně sedimentací a dekantací. Užitý postup musí být zaznamenán. Případná předúprava se provede po odstátí.
|
Zásobní roztoky pro minerální živné médium
|
13.
|
Za použití reakčních činidel čistoty p.a. se připraví tyto zásobní roztoky:
|
a)
|
Dihydrogenfosforečnan draselný, KH2PO4
|
8,50 g
|
|
Hydrogenfosforečnan didraselný, K2HPO4
|
21,75 g
|
|
Dihydrát hydrogenfosforečnanu sodného, Na2HPO4 · 2H2O
|
33,30 g
|
|
Chlorid amonný, NH4Cl
|
0,50 g
|
|
Rozpustí se a doplní na 1 litr destilovanou vodou.
|
|
|
b)
|
Chlorid vápenatý, CaCl2
|
27,50 g
|
|
Rozpustí se a doplní na 1 litr destilovanou vodou.
|
|
|
c)
|
Heptahydrát síranu hořečnatého, MgSO4
.7H2O
|
22,50 g
|
|
Rozpustí se a doplní na 1 litr destilovanou vodou.
|
|
|
d)
|
Hexahydrát chloridu železitého, FeCl3 · 6H2O
|
0,25 g
|
|
Rozpustí se a doplní na 1 litr destilovanou vodou.
|
|
Srážení v roztoku d) lze předejít přidáním jedné kapky koncentrované kyseliny chlorovodíkové nebo 0,4 g disodné soli kyseliny ethylendiamintetraoctové (EDTA) na 1 litr. Vytvoří-li se v zásobním roztoku sraženina, nahraďte ho nově připraveným roztokem.
|
Příprava zkušebního média
|
14.
|
Na litr předupravené mořské vody se přidá 1 ml každého z výše uvedených zásobních roztoků.
|
Inokulum
|
15.
|
Kromě mikroorganismů, které jsou v mořské vodě již přítomny, se žádné specifické inokulum nepřidává. Určete (volitelně) počet heterotrofních organismů tvořících kolonie ve zkušebním médiu s mořskou vodou (a pokud možno také v původních vzorcích mořské vody), např. určením počtů na misce pomocí mořského agaru. To je zvlášť žádoucí u vzorků z pobřežních nebo znečištěných lokalit. Zkontroluje se aktivita heterotrofních mikroorganismů v mořské vodě provedením testu s referenční látkou.
|
Příprava baněk
|
16.
|
Zajistěte, aby veškeré sklo bylo před použitím absolutně čisté, ne nutně sterilní (např. pomocí alkoholového roztoku kyseliny chlorovodíkové), opláchnuté a vysušené, aby nedošlo ke kontaminaci zbytky dřívějších zkoušek. Baňky se před prvním použitím musí také vyčistit.
|
|
17.
|
Zkoušené látky se hodnotí ve dvou stejných baňkách současně, spolu s jednou baňkou pro zkoušku s referenční látkou. Provede se slepá zkouška ve dvou opakováních bez zkoušené a bez referenční látky s cílem stanovit analytické údaje slepých zkoušek. Zkoušené látky se rozpustí ve zkušebním médiu – mohou být snadno přidány prostřednictvím koncentrovaného zásobního roztoku – aby se dosáhlo žádoucích výchozích koncentrací, obvykle 5–40 mg DOC/l. Referenční látka se testuje obvykle při výchozí koncentraci odpovídající 20 mg DOC/l. Jsou-li použity zásobní roztoky zkoušené a/nebo referenční látky, zajistí se, aby se u média s mořskou vodou výrazně nezměnila salinita.
|
|
18.
|
Pokud lze předpokládat toxické účinky nebo je nelze vyloučit, lze doporučit zařazení zkoušky na inhibici, ve dvou opakováních, do zkušebního uspořádání. Zkoušená a referenční látka se přidají do téže nádoby, přičemž koncentrace referenční látky je obvykle stejná jako při kontrolní zkoušce (tj. 20 mg DOC/l), aby se umožnilo srovnání.
|
|
19.
|
Přiměřené množství zkušebních roztoků se nalije do Erlenmeyerových baněk (vhodné množství je přibližně do poloviny objemu baňky) a každá baňka se poté opatří volným uzávěrem (např. hliníkovou fólii), který umožní výměnu plynů mezi baňkou a okolním ovzduším. (Zátky z vaty nejsou vhodné, provádí-li se analýza DOC). Nádoby se umístí do třepačky a protřepávají nepřetržitě mírným tempem (např. 100 rpm) po celou dobu zkoušky. Teplota je řízena (v rozmezí 15–20 °C, s tolerancí ± 2 °C) a nádoby se chrání před světlem, aby se zamezilo růstu řas. Je nutno zajistit, aby vzduch neobsahoval toxické materiály.
|
Fyzikálně-chemická kontrolní zkouška (volitelná)
|
20.
|
Existuje-li podezření na abiotický rozklad nebo jiné ztrátové mechanismy, jako je hydrolýza (problém, který vzniká pouze při specifické analýze), těkání nebo adsorpce, lze doporučit provedení fyzikálně-chemického kontrolního experimentu. Ten lze provést tak, že do nádob se zkoušenou látkou se přidá chlorid rtuťnatý (HgCl2) (32) (v koncentraci 50–100 mg/l) k zastavení mikrobiální aktivity. Významné snížení DOC nebo koncentrace konkrétní látky při fyzikálně-chemické zkoušce nasvědčuje mechanismům abiotického odstraňování. (Je-li užito chloridu rtuťnatého, je třeba při analýze DOC věnovat pozornost tomu, aby nedošlo k interferencím nebo otravě katalyzátoru.)
|
Počet nasazených baněk
|
21.
|
V typické zkoušce se použijí tyto baňky:
|
Baňka 1 a 2
|
–
|
obsahující zkoušenou látku (zkušební suspenze);
|
|
Baňka 3 a 4
|
–
|
obsahující pouze mořskou vodu (slepá zkouška);
|
|
Baňka 5
|
–
|
obsahující referenční látku (kontrolní zkouška postupu);
|
|
Baňka 6
|
–
|
obsahující zkoušenou a referenční látku (kontrola toxicity) – volitelná;
|
|
Baňka 7
|
–
|
obsahující zkoušenou látku a sterilizační činidlo (abiotická sterilní kontrola) – volitelná.
|
|
Analýza DOC
|
22.
|
V průběhu zkoušky se ve vhodných intervalech odeberou vzorky pro analýzu DOC (dodatek 1). Vzorky je třeba vždy odebrat na počátku zkoušky (den 0) a v den 60. Pro popis průběhu rozkladu v čase se požaduje minimálně pět vzorků. Pro odběr vzorků nelze stanovit žádný časový harmonogram, protože rychlost biologického rozkladu se v jednotlivých případech liší. Stanovení DOC se provede ve dvou opakováních na každém vzorku.
|
Odběr vzorků
|
23.
|
Požadovaný objem vzorků závisí na analytické metodě (specifická analýza), na použitém analyzátoru uhlíku a na postupu (membránová filtrace nebo odstředění) zvoleném pro zpracování vzorku před stanovením uhlíku (odstavce 25 a 26). Před odběrem vzorků se zajistí, aby zkušební médium bylo dobře promícháno a aby veškerý materiál ulpívající na stěně baňky byl rozpuštěn nebo suspendován.
|
|
24.
|
Membránová filtrace nebo odstředění se provede ihned po odběru vzorků. Je-li to nezbytné, filtrované nebo odstředěné vzorky se skladují při teplotě 2–4 °C pro dobu do 48 hodin nebo při teplotě nižší než – 18 °C pro delší období (je-li známo, že nedojde k ovlivnění látky, před skladováním se okyselí na pH 2).
|
|
25.
|
Membránové filtry (velikost pórů 0,2–0,45 μm) jsou vhodné, je-li zajištěno, že při kroku filtrace neuvolňují uhlík ani neadsorbují látku, např. polykarbonátové membránové filtry. Některé membránové filtry jsou impregnovány povrchově aktivními látkami za účelem jejich hydrofilizace a mohou uvolňovat značné množství rozpuštěného uhlíku. Takové filtry se připraví tak, že se třikrát po sobě vyvaří jednu hodinu v deionizované vodě. Po vyvaření se filtry skladují v deionizované vodě. Prvních 20 ml filtrátu se vylije.
|
|
26.
|
Alternativně lze k membránové filtraci zvolit odstředění vzorků. Odstřeďuje se rychlostí 40 000 m.s– 2 (~ 4 000 g) po dobu 15 minut, přednostně v chlazené odstředivce.
Poznámka: Rozlišení celkového množství organického uhlíku (TOC) od DOC (TOC/DOC) pomocí odstředění při velmi nízkých koncentracích, jak se zdá, není možné, protože buď nelze odstranit všechny bakterie, nebo se zpětně rozpouští uhlík, který je součástí bakteriální plazmy. Při vyšších zkušebních koncentracích (> 10 mg C na litr) je chyba při odstředění zřejmě poměrně malá.
|
Četnost odběru vzorků
|
27.
|
Provádějí-li se analýzy ihned po odběru vzorků, doba příštího odběru vzorků se posoudí podle zvážení výsledku analytického stanovení.
|
|
28.
|
Pokud se vzorky uchovávají pro pozdější analýzu (odstavec 24), odebere se více vzorků, než je požadovaný minimální počet pěti vzorků. Nejprve se analyzují nejnovější vzorky a postupným výběrem vhodných vzorků pro analýzu ‚v opačném pořadí‘ lze s poměrně malým počtem analytických stanovení získat dobrý popis křivky biologického rozkladu. Pokud do ukončení zkoušky nedojde k žádnému rozkladu, nemusejí se žádné další vzorky analyzovat a výběr vzorků ‚v opačném pořadí‘ může za této situace uspořit značné náklady na analýzu.
|
|
29.
|
Je-li plató na křivce rozkladu zaznamenáno před 60. dnem zkoušky, zkouška se ukončí. Pokud k 60. dni rozklad zjevně začal, ale plató nebylo ještě dosaženo, experiment se prodlouží o další období.
|
ÚDAJE A JEJICH PŘEDKLÁDÁNÍ
Zpracování výsledků
|
30.
|
Výsledky analýz se zaznamenají do přiloženého přehledu dat (dodatek 2) a vypočítají se hodnoty biologického rozkladu pro zkoušené a referenční látky podle této rovnice:

kde:
|
Dt
|
=
|
rozklad v procentech odstranění DOC nebo konkrétní látky v čase t,
|
|
Co
|
=
|
výchozí koncentrace DOC nebo konkrétní látky ve zkušebním médiu,
|
|
Ct
|
=
|
koncentrace DOC nebo konkrétní látky ve zkušebním médiu v čase t,
|
|
Cbl(0)
|
=
|
výchozí koncentrace DOC nebo konkrétní látky při slepé zkoušce,
|
|
Cbl(t)
|
=
|
koncentrace DOC nebo konkrétní látky při slepé zkoušce v čase t.
|
|
|
31.
|
Rozklad se uvede jako procento odstranění DOC (konečný rozklad) nebo odstranění konkrétní látky (primární degradace) v čase t. Koncentrace DOC se vypočítají s přesností na 0,1 mg/l a střední hodnoty Dt se zaokrouhlí na celá procenta.
|
|
32.
|
Průběh rozkladu se graficky znázorní pomocí diagramu, jak je uvedeno na obrázku v oddíle ‚Platnost a interpretace výsledků‘. Je-li údajů dostatek, z křivky se vypočítá fáze iniciace (tL) a doba potřebná k dosažení 50 % odstranění po ukončení fáze iniciace (t50).
|
Závěrečná zpráva
|
33.
|
Závěrečná zpráva musí obsahovat tyto informace:
|
|
Zkoušená látka:
|
—
|
fyzikální povaha a, je-li to podstatné, fyzikálně-chemické vlastnosti,
|
|
|
|
Zkušební podmínky:
|
—
|
lokalita a popis místa odběru vzorku; stav znečištění a živin (počet kolonií, dusičnany, amoniak, případně fosfáty),
|
|
—
|
charakteristiky vzorku (datum odběru, hloubka, vzhled, teplota, salinita, DOC (volitelné), zpoždění mezi odběrem a použitím ve zkoušce,
|
|
—
|
metoda použitá pro případné odstátí mořské vody,
|
|
—
|
metoda použitá pro předúpravu (filtraci/sedimentaci) mořské vody,
|
|
—
|
metoda použitá pro stanovení DOC,
|
|
—
|
metoda použitá pro specifickou analýzu (volitelné),
|
|
—
|
metoda použitá pro určení počtu heterotrofních organismů v mořské vodě (metoda určení počtů na misce nebo alternativní postup) (volitelné),
|
|
—
|
jiné metody (volitelné) použité k určení charakteristik mořské vody (měření obsahu ATP atd.).
|
|
|
|
Výsledky:
|
—
|
analytické údaje uvedené v přehledu dat (dodatek 2),
|
|
—
|
postup rozkladu se graficky znázorní pomocí diagramu s vyznačením fáze iniciace (tL), směrnice a doby (od ukončení fáze iniciace) do dosažení 50 % odstranění (t50). Fázi iniciace lze odhadnout graficky, jak je uvedeno na obrázku v oddíle ‚Platnost a interpretace výsledků‘, nebo snadno zaznamenat jako dobu nezbytnou pro dosažení 10 % rozkladu,
|
|
—
|
stupeň rozkladu vyjádřený v procentech, dosažený po 60 dnech nebo na konci zkoušky.
|
|
|
Platnost a interpretace výsledků
|
34.
|
Výsledky získané s referenčními látkami, např. benzoanem sodným, octanem sodným nebo anilinem, by měly být srovnatelné s výsledky získanými při mezilaboratorní porovnávací zkoušce (3) (viz oddíl ‚Referenční látky‘, odstavec 7). Pokud jsou výsledky získané s referenční látkou atypické, zkouška by měla být opakována s jiným vzorkem mořské vody. I přesto, že výsledky zkoušek inhibice nemusí vždy být snadné interpretovat kvůli příspěvku DOC ze zkušební látky, významné snížení rychlosti celkového odstraňování DOC v porovnání s rychlostí celkového odstranění DOC u kontrolního vzorku je příznakem toxických účinků.
|
|
35.
|
Vzhledem k poměrně vysokým zkušebním koncentracím použitým v porovnání s většinou přírodních systémů (a následně nepříznivému poměru mezi koncentracemi zkoušených látek a jiných zdrojů uhlíku) je třeba tuto metodu považovat za předběžnou zkoušku, kterou lze použít k indikaci toho, zda určitá látka je, či není snadno biologicky rozložitelná. Nízká hodnota výsledku tudíž nutně neznamená, že zkoušená látka není biologicky rozložitelná v mořském prostředí, avšak naznačuje, že ke stanovení biologické rozložitelnosti bude zapotřebí další práce.
Na obrázku níže je uveden příklad teoretického experimentu rozkladu, který ukazuje proveditelný způsob odhadu hodnot tL (délka ‚fáze iniciace‘) a t50 (časový interval začínající v bodě tL, nezbytný pro dosažení 50 % odstranění).

|
METODA UZAVŘENÝCH LAHVIČEK
ÚVOD
|
1.
|
Tato metoda je variantou zkoušky v uzavřených lahvičkách (5), prováděnou s mořskou vodou, a byla dokončena jako výsledek mezilaboratorní porovnávací zkoušky, kterou pro Evropskou komisi zorganizoval dánský Institut pro kvalitu vody (3).
|
|
2.
|
Stejně jako u doprovodné metody třepací lahve pro mořské prostředí nelze výsledky této zkoušky považovat za indikaci snadné biologické rozložitelnosti, nýbrž mají být využívány výlučně pro získání informací o biologické rozložitelnosti látek v mořském prostředí.
|
PODSTATA METODY
|
3.
|
Předem určené množství zkoušené látky se rozpustí ve zkušebním médiu v koncentraci obvykle 2–10 mg zkoušené látky na litr (lze použít jednu nebo více koncentrací). Roztok se uchovává v zaplněné a uzavřené lahvi v temnu v lázni nebo obalu s konstantní teplotou udržovanou v rozmezí 15–20 °C s tolerancí ± 1 °C. V případech, kdy je cílem studie simulovat situace v životním prostředí, mohou být prováděny zkoušky přesahující toto obvyklé teplotní rozmezí za předpokladu, že budou provedeny vhodné úpravy v regulaci teploty. Rozložitelnost se zkoumá pomocí analýz kyslíku po dobu 28 dnů.
|
|
4.
|
Z mezilaboratorní porovnávací zkoušky vyplynulo, že při prodloužení zkoušky na více než 28 dnů nebylo ve většině případů kvůli silným interferencím možné získat žádné užitečné informace. Hodnoty biologické spotřeby kyslíku (BSK) při slepých zkouškách byly nadměrně vysoké, snad v důsledku růstu řas na stěnách vyvolaného nedostatečným protřepáváním a v důsledku nitrifikace. Doporučená doba trvání je tedy 28 dnů, avšak pokud hodnota BSK při slepé zkoušce nepřekročí hranici 30 % (odstavec 15 a 40), zkoušku lze prodloužit.
|
INFORMACE O ZKOUŠENÉ LÁTCE
|
5.
|
Aby bylo možné poznat, zda lze zkoušku aplikovat na konkrétní látku, musí být známy některé její vlastnosti. K tomu, aby bylo možné vypočítat teoretickou spotřebu kyslíku (TSK) (viz dodatek 3), je zapotřebí empirický vzorec; jinak musí být stanovena chemická spotřeba kyslíku (CHSK) dané látky, která pak bude sloužit jako referenční hodnota. Použití CHSK je méně uspokojivé, protože některé látky nejsou při zkoušce CHSK plně zoxidovány.
|
|
6.
|
Rozpustnost látky by měla být alespoň 2 mg/l, i když v zásadě lze testovat i méně rozpustné látky (např. pomocí ultrazvuku), a stejně tak i těkavé látky. Pro interpretaci získaných výsledků, zejména pokud se tyto výsledky pohybují okolo ‚ještě vyhovujících‘ hodnot, jsou vyžadovány informace o čistotě nebo relativních podílech hlavních složek zkoušené látky.
|
|
7.
|
Pro volbu vhodných zkušebních koncentrací mohou být velmi užitečné informace o toxicitě dané látky pro bakterie, například o toxicitě naměřené při krátkodobých testech rychlosti dýchání (4); tyto informace mohou být důležité pro správnou interpretaci nízkých hodnot biologického rozkladu. Takové informace však pro interpretaci výsledků získaných ve zkoušce biologické rozložitelnosti ne vždy postačují a vhodnější je postup popsaný v odstavci 27.
|
REFERENČNÍ LÁTKY
|
8.
|
Musí být použity vhodné referenční látky, aby se prověřila mikrobiální aktivita daného vzorku mořské vody. Za tímto účelem lze použít (například) anilin, octan sodný nebo benzoan sodný. V přiměřeně krátké době musí dojít k rozkladu těchto látek alespoň v rozsahu 60 % (jejich TSK); v opačném případě se doporučuje zkoušku zopakovat s jiným vzorkem mořské vody.
|
|
9.
|
V mezilaboratorní porovnávací zkoušce EK, kdy byly vzorky mořské vody odebrány v různých lokalitách a v různých ročních obdobích, při použití benzoanu sodného činila fáze iniciace (tL) 0 až 2 dny a doba nezbytná pro dosažení 50 % rozkladu (t50) činila bez fáze iniciace 1 až 4 dny. Při použití anilinu byla hodnota tL 0 až 7 dnů a hodnota t50 činila 2 až 12 dnů.
|
REPRODUKOVATELNOST
|
10.
|
Reprodukovatelnost metod byla stanovena mezilaboratorní porovnávací zkouškou EK (3).
|
POPIS METODY
Přístroje a pomůcky
|
11.
|
Běžné laboratorní vybavení a dále:
|
a)
|
lahve pro analýzu BSK o objemu 250–300 ml se skleněnými zátkami, nebo lze použít lahve s úzkým hrdlem o objemu 250 ml se skleněnými zátkami;
|
|
b)
|
několik lahví o objemu 2, 3 a 4 litry s označením litrů pro přípravu experimentu a pro naplnění lahviček pro analýzu BSK;
|
|
c)
|
vodní lázeň nebo prostor s konstantní teplotou pro udržování lahviček při konstantní teplotě (tolerance ± 1 °C) v temnu;
|
|
d)
|
vybavení pro analýzu rozpuštěného kyslíku;
|
|
e)
|
membránové filtry, velikost pórů 0,2–0,45 μm (volitelné);
|
|
f)
|
vybavení pro specifickou analýzu (volitelné).
|
|
Mořská voda
|
12.
|
Vzorek mořské vody se odebere do důkladně vyčištěného zásobníku a dopraví se do laboratoře, pokud možno během jednoho nebo dvou dnů po odběru. Během dopravy nesmí dojít k tomu, aby teplota vzorku byla značně vyšší než teplota, která bude použita při zkoušce.
|
|
13.
|
Přesně se identifikuje lokalita odběru vzorků a popíše se stav znečištění a živin. Zejména u pobřežních vod nebo znečištěných vod se v této charakteristice uvede také počet kolonií heterotrofních mikroorganismů a stanovení koncentrací rozpuštěných dusičnanů, amoniaku a fosfátů.
|
|
14.
|
O samotném vzorku mořské vody se uvedou tyto informace:
|
—
|
vzhled vzorku – zakalený atd.,
|
|
—
|
rozpuštěný organický uhlík (DOC),
|
|
—
|
zpoždění mezi odběrem a použitím ve zkoušce.
|
|
|
15.
|
Zjistí-li se, že obsah DOC ve vzorku je vyšší, nebo existuje-li domněnka, že obsah BSK při slepé zkoušce po 28 dnech bude vyšší než 30 % obsahu BSK v referenčních látkách, doporučuje se před použitím mořské vody ve zkoušce nechat vodu přibližně jeden týden odstát.
|
|
16.
|
Vzorek se nechá odstát umístěný v aerobních podmínkách při zkušební teplotě, v temnu nebo v rozptýleném světle. Je-li to nezbytné, aerobní podmínky se udržují jemným provzdušňováním. Během odstátí se sníží obsah snadno rozložitelného organického materiálu. Při mezilaboratorní porovnávací zkoušce (3) nebyl zjištěn žádný rozdíl mezi potenciálem rozkladu vzorků odstáté mořské vody a nově odebrané mořské vody.
|
|
17.
|
Před použitím se mořská voda upraví tak, aby se odstranily hrubé částice, např. filtrací přes nylonový filtr nebo přes hrubý papírový filtr (nikoli přes membránový nebo GF/C filtr), případně sedimentací a dekantací. Použitý postup se zaznamená. Případná předúprava se provede po odstátí.
|
Zásobní roztoky pro minerální živné médium
|
18.
|
Za použití reakčních činidel čistoty p.a. se připraví tyto zásobní roztoky:
|
a)
|
dihydrogenfosforečnan draselný, KH2PO4
|
8,50 g
|
|
Hydrogenfosforečnan didraselný, K2HPO4
|
21,75 g
|
|
Dihydrát hydrogenfosforečnanu sodného, Na2HPO4 · 2H2O
|
33,30 g
|
|
Chlorid amonný, NH4Cl
|
0,50 g
|
|
Rozpustí se a doplní na 1 litr destilovanou vodou.
|
|
|
b)
|
Chlorid vápenatý, CaCl2
|
27,50 g
|
|
Rozpustí se a doplní na 1 litr destilovanou vodou.
|
|
|
c)
|
Heptahydrát síranu hořečnatého, MgSO4 · 7H2O
|
22,50 g
|
|
Rozpustí se a doplní na 1 litr destilovanou vodou.
|
|
|
d)
|
Hexahydrát chloridu železitého, FeCl3 · 6H2O
|
0,25 g
|
|
Rozpustí se a doplní na 1 litr destilovanou vodou.
|
|
Srážení v roztoku d) lze předejít přidáním jedné kapky koncentrované kyseliny chlorovodíkové nebo 0,4 g disodné soli kyseliny ethylendiamintetraoctové (EDTA) na 1 litr. Vytvoří-li se v zásobním roztoku sraženina, nahradí se nově připraveným roztokem.
|
Příprava zkušebního média
|
19.
|
Na litr upravené mořské vody se přidá 1 ml každého z výše uvedených zásobních roztoků. Zkušební médium se při zkušební teplotě nasytí vzduchem provzdušněním čistým, stlačeným vzduchem po dobu přibližně 20 minut. Stanoví se koncentrace rozpuštěného kyslíku pro účely kontroly. Koncentraci rozpuštěného kyslíku v nasyceném stavu jako funkci salinity a teploty lze zjistit z nomogramu, který je uveden v příloze k této zkušební metodě (dodatek 4).
|
Inokulum
|
20.
|
Kromě mikroorganismů, které jsou v mořské vodě již přítomny, se žádné specifické inokulum nepřidává. Určí se (volitelně) počet heterotrofních organismů tvořících kolonie ve zkušebním médiu s mořskou vodou (a pokud možno také v původním vzorku mořské vody), např. určením počtů na misce za použití mořského agaru. To je zvlášť žádoucí u vzorků z pobřežních nebo znečištěných lokalit. Zkontroluje se aktivita heterotrofních mikroorganismů v mořské vodě provedením testu s referenční látkou.
|
Příprava zkušebních lahviček
|
21.
|
Provedou se všechny nezbytné manipulace včetně odstátí a předúpravy mořské vody za zvolené zkušební teploty mezi 15 až 20 °C, přičemž se zajistí čistota, avšak nikoli sterilita veškerého skla.
|
|
22.
|
Připraví se skupiny lahviček pro analýzu BSK pro stanovení BSK zkoušené látky a referenční látky v souběžných sériích experimentů. Všechny analýzy se provádějí v duplicitních lahvičkách (pro slepé zkoušky, s referenční a se zkoušenou látkou), tj. pro každé stanovení se připraví dvě lahvičky. Analýzy se provedou alespoň v den 0, 5, 15 a 28 (čtyři stanovení). Pro analýzy kyslíku jsou pro čtyři stanovení zapotřebí celkem 3 × 2 × 4 = 24 lahvičky (pro slepé zkoušky, s referenční a se zkoušenou látkou), a tudíž přibližně osm litrů zkušebního média (pro jednu koncentraci zkušební látky).
|
|
23.
|
Do velkých lahví o dostatečném objemu (odstavec 11) se odděleně připraví roztoky zkoušené a referenční látky tak, že nejprve se do částečně zaplněných velkých lahví přidá zkoušená nebo referenční látka buď přímo, nebo pomocí koncentrovaného zásobního roztoku. Přidá se další zkušební médium, aby se dosáhlo konečných požadovaných koncentrací. Jsou-li použity zásobní roztoky zkoušené a/nebo referenční látky, je třeba zajistit, aby se u média s mořskou vodou výrazně nezměnila salinita.
|
|
24.
|
Koncentrace zkoušené a referenční látky se zvolí s ohledem na:
|
a)
|
rozpustnost rozpuštěného kyslíku v mořské vodě při převládající zkušební teplotě a salinitě (viz připojený nomogram – dodatek 4);
|
|
b)
|
BSK mořské vody při slepé zkoušce a
|
|
c)
|
předpokládanou biologickou rozložitelnost zkoušené látky.
|
|
|
25.
|
Rozpustnost rozpuštěného kyslíku při teplotě 15 °C a salinitě 32 promile (oceánská voda) činí přibližně 8,1 mg/l a při teplotě 20 °C a salinitě 32 promile činí přibližně 7,4 mg/l. Nebyla-li mořská voda ponechána k odstátí, může spotřeba kyslíku samotné mořské vody (respirace při slepé zkoušce) dosáhnout 2 mg O2/l i více. Aby se zajistilo, že po oxidaci zkoušené látky zůstane dostatečná koncentrace kyslíku, použije se proto u látek, u nichž se předpokládá, že se v podmínkách zkoušky zcela rozloží (jako jsou referenční látky), výchozí koncentrace zkoušené látky přibližně 2–3 mg/l (v závislosti na TSK). Látky s menší rozložitelností se testují při vyšších koncentracích až do přibližně 10 mg/l, za podmínky, že nenastanou toxické účinky. Může být výhodné provádět souběžné zkoušky s nízkou (přibližně 2 mg/l) a vysokou (přibližně 10 mg/l) koncentrací zkoušené látky.
|
|
26.
|
Souběžně musí být obsah kyslíku stanoven ve slepé zkoušce, v lahvičkách, které neobsahují ani zkoušenou, ani referenční látku.
|
|
27.
|
Mají-li být stanoveny inhibiční účinky, do jednotlivých velkých lahví (odstavec 13) se zvlášť připraví tato série roztoků:
|
a)
|
snadno rozložitelné látky, např. kterékoli z uvedených referenčních látek, v koncentraci 2 mg/l;
|
|
b)
|
zkoušené látky v koncentraci x mg/l (x se obvykle rovná 2);
|
|
c)
|
snadno rozložitelné látky v koncentraci 2 mg/l plus zkoušené látky v koncentraci x mg/l.
|
|
Fyzikálně-chemická kontrolní zkouška (volitelná)
|
28.
|
Je-li využito možnosti provedení specifických analýz, může se provést fyzikálně-chemická zkouška k ověření toho, zda zkušební látka nebyla odstraněna abiotickými mechanismy, jako je hydrolýza nebo adsorpce. Fyzikálně-chemickou kontrolní zkoušku lze provést tak, že do duplicitních lahviček se zkušební látkou se přidá chlorid rtuťnatý (HgCl2) (33) (v koncentraci 50-100 mg/l) k zastavení mikrobiální aktivity. Významné snížení koncentrace konkrétní látky během zkoušky nasvědčuje mechanismům abiotického odstraňování.
|
Počet lahviček pro analýzu BSK v typické zkoušce
|
29.
|
V typické zkoušce se použijí tyto lahvičky:
|
—
|
nejméně 8 lahviček se zkoušenou látkou,
|
|
—
|
nejméně 8 lahviček pouze s živinami obohacenou mořskou vodou,
|
|
—
|
nejméně 8 lahviček s referenční látkou, a
|
|
—
|
je-li to nezbytné, 6 lahviček se zkoušenou a referenční látkou (kontrola toxicity).
|
|
POSTUP
|
30.
|
Ihned po přípravě se každý roztok odsaje ze spodní čtvrtiny (nikoli ode dna) příslušné velké lahve a naplní se jím příslušná skupina lahviček pro analýzu BSK. Ihned (v čase nula) se provede stanovení obsahu rozpuštěného kyslíku (odstavec 33) v kontrolních vzorcích, nebo se uchovají pro pozdější chemickou analýzu srážením s MnCl2 (chloridem manganatým) a NaOH (hydroxidem sodným).
|
|
31.
|
Zbylé lahvičky pro souběžnou analýzu BSK se inkubují při zkušební teplotě (15–20 °C), uchovávají v temnu a ve vhodných časových intervalech (například minimálně po 5, 15 a 28 dnech) se z inkubačního prostoru odstraní a analyzuje se obsah rozpuštěného kyslíku v nich (odstavec 33).
|
|
32.
|
Pro (volitelnou) specifickou analýzu se vzorky filtrují pomocí membránového filtru (velikost pórů 0,2–0,45 μm) nebo se odstředí po dobu 15 minut. Pokud nejsou analyzovány ihned, skladují se do 48 hodin při teplotě 2-4 °C nebo na delší období při teplotě – 18 °C (je-li známo, že nedojde k ovlivnění zkoušené látky, zkoušená látka se před uskladněním okyselí na pH 2).
|
Stanovení rozpuštěného kyslíku
|
33.
|
Koncentrace rozpuštěného kyslíku se stanoví vnitrostátně nebo mezinárodně uznávanou chemickou nebo elektrochemickou metodou.
|
ÚDAJE A JEJICH PŘEDKLÁDÁNÍ
Zpracování výsledků
|
34.
|
Výsledky analýz se zaznamenají do přiložených přehledů dat (dodatek 5).
|
|
35.
|
Vypočítá se BSK jako rozdíl v úbytku kyslíku mezi slepou zkouškou a roztokem zkoušené látky za podmínek zkoušky. Čistý úbytek kyslíku se vydělí koncentrací objemové hmotnosti látky, aby bylo možno vyjádřit BSK jako mg BSK na mg zkoušené látky. Rozklad je definován jako poměr mezi biochemickou spotřebou kyslíku a, přednostně, teoretickou spotřebou kyslíku (TSK), anebo chemickou spotřebou kyslíku (CHSK), vyjádřený v procentech (viz odstavec 36).
|
|
36.
|
Hodnoty biologického rozkladu zkoušené látky a referenční látky pro každý čas odběru vzorku se vypočítají za pomoci jedné z těchto dvou rovnic:


kde:
|
TSK
|
=
|
teoretická spotřeba kyslíku (výpočet viz dodatek 3),
|
|
CHSK
|
=
|
chemická spotřeba kyslíku, stanovená experimentálně.
|
Poznámka: Uvedené dva způsoby výpočtu (procentní podíl TSK nebo procentní podíl CHSK) někdy nevedou ke stejným výsledkům; přednostně se použije TSK, protože u některých látek ve zkoušce CHSK nedochází k úplné oxidaci.
|
|
37.
|
Průběh rozkladu se graficky znázorní pomocí diagramu (viz příklad v oddíle ‚Platnost a interpretace výsledků‘). Je-li údajů dostatek, z křivky biologického rozkladu se vypočítá fáze iniciace (tL) a doba (t50) potřebná k dosažení 50 % odstranění po ukončení fáze iniciace.
|
|
38.
|
Pokud se provádí specifická analýza (volitelná), uvede se procento primárního rozkladu jako procento odstranění konkrétní látky za dobu zkoušky (korigované o analytické údaje slepých zkoušek).
|
Závěrečná zpráva
|
39.
|
Závěrečná zpráva musí obsahovat tyto informace:
|
|
Zkoušená látka:
|
—
|
fyzikální povaha a, je-li to podstatné, fyzikálně-chemické vlastnosti,
|
|
|
|
Zkušební podmínky:
|
—
|
lokalita a popis místa odběru vzorku: stav znečištění a živin (počet kolonií, dusičnany, amoniak, případně fosfáty),
|
|
—
|
charakteristiky vzorku (datum odběru, hloubka odběru, vzhled, teplota, salinita, DOC (volitelné), zpoždění mezi odběrem a použitím ve zkoušce),
|
|
—
|
metoda použitá pro odstátí mořské vody (bylo-li použito),
|
|
—
|
metoda použitá pro předúpravu (filtraci/sedimentaci) mořské vody,
|
|
—
|
metoda použitá pro stanovení CHSK (bylo-li provedeno),
|
|
—
|
metoda použitá pro měření kyslíku,
|
|
—
|
postup rozptýlení u látek, které jsou za zkušebních podmínek špatně rozpustné,
|
|
—
|
metoda použitá pro určení počtu heterotrofních organismů v mořské vodě (metoda určení počtů na misce nebo alternativní postup),
|
|
—
|
metoda použitá pro stanovení DOC v mořské vodě (volitelné),
|
|
—
|
metoda použitá pro specifickou analýzu (volitelné),
|
|
—
|
jiné volitelné metody použité k určení charakteristik mořské vody (měření obsahu ATP atd.).
|
|
|
|
Výsledky:
|
—
|
analytické údaje uvedené v přehledu dat (viz příloha, dodatek 5),
|
|
—
|
postup rozkladu se graficky znázorní pomocí diagramu s vyznačením fáze iniciace (tL), směrnice a času (od ukončení fáze iniciace) do dosažení 50 % celkové spotřeby kyslíku vyvolané oxidací zkoušené látky (t50). Fázi iniciace lze odhadnout graficky, jak je uvedeno na připojeném obrázku, nebo snadno zaznamenat jako dobu nezbytnou pro dosažení 10 % rozkladu,
|
|
—
|
procento rozkladu naměřené po 28 dnech.
|
|
|
Platnost a interpretace výsledků
|
40.
|
Respirace při slepé zkoušce by neměla přesahovat 30 % spotřeby kyslíku ve zkušební lahvičce. Není-li možné toto kritérium splnit pomocí čerstvě odebrané mořské vody, musí se mořská voda před použitím nechat odstát (stabilizovat).
|
|
41.
|
Je třeba zvážit možnost, že látky obsahující dusík mohou ovlivnit výsledky.
|
|
42.
|
Výsledky získané s referenčními látkami benzoanem sodným a anilinem by měly být srovnatelné s výsledky získanými v mezilaboratorní porovnávací zkoušce (3) (odstavec 9). Pokud jsou výsledky získané s referenčními látkami atypické, zkouška by měla být opakována s jiným vzorkem mořské vody.
|
|
43.
|
Zkušební látku lze považovat za inhibiční pro bakterie (při použité koncentraci), je-li hodnota BSK směsi referenční a zkušební látky nižší než součet hodnot BSK samostatných roztoků těchto dvou látek.
|
|
44.
|
Vzhledem k poměrně vysokým zkušebním koncentracím v porovnání s většinou přírodních systémů a následkem toho k nepříznivému poměru mezi koncentracemi zkoušené látky a jiných zdrojů uhlíku je třeba tuto metodu považovat za předběžnou zkoušku, kterou lze použít k indikaci toho, zda určitá látka je, či není snadno biologicky rozložitelná. Nízká hodnota výsledku tudíž nutně neznamená, že zkoušená látka není biologicky rozložitelná v mořském prostředí, avšak naznačuje, že pro stanovení biologické rozložitelnosti bude zapotřebí další práce.
Na obrázku níže je uveden příklad teoretického experimentu s rozkladem, který ukazuje proveditelný způsob odhadu hodnot tL (délka ‚fáze iniciace‘) a t50, časového intervalu (začínajícího v bodě tL) potřebného pro dosažení 50 % celkové spotřeby kyslíku vyvolané oxidací zkušební látky:

|
LITERATURA
|
1)
|
de Kreuk, J. F. and Hanstveit, A. O. (1981) Determination of the biodegradability of the organic fraction of chemical wastes. Chemosphere, 10 (6); pp. 561-573.
|
|
2)
|
Kapitola C.4–B této přílohy: Stanovení ‚snadné‘ biologické rozložitelnosti, Část III. Modifikovaná screeningová zkouška OECD.
|
|
3)
|
Nyholm, N. and Kristensen, P. (1987) Screening Test Methods for Assessment of Biodegradability of Chemical Substances in Seawater. Final Report of the ring test programme 1984-1985, March 1987, Commission of the European Communities.
|
|
4)
|
Kapitola C.11 této přílohy: Biologická rozložitelnost – Zkouška na inhibici dýchání aktivovaného kalu.
|
|
5)
|
Kapitola C.4–E této přílohy: Stanovení ‚snadné‘ biologické rozložitelnosti, Část VI. Zkouška v uzavřených lahvičkách.
|
Dodatek 1
Stanovení organického uhlíku v mořské vodě
METODA TŘEPACÍ LAHVE
Pro stanovení organického uhlíku ze vzorku vody se organické složky ve vzorku nechají zoxidovat na oxid uhličitý, zpravidla za použití jedné z těchto tří technik:
|
—
|
mokrá oxidace persíranem s UV zářením,
|
|
—
|
mokrá oxidace persíranem za zvýšené teploty (116–130 °C ),
|
Uvolněný CO2 se kvantifikuje pomocí infračervené spektrometrie nebo titrační metodou. Alternativně se CO2 redukuje na metan, který se kvantifikuje pomocí plamenoionizačního detektoru (FID).
Metoda persíranu s UV zářením se běžně užívá pro analýzu ‚čisté‘ vody s nízkým obsahem pevných částic. Další dvě metody lze použít na většinu druhů vodních vzorků, přičemž oxidace persíranem za zvýšené teploty je nejvhodnější pro vzorky s nízkým obsahem a technika spalování je použitelná na vzorky s obsahem netěkavého organického uhlíku (NVOC) značně převyšujícím 1 mg C/l.
Interference
Všechny tři metody jsou závislé na eliminaci nebo kompenzaci anorganického uhlíku (IC), který je přítomen ve vzorku. Nejčastěji používanou metodou eliminace IC je vymývání CO2 z okyseleného vzorku, ačkoli to současně vede ke ztrátě těkavých organických složek (1). U každé vzorkovací matice musí být zaručena úplná eliminace nebo kompenzace IC a kromě NVOC musí být, v závislosti na typu vzorku, stanoven i obsah těkavého organického uhlíku (VOC).
Vysoké koncentrace chloridů vedou ke snížené účinnosti oxidace pomocí metody persíranu s UV zářením (2). Tuto interferenci však může odstranit použití oxidačního činidla upraveného přidáním dusičnanu rtuťnatého. Pro vyhodnocení každého typu vzorků obsahujícího chloridy se doporučuje použít maximální tolerovaný objem vzorku. Vysoké koncentrace solí ve vzorku analyzovaném metodou spalování mohou způsobit usazení solí na katalyzátoru a nadměrnou korozi spalovací trubice. Měla by být přijata preventivní opatření podle příručky výrobce.
U vysoce zakalených vzorků a u vzorků obsahujících pevné částice nemusí při použití metody persíranu s UV zářením dojít k úplně oxidaci.
Příklad vhodné metody
Netěkavý organický uhlík se stanoví oxidací s persíranem a UV zářením a následnou kvantifikací uvolněného CO2 pomocí nedisperzní infračervené spektrometrie.
Oxidační činidlo se upraví v souladu s doporučeními uvedenými v položce seznamu literatury (2) a podle toho, jak uvádí příručka výrobce:
|
a)
|
8,2 g HgCl2 a 9,6 g Hg(NO3)2 · H2O se rozpustí v několika stech mililitrech reagenční vody s nízkou koncentrací uhlíku;
|
|
b)
|
20 g K2S2O8 se rozpustí v roztoku obsahujícím rtuťnaté soli;
|
|
c)
|
do směsi se přidá 5 ml HNO3 (koncentrované);
|
|
d)
|
činidlo se zředí na 1 000 ml.
|
Interference způsobené chloridy se odstraní použitím 40 μl objemu vzorku na 10 % chloridů a 200 μl objemu vzorku na 1,9 % chloridů. Vzorky s vysokými koncentracemi chloridů a/nebo vzorky o větším objemu lze podle této metody analyzovat za podmínky, že se zabrání hromadění chloridů v oxidační nádobě. Následně lze u příslušných typů vzorků podle potřeby provádět stanovení těkavého organického uhlíku.
LITERATURA
|
1)
|
ISO, Water quality – determination of total organic carbon. Draft International Standard ISO/DIS 8245, January 16, 1986.
|
|
2)
|
American Public Health Association, Standard Methods for the Estimation of Water and Wastewater. American Water Works Association & Water Pollution Control Federation, 16th edition, 1985.
Zajímavá je rovněž (podává popis automatizovaného analytického systému):
|
|
3)
|
Schreurs, W. (1978) An automated colorimetric method for the determination of dissolved organic carbon in seawater by UV destruction. Hydrobiological Bulletin 12, pp. 137–142.
|
Dodatek 2
Biologická rozložitelnost v mořské vodě
METODA TŘEPACÍ LAHVE
PŘEHLED DAT
|
2.
|
DATUM POČÁTKU ZKOUŠKY:
|
|
3.
|
ZKOUŠENÁ LÁTKA:
Název:
|
Koncentrace chemické látky v zásobním roztoku:
|
mg/l
|
|
Počáteční koncentrace chemické látky v médiu v čase t0:
|
mg/l
|
|
:
|
v mg DOC/l
|
|
|
4.
|
MOŘSKÁ VODA:
Zdroj:
Datum odběru:
Hloubka odběru:
Vzhled v době odběru (např. zakalení atd.):
|
Salinita při odběru:
|
‰
|
|
Teplota při odběru:
|
°C
|
|
DOC ‚x‘ hodin po odběru:
|
mg/l
|
Úprava před zkouškou (např. filtrace, sedimentace, odstátí atd.):
|
Počet kolonií mikroorganismů
|
|
kolonií na ml
|
|
|
|
kolonií na ml
|
|
Ostatní charakteristiky:
|
|
|
|
|
5.
|
STANOVENÍ UHLÍKU:
Analyzátor uhlíku:
|
|
Baňka č.
|
|
DOC po n dnech (mg/l)
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
Zkouška: živinami obohacená mořská voda se zkoušenou látkou
|
1
|
a1
|
|
|
|
|
|
|
a2
|
|
|
|
|
|
|
střední hodnota, Ca(t)
|
|
|
|
|
|
|
2
|
b1
|
|
|
|
|
|
|
b2
|
|
|
|
|
|
|
střední hodnota, Cb(t)
|
|
|
|
|
|
|
Slepá zkouška: živinami obohacená mořská voda bez zkoušené látky
|
1
|
c1
|
|
|
|
|
|
|
c2
|
|
|
|
|
|
|
střední hodnota, Cc(t)
|
|
|
|
|
|
|
2
|
d1
|
|
|
|
|
|
|
d2
|
|
|
|
|
|
|
střední hodnota, Cd(t)
|
|
|
|
|
|
| střední hodnota,

|
|
|
|
|
|
|
|
|
|
|
|
|
|
6.
|
VYHODNOCENÍ NAMĚŘENÝCH DAT:
|
Baňka č.
|
Výpočet výsledků
|
Rozklad v % po n dnech
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
1
|
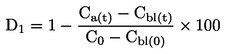
|
0
|
|
|
|
|
|
2
|

|
0
|
|
|
|
|
|
Střední hodnota (34)
|
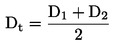
|
0
|
|
|
|
|
|
Poznámka:
|
Podobné formuláře lze použít, když po rozkladu následuje specifická analýza, a pro referenční látku a kontrolu toxicity.
|
|
|
7.
|
ABIOTICKÝ ROZKLAD (volitelné)
|
|
Čas (dny)
|
|
0
|
t
|
|
DOC (mg/l) ve sterilní kontrole
|
Cs(o)
|
Cs(t)
|

|
Dodatek 3
Výpočet teoretické biochemické spotřeby kyslíku
METODA UZAVŘENÝCH LAHVIČEK
TSK látky CcHhClclNnNanaOoPpSs o molekulové hmotnosti MW se vypočítá podle vzorce:

Z tohoto výpočtu vyplývá, že C se mineralizuje naCO2, H na H2O, P na P2O5 a Na na Na2O. Halogeny se eliminují jako halogenovodíky a dusík jako amoniak.
Například:
glukóza C6H12O6, MW = 180
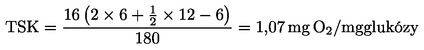
Molekulové hmotnosti jiných solí než solí alkalických kovů se vypočítají s tím, že se předpokládá, že došlo k hydrolýze těchto solí.
Předpokládá se, že síra oxiduje do stavu + 6.
Například:
dodecylbenzensulfonan sodný C18H29SO3Na, MW = 348

V případě látek, jež obsahují dusík, může být dusík eliminován jako amoniak, dusitany nebo dusičnany, což odpovídá různé teoretické biochemické spotřebě kyslíku.


V případě sekundárních aminů se předpokládá, že analýzou byla zjištěna úplná tvorba dusičnanů:
(C12H25)2 NH, MW = 353
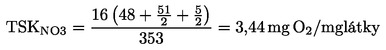
Dodatek 4

Dodatek 5
Biologická rozložitelnost v mořské vodě
METODA UZAVŘENÝCH LAHVIČEK
PŘEHLED DAT
|
2.
|
DATUM POČÁTKU ZKOUŠKY:
|
|
3.
|
ZKOUŠENÁ LÁTKA:
Název:
|
Koncentrace zásobního roztoku:
|
mg/l
|
|
Počáteční koncentrace v médiu s mořskou vodou:
|
mg/l
|
|
TSK nebo CHSK:
|
mg O2 na mg zkoušené látky
|
|
|
4.
|
MOŘSKÁ VODA:
Zdroj:
Datum odběru:
Hloubka odběru:
Vzhled v době odběru (např. zakalený, atd.):
|
Salinita při odběru:
|
‰
|
|
Teplota při odběru:
|
°C
|
|
DOC ‚x‘ hodin po odběru:
|
mg/l
|
Úprava před zkouškou (např. filtrace, sedimentace, odstátí atd.):
|
Počet kolonií mikroorganismů:
|
|
kolonií na ml
|
|
|
|
kolonií na ml
|
|
Ostatní charakteristiky:
|
|
|
|
|
5.
|
ZKUŠEBNÍ MEDIUM:
|
Teplota po provzdušnění:
|
°C
|
|
Koncentrace O2 po provzdušnění: Stav před počátkem zkoušky:
|
mg O2 na litr
|
|
|
6.
|
STANOVENÍ ROZPUŠTĚNÉHO KYSLÍKU:
Metoda: Winklerova metoda/oximetr
|
|
Baňka č.
|
|
mg O2 na litr po n dnech
|
|
0
|
5
|
15
|
28
|
|
Zkouška: živinami obohacená mořská voda se zkoušenou látkou
|
1
|
a1
|
|
|
|
|
|
2
|
a2
|
|
|
|
|
|
Střední hodnota při zkoušce
|

|
|
|
|
|
|
Slepá zkouška: živinami obohacená mořská voda, avšak bez zkoušené látky
|
1
|
c1
|
|
|
|
|
|
2
|
c2
|
|
|
|
|
|
Střední hodnota při slepé zkoušce
|
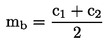
|
|
|
|
|
Poznámka: Podobný formulář lze použít i pro referenční látku a pro kontroly toxicity.
|
|
7.
|
ÚBYTEK ROZPUŠTĚNÉHO KYSLÍKU: ROZKLAD V PROCENTECH ( %D):
|
|
Úbytek rozpuštěného kyslíku po n dnech
|
|
5
|
15
|
28
|
|
(mb
– mt
) (35)
|
|
|
|
|

|
|
|
|
|
C.43. ANAEROBNÍ BIOLOGICKÁ ROZLOŽITELNOST ORGANICKÝCH LÁTEK VE VYHNILÉM KALU MĚŘENÍM PRODUKCE PLYNU
ÚVOD
|
1.
|
Tato zkušební metoda je rovnocenná Pokynu OECD pro zkoušení č. 311 (2006). Existuje řada screeningových zkoušek pro posuzování aerobní biologické rozložitelnosti organických látek (zkušební metody C.4, C.9, C.10, a C.11 (1) a OECD TG 302C (2)) a výsledky jejich aplikace jsou úspěšně využívány pro předpovídání osudu látek v aerobním prostředí, zejména v aerobních fázích čištění odpadních vod. Aerobně se odstraňují i různé podíly látek, které jsou ve vodě nerozpustné, a také látek, které adsorbují do odpadních pevných látek, neboť jsou přítomny v usazeném kalu. Větší frakce těchto látek jsou však vázány na primárně usazený kal, který se odděluje od nevyčištěných odpadních vod v usazovacích nádržích předtím, než se usazená odpadní voda nebo supernatant čistí aerobně. Kal, který obsahuje některé rozpustné látky v intersticiální tekutině, poté postupuje do vyhřívaných vyhnívacích nádrží k anaerobnímu čištění. V této sérii dosud neexistují žádné zkoušky pro posuzování anaerobní biologické rozložitelnosti v anaerobních vyhnívacích nádržích a tato zkouška má sloužit k vyplnění této mezery; nemusí být použitelná pro jiné anoxické složky životního prostředí.
|
|
2.
|
Pro posuzování anaerobní biologické rozložitelnosti byly úspěšně využívány respirometrické metody, které měří množství plynu, hlavně metanu (CH4) a oxidu uhličitého (CO2) vzniklého za anaerobních podmínek. Birch a kol. (3) tyto postupy podrobili revizi a dospěli k závěru, že nejkomplexnější je práce Sheltona a Tiedjeho (4), založená na dřívějších studiích (5)(6)(7). Metoda (4), kterou dále rozvinuli jiní (8) a stala se součástí amerických norem (9)(10), neřešila problémy spojené s rozdílnou rozpustností CO2 a CH4 ve zkušebním médiu a s výpočtem teoretické produkce plynů vyprodukovaných zkoušenou látkou. Zpráva ECETOX (3) doporučila další měření obsahu rozpuštěného anorganického uhlíku (DIC) v supernatantu, což zvýšilo použitelnost této metody. Metoda ECETOX byla podrobena mezinárodní kalibrační zkoušce (mezilaboratorní porovnávací zkoušce) a stala se normou ISO – ISO 11734 (11).
|
|
3.
|
Tato zkušební metoda, která je založena na normě ISO 11734 (11), popisuje screeningovou metodu pro hodnocení potenciální anaerobní biologické rozložitelnosti organických látek za specifických podmínek (tj. v anaerobní vyhnívací nádrži v daném čase a v daném rozmezí koncentrace mikroorganismů). Jelikož se používá zředěný kal s poměrně vysokou koncentrací zkoušené látky a trvání zkoušky je typicky delší než doba zdržení kalu v anaerobních vyhnívacích nádržích, nemusí podmínky zkoušky nutně odpovídat podmínkám v anaerobních vyhnívacích nádržích a nejsou použitelné ani pro posuzování biologické rozložitelnosti organických látek za odlišných environmentálních podmínek. Kal se exponuje zkoušené látce až 60 dní, tj. déle, než je doba zdržení běžného kalu v anaerobních vyhnívacích nádržích (25–30 dnů), ačkoli v průmyslových lokalitách může doba zdržení kalu být mnohem delší. Předpovědi založené na výsledcích této zkoušky nemohou být tak přesvědčivé jako v případě aerobní biologické rozložitelnosti, jelikož důkazy shromážděné na základě chování zkoušených látek v ‚hotových‘ aerobních zkouškách a v simulačních zkouškách a v aerobním prostředí jsou dostatečné, abychom si mohli být jisti, že zde existuje souvislost, zatímco pro anaerobní prostředí existuje podobných důkazů málo. Lze předpokládat, že k úplnému anaerobnímu biologickému rozkladu dojde tehdy, je-li dosaženo 75–80 % teoretické produkce plynu. Vysoký poměr mezi látkou a biomasou použitý v těchto zkouškách znamená, že látka, která je zkoušena, se v anaerobní vyhnívací nádrži rozloží s větší pravděpodobností. Navíc látky, které se při zkoušce nepřemění na plyn, nemusí nutně přetrvávat při poměrech mezi látkou a biomasou, které jsou v životním prostředí reálnější. Dochází také k jiným anaerobním reakcím, při kterých se látky mohou alespoň částečně rozkládat, např. k dechloraci, avšak tato zkouška takové reakce nezjišťuje. Při použití specifických analytických metod ke stanovení zkoušené látky může být nicméně sledován její úbytek (viz odstavce 6, 30, 44 a 53).
|
PODSTATA ZKOUŠKY
|
4.
|
Promytý vyhnilý kal (36), který obsahuje nízké (< 10 mg/l) koncentrace anorganického uhlíku (IC), se rozředí asi desetinásobně na celkovou koncentraci pevných látek 1 g/l až 3 g/l a inkubuje při teplotě 35 °C ± 2 °C v uzavřených nádobách se zkoušenou látkou v koncentraci 20 až 100 mg C/l po dobu až 60 dnů. Měření aktivity kalu se zohlední provedením souběžné slepé zkoušky s inokulem kalu v médiu, ale bez zkoušené látky.
|
|
5.
|
Měří se zvýšení tlaku ve volném prostoru pod víkem nádob, který je výsledkem produkce oxidu uhličitého a metanu. Značná část vyprodukovaného CO2 se za podmínek zkoušky rozpustí v kapalné fázi nebo se přemění na uhličitany nebo hydrogenuhličitany. Tento anorganický uhlík se měří na konci zkoušky.
|
|
6.
|
Množství uhlíku (anorganického a v metanu) vzniklého biologickým rozkladem zkoušené látky se vypočítá z čisté produkce plynu a čisté tvorby IC v kapalné fázi po odečtení hodnot slepých zkoušek. Rozsah biologického rozkladu se vypočítá z celkového vyprodukovaného IC a C v metanu jako procentní podíl naměřeného nebo vypočítaného množství přidaného uhlíku ve zkoušené látce. Průběh biologického rozkladu lze sledovat pouze průběžným měřením produkce plynu. Pomocí specifických analýz na počátku a na konci zkoušky lze rovněž stanovit primární biologický rozklad.
|
INFORMACE O ZKOUŠENÉ LÁTCE
|
7.
|
Pro správnou interpretaci výsledků by měla být známa čistota zkoušené látky, její rozpustnost ve vodě, těkavost a adsorpční vlastnosti. Musí být znám obsah organického uhlíku (v % hmot.) ve zkoušené látce, a to buď na základě její chemické struktury, nebo na základě měření. U těkavých zkoušených látek je pro rozhodnutí, zda je tato zkouška použitelná, vhodné použít změřenou nebo vypočítanou Henryho konstantu. Informace o toxicitě zkoušené látky pro anaerobní bakterie jsou užitečné při výběru vhodné zkušební koncentrace a při interpretaci výsledků, které ukazují na špatnou biologickou rozložitelnost. Doporučuje se zařadit kontrolu inhibice s výjimkou případů, kdy je známo, že zkoušená látka nepůsobí inhibičně na aktivity anaerobních mikroorganismů (viz odstavec 21 a norma ISO 13641-1 (12)).
|
POUŽITELNOST ZKUŠEBNÍ METODY
|
8.
|
Tuto zkušební metodu lze použít na látky rozpustné ve vodě; lze ji rovněž použít na špatně rozpustné a nerozpustné látky za předpokladu použití metody přesného dávkování, viz např. norma ISO 10634 (13). V případě těkavých látek je obecně nutné rozhodovat v jednotlivých případech. Mohou být nezbytné zvláštní kroky, například neuvolňování plynu během zkoušky.
|
REFERENČNÍ LÁTKY
|
9.
|
Pro ověření postupu se v rámci zkoušky souběžně ve vhodných nádobách testuje referenční látka. Vhodný je například fenol, benzoan sodný nebo polyethylenglykol 400 a lze očekávat, že se při více než 60 % teoretické produkce plynu (tj. metanu a anorganického uhlíku) rozloží do 60 dnů (3)(14).
|
REPRODUKOVATELNOST VÝSLEDKŮ ZKOUŠKY
|
10.
|
Při mezinárodní mezilaboratorní porovnávací zkoušce (14) bylo dobře reprodukovatelné měření tlaku plynu ve třech nádobách. Relativní směrodatná odchylka (variační koeficient, CV) byla převážně nižší než 20 %, avšak za přítomnosti toxických látek nebo ke konci 60denní inkubační doby tato hodnota často vzrostla nad 20 %. Vyšší odchylky byly zjištěny také v nádobách o objemu nižším než 150 ml. Konečné hodnoty pH zkušebního média byly v rozmezí 6,5–7,0.
|
|
11.
|
Při mezilaboratorní porovnávací zkoušce byly získány tyto výsledky:
|
Zkoušená látka
|
Celkové údaje
n1
|
Střední hodnota rozkladu
(z celkových údajů)
(v %)
|
Relativní směrodatná odchylka
(z celkových údajů)
(v %)
|
n2
|
Střední hodnota rozkladu
(z ověřených údajů
(v %)
|
Relativní směrodatná odchylka
(z ověřených údajů
(v %)
|
Údaje > 60 % rozkladu v ověřených zkouškách
n3
|
|
Kyselina palmitová
|
36
|
68,7 + 30,7
|
45
|
27
|
72,2 + 18,8
|
26
|
19 = 70 % (37)
|
|
Polyethylenglykol 400
|
38
|
79,8 + 28,0
|
35
|
29
|
77,7 + 17,8
|
23
|
24 = 83 % (37)
|
|
|
12.
|
Variační koeficient středních hodnot vypočtených ze všech získaných hodnot činil u kyseliny palmitové celých 45 % (n = 36) a u polyethylenglykolu 400 činil 35 % (n = 38). Po vyloučení hodnot < 40 % a > 100 % (první z nich byly zřejmě důsledkem horších zkušebních podmínek, druhé vznikly z neznámých důvodů) se CV snížil u kyseliny palmitové na 26 % a u ethylenglykolu 400 na 23 %. Podíl ‚platných‘ hodnot, kdy bylo dosaženo nejméně 60 % rozkladu, činil u kyseliny palmitové 70 % a u polyethylenglykolu 400 dosáhl 83 %. Podíly biologické rozložitelnosti v % odvozené z měření rozpuštěného IC byly poměrně malé, avšak kolísaly. U kyseliny palmitové činilo rozmezí 0–35 % a střední hodnota 12 % při CV 92 % a u polyethylenglykolu 400 bylo rozmezí 0–40 % a střední hodnota 24 % při CV 54 %.
|
POPIS ZKUŠEBNÍ METODY
Přístroje a pomůcky
|
13.
|
Potřebné je obvyklé laboratorní vybavení a dále:
|
a)
|
inkubátor – jiskrově bezpečný, umožňující udržovat teplotu 35 °C ± 2 °C,
|
|
b)
|
skleněné zkušební nádoby odolné vůči tlaku o vhodné jmenovité velikosti (38), každá vybavená plynotěsným septem schopným odolat tlaku přibližně 2 bar. Objem volného prostoru pod víkem by měl činit přibližně 10 % až 30 % celkového objemu. Uvolňuje-li se bioplyn pravidelně, je vhodný objem prostoru pod víkem přibližně 10 %, avšak dojde-li k uvolnění plynu až na konci zkoušky, je vhodný objem prostoru pod víkem 30 %. Skleněné lahvičky na sérum o jmenovitém objemu 125 ml, celkovém objemu kolem 160 ml, uzavřené sérovými septy (39), a dochází-li k uvolňování tlaku při každém odběru vzorku, doporučují se tvarované hliníkové uzávěry,
|
|
c)
|
měřidlo tlaku (40) upravené tak, aby umožňovalo měření a odvod vyprodukovaného plynu, například ruční přesný tlakoměr připojený ke vhodné injekční jehle; třícestný plynotěsný ventil usnadňuje uvolnění přebytečného tlaku (dodatek 1). Vnitřní objem trubky čidla tlaku a ventilu je nezbytné udržovat co nejmenší, tak aby chyby v důsledku zanedbání objemu tohoto vybavení nebyly významné.
Poznámka – odečty tlaku se použijí přímo pro výpočet množství uhlíku vyprodukovaného ve volném prostoru pod víkem (odstavce 42 až 44). Alternativně lze údaje o tlaku pomocí převodního grafu převést na objemy (při teplotě 35 °C, atmosférickém tlaku) vyprodukovaného plynu. Tento graf se sestaví na základě údajů získaných vstříknutím známých objemů plynného dusíku do série zkušebních nádob (např. lahviček na sérum) při teplotě 35 °C +/– 2 °C a zaznamenání výsledných stabilizovaných odečtů tlaku (viz dodatek 2). Výpočet je uveden v poznámce v odstavci 44.
Upozornění – je třeba dbát na to, aby při použití mikrostříkaček nedošlo k poranění jehlou,
|
|
d)
|
analyzátor uhlíku, vhodný pro přímé stanovení anorganického uhlíku v rozmezí koncentrací 1 mg/l až 200 mg/l,
|
|
e)
|
injekční stříkačky s vysokou přesností pro plynné a vodné vzorky,
|
|
f)
|
magnetické míchačky a dotykové hroty (volitelné),
|
|
g)
|
suchá skříň (doporučeno).
|
|
Činidla
|
14.
|
Je nutno používat pouze chemikálie zaručené analytické jakosti.
|
Voda
|
15.
|
Destilovaná nebo deionizovaná voda (odkysličená probubláváním plynného dusíku a s obsahem méně než 5 μl kyslíku na litr vody), obsahující méně než 2 mg rozpuštěného organického uhlíku na litr vody.
|
Zkušební médium
|
16.
|
Ředicí médium se musí připravit tak, aby obsahovalo následující složky v uvedených množstvích:
|
Bezvodý dihydrogenfosforečnan draselný (KH2PO4)
|
0,27 g
|
|
Dodekahydrát hydrogenfosforečnanu sodného (Na2HPO4·12H2O)
|
1,12 g
|
|
Chlorid amonný (NH4Cl)
|
0,53 g
|
|
Dihydrát chloridu vápenatého (CaCl2 · 2H2O)
|
0,075 g
|
|
Hexahydrát chloridu hořečnatého (MgCl2 · 6H2O)
|
0,10 g
|
|
Tetrahydrát chloridu železnatého (FeCl2 · 4H2O)
|
0,02 g
|
|
Resazurin (indikátor kyslíku)
|
0,001 g
|
|
Nonahydrát sulfidu sodného (Na2S · 9H2O)
|
0,10 g
|
|
Zásobní roztok stopových prvků (volitelné, viz odstavec 18)
|
10 ml
|
|
Doplní se odkysličenou vodou (odstavec 15)
|
na 1 litr
|
Poznámka: Sulfid sodný by se měl použít čerstvě dodaný nebo by se měl před použitím promýt a vysušit, aby se zajistila dostatečná redukční schopnost. Zkoušku lze provést bez použití suché skříně (viz odstavec 26). V tom případě by konečná koncentrace sulfidu sodného měla být zvýšena na 0,20 g Na2S · 9H2O na litr. Sulfid sodný lze také dodat z vhodného anaerobního zásobního roztoku přes septum uzavřených zkušebních nádob, jelikož tento postup sníží riziko oxidace. Sulfid sodný lze nahradit citronanem titanitým, který se dodá přes septum uzavřených zkušebních nádob do konečné koncentrace 0,8 až 1,0 mmol/l. Citronan titanitý je vysoce účinný redukční činitel s nízkou toxicitou, který se připraví takto: 2,94 g dihydrátu citronanu sodného se rozpustí v 50 ml odkysličené vody (takže vznikne roztok o koncentraci 200 mmol/l) a přidá se 5 ml 15 % (m/V) roztoku chloridu titanitého. Neutralizuje se minerálními alkáliemi na pH 7 ± 0,2 a pod proudem dusíku se odpipetuje do vhodné nádoby. Koncentrace citronanu titanitého v tomto zásobním roztoku činí 164 mmol/l.
|
|
17.
|
Složky zkušebního média kromě redukčního činitele (sulfidu sodného / citronanu titanitého) se smíchají a roztok se bezprostředně před užitím po dobu asi 20 minut nechá probublávat plynným dusíkem, aby se odstranil kyslík. Poté se těsně před použitím přidá příslušný objem čerstvě připraveného roztoku redukčního činitele (připraveného v odkysličené vodě). Hodnota pH média se, je-li to nezbytné, upraví rozředěnou minerální kyselinou nebo alkálií na hodnotu 7 ± 0,2.
|
Zásobní roztok stopových prvků (volitelné)
|
18.
|
Doporučuje se, aby pro zlepšení procesů anaerobního rozkladu zkušební médium obsahovalo následující stopové prvky, zejména pokud se použijí nízké koncentrace inokula (např. 1 g/l) (11):
|
Tetrahydrát chloridu manganatého (MnCl2 · 4H2O)
|
50 mg
|
|
Kyselina boritá (H3BO3).
|
5 mg
|
|
Chlorid zinečnatý (ZnCl2)
|
5 mg
|
|
Chlorid měďnatý (CuCl2)
|
3 mg
|
|
Dihydrát molybdenanu sodného (Na2MoO4 · 2H2O)
|
1 mg
|
|
Hexahydrát chloridu kobaltnatého (CoCl2 · 6H2O)
|
100 mg
|
|
Hexahydrát chloridu nikelnatého (NiCl2 · 6H2O)
|
10 mg
|
|
Seleničitan sodný (Na2SeO3)
|
5 mg
|
|
Doplní se odkysličenou vodou (odstavec 15)
|
na 1 litr
|
|
Zkoušená látka
|
19.
|
Přidá se zkoušená látka ve formě roztoku, suspenze, emulze nebo přímo jako pevná látka či kapalina nebo adsorbovaná na filtru ze skleněných vláken, aby se získala koncentrace organického uhlíku nejvýše 100 mg/l. Použijí-li se zásobní roztoky, připraví se příslušný roztok s vodou (odstavec 15) (předtím odkysličenou probubláváním plynného dusíku) v takové koncentraci, aby přidaný objem byl menší než 5 % celkového objemu reakční směsi. Hodnota pH zásobního roztoku se, je-li to nutné, upraví na hodnotu 7 ± 0,2. V případě zkoušených látek, které jsou nedostatečně rozpustné ve vodě, lze postupovat viz norma ISO 10634 (13). Je-li užito rozpouštědlo, připraví se další kontrolní vzorek, ve kterém se do média s inokulem přidá pouze rozpouštědlo. Neměla by se používat organická rozpouštědla, o nichž je známo, že inhibují produkci metanu, jako např. chloroform a chlorid uhličitý.
Upozornění – s toxickými zkušebními látkami se musí zacházet opatrně, stejně jako s látkami, jejichž vlastnosti nejsou známy.
|
Referenční látky
|
20.
|
K ověření postupu byly úspěšně použity referenční látky jako např. benzoan sodný, fenoly a polyethylenglykol 400, které se během 60 dnů biologicky rozložily z více než 60 %. Zásobní roztok zvolené referenční látky (v odkysličené vodě) se připraví stejně jako v případě zkoušené látky, a je-li to nezbytné, upraví se pH na hodnotu 7 ± 0,2.
|
Kontrola inhibice (podmíněně)
|
21.
|
Pro získání informací o toxicitě zkoušené látky pro anaerobní mikroorganismy a pro nalezení nejvhodnější zkušební koncentrace se zkoušená látka a referenční látka přidají do nádoby se zkušebním médiem (viz odstavec 16), každá ve stejné koncentraci (viz odstavec 19 a 20 a viz také normu ISO 13641-1 (12)).
|
Vyhnilý kal
|
22.
|
Odeberte vyhnilý kal z vyhnívací nádrže v čistírně odpadních vod, kde jsou čištěny převážně domovní odpadní vody. Kal by měl být plně charakterizován a základní informace o něm by měly být uvedeny ve zprávě (viz odstavec 54). Má-li se použít upravené inokulum, lze zvážit odběr vyhnilého kalu z čistírny průmyslových odpadních vod. Pro odběr vyhnilého kalu se použijí lahve se širokým hrdlem vyrobené z polyethylenu s vysokou hustotou nebo z podobného materiálu, které mohou zvětšovat svůj objem. Lahve se naplní kalem do výše asi 1 cm od horního okraje a pevně se uzavřou, nejlépe víkem s bezpečnostním ventilem. Po dopravě do laboratoře může být odebraný kal použit buď přímo, nebo může být umístěn do laboratorní vyhnívací nádrže. Opatrným otevřením lahví s kalem se uvolní přebytečný bioplyn. Alternativně lze jako zdroj inokula použít laboratorně získaný anaerobní kal, mohlo však dojít k narušení spektra jeho aktivity.
Upozornění – vyhnilý kal produkuje hořlavé plyny, které představují riziko požáru a výbuchu; obsahuje rovněž potenciálně patogenní organismy, takže při manipulaci je třeba přijmout příslušná preventivní opatření. Z důvodů bezpečnosti nepoužívejte pro odběr kalu skleněné nádoby.
|
|
23.
|
Pro omezení základní produkce plynu a pro snížení vlivu slepých zkoušek lze zvážit předběžné vyhnití kalu. Je-li nutné předběžné vyhnití, kal by se měl nechat vyhnít až 7 dnů při teplotě 35 °C ± 2 °C, a to bez přidání jakýchkoli živin nebo substrátů. Bylo zjištěno, že předběžné vyhnití kalu přibližně po dobu 5 dnů obvykle vede k optimálnímu snížení produkce plynu ve slepé zkoušce, aniž by došlo k nepřijatelnému nárůstu ve fázi iniciace nebo v inkubační době.
|
|
24.
|
U zkoušených látek, které jsou (nebo se předpokládá, že jsou) špatně biologicky rozložitelné, je třeba zvážit předběžnou expozici kalu zkoušené látce pro získání inokula, které je lépe přizpůsobené. V takovém případě se do vyhnilého kalu přidá zkoušená látka při koncentraci organického uhlíku 5 mg/l až 20 mg/l a inkubuje se až 2 týdny. Předexponovaný kal se před použitím pečlivě promyje (viz odstavec 25) a v závěrečné zprávě se uvedou podmínky předběžné expozice.
|
Inokulum
|
25.
|
Kal se těsně před použitím promyje (viz odstavce 22 až 24) pro snížení koncentrace IC v konečné zkušební suspenzi na méně než 10 mg/l. Kal v uzavřených zkumavkách se odstředí (např. při 3 000 g po dobu 5 min) a supernatant se odstraní. Výsledná peleta se suspenduje v odkysličeném médiu (odstavec 16 a 17), suspenze se znovu odstředí a supernatant se odstraní. Pokud nedojde k dostatečnému snížení obsahu IC, lze postup promytí kalu nejvýše dvakrát opakovat. To by nemělo nepříznivě ovlivnit mikroorganismy. Nakonec se peleta suspenduje v potřebném objemu zkušebního média a stanoví se koncentrace celkového obsahu pevných látek (např. podle normy ISO 11923 (15)). Konečná koncentrace celkového obsahu pevných látek ve zkušebních nádobách by měla být v rozmezí od 1 g/l do 3 g/l (nebo asi 10 % celkového obsahu pevných látek v nezředěném vyhnilém kalu). Výše uvedené postupy musí být provedeny tak, aby se kal v co nejmenší míře dostal do styku s kyslíkem (např. za použití dusíkové atmosféry).
|
POSTUP ZKOUŠKY
|
26.
|
Následující úvodní postupy provádějte pomocí takových technik, aby byl kontakt vyhnilého kalu s kyslíkem na co možná nejnižší míře, například může být nezbytné pracovat v suché skříni v dusíkové atmosféře a/nebo vyplachovat lahve dusíkem (4).
|
Příprava zkoušky a zkoušky s kontrolními vzorky
|
27.
|
Připraví se zkušební nádoby nejméně ve třech opakováních (viz odstavec 13b) pro zkoušenou látku, slepé zkoušky, referenční látku, kontroly inhibice (podmíněné) a komory pro kontrolu tlaku (volitelný postup) (viz odstavec 7, 19 až 21). Připravit lze také další nádoby za účelem hodnocení primárního biologického rozkladu specifickými analýzami zkoušené látky. Stejný soubor slepých zkoušek lze použít pro několik zkoušených látek v rámci téže zkoušky, jsou-li objemy volného prostoru pod víkem shodné.
|
|
28.
|
Připraví se naředěné inokulum a vloží se do nádob, např. pomocí široké pipety. Přidají se poměrné podíly dobře promíchaného inokula (odstavec 25) tak, aby koncentrace celkového obsahu pevných látek byla ve všech nádobách stejná (mezi 1 g/l a 3 g/l). Přidají se zásobní roztoky zkoušené a referenční látky, poté co jejich pH bylo v případě potřeby upraveno na hodnotu 7 ± 0,2. Zkoušená látka a referenční látka by měly být přidány nejvhodnějším způsobem (odstavec 19).
|
|
29.
|
Zkušební koncentrace organického uhlíku by se obvykle měly pohybovat mezi 20 a 100 mg/l (odstavec 4). Je-li zkoušená látka toxická, měla by se zkušební koncentrace snížit na 20 mg C/l nebo i na nižší hodnotu, má-li se měřit pouze primární biologický rozklad pomocí specifických analýz. Je třeba poznamenat, že při nižších zkušebních koncentracích se zvyšuje variabilita výsledků zkoušky.
|
|
30.
|
Ve slepých zkouškách se namísto zásobního roztoku, suspenze nebo emulze zkoušené látky přidá odpovídající množství nosiče používaného pro dávkování zkoušené látky. Byla-li zkoušená látka podána za použití filtrů ze skleněných vláken nebo organických rozpouštědel, zařadí se do slepých zkoušek filtr nebo odpovídající objem rozpouštědla, které se vypaří. Pro měření hodnoty pH se připraví jedno další opakování se zkoušenou látkou. Hodnota pH se, je-li to nezbytné, pomocí malých množství zředěné minerální kyseliny nebo alkálie upraví na hodnotu 7 ± 0,2. Do všech zkušebních nádob by se měla přidat stejná množství neutralizačních činitelů. Tyto látky by se v optimálním případě přidávat nemusely, jelikož hodnota pH zásobních roztoků zkoušené látky a referenční látky již byla upravena (viz odstavec 19 a 20). Má-li se měřit primární biologický rozklad, měl by se z nádoby pro kontrolu pH nebo z další zkušební nádoby odebrat vhodný vzorek a koncentrace zkoušené látky by měla být změřena pomocí specifických analýz. Mají-li se reakční směsi míchat, lze do všech nádob umístit kryté magnety (volitelné).
|
|
31.
|
Je třeba zajistit, aby celkový objem kapaliny V1 a objem volného prostoru pod víkem Vh byly ve všech nádobách stejné; hodnoty V1 a Vh se zaznamenají a uvedou v protokolu. Každá nádoba by měla být uzavřena plynovým septem a přenesena ze suché skříně (viz odstavec 26) do inkubátoru (viz odstavec 13-a).
|
Nerozpustné zkoušené látky
|
32.
|
Odvážené množství látek, které jsou špatně rozpustné ve vodě, se přidá přímo do připravených nádob. Musí-li se použít rozpouštědlo (viz odstavec 19), roztok nebo suspenze zkoušené látky se přemístí do prázdných nádob. Tam, kde je to možné, se rozpouštědlo odpaří propláchnutím nádob plynným dusíkem a poté se přidají ostatní složky, a sice naředěný kal (odstavec 25) a odkysličená voda podle potřeby. Měla by se připravit také další kontrola s rozpouštědlem (viz odstavec 19). Pro další metody přidávání nerozpustných látek viz norma ISO 10634 (13). Kapalné zkoušené látky lze dávkovat stříkačkou do zcela připravených uzavřených nádob, pokud lze očekávat, že počáteční pH nepřekročí hodnotu 7 ± 1, jinak se dávkuje tak, jak uvedeno výše (viz odstavec 19).
|
Inkubace a měření tlaku plynů
|
33.
|
Připravené nádoby se přibližně 1 hodinu inkubují při teplotě 35 °C ± 2 °C, aby se umožnilo ustavení rovnováhy a uvolnění přebytku plynu do ovzduší, například tak, že každá nádoba se postupně protřepe, jehlou tlakoměru (odstavec 13-c) se propíchne uzávěr a otevře se ventil, dokud tlakoměr nevykáže nulovou hodnotu. Je-li v této fázi nebo při provádění průběžných měření tlak ve volném prostoru pod víkem nižší než atmosférický tlak, měl by být zaveden plynný dusík pro opětovné nastolení atmosférického tlaku. Ventil se uzavře (viz odstavec 13-c) a pokračuje inkubace v temnu, přičemž se zajistí, aby všechny části nádob byly udržovány při teplotě rozkladu. Po inkubaci v trvání 24 až 48 hodin se nádoby vizuálně zkontrolují. Pokud se supernatant zřetelné zbarvil do růžova, tj. pokud Resazurin (viz odstavec 16) změnil barvu a ukázal na přítomnost kyslíku (viz odstavec 50), tyto nádoby se ze zkoušky vyřadí. Malá množství kyslíku může systém tolerovat, avšak vyšší koncentrace mohou průběh anaerobního biologického rozkladu výrazně ztlumit. Výjimečné vyřazení jedné nádoby ze souboru tří opakování lze akceptovat, avšak výskyt více takových selhání musí vést k prošetření experimentálních postupů a k opakování zkoušky.
|
|
34.
|
Obsah každé nádoby se opatrně smísí mícháním nebo protřepáním po dobu několika minut nejméně dvakrát nebo třikrát týdně a krátce před každým měřením tlaku. Protřepání opětovně suspenduje inokulum a zajistí plynovou rovnováhu. Veškerá měření tlaku by měla být prováděna rychle, jelikož ve zkušebních nádobách by mohlo dojít ke snížení teploty, což vede k falešným údajům. Při měření tlaku by celá zkušební nádoba včetně volného prostoru pod víkem měla být udržována při teplotě rozkladu. Změří se tlak plynu, například propíchnutím septa injekční jehlou (odstavec 13-c) napojenou na tlakoměr. Mělo by se dbát na to, aby se do jehly nedostala voda; pokud k tomu dojde, mokré části by měly být vysušeny a měla by se použít nová jehla. Tlak by měl být měřen v milibarech (viz odstavec 42). Tlak plynu v nádobě lze měřit periodicky, např. týdně, a přebytek plynu volitelně vypouštět do ovzduší. Alternativně se tlak měří pouze na konci zkoušky, aby se stanovilo množství vyprodukovaného bioplynu.
|
|
35.
|
Odečty tlaku plynu se doporučuje provádět průběžně, protože nárůst tlaku poskytuje vodítko ohledně toho, kdy lze zkoušku ukončit, a umožňuje sledovat kinetiku (viz odstavec 6).
|
|
36.
|
Zkouška se obvykle ukončí po uplynutí inkubační doby 60 dnů, pokud křivka biologického rozkladu získaná z měření nedosáhne dříve fáze plató; to je fáze, kdy bylo dosaženo maximálního rozkladu a křivka biologického rozkladu se vyrovná. Je-li hodnota plató nižší než 60 %, interpretace je problematická, protože to naznačuje, že se mineralizovala pouze část molekuly nebo že došlo k chybě. Pokud byl na konci obvyklé inkubační doby vyprodukován plyn, avšak zjevně nebylo dosaženo fáze plató, mělo by se zvážit prodloužení zkoušky, aby se ověřilo, zda plató (> 60 %) bude dosaženo.
|
Měření anorganického uhlíku
|
37.
|
Na konci zkoušky, po posledním měření tlaku plynu, se kal nechá usadit. Všechny nádoby se postupně otevřou a ihned se odebere vzorek pro stanovení koncentrace (mg/l) anorganického uhlíku (IC) v supernatantu. Supernatant by se neměl odstřeďovat ani filtrovat, protože by došlo k nepřijatelné ztrátě rozpuštěného oxidu uhličitého. Nemůže-li být kapalina analyzována při odběru vzorků, skladuje se v uzavřené zkumavce bez volného prostoru nad kapalinou, ochlazená přibližně na 4 °C až po dobu 2 dnů. Po změření IC se změří hodnota pH a zaznamená se.
|
|
38.
|
Alternativně lze IC v supernatantu stanovit nepřímo pomocí uvolnění rozpuštěného IC jako oxidu uhličitého, který lze změřit ve volném prostoru pod víkem. Po posledním měření tlaku plynu se tlak ve všech zkušebních nádobách upraví na atmosférický tlak. Obsah každé nádoby se okyselí přibližně na pH 1 přidáním koncentrované minerální kyseliny (např. H2SO4) přes septum uzavřených nádob. Protřepané nádoby se asi 24 hodin inkubují při teplotě 35 °C ± 2 °C a pomocí tlakoměru se změří tlak plynu vzniklý v důsledku uvolňování oxidu uhličitého.
|
|
39.
|
Podobné odečty se provedou u odpovídající slepé zkoušky, referenční látky a u nádob pro kontrolu inhibice, byla-li zařazena (viz odstavec 21).
|
|
40.
|
V některých případech, zejména jsou-li tytéž kontrolní nádoby použity pro několik zkoušených látek, by případně měla být zvážena měření průběžných koncentrací IC ve zkušebních a kontrolních nádobách. V takovém případě by měl být připraven dostatečný počet nádob pro všechna průběžná měření. Tento postup se upřednostňuje před odběrem všech vzorků pouze z jedné nádoby. Odběr všech vzorků z jedné nádoby lze provádět pouze tehdy, není-li požadovaný objem pro analýzu rozpuštěného IC považován za příliš vysoký. Měření rozpuštěného IC by se mělo provádět po změření tlaku plynu bez uvolnění přebytku plynu, jak je popsáno níže:
|
—
|
pomocí injekční jehly se přes septum bez otevření nádob odebere co možná nejmenší objem vzorků supernatantu a stanoví se obsah IC ve vzorku,
|
|
—
|
po odebrání vzorku se uvolní nebo neuvolní přebytek plynu,
|
|
—
|
mělo by se vzít v úvahu, že i malý pokles objemu supernatantu (např. kolem 1 %) může vést ke značnému nárůstu objemu plynu v prostoru pod víkem (Vh),
|
|
—
|
rovnice (viz odstavec 44) se zkorigují zvýšením hodnoty Vh v rovnici 3 podle potřeby.
|
|
Specifické analýzy
|
41.
|
Má-li být stanovován primární anaerobní rozklad (viz odstavec 30), z nádob se zkoušenou látkou se na počátku a na konci zkoušky odeberou vzorky v přiměřeném objemu pro specifické analýzy. Je-li to provedeno, je třeba si uvědomit, že objemy volného prostoru pod víkem (Vh) a objemy kapaliny (Vl) se změní, a vzít to v úvahu při výpočtu výsledků produkce plynu. Alternativně lze vzorky pro specifické analýzy odebrat z dalších směsí, které byly pro tento účel dříve připraveny (odstavec 30).
|
ÚDAJE A JEJICH PŘEDKLÁDÁNÍ
Zpracování výsledků
|
42.
|
Z praktických důvodů se tlak plynu měří v milibarech (1 mbar = 1h Pa = 102 Pa; 1 Pa = 1 N/m2), objem v litrech a teplota ve stupních Celsia.
|
Uhlík ve volném prostoru pod víkem
|
43.
|
Jelikož 1 mol metanu a 1 mol oxidu uhličitého obsahují shodně 12 g uhlíku, lze hmotnost uhlíku v daném objemu uvolněného plynu vyjádřit jako:
|
m= 12 × 103×n
|
rovnice [1]
|
kde:
|
m
|
=
|
hmotnost uhlíku (v mg) v daném objemu uvolněného plynu,
|
|
12
|
=
|
relativní atomová hmotnost uhlíku,
|
|
n
|
=
|
počet molů plynu v daném objemu.
|
Vyprodukuje-li se jiný plyn než metan nebo oxid uhličitý (např. N2O) ve významných množstvích, vzorec [1] by měl být doplněn tak, aby popisoval možnost účinků vyvolaných vyprodukovanými plyny.
|
|
44.
|
Podle zákonů o plynu lze n vyjádřit jako:
|
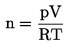
|
rovnice [2]
|
kde:
|
p
|
=
|
tlak plynu (v pascalech),
|
|
V
|
=
|
objem plynu (v m3),
|
|
R
|
=
|
molární plynová konstanta [8,314 J/(mol K)],
|
|
T
|
=
|
inkubační teplota (v kelvinech).
|
Kombinací rovnic [1] a [2] a racionalizací se získá produkce plynu ve slepé zkoušce:
|

|
rovnice [3]
|
kde:
|
mh
|
=
|
hmotnost čistého uhlíku vyprodukovaného jako plyn ve volném prostoru pod víkem (v mg),
|
|
Δp
|
=
|
střední hodnota rozdílu mezi počátečním a konečným tlakem ve zkušebních nádobách po odečtení odpovídající střední hodnoty ve slepých zkouškách (v milibarech),
|
|
Vh
|
=
|
objem volného prostoru pod víkem nádoby (v l),
|
|
0,1
|
=
|
faktor pro přepočet z newtonů/m2 na milibary a z m3 na litry.
|
Rovnice [4] by měla být použita pro běžnou inkubační teplotu 35 °C (308 K):
|
mh
= 0,468(Δp·Vh
)
|
rovnice [4]
|
Poznámka: Alternativní výpočet objemu: Údaje tlakoměru se přepočtou na ml vyprodukovaného plynu pomocí standardní křivky, která se vytvoří vynesením vstříknutého objemu (v ml) v závislosti na údajích měřiče (dodatek 2). Počet molů (n) plynu v prostoru pod víkem každé nádoby se vypočítá vydělením kumulativní produkce plynu (v ml) hodnotou 25 286 ml/mol, což je objem, který zaujímá jeden mol plynu při teplotě 35 °C a standardním atmosférickém tlaku. Jelikož 1 mol CH4 a 1 mol CO2 shodně obsahují 12 g uhlíku, množství uhlíku (v mg) ve volném prostoru pod víkem (mh
) je dáno rovnicí [5]:
|
mh
= 12 × 103×n
|
rovnice [5]
|
Racionalizace umožňující získat produkci plynu ve slepé zkoušce:
|

|
rovnice [6]
|
kde:
|
mh
|
=
|
hmotnost čistého uhlíku vyprodukovaného jako plyn ve volném prostoru pod víkem (v mg),
|
|
ΔV
|
=
|
střední hodnota rozdílu mezi objemem plynu vyprodukovaného ve volném prostoru pod víkem zkušebních nádob a nádob pro slepou zkoušku,
|
|
25 286
|
=
|
objem, který zaujímá 1 mol plynu při teplotě 35 °C a tlaku 1 atmosféry.
|
|
|
45.
|
Průběh biologického rozkladu lze případně sledovat vynesením kumulovaného přírůstku tlaku Δp (v milibarech) v závislosti na čase. Z této křivky se zjistí fáze iniciace (ve dnech) a zaznamená se. Fáze iniciace je doba od počátku zkoušky do začátku významného rozkladu (viz například dodatek 3). Pokud byly odebírány a analyzovány průběžné vzorky supernatantu (viz odstavec 40, 46 a 47), lze vynést celkový vyprodukovaný C (v plynu plus v kapalině), a nikoli pouze kumulovaný tlak.
|
Uhlík v kapalině
|
46.
|
Množství metanu v kapalině se zanedbá, jelikož je známo, že jeho rozpustnost ve vodě je velmi nízká. Hmotnost anorganického uhlíku v kapalině ve zkušebních nádobách se vypočítá pomocí rovnice [7]:
kde:
|
ml
|
=
|
hmotnost anorganického uhlíku v kapalině (v mg),
|
|
Cnet
|
=
|
koncentrace anorganického uhlíku ve zkušebních nádobách po odečtení anorganického uhlíku v kontrolních nádobách na konci zkoušky (v mg/l),
|
|
Vl
|
=
|
objem kapaliny v nádobě (v l).
|
|
Celkové množství zplynovaného uhlíku
|
47.
|
Celková hmotnost zplynovaného uhlíku v nádobě se vypočítá pomocí rovnice [8]:
kde:
|
|
mt
= celková hmotnost zplynovaného uhlíku (v mg),
|
|
|
mh
a ml
, jak jsou definovány výše.
|
|
Uhlík ze zkoušené látky
|
48.
|
Hmotnost uhlíku ve zkušebních nádobách získaného z přidané zkoušené látky se vypočítá pomocí rovnice [9]:
kde:
|
mv
|
=
|
hmotnost uhlíku ze zkoušené látky (v mg),
|
|
Cc
|
=
|
koncentrace uhlíku ze zkoušené látky ve zkušební nádobě (v mg/l),
|
|
Vl
|
=
|
objem kapaliny ve zkušební nádobě (v l).
|
|
Rozsah biologického rozkladu
|
49.
|
Biologický rozklad v procentech se vypočítá z plynu pod víkem pomocí rovnice [10] a celkový biologický rozklad v procentech se vypočítá pomocí rovnice [11]:
|
Dh
= (mh
/mv
) × 100
|
rovnice [10]
|
|
Dt
= (mt
/mv
) × 100
|
rovnice [11]
|
kde:
|
|
Dh
= biologický rozklad vypočtený z plynu v prostoru pod víkem (v %),
|
|
|
Dt
= celkový biologický rozklad (v %),
|
|
|
mh, mv
a mt
, jak jsou definovány výše.
|
Stupeň primárního biologického rozkladu se vypočítá z (volitelných) měření koncentrace zkoušené látky na počátku a na konci inkubace pomocí rovnice [12]:
|
Dp
= (1 –Se
/Si
) × 100
|
rovnice [12]
|
kde:
|
Dp
|
=
|
primární rozklad zkoušené látky (v %),
|
|
Si
|
=
|
počáteční koncentrace zkoušené látky (v mg/l),
|
|
Se
|
=
|
koncentrace zkoušené látky na konci (v mg/l).
|
Pokud jsou na základě analytické metody stanoveny významné koncentrace zkoušené látky v neexponovaném inokulu anaerobního kalu, použije se rovnice [13]:
|
Dp
1
= [1 – (Se
–Seb
)/(Si
–Sib
)] × 100
|
rovnice [13]
|
kde:
|
Dp
1
|
=
|
korigovaný primární rozklad zkoušené látky (v %),
|
|
Sib
|
=
|
počáteční ‚zjevná‘ koncentrace zkoušené látky ve slepých zkouškách (v mg/l),
|
|
Seb
|
=
|
‚zjevná‘ koncentrace zkoušené látky ve slepých zkouškách na konci (v mg/l).
|
|
Platnost výsledků
|
50.
|
Údaje o tlaku by měly být použity pouze z nádob, které nevykazují růžové zbarvení (viz odstavec 33). Kontaminace kyslíkem se minimalizuje použitím vhodných anaerobních manipulačních postupů.
|
|
51.
|
Je třeba mít na paměti, že zkouška je platná, pokud referenční látka dosáhne plató, které představuje více než 60 % biologického rozkladu (41).
|
|
52.
|
Překročí-li pH na konci zkoušky rozmezí 7 ± 1 a došlo k nedostatečnému biologickému rozkladu, zkouška se opakuje se zvýšenou pufrační kapacitou média.
|
Inhibice rozkladu
|
53.
|
Produkce plynu v nádobách obsahujících jak zkoušenou, tak referenční látku by měla být přinejmenším stejná jako produkce plynu v nádobách pouze s referenční látkou; v opačném případě je indikována inhibice produkce plynu. V některých případech bude produkce plynu v nádobách obsahujících zkoušenou látku bez referenční látky nižší než produkce plynu ve slepých zkouškách, což naznačuje, že zkoušená látka působí inhibičně.
|
Závěrečná zpráva
|
54.
|
Závěrečná zpráva musí obsahovat tyto údaje:
|
|
Zkoušená látka:
|
—
|
obecný název, chemický název, číslo CAS, strukturní vzorec a relevantní fyzikálně-chemické vlastnosti,
|
|
—
|
čistota (nečistoty) zkoušené chemické látky.
|
|
|
|
Zkušební podmínky:
|
—
|
objem naředěné směsi ve vyhnívací nádrži (Vl
) a objem volného prostoru pod víkem (Vh
) nádoby,
|
|
—
|
popis zkušebních nádob, hlavní charakteristiky měření bioplynu (např. druh tlakoměru) a analyzátoru IC,
|
|
—
|
aplikace zkoušené látky a referenční látky do zkušebního systému: použitá zkušební koncentrace a jakékoli použití rozpouštědel,
|
|
—
|
podrobnosti o použitém inokulu: název čistírny odpadních vod, popis zdroje čištěné odpadní vody (např. provozní teplota, doba zdržení kalu, zda je převážně domovní apod.), koncentrace, veškeré informace potřebné k odůvodnění výběru a informace o jakékoli předúpravě inokula (např. předběžné vyhnití, předběžná expozice);
|
|
|
|
Výsledky:
|
—
|
hodnoty pH a IC na konci zkoušky,
|
|
—
|
bylo-li provedeno měření pro specifické analýzy, koncentrace zkoušené látky na počátku a na konci zkoušky,
|
|
—
|
veškeré naměřené údaje získané z nádob používaných během zkoušky a slepé zkoušky, z nádob s referenční látkou a případně z nádob pro kontrolu inhibice (např. tlak v milibarech, koncentrace anorganického uhlíku (v mg/l)) ve formě tabulky (naměřené údaje o volném prostoru pod víkem a o kapalině by měly být uvedeny zvlášť),
|
|
—
|
statistické zpracování údajů, doba trvání zkoušky a diagram biologického rozkladu zkoušené látky, referenční látky a kontroly inhibice,
|
|
—
|
procento biologického rozkladu zkoušené látky a referenční látky,
|
|
—
|
odůvodnění případného odmítnutí výsledků zkoušky,
|
|
|
LITERATURA
|
1)
|
Následující kapitoly této přílohy:
|
|
C.4, Stanovení snadné biologické rozložitelnosti;
|
|
|
C.9, Biologická rozložitelnost – Zahn-Wellensova zkouška;
|
|
|
C.10, Simulační zkouška aerobního čištění odpadních vod:
A: Jednotky aktivovaného kalu, B: Biofilmy
|
|
|
C.11, Biologická rozložitelnost – Zkouška na inhibici dýchání aktivovaného kalu
|
|
|
2)
|
OECD (2009) Inherent Biodegradability: Modified MITI Test (II), OECD Guideline for Testing of Chemicals, No. 302C, OECD, Paris.
|
|
3)
|
Birch, R. R., Biver, C., Campagna, R., Gledhill, W. E., Pagga,U., Steber, J., Reust, H. and Bontinck, W. J. (1989) Screening of chemicals for anaerobic biodegradation. Chemosphere 19, pp. 1527–1550. (Also published as ECETOC Technical Report No. 28, June 1988).
|
|
4)
|
Shelton, D. R. and Tiedje, J. M. (1984) General method for determining anaerobic biodegradation potential. Appl. Environ. Mircobiology, 47, pp. 850–857.
|
|
5)
|
Owen, W. F., Stuckey, D. C., Healy, J. B., Jr., Young, L. Y. and McCarty, P. L. (1979) Bioassay for monitoring biochemical methane potential and anaerobic toxicity. Water Res. 13, pp. 485–492.
|
|
6)
|
Healy, J. B., Jr. and Young, L. Y. (1979) Anaerobic biodegradation of eleven aromatic compounds to methane. Appl. Environ. Microbiol. 38, pp. 84–89.
|
|
7)
|
Gledhill, W. E. (1979) Proposed standard practice for the determination of the anaerobic biodegradation of organic chemicals. Working document. Draft 2 no.35.24. American Society for Testing Materials, Philadelphia.
|
|
8)
|
Battersby, N. S. and Wilson, V. (1988) Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic chemicals under methanogenic conditions. Chemosphere, 17, pp. 2441–2460.
|
|
9)
|
E1192-92. Standard Test Method for Determining the Anaerobic Biodegradation Potential of Organic Chemicals. ASTM, Philadelphia.
|
|
10)
|
US-EPA (1998) Fate, Transport and Transformation Test Guidelines OPPTS 835.3400 Anaerobic Biodegradability of Organic Chemicals.
|
|
11)
|
International Organization for Standardization (1995) ISO 11 734 Water Quality – Evaluation of the ultimate anaerobic biodegradation of organic compounds in digested sludge – Method by measurement of the biogas production.
|
|
12)
|
International Organization for Standardization (2003) ISO 13 641-1 Water Quality – Determination of inhibition of gas production of anaerobic bacteria – Part 1 General Test.
|
|
13)
|
International Organization for Standardization (1995) ISO 10 634 Water Quality – Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium.
|
|
14)
|
Pagga, U. and Beimborn, D. B. (1993) Anaerobic biodegradation test for organic compounds. Chemosphere, 27, pp. 1499–1509.
|
|
15)
|
International Organization for Standardization (1997) ISO 11 923 Water Quality – Determination of suspended solids by filtration through glass-fibre filters.
|
Dodatek 1
Příklad zařízení k měření produkce bioplynu pomocí tlaku plynu

Vysvětlivky:
|
1
|
–
|
Tlakoměr
|
|
2
|
–
|
Třícestný plynotěsný ventil
|
|
3
|
–
|
Injekční jehla
|
|
4
|
–
|
Plynotěsný uzávěr (tvarovaný uzávěr a septum)
|
|
5
|
–
|
Volný prostor pod víkem (Vh
)
|
|
6
|
–
|
Inokulum vyhnilého kalu (Vl
)
|
Zkušební nádoby v prostředí o teplotě 35 °C ± 2 °C
Dodatek 2
Převod údajů tlakoměru
Údaje tlakoměru lze převést na objemy plynu pomocí standardní křivky získané nástřikem známých objemů vzduchu o teplotě 35 °C ± 2 °C do lahviček na sérum, které obsahují vodu ve stejném objemu, jako je objem reakční směsi, V
R:
|
—
|
do pěti lahviček na sérum se rozdělí poměrné části vody odpovídající objemu V
R v ml, udržované o teplotě 35 ± 2 °C. Lahvičky se uzavřou a vloží se na 1 hodinu do vodní lázně o teplotě 35 °C pro dosažení rovnováhy,
|
|
—
|
zapne se tlakoměr, nechá se ustálit a vynuluje se,
|
|
—
|
injekční jehlou se propíchne víčko jedné z lahviček, otevře se ventil, dokud tlakoměr neukáže nulovou hodnotu, a ventil se uzavře,
|
|
—
|
tento postup se opakuje s ostatními lahvičkami,
|
|
—
|
do každé lahvičky se nastříkne 1 ml vzduchu o teplotě 35 °C ± 2 °C. Jehlou (napojenou na tlakoměr) se propíchne víčko jedné z lahviček a údaj o tlaku se nechá stabilizovat. Tlak se zaznamená, otevře se ventil, dokud tlak nevykáže nulovou hodnotu, a poté se ventil uzavře,
|
|
—
|
tento postup se opakuje s ostatními lahvičkami,
|
|
—
|
výše uvedený postup se opakuje s 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml a 50 ml vzduchu,
|
|
—
|
vynese se převodní křivka tlaku (Pa) v závislosti na objemu vstříknutého plynu Vb (v ml). V rozmezí 0 Pa až 70 000 Pa a v rozmezí 0 ml až 50 ml produkce plynu je odezva přístroje lineární.
|
Dodatek 3
Příklad křivky rozkladu (přírůstek kumulovaného čistého tlaku)

Dodatek 4
Příklad přehledu dat pro zkoušku anaerobního biologického rozkladu – Přehled dat o zkoušené látce
|
Laboratoř: …
|
Zkoušená látka: …
|
Zkouška č.: …
|
|
Zkušební teplota: (°C) …
|
Objem volného prostoru pod víkem (V
h): …(l)
|
Objem kapaliny (V
l): …(l)
|
|
Množství uhlíku ve zkoušené látce C
c,v: …(mg/l)
|
mv
(42): …(mg)
|
|
|
Den
|
p
1 (zkouška)
(v mbar)
|
p
2 (zkouška)
(v mbar)
|
p
3 (zkouška)
(v mbar)
|
p (zkouška)
střední hodnota
(v mbar)
|
p
4 (slepá zkouška)
(v mbar)
|
p
5 (slepá zkouška)
(v mbar)
|
p
6 (slepá zkouška)
(v mbar)
|
p (slepá zkouška)
střední hodnota
(v mbar)
|
p (čisté množství)
zkouška minus slepá zkouška
střední hodnota (v mbar)
|
Δ
p (čisté množství)
kumulované
(v mbar)
|
mh
C pod víkem (43)
(v mg)
|
D
h
Biologický rozklad (44)
(v %)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
IC, 1
zkouška
(v mg)
|
C
IC, 2
zkouška
(v mg)
|
C
IC, 3
zkouška
(v mg)
|
C
IC
zkouška, střední hodnota
(v mg)
|
C
IC, 4
slepá zkouška
(v mg)
|
C
IC, 5
slepá zkouška
(v mg)
|
C
IC, 6
slepá zkouška
(v mg)
|
C
IC
slepá zkouška, střední hodnota
(v mg)
|
C
IC, net
zkouška minus slepá zkouška
střední hodnota
(v mg)
|
m
l
C v kapalině (45)
(v mg)
|
m
t
Celkový C (46)
(v mg)
|
Dt
Biologický rozklad (47)
(v %)
|
|
IC (na konci)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH (na konci)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Laboratoř: …
|
Referenční látka: …
|
Zkouška č.: …
|
|
Zkušební teplota: (°C) …
|
Objem volného prostoru pod víkem (V
h) (v l): …
|
Objem kapaliny (V
l) (v l): …
|
|
Množství uhlíku v referenční látce C
c,v: …(mg/l)
|
mv
(48) (v mg): …
|
|
|
Den
|
p
1 (referenční)
(v mbar)
|
p
2 (referenční)
(v mbar)
|
p
3 (referenční)
(v mbar)
|
p (referenční)
střední hodnota
(v mbar)
|
p
4 (kontrola inhibice)
(v mbar)
|
p
5 (kontrola inhibice)
(v mbar)
|
p
6 (kontrola inhibice)
(v mbar)
|
p (kontrola inhibice)
střední hodnota
(v mbar)
|
p (referenční)
ref. minus slepá zkouška
(v mbar)
|
Δ
p (referenční)
kumulovaný
(v mbar)
|
mh
C pod víkem (49)
(v mg)
|
D
h
Biologický rozklad (50)
(v %)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
IC, 1
referenční
(v mg)
|
C
IC, 2
referenční
(v mg)
|
C
IC, 3
referenční
(v mg)
|
C
IC
referenční, střední hodnota
(v mg)
|
C
IC, 4
kontrola inhibice
(v mg)
|
C
IC, 5
kontrola inhibice
(v mg)
|
C
IC, 6
kontrola inhibice
(v mg)
|
C
IC
kontrola inhibice, střední hodnota
(v mg)
|
C
IC, net
referenční minus kontrola inhibice
(v mg)
|
m
l
C v kapalině (51)
(v mg)
|
m
t
Celkový C (52)
(v mg)
|
D
t
Biologický rozklad (53)
(v %)
|
|
IC (na konci)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH (na konci)
|
|
|
|
|
|
|
|
|
|
|
|
|
C.44. VYPLAVOVÁNÍ V PŮDNÍCH SLOUPCÍCH
ÚVOD
|
1.
|
Tato zkušební metoda je rovnocenná Pokynu OECD pro zkoušení č. 312 (2004). Chemické látky vznikající v důsledku lidské činnosti se mohou dostat do půdy buď přímo úmyslnou aplikací (např. chemické látky používané v zemědělství), nebo nepřímými cestami (např. prostřednictvím odpadních vod do čistírenských kalů a z nich skrze mokré/suché depozice do půdy nebo vzduchu). Aby bylo možné posoudit rizika spojená s těmito chemickými látkami, je důležité odhadnout jejich potenciál pro transformaci v půdě a pro pohyb (vyplavování) do hlubších půdních vrstev a následně do podzemních vod.
|
|
2.
|
Pro změření potenciálu vyplavování chemických látek v půdě za řízených laboratorních podmínek existuje několik metod, a to chromatografie na tenké vrstvě půdy, chromatografie na silné vrstvě půdy, kolonová chromatografie půd a měření adsorpce/desorpce (1)(2). U nedisociovaných chemických látek umožňuje předběžný odhad jejich adsorpce a potenciálu vyplavování rozdělovací koeficient n-oktanol/voda (Pow) (3)(4)(5).
|
|
3.
|
Postup popsaný v této zkušební metodě je založen na kolonové chromatografii půd v porušené půdě (viz definice v dodatku 1). Provádějí se dva druhy experimentů za účelem zjištění i) potenciálu vyplavování zkoušené chemické látky a ii) potenciálu vyplavování transformačních produktů (studie vyplavování tzv. vyzrálých reziduí) v půdách za řízených laboratorních podmínek (54). Tato zkušební metoda je založena na stávajících postupech (6)(7)(8)(9)(10)(11).
|
|
4.
|
Na semináři OECD o výběru půd/sedimentů, který se konal v roce 1995 v italském Belgiratu (12), bylo dosaženo shody na počtu a druzích půd, které mají být v této zkušební metodě používány. Vzešla odtud rovněž doporučení ohledně odběru půdních vzorků, manipulace s nimi a jejich skladování pro experimenty s vyplavováním.
|
PODSTATA ZKUŠEBNÍ METODY
|
5.
|
Kolony vyrobené z vhodného inertního materiálu (např. skla, nerezové oceli, hliníku, teflonu, PVC apod.) se naplní půdou, která se poté nasytí a uvede do rovnováhy roztokem ‚umělého deště‘ (viz definici v dodatku 1) a ten se nechá odtéct. Povrch každého půdního sloupce se exponuje zkoušené chemické látce a/nebo vyzrálým reziduím zkoušené chemické látky. Na půdní sloupce se poté aplikuje umělý déšť a odebere se výluh. Po ukončení vyplachovacího procesu se půda vyjme z kolon a rozdělí na vhodný počet segmentů v závislosti informacích, které mají být výsledkem studie. Každý půdní segment a každý výluh se poté analyzuje na zkoušenou chemickou látku a případně na transformační produkty nebo na jiné relevantní chemické látky.
|
POUŽITELNOST ZKUŠEBNÍ METODY
|
6.
|
Tato zkušební metoda je použitelná na zkoušené chemické látky (radioizotopově neznačené nebo značené, např. 14C), pro které je k dispozici analytická metoda s dostatečnou přesností a citlivostí. Neměla by se používat na chemické látky, které z půdy a z vody těkají, nezůstávají tedy v půdě a/nebo ve výluhu za experimentálních podmínek této zkušební metody.
|
INFORMACE O ZKOUŠENÉ LÁTCE
|
7.
|
Pro měření chování látek z hlediska vyplavování v půdních sloupcích lze použít radioizotopově neznačené nebo značené zkoušené chemické látky. Pro studium vyplavování transformačních produktů (vyzrálých reziduí zkoušené chemické látky) a pro stanovení hmotnostní bilance je nezbytná radioizotopově značená látka. Doporučuje se radioizotopové značení 14C, vhodné však může být použití i jiných izotopů jako 13C, 15N, 3H či 32P. Značení by se mělo pokud možno nacházet v nejstabilnější části molekuly. Čistota zkoušené chemické látky by měla být alespoň 95 %.
|
|
8.
|
Většina chemických látek by měla být použita jako samostatné látky. V případě účinných látek v přípravcích na ochranu rostlin však lze pro studium vyplavování výchozí zkoušené látky použít výrobky ve směsi, avšak jejich zkoušení je nezbytné zejména tehdy, je-li pravděpodobné, že směs ovlivní rychlost uvolňování (např. látky ve formě granulí nebo látky s řízeným uvolňováním). Pokud jde o požadavky na uspořádání zkoušky specifické pro danou směs, může být užitečné je před provedením zkoušky konzultovat s regulačním orgánem. Ve studiích vyplavování vyzrálých reziduí by měla být použita čistá výchozí zkoušená látka.
|
|
9.
|
Před prováděním zkoušek vyplavování v půdních sloupcích by měly být o zkoušené chemické látce známy pokud možno tyto informace:
|
1)
|
rozpustnost ve vodě (zkušební metoda A.6) (13);
|
|
2)
|
rozpustnost v organických rozpouštědlech;
|
|
3)
|
tlak par (zkušební metoda A.4) (13) a Henryho konstanta;
|
|
4)
|
rozdělovací koeficient n-oktanol/voda (zkušební metody A.8 a A.24) (13);
|
|
5)
|
adsorpční koeficient (Kd, Kf nebo KOU) (zkušební metody C.18 a/nebo C.19) (13);
|
|
6)
|
hydrolýza (zkušební metoda C.7) (13);
|
|
7)
|
disociační konstanta (pKa) (OECD TG 112) (25);
|
|
8)
|
aerobní a anaerobní transformace v půdě (zkušební metoda C.23) (13).
|
Poznámka: Teplota, při níž byla tato měření prováděna, by měla být uvedena v příslušných závěrečných zprávách.
|
|
10.
|
Množství zkoušené chemické látky aplikované na půdní sloupce by mělo být dostatečné, aby umožnilo zjištění alespoň 0,5 % aplikované dávky v každém jednotlivém segmentu. V případě účinných chemických látek v přípravcích na ochranu rostlin může aplikované množství zkoušené chemické látky odpovídat maximální doporučené dávce (při jedné aplikaci).
|
|
11.
|
K dispozici musí být vhodná analytická metoda o známé správnosti, přesnosti a citlivosti pro stanovení obsahu zkoušené chemické látky a případně jejích transformačních produktů v půdě a ve výluhu. Měly by být také známy meze detekce zkoušené chemické látky a jejích významných transformačních produktů (obvykle alespoň všech transformačních produktů v množství ≥ 10 % aplikované dávky zjištěných ve studiích způsobu transformace, ale nejlépe všech příslušných transformačních produktů) (viz odstavec 17).
|
REFERENČNÍ CHEMICKÉ LÁTKY
|
12.
|
Pro hodnocení relativní mobility zkoušené chemické látky v půdě by měly být použity referenční chemické látky se známým chováním z hlediska vyplavování, např. atrazin nebo monuron, které lze považovat za látky s mírným vyplavováním z půdy (1)(8)(11). Pro potvrzení hydrodynamických vlastností půdního sloupce může být rovněž užitečná nesorbující a nerozložitelná polární referenční chemická látka (např. tritium, bromidy, fluorescein, eosin), jež umožní sledování pohybu vody v koloně.
|
|
13.
|
Užitečné mohou být i standardní analytické chemikálie pro charakteristiku a/nebo identifikaci transformačních produktů zjištěných v segmentech půdy a ve výluzích pomocí chromatografických, spektroskopických nebo jiných příslušných metod.
|
DEFINICE A JEDNOTKY
KRITÉRIA JAKOSTI
Výtěžnost
|
15.
|
Výtěžnost experimentu s vyplavováním se získá součtem procent zkoušené chemické látky zjištěných v segmentech půdy a ve výluhu z kolony po vyplavování. Výtěžnost by se měla pohybovat v rozmezí 90 % až 110 % u značených chemických látek (11) a v rozmezí 70 % až 110 % u neznačených chemických látek (8).
|
Opakovatelnost a citlivost analytické metody
|
16.
|
Opakovatelnost analytické metody pro kvantifikaci zkoušené chemické látky a transformačních produktů lze ověřit provedením analýzy duplikátních vzorků stejných extraktů ze segmentu půdy nebo z výluhu (viz odstavec 11).
|
|
17.
|
Mez detekce (LOD) analytické metody pro zkoušenou chemickou látku a pro transformační produkty by měla být alespoň 0,01 mg na kg každého segmentu půdy nebo výluhu (pro zkoušenou chemickou látku) nebo 0,5 % aplikované dávky v každém jednotlivém segmentu, podle toho, která z hodnot je nižší. Rovněž by měla být specifikována mez stanovitelnosti (LOQ).
|
POPIS ZKUŠEBNÍ METODY
Zkušební zařízení
|
18.
|
Pro zkoušku se použijí vyplavovací kolony (dělitelné nebo nedělitelné) z vhodného inertního materiálu (např. skla, nerezové oceli, hliníku, teflonu, PVC apod.) o vnitřním průměru nejméně 4 cm a minimální výšce 35 cm. Materiál kolon by měl být testován na možné interakce se zkoušenou chemickou látkou a/nebo jejími transformačními produkty. Příklady vhodných dělitelných a nedělitelných kolon jsou uvedeny v dodatku 2.
|
|
19.
|
Pro plnění půdy do kolon se použije lžíce, plunžrový píst a vibrační zařízení.
|
|
20.
|
Pro aplikaci umělého deště na půdní sloupce lze použít pístová nebo peristaltická čerpadla, sprchové hlavice, Mariottovy lahve nebo jednoduché přikapávací nálevky.
|
Laboratorní vybavení a chemikálie
|
21.
|
Pro zkoušku je zapotřebí standardní laboratorní vybavení, zejména:
|
1)
|
analytické přístroje jako zařízení pro plynovou chromatografii (GLC), vysoce účinnou kapalinovou chromatografii (HPLC) a chromatografii na tenké vrstvě (TLC), včetně odpovídajících detekčních systémů pro analýzu značených a neznačených látek nebo pro inverzní izotopovou zřeďovací analýzu;
|
|
2)
|
přístroje pro účely identifikace (např. pro hmotnostní spektrometrii (MS), plynovou chromatografii-hmotnostní spektrometrii (GC-MS), vysoce účinnou kapalinovou chromatografii-hmotnostní spektrometrii (HPLC-MS), nukleární magnetickou rezonanci (NMR) atd.);
|
|
3)
|
kapalinový scintilační spektrometr pro radioizotopově značené zkoušené chemické látky;
|
|
4)
|
oxidační zařízení pro spalování značeného materiálu;
|
|
5)
|
extrakční aparatura (např. centrifugační zkumavky pro extrakci za studena a Soxhletův přístroj pro kontinuální extrakci s refluxem);
|
|
6)
|
zařízení pro zkoncentrování roztoků a extraktů (např. rotační odparka).
|
|
|
22.
|
Použijí se tyto chemické látky: organická rozpouštědla čistoty p. a., např. aceton, methanol atd.; kapalný scintilátor; 0,01 M roztok CaCl2 v destilované nebo deionizované vodě (= umělý déšť).
|
Zkoušená chemická látka
|
23.
|
Pro aplikaci zkoušené chemické látky na půdní sloupec by tato látka měla být rozpuštěná ve vodě (deionizované nebo destilované). Je-li zkoušená chemická látka ve vodě špatně rozpustná, lze ji aplikovat buď ve formě produktu (je-li to nezbytné, po suspendování nebo emulgaci ve vodě), nebo rozpuštěnou v jakémkoli organickém rozpouštědle. V případě použití organického rozpouštědla by jeho množství mělo být omezeno na minimum a mělo by být z povrchu sloupce půdy odpařeno ještě před zahájením vyplavování. Látky v pevné formě, např. granule, by měly být použity v pevné formě bez vody; aby se umožnilo lepší rozptýlení po povrchu půdního sloupce, lze výrobek ve směsi před použitím smísit s malým množstvím (např. 1 g) křemenného písku.
|
|
24.
|
Množství zkoušené chemické látky aplikované na půdní sloupce by mělo být dostatečné, aby umožnilo zjištění alespoň 0,5 % aplikované dávky v každém jednotlivém segmentu. V případě účinných chemických látek v přípravcích na ochranu rostlin může jejich množství být založeno na maximální doporučené dávce (jednorázově aplikované dávce) a při vyplavování výchozí chemické látky a vyzrálých reziduí by se mělo odvíjet od velikosti povrchu použitého půdního sloupce (55).
|
Referenční chemická látka
|
25.
|
Při experimentech s vyplavováním by měla být použita referenční chemická látka (viz odstavec 12). Měla by se aplikovat na povrch půdního sloupce podobným způsobem jako zkoušená chemická látka a v přiměřené dávce, která umožní její zjištění, a to buď jako vnitřní standard spolu se zkoušenou chemickou látkou v témž půdním sloupci, nebo samostatně ve zvláštním půdním sloupci. Upřednostňuje se zkoušet obě chemické látky v téže koloně, kromě případů, kdy jsou obě chemické látky podobně radioizotopově značeny.
|
Půdy
Výběr půd
|
26.
|
Pro studie vyplavování s výchozí zkoušenou chemickou látkou by měly být použity tři až čtyři půdy s různým pH, různým obsahem organického uhlíku a různou půdní strukturou (12). Pokyny pro výběr půd pro experimenty s vyplavováním jsou uvedeny níže v tabulce 1. U disociovatelných zkoušených chemických látek by vybrané půdy měly zahrnovat široké rozmezí pH, aby bylo možné vyhodnotit mobilitu chemické látky v její disociované a nedisociované formě; alespoň tři půdy by měly mít pH, při kterém je zkoušená chemická látka ve své mobilní formě.
Tabulka 1
Návod pro výběr půd pro studie vyplavování
|
Půda č.
|
Hodnota pH
|
Organický uhlík
(v %)
|
Obsah jílu
(v %)
|
Struktura (56)
|
|
1
|
> 7,5
|
3,5–5,0
|
20–40
|
jílovitohlinitá
|
|
2
|
5,5–7,0
|
1,5–3,0
|
15–25
|
prachovitohlinitá
|
|
3
|
4,0–5,5
|
3,0–4,0
|
15–30
|
hlinitá
|
|
4
|
< 4,0–6,0 (57)
|
< 0,5–1,5 (57)
(58)
|
< 10–15 (56)
|
hlinitopísčitá
|
|
5
|
< 4,5
|
> 10 (59)
|
< 10
|
hlinitopísčitá/písek
|
|
|
27.
|
Někdy mohou být nezbytné jiné druhy půd, aby byly zastoupeny podmínky chladnějších, mírných a tropických oblastí. Jsou-li upřednostněny jiné druhy půd, měly by být charakterizovány stejnými parametry a jejich vlastnosti by se měly nacházet v podobných rozmezích, jako jsou rozmezí uvedená v pokynech pro výběr půd pro studie vyplavování (viz tabulka 1 výše), a to i v případě, že těmto kritériím přesně neodpovídají.
|
|
28.
|
Pro studie vyplavování vyzrálých reziduí by měla být použita jedna půda (12). Měla by mít obsah písku > 70 % a obsah organického uhlíku v rozmezí 0,5–1,5 % (viz půda č. 4 v tabulce 1). Je-li důležité získat údaje o transformačních produktech, může být nezbytné použít více druhů půd.
|
|
29.
|
Všechny půdy by měly být charakterizovány alespoň strukturou ( % písku, % prachu, % jílu podle klasifikačních systémů FAO a USDA (14)), pH, kationtovou výměnnou kapacitou, obsahem organického uhlíku, sypnou hustotou (u porušené půdy) a retenční vodní kapacitou. Měření mikrobiální biomasy se požaduje pouze u půdy, která je použita v době stárnutí/inkubace prováděné před experimentem s vyplavováním vyzrálých reziduí. Pro interpretaci výsledků této studie mohou být užitečné informace o dalších vlastnostech půdy (např. klasifikace půd, mineralogie jílu, specifická velikost povrchu). Pro stanovení půdních charakteristik lze použít metody, které jsou doporučeny v odkazech (15)(16)(17)(18)(19).
|
Sběr a uchovávání půd
|
30.
|
Půdy by měly být odebrány z horní vrstvy (z horizontu A) do maximální hloubky 20 cm. Odstraní se zbytky vegetace, makrofauna a kameny. Půdy (kromě těch, které se použijí pro vyzrání zkoušené chemické látky) se vysuší na vzduchu při pokojové teplotě (přednostně v rozmezí 20–25 °C). Rozrušení půd se provede minimální silou, aby se původní struktura půdy změnila co nejméně. Půdy se prosejí na sítu o velikosti ok ≤ 2 mm. Doporučuje se opatrná homogenizace, neboť se tak zvýší reprodukovatelnost výsledků. Před použitím mohou být půdy uchovávány při teplotě okolí a sušeny na vzduchu (12). Pro dobu uchovávání neexistuje žádný doporučený limit, ale půdy uchovávané déle než tři roky by měly být před použitím znovu analyzovány na obsah organického uhlíku a pH.
|
|
31.
|
K dispozici by měly být podrobné informace o historii lokalit, ze kterých jsou půdy odebírány. Těmito informacemi jsou přesná poloha (přesně definovaná souřadnicemi UTM (Universal Transversal Mercator-Projection/European Horizontal Datum) nebo zeměpisnými souřadnicemi), vegetační kryt, údaje o ošetřování přípravky na ochranu rostlin, použití organických a minerálních hnojiv a přídavcích biologického materiálu nebo informace o náhodné kontaminaci (12). Pokud byla půda v předchozích čtyřech letech ošetřena zkoušenou chemickou látkou nebo látkami s analogickou strukturou, neměla by se pro studie vyplavování používat.
|
Zkušební podmínky
|
32.
|
V průběhu zkoušky by kolony pro vyplavování z půdy měly být uchovávány v temnu při teplotě okolí, pokud je tato teplota udržována v rozmezí ± 2 °C. Doporučené teploty jsou mezi 18 a 25 °C.
|
|
33.
|
Umělý déšť (0,01 M roztok CaCl2) by měl být aplikován na povrch půdních sloupců nepřetržitě tempem 200 mm za 48 hodin (60); toto množství odpovídá aplikaci 251 ml na kolonu o vnitřním průměru 4 cm. Je-li to pro účel zkoušky potřeba, mohou být doplňkově použita jiná tempa umělých dešťových srážek a v delším trvání.
|
Provedení zkoušky
Vyplavování s výchozí zkoušenou chemickou látkou
|
34.
|
Nejméně dvě duplikátní vyplavovací kolony se naplní neupravenou půdou, vysušenou na vzduchu a prosátou (< 2 mm), až do výše přibližně 30 cm. Pro dosažení jednotného plnění se půda do kolon přidává lžící po malých dávkách a pěchuje se plunžrovým pístem za současné jemné vibrace kolony, dokud horní část půdního sloupce neklesne. Jednotné plnění je nezbytné pro získání opakovatelných výsledků z vyplavovacích kolon. Podrobnější informace o způsobech plnění kolon lze najít v položkách seznamu literatury (20), (21) a (22). Pro ověření opakovatelnosti postupu plnění se stanoví celková hmotnost půdy naplněné do kolon (61); hmotnosti duplikátních kolon by měly být podobné.
|
|
35.
|
Po naplnění se sloupce půdy předběžně navlhčí umělým deštěm (0,01 M roztok CaCl2) ode dna až po povrch, aby voda vytěsnila vzduch v půdních pórech. Sloupce půdy se poté nechají ustálit do vyváženého stavu a přebytek vody se nechá odtéct působením gravitace. Přehled metod nasycení sloupců je uveden v položce seznamu literatury (23).
|
|
36.
|
Na půdní sloupce se poté aplikuje zkoušená chemická látka nebo referenční chemická látka (viz též odstavce 23–25). Pro dosažení homogenního rozptýlení by se roztoky, suspenze nebo emulze zkoušené a/nebo referenční látky měly aplikovat na povrch půdních sloupců rovnoměrně. Je-li za účelem aplikace zkoušené chemické látky doporučeno ji vpravit do půdy, měla by se smísit s malým množstvím (např. 20 g) půdy a přidat na povrch půdního sloupce.
|
|
37.
|
Povrch sloupců půdy se poté přikryje skleněným sintrem, skleněnými kuličkami, filtrem ze skleněných vláken nebo kolečkem filtračního papíru, aby se umělý déšť rozptýlil rovnoměrně na celou plochu a aby nedošlo k narušení půdního povrchu kapkami deště. Čím větší je průměr kolony, tím větší opatrnost je při aplikaci umělého deště na půdní sloupce nezbytná, aby se zajistilo stejnoměrné rozptýlení umělého deště na celý povrch půdy. Poté se umělý déšť do půdních sloupců přidává po kapkách pomocí pístového nebo peristaltického čerpadla nebo přikapávací nálevky. Výluhy by přednostně měly být shromažďovány ve frakcích a jejich objemy se zaznamenají (62).
|
|
38.
|
Po vyplavování a poté, co se kolony nechají odkapat, se půdní sloupce rozdělí na vhodný počet segmentů v závislosti na informacích, které má studie poskytnout, segmenty se extrahují pomocí vhodných rozpouštědel nebo směsí a analyzují se na zkoušenou chemickou látku a případně na transformační produkty, na celkovou radioaktivitu a na referenční chemickou látku. Výluhy nebo frakce výluhů se analyzují – přímo nebo po extrakci – na tytéž látky/produkty. Byla-li použita radioizotopově značená chemická látka, měly by být identifikovány všechny frakce obsahující ≥ 10 % aplikované radioaktivity.
|
Vyplavování vyzrálých rezidui
|
39.
|
Čerstvá půda (která nebyla vysušena na vzduchu) se exponuje radioizotopově značené zkoušené chemické látce v míře odpovídající velikosti povrchu půdních sloupců (viz odstavec 24) a inkubuje se za aerobních podmínek podle zkušební metody C.23 (13). Doba inkubace (stárnutí) by měla být dostatečně dlouhá, aby se získalo významné množství transformačních produktů; doporučuje se doba stárnutí v délce jednoho poločasu eliminace zkoušené chemické látky (63), ale neměla by být delší než 120 dnů. Před vyplavováním se vyzrálá půda analyzuje na zkoušenou chemickou látku a na její transformační produkty.
|
|
40.
|
Vyplavovací kolony se naplní až do výše 28 cm stejnou půdou (ale vysušenou na vzduchu), jako byla půda použitá v experimentu s vyzrálými rezidui, jak bylo popsáno v odstavci 34, a stanoví se rovněž celková hmotnost naplněných půdních sloupců. Sloupce půdy se posléze předběžně navlhčí, jak bylo popsáno v odstavci 35.
|
|
41.
|
Zkoušená chemická látka a její transformační produkty se poté aplikují na povrch půdních sloupců ve formě vyzrálých půdních reziduí (viz odstavec 39) jako segment půdy o výšce 2 cm. Celková výška sloupců půdy (neošetřená půda + vyzrálá půda) by pokud možno neměla přesahovat 30 cm (viz odstavec 34).
|
|
42.
|
Provede se vyplavování, jak bylo popsáno v odstavci 37.
|
|
43.
|
Po vyplavování se segmenty půdy a výluhy analyzují, jak je uvedeno v odstavci 38, na zkoušenou chemickou látku, na její transformační produkty a na neextrahovanou radioaktivitu. Pro stanovení, kolik vyzrálého rezidua zůstalo ve vrchní 2cm vrstvě po vyplavení, by se tento segment měl analyzovat zvlášť.
|
ÚDAJE A JEJICH PŘEDKLÁDÁNÍ
Zpracování výsledků
|
44.
|
Pro každý segment a každou frakci výluhu se uvede množství zkoušené chemické látky, transformačních produktů, neextrahovatelných látek a, je-li zařazena, referenční chemické látky v procentech výchozí aplikované dávky. Pro každou kolonu by mělo být vytvořeno grafické znázornění s vynesením zjištěných procent jako funkce hloubky půdy.
|
|
45.
|
Je-li ve studii vyplavování na kolonách použita referenční chemická látka, lze vyplavování určité chemické látky hodnotit jako relativní veličinu pomocí faktorů relativní mobility (RMF, viz definici v dodatku 3) (1)(11), což umožní porovnávat údaje o vyplavování různých chemických látek získané s různými druhy půdy. Příklady hodnot RMF pro různé přípravky na ochranu rostlin jsou uvedeny v dodatku 3.
|
|
46.
|
Odhady Kou (adsorpční koeficient normalizovaný na organický uhlík) a Kom (distribuční koeficient normalizovaný na obsah organických látek) lze z výsledků vyplavování na kolonách získat také pomocí průměrné vzdálenosti vyplavování nebo zjištěných korelací mezi RMF a Kom, případně Kou (4) nebo za využití jednoduché chromatografické teorie (24). Posledně uvedená metoda by však měla být používána opatrně, zejména s ohledem na to, že postup vyplavování nezahrnuje pouze podmínky nasyceného toku, nýbrž spíše nenasycené systémy.
|
Interpretace výsledků
|
47.
|
Studie vyplavování na kolonách popsané v této metodě umožňují určit potenciál vyplavování nebo mobility zkoušené chemické látky v půdě (ve studii vyplavování výchozí chemické látky) a/nebo jejích transformačních produktů (ve studii vyplavování vyzrálých reziduí). Tyto zkoušky kvantitativně nepředpovídají chování z hlediska vyplavování v terénu, ale lze je použít pro porovnání ‚vyplavitelnosti‘ jedné chemické látky s jinými chemickými látkami, jejichž chování při vyplavování může být známo (24). Stejně tak neměří ani to, jak velké procento aplikované chemické látky by mohlo dosáhnout pozemních vod (11). Výsledky studií vyplavování na kolonách však mohou pomoci při rozhodování, zda je třeba provést další částečně terénní a terénní zkoušky chemických látek, které v laboratorních zkouškách vykazují vysoký potenciál mobility.
|
Závěrečná zpráva
|
48.
|
Závěrečná zpráva musí obsahovat:
|
|
Zkoušená chemická látka a referenční chemická látka (byla-li použita):
|
—
|
obecný název, chemický název (podle nomenklatury IUPAC a CAS), číslo CAS, chemická struktura (s uvedením polohy značícího atomu při použití radionuklidů) a relevantní fyzikálně-chemické vlastnosti,
|
|
—
|
čistota zkoušené chemické látky (obsah nečistot),
|
|
—
|
popřípadě radiochemická čistota značené chemické látky a specifická aktivita.
|
|
|
|
Zkušební půdy:
|
—
|
podrobné údaje o místě odběru,
|
|
—
|
vlastnosti půdy, např. pH, obsah organického uhlíku a obsah jílu, struktura a sypná hustota (u porušené půdy),
|
|
—
|
aktivita půdních mikroorganismů (pouze u půd použitých pro vyzrání zkoušené chemické látky),
|
|
—
|
doba skladování půdy a podmínky skladování.
|
|
|
|
Zkušební podmínky:
|
—
|
datum provedení studií,
|
|
—
|
délka a průměr vyplavovacích kolon,
|
|
—
|
celková hmotnost půdy v půdních sloupcích,
|
|
—
|
množství aplikované zkoušené chemické látky a případně referenční chemické látky,
|
|
—
|
množství, četnost a délka aplikace umělého deště,
|
|
—
|
počet duplikátních vzorků (alespoň dva),
|
|
—
|
metody analýzy zkoušené chemické látky, transformačních produktů a případně referenční chemické látky v různých segmentech půdy a ve výluzích,
|
|
—
|
metody charakterizace a identifikace transformačních produktů v segmentech půdy a ve výluzích.
|
|
|
|
Výsledky zkoušek:
|
—
|
tabulky s výsledky vyjádřenými v koncentracích a v procentech aplikované dávky v segmentech půdy a ve výluzích,
|
|
—
|
případně hmotnostní bilance,
|
|
—
|
vzdálenosti vyplavování a případně faktory relativní mobility,
|
|
—
|
grafické vynesení procentních podílů zjištěných v segmentech půdy oproti hloubce segmentu půdy,
|
|
—
|
rozbor a interpretace výsledků.
|
|
|
LITERATURA
|
1)
|
Guth, J. A., Burkhard, N. and Eberle, D. O. (1976) Experimental Models for Studying the Persistence of Pesticides in Soil. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides.
|
|
2)
|
Russel, M. H. (1995) Recommended approaches to assess pesticide mobility in soil. In progress in Pesticide Biochemistry and Toxicology, Vol. 9 (Environmental Behaviour of Agrochemicals – T. R. Roberts and P. C. Kearney, Eds.). J. Wiley & Sons.
|
|
3)
|
Briggs, G. G. (1981) Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficient, water solubilities, bioconcentration factors, and the parachor. J.Agric. Food Chem. 29, pp. 1050–1059.
|
|
4)
|
Chiou, C. T., Porter, P. E. and Schmedding, D. W. (1983) Partition equilibria of non-ionic organic compounds between soil organic matter and water. Environ. Sci. Technol. 17, pp. 227–231.
|
|
5)
|
Guth, J. A. (1983) Untersuchungen zum Verhalten von Pflanzenschutzmitteln im Boden. Bull. Bodenkundliche Gesellschaft Schweiz 7, pp. 26–33.
|
|
6)
|
US-Environmental Protection Agency (1982) Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate.
|
|
7)
|
Agriculture Canada (1987) Environmental Chemistry and Fate Guidelines for registration of pesticides in Canada.
|
|
8)
|
Příloha 1 směrnice Komise 95/36/ES ze dne 14. července 1995, kterou se mění směrnice Rady 91/414/EHS o uvádění přípravků na ochranu rostlin na trh, Úř. věst. L 172, 22.7.1995, s. 8.
|
|
9)
|
Dutch Commission for Registration of Pesticides (1991) Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air.
|
|
10)
|
BBA (1986) Richtlinie für die amtliche Prüfung von Pflanzenschutzmitteln, Teil IV, 4-2. Versickerungsverhalten von Pflanzenschutzmitteln.
|
|
11)
|
SETAC (1995) Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed.
|
|
12)
|
OECD (1995) Final Report of the OECD Workshop on Selection of Soils/Sediments. Belgirate, Italy, 18–20 January 1995.
|
|
13)
|
Následující kapitoly v této příloze:
|
|
Kapitola A.6, Rozpustnost ve vodě
|
|
|
Kapitola A.8, Rozdělovací koeficient, metoda třepací lahve
|
|
|
Kapitola A.24, Rozdělovací koeficient, metoda HPLC
|
|
|
Kapitola C.7, Abiotický rozklad – Hydrolýza jako funkce pH
|
|
|
Kapitola C.18, Stanovení adsorpce/desorpce dávkovou rovnovážnou metodou
|
|
|
Kapitola C.23, Aerobní a anaerobní transformace v půdě
|
|
|
14)
|
Soil Texture Classification (US and FAO systems). Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26, 305 (1962).
|
|
15)
|
Methods of Soil Analysis (1986). Part 1, Physical and Mineralogical Methods (A. Klute, Ed.). Agronomy Series No. 9, 2nd Edition.
|
|
16)
|
Methods of Soil Analysis (1982) Part 2, Chemical and Microbiological Properties (A. L. Page, R. H. Miller and D. R. Kelney, Eds.). Agronomy Series No. 9, 2nd Edition.
|
|
17)
|
ISO Standard Compendium Environment (1994) Soil Quality – General aspects; chemical and physical methods of analysis; biological methods of analysis. First Edition.
|
|
18)
|
Mückenhausen, E. (1975) Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt/Main.
|
|
19)
|
Scheffer, F. and Schachtschabel, P. (1998) Lehrbuch der Bodenkunde. F. Enke Verlag, Stuttgart.
|
|
20)
|
Weber, J. B. and Peeper, T. F. (1977) In: Research Methods in Weed Science, 2nd Edition (B. Truelove, Ed.). Soc. Weed Sci., Auburn, Alabama, pp. 73–78.
|
|
21)
|
Weber, J. B., Swain, L. R., Strek, H. J. and Sartori, J. L. (1986) In: Research Methods in Weed Science, 3rd Edition (N.D. Camper, Ed.). Soc. Weed Sci., Champaign, IL, pp. 190–200.
|
|
22)
|
Oliveira, et al. (1996) Packing of sands for the production of homogeneous porous media. Soil Sci. Soc. Amer. J. 60(1): pp. 49–53.
|
|
23)
|
Shackelford, C. D. (1991) Laboratory diffusion testing for waste disposal. – A review. J. Contam. Hydrol. 7, pp. 177–217.
|
|
24)
|
Hamaker, J. W. (1975) Interpretation of soil leaching experiments. In Environmental Dynamics of Pesticides (R. Haque, V. H. Freed, Eds.), pp. 115–133. Plenum Press, New York.
|
|
25)
|
OECD (1981) Dissociation constants in water. OECD Guideline for Testing of Chemicals, No. 4112, OECD, Paris
|
Dodatek 1
Definice a jednotky
Vyzrálé půdní reziduum
: Zkoušená chemická látka a transformační produkty přítomné v půdě po aplikaci a po uplynutí dostatečně dlouhé doby umožňující, aby procesy dopravy, adsorpce, metabolismu a zániku změnily distribuci a chemickou povahu některých z aplikovaných chemických látek (1).
Umělý déšť
: 0,01 M roztok CaCl2 v destilované nebo deionizované vodě.
Průměrná vzdálenost vyplavování
: Dno půdní sekce, kde se kumulovaná výtěžnost chemické látky = 50 % celkové výtěžnosti chemické látky (při normálním experimentu s vyplavováním) nebo dno půdní sekce, kde se kumulovaná výtěžnost chemické látky = 50 % celkové výtěžnosti zkušební chemické látky po odečtení tloušťky vrstvy vyzrálého rezidua vydělené 2 (ve studii vyplavování vyzrálých reziduí).
Chemická látka
: látka nebo směs.
Výluh
: Vodná fáze, která prosákla půdním profilem nebo půdním sloupcem (1).
Vyplavování
: Proces, při kterém se chemická látka pohybuje půdním profilem nebo půdním sloupcem směrem dolů (1).
Vzdálenost vyplavování
: Nejhlubší segment půdy, v němž bylo po ukončení postupu vyplavování zjištěno ≥ 0,5 % aplikované zkoušené chemické látky nebo vyzrálého rezidua (odpovídá hloubce proniknutí).
Mez detekce (LOD) a mez stanovitelnosti (LOQ)
: Mez detekce (LOD) je koncentrace chemické látky, pod níž nelze odlišit identitu této chemické látky od analytických artefaktů. Mez stanovitelnosti (LOQ) je koncentrace chemické látky, pod níž nelze určit koncentraci s přijatelnou přesností.
Faktor relativní mobility (RMF)
: Vzdálenost vyplavování zkoušené chemické látky (v cm) vydělená vzdáleností vyplavování referenční chemické látky (v cm).
Zkoušená chemická látka
: Jakákoli látka nebo směs zkoušená touto zkušební metodou.
Transformační produkt
: Veškeré chemické látky, které jsou výsledkem biotických nebo abiotických transformačních reakcí zkoušené chemické látky, včetně CO2 a produktů, jež jsou vázány v reziduích.
Půda
: Směs minerálních a organických chemických složek obývaná malými organismy (většinou mikroorganismy), jejíž organické složky obsahují sloučeniny s vysokým obsahem uhlíku a dusíku a vysokou molekulovou hmotností. Lze pracovat s dvěma formami půdy:
|
—
|
s neporušenou půdou, jak v průběhu času vznikla, s charakteristickými vrstvami různých druhů půdy,
|
|
—
|
s porušenou půdou, která se obvykle vyskytuje na obdělávaných polích v případě, že se vzorky odebírají vyrýváním a používají se v této zkušební metodě (2).
|
|
1)
|
Holland, P. T. (1996) Glossary of Terms Relating to Pesticides. IUPAC Reports on Pesticide (36). Pure & Appl. Chem. 68, pp. 1167–1193.
|
|
2)
|
OECD Test Guideline 304 A: Inherent Biodegradability in Soil (adopted 12 May 1981).
|
Dodatek 2
Obrázek 1
Příklad nedělitelných vyplavovacích kolon vyrobených ze skla
s délkou 35 cm a vnitřním průměrem 5 cm (1)
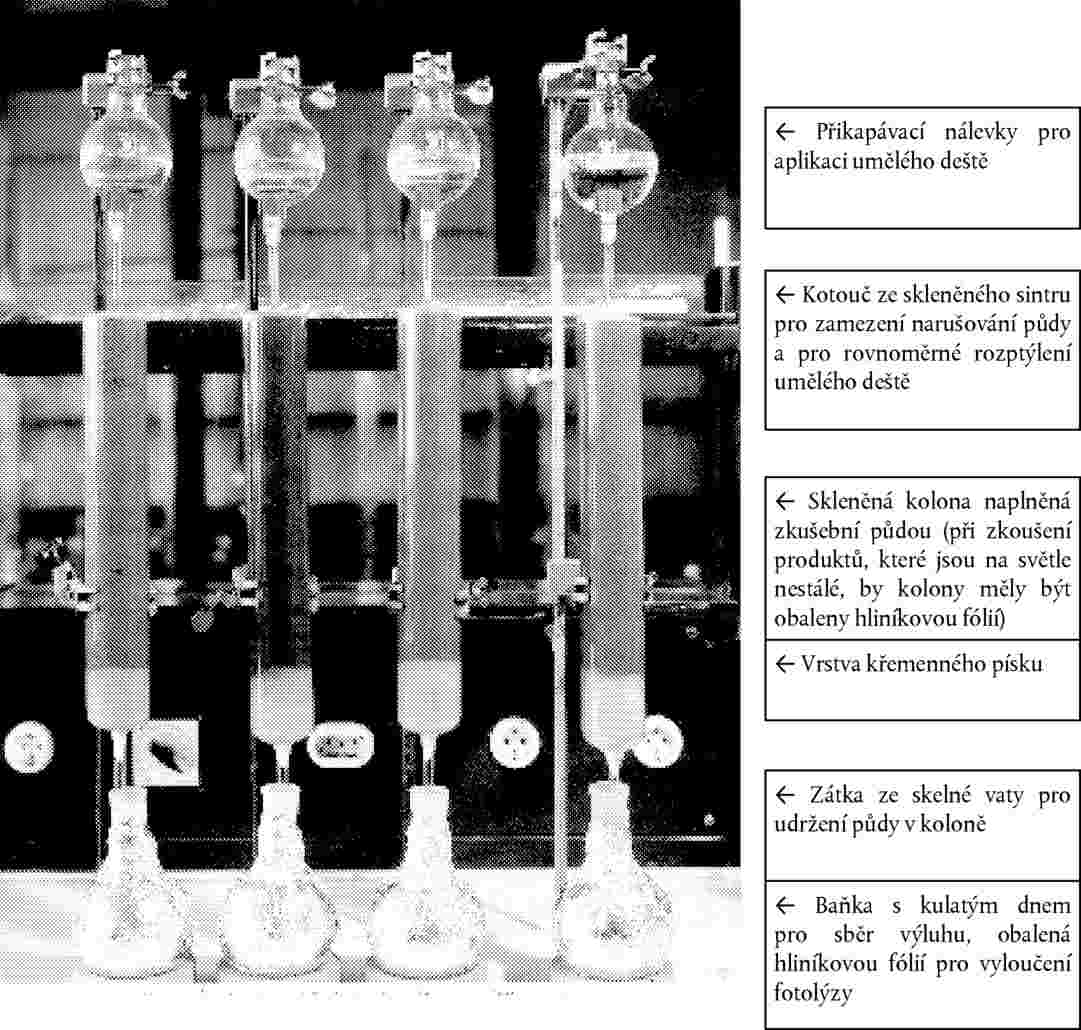
|
1)
|
Drescher, N. (1985) Moderner Acker- und Pflanzenbau aus Sicht der Pflanzenschutzmittelindustrie. In Unser Boden – 70 Jahre Agrarforschung der BASF AG, pp. 225–236. Verlag Wissenschaft und Politik, Köln.
|
Obrázek 2
Příklad dělitelné kovové kolony s vnitřním průměrem 4 cm (1)

|
1)
|
Burkhard, N., Eberle D. O. and Guth, J. A. (1975) Model systems for studying the environmental behaviour of pesticides. Environmental Quality and Safety, Suppl. Vol. III, pp. 203–213.
|
Dodatek 3
Příklady faktorů relativní mobility
(64)
(RMF) pro různé přípravky na ochranu rostlin (1)(2) a odpovídající třídy mobility
(66)
|
Rozmezí RMF
|
Chemická látka (RMF)
|
Třída mobility
|
|
≤ 0,15
|
parathion (< 0,15), fluorodifen (0.15)
|
I
imobilní
|
|
0,15–0,8
|
profenofos (0,18), propikonazol (0,23), diazinon (0,28), diuron (0,38), terbuthylazin (0,52), methidathion (0,56), prometryn (0,59), propazin (0,64), alachlor (0,66), metolachlor (0,68)
|
II
málo mobilní
|
|
0,8–1,3
|
monuron (65) (1,00), atrazin (1,03), simazin (1,04), fluometuron (1,18)
|
III
mírně mobilní
|
|
1,3–2,5
|
prometon (1,67), kyanazin (1,85), bromacil (1,91), karbutilát (1,98)
|
IV
dosti mobilní
|
|
2,5–5,0
|
karbofuran (3,00), dioxakarb (4,33)
|
V
mobilní
|
|
> 5,0
|
monokrotofos (> 5,0), dikrotofos (> 5,0)
|
VI
velmi mobilní
|
|
1)
|
Guth, J. A. (1985) Adsorption/desorption. In: Joint International Symposium ‚Physicochemical Properties and their Role in Environmental Hazard Assessment.‘ Canterbury, UK, 1–3 July 1985.
|
|
2)
|
Guth, J. A. and Hörmann, W. D. (1987) Problematik und Relevanz von Pflanzenschutzmittel-Spuren im Grund (Trink-) Wasser. Schr. Reihe Verein WaBoLu, 68, pp. 91–106.
|
|
3)
|
Harris, C. I. (1967) Movement of herbicides in soil. Weeds 15, pp. 214–216.
|
|
4)
|
Helling, C. S. (1971) Pesticide mobility in soils. Soil Sci. Soc. Am. Proc. 35, pp. 743–748.
|
|
5)
|
McCall, P. J., Laskowski, D. A., Swann, R. L. and Dishburger, H. J. (1981) Measurements of sorption coefficients of organic chemicals and their use in environmental fate analysis. In Test Protocols for Environmental Fate and Movement of Toxicants. Proceedings of AOAC Symposium, AOAC, Washington D.C.
|
|
6)
|
Hollis, J. M. (1991) Mapping the vulnerability of aquifers and surface waters to pesticide contamination at the national/regional scale. BCPC Monograph No. 47 Pesticides in Soil and Water, pp. 165–174.
|
C.45. ODHAD EMISÍ ZE DŘEVA OŠETŘENÉHO KONZERVAČNÍMI PŘÍPRAVKY DO ŽIVOTNÍHO PROSTŘEDÍ: LABORATORNÍ METODA PRO VÝROBKY ZE DŘEVA, KTERÉ NEJSOU ZAKRYTÉ A JSOU V KONTAKTU SE SLADKOU NEBO SLANOU VODOU
ÚVOD
|
1.
|
Tato zkušební metoda je rovnocenná Pokynu OECD pro zkoušení 313 (2007). Emise ze dřeva ošetřeného konzervačními přípravky do životního prostředí je třeba kvantifikovat, aby bylo možno posoudit rizika pro životní prostředí plynoucí z dřeva ošetřeného konzervačními přípravky. Tato zkušební metoda popisuje laboratorní metodu odhadu emisí ze dřeva ošetřeného konzervačními přípravky ve dvou situacích, kdy by emise mohly vstupovat do životního prostředí:
|
—
|
Emise z ošetřeného dřeva v kontaktu se sladkou vodou. Emise z povrchu ošetřeného dřeva by mohly vstupovat do vody.
|
|
—
|
Emise z ošetřeného dřeva v kontaktu s mořskou vodou. Emise z povrchu ošetřeného dřeva by mohly vstupovat do mořské vody.
|
|
|
2.
|
Tato zkušební metoda je určena pro zkoušení emisí ze dřeva a dřevěných produktů, které nejsou zakryté a jsou v kontaktu se sladkou vodou nebo slanou vodou. Mezinárodně používané třídy použití kategorizují biologické riziko, kterému budou ošetřené produkty vystaveny. Třídy použití rovněž definují situaci, ve které se ošetřený produkt používá, a stanovují složky životního prostředí (vzduch, voda, půda), které jsou potenciálně ohroženy dřevem ošetřeným konzervačními přípravky.
|
|
3.
|
Zkušební metoda je laboratorní postup získávání vzorků (‚emisátů‘) z vody použité k ponoření ošetřeného dřeva při vzrůstajícím časovém odstupu od expozice. Odhadovaný tok emisí v mg/m2/dny je množství emisí v emisátu vztažené k ploše povrchu dřeva a délce jeho expozice. Tak je možné odhadnout tok (rychlost vyluhování) při vzrůstajících dobách expozice.
|
|
4.
|
Množství emisí se dá použít k posouzení rizik pro životní prostření z ošetřeného dřeva.
|
VÝCHOZÍ ÚVAHY
|
5.
|
Předpokládá se, že mechanismus vylouhování z povrchu dřeva sladkou vodou není svou povahou ani závažností shodný s vylouhováním z povrchu dřeva mořskou vodou. Proto pro přípravky nebo směsi na ochranu dřeva používané k ošetření dřeva používaného v prostředí mořské vody je třeba studie louhování dřeva v mořské vodě.
|
|
6.
|
Dřevo, míníme tím ošetřené přípravkem na ochranu dřeva, by mělo reprezentovat komerčně používané dřevo. Mělo by být ošetřeno v souladu s instrukcemi výrobce konzervačního přípravku a ve shodě s příslušnými normami a požadavky. Je třeba uvést parametry kondicionování dřeva po ošetření před zahájením zkoušky.
|
|
7.
|
Použité vzorky dřeva by měly reprezentovat použité výrobky (např. pokud jde o druh, hustotu a další typické znaky).
|
|
8.
|
Zkoušku je možné aplikovat na dřevo použitím penetračního procesu nebo povrchové aplikace nebo na ošetřené dřevo, u kterého se provádí dodatečné povinné ošetření povrchu (např. barva, která se aplikuje na základě požadavku na komerční použití).
|
|
9.
|
Složení, množství, pH a skupenství vody jsou důležité při stanovení množství, obsahu a povahy emisí ze dřeva.
|
PODSTATA ZKUŠEBNÍ METODY
|
10.
|
Zkušební vzorky dřeva ošetřeného konzervačními přípravky se ponoří do vody. Voda (emisát) se shromáždí a chemicky analyzuje několikrát během expoziční doby dostatečné pro provedení statistických výpočtů. Rychlosti (toky) emisí v mg/m2/dny se vypočítají z analytických výsledků. Zaznamenají se doby vzorkování. Zkoušky s neošetřenými vzorky mohou být přerušeny, jestliže se při prvních třech měřeních nedetekuje žádné pozadí.
|
|
11.
|
Zahrnutí vzorků neošetřeného dřeva do zkoušky umožňuje stanovit základní úroveň (úroveň pozadí) pro emisáty ze dřeva jiného než s použitým konzervačním přípravkem.
|
KRITÉRIA JAKOSTI
Přesnost
|
12.
|
Přesnost zkušební metody při odhadu emisí závisí na tom, zda zkušební vzorky jsou reprezentanty komerčně ošetřeného dřeva, nakolik voda reprezentuje reálnou vodu a jak dalece režim expozice odpovídá přírodním podmínkám.
|
|
13.
|
Přesnost, správnost a opakovatelnost analytické metody je třeba stanovit před provedením zkoušky.
|
Reprodukovatelnost
|
14.
|
Tři vzorky vody se shromáždí a analyzují a střední hodnota se bere jako hodnota emisí. Reprodukovatelnost výsledků v rámci jedné laboratoře a mezi různými laboratořemi závisí na režimu ponoření a dřevu použitém na zkušební vzorky.
|
Přijatelný rozsah výsledků
|
15.
|
Rozpětí výsledků této zkoušky, při kterém se horní a dolní hodnoty liší o méně než jeden řád, je přijatelné.
|
ZKUŠEBNÍ PODMÍNKY
Voda
|
16.
|
Scénáře vylouhování sladkou vodou: deionizovaná voda (např. ASTM D 1193 Typ II) se doporučuje pro použití ve zkoušce vylouhování, když se má vyhodnotit dřevo vystavené sladké vodě. Teplota vody by měla být 20 °C ± 2 °C; změřené hodnoty pH a teploty vody musejí být uvedeny v závěrečné zprávě. Analýza vzorků použité vody odebraných před ponořením ošetřených vzorků umožňuje odhad analyzovaných chemických látek ve vodě. Toto je kontrola ke stanovení základní úrovně chemických látek, které se pak chemicky analyzují.
|
|
17.
|
Scénáře vylouhování mořskou vodou: syntetická mořská voda (např. ASTM D 1141 náhradní mořská voda, bez těžkých kovů) se doporučuje pro použití ve zkoušce louhování, když se má vyhodnotit dřevo vystavené mořské vodě. Teplota vody by měla být 20 °C ± 2 °C; změřené hodnoty pH a teploty vody musejí být uvedeny v závěrečné zprávě. Analýza vzorků použité vody odebraných před ponořením ošetřených vzorků umožňuje odhad analyzovaných chemických látek ve vodě. Toto je kontrola ke stanovení základních úrovní důležitých chemických látek.
|
Zkušební vzorky dřeva
|
18.
|
Druh dřeva musí být typický druh dřeva používaný pro zkoušení účinnosti přípravků na ochranu dřeva. Doporučené druhy jsou Pinus sylvestris L. (borovice lesní), Pinus resinosa Ait. (borovice smolná) nebo Pinus spp (další druhy tvrdých borovic). Dodatečné zkoušky je možné provést použitím jiných druhů.
|
|
19.
|
Je třeba použít dřevo s rovnými vlákny bez suků. Materiál se smolným vzhledem se musí vyřadit. Dřevo musí být typické komerčně dostupné dřevo. Je třeba zaznamenat jeho zdroj a hustotu a počet letokruhů na 10 mm.
|
|
20.
|
Doporučuje se, aby zkušební vzorky dřeva tvořily sady po pěti s velikostí bloků 25 × 50 × 15 mm odpovídající normě EN 113 s podélnými plochami rovnoběžnými s vlákny dřeva, nicméně lze použít i jiné rozměry, např. 50 × 150 × 10 mm. Zkušební vzorek musí být úplně ponořen do vody. Zkušební vzorky musejí sestávat ze 100 % bělového dřeva. Každý vzorek má jedinečné označení, aby bylo možno ho identifikovat kdykoli v průběhu zkoušky.
|
|
21.
|
Všechny zkušební vzorky musejí být ohoblované nebo hladce uříznuté a povrchy se nesmějí brousit skelným papírem.
|
|
22.
|
Počet souborů zkušebních vzorků dřeva použitých pro analýzu je alespoň pět: tři sady vzorků se ošetří konzervačním přípravkem, jedna sada vzorků se neošetří a jedna sada vzorků se použije pro odhad obsahu vlhkosti zkušebních vzorků vysušených v sušárně před ošetřením. Připraví se dostatečný počet zkušebních vzorků, aby bylo možno ze zásoby zkušebních vzorků vybrat tři sady, které se neodchýlí o více než 5 % od střední hodnoty retence konzervačního přípravku.
|
|
23.
|
Všechny zkušební vzorky mají konce zatmelené, aby se zabránilo penetraci konzervačního přípravku do konce vláken vzorků nebo vylouhování přípravku ze vzorků skrz konce vláken. Při aplikaci koncové tmelící látky je nezbytné rozlišovat mezi vzorky použitými pro povrchovou aplikaci a penetrační procesy. Koncová tmelící látka se musí aplikovat před ošetřením pouze v případě povrchové aplikace.
|
|
24.
|
Koncová vlákna musejí být otevřená pro ošetření penetračními procesy. Proto vzorky musejí být na koncích zatmelené až na konci doby kondicionování. Emise se odhadují pouze pro podélnou plochu povrchu. Tmel je třeba kontrolovat a podle potřeby znovu aplikovat před zahájením louhování a nesmí se znovu aplikovat po zahájení louhování.
|
Ponořovací nádoba
|
25.
|
Nádoba je vyrobena z inertního materiálu a je dostatečně velká, aby se do ní vešlo 5 vzorků dřeva dle normy EN113 ponořených do 500 ml vody, což znamená poměr plochy povrchu k objemu vody 0,4 cm2/ml.
|
Zkušební sestava vzorků
|
26.
|
Zkušební vzorky jsou ve vodě podepřeny tak, aby všechny exponované povrchy vzorků byly v kontaktu s vodou.
|
POSTUP OŠETŘENÍ KONZERVAČNÍM PŘÍPRAVKEM
Příprava ošetřených zkušebních vzorků
|
27.
|
Zkušební vzorek dřeva, který má být ošetřen konzervačním přípravkem v rámci zkoušky, je ošetřen metodou určenou pro daný konzervační přípravek, což může být buď penetrace, nebo povrchová aplikace ponořením, postřikem nebo štětcem.
|
Konzervační přípravky aplikované procesem penetrace
|
28.
|
Připraví se roztok konzervačního přípravku, kterým se dosáhne určené absorpce nebo retence při aplikaci penetrací. Zkušební vzorek dřeva se zváží a změří se jeho rozměry. Penetrace se provede postupem určeným pro aplikaci konzervačního přípravku na dřevo podle třídy použití 4 nebo 5. Vzorek se opět zváží po ošetření a množství zadrženého konzervačního přípravku (kg/m3) se vypočítá podle rovnice:
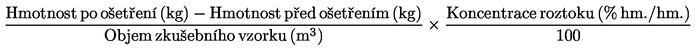
|
|
29.
|
Řezivo ošetřené v průmyslových úpravnách (např. vakuovou impregnací) lze rovněž při této zkoušce použít. Zaznamenají se použité postupy a retenční schopnost materiálu ošetřeného tímto způsobem se musí analyzovat a zaznamenat.
|
Konzervační přípravky aplikované procesy povrchové aplikace
|
30.
|
Povrchová aplikace se provádí namáčením, postřikem nebo nanášením prostřednictvím štětce na zkušební vzorek dřeva. Proces a rychlost aplikace (např. litry/m2) musí odpovídat předpisu pro povrchovou aplikaci konzervačního přípravku.
|
|
31.
|
V tomto případě je také možné použít řezivo ošetřené v průmyslových úpravnách. Zaznamenají se použité postupy a retenční schopnost materiálu ošetřeného tímto způsobem se musí analyzovat a zaznamenat.
|
Kondicionování zkušebních vzorků po ošetření
|
32.
|
Po ošetření se ošetřené zkušební vzorky musejí kondicionovat v souladu s doporučeními dodavatele zkoušeného konzervačního přípravku podle požadavků na štítku konzervačního přípravku nebo v souladu s praxí komerčního ošetření anebo v souladu s normou EN 252.
|
Příprava a výběr zkušebních vzorků
|
33.
|
Po kondicionování po ošetření se pro skupinu zkušebních vzorků vypočítá střední hodnota retence přípravku a pro měření louhování se náhodně vyberou tři reprezentativní sady vzorků s retencí do 5 % střední hodnoty pro danou skupinu.
|
POSTUP MĚŘENÍ EMISÍ KONZERVAČNÍCH PŘÍPRAVKŮ
Metoda ponoření
|
34.
|
Zkušební vzorky se zváží, následně zcela ponoří do vody a zaznamená se datum a čas. Nádoba se zakryje, aby se snížilo odpařování.
|
|
35.
|
Voda se vymění v následujících intervalech: 6 hodin, 1 den, 2 dny, 4 dny, 8 dní, 15 dní, 22 dní, 29 dní (poznámka: toto jsou celkové časy, ne časové intervaly). Zaznamenají se čas a datum výměny vody a hmotnost vody získané zpět z nádoby.
|
|
36.
|
Po každé výměně vody se vzorek vody, ve kterém byl soubor zkušebních vzorků ponořen, uchová pro následnou chemickou analýzu.
|
|
37.
|
Postup vzorkování umožňuje výpočet profilu množství emisí jako funkce času. Vzorky se musejí skladovat za podmínek, které uchovají analyt, např. v chladničce v temnu pro snížení mikrobiálního růstu ve vzorku před analýzou.
|
MĚŘENÍ EMISÍ
Ošetřené vzorky
|
38.
|
Shromážděná voda se chemicky analyzuje na obsah účinné látky a/nebo odpovídajících produktů rozkladu/transformace, je-li to náležité.
|
Neošetřené vzorky
|
39.
|
Shromáždění vody (emisátu) v tomto systému a následná analýza chemických látek, které se vylouhovaly ze vzorků neošetřeného dřeva, umožňují odhadnout možnou rychlost emisí konzervačního přípravku z neošetřeného dřeva. Shromáždění a analýza emisátu po stále delší době expozice umožňují odhadnout rychlost změny rychlosti emisí s časem. Tato analýza představuje kontrolní postup ke stanovení základní úrovně zkoušené chemické látky v neošetřeném dřevu pro potvrzení, že dřevo použité jako zdroj vzorků nebylo dříve ošetřeno konzervačním přípravkem.
|
ÚDAJE A JEJICH PŘEDKLÁDÁNÍ
Chemická analýza
|
40.
|
Shromážděná voda se chemicky analyzuje a výsledek analýzy vody se vyjádří ve vhodných jednotkách, např. μg/l.
|
Předkládání údajů
|
41.
|
Všechny výsledky se zaznamenají. V dodatku je uveden příklad doporučeného formuláře pro jeden soubor ošetřených zkušebních vzorků a souhrnná tabulka pro střední hodnoty emisí pro každý interval vzorkování.
|
|
42.
|
Denní tok emisí v mg/m2/den se vypočítá tak, že se střední hodnota tří měření ze tří opakování vydělí počtem dní ponoření.
|
Závěrečná zpráva
|
43.
|
V závěrečné zprávě musejí být uvedeny alespoň následující informace:
|
—
|
název dodavatele zkoušeného konzervačního přípravku,
|
|
—
|
specifický a jednoznačný název nebo kód zkoušeného konzervačního přípravku,
|
|
—
|
obchodní nebo obecný název účinné složky (složek) s generickým popisem formulačních přísad (např. pomocné rozpouštědlo, pryskyřice) a složení v % hmot. složek,
|
|
—
|
odpovídající retence nebo dávkování (v kg/m3 nebo l/m2) určené pro dřevo používané v kontaktu s vodou,
|
|
—
|
druh použitého dřeva s jeho hustotou a růstovou rychlostí v letokruzích na 10 mm,
|
|
—
|
dávkování nebo retence zkoušeného konzervačního přípravku a vzorec použitý k výpočtu retence vyjádřené v l/m2nebo kg/m3,
|
|
—
|
metoda aplikace konzervačního přípravku se specifikací harmonogramu ošetření použitého pro penetrační proces a metoda aplikace, jde-li o povrchové ošetření,
|
|
—
|
datum aplikace konzervačního přípravku a odhadnutý obsah vlhkosti ve zkušebních vzorcích vyjádřený v procentech,
|
|
—
|
použité postupy kondicionování se specifikací typu, podmínek a trvání,
|
|
—
|
přesný popis použitého koncového tmelu a počet aplikací,
|
|
—
|
přesný popis jakéhokoli následného ošetření dřeva, např. specifikace dodavatele, typu, typické znaky a dávkování barvy,
|
|
—
|
čas a datum každého ponoření, množství vody použité pro ponoření zkušebních vzorků při každém úkonu a množství vody absorbované dřevem během ponoření,
|
|
—
|
jakákoli odchylka od popsané metody a jakékoli faktory, které mohly ovlivnit výsledky.
|
|
LITERATURA
|
1)
|
Evropská norma, EN 84 – 1997. Wood preservatives. Accelerated ageing of treated wood prior to biological testing. Leaching procedure.
|
|
2)
|
Evropská norma, EN 113/A1 – 2004. Wood preservatives. Test method for determining the protective effectiveness against wood destroying basidiomycetes. Determination of the toxic values.
|
|
3)
|
Evropská norma, EN 252 – 1989. Field test method for testing the relative protective effectiveness of a wood preservative in ground contact.
|
|
4)
|
Evropská norma, EN 335 – Part 1: 2006. Durability of wood and wood-based products – Definition of use classes – Part1: General.
|
|
5)
|
American Society for Testing and Materials Standards, ASTM D 1141 – 1998. Standard Practice for the Preparation of Substitute Ocean Water, Without Heavy Metals. Annual Book of ASTM Standards, Volume 11.02.
|
|
6)
|
American Society for Testing and Materials Standards, ASTM D 1193-77 Type II – 1983. Specifications for Reagent Water. Annual Book of ASTM Standards, Volume 11.01.
|
Dodatek 1
Záznamový formulář pro zkušební metodu
Odhad emisí ze dřeva ošetřeného konzervačním přípravkem do životního prostředí: laboratorní metoda pro dřevěné produkty, které jsou v kontaktu se sladkou nebo slanou vodou
|
Zkušební budova
|
|
|
Konzervační přípravky pro dřevo
|
|
Dodavatel konzervačního přípravku
|
|
|
Specifický a jednoznačný název nebo kód konzervačního přípravku
|
|
|
Obchodní nebo obecný název konzervačního přípravku
|
|
|
Formulační přísady
|
|
|
Odpovídající retence dřeva použité v kontaktu s vodou
|
|
|
Aplikace
|
|
Metoda aplikace
|
|
|
Datum aplikace
|
|
|
Vzorec použitý pro výpočet retence:
|
|
|
Postup kondicionování
|
|
|
Trvání kondicionování
|
|
|
Koncový tmel / počet aplikací
|
|
|
Další ošetření
|
Případně dále:
|
|
Zkušební vzorky
|
|
Druh dřeva
|
|
|
Hustota dřeva
|
(minimální … střední … maximální)
|
|
Růstová rychlost (letokruhy na 10 mm)
|
(minimální … střední … maximální)
|
|
Obsah vlhkosti
|
|
|
Zkušební sestavy
(67)
|
Retence (např. kg/m3)
|
|
Ošetřeno ‚x‘
|
Střední hodnota a směrodatná odchylka nebo rozpětí pro 5 vzorků
|
|
Ošetřeno ‚y‘
|
Střední hodnota a směrodatná odchylka nebo rozpětí pro 5 vzorků
|
|
Ošetřeno ‚z‘
|
Střední hodnota a směrodatná odchylka nebo rozpětí pro 5 vzorků
|
|
Neošetřeno
|
|
|
Odchylky parametrů zkušební metody
|
např. kvalita vody, rozměr zkušebních vzorků atd.
|
|
Čas
|
Výměna vody
|
Hmotnost vzorku
|
Absorpce vody
|
Vzorek vody
|
|
Ošetřeno (střední hodnota)
|
Neošetřeno
|
Ošetřeno (střední hodnota)
|
Neošetřeno
|
|
Zkouška vody
|
x
|
y
|
z
|
|
|
Datum
|
g
|
g
|
g
|
g
|
č.
|
pH
|
pH
|
pH
|
pH
|
|
začátek:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 h
|
|
|
|
|
|
1
|
|
|
|
|
|
24 h
|
|
|
|
|
|
2
|
|
|
|
|
|
2 d
|
|
|
|
|
|
3
|
|
|
|
|
|
4 d
|
|
|
|
|
|
4
|
|
|
|
|
|
8 d
|
|
|
|
|
|
5
|
|
|
|
|
|
15 d
|
|
|
|
|
|
6
|
|
|
|
|
|
22 d
|
|
|
|
|
|
7
|
|
|
|
|
|
29 d
|
|
|
|
|
|
8
|
|
|
|
|
|
|
|
Připravte samostatné tabulky pro každou účinnou složku
|
Čas
|
Výměna vody
|
Výsledky analýzy
|
|
Neošetřené vzorky
|
Ošetřené vzorky
|
|
Koncentrace ú.s. ve vodě
mg/l
|
Emitované množství
mg/m2
|
Rychlost emisí
mg/m2/d
|
Koncentrace ú.s. ve vodě
|
Emitované množství
|
Rychlost emisí
|
|
x
|
y
|
z
|
Průměr
|
x
|
y
|
z
|
Průměr
|
x
|
y
|
z
|
Průměr
|
|
|
Datum
|
mg/l
|
mg/l
|
mg/l
|
mg/l
|
mg/m2
|
mg/m2
|
mg/m2
|
mg/m2
|
mg/m2/d
|
mg/m2/d
|
mg/m2/d
|
mg/m2/d
|
|
6 h
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
24 h
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 d
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 d
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 d
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15 d
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
22 d
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
29 d
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Poznámka: Jelikož výsledky z neošetřených vzorků mohou být použity ke korekci rychlostí emisí z ošetřených vzorků, výsledky pro neošetřené vzorky je třeba uvést první a všechny hodnoty pro ošetřené vzorky pak budou ‚korigovanými hodnotami‘. Také je možné provést korekci počáteční analýzy vody.
Dodatek 2
Definice
Chemická látka
: látka nebo směs.
Zkoušená látka
: jakákoli látka nebo směs zkoušená pomocí této zkušební metody.
C.46. BIOAKUMULACE V BENTICKÝCH MÁLOŠTĚTINATCÍCH PŘEBÝVAJÍCÍCH V SEDIMENTECH
ÚVOD
|
1.
|
Tato zkušební metoda je rovnocenná Pokynu OECD pro zkoušení 315 (2008). Endobentičtí živočichové živící se sedimenty mohou být vystaveni látkám vázaným na sediment (1). Mezi těmito konzumenty sedimentů na dně vodních systémů hrají důležitou úlohu vodní máloštětinatci. Žijí v sedimentu a často představují nejpočetnější druh, zejména v přirozeném prostředí s životními podmínkami nepříznivými pro jiné živočichy. Bioturbací sedimentu a tím, že slouží jako kořist, mohou mít tito živočichové silný vliv na biodostupnost těchto látek pro jiné organismy, např. ryby živící se bentickými živočichy. Na rozdíl od epibentických organismů se endobentičtí vodní máloštětinatci zahrabávají do sedimentu a pojídají sedimentové částice pod povrchem sedimentu. Proto jsou tyto organismy vystaveny působení látek prostřednictvím řady absorpčních cest, včetně přímého kontaktu, pozření kontaminovaných částic sedimentu, kapilární vody a vody nad sedimentem. Některé druhy terestrických máloštětinatců, které jsou v současné době využívány pro ekotoxikologické zkoušky, jsou popsány v dodatku 6.
|
|
2.
|
Mezi parametry, které charakterizují bioakumulaci zkoušené chemické látky, patří bioakumulační faktor (BAF), rychlostní konstanta příjmu (ks), rychlostní konstanta vylučování (ke). Podrobné definice těchto parametrů jsou uvedeny v dodatku 1.
|
|
3.
|
Pro obecné posouzení bioakumulačního potenciálu látek a pro zkoumání bioakumulace látek, které mají tendenci se rozdělovat do sedimentů nebo na ně, je zapotřebí zkušební metoda specifická pro určité prostředí (1)(2)(3)(4).
|
|
4.
|
Tato zkušební metoda je určena k posouzení bioakumulace látek vázaných na sediment u endobentických máloštětinatců. Zkoušená chemická látka se přidá do sedimentu. Obohacený sediment je modelem kontaminovaného sedimentu.
|
|
5.
|
Tato metoda je založena na stávajících zkušebních metodách toxicity sedimentu a bioakumulace (1)(4)(5)(6)(7)(8)(9). Dalšími užitečnými dokumenty jsou diskuse a výsledky mezinárodních seminářů (11) a výsledky mezinárodního okružního testu (12).
|
|
6.
|
Tato zkouška se aplikuje na stabilní, neutrální organické látky, které mají tendenci se vázat na sedimenty. Touto metodou se rovněž může měřit bioakumulace na sediment vázaných, stabilních organo-kovových sloučenin (12). Bez modifikace zkušebního postupu s přihlédnutím k objemům substrátu a vody a velikosti možných vzorků tkání se tato metoda nedá se použít na kovy a jiné stopové prvky (11).
|
PŘEDPOKLADY A INFORMACE O ZKOUŠENÉ LÁTCE
|
7.
|
Pokud jde o bioakumulační procesy, existuje pouze několik dobře zavedených, v současnosti dostupných kvantitativních vztahů struktura-aktivita (QSAR) (14). Nejpoužívanějším vztahem je korelace mezi bioakumulací a biokoncentrací stabilních organických látek a jejich lipofilností (vyjádřená jako logaritmus rozdělovacího koeficientu oktanol-voda (log Kow); viz definice v dodatku 1), který byl vyvinut pro popis rozdělování chemické látky mezi vodu a ryby. Korelace pro prostředí sedimentu byla rovněž stanovena za použití tohoto vztahu (15)(16)(17)(18). Korelace log Kow-log BCF jako hlavní QSAR může být prospěšná pro první předběžný odhad bioakumulačního potenciálu látek vázaných na sediment. Avšak BAF může být ovlivněn obsahem lipidů ve zkušebním organismu a obsahem organického uhlíku v sedimentu. Proto je rovněž možné použít rozdělovací koeficient organický uhlík-voda (Kou) jako hlavní určující faktor bioakumulace organických látek vázaných na sediment.
|
|
8.
|
Tato zkouška se aplikuje na:
|
—
|
stabilní organické látky s hodnotami log Kow mezi 3,0 a 6,0 (5)(19) a superlipofilní látky, které vykazují log Kow vyšší než 6,0 (5),
|
|
—
|
látky patřící do třídy organických látek známých pro jejich bioakumulační potenciál v živých organismech, např. povrchově aktivní látky nebo vysoce adsorbující látky (např. vysoký Kou).
|
|
|
9.
|
Informace o zkoušené chemické látce, jako jsou bezpečnostní opatření, náležité podmínky skladování a stabilita nebo analytické metody, musejí být zajištěny před zahájením studie. Pokyny pro zkoušení látek s fyzikálně-chemickými vlastnostmi, které činí jejich zkoušení obtížné, jsou uvedeny v (20) a (21). Před provedením zkoušky bioakumulace s vodními máloštětinatci je třeba získat o zkoušené látce následující informace:
|
—
|
obecný název, chemický název (přednostně název IUPAC), strukturní vzorec, číslo CAS, čistota,
|
|
—
|
rozpustnost ve vodě [zkušební metoda A.6 (22)],
|
|
—
|
rozdělovací koeficient oktanol-voda Kow [zkušební metody A.8, A.24 (22)],
|
|
—
|
rozdělovací koeficient sediment-voda vyjádřený jako Kd nebo Kou [zkušební metoda C.19 (22)],
|
|
—
|
hydrolýza [zkušební metoda C.7 (22)],
|
|
—
|
fototransformace ve vodě (23),
|
|
—
|
tlak par [zkušební metoda A.4 (22)],
|
|
—
|
přímá biologická rozložitelnost [zkušební metody C.4 a C.29 (22)],
|
|
—
|
povrchové napětí [zkušební metoda A.5 (22)],
|
|
—
|
kritická koncentrace micel (24).
|
Kromě toho by byly relevantní následující informace – pokud budou dostupné:
|
—
|
biologický rozklad ve vodním prostředí [zkušební metody C.24 a C.25 (22)],
|
|
|
10.
|
Radioizotopově značené zkoušené látky mohou usnadnit analýzu vody, sedimentu a biologických vzorků a mohou být použity ke stanovení, zda by se měla provést identifikace a kvantifikace produktů rozkladu. Zde popsaná metoda byla validována v mezinárodním okružním testu (12) pro látky značené pomocí 14C. Jestliže se měří celková zbytková radioaktivita, je bioakumulační faktor (BAF) založen na mateřské látce, včetně jakýkoli zadržených produktů rozkladu. Je rovněž možné kombinovat metabolickou studii se studií bioakumulace analýzou a kvantifikací procentních podílů mateřské látky a jejích produktů rozkladu ve vzorcích odebraných na konci fáze příjmu nebo při maximální úrovni bioakumulace. V každém případě se doporučuje, aby výpočet BAF byl založen na koncentraci mateřské látky v organismech, a ne pouze na celkové zbytkové radioaktivitě.
|
|
11.
|
Kromě vlastností zkoušené chemické látky je další požadovanou informací toxicita pro druhy máloštětinatců používané ve zkoušce, např. medián letální koncentrace (LC50) za dobu nezbytnou pro fázi příjmu, aby se zajistilo, že vybrané expoziční koncentrace budou daleko nižší než toxické úrovně. Pokud je to možné, měla by být dána přednost hodnotám toxicity odvozeným z dlouhodobých studií o subletálních koncových bodech (51)(52). Jestliže takové údaje nejsou dostupné, mohou poskytnout užitečné informace zkouška akutní toxicity za podmínek shodných s podmínkami bioakumulační zkoušky nebo údaje o toxicitě dalších náhradních druhů.
|
|
12.
|
K dispozici musí být vhodná analytická metoda o známé správnosti, přesnosti a citlivosti pro kvantitativní stanovení chemické látky ve zkušebních roztocích, v půdě a v biologickém materiálu a dále podrobnosti o přípravě a uchovávání vzorků a bezpečnostní listy. Musí být rovněž známy analytické detekční meze zkoušené chemické látky ve vodě, sedimentu a tkáni máloštětinatců. Je-li použita radioizotopově značená zkoušená látka, je třeba rovněž znát specifickou radioaktivitu (tj. Bq.mol– 1), polohu radioizotopově značeného atomu a procentní podíl radioaktivity spojené s nečistotami. Specifická radioaktivita zkoušené chemické látky by měla být co největší, aby bylo možno zaznamenat co nejmenší koncentrace zkoušené látky (11).
|
|
13.
|
Informace o typických znacích sedimentu, který má být použit (např. původ sedimentu nebo jeho složek, pH a koncentrace amoniaku v kapilární vodě (polní sedimenty), obsah organického uhlíku (TOC), rozložení velikosti částic (procentní podíl písku, naplavenin a jílu) a procentní podíl sušiny) by rovněž měly být dostupné (6).
|
PODSTATA ZKOUŠKY
|
14.
|
Zkouška sestává ze dvou fází – fáze příjmu (expozice) a fáze vylučování (po expozici). Během fáze příjmu jsou organismy vystaveny sedimentu s přidanou zkoušenou látkou, který je překryt rekonstituovanou vodou a příslušně ekvilibrován (11). Skupina kontrolních organismů je držena za shodných podmínek, ale bez zkoušené látky.
|
|
15.
|
Pro fázi vylučování se organismy přemístí do systému sediment-voda neobsahujícího zkoušenou chemickou látku. Fáze vylučování je nezbytná pro získání informací o rychlosti, jakou je zkoušená látka vylučována zkušebním organismem (19)(25). Fáze vylučování je požadována vždy, pokud příjem zkoušené látky během fáze expozice nebyl nevýznamný (např. pokud není žádný statistický rozdíl mezi koncentrací zkoušené látky ve zkušebních a kontrolních organismech). Jestliže nebylo dosaženo rovnovážného stavu během fáze příjmu, kinetiku – BAFk, rychlostní konstanta(y) příjmu a vylučování – lze určit prostřednictvím výsledků fáze vylučování. Koncentrace zkoušené chemické látky v organismech a na nich je sledována v průběhu obou fází zkoušky.
|
|
16.
|
Během fáze příjmu se provádí měření, až se dosáhne BAF plató nebo rovnovážného stavu. Standardně by fáze příjmu měla trvat 28 dní. Praktická zkušenost ukázala, že dvanácti- až čtrnáctidenní fáze příjmu je pro dosažení rovnovážného stavu u řady stabilních neutrálních organických látek dostatečná (6)(8)(9).
|
|
17.
|
Avšak jestliže se rovnovážného stavu nedosáhne během 28 dní, zahájí se fáze vylučování přenesením exponovaných máloštětinatců do nádob obsahujících stejné médium bez zkoušené chemické látky. Fáze vylučování se ukončí, buď když se dosáhne 10 % úrovně koncentrace měřené počtem jedinců v 28. dni fáze příjmu, nebo po maximální době trvání v délce 10 dnů. Zbytková úroveň vyjádřená počtem jedinců na konci fáze vylučování se uvádí jako dodatečný koncový bod, např. jako neeliminované zbytky (NER). Bioakumulační faktor (BAFss) se vypočítá přednostně jednak jako poměr koncentrace vyjádřené počtem jedinců (Ca) ke koncentraci v sedimentu (Cs) při zřetelném rovnovážném stavu, jednak jako kinetický bioakumulační faktor BAFK jako poměr rychlostní konstanty příjmu ze sedimentu (ks) a vylučovací rychlostní konstanty (ke) za předpokladu kinetiky prvního řádu. Jestliže se rovnovážného stavu nedosáhne během 28 dní, vypočítá se BAFK z rychlostní konstanty příjmu a rychlostní konstanty vylučování. Výpočet viz dodatek 2. Jestliže se kinetika prvního řádu nedá použít, je třeba aplikovat složitější modely (dodatek 2 a odkaz (25).
|
|
18.
|
Jestliže se rovnovážného stavu nedosáhne během 28 dní, je možné fázi příjmu volitelně prodloužit tím, že se skupina exponovaných červů – je-li dostupná – podrobí dalším měřením, až je dosaženo rovnovážného stavu; nicméně souběžně se musí zahájit fáze vylučování v den 28 fáze příjmu.
|
|
19.
|
Rychlostní konstanta příjmu, rychlostní konstanta (nebo konstanty, jsou-li použity složitější modely) vylučování, kinetický bioakumulační faktor (BAFK), a je-li to možné, intervaly spolehlivosti každého z těchto parametrů se vypočítají z modelových rovnic za použití počítače (modely viz dodatek 2). Míru shody jakéhokoli modelu lze určit např. z korelačního koeficientu nebo z koeficientu určení (koeficienty, jejichž hodnota se blíží jedné, indikují dobrou kvalitu proložení).
|
|
20.
|
Pro snížení variability výsledků zkoušky pro organické látky s vysokou lipofilitou je třeba bioakumulační faktory vyjádřit dodatečně ve vztahu k obsahu lipidů ve zkušebních organismech a k obsahu organického uhlíku (TOC) v sedimentu (akumulační faktor bioty sedimentu nebo BSAF v kg sedimentu TOC kg– 1 obsahu lipidů v organismech). Tento přístup je založen na zkušenostech a teoretických korelacích pro vodní prostředí, kde – pro některé třídy chemických látek – existuje jasný vztah mezi schopností látky bioakumulovat a jejím lipofilním charakterem, což bylo dobře stanoveno pro ryby jako modelové organismy (14)(25)(27). Existuje rovněž vztah mezi obsahem lipidů ve zkušebních rybách a pozorovanou bioakumulací takových látek. U bentických organismů byly nalezeny podobné korelace (15)(16)(17)(18). Pokud je k dispozici dostatečné množství tkání organismů, lze stanovit obsah lipidů u pokusných živočichů na stejném biologickém materiálu, který byl použit ke stanovení koncentrace zkoušené chemické látky. Je však praktické použít aklimatizované kontrolní živočichy alespoň na začátku nebo – přednostně – na konci fáze příjmu pro měření obsahu lipidů, který se pak může použít k normalizaci BAF hodnot.
|
VALIDITA ZKOUŠKY
|
21.
|
Má-li být zkouška platná, musí být splněny tyto podmínky:
|
—
|
kumulativní mortalita organismů (kontrolních a exponovaných) do konce zkoušky by neměla překročit 20 % počáteční hodnoty,
|
|
—
|
kromě toho je třeba ukázat, že se organismy zavrtávají do sedimentu, aby se počítalo s maximální expozicí. Podrobnosti viz odstavec 28.
|
|
POPIS METODY
Zkušební druh
|
22.
|
Pro zkoušky se dá použít několik druhů vodních máloštětinatců. Nejběžněji používané druhy jsou uvedeny v dodatku 6.
|
|
23.
|
Zkoušky toxicity (96 h, pouze ve vodě) je třeba provádět v pravidelných intervalech (např. každý měsíc) s referenční toxickou látkou, jako např. chloridem draselným (KCl) nebo síranem měďnatým (CuSO4) (1), aby byly ukázány zdravotní podmínky zkušebních živočichů (1)(6). Jestliže se zkoušky toxicity s referenční látkou neprovádějí v pravidelných intervalech, musí se populace organismů použitých ve zkoušce bioakumulace sedimentu kontrolovat za použití referenční toxické látky. Měření obsahu lipidů by mohlo rovněž poskytnout užitečné informace o stavu živočichů.
|
Kultivace zkušebních organismů
|
24.
|
Aby byl k dispozici dostatečný počet jedinců pro provedení zkoušek bioakumulace, je možné živočichy uchovávat v permanentní jednodruhové laboratorní kultuře. Metody s laboratorními kulturami pro vybrané zkušební druhy jsou shrnuty v dodatku 6. Podrobnosti jsou uvedeny v odkazech (8)(9)(10)(18)(28)(29)(30)(31)(32).
|
Přístroje a pomůcky
|
25.
|
U všech částí zařízení je nutno nepoužívat takové materiály, které se mohou rozpouštět, adsorbovat zkoušenou chemickou látku nebo se z nich mohou vylouhovat jiné chemické látky a mají nepříznivý účinek na pokusné živočichy. Doporučuje se použít standardní pravoúhlé nebo válcové nádoby vyrobené z chemicky inertního materiálu o vhodném objemu s ohledem na náplň, tj. počet zkušebních jedinců. Použití měkkého plastového potrubí pro dodávku vody nebo vzduchu je třeba vyloučit. Jakékoli zařízení přicházející do kontaktu se zkušebními médii by mělo být vyrobeno z polytetrafluoretylenu, nerezové oceli anebo skla. Pro látky s vysokými adsorpčními koeficienty, jako jsou syntetické pyrethroidy, je nutné použít silanizované sklo. V těchto případech musí být zařízení po použití zlikvidováno (5). U radioizotopově značených zkoušených látek a u těkavých látek je třeba dávat pozor na to, aby nedošlo k odstranění a úniku odstraněné zkoušené látky. Je třeba použít lapače (např. skleněné láhve na promývání plynů) obsahující vhodné absorbenty pro zachycení jakýchkoli zbytků odpařených ze zkušebních komor (11).
|
Voda
|
26.
|
Voda nad sedimentem musí mít kvalitu umožňující přežití zvoleného zkušebního druhu po dobu aklimatizace a během zkoušky, aniž by vykazoval abnormální vzhled nebo chování. Doporučuje se použít rekonstituovanou vodu podle zkušební metody C.1 (25) jako vodu nad sedimentem, a to ve zkouškách i v laboratorních kulturách pro živočichy. Bylo prokázáno, že v této vodě může přežít, růst a rozmnožovat se řada zkušebních druhů (8), a při tom je zajištěna maximální standardizace podmínek zkoušky a kultur. Voda musí být popsána alespoň hodnotami pH, vodivosti a tvrdosti. Užitečné informace může před použitím poskytnout analýza vody na mikropolutanty (dodatek 4).
|
|
27.
|
Voda by měla mít po celou dobu zkoušky stejnou kvalitu. Hodnota pH vody nad sedimentem by měla být mezi 6 a 9. Celková tvrdost má být na začátku zkoušky mezi 90 a 400 mg CaCO3 na litr (7). Rozsahy pro pH a tvrdost ve výše uvedené rekonstituované vodě jsou uvedeny ve zkušební metodě C.1 (25). Jestliže existuje podezření na interakci mezi ionty tvrdosti a zkoušenou chemickou látkou, je třeba použít vodu o nižší tvrdosti. Dodatek 4 shrnuje doporučená kritéria přijatelné ředicí vody podle Pokynu OECD pro zkoušení č. 210 (34).
|
Sedimenty
|
28.
|
Sediment by měl mít takovou kvalitu, aby umožnila přežití zkušebních organismů a pokud možno jejich rozmnožování po dobu aklimatizace a během zkoušky, aniž by vykazovaly abnormální vzhled nebo chování. Organismy by se měly zavrtat do sedimentu. Zavrtávání může mít vliv na expozici a v důsledku toho na BAF. Proto je třeba zaznamenat vyhýbání se sedimentu nebo zavrtávání zkušebních organismů tam, kde taková pozorování umožní zákal vody nad sedimentem. Jedinci (kontrolní a exponovaní) by se měli zavrtat do sedimentu během 24 hodin po vložení do zkušebních nádob. Jestliže se organismy odmítají zavrtávat nebo se sedimentu vyhýbají (např. více než 20 % po dobu delší než polovina fáze příjmu), pak nejsou zkušební podmínky vhodné nebo nejsou zkušební organismy zdravé anebo toto chování vyvolává koncentrace zkoušené chemické látky. V takovém případě se zkouška musí zastavit a opakovat za zlepšených podmínek. Další informace o pojídání sedimentu lze získat použitím metod popsaných v (35)(36), které specifikují pojídání sedimentu nebo výběr částic u zkušebních organismů. Jestliže je možné je pozorovat, zaznamenává se alespoň přítomnost nebo nepřítomnost vloček výkalů na povrchu sedimentu, které indikují pojídání sedimentu zkušebními organismy, a toto zohlednit to při interpretaci výsledků zkoušky v souvislosti se způsobem expozice.
|
|
29.
|
Pro zkoušky i pro laboratorní kultury organismů (dodatek 5) se doporučuje použít umělý sediment na základě umělé půdy popsaný ve zkušební metodě C.8 (40), neboť přírodní sedimenty příslušné kvality nemusejí být během roku dostupné. Zkoušku by kromě toho mohly ovlivnit i autochtonní organismy stejně jako možná přítomnost mikropolutantů v přírodních sedimentech. V umělém sedimentu může přežít, růst a rozmnožovat se řada zkušebních druhů (8).
|
|
30.
|
Umělý sediment by měl být charakterizován alespoň z hlediska původu složek, rozložení velikosti zrn (procentní podíl písku, naplavenin a jílu), obsahu organického uhlíku (TOC), obsahu vody a pH. Volitelné je měření redox potenciálu. Jako zkušební a/nebo kultivační sedimenty však mohou sloužit přírodní sedimenty z neznečištěných míst (1). Přírodní sedimenty by měly být popsány alespoň původem (místo sběru), pH a obsahem amoniaku v kapilární vodě, obsahem organického uhlíku (TOC), rozložením velikosti částic (procentní podíl písku, naplavenin a jílu) a procentním podílem vody (6). Jestliže se očekává vznik amoniaku, doporučuje se, aby před přidáním zkoušené látky byl přírodní sediment kondicionován po dobu sedmi dní za stejných podmínek, jaké budou převládat v následné zkoušce. Na konci této doby kondicionování se voda, která je nad sedimentem, odstraní a vylije. Užitečné informace by měla poskytnout analýza půdy nebo jejích složek na mikroskopické znečišťující látky před použitím.
|
Příprava
|
31.
|
Zacházení s přírodními sedimenty před jejich použitím v laboratoři je popsáno v (1)(6)(44). Příprava umělého sedimentu je popsána v dodatku 5.
|
Skladování
|
32.
|
Skladování přírodních sedimentů v laboratoři by mělo být co možná nejkratší. U.S. EPA (6) doporučuje maximální dobu skladování 8 týdnů při 4 ± 2 °C v temnu. Nad sedimentem ve skladovacích nádobách nesmí být žádný volný prostor. Doporučení pro skladování umělého sedimentu jsou uvedena v dodatku 5.
|
Aplikace zkoušené látky
|
33.
|
Do sedimentu se přidá zkoušená chemická látka. Postup přidávání spočívá v pokrytí jedné nebo více složek sedimentu zkoušenou látkou. Například křemenný písek nebo jeho část (např. 10 g křemenného písku na zkušební nádobu) se může nechat nasáknout roztokem zkoušené chemické látky ve vhodném rozpouštědle, které se pak pomalu odpaří do sucha. Pokrytou část lze následně promíchat s vlhkou půdou. Při přípravě sedimentu je třeba brát v úvahu množství písku obohaceného směsí zkoušené chemické látky, tj. sediment se tak musí připravit s menším množstvím písku (6).
|
|
34.
|
Do přírodního sedimentu se může zkoušená látka přidat obohacením vysušeného dílu sedimentu, jak je popsáno výše pro umělý sediment, nebo zamícháním zkoušené látky do mokrého sedimentu a následným odpařením použitých solubilizačních činidel. Vhodnými rozpouštědly pro přidání do mokrého sedimentu jsou etanol, metanol, etylenglykol monometyléter, etylenglykol dimetyléter, dimetylformamid a trietylenglykol (5)(34). Hlavním kritériem pro výběr vhodného solubilizačního činidla by měla být toxicita a těkavost rozpouštědla a rozpustnost zkoušené látky ve zvoleném rozpouštědle. Další pokyny týkající se postupů přidávání jsou uvedeny v Environment Canada (1995)(41). Je třeba dbát na to, aby zkoušená látka přidaná do sedimentu byla v sedimentu důkladně a rovnoměrně rozptýlena. Opakované dílčí vzorky obohaceného sedimentu je třeba analyzovat pro ověření koncentrací zkoušené chemické látky v sedimentu a stanovení stupně homogenity rozložení zkoušené látky.
|
|
35.
|
Poté, co byl obohacený sediment s překrývající vodou připraven, je žádoucí umožnit rozdělení zkoušené látky mezi sediment a vodnou fázi. To by se mělo provádět pokud možno za stejných podmínek z hlediska teploty a provzdušňování použité při zkoušce. Vhodná doba pro ustavení rovnováhy je specifická pro konkrétní sediment a chemickou látku a může se pohybovat v řádu hodin až dní, zřídka až několika týdnů (4–5 týdnů) (28)(42). Při této zkoušce se neočekává dosažení rovnováhy, ale doporučuje se doba ekvilibrace 48 hodin až 7 dní. V závislosti na účelu studie, např. když se napodobují podmínky životního prostředí, se může obohacený sediment ekvilibrovat nebo nechat vyzrát po delší dobu (11).
|
PROVEDENÍ ZKOUŠKY
Předběžná zkouška
|
36.
|
V zájmu optimalizace zkušebních podmínek konečné zkoušky může být užitečné provést předběžný experiment, např. výběr koncentrace (koncentrací) zkoušené látky, délka fáze příjmu a fáze vylučování. Během předběžné zkoušky se musí pozorovat a zaznamenat chování organismů, například vyhýbání se sedimentu, tj. že unikají ze sedimentu, což může být způsobeno zkoušenou látkou anebo samotným sedimentem. Vyhýbání se sedimentu se může rovněž použít jako subletální parametr v předběžné zkoušce pro odhad koncentrace(í) zkoušené chemické látky, která se použije ve zkoušce bioakumulace.
|
Podmínky expozice
Délka fáze příjmu
|
37.
|
Zkušební organismy se vystavují zkoušené látce během fáze příjmu. První vzorek se odebere mezi 4 a 24 h od začátku fáze příjmu. Fáze příjmu trvá 28 dnů (1)(6)(11), není-li prokázáno, že je rovnováhy dosaženo dříve. Rovnovážný stav nastane, jestliže: i) závislost bioakumulačních faktorů na čase je při každé době vzorkování popsána přímkou rovnoběžnou s časovou osou; ii) tři následné analýzy BAF provedené na vzorcích odebraných v intervalech alespoň dvou dní se navzájem neliší o více než ± 20 % a iii) nejsou žádné významné rozdíly mezi třemi dobami vzorkování (na základě statistického srovnání, např. analýzou rozptylu a regresní analýzou). Jestliže se nedosáhlo rovnovážného stavu během 28 dní, fáze příjmu se může ukončit zahájením fáze vylučování; BAFK se může vypočítat z rychlostních konstant příjmu a vylučování (viz rovněž odstavce 16 až 18).
|
Trvání fáze vylučování
|
38.
|
První vzorek se odebere mezi 4 a 24 h od začátku fáze vylučování, neboť během počátečního období se mohou vyskytnout rychlé změny ve zbytcích tkání. Doporučuje se ukončit fázi vylučování, buď když koncentrace zkoušené chemické látky je nižší než 10 % koncentrace v rovnovážném stavu, nebo po maximální době trvání 10 dní. Zbytková úroveň v organismech na konci fáze vylučování se uvede v protokolu jako sekundární koncový bod. Délka fáze však může být určena dobou, po kterou zůstává koncentrace zkoušené látky v organismech nad mezí detekce analytické metody.
|
Zkušební organismy
Počet zkušebních jedinců
|
39.
|
Počet jedinců na vzorek musí představovat takovou hmotnost tkáně organismů, aby hmotnost zkoušené látky na vzorek při zahájení fáze příjmu a na konci fáze vylučování byla významně vyšší než detekční mez pro zkoušenou chemickou látku v biologickém materiálu. V uvedených stadiích příjmu a vylučování je koncentrace ve zkušebních živočiších obvykle relativně nízká (6)(8)(18). Jelikož individuální hmotnost u mnoha druhů vodních máloštětinatců je velmi nízká (5–10 mg mokré hmotnosti na jedince Lumbriculus variegatus a Tubifex tubifex), je možné organismy z dané paralelní zkušební komory sloučit pro účely vážení a chemické analýzy zkoušky. Pro zkušební druh s vyšší individuální hmotností (např. Branchiura sowerbyi) lze použít opakované pokusy obsahující jednoho jedince, ale v takových případech je třeba počet opakování zvýšit na pět na odběr (11). Je však třeba poznamenat, že B. sowerbyi nebyl zahrnut do okružního testu (12), a proto není pro tuto metodu doporučen jako vhodnější druh.
|
|
40.
|
Měli by se použít jedinci podobné velikosti (L. variegatus viz dodatek 6). Musí pocházet ze stejného zdroje a musí se jednat o dospělé nebo velké živočichy stejné třídy, pokud jde o věk (viz dodatek 6). Hmotnost a stáří živočicha může mít významný vliv na hodnoty BAF (např. kvůli různému obsahu lipidů anebo přítomnosti vajíček); tyto parametry je třeba přesně zaznamenat. Při měření průměrné mokré a suché hmotnosti se dílčí vzorky zkušebních organismů před začátkem zkoušky zváží.
|
|
41.
|
U Tubifex tubifex a Lumbriculus variegatus se během zkoušky očekává rozmnožování. Absence rozmnožování při zkoušce bioakumulace se zaznamená a bere v úvahu při interpretaci výsledků zkoušky.
|
Zatížení
|
42.
|
Je třeba použít vysoké poměry sediment-organismy a voda-organismy, aby se minimalizovalo snížení koncentrace zkoušené chemické látky v sedimentu během fáze příjmu a aby se zabránilo poklesu koncentrace rozpuštěného kyslíku. Zvolená rychlost nasazování by měla rovněž odpovídat v přírodě se vyskytujícím hustotám populace vybraného druhu (43). Například pro Tubifex tubifex se doporučuje rychlost nasazování 1–4 mg tkáně organismů (mokrá hmotnost) na gram mokrého sedimentu (8)(11). V odkazech (1) a (6) se pro L. variegatus doporučuje rychlost nasazování ≤ 1 g sušiny tkáně organismů na 50 g organického uhlíku sedimentu.
|
|
43.
|
Organismy pro použití ve zkoušce se vyjmou z kultury prosátím sedimentu kultury. Živočichové (dospělí nebo velcí jedinci bez známek nedávného dělení) se přemístí do skleněných misek (např. Petriho misek) obsahujících čistou vodu. Jestliže se zkušební podmínky liší od kultivačních podmínek, měla by být aklimatizační fáze v délce 24 h dostatečná. Před vážením se z organismů odstraní přebytek vody. To se může provést tak, že se organismy opatrně umístí na předem zvlhčený hedvábný papír. Pro vysušení organismů se nedoporučuje použít absorpční papír, neboť to může způsobit stres nebo poškození organismů. Brunson a kol. (1998) doporučují použít neosušené organismy o hmotnosti rovné přibližně 1,33násobku cílové biomasy. Těchto dodatečných 33 % odpovídá rozdílu mezi osušenými a neosušenými organismy (28).
|
|
44.
|
Na začátku fáze příjmu (den 0 zkoušky) se zkušební organismy vyjmou z aklimatizační komory a rozdělí náhodně do nádob (např. Petriho misek) obsahujících rekonstituovanou vodu tak, že se přidají skupiny po dvou jedincích do každé nádoby, až každá nádoba obsahuje deset jedinců. Každá z těchto skupin se pak náhodně přemístí do samostatné zkušební nádoby, např. použitím měkké ocelové pinzety. Zkušební nádoby se následně inkubují za zkušebních podmínek.
|
Krmení
|
45.
|
Vzhledem k nízkému obsahu živin v umělém sedimentu se musí sediment doplnit o zdroj potravy. Aby se nepodcenila expozice zkušebních organismů, např. selektivním krmením nekontaminovanou potravou, potrava nezbytná pro rozmnožování a růst zkušebních organismů se musí přidávat do sedimentu jednou před aplikací zkoušené chemické látky nebo během ní (viz dodatek 5).
|
Poměr sediment-voda
|
46.
|
Doporučený poměr sediment-voda je 1:4 (45). Tento poměr je považován za vhodný pro udržení koncentrací kyslíku na příslušných úrovních a pro zabránění zvyšování obsahu amoniaku ve vodě nad sedimentem. Obsah kyslíku v této vodě by se měl udržet na úrovni ≥ 40 % nasycení. Voda nad sedimentem ve zkušebních nádobách by měla být mírně provzdušňována (např. 2–4 bubliny za sekundu) prostřednictvím Pasteurovy pipety umístěné přibližně 2 cm nad povrchem sedimentu, aby se minimalizovalo rozrušení sedimentu.
|
Světlo a teplota
|
47.
|
Fotoperioda v kultuře a při zkoušce je 16 hodin (1)(6). Intenzita světla v místě zkoušky by měla být udržována na hodnotě přibližně 500–1 000 lx. Zkušební teplota by se po celou dobu zkoušky měla udržovat na 20 ± 2 °C.
|
Zkušební koncentrace
|
48.
|
Jedna zkušební koncentrace (pokud možno co nejnižší) se použije pro stanovení kinetiky příjmu, ale druhá (vyšší) koncentrace se dá také použít (např. (46)). V tomto případě se vzorky odeberou a analyzují v rovnovážném stavu nebo po 28 dnech pro potvrzení hodnoty BAF měřené při nižší koncentraci (11). Vyšší koncentrace by se měla zvolit tak, aby bylo možné vyloučit nepříznivé vlivy (např. výběrem přibližně 1 % nejnižší známé koncentrace chronického efektu ECx získané z příslušných studií chronické toxicity). Nižší zkušební koncentrace by měla být významně vyšší než mez stanovitelnosti v sedimentu a biologických vzorcích pro použitou analytickou metodu. Jestliže účinná koncentrace zkoušené chemické látky je blízko analytické mezi stanovitelnosti, doporučuje se použít radioizotopově značenou zkoušenou látku s vysokou specifickou radioaktivitou.
|
Exponované a kontrolní repliky
|
49.
|
Minimální počet exponovaných replik pro kinetická měření by měl být tři na odběr (11) během celé fáze příjmu a vylučování. Další repliky je třeba použít např. pro volitelné dodatečné termíny vzorkování. Pro fázi vylučování se připraví odpovídající počet replik s neobohaceným sedimentem a překrývající vodou, aby mohli být na konci fáze příjmu exponovaní jedinci přemístěni z určených exponovaných nádob do neexponovaných nádob. Celkový počet exponovaných replik by měl být dostatečný jak pro fázi příjmu, tak pro fázi vylučování.
|
|
50.
|
Alternativě mohou být jedinci určení ke vzorkování během fáze vylučování exponováni v jedné velké nádobě obsahující obohacený sediment ze stejné várky jako ten, který byl použit pro kinetiku příjmu. Je třeba prokázat, že zkušební podmínky (např. hloubka sedimentu, poměr sediment-voda, nasazování, teplota, kvalita vody) jsou srovnatelné s replikami navrženými pro fázi příjmu. Na konci fáze příjmu se z této nádoby odeberou vzorky vody, sedimentu a organismů pro analýzu; dostatečný počet velkých jedinců, kteří nevykazují žádné známky nedávného dělení, se opatrně vyjme a přemístí do paralelních nádob připravených pro fázi vylučování (např. deset organismů na paralelní nádobu).
|
|
51.
|
Jestliže se nepoužije jiné rozpouštědlo než voda, je třeba zajistit alespoň 9 replik negativní kontroly (alespoň 3 vzorkování na začátku, 3 na konci příjmu a 3 na konci vylučování) pro biologickou analýzu a analýzu pozadí. Jestliže se použije jakékoli solubilizační činidlo pro aplikaci zkoušené látky, je třeba provést kontrolní měření s rozpouštědlem (alespoň 3 repliky se odeberou na začátku, 3 na konci fáze příjmu a 3 na konci fáze vylučování). V tomto případě je třeba pro vzorkování na konci fáze příjmu zajistit alespoň 4 repliky negativní kontroly (bez rozpouštědla). Tyto paralelní nádoby lze biologicky srovnat s kontrolou obsahující rozpouštědlo s cílem získat informace o možném vlivu rozpouštědla na zkušební organismy. Podrobnosti jsou uvedeny v dodatku 3.
|
Četnost měření kvality vody
|
52.
|
Jako minimum se změří následující parametry kvality vody nad sedimentem během fází příjmu a vylučování:
|
Teplota
|
v jedné nádobě pro každou úroveň expozice v den vzorkování a v jedné kontrolní nádobě jednou týdně a na začátku a na konci fází příjmu a vylučování; teplota v okolním médiu (okolní vzduch nebo vodní lázeň) nebo se rovněž může zaznamenat v jedné reprezentativní zkušební nádobě, např. v souvislých nebo hodinových intervalech
|
|
Obsah rozpuštěného kyslíku
|
v jedné nádobě pro každou úroveň expozice a v jedné kontrolní nádobě v den vzorkování; vyjádřeno jako mg/l a % ASV (hodnota saturace vzduchu)
|
|
Přívod vzduchu
|
kontroluje se alespoň jedenkrát za den (pracovní) a podle potřeby nastaví
|
|
pH
|
v jedné exponované nádobě pro každou úroveň expozice v den vzorkování a v jedné kontrolní nádobě jednou týdně a na začátku a na konci fází příjmu a vylučování
|
|
Celková tvrdost vody
|
alespoň v jedné exponované nádobě a jedné kontrolní zkušební nádobě na začátku a konci fází příjmu a vylučování, vyjádřeno v mg/l CaCO3
|
|
Celkový obsah amoniaku
|
alespoň v jedné exponované nádobě a jedné kontrolní zkušební nádobě na začátku a konci fází příjmu a vylučování, vyjádřeno v mg/l NH4
+ nebo NH3 nebo celkový amoniak-N
|
|
Vzorkování a analýza organismů, sedimentu a vody
Harmonogram vzorkování
|
53.
|
Příklady harmonogramů odběru vzorků pro 28denní fázi příjmu a 10denní fázi vylučování jsou uvedeny v dodatku 3.
|
|
54.
|
Provede se vzorkování vody a sedimentu ze zkušebních komor pro stanovení koncentrace zkoušené látky před přidáním organismů a během fází příjmu a vylučování. Během zkoušky se stanovují koncentrace zkoušené chemické látky v organismech, sedimentu a vodě pro sledování rozložení zkoušené látky ve složkách zkušebního systému.
|
|
55.
|
Vzorkování organismů, sedimentu a vody se provede během fází příjmu a vylučování alespoň šestkrát.
|
|
56.
|
Vzorkování pokračuje, než se dosáhne plató (rovnovážný stav) (viz dodatek 1), nebo po dobu 28 dní. Jestliže se plató nedosáhne do 28 dní, zahájí se fáze vylučování. Při zahájení fáze vylučování se přenesou určení jedinci do paralelních komor obsahujících neexponovaný sediment a vodu (viz rovněž odstavce 17 a 18).
|
Odběr a příprava vzorků
|
57.
|
Vzorky vody se získají dekantací, odsátím nebo pipetováním objemu dostatečného pro měření množství zkoušené látky ve vzorku.
|
|
58.
|
Zbývající voda nad sedimentem se opatrně dekantuje nebo odsaje ze zkušební komory. Vzorky sedimentu se musejí odebrat opatrně, aby byly organismy rušeny co nejméně.
|
|
59.
|
V čase vzorkování se vyjmou všechny organismy ze zkušebních opakovaných pokusů např. tak, že se sediment suspenduje ve vodě nad sedimentem, obsah každého opakování se rozprostře na mělký tác a organismy se vyberou použitím měkké ocelové pinzety. Pak se rychle opláchnou vodou v mělkém skleněném nebo ocelovém tácu. Přebytečná voda se vylije. Organismy se opatrně přenesou do předem zvážené nádoby a zváží se. Potom se usmrtí zmražením (např. ≤ – 18 °C). Zaznamená se přítomnost a počet kokonů anebo mláďat.
|
|
60.
|
Obecně je třeba organismy zvážit a usmrtit okamžitě po vzorkování bez fáze vyprázdnění střev, aby se získala konzervativní hodnota BAF, která zahrnuje kontaminovaný obsah střev, a aby se zabránilo ztrátám tělesných zbytků během jakékoli doby vyprazdňování střev pouze ve vodě (8). U látek s log Kow vyšší než 5 se neočekává, že budou významně vyloučeny během jakékoli doby vyprazdňování střev pouze ve vodě, zatímco u látek s log Kow nižším než 4 se může ztratit významné množství (47).
|
|
61.
|
Během fáze vylučování živočichové vyprazdňují svá střeva do čistého sedimentu. To znamená, že měření bezprostředně před fází vylučování zahrnují kontaminovaný sediment ze střev, zatímco po počátečních 4–24 hodinách fáze vylučování se předpokládá, že se většina kontaminovaného obsahu střev nahradí čistým sedimentem (11)(47). Koncentraci v organismech z tohoto vzorku pak lze považovat za koncentraci tkáně po vyprázdnění střev. Aby se zohlednilo naředění koncentrace zkoušené látky nekontaminovanou půdou v průběhu fáze vylučování, lze odhadnout hmotnost střevního obsahu z poměru hmotnosti organismu ve vlhkém stavu a hmotnosti popela po spálení organismu, případně z poměru suché hmotnosti organismu a hmotnosti popela po spálení organismu.
|
|
62.
|
Jestliže je účelem specifické studie měření biologické dostupnosti a zbytků pravé tkáně ve zkušebních organismech, pak je třeba alespoň dílčí vzorek exponovaných živočichů (např. ze tří dodatečných opakovacích nádob), přednostně odebraný během rovnovážného stavu, zvážit, nechat vyprazdňovat v čisté vodě pro dobu 6 hodin (47) a před analýzou opět zvážit. Údaje o hmotnosti živočichů a koncentraci látky v tělech živočichů v tomto dílčím vzorku lze pak srovnat s hodnotami získanými z nevyprázdněných jedinců. Organismy určené pro měření vylučování by se neměly vyprazdňovat před přenosem do čistého sedimentu, aby se minimalizoval další stres.
|
|
63.
|
Vzorky vody, sedimentu a živočichů se v optimálním případě analyzují okamžitě (tj. během 1–2 dnů) po vyjmutí, aby se zabránilo rozkladu nebo jiným ztrátám a aby se vypočítaly přibližné rychlosti příjmu a vylučování v dalším průběhu zkoušky. Okamžitá analýza rovněž zabrání opožděnému určení okamžiku, kdy bylo dosaženo plató.
|
|
64.
|
Jestliže okamžitou analýzu nelze provést, vzorky je třeba skladovat za vhodných podmínek. Informace o stabilitě a správných podmínkách skladování pro příslušnou zkoušenou látku je třeba získat před zahájením studie (např. trvání a teplota skladování, extrakční postupy atd.). Jestliže takové informace nejsou dostupné a jsou-li považovány za nezbytné, je možné provést souběžný pokus s obohacenými kontrolními tkáněmi pro stanovení stability během skladování.
|
Kvalita analytické metody
|
65.
|
Vzhledem k tomu, že celý postup je určen hlavně vhodností, přesností a citlivostí analytické metody použité pro analýzu zkoušené látky, je třeba experimentálně kontrolovat, zda přesnost a reprodukovatelnost chemické analýzy a rovněž výtěžek zkoušené látky jak z vody, tak ze vzorků živočichů jsou pro danou analytickou metodu dostatečné. Rovněž je třeba kontrolovat, zda se zkoušená chemická látka nevyskytuje v kontrolních komorách v koncentracích vyšších než u pozadí. Jestliže je to nezbytné, provede se korekce hodnot Cw, Cs a Ca na hodnoty výtěžku a pozadí v kontrolních vzorcích. V průběhu zkoušky je třeba se všemi vzorky zacházet tak, aby byla minimalizována kontaminace a ztráta (např. v důsledku adsorpce zkoušené látky na vzorkovacích pomůckách).
|
|
66.
|
Celkový výtěžek a výtěžek zkoušené látky v organismech, sedimentu, vodě a také v lapačích obsahujících absorbenty pro zadržení odpařené zkoušené chemické látky, jsou-li použity, se musí zaznamenat a uvést ve zprávě.
|
|
67.
|
Jelikož se doporučuje používat radioizotopově značené látky, je možné analyzovat celkovou radioaktivitu (tj. mateřské látky a produktů rozkladu). Avšak jestliže je to analyticky proveditelné, může kvantifikace mateřské látky a produktů rozkladu v rovnovážném stavu nebo na konci fáze příjmu poskytnout důležité informace. Jestliže se uvažuje o provedení takových měření, vzorky by pak měly procházet příslušnými extrakčními postupy, aby bylo možné mateřskou látku kvantifikovat samostatně. Tam, kde zaznamenané produkty rozkladu představují významný procentní podíl (např. > 10 %) radioaktivity naměřené ve zkušebních organismech v rovnovážném stavu nebo na konci fáze příjmu, doporučuje se takové produkty rozkladu identifikovat (5).
|
|
68.
|
Vzhledem k nízké individuální biomase často není možné stanovit koncentraci zkoušené látky v každém jednotlivci, pokud není jako zkušební druh použit Branchiura sowerbyi (40–50 mg mokré hmotnosti na jedince) (11). Proto je přijatelné sloučení vzorkovaných jedinců z dané zkušební nádoby; to však omezuje statistické postupy, které lze aplikovat na data. Pokud jsou podstatnými faktory konkrétní statistický postup a síla, pak je třeba zahrnout do zkoušky odpovídající počet zkušebních živočichů anebo paralelních zkušebních komor, aby byl dostatečný prostor pro žádoucí sloučení, postup a sílu.
|
|
69.
|
Doporučuje se, aby BAF byl vyjádřen jako funkce celkové mokré hmotnosti i celkové sušiny, a je-li to požadováno (např. pro vysoce lipofilní látky), jako funkce obsahu lipidů a TOC v sedimentu. Pro stanovení obsahu lipidů by měla být použita vhodná metoda (48)(49). Jako standardní metoda (48) může být doporučena technika extrakce směsí chloroform-metanol (50). Aby se však zabránilo používání chlorovaných rozpouštědel, je možné použít modifikaci metody podle Bligha & Dyera (50) testovanou okružním testem, jak je popsáno v (51). Různé metody neposkytují stejné hodnoty (48), proto je důležité uvést podrobnosti o použité metodě. Je-li to možné, tj. jestliže je k dispozici dostatečné množství tkáně živočichů, změří se obsah lipidů ve stejném vzorku nebo extraktu, jako je ten připravený pro analýzu na zkoušenou látku, neboť lipidy je často třeba odstranit z extraktu před chromatografickou analýzou (5). Je však praktické použít aklimatizované kontrolní živočichy alespoň na začátku nebo – optimálně – na konci fáze příjmu pro měření obsahu lipidů, např. ve třech vzorcích.
|
ÚDAJE A JEJICH PŘEDKLÁDÁNÍ
Zpracování výsledků
|
70.
|
Křivka příjmu zkoušené chemické látky se získá vynesením koncentrace zkoušené látky v organismech nebo na nich během fáze příjmu jako funkce času v aritmetické stupnici. Jestliže křivka dosáhla plató, vypočítá se BAFss v rovnovážném stavu:
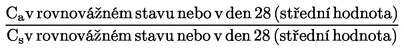
|
|
71.
|
Stanoví se akumulační faktor (BAFK) jako poměr ks/ke. Rychlostní konstanta vylučování (ke) se obvykle stanoví z křivky vylučování (tj. grafu poklesu koncentrace zkoušené chemické látky v organismech v průběhu fáze vylučování). Rychlostní konstanta příjmu ks se pak vypočítá z kinetiky křivky příjmu. Upřednostňovanou metodou získání hodnoty BAFK a rychlostních konstant ks a ke je metoda nelineárního odhadu parametrů s využitím počítače (viz dodatek 2). Není-li zjevně křivka vylučování křivkou prvního řádu, je třeba použít složitější modely (25)(27)(52).
|
|
72.
|
Akumulační faktor bioty sedimentu (BSAF) se stanoví normalizováním BAFK pro obsah lipidů v organismech a obsah celkového organického uhlíku v sedimentu.
|
Interpretace výsledků
|
73.
|
Výsledky by měly být interpretovány opatrně v případě, že se naměřené koncentrace zkoušených roztoků pohybují na úrovních blízkých mezi stanovitelnosti analytické metody.
|
|
74.
|
Jasně definované křivky příjmu a vylučování jsou ukazatelem dobré kvality údajů o bioakumulaci. Obecně by mez spolehlivosti pro BAF hodnoty z dobře navržených studií neměla překročit 25 % (5).
|
Závěrečná zpráva
|
75.
|
Závěrečná zpráva musí obsahovat tyto informace:
|
|
Zkoušená látka
|
—
|
fyzikální povaha a fyzikálně-chemické vlastnosti, např. log Kow, rozpustnost ve vodě,
|
|
—
|
údaje o chemické identifikaci; zdroj zkoušené chemické látky, identita a koncentrace jakéhokoli použitého rozpouštědla,
|
|
—
|
při použití radioizotopového značení přesná poloha značených atomů, specifická radioaktivita a procentní podíl radioaktivity spojené s nečistotami.
|
|
|
|
Zkušební druh
|
—
|
vědecký název, kmen, zdroj, případné předběžná úprava, aklimatizace, věk, rozmezí velikostí atd.
|
|
|
|
Zkušební podmínky
|
—
|
použitý zkušební postup (statický, semistatický nebo průtokový),
|
|
—
|
typ a charakteristiky použitého osvětlení a fotoperioda (fotoperiody),
|
|
—
|
návrh zkoušky (např. počet, materiál a velikost zkušebních komor, objem vody, hmotnost a objem sedimentu, rychlost výměny objemu vody (pro průtočný nebo semistatický postup), jakékoli provzdušňování použité před zkouškou a během ní, počet replik, počet jedinců na repliku, počet zkušebních koncentrací, délka fází příjmu a vylučování, četnost vzorkování),
|
|
—
|
metoda přípravy a aplikace zkoušené látky, důvody pro výběr konkrétní metody,
|
|
—
|
nominální zkušební koncentrace,
|
|
—
|
zdroj složek umělé vody a sedimentu nebo – jsou-li použita přírodní média – původ vody a sedimentu, popis jakékoli předběžné úpravy, výsledky jakéhokoli předvedení schopnosti zkušebních živočichů žít anebo rozmnožovat se v použitém médiu, typické znaky sedimentu (pH a amoniak v kapilární vodě (přírodní sedimenty), obsah organického uhlíku (TOC), rozložení velikosti částic (procentní podíl písku, naplavenin a jílu), procentní podíl vody a jakákoli jiná provedená měření) a typické znaky vody (pH, tvrdost, vodivost, teplota, koncentrace rozpuštěného kyslíku, úrovně zbytkového chlóru (jsou-li měřené) a jakákoli jiná prováděná měření),
|
|
—
|
nominální a měřený obsah sušiny v % mokré hmotnosti (nebo poměr suché k mokré hmotnosti) umělého sedimentu; měření obsahu sušiny v % mokré hmotnosti (nebo poměr suché k mokré hmotnosti) pro terénní sedimenty,
|
|
—
|
kvalita vody ve zkušebních komorách charakterizovaná teplotou, pH, obsahem amoniaku, celkovou tvrdostí a koncentrací rozpuštěného kyslíku,
|
|
—
|
podrobné informace o expozici vzorků půdy a organismů, včetně podrobností o přípravě, uchovávání, postupech obohacování, extrakci a analytických postupech (a přesnosti), pokud jde o zkoušenou látku v organismech a půdě, obsah lipidů (je-li měřen) a výtěžky zkoušené látky.
|
|
|
|
Výsledky
|
—
|
mortalita kontrolních jedinců a jedinců v každé zkušební komoře a jakékoli pozorované subletální vlivy včetně abnormálního chování (např. vyhýbání se sedimentu, přítomnost nebo nepřítomnost vloček výkalů, žádné rozmnožování),
|
|
—
|
měřený obsah sušiny v % mokré hmotnosti (nebo poměr suché k mokré hmotnosti) sedimentu a zkušebních organismů (užitečné pro normalizaci),
|
|
—
|
obsah lipidů v organismech,
|
|
—
|
křivky kinetiky příjmu a vylučování zkoušené chemické látky organismy a doba dosažení rovnovážného stavu,
|
|
—
|
hodnoty Ca, Cs a Cw (popřípadě se směrodatnými odchylkami a rozpětím) pro všechny odběry (hodnota Ca se vyjadřuje v g/kg vlhké a suché hmotnosti celého těla, hodnota Cs se vyjadřuje v g/kg mokré a suché hmotnosti půdy a Cw v mg/l). Pokud je vyžadován akumulační faktor půdní bioty (BSAF; definice viz dodatek 1) (například pro porovnání výsledků dvou nebo více zkoušek provedených s živočichy s odlišným obsahem lipidů), lze navíc vyjádřit i hodnotu Ca jako g/kg obsahu lipidů v organismu a hodnotu Cs jako g/kg organického uhlíku (OC) v půdě,
|
|
—
|
BAF (vyjádřeno v kg mokrého sedimentu na kg mokrých organismů), rychlostní konstanta příjmu sedimentu ks (vyjádřená v g mokrého sedimentu na kg mokrých organismů za den) a rychlostní konstanta vylučování ke (vyjádřená v d– 1); BSAF (vyjádřený v kg sedimentu OC na kg obsahu lipidů v organismech) mohou být zapsány do protokolu dodatečně,
|
|
—
|
nevyloučené zbytky (NER) na konci fáze vylučování,
|
|
—
|
jsou-li měřeny: procentní podíl mateřské látky, produkty rozkladu a vázané zbytky (tj. procento zkoušené chemické látky, které nelze extrahovat běžnými extrakčními metodami) detekované ve zkušebních organismech,
|
|
—
|
metody užívané pro statistické analýzy dat.
|
|
|
|
Vyhodnocení výsledků
|
—
|
soulad výsledků s kritérii platnosti uvedenými v odstavci 21,
|
|
—
|
neočekávané nebo neobvyklé výsledky, např. nekompletní vylučování zkoušené látky ze zkušebních živočichů; v takových případech mohou výsledky z jakékoli předběžné studie poskytnout užitečné informace.
|
|
|
Dodatek 1
Definice a jednotky
|
|
Umělý sediment, nebo připravený, rekonstituovaný či syntetický sediment je směs materiálů použitá k napodobení fyzických složek přírodního sedimentu.
|
|
|
Bioakumulace je nárůst koncentrace zkoušené chemické látky v organismu nebo na něm v porovnání s koncentrací zkoušené chemické látky v okolním médiu. Bioakumulace je výsledkem biokoncentračních a bioobohacovacích procesů (viz níže).
|
|
|
Bioakumulační faktor (BAF) v jakémkoli čase během fáze příjmu při této zkoušce bioakumulace představuje koncentraci zkoušené látky ve zkušebním organismu nebo na něm (Ca v g.kg– 1 mokré nebo suché hmotnosti organismů) dělenou koncentrací látky v okolním médiu (Cs jako g.kg– 1 mokré nebo suché hmotnosti sedimentu). S odkazem na jednotky Ca a Cs má BAF jednotky kg sedimentu kg– 1 organismů (15).
|
|
|
Bioakumulační faktory vypočítané přímo z poměru rychlostní konstanty příjmu sedimentu k rychlostní konstantě vylučování (ks a ke – viz níže) se nazývají kinetické bioakumulační faktory (BAFK).
|
|
|
Biokoncentrace je nárůst koncentrace zkoušené látky v organismu nebo na něm pocházející výhradně z příjmu prostřednictvím tělesného povrchu v porovnání s koncentrací zkoušené látky v okolním médiu.
|
|
|
Bioobohacování je nárůst koncentrace zkoušené chemické látky v organismu nebo na něm, hlavně příjmem kontaminované potravy nebo kořisti, v porovnání s koncentrací zkoušené chemické látky v této potravě nebo kořisti. Bioobohacování může vést k přesunu nebo akumulaci zkoušené látky v potravních řetězcích.
|
|
|
Akumulační faktor půdní bioty (BSAF) je koncentrace zkoušené látky ve zkušebním organismu nebo na něm normalizovaná na lipidy, dělená koncentrací zkoušené látky v půdě v rovnovážném stavu normalizované na organický uhlík. Ca je pak vyjádřena jako g.kg– 1 obsahu lipidů v organismu a Cs jako g.kg– 1 obsahu organického podílu v sedimentu.
|
|
|
Doba kondicionování se používá ke stabilizaci mikrobiální složky sedimentu a k odstranění např. amoniaku vznikajícího ze sedimentových složek; nastává před přidáním zkoušené látky do sedimentu. Voda nad sedimentem se obvykle po kondicionování vylije.
|
|
|
Vylučování zkoušené chemické látky je úbytek této chemické látky z tkáně zkoušeného organismu na základě aktivních nebo pasivních procesů, ke kterému dochází nezávisle na přítomnosti nebo nepřítomnosti zkoušené látky v okolním médiu.
|
|
|
Vylučovací fáze je časový úsek po přemístění zkušebních organismů z kontaminovaného média do média, které zkoušenou látku neobsahuje, během něhož se studuje vylučování chemické látky ze zkušebních organismů (nebo její čistý úbytek v nich).
|
|
|
Rychlostní konstanta vylučování (ke) je číselná hodnota definující rychlost poklesu koncentrace zkoušené látky ve zkoušeném organismu nebo na něm po přemístění zkoušených organismů z média obsahujícího zkoušenou látku do média, které neobsahuje chemickou látku; ke je vyjádřeno jako číselná hodnota za den.
|
|
|
Doba ekvilibrace (dosažení rovnováhy) se používá, aby byla umožněna distribuce zkoušené látky mezi pevnou fázi, kapilární vodu a vodu nad sedimentem; nastává po přidání zkoušené látky do sedimentu a před vložením zkušebních organismů.
|
|
|
Rozdělovací koeficient n-oktanol/voda (Kow) je rovnovážný poměr mezi rozpustností chemické látky v n-oktanolu a ve vodě (někdy se označuje také jako Pow). Logaritmus hodnoty Kow (log Kow) se používá jako ukazatel schopnosti bioakumulace chemické látky ve vodních organismech.
|
|
|
Rozdělovací koeficient organický uhlík/voda (Kou) je rovnovážný poměr mezi koncentrací chemické látky ve/na frakci organického uhlíku v půdě a koncentrace chemické látky ve vodě.
|
|
|
Voda nad sedimentem (překrývající voda) je voda ležící navrchu sedimentu ve zkušební nádobě.
|
|
|
Plató nebo rovnovážný stav je definován jako rovnováha mezi procesem příjmu a vylučování, ke kterým dochází ve fázi expozice současně. Rovnovážného stavu je dosaženo tehdy, je-li při grafickém znázornění křivka časové závislosti BAF rovnoběžná s časovou osou a tři po sobě jdoucí analýzy BAF vzorků odebraných v intervalech alespoň dvou dnů se neliší více než o ± 20 % a není-li mezi těmito třemi dobami odběru žádný statisticky významný rozdíl. V případě zkoušených látek, jejichž příjem probíhá pomalu, jsou vhodnější sedmidenní intervaly (5).
|
|
|
Intersticiální voda nebo kapilární voda je voda zabírající prostor mezi sedimentem a částicemi půdy.
|
|
|
Rychlostní konstanta příjmu ze sedimentu (ks) je číselná hodnota definující rychlost nárůstu koncentrace zkoušené látky ve zkušebních organismech nebo na nich v důsledku příjmu ze sedimentové fáze. ks se vyjadřuje v g sedimentu na kg organismů za den.
|
|
|
Obohacený sediment je sediment, do něhož byla přidána zkoušená látka.
|
|
|
Bioakumulační faktor v rovnovážném stavu (BAFSS) je BAF v rovnovážném stavu, který se po dlouhou dobu výrazně nemění; koncentrace zkoušené látky v okolním médiu (Cs jako g/kg suché hmotnosti půdy) je po tuto dobu konstantní.
|
|
|
Fáze expozice nebo příjmu je časový úsek, během něhož jsou zkoušené organismy vystaveny působení zkoušené chemické látky.
|
Dodatek 2
Výpočet parametrů příjmu a vylučování
Hlavním koncovým bodem (parametrem) bioakumulační zkoušky je bioakumulační faktor BAF. Měřený BAF se může vypočítat jako podíl koncentrace zkoušené látky ve zkušebním organismu Ca a koncentrace zkoušené látky v sedimentu Cs v rovnovážném stavu. Jestliže rovnovážného stavu není dosaženo během fáze příjmu, BAF se vypočítá stejným způsobem pro den 28. Je však třeba zjistit, zda BAF je založen na koncentracích v rovnovážném stavu nebo ne.
Upřednostňovaným způsobem, jak získat kinetický bioakumulační faktor (BAFK), rychlostní konstantu příjmu sedimentu (ks) a rychlostní konstantu vylučování (ke), je použití metod odhadu nelineárních parametrů na počítači. Vzhledem k časové řadě průměrných akumulačních faktorů (Ca, střední hodnoty pro každý den vzorkování /Cs, střední hodnoty pro každý den vzorkování = AF) fáze příjmu na základě mokré hmotnosti organismů a sedimentu a modelové rovnici
|
AF(t) = BAF × (1 – eke × t)
|
[rovnice 1]
|
kde AF(t) je poměr koncentrace zkoušené látky v organismech a její koncentrace v sedimentu v jakémkoli daném časovém bodě (t) fáze příjmu, tyto počítačové programy vypočítají hodnoty pro BAFK, ks a ke.
Když je rovnovážného stavu dosaženo během fáze příjmu (tj. t = ∞), rovnice 1 se může redukovat na:
|
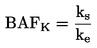
|
[rovnice 2]
|
kde
|
|
ks je rychlostní konstanta příjmu v tkáni [g půdy na kg organismů za den] a
|
|
|
ke je rychlostní konstanta vylučování [1/d],
|
Pak ks/ke × Cs se blíží ke koncentraci zkoušené látky v tkáni organismů v rovnovážném stavu (Ca,ss).
Akumulační faktor půdní bioty (BSAF) lze vypočítat následovně:

kde foc je frakce organického uhlíku v sedimentu a flip je frakce lipidů v organismech, obě vztaženy buď na hmotnost sušiny, nebo na mokrou hmotnost.
Vzhledem k časové řadě hodnot koncentrací může být kinetika vylučování modelována použitím následujících modelových rovnic a metody odhadu nelineárních parametrů na základě počítačového výpočtu.
Střední hodnota měřeného tělesného zbytku na konci fáze příjmu je doporučována jako implicitní počáteční bod. Hodnota modelovaná/odhadnutá z fáze příjmu se použije např. pouze tehdy, jestliže se naměřená hodnota odchyluje významně od modelového tělesného zbytku. Viz rovněž odstavec 50 – alternativní předběžná expozice organismů určených pro vylučování; při tomto přístupu se předpokládá, že vzorky těchto předběžně exponovaných organismů v den 0 fáze vylučování poskytnou realistický tělesný zbytek pro zahájení kinetiky vylučování.
Pokud data vynesená do grafu proti času indikují stálý exponenciální pokles koncentrace zkoušené látky u živočichů, lze použít k popisu časového průběhu vylučování model s jedním oddělením (rovnice 4).
|

|
[rovnice 3]
|
Procesy vylučování se někdy jeví jako dvoufázové, neboť vykazují rychlý pokles Ca během raných fází, který se v pozdějších fázích vylučování změní na pomalejší úbytek zkoušených látek, např. (8)(19)(25). Tyto dvě fáze mohou být interpretovány na základě předpokladu, že v organismu existují dvě různé oddělené části, z nichž dochází k úbytku zkoušené látky odlišnou rychlostí. V těchto případech je nutno studovat specifickou literaturu, např. (15)(16)(17)(25).
Vylučování ze dvou oddílů je popsáno např. následující rovnicí (25):
|

|
[rovnice 4]
|
A a B představují velikost oddílu (v procentním podílu z celkového tkáňového zbytku), kde A je oddíl s rychlou ztrátou látky a B oddíl s pomalou ztrátou zkoušené látky. Součet A + B je roven 100 % celkového objemu živočicha v rovnovážném stavu. ka a kb jsou odpovídající vylučovací konstanty [d– 1]. Jestliže se model se dvěma oddíly proloží daty týkajícími se vylučování, rychlostní konstanta příjmu ks se může stanovit následovně (53) (54):
|

|
[rovnice 5]
|
Nicméně, tyto modelové rovnice by se měly používat s opatrností, zejména když se během zkoušky vyskytnou změny v biologické dostupnosti zkoušené chemické látky (42).
Pomocí výše uvedených modelových rovnic lze také zároveň vypočítat kinetické parametry (ks a ke) uplatněním modelu kinetiky prvního řádu na všechna data z fáze příjmu a z fáze vylučování současně. Popis metody, která by mohla umožnit takový kombinovaný výpočet rychlostních konstant příjmu a vylučování, lze nalézt v odkazech (55)(56)(57).
Nevyloučené zbytky (NER) se vypočítají jako sekundární koncový bod násobením poměru průměrné koncentrace vyjádřené počtem jedinců (Ca) v den 10 fáze vylučování k průměrné koncentraci vyjádřené počtem jedinců (Ca) v rovnovážném stavu (den 28 fáze příjmu) hodnotou 100:

Dodatek 3
Příklad harmonogramu vzorkování pro 28denní zkoušku bioakumulace
a) Fáze příjmu (včetně 4denní fáze ekvilibrace)
|
Den
|
Činnosti
|
|
– 6
|
Příprava suspenze rašeliny pro sediment; kondicionování suspenze po dobu 48 h
|
|
– 4
|
Přidání chemické látky do sedimentu nebo frakce sedimentu; promíchání všech složek sedimentu; odebrání vzorků z exponovaného sedimentu a z kontrolního sedimentu s rozpouštědlem pro stanovení koncentrace zkoušené látky; přidání vody nad sediment; inkubace za zkušebních podmínek (fáze ekvilibrace)
|
|
– 3/– 2
|
Separace zkušebních organismů z kultury pro aklimatizaci
|
|
0
|
Měření kvality vody (viz odstavec 52); vyjmutí opakovaných pokusů pro odebrání vzorků vody a sedimentu ke stanovení koncentrace zkoušené chemické látky; náhodné rozdělení živočichů do zkušebních komor; ponechání dostatečného počtu dílčích vzorků živočichů pro stanovení hodnot analytického pozadí; kontrola přívodu vzduchu, je-li používán uzavřený zkušební systém
|
|
1
|
Vyjmutí paralelních nádob pro vzorkování; kontrola přívodu vzduchu, chování živočichů, kvality vody (viz odstavec 56); odebrání vzorků vody, sedimentu a živočichů pro stanovení koncentrací zkoušené látky
|
|
2
|
Kontrola přívodu vzduchu, zaznamenání chování živočichů a teploty
|
|
3
|
Stejné jako 1. den
|
|
4–6
|
Stejné jako 2. den
|
|
7
|
Stejné jako 1. den, kompenzace odpařené vody, podle potřeby
|
|
8–13
|
Stejné jako 2. den
|
|
14
|
Stejné jako 1. den; kompenzace odpařené vody, podle potřeby
|
|
15–20
|
Stejné jako 2. den
|
|
21
|
Stejné jako 1. den; kompenzace odpařené vody, podle potřeby
|
|
22–27
|
Stejné jako 2. den
|
|
28
|
Stejné jako 1. den; měření kvality vody (viz odstavec 52); konec fáze příjmu; ponechání dostatečného počtu dílčích vzorků živočichů pro stanovení hodnot analytického pozadí, mokré a suché hmotnosti a obsahu lipidů; přenos živočichů ze zbývajících exponovaných opakovaných nádob do nádob obsahujících čistý sediment pro fázi vylučování (žádné vyprazdňování střev); vzorkování vody, sedimentu a organismů z kontrolních pokusů s rozpouštědlem; vzorkování roztoků v lapačích, jsou-li instalovány.
|
|
|
Adaptační činnosti (fáze ustavování rovnováhy) by měly být naplánovány s ohledem na vlastnosti zkoušené chemické látky. Jestliže je to požadováno, kondicionování připraveného sedimentu pod překrývající vodou při 20 ± 2 °C po dobu 7 dní; v tomto případě dřívější příprava sedimentu!
|
|
|
Činnosti popsané pro 2. den by se měly provádět denně (alespoň v pracovní dny)
|
b) Fáze vylučování
|
Den
|
Činnosti
|
|
– 6
|
Příprava suspenze rašeliny pro sediment; kondicionování suspenze po dobu 48 h
|
|
– 4
|
Smíchání všech složek sedimentu; odebrání vzorků exponovaného sedimentu a kontrolního sedimentu s rozpouštědlem pro stanovení koncentrace zkoušené látky; přidání překrývající vody; inkubace za zkušebních podmínek
|
|
0 (den 28 fáze příjmu)
|
Měření kvality vody (viz odstavec 52); přenos živočichů ze zbývajících exponovaných opakování do nádob obsahujících čistý sediment; po 4–6 h vyjmutí opakovaných pokusů pro odebrání vzorků vody, sedimentu a živočichů ke stanovení koncentrace zkoušené chemické látky; náhodné rozdělení živočichů do zkušebních komor
|
|
1
|
Vyjmutí opakovaných nádob pro vzorkování; kontrola přívodu vzduchu, chování živočichů, kvality vody (viz odstavec 52); odebrání vzorků vody, sedimentu a živočichů pro stanovení koncentrace zkoušené látky
|
|
2
|
Kontrola přívodu vzduchu, zaznamenání chování živočichů a teploty
|
|
3
|
Stejné jako 1. den
|
|
4
|
Stejné jako 2. den
|
|
5
|
Stejné jako 1. den
|
|
6
|
Stejné jako 2. den
|
|
7
|
Stejné jako 1. den, kompenzace odpařené vody, podle potřeby
|
|
8–9
|
Stejné jako 2. den
|
|
10
|
Stejné jako 1. den; konec fáze vylučování; měření kvality vody (viz odstavec 52); vzorkování vody, sedimentu a živočichů z kontrolních pokusů s rozpouštědlem; vzorkování roztoků v lapačích, jsou-li instalovány.
|
|
|
Příprava půdy před zahájením fáze vylučování by měla být provedena stejným způsobem jako před fází příjmu.
|
|
|
Činnosti popsané pro 2. den by se měly provádět denně (alespoň v pracovní dny)
|
Dodatek 4
Některé fyzikálně-chemické typické znaky doporučené ředicí vody
|
SLOŽKA
|
KONCENTRACE
|
|
Pevné částice
|
< 20 mg/l
|
|
Celkový obsah organického uhlíku
|
< 2μg/l
|
|
Neionizovaný amoniak
|
< 1 μg/l
|
|
Zbytkový chlor
|
< 10 μg/l
|
|
Celkové organofosforové pesticidy
|
< 50 ng/l
|
|
Celkové organochlorové pesticidy, polychlorované bifenyly
|
< 50 ng/l
|
|
Celkový organický chlor
|
< 25 ng/l
|
SLOŽENÍ DOPORUČENÉ REKONSTITUOVANÉ VODY
|
a)
|
Roztok chloridu vápenatého:
Rozpustí se 11,76 g CaCl2 · 2H2O v deionizované vodě; doplní se do 1 l deionizovanou vodou.
|
|
b)
|
Roztok síranu hořečnatého:
Rozpustí se 4,93 g MgSO4 · 7H2O v deionizované vodě; doplní se do 1 l deionizovanou vodou.
|
|
c)
|
Roztok hydrogenuhličitanu sodného:
Rozpustí se 2,59 g NaHCO3 v deionizované vodě; doplní se do 1 l deionizovanou vodou.
|
|
d)
|
Roztok chloridu draselného:
Rozpustí se 0,23 g KCl v deionizované vodě; doplní se do 1 l deionizovanou vodou.
|
Všechny chemické látky musí být čistoty p. a.
Vodivost destilované nebo deionizované vody nesmí překročit 10 μScm– 1.
25 ml každého z roztoků (a) až (d) se smíchá a celkový objem se doplní do 1 l deionizovanou vodou. Součet obsahu vápenatých a hořečnatých iontů v tomto roztoku je 2,5 mmol/l.
Poměr iontů Ca: Mg je 4: 1 a iontů Na: K je 10: 1; kyselinová (neutralizační) kapacita KS4.3 tohoto roztoku je 0,8 mmol/l.
Vodu nad sedimentem je třeba provzdušňovat, až dosáhne saturace kyslíkem; pak se skladuje přibližně dva dny bez dalšího provzdušňování před použitím.
pH přijatelné zřeďovací vody by mělo být v rozsahu 6–9.
Dodatek 5
Umělý sediment – doporučení pro přípravu a skladování
Na rozdíl od požadavků ve zkušební metodě C.8 (40) se doporučuje obsah rašeliny v umělém sedimentu 2 % namísto 10 % sušiny tak, aby odpovídal nízkému až střednímu obsahu organického podílu v přírodních sedimentech (58).
Procentní podíl suchých složek umělého sedimentu:
|
Složka
|
Vlastnosti
|
% suchého sedimentu
|
|
Rašelina
|
Sfagnová rašelina, stupeň rozkladu: ‚střední‘, na vzduchu sušená, žádné viditelné zbytky rostlin, jemně mletá (velikost částic ≤ 0,5 mm)
|
2 ± 0,5
|
|
Křemenný písek
|
Velikost zrn: ≤ 2 mm, ale > 50 % částic by mělo být v rozpětí 50–200 μm
|
76
|
|
Kaolinitický jíl
|
Obsah kaolinitu ≥ 30 %
|
22 ± 1
|
|
Zdroj potravy
|
Folia urticae, drcené listy Urtica sp. (kopřiva dvoudomá), jemně mleté (velikost částic ≤ 0,5 mm), nebo směs drcených listů Urtica sp. s alfa-celulózou (1: 1); v souladu s lékárnickými normami, pro lidskou výživu; v přídavku do suchého sedimentu
|
0,4–0,5 %
|
|
Uhličitan vápenatý
|
CaCO3, práškový, chemicky čistý, v přídavku do suchého sedimentu
|
0,05–1
|
|
Deionizovaná voda
|
Vodivost ≤ 10 μS/cm, v přídavku do suchého sedimentu
|
30–50
|
Jestliže se očekávají zvýšené koncentrace amoniaku, např. je-li o zkoušené látce známo, že inhibuje nitrifikaci, může být užitečné nahradit 50 % prášku kopřivy bohaté na dusík celulózou (např. práškem α-celulózy, chemicky čisté, velikost částic ≤ 0,5 mm).
Příprava
Rašelina se vysuší na vzduchu a umele na jemný prášek (velikost částic ≤ 0,5 mm, žádné viditelné zbytky rostlin). Suspenze požadovaného množství rašelinového prášku se připraví použitím dílu deionizované vody přidaného k suchému sedimentu (zjistilo se, že objem vody 11,5 × sušina rašeliny je schopný vytvořit míchatelnou rašelinovou kaši (8)) použitím vysoce výkonného homogenizátoru.
pH této suspenze se upraví na 5,5 ± 0,5 pomocí CaCO3. Suspenze se kondicionuje po dobu alespoň dvou dní za mírného míchání při 20 ± 2 °C, pro stabilizaci pH a ustavení stabilního mikrobiálního prostředí. Změří se opět pH a podle potřeby nastaví na 6,0 ± 0,5 pomocí CaCO3. Pak se veškerá suspenze smíchá s ostatními suchými složkami, přičemž se bere v úvahu jakýkoli díl použitý pro obohacení. Zbývající deionizovaná voda se přidá a získá se homogenní sediment. Opět se změří pH a podle potřeby upraví na 6,5 až 7,5 pomocí CaCO3. Jestliže se však očekává vývin amoniaku, může být užitečné udržet pH sedimentu pod 7,0 (např. mezi 6,0 a 6,5). Odeberou se vzorky sedimentu pro stanovení obsahu sušiny a obsahu organického uhlíku. Jestliže se očekává tvorba amoniaku, může se umělý sediment kondicionovat po dobu sedmi dní za stejných podmínek, které budou převládat v následné zkoušce (např. poměr sediment – voda 1: 4, výška vrstvy sedimentu jako ve zkušebních nádobách), před přidáním zkoušené látky, tj. měl by být převrstven provzdušněnou vodou. Na konci doby kondicionování se překrývající voda odebere a vylije. Odeberou se vzorky sedimentu pro stanovení obsahu sušiny a celkového organického uhlíku (např. 3 vzorky).
Potom se obohacený křemenný písek smíchá se sedimentem pro každou úroveň expozice, sediment se rozdělí do zkušebních nádob opakování a přelije se zkušební vodou (např. poměr sediment – voda 1: 4, výška vrstvy sedimentu jako ve zkušebních nádobách). Nádoby se pak inkubují za stejných podmínek, jaké budou převládat v následné zkoušce. V tomto okamžiku začíná doba ekvilibrace. Voda nad sedimentem musí být provzdušněna.
Vybraný zdroj potravy musí být přidán před přidáním zkoušené látky do sedimentu nebo během něj. Může se na začátku smíchat s rašelinovou suspenzí (viz výše). Avšak nadměrný rozklad zdroje potravy před přidáním zkušebních organismů – např. v případě dlouhé ekvilibrace – se může potlačit tak, že doba mezi přidáním potravy a začátkem expozice se co nejvíce zkrátí. Aby se zajistilo, že potrava bude v dostatečném kontaktu se zkoušenou chemickou látkou, měl by se zdroj potravy smíchat se sedimentem nejpozději v den, kdy je zkoušená látka přidána do sedimentu. Výjimkou může být, když délka ekvilibrační doby vede k nadměrnému mikrobiálnímu rozkladu potravy před vložením zkušebních organismů. Vzorky sedimentu se odeberou pro stanovení obsahu sušiny a celkového organického uhlíku (např. 3 vzorky obohaceného nebo kontrolního sedimentu).
Obsah sušiny složek (rašeliny, písku, kaolinu) se zaznamená do protokolu v g a procentním podílu celkové sušiny.
Objem vody, která se má přidat k suchým složkám během přípravy sedimentu, se rovněž uvede v protokolu jako procentní podíl z celkové sušiny (např. 100 % sušiny + 46 % vody znamená, že k 1 000 g sušiny se přidá celkem 460 ml vody, což ve výsledku dá 1 460 g mokrého sedimentu).
Skladování
Suché složky pro přípravu umělého sedimentu lze skladovat na suchém chladném místě při pokojové teplotě. Připravený mokrý sediment lze skladovat (pro další použití pouze v kultuře) při 4 ± 2 °C v temnu pro dobu 2 až 4 týdnů ode dne přípravy (8).
Sediment obohacený zkoušenou látkou by měl být použit ihned, pokud nejsou k dispozici informace o tom, že tento určitý sediment lze skladovat bez vlivu na toxicitu a biologickou dostupnost zkoušené chemické látky. Vzorky obohaceného sedimentu pak mohou být uchovány za podmínek doporučených pro konkrétní zkoušenou látku až do provedení analýzy.
Dodatek 6
Druhy máloštětinatců doporučených pro zkoušení bioakumulace
Tubifex tubifex (MÜLLER), nítěnkovití, máloštětinatci
Nítěnkovití máloštětinatci (nítěnkovití, máloštětinatci) Tubifex tubifex (Müller) žijí ve sladkovodních sedimentech v trubkách potažených slizem. V těchto trubkách přebývají hlavou dolů, pojídají částice sedimentu, přičemž využívají přidružené mikroorganismy a organické zbytky. Zadní část se jim obvykle vlní ve vodě nad sedimentem a zajišťuje dýchání. Ačkoliv tento druh obývá velký rozsah typů sedimentu po celé severní polokouli, Tubifex tubifex preferuje relativně jemné velikosti zrn (59). Vhodnost tohoto druhu pro ekotoxikologické zkoušky je popsána například v (8)(29)(31)(39)(60)(62)(63).
Metody kultivace
Aby bylo možno získat dostatečný počet jedinců Tubifex tubifex pro provedení bioakumulačních zkoušek, je třeba organismy udržovat v permanentní laboratorní kultuře. Pro kulturu T. tubifex je doporučen systém sestávající z umělého sedimentu na základě umělé půdy podle zkušební metody C.8 (40) a rekonstituované vody podle zkušební metody C.1 (8).
Skleněné nebo nerezové nádoby o výšce 12 až 20 cm lze použít jako kultivační nádoby. Do každé kultivační nádoby je vložena vrstva mokrého umělého sedimentu připraveného podle popisu v dodatku 5. Hloubka vrstvy sedimentu by měla umožnit přirozené chování organismů se zavrtáváním (2 cm minimální hloubka pro T. tubifex). Do systému se přidá rekonstituovaná voda. Je třeba dbát na to, aby se minimalizovalo narušení sedimentu. Vodní vrstva se opatrně provzdušňuje (např. 2 bubliny za vteřinu vzduchu filtrovaného přes 0,45 μm) prostřednictvím Pasteurovy pipety umístěné 2 cm nad povrchem sedimentu. Doporučená teplota kultury je 20 ± 2 °C.
Organismy se vloží do kultivačního systému s maximálním počtem 20 000 jedinců/m2 povrchu sedimentu. Vyšší zátěž by mohla způsobit snížení rychlosti růstu a rozmnožování (43).
V kultuře umělého sedimentu je živočichy třeba krmit. Dieta sestávající z jemně namleté rybí potravy, např. TetraMin®, může sloužit jako dodatečná výživa (8); Klerks 1994, osobní sdělení. Rychlosti krmení by měly zajistit dostatečný růst a rozmnožování a udržet vývoj amoniaku a růst hub v kultuře na minimu. Potrava může být podávána dvakrát týdně (např. 0,6–0,8 mg na cm2 povrchu sedimentu). Praktické zkušenosti ukázaly, že aplikace potravy suspendované a homogenizované v deionizované vodě může usnadnit homogenní distribuci potravy na povrchu sedimentu v kultivačních nádobách.
Aby se zabránilo akumulaci amoniaku, musí se voda nad sedimentem vyměňovat za použití průtočného systému nebo alespoň jednou týdně manuálně. Sediment by se měl měnit každé tři měsíce v zásobních kulturách.
Vzorkování živočichů z kultury se může provádět proséváním kultivačního sedimentu přes 1 mm síto, jsou-li požadováni pouze dospělí jedinci. Pro uchování kokonů se používá velikost ok 0,5 mm a pro mláďata 0,25 mm. Síta je možné umístit do rekonstituované vody poté, co skrz ně prošel sediment. Zkušební živočichové opustí pletivo a mohou pak být vybráni z vody použitím měkké ocelové pinzety nebo pipety s hranami vyhlazenými v plamenu.
Pouze neporušené a jasně identifikované vzorky Tubifex tubifex (např. (64)) se použijí pro začátek zkoušky nebo pro nové kultury. Nemocné nebo zraněné jedince, stejně jako kokony zamořené houbovými vlákny je třeba vyhodit.
Synchronizovaná kultura může poskytnout jedince určitého stáří ve vhodných intervalech podle požadavku. Nádoby s novými kulturami jsou připraveny ve zvolených intervalech (např. každé dva týdny), počínaje živočichy určitého stáří (např. kokony). Za kultivačních podmínek zde popsaných organismy dospějí po 8–10 týdnech. Kultury mohou být sklizeny, když dospělci nakladli nové kokony, např. po deseti týdnech. Vzorky dospělců se mohou použít pro zkoušky a s kokony se mohou zahájit nové kultury.
Lumbriculus variegatus (MÜLLER), žížalicovití, máloštětinatci
Lumbriculus variegatus (žížalicovití, máloštětinatci) jsou rovněž obyvateli sladkovodních sedimentů po celém světě a jsou široce použitelní v ekotoxikologických zkouškách. Informace o biologii, kultivačních podmínkách a citlivosti druhu lze získat v (1)(6)(9)(36). Lumbriculus variegatus může být rovněž kultivován v umělém sedimentu doporučeném pro T. tubifex podle (8) v rámci určitých omezení. Jelikož L. variegatus preferuje v přírodě hrubší sedimenty než T. tubifex (59), laboratorní kultury s umělým sedimentem použité pro T. tubifex mohou zaniknout po 4 až 6 měsících. Praktické zkušenosti ukázaly, že L. variegatus se dá držet v písečném substrátu (např. křemenný písek, jemný štěrk) v průtočném systému za použití rybí potravy jako nutričního zdroje po řadu let bez obnovování substrátu. Hlavní výhodou L. variegatus oproti jiným vodním druhům máloštětinatců je jeho rychlé rozmnožování s následným rychlým nárůstem biomasy u laboratorně kultivovaných populací (1)(6)(9)(10).
Metody kultivace
Kultivační podmínky pro Lumbriculus variegatus jsou podrobně uvedeny ve Phipps a kol. (1993) (10), Brunson a kol. (1998) (28), ASTM (2000) (1), U.S. EPA (2000) (6). Krátký souhrn těchto podmínek je uveden dále.
Živočichy lze kultivovat ve velkých akváriích (57–80 l) při 23 °C s fotoperiodou 16 h světlo: 8 h tma (100–1 000 lux) použitím denně vyměňované přírodní vody (45–50 l na akvárium). Substrát se připraví tak, že se nařežou ručníky z neběleného hnědého papíru na proužky, které se pak mohou míchat s kultivační vodou po dobu několika vteřin, čímž se získá papírový substrát s malými kousky. Tento substrát pak lze přímo použít v akváriu s kulturou Lumbriculus pokrytím plochy dna nádrže nebo je lze skladovat zmražené v deionizované vodě pro pozdější použití. Nový substrát v nádrži obecně vydrží po dobu přibližně dvou měsíců.
Každá kultura živočichů je zahájena s 500–1 000 jedinci krmenými 10 ml suspenze obsahující 6 g krmiva pro mladé lososovité ryby 3krát týdně za obnovovacích podmínek nebo podmínek průtokové kultivace. V případě statických nebo semistatických kultur se aplikují nižší rychlosti krmení, aby se zabránilo růstu bakterií a hub. Potravu a papírový substrát je třeba analyzovat na látky používané v bioakumulačních zkouškách.
Za těchto podmínek se počet jedinců v kultuře obecně zdvojnásobí během přibližně 10 až 14 dnů.
Lumbriculus variegatus se může vyjmout z kultur, např. přenesením substrátu pomocí sítě s jemnými oky nebo organismů použitím skleněné pipety s širokým ústím protaženým plamenem (přibližně 5 mm v průměru) do samostatné kádinky. Jestliže je substrát rovněž přemístěn do této kádinky, ponechá se kádinka obsahující organismy a substrát přes noc za podmínek průtokové kultivace, čímž se z kádinky vyplaví substrát, zatímco organismy zůstanou na dně nádoby. Pak je možné je vložit do nově připravených kultivačních nádrží nebo je dále zpracovat pro zkoušku, jak je ukázáno v (1) a (6). Při zacházení s těmito jedinci je třeba zabránit zranění nebo oddělení části těla, např. použitím pipet s hranami protaženými plamenem nebo pinzet z nerezové oceli.
Problémem, na který je třeba kriticky pohlížet při použití druhu L. variegatus ve zkouškách bioakumulace sedimentů, je jeho způsob rozmnožování (architomie následovaná morfalaxí). Tato nepohlavní rozmnožování vyústí ve dva fragmenty, které nepřijímají potravu po určitou dobu, než zregeneruje hlavová nebo ocasní část (např. (36)(37)). To znamená, že u L. variegatus nemusí docházet k příjmu sedimentu a příměsí prostřednictvím pojídání průběžně jako u nítěnkovitých, kteří se nerozmnožují dělením.
Proto je třeba provést synchronizaci, aby se minimalizovalo nekontrolované rozmnožování a regenerace a následné velké odchylky ve výsledcích zkoušky. Takové odchylky mohou nastat, když někteří jedinci, kteří se rozdělili, a proto po určitou dobu nepřijímají potravu, jsou méně vystaveni zkoušené chemické látce než jiní jedinci, kteří se nedělí během zkoušky, např. (38). 10 až 14 dní před začátkem expozice by organismy měly být rozděleny (synchronizace) (65). Použijí se velcí jedinci, kteří přednostně nevykazují známky nedávného dělení. Tito jedinci mohou být umístěni na skleněnou plošku do kapky kultivační vody a rozříznuti v oblasti středu těla pomocí skalpelu. Je třeba dbát na to, aby zadní konce byly podobně veliké. Zadní konce se pak ponechají, aby regenerovaly nové hlavy v kultivační nádobě obsahující stejný substrát, jaký je použitý v kultuře a rekonstituované vodě až do začátku expozice. Regenerace nových hlav je indikována, když se synchronizovaní jedinci zavrtávají do substrátu (přítomnost regenerovaných hlav může být potvrzena pozorováním reprezentativních dílčích vzorků pod binokulárním mikroskopem). Očekává se, že zkušební organismy budou poté v podobném fyziologickém stavu. To znamená, že když k regeneraci morfalaxí dojde u synchronizovaných jedinců během zkoušky, předpokládá se, že v podstatě všichni živočichové budou stejně vystaveni obohacenému sedimentu. Krmení synchronizovaných jedinců je třeba provádět, jakmile se začnou zavrtávat do substrátu, nebo 7 dní po disekci. Krmný režim by měl být srovnatelný se standardními kulturami; dá se však doporučit, aby synchronizovaní jedinci byli krmeni ze stejného zdroje potravy, jaký bude použit při zkoušce. Živočichy je třeba držet při zkušební teplotě při 20 ± 2 °C. Po regeneraci se neporušení kompletní jedinci podobné velikosti, kteří aktivně plavou nebo se plazí při jemném mechanickém podnětu, použijí pro zkoušku. Při zacházení s těmito jedinci je třeba zabránit jejich poranění nebo autotomii, např. použitím pipet s hranami protaženými plamenem nebo pinzet z nerezové oceli.
Při použití Lumbriculus variegatus ve zkoušce by vzhledem ke specifickému způsobu rozmnožování tohoto druhu mělo během zkoušky dojít k nárůstu počtu jedinců, jsou-li příslušné podmínky (6). Absence rozmnožování při bioakumulační zkoušce s L. variegatus se musí zaznamenat a vzít v úvahu při interpretaci výsledků zkoušky.
Branchiura sowerbyi (BEDDARD), nítěnkovití, máloštětinatci (není validována okružním testem)
Branchiura sowerbyi obývají rozličné typy sedimentů v nádržích, jezerech, rybnících a řekách, původně v tropických oblastech. Lze se s nimi rovněž setkat v teplých vodních plochách severní polokoule. Jsou však početnější v bahnitojílovitých sedimentech s vysokým obsahem organické hmoty. Kromě toho tyto organismy žijí ve vrstvě sedimentu. Dokonce i jejich zadní konec je obvykle zavrtán. Tento druh se dá snadno identifikovat podle žábrových vláken na jejich zadní části. Dospělí jedinci mohou dosáhnout délky 9–11 cm a mokré hmotnosti 40–50 mg. Branchiura sowerbyi mají vysokou rychlost rozmnožování, vykazují časy zdvojnásobení populace kratší než 2 týdny a za podmínek teploty a krmení popsaných níže (Aston a kol., 1982, (65)). Druh B. sowerbyi byl použit jak ve studiích toxicity, tak bioakumulace (Marchese & Brinkhurst 1996, (31) Roghair a kol. 1996, (67)).
Metody kultivace
Souhrn kultivačních podmínek pro Branchiura sowerbyi je uveden níže (poskytnuto Mercedes R. Marchese, INALI, Argentina, a Carla J. Roghair, RIVM, Nizozemsko).
Není požadována žádná jednotlivá technika kultivace zkušebních organismů. Organismy je možné kultivovat použitím nekontaminovaného přírodního sedimentu (31). Praktické zkušenosti ukázaly, že médium sestávající z přírodního sedimentu a písku zlepšuje stav organismů ve srovnání s čistým přírodním sedimentem (32)(67). Pro kultivaci je možné použít 3 l kádinky obsahující 1 500 ml média sediment/voda, sestávající z 375 ml přírodního nekontaminovaného sedimentu (přibližně 10 % celkového organického uhlíku; přibližně 17 % částic ≤ 63 μm), 375 ml čistého písku (M32) a 750 ml rekonstituované nebo dechlorované vodovodní vody (31)(32)(67). Jako substrát pro kultivaci se rovněž dají použít papírové ručníky, ale růst populace je nižší než v přírodním sedimentu. V semistatických systémech se vodní vrstva v kádince pomalu provzdušňuje a překrývající vodu je třeba obnovovat každý týden.
Každá kádinka obsahuje pro začátek 25 mladých jedinců. Po dvou měsících se velcí jedinci vyjmou ze sedimentu pomocí pinzety a vloží do nové kádinky s čerstvě připraveným médiem sediment/voda. Stará kádinka rovněž obsahuje kokony a mladé jedince. Tímto způsobem lze získat až 400 mladých jedinců na kádinku. Dospělci se dají použít pro rozmnožování po dobu alespoň jednoho roku.
Kultury je třeba uchovávat při teplotě 21 až 25 °C. Výchylky teploty by se měly udržovat pod ± 2 °C. Čas potřebný pro vývoj embryí z vajíček nakladených dokud mláďata neopustí kokony, je přibližně tři týdny při 25 oC. Bylo zjištěno, že produkce vajíček získaných na přeživšího dospělce v B. sowerbyi je v rozmezí od 6,36 (31) do 11,2 (30) v bahně při 25 °C. Počet vajíček na kokon je v rozmezí od 1,8 do 2,8 (66)(69) nebo až do 8 (68).
Každý týden se musí měřit rozpuštěný kyslík, tvrdost vody, teplota a pH. Rybí potrava (např. TetraMin®) se může podávat jako suspenze dvakrát nebo třikrát týdně ad libitum. Živočichové mohou být rovněž krmeni rozmraženým hlávkovým salátem dle libosti.
Hlavní výhodou tohoto druhu je vysoká individuální biomasa (až 40–50 mg mokré hmotnosti na jedince). Proto se tento druh dá použít pro zkoušení bioakumulace radioizotopově neznačených zkoušených látek. Může být exponován v systémech používaných pro T. tubifex nebo L. variegatus s jedním jedincem na opakování (11). Počet opakování však musí potom být zvýšeno, pokud se nepoužijí větší zkušební komory (11). Pro tento druh je rovněž třeba nastavit kritérium platnosti ve vztahu k chování se zavrtáváním.
LITERATURA
|
1)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
2)
|
European Commission (EC) (2003). Technical Guidance Document on Risk Assessment in support of Commission Directive 93/67/EEC on Risk Assessment for new notified substances, Commission Regulation (EC) No 1488/94 on Risk Assessment for existing substances and Directive 98/8/EC of the European Parliament and of the Council concerning the placing of biocidal products on the market; Part I – IV. Office for Official Publications of the European Communities, Luxembourg.
|
|
3)
|
OECD (1992a). Report of the OECD workshop on effects assessment of chemicals in sediment. OECD Monographs No. 60. Organisation for Economic Co-operation and Development (OECD), Paris.
|
|
4)
|
Ingersoll, C.G., Ankley, G.T., Benoit D.A., Brunson, E.L., Burton, G.A., Dwyer, F.J., Hoke, R.A., Landrum, P. F., Norberg-King, T. J. and Winger, P.V. (1995). Toxicity and bioaccumulation of sediment-associated contaminants using freshwater invertebrates: A review of methods and applications. Environ. Toxicol. Chem. 14, 1885-1894.
|
|
5)
|
Kapitola C.13 této přílohy, Bioakumulace: Průtoková zkouška na rybách.
|
|
6)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
7)
|
Kapitola C.27 této přílohy, Test toxicity na Chironomidae v systému sediment-voda za použití obohaceného sedimentu
|
|
8)
|
Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G. & Nagel, R. (1997). Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere 35, 835-852.
|
|
9)
|
Ingersoll, C.G., Brunson, E.L., Wang N., Dwyer, F.J., Ankley, G.T., Mount D.R., Huckins J., Petty. J. and Landrum, P. F. (2003). Uptake and depuration of nonionic organic contaminants from sediment by the oligochaete, Lumbriculus variegatus. Environmental Toxicology and Chemistry 22, 872-885.
|
|
10)
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. and Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269-279.
|
|
11)
|
Egeler, Ph., Römbke, J., Knacker, Th., Franke, C. & Studinger, G. (1999). Workshop on ‚Bioaccumulation: Sediment test using benthic oligochaetes‘, 26.-27.04.1999, Hochheim/Main, Germany. Report on the R+D-project No. 298 67 419, Umweltbundesamt, Berlin.
|
|
12)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2006). Validation of a sediment bioaccumulation test with endobenthic aquatic oligochaetes by an international ring test. Report to the Federal Environmental Agency (Umweltbundesamt Dessau), R&D No.: 202 67 437.
|
|
13)
|
Kelly, J.R., Levine, S.N., Buttel, L.A., Kelly, A.C., Rudnick, D.T. & Morton, R.D. (1990). Effects of tributyltin within a Thalassia seagrass ecosystem. Estuaries 13, 301-310.
|
|
14)
|
Nendza, M. (1991). QSARs of bioaccumulation: Validity assessment of log Kow/log BCF correlations. In: R. Nagel and R. Loskill (eds.): Bioaccumulation in aquatic systems. Contributions to the assessment. Proceedings of an international workshop, Berlin 1990. VCH, Weinheim
|
|
15)
|
Landrum, P.F., Lee II, H., & Lydy, M.J. (1992). Toxicokinetics in aquatic systems: Model comparisons and use in hazard assessment. Environ. Toxicol. Chem. 11, 1709-1725.
|
|
16)
|
Markwell, R.D., Connell, D.W. & Gabric, A.J. (1989). Bioaccumulation of lipophilic compounds from sediments by oligochaetes. Wat. Res. 23, 1443-1450.
|
|
17)
|
Gabric, A.J., Connell, D.W. & Bell, P.R.F. (1990). A kinetic model for bioconcentration of lipophilic compounds by oligochaetes. Wat. Res. 24, 1225-1231.
|
|
18)
|
Kukkonen, J. and Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457-1468.
|
|
19)
|
Franke, C., Studinger, G., Berger, G., Böhling, S., Bruckmann, U., Cohors-Fresenborg, D. and Jöhncke, U. (1994). The assessment of bioaccumulation. Chemosphere 29, 1501-1514.
|
|
20)
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
21)
|
U.S. EPA (1996). Special Considerations for Conducting Aquatic Laboratory Studies. Ecological Effects Test Guidelines. OPPTS 850.1000. Public Draft. EPA 712-C-96-113. U.S. Environmental Protection Agency.
|
|
22)
|
Následující kapitoly této přílohy:
|
|
Kapitola A.5, Povrchové napětí
|
|
|
Kapitola A.6, Rozpustnost ve vodě
|
|
|
Kapitola A.8, Rozdělovací koeficient, metoda třepací láhve
|
|
|
Kapitola A.24, Rozdělovací koeficient, metoda vysokoúčinné kapalinové chromatografie
|
|
|
Kapitola C.7, Rozklad — Abiotický rozklad – hydrolýza jako funkce pH
|
|
|
Kapitola C.4 A–F Stanovení snadné biologické rozložitelnosti
|
|
|
Kapitola C.19, Odhad adsorpčního koeficientu (KOU ) pro půdy a čistírenské kaly pomocí vysokoúčinné kapalinové chromatografie (HPLC)
|
|
|
Kapitola C.29, Hodnocení snadné biologické rozložitelnosti – uvolňování CO2 v těsně uzavřených lahvičkách
|
|
|
23)
|
OECD (1996). Direct phototransformation of chemicals in water. Environmental Health and Safety Guidance Document Series on Testing and Assessment of Chemicals No. 3. OECD, Paris.
|
|
24)
|
Antoine, M.D., Dewanathan, S. & Patonay, G. (1991). Determination of critical micelles concentration of surfactants using a near-infrared hydrophobicity probe. Microchem. J. 43, 165-172.
|
|
25)
|
Beek, B., S. Boehling, U. Bruckmann, C. Franke, U. Joehncke & G. Studinger (2000). The assessment of bioaccumulation. In Hutzinger, O. (editor), The Handbook of Environmental Chemistry, Vol. 2 Part J (Vol. editor: B. Beek): Bioaccumulation – New Aspects and Developments. Springer-Verlag Berlin Heidelberg: 235-276.
|
|
26)
|
Spacie, A. & Hamelink, J.L. (1982). Alternative models for describing the bioconcentration of organics in fish. Environ. Toxicol. Chem. 1, 309-320.
|
|
27)
|
Hawker, D.W. & Connell, D.W. (1988). Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Res. 22, 701-707.
|
|
28)
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191-201.
|
|
29)
|
Reynoldson, T.B., Thompson, S.P. and Bamsey, J.L. (1991). A sediment bioassay using the tubificid oligochaete worm Tubifex tubifex. Environ. Toxicol. Chem. 10, 1061-1072.
|
|
30)
|
Aston, R.J. & Milner, A.G.P. (1981). Conditions for the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) in activated sludge. Aquaculture 26, 155-160.
|
|
31)
|
Marchese, M.R. & Brinkhurst, R.O. (1996). A comparison of two tubificid species as candidates for sublethal bioassay tests relevant to subtropical and tropical regions. Hydrobiologia 334, 163-168.
|
|
32)
|
Roghair, C.J. & Buijze, A. (1994). Development of sediment toxicity tests. IV. A bioassay to determine the toxicity of field sediments to the oligochaete worm Branchiura sowerbyi. RIVM Report 719102027.
|
|
33)
|
Kapitola C.1 této přílohy, Akutní toxicita pro ryby.
|
|
34)
|
OECD (1992c). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Paris.
|
|
35)
|
Kaster, J.L., Klump, J.V., Meyer, J., Krezoski, J. & Smith, M.E. (1984). Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia 11, 181-184.
|
|
36)
|
Leppänen, M.T. & Kukkonen, J.V.K. 1998: Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183-194.
|
|
37)
|
Leppänen, M.T. & Kukkonen, J.V.K. 1998: Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196-2202.
|
|
38)
|
Leppänen M.T. & Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503-1508.
|
|
39)
|
Martinez-Madrid, M., Rodriguez, P., Perez-Iglesias, J.I. & Navarro, E. (1999). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology 8, 111-124.
|
|
40)
|
Kapitola C.8 této přílohy, Toxicita pro žížaly.
|
|
41)
|
Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
|
|
42)
|
Landrum, P.F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Toxicol. 23, 588-595.
|
|
43)
|
Poddubnaya, T.L. (1980). Life cycles of mass species of Tubificidae (Oligochaeta). In: R.O. Brinkhurst and D.G. Cook (eds.): Aquatic Oligochaeta Biology, 175-184. Plenum Press, New York.
|
|
44)
|
ASTM (1998). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing. American Society for Testing and Materials, E 1391-94.
|
|
45)
|
Hooftman, R.N., van de Guchte, K. & Roghair, C.J. (1993). Development of ecotoxicological test systems to assess contaminated sediments. Joint report no. 1: Acute and (sub)chronic tests with the model compound chlorpyrifos. RIVM-719102022.
|
|
46)
|
Franke, C. (1996). How meaningful is the bioconcentration factor for risk assessment?. Chemosphere 32, 1897-1905.
|
|
47)
|
Mount, D.R., Dawson, T.D. & Burkhard, L.P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Environ. Toxicol. Chem. 18, 1244-1249.
|
|
48)
|
Randall, R.C., Lee II, H., Ozretich, R.J., Lake, J.L. & Pruell, R.J. (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Environ.Toxicol. Chem. 10, 1431-1436.
|
|
49)
|
Gardner, W.S., Frez, W.A., Cichocki, E.A. & Parrish, C.C. (1985). Micromethods for lipids in aquatic invertebrates. Limnology and Oceanography, 30, 1099-1105.
|
|
50)
|
Bligh, E.G. & Dyer, W.J. (1959). A rapid method of total lipid extraction and purification. Can. J. Biochem. Physiol. 37, 911-917.
|
|
51)
|
De Boer, J., Smedes, F., Wells, D. & Allan, A. (1999). Report on the QUASH interlaboratory study on the determination of total-lipid in fish and shellfish. Round 1 SBT-2. Exercise 1000. EU, Standards, Measurement and Testing Programme.
|
|
52)
|
Kristensen, P. (1991). Bioconcentration in fish: comparison of bioconcentration factors derived from OECD and ASTM testing methods; influence of particulate matter to the bioavailability of chemicals. Water Quality Institute, Denmark.
|
|
53)
|
Zok, S., Görge, G., Kalsch, W. & Nagel, R. (1991). Bioconcentration, metabolism and toxicity of substituted anilines in the zebrafish (Brachydanio rerio). Sci. Total Environment 109/110, 411-421
|
|
54)
|
Nagel, R. (1988). Umweltchemikalien und Fische – Beiträge zu einer Bewertung. Habilitationsschrift, Johannes Gutenberg-Universität Mainz, Germany.
|
|
55)
|
Janssen, M.P.M., A Bruins, T.H. De Vries & Van Straalen, N.M. (1991). Comparison of cadmium kinetics in four soil arthropod species. Arch. Environ. Contam. Toxicol. 20: 305-312.
|
|
56)
|
Van Brummelen, T.C. & Van Straalen, N.M. (1996). Uptake and elimination of benzo(a)pyrene in the terrestrial isopod Porcellio scaber. Arch. Environ. Contam. Toxicol. 31: 277-285.
|
|
57)
|
Sterenborg, I., Vork, N.A., Verkade, S.K., Van Gestel, C.A.M. & Van Straalen, N.M. (2003). Dietary zinc reduces uptake but not metallothionein binding and elimination of cadmium in the springtail Orchesella cincta. Environ. Toxicol. Chemistry 22: 1167-1171.
|
|
58)
|
Suedel, B.C. and Rodgers, J.H. (1993). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13, 1163-1175.
|
|
59)
|
Wachs, B. (1967). Die Oligochaeten-Fauna der Fließgewässer unter besonderer Berücksichtigung der Beziehung zwischen der Tubificiden-Besiedlung und dem Substrat. Arch. Hydr. 63, 310-386.
|
|
60)
|
Oliver, B. G. (1987). Biouptake of chlorinated hydrocarbons from laboratory-spiked and field sediments by oligochaete worms. Environ. Sci. Technol. 21, 785-790.
|
|
61)
|
Chapman, P.M., Farrell, M.A. & Brinkhurst, R.O. (1982a). Relative tolerances of selected aquatic oligochaetes to individual pollutants and environmental factors. Aquatic Toxicology 2, 47-67.
|
|
62)
|
Chapman, P.M., Farrell, M.A. & Brinkhurst, R.O. (1982b). Relative tolerances of selected aquatic oligochaetes to combinations of pollutants and environmental factors. Aquatic Toxicology 2, 69-78.
|
|
63)
|
Rodriguez, P. & Reynoldson, T.B. (1999). Laboratory methods and criteria for sediment bioassessment. In: A. Mudroch, J.M. Azcue & P. Mudroch (eds.): Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
|
|
64)
|
Brinkhurst, R.O. (1971). A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. No. 22.
|
|
65)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
|
|
66)
|
Aston, R.J., Sadler, K. & Milner, A.G.P. (1982). The effect of temperature on the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) on activated sludge. Aquaculture 29, 137-145.
|
|
67)
|
Roghair, C.J., Buijze, A., Huys, M.P.A., Wolters-Balk, M.A.H., Yedema, E.S.E. & Hermens, J.L.M. (1996). Toxicity and toxicokinetics for benthic organisms; II: QSAR for base-line toxicity to the midge Chironomus riparius and the tubificid oligochaete worm Branchiura sowerbyi. RIVM Report 719101026.
|
|
68)
|
Aston, R.J. (1984). The culture of Branchiura sowerbyi (Tubificidae, Oligochaeta) using cellulose substrate. Aquaculture 40, 89-94.
|
|
69)
|
Bonacina, C., Pasteris, A., Bonomi, G. & Marzuoli, D. (1994). Quantitative observations on the population ecology of Branchiura sowerbyi (Oligochaeta, Tubificidae). Hydrobiologia, 278, 267-274
|
“ |