
2005R2074 — CS — 03.06.2016 — 010.001
Tento dokument slouží výhradně k informačním účelům a nemá žádný právní účinek. Orgány a instituce Evropské unie nenesou za jeho obsah žádnou odpovědnost. Závazná znění příslušných právních předpisů, včetně jejich právních východisek a odůvodnění, jsou zveřejněna v Úředním věstníku Evropské unie a jsou k dispozici v databázi EUR-Lex. Tato úřední znění jsou přímo dostupná přes odkazy uvedené v tomto dokumentu
|
NAŘÍZENÍ KOMISE (ES) č. 2074/2005 ze dne 5. prosince 2005, kterým se stanoví prováděcí opatření pro některé výrobky podle nařízení Evropského parlamentu a Rady (ES) č. 853/2004 a pro organizaci úředních kontrol podle nařízení Evropského parlamentu a Rady (ES) č. 854/2004 a (ES) č. 882/2004, kterým se stanoví odchylka od nařízení Evropského parlamentu a Rady (ES) č. 852/2004 a kterým se mění nařízení (ES) č. 853/2004 a (ES) č. 854/2004 (Úř. věst. L 338 22.12.2005, s. 27) |
Ve znění:
|
|
|
Úřední věstník |
||
|
Č. |
Strana |
Datum |
||
|
L 320 |
13 |
18.11.2006 |
||
|
L 281 |
12 |
25.10.2007 |
||
|
L 277 |
18 |
18.10.2008 |
||
|
L 337 |
31 |
16.12.2008 |
||
|
L 6 |
3 |
11.1.2011 |
||
|
PROVÁDĚCÍ NAŘÍZENÍ KOMISE (EU) č. 809/2011 ze dne 11. srpna 2011, |
L 207 |
1 |
12.8.2011 |
|
|
PROVÁDĚCÍ NAŘÍZENÍ KOMISE (EU) č. 1012/2012 ze dne 5. listopadu 2012, |
L 306 |
1 |
6.11.2012 |
|
|
L 69 |
95 |
8.3.2014 |
||
|
PROVÁDĚCÍ NAŘÍZENÍ KOMISE (EU) 2015/2295 ze dne 9. prosince 2015, |
L 324 |
5 |
10.12.2015 |
|
|
PROVÁDĚCÍ NAŘÍZENÍ KOMISE (EU) 2016/759 ze dne 28. dubna 2016, |
L 126 |
13 |
14.5.2016 |
|
Opraveno:
NAŘÍZENÍ KOMISE (ES) č. 2074/2005
ze dne 5. prosince 2005,
kterým se stanoví prováděcí opatření pro některé výrobky podle nařízení Evropského parlamentu a Rady (ES) č. 853/2004 a pro organizaci úředních kontrol podle nařízení Evropského parlamentu a Rady (ES) č. 854/2004 a (ES) č. 882/2004, kterým se stanoví odchylka od nařízení Evropského parlamentu a Rady (ES) č. 852/2004 a kterým se mění nařízení (ES) č. 853/2004 a (ES) č. 854/2004
(Text s významem pro EHP)
Článek 1
Požadavky na informace o potravinovém řetězci pro účely nařízení (ES) č. 853/2004 a (ES) č. 854/2004
Požadavky na informace o potravinovém řetězci uvedené v příloze II oddílu III nařízení (ES) č. 853/2004 a příloze I oddílu I kapitole II části A nařízení (ES) č. 854/2004 jsou stanoveny v příloze I tohoto nařízení.
Článek 2
Požadavky na produkty rybolovu pro účely nařízení (ES) č. 853/2004 a (ES) č. 854/2004
Požadavky na produkty rybolovu uvedené v čl. 11 odst. 9 nařízení (ES) č. 853/2004 a čl. 18 odst. 14 a 15 nařízení (ES) č. 854/2004 jsou stanoveny v příloze II tohoto nařízení.
Článek 3
Uznané zkušební metody pro mořské biotoxiny pro účely nařízení (ES) č. 853/2004 a 854/2004
Uznané zkušební metody pro mořské biotoxiny uvedené v čl. 11 odst. 4 nařízení (ES) č. 853/2004 a čl. 18 odst. 13 písm. a) nařízení (ES) č. 854/2004 jsou stanoveny v příloze III tohoto nařízení.
Článek 4
Obsah vápníku u mechanicky oddělovaného masa pro účely nařízení (ES) č. 853/2004
Obsah vápníku u mechanicky oddělovaného masa ve smyslu čl. 11 odst. 4 nařízení (ES) č. 853/2004 je stanoven v příloze IV tohoto nařízení.
Článek 5
Seznamy zařízení pro účely nařízení (ES) č. 882/2004
Požadavky na seznamy zařízení uvedené v čl. 31 odst. 2 písm. f) nařízení (ES) č. 882/2004 jsou stanoveny v příloze V tohoto nařízení.
Článek 6
Vzory veterinárních osvědčení a dokladů pro dovoz některých produktů živočišného původu pro účely nařízení (ES) č. 853/2004 a č. 854/2004
1. Vzory veterinárních osvědčení a dokladů uvedené v čl. 6 odst. 1 písm. d) nařízení (ES) č. 853/2004, které mají být použity při dovozu produktů živočišného původu uvedených v příloze VI tohoto nařízení, jsou stanoveny v uvedené příloze.
2. Vzor dokladu, který má podepisovat kapitán a který může nahradit doklad požadovaný podle článku 14 nařízení (ES) č. 854/2004, pokud jsou produkty rybolovu dováženy přímo z mrazírenského plavidla, jak je stanoveno v čl. 15 odst. 3 uvedeného nařízení, je uveden v příloze VI tohoto nařízení.
Článek 6a
Testovací metody pro syrové mléko a tepelně ošetřené mléko
Analytické metody stanovené v příloze VIa tohoto nařízení použijí příslušné orgány, popřípadě provozovatelé potravinářských podniků ke kontrole dodržování limitů stanovených v příloze III oddílu IX kapitole I části III nařízení (ES) č. 853/2004 a k zajištění řádného použití procesu pasterizace mléčných výrobků podle přílohy III oddílu IX kapitoly II části II uvedeného nařízení.
Článek 6b
Požadavky na úřední kontroly prohlídky masa pro účely nařízení (ES) č. 854/2004
Požadavky na úřední kontroly prohlídky masa jsou stanoveny v příloze VIb.
Článek 7
Odchylka od nařízení (ES) č. 852/2004 pro potraviny s tradičními vlastnostmi
1. Pro účely tohoto nařízení se „potravinami s tradičními vlastnostmi“ rozumějí potraviny, které jsou v členském státě, v němž se tradičně vyrábějí:
a) historicky uznávány jako tradiční výrobky, nebo
b) vyráběny v souladu s kodifikovanými nebo registrovanými technickými popisy tradičního postupu nebo v souladu s tradičními výrobními postupy, nebo
c) chráněny vnitrostátními, regionálními nebo místními právními předpisy nebo předpisy Společenství jako tradiční potravinářské výrobky.
2. Členské státy mohou zařízením vyrábějícím potraviny s tradičními vlastnostmi udělovat jednotlivé nebo obecné odchylky od požadavků stanovených:
a) v příloze II kapitole II bodu 1 nařízení (ES) č. 852/2004, pokud jde o prostory, v nichž jsou tyto produkty vystaveny prostředí potřebnému k vyvinutí části jejich vlastností. Tyto prostory mohou zejména obsahovat stěny, stropy a dveře, které nejsou hladké, neprodyšné, nepohlcující nebo z nerezového materiálu, jakož i přirozené geologické stěny, stropy a podlahy;
b) v příloze II kapitole II bodu 1 písm. f) a kapitole V bodu 1 nařízení (ES) č. 852/2004, pokud jde o druh materiálu, z nichž jsou vyráběny nástroje a zařízení výhradně používané k přípravě, prvnímu balení a dalšímu balení těchto výrobků.
Opatření pro úklid a dezinfekci prostor uvedených v písmenu a) a frekvence jejich provádění se přizpůsobí činnosti tak, aby byla zohledněna jejich specifická okolní flóra.
Nástroje a zařízení uvedené v písmenu b) se vždy uchovávají v uspokojivém hygienickém stavu a pravidelně se čistí a dezinfikují.
3. Členské státy udělující výjimky ve smyslu odstavce 2 oznámí jednotlivé nebo obecné výjimky do 12 měsíců od jejich udělení Komisi a ostatním členským států. Každé oznámení:
a) obsahuje stručný popis požadavků, které byly přizpůsobeny;
b) popisuje dotyčné potraviny a podniky a
c) obsahuje veškeré další příslušné informace.
Článek 8
Změny nařízení (ES) č. 853/2004
Přílohy II a III nařízení (ES) č. 853/2004 se mění v souladu s přílohou VII tohoto nařízení.
Článek 9
Změny nařízení (ES) č. 854/2004
Přílohy I, II a III nařízení (ES) č. 854/2004 se mění v souladu s přílohou VIII tohoto nařízení.
Článek 10
Vstup v platnost a použitelnost
Toto nařízení vstupuje v platnost dvacátým dnem po vyhlášení v Úředním věstníku Evropské unie.
Použije se ode dne 1. ledna 2006 s výjimkou přílohy V kapitol II a III, jež se použijí ode dne 1. ledna 2007.
Toto nařízení je závazné v celém rozsahu a přímo použitelné ve všech členských státech.
PŘÍLOHA I
INFORMACE O POTRAVINOVÉM ŘETĚZCI
ODDÍL I
POVINNOSTI PROVOZOVATELŮ POTRAVINÁŘSKÝCH PODNIKŮ
Provozovatelé potravinářských podniků chovající zvířata odesílaná na porážku zajistí, aby informace o potravinovém řetězci uvedené v nařízení (ES) č. 853/2004 byly případně zahrnuty v dokumentaci o odesílaných zvířatech ve snaze zpřístupnit tyto informace provozovatelům příslušných jatek.
ODDÍL II
POVINNOSTI PŘÍSLUŠNÝCH ORGÁNŮ
KAPITOLA I
OSKYTOVÁNÍ INFORMACÍ O POTRAVINOVÉM ŘETĚZCI
1. Příslušný orgán v místě odeslání informuje provozovatele odesílajícího potravinářského podniku, jaké minimální informace o potravinovém řetězci mají být předány jatkám v souladu s přílohou II oddílem III nařízení (ES) č. 853/2004.
2.
Příslušný orgán v místě porážky ověřuje:
a) zda jsou mezi provozovatelem potravinářského podniku, který choval nebo držel zvířata před jejich odesláním, a provozovatelem jatek souvisle a účinně předávány informace o potravinovém řetězci;
b) zda jsou informace o potravinovém řetězci platné a spolehlivé;
c) zda je podniku poskytována případná zpětná vazba v podobě příslušných informací.
3. Jsou-li zvířata odesílána na porážku do jiného členského státu, příslušné orgány v místě odeslání spolupracují s orgány v místě porážky tak, aby provozovateli jatek zajistily snadný přístup k informacím, jenž mu poskytne provozovatel odesílajícího potravinářského podniku.
KAPITOLA II
POSKYTOVÁNÍ ZPĚTNÉ VAZBY PODNIKU PŮVODU
1. Úřední veterinární lékař může pro příslušné výsledky prohlídky, které musejí být v souladu s přílohou I oddílem II kapitolou I nařízení (ES) č. 854/2004 sděleny podniku, v němž byla zvířata chována před porážkou ve stejném členském státě, použít vzor dokumentu podle dodatku I.
2. V případech, kdy jsou zvířata chována v podniku v jiném členském státě, odpovídá příslušný orgán za sdělení příslušných výsledků prohlídky a je povinen použít vzor dokumentu podle dodatku jak ve znění v jazyce odesílající země, tak i ve znění v jazyce země příjemce.
Dodatek k příloze I
VZOR DOKUMENTU
|
1. |
Identifikační údaje |
||
|
|
1.1 |
Podnik původu (např. majitel nebo správce) |
|
|
|
|
jméno/číslo |
|
|
|
|
úplná adresa |
|
|
|
|
telefonní číslo |
|
|
|
1.2 |
Identifikační čísla (připojit zvláštní seznam) |
|
|
|
|
celkový počet zvířat (podle druhů) |
|
|
|
|
překážky při identifikace (jsou-li nějaké) |
|
|
|
1.3 |
Identifikace stáda/hejna/klece (provádí-li se) |
|
|
|
1.4 |
Druhy zvířat |
|
|
|
1.5 |
Referenční číslo veterinárního osvědčení |
|
|
2. |
Nálezy prohlídky před porážkou (ante-mortem) |
||
|
|
2.1 |
Dobré životní podmínky zvířat |
|
|
|
|
počet postižených zvířat |
|
|
|
|
typ/třída/stáří |
|
|
|
|
zjištění (např. pokousání ocasu) |
|
|
|
2.2 |
Zvířata byla dodána špinavá |
|
|
|
2.3 |
Klinický nález (choroba) |
|
|
|
|
počet postižených zvířat |
|
|
|
|
typ/třída/stáří |
|
|
|
|
zjištění |
|
|
|
|
datum prohlídky |
|
|
|
2.4. |
Laboratorní výsledky () |
|
|
3. |
Nález prohlídky po porážce (post-mortem) |
||
|
|
3.1 |
(Makroskopický) nález |
|
|
|
|
počet postižených zvířat |
|
|
|
|
typ/třída/stáří |
|
|
|
|
postižený orgán nebo část zvířete/zvířat |
|
|
|
|
datum porážky |
|
|
|
3.2 |
Choroba (lze zapsat kódem () |
|
|
|
|
počet postižených zvířat |
|
|
|
|
typ/třída/stáří |
|
|
|
|
postižený orgán nebo část zvířete/zvířat |
|
|
|
|
jatečně upravené tělo určené k částečnému nebo úplnému zničení (uveďte důvod) |
|
|
|
|
datum porážky |
|
|
|
3.3 |
Laboratorní výsledky () |
|
|
|
3.4 |
Jiné příčiny (např. paraziti, cizorodé předměty atd.) |
|
|
|
3.5 |
Nález týkající se životních podmínek (např. zlomené nohy) |
|
|
4. |
Doplňující údaje |
||
|
5. |
Kontaktní údaje |
||
|
|
5.1 |
Jatka (číslo schválení) |
|
|
|
|
název |
|
|
|
|
úplná adresa |
|
|
|
|
telefonní číslo |
|
|
|
5.2 |
Elektronická adresa (existuje-li) |
|
|
6. |
Úřední veterinární lékař (otisknout jméno) |
||
|
|
|
podpis a razítko |
|
|
7. |
Datum |
||
|
8. |
Počet stran příloh k tomuto formuláři |
||
|
(1) Mikrobiologické, chemické, sérologické atd. (v příloze uveďte výsledky). (2) Příslušné orgány mohou zavést tyto kódy: Kód A pro choroby na seznamu Mezinárodního úřadu pro nákazy zvířat (OIE); kódy B100 a B200 pro záležitosti týkající se dobrých životních podmínek zvířat (příloha I oddíl I kapitola II část C nařízení (ES) č. 854/2004) a C100 až C290 pro rozhodnutí týkající se masa (příloha I oddíl II kapitola V bod 1 písm. a) až u) nařízení (ES) č. 854/2004). Kódovací systém může v případě potřeby obsahovat další členění (např. C141 pro obecnou mírnou formu choroby, C142 pro těžší formu choroby apod.). Používají-li se kódy, musejí být snadno dostupné pro provozovatele potravinářských podniků společně s vhodným vysvětlením jejich smyslu. (3) Mikrobiologické, chemické, sérologické atd. (v příloze uveďte výsledky). |
|||
PŘÍLOHA II
PRODUKTY RYBOLOVU
ODDÍL I
POVINNOSTI PROVOZOVATELŮ POTRAVINÁŘSKÝCH PODNIKŮ
Tento oddíl stanoví podrobná pravidla pro vizuální kontroly, jejichž účelem je zjistit parazity v produktech rybolovu.
KAPITOLA I
DEFINICE
1. „Viditelným parazitem“ se rozumí parazit nebo skupina parazitů o rozměrech, barvě nebo struktuře jasně rozeznatelné od rybí tkáně.
2. „Vizuální kontrolou“ se rozumí nedestruktivní zkoumání ryb nebo produktů rybolovu prováděné se zvětšovacími optickými prostředky nebo bez nich a za dobrých světelných podmínek pro lidské vidění, včetně, je-li to nutné, prosvícením.
3. „Prosvícením“ se, pokud jde o ploché ryby nebo rybí filety, rozumí držení ryby proti světlu v zatemněné místnosti za účelem zjištění parazitů.
KAPITOLA II
VIZUÁLNÍ KONTROLA
1. Vizuální kontrola musí být prováděna na reprezentativním počtu vzorků. Osoby odpovědné za zařízení na pevnině a kvalifikované osoby na výrobních plavidlech musejí určit, v závislosti na povaze produktů rybolovu, jejich zeměpisném původu a použití, rozsah a frekvenci kontrol. Při produkci musí být kvalifikovanými osobami provedena u kuchaných ryb vizuální kontrola břišní dutiny, jater a mlíčí určených k lidské spotřebě. V závislosti na použitém způsobu kuchání musí být vizuální kontrola provedena:
a) v případě ručního kuchání, průběžně pracovníkem při kuchání a propírání;
b) v případě strojového kuchání, odebráním reprezentativního počtu vzorků o alespoň deseti kusech ryb na partii.
2. Vizuální kontrolu rybích filetů nebo rybích plátků musejí provádět kvalifikované osoby během očišťování po filetování nebo plátkování. Není-li možné jednotlivé zkoumání z důvodu velikosti filetů nebo filetovacích úkonů, musí být vypracován plán odběru vzorků, který je přístupný příslušnému úřadu podle přílohy III oddílu VIII kapitoly II bodu 4 nařízení (ES) č. 853/2004. Je-li z technického hlediska možné provádět prosvícení filetů, musí být prosvícení zahrnuto do plánu odběru vzorků.
ODDÍL II
POVINNOSTI PŘÍSLUŠNÝCH ORGÁNŮ
KAPITOLA I
MEZNÍ HODNOTY CELKOVÉ TĚKAVÉ DUSÍKATÉ BÁZE (ABVT) PRO NĚKTERÉ KATEGORIE PRODUKTŮ RYBOLOVU A POUŽITELNÉ METODY ANALÝZY
1. Nezpracované produkty rybolovu se považují za nevhodné k lidské spotřebě, pokud organoleptické hodnocení vyvolalo pochybnosti o jejich čerstvosti a chemická kontrola zjistila překročení těchto mezních hodnot ABVT:
a) 25 mg dusíku/100 g masa pro druhy uvedené v kapitole II bodě 1;
b) 30 mg dusíku/100 g masa pro druhy uvedené v kapitole II bodě 2;
c) 35 mg dusíku/100 g masa pro druhy uvedené v kapitole II bodě 3;
d) 60 mg dusíku/100 g celých produktů rybolovu přímo použitých k přípravě rybího tuku určeného k lidské spotřebě, jak je uvedeno v příloze III oddílu VIII kapitole IV části B bodě 1 druhém pododstavci nařízení (ES) č. 853/2004; pokud však surovina splňuje ustanovení části B bodu 1 písm. a), b) a c) uvedené kapitoly, mohou členské státy do doby, než se přijmou zvláštní právní předpisy Společenství, stanovit u některých druhů vyšší mezní hodnoty.
Referenční metoda použitelná ke kontrole mezních hodnot ABVT je metoda destilace extraktu denaturovaného kyselinou chloristou podle kapitoly III.
2. Destilace podle bodu 1 se musí provést za použití přístroje, který odpovídá obrázku v kapitole IV.
3. Běžné metody použitelné ke kontrole mezních hodnot ABVT, jsou tyto:
— metoda mikrodifuze, kterou popsal Conway a Byrne (1933),
— metoda přímé destilace, kterou popsal Antonacopoulos (1968),
— destilace extraktu denaturovaného kyselinou trichloroctovou (Codex Alimentarius – Výbor pro ryby a produkty rybolovu (1968).
4. Vzorek musí sestávat přibližně ze 100 g masa odebraného nejméně ze tří různých míst a smíchaného semletím.
Členské státy doporučí úředním laboratořím, aby běžně používaly výše uvedenou referenční metodu. V případě pochybných výsledků nebo v případě sporu o výsledky analýzy provedené jednou z běžných metod lze k ověření výsledků použít pouze referenční metodu.
KAPITOLA II
KATEGORIE DRUHŮ, PRO KTERÉ JE STANOVENA MEZNÍ HODNOTA ABVT
1. Sebastes spp., Helicolenus dactylopterus, Sebastichthys capensis.
2. Druhy čeledi Pleuronectidae (s výjimkou platýze: Hippoglossus spp.).
3. Salmo salar, druhy čeledi Merlucciidae, druhy čeledi Gadidae.
KAPITOLA III
STANOVENÍ KONCENTRACE ABVT V RYBÁCH A PRODUKTECH RYBOLOVU
Referenční postup
1. Účel a oblast působnosti
Tato metoda popisuje referenční postup pro zjištění koncentrace ABVT v rybách a produktech rybolovu. Tento postup lze použít u koncentrací ABVT o hodnotě 5 mg/100 g až do nejméně 100 mg/100 g.
2. Definice
„Koncentrací ABVT“ se rozumí obsah dusíku těkavých dusíkatých bází určený popsaným postupem.
Koncentrace se vyjadřuje v mg/100 g.
3. Stručný popis
Těkavé dusíkaté báze se extrahují ze vzorku roztokem 0,6 mol/l kyseliny chloristé. Po alkalizaci je extrakt podroben parní destilaci a těkavé báze se jímají kyselým jímačem. Koncentrace ABVT se stanoví titrací najímané báze.
4. Chemikálie
Není-li stanoveno jinak, použijí se chemické látky na úrovni činidel. Použitá voda musí být buď destilovaná, nebo demineralizovaná a přinejmenším stejné čistoty. Není-li stanoveno jinak, rozumí se „roztokem“ vodní roztok následujícího složení:
a) roztok kyseliny chloristé = 6 g/100 ml;
b) roztok hydroxidu sodného = 20 g/100 ml;
c) standardní roztok kyseliny chlorovodíkové 0,05 mol/l (0,05 N).
|
Poznámka: |
Při použití automatického destilačního zařízení se musí titrace provádět standardním roztokem kyseliny chlorovodíkové 0,01 mol/l (0,01 N). |
d) roztok kyseliny borité = 3 g/100 ml;
e) silikonové činidlo zabraňující pěnění;
f) fenolftaleinový roztok = 1 g/100 ml 95 % ethanolu;
g) indikační roztok (směsný indikátor Tashiro) 2 g methyl-červeně a 1 g methylen modři se rozpustí v 1 000 ml 95 % ethanolu.
5. Přístroje a příslušenství
a) Mlýnek na maso k přípravě dostatečně homogenního mletého masa;
b) vysokorychlostní mixér s otáčkami mezi 8 000 a 45 000 min-1;
c) rýhovaný filtr o průměru 150 mm, rychle filtrující;
d) pipeta 5 ml dělená po 0,01 ml;
e) přístroj pro destilaci vodní parou. Přístroj musí být schopen regulovat různá množství vodní páry a produkovat stálé množství vodní páry po danou dobu. Musí zajistit, aby při přidávání alkalizujících látek nemohly unikat vznikající volné báze.
6. Provedení
Upozornění: Při práci s kyselinou chloristou, která je silně žíravá, se musí postupovat opatrně a musí přijata preventivní opatření. Vzorky musí být, pokud možno, připraveny co nejdříve po jejich doručení a při dodržení těchto pokynů:
a) :
Vzorek k analýze se pečlivě umele na masovém strojku podle bodu 5 písm. a). Přesně 10 g ± 0,1 g mletého vzorku se zváží ve vhodné nádobce, smísí s 90,0 ml roztoku kyseliny chloristé podle bodu 4 písm. a), homogenizuje 2 minuty v mixéru podle bodu 5 písm. b) a pak filtruje.
Takto získaný extrakt je možné uchovávat nejméně sedm dní při teplotě mezi přibližně 2 oC a 6 oC.
b) :
50,0 ml extraktu získaného podle písm. a) se vloží do přístroje pro destilaci vodní parou podle bodu 5 písm. e). Pro pozdější kontrolu dostatečné alkalizace extraktu se přidá několik kapek fenolftaleinu podle bodu 4 písm. f). Po přidání několika kapek silikonového činidla proti pěnění se k extraktu přidá 6,5 ml roztoku hydroxidu sodného podle bodu 4 písm. b) a okamžitě se zahájí destilace vodní parou.
Destilace vodní parou se řídí tak, aby bylo za 10 minut vytvořeno 100 ml destilátu. Destilační odtoková trubice je ponořena do jímače se 100 ml roztoku kyseliny borité podle bodu 4 písm. d), kam se přidá tři až pět kapek indikačního roztoku podle bodu 4 písm. g). Přesně po 10 minutách se destilace ukončí. Destilační odtoková trubice se odstraní z jímače a omyje vodou. Těkavé báze obsažené v jímavém roztoku se určí titrací standardním roztokem kyseliny chlorovodíkové podle bodu 4 písm. c).
Hodnota pH konečného bodu má být 5,0 ± 0,1 .
c)
Vyžaduje se dvojitá analýza. Použitá metoda je správná, pokud rozdíl mezi výsledky nepřesahuje 2 mg/100 g.
d) :
Slepý pokus se provádí podle písmene b). Místo extraktu se použije 50,0 ml roztoku kyseliny chloristé podle bodu 4 písm. a).
7. Výpočet ABVT
Titrací získaného roztoku kyselinou chlorovodíkovou podle bodu 4 písm. c) se koncentrace ABVT vypočítá podle této rovnice:

V1 = objem 0,01 M roztoku kyseliny chlorovodíkové v ml na vzorek
V0 = objem 0,01 M roztoku kyseliny chlorovodíkové v ml na slepý pokus
M = hmotnost vzorku v g.
Poznámky:
1. Vyžaduje se dvojitá analýza. Použitá metoda je správná, pokud rozdíl mezi výsledky nepřesahuje 2 mg/100 g.
2. Kontrola zařízení destilací roztoků NH4Cl rovnocenných 50 mg ABVT/100 g.
3. Standardní odchylka reprodukovatelnosti Sr = 1,20 mg/100 g. Standardní odchylka srovnatelnosti SR = 2,50 mg/100 g.
KAPITOLA IV
PŘÍSTROJ NA DESTILACI ABVT VODNÍ PAROU
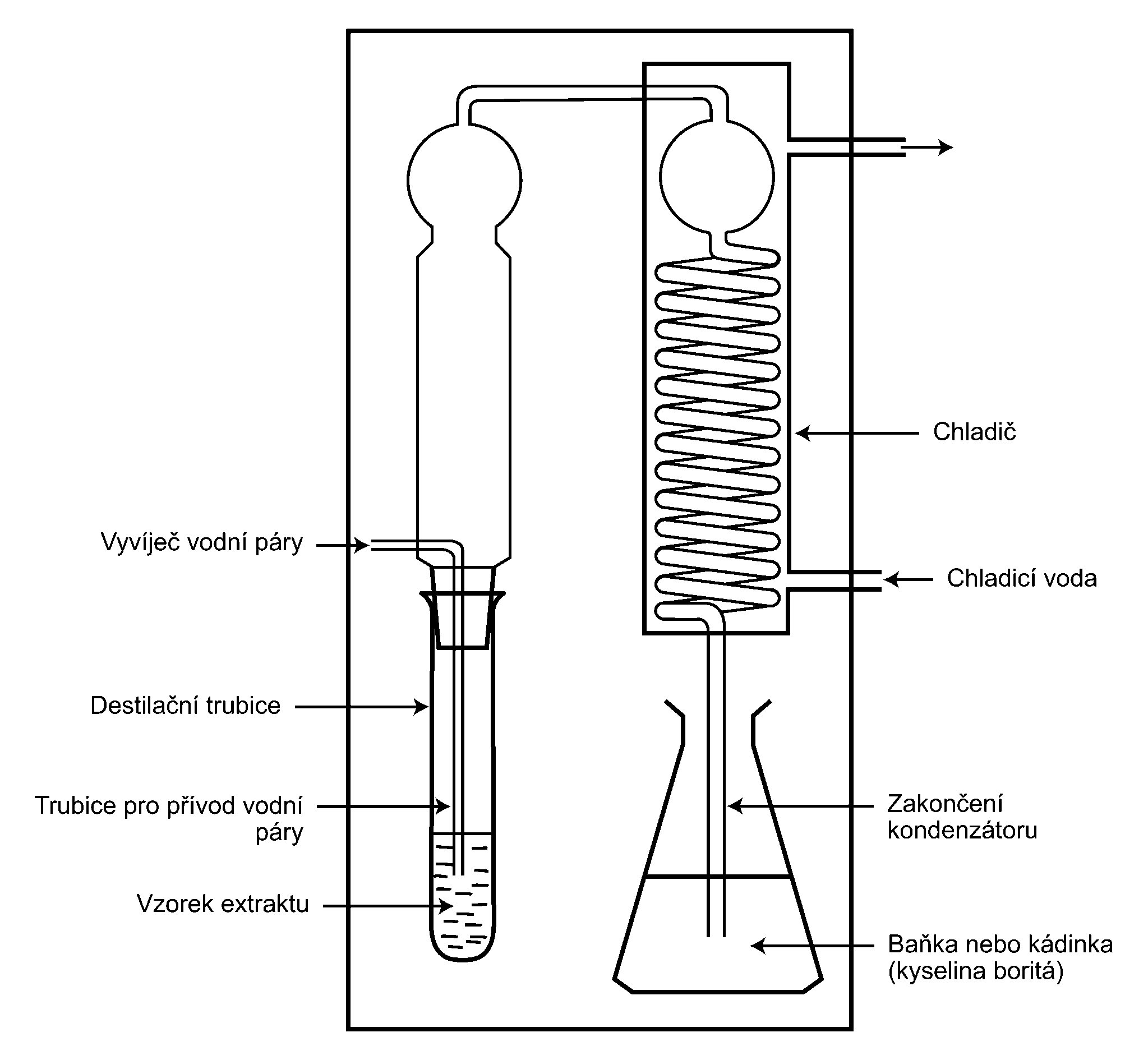
PŘÍLOHA III
UZNANÉ VYŠETŘOVACÍ METODY ZJIŠŤOVÁNÍ MOŘSKÝCH BIOTOXINŮ
Příslušné orgány, a je-li to vhodné i provozovatelé potravinářských podniků, použijí následující analytické metody pro kontrolu dodržování omezení stanovených v příloze III oddílu VII kapitole V bodu 2 nařízení (ES) č. 853/2004.
V souladu s čl. 7 odst. 2 a 3 směrnice Rady 86/609/EHS ( 8 ) musejí být při biologických metodách zohledněny prvky nahrazení, zlepšení a snížení.
KAPITOLA I
METODA ZJIŠŤOVÁNÍ PARALYTICKÉHO TOXINU (PSP = PARALYTIC SHELLFISH POISON)
1. Obsah paralytického toxinu (PSP) v jedlých částech mlžů (celé tělo nebo jednotlivé jedlé části těl mlžů) musí být zjištěn v souladu s biologickou vyšetřovací metodou nebo jakoukoli jinou mezinárodně uznanou metodou. Jako alternativní metodu zjišťování uvedených toxinů lze rovněž použít tzv. Lawrencovu metodu, jež byla zveřejněna v AOAC Official Method 2005.06 („Paralytic Shellfish Poisoning Toxins in Shellfish“ – Paralytické toxiny v mlžích).
2. Jsou-li výsledky zpochybněny, referenční metodou je biologická metoda.
3. Body 1 a 2 se přehodnotí na základě úspěšného dokončení harmonizace prováděcích kroků Lawrencovy metody referenční laboratoří Společenství pro mořské biotoxiny.
KAPITOLA II
METODA ZJIŠŤOVÁNÍ TOXINU „AMNESIC SHELLFISH POISON“ (ASP)
Celkový obsah toxinu „Amnesic Shellfish Poison“ (ASP) v jedlých částech mlžů (celé tělo nebo jednotlivé jedlé části mlžů) musí být zjištěn použitím metody vysokoúčinné kapalinové chromatografie (HPLC) nebo jakékoli jiné mezinárodně uznané metody.
Pro účely screeningu lze však na stanovení celkového obsahu toxinu „Amnesic Shellfish Poison“ (ASP) v jedlých částech mlžů použít také metodu 2006.02 ASP ELISA zveřejněnou v AOAC Journal v červnu 2006.
V případě sporných výsledků je za referenční metodu považována metoda HPLC.
KAPITOLA III
METODY ZJIŠŤOVÁNÍ LIPOFILNÍHO TOXINU
A. Chemické metody
1) Metoda LC-MS/MS referenční laboratoře Evropské unie je referenční metodou pro zjišťování mořských toxinů, jak jsou uvedeny v příloze III oddíle VII kapitole V odst. 2 písm. c), d) a e) nařízení (ES) č. 853/2004. Touto metodou se zjistí alespoň následující sloučeniny:
|
— |
toxiny ze skupiny kyseliny okadaové : OA, DTX1, DTX2, DTX3, včetně jejich esterů, |
|
— |
toxiny ze skupiny pektenotoxinů : PTX1 a PTX2, |
|
— |
toxiny ze skupiny yessotoxinů : YTX, 45 OH YTX, homo YTX a 45 OH homo YTX, |
|
— |
toxiny ze skupiny kyselin azaspirových : AZA1, AZA2 a AZA3. |
2) Celková ekvivalentní toxicita se vypočítá pomocí faktorů toxického ekvivalentu (TEF) podle doporučení EFSA.
3) Jestliže se objeví nová analoga, která mají význam pro veřejné zdraví, měla by být zahrnuta do analýzy. Celková ekvivalentní toxicita se vypočítá pomocí faktorů toxického ekvivalentu (TEF) podle doporučení EFSA.
4) Jiné metody, jako je metoda kapalinová chromatografie (LC) – hmotnostní spektrometrie (MS), vysokoúčinná kapalinová chromatografie (HPLC) s vhodnou detekcí, imunologické a funkční zkoušky, jako je zkouška inhibice fosfatázy, mohou být použity jako alternativní nebo doplňkové metody k metodě LC-MS/MS referenční laboratoře Evropské unie za předpokladu, že:
a) buď samostatně nebo kombinovaně je možné těmito metodami zjistit alespoň ta analoga, která jsou identifikována v bodě A.1 této kapitoly; v případě potřeby se vymezí vhodnější kritéria;
b) splňují kritéria účinnosti metod stanovená referenční laboratoří Evropské unie. Takové metody by měly být validovány v rámci laboratoře a úspěšně vyzkoušeny v rámci uznaného systému zkoušek účinnosti. Referenční laboratoř Evropské unie podpoří činnosti zaměřené na mezilaboratorní validaci techniky s cílem umožnit formální normalizaci;
c) jejich provádění poskytuje rovnocennou úroveň ochrany veřejného zdraví.
B. Biologické metody
1) Aby členské státy mohly přizpůsobit své metody metodě LC-MS/MS, jak je definována v bodě A.1 této kapitoly, mohou ke zjišťování mořských toxinů uvedených v příloze III oddílu VII kapitole V bodě 2 písm. c), d) a e) nařízení (ES) č. 853/2004 až do 31. prosince 2014 nadále používat řadu postupů biologických zkoušek na myších, která se liší v testovací části (hepatopankreas nebo celé tělo) a v roztocích použitých při extrakci a purifikaci.
2) Citlivost a selektivita závisí na výběru rozpouštědel použitých k extrakci a purifikaci, což by se mělo zohlednit při rozhodování o metodě, která se má použít, aby se pokryla celá škála toxinů.
3) Jediná biologická zkouška na myších zahrnující extrakci acetonem může být použita ke zjištění kyseliny okadaové, dinofysistoxinů, kyselin azaspirových, pektenotoxinů a yessotoxinů. Tato zkouška může být v případě potřeby doplněna fázemi oddělování tekutiny/tekutiny s ethylacetátem/vodou nebo dichlormetanem/vodou, aby se odstranily případné interference.
4) Pro každou zkoušku se použijí tři myši. Smrt dvou ze tří myší do 24 hodin po naočkování extraktu, který je rovnocenný 5 g hepatopankreasu nebo 25 g celého těla, by se měla považovat za pozitivní výsledek na přítomnost jednoho nebo více toxinů podle přílohy III oddílu VII kapitoly V bodě 2 písm. c), d) a e) nařízení (ES) č. 853/2004 v koncentracích přesahujících stanovené hodnoty.
5) Biologická zkouška na myších s extrakcí acetonem následovaná oddělením tekutiny/tekutiny diethyletherem může být použita ke zjištění kyseliny okadaové, dinofysistoxinů, pektenotoxinů a kyselin azaspirových, ale nemůže být použita ke zjištění yessotoxinů vzhledem k tomu, že ve fázi oddělování mohou nastat ztráty těchto toxinů. Pro každou zkoušku se použijí tři myši. Smrt dvou ze tří myší do 24 hodin po naočkování extraktu, který je rovnocenný 5 g hepatopankreasu nebo 25 g celého těla, by se měla považovat za pozitivní výsledek na přítomnost kyseliny okadaové, dinofysistoxinů, pektenotoxinů a kyselin azaspirových v hodnotách, které přesahují hodnoty stanovené v příloze III oddílu VII kapitole V bodě 2 písm. c) a e) nařízení (ES) č. 853/2004.
6) Biologická zkouška na krysách může být použita ke zjištění kyseliny okadaové, dinofysistoxinů a kyselin azaspirových. Pro každou zkoušku se použijí tři krysy. Průjmová reakce u kterékoli ze tří krys se považuje za pozitivní výsledek na přítomnost kyseliny okadaové, dinofysistoxinů a kyselin azaspirových v hodnotách, které přesahují hodnoty stanovené v příloze III oddílu VII kapitole V bodě 2 písm. c) a e) nařízení (ES) č. 853/2004.
|
C. |
Po uplynutí období stanoveného v bodě B.1 této kapitoly se biologická zkouška na myších bude používat pouze během pravidelného monitorování produkčních oblastí a sádkovacích oblastí zaměřeného na zjištění nových nebo neznámých mořských toxinů na základě vnitrostátních programů kontroly vypracovaných členskými státy. |
PŘÍLOHA IV
OBSAH VÁPNÍKU V MECHANICKY ODDĚLOVANÉM MASE
Obsah vápníku v MOM podle nařízení (ES) č. 853/2004:
1. nepřesáhne 0,1 % (= 100 mg/100 g nebo 1 000 ppm) v čerstvém produktu;
2. se stanoví mezinárodně standardizovanou metodou.
PŘÍLOHA V
Seznamy schválených zařízení
KAPITOLA I
PŘÍSTUP K SEZNAMŮM SCHVÁLENÝCH ZAŘÍZENÍ
Ve snaze pomáhat členským státům při sestavování aktuálních seznamů schválených potravinářských zařízení dostupných jiným členským státům a veřejnosti Komise provozuje internetovou stránku, na kterou každý členský stát umístí odkaz na své vnitrostátní internetové stránky nebo na níž poskytne informace, pokud jsou tyto seznamy zveřejňovány prostřednictvím systému TRACES.
KAPITOLA II
FORMÁT PRO VNITROSTÁTNÍ INTERNETOVÉ STRÁNKY
A. Přehled seznamů
1. Každý členský stát poskytne Komise adresu odkazu na jednu vnitrostátní internetovou stránku, která obsahuje přehled seznamů schválených potravinářských zařízení pro produkty živočišného původu ve smyslu přílohy I bodu 8.1 nařízení (ES) č. 853/2004.
2. Přehled seznamů uvedený v bodu 1 sestává z jedné stránky a sestavuje se v jednom nebo více úředních jazycích Unie.
B. Pracovní schéma
1. Internetovou stránku, která obsahuje přehled seznamů, spravuje příslušný orgán, popřípadě jeden z příslušných orgánů uvedených v článku 4 nařízení (ES) č. 882/2004.
2. Přehled seznamů obsahuje odkazy na:
a) jiné stránky umístěné na stejné internetové adrese;
b) internetové stránky spravované jinými příslušnými orgány, útvary nebo subjekty, nevede-li některé seznamy schválených potravinářských zařízení příslušný orgán uvedený v bodu 1.
C. Zařazení na seznam prostřednictvím systému TRACES
Odchylně od částí A a B mohou členské státy stanovit seznamy prostřednictvím systému TRACES.
KAPITOLA III
STRUKTURA A KÓDY PRO SEZNAMY SCHVÁLENÝCH ZAŘÍZENÍ
Pro zajištění široké dostupnosti informací o schválených potravinářských zařízeních a pro lepší čitelnost seznamů těchto zařízení se sestaví struktury, včetně příslušných údajů a kódů.
KAPITOLA IV
TECHNICKÉ SPECIFIKACE
Úkoly a činnosti uvedené v kapitolách II a III se vykonávají v souladu s technickými specifikacemi zveřejněnými Komisí.
PŘÍLOHA VI
VZORY VETERINÁRNÍCH OSVĚDČENÍ A DOKLADŮ PRO DOVOZ NĚKTERÝCH PRODUKTŮ ŽIVOČIŠNÉHO PŮVODU
ODDÍL I
▼M10 —————
KAPITOLA IV
PRODUKTY RYBOLOVU
Veterinární osvědčení pro dovoz produktů rybolovu podle čl. 6 odst. 1 písm. d) nařízení (ES) č. 853/2004 musí odpovídat vzoru uvedenému v dodatku IV této přílohy.
KAPITOLA V
ŽIVÍ MLŽI
Veterinární osvědčení pro dovoz živých mlžů podle čl. 6 odst. 1 písm. d) nařízení (ES) č. 853/2004 musí odpovídat vzoru uvedenému v dodatku V této přílohy.
▼M10 —————
ODDÍL II
VZOR DOKLADU, KTERÝ MÁ PODEPISOVAT KAPITÁN
Doklad, který má podepisovat kapitán a který může nahradit doklad požadovaný podle článku 14 nařízení (ES) č. 854/2004, pokud jsou mrazené produkty rybolovu dováženy přímo z mrazírenského plavidla, jak je stanoveno v čl. 15 odst. 3 uvedeného nařízení, musí být v souladu se vzorem dokladu uvedeným v dodatku VII této přílohy.
▼M10 —————
Dodatek IV přílohy VI
Vzor veterinárního osvědčení pro dovoz produktů rybolovu určených k lidské spotřebě




Dodatek V přílohy VI
ČÁST A
VZOR VETERINÁRNÍHO OSVĚDČENÍ PRO DOVOZ ŽIVÝCH MLŽŮ, OSTNOKOŽCŮ, PLÁŠTĚNCŮ A MOŘSKÝCH PLŽŮ URČENÝCH K LIDSKÉ SPOTŘEBĚ



ČÁST B
DODATEČNÝ VZOR VETERINÁRNÍHO OSVĚDČENÍ PRO ZPRACOVANÉ MLŽE PATŘÍCÍ K DRUHU ACANTHOCARDIA TUBERCULATUM
Úřední inspektor potvrzuje, že zpracovaní mlži druhu Acanthocardia tuberculatum schválení osvědčením o zdravotní nezávadnosti č.: …
1. byli sebráni v jasně označených produkčních oblastech, sledováni a povoleni příslušným orgánem za účelem rozhodnutí Komise 2006/766/ES ( 9 ), a že množství PSP v jedlých částech těchto mlžů bylo nižší než 300 μg/100g;
2. byli přepraveni v kontejnerech nebo vozech, které byly zapečetěny příslušným orgánem, přímo do zařízení:
…
…
(název a číslo úředního schválení zařízení, které příslušný orgán pověřil jejich zpracováním);
3. během přepravy do tohoto zařízení k nim byl přiložen doklad vydaný příslušným orgánem, jenž povolil přepravu, potvrzující podstatu a množství produktu, oblast původu a cílové zařízení;
4. byli podrobeni tepelnému ošetření podle přílohy rozhodnutí 96/77/ES;
5. neobsahují PSP v množství, které je zjistitelné biologickou testovací metodou, jak ukazuje připojená analytická zpráva (připojené analytické zprávy) o testu, jenž byl proveden u každé partie obsažené v zásilce, na niž se vztahuje toto osvědčení.
Úřední inspektor potvrzuje, že příslušný orgán ověřil, že „vlastní hygienické“ kontroly zavedené v zařízení uvedeném v bodě 2 se vztahují především na tepelné ošetření uvedené v bodě 4.
Níže podepsaný úřední inspektor prohlašuje, že jsou mu známa ustanovení rozhodnutí 96/77/ES a že připojená analytická zpráva (připojené analytické zprávy) odpovídá (odpovídají) testu provedenému u produktů po zpracování.
|
Úřední inspektor |
|
|
Jméno (hůlkovým písmem): Datum: Razítko: |
Kvalifikace a titul: Podpis: |
▼M10 —————
Dodatek VII přílohy VI
VZOR DOKLADU, KTERÝ MÁ PODEPISOVAT KAPITÁN A KTERÝ DOPROVÁZÍ ZÁSILKY MRAZENÝCH PRODUKTŮ RYBOLOVU, POKUD JSOU DO EVROPSKÉ UNIE DOVÁŽENY PŘÍMO Z MRAZÍRENSKÉHO PLAVIDLA



PŘÍLOHA VIa
TESTOVACÍ METODY PRO SYROVÉ MLÉKO A TEPELNĚ OŠETŘENÉ MLÉKO
KAPITOLA I
STANOVENÍ OBSAHU MIKROORGANISMŮ A SOMATICKÝCH BUNĚK
1. Při kontrole kritérií stanovených v příloze III oddílu IX kapitole I části III nařízení (ES) č. 853/2004, musí být jako referenční metody použity následující normy:
a) EN/ISO 4833 pro obsah mikroorganismů při 30 oC;
b) ISO 13366-1 pro obsah somatických buněk.
2. Použití alternativních analytických metod je přijatelné:
a) pro obsah mikroorganismů při 30 oC, pokud jsou metody validovány podle referenční metody uvedené v bodě 1 písm. a) v souladu s protokolem stanoveným v normě EN/ISO 16140 nebo v souladu s jinými obdobnými mezinárodně přijatými protokoly.
Konverzní vztah mezi alternativní metodou a referenční metodou zmíněnou v bodě 1 písm. a) je určen podle normy ISO 21187;
b) pro obsah somatických buněk, pokud jsou metody validovány podle referenční metody uvedené v bodě 1 písm. b) v souladu s protokolem stanoveným v normě ISO 8196 a pokud se používají v souladu s normou ISO 13366-2 nebo s jinými obdobnými mezinárodně přijatými protokoly.
KAPITOLA II
STANOVENÍ AKTIVITY ALKALICKÉ FOSFATÁZY
1. Při stanovování aktivity alkalické fosfatázy musí být jako referenční metoda použita norma ISO 11816-1.
2. Aktivita alkalické fosfatázy je vyjádřena v milijednotkách enzymové aktivity na litr (mU/l). Jednotka aktivity alkalické fosfatázy je množství enzymu alkalické fosfatázy, jež katalyzuje konverzi 1 mikromolu substrátu za minutu.
3. Výsledek testu alkalické fosfatázy se považuje za negativní, pokud naměřená aktivita v kravském mléce nepřesahuje 350 mU/l.
4. Použití alternativních analytických metod je přijatelné, pokud jsou metody validovány podle referenční metody uvedené v bodě 1 v souladu s mezinárodně přijatými protokoly.
PŘÍLOHA VIb
POŽADAVKY NA ÚŘEDNÍ KONTROLY PROHLÍDKY MASA
|
1. |
Pro účely této přílohy platí následující definice: a) „kontrolovanými podmínkami chovu a integrovanými výrobními systémy“ se rozumí druh chovu zvířat, kdy jsou zvířata chována za podmínek v souladu s kritérii stanovenými v dodatku; b) „mladým skotem“ se rozumí skot kteréhokoli pohlaví, ne starší než 8 měsíců; c) „mladou ovcí“ se rozumí ovce kteréhokoli pohlaví, která nemá prořezaný žádný trvalý řezák a která není starší než 12 měsíců; d) „mladou kozou“ se rozumí koza kteréhokoli pohlaví, ne starší než 6 měsíců; e) „stádem“ se rozumí zvíře nebo skupina zvířat držených v hospodářství jako epizootologická jednotka; jestliže je v hospodářství drženo více než jedno stádo, tvoří každé z těchto stád samostatnou epizootologickou jednotku; f) „hospodářstvím“ se rozumí jakékoli zařízení, stavba nebo v případě chovu pod širým nebem místo na území stejného členského státu, kde jsou zvířata držena, chována nebo kde se s nimi zachází; g) „zařízením provádějícím porážku nebo zpracování zvěřiny v přetržitém provozu“ se rozumí jatky nebo zařízení pro zpracování zvěřiny určené příslušným orgánem na základě analýzy rizik, v nichž se porážka nebo zpracování zvěřiny neprovádí nepřetržitě během celého pracovního dne nebo během po sobě jdoucích pracovních dnů v týdnu. |
|
2. |
Prohlídky po porážce v zařízeních provádějících porážku nebo zpracování zvěřiny v přetržitém provozu.
|
|
3. |
Požadavky na prohlídky masa na základě posouzení rizika, bez postupů nařezávání. ▼M8 —————
|
|
4. |
Doplňkový požadavek na prohlídku po porážce u lichokopytníků.
|
Dodatek k příloze VIb
Pro účely této přílohy se „kontrolovanými podmínkami chovu a integrovanými výrobními systémy“ rozumí to, že provozovatel potravinářského podniku musí splnit níže uvedená kritéria:
a) Veškeré krmivo bylo získáno ze zařízení, které produkuje krmivo v souladu s požadavky stanovenými v článcích 4 a 5 nařízení Evropského parlamentu a Rady (ES) č. 183/2005 ( 10 ). Jsou-li zvířata krmena objemným krmivem nebo plodinami, je takové krmivo náležitě ošetřeno a je pokud možno sušené a/nebo granulované.
b) V nejvyšší možné míře je používán turnusový systém. Jsou-li do stáda zaváděna nová zvířata, musejí být ponechána v izolaci po dobu, kterou požadují orgány veterinární péče, aby se zabránilo zavlečení případné nákazy.
c) Žádné ze zvířat nemá přístup k venkovním zařízením, ledaže provozovatel potravinářského podniku může na základě analýzy rizik prokázat ke spokojenosti příslušného orgánu, že příslušné časové období, zařízení ani okolnosti přístupu do venkovních prostor nepředstavují z hlediska zavlečení nákazy do stáda žádné riziko.
d) K dispozici jsou podrobné informace o zvířatech od jejich narození po porážku a o podmínkách nakládání s nimi podle přílohy II oddílu III nařízení (ES) č. 853/2004.
e) Pokud mají zvířata podestýlku, předchází se případné nákaze nebo zavlečení nákazy náležitým ošetřením materiálu podestýlky.
f) Pracovníci zemědělského podniku dodržují obecné hygienické předpisy podle přílohy I nařízení (ES) č. 852/2004.
g) Jsou zavedeny postupy pro dohled nad vstupem do prostor, kde jsou zvířata chována.
h) Hospodářství neposkytuje zařízení pro turisty ani pro kempování, ledaže provozovatel potravinářského podniku může na základě analýzy rizik prokázat ke spokojenosti příslušného orgánu, že daná zařízení jsou od chovných jednotek zvířat dostatečným způsobem oddělena, takže mezi zvířaty a lidmi nemůže docházet k přímému ani nepřímému kontaktu.
i) Zvířata nemají přístup ke skládce odpadků ani k domovnímu odpadu.
j) Je zaveden plán ochrany proti škůdcům a hubení škůdců.
k) Siláž se ke krmení nepoužívá, ledaže provozovatel potravinářského podniku může na základě analýzy rizik prokázat ke spokojenosti příslušného orgánu, že takové krmivo nemůže pro zvířata představovat žádné ohrožení.
l) Odtoková voda a usazeniny z čistíren odpadních vod se nevypouštějí v oblastech, ke kterým mají přístup zvířata, ani se nepoužívají ke hnojení pastvin používaných k pěstování plodin, jež jsou určeny ke krmení zvířat, ledaže je provedeno náležité ošetření ke spokojenosti příslušného orgánu.
PŘÍLOHA VII
ZMĚNY NAŘÍZENÍ (ES) č. 853/2004
V nařízení (ES) č. 853/2004 se přílohy II a III mění takto:
1. V příloze II se oddíl I část B mění takto:
a) V bodu 6 se druhý pododstavec nahrazuje tímto:
„BE, CZ, DK, DE, EE, GR, ES, FR, IE, IT, CY, LV, LT, LU, HU, MT, NL, AT, PL, PT, SI, SK, FI, SE a UK.“
b) Bod 8 se nahrazuje tímto:
„8. Pokud označení umísťuje zařízení nacházející se ve Společenství, musí být označení oválné a musí obsahovat zkratky CE, EC, EF, EG, EK, EY, ES, EÜ, EK, EB nebo WE.“
2. Příloha III se mění takto:
a) V oddílu I kapitole IV se bod 8 nahrazuje tímto:
„8. Z jatečně upravených těl nebo jiných částí těla určených k lidské spotřebě, s výjimkou prasat, hlav ovcí, koz a telat a končetin krav, ovcí a koz, musí být stažena kůže. S hlavami a končetinami musí být manipulováno tak, aby nedošlo ke kontaminaci.“
b) V oddílu II se doplňuje nová kapitola VII, která zní:
„KAPITOLA VII: PROSTŘEDKY ZADRŽUJÍCÍ VODU
Provozovatelé potravinářských podniků zajistí, aby se drůbeží maso, které bylo ošetřeno zvláštním způsobem, kterým se podpoří zadržování vody, neuvádělo na trh jako čerstvé maso, ale jako masné polotovary, nebo se použilo k výrobě zpracovaných výrobků.“
c) V oddílu VIII kapitole V části E se bod 1 nahrazuje tímto:
„1. Produkty rybolovu vyrobené z jedovatých ryb těchto čeledí nesmějí být uváděny na trh: Tetraodontidae, Molidae, Diodontidae a Canthigasteridae. Čerstvé, připravené a zpracované produkty rybolovu čeledi Gempylidae, zejména Ruvettus pretiosus a Lepidocybium flavobrunneum, mohou být uváděny na trh pouze v prvním nebo dalším balení a musí být vhodným způsobem označeny informacemi pro spotřebitele o způsobech přípravy/vaření a rizicích souvisejících s přítomností látek s nepříznivými gastrointestinálními účinky. Obecný název na etiketě musí být doplněn názvem vědeckým.“
d) Oddíl IX se mění takto:
i) V kapitole I podkapitole II části B bodu 1 se písmeno e) nahrazuje tímto:
„e) aby koupele nebo postřiky struku byly použity pouze po schválení nebo registraci v souladu s postupy podle směrnice Evropského parlamentu a Rady 98/8/ES ze dne 16. února 1998 o uvádění biocidních přípravků na trh ( 11 ).
ii) V kapitole II podkapitole II se bod 1 nahrazuje tímto:
„1. Pokud jsou syrové mléko nebo mléčné výrobky podrobovány tepelnému ošetření, provozovatelé potravinářských podniků musí zajistit, aby toto ošetření splňovalo požadavky podle přílohy II kapitoly XI nařízení (ES) č. 852/2004. Provozovatelé musejí zejména zajistit, aby následující postupy byly prováděny v souladu s uvedenými specifikacemi:
a) Pasterizace se dosahuje ošetřením:
i) vysokou teplotou po krátkou dobu (nejméně 72 oC po dobu 15 sekund),
ii) nízkou teplotou po dlouhou dobu (nejméně 63 oC po dobu 30 minut) nebo
iii) jakoukoli jinou kombinací času a teploty vedoucí k rovnocennému účinku,
aby výrobky bezprostředně po tomto ošetření vykazovaly negativní reakci na fosfatázový test v případech, kdy je test použitelný.
b) Ošetření velmi vysokou teplotou (UHT) se dosahuje ošetřením:
i) zahrnujícím souvislý přítok tepla za vysoké teploty po krátkou dobu (nejméně 135 oC v kombinaci s přiměřenou dobou zdržení), aby v ošetřeném výrobku nebyly žádné živé mikroorganizmy ani spory schopné růstu v prostředí aseptické uzavřené nádoby v pokojové teplotě, a
ii) dostačujícím k tomu, aby výrobky zůstaly mikrobiologicky stabilní po patnáctidenní inkubaci při 30 oC v uzavřených nádobách nebo po sedmidenní inkubaci při 55 oC v uzavřených nádobách nebo po jakékoliv jiné metodě prokazující, že bylo použito vhodné tepelné ošetření.“
e) V oddílu X se kapitola II mění takto:
i) V části III se bod 5 nahrazuje tímto:
„5. Po vytlučení musí být všechny složky tekutého vejce zpracovány co nejdříve, aby se vyloučilo mikrobiologické riziko nebo aby se snížilo na přijatelnou úroveň. Šarže, která nebyla dostatečně zpracována, může být ihned opět zpracována v tomtéž zařízení, pokud ji toto zpracování učiní vhodnou k lidské spotřebě. Prováželi se, že tato šarže není vhodná k lidské spotřebě, musí být denaturována, aby bylo zajištěno, že nebude použita k lidské spotřebě.“
ii) V části V se bod 2 nahrazuje tímto:
„2. U tekutých vajec musí být na štítku podle bodu 1 uvedena také slova: ‚Tekuté vejce nepasterizované – k ošetření na místě určení‘ a údaj o datu a hodině výtluku.“
f) V oddílu XIV se doplňuje nová kapitola V, která zní:
„KAPITOLA V: OZNAČOVÁNÍ
Na prvním balení a dalším balení obsahujícím želatinu musí být uvedena slova ‚poživatelná želatina‘ a datum přípravy.“
PŘÍLOHA VIII
ZMĚNY NAŘÍZENÍ (ES) č. 854/2004
V nařízení (ES) č. 854/2004 se přílohy I, II a III mění takto:
1. V příloze I oddílu I kapitole III se bod 3 mění takto:
a) V písmenu a) se druhý pododstavec nahrazuje tímto:
„BE, CZ, DK, DE, EE, GR, ES, FR, IE, IT, CY, LV, LT, LU, HU, MT, NL, AT, PL, PT, SI, SK, FI, SE a UK.“
b) Písmeno c) se nahrazuje tímto:
„c) zkratky CE, EC, EF, EG, EK, EY, ES, EÜ, EK, EB nebo WE, pokud značku umísťují jatky nacházející se ve Společenství.“
2. V příloze II kapitole II části A se body 4 a 5 nahrazují tímto:
„4. Příslušný orgán může klasifikovat jako oblasti třídy B ty oblasti, ve kterých mohou být živí mlži sbíráni, avšak mohou být uvedeni na trh k lidské spotřebě až po umístění ve středisku pro čištění nebo po sádkování, aby splňovali hygienické normy uvedené v bodu 3. Živí mlži z těchto oblastí nesmějí překročit hodnotu 4 600 E. coli na 100 g svaloviny a tekutiny mezi lasturami. Referenční metodou pro tento rozbor je test MPN v pěti zkumavkách a ve třech ředěních uvedený v normě ISO 16649-3. Alternativní metody mohou být použity, jsou-li v souladu s kritérii EN/ISO 16140 validovány pro tuto referenční metodu.
5. Příslušný orgán může klasifikovat jako oblasti třídy C ty oblasti, ve kterých mohou být živí mlži sbíráni, avšak mohou být uvedeni na trh až po dlouhodobém sádkování, aby splňovali hygienické normy uvedené v bodu 3. Živí mlži z těchto oblastí nesmějí překročit hodnotu 46 000 E. coli na 100 g svaloviny a tekutiny mezi lasturami. Referenční metodou pro tento rozbor je test MPN v pěti zkumavkách a ve třech ředěních uvedený v normě ISO 16649-3. Alternativní metody mohou být použity, jsou-li v souladu s kritérii EN/ISO 16140 validovány pro tuto referenční metodu.“
3. V příloze III kapitole II části G se bod 1 nahrazuje tímto:
„1. Produkty rybolovu vyrobené z jedovatých ryb těchto čeledí nesmějí být uváděny na trh: Tetraodontidae, Molidae, Diodontidae a Canthigasteridae. Čerstvé, připravené a zpracované produkty rybolovu patřící k čeledi Gempylidae, zejména Ruvettus pretiosus a Lepidocybium flavobrunneum, mohou být uváděny na trh pouze v prvním balení nebo dalším balení a musí být vhodným způsobem označeny informacemi pro spotřebitele o způsobech přípravy/vaření a o rizicích souvisejících s přítomností látek s nepříznivými gastrointestinálními účinky. Obecný název na etiketě musí být doplněn názvem vědeckým.“
( 1 ) Úř. věst. L 139, 30.4.2004, s. 1; opraveno v Úř. věst. L 226, 25.6.2004, s. 3.
( 2 ) Úř. věst. L 139, 30.4.2004, s. 55; opraveno v Úř. věst. L 226, 25.6.2004, s. 22.
( 3 ) Úř. věst. L 139, 30.4.2004, s. 206; opraveno v Úř. věst. L 226, 25.6.2004, s. 83.
( 4 ) Úř. věst. L 165, 30.4.2004, s. 1; opraveno v Úř. věst. L 191, 28.5.2004, s. 1.
( 5 ) Dosud nezveřejněné v Úředním věstníku.
( 6 ) Úř. věst. L 157, 30.4.2004, s. 33; opraveno v Úř. věst. L 195, 2.6.2004, s. 12.
( 7 ) Viz strana 1 v tomto čísle Úředního věstníku.
( 8 ) Úř. věst. L 358, 18.12.1986, s. 1.
( 9 ) Viz strana 50 v tomto čísle Úředního věstníku.
( 10 ) Úř. věst. L 35, 8.2.2005, s. 1.
( 11 ) Úř. věst. L 123, 24.4.1998, s. 1.“