1992L0065 — CS — 29.12.2014 — 014.003
Tento dokument je třeba brát jako dokumentační nástroj a instituce nenesou jakoukoli odpovědnost za jeho obsah
Ve znění:
|
|
|
Úřední věstník
|
|
No
|
page
|
date
|
|
M1
|
ROZHODNUTÍ KOMISE ze dne 6. dubna 1995,
|
L 117
|
23
|
24.5.1995
|
|
M2
|
ROZHODNUTÍ KOMISE ze dne 30. března 2001,
|
L 102
|
63
|
12.4.2001
|
|
►M3
|
NAŘÍZENÍ KOMISE (ES) č. 1282/2002 ze dne 15. července 2002,
|
L 187
|
3
|
16.7.2002
|
|
►M5
|
NAŘÍZENÍ EVROPSKÉHO PARLAMENTU A RADY č. 998/2003/ES ze dne 26. května 2003
|
L 146
|
1
|
13.6.2003
|
|
►M6
|
NAŘÍZENÍ KOMISE (ES) č. 1398/2003 ze dne 5. srpna 2003,
|
L 198
|
3
|
6.8.2003
|
|
►M7
|
SMĚRNICE RADY 2004/68/ES Text s významem pro EHP ze dne 26. dubna 2004,
|
L 139
|
320
|
30.4.2004
|
|
►M8
|
ROZHODNUTÍ KOMISE ze dne 26. dubna 2007,
|
L 114
|
17
|
1.5.2007
|
|
►M9
|
SMĚRNICE RADY 2008/73/ES Text s významem pro EHP ze dne 15. července 2008,
|
L 219
|
40
|
14.8.2008
|
|
►M10
|
NAŘÍZENÍ KOMISE (EU) č. 176/2010 ze dne 2. března 2010,
|
L 52
|
14
|
3.3.2010
|
|
►M11
|
ROZHODNUTÍ KOMISE ze dne 6. května 2010,
|
L 118
|
56
|
12.5.2010
|
|
M12
|
ROZHODNUTÍ KOMISE ze dne 10. listopadu 2010,
|
L 293
|
62
|
11.11.2010
|
|
►M13
|
PROVÁDĚCÍ ROZHODNUTÍ KOMISE ze dne 17. února 2012,
|
L 50
|
51
|
23.2.2012
|
|
►M14
|
SMĚRNICE EVROPSKÉHO PARLAMENTU A RADY 2013/31/EU Text s významem pro EHP ze dne 12. června 2013,
|
L 178
|
107
|
28.6.2013
|
|
►M15
|
PROVÁDĚCÍ ROZHODNUTÍ KOMISE ze dne 21. října 2013,
|
L 281
|
14
|
23.10.2013
|
|
►M16
|
PROVÁDĚCÍ NAŘÍZENÍ KOMISE (EU) č. 846/2014 ze dne 4. srpna 2014,
|
L 232
|
5
|
5.8.2014
|
Ve znění:
|
►A1
|
AKT o podmínkách přistoupení Rakouské republiky, Finské republiky a Švédského království a o úpravách smluv, na nichž je založena Evropská unie
|
C 241
|
21
|
29.8.1994
|
|
►A2
|
AKT o podmínkách přistoupení České republiky, Estonské republiky, Kyperské republiky, Lotyšské republiky, Litevské republiky, Maďarské republiky, Republiky Malta, Polské republiky, Republiky Slovinsko a Slovenské republiky a o úpravách smluv, na nichž je založena Evropská unie
|
L 236
|
33
|
23.9.2003
|
Opraveno:
▼B
SMĚRNICE RADY 92/65/EHS
ze dne 13. července 1992
o veterinárních předpisech pro obchod se zvířaty, spermatem, vajíčky a embryi uvnitř Společenství a jejich dovoz do Společenství, pokud se na ně nevztahují zvláštní veterinární předpisy Společenství uvedené v příloze A oddíle I směrnice 90/425/EHS
RADA EVROPSKÝCH SPOLEČENSTVÍ,
s ohledem na Smlouvu o založení Evropského hospodářského společenství, a zejména na článek 43 této smlouvy,
s ohledem na návrh Komise (
1
),
s ohledem na stanovisko Evropského parlamentu (
2
),
s ohledem na stanovisko Hospodářského a sociálního výboru (
3
),
vzhledem k tomu, že živá zvířata a výrobky živočišného původu jsou zahrnuty do seznamu produktů v příloze II Smlouvy; že uvedení těchto zvířat a produktů na trh tvoří zdroj příjmů pro část obyvatelstva zabývajícího se zemědělstvím;
vzhledem k tomu, že je nutné zajistit v tomto sektoru racionální vývoj a zvýšit produktivitu, měly by se stanovit na úrovni Společenství veterinární předpisy pro zvířata a produkty;
vzhledem k tomu, že Společenství musí přijmout opatření k postupnému vytváření vnitřního trhu v období do 31. prosince 1992;
vzhledem k tomu, že se zřetelem k výše uvedeným cílům stanovila Rada veterinární předpisy pro skot, prasata, ovce a kozy, koňovité, drůbež a násadová vejce, ryby a rybí výrobky, mušle, sperma býků a kanců, embrya skotu, čerstvé maso, drůbeží maso, masné výrobky, maso ze zvěřiny a králičí maso;
vzhledem k tomu, že by se měly přijmout veterinární předpisy pro uvádění na trh těch zvířat a výrobků živočišného původu, na něž se dosud nevztahují výše uvedené předpisy;
vzhledem k tomu, že by se měly vydat prováděcí předpisy k této směrnici, aniž by bylo dotčeno nařízení Rady (EHS) č. 3626/82 ze dne 3. prosince 1982 o provádění úmluvy o mezinárodním obchodu s ohroženými druhy volně žijících živočichů a planě rostoucích rostlin ve Společenství (
4
);
vzhledem k tomu, že na určité technické aspekty se musí odkazovat na směrnici Rady 64/432/EHS ze dne 26. června 1964 o veterinárních otázkách obchodu se skotem a prasaty uvnitřSpolečenství (
5
) a směrnici 85/511/EHS ze dne 18. listopadu 1985, kterou se zavádějí opatření Společenství ke tlumení slintavky a kulhavky (
6
);
vzhledem k tomu, že v oblasti organizace kontrol a odpovídajících následných a ochranných opatření, která je nutno provádět, se musí odkazovat na obecná pravidla stanovená ve směrnici Rady 90/425/EHS ze dne 26. června 1990 o veterinárních a zootechnických kontrolách v obchodu s některými živými zvířaty a produkty uvnitř Společenství s cílem dotvoření vnitřního trhu (
7
);
vzhledem k tomu, že pokud není stanoveno jinak, musí být obchod se zvířaty a výrobky živočišného původu liberalizován, aniž by bylo dotčeno použití případných ochranných opatření;
vzhledem k tomu, že při značném riziku rozšíření nákaz, kterému jsou zvířata vystavena, měly by se na určitá zvířata a výrobky živočišného původu stanovit zvláštní požadavky, které budou předepsány pro jejich uvádění na trh k obchodním účelům, zejména jsou-li určeny pro oblasti s velmi dobrým nákazovým statusem;
vzhledem k tomu, že zvláštní situace, týkající se Spojeného království Velké Británie a Severního Irska a Irska, daná ostrovní pozicí těchto zemí a skutečnost, že se na jejich území po dlouhou dobu nevyskytovala vzteklina, ospravedlňují zvláštní opatření, jimiž se dá zajistit, aby uvádění psů a koček na trh ve Spojeném království a Irsku, jež nepocházejí z těchto zemí, neneslo s sebou riziko zavlečení vztekliny do těchto států, aniž by ovšem tato opatření zasahovala do zrušení veterinárních kontrol na hranicích mezi členskými státy;
vzhledem k tomu, že veterinární osvědčení je nejvhodnějším prostředkem záruky a kontroly shody s těmito požadavky;
vzhledem k tomu, že za účelem udržení nákazové situace ve Společenství by měla zvířata a výrobky živočišného původu, na něž odkazuje tato směrnice, podléhat při uvádění na trh minimálním požadavkům stanoveným pro obchod a jejich dodržování by mělo být kontrolováno v souladu s principy a pravidly stanovenými ve směrnici Rady 90/675/EHS ze dne 10. prosince 1990, kterou se stanoví zásady organizace veterinární kontroly produktů dovážených do Společenství ze třetích zemí (
8
);
vzhledem k tomu, že by měl být vydán předpis pro postup zakládající úzkou spolupráci mezi členskými státy a Komisí v rámci Stálého veterinárního výboru;
vzhledem k tomu, že konečný termín pro provedení do vnitrostátních právních předpisů stanovený na den 1. ledna 1994 v článku 29 by neměl mít dopad na zrušení veterinárních kontrol na hranicích ke dni 1. ledna 1993,
PŘIJALA TUTO SMĚRNICI:
KAPITOLA I
Obecná ustanovení
Článek 1
▼M7
Tato směrnice stanoví veterinární požadavky pro obchod uvnitř Společenství se zvířaty, spermatem, vajíčky a embryi a pro jejich dovoz do Společenství, pokud se na ně nevztahují veterinární požadavky stanovené ve zvláštních předpisech Společenství uvedené v příloze F.
▼B
Tato směrnice se použije, aniž jsou dotčena ustanovení podle nařízení (EHS) č. 3626/82.
Touto směrnicí zůstávají nedotčeny vnitrostátní předpisy pro zvířata chovaná v zájmovém chovu; jejich ponechání však nesmí ohrozit odstranění veterinárních kontrol na hranicích mezi členskými státy.
Článek 2
1. Pro účely této směrnice se rozumí:
a) „obchodem“ obchod, jak je definován v čl. 2 odst. 3 směrnice 90/425/EHS;
b) „zvířaty“ zástupci jiných druhů živočichů, než které jsou uvedeny ve směrnicích 64/432/EHS, 90/426/EHS (
9
), 90/539/EHS (
10
), 91/67/EHS, (
11
) 91/68/EHS (
12
), 91/492/EHS (
13
) a 91/493/EHS;
c) „schválenou organizací, schválený institutem, nebo schváleným střediskem“ každé stálé, zeměpisně ohraničené zařízení schválené podle článku 13, ve kterém se chová nebo šlechtí jeden nebo více druhů zvířat k obchodním nebo neobchodním účelům a výlučně za jedním nebo více následujícími účely:
— výstavu těchto zvířat a poučení veřejnosti,
— základní nebo aplikovaný vědecký výzkum nebo šlechtění zvířat pro účely takového výzkumu;
d) „chorobami povinnými hlášením“ choroby uvedené v příloze A.
2. Kromě toho se přiměřeně použijí jiné definice, které jsou uvedeny v článku 2 směrnic 64/432/EHS, 91/67/EHS a 90/539/EHS, kromě definic schválených středisek a organizací.
KAPITOLA II
Ustanovení pro obchod
Článek 3
Členské státy zajistí, aby obchod podle čl. 1 odst. 1 nebyl zakázán nebo omezen z jiných veterinárních důvodů, než které vyplývají z použití této směrnice nebo z právních předpisů Společenství, a zejména z případně přijatých ochranných opatření.
▼A1
Do přijetí předpisů Společenství v této oblasti může Švédsko zachovat své vnitrostátní předpisy týkající se hadů a ostatních plazů, kteří jsou zasíláni na jeho území.
▼B
Článek 4
Členské státy přijmou nezbytná opatření k zajištění toho, aby při provádění čl. 4 odst. 1 písm. a) směrnice 90/425/EHS zvířata uvedená v článcích 5 až 10 této směrnice mohla být bez dotčení článku 13 a zvláštních předpisů, které se přijmou k provedení článku 24, předmětem obchodu jen tehdy, splňují-li podmínky stanovené v článcích 5 až 10 a pocházejí-li z hospodářství nebo obchodních podniků podle čl. 12 odst. 1 a 3 této směrnice, které jsou u příslušného orgánu zaregistrovány, a které se zaváží:
— nechávat pravidelně prohlížet držená zvířata v souladu s čl. 3 odst. 3 směrnice 90/425/EHS,
— hlásit příslušnému orgánu, kromě vypuknutí chorob povinných hlášením, vypuknutí chorob podle přílohy B, na které vypracoval příslušný členský stát program ke tlumení nebo program dohledu,
— respektovat zvláštní vnitrostátní opatření ke tlumení choroby, která má pro daný členský stát zvláštní význam a je zahrnuta do programu vypracovaného podle článku 14 nebo do rozhodnutí podle čl. 15 odst.2,
— uvádět na trh pro účely obchodu pouze zvířata, která nejeví příznaky choroby a pocházejí z hospodářství nebo pásem, na která se nevztahují žádné zákazy vydané z veterinárních důvodů, a pokud jde o zvířata, která nejsou provázena veterinárním osvědčením nebo obchodním dokumentem podle článků 5 až 11, pouze taková zvířata, která jsou provázena vlastním osvědčením zemědělce, v němž potvrzuje, že dotyčná zvířata v čase odeslání nevykazují žádný zjevný příznak choroby a že jeho hospodářství nepodléhá žádným veterinárním omezením,
— vyhovět požadavkům zajišťujícím dobré životní podmínky držených zvířat.
Článek 5
1. Členské státy zajistí, aby se obchod s opicemi (simiae a prosimiae) omezil výhradně na zvířata odesílaná z a do organizací, institutů nebo středisek schválených příslušnými orgány členských států v souladu s článkem 13, a že taková zvířata jsou provázena veterinárním osvědčením, které odpovídá vzoru v příloze E, tj. prohlášením, ve kterém úřední veterinární lékař organizace, institutu nebo střediska původu musí vyplnit, že zaručuje zdravotní stav zvířat.
2. Příslušný orgán členského státu může, odchylně od odstavce 1, povolit schválené organizaci, institutu nebo středisku získání opic patřících soukromé osobě.
Článek 6
A. Bez dotčení článků 14 a 15 členské státy zajistí, aby kopytnatci jiných druhů, než které jsou uvedeny ve směrnicích 64/432/EHS, 90/426/EHS a 91/68/EHS, mohli být předmětem obchodu pouze tehdy, splňují-li následující požadavky:
1. obecně:
a) musí být označeni v souladu s čl. 1 odst. 1 písm c) směrnice 90/425/EHS;
b) nesmějí být určeni k porážce v rámci programu eradikace určité nakažlivé choroby;
c) nesmějí být očkováni proti slintavce a kulhavce a musí vyhovovat příslušným požadavkům směrnice 85/511/EHS a článku 4a směrnice 64/432/EHS;
d) musí pocházet z hospodářství uvedeného v čl. 3 odst. 2 písm, b) a c) směrnice 64/432/EHS, na které se nevztahují veterinární opatření, zejména ta, která byla provedena podle směrnic 85/511/EHS, 80/217/EHS (
14
) a 91/68/EHS, a v němž byli nepřetržitě drženi od narození nebo alespoň posledních třicet dní před odesláním;
▼M7
e) musí být doprovázeni osvědčením, které odpovídá vzoru uvedenému v příloze E části 1 a obsahuje toto prohlášení:

▼M7 —————
▼B
2. v případě přežvýkavců:
a) musí pocházet ze stáda, které je úředně prosté tuberkulózy a úředně prosté brucelózy podle směrnice 64/432/EHS nebo směrnice 91/68/EHS a splňovat, pokud jde o veterinární předpisy, příslušné požadavky stanovené pro hovězí druhy v čl. 3 odst. 2 písm. c), d), f), g) a h) směrnice 64/432/EHS nebo v článku 3 směrnice 91/68/EHS;
▼M7
b) jestliže nepocházejí ze stáda, které splňuje podmínky uvedené pod písmenem a), musí pocházet z hospodářství, ve kterém nebyl v rozmezí 42 dnů před naložením zvířat zaznamenán žádný případ brucelózy nebo tuberkulózy a ve kterém byli přežvýkavci během 30 dnů před odesláním vyšetřeni na brucelózu a tuberkulózu s negativními výsledky;
▼A1
c) postupem podle článku 26 mohou být přijata ustanovení týkající se leukózy;
▼B
3. v případě prasat:
a) nesmějí pocházet z oblasti, na kterou byly v souvislosti s africkým morem prasat vydány zákazy podle článku 9a směrnice 64/432/EHS;
b) musí pocházet z hospodářství, které v souvislosti s klasickým morem prasat nepodléhá žádným omezením stanoveným ve směrnici 80/217/EHS;
c) musí, v souladu se směrnicí 64/432/EHS, pocházet z hospodářství prostého brucelózy a vyhovovat příslušným veterinárním požadavkům stanoveným pro prasata ve směrnici 64/432/EHS;
d) pokud nepocházejí ze stáda, které splňuje podmínky stanovené v písmenu c), musí být v rozmezí 30 dnů před odesláním podrobena testu s negativním výsledkem, určenému k prokázání absence protilátek brucelózy;
▼M7 —————
▼M7
4. Požadavky na vyšetření uvedené v tomto článku a jejich kritéria mohou být stanoveny v souladu s postupem stanoveným v článku 26. Tato rozhodnutí vezmou v úvahu případ přežvýkavců chovaných v arktických regionech Společenství.
Do přijetí rozhodnutí uvedených v předchozím pododstavci se nadále použijí vnitrostátní předpisy.
▼B
B. Směrnice 64/432/EHS se mění takto:
1. V čl. 2 písm. b) a c), se nahrazuje slovo „skot“ slovy „skot (včetně druhu Bubalus bubalus)“.
2. Vkládá se nový článek, který zní:
„Článek 10a
Postupem podle článku 12 lze veterinární osvědčení, jejichž vzor je uveden v příloze F, změnit nebo doplnit zejména proto, aby se přihlédlo k požadavkům článku 6 směrnice 92/65/EHS.“
Článek 7
A. Členské státy zajistí, aby ptáci neuvedení ve směrnici 90/539/EHS mohli být předmětem obchodu, pouze vyhovují-li následujícím požadavkům:
1. obecně platí, že musí:
a) pocházet z hospodářství, ve kterém během posledních 30 dnů před odesláním nebyla zjištěna žádná influenza ptáků;
b) pocházet z hospodářství nebo oblasti, na které/kterou se nevztahují žádná omezení v rámci opatření ke tlumení Newcastleské choroby.
Až do provedení opatření Společenství uvedených v článku 19 směrnice 90/539/EHS nadále platí vnitrostátní předpisy ke tlumení Newcastleské choroby ve shodě s obecnými ustanoveními Smlouvy;
c) být dáni, v souladu s třetí odrážkou čl. 10 odst.1 směrnice 91/496/EHS, do karantény v hospodářství, do kterého byli vzati poté, co vstoupili na území Společenství, jestliže byli dovezeni ze třetí země;
2. pro papoušky kromě toho platí, že:
a) nesmějí pocházet z hospodářství, ani přijít do styku se zvířaty hospodářství, ve kterém byla zjištěna psittakóza (Chlamydia psittaci).
Doba trvání zákazu od posledního zaznamenaného případu a doby léčení pod dozorem veterinárního lékaře, uznaného postupem podle článku 26, činí alespoň dva měsíce;
b) musí být označeni podle čl. 3 odst. 1 písm. c) směrnice 90/425/EHS.
Metody pro označení papoušků, a zejména nemocných papoušků, se stanoví postupem podle článku 26;
c) musí být provázeni obchodním dokumentem podepsaným úředním veterinárním lékařem nebo veterinárním lékařem, který je příslušný pro hospodářství nebo obchodní organizaci původu a je k tomu účelu příslušným orgánem zmocněn.
B. Ve druhém pododstavci čl. 2 odst. 2 směrnice Rady 91/495/EHS ze dne 27. listopadu 1990 o veterinárních a hygienických otázkách při produkci králičího masa a masa z farmové zvěře a jeho uvádění na trh (
15
) se vkládají do třetí řádky slova „a běžci (Ratitae)“ za slova „směrnice 90/539/EHS“.
V čl. 2 odst. 2 bodě 1 směrnice Rady 90/539/EHS ze dne 15. října 1990 o veterinárních předpisech pro obchod s drůbeží a násadovými vejci uvnitř Společenství a jejich dovoz ze třetích zemí (
16
), se za slova „a koroptve“ vkládají slova „a běžci (Ratitae)“.
Článek 8
Členské státy zajistí, aby včely (Apis melifera) mohly být předmětem obchodu pouze, splňují-li tyto požadavky:
a) musí pocházet z oblasti, na kterou se nevztahuje zákaz spojený s výskytem moru včelího plodu.
Období zákazu musí trvat nejméně 30 dní, které následují po naposledy zaznamenaném případu a datu, ve kterém byly všechny úly v okruhu třech kilometrů kontrolovány příslušným orgánem a všechny infikované úly spáleny nebo ošetřeny a prohlédnuty k uspokojení zmíněného příslušného orgánu.
Postupem podle článku 26 a po konzultaci s Vědeckým veterinárním výborem mohou být požadavky uplatňované na včely (Apis melifera) nebo rovnocenné požadavky uplatňovány na čmeláky;
b) jsou provázeny veterinárním osvědčením podle vzoru uvedeného v příloze E, tj. prohlášením vyplněným příslušným orgánem, potvrzujícím, že požadavky stanovené v písmenu a) jsou splněny.
Článek 9
1. Členské státy zajistí, aby zvířata čeledi zajícovitých mohla být předmětem obchodu, pouze splňují-li tyto požadavky:
a) nesmějí pocházet nebo nesměla být ve styku se zvířaty z hospodářství, ve kterém se vyskytuje vzteklina nebo je podezření, že se v něm vyskytovala během posledního měsíce;
b) musí pocházet z hospodářství, ve kterém žádné zvíře nevykazuje klinické příznaky myxomatózy.
2. Členské státy, které požadují veterinární osvědčení pro přepravu zvířat čeledi zajícovitých na jejich území, mohou požadovat, aby zvířata jim zasílaná byla provázena veterinárním osvědčením, které odpovídá vzoru v příloze E, doplněnému tímto prohlášením:
„Já níže podepsaný,…, potvrzuji, že výše uvedená zásilka vyhovuje požadavkům článku 9 směrnice 92/65/EHS a že zvířata nejevila při prohlídce klinické příznaky choroby.“
Toto osvědčení musí vydat úřední veterinární lékař nebo veterinární lékař příslušný pro hospodářství původu, zmocněný k tomu účelu příslušným orgánem a pro živnostenský chov úředním veterinárním lékařem. Členské státy, které si přejí využít této možnosti, uvědomí Komisi, která musí zajistit, aby požadavek stanovený v prvním odstavci byl splněn.
3. Irsko a Spojené království mohou požadovat předložení veterinárního osvědčení, jímž se potvrzuje, že požadavek stanovený v odst. 1 písm. a) byl splněn.
Článek 10
1. Členské státy zajistí, aby byl zakázán obchod s
►M5
————— ◄ norky a liškami, které pocházejí nebo byly ve styku se zvířaty z hospodářství, na kterém se vyskytuje vzteklina nebo je podezření, že se v něm vyskytovala během posledních šesti měsíců, pokud nebyly podrobeny systematickému očkovacímu programu.
▼M14
2. Pro obchod musí psi, kočky a fretky:
a) splňovat podmínky stanovené v článku 6 a tam, kde je to vhodné, článku 7 nařízení Evropského parlamentu a Rady (EU) č. 576/2013 ze dne 12. června 2013 o neobchodních přesunech zvířat v zájmovém chovu (
17
);
b) podstoupit během 48 hodin před odesláním klinické vyšetření provedené veterinárním lékařem schváleným příslušným orgánem a
c) být během přepravy do místa určení doprovázeni veterinárním osvědčením, které:
i) odpovídá vzoru obsaženému v části 1 přílohy E a
ii) je podepsáno úředním veterinárním lékařem, který potvrdí, že veterinární lékař schválený příslušným orgánem zaznamenal v příslušném oddíle identifikačního dokladu ve formátu stanoveném v čl. 21 odst. 1 nařízení (EU) č. 576/2013 klinické vyšetření provedené v souladu s písmenem b), při němž se ukázalo, že v době tohoto vyšetření byla zvířata způsobilá k přepravě na zamýšlenou cestu v souladu s nařízením Rady (ES) č. 1/2005 ze dne 22. prosince 2004 o ochraně zvířat během přepravy a souvisejících činností (
18
).
▼M14 —————
▼A2
4. Irsko, Kypr, Malta a Spojené království si mohou bez dotčení odstavců 2 a 3 zachovat svá vnitrostátní pravidla pro karanténu všech masožravců,
►M5
s výjimkou druhů uvedených v odstavcích 2 a 3, ◄ primátů (nehetnatců), netopýrů a jiných zvířat vnímavých na vzteklinu, na které se vztahuje tato směrnice a u nichž nelze prokázat, že se narodila v hospodářství původu a byla tam od narození držena v zajetí, i když ponechání takových předpisů nesmí ohrozit odstranění veterinárních kontrol na hranicích mezi členskými státy.
▼B
5. Rozhodnutí 90/638/EHS se mění takto:
1. V článku 1 se doplňuje nová odrážka, která zní:
„— pro programy ke tlumení vztekliny: kritéria uvedená v příloze III.“
2. Vkládá se nová příloha, která zní:
„PŘÍLOHA III
Kritéria pro programy ke tlumení vztekliny
Programy ke tlumení vztekliny musí přinejmenším obsahovat:
a) kritéria uváděná v bodech 1 až 7 přílohy I;
b) podrobné informace o oblasti nebo oblastech, ve kterých se provádí orální imunizace lišek, a o jejich přírodních hranicích. Tato oblast nebo tyto oblasti se musí rozprostírat na nejméně 6 000 km2 nebo na celém území členského státu a mohou zahrnovat i přilehlé oblasti třetí země;
c) podrobnou informaci o navrhovaných očkovacích látkách a o systému distribuce, hustotě a četnosti kladení vnadidel;
d) případně všechny podrobnosti a náklady a účel projektů na zachování nebo ochranu flory a fauny, kterých se ujaly dobrovolné organizace na území, kterého se tyto projekty týkají.“
6. Na návrh Komise určí Rada kvalifikovanou většinou zvláštní orgán, který vypracuje kritéria nutná pro normalizaci sérologických testů, a rozhodne o jeho pravomoci.
7. Členské státy zajistí, aby náklady, které vznikají na základě provedení sérologického testu, nesl dovozce.
▼M5 —————
▼A1
Článek 10a
Pokud jde o vzteklinu, změní se po předložení vhodných dokladů články 9 a 10 postupem podle článku 26 tak, aby se zohlednila situace ve Finsku a Švédsku a na tyto státy mohla být použita stejná ustanovení, jaká jsou použitelná v rovnocenné situaci na členské státy.
▼M9
Článek 11
1. Členské státy zajistí, aby bez dotčení rozhodnutí přijímaných při provádění článků 21 a 23 byly předmětem obchodu jen sperma, vajíčka a embrya, která vyhovují podmínkám odstavců 2, 3, 4 a 5.
2. Sperma živočišných druhů ovcí, koz a koní musí, aniž jsou dotčena kritéria pro zápis určitých plemen koňovitých do plemenných knih, být:
— odebíráno, zpracováváno a skladováno za účelem umělé inseminace ve stanici nebo středisku schválených ze zdravotního hlediska podle přílohy D kapitoly I nebo v případě ovcí a koz odchylně od shora uvedeného v hospodářství, které vyhovuje požadavkům směrnice 91/68/EHS,
— odebíráno od zvířat, která splňují podmínky stanovené v příloze D kapitole II,
— odebíráno, zpracováváno, uchováváno, skladováno a přepravováno podle přílohy D kapitoly III,
— provázeno během přepravy do jiného členského státu veterinárním osvědčením, které odpovídá vzoru, jenž se stanoví postupem podle článku 26.
3. Vajíčka a embrya živočišných druhů ovcí, koz, koní a prasat musí být:
— odebírána dárkyním splňujícím podmínky stanovené v příloze D kapitole IV týmem pro odběr vajíček a embryí nebo vyprodukována týmem pro produkci embryí, který je schválen příslušným orgánem členského státu a splňuje podmínky stanovené v příloze D kapitole I postupem podle článku 26,
— odebírána, ošetřena, uchovávána v příslušné laboratoři, skladována a přepravována podle přílohy D kapitoly III,
— provázena během převozu do jiného členského státu veterinárním osvědčením, které odpovídá vzoru, jenž se stanoví postupem podle článku 26.
Sperma používané pro inseminaci dárkyň musí v případě ovcí, koz a koňovitých vyhovovat ustanovením odstavce 2 a v případě prasat ustanovením směrnice 90/429/EHS.
Případné další záruky lze stanovit postupem podle článku 26.
4. Schválené stanice nebo střediska uvedené v odst. 2 první odrážce a schválené týmy uvedené v odst. 3 první odrážce jsou registrovány příslušným orgánem dotčeného členského státu, který každé stanici, středisku či týmu přidělí veterinární registrační číslo.
Každý členský stát vypracuje a průběžně aktualizuje seznam schválených stanic, středisek a týmů a jejich veterinárních registračních čísel a zpřístupní jej ostatním členským státům a veřejnosti.
Podrobná pravidla pro jednotné uplatňování tohoto odstavce mohou být přijata postupem podle článku 26.
5. Veterinární požadavky a vzorová veterinární osvědčení platná pro sperma, vajíčka nebo embrya těch druhů zvířat, které nejsou uvedeny v odstavcích 2 a 3, se stanoví postupem podle článku 26.
Do stanovení veterinárních požadavků a vzorových veterinárních osvědčení platí pro obchodování s takovým spermatem, vajíčky a embryi nadále vnitrostátní pravidla.
▼B
Článek 12
1. Pravidla pro kontroly stanovená směrnicí 90/425/EHS se použijí, zvláště pokud jde o organizaci kontrol a následná opatření, která mají být prováděna u zvířat, spermatu, vajíček a embryí, na něž se vztahuje tato směrnice, a která jsou vybavena průvodním veterinárním osvědčením. Ostatní zvířata musí pocházet z hospodářství, na která se vztahují zásady uvedené směrnice, pokud jde o kontroly původu a místa určení.
2. Článek 10 směrnice 90/425/EHS se použije na zvířata, sperma, vajíčka a embrya, na něž se vztahuje tato směrnice.
3. Pro obchodní účely se rozšiřuje článek 12 směrnice 90/425/EHS na obchodní zástupce, kteří trvale nebo příležitostně chovají zvířata uvedená v článcích 7, 9 a 10.
4. Oznámení místa určení podle čl. 4 odst. 2 směrnice 90/425/EHS se u zvířat, spermatu, vajíček a embryí provázených veterinárním osvědčením podle této směrnice musí učinit s použitím systému „ANIMO“.
5. Aniž by byla dotčena zvláštní ustanovení této směrnice, provede příslušný orgán, v případě podezření, že tato směrnice nebyla dodržena nebo při pochybnostech o zdraví zvířat jmenovaných v článku 1 nebo o jakosti spermatu, vajíček a embryí uvedených v článku 1, veškeré kontroly, které považuje za vhodné.
6. Členské státy přijmou vhodná správní nebo trestněprávní opatření, aby postihly každé porušení této směrnice, zejména když se zjistí, že vystavená osvědčení nebo dokumenty neodpovídají skutečnému stavu zvířat uvedených v článku 1, že označení dotyčných zvířat nebo spermatu, vajíček a embryí nevyhovují této směrnici nebo že dotyčná zvířata resp. produkty neprošla kontrolami stanovenými v této směrnici.
Článek 13
1. Při obchodu se zvířaty vnímavými k chorobám uvedeným v příloze A nebo k chorobám uvedeným v příloze B, kde členský stát místa určení využívá záruky stanovené v článcích 14 a 15 a při obchodu se spermatem, vajíčky nebo embryi takových zvířat, přepravovaných mezi organizacemi, instituty nebo středisky schválenými v souladu s přílohou C, se musí vyhotovit přepravní dokument odpovídající vzoru v příloze E. Tento dokument, který musí vyplnit veterinární lékař příslušný pro organizaci, institut nebo středisko původu, musí výslovně uvádět, že zvířata, sperma, vajíčka a embrya pocházejí z organizace, institutu nebo střediska schváleného v souladu s přílohou C; a musí je provázet během přepravy.
2.
a) Aby organizace, instituty nebo střediska byly schváleny, musí, pokud jde o choroby povinné hlášením, předložit příslušnému orgánu členského státu všechny relevantní podpůrné dokumenty vztahující se k požadavkům obsaženým v příloze C.
b) Po obdržení podkladů vztahujících se k žádosti o schválení nebo o obnovení schválení posoudí příslušný orgán doklady na základě údajů v nich obsažených a případně výsledků kontrol provedených na místě.
c) Příslušný orgán odejme schválení v souladu s bodem 3 přílohy C.
▼M9
d) Všechny schválené organizace, instituty, stanice a střediska zaregistruje příslušný orgán a vydá jim číslo schválení.
Každý členský stát vypracuje a průběžně aktualizuje seznam schválených organizací, institutů, stanic a středisek a jejich čísel schválení a zpřístupní jej ostatním členským státům a veřejnosti.
Podrobná pravidla pro jednotné uplatňování tohoto odstavce mohou být přijata postupem podle článku 26.
▼A1
e) Švédsko zavede opatření týkající se zařízení, institutů a středisek do dvou let ode dne vstupu smlouvy o přistoupení v platnost.
▼B
Článek 14
1. Pokud členský stát vypracuje nebo vypracoval buď přímo, nebo se zapojením chovatelů, dobrovolný nebo povinný program ke tlumení nebo sledování pro jednu z chorob uvedených v příloze B, může tento program předložit Komisi a uvede přitom zejména:
— výskyt choroby na jeho území,
— zda je choroba povinná hlášením,
— důvody pro provedení programu, s přihlédnutím k závažnosti choroby a účelnosti jeho nákladů vzhledem k výsledkům,
— zeměpisnou oblast, ve které má být program proveden,
— kategorie statusu použitelné na organizace, požadavky na každý druh zvířat při přijímání do hospodářství a testovací postupy, které se musí použít,
— postupy kontroly programu, včetně rozsahu zapojení chovatelů při provádění programu ke tlumení nebo k dozoru,
— opatření, která budou provedena, ztratí-li hospodářství z jakéhokoli důvodu svůj status,
— opatření, která se učiní, jestliže výsledky testů prováděných v rámci programu jsou pozitivní,
— nediskriminační povahu obchodu na území příslušného členského státu se zřetelem k obchodu uvnitř Společenství.
2. Komise posoudí programy předkládané členskými státy. Programy je možno schválit postupem podle článku 26, v souladu s kritérii stanovenými v odstavci 1. Stejným postupem se současně, nejpozději však do tří měsíců po předložení programu určí, které obecné nebo omezené doplňující záruky je možné při obchodu požadovat. Tyto záruky jít nad rámec záruk, které členský stát používá vnitrostátně.
3. Programy předkládané členskými státy mohou být měněny nebo doplňovány postupem podle článku 26. Stejným postupem mohou být měněny i záruky uvedené v odstavci 2.
Článek 15
1. Pokud je členský stát toho názoru, že je úplně nebo částečně prostý některé z chorob uvedených v příloze B, na kterou jsou zvířata uvedená v této směrnici vnímavá, předloží Komisi odpovídající podpůrnou dokumentaci; upřesní především:
— povahu choroby a její výskyt na jeho území v minulosti,
— výsledky testů v rámci dohledu na základě sérologického, mikrobiologického, patologického nebo epidemiologického vyšetření,
— období, během kterého je choroba povinná hlášením příslušným orgánům,
— dobu prováděného dohledu,
— případně období, během kterého bylo zakázáno očkování proti dané chorobě a zeměpisnou oblast na kterou se tento zákaz vztahoval,
— předpisy, na základě kterých lze ověřovat absenci výskytu choroby.
2. Komise po posouzení podpůrné dokumentace uvedené v odstavci 1 předloží Stálému veterinárnímu výboru rozhodnutí o schválení nebo zamítnutí plánu předloženého členským státem. Je-li plán přijat, stanoví se postupem podle článku 26 obecné nebo omezené doplňující záruky, které je možno při obchodu požadovat. Nesmějí jít nad rámec záruk, které členský stát uplatňuje vnitrostátně.
Až do rozhodnutí může příslušný členský stát trvat při obchodních jednáních na odpovídajících požadavcích, které jsou nutné pro dodržování jeho statusu.
3. Příslušný členský stát sdělí Komisi jakoukoli změnu v údajích uvedených v odstavci 1. Záruky definované v odstavci 2 mohou být podle takového sdělení změněny nebo zrušeny postupem podle článku 26.
KAPITOLA III
Ustanovení pro dovoz do Společenství
Článek 16
Podmínky pro dovoz zvířat, spermat, vajíček a embryí, na něž se vztahuje tato směrnice, musí být alespoň rovnocenné podmínkám stanoveným v kapitole II.
▼M14
Pokud jde o kočky, psy a fretky, musí být podmínky dovozu přinejmenším rovnocenné podmínkám stanoveným v čl. 10 odst. 1 písm. a) až d) a čl. 12 písm. a) nařízení (EU) č. 576/2013.
Kromě podmínek uvedených v druhém pododstavci musí být psi, kočky a fretky během přepravy na místo určení doprovázeni veterinárním osvědčením vyplněným a podepsaným úředním veterinárním lékařem, který potvrdí, že během 48 hodin před odesláním zvířat bylo provedeno klinické vyšetření veterinárním lékařem schváleným příslušným orgánem, který ověřil, že v době tohoto vyšetření byla zvířata způsobilá k přepravě na zamýšlenou cestu.
▼B
Článek 17
1. Pro jednotné provádění článku 16 se použijí ustanovení následujících odstavců.
▼C1
2. Do Společenství se mohou dovážet pouze zvířata a sperma, vajíčka a embrya, uvedené v článku 11, které vyhovují následujícím požadavkům:
▼M9
a) musí pocházet ze třetí země uvedené na seznamu vypracovaném podle odst. 3 písm. a);
b) musí být provázena veterinárním osvědčením, které odpovídá vzoru vyhotovenému postupem podle článku 26, je podepsáno příslušným orgánem vyvážející země a potvrzuje, že:
i) zvířata
— vyhovují doplňkovým podmínkám nebo nabízejí rovnocenné záruky podle článku 4 a
— pocházejí ze schválených stanic, středisek, organizací či institutů, jež poskytují záruky přinejmenším rovnocenné těm uvedeným v příloze C,
ii) sperma, vajíčka a embrya byly dodány schválenými inseminačními stanicemi nebo středisky pro jejich skladování a týmy pro odběr či produkci embryí, jež poskytují záruky přinejmenším rovnocenné těm, které mají být stanoveny v příloze D kapitole I postupem podle článku 26.
Do doby, než budou vypracovány seznamy třetích zemí a schválených zařízení uvedených v písmeni b) a než budou stanoveny veterinární požadavky a vzory veterinárních osvědčení podle písmen a) a b), platí nadále vnitrostátní pravidla za předpokladu, že nejsou příznivější než ta, která jsou stanovena v kapitole II.
3. Stanoví se následující:
a) postupem podle článku 26 seznam třetích zemí nebo částí třetích zemí, které mohou poskytnout členským státům a Komisi záruky rovnocenné zárukám stanoveným v kapitole II ve vztahu ke zvířatům, spermatu, vajíčkům a embryím;
b) podle tohoto písmene seznam schválených stanic, středisek nebo týmů, jak je uvedeno v čl. 11 odst. 2 první odrážce a v čl. 11 odst. 3 první odrážce, které se nacházejí v některé ze třetích zemí ze seznamu uvedeného v písmenu a) tohoto odstavce a pro které může příslušný orgán poskytnout záruky stanovené v čl. 11 odst. 2 a 3.
Seznam schválených stanic, středisek a týmů uvedený v prvním pododstavci a jejich veterinárních registračních čísel se sděluje Komisi.
Schválení stanic, středisek nebo týmů musí příslušný orgán třetí země neprodleně pozastavit nebo odejmout, pokud tato stanice, středisko nebo tým již nesplňuje podmínky stanovené v čl. 11 odst. 2 a 3, a musí o tom ihned informovat Komisi.
Komise poskytne členským státům veškeré nové a aktualizované seznamy, které podle druhého a třetího pododstavce obdrží od příslušného orgánu třetí země, a zpřístupní je veřejnosti pro informační účely.
Podrobná pravidla pro jednotné uplatňování tohoto písmene mohou být přijata postupem podle článku 26;
c) postupem podle článku 26 zvláštní veterinární požadavky, zvláště na ochranu Společenství před určitými exotickými chorobami, nebo záruky rovnocenné těm, které jsou uvedeny v této směrnici.
Zvláštní požadavky a rovnocenné záruky stanovené pro třetí země nesmí být příznivější než podmínky a záruky stanovené v kapitole II.
▼B
4. Seznamy uvedené v odstavci 3 mohou obsahovat jen třetí země nebo části třetích zemí:
a) ze kterých není zakázán dovoz:
— na základě výskytu jedné z chorob uvedených v příloze A nebo jakékoli jiné pro Společenství exotické choroby,
— podle článků 6, 7 a 14 směrnice 72/462/EHS a článku 17 směrnice 91/495/EHS a směrnice 71/118/EHS (
19
) nebo v případě jiných zvířat zahrnutých do této směrnice podle rozhodnutí učiněného v souladu s postupem stanoveným v článku 26 a beroucího v úvahu jejich zdravotní stav;
b) které vzhledem k jejich právním předpisům a organizaci jejich veterinárních útvarů a inspekčních útvarů, k oprávněním, která tyto orgány mají a k dozoru, kterému podléhají, byly uznány v souladu s čl. 3 odst. 2 směrnice 72/462/EHS za způsobilé zaručit provádění jejich právních předpisů;
c) jejichž veterinární útvary jsou schopny zaručit dodržování veterinárních požadavků, které jsou přinejmenším rovnocenné požadavkům stanoveným v kapitole II.
5. Odborníci Komise a členských států provedou kontroly na místě, aby ověřili, zda záruky dávané třetí zemí, pokud jde o podmínky pro produkci a uvádění na trh, lze považovat za rovnocenné podmínkám uplatňovaným ve Společenství.
Komise jmenuje na návrh členských států odborníky z členských států příslušné pro tyto kontroly.
Tyto kontroly se provádějí jménem Společenství, které v této souvislosti nese odpovídající náklady.
6. Dokud se neuskuteční organizace kontrol podle odstavce 5, používají se nadále vnitrostátní předpisy pro kontroly v třetích zemích s tím, že jakékoli porušení záruk daných odstavcem 3, které bylo zjištěno při těchto kontrolách, se hlásí v rámci Stálého veterinárního výboru.
Článek 18
1. Členské státy zajistí, aby se zvířata, sperma, vajíčka a embrya, na něž se vztahuje tato směrnice, dovážela do Společenství jen tehdy, jestliže:
— jsou provázena osvědčením vystaveným úředním veterinárním lékařem.
— Vzorové osvědčení se vypracuje v závislosti na druhu postupem podle článku 26,
— vyhověla kontrolám požadovaným směrnicemi 90/675/EHS a 91/496/EHS (
20
),
— byla před odesláním na území Společenství podrobena kontrole, při níž se úřední veterinární lékař přesvědčí, že podmínky pro přepravu stanovené ve směrnici 91/628/EHS (
21
) byly respektovány, zejména pokud jde o zaopatření vodou a krmivem,
— zvířata uvedená v článcích 5 až 10 byla před uvedením na trh držena v karanténě, jejíž náležitosti se mají stanovit postupem podle článku 26.
2. Až do stanovení prováděcích pravidel k tomuto článku se nadále použijí vnitrostátní předpisy pro dovozy ze třetích zemí, pro které dosud nebyly na úrovni Společenství takové požadavky stanoveny, pokud nejsou příznivější než předpisy uvedené v kapitole II.
Článek 19
Postupem podle článku 26 se stanoví:
a) zvláštní veterinární požadavky na dovoz do Společenství a povaha a obsah průvodních dokumentů zvířat určených pro zoologické zahrady, cirkusy, zábavní parky nebo pokusné laboratoře, podle druhů;
b) doplňkové záruky k těm, které jsou stanoveny pro různé druhy zvířat, na které se vztahuje tato směrnice, za účelem ochrany dotyčných druhů žijících ve Společenství.
Článek 20
▼M9
Pravidla stanovená směrnicí 97/78/ES se použijí zejména pro organizaci kontrol, které mají provádět členské státy, a následný postup v návaznosti na tyto kontroly a pro ochranná opatření, která se mají používat v souladu s postupem podle článku 22 uvedené směrnice.
▼B
►C2
Až do provedení rozhodnutí uvedených v čl. 8 bodu B a článku 30 směrnice 91/496/EHS ◄ nadále platí dotyčné vnitrostátní prováděcí předpisy k čl. 8 odst. 1 a 2 zmíněné směrnice, bez dotčení shody se zásadami a pravidly uvedenými v odstavci 1 tohoto článku.
KAPITOLA IV
Společná a závěrečná ustanovení
Článek 21
Případné vzory osvědčení pro obchod a veterinární předpisy, které musí být splněny, aby byl možný obchod se zvířaty, spermatem, vajíčky a embryi, a jež nejsou uvedeny v článcích 5 až 11, se v případě potřeby určí postupem podle článku 26.
Článek 22
Přílohy k této směrnici budou v případě potřeby pozměněny postupem podle článku 26.
▼A1
Příloha B bude přezkoumána přede dnem vstupu smlouvy o přistoupení v platnost, a to zejména za účelem změny seznamu nemocí zahrnutím nemocí, na něž jsou vnímaví přežvýkavci a prasata, a nemocí přenosných spermatem, vajíčky a embryi ovcí.
▼B
Článek 23
Postupem podle článku 26 mohou být v případě potřeby stanoveny odchylně
►M7
————— ◄ od kapitoly II zvláštní podmínky pro přesuny zvířat cirkusů a lunaparků a pro obchod se zvířaty, spermatem, vajíčky a embryi určenými pro zoologické zahrady.
Článek 24
1. Členské státy jsou oprávněny podřídit vstup zvířat na svá uzemí (včetně voliérového ptactva) spermatu, vajíček a embryí uvedených v této směrnici, která prošly územím třetí země, předložením veterinárního osvědčení potvrzujícího soulad s požadavky této směrnice.
2. Členské státy, které využívají možnosti stanovené v odstavci 1, informují o tom Komisi a ostatní členské státy v rámci Stálého veterinárního výboru.
Článek 25
V příloze A směrnice 90/425/EHS se doplňuje následující text:
„Směrnice Rady 92/65/EHS ze dne 13. července 1992 o veterinárních předpisech pro obchod se zvířaty, spermatem, vajíčky a embryí uvnitř Společenství a jejich dovoz do Společenství, pokud se na něž nevztahují veterinární předpisy stanovené ve zvláštních předpisech Společenství uvedené v příloze A oddíl I směrnice 90/425/EHS (Úř. věst. L 268, 14.9.1992, s. 54).“
▼M7
Článek 26
1. Komisi je nápomocen Stálý výbor pro potravinový řetězec a zdraví zvířat zřízený článkem 58 nařízení Evropského parlamentu a Rady (ES) č. 178/2002. (
22
)
2. Odkazuje-li se na tento odstavec, použijí se články 5 a 7 rozhodnutí 1999/468/ES.
Doba stanovená v čl. 5 odst. 6 rozhodnutí 1999/468/ES (
23
) je tři měsíce.
3. Výbor přijme svůj jednací řád.
▼B
Článek 27
Členské státy, které používají jinou úpravu kontrol, která poskytuje záruky rovnocenné zárukám uvedeným v této směrnici, pokud jde v rámci jejich území o přesuny zvířat, spermatu, vajíček a embryí, jichž se tato směrnice týká, si mohou navzájem na základě vzájemnosti povolit odchylky od čl. 6 odd. A odst. 1 písm. f), čl. 8 písm. b) a čl. 11 odst. 1 písm. d).
Článek 28
Postupem podle článku 26 mohou být přijata pro období tří let přechodná opatření, aby se usnadnil přechod na nový systém stanovený touto směrnicí.
Článek 29
1. Členské státy uvedou v účinnost právní a správní předpisy nezbytné pro dosažení souladu s touto směrnicí. Neprodleně o nich uvědomí Komisi.
Tato opatření přijatá členskými státy musí obsahovat odkaz na tuto směrnici nebo musí takový odkaz učiněn při jejich úředním vyhlášení. Způsob odkazu si stanoví členské státy.
2. Členské státy sdělí Komisi znění hlavních ustanovení vnitrostátních právních předpisů, které přijmou v oblastech působnosti této směrnice.
3. Stanovením konečného termínu pro provedení do vnitrostátního práva na den 1. leden 1994 zůstává nedotčeno zrušení veterinárních kontrol na hranicích stanovené ve směrnicích 89/662/EHS a 90/425/EHS.
Článek 30
Tato směrnice je určena členským státům.
▼M6
PŘÍLOHA A
CHOROBY POVINNÉ HLÁŠENÍM V RÁMCI TÉTO SMĚRNICE
|
Choroby
|
Primárně postižené řády/rody/druhy
|
|
Mor koní
|
Equidae
|
|
Africký mor prasat
|
Suidae a Tayassuidae
|
|
Influenza ptáků
|
Aves
|
|
Mor včelího plodu
|
Apis
|
|
Sněť slezinná
|
Bovidae, Camelidae, Cervidae, Elephantidae, Equidae a Hippopotamidae
|
|
Katarální horečka ovcí
|
Antilocapridae, Bovidae, Cervidae, Giraffidae a Rhinocerotidae
|
|
Brucellosis abortus
|
Antilocapridae, Bovidae, Camelidae, Cervidae, Giraffidae, Hippopotamidae a Tragulidae
|
|
Brucellosis melitensis
|
Antilocapridae, Bovidae, Camelidae, Cervidae, Giraffidae, Hippopotamidae a Tragulidae
|
|
Brucellosis ovis
|
Camelidae, Tragulidae, Cervidae, Giraffidae, Bovidae a Antilocapridae
|
|
Brucellosis suis
|
Cervidae, Leporidae, Ovibos moschatus, Suidae a Tayassuidae
|
|
Klasický mor prasat
|
Suidae a Tayassuidae
|
|
Plicní nákaza skotu
|
Turovití (včetně zebu, buvolů, bizonů a jaků)
|
|
Ebola
|
Primáti
|
|
Slintavka a kulhavka
|
Artiodactylaa asijští sloni
|
|
Infekční nekróza krvetvorné tkáně
|
Salmonidae
|
|
Nodulární dermatitida
|
Bovidae a Giraffidae
|
|
Neštovice opic
|
Rodentia a primáti
|
|
Mycobacterium bovis
|
Mammalia, zejména Antilocapridae, Bovidae, Camelidae, Cervidae, Giraffidae a Tragulidae
|
|
Newcastleská choroba
|
Aves
|
|
Mor malých přežvýkavců
|
Bovidae a Suidae
|
|
Enterovirová encefalomyelitida prasat
|
Suidae
|
|
Psittakóza (papouščí nemoc)
|
Psittaciformes
|
|
Vzteklina
|
Carnivora a Chiroptera
|
|
Horečka údolí Rift
|
Bovidae, druhy Camelus a Rhinocerotidae
|
|
Mor skotu
|
Artiodactyla
|
|
Malý úlový brouk (Aethina tumida)
|
Apis a Bombus
|
|
Neštovice ovcí a koz
|
Bovidae
|
|
Vezikulární choroba prasat
|
Suidae a Tayassuidae
|
|
Roztoč Tropilaelaps (Tropilaelapsspp.)
|
Apis
|
|
Vezikulární stomatitida
|
Artiodactyla a Equidae
|
|
TSE
|
Bovidae, Cervidae, Felidae a Mustelidae
|
▼B
PŘÍLOHA B
SEZNAM CHOROB, PRO KTERÉ JE V RÁMCI TÉTO SMĚRNICE MOŽNÉ UZNAT VNITROSTÁTNÍ PROGRAMY
|
norci
|
virová enteritida
aleutská choroba
|
|
včely
|
hniloba včelího plodu
varroáza a akarapidóza
|
|
opice a šelmy kočkovité
|
tuberkulóza
|
|
přežvýkavci
|
tuberkulóza
|
|
zajícovití
|
myxomatóza
virová a hemoragická onemocnění
tularémie
|
▼M3
PŘÍLOHA C
PODMÍNKY PRO SCHVÁLENÍ ORGANIZACÍ, INSTITUTŮ NEBO STŘEDISEK
1. K získání úředního schválení podle čl. 13 odst. 2 této směrnice musí organizace, instituty nebo střediska definovaná v čl. 2 odst. 1 písm. c):
a) být jasně ohraničena a oddělena od svého okolí, případně zvířata musí být umístěna v dostatečně vzdálenosti od zemědělských hospodářství, jejichž nákazový status by mohl být ohrožen;
b) mít vhodné prostředky pro chytání, uzavírání a izolování zvířat a musí mít k dispozici přiměřené karanténní zařízení a dodržovat schválené postupy pro zvířata pocházející z neschválených zdrojů;
c) být prostá chorob uvedených v příloze A a chorob uvedených v příloze B, pokud jde choroby, které jsou v dotyčné zemi zahrnuty do programu podle článku 14. Příslušný orgán za účelem prohlášení organizace, institutu nebo střediska za prosté nákazy vyhodnotí záznamy o nákazovém statusu, uchovávané alespoň za poslední tři roky, a záznamy klinických a laboratorních vyšetření prováděných na zvířatech v organizaci, institutu nebo středisku. Odchylně od tohoto požadavku se však nová zařízení schválí, byla-li zvířata tvořící skupinu získána ze schválených zařízení;
d) vést aktuální záznamy o:
i) počtu a identitě (stáří, pohlaví, druh a v případě potřeby také individuální identifikace) zvířat každého druhu přítomného v zařízení;
ii) počtu a totožnosti (stáří, pohlaví, druh a v případě potřeby také individuální identifikace) zvířat přicházejících do zařízení a opouštějících zařízení, spolu s údaji o jejich původu nebo místu určení, přepravě z nebo do zařízení a nákazovém statusu;
iii) výsledcích sérologických vyšetření a všech ostatních diagnostických postupů;
iv) případech onemocnění a případně o prováděném léčení;
v) výsledcích pitev všech zvířat uhynulých v zařízení, včetně mrtvě narozených zvířat;
vi) pozorováních prováděných během období izolace nebo karantény,
e) mít buď dohodu s laboratoří příslušnou k provádění pitev, nebo mít jedno či více vhodných zařízení, v nichž může příslušná osoba pod kontrolou úředního veterinárního lékaře tyto pitvy provádět;
f) mít buď dohodu nebo zařízení na místě pro řádné odstraňování zvířat uhynulých na chorobu nebo utracených;
g) zajistit smluvně nebo pomocí právně závazné úpravy služby veterinárního lékaře schváleného a pracujícího pod kontrolou příslušného orgánu, který:
i) přiměřeně vyhovuje požadavkům uvedeným v čl. 14 odst. 3 písm. B směrnice 64/432/EHS;
ii) zajistí, aby příslušný orgán schválil vhodný dozor nad nákazou a zdolávací opatření ve vztahu k nákazové situaci dotyčné země a používal je v organizaci, institutu nebo středisku. Taková opatření zahrnují:
— roční plán dozoru nad nákazami včetně příslušných kontrol zoonóz zvířat,
— klinická, laboratorní a pitevní vyšetření zvířat, u nichž existuje podezření z nakažení chorobami,
— očkování vnímavých zvířat proti chorobám podle potřeby, a to pouze v souladu s právními předpisy Společenství;
iii) zajistí, aby se všechna podezřelá uhynutí nebo přítomnost každého podezřelého příznaku naznačujícího, že se zvíře nakazilo jednou nebo více chorobami uvedenými v příloze A a B, bez prodlení oznámila příslušnému orgánu, jestliže se jedná o chorobu v dotyčném členském státě povinnou hlášením;
iv) zajistí, aby byla příchozí zvířata izolována podle potřeby a v souladu s požadavky této směrnice a pokyny, existují-li takové, které vydal příslušný orgán;
v) je zodpovědný za každodenní dodržování veterinárních požadavků této směrnice a právních předpisů Společenství, týkajících se ochrany zvířat během přepravy, a za zneškodňování odpadu živočišného původu;
h) jestliže chová zvířata určená k laboratorním pokusům v souladu s ustanoveními článku 5 směrnice Rady č. 86/609/EHS.
2. Schválení se zachová, pokud jsou splněny tyto požadavky:
a) místo je pod kontrolou úředního veterinárního lékaře z příslušného orgánu, který:
i) navštíví objekty organizace, institutu nebo střediska alespoň jednou za rok;
ii) prověří činnost úředního veterinárního lékaře a provádění ročního plánu dozoru nad nákazami;
iii) zajistí plnění ustanovení této směrnice;
b) do zařízení se přivádějí pouze zvířata pocházející z jiné schválené organizace, institutu nebo střediska, a to v souladu s ustanoveními této směrnice;
c) úřední veterinární lékař prověřuje, zda:
— se plní ustanovení této směrnice,
— výsledky klinických, pitevních a laboratorních vyšetření zvířat neodhalily žádný výskyt choroby uvedené v přílohách A a B;
d) organizace, institut nebo středisko po schválení uchovává záznamy uvedené v bodě 1 písm. d) po dobu alespoň deseti let.
3. Odchylně od čl. 5 odst. 1 této směrnice a bodu 2 písm. b) této přílohy mohou být zvířata včetně opic (Simiae a Prosimiae), jež mají jiný původ než schválené organizace, institut nebo středisko, přivezena do schválené organizace, institutu nebo střediska, a to za předpokladu, že tato zvířata podstoupí předtím, než jsou zařazena do skupiny, karanténu pod úřední kontrolou a v souladu s pokyny vydanými příslušným orgánem.
U opic (Simiae a Prosimiae) se respektují požadavky na karanténu stanovené Mezinárodním veterinárním kodexem OIE (kapitola 2.10.1 a dodatek 3.5.1).
U ostatních zvířat, která podstupují karanténu v souladu s bodem 2 písm. b) této přílohy, musí období karantény trvat alespoň 30 dnů, pokud jde o choroby uvedené v příloze A.
4. Zvířata chovaná ve schválené organizaci, institutu nebo středisku smějí opustit toto zařízení pouze tehdy, jsou-li určena pro jinou schválenou organizaci, institut nebo středisko, a to v uvedeném členském státě nebo jiném členském státě; pokud však nejsou určena pro jinou schválenou organizaci, institut nebo středisko, smějí je opustit pouze v souladu s požadavky příslušného orgánu na vyloučení veškerého rizika možného rozšíření nákazy.
5. Pokud členský stát využívá z doplňkové záruky podle právních předpisů Společenství, může požádat o to, aby schválená organizace, institut nebo středisko doplnilo příslušná doplňková opatření a osvědčení pro vnímavé druhy.
6. Postupy pro částečné nebo úplné pozastavení, odnětí nebo obnovení schválení jsou tyto:
a) pokud příslušný orgán zjistí, že požadavky bodu 2 nebyly splněny nebo že došlo ke změně v účelu použití, který již nespadá do působnosti článku 2 směrnice, schválení se pozastaví nebo zruší;
b) pokud se podá oznámení o podezření na jednu z chorob uvedených v příloze A nebo B, příslušný orgán pozastaví schválení organizace, institutu nebo střediska, dokud se podezření úředně nevyloučí. Podezření se může v závislosti na dotyčné chorobě a riziku přenosu nákazy vztahovat k nařízení jako celku nebo pouze k některým kategoriím zvířat vnímavých na dotyčnou chorobu. Příslušný orgán zajistí, aby se učinila opatření, která jsou nezbytná za účelem potvrzení nebo vyloučení podezření a za účelem zabránění jakémukoli rozšíření nákazy, a to v souladu s právními předpisy Společenství pro zdolávací opatření proti dotyčné nákaze a pro obchod se zvířaty;
c) pokud se podezření na nákazu potvrdí, organizace, institut nebo středisko se znovu schválí pouze v případě, že v zařízení jsou po eradikaci nákazy a zdroje nákazy včetně příslušného čištění a desinfikování znovu splněny podmínky stanovené v bodě 1 této přílohy, s výjimkou bodu 1 písm. c);
d) příslušný orgán informuje Komisi o pozastavení, odnětí nebo obnovení schválení organizace, institutu nebo střediska.
▼M10
PŘÍLOHA D
KAPITOLA I
Podmínky pro inseminační stanice, střediska pro skladování spermatu a týmy pro odběr embryí a týmy pro produkci embryí
I.
Podmínky pro schvalování inseminačních stanic a středisek pro skladování spermatu
|
1.
|
Pro schválení a udělení veterinárního registračního čísla podle čl. 11 odst. 4 musí každá inseminační stanice:
▼M16
1.1 být pod dozorem veterinárního lékaře pověřeného příslušným orgánem;
▼M10
1.2 mít alespoň:
a) uzamykatelná zařízení pro ustájení zvířat a u koňovitých v případě potřeby výběh, oddělený od zařízení pro odběr, místností pro zpracování a pro skladování;
b) izolační zařízení bez přímého kontaktu s obvyklým místem ustájení zvířat;
c) zařízení pro odběr spermatu, které umožňuje ochranu proti nepříznivým povětrnostním vlivům, s neklouzavou podlahou, která chrání proti vážným úrazům v případě pádu v místě odběru spermatu a okolí, aniž jsou dotčeny požadavky uvedené v bodě 1.4;
d) samostatnou místnost pro čištění a dezinfekci nebo sterilizaci vybavení;
e) místnost pro zpracování spermatu, oddělenou od zařízení pro odběr a místnosti pro čištění vybavení uvedené v písmeni d), která nemusí být nutně na stejném místě;
f) místnost pro skladování spermatu, která nemusí být nutně na stejném místě;
1.3 být postavena nebo izolována způsobem, který zabrání jakémukoliv kontaktu se zvířaty vně stanice;
1.4 být postavena způsobem, který umožní snadné čištění a dezinfekci celé inseminační stanice kromě kancelářských prostor a v případě koňovitých i výběhu.
|
|
2.
|
Pro schválení musí každé středisko pro skladování spermatu:
a) mít zvláštní veterinární registrační číslo podle čl. 11 odst. 4 pro každý živočišný druh, jehož sperma je ve středisku skladováno – pokud skladování není omezeno na sperma jednotlivých živočišných druhů odebírané v inseminačních stanicích schválených podle této směrnice nebo pokud jsou ve středisku skladována embrya v souladu s touto směrnicí;
b) být pod trvalým dozorem veterinárního lékaře pověřeného příslušným orgánem;
c) mít místnost pro skladování spermatu vybavenou potřebným zařízením pro skladování spermatu a/nebo embryí, jejíž stavební řešení je takové, aby tyto produkty a zařízení byly chráněny před nepříznivými vlivy prostředí a povětrnostními vlivy;
d) být postaveno způsobem, který zabrání kontaktu s hospodářskými zvířaty nebo jinými zvířaty vně stanice;
e) být postaveno způsobem, který umožní snadné čištění a dezinfekci celého střediska kromě kancelářských prostor a v případě koňovitých i výběhu;
f) být postaveno způsobem, který účinně zabrání v přístupu nepovolaným osobám.
|
II.
Podmínky pro dozor nad inseminačními stanicemi a středisky pro skladování spermatu
|
1.
|
Inseminační stanice musí:
1.1 mít dozor, který zaručí, že
a) v nich budou pouze zvířata těch druhů, jejichž sperma se má odebírat.
Mohou však být přijata jiná domácí zvířata, pokud nepředstavují nebezpečí nákazy pro druhy, jejichž sperma se má odebírat, a splňují podmínky stanovené veterinárním lékařem stanice.
Pokud v případě koňovitých se inseminační stanice nachází ve stejném areálu jako středisko umělého oplodnění nebo plemenitby, pak se klisny a nekastrovaní koně (hřebci) jako prubíři nebo k přirozené plemenitbě přijímají, pokud splňují požadavky uvedené v kapitole II oddíle I bodech 1.1, 1.2, 1.3 a 1.4;
b) není možný přístup nepovolaných osob a oprávnění návštěvníci musí splňovat podmínky stanovené veterinárním lékařem stanice;
c) je zaměstnáván výhradně způsobilý personál s odpovídajícím vzděláním, pokud jde o dezinfekční a hygienické postupy, aby nedocházelo k šíření chorob;
1.2 být sledovány, aby bylo zajištěno, že:
a) jsou vedeny záznamy, které evidují
i) druhy, plemena, data narození a identifikaci každého zvířete ve stanici,
ii) každý pohyb zvířat přijímaných a opouštějících stanici,
iii) zdravotní záznamy, veškeré diagnostické testy a jejich výsledky, ošetření a očkování zvířat nacházejících se ve stanici,
iv) datum odběru a zpracování spermatu,
v) místo určení spermatu,
b) žádné zvíře nacházející se ve stanici nebude použito pro účely přirozeného rozmnožování nejméně 30 dnů před prvním odběrem spermatu a po dobu odběru;
c) odběr, zpracování a skladování spermatu bude probíhat výhradně v místech k těmto účelům vyhrazených;
d) všechny nástroje, které se dostávají do styku se spermatem nebo dárcovským zvířetem během odběru a zpracování, jsou před použitím řádně dezinfikovány či sterilizovány, s výjimkou nástrojů nových, jednorázově používaných a po použití likvidovaných (na jedno použití).
Pokud v případě koňovitých se inseminační stanice nachází ve stejném areálu jako středisko umělého oplodnění nebo plemenitby, musí být sperma a nástroje a vybavení pro umělé oplodnění nebo přirozenou plemenitbu důsledně odděleny od nástrojů a vybavení, s nimiž přicházejí do styku dárcovská zvířata či jiná zvířata nacházející se ve stanici;
e) produkty živočišného původu používané při zpracovávání spermatu, včetně ředidel, doplňkových látek nebo nastavovadel, byly získány ze zdrojů, které nejsou nebezpečné pro zdraví zvířat nebo byly před použitím ošetřeny tak, aby se toto riziko vyloučilo;
f) mrazicí směsi používané ke konzervaci nebo skladování spermatu nebyly předtím použity na jiné produkty živočišného původu;
g) skladovací a přepravní nádoby byly před každým naplněním řádně dezinfikovány, nebo sterilizovány, s výjimkou nádob nových, jednorázově používaných a po použití likvidovaných (na jedno použití);
h) každá dávka spermatu nebo každý ejakulát čerstvého spermatu určeného k dalšímu zpracování jsou zřetelně označeny tak, aby bylo možno snadno určit datum odběru, druh, plemeno a identifikaci dárcovského zvířete a číslo schválení inseminační stanice;
1.3 být kontrolovány úředním veterinárním lékařem během plemenné sezóny alespoň jednou v každém kalendářním roce v případě sezónně plemenných zvířat a dvakrát v každém kalendářním roce v případě zvířat s nesezónní reprodukcí, aby analyzoval a ověřil veškeré aspekty týkající se podmínek pro schvalování, dozor a sledování, podle potřeby na základě záznamů, standardních provozních postupů a interních auditů.
|
|
2.
|
Střediska pro skladování spermatu:
2.1 musí mít takový dozor, aby bylo zajištěno, že
a) veterinární status dárcovských zvířat, jejichž sperma je skladováno ve středisku, splňuje požadavky této směrnice;
b) jsou splněny požadavky stanovené v bodě 1.1 písm. b) a c);
c) jsou vedeny záznamy o veškerém pohybu spermatu přijímaného i opouštějícího skladovací středisko;
2.2 musí být sledovány, aby
a) do schváleného střediska pro skladování bylo přijímáno pouze sperma, které bylo odebráno a pochází ze schválené inseminační stanice nebo schváleného střediska pro skladování spermatu, bylo přepravováno za podmínek zaručujících veškeré veterinární záruky a nepřišlo do styku se spermatem nesplňujícím podmínky této směrnice;
b) sperma bylo za přísných hygienických podmínek skladováno pouze v místech k tomuto účelu vyhrazených;
c) veškeré nástroje, které se dostanou do styku se spermatem, byly před použitím řádně dezinfikovány nebo sterilizovány s výjimkou nástrojů na jedno použití;
d) skladovací a přepravní nádoby byly před každým naplněním řádně dezinfikovány nebo sterilizovány s výjimkou nádob na jedno použití;
e) mrazicí směsi používané ke konzervaci nebo skladování spermatu nebyly předtím použity na jiné produkty živočišného původu;
f) každá dávka spermatu byla zřetelně označena tak, aby bylo možné snadno určit datum odběru, druh, plemeno a identifikaci dárcovského zvířete a číslo schválení inseminační stanice; každý členský stát sdělí Komisi a ostatním členským státům charakteristiky a formu značení používaného na jeho území;
2.3 mohou odchylně od bodu 2.2 písm. a) skladovat embrya, pokud tato embrya splňují požadavky této směrnice a jsou skladována v samostatných nádobách;
2.4 být kontrolována úředním veterinárním lékařem alespoň dvakrát v každém kalendářním roce, aby analyzoval a ověřil veškeré aspekty týkající se podmínek pro schvalování, dozor a sledování, podle potřeby na základě záznamů, standardních provozních postupů a interních auditů.
|
III.
Podmínky pro schvalování a dozor nad týmy pro odběr embryí a týmy pro produkci embryí
|
1.
|
Pro schválení musí každý tým pro odběr embryí splňovat tyto podmínky:
1.1 odběr, zpracování a skladování embryí provádí buď veterinární lékař týmu, nebo na jeho odpovědnost jeden či více způsobilých techniků, veterinárním lékařem vyškolených v hygienických metodách a technikách a v technikách a principech tlumení nákaz;
1.2 veterinární lékař týmu odpovídá za veškerou činnost týmu, tj. mimo jiné za:
a) ověřování identity a veterinárního statusu dárcovských zvířat;
b) sanitární nezávadnosti ošetřování dárcovských zvířat a zacházení s nimi;
c) dezinfekci a hygienické postupy;
d) vedení záznamů, které evidují:
i) druhy, plemena, data narození a identifikaci každého dárcovského zvířete,
ii) zdravotní záznamy, veškeré diagnostické testy a jejich výsledky, ošetření a očkování dárcovských zvířat,
iii) místo a datum odběru, zpracování a skladování oocytů, vajíček a embryí,
iv) identifikační údaje embryí a podrobné údaje o jejich místě určení, jsou-li známé;
1.3 tým podléhá všeobecnému dozoru ze strany úředního veterinárního lékaře, který kontrolou alespoň jednou v každém kalendářním roce zabezpečí dodržování sanitárních podmínek pro odběr, zpracování a skladování embryí a ověří všechny aspekty týkající se podmínek schvalování a dozoru, podle potřeby na základě záznamů, standardních provozních postupů a interních auditů;
1.4 tým musí mít na vyšetřování, zpracování a ukládání embryí k dispozici stálou nebo mobilní laboratoř, která má alespoň pracovní plochu, optický nebo elektronový mikroskop a podle potřeby mrazicí zařízení;
1.5 stálá laboratoř musí mít:
a) místnost na zpracování embryí, fyzicky oddělenou od prostoru pro odběry od dárcovských zvířat;
b) místnost pro čištění a sterilizaci nástrojů, pokud nejsou užívány nástroje na jedno použití;
c) místnost na skladování embryí;
1.6 mobilní laboratoř musí:
a) mít speciálně zařízenou část vozidla, rozdělenou na dva oddělené sektory:
i) sterilní – na vyšetřování a zpracování embryí a
ii) ukládací – na vybavení a materiály používané ve styku s dárcovskými zvířaty;
b) užívat pouze vybavení na jedno použití, pokud nelze ve spojení se stálou laboratoří zajistit sterilizaci vybavení a přívod tekutin a ostatních produktů potřebných pro odběr a zpracování embryí;
1.7 stavební a dispoziční řešení budovy i laboratoří a provádění činnosti týmu musí být takové, aby byla zaručena ochrana proti vzájemné kontaminaci embryí;
1.8 tým musí mít k dispozici skladovací prostory umožňující:
a) vyčlenit alespoň jednu uzamykatelnou místnost na skladování vajíček a embryí;
b) snadné čištění a dezinfekci;
c) trvale vést záznamy o všech přijímaných a vydávaných vajíčkách a embryích;
d) skladovat nádoby na vajíčka a embrya na místě kontrolovaném veterinárním lékařem týmu a pravidelně kontrolovatelném úředním veterinárním lékařem;
1.9 skladování spermatu ve skladovacích prostorách podle bodu 1.8 může být příslušným orgánem povoleno za podmínek, že:
a) sperma splňuje požadavky této směrnice pro živočišné druhy ovcí, koz nebo koní nebo požadavky směrnice Rady 90/429/EHS ze dne 26. června 1990, kterou se stanoví veterinární požadavky na obchod se spermatem prasat uvnitř Společenství a na jeho dovoz (
24
);
b) sperma je pro potřeby týmu ukládáno v samostatných skladovacích nádobách v prostorách schválených pro skladování embryí.
|
|
2.
|
Pro schválení musí každý tým pro produkci embryí splňovat také tyto doplňkové podmínky:
2.1 členové týmu jsou patřičně vzděláni v oblasti tlumení nákaz a laboratorních metod, zejména pokud jde o postupy práce ve sterilních podmínkách;
2.2 tým má k dispozici stálou laboratoř, která:
a) má náležité vybavení a příslušenství, včetně samostatných místností pro:
— izolaci oocytů z vaječníků,
— zpracování oocytů, vajíček a embryí,
b) má zařízení s laminárním prouděním či jiné vhodné zařízení na technické operace ve specifických sterilních podmínkách (zpracování vajíček, embryí a spermatu).
Odstřeďování spermatu lze však při dodržení hygienických podmínek provádět mimo zařízení s laminárním prouděním či jiné zařízení;
2.3 v případě, že se vajíčka a jiné tkáně odebírají na jatkách, musí mít jatka k dispozici vhodné vybavení pro hygienický a bezpečný odběr a přepravu vaječníků a jiných tkání do laboratoře ke zpracování.
|
KAPITOLA II
Podmínky pro dárcovská zvířata
I.
Podmínky pro dárcovské hřebce
|
1.
|
Pro využití k odběru spermatu musí dárcovský hřebec splňovat následující podmínky, které ověřuje veterinární lékař střediska:
1.1 nejeví žádné klinické příznaky infekční nebo přenosné choroby při přijetí ani v den odběru spermatu;
1.2 pochází z území nebo v případě rozdělení do oblastí z části území členského státu nebo třetí země a z hospodářství pod dozorem veterinárního lékaře splňujících požadavky směrnice 90/426/EHS;
1.3 nacházel se po dobu 30 dnů před datem odběru spermatu v hospodářstvích, kde žádný koňovitý nevykazoval klinické příznaky infekční arteritidy koní nebo nakažlivé metritidy koní během tohoto období;
1.4 nebyl použit k účelům přirozeného rozmnožování během 30 dnů předcházejících prvnímu odběru spermatu a během období odběru;
▼M16
1.5 byl podroben testům provedeným a osvědčeným v laboratoři, kterou uznávají příslušné orgány a která má níže zmíněné testy ve své akreditaci podle článku 12 nařízení Evropského parlamentu a Rady (ES) č. 882/2004 (
25
), podle programu zmíněného v bodě 1.6:
▼C3
a) testu na imunodifúzi na agarovém gelu (test dle Cogginse) nebo testu ELISA pro testování nakažlivé chudokrevnosti koní, a to s negativním výsledkem;
▼M16
b) testu na izolaci viru infekční arteritidy koní nebo na zjištění jejího genomu polymerázovou řetězovou reakcí (PCR) nebo PCR v reálném čase provedenému s negativním výsledkem na alikvotní části veškerého spermatu dárcovského hřebce, pokud nebylo negativního výsledku dosaženo na séru ředěném 1:4 při testu na séroneutralizaci pro testování infekční arteritidy koní;
c) testu na určení původce nakažlivé metritidy koní provedenému s negativním výsledkem na třech vzorcích (stěrech) odebraných dárcovskému hřebci dvakrát po sobě v intervalu nejméně sedmi dnů a v žádném případě ne dříve než sedm dnů (u systémové léčby) či 21 dnů (u lokální léčby) po možné antimikrobiální léčbě dárcovského hřebce z alespoň následujících částí těla:
Před odesláním do laboratoře musí být vzorky umístěny do transportního média s aktivním uhlím (např. Amies).
Vzorky musí být podrobeny alespoň jednomu z následujících testů:
i) kultuře za mikroaerofilních podmínek po dobu alespoň sedmi dní na izolaci Taylorella equigenitalis, založené do 24 hodin po odebrání vzorku z dárcovského zvířete, nebo do 48 hodin v případech, kdy jsou vzorky během transportu uchovávány v chladu; nebo
ii) polymerázové řetězové reakci (PCR) nebo PCR v reálném čase na zjištění genomu Taylorella equigenitalis, provedené do 48 hodin od odebrání vzorků z dárcovského zvířete.
▼M10
1.6 byl podroben některému z těchto testovacích programů:
▼M16
a) pokud dárcovský hřebec nepřetržitě pobýval v inseminační stanici alespoň 30 dnů před datem prvního odběru spermatu a po dobu odběru, a pokud žádní koňovití v inseminační stanici nepřišli do přímého styku s koňovitým s veterinárním statusem nižším, než má dárcovský hřebec, provedou se testy podle bodu 1.5 na vzorcích odebraných dárcovskému hřebci alespoň jednou ročně na začátku plemenné sezóny nebo před prvním odběrem spermatu určeného k obchodu s čerstvým, chlazeným nebo zmrazeným spermatem a minimálně 14 dní po počátečním datu pobytu trvajícího alespoň 30 dnů před prvním odběrem spermatu;
b) pokud dárcovský hřebec nepřetržitě pobýval v inseminační stanici alespoň 30 dnů před datem prvního odběru spermatu a po dobu odběru, ale může stanici příležitostně opouštět se souhlasem veterinárního lékaře stanice na nepřetržitou dobu kratší než 14 dnů a/nebo jiní koňovití v inseminační stanici přicházejí do přímého styku s koňovitým s nižším veterinárním statusem, provedou se testy podle bodu 1.5 takto:
i) alespoň jednou ročně na vzorcích odebraných dárcovskému hřebci na začátku plemenné sezóny nebo před prvním odběrem spermatu určeného k obchodu s čerstvým, chlazeným nebo zmrazeným spermatem a minimálně 14 dní po počátečním datu pobytu trvajícího alespoň 30 dnů před prvním odběrem spermatu; a
ii) během doby odběru spermatu určeného k obchodu s čerstvým, chlazeným nebo zmrazeným spermatem takto:
— test podle bodu 1.5 písm. a) na vzorcích odebraných maximálně 90 dnů před odběrem spermatu určeného k obchodu;
▼C3
— test podle bodu 1.5 písm. b) na vzorcích odebraných maximálně 30 dnů před odběrem spermatu určeného k obchodu, kromě případu, kdy test na izolaci viru, PCR nebo PCR v reálném čase provedený na vzorcích alikvotní části veškerého spermatu odebraného maximálně 6 měsíců před odběrem spermatu určeného k obchodu potvrdí, že dárcovský hřebec není šiřitelem, a kdy dárcovský hřebec reagoval pozitivně v sérumneutralizačním testu na infekční arteritidu koní se sérem ředěným v poměru alespoň 1:4;
▼M16
— test podle bodu 1.5 písm. c) na vzorcích odebraných maximálně 60 dnů před odběrem spermatu určeného k obchodu, který může být v případě PCR nebo PCR v reálném čase proveden na třech vzorcích (stěrech) odebraných jen jednou;
c) pokud dárcovský hřebec nesplňuje podmínky uvedené v písmenech a) a b) a odběr spermatu se provádí pro účely obchodu se zmrazeným spermatem, provedou se testy podle bodu 1.5 na vzorcích odebraných dárcovskému hřebci takto:
i) alespoň jednou za rok na začátku plemenné sezóny;
ii) během doby skladování uvedené v bodě kapitole III oddíle I bodě 1.3 písm. b) a před odstraněním spermatu ze střediska nebo použitím, na vzorcích odebraných 14 až 90 dnů po datu odběru spermatu.
Odchylně od podbodu ii) není postup pro vzorky po odběru a testy na infekční arteritidu koní popsaný v bodě 1.5 písm. b) vyžadován v případě, kdy test na izolaci viru, PCR, nebo PCR v reálném čase provedený na alikvotní části veškerého spermatu odebraného dvakrát ročně v minimálně čtyřměsíčním intervalu potvrdí, že séropozitivní hřebec není šiřitelem a kdy dárcovský hřebec reagoval pozitivně v sérumneutralizačním testu na infekční arteritidu koní se sérem ředěným v poměru alespoň 1:4.
▼M10
1.7 vyjde-li některý z testů podle bodu 1.5 pozitivní, musí být dárcovský hřebec izolován a sperma od něj odebrané od data posledního negativního testu nebude obchodováno; výjimkou, jde-li o infekční arteritidu koní, je sperma z každého ejakulátu, který byl podroben testu na izolaci viru infekční arteritidy koní s negativním výsledkem.
Sperma odebrané od všech ostatních hřebců v inseminační stanici od data odběru posledního vzorku s negativním výsledkem některého z testů podle bodu 1.5 se uloží odděleně a nesmí být obchodováno, dokud veterinární status inseminační stanice nebude obnoven a uložené sperma nebude podrobeno příslušným úředním přezkoumáním, kterými bude vyloučena přítomnost patogenů způsobujících choroby uvedené v bodě 1.5;
1.8 sperma odebrané od hřebců v inseminační stanici, kteří podléhají zákazu podle článku 4 nebo 5 směrnice 90/426/EHS, se uloží odděleně a nesmí být obchodováno, dokud veterinární status inseminační stanice nebude obnoven úředním veterinárním lékařem podle směrnice 90/426/EHS a uložené sperma nebude podrobeno příslušným úředním přezkoumáním, kterými bude vyloučena přítomnost patogenů způsobujících choroby uvedené v příloze A směrnice 90/426/EHS.
|
II.
Podmínky pro dárcovské berany a kozly
|
1.
|
Pro všechny berany a kozly přijaté do inseminační stanice platí tyto podmínky:
1.1 na dobu alespoň 28 dnů byli umístěni do karantény v zařízení pro tento účel zvláště schváleném příslušným orgánem („karanténní zařízení“), v němž se nacházejí pouze zvířata s alespoň stejným veterinárním statusem;
1.2 před umístěním do karanténního zařízení patřili hospodářství chovajícímu ovce a kozy úředně prostému brucelózy podle článku 2 směrnice 91/68/EHS a nebyli předtím chováni v hospodářství s nižším veterinárním statusem, pokud jde o brucelózu;
1.3 pocházejí z hospodářství, v němž během 60 dnů před umístěním do karanténního zařízení podstoupili sérologický test na epididymitidu beranů (B. ovis) provedený v souladu s přílohou D směrnice 91/68/EHS nebo jiný test s rovnocennou zaznamenanou citlivostí a specifičností;
1.4 podstoupili následující testy krevních vzorků odebraných v průběhu 28 dnů před začátkem karantény podle bodu 1.1, ve všech případech s negativním výsledkem, s výjimkou testu na virus border nemoci ovcí podle písm. c) podbodu ii):
a) na brucelózu (B. melitensis) – sérologický test provedený v souladu s přílohou C směrnice 91/68/EHS;
b) na epididymitidu beranů (B. ovis) – sérologický test podle přílohy D směrnice 91/68/EHS nebo jiný test s rovnocennou zaznamenanou citlivostí a specifičností;
c) na border nemoc ovcí:
i) test na izolaci viru nebo test k prokázání virového antigenu,
ii) sérologický test ke stanovení přítomnosti nebo nepřítomnosti protilátek (test na protilátky).
Příslušný orgán může povolit provedení testů uvedených v tomto bodě na vzorcích odebraných v karanténním zařízení. Pokud je toto povolení vydáno, nemůže karanténní doba podle bodu 1.1 začít před datem odběru vzorků. Pokud je však výsledek některého z testů uvedených v tomto bodě pozitivní, musí být dotčené zvíře okamžitě odstraněno z karanténního zařízení. V případě skupinové izolace nemůže karanténní doba podle bodu 1.1 začít pro ostatní zvířata začít dříve, než bude zvíře s pozitivním výsledkem testu odstraněno;
1.5 nejméně 21 dnů po přijetí do karanténního zařízení byli s negativními výsledky podrobeni následujícím testům vzorků odebraných v průběhu karantény podle bodu 1.1:
a) na brucelózu (B. melitensis) – sérologický test provedený v souladu s přílohou C směrnice 91/68/EHS;
b) na epididymitidu beranů (B. ovis) – sérologický test podle přílohy D směrnice 91/68/EHS nebo jiný test s rovnocennou zaznamenanou citlivostí a specifičností;
1.6 podstoupili testy na border nemoc ovcí podle bodu 1.4 písm. c) podbodů i) a ii), provedené na krevních vzorcích odebraných v průběhu karantény podle bodu 1.1 nejméně 21 dnů po přijetí do karanténního zařízení.
Jakémukoli zvířeti (ať je séronegativní nebo séropozitivní) může být povolen vstup do inseminační stanice pouze v případě, že nedojde k sérokonverzi u žádného zvířete, které bylo před vstupem do karanténního zařízení séronegativní.
Dojde-li k sérokonverzi, musí všechna zvířata, která zůstávají séronegativní, zůstat v karanténě tak dlouho, dokud v této skupině již nedojde k další sérokonverzi po dobu tří týdnů.
Sérologicky pozitivní zvířata lze do inseminační stanice přijmout pod podmínkou negativního výsledku testu podle bodu 1.4 písm. c) podbodu i).
|
|
2.
|
Zvířata se do inseminační stanice přijímají pouze s výslovným souhlasem veterinárního lékaře stanice. Veškeré přesuny do inseminační stanice i z ní musí být zaznamenány.
|
|
3.
|
Žádné zvíře přijaté do inseminační stanice nesmí v den přijetí jevit žádné klinické známky choroby.
Aniž je dotčen bod 4, musí všechna zvířata přijímaná pocházet z karanténního zařízení, které v den odeslání zvířat do inseminační stanice splňuje tyto podmínky:
a) leží v oblasti, v níž se za posledních 30 dnů nevyskytl žádný případ slintavky a kulhavky v okruhu o poloměru 10 km;
b) nejméně 3 měsíce nedošlo v zařízení k výskytu brucelózy, slintavky a kulhavky;
c) nejméně 30 dnů se v zařízení nevyskytla choroba podléhající povinnému hlášení podle čl. 2 písm. b) bodu 6 směrnice 91/68/EHS.
|
|
4.
|
Pokud jsou splněny podmínky uvedené v bodě 3 a během 12 měsíců před přesunem zvířat byly provedeny rutinní testy podle bodu 5, lze zvířata převézt z jedné schválené inseminační stanice do druhé se stejným veterinárním statusem, a to bez izolace nebo testů, pokud je přeprava přímá. Dotyčné zvíře nesmí přijít do přímého ani nepřímého styku se sudokopytníky nižšího veterinárního statusu a použitý přepravní prostředek musí být před použitím dezinfikován. Převoz zvířat z jedné inseminační stanice do druhé inseminační stanice v jiném členském státě musí být prováděn v souladu se směrnicí 91/68/EHS.
|
|
5.
|
Všechny ovce a kozy nacházející se ve schválené inseminační stanici musí být alespoň jednou v každém kalendářním roce podrobeny následujícím testům, a to s negativními výsledky:
a) na brucelózu (B. melitensis) – sérologický test provedený v souladu s přílohou C směrnice 91/68/EHS;
b) na epididymitidu beranů (B. ovis) – sérologický test provedený v souladu s přílohou D směrnice 91/68/EHS, nebo jiný test s rovnocennou zaznamenanou citlivostí a specifičností;
c) na border nemoc ovcí – test na protilátky podle bodu 1.4 písm. c) podbodu ii) se provádí pouze u séronegativních zvířat.
|
|
6.
|
Všechny testy zmíněné v tomto oddíle musí provádět schválená laboratoř.
|
|
7.
|
Pokud je výsledek některého z testů uvedených v bodě 5 pozitivní, musí být dotyčné zvíře izolováno a sperma od něj odebrané po posledním negativním výsledku testu nesmí být obchodováno.
Toto zvíře musí být z inseminační stanice odstraněno, s výjimkou případu border nemoci ovcí, kdy musí zvíře podstoupit test podle bodu 1.4 písm. c) podbodu i) s negativním výsledkem.
Sperma odebrané od všech ostatních zvířat v inseminační stanici od data odběru posledního vzorku s negativním výsledkem některého z testů podle bodu 5 se uloží odděleně a nesmí být obchodováno, dokud veterinární status inseminační stanice nebude obnoven a uložené sperma nebude podrobeno příslušným úředním přezkoumáním, kterými bude vyloučena přítomnost patogenů způsobujících choroby uvedené v bodě 5.
|
|
8.
|
Sperma se smí odebírat od zvířat, která:
a) nejeví žádné klinické známky choroby v den odběru spermatu;
b) během 12 měsíců přede dnem odběru spermatu:
i) buď nebyla očkována proti slintavce a kulhavce, nebo
ii) byla očkována proti slintavce a kulhavce nejméně 30 dnů před odběrem; v tomto případě musí být 5 % (minimálně pět pejet) z každého odběru spermatu podrobeno testu na izolaci viru slintavky a kulhavky, s negativním výsledkem;
c) v případě odběru čerstvého spermatu byla nepřetržitě alespoň 30 dnů přede dnem odběru chována ve schválené inseminační stanici;
d) splňují požadavky stanovené v článcích 4, 5 a 6 směrnice 91/68/EHS;
e) pokud byla chována v hospodářstvích podle čl. 11 odst. 2 první odrážky, podstoupila během 30 dnů před odběrem spermatu s negativními výsledky tyto testy:
i) sérologický test na brucelózu (B. melitensis) provedený v souladu s přílohou C směrnice 91/68/EHS,
ii) sérologický test na epididymitidu beranů (B. ovis) provedený v souladu s přílohou D směrnice 91/68/EHS, nebo jiný test s rovnocennou zaznamenanou citlivostí a specifičností,
iii) test na virus border nemoci ovcí;
f) nebyla použita pro účely přirozeného rozmnožování alespoň 30 dnů před datem prvního odběru spermatu a mezi dnem prvního odběru vzorku podle bodů 1.5 a 1.6 nebo písmene e) a do konce doby odběru.
|
|
9.
|
Sperma odebrané od dárcovských beranů a kozlů v inseminační stanici nebo v hospodářství podle čl. 11 odst. 2 první odrážky, na které se z veterinárních důvodů vztahuje určitý zákaz v souladu s článkem 4 směrnice 91/68/EHS, se uloží odděleně a nesmí být obchodováno, dokud veterinární status inseminační stanice nebude obnoven úředním veterinárním lékařem podle směrnice 91/68/EHS a uložené sperma nebude podrobeno příslušným úředním přezkoumáním, kterými bude vyloučena přítomnost patogenů, způsobujících choroby uvedené v části I přílohy B směrnice 91/68/EHS.
|
KAPITOLA III
Podmínky pro sperma, vajíčka a embrya
I.
Podmínky pro odběr, zpracování, konzervaci, skladování a přepravu spermatu
1.1 Pokud jsou, aniž by byla dotčena ustanovení směrnice Evropského parlamentu a Rady 2001/82/ES (
26
), přidávána antibiotika nebo jejich směsi s baktericidním účinkem na každý mililitr spermatu přinejmenším rovnocenným baktericidnímu účinku směsí gentamicin (250 μg), tylosin (50 μg), linkomycin-spektinomycin (150/300 μg), penicilin (500 IU), streptomycin (500 μg), linkomycin-spektinomycin (150/300 μg), amikacin (75 μg) nebo divekacin (25 μg), musí být název antibiotika spolu s koncentrací uveden ve veterinárním osvědčení podle 11 odst. 2 čtvrté odrážky.
1.2 Všechny nástroje sloužící pro odběr, zpracování, uchovávání či zmrazování spermatu musí být před použitím náležitě dezinfikovány nebo sterilizovány, s výjimkou nástrojů na jedno použití.
1.3 Zmrazené sperma musí být:
a) ukládáno a skladováno ve skladovacích nádobách:
i) které byly před použitím vyčištěny a dezinfikovány nebo sterilizovány, nebo jsou nádoby na jedno použití,
ii) s mrazicí směsí, která nebyla předtím použita pro jiné produkty živočišného původu;
b) před přepravou nebo použitím uloženo za schválených podmínek po dobu nejméně 30 dnů od data odběru.
1.4 Sperma, které má být předmětem obchodování, musí být:
a) přepravováno do členského státu určení v přepravních nádobách, které byly před použitím vyčištěny a dezinfikovány nebo sterilizovány, nebo jsou nádoby na jedno použití, a které byly zapečetěny a očíslovány před odesláním ze schválené inseminační stanice nebo střediska pro skladování;
b) označeno tak, aby se číslo na pejetách či jiných zásobnících shodovalo s číslem uvedeným ve veterinárním osvědčení podle čl. 11 odst. 2 čtvrté odrážky a s nádobou, v níž je uloženo a přepravováno.
II.
Podmínky pro vajíčka a embrya
1. Odběr a zpracování embryí získaných in vivo
Embrya získaná in vivo se považují za výsledek umělého oplodnění spermatem splňujícím požadavky této směrnice a pro jejich odběr, zpracování a konzervaci platí následující podmínky:
1.1 odběr a zpracování embryí provádí schválený tým pro odběr embryí, přičemž embrya nesmí přijít do styku s jakoukoliv jinou dávkou embryí, která nesplňují požadavky této směrnice;
1.2 odběr embryí se provádí na místě, které je oddělené od ostatních částí stanice nebo hospodářství, je v dobrém stavu a stavební řešení umožňuje jeho účinné a snadné čištění a dezinfekci;
1.3 zpracování embryí (vyšetřování, mytí, ošetřování a ukládání do označených a sterilních pejet, ampulí či jiných zásobníků) se provádí ve stálé nebo mobilní laboratoři, pro citlivé druhy situované v oblasti, v níž se za posledních 30 dnů nevyskytl žádný případ slintavky a kulhavky v okruhu o poloměru 10 km;
1.4 veškeré vybavení používané pro odběr, manipulaci, mytí, zmrazování a ukládání embryí musí být buď před použitím sterilizováno či náležitě očištěno a dezinfikováno podle příručky IETS (
27
), nebo musí být na jedno použití;
1.5 jakýkoli biologický produkt živočišného původu používaný v médiích a roztocích pro odběr, zpracování, mytí nebo skladování embryí musí být prostý patogenních mikroorganismů. Média a roztoky použité pro odběr, zmrazování a skladování embryí musí být schválenou metodou sterilizovány v souladu s příručkou IETS a manipulace s nimi musí probíhat tak, aby byla jejich sterilita zachována. V souladu s příručkou IETS lze podle potřeby do média pro odběr, zpracování, mytí a skladování přidávat antibiotika;
1.6 mrazicí směsi používané ke konzervaci nebo skladování embryí nesmí být předtím použity pro jiné produkty živočišného původu;
1.7 veškeré pejety, ampule nebo jiné zásobníky s embryi musí být jasně označeny štítkem podle standardizovaného systému příručky IETS;
▼M16
1.8 embrya musí být umyta a před umytím, po něm, ani v jeho průběhu nesmí být narušena zona pellucida, čili embryonální pouzdro u embryí koňovitých. V souladu s příručkou IETS se standardní postup mytí pozmění tak, aby zahrnoval další mytí s enzymem trypsin, pokud to bylo doporučeno za účelem inaktivace nebo odstranění určitých patogenů.
▼M10
1.9 embrya od různých dárcovských zvířat se nesmí mýt společně;
▼M16
1.10
zona pellucida každého embrya, čili embryonální pouzdro u embryí koňovitých, musí být prověřena po celém povrchu při nejméně padesátinásobném zvětšení a musí být potvrzeno, že je nedotčena a bez ulpělých cizorodých částic.
▼M10
1.11 embrya z dávky prověřené podle bodu 1.10 se ukládají do sterilních pejet, ampulí či jiných zásobníků podle bodu 1.7 a ihned zapečetí;
1.12 každé embryo určené ke zmrazení se musí bezodkladně zmrazit a uložit na místě, které je pod kontrolou veterinárního lékaře týmu;
1.13 každý tým pro odběr embryí předkládá k oficiálnímu přezkumu bakteriální a virové kontaminace rutinní vzorky života neschopných embryí nebo vajíček, proplachovacích nebo mycích tekutin na základě své činnosti podle příručky IETS;
1.14 každý tým pro odběr embryí musí vést záznamy o své činnosti, pokud jde o odběr embryí, a uchovávat je dva roky po uskutečnění obchodu či dovozu embryí. Záznamy obsahují tyto údaje:
a) plemeno, věk a identifikaci dotčených dárcovských zvířat;
b) místo odběru, zpracování a uskladnění embryí odebraných týmem;
c) identifikace embryí a údaje o jejich příjemci.
2. Odběr a zpracování vajíček, vaječníků a dalších tkání k produkci embryí získaných in vitro
Podmínky stanovené v bodech 1.1 až 1.14 platí obdobně pro odběr a zpracování vajíček, vaječníků a dalších tkání pro oplodnění in vitro a/nebo kultury in vitro. Kromě toho platí tyto podmínky:
2.1 příslušný orgán musí znát hospodářství, ze kterého/kterých dárcovská zvířata pocházejí, a mít vůči nim příslušnou pravomoc;
2.2 v případě, že se vaječníky a jiné tkáně odebírají na jatkách, a to buď od jednotlivých zvířat nebo od skupin zvířat („skupinový odběr“), musí být jatka oficiálně schválená podle nařízení Evropského parlamentu a Rady (ES) č. 854/2004 ze dne 29. dubna 2004, kterým se stanoví zvláštní pravidla pro organizaci úředních kontrol produktů živočišného původu určených k lidské spotřebě (
28
) a pod dozorem veterinárního lékaře, jehož odpovědností je zajistit, aby byly provedeny prohlídky potenciálních dárcovských zvířat před porážkou a po porážce, a potvrdit, že jsou tato zvířata prosta příznaků příslušných nakažlivých chorob přenosných na zvířata. Jatka musí ležet v oblasti, v níž se, pokud jde o vnímavé druhy, za posledních 30 dnů nevyskytl žádný případ slintavky a kulhavky v okruhu o poloměru 10 km;
2.3 dávky vaječníků se nesmí dostat do zpracovatelské laboratoře, dokud není provedena prohlídka dárcovských zvířat po porážce;
2.4 vybavení pro odstranění vaječníků a jiných tkání a jejich převoz musí být před použitím vyčištěno a dezinfikováno a smí být použito výhradně pro tyto účely.
3. Zpracování embryí získaných in vitro
Podmínky stanovené v bodech 1.1 až 1.14 platí obdobně pro zpracování embryí získaných in vitro. Kromě toho platí tyto podmínky:
3.1 embrya získaná in vitro se považují za výsledek oplodnění in vitro spermatem splňujícím požadavky této směrnice;
3.2 po skončení in vitro kultury musí být embrya před zmrazením, uskladněním a přepravou omyta a ošetřena podle bodů 1.8, 1.10 a 1.11;
3.3 embrya z různých dárcovských zvířat, v případě individuálního odběru, nebo z různých skupinových odběrů nesmí být myta společně;
3.4 embrya z různých dárcovských zvířat, v případě individuálního odběru, nebo z různých skupinových odběrů se nesmí ukládat do stejné pejety, ampule či jiného zásobníku.
4. Zpracování embryí podrobených mikromanipulaci
Před mikromanipulací, kterou je porušena zona pellucida, musí být všechna embrya nebo vajíčka odebrána a zpracována podle sanitárních podmínek stanovených v bodech 1, 2 a 3. Kromě toho platí tyto podmínky:
4.1 mikromanipulace s embryi, která zahrnuje penetraci zona pellucida, se musí provádět ve vhodném laboratorním zařízení, pod dohledem schváleného veterinárního lékaře týmu;
4.2 každý tým pro odběr embryí musí vést záznamy o své činnosti podle bodu 1.14, včetně údajů o technikách mikromanipulace, jejichž součástí je penetrace zona pellucida a které byly prováděny na embryích. Identifikace embryí získávaných oplodněním in vitro se může provádět podle dávek, musí však obsahovat údaje o datu a místě odběru vaječníků a/nebo vajíček a umožňovat identifikaci hospodářství, z něhož dárcovská zvířata pocházela.
5. Skladování embryí
5.1 Každý tým pro odběr a produkci embryí musí zajistit skladování embryí při vhodných teplotách, ve skladovacích prostorách podle kapitoly I oddílu III bodu 1.8.
5.2 Zmrazená embrya musí být před odesláním skladována za schválených podmínek po dobu jméně 30 dnů od data odběru či produkce.
6. Přeprava embryí
6.1 Embrya, která mají být předmětem obchodování, musí být přepravována do členského státu určení v přepravních nádobách, které byly před použitím vyčištěny a dezinfikovány nebo sterilizovány, nebo jsou nádoby na jedno použití, a které byly zapečetěny a očíslovány před odesláním ze schváleného střediska pro skladování.
6.2 Pejety, ampule či jiné zásobníky musí být označeny tak, aby se číslo na pejetách ampulích či jiných zásobnících shodovalo s číslem uvedeným ve veterinárním osvědčení podle čl. 11 odst. 3 třetí odrážky a s nádobou, v níž jsou uloženy a přepravovány.
KAPITOLA IV
Podmínky pro dárcovské samice
|
1.
|
Pro využití k odběru embryí nebo vajíček musí dárkyně a hospodářství, z nichž pocházejí, splňovat úředním veterinárním lékařem ověřované podmínky příslušných směrnic o obchodu uvnitř Unie s živými zvířaty pro chov a produkci, pokud jde o dotčené živočišné druhy.
|
|
2.
|
Kromě požadavků stanovených směrnicí 64/432/EHS musí dárkyně živočišných druhů prasat, vyjma embryí získaných in vivo a ošetřovaných trypsinem, splňovat podmínky související s Aujeszkyho chorobou, stanovené články 9 nebo 10 uvedené směrnice.
|
|
3.
|
Pro dárkyně živočišných druhů ovcí a koz platí ustanovení směrnice 91/68/EHS.
|
▼M16
|
4.
|
Pro dárcovské klisny platí kromě požadavků stanovených směrnicí 90/426/EHS tyto podmínky:
4.1 nesmí být použity pro účely přirozeného rozmnožování nejméně 30 dnů před datem odběru vajíček či embryí a v období od data prvního odběru vzorku podle bodů 4.2 a 4.3 do data odběru vajíček a embryí;
4.2 musí mít negativní výsledek testu na imunodifúzi na agarovém gelu (test dle Cogginse) nebo testu ELISA pro testování nakažlivé chudokrevnosti koní provedeného na krevním vzorku odebraném minimálně 14 dní po počátečním datu pobytu trvajícího alespoň 30 dnů podle bodu 4.1 a maximálně 90 dnů před odběrem vajíček či embryí určených k obchodu;
4.3
►C3
musí být podrobeny testu na určení původce nakažlivé metritidy koní provedenému s pokaždé negativním výsledkem v laboratoři podle bodu 1.5 kapitoly II oddílu I na alespoň dvou vzorcích (stěrech) odebraných dárcovské klisně v žádném případě ne dříve než sedm dní (u systémové léčby) nebo 21 dní (u lokální léčby) po možné antimikrobiální léčbě dárcovské klisny z alespoň následujících částí těla: ◄
— slizniční povrch fossa clitoralis;
Vzorky musí být odebrány v době uvedené v bodě 4.1 dvakrát po sobě v intervalu nejméně sedmi dnů pro testy podle podbodu i) a jednou pro testy podle podbodu ii).
Před odesláním do laboratoře musí být vzorky umístěny do transportního média s aktivním uhlím (např. Amies).
Vzorky musí být podrobeny alespoň jednomu z následujících testů:
i) kultuře za mikroaerofilních podmínek po dobu alespoň sedm dní na izolaci Taylorella equigenitalis, založené do 24 hodin po odebrání vzorku z dárcovského zvířete, nebo do 48 hodin v případech, kdy jsou vzorky během transportu uchovávány v chladu; nebo
ii) polymerázové řetězové reakci (PCR) nebo PCR v reálném čase na zjištění genomu Taylorella equigenitalis, provedené do 48 hodin od odebrání vzorků z dárcovského zvířete.
|
▼M8
PŘÍLOHA E
▼M15
Část 1 – Veterinární osvědčení pro obchod se zvířaty pocházejícími z hospodářství (kopytníci, ptáci očkovaní proti influenze ptáků, zajícovití, psi, kočky a fretky) 92/65 EI




▼M11
Část 2 – Veterinární osvědčení pro obchod se včelami a čmeláky
92/65 EII


▼M13
Část 3 – Veterinární osvědčení pro obchod se zvířaty, spermatem, vajíčky a embryi pocházejícími ze schválených organizací, institutů nebo středisek 92/65 EIII
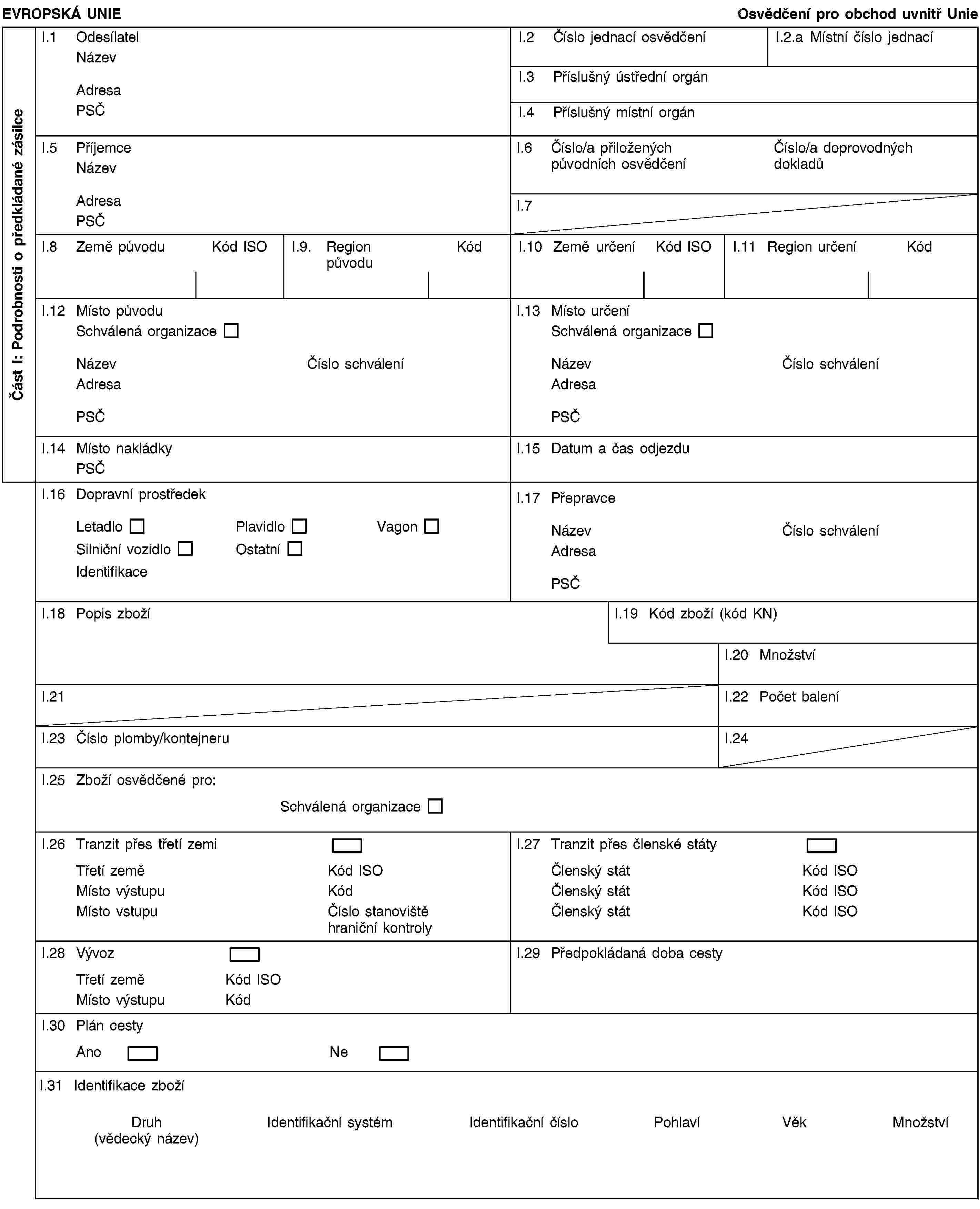

▼M7
PŘÍLOHA F
Směrnice Rady 64/432/EHS ze dne 26. června 1964 o veterinárních otázkách obchodu se skotem a prasaty uvnitř Společenství
Směrnice Rady 88/407/EHS ze dne 14. června 1988 o veterinárních požadavcích na obchod s hluboce zmrazeným spermatem skotu uvnitř Společenství a na jeho dovoz
Směrnice Rady 89/556/EHS ze dne 25. září 1989 o veterinárních otázkách obchodu s embryi skotu ve Společenství a dovozu těchto embryí ze třetích zemí
Směrnice Rady 90/426/EHS ze dne 26. června 1990 o veterinárních předpisech pro přesun koňovitých a jejich dovoz ze třetích zemí
Směrnice Rady 90/429/EHS ze dne 26. června 1990, kterou se stanoví veterinární požadavky na obchod se spermatem prasat uvnitř Společenství a na jeho dovoz
Směrnice Rady 90/539/EHS ze dne 15. října 1990 o veterinárních podmínkách pro obchod s drůbeží a násadovými vejci uvnitř Společenství a jejich dovoz ze třetích zemí
Směrnice Rady 91/67/EHS ze dne 28. ledna 1991 o veterinárních předpisech pro uvádění živočichů pocházejících z akvakultury a produktů akvakultury na trh
Směrnice Rady 91/68/EHS ze dne 28. ledna 1991 o veterinárních podmínkách obchodu s ovcemi a kozami uvnitř Společenství
Směrnice Rady 2004/68/ES ze dne 26. dubna 2004, kterou se stanoví veterinární předpisy pro dovoz některých živých kopytníků do Společenství pro a jejich tranzit, mění směrnice 90/426/EHS a 92/65/EHS, a zrušuje směrnice 72/462/EHS.








