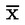EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 32017R0644
Commission Regulation (EU) 2017/644 of 5 April 2017 laying down methods of sampling and analysis for the control of levels of dioxins, dioxin-like PCBs and non-dioxin-like PCBs in certain foodstuffs and repealing Regulation (EU) No 589/2014 (Text with EEA relevance. )
Nařízení Komise (EU) 2017/644 ze dne 5. dubna 2017, kterým se stanoví metody odběru vzorků a analýzy pro kontrolu obsahu dioxinů, PCB s dioxinovým efektem a PCB bez dioxinového efektu v některých potravinách a kterým se zrušuje nařízení (EU) č. 589/2014 (Text s významem pro EHP. )
Nařízení Komise (EU) 2017/644 ze dne 5. dubna 2017, kterým se stanoví metody odběru vzorků a analýzy pro kontrolu obsahu dioxinů, PCB s dioxinovým efektem a PCB bez dioxinového efektu v některých potravinách a kterým se zrušuje nařízení (EU) č. 589/2014 (Text s významem pro EHP. )
C/2017/2185
OJ L 92, 6.4.2017, p. 9–34
(BG, ES, CS, DA, DE, ET, EL, EN, FR, HR, IT, LV, LT, HU, MT, NL, PL, PT, RO, SK, SL, FI, SV)
 In force
In force
|
6.4.2017 |
CS |
Úřední věstník Evropské unie |
L 92/9 |
NAŘÍZENÍ KOMISE (EU) 2017/644
ze dne 5. dubna 2017,
kterým se stanoví metody odběru vzorků a analýzy pro kontrolu obsahu dioxinů, PCB s dioxinovým efektem a PCB bez dioxinového efektu v některých potravinách a kterým se zrušuje nařízení (EU) č. 589/2014
(Text s významem pro EHP)
EVROPSKÁ KOMISE,
s ohledem na Smlouvu o fungování Evropské unie,
s ohledem na nařízení Evropského parlamentu a Rady (ES) č. 882/2004 ze dne 29. dubna 2004 o úředních kontrolách za účelem ověření dodržování právních předpisů týkajících se krmiv a potravin a pravidel o zdraví zvířat a dobrých životních podmínkách zvířat (1), a zejména na čl. 11 odst. 4 uvedeného nařízení,
vzhledem k těmto důvodům:
|
(1) |
Nařízení Komise (ES) č. 1881/2006 (2) stanoví maximální limity pro polychlorované bifenyly (PCB) bez dioxinového efektu, dioxiny a furany a pro sumu dioxinů, furanů a PCB s dioxinovým efektem v některých potravinách. |
|
(2) |
Doporučení Komise 2013/711/EU (3) stanoví intervenční prahové hodnoty (akční limity) s cílem podpořit proaktivní přístup ke snižování přítomnosti polychlorovaných dibenzo-p-dioxinů a polychlorovaných dibenzofuranů (PCDD/PCDF) a PCB s dioxinovým efektem v potravinách. Tyto akční limity slouží příslušným orgánům a provozovatelům k určení, zda je vhodné identifikovat zdroj kontaminace a přijmout nezbytná opatření k jeho omezení nebo odstranění. |
|
(3) |
Nařízení Komise (ES) č. 589/2014 (4) zavádí zvláštní ustanovení týkající se odběru vzorků a metod analýzy pro účely úřední kontroly obsahu dioxinů, PCB s dioxinovým efektem a PCB bez dioxinového efektu. |
|
(4) |
Ustanovení tohoto nařízení se týkají pouze odběru vzorků a analýzy dioxinů, PCB s dioxinovým efektem a PCB bez dioxinového efektu pro účely provádění nařízení (ES) č. 1881/2006 a doporučení 2013/711/EU. Tato ustanovení nemají vliv na strategii, rozsah nebo četnost odběru vzorků, jak jsou vymezeny v přílohách III a IV směrnice Rady 96/23/ES (5). Rovněž nemají vliv na kritéria pro cílený odběr vzorků, jak jsou stanovena v rozhodnutí Komise 98/179/ES (6). |
|
(5) |
Je vhodné zajistit, aby provozovatelé potravinářských zařízení podléhající kontrolám, které se provádějí v rámci článku 4 nařízení Evropského parlamentu a Rady (ES) č. 852/2004 (7), používali postupy odběru vzorků, které jsou rovnocenné postupům odběru vzorků stanoveným tímto nařízením, aby se zajistilo, že vzorky odebrané pro tyto kontroly jsou reprezentativní. Kromě toho referenční laboratoř Evropské unie pro dioxiny a PCB poskytla důkazy, že analytické výsledky nejsou v některých případech spolehlivé, pokud laboratoře provádějící analýzu vzorků odebraných provozovateli potravinářských zařízení v rámci článku 4 nařízení (ES) č. 852/2004 nepoužívají pracovní kritéria stanovená tímto nařízením. Je proto vhodné stanovit, aby se používání pracovních kritérií stalo závazným rovněž pro analýzu těchto vzorků. |
|
(6) |
Vzhledem k tomu, že se přístup používání rozhodovací meze pro zajištění toho, aby analytický výsledek překročil maximální úroveň s určitou pravděpodobností, jak je stanoveno v rozhodnutí Komise 2002/657/ES (8), pro analýzu dioxinů a PCB v potravinách již nepoužívá, je vhodné tento přístup zrušit a zachovat pouze přístup rozšířené nejistoty při použití faktoru pokrytí 2, který odpovídá hladině spolehlivosti asi 95 %. |
|
(7) |
V souladu s požadavky na podávání zpráv o bioanalytických screeningových metodách je vhodné stanovit rovněž fyzikálně-chemické metody používané pro screening specifických požadavků na podávání zpráv. |
|
(8) |
Vzhledem k tomu, že se analýzy dioxinů, PCB s dioxinovým efektem a PCB bez dioxinového efektu ve většině případů provádějí společně, je vhodné sladit pracovní kritéria pro PCB bez dioxinového efektu s pracovními kritérii pro dioxiny a PCB s dioxinovým efektem. Jedná se o zjednodušení bez podstatných změn v praxi, jelikož je v případě PCB bez dioxinového efektu relativní intenzita identifikačních iontů v porovnání s cílovým iontem > 50 %. |
|
(9) |
Kromě toho se navrhuje několik dalších drobných změn stávajících ustanovení, kvůli kterým je třeba nařízení (EU) č. 589/2014 zrušit a nahradit je novým nařízením, aby se zachovala srozumitelnost textu. |
|
(10) |
Opatření stanovená tímto nařízením jsou v souladu se stanoviskem Stálého výboru pro rostliny, zvířata, potraviny a krmiva, |
PŘIJALA TOTO NAŘÍZENÍ:
Článek 1
Pro účely tohoto nařízení se použijí definice a zkratky uvedené v příloze I.
Článek 2
Odběr vzorků pro úřední kontrolu obsahu dioxinů, furanů, PCB s dioxinovým efektem a PCB bez dioxinového efektu v potravinách uvedených v oddíle 5 přílohy nařízení (ES) č. 1881/2006 se provede v souladu s metodami uvedenými v příloze II tohoto nařízení.
Článek 3
Příprava vzorků a analýzy pro kontrolu obsahu dioxinů, furanů a PCB s dioxinovým efektem v potravinách uvedených v oddíle 5 přílohy nařízení (ES) č. 1881/2006 se provedou v souladu s metodami uvedenými v příloze III tohoto nařízení.
Článek 4
Analýzy pro kontrolu obsahu PCB bez dioxinového efektu v potravinách uvedených v oddíle 5 přílohy nařízení (ES) č. 1881/2006 se provedou v souladu s požadavky na analytické postupy uvedenými v příloze IV tohoto nařízení.
Článek 5
Nařízení (EU) č. 589/2014 se zrušuje.
Odkazy na zrušené nařízení se považují za odkazy na toto nařízení.
Článek 6
Toto nařízení vstupuje v platnost dvacátým dnem po vyhlášení v Úředním věstníku Evropské unie.
Toto nařízení je závazné v celém rozsahu a přímo použitelné ve všech členských státech.
V Bruselu dne 5. dubna 2017.
Za Komisi
předseda
Jean-Claude JUNCKER
(1) Úř. věst. L 165, 30.4.2004, s. 1.
(2) Nařízení Komise (ES) č. 1881/2006 ze dne 19. prosince 2006, kterým se stanoví maximální limity některých kontaminujících látek v potravinách (Úř. věst. L 364, 20.12.2006, s. 5).
(3) Doporučení Komise 2013/711/EU ze dne 3. prosince 2013 o snižování přítomnosti dioxinů, furanů a PCB v krmivech a potravinách (Úř. věst. L 323, 4.12.2013, s. 37).
(4) Nařízení Komise (EU) č. 589/2014 ze dne 2. června 2014, kterým se stanoví metody odběru vzorků a analýzy pro kontrolu obsahu dioxinů, PCB s dioxinovým efektem a PCB bez dioxinového efektu v některých potravinách a kterým se ruší nařízení (EU) č. 252/2012 (Úř. věst. L 164, 3.6.2014, s. 18).
(5) Směrnice Rady 96/23/ES ze dne 29. dubna 1996 o kontrolních opatřeních u některých látek a jejich reziduí v živých zvířatech a živočišných produktech a o zrušení směrnic 85/358/EHS a 86/469/EHS a rozhodnutí 89/187/EHS a 91/664/EHS (Úř. věst. L 125, 23.5.1996, s. 10).
(6) Rozhodnutí Komise 98/179/ES ze dne 23. února 1998, kterým se stanoví prováděcí pravidla k úřednímu odběru vzorků pro zjišťování některých látek a jejich reziduí v živých zvířatech a živočišných produktech (Úř. věst. L 65, 5.3.1998, s. 31).
(7) Nařízení Evropského parlamentu a Rady (ES) č. 852/2004 ze dne 29. dubna 2004 o hygieně potravin (Úř. věst. L 139, 30.4.2004, s. 1).
(8) Rozhodnutí Komise 2002/657/ES ze dne 14. srpna 2002, kterým se provádí směrnice Rady 96/23/ES, pokud jde o provádění analytických metod a interpretaci výsledků (Úř. věst. L 221, 17.8.2002, s. 8).
PŘÍLOHA I
DEFINICE A ZKRATKY
I. DEFINICE
Pro účely tohoto nařízení se použijí definice stanovené v příloze I rozhodnutí 2002/657/ES.
Kromě uvedených definic se pro účely tohoto nařízení použijí následující definice:
|
1.1. |
„Akčním limitem“ se rozumí množství dané látky stanovené v příloze doporučení 2013/711/EU, které vede k zahájení šetření za účelem zjištění zdroje uvedené látky v případech, kdy jsou zjištěny zvýšené hodnoty příslušné látky. |
|
1.2. |
„Screeningovými metodami“ se rozumí metody používané k identifikaci vzorků s obsahem PCDD/PCDF a PCB s dioxinovým efektem převyšujícím maximální nebo akční limity. Tyto metody musí umožňovat nákladově efektivní analýzu velkého množství vzorků, čímž se zvyšuje možnost zjistit nové případy, při nichž může vysoká expozice vést k ohrožení zdraví spotřebitelů. Screeningové metody musí být založeny na bioanalytických metodách nebo metodách GC-MS. Výsledky u vzorků, které překročily mezní hodnotu pro kontrolu dodržení maximálních limitů, musí být ověřeny úplnou opětovnou analýzou z původního vzorku pomocí konfirmační metody. |
|
1.3. |
„Konfirmačními metodami“ se rozumí metody, které poskytují úplné nebo doplňující informace pro jednoznačnou identifikaci a kvantifikaci PCDD/PCDF a PCB s dioxinovým efektem u maximálního nebo, v případě potřeby, akčního limitu. Tyto metody využívají plynovou chromatografii / hmotnostní spektrometrii s vysokým rozlišením (GC-HRMS) nebo plynovou chromatografii / tandemovou hmotnostní spektrometrii (GC-MS/MS). |
|
1.4. |
„Bioanalytickými metodami“ se rozumí metody založené na využití biologických principů, jako jsou buněčné testy, receptorové testy nebo imunologické testy. Neposkytují výsledky na úrovni kongeneru, ale pouze orientační hodnoty (1) úrovně TEQ, vyjádřené v bioanalytických ekvivalentech (BEQ), aby byla zohledněna skutečnost, že ne všechny sloučeniny přítomné v extraktu vzorku, který při zkoušce dává odezvu, nutně splňují všechny požadavky principu TEQ. |
|
1.5. |
„Zjevnou výtěžností biologické zkoušky“ se rozumí hodnota BEQ vypočtená z kalibrační křivky TCDD nebo PCB 126 upravená o hodnoty slepého stanovení a poté vydělená hodnotou TEQ určenou konfirmační metodou. Jejím účelem je korekce činitelů, jako je ztráta PCDD/PCDF a sloučenin s dioxinovým efektem během extrakce a čištění, současně extrahované sloučeniny zesilující nebo tlumící odezvu (agonistické a antagonistické účinky), kvalita kalibrace nebo rozdíly mezi hodnotami TEF a REP. Zjevná výtěžnost biologické zkoušky se vypočte z vhodných referenčních vzorků s reprezentativním zastoupením kongenerů kolem maximálního nebo akčního limitu. |
|
1.6. |
„Opakovanou analýzou“ se rozumí samostatná analýza sledovaných analytů na základě druhého alikvotu téhož homogenizovaného vzorku. |
|
1.7. |
„Schválenou specifickou mezí stanovitelnosti (2) jednotlivého kongeneru ve vzorku“ se rozumí nejnižší obsah analytu, který může být změřen s rozumnou mírou statistické jistoty, splňující identifikační kritéria popsaná v mezinárodně uznávaných normách, jako je například norma EN 16215:2012 („Krmiva – stanovení dioxinů a PCB s dioxinovým efektem pomocí GC/HRMS a indikátorových PCB pomocí GC/HRMS“) a/nebo v metodách EPA 1613 a 1668 ve znění pozdějších revizí. Mez stanovitelnosti jednotlivého kongeneru může být identifikována jako:
|
|
1.8. |
„Horním odhadem“ se rozumí koncept, který vyžaduje pro příspěvek každého nekvantifikovaného kongeneru použití hodnoty meze stanovitelnosti. |
|
1.9. |
„Dolním odhadem“ se rozumí koncept, který vyžaduje pro příspěvek každého nekvantifikovaného kongeneru použití nulové hodnoty. |
|
1.10. |
„Středním odhadem“ se rozumí koncept, který vyžaduje pro výpočet příspěvku každého nekvantifikovaného kongeneru použití poloviny hodnoty meze stanovitelnosti. |
|
1.11. |
„Šarží“ se rozumí identifikovatelné množství potravinové komodity dodané ve stejném okamžiku, u nějž příslušný pracovník zjistil jednotné vlastnosti, jako je původ, druh, typ obalu, balírna, zasílatel nebo označení. U ryb a produktů rybolovu musí být srovnatelná také velikost ryb. I v případě, že velikost a/nebo hmotnost ryb nejsou v rámci zásilky srovnatelné, lze zásilku považovat za šarži, musí se však použít specifický postup odběru vzorků. |
|
1.12. |
„Částí šarže“ se rozumí určitá část velké šarže vyčleněná k tomu, aby z ní byl proveden odběr vzorků. Každá část šarže musí být fyzicky samostatná a identifikovatelná. |
|
1.13. |
„Dílčím vzorkem“ se rozumí množství materiálu odebrané z jednoho místa šarže nebo části šarže. |
|
1.14. |
„Souhrnným vzorkem“ se rozumí souhrn všech dílčích vzorků odebraných ze šarže nebo části šarže. |
|
1.15. |
„Laboratorním vzorkem“ se rozumí reprezentativní část nebo množství souhrnného vzorku určené pro laboratoř. |
II. POUŽITÉ ZKRATKY
|
BEQ |
Bioanalytické ekvivalenty |
|
GC |
Plynová chromatografie |
|
HRMS |
Hmotnostní spektrometrie s vysokým rozlišením |
|
LRMS |
Hmotnostní spektrometrie s nízkým rozlišením |
|
MS/MS |
Tandemová hmotnostní spektrometrie |
|
PCB |
Polychlorovaný bifenyl |
|
PCB bez dioxinového efektu |
PCB 28, PCB 52, PCB 101, PCB 138, PCB 153 a PCB 180 |
|
PCDD |
Polychlorované dibenzo-p-dioxiny |
|
PCDF |
Polychlorované dibenzofurany |
|
QC |
Kontrola kvality |
|
REP |
Relativní účinnost |
|
TEF |
Faktor toxické rovnocennosti |
|
TEQ |
Toxické ekvivalenty |
|
TCDD |
2,3,7,8-tetrachlordibenzo-p-dioxin |
|
U |
Rozšířená nejistota měření |
(1) Bioanalytické metody nejsou specifické pro kongenery zahrnuté v systému TEF. V extraktu vzorku mohou být přítomny jiné strukturně příbuzné AhR-aktivní sloučeniny, které přispívají k celkové reakci. Proto bioanalytické výsledky nelze považovat za odhad, ale spíše za orientační úroveň TEQ ve vzorku.
(2) V příslušném případě je třeba se řídit zásadami popsanými v dokumentu Guidance Document on the Estimation of LOD and LOQ for Measurements in the Field of Contaminants in Feed and Food [link to website].
(3) Mez stanovitelnosti se vypočte z nejnižšího bodu koncentrace, přičemž se zohlední výtěžnost vnitřních standardů a množství vzorku.
PŘÍLOHA II
METODY ODBĚRU VZORKŮ PRO ÚŘEDNÍ KONTROLU OBSAHU DIOXINŮ (PCDD/PCDF), PCB S DIOXINOVÝM EFEKTEM A PCB BEZ DIOXINOVÉHO EFEKTU V NĚKTERÝCH POTRAVINÁCH
I. OBLAST PŮSOBNOSTI
Vzorky určené pro úřední kontrolu obsahu dioxinů (PCDD/PCDF), PCB s dioxinovým efektem a PCB bez dioxinového efektu v potravinách musí být odebírány pomocí metod popsaných v této příloze. Takto získané souhrnné vzorky se považují za reprezentativní pro šarže nebo části šarží, z nichž byly odebrány. Dodržení maximálních limitů stanovených v nařízení (ES) č. 1881/2006 se posuzuje na základě hodnot zjištěných v laboratorních vzorcích.
Aby se zajistilo dodržování ustanovení článku 4 nařízení (ES) č. 852/2004, musí provozovatel potravinářského podniku odebírat vzorky určené pro kontrolu obsahu dioxinů (PCDD/PCDF), PCB s dioxinovým efektem a PCB bez dioxinového efektu pomocí metod popsaných v kapitole III této přílohy nebo použít rovnocenný postup odběru vzorků, který je prokazatelně stejně reprezentativní jako postup odběru vzorků popsaný v kapitole III této přílohy.
II. OBECNÁ USTANOVENÍ
1. Personál
Úřední odběr vzorků provádí oprávněná osoba určená členským státem.
2. Materiál, který má být odebrán
Každá šarže nebo část šarže, která má být analyzována, se vzorkuje samostatně.
3. Předběžná opatření
Při odběru vzorků a při přípravě vzorků se provedou předběžná opatření s cílem zamezit jakýmkoliv změnám, které by mohly ovlivnit obsah dioxinů a PCB, nepříznivě ovlivnit analytické stanovení nebo znehodnotit reprezentativnost souhrnných vzorků.
4. Dílčí vzorky
Dílčí vzorky se odeberou pokud možno z různých míst celé šarže nebo části šarže. Odchylky od tohoto postupu se zaznamenají v záznamu podle bodu II.8.
5. Příprava souhrnného vzorku
Souhrnný vzorek se připraví kombinací dílčích vzorků. Jeho hmotnost musí být nejméně 1 kg, pokud to není nepraktické, například odebírá-li se vzorek jediného balení nebo pokud jde o výrobek velké obchodní hodnoty.
6. Replicitní vzorky
Replicitní vzorky pro účely prosazování předpisů, obhajoby a rozhodčího řízení se odeberou z homogenizovaného souhrnného vzorku, pokud tento postup není v rozporu s předpisy členských států týkajícími se práv provozovatele potravinářského podniku. Velikost laboratorních vzorků pro účely prosazování předpisů musí být dostatečná alespoň pro provedení opakované analýzy.
7. Balení a přeprava vzorků
Každý vzorek se uloží do čisté nádoby z inertního materiálu, která poskytuje dostatečnou ochranu před kontaminací, ztrátou analytů adsorpcí na vnitřních stěnách nádoby a před poškozením při přepravě. Přijmou se všechna nezbytná opatření s cílem zamezit jakékoli změně složení vzorku, ke které může dojít při přepravě nebo skladování.
8. Uzavření a označení vzorků
Každý vzorek odebraný k úředním účelům se uzavře na místě odběru a označí se podle předpisů členského státu.
Z každého odběru vzorků se vystaví záznam umožňující jednoznačnou identifikaci šarže, v němž se uvede den a místo odběru vzorků a jakékoli další údaje, které mohou být pro osobu provádějící analýzu užitečné.
III. PLÁN ODBĚRU VZORKŮ
Použitá metoda odběru vzorků musí zaručit, že je souhrnný vzorek reprezentativní pro šarži (část šarže), která má být kontrolována.
1. Rozdělení šarží na části
Velké šarže se rozdělí na části za podmínky, že části šarže lze fyzicky oddělit. Na produkty, s nimiž se obchoduje ve velkých volně ložených zásilkách (např. rostlinné oleje), se vztahuje tabulka 1. Na ostatní produkty se vztahuje tabulka 2. Vzhledem k tomu, že hmotnost šarže není vždy přesným násobkem hmotnosti částí šarže, může hmotnost části šarže překročit uvedenou hmotnost nejvýše o 20 %.
Tabulka 1
Rozdělení šarží na části u produktů, s nimiž se obchoduje ve volně ložených zásilkách
|
Hmotnost šarže (v tunách) |
Hmotnost nebo počet částí šarže |
|
≥ 1 500 |
500 tun |
|
> 300 a < 1 500 |
3 části šarže |
|
≥ 50 a ≤ 300 |
100 tun |
|
< 50 |
–– |
Tabulka 2
Rozdělení šarží na části u ostatních produktů
|
Hmotnost šarže (v tunách) |
Hmotnost nebo počet částí šarže |
|
≥ 15 |
15–30 tun |
|
< 15 |
— |
2. Počet dílčích vzorků
Hmotnost souhrnného vzorku, který vznikne sdružením všech dílčích vzorků, musí být alespoň 1 kg (viz bod II.5).
Minimální počet dílčích vzorků, které mají být odebrány z šarže nebo z části šarže, je uveden v tabulkách 3 a 4.
V případě volně ložených kapalných produktů musí být šarže nebo část šarže těsně před odebráním vzorku manuálně nebo mechanicky důkladně promíchána, pokud je to možné a pokud tím není ovlivněna jakost produktu. V tomto případě lze předpokládat rovnoměrné rozložení kontaminujících látek v dané šarži nebo její části. Proto stačí z každé šarže nebo její části odebrat tři dílčí vzorky, které budou tvořit souhrnný vzorek.
Dílčí vzorky musí mít podobnou hmotnost. Hmotnost dílčího vzorku musí být alespoň 100 gramů.
Odchylky od tohoto postupu musí být zaznamenány v záznamu podle bodu II.8 této přílohy. V souladu s ustanoveními rozhodnutí Komise 97/747/ES (1) je velikost souhrnného vzorku u slepičích vajec alespoň 12 vajec (pro šarže volně ložených vajec i pro šarže sestávající z jednotlivých balení se použijí tabulky 3 a 4).
Tabulka 3
Minimální počet dílčích vzorků, které musí být odebrány ze šarže nebo z části šarže
|
Hmotnost nebo objem šarže / části šarže (v kg nebo v litrech) |
Minimální počet dílčích vzorků, které musí být odebrány |
|
< 50 |
3 |
|
50 až 500 |
5 |
|
> 500 |
10 |
Sestává-li šarže nebo její část z jednotlivých balení nebo jednotek, je počet balení nebo jednotek, které musí být odebrány za účelem vytvoření souhrnného vzorku, uveden v tabulce 4.
Tabulka 4
Počet balení nebo jednotek (dílčích vzorků), které musí být odebrány za účelem vytvoření souhrnného vzorku, sestává-li šarže nebo její část z jednotlivých balení nebo jednotek
|
Počet balení nebo jednotek v šarži / části šarže |
Počet balení nebo jednotek, které musí být odebrány |
|
1 až 25 |
alespoň 1 balení nebo 1 jednotka |
|
26 až 100 |
přibližně 5 %, alespoň 2 balení nebo 2 jednotky |
|
> 100 |
přibližně 5 %, nejvýše 10 balení nebo 10 jednotek |
3. Zvláštní ustanovení pro odběr vzorků z šarží sestávajících z celých ryb srovnatelné velikosti a hmotnosti
Ryby jsou z hlediska velikosti a hmotnosti považovány za srovnatelné, pokud rozdíl ve velikosti a hmotnosti nepřesahuje přibližně 50 %.
Počet dílčích vzorků, které musí být odebrány z šarže, je stanoven v tabulce 3. Hmotnost souhrnného vzorku, který vznikne sdružením všech dílčích vzorků, musí být alespoň 1 kg (viz bod II.5).
|
— |
Pokud vzorkovaná šarže obsahuje malé ryby (jednotlivé ryby o hmotnosti < přibližně 1 kg), odebírá se jako dílčí vzorek k vytvoření souhrnného vzorku celá ryba. Pokud je hmotnost takto vytvořeného souhrnného vzorku větší než 3 kg, může dílčí vzorek sestávat ze středních částí ryb tvořících souhrnný vzorek, přičemž každá tato část má hmotnost alespoň 100 g. Celá část, na niž se vztahuje maximální limit, se použije k homogenizaci vzorku. Střední část ryby je část, v níž je těžiště. To se zpravidla nachází v hřbetní ploutvi (pokud ryba takovou ploutev má) nebo v polovině mezi žaberním a řitním otvorem. |
|
— |
Pokud vzorkovaná šarže obsahuje větší ryby (jednotlivé ryby o hmotnosti větší než přibližně 1 kg), tvoří dílčí vzorek střední část ryby. Hmotnost každého dílčího vzorku je alespoň 100 gramů. U ryb s průměrnou velikostí (přibližně 1–6 kg) se dílčí vzorek odebírá jako řez od páteře k břichu ve střední části ryby. U velmi velkých ryb (tj. > přibližně 6 kg) je dílčí vzorek odebrán ze svaloviny na pravé straně (pohled zpředu) hřbetu a boku ve střední části ryby. Pokud by odebrání takového kusu ze střední části způsobilo významnou hospodářskou škodu, lze za dostatečné považovat odebrání alespoň tří dílčích vzorků o alespoň 350 gramech, a to bez ohledu na velikost šarže, nebo lze případně odebrat rovnocennou část svaloviny z blízkosti ocasu a z blízkosti hlavy z téže ryby, což představuje dílčí vzorek, jenž je reprezentativní z hlediska množství dioxinů v celé rybě. |
4. Odebírání vzorků z šarží ryb sestávajících z celých ryb různé velikosti a/nebo hmotnosti
|
— |
Pokud jde o strukturu vzorku, použijí se ustanovení bodu III.3. |
|
— |
Pokud převládá určitá třída/kategorie velikosti nebo hmotnosti (přibližně 80 % nebo větší podíl šarže), odebere se vzorek z ryb s převládající velikostí nebo hmotností. Takový vzorek se považuje za reprezentativní pro celou šarži. |
|
— |
Pokud žádná konkrétní třída/kategorie velikosti nebo hmotnosti nepřevládá, musí se zajistit, aby ryby vybrané do vzorku byly pro danou šarži reprezentativní. Zvláštní pokyny pro takové případy jsou stanoveny v „Pokynech pro odběr vzorků z celých ryb různé velikosti a/nebo hmotnosti“ (2). |
5. Odběr vzorků v maloobchodním prodeji
Odběr vzorků potravin v maloobchodním prodeji se provádí pokud možno podle ustanovení o odběru vzorků uvedených v bodě III.2.
Pokud to není možné, lze použít náhradní metodu odběru vzorků v maloobchodním prodeji, pokud tato metoda zaručuje, že je daná šarže nebo její část dostatečně reprezentativní.
IV. SOULAD ŠARŽE S PŘÍSLUŠNOU SPECIFIKACÍ
1. Pokud jde o PCB bez dioxinového efektu
Šarže se přijme jako vyhovující, pokud analytický výsledek nepřekračuje příslušný maximální limit pro PCB bez dioxinového efektu stanovený v nařízení (ES) č. 1881/2006 při zohlednění rozšířené nejistoty měření (3).
Šarže nevyhovuje maximálnímu limitu stanovenému v nařízení (ES) č. 1881/2006, pokud střední hodnota dvou horních odhadů výsledků analýzy získaná opakovanou analýzou (4) při zohlednění rozšířené nejistoty měření takřka nepochybně překračuje maximální limit.
Rozšířená nejistota měření se vypočítá za použití faktoru pokrytí 2, který odpovídá míře spolehlivosti přibližně 95 %. Šarže nevyhovuje, pokud je střední hodnota naměřených hodnot minus rozšířená nejistota měření střední hodnoty vyšší než stanovené maximální limity.
Pravidla zmíněná ve výše uvedených odstavcích tohoto bodu se použijí na analytické výsledky získané u vzorků pro úřední kontrolu. V případě analýzy za účelem obhajoby nebo rozhodčího řízení se použijí vnitrostátní předpisy.
2. Pokud jde o dioxiny (PCDD/PCDF) a PCB s dioxinovým efektem
Šarže vyhovuje, pokud výsledek jedné analýzy
|
— |
provedené screeningovou metodou s mírou falešně vyhovujících vzorků nižší než 5 % naznačuje, že hladina nepřekračuje příslušný maximální limit pro PCDD/PCDF a pro sumu PCDD/PCDF a PCB s dioxinovým efektem stanovené v nařízení (ES) č. 1881/2006, |
|
— |
provedené konfirmační metodou nepřekročí příslušný maximální limit pro PCDD/PCDF a pro sumu PCDD/PCDF a PCB s dioxinovým efektem stanovené v nařízení (ES) č. 1881/2006, při zohlednění rozšířené nejistoty měření (5). |
U screeningových zkoušek se pro rozhodnutí o souladu s příslušnými maximálními limity stanovenými buď pro PCDD/PCDF, nebo pro sumu PCDD/PCDF a PCB s dioxinovým efektem stanoví mezní hodnoty.
Šarže nevyhovuje maximálnímu limitu stanovenému v nařízení (ES) č. 1881/2006, pokud střední hodnota dvou horních odhadů výsledků analýzy (opakovaná analýza) (6) získaná konfirmační metodou při zohlednění rozšířené nejistoty měření takřka nepochybně překračuje maximální limit.
Rozšířená nejistota měření se vypočítá za použití faktoru pokrytí 2, který odpovídá míře spolehlivosti přibližně 95 %. Šarže nevyhovuje, pokud je střední hodnota naměřených hodnot minus rozšířená nejistota měření střední hodnoty vyšší než stanovené maximální limity.
Pro odhad rozšířené nejistoty měření sumy PCDD/PCDF a PCB s dioxinovým efektem se musí použít suma odhadované rozšířené nejistoty měření samostatných analytických výsledků u PCDD/PCDF a PCB s dioxinovým efektem.
Pravidla zmíněná ve výše uvedených odstavcích tohoto bodu se použijí na analytické výsledky získané u vzorků pro úřední kontrolu. V případě analýzy za účelem obhajoby nebo rozhodčího řízení se použijí vnitrostátní předpisy.
V. PŘEKROČENÍ AKČNÍCH LIMITŮ
Akční limity slouží jako nástroj pro výběr vzorků v případech, kdy je žádoucí zjistit zdroj kontaminace a přijmout opatření pro jeho omezení nebo odstranění. Screeningové metody stanoví vhodné mezní hodnoty pro výběr těchto vzorků. V případě, kdy je zjištění zdroje a omezení nebo odstranění kontaminace velmi náročné, může být účelné potvrdit překročení akčního limitu opakovanou analýzou s použitím konfirmační metody s přihlédnutím k rozšířené nejistotě měření (7).
(1) Rozhodnutí Komise 97/747/ES ze dne 27. října 1997, kterým se stanoví rozsah a četnost odběru vzorků podle směrnice Rady 96/23/ES o kontrolních opatřeních u některých látek a jejich reziduí v živých zvířatech a živočišných produktech (Úř. věst. L 303, 6.11.1997, s. 12).
(2) https://ec.europa.eu/food/sites/food/files/safety/docs/cs_contaminants_catalogue_dioxins_guidance-sampling_exemples-dec2006_en.pdf
(3) V příslušném případě je třeba se řídit zásadami popsanými v dokumentu Guidance Document on Measurement Uncertainty for Laboratories performing PCDD/F and PCB Analysis using Isotope Dilution Mass Spectrometry [link to website].
(4) Opakovaná analýza je nutná, pokud je výsledek prvního stanovení nevyhovující. Opakovaná analýza je nutná k vyloučení možnosti vnitřní křížové kontaminace nebo náhodného promíchání vzorků. Je-li analýza prováděna v rámci kontaminační aféry, lze od konfirmace opakovanou analýzou upustit, pokud lze zpětně vysledovat spojitost vzorků vybraných pro analýzu s danou kontaminační aférou a zjištěný obsah je výrazně vyšší než maximální limit.
(5) Guidance Document on Measurement Uncertainty for Laboratories performing PCDD/F and PCB Analysis using Isotope Dilution Mass Spectrometry [link to website], Guidance Document on the Estimation of LOD and LOQ for Measurements in the Field of Contaminants in Feed and Food [link to website].
(6) Opakovaná analýza je nutná, pokud výsledek prvního stanovení při použití konfirmačních metod s použitím vnitřního standardu značeného izotopem13C pro příslušné analyty není vyhovující. Opakovaná analýza je nutná k vyloučení možnosti vnitřní křížové kontaminace nebo náhodného promíchání vzorků. Je-li analýza prováděna v rámci kontaminační aféry, lze od konfirmace opakovanou analýzou upustit, pokud lze zpětně vysledovat spojitost vzorků vybraných pro analýzu s danou kontaminační aférou a zjištěný obsah je výrazně vyšší než maximální limit.
(7) Totožné vysvětlení a požadavky na provedení opakované analýzy pro kontrolu akčních limitů jako v poznámce pod čarou č. 6 pro maximální limity.
PŘÍLOHA III
PŘÍPRAVA VZORKŮ A POŽADAVKY NA ANALYTICKÉ METODY POUŽÍVANÉ PŘI KONTROLE OBSAHU DIOXINŮ (PCDD/FS) A PCB S DIOXINOVÝM EFEKTEM V NĚKTERÝCH POTRAVINÁCH
1. OBLAST POUŽITÍ
Požadavky stanovené v této příloze se vztahují na analýzu potravin pro úřední kontrolu obsahu polychlorovaných dibenzo-p-dioxinů substituovaných v polohách 2,3,7,8 a polychlorovaných dibenzofuranů (PCDD/PCDF) a polychlorovaných bifenylů s dioxinovým efektem (PCB s dioxinovým efektem) a pro přípravu vzorků a analytické požadavky k jiným regulačním účelům, včetně kontrol prováděných provozovatelem potravinářského podniku k zajištění dodržování ustanovení článku 4 nařízení (ES) č. 852/2004.
Sledování přítomnosti PCDD/PCDF a PCB s dioxinovým efektem v potravinách může být provedeno dvěma různými druhy analytických metod:
a) Screeningové metody
Cílem screeningových metod je identifikovat vzorky s obsahem PCDD/PCDF a PCB s dioxinovým efektem převyšujícím maximální nebo akční limity. Screeningové metody zajistí nákladově efektivní analýzu velkého množství vzorků, čímž se zvyšuje možnost zjistit nové případy, při nichž může vysoká expozice vést k ohrožení zdraví spotřebitelů. Cílem jejich použití je zabránit falešně vyhovujícím výsledkům. Tyto metody mohou zahrnovat bioanalytické metody a metody GC/MS.
Screeningové metody porovnávají analytický výsledek s mezní hodnotou a poskytují tak odpověď ano/ne, pokud jde o možné překročení maximálního nebo akčního limitu. Koncentraci PCDD/PCDF a sumu PCDD/PCDF a PCB s dioxinovým efektem ve vzorcích, u nichž panuje podezření, že jsou nevyhovující, pokud jde o maximální limit, je třeba stanovit nebo potvrdit konfirmační metodou.
Kromě toho mohou screeningové metody udávat orientační obsah PCDD/PCDF a PCB s dioxinovým efektem přítomných ve vzorku. V případě použití bioanalytických screeningových metod se výsledek vyjádří v bioanalytických ekvivalentech (BEQ), zatímco v případě použití fyzikálně-chemických metod GC-MS se vyjádří v toxických ekvivalentech (TEQ). Numericky vyjádřené výsledky screeningových metod jsou vhodné k prokázání souladu nebo podezření na nedodržení nebo překročení akčních limitů a udávají rozmezí úrovní v případě následné zkoušky pomocí konfirmačních metod. Nejsou vhodné pro účely, jako je hodnocení úrovní pozadí, odhad příjmu, sledování vývoje úrovní v čase nebo přehodnocení akčních a maximálních limitů.
b) Konfirmační metody
Konfirmační metody umožňují jednoznačnou identifikaci a kvantifikaci PCDD/PCDF a PCB s dioxinovým efektem přítomných ve vzorku a poskytují úplné informace o úrovni kongeneru. Uvedené metody proto umožňují kontrolu maximálních a akčních limitů, včetně konfirmace výsledků získaných pomocí screeningových metod. Výsledky mohou být navíc dále využity pro účely, jako je stanovení nízkých úrovní pozadí při monitoringu potravin, sledování vývoje v čase, posouzení expozice populace a vytvoření databáze za účelem případného přehodnocení akčních a maximálních limitů. Rovněž jsou významné pro stanovení zastoupení kongenerů za účelem zjištění zdroje možné kontaminace. Tyto metody využívají GC-HRMS. Pro konfirmaci souladu nebo nesouladu s maximálními limity lze rovněž použít GC-MS/MS.
2. SOUVISLOSTI
Pro výpočet koncentrací TEQ se koncentrace jednotlivých látek v daném vzorku vynásobí jejich příslušnými TEF, které jsou stanoveny Světovou zdravotnickou organizací a jsou uvedeny v dodatku k této příloze, sečtou se a výsledná suma je celkovou koncentrací sloučenin s dioxinovým efektem vyjádřenou v TEQ.
Screeningové a konfirmační metody mohou být použity pouze pro kontrolu určité matrice, pokud jsou tyto metody dostatečně citlivé, aby spolehlivě zjistily hladiny na úrovni maximálního nebo akčního limitu.
3. POŽADAVKY NA ZABEZPEČENÍ KVALITY
|
— |
Na každém stupni odběru vzorků a analýzy se musí přijmout opatření k zamezení křížové kontaminaci. |
|
— |
Vzorky musí být uchovávány a přepravovány ve skleněných, hliníkových, polypropylenových nebo polyethylenových nádobách vhodných pro skladování bez jakéhokoli vlivu na úrovně PCDD/PCDF a PCB s dioxinovým efektem ve vzorcích. Z nádoby na vzorky musí být odstraněny stopy papírového prachu. |
|
— |
Vzorky musí být uchovávány a přepravovány tak, aby byla zachována integrita vzorku potraviny. |
|
— |
Pokud je to relevantní, jednotlivé laboratorní vzorky se jemně rozemelou a důkladně promísí postupem, u něhož je prokázáno, že se jím dosáhne úplné homogenizace (např. rozemletím a proséváním přes síto s průměrem oček 1 mm); je-li vlhkost vzorků příliš vysoká, musí se vzorky před rozemletím sušit. |
|
— |
Je vždy důležité zkontrolovat činidla, pomůcky ze skla a vybavení z hlediska možného vlivu na výsledky založené na TEQ nebo BEQ. |
|
— |
Provede se slepý pokus, při němž se provede celý analytický postup bez vzorku. |
|
— |
U bioanalytických metod je velmi důležité, aby u veškerých pomůcek ze skla a rozpouštědel použitých při analýze bylo zkouškou potvrzeno, že jsou prosty sloučenin, které mohou bránit zjištění cílových sloučenin v pracovním rozsahu. Skleněné pomůcky se vypláchnou rozpouštědly nebo/a zahřejí na teploty vhodné pro odstranění stop PCDD/PCDF, sloučenin s dioxinovým efektem a interferujících sloučenin z jejich povrchu. |
|
— |
Množství vzorku použité pro extrakci musí být dostatečné, aby byly splněny požadavky s ohledem na dostatečně nízký pracovní rozsah včetně koncentrací maximálních nebo akčních limitů. |
|
— |
Specifické postupy přípravy vzorku použité pro zkoumané produkty musí splňovat mezinárodně uznávané metodiky. |
|
— |
Z ryb se musí odstranit kůže, vzhledem k tomu, že maximální limit se vztahuje na svalovinu bez kůže. Je však nutné, aby všechna zbylá svalovina a tuková tkáň na vnitřní straně kůže byly z kůže pečlivě a úplně seškrabány a přidány k analyzovanému vzorku. |
4. POŽADAVKY NA LABORATOŘE
|
— |
V souladu s nařízením (ES) č. 882/2004 musí být laboratoře akreditovány uznaným subjektem působícím v souladu s pokyny ISO Guide 58, aby bylo zaručeno, že uplatňují postupy zajištění analytické kvality. Laboratoře musí být akreditovány podle normy EN ISO/IEC 17025. V příslušném případě je třeba se řídit zásadami popsanými v technických pokynech pro odhad nejistoty měření a meze stanovitelnosti pro analýzu PCDD/PCDF a PCB (1). |
|
— |
Způsobilost laboratoře prokazuje soustavná úspěšná účast v mezilaboratorních studiích týkajících se stanovení PCDD/PCDF a PCB s dioxinovým efektem v příslušných matricích potravin a koncentračních rozpětích. |
|
— |
Laboratoře, které pro rutinní kontrolu vzorků používají screeningové metody, by měly úzce spolupracovat s laboratořemi používajícími konfirmační metodu, za účelem jak kontroly kvality, tak konfirmace výsledku analýzy podezřelých vzorků. |
5. ZÁKLADNÍ POŽADAVKY, KTERÉ MUSÍ SPLŇOVAT ANALYTICKÝ POSTUP U DIOXINŮ (PCDD/PCDF) A PCB S DIOXINOVÝM EFEKTEM
5.1. Nízký pracovní rozsah a meze stanovitelnosti
|
— |
V případě PCDD/PCDF musí být zjistitelná množství z důvodu extrémní toxicity některých těchto sloučenin na horní úrovni femtogramů (10– 15 g). V případě většiny kongenerů PCB je dostatečná již mez stanovitelnosti na úrovni nanogramů (10– 9 g). Pro měření toxičtějších kongenerů PCB s dioxinovým efektem (zejména non-orto substituovaných kongenerů) však musí nejspodnější část pracovního rozsahu dosahovat nízkých úrovní pikogramů (10– 12 g). |
5.2. Vysoká selektivita (specifičnost)
|
— |
Je třeba rozlišit PCDD/PCDF a PCB s dioxinovým efektem a řadu jiných sloučenin, které se extrahují společně s těmito látkami, mohou rušit při jejich stanovování a jsou přítomny v koncentracích až o několik řádů vyšších než koncentrace sledovaných analytů. U metod založených na plynové chromatografii / hmotnostní spektrometrii (GC-MS) je nezbytné rozlišení mezi různými kongenery, např. mezi toxickými kongenery (např. sedmnácti PCDD/PCDF substituovanými v polohách 2,3,7,8 a dvanácti PCB s dioxinovým efektem) a ostatními kongenery. |
|
— |
Bioanalytické metody musí být schopny detekovat cílové sloučeniny jako sumu PCDD/PCDF a/nebo PCB s dioxinovým efektem. Přečištění vzorku se zaměří na odstranění sloučenin způsobujících falešně nevyhovující výsledky nebo sloučenin, které mohou způsobovat snížení odezvy vedoucí k falešně vyhovujícím výsledkům. |
5.3. Vysoká správnost (pravdivost a přesnost, zjevná výtěžnost biologické zkoušky)
|
— |
U metod GC-MS musí stanovení poskytovat správný odhad skutečné koncentrace ve vzorku. Vysoká správnost (správnost měření: těsnost shody mezi výsledkem měření a skutečnou nebo přidělenou hodnotou) je nezbytná k tomu, aby nedošlo k zamítnutí výsledku analýzy vzorku na základě malé spolehlivosti stanovené úrovně TEQ. Správnost je vyjádřena pravdivostí (rozdílem mezi střední naměřenou hodnotou analytu v certifikovaném materiálu a jeho certifikovanou hodnotou, vyjádřeným v procentech této hodnoty) a přesností (RSDR je relativní směrodatná odchylka vypočtená z výsledků získaných za podmínek reprodukovatelnosti). |
|
— |
Pro bioanalytické metody se určí zjevná výtěžnost biologické zkoušky. |
5.4. Validace v rozsahu maximálního limitu a obecná opatření pro kontrolu kvality
|
— |
Laboratoře musí prokázat výkonnost metody v rozsahu kolem maximálního limitu, např. v polovině, jednonásobku a dvojnásobku maximálního limitu, a to s přijatelným variačním koeficientem pro opakovanou analýzu, a sice během validace a/nebo během rutinní analýzy. |
|
— |
Jako opatření v rámci vnitřní kontroly kvality se provádějí pravidelná slepá kontrolní stanovení, stanovení s obohacenými vzorky nebo analýzy kontrolních vzorků (nejlépe certifikovaného referenčního materiálu, je-li k dispozici). Ze slepých kontrolních stanovení, stanovení s obohacenými vzorky nebo analýz kontrolních vzorků se vyhotoví a ověří grafy kontroly kvality, aby bylo zajištěno, že analytická výkonnost je v souladu s požadavky. |
5.5. Mez stanovitelnosti
|
— |
Pro bioanalytické screeningové metody není stanovení meze stanovitelnosti nezbytné, příslušná metoda však musí prokázat, že umožňuje rozlišení mezi hodnotou slepého stanovení a mezní hodnotou. Při poskytování úrovně BEQ se stanoví oznamovací mez pro vzorky s odezvou nižší než tato mez. Musí být prokázáno, že se oznamovací mez významně (nejméně trojnásobně) liší od slepých vzorků odrážejících celý pracovní postup s odezvou nižší než pracovní rozsah. Vypočte se proto ze vzorků obsahujících cílové sloučeniny přibližně v požadované minimální úrovni, a nikoli z poměru signál-šum nebo ze slepé zkoušky. |
|
— |
Mez stanovitelnosti u konfirmačních metod činí přibližně jednu pětinu maximálního limitu. |
5.6. Analytická kritéria
|
— |
Pro spolehlivé výsledky konfirmačních nebo screeningových metod musí být v rozsahu maximálního limitu splněna následující kritéria pro hodnotu TEQ a BEQ, ať už je určena jako celkový TEQ nebo celkový BEQ (jako suma PCDD/PCDF a PCB s dioxinovým efektem), nebo samostatně pro PCDD/PCDF a PCB s dioxinovým efektem. |
|
|
Screening pomocí bioanalytických nebo fyzikálně-chemických metod |
Konfirmační metody |
|
Míra falešně vyhovujících výsledků (*1) |
< 5 % |
|
|
Pravdivost |
|
– 20 % až + 20 % |
|
Opakovatelnost (RSDr) |
< 20 % |
|
|
Mezilehlá přesnost (RSDR) |
< 25 % |
< 15 % |
5.7. Zvláštní požadavky na screeningové metody
|
— |
Pro screening mohou být použity jak metody GC-MS, tak bioanalytické metody. V případě metod GC-MS platí požadavky uvedené v bodě 6. Pro buněčné bioanalytické metody jsou zvláštní požadavky stanoveny v bodě 7. |
|
— |
Laboratoře, které pro rutinní kontrolu vzorků používají screeningové metody, by měly úzce spolupracovat s laboratořemi používajícími konfirmační metodu. |
|
— |
Během rutinní analýzy je nutné ověřovat výkonnost příslušné screeningové metody, a to kontrolou kvality při analýzách a průběžnou validací metody. Musí být zaveden stálý program kontroly vyhovujících výsledků. |
|
— |
Kontrola možného potlačení buněčné odezvy a cytotoxicity. 20 % extraktů vzorků se změří při rutinním screeningu bez přidání a s přidáním TCDD v množství odpovídajícím maximálnímu nebo akčnímu limitu, aby se zjistilo, zda odezva není potlačována interferujícími látkami přítomnými v extraktu vzorku. Naměřená koncentrace u obohaceného vzorku se porovná se sumou koncentrace neobohaceného extraktu a koncentrace obohacující látky. Pokud je tato naměřená koncentrace o více než 25 % nižší než vypočtená (souhrnná) koncentrace, svědčí to o tom, že možná dochází k potlačení odezvy, a dotčený vzorek musí být podroben konfirmační analýze. Výsledky musí být zaznamenány v grafech kontroly kvality. |
|
— |
Kontrola kvality u vyhovujících vzorků Potvrzeno musí být přibližně 2 % až 10 % vyhovujících vzorků, v závislosti na matrici vzorků a zkušenostech laboratoře. |
|
— |
Určení míry falešně vyhovujících vzorků na základě údajů z kontroly kvality Určí se míra falešně vyhovujících výsledků na základě screeningu nižších a vyšších než maximální nebo akční limit. Skutečný podíl falešně vyhovujících výsledků musí být nižší než 5 %. Poté, co je k dispozici nejméně 20 potvrzených výsledků z kontroly kvality vyhovujících vzorků na matrici/matricovou skupinu, vyvodí se z těchto výsledků závěry ohledně míry falešně vyhovujících výsledků. Do minimálního počtu 20 výsledků pro hodnocení míry falešně vyhovujících výsledků se mohou zahrnout i výsledky ze vzorků analyzovaných pomocí kruhových testů nebo při kontaminačních aférách, které pokrývají rozpětí koncentrace až např. do dvojnásobku maximálního limitu. Vzorky musí zahrnovat nejčastější zastoupení kongenerů, které představují různé zdroje. Ačkoli se mají screeningové testy přednostně zaměřit na zjištění vzorků přesahujících akční limit, je kritériem pro stanovení míry falešně vyhovujících vzorků maximální limit, s přihlédnutím k rozšířené nejistotě měření konfirmační metody. |
|
— |
Případné nevyhovující výsledky ze screeningu musí být vždy ověřeny kompletní opakovanou analýzou původního vzorku pomocí konfirmační metody. Tyto vzorky mohou být také použity pro vyhodnocení podílu falešně nevyhovujících výsledků. U screeningových metod je mírou falešně nevyhovujících výsledků podíl výsledků, které konfirmační analýza potvrdí jako vyhovující, zatímco při předchozím screeningu bylo vysloveno podezření, že je vzorek nevyhovující. Hodnocení výhodnosti použití screeningové metody však musí vycházet z porovnání falešně nevyhovujících vzorků a celkového počtu kontrolovaných vzorků. Tento poměr musí být dostatečně nízký, aby bylo možné považovat používání příslušného screeningového nástroje za výhodné. |
|
— |
Bioanalytické metody musí alespoň při validačních podmínkách poskytovat platné údaje o úrovni TEQ, vypočtené a vyjádřené jako BEQ. |
|
— |
Pro bioanalytické metody prováděné za podmínek opakovatelnosti je vnitrolaboratorní RSDr obvykle menší než reprodukovatelnost RSDR. |
6. ZVLÁŠTNÍ POŽADAVKY, KTERÉ MUSÍ SPLŇOVAT METODY GC-MS, ABY VYHOVOVALY PRO ÚČELY SCREENINGU NEBO KONFIRMACE
6.1. Přijatelné rozdíly mezi horním odhadem a dolním odhadem hladin WHO-TEQ
|
— |
Rozdíl mezi horním odhadem a dolním odhadem nesmí překročit 20 %, aby bylo potvrzeno překročení maximálního nebo v případě potřeby akčního limitu. |
6.2. Kontrola výtěžnosti
|
— |
Vnitřní standardy 2,3,7,8-chlor-substituovaných PCDD/PCDF značené izotopem 13C a standardy PCB s dioxinovým efektem značené izotopem 13C musí být přidány na samém začátku analýzy, např. před extrakcí, aby bylo možné validovat analytický postup. Alespoň jeden kongener musí být přidán pro každou z tetra až okta-chlorovaných homologických skupin PCDD/PCDF a alespoň jeden kongener pro každou z homologických skupin PCB s dioxinovým efektem (nebo alespoň jeden kongener pro každou skupinu vybraných iontů při použití hmotnostní spektrometrie v režimu registrace vybraných iontů použitou pro sledování PCDD/PCDF a PCB s dioxinovým efektem). V případě konfirmačních metod se použije všech 17 vnitřních standardů 2,3,7,8-substituovaných PCDD/PCDF značených izotopem 13C a všech 12 vnitřních standardů PCB s dioxinovým efektem značených izotopem 13C. |
|
— |
Relativní faktory odezvy se s pomocí vhodných kalibračních roztoků stanoví také pro kongenery, pro něž nebyly přidány sloučeniny značené izotopem 13C. |
|
— |
U potravin rostlinného původu a potravin živočišného původu s obsahem tuku nižším než 10 % je přidání vnitřních standardů povinné před extrakcí. U potravin živočišného původu s obsahem tuku vyšším než 10 % lze vnitřní standardy přidat buď před extrakcí tuku, nebo po ní. Vhodným způsobem se validuje účinnost extrakce, a to v závislosti na fázi, ve které se přidávají vnitřní standardy, a podle toho, zda se vydávané výsledky vztahují na výrobek nebo na tuk ve výrobku obsažený. |
|
— |
Před analýzou metodou GC-MS musí být přidány 1 nebo 2 obohacené standardy (recovery standardy) pro stanovení výtěžnosti. |
|
— |
Kontrola výtěžnosti je nezbytná. U konfirmačních metod se výtěžnost jednotlivých vnitřních standardů musí pohybovat v rozmezí 60 až 120 %. Nižší nebo vyšší hodnota výtěžnosti u jednotlivých kongenerů, zejména některých hepta- a okta-chlorovaných dibenzo-p-dioxinů a dibenzofuranů, je přípustná pod podmínkou, že jejich příspěvek k hodnotě TEQ nepřesáhne 10 % celkové hodnoty TEQ (na základě sumy PCDD/PCDF a PCB s dioxinovým efektem). Hodnota výtěžnosti u screeningových metod GC-MS se musí pohybovat mezi 30 a 140 %. |
6.3. Odstranění interferujících látek
|
— |
Oddělení PCDD/PCDF od interferujících chlorovaných sloučenin, jako jsou PCB bez dioxinového efektu a chlorované difenylethery, se provede vhodnými chromatografickými technikami (nejlépe na florisilové, aluminové a/nebo uhlíkové koloně). |
|
— |
Oddělení isomerů pomocí plynové chromatografie musí být dostatečné (< 25 % překryvu mezi píky 1,2,3,4,7,8-HxCDF a 1,2,3,6,7,8-HxCDF). |
6.4. Kalibrace pomocí standardní křivky
|
— |
Rozsah kalibrační křivky musí pokrývat odpovídající rozpětí maximálních nebo akčních limitů. |
6.5. Zvláštní kritéria pro konfirmační metody
|
— |
Pro GC-HRMS:
|
|
— |
Pro GC-MS/MS:
|
7. ZVLÁŠTNÍ POŽADAVKY NA BIOANALYTICKÉ METODY
Bioanalytické metody jsou metody založené na využití biologických principů, jako jsou buněčné testy, receptorové testy nebo imunologické testy. V této části se stanoví obecné požadavky na bioanalytické metody.
Screeningové metody v zásadě klasifikují vzorky jako vyhovující nebo vzorky podezřelé jako nevyhovující. Za tímto účelem se vypočtená hladina BEQ porovnává s mezní hodnotou (viz bod 7.3). Vzorky nižší než mezní hodnota se považují za vyhovující, vzorky rovnající se mezní hodnotě nebo vyšší se považují za podezřelé jako nevyhovující a je nutné provést jejich analýzu pomocí konfirmační metody. Prakticky může jako mezní hodnota sloužit množství BEQ odpovídající 2/3 maximálního limitu, pokud je zajištěna míra falešně vyhovujících vzorků nižší než 5 % a přijatelná míra falešně nevyhovujících vzorků. Při různém maximálním limitu pro PCDD/PCDF a pro sumu PCDD/PCDF a PCB s dioxinovým efektem vyžaduje kontrola souladu vzorků bez frakcionace vhodné mezní hodnoty pro biologickou zkoušku pro PCDD/PCDF. Pro kontrolu vzorků překračujících akční limity je vhodnou mezní hodnotou přiměřené procento příslušného akčního limitu.
Je-li orientační úroveň vyjádřená v BEQ, musí být výsledky vzorku vyjádřeny v pracovním rozsahu a přesahovat oznamovací mez (viz body 7.1.1 a 7.1.6).
7.1. Hodnocení odezvy zkoušky
7.1.1. Obecné požadavky
|
— |
Při výpočtu koncentrace z kalibrační křivky TCDD vykáží hodnoty na horním konci křivky velký křivkový rozptyl (vysoký variační koeficient (CV)). Pracovní rozsah je oblast, kde je tento CV menší než 15 %. Nejspodnější část pracovního rozsahu (oznamovací mez) musí být stanovena tak, aby výrazně (nejméně trojnásobně) přesahovala hodnoty slepých vzorků odrážejících celý pracovní postup. Horní část pracovního rozsahu obvykle představuje hodnota EC70 (70 % maximální účinné koncentrace), je však nižší, pokud je CV v tomto rozpětí vyšší než 15 %. Pracovní rozsah se stanoví během validace. Mezní hodnoty (viz bod 7.3) musí být uvnitř pracovního rozsahu. |
|
— |
Standardní roztoky a extrakty vzorku se zkouší třikrát nebo alespoň duplicitně. Při duplicitních zkouškách musí standardní roztok nebo kontrolní extrakt zkoušený ve 4–6 jamkách rozložených na destičce poskytnout odezvu nebo koncentraci (možné pouze v pracovním rozsahu) vycházející z CV < 15 %. |
7.1.2. Kalibrace
7.1.2.1. Kalibrace pomocí standardní křivky
|
— |
Za účelem výpočtu úrovně BEQ v extraktu a následně ve vzorku lze úroveň ve vzorcích odhadnout srovnáním jejich odezvy s odezvou kalibrační křivky TCDD (nebo PCB 126 nebo standardní směsi PCDD/PCDF/PCB s dioxinovým efektem). |
|
— |
Kalibrační křivky musí obsahovat 8 až 12 koncentrací (alespoň duplicitních), s dostatečným počtem koncentrací ve spodní části křivky (pracovním rozsahu). Zvláštní pozornost musí být věnována kvalitě proložení kalibračních bodů křivkou v pracovním rozsahu. Hodnota R2 sama o sobě má pouze zanedbatelný nebo žádný význam při hodnocení kvality proložení kalibračních bodů křivkou při nelineární regresi. Lepšího proložení se dosáhne minimalizací rozdílu mezi vypočtenými a zjištěnými úrovněmi v pracovním rozsahu křivky (např. minimalizací sumy druhých mocnin reziduí). |
|
— |
Od odhadované úrovně v extraktu vzorku se následně odečte úroveň BEQ vypočtená pro slepý vzorek matrice nebo rozpouštědla (aby se zohlednily nečistoty z použitých rozpouštědel a chemikálií) a provede se korekce na zjevnou výtěžnost (vypočtenou na základě úrovně BEQ vhodných referenčních vzorků s reprezentativním zastoupením kongenerů kolem maximálního nebo akčního limitu). Pro provedení korekce na výtěžnost musí být zjevná výtěžnost vždy v požadovaném rozmezí (viz bod 7.1.4). Referenční vzorky použité pro korekci na výtěžnost musí splňovat požadavky uvedené v bodě 7.2. |
7.1.2.2. Kalibrace pomocí referenčních vzorků
Případně lze použít kalibrační křivku zhotovenou alespoň ze čtyř referenčních vzorků (viz bod 7.2): jednoho matričního slepého vzorku plus tří referenčních vzorků na polovině, jednonásobku a dvojnásobku maximálního nebo akčního limitu, čímž odpadne nutnost odečtu hodnoty slepého stanovení a korekce na výtěžnost, pokud se vlastnosti matrice referenčních vzorků kryjí s vlastnostmi neznámých vzorků. V tomto případě lze odezvu odpovídající 2/3 maximálního limitu (viz bod 7.3) vypočítat přímo z těchto vzorků a použít ji jako mezní hodnotu. Pro kontrolu vzorků překračujících akční limity je vhodnou mezní hodnotou přiměřené procento těchto akčních limitů.
7.1.3. Samostatné stanovení PCDD/PCDF a PCB s dioxinovým efektem
Extrakty lze rozdělit do frakcí obsahujících PCDD/PCDF a PCB s dioxinovým efektem, což umožňuje získání oddělených údajů o hladinách TEQ pro PCDD/PCDF a PCB s dioxinovým efektem (v BEQ). Pro hodnocení výsledků pro frakci obsahující PCB s dioxinovým efektem se přednostně použije kalibrační křivka standardu PCB 126.
7.1.4. Zjevná výtěžnost biologické zkoušky
„Zjevná výtěžnost biologické zkoušky“ se vypočte z vhodných referenčních vzorků s reprezentativním zastoupením kongenerů kolem maximálního nebo akčního limitu a vyjádří se jako procento hladiny BEQ v porovnání s hladinou TEQ. V závislosti na použitém typu zkoušky a použitých TEF (2) mohou rozdíly mezi faktory TEF a REP pro PCB s dioxinovým efektem způsobit nízkou zjevnou výtěžnost u PCB s dioxinovým efektem v porovnání s PCDD/PCDF. Proto při samostatném stanovení PCDD/PCDF a PCB s dioxinovým efektem musí být zjevná výtěžnost biologických zkoušek následující: u PCB s dioxinovým efektem 20 až 60 %, u PCDD/PCDF 50 až 130 % (rozmezí platná pro kalibrační křivku TCDD). Jelikož podíl PCB s dioxinovým efektem na sumě PCDD/PCDF a PCB s dioxinovým efektem se může u různých matric a vzorků lišit, odráží se tyto rozdíly i ve zjevné výtěžnosti biologických zkoušek pro tento souhrnný parametr, která se musí pohybovat v rozmezí 30 až 130 %.
7.1.5. Kontrola výtěžnosti pro účely čištění
Při validaci je nutné zkontrolovat ztrátu sloučenin během čištění. Slepý vzorek obohacený směsí různých kongenerů se podrobí čištění (alespoň n = 3) a výtěžnost a variabilita se ověří konfirmační metodou. Výtěžnost musí být v rozmezí 60 až 120 %, zejména u kongenerů s podílem na množství TEQ v různých směsích, který je vyšší než 10 %.
7.1.6. Oznamovací mez
Při vydávání úrovní BEQ musí být stanovena oznamovací mez z příslušných matričních vzorků zahrnujících typická zastoupení kongenerů, avšak vzhledem k nízké přesnosti v dolním rozsahu křivky nikoli z kalibrační křivky standardů. Je třeba vzít v úvahu účinky extrakce a čištění. Oznamovací mez musí být stanovena významně (nejméně trojnásobně) vyšší než hodnoty slepých vzorků odrážejících celý pracovní postup.
7.2. Použití referenčních vzorků
|
— |
Referenční vzorky musí představovat matrice vzorku, zastoupení kongenerů a rozpětí koncentrací pro PCDD/PCDF a PCB s dioxinovým efektem kolem maximálního nebo akčního limitu. |
|
— |
Každá série zkoušek musí zahrnovat slepý vzorek odrážející celý pracovní postup, či nejlépe slepý matriční vzorek, a referenční vzorek maximálního nebo akčního limitu. Tyto vzorky musí být extrahovány a zkoušeny současně a za stejných podmínek. Referenční vzorek musí vykázat jasně vyšší odezvu v porovnání s odezvou slepého vzorku, čímž je zajištěna vhodnost zkoušky. Tyto vzorky mohou být použity pro korekci o hodnoty slepého stanovení a korekci na výtěžnost. |
|
— |
Referenční vzorky vybrané pro provedení korekce na výtěžnost musí být reprezentativní pro zkušební vzorky, což znamená, že zastoupení kongenerů nesmí vést k podhodnocení úrovní. |
|
— |
Pro prokázání odpovídající výkonnosti zkoušky ve sledovaném rozsahu pro kontrolu maximálního nebo akčního limitu lze kromě toho zahrnout ještě referenční vzorky o např. poloviční a dvojnásobné koncentraci, než je maximální nebo akční limit. Dohromady mohou být tyto vzorky použity pro výpočet úrovní BEQ ve zkušebních vzorcích (viz bod 7.1.2.2). |
7.3. Stanovení mezních hodnot
Je nutné určit vztah mezi výsledky biologické zkoušky v BEQ a výsledky z konfirmačních metod v TEQ (např. pomocí kalibračních pokusů, které zohledňují vliv matrice, s referenčními vzorky obohacenými na nule, polovině, jednonásobku a dvojnásobku maximálního limitu s šesti opakováními na každé úrovni (n = 24)). Na základě tohoto vztahu lze odhadnout korekční faktory (odečtení blanku a korekce na výtěžnost), je však nutno je v každé sérii zkoušek ověřit zahrnutím slepých vzorků/matričních slepých vzorků a vzorků výtěžnosti (viz bod 7.2).
Je nutné stanovit mezní hodnoty pro účely rozhodnutí ohledně souladu vzorku s maximálními limity nebo pro kontrolu akčních limitů, jsou-li sledovanou hodnotou, s příslušnými maximálními nebo akčními limity buď zvlášť pro PCDD/PCDF a PCB s dioxinovým efektem, nebo pro sumu PCDD/PCDF a PCB s dioxinovým efektem. Tyto hodnoty jsou zastoupeny nižším cílovým bodem distribuce výsledků biologické zkoušky (upravených o hodnoty slepého stanovení a korigovaných na výtěžnost) odpovídajícím rozhodovací mezi u příslušné konfirmační metody na základě 95 % spolehlivosti, z čehož vyplývá míra falešně vyhovujících výsledků < 5 %, a na základě RSDR < 25 %. Rozhodovací mezí u konfirmační metody je maximální limit při zohlednění rozšířené nejistoty měření.
V praxi lze mezní hodnotu (v BEQ) vypočítat těmito způsoby (viz graf 1):
7.3.1. S použitím nižší části 95 % predikčního intervalu ve výši rozhodovací meze konfirmační metody:

kde:
|
BEQDL |
je BEQ odpovídající rozhodovací mezi u konfirmační metody, což je maximální limit včetně rozšířené nejistoty měření |
|
sy,x |
je reziduální směrodatná odchylka |
|
t α,f = m – 2 |
je kvantil Studentova t-rozdělení (α = 5 %, f = stupně volnosti, jednostranný) |
|
m |
je celkový počet kalibračních bodů (index j) |
|
n |
je počet opakování na každé úrovni |
|
xi |
je koncentrace vzorku (v TEQ) v kalibračním bodě i stanovená konfirmační metodou |
|
|
je průměr koncentrací (v TEQ) všech kalibračních vzorků |
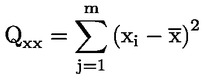 je parametr sumy čtverců
je parametr sumy čtverců
|
i |
= |
index pro kalibrační bod i |
7.3.2. Z výsledků biologické zkoušky (upravených o hodnoty slepého stanovení a korigovaných na výtěžnost) získaných z vícenásobných analýz vzorků (n ≥ 6) kontaminovaných na úrovni rozhodovací meze konfirmační metody, jakožto nižší část rozdělení výsledků na odpovídající průměrné hodnotě BEQ:
Mezní hodnota = BEQDL – 1,64 × SDR
kde
|
SDR |
je směrodatná odchylka výsledků biologické zkoušky na BEQDL, měřeno za podmínek vnitrolaboratorní reprodukovatelnosti. |
7.3.3. Výpočet jako střední hodnota výsledků biologické zkoušky (v BEQ, upravených o hodnoty slepého stanovení a korigovaných na výtěžnost) z vícenásobné analýzy vzorků (n ≥ 6) kontaminovaných na 2/3 maximálního nebo akčního limitu. To vychází z poznatku, že tato úroveň se bude pohybovat kolem mezní hodnoty určené podle bodu 7.3.1 nebo 7.3.2.
Výpočet mezních hodnot vycházející z 95 % míry spolehlivosti, z níž vyplývá míra falešně vyhovujících výsledků < 5 %, a z RSDR < 25 %:
|
1. |
Z nižší části 95 % predikčního intervalu na úrovni rozhodovací meze konfirmační metody; |
|
2. |
z vícenásobné analýzy vzorků (n ≥ 6) kontaminovaných na úrovni rozhodovací meze konfirmační metody jakožto nižší část distribuce údajů (v grafu je znázorňuje křivka ve tvaru zvonu) na odpovídající průměrné hodnotě BEQ. |
Graf 1
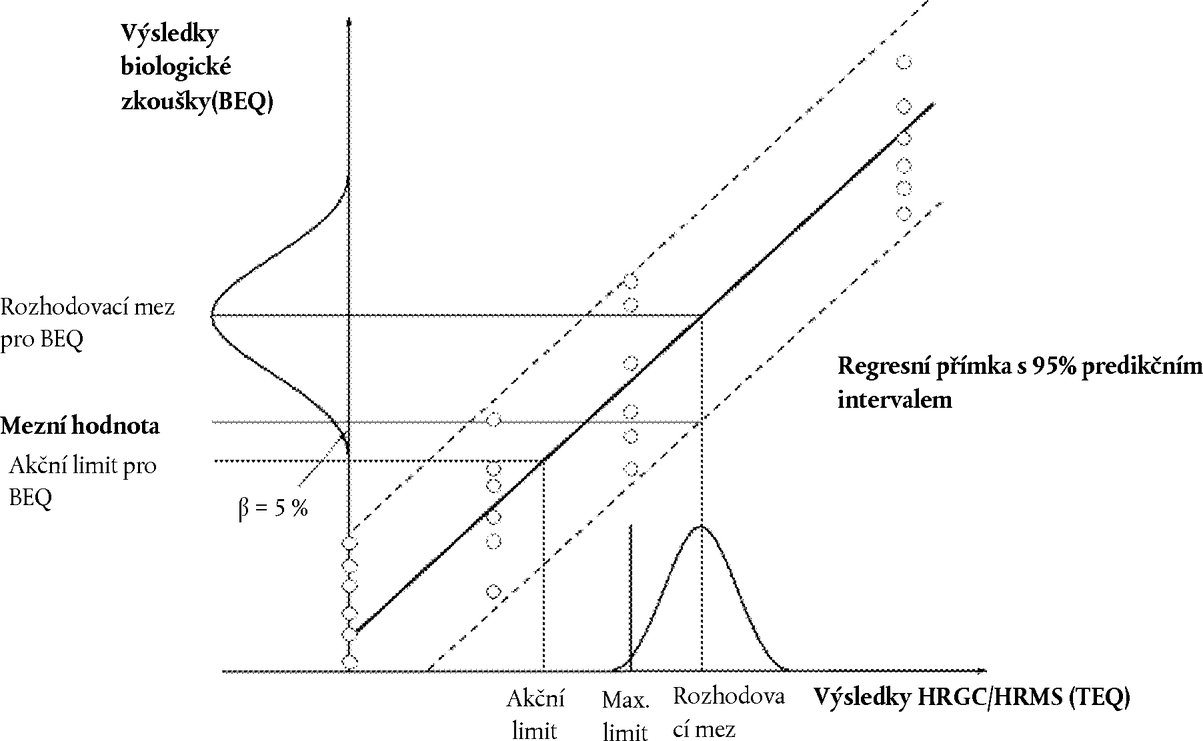
7.3.4. Omezení mezních hodnot
Mezní hodnoty vycházející z BEQ a vypočtené z RSDR dosažené při validaci s použitím omezeného počtu vzorků s různým zastoupením matrice/kongenerů mohou být vyšší než maximální nebo akční limity vycházející z TEQ, vzhledem k větší přesnosti, než je přesnost, jíž lze běžně dosáhnout s neznámým spektrem zastoupení kongenerů. V takových případech se mezní hodnoty vypočtou z RSDR = 25 % nebo se dá přednost dvěma třetinám maximálního nebo akčního limitu.
7.4. Pracovní charakteristiky
|
— |
Vzhledem k tomu, že při bioanalytických metodách nelze použít žádné vnitřní standardy, provedou se zkoušky opakovatelnosti pro získání informací o směrodatné odchylce v rámci zkoušek a mezi sériemi zkoušek. Opakovatelnost musí být nižší než 20 %, vnitrolaboratorní reprodukovatelnost pak nižší než 25 %. To musí vycházet z vypočtených úrovní v BEQ po odečtení hodnot slepého stanovení a korekci na výtěžnost. |
|
— |
Jako součást postupu validace musí být prokázáno, že zkouška umožňuje rozlišit slepý vzorek a úroveň ve výši mezní hodnoty, a umožňuje tak identifikovat vzorky nad příslušnou mezní hodnotou (viz bod 7.1.2). |
|
— |
Je třeba určit cílové sloučeniny, možné interference a nejvyšší přípustný obsah ve slepém vzorku. |
|
— |
Procentní směrodatná odchylka odezvy nebo koncentrace vypočtená z odezvy (možné pouze v pracovním rozsahu) trojnásobného stanovení extraktu vzorku nesmí být vyšší než 15 %. |
|
— |
Pro hodnocení výkonnosti bioanalytické metody v daném časovém období se použijí nekorigované výsledky referenčního vzorku (referenčních vzorků) vyjádřené v BEQ (pro slepý vzorek a maximální nebo akční limit). |
|
— |
Pro slepé vzorky odrážející celý pracovní postup a pro každý typ referenčního vzorku se zaznamenávají a ověřují grafy kontroly kvality, aby bylo zajištěno, že analytická výkonnost je v souladu s příslušnými požadavky, u slepých vzorků odrážejících celý pracovní postup zejména s ohledem na požadovanou minimální odlišnost v nejnižší části pracovního rozsahu a u referenčních vzorků zejména s ohledem na vnitrolaboratorní reprodukovatelnost. Slepé vzorky odrážející celý pracovní postup musí být důkladně kontrolovány, aby se zamezilo falešně vyhovujícím výsledkům po jejich odečtení. |
|
— |
Výsledky konfirmačních metod u podezřelých vzorků a 2 až 10 % vyhovujících vzorků (minimálně 20 vzorků na jednu matrici) se zaznamenají a použijí se pro hodnocení výkonnosti screeningové metody a vztahu mezi BEQ a TEQ. Tuto databázi lze použít pro přehodnocení mezních hodnot platných pro běžné vzorky pro validované matrice. |
|
— |
Dobrou výkonnost metody lze rovněž prokázat v kruhových testech. Výsledky vzorků analyzovaných v kruhových testech, které pokrývají rozsah koncentrací až do např. dvojnásobku maximálního limitu, se rovněž mohou zahrnout do hodnocení podílu falešně vyhovujících výsledků, je-li laboratoř schopna prokázat dobrou výkonnost. Vzorky musí zahrnovat nejčastější zastoupení kongenerů, které představují různé zdroje. |
|
— |
Při incidentech lze mezní hodnoty přehodnotit, aby odrážely konkrétní matrici a zastoupení kongenerů tohoto konkrétního incidentu. |
8. VYDÁVÁNÍ VÝSLEDKŮ
Konfirmační metody
|
— |
Analytické výsledky musí obsahovat hodnoty jednotlivých kongenerů PCDD/PCDF a PCB s dioxinovým efektem a hodnoty TEQ se vydávají jako dolní, horní a střední odhad, aby se do vydávání výsledků zahrnulo co nejvíce informací, a umožnil se tak výklad výsledků podle příslušných zvláštních požadavků. |
|
— |
Protokol musí také zahrnovat metodu použitou pro extrakci PCDD/PCDF, PCB s dioxinovým efektem a lipidů. Obsah lipidů ve vzorku musí být stanoven a vydán pro potravinové vzorky s maximálními limity vztaženými na tuk a očekávané koncentrace tuku v rozmezí 0–2 % (v souladu se stávajícími předpisy). U ostatních vzorků je stanovení obsahu lipidů nepovinné. |
|
— |
Pokud výtěžnost leží mimo rozpětí uvedené v bodě 6.2, je-li překročen maximální limit (v tomto případě výtěžnosti pro jednu ze dvou opakovaných analýz) nebo v ostatních případech na žádost musí být dány k dispozici hodnoty výtěžnosti pro jednotlivé vnitřní standardy. |
|
— |
Protože se má při rozhodování o souladu vzorku přihlédnout také k rozšířené nejistotě měření, je třeba poskytnout také tento parametr. Analytické výsledky se proto vydají ve tvaru „x +/– U“, kde x je výsledek analýzy a U je rozšířená nejistota měření, přičemž se použije faktor pokrytí 2, který odpovídá míře spolehlivosti přibližně 95 %. V případě samostatného stanovení PCDD/PCDF a PCB s dioxinovým efektem se pro sumu PCDD/PCDF a PCB s dioxinovým efektem musí použít suma odhadované rozšířené nejistoty měření samostatných výsledků analýzy pro PCDD/PCDF a PCB s dioxinovým efektem. |
|
— |
Výsledky se vyjádří ve stejných jednotkách a stejným počtem platných číslic jako maximální limity stanovené v nařízení (ES) č. 1881/2006. |
Bioanalytické screeningové metody
|
— |
Výsledek screeningu se vyjádří jako vyhovující nebo podezřelý jako nevyhovující („podezřelý“). |
|
— |
Kromě toho je možné vydat orientační výsledek pro PCDD/PCDF a/nebo PCB s dioxinovým efektem vyjádřený v BEQ (nikoli TEQ) (viz bod 1). Vzorky s odezvou nižší než oznamovací mez musí být vyjádřeny jako nižší než oznamovací mez. Vzorky s odezvou vyšší než pracovní rozsah se vydávají jako vzorky překračující pracovní rozsah a úroveň odpovídající horní části pracovního rozsahu se uvede v BEQ. |
|
— |
Pro každý typ matrice vzorku musí protokol uvádět maximální nebo akční limit, z něhož hodnocení vychází. |
|
— |
Protokol musí uvádět použitý typ zkoušky, základní principy zkoušky a druh kalibrace. |
|
— |
Protokol musí také zahrnovat metodu použitou pro extrakci PCDD/PCDF, PCB s dioxinovým efektem a lipidů. Obsah lipidů ve vzorku musí být stanoven a vydán pro potravinové vzorky s maximálními limity vztaženými na tuk a očekávané koncentrace tuku v rozmezí 0–2 % (v souladu se stávajícími předpisy). U ostatních vzorků je stanovení obsahu lipidů nepovinné. |
|
— |
V případě vzorků podezřelých jako nevyhovující musí protokol obsahovat poznámku o tom, jaká opatření mají být učiněna. Koncentraci PCDD/PCDF a sumu PCDD/PCDF a PCB s dioxinovým efektem v těchto vzorcích se zvýšeným obsahem je třeba stanovit/potvrdit konfirmační metodou. |
|
— |
Nevyhovující výsledky se vydávají pouze tehdy, pokud byly zjištěny konfirmační analýzou. |
Fyzikálně-chemické screeningové metody
|
— |
Výsledek screeningu se vyjádří jako vyhovující nebo podezřelý jako nevyhovující („podezřelý“). |
|
— |
Pro každý typ matrice vzorku musí protokol uvádět maximální nebo akční limit, z něhož hodnocení vychází. |
|
— |
Kromě toho mohou být hodnoty jednotlivých kongenerů PCDD/PCDF a/nebo PCB s dioxinovým efektem a hodnoty TEQ udávány jako dolní, horní a střední odhad. Výsledky se vyjádří ve stejných jednotkách a (alespoň) se stejným počtem platných číslic jako maximální limity stanovené v nařízení (ES) č. 1881/2006. |
|
— |
Pokud výtěžnost leží mimo rozpětí uvedené v bodě 6.2 a v ostatních případech na žádost musí být dány k dispozici hodnoty výtěžnosti pro jednotlivé vnitřní standardy. |
|
— |
V protokolu musí být uvedeno, která metoda GC-MS byla použita. |
|
— |
Protokol musí také zahrnovat metodu použitou pro extrakci PCDD/PCDF, PCB s dioxinovým efektem a lipidů. Obsah lipidů ve vzorku musí být stanoven a vydán pro potravinové vzorky s maximálními limity vztaženými na tuk a očekávané koncentrace tuku v rozmezí 0–2 % (v souladu se stávajícími předpisy). U ostatních vzorků je stanovení obsahu lipidů nepovinné. |
|
— |
V případě vzorků podezřelých jako nevyhovující musí protokol obsahovat poznámku o tom, jaká opatření mají být učiněna. Koncentraci PCDD/PCDF a sumu PCDD/PCDF a PCB s dioxinovým efektem v těchto vzorcích se zvýšeným obsahem je třeba stanovit/potvrdit konfirmační metodou. |
|
— |
O nevyhovění může být rozhodnuto pouze konfirmační analýzou. |
(1) Guidance Document on Measurement Uncertainty for Laboratories performing PCDD/F and PCB Analysis using Isotope Dilution Mass Spectrometry [link to website], Guidance Document on the Estimation of LOD and LOQ for Measurements in the Field of Contaminants in Feed and Food [link to website].
(*1) S ohledem na maximální limity.
(2) Současné požadavky vycházejí z TEF vydaných v: M. Van den Berg et al, Toxicol Sci 93 (2), 223–241 (2006).
Dodatek
WHO-TEF (faktory toxické rovnocennosti Světové zdravotnické organizace) pro hodnocení nebezpečnosti pro člověka vycházející ze závěrů zasedání odborníků Světové zdravotnické organizace (WHO) – Mezinárodní program chemické bezpečnosti (IPCS), které se konalo v Ženevě v červnu 2005 (1)
|
Kongener |
Hodnota TEF |
Kongener |
Hodnota TEF |
||
|
Dibenzo-p-dioxiny („PCDD“) |
PCB „s dioxinovým efektem“ Non-ortho PCB + Mono-ortho PCB |
||||
|
2,3,7,8-TCDD |
1 |
|
|
||
|
1,2,3,7,8-PeCDD |
1 |
Non-ortho PCB |
|
||
|
1,2,3,4,7,8-HxCDD |
0,1 |
PCB 77 |
0,0001 |
||
|
1,2,3,6,7,8-HxCDD |
0,1 |
PCB 81 |
0,0003 |
||
|
1,2,3,7,8,9-HxCDD |
0,1 |
PCB 126 |
0,1 |
||
|
1,2,3,4,6,7,8-HpCDD |
0,01 |
PCB 169 |
0,03 |
||
|
OCDD |
0,0003 |
|
|
||
|
Dibenzofurany (PCDF) |
Mono-ortho PCB |
||||
|
2,3,7,8-TCDF |
0,1 |
PCB 105 |
0,00003 |
||
|
1,2,3,7,8-PeCDF |
0,03 |
PCB 114 |
0,00003 |
||
|
2,3,4,7,8-PeCDF |
0,3 |
PCB 118 |
0,00003 |
||
|
1,2,3,4,7,8-HxCDF |
0,1 |
PCB 123 |
0,00003 |
||
|
1,2,3,6,7,8-HxCDF |
0,1 |
PCB 156 |
0,00003 |
||
|
1,2,3,7,8,9-HxCDF |
0,1 |
PCB 157 |
0,00003 |
||
|
2,3,4,6,7,8-HxCDF |
0,1 |
PCB 167 |
0,00003 |
||
|
1,2,3,4,6,7,8-HpCDF |
0,01 |
PCB 189 |
0,00003 |
||
|
1,2,3,4,7,8,9-HpCDF |
0,01 |
|
|
||
|
OCDF |
0,0003 |
|
|
||
|
|||||
(1) Martin van den Berg et al., The 2005 World Health Organization Re-evaluation of Human and Mammalian Toxic Equivalency Factors for Dioxins and Dioxin-like Compounds. Toxicological Sciences 93(2), 223–241 (2006).
PŘÍLOHA IV
PŘÍPRAVA VZORKŮ A POŽADAVKY NA ANALYTICKÉ METODY POUŽÍVANÉ PŘI KONTROLE OBSAHU PCB BEZ DIOXINOVÉHO EFEKTU V NĚKTERÝCH POTRAVINÁCH
Požadavky stanovené v této příloze se vztahují na analýzu potravin pro úřední kontrolu obsahu PCB bez dioxinového efektu a pro přípravu vzorků a analytické požadavky k jiným regulačním účelům, včetně kontrol prováděných provozovatelem potravinářského podniku k zajištění dodržování ustanovení článku 4 nařízení (ES) č. 852/2004.
Ustanovení o přípravě vzorku podle bodu 3 přílohy III tohoto nařízení se použijí rovněž na kontrolu obsahu PCB bez dioxinového efektu v potravinách.
1. Použitelné metody detekce
Plynová chromatografie v tandemu s detektorem elektronového záchytu (GC-ECD), GC-LRMS, GC-MS/MS, GC-HRMS nebo rovnocenné metody.
2. Identifikace a konfirmace sledovaných analytů
|
— |
Relativní retenční čas ve vztahu k vnitřním standardům nebo referenčním standardům (s přijatelnou odchylkou ± 0,25 %). |
|
— |
Separace PCB bez dioxinového efektu plynovou chromatografií od interferujících látek, zejména současně se eluujících PCB, zvláště jsou-li úrovně vzorků v rozmezí limitů stanovených právními předpisy a případné nevyhovění má být teprve potvrzeno (1). |
|
— |
Techniky GC-MS:
|
|
— |
Pro GC-ECD: Konfirmace výsledků překračujících maximální limit s dvěma kolonami GC se stacionární fází jiné polarity. |
3. Prokazování výkonnosti metody
Validace v rozsahu maximálního limitu (polovina až dvojnásobek maximálního limitu) s přijatelným variačním koeficientem pro opakovanou analýzu (viz požadavky na mezilehlou přesnost uvedené v bodě 8).
4. Mez stanovitelnosti
Suma mezí stanovitelnosti (2) PCB bez dioxinového efektu nesmí překročit jednu třetinu maximálního limitu (3).
5. Kontrola kvality
Pravidelné slepé kontrolní vzorky, analýzy obohacených vzorků, vzorky pro kontrolu kvality, účast v mezilaboratorních studiích na příslušných matricích.
6. Kontrola výtěžností
|
— |
Použití vhodných vnitřních standardů s fyzikálně-chemickými vlastnostmi porovnatelnými se sledovanými analyty. |
|
— |
Přidání vnitřních standardů:
|
|
— |
Požadavky na metody s využitím všech šesti izotopicky značených kongenerů PCB bez dioxinového efektu:
|
|
— |
Požadavky na metody, které nevyužívají všech šesti izotopicky značených vnitřních standardů nebo jiných vnitřních standardů:
|
|
— |
Výtěžnosti neoznačených kongenerů se ověří pomocí obohacených vzorků nebo vzorků pro kontrolu kvality s koncentracemi v rozsahu maximálního limitu. Přijatelné výtěžnosti těchto kongenerů jsou mezi 60 a 120 %. |
7. Požadavky na laboratoře
V souladu s ustanoveními nařízení (ES) č. 882/2004 musí být laboratoře akreditovány uznaným subjektem působícím v souladu s pokyny ISO Guide 58, aby bylo zaručeno, že uplatňují postupy zajištění analytické kvality. Laboratoře musí být akreditovány podle normy EN ISO/IEC 17025. Kromě toho je v příslušném případě třeba řídit se zásadami popsanými v technických pokynech pro odhad nejistoty měření a meze stanovitelnosti pro analýzu PCB (4).
8. Pracovní charakteristiky: kritéria pro sumu PCB bez dioxionového efektu při maximálním limitu
|
|
Hmotnostní spektrometrie s izotopovým zřeďováním (*1) |
Jiné techniky |
|
Pravdivost |
– 20 % až + 20 % |
– 30 % až + 30 % |
|
Mezilehlá přesnost (RSDR) |
≤ 15 % |
≤ 20 % |
|
Rozdíl mezi výpočtem horního a dolního odhadu |
≤ 20 % |
≤ 20 % |
9. Vydávání výsledků
|
— |
Analytické výsledky musí obsahovat hodnoty jednotlivých kongenerů PCB bez dioxinového efektu a sumu PCB bez dioxinového efektu uváděných jako dolní, horní a střední odhad, aby se do vydávání výsledků zahrnulo co nejvíce informací, a umožnil se tak výklad výsledků podle příslušných zvláštních požadavků. |
|
— |
Protokol musí také zahrnovat metodu použitou pro extrakci PCB a lipidů. Obsah lipidů ve vzorku musí být stanoven a uváděn pro potravinové vzorky s maximálními limity vztaženými na tuk a očekávané koncentrace tuku v rozmezí 0–2 % (v souladu se stávajícími předpisy). U ostatních vzorků je stanovení obsahu lipidů nepovinné. |
|
— |
Pokud výtěžnost leží mimo rozpětí uvedené v bodě 6, je-li překročen maximální limit nebo v ostatních případech na žádost musí být dány k dispozici hodnoty výtěžnosti pro jednotlivé vnitřní standardy. |
|
— |
Protože se má při rozhodování o vyhovění vzorku přihlédnout také k rozšířené nejistotě měření, je třeba poskytnout také tento parametr. Analytické výsledky se proto uvádějí ve tvaru „x +/– U“, kde x je výsledek analýzy a U je rozšířená nejistota měření, přičemž se použije faktor pokrytí 2, který odpovídá míře spolehlivosti přibližně 95 %. |
|
— |
Výsledky se vyjádří ve stejných jednotkách a stejným počtem platných číslic jako maximální limity stanovené v nařízení (ES) č. 1881/2006. |
(1) Mezi kongenery, u nichž je často zjištěno, že se eluují zároveň, patří např. PCB 28/31, PCB 52/69 a PCB 138/163/164. U GC-MS je rovněž nutné vzít v úvahu možné interference z fragmentů vyšších chlorovaných kongenerů.
(2) V příslušném případě je třeba se řídit zásadami popsanými v dokumentu Guidance Document on the Estimation of LOD and LOQ for Measurements in the Field of Contaminants in Feed and Food [link to website].
(3) Velmi se doporučuje, aby hodnoty slepého stanovení činidla byly nižší, než je obsah kontaminující látky ve vzorku. Je povinností laboratoře kontrolovat rozptyl hodnot slepých stanovení, zejména v případě, kdy se hodnoty slepého stanovení odečítají.
(4) Guidance Document on Measurement Uncertainty for Laboratories performing PCDD/F and PCB Analysis using Isotope Dilution Mass Spectrometry [link to website], Guidance Document on the Estimation of LOD and LOQ for Measurements in the Field of Contaminants in Feed and Food [link to website].
(*1) Jako vnitřní standardy musí být použito všech šest sloučenin značených izotopem 13C.