|
31.5.2008
|
BG
|
Официален вестник на Европейския съюз
|
L 142/1
|
РЕГЛАМЕНТ (ЕО) № 440/2008 НА КОМИСИЯТА
от 30 май 2008 година
за определяне на методи за изпитване в съответствие с Регламент (ЕО) № 1907/2006 на Европейския парламент и на Съвета относно регистрацията, оценката, разрешаването и ограничаването на химикали (REACH)
(текст от значение за ЕИП)
КОМИСИЯТА НА ЕВРОПЕЙСКИТЕ ОБЩНОСТИ,
като взе предвид Договора за създаване на Европейската общност,
като взе предвид Регламент (EО) № 1907/2006 на Европейския парламент и на Съвета от 18 декември 2006 г. относно регистрацията, оценката, разрешаването и ограничаването на химикали (REACH), за създаване на Европейска агенция по химикали, за изменение на Директива 1999/45/EО и за отмяна на Регламент (EИО) № 793/93 на Съвета и Регламент (EО) № 1488/94 на Комисията, както и на Директива 76/769/EИО на Съвета и директиви 91/155/EИО, 93/67/EИО, 93/105/EО и 2000/21/EО на Комисията (1), и по-специално член 13, параграф 3 от него,
като има предвид, че:
|
(1)
|
В съответствие с Регламент (ЕО) № 1907/2006 на общностно равнище следва да се приемат методи за изпитване за целите на изпитванията на вещества, когато подобни изпитвания се изискват, за да се събере информация за характерните свойства на веществата.
|
|
(2)
|
Директива 67/548/ЕИО на Съвета от 27 юни 1967 г. за сближаването на законовите, подзаконовите и административните разпоредби относно класификацията, опаковането и етикетирането на опасни вещества (2) посочва в приложение V методите за определяне на физикохимичните свойства, токсичността и екотоксичността на веществата и препаратите. Приложение V към Директива 67/548/ЕИО се заличава с Директива 2006/121/ЕО на Европейския парламент и на Съвета, считано от 1 юни 2008 г.
|
|
(3)
|
Методите за изпитване, съдържащи се в приложение V към Директива 67/548/ЕИО, следва да бъдат включени в настоящия регламент.
|
|
(4)
|
Настоящият регламент не изключва прилагането на други методи на изпитване, при условие че те се прилагат в съответствие с член 13, параграф 3 от Регламент (ЕО) № 1907/2006.
|
|
(5)
|
Принципите на заместване, намаляване и усъвършенстване на използването на животни в процедури следва да бъдат взети предвид изцяло при изготвянето на методи на изпитване, по-специално в случаите, когато са налице подходящи одобрени методи, които да заместят, намалят или усъвършенстват изпитванията с животни.
|
|
(6)
|
Разпоредбите на настоящия регламент са в съответствие със становището на комитета, създаден съгласно член 133 от Регламент (ЕО) № 1907/2006,
|
ПРИЕ НАСТОЯЩИЯ РЕГЛАМЕНТ:
Член 1
Методите на изпитване, които следва да се прилагат за целите на Регламент (ЕО) № 1907/2006, са посочени в приложението към настоящия регламент.
Член 2
Когато е целесъобразно, Комисията ще преразгледа методите на изпитване, съдържащи се в настоящия регламент, с цел заместване, намаляване или усъвършенстване на изпитванията върху гръбначни животни.
Член 3
Всички позовавания на приложение V към Директива 67/548/ЕИО се тълкуват като позовавания на настоящия регламент.
Член 4
Настоящият регламент влиза в сила в деня след публикуването му в Официален вестник на Европейския съюз.
Той се прилага от 1 юни 2008 г.
Съставено в Брюксел на 30 май 2008 година.
За Комисията
Stavros DIMAS
Член на Комисията
(1) ОВ L 396, 30.12.2006 г., стр. 1.
(2) ОВ X 196, 16.8.1967 г., стр. 1. Директива, последно изменена с Директива 2006/121/ЕО на Европейския парламент и на Съвета (ОВ L 396, 30.12.2006 г., стр. 850) — ще последва актуализация със съответни препратки веднага след публикуването на 30-то адаптиране към техническия прогрес.
ПРИЛОЖЕНИЕ
ЧАСТ А: МЕТОДИ ЗА ОПРЕДЕЛЯНЕ НА ФИЗИКОХИМИЧНИ СВОЙСТВА
СЪДЪРЖАНИЕ
|
А.1.
|
ТЕМПЕРАТУРА НА ТОПЕНЕ/ЗАМРЪЗВАНЕ |
|
А.2.
|
ТЕМПЕРАТУРА НА КИПЕНЕ |
|
А.3.
|
ОТНОСИТЕЛНА ПЛЪТНОСТ |
|
А.5.
|
ПОВЪРХНОСТНО НАПРЕЖЕНИЕ |
|
А.6.
|
РАЗТВОРИМОСТ ВЪВ ВОДА |
|
А.7.
|
КОЕФИЦИЕНТ НА РАЗПРЕДЕЛЕНИЕ |
|
А.8.
|
ТОЧКА НА ВЪЗПЛАМЕНЯВАНЕ |
|
А.9.
|
ЗАПАЛИМОСТ (ТВЪРДИ ВЕЩЕСТВА) |
|
А.10.
|
ЗАПАЛИМОСТ (ГАЗОВЕ) |
|
А.11.
|
ЗАПАЛИМОСТ (ПРИ КОНТАКТ С ВОДА) |
|
А.12.
|
ПИРОФОРНИ СВОЙСТВА НА ТВЪРДИ ВЕЩЕСТВА И ТЕЧНОСТИ |
|
А.13.
|
ЕКСПЛОЗИВНИ СВОЙСТВА |
|
А.14.
|
ТЕМПЕРАТУРА НА САМОЗАПАЛВАНЕ (ТЕЧНОСТИ И ГАЗОВЕ) |
|
А.15.
|
ОТНОСИТЕЛНА ТЕМПЕРАТУРА НА САМОЗАПАЛВАНЕ НА ТВЪРДИ ВЕЩЕСТВА |
|
А.16.
|
ОКСИДИРАЩИ СВОЙСТВА (ТВЪРДИ ВЕЩЕСТВА) |
|
А.17.
|
СРЕДНО БРОЙНО МОЛЕКУЛНО ТЕГЛО И РАЗПРЕДЕЛЕНИЕ НА МОЛЕКУЛНОТО ТЕГЛО НА ПОЛИМЕРИ |
|
А.18.
|
НИСКОМОЛЕКУЛНО ТЕГЛОВНО СЪДЪРЖАНИЕ НА ПОЛИМЕРИ |
|
А.19.
|
ПОВЕДЕНИЕ НА РАЗТВАРЯНЕ/ЕКСТРАКЦИЯ НА ПОЛИМЕРИ ВЪВ ВОДА |
|
A.20.
|
ОКСИДИРАЩИ СВОЙСТВА (ТЕЧНОСТИ) |
А.1. ТЕМПЕРАТУРА НА ТОПЕНЕ/ЗАМРЪЗВАНЕ
1. МЕТОД
Повечето от описаните методи се основават на Ръководството за провеждане на изпитвания на ОИСР (1). Основните принципи са дадени в препратки (2) и (3).
1.1. ВЪВЕДЕНИЕ
Описаните методи и апаратура се прилагат за определяне на температурата на топене на веществата без никакви ограничения относно тяхната степен на чистота.
Изборът на метода зависи от природата на веществото, което трябва да се изследва. По тази причина ограничаващият фактор ще бъде свързан с това, дали веществото може да се приведе в прахообразно състояние (лесно или трудно) или не.
За някои вещества е по-подходящо да се определя температурата на замръзване или втвърдяване. Ето защо в този метод са включени стандарти и за тези определения.
Когато, поради по-особените свойства на веществото, определянето на гореспоменатите параметри е по-трудно, може да се определи точката на застиване.
1.2. ОПРЕДЕЛЕНИЯ И МЕРНИ ЕДИНИЦИ
Температурата на топене се определя като температурата, при която се извършва фазовият преход от твърдо към течно състояние при атмосферно налягане; тази температура напълно съответства на температурата на замръзване.
Фазовият преход при много вещества се извършва в температурен интервал, наричан „интервал на топене“.
Превръщане на мерните единици (К към oС)
t = Т - 273,15
|
t
|
:
|
Целзиева температура, градус Целзий (oС)
|
|
Т
|
:
|
термодинамична температура, Келвин (К)
|
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Не във всички случаи, когато се изследва ново вещество, е необходимо да се използват вещества за сравнение. Преди всичко те трябва да служат за периодична проверка на действието на метода и да позволяват сравнение с резултатите, получени по други методи.
Някои калибровъчни вещества са изброени в препратка (4).
1.4. ПРИНЦИП НА ИЗПИТВАТЕЛНИЯ МЕТОД
Определя се температурата (температурният интервал) на фазовия преход от твърдо към течно или от течно към твърдо състояние. На практика, когато се нагрява/охлажда проба от изследваното вещество при атмосферно налягане, се определят началната температура на топене/замръзване и температурата в последната фаза на топенето/замръзването. Описани са пет типа методи, а именно — капилярен метод, методи с горещи подложки, методи за определяне на температурата на замръзване, методи на термичния анализ и определяне на точката на застиване (разработен за нефтени масла).
В някои случаи е по-подходящо вместо температурата на топене да се измери температурата на замръзване.
1.4.1. Метод с капилярка
1.4.1.1. Устройства за температура на топене с течностна баня
Малко количество от фино стритото вещество се поставя в капилярка и се стръсква в плътна маса. Капилярката се нагрява заедно с термометър. Повишаването на температурата се регулира така, че да не надвишава 1 К/min по време на самото топене. Определят се началната и крайната температура на топене.
1.4.1.2. Устройства за температура на топене с метален блок
Както е описано в 1.4.1.1, но капилярката и термометърът са разположени в нагрят метален блок и могат да се наблюдават през отвори в блока.
1.4.1.3. Отчитане с фотоклетка
Пробата в капилярката се нагрява автоматично в метален цилиндър. С помощта на отвор в цилиндъра светлинен лъч се насочва през веществото към прецизно калибрирана фотоклетка. В процеса на топене оптичните свойства на повечето вещества се променят от непрозрачно към прозрачно. Интензитетът на светлината, която достига до фотоклетката, се увеличава и тя изпраща сигнал за спиране към цифровия индикатор, отчитащ температурата на платинов съпротивителен термометър, разположен в нагревателната камера. Този метод не е подходящ за някои силнооцветени вещества.
1.4.2. Горещи подложки
1.4.2.1. Кофлеров апарат с гореща пръчка
Кофлеровият апарат с гореща пръчка използва две парчета метал с различна топлопроводимост, нагрявани електрически, с пръчка, направена така, че температурният градиент да е почти линеен по дължината ѝ. Температурата на горещата пръчка може да се изменя по дължината и между 283 и 573 К се отчита със специално устройство, включващо плъзгач с показалец и етикети, направени специално за дадената пръчка. За да се определи температурата на топене, веществото се разстила на тънък пласт направо по повърхността на горещата пръчка. След няколко секунди се появява рязка разделителна линия между течната и твърдата фаза. Температурата на разделителната линия се отчита, като стрелката се нагласява да лежи върху нея.
1.4.2.2. Микроскоп за стапяне
Използват се няколко вида горещи масички за микроскопа, които служат за определяне на температурата на топене на съвсем малки количества от веществото. При повечето от горещите масички температурата се измерва с чувствителна термодвойка, но понякога се използват и живачни термометри. Типичният апарат за температура на топене с микроскоп с гореща масичка има нагревателна камера, съдържаща метална плочка, върху която пробата се поставя на стъкло. В центъра на металната плочка има отвор, през който навлиза светлината от осветителното огледало на микроскопа. Когато се използва, камерата е затворена със стъклена пластинка, така че да се изолира въздухът около пробата.
Нагряването на пробата се регулира с реостат. За много точни измервания на оптически анизотропни вещества може да се използва поляризирана светлина.
1.4.2.3. Менискусен метод
Този метод се използва специално за полиамиди.
Визуално се определя температурата, при която се измества менискусът от силиконово масло, поставено между горещата подложка и покривното стъкло, което се поддържа от пробния образец от полиамид.
1.4.3. Метод за определяне на температурата на замръзване
Пробата се слага в специална епруветка и се поставя в апарат за определяне на температурата на замръзване. По време на охлаждането пробата се разбърква внимателно без прекъсване, а температурата се измерва на подходящи интервали от време. Когато температурата остане постоянна при няколко последователни измервания, тази температура (коригирана с грешката на термометъра) се отчита като температура на замръзване.
Трябва да се избягва преохлаждането, като се поддържа равновесие между твърдата и течната фаза.
1.4.4. Термичен анализ
1.4.4.1. Диференциален термичен анализ (ДТА)
При тази техника се прави запис на разликата в температурите на веществото и на сравнителния материал като функция от температурата, като веществото и сравнителният материал са подложени на една и съща контролирана температурна програма. Когато пробата претърпява преход, свързан с промяна на енталпията, тази промяна се проявява като ендотермично (топене) или екзотермично (замръзване) отклонение от основната линия на записа на температурата.
1.4.4.2. Диференциална сканираща калориметрия (ДСК)
При тази техника се прави запис на разликата в подадената енергия към веществото и към сравнителния материал като функция от температурата, като веществото и сравнителният материал са подложени на една и съща контролирана температурна програма. Тази енергия представлява енергията, необходима да се установи нулева температурна разлика между веществото и сравнителния материал. Когато пробата претърпява преход, свързан с промяна на енталпията, тази промяна се регистрира като ендотермично (топене) или екзотермично (замръзване) отклонение от основната линия на записа на топлинния поток.
1.4.5. Точка на застиване
Този метод е разработен за нефтени масла и е подходящ за маслообразни вещества с ниски температури на топене.
След предварително нагряване пробата се охлажда с определена скорост и характеристиките ѝ на течливост се изследват на интервали от 3 К. Най-ниската температура, при която все още се наблюдава движение на веществото, се отчита като точка на застиване.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Приложимостта и точността на различните методи, които се използват за определяне на температурата на топене/интервала на топене, са дадени в следните таблици:
ТАБЛИЦА: ПРИЛОЖИМОСТ НА МЕТОДИТЕ
А. Капилярни методи
|
Метод за измерване
|
Вещества, които могат да се разпрашават
|
Вещества, които се разпрашават трудно
|
Температурен интервал
|
Оценка на точността (1)
|
Съществуващ стандарт
|
|
Устройства за температура на топене с водна баня
|
да
|
само в известна степен
|
от 273 до 573 K
|
±0,3 К
|
JIS K 0064
|
|
Устройства за температура на топене с метален блок
|
да
|
само в известна степен
|
от 293 до > 573 К
|
±0,5 K
|
ISO 1218 (E)
|
|
Отчитане с фотоклетка
|
да
|
няколко с допълнителни приспособления
|
от 253 до 573 K
|
±0,5 K
|
|
Б. Методи с горещи подложки и методи със замразяване
|
Метод за измерване
|
Вещества, които могат да се разпрашават
|
Вещества, които се разпрашават трудно
|
Температурен интервал
|
Оценка на точността (2)
|
Съществуващ стандарт
|
|
Кофлер с гореща пръчка
|
да
|
не
|
от 283 до > 573 K
|
± 1К
|
АNSI/ASTM D 3451-76
|
|
Микроскоп за стапяне
|
да
|
само в известна степен
|
от 273 до > 573 K
|
±0,5 K
|
DIN 53736
|
|
Менискусен метод
|
не
|
специално за полиамиди
|
от 293 до > 573 K
|
±0,5 K
|
ISO 1218 (E)
|
|
Методи за температура на замръзване
|
да
|
да
|
от 223 до 573 K
|
±0,5 K
|
например BS 4695
|
В. Термичен анализ
|
Метод за измерване
|
Вещества, които могат да се разпрашават
|
Вещества, които се разпрашават трудно
|
Температурен интервал
|
Оценка на точността (3)
|
Съществуващ стандарт
|
|
Диференциален термичен анализ
|
да
|
да
|
от 173 до 1 273 K
|
до 600 K ±0,5 K до 1 273 K ±2,0 K
|
ASTM E 537-76
|
|
Диференциална сканираща калориметрия
|
да
|
да
|
от 173 до 1 273 K
|
до 600 K ±0,5 K до 1 273 K ±2,0 K
|
ASTM E 537-76
|
Г. Точка на застиване
|
Метод за измерване
|
Вещества, които могат да се разпрашават
|
Вещества, които се разпрашават трудно
|
Температурен интервал
|
Оценка на точността (4)
|
Съществуващ стандарт
|
|
Точка на застиване
|
за нефтени масла и маслени субстанции
|
за нефтени масла и маслени субстанции
|
от 223 до 323 K
|
±3,0 K
|
ASTM D 97-66
|
1.6. ОПИСАНИЕ НА МЕТОДИТЕ
Процедурите на почти всички методи за изпитване са описани в международни и национални стандарти (вж. допълнение 1).
1.6.1. Методи с капилярна тръбичка
При бавно повишаване на температурата фино разпратените вещества обикновено преминават през фазите на топене, показани на фигура 1.
Фигура 1

При определяне на температурата на топене се отчитат температурата в началото на топенето и тази в крайната му фаза.
1.6.1.1. Прибори за определяне на температурата на топене в апарат с течностна баня
На фигура 2 е показан един тип стандартизиран апарат за температура на топене, изработен от стъкло (JIS K 0064); всички размери са в милиметри.
Фигура 2

Течност за банята:
Трябва да се избере подходяща течност. Изборът на течността зависи от температурата на топене, която трябва да се определя: например течен парафин — за температури на топене не по-високи от 473 К, силиконово масло — за температури на топене не по-високи от 573 К.
За температури на топене над 523 К може да се използва смес, която се състои от три части сярна киселина и две части калиев сулфат (масово съотношение). Ако се използва такава течност, трябва да се вземат подходящи предпазни мерки.
Термометър:
Могат да се използват само такива термометри, които съответстват на изискванията на посочените по-долу или на еквивалентни стандарти:
АSТМ Е 1-71, DIN 12770, JIS K 8001.
Процедура на измерване:
Сухото вещество се стрива на фин прах в хаванче и се поставя в капилярка, запоена от едната страна, така че нивото на запълване да е приблизително 3 mm, след като веществото се сбие в плътна маса. За да се получи равномерно уплътнена проба, капилярката трябва да се пуска от височина около 700 mm през вертикална стъклена тръба върху часовниково стъкло.
Напълнената капилярка се поставя в банята, така че средната част на живачния резервоар на термометъра да се допира до нея в областта, където е разположена пробата. Обикновено капилярката се въвежда в апарата около 10 К преди да се достигне температурата на топене.
Течността в банята се нагрява по такъв начин, че покачването на температурата да е приблизително 3 K/min. Течността трябва да се разбърква. При около 10 К под очакваната температура на топене скоростта на покачване на температурата се регулира така, че да не надвишава 1 K/min.
Изчисления:
Температурата на топене се изчислява, както следва:
Т = TD+0,00016 (ТD – ТЕ) n
където:
|
Т
|
=
|
коригираната температура на топене в К
|
|
ТD
|
=
|
температурата, отчетена по термометъра D в К
|
|
ТЕ
|
=
|
температурата, отчетена по термометъра Е в К
|
|
n
|
=
|
броя деления на живачната нишка на термометър D при нивото на потапяне на ствола му.
|
1.6.1.2. Уреди за измерване на температурата на топене в метален блок
Апаратура
Тя се състои от:
|
—
|
цилиндричен метален блок, чиято горна част е куха и образува камера (вж. фигура 3),
|
|
—
|
метална запушалка с два или повече отвори, които позволяват капилярките да се монтират в металния блок,
|
|
—
|
нагревателна система за металния блок, осигурена например от електрическо съпротивление, включено в блока,
|
|
—
|
реостат за регулиране на входното напрежение (ако се използва електрическо нагряване),
|
|
—
|
четири прозорчета от термоустойчиво стъкло на страничните стени на камерата, диаметрално разположени и под прав ъгъл едно спрямо друго. Пред едно от тези прозорчета се монтира окуляр за наблюдение на капилярката. Другите три прозорчета се използват за осветяване на вътрешността на апарата с помощта на лампи,
|
|
—
|
капилярка от термоустойчиво стъкло, запоена в единия край (вж. 1.6.1.1).
|
Термометър:
Вижте стандартите, посочени в 1.6.1.1. Могат да се прилагат и термоелектрически измервателни устройства със съпоставима точност.
Фигура 3

1.6.1.3. Отчитане с фотоклетка
Апаратура и процедура:
Апаратът се състои от метална камера с автоматична нагревателна система. Три капилярки се напълват, както е описано в 1.6.1.1, и се поставят в пещта.
Може да се направят няколко линейни покачвания на температурата за калибриране на апарата и подходящото температурно покачване се нагласява електрически на предварително подбрана постоянна линейна скорост. Записващите устройства показват действителната температура на пещта и температурата на веществото в капилярката.
1.6.2. Горещи подложки
1.6.2.1. Кофлер с гореща пръчка
Вж. допълнението.
1.6.2.2. Топилен микроскоп
Вж. допълнението.
1.6.2.3. Менискусен метод (полиамиди)
Вж. допълнението.
Скоростта на нагряване при температурата на топене трябва да е по-ниска от 1 K/min.
1.6.3. Методи за определяне на температурата на замръзване
Вж. допълнението.
1.6.4. Термичен анализ
1.6.4.1. Диференциален термичен анализ
Вж. допълнението.
1.6.4.2. Диференциална сканираща калориметрия
Вж. допълнението.
1.6.5. Определяне на точката на застиване
Вж. допълнението.
2. ДАННИ
В някои случаи е необходима корекция на термометъра.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
По възможност протоколът от изпитването трябва да включва следната информация:
|
—
|
точна спецификация на веществото (вид и примеси) и предварителни стъпки на пречистване, ако има такива,
|
Като температура на топене се съобщава средноаритметичното от най-малко две измервания, които са в обхвата на оценката на точността (вж. таблиците).
Ако разликата в температурите на началната и крайната фаза на топенето е в границите на точността на метода, температурата в крайната фаза на топенето се приема за температура на топене на веществото; в другия случай трябва да се съобщят и двете температури.
Ако веществото се разлага или сублимира, преди да се достигне температурата на топене, трябва да бъде указана температурата, при която се наблюдава този ефект.
Всяка информация и бележки, свързани с интерпретацията на резултатите, трябва да се отразят в протокола, особено онези, които се отнасят до примесите и физичното състояние на веществото.
4. ПРЕПРАТКИ
|
(1)
|
OИCP, Paris, 1981, Test Guideline 102, решение на Съвета C(81) 30 окончателен.
|
|
(2)
|
IUPAC, B. Le Neidre, B. Vodar, eds. Experimental thermodynamics. Butterworths, London 1975, vol. II, 803—834.
|
|
(3)
|
R. Weissberger ed.: Technique of organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed., Interscience Publ., New York, 1959, vol. I, Part I, Chapter VII.
|
|
(4)
|
IUPAC, Physicochemical measurements: Catalogue of reference materials from national laboratories, Pure and applied chemistry, 1976, vol. 48, 505-515.
|
Допълнение
За допълнителни технически детайли може да се направи справка например със следните стандарти.
1. Капилярни методи
1.1. Приспособления за измерване на температурата на топене в течна баня
|
ASTM E 324-69
|
Standard test method for relative initial and final melting points and the melting range of organic chemicals (Стандартен метод за изпитване на относителната начална и крайна точка на топене и областите на топене на органични химикали)
|
|
ВS 4634
|
Method for the determination of melting point and/or melting range (Метод за определяне на точка на топене и/или интервал на топене)
|
|
DIN 53181
|
Bestimmung des Schmelzintervalles von Harzen nach Kapilarverfahren (Определяне на интервала на топене на смоли по капилярен метод)
|
|
JIS K 00-64
|
Testing methods for melting point of chemical products (Методи за изпитване на точката на топене на химически продукти)
|
1.2. Приспособления за измерване на температурата на топене в метален блок
|
DIN 53736
|
Visuelle Bestimmung der Schmelztemperatur von teilkristallinen Kunststoffen (Визуално определяне на температурата на топене на частичнокристални пластмаси)
|
|
ISO 1218 (E)
|
Plastics — Polyamides — Determination of ’melting point’ (Пластмаси — полиамиди — определяне на „точка на топене“)
|
2. Нагорещени подложки
2.1. Гореща пръчка на Кофлер
|
ANSI/ASTM D 3451-76
|
Standard recommended practices for testing polymeric powder coatings (Стандартни препоръчителни практики за изпитване на полимерни прахообразни покрития)
|
2.2. Микроскоп за точка на топене
|
DIN 53736
|
Visuelle Bestimmung der Schmelztemperatur von teilkristallinen Kunststoffen (Визуално определяне на температурата на топене на частичнокристални пластмаси)
|
2.3. Менискусен метод (полиамиди)
|
ISO 1218 (E)
|
Plastics — Polyamides — Determination of ’melting point’ (Пластмаси — полиамиди — определяне на „точка на топене“)
|
|
ANSI/ASTM D 2133-66
|
Standard specification for acetal resin injection moulding and extrusion materials (Стандартни характеристики на материали за шприцоване под налягане и екструдиране на основата на ацетални смоли)
|
|
NF T 51-050
|
Resines de polyamides. Determination du ’point de fusion’. Methode du menisque (Полиамидни смоли. Определяне на „точка на топене“. Менискусен метод)
|
3. Методи за определяне на температурата на замръзване
|
ВS 4633
|
Method for the determination of crystallizing point (Метод за определяне на точката на кристализация)
|
|
ВS 4695
|
Method for Determination of Melting Point of petroleum wax (Cooling Curve) (Метод за определяне на точката на топене на нефтен парафин (крива на охлаждане)
|
|
DIN 51421
|
Bestimmung des Gefrierpunktes von Flugkraftstoffen, Ottokraftstoffen und Motorenbenzolen (Определяне на точката на замръзване на авиационни бензини, автомобилни бензини и моторни бензоли)
|
|
ISO 2207
|
Cires de petrole: determination de la temperature de figeage (Нефтен восък: определяне на точката на замръзване)
|
|
DIN 53175
|
Bestimmung des Erstarrungspunktes von Fettsäuren (Определяне на точката на застиване на мастни киселини)
|
|
NF T 60-114
|
Point de fusion des paraffines (Точка на топене на парафини)
|
|
NF T 20-051
|
Methode de determination du point de cristallisation (point de congelation) (Метод за определяне на точката на кристализация (точката на замръзване))
|
|
ISO 1392
|
Method for the determination of the freezing point (Метод за определяне на точката на замръзване)
|
4. Термичен анализ
4.1. Диференциален термичен анализ
|
ASTM E 537-76
|
Standard method for assessing the thermal stability of chemicals by methods of differential thermal analysis (Стандартен метод за оценка на термичната устойчивост на химикали чрез методите на диференциалния термичен анализ)
|
|
ASTM E 473-85
|
Standard definitions of terms relating to thermal analysis (Стандартни определения на термините, отнасящи се до термичния анализ)
|
|
ASTM 472-86
|
Standard practice for reporting thermoanalytical data (Стандартна практика за докладване на данни от термичния анализ)
|
|
DIN 51005
|
Thermische Analyse, Begriffe (Термичен анализ. Основни понятия)
|
4.2. Диференциална сканираща калориметрия
|
ASTM E 537-76
|
Standard method for assessing the thermal stability of chemicals by methods of differential thermal analysis (Стандартен метод за оценка на термичната устойчивост на химикали чрез методите на диференциалния термичен анализ)
|
|
ASTM E 473-85
|
Standard definitions of terms relating to thermal analysis (Стандартни определения на термините, отнасящи се до термичния анализ)
|
|
ASTM 472-86
|
Standard practice for reporting thermoanalytical data (Стандартна практика за докладване на данни от термичния анализ)
|
|
DIN 51005
|
Thermische Analyse, Begriffe (Термичен анализ. Основни понятия)
|
5. Определяне на точката на застиване
|
NBN 52014
|
Echantillonnage et analyse des produits du pétrole: Point de trouble et point d'écoulement limite — Monstememing en ontleding van aardolieproducten: Troebelingspunt en vloeipunt
|
|
ASTM D 97-66
|
Standard test method for pour point of petroleum oils (Стандартен метод за определяне на точката на застиване на нефтени масла)
|
|
ISO 3016
|
Petroleum oils — Determination of pour point. (Нефтени масла — определяне на точката на застиване)
|
А.2. ТЕМПЕРАТУРА НА КИПЕНЕ
1. МЕТОД
Повечето от описаните методи се основават на Ръководството за провеждане на изпитвания на ОИСР (1). Основните принципи са дадени в препратки (2) и (3).
1.1. ВЪВЕДЕНИЕ
Описаните тук методи и апаратури могат да се прилагат за течности и нискотопими вещества, ако те не претърпяват химична реакция, преди да се достигне температурата им на кипене (например автоокисление, прегрупировка, разграждане и др.). Методите могат да се прилагат за чисти и за непречистени течни вещества.
Акцентира се на методите, които използват отчитане с фотоклетка и термичен анализ, защото те позволяват да се определят както температурата на кипене, така и температурата на топене. Нещо повече, измерванията може да се извършват автоматично.
„Динамичният метод“ има това предимство, че може да се използва и за определяне на парното налягане, а и не е необходимо температурата на кипене да се коригира към нормално налягане (101,325 kРа), защото то може да се задава по време на измерването с маностат.
Забележки:
Влиянието, което примесите оказват върху определянето на температурата на кипене, зависи в голяма степен от природата на тези примеси. Когато в пробата има летливи примеси, които могат да повлияят на резултатите, веществото може да се пречисти.
1.2. ОПРЕДЕЛЕНИЯ И МЕРНИ ЕДИНИЦИ
Нормалната температура на кипене е температурата, при която налягането на наситените пари над течността е 101,325 kРа.
Ако температурата на кипене не се измерва при нормално атмосферно налягане, зависимостта на парното налягане от температурата може да се опише с уравнението на Клаузиус-Клапейрон:

където:
|
р
|
=
|
парното налягане на веществото в паскали
|
|
ΔHV
|
=
|
неговата топлина на изпарение в J mol-1
|
|
R
|
=
|
универсалната моларна газова константа = 8,314 J mol-1 K-1
|
|
Т
|
=
|
термодинамичната температура в K
|
Температурата на кипене се определя спрямо външното налягане по време на измерването.
Превръщане на мерните единици
Налягане (единици: kРа)
|
100 kPa
|
=
|
1 bar = 0,1 MPa
(„bar“ все още е разрешена единица, но не се препоръчва)
|
|
133 Pa
|
=
|
1 mm Hg = 1 Тоrr
(единиците „mm Hg“ и „Тоrr“ не са позволени)
|
|
1 atm
|
=
|
стандартна атмосфера = 101 325 Ра
(единицата „atm“ не е позволена)
|
Температура (единици: K)
t = T – 273,15
|
t
|
:
|
Целзиева температура, градус Целзий (oС)
|
|
Т
|
:
|
термодинамична температура, Келвин (K)
|
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Не във всички случаи, когато се изследва ново вещество, е необходимо да се използват вещества за сравнение. Преди всичко те трябва да служат за периодична проверка на действието на метода, а също и да позволяват да се прави сравнение с резултатите, получени по други методи.
Някои калибровъчни вещества могат да бъдат намерени в методите, изброени в допълнението.
1.4. ПРИНЦИП НА МЕТОДА
Пет от методите за определяне на температурата на кипене (интервала на кипене) се основават на измерване на температурата на кипене, останалите два метода се основават на термичен анализ.
1.4.1. Определяне с помощта на ебулиометър
Поначало ебулиометрите са предназначени за определяне на молекулното тегло по нарастването на температурата на кипене, но те също са подходящи и за точни измервания на самата температура на кипене. Един съвсем просто устроен апарат е описан в ASTM D 1120-72 (вж. допълнението). В този апарат течността се нагрява в равновесни условия при атмосферно налягане, докато започне да кипи.
1.4.2. Динамичен метод
Този метод включва измерване на температурата на повторна кондензация на парите с помощта на подходящ термометър в обратния хладник по време на кипенето. При този метод може да се изменя налягането.
1.4.3. Дестилационен метод за температура на кипене
Този метод включва дестилация на течността, измерване на температурата на повторна кондензация на парите и определяне на количеството на дестилата.
1.4.4. Метод по Сиволобоф (Siwoloboff)
Пробата се нагрява в епруветка, поставена в течността на нагревателна баня. В епруветката с пробата е потопена запоена капилярка, която съдържа въздушно мехурче в долната си част.
1.4.5. Отчитане с фотоклетка
По принципа на Сиволобоф се провежда автоматично фотоелектрично измерване, като се използва увеличаващият се брой мехурчета.
1.4.6. Диференциален термичен анализ
При тази техника се прави запис на разликата в температурите на веществото и на сравнителния материал като функция от температурата, докато веществото и сравнителният материал са подложени на една и съща контролирана температурна програма. Когато пробата претърпява преход, свързан с промяна на енталпията, тази промяна се отбелязва като ендотермично отклонение (кипене) от основната линия на записа на температурата.
1.4.7. Диференциална сканираща калориметрия
При тази техника се прави запис на разликата в подадените енергии към веществото и към сравнителния материал като функция от температурата, докато веществото и сравнителният материал са подложени на една и съща контролирана температурна програма. Тази енергия представлява енергията, необходима да се установи нулева температурна разлика между изследваното вещество и сравнителния материал. Когато пробата претърпява преход, свързан с промяна на енталпията, тази промяна се отбелязва чрез ендотермично отклонение (кипене) от основната линия на записа на топлинния поток.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Приложимостта и точността на различните методи за определяне на температурата на кипене/интервала на кипене са дадени в таблица 1.
Таблица 1
Сравнение на методите
|
Метод на изпитване
|
Оценка на точността
|
Съществуващ стандарт
|
|
Ебулиометър
|
±1,4 K (до 373 K) (5)
(6)
±2,5 K (до 600 K) (5)
(6)
|
ASTM D 1120-72 (5)
|
|
Динамичен метод
|
±0,5 K (до 600 K) (6)
|
|
|
Дестилационен процес (област на кипене)
|
±0,5 K (до 600 K)
|
ISO/R 918, DIN 53171, BS 4591/71
|
|
По Сиволобоф
|
± 2 K (до 600 K) (6)
|
|
|
Отчитане с фотоклетка
|
±0,3 K (при 373 K) (6)
|
|
|
Диференциална термична калориметрия
|
±0,5 K (до 600 K)
±2,0 K (до 1 273 K)
|
ASTM E 537-76
|
|
Диференциална сканираща калориметрия
|
±0,5 K (до 600 K)
±2,0 K (до 1 273 K)
|
ASTM Е 537-76
|
1.6. ОПИСАНИЕ НА МЕТОДИТЕ
Начините на работа при някои от методите са описани в международни и национални стандарти (вж. допълнението).
1.6.1. Ебулиометър
Вж. допълнението
1.6.2. Динамичен метод
Вж. метод А.4 за определяне на парното налягане.
Записва се температурата на кипене, която се наблюдава при приложено налягане от 101,325 kРа.
1.6.3. Дестилационен процес (интервал на кипене)
Вж. допълнението
1.6.4. Метод по Сиволобоф
Пробата се нагрява в апаратурата за определяне на температура на топене в епруветка с диаметър приблизително 5 mm (фигура 1).
На фигура 1 е показан един тип стандартизиран апарат за температури на топене и кипене (JIS K 0064) (направен от стъкло; всички размери са в милиметри).
Фигура 1

В тръбата за пробата се поставя капилярка (кипяща капилярка), запоена на разстояние около 1 cm над долния край. Нивото, до което се запълва с изследваното вещество, е такова, че запоената част на капилярката да се намира под повърхността на течността. Тръбата с пробата, съдържаща кипящата капилярка, се закрепва или към термометъра с гумена лента, или се фиксира с подпора отстрани (вж. фигура 2).
|
Фигура 2
Принцип по Сиволобоф
|
Фигура 3
Модифициран принцип
|
|

|

|
Течността за банята се избира според температурата на кипене. При температури до 573 K може да се използва силиконово масло. Течен парафин може да се използва само до 473 K. Отначало нагряването на течността в банята трябва да се нагласи така, че скоростта на повишаване на температурата да е 3 K/min. Течността на банята трябва да се разбърква. При около 10 K под очакваната температура на кипене нагряването се забавя, така че скоростта на повишаване на температурата да не надвишава 1 K/min. C приближаването до температурата на кипене от кипящата капилярка бързо започват да се появяват мехурчета.
Температурата на кипене е тази температура, когато при моментно охлаждане веригата от мехурчета се прекъсва и течността в капилярката започва внезапно да се покачва. Показанието на термометъра в този момент представлява температурата на кипене на веществото.
При модифицирания принцип (фигура 3) температурата на кипене се определя в капилярка за температура на топене. Капилярката се изтегля на дължина около 2 cm в единия край, така че да образува остър връх (а), и се засмуква малко количество от пробата. Отвореният край на изтънената капилярка се затваря чрез стопяване така, че в края да се разположи малко въздушно мехурче. При нагряването в апарата за температура на топене (b) въздушното мехурче се разширява. Температурата на кипене съответства на температурата, при която тапата, образувана от веществото над въздуха, достигне до нивото на течността на банята (с).
1.6.5. Отчитане с фотоклетка
Пробата се нагрява в капилярка във вътрешността на нагрят метален блок.
През подходящ отвор в блока се насочва светлинен лъч, който преминава през веществото и попада върху прецизно калибрирана фотоклетка.
В процеса на повишаване на температурата на пробата от кипящата капилярка се появяват единични въздушни мехурчета. Когато се достигне температурата на кипене, броят на мехурчетата нараства много. Това води до промяна в интензитета на светлината, регистрирана от фотоклетката, и изпраща сигнал за застопоряване на показанието на индикатора, който отчита температурата на платинов съпротивителен термометър, разположен в блока.
Този метод е особено подходящ, защото позволява измервания при температури под стайната до 253,15 K (- 20 oС), без да се налагат промени в апарата. Приборът просто трябва да се постави в охлаждаща баня.
1.6.6. Термичен анализ
1.6.6.1. Диференциален термичен анализ
Вж. допълнението.
1.6.6.2. Диференциална сканираща калориметрия
Вж. допълнението.
2. ДАННИ
При малки отклонения от нормалното налягане (максимум ± 5 kРа), температурите на кипене се нормализират към Тn с числовото уравнение на Сидни Юнг:
Tn = T + (fT × Δp)
където:
|
Δp
|
=
|
(101,325 - p) [отбележи знака]
|
|
р
|
=
|
измереното налягане в kРа
|
|
fT
|
=
|
скоростта на промяна на температурата на кипене с налягането в K/kРа
|
|
Т
|
=
|
измерената температура на кипене в K
|
|
Тn
|
=
|
температурата на кипене, коригирана към нормално налягане в K
|
Коефициентите на температурната корекция, fT и уравненията за тяхното приблизително определяне за много вещества са включени в споменатите по-горе международни и национални стандарти.
Например методът в DIN 53171 дава следните груби корекции за разтворители, включени в бои:
Таблица 2
Коефициенти за температурна корекция fT
|
Температура Т (K)
|
Корекционен коефициент fT (K/kРа)
|
|
323,15
|
0,26
|
|
348,15
|
0,28
|
|
373,15
|
0,31
|
|
398,15
|
0,33
|
|
423,15
|
0,35
|
|
448,15
|
0,37
|
|
473,15
|
0,39
|
|
498,15
|
0,41
|
|
523,15
|
0,44
|
|
548,15
|
0,45
|
|
573,15
|
0,47
|
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
По възможност при отчитане на резултатите от изпитването трябва да се включи следната информация:
|
—
|
точна спецификация на веществото (вид и примеси) и предварителни етапи на пречистване, ако има такива,
|
Като температура на кипене се съобщава средноаритметичното от най-малко две измервания, които са в границите на оценката на точността (вж. таблица 1).
Трябва да се укажат както измерените температури на кипене и тяхната средна стойност, така и налягането(ията) в kРа, при което(ито) са проведени измерванията. За предпочитане е наляганията да са близки до нормалното атмосферно налягане.
Цялата информация и бележките относно интерпретацията на резултатите трябва да се докладват и особено онези, които са свързани с примесите и физичното състояние на веществото.
4. ПРЕПРАТКИ
|
(1)
|
ОИСР, Paris, 1981, Test guideline 103, решение на Съвета C(81) 30 окончателен.
|
|
(2)
|
IUPAC, B. Le Neidre, B. Vodar, editions. Experimental thermodynamics, Burretworths, London, 1975, vol. II.
|
|
(3)
|
R. Weissberger edition: Technique of organic chemistry, Physical methods of organic chemistry, Third Edition, Interscience Publications, New York, 1959, vol. I, Part I, Chapter VIII.
|
Допълнение
За допълнителни технически детайли може да се направи справка например със следните стандарти:
1. Ебулиометър
|
1.1.
|
Уреди за измерване на температурата на кипене с течна баня
|
|
ASTM D 1120-72
|
Standard test method for boiling point of engine anti-freezes (Стандартен метод за определяне на температурата на кипене на антифриз за двигатели)
|
2. Дестилационен процес (интервал на кипене)
|
ISO/R 918
|
Test Method for Distillation (Distillation Yield and Distillation Range) Метод за изпитване на дестилацията (дестилационен добив и дестилационен обхват)
|
|
ВS 4349/68
|
Method for determination of distillation of petroleum products (Метод за определяне на дестилацията на нефтени продукти)
|
|
BS 4591/71
|
Method for the determination of distillation characteristics (Метод за определяне на дестилационни характеристики)
|
|
DIN 53171
|
Lösungsmittel für Anstrichstoffe, Bestimmung des Siedeverlaufes (Разтворители за лакобояджийски материали, определяне хода на дестилацията)
|
|
NF T 20-608
|
Distillation: determination du rendement et de l'intervalle de distillation (Дестилация: определяне на добива и на дестилационния интервал)
|
3. Диференциален термичен анализ и диференциална сканираща калориметрия
|
ASTM E 537-76
|
Standard method for assessing the thermal stability of chemicals by methods of differential thermal analysis (Стандартен метод за оценка на термичната устойчивост на химикали чрез методите на диференциалния термичен анализ)
|
|
ASTM E 473-85
|
Standard definitions of terms relating to thermal analysis (Стандартни определения на термините, отнасящи се до термичния анализ)
|
|
ASTM E 472-86
|
Standard practice for reporting thermoanalytical data (Стандартна практика за докладване на данни от термичен анализ)
|
|
DIN 51005
|
Thermische Analyse: Begriffe (Термичен анализ: основни понятия).
|
А.З. ОТНОСИТЕЛНА ПЛЪТНОСТ
1. МЕТОД
Описаните методи се основават на Ръководството за провеждане на изпитвания на ОИСР (1). Основните принципи са дадени в препратка (2).
1.1. ВЪВЕДЕНИЕ
Описаните методи за определяне на относителната плътност са приложими за твърди и течни вещества без всякакво ограничение с оглед на тяхната степен на чистота. Различните методи, които могат да се използват, са дадени в таблица 1.
1.2. ОПРЕДЕЛЕНИЯ И МЕРНИ ЕДИНИЦИ
Относителната плътност D4
20 на твърди вещества и течности представлява съотношението между масата на даден обем от веществото, което ще се изследва, определена при 20 oС, и масата на същия обем вода, определена при 4 oС. Относителната плътност е безразмерна величина.
Плътността на едно вещество „р“ е частното на масата „m“ и обема „v“.
В системата SI плътността „р“ се изразява в kg/m3.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ (1) (3)
Не е необходимо да се използват вещества за сравнение във всички случаи, когато се изследва ново вещество. Преди всичко те трябва да служат за периодична проверка на действието на метода и да позволяват да се правят сравнения с резултатите, получени по други методи.
1.4. ПРИНЦИП НА МЕТОДИТЕ
Използват се четири класа методи.
1.4.1. Методи, основани на силата на изтласкване
1.4.1.1. Ареометър (за течни вещества)
Достатъчно точни и бързи измервания на плътността могат да се получат с плаващи ареометри, които позволяват плътността на дадена течност да се изчисли от дълбочината на потапяне по показанията на градуирана скала.
1.4.1.2. Хидростатична везна (за течни и твърди вещества)
За определяне на плътността може да се използва разликата в теглата на изследваната проба, измерени във въздуха и в подходяща течност (например вода).
За твърди вещества измерената плътност е представителна само за конкретната проба, с която е извършено измерването. За определяне на плътността на течности тяло с известен обем „v“ се претегля отначало на въздуха и след това в течността.
1.4.1.3. Метод с потопено тяло (за течни вещества) (4)
При този метод плътността на дадена течност се определя от разликата в резултатите, получени при претеглянето на течността преди и след потапянето на тяло с известен обем в нея.
1.4.2. Пикнометрични методи
За твърди вещества или течности могат да се използват пикнометри с различни форми и с известни обеми. Плътността се изчислява от разликата в теглата на празния и пълния пикнометър и неговия известен обем.
1.4.3. Пикнометри с въздушно сравняване (за твърди вещества)
Плътността на дадено твърдо вещество с произволна форма може да се измери при стайна температура с помощта на пикнометър с въздушно сравняване. Обемът на веществото се измерва на въздуха или в инертен газ в цилиндър с променлив калибриран обем. За да се изчисли плътността, след като приключи измерването на обема се прави едно измерване и на масата.
1.4.4. Осцилиращ денситометър (5) (6) (7)
Плътността на дадена течност може да се измери с осцилиращ денситометър. Механичен осцилатор, конструиран под формата на U-образна тръба, се привежда в трептене при резонансната честота на осцилатора, която зависи от масата му. Въвеждането на проба променя резонансната честота на осцилатора. Апаратът трябва да се калибрира с помощта на две течности с известни плътности. Препоръчително е тези течни вещества да се подберат така, че плътностите им да покриват обхвата, в който ще се извършва измерването.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Приложимостта на различните методи, които се използват за определяне на относителната плътност, е показана в таблицата.
1.6. ОПИСАНИЕ НА МЕТОДИТЕ
В допълнението са дадени като примери стандарти, в които може да се направи справка за допълнителни технически подробности.
Изпитванията трябва да се извършват при 20 oС, като се правят поне по две измервания.
2. ДАННИ
Вж. стандартите.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
По възможност протоколът от изпитванията трябва да включва следната информация:
|
—
|
точна спецификация на веществото (вид и примеси) и предварителни етапи на пречистване, ако има такива.
|
Относителната плътност 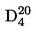 трябва да се съобщава по начина, определен в 1.2, заедно с физичното състояние на измерваните вещества.
трябва да се съобщава по начина, определен в 1.2, заедно с физичното състояние на измерваните вещества.
Цялата информация и бележките относно интерпретацията на резултатите трябва да се включат в протокола, особено онези, които са свързани с примесите и физичното състояние на веществото.
Таблица
Приложимост на методите
|
Метод на измерване
|
Плътност
|
Максимален възможен динамичен вискозитет
|
Съществуващи стандарти
|
|
твърди вещества
|
течности
|
|
|
|
да
|
5 Pa s
|
ISO 387,
ISO 649-2,
NF T 20-050
|
|
1.4.1.2.
|
Хидростатична везна
|
|
|
|
|
|
|
|
да
|
|
|
ISO 1183 (A)
|
|
|
|
да
|
5 Pa s
|
ISO 901 и 758
|
|
1.4.1.3.
|
Метод с потопено тяло
|
|
|
да
|
20 Pa s
|
DIN 53217
|
|
|
|
|
|
ISO 3507
|
|
|
да
|
|
|
ISO 1183 (B)
NF T 20-053
|
|
|
|
да
|
500 Ра s
|
ISO 758
|
|
1.4.3.
|
Пикнометър с въздушно сравняване
|
|
да
|
|
|
DIN 55990 Teil 3,
DIN 53243
|
|
1.4.4.
|
Осцилиращ денситометър
|
|
|
да
|
5 Pa s
|
|
4. ПРЕПРАТКИ
|
(1)
|
ОИСР, Paris, 1981, Test Guideline 103, решение на Съвета C(81) 30 окончателен.
|
|
(2)
|
R. Weissberger ed., Technique of Organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed., Chapter IV, Interscience Publ. New York, 1959, vol. I, Part 1.
|
|
(3)
|
IUPAC, Recommended reference materials for realization of physico-chemical properties, Pure and Applied Chemistry, 1976, vol. 48, 508.
|
|
(4)
|
Wagenbreth, H., Die Tauchkugel zur Bestimmung der Dichte von Fluessigkeiten, Technisches Messen tm, 1979, vol. 11, 427—430.
|
|
(5)
|
Leopold, H., Die digitale Messung von Fluessigkeiten, Elektronik, 1970, vol. 19, 297—302.
|
|
(6)
|
Baumgarten, D., Fullmengenkontrolle bei vorgepackten Erzeugnissen — Verfahren zur Dichtebestimmung bei fluessigen Produkten und ihre praktische Anwendung, Die Pharmazeutische Industrie, 1975, vol. 37, 717-726.
|
|
(7)
|
Riemann, J., Der Einsatz der digitalen Dichtemessung im Brauerwissenschaft, 1976, vol. 9, 253—255.
|
Допълнение
За допълнителни технически детайли може да се направи справка например със следните стандарти:
1. Методи със сила на изтласкване
1.1. Ареометър
|
DIN 12790, ISO 387
|
Hydrometer; general instructions (Ареометър; основни инструкции);
|
|
DIN 12791
|
Part I: Density hydrometers; construction, adjustment and use (Част I: Ареометри за плътност: конструкция, настройка и употреба);
Part II: Density hydrometers; standardized sizes, designation (Част II: Ареометри за плътност; стандартизирани размери, обозначаване);
Part III: Use and test (Част III: Употреба и методи за изпитване).
|
|
ISO 649-2
|
Laboratory glassware: Density hydrometers for general purpose (Лабораторна стъклария: ареометри с общо предназначение);
|
|
NF T 20-050
|
Chemical products for industrial use — Determination of density of liquids — Areometric method (Химични продукти за индустриална употреба — определяне плътността на течности — ареометричен метод);
|
|
DIN 12793
|
Laboratory glassware: range find hydrometers (Лабораторна стъклария: широкообхватни хидрометри);
|
1.2. Хидростатична везна
За твърди вещества
|
ISO 1183
|
Method A: Methods for determining the density and relative density of рlastics excluding cellular plastics (Метод А: Методи за определяне на плътността и относителната плътност на пластмаси с изключение на пенопластмаси) ;
|
|
NF T 20-049
|
Chemical products for industrial use — Determination of the density of solids other than powders and cellular products — Hydrostatic balance method (Химични продукти за индустриална употреба. Определяне плътността на твърди вещества с изключение на прахообразни и разпенени продукти — метод с хидростатична везна);
|
|
ASTM-D-792
|
Specific gravity and density of plastics by displacement (Относително тегло и плътност на пластмаси чрез изместване);
|
|
DIN 53479
|
Testing of plastics and elastomers; determination of density (Изследване на пластмаси и еластомери; определяне на плътността);
|
За течни вещества
|
ISO 901
|
ISO 758
|
|
DIN 51757
|
Testing of mineral oils and related materials; determination of density (Изпитване на минерални масла и свързани с тях материали; определяне на плътността);
|
|
ASTM D 941-55, ASTM D 1296-67 и ASTM D 1481-62
|
|
ASTM D 1298
|
Density, specific gravity or API gravity of crude petroleum and liquid petroleum products by hydrometer method (Плътност, специфично тегло или API относително тегло на суров нефт и течни нефтени продукти чрез хидрометричен метод);
|
|
ВS 4714
|
Density, specific gravity or API gravity of crude petroleum and liquid petroleum products by hydrometer method (Плътност, специфично тегло или API относително тегло на суров нефт и течни нефтени продукти чрез хидрометричен метод);
|
1.3. Метод с потопено тяло
|
DIN 53217
|
Testing of paints, varnishes and similar coating materials; determination of density; immersed body method (Изпитване на бои, лакове и подобни материали за покрития; определяне на плътността; метод с потопено тяло)
|
2. Пикнометрични методи
2.1. За течни вещества
|
ISO 3507
|
Pycnometers (Пикнометри);
|
|
ISO 758
|
Liquid chemical products; determination of density at 20 oC (Течни химични продукти; определяне на плътността при 20 oС);
|
|
DIN 12797
|
Gay-Lussac pycnometer (for non-volatile liquids which are not too viscous) (Пикнометър на Гей-Люсак (за нелетливи течности, които не са много вискозни));
|
|
DIN 12798
|
Lipkin pycnometer (for liquids with a kinematic viscosity of less than 100.10-6 m2 s-1 at 15 oC) (Пикнометър на Липкин (за течности с кинематичен вискозитет, по-малък от 100.10-6 m2 s-1 при 15 oС));
|
|
DIN 12800
|
Sprengel pycnometer (for liquids as DIN 12798) (Пикнометър на Шпренгел (за течности както в DIN 12798));
|
|
DIN 12801
|
Reischauer pyenometer (for liquids with a kinematic viscosity of less than l00.10-6 m2 s-1 at 20 oC, applicable in particular also to hydrocarbons and aqueous solutions as well as to liquids with higher vapour pressure, approximately 1 bar at 90 oC) (Пикнометър на Райшауер (за течности с кинематиченвискозитет по-малък от 100.10-6 m2 s-1 при 20 oС, приложим по-специално също и за въглеводороди и водни разтвори, както и за течности с по-високо налягане на парите, приблизително 100 kPa при 90 oС));
|
|
DIN 12806
|
Hubbard pycnometer (for viscous liquids of all types which do not have too high a vapour pressure, in particular also for paints, varnishes and bitumen) (Пикнометър на Хубард (за вискозни течности от всички типове, които нямат много високо налягане на парите, по-специално също и за бои, лакове и битуми));
|
|
DIN 12807
|
Bingham pycnometer (for liquids, as in DIN 12801) (Пикнометър на Бингам (за течности както в DIN 12801));
|
|
DIN 12808
|
Jaulmes pycnometer (in particular for ethanol — water mixture) (Пикнометър на Йолм (по-специално за смес етанол—вода));
|
|
DIN 12809
|
Pycnometer with ground-in thermometer and capillary side tube (for liquids which are not too viscous) (Пикнометър с вграден термометър и странична капилярна тръбичка (за течности, които не са твърде вискозни));
|
|
DIN 53217
|
Testing of paints, varnishes and similar products; determination of density by pycnometer (Изпитване на бои, лакове и подобни продукти; определяне на плътността чрез пикнометър);
|
|
DIN 51757
|
Point 7: Testing of mineral oils and related materials; determination of density (Точка 7: Изследване на минерални масла и свързаните с тях продукти; определяне на плътността);
|
|
ASTM D 297
|
Section 15: Rubber products — chemical analysis (Част 15: Каучукови продукти — химичен анализ);
|
|
ASTM D 2111
|
Method C: Halogenated organic compounds (Метод С: Халогенирани органични съединения);
|
|
ВS 4699
|
Method for determination of specific gravity and density of petroleum products (graduated bicapillary pycnometer method) (Метод за определяне на специфичното тегло и плътността на нефтени продукти (метод с градуиран двукапилярен пикнометър);
|
|
ВS 5903
|
Method for determination of relative density and density of petroleum products by the capillary — stoppered pycnometer method (Метод за определяне на относителната плътност и плътността на нефтени продукти с капилярка — метод със запушен пикнометър);
|
|
NF Т 20-053
|
Chemical products for industrial use — Détermination of density of solids in powder and liquids — Pyknometric method (Химични продукти за индустриална употреба — определяне на плътността на твърди вещества в прахове и течности — пикнометричен метод);
|
2.2. За твърди вещества
|
ISO 1183
|
Method B: Methods for determining the density and relative density of plastics excluding cellular plastics (Метод В: Методи за определяне на плътността и относителната плътност на пластмаси с изключение на разпенени пластмаси);
|
|
NF Т 20-053
|
Chemical products for industrial use — Détermination of density of solids in powder and liquids — Pyknometric method (Химични продукти за индустриална употреба — определяне на плътността на твърди вещества в прахове и течности — пикнометричен метод);
|
|
DIN 19683
|
Determination of the density of soils (Определяне на плътността на почви)
|
3. Пикнометър с въздушно сравняване
|
DIN 55990
|
Part 3: Prüfung von Anstrichstoffen und ähnlichen Beschichtungsstoffen; Pulverlack; Bestimmung der Dichte (Част 3: Изпитване на лакове и бои и подобни материали за покрития; прахообразен лак; определяне на плътността);
|
|
DIN 53243
|
Anstrichstoffe; Chlorhaltige Polymere; Prüfung (Лакобояджийски материали; хлорсъдържащи полимери; изпитване).
|
А.4. ПАРНО НАЛЯГАНЕ
1. МЕТОД
Повечето от описаните методи се основават на Ръководството за провеждане на изпитвания на ОИСР (1). Основните принципи са дадени в препратки (2) и (3).
1.1. ВЪВЕДЕНИЕ
За провеждането на това изпитване е полезно да се знае предварителна информация върху структурата, температурата на топене и температурата на кипене на веществото.
Не съществува единствена измервателна процедура, приложима за целия обхват от парни налягания. Затова се препоръчва да се използват няколко метода за измерване на парното налягане от < 10-4 до 105 Ра.
Примесите обикновено влияят върху парното налягане до степен, която зависи значително от вида им.
Когато в пробата има летливи примеси, които биха могли да повлияят на резултата, веществото може да се пречисти. Също така може да е подходящо да се укаже и парното налягане на материала с техническа степен на чистота.
В някои от описаните тук методи се използват апарати с метални части; това трябва да се има предвид, когато се изследват вещества с корозивно действие.
1.2. ОПРЕДЕЛЕНИЯ И МЕРНИ ЕДИНИЦИ
Парното налягане на едно вещество е налягането на наситените пари над твърдото или течното вещество. В условията на термодинамично равновесие парното налягане на чистото вещество зависи само от температурата.
Трябва да се използва SI-единицата за налягане, която е Паскал (Ра).
Мерните единици, употребявани в миналото, и техните коефициенти на превръщане са следните:
|
1 Torr (≡ 1 mm Hg)
|
= 1,333 × 102 Ра
|
|
1 атмосфера
|
= 1,013 × 105 Ра
|
|
1 bаr
|
= 105 Ра
|
SI-единицата за температура е Келвин (K).
Универсалната моларна газова константа R е 8,314 J mol-1 K-1.
Зависимостта на парното налягане от температурата се описва с уравнението на Клаузиус-Клапейрон:

където:
|
р
|
=
|
парното налягане на веществото в паскали
|
|
ΔHV
|
=
|
неговата топлина на изпарение в J mol-1
|
|
R
|
=
|
универсалната моларна газова константа в J mol-1 K-1
|
|
Т
|
=
|
термодинамичната температура в K
|
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Не е необходимо да се използват вещества за сравнение във всички случаи, когато се изследва ново вещество. Преди всичко те трябва да служат за периодична проверка на действието на метода, както и да позволяват сравнение с резултатите, получени по други методи.
1.4. ПРИНЦИП НА МЕТОДИТЕ
Предложени са седем метода за определяне на парното налягане, които могат да се прилагат в различни обхвати от парни налягания. Във всеки метод парното налягане се определя при няколко температури. В ограничен температурен интервал логаритъмът от парното налягане на едно чисто вещество е линейна функция на обратната стойност на температурата.
1.4.1. Динамичен метод
При динамичния метод се измерва температурата на кипене, която се отнася за дадено налягане.
Препоръчителен обхват:
от 103 до 105 Ра.
Този метод се препоръчва също и за определяне на нормалната температура на кипене и е приложим за тази цел до 600 K.
1.4.2. Статичен метод
При статичния метод се определя парното налягане, което се установява в една затворена система при дадена температура в условията на термодинамично равновесие. Този метод е подходящ за еднокомпонентни и многокомпонентни твърди и течни вещества.
Препоръчителен обхват:
от 10 до 105 Ра.
Ако се вземат предпазни мерки, горепосоченият метод може да се използва и в областта от 1 до 10 Ра.
1.4.3. Изотенископ
Този стандартизиран метод също е статичен, но обикновено не е подходящ за многокомпонентни системи. Допълнителна информация можете да намерите в ASTM метод D-2879-86.
Препоръчителен обхват:
от 100 до 105 Ра.
1.4.4. Ефузионен метод: везна за парно налягане
Определя се количеството вещество, което напуска една клетка за единица време през отвор с известен размер в условията на вакуум, така че връщането на веществото в клетката да е пренебрежимо малко (например чрез измерване на импулса, който парната струя генерира върху чувствителна везна, или чрез измерване на загубата на тегло).
Препоръчителен обхват:
от 10-3 до 1 Ра.
1.4.5. Ефузионен метод: по загубата на тегло или чрез улавяне на изпареното вещество
Методът се основава на измерване на масата от изпитваното вещество, която изтича под формата на пари за единица време от Кнудсенова клетка (4) през микроотверстие в условията на свръхвакуум. Масата на изтеклите пари може да се получи или като се определи загубата на маса от клетката, или чрез кондензация на парите при ниска температура и определяне на количеството на изпареното вещество, като се използва хроматографски анализ. Парното налягане се из0числява чрез прилагане на зависимостта на Херц-Кнудсен.
Препоръчителен обхват:
от 10-3 до 1 Ра.
1.4.6. Метод с насищане на газ
Поток от инертен газ носител се пропуска над веществото по такъв начин, че да се насити с неговите пари. Количеството на пренесения материал от известно количество газ носител може да се измери или като се събере в подходящ уловител, или с помощта на присъединена последователно аналитична техника. След това, това количество се използва, за да се изчисли парното налягане при дадена температура.
Препоръчителен обхват:
от 10-4 до 1 Ра.
Ако се вземат предпазни мерки, този метод може да се прилага също и в областта от 1 до 10 Ра.
1.4.7. Въртящ се ротор
В измерителния уред с въртящ се ротор същинският измервателен елемент е малко стоманено топче, което е окачено в магнитно поле и се върти с висока скорост. Налягането на газа се изчислява от забавянето на стоманеното топче, което зависи от натиска върху него.
Препоръчителен обхват:
от 10-4 до 0,5 Ра.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Различните методи за определяне на парното налягане са сравнени по тяхната приложимост, повторяемост, възпроизводимост, обхват на измерване и съществуващ стандарт. Това е направено в следната таблица.
|
Метод на измерване
|
Вещества
|
Оценка на повторяемостта (7)
|
Оценка на възпроизводимостта (7)
|
Препоръчителен обхват
|
Съществуващ стандарт
|
|
Твърди вещества
|
Течности
|
|
|
Нискотопими
|
да
|
до 25 %
|
до 25 %
|
от 103 Ра до 2 × 103 Ра
|
—
|
|
|
|
|
от 1 до 5 %
|
от 1 до 5 %
|
от 2 х 103 Ра до 105 Ра
|
—
|
|
|
да
|
да
|
от 5 до 10 %
|
от 5 до 10 %
|
от 10 Ра до 105 Ра (8)
|
NFT 20-048 (5)
ASTM-D 2879-86
|
|
|
да
|
да
|
от 5 до 10 %
|
от 5 до 10 %
|
от 102 Ра до 105 Ра
|
—
|
|
1.4.4.
|
Ефузионен метод: везна за парно налягане
|
|
да
|
да
|
от 5 до 20 %
|
до 50 %
|
от 10-3 до 1 Ра
|
NFT
20-047 (6)
|
|
1.4.5.
|
Ефузионен метод: загуба на тегло
|
|
да
|
да
|
от 10 до 30 %
|
—
|
от 10-3 до 1 Ра
|
—
|
|
1.4.6.
|
Метод с насищане на газ
|
|
да
|
да
|
от 10 до 30 %
|
до 50 %
|
от 10-4 до 1 Ра (8)
|
—
|
|
1.4.7.
|
Метод с въртящ се ротор
|
|
да
|
да
|
от 10 до 20 %
|
—
|
от 10-4 до 0,5 Ра
|
—
|
1.6. ОПИСАНИЕ НА МЕТОДИТЕ
1.6.1. Динамично измерване
1.6.1.1. Апаратура
Измервателната апаратура по принцип се състои от съд за кипене с присъединен към него стъклен или метален хладник (фигура 1), устройство за измерване на температурата и устройство за регулиране и измерване на налягането. Един типичен измервателен апарат, показан на схемата, е направен от термоустойчиво стъкло и е съставен от пет части:
Голямата, отчасти двойностенна тръба, се състои нагреваема връзка на шлиф с кожух, хладник, охладителен съд и входен отвор.
Стъкленият цилиндър с „помпа“ на Котрел е монтиран в зоната за кипене на тръбата и има груба повърхност от грапаво стъкло, за да се избегнат „тласъците“ при кипенето.
Температурата се измерва с подходящ термочувствителен елемент (например съпротивителен термометър, изолирана термодвойка), вкаран в апарата до точката на измерването (№ 5, фигура 1) през подходящ вход (например връзка с мъжки шлиф).
Направени са необходимите връзки към устройствата за регулиране и измерване на налягането.
Разширение, което действа като буферен обем, е свързано към измервателния апарат с помощта на капилярна тръба.
Съдът, в който става кипенето, се загрява с нагревателен елемент (например патронен нагревател), въведен в стъкления апарат от долната му страна. Необходимият за нагряването ток се настройва и регулира с термодвойка.
Нужният вакуум в диапазона от 102 Ра до около 105 Ра се създава с вакуумпомпа.
Използва се подходящ клапан за дозиране на въздуха или азота, чрез които се регулира налягането (измервателен обхват приблизително 102 до 105 Ра) и за вентилация.
Налягането се измерва с манометър.
1.6.1.2. Процедура на измерване
Парното налягане се измерва, като се определя температурата на кипене на пробата при няколко определени налягания между грубо 103 и 105 Ра. Ако при постоянно налягане температурата също не се променя, това показва, че е достигната температурата на кипене. С този метод не могат да се измерват вещества, които образуват пяна.
Веществото се поставя в чистия сух съд за пробата. Проблеми могат да възникнат с веществата, които не са в прахообразно състояние, но в някои случаи те могат да се решат, като се нагрее охладителният кожух. След напълване на съда апаратът се затваря плътно при фланеца и веществото се дегазира. След това се наглася на най-ниското желано налягане и се включва нагряването. В същото време температурният сензор се свързва със записващо устройство.
Равновесието е достигнато, когато при постоянно налягане се отчита една и съща температура на кипене. Особено много трябва да се внимава кипенето да не става на тласъци. Освен това в охладителя трябва да се извършва пълна кондензация на парите. Когато се определя парното налягане на нискотопими твърди вещества, трябва да се вземат мерки да не се блокира кондензаторът.
След като се регистрира тази равновесна точка, уредът се наглася на по-високо налягане. Процесът продължава по този начин, докато се достигне налягане от 105 Ра (общо приблизително от 5 до 10 измервателни точки). За проверка равновесните точки трябва да се повторят и при намаляване на налягането.
1.6.2. Статично измерване
1.6.2.1. Апаратура
Апаратът се състои от контейнер за пробата, нагревателна и охладителна система за регулиране на температурата на пробата и за измерване на температурата. Апаратът също включва и прибори за регулиране и измерване на налягането. Фигури 2а и 2б илюстрират основните използвани принципи.
Камерата за пробата (фигура 2а) е ограничена от едната страна от подходящ високовакуумен клапан. Към другата му страна е прикрепена U-образна тръба, която съдържа подходяща манометрична течност. Единият край на U-образната тръба се разклонява към вакуумпомпата, цилиндъра с азот или вентилационния клапан и към манометъра.
Вместо U-образна тръба може да се използва манометър с индикатор за налягане (фигура 2б).
За да се регулира температурата на пробата, съдът с пробата заедно с клапана и U-образната тръба (или манометъра) се поставят в баня, в която температурата се поддържа постоянна с точност ±0,2 K. Измерванията на температурата стават върху външната стена на съда, съдържащ пробата, или вътре в самия съд.
За обезвъздушаване на апаратурата се използва вакуумпомпа с охлаждащ уловител за парите преди нея.
При метод 2а парното налягане на веществото се измерва индиректно, като се използва нулев индикатор. При това се отчита фактът, че плътността на течността в U-образна тръба се променя, ако температурата се измени значително.
В зависимост от обхвата на налягането и химичните отнасяния на веществото, като нулеви индикатори в U-образната тръба могат да се използват следните течности: силиконови течности, фталати. Изпитваното вещество не бива да се разтваря забележимо или да реагира с течността в U-образната тръба.
В областта от нормалното въздушно налягане до 102 Ра в манометъра може да се използва живак, докато силиконовите течности и фталатите са подходящи за използване под 102 Ра до 10 Ра. Нагреваемите мембранни капацитивни манометри могат да се прилагат дори под 10-1 Ра. Съществуват и други типове манометри, които могат да се ползват под 102 Ра.
1.6.2.2. Процедура на измерване
Преди измерването всички компоненти на апаратурата, показана на фигура 2, трябва основно да се почистят и подсушат.
При метод 2а U-образната тръба се напълва с избраната течност, която трябва да се дегазира при повишена температура преди да започне отчитането.
Изпитваното вещество се поставя в апарата, който се затваря и температурата се намалява достатъчно, за да може да се дегазира. Температурата трябва да е достатъчно ниска, за да осигурява пълно изпомпване на въздуха, но в случай на многокомпонентна система тя не бива да променя състава на материала. Ако е необходимо, равновесието може да се установи по-бързо чрез разбъркване.
Пробата може да се преохлади с помощта например на течен азот (като се внимава да се избегне кондензацията на въздуха или на помпената течност) или със смес от етанол и сух лед. За нискотемпературни измервания се използва баня с регулируема температура, свързана с хладилен ултратермостат.
Клапанът над съда с пробата се отваря и в продължение на няколко минути се засмуква, за да се отстрани въздухът. След това клапанът се затваря и температурата на пробата се понижава до най-ниското желано ниво. Ако е необходимо, операцията по дегазирането трябва да се повтори няколко пъти.
Когато пробата се нагрява, налягането на парите се увеличава. Това променя равновесието на течността в U-образната тръба. За да се компенсира тази промяна, в апарата през клапан се въвежда азот или въздух, докато течността в индикатора на налягането отново достигне нулата. Необходимото за това налягане може да се отчете с прецизен манометър при стайна температура. Това налягане съответства на парното налягане на веществото при дадената температура на измерване.
Метод 2б е подобен, но парното налягане се отчита директно.
Температурната зависимост на парното налягане се определя на подходящи малки интервали (приблизително от 5 до 10 измервателни пункта общо), докато се достигне желаният максимум. За проверка отчитането при ниски температури трябва да се повтори.
Ако стойностите, измерени при това повторно отчитане, не съвпадат с кривата, получена при повишаване на температурата, това може да се дължи на една от следните причини:
|
1.
|
Пробата все още съдържа въздух (например високовискозните материали) или нискокипящи вещества, които се отделят при нагряването и могат да се отстранят чрез засмукване след допълнително преохлаждане.
|
|
2.
|
Температурата на охлаждане не е достатъчно ниска. В този случай като охлаждащ агент трябва да се използва течен азот.
Ако причината е 1 или 2, измерванията трябва да се повторят.
|
|
3.
|
Веществото претърпява химична реакция в изследвания температурен интервал (например разграждане, полимеризация).
|
1.6.3. Изотенископ
Пълно описание на този метод може да се намери в препратка (7). Принципът на измервателното устройство е показан на фигура 3. Подобно на статичния метод, описан в 1.6.2, изотенископът е подходящ за изследване на твърди вещества и на течности.
Когато се изпитват течности, самото вещество служи за флуид в спомагателния манометър. В изотенископа се поставя количество от течността, достатъчно да запълни резервоара и късото коляно на манометъра. Изотенископът се присъединява към система за вакуум и се обезвъздушава, след което се запълва с азот. Евакуацията и прочистването на системата се повтарят два пъти, за да се отстрани остатъчният кислород. Напълненият изотенископ се поставя в хоризонтално положение, така че пробата да се разстеле на тънък пласт в резервоара за пробата и в зоната на манометъра (U-образна част). Налягането на системата се намалява до 133 Ра и пробата внимателно се нагрява до малко преди да закипи (отстраняване на разтворените фиксирани газове). След това изотенископът се поставя в такова положение, че пробата да се върне в резервоара и в късото коляно на манометъра, докато и двете се запълнят изцяло с течност. Налягането се поддържа, както за дегазиране; изтегленият край на резервоара за пробата се нагрява с малък пламък, докато отделената пара се разшири достатъчно, за да измести част от пробата от горната част на резервоара и рамото на манометъра към манометричната зона на изотенископа, като по този начин се създава изпълнено с пари и свободно от азот пространство.
След това изотенископът се поставя в баня с постоянна температура и налягането на азота се регулира, докато се изравни с това на пробата. Равновесното налягане се отчита в манометричната зона на изотенископа. При равновесие парното налягане на азота е равно на парното налягане на веществото.
При твърди вещества в зависимост от обхвата от налягания и температури се използват манометричните течности, посочени в 1.6.2.1. С дегазираната течност на манометъра се запълва едно разширение върху дългото рамо на изотенископа. След това твърдото вещество, което ще бъде изпитвано, се поставя в резервоара и се дегазира при повишаване на температурата. После изотенископът се накланя така, че течността в манометъра да навлезе в U-образната тръба. Измерването на парното налягане като функция от температурата се прави, както е описано в 1.6.2.
1.6.4. Ефузионен метод: везна за измерване на парно налягане
1.6.4.1. Апаратура
В препратка (1) са описани няколко варианти на апаратурата. Описаната тук апаратура илюстрира основния принцип (фигура 4). На фигура 4 са показани главните компоненти на апаратурата, която включва: високовакуумен контейнер от неръждаема стомана или стъкло, устройства за създаване и измерване на вакуума и вградени приспособления за измерване на парното налягане с везна. В апаратурата са включени следните вградени приспособления:
|
—
|
изпарителна пещ с фланец и въртящ се вход. Изпарителната пещ представлява цилиндричен съд, направен например от мед или от химически устойчива сплав с добра топлопроводимост. Също така може да се използва и стъклен съд с медна стена. Пещта има диаметър приблизително от 3 до 5 cm и е висока от 2 до 5 cm. За преминаването на потока от парите са направени от един до три отвора с различни размери. Пещта се нагрява или с нагревателна плоча отдолу, или с нагревателна спирала по външната стена. За да се избегне разсейването на топлината към основната плоча, нагревателят се прикрепя към нея с помощта на метал, който има ниска топлопроводимост (никелово-сребърна или хромово-никелова стомана), например никелово-сребърна тръба, прикрепена към въртящия се вход, ако се използва пещ с няколко отвора. Този начин на свързване има това предимство, че позволява да се използва медна пръчка. Медната пръчка дава възможност охлаждането да става с охлаждаща баня от външната страна,
|
|
—
|
ако капакът на медната пещ има три отвора с различни размери, разположени на 90o един спрямо друг, могат да се покрият няколко области от парни налягания в целия обхват на измерване (отворите са приблизително от 0,30 до 4,50 mm в диаметър). Големите отвори се използват за ниски парни налягания и обратно. Като се върти пещта, може да се нагласи желаният отвор или междинното положение на парния поток (отвор на пещта-преграда-блюдо на везната) и така потокът от молекули се насочва или отклонява през отвора на пещта към блюдото на везната. За измерване на температурата на веществото в подходяща точка се поставя термодвойка или съпротивителен термометър,
|
|
—
|
над преградата се намира блюдото, което е част от високочувствителна микровезна (вж. по-долу). Блюдото на везната е приблизително 30 mm в диаметър. Подходящ материал за направата му е алуминий със златно покритие,
|
|
—
|
блюдото на везната е заобиколено от цилиндрична охладителна кутия, направена от бронз или мед. В зависимост от типа на везната охладителната кутия има отвори за рамото на везната и един преграден отвор за потока от молекули. Тя трябва да гарантира пълна кондензация на парите върху блюдото. Разсейването на топлината към външната среда се осигурява например от медна пръчка, свързана с охладителната кутия. Пръчката е насочена към основната плоча и е термично изолирана от нея, например с тръба от хромово-никелова стомана. Пръчката е потопена в Дюаров съд, съдържащ течен азот под основната плоча, или течният азот циркулира през пръчката. По този начин охладителната кутия се поддържа при температура приблизително – 120 oС. Блюдото на везната се охлажда изключително чрез излъчване и е достатъчно надеждно за изследваната област от налягания (охлаждането става приблизително 1 час преди началото на измерването),
|
|
—
|
везната е разположена над охладителната кутия. Подходящи везни са например високочувствителната двураменна електронна микровезна (8) или високочувствителният прибор с подвижна намотка (виж ОИСР Ръководство за изпитване 104, издание от 12.5.1981 г.),
|
|
—
|
основната плоча също включва електрически връзки за термодвойки (или съпротивителни термометри) и нагревателни реотани,
|
|
—
|
вакуумът в съда се създава от парциална вакуумпомпа или от високовакуумна помпа (необходимият вакуум от приблизително 1 до 2 x 10-3 Ра се получава след 2 часа изпомпване). Налягането се регулира с подходящ йонизационен манометър.
|
1.6.4.2. Процедура на измерване
Съдът се напълва с изследваното вещество и капакът се затваря. Преградата и охлаждащата кутия се плъзгат напряко на пещта. Апаратът се затваря и вакуумпомпите се включват. Крайното налягане преди да започнат измерванията трябва да е приблизително 10-4 Ра. Охлаждането на охладителната кутия започва при 10-2 Ра.
След като се достигне нужният вакуум, започва калибровъчната серия при най-ниската желателна температура. Нагласява се съответният отвор на капака; потокът на парите преминава през преградата направо над отвора и удря охладеното блюдо на везната. Блюдото трябва да е достатъчно голямо, за да може целият поток, насочен през преградата, да попадне върху него. Моментът на потока на парите действа като сила на натиск върху блюдото на везната и молекулите кондензират по охладената повърхност.
Моментът и едновременната кондензация произвеждат сигнал върху записващото устройство. Оценката на сигналите осигурява два вида информация:
|
1.
|
В описания тук апарат парното налягане се определя направо от момента върху блюдото на везната (за това не е необходимо да се знае молекулното тегло (2). Когато се оценяват показанията на записващото устройство, трябва да се вземат предвид и геометричните фактори, като отвора на пещта и ъгъла на молекулния поток.
|
|
2.
|
Едновременно може да се измери и масата на кондензата и от нея може да се изчисли скоростта на изпарение. Парното налягане може също да се изчисли от скоростта на изпарение и молекулното тегло, като се използва уравнението на Херц (2):
|
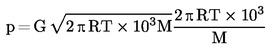
където:
|
G
|
=
|
скоростта на изпарение (kg s-1 m-2)
|
|
M
|
=
|
моларната маса (g mol-1)
|
|
T
|
=
|
температурата (K)
|
|
R
|
=
|
универсалната моларна газова константа (J mol-1 K-1)
|
|
р
|
=
|
парното налягане (Ра)
|
След като се достигне нужният вакуум, серията от измервания започва при най-ниската измервателна температура.
При следващите измервания, температурата се увеличава на малки интервали, докато се достигне максималната ѝ желана стойност. След това пробата се охлажда отново, при което може да се отчете втора крива на парното налягане. Ако втората крива не потвърждава резултатите от първата, е възможно веществото да се разлага в температурния обхват на измерването.
1.6.5. Ефузионен метод — чрез загуба на тегло
1.6.5.1. Апаратура
Ефузионният апарат се състои от следните основни части:
|
—
|
резервоар, който може да се термостатира и обезвъздушава и в който са разположени ефузионните клетки,
|
|
—
|
високовакуумна помпа (например дифузионна или турбомолекулярна помпа) с вакуумметър,
|
|
—
|
уловител на парите, за който се използва течен азот или сух лед.
|
На фигура 5 е показан като пример алуминиев вакуумен резервоар с електрическо нагряване, с 4 ефузионни клетки от неръждаема стомана. Тънък лист от неръждаема стомана с дебелина около 0,3 mm, на който има ефузионно отверстие с диаметър от 0,2 до 1,0 mm, е прикрепен към ефузионната клетка посредством решетъчен капак.
1.6.5.2. Процедура на измерване
Сравнителното и изпитваното вещество се поставят в отделни ефузионни клетки, металната диафрагма с отверстието се осигурява с помощта на решетъчния капак и всяка от клетките се претегля с точност до 0,1 mg. Клетката се поставя в термостатирания апарат, който се вакуумира, докато налягането достигне стойност, по-малка от една десета от очакваното налягане. На определени интервали от време – между 5 и 30 часа, в апарата се пропуска въздух и чрез повторно претегляне се определя масата, която е загубила клетката.
За да е сигурно, че резултатите не са повлияни от летливи примеси, клетката се претегля на точно определени интервали от време. Така се проверява дали ефузионната скорост е постоянна през най-малко два такива интервала.
Парното налягане „р“ в ефузионната клетка се дава със следното уравнение:

където:
|
р
|
=
|
парното налягане (Ра)
|
|
m
|
=
|
масата на веществото, напускащо клетката за време t (kg)
|
|
t
|
=
|
времето (s)
|
|
A
|
=
|
площта на отвора (m2
|
|
К
|
=
|
корекционния коефициент
|
|
R
|
=
|
универсалната газова константа (J mol-1 K-1)
|
|
Т
|
=
|
температурата (K)
|
|
M
|
=
|
молекулната маса (kg mol-1)
|
Корекционният коефициент К зависи от съотношението между дължината и радиуса на цилиндричното отверстие:
|
Съотношение
|
0,1
|
0,2
|
0,6
|
1,0
|
2,0
|
|
К
|
0,952
|
0,909
|
0,771
|
0,672
|
0,514
|
Горното уравнение може да се запише така:

където  и представлява ефузионната константа на клетката.
и представлява ефузионната константа на клетката.
Тази ефузионна константа на клетката Е може да се определи със сравнително вещество (2,9), като се използва следното уравнение:

където:
|
р(r)
|
=
|
парното налягане на сравнителното вещество (Ра)
|
|
М(r)
|
=
|
молекулната маса на сравнителното вещество (kg х mol-1)
|
1.6.6. Метод с насищане на газ
1.6.6.1. Апаратура
Типичната апаратура, която се използва за провеждането на това изпитване, обхваща голям брой компоненти. Тези компоненти са дадени на фигура 6а и са описани по-долу (1).
Инертен газ:
Газът носител не бива да реагира химически с изпитваното вещество. Обикновено азотът е подходящ за тази цел, но в някои случаи може да е необходимо да се използват други газове (10). Използваният газ трябва да е сух (виж фигура 6а, ключ 4: сензор за относителна влажност).
Регулиране на потока:
Необходима е подходяща система за регулиране на газа, която да осигури постоянен предварително подбран поток през колоната за насищане.
Уловители на парите:
Те зависят от характеристиките на конкретната проба и от избрания метод за анализ. Парите трябва да се задържат количествено под форма, която позволява последващо анализиране. За някои изследвани вещества са подходящи уловители с течности като хексан или етилен гликол. За други може да са приложими твърди адсорбенти.
Алтернатива на улавянето на парите и следващият им анализ са директните аналитични техники (като хроматографията), които се включват веднага след апаратурата. Те могат да се използват за определяне количеството на материала, пренесен от известно количество газ носител. Освен това може да се измерва и загубата на маса от пробата.
Топлообменник:
За измервания при различни температури може да се наложи в апаратурата да се включи и топлообменник.
Колона за насищане:
Изпитваното вещество се отлага из разтвор върху подходящ инертен носител. Покритият носител се насипва в колоната за насищане, чиито размери и дебит трябва да са такива, че да осигуряват пълното насищане на газа носител. Колоната за насищане трябва да е термостатирана. При измервания над стайната температура областта между насищащата колона и уловителя трябва да се нагрява, за да се избегне кондензацията на изпитваното вещество.
За да се намали масовият транспорт вследствие на дифузията, след насищащата колона може да се постави капилярка (фигура 6б).
1.6.6.2. Процедура на измерване
Приготвяне на колоната за насищане:
Разтвор на изпитваното вещество в леснолетлив разтворител се прибавя към достатъчно количество носител. Трябва да се добави достатъчно количество от изпитваното вещество, за да се поддържа насищането през цялото време на измервателната процедура. Разтворителят се изпарява напълно на въздух или в ротационен изпарител и добре смесеният материал се насипва в колоната за насищане. След термостатиране на пробата през апарата се пропуска сух азот.
Измерване:
Уловителите или включеният в линията детектор се свързват към изходящата линия от колоната и започва да се отчита времето. Дебитът на потока се проверява в началото и на равни интервали от време, докато трае измерването. За целта се използва филм-дебитомер (със сапунена ципа) или се правят непрекъснати измервания с мас-дебитомер.
Трябва да се измерва налягането на изхода от колоната. Това може да се направи по следните начини:
|
а)
|
като се включи манометър между колоната за насищане и уловителите (това може да не даде добри резултати, защото така се увеличават мъртвият обем и повърхността на адсорбция); или
|
|
б)
|
като се определя падът на налягането през дадената улавяща система като функция от дебита на потока за всеки отделен опит (това може да не дава задоволителни резултати при уловителите с течност).
|
Времето, необходимо да се събере достатъчно количество от изпитваното вещество за различните аналитични методи, се определя с предварителни опити или чрез изчисления. Като алтернатива на събирането на вещество за последващо анализиране може да се използва последователно свързана към апаратурата количествена аналитична техника (например хроматография). Преди да се изчисли парното налягане при дадена температура, трябва да се направят предварителни изпитвания, за да се определи максималният дебит на потока, при който газът носител изцяло ще се насити с парите на веществото. Това става със сигурност, ако газът носител преминава през колоната достатъчно бавно, така че по-малкият дебит на потока да не дава по-големи стойности на парното налягане при изчисленията.
Специфичният аналитичен метод се определя в зависимост от природата на изпитваното вещество (например газова хроматография или гравиметрия).
Определя се количеството вещество, пренесено от известно количество газ носител.
1.6.6.3. Изчисляване на парното налягане
Парното налягане се изчислява от плътността на парите W/V по уравнението:

където:
|
р
|
=
|
парното налягане (Ра)
|
|
W
|
=
|
масата на изпареното вещество (g)
|
|
V
|
=
|
обема на наситения газ (m3)
|
|
R
|
=
|
универсалната моларна газова константа (J mol-1 K1-)
|
|
Т
|
=
|
температурата (K)
|
|
M
|
=
|
моларната маса на изпитваното вещество (g mol-1)
|
Измерените обеми трябва да се коригират за разликите в температурата и налягането между дебитомера и термостатираната колона. Ако дебитомерът е разположен успоредно на пароуловителя, е необходимо да се изчислят корекциите за всеки изпарен компонент в уловителя (1).
1.6.7. Въртящ се ротор (8, 11, 13)
1.6.7.1. Апаратура
Техниката с въртящ се ротор може да се провежда с вискозиметър с въртящ се ротор, както е показано на фигура 8. Схематичен чертеж на експерименталната установка е показан на фигура 7.
Измервателната апаратура обикновено се състои от измервателна глава с въртящ ротор, разположена в термостатиран съд (температурата се регулира в рамките на 0,1oС). Контейнерът с пробата се поставя в термостатиран съд (регулиране на температурата до 0,01oС); всички останали части на установката се държат при по-висока температура, за да се избегне кондензацията. Приспособление с високовакуумна помпа е свързано към системата чрез високовакуумни клапани.
Измервателната глава с въртящ се ротор се състои от стоманено топче (от 4 до 5 mm в диаметър), поставено в тръба. Топчето е окачено и стабилизирано в магнитно поле, за което обикновено се използва комбинация от постоянни магнити и регулиращи бобини.
Топчето се привежда във въртеливо движение от въртящите се полета, създадени от намотките. Измервателни намотки, които отчитат винаги наличната слаба несиметрична намагнитеност на топчето, позволяват да се измери неговата скорост на въртене.
1.6.7.2. Процедура на измерване
Когато топчето достигне дадена скорост на въртене v(o) (обикновено около 400 оборота в секунда), задвижването му се прекратява и скоростта му започва да намалява поради триенето с газовете.
Падането на скоростта на въртене се измерва като функция от времето. Понеже триенето, дължащо се на магнитното окачване, е незначително в сравнение с триенето на газа, налягането на газа „р“ се дава с уравнението:

където:
|

|
=
|
средна скорост на газовите молекули
|
|
r
|
=
|
радиус на топчето
|
|
ρ
|
=
|
масова плътност на топчето
|
|
σ
|
=
|
коефициент на тангенциалния импулсен пренос (с = 1 за идеално сферична повърхност на топчето)
|
|
t
|
=
|
време
|
|
v(t)
|
=
|
скорост на въртене след време t
|
|
v(0)
|
=
|
начална скорост на въртене.
|
Уравнението може да се запише и така:

където tn, tn–1 са времената, необходими за даден брой n завъртания. Тези интервали от време са последователни и tn > tn–1.
Средната скорост на газовата молекула „ “ се дава с:
“ се дава с:

където:
|
T
|
=
|
температурата
|
|
R
|
=
|
универсалната моларна газова константа
|
|
M
|
=
|
моларната маса.
|
2. ДАННИ
Парното налягане при всеки от описаните методи трябва да се определи поне при две температури. За да се провери дали кривата на парното налягане е линейна, за предпочитане е да се направят три или повече измервания в областта от 0 до 50 oС.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
Докладването на резултатите от измерването трябва, ако е възможно, да включва следната информация:
|
—
|
точна спецификация на веществото (вид и примеси) и предварителни етапи на пречистване, ако има такива,
|
|
—
|
най-малко две стойности на парното налягане и температурата, за предпочитане в областта от 0 до 50 oС,
|
|
—
|
всички необработени данни,
|
|
—
|
кривата на зависимостта на log p от 1/Т,
|
|
—
|
изчисление на парното налягане при 20 или 25 oС.
|
Ако се наблюдава преход (промяна в състоянието, разграждане), трябва да се отбележи следната информация:
|
—
|
температура, при която се извършва промяната при атмосферното налягане,
|
|
—
|
парно налягане при 10 и 20 oС под температурата на прехода и 10 и 20 oС над тази температура (освен ако преходът е от твърдо към газообразно състояние).
|
Цялата информация и бележките, свързани с интерпретацията на резултатите, трябва да се включат в протокола, особено когато става дума за онечиствания или за физичното състояние на веществото.
4. ПРЕПРАТКИ
|
(1)
|
ОИСР, Paris, 1981, Test Guideline 104, решение на Съвета C(81) 30 окончателен.
|
|
(2)
|
Ambrose, D. in B. Le Neindre, B. Vodar, (Eds.): Experimental Thermodynamics, Butterworths, London, 1975, Vol. II.
|
|
(3)
|
R.Weissberger ed.: Technique of Organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed. Chapter IX, Interscience Publ., New York, 1959, Vol. I, Part I.
|
|
(4)
|
Knudsen, M. Ann. Phys. Lpz., 1909, vol. 29, 1979; 1911, vol. 34, 593.
|
|
(5)
|
NF T 20-048 AFNOR (Sept. 85). Chemical products for industrial use — Determination of vapour pressure of solids and liquids within range from 10-1 to 105 Pa — Static method.
|
|
(6)
|
NF T 20-047 AFNOR (Sept. 85). Chemical products for industrial use — Determination of vapour pressure of solids and liquids within range from 10-3 to 1 Pa — Vapor pressure balance method.
|
|
(7)
|
ASTM D 2879-86, Standart test method for vapour pressure — tempetature relationship and initial decomposition temperature of liquids by isoteniscope.
|
|
(8)
|
G. Messer, P. Roehl, G. Grosse and W. Jitschin. J. Vac. Sci. Technol. (A), 1987, vol. 5 (4), 2440.
|
|
(9)
|
Ambrose, D.; Lawrenson, I. J.; Sprake, C.H.S. J. Chem. Thermodynamics, 1975, vol. 7, 1173.
|
|
(10)
|
B. F. Rordorf. Thermochimica Acta, 1985, vol. 85, 435.
|
|
(11)
|
G. Gomsa, J. K. Fremerey and B. Lindenau, J. Vac. Sci. Technol., 1980, vol. 17 (2), 642.
|
|
(12)
|
G. Reich, J. Vac. Sci. Technol., 1982, vol. 20 (4), 1148.
|
|
(13)
|
J. K. Fremerey. J. Vac. Sci. Technol. (A), 1985, vol. 3 (3), 1715.
|
Допълнение 1
Изчислителен метод
ВЪВЕДЕНИЕ
Изчислените стойности на парното налягане могат да се използват:
|
—
|
за да се прецени кой от използваните експериментални методи е подходящ,
|
|
—
|
да се получи оценка или граничните стойности в случаите, когато експерименталният метод не може да се приложи по технически причини (включително когато парното налягане е много ниско),
|
|
—
|
да помогнат да се разпознаят онези случаи, в които е оправдано да не се проведе експериментално измерване, тъй като най-вероятно парното налягане е < 10-5 Ра при температурата на околната среда.
|
ИЗЧИСЛИТЕЛЕН МЕТОД
Парното налягане на течности и твърди вещества може да се изчисли, като се използва модифицираната корелация на Уотсън (а). Експериментално е необходимо да се определи само точката на кипене при нормални условия. Методът е приложим върху цялата област от парни налягания от 105 до 10-5 Ра.
Подробна информация за метода е дадена в Наръчник на методите за изчисляване на химични свойства (б).
ИЗЧИСЛИТЕЛНА ПРОЦЕДУРА
Според (б), парното налягане се изчислява, както следва:
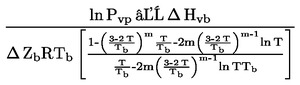
където:
|
Т
|
=
|
температурата, за която се изчислява парното налягане
|
|
Тb
|
=
|
точката на кипене при нормални условия
|
|
Pvp
|
=
|
парното налягане при температура Т
|
|
ΔHvb
|
=
|
топлината на изпарение
|
|
ΔZb
|
=
|
коефициента на свиваемост (оценен на 0,97)
|
|
m
|
=
|
емпиричен коефициент, зависещ от физичното състояние при интересуващата ни температура.
|
По-нататък
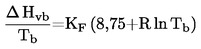
където KF е емпиричен коефициент, отчитащ полярността на веществото. В препратка (б) са дадени коефициентите KF за няколко типа съединения.
Доста често могат да се намерят данни, в които точката на кипене е дадена при понижено налягане. В такъв случай, според (б), парното налягане се изчислява така:

където T1 е точката на кипене при пониженото налягане Р1.
ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
Когато се използва изчислителен метод, в протокола с резултатите трябва да се включи съответната документация от изчисленията.
ПРЕПРАТКИ
|
(а)
|
K. M. Watson, Ind. Eng. Chem., 1943, vol. 35, 398.
|
|
(б)
|
W. J. Lyman, W. F. Reehl, D. H. Rosenblatt. Handbook of Chemical Property Estimation Methods, Mc Graw-Hill, 1982.
|
Допълнение 2
Фигура 1
Апаратура за определяне кривата на налягането на парите по динамичния метод
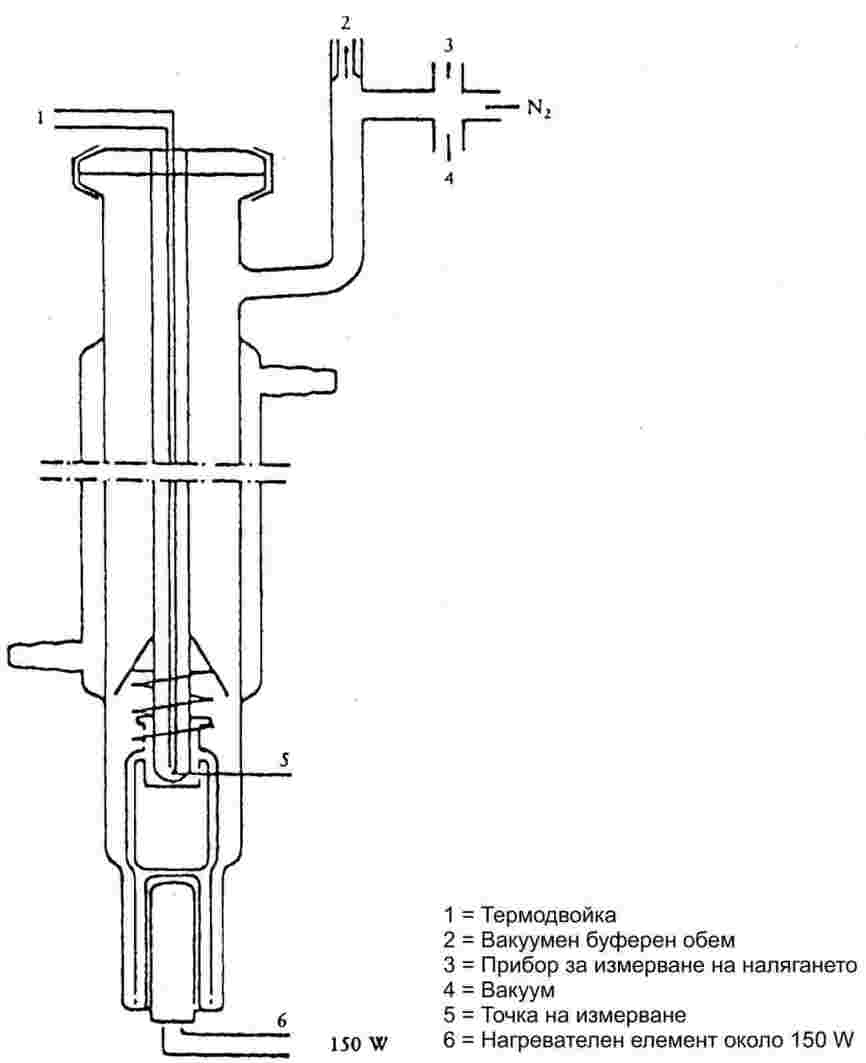
Фигура 2а
Апаратурата за определяне кривата на налягането на парите по статичния метод (при използване на U-образен манометър)
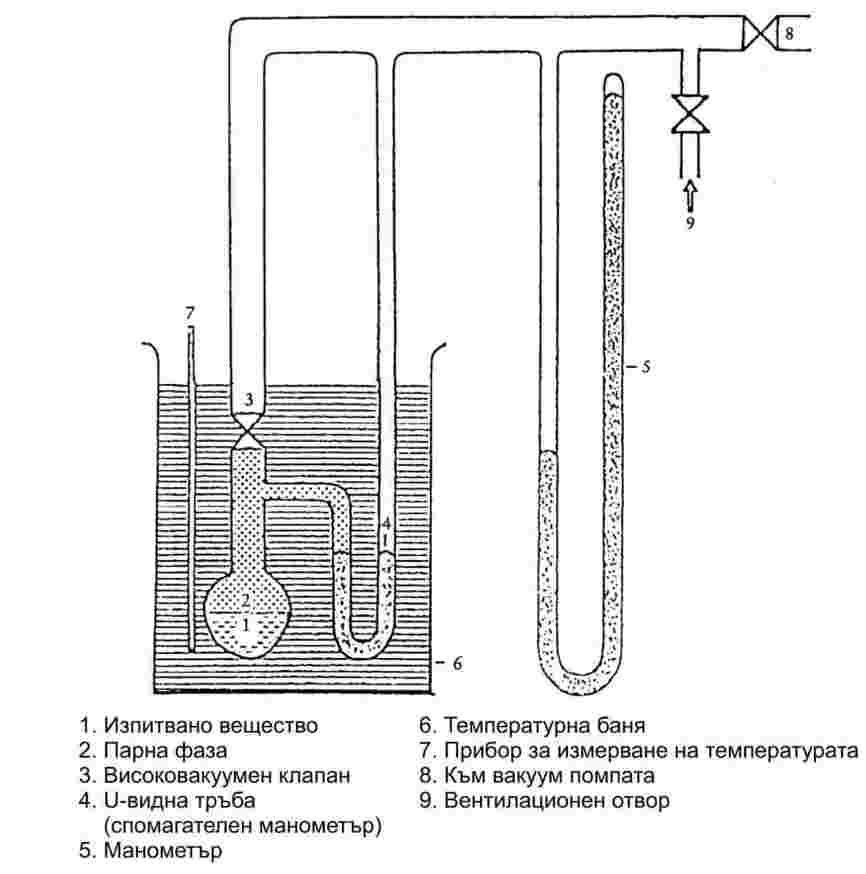
Фигура 2б
Апаратура за определяне кривата на налягането на парите по статичния метод (при използване на индикатор за налягането)

Фигура 3
Изотенископ (виж препратка 7)

Фигура 4
Апаратура за определяне кривата на налягането на парите по метода с везна за парно налягане

Фигура 5
Примерна апаратура за изпаряване при ниско налягане по ефузионния метод при обем на ефузионната клетка 8 cm

Фигура 6а
Пример на поточна система за определяне на налягането на парите по метода с насищане на инертен газ
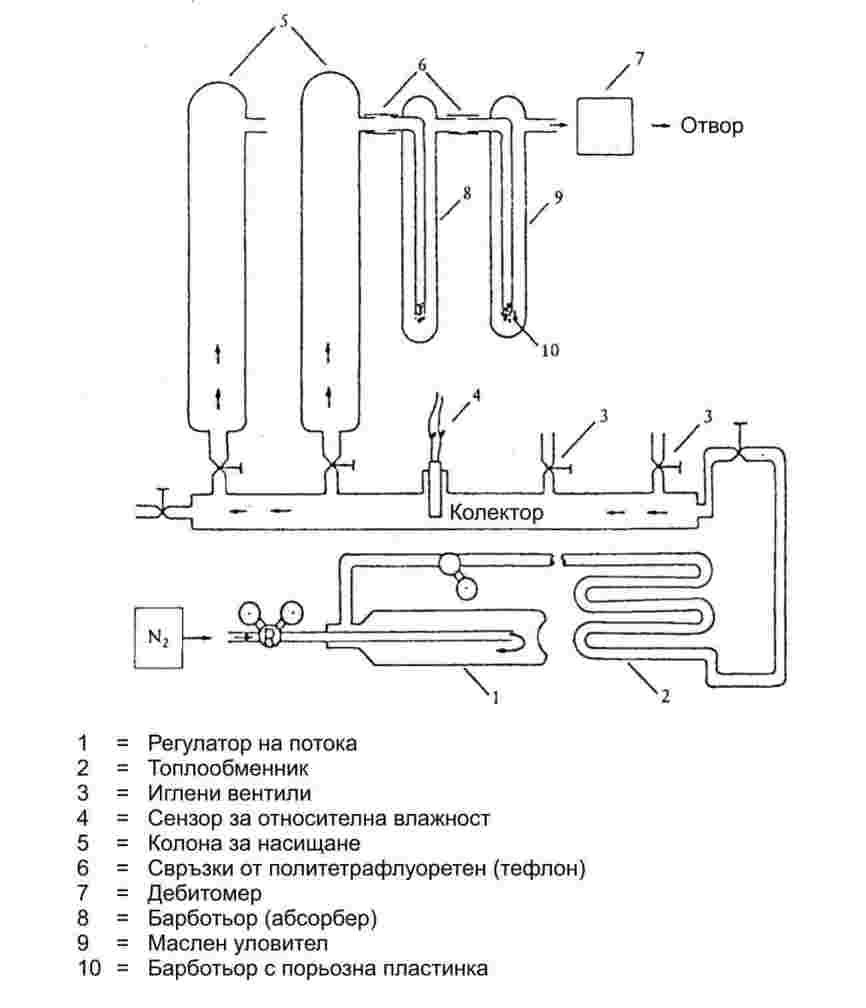
Фигура 6б
Пример на система за определяне на налягането на парите по метода с насищане на инертен газ — с капилярка, разположена след камерата за насищане

Фигура 7
Пример на експериментална установка за метода с въртящ се ротор

Фигура 8
Пример на измерителна глава с въртящ се ротор
А.5. ПОВЪРХНОСТНО НАПРЕЖЕНИЕ
1. МЕТОД
Описаните методи се основават на Ръководството на ОИСР за провеждане на изпитвания (1). Основните принципи са дадени в препратка (2).
1.1. ВЪВЕДЕНИЕ
Описаните методи се прилагат за изпитване на повърхностното напрежение на водни разтвори.
Преди да се извършат тези изпитвания, е полезно да има предварителна информация за разтворимостта във вода, структурата, хидролизните свойства и критичната концентрация на мицелообразуване на веществото.
Описаните по-долу методи са приложими за повечето химични съединения без каквито и да било ограничения, свързани с тяхната степен на чистота.
Измерването на повърхностното напрежение с тензиометър с пръстен е ограничено до водни разтвори с динамичен вискозитет по-нисък от 200 mPa s.
1.2. ОПРЕДЕЛЕНИЯ И МЕРНИ ЕДИНИЦИ
Енталпията на единица площ от свободната повърхност се нарича повърхностно напрежение.
Повърхностното напрежение се измерва в:
N/m (SI-единица) или
mN/m (SI-подединица)
1 N/m = 103 DYN/cm
1 mN/m = 1 DYN/cm в излязлата от употреба система CGS.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Не е необходимо да се използват вещества за сравнение във всички случаи, при които се изпитва ново вещество. Те трябва преди всичко да служат за периодична проверка на действието на метода, както и да позволяват сравнение с резултатите, получени по други методи.
В препратки (1) и (3) са дадени сравнителни вещества, които покриват широк обхват от повърхностни напрежения.
1.4. ПРИНЦИП НА МЕТОДИТЕ
Методите се основават на измерването на максималната сила, която трябва да се приложи вертикално върху скоба или пръстен, намиращи се в контакт с повърхността на изпитваната течност, поставена в измервателен съд, за да се отделят от повърхността ѝ, или върху пластинка, единият край на която се допира до повърхността, за да се прекъсне образуваният филм.
Веществата, които се разтварят във вода до концентрация най-малко 1 mg/l, ce изпитват във воден разтвор само при една концентрация.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Методите могат да осигурят по-висока точност от тази, която вероятно се изисква при полеви измервания.
1.6. ОПИСАНИЕ НА МЕТОДИТЕ
Приготвя се разтвор на веществото в дестилирана вода. Концентрацията на този разтвор трябва да бъде 90 % от концентрацията на наситения разтвор на веществото във вода; когато разтворимостта на веществото надвишава 1 g/l, при изпитванията се използва разтвор с концентрация 1 g/l. Не е необходимо да се извършват изпитвания върху вещества, чиято разтворимост във вода е по-ниска от 1 mg/l.
1.6.1. Метод с използване на пластинка
Виж ISO 304 и NF T 73-060 (Повърхностноактивни вещества — определяне на повърхностното напрежение чрез изтегляне на течни филми).
1.6.2. Метод с използване на скоба
Виж ISO 304 и NF T 73-060 (Повърхностноактивни вещества — определяне на повърхностното напрежение чрез изтегляне на течни филми).
1.6.3. Метод с използване на пръстен
Виж ISO 304 и NF T 73-060 (Повърхностноактивни вещества — определяне на повърхностното напрежение чрез изтегляне на течни филми).
1.6.4. Метод на ОИСР с хармонизиран пръстен
1.6.4.1. Апаратура
За това изпитване могат да се използват тензиометри. Те се състоят от следните елементи:
|
—
|
подвижна масичка за пробата,
|
|
—
|
система за измерване на силата,
|
|
—
|
измервателно тяло (пръстен),
|
1.6.4.1.1. Подвижна масичка за пробата
Подвижната масичка е предназначена да поддържа измервателния съд с контролируема температура, в който е поставена течността за изпитване. Тя е монтирана на стенд заедно със системата за измерване на силата.
1.6.4.1.2. Система за измерване на силата
Системата за измерване на силата (виж фигурата) е разположена над масичката за пробата. Грешката при измерването на силата не бива да надвишава ± 10-6 N, което съответства на грешка в границите на ±0,1 mg при измерване на масата. В повечето случаи измервателната скала на разпространените в търговската мрежа тензиометри е калибрирана в mN/m, така че повърхностното напрежение може да се отчита направо в mN/m с точност 0,1 mN/m.
1.6.4.1.3. Измервателно тяло (пръстен)
Пръстенът обикновено се прави от платиново-иридиева жица с дебелина около 0,4 mm и обиколка 60 mm. Пръстенът се провесва в хоризонтално положение от метална ос и монтираща скоба, направена от жица, така че да се осигури връзката с измервателната система (вж. фигурата).
Фигура
Измервателно тяло
(всички размери са дадени в милиметри)

1.6.4.1.4. Измервателен съд
Измервателният съд, съдържащ разтвора за изпитване, е стъклен съд, чиято температура може да се контролира. Той трябва да е проектиран така, че по време на измерването температурата на изпитвания разтвор и на газовата фаза над него да остава постоянна, а пробата да не може да се изпарява. Допуска се използването на цилиндрични стъклени съдове с вътрешен диаметър не по-малък от 45 mm.
1.6.4.2. Подготовка на апаратурата
1.6.4.2.1. Почистване
Стъклените съдове се почистват внимателно. Ако е необходимо, те се измиват с гореща бихромна смес, след това със сироповидна фосфорна киселина (от 83 до 98 тегл. % Н3РО4), основно се изплакват с течаща вода и накрая се измиват с бидестилирана вода до неутрална реакция. След това се подсушават или се изплакват с част от течната проба, която подлежи на изпитване.
Пръстенът първо се изплаква основно с вода, за да се отстранят всички разтворими във вода вещества. После за кратко се потапя в бихромна смес, измива се с бидестилирана вода до неутрална реакция и накрая се загрява за малко над метанолов пламък.
Забележка:
Замърсяванията от вещества, които не се разтварят или разрушават от бихромната смес и от фосфорната киселина, като силиконовите материали, трябва да се отстранят с помощта на подходящ органичен разтворител.
1.6.4.2.2. Калибриране на апаратурата
Подготовката на апаратурата се състои в проверка на нулевата точка и настройване на показанията на инструмента, което да позволи провеждането на достоверни измервания в mN/m.
Инсталиране
Апаратурата трябва да се нивелира с помощта, например, на спиртен нивелир върху основата на тензиометъра, като се регулират нивелиращите винтове на основата.
Нагласяване на нулата
След монтирането на пръстена върху апаратурата и преди потапянето му в течността показанието на тензиометъра трябва да се нулира и да се провери дали пръстенът е разположен успоредно на повърхността на течността. За тази цел течната повърхност може да се използва като огледало.
Калибриращи процедури
Действителното пробно калибриране може да се извърши с помощта на една от следните две процедури:
|
а)
|
Чрез масата: при процедурата се използват тежести с определено тегло (между 0,1 и 1,0 g), разположени върху пръстена. Калибрационният коефициент Фа, с който се умножават всички показания на инструмента, се определя по следното уравнение (1):
|

|
(1)
|
където:
 (mN/m) (mN/m)
|
m
|
=
|
масата на допълнителната тежест (g)
|
|
g
|
=
|
земното ускорение (981 cm s-2 при морското равнище)
|
|
b
|
=
|
средната обиколка на пръстена (cm)
|
|
σа
|
=
|
показанието на тензиометъра след поставянето на тежестта върху пръстена (mN/m).
|
|
|
б)
|
Чрез вода: използва се чиста вода, чието повърхностно напрежение например при 23 oС е равно на 72,3 mN/m. Тази процедура се изпълнява по-бързо, отколкото калибрирането с тежести, но винаги съществува опасност повърхностното напрежение на водата да не е истинското поради наличието на следи от повърхностноактивни вещества като замърсители.
Калибрационният коефициент Фb, по който трябва да се умножават всички показания на инструмента, се определя по следното уравнение (2):
|

|
(2)
|
където:
|
σo
|
=
|
стойността на повърхностното напрежение на водата, дадена в препратката (mN/m)
|
|
σg
|
=
|
измерената стойност на повърхностното напрежение на водата (mN/m) като и двете се взимат при една и съща температура.
|
|
1.6.4.3. Подготовка на пробите
Приготвят се водни разтвори с необходимите концентрации от изпитваните веществата, които не съдържат неразтворени вещества.
Разтворът трябва да се поддържа при постоянна температура (±0,5oС). Тъй като повърхностното напрежение на разтвора в измервателния съд се променя с течение на времето, трябва да се направят няколко измервания през различни интервали от време и да се начертае крива, показваща зависимостта на повърхностното напрежение от времето. Когато не се наблюдават повече изменения, се счита, че е достигнато равновесното състояние.
Прахът и газообразните замърсявания от други вещества пречат на измерването. Затова трябва да се работи под защитен похлупак.
1.6.5. Условия на изпитването
Изпитването се извършва при 20 oС, като температурата се контролира с точност от ±0,5oС.
1.6.6. Провеждане на изпитването
Изпитваният разтвор се прехвърля в добре почистен измервателен съд, като се внимава да не се образува пяна. След това съдът се поставя върху масичката на измервателната апаратура. Горният край на масичката заедно с измервателния съд се повдига, докато пръстенът се потопи под повърхността на разтвора. После горният край на масичката се сваля постепенно и равномерно (със скорост приблизително 0,5 cm/min), така че пръстенът да се отдели от повърхността. Това продължава до достигане на максималната стойност на силата. Течният слой, прикрепен към пръстена, не бива да се отделя от него. След приключване на изпитването пръстенът отново се потапя под повърхността и измерването се повтаря, докато се достигне постоянна стойност на повърхностното напрежение. При всяко определяне трябва да се записва времето от момента на прехвърлянето на разтвора в измервателния съд. Отчита се максималната сила, необходима за отделянето на пръстена от повърхността на течността.
2. ДАННИ
За да се изчисли повърхностното напрежение, отчетеното показание на апаратурата в mN/m първо се умножава по калибрационния коефициент Фа или Фb в зависимост от използваната процедура на калибриране. Така се получава стойност, която е само приблизителна и се нуждае от корекции.
Харкинс и Джордан (4) са определили емпирично корекционните коефициенти за измерените стойности на повърхностното напрежение по метода на пръстена. Тези стойности зависят от размерите на пръстена, плътността на течността и нейното повърхностно напрежение.
Тъй като определянето на корекционния коефициент по таблиците на Харкинс и Джордан за всяко отделно измерване е много трудоемък процес, при изчисляването на повърхностното напрежение на водни разтвори може да се използва улеснена процедура, която отчита от таблица направо коригираната стойност на повърхностното напрежение. (Когато отчетените при опита стойности се намират между посочените в таблицата, се прилага интерполация).
Таблица
Коригиране на измереното п овърхностно напрежение
Само за водни разтвори, ρ = 1 g/cm3
|
R
|
= 9,55 mm (среден радиус на пръстена)
|
|
r
|
= 0,185 mm (радиус на проводника, от който е направен пръстенът)
|
|
Отчетена стойност в резултат от изпитването (mN/m)
|
Коригирана стойност (mN/m)
|
|
Калибриране с тежести (вж. 1.6.4.2.2, буква a)
|
Калибриране с вода (вж. 1.6.4.2, буква б)
|
|
20
|
16,9
|
18,1
|
|
22
|
18,7
|
20,1
|
|
24
|
20,6
|
22,1
|
|
26
|
22,4
|
24,1
|
|
28
|
24,3
|
26,1
|
|
30
|
26,2
|
28,1
|
|
32
|
28,1
|
30,1
|
|
34
|
29,9
|
32,1
|
|
36
|
31,8
|
34,1
|
|
38
|
33,7
|
36,1
|
|
40
|
35,6
|
38,2
|
|
42
|
37,6
|
40,3
|
|
44
|
39,5
|
42,3
|
|
46
|
41,4
|
44,4
|
|
48
|
43,4
|
46,5
|
|
50
|
45,3
|
48,6
|
|
52
|
47,3
|
50,7
|
|
54
|
49,3
|
52,8
|
|
56
|
51,2
|
54,9
|
|
58
|
53,2
|
57,0
|
|
60
|
55,2
|
59,1
|
|
62
|
57,2
|
61,3
|
|
64
|
59,2
|
63,4
|
|
66
|
61,2
|
65,5
|
|
68
|
63,2
|
67,7
|
|
70
|
65,2
|
69,9
|
|
72
|
67,2
|
72,0
|
|
74
|
69,2
|
—
|
|
76
|
71,2
|
—
|
|
78
|
73,2
|
—
|
Тази таблица е съставена въз основа на данни от корекциите на Харкинс и Джордан. Тя е подобна на таблицата в стандарта DIN 53914 за вода и водни разтвори (плътност ρ = 1 g/cm3 и се отнася за пръстен с размери R = 9,55 mm (среден радиус на пръстена) и r = 0,185 mm (радиус на проводника на пръстена). Таблицата предоставя коригираните стойности на повърхностното напрежение за изпитвания, проведени след калибриране с тежести или след калибриране с вода.
Без предварително калибриране повърхностното напрежение може да се изчисли по следната формула:
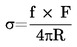
където:
|
F
|
=
|
силата, измерена с динамометър, в точката на прекъсване на филма
|
|
R
|
=
|
радиуса на пръстена
|
|
f
|
=
|
корекционния коефициент (1).
|
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. ПРОТОКОЛ С РЕЗУЛТАТИТЕ ОТ ИЗПИТВАНЕТО
По възможност протоколът с резултатите от изпитването трябва да включва следната информация:
|
—
|
тип на използвания разтвор,
|
|
—
|
точно определение на веществото (вид и примеси),
|
|
—
|
резултати от изпитванията: повърхностно напрежение (отчетено) — включват се показанията при отделните измервания и тяхната средноаритметична стойност, както и коригираната средна стойност (в която са взети под внимание типът на оборудването и корекционната таблица),
|
|
—
|
концентрация на разтвора,
|
|
—
|
температура на изпитването,
|
|
—
|
време на престояване на разтвора; по-точно времето между приготвянето и измерването на разтвора,
|
|
—
|
описание на зависимостта на повърхностното напрежение от времето след прехвърлянето на разтвора в измервателния съд,
|
|
—
|
трябва да се докладват цялата информация и бележките върху интерпретацията на резултатите, особено онези, които са свързани с примесите и физичното състояние на веществата.
|
3.2. АНАЛИЗИРАНЕ НА РЕЗУЛТАТИТЕ
Като се има предвид, че повърхностното напрежение на водата е 72,75 mN/m при 20 oС, веществата с повърхностно напрежение, по-ниско от 60 mN/m, определено при условията на този метод, трябва да се разглеждат като повърхностноактивни вещества.
4. ПРЕПРАТКИ
|
(1)
|
ОИСР, Paris, 1981, Test Guideline 115, решение на Съвета C(81) 30 окончателен.
|
|
(2)
|
R. Weissberger ed.; Technique of Organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed., Interscience Publ., New York, 1959, Vol. I, Part I, Chapter XIV.
|
|
(3)
|
Pure Appl. Chem., 1976, vol. 48, 511.
|
|
(4)
|
Harkins, W. D., Jordan, H. F., J. Amer. Chem. Soc, 1930, vol. 52, 1751.
|
A.6. РАЗТВОРИМОСТ ВЪВ ВОДА
1. МЕТОД
Описаният метод се основава на Ръководството за провеждане на изпитвания на ОИСР (1).
1.1. ВЪВЕДЕНИЕ
За провеждането на това изпитване е полезно да има предварителна информация за структурната формула, парното налягане, дисоциационната константа и хидролизата (като функция от рН) на веществото.
Не съществува универсален метод, с който да се покрие целият обхват от разтворимости във вода.
Двата метода за изпитване, описани по-долу, покриват цялата област от разтворимости, но не могат да се използват за летливи вещества:
|
—
|
единият метод, който се прилага към почти чисти вещества с ниски разтворимости (< 10-2 грама на литър), стабилни във вода, се нарича „метод на елуиране от колона“,
|
|
—
|
другият метод, който се прилага към почти чисти вещества с по-високи разтворимости (> 10-2 грама на литър), стабилни във вода, се нарича „метод на стъкленицата“.
|
Разтворимостта на изпитваното вещество може значително да се повлияе от присъствието на примеси.
1.2. ОПРЕДЕЛЕНИЕ И МЕРНИ ЕДИНИЦИ
Разтворимостта във вода на едно вещество се определя като масовата концентрация на наситения разтвор на веществото във вода при дадена температура. Разтворимостта във вода се дава в единици маса за обем разтвор. Мерната единица в системата SI е kg/m3 (може също да се използва и грам на литър).
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Не е необходимо да се използват вещества за сравнение във всички случаи, когато се изпитва ново вещество. Преди всичко те трябва да служат за периодична проверка на действието на метода и да позволяват сравнение с резултатите, получени по други методи.
1.4. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Приблизителното количество на пробата и времето, необходимо за достигане на масовата концентрация на насищане, трябва да се определят с просто предварително изпитване.
1.4.1. Метод на елуиране от колона
Този метод се основава на елуиране на изпитваното вещество с вода от микроколона, запълнена с инертен носител, например стъклени перли или пясък, покрит с излишък от изпитваното вещество. Разтворимостта във вода се определя, когато масовата концентрация на елуата стане постоянна. Това се изразява като плато в кривата на зависимостта на концентрацията от времето.
1.4.2. Метод на стъкленицата
При този метод веществото (твърдите вещества трябва да се привеждат в прахообразно състояние) се разтваря във вода при температура, малко по-висока от температурата на изпитването. Когато се достигне насищането, сместа се охлажда и се държи при температурата на изпитването, като се разбърква колкото е необходимо до достигане на равновесие. Също така изпитването може да се проведе и направо при желаната температура, ако с помощта на подходящи проби се докаже, че е достигнато равновесие. След това с подходящ аналитичен метод се определя масовата концентрация на веществото във водния разтвор, който не бива да съдържа неразтворени частици.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
1.5.1. Повторяемост
При метода на елуиране от колона е възможно да се получат разлики < 30 %; за метода на стъкленицата трябва да се наблюдават разлики < 15 %.
1.5.2. Чувствителност
Тя зависи от аналитичния метод, но трябва да могат да се определят масови концентрации до 10-6 грама на литър.
1.6. ОПИСАНИЕ НА МЕТОДА
1.6.1. Условия на изпитването
За предпочитане е изпитването да се провежда при 20 ±0,5oС. Ако температурната зависимост на разтворимостта е > 3 % на oС, изпитването трябва да се направи при още две температури, които да са поне с 10 oС над и под първоначално подбраната температура. В този случай точността, с която се поддържа температурата, трябва да бъде ±0,1oС. Избраната температура трябва да се поддържа постоянна във всички свързани части на оборудването.
1.6.2. Предварително изпитване
Към приблизително 0,1 g от пробата (твърдите вещества трябва да са в прахообразно състояние), поставена в градуиран цилиндър от 10 ml със стъклена запушалка, при стайна температура се прибавят нарастващи обеми дестилирана вода, както е показано в таблицата:
|
0,1 g разтворими в „x“ ml вода
|
0,1
|
0,5
|
1
|
2
|
10
|
100
|
> 100
|
|
Приблизителна разтворимост (грама на литър)
|
> 1 000
|
от 1 000 до 200
|
от 200 до 100
|
от 100 до 50
|
от 50 до 10
|
от 10 до 1
|
< 1
|
След всяко прибавяне на посоченото количество вода сместа се разклаща силно в продължение на 10 минути и визуално се проверява за наличието на неразтворени частици. Ако след прибавянето на 10 ml вода пробата или частици от нея останат неразтворени, опитът трябва да се повтори в мерителен цилиндър от 100 ml c по-големи обеми вода. При по-ниски разтворимости времето, необходимо за разтваряне на веществото, трябва да е значително по-дълго (трябва да се предвидят поне 24 часа). Приблизителната разтворимост се дава в таблицата под онзи обем добавена вода, при който настъпва пълното разтваряне на пробата. Ако веществото все още очевидно не е разтворено, трябва да се предвидят повече от 24 часа (максимум 96 часа) или да се предприеме ново разреждане, за да се разбере кой от двата метода — методът на елуиране от колона или методът на стъкленицата — трябва да се приложи.
1.6.3. Метод на елуиране от колона
1.6.3.1. Носител, разтворител и елуиращ агент
При метода на елуиране от колона носителят трябва да бъде инертен. Материалите, които могат да се използват като носители, са стъклени перли или пясък. За да може изпитваното вещество да се отложи върху носещия материал, се използва подходящ летлив разтворител с аналитична степен на чистота. Като елуиращ агент се използва вода, бидестилирана в стъклен или кварцов апарат.
Забележка:
Не бива да се ползва вода, взета направо от органичен йонообменник.
1.6.3.2. Натоварване на веществото върху носителя
Приблизително 600 mg от носещия материал се претеглят и прехвърлят в облодънна колба от 50 ml.
Подходящо количество от изпитваното вещество се претегля и разтваря в избрания разтворител. Част от този разтвор се прибавя към носещия материал. Разтворителят трябва да се изпари напълно, например с ротационен изпарител. В противен случай, поради ефектите на разпределение на повърхността на носителя, колоната няма да може да се насити с вода.
Натоварването на носещия материал може да създаде проблеми (неверни резултати), ако изпитваното вещество се отлага под формата на масло или в различно кристално състояние. Проблемът трябва да се разгледа експериментално и подробностите да се опишат в протокола.
Натовареният с веществото носител се оставя да се просмуче за около два часа в около 5 ml вода, след което суспензията се поставя в микроколоната. Също така е възможно сухият носител, натоварен с веществото, да се насипе в предварително запълнената с вода микроколона и да се изчака около два часа, докато се достигне равновесие.
Процедура на изпитване:
Елуирането на веществото от носещия материал може да се извърши по един от следните два начина:
|
—
|
рециркулационна помпа (вж. фигура 1),
|
|
—
|
нивелиращ съд (вж. фигура 4).
|
1.6.3.3. Метод на елуиране от колона с рециркулационна помпа
Апаратура
На фигура 1 е показано схематично подреждането на апаратите в една типична за целта система. На фигура 2 е показана подходяща микроколона; колоната може да има произволни размери, стига те да покриват изискванията за възпроизводимост и чувствителност на метода. В колоната трябва да е предвидено входно разширение, което може да поема поне пет пъти по-голям обем вода от обема на колоната и в което да могат да се поставят най-малко пет проби. От друга страна, размерът може да е и по-малък, в случай че се използва разтворител, който да замести първоначалните пет обема, предназначени за отстраняване на примесите.
Колоната трябва да се свърже с рециркулационна помпа, с която може да се контролира подаването на потоци от приблизително 25 ml/h. Помпата се свързва чрез съединения, направени от политетрафлуороетилен (P.T.F.E.) и/или стъкло. При събирането на колоната и помпата трябва да се предвидят приспособления за отбиране на проби от изходния поток и за изравняване на налягането във входното пространство с атмосферното. Пълнителят в колоната лежи върху малка тапа (5 mm) от стъклена вата, която служи и за филтруване на твърдите частици. Рециркулационната помпа може да бъде например перисталтична или мембранна помпа (трябва да се вземат мерки помпата да не се замърсява и/или да не абсорбира веществото от тръбата).
Процедура на изпитване
Потокът през колоната се стартира. Препоръчително е да се работи при скорост на потока приблизително 25 ml/h (за описаната тук колона това съответства на 10 обема на колоната за час). Първите пет обема (минимум) се изхвърлят, за да се отстранят разтворимите във вода примеси. След това рециркулационната помпа се пуска да работи, докато се установи равновесие. Настъпването на равновесието се определя по пет последователни проби, чиито концентрации, взети в произволен ред, не се различават една от друга с повече от ± 30 %. Тези проби трябва да се отбират на интервали от време, не по-малки от времето, необходимо за преминаването на 10 колонни обема от елуиращия агент.
1.6.3.4. Метод на елуиране от колона с нивелиращ съд
Апаратура (вж. фигури 4 и 3)
Нивелиращ съд: свързването към нивелиращия съд се прави, като се използва шарнир от шлифовано стъкло, който е свързан чрез тръбички от политетрафлуороетилен (P.T.F.E.). Препоръчително е да се работи при приблизителна скорост на потока от 25 ml/h. Последователни фракции от елуата се събират и анализират по избрания метод.
Процедура на изпитване
Разтворимостта във вода се определя по онези фракции от елуата, чиито концентрации са постоянни (± 30 %) при най-малко пет последователни пробоотбора.
И в двата случая (при използването на рециркулационна помпа и на нивелиращ съд), трябва да се направи второ измерване при скорост на потока, два пъти по-малка от първата. Ако резултатите от двата опита са съвместими, изпитването се счита за успешно; ако при по-малка скорост на потока се получи по-висока стойност за разтворимостта, скоростта на потока отново се намалява наполовина и това продължава, докато при две последователни изпитвания се получи една и съща разтворимост.
И в двата случая (при използването на рециркулационна помпа и на нивелиращ съд) отбраните фракции трябва да се проверяват за наличието на колоидни частици чрез изпитване за Тиндалов ефект (разсейване на светлината). Наличието на такива частици прави резултатите невалидни и изпитването трябва да се повтори, след като се подобри филтруването от колоната.
Трябва да се записва рН на всяка проба. При същата температура трябва да се направи още едно изпитване.
1.6.4. Метод на стъкленицата
1.6.4.1. Апаратура
За метода на стъкленицата са необходими следните материали:
|
—
|
обичайните лабораторни прибори и стъклария,
|
|
—
|
приспособление, в което разтворите могат да се разбъркват при контролирани постоянни температури,
|
|
—
|
центрофуга (за предпочитане термостатирана), и
|
|
—
|
оборудване за аналитични изпитвания.
|
1.6.4.2. Процедура на изпитване
Количеството вещество, необходимо да насити желания обем вода, се изчислява при предварителните изпитвания. Необходимият обем вода зависи от аналитичния метод и от областта, в която се намира разтворимостта. Около пет пъти по-големи количества материал от определените по-горе се претеглят и се поставят в три стъклени съда, снабдени със стъклени запушалки (например центрофужни епруветки или колби). След това съдовете се затварят и съдържанието им се размесва при 30 oС (трябва да се използват клатачни машини или бъркалки, които могат да работят при постоянна температура, например магнитна бъркалка в термостатирана водна баня). След един ден един от съдовете се взима и чрез периодично разклащане се темперира отново за 24 часа, но при температурата на изпитването. След това съдържанието на съда се центрофугира също при температурата на изпитването и концентрацията на изпитваното вещество в бистрата водна фаза се определя с подходящ аналитичен метод. Другите две стъкленици се обработват по същия начин след първоначално темпериране при 30 oС, продължаващо съответно два и три дни. Ако резултатите за концентрацията при поне два от съдовете съвпадат с исканата точност, изпитването се счита за сполучливо. Ако резултатите от съдове 1, 2 и 3 показват тенденция към нарастване на получените стойности за разтворимостта, цялото изпитване трябва да се повтори при по-продължителни времена за темпериране.
Измервателната процедура може да се провежда също и без предварителна инкубация при 30 oС. За да се определи скоростта, с която се установява равновесието на насищане, се вземат проби, докато времето на разбъркване спре да влияе върху концентрацията на изпитвания разтвор.
Трябва да се записва рН на всяка проба.
1.6.5. Анализ
За тези определения се предпочита специфичен за дадено вещество аналитичен метод, тъй като малки количества от разтворените примеси могат да доведат до големи грешки в измерената величина на разтворимостта. Примери за такива методи са газова или течна хроматография, титрувални методи, фотометрични методи, волтаметрични методи.
2. ДАННИ
2.1. МЕТОД НА ЕЛУИРАНЕ ОТ КОЛОНА
При всяко изпитване трябва да се изчислява средната стойност на най-малко пет последователни проби, взети в платото на насищане, както и стандартното отклонение. Резултатите трябва да се дават в единици маса за обем разтвор.
Сравняват се средните стойности, получени при две изпитвания с различни скорости на потока. Те трябва да се различават с по-малко от 30 %.
2.2. МЕТОД НА СТЪКЛЕНИЦАТА
Дават се индивидуалните резултати за всяка от трите стъкленици. Онези резултати, които се считат за еднакви (с разлика по-малка от 15 %), се осредняват и получената средна стойност се дава в единици маса за обем разтвор. Когато разтворимостта е много голяма (> 100 g/l), се налага превръщането на единиците за маса в единици за обем, като се използва плътността.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. МЕТОД НА ЕЛУИРАНЕ ОТ КОЛОНА
Протоколът с резултатите от изпитването трябва по възможност да включва следната информация:
|
—
|
резултатите от предварителното изпитване,
|
|
—
|
точното определение на веществото (вид и примеси),
|
|
—
|
индивидуалните концентрации, скорости на потока и рН за всяка проба,
|
|
—
|
средните стойности и стандартните отклонения на най-малко пет проби от платото на насищане при всеки опит,
|
|
—
|
средната стойност на два последователни успешни опита,
|
|
—
|
температурата на водата по време на насищането,
|
|
—
|
използваният метод за анализ,
|
|
—
|
природата на носещия материал,
|
|
—
|
натоварването на носещия материал,
|
|
—
|
използваният разтворител,
|
|
—
|
данните за химичната неустойчивост на веществото в процеса на изпитването и използвания метод,
|
|
—
|
всяка информация относно интерпретиране на резултатите, особено онази, която се отнася до примесите и физичното състояние на веществото.
|
3.2. МЕТОД НА СТЪКЛЕНИЦАТА
Протоколът с резултатите от изпитването трябва по възможност да включва следната информация:
|
—
|
резултатите от предварителното изпитване,
|
|
—
|
точното определение на веществото (вид и примеси),
|
|
—
|
индивидуалните резултати от аналитичните определения, както и средната стойност в случаите, когато за всяка колба е определена повече от една стойност,
|
|
—
|
средната стойност за различните колби, които са дали близки резултати,
|
|
—
|
температурата на изпитването,
|
|
—
|
данните за химичната неустойчивост на веществото в процеса на изпитването и използвания метод,
|
|
—
|
всяка информация относно интерпретирането на резултатите, особено онази, която се отнася до примесите и физичното състояние на веществото.
|
4. ПРЕПРАТКИ
|
(1)
|
ОИСР, Paris, 1981, Test Guideline 105, решение на Съвета C(81) 30 окончателен.
|
|
(2)
|
NF T 20-045 (AFNOR) (Sept. 85). Chemical products for industrial use — Determination of water solubility of solids and liquids with low solubility — Column elution method.
|
|
(3)
|
NF T 20-046 (AFNOR) (Sept. 85). Chemical products for industrial use — Determination of water solubility of solids and liquids with high solubility — Flask method.
|
Допълнение
Фигура 1
Метод на елуиране от колона с рециркулационна помпа
Фигура 2
Типична микроколона
(всички размери са в милиметри)

Фигура 3
Типична микроколона
(всички размери са в милиметри)

Фигура 4
Метод на елуиране от колона с нивелиращ съд
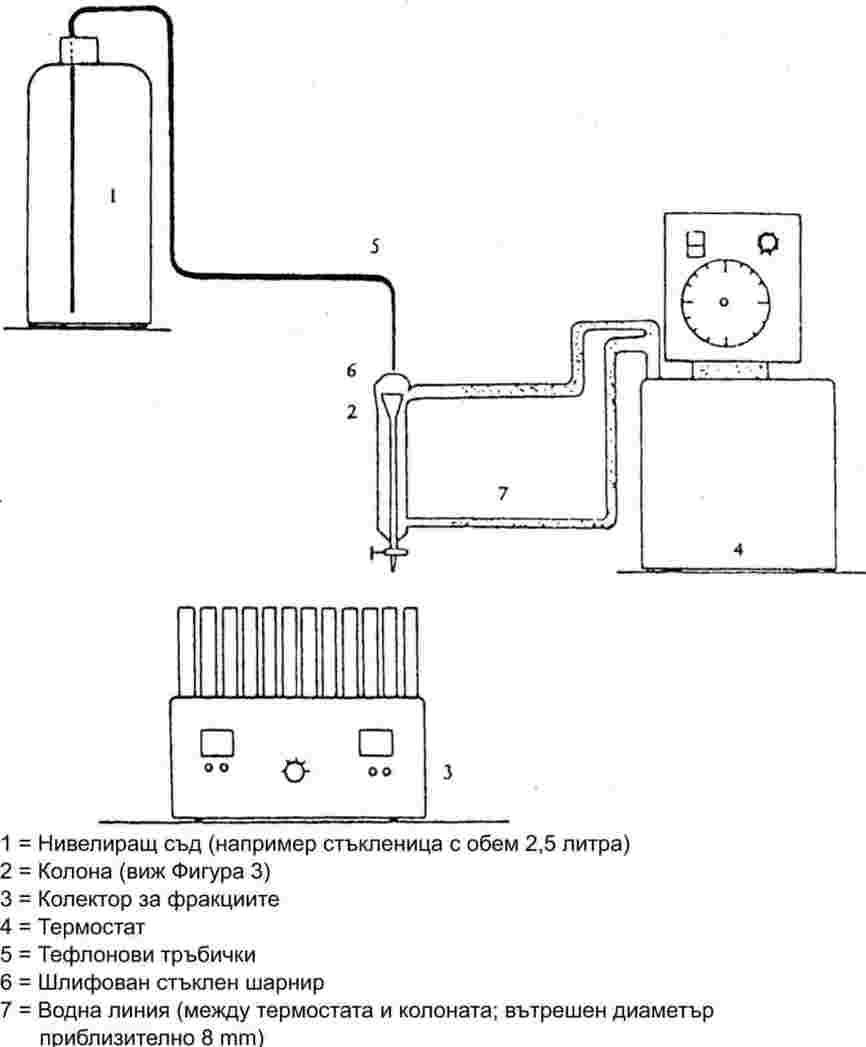
А.8. КОЕФИЦИЕНТ НА РАЗПРЕДЕЛЕНИЕ
1. МЕТОД
Методът на „разклащането в стъкленица“ се основава на Ръководството за провеждане на изпитвания на ОИСР (1).
1.1. ВЪВЕДЕНИЕ
За провеждането на това изпитване е полезно да има предварителна информация за структурната формула, дисоциационната константа, разтворимостта във вода, хидролизата, разтворимостта в n-октанол и повърхностното напрежение на веществото.
Изпитванията върху вещества, които могат да се йонизират, трябва да се провеждат в нейонната им форма (свободна киселина или свободна база). Тя се получава с помощта на подходящ буфер с рН, най-малко една единица по-ниско (свободна киселина) или по-високо (свободна база) от рК на веществото.
Този изпитвателен метод обхваща две отделни процедури: метод на разклащането в стъкленица и високочувствителна течна хроматография (HPLC). Първият метод се прилага, когато стойността на log Pow (вижте по-долу при определенията) попада в областта от — 2 до 4, а вторият — в областта от 0 до 6. Преди да се проведе някоя от двете експериментални процедури, трябва да се направи предварителна оценка на коефициента на разпределение.
Методът на разклащането в стъкленица се прилага само за абсолютно чисти вещества, разтворими във вода и n-октанол. Той не може да се използва за повърхностноактивни вещества (за които трябва да се предостави изчислена стойност или приблизителна оценка, основана на разтворимостите им в n-октанол и във вода, получени поотделно).
Методът на HPLC не може да се прилага за силни киселини и основи, метални комплекси, повърхностноактивни материали или вещества, които реагират с елуиращия агент. За такива вещества трябва да се предостави изчислена стойност или приблизителна оценка, основана на разтворимостите им в n-октанол и във вода, получени поотделно.
Методът на HPLC е по-малко чувствителен към присъствието на примеси в изпитваното вещество, отколкото методът на разклащането в стъкленица. Независимо от това и при този метод в някои случаи присъствието на примеси може да доведе до трудно интерпретиране на резултатите, защото определянето на пиковете става несигурно. За смеси, които дават недобро разделяне на пиковете, трябва да се посочват горната и долната граница на log P.
1.2. ОПРЕДЕЛЕНИЯ И МЕРНИ ЕДИНИЦИ
Коефициентът на разпределение (Р) се дефинира като съотношението между равновесните концентрации (сi) на разтвореното вещество в двуфазна система, която се състои от два практически несмесващи се разтворителя, в случая n-октанол и вода:

Следователно коефициентът на разпределение (Р) представлява съотношение между две концентрации и обикновено се дава във формата на логаритъм при основа 10 (log P).
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Метод на разклащането в стъкленица
Когато се изпитва ново вещество, не във всички случаи е необходимо да се използват вещества за сравнение. Преди всичко те трябва да служат за периодична проверка на действието на метода и да позволяват сравнение с резултатите, получени по други методи.
HPLC метод
За да се установи съотношението, в което се намират данните за дадено вещество, получени по метода на HPLC, и неговата Р стойност, трябва да се начертае калибрационна графика на log Р спрямо хроматографските данни. За целта се използват най-малко 6 точки, получени от сравнителни вещества. Подборът на подходящи сравнителни вещества остава на грижата на потребителя. Когато е възможно, поне едно съединение за сравнение трябва да има Pow, по-високо от това на изпитваното вещество, а друго съединение за сравнение да има Pow, по-ниско от това на изпитваното вещество. За стойности на log P по-малки от 4 калибрирането трябва да се основава на данни, получени по метода на разклащането в стъкленица. За стойности на log P по-големи от 4 калибрирането трябва да се базира на утвърдени литературни данни, ако те се съгласуват с изчислените стойности. По-висока точност може да се постигне, ако се изберат сравнителни вещества, подобни по структура на изпитваното вещество.
В литературните източници (2) и (3) могат да се намерят обширни списъци със стойностите на log Pow за много групи от химични вещества. Ако не могат да се открият данни за коефициентите на разпределение на вещества, които са подобни по структура на изпитваното, може да се направи по-общо калибриране, като се използват други съединения за сравнение.
В допълнение 2 е даден списък от вещества, които се препоръчват като сравнителни, а също и техните Pow стойности.
1.4. ПРИНЦИП НА МЕТОДА
1.4.1. Метод на разклащането в стъкленица
За да се намери коефициентът на разпределение, трябва да се достигне равновесие между всички взаимодействащи компоненти на системата и да се определят концентрациите на разтвореното вещество в двете фази. Изучаването на литературата по този въпрос показва, че за решаването на проблема — тоест смесването на двете фази и последващото им разделяне с цел определяне на равновесната концентрация на изпитваното вещество — могат да се използват няколко различни техники.
1.4.2. Метод на HPLC
Изпитването с HPLC ce провежда в аналитични колонки с търговски пълнител, състоящ се от дълги въглеводородни вериги (например С8, C18), химически свързани към силициев диоксид. Химичните вещества, инжектирани в такава колонка, се придвижват по дължината ѝ с различна скорост поради различната степен на разпределение между подвижната фаза и неподвижната въглеводородна фаза. Смесите от химични вещества се елуират по реда на тяхната хидрофобност, като разтворимите във вода вещества се елуират първи, а разтворимите в мазнини вещества се елуират последни в съответствие с техните коефициенти на разпределение между въглеводородната и водната фаза. Това позволява да се установи връзка между времето на задържане в такава колонка (с обърната фаза) и коефициента на разпределение n-октанол/вода. Коефициентът на разпределение се извежда от коефициента на пропускане „k“, който се дава с израза:

където tr = времето на задържане на изпитваното вещество в колоната, a t0 = средното време, необходимо на една молекула от разтворителя да премине през колоната (мъртво време).
Не е необходимо да се прилагат количествени аналитични методи. Нужно е само да се определят времената на елуиране.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
1.5.1. Повторяемост
Метод на разклащането в стъкленица
За да се постигне точно определяне на коефициента на разпределение, трябва да се направят по две изпитвания при три различни експериментални условия, които могат да се задават, като се променя количеството на изпитваното вещество, както и съотношенията между обемите на разтворителите. Определените стойности за коефициента на разпределение, изразени в десетични логаритми, трябва да попадат в областта ±0,3 логаритмични единици.
Метод на HPLC
За да се увеличи достоверността на резултатите, трябва да се правят по две изпитвания. Стойностите на log P, получени при отделните изпитвания, трябва да попадат в областта ±0,1 логаритмични единици.
1.5.2. Чувствителност
Метод на разклащането в стъкленица
Областта, в която може да се използва методът, се определя от ограниченията на аналитичната процедура. Тя трябва да позволява оценка на стойностите на log Pow в областта от – 2 до 4 (в някои случаи, като се подберат условията, тази област може да се разшири до log Pow = 5), като концентрациите на разтвореното вещество във всяка от двете фази не надвишават 0,01 мола на литър.
Метод на HPLC
Методът на HPLC позволява коефициентите на разпределение да се определят в областта на log Pow от 0 до 6.
Обикновено коефициентът на разпределение на едно вещество може да се прецени с точност до ± 1 логаритмична единица от стойността, получена по метода с разклащане на стъкленица. Типичните корелации могат да се намерят в литературните източници (4) (5) (6) (7) (8). По-висока точност се постига, когато корелационните графики се базират на подобни по структура съединения (9).
1.5.3. Специфичност
Метод на разклащането в стъкленица
Законът на Нернст за разпределението се отнася само за разредени разтвори при постоянна температура, налягане и рН. Той се прилага само за чисти вещества, разпределени между два чисти разтворителя. Резултатите могат да се повлияят, ако се окаже, че в едната или и в двете фази има няколко различни разтворени вещества.
Дисоциацията или асоциацията на разтворените молекули води до отклонения от Закона на Нернст за разпределението. Тези отклонения се откриват по това, че коефициентът на разпределение започва да зависи от концентрацията на разтвора.
Този метод не може да се прилага, без да се нанасят корекции за вещества, които могат да преминават в йонно състояние, поради многобройните равновесия, които се установяват в системата. За такива вещества вместо вода могат да се използват буферни разтвори; рН на буфера трябва да се различава от рКа на веществото с поне една рН единица и винаги трябва да се внимава дали това рН е приложимо за дадената среда.
1.6. ОПИСАНИЕ НА МЕТОДА
1.6.1. Предварителна оценка на коефициента на разпределение
За предпочитане е коефициентът на разпределение да се намери чрез изчислителни методи (вж. допълнение 1) или когато е възможно, от съотношението на разтворимостите на изпитваното вещество в чистите разтворители (10).
1.6.2. Метод на разклащането в стъкленица
1.6.2.1. Подготовка
n-октанол: определянето на коефициента на разпределение трябва да се извършва в реактив с висока аналитична степен на чистота.
Вода: трябва да се използва дестилирана или бидестилирана в стъклен или кварцов съд вода. Ако е оправдано, за вещества, които имат йонна форма, вместо вода се използват буферни разтвори.
Забележка:
Не бива да се използва вода, взета направо от йонообменник.
1.6.2.1.1. Предварително насищане на разтворителите
Преди определянето на коефициента на разпределение двете фази на системата от разтворители трябва взаимно да се наситят, като се разклащат при температурата на изпитването. За да се направи това, е добре в два големи лабораторни съда да се поставят съответно n-октанол с висока степен на чистота и вода, към всеки съд да се добави достатъчно количество от другия разтворител и съдовете да се разклащат в продължение на 24 часа на механична клатачка. След това те се оставят да престоят достатъчно дълго, така че фазите да се разделят и да се постигне състоянието на насищане.
1.6.2.1.2. Подготовка за изпитването
Целият обем на двуфазната система трябва да запълни почти изцяло измервателния съд. Това ще помогне да се избегне загубата на материал чрез изпарение. Съотношението на обемите на разтворителите и количеството вещество, които ще се използват при изпитването, се определят от следните фактори:
|
—
|
предварителната оценка на коефициента на разпределение (вж. по-горе),
|
|
—
|
минималното количество от изпитваното вещество, необходимо за провеждането на аналитичната процедура, и
|
|
—
|
ограничението за максималната концентрация във всяка от фазите, което е 0,01 мола на литър.
|
Извършват се три изпитвания. При първото се използва изчисленото обемно съотношение на n-октанола към водата; при второто това съотношение се разделя на две; при третото отношението се умножава по две (например 1:1, 1:2, 2:1).
1.6.2.1.3. Изпитвано вещество
Приготвя се сток-разтвор в n-октанола, наситен с вода. Концентрацията на този разтвор трябва да се определи с висока точност, преди той да се използва за определяне на коефициента на разпределение. Разтворът се съхранява при условия, осигуряващи стабилността му.
1.6.2.2. Условия на изпитването
Температурата на изпитването трябва да се поддържа постоянна (± 1 oС) и да бъде в интервала от 20 до 25 oС.
1.6.2.3. Процедура на изпитването
1.6.2.3.1. Установяване на равновесието на разпределение
За всяко изпитване при дадени условия трябва да се приготвят по два изпитвателни съда, съдържащи необходимото точно премерено количество от двата разтворителя, заедно с нужното количество сток-разтвор.
Фазите на n-октанола трябва да се премерят по обем. Измервателните съдове се поставят в подходяща клатачна машина или се разклащат на ръка. Ако се използва центрофужна епруветка, препоръчително е тя да се завърта бързо на 180o около напречната ѝ ос, така че задържаният въздух да преминава през двете фази. Опитът е показал, че 50 такива завъртания обикновено са достатъчни да се достигне равновесието на насищане. За по-голяма сигурност е добре да се направят 100 завъртания за пет минути.
1.6.2.3.2. Разделяне на фазите
Когато е необходимо, разделянето на фазите се постига, като сместа се центрофугира. Това се прави на лабораторна центрофуга, в която се поддържа стайна температура, или ако се използва центрофуга без температурен контрол, центрофужните епруветки трябва да се темперират при температурата на изпитването поне един час преди анализа.
1.6.2.4. Анализ
За да се определи коефициентът на разпределение, е необходимо да се измери концентрацията на изпитваното вещество във всяка от фазите. Това може да се направи, като се вземе аликвотна част от отделните фази във всяка епруветка при всяко измерване и тя се анализира с помощта на избраната процедура. Трябва да се изчисли общото количество вещество в двете фази и да се сравни с първоначално въведеното количество.
Пробата от водната фаза трябва да се вземе така, че рискът от замърсяване със следи от n-октанол да е минимален. За целта може да се използва стъклена спринцовка с подвижна игла. Първоначално спринцовката се запълва частично с въздух. Въздухът внимателно се изпуска, докато иглата преминава през слоя от n-октанол. Със спринцовката се поема необходимият обем от водната фаза. След това тя бързо се изважда от разтвора и иглата се отстранява. Тогава съдържанието на спринцовката може да се използва като проба от водната фаза. Концентрацията в двете разделени фази се определя за предпочитане по метод, специфичен за веществото. Примери за подходящи аналитични методи са следните:
|
—
|
високочувствителна течна хроматография.
|
1.6.3. Метод на HPLC
1.6.3.1. Подготовка
Апаратура
Необходим е течен хроматограф, снабден с помпа за равномерно подаване на течности и подходящо отчитащо устройство. Препоръчва се да се използва инжекционен клапан с инжекционни скоби. Присъствието на полярни групи в неподвижната фаза може значително да влоши действието на HPLC-колоната. Затова неподвижната фаза трябва да има минимален процент от полярни групи (11). Могат да се използват търговските пълнители от микрочастици за обърнати фази или готови напълнени колони. Между инжекционната система и аналитичната колона може да се постави предпазна колона.
Подвижна фаза
Като елуиращи разтворители (които се дегазират преди употреба) се използват метанол и вода със степени на чистота за колонна хроматография. Прилага се изократно елуиране. Съотношенията метанол/вода трябва да предвиждат минималното съдържание на вода да бъде 25 %. Обикновено сместа метанол-вода 3:1 (v/v) е подходяща за елуиране на съединения с log P = 6 в рамките на един час при скорост на потока = 1 ml/min. За вещества с по-високи стойности на log P може да се наложи намаляване на времето за елуиране (също и на сравнителните вещества), като се намали полярността на подвижната фаза или дължината на колоната.
Веществата с много ниска разтворимост в n-октанол често дават необичайно ниски стойности на log Pow по метода на HPLC; пиковете на тези вещества понякога се появяват с фронта на разтворителя. Това вероятно се дължи на факта, че процесът на разпределение е твърде бавен, за да се достигне равновесие за времето, което обикновено се предвижда за разделянето чрез HPLC. Възможно е, като се намали скоростта на потока и/или съотношението метанол/вода, да се достигне до получаването на достоверна величина.
Както изпитваните, така и сравнителните вещества трябва да са разтворими в подвижната фаза в концентрации, достатъчни да позволят изпитването им. Използването на добавки към сместа от метанол и вода се разрешава само в изключителни случаи, тъй като те променят свойствата на колоната. За получаването на хроматограми с добавки задължително се използва отделна колона от същия тип. Ако сместа метанол-вода не е подходяща, може да се използва смес от друг органичен разтворител и вода, например етанол-вода или ацетонитрил-вода.
Стойността на рН на елуиращия агент е важна за съединенията, които могат да преминават в йонна форма. Тя трябва да бъде в работната рН-област на колоната, която обикновено е между 2 и 8. Препоръчва се използването на буфери. Трябва да се внимава да се избегне утаяването на соли и замърсяването на колоната, което може да се получи при някои смеси органичен разтворител/буферен разтвор. Измерванията с HPLC с неподвижна фаза на базата на силициев диоксид при рН над 8 не се препоръчват, тъй като употребата на алкална подвижна фаза може да доведе до бързо влошаване на качествата на колоната.
Разтворени вещества
Сравнителните вещества трябва да бъдат с възможно най-голяма степен на чистота. Ако е възможно, веществата, които ще се изпитват, и тези, които ще се използват за калибриране, се разтварят в подвижната фаза.
Условия на измерването
Температурата по време на измерването не бива да се променя с повече от ± 2 K.
1.6.3.2. Измерване
Изчисляване на мъртвото време t0
Мъртвото време t0 може да определи, като се използва или хомоложна серия (например n-алкилметил кетони), или органични съединения, които не се задържат (например тиоуреа или формамид). С помощта на хомоложна серия, мъртвото време t0 ce изчислява, като поредица от най-малко седем члена на хомоложния ред се инжектира в колоната и се определят съответните времена на задържане. Времената на задържане tr(nc+1) ce нанасят на графика като функция на tr(nc), a отрязъкът „а“ и наклонът „b“ ce определят по регресионното уравнение:
tr(nc + 1) = a + b tr(nc)
където nс = броя въглеродни атоми. Тогава мъртвото време се дава с:
to = a/(1 - b)
Калибрационна графика
Следващата стъпка е да се построят корелационни криви на log k към log p за подходящи сравнителни вещества. На практика серия от 5 до 10 сравнителни вещества, чийто log p е близо до очакваната област, се инжектират едновременно и времената им на задържане се определят за предпочитане на записващ интегратор, свързан към измерителната системата. Съответните логаритми от коефициента на пропускане, log k, се изчисляват и нанасят като функция от log p, определен по метода на разклащането в стъкленица. Калибрирането се прави през равномерни интервали поне веднъж дневно, така че да се отчитат възможните изменения в работата на колоната.
Определяне на коефициента на пропускане на изпитваното вещество
Изпитваното вещество се инжектира в колоната с колкото е възможно по-малко количество от подвижната фаза. Определя се времето на задържане (два пъти), което позволява да се изчисли коефициентът на пропускане „k“. Коефициентът на разпределение на изпитваното вещество може да се получи от корелационната графика на сравнителните вещества. За много ниски или много високи коефициенти на разпределение се налага да се извърши екстраполация. В тези случаи трябва да се внимава за границите на достоверност на регресионната права.
2. ДАННИ
Метод на разклащането в стъкленица
Надеждността на определените стойности на Р може да се провери, като се сравнят средните стойности от двукратните определения и средната стойност, получена от целия опит.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
Протоколът с резултатите трябва по възможност да включва следната информация:
|
—
|
точното описание на веществото (вид и примеси),
|
|
—
|
когато гореспоменатите методи не могат да се приложат (например при повърхностноактивни вещества), трябва да се представи стойност, изчислена посредством разтворимостите в n-октанол и във вода, намерени поотделно,
|
|
—
|
цялата информация и бележките относно интерпретирането на резултатите, особено онези, свързани с примесите и физичното състояние на веществото.
|
За метода на разклащането в стъкленица:
|
—
|
резултатите от предварителните изпитвания, ако има такива,
|
|
—
|
температурата на изпитването,
|
|
—
|
данните за аналитичната процедура, с която са определяни концентрациите,
|
|
—
|
времето и скоростта на центрофугиране, ако е провеждано такова,
|
|
—
|
намерените концентрации в двете фази при всяко измерване (това означава, че се представят общо 12 концентрации),
|
|
—
|
теглото на изпитваното вещество, обемът на отделните фази във всеки от измервателните съдове и изчисленото общо количество изпитвано вещество, което присъства във фазите след достигането на равновесие,
|
|
—
|
изчислените стойности на коефициента на разпределение (Р) и тяхната средна стойност за отделните изпитвания, проведени при дадени условия, както и средната стойност за всички опити. Ако има предположение, че коефициентът на разпределение зависи от концентрацията, това също трябва да се отбележи в протокола,
|
|
—
|
съобщава се стандартното отклонение на индивидуалните Р стойности от средната стойност,
|
|
—
|
средната стойност на Р от всички изпитвания трябва да се изрази и като десетичен логаритъм,
|
|
—
|
изчисленото теоретично Pow, когато тази величина е била определена или когато измерената стойност е > 104,
|
|
—
|
рН на използваната вода, както и това на водната фаза по време на изпитването,
|
|
—
|
ако са използвани буфери, трябва да се даде обосновка защо вместо вода е използван буфер, неговият състав, концентрацията и рН, рН на водната фаза преди и след изпитването.
|
За метода на HPLC:
|
—
|
резултатите от предварителните изпитвания, ако има такива,
|
|
—
|
изпитваните и сравнителните вещества и тяхната степен на чистота,
|
|
—
|
температурната област на изпитванията,
|
|
—
|
рН, при което са правени изпитванията,
|
|
—
|
детайлно описание на аналитичната и предпазната колона, подвижната фаза и средствата, с които са провеждани изпитванията,
|
|
—
|
данните за времето на задържане и литературни стойности на log P на сравнителните вещества, използвани за калибриране,
|
|
—
|
данните за направената регресионна права (log k към log P),
|
|
—
|
данните за средното време на задържане и за интерполираната log P стойност на изпитваното съединение,
|
|
—
|
описанието на оборудването и условията на работа,
|
|
—
|
профилите на елуирането,
|
|
—
|
количествата на изпитваното и на сравнителните вещества, въведени в колоната,
|
|
—
|
мъртвото време и как е измерено.
|
4. ПРЕПРАТКИ
|
(1)
|
ОИСР, Paris, 1981, Test Guideline 107, решение на Съвета C(18) 30 окончателен.
|
|
(2)
|
C. Hansch and A. J. Leo, Substituent Constants for Correlation Analysis in Chemistry and Biology, John Wiley, New York, 1979.
|
|
(3)
|
Log P and Parameter Database, A tool for the quantitative prediction of bioactivity (C. Hansch, chairman, A. J. Leo, dir.) — Available from Pomona College Medical Chemistry Project, 1982, Pomona College, Claremont, California 91711.
|
|
(4)
|
L. Renberg, G. Sundstroem and K. Sundh-Nygaerd, Chemosphere, 1980, vol. 80, 683.
|
|
(5)
|
H. Ellgehausen, C. D'Hondt and R. Fuerer, Pestic. Sci., 1981, vol. 12, 219.
|
|
(6)
|
B. McDuffie, Chemosphere, 1981, vol. 10, 73.
|
|
(7)
|
W. E. Hammers et al., J. Chromatogr., 1982, vol. 247, 1.
|
|
(8)
|
J. E. Haky and A. M. Young, J. Liq. Chromat., 1984, vol. 7, 675.
|
|
(9)
|
S. Fujisava and E. Masuhara, J. Biomed. Mat. Res., 1981, vol. 15, 787.
|
|
(10)
|
O. Jubermann, Verteilen und Extrahieren, in Methoden der Organischen Chemie (Houben Weyl), Allgemeine Laboratoriumpraxis (edited by E. Muller), Georg Thieme Verlag, Stuttgart, 1958, Band I/1, 223-339.
|
|
(11)
|
R.F. Rekker and H. M. de Kort, Euro. J. Med. Chem., 1979, vol. 14, 479.
|
|
(12)
|
A. Leo, C. Hansch and D. Elkins, Partition coefficients and their uses. Chem. Rev., 1971, vol. 71, 525.
|
|
(13)
|
R. F. Rekker, The Hydrophobic Fragmental Constant, Elsevier, Amsterdam, 1977.
|
|
(14)
|
NF T 20-043 AFNOR, 1985. Chemical products for industrial use — Determination of partition coefficient — Flask shaking method.
|
|
(15)
|
C. V. Eadsforth and P. Moser, Chemosphere, 1983, vol. 12, 1 459.
|
|
(16)
|
A. Leo, C. Hansch and D. Elkins, Chem. Rev., 1971, vol. 71, 525.
|
|
(17)
|
C. Hansch, A. Leo, S. H. Unger, K. H. Kim, D. Nikaitani and E. J. Lien, J. Med. Chem., 1973, vol. 16, 1 207.
|
|
(18)
|
W. B. Neely, D. R. Branson and G. E. Blau, Environ. Sci. Technol., 1974, vol. 8, 1 113.
|
|
(19)
|
D. S. Brown and E. W. Flagg, J. Environ. Qual., 1981, vol. 10, 382.
|
|
(20)
|
J. K. Seydel and K. J. Schaper, Chemische Struktur und biologische Activitaetvon Wirkstoffen, Verlag Chemie, Weinheim, New York, 1979.
|
|
(21)
|
R. Franke, Theoretical Drug Design Methods, Elsevier, Amsterdam, 1984.
|
|
(22)
|
Y. C. Martin, Quantitative Drug Design, Marcel Dekker, New York, Basel, 1978.
|
|
(23)
|
N. S. Nirrlees, S. J. Noulton, C. T. Murphy, P. J. Taylor, J. Мed. Chem., 1976, vol. 19, 615.
|
Допълнение 1
МЕТОДИ ЗА ИЗЧИСЛЯВАНЕ/ПРИБЛИЗИТЕЛНА ОЦЕНКА
ВЪВЕДЕНИЕ
Общо въведение към изчислителните методи, както и различни данни и примери, са дадени в Ръководството с методи за определяне на химични свойства (а).
Изчислените стойности на Pow могат да се използват:
|
—
|
за да се определи кой от експерименталните методи е по-подходящ (методът на разклащането в стъкленица се прилага в областта: log Pow = - 2 до 4, а методът на HPLC — в областта: log Pow = 0 до 6),
|
|
—
|
за да се изберат подходящи условия на изпитването (например сравнителни вещества за HPLC-процедурите, съотношение n-октанол/вода за метода на разклащането в стъкленица),
|
|
—
|
като вътрешнолабораторна проверка за възможни експериментални грешки,
|
|
—
|
за да се осигури приблизителна оценка на Pow в случаите, когато експерименталните методи не могат да се приложат по технически причини.
|
МЕТОДИ ЗА ОЦЕНКА
Предварителна преценка на коефициента на разпределение
Стойността на коефициента на разпределение може да се оцени приблизително, като се използват разтворимостите на изпитваното вещество в чистите разтворители. За тази цел се пресмята:

ИЗЧИСЛИТЕЛНИ МЕТОДИ
Принцип на изчислителните методи
Всички изчислителни методи се основават на формалното фрагментиране на молекулата на подходящи подструктури, за които са известни надеждни стойности на log Pow. След това log Pow на цялата молекула се изчислява, като се сумират стойностите на съответните фрагменти и се прибавят корекционни членове, отчитащи вътрешномолекулните взаимодействия.
Списък с константите на фрагментите и корекционните членове може да се намери в литературните източници (б) (в) (г) (д), някои от които редовно се осъвременяват (б).
Критерии за качество
По принцип надеждността на изчислителния метод се намалява с усложняването на изпитваното съединение. В случаите на прости молекули с ниски молекулни тегла и една или две функционални групи могат да се очакват отклонения от 0,1 до 0,3 логаритмични единици в стойностите на log Pow, получени по различни методи на фрагментиране и измерената стойност на тази величина. Когато молекулите са по-сложни, грешката става по-голяма. Тя зависи от надеждността и достъпността на фрагментационните константи, както и от възможността да се разпознаят вътрешномолекулните взаимодействия (например водородни връзки). Тя зависи също и от правилното използване на корекционните членове (този проблем отпада, ако се използва компютърният софтуер CLOGP-3) (б). За съединения, които могат да преминават в йонно състояние, е важно да бъдат пресметнати правилно зарядът и степента на йонизацията.
Изчислителни процедури
π-метод на Ханш
Първоначалната константа за хидрофобен заместител π, въведена от Фуджира и сътрудници (е), е дефинирана като:
πx = log Pow (PhX) - log Pow (PhH)
където Pow (PhX) е коефициентът на разпределение на ароматното производно, а Pow (PhH) е този на основното съединение.
Например:
πCl = log Pow (C6H5Cl) - log Pow (C6H6) = 2,84 - 2,13 = 0,71
Съответно на названието си, π-методът се прилага предимно за ароматни съединения. Стойностите π на голям брой заместители са дадени в таблици в (б), (в) и (г). Te се използват за изчисляване на log Pow зa ароматни молекули или ароматни субструктури.
Метод на Рекер
Според Рекер (ж) стойността на log Pow ce изчислява така:

Където fj представляват константите на различни молекулни фрагменти, а аi — честотата, с която те се срещат в изпитваната молекула. Корекционните членове могат да се представят като интегрален множител на една обща константа Сm (така наречената „магическа константа“). Фрагментационните константи fj и Cm ce определят от списък от 1 054 експериментално получени стойности на Pow (825 съединения), като се използва мултипликационен регресионен анализ (в) (з). Определянето на членовете, отчитащи вътрешномолекулните взаимодействия, става по редица от правила, описани в препратки (д) (з) (и).
Метод на Ханш и Лео
Според Ханш и Лео (в), стойността на log Pow ce изчислява по уравнението:
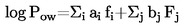
където fi представляват константите на различни молекулни фрагменти, Fj – корекционните членове, а „а“ и „b“ са съответните честоти, с които се срещат тези фрагменти. Изведени от експерименталните стойности на Pow по принципа на пробата и грешката, са получени списъци от стойностите на атомни и групови фрагменти, както и списъци с корекционните членове Fj (така наречените „фактори“). В (а) и (в) са предложени корекционните членове за няколко различни класа. Доста трудоемко и бавно е да се вземат под внимание всички правила и корекционни параметри. Затова са разработени софтуерни продукти (б).
Комбиниран метод
Изчисляването на log Pow за сложни молекули може значително да се подобри, ако молекулата се раздели на по-големи структури, за които могат да се намерят точни log Pow стойности или от таблици (б) (в), или от собствени измервания. Такива фрагменти (например хетероцикли, антрахинон, азобензен) могат да се комбинират с π-стойностите на Ханш или с фрагментационните константи на Рекер и Лео.
Забележки:
|
i)
|
Изчислителните методи могат да се прилагат само за съединения, които преминават частично или напълно в йонно състояние, където е възможно да се предвидят необходимите корекционни фактори.
|
|
ii)
|
Ако може да се предположи наличието на вътрешномолекулни водородни връзки, трябва да се прибавят съответните корекционни членове (прибл. от +0,6 до +1,0 log Pow единици) (а). Данни за присъствието на такива връзки могат да се получат от пространствени модели или от спектроскопски данни за молекулата.
|
|
iii)
|
Ако са възможни няколко тавтомерни форми, за основа на изчисленията се взема най-вероятната форма.
|
|
iv)
|
Внимателно трябва да се следят промените, които се правят в списъците от константи на фрагментите.
|
Отчитане на резултатите
Когато се използват методи за изчисляване или приблизителна оценка, в протокола трябва по възможност да се включи следната информация:
|
—
|
описание на веществото (смес, примеси и т.н.),
|
|
—
|
признаци за възможни вътрешномолекулни водородни връзки, за дисоциация, поява на заряд или някакви други необичайни ефекти (напр. тавтомерия),
|
|
—
|
описание на изчислителния метод,
|
|
—
|
указание какви бази данни са използвани или предоставяне на такива,
|
|
—
|
особености при подбора на фрагментите,
|
|
—
|
разбираема документация от изчисленията.
|
ПРЕПРАТКИ
|
(а)
|
W. J. Lyman, W. F. Rehl and D. H. Rosenblatt (ed.), Handbook of Chemical Property Estimation Methods, McGraw-Hill, New York, 1983.
|
|
(б)
|
Pomona College, Medicinal Chemistry Project, Claremon, California 91711, USA, Log P Database and Med. Chem. Software (Program CLOGP - 3).
|
|
(в)
|
C. Hansch, A. J. Leo, Substituent Constants for Correlation Analysis in Chemistry and Biology, John Wiley, New York, 1979.
|
|
(г)
|
A. Leo, C. Hansch, D. Elkins, Chem. Rev., 1971, vol. 71, 525.
|
|
(д)
|
F. Rekker, H. M., de Kort, E. J. Med. Chem. - Chill. Ther., 1979, vol. 14, 479.
|
|
(е)
|
T. Fujita, J. Iwasa and C. Hansch, J. Am. Chem. Soc., 1964, vol. 86, 5175.
|
|
(ж)
|
R. F. Rekker, The hydrophobic Fragmental Constant, Pharmacochemistry Library, Elsevier, New York, 1977, vol. 1.
|
|
(з)
|
C. V. Eadsforth, P. Moser, Chemosphere, 1983, vol. 12, 1459.
|
|
(и)
|
R. A. Scherrer, ACS, American Chemical Society, Washington DC, 1984, Symposium Series 255, p. 225.
|
Допълнение 2
Препоръчвани сравнителни вещества за метода на HPLC
|
№
|
Сравнително вещество
|
log Pow
|
рКа
|
|
1
|
2-бутанон
|
0,3
|
|
|
2
|
4-ацетилпиридин
|
0,5
|
|
|
3
|
Анилин
|
0,9
|
|
|
4
|
Ацетанилид
|
1,0
|
|
|
5
|
Бензилов алкохол
|
1,1
|
|
|
6
|
р-метоксифенол
|
1,3
|
pKa = 10,26
|
|
7
|
Феноксиоцетна киселина
|
1,4
|
рКа = 3,12
|
|
8
|
Фенол
|
1,5
|
pKa = 9,92
|
|
9
|
2,4-динитрофенол
|
1,5
|
pKa = 3,96
|
|
10
|
Бензонитрил
|
1,6
|
|
|
11
|
Фенилацетонитрил
|
1,6
|
|
|
12
|
4-метилбензилов алкохол
|
1,6
|
|
|
13
|
Ацетофенон
|
1,7
|
|
|
14
|
2-нитрофенол
|
1,8
|
рКа = 7,17
|
|
15
|
3-нитробензоена киселина
|
1,8
|
pKa = 3,47
|
|
16
|
4-хлороанилин
|
1,8
|
рКа = 4,15
|
|
17
|
Нитробензен
|
1,9
|
|
|
18
|
Канелен алкохол
|
1,9
|
|
|
19
|
Бензоена киселина
|
1,9
|
рКа = 4,19
|
|
20
|
р-крезол
|
1,9
|
pKa = 10,17
|
|
21
|
Канелена киселина
|
2,1
|
pKa = 3,89 цис 4,44 транс
|
|
22
|
Анизол
|
2,1
|
|
|
23
|
Метилбензоат
|
2,1
|
|
|
24
|
Бензен
|
2,1
|
|
|
25
|
3-метилбензоена киселина
|
2,4
|
pKa = 4,27
|
|
26
|
4-хлорфенол
|
2,4
|
рКа = 9,1
|
|
27
|
Трихлороетилен
|
2,4
|
|
|
28
|
Атрацин
|
2,6
|
|
|
29
|
Етилбензоат
|
2,6
|
|
|
30
|
2,6-дихлоробензонитрил
|
2,6
|
|
|
31
|
3-хлорбензоена киселина
|
2,7
|
pKa = 3,82
|
|
32
|
Толуен
|
2,7
|
|
|
33
|
1-нафтол
|
2,7
|
pKa = 9,34
|
|
34
|
2,3-дихлоранилин
|
2,8
|
|
|
35
|
Хлорбензен
|
2,8
|
|
|
36
|
Алил-фенил етер
|
2,9
|
|
|
37
|
Бромбензен
|
3,0
|
|
|
38
|
Етилбензен
|
3,2
|
|
|
39
|
Бензофенон
|
3,2
|
|
|
40
|
4-фенилфенол
|
3,2
|
pKa = 9,54
|
|
41
|
Тимол
|
3,3
|
|
|
42
|
1,4-дихлорбензен
|
3,4
|
|
|
43
|
Дифениламин
|
3,4
|
pKa = 0,79
|
|
44
|
Нафтален
|
3,6
|
|
|
45
|
Фенилбензоат
|
3,6
|
|
|
46
|
Изопропилбензен
|
3,7
|
|
|
47
|
2,4,6-трихлорфенол
|
3,7
|
рКа = 6
|
|
48
|
Бифенил
|
4,0
|
|
|
49
|
Бензилбензоат
|
4,0
|
|
|
50
|
2,4-динитро-6-sес.-бутилфенол
|
4,1
|
|
|
51
|
1,2,4-трихлрбензен
|
4,2
|
|
|
52
|
Додеканова киселина
|
4,2
|
|
|
53
|
Дифенилов етер
|
4,2
|
|
|
54
|
n-бутилбензен
|
4,5
|
|
|
55
|
Фенантрен
|
4,5
|
|
|
56
|
Флуорантен
|
4,7
|
|
|
57
|
Дибензил
|
4,8
|
|
|
58
|
2,6-дифенилпиридин
|
4,9
|
|
|
59
|
Трифениламин
|
5,7
|
|
|
60
|
ДДТ
|
6,2
|
|
|
Други сравнителни вещества с нисък log Pow
|
|
1
|
Никотинова киселина
|
-0,07
|
|
А.9. ТОЧКА НА ВЪЗПЛАМЕНЯВАНЕ
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Преди да се проведе това изпитване, е полезно да има предварителна информация за запалимостта на веществото. Изпитвателната процедура се прилага за течни вещества, чиито пари могат да се възпламенят от източници на възпламеняване. Методите за изпитване, изброени в този текст, дават достоверни резултати само за онези обхвати от точки на възпламеняване, които са посочени в отделните методи.
При подбора на метода трябва да се предвиди възможността за химична реакция между веществото и държателя на пробата.
1.2. ОПРЕДЕЛЕНИЯ И МЕРНИ ЕДИНИЦИ
Точката на възпламеняване е най-ниската температура, коригирана към налягане 101,325 кРа, при която една течност, в условията на метода, отделя пари в такова количество, че в измервателния съд се получават запалими пари или смес, запалима на въздух.
Единици: oС
t = T – 273,15
(t в oC и T в K)
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Не във всички случаи, когато се изпитва ново вещество, е необходимо да се използват вещества за сравнение. Преди всичко те трябва да служат за периодична проверка на действието на метода и да позволяват сравняване с резултатите, получени по други методи.
1.4. ПРИНЦИП НА МЕТОДА
Веществото се поставя в изпитвателен съд и се нагрява или охлажда до температурата на изпитване по начина, който е описан при отделните методи за изпитване. Правят се опити за запалване на веществото, за да се разбере дали пробата може да се възпламени при дадената температура.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
1.5.1. Повторяемост
Повторяемостта е различна в зависимост от областта, в която се намира точката на възпламеняване и от използвания метод за измерването ѝ; максимум 2oС.
1.5.2. Чувствителност
Чувствителността зависи от използвания метод на изпитване.
1.5.3. Специфичност
Специфичността на някои от методите е ограничена до няколко обхвата от точки на възпламеняване и е свързана с данните за самото вещество (например висок вискозитет).
1.6. ОПИСАНИЕ НА МЕТОДА
1.6.1. Подготовка
Проба от изпитваното вещество се поставя в изпитвателния апарат съгласно 1.6.3.1 и/или 1.6.3.2.
С оглед на безопасността се препоръчва при този метод да се употребяват само проби с малък размер — до 2 cm3, от горива или токсични вещества.
1.6.2. Условия на изпитването
Доколкото е съобразно с оглед на безопасността, апаратът трябва да се постави на място, където не става течение.
1.6.3. Извършване на изпитването
1.6.3.1. Равновесен метод
Вж. ISO 1516, ISO 3680, ISO 1523, ISO 3679.
1.6.3.2. Неравновесен метод
Апарат на Абел:
Вж. BS 2000 част 170, NF M 07-011, NF T 66-009.
Апарат на Абел-Пенски:
Вж. EN 57, DIN 51755 част 1 (за температури от 5 до 65 oС), DIN 51755 част 2 (за температури под 5 oС), NF M 07-036.
Апарат на Таг:
Вж. ASTM D 56.
Апарат на Пенски-Мартенс:
Вж. ISO 2719, EN 11, DIN 51758, ASTM D 93, BS 2000-34, NF M 07-019.
Забележки:
Когато точката на възпламеняване, определена по неравновесния метод от 1.6.3.2, се окаже 0 ± 2 oС, 21 ± 2 oС или 55 ± 2 oС, тя трябва да се потвърди със същия апарат по равновесния метод.
В протокола се посочват само методите, чрез които се определя температурата, при която е измерена точката на възпламеняване.
За да се определи точката на възпламеняване на вискозни течности (бои, лепила и други подобни), съдържащи разтворители, се използват само апарати и методи за изпитване, подходящи за определяне на точката на възпламеняване на вискозни течности.
Вж. ISO 3679, ISO 3680, ISO 1523, DIN 53213 част 1.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
Протоколът с резултатите от изпитването трябва по възможност да включва следната информация:
|
—
|
точно определение на веществата (вид и примеси),
|
|
—
|
съобщава се използваният метод, както и всички възможни отклонения от него,
|
|
—
|
резултатите и всички допълнителни бележки относно тяхното интерпретиране.
|
4. ПОЗОВАВАНИЯ
Няма.
А.10. ЗАПАЛИМОСТ (ТВЪРДИ ВЕЩЕСТВА)
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Преди да се проведе това измерване, е полезно да има предварителна информация за потенциалните експлозивни свойства на веществото.
Методът трябва да се прилага само върху прахообразни, зърнести или пастообразни вещества.
За да не бъдат включвани всички вещества, които могат да се запалват, а само онези, които горят бързо или чието поведение при горене по някакъв начин е особено опасно, за леснозапалими се считат само веществата със скорост на изгаряне, по-висока от някаква гранична стойност.
Особено опасно е, ако накаляването до бяло се разпространи през разпрашен метал, защото гасенето на пожара е свързано с много трудности. Разпрашените метали се считат за леснозапалими, ако поддържат разпространението на накаляването през масата си в рамките на определено време.
1.2. ОПРЕДЕЛЕНИЯ И МЕРНИ ЕДИНИЦИ
Време на изгаряне, изразено в секунди.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Няма определени.
1.4. ПРИНЦИП НА МЕТОДА
Веществото се формова в непрекъсната лента или ако е прахообразно, се насипва под формата на лента, дълга около 250 mm. Провежда се предварителен скрийнинг, за да се определи дали при запалване с газова горелка горенето се разпространява с пламък, или започва тлеене. Ако в рамките на определено време горенето се разпространи до над 200 mm от дължината на лентата, се провежда пълната програма за измерване на скоростта на изгаряне.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Не са определени.
1.6. ОПИСАНИЕ НА МЕТОДА
1.6.1. Предварителен скрийнинг-метод
Веществото се формова в непрекъсната лента или се насипва под формата на купчинка с дължина 250 mm, ширина 20 mm и височина 10 mm върху плоча от негорящ непорьозен материал с ниска топлопроводимост. Горещият пламък на газовата горелка (с минимален диаметър 5 mm) ce допира до единия край на лентата, докато пудрата се запали или най-много за 2 минути (5 минути за разпрашени метали или метални сплави). Трябва да се проследи дали горенето се разпространява до 200 mm от дължината на лентата в рамките на 4 минути (или 40 минути за разпрашени метали). Ако веществото не се запали или не разпространява горенето (чрез изгаряне с пламък или чрез тлеене) до 200 mm от лентата за по-малко от 4 минути (или 40 минути), веществото не се счита за високозапалимо и не е необходимо да се провеждат повече измервания. Ако веществото разпространява горенето на 200 mm дължина за по-малко от 4 минути (или 40 минути за разпрашени метали), трябва да се приложи описаната по-долу процедура (точка 1.6.2 и следващите).
1.6.2. Измерване на скоростта на горене
1.6.2.1. Подготовка
Прахообразните или зърнести вещества се насипват свободно в матрица с дължина 250 mm и триъгълно напречно сечение с височина на вътрешната част 10 mm и ширина 20 mm. От двете страни на матрицата надлъжно се монтират две метални пластини като латерални ограничители. Те изпъкват с 2 mm над горния край на триъгълното сечение (фигура). След това матрицата се пуска три пъти от височина 2 cm върху твърда повърхност и при необходимост се допълва догоре. После латералните ограничители се махат и излишното вещество се изважда. Върху матрицата се поставя плоча от негорящ непорьозен материал с ниска топлопроводимост, приспособлението се обръща и матрицата се отстранява.
Пастообразните вещества се разстилат върху плочата от негорящ гладък материал с ниска топлопроводимост под формата на въже с дължина 250 mm и напречно сечение около 1 cm2.
1.6.2.2. Условия на изпитването
Ако изпитваното вещество е чувствително към влага, изпитването трябва да се извърши колкото е възможно по-бързо след неговото изваждане от контейнера.
1.6.2.3. Провеждане на изпитването
Купчинка от веществото се поставя напречно на въздушния поток във вентилационен шкаф.
Скоростта на въздуха трябва да е достатъчно висока, за да се избегне излитането на парите в лабораторията, и не бива да се променя по време на изпитването. Около апарата се издига защитен екран.
Горещият пламък от газова горелка (с минимален диаметър 5 mm) ce използва за запалването на купчината от единия край. Когато купчината изгори до дължина 80 mm, ce измерва скоростта на изгаряне на следващите 100 mm.
Изпитването се провежда шест пъти (освен ако по-рано не се наблюдава положителен резултат), като всеки път се използва чиста студена плоча.
2. ДАННИ
За изчисленията се използват времето на изгаряне, получено от предварителния скрийнинг (1.6.1) и най-краткото време на изгаряне от най-много шест изпитвания (1.6.2.3).
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. ПРОТОКОЛ ОТ ИЗМЕРВАНЕТО
Протоколът с резултатите от изпитването трябва по възможност да съдържа следната информация:
|
—
|
точно определение на веществото (вид и примеси),
|
|
—
|
описание на изпитваното вещество, неговото физично състояние, включително съдържанието на влага,
|
|
—
|
резултати от предварителния скрийнинг и от измерването на скоростта на изгаряне, ако е правено такова,
|
|
—
|
всички допълнителни бележки относно интерпретирането на резултатите.
|
3.2. ИНТЕРПРЕТИРАНЕ НА РЕЗУЛТАТИТЕ
Прахообразните, зърнестите или пастообразните вещества трябва да се считат за леснозапалими, ако времето на изгаряне, получено при някое от изпитванията съгласно изпитвателната процедура, описана в 1.6.2, е по-малко от 45 секунди. Разпрашените метали или метални сплави се считат за леснозапалими, ако могат да се възпламенят и пламъкът или зоната на реакцията се разпространяват по цялата дължина на образеца за 10 минути или по-малко.
4. ПРЕПРАТКИ
NF T 20-042 (SEPT 85), Chemical products for industrial use. Determination of the flammability of solids.
Допълнение
Фигура
Матрица и спомагателни приспособления за приготвяне на купчинката от веществото
(всички размери са в милиметри)

А.11. ЗАПАЛИМОСТ (ГАЗОВЕ)
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Този метод позволява да се определи дали газовете, смесени с въздух при стайна температура (до 20 oС) и атмосферно налягане, са запалими и ако е така, в каква област от концентрации става запалването. Смесите с нарастващи концентрации на изпитвания газ във въздух се подлагат на действието на електрическа искра и се наблюдава дали следва запалване.
1.2. ОПРЕДЕЛЕНИЯ И МЕРНИ ЕДИНИЦИ
Областта на запалимост представлява областта от концентрации между горната и долната граница на експлозивност. Горната и долната граница на експлозивност са онези граници на концентрацията на запалимия газ при смесването му с въздуха, при които не се наблюдава разпространяване на пламък.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Не са определени.
1.4. ПРИНЦИП НА МЕТОДА
Концентрацията на газа във въздух се увеличава постепенно, като на всяка стъпка сместа се подлага на действието на електрическа искра.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Не са дадени.
1.6. ОПИСАНИЕ НА МЕТОДА
1.6.1. Апаратура
Измервателният съд представлява изправен стъклен цилиндър с минимален вътрешен диаметър 50 mm и минимална височина 300 mm. Запалителните електроди са разделени на разстояние от 3 до 5 mm и са разположени на височина 60 mm от дъното на цилиндъра. Цилиндърът е снабден с отвор за намаляване на налягането. Апаратът трябва да бъде защитен с екран, за да се ограничат щетите при експлозия.
Като средство за запалване се използва стояща индукционна искра с продължителност 0,5 sec, която се генерира от трансформатор за високо напрежение с изходно напрежение от 10 до 15 kV (максимална входна мощност 300 W). Пример за подходящ апарат е описан в препратка (2).
1.6.2. Условия на изпитването
Изпитването трябва да се провежда при стайна температура (около 20 oС).
1.6.3. Провеждане на изпитването
Смес от газ и въздух с известна концентрация на газа се въвежда в стъкления цилиндър с помощта на пропорционираща помпа. През сместа се прекарва искра и се наблюдава дали пламъкът се отделя самостоятелно от източника на възпламеняване и дали се разпространява независимо. Концентрацията на газа се променя на стъпки от 1 об. %, докато протече запалването по описания по-горе начин.
Ако химичната структура на газа показва, че той може да не е запалим и ако стехиометричната му смес с въздуха може да се пресметне, е необходимо да се изпитват на стъпки от 1 % само смеси с концентрации на газа до 10 %, следователно стехиометричният състав е над 10 %.
2. ДАННИ
За определянето на това свойство единствената полезна информация е наличието на разпространение на пламъка.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
Протоколът с резултатите от изпитването трябва по възможност да съдържа следната информация:
|
—
|
точно определение на веществото (вид и примеси),
|
|
—
|
описание и размери на използвания апарат,
|
|
—
|
температурата, при която е проведено изпитването,
|
|
—
|
измерени концентрации и получени резултати,
|
|
—
|
резултат от изпитването: незапалим газ или леснозапалим газ,
|
|
—
|
ако е направено заключението, че газът не е запалим, трябва да се съобщи обхватът от концентрации, в който е проведено изпитването на стъпки от 1 %,
|
|
—
|
да се отчете цялата информация и всички бележки, свързани с интерпретирането на резултатите.
|
4. ПРЕПРАТКИ
|
(1)
|
NF T 20-041 (Sept. 85). Chemical products for industrial use. Determination of the flammability of gases.
|
|
(2)
|
W. Berthold, B. Conrad, T. Grewer, H. Grosse. Einer Standart-Apparatur zur Messung von Explosionsgrenzen. Chem.-Ing.-Tech., 1984, vol. 56, 2, 126-127. Wortmann, T. Rekker und H. Schacke. 'Entwicklung.
|
A.12. ЗАПАЛИМОСТ (ПРИ КОНТАКТ С ВОДА)
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Този метод за изпитване може да се използва, за да се определи дали реакцията на дадено вещество с вода или влажен въздух води до появата на опасно количество от един или няколко газа, които може да се окажат леснозапалими.
Методът може да се прилага както за твърди, така и за течни вещества. Той не се прилага за вещества, които се запалват спонтанно при контакт с въздуха.
1.2. ОПРЕДЕЛЕНИЯ И МЕРНИ ЕДИНИЦИ
Леснозапалими: веществата, които при контакт с вода или влажен въздух отделят леснозапалими газове в опасни количества с минимална скорост 1 литър/kg за един час.
1.3. ПРИНЦИП НА МЕТОДА
Веществото се изпитва съгласно описаната по-долу последователност от стъпки; ако при някоя стъпка протече запалване, не са необходими повече изпитвания. Ако е известно, че веществото не реагира бурно с вода, се продължава до стъпка 4 (1.3.4).
1.3.1. Стъпка 1
Изпитваното вещество се поставя в плитък съд, съдържащ дестилирана вода, при 20 oС и се наблюдава дали отделеният газ се запалва или не.
1.3.2. Стъпка 2
Изпитваното вещество се поставя на филтърна хартия, която плува на повърхността на съд, напълнен с дестилирана вода, при 20 oС и се наблюдава дали отделеният газ се запалва. Филтърната хартия е необходима само да задържа веществото на едно място, така че да се увеличи вероятността от запалване.
1.3.3. Стъпка 3
Прави се купчинка от изпитваното вещество с височина приблизително 2 cm и диаметър 3 cm. В купчинката се капват няколко капки вода и се наблюдава дали отделеният газ се запалва.
1.3.4. Стъпка 4
Изпитваното вещество се смесва с дестилирана вода при 20 oС и скоростта на отделяне на газ се измерва в продължение на седем часа на едночасови интервали. Ако скоростта на отделяне на газа е променлива или нараства в края на седемчасовия период, времето на изпитване трябва да се удължи до максимум пет дена. Изпитването се прекратява в момента, в който скоростта на отделяне надвиши 1 литър/kg за час.
1.4. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Не са определени.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Не са дадени.
1.6. ОПИСАНИЕ НА МЕТОДА
1.6.1. Стъпка 1
1.6.1.1. Условия на изпитването
Изпитването се провежда при стайна температура (около 20 oС).
1.6.1.2. Провеждане на изпитването
Малко количество (приблизително 2 mm в диаметър) от изпитваното вещество се поставя в плитък съд с дестилирана вода. Следи се: i) дали се отделя газ, и ii) дали газът се запалва. Ако се наблюдава запалване на газа, не са необходими повече изпитвания на веществото, защото то се определя като опасно.
1.6.2. Стъпка 2
1.6.2.1. Приспособление за изпитване
Филтърна хартия се поставя да легне на повърхността на дестилирана вода в подходящ съд, например изпарителен съд с диаметър 100 mm.
1.6.2.2. Условия на изпитването
Изпитването се провежда при стайна температура (около 20 oС).
1.6.2.3. Провеждане на изпитването
Малко количество от изпитваното вещество (приблизително 2 mm в диаметър) се поставя в центъра на филтърната хартия. Следи се: i) дали се отделя газ, и ii) дали газът се запалва. Ако се наблюдава запалване на газа, не са необходими повече изпитвания на веществото, защото то се определя като опасно.
1.6.3. Стъпка 3
1.6.3.1. Условия на изпитването
Изпитването се провежда при стайна температура (около 20 oС).
1.6.3.2. Провеждане на изпитването
Оформя се купчинка от изпитваното вещество с височина приблизително 2 cm и диаметър 3 cm, на върха на която се прави вдлъбнатина. Във вдлъбнатината се прибавят няколко капки вода и се следи: i) дали се отделя газ, и ii) дали газът се запалва. Ако се наблюдава запалване на газа, не са необходими повече изпитвания на веществото, защото то се определя като опасно.
1.6.4. Стъпка 4
1.6.4.1. Апаратура
Апаратурата се приготвя, както е показано на фигурата.
1.6.4.2. Условия на изпитването
Проверява се дали контейнерът с веществото съдържа прахообразни частици с размери < 500 μm. Ако прахът е повече от 1 тегл. % от общото количество или веществото е ронливо, цялото вещество трябва да се стрие на прах преди изпитването, така че при съхранение или работа с него да няма възможност за намаляване на размера на частиците. В противен случай веществото се изпитва така, както е получено. Изпитването се провежда при стайна температура (около 20 oС) и атмосферно налягане.
1.6.4.3. Провеждане на изпитването
От 10 до 20 ml вода се поставят в делителната фуния на апарата. Десет грама от веществото се слагат в коничната колба. Обемът на отделения газ може да се измерва с някое подходящо приспособление. Запушалката на делителната фуния се маха, за да може водата да влиза в коничната колба, и часовникът се пуска. Отделеният газ се измерва на всеки час в продължение на седем часа. Ако по време на този период отделянето на газ е неравномерно или ако в края на периода скоростта на отделяне нараства, изпитването трябва да продължи до максимум пет дена. Ако в даден момент от изпитването скоростта на отделяне на газа надвиши 1 литър/kg за час, изпитването се прекратява. Изпитването се провежда три пъти.
Ако химичната природа на газа не е известна, той трябва да се анализира. Когато газът съдържа леснозапалими компоненти и не е известно дали цялата смес не е леснозапалима, трябва да се приготви смес със същия състав и да се изпита по метод А.11.
2. ДАННИ
Веществото се счита за опасно, ако:
|
—
|
при някоя от стъпките на изпитвателната процедура настъпи спонтанно запалване,
или
|
|
—
|
има отделяне на запалим газ със скорост, по-голяма от 1 литър/kg вещество за един час.
|
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
Протоколът с резултатите от изпитването трябва по възможност да съдържа следната информация:
|
—
|
точно определение на веществото (вид и примеси),
|
|
—
|
детайлно описание на първоначалното приготвяне на изпитваното вещество,
|
|
—
|
резултати от изпитванията (стъпки 1, 2, 3 и 4),
|
|
—
|
химична природа на отделения газ,
|
|
—
|
скорост на отделяне на газа, ако е била изпълнена стъпка 4 (1.6.4),
|
|
—
|
всички допълнителни бележки, свързани с интерпретирането на резултатите.
|
4. ПРЕПРАТКИ
|
(1)
|
Recommendations on the transport of dangerous goods, test and criteria, 1990, United Nations, New York.
|
|
(2)
|
NF T 20-040 (Sept. 85). Chemical products for industrial use. Determination of the flammability of gases formed by the hydrolysis of solid and liquid products.
|
Допълнение
Фигура
Апаратура
А.13. ПИРОФОРНИ СВОЙСТВА НА ТВЪРДИ ВЕЩЕСТВА И ТЕЧНОСТИ
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Процедурата за изпитване се прилага за твърди и течни вещества, които се запалват спонтанно на стайна температура (около 20 oС), малко след като са влезли в контакт с въздуха.
Веществата, които трябва да бъдат изложени на въздух за часове или дни при стайна температура или при нарастващи температури преди да се запалят, не са обект на изпитване по този метод.
1.2. ОПРЕДЕЛЕНИЯ И МЕРНИ ЕДИНИЦИ
Счита се, че пирофорни свойства притежават вещества, които се запалват или овъгляват при условията, описани в 1.6.
Самозапалването на течности може да се изпитва също и по метод А.15 Температура на самозапалване (течности и газове).
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Не са определени.
1.4. ПРИНЦИП НА МЕТОДА
Веществото, твърдо или течно, се смесва с инертен носител и се привежда в контакт с въздуха при температурата на околната среда за период от пет минути. Ако течните вещества не се запалят, те се абсорбират върху филтърна хартия и се излагат на въздух при температурата на средата (около 20 oС) за пет минути. Ако твърдото вещество или течността се запалят или ако течността се запали или овъгли филтърната хартия, веществото се счита за пирофорно.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Повторяемост: с оглед на безопасността един положителен резултат се счита за достатъчен за причисляване на веществото към пирофорните вещества.
1.6. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
1.6.1. Апаратура
Порцеланова чашка с диаметър към 10 cm се запълва с диатомит до височина приблизително 5 mm при стайна температура (около 20 oС).
Забележка:
Диатомитът или друго подобно леснодостъпно инертно вещество се приема за представител на почвата, върху която изпитваното вещество може да се разлее в случай на злополука.
За изпитването на течности, които не се запалват на въздуха, ако са в контакт с инертен носител, е необходимо да се използва суха филтърна хартия.
1.6.2. Провеждане на изпитването
а) Прахообразни твърди вещества
От 1 до 2 cm3 от изпитваното вещество се изсипват от височина около 1 m върху негоряща повърхност и се наблюдава дали веществото се запалва по време на падането или в рамките на пет минути след това.
Процедурата се повтаря шест пъти, освен ако преди това не настъпи запалване.
б) Течности
Около 5 cm3 от изпитваната течност се изливат в предварително приготвена порцеланова чашка и се наблюдава дали веществото ще се запали в рамките на пет минути.
Ако след шесткратно повторение на тази процедура не настъпи запалване, се провежда следното изпитване:
0,5 ml от изпитваната проба се изпръскват от спринцовка върху нагъната филтърна хартия и се следи дали филтърната хартия ще се запали или ще се овъгли в рамките на пет минути след прибавянето на течността. Опитът се повтаря три пъти, освен ако запалването или овъгляването на хартията не настъпи по-рано.
2. ДАННИ
2.1. ОБРАБОТВАНЕ НА РЕЗУЛТАТИТЕ
Изпитването се прекратява веднага след получаване на положителен резултат при някой от опитите.
2.2. ОЦЕНКА НА ДАННИТЕ
Ако веществото, смесено с инертен носител, се запали до пет минути след като е изложено на въздуха или ако течността овъгли или изгори филтърната хартия до пет минути след като е накапана върху нея и изложена на въздуха, съответното вещество се счита за пирофорно.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
Протоколът с резултатите трябва по възможност да съдържа следната информация:
|
—
|
точно определение на веществото (вид и примеси),
|
|
—
|
резултати от изпитванията,
|
|
—
|
всички допълнителни бележки, свързани с интерпретирането на резултатите.
|
4. ПРЕПРАТКИ
|
(1)
|
NF T 20-039 (Sept. 85). Chemical products for industrial use. Determination of the spontaneous flammability of solids and liquids.
|
|
(2)
|
Recommendations on the Transport of Dangerous Goods, Test and criteria, 1990, United Nations, New York.
|
A.14. ЕКСПЛОЗИВНИ СВОЙСТВА
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Методът предоставя експериментална схема, предназначена да определи дали дадено твърдо или пастообразно вещество е експлозивно, когато е подложено на действието на пламък (термична чувствителност) или на удар, или триене (чувствителност към механични въздействия) и дали дадена течност може да експлодира под действието на пламък или при удар.
Методът се състои от три части:
|
а)
|
изпитване на термичната чувствителност (1);
|
|
б)
|
изпитване на механичната чувствителност при удар (1);
|
|
в)
|
изпитване на механичната чувствителност при триене (1).
|
Методът осигурява данни за оценка на вероятността да се причини експлозия чрез някое обичайно въздействие. Той не е предназначен да установява дали веществото може да експлодира при всякакви условия.
Методът е подходящ за определяне дали едно вещество е експлозивно (термична и механична чувствителност) при точно определените условия, посочени в директивата. Той се базира на различни типове апарати, широко използвани в много страни (1), които обикновено дават значими резултати. Трябва да се признае, че методът не е окончателен. При него може да се използва и алтернативна апаратура, освен описаната, в случай че тя е международно утвърдена и може да се направи адекватна връзка между получените резултати и тези, получени с установената апаратура.
Когато достъпните термодинамични данни (например топлина на образуване, топлина на разлагане) и/или отсъствието на някои функционални групи (2) в структурната формула показват извън всякакво съмнение, че веществото не може да се разлага бързо с отделяне на газове или освобождаване на топлина (т.е. материалът не е експлозивен), не е необходимо да се провеждат изпитвания. За течностите не се изисква изпитване на механична чувствителност при триене.
1.2. ОПРЕДЕЛЕНИЯ И МЕРНИ ЕДИНИЦИ
Експлозивни:
за експлозивни се считат вещества, които могат да експлодират при действието на пламък или които са чувствителни към удар или триене в определената апаратура (или проявяват по-голяма механична чувствителност от 1,3-динитробензена в алтернативна апаратура).
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
За методите с триене и удар като сравнително вещество се използва кристален 1,3-динитробензен с техническа чистота, пресят до размер на частиците 0,5 mm.
За втората серия от изпитвания с триене и удар се използва перхидро-1,3,5-тринитро-1,3,5-триазин (RDX, хексоген, циклонит — CAS 121-82-4), прекристализиран от воден цеклохексанон, пресят във влажно състояние през 250 μm, съхраняван над сито от 150 μm и изсушен при 103 ± 2oС (за 4 часа).
1.4. ПРИНЦИП НА МЕТОДА
За да се определят условията за безопасното провеждане на трите изпитвания на чувствителността, е необходимо да се проведат предварителни изпитвания.
1.4.1. Определяне на условията за безопасна работа (3)
С оглед на безопасността преди провеждането на основните изпитвания много малки проби (около 10 mg) от веществото се подлагат на нагряване на открито с газова горелка, на удар в някакъв подходящ по форма апарат и на триене с дървен чук върху наковалня или в каква да е по форма фрикционна машина. Целта е да се установи дали веществото е толкова чувствително и експлозивно, че предписаните изпитвания, по-специално тези за термичната чувствителност, трябва да се провеждат със специални предпазни мерки, така че да се избегне нараняването на оператора.
1.4.2. Термична чувствителност
Методът включва нагряване на веществото в стоманена тръба, закрита с пластинки с отвори с различен диаметър на дупките, при което се определя дали веществото може да експлодира в условията на интензивно нагряване в затворено пространство.
1.4.3. Механична чувствителност (удар)
Методът включва подлагане на веществото на удар с точно определена маса, която се пуска върху него от определена височина.
1.4.4. Механична чувствителност (триене)
Методът включва подлагане на твърдото или пастообразно вещество на триене между стандартни повърхности при определени условия на натиск и относителна скорост на движение.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Не са дадени.
1.6. ОПИСАНИЕ НА МЕТОДА
1.6.1. Термична чувствителност (ефект от пламък)
1.6.1.1. Апаратура
Апаратът се състои от стоманена тръба за еднократна употреба със затварящи приспособления за многократна употреба (фигура 1), инсталирана в нагревателно защитно устройство. Всяка тръба е направена от лист закалена стомана (вж. допълнението) и има вътрешен диаметър 24 mm, дължина 75 mm и дебелина на стената 0,5 mm. На отворения край на тръбите са монтирани фланци, които позволяват затварянето на тръбите с перфорирани плочи. Приспособлението за затваряне се състои от плочка с централен отвор, устойчива на високо налягане, закрепена здраво за тръбата с помощта на винтово съединение от две части (гайка и резбована втулка). Гайката и резбованата втулка са направени от хромово-магнезиева стомана (вж. допълнението), която не дава искри до 800 oС. Плочките с отворите са с дебелина 6 mm и са направени от термоустойчива стомана (вж. допълнението). Те могат да имат различен диаметър на отворите.
1.6.1.2. Условия на изпитването
Обикновено веществата се изпитват във вида, в който са получени, макар че в някои случаи, например ако са пресовани, в отлята форма или сбити по някакъв друг начин, може да се наложи да се натрошат преди изпитването.
За твърдите вещества количеството материал, което ще се използва при всяко изпитване, се определя като се използва двуетапна подготвителна процедура. Празна тръба се напълва с 9 cm3 вещество, което се трамбова със сила 80 N, приложена към цялото напречно сечение на тръбата. За по-голяма безопасност или ако физичната форма на пробата може да се промени при натиск, могат да се използват други способи за пълнене на тръбата, например ако веществото е много чувствително на триене, трамбоването не е подходящо. Ако материалът се свие, се прибавя още от него и отново се трамбова, докато тръбата се изпълни до височина 55 mm от горния край. Определя се масата на веществото, необходима да запълни тръбата до това ниво (55 mm). Още на два пъти се прибавя по толкова вещество, което се трамбова също със сила 80 N. След това се прибавя още материал чрез трамбоване или ако е необходимо, се изважда, докато тръбата се напълни на височина 15 mm от горния край. Провежда се второ пробно пълнене на тръбата, като се започне с една трета от количеството, използвано за запълването ѝ при първата проба Прибавя се още два пъти същото количество вещество при трамбоване с 80 N и нивото на веществото се нагласява на 15 mm от горния край, като се добавя или изважда от материала. При следващите изпитвания се използва количеството вещество, определено при второто пробно пълнене на тръбата. Тръбата се пълни, като на три пъти се прибавят равни количества вещество и всеки път обемът на веществото се довежда до 9 cm3 чрез натиск с каквато сила е необходима. (Процедурата може да се улесни, като се използват ограничителни пръстени.)
Течностите и геловете се изсипват в тръбата до височина 60 mm, като се внимава, особено при геловете, да не се образуват кухини. Долният край на резбованата втулка се приплъзва върху тръбата, поставя се подходяща плочка с отвор и след като се смаже с малко масло на основата на молибденов дисулфид, гайката се затяга. Важно е да се провери да няма от изпитваното вещество между фланеца и пластинката, а също и в гънките на резбата.
Нагряването става с пропан от индустриална бутилка, снабдена с регулатор на налягането (60 до 70 mbar) през дозатор. Пропанът се разпределя равномерно (което се разбира визуално, като се наблюдават пламъците на горелките) чрез тръба с разклонения към четирите горелки. Горелките са разположени около изпитателната камера, както е показано на фигура 1. Четирите горелки общо изразходват около 3,2 литра пропан на минута. Могат да се използват и други горивни газове и горелки, но скоростта на нагряване трябва да бъде такава, каквато е описана на фигура 3. При всички апарати скоростта на нагряване трябва да се проверява периодично, като се използват тръби, напълнени с дибутилфталат, както е отбелязано на фигура 3.
1.6.1.3. Провеждане на изпитванията
Всяко изпитване се провежда, докато тръбата се пръсне на парчета. Ако това не стане, нагряването продължава не повече от пет минути. Изпитването, което довежда до фрагментиране на тръбата на три или повече парчета (в някои случаи парчетата са свързани помежду си с тънки ивици метал, както е показано на фигура 2), се отчита като експлозия. За изпитване, при което се получават по-малко парчета или изобщо не настъпва фрагментация, се счита, че не е довело до експлозия.
Най-напред се прави серия от три изпитвания с плочки с диаметър на отворите 6,0 mm. Ако не се получи експлозия, се провежда втора серия от три изпитвания с диаметър на отвора 2,0 mm. Ако по време и на двете серии от изпитвания се получат експлозии, не се правят повече изпитвания.
1.6.1.4. Оценка на резултатите
Изпитването се счита за положително, ако и при двете описани по-горе серии от изпитвания се получат експлозии.
1.6.2. Механична чувствителност (удар)
1.6.2.1. Апарат (фигура 4)
Най-важните части на един типичен апарат с падащ чук са следните: блок от лята стомана с основа, наковалня, колона, водачи, подвижни тежести, устройство за освобождаване и държател на пробата. Стоманената наковалня с размери 100 mm (диаметър) х 70 mm (височина) е завинтена за горния край на стоманен блок с размери 230 mm (дължина) х 250 mm (ширина) х 200 mm (височина), който има излята основа с размери 450 mm (дължина) х 450 mm (ширина) х 60 mm (височина). Колона, направена от закалена стоманена тръба без спойки, е закрепена здраво с държател, завинтен към задната част на стоманения блок. Четири винта задържат апарата към монолитен бетонен блок с размери 60 х 60 х 60 cm, така че водещите релси да са съвършено вертикални и подвижните тежести да падат свободно (използват се тежести от 5 и 10 kg, направени от плътна стомана). Удрящата повърхност на тежестите е от закалена стомана, HRC от 60 до 63 и има минимален диаметър 25 mm.
Измерваната проба е затворена в ударно устройство, съставено от два коаксиални цилиндъра от плътна стомана, разположени един над друг в кух цилиндричен водещ жлеб (също от стомана). Стоманените цилиндри трябва да бъдат с диаметър 10 (-0,003, -0,005) mm и височина 10 mm, да имат полирани повърхности, заоблени краища (радиус на кривината 0,5 mm) и твърдост на HRC от 58 до 65. Кухият цилиндър трябва да бъде с външен диаметър 16 mm, полиран отвор от 10 (+0,005, +0,010) mm и височина 13 mm. Ударното устройство е монтирано върху междинна наковалня (26 mm диаметър и 26 mm височина), направена от стомана и центрована с помощта на пръстен с отвори, които позволяват изпускането на парите.
1.6.2.2. Условия на изпитването
Обемът на пробата трябва да бъде 40 mm3 или да е подходящо подбран при използването на алтернативни апарати. Твърдите вещества се измерват в сухо състояние и трябва да се подготвят по следния начин:
|
а)
|
стритите вещества се пресяват през сито с размер на отворите 0,5 mm; целият материал, преминал през ситото, се използва за изпитването;
|
|
б)
|
пресованите, излети или сбити по друг начин вещества се натрошават на малки парченца и се пресяват; пресетите частици с размери между 0,5 и 1 mm в диаметър се използват при изпитването и се смятат за представителна фракция на първоначалното вещество.
|
Веществата, които се доставят в пастообразна форма, се изпитват в сухо състояние. Ако това не е възможно, трябва да се отстрани колкото може по-голямо количество от разредителя. Течностите се изпитват като между долния и горния стоманен цилиндър се оставя пролука от 1 mm.
1.6.2.3. Провеждане на изпитванията
Провежда се серия от шест изпитвания, като тежест с тегло 10 kg ce пуска от височина 0,40 m (40 J). Ако при тези шест опита се получи експлозия, се провежда нова серия, също от шест изпитвания, но като маса с тегло 5 kg ce пуска от височина 0,15 m (7,5 J). В друг апарат пробата се сравнява с избрано сравнително вещество, като се използва предварително установена процедура (например техниката up-and-down или друга).
1.6.2.4. Оценка на резултатите
Резултатите от изпитванията се считат за положителни, ако протече експлозия (избухване в пламъци или изгърмяване се равняват на експлозия) поне веднъж при някой от опитите с утвърдения апарат, или ако пробата е по-чувствителна от 1,3-динитробензен или от циклонит при алтернативен начин на изпитване.
1.6.3. Механична чувствителност (триене)
1.6.3.1. Апарат (фигура 5)
Фрикционният апарат се състои от основна плоча, излята от стомана, върху която е монтирано фрикционното устройство. То се състои от фиксиран порцеланов пестик и подвижна порцеланова плочка. Порцелановата плочка е поставена в шейна, която се движи в два водача. Шейната е свързана с електромотор чрез свързващ лост, ексцентрик и подходяща зъбна предавка, така че порцелановата плочка да се придвижва само един път назад и напред под пестика на разстояние 10 mm. Порцелановият пестик може да се натовари например със 120 или 360 нютона.
Плоската порцеланова плочка се изработва от бял технически порцелан (грапавост от 9 до 32 μm) и е с размери 25 mm (дължина) х 25 mm (ширина) х 5 mm (височина). Цилиндричният порцеланов пестик също се прави от бял технически порцелан и е дълъг 15 mm, диаметърът му е 10 mm, краищата му са грапави и имат сферична форма с радиус на кривината 10 mm.
1.6.3.2. Условия на изпитването
Обемът на пробата трябва да бъде 10 mm3 или друг подходящ за алтернативния апарат.
Твърдите вещества се измерват в сухо състояние и се подготвят, както следва:
|
а)
|
стритите вещества се пресяват през сито с размер на отворите 0,5 mm; целият материал, преминал през ситото, се използва за измерването;
|
|
б)
|
пресованите, излети или сбити по друг начин вещества се натрошават на малки парченца и се пресяват; пресетите частици с размери < 0,5 mm в диаметър се използват при изпитването.
|
Веществата, които обикновено се доставят в пастообразна форма, се изпитват, ако е възможно, в сухо състояние. Ако веществото не може да се приготви в сухо състояние (след отстраняване на максималното възможно количество от разредителя), то се изпитва под формата на филм с дебелина 0,5 mm, ширина 2 mm и дължина 10 mm, направен в матрица.
1.6.3.3. Провеждане на изпитванията
Порцелановият пестик се довежда върху изпитваната проба и се натоварва. По време на изпитването грапавините на порцелановата плочка трябва да са разположени напряко на посоката на движението. Трябва да се внимава за следното: пестикът да се опира върху пробата, под него да има достатъчно количество изпитван материал и плочката да се придвижва правилно под пестика. Пастообразните вещества се нанасят върху плочката с помощта на уред с дебелина 0,5 mm и прорез с размери 2 х 10 mm. Порцелановата плочка трябва да изминава 10 mm напред и назад под пестика за време 0,44 секунди. Всяка от повърхностите на плочката и на пестика се използва само веднъж; двата края на всеки пестик служат за два опита, а всяка от двете повърхности на плочката служи за три опита.
Провежда се серия от шест измервания с товар от 360 N. Ако по време на тези шест опита се получи положителен резултат, се провежда серия от нови шест измервания при натоварване 120 N. При други апарати пробата се сравнява с избрано сравнително съединение, като се използва утвърдена процедура (например техниката up-and-down или друга).
1.6.3.4. Оценка на резултатите
Резултатът от изпитването се смята за положителен, ако се получи експлозия (пращене и/или гръм или избухване в пламъци са равносилни на експлозия) поне веднъж при всеки от опитите с утвърдената фрикционна апаратура, или ако задоволява еквивалентните критерии при алтернативно изпитване.
2. ДАННИ
По принцип се счита, че едно вещество е експлозивно по смисъла на директивата, ако е получен положителен резултат при изпитването на термичната чувствителност или на чувствителността при удар или при триене.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. ИЗПИТВАНЕ
Протоколът от изпитването трябва по възможност да съдържа следната информация:
|
—
|
вид, състав, чистота, съдържание на влага и т.н. на изпитваното вещество,
|
|
—
|
физична форма на пробата и дали тя е била натрошавана, чупена и/или пресявана,
|
|
—
|
наблюдения по време на изпитванията на термичната чувствителност (например маса на пробата, брой на фрагментите и др.),
|
|
—
|
наблюдения при изпитването на механичната чувствителност (образуване на значително количество дим или пълно разлагане с взрив, пламъци, искри, гърмеж, прашене и т.н.),
|
|
—
|
резултати от всеки вид изпитвания,
|
|
—
|
ако е използван алтернативен апарат, трябва да се представи научна обосновка, както и доказателство за корелацията между резултатите, получени с утвърдения апарат, и тези, получени с еквивалентния апарат,
|
|
—
|
всички полезни коментари, като например позоваване на изпитвания на подобни продукти, които може да се отнасят до правилното интерпретиране на резултатите,
|
|
—
|
всички допълнителни бележки, свързани с интерпретирането на резултатите.
|
3.2. ИНТЕРПРЕТИРАНЕ И ОЦЕНКА НА РЕЗУЛТАТИТЕ
В протокола от изпитванията трябва да са посочени всички резултати, които са сметнати за погрешни, аномални или непредставителни. Ако някой от резултатите е отхвърлен, трябва да се даде обяснение, както и резултатите от всички алтернативни или спомагателни изпитвания. В случай че отхвърлянето на даден аномален резултат не може да се обясни, той трябва да се приеме за действителен и да се използва при класифицирането на веществото.
4. ПРЕПРАТКИ
|
(1)
|
Recommendations on the Transport of Dangerous Goods: Tests and criteria, 1990, United Nations, New York.
|
|
(2)
|
Bretherick, L., Handbook of reactive Chemical Hazards, 4th edition, Butterworths, London, ISBN 0-750-60103-5, 1990.
|
|
(3)
|
Koenen, H., Ide, K. H. and Swart, K. H., Explosivstoffe, 1961, vol. 3, 6-13 и 30-42.
|
|
(4)
|
NF T 20-038 (Sept. 85). Chemical products for industrial use — Determination of explosion risk.
|
Допълнение
Пример за спецификация на материалите за изпитването на термичната чувствителност (вж. DIN 1623)
|
(1)
|
Тръба: спецификации на материалите № 1.0336.505 g
|
|
(2)
|
Плочка с отверстия: спецификация на материалите № 1.4873
|
|
(3)
|
Резбована втулка и гайка: спецификация на материалите № 1.3817
|
Фигура 1
Апарат за измерване на термичната чувствителност
(всички размери са в милиметри)

Фигура 2
Изпитване на термичната чувствителност
(примери за фрагментиране)

Фигура 3
Калибриране на скоростта на нагряване за изпитването на термичната чувствителност

Крива температура/време, получена при нагряването на дибутилфталат (27 cm3) в затворена тръба (с плоча с отвор 1,5 mm) посредством пропанов пламък със скорост 3,2 l/min. Температурата е измерена с хромалумелова термодвойка, обшита с неръждаема стомана с диаметър 1 mm и разположена централно на разстояние 43 mm под пръстена на тръбата. Скоростта на нагряване между 135 oС и 285 oС трябва да бъде между 185 и 215 K/минута.
Фигура 4
Апарат за изпитване на удар
(всички размери са в милиметри)
Фигура 4
Продължение

Фигура 5
Апарат за чувствителност при триене

А.15. ТЕМПЕРАТУРА НА САМОЗАПАЛВАНЕ (ТЕЧНОСТИ И ГАЗОВЕ)
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Това изпитване не се отнася за експлозивни вещества, както и за веществата, които се самозапалват при контакт с въздуха на стайна температура. Процедурата за изпитване е приложима за газове, течности и пари, които в присъствието на въздух могат да се запалят от нагорещена повърхност.
Температурата на самозапалване може да бъде понижена значително при използване на примеси с каталитични свойства, от материала на нагорещената повърхност или поради това, че обемът на измервателния съд е твърде голям.
1.2. ОПРЕДЕЛЕНИЯ И МЕРНИ ЕДИНИЦИ
Степента на самозапалване се изразява чрез температурата на самозапалване. Температурата на самозапалване е най-ниската температура, при която изпитваното вещество се запалва, смесвайки се с въздух при условията, определени в метода.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Веществата за сравнение са посочени в стандартите (вж. 1.6.3). Преди всичко те трябва да служат за периодична проверка на ефикасността на метода, както и да позволяват сравнение с резултатите, получени по други методи.
1.4. ПРИНЦИП НА МЕТОДА
Методът определя минималната температура на вътрешната повърхност на затворен съд, която води до запалването на газ, пара или течност, впръскани в съда.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Точността зависи от областта, в която се намира температурата на самозапалване, както и от използвания метод за изпитване.
Чувствителността и специфичността зависят от използвания метод за изпитване.
1.6. ОПИСАНИЕ НА МЕТОДА
1.6.1. Апаратура
Апаратурата е описана в метода, посочен в 1.6.3.
1.6.2. Условия на изпитването
Проба от изпитваното вещество се изпитва по метода, посочен в 1.6.3.
1.6.3. Провеждане на изпитването
Вж. IEC 79-4, DIN 51794, ASTM-E 659-78, BS 4056, NF Т 20-037.
2. ДАННИ
Записват се температурата на изпитването, атмосферното налягане, използваното количество от пробата и времето до момента на запалването.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
Протоколът с резултатите от изпитването трябва по възможност да съдържа следната информация:
|
—
|
точно идентифициране на веществото (вид и примеси),
|
|
—
|
количество на пробата; атмосферното налягане,
|
|
—
|
резултати от изпитванията (температури, при които са проведени изпитванията, резултати, свързани със запалването; съответни времена до запалването),
|
|
—
|
всички допълнителни бележки, свързани с интерпретирането на резултатите.
|
4. ПРЕПРАТКИ
Няма.
А.16. ОТНОСИТЕЛНА ТЕМПЕРАТУРА НА САМОЗАПАЛВАНЕ НА ТВЪРДИ ВЕЩЕСТВА
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Това изпитване не се отнася за експлозивни вещества, както и за вещества, които се самозапалват при контакт с въздух на стайна температура.
Целта на това изпитване е да се осигури предварителна информация за самозапалването на твърдите вещества при повишаване на температурата.
Ако топлината, която се отделя при взаимодействие на веществото с кислород или при екзотермичното му разлагане, не се разсейва достатъчно бързо в околната среда, се получава самонагряване, което води до самозапалване. Следователно самозапалване настъпва, когато скоростта на топлопроизводството е по-висока от скоростта на топлоотделянето.
Процедурата за изпитване се използва като предварителен скрийнинг-метод за твърди вещества. Като се има предвид сложната същност на процесите на запалване и изгаряне на твърди вещества, определената по този метод температура на самозапалване трябва да се използва само за сравнителни цели.
1.2. ОПРЕДЕЛЕНИЯ И МЕРНИ ЕДИНИЦИ
Температурата на самозапалване, получена по този метод, е минималната температура на околната среда в oС, при която определено количество вещество ще се запали при определени условия.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Няма.
1.4. ПРИНЦИП НА МЕТОДА
Определено количество от изпитваното вещество се поставя в пещ при стайна температура; записва се крива температура/време, регистрираща условията в средата на пробата, докато температурата на пещта се повиши до 400 oС (или до точката на топене на веществото, ако тя е по-ниска) при скорост на повишаване 0,5 oC/min. Във връзка с целта на това изпитване температурата на пещта, при която температурата на пробата достигне 400 oС чрез самонагряване, се нарича температура на самозапалване.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Няма.
1.6. ОПИСАНИЕ НА МЕТОДА
1.6.1. Апаратура
1.6.1.1. Пещ
Температурно програмирана лабораторна пещ (вместимост около 2 литра), снабдена с устройство за въздушна циркулация и обезопасена срещу експлозии. За да се избегне потенциалната опасност от взрив, отделените при разлагането на веществото газове не бива да влизат в контакт с електронагревателните елементи.
1.6.1.2. Куб от телена мрежа
Парче от телена мрежа с размер на отворите 0,045 mm, направена от неръждаема стомана, се изрязва по начина, показан на фигура 1. Мрежата се сгъва под формата на куб с открит горен край и се закрепва с тел.
1.6.1.3. Термодвойки
Подходящи термодвойки.
1.6.1.4. 3аписващо устройство
Двуканално записващо устройство от 0 до 600 oС или за съответното напрежение.
1.6.2. Условия на изпитването
Веществата се изпитват във вида, в който са получени.
1.6.3. Провеждане на изпитването
Кубът се напълва с изпитваното вещество, стръсква се внимателно и се прибавя още вещество, докато се напълни догоре. След това кубът се окачва в центъра на пещта при стайна температура. Едната от термодвойките се поставя в центъра на куба, а другата — между куба и стената на пещта, за да се отчита температурата на пещта.
Температурите на пещта и на пробата се записват непрекъснато, докато температурата на пещта се повишава до 400 oС или до точката на топене (ако е по-ниска) при скорост на повишаване 0,5 oC/min.
Когато веществото се запали, термодвойката, поставена в него, ще покаже много рязко повишаване на температурата над тази на пещта.
2. ДАННИ
За оценяване се използва температурата на пещта, при която температурата на пробата достигне 400 oС чрез самонагряване (вж. фигура 2).
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
Протоколът с резултатите от изпитването трябва по възможност да съдържа следната информация:
|
—
|
описание на изпитваното вещество,
|
|
—
|
резултати от изпитванията, включително кривата температура/време,
|
|
—
|
всички допълнителни бележки, свързани с интерпретирането на резултатите.
|
4. ПРЕПРАТКИ
NF T 20-036 (Sept. 85). Chemical products for industrial use. Determination of the relative temperature of the spontaneous flammability of solids.
Фигура 1
Модел на измервателния куб с дължина на страната 20 mm

Фигура 2
Типична крива температура/време

А.17. ОКСИДИРАЩИ СВОЙСТВА (ТВЪРДИ ВЕЩЕСТВА)
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Преди да се проведе това изпитване, ще е от полза да има предварителна информация за евентуалните експлозивни свойства на веществото.
Методът е неприложим за течности, газове, експлозивни или леснозапалими вещества, както и за органични пероксиди.
Провеждането на това изпитване не е необходимо, когато проучването на структурната формула показва без съмнение, че веществото не реагира екзотермично с горивни материали.
За да се разбере дали изпитването трябва да се провежда при специални мерки за сигурност, е необходимо да се направи предварително изпитване.
1.2. ОПРЕДЕЛЕНИЯ И МЕРНИ ЕДИНИЦИ
Време на изгаряне: реакционното време в секунди, необходимо на зоната, в която протича реакцията, да премине по цялата дължина на образеца в съответствие с процедурата, описана в 1.6.
Скорост на изгаряне: изразява се в милиметри за секунда.
Максимална скорост на изгаряне: най-високата стойност на скоростта на изгаряне, получена при смеси, съдържащи от 10 до 90 тегл. % окислител.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
За изпитването, както и за предварителното изпитване, като вещество за сравнение се използва бариев нитрат с аналитична чистота.
Приготвената съгласно точка 1.6 смес от бариев нитрат и прахообразна целулоза се използва като смес за сравнение. Тя има максимална скорост на изгаряне (обикновено това е смес, съдържаща 60 тегл. % бариев нитрат).
1.4. ПРИНЦИП НА МЕТОДА
С оглед на безопасността се провежда предварително изпитване. Ако предварителното изпитване покаже ясно, че изпитваното вещество притежава оксидиращи свойства, не е необходимо да се провеждат повече изпитвания. В противен случай веществото се подлага на пълната процедура за изпитване.
При пълното изпитване изпитваното вещество и определено горивно вещество се смесват в различни съотношения. След това от всяка смес се оформя купчинка, която се запалва от единия край. Така определената максимална скорост на изгаряне се сравнява с тази на сравнителната смес.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Всеки метод на стриване и смесване се приема за валиден, в случай че максималната скорост на изгаряне при шест отделни опита се различава от средноаритметичната с не повече от 10 %.
1.6. ОПИСАНИЕ НА МЕТОДА
1.6.1. Подготовка
1.6.1.1. Изпитвано вещество
Размерът на частиците на изпитваното вещество се намалява до < 0,125 mm по следния начин: веществото се пресява, остатъчната фракция се стрива и тази процедура се повтаря, докато цялата проба премине през ситото.
Може да се използват всякакви методи на стриване и пресяване, стига те да са в съответствие с критериите за качество.
Преди да се приготви сместа, веществото се суши при 105 oС до достигане на постоянно тегло. Ако температурата на разлагане на изпитваното вещество е по-ниска от 105 oС, то се суши при подходяща по-ниска температура.
1.6.1.2. Горивно вещество
Като горивно вещество се използва прахообразна целулоза. Целулозата трябва да бъде от вид, използван за тънкослойна или за колонна хроматография. Целулоза с дължини на нишките, по-големи от 85 % между 0,020 и 0,075 mm, е подходяща за целта. Разпрашената целулоза се прокарва през сито с размер на порите 0,125 mm. По време на цялото изпитване се използва една и съща партида целулоза.
Преди приготвянето на сместа прахообразната целулоза се суши при 105 oС до постоянно тегло.
Ако при предварителното изпитване се използва дървесно брашно, то трябва да се приготви от влажна дървесина, като се събере порцията, която преминава през сито с размер на отворите 1,6 mm, разбърква се добре и се суши 4 часа при 105 oС на пласт, не по-дебел от 25 mm. След това се охлажда и се съхранява до употребата в обезвъздушен контейнер, запълнен колкото е възможно повече. За предпочитане е да се използва в рамките на 24 часа след сушенето.
1.6.1.3. Източник на възпламеняване
Като източник на възпламеняване се използва горещ пламък от газова горелка (минимален диаметър 5 mm). Ако се използва друг източник (например при изпитване в инертна атмосфера), той трябва да се опише и използването му да се обоснове.
1.6.2. Провеждане на изпитването
Забележка:
Смесите от окислители и целулоза или дървесно брашно трябва да се третират като потенциално експлозивни и с тях да се работи със съответното внимание.
1.6.2.1. Предварително изпитване
Сухото вещество се смесва добре с изсушената целулоза или дървесно брашно в тегловно съотношение 2 към 1 и сместа се оформя като малка конусовидна купчинка с размери 3,5 cm (диаметър на основата) х 2,5 cm (височина). Оформянето на купчинката става чрез пълнене и трамбоване в конусообразна матрица (например лабораторна стъклена фуния със запушен ствол).
Купчинката се поставя върху хладка незапалима гладка плоча с ниска топлопроводимост. Изпитването се провежда във вентилационен шкаф, както е описано в 1.6.2.2.
Източникът на възпламеняване се допира до конуса. Интензивността и продължителността на получената реакция се наблюдават и записват.
Ако реакцията е бурна, веществото се счита за оксидиращо.
В случай че резултатът буди съмнение, е необходимо да се проведе цялата поредица от процедури, описана по-долу.
1.6.2.2. Последователност на изпитвателните процедури
Приготвят се смеси от сухото вещество и целулозата със съдържание на сухо вещество от 10 до 90 тегл. %, като концентрацията на веществото нараства с по 10 % при всяка следваща смес. В случай че резултатите са на границата на две концентрации, за да се получи по-точна стойност на максималната скорост на изгаряне, трябва да се приготвят и смеси с междинно съдържание.
Купчинката се оформя с помощта на матрица. Матрицата е направена от метал, има дължина 250 mm, триъгълно напречно сечение с височина 10 mm и вътрешна ширина 20 mm. От двете страни на матрицата в надлъжна посока се монтират две метални пластинки като латерални ограничители, които изпъкват с по 2 mm над горния край на триъгълното сечение (вж. фигурата). В това приспособление се насипва свободно малък излишък от сместа. След като матрицата се пусне веднъж от височина 2 cm върху твърда повърхност, излишното вещество се изстъргва с помощта на наклонен лист, латералните ограничители се снемат и останалият прах се заглажда с валяк. След това върху матрицата се поставя плоча от незапалим непорьозен материал с ниска топлопроводимост, приспособлението се обръща и матрицата се отстранява.
Купчинката се поставя срещу въздушен поток във вентилационен шкаф.
Скоростта на въздушния поток трябва да е достатъчно висока, за да се избегне проникването на дим в лабораторията. Тя не бива да се променя по време на изпитването. Около апарата се издига защитен екран.
Тъй като целулозата, както и някои изпитвани вещества, са хигроскопични, изпитването трябва да се проведе колкото е възможно по-бързо.
Единият край на купчинката се запалва чрез допиране на пламък.
След като зоната на реакцията се разпространи на първоначално разстояние от 30 mm, ce измерва времето на реакцията за следващите 200 mm.
Провежда се изпитване със сравнително вещество и поне по едно изпитване със смесите на веществото с целулоза с концентрации в определената област.
Ако максималната скорост на изгаряне се окаже значително по-висока от тази на сместа за сравнение, изпитването се прекратява; в противен случай то се провежда по пет пъти за всяка от трите смеси с най-високи скорости на изгаряне.
Ако има съмнение, че полученият положителен резултат не е реален, изпитването трябва да се повтори, като вместо целулоза се използва инертно вещество с подобен размер на частиците, например кизелгур. Също така изпитването на сместа (изпитвано вещество-целулоза) с най-висока скорост на изгаряне трябва да се повтори в инертна атмосфера (< 2 об. % съдържание на кислород).
2. ДАННИ
От съображения за безопасност като характеристика за оксидиращите свойства на изпитваното вещество се приема максималната скорост на изгаряне, а не средната стойност на скоростта на изгаряне.
За оценяване се използва най-високата стойност на скоростта на изгаряне, получена след шест опита с определена смес.
Начертава се графика на най-високите стойности на скоростта на изгаряне за всяка смес към концентрациите на окислителя. От графиката се снема максималната скорост на изгаряне.
Шестте измерени стойности на скоростта на изгаряне, получени при един опит със сместа с най-висока скорост на изгаряне, не трябва да се различават от средноаритметичната стойност с повече от 10 %; в противен случай методите на стриване и смесване трябва да се подобрят.
Сравнява се получената максимална скорост на изгаряне с тази на сравнителното вещество (вж. 1.3).
Ако изпитванията се провеждат в инертна атмосфера, максималната скорост на реакцията се сравнява с тази на сместа за сравнение също в инертна атмосфера.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Протоколът от изпитването трябва по възможност да съдържа следната информация:
|
—
|
вид, състав, чистота, влагосъдържание и т.н. на изпитваното вещество,
|
|
—
|
всяка обработка на изпитваното вещество (например стриване, сушене и т.н.),
|
|
—
|
източник на възпламеняване, използван при изпитването,
|
|
—
|
резултати от изпитванията,
|
|
—
|
начин на протичане на реакцията (например пламък, горящ на повърхността, изгаряне в цялата маса на веществото, информация, свързана с продуктите на изгарянето),
|
|
—
|
всички допълнителни бележки относно интерпретацията на резултатите, включително описание на интензивността на реакцията (пламъци, искри, дим, бавно тлеене и т.н.) и приблизителната продължителност, получена при предварителния скрийнинг, както за изпитваното, така и за сравнителното вещество,
|
|
—
|
резултати от изпитвания с инертно вещество, ако има такива,
|
|
—
|
резултати от изпитвания в инертна атмосфера, ако има такива.
|
3.2. АНАЛИЗ НА РЕЗУЛТАТИТЕ
Едно вещество се счита за оксидиращо, когато:
|
а)
|
при предварителното изпитване е протекла бурна реакция;
|
|
б)
|
при провеждането на пълното изпитване максималната скорост на изгаряне на изпитваните смеси е по-голяма или равна на максималната скорост на изгаряне на сместа целулоза-бариев нитрат, използвана за сравнение.
|
За да се избегне получаването на неверни положителни резултати, получените при изпитване на смесеното с инертен материал вещество и/или при изпитване в инертна атмосфера данни също трябва да се вземат предвид при интерпретиране на резултатите.
4. ПРЕПРАТКИ
NF T 20-035 (Sept. 85). Chemical products for industrial use. Determination of the oxidizing properties of solids.
Допълнение
Фигура
Матрица и спомагателни приспособления за приготвяне на купчинката
(всички размери са в милиметри)

А.18. СРЕДНО БРОЙНО МОЛЕКУЛНО ТЕГЛО И РАЗПРЕДЕЛЕНИЕ НА МОЛЕКУЛНОТО ТЕГЛО НА ПОЛИМЕРИ
1. МЕТОД
Този хроматографски метод с гел инфилтрация е точно копие на метода ОИСР TG 118 (1996 г.). Основните принципи и по-подробна техническа информация са дадени в препратка (1).
1.1. УВОД
Тъй като свойствата на полимерите са много разнообразни, не e възможно да се опише един-единствен метод, установяващ точно условията за сепарация и оценка, който да обхваща възможностите и спецификата, които се получават при сепарацията на полимерите. В частност сложните полимерни системи често не се поддават на хроматография с гел инфилтрация (GPC). Когато GPC е неприложима, молекулното тегло се определя с помощта на други методи (виж допълнението). В такива случаи пълните подробности и оценката се правят на базата на използвания метод.
Описаният метод се базира на DIN стандарта 55672 (1). В този DIN стандарт може да се намери подробна информация как да се извършат изпитванията и как да се оценят данните. В случай че са необходими модификации на експерименталните условия, тези промени трябва да бъдат оправдани. Могат да се използват и други стандарти, ако са напълно подходящи. Описаният метод използва проби от полистирол с позната полидисперсност за калибровка и може да се наложи да бъде променен, с цел да бъде подходящ за определени полимери, например водоразтворими полимери и полимери с дълги разклонени вериги.
1.2. ОПРЕДЕЛЕНИЯ И МЕРНИ ЕДИНИЦИ
Средното бройно молекулно тегло Мn и средното тегловно молекулно тегло Mw ce определят с помощта на следните уравнения:
където:
Hi = нивото на детекторния сигнал от базовата линия на обема на задържане Vi,
Mi = молекулното тегло на полимерната фракция при обема на задържане Vi, и
n = броя на точките с данни.
Широчината на разпределение на молекулното тегло, която е мярка за дисперсността на системата, се изразява чрез съотношението Mw/Mn.
1.3. ЕТАЛОННИ ВЕЩЕСТВА
Тъй като GPC е относителен метод, трябва да се извърши калибровка. За целта обикновено се използват полистиролови стандарти с линеен строеж и тясно разпределение, с известни средни молекулни тегла Мn и Mw и известно молекулно тегловно разпределение. Калибрационната крива може да се използва само при определяне на молекулното тегло на непозната проба, ако условията за разделяне на пробата и стандартите са били подбрани по идентичен способ.
Една установена връзка между молекулното тегло и елуиращия обем е валидна само при специфичните условия на даденото изпитване. Условията включват преди всичко температурата, разтворителя (или сместа от разтворители), хроматографските условия и сепарационната колона или система от колони.
Молекулните тегла на пробата, определени по този начин, са относителни стойности и се описват като „полистиролови еквивалентни молекулни тегла“. Това означава, че в зависимост от структурните и химическите различия между пробата и стандартите, молекулните тегла могат да се отклоняват от абсолютните стойности в по-голяма или по-малка степен. Ако се използват други стандарти, например полиетиленгликол, полиетиленов окис, полиметил метакрилат, полиакрилна киселина, трябва да се посочи причината за това.
1.4. ПРИНЦИП НА МЕТОДА
Както разпределението на молекулното тегло на пробата, така и нейните средни молекулни тегла (Mn, Mw) могат да се определят чрез GPC. GPC е специален тип течна хроматография, при която пробата се сепарира според хидродинамичните обеми на отделните съставни части (2).
Сепарацията се извършва, като пробата преминава през колона, която е пълна с порест материал, обикновено органичен гел. Малките молекули могат да проникват през порите, докато големите молекули не могат. Следователно пътеката на по-големите молекули е по-къса и те елуират първи. Молекулите със среден размер проникват през някои от порите и елуират по-късно. Най-малките молекули, със среден хидродинамичен радиус, по-малък от този на порите на гела, могат да проникват през всички пори. Те елуират последни.
В идеалния случай сепарацията се контролира изцяло от размера на молекулните видове, но на практика е трудно да се избегнат поне някои от абсорбционните ефекти, които смущават процеса. Неравномерната облицовка на колоната и мъртвите обеми могат да влошат ситуацията (2).
Детекцията се извършва например чрез рефрактивен индекс или UV-абсорбция и се получава проста крива на разпределението. За да се прибавят обаче действителните стойности на молекулните тегла към кривата, е необходимо да се калибрира колоната, като през нея се пуснат полимери с познато молекулно тегло и в идеалния случай, с доста широка подобна структура, например различни полистиролови стандарти. Резултатът е типична крива на Gaussian, на места изкривена от малка опашка по посока на страната с ниско молекулно тегло, като вертикалната ос показва количеството по тегло на различните елуирани видове молекулни тегла, а хоризонталната ос показва регистрираното молекулно тегло.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Повторяемостта (относителното стандартно отклонение — Relative Standard Deviation (RSD) на елуиращия обем трябва да бъде по-добра от 0,3 %. Желаната повторяемост на анализа трябва да се гарантира чрез корекция през вътрешен стандарт, ако хроматограмата се оценява в зависимост от времето и не отговаря на горепосочените критерии (1). Полидисперсностите зависят от молекулните тегла на стандартите. В случая с полистироловите еталони типичните стойности са:
|
Mp < 2 000
|
Mw/Mn < 1,20
|
|
2 000 ≤ Mp ≤ 106
|
Mw/Mn < 1,05
|
|
Mp > 106
|
Mw/Mn < 1,20
|
(Мр е молекулното тегло на еталона при максималния пик)
1.6. ОПИСАНИЕ НА ИЗПИТВАТЕЛНИЯ МЕТОД
1.6.1. Подготовка на стандартните полистиролови разтвори
Полистироловите стандарти се разтварят чрез внимателно смесване в избрания елуент. При подготовката на разтворите трябва да се вземат предвид препоръките на производителя.
Концентрациите на избраните стандарти зависят от различни фактори, например обем на инжектиране, вискозитет на разтвора и чувствителност на аналитичния детектор. Максималният обем на инжектиране трябва да се адаптира към дължината на колоната, с цел да се избегне претоварване. Типичните обеми на инжектиране за аналитична сепарация чрез GPC с колона 30 cm х 7,8 mm обикновено са между 40 и 100 μl. Възможни са и по-големи обеми, но те не трябва да превишават 250 μl. Оптималното съотношение между обема на инжектиране и концентрацията трябва да се определи преди действителната калибровка на колоната.
1.6.2. Подготовка на разтвора проба
Принципно при подготовката на разтворите проби се прилагат същите изисквания. Мострата се разтваря в подходящ разтворител, например тетрахидрофуран (THF), чрез старателно разклащане. Тя не трябва при никакви обстоятелства да се разтваря с помощта на ултразвукова баня. Когато е необходимо, разтворът проба се пречиства през мембранен филтър с размер на порите между 0,2 и 2 μm.
Присъствието на неразтворени частици трябва да се отчете във финалния протокол, тъй като тези частици може да се дължат на високомолекулни видове. Трябва да се използва подходящ метод за определяне процента на теглото на разтворените частици. Разтворите трябва да се използват в рамките на 24 часа.
1.6.3. Апаратура
|
—
|
резервоар за разтворител,
|
|
—
|
дегазатор (когато е уместно),
|
|
—
|
гасител на пулсации (когато е уместно),
|
|
—
|
разходомер за дебит (когато е уместно),
|
|
—
|
процесор-рекордер за данни,
|
Трябва да се гарантира, че GPC системата е инертна по отношение на използваните разтворители (например чрез използване на стоманени капиляри за THF-разтворителя).
1.6.4. Система за инжектиране и подаване на разтворител
Към колоната се подава определен обем разтвор на пробата, автоматично или ръчно, в строго определена зона. Твърде бързото издърпване или натискане на буталото на помпата, ако се прави ръчно, може да причини промени в наблюдаваното разпределение на молекулното тегло. Системата за подаване на разтворител трябва, доколкото е възможно, да няма пулсации, включвайки гасител на пулсации в идеалния случай. Дебитът е от порядъка на 1 ml/min.
1.6.5. Колона
В зависимост от пробата полимерът може да се охарактеризира или с помощта на проста колона, или чрез няколко колони, свързани последователно. На пазара се предлагат порести материали за колони с определени свойства (например размер на порите, лимити на изключване). Изборът на сепарационен гел или на дължина на колоната зависи както от свойствата на пробата (хидродинамични обеми, разпределение на молекулното тегло), така и от специфичните условия за сепарация като разтворител, температура и дебит (1) (2) (3).
1.6.6. Теоретични пластини
Колоната или комбинацията от колони, използвани за сепарация, трябва да се охарактеризират чрез броя на теоретичните пластини. Това включва, в случая на THF като елуиращ разтворител, подаване на разтвор на етилбензол или друг подходящ неполярен разтвор към колона с позната дължина. Броят на теоретичните пластини се определя чрез следното уравнение:
|

|
или:
|

|
където:
|
N
|
=
|
броя на теоретичните пластини
|
|
Ve
|
=
|
елуиращия обем при максималния пик
|
|
W
|
=
|
пика на широчината на базовата линия
|
|
W1/2
|
=
|
пиковата широчина при половин височина.
|
1.6.7. Сепарационна производителност
Освен броя на теоретичните пластини, който е количество, определящо широчината на зоната, известна роля играе и сепарационната производителност, която се определя от стръмността на калибрационната крива. Сепарационната производителност на една колона се получава от следната зависимост:
където:
|
Vey, Mx
|
=
|
елуиращия обем за полистирол с молекулно тегло Мх
|
|
Vey(10Mx)
|
=
|
елуиращия обем за полистирол с 10 пъти по-голямо молекулно тегло.
|
Резолюцията на системата обикновено се определя, както следва:

където:
|
Ve1, Ve2
|
=
|
елуиращите обеми на двата полистиролови стандарта в максималния пик
|
|
W1, W2
|
=
|
пиковите широчини в базовата линия
|
|
M1, M2
|
=
|
молекулните тегла в максималния пик (трябва да се различават с коефициент 10).
|
R-стойността на системата колони трябва да бъде по-голяма от 1,7 (4).
1.6.8. Разтворители
Всички разтворители трябва да бъдат с висока чистота (за THF ce използва чистота 99,5 %). Резервоарът за разтворител (ако е необходимо в атмосфера от инертен газ) трябва да е достатъчно голям за калибровката на колоната и няколко анализа на проби. Разтворителят трябва да се дегазира, преди да бъде транспортиран през помпата.
1.6.9. Температурен контрол
Температурата на критичните вътрешни компоненти (инжекторна верига, колони, детектор и тръбна инсталация) трябва да бъде постоянна и съвместима с избора на разтворител.
1.6.10. Детектор
Предназначението на детектора е да отчита количествено концентрацията на пробата, елуирала от колоната. С цел да се избегне ненужното разширяване на пиковете, обемът на кюветката на детекторната клетка трябва да се поддържа възможно най-малък. Той не трябва да бъде по-голям от 10 μ1, освен при разсейване и детектори за вискозитет. За детекция обикновено се използва диференциална рефрактометрия. Въпреки това, ако специфичните свойства на пробата или на елуиращия разтвор го изискват, може да се използват други видове детектори, например UV/VIS, IR, детектори за вискозитет и т.н.
2. ДАННИ И ОТЧИТАНЕ
2.1. Данни
Подробните оценъчни критерии, както и изискванията относно събирането и обработката на данни, са посочени в DIN стандарт (1).
За всяка проба трябва да се извършат два независими опита. Те се анализират индивидуално.
При всяко измерване се обезпечават Mn, Mw, Mw/Mn и Мр. Необходимо е изрично да се посочи, че измерените стойности са относителни стойности, еквивалентни на молекулните тегла на използвания стандарт.
След определяне на обемите на задържане или времената на задържане (които може да са коригирани чрез вътрешен стандарт), регистрираните Мр стойности (Мр като максимален пик на калибрационния стандарт) се изчертават спрямо едно от тези количества. Необходими са поне две калибрационни точки за десет молекулни тегла и поне пет измервателни точки за цялата крива, които трябва да покриват очакваното молекулно тегло на пробата. Прекъсващата точка с нискомолекулно тегло на калибрационната крива се определя от n-хексилбензола или друг подходящ неполярен разтворител. Бройните и тегловните средни молекулни тегла обикновено се определят с помощта на електронна обработка на данните, на базата на формулите в точка 1.2. В случай че се използва ръчна цифровизация на данните, може да се обърнете към ASTM D 3536-91 (3).
Кривата на разпределението трябва да се направи под формата на таблица или като диаграма (диференциална честота или сума на процентите спрямо отчетените М). При графичното представяне една декада от молекулни тегла трябва да има около 4 cm широчина и максималният пик да има около 8 cm височина. При интегрални криви на разпределение разликата в ординатата между 0 и 100 % трябва да бъде около 10 cm.
2.2. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Протоколът от изпитването трябва да включва следна информация:
2.2.1. Изпитвано вещество
|
—
|
налична информация за изпитваното вещество (идентичност, добавки, примеси),
|
|
—
|
описания на обработката на пробата, наблюдения, проблеми.
|
2.2.2. Оборудване
|
—
|
резервоар за елуент, инертен газ, дегазиране на елуента, състав на елуента, примеси,
|
|
—
|
помпа, гасител на пулсации, инжекторна система,
|
|
—
|
сепарационни колони (производител, пълна информация за характеристиките на колоните, като размер на порите, вид на сепарационния материал, брой, дължина и ред на използваните колони),
|
|
—
|
брой на теоретичните пластини на колоната (или комбинацията от колони), сепарационна производителност (резолюция на системата),
|
|
—
|
информация за симетрията на пиковете,
|
|
—
|
температура на колоната, вид на температурния контрол,
|
|
—
|
детектор (принцип на измерване, тип, обем на кюветката),
|
|
—
|
разходомер, ако се използва (производител, принцип на измерване),
|
|
—
|
система за записване и обработка на данните (хардуер и софтуер).
|
2.2.3. Калибровка на системата
|
—
|
подробно описание на метода, използван за построяване на калибрационната крива,
|
|
—
|
информация за критериите за качество при този метод (например корелационен коефициент, квадратична сума на грешките и т.н.),
|
|
—
|
информация за всички екстраполации, допускания и приближения, направени по време на експерименталната процедура, а също и за оценката и обработката на данните,
|
|
—
|
всички измервания, използвани за построяване на калибрационната крива, трябва да са документирани в таблица, която включва следната информация за всяка калибрационна точка:
|
—
|
производител на пробата,
|
|
—
|
характерни стойности на стандартите Мр, Mn, Mw и Mw/Mn, дадени от производителя или получени при последващи измервания, заедно с подробностите за метода на определяне,
|
|
—
|
инжекторен обем или инжекторна концентрация,
|
|
—
|
стойност на Мр, използвана за калибровка,
|
|
—
|
елуиращ обем или коригирано време на задържане, измерено в максималния пик,
|
|
—
|
Мр, изчислено при максималния пик,
|
|
—
|
процентна грешка на изчисленото Мр и калибрационната стойност.
|
|
2.2.4. Оценка
|
—
|
оценка на база време: методи, използвани за обезпечаване на необходимата възпроизводимост (метод на корекция, вътрешен стандарт и т.н.),
|
|
—
|
информация дали оценката е била извършена на базата на елуиращия обем или на базата на времето на задържане,
|
|
—
|
информация за лимитите на оценката, ако пикът не е напълно анализиран,
|
|
—
|
описание на методите за изглаждане, ако са използвани такива,
|
|
—
|
подготовка и предварителни процедури преди обработката на пробата,
|
|
—
|
наличие на неразтворени частици, ако има,
|
|
—
|
инжекторен обем (μ1) и инжекторна концентрация (mg/ml),
|
|
—
|
наблюдения, посочващи ефекти, които водят до отклонения от идеалния GPC профил,
|
|
—
|
подробно описание на всички модификации в изпитвателните процедури,
|
|
—
|
подробности за диапазоните на грешките,
|
|
—
|
всякаква друга информация и наблюдения, подходящи за интерпретация на резултатите.
|
3. ПРЕПРАТКИ
|
(1)
|
DIN 55672, 1995. Gelpermeationschromatographie (GPC) mit Tetrahydrofuran (THF) als Elutionsmittel, Teil 1.
|
|
(2)
|
Yau, W. W., Kirkland, J. J., and Bly, D. D. eds, 1979. Modern Size Exclusion Liquid Chromatography, J. Wiley and Sons.
|
|
(3)
|
ASTM D 3536-91, 1991. Standard Test Method for Molecular Weight Averages and Molecular Weight Distribution by Liquid Exclusion Chromatography (Gel Permeation Chromatography – GPC). American Society for Testing and Materials, Philadelphia, Pennsylvania.
|
|
(4)
|
ASTM D 5296-92, 1992. Standard Test Method for Molecular Weight Averages and Molecular Weight Distribution of Polystyrene by High Performance Size-Exclusion Chromatography. American Society for Testing and Materials, Philadelphia, Pennsylvania.
|
Допълнение
Примери за други методи за определяне на средното бройно молекулно тегло (Мn) за полимери
Хроматографският метод с гел инфилтрация (GPC) е предпочитаният метод за определяне на Мn, особено когато има набор от стандарти, чиято структура е сравнима с полимерната структура. Независимо от това, било поради практически трудности при използването на GPC, или поради очакването, че веществото няма да отговори на задължителните критерии за Мn (което води до потвърждаване), се срещат алтернативни методи, като например:
1. Употреба на колигативни свойства
|
1.1.
|
Ебулиоскопия/криоскопия:
включва измерване на повишаването на точката на кипене (ебулиоскопия) или понижаването на точката на замръзване (криоскопия) на разтворител при прибавяне на полимер. Този метод се базира на факта, че ефектът от разтворения полимер върху точката на кипене/замръзване на течността зависи от молекулното тегло на полимера (1) (2).
Приложимост: Мn < 20 000.
|
|
1.2.
|
Понижаване на парното налягане:
включва измерване на парното налягане на избрана еталонна течност преди и след прибавянето на определени количества полимер (1) (2).
Приложимост: Мn < 20 000 (теоретично; на практика обаче е лимитирана стойност).
|
|
1.3.
|
Мембранна осмометрия:
основава се на принципа на осмозата, т.е. естествената тенденция на молекулите на разтворителя да преминават през полупропускливата мембрана от разреден към концентриран разтвор, за да се получи равновесие. При изпитването разреденият разтвор е с нулева концентрация, докато концентрираният разтвор съдържа полимера. Ефектът на преминаване на разтворителя през мембраната причинява разлика в налягането, която зависи от концентрацията и молекулното тегло на полимера (1) (3) (4).
Приложимост: Mn между 20 000 и 200 000.
|
|
1.4.
|
Осмометрия в нарова фаза:
включва сравнение на скоростта на изпаряване на чист аерозолен разтворител спрямо поне три аерозола, съдържащи полимера в различни концентрации (1) (5) (6).
Приложимост: Мn < 20 000.
|
2. Анализ на групата, прекъсваща нарастването на веригата
За да се използва този метод, са необходими както познания за общата структура на полимерите, така и за естеството на групите, прекъсващи нарастването на веригата (която трябва да се разграничава от основния скелет например по NMR или титруване/дериватизация). Определянето на молекулната концентрация на прекъсващите групи, присъстващи в полимера, може да доведе до стойност за молекулното тегло (7) (8) (9).
Приложимост: Мn до 50 000 (с намаляваща надеждност).
3. Препратки
|
(1)
|
Billmeyer, F. W. Jr., 1984. Textbook of Polymer Science, 3rd Ed., John Wiley, New York.
|
|
(2)
|
Glover, C. A., 1975. Absolute Colligative Property Methods. Chapter 4. In: Polymer Molecular Weights, Part I, P. E. Slade, Jr. ed., Marcel Dekker, New York.
|
|
(3)
|
ASTM D 3750-79, 1979. Standard Practice for Determination of Number-Average Molecular Weight of Polymers by Membrane Osmometry. American Society for Testing and Materials, Philadelphia, Pennsylvania.
|
|
(4)
|
Coll, H., 1989. Membrane Osmometry. In: Determination of Molecular Weight, A. R. Cooper ed., J. Wiley and Sons, pp. 25 to 52.
|
|
(5)
|
ASTM 3592-77, 1977. Standard Recommended Practice for Determination of Molecular Weight by Vapour Pressure, American Society for Testing and Materials, Philadelphia, Pennsylvania.
|
|
(6)
|
Morris, C. E. M., 1989. Vapour Pressure Osmometry. In: Determination of Molecular Weight, A. R. Cooper ed., John Wiley and Sons.
|
|
(7)
|
Schrîder, E., Müller, G., and Arndt, K-F., 1989. Polymer Characterisation, Carl Hanser Verlag, Munich.
|
|
(8)
|
Garmon, R. G., 1975. End-Group Determinations, Chapter 3. In: Polymer Molecular Weights, Part I, P. E. Slade, Jr. ed. Marcel Dekker, New York.
|
|
(9)
|
Amiya, S., et al., 1990. Pure and Applied Chemistry, 62, 2139-2146.
|
A.19. НИСКОМОЛЕКУЛНО ТЕГЛОВНО СЪДЪРЖАНИЕ НА ПОЛИМЕРИ
1. МЕТОД
Този хроматографски метод с гел инфилтрация е точно копие на метода ОИСР TG 119 (1996 г.). Основните принципи и по-подробна техническа информация са дадени в препратките.
1.1. УВОД
Тъй като свойствата на полимерите са много разнообразни, не е възможно да се опише един-единствен метод, установяващ точно условията за сепарация и оценка, който да обхваща възможностите и спецификата, които се получават при сепарацията на полимерите. По-специално сложните полимерни системи често не се поддават на хроматография с гел инфилтрация (GPC). Когато GPC е неприложима, молекулното тегло се определя с помощта на други методи (вж. допълнението). В такива случаи пълните подробности и оценката се правят на базата на използвания метод.
Описаният метод се базира на DIN стандарта 55672 (1). В този DIN стандарт може да се намери подробна информация как да се извършат изпитванията и как да се оценят данните. В случай че са необходими модификации на условията на изпитване, тези промени трябва да бъдат оправдани. Могат да се използват и други стандарти, ако са напълно подходящи. Описаният метод използва проби от полистирол с позната полидисперсност за калибровка и може да се наложи да бъде променен, с цел да бъде подходящ за определени полимери, например водоразтворими полимери и полимери с дълги разклонени вериги.
1.2. ОПРЕДЕЛЕНИЯ И МЕРНИ ЕДИНИЦИ
Нискомолекулното тегло условно се определя като молекулно тегло под 1 000 далтона.
Средното бройно молекулно тегло Мn и средното тегловно молекулно тегло Mw ce определят с помощта на следните уравнения:
където:
|
Hi
|
=
|
нивото на детекторния сигнал от базовата линия на обема на задържане Vi,
|
|
Mi
|
=
|
молекулното тегло на полимерната фракция при обема на задържане Vi, и n броя на точките с данни.
|
Широчината на разпределение на молекулното тегло, която е мярка за дисперсността на системата, се изразява чрез съотношението Mw/Mn.
1.3. ЕТАЛОННИ ВЕЩЕСТВА
Тъй като GPC е относителен метод, трябва да се извърши калибровка. За целта обикновено се използват полистиролови стандарти с линеен строеж и тясно разпределение, с познати средни молекулни тегла Мn и Mw и познато молекулно тегловно разпределение. Калибрационната крива може да се използва само при определяне на молекулното тегло на непозната проба, ако условията за разделяне на пробата и стандартите са били подбрани по идентичен способ.
Една установена връзка между молекулното тегло и елуиращия обем е валидна само при специфичните условия на даденото изпитване. Условията включват преди всичко температурата, разтворителя (или сместа от разтворители), хроматографските условия и сепарационната колона или система от колони.
Молекулните тегла на пробата, определени по този начин, са относителни стойности и се описват като „полистиролови еквивалентни молекулни тегла“. Това означава, че в зависимост от структурните и химическите различия между пробата и стандартите, молекулните тегла могат да се отклоняват от абсолютните стойности в по-голяма или по-малка степен. Ако се използват други стандарти, например полиетиленгликол, полиетиленов окис, полиметил метакрилат, полиакрилна киселина, трябва да се посочи причината за това.
1.4. ПРИНЦИП НА ИЗПИТВАТЕЛНИЯ МЕТОД
Както разпределението на молекулното тегло на пробата, така и нейните средни молекулни тегла (Mn, Mw) могат да се определят чрез GPC. GPC е специален тип течна хроматография, при която пробата се сепарира според хидродинамичните обеми на отделните съставни части (2).
Сепарацията се извършва, като пробата преминава през колона, която е пълна с порест материал, обикновено органичен гел. Малките молекули могат да проникват през порите, докато големите молекули не могат. Следователно пътят на по-големите молекули е по-къс и те елуират първи. Молекулите със среден размер проникват през някои от порите и елуират по-късно. Най-малките молекули, със среден хидродинамичен радиус, по-малък от този на порите на гела, могат да проникват през всички пори. Те елуират последни.
В идеалния случай сепарацията се контролира изцяло от размера на молекулните видове, но на практика е трудно да се избегнат поне някои от абсорбционните ефекти, които смущават процеса. Неравномерната облицовка на колоната и мъртвите обеми могат да влошат ситуацията (2).
Детекцията се извършва например чрез рефрактивен индекс или UV-абсорбция и се получава проста крива на разпределението. За да се прибавят обаче действителните стойности на молекулните тегла към кривата, е необходимо да се калибрира колоната, като през нея се пуснат полимери с известно молекулно тегло и в идеалния случай с доста широка подобна структура, например различни полистиролови стандарти. Резултатът е типична крива на Gaussian, на места изкривена от малка опашка по посока на страната с ниско молекулно тегло, като вертикалната ос показва количеството по тегло на различните елуирани видове молекулни тегла, а хоризонталната ос показва регистрираното молекулно тегло.
Съдържанието на нискомолекулно тегло се получава от тази крива. Изчислението може да бъде точно само ако нискомолекулните видове реагират еквивалентно на база маса спрямо полимера като цяло.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Повторяемостта (относителното стандартно отклонение — Relative Standard Deviation (RSD) на елуиращия обем трябва да бъде по-добра от 0,3 %. Желаната повторяемост на анализа трябва да се гарантира чрез корекция през вътрешен стандарт, ако хроматограмата се оценява в зависимост от времето и не отговаря на горепосочените критерии (1). Полидисперсностите зависят от молекулните тегла на стандартите. В случая с полистироловите еталони типичните стойности са:
|
Mp < 2 000
|
Mw/Mn < 1,20
|
|
2 000< Mp
< 106
|
Mw/Mn < 1,05
|
|
Mp > 106
|
Mw/Mn < 1,20
|
(Мр е молекулното тегло на еталона при максималния пик)
1.6. ОПИСАНИЕ НА ИЗПИТВАТЕЛНИЯ МЕТОД
1.6.1. Подготовка на стандартните полистиролови разтвори
Полистироловите стандарти се разтварят чрез внимателно смесване в избрания елуент. При подготовката на разтворите трябва да се вземат предвид препоръките на производителя.
Концентрациите на избраните стандарти зависят от различни фактори, например обем на инжектиране, вискозитет на разтвора и чувствителност на аналитичния детектор. Максималният обем на инжектиране трябва да се адаптира към дължината на колоната, с цел да се избегне претоварване. Типичните обеми на инжектиране за аналитична сепарация чрез GPC с колона 30 cm х 7,8 mm, са обикновено между 40 и 100 μl. Възможни са и по-големи обеми, но те не трябва да превишават 250 μl. Оптималното съотношение между обема на инжектиране и концентрацията трябва да се определи преди действителната калибровка на колоната.
1.6.2. Подготовка на разтвора проба
Принципно при подготовката на разтворите проби се прилагат същите изисквания. Мострата се разтваря в подходящ разтворител, например тетрахидрофуран (THF), чрез старателно разклащане. Тя не трябва при никакви обстоятелства да се разтваря с помощта на ултразвукова баня. Когато е необходимо, разтворът проба се пречиства през мембранен филтър с размер на порите между 0,2 и 2 μm.
Присъствието на неразтворени частици трябва да се отчете във финалния протокол, тъй като тези частици може да се дължат на високомолекулни видове. Трябва да се използва подходящ метод за определяне процента на теглото на разтворените частици. Разтворите трябва да се използват в рамките на 24 часа.
1.6.3. Корекция на съдържанието на примеси и добавки
Обикновено не се налага корекцията на съдържанието на видове с M < 1 000 поради приноса от присъстващите неполимерни специфични компоненти (например примеси и/или добавки), освен ако измереното съдържание вече е < 1 %. Това се постига чрез пряк анализ за полимерния разтвор или GPC елуат.
В случаите, когато елуатът, след преминаване през колоната, е твърде разреден за по-нататъшен анализ, той трябва да се концентрира. За целта може би ще е необходимо да се изпари елуатът до изсушаване и да се разтвори отново. Концентрацията на елуата трябва да се извърши при условия, които да не допускат никакви промени в елуата. Обработката на елуата след GPC зависи от използвания аналитичен метод за количествено определяне.
1.6.4. Апаратура
GPC-апаратурата се състои от следните компоненти:
|
—
|
резервоар за разтворител,
|
|
—
|
дегазатор (ако е необходимо),
|
|
—
|
гасител на пулсации (ако е необходимо),
|
|
—
|
разходомер за дебит (ако е необходимо),
|
|
—
|
процесор-рекордер за данни,
|
Трябва да се гарантира, че GPC системата е инертна по отношение на използваните разтворители (например, чрез използване на стоманени капиляри за THF-разтворителя).
1.6.5. Система за инжектиране и подаване на разтворител
Към колоната се подава определен обем разтвор на пробата или автоматично, или ръчно в строго определена зона. Твърде бързото издърпване или натискане на буталото на помпата, ако се прави ръчно, може да причини промени в наблюдаваното разпределение на молекулното тегло. Системата за подаване на разтворител трябва, доколкото е възможно, да няма пулсации, включвайки гасител на пулсации в идеалния случай. Дебитът е от порядъка на 1 ml/min.
1.6.6. Колона
В зависимост от пробата полимерът може да се охарактеризира или с помощта на проста колона, или чрез няколко колони, свързани последователно. На пазара се предлагат порести материали за колони с определени свойства (например размер на порите, лимити на изключване). Изборът на сепарационен гел или на дължина на колоната зависи както от свойствата на пробата (хидродинамични обеми, разпределение на молекулното тегло), така и от специфичните условия за сепарация, като разтворител, температура и дебит (1) (2) (3).
1.6.7. Теоретични пластини
Колоната или комбинацията от колони, използвана(и) за сепарация, трябва да се охарактеризира(т) чрез броя на теоретичните пластини. Това включва, в случая на THF като елуиращ разтворител, подаване на разтвор на етилбензол или друг подходящ неполярен разтвор към колона с известна дължина. Броят на теоретичните пластини се определя чрез следното уравнение:
|

|
или
|

|
където:
|
N
|
=
|
броя на теоретичните пластини
|
|
Ve
|
=
|
елуиращия обем при максималния пик
|
|
W
|
=
|
пика на широчината на базовата линия
|
|
W1/2
|
=
|
е пиковата широчина при половин височина
|
1.6.8. Сепарационна производителност
Освен броя на теоретичните пластини, който е количество, определящо широчината на зоната, известна роля играе и сепарационната производителност, която се определя от стръмността на калибрационната крива. Сепарационната производителност на една колона се получава от следната зависимост:

|
VeyMx
|
=
|
елуиращия обем за полистирол с молекулно тегло Мх
|
|
Vеу(10Мх)
|
=
|
елуиращия обем за полистирол с 10 пъти по-голямо молекулно тегло.
|
Резолюцията на системата обикновено се определя, както следва:

където,
|
Ve1, Ve2
|
=
|
елуиращите обеми на двата полистиролови стандарта в максималния пик
|
|
W1, W2
|
=
|
пиковите широчини в базовата линия
|
|
M1, M2
|
=
|
молекулните тегла в максималния пик (трябва да се различават с коефициент 10).
|
R-стойността на системата колони трябва да бъде по-голяма от 1,7 (4).
1.6.9. Разтворители
Всички разтворители трябва да бъдат с висока чистота (за THF ce използва чистота 99,5 %). Резервоарът за разтворител (ако е необходимо в атмосфера от инертен газ) трябва да е достатъчно голям за калибровката на колоната и няколко анализа на проби. Разтворителят трябва да се дегазира, преди да бъде транспортиран през помпата.
1.6.10. Температурен контрол
Температурата на критичните вътрешни компоненти (инжекторна верига, колони, детектор и тръбна инсталация) трябва да бъде постоянна и съвместима с избора на разтворител.
1.6.11. Детектор
Предназначението на детектора е да отчита количествено концентрацията на пробата, елуирала от колоната. С цел да се избегне ненужното разширяване на пиковете, обемът на кюветката на детекторната клетка трябва да се поддържа възможно най-малък. Той не трябва да бъде по-голям от 10 μl, освен при разсейване и детектори за вискозитет. За детекция обикновено се използва диференциална рефрактометрия. Въпреки това, ако специфичните свойства на пробата или на елуиращия разтвор го изискват, може да се използват други видове детектори, например UV/VIS, IR, детектори за вискозитет и т.н.
2. ДАННИ И ОТЧИТАНЕ
2.1. ДАННИ
Подробните оценъчни критерии, както и изискванията относно събирането и обработката на данни, са посочени в DIN стандарт (1).
За всяка проба трябва да се извършат два независими опита. Те се анализират индивидуално. При всички случаи е важно да се определят също данните от контролните опити, обработени при същите условия както пробата.
Необходимо е изрично да се посочи, че измерените стойности са относителни стойности, еквивалентни на молекулните тегла на използвания стандарт.
След определяне на обемите на задържане или времената на задържане (които може да са коригирани чрез вътрешен стандарт), регистрираните Мр стойности (Мр като максимален пик на калибрационния стандарт) се изчертават спрямо едно от тези количества. Необходими са поне две калибрационни точки за една декада молекулни тегла и поне пет измервателни точки за цялата крива, които трябва да покриват очакваното молекулно тегло на пробата. Прекъсващата точка с нискомолекулно тегло на калибрационната крива се определя от n-хексилбензола или друг подходящ неполярен разтворител. Частта от кривата, съответстваща на молекулни тегла под 1 000, се определя и коригира, както е необходимо за примеси и добавки. Елуиращите криви обикновено се оценяват чрез електронна обработка на данните. В случай че се използва ръчна цифровизация на данните, може да направите справка в ASTM D 3536-91 (3).
Ако в колоната се задържи някакъв неразтворим полимер, неговото молекулно тегло вероятно ще бъде по-високо от това на разтворимата фракция и ако не се отчете, ще резултира в надценяване на съдържанието на нискомолекулно тегло. В допълнението е дадено ръководство за съдържание на нискомолекулно тегло за неразтворим полимер.
Кривата на разпределението трябва да се направи под формата на таблица или като диаграма (диференциална честота или сума на процентите спрямо отчетените М). При графичното представяне една декада от молекулни тегла трябва да има около 4 cm широчина и максималният пик да има около 8 cm височина. При интегралните криви на разпределение разликата в ординатата между 0 и 100 % трябва да бъде около 10 cm.
2.2. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Протоколът от изпитването трябва да включва следна информация:
2.2.1. Изпитвано вещество
|
—
|
налична информация за изпитваното вещество (идентичност, добавки, примеси),
|
|
—
|
описания на обработката на пробата, наблюдения, проблеми.
|
2.2.2. Оборудване
|
—
|
резервоар за елуент, инертен газ, дегазиране на елуента, състав на елуента, примеси,
|
|
—
|
помпа, гасител на пулсации, инжекторна система,
|
|
—
|
сепарационни колони (производител, пълна информация за характеристиките на колоните, като размер на порите, вид на сепарационния материал, брой, дължина и ред на използваните колони),
|
|
—
|
брой на теоретичните пластини на колоната (или комбинацията от колони), сепарационна производителност (резолюция на системата),
|
|
—
|
информация за симетрията на пиковете,
|
|
—
|
температура на колоната, вид на температурния контрол,
|
|
—
|
детектор (принцип на измерване, тип, обем на кюветката),
|
|
—
|
разходомер, ако се използва (производител, принцип на измерване),
|
|
—
|
система за записване и обработка на данните (хардуер и софтуер).
|
2.2.3. Калибровка на системата
|
—
|
подробно описание на метода, използван за построяване на калибрационната крива,
|
|
—
|
информация за критериите за качество при този метод (например корелационен коефициент, квадратична сума на грешките и т.н.),
|
|
—
|
информация за всички екстраполации, допускания и приближения, направени по време на изпитвателната процедура, а също и за оценката и обработката на данните,
|
|
—
|
всички измервания, използвани за построяване на калибрационната крива, трябва да са документирани в таблица, която включва следната информация за всяка калибрационна точка:
|
—
|
производител на пробата,
|
|
—
|
характерни стойности на стандартите Мр, Mn, Mw и Mw/Mn, дадени от производителя или получени при последващи измервания, заедно с подробностите за метода на определяне,
|
|
—
|
инжекторен обем или инжекторна концентрация,
|
|
—
|
стойност на Мр, използвана за калибровка,
|
|
—
|
елуиращ обем или коригирано време на задържане, измерено в максималния пик,
|
|
—
|
Мр, изчислено при максималния пик,
|
|
—
|
процентна грешка на изчисленото Мр и калибрационната стойност.
|
|
2.2.4. Информация за съдържанието на полимер с нискомолекулно тегло
|
—
|
описание на методите, използвани в анализа, и начина, по който са проведени изпитванията,
|
|
—
|
информация за процента на съдържанието на видове полимери с нискомолекулно тегло (т/т), отнесен към общата проба,
|
|
—
|
информация за примесите, добавките и други неполимерни видове, в тегловен процент, отнесен към общата проба.
|
2.2.5. Оценка
|
—
|
оценка на база време: всички методи, използвани за обезпечаване на необходимата възпроизводимост (метод на корекция, вътрешен стандарт и т.н.),
|
|
—
|
информация дали оценката е била извършена на базата на елуиращия обем, или на базата на времето на задържане,
|
|
—
|
информация за лимитите на оценката, ако пикът не е напълно анализиран,
|
|
—
|
описание на методите за изглаждане, ако са използвани такива,
|
|
—
|
подготовка и предварителни процедури преди обработката на пробата,
|
|
—
|
наличие на неразтворени частици, ако има,
|
|
—
|
инжекторен обем (μl) и инжекторна концентрация (mg/ml),
|
|
—
|
наблюдения, посочващи ефекти, които водят до отклонения от идеалния GPC-профил,
|
|
—
|
подробно описание на всички модификации в изпитвателните процедури,
|
|
—
|
подробности за диапазоните на грешките,
|
|
—
|
всякаква друга информация и наблюдения, подходящи за интерпретация на резултатите.
|
3. ПРЕПРАТКИ
|
(1)
|
DIN 55672, 1995. Gelpermeationschromatographie (GPC) mit Tetrahydrofuran (THF) als Elutionsmittel, Teil 1.
|
|
(2)
|
Yau, W. W., Kirkland, J. J., and Bly, D. D. eds., 1979. Modem Size Exclusion Liquid Chromatography, J. Wiley and Sons.
|
|
(3)
|
ASTM D 3536-91, 1991. Standard Test method for Molecular Weight Averages and Molecular Weight Distribution by Liquid Exclusion Chromatography (Gel Permeation Chromatography — GPC). American Society for Testing and Materials, Philadelphia, Pennsylvania.
|
|
(4)
|
ASTM D 5296-92, 1992. Standard Test method for Molecular Weight Averages and Molecular Weight Distribution of Polystyrene by High Performance Size-Exclusion Chromatography. American Society for Testing and Materials, Philadelphia, Pennsylvania.
|
Допълнение
Ръководство за коригиране на нискомолекулното съдържание за присъствието на неразтворим полимер
Когато в една проба присъства неразтворим полимер, това резултира в загуба на маса по време на GPC-анализа. Неразтворимият полимер необратимо се задържа върху колоната или филтъра за пробата, докато разтворимата част преминава през колоната. В случая, когато може да се изчисли или измери нарастването (dn/dc) на рефрактивния индекс на полимера, е възможно да се изчисли и загубата на маса на пробата в колоната. В този случай се прави корекция с помощта на външна калибровка със стандартни материали с познати концентрация и dn/dc, за да се калибрира реакцията на рефрактометъра. В дадения тук пример е използван поли(метилметакрилат) (рММА) стандарт.
При външна калибровка за анализ на акрилни полимери един рММА стандарт с позната концентрация в тетрахидрофуран се анализира чрез GPC и получените данни се използват за намиране на константата на рефрактометъра съгласно уравнението:
K = R/(C × V × dn/dc)
където:
|
K
|
=
|
рефрактометричната константа (в μVs/ml)
|
|
R
|
=
|
реакцията на рММА стандарта (в μVs)
|
|
С
|
=
|
концентрацията на рММА стандарта (в mg/ml)
|
|
V
|
=
|
инжекторния обем (в ml), и
|
|
dn/dc
|
=
|
нарастването на рефрактивния индекс за рММА в тетрахидрофуран (в ml/mg).
|
Следните данни са типични за един рММА стандарт:
|
R
|
=
|
2 937 891
|
|
С
|
=
|
1,07 mg/ml
|
|
V
|
=
|
0,1 ml
|
|
dn/dc
|
=
|
9 х 105 ml/mg
|
Резултантната стойност K, 3,05 х 1011, се използва за изчисляване на теоретичната детекторна реакция, ако 100 % от инжектирания полимер е елуирал през детектора.
А.20. ПОВЕДЕНИЕ НА РАЗТВАРЯНЕ/ЕКСТРАКЦИЯ НА ПОЛИМЕРИ ВЪВ ВОДА
1. МЕТОД
Описаният метод е точно копие на преработената версия на ОИСР TG 120 (1997 г.). По-подробна техническа информация е дадена в препратка (1).
1.1. УВОД
За някои полимери, като емулсионните полимери например, вероятно ще бъде необходима първоначална подготвителна работа, преди да се използва описаният по-долу метод. Този метод не е приложим за течни полимери и за полимери, които взаимодействат с вода при условията на изпитването.
Когато методът не е практичен или възможен, поведението на разтваряне/екстракция може да се изследва чрез други методи. В такива случаи трябва да се дадат пълни подробности и причини за използвания метод.
1.2. ЕТАЛОННИ ВЕЩЕСТВА
Няма.
1.3. ПРИНЦИП НА ИЗПИТВАТЕЛНИЯ МЕТОД
Поведението на разтваряне/екстракция на полимерите във водна среда се определя с помощта на метода на стъкленицата (вижте А.6 Разтворимост във вода, метод на стъкленицата) с модификациите, описани по-долу.
1.4. КРИТЕРИИ ЗА КАЧЕСТВО
Няма.
1.5. ОПИСАНИЕ НА ИЗПИТВАТЕЛНИЯ МЕТОД
1.5.1. Оборудване
За метода се изисква следното оборудване:
|
—
|
устройство за надробяване, например мелница за производство на частици с определен размер,
|
|
—
|
апаратура за разбъркване с възможност за температурен контрол,
|
|
—
|
мембранна филтърна система,
|
|
—
|
подходящо аналитично оборудване,
|
1.5.2. Подготовка на пробата
Представителната проба първо се довежда до размер на частиците между 0,125 и 0,25 mm с помощта на подходящи сита. Може да е необходимо да се извърши охлаждане за устойчивостта на пробата или за процеса на смилане. Материалите с каучуково естество се раздробяват при температурата на течния азот (1).
Ако не се получи фракция с желания размер на частиците, трябва да се предприемат действия за намаляване на размера на частиците доколкото е възможно и резултатът да се отчете. В протокола е необходимо да се посочи начинът, по който раздробената проба е съхранявана преди изпитването.
1.5.3. Процедура
Три проби по 10 g от изпитваното вещество се претеглят във всеки един от трите съда, снабдени със стъклени запушалки, и към всеки съд се добавят по 1 000 ml вода. Ако се докаже, че количеството от 10 g е непригодно, се използва следващото най-голямо количество и обемът вода се напасва съответно.
Съдовете се запушват плътно и след това се разбъркват при 20 oС. За целта се използва прибор за разбъркване или разклащане, който да работи при постоянна температура. След период от 24 часа съдържанието на всеки съд се центрофугира или филтрира и концентрацията на полимера в бистрата водна фаза се определя чрез подходящ аналитичен метод. Ако няма подходящи аналитични методи за водната фаза, общата разтворимост/екстракция може да се изчисли от сухото тегло на филтърния остатък или центрофугираната утайка.
Обикновено е необходимо да се разграничат количествено примесите и добавките, от една страна, и нискомолекулните видове, от друга. При гравиметричното определяне е важно също да се извърши контролно (празно) изпитване без изпитвано вещество, за да се отчетат остатъците, които се появяват при процедурата на изпитването.
Поведението на разтворимост/екстракция на полимерите във вода при 37 oС и рН 2 и рН 9 се определя по същия начин, както описания по-горе за провеждането на изпитването при 20 oС. Стойностите за рН могат да се постигнат чрез добавяне или на подходящи буферни разтвори, или на подходящи киселини или основи, като солна киселина, оцетна киселина, аналитичен натриев или калиев хидроокис или NH3.
В зависимост от използвания метод за анализ трябва да се извършат едно или две изпитвания. Когато са налице достатъчно специфични методи за директен анализ на водната фаза за полимерния компонент, едно изпитване като описаното по-горе би било достатъчно. Ако обаче не са налице такива методи и определянето на поведението на разтворимост/екстракция на полимера се ограничава до индиректен анализ чрез определяне само на общото съдържание на въглерод (TOC) на водния екстракт, трябва да бъде проведено допълнително изпитване. Това допълнително изпитване също трябва да бъде извършено три пъти, като се използват 10 пъти по-малки проби от полимера и същите количества вода, като тези, използвани в първото изпитване.
1.5.4. Анализ
1.5.4.1. Изпитване, проведено с един обем проба
Съществуват методи за директен анализ на полимерните компоненти във водната фаза. Алтернативно може да се използва и индиректният анализ на разтворени/екстрахирани полимерни компоненти чрез определяне на общото съдържание на разтворими части и коригиране за неполимерни специфични компоненти във водната фаза.
Възможно е да се извърши анализ на водната фаза за общите полимерни видове:
или чрез достатъчно чувствителен метод, например:
|
—
|
TOC, използващ изваряване на персулфат или дихромат, за да се получи СО2, последван от изчисление чрез IR или химичен анализ,
|
|
—
|
атомна абсорбционна спектрометрия (AAS) или нейния индуктивно куплиран плазмен (ICP) емисионен еквивалент за силиций или полимери, съдържащи метали,
|
|
—
|
UV-абсорбция или спектрофлуорометрия за арилни полимери,
|
|
—
|
LC-MS за нискомолекулни проби,
|
или чрез вакуумно изпарение до изсушаване на водния екстракт и спектроскопен (IR, UV и т.н.) или AAS/ICP анализ на остатъка.
Ако анализът на водната фаза като такъв не е приложим, водният екстракт трябва да се екстрахира с органичен разтворител, който не се смесва с вода, например хлориран въглеводород. Разтворителят се изпарява и остатъкът се анализира, както е описано по-горе, за оповестеното съдържание на полимера. Всички компоненти в този остатък, идентифицирани като примеси или добавки, трябва да се извадят за целите на определянето на степента на разтворимост/екстракция на самия полимер.
Когато присъстват относително големи количества от такива материали, може би ще е необходимо да се направи анализ на остатъка, например HPLC или GC анализ, за да се разграничат примесите от мономера и присъстващите видове, получени от мономера, така че да бъде определено истинското съдържание на последния.
В някои случаи може да е достатъчно просто изпаряване на органичния разтворител до изсушаване и претегляне на сухия остатък.
1.5.4.2. Изпитване, проведено с два различни обема проба
Всички водни екстракти се анализират за TOC.
Извършва се гравиметрично определяне на неразтворената/неекстрахиралата част на пробата. Ако след центрофугирането или филтрирането на съдържанието на всеки съд полимерните остатъци останат залепнали към стената на съда, съдът трябва да се изплаква с филтрата, докато се изчисти от всички видими остатъци. След това филтратът отново се центрофугира или филтрира. Остатъците, останали върху филтъра или в центрофугиращата тръба, се изсушават при 40 oС във вакуум и се претеглят. Сушенето продължава, докато се достигне постоянно тегло.
2. ДАННИ
2.1. ИЗПИТВАНЕ, ПРОВЕДЕНО С ЕДИН ОБЕМ ПРОБА
Индивидуалните резултати за всяка от трите колби и средните стойности се посочват и изразяват в единици за маса/обем на разтвора (обикновено mg/1) или за маса на полимера (обикновено mg/g). Освен това се посочва загубата на тегло на пробата (изчислена като тегло на разтвора, разделено на началното тегло на пробата). Трябва да се изчислят и относителните стандартни отклонения (RSD). Посочват се индивидуалните цифри за общото количество вещество (полимер + съществени добавки и т.н.) и само за полимера (т.е. след изваждане на участието от такива добавки).
2.2. ИЗПИТВАНЕ, ПРОВЕДЕНО С ДВА РАЗЛИЧНИ ОБЕМА ПРОБА
Индивидуалните TOC-стойности на водните екстракти на две тройни изпитвания и средната стойност за всяко изпитване се посочват като единици за маса/обем на разтвора (обикновено mgС/l), както и като единици за маса/тегло на първоначалната проба (обикновено mgС/g).
Ако няма разлика между резултатите при най-високото и най-ниското съотношение проба/вода, това може да означава, че всички ектрахируеми компоненти наистина са били екстрахирани. В такъв случай обикновено не е необходим директен анализ.
Индивидуалните тегла на остатъците се посочват и изразяват в процент от началните тегла на пробите. Средните стойности се изчисляват за всяко изпитване. Разликите между 100 и процентите, които се получават, представляват процента на разтворения и екстрахирал материал в първоначалната проба.
3. ОТЧИТАНЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Протоколът от изпитването трябва да включва следна информация:
3.1.1. Изпитвано вещество
|
—
|
налична информация за изпитваното вещество (идентичност, добавки, примеси, съдържание на нискомолекулни видове).
|
3.1.2. Условия на изпитването
|
—
|
описание на използваните процедурите и условията на изпитването,
|
|
—
|
описание на аналитичните методи и методите за детекция.
|
3.1.3. Резултати
|
—
|
резултати за разтворимост/екстрахируемост в mg/1; индивидуални усреднени стойности за изпитването на екстракция при различните разтвори, с разбивка за съдържание на полимер и примеси, добавки и т.н.,
|
|
—
|
резултати за разтворимост/екстрахируемост в mg/g на полимера,
|
|
—
|
TOC-стойности на водни екстракти, тегло на разтвора и изчислените проценти, ако са измерени,
|
|
—
|
информация за контролните стойности,
|
|
—
|
когато е необходимо, указания за химичната неустойчивост на изпитваното вещество, както по време на процеса на изпитване, така и по време на аналитичния процес,
|
|
—
|
цялата информация, която е важна за интерпретацията на резултатите.
|
4. ПРЕПРАТКИ
|
|
DIN 53733, 1976. Zerkleinerung von Kunststofferzeugnissen für Prüfzwecke.
|
A.21. ОКСИДИРАЩИ СВОЙСТВА (ТЕЧНОСТИ)
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Този метод за изпитване е предназначен за измерване на потенциала на вещество в течно състояние да повишава степента си на изгаряне или на интензивността на изгаряне на запалимите вещества, или да образува смес със запалимо вещество, която може спонтанно да се възпламени при пълно смесване на двете вещества. Той се основава на метода на ООН за оксидиращи течности (1) и е еквивалентен на него. Въпреки това, тъй като методът А.21 е предназначен преди всичко да отговори на изискванията на Регламент (ЕО) № 1907/2006, се изисква да се направи сравнение само с едно вещество за сравнение. Може да се наложи провеждането на допълнителни изпитвания и сравнения с други вещества за сравнение, когато се очаква резултатите от изпитването да бъдат използвани за други цели (9).
Този метод не може да бъде използван, когато изследването на структурната формула установи по безспорен начин, че веществото не може да реагира екзотермично със запалим материал.
Полезно е, преди провеждане на изпитването, да има предварителна информация за евентуалните експлозивни свойства на веществото.
Този метод не може да бъде приложен за твърди вещества, газове, експлозивни или силнозапалими вещества, или органични пероксиди.
Провеждането на това изпитване не е необходимо, когато вече има резултати за изпитваното вещество по метода на ООН за оксидиращи течности (1).
1.2. ОПРЕДЕЛЕНИЯ И МЕРНИ ЕДИНИЦИ
Средно време за повишаване на налягането е средноаритметичната стойност от измерените времена, за които изпитваната смес предизвиква повишаване на налягането от 690 kРа до 2 070 kРа над атмосферното налягане.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Като вещество за сравнение (10) се използва воден разтвор 65 тегл. % на азотната киселина (х.ч.а).
В случаите, когато лицето, провеждащо изпитването, предполага, че резултатите от това изпитване може да бъдат използвани за други цели (9), може също да се проведе едно изпитване с други допълнителни вещества за сравнение (11).
1.4. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Течността, която ще бъде изпитвана, се смесва в тегловно съотношение 1:1 с фиброзна целулоза и се вкарва в съд под налягане. Ако по време на смесването или при въвеждането ѝ в реактора възникне спонтанно запалване, не е необходимо по-нататъшно изпитване.
Ако по време на провеждане на изпитването не възникне спонтанно запалване, сместа се нагрява в съда под налягане, докато налягането не нарасне от 690 kРа до 2 070 kРа над атмосферното налягане, и се отчита средното време за повишаване на налягането. То се сравнява със средното време за повишаване на налягането на смес в съотношение 1:1 на веществото(ата) за сравнение и целулозата.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
В серии от по пет опита за едно вещество следва резултатите да не се различават с повече от 30 % от средноаритметичната стойност. Резултатите, които се различават с повече от 30 % от стойността, се пренебрегват, процедурите по смесване и напълване се оптимизират и изпитването се повтаря.
1.6. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
1.6.1. Подготовка
1.6.1.1. Запалими вещества
Като запалим материал се използва изсушена фиброзна целулоза с нишки с дължина между 50 и 250 μm и среден диаметър 25 μm (12). Материалът се суши до достигане на постоянно тегло на слоя с дебелина не повече от 25 mm при 105 oС в продължение на 4 часа и се оставя в сушилня в присъствие на консервант, докато изстине и стане подходящ за използване. Съдържанието на вода в сухия остатък целулоза не следва да надвишава 0,5 % сухо тегло (13). Ако е необходимо, времето на сушене се удължава до достигане на тези параметри (14). По време на изпитването трябва да се използва целулоза от една проба.
1.6.1.2. Апаратура
1.6.1.2.1. Съд под налягане
Изисква се съд под налягане. Съдът представлява цилиндричен стоманен съд под налягане с дължина 89 mm и външен диаметър 60 mm (вж. фигура 1). Двете повърхности са свързани с противоположните си страни (намалявайки напречното сечение на съда до 50 mm), за да се подобри прикрепването, докато се монтират пожарният хидрант и пробката с вентилационния отвор. Съдът, който има отвор с диаметър 20 mm, е вътрешно вдълбан във всеки край до такава дебелина, че там да бъде поставена едноинчова тръба по британския стандарт (BSP) или метричния еквивалент. Приспособлението за повишаване на налягането, под формата на разклонение (коляно), е завинтено към извивката на съда под налягане на 35 mm от единия край и е на 90o спрямо механично обработените повърхности. Вдлъбнатината за него е с дълбочина 12 mm и е вътрешно резбована, за да приеме 1/2" BSP (или метричния еквивалент) външно резбования край на разклонението. Ако е необходимо, се използва инертно уплътнение, за да се осигури неподвижна газонепропусклива свръзка. Разклонението продължава 55 mm след тялото на съда под налягане и има 6 mm отвор. Краят на разклонението е вжлебен и е предназначен да приеме датчика за налягане във вид на диафрагма. За измерване на налягането може да бъде използван всякакъв уред, при условие че не може да бъде повлиян от горещи газове или разграждащи се продукти и може да отговори на повишаващото се налягане в интервала 690-2 070 kРа в рамките на не повече от 5 ms.
Най-отдалеченият от разклонението край на съда под налягане е близо до пожарния хидрант, който е свързан с два електрода — единия изолиран от, а другия заземен към тялото на хидранта. Другият край на съда под налягане е близо до предпазната мембрана (предпазваща от налягане приблизително 2 200 kРа), здраво неподвижно закрепена за спирателния клапан, който има 20 mm отвор. Ако е необходимо, се използва уплътнение от инертен материал с пожарния хидрант, за да се осигури непропусклива за газове неподвижна сглобка. Поддържащ стенд (фигура 2) поддържа апаратурата на подходящата височина през периода на използването ѝ. Обикновено той се състои от мека стоманена плоска основа с размери 235 mm × 184 mm × 6 mm и една 185-милиметрова дълга квадратна куха част с размери 70 mm × 70 mm × 4 mm.
Частта е скосена от всяка от двете срещуположни страни в единия край по дължината на квадратната куха част, така че да се получи структура с две допълнителни плоски подпори, надхвърлящи с 86 mm дължината на цялата част. Краищата на тези плоски подпори са прорязани под ъгъл 60o към хоризонтала и са заварени към повърхността на основата. Прорезът с размери 22 mm ширина х 46 mm дълбочина се обработва от едната страна на по-горния край на основната част, така че когато монтираният съд под налягане е по-надолу, пожарният хидрант да спре първи в частта, поддържаща кутията, а коляното е разположено в прореза. Стоманен детайл с размери 30 mm ширина и 6 mm дебелина е заварен към по-ниската вътрешна повърхност на кутията и действа като дистанционен елемент (раздалечител). Два 7-милиметрови винта с крилчати глави, поставени на срещуположната повърхност, задържат неподвижен на място съда под налягане. Две стоманени шини с ширина 12 mm и дебелина 6 mm, заварени към стената на детайлите, допиращи се към основата на кутията, поддържат отдолу съда под налягане.
1.6.1.2.2. Система за запалване
Системата за запалване се състои от 25 cm дълга Ni/Сr жица с диаметър 0,6 mm и съпротивление 3,85 ohm/m. Жицата се намотава чрез използване на пръчка с диаметър 5 mm под формата на спирала и се прибавя към електродите на пожарния хидрант. Спиралата следва да е с някоя от конфигурациите, показани на фигура 3. Разстоянието между дъното на съда и долната повърхност на запалващата спирала следва да бъде 20 mm. Ако електродите не са подвижни, краищата на запалващата жица между серпентината и дъното на съда следва да бъдат изолирани с керамична обвивка. Жицата се загрява чрез постоянен електроизточник, осигуряващ поне 10 А ток.
1.6.2. Извършване на изпитването
(15)
Апаратурата, цялостно сглобена с датчик за налягане и нагряваща система, но без позиционирана предпазна мембрана, се поддържа от пожарен хидрант в долния край. 2,5 g от изпитваната течност се смесват с 2,5 g изсушена целулоза в чаша от химично стъкло чрез използване на стъклена пръчка за разбъркване (16). За осигуряване на безопасност смесването следва да бъде извършвано при наличието на защитна преграда между оператора и сместа. Ако сместа се запали по време на смесването или разбъркването, не е необходимо изпитването да се провежда докрай. Сместа се вкарва на малки порции в съда под налягане и следва да сте сигурни, че тя се натрупва около запалващата спирала и прави добър контакт с нея. Важно е спиралата да не се изкриви по време на процеса на натрупване, тъй като това може да доведе до погрешни резултати (17). Предпазната мембрана е поставена в готовност и спирателният клапан е завинтен плътно. Напълненият съд се премества до поддържащия пожарен стенд, предпазната мембрана следва да бъде поставена най-отгоре в подходящ армиран смукателен (вентилационен) шкаф или в камерата за изгаряне. Електроенергия се доставя чрез свързване на пожарния хидрант с външен източник и се пуска ток със сила 10 А. Времето между започването на смесването и включването към енергоизточник не следва да надвишава 10 минути.
Сигналът, получаван чрез датчика за налягане, се записва от подходяща за целта система, която позволява едновременно оценяването и генерирането на траен запис на получения времеви контур на налягането (напр. свързани самопишещо и графично устройство). Сместа се нагрява, докато предпазната мембрана се пробие или докато изминат поне 60 секунди. Ако предпазната мембрана не се разкъса, сместа трябва да бъде оставена да се охлади, преди апаратурата внимателно да бъде демонтирана, като се вземат предпазни мерки срещу евентуално поставяне под налягане. Извършват се пет опита с изпитваното вещество и веществото(ата) за сравнение. Отчита се времето за повишаване на налягането от 690 kРа до 2 070 kРа над атмосферното налягане. Изчислява се средното време за повишаване на налягането.
В някои случаи веществата могат да генерират повишено налягане (твърде високо или твърде ниско), получено в резултат на химични реакции, които не определят окислителните свойства на веществото. В тези случаи може да се наложи изпитването да се повтори с инертно вещество, напр. диатомит (кизелгур), вместо целулоза, за да се изясни същността на реакцията.
2. ДАННИ
Времето за повишаване на налягането за изпитваното вещество и веществото(ата) за сравнение. Времето за повишаване на налягането при изпитвания с инертно вещество, ако се провеждат такива.
2.1. ОБРАБОТВАНЕ НА РЕЗУЛТАТИТЕ
Изчисляват се средните времена за повишаване на налягането за изпитваното вещество и за веществото(ата) за сравнение.
Изчислява се средното време за повишаване на налягането от изпитванията с инертно вещество (ако са провеждани такива).
Примери за някои резултати са представени в таблица 1.
Таблица 1
Примерни резултати
(21)
|
Вещество (20)
|
Средно време за повишаване на налягането за смес 1:1 с целулоза
(ms)
|
|
Амониев бихромат, наситен воден разтвор
|
20 800
|
|
Калциев нитрат, наситен воден разтвор
|
6 700
|
|
Железен нитрат, наситен воден разтвор
|
4 133
|
|
Литиев перхлорат, наситен воден разтвор
|
1 686
|
|
Магнезиев перхлорат, наситен воден разтвор
|
777
|
|
Никелов нитрат, наситен воден разтвор
|
6 250
|
|
Азотна киселина, 65 %
|
4 767 (18)
|
|
Перхлорна киселина, 50 %
|
121 (18)
|
|
Перхлорна киселина, 55 %
|
59
|
|
Калиев нитрат, 30 % воден разтвор
|
26 690
|
|
Сребърен нитрат, наситен воден разтвор
|
(19)
|
|
Натриев хлорат, 40 % воден разтвор
|
2 555 (18)
|
|
Натриев нитрат, 45 % воден разтвор
|
4 133
|
|
Инертно вещество
|
|
|
Вода:целулоза
|
(19)
|
3. ОТЧИТАНЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Протоколът от изпитването следва да съдържа следната информация:
|
—
|
идентичност, състав, чистота и т.н. на изпитваното вещество;
|
|
—
|
концентрация на изпитваното вещество;
|
|
—
|
процедура за сушене на използваната целулоза;
|
|
—
|
съдържание на вода в използваната целулоза;
|
|
—
|
резултати от измерванията;
|
|
—
|
резултати от изпитванията с инертно вещество, ако има такива;
|
|
—
|
изчислени средни стойности на времето за повишаване на налягането;
|
|
—
|
всички отклонения от този метод и причините за тях;
|
|
—
|
цялата допълнителна информация или бележки, свързани с интерпретирането на резултатите.
|
3.2. ИНТЕРПРЕТИРАНЕ НА РЕЗУЛТАТИТЕ (22)
Резултатите от изпитването се оценяват въз основа на:
|
а)
|
наличието на спонтанно запалване на сместа от изпитваното вещество и целулозата; и
|
|
б)
|
сравнението между средното време, за което налягането се е повишило от 690 kРа до 2 070 kРа, и това при веществото(ата) за сравнение.
|
Течно вещество се счита за окислител, когато:
|
а)
|
смес в съотношение 1:1 от масата на веществото и на целулозата се самозапали спонтанно; или
|
|
б)
|
смес в съотношение 1:1 от масата на веществото и на целулозата покаже средно време за повишаване на налягането, по-малко или равно на средното време за повишаване на налягането на смес в съотношение 1:1 от масата на 65 тегл. % воден разтвор на азотна киселина и целулоза.
|
За да се избегнат неверни положителни резултати, ако е необходимо, резултатите, получени при изпитването на веществото с инертен материал, също могат да се вземат под внимание при интерпретирането на резултатите.
4. ПРЕПРАТКИ
|
|
Препоръки при транспорт на опасни стоки, ръководство за изпитвания и критерии. Трето преработено издание. Публикация на ООН №: ST/SG/AC.10/11/Rev. 3, 1999 г., стр. 342. Метод О.2: Изпитване на оксидиращи течности.
|
Фигура 1
Съд под налягане
Фигура 2
Поддържащ стенд
Фигура 3
Система на запалване

Забележка: може да бъде използвана всяка от тези конфигурации.
(1) Зависи от типа на апарата и степента на чистота на веществото.
(2) Зависи от типа на апарата и степента на чистота на веществото.
(3) Зависи от типа на апарата и от степента на чистота на веществото.
(4) Зависи от типа на апарата и от степента на чистота на веществото.
(5) Тази точност е валидна само за опростен апарат, като например описания в ASTM D 1120-72; тя може да се подобри с по-усъвършенствани ебулиометрични прибори.
(6) Валидна само за чисти вещества. Използването при други условия трябва да се оправдае.
(7) Зависи от степента на чистота.
(8) Този метод може да се използва и в областта от 1 до 10 Ра, като се вземат предпазни мерки.
(9) Както например в рамките на правилата на ООН, свързани с транспорта.
(10) Киселината следва да се титрува преди изпитването, за да се установи нейната концентрация.
(11) Напр. в препратка (1) се използват 50 масови % перхлорна киселина и 40 масови % натриев хлорат.
(12) Напр. хроматографска колона на Whatman с целулоза на прах CF 11, каталожен № 4021 050.
(13) Потвърдено (напр.) чрез титруване по Карл-Фишер.
(14) По друг начин това водно съдържание може да бъде постигнато (напр.) чрез нагряване при 105 oС във вакуум в продължение на 24 часа.
(15) Смесите на окислители с целулоза трябва да бъдат третирани като потенциално експлозивни и с тях да се работи с повишено внимание.
(16) На практика това може да се постигне чрез приготвяне на смес в съотношение 1:1 от течността за изпитване и целулоза в по-големи количества от нужното за опита и прибавяне на 5 +0,1 g в съда под налягане. Сместа трябва да се приготвя непосредствено при всеки отделен опит.
(17) По-специално трябва да се избягва контакт между съседните намотки на спиралата.
(18)
|
(а)
|
Средна стойност от сравнителни опити на различни лаборатории.
|
(19)
|
(б)
|
Не се достига максималното налягане от 2 070 kРа.
|
(20)
|
(в)
|
Наситените разтвори се приготвят при 20 oС.
|
(21)
|
(г)
|
Вж. препратка (1) за класификация по схемата на ООН за транспорт.
|
(22) Вж. препратка 1 за интерпретиране на резултатите съгласно правилата на ООН, свързани с транспорта, с използването на няколко вещества за сравнение.
ЧАСТ Б: МЕТОДИ ЗА ОПРЕДЕЛЯНЕ НА ТОКСИЧНОСТТА И ДРУГИ ЕФЕКТИ ВЪРХУ ЗДРАВЕТО
СЪДЪРЖАНИЕ
ОБЩО ВЪВЕДЕНИЕ
|
Б.1А.
|
ОСТРА ОРАЛНА ТОКСИЧНОСТ — ПРОЦЕДУРА С ФИКСИРАНИ ДОЗИ |
|
Б.1Б.
|
ОСТРА ОРАЛНА ТОКСИЧНОСТ — МЕТОД КЛАС ОСТРА ТОКСИЧНОСТ |
|
Б.2.
|
ОСТРА ТОКСИЧНОСТ (ИНХАЛАТОРНА) |
|
Б.3.
|
ОСТРА ТОКСИЧНОСТ (ДЕРМАЛНА) |
|
Б.4.
|
ОСТРА ТОКСИЧНОСТ: КОЖНО ДРАЗНЕЩО/КОРОЗИВНО ДЕЙСТВИЕ |
|
Б.5.
|
ОСТРА ТОКСИЧНОСТ: ОЧНО ДРАЗНЕЩО/КОРОЗИВНО ДЕЙСТВИЕ |
|
Б.6.
|
КОЖНА СЕНСИБИЛИЗАЦИЯ |
|
Б.7.
|
ТОКСИЧНОСТ НА ПОВТАРЯЩА СЕ (ОРАЛНА) ДОЗА (28 ДНИ) |
|
Б.8.
|
ТОКСИЧНОСТ (ИНХАЛАТОРНА) С МНОГОКРАТНИ ДОЗИ (28 ДНИ) |
|
Б.9.
|
ТОКСИЧНОСТ (ДЕРМАЛНА) С МНОГОКРАТНИ ДОЗИ (28 ДНИ) |
|
Б.10.
|
МУТАГЕННОСТ — ТЕСТ IN VITRO ЗА ХРОМОЗОМНИ АБЕРАЦИИ ПРИ БОЗАЙНИЦИ |
|
Б.11.
|
МУТАГЕННОСТ — ТЕСТ IN VIVO ЗА ХРОМОЗОМНИ АБЕРАЦИИ В КОСТНИЯ МОЗЪК НА БОЗАЙНИЦИ |
|
Б.12.
|
МУТАГЕННОСТ — IN VIVO МИКРОЯДРЕН ТЕСТ НА ЕРИТРОЦИТИ ОТ БОЗАЙНИЦИ |
|
Б.13/14.
|
МУТАГЕННОСТ — БАКТЕРИИ ЗА ТЕСТВАНЕ НА ОБРАТНИ МУТАЦИИ |
|
Б.15.
|
ИЗПИТВАНЕ ЗА МУТАГЕННОСТ И ПРЕСЯВАЩО ИЗПИТВАНЕ ЗА КАНЦЕРОГЕННОСТ НА ГЕННИ МУТАЦИИ — SАССНАRОМYСЕS СЕREVISIAE
|
|
Б.16.
|
МИТОТИЧНИ РЕКОМБИНАЦИИ — SАССНАRОМYСЕS СЕREVISIAE
|
|
Б.17.
|
МУТАГЕННОСТ — IN VITRO ТЕСТ ЗА КЛЕТЪЧНИ ГЕННИ МУТАЦИИ ПРИ БОЗАЙНИЦИ |
|
Б.18.
|
УВРЕЖДАНЕ И РЕПАРАЦИЯ НА ДНК — НЕПЛАНИРАН СИНТЕЗ НА ДНК КЛЕТКИ ОТ БОЗАЙНИЦИ (IN VITRO) |
|
Б.19.
|
ИЗПИТВАНЕ IN VITRO ЗА ОБМЕНИ НА СЕСТРИНСКИ ХРОМАТИДИ |
|
Б.20.
|
ИЗПИТВАНЕ ЗА ПОЛОВО СВЪРЗАНА РЕЦЕСИВНА ЛЕТАЛНОСТ ПРИ DROSOPHILA MELANOGASTER
|
|
Б.21.
|
ИЗПИТВАНИЯ IN VITRO ЗА ТРАНСФОРМАЦИИ В КЛЕТКИ ОТ БОЗАЙНИЦИ |
|
Б.22.
|
ИЗПИТВАНЕ ЗА ДОМИНАНТНА ЛЕТАЛНОСТ ПРИ ГРИЗАЧИ |
|
Б.23.
|
ТЕСТ ЗА СПЕРМАТОГОНИАЛНИ ХРОМОЗОМНИ АБЕРАЦИИ ПРИ БОЗАЙНИЦИ |
|
Б.24.
|
ИЗПИТВАНЕ ЗА ПЕТНА ПО КОЗИНАТА ПРИ МИШКИ |
|
Б.25.
|
НАСЛЕДСТВЕНИ ТРАНСЛОКАЦИИ ПРИ МИШКИ |
|
Б.26.
|
ТЕСТВАНЕ НА СУБХРОНИЧНА ОРАЛНА ТОКСИЧНОСТ — 90-ДНЕВНО ИЗСЛЕДВАНЕ НА ТОКСИЧНОСТТА ПРИ ГРИЗАЧИТЕ С ПОВТАРЯЩА СЕ ДОЗА |
|
Б.27.
|
ИЗСЛЕДВАНЕ НА СУБХРОНИЧНА ОРАЛНА ТОКСИЧНОСТ — 90-ДНЕВНО ИЗСЛЕДВАНЕ НА ТОКСИЧНОСТТА ПРИ НЕ ГРИЗАЧИ С ПОВТАРЯЩА СЕ ДОЗА |
|
Б.28.
|
ИЗПИТВАНЕ ЗА СУБХРОНИЧНА ДЕРМАЛНА ТОКСИЧНОСТ — 90-ДНЕВНИ МНОГОКРАТНИ ДЕРМАЛНИ ДОЗИ ПРИ ГРИЗАЧИ |
|
Б.29.
|
ИЗПИТВАНЕ ЗА СУБХРОНИЧНА ИНХАЛАЦИОННА ТОКСИЧНОСТ — 90-ДНЕВНИ МНОГОКРАТНИ ИНХАЛАЦИОННИ ДОЗИ ПРИ ГРИЗАЧИ |
|
Б.30.
|
ИЗПИТВАНЕ ЗА ХРОНИЧНА ТОКСИЧНОСТ |
|
Б.31.
|
ИЗПИТВАНЕ ЗА ОЦЕНКА НА ТОКСИЧНОСТТА ЗА ПРЕНАТАЛНОТО РАЗВИТИЕ |
|
Б.32.
|
ИЗПИТВАНЕ ЗА КАНЦЕРОГЕННОСТ |
|
Б.33.
|
КОМБИНИРАНО ИЗПИТВАНЕ ЗА ХРОНИЧНА ТОКСИЧНОСТ/КАНЦЕРОГЕННОСТ |
|
Б.34.
|
ИЗПИТВАНЕ ЗА ТОКСИЧНОСТ ЗА РАЗМНОЖАВАНЕТО В ЕДНО ПОКОЛЕНИЕ |
|
Б.35.
|
ИЗПИТВАНЕ ЗА РЕПРОДУКТИВНА ТОКСИЧНОСТ В ДВЕ ПОКОЛЕНИЯ |
|
Б.37.
|
ЗАБАВЕНА НЕВРОТОКСИЧНОСТ КЪМ ОРГАНИЧНИ ФОСФОРСЪДЪРЖАЩИ ВЕЩЕСТВА СЛЕД ОСТРО ИЗЛАГАНЕ |
|
Б.38.
|
ЗАБАВЕНА НЕВРОТОКСИЧНОСТ КЪМ ОРГАНИЧНИ ФОСФОРСЪДЪРЖАЩИ ВЕЩЕСТВА НА 28-ИЯ ДЕН В ПРОУЧВАНЕ ЗА ПОВТАРЯЩА СЕ ДОЗА |
|
Б.39.
|
ИЗПИТВАНЕ ЗА НЕРЕПАРАТИВЕН СИНТЕЗ НА ДНК (НСД) С ЧЕРНОДРОБНИ КЛЕТКИ ОТ БОЗАЙНИЦИ IN VIVO
|
|
Б.40.
|
IN VITRO КОЖНА КОРОЗИЯ: ТРАНСКУТАННО ИЗМЕРВАНЕ НА ЕЛЕКТРИЧЕСКОТО СЪПРОТИВЛЕНИЕ НА КОЖАТА (TER) |
|
Б.40А.
|
IN VITRO КОЖНА КОРОЗИЯ: ИЗПИТВАНЕ ВЪРХУ МОДЕЛ НА ЧОВЕШКА КОЖА |
|
Б.41.
|
IN VITRO 3T3 NRU ИЗПИТВАНЕ ЗА ФОТОТОКСИЧНОСТ |
|
Б.42.
|
КОЖНА СЕНСИБИЛИЗАЦИЯ: ИЗСЛЕДВАНЕ НА ЛОКАЛНИТЕ ЛИМФНИ ВЪЗЛИ |
|
Б.43.
|
НЕВРОТОКСИКОЛОГИЧНО ИЗСЛЕДВАНЕ ПРИ ГРИЗАЧИ |
|
Б.44.
|
КОЖНА АБСОРБЦИЯ: IN VITRO МЕТОД |
|
Б.45.
|
КОЖНА АБСОРБЦИЯ: IN VIVO МЕТОД |
ОБЩО ВЪВЕДЕНИЕ
А. ХАРАКТЕРИСТИКА НА ПРОУЧВАНОТО ВЕЩЕСТВО
Преди началото на всяко едно проучване на токсичност следва да се знае съставът на проучваното вещество, включително основните примеси, както и съответстващите физикохимични свойства, включително стабилност.
Физикохимичните свойства на проучваното вещество предоставят важна информация за избор на пътя на прилагане на веществото, за проектиране на всяко отделно проучване, както и за начина на работа и съхранение на проучваното вещество.
Създаването на аналитичен метод за количествено и качествено определяне на проучваното вещество (включително основните примеси, при възможност) в средата за дозиране, както и в биологичния материал, следва да предхожда началото на проучването.
Цялата информация, отнасяща се до идентифицирането, физикохимичните свойства, чистотата и поведението на проучваното вещество, следва да бъде включена в доклада за теста.
Б. ГРИЖИ ЗА ЖИВОТНИТЕ
Строгият контрол на условията на заобикалящата среда и техниката за добри грижи към животните са основни изисквания за тестовете върху токсичност.
i) Условия на отглеждане
Условията на средата в стаите или определените места на експерименталните животни следва да бъдат подходящи за проучваните видове. Подходящи условия за плъхове, мишки и морски свинчета са стайна температура – 22o С ± 3o С при относителна влажност от 30 до 70 %; за зайците температурата следва да бъде 20 + 3o С при относителна влажност от 30 до 70 %.
Някои експериментални техники са особено чувствителни към температурните ефекти, ето защо в такива случаи в описанието на тестовия метод се посочват всички подробности за подходящите условия. Във всички изследвания за токсични ефекти температурата и влажността следва да се мониторират, записват и включат в окончателния доклад на проучването.
Осветлението е изкуствено, последователността е 12 часа светлина, 12 часа тъмнина. Подробностите, свързани с начина на осветление, се записват и включват в окончателния доклад на проучването.
Ако няма други изисквания, специални за метода, животните могат да се отглеждат индивидуално или в клетки на малки групи от един и същи пол; при групово отглеждане не бива да има повече от пет животни в клетка.
В докладите за експериментални животни е важно да се посочат видът на клетката и броят на животните, обитаващи всяка една клетка, както по време на излагане на действието на химическото вещество, така и в последвалия период на наблюдение.
ii) Условия на хранене
Диетата следва да отговаря на всички хранителни изисквания на видовете, участващи в теста. При прилагане на проучваните вещества в храната на животните хранителната стойност на последната може да бъде намалена поради взаимодействие между веществото и хранителните съставки. Възможността за такава реакция следва да се отчита при интерпретиране на резултатите от теста. Уместно е да се използват конвенционални лабораторни храни при неограничено количество вода за пиене. Изборът на храната се влияе от необходимостта да се осигури подходяща смес за проучваното вещество при прилаганата му по този метод.
Хранителните примеси, за които се знае, че влияят на токсичността, не бива да присъстват в интерфериращи концентрации.
В. АЛТЕРНАТИВНО ТЕСТВАНЕ
Европейският съюз се е ангажирал с насърчаване на развитието и узаконяването на алтернативни техники, които могат да предоставят същото ниво на информация, както и настоящите тестове с животни, но използват по-малко животни, причиняват по-малко страдание или изобщо избягват употребата на животни.
След като станат достъпни, тези методи трябва да се имат предвид винаги, когато е възможно, за характеризиране на риска и последваща класификация и етикетиране на съществени рискове.
Г. ОЦЕНКА И ИНТЕРПРЕТАЦИЯ
При оценка и интерпретация на тестовете следва да се има предвид границата на областта, до която резултатите от проучванията сред животни и in vitro могат да бъдат директно екстраполирани към човека. Ето защо данните за наличие на странични ефекти при хората, където ги има, могат да се използват за потвърждение на опитните резултати.
Д. ПРЕПРАТКИ
Повечето от тези методи са създадени в рамките на програмата на ОИСР за изработване на ръководство за тестове и следва да се прилагат в съгласие с принципите за добрата лабораторна практика, така че да се осигури възможно най-широко „взаимно приемане на данните“.
Допълнителна информация може да се намери в препратките на ръководството на ОИСР, както и в съответната литература, публикувана на други места.
Б.1А. ОСТРА ОРАЛНА ТОКСИЧНОСТ — ПРОЦЕДУРА С ФИКСИРАНИ ДОЗИ
1. МЕТОД
Този метод за изпитване е еквивалентен на ОИСР ТG 420 (2001).
1.1. ВЪВЕДЕНИЕ
При традиционните методи за оценяване на остра токсичност като краен резултат се достига до смърт на използваните животни. През 1984 г. бе предложен нов подход за тестване на остра токсичност от Британското токсикологично дружество, основаващ се на определяне на поредица от нива с фиксирани дози (1). При този подход се избягва смъртта на животните в края на експериментите и се разчита изпяло на наблюдението за ясни признаци за токсичност във всяка поредица от нива с фиксирани дози. След направените в Обединеното кралство (2) и международните (3) изследвания in vivo за утвърждаване процедурата бе одобрена като метод за изпитване през 1992 г. Впоследствие статистическите възможности на процедурата с фиксирани дози са оценени чрез използването на математически модели в поредица от изследвания (4) (5) (6). Едновременно, изследванията in vivo и тези чрез създаване на модели показват, че процедурата е репродуктивна, използва по-малко животни и причинява по-малко страдание от традиционните методи и дава възможност да се категоризират веществата по начин, подобен на този при другите методи за изпитване на остра токсичност.
Насоки за избор на най-подходящия метод за изследване с определена цел могат да бъдат намерени в Ръководството за провеждане на изследвания на остра орална токсичност (7). Това ръководство също съдържа допълнителна информация за провеждането и интерпретирането на метода за изследване Б.1А.
В този метод по принцип се използват само дози с умерена токсичност и следва да се избягва прилагането на дози, за които се очаква да са летални. Така също дози, за които е известно, че могат да причинят болка и страдание поради корозивни или силно дразнещи въздействия, не следва да бъдат прилагани. Умиращите животни или животните, очевидно изпитващи болка или показващи признаци на дълбоко и продължително страдание, се убиват по хуманен начин и се вземат предвид при интерпретирането на резултатите по същия начин, както животните, умрели по време на експеримента. Критериите за вземане на решение да бъде убито умиращо или дълбоко страдащо животно и насоките за разпознаване на предвидима или предстояща смърт са предмет на отделно ръководство (8).
Методът осигурява информация за опасните свойства и позволява веществото да бъде категоризирано и класифицирано съгласно Глобалната система за хармонизиране (GHS) на класификацията на химични вещества, които причиняват остра токсичност (9).
Лабораториите за изпитване следва да вземат предвид цялата налична информация за изпитваното вещество преди провеждане на експеримента. Такава информация включва идентичността и химичната структура на веществото; неговите физикохимични свойства; резултатите от всякакви други in vitro или in vivo токсикологични изпитвания на веществото; токсикологичните данни за структурно близки вещества и очакваната(ите) употреба(и) на веществото. Тази информация е необходима, за да се удостовери напълно, че това изпитване е свързано със защитата на човешкото здраве и ще бъде от полза при избора на подходяща начална доза.
1.2. ОПРЕДЕЛЕНИЯ
Остра орална токсичност: отнася се до онези вредни ефекти, които се появяват в резултат на орален прием на еднократна доза вещество или многократни дози, давани в рамките на 24 часа.
Бавна смърт означава, че животното не умира или не се проявяват признаци, че умира в рамките на 48 часа, но умира по-късно през 14-дневния период на наблюдение.
Доза е количеството на приетото вещество за тестване. Дозата се изразява като маса на тестваното вещество за единица тегло на изследваното животно (напр. mg/kg).
Доказана токсичност е общоприет термин, описващ ясните признаци на токсичност вследствие на приемане на изпитваното вещество (вж. (3) например), такива че при приемане на следваща най-висока фиксирана доза могат да бъдат очаквани всякакви признаци на дълбока болка и продължителни дълбоки страдания, терминално състояние (критериите са представени в Ръководството за хуманен край (8) или вероятна смърт на повечето животни.
GHS: Глобална система за хармонизиране на класификацията на химични вещества и смеси. Съвместна дейност на ОИСР (човешко здраве и околна среда), Комитета на ООН от експерти в областта на транспортирането на опасни стоки (физикохимични свойства) и МОТ (опасни комуникации) и координирана чрез Междуорганизационната програма за правилно управление на химикалите (IOМС).
Неизбежна смърт: когато животното умира или се очаква настъпването на смъртта преди следващото планирано време за наблюдение. Признаците, които показват това състояние при гризачите, могат да включват конвулсии, латерално положение, отпуснатост и треперене. (Вж. Ръководството за хуманен край (8) за повече подробности.)
LD50 (средна летална доза) е статистически получена еднократна доза на вещество, за което може да се очаква, че ще причини смърт при 50 % от животните, когато бъде въведено в тях по орален път. Стойността LD50 се изразява за определени периоди като масата на изпитваното вещество за единица тегло на изследваното животно (mg/kg).
Ограничена доза: отнася се до доза, при която има по-високо ограничаване при изследването (2 000 или 5 000 mg/kg).
Настъпване на смърт: оставане в терминално състояние или неспособност да оцелее, дори ако се приложи лечение. (Вж. Ръководството за хуманен край (8) за повече подробности.)
Предсказуема смърт: присъствие на клинични признаци, които показват, че ще настъпи смърт в един предстоящ период от време преди планирания край на експеримента, например: неспособност да се достигне вода или храна. (Вж. Ръководството за хуманен край (8) за повече подробности.)
1.3. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Групи животни от един и същ пол са дозирани чрез прилагане на поетапна процедура чрез използване на фиксирани дози от 5, 50, 300 и 2 000 mg/kg (по изключение може да бъде приложена допълнителна фиксирана доза от 5 000 mg/kg, вижте точка 1.6.2). Нивото на началната доза е определено въз основа на зрителни изследвания, като се очаква дозата да предизвика някои признаци на токсичност, без да причинява дълбоки токсични ефекти или смърт. Клиничните признаци и условията, свързани с болка, страдание и неизбежна смърт, са подробно описани в отделно ръководство на ОИСР (8). Следващи групи животни могат да бъдат дозирани с по-високи или по-ниски фиксирани дози в зависимост от присъствието или отсъствието на признаци за отравяне или смърт. Тази процедура продължава до достигане на дозата, причиняваща доказана токсичност, или дотогава, докато бъде идентифицирана смъртта на животното или не се наблюдават ефекти при най-високата доза, или когато се появят смъртни случаи при най-ниската доза.
1.4. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
1.4.1. Избор на животински видове
Предпочитаният вид от групата на гризачите е плъх, въпреки че могат да бъдат използвани и други видове гризачи. Обикновено се използват животни от женски пол (7). Причината за това е, че изследванията в научната литература от конвенционални изпитвания на LD50 показват, че обикновено има малка разлика в междуполовата сетивност, но в случаите, при които се наблюдават различия, женските индивиди като цяло са малко по-чувствителни (10). Въпреки това, ако познанията за токсикологичните и токсикокинетичните свойства на структурно близки химикали показват, че има вероятност мъжките индивиди да са по-чувствителни от женските, тогава се използват екземпляри от този пол. Когато изпитването се провежда върху мъжки индивиди, трябва да бъде предоставено адекватно обяснение за това.
Обикновено в лабораторните опитни постановки следва да се използват здрави млади полово зрели животни. Женските индивиди следва да не са раждали и да не са бременни. Всяко животно, при започване на дозирането му, следва да бъде на възраст между 8 и 12 седмици и теглото му да попада в интервала ± 20 % от средното тегло на всички предварително дозирани животни.
1.4.2. Условия за отглеждане и хранене
Температурата в стаята на опитните животни следва да бъде 22 oС (± 3 oС). Въпреки че относителната влажност следва да бъде поне 30 % и е препоръчително тя да не надвишава 70 %, освен при почистване на стаята, целта е да се постигне 50—60 % относителна влажност. Светлината следва да бъде изкуствена, с редуващи се 12 часа светъл период, 12 часа тъмен период. За хранене могат да бъдат използвани конвенционалните лабораторни диети с неограничен достъп до питейна вода. Животните могат да бъдат групирани в клетките по доза, но броят на животните в клетка не трябва да възпрепятства точните наблюдения на всяко животно.
1.4.3. Подготовка на животните
Животните са произволно избрани, маркирани, за да е възможно индивидуалното им идентифициране, и поставени в клетките си поне 5 дни преди започване на дозирането, за да се аклиматизират към лабораторните условия.
1.4.4. Подготовка на дозите
Най-общо изпитваните вещества трябва да бъдат приемани в постоянен обем в обхвата на дозите, които се изпитват чрез вариране в концентрацията на дозирания препарат. Когато крайният продукт, който трябва да бъде изпитван, е под формата на течност или смес обаче, за последващата оценка на риска от това вещество може да бъде по-подходящо изпитваното вещество да се употребява неразредено, т.е. при постоянна концентрация, което е и изискване от страна на някои регулаторни органи. Във всеки случай, обемът на максималната доза за администриране не трябва да бъде завишаван. Максималният обем на течността, която може да бъде приета наведнъж, зависи от размера на изследваното животно. При гризачи обикновено обемът не надвишава 1 ml/100 g телесно тегло: обаче в случай на водни разтвори може да се приемат 2 ml/100 g телесно тегло. Във връзка с изготвянето на дозирани препарати се препоръчва, където е възможно, да се използва воден разтвор/суспензия/емулсия, следван първо от разтвор/суспензия/емулсия в масло (напр. царевично масло) и след това по възможност от разтвор при други разтворители. Трябва да се знаят токсикологичните характеристики на разтворителите, с изключение на водата. Дозите не трябва да бъдат приготвяни дълго време преди приемането им, освен когато е известно и доказано, че препаратът ще остане стабилен и в добро състояние през времето, в което ще бъде използван.
1.5. ПРОЦЕДУРА
1.5.1. Приемане на дозите
Изпитваното вещество се приема на еднократни дози, чрез изкуствено хранене, в стомашния тръбопровод или чрез подходяща интубационна канюла. При извънредни обстоятелства, при които приемането на еднократна доза не е възможно, дозата може да бъде давана на по-малки части през период, който не може да превишава 24 часа.
Преди дозирането животните следва да бъдат поставени на ограничен режим на хранене за известно време (напр. на плъховете не следва да се дава храна, а само вода през нощта преди експеримента; на мишките в продължение на 3—4 часа не следва да се дава храна, а само вода). След периода на „постене“ животните трябва да бъдат претеглени и изпитваното вещество – приложено. След като веществото бъде прието, може да не се дава храна в следващите 3—4 часа при плъховете или 1—2 часа при мишките. Когато дозата се приема на части, в определен период от време може да се наложи да се осигури храна и вода на животните в зависимост от продължителността на периода.
1.5.2. Зрително изследване
Целта на зрителното изследване е да подпомогне избора на подходящата начална доза за основното изследване. Изпитваното вещество се приема от отделните животни последователно по начина, показан на графичните алгоритми в приложение 1. Зрителното изследване приключва, когато може да бъде взето решение за първоначалната доза в основното изследване (или ако смъртта е настъпила при най-ниската фиксирана доза).
Началната доза за зрителното изследване се избира от нивата на фиксираната доза: 5, 50, 300 и 2 000 mg/kg. Като основа се взема дозата, при която се очаква проява на доказана токсичност, когато е възможно, на база доказателство от in vivo и in vitro данни за същия химикал или за структурно близки химикали. При липсата на такава информация началната доза е 300 mg/kg.
Следва да има поне 24-часов период между дозирането на всяко животно. Всички животни следва да бъдат наблюдавани поне 14 дни.
По изключение и само когато е оправдано от определени регулаторни нужди, може да бъде приложена допълнителна фиксирана доза с по-високо ниво 5 000 mg/kg (вж. приложение 3). По причини, свързани с хуманното отношение към животните, изследването на животни в категория 5 на GHS в обхвата 2 000—5 000 mg/kg е нежелателно и следва да се има предвид само когато съществува голяма вероятност резултатите от такова изследване да имат практическо значение за опазване здравето на хората или животните, или за околната среда.
В случаите, когато животното, изследвано при най-ниското ниво с фиксирана доза (5 mg/kg) при провеждане на зрителното изследване, умре, при нормалната процедура изследването приключва и веществото се отнася към категория 1 на GHS (както е показано в приложение 1). Обаче, ако се изисква последващо потвърждаване на класифицирането, може да се предвиди евентуална допълнителна процедура, както следва. Второ животно се дозира с 5 mg/kg. Ако и второто животно умре, тогава категория 1 в GHS се потвърждава и изследването незабавно се прекратява. Ако второто животно оцелее, тогава максимум три допълнителни животни биват дозирани с по 5 mg/kg. Тъй като ще съществува висок риск от смъртност, тези животни следва да бъдат дозирани по начин, целящ опазване на хуманното отношение към животните. Времевият интервал между дозирането на всяко животно следва да бъде достатъчен, за да се установи, че предишното животно вероятно ще оцелее. Ако се установи втора смърт, дозирането следва да бъде незабавно преустановено и следващите животни не се дозират. Заради появата на втори смъртен случай (независимо от броя на изследваните животни в периода на приключването), попадащ в резултат А (два или повече смъртни случаи), следва правилото за класифициране на приложение 2 при 5 mg/kg фиксирана доза (категория 1, ако има два или повече смъртни случаи или категория 2, ако няма повече от 1 смъртен случай). Освен това приложение 4 дава насоки за класифициране по системата на ЕС, докато бъде въведена новата система GHS.
1.5.3. Основно изпитване
1.5.3.1. Брой животни и нива на дозиране
След изпитване с началното ниво на дозиране действието, което трябва да се извърши, е показано чрез графичния алгоритъм в приложение 2. Изисква изпълнението на едно от следните действия: да се прекрати всяко изпитване и да се определи, след класифициране, подходящият клас на опасност; да се проведе изпитване при по-висока фиксирана доза или изпитване при по-ниска фиксирана доза. Въпреки това, за защита на животните, нивото на дозата, причинила смърт при зрителното изследване, не се повтаря при основното изследване (вж. приложение 2). Опитът показва, че най-вероятният резултат при нивото на началната доза е, че веществото може да бъде класифицирано и не е необходимо по-нататъшно изследване.
Обикновено се използват общо пет животни от един и същ пол при всяко изследвано ниво на дозата. Едно от петте животни, което е било използвано при зрителното изследване, се дозира заедно с четирите останали животни (освен, по изключение, ако използваното ниво на дозата при основното изследване не е било включено в зрителното изследване).
Интервалът от време между дозирането на всяко ниво се определя от началото, продължителността и остротата на токсичните признаци. Третирането на животните със следваща доза следва да бъде забавено, докато се докаже, че животните, приели определената доза по-рано, ще оцелеят. Препоръчва се да има период от 3 или 4 дни между дозирането на всяко ниво, ако е нужно, за да има възможност за наблюдения върху забавената токсичност. При необходимост времевият интервал може да бъде регулиран, напр. в случай на незавършен отговор.
Когато се обмисля прилагането на по-високата фиксирана доза 5 000 mg/kg, се следва процедурата, представена в приложение 3 (вж. също точка 1.6.2).
1.5.3.2. Ограничено изпитване
Ограниченото изпитване се използва предимно в случаите, при които експериментаторът разполага с информация, съгласно която изпитваният материал по всяка вероятност не е токсичен, т.е. проявява токсичност само над нормативно ограничените дози. Информация за токсичността на изпитвания материал може да бъде събрана от познания за подобни тествани съединения или подобни тествани смеси или продукти, като се вземат предвид идентичността и процентното съдържание на съединенията, за които е известно, че са токсикологически значими. В случаите, когато има малко или няма информация за токсичността на материала или когато се очаква изпитваният материал да бъде токсичен, трябва да бъде проведено основното изследване.
Прилага се нормалната процедура, като началната доза при зрително изследване е 2 000 mg/kg (или по изключение 5 000 mg/kg), последвана от дозиране на допълнителни четири животни на това ниво на ограниченото изпитване по това ръководство.
1.6. НАБЛЮДЕНИЯ
Животните се наблюдават индивидуално след поне еднократно дозиране през първите 30 минути, периодично през първите 24 часа, с повишено внимание през първите 4 часа и ежедневно след това, през общо 14-дневен период от време, освен когато е необходимо да бъдат извадени от експеримента и убити по хуманен начин по причини, свързани с хуманното отношение към животните, или когато са намерени мъртви. Продължителността на наблюдението обаче не следва да бъде строго фиксирана. Тя следва да се определя въз основа на токсичните реакции, началното време и продължителността на периода за възстановяване и може да бъде увеличена, когато се сметне за необходимо. Периодите от време, в които се появяват и изчезват признаците на токсичност, са важни, особено ако има тенденция токсичните признаци да бъдат забавени (11). Всички наблюдения систематично се записват, с отделни записи, направени за всяко животно.
Допълнителни изследвания са необходими, ако животните продължат да показват признаци на токсичност. Наблюденията следва да включват промените в кожата и козината, очите и лигавиците, и също респираторната, циркулационната, автономната и централната нервна система, соматомоторна активност и моделите на поведение. Следва да бъде обърнато внимание на наблюденията за треперене, конвулсии, слюноотделяне, диария, летаргия, сън и кома. Следва да бъдат взети предвид принципите и критериите, резюмирани в Ръководството за хуманен край (8). Животните, намерени в терминално състояние, и животните, показващи дълбока болка или трайни признаци на дълбоко страдание, следва да бъдат хуманно убити. Когато животните са убити по хуманни причини или са намерени мъртви, следва да бъде записано времето на смъртта им, колкото е възможни по-точно.
1.6.1. Телесно тегло
Индивидуалното тегло на животните следва да бъде измервано в кратък интервал от време преди приемането на изпитваното вещество и поне веднъж седмично след това. Промените в теглото следва да бъдат изчислявани и записвани. В края на експеримента оцелелите животни се претеглят и след това хуманно се убиват.
1.6.2. Патология
Всички изследвани животни (включително умрелите по време на експеримента или извадените от експеримента животни по причини, свързани с хуманното отношение към животните) следва да бъдат подложени на цялостна аутопсия. Всички цялостни патологични изменения във всяко животно следва да бъдат записани. Микроскопските изследвания на органите показват доказателствата за цялостна патология при животните, оцелели 24 часа или повече след първоначалното дозиране, и също могат да допринесат за получаването на полезна информация.
2. ДАННИ
Следва да бъдат осигурени индивидуални данни за всяко животно. Освен това всички данни следва да бъдат обобщени в таблична форма, показваща броя на използваните животни във всяка от изследваните групи, броя на животните, проявяващи признаци за токсичност, броя на животните, намерени мъртви по време на изследването или убити по хуманни причини, времето на настъпване на смъртта на животинския индивид, описание и развитие във времето на токсичните ефекти и обратимостта им, както и заключенията от аутопсията.
3. ОТЧИТАНЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Протоколът от изпитването по целесъобразност трябва да включва следната информация:
|
|
Изпитвано вещество:
|
—
|
физична форма, чистота и, където е подходящо, физикохимични свойства (включително изомеризация);
|
|
—
|
данни за идентичността, включително САS номер.
|
|
|
|
Разтворител (ако има такъв):
|
—
|
обосноваване на избора на разтворител, ако е различен от вода.
|
|
|
|
Изследвани животни:
|
—
|
използвани видове/породи;
|
|
—
|
микробиологично състояние на животните, когато е известно;
|
|
—
|
брой, възраст и пол на животните (включително, при необходимост, обосноваване използването на мъжки индивиди вместо женски);
|
|
—
|
водоизточник, условия за отглеждане, диета и т.н.
|
|
|
|
Условия на експеримента:
|
—
|
подробности за формулирането на изпитваното вещество, включително подробности за физичното състояние на приемания материал;
|
|
—
|
подробности, свързани с приемането на изпитваното вещество, обеми на дозите и време на дозиране;
|
|
—
|
подробности във връзка с качеството на храната и водата (включително вид/източник на диетата, водоизточник);
|
|
—
|
обосновка на избора на началната доза.
|
|
|
|
Резултати:
|
—
|
таблици/диаграми на получените данни и ниво на дозата за всяко животно (т.е. при които животното показва признаци на токсичност, включително смърт, природа, острота и продължителност на ефектите);
|
|
—
|
таблици/диаграми на телесното тегло и на измененията в него;
|
|
—
|
индивидуални тегла на животните в деня на дозиране, през седмични интервали след това и по време на смърт или убиване;
|
|
—
|
дата и време на смъртта, ако умрат преди програмираното унищожаване;
|
|
—
|
развитие във времето от първоначалното появяване на признаци за токсичност и дали са били обратими при всяко животно;
|
|
—
|
заключения при аутопсията и хистопатологични заключения за всяко животно, ако има такива.
|
|
|
|
Дискусия и интерпретиране на резултатите.
|
4. ПРЕПРАТКИ
|
(1)
|
British Toxicology Society Working Party on Toxicity (1984). Special report: a new approach to the classification of substances and preparations on the basis of their acute toxicity. Human Toxicol., 3, 85—92.
|
|
(2)
|
Van den Heuvel, M. J., Dayan, A. D. and Shillaker, R. O. (1987). Evaluation of the BTS approach to the testing of substances and preparations for their acute toxicity. Human Toxicol., 6, 279—291.
|
|
(3)
|
Van den Heuvel, M. J., Clark, D. G., Fielder, R. J., Koundakjian, P. P., Oliver, G. J. A., Pelling, D., Tomlinson, N. J. and Walker, A. P. (1990). The international validation of a fixed-dose procedure as an alternative to the classical LD50 test. Fd. Chem. Toxicol. 28, 469—482.
|
|
(4)
|
Whitehead, A. and Curnow, R. N. (1992). Statistical evaluation of the fixed-dose procedure. Fd. Chem. Toxicol., 30, 313—324.
|
|
(5)
|
Stallard, N. and Whitehead, A. (1995). Reducing numbers in the fixed-dose procedure. Human Exptl. Toxicol. 14, 315—323. Human Exptl. Toxicol.
|
|
(6)
|
Stallard, N., Whitehead, A. and Ridgeway, P. (2002). Statistical evaluation of the revised fixed dose procedure. Hum. Exp. Toxicol., 21, 183—196.
|
|
(7)
|
OECD (2001). Guidance Document on Acute Oral Toxicity Testing. Environmental Health and Safety Monograph Series on Testing and Assessment N. 24. Paris
|
|
(8)
|
OECD (2000). Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. Environmental Health and Safety Monograph Series on Testing and Assesment N. 19.
|
|
(9)
|
OECD (1998). Harmonised Integrated Hazard Classification for Human Health and Environmental Effects of Chemical Substances as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals in November 1998, Part 2, p. 11 [http://webnetl.oecd.org/oecd/pages/home/displaygeneral/0,3380,EN-documents-521-14-№-24-№-0,FF.html].
|
|
(10)
|
Lipnick, R. L., Cotruvo, J. A., Hill, R. N., Bruce, R. D., Stitzel, K. A., Walker, A. P., Chu, I., Goddard, M., Segal, L., Springer, J. A. and Myers, R. C. (1995). Comparison of the Up-and-Down, Conventional LD50, and Fixed-Dose Acute Toxicity Procedures. Fd. Chem. Toxicol. 33, 223—231.
|
|
(11)
|
Chan P. K and A. W. Hayes (1994) Chapter 16 Acute Toxicity and Eye Irritation. In: Principles and Methods of Toxicology . 3 rd Edition. A. W. Hayes, Editor. Raven Press, Ltd. New York, USA.
|
ПРИЛОЖЕНИЕ 1
ГРАФИЧЕН АЛГОРИТЪМ ЗА ЗРИТЕЛНОТО ИЗСЛЕДВАНЕ

ПРИЛОЖЕНИЕ 2:
ГРАФИЧЕН АЛГОРИТЪМ ЗА ОСНОВНОТО ИЗСЛЕДВАНЕ


ПРИЛОЖЕНИЕ 3
КРИТЕРИИ ЗА КЛАСИФИЦИРАНЕ НА ИЗПИТВАНО ВЕЩЕСТВО С ОЧАКВАНА СТОЙНОСТ НА LD50 НАД 2 000 MG/KG БЕЗ НЕОБХОДИМОСТОТ ИЗПИТВАНЕ
Критериите за опасност в категория 5 се предназначени да подпомогнат идентифицирането на изпитваните вещества, които са с относително ниска опасност от остра токсичност, но които при определени обстоятелства могат да представляват опасност за уязвимите поколения. Тези вещества се очаква да имат орална или дермална LD50 в обхвата 2 000—5 000 mg/kg или еквивалентни дози при други начини на приемане. Изпитваните вещества могат да бъдат класифицирани в категория на опасност, определена чрез: 2 000 mg/kg < LD50 < 5 000 mg/kg (категория 5 в GHS) в следните случаи:
|
а)
|
ако са стигнали до тази категория по някоя от схемите за изследване от приложение 2, основани на смъртни инциденти;
|
|
б)
|
ако вече съществува достоверно доказателство, което показва, че LD50 е в обхвата от стойности на категория 5, или други изследвания върху животни, или токсикологични изследвания върху хора дават основания за сериозно безпокойство относно човешкото здраве;
|
|
в)
|
чрез данни от екстраполация, оценяване или измерване, ако няма основание да се отнесе към по-висок клас на опасност, и
|
—
|
има налична достоверна информация, показваща значителни токсикологични ефекти при хората, или
|
|
—
|
наблюдава се смъртност при изпитване с високи стойности като тези в категория 4 чрез орален път на приемане, или
|
|
—
|
когато експертната оценка потвърди съществените клинични признаци на токсичност при изпитване с високи стойности като тези в категория 4, освен при диария, пилоерекция или недобър външен вид, или
|
|
—
|
когато експертната оценка потвърди достоверната информация, която индикира потенциална възможност за значими остри ефекти от други изпитвания върху животни.
|
|
ИЗСЛЕДВАНЕ С ДОЗИ НАД 2 000 MG/KG
По изключение и само когато е оправдано от определена необходимост за регулиране, може да се проведе изследване с използване на допълнителна по-висока фиксирана доза с ниво 5 000 mg/kg. Приемайки необходимостта от хуманно отношение към животните, не се препоръчва изследване с 5 000 mg/kg и следва да бъде взето предвид само, когато има голяма вероятност резултатите от такова изследване да имат пряко практическо значение за опазване здравето на хората или животните (9).
Зрително изследване
Правилата за вземане на решение, които са указани в следващата процедура, представена в приложение 1, включват доза с ниво 5 000 mg/kg. По този начин, когато при зрително изследване се използва начална доза 5 000 mg/kg и резултатът е А (смърт), се налага второто животно да бъде изследвано с 2 000 mg/kg; резултати В и С (доказана токсичност или нетоксичност) позволяват като начална доза за основното изследване да бъде избрана 5 000 mg/kg. По подобен начин, ако се използва начална доза, различна от 5 000 mg/kg, тогава изпитването ще доведе до прилагане на 5 000 mg/kg в случай на резултат В или С при 2 000 mg/kg; резултат А след прилагането на 5 000 mg/kg налага началната доза за основното изследване да бъде 2 000 mg/kg, a резултати В и С налагат началната доза за основното изследване да бъде 5 000 mg/kg.
Основно изследване
Правилата за вземане на решение, които са указани в следващата процедура, представена в приложение 2, включват доза с ниво 5 000 mg/kg. По този начин, когато при основно изследване се използва начална доза 5 000 mg/kg, резултат А (> 2 смъртни случая) налага изследване на втора група при 2 000 mg/kg; резултат В (доказана токсичност и/или < 1 смъртен случай) или С (нетоксичност) води до резултат веществото да не бъде класифицирано съгласно GHS. По подобен начин, ако се използва начална доза, различна от 5 000 mg/kg, тогава изпитването води до прилагане на 5 000 mg/kg в случай на резултат С при 2 000 mg/kg; резултат А след прилагането на 5 000 mg/kg води до това веществото да бъде определено в категория 5 на GHS, а резултат В или С води до това веществото да не бъде класифицирано.
ПРИЛОЖЕНИЕ 4
МЕТОД ЗА ИЗПИТВАНЕ Б.1А
Ръководство за класифициране съгласно схемата на ЕС за обхващане на преходния период до пълното прилагане на Глобалната система за хармонизиране на класификацията (GНS) (взето от препратка 8)


Б.1Б. ОСТРА ОРАЛНА ТОКСИЧНОСТ — МЕТОД КЛАС ОСТРА ТОКСИЧНОСТ
1. МЕТОД
Този метод за изпитване е еквивалентен на ОИСР ТG 423 (2001)
1.1. ВЪВЕДЕНИЕ
Методът при клас остра токсичност (1), представен с това изследване, е поетапна процедура, при която се използват по 3 животни от един и същ пол на всеки етап. В зависимост от смъртността и/или състоянието на предстояща смърт при животните може да се наложи средно на 2—4 стъпки да бъде взето решение относно острата токсичност на изпитваното вещество. Тази процедура е репродуктивна, използва много малко животни и дава възможност за категоризиране на веществата по начин, подобен на този при други методи за изпитване за остра токсичност. Методът при клас остра токсичност се основава на биометрични оценки (2)(3)(4)(5) с фиксирани дози, подходящо отделени, за да може едно вещество да бъде категоризирано за целите на класифицирането и оценката на риска. Методът, който е одобрен през 1996 г., е широко утвърден in vivo спрямо LD50 данните, получени от публикуваните национални (6) и международни (7) изследвания.
Насоките за избор на най-подходящият метод за изпитване с определена цел се намират в Ръководството за изпитване на острата орална токсичност (8). Това ръководство съдържа също допълнителна информация за провеждането и интерпретирането на метода за тестване Б.1б.
Изпитваните вещества, в дози, за които е известно, че могат да причинят болка и страдание поради корозивно или силно дразнещо действие, не следва да бъдат прилагани. Умиращи животни или животни, очевидно изпитващи болка или показващи признаци на дълбоко и продължително страдание, биват хуманно убивани и също се вземат предвид при интерпретирането на резултатите, по същия начин както животните, умрели по време на експеримента. Критериите за вземане на решение да бъде убито умиращо или дълбоко страдащо животно и насоки за разпознаване на предсказуема или предстояща смърт са обект на отделно ръководство (9).
При този метод се използват предварително определени дози и резултатите позволяват веществото да бъде категоризирано и класифицирано съгласно Глобалната система (GНS) за хармонизиране на класификацията на химични вещества, които причиняват остра токсичност (10).
По принцип методът цели изчисляването на точната LD50, но позволява установяването на определени области на експозиция, в които се очаква леталност, доколкото смъртност като пропорционално съотношение при животните се достига едва в самия край на това изследване. Методът позволява определяне стойността на LD50 само когато в резултат от прилагането на най-малко две дози се постига ръст на смъртността, по-висок от 0 % и по-нисък от 100 %. Използването на избрани предварително определени дози, независимо от изпитваното вещество, с класифициране, което е категорично свързано с броя на наблюдаваните животни в различните етапи, подобрява възможността за последователно и многократно докладване на резултатите между отделните лаборатории.
В лабораторията за изследване следва да се вземе предвид цялата налична информация за изследваното вещество преди провеждане на експеримента. Такава информация включва идентичност и химична структура на веществото; неговите физикохимични свойства; резултатите от всякакви други in vivo или in vitro токсикологични изпитвания на веществото; токсикологични данни за структурно близки вещества и очаквана(и) употреба(и) на веществото. Тази информация е необходима, за да се удостовери напълно, че това изпитване е свързано със защитата на човешкото здраве и ще бъде от полза при избора на най-подходящата начална доза.
1.2. ОПРЕДЕЛЕНИЯ
Остра орална токсичност: отнася се до онези вредни ефекти, които се появяват в резултат на орален прием на еднократна доза вещество или многократни дози, давани в рамките на 24 часа.
Бавна смърт: означава животното да не умира или да не се проявят признаци на смърт в рамките на 48 часа, но да умре по-късно, през 14-дневния период на наблюдения.
Доза: е количеството прието изпитвано вещество. Дозата се изразява като маса на изпитваното вещество за единица тегло на изследваното животно (напр. mg/kg).
GНS: Глобална система за хармонизиране на класификацията на химични вещества и смеси. Съвместна дейност на ОИСР (човешко здраве и околна среда), Комитета на ООН от експерти в областта на транспортирането на опасни стоки (физикохимични свойства) и МОТ (опасни комуникации) и координирана чрез Междуорганизационната програма за правилно управление на химикалите (IOМС).
Неизбежна смърт: когато животното умира или се очаква настъпването на смърт преди следващото планирано време за наблюдение. Признаците, показващи това състояние при гризачи, могат да включват конвулсии, латерално (странично) положение, лежане и треперене. (Вж. Ръководството за хуманен край (9) за повече подробности.)
LD50 (средна летална орална доза): е статистически получена еднократна доза на вещество, за която може да се очаква, че ще причини смърт при 50 % от животните, когато бъде въведена в тях по орален път. Стойността LD50 се изразява за периоди като масата на изпитваното вещество за единица тегло на изследваното животно (mg/kg).
Ограничена доза: отнася се до доза с по-голямо ограничение при изследването (2 000 или 5 000 mg/kg).
Настъпване на смърт: оставане в терминално състояние или неспособност да се оцелее, дори ако се приложи лечение. (Вж. Ръководството за хуманен край (9) за повече подробности.)
Предсказуема смърт: присъствие на клинични признаци, които показват, че е налице смърт в определен предстоящ период от време преди планирания край на експеримента, например: неспособност да се достигне вода или храна. (Вж. Ръководството за хуманен край (9) за повече подробности.)
1.3. ПРИНЦИП НА МЕТОДА ЗА ИЗСЛЕДВАНЕ
Принцип на метода за изследване е, че въз основа на поетапна процедура, при която се използват минимален брой животни на етап, се получава допълнителна информация за острата токсичност на изследваното вещество, която дава възможност за неговото класифициране. Веществото се приема по орален път на постъпване от група експериментални животни в една от определените дози. Веществото се изпитва чрез прилагане на поетапна процедура, като на всеки етап се използват по три животни от един и същ пол (обикновено женски индивиди). Наличието или отсъствието на смъртни случаи, свързани с веществото на един етап, е определящо за дозирането на следващия етап, т.е.:
|
—
|
не са необходими допълнителни изследвания;
|
|
—
|
дозиране на три допълнителни животни със същата доза;
|
|
—
|
дозиране на три допълнителни животни с по-високо или по-ниско ниво на дозата.
|
Подробностите около провеждането на процедурата за изпитване са описани в приложение 1. Методът дава възможност да се вземе решение относно класифицирането на изследваното вещество и да бъде причислено към един от поредицата токсикологични класове чрез определяне на точните стойности на LD50.
1.4. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
1.4.1. Избор на животински видове
Предпочитаният вид от групата на гризачите е плъх, въпреки че и други видове гризачи могат да бъдат използвани. Обикновено се използват животни от женски пол (9). Причина за това е, че изследванията в научната литература чрез конвенционални тестове с LD50 показват, че независимо от малката разлика в междуполовата сетивност в случаите, при които се наблюдават различия, женските индивиди като цяло са малко по-чувствителни (11). Въпреки това, ако познанията за токсикологичните и токсикокинетичните свойства на близки по структура химически вещества показват, че има вероятност мъжките индивиди да са по-чувствителни от женските, тогава се използват животни от този пол. Когато изпитването се провежда върху мъжки индивиди, то следва да бъде подходящо обосновано.
Използват се здрави млади полово зрели животни от най-често употребяваните за лабораторни изследвания видове. Женските индивиди следва да не са раждали и да не са бременни. Всяко животно в началото на дозирането му следва да бъде на възраст между 8 и 12 седмици и теглото му следва да попада в интервала ± 20 % от средното тегло на всички дозирани преди това животни.
1.4.2. Условия за отглеждане и хранене
Температурата в стаята на опитните животни следва да бъде 22 oС (± 3 oС). Въпреки че относителната влажност следва да бъде поне 30 % и е препоръчително тя да не надвишава 70 % освен при почистване на стаята, като целта е да се постигне 50—60 % относителна влажност. Светлината следва да бъде изкуствена, с редуващи се 12 часа светъл период, 12 часа тъмен период. За хранене могат да бъдат използвани конвенционалните лабораторни диети с неограничен достъп до питейна вода. Животните могат да бъдат групирани в клетките по доза, но броят на животните в клетка не трябва да възпрепятства точните наблюдения върху всяко животно.
1.4.3. Подготовка на животните
Животните са произволно избрани, маркирани, за да е възможно индивидуалното им идентифициране, и държани в клетките си поне 5 дни преди дозирането, за да се аклиматизират към лабораторните условия.
1.4.4. Подготовка на дозите
Най-общо изпитваните вещества следва да бъдат приемани в постоянен обем в рамките на дозите, които се изпитват чрез изменения в концентрацията на дозирания препарат. Когато обаче крайният продукт, който трябва да бъде изследван, е под формата на течност или смес, за последващата оценка на риска от това вещество може да се окаже по-подходяща употребата му в неразредено състояние, т.е. при постоянна концентрация, което е и изискване от страна на някои регулаторни органи. Във всеки случай обемът на максималната доза за администриране не следва да бъде завишаван. Максималният обем на течността, която може да бъде въвеждана наведнъж, зависи от големината на изследваното животно. При гризачи обикновено обемът не надвишава 1 ml/100 g телесно тегло: обаче в случай на водни разтвори може да се приемат 2 ml/100 g телесно тегло. Във връзка с изготвянето на дозирани препарати се препоръчва, където е възможно, да се използва воден разтвор/суспензия/емулсия, следван първоначално от разтвор/суспензия/емулсия в масло (напр. царевично масло), а след това е възможен разтвор в други разтворители. Следва да се знаят токсикологичните характеристики на разтворителите с изключение на водата. Дозите следва да бъдат приготвяни кратко време преди приемането им, освен когато е известно, че препаратът остава стабилен и в добро състояние през периода, в който се използва.
1.5. ПРОЦЕДУРА
1.5.1. Приемане на дозите
Изпитваното вещество се приема на еднократни дози чрез принудително хранене или с подходяща интубационна канюла. При извънредни обстоятелства, при които приемането на еднократна доза не е възможно, дозата може да бъде давана на по-малки части през период, който не може да превишава 24 часа.
Преди дозирането животните следва да бъдат поставени на ограничен режим на хранене за известно време (напр. на плъхове следва да не се дава храна, но не и вода през нощта преди експеримента; на мишки в продължение на 3—4 часа следва да не се предоставя храна, но не и вода). След периода на „постене“, животните следва да бъдат претеглени и изпитваното вещество да бъде приложено. След като веществото бъде прието, може да не се предоставя храна в следващите 3—4 часа при плъхове или 1—2 часа при мишки. Когато дозата се приема на части в определен период от време, може да се наложи да бъдат осигурени храна и вода на животните в зависимост от продължителността на периода.
1.5.2. Брой на животните и нива на дозите
Във всеки етап се използват по три животни. Нивото на дозата, която ще бъде използвана като начална доза, се избира от едно от четирите фиксирани нива: 5, 50, 300 и 2 000 mg/kg телесно тегло. Нивото на началната доза следва да бъде такова, при което вероятността да причини смърт при някое от дозираните животни е най-висока. Графичните алгоритми на приложение 1 описват процедурата, която трябва да бъде следвана за всяка от началните дози. Освен това приложение 4 дава насоки за класифициране по системата на ЕС, докато бъде въведена новата система GHS.
Когато по наличната информация се предполага, че смъртност при начално дозиране с най-високото ниво (2 000 mg/kg телесно тегло) е малко вероятна, тогава се прилага ограничено изпитване. Когато няма информация за изпитваното вещество, с цел хуманно отношение към животните се препоръчва за начална доза да се използва 300 mg/kg телесно тегло.
Интервалът от време между третирането на групите се определя от началото, продължителността и остротата на токсичните признаци. Третирането на животните със следваща доза следва да бъде забавено, докато не се докаже, че дозираните по-рано животни са останали живи.
По изключение и само когато е оправдано от определени регулаторни нужди, може да бъде приложена допълнителна фиксирана доза с по-високо ниво 5 000 mg/kg телесно тегло (вж. приложение 2). По причини, свързани с хуманното отношение към животните, изследването на животни в категория 5 от GHS в обхвата 2 000—5 000 mg/kg е нежелателно и следва да се има предвид само когато съществува голяма вероятност резултатите от такова изследване да имат практическо значение за опазване здравето на хората или животните или околната среда.
1.5.3. Ограничено изпитване
Ограниченото изпитване се използва предимно в случаите, при които извършващият опитите разполага с информация, съгласно която изследваният материал по всяка вероятност не е токсичен, т.е. проявява токсичност само над нормативно ограничените дози. Информация за токсичността на изпитвания материал може да бъде получена от познания за подобни изпитани съединения или подобни изпитани смеси или продукти, като се вземат предвид идентичността и процентното съдържание на съставките, за които е известно, че са с токсикологично значение. В случаите, когато има малко или няма информация за неговата токсикологичност, или при които се очаква изпитваният материал да бъде токсичен, следва да се провежда основното изследване.
При ниво на еднократна доза 2 000mg/kg телесно тегло може да бъде проведено ограничено изследване на 6 животни (по три животни на етап). По изключение може да бъде проведено ограничено изследване на три животни при ниво на еднократната доза 5 000 mg/kg (вж. приложение 2). Ако има смъртни случаи, свързани с веществото, може да се окаже необходимо следващите изследвания да се проведат при по-ниски нива на дозиране.
1.6. НАБЛЮДЕНИЯ
Животните се наблюдават индивидуално, след поне еднократно дозиране през първите 30 минути, периодично през първите 24 часа, с повишено внимание през първите 4 часа и ежедневно след това през общо 14-дневен период от време, освен когато е необходимо да бъдат извадени от експеримента и убити по хуманен начин по причини на хуманно отношение към животните, или са намерени мъртви. Продължителността на наблюдението обаче не следва да бъде строго фиксирана. Тя следва да се определя въз основа на токсичните реакции, началния момент и продължителността на периода за възстановяване и може да бъде увеличена, когато се сметне за необходимо. Периодите от време, в които се появяват и изчезват признаците на токсичност, са важни, особено ако има тенденция токсичните признаци да бъдат забавени (12). Всички наблюдения систематично се записват, с отделни записи, направени за всяко животно.
Допълнителни изследвания ще бъдат необходими, ако животните продължат да показват признаци на токсичност. Наблюденията следва да включват промените в кожата и козината, очите и лигавицата и също дихателната, кръвоносната, автономната и централната нервна система, соматомоторната активност и моделите на поведение. Вниманието следва да бъде насочено към наблюдения на треперене, конвулсии, слюноотделяне, диария, летаргия, сън и кома. Следва да бъдат взети предвид принципите и критериите, резюмирани в Ръководството за хуманен край (9). Животните, намерени в терминално състояние, и животните, показващи дълбока болка или непрекъснати признаци на дълбоко страдание, следва да бъдат убити по хуманен начин. Когато животните са убити по хуманни причини или са намерени мъртви, времето на смъртта им следва да бъде записано колкото е възможно по-точно.
1.6.1. Телесно тегло
Индивидуалното тегло на животните следва да бъде измервано в кратък интервал от време преди приемането на изпитваното вещество и поне веднъж седмично след това. Промените в теглото следва да бъдат изчислявани и записвани. В края на експеримента оцелелите животни се претеглят и след това се убиват по хуманен начин.
1.6.2. Патология
Всички изследвани животни (включително умрелите по време на експеримента или извадените от експеримента животни по причини на хуманно отношение към животните) следва да бъдат подложени на цялостна аутопсия. Всички цялостни патологични изменения във всяко животно следва да бъдат записани. Микроскопските изследвания на органите, даващи доказателства за цялостна патология при животните, оцелели 24 часа или повече след първоначалното дозиране, също могат да допринесат за получаването на полезна информация.
2. ДАННИ
Следва да бъдат осигурени индивидуални данни за всяко животно. Освен това всички данни следва да бъдат обобщени в таблична форма, показваща броя на използваните животни във всяка от изследваните групи, броя на животните, проявяващи признаци за токсичност, броя на животните, намерени мъртви по време на изследването или убити по хуманни причини, времето на настъпване на смъртта на животинския индивид, описание и развитие във времето на токсичните ефекти и обратимостта им, както и заключенията от аутопсията.
3. ОТЧИТАНЕ
3.1. Протокол от изпитването
Протоколът от изпитването по целесъобразност следва да включва следната информация:
|
|
Изпитвано вещество:
|
—
|
физична форма, чистота и, където е подходящо, физикохимични свойства (включително изомеризация);
|
|
—
|
данни за идентичността, включително САS номер.
|
|
|
|
Разтворител (ако има такъв):
|
—
|
обосноваване на избора на разтворител, ако е различен от вода.
|
|
|
|
Изследвани животни:
|
—
|
използвани видове/породи;
|
|
—
|
микробиологично състояние на животните, когато е известно;
|
|
—
|
брой, възраст и пол на животните (включително, при необходимост, обосноваване на използването на мъжки индивиди вместо женски);
|
|
—
|
водоизточник, условия за отглеждане, диета и т.н.
|
|
|
|
Условия на експеримента:
|
—
|
подробности за формулирането на изпитваното вещество, включително подробности за физичното състояние на приемания материал;
|
|
—
|
подробности, свързани с приемането на изпитваното вещество, обеми на дозите и време на дозиране;
|
|
—
|
подробности във връзка с качеството на храната и водата (включително вид/източник на диетата, водоизточник);
|
|
—
|
обосновка на избора на началната доза.
|
|
|
|
Резултати:
|
—
|
таблици/диаграми на получените данни и ниво на дозата за всяко животно (т.е. при които животното показва признаци на токсичност, включително смърт; природа, острота и продължителност на ефектите);
|
|
—
|
таблици/диаграми на телесното тегло и на измененията в него;
|
|
—
|
индивидуални тегла на животните през деня на дозиране, на седмични интервали след това и при смърт;
|
|
—
|
дата и време на смъртта, ако умрат преди приключване на програмата;
|
|
—
|
развитие във времето от първоначалното появяване на признаци за токсичност и дали е имало обратимост за всяко животно;
|
|
—
|
заключения при аутопсията и хистопатологични заключения за всяко животно, ако има такива.
|
|
|
|
Дискусия и интерпретиране на резултатите.
|
4. ПРЕПРАТКИ
|
(1)
|
Roll R., Hцfer-Bosse Th. And Kayser D. (1986). New Perspectives in Acute Toxicity Testing of Chemicals. Toxicol. Lett., Suppl. 31, 86
|
|
(2)
|
Roll R., Riebschlflдger M., Mischke U. and Kayser D. (1989). Neue Wege zur Bestimmung der akuten Toxizitдt von Chemikalien. Bundesgesundheitsblatt 32, 336—341.
|
|
(3)
|
Diener W., Sichha L., Mischke U., Kayser D. and Schlede E. (1994). The Biometric Evaluation of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 68, 559—610
|
|
(4)
|
Diener W., Mischke U., Kayser D. and Schlede E. (1995). The Biometric Evaluation of the OECD Modified Version of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 69, 729—734.
|
|
(5)
|
Diener W., and Schlede E. (1999) Acute Toxicity Class Methods: Alterations to LD/LC50 Tests. ALTEX 16, 129—134
|
|
(6)
|
Schlede E., Mischke U., Roll R. and Kayser D. (1992). A National Validation Study of the Acute-Toxic-Class Method — An Alternative to the LD50 Test. Arch. Toxicol. 66, 455—470.
|
|
(7)
|
Schlede E., Mischke U., Diener W. and Kayser D. (1994). The International Validation Study of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 69, 659—670.
|
|
(8)
|
OECD (2001) Guidance Document on Acute Oral Toxicity Testing. Environmental Health and Safety Monograph Series on Testing and Assessment N. 24. Paris.
|
|
(9)
|
OECD (2000) Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. Environmental Health and Safety Monograph Series on Testing and Assessment N 19.
|
|
(10)
|
OECD (1998) Harmonized Integrated Hazard Classification System For Human Health And Environmental Effects Of Chemical Substances as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals in November 1998, Part 2, p. 11 [http://webnetl.oecd.org/oecd/pages/home/displaygeneral/0,3380,EN-documents-521-14-№-24-№-0,FF.html]
|
|
(11)
|
Lipnick R. L., Cotruvo, J. A., Hill R. N., Bruce R. D., Stitzel K. A., Walker A. P., Chu I; Goddard M., Segal L., Springer J. A. and Myers R. C. (1995) Comparison of the Up-and Down, Conventional LD50, and Fixed Dose Acute Toxicity Procedures. Fd. Chem. Toxicol 33, 223—231.
|
|
(12)
|
Chan P. K. and A. W. Hayes. (1994). Chap. 16. Acute Toxicity and Eye Irritancy. Principles and Methods of Toxicology. Third Edition. A. W. Hayes, Editor. Raven Press, Ltd., New York, USA.
|
ПРИЛОЖЕНИЕ 1
ПРОЦЕДУРА, КОЯТО ТРЯБВА ДА БЪДЕ СЛЕДВАНА ЗА ВСЯКА ОТ НАЧАЛНИТЕДОЗИ
ОБЩИ БЕЛЕЖКИ
За всяка начална доза в това приложение са включени съответните схеми за изпитване, които трябва да бъдат следвани.
|
—
|
Приложение 1а: началната доза е 5 mg/kg тт
|
|
—
|
Приложение 1б: началната доза е 50 mg/kg тт
|
|
—
|
Приложение 1в: началната доза е 300 mg/kg тт
|
|
—
|
Приложение 1г: началната доза е 2 000 mg/kg тт
|
В зависимост от броя на убитите по хуманен начин или умрели животни процедурата за изпитване следва посочените стрелки.
ПРИЛОЖЕНИЕ 1А
ПРОЦЕДУРА ЗА ИЗПИТВАНЕ С НАЧАЛНА ДОЗА 5 МG/КG ТЕЛЕСНО ТЕГЛО

ПРИЛОЖЕНИЕ 1Б
ПРОЦЕДУРА ЗА ИЗПИТВАНЕ С НАЧАЛНА ДОЗА 50 МG/КG ТЕЛЕСНО ТЕГЛО

ПРИЛОЖЕНИЕ 1В
ПРОЦЕДУРА ЗА ИЗПИТВАНЕ С НАЧАЛНА ДОЗА 300 МG/КG ТЕЛЕСНО ТЕГЛО

ПРИЛОЖЕНИЕ 1Г
ПРОЦЕДУРА ЗА ИЗПИТВАНЕ С НАЧАЛНА ДОЗА 2 000 МG/КG ТЕЛЕСНО ТЕГЛО

ПРИЛОЖЕНИЕ 2
КРИТЕРИИ ЗА КЛАСИФИЦИРАНЕ НА ИЗПИТВАНОТО ВЕЩЕСТВО С ОЧАКВАНИ СТОЙНОСТИ НА LD50 НАД 2 000 МG/КG БЕЗ ,НЕОБХОДИМОСТ ОТ ИЗПИТВАНЕ
Критериите за категория на опасност 5 са предназначени да подпомогнат идентифицирането на изпитвани вещества, които представляват относително ниска остра токсикологична опасност, но които при определени обстоятелства могат да представляват опасност за уязвимото поколение. Тези вещества се очаква да имат орална или дермална LD50 в обхвата от 2 000 до 5 000 mg/kg или еквивалентни дози при други начини на въвеждане. Изпитваното вещество следва да бъде класифицирано в категория на опасност, определена по: 2 000 mg/kg < LD50 < 5 000 mg/kg (категория 5 от GHS) в следните случаи:
|
а)
|
ако е насочено към тази категория по някоя от схемите за изследване от приложения 1а—1г, основани на смъртни инциденти;
|
|
б)
|
ако вече съществува достоверно доказателство, което показва, че LD50 е в обхвата от стойности на категория 5, или други изследвания върху животни, или токсикологични изследвания върху хора дават основание за сериозно безпокойство поради въздействие върху здравето на човека;
|
|
в)
|
чрез данни от екстраполации, оценяване или измерване, ако няма основание да се отнесе към по-висок клас на опасност, и
|
—
|
има налична достоверна информация, показваща значителни токсикологични ефекти при хората, или
|
|
—
|
се наблюдава смърт при изпитване със стойности, по-високи от посочените в категория 4 по орален начин на въвеждане, или
|
|
—
|
когато експертната оценка потвърди значимите клинични признаци на токсичност при изпитване със стойности, по-високи от тези в категория 4, освен при диария, пилоерекция или недобър външен вид, или
|
|
—
|
когато експертната оценка потвърди достоверната информация, която посочва потенциална възможност за значителни остри ефекти от други изследвания върху животни.
|
|
ИЗСЛЕДВАНЕ С ДОЗИ НАД 2 000 МG/КG
Признавайки необходимостта от запазване на хуманно отношение към животните, изследването на животни, попадащи в обхвата на категория 5 (5 000 mg/kg), не е препоръчително и следва да бъде разглеждано само когато има голяма вероятност резултатите от такова изследване да имат пряко практическо значение за опазване здравето на хората или животните (10). Следва да не бъдат провеждани допълнителни изследвания при по-високи нива на дозите.
Когато за изследването се изисква прилагане на доза 5 000 mg/kg, се изпълнява само един етап (т.е. три животни). Ако първото дозирано животно умре, тогава продължава дозирането при 2 000 mg/kg в съответствие с графичния алгоритъм в приложение 1. Ако първото животно оцелее, се дозират и другите две животни. Ако само едно от трите животни умре, се очаква стойността на LD50 да надвишава 5 000 mg/kg. Ако и двете животни умрат, тогава дозирането продължава при 2 000 mg/kg.
ПРИЛОЖЕНИЕ 3
МЕТОД ЗА ИЗПИТВАНЕ Б.1б: Ръководство за класифициране съгласно схемата на ЕС за обхващане на преходния период до пълното прилагане на Глобалната система за хармонизиране на класификацията (GНS) (взето от препратка 8)




Б.2. ОСТРА ТОКСИЧНОСТ (ИНХАЛАТОРНА)
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Полезно е да има предварителна информация за разпределението на частиците по размери, както и за парното налягане, температурата на топене, температурата на кипене, точката на възпламеняване и експлозивните свойства (когато могат да намерят приложение) на изпитваното вещество.
Виж също общо въведение към част Б (А).
1.2. ОПРЕДЕЛЕНИЯ
Виж общо въведение към част Б (Б).
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Няма
1.4. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Няколко групи от експериментални животни се подлагат на въздействието на изпитваното вещество за определен период от време, при нарастващи концентрации, като за всяка група се използва една концентрация. След това се провеждат наблюдения върху ефектите и случаите на смърт. Животните, умрели по време на изпитването, се подлагат на аутопсия. Оцелелите животни в края на изпитването също се аутопсират.
Животните, които показват тежки и трайни симптоми на стрес и болка, може да се наложи да бъдат убити по безболезнен начин. Дозирането на изпитваните вещества по начин, за който се знае, че причинява значителна болка и стрес поради разяждащи или остро дразнещи въздействия, няма нужда да се прилага.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Няма.
1.6. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
1.6.1. Подготовка
Животните се настаняват и хранят при експерименталните условия най-малко пет дни преди началото на опита. Преди изпитването на случаен принцип се подбират здрави млади животни и се разпределят в съответния брой групи. Няма нужда животните да се подлагат на симулирана (предварителна) експозиция, освен ако това не е включено в изискванията към използвания тип апаратура за експониране.
Твърдите изпитвани вещества следва да се стрият до получаването на частици с подходящ размер.
Когато е необходимо, към изпитваното вещество може да се прибави подходящ носител, който ще помогне да се получи нужната концентрация на веществото в атмосферата. В такива случаи следва да се предвиди контролна група за носителя. Ако за улесняване на дозирането се използва носител или други добавки, за тях следва да е известно, че нямат токсични ефекти. За тази цел могат да се използват данни, получени при предишни опити.
1.6.2. Условия на изпитването
1.6.2.1. Опитни животни
Плъховете са предпочитаният вид за този опит, освен ако няма други данни. Използват се обичайните лабораторни породи. В началото на изпитването диапазонът на масата на животните не бива да надвишава ± 20 % спрямо съответната средна стойност за всеки от половете.
1.6.2.2. Брой и пол
При всяка концентрация се използват най-малко 10 гризачи (пет женски и пет мъжки). Женските не бива да са раждали, нито да са бременни.
Забележка: При опитите за остра токсичност с животни от по-висш разред от гризачите следва да се обмисли използването на по-малък брой животни. Дозите следва да се подберат внимателно, като се полагат усилия да не се надвиши умерено токсичната доза. При тези изпитвания следва да се избягва въвеждането на летални дози от веществото.
1.6.2.3. Концентрации на експозицията
Концентрациите следва да бъдат достатъчно на брой (поне три) и да са правилно разпределени, така че да се получат групи от животни с определен обхват от токсични въздействия и степени на смъртност. Данните следва да бъдат достатъчни за начертаването на крива концентрация/смъртност и, където е възможно, да позволят приемливо определяне на стойността на LC50.
1.6.2.4. Гранично изпитване
Ако експозицията на пет мъжки и пет женски опитни животни на 5 mg/l газ или 5 rug/l аерозол на течни или твърди вещества в продължение на четири часа дневно в рамките на 14 дни не предизвиква смъртност, свързана с третирането, по-нататъшно изследване се смята за ненужно. В случаи, когато изследваното вещество има физикохимична характеристика (включително експлозивни свойства), непозволяваща достигане на тези концентрации, то се прилага максимално постижимата технически концентрация на изследваното вещество.
1.6.2.5. Време на експозицията
Периодът на експозицията следва да бъде четири часа.
1.6.2.6. Апаратура
Опитите с животните се провеждат в апаратура за инхалации, проектирана така, че да поддържа динамичен въздушен поток (поне 12 смени на въздуха за един час), да осигурява подходящо съдържание на кислород и равномерно разпределение на веществото в атмосферата за експозиция. Когато се използва камера, нейната конструкция следва да е такава, че да свежда до минимум струпването на животните и да осигурява максимално тяхната експозиция чрез вдишване на изпитваното вещество. Основно правило за осигуряването на стабилна атмосфера в камерата е общият „обем“ на опитните животни да не е по-голям от 5 % от обема на камерата. Могат да се използват индивидуални камери, които да обхващат устата и носа, само главата или цялото тяло. Първите два вида камери спомагат да бъде сведено до минимум поемането на веществото по други пътища.
1.6.2.7. Период на наблюдение
Периодът на наблюдение следва да бъде най-малко 14 дни. Продължителността на наблюденията обаче не бива да е строго фиксирана. Тя се определя от токсичните реакции, скоростта, с която те настъпват, и времетраенето на възстановителния период. Така периодът на наблюдение може да се удължи, докогато се сметне за необходимо. Времето, за което се появяват и изчезват симптомите на токсичното действие, както и времето на смъртта са много важни, особено когато съществува тенденция към забавяне на смъртния изход.
1.6.3. Процедура
Животните се претеглят малко преди експозицията. Те се подлагат на въздействието на изпитваното вещество при съответната концентрация за период от четири часа, който се отчита след нагласяването на концентрацията в камерата. Времето за постигане на нужната концентрация в камерата следва да бъде кратко. Температурата по време на изпитването следва да се поддържа в интервала 22 ± 3 oС. В идеалния случай относителната влажност следва да бъде между 30 и 70 %, но понякога (например при изпитването на някои аерозоли) това не може да се постигне. Поддържането на малко по-ниско налягане в камерата (< 5 mm воден стълб) би предотвратило изтичане на изпитваното вещество в околната среда. По време на експозицията на животните не бива да се дават храна и вода. Следва да се използват подходящи системи за създаване и контрол на атмосферата за изпитването. Тези системи следва да осигуряват колкото е възможно по-бързото постигане на стабилни условия на експозицията. Камерата следва да е така проектирана и с нея да се работи по такъв начин, че да се поддържа равномерно разпределение на изпитваното вещество в обема на камерата.
Провеждат се следните измервания или наблюдения:
|
а)
|
на дебита на въздушния поток (постоянно);
|
|
б)
|
на действителната концентрация на изпитваното вещество. Тя се измерва в зоната на дишане поне три пъти по време на експозицията (при някои атмосфери, например аерозоли във високи концентрации, може да е необходимо по-често контролиране на концентрацията). По време на експозицията концентрацията не бива да варира с повече от ± 15 % от средната стойност. При някои аерозоли обаче това ниво на контрол не може да се постигне. В такива случаи се налага да се приемат по-широки граници на вариране на концентрациите. При аерозолите следва да се провеждат анализи на размера на частиците толкова често, колкото е необходимо (поне един път за всяка група животни);
|
|
в)
|
на температурата и влажността (ако е възможно, непрекъснато).
|
Наблюдения се провеждат както по време на експозицията, така и след това. Те се записват системно, като се води индивидуален протокол за всяко животно. През първия ден наблюденията се правят много често. Обстоен клиничен преглед следва да се прави поне един път на всеки работен ден. Другите наблюдения се правят ежедневно, като се предприемат мерки за свеждане до минимум на загубата на животни от изпитването, например аутопсия или замразяване на животните, намерени мъртви, и изолиране или умъртвяване на слабите или умиращите животни.
Наблюденията следва да включват промените на кожата и козината, очите, лигавиците, измененията в дихателната, кръвоносната, автономната и централната нервна система, както и соматомоторната активност и поведението на животните. Особено внимание следва да се обърне на наблюденията на дишането, треморите, конвулсиите, слюноотделянето, диария, летаргия, сън и кома. Времето на смъртта следва да се записва колкото е възможно по-точно. Масата на всяко животно се определя по веднъж на седмица след експозиция и при настъпването на смъртта.
Животните, умрели по време на изпитването, както и оцелелите до края на експеримента се подлагат на аутопсия, като особено внимание се обръща на измененията в горните и долните дихателни пътища. Записват се всички видими макроскопски патологични изменения. Където е нужно, следва да се вземат тъкани за хистопатологично изпитване.
2. ДАННИ
Данните се обобщават в табличен вид. За всяка група от опитни животни те следва да показват: брой на животните в началото на изпитването, време на смъртта на всяко животно, брой на животните, показали други симптоми на токсичното действие, описание на токсичните ефекти и находките при аутопсията. Когато времето на преживяване е по-дълго от един ден, следва да се изчисляват и записват промените в телесната маса. Животните, които са умъртвени по хуманни съображения поради свързани с веществото признаци на стрес и болка, се отчитат като умрели в резултат на въздействието на веществото. Стойността на LС50 се определя по утвърдения метод. Оценката на данните следва да включва връзката (ако има такава) между експозицията на животното и проявите и степента на всички аномалии, включително тези в поведението, клиничните аномалии, видимите поражения, промените в телесната маса, смъртността и другите ефекти на токсичното действие.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Протоколът от изпитването следва по възможност да съдържа следната информация:
|
—
|
вид, порода, източник, условия на околната среда, диета и т.н.;
|
|
—
|
условия на изпитването: описание на апаратурата за експозиция, в това число конструкцията, типа, размерите, източника на въздух, системата за получаване на аерозоли, метода за кондициониране на въздуха и метода за разполагане на животните в камерата (когато е използвана камера). Също следва да се описват техническите средства за измерване на температурата, влажността и концентрацията на аерозола, както и разпределението на частиците по размери.
|
Данни за експозицията.
Данните за експозицията следва да се представят в табличен вид, като се представят със средните си стойности и измерените отклонения (например стандартното отклонение) и, ако е възможно, да включват:
|
а)
|
дебитите на въздушния поток през апаратурата за инхалиране;
|
|
б)
|
температурата и влажността на въздуха;
|
|
в)
|
номиналните концентрации (общото количество изследвано вещество, подадено в апаратурата за инхалиране, разделено на обема въздух);
|
|
г)
|
природата на носителя (ако е използван);
|
|
д)
|
действителните концентрации в изпитваната зона на дишане;
|
|
е)
|
масовия среден аеродинамичен диаметър (ММАD) и геометричното стандартно отклонение (СSD);
|
|
ж)
|
периода за влизане на апаратурата в режим;
|
|
з)
|
периода на експозиция;
|
—
|
таблични данни за отговора по пол и ниво на експозицията (например брой животни, които са умрели или са били убити по време на изпитването; брой животни, показващи признаци на токсично действие; брой животни, подложени на експозиция);
|
|
—
|
времена на смъртта по време на експозицията или след нея, причини и използвани критерии за умъртвяването по хуманни съображения;
|
|
—
|
стойността на LС50 за всеки от половете, определена в края на наблюдателния период (като се посочи и методът на изчисляване);
|
|
—
|
95 % интервал на достоверност за LС50 (където може да се предостави);
|
|
—
|
крива доза/смъртност и наклон на кривата (където е възможно да се измери в зависимост от метода на определянето);
|
|
—
|
находки при аутопсията;
|
|
—
|
всички хистопатологични находки;
|
|
—
|
обсъждане на резултатите (особено внимание се обръща на ефекта, който оказва умъртвявянето на животни по хуманни съображения по време на изпитването върху изчислената стойност на LС50);
|
|
—
|
интерпретиране на резултатите.
|
|
3.2. ОЦЕНКА И ИНТЕРПРЕТИРАНЕ
Вж. Общо въведение, част Б, буква Г.
4. ПРЕПРАТКИ
Вж. Общо въведение, част Б, буква Д.
Б.3. ОСТРА ТОКСИЧНОСТ (ДЕРМАЛНА)
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Вж. Общо въведение, част Б, буква А.
1.2. ОПРЕДЕЛЕНИЕ
Вж. Общо въведение, част Б, буква Б.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Няма.
1.4. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Изпитваното вещество в нарастващи дози се нанася върху кожата при няколко групи експериментални животни, като за всяка група се използва по една доза. След това се провеждат наблюдения върху вредните ефекти и смъртните случаи. Животните, умрели по време на изпитването, се подлагат на аутопсия. Оцелелите животни се аутопсират в края на изпитването.
Животните с остри и продължителни симптоми на болка и стрес може да се наложи да бъдат убити по безболезнен начин. Не бива да се прилага дозиране на изследваните вещества по начини, за които е известно, че причиняват силна болка и стрес, поради характерни за тях ефекти на разяждане или силно дразнене.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Няма.
1.6. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
1.6.1. Подготовка
Животните се разполагат по клетки и се държат и хранят в експериментални условия най-малко пет дни преди началото на експеримента. Преди изпитването млади, полово зрели животни в добро здравословно състояние се подбират по произволен начин и се разпределят на групи. Приблизително 24 часа преди опита козината по гръбната (дорзалната) част на тялото се отстранява чрез подрязване или бръснене. Следва да се внимава да не се охлузи кожата, защото това би могло да промени нейната пропускливост. За прилагането на изпитваното вещество е необходимо да се почистят най-малко 10 % от повърхността на тялото. При изпитването на твърди вещества (които може да се приведат в прахообразно състояние) веществото следва добре да се омокри с вода или, ако е необходимо, с подходящ носител, за да се осигури добър контакт с кожата. Ако се използва носител, следва да се има предвид неговото влияние върху проникването на веществото през кожата. По принцип течните вещества се прилагат без разреждане.
1.6.2. Условия на изпитването
1.6.2.1. Опитни животни
Могат да се използват плъхове или зайци в зряла възраст. Възможно е използването и на други видове животни, но за това е необходима обосновка. Използват се обикновените лабораторни породи. Вариациите в телесната маса на животните в началото на изпитването не бива да надвишават ± 20 % от съответната средна стойност за всеки от двата пола.
1.6.2.2. Брой и пол
При всяко ниво на дозиране се използват най-малко пет животни. Всички те следва да са от един и същи пол. Женските не бива да са раждали, както и да не са бременни. Ако има информация, че един от двата пола проявява значително по-висока чувствителност, то се използват животни от този пол.
Забележка: При изследванията за остра токсичност с животни от по-висш разред от гризачите, следва да се обмисли употребата на по-малък брой животни. Дозите следва да се подбират внимателно, като се полагат усилия да не се надвишават умерено токсичните дози. При тези изпитвания се избягва прилагането на летални дози от веществото.
1.6.2.3. Нива на дозите
Те следва да са достатъчно на брой (поне три) и да са правилно разпределени количествено, така че при изпитването да се получат групи от животни с определен обхват от токсични ефекти и нива на смъртност. При определянето на нивата на дозите следва да се вземат под внимание всички ефекти на дразнене и разяждане на кожата. Данните следва да са достатъчни за получаването на крива доза/отговор и, когато е възможно, да позволяват приемливо определяне на LD50.
1.6.2.4 .Гранично изпитване
С помощта на описаните по-горе процедури може да се проведе гранично изпитване с една доза на ниво най-малко 2 000 mg/кg телесна маса върху група от 5 мъжки и 5 женски животни. Ако това доведе до смъртност, свързана със съединението, може да се реши провеждане на пълното изследване.
1.6.2.5. Период на наблюдение
Периодът на наблюдение следва да бъде най-малко 14 дни. Продължителността на наблюдението обаче не бива да се фиксира точно. Тя се определя от реакциите на токсичното въздействие, скоростта, с която те настъпват, и времетраенето на възстановителния период. Така тя може да се удължи, докогато се сметне за необходимо. Времето, за което се появяват и изчезват симптомите на токсичното действие, тяхната продължителност и моментът на смъртта са важни, особено когато съществува тенденция към забавяне на смъртния изход.
1.6.3. Процедура
Животните се разполагат по клетки индивидуално. Изпитваното вещество се нанася равномерно върху площ около 10 % от общата повърхност на тялото. При силно токсичните вещества покритата повърхност от тялото може да бъде и по-малка, но при всички случаи покриването следва да стане на колкото е възможно по-тънък и равномерен пласт.
Изпитваните вещества се поддържат в контакт с кожата с помощта на марлена превръзка и лепенки, които не предизвикват дразнене. Времетраенето на експозицията е 24 часа. Мястото на прилагане следва да се покрие допълнително по подходящ начин, така че марлята и веществото да са добре закрепени и да се избегне възможността животното да погълне веществото. За тази цел може да се използват приспособления за ограничаване на движенията, но пълното обездвижване на животното не е препоръчително.
В края на експозиционния период останалото вещество се отстранява, като кожата се почиства с вода (ако е възможно) или по друг подходящ начин.
Наблюденията се записват системно в реда, в който са направени. За всяко животно се води индивидуален протокол. През първия ден наблюденията се провеждат често. Поне веднъж на всеки работен ден се прави обстоен клиничен преглед. Останалите наблюдения се провеждат ежедневно, като се прави всичко възможно загубата на животни да бъде сведена до минимум, например аутопсия или замразяване на животните, намерени мъртви, и изолиране или умъртвяване на слабите или умиращите животни.
Наблюденията следва да включват: промени в козината, третираната кожа, очите и лигавиците, както и на дихателната, кръвоносната, автономната и централната нервна система, соматомоторната активност и поведението на животните. Особено внимание следва да се обръща за тремори, конвулсии, слюноотделяне, диария, летаргия, сън и кома. Времето на смъртта се записва колкото е възможно по-точно. Животните, умрели по време на изпитването, както и оцелелите до края на изпитването се подлагат на аутопсия. Записват се всички видими патологични изменения. Когато е необходимо, някои тъкани се вземат за хистопатологично изследване.
Оценка на токсичното действие при другия пол
След приключването на опита с единия пол група от най-малко пет животни от другия пол също се подлага на третиране. Така може да се разбере дали животните от този пол не са забележимо по-чувствителни към изпитваното вещество. В отделни случаи е оправдано използването на по-малък брой животни. Когато има адекватна информация, показваща, че животните от изследвания пол са много по-чувствителни, то експериментирането с другия пол може и да не се прави.
2. ДАННИ
Данните се обобщават в табличен вид като за всяка група животни се показват: брой на животните в началото на изпитването, време на смъртта на всяко животно поотделно, брой животни с други признаци на токсично въздействие, описание на тосичните ефекти и находките при аутопсията. Индивидуалните телесни маси на животните се определят и записват непосредствено преди прилагането на изпитваното вещество, по един път на седмица след това и при смъртта. Когато времето на преживяване е по-голямо от един ден, измененията в теглото на животните се изчисляват и записват. Животните, убити по хуманни съображения заради стреса и болката, свързани с въздействието на веществото, се отчитат като случаи на смърт, причинена от веществото. Стойността на LD50 следва да се определи по утвърдения метод.
Оценката на данните следва да включва преценка на зависимостта (ако има такава) между експозицията на животните и появата и остротата на всички аномалии, включително в поведението и клиничните аномалии, видимите поражения, промените в телесната маса, смъртността и всички останали токсикологични ефекти.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Протоколът от изпитването следва по възможност да съдържа следната информация:
|
—
|
вид, порода, източник, условия на средата, диета и т.н.;
|
|
—
|
условия на изпитването (включително метод за почистване на кожата и вид на превръзката: оклузивна (запушваща) или неоклузивна);
|
|
—
|
нива на дозите (с носителите, ако са използвани, и концентрациите);
|
|
—
|
пол на третираните животни;
|
|
—
|
таблични данни за отговора по пол и ниво на дозата (т.е. брой на животните, умрели или убити по време на опита; брой на животните със симптоми на токсично действие; общ брой на животните);
|
|
—
|
време на смъртта след дозирането; причини и критерии за умъртвяването на животни по хуманни съображения;
|
|
—
|
стойност на LD50 за пола, подложен на цялостно изследване, определена на четиринадесетия ден, и метод на определянето ѝ;
|
|
—
|
95 % интервал на достоверност за LD50 (където може да се предостави);
|
|
—
|
крива доза/смъртност и наклон на кривата (където методът позволява да се определи);
|
|
—
|
находки при аутопсията;
|
|
—
|
всички хистопатологични находки;
|
|
—
|
резултатите от всички направени изпитвания върху другия пол;
|
|
—
|
обсъждане на резултатите (особено внимание се обръща на ефекта, който умъртвяването на животните по хуманни съображения по време на изпитването оказва върху изчислената стойност на LD50);
|
|
—
|
интерпретиране на резултатите.
|
3.2. ОЦЕНКА И ИНТЕРПРЕТИРАНЕ
Вж. Общо въведение, част Б, буква Г.
4. ПРЕПРАТКИ
Вж. Общо въведение, част Б, буква Д.
Б.4. ОСТРА ТОКСИЧНОСТ: КОЖНО ДРАЗНЕЩО/КОРОЗИВНО ДЕЙСТВИЕ
1. МЕТОД
Този метод е еквивалентен на метод ОECD ТG 404 (2002).
1.1. ВЪВЕДЕНИЕ
При подготовката на този осъвременен метод специално внимание беше обърнато на възможностите за усъвършенстване във връзка с осигуряване хуманно отношение към опитните животни и с цялостната оценка на съществуващата информация за изпитваното вещество с цел избягване на ненужно изпитване върху опитни животни. При този метод се препоръчва, преди да се пристъпи към теста in vivo за оценка на корозивно/дразнещо действие на веществото, да се извърши анализ на съществуващите данни за химичното вещество, които имат отношение към това действие. Когато липсват достатъчно данни, те могат да се получат чрез извършване на последващо проучване (1). Стратегията на изследване включва извършване на валидирани и утвърдени изследвания in vitro и е представена като приложение към този метод. Освен това се препоръчва, когато е възможно, при първоначалното изследване in vivo веществото да се прилага на животното в трите тестови апликации последователно, а не едновременно.
За целите и на научната стойност на проучването, и на хуманното отношение към животните следва да не се пристъпва към изпитване in vivo, преди да бъдат анализирани и оценени всички налични данни във връзка с потенциалното корозивно/дразнещо действие на веществото върху кожата. Тези данни включват доказателства от съществуващи проучвания върху хора и/или лабораторни животни, сведения за корозивно/дразнещо действие на едно или повече вещества с подобен химичен строеж или смеси от такива вещества, данните за висока киселинност или алкалност на веществото (2)(3), както и резултатите от валидирани и утвърдени изследвания in vivo или ех vivo (4)(5)(5а). Този анализ следва да доведе до намаляване на необходимостта от извършване на изследвания in vivo за оценка на дразнещо/корозивно действие на веществата върху кожата, за които вече съществуват достатъчно данни от други проучвания относно тези ефекти.
Като приложение към този метод е изложена препоръчителна стратегия за последователно изпитване, която включва извършването на валидирани и утвърдени in vitro или ех vivo изпитвания за оценка на корозивно/дразнещо действие. Стратегията е разработена и единодушно препоръчана от участниците в семинар на ОECD (6) и е приета като препоръчителна стратегия за изпитване в рамките на Глобалната система за хармонизиране на класификацията на химични вещества (GНS) (7). Препоръчва се тази стратегия да бъде приложена, преди да се предприеме in vivo изпитване. За нови вещества стратегията представлява препоръчителният подход за поетапно изпитване с цел получаване на достоверни научни данни за корозивното или дразнещото действие на веществото. За съществуващи вещества с недостатъчно данни за корозивно/дразнещо действие върху кожата стратегията следва да се прилага, когато се провеждат проучвания, за да се получат липсващите данни. Използването на друга стратегия или процедура за изпитване или решението да не се прилага поетапен подход за изпитване следва да бъдат обосновани.
Когато оценката за корозивно/дразнещо действие не може да бъде извършена чрез анализ на данните в съответствие със стратегията за последователно изпитване, следва да се пристъпи към in vivo изпитване (вж. приложението).
1.2. ОПРЕДЕЛЕНИЯ
Кожно дразнене е предизвикването на обратимо увреждане на кожата след прилагането на дадено химично вещество за период до 4 часа.
Корозивно действие върху кожата е предизвикването на необратимо увреждане на кожата, а именно видима некроза на епидермиса и дермата след прилагането на дадено химично вещество за период до 4 часа. Характерните прояви на корозивно действие включват язви, кървене, а до края на 14-дневния период на наблюдение се появяват промени в цвета на кожата, области с пълна алопеция и цикатрикси. При съмнение за вида на увреждането следва да се извърши хистопатологично изследване.
1.3. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Изпитваното вещество се прилага еднократно върху кожата на опитно животно. Участък от кожата на животното, който не е третиран, служи като контрола. През определени интервали от време се отчита и оценява степента на дразнещо/корозивно действие. Наблюдаваните ефекти се описват подробно, за да може да се извърши цялостната им оценка. Продължителността на наблюдението следва да бъде достатъчно голяма, за да може да се установи дали ефектите са обратими или не.
Животните, които показват трайни признаци на тежък стрес и/или болка, следва да бъдат умъртвени по хуманен начин и тези ефекти да се вземат под внимание при оценката на веществото. Критериите за вземане на решение за умъртвяване по хуманен начин на животните, които изпитват тежко страдание и са в терминално състояние, са посочени в препратка (8).
1.4. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
1.4.1. Подготовка на in vivo изпитването
1.4.1.1. Избор на вида опитни животни
Предпочитаният вид опитни животни са зайците албиноси. Използват се млади, здрави, полово зрели животни. Използването на други животински видове следва да бъде обосновано.
1.4.1.2. Подготовка на животните
Приблизително 24 часа преди изпитването козината от дорзалната част на тялото на животните се отстранява чрез подстригване или бръснене. При подстригването или бръсненето кожата не следва да се охлузва. Използват се само животни без наранявания или заболявания на кожата.
В козината на някои породи зайци има гъсто окосмени участъци, които са по-забележими през определени периоди от годината. Изпитваните вещества следва да не се прилагат върху участъците с гъсто окосмяване.
1.4.1.3. Условия на отглеждане и хранене
Животните следва да бъдат разпределени в отделни клетки. В помещението на зайците следва да се поддържа температура 20 oС (±3 oС). Стойностите на относителната влажност не следва да бъдат по-ниски от 30 % и е желателно да не превишават 70 % освен при почистване на помещението. Целта следва да бъде относителната влажност да се поддържа в интервала 50—60 %. Осветлението следва да бъде изкуствено, като се редуват 12 часа светлина и 12 часа тъмнина. При храненето се прилагат обичайните лабораторни диети с неограничен достъп до питейна вода.
1.4.2. Процедура на изпитването
1.4.2.1. Прилагане на изпитваното вещество
Изпитваното вещество се нанася върху малък участък от кожата (около 6 cm) и се покрива с марля. Марлята се прикрепва с помощта на лепенка, която не предизвиква дразнене на кожата. Когато не е възможно директно третиране (напр. при течности или някои пастообразни вещества), изпитваното вещество се нанася първо върху марлята, след което марлята се поставя върху кожата. През периода на експозиция марлята следва да се задържи в контакт с кожата, без да е притисната силно, с помощта на подходяща полуоклузивна превръзка. Когато изпитваното вещество се нанася върху марлята, тя следва да бъде прикрепена към кожата по такъв начин, че да се осигури плътен контакт и равномерно разпределение на веществото върху третирания участък. Достъпът на животното до марлята и поглъщането или вдишването на изпитваното вещество следва да бъде предотвратен.
Течните вещества най-често се използват, без да се разреждат. Когато се изпитва твърдо вещество (което може да се стрие на прах, ако това е необходимо), то следва да се навлажни с възможно най-малкото количество вода (или, при нужда, друг подходящ носител), което е достатъчно, за да се постигне плътен контакт с кожата. Когато се използва друг носител освен водата, той следва да не оказва влияние върху кожното дразнене, предизвикано от изпитваното вещество, или влиянието му следва да бъде минимално.
В края на периода на експозиция (обикновено 4 часа) остатъкът от веществото се отстранява от кожата, когато това е възможно, с вода или подходящ разтворител, без да се променя видът на кожната реакция или да се нарушава целостта на епидермиса.
1.4.2.2. Дози
Върху кожния участък се нанасят 0,5 ml от течни химични вещества или 0,5 g от твърди или пастообразни химични вещества.
1.4.2.3. Първоначално изпитване (in vivo изпитване за дразнещо/корозивно действие върху кожата с използване на едно опитно животно).
Препоръчва се in vivo изпитването да се извърши първоначално върху едно опитно животно, особено в случаите, когато се предполага, че веществото проявява корозивно действие. Този подход е в съответствие със стратегията за последователно изпитване (вж. приложение 1).
Когато въз основа на анализа на съществуващите данни се прецени, че веществото проявява корозивно действие, не е необходимо по-нататък то да се изпитва върху лабораторни животни. За повечето химични вещества, за които се предполага, че са корозивни, най-често не е необходимо да се извършва in vivo изпитване. Въпреки това в случаите, когато се прецени, че са необходими допълнителни данни поради недостатъчни доказателства, може да се извърши изпитване върху животни в ограничен обем, като се използва следният подход: веществото се прилага върху едно и също животно последователно до 3 пъти. Първия път превръзката и марлята се отстраняват след три минути. Ако не се наблюдава значителна кожна реакция, веществото се прилага втори път за един час. Ако наблюденията на този етап показват, че експозицията може да продължи 4 часа, като се спази принципът за хуманно отношение към животните, веществото се нанася трети път за четири часа, след което се оценява степента на реакцията.
Когато след една от трите последователни апликации се открие корозивен ефект, изпитването се прекратява веднага. Когато след нито една от апликациите не се наблюдава корозивен ефект, опитното животно се проследява в продължение на 14 дни, освен ако на по-ранен етап не се появят корозивни промени.
В случаите, когато не се очаква изпитваното вещество да прояви корозивно действие, но може да предизвика дразнене, третирането се провежда върху едно животно с една апликация за четири часа.
1.4.2.4. Потвърдително изпитване (in vivo изпитване за кожно дразнещо действие с използване на допълнителни опитни животни).
Когато при първоначалното изпитване не се установява корозивен ефект, наблюдаваните прояви на дразнене или отрицателната реакция следва да бъдат потвърдени, като се извърши еднократно третиране на най-много две допълнителни животни за 4 часа. Ако при първоначалното изпитване са отчетени прояви на дразнене, потвърдителното изпитване може да се извърши последователно с използване на едно или две опитни животни или едновременно върху двете опитни животни. Когато по изключение не е проведено първоначално изпитване, могат да се третират две или три животни, като на всяко животни се прави по една апликация за 4 часа. Когато се използват две животни и при двете се наблюдава една и съща реакция, не е необходимо по-нататъшно продължаване на изпитването. В обратния случай се третира и трето допълнително животно. При получаване на противоречиви резултати може да се наложи използването на още допълнителни животни.
1.4.2.5. Период на наблюдение
Продължителността на периода на наблюдение следва да бъде достатъчна за пълната оценка на обратимостта на наблюдаваните ефекти. Въпреки това изпитването следва да се прекрати във всеки момент, когато животните покажат трайни признаци на силна болка или стрес. Обикновено за да се установи дали ефектите са обратими, животните се наблюдават в продължение на 14 дни след прекратяване на експозицията. Ако преди края на 14-дневния период се установи, че промените са обратими, изпитването се прекратява в момента, когато това е установено.
1.4.2.6. Клинични наблюдения и оценка на кожните реакции
Всички животни се преглеждат за признаци на еритема и едем и реакциите се оценяват 60 минути, а след това 24, 48 и 72 часа след прекратяването на експозицията. При първоначалното изпитване върху едно животно третираният участък се преглежда и веднага след отстраняването на превръзката и марлята. Кожните промени се класифицират и отчитат според скалата, дадена в таблица 1. Когато до 72-рия час не може да се определи дали настъпилото увреждане на кожата е проява на дразнещо или корозивно действие, наблюдението продължава до 14-ия ден, за да се оцени дали промените са обратими. Освен признаците на дразнене следва да се опишат подробно и всички локални токсични прояви (напр. изсушаване на кожата) и системни неблагоприятни ефекти (напр. клинични симптоми на отравяне, промени в телесната маса). Когато е необходимо да се изяснят противоречиви резултати, следва да се използва хистопатологично изследване.
Класифицирането на кожните промени е субективен процес. За да се постигне съответствие в оценките при класифицирането на кожните промени и да се подпомогнат лабораториите, в които се провеждат изпитвания, и лицата, които наблюдават животните и оценяват намерените промени, персоналът, извършващ наблюдението, е необходимо да бъде добре обучен да прилага класификационната скала (вж. таблицата по-долу). Може да се използва и илюстрирано ръководство за класифициране на проявите на кожно дразнене и други увреждания (9).
2. ДАННИ
2.1. ПРЕДСТАВЯНЕ НА РЕЗУЛТАТИТЕ
В отчета за изпитването получените резултати следва да се обобщят в табличен вид. Той следва да включва всички данни, посочени в точка 3.1.
2.2. ОЦЕНКА НА РЕЗУЛТАТИТЕ
Баловата оценка на кожното дразнене следва да се разглежда във връзка с вида, тежестта и обратимостта или необратимостта на уврежданията. Индивидуалната балова оценка не е единственият критерий за определяне на дразнещите свойства на изпитваното вещество, тъй като се оценяват и други ефекти на веществото. Вместо това индивидуалният бал следва да се разглежда като стойност, която се оценява съвместно с всички други наблюдения от проучването.
При оценката на дразнещия ефект следва да се има предвид дали кожните увреждания са обратими или не. Когато промени като алопеция (в ограничени участъци), хиперкератоза, хиперплазия и излющване на кожата се задържат до края на 14-дневния период на наблюдение, изпитваното вещество следва да се класифицира като дразнещо.
3. ДОКЛАДВАНЕ НА РЕЗУЛТАТИТЕ
3.1. ОТЧЕТ ЗА ИЗПИТВАНЕТО
Отчетът за изпитването следва да включва следната информация:
|
|
Обосновка за провеждане на in vivo изпитване: резултати от анализа на съществуващите данни, включително резултатите от прилагането на стратегията за последователно изпитване:
|
—
|
описание на съответните данни от предишни изпитвания;
|
|
—
|
данни, получени при всеки етап от стратегията за изпитване;
|
|
—
|
описание на извършените in vitro изпитвания, включително подробно представяне на процедурите на изпитване и резултатите за изпитваните и референтните химични вещества;
|
|
—
|
анализ на съществуващите данни с оглед преценка на необходимостта от извършване на in vivo проучване.
|
|
|
|
Изпитвано вещество:
|
—
|
данни за идентифициране на химичното вещество (напр. CAS номер, източник, чистота, известни примеси, номер на партидата);
|
|
—
|
физична природа и физикохимични свойства (напр. рН, летливост, разтворимост, стабилност);
|
|
—
|
при изпитване на смеси се представят данни за качествения състав на сместа и процентното съдържание на компонентите ѝ.
|
|
|
|
Носител (ексципиент):
|
—
|
химично идентифициране, концентрация (където е необходимо), използван обем;
|
|
—
|
обосновка за избора на носителя.
|
|
|
|
Опитни животни:
|
—
|
използван вид/порода, обосновка за използване на други животински видове/породи освен зайци албиноси;
|
|
—
|
брой на животните от всеки пол;
|
|
—
|
индивидуална телесна маса на всяко животно в началото и в края на изпитването;
|
|
—
|
възраст на животните в началото на проучването;
|
|
—
|
източник за доставка на животните, условия на отглеждане, диета и т.н.
|
|
|
|
Условия на изпитването:
|
—
|
начин за подготовка на кожния участък за третиране;
|
|
—
|
описание на материалите, използвани при апликацията на веществото и приготвянето на превръзката, и на начина на поставяне на превръзката;
|
|
—
|
описание на подготовката на изпитваното вещество за нанасяне и на нанасянето и отстраняването му.
|
|
|
|
Резултати:
|
—
|
таблица с баловите оценки на проявите на дразнещо/корозивно действие за всяко животно във всички моменти на отчитане;
|
|
—
|
описание на всички наблюдавани увреждания;
|
|
—
|
описание в разказна форма на вида и степента на наблюдаваните прояви на дразнене/корозивно действие, както и на хистопатологичните заключения;
|
|
—
|
описание на други неблагоприятни локални (напр. отстраняване на мазнините на кожата) и системни ефекти освен проявите на кожно дразнене и корозивно действие.
|
|
|
|
Обсъждане на резултатите.
|
4. ПРЕПРАТКИ
|
(1)
|
Barratt, M. D., Castell, J. V., Chamberlain, M., Combes, R. D., Dearden, J. C., Fentem, J. H., Gerner, I., Giuliani, A., Gray, T. J. B., Livingston, D. J., Provan, W. M., Rutten, F. A. J. J. L., Verhaar, H. J. M., Zbinden, P. (1995) The Integrated Use of Alternative Approaches for Predicting Toxic Hazard. ECVAM Workshop Report 8. ATLA 23, 410—429.
|
|
(2)
|
Young, J. R., How, M. J., Walker, A. P., Worth W. M. H. (1988) Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicol. In Vitro, 2, 19—26.
|
|
(3)
|
Worth, A. P., Fentem, J. H., Balls, M., Botham, P. A., Curren, R. D., Earl, L. K., Esdaile, D. J., Liebsch, M. (1998) Evaluation of the proposed OECD Testing Strategy for skin corrosion. ATLA 26, 709—720.
|
|
(4)
|
ECETOC (1990) Monograph №.15, „Skin Irritation“, European Chemical Industry, Ecology and Toxicology Centre, Brussels.
|
|
(5)
|
Fentem, J. H., Archer, G. E. B., Balls, M., Botham, P. A., Curren, R. D., Earl, L. K., Esdaile, D. J., Holzhutter, H. G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2.Results and evaluation by the Management Team. Toxicology in Vitro 12, pp.483—524.
|
|
(5a)
|
Testing Method B.40 Skin Corrosion.
|
|
(6)
|
OECD (1996) OECD Test Guidelines Programme: Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held in Solna, Sweden, 22—24 January 1996 (http://www1.oecd.org/ehs/test/background.htm).
|
|
(7)
|
OECD (1998) Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www1.oecd.org/ehs/Class/HCL6.htm).
|
|
(8)
|
OECD (2000). Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. OECD Environmental Health and Safety Publications. Series on Testing and Assessment №.19 (http://www1.oecd.org/ehs/test/monos.htm).
|
|
(9)
|
EPA (1990). Atlas of Dermal Lesions, (20T-2004). United States Environmental Protection Agency, Office of Pesticides and Toxic Substances, Washington, DC, August 1990.
[Може да се получи от секретариата на OECD].
|
Таблица I
СКАЛА НА КОЖНИТЕ ПРОМЕНИ
Образуване на еритема и есхара
|
Отсъствие на еритема …
|
0
|
|
Много слаба еритема (едва забележима) …
|
1
|
|
Добре изразена еритема …
|
2
|
|
Умерена до тежка еритема …
|
3
|
|
Тежка еритема (силно зачервяване — с цвят на цвекло) до образуване на есхара, което не позволява да се отчете балът на еритемата …
|
4
|
Максимален бал — 4
Образуване на едем
|
Отсъствие на едем …
|
0
|
|
Много слаб едем (едва забележим) …
|
1
|
|
Лек едем (границите на едемния участък са видимо повдигнати и се очертават ясно) …
|
2
|
|
Умерено изразен едем (подуване около 1 мм) …
|
3
|
|
Тежък едем (подуване повече от 1 мм, което обхваща участък, по-голям от третирания) …
|
4
|
Максимален бал — 4
Когато е необходимо да се изяснят противоречиви резултати, може да се проведе хистопатологично изследване.
ПРИЛОЖЕНИЕ
Стратегия за последователно изпитване за оценка на дразнещо/корозивнодействие върху кожата
ОБЩИ СЪОБРАЖЕНИЯ
В интерес на научната стойност на проучването и на хуманното отношение към животните е важно да се избягва ненужното използване на опитни животни и да се допускат колкото е възможно по-малко изпитвания, за които се очаква, че ще предизвикат тежки увреждания. Преди да се пристъпи към in vivo изпитвания, следва да се оцени пялата съществуваща информация по отношение на дразнещия/корозивния потенциал на дадено химично вещество за кожата. Възможно е вече да съществуват достатъчно данни, въз основа на които веществото може да се класифицира по отношение на кожно дразнещо/корозивно действие, без да е необходимо да се извършват изпитвания върху лабораторни животни. Затова чрез анализа на съществуващите данни и стратегията за последователно изпитване се свежда до минимум необходимостта от in vivo изпитвания, особено когато се очаква, че химичното вещество ще предизвика тежки увреждания у животните.
Препоръчва се да се извърши анализ на съществуващите данни за кожното дразнещо и корозивно действие на химичното вещество, за да се прецени дали да се проведат други проучвания освен in vivo дермалните изпитвания, които могат да подпомогнат оценката на дразнещия/корозивния потенциал. Когато се прецени, че са нужни по-нататъшни проучвания, се препоръчва необходимите експериментални данни да се получат, като се приложи стратегията за последователно изпитване. За химични вещества, които не са изпитвани досега, стратегията за последователно изпитване следва да се използва, за да се съберат всички данни, необходими за оценката на дразнещия/корозивния ефект върху кожата. Стратегията за изпитване, изложена в настоящото приложение, е разработена на семинар на OECD (1) и по-късно е утвърдена и разширена в рамките на Хармонизираната интегрирана система за класифициране на опасностите във връзка с ефектите на химичните вещества върху човешкото здраве и околната среда, приета на 28-ата съвместна среща на Комитета по химикалите и работната група по химикалите през ноември 1998 г. (2).
Въпреки че стратегията за последователно изпитване не е включена като неразделна част от метод Б.4, тя представлява препоръчителният подход за оценка на дразнещия и корозивния ефект върху кожата. Този подход съответства в най-висока степен на критериите за добра практика и етика при in vivo изпитванията за оценка на кожното дразнещо и корозивно действие. В представения метод са дадени указания за провеждането на in vivo изпитването и се обобщават факторите, които следва да се вземат предвид, преди да се пристъпи към него. Стратегията предлага подход за оценка на съществуващите данни за кожното дразнещо/корозивно действие на химичните вещества и поетапен подход за получаване на необходимите данни за веществата, които досега не са били изследвани или за които са необходими допълнителни проучвания. В нея също се препоръчва при определени условия извършването на валидирани и утвърдени in vitro или ех vivo методи за оценка на кожно корозивно/дразнещо действие.
ОПИСАНИЕ НА СТРАТЕГИЯТА ЗА ОЦЕНКА И ИЗПИТВАНЕ
Преди да се предприемат изпитвания в рамките на стратегията за последователно изпитване (вж. фигурата), следва да се прецени цялата налична информация, за да се определи необходимостта от провеждане на in vivo дермално изпитване. Въпреки че при оценката на отделни параметри (например много високи или ниски стойности на рН) може да се получи съществена информация, следва да се разгледат всички съществуващи данни. Всички сведения за ефектите на дадено вещество или негови структурни аналози следва да бъдат оценени в процеса на вземане на решение и да се представи обосновката на взетото решение. На първо място следва да се обърне внимание на съществуващите данни за ефектите върху хора и животни, а след това да се оценят резултатите от in vitro или ех vivo изпитвания. Във всички случаи, когато е възможно, следва да се избягва провеждането на in vivo изпитвания на корозивни химични вещества. Факторите, които се вземат под внимание в стратегията на изпитване, включват:
Оценка на съществуващите данни за хора и животни (стъпка 1). Съществуващите данни за хора, като например данни от клинични проучвания, проучвания върху работници, описания на случаи и/или данни от изпитвания върху животни, например от проучвания на острата дермална токсичност или дермалната токсичност при многократно постъпване, следва да се разглеждат с предимство, защото те осигуряват информация, пряко свързана с ефектите върху кожата. Не е необходимо да се провеждат in vivo изпитвания на вещества с известно дразнещо или корозивно действие, както и на тези, при които данните убедително показват отсъствие на дразнещ или корозивен ефект.
Анализ на зависимостите „структура-активност“ (structure activity relationships, SAR) (стъпка 2). Резултатите от изпитвания на вещества с подобна химична структура следва да се вземат под внимание, ако са налице такива данни. Когато съществуват достатъчно данни за хора и/или животни, свидетелстващи за дермално дразнещо/корозивно действие на химични вещества с аналогична структура или смеси от такива вещества, може да се приеме, че веществото, което подлежи на проучване, ще предизвика същия ефект. В тези случаи може да се прецени, че не е необходимо да се провежда изпитване. Съгласно стратегията за последователно изпитване негативните данни от проучвания на химични вещества с аналогична структура или смеси от такива вещества не се смятат като достатъчно основание, за да се приеме отсъствие на корозивен или дразнещ ефект за дадено химично вещество. За установяване на потенциално корозивно/дразнещо действие върху кожата, следва да се използват валидирани и утвърдени SAR подходи.
Физикохимични свойства и химична активност (стъпка 3). Химични вещества с много високо или много ниско рН (рН ≥ 11,5 или рН ≤ 2,0) могат да предизвикат силно изразени локални ефекти. Когато дадено химично вещество може да се определи като корозивно за кожата въз основа на високо или ниско рН, следва да се вземе под внимание и неговият алкално-киселинен резерв (или буферен капацитет) (3)(4). Когато данните за буферния капацитет показват, че веществото може да не е корозивно за кожата, следва да се проведе по-нататъшно проучване за потвърждаване на това предположение, за предпочитане посредством валидирано и утвърдено in vitro или ех vivo изпитване (вж. стъпки 5 и 6).
Дермална токсичност (стъпка 4). Когато е доказано, че дадено химично вещество проявява висока токсичност по дермален път на постъпване, провеждането на in vivo изпитване за кожно дразнещо/корозивно действие може да бъде практически невъзможно, тъй като количеството от изпитваното вещество, което обикновено се прилага, може да надвиши дозите, водещи до изразена токсичност или леталитет, и вследствие на това изпитването да доведе до смърт или тежко страдание на опитните животни. В допълнение, когато са извършени проучвания на дермалната токсичност върху зайци албиноси с лимитираща доза 2 000 mg/kg т. т. или по-високи дози и при тях не е установено кожно дразнене или корозивен ефект, може да се прецени, че не е необходимо да се провежда по-нататъшно изпитване за кожно дразнещо/корозивно действие. Когато острата дермална токсичност се оценява въз основа на извършени в миналото проучвания, следва да се имат предвид редица съображения. Например представените данни за кожни увреждания могат да бъдат непълни. Изпитването и наблюденията може да са извършени не върху зайци, а върху друг животински вид, който се различава значително по своята чувствителност към веществото. Също така формата, в която изпитваното вещество е приложено на животните, може да не е избрана подходящо с оглед оценката на кожно дразнещо/корозивно действие (например при оценката на дермалната токсичност веществата се използват често в разредено състояние (5)). Въпреки това, в случаите, когато са налице адекватно планирани и проведени проучвания на дермалната токсичност върху зайци, отрицателните резултати могат да се смятат като достатъчно доказателство за това, че веществото не проявява корозивно или дразнещо действие.
Резултати от in vitro или ех vivo изпитвания (стъпки 5 и 6). Химични вещества, които проявяват корозивни или силно изразени дразнещи свойства при валидирано и утвърдено in vitro или ех vivo изпитване за оценка на тези специфични ефекти (6)(7), не е необходимо да се изпитват върху животни. Може да се приеме, че тези вещества ще предизвикат подобни силно изразени ефекти in vivo.
In vivo изпитване върху зайци (стъпки 7 и 8). Когато е взето решение за провеждане на in vivo изпитване, то следва да започне с третиране на едно животно. Когато резултатите от третирането показват, че веществото е корозивно за кожата, по-нататъшно изпитване не следва да се извършва. Ако при първоначалното изпитване не се наблюдава корозивен ефект, дразнещият ефект или негативният резултат следва да се потвърди, като се третират най-много две допълнителни животни при 4-часова експозиция. Когато при първоначалното изпитване се наблюдава дразнещо действие, изпитването за потвърждение на резултата може да се извърши последователно (върху едно животно и при необходимост — върху второ животно) или едновременно върху две животни.
ПРЕПРАТКИ
|
(1)
|
OECD (1996) Test Guidelines Programme: Final Report on the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held on Solna, Sweden, 22—24 January 1996 (http://www1.oecd.org/ehs/test/background.htm).
|
|
(2)
|
OECD (1998) Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www1.oecd.org/ehs/Class/HCL6.htm).
|
|
(3)
|
Worth, A. P., Fentem J. H., Balls M., Botham P. A., Curren R. D., Earl L. K., Esdail D. J., Liebsch M.(1998). An Evaluation of the Proposed OECD Testing Strategy for Skin Corrosion. ATLA 26, 709—720.
|
|
(4)
|
Young, J. R., How, M. J., Walker, A. P., Worth, W. M. H. (1988). Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substances, Without Testing on Animals. Toxic. In Vitro,2 (1) pp. 19—26.
|
|
(5)
|
Patil, S. M., Patrick, E., Maibach, H. I. (1996) Animal, Human, and In Vitro Test Methods for Predicting Skin Irritation, in:Francis N. Marzulli and Howard I. Maibach (editors): Dermatotoxicology. Fifth Edition ISBN 1-56032-356-6, Chapter 31, 411—436.
|
|
(7)
|
Fentem, J. H., Archer, G. E. B., Balls, M., Botham, P. A., Curren, R. D., Earl, L. K., Edsail, D. J., Holzhutter, H. G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in Vitro 12, pp.483—524.
|
Фигура
СТРАТЕГИЯ ЗА ИЗПИТВАНЕ И ОЦЕНКА НА ДРАЗНЕЩО/КОРОЗИВНОДЕЙСТВИЕ ВЪРХУ КОЖАТА

Б.5. ОСТРА ТОКСИЧНОСТ: ОЧНО ДРАЗНЕЩО/КОРОЗИВНО ДЕЙСТВИЕ
1. МЕТОД
Този метод е еквивалентен на ОECD TG 405 (2002)
1.1. ВЪВЕДЕНИЕ
При подготовката на този осъвременен метод специално внимание е отделено на възможностите за усъвършенстване на метода посредством оценка на пялата съществуваща информация за изпитваното вещество с оглед избягване на ненужно изпитване върху лабораторни животни. В този метод се препоръчва, преди да се пристъпи към in vivo изпитването за оценка на острото корозивно/дразнещо действие върху очите, да се извърши анализ на съществуващите данни за химичното вещество (1), които имат отношение към тези ефекти. Когато липсват достатъчно данни, се препоръчва те да бъдат получени чрез извършване на последователно изпитване (2)(3). Стратегията за изпитването включва извършването на валидирани и утвърдени in vitro изпитвания и е изложена като приложение към този метод. Също така се препоръчва, преди да се вземе решение за провеждане на in vivo изпитване за очно дразнещо/корозивно действие, да се проведе in vivo изпитване за оценка на кожното дразнещо/корозивно действие, въз основа на което може да се предвиди корозивният ефект върху очите.
В интерес както на научната стойност на проучването, така и на хуманното отношение към лабораторните животни е да не се взима решение за провеждане на in vivo изпитване, преди да бъдат анализирани и оценени всички налични данни във връзка с потенциалното корозивно/дразнещо действие на веществото върху очите. Тук се включват данни от съществуващи проучвания върху хора и/или лабораторни животни, данни за корозивно/дразнещо действие на едно или повече вещества с подобен химичен строеж или смеси от такива вещества, данни за висока киселинност или алкалност (4)(5), както и резултати от валидирани и утвърдени in vitro или ех vivo методи за оценка на дразнещо/корозивно действие върху кожата (6) (6а). Проучванията могат да бъдат извършени преди анализа на съществуващите данни или в резултат от този анализ.
За някои вещества анализът може да покаже необходимост от извършване на in vivo изпитване за оценка на потенциалното дразнещо/корозивно действие върху очите. Във всички тези случаи, преди да се вземе решение за провеждане на това изпитване, се препоръчва да се извърши in vivo изпитване на дермалните ефекти на веществото и оценка на резултатите от него съгласно метод Б.4 (7). Прилагането на анализа на съществуващите данни и стратегията за последователно изпитване следва да доведе до намаляване на необходимостта от извършване на in vivo изпитвания за очно корозивно/дразнещо действие на веществата, за които съществуват достатъчно събрани данни от други проучвания. In vivo изпитване за оценка на очното корозивно/дразнещо действие може да се проведе, когато потенциалното очно корозивно/дразнещо действие не може да се оцени чрез прилагане на стратегията за последователно изпитване дори след извършването на in vivo изпитване за кожно дразнещо/корозивно действие.
В приложението към този метод е представена препоръчителна стратегия за последователно изпитване, която включва прилагането на валидирани in vitro или ех vivo методи за оценка на корозивно/дразнещо действие. Стратегията е разработена и единодушно препоръчана от участниците в семинар на ОECD (8) и е приета като препоръчителна стратегия за изпитване в рамките на Глобалната система за хармонизиране на класификацията на химични вещества (GSH) (9). Препоръчва се тази стратегия за изпитване да се приложи, преди да се проведе in vivo изпитване. За нови вещества стратегията представлява препоръчителният подход за поетапно изпитване с цел получаване на достоверни научни данни за корозивно/дразнещо действие. За съществуващи вещества с недостатъчно данни за кожно и очно корозивно/дразнещо действие стратегията следва да се приложи, за да се получат липсващите данни. Използването на друга стратегия или процедура за изпитване или решението да не се прилага поетапният подход за изпитване следва да бъдат обосновани.
1.2. ОПРЕДЕЛЕНИЯ
Очно дразнене е предизвикването на промени в окото след прилагане на изпитваното вещество върху предната очна повърхност, като промените се възстановяват напълно до 21-вия ден след третирането.
Корозивно действие върху очите е предизвикването на увреждане на тъканите на окото или сериозно увреждане на зрението вследствие прилагането на изпитваното вещество върху предната очна повърхност, като увреждането не се възстановява напълно до 21-вия ден след третирането.
1.3. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Изпитваното вещество се прилага еднократно върху едно от очите на опитното животно, а окото, което не е третирано, служи като контрола. През определени интервали от време се отчита и оценява степента на дразнещо/корозивно действие върху конюнктивата, роговицата и ириса. Други ефекти върху очите, както и неблагоприятни системни ефекти също се описват с оглед извършването на цялостна оценка на токсичното действие. Продължителността на наблюдението следва да бъде достатъчно голяма, за да може да се отчете дали наблюдаваните ефекти са обратими или не.
Животните, които показват трайни признаци на тежък стрес и/или болка в който и да е момент от изпитването, следва да бъдат умъртвени по хуманен начин и наблюдаваните ефекти да се вземат под внимание при оценката на веществото. Критериите за вземане на решение за умъртвяване по хуманен начин на животните, които изпитват тежко страдание и се намират в терминално състояние, са посочени в препратка (10)
1.4. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
1.4.1. Подготовка на in vivo изпитването
1.4.1.1. Избор на вида опитни животни
Предпочитаните опитни животни са зайците албиноси. Използват се млади, здрави, полово зрели животни. Използването на други животински видове следва да бъде обосновано.
1.4.1.2. Подготовка на животните
Двете очи на всяко експериментално животно, което е избрано за евентуално включване в изпитването, следва да се прегледат през последните 24 часа преди началото му. Животните, при които се установяват признаци на очно дразнене, очни дефекти или предшестващо увреждане на роговицата, не следва да се използват.
1.4.1.3. Условия на отглеждане и хранене
Животните следва да бъдат разпределени в отделни клетки. В помещението, в което се намират зайците, следва да се поддържа температура 20 oС (± 3 oС). Стойностите на относителната влажност следва да не са по-ниски от 30 % и е желателно да не превишават 70 % освен по време на почистване на помещението. Целта е относителната влажност да се поддържа в интервала 50—60 %. Осветлението следва да бъде изкуствено, като се редуват 12 часа светлина и 12 часа тъмнина. При храненето се прилагат обичайните лабораторни диети с неограничен достъп до питейна вода.
1.4.2. Процедура на изпитването
1.4.2.1. Прилагане на изпитваното вещество
Изпитваното вещество следва да се постави в конюнктивалната торбичка на едното око на всяко от животните след леко издърпване на долния клепач по-напред от очната ябълка. След това двата клепача се държат долепени за около една секунда, за да може цялото поставено количество от веществото да се задържи в контакт с окото. Другото око не се третира и служи за контрола.
1.4.2.2. Промивка
Очите на опитните животни не следва да се промиват в продължение най-малко на 24 часа след прилагане на веществото, освен в случаите, когато веществото е в твърдо агрегатно състояние (виж точка 1.4.2.3.2) и когато корозивният или дразнещият ефект се проявява непосредствено след третирането. Промивка може да се направи на 24-ия час след третирането, ако е необходимо.
Използването на допълнителна група животни за изследване влиянието на промивката не се препоръчва, освен ако не е достатъчно обосновано от научна гледна точка. Когато е необходимо използването на допълнителна група, тя следва да включва два заека. Условията за извършване на промивката следва да се документират внимателно, включително дата и час, състав и температура на разтвора за промиване и използвано количество от него, продължителност и скорост на промиването.
1.4.2.3. Дози
1.4.2.3.1. Изпитване на течности
Когато се изпитват течни вещества, третирането се извършва с количество от 0,1 ml. Вещества, които се употребяват под формата на спрей, следва да не бъдат прилагани директно върху окото чрез пръскане. В този случай част от течността следва да се изпръска и да се събере в контейнер, след което от нея се взема необходимото количество от 0,1 ml и се поставя в окото.
1.4.2.3.2. Изпитване на твърди вещества
Когато се изпитват твърди, пастообразни вещества и вещества, съставени от дребни частици, се прилага количество с обем 0,1 ml или маса не повече от 100 mg. Материалът, който се изпитва, следва да бъде стрит до фин прах. Обемът на прахообразното твърдо вещество следва да бъде измерен след леко уплътняване, например чрез почукване върху съда, в който се извършва измерването. Когато твърдото вещество не се е отстранило от окото по естествен път при първото отчитане на наблюдаваните промени (един час след третирането), окото може да се изплакне с физиологичен разтвор или дестилирана вода.
1.4.2.3.3. Изпитване на аерозоли
При всички веществата, които се прилагат като спрей (спрей с помпа или аерозол), се препоръчва част от течността да се изпръска в контейнер и от нея да се вземе количеството, необходимо за третиране на окото. Изключение се прави само за вещества в аерозолни флакони под налягане, които не могат да се съберат по този начин, поради това че се изпаряват. В тези случаи окото следва да се придържа отворено и изпитваното вещество се поставя директно върху предната му повърхност с едно изпръскване в продължение на около една секунда. Флаконът се държи пред окото на разстояние 10 cm. Разстоянието може да варира в зависимост от налягането на аерозола и неговия състав. Изпръскването под налягане следва да се извърши внимателно, за да не се увреди окото. В някои случаи може да бъде необходимо да се оцени потенциалът за „механично“ увреждане на окото от налягането на аерозола.
Оценка на дозата от аерозола, с която е третирано окото, може да бъде направена чрез следната процедура: веществото се напръсква върху тегловна хартия през отвор с размерите на окото на заека, поставен непосредствено пред хартията. Чрез разликата в теглото на хартията преди и след напръскването се определя приблизително количеството, което би попаднало върху окото. За летливи вещества вместо тегловна хартия може да се използва контейнер. Изпръсканото в него количество се определя чрез претегляне на контейнера преди и след изпразването му.
1.4.2.4. Първоначално изпитване (in vivo изпитване за оценка на очно дразнещо/корозивно действие с използване на едно опитно животно)
В съответствие със стратегията за последователно изпитване (вж. приложение 1) се препоръчва in vivo изпитването да се извърши първоначално върху едно опитно животно.
Когато това изпитване се проведе съгласно описаната процедура и резултатите показват, че веществото може да прояви корозивно или изразено дразнещо действие върху очите, не следва да се извършва по-нататъшно изпитване за оценка на очното дразнещо/корозивно действие.
1.4.2.5. Местна упойка
Необходимостта от използване на местни анестетици се преценява конкретно за всеки отделен случай. Когато анализът на съществуващите данни показва, че изпитваното вещество може да причини болка или при първоначалното изпитване се появява болка, преди третирането може да се приложи местен анестетик. Видът, концентрацията и дозата на анестетика следва да се подберат внимателно, така че употребата му да не доведе до промяна в реакцията към изпитваното вещество. Контролното око се третира с анестетика по същия начин.
1.4.2.6. Потвърдително изпитване (in vivo изпитване за оценка на очно дразнещо действие с използване на допълнителни опитни животни).
Когато при първоначалното изпитване не се наблюдава корозивен ефект, дразнещият ефект или негативният резултат следва да се потвърдят, като се третират най-много две допълнителни животни. Ако при първоначалното изпитване се установява силно изразено дразнещо действие и при потвърдителното изпитване се очаква силно изразен (необратим) ефект, се препоръчва потвърдителното изпитване да се извърши чрез последователно третиране (върху едно животно и след това при необходимост — върху още едно животно) вместо едновременно върху двете допълнителни животни. Когато при второто третирано животно се наблюдава корозивен или силно изразен дразнещ ефект, изпитването се прекратява. При поява на слаб или умерен дразнещ ефект може да се наложи използването на допълнителни опитни животни, за да се потвърдят тези резултати.
1.4.2.7. Период на наблюдение
Продължителността на периода на наблюдение следва да бъде достатъчна за цялостната оценка на степента и обратимостта на наблюдаваните ефекти. Въпреки това изпитването следва да се прекрати във всеки момент, когато опитните животни покажат трайни признаци на силна болка или стрес (9). Обикновено за да се установи дали ефектите са обратими, животните следва да се наблюдават в продължение на 21 дни след прилагането на веществото. Ако преди края на 21-дневния период се установи, че промените са обратими, изпитването се прекратява в момента, когато това е установено.
1.4.2.7.1. Клинично наблюдение и оценка на очните реакции
Очите се преглеждат на 1-вия, 24-ия, 48-ия и 72-рия час след прилагането на изпитваното вещество. Наблюдението не следва да продължава по-дълго от необходимото за получаване на достатъчно ясна и пълна информация. Животните, които показват трайни признаци на силна болка или стрес, следва да бъдат умъртвени незабавно по хуманен начин и тези ефекти да се вземат под внимание при оценката на веществото. Опитните животни със следните очни увреждания, настъпили след третирането, следва да бъдат умъртвени по хуманен начин: перфорация на роговицата или язви, засягащи значителна част от роговицата, включително стафилома; кръв в предната камера на окото; помътняване на роговицата от четвърта степен, коетс персистира за 48 часа; отсъствие на реакция на светлината (промени в ириса от втора степен), което персистира за 72 часа; язви на конюнктивата; некроза на конюнктивата или мигателните ципи; влажна некроза. Умъртвяването се налага, защото тези лезии най-често са необратими.
Опитните животни, при които не се развиват очни лезии, следва да бъдат умъртвени не по-рано от 3 дни след третирането. Опитни животни с леко до умерено изразени лезии следва да се наблюдават, докато лезиите отзвучат или в продължение на 21 дни, след което изпитването се прекратява. Наблюдението следва да се извърши на 7-ия, 14-ия и 21-вия ден след третирането, за да се прецени състоянието на получените лезии и тяхната обратимост или необратимост.
При всяко наблюдение следва да се отчита степента на очните реакции (за конюнктива, роговица и ирис) (таблица 1). Всички други очни лезии (например панус, пигментиране) или неблагоприятни системни ефекти също следва да се опишат.
Прегледът на очните реакции може да се улесни чрез използване на бинокулярна лупа, ръчна шпалт-лампа, биомикроскоп или друг подходящ уред. След отчитане на наблюденията на 24-ия час очите могат допълнително да се изследват с помощта на флуоресцеин.
Оценката и степенуването на очните промени е субективен процес. За да се постигне съответствие в оценките при класифицирането на очните промени и да се подпомогнат лабораториите, в които се провеждат изпитвания, и лицата, които наблюдават животните и оценяват намерените промени, персоналът, извършващ наблюдението, следва да се обучи добре да прилага класификационната скала.
2. ДАННИ
2.2. ОЦЕНКА НА РЕЗУЛТАТИТЕ
Баловата оценка на очното дразнене следва да се разглежда заедно с вида, тежестта и обратимостта или необратимостта на настъпилите лезии. Индивидуалната балова оценка не е единственият критерий за определяне на дразнещите свойства на изпитваното вещество, той като се оценяват и други ефекти на веществото. Вместо това индивидуалният бал следва да се разглежда като стойност, която има съдържание само когато е подкрепена от пълното описание и оценка на всички наблюдения.
3. ДОКЛАДВАНЕ НА РЕЗУЛТАТИТЕ
3.1. ОТЧЕТ ЗА ИЗПИТВАНЕТО
Отчетът за изпитването следва да включва следната информация:
|
|
Обосновка на извършеното in vivo изпитване: резултати от анализа на съществуващите данни от предишни изпитвания, включително резултатите от прилагането на стратегията за последователно изпитване:
|
—
|
описание на съществените данни от предишни изпитвания;
|
|
—
|
данни, получени при всяка стъпка от стратегията за изпитване;
|
|
—
|
описание на извършените in vitro изпитвания, включително подробно представяне на процедурите за изпитване и резултатите, получени при прилагане на изпитваните и референтните химични вещества;
|
|
—
|
описание на проведеното in vivo изпитване за оценка на кожно дразнещо/корозивно действие и на получените резултати;
|
|
—
|
анализ на съществуващите данни с оглед преценка на необходимостта от извършване на in vivo проучване.
|
|
|
|
Изпитвано вещество:
|
—
|
данни за идентифициране на химичното вещество (напр. CAS номер, източник, чистота, известни примеси, номер на партидата);
|
|
—
|
физична природа и физикохимични свойства (напр. рН, летливост, разтворимост, стабилност, химична реакция с вода);
|
|
—
|
при изпитване на смеси следва да се представят данни за качествения състав на сместа и процентното съдържание на компонентите ѝ;
|
|
—
|
когато се използва местен анестетик, за него се представят данни за идентичност, чистота, вид, доза, възможност за взаимодействие с изпитваното вещество.
|
|
|
|
Носител:
|
—
|
химично идентифициране, концентрация (когато е необходимо), използван обем;
|
|
—
|
обосновка за избора на носителя.
|
|
|
|
Опитни животни:
|
—
|
вид/порода, обосновка за използване на други животински видове/породи освен зайци албиноси;
|
|
—
|
възраст на животните в началото на проучването;
|
|
—
|
брой на животните от всеки пол в опитните и контролните групи (когато се изисква);
|
|
—
|
индивидуална телесна маса на всяко животно в началото и в края на изпитването;
|
|
—
|
източник за доставка на животните, условия на отглеждане, диета и т.н.
|
|
|
|
Резултати:
|
—
|
описание на методите за изследване на очния статус, използвани при характеризирането и степенуването на очните промени във всеки момент на отчитане (напр. използване на ръчна шпалт-лампа, биомикроскоп, флуоресцеин и др.);
|
|
—
|
представяне в табличен вид на данните за проявите на дразнещо/корозивно действие за всяко животно във всички моменти на отчитане до отстраняването на животното от изпитването;
|
|
—
|
описание в разказна форма на вида и степента на наблюдаваните прояви на дразнещо/корозивно действие;
|
|
—
|
описание на всички други очни лезии (например васкуларизация, образуване на панус, адхезии, пигментиране);
|
|
—
|
описание на неблагоприятни локални ефекти освен очните лезии, както и на неблагоприятни системни ефекти и хистопатологични наблюдения, ако такива са налице.
|
|
|
|
Обсъждане на резултатите.
|
3.2. ИНТЕРПРЕТАЦИЯ НА РЕЗУЛТАТИТЕ
Екстраполацията на резултатите от проучванията на очното дразнене върху лабораторни животни е валидна само в ограничена степен. В много случаи зайците албиноси са по-чувствителни от хората към вещества с очно дразнещо или корозивно действие.
При интерпретацията на данните следва внимателно да се прецени и изключи възможността дразненето да е предизвикано вторично вследствие на инфекция.
4. ПРЕПРАТКИ
|
(1)
|
Barratt, M. D., Castell, J. V., Chamberlain, M., Combes, R. D., Dearden, J. C., Fentem, J. H., Gerner, I., Giuliani, A., Gray, T. J. B., Livingston, D. J., Provan, W. M., Rutten, F. A. J. J. L., Verhaar, H. J. M., Zbinden, P. (1995) The Integrated Use of Alternative Approaches for Predicting Toxic Hazard. ECVAM Workshop Report 8. ATLA 23, 410—429.
|
|
(2)
|
de Silva, O., Cottin, M., Dami, N., Roguet, R., Catroux, P., Toufic, A., Sicard, C. Dossou, K. G., Gerner, I., Schlede, E., Spielmann, H., Gupta, K. C., Hill, R. N. (1997) Evaluation of Eye Irritation Potential: Statistical Analysis and Tier Testing Strategies. Food Chem.Toxicol 35, 159—164.
|
|
(3)
|
Worth A. P. and Fentem J. H. (1999) A general approach for evaluating stepwise testing strategies ATLA 27, 161—177.
|
|
(4)
|
Young, J. R., How, M. J., Walker, A. P., Worth W. M. H.(1988) Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicol. In Vitro ,2, 19—26.
|
|
(5)
|
Neun, D. J. (1993) Effects of Alkalinity on the Eye Irritation Potential of Solutions Prepared at a Single pH. J. Toxicol. Cut. Ocular Toxicol. 12, 227—231.
|
|
(6)
|
Fentem, J. H., Archer, G. E. B., Balls, M., Botham, P. A., Curren, R. D., Earl, L. K., Edsaile, D. J., Holzhutter, H. G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in Vitro 12, pp.483—524.
|
|
(6a)
|
Testing Method B.40. Skin Corrosion.
|
|
(7)
|
Testing method B.4. Acute toxicity: dermal irritation/corrosion.
|
|
(8)
|
OECD (1996) OECD Test Guidelines Programme: Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held in Solna, Sweden, 22—24 January 1996 (http://www.oecd.org/ehs/test/background.htm).
|
|
(9)
|
OECD (1998) Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www.oecd.org/ehs/Class/HCL6.htm).
|
|
(10)
|
Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. OECD Environmental Health and Safety Publications. Series on Testing and Assessment №.19 (http://www.oecd.org/ehs/test/monos.htm).
|
Таблица 1
СКАЛА НА ОЧНИТЕ УВРЕЖДАНИЯ
Роговица
Помътняване: степен на плътност (отчитането се извършва за участъка с най-плътно помътняване) (1)
|
Отсъствие на улцерация или помътняване …
|
0
|
|
Разпръснати или дифузни зони на помътняване (изключва се лекото замъгляване на нормалния блясък); детайлите на ириса са ясно различими …
|
1
|
|
Ясно различима полупрозрачна зона; детайлите на ириса са леко замъглени …
|
2
|
|
Зона със седефен цвят; детайлите на ириса не се забелязват; големината на зеницата се определя трудно …
|
3
|
|
Непрозрачна роговица; ирисът не се различава през помътнената роговица …
|
4
|
Максимален бал: 4
vide
Ирис
|
Без промени …
|
0
|
|
Забележимо увеличени гънки, конгестия, оток, умерена перикорнеална хиперемия; ирисът реагира на светлина (вялата реакция се смята за признак на увреждане) …
|
1
|
|
Кръвоизлив, разрушаване на нормалната структура, което е видимо макроскопски, или липса на реакция на светлина …
|
2
|
Максимален бал: 2
Конюнктиви
Еритем (отнася се за палпебралната и булбарната конюнктива, като се изключват роговицата и ирисът)
|
Нормални кръвоносни съдове …
|
0
|
|
Хиперемия на някои кръвоносни съдове …
|
1
|
|
Дифузно кървавочервено оцветяване; отделните кръвоносни съдове са трудно различими …
|
2
|
|
Дифузно тъмночервено оцветяване …
|
3
|
Максимален бал: 3
Хемоза
Подуване (отнася се за конюнктивата на клепачите и/или мигателните ципи)
|
Липсва подуване …
|
0
|
|
Наличие на подуване, забелязва се известна разлика спрямо нормалното състояние …
|
1
|
|
Ясно изразено подуване с частично обръщане на клепачите …
|
2
|
|
Подуване със затворени приблизително наполовина клепачи …
|
3
|
|
Подуване със затворени повече от наполовина клепачи …
|
4
|
Максимален бал: 4
ПРИЛОЖЕНИЕ
Стратегия за последователно изпитване за оценка на дразнещо/корозивно действие върху очите
ОБЩИ СЪОБРАЖЕНИЯ
В интерес на научната стойност на проучването и на благополучието на животните е важно да се избягва ненужното използване на опитни животни и да се допускат колкото е възможно по-малко изпитвания, за които се очаква, че ще предизвикат тежки увреждания. Преди да се пристъпи към in vivo изпитване, следва да се оцени цялата съществуваща информация по отношение на дразнещия/корозивния потенциал на дадено химично вещество за очите. Възможно е вече да съществуват достатъчно данни, въз основа на които веществото може да се класифицира по отношение на очното дразнещо/корозивно действие, без да е необходимо да се извършват изпитвания върху лабораторни животни. Затова чрез анализа на съществуващите данни и стратегията за последователно изпитване ще се сведе до минимум необходимостта от in vivo изпитвания, особено когато се очаква, че химичното вещество ще предизвика тежки увреждания у животните.
Препоръчва се да се извърши анализ на съществуващите данни за очното дразнещо и корозивно действие на химичното вещество, за да се прецени дали да се проведат други проучвания освен in vivo изпитвания върху очите, които могат да подпомогнат оценката на дразнещия/корозивния потенциал. Когато се прецени, че са нужни по-нататъшни проучвания, се препоръчва необходимите експериментални данни да се получат, като се приложи стратегията за последователно изпитване. За химични вещества, които не са изпитвани досега, стратегията за последователно изпитване следва да се използва, за да се съберат всички данни, необходими за оценката на дразнещия/корозивния ефект върху очите. Стратегията за изпитване, изложена в настоящото приложение, е разработена на семинар на OECD (1). По-късно тя е утвърдена и разширена в рамките на Хармонизираната интегрирана система за класифициране на опасностите във връзка с ефектите на химичните вещества върху човешкото здраве и околната среда, приета на 28-ата съвместна среща на Комитета по химикалите и работната група по химикалите през ноември 1998 г. (2).
Въпреки че стратегията за последователно изпитване не е включена като неразделна част от метод В.5, тя представлява препоръчителният подход за оценка на дразнещия и корозивния ефект върху очите. Този подход съответства в най-висока степен на критериите за добра практика и етика при in vivo изпитванията за оценка на очното дразнещо и корозивно действие. В представения метод са дадени указания за провеждането на in vivo изпитването и се обобщават факторите, които следва да се вземат предвид, преди да се пристъпи към него. Стратегията предлага подход за оценка на съществуващите данни за очното дразнещо/корозивно действие на химичните вещества и поетапен подход за получаване на необходимите данни за веществата, които досега не са изследвани или за които са необходими допълнителни проучвания. В стратегията се включва първоначалното извършване на валидирани и утвърдени in vitro или ех vivo изпитвания и след това на изпитването за оценка на кожно корозивно/дразнещо действие (метод В.4) при определени условия (3)(4).
ОПИСАНИЕ НА СТРАТЕГИЯТА ЗА ПОСЛЕДОВАТЕЛНО ИЗПИТВАНЕ
Преди да се предприемат изпитвания в рамките на стратегията за последователно изпитване (вж. фигурата), следва да се разгледа цялата налична информация, за да се оцени необходимостта от провеждане на in vivo изпитване върху очите. Въпреки че при оценката на отделни параметри (например при много високи или ниски стойности на рН) може да се получи съществена информация, следва да се разгледат всички съществуващи данни. Всички сведения за ефектите на дадено вещество и неговите структурни аналози следва да бъдат оценени в процеса на вземане на решение и следва да се представи обосновката на взетото решение. На първо място следва да се обърне внимание на съществуващите данни за ефектите на веществото върху хора и животни, а след това да се оценят резултатите от in vitro или ех vivo изпитвания. Във всички случаи, когато е възможно, следва да се избягва провеждането на in vivo изпитвания на корозивни химични вещества. Факторите, които се вземат под внимание в стратегията на изпитване, включват:
Оценка на съществуващите данни за хора и животни (стъпка 1). Съществуващите данни за хора, като например данни от клинични проучвания, проучвания върху работници, описания на случаи и/или данни от изпитвания върху животни за оценка на ефекта върху очите, следва да се разглеждат с предимство, защото те осигуряват информация, пряко свързана с действието на веществото върху очите. След това следва да се оценят данните от проучвания на кожното корозивно/дразнещо действие при хора и/или животни. Опитните животни не следва да се третират с вещества с известно корозивно или изразено дразнещо действие върху очите. Това се отнася и за вещества с корозивно/дразнещо действие върху кожата. Тези вещества следва да се разглеждат като корозивни/дразнещи и за очите. Също така не е необходимо да се провеждат in vivo изпитвания на вещества, за които съществуват достатъчно данни от предишни проучвания за отсъствие на очно дразнещо или корозивно действие.
Анализ на зависимостта „структура/активност“ (structure activity relationships, SAR) (стъпка 2). Резултатите от изпитвания на вещества с подобна химична структура следва да се вземат под внимание, ако са налице такива данни. Когато съществуват достатъчно данни за хора и/или животни, свидетелстващи за очно дразнещо/корозивно действие на химични вещества с аналогична структура или смеси от такива вещества, може да се приеме, че веществото, което подлежи на проучване, ще предизвика същия ефект. В тези случаи може да се прецени, че не е необходимо да се провежда изпитване. Съгласно стратегията за последователно изпитване негативните данни от проучвания на химични вещества с аналогична структура или смеси от такива вещества не се смятат като достатъчно основание, за да се приеме отсъствие на корозивен или дразнещ ефект за дадено химично вещество. За установяване на потенциално корозивно/дразнещо действие върху кожата и очите следва да се използват валидирани и утвърдени SAR подходи.
Физикохимични свойства и химична активност (стъпка 3). Химични вещества с много високо или много ниско рН (рН ≥ 11,5 или рН ≤ 2,0) могат да предизвикат силно изразени локални ефекти. Когато дадено химично вещество може да се определи като корозивно за кожата въз основа на високо или ниско рН, следва да се вземе под внимание и неговият алкално-киселинен резерв (или буферен капацитет) (5) (6). Когато данните за буферния капацитет показват, че веществото може да не е корозивно за кожата, следва да се проведе по-нататъшно проучване за потвърждаване на това предположение, за предпочитане посредством валидирано и утвърдено in vitro или ех vivo изпитване (вж. стъпки 5 и 6).
Оценка на други съществуващи данни (стъпка 4). На този етап следва да се оцени цялата налична информация за системната токсичност по дермален път на постъпване. Острата дермална токсичност на химичното вещество също следва да се вземе под внимание. Когато е доказано, че дадено химично вещество проявява висока токсичност по дермален път на постъпване, може да се прецени, че не е необходимо да се изпитва върху опитни животни. Въпреки че не винаги съществува връзка между острата дермална токсичност и очното дразнещо/корозивно действие, може да се приеме, че ако дадено вещество проявява висока токсичност по дермален път на постъпване, то може да прояви висока токсичност и при инсталиране в очите. Тези данни могат да се разгледат също и между стъпки 2 и 3.
Резултати от in vitro или ех vivo изпитвания (стъпки 5 и 6). Химични вещества, които проявяват корозивни или силно изразени дразнещи свойства при валидирано и утвърдено in vitro или ех vivo изпитване за оценка на кожно или очно дразнещо/корозивно действие (7)(8), не е необходимо да се изпитват върху животни. Може да се приеме, че тези вещества ще предизвикат подобни силно изразени ефекти in vivo. Когато не съществуват валидирани и утвърдени in vitro/ex vivo изпитвания, стъпки 5 и 6 се пропускат и се преминава директно към стъпка 7.
Оценка на in vivo дразнещото или корозивно действие на химичното вещество върху кожата (стъпка 7). Когато съществуващите данни за потенциалното очно дразнещо/корозивно действие на дадено вещество, получени от посочените по-горе проучвания, не са достатъчни, за да се извърши анализ и да се стигне до убедителни изводи, първо следва да се оцени потенциалното кожно дразнещо/корозивно действие посредством метод В.4 (4) и приложението към него (9). Когато е доказано, че веществото предизвиква корозивен ефект или силно изразено дразнене върху кожата, то следва да се разглежда като корозивно за очите, освен ако съществуват други данни, които не са в подкрепа на това заключение. Затова в този случай не е необходимо да се извършва in vivo изпитване за оценка на действието върху очите. Когато веществото не е корозивно или силно дразнещо за кожата, in vivo изпитването следва да се извърши.
In vivo изпитване върху зайци (стъпки 8 и 9). In vivo изпитването за оценка на действието върху очите следва да започне с изпитване върху едно опитно животно. Когато резултатите от него показват, че веществото проявява изразено очно дразнещо или корозивно действие, не следва да се извършва по-нататъшно изпитване. Когато при първоначалното изпитване не се наблюдават корозивен или изразен дразнещ ефект, се извършва потвърдително изпитване с две допълнителни животни.
ПРЕПРАТКИ
|
(1)
|
OECD (1996) OECD Test Guidelines Programme:Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held in Solna, Sweden, 2222—24 January 1996 (http://www1.oecd.org/ehs/test/background.htm).
|
|
(2)
|
OECD (1998) Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www1.oecd.org/ehs/Class/HCL6.htm).
|
|
(3)
|
Worth, A. P. and Fentem, J. H.(1999). A General Approach for Evaluating Stepwise Testing Strategies. ATLA 27,161—177.
|
|
(4)
|
Testing method B.4. Acute Toxicity: dermal irritation/corrosion.
|
|
(5)
|
Young, J. R., How, M. J., Walker, A. P., Worth W. M. H. (1988) Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicol. In Vitro, 2, 19—26.
|
|
(6)
|
Neun, D. J. (1993) Effects of Alkalinity on the Eye Irritation Potential of Solutions Prepared at a Single pH. J. Toxicol. Cut. Ocular Toxicol. 12, 227—231.
|
|
(7)
|
Fentem, J. H., Archer, G. E. B., Balls, M., Botham, P. A., Curren, R. D., Earl, L. K., Edsail, D. J., Holzhutter, H. G. and Liebsch, M.(1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in Vitro 12, pp.483—524.
|
|
(8)
|
Testing Method B.40 Skin Corrosion.
|
|
(9)
|
приложение to Testing method B.4: A Sequential Testing Strategy for Skin Irritation and Corrosion.
|
Фигура
Стратегия за изпитване и оценка на дразнещо/корозивно действие върху очите


Б.6. КОЖНА СЕНСИБИЛИЗАЦИЯ
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Забележки:
Чувствителността и възможността на тестовете да определят потенциалните за човека кожни сенсибилизиращи агенти се считат за важни качества в системата за класификация на токсичността, отнасяща се до общественото здраве.
Не съществува един-единствен тест-метод, който адекватно да идентифицира всички вещества, способни да сенсибилизират кожата на човек, и който да е подходящ за всички.
При избора на тест следва да се имат предвид фактори като физични характеристики на веществото, включително способността му да премине през кожата.
Разработени са два вида тестове, използващи морски свинчета: тестовете с адювант, в които състоянието на алергия се потенциира от разтваряне или суспендиране на проучваното вещество в цялостния адювант на Freunds (FСА), и тестове без адювант.
Тестовете с адювант изглеждат по-точни при предсказване на възможните кожни сенсибилизиращи ефекти на дадено вещество у човека, отколкото методите, неизползващи адюванта на Freunds, и затова са предпочитаните методи.
Максимизиращият тест с морски свинчета (GРМТ) е широко употребяван тест с адювант. Въпреки че се използват и някои други методи за откриване потенциала на веществото да предизвика реакция на кожна сенсибилизация, GРМТ се смята за предпочитаната адювантна техника.
Неадювантните тестове, притежаващи много химични класове (предпочитаният е тестът на Вuehlег) се смятат за по-малко чувствителни.
В определени случаи може да има достатъчно причини за избор на теста на Вuehlег, който включва по-скоро локално приложение, отколкото интрадермални инжекции, използвани в максимизиращия тест с морски свинчета (GРМТ). При използване на теста на Вuehlег следва да се даде научно обяснение.
Максимизиращият тест с морски свинчета (GРМТ) и тестът на Вuehlег са описани в настоящия метод. Може да се използват и други методи, само ако са добре потвърдени и научно обосновани.
Ако се получи положителен резултат в стандартен скриниращ тест, проучваното вещество може да бъде обявено за потенциален сенсибилизиращ агент и няма да бъде необходимо продължаване на теста с морски свинчета. Ако резултатът в този тест е отрицателен, то тестът с морски свинчета следва да се продължи според процедурата, описана в настоящия метод.
Вж. също Общо въведение, част Б
1.2. ДЕФИНИЦИИ
Кожна сенсибилизация: (алергичен контактен дерматит) имунологично медиирана кожна реакция към вещество. При човека отговорите се характеризират със сърбеж, еритем, оток, папули, везикули, були или комбинация от всички тях. При други видове реакциите може да са различни и да се наблюдава само еритем и оток.
Индукционна експозиция: експериментално излагане на субекта на действието на проучваното вещество с намерението да се индуцира състояние на хиперсензитивност.
Период на индукция: период с продължителност най-малко една седмица, последвал индукционната експозиция, през който може да се развие състояние на хиперсензитивност.
Провокационна експозиция: експериментално излагане на предварително третиран с проучваното вещество субект, след периода на ииндукция, с цел определяне дали субектът реагира по типа на хиперсензитивност.
1.3. РЕФЕРЕНТНИ ВЕЩЕСТВА
Чувствителността и достоверността на използваните експериментални техники следва да бъдат проверявани на всеки шест месеца с помощта на вещества, за които се знае, че притежават слаби до умерени свойства да предизвикват кожна сенсибилизация.
В добре проведения тест за слаби/умерено силни сенсибилизиращи агенти следва да се очаква отговор от поне 30 % в теста с адювант и поне 15 % в неадювантния тест.
Предпочитат се следните вещества:
|
САS номера
|
ЕINECS номера
|
ЕINECS имена
|
Общоприети имена
|
|
101-86-0
|
202-983-3
|
2-хексил-З-фенилпроп-2-енал (хексилинамалдехид)
|
2-хексил-3-фенилпроп-2-енал (хексилинамалдехид)
|
|
149-30-4
|
205-736-8
|
бензотиазол-2-тиол (меркаптобензотиазол)
|
каптакс
|
|
94-09-7
|
202-303-5
|
бензокаин
|
нордкаин
|
Съществуват обстоятелства, при които могат да се използват и други контролни вещества, стига те да отговарят на горните критерии и за тях да е дадено съответно обяснение.
1.4. ПРИНЦИП НА МЕТОДА НА ИЗПИТВАНЕ
В началото опитните животни се излагат на действието на проучваното вещество посредством вътрекожни инжекции и/или епидермално прилагане (индукционна експозиция). След период на почивка от 10 до 14 дни (период на индукция), по време на който може да се развие имунен отговор, животните се подлагат на провокационна доза. Сравнява се обхватът и степента на кожна реакция към провокационното излагане при опитните животни с тази, показана от контролите, които претърпяват същото третиране по време на индукция и са подложени на провокация.
1.5. ОПИСАНИЕ НА МЕТОДИТЕ НА ИЗПИТВАНЕ
Ако се наложи отстраняване на проучваното вещество, това следва да се извърши с вода или друг подходящ разтворител, без да се промени съществуващият (наличният) отговор или целостта на епидермиса.
1.5.1. Максимизиращ тест с морски свинчета (GРМТ)
1.5.1.1. Подготовка
Здрави млади, полово зрели морски свинчета албиноси се аклиматизират в продължение на поне 5 дни преди теста към лабораторните условия. Преди теста животните се подбират случайно и се разпределят в групите за третиране. Отстраняването на козината става чрез подстригване, бръснене или при възможност химическа депилация, в зависимост от използвания тест-метод. Следва да се внимава да не се увреди кожата. Животните се претеглят преди началото на теста и в неговия край.
1.5.1.2. Условия за провеждане на теста
1.5.1.2.1. Опитни животни
Обикновено се използват лабораторни породи от морски свинчета албиноси.
1.5.1.2.2. Брой и пол
Могат да се използват мъжки и/или женски животни. Ако се използват женски, те следва да нямат партньор и да не са бременни.
Използват се минимум по 10 животни в третираните групи и поне 5 в контролната група. Ако се използват по-малко от 20 опитни и 10 контролни морски свинчета и не е възможно да се направи изводът, че проучваното вещество е сенсибилизиращ агент, силно се препоръчва тестване на допълнителен брой животни, така че общият брой да бъде поне 20 опитни и 10 контролни животни.
1.5.1.2.3. Дозови нива
Концентрацията на проучваното вещество, използвано за индукционна експозиция, следва да бъде системно добре толерирано и би следвало да представлява най-високата концентрация, която предизвиква леко до умерено кожно дразнене. Концентрацията, използвана за провокационно излагане, следва да бъде най-високата не предизвикваща дразнене доза. При необходимост подходящата концентрация може да се определи чрез пилотно проучване, използващо две или три животни. За тази цел следва да се отдаде внимание (предпочитание) на използването на животни, третирани с FСА.
1.5.1.3. Процедура
1.5.1.3.1. Индукция
Ден 0 за третираната група
Поставят се три двойки вътрекожни инжекции с обем 0,1 ml в областта на рамото, което следва да се почисти от козина, така че всяко едно убождане от двойката да лежи от всяка страна на срединната линия.
Инжекция 1: в отношение 1:1 смес (об/об) FСA/вода или физиологичен разтвор.
Инжекция 2: проучваното вещество в избраната концентрация, поставено в подходяща среда.
Инжекция 3: проучваното вещество в избраната концентрация, поставено в съотношение 1:1 смес (об/об) FCА/вода или физиологичен разтвор.
В инжекция 3 водноразтворимите вещества се разтварят във водната фаза преди смесването им с FСА. Мастноразтворимите или неразтворимите вещества се суспендират в FСА преди смесването им с водната фаза. Крайната концентрация на проучваното вещество следва да бъде еднаква с използваната в инжекция 2.
Инжекции 1 и 2 се поставят близо една до друга, възможно най-близо до главата, докато № 3 се поставя към най-долната (каудалната) част на опитната област.
Ден 0 на контролната група
Поставят се три двойки вътрекожни инжекции с обем 0,1 m1 в същите области както на третираните животни.
Инжекция 1: в отношение 1:1 смес (об/об) FСА/вода или физиологичен разтвор.
Инжекция 2: неразредена среда.
Инжекция 3: съотношение 50 % т/об от средата в отношение 1:1 смес (об/об) FСА/вода или физиологичен серум.
Ден 5—7 на третираната и контролната група
Около двадесет и четири часа преди локално (местно) приложената индукция, ако веществото не е кожен дразнител, мястото за опит, след добро подстригване и/или бръснене, се третира с 0,5 ml 10 % натриев лаурил сулфат във вазелин с цел създаване на местно дразнене.
Ден 6—8 на третираната група
Мястото за опита отново се почиства от козина. Филтърна хартия (2 × 4 см), добре натоварена с проучваното вещество в подходяща среда, се поставя на опитното място и се оставя в тесен контакт чрез оклузивна превръзка в продължение на 48 часа. Изборът на средата следва да се обоснове. Твърдите вещества се пулверизират и инкорпорират в подходяща среда. Ако е необходимо, течните вещества могат да се прилагат неразредени.
Ден 6—8 на контролната група
Мястото за опит се почиства отново от козината. Средата се поставя самостоятелно по подобен начин на опитното място и се поддържа в контакт с помощта на оклузивна превръзка в продължение на 48 часа.
1.5.1.3.2. Провокация
Ден 20—22 на третираната и контролната група
Хълбоците на третираните и контролните животни се почиства от козина. Част от пластир или цяла превръзка, натоварена с проучваното вещество, се прилага на единия хълбок на опитното животно и при необходимост част от пластир, натоварен само със средата, може да се постави на другия хълбок. Пластирите се поддържат в контакт чрез оклузивни превръзки в продължение на 24 часа.
1.5.1.3.3. Наблюдение и степенуване: третирана и контролна група
|
—
|
около 21 часа след премахване на пластира мястото за провокация се почиства и се подстригва и/или бръсне добре и при необходимост се депилира;
|
|
—
|
около 3 часа по-късно (приблизително 48 часа след началото на провокационното прилагане) се наблюдава кожната реактивност и данните се записват според степените, показани в допълнението;
|
|
—
|
около 24 часа след това наблюдение се извършва второ (72 часа) и отново данните се записват.
|
Препоръчва се сляпото наблюдение на опитните и контролните животни.
Ако е необходимо да се изяснят резултатите, получени по време на първата провокация, следва да се обсъди втора провокация (т.е. репровокация), около една седмица след първата, при възможност с нова контролна група. Повторната провокация може да се извърши и с първата контролна група.
Всички кожни реакции, както и всяко необичайно явление, включително системни реакции, резултат на индукционни или провокационни процедури, следва да се наблюдават и записват според скалата за степени на Маgnusson/Kligman (вж. допълнението). За да се уточнят съмнителните резултати, може да се проведат и други процедури, като напр. хистопатологично изследване, измерване на дебелината на кожната гънка.
1.5.2. Тест на Buehler
1.5.2.1. Подготовка
Здрави млади, полово зрели морски свинчета албиноси се аклиматизират в продължение на поне 5 дни преди теста към лабораторните условия. Преди теста животните се подбират случайно и се разпределят в групите за третиране. Отстраняването на козината става чрез подстригване, бръснене или при възможност чрез химическа депилация, в зависимост от използвания тест-метод. Следва да се внимава да не се увреди кожата. Животните се претеглят преди началото на теста и в неговия край.
1.5.2.2. Условия за провеждане на теста
1.5.2.2.1. Опитни животни
Обикновено се използват лабораторни породи от морски свинчета албиноси.
1.5.2.2.2. Брой и пол
Могат да се използват мъжки и/или женски животни. Ако се използват женски, те следва да нямат партньор и да не са бременни.
Използват се минимум 20 животни в третираната група и поне 10 в контролната.
1.5.2.2.3. Дозови нива
Концентрацията на проучваното вещество, използвано за индукционна експозиция, следва да бъде възможно най-високата концентрация, която предизвиква умерено, но не значително кожно дразнене. Концентрацията, използвана за провокационно излагане, следва да бъде най-високата непредизвикваща дразнене доза. При необходимост подходящата концентрация може да се определи чрез пилотно проучване, използващо две или три животни.
За водноразтворимите проучвани вещества е подходящо да се използва вода или недразнещ разтвор на сърфактант като среда. За другите проучвани вещества се предпочита 80 % етанол/вода за индукцията и ацетон за провокацията.
1.5.2.3. Процедура
1.5.2.3.1. Индукция
Ден 0 на третираната група
Единият хълбок се почиства от козина (ниско подстриган). Пластирът, предназначен за теста, следва да бъде добре натоварен с проучваното вещество в подходяща среда (изборът на средата следва да се обоснове; при необходимост течните вещества могат да се прилагат неразредени).
Пластирът за опита се поставя на опитното място и се оставя в тесен контакт с кожата чрез оклузивна превръзка в продължение на 6 часа.
Системата с пластири за опита следва да бъде оклузивна. Подходящо е използването на памучен тампон — кръгъл или правоъгълен по форма, с площ около 4—6 cm2. Предпочита се използването на специални задържащи превръзки, с които да се постигне максимална оклузия. Ако се използва бинтоване, е възможно да се наложи допълнително излагане на действието на веществото.
Ден 0 на контролната група
Единият хълбок се почиства от козина (ниско подстриган). Прилага се само средата по начин, подобен на описания за третираната група. Пластирът за опита се поставя на опитното място и се оставя в тесен контакт с кожата чрез оклузивна превръзка в продължение на 6 часа. Ако се покаже, че не е необходимо включването на фалшива контролна група, може да се използва началната.
Ден 6—8 и 13—15 на третираната и контролната група
Извършва се същият начин на прилагане както в ден 0, на същото опитно място (при необходимост почистено от козина), на същия хълбок — на ден 6—8 и отново на ден 13—15.
1.5.2.3.2. Провокация
Ден 27—29 на третираната и контролната група
Нетретираният хълбок на третираните и контролните животни се почиства от косми (ниско подстригване). Поставя се част или целият оклузивен пластир, съдържащ съответното количество проучвано вещество в максимално недразнеща концентрация, върху задната част на нетретирания хълбок на третираните и контролните животни.
Ако е уместно, се поставя също и част или целият оклузивен пластир, натоварен само със средата, върху предната част на нетретирания хълбок, както на третираните, така и на контролните животни. Пластирът се оставя в тесен контакт с кожата чрез подходяща превръзка в продължение на 6 часа.
1.5.2.3.3. Наблюдение и степенуване
|
—
|
около 21 часа след премахване на пластира мястото за провокация се почиства от козина;
|
|
—
|
около 3 часа по-късно (приблизително 30 часа след прилагане на пластира за провокация) се наблюдава кожната реактивност и данните се записват според степените, показани в допълнението;
|
|
—
|
около 24 часа след тридесетте часа на наблюдение (около 54 часа след прилагане на пластира за провокация) отново се наблюдава кожната реактивност, отново данните се записват.
|
Препоръчва се сляпото наблюдение на опитните и контролните животни.
Ако е необходимо да се изяснят резултатите, получени по време на първата провокация, следва да се обсъди втора провокация (т.е. репровокация) около една седмица след първата, при възможност с нова контролна група. Повторната провокация може да се извърши и с първата контролна група.
Всички кожни реакции, както и всяко необичайно явление, включително системни реакции, резултат на индукционни или провокационни процедури, следва да се наблюдават и записват според степенната скала на Маgnusson/Kligman (вж. допълнението). За са се уточнят съмнителните резултати, може да се проведат и други процедури, като напр. хистопатологично изследване, измерване на дебелината на кожната гънка.
2. ДАННИ (GРМТ И BUEHLER)
Данните следва да се обобщят в таблична форма, показваща кожните реакции на всяко едно животно при всяко наблюдение.
3. ДОКЛАДВАНЕ (GРМТ И ВUEHLER)
Ако скриниращото изследване се проведе преди теста с морски свинчета, следва да се приложи описанието или позовавания към теста (напр. изследване на регионарните лимфни възли (LLNА), тест за подуване ушите на мишките (МЕSТ), включващи подробности от процедурата, както и получените резултати за проучваното и референтните вещества.
Доклад за теста (GМРТ и Вuehleг test)
Докладът за теста следва да включва, по възможност, следната информация:
|
|
Опитни животни:
|
—
|
използвана порода морски свинчета;
|
|
—
|
брой, възраст и пол на животните;
|
|
—
|
източник, условия на отглеждане, хранене и т.н.;
|
|
—
|
индивидуалното тегло на животните в началото и в края на теста.
|
|
|
|
Условия за провеждане на теста:
|
—
|
техника за подготовка на мястото за прилагане на пластира;
|
|
—
|
подробно описание на естеството на използваните пластири и техники за прилагането им;
|
|
—
|
резултати от пилотно проучване, даващо обосновка на използваните в теста концентрации за индукция и провокация;
|
|
—
|
подробно описание на подготовката на проучваното вещество, начина на прилагане и отстраняването му;
|
|
—
|
обосновка на избора на среда;
|
|
—
|
концентрации на проучваното вещество и средата в стадий на индукция и провокация, както и общото количество вещество, приложено при индукцията и провокацията.
|
|
|
|
Резултати:
|
—
|
обобщение на резултатите от последната проверка за чувствителност и достоверност (вж. 1.3), включително информация относно използваните вещество, концентрация и среда;
|
|
—
|
за всяко животно, включително скала за степенуване;
|
|
—
|
подробно описание на същността и степента на наблюдаваните ефекти;
|
|
—
|
всички хистопатологични резултати.
|
|
|
|
Обсъждане на резултатите.
|
4. ПРЕПРАТКИ
Този метод е еднакъв с OECD ТG 406.
Допълнение
ТАБЛИЦА
Степенна скала на Маgnusson/Kligman за оценка на реакциите при провокация спластир, натоварен с отровни вещества
0 = няма видими промени
1 = дискретна или на петна еритема
2 = умерена и конфлуираща еритема
3 = интензивна еритема и оток
Б.7. ТОКСИЧНОСТ НА ПОВТАРЯЩА СЕ (ОРАЛНА) ДОЗА (28 ДНИ)
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Вж. Общо въведение, част Б.
1.2. ДЕФИНИЦИИ
Вж. Общо въведение, част Б.
1.3. ПРИНЦИП НА МЕТОДА НА ИЗПИТВАНЕ
Проучваното вещество се прилага орално, ежедневно, в постепенно нарастващи дози на няколко групи експериментални животни, една доза на група в продължение на 28 дни. По време на периода на прилагане животните се наблюдават отблизо — всеки ден — за признаци на токсичност. Животните, които умрат или бъдат убити по време на теста, се аутопсират, при завършване на теста преживелите животни се убиват и също се аутопсират.
Настоящият метод поставя ударение предимно върху неврологичните ефекти като специфична крайна цел, като се подчертава необходимостта от внимателно клинично наблюдение, така че да се получи възможно най-пълна информация. Методът следва да идентифицира химичните вещества с невротоксичен потенциал, което да даде основания за по-нататъшно задълбочено изследване в този аспект. В допълнение, методът може да посочи имунологични ефекти, както и токсичност върху репродуктивните органи.
1.4. ОПИСАНИЕ НА МЕТОДА НА ИЗПИТВАНЕ
1.4.1. Подготовка
Здрави млади, полово зрели животни се подбират случайно и се разпределят в контролна и третирана група. Клетките се подреждат така, че да бъдат сведени до минимум възможните ефекти, дължащи се на местоположението на клетката. Животните се идентифицират поотделно и се отглеждат в клетките им в продължение на поне пет дни преди началото на проучването с цел аклиматизация към лабораторните условия.
Проучваното вещество се прилага чрез сонда или с храната. Методът на орално прилагане зависи както от целта на изследването, така и от физичните/химичните свойства на веществото.
При необходимост проучваното вещество се разтваря или суспендира в подходяща среда. Препоръчва се при възможност най-напред да се обсъди употребата на воден разтвор/суспензия, последвана от разтвор/емулсия в мазнина (напр. царевично олио) и накрая — разтвор в други среди. Ако разтворителят не е вода, следва да се знаят токсичните характеристики на средата. Следва да се определи стабилността на проучваното вещество в използваната среда.
1.4.2. Условия за провеждане на теста
1.4.2.1. Опитни животни
Плъховете са предпочитан вид, въпреки че се използват и други видове. На изследване се подлагат обичайно използвани лабораторни породи. Женските следва да нямат партньор и да не са бременни. Дозирането следва да започне възможно най-бързо след отбиването и във всеки случай преди животните да навършат деветседмична възраст.
В началото на проучването различията в теглото на използваните животни следва да бъдат минимални и да не надхвърлят ± 20 % от средното за всеки пол тегло.
Ако се провежда проучване за повтаряща се орална доза като предхождащо продължително проучване, предпочита се използването на животни от една и съща порода и в двете проучвания.
1.4.2.2. Брой и пол
За всяко ниво на доза следва да се използват най-малко 10 животни (пет женски и пет мъжки). Ако междувременно се планира убиване на животни, броят на участващите следва да се увеличи в зависимост от броя на животните, предвидени да бъдат убити преди завършване на проучването.
В допълнение, може да бъде третирана сателитна група от 10 животни (пет за всеки пол) с високи нива на доза в продължение на 28 дни, да бъде наблюдавана за обратимост, персистиране или забавена поява на токсичните ефекти до 14 дни след завършване на третирането. Използва се и сателитна група от 10 контролни животни (пет животни от всеки пол).
1.4.2.3. Нива на доза
Обикновено се използват поне три опитни групи и една контролна. Животните от контролната група се гледат по същия начин както участващите в опитната група, с изключение на третирането с проучваното вещество. Ако за прилагането на проучваното вещество се използва среда, то контролната група следва да получи средата в най-големия използван обем.
Ако въз основа на оценката на останалите данни не се очакват странични ефекти при доза 1 000 mg/kg телесно тегло дневно, може да се проведе тест за определяне на граница. Ако няма на разположение подходящи данни, може да се проведе проучване за обхват, което да подпомогне определянето на използваните дози.
Нивата на доза се подбират, като се имат предвид всички налични данни относно токсичност и (токсо-) кинетика на проучваното вещество или свързани с него вещества. Целта при избор на най-високата доза е индуциране на токсични ефекти, но не смърт или тежко страдание. След това се подбират постепенно намаляващи нива на доза с оглед установяване на всеки един свързан с дозата отговор, както и достигане на най-ниско ниво на доза, при което не се наблюдават странични ефекти (NOAEL). Дву- до четирикратни интервали обикновено са оптимални за подреждане на намаляващи нива на доза, прибавянето на четвърта опитна група често е за предпочитане пред използването на много големи интервали (напр. повече от фактор 10) между дозирането.
За веществата, приложени чрез храната или питейната вода, е важно да се знае, че включените количества проучвано вещество не взаимодействат с нормалния хранителен или воден баланс. При прилагане на проучваното вещество с храната може да се използва или постоянна хранителна концентрация (ррm), или постоянно ниво на доза по отношение теглото на животното; използваният вариант следва да се отбележи точно. Ако веществото се прилага чрез сонда, дозата следва да се прилага по едно и също време всеки ден, както и да се адаптира така, че да поддържа постоянно ниво на доза при наличното тегло на животното.
При използване на проучване с повтаряща се доза като предхождащо продължително проучване следва да се използва една и съща диета и в двете проучвания.
1.4.2.4. Тест за определяне на граници
Ако тест при ниво на доза от поне 1 000 mg/kg телесно тегло дневно или при прилагане с храна или питейна вода — на еквивалентна концентрация в храната или питейната вода (основаваща се на определяне на телесното тегло), използвайки процедурите, описани в настоящото проучване, не предизвикват видими токсични ефекти и ако не се очаква токсичност, изхождайки от данните за структурно свързани вещества, то тогава е необходимо да се обмисли извършването на пълно проучване, използващо три нива на доза. Прилага се тестът за определяне на граници, освен ако излагането на хора показва необходимост от използване на по-високо ниво на доза.
1.4.2.5. Период на наблюдение
Периодът на наблюдение е 28 дни. Животните от сателитната група, определени за проследяване, следва да се наблюдават в следващите 14 дни, без да бъдат третирани, за да се открият късно появили се персистиране или възстановяване от токсичните ефекти.
1.4.3. Процедура
Животните се дозират с проучваното вещество ежедневно в продължение на 7 дни всяка седмица за период от 28 дни; употребата на режим на дозиране от 5 дни седмично следва да се обоснове. При прилагане на проучваното вещество чрез сонда това става като една-единствена доза посредством стомашна сонда или съответно интубационна канюла. Максималното количество течност, което може да се приложи еднократно, зависи от размера на опитното животно. Обемът не бива да надминава 1 ml/100 g телесно тегло освен в случай на водни разтвори, където могат да се използват до 2 ml/100 g телесно тегло. С изключение на дразнещите или корозивните вещества, които нормално разкриват обострените ефекти при високи концентрации, променливостта на проучваното вещество следва да бъде сведена до минимум чрез адаптиране на концентрацията, така че да осигури постоянен обем на всички дозови нива.
1.4.3.1. Общи наблюдения
Общи клинични наблюдения следва да бъдат извършвани поне един път дневно, за предпочитане по едно и също време всеки ден и имайки пред вид връхния момент за поява на очакваните ефекти след дозиране. Записва се здравното състояние на животните. Поне два пъти дневно всички животни се преглеждат за заболеваемост и смъртност. Умиращите животни и тези, изпитващи тежък дистрес или болка, следва да бъдат отстранени, когато бъдат забелязани, хуманно убити и аутопсирани.
За всички животни следва да се провежда внимателен клиничен преглед – веднъж преди първото излагане (да даде възможност за сравнение между субектите) и поне една седмица по-късно. Тези прегледи следва да се извършват извън домашната клетка, на стандартна площадка, за предпочитане всеки път по едно и също време. Наблюденията се записват внимателно, предпочита се използването на цифрова (балова) оценка, изрично определена от тестващата лаборатория. Следва да се положат достатъчно усилия, така че да бъдат осигурени минимални различия в условията на теста, както и извършване на наблюденията предимно от хора, неинформирани за третирането. Отбелязваните симптоми следва да включват, но не и да се ограничат до промяна в кожата, козината, очите, мукозните мембрани (лигавиците), поява на секреция и екскреция, както и автономна активност (напр. сълзене, пилоерекция — настръхване на козината, промяна в големината на зениците, необичаен начин на дишане). Следва да се запишат и промени в походката, стойката и отговор към общуването, както и наличие на клонични или тонични движения, стереотипни (напр. прекалено перене, повтарящо се ходене в кръг) или необичайно поведение (напр. самоизяждане — изяждане на части от тялото, ходене назад).
По време на четвъртата седмица на излагане следва да се проведе оценка на сензорната реактивност към различни видове стимули (напр. слухови, зрителни и проприоцептивни), оценка на силата на захвата и двигателната активност. Повече подробности относно процедурите, които биха могли да бъдат проведени, са дадени в литературата (вж. Общо въведение, част Б).
Функционалните наблюдения, проведени по време на четвъртата седмица на излагане, могат да бъдат пропуснати, ако проучването се извършва като предварително към следващо подостро (90-дневно) проучване. В този случай функционалните наблюдения се включват в това проучване и проследяване. От друга страна, наличните данни от функционалните наблюдения от проучването с повтарящи се дози могат да увеличат възможността за избор на нива на доза за следващото подостро проучване.
По изключение функционалните наблюдения могат да бъдат пропуснати и за групи, които показват по друг начин признаци на токсичност — до степен, при която има значително взаимодействие с функционалните изяви на теста.
1.4.3.2. Телесно тегло и консумация на храна/вода
Всички животни се претеглят поне един път седмично. Измерването на консумираните храна и вода се прави поне един път седмично. Ако проучваното вещество се прилага с питейната вода, консумацията на питейна вода следва да се измерва поне един път седмично.
1.4.3.3. Хематология
В края на опитния период следва да се извършат следните хематологични изследвания: хематокрит, концентрация на хемоглобина, брой на еритроцитите, общ брой и диференциално броене на левкоцитите, брой на тромбоцитите, както и измерване на времето на кървене.
Кръвните проби се вземат поименно преди или като част от процедурата по убиване на животните, като се съхраняват при определени условия.
1.4.3.4. Клинична биохимия
Клинико-биохимични изследвания за определяне на основните токсични ефекти върху тъканите, и по-специално върху бъбреците и черния дроб, следва да се извършват върху кръвни проби, получени от всички животни преди или като част от процедурата за убиване на животните (независимо от намерените умиращи и/или междувременно убити). Препоръчва се една нощ гладуване за животните, на които ще се изследва кръвна захар (2). Изследванията на плазма и серум следва да включват серумен натрий, калий, кръвна захар, общ холестерол, урея, креатинин, общ белтък и албумини, поне два ензима, показателни за хепатоцелуларни ефекти (като аланин аминотрансфераза, аспартат аминотрансфераза, алкална фосфатаза, гама глутамил транспептидаза и сорбитол дехидрогеназа). Определянето на допълнителни ензими (от чернодробен и друг произход), както и жлъчни киселини може да даде допълнителна полезна информация при определени обстоятелства.
Възможно е през последната седмица на проучването да бъдат проведени следните анализи на урината, като се използва събиране на урината по часове: вид, обем, осмолалитет или специфично тегло, рН, съдържание на белтък, глюкоза и кръв/кръвни клетки.
В допълнение, следва да се обмислят и проучвания за изследване на серумни маркери за обща тъканна увреда. Други тестове, които следва да се проведат, ако известните свойства на проучваното вещество могат или се предполага, че повлияват свързаните метаболитни профили, са серумен калций, фосфор, триглицериди на гладно, специфични хормони, метхемоглобин и холинестераза. Необходимо е да бъдат идентифицирани за вещества от определени категории или за всеки отделен случай.
В заключение, необходим е гъвкав подход в зависимост от породите и наблюдаваните и/или очакваните ефекти от дадено вещество.
Ако анамнестичните основни данни са недостатъчни, следва да се обмисли определяне на хематологичните и клинико-лабораторните биохимични променливи преди началото на дозирането.
1.4.3.5. Макроскопска дисекция (аутопсия)
Всички животни, участващи в проучването, се подлагат на подробна макроскопска дисекция, която включва внимателно изследване на външната повърхност на тялото, всичките му отверстия, както и черепната, гръдната и коремната кухина с тяхното съдържимо. Черният дроб, бъбреците, надбъбречните жлези, тестисите, епидидимиса, тимуса, далака, мозъка и сърцето на всички животни се почистват от каквато и да е допълнителна тъкан, ако е необходимо, и се претеглят възможно най-бързо след дисекцията с цел избягване на изсъхване.
Следните тъкани се фиксират във възможно най-подходяща среда както за вида тъкан, така и за последващото хистопатологично изследване: всички макроскопски увреждания, мозък (представителните области, включително главен мозък, малък мозък и моста), гръбначен мозък, стомах, тънко и дебело черво (включително Пайеровите плаки), черен дроб, бъбреци, надбъбречни жлези, далак, сърце, тимус, щитовидна жлеза, трахея и бели дробове (запазени чрез инфлация на фиксатор, след което поставени в имерсия), полови жлези, допълнителни полови органи (напр. матка, простатна жлеза), пикочен мехур, лимфни възли (за предпочитане един лимфен възел в близост до мястото на прилагане и втори, отдалечен от мястото на прилагане, представителен за изследване на системните ефекети), периферни нерви (нервус ишиадикус или нервус тибиалис) — препоръчва се близо до мускула, както и срез от костен мозък (или, като алтернатива, костномозъчен аспират, прясно фиксиран). Клиничните и други данни могат да наложат изследване и на други тъкани. Уместно е да се запазят и всички други органи, смятани за таргетни въз основа на вече познати свойства на проучваното вещество.
1.4.3.6. Хистопатологично изследване
Извършва се пълно хистопатологично изследване на запазените органи и тъкани на всички животни в контролната група и групите, получили високи дози от проучваното вещество. Тези изследвания следва да обхванат и животни от всички други дозови групи, ако бъдат установени промени, свързани с третирането, в групата с висока доза.
Изследват се всички макроскопски увреждания.
Когато се използва сателитна група, хистопатологични изследвания се извършват върху тъкани и органи, идентифицирани като показали ефекти в третираните групи.
2. ДАННИ
Предоставят се индивидуалните данни за животните. В допълнение всички данни се обобщават в таблична форма, показваща за всяка опитна група: броя на животни в началото на теста, броя на животните, показали симптоми на токсичност, описание на наблюдаваните симптоми на токсичност, включително време на настъпване, продължителност и тежест на токсичните ефекти, броя на животните, намерени мъртви по време на теста или убити по хуманни съображения, броя на животните с увреждания, вид на уврежданията и процент на животните, показали определен тип увреждания.
При възможност числовите резултати следва да бъдат оценени чрез съответни и общоприети статистически методи. Статистическите методи се подбират по време на проектиране на проучването.
3. ДОКЛАДВАНЕ
ДОКЛАД ЗА ТЕСТА
Докладът за теста следва да съдържа по възможност следната информация:
|
|
Опитни животни:
|
—
|
използвани видове/породи;
|
|
—
|
брой, възраст и пол на животните;
|
|
—
|
източник, условия на отглеждане, хранене и т.н.;
|
|
—
|
индивидуално тегло на животните в началото на теста, след което веднъж седмично, както и при завършване на теста.
|
|
|
|
Условия на теста:
|
—
|
обосновка за избор на средата, ако не е вода;
|
|
—
|
—обосновка на избора на доза;
|
|
—
|
подробности относно състава на проучваното вещество/приготвяне на храната, постигната концентрация, стабилност и хомогенност на приговянето;
|
|
—
|
подробности относно прилагане на проучваното вещество;
|
|
—
|
превръщане на концентрацията на проучваното вещество в храна/питейна вода (ррm) в същинската доза (mg/kg телесна маса дневно), ако е уместно;
|
|
—
|
подробности относно качество на храната и водата.
|
|
|
|
Резултати:
|
—
|
телесно тегло/промени в телесното тегло;
|
|
—
|
при необходимост — консумирана храна и вода;
|
|
—
|
данни относно реакции на токсичност според пол и ниво на доза, включително симптоми на токсичност;
|
|
—
|
същност, тежест и продължителност на клиничните наблюдения (обратимост на наблюдаваното или не);
|
|
—
|
сензорна активност, сила на захвата и оценка на двигателната активност;
|
|
—
|
хематологични тестове със съответните им начални стойности;
|
|
—
|
клинико-биохимични тестове със съответните им начални стойности;
|
|
—
|
телесно тегло при убиване на животното и данни за теглото на отделните органи;
|
|
—
|
подробно описание на всички хистопатологични находки;
|
|
—
|
данни за абсорбция, ако са налични;
|
|
—
|
при възможност — статистическа обработка на резултатите.
|
|
|
|
Обсъждане на резултатите.
|
4. ПРЕПРАТКИ
Този метод е еднакъв с OECD ТG 407.
Б.8. ТОКСИЧНОСТ (ИНХАЛАТОРНА) С МНОГОКРАТНИ ДОЗИ (28-ДНЕВНО)
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Необходимо е да се получи предварителна информация относно размера на разпръскваните частици, парния натиск, точката на топене, точката на кипене, точката на запалване и експлозивност (ако е приложимо) на веществото.
Вж. Общо въведение, част Б, буква А.
1.2. ОПРЕДЕЛЕНИЕ
Вж. Общо въведение, част Б, буква Б.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Няма.
1.4. ПРИНЦИП НА МЕТОДА
Отделни групи от опитни животни се експонират на изследваното вещество в градуиращи концентрации за период от 28 дни, като за всяка група животни се използва определена концентрация. Ако е необходимо, може да се добави подходящ носител, който да улесни получаването на подходяща концентрация на веществото във въздуха в камерата. В този случай следва да се използва контролна група, експонирана на носителя. По време на експеримента животните се наблюдават ежедневно за откриване на признаци на токсичност. Животните, починали по време на експеримента, както и тези, преживели до края на опита, се аутопсират.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Няма.
1.6. ОПИСАНИЕ НА МЕТОДА
1.6.1. Подготовка
Животните се държат в условията на експериментално отглеждане и хранене най-малко пет дни преди експеримента. Преди експеримента млади и здрави животни се подбират на случаен принцип и се разпределят съгласно изисквания брой в групи. Ако е необходимо, може да се добави подходящ носител, който да улесни получаването на подходяща концентрация на веществото във въздуха в камерата. В случай че се използват разтворители с оглед улесняване на дозировката, то за тях следва да е известно, че не предизвикват токсични ефекти. Използването на данни от историческа контрола е допустимо, стига да се сметне за подходящо.
1.6.2. Условия на опита
1.6.2.1. Опитни животни
Предпочитан животински вид са плъховете, освен ако няма контраиндикации. Използват се обичайните лабораторни породи и за двата пола, като в началото на опита допустимата разлика в теглото на животните не следва да надвишава ± 20 % от средната стойност за групата.
1.6.2.2. Брой и пол на животните
Най-малко 10 гризачи (пет мъжки и пет женски) се използват за всяко ниво на концентрация. Женските не следва да са чифтосани или бременни. Ако се предвижда убиване на животни по време на опита, групите следва да бъдат допълнително попълнени с предвидения брой. Освен това една сателитна (допълнителна) група от 10 животни (по пет от двата пола) се експонират на най-високата концентрация от изследваното вещество в продължение на 28 дни и се наблюдават за развитие на обратими, персистиращи или по-късно проявяващи се токсични ефекти 14 дни след приключване на опита. Получените резултати се сравняват с допълнителна контролна група от десет животни (по пет от двата пола).
1.6.2.3. Концентрации
Използват се най-малко три концентрации и една контрола. При използване на носител се използва и контролна група, изложена на действието на носителя в концентрация, отговарящи на концентрацията на носителя в най-високо експонираната група. С изключение на експозицията на изпитваното вещество, животните от контролните групи се отглеждат по идентичен начин на опитните. Най-високата концентрация следва да предизвиква токсични ефекти и да не предизвиква летален изход. Ако все пак тази концентрация води до леталитет, то той следва да бъде минимален. Най-ниската концентрация не следва да предизвиква токсични ефекти. Теоретично междинната концентрация би следвало да предизвиква минимални токсични ефекти. Ако се използват повече от една междинна концентрация, те следва да позволяват отчитането на степенни разлики в токсичните ефекти. При ниските и междинните групи, както и при контролната смъртните случаи следва да бъдат малко, което позволява добра оценка на резултатите.
1.6.2.4. Продължителност на въздействие
Продължителността на експонирането следва да е шест часа дневно, но при определени условия може да се използва и друга продължителност.
1.6.2.5. Апаратура
Животните следва да се изследват с апаратура, предназначена да поддържа динамичен въздушен поток, с най-малко 12 подавания на час, с оглед осигуряването на подходящо съдържание на кислород в опитната атмосфера и равномерна експозиция в атмосферата на въздушната камера. Когато се използва въздушна камера, тя следва да е с дизайн, който да не допуска струпването на животните и да оптимизира експонирането им на изследваното вещество. Като общо правило за осигуряване на стабилност на атмосферата общият обем на опитните животни не следва да надвишава 5 % от обема на камерата. Може да се използва орално-назално експониране, експониране на цялата глава или на цялото тяло в индивидуални клетки. Първите два способа се прилагат, когато се цели намаляване до минимум на приема на изследваното вещество чрез останалите пътища.
1.6.2.6. Период на наблюдение
Опитните животни се наблюдават ежедневно за признаци на токсичност по време на целия опит и на възстановителния период. Отбелязва се времето на настъпване на смъртта, както и това на появата и изчезването на токсичните ефекти.
1.6.3. Процедура
Животните се експонират на опитното вещество от пет до седем дни в седмицата, за период от 28 дни. Животните от всички сателитни групи се проследяват допълнителни 14 дни, през които те не се третират, за отчитане на обратимостта или персистирането на токсичните ефекти. Температурата, при която се провежда опитът, следва да се поддържа 22 ± 3 oС.
Теоретично влажността следва да бъде между 30 и 70 %, но на практика това е трудно постижимо. Поддържането на леко отрицателно налягане вътре в камерата ще предотвратява изтичането на изследваното вещество в околната среда. По време на експонирането не се дават храна и вода.
Използва се динамична инхалаторна система с подходяща система за аналитичен контрол на концентрацията. За определяне на подходящите концентрации се препоръчва да се направи предварителен тест. Въздушният поток следва да бъде изчислен по начин, осигуряващ хомогенни условия за експониране в камерата. Системата следва да осигури максимално бързото постигане на оптималните условия на опита.
Измервания или мониторинг се извършват на следните параметри:
|
а)
|
ниво на въздушния поток (постоянно);
|
|
б)
|
концентрацията на изследваното вещество в зоната на дишане. Концентрацията не следва да варира повече от ± 15 % от средната стойност по време на експонирането. При някои аерозоли обаче е допустимо отклонение от тази величина. По време на експеримента концентрациите в камерите следва да се поддържат постоянни. Задължително следва да се прави анализ на размера на частиците поне веднъж седмично за всяка изследвана концентрация;
|
|
в)
|
температурата и влажността (постоянно, при възможност).
|
По време и след експонирането се провеждат наблюдения, които систематично се записват. Всяко животно се проследява индивидуално. Всички животни се наблюдават ежедневно, като установените признаци на токсичност се записват, включително времето на тяхната поява, тежест и продължителност. Наблюденията следва да включват промени в кожата, козината, очите, лигавиците, дишането, кръвообращението, вегетативната и централната нервна система, двигателната активност и начина на поведение. Телесната маса следва да бъде измервана веднъж седмично. Препоръчва се консумацията на храна да се измерва веднъж седмично. Редовните наблюдения на животните са необходими, за да се осигури, че животните не са отпаднали от експеримента в резултат на канибализъм, автолиза или неправилно разположение в камерите. В края на експеримента всички животни от несателитните групи се аутопсират. Болните животни, животните, показали признаци на силна болка или стрес, следва да бъдат отстранени от експеримента веднага щом бъдат забелязани, хуманно убити и аутопсирани.
В края на опита на всички животни, включително и контролните се провеждат следните изследвания:
|
i)
|
хематологични: хематокрит, концентрация на хемоглобин, общ брой еритроцити, общ и диференциален брой левкоцити, кръвосъсирващ потенциал;
|
|
ii)
|
клинико-лабораторни и биохимични, които включват определянето в кръвта на най-малко един от параметрите за чернодробна и бъбречна функция: аланинаминотрансфераза, аспартатаминотрансфераза, уреа, албумин, креатинин, общ билирубин и общ белтък.
|
При необходимост за адекватна токсикологична оценка могат да се проведат и други изследвания, като определяне на калций, фосфор, хлориди, калий, глюкоза, липиди, хормони, основи/бази баланс, метахемоглобин и активност на холинестераза.
1.6.3.1. Макроскопски оглед
Всички животни, участвали в опита, се подлагат на пълен макроскопски оглед. Черният дроб, бъбреците, надбъбречните жлези, белите дробове и тестисите се претеглят веднага след аутопсията, за да се избегне изсъхването им. Органи и тъкани (респираторен тракт, черен дроб, бъбреци, слезка, тестиси, надбъбречни жлези, сърце и всички други органи, показващи големи патологични изменения или промени в размера) се съхраняват в подходяща среда с оглед евентуални бъдещи хистопатологични изследвания. Белите дробове следва да се извадят невредими, да се претеглят и третират с подходящ фиксатор за запазване на структурата им.
1.6.3.2. Хистопатологични изследвания
Хистопатологични изследвания се провеждат върху фиксирани органи и тъкани от контролата и опитната група, експонирана на най-високата концентрация. Органите и тъканите, при които се установяват изменения, дължащи се на изпитваното вещество, се изследват и при животните от групите, третирани с по-ниска концентрация. Животните от сателитните групи също се изследват хистологично, като се обръща внимание на органите и тъканите, показали изменения при другите групи.
2. ДАННИ
Данните се представят в таблична форма, като се посочват броят на животните във всяка група в началото на опита и броят на животните с всеки отделен вид увреждане.
Всички получени резултати се обработват с подходящ статистически метод. Всички признати статистически методи могат да бъдат използвани.
3. ДОКЛАДВАНЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
По възможност протоколът от изпитването следва да съдържа:
|
—
|
вид, порода, източник, околна среда, хранителен режим и др.;
|
|
—
|
опитни условия:
Описание на апаратурата, включително вид, тип, размери, източник на въздухоподаване, система за генериране на аерозолите, метод на отглеждане на животните, както и разполагането им в камерата. Следва да се опише апаратурата за измерване на температурата, влажността и аерозолната концентрация.
Данни за експонирането:
Данните за експонирането следва да бъдат отразени в таблици, представени със средни стойности и отклонения. Таблиците следва да съдържат:
|
а)
|
дебит на въздушния поток през апаратурата за инхалации;
|
|
б)
|
температура и влажност на въздуха;
|
|
в)
|
номинални концентрации (общото количество на изпитваното вещество, подадено в инхалационната апаратура, разделено на обема на въздуха);
|
|
г)
|
природа на носителя (ако е използван);
|
|
д)
|
действителни концентрации в зоната на дишане;
|
|
е)
|
масов медианен аеродинамичен диаметър (MMAD) и геометрично стандартно отклонение (GSD);
|
|
|
—
|
данни за отговора на токсичното въздействие по пол и концентрация;
|
|
—
|
време на смъртта през периода на изпитването или дали животните са преживели до края;
|
|
—
|
описание на токсичните или други ефекти; ниво, при което няма ефекти;
|
|
—
|
времето, в което е забелязан всеки аномален признак, и неговото следващо развитие;
|
|
—
|
данни за храната и телесната маса;
|
|
—
|
използвани хематологични анализи и резултатите от тях;
|
|
—
|
клинични биохимични анализи и резултатите от тях;
|
|
—
|
находки при аутопсията;
|
|
—
|
детайлно описание на всички хистопатологични находки;
|
|
—
|
статистическа обработка на резултатите (където е възможна);
|
|
—
|
обсъждане на резултатите;
|
|
—
|
интерпретиране на резултатите.
|
3.2. ОЦЕНКА И ИНТЕРПРЕТАЦИЯ
Вж. Общо въведение, част Б, буква Г.
4. ПРЕПРАТКИ
Вж. Общо въведение, част Б, буква Д.
Б.9. ТОКСИЧНОСТ (ДЕРМАЛНА) С МНОГОКРАТНИ ДОЗИ (28 ДНИ)
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Вж. Общо въведение, част Б, буква А.
1.2. ОПРЕДЕЛЕНИЯ
Вж. Общо въведение, част Б, буква Б.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Няма.
1.4. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Изпитваното вещество се прилага ежедневно в продължение на 28 дни върху кожата, в нарастващи дози при няколко групи експериментални животни, като за всяка група се използва по една доза. По време на експозицията животните се наблюдават всеки ден за появата на симптоми на токсичното действие. Животните, умрели по време на изпитването, се подлагат на аутопсия, а преживелите се аутопсират в края на изпитването.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Няма.
1.6. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
1.6.1. Подготовка
Животните се настаняват и хранят в лабораторни условия най-малко пет дни преди началото на изпитването. Преди изпитването млади здрави животни се избират по случаен начин и (също случайно) се разпределят на експериментални и контролни групи. Малко преди началото на изпитването се подстригва козината по гръбната част на тялото. Козината може и да се обръсне, но това се прави около 24 часа преди изпитването. Обикновено се налага ежеседмично подстригване или бръснене на козината, като се внимава да не се охлузи кожата. За прилагането на изпитваното вещество следва да се почистят не по-малко от 10 % от повърхността на тялото. За точното определяне на площта от тялото, която следва да се почисти от косми, а също и на размера на покритието е необходимо за се вземе предвид телесната маса на животното. При изпитването на твърди вещества (които могат да се стрият до прахообразно състояние, ако се сметне за необходимо) изпитваното вещество следва добре да се омокри с вода или с подходящ носител, което осигурява добър контакт с кожата. Течните вещества по принцип се прилагат без разреждане. Веществото се прилага ежедневно по пет до седем дни в седмицата.
1.6.2. Условия на изпитване
1.6.2.1. Опитни животни
Може да се използват полово зрели плъхове, зайци или морски свинчета. Употребата на други видове е също възможна, но следва да се обоснове.
В началото на изпитването интервалът в който варират масите на животните, не бива да е по-голям от ± 20 % от съответната средна стойност.
1.6.2.2. Брой и пол
При всяко ниво на дозиране се използват най-малко 10 животни (пет женски и пет мъжки) със здрава кожа. Женските не бива да са раждали, нито да са бременни. Ако е планирано част от животните да бъдат убивани на междинни етапи от експеримента, първоначалният брой животни следва да се увеличи с толкова, колкото ще бъдат убити преди края на изпитването. Освен това „сателитна“ група от 10 животни (по пет от двата пола) може да се третира с високо ниво на дозата за 28 дни. В продължение на 14 дни след това при тази група се провеждат наблюдения за случаи на обратимост, задържане или забавяне на токсичните ефекти. Използва се също и сателитна контролна група от 10 животни (по пет от двата пола).
1.6.2.3. Нива на дозите
Необходими са най-малко три нива на дозите и една контрола или контрола с носител (ако е използван носител). Експозиционният период следва да бъде поне по шест часа на ден. Прилагането на изпитваното вещество следва да става по едно и също време на деня; интервалите между експозициите се регулират (на една или две седмици), така че да се поддържа постоянно ниво на дозата спрямо телесната маса на животните. Животните от контролната група се третират по същия начин, както и тези от експерименталните групи с тази разлика, че при тях не се прилага изпитваното вещество. Когато за улеснение на дозирането е използван носител, животните от контролната група се третират с носителя по същия начин, както и животните от третираните групи, като количеството на приложения носител съвпада с това, получавано от групата с най-високо ниво на дозата. Най-високото ниво на дозиране следва да води до появата на токсични ефекти, но не и (или не в големи размери) да предизвиква смъртта на животните. При най-ниското ниво на дозата не бива да се наблюдават никакви признаци на токсично действие. Когато съществува използваема оценка за експозицията при хора, най-ниското ниво следва да я надвишава. В идеалния случай междинното ниво на дозата следва да води до минимални видими токсични ефекти. Ако се използват повече от една междинна доза, то техните нива следва да са правилно разпределени в количествено отношение, така че да се получи градация на токсичните ефекти. Случаите на смърт в групите с ниско и междинно ниво на дозата, както и в контролните групи следва да са минимален брой, което би позволило съдържателна оценка на резултатите.
Ако прилагането на изпитваното вещество предизвиква силно дразнене на кожата, концентрациите се намаляват, което може да доведе до намаление или отсъствие на другите ефекти от токсичното действие при високи нива на дозата. Нещо повече, ако кожата е силно разранена, то е необходимо изпитването да се прекрати и да се предприеме нов опит при по-ниски концентрации.
1.6.2.4. Гранично изпитване
Ако предварителното изпитване при ниво на дозата 1 000 mg/kg или при по-висока доза, свързана с възможна експозиция на хора (ако е известна), не доведе до токсични ефекти, то повече изпитвания могат да се смятат за излишни.
1.6.2.5. Период на наблюдение
Експерименталните животни се наблюдават всеки ден за симптоми на токсичното действие. Записват се времето на смъртта, както и времената на поява и изчезване на симптомите.
1.6.3. Процедура
Животните следва да се разположат в индивидуални клетки. Третирането с изпитваното вещество в идеалния случай става по седем дни в седмицата в продължение на 28 дни. Животните от всички сателитни групи, предназначени за продължителни наблюдения, се оставят без третиране още 14 дни, при което се проследява възстановяването от токсичните симптоми или тяхното устойчиво задържане. Времето за експозиция следва да бъде поне шест часа на ден.
Изпитваното вещество се прилага на равномерен слой върху площ приблизително 10 % от телесната повърхност. При вещества с висока токсичност покритата площ може да бъде и по-малка, но във всички случаи тя следва да се покрие с колкото е възможно по-тънък и равномерен пласт.
По време на експозицията изпитваното вещество се задържа в контакт с кожата с помощта на марлена превръзка и лепенка, която не дразни кожата. Мястото на прилагане на веществото се покрива допълнително по подходящ начин, така че превръзката и веществото да се задържат стабилно и освен това да се предотврати поглъщането на веществото от животното. За целта могат да се използват приспособления за ограничаване на движенията, но пълното обездвижване не се препоръчва. Може да се използва и „защитен обездвижващ нашийник“.
В края на периода на експозиция останалото изпитвано вещество се отстранява, ако може, с вода или кожата се почиства по друг подходящ начин.
Провежда се ежедневно наблюдение на всички животни и симптомите на токсичното действие се записват заедно с времето на появата им, техните острота и продължителност. Наблюденията следва да включват изменения в кожата и козината, очите и лигавиците, както и промените в дихателната, кръвоносната, автономната и централната нервна система, соматомоторната активност и поведението. Масата на животните следва да се измерва всяка седмица. Препоръчва се също всяка седмица да се измерва и консумацията на храна. Редовното наблюдаване на животните е необходимо и за да се избегне загубата на животни по такива причини, като канибализъм, автолиза на тъканите или неправилно положение в клетката. В края на проучвателния период всички оцелели животни от основните (несателитните) третирани групи се подлагат на аутопсия. Умиращите животни, както и животните с признаци на тежък стрес или болка следва да се отстраняват от изпитването в момента, в който са забелязани, да бъдат убивани безболезнено и подлагани на аутопсия.
Изброените по-долу анализи се правят в края на теста на всички животни, включително тези от контролните групи:
|
1)
|
хематологични анализи, които да включват най-малко хематокрит, концентрация на хемоглобина, брой на еритроцитите, общо и диференциално броене на левкоцитите и измерване потенциала на съсирване;
|
|
2)
|
клинична биохимия на кръвта, в това число поне по един параметър за чернодробна и бъбречна функция: серумна аланин аминотрансфераза (първоначално известна като глутамат пируват трансаминаза), серумна аспартат аминотрансфераза (първоначално позната като глутамат оксалоацетат трансаминаза), карбамиден азот, албумин, кръвен креатинин, общ билирубин и общ белтък в серума.
|
Други анализи, които може да са необходими за правилната токсикологична оценка, са следните: калций, фосфор, хлориди, натрий, калий, глюкоза при гладуване, анализ на липиди, хормони, киселинно-основен баланс, метхемоглобин и холинестеразна активност.
Когато е необходимо, за разширяване на изпитванията върху наблюдаваните ефекти може да се включат и допълнителни клинични биохимични анализи.
1.6.4. Аутопсия
Всички животни, участвали в изпитването, следва да се подложат на пълна макроскопска аутопсия. Най-малко черният дроб, бъбреците, надбъбречните жлези и тестисите се претеглят във влажно състояние, колкото е възможно по-бързо след дисекцията (така че да не изсъхват). Някои органи и тъкани, т.е. нормална и третирана кожа, черен дроб, бъбрек, слезка, тестиси, надбъбречни жлези, сърце и критични органи (т.е. онези органи, които показват видими поражения или изменения в размерите) следва да се запазят в подходяща среда за възможно бъдещо хистопатологично изпитване.
1.6.5. Хистопатологично изпитване
В групата с високо ниво на дозата, както и в контролната група се правят хистопатологични изпитвания на запазените органи и тъкани. Органите и тъканите, които показват дефекти, свързани с действието на изпитваното вещество при най-високата доза, следва да се изпитват и във всички групи с по-ниски нива на дозиране. При хистологичното изпитване на животните от сателитната група особено внимание се отделя на онези органи и тъкани, при които са наблюдавани ефекти в останалите третирани групи.
2. ДАННИ
Данните се обобщават в таблична форма, като за всяка изпитвана група се дават броят на животните в началото на изпитването и броят на животните, показали различните видове увреждания.
Всички наблюдавани резултати се обработват с подходящ статистически метод. Може да се използва всеки от общоприетите статистически методи.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Протоколът от изпитването следва по възможност да съдържа следната информация:
|
—
|
данни за животните (вид, порода, източник, условия на средата, диета и др.);
|
|
—
|
условия на изпитване (включително видът на превръзката: оклузивна или неоклузивна);
|
|
—
|
нива на дозиране (в това число и носителя, ако е използван) и концентрации;
|
|
—
|
когато е възможно, се указва и нивото, при което не се наблюдават ефекти;
|
|
—
|
данни за отговора на токсичното действие по пол и доза;
|
|
—
|
време на смъртта в процеса на изпитването или дали животните са преживели до края на изпитването;
|
|
—
|
токсични или други ефекти;
|
|
—
|
време на наблюдаване на всеки аномален признак и неговото следващо развитие;
|
|
—
|
данни за храната и телесната маса;
|
|
—
|
използвани хематологични анализи и резултатите от тях;
|
|
—
|
използвани клинични биохимични анализи и резултатите от тях;
|
|
—
|
находки при аутопсията;
|
|
—
|
детайлно описание на всички хистопатологични находки;
|
|
—
|
статистическа обработка на резултатите (когато е възможна);
|
|
—
|
обсъждане на резултатите;
|
|
—
|
интерпретиране на резултатите.
|
3.2. ОЦЕНКА И ИНТЕРПРЕТИРАНЕ
Вж. Общо въведение, част Б, буква Г.
4. ПРЕПРАТКИ
Вж. Общо въведение, част Б, буква Д.
Б.10. МУТАГЕННОСТ — ТЕСТ ИН ВИТРО ЗА ХРОМОЗОМНИ АБЕРАЦИИ ПРИ БОЗАЙНИЦИ
1. МЕТОД
Настоящият метод е изцяло подобен на теста in vitro за хромозомни аберации при бозайници на OECD TG 473 от 1997 г.
1.1. ВЪВЕДЕНИЕ
Целта на теста in vitro за хромозомни аберации е да се идентифицират агентите, причиняващи структурни хромозомни аберации в култивирани клетки от бозайници (1) (2) (3). Структурните аберации могат да бъдат два типа: хромозомни и хроматидни. При повечето химични мутагени индуцираните аберации са от хроматиден тип, но се срещат също и аберации от хромозомен тип. Увеличение в полиплоидията може да е показателно за това, че един химикал има потенциал да предизвиква геномни аберации. Все пак настоящият метод не е предназначен да измерва геномни аберации и не се използва рутинно за тази цел. Хромозомните мутации и свързаните с тях събития са причината за много генетични болести при човека, а има реални доказателства, че хромозомните мутации и свързаните с тях събития, които водят до промени в онкогените и тумороподтискащите гени на соматични клетки, участват в причиняването на рак при хора и опитни животни.
За in vitro теста за хромозомни аберации могат да се използват култури на доказани клетъчни линии, клетъчни щамове или първични клетъчни култури. Клетките се избират въз основа на способността на растеж в културата, стабилността на кариотипа, броя на хромозомите, хромозомното разнообразие и спонтанната честота на хромозомни аберации.
Тестове, провеждани in vitro, no принцип изискват използването на екзогенен източник на метаболична активация. Тази система на метаболична активация не може изцяло да възпроизведе in vivo условията при бозайници. Следва внимателно да се избягват условия, които биха довели до положителни резултати, неотразяващи свойствена мутагенност и които биха могли да възникнат от промени на рН, осмотично налягане или високи нива на цитотоксичност (4) (5).
Настоящият тест се използва за откриване на евентуални мутагени и канцерогени при бозайници. Много съединения, които са положителни в настоящия тест, са канцерогени за бозайници; все пак няма идеално съответствие между настоящия тест и канцерогенността. Съответствието зависи от химичния клас, а се появяват все повече доказателства, че съществуват канцерогени, които не се откриват с настоящия тест, тъй като очевидно те действат чрез други механизми, различни от прякото увреждане на ДНК.
Вижте също Общо въведение, част Б.
1.2. ДЕФИНИЦИИ
Хроматиден тип аберация: структурно увреждане на хромозомата, изразяващо се в разкъсване на единични хроматиди или разкъсване и повторно съединяване между хроматиди.
Хромозомен тип аберация: структурно увреждане на хромозомата, изразяващо се в разкъсване, или разкъсване и повторно съединяване на двата хроматида от една и съща страна.
Ендоредупликация: процес, при които след период S на ДНК репликация ядрото не навлиза в митоза, а започва друг S период. Резултатът е хромозоми с 4, 8, 16, … хроматиди.
Празнина: ахроматично увреждане, по-малко от ширината на един хроматид с минимална несъосност на хроматидите.
Митотичен индекс: съотношението на клетки в метафаза, разделени на броя клетки, наблюдавани в клетъчна популация; показател за степента на пролиферация на тази популация.
Гсномна аберация: промяна в броя на хромозомите в сравнение с нормалния брой, характерен за използваните клетки.
Полиплоидия: множимо на хаплоидния брой хромозоми (n), различно от диплоидния брой (т.е. 3n, 4n и т.н.).
Структурна аберация: промяна в хромозомната структура, която се открива при микроскопско изследване на етапа на метафаза на клетъчното деление, наблюдавана във вид на заличавания и фрагменти, вътрешнохромозомни или междухромозомни изменения.
1.3. ПРИНЦИП НА МЕТОДА НА ТЕСТА
Клетъчни култури се подлагат на въздействието на тестваното вещество със и без метаболична активизация. На предварително определени интервали след експозицията на клетъчните култури към тестваното вещество те се третират с блокиращо метафазата вещество (напр. Колцемид® или колхицин), събират се, оцветяват се и метафазните клетки се анализират под микроскоп за наличието на хромозомни аберации.
1.4. ОПИСАНИЕ НА МЕТОДА НА ТЕСТА
1.4.1. Подготовка
1.4.1.1. Клетки
Могат да се използват разнообразни клетъчни линии, щамове или първични клетъчни култури, включително и човешки клетки (напр. фибробласти от китайски хамстер, лимфоцити от периферна кръв на хора или други бозайници).
1.4.1.2. Хранителни среди и условия за отглеждане на културата
При отглеждането на културата следва да се използват подходящи хранителни среди и инкубационни условия (носители на културата, концентрация на СО2, температура и влажност). Доказаните клетъчни линии и щамове следва да се проверяват редовно за стабилност на модалния хромозомен брой и отсъствие на микоплазмено замърсяване, а ако са замърсени, не следва да се използват. Следва да се знае нормалното време на клетъчен цикъл при клетките и използваните условия за отглеждане на културата.
1.4.1.3. Приготвяне на културите
Установени клетъчни линии и щамове: от изходни култури се размножават клетки, посяват се в хранителна среда с такава гъстота, че културите да не достигат точката на сливане преди времето на обиране, и се инкубират при 37 oС.
Лимфоцити: цялостна кръв, третирана с антикоагулант (напр. хепарин), или сепарирани лимфоцити, получени от здрави субекти, се добавят към хранителната среда, съдържаща митоген (напр. фитохемаглутинин), и се инкубират при 37 oС.
1.4.1.4. Метаболична активация
Клетките следва да се излагат на тестваното вещество както в присъствието, така и в отсъствието на подходяща система за метаболична активация. Най-често използваната система е постмитохондрична фракция (S9) с добавка на ко-фактор, приготвена от черните дробове на гризачи, третирани с ензимно индуциращи реактиви, като Ароклор 1254 (6) (7) (8) (9) или смес от фенобарбитон и β-нафтофлавон (10) (11) (12).
Постмитохондричната фракция обичайно се използва в концентрации с обхват от 1 до 10 % v/v в последната тестова среда. Състоянието на система за метаболична активация може да зависи от изпитвания химикал. В някои случаи може да е подходящо да се прилага повече от една концентрация на постмитохондрична фракция.
Редица разработки, включително изграждането на клетъчни линии чрез генно инженерство, изразяващи специфични активизиращи ензими, могат да осигурят възможности за ендогенна активация. Изборът на използваните клетъчни линии следва да е научно обоснован (напр. чрез приложимостта на изоензим цитохром Р450 за метаболизма на тестваното вещество).
1.4.1.5. Тествано вещество/подготовка
Твърдите вещества за теста следва да се разтворят или суспендират в подходящи разтворители или носители и, ако е необходимо, да се разредят преди третирането на клетките. Течните тествани вещества могат да се добавят директно към тестовите системи и/или да се разредят преди третирането. Следва да се използват пресни препарати на тестваното вещество, освен ако данните за устойчивостта му не показват, че може да се съхранява.
1.4.2. Условия за провеждане на теста
1.4.2.1. Разтворител/носител
Не следва да има съмнения за химическа реакция на разтворителя/носителя с тестваното вещество и той следва да е съвместим с оцеляването на клетките и активността на S9. Ако се използват други освен добре познатите разтворители/носители, включването им в теста следва да се подкрепи от данни за съвместимостта им. Препоръчва се винаги когато е възможно, първо да се разглежда възможността за прилагането на воден разтворител/носител. При тестването на вещества, нестабилни във вода, използваните органични разтворители не следва да съдържат вода. Водата може да се отстрани чрез добавянето на молекулно сито.
1.4.2.2. Концентрации на експозицията
Измежду критериите, които следва да се имат предвид при определянето на най-високите концентрации, са цитотоксичността, разтворимостта в тестовата система и промените в рН или осмотичното налягане.
Цитотоксичността следва да се определи със и без метаболична активация в главния експеримент, като се използва подходяща индикация на клетъчната цялост и растеж, като степен на сливане, количества жизнеспособни клетки или митотичен индекс. Може да бъде полезно, ако се определят цитотоксичността и разтворимостта в предварителен експеримент.
Следва да се използват най-малко три концентрации, които могат да бъдат подложени на анализ. Там, където се среща цитотоксичност, тези три концентрации следва да покриват обхват от максимална до слаба или липса на токсичност; това обикновено означава, че концентрациите следва да се различават с коефициент не повече от 2 до √10. В момента на събиране на реколтата най-високата концентрация следва да показва значително намаляване на степента на сливане, клетъчния брой или митотичния индекс (всички са повече от 50 %). Митотичният индекс е само едно косвено мерило за цитотоксичните/цитостатичните ефекти и зависи от времето след третирането. Все пак митотичният индекс е приложим за суспензионни култури, при които други начини на измерване на токсичността могат да се окажат неудобни и непрактични. Информацията за клетъчната кинетика, като например средно генерационно време (СГВ), може да се използва като допълваща информация. СГВ обаче е едно общо средно число, което не винаги е показателно за съществуването на забавени субпопулации, а дори съвсем малко увеличение на средното генерационно време може да се свърже с особено голямо забавяне на времето на оптимален добив на аберации.
За относително нецитотоксични вещества максималната тестова концентрация следва да е 5μl/ml, 5 mg/ml или 0,01 М, в зависимост от това коя е най-ниска.
За относително неразтворими вещества, които не са токсични в концентрации, по-ниски от неразтворимата концентрация, най-високата използвана доза следва да е в концентрация над границата на разтворимост в последната хранителна среда в края на периода на третиране. В някои случаи (напр. когато токсичността се получава само с концентрация, по-висока от най-ниската неразтворима концентрация), препоръчително е тестът да се провежда при повече от една концентрация с видимо утаяване. Полезно би било разтворимостта да се прецени в началото и в края на обработването, тъй като разтворимостта може да се измени по време на курса на експозиция в тестовата система поради наличието на клетки, серум S9 и др. Неразтворимостта може да се установи и с просто око. Преципитатът не следва да пречи на отчитането.
1.4.2.3. Отрицателни и положителни контроли
Във всеки експеримент следва да се включат паралелни положителни и отрицателни (разтворител или носител) контроли, със и без метаболична активация. Когато се прилага метаболична активация, химикалът за положителен контрол следва да е такъв, че да изисква активация, за да произведе мутагенна реакция.
За извършване на положителни контроли следва да се използва известен еластоген при нива на експозиция, при които се очаква да се достигне репродуцируемо и забележимо увеличение спрямо фон, показващ нагледно чувствителността на тестовата система.
Концентрациите на положителен контрол следва да са така избрани, че ефектите да са ясни, но да не разкриват непосредствено на четящото устройство идентичността на кодираните предметни стъкла. Примерите за положителни контролни вещества включват:
|
Метаболична активация
|
Вещество
|
CAS №
|
Einecs №
|
|
Отсъствие на екзогенна метаболична активация
|
Метил метансулфонат
|
66-27-3
|
200-625-0
|
|
Етил метансулфонат
|
62-50-0
|
200-536-7
|
|
Етил нитрозокарбамид
|
759-73-9
|
212-072-2
|
|
Митомицин С
|
50-07-7
|
200-008-6
|
|
4-нитрохинолин-N-оксид
|
56-57-5
|
200-281-1
|
|
Наличие на екзогенна метаболична активация
|
бензо[а]пирен
|
50-32-8
|
200-028-5
|
|
Циклофосфамид
Циклофосфамид монохидрат
|
50-18-0
6055-19-2
|
200-015-4
|
Могат да се използват други подходящи положителни контролни вещества. За положителна контрола следва да се взема предвид използването на химикали, принадлежащи към химичен клас, когато такива са налични.
Отрицателните контроли, състоящи се само от разтворител или носител в средата, в която се извършва обработването, и третирани по същия начин като културите, които се обработват, следва да се включат за всяко прибиране на клетъчна реколта. В допълнение към това следва също да се използват нетретирани контроли, освен ако няма контролни данни от предишни изследвания, показващи, че от избрания разтворител не се предизвикват делеционни или мутагенни ефекти.
1.4.3. Процедура
1.4.3.1. Третиране с тестваното вещество
Пролифериращите клетки се обработват с тестваното вещество при наличието и при отсъствието на метаболична активационна система. Третирането на лимфоцити следва да започне около 48 часа след митогенната стимулация.
|
1.4.3.2.
|
Нормално за всяка концентрация следва да е използването на дубликатни култури, а те са силно препоръчителни и за отрицателни/разтворителни контролни култури. Когато на базата на данни от предишни изследвания може да се демонстрира минимално вариране между дубликатни култури (13) (14), би могло да се приеме използването на една култура за всяка концентрация.
Газообразни или летливи вещества следва да се тестват чрез подходящи методи, като например в запечатани носители на културата (15) (16).
|
1.4.3.3. Време за събиране на реколтата от културата
В първия експеримент клетките следва да се експонират на въздействието на тестваното вещество както със, така и без метаболична активация, в продължение на 3 до 6 часа и да се вземе проба след време, равно на около 1,5 пъти от нормалната продължителност на клетъчния цикъл след началото на третирането (12). Ако тази процедура дава отрицателни резултати както със, така и без активация, следва да се извърши допълнителен експеримент без активация, с непрекъснато третиране до вземането на проба след време, равно на около 1,5 пъти от нормалната продължителност на клетъчния цикъл. Някои химични вещества могат по-лесно да се различат при периоди на обработване/вземане на проба, по-дълги от 1,5 пъти от продължителността на клетъчния цикъл. Отрицателните резултати с метаболична активация следва да се потвърдят за всеки случай поотделно. В случаите, когато се смята, че не е необходимо потвърждаването на отрицателни резултати, това следва да е обосновано.
1.4.3.4. Подготовка на хромозомите
Клетъчните култури се третират с Колцемид ® или колхицин обикновено в продължение на 1 до 3 часа преди събирането на реколтата. Всяка клетъчна култура се обира и обработва отделно за подготовката на хромозомите. Подготовка на хромозомите включва хипотонично третиране на клетките, фиксиране и оцветяване
1.4.3.5. Анализ
Всички предметни стъкла, включително и тези на положителните и отрицателните контроли, следва да се кодират независимо едно от друго преди микроскопския анализ. Тъй като процедурите на фиксиране водят често до разкъсване на част от метафазните клетки със загуба на хромозоми, отчетените клетки следва да съдържат известен брой центромери, равен на модалния брой ± 2 за всички клетъчни типове. Следва да се отчетат най-малко 200 добре разнесени метафази за всяка концентрация и контрола, разделени поравно между дубликатите, ако това е приложимо. Този брой може да се намали, когато се наблюдава голям брой аберации.
Въпреки че целта на теста е да се открият структурни хромозомни аберации, от значение е да се регистрират полиплоидия и ендоредупликация, когато тези събития се наблюдават.
2. ДАННИ
2.1. ОБРАБОТКА НА РЕЗУЛТАТИТЕ
Експерименталната единица е клетката и по тази причина следва да се оценява процентът на клетки със структурна(и) хромозомна(и) аберация(и). Следва да се изготвят списъци на различни типове структурни хромозомни аберации с техния брой и честоти при експерименталните и контролните култури. Празнините се отбелязват отделно и се протоколират, но по принцип не се включват в общата честота на аберациите.
Следва също да се документират съпътстващите измервания на цитотоксичността за всички третирани и отрицателни контролни култури в главните опити за аберации.
Следва да се осигурят данни за отделните култури. Освен това всички данни следва да се резюмират в табличен вид.
Няма изискване за потвърждаване на ясна положителна реакция. Двузначните резултати следва да се изяснят чрез допълнително тестване, като за предпочитане е условията на опита да се модифицират. Необходимостта от потвърждаване на отрицателни резултати е разгледана в т. 1.4.3.3. Изменението на параметрите на изследването с цел разширяване на обхвата на изследваните условия следва да се има предвид при последващите експерименти. Параметрите на изследването, които могат да се изменят, включват границите на концентрацията и условията на метаболична активация.
2.2. ОЦЕНКА И ТЪЛКУВАНЕ НА РЕЗУЛТАТИТЕ
Има няколко критерия за определяне на положителен резултат, като например увеличение, свързано с концентрацията, или репродуцируемо увеличение в броя на клетки с хромозомни аберации. Първо, следва да се вземе предвид биологичната значимост на резултатите. При оценката на резултатите от теста биха могли да се използват статистически методи (3) (13). Статистическата значимост не следва да е единственият решаващ фактор за положителна реакция.
Едно увеличение в броя на полиплоидни клетки може да показва, че тестваното вещество е способно да инхибира митотични процеси и да индуцира многобройни хромозомни аберации. Увеличение в броя на клетки с ендоредуплицирани хромозоми може да е показателно за способността на тестваното вещество да инхибира прогресията на клетъчния цикъл (17) (18).
Тествано вещество, за което резултатите не удовлетворяват горните критерии, се смята немутагенно в настоящата система.
Въпреки че повечето опити дават ясно положителни или отрицателни резултати, в редки случаи получените данни изключват възможността да се направи категорична преценка за активността на тестваното вещество. Резултатите могат да останат неясни или под въпрос, независимо от това колко пъти е повторен опитът.
Положителните резултати от теста ин витро за хромозомни аберации показват, че тестваното вещество индуцира структурни хромозомни аберации в култивирани соматични клетки на бозайници. Отрицателните резултати показват, че при условията на теста изследваното вещество не предизвиква хромозомни аберации в култивирани соматични клетки на бозайници.
3. ДОКЛАДВАНЕ
ДОКЛАД ЗА ТЕСТА
Докладът за теста следва да съдържа следната информация:
|
|
Разтворител/носител:
|
—
|
обосновка за избора на носител,
|
|
—
|
разтворимост и стабилност на тестваното вещество в разтворител/носител, ако са известни.
|
|
|
|
Клетки:
|
—
|
тип и източник на клетки,
|
|
—
|
кариотипни особености и дали използваният тип клетки е подходящ,
|
|
—
|
отсъствие на микоплазма, ако е приложимо,
|
|
—
|
информация за продължителността на клетъчния цикъл,
|
|
—
|
пол на кръвните донори, цялостна кръв или изолирани лимфоцити, използван митоген,
|
|
—
|
брой на пасажи, ако е приложим,
|
|
—
|
методи за поддържане на клетъчна култура, ако са приложими,
|
|
—
|
модален брой на хромозомите.
|
|
|
|
Условия за провеждане на теста:
|
—
|
идентичност на веществото, блокиращо метафазата, концентрация и времетраене на експозицията на клетките,
|
|
—
|
основна причина за избора на концентрации и брой култури, в т.ч. напр. цитотоксични данни и ограничения за разтворимостта, ако са налични,
|
|
—
|
състав на средите, СО2 концентрация, ако са приложими,
|
|
—
|
концентрация на тестваното вещество,
|
|
—
|
общ обем на носителя и тестваното вещество,
|
|
—
|
температура на инкубация,
|
|
—
|
времетраене на третирането,
|
|
—
|
гъстота на клетките при посяване, ако е необходимо,
|
|
—
|
тип и състав на система за метаболична активация, в.т.ч. критериите за приемливост,
|
|
—
|
положителни и отрицателни контроли,
|
|
—
|
методи на подготовка на предметно стъкло,
|
|
—
|
критерии за отчитане на аберации,
|
|
—
|
брой на анализираните метафази,
|
|
—
|
методи за измерване на токсичността,
|
|
—
|
критерии за приемане на проучванията за положителни, отрицателни или двузначни,
|
|
|
|
Резултати:
|
—
|
признаци на токсичност, напр. степен на сливане, данни за клетъчния цикъл, клетъчно броене, митотичен индекс,
|
|
—
|
данни за рН и осмотичното налягане на средата за тестване, ако са определени,
|
|
—
|
дефиниция за аберации, в т.ч. празнини,
|
|
—
|
брой на клетки с хромозомни аберации и тип на хромозомните аберации, дадени отделно за всяка третирана и контролна култура,
|
|
—
|
изменения в полиплоидията, ако се наблюдават,
|
|
—
|
взаимоотношение доза/реакция, при възможност,
|
|
—
|
статистически анализ, ако има такъв,
|
|
—
|
данни от паралелни отрицателни (разтворител/носител) и положителни контроли,
|
|
—
|
данни от предишни изследвания от отрицателни (разтворител/носител) и положителни контроли, с обхвати, средни стойности и стандартни отклонения.
|
|
|
|
Обсъждане на резултатите.
|
4. ПРЕПРАТКИ
|
(1)
|
Evans, H. J. (1976), Cytological Methods for Detecting Chemical Mutagens, w: Chemical mutagens, Principles and Methods for their Detection, Vol. 4, Hollaender, A. (ed) Plenum Press, New York and London, pp. 1—29.
|
|
(2)
|
Ishidate, M. Jr. and Sofumi, T. (1985), The In Vitro Chromosomal Aberration Test Using Chinese Hamster Lung (CHL) Fibroblast Cells in Culture, in: Progress in Mutation Research, Vol. 5, Ashby, J. et al., (eds) Elsevier Science Publishers, Amsterdam-New York-Oxford, pp. 427—432.
|
|
(3)
|
Galloway, S. M., Armstrong, M. J., Reuben, C, Colman, S., Brown, B., Cannon, C, Bloom, A. D., Nakamura, F., Ahmed, M., Duk, S., Rimpo, J., Margolin, G. H., Resnick, M. A., Anderson, G. and Zeiger E. (1978), Chromosome aberration and sister chromatic exchanges in Chinese hamster ovary cellS: Evaluation of 108 chemicals, Environs, Molec. Mutagen 10 (suppl.10), pp. 1—175.
|
|
(4)
|
Scott, D., Galloway, S. M., Marshall, R. R., Ishidate, M. Jr., Brusick, D., Ashby, J. and Myhr, B. C. (1991), Genotoxicity under Extreme Culture Conditions. A report from ICPEMC Task Group 9, Mutation Res., 257, pp. 147—204.
|
|
(5)
|
Morita, T., Nagaki, T., Fukuda, I. and Okumura, K., (1992), Clastogenicity of low pH to Various Cultured Mammalian Cells, Mutation Res., 268, pp. 297—305.
|
|
(6)
|
Ames, B. N., McCann, J. and Yamasaki, E. (1975), Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian Microsome Mutagenicity Test, Mutation Res., 31, pp. 347—364.
|
|
(7)
|
Maron, D. M. and Ames, B. N. (1983), Revised Methods for the Salmonella Mutagenicity Test, Mutation Res., 113, pp. 173—215.
|
|
(8)
|
Natarajan, A. T., Tates, A. D., van Buul, P. P. W., Meijers, M. and de Vogel, N. (1976), Cytogenetic Effects of Mutagen/Carcinogens after Activation in a Mircrosomal System In Vitro, I. Induction of Chromosome Aberrations and Sister Chromatid Exchange by Diethylnitrosamine (DEN) and Dimethylnitrosamine (DMN) in CHO Cells in the Presence of Rat-Liver Microsomes, Mutation Res., 37, pp. 83—90.
|
|
(9)
|
Matsuoka, A., Hayashi, M. and Ishidate, M. Jr. (1979), Chromosomal Aberration Tests on 29 Chemicals Combined with S9 Mix In Vitro, Mutation Res., 66, pp. 277—290.
|
|
(10)
|
Elliot, B. M., Combes, R. D., Elcombe, C. R., Gatehouse, D. G., Gibson, G. G., Mackay, J. M. and Wolf, R. C. (1992), Report of UK Environmental Mutagen Society Working Party. Alternative to Aroclor 1254-induced S9 in In Vitro Genotoxicity Assays, Mutagenesis, 7, pp. 175—177.
|
|
(11)
|
Matsushima, T., Sawamura, M., Hara, K. and Sugimura, T. (1976), A. Safe Substitute for Polychlorinated Biphenyls as an Inducer of Metabolic Activation Systems, in: de Serres, F. J. Fouts, J. R. Bend, J. R. and Philpot, R. M. (eds), In Vitro Metabolic Activation in Mutagenesis Testing, Elsevier, North-Holland, pp. 85—88.
|
|
(12)
|
Galloway, S. M., Aardema, M. J., Ishidate, M. Jr., Ivett, J. L., Kirkland, D. J. Morita, T., Mosesso, P., Sofumi, T. (1994), Report from Working Group on in In Vitro Tests for Chromosomal Aberrations, Mutation Res., 312, pp. 241—261.
|
|
(13)
|
Richardson, C, Williams, D. A., Allen, J. A., Amphlett, G., Chanter, D. O. and Phillips, B. (1989), Analysis of Data from In Vitro Cytogenetic Assays, w: Statistical Evaluation of Mutagenicity Test Data, Kirkland, D. J., (cd) Cambridge University Press, Cambridge, pp. 141—154.
|
|
(14)
|
Soper, K. A. and Galloway, S. M. (1994), Replicate Flasks are not Necessary for In Vitro Chromosome Aberration Assays in CHO Cells, Mutation Res., 312, pp. 139—149.
|
|
(15)
|
Krahn, D. F., Barsky, F. C. and McCooey, K. T. (1982), CHO/HGPRT Mutation Assay: Evaluation of Gases and Volatile Liquids, in: Tice, R. R., Costa, D. L., Schaich, K. M. (eds), Genotoxic Effects of Airborne Agents, New York, Plenum, pp. 91—103.
|
|
(16)
|
Zamora, P. O., Benson, J. M., Li, A. P. and Brooks, A. L. (1983), Evaluation of an Exposure System Using Cells Grown on Collagen Gels for Detecting Highly Volatile Mutagens in the CHO/HGPRT Mutation Assay, Environmental Mutagenesis, 5, pp. 795—801.
|
|
(17)
|
Locke-Huhle, C. (1983), Endoreduplication in Chinese hamster cells during alpha- radiation induced G2 arrest, Mutation Res., 119, pp. 403—413.
|
|
(18)
|
Huang, Y., Change, C. and Trosko, J. E. (1983), Aphidicolin-induced endoreduplication in Chinese hamster cells, Cancer Res., 43, pp. 1362—1364
|
Б.11. МУТАГЕННОСТ — ТЕСТ IN VIVO ЗА ХРОМОЗОМНИ АБЕРАЦИИ В КОСТНИЯ МОЗЪК НА БОЗАЙНИЦИ
1. МЕТОД
Настоящият метод е изцяло подобен на теста за хромозомни аберации в костния мозък на бозайници на OECD TG 475 от 1997 г.
1.1. ВЪВЕДЕНИЕ
Тестът in vivo в микроядрата на клетки от бозайници се използва за откриване на структурни хромозомни аберации, индуцирани от тествано вещество в клетки от костен мозък на животни, обикновено гризачи (1) (2) (3) (4). Структурните хромозомни аберации могат да бъдат два вида: хромозомни или хроматидни. Едно увеличение в полиплоидията би могло да показва, че дадено химично вещество има потенциал да предизвиква геномни аберации. С повечето химични мутагени се предизвикват аберации от хроматиден тип, но хромозомният тип аберации също се срещат. Хромозомните аберации и свързаните с тях събития са причината за генетични болести у човека, а има реални доказателства, че хромозомните мутации и свързаните с тях събития, причиняващи промени в онкогените и тумороподтискащите гени, участват в причиняването на рак на хора и експериментални системи.
В настоящия тест обикновено се използват гризачи. Обект на настоящия тест е тъканта на костният мозък, тъй като последният представлява високо васкуларизирана тъкан и съдържа популация от бързо циклиращи клетки, които могат лесно да се изолират и обработят. Други видове и тъкани не са обекти на настоящия метод.
Настоящият тест за хромозомни аберации е от специално значение за оценка на мутагенната опасност, поради това че позволява разглеждане на фактори на in vivo метаболизма, фармакокинетиката и процесите на ДНК репарация, въпреки че те варират при различните видове и тъкани. Тест in vivo е също полезен за по-нататъшното изследване на мутагенния ефект, установен чрез тест in vitro.
Ако има доказателства, че тестваното вещество или реактивен метаболит няма да достигнат до тъканта, която е обект на изследване, не е подходящо да се използва в настоящия тест.
Вижте също Общо въведение, част Б.
1.2. ДЕФИНИЦИИ
Хроматиден тип аберация: структурно увреждане на хромозомата, изразяващо се в разкъсване на единични хроматиди или разкъсване и повторно съединяване между хроматиди.
Хромозомен тип аберация: структурно увреждане на хромозомата, изразяващо се в разкъсване или разкъсване и повторно съединяване на двата хроматида на същата страна.
Ендоредупликация: процес, при който след период S на ДНК репликация ядрото не навлиза в митоза, а започва друг S период. Резултатът е хромозоми с 4, 8, 16, ... хроматиди.
Празнина: ахроматично увреждане, по-малко от ширината на един хроматид с минимална несъосност на хроматида(ите).
Геномна аберация: промяна в броя на хромозомите в сравнение с нормалния брой, характерен за използваните клетки.
Полиплоидия: кратно число на хаплоидния брой хромозоми (n), различно от диплоидния брой (т.е. 3n, 4n и т.н.).
Структурна аберация: промяна в хромозомната структура, която се открива чрез микроскопско изследване на етапа на метафаза на клетъчното деление, наблюдавана във вид на заличавания и фрагменти, вътрешнохромозомни или междухромозомни изменения.
1.3 ПРИНЦИП НА МЕТОДА НА ТЕСТА
Животни се излагат на тестваното вещество по подходящ начин и се убиват в подходящи моменти след обработването. Преди убиването животните се третират с блокиращ метафазата агент (напр. колхицин или Колцемид®). След това се приготвя хромозомен препарат от клетки на костния мозък, оцветява се и клетките в метафаза се анализират за хромозомни аберации.
1.4. ОПИСАНИЕ НА МЕТОДА НА ТЕСТА
1.4.1. Подготовка
1.4.1.1. Подбор на животински вид
Обичайно използваните животни са плъхове, мишки и китайски хамстери, въпреки че всеки подходящ вид бозайник би могъл да се използва. Следва да се вземат общо използваните лабораторни щамове на млади, здрави, пораснали животни. В началото на изследването вариациите в теглото на животните следва да са минимални и да не превишават ± 20 % от средното тегло на всеки пол.
1.4.1.2. Условия на отглеждане и хранене
Прилагат се общите условия в Общото въведение към част Б, въпреки че следва да се цели влажността на въздуха да е 50—60 %.
1.4.1.3. Подготовка на животните
Здрави, млади, пораснали животни се определят произволно за контролните и опитните групи. Клетките следва да се подредят така, че да се намалят до минимум евентуалните ефекти от разполагането им. На животните се дава уникална идентифакация. Животните се аклиматизират към лабораторните условия поне пет дни.
1.4.1.4. Приготвяне на дози
Твърдите вещества за теста следва да се разтворят или суспендират в подходящи разтворители или носители и, при необходимост, да се разредят преди даване на дозата на животните. Течните вещества за теста могат да се дават директно или да се разредят преди дозиране. Следва да се използват пресни препарати на тестваното вещество, освен ако данните за устойчивостта му не показват, че може да се съхранява.
1.4.2. Условия за провеждане на теста
1.4.2.1. Разтворител/носител
Разтворителят/носителят не следва да предизвиква токсично въздействие с използваните нива на дозиране, а също така не следва да има съмнения за химическа реакция между него и тестваното вещество. Ако се използват други освен добре познатите разтворители/носители, включването им в теста следва да се подкрепи от данни за съвместимостта им. Препоръчва се, винаги когато е възможно, първо да се разглежда възможността за прилагането на воден разтворител/носител.
1.4.2.2. Контроли
Във всеки тест следва да се включват паралелни положителни и отрицателни (разтворител/носител) контроли за всеки пол. Като се изключи третирането с тестваното вещество, животните в контролните групи следва да се третират по един и същи начин, както животните от опитните групи.
Положителните контроли следва да произвеждат структурни аберации in vivo при нива на експозиция, при които се очаква да се постигне забележимо увеличение спрямо дадения фон. Положителните контролни дози следва да са така избрани, че ефектите да са ясни, но да не разкриват непосредствено на четеца идентичността на кодираните предметни стъкла. Приемливо е положителните контроли да се прилагат по различен начин от тестваното вещество и да им се взема проба само еднократно. За положителна контрола може да се разглежда използването на химикали, принадлежащи към химичен клас, когато такива са налични. Примерите за положителни контролни вещества включват:
|
Вещество
|
САS №
|
ЕINECS №
|
|
Етил метасулфонат
|
62-50-0
|
200-536-7
|
|
Етил нитрозокарбамид
|
759-73-9
|
212-072-2
|
|
Митомицин С
|
50-07-7
|
200-008-6
|
|
Циклофосфамид
Циклофосфамид монохидрат
|
50-18-0
6055-19-2
|
200-015-4
|
|
Триетиленмеламин
|
51-18-3
|
200-083-5
|
За всяко вземане на проби следва да се включват отрицателните контроли, третирани само с разтворител или носител, а за всичко останало третирани както опитните групи, освен ако няма приемлива изменчивост между животните и честотите на клетки с хромозомни аберации са доказани с контролни данни от предшестващи изследвания. Ако за отрицателни контроли се прилага еднократно вземане на проби, най-подходящият момент е първото вземане на проба. Освен това следва също да се използват нетретирани контроли, освен ако няма данни от предшестващи изследвания или публикувани контролни данни, показващи, че няма никакви вредни или мутагенни ефекти, предизвикани от избрания разтворител/носител.
1.5. ПРОЦЕДУРА
1.5.1. Брой и пол на животните
Всяка група от животни, с които се извършват опити, и всяка контролна група включват поне пет животни за анализ от един и същ пол. Ако по времето на изследването има налични данни от изследвания на същия вид и по същия начин на експозиция, които показват, че няма значителни разлики между половете по отношение на токсичността, то тестването на един пол ще бъде достатъчно. Когато експозицията на хора спрямо химически вещества може да е в специфична зависимост от пола, като например към някои фармацевтични агенти, тестът следва да се проведе с животни от подходящия пол.
1.5.2. График на обработване
За предпочитане е тестваните вещества да се въвеждат чрез еднократно третиране. Тестваните вещества могат също да се въвеждат като доза на отделни части, т.е. две обработвания в един и същи ден, разделени от не повече от няколко часа, за да се улесни прилагането на голям обем материал. Други режими на дозиране следва да са научно обосновани.
Пробите следва да се вземат в два отделни момента след третирането в един ден. За гризачи първият интервал на вземане на проба е 1,5 пъти от продължителността на нормалния клетъчен цикъл (който нормално е 12—18 часа) след третирането. Тъй като времето за поемането и метаболизма на тестваното вещество, както и за ефекта му върху кинетиката на клетъчния цикъл може да повлияе на оптималното време за откриване на хромозомни аберации, препоръчва се и вземане на по-късна проба 24 часа след първата проба. Ако се използват режими на дози за повече от един ден, следва да се взема една проба 1,5 пъти продължителността на нормалните клетъчни цикли след последното третиране.
Преди убиването животните се инжектират интраперитонеално с подходяща доза на блокиращ метафазата агент (напр. Колцемид® или колхицин). След това, след подходящ интервал от време от животните се взема проба. За мишки този интервал е приблизително 3—5 часа; за китайски хамстери — около 4—5 часа. Клетките се събират от костния мозък и се анализират за хромозомни аберации.
1.5.3. Нива на дозиране
Ако се извършва изследване за обхват, поради това че няма подходящи данни в наличност, то следва да е в същата лаборатория, като се използва същият вид, щам, пол и режим на третиране както в главното изследване (5). Ако има токсичност, за първото вземане на проба се използват три нива на дозиране. Тези нива на дозиране следва да включват обхват от максимална до слаба токсичност или липса на токсичност. При вземане на проба на по-късен етап следва да се прилага само най-високата доза. Най-високата доза се дефинира като доза, създаваща признаци на такава токсичност, че от по-високи нива на дозиране, базирани на същия режим, би могло да се очаква да доведат до леталност. Вещества със специфични биологични активности при ниски, нетоксични дози (като хормони и митогени) могат да бъдат изключения от критериите за определяне на дозата и следва да се оценяват за всеки конкретен случай. Най-високата доза може също да се дефинира като доза, която показва известни признаци на токсичност в костния мозък (напр. намаляване на митотичния индекс с повече от 50 %).
1.5.4. Граничен тест
Ако тест с едно ниво на дозиране от минимум 2 000 mg/kg телесно тегло при еднократно третиране или две третирания в един и същи ден не дава забележими токсични ефекти, а не би могло да се очаква генотоксичност на базата на данни от структурно свързани вещества, то тогава пълно изследване с три нива на дозиране може да не се смята за необходимо. За по-дълготрайни изследвания граничната доза е 2 000 mg/kg/телесно тегло на ден за период на третиране до 14 дни и 1 000 mg/kg/телесно тегло на ден за период на третиране, по-дълъг от 14 дни. Очакваната експозиция при хора може да покаже необходимост в граничния тест да се използва по-високо ниво на дозиране.
1.5.5. Администриране на дозите
Тестваното вещество обикновено се дава със стомашна сонда, като се използва тръба или подходяща интубационна канюла, или чрез интраперитонеална инжекция. Други начини на експозиция биха били приемливи, ако могат да се обосноват. Максималният обем течност, който може да се вкара еднократно със стомашна сонда или инжекция, зависи от големината на опитното животно. Обемът не следва да превишава 2m1/100g телесно тегло. Обеми, по-високи от тези, следва да се обосноват. С изключение на дразнещи или корозивни вещества, които нормално дават изострящи ефекти при по-високи концентрации, варируемостта на тестовия обем следва да се сведе до минимум чрез регулиране на концентрацията с цел осигуряване на постоянен обем на всички нива на дозиране.
1.5.6. Подготовка на хромозомитe
Непосредствено след убиването на животните костният мозък се извлича, експонира се в хипотоничен разтвор и се фиксира. След това клетките се разнасят върху предметни стъкла и се оцветяват.
1.5.7. Анализ
Митотичният индекс следва да се определи като мярка на цитотоксичност в най-малко 1 000 клетки на едно животно за всички опитни животни (включително и положителните контроли) и животни, които не са подлагани на опити, с отрицателни контроли.
За всяко животно следва да се анализират най-малко 100 клетки. Този брой би могъл да се намали, когато се наблюдава висок брой аберации. Всички предметни стъкла, включително и тези на положителните и отрицателните контроли, следва да се кодират поотделно преди анализа под микроскоп. Тъй като процедурите по подготовка на предметно стъкло често водят до разкъсване на част от метафазите със загуба на хромозоми, отчетените клетки следва да съдържат известен брой центромери, равни на броя 2n ± 2.
2. ДАННИ
2.1. ОБРАБОТКА НА РЕЗУЛТАТИТЕ
Данните за всяко от животните следва да се представят в таблица. Експерименталната единица е животното. За всяко изследвано животно отделно се оценяват броят на отчетените клетки, броят на аберации на клетка и процентът на клетки със структурна(и) хромозомна(и) аберация(и). Следва да се показват различните типове структурни хромозомни аберации с броя и честотота им за групите, при които се извършват опити, и за контролните групи. Празнини се регистрират отделно и се докладват, но принципно не се включват в общата честота на аберациите. Ако няма факти за разлика в реакцията между половете, данните от двата пола могат да се комбинират за статистическия анализ.
2.2. ОЦЕНКА И ТЪЛКУВАНЕ НА РЕЗУЛТАТИТЕ
Има няколко критерия за определяне на положителен резултат, като например свързано с дозата увеличение в относителния брой на клетки с хромозомни аберации, или явно увеличение в броя на клетки с аберации в групата с еднократна доза и еднократно вземане на проба. Първо следва да се вземе предвид биологичната значимост на резултатите. Статистически методи може да се използват като помощно средство за оценката на резултатите от теста (6). Статистическата значимост не следва да е единственият решаващ фактор за положителна реакция. Двузначните резултати следва да се изяснят чрез още тестове, като за предпочитане е да се изменят условията на експеримента.
Увеличение в полоплоидията може да е показателно за това, че тестваното вещество има потенциала да индуцира геномни хромозомни аберации. Увеличение в ендоредупликацията може да показва, че тестваното вещество е в състояние да инхибира прогресията на клетъчния цикъл (7) (8).
Тествано вещество, за което резултатите не отговарят на горните критерии, се смята за немутагенно при настоящия тест.
Въпреки че повечето опити дават ясно положителни или отрицателни резултати, в редки случаи наборът данни изключва възможността да се направи категорична преценка за активността на тестваното вещество. Резултатите могат да останат неясни или под въпрос, независимо от това колко пъти е извършен опитът.
Положителните резултати от теста in vivo за хромозомни аберации показват, че тестваното вещество предизвиква структурни хромозомни аберации в костния мозък на тествания вид. Отрицателните резултати показват, че при условията за провеждане на теста тестваното вещество не предизвиква хромозомни аберации в костния мозък на тествания вид.
Следва да се обсъди вероятността тестваното вещество или метаболитите му да достигнат общото кръвообращение или по-конкретно тъканта, която е обект на тестването (напр. системна токсичност).
3. ДОКЛАДВАНЕ
3.1. ДОКЛАД ЗА ТЕСТА
Докладът за теста следва да включва следната информация:
|
|
Разтворител/носител:
|
—
|
обосновка за избора на носител,
|
|
—
|
разтворимост и стабилност на тестваното вещество в разтворител/носител, ако са известни.
|
|
|
|
Опитни животни:
|
—
|
брой, възраст и пол на животните,
|
|
—
|
източник, условия на отглеждане, начин на хранене и др.,
|
|
—
|
индивидуално тегло на животните в началото на теста, в т.ч. обхват на телесното тегло, средни стойности и стандартно отклонение за всяка група.
|
|
|
|
Условия за провеждане на теста:
|
—
|
положителни и отрицателни (носител/разтворител) контролни данни,
|
|
—
|
данни от изследването за установяване на обхват, ако е проведено,
|
|
—
|
основна причина за избора на нивото на дозата,
|
|
—
|
подробности за приготвянето на тестваното вещество,
|
|
—
|
подробности за администрирането на тестваното вещество,
|
|
—
|
основна причина за начина на администриране,
|
|
—
|
методи за проверка на достигането на тестваното вещество до общото кръвообращение или тъкан, която е обект на тестването, ако са приложими,
|
|
—
|
преминаване от концентрация (ррm) на тестваното вещество в храната/питейната вода към действителната доза (mg/kg телесно тегло), ако е приложимо,
|
|
—
|
подробности за качеството на храната и водата,
|
|
—
|
подробно описание на графиците на третиране и вземане на проби,
|
|
—
|
методи на измерване на токсичността,
|
|
—
|
идентичност на блокиращото метафазата вещество, концентрация и времетраене на третирането,
|
|
—
|
методи на приготвяне на предметно стъкло,
|
|
—
|
критерии за отчитане на аберации,
|
|
—
|
брой на анализирани клетки/животно,
|
|
—
|
критерии за определяне на изследванията като положителни, отрицателни или двузначни.
|
|
|
|
Резултати:
|
—
|
признаци на токсичност,
|
|
—
|
тип и брой на аберациите, дадени отделно за всяко животно,
|
|
—
|
общ брой на аберациите на група със средни стойности и стандартни отклонения,
|
|
—
|
брой клетки с аберации на група със средни стойности и стандартни отклонения,
|
|
—
|
изменения в полиплоидията, ако се наблюдават,
|
|
—
|
взаимоотношение доза/реакция, където е възможно,
|
|
—
|
статистически анализи, ако има такива,
|
|
—
|
паралелни отрицателни контролни данни,
|
|
—
|
исторически отрицателни данни от предишни изследвания с обхвати, средни стойности и стандартни отклонения,
|
|
—
|
паралелни положителни контролни данни.
|
|
|
|
Обсъждане на резултатите.
|
4. ПРЕПРАТКИ
|
(1)
|
Adler, I. D. (1984), Cytogenetic Tests in Mammals, w: Mutagenicity Testing: a Practical Approach, S. Venitt and J. M. Parry (eds), IRL Press, Oxford, Washington D.C., pp. 275—306.
|
|
(2)
|
Preston, R. J., Dean, B. J., Galloway, S., Holden, H., McFee, A. F. and Shelby, M. (1987), Mammalian In vivo Cytogenetic AssayS: Analysis of Chromosome Aberrations in Bone Marrow Cells, Mutation Res., 189, pp. 157—165.
|
|
(3)
|
Richold, M., Chandley, A., Ashby, J., Gatehouse, D. G., Bootman, J. and Henderson, L. (1990), In vivo Cytogenetic Assays, w: D. J. Kirkland (ed.), Basic Mutagenicity Tests, UKEMS Recommended Procedures. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Report, Part I revised, Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, pp. 115—141.
|
|
(4)
|
Tice, R. R., Hayashi, M., MacGregaro, J. T., Anderson, D., Blakey, D. H., Holden, H. E., Kirsch-Volders, M., Oleson Jr., F. B., Pacchierotti, F., Preston, R. J., Romagna, F., Shimada, H., Sutou, S. and Vannier, B. (1994), Report from the Working Group on the in Vivo Mammalian Bone Marrow Chromosomal Aberration Test, Mutation Res., 312, pp. 305—312.
|
|
(5)
|
Fielder, R. J., Allen, J. A., Boobis, A. R., Botham, P. A., Doe, J., Esdaile, D. J., Gatehouse, D. G., Hodson-Walker, G., Morton, D. B., Kirkland, D. J. and Richold, M. (1992), Report of British Toxicology Society/UK Environmental Mutagen Society Working Group: Dose setting in In Vivo Mutagenicity Assays, Mutagenesis, 7, pp. 313—319.
|
|
(6)
|
Lovell, D. P., Anderson, D., Albanese, R., Amphlett, G. E., Clare, G., Ferguson, R., Richold, M., Papworth, D. G. and Savage, J. R. K. (1989), Statistical Analysis of In Vivo Cytogenetic Assays, w: UKEMS Sub-Committee on Guidelines for Mutagenicity Testing, Report Part III. Statistical Evaluation of Mutagenicity Test Data, D. J. Kirkland (ed.) Cambridge University Press, Cambridge, pp. 184—232.
|
|
(7)
|
Locke-Huhle, C. (1983), Endoreduplication in Chinese hamster cells during alpha-radiation-induced G2 arrest, Mutation Res., 119, pp. 403—413.
|
|
(8)
|
Huang, Y., Change, C. and Trosko, J. E. (1983), Aphidicolin-induced endoreduplication in Chinese hamster cells, Cancer Res., 43, pp. 1362—1364.
|
Б.12. МУТАГЕННОСТ — IN VIVO МИКРОЯДРЕН ТЕСТ НА ЕРИТРОЦИТИ ОТ БОЗАЙНИЦИ
1. МЕТОД
Настоящият метод е изцяло подобен на микроядрен тест на еритроцити от бозайници на OECD TG 474 от 1997 г.
1.1. ВЪВЕДЕНИЕ
Микроядрен тест in vivo на еритроцити от бозайници се използва за откриване на увреждания, предизвиквани от тестваното вещество, на хромозомите или митотичния апарат на еритробласти чрез анализ на еритроцити, така както са взети като проби от клетки в костния мозък и/или периферната кръв на животни, обичайно гризачи.
Целта на микроядрения тест е да се идентифицират вещества, причиняващи цитогенно увреждане, което води до образуването на микроядра, съдържащи изоставащи хромозомни фрагменти или цели хромозоми.
Когато еритробласт на костен мозък се развие в полихроматичен еритроцит, главното ядро се екструдира, а всяко образувано вече микроядро може да изостане в иначе обезядрената цитоплазма. Онагледяването на микроядрата се улеснява в тези клетки, тъй като на тях им липсва главното ядро. Увеличаването на честотата на полихроматични еритроцити с микроядра в третираните животни е показател за индуцирано хромозомно увреждане.
В настоящия тест обикновено се използва костният мозък на гризачи, тъй като в тази тъкан се произвеждат полихроматични еритроцити. Измерването на незрели (полихроматични) еритроцити с микроядра в периферна кръв е еднакво приемливо във всеки вид, при който неспособността на далака да отстранява еритроцити с микроядра е изявена или който е показал адекватна чувствителност да открива агенти, причиняващи структурни или геномни хромозомни аберации. Микроядрата могат да бъдат разграничени чрез редица критерии. Те включват идентификация на наличието или отсъствието на кинетохорна или центромерна ДНК в микроядрата. Честотата на незрели (полихроматични) еритроцити с микроядра е главнита крайна точка. Броят на зрели (нормохроматични) еритроцити в периферната кръв, съдържащи микроядра измежду даден брой зрели еритроцити, може също да се използва като крайна точка за анализа на опита, когато животните се третират в продължение на четири или повече седмици.
Настоящият микроядрен тест in vivo на еритроцити от бозайници е особено важен за оценка на мутагенната опасност, поради това че дава възможност за разглеждане на фактори на процесите in vivo на метаболизма, фармакокинетиката и възстановителните процеси в ДНК, въпреки че те могат да варират според вида, тъканта и генетичните крайни точки. Анализ чрез тест in vivo е полезен и за по-нататъшното изследване на мутагенния ефект, установен чрез система in vitro.
Ако има доказателства, че тестваното вещество или реактивен метаболит няма да достигнат до тъкан, която е обект на анализ, не е подходящо да се използва настоящият тест.
Вижте също Общо въведение, част Б.
1.2. ДЕФИНИЦИИ
Цeнтромeра (Кинетохора): област(и) на хромозомата, с която(които) вретеновидни фибри се свързват по време на клетъчното деление, като така позволяват методично придвижване на дъщерните хромозоми към полюсите на дъщерните клетки.
Микроядра: малки ядра, отделни от главното ядро и в допълнение към него, на клетките, произведени по време на телофазата на митоза (мейоза) чрез изоставащи хромозомни фрагменти или цели хромозоми.
Нормохроматичен еритроцит: зрял еритроцит, на който му липсват рибозоми и може да бъде отличен от незрели, полихроматични еритроцити чрез оцветявания, селективни за рибозоми.
Полихроматичен еритроцит: незрял еритроцит в междинен етап на развитие, който все още съдържа рибозоми и следователно може да бъде отличен от зрели нормохроматични еритроцити чрез оцветявания, селективни за рибозоми.
1.3. ПРИНЦИП НА МЕТОДА НА ТЕСТА
Животните се експонират на въздействието на тестваното вещество по подходящ начин. Ако се използва костен мозък, животните се убиват в подходящи моменти след третирането, костният мозък се извлича, а препаратите се изготвят и оцветяват (1) (2) (3) (4) (5) (6) (7). Когато се използва периферна кръв, кръвта се взема в подходящи моменти след третирането, а препаратите за намазка се изготвят и оцветяват (4) (8) (9) (10). За опити с периферна кръв следва да мине възможно най-малко време между експозицията и обирането на реколтата от клетки. Препаратите се анализират за наличие на микроядра.
1.4. ОПИСАНИЕ НА МЕТОДА НА ТЕСТА
1.4.1. Подготовка
1.4.1.1. Подбор на животинския вид
Ако се използва костен мозък, препоръчват се мишки или плъхове, въпреки че всеки подходящ вид от бозайници би могъл да се използва. Когато се използва периферна кръв, препоръчват се мишки. Все пак всеки подходящ вид от бозайници би могъл да се използва, при условие че това е вид, в който далакът не отстранява еритроцити с микроядра, или вид, показал адекватна чувствителност за откриване на агенти, които причиняват структурни или геномни хромозомни аберации. За теста следва да се вземат общо използваните лабораторни щамове на млади, здрави животни. В началото на изследването вариациите в теглото на животните следва да са минимални и да не превишават ± 20 % от средното тегло на всеки пол.
1.4.1.2. Условия на отглеждане и хранене
Прилагат се общите условия в Общото въведение към част Б, въпреки че целта е влажността на въздуха да е 50—60 %.
1.4.1.3. Подготовка на животните
Здрави млади животни се отделят на произволен принцип за контролните и опитните групи. На животните се дава уникална идентифакация. Животните са аклиматизират към лабораторните условия поне пет дни. Клетките следва да се подредят така, че да се намалят до минимум евентуалните ефекти от разполагането им.
1.4.1.4. Приготвяне на дози
Твърдите вещества за теста следва да се разтворят или суспендират в подходящи разтворители или носители и, при необходимост, да се разредят преди даване на дозата на животните. Течните вещества за теста могат да се дозират директно или да се разредят преди дозиране. Следва да се използват пресни препарати на тестваното вещество, освен ако данните за устойчивостта му не показват, че може да се съхранява.
1.4.2. Условия за провеждане на теста
1.4.2.1. Разтворител/носител
Разтворителят/носителят не следва да има токсично въздействие при използваните нива на дозиране, а също така не следва да предизвиква съмнения за химическа реакция между него и тестваното вещество. Ако се използват други освен добре познатите разтворители/носители, включването им в теста следва да се подкрепи от данни за съвместимостта им. Препоръчва се, винаги когато е възможно, първо да се разглежда възможността за прилагането на воден разтворител/носител.
1.4.2.2. Контроли
Във всеки тест следва да се включват паралелни положителни и отрицателни (разтворител/носител) контроли за всеки пол. Като се изключи третирането с тестваното вещество, с животните в контролните групи следва да се борави по един и същи начин както с животните от групите, с които се извършват опити.
Положителните контроли следва да произвеждат микроядра in vivo при нива на експозиция, при които се очаква да се постигне забележимо увеличение спрямо съответния фон. Положителните контролни дози следва да са така избрани, че ефектите да са ясни, но да не разкриват непосредствено на четеца идентичността на кодираните предметни стъкла. Приемливо е положителните контроли да се администрират по различен начин от тестваното вещество и да им се взема проба само еднократно. Освен това за положителна контрола следва да се смята използването на химикали, принадлежащи към химичен клас, когато такива са налични. Примерите за положителни контролни вещества включват:
|
Вещество
|
САS №
|
ЕINECS №
|
|
Етил метансулфонат
|
62-50-0
|
200-536-7
|
|
N- етил -N-нитрозокарбамид
|
759-73-9
|
212-072-2
|
|
Митомицин С
|
50-07-7
|
200-008-6
|
|
Циклофосфамид
|
50-18-0
|
200-015-4
|
|
Циклофосфамид монохидрат
|
6055-19-2
|
|
|
Триетиленмеламин
|
51-18-3
|
200-083-5
|
За всяко вземане на проби следва да се включват отрицателните контроли, третирани само с разтворител или носител, а за всичко останало третирани както опитните групи, освен ако няма приемлива изменчивост между животните и честотите на клетки с микроядра са доказани с контролни данни от предишни изследвания. Ако за отрицателни контроли се прилага еднократно вземане на проби, най-подходящият момент е първият. Освен това следва също да се използват необработени контроли, освен ако няма контролни данни от предишни изследвания или публикувани контролни данни, които показват, че няма никакви вредни или мутагенни ефекти, предизвикани от избрания разтворител/носител.
Ако се използва периферна кръв, проба преди третирането може да е приемлива в качеството на паралелна отрицателна контрола, но само при кратките изследвания на периферна кръв (напр. 1—3 третирания), когато резултантните данни са в очаквания обхват за контрола от предишни изследвания.
1.5. ПРОЦЕДУРА
1.5.1. Брой и пол на животните
Всяка група за опити и всяка контролна група следва да включват поне пет анализируеми животни от един пол (11). Ако по времето на изследването има налични данни от изследвания на същия вид и чрез същия начин на експозиция, които показват, че няма значителни разлики между половете по отношение на токсичността, то тестването на един пол ще бъде достатъчно. Когато експозицията на хора спрямо химически вещества може да е в специфична зависимост от пола, като например с някои фармацевтични агенти, тестът следва да се проведе с животни от подходящия пол.
1.5.2. График на обработване
Не може да се препоръча стандартен график на обработване (т.е. едно, две или повече третирания на 24-часови интервали). Пробите от обширни режими на дози са приемливи, доколкото е демонстриран положителен ефект за настоящото изследване, или за изследване с отрицателен ефект, доколкото е демонстрирана токсичността или е използвана граничната доза и дозирането е продължило до времето на вземане на проба. Тестваните вещества могат също да се администрират като разделена доза, т.е. две третирания в един и същи ден, разделени от не повече от няколко часа, за да се улесни даването на голям обем материал.
Тестът може да се извърши по два начина:
|
а)
|
животните се третират веднъж с тестваното вещество. Проби от костен мозък се вземат най-малко два пъти, като се започне не по-рано от 24 часа след третирането, но не повече от 48 часа след третирането, на подходящи интервали между пробите. Вземането на проби по-рано от 24 часа след третирането следва да бъде обосновано. Проби от периферна кръв се вземат най-малко два пъти, като се започне не по-рано от 36 часа след третирането, на подходящи интервали след първото, но не повече от 72 часа. Когато се разпознае положителна реакция след едно вземане на проба, не се изисква допълнително вземане на проба;
|
|
б)
|
ако се прилагат две или повече обработвания на ден (напр. две или повече третирания на 24-часови интервали), следва да се вземат проби веднъж между 18-ия и 24-ия час след последното третиране за костния мозък и веднъж между 36-ия и 48-ия час след последното третиране за периферната кръв (12).
|
Когато е уместно, може да се използва друг график на вземане на проби.
1.5.3. Нива на дозиране
Ако се извършва изследване за обхват, поради това че няма в наличност подходящи данни, то следва да се извърши в същата лаборатория, като се използва същият вид, щам, пол и режим на третиране, който се използва и в главното изследване (13). Ако има токсичност, за първото вземане на проба се използват три нива на дозиране. Тези нива на дозиране следва да включват обхват от максимална до слаба токсичност или липса на токсичност. При вземане на проба на по-късен етап е необходимо да се прилага само най-високата доза. Най-високата доза се дефинира като доза, създаваща признаци на такава токсичност, че от по-високи нива на дозиране, базирани на същия режим, би могло да се очаква да доведат до леталност. Вещества със специфични биологични активности при ниски, нетоксични дози (като хормони и митогени) могат да бъдат изключения по отношение на критериите за определяне на дозата и следва да се оценяват за всеки конкретен случай. Най-високата доза може също да се дефинира като доза, която показва известни признаци на токсичност в костния мозък (напр. намаляване на съответната част от незрели еритроцити спрямо общия брой еритроцити в костния мозък или периферната кръв).
1.5.4. Граничен тест
Ако тест с едно ниво на дозиране от минимум 2 000 mg/kg телесно тегло при еднократно третиране или две третирания в един и същи ден не дава забележими токсични ефекти, а генотоксичност не би могла да се очаква на базата на данни от структурно свързани вещества, то тогава пълно изследване с три нива на дозиране може да не се смята за необходимо. За по-дълготрайни изследвания граничната доза е 2 000 mg/kg/телесно тегло/ден за период на третиране до 14 дни и 1 000 mg/kg/телесно тегло/ден за период на третиране, по-дълъг от 14 дни. Очакваната експозиция към хора може да покаже, че е необходимо в граничния тест да се използва по-високо ниво на дозиране.
1.5.5. Администриране на дозите
Тестваното вещество обикновено се дава със стомашна сонда, като се използва тръба или подходяща интубационна канюла, или чрез интраперитонеална инжекция. Други начини на експозиция биха били приемливи, ако могат да се обосноват. Максималният обем течност, който може да се вкара еднократно със стомашна сонда или инжекция, зависи от големината на опитното животно. Обемът не следва да превишава 2 ml/100g телесно тегло. Използването на обеми, по-големи от тези, следва да бъде обосновано. С изключение на дразнещи или корозивни вещества, които нормално дават изострящи ефекти при по-високи концентрации, променливостта на тестовия обем следва да се сведе до минимум чрез регулиране на концентрацията с цел осигуряване на постоянен обем на всички нива на дозиране.
1.5.6. Подготовка на костния мозък/кръвта
Клетките на костния мозък обичайно се вземат от бедрените кости или от тибиите (големите пищяли) непосредствено след убиването на животното. Според общоприетата практика клетките се изваждат от бедрените кости или от тибиите, подготвят се и се оцветяват по установените методи. Периферната кръв се взема от опашната вена или друг подходящ кръвоносен съд и незабавно се оцветява суправитално (8) (9) (10), или се приготвят препарати за намазка, след което се оцветяват. Използването на специфични оцветители за ДНК (напр. акридин оранжево (14) или Хьохст 33258 плюс пиронин-Y (15) може да елиминира някои от аретафктите, свързани с използването на оцветител, което не е специфично за ДНК. Това предимство не изключва използването на конвенционални багрила (напр. Гиемса). Могат също да се използват допълнителни системи (напр. целулозни колони за отстраняване на клетки с ядра (16), при условие че е доказано, че тези системи работят адекватно в лабораторното приготвяне на микроядра.
1.5.7. Анализ
Пропорцията на незрелите от общо (незрели + зрели) еритроцити се определя за всяко животно, като се отброяват общо най-малко 200 еритроцити за костен мозък и 1 000 еритроцити за периферна кръв (17). Всички предметни стъкла, включително и тези за положителни и отрицателни контроли, следва да се кодират поотделно преди анализа под микроскоп. Най-малко 2 000 незрели еритроцити на животно се изследват за разпространението на незрели еритроцити с микроядра. Допълнителна информация може да се получи чрез изследване на зрели еритроцити за микроядра. Когато се анализират предметни стъкла, пропорцията незрели от общия брой еритроцити не следва да е по-малко от 20 % от контролната стойност. Когато животните се третират непрекъснато в течение на четири или повече седмици, най-малко 2 000 зрели еритроцити на животно могат също да се изследват за разпространението на микроядра. Приемливи алтернативи на ръчния анализ са системите за автоматизиран анализ (анализ на изображението и поточен цитометричен анализ на клетъчни суспензии), ако са подходящо обосновани и валидирани.
2. ДАННИ
2.1. ОБРАБОТКА НА РЕЗУЛТАТИТЕ
Индивидуалните данни за животните следва да се представят в таблица. Експерименталната единица е животното. За всяко изследвано животно следва да се дават отделно броят на отчетените незрели еритроцити, броят на незрелите еритроцити с микроядра и броят на незрелите спрямо общото количество на еритроцитите. Когато животните се третират непрекъснато в течение на четири или повече седмици, данни за зрелите еритроцити следва също да се дадат, ако са събрани. Пропорцията на незрелите спрямо общия брой на еритроцитите и, ако се смята за приложимо, процентът на еритроцитите с микроядра, се посочва за всяко животно. Ако няма факти за разлика в реакцията между половете, данните от двата пола могат да се комбинират за статистическия анализ.
2.2. ОЦЕНКА И ТЪЛКУВАНЕ НА РЕЗУЛТАТИТЕ
Има няколко критерия за определяне на положителен резултат, като свързано с дозата увеличение на броя клетки с микроядра или явно увеличение на броя клетки с микроядра в група с еднократна доза и еднократно вземане на проба. Първо следва да се разгледа биологичната значимост на резултатите. При оценката на резултатите от теста като помощно средство може да се използват статистически методи (18) (19). Статистическата значимост не следва да е единственият решаващ фактор за положителна реакция. Двузначните резултати следва да се изяснят чрез допълнително тестване, като за предпочитане е да се изменят условията на експеримента.
Тествано вещество, за което резултатите не отговарят на горните критерии, се смята за немутагенно при настоящия тест.
Въпреки че повечето експерименти дават ясно положителни или отрицателни резултати, в редки случаи наборът данни изключва възможността да се направи категорична преценка за активността на тестваното вещество. Резултатите могат да останат двузначни или под въпрос, независимо от това колко пъти е повторен опитът.
Положителните резултати в микронуклеарния тест показват, че веществото индуцира микроядра, които са резултат от хромозомно увреждане или увреждане на митотичния апарат в еритробластите на опитния вид. Отрицателните резултати показват, че при условията за провеждане на теста тестваното вещество не създава микроядра в незрелите еритроцити на тествания вид.
Следва да се обсъди вероятността тестваното вещество или метаболитите му да достигнат общото кръвообращение или конкретно тъканта, която е обект на изследване (напр. системна токсичност).
3. ДОКЛАДВАНЕ
ДОКЛАД ЗА ТЕСТА
Докладът за теста следва да включва следната информация:
|
|
Разтворител/носител:
|
—
|
обосновка за избора на носител,
|
|
—
|
разтворимост и стабилност на тестваното вещество в разтворител/носител, ако са известни.
|
|
|
|
Опитни животни:
|
—
|
брой, възраст и пол на животните,
|
|
—
|
източник, условия на отглеждане, начин на хранене и др.,
|
|
—
|
индивидуално тегло на животните в началото на теста, в т.ч. обхват на телесното тегло, средни стойности и стандартно отклонение за всяка група.
|
|
|
|
Условия за провеждане на теста:
|
—
|
положителни и отрицателни (носител/разтворител) контролни данни,
|
|
—
|
данни от изследването за установяване на обхват, ако е проведено,
|
|
—
|
основна причина за избора на нивото на дозата,
|
|
—
|
подробности за приготвянето на тестваното вещество,
|
|
—
|
подробности за администрирането на тестваното вещество,
|
|
—
|
основна причина за начина на администриране,
|
|
—
|
методи за проверка на достигането на тестваното вещество до общото кръвообращение или прицелната тъкан, ако са приложими,
|
|
—
|
преминаване от концентрация (ррm) на тестваното вещество в храната/питейната вода към действителната доза (mg/kg телесно тегло), ако е приложимо,
|
|
—
|
подробности за качеството на храната и водата,
|
|
—
|
подробно описание на графиците на третиране и вземане на проби,
|
|
—
|
методи на приготвяне на предметно стъкло,
|
|
—
|
методи на измерване на токсичността,
|
|
—
|
критерии за отчитане на незрели еритроцити,
|
|
—
|
брой на анализирани клетки/животно,
|
|
—
|
критерии за отчитане на изследванията като положителни, отрицателни или двузначни.
|
|
|
|
Резултати:
|
—
|
признаци на токсичност,
|
|
—
|
пропорция на незрелите еритроцити от общия брой еритроцити,
|
|
—
|
брой на незрелите еритроцити с микроядра, посочен отделно за всяко животно,
|
|
—
|
средна стойност ± стандартно отклонение на незрелите еритроцити с микроядра на група,
|
|
—
|
взаимоотношение доза/реакция, където е възможно,
|
|
—
|
статистически анализи, ако има такива,
|
|
—
|
паралелни отрицателни данни и отрицателни данни от предишни изследвания,
|
|
—
|
паралелни положителни контролни данни.
|
|
|
|
Обсъждане на резултатите.
|
4. ПРЕПРАТКИ
|
(1)
|
Heddle, J. A. (1973), A Rapid In Vivo Test for Chromosomal Damage, Mutation Res., 18, pp. 187—190.
|
|
(2)
|
Schmid, W. (1975), The Micronucleus Test, Mutation Res., 31, pp. 9—15.
|
|
(3)
|
Heddle, J. A., Salamone, M. F., Hite, M., Kirkhart, B., Mavournin, K., MacGregor, J. G. and Newell, G. W. (1983), The Induction of Micronuclei as a Measure of Genotoxicity, Mutation Res. 123,pp. 61—118.
|
|
(4)
|
Mavournin, K. H., Blakey, D. H., Cimino, M. C, Salamone, M. F. and Heddle, J. A. (1990), The In Vivo Micronucleus Assay in Mammalian Bone Marrow and Peripheral Blood. A report of the U.S. Environmental Protection Agency Gene-Tox Program, Mutation Res., 239, pp. 29—80.
|
|
(5)
|
MacGregor, J. T., Schlegel, R., Choy, W. N. and Wehr, C. M. (1983), Micronuclei in Circulating ErythrocyteS: A Rapid Screen for Chromosomal Damage During Routine Toxicity Testing in Mice, w: Developments in Science and Practice of Toxicology, ed. A. W. Hayes, R. C. Schnell and T. S. Miya. Elsevier, Amsterdam, pp. 555—558.
|
|
(6)
|
MacGregor, J. T., Heddle, J. A. Hite, M., Margolin, G. H., Ramel, C, Salamone, M. F., Tice, R. R., and Wild, D. (1987), Guidelines for the Conduct of Micronucleus Assays in Mammalian Bone Marrow Erythrocytes, Mutation Res., 189, pp. 103—112.
|
|
(7)
|
MacGregor, J. T., Wehr, C. M., Henika, P. R. and Shelby, M. E. (1990), The in vivo Erythrocyte Micronucleus Test: Measurement at Steady State Increases Assay Efficiency and Permits Integration with Toxicity Studies, Fund. Appl. Toxicol. 14, pp. 513 —522.
|
|
(8)
|
Hayashi, M., Morita, T., Kodama, Y., Sofumi, T. and Ishidate, M. Jr. (1990), The Micronucleus Assay with Mouse Peripheral Blood Reticulocytes Using Acridine Orange-Coated Slides, Mutation Res., 245, pp. 245—249.
|
|
(9)
|
The Collaborative Study Group for the Micronucleus Test (1992). Micronucleus Test with Mouse Peripheral Blood Erythrocytes by Acridime Orange Supravital Staining: The Summary Report of the 5th Collaborative Study by CSGMT/JEMMS, MMS, Mutation Res., 278, pp. 83—98.
|
|
(10)
|
The Collaborative Study Group for the Micronucleus Test (CSGMT/JEMMS, MMS: The Mammalian Mutagenesis Study Group of the Environmental Mutagen Society of Japan) (1995), Protocol recommended for the short-term mouse peripheral blood micronucleus test, Mutagenesis, 10, pp. 53—159.
|
|
(11)
|
Hayashi, M., Tice, R. R., MacGregor, J. T., Anderson, D., Blackey, D. H., Kirsch-Volders, M., Oleson, Jr. F. B., Pacchicrotti, F., Romagna, F., Shimada, H. Sutou, S. and Vannier, B. (1994), in Vivo Rodent Erythrocyte Micronucleus Assay, Mutation Res., 312, pp. 293—304.
|
|
(12)
|
Higashikuni, N. and Sutou, S. (1995), An optimal, generalised sampling time of 30 ± 6 h after double dosing in the mouse peripheral micronucleus test, Mutagenesis, 10, pp. 313—319.
|
|
(13)
|
Fielder, R. J., Allen, J. A., Boobis, A. R., Botham, P. A., Doe, J., Esdaile, D. J., Gatehouse, D. G., Hodson-Walker, G., Morton, D. B., Kirkland, D. J. and Rochold, M. (1992), Report of British Toxicology Society/UK Environmental Mutagen Society Working Group: Dose Setting in In Vivo Mutagenicity Assays, Mutagenesis, 7, pp. 313—319.
|
|
(14)
|
Hayashi, M., Sofumi, T. and Ishidate, M. Jr. (1983), An Application of Acridine Orange Fluorescent Staining to the Micronucleus Test, Mutation Res., 120, pp. 241—247.
|
|
(15)
|
MacGregor, J. T., Wehr, C. M. and Langlois, R. G. (1983), A Simple Fluorescent Staining Procedure for Micronuclei and RNA in Erythrocytes Using Hoechst 33258 and Pyromin Y, Mutation Res., 120, pp. 269—275.
|
|
(16)
|
Romagna, F. and Staniforth, C. D. (1989), The automated bone marrow micronucleus test, Mutation Res., 213, pp. 91—104.
|
|
(17)
|
Gollapudi, B. and McFadden, L. G. (1995), Sample size for the estimation of polychromatic to normochromatic erythrocyte ratio in the bone marrow micronucleus test, Mutation Res., 347, pp. 97—99.
|
|
(18)
|
Richold, M., Ashby, J., Bootman, J., Chandley, A., Gatehouse, D. G. and Henderson, L. (1990), In Vivo Cytogenetics Assay, w: D. J. Kirkland (ed.), Basic Mutagenicity tests, UKEMS Recommended Procedures, UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Report, Part 1, revised, Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, pp. 115—141.
|
|
(19)
|
Lovell, D. P., Anderson, D., Albanese, R., Amphlett, G. E., Clare, G., Ferguson R., Richold, M., Papworth, D. G. and Savage, J. R. K. (1989), Staticical Analysis of In Vivo Cytogenetic Assays, w: D. J. Kirkland (ed.), Statistical Evaluation of Mutagenicity Test Data. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Report, Part III, Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, pp. 184—232.
|
Б.13/14. МУТАГЕННОСТ — БАКТЕРИИ ЗА ТЕСТВАНЕ НА ОБРАТНИ МУТАЦИИ
1. МЕТОД
Настоящият метод е изцяло подобен на бактериалния тест за обратни мутации на ОECD TG 471 от 1997 г.
1.1. ВЪВЕДЕНИЕ
Бактериалният тест за обратни мутации използва изискващи аминокиселина щамове на Salmonella typhimurium и на Escherichia coli, за да се открият точкови мутации, състоящи се в заместване, добавяне или делеция на една или няколко ДНК базови двойки (1) (2) (3). Принципът на настоящия бактериален тест за обратни мутации се състои в това, че той открива мутации, които обръщат мутациите, налични в тестваните щамове, и възстановяват функционалните способности на бактериите да синтезират основна аминокиселина. Ревертантните бактерии се откриват по способността им да растат при отсъствието на аминокиселина, изисквана от родителския тестван щам.
Точковите мутации са причината за много човешки генетични заболявания и има фактически доказателства, че точковите мутации в онкогени и туморопотискащи гени на соматични клетки участват в образуването на тумори у хора и експериментални животни. Бактериалният тест за обратни мутации е бърз, евтин и относително лесен за провеждане. Много от тестваните щамове имат няколко характеристики, които ги правят по-чувствителни за откриване на мутации, включително реагиращи секвенции на ДНК в положение на реверсия, повишена клетъчна пропускливост към големи молекули и елиминиране на системи за репарация на ДНК или увеличаването на репарационните процеси на ДНК, при които са възможни грешки. Специфичността на тестваните щамове може да даде полезна информация за типовете мутации, които се индуцират от генотоксични агенти. За бактериалните тестове за обратни мутации съществува огромна база данни с резултати за голямо разнообразие от структури, а също така са разработени и добре установени методологии за тестване на химикали с различни физикохимични свойства, в т.ч. летливи съединения.
Вижте също Общо въведение, част Б.
1.2. ДЕФИНИЦИИ
Тест за обратни мутации в Salmonella typhimurium или Escherichia coli открива мутация в нуждаещия се от аминокиселина щам (съответно хистидин или триптофан), за да се получи независим от външна доставка на аминокиселина щам.
Мутагени — заместители на основна двойка, са агенти, причиняващи основна промяна в ДНК. В реверсивен тест тази промяна може да възникне от страната на първоначалната мутация или от втора страна в бактериалния геном.
Фреймшифт мутагени са агенти, предизвикващи добавянето или делецията на една или повече основни двойки в ДНК, като по този начин се променя четящата рамка в РНК.
1.3. НАЧАЛНИ СЪОБРАЖЕНИЯ
Бактериалният тест за обратни мутации използва прокариотни клетки, които се различават от клетките на бозайниците по фактори, като поглъщане, метаболизъм, хромозомна структура и ДНК репарационни процеси. Провежданите тестове in vitro по принцип изискват използването на екзогенен източник на метаболична активация. Системите in vitro за метаболична активация не могат изцяло да имитират условията in vivo на бозайниците. Следователно тестът не осигурява пряка информация за мутагенната и канцерогенната сила на дадено вещество при бозайници.
Бактериалният тест за обратни мутации обикновено се използва като първоначално откриване на генотоксична дейност, и в частност на дейност, индуцираща точкова мутация. Обширна база данни е показала, че много химикали, които са положителни при настоящия тест, също проявяват мутагенна активност при други тестове. Има примери за мутагенни агенти, които не се откриват с настоящия тест; причините за тези недостатъци могат да се припишат на специфичното естество на установената крайна точка, разлики в метаболичната активация или разлики в бионаличността. От друга страна, факторите, които подобряват чувствителността на бактериалния тест за обратни мутации, могат да доведат до надценяване на мутагенна активност.
Бактериалният тест за обратни мутации може да не е подходящ за оценката на някои класове химични вещества, например някои съединения с високо бактерицидно съдържание (напр. някои антибиотици) и тези, за които се смята (или се знае), че си взаимодействат конкретно със системата на клетъчна репликация у бозайниците (напр. някои инхибитори на топоизомеразата и някои нуклеозидни аналози). В подобни случаи може би по-подходящи са тестовете за мутации при бозайници.
Въпреки че много съединения, които са положителни в настоящия тест, са канцерогени за бозайниците, съответствието не е абсолютно. То зависи от химичния клас, а има канцерогени, които не се откриват с настоящия тест, тъй като те действат чрез други, негенотоксични механизми или механизми, които не се срещат в бактериалните клетки.
1.4. ПРИНЦИП НА МЕТОДА НА ТЕСТА
Суспензии на бактериални клетки се експонират на въздействието на тестваното вещество с наличие и отсъствие на система за екзогенна метаболична активация. При метода с посяване на блюдо тези суспензии се смесват с пласт от агар и незабавно се посяват в блюдо върху минимална среда. При метода с предварително инкубиране сместа за обработване се инкубира и след това се смесва с пласт от агар, преди да се посее в блюдо върху минимална среда. При двата метода след два или три дни инкубация се преброяват ревертантните колонии и се сравняват с броя на спонтанни ревертантни колонии в контролни плочки с разтворител.
Описани са няколко процедури за провеждането на бактериалния тест за обратни мутации. Измежду най-често използваните са методът с посяване в блюдо (1) (2) (3) (4), прединкубационният метод (2) (3) (5) (6) (7) (8), флуктуационният метод (9) (10) и суспензионният метод (11). Описани са и модификации за тестване на газове или пари (12).
Описаните в метода процедури се отнасят главно за метода с посяване в блюдо и прединкубационния метод. Който и да е от тях е приемлив за провеждане на опити както със, така и без метаболична активация. Някои вещества могат да се открият по-ефикасно, като се използва прединкубационният метод. Тези вещества принадлежат към химични класове, включващи алифатни нитрозамини с къси вериги, двувалентни метали, алдехиди, азо багрила и диазо съединения, пиролизидинови алкалоиди, алилни съединения и нитросъединения (3). Признава се също, че някои класове мутагени не винаги се откриват със стандартните процедури, като метода на посяване в блюдо или прединкубационния метод. Те следва да се смятат за „специални случаи“ и силно се препоръчва за откриването им да се използват други процедури. Следните „специални случаи“ биха могли да бъдат идентифицирани (заедно с примери за процедурите, които биха могли да се използват за откриването им): азо багрила и диазо съединения (3) (5) (6) (13), газове и летливи химикали (12) (14) (15) (16) и гликозиди (17) (18). Отклонение от стандартната процедура следва да бъде научно обосновано.
1.5. ОПИСАНИЕ НА МЕТОДА НА ТЕСТА
1.5.1. Подготовка
1.5.1.1. Бактерии
Свежи бактериални култури следва да се отглеждат до късната експоненциална или ранна стационарна фаза на растеж (приблизително 109 клетки на ml). He следва да се използват култури в късна стационарна фаза. От първостепенна важност е културите, използвани в опита, да съдържат висок титър жизнеспособни бактерии. Титърът може да се илюстрира с контролни данни от предишни изследвания за кривите на растежа или във всеки анализ на опита чрез определяне количествата на жизнеспособни клетки чрез експеримент с посев в блюдо.
Препоръчителната температура на инкубация е 37 oС.
Следва да се използват най-малко пет бактериални щама. Те включват четири щама на Salmonella typhimurium (TA 1535; TA 1537 или TA97a или TA97; TA98; и TA100), които са показали, че са надеждни и репродуктивно реагиращи между лабораториите. Тези четири щама на Salmonella typhimurium имат GC основни двойки на главната реверсивна страна и е известно, че те не биха могли да открият някои оксидиращи мутагени, напречно свързващи се агенти и хидразини. Подобни вещества могат да се открият с щамове на Escherichia coli WP2 или Salmonella typhimurium TA102 (19), които имат AT основна двойка на главната реверсивна страна. Следователно препоръчителната комбинация от щамове е:
|
—
|
Salmonella typhimurium TA1535, и
|
|
—
|
Salmonella typhimurium TA1537 или TA97 или TA97a, и
|
|
—
|
Salmonella typhimurium TA98, и
|
|
—
|
Salmonella typhimurium TA100, и
|
|
—
|
Escherichia coli WP2 uvrA, или Escherichia coli WP2 uvrA (pKM101), или Salmonella typhimurium TA102.
|
За да се открият напречно свързващи се мутагени, може би е за предпочитане да се включи ТА102 или да се добави щам of Escherichia coli с изобилие от ДНК репарации (напр. Escherichia coli WP2 или Escherichia coli WP2 (pKM101).
Следва да се използват установените процедури за приготвяне на изходна култура, проверка на маркера и съхранение. Следва да се посочи необходимата за растеж аминокиселина за приготвянето на всяка замразена изходна култура (хистидин за щамове на Salmonella typhimurium и триптофан за щамове на Escherichia coli). По аналогичен начин следва да се проверят други фенотипни характеристики, а именно: наличието или отсъствието на плазмиди на R-фактор, при необходимост (т.е. устойчивост на ампицилин в щамовете ТА98, ТА100 и ТА97а или ТА97, WP2 uvrA и WP2 uvrA (pKM101), и устойчивост на ампицилин + тетрациклин в щам ТА 102); наличието на характерни мутации (т.е. rfa мутация в Salmonella typhimurium чрез чувствителност към кристално виолетово, и uvrA мутация в Escherichia coli или uvrB мутация в Salmonella typhimurium чрез чувствителност към ултравиолетова светлина) (2) (3). Щамовете следва също така да произвеждат спонтанни ревертантни колонии в блюдо в рамките на честотните обхвати, които се очакват от контролните данни, получени от предишни изследвания в лабораторията и, за предпочитане, в обхвата, описан в литературата.
1.5.1.2. Среда
Използва се подходящ минимален агар (напр. съдържащ минимална среда Е на Фьогел-Бонер и глюкоза), и пласт от агар, съдържащ хистидин и биотин или триптофан, за да се получат няколко клетъчни деления (1) (2) (9).
1.5.1.3. Метаболична активация
Бактериите следва да се ескпонират на тестваното вещество, както при наличие, така и при липса на подходяща система за метаболична активация. Най-често използваната система е постмитохондрична фракция (S9) с добавка на ко-фактор, приготвена от черните дробове на гризачи, третирани с ензимно-индуциращи реактиви. като Ароклор 1254 (1) (2) или смес от фенобарбитон и ß-нафтофлавон (18) (20) (21). Постмитохондричната фракция обичайно се използва с концентрации в обхвата от 5 до 30 % v/v в сместа S9. Изборът и състоянието на системата за метаболична активация може да зависи от класа на тествания химикал. В някои случаи е подходящо да се използва повече от една концентрация на постмитохондрична фракция. За азо багрила и диазо съединения може да е по-подходяща редуцираща система за метаболична активация (6) (13).
1.5.1.4. Тествано вещество/приготвяне
Твърдите вещества за теста следва да се разтворят или суспендират в подходящи разтворители или носители и, при необходимост, да се разредят преди третиране на клетките. Течните вещества за теста могат да се добавят директно към системите за тестване и/или да се разредят преди третиране. Следва да се използват пресни препарати на тестваното вещество, освен ако данните за устойчивостта му не показват, че може да се съхранява.
Не следва да има съмнения за химическа реакция на разтворителя/носителя с тестваното вещество и той следва да е съвместим с оцеляването на бактериите и активността на S9 (22). Ако се използват други освен добре познатите разтворители/носители, включването им в теста следва да се подкрепи от данни за съвместимостта им. Препоръчва се, винаги когато е възможно, първо да се разглежда възможността за прилагането на воден разтворител/носител. При тестването на вещества, нестабилни във вода, използваните органични разтворители не следва да съдържат вода.
1.5.2. Условия за провеждане на теста
1.5.2.1. Тествани щамове (вж. 1.5.1.1)
1.5.2.2. Концентрация на експозиция
Измежду критериите, които следва да се вземат предвид при определянето на най-високото количество на тестваното вещество, са цитотоксичността и разтворимостта в окончателната смес за третиране.
Полезно би било да се определят токсичността и неразтворимостта в предварителен опит. Цитотоксичността може да се открие чрез намаляване на броя на ревертантните колонии, почистване или намаляване на фона, или степента на оцеляване на третираните култури. Цитотоксичността на едно вещество може да се промени в присъствието на системи за метаболична активация. Неразтворимостта следва да се оценява като утаяване в крайната смес при реални условия за провеждане на теста и е видима с просто око.
Препоръчителната максимална тестова концентрация за разтворими нецитотоксични вещества е 5 mg/блюдо или 5 μl/блюдо. За нецитотоксични вещества, които не са разтворими при 5 mg/блюдо или 5 μl/блюдо, една или повече тествани концентрации следва да са неразтворими в крайната смес за третиране. Тествани вещества, които вече са цитотоксични под 5 mg/блюдо или 5 μl/блюдо, следва да се тестват до границата на цитотоксична концентрация. Преципитатът не следва да влияе на отчитането.
Използват се най-малко пет различни, даващи възможност за анализ концентрации на тестваното вещество на приблизително полулогаритмични (т.e. √10) интервали между тестваните точки за начален опит. Могат да бъдат подходящи и по-малки интервали, когато се изследва реакция на концентрация. Тестване над концентрацията от 5 mg/блюдо или 5 μl/блюдо може евентуално да се извършва, когато се изследват вещества, съдържащи значителни количества потенциално мутагенни примеси.
1.5.2.3. Отрицателни и положителни контроли
Във връзка с анализа на всеки отделен опит следва да се включват паралелни положителни и отрицателни (разтворител или носител) контроли със специфичен щам, както със, така и без метаболична активация. Следва да се избират положителните контролни концентрации, показващи ефективно провеждане на всеки опит.
За тестове със система за метаболична активация референтното(ите) вещество(а) за положителни контроли се избира(т) въз основа на вида на използваните бактериални щамове.
Следните вещества са примери за подходящи положителни контроли за тестове с метаболична активация:
|
CAS №
|
EINECS №
|
Вещество
|
|
781-43-1
|
212-308-4
|
9,10-диметилантрацен
|
|
57-97-6
|
200-359-5
|
7,1 2-диметилбенз[а]антрацен
|
|
50-32-8
|
200-028-5
|
бензо[а]пирен
|
|
613-13-8
|
210-330-9
|
2-аминоантрацен
|
|
50-18-0
|
|
циклофосфамид монохидрат
|
|
6055-19-2
|
200-015-4
|
циклофосфамид
|
Следното вещество е подходяща положителна контрола за метода с редуцираща метаболична активация:
|
CAS №
|
EINECS №
|
Вещество
|
|
573-58-0
|
209-358-4
|
конгочервено
|
Не следва да се използва 2-аминоантрацен като единствен показател за ефикасността на сместа S9. Ако се използва 2-аминоантрацен, всяка партида от S9 следва също да се характеризира с мутаген, изискващ метаболична активация от микрозомни ензими, напр., бензо[а]пирен, диметилбензантрацен.
Следните вещества са примери на специфични по щам положителни контроли за тестове без система за екзогенна метаболична активация:
|
CAS №
|
EINECS №
|
Вещество
|
Щам
|
|
26628-22-8
|
247-852-1
|
натриев азид
|
TA 1535 и TA 100
|
|
607-57-8
|
210-138-5
|
2-нитрофлуорен
|
TA 98
|
|
90-45-9
|
201-995-6
|
9-амноакридин
|
TA 1537, TA 97 и TA 97a
|
|
17070-45-0
|
241-129-4
|
ICR 191
|
TA 1537, TA 97 и TA 97a
|
|
80-15-9
|
201-254-7
|
кумол хидроперокисид
|
TA 102
|
|
50-07-7
|
200-008-6
|
митомицин С
|
WP2 uvrA и TA 102
|
|
70-25-7
|
200-730-1
|
N-eтил-N-нитpo-N-нитрозогуанидин
|
WP2, WP2uvrA и WP2uvrA (pKM101)
|
|
56-57-5
|
200-281-1
|
4-нитрохинолин-1-оксид
|
WP2, WP2uvrA и WP2uvrA (pKM101)
|
|
3688-53-7
|
|
фурилфурамид (AF2)
|
щамове, съдържащи плазмид
|
Могат да се използват други референтни вещества за положителни контроли. За положителна контрола следва да се разглежда използването на химикали, принадлежащи към химичен клас, когато такива са налични.
Следва да бъдат включени отрицателните контроли, състоящи се само от разтворител или носител в средата за третиране, и третирани по същия начин както опитните групи. В допълнение към това следва също да се използват нетретирани контроли, освен ако няма исторически контролни данни от предишни изследвания, показващи, че избраният разтворител не причинява вредни или мутагенни ефекти.
1.5.3. Процедура
При метода на посяване в блюдо (1) (2) (3) (4) без метаболична активация се смесват обичайно 0,05 ml или 0,1 ml тестовите разтвори, 0,1 ml свежа бактериална култура (съдържаща около 108 жизнеспособни клетки) и 0,5 ml стерилен буфер с 2,0 ml слой от агар. За тест с метаболична активация се смесват обикновено 0,5 ml от сместа за метаболична активация, съдържаща адекватно количество постмитохондрична фракция (в границите от 5 до 30 % v/v в сместа за метаболична активация), със слой от агар (2,0 ml) заедно с бактериите и тестваното вещество/тестван разтвор. Съдържанието на всяка епруветка се смесва и изсипва върху повърхността на блюдо с минимален агар. Слоят от агар се оставя да се втвърди преди инкубацията.
При прединкубационния метод (2) (3) (5) (6) тестваното вещество/тестваният разтвор се инкубира предварително с тествания щам (съдържащ около 108 жизнеспособни клетки) и стерилен буфер или система за метаболична активация (0,5 ml) обичайно за 20 или повече минути при 30—37 oС преди смесването със слоя от агар и изливането върху повърхността на блюдо с минимален агар. Обикновено 0,05 или 0,1 ml от тестваното вещество/тестван разтвор, 0,1 ml бактерии и 0,5 ml от S9 или стерилен буфер се смесват с 2,0 ml слой от агар. Епруветките се аерират по време на предварителната инкубация с шейкър.
За адекватна оценка на променливостта при всяко ниво на дозиране се използват по три блюда. Използването на две блюда е приемливо, когато е научно обосновано. Загубата по невнимание на блюдо не обезсилва опита по необходимост.
Газообразни или летливи вещества се изпитват чрез подходящи методи, като например в запечатани съдове (12) (14) (15) (16).
1.5.4. Инкубация
Всички блюда на даден тест се инкубират при 37oС за 48—72 часа. След инкубационния период се преброяват ревертантните колонии на блюдо.
2. ДАННИ
2.1. ОБРАБОТКА НА РЕЗУЛТАТИТЕ
Данните се представят като брой ревертантни колонии на блюдо. Също се дава броят ревертантни колонии както върху блюдата за отрицателни (контрола на разтворител и нетретирана контрола, ако се използва), така и за положителните контроли. Представят се броят на отделните блюда, средният брой ревертантни колонии на блюдо и стандартното отклонение за тестваното вещество и положителните и отрицателните (третирани и/или разтворител) контроли.
Няма изискване за потвърждаване на явно положителна реакция. Резултатите, които не са категорични, следва да се изяснят с още тестове, като за предпочитане е да се изменят условията на експеримента. Отрицателните резултати следва да се потвърдят за всеки случай поотделно. В случаите, когато не се смята необходимо потвърждаването на отрицателни резултати, следва да се даде обосновка. Изменението на параметрите на изследването с цел разширяване на обхвата на оценяваните условия следва да се вземе под внимание при следващите експерименти. Параметрите на изследването, които биха могли да се променят, включват границите на концентрацията, метода на третиране (посев върху блюдо или течна прединкубация) и условията на метаболична активация.
2.2. ОЦЕНКА И ТЪЛКУВАНЕ НА РЕЗУЛТАТИТЕ
Има няколко критерия за определяне на положителен резултат, като например увеличение на концентрацията спрямо тествания обхват и/или репродуцируемо увеличение при една или повече концентрации на броя на ревертантни колонии на блюдо в поне един щам със или без система за метаболична активация (23). Първо следва да се разгледа биологичната значимост на резултатите. При оценката на резултатите от теста биха могли да се използват статистически методи (24). Статистическата значимост не следва да е единственият решаващ фактор за положителна реакция.
Тествано вещество, за което резултатите не отговарят на горните критерии, се смята за немутагенно в настоящия тест.
Въпреки че повечето експерименти дават ясно положителни или отрицателни резултати, в редки случаи наборът данни изключва възможността да се направи категорична преценка за активността на тестваното вещество. Резултатите могат да останат двусмислени или под въпрос, независимо от това колко пъти е повторен опитът.
Положителните резултати от бактериалния тест за обратни мутации показват, че веществото индуцира точкови мутации чрез заместване на бази или фреймшифтове в генома на Salmonella typhimurium и/или Escherichia соli. Отрицателните резултати показват, че при условията за провеждане на теста тестваното вещество не е мутагенно в тествания вид.
3. ДОКЛАДВАНЕ
ДОКЛАД ЗА ТЕСТА
Докладът за теста следва да включва следната информация:
|
|
Разтворител/носител:
|
—
|
обосновка за избора на носител,
|
|
—
|
разтворимост и стабилност на тестваното вещество в разтворител/носител, ако са известни.
|
|
|
|
Щамове:
|
—
|
брой на клетки на култура,
|
|
—
|
характеристики на щама.
|
|
|
|
Условия за провеждане на теста:
|
—
|
количество тествано вещество на блюдо (mg/блюдо или μl/блюдо) c основна причина за избора на доза и брой на блюдата на концентрация,
|
|
—
|
тип и състав на системата за метаболична активация, в т.ч. критерии за приемливост,
|
|
—
|
процедури на третиране.
|
|
|
|
Резултати:
|
—
|
признаци на токсичност,
|
|
—
|
среден брой на ревертантните колонии на блюдо и стандартно отклонение,
|
|
—
|
взаимоотношение доза-реакция, където е възможно,
|
|
—
|
статистическа оценка, ако има такава,
|
|
—
|
паралелни отрицателни (разтворител/носител) и положителни контролни данни с обхват, средни стойности и стандартни отклонения,
|
|
—
|
—отрицателни (разтворител/носител) и положителни контролни данни от предишни изследвания, с обхват, средни стойности и стандартни отклонения.
|
|
|
|
Обсъждане на резултатите.
|
4. ПРЕПРАТКИ
|
(1)
|
Ames, B. N., McCann, J. and Yamasaki E. (1975), Methods of Detecting Carcinogens and Mutagens with the Salmonella/Mammalian-Microsome Mutagenicity Test, Mutation Res., 31, pp. 347—364.
|
|
(2)
|
Maron, D. M. and Ames, B. N. (1983), Revised Methods for the Salmonella Mutagenicity Test, Mutation Res., 113, pp. 173—215.
|
|
(3)
|
Gatehouse, D., Haworth, S., Cebula, T., Gocke, E., Kier, L., Matsushima, T., Melcion, C, Nohmi, T., Venitt, S. and Zeiger, E. (1994), Recommendations for the Performance of Bacterial Mutation Assays, Mutation Res., 312, pp. 217—233.
|
|
(4)
|
Kier, L. D., Brusick D. J., Auletta, A. E., Von Halle, E. S., Brown, M. M., Simmon, V. F., Dunkel, V., McCann, J., Mortelmans, K., Prival, M., Rao, T. K. and Ray V. (1986), The Salmonella typhimurium/Mammalian Microsomal Assay: A Report of the U.S. Environmental Protection Agency Gene-Tox Program, Mutation Res., 168, pp. 69—240.
|
|
(5)
|
Yahagi, T., Degawa, M., Seino, Y. Y., Matsushima, T., Nagao, M., Sugimura, T. and Hashimoto, Y. (1975), Mutagenicity of Carcinogen Azo Dyes and their Derivatives, Cancer Letters 1, pp. 91—96.
|
|
(6)
|
Matsushima, M., Sugimura, T., Nagao, M., Yahagi, T., Shirai, A. and Sawamura, M. (1980), Factors Modulating Mutagenicity Microbial Tests, w: Short-term Test Systems for Detecting Carcinogens, ed. Norpoth K. H. and Garner, R. C, Springer, Berlin-Heidelberg-New York, pp. 273—285.
|
|
(7)
|
Gatehouse, D. G., Rowland, I. R., Wilcox, P., Callender, R. D. and Foster, R. (1980), Bacterial Mutation Assays, w: Basic Mutagenicity TestS: UKEMS Part 1 Revised, ed. D. J. Kirkland, Cambridge University Press, pp. 13—61.
|
|
(8)
|
Aeschacher, H. U., Wolleb, U. and Porchet, L. (1987), Liquid Preincubation Mutagenicity Test for Foods, J. Food Safety, 8, pp. 167—177.
|
|
(9)
|
Green, M. H. L., Muriel, W. J. and Bridges, B. A. (1976), Use of a simplified fluctuation test to detect low levels of mutagens, Mutation Res., 38, pp. 33—42.
|
|
(10)
|
Hubbard, S. A., Green, M. H. L., Gatehouse, D. and Bridges, J. W. (1984), The Fluctuation Test in Bacteria, w: Handbook of Mutagenicity Test Procedures, 2nd Edition, ed. Kilbey, B. J., Legator, M., Nichols, W. and Ramel, C, Elsevier, Amsterdam-New York-Oxford, pp. 141—161.
|
|
(11)
|
Thompson, E. D. and Melampy, P. J. (1981), An Examination of the Quantitative Suspension Assay for Mutagenesis with Strains of Salmonella typhimurium, Environmental Mutagenesis, 3, pp. 453—465.
|
|
(12)
|
Araki, A., Noguchi, T., Kato, F. and Matsushima, T. (1994), Improved Method for Mutagenicity Testing of Gaseous Compounds by Using a Gas Sampling Bag, Mutation Res., 307, pp. 335—344.
|
|
(13)
|
Prival, M. J., Bell, S. J., Mitchell, V. D., Reipert, M. D. and Vaughan, V. L. (1984), Mutagenicity of Benzidine and Benzidine-Congener Dyes and Selected Monoazo Dyes in a Modified Salmonella Assay, Mutation Res., 136, pp. 33—47.
|
|
(14)
|
Zeiger, E., Anderson, B. E., Haworth, S., Lawlor, T. and Mortelmans, K. (1992), Salmonella Mutagenicity Tests. V. Results from the Testing of 311 Chemicals, Environ. Mol. Mutagen., 19, pp. 2—141.
|
|
(15)
|
Simmon, V., Kauhanen, K. and Tardiff, R. G. (1977), Mutagenic Activity of Chemicals Identified in Drinking Water, in Progress in Genetic Toxicology, D. Scott, B. Bridges and F., Sobels (eds.) Elsevier, Amsterdam, pp. 249—258.
|
|
(16)
|
Hughes, T. J., Simmons, D. M., Monteith, I. G. and Claxton, L. D. (1987), Vaporisation Technique to Measure Mutagenic Activity of Volatile Organic Chemicals in the Ames/Salmonella Assay, Environmental Mutagenesis, 9, pp. 421—441.
|
|
(17)
|
Matsushima, T., Matsumoto, A., Shirai, M., Sawamura, M., and Sugimura, T. (1979), Mutagenicity of the Naturally Occurring Carcinogen Cycasin and Synthetic Methylazoxy Methane Conjugates in Salmonella typhimurium, Cancer Res., 39, pp. 3780—3782.
|
|
(18)
|
Tamura, G., Gold, C, Ferro-Luzzi, A. and Ames, B. N. (1980), Fecalase: A Model for Activation of Dietary Glycosides to Mutagens by Intestinal Flora, Proc. Natl. Acad. Sci. USA, 77, pp. 4961—4965.
|
|
(19)
|
Wilcox, P., Naidoo, A., Wedd, D. J. and Gatehouse, D. G. (1990), Comparison of Salmonella typhimurium TA 102 with Escherichia coli WP2 Tester strains, Mutagenesis, 5, pp. 285—291.
|
|
(20)
|
Matsushima, T., Sawamura, M., Hara, K. and Sugimura, T. (1976), A Safe Substitute for Polychlorinated Biphenyls as an Inducer or Metabolic Activation Systems, w: In vitro Metabolic Activation in Mutagenesis Testing, eds. F. J. de Serres et al. Elsevier, North Holland, pp. 85—88.
|
|
(21)
|
Elliot, B. M., Combes, R. D., Elcombe, C. R., Gatehouse, D. G., Gibson, G. G., Mackay, J. M. and Wolf, R. C. (1992), Alternatives to Aroclor 1254-induced S9 in in vitro Genotoxicity Assays, Mutagenesis, 7, pp. 175—177.
|
|
(22)
|
Maron, D., Katzenellenbogen, J. and Ames, B. N. (1981), Compatibility of Organic Solvents with the Salmonella/Microsome Test, Mutation Res., 88, pp. 343—350.
|
|
(23)
|
Claxton, L. D., Allen, J., Auletta, A., Mortelmans, K., Nestmann, E. and Zeiger, E. (1987), Guide for the Salmonella typhimurium/Mammalian Microsome Tests for Bacterial Mutagenicity, Mutation Res., 189, pp. 83—91.
|
|
(24)
|
Mahon, G. A. T., Green, M. H. L., Middleton, B., Mitchel, I., Robinson, W. D. and Tweats, D. J. (1989), Analysis of Data from Microbial Colony Assays, w: UKEMS Sub-Committee on Guidelines for Mutagenicity Testing, Part II. Statistical Evaluation of Mutagenicity Test Data, ed. Kirkland, D. J., Cambridge University Press, pp. 28—65.
|
Б.15. ИЗПИТВАНЕ ЗА МУТАГЕННОСТ И ПРЕСЯВАЩО ИЗПИТВАНЕ ЗА КАНЦЕРОГЕННОСТ ГЕННИ МУТАЦИИ — SACCHAROMYCES CEREVISIAE
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Вижте Общо въведение, част Б.
1.2. ОПРЕДЕЛЕНИЕ
Вижте Общо въведение, част Б.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Няма.
1.4. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
За измерване продукцията на генни мутации, предизвикани от химични агенти със или без метаболитно активиране, могат да се използват разнообразни хаплоидни и диплоидни щамове на дрождите Saccharomyces cerevisiae.
Използват се системите за прави мутации в хаплоидни щамове, например измерване на мутацията от червени, аденин зависими мутанти (ade-1, ade-2) към двойно аденин зависими бели мутанти, и селективни системи, например предизвикване на резистентност към канавнаин и циклохексимид.
Най-широко утвърдената система за обратни мутации включва използването на хаплоидния щам XV 185—14С, който е носител на охра „безсмислени“ мутации ade 2—1, arg 4—17, lys 1—1 и trp 5—48, които са обратими от мутагени за заместване на бази, които предизвикват специфични по място мутации или охра потискащи мутации. XV 185—14С е носител и на маркера his 1—7, „променяща смисъла“ мутация, която е обратима главно от мутации на друго място, и маркера horn 3—10, който е обратим от мутагени, свързани с изместване на рамката.
При диплоидните щамове на S. cerevisiae единственият широко използван щам е D7, който е хомозиготен по ilv 1—92.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Няма.
1.6. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
Подготовка
Разтворите на изпитваните химически вещества следва да бъдат приготвени непосредствено преди изпитването, като се използва подходящ носител. При органични съединения, които не са разтворими във вода, следва да се използва не по-концентриран от 2 % об/об разтвор на органични разтворители, като етанол, ацетон или диметилсулфоксид. Крайната концентрация на носителя не следва да оказва значимо влияние върху клетъчната жизнеспособност и растежните характеристики.
Метаболитно активиране
Клетките следва да бъдат подложени на експозиция на изпитваните химически вещества както в присъствие, така и в отсъствие на подходяща екзогенна система за метаболитно активиране.
Най-често използваната система е допълнена с ко-фактор митохондриална фракция от черни дробове на гризачи, предварително обработени със средства за ензимна индукция. За метаболитно активиране може да бъде подходящо и използването на други видове, тъкани, постмитоходриални фракции или процедури.
Условия на изпитване
Експериментални щамове
При изпитвания за генни мутации най-широко се използват хаплоидният щам XV185-14C и диплоидният щам D7. Други щамове също могат да бъдат подходящи.
Среди
За определяне броя на преживелите микроорганизми и на мутантите се използват подходящи среди за култивиране.
Използване на положителни и отрицателни контроли
Паралелно следва да се използват положителни и отрицателни контроли и контроли за разтворителите. За всяка конкретна мутационна крайна точка следва да се използват подходящи химически вещества за положителни контроли.
Експозиционна концентрация
Следва да се използват поне пет концентрации, които са адекватно разделени една от друга. За токсичните вещества най-високата изпитвана концентрация не следва да понижава преживяемостта под 5 до 10 %. Относително неразтворимите във вода вещества следва да се изпитват до границата на разтворимостта им, като се използват подходящи процедури. За лесно разтворимите във вода нетоксични вещества високата концентрация следва да се определя за всеки конкретен случай.
Условия за инкубиране
Петриевите панички се инкубират в продължение на четири до седем дни при 28 до 30 oС на тъмно.
Честоти на спонтанните мутации
Следва да се използват субкултури с честоти на спонтанните мутации в рамките на приетия нормален диапазон.
Брой на повторенията
За изследване на прототрофи, получени посредством генна мутация, и за изследване на клетъчната жизнеспособност следва да се използват поне по три петриеви панички за всяка концентрация. При експерименти с маркери като horn 3—10 с ниска честота на мутациите броят на използваните петриеви панички следва да бъде увеличен, за да се обезпечат статистически значими данни.
Процедура
Третирането на щамовете S. Cerevisiae обикновено се извършва в течна среда с клетки в стационарна фаза или фаза на растеж. Първоначалните експерименти следва да се провеждат върху растящи клетки. На експозиция на изпитваното химическо вещество се подлагат 1 – 5 × 107 клетки/ml в продължение на не повече от 18 часа при 28 до 37 oС, като се разклащат. Когато е необходимо, по време на третирането се добавя адекватно количество система за метаболитно активиране. В края на третирането клетките се центрофугират, промиват се и се посяват върху подходяща среда за култивиране. След инкубиране на петриевите панички се отчитат преживяемостта и предизвикването на генни мутации. Ако първият експеримент е отрицателен, тогава следва да се проведе втори експеримент, като се използват клетки в стационарна фаза. Ако първият експеримент е положителен, това се потвърждава с помощта на подходящ независим експеримент.
2. ДАННИ
Данните следва да бъдат представени в табличен вид, като се отбелязват броят на преброените колонии, броят на мутантите, преживяемостта и честотата на мутациите. Всички резултати следва да бъдат потвърдени в независим експеримент. Данните следва да бъдат оценени с помощта на подходящи статистически методи.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
—
|
условия на изпитването, клетки в стационарна фаза или фаза на растеж, състав на средите, температура и продължителност на инкубирането, система за метаболитно активиране,
|
|
—
|
условия на третиране, нива на експозиция, процедура и продължителност на третирането, температура на третиране, положителни и отрицателни контроли,
|
|
—
|
брой на преброените колонии, брой на мутантите, преживяемост и честота на мутантите, връзка между доза и отговор, ако е необходимо, статистическа оценка на данните,
|
|
—
|
обсъждане на резултатите,
|
|
—
|
интерпретиране на резултатите,
|
3.2. ОЦЕНКА И ИНТЕРПРЕТИРАНЕ
Вижте Общо въведение, част Б.
4. ПРЕПРАТКИ
Вижте Общо въведение, част Б.
Б.16. МИТОТИЧНИ РЕКОМБИНАЦИИ — SАССНАRОМУСЕS СЕREVISIAE
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Вижте Общо въведение, част Б.
1.2. ОПРЕДЕЛЕНИЕ
Вижте Общо въведение Част Б.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Няма.
1.4. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Митотичната рекомбинация при Saccharomyces сеrevisiae може да бъде открита между гените (или по-общо, между гена и неговия центромер) и в рамките на отделните гени. Първото явление се нарича кросинговър и води до получаване на реципрочни продукти, докато второто най-често не е реципрочно и се нарича генна конверсия. Кросинговърът обикновено се изследва посредством получаване на рецесивни хомозиготни колонии или сектори в хетерозиготен щам, докато генната конверсия се изследва посредством получаване на прототрофни ревертанти, получени в ауксотрофен хетероалелен щам и носещи два различни дефектни алела на един и същ ген. Най-широко използваните за откриване на митотична генна конверсия щамове са D4 (хетероалелен по аdе 2 и trр 5), D7 (хетероалелен по trp 5), ВZ34 (хетероалелен по arg 4) и JD1 (хетероалелен по his 4 и trp 5). Митотичният кросинговър, от който се получават червени и розови хомозиготни сектори, може да се изследва при D5 или при D7 (като се измерват и митотичната генна конверсия, и обратната мутация при ilv 1—92), като и двата щама са хетероалелни за комплементните алели на adе 2.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Няма.
1.6. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
Подготовка
Разтворите на изпитваните химически вещества и съединенията за сравнение следва да бъдат приготвени непосредствено преди изпитването, като се използва подходящ носител. При органични съединения, които не са разтворими във вода, следва да се използва не по-концентриран от 2 % об/об разтвор на органични разтворители, като етанол, ацетон или диметилсулфоксид. Крайната концентрация на носителя не следва да оказва значимо влияние върху клетъчната жизнеспособност и растежните характеристики.
Метаболитно активиране
Клетките следва да бъдат подложени на експозиция на изпитваните химически вещества както в присъствие, така и в отсъствие на подходяща система за метаболитно активиране. Най-често използваната система е допълнена с ко-фактор митохондриална фракция от черни дробове на гризачи, предварително обработени със средства за ензимна индукция. За метаболитно активиране може да бъде подходящо и използването на други видове, тъкани, постмитохондриални фракции или процедури.
Условия на изпитване
Експериментални щамове
Най-често използвани са диплоидните щамове D4, D5, D7 и JD1. Може да е целесъобразно използването на други щамове.
Среди
За определяне на преживяемостта и честотата на митотичните рекомбинации се използват подходящи среди за култивиране.
Използване на положителни и отрицателни контроли
Паралелно следва да се използват положителни и отрицателни контроли и контроли за разтворителите. За всяка конкретна рекомбинантна крайна точка следва да се използват подходящи химически вещества за положителни контроли.
Експозиционни концентрации
Следва да се използват поне пет концентрации на изпитваното вещество, които са адекватно разделени една от друга. Сред факторите, които следва да се вземат предвид, са клетъчната токсичност и разтворимостта. Най-ниската концентрация не следва да оказва влияние върху клетъчната жизнеспособност. За токсичните химически вещества най-високата изпитвана концентрация не следва да понижава преживяемостта под 5 до 10 %. Относително неразтворимите във вода химически вещества следва да се изпитват до границата на разтворимостта си, като се използват подходящи процедури. За лесно разтворимите във вода нетоксични вещества високата концентрация следва да се определя за всеки конкретен случай.
Клетките могат да бъдат подложени на експозиция на изпитваните химически вещества в стационарна или растежна фаза за периоди с продължителност до 18 часа. При продължителни периоди на третиране обаче културите следва да бъдат огледани микроскопски за образуване на спори, чието присъствие прави изпитването невалидно.
Условия за инкубиране
Петриевите панички се инкубират на тъмно за четири до седем дни при 28 до 30 oС. Петриевите панички, използвани за изследване на червени и розови хомозиготни сектори, получени посредством митотичен кросинговър, следва да бъдат съхранявани в хладилник (около 4 oС) за допълнителни един до два дни преди отчитането, за да се даде възможност за развитие на съответните пигментирани колонии.
Спонтанни честоти на митотичните рекомбинации
Следва да се използват субкултури с честоти на спонтанните митотични рекомбинантни мутации в рамките на приетия нормален диапазон.
Брой на повторенията
За изследване на прототрофи, получени посредством генна мутация, и за изследване на клетъчната жизнеспособност следва да се използват поне по три петриеви панички за всяка концентрация. При изпитване на рецесивни хомозиготи, получени посредством митотичен кросинговър, броят на петриевите панички следва да бъде увеличен, за да се осигури адекватен брой колонии.
Процедури
Третирането на щамовете S. Сerevisiае обикновено се извършва в течна среда с клетки в стационарна фаза или фаза на растеж. Първоначалните експерименти следва да се провеждат върху растящи клетки. На експозиция на изпитваното химическо вещество се подлагат 1 – 5 × 107 клетки/ml в продължение на не повече от 18 часа при 28 до 37 oС, като се разклащат. Когато е необходимо, по време на третирането се добавя адекватно количество система за метаболитно активиране.
В края на третирането клетките се центрофугират, промиват се и се посяват върху подходяща среда за култивиране. След инкубиране петриевите панички се отчитат за преживяемост и предизвикване на митотична рекомбинация.
Ако първият експеримент е отрицателен, следва да се проведе втори експеримент, като се използват клетки в стационарна фаза. Ако първият експеримент е положителен, това се потвърждава с помощта на независим експеримент.
2. ДАННИ
Данните следва да бъдат представени в табличен вид, като се отбелязват броят на преброените колонии, броят на рекомбинантите, преживяемостта и честотата на рекомбинантите.
Резултатите следва да бъдат потвърдени в независим експеримент.
Данните следва да бъдат оценени с помощта на подходящи статистически методи.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
—
|
условия на изпитването, клетки в стационарна фаза или фаза на растеж, състав на средите, температура и продължителност на инкубирането, система за метаболитно активиране,
|
|
—
|
условия на третиране, експозиционна концентрация, процедура и продължителност на третирането, температура на третиране, положителни и отрицателни контролни групи,
|
|
—
|
брой на преброените колонии, брой на рекомбинантите, преживяемост и честота на рекомбинациите, ако е необходимо, връзка между доза и отговор, статистическа оценка на данните,
|
|
—
|
обсъждане на резултатите,
|
|
—
|
интерпретиране на резултатите,
|
3.2. ОЦЕНКА И ИНТЕРПРЕТИРАНЕ
Вижте Общо въведение, част Б.
4. ПРЕПРАТКИ
Вижте Общо въведение, част Б.
Б.17. МУТАГЕННОСТ — IN VITRO ТЕСТ ЗА КЛЕТЪЧНИ ГЕННИ МУТАЦИИ ПРИ БОЗАЙНИЦИ
1. МЕТОД
Настоящият метод е изцяло подобен kd теста in vitro за клетъчни генни мутации при бозайници на ОИСР ТG 476 от 1997 г.
1.1. ВЪВЕДЕНИЕ
Тестът in vitro за клетъчни генни мутации при бозайници може да се използва за откриване на генни мутации, индуцирани от химични вещества. Подходящи клетъчни линии са L5178Y на миши лимфомни клетки, линиите СНО, СНО-АS52 и V79 на клетките на китайски хамстер и ТК6 на човешки лимфобластоидни клетки (1). В тези клетъчни линии най-често използваните генетични крайни точки измерват мутацията на киназата на тимидина (ТК) и трансферазата на хипокснатин-гуанин фосфорибозил (НРRТ), както и трансген от трансферазата на ксантин-гуанин фосфорибозил (ХРRТ). Тестовете за мутации на ТК, НРRТ и ХРRТ откриват различни спектри на генетични събития. Автозомното разполагане на ТК и ХРRТ може да даде възможност за откриването на генетични събития (напр. големи делеции), които не се забелязват на локуса на НРRТ върху X хромозоми (2)(3)(4)(5)(6).
В теста in vitro за клетъчни генни мутации при бозайници могат да се използват култури на установени клетъчни линии или клетъчни щамове. Клетките се избират въз основа на способността за растеж в дадена култура и устойчивостта в честотата на спонтанните мутации.
Тестовете in vitro по принцип изискват екзогенен източник на метаболична активация. Тази система за метаболична активация не може изпяло да имитира условията in vivo при бозайниците. Следва да се избягват условия, които биха довели до резултати, неотразяващи присъща мутагенност. Положителни резултати, които не отразяват присъща мутагенност, могат да възникнат от промени в рН, осмотично налягане или високи нива на цитотоксичност (7).
Настоящият тест се използва за откриване на евентуални мутагени и канцерогени. Много съединения, които са положителни в настоящия тест, са канцерогени за бозайници; все пак няма идеално съответствие между настоящия тест и канцерогенността. Съответствието зависи от химичния клас, а има все повече доказателства за това, че съществуват канцерогени, които не се откриват чрез настоящия тест, защото вероятно те действат чрез други, негенотоксични механизми или механизми, отсъстващи в бактериалните клетки(6).
Вижте също Общо въведение, част Б.
1.2. ДЕФИНИЦИИ
Мутация в поколението напред: генна мутация от родителския тип на мутанта, от който възниква изменение или загуба на ензимна активност на функцията на кодирания протеин.
Мутагени — заместители на основна двойка: вещества, които причиняват заместване на една или няколко основни двойки в ДНК.
Фрeймшифт мутагени: вещества, които причиняват добавяне или делеция на една или много основни двойки в ДНК молекула.
Време на фенотипно изразяване: период, през който непроменените генни продукти са изчерпани от новомутиралите клетки.
Мутантна честота: броят на наблюдаваните мутантни клетки, разделен на броя на жизнеспособните клетки.
Относителен общ растеж: увеличение в броя на клетките за период време в сравнение контролна популация клетки; изчислен като продукта от суспензионния растеж спрямо в отрицателната контрола, умножен по ефективността (к.п.д.) на клониране спрямо отрицателна контрола.
Относителен суспензионен растеж: увеличение в броя на клетките за период на изразяване спрямо отрицателната контрола.
Жизнеспособност: ефективността на клониране на третираните клетки по време на посяването в блюдо в селективни условия след периода на изразяване.
Оцеляване: ефективността на клониране на третираните клетки, когато са посети в блюдо в края на периода на третиране; оцеляването обикновено се изразява по отношение на оцеляването в контролната клетъчна популация.
1.2. ПРИНЦИП НА МЕТОДА НА ТЕСТА
Клетките с дефицит от тимидин киназа (ТК) поради мутацията ТК+/- —> ТК-/- са устойчиви на цитотоскичните ефекти на пиримидиновия аналог трифлуороитимидин (ТFТ). Клетките с изобилие от тимидин киназа са чувствителни към ТFТ, което причинява инхибиране на клетъчния метаболизъм и спира по-нататъшното клетъчно деление. Така мутантните клетки са способни да пролиферират в присъствието на ТFТ, докато нормални клетки, съдържащи тимидин киназа, не са. Аналогично, клетките с дефицит от НРRТ или ХРRТ се избират според устойчивостта им към 6-тиогуанин (ТG) или 8-азагуанин (АС). Следва внимателно да се подходи към свойствата на тестваното вещество, ако базов аналог или съединение се тестват в някой от тестовете за клетъчни генни мутации при бозайници. Например, следва всяка съмнителна селективна токсичност, предизвикана от тестваното вещество за мутантни или немутантни клетки, да бъде проучена. Следователно характеристиките на селекционната система/агент следва да се потвърдят, когато се тестват химикали, структурно свързани със селективния агент (8).
Клетки в суспензия или еднослойна култура се излагат на тестваното вещество, със и без метаболична активация, за подходящ период от време и се субкултивират, за да се определи цитотоксичността и да се даде възможност за фенотипно изразяване преди селекцията на мутанти (9) (10) (11) (12) (13). Цитотоксичността обикновено се определя чрез измерване на относителната ефективност на клониране (оцеляване) или относителния общ растеж на културите след периода на третиране. Третираните култури се поддържат в среда на растеж за достатъчен период от време, характерен за всеки избран локус и клетъчен тип, за да се осигури почти оптимално фенотипно изразяване на индицираните мутации. Мутантната честота се определя чрез посяване на известни количества клетки в среда, съдържаща селективния агент, за да се открият мутантни клетки, и в среда без селективен агент, за да се определи ефективността на клониране (оцеляване). След подходящ инкубационен период колониите се преброяват. Мутантната честота се получава от броя на мутантни колонии в селективна среда и броя на колониите в неселективна среда.
1.4. ОПИСАНИЕ НА МЕТОДА НА ТЕСТА
1.4.1. Подготовка
1.4.1.1. Клетки
За настоящия тест има в наличност разнообразни клетъчни типове, включително и субклони на L5171Y, СНО, СНО-АS52, V79 или ТК6 клетки. Типовете клетки, използвани в настоящия тест, следва да са показали чувствителност към химични мутагени, висока ефективност на клониране и стабилна честота на спонтанни мутации. Клетките следва да се проверят за замърсяване на микоплазмата и ако са замърсени, не следва да се използват.
Тестът следва да се провежда с предварително определени чувствителност и енергия. Броят клетки, култури и концентрации на тестваното вещество следва да отразяват тези дефинирани параметри (14). Минималният брой жизнеспособни клетки, оцеляващи от третирането и използвани на всеки етап на теста, следва да се базира на честотата на спонтанни мутации. Една принципна насока е да се използва брой клетки, който е равен най-малко на 10 пъти реципрочната стойност на честотата на спонтанни мутации. Все пак препоръчително е да се използват поне 106 клетки. Следва да има съответстващи данни от предишни изследвания за използваната клетъчна система, които да свидетелстват за последователност при провеждането на теста.
1.4.1.2. Среда и условия за отглеждане на културите
Следва да се използват подходяща хранителна среда и инкубационни условия (носители на културата, температура, концентрация на СО2 и влажност на въздуха). Видовете хранителна среда следва да се подберат в съответствие със селективните системи и типа клетки на теста. Особено важно е условията за отглеждане на културите да се подберат така, че да осигуряват оптимален растеж на клетките по време на периода на изразяване и способност за образуване на колонии както за мутантни, така и за немутантни клетки.
1.4.1.3. Приготвяне на културите
Размножават се клетки от изходни култури, посяват се в хранителна среда и се инкубират при 37 oС. Преди употребата им в настоящия тест може да се окаже необходимо културите да се почистят от съществуващи преди това мутантни клетки.
1.4.1.4. Метаболична активация
Клетките следва да се експонират на тестваното вещество както в наличието, така и в отсъствието на подходяща система за метаболична активация. Най-често използваната система е постмитохондрична фракция (89) с добавка на ко-фактор, приготвена от черните дробове на гризачи, третирани с ензимно индуциращи реактиви, като Ароклор 1254 (15) (16) (17) (18) или смес от фенобарбитон и ß-нафтофлавон (19) (20).
Постмитохондричната фракция обикновено се използва с концентрации в обхвата от 1 — 10 % V/V в последната среда на теста. Изборът и състоянието на системата за метаболична активация може да зависи от класа на тествания химикал. В някои случаи би било подходящо да се използва повече от една концентрация на постмитохондрична фракция.
Редица разработки, включително и създаването на генно конструирани клетъчни линии, изразяващи специфични активизиращи ензими, могат да осигурят потенциал за ендогенна активация. Изборът на клетъчни линии за теста следва да е научно обоснован (напр. чрез значението на изоензим цитохром Р450 за метаболизма на тестваното вещество).
1.4.1.5. Подготовка на тестваното вещество
Твърдите вещества за теста следва да се разтворят или суспендират в подходящи разтворители или носители и, ако е необходимо, да се разредят преди третиране на клетките. Течните вещества за теста могат да се добавят директно или да се разредят преди третиране. Следва да се използват пресни препарати на тестваното вещество, освен ако данните за стабилността му не показват, че може да се съхранява.
1.4.2. Условия за провеждане на теста
1.4.2.1. Разтворител/носител
Не следва да съществуват съмнения за химическа реакция на разтворителя/носителя с тестваното вещество и той следва да е съвместим с оцеляването на клетките и активността на S9. Ако се използват други освен добре познатите разтворители/носители, включването им в теста следва да се подкрепи от данни за съвместимостта им. Препоръчва се, винаги когато е възможно, първо да се разглежда възможността за прилагането на воден разтворител/носител. При тестването на вещества, нестабилни във вода, използваните органични разтворители не следва да съдържат вода. Водата може да се отстрани чрез добавянето на молекулно сито.
1.4.2.2. Концентрации на експозиция
Измежду критериите, които следва да се имат предвид при определянето на най-високите концентрации, са цитотоксичността, разтворимостта в тестовата система и промените в рН или осмотичното налягане.
Цитотоксичността следва да се определи със и без метаболична активация в главния експеримент, като се използва подходяща индикация на клетъчната цялост и растеж като относителна ефективност на клониране (оцеляване) или относителен общ растеж. Може би ще е полезно да се определи цитотоксичността и разтворимостта в предварителен експеримент.
Следва да се използват най-малко четири анализируеми концентрации. Там, където се среща цитотоксичност, тези концентрации следва да покриват обхват от максимална до слаба токсичност или липса на токсичност; това обикновено означава, че концентрациите следва да се различават с коефициент не повече от 2 до √10. Ако максималната концентрация е базирана на цитотоксичност, то резултатът следва да е приблизително 10—20 % (но не по-малко от 10 %) относително оцеляване (относителна ефективност на клониране) или относителен общ растеж. За относително нецитотоксични вещества, максималната тестова концентрация следва да е 5 mg/ml, 5 μl/ml, или 1,01 М, в зависимост от това коя е най-ниска.
Относително неразтворимите вещества следва да се тестват до или над границата им на разтворимост при условията на отглеждане на културата. Доказателствата за неразтворимост следва се определят в последната среда на третиране, на която са експонирани клетките. може да бъде да се определи разтворимостта в началото и края на третирането, тъй като тя може да се промени в течение на експонирането в тестваната система поради присъствието на клетки, 89, серум и др. Неразтворимостта може да се установи с просто око. Утайката не следва да пречи на отчитането.
1.4.2.3. Контроли
Паралелни положителни и отрицателни (разтворител или носител) контроли, както със, така и без метаболична активация, следва да се включат във всеки експеримент. Когато се използва метаболична активация, химикалът за положителните контроли следва да е от такъв вид, че да изисква активация, за да произведе мутагенна реакция.
Примерите за положителни контролни вещества включват:
|
Състояние на метаболична активация
|
Локус
|
Вещество
|
САS №
|
Einecs №
|
|
Отсъствие на екзогенна метаболична активация
|
НРRТ
|
Етил метансулфонат
|
62-50-0
|
200-536-7
|
|
Етил нитрозокарбамид
|
759-73-9
|
212-072-2
|
|
ТК (малки и големи колонии)
|
Метил метансулфонат
|
66-27-3
|
200-625-0
|
|
ХРRТ
|
Етил метансулфонат
|
62-50-0
|
200-536-7
|
|
Етил нитрозокарбамид
|
759-73-9
|
212-072-2
|
|
Наличие на екзогенна метаболична активация
|
НРRТ
|
3-метилхолантрен
|
56-49-5
|
200-276-4
|
|
]N-нитрозодиметиламин
|
62-75-9
|
200-549-8
|
|
7,12-диметилбензантрацен
|
57-97-6
|
200-359-5
|
|
ТК (малки и големи колонии)
|
Циклофосфамид
|
50-18-0
|
200-015-4
|
|
Циклофосфамид монохидрат
|
6055-19-2
|
|
|
Бензо[а]пирен
|
50-32-8
|
200-028-5
|
|
3-метилхолантрен
|
56-49-5
|
200-276-5
|
|
XPRT
|
N-нитрозодиметиламин (за високи нива на S-9)
|
62-75-9
|
200-549-8
|
|
Бензо[а]пирен
|
50-32-8
|
200-028-5
|
Могат да се използват други подходящи референтни вещества за положителни контроли, напр. ако една лаборатория има база данни от предишни изследвания за 5-бромо 2'-деоксиуридин (CAS № 59-14-3, EINECS № 200-415-9), това рефрентно вещество би могло също да се използва. Следва да се има предвид използването на химикали за положителна контрола, принадлежащи към химичен клас, когато такива са налични.
Следва да се включат отрицателните контроли, състоящи се само от разтворител или носител в средата за третиране и третирани по същия начин както опитните групи. В допълнение към това следва също да се използват нетретирани контроли, освен ако няма контролни данни от предишни изследвания, показващи, че избраният разтворител не причинява делеционни или мутагенни ефекти.
1.4.3. Процедура
1.4.3.1. Третиране с тестваното вещество
Пролифериращи клетки се експонират на въздействието на тестваното вещество както със, така и без метаболична активация. Експозицията следва да е за подходящ период от време (обикновено 3—6 часа е ефективният период). Времето на експозиция може да обхване един или повече клетъчни цикли.
За всяка тествана концентрация може да се използват две или една третирана култура. Когато се използва по една култура, броят на концентрациите следва да се увеличи, за да се осигури адекватен брой култури за анализ (напр. най-малко осем анализируеми концентрации). Отрицателните (разтворител) контролни култури следва да са две.
Газообразните или летливи вещества следва да се тестват чрез подходящи методи, като например в запечатани носители на културата (21) (22).
1.4.3.2. Измерване на оцеляването, жизнеспособността и честотата на мутантите
В края на периода на експозиция клетките се промиват и култивират, за да се определи оцеляването и да се даде възможност за изразяване на мутантния фенотип. Измерването на цитотоксичността чрез определяне на относителната ефективност на клониране (оцеляване) или относителния общ растеж на културите обикновено започва след периода на третиране.
Всеки локус изисква точно определено минимално време за почти оптимално изразяване на фенотипа на новоиндуцираните мутанти (HPRT и XPRT изискват поне 6—8 дни, а ТК — поне два дни). Клетките се отглеждат в среда със и без селективен(и) агент(и) за определяне на бройките мутанти и съответно на ефективността на клониране. Измерването на жизнеспособността (използвано за изчисляване на честотата на мутантите) започва в края на времето на изразяване чрез култивиране в блюдо в неселективна среда.
Ако тестваното вещество е положително в теста L5178Y ТК+/-, сортирането на колониите следва да се извърши поне на една от тестваните култури (най-високата положителна концентрация) и на отрицателните и положителните контроли. Ако тестваното вещество е отрицателно в теста L5178Y ТК+/-, сортирането на колониите следва да се извърши на отрицателните и положителните контроли. В изследвания, използващи ТК6ТК+/-, може също да се направи сортиране на колониите.
2. ДАННИ
2.1. ОБРАБОТКА НА РЕЗУЛТАТИТЕ
Данните следва да обхващат цитотоксичността и жизнеспособността, броя на колониите и честотите на мутантите за третираните и контролни култури. В случай на положителна реакция в теста L5178Y ТК+/- колониите се отчитат, като се използват критериите за малки и големи колонии при поне една концентрация на тестваното вещество (най-високата положителна концентрация) и на отрицателните и положителните контроли. Молекулното и цитогенетичното естество на мутантите както от големите, така и от малките колонии е изследвано в детайли (23) (24). В теста ТК+/- колониите се отчитат с помощта на критериите за колонии с нормален растеж (големи) и бавен растеж (малки) (25). Мутантните клетки, претърпели най-обширното генетично увреждане, имат удължени времена за удвояване и поради това образуват малки колонии. Това увреждане типично варира по мащаб от загубите на целия ген до кариотипно видими хромозомни аберации. Индуцирането на мутанти на малки колонии се свързва с химикали, индуциращи едри хромозомни аберации (26). По-малко засегнатите мутантни клетки растат с темпове, подобни на тези на родителските клетки и формират големи колонии.
Следва да се посочи оцеляването (относителни ефективности на клониране) или относителният общ растеж. Честотата на мутантите следва да се изрази като брой на мутиралите клетки спрямо броя на оцеляващите клетки.
Посочват се данните за отделните култури. Освен това всички данни се резюмират в таблица.
Няма изискване за потвърждаване на ясна положителна реакция. Двузначните резултати следва да се изяснят чрез допълнително тестване, като за предпочитане е да бъдат изменени условията на извършване на опита. Отрицателните резултати следва да се потвърдят за всеки случай поотделно. В случаите, когато не се смята необходимо потвърждаването на отрицателни резултати, следва да се даде обосновка. Няма изискване за потвърждаване на ясна положителна реакция. Следва да се предвиди изменение в параметрите на изследване, за да се разширят условията, при които се прави оценка, при последващи опити или двузначните или отрицателните резултати. Параметрите на изследването, които биха могли да се изменят, обхващат границите на концентрацията и условията на метаболична активация.
2.2. ОЦЕНКА И ТЪЛКУВАНЕ НА РЕЗУЛТАТИТЕ
Има няколко критерия за определяне на положителен резултат, като например увеличение, свързано с концентрацията, или репродуцируемо увеличение на честотата на мутантите. Първо следва да се разгледа биологичната значимост на резултатите. При оценката на резултатите от теста биха могли да се използват статистически методи. Статистическата значимост не следва да е единственият решаващ фактор за положителна реакция.
Тествано вещество, за което резултатите не удовлетворяват горните критерии, се счита немутагенно в настоящата система.
Въпреки че повечето опити дават ясно положителни или отрицателни резултати, в редки случаи наборът данни изключва правенето на категорична преценка за активността на тестваното вещество. Резултатите могат да останат двузначни или под въпрос, независимо от това колко пъти е повторен опитът.
Положителните резултати от теста in vitro за клетъчни генни мутации при бозайници показват, че тестваното вещество индуцира генни мутации в използваните в теста култивирани клетки на бозайници. Най-значима е положителната реакция на концентрация, която е репродуцируема. Отрицателните резултати показват, че при условията на теста тестваното вещество не предизвиква генни мутации в използваните в теста култивирани клетки на бозайници.
3. ДОКЛАДВАНЕ
ДОКЛАД ЗА ТЕСТА
Докладът за теста следва да включва следната информация:
|
|
Разтворител/носител:
|
—
|
обосновка за избора на носител,
|
|
—
|
разтворимост и стабилност на тестваното вещество в разтворител/носител, ако са известни.
|
|
|
|
Клетки:
|
—
|
тип и източник на клетки,
|
|
—
|
брой клетъчни пасажи, ако е приложим,
|
|
—
|
методи за поддържане на клетъчна култура, ако е приложимо,
|
|
—
|
отсъствие на микоплазма.
|
|
|
|
Условия за провеждане на теста:
|
—
|
основна причина за избора на концентрации и броя на култури, в т.ч. напр. данни за цитотоксичността и граници на разтворимост, ако са налични,
|
|
—
|
състав на средите, СО2 концентрация,
|
|
—
|
концентрация на тестваното вещество,
|
|
—
|
обем на носителя и добавеното тествано вещество,
|
|
—
|
температура на инкубация,
|
|
—
|
времетраене на третирането,
|
|
—
|
гъстота на клетките по време на третиране,
|
|
—
|
тип и състав на системата за метаболична активация, в т.ч. критерии за приемливост,
|
|
—
|
положителни и отрицателни контроли,
|
|
—
|
продължителност на периода на изразяване (в т.ч. брой на посетите клетки и субкултури и графици на подхранване, ако са уместни),
|
|
—
|
критерии за приемане на тестовете за положителни, отрицателни или двузначни,
|
|
—
|
използвани методи за преброяване на жизнеспособните и мутиралите клетки,
|
|
—
|
кои дефиниции за размера и типа на колониите са взети предвид (в т.ч. критерии за „малки“ и „големи“ колонии, както е уместно).
|
|
|
|
Резултати:
|
—
|
признаци на токсичност,
|
|
—
|
данни за рН и осмотичното налягане по време на експозицията към тестваното вещество, ако са определени,
|
|
—
|
размер на колониите, ако са отчетени поне за отрицателни и положителни контроли,
|
|
—
|
адекватност на лабораторията за откриване на мутанти от малки колонии със системата L5178Y ТК+/-, когато е уместно,
|
|
—
|
взаимоотношение доза-реакция, където е възможно,
|
|
—
|
статистически анализи, ако има такива,
|
|
—
|
паралелни отрицателни (разтворител/носител) и положителни контролни данни,
|
|
—
|
отрицателни (разтворител/носител) и положителни контролни данни от предишни изследвания с обхвати, средни стойности и стандартни отклонения,
|
|
|
|
Обсъждане на резултатите.
|
4. ПРЕПРАТКИ
|
(1)
|
Moore, M. M., DeMarini, D. M., DeSerres, F. J. and Tindal, K. R. (eds.) (1987), Banbury Report 28; Mammalian Cell Mutagenesis, Cold Spring Harbor Laboratory, New York.
|
|
(2)
|
Chu, E. .Y. and Malling H. V. (1968), Mammalian Cell Genetics. II. Chemical Induction of Specific Locus Mutations in Chinese Hamster Cells In Vitro, Proc. Natl. Acad. Sci. USA, 61, pp. 1306—1312.
|
|
(3)
|
Liber, H. L. and Thilly, W. G. (1982), Mutation Assay at the Thymidine Kinase Locus in Diploid Human Lymphoblasts, Mutation Res. 94, pp. 467—485.
|
|
(4)
|
Moore, M. M., Harington-Brock, K., Doerr, C. L. and Dearfield, K. L. (1989), Differential Mutant Quantitation at the Mouse Lymphoma TK and CHO HGPRT Loci, Mutagenesis, 4, pp. 394—403.
|
|
(5)
|
Aaron, C. S., and Stankowski, Jr. L. F., (1989), Comparison of the AS52/XPRT and the CHO/HPRT AssayS: Evaluation of Six Drug Candidates, Mutation Res. 223, pp. 121—128.
|
|
(6)
|
Aaron, C. S., Bolcsfoldi, G., Glatt, H. R., Moore, M., Nishi, Y., Stankowski, Jr. L. F., Theiss, J. and Thompson, E. (1994), Mammalian Cell Gene Mutation Assays Working Group Report. Report of the International Workshop on Standardisation of Genotoxicity Test Procedures. Mutation Res. 312, pp. 235—239.
|
|
(7)
|
Scott, D., Galloway, S. M., Marshall, R. R., Ishidate, M., Brusick, D., Ashby, J. and Myhr, B.C. (1991), Genotoxicity Under Extreme Culture Conditions. A report from ICPEMC Task Group 9, Mutation Res. 257, pp. 147—204.
|
|
(8)
|
Clive, D., McCuen, R., Spector, J. F. S., Piper, C. and Mavournin, K. H. (1983), Specific Gene Mutations in L5178Y Cells in Culture. A Report of the U.S. Environmental Protection Agency Gene-Tox Program, Mutation Res., 115, pp. 225—251.
|
|
(9)
|
Li, A. P., Gupta, R. S., Heflich, R. H. and Wasson, J. S. (1988), A Review and Analysis of the Chinese Hamster Ovary/Hypoxanthine Guanine Phosphoribosyl Transferase System to Determine the Mutagenicity of Chemical AgentS: A Report of Phase III of the U.S. Environmental Protections Agency Gene-Tox Program, Mutation Res., 196, pp. 17—36.
|
|
(10)
|
Li, A. P., Carver, J. H., Choy, W. N., Hsie, A. W., Gupta, R. S., Loveday, K. S., ÓNeill, J. P., Riddle, J. C, Stankowski, L. F. Jr. and Yang, L. L. (1987), A Guide for the Performance of the Chinese Hamster Ovary Cell/Hypoxanthine-Guanine Phosphoribosyl Transferase Gene Mutation Assay, Mutation Res., 189, pp. 135—141.
|
|
(11)
|
Liber, H. L., Yandell, D. W. and Little, J. B. (1989), A Comparison of Mutation Induction at the TK and HPRT Loci in Human Lymphoblastoid CellS: Quantitative Differences are Due to an Additional Class of Mutations at the Autosomal TK Locus, Mutation Res., 216, pp. 9—17.
|
|
(12)
|
Stankowski, L. F. Jr., Tindal,, K. R., and Hsie, A. W. (1986), Quantitative and Molecular Analyses of Ethyl Methanosulphonate — and ICR 191-Induced Molecular Analyses of Ethyl Methanosulphonate — and ICR 191 Induced Mutation in AS52 Cells, Mutation Res., 160, pp. 133—147.
|
|
(13)
|
Turner, N. T., Batson, A. G. and Clive, D. (1984), Procedure for the L5178Y/TK+/- — TK+/- Mouse Lymphoma Cell Mutagenicity Assay, w: Kilbey, B. J. et al (eds.) Handbook of Mutagenicity Test Procedures, Elsevier Science Publishers, New York, pp. 239—268.
|
|
(14)
|
Arlett, C. F., Smith, D. M., Clarke, G. M., Green, M. H. L., Cole, J., McGregor, D. B. and Asquith S. C. (1989), Mammalian Cell Gene Mutation Assays Based upon Colony Formation, w: Statistical Evaluation of Mutagenicity Test Data, Kirkland, D. J., ed., Cambirdge University Press, pp. 66—101.
|
|
(15)
|
Abbondandolo, A., Bonatti, S., Corti, G., Fiorio, R., Loprieno, N. and Mazzaccoro, A. (1977), Induction of 6-Thioguanine-Resistant Mutants in V79 Chinese Hamster Cells by Mouse-Liver Microsome- Activated Dimethylnitrosamine, Mutation Res. 46, pp. 365—373.
|
|
(16)
|
Ames, B. N., McCann, J. and Yamasaki, E. (1975), Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian-Microsome Mutagenicity Test, Mutation Res. 31, pp. 347—364.
|
|
(17)
|
Clive, D., Johnson, K. O., Spector, J. F. S., Batson A. G. and Brown M. M. M. (1979), Validation and Characterisation of the L5178Y/TK+/ – Mouse Lymphoma Mutagen Assay System, Mutat. Res. 59, pp. 61—108.
|
|
(18)
|
Maron, D. M. and Ames, B. N. (1983), Revised Methods for the Salmonella Mutagenicity Test, Mutation Res. 113, pp. 173—215.
|
|
(19)
|
Elliott, B. M., Combes, R. D., Elcombe, C. R., Gatehouse, D. G., Gibson, G. G., Mackay, J. M. and Wolf, R. C. (1992), Alternatives to Aroclor 1254-Induced S9 in: In Vitro Genotoxicity Assays, Mutagenesis 7, pp. 175—177.
|
|
(20)
|
Matsushima, T., Sawamura, M., Hara, K. and Sugimura, T. (1976), A Safe Substitute for Polycholrinated Biphenyls as an Inducer of Metabolic Activation Systems, in: In Vitro Metabolic Activation in Mutagenesis Testing, de Serres, F. J., Fouts, J. R., Bend, J. R. and Philpot, R. M. (eds), Elsevier, North-Holland, pp. 85—88.
|
|
(21)
|
Krahn, D. F., Barsky, F. C. and McCooey, K. T. (1982), CHO/HGPRT Mutation Assay: Evaluation of Gases and Volatile Liquids, in: Ticc, R. R., Costa, D. L., Schaich, K. M. (eds), Genotoxic Effects of Airborne Agents, New York, Plenum, pp. 91—103.
|
|
(22)
|
Zamora, P. O., Benson, J. M., Li, A. P. and Brooks, A. L. (1983), Evaluation of an Exposure System Using Cells Grown on Collagen Gels for Detecting Highly Volatile Mutagens in the CHO/HGPRT Mutation Assay, Environmental Mutagenesis, 5, pp. 795—801.
|
|
(23)
|
Applegate, M. L., Moore, M. M., Broder, C. B., Burrell, A. and Hozier, J. C. (1990), Molecular Dissection of Mutations at the Heterozygous Thymidine Kinase Locus in Mouse Lymphoma Cells, Proc. Natl. Acad. Sci. USA, 87, pp. 51—55.
|
|
(24)
|
Moore, M. M., Clive, D. Hozier, J. C, Howard, B. E., Batson, A. G., Turner, N. T. and Sawyer, J. (1985), Analysis of Trifluoronthymidine, Resistant (TFT+) Mutants of L5178Y/TK+/- — Mouse Lymphoma Cells, Mutation Res. 151, pp. 161—174.
|
|
(25)
|
Yandell, D. W., Dryja, T. P. and Little, J. B. (1990), Molecular Genetic Analysis of Recessive Mutations at a Heterozygous Autosomal Locus in Human Cells, Mutation Res. 229, pp. 89—102.
|
|
(26)
|
Moore, M. M. and Doerr, C. L. (1990), Comparison of Chromosome Aberration Frequency and Small Colony TK-Deficient Mutant Frequency in L5178Y/TK+/- - 3.7.2C Mouse Lymphoma Cells, Mutagenesis, 5, pp. 609—614.
|
Б.18. УВРЕЖДАНЕ И РЕПАРАЦИЯ НА ДНК — НЕПЛАНИРАН СИНТЕЗ НА ДНК — КЛЕТКИ ОТ БОЗАЙНИЦИ (IN VITRO)
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Вижте Общо въведение, част Б.
1.2. ОПРЕДЕЛЕНИЕ
Вижте Общо въведение, част Б.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Няма.
1.4. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Изпитването за непланиран синтез на ДНК (UDS) измерва синтеза за репарация на ДНК след изрязване и отстраняване на последователност от ДНК, която съдържа участъка с повреда, предизвикана от химични или физични агенти. Изпитването се базира на включването на маркиран с тритий тимидин 3H-TdR) в ДНК на клетки от бозайници, които не са във фаза S на клетъчния цикъл. Навлизането на 3H-TdR може да бъде определено с помощта на авторадиография или посредством течно сцинтилационно броене (LSC) на ДНК от третираните клетки. Културата на клетките от бозайници, освен ако не се използват първични хепатоцити от плъх, се третира с изпитвания агент със и без екзогенна система за метаболитно активиране. UDS може да се измерва и в in vivo системи.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Няма.
1.6. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
Подготовка
Изпитваните химически вещества и веществата за сравнение следва да бъдат приготвени в средата за растеж или разтворени или суспендирани в подходящи носители и после да бъдат разредени допълнително в средата за растеж, която се използва при изпитването. Крайната концентрация на носителя не следва да оказва влияние върху жизнеспособността на клетките.
При изпитването могат да се използват първични култури от хепатоцити на плъх, човешки лимфоцити или постоянни клетъчни линии (например човешки диплоидни фибробласти).
Клетките следва да бъдат подложени на експозиция на изпитваното химическо вещество както в присъствие, така и в отсъствие на подходяща система за метаболитно активиране.
Условия на изпитване
Брой на културите
За всяка експериментална точка са необходими поне две клетъчни култури за авторадиография и шест култури (или по-малко, ако е научно оправдано) за LSC UDS изпитвания.
Използване на положителни и отрицателни контроли
Във всеки експеримент следва да бъдат включени паралелни положителни и отрицателни (нетретирани и/или с носител) контроли със и без метаболитно активиране.
Примери за положителни контроли за изследване на хепатоцити от плъх са 7,12-диметилбензантрацен (7,12-DMBA) или 2-ацетиламинофлуорен (2-AAF). При постоянни клетъчни линии пример за положителна контрола е 4-нитроквинолин-N-оксид (4-NQO), както за авторадиографски, така и за LSC изследвания, проведени без метаболитно активиране. N-диметилнитрозаминът представлява пример за положително контролно съединение, когато се използват системи за метаболитно активиране.
Експозиционни концентрации
Следва да се използват множество концентрации на изпитваното вещество в диапазон, който е адекватен за определяне на отговора. Най-високата концентрация следва да предизвиква известни токсични за клетката ефекти. Относително неразтворимите във вода съединения следва да се изпитват до границата на разтворимостта си. За лесно разтворимите във вода нетоксични химически вещества високата концентрация на изпитваните химически вещества следва да се определя за всеки конкретен случай.
Клетки
При поддържане на културите следва да се използват подходящи среди за растеж, концентрация на СО2, температура и влажност. Постоянните клетъчни линии следва да се проверяват периодично за заразяване с Mycoplasma.
Метаболитно активиране
При първични култури от хепатоцити не се използват системи за метаболитно активиране. Постоянните клетъчни линии и лимфоцитите се подлагат на експозиция на изпитваното вещество както в присъствие, така и при липса на подходяща система за метаболитно активиране.
Процедура
Приготвяне на култури
Постоянните клетъчни култури се получават от изходни култури (например чрез трипсинизация или отделяне), посети в съдове за култивиране при подходяща плътност и инкубирани при 37 oС.
Краткотрайните култури от хепатоцити на плъх се създават чрез даване възможност на прясно дисоциирани в подходяща среда хепатоцити да се закрепят към растежната повърхност.
Култури от човешки хепатоцити се създават с помощта на подходящи техники.
Третиране на културите с изпитваното вещество
Първични хепатоцити от плъх
Прясно изолирани хепатоцити от плъх се третират с изпитваното вещество в среда, съдържаща 3H-TdR, в продължение на подходящ по продължителност период от време. В края на третирането от средата се отстраняват клетките, които след това се измиват, фиксират и изсушават. Предметните стъкла се потопяват в авторадиографска емулсия (алтернативено може да се използва филм с отлепващ се слой), експонират се, проявяват се, оцветяват се и се преброяват.
Постоянни клетъчни линии и лимфоцити
Авторадиографски техники: Клетъчните култури се подлагат на експозиция на изпитваното вещество за периоди с подходяща продължителност, последвани от третиране с 3H-TdR. Времената зависят от естеството на веществото, активността на метаболизиращите системи и типа клетки. За да се открият пиковете на UDS, 3H-TdR следва да бъде добавен едновременно с изпитваното вещество или в рамките на няколко минути след експозицията на изпитваното вещество. Изборът между тези две процедури ще зависи от възможните взаимодействия между изпитваното вещество и 3H-TdR. За да се направи разлика между UDS и полуконсервативната репликация на ДНК, последната следва да бъде потисната, например чрез използване на среда с дефицит на аргинин, ниско съдържание на серум или чрез хидроксиурея към средата за култивиране.
LSC измервания на UDS: Преди третиране с изпитваното вещество навлизането на клетки в S- фазата следва да бъде блокирано, както е описано по-горе. След това клетките следва да бъдат подложени на експозиция на изпитваното химическо вещество, както е описано при авторадиографията. В края на инкубирането ДНК следва да бъде извлечена от клетките и следва да се определят общото съдържание на ДНК и степента на включване на 3H-TdR.
Следва да се отбележи, че когото при горепосочените техники се използват човешки лимфоцити, потискането на полуконсервативната репликация на ДНК в нестимулирани култури не е необходимо.
Анализ
Авторадиографски изследвания
При определяне на UDS в клетки от култура не се броят ядрата във фаза S. Следва да се преброят поне по 50 клетки от всяка концентрация. Преди преброяването предметните стъкла следва да бъдат кодирани. На всяко предметно стъкло следва да се преброят по няколко разделени на голямо разстояние едно от друго случайни полета. Количеството на включения в цитоплазмата 3H-TdR следва да бъде определено посредством преброяване на три цитоплазмени полета с размер колкото ядро от всяка преброена клетка.
Измервания с LSC
При всяка концентрация и при контролите за изследване на непланирания синтез на ДНК чрез измервания с LSC следва да се използва адекватен брой култури.
Всички резултати следва да бъдат потвърдени в независим експеримент.
2. ДАННИ
Данните следва да бъдат представени в табличен вид.
2.1. АВТОРАДИОГРАФСКИ ИЗСЛЕДВАНИЯ
Степента на включване на 3H-TdR в цитоплазмата и броят на гранулите, открити в клетъчното ядро, следва да бъдат регистрирани поотделно.
За да се опише разпределението на степента на включване на 3H-TdR в цитоплазмата и броя на гранулите за ядро, може да се използват средната стойност и стойностите на медианата и модата.
2.2. ИЗМЕРВАНИЯ С LSC
За измерванията с LSC включването на 3H-TdR следва да се отчита като dpm/μg ДНК. Средната стойност на dpm/μg ДНК със стандартното отклонение може да се използват за описване на разпределението на включването.
Данните следва да бъдат оценени с помощта на подходящи статистически методи.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
—
|
използваните клетки, плътността и броя на пасажите при третирането, броя на клетъчните култури,
|
|
—
|
методите, използвани за поддържане на клетъчните култури, включително средата, температурата и концентрациите на СО2,
|
|
—
|
изпитваното вещество, носителя, концентрациите и обосновката за избор на концентрации, използвани при изпитването,
|
|
—
|
подробности за системите за метаболитно активиране,
|
|
—
|
положителни и отрицателни контроли,
|
|
—
|
използваната авторадиографска техника,
|
|
—
|
процедурите, използвани за блокиране влизането на клетките в S-фаза,
|
|
—
|
процедурите, използвани за извличане на ДНК и за определяне на общото съдържание на ДНК при измерването с LSC,
|
|
—
|
когато е възможно, връзката доза/отговор,
|
|
—
|
обсъждане на резултатите,
|
|
—
|
интерпретиране на резултатите.
|
3.2. ОЦЕНКА И ИНТЕРПРЕТИРАНЕ
Вижте Общо въведение част Б.
4. ПРЕПРАТКИ
Вижте Общо въведение част Б.
Б.19. ИЗПИТВАНЕ IN VITRO ЗА ОБМЕНИ НА СЕСТРИНСКИ ХРОМАТИДИ
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Вижте Общо въведение част Б.
1.2. ОПРЕДЕЛЕНИЕ
Вижте Общо въведение част Б.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Няма.
1.4. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Изпитването за обмени на сестрински хроматиди (SСЕ) представлява краткотрайно изпитване за откриване на реципрочни обмени на ДНК между две сестрински хроматиди в удвояваща се хромозома. SСЕ представляват обмена на продукти от репликацията на ДНК в предполагаеми хомоложни локуси. Предполага се, че процесът на обмен включва разкъсване и след това повторно съединяване на ДНК, въпреки че е известно малко за молекулната му основа. Откриването на SСЕ изисква средство за диференциално маркиране на сестринските хроматиди и това може да бъде постигнато посредством включване на бромодеоксиуридин (BrdU) за два клетъчни цикъла в хромозомната ДНК.
Клетките на бозайниците се подлагат in vitro на експозиция на изпитваното химическо вещество със и без екзогенна система за метаболитно активиране на при бозайници, ако е необходимо, и се култивират в продължение на два цикъла на репликация в среда, съдържаща BrdU. След третиране на клетките със средство, потискащо делителното вретено (например колхицин), за да се натрупат клетки в подобен на метафаза етап от митозата (с-метафаза), те се отлепват и от хромозомите се приготвят препарати.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Няма.
1.6. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
Подготовка
|
—
|
При изпитването могат да се използват първични култури, (човешки лимфоцити) или постоянни клетъчни линии (например яйчникови клетки от китайски хамстер). Клетъчните линии трябва да се проверяват за заразяване с Мусорlаsта.
|
|
—
|
Трябва да се използват подходящи среди за култивиране и условия за инкубиране (т.е. температура, съдове за култивиране, концентрации на СО2 и влажност).
|
|
—
|
Изпитваните вещества могат да бъдат приготвени в средите за култивиране или да бъдат разтворени или суспендирани в подходящи носители преди третирането на клетките. Крайната концентрация на носителя в системата за култивиране не трябва да оказва значително влияние върху жизнеспособността или скоростта на растеж на клетките и ефектите върху честотата на обмена на сестрински хроматиди трябва да бъде мониториран посредством контрол за разтворителя.
|
|
—
|
Клетките трябва да бъдат подложени на експозиция на изпитваното вещество както в присъствие, така и в отсъствие на екзогенна система за метаболитно активиране при бозайници. Алтернативно, когато се използват клетки с вътрешна метаболитна активност, скоростта и естеството на активността трябва да бъдат подходящи за изпитвания клас химически вещества.
|
Условия на изпитване
Брой на културите
За всяка експериментална точка трябва да се използват най-малко по две култури.
Използване на положителни и отрицателни контроли
Във всеки експеримент трябва да бъдат включени положителни контроли, като се използва както пряко действащо съединение, така и съединение, което изисква метаболитно активиране. Трябва да се използват и контроли за носителя.
Следват примери за вещества, които могат да бъдат използвани като положителни контроли:
|
—
|
съединение с пряко действие:
|
|
—
|
съединение с непряко действие:
|
Когато е целесъобразно, може да се включи допълнителна положителна контрола със същия клас химически вещества, както изпитваното.
Експозиционни концентрации
Трябва да се използват поне три концентрации, които са адекватно разделени една от друга. Най-високата концентрация трябва да предизвиква значителен токсичен ефект, но все пак трябва да дава възможност за осъществяването на адекватна клетъчна репликация. Относително неразтворимите във вода вещества трябва да се изследват до границата на разтворимостта си, като се използват подходящи процедури. За лесно разтворимите във вода нетоксични вещества високата изпитвана концентрация трябва да се определя за всеки конкретен случай.
Процедура
Приготвяне на култури
Постоянните клетъчни култури се получават от изходни култури (например чрез трипсинизиране или отделяне), посети в съдове за култивиране при подходяща плътност и инкубирани при 37 oС. За еднослойните култури броят на клетките за съд за култивиране трябва да бъде коригиран така, че културите да не се сливат над 50 % в момента на отлепват. Алтернативно, клетките могат да бъдат използвани в суспензионна култура. Културите от човешки лимфоцити се получават от хепаринизирана кръв, като се използват подходящи техники и се инкубират при 37 oС.
Третиране
Клетките в експоненциален стадий на растеж се подлагат на експозиция на изпитваното вещество за период с подходяща продължителност. В повечето случаи един до два часа могат да бъдат ефективни, но в определени случаи продължителността на третирането може да бъде удължена до два пълни клетъчни цикъла. Клетките без достатъчна вътрешна метаболитна активност трябва да бъдат подложени на експозиция на изпитваното химическо вещество както в присъствие, така и в отсъствие на подходяща система за метаболитно активиране. В края на експозицията клетките се измиват напълно от изпитваното вещество и се култивират в продължение на два цикъла на репликация в присъствието на ВrdU. Като алтернативна процедура клетките могат да бъдат подложени на експозиция едновременно на изпитваното химическо вещество и на ВrdU в продължение на пълното време на култивиране на два клетъчни цикъла.
Културите от човешки лимфоцити се третират, когато се намират в полусинхронно състояние
Клетките се анализират при второто им деление след третирането, като най-чувствителните етапи от клетъчния цикъл трябва да бъдат подложени на експозиция на химическото вещество. С всички култури, към които се добавя ВrdU, трябва да се работи на тъмно или при матова светлина от лампи с нажежени жички до отлепването на клетките, за да се намали до минимум фотолизата на съдържащата ВrdU ДНК.
Отлепване на клетки
Клетъчните култури се третират с инхибитори на делителното вретено (например колхицин) един до четири часа преди отлепването. Всяка култура се отлепва и обработва поотделно за приготвяне на хромозоми.
Приготвяне и оцветяване на хромозоми
Хромозомните препарати се приготвят с помощта на стандартни цитогенетични техники. Оцветяването на предметните стъкла, за да се демонстрират SCEs може да се направи с помощта на няколко техники (например метод с флуоресценция плюс Giemsa).
Анализ
Броят на анализираните клетки трябва да се базира на спонтанната честота на SСЕ в контролата. Обикновено за SСЕs се анализират най-малко 25 добре разгърнати метафази за култура. Преди анализа предметните стъкла се кодират. При човешки лимфоцити се анализират само метафази, които съдържат 46 центромера. При постоянни клетъчни линии се анализират само метафази, които съдържат ± 2 от модалния брой. Трябва да се посочи дали центромерното превключване на маркера се брои за SСЕ или не. Резултатите трябва да бъдат потвърдени в независим експеримент.
2. ДАННИ
Данните трябва да бъдат представени в табличен вид. За всички третирани и контролни култури поотделно трябва да се дадат броят на обмените на сестрински хроматиди във всяка метафаза и броят на обмените на сестрински хроматиди за хромозома във всяка метафаза.
Данните трябва да бъдат оценени с помощта на подходящи статистически методи.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
—
|
използваните клетки, методите за поддържане на клетъчната култура,
|
|
—
|
условия на изпитване: състав на средите, концентрация на СО2, концентрация на изпитваното вещество, използван носител, температура на инкубиране, продължителност на третирането, използван инхибитор на делителното вретено, неговата концентрация и продължителността на третирането с него, тип на използваната система за метаболитно активиране, положителни и отрицателни контроли,
|
|
—
|
брой на клетъчните култури за една експериментална точка,
|
|
—
|
подробности за техниката, използвана за приготвяне на предметни стъкла,
|
|
—
|
брой на анализираните метафази (данните се дават поотделно за всяка култура),
|
|
—
|
среден брой SСЕ за клетка и за хромозома (данните се дават поотделно за всяка култура),
|
|
—
|
критерии за отчитане на SСЕ,
|
|
—
|
обосновка за избора на доза,
|
|
—
|
когато е необходимо, връзката доза/отговор,
|
|
—
|
обсъждане на резултатите,
|
|
—
|
интерпретиране на резултатите.
|
3.2. ОЦЕНКА И ИНТЕРПРЕТИРАНЕ
Вижте Общо въведение част Б.
4. ПРЕПРАТКИ
Вижте Общо въведение част Б.
Б.20. ИЗПИТВАНЕ ЗА ПОЛОВО СВЪРЗАНА РЕЦЕСИВНА ЛЕТАЛНОСТ ПРИ DROSOPHILA MELANOGASTER
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Вижте Общо въведение част Б.
1.2. ОПРЕДЕЛЕНИЕ
Вижте Общо въведение част Б.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Няма.
1.4. ПРИНЦИПИ НА МЕТОДА ЗА ИЗПИТВАНЕ
Изпитването за полово свързана леталност (SLRL) при Drosophila те1апоgaster открива появата на мутации, точкови мутации и малки делеции в зародишната линия на насекомото. Това изпитване представлява метод за изследване за прави мутации, с който може да се направи пресяващо изпитване за мутации при около 800 локуса в X-хромозомата, като това представлява около 80 % от всички локуси в Х-хромозомата. X-хромозомата представлява около една пета от целия хаплоиден геном.
Мутациите в Х-хромозомата на Drosophila те1апоgaster са фенотипно изявени при мъжките индивиди, които са носители на мутантния ген. Когато мутацията е летална в хомозиготно състояние, за присъствието ѝ се съди по липсата на единия от двата класа мъжко потомство, които нормално се получават от хетерозиготно женско насекомо. При изпитването SLRL се използват тези факти с помощта на специално маркирани и подредени хромозоми.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Няма.
1.6. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
Подготовка
Източници
Могат да се използват мъжки насекоми от добре дефинирани източници на насекоми от див тип и женски от източник на вида Muller-5. Могат да се използват и други съответно маркирани източници на женски насекоми с множество инвертирани Х-хромозоми.
Изпитвано вещество
Изпитваните вещества трябва да бъдат разтворени във вода. Веществата, които са неразтворими във вода, могат да бъдат разтворени или суспендирани в подходящи носители (например смес от етанол и Тween-60 или 80), а след това да бъдат разтворени във вода или физиологичен разтвор преди прилагането. Трябва да се избягва използването на диметилсулфоксид като носител.
Брой на животните
Изпитването трябва да бъде проектирано с предварително определена чувствителност и възможности. Наблюдаваната честота на спонтанните мутации при съответната контрола ще окаже силно влияние върху броя на третираните хромозоми, които трябва да бъдат анализирани.
Начин на прилагане
Експозицията може да бъде орална, чрез инжектиране или чрез експозиция на газове или пари. Подхранване с изпитваното вещество може да се направи със захарен разтвор. Когато е необходимо, веществата могат да бъдат разтворени в 0,7 % разтвор на NaCl и да бъдат инжектирани в гръдния кош или корема.
Използване на отрицателни и положителни контроли
Трябва да бъдат включени отрицателни (за носителя) и положителни контроли. Обаче ако съществуват подходящи исторически контролни данни, паралелни контроли не са необходими.
Нива на експозиция
Трябва да се използват три нива на експозиция. За предварителна оценка може да се използва едно ниво на експозиция на изпитваното вещество, като това ниво представлява максималната поносима концентрация или нивото, което води до някакви признаци на токсичност. За нетоксичните вещества, трябва да се използва експозиция на максималната възможна концентрация.
Процедура
Мъжките насекоми див тип (на възраст три до пет дни) се третират с изпитваното вещество и се чифтосват поотделно с по-голям брой девствени женски насекоми от вида Muller-5 или от друг подходящо маркиран (с множество инвертирани Х-хромозоми) вид. Женските се заместват с нови девствени женски насекоми на всеки два до три дни, за да се покрие целият цикъл на зародишните клетки. Потомството на тези женски се оценява за леталност, съответстваща на ефектите върху зрялата сперма, сперматидите от средна или късна фаза, ранните сперматиди, сперматоцитите и сперматогониите по време на третирането.
Хетерозиготните женски насекоми от поколението F1 от горните кръстосвания се чифтосват поотделно (т.е. една женска за флакон) със своите братя. В поколението F2 всяка култура се отчита за липса на мъжки насекоми от див тип . Ако изглежда, че една култура е възникнала от женско насекомо от поколение F1, което носи летален признак в родителската Х-хромозома (т.е. не се наблюдават мъжки насекоми с третираната хромозома), дъщерите на тази женска със същия генотип трябва да бъдат изследвани, за да се уверим, че леталният признак се повтаря в следващото поколение.
2. ДАННИ
Данните трябва да бъдат представени в табличен вид, за да бъде показан броят на изследваните Х-хромозоми, броят на безплодните мъжки насекоми и броят на хромозомите с летален признак при всяка експозиционна концентрация и за всяко чифтосване на всяко третирано мъжко насекомо. Трябва да бъде даден броят на клъстерите. Тези резултати трябва да бъдат потвърдени в отделен експеримент.
За оценка на изпитванията за полово свързана леталност трябва да се използват подходящи статистически методи. Образуването на клъстери от рецесивни летални признаци, произхождащи от едно мъжко насекомо, трябва да се вземат предвид и да се оценят с подходящ статистически метод.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
—
|
източник: използваните източници/видове и породи Drosophila, възрастта на насекомите, броят на третираните мъжки насекоми, броят на стерилните мъжки насекоми, броят на постоянните култури от поколение F2, броят на културите F2 без потомство, броят на хромозомите, носещи летален признак, открити на всеки стадий от развитието на зародишните клетки,
|
|
—
|
критериите за определяне размера на третираните групи,
|
|
—
|
условия на изпитване: подробно описание на схемата за третиране и вземане на проби, нивата на експозиция, данните за токсичността, ако е необходимо, отрицателните (за разтворителя) и положителните контроли,
|
|
—
|
критерии за отчитане на леталните мутации,
|
|
—
|
връзката контакт/ефект, когато е възможно,
|
|
—
|
обсъждане на резултатите,
|
|
—
|
интерпретиране на резултатите.
|
3.2. ОЦЕНКА И ИНТЕРПРЕТИРАНЕ
Вижте Общо въведение част Б.
4. ПРЕПРАТКИ
Вижте Общо въведение част Б.
Б.21. ИЗПИТВАНИЯ IN VITRO ЗА ТРАНСФОРМАЦИИ В КЛЕТКИ ОТ БОЗАЙНИЦИ
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Вижте Общо въведение част Б.
1.2. ОПРЕДЕЛЕНИЕ
Вижте Общо въведение част Б.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Няма.
1.4. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
За откриване на фенотипни изменения in vitro, предизвикани от химични вещества, свързани с in vivo злокачествена трансформация, могат да бъдат използвани системи за култивиране на клетки от бозайници. Често използваните клетки са СЗН10T1/2, 3Т3, SНЕ, плъх на Fisher и при изпитванията се разчита на измененията в клетъчната морфология, образуването на огнища и закрепването в полутвърд агар. Съществуват по-рядко използвани системи, които откриват други физиологични и морфологични изменения в клетките след експозиция на канцерогенни химически вещества. Никоя от изпитваните in vitro крайни точки няма установена механистична връзка с рака. Някои от изпитваните системи могат да долавят туморни промотори. Клетъчната токсичност може да се определя чрез измерване на ефекта на изпитвания материал върху способността за образуване на колонии (ефективност на клониране) или скоростта на растеж на културите. За да се измери клетъчната токсичност, трябва да се установи дали експозицията на изпитваното химическо вещество е свързано с токсикологични ефекти, но не може да се използва за изчисляване на честотата на трансформациите при всички изпитвания, защото някои могат да включват продължително инкубиране и/или повторно посяване/пресяване.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Няма.
1.6. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
Подготовка
Клетки
В зависимост от използваното трансформационно изпитване съществуват разнообразни клетъчни линии или първични клетки. Изследователят трябва да бъде сигурен, че всички клетки при провежданото изпитване демонстрират подходящи фенотипни изменения след експозиция на известни канцерогени и че изпитването в лабораторията на изследователя е с доказана и документирана валидност и надеждност.
Среда
Трябва да е използват среди и експериментални условия, които са подходящи за използваното трансформационно изпитване.
Изпитвано вещество
Изпитваните вещества могат да бъдат приготвени в средите за култивиране или да бъдат разтворени или суспендирани в подходящи носители преди третирането на клетките. Крайната концентрация на носителя в системата за култивиране не трябва да оказва влияние върху жизнеспособността, скоростта на растеж на клетките или честотата на трансформациите.
Метаболитно активиране
Клетките трябва да бъдат подложени на експозиция на изпитваното вещество както в присъствие, така и в отсъствие на подходяща система за метаболитно активиране. Алтернативно, когато се използват клетки, които притежават вътрешна метаболитна активност, трябва да бъде известно, че естеството на активността е подходящо за изпитвания клас химически вещества.
Условия на изпитване
Използване на отрицателни и положителни контроли
Във всеки експеримент трябва да бъдат включени положителни контроли, като се използва както пряко действащо съединение, така и съединение, което изисква метаболитно активиране. Трябва да се използват и отрицателни контроли (за носителя).
Следват примери за вещества, които могат да бъдат използвани като положителни контроли:
|
—
|
Пряко действащи химически вещества:
|
|
—
|
Съединения, изискващи метаболитно активиране:
|
—
|
4-диметиламиноазобензен,
|
|
—
|
7,12-диметилбензантрацен.
|
|
Когато е целесъобразно, трябва да се включи допълнителна положителна контрола със същия химически клас, както изпитваното съединение.
Експозиционни концентрации
Трябва да се използват няколко концентрации на изпитваното вещество. Тези концентрации трябва да предизвикат токсичен ефект, свързан с концентрацията, като най-високата концентрация води до ниско ниво на преживяемост, а преживяемостта при най-ниската концентрация е приблизително същата, както при отрицателната контрола. Относително неразтворимите във вода вещества трябва да се изпитват до границата на разтворимостта им, като се използват подходящи процедури. За лесно разтворимите във вода нетоксични вещества високата изпитвана концентрация трябва да се определя за всеки конкретен случай.
Процедура
Клетките трябва да бъдат подложени на експозиция с подходяща продължителност в зависимост от използваната експериментална система, а това може да включва повторно дозиране, придружено с промяна на средата (и, ако е необходимо, прясна смес за метаболитно активиране), ако експозицията е продължителна. Клетките без достатъчна вътрешна метаболитна активност трябва да бъдат подложени на експозиция на изпитваното вещество както в присъствие, така и в отсъствие на подходяща система за метаболитно активиране. В края на експозицията клетките се промиват напълно от изпитваното вещество и се култивират при условия, които са подходящи за появата на трансформирания фенотип, който се мониторира, и се определя честотата на трансформацията. Всички резултати се потвърждават в независим експеримент.
2. ДАННИ
Данните следва да бъдат представени в табличен вид и могат да бъдат в различна форма според използваното изпитване, например брой на петриевите панички, положителни петриеви панички или брой на трансформираните клетки. Когато е целесъобразно, преживяемостта следва да се изрази като процент от контролните нива, а честотата на трансформациите да се изрази за брой преживели клетки. Данните следва да бъдат оценени с помощта на подходящи статистически методи.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
—
|
използван тип клетки, брой на клетъчните култури, методи за поддържане на клетъчните култури,
|
|
—
|
условия на изпитване, концентрация на изпитваното вещество, използван носител, времето на инкубиране, продължителност и честота на третирането, плътност на клетките по време на третирането, тип на използваната екзогенна система за метаболитно активиране, положителни и отрицателни контролни групи, спецификация на мониторирания фенотип, използвана селективна система (ако е необходимо), обосновка за избор на дозата,
|
|
—
|
използван метод за пресмятане броя на жизнеспособните и трансформираните клетки,
|
|
—
|
обсъждане на резултатите,
|
|
—
|
интерпретиране на резултатите,
|
3.2. ОЦЕНКА И ИНТЕРПРЕТИРАНЕ
Вижте Общо въведение, част Б.
4. ПОЗОВАВАНИЯ
Вижте Общо въведение, част Б.
Б.22. ИЗПИТВАНЕ ЗА ДОМИНАНТНА ЛЕТАЛНОСТ ПРИ ГРИЗАЧИ
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Вижте Общо въведение, част Б.
1.2. ОПРЕДЕЛЕНИЕ
Вижте Общо въведение, част Б.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Няма.
1.4. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Доминантната леталност предизвиква ембрионална или фетална смърт. Предизвикването на доминантна леталност чрез контакт с химично вещество показва, че веществото е оказало влияние върху зародишната тъкан на изпитвания вид. Общоприето е, че доминантната леталност се дължи на увреждане на хромозомите (структурни или бройни аномалии). Ембрионалната смърт, ако женските индивиди са третирани, може да бъде и в резултат на токсични ефекти.
Обикновено мъжките животни се подлагат на експозиция на изпитваното съединение и се чифтосват с нетретирани девствени женски индивиди. Различните стадии на развитието на зародишните клетки могат да бъдат изпитвани поотделно с помощта на последователни чифтосвания. Нарастването на броя на мъртвите имплантирани зародиши за женски индивид в третираната група в сравнение с броя на мъртвите имплантирани зародиши за женски индивид в контролната група отразява постимплантационната загуба. Предимплантационната загуба може да бъде оценена въз основа на броя на жълтите тела или чрез сравняване на общия брой имплантирани зародиши за женски индивид в третираната и контролната група. Общата доминантна леталност представлява сумата от пред- и постимплантационната загуба. Изчисляването на общата доминантна леталност става чрез сравняване на броя живи имплантирани зародиши за женски индивид в експерименталната група и броя на живите имплантирани зародиши за женски индивид в контролната група. Намаляването на броя на имплантираните зародиши през определени интервали може да се дължи на убиване на клетки (т.е. на сперматоцити и/или сперматоонии).
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Няма.
1.6. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
Подготовка
Когато е възможно, изпитваните вещества следва да бъдат разтворени или суспендирани в изотоничен физиологичен разтвор. Неразтворимите във вода химически вещества могат да бъдат разтворени или суспендирани в подходящи носители. Използваният носител не следва да оказва влияние върху изпитваното химическо вещество, нито да предизвиква токсични ефекти. Следва да се използват прясно приготвени препарати от изпитваните химически вещества.
Условия на изпитване
Начин на прилагане
Обикновено изпитваното съединение следва да се приложи еднократно. Въз основа на токсикологичната информация може да се използва схема за многократно третиране. Обичайните начини на прилагане са чрез орално интубиране или интраперитонеално инжектиране. Може да са целесъобразни други начини на прилагане.
Експериментални животни
Като експериментални видове се препоръчват плъхове или мишки. Здрави, напълно полово съзрели животни се избират по случаен признак и се разпределят в третирана и контролна група.
Брой и пол
Следва да се използва адекватен брой третирани мъжки индивиди, като се вземат предвид спонтанните колебания в оценяваната биологична характеристика. Избраният брой следва да се базира на предварително определената чувствителност на откриването и възможностите. Например при типично изпитване броят на мъжките индивиди във всяка дозирана група следва да бъде достатъчен, за да се осигурят между 30 и 50 бременни женски индивиди за чифтосване.
Използване на отрицателни и положителни контроли
Обикновено във всеки експеримент следва да се включат паралелни положителни и отрицателни (за носителя) контроли. Когато съществуват приемливи положителни контролни резултати от наскоро проведени в същата лаборатория експерименти, тези резултати могат да бъдат използвани вместо паралелна положителна контрола. Положителните контролни вещества следва да се използват при подходяща ниска доза (например метил метансулфонат (ММS) интраперитонеално в доза 10 mg/kg), за да се демонстрира чувствителността на изпитването.
Нива на дозиране
Нормално следва да се използват три нива на дозиране. Високата доза следва да предизвиква признаци на токсичност или намалена плодовитост при третираните животни. В определени случаи може да е достатъчно едно-единствено ниво на дозиране.
Гранично изпитване
Нетоксичните вещества следва да бъдат изпитвани при 5 g/kg при еднократно прилагане и при 1 g/kg на ден при многократно прилагане.
Процедура
Съществуват няколко схеми за третиране. Най-широко се прилага еднократното прилагане на изпитваното вещество. Могат да се използват други схеми за третиране.
Отделните мъжки индивиди се чифтосват последователно с едно или две нетретирани девствени женски животни на подходящи интервали след третирането. Женските индивиди следва да бъдат оставени с мъжките животни в продължение поне на един цикъл на разгонване или докато се осъществи чифтосване, което се определя по наличието на сперма във влагалището или на вагинална запушалка.
Броят на чифтосванията след третирането зависи от схемата на третиране и следва да осигури вземане на проби от всички стадии на развитие на зародишните клетки.
Женските индивиди се пожертват през втората половина на бременността и съдържанието на матката се изследва, за да се определи броят на мъртвите и живите имплантирани зародиши. Могат да се изследват яйчниците, за да се определи броят на жълтите тела.
2. ДАННИ
Данните следва да бъдат представени в табличен вид, за да покажат броя на мъжките индивиди, броя на бременните женски и броя на женските животни, които не са бременни. Поотделно следва да се отчетат резултатите от всяко чифтосване, включително идентичността на всеки мъжки и женски индивид. За всеки женски индивид следва да се регистрират седмицата на чифтосването, нивото на дозиране, получено от мъжките, честотата на живите имплантирани зародиши и на мъртвите имплантирани зародиши.
Изчисляването на общата доминантна леталност се базира на сравняване на броя живи имплантирани зародиши за женски индивид в експерименталната група към броя на живите имплантирани зародиши за женски индивид в контролната група. Анализира се съотношението на живите към мъртвите имплантирани зародиши от третираната група, сравнено със същото съотношение от контролната група, за да се отбележи постимплантационната загуба.
Данните се регистрират като ранни и късни смъртни случаи, като от таблиците това следва да става ясно. Ако се оценява предимплантационната загуба, тя следва да бъде съобщена. Предимплантационната загуба може да бъде изчислена като несъответствие между броя на жълтите тела и броя на имплантираните зародиши или като намаляване на средния брой имплантирани зародиши за матка в сравнение с контролните чифтосвания.
Данните се оценяват с помощта на подходящи статистически методи.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
—
|
вид, порода, възраст и тегло на използваните животни, броя на животните от всеки пол в експерименталната и контролната група,
|
|
—
|
изпитваното вещество, носителя, изследваните нива на дозиране и обосновката за избор на доза, отрицателните и положителните контроли, данните за токсичността,
|
|
—
|
начина и схемата на третиране,
|
|
—
|
използвания метод за определяне дали е осъществено чифтосване,
|
|
—
|
критериите за отчитане на доминантната леталност,
|
|
—
|
когато е необходимо, връзката доза/отговор,
|
|
—
|
обсъждане на резултатите,
|
|
—
|
интерпретиране на резултатите,
|
3.2. ОЦЕНКА И ИНТЕРПРЕТИРАНЕ
Вижте Общо въведение, част Б.
4. ПРЕПРАТКИ
Вижте Общо въведение, част Б.
Б.23. ТЕСТ ЗА СПЕРМАТОГОНИАЛНИ ХРОМОЗОМНИ АБЕРАЦИИ ПРИ БОЗАЙНИЦИ
1. МЕТОД
Настоящият метод е изцяло подобен на теста за сперматогониални хромозомни аберации при бозайници на ОECD ТG 483 от 1997 г.
1.1. ВЪВЕДЕНИЕ
Целта на теста in vivo за сперматогониални хромозомни аберации при бозайници е да се идентифицират веществата, причиняващи структурни хромозомни аберации в сперматогониалните клетки на бозайници (1) (2) (3) (4) (5). Структурните аберации могат да бъдат два типа: хромозомни и хроматидни. При повечето химични мутагени индуцираните аберации са от хроматиден тип, но се срещат също и аберации от хоромозомен тип. Настоящият метод не е предназначен да измерва геномни аберации и не се използва обикновено за тази цел. Хромозомните мутации и свързаните с тях събития са причината за много генетични болести при човека
Настоящият тест измерва хромозомните събития в сперматогониалните зародишни клетки и следователно от него се очаква да предсказва индуцирането на унаследяеми мутации в зародишни клетки.
В настоящия тест се използват обикновено гризачи. Този цитогенетичен тест in vivo открива хромозомни аберации в сперматогониални митози. Други прицелни клетки на са обект на настоящия метод.
За да се открият аберации от хроматиден тип в сперматогониални клетки, следва да се изследва първото митотично клетъчно деление след третиране. преди тези увреждания да се загубят в следващите клетъчни деления. Допълнителна информация от третирани сперматогониални стволови клетки може да се получи чрез мейотичен хромозомен анализ за аберации от хромозомен тип на диакинезисна метафаза I, когато третираните клетки стават сперматоцити.
Настоящият тест in vivo е предназначен да изследва дали мутагените на соматични клетки са също така активни в зародишни клетки. Освен това сперматогониалният тест е от значение за оценката на опасността от това, че позволява разглеждането на фактори като in vivo метаболизма, фармакокинетиката и процесите на ДНК репарация.
В тестиса съществува редица генерации сперматогони със спектър на чувствителност към химично третиране. Следователно откритите аберации представляват съвкупна реакция на третираните популации сперматогониални клетки, като преобладаващи са по-многобройните диференцирани сперматогониални клетки. В зависимост от положението им в границите на тестиса различните генерации сперматогони биха могли или не да бъдат експонирани на общото кръвообращение поради физическата и физиологичната клетъчна бариера на Сертоли и бариерата кръв-тестис.
Ако има доказателства, че тестваното вещество или реактивен метаболит няма да достигне до прицелната тъкан, не е подходящо да се използва настоящият тест.
Вижте също Общо въведение, част Б.
1.2. ДЕФИНИЦИИ
Хроматиден тип аберация: структурно увреждане на хромозомата, изразяващо се в скъсване на единични хроматиди или скъсване и повторно съединяване между хроматиди.
Хромозомен тип аберация: структурно увреждане на хромозомата, изразяващо се в скъсване или скъсване и повторно съединяване на двата хроматида на една и съща страна.
Празнина: ахроматично увреждане, по-малко от ширината на един хроматид с минимално отклонение в реда на хроматида(ите).
Геномна аберация: промяна в броя на хромозоми в сравнение с нормалния брой, характерен за използваните животни.
Полиплоидия: множимо на хаплоидния брой хромозоми (n), различно от диплоидния брой (т.е. 3n, 4n и т.н.).
Структурна аберация: промяна в хромозомната структура, откриваема чрез наблюдение с микроскоп на етапа на метафаза на клетъчното деление, наблюдавана като делеции и фрагменти, вътрешнохромозомни или междухромозомни промени.
1.3. ПРИНЦИП НА МЕТОДА НА ТЕСТА
Животни се експонират на тестваното вещество по подходящ начин и се убиват в подходящи моменти след третирането. Преди убиването животните се третират с блокиращ метафазата агент (напр. колхицин или Колцемид®). След това се приготвя хромозомен препарат от клетки на зародиш, оцветява се и клетките в метафаза се анализират за хромозомни аберации.
1.4. ОПИСАНИЕ НА МЕТОДА НА ТЕСТА
1.4.1. Подготовка
1.4.1.1. Подбор на животинския вид
Мъжките китайски хамстери и мишки са общо използваните. Обаче мъжки индивиди от друг подходящ вид бозайници също биха могли да се използват. За теста следва да се вземат общо използваните лабораторни щамове на млади, здрави, пораснали животни. В началото на изследването вариациите в теглото на животните следва да са минимални и да не превишават ± 20 % от средното тегло.
1.4.1.2. Условия на отглеждане и хранене
Прилагат се общите условия в Общото въведение към част Б, въпреки че целта е влажността на въздуха да е 50—60 %.
1.4.1.3. Подготовка на животните
Здрави, млади, пораснали животни от мъжки пол се отделят на произволен принцип за контролните и опитните групи. Клетките следва да се подредят така, че да се намалят до минимум евентуалните ефекти от разполагането им. На животните се дава уникална идентифакация. Животните се аклиматизират към лабораторните условия поне пет дни преди началото на изследването.
1.4.1.4. Приготвяне на дози
Твърдите вещества за теста следва да се разтворят или суспендират в подходящи разтворители или носители и, ако следва, да се разредят преди даване на дозата на животните. Течните вещества за теста могат да се дават директно или да се разредят преди дозиране. Следва да се използват пресни препарати на тестваното вещество, освен ако данните за стабилността му не показват, че може да се съхранява.
1.4.2. Условия за провеждане на теста
1.4.2.1. Разтворител/носител
Разтворителят/носителят не следва да има токсично въздействие с използваните нива на дозиране, а също така не следва да има съмнения за химическа реакция между него и тестваното вещество. Ако се използват други, освен добре познатите разтворители/носители, включването им в теста следва да се подкрепи от данни за съвместимостта им. Препоръчва се, винаги когато е възможно, първо да се разглежда възможността за прилагането на воден разтворител/носител.
1.4.2.2. Контроли
Във всеки тест следва да се включват паралелни положителни и отрицателни (разтворител/носител) контроли. Като се изключи третирането с тестваното вещество, с животните в контролните групи следва да се борави по един и същи начин както с животните от опитните групи.
Положителните контроли следва да произвеждат структурни хромозомни аберации in vivo в сперматогониални клетки, когато се администрират при нива на експозиция, при които се очаква да се постигне забележимо увеличение спрямо фона.
Положителните контролни дози следва да са така избрани, че ефектите да са ясни, но да не разкриват непосредствено на четеца идентичността на кодираните предметни стъкла. Приемливо е положителните контроли да се администрират по различен начин от тестваното вещество и да им се взема проба само еднократно. Освен това за положителна контрола следва да се разглежда използването на химикали, принадлежащи към химичен клас, когато такива са налични. Примерите за положителни контролни вещества включват:
|
Вещество
|
САS №
|
ЕINЕСS №
|
|
циклофосфамид
циклофосфамид монохидрат
|
50-18-0
6055-19-2
|
200-015-4
|
|
Циклохексамин
|
108-91-8
|
203-629-0
|
|
Митомицин С
|
50-07-7
|
200-008-6
|
|
Акриламид мономер
|
79-06-1
|
201-173-7
|
|
Триетиленмеламин
|
51-18-3
|
200-083-5
|
За всяко вземане на проби следва да се включват отрицателните контроли, третирани само с разтворител или носител, а за всичко останало третирани както опитните групи, освен ако няма приемлива изменчивост между животните и честотите на клетки хромозомни аберации са доказани с исторически контролни данни от предишни изследвания. Освен това следва също да се използват нетретирани контроли, освен ако няма данни от предишни контролни изследвания или публикувани контролни данни, показващи, че няма никакви делеционни или мутагенни ефекти, индуцирани от избрания разтворител/носител.
1.5. ПРОЦЕДУРА
1.5.1 Брой на животните
Всяка опитна и контролна група следва да включва най-малко пет анализируеми мъжки животни.
1.5.2. График на третиране
За предпочитане е тестваните вещества да се администрират веднъж или два пъти (т.е. като едно или две третирания). Тестваните вещества могат също да се администрират като разделена доза, т.е. две третирания в един и същи ден, разделени от не повече от няколко часа, за да се улесни даването на голям обем материал. Други режими на дозиране следва да се обосноват научно.
В групата с най-висока доза проби се вземат два пъти след третирането. Тъй като кинетиката на клетъчния цикъл може да се повлияе от тестваното вещество, практикува се едно ранно и едно късно вземане на проба около 24 и 48 часа след третирането. За дози, различни от най-високата, проба се взема на 24 часа или 1,5 пъти продължителността на клетъчния цикъл, освен ако не е известно друго време за вземане на проба, по-подходящо за откриване на ефектите (6).
Освен това могат да се използват други времена на вземане на проби. Например когато се използват химикали, които могат да индуцират хромозомно изоставане или могат да предизвикат S-независими ефекти, по-ранните периоди на вземане проби могат да бъдат по-подходящи (1).
Доколко е уместно използването на повторен график на третиране следва да се идентифицира за всеки случай поотделно. След повторен график на третиране животните следва да бъдат убити 24 часа (1,5 пъти от продължителността на клетъчния цикъл) след последното третиране. При необходимост могат да се прилагат допълнителни периоди на вземане на проби.
Преди убиването животните се инжектират интраперитонеално с подходящо блокиращо метафазата вещество (напр. Колцемид® или колхицин). След това, след подходящ интервал, от животните се взема проба. За мишки този интервал е приблизително 3—5 часа, за китайски хамстери той е около 4—5 часа.
1.5.3. Нива на дозиране
Ако се извършва изследване за обхват, поради това че няма в наличност подходящи данни, то следва да се извърши в същата лаборатория, като се използват същият вид, щам, пол и режим на третиране както в главното изследване (7). Ако има токсичност, за първото вземане на проба се използват три нива на дозиране. Тези нива на дозиране следва да обхващат от максимална до слаба или липса на токсичност. При вземане на проба на по-късен етап следва да се прилага само най-високата доза. Най-високата доза се дефинира като доза, създаваща признаци на такава токсичност, че по-високи нива на дозиране, базирани на същия режим, би могло да се очаква да доведат до леталност.
Вещества със специфични биологични активности при ниски, нетоксични дози (като хормони и митогени) могат да бъдат изключения за критериите за определяне на дозата и следва да се оценяват за всеки конкретен случай. Най-високата доза може също да се дефинира като доза, която показва известни признаци на токсичност в сперматогониалните клетки (напр. намаляване на съотношението на сперматогониални митози спрямо първата и втората метафаза на клетъчното деление; това намаляване не следва да надвишава 50 %).
1.5.4. Граничен тест
Ако тест с едно ниво на дозиране от минимум 2 000 mg/kg телесно тегло/ден при еднократно третиране или две третирания в един и същи ден не дава забележими токсични ефекти, а генотоксичност не би могла да се очаква на базата на данни от структурно свързани вещества, то тогава пълно изследване с три нива на дозиране може да не се счита за необходимо. Очакваната експозиция на хора може да покаже, че е необходимо в граничния тест да се използва по-високо ниво на дозиране.
1.5.5. Администриране на дозите
Тестваното вещество обикновено се дава със стомашна сонда, като се използва тръба или подходяща интубационна канюла, или чрез интраперитонеална инжекция. Други начини на експозиция са приемливи, ако могат да бъдат обосновани. Максималният обем течност, който може да се вкара еднократно със стомашна сонда или инжекция, зависи от големината на опитното животно. Обемът не следва да превишава 2 ml/100 g телесно тегло. Обеми, по-високите от тези, следва да се обосноват. С изключение на дразнещи или корозивни вещества, които нормално дават изострящи ефекти при по-високи концентрации, променливостта на тестовия обем следва да се сведе до минимум чрез регулиране на концентрацията с цел осигуряване на постоянен обем на всички нива на дозиране.
1.5.6. Подготовка на хромозомите
Незабавно след убиване на животните от един или двата тестиса се приготвят клетъчни суспензии, експонират се на хипотоночен разтвор и се фиксират. Клетките се разнасят по предметни стъкла и се оцветяват.
1.5.7. Анализ
За всяко животно следва да се анализират най-малко 100 добре разнесени метафази (т.е. минимум 500 метафази на група). Този брой може да се намали, когато се наблюдават голям брой аберации. Всички предметни стъкла, включително и тези на положителни и отрицателни контроли, следва да се кодират независимо едно от друго преди микроскопския анализ. Тъй като процедурите по фиксиране водят до разкъсване на част от метафазите със загуба на хромозоми, отчетените клетки следва да съдържат известен брой центромери, равни на броя 2n ± 2.
2. ДАННИ
2.1. ОБРАБОТКА НА РЕЗУЛТАТИТЕ
Индивидуалните данни за животните следва да се представят в таблица. Експерименталната единица е животното. За всяко изследвано животно отделно се оценява броят клетки със структурни хромозомни аберации и хромозомни аберации на клетка. Следва да се попоказват различните типове структурни хромозомни аберации с броя и честотота им за опитните и контролните групи. Празнините се записват отделно и докладват, но принципно не се включват в общата честота на аберациите.
Ако се наблюдава митоза, както и мейоза, следва да се определи съотношението на сперматогониалните митози спрямо първата и втора мейотични метафази като мярка за цитотоксичността за всички опитни животни и тези от отрицателните контроли в обща проба от 100 делящи клетки на животно, за да се установи евентуален цитотоксичен ефект. Ако се наблюдава само митоза, митозният индекс следва да се определи в минимум 1 000 клетки за всяко животно.
2.2. ОЦЕНКА И ТЪЛКУВАНЕ НА РЕЗУЛТАТИТЕ
Има няколко критерия за определяне на положителен резултат, като свързано с дозата увеличение в броя клетки хромозомни аберации или явно увеличение в броя на клетки с аберации при еднократна доза и еднократно вземане на проба. Първо следва да се вземе предвид биологичната значимост на резултатите. При оценката на резултатите от теста като помощно средство е възможно използването на статистически методи (8). Статистическата значимост не следва да е единственият решаващ фактор за положителна реакция. Двузначните резултати следва да се изяснят чрез допълнителни тестове, като за предпочитане е да се изменят условията на експеримента.
Тествано вещество, за което резултатите не удовлетворяват горните критерии, се счита немутагенно в настоящия тест.
Въпреки че повечето експерименти дават ясно положителни или отрицателни резултати, в редки случаи наборът данни изключва възможността да се направи категорична преценка за активността на тестваното вещество. Резултатите могат да останат двузначни или под въпрос, независимо от това колко пъти е повторен опитът.
Положителните резултати от теста in vivo за сперматогониални хромозомни аберации показват, че тестваното вещество индуцира структурни хромозомни аберации в зародишните клетки на тествания вид. Отрицателните резултати показват, при условията за провеждане на теста, че тестваното вещество не индуцира хромозомни аберации в зародишните клетки на тествания вид.
Следва да се обсъди вероятността тестваното вещество или метаболитите му да достигнат тъканта, която е обект на изследването.
3. ДОКЛАДВАНЕ
ДОКЛАД ЗА ТЕСТА
Докладът за теста трябва да включва следната информация:
|
|
Разтворител/носител:
|
—
|
обосновка за избора на носител,
|
|
—
|
разтворимост и стабилност на тестваното вещество в разтворител/носител, ако са известни.
|
|
|
|
Опитни животни:
|
—
|
брой и възраст на животните,
|
|
—
|
източник, условия на отглеждане, начин на хранене и др.
|
|
—
|
индивидуално тегло на животните в началото на теста, в т.ч. обхват на телесното тегло, средни стойности и стандартно отклонение за всяка група.
|
|
|
|
Условия за провеждане на теста:
|
—
|
основна причина за определяне времето на убиване на животните,
|
|
—
|
данни от изследването за установяване на обхват, ако е проведено,
|
|
—
|
основна причина за избора на нивото на дозата,
|
|
—
|
подробности за приготвянето на тестваното вещество,
|
|
—
|
подробности за администрирането на тестваното вещество,
|
|
—
|
основна причина за определяне на момента на убиване на животните
|
|
—
|
преминаване от концентрация (ррm) на тестваното вещество в храната/питейната вода към действителната доза (mg/kg телесно тегло), ако е приложимо,
|
|
—
|
подробности за качеството на храната и водата,
|
|
—
|
подробно описание на графиците на третиране и вземане на проби,
|
|
—
|
методи на измерване на токсичността,
|
|
—
|
идентичност на блокиращото метафазата вещество, концентрация и времетраене на третирането,
|
|
—
|
методи на приготвяне на предметно стъкло,
|
|
—
|
критерии за отчитане на аберации,
|
|
—
|
брой анализирани клетки/животно,
|
|
—
|
критерии за считане на изследванията положителни, отрицателни или двусмислени.
|
|
|
|
Резултати:
|
—
|
признаци на токсичност,
|
|
—
|
съотношение на сперматогониалните митозни клетки към първата и втора мейотична метафаза,
|
|
—
|
тип и брой на аберациите, дадени отделно за всяко животно,
|
|
—
|
общ брой аберации на група,
|
|
—
|
брой на клетки с аберации на група,
|
|
—
|
взаимоотношение доза—реакция, където е възможно,
|
|
—
|
статистически анализи, ако има такива,
|
|
—
|
паралелни отрицателни контролни данни,
|
|
—
|
отрицателни контролни данни от предишни изследвания с обхвати, средни стойности и стандартни отклонения,
|
|
—
|
паралелни положителни контролни данни,
|
|
—
|
промени в плоидията, ако се забелязват.
|
|
|
|
Обсъждане на резултатите.
|
4. ПРЕПРАТКИ
|
(1)
|
Adler, I. D. (1986), Clastogenic Potential in Mouse Spermatogonia of Chemical Mutagens Related to their Cell-Cycle Specifications, in: Genetic Toxicology of Environmental Chemicals, Part B: Genetic Effects and Applied Mutagenesis, Ramel, C, Lambert B., and Magnusson, J. (eds.) Liss, New York, pp. 477—484.
|
|
(2)
|
Adler, I. D. (1984), Cytogenic tests in Mammals, in: Mutagenicity Testing: a Practical Approach, ed. S. Venitt and J. M. Parry, IRL Press, Oxford, Washington DC, pp. 275—306.
|
|
(3)
|
Evans, E. P., Breckon, G. and Ford, C. E. (1964), An Air-Drying Method for Meiotic Preparations from Mammalian Testes, Cytogenetics and Cell Genetics, 3, pp. 289—294.
|
|
(4)
|
Richold, M., Ashby, J., Chandley, A., Gatehouse, D. G. and Henderson L. (1990), In Vivo Cytogenetic Assays, in: D. J. Kirkland (ed.), Basic Mutagenicity Tests, UKEMS Recommended Procedures. UKEMS Subcommittee on Guidelines for Mutagenicity Testing. Report. Part I revised, Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, pp. 115—141.
|
|
(5)
|
Yamamoto, K. and Kikuchi, Y. (1978), A New Method for Preparation of Mammalian Spermatogonial Chromosomes, Mutation Res., 52, pp. 207—209.
|
|
(6)
|
Adler, I. D., Shelby, M. D., Bootman, J., Favor, J., Generoso, W., Pacchierotti, F., Shibuya, T. and Tanaka, N. (1994), International Workshop on Standardisation of Genotoxicity Test Procedures. Summary Report of the Working Group on Mammalian Germ Cell Tests, Mutation Res., 312, pp. 313—318.
|
|
(7)
|
Fielder, R. J., Allen, J. A., Boobis, A. R., Botham, P. A., Doe, J., Esdaile, D. J., Gatehouse, D. G., Hodson-Walker, G., Morton, D. B., Kirkland D. J. and Richold, M. (1992), Report of British Toxicology Society/UK Environmental Mutagen Society Working group: Dose setting in In Vivo Mutagenicity Assays, Mutagenesis, 7, pp. 313—319.
|
|
(8)
|
Lovell, D. P., Anderson, D., Albanese, R., Amphlett, G. E., Clare, G., Ferguson, R., Richold, M., Papworth, D. G. and Savage, J. R. K. (1989), Statistical Analysis of In Vivo Cytogenetic Assays, in: D. J. Kirkland (ed.), Statistical Evaluation of Mutagenicity Test Data. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing, report, Part III, Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, pp. 184—232.
|
Б.24. ИЗПИТВАНЕ ЗА ПЕТНА ПО КОЗИНАТА ПРИ МИШКИ
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Вижте Общо въведение част Б.
1.2. ОПРЕДЕЛЕНИЕ
Вижте Общо въведение част Б.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Няма.
1.4. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Това е изпитване in vivo върху мишки, при който развиващите се зародиши се подлагат на експозиция на химически вещества. Целевите клетки в развиващите се зародиши са меланобластите, а целевите гени са тези, които контролират пигментирането на космите на козината. Развиващите се зародиши са хетерозиготни по много от тези гени за цвета на козината. Една мутация в доминантния алел или загуба на доминантния алел на такъв ген в меланобластна клетка (причинени от разнообразни генетични събития) водят до изява на рецесивния фенотип в клетките потомци, което се изразява в петно с променен цвят по козината на получената мишка. Оценява се броят на потомството с такива петна (т.е. мутации) и честотата им се сравнява с тази сред поколението, получено от зародиши, които са третирани само с разтворител. Изпитването за петна по козината при мишки открива предполагаеми соматични мутации във феталните клетки.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Няма.
1.6. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
Подготовка
Когато е възможно, изпитваните вещества трябва да бъдат разтворени или суспендирани в изотоничен физиологичен разтвор. Неразтворимите във вода химически вещества могат да бъдат разтворени или суспендирани в подходящи носители. Използваният носител не трябва да оказва влияние върху изпитваното химическо вещество, нито да предизвиква токсични ефекти. Трябва да се използват прясно приготвени препарати от изпитваните химически вещества.
Експериментални животни
Мишки от породата T (nonagouti, a/a; chinchilla, pink eye, cch p/cchp; brown, b/b; dilute, short ear, d se/d se; piebald spotting, s/s) са чифтосани с породата HT (pallid, nonagouti, brachypody, pa a bp/pa a bp; leaden fuzzy, ln fz/ln fz; pearl pe/pe) или C57BL (nonagouti, a/a). Могат да се използват други подходящи кръстоски, например между NMRI (nonagouti, a/a; albino, c/c) и DBA (nonagouti, a/a; brown, b/b; dilute d/d), при условия че от тях се получава потомство неагути.
Брой и пол
Третират се достатъчно на брой бременни женски индивиди, за да се получи подходящ брой преживяващо поколение за всяко използвано ниво на дозиране. Подходящата големина на извадката зависи от броя на наблюдаваните петна при третираните мишки и от количеството контролни данни. Отрицателният резултат е приемлив само ако се оценяват най-малко 300 индивида от потомството на женските животни, третирани с най-високата доза.
Използване на отрицателни и положителни контроли
Трябва да има паралелни контролни данни от мишки, третирани само с носител (отрицателни контроли). От историческите контролни данни от същата лаборатория може да се направи пул, за да се повиши чувствителността на изпитването, при условие че тези данни са хомогенни. Ако не бъде открита мутагенност на изпитваното химическо вещество, трябва да съществуват новополучени положителни контролни данни за третиране с химическо вещество, за което е известно, че при това изпитване демонстрира мутагенност, от същата лаборатория.
Начин на прилагане
Обичайните начини на прилагане са чрез орално интубиране или интрапериотонеално инжектиране при бременните женски индивиди. Когато е целесъобразно, се използват третиране чрез инхалиране или други начини на прилагане.
Нива на дозиране
Използват се най-малко две нива на дозиране, включително едно, при което се наблюдават признаци на токсичност или намалена големина на котилото. За нетоксичните вещества трябва да се използва експозиция на максималната възможна доза.
Процедура
Нормално се провежда единично третиране на ден 8,9 или 10 от бременността, като за ден 1 се брои денят, на който за първи път се наблюдава вагинална запушалка. Тези дни съответстват на дни 7,25, 8,25 и 9,25 след зачеването. През тези дни може да се използва последователно третиране.
Анализ
Потомството се кодира и изследва за петна между три и четири седмици след раждането. Различават се три класа петна:
|
а)
|
бели петна на разстояние до 5 мм от средната коремна линия (WMVS), за които се смята, че се дължат на убийство на клетки;
|
|
б)
|
жълти, подобни на агути, петна, асоциирани с гръдните жлези, гениталиите, гърлото, аксиларните и ингвиналните области и по средата на челото, за които се смята, че се дължат на нарушена диференциация (MDS), и
|
|
в)
|
пигментирани и бели петна, случайно разпръснати по козината, за които се смята, че се дължат на соматични мутации (RS).
|
Отчитат се всичките три класа, но само един от тях, последният RS, има генетично значение. Проблемите с разграничаването между MDS и RS могат да бъдат разрешени с помощта на флуоресцентна микроскопия на проби от косми.
Трябва да се отбележат очевидните макроскопски аномалии при потомството.
2. ДАННИ
Данните се представят като общ брой на проследяваното потомство и брой на индивидите с едно или повече петна, за които се предполага, че се дължат на соматични мутации. Данните от третираните групи и отрицателните контроли се сравняват с помощта на подходящи методи. Данните се представят и за отделно котило.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
—
|
породите, използвани при кръстосването,
|
|
—
|
броят бременни женски животни в експерименталната и контролната група,
|
|
—
|
средната големина на котилото в експерименталната и контролната група при раждането и при отбиването,
|
|
—
|
нивото(ата) на дозиране на изпитваното химическо вещество,
|
|
—
|
използваният разтворител,
|
|
—
|
денят от бременността, на който е извършено третирането,
|
|
—
|
общият брой проследявано потомство и броят на животните с WMVS, MDS и RS в експерименталните и контролните групи,
|
|
—
|
микроскопските морфологични аномалии,
|
|
—
|
когато е възможно, връзката доза/отговор за RS,
|
|
—
|
обсъждане на резултатите,
|
|
—
|
интерпретиране на резултатите,
|
3.2. ОЦЕНКА И ИНТЕРПРЕТИРАНЕ
Вижте Общо въведение част Б.
4. ПРЕПРАТКИ
Вижте Общо въведение част Б.
Б.25. НАСЛЕДСТВЕНИ ТРАНСЛОКАЦИИ ПРИ МИШКИ
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Вижте Общо въведение част Б.
1.2. ОПРЕДЕЛЕНИЕ
Вижте Общо въведение част Б.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Няма.
1.4. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Изпитването за наследствени транслокации при мишки открива структурните и бройните изменения в хромозомите в зародишни клетки от бозайници, както се проявяват при потомството от първо поколение. Откриваните хромозомни изменения са от типа на реципрочните транслокации и, ако се включи женското потомство, загуба на X-хромозоми. Носителите на транслокации и женските индивиди с ХО-генотип демонстрират намалена плодовитост, която се използва за селекция на потомство от поколение F1 за цитогенетичен анализ. Пълно безплодие се причинява от определени типове транслокации (Х-автозомни и c-t-тип). Транслокациите се наблюдават цитогенетично в мейотичните клетки в метафаза I на диакинезата при мъжките индивиди от поколение F1, или мъжкото потомство на женските от поколение F1. Женските с ХО-генотип се идентифицират генетично по наличието само на 39 хромозоми при митозите в костния мозък.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Няма.
1.6. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
Подготовка
Изпитваните химически вещества се разтварят в изотоничен физиологичен разтвор. Ако са неразтворими, те се разтварят или суспендират в подходящи носители. Използват се прясно приготвени разтвори на изпитваното съединение. Ако за улесняване на дозирането се използва носител, той не трябва да влияе на изпитваното съединение, нито да предизвиква токсични ефекти.
Начин на прилагане
Обикновено начините на прилагане са орална интубация или интраперитонеално инжектиране. Може да са целесъобразни други начини на прилагане.
Експериментални животни
За улесняване на отглеждането и цитологичното потвърждаване тези експерименти се правят с мишки. Не е необходима конкретна порода мишки. Средната големина на котилото на породата, обаче, трябва да е по-голяма от осем и да бъде относително постоянна.
Използват се здрави полово зрели животни.
Брой на животните
Броят на необходимите животни зависи от честотата на спонтанните транслокации и от минималната честота на предизвикването, необходима за положителен резултат.
Изпитването обикновено се провежда посредством анализиране на мъжкото потомство F1. Трябва да се изследват най-малко по 500 мъжки индивида от поколението F1 за дозирана група. Ако се включват женските животни от поколение F1, необходими са 300 мъжки и 300 женски индивида.
Използване на отрицателни и положителни контроли
Трябва да съществуват адекватни данни, получени от паралелни и исторически контроли. Когато съществуват приемливи положителни контролни резултати от наскоро проведени в същата лаборатория експерименти, тези резултати могат да бъдат използвани вместо паралелна положителна контрола.
Нива на дозиране
Изпитва се едно ниво на дозиране, обикновено най-високата доза, свързана с предизвикване на минимални токсични ефекти, но без засягане на размножителното поведение или преживяването. За да се установи връзката доза/отговор, са необходими две допълнителни по-ниски дози. За нетоксичните вещества трябва да се използва експозиция на максималната възможна доза.
Процедура
Третиране и чифтосване
Съществуват две схеми за третиране. Най-широко се използва еднократното прилагане на изпитваното вещество. Може да се използва и прилагане на изпитваното вещество седем дни в седмицата в продължение на 35 дни. Броят на чифтосванията след третирането зависи от схемата на третиране и трябва да осигури вземане на проби от всички третирани стадии на развитие на зародишните клетки. В края на чифтосването женските животни се настаняват в индивидуални клетки. Когато женските родят, регистрират се датата, големината на котилото и полът на потомството. Цялото мъжко потомство се отбива и цялото женско потомство се изхвърля, освен ако не е включено в експеримента.
Изпитване за хетерозиготност на транслокациите
Използва се единият от два възможни метода:
|
—
|
изпитване за плодовитост на потомството F1 и последващо потвърждаване на възможните носители на транслокация чрез цитогенетичен анализ,
|
|
—
|
цитогенетичен анализ на всички мъжки индивиди от поколението F1 без предварителна селекция чрез изпитване за плодовитост.
|
|
а)
|
Изпитване за плодовитост
Намалената плодовитост на даден индивид от поколение F1 може да се установи чрез наблюдение на големината на котилото и/или анализ на съдържанието на матката при женските индивиди.
За използваната порода мишки трябва да бъдат установени критериите за определяне на нормална и намалена плодовитост.
Наблюдение на големината на котилото: Експерименталните мъжките индивиди от поколение F1 трябва да се настанят в индивидуални клетки с женски от същия експеримент или от колонията. Клетките се проверяват ежедневно от 18-ия ден след чифтосването. Големината на котилото и полът на потомството F2 се регистрират при раждането и след това котилата се изхвърлят. Ако се изследва женското потомство от поколение F1, потомството от поколение F2 от малките котила се запазва за допълнително изпитване. Женските носители на транслокации се потвърждават посредством цитогенетичен анализ на транслокациите в пялото им мъжко потомство. Женските животни с ХО-генотип се разпознават по измененото съотношение между половете в тяхното потомство от 1:1 на 1:2 мъжки към женски индивиди. При следваща процедура нормалните животни от поколение F1 се елиминират от допълнителното изпитване, ако първото котило от поколение F2 достигне или превиши предварително определена нормална големина. В противен случай се наблюдават второ или трето котило от поколение F2.
Животните от поколение F1, които не могат да бъдат класифицирани като нормални след наблюдение на до три котила от поколение F2, се изследват допълнително чрез анализ на съдържанието на матката на женските партньори или направо се подлагат на цитогенетичен анализ.
Анализ на съдържанието на матката: Намаляването на големината на котилото при носителите на транслокация се дължи на смърт на зародиши, така че големият брой мъртви имплантирани зародиши е показателен за наличието на транслокация при експерименталното животно. Всеки от експерименталните мъжки индивиди от поколение F1 се чифтосва с по две до три женски животни. Зачеването се установява чрез ежедневна сутрешна проверка за вагинални запушалки. Женските се пожертват 14 до 16 дни по-късно и се регистрират живите и мъртвите имплантирани зародиши в матките им.
|
|
б)
|
Цитогенетичен анализ
Препарати от тестиси се приготвят по техниката за изсушаване с въздух. Носителите на транслокации се идентифицират по наличието на мултивалентни конфигурации в метафаза I на диакинезата на първичните сперматоцити. За да се докаже, че едно животно е носител на транслокация, трябва да се наблюдават поне две клетки с мултивалентно асоцииране.
Ако не е извършвана селекция чрез кръстосване, всички мъжки индивиди от поколение F1 се анализират цитогенетично. Трябва да се направи микроскопски анализ на най-малко 25 клетки в метафаза I на диакинезата за мъжки индивид. При мъжките индивиди от поколение F1, които имат малки тестиси и мейотично разкъсване преди диакинезата, или при женски индивиди от поколение F1, за които се подозира, че имат ХО-генотип, трябва да се изследват митотичните метафази в сперматогонии или костен мозък. Наличието на необичайно дълга и/или къса хромозома във всяка една от 10 клетки свидетелства за особена транслокация, причиняваща безплодие при мъжките индивиди (с-t-тип). Някои Х-автозомни транслокации, които причиняват безплодие при мъжките индивиди, могат да бъдат идентифицирани само посредством анализ на ивиците на митотичните хромозоми. Наличието на 39 хромозоми при всички 10 митози свидетелства за наличие на ХО-генотип в женски индивид.
|
2. ДАННИ
Данните се представят в табличен вид.
За всяко чифтосване се съобщават средната големина на котилото и съотношението между половете от чифтосванията на родителите при раждането и при отбиването.
За оценка на плодовитостта на животните от поколение F1 се представят средната големина на котилото от всички нормални чифтосвания и големината на отделните котила на носителите на транслокации от поколение F1. За анализиране на съдържанието на матката се отчитат средният брой на живите и мъртвите имплантирани зародиши от нормалните чифтосвания и броят на живите и мъртвите имплантирани зародиши за всяко чифтосване поотделно за носителите на транслокации от поколение F1.
За цитогенетичен анализ на метафаза I на диакинезата се изброяват броят на типовете мултивалентни конфигурации и общият брой на клетките за всеки носител на транслокация.
За стерилните индивиди от поколение F1 се съобщават общият брой чифтосвания и продължителността на чифтосването. Дават се теглата на тестисите и подробности от цитогенетичния анализ.
За женските с ХО-генотип се съобщават средната големина на котилото, съотношението между половете в потомството F1 и резултатите от цитогенетичния анализ.
Когато евентуалните носители на транслокации от поколението F1 се селекционират предварително с помощта на изпитвания за плодовитост, таблиците трябва да включват информация за това колко от индивидите са потвърдени хетерозиготи по отношение на транслокацията.
Съобщават се данните от отрицателните контроли и положителните контролни експерименти.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
—
|
порода мишки, възраст на животните, тегло на третираните животни,
|
|
—
|
брой на животните от родителското поколение от всеки пол в експерименталните и контролните групи,
|
|
—
|
условия на изпитването, подробно описание на третирането, нива на дозиране, разтворители, схема на чифтосването,
|
|
—
|
брой и пол на потомството за един женски индивид, брой и пол на потомството, отгледано за анализ на транслокациите,
|
|
—
|
време и критерии за анализ на транслокациите,
|
|
—
|
брой и подробно описание на носителите на транслокации, включително данни за кръстосването и данни за съдържанието на матката, ако е необходимо,
|
|
—
|
цитогенетични процедури и подробности за микроскопския анализ, за предпочитане със снимки,
|
|
—
|
обсъждане на резултатите,
|
|
—
|
интерпретиране на резултатите.
|
3.2. ОЦЕНКА И ИНТЕРПРЕТИРАНЕ
Вижте Общо въведение част Б.
4. ПРЕПРАТКИ
Вижте Общо въведение част Б.
Б.26. ТЕСТВАНЕ НА СУБХРОНИЧНА ОРАЛНА ТОКСИЧНОСТ — 90-ДНЕВНО ИЗСЛЕДВАНЕ НА ТОКСИЧНОСТТА ПРИ ГРИЗАЧИТЕ С ПОВТАРЯЩА СЕ ДОЗА
1. МЕТОД
Този метод за изследване на субхроничната орална токсичност е точно копие на ОИСР TG 408 (1998).
1.1. ВЪВЕДЕНИЕ
Когато се извършва оценка и изчисление на токсичните характеристики на химикала, субхроничната токсичност, използваща повторни дози може да се определи, след като е била получена предварителна информация от токсичността от 28-дневни тестове на токсичността с акутна и повторена доза. 90-дневното изследване предоставя информация за възможните рискове за здравето, произтичащи по всяка вероятност от повтарящото се излагане за продължителен период от време, покриващ времето на узряване след отбиване от кърмене и развитието до пълнолетие. Това изследване предоставя информация за основните ефекти от токсичността, посочва засегнатия орган и възможността за акумулиране, както и може да предостави оценка за нивото на ненаблюдавано вредно въздействие при излагане, която може да се използва при определена доза за хронично изследване и за създаване на критерии за защита при излагане на хората.
Този метод допълнително набляга на неврологичните окончания и отбелязва въздействията върху имунната и репродуктивната системи. Набляга се и върху нуждата от обстойни клинични наблюдения, правени над животни с цел да се получи колкото е възможно повече информация. Такова изследване позволява индентификация на химикалите, които може да въздействат върху невротоксични, имунни и репродуктивни органи и което може да даде основание за по-нататъшни и по-дълбоки изследвания.
Вижте Общо въведение част Б.
1.2. ОПРЕДЕЛЕНИЯ
Доза: е определено количество извлечено вещество, дадено за тестване. Дозата се изразява като тегло (g, mg) или като тегло на тестваното вещество върху определена единица тегло от тестваното животно (т.е. mg/kg), или като постоянни диетични концентрации (pрm).
Дозировка: е обобщен термин състоящ се от отделните дози, тяхната честота и продължителност.
NOAEL: е абревиатура за ниво на ненаблюдавано неблагоприятно въздействие и е най-високото ниво на дозиране, където не се наблюдават неблагоприятни открития, свързани с третирането.
1.3. ПРИНЦИПИ НА МЕТОДА ЗА ТЕСТВАНЕ
Веществото, което се тества, се приема всекидневно през устата в последователни дози от няколко групи от експериментални животни, посредством едно ниво на дозиране за една група за период от 90 дни. По време на периода на приемането животните се наблюдават отблизо за появяване на признаци на токсичност. В края на изследването се прави аутопсия на животните, които са умрели или са убити по време на извършването на опитите, а при завършването на изследването, оцелелите животни също се убиват и се извършва аутопсия.
1.4. ОПИСАНИЕ НА МЕТОДА ЗА ТЕСТВАНЕ
1.4.1. Подготовка на животните
Използват се здравите животни, които са приспособени към лабораторните условия за период от поне пет дена и които не са били обект на предишно експериментални процедури. Животните, които се използват при извършване на изследването, се характеризират според вида, рода, източника, пола, теглото и/или годините. Животните се разпределят случайно на контролни групи и групи за обработване. Клетките се подреждат така, че да се да се сведат до минимум възможните влияния, получени в резултата от разположението на клетките. За всяко животно се определя уникален идентификационен номер.
1.4.2. Подготовка на дозите
Веществото, което се изследва, се приема през тръбичка или при хранителен режим или чрез питейната вода. Методът на приемане на веществото през устата се определя в зависимост от целите на изследването и физичните/химични свойства на тествания материал.
При необходимост веществото, което се изследва, се разтваря или суспендира в подходящ разтворител. Където е възможно се препоръчва първо употребата на воден разтвор/суспензия, последвана от петролен разтвор/емулсия, след което е възможен разтвор с други разтворители. Трябва да се познати токсичните характеристики на разтворителите, различни от вода. По време на процеса на приемане се определя и устойчивостта на веществото, което се изследва.
1.4.3. Условия, при които се извършва теста
1.4.3.1. Опитни животни
Предпочитаните видове са плъхове, въпреки че могат да се използват и други видове от гризачи, например мишки. Употребяват се родовете от млади, здрави, възрастни животни, които обичайно се използват в лабораториите. Женските индивиди трябва да не са раждали и да не са бременни. Дозирането започва колкото е възможно по-скоро след отбиването на животното и при всички случаи преди то да е навършило девет седмици. При започване на изследването измененията в теглото на използваните животни следва да бъде минимално и да не надвишава 20 % от средното за всеки пол тегло. Когато изследването се провежда като предварително по отношение на следващо дългосрочно изследване на хроничната токсичност, и за двете изследвания следва да се използват животни от същия род и източник.
1.4.3.2. Брой и пол
Поне 20 животни (10 женски и 10 мъжки) следва да се използват при всяко ниво на дозиране. Ако се планира умъртвяване на животни, преди завършването на изследването, броят им се увеличава в зависимост от броя на животните, които са планирани да бъдат умъртвени. Въз основа на предишни познания върху химикала или върху близък до него аналог се разглежда въпроса относно включването на допълнителна придружаваща група от 10 животни (по пет за всеки пол), поставени в контролната група и в групата с най-висока доза за наблюдаване, след периода на третиране, на способността за реверсиране и устойчивостта на всякакви токсични въздействия. Продължителността на периода след обработката се определя по подходящ начин с оглед наблюдаваните въздействия.
1.4.3.3. Нива на дозите
Използват се поне три нива дози и една за едновременен контрол, с изключение на случаите, когато се извършват ограничени тестове (виж 1.4.3.4). Нивата на дозите може да са основани на резултатите от повтаряната доза или на обем от сведения, получени от проучвания и се вземат предвид всички съществуващи токсикологични и токсико-кинетични данни за тестваното вещество или съответните материали, които са на разположение. Освен ограничена от физико-химичната природа или биологичните въздействия на тестваното вещество, най-високото ниво на дозата се избира с цел да се намали токсичността, но не и смъртта или ужасното страдание. Избира се намаляваща последователност на нивата на дозата с оглед да се покажат всички ответни реакции и ненаблюдаваното неблагоприятно въздействие (NOAEL) на най-ниското ниво на дозата. Два от четирите затворени интервала са често оптимални за поставяне на намаляващите нива на дозата и допълнението от четвърта групи за тестване често се предпочита, за да се използват големи интервали (например повече от един фактор от около 6—10) между дозирането.
Контролната група е група, която не е третирана или групата за контрол на разтворителя, при условие че разтворителят се използва при приемане на веществото, което се изследва. С изключение на самата обработка с веществото, което се изследва, животните в контролната група се третират по същия начин като тези от групите за тестване. Ако се използва разтворител, контролната група получава най-високото използвано количество от разтвора. Ако тестваното вещество се приема чрез хранителен режим и причини намалено приемане на храна, тогава една контролна група за сверяване може да бъде полезна при правенето на разлика между намаляването в резултат на липсата на вкус или токсикологични изменения при модела за изследване.
Когато е целесъобразно, се разглеждат следните характеристики на разтвора или други адитивни свойства: въздействия върху абсорбцията, разпределението, метаболизма или задържане на веществото, което се изследва; въздействия върху химичните свойства на веществото, което се изследва, което може да измени неговите токсикологични характеристики; и въздействия върху консумацията на храна и вода или хранителния статус на животните.
1.4.3.4. Ограничен тест
Ако тест, при ниво на дозата, равна на поне 1 000 mg/kg телесно тегло на ден, който използва процедурите, описани за това изследване, причинява ненаблюдавани неблагоприятни въздействия и ако въз основа на данни от вещества, отнасящи се до структурата, не се очаква токсичност, то пълното проучване с използване на трите нива дози не може да се счита за необходимо. Ограниченият тест се прилага, с изключение когато излагането на човека подсказва нуждата от използване на по-високо ниво доза .
1.5. ПРОЦЕДУРА
1.5.1. Приемане на дозите
Животните приемат дозата от тестваното вещество всеки ден в продължение на седем дни, всяка седмица за периода от 90 дни. Посочват се причините за използването на всеки друг режим на приемане на дозата, например от 5 дни. Когато вещество се приема при хранене с тръбичка, това става като една доза се дава на животното чрез стомашна тръба или подходяща интубационна канула. Максималното количество течност, което може да бъде прието наведнъж, зависи от размера на тестваното животно. Количеството не може да превишава 1 ml/100 g телесно тегло, освен в случаите на воден разтвор, когато могат да се използват 2 ml/100g телесно тегло. Освен в случаите на дразнещи и корозивни вещества, които нормално ще показват засилени въздействия с висока концентрация, променливостта в количеството се намалява до минимум чрез регулиране на концентрацията за да се осигури постоянно количество при всички нива на дозиране.
За вещества, които се приемат чрез хранителен режим или вода за пиене, е важно да се гарантира, че количеството използвано вещество за изследване не въздейства върху нормалното хранене и водния баланс. Когато веществото, което се изследва се приема чрез хранителен режим, може да се използват или постоянна хранителна концентрация (ррm) или постоянно ниво на доза от гледна точка на телесното тегло на животното; трябва да се определи използваният алтернативен вариант. За вещество, което се приема при хранене с тръбичка, дозата се дава по едно и също време всеки ден и е пригодена, в случаи на необходимост, да поддържа постоянно ниво на дозата с оглед телесното тегло на животното.Когато 90-дневното изследване се използва като предварително по отношение на дългосрочно изследване на хроничната токсичност, и при двете изследвания следва да се използва един и същ хранителен режим.
1.5.2. Наблюдения
Периодът на наблюдение е най-малко 90 дни. Животните от придружаващата група, които са разпределени за следващи наблюдения, се запазват за подходящ период без да бъдат третирани с цел да се уточни устойчивостта им или възстановяването от токсичните въздействия.
Поне един път на ден следва да се правят основни клинични наблюдения, за предпочитане по едно и също време, като се разглежда максималния период на предвидените въздействия след получаване на дозата. Клиничните условия, при които живеят животните, следва да се описват. Поне два пъти на ден, обикновено в началото и в края на деня, всички животни се оглеждат за проявени признаци на заболеваемост или смъртност.
Поне един път преди първото излагане (с цел да е възможно сравнение в рамките на обекта) и след това поне веднъж в седмицата на всички животни следва да се правят подробни клинични изследвания. Тези изследвания се правят извън клетката, която обитава животното, за предпочитане в стандартна обстановка и във всички случаи по едно и също време. Тези изследвания се описват внимателно, за предпочитане се използват изчислителни системи, изрично определени от лабораторията, която извършва теста. Полагат се необходимите усилия, за да се гарантира, че променливостта в условията за наблюдаване и минимална. Забелязаните признаци следва да включват, но не и да се ограничават само с: изменения в кожата, козината, очите, лигавиците, появяване на секреции и екскреция и органична независима активност (например лакримация, пило-ерекция, размер на зеницата, необикновена респираторна схема). Записват се също и изменения в походката, стойката и чувствителност при маневриране, както и наличието на спазми или свивания на мускулите, стереотипа (например остатъчно дращене, повтарящо се обикаляне в кръг) или странно държание (например самоосакатяване, вървене назад) (1).
Преди приемането на веществото, което се изследва и при приключването на изследването, се прави офталмологичен преглед чрез използване на офталмоскоп или равнозначно подходящо оборудване, за предпочитане на всички животни, но поне при групата с най-високо ниво доза и контролната група. Ако се открият изменения при очите, всички животни се подлагат на преглед.
Към края на изследването и във всички случаи не по-рано от единадесетата седмица, се проверява чувствителната реактивност по отношение на различни видове стимуланти (1) (например слухови, визуални и проприосептични стимуланти) (2), (3), (4), оценка на силата при хващане (5) и оценка на двигателната активност (6). Допълнителни уточнения по процедурите, които могат да се следват, са дадени в съответните препратки. Въпреки всичко могат да се използват и алтернативни процедури, различни от тези, към които се препраща.
Проведените в края на изследването функционални наблюдения могат се пропуснат, когато са на разположение данните от функционалните наблюдения от други изследвания и когато всекидневните клинични наблюдения не показват никакви функционални недостатъци.
По изключение, функционалните наблюдения могат също да се избегнат за групи, които иначе показват признаци на токсичност в размер, който значително би попречил на извършването на функционалния тест.
1.5.2.1. Телесно тегло и консумация на храна/вода
Теглото на всички животни следва да се измерва поне един път в седмицата. Консумацията на храна също се измерва един път седмично. Ако веществото, което се изследва, се приема чрез водата за пиене, един път в седмицата се измерва и консумацията на вода. Консумацията на вода може също да се вземе предвид при проучвания на хранителния режим или при хранене с тръбичка, когато питейната активност може да се измени.
1.5.2.2. Хематология и клинична биохимия
Ако е приложимо, при определени условия се вземат и се запазват кръвните проби от избран обект. В края на изследването пробите се събират точно преди или като част от процедурата по умъртвяването на животните.
В края на изследването и когато могат да се съберат някои промеждутъчни кръвни проби, се правят и следните хематологични изследвания: хематокрит, концентрация на хемоглобин, брой на еритроцитите, общ и отделен брой на левкоцитите, брой на тромбоцитите и измерване на времето на съсирване/възможно.
За да се изследват основните токсични въздействия върху тъканите, и по-специално въздействията върху бъбреците и черния дроб, върху кръвните проби, взети от всяко животно точно преди или като част процедурата по умъртвяване на животните (като част от тези, които са намерени умиращи и/или междувременно умъртвени), се извършват клинични биохимични изследвания. По подобен на хематологичните изследвания начин, може между другото да се вземат проби и за клиничен биохимичен тест. Препоръчва се в нощта преди вземането на кръвните проби да не се дава на животните месо за консумиране (3). Изследванията на плазма и серум следва да включват натрий, калий, глюкоза, холестероли, карбамид, хелио-азотен карбамид, креатинин, протеини и албумини и повече от два ензими, показващи чернодробно-клетъчно въздействия (като аланин аминотрансфераза, аспарат аминотрансфераза, алкална фосфатаза, гама глутамил траспепидаза, сорбитолна дехидрогеназа). Може да се включат и изследвания на с допълнителни ензими (на хепатит или с друг произход) и жлъчни киселини, които могат да дадат полезна информация при определени обстоятелства.
По избор през последната седмица от изследването може да се направят изследвания на урината, като се използва синхронно събраното количество урина: външен вид, количество, осмоза и относително тегло, рН, протеини, глюкоза и кръв/кръвни клетки.
Като допълнение следва да се предвидят проучвания на маркерите за серума на основните увреждания на тъканите. Други изчисления се извършват, ако познатите свойства на тестваното вещество могат или се подозира, че могат да въздействат върху съответните метаболитни профили включително калций, фосфор, постни триглицериди, специфични хормони, метамоглобин и холистераза. Тези изчисления е нужно да се определят за химикалите от определени класове или въз основа на всеки отделен случай.
Накрая има нужда от гъвкав подход, в зависимост от видовете и от наблюдаваното и/или очаквано въздействие от всяко дадено вещество.
Ако основните сведения са недостатъчни, следва да се вземе предвид дали е необходимо хематологичната или клиничната биохимична променливост да се определят преди започване на приемането на дозите; по принцип не се препоръчва тези данни да се генерират преди третирането (7).
1.5.2.3. Обща аутопсия
Всички животни, подложени на експеримент, са обект на пълна, подробна аутопсия, която включва внимателен преглед на външната повърхност на тялото, всички отвори и мозъчната, гръдната и коремната кухини и тяхното съдържание. Черният дроб, бъбреците, надбъбречните жлези, тестисите, епидимидите, матката, яйчниците, тимуса, далака, мозъка и сърцето на всички животни (без тези, които са намерени заболели и/или са междувременно умъртвени) се почистват от полепналите по тях тъкани, когато е целесъобразно, и след дисекцията колкото е възможно по-скоро се измерва тяхното мокро тегло за да се избегне изсушаването.
Следните тъкани се запазват при най-подходящата консервираща среда за вида тъкан и за очакваните последващи хистопатологични изследвания: общи наранявания, мозък (представени области включващи главен, малък и костен мозък, гръбначен мозък (на три нива: шиен, среден и лумбален), хипофизна жлеза, щитовидна жлеза, паратироид, тимус, хранопровод, слюнчени лимфни жлези, стомах, дебели и тънки черва (включително Пайеровите плочки), черен дроб, панкреас, бъбреци, надбъбречните жлези, далака, сърцето, трахеята и белия дроб (запазени чрез надуване с фиксатор и след това потапяне в течност), аорта, гонадите, матката, вторични полови органи, женски млечни жлези, простата, пикочен мехур, жлъчен мехур (мишка), лимфни възли (за предпочитане един лимфен възел, по пътя на приемането и друг по-далече от него, за да се покрият и систематичните въздействия), периферни нерви (седалище и пищял) за предпочитане близо до мускул, разрез на кост с костен мозък (и/или кост с изваден костен мозък), кожата и очите (ако са наблюдавани изменения по време на офталмологичните изследвания). Клиничните и другите сведения могат да посочат необходимостта от допълнителни изследвания на тъканите. Всички други органи, които на основата на познатите свойства на тестваното вещество, се считат за вероятни обекти, също се запазват.
1.5.2.4. Хистопатология
Пълна хистопатология се извършва на запазените органи и тъкани на всички животни от контролните групи и групите с висока доза. Тези прегледи следва да се приложат и за животните от всички други групи, получили дозата, ако се наблюдават изменения в резултат от третирането на групата с най-високо доза.
Преглеждат се всички общи наранявания.
Когато се използва придружаваща група, хистопатология се извършва на тъканите и органите с показано въздействие в третираните групи.
2. ДАННИ И ДОКЛАДВАНЕ
2.1. ДАННИ
Предоставят се индивидуални данни. Допълнително се синтезират данни в таблична форма, показваща за всяка тествана група броя на животните при започване на теста, броя на животните, които са открити мъртви по време на изследването или са били умъртвени и времето на смъртта или умъртвяването, броя на проявените признаци на токсичност, описание на признаците на наблюдаваната токсичност, включително времето на започването, продължителността и остротата на всички токсични въздействия, броя на животните с наранявания, вида на нараняванията и процента на животните за всеки отделен вид нараняване.
Когато е необходимо, се оценяват числовите резултати чрез използване на подходящ и основно приемлив статистически начин. Статистическите методи и данни, които трябва да се анализират, следва да се избират по време на планирането на изследването.
2.2. ОТЧИТАНЕ
Докладът от проведеното изследване трябва да включва следната информация:
2.2.1. Веществото, което се изследва:
|
—
|
физична същност, чистота и физико-химични свойства,
|
|
—
|
идентификационни данни,
|
|
—
|
разтвор (ако е приложимо): посочване на причините за избор на разтвор, различен от водата.
|
2.2.2. Видове животни, които се тестват:
|
—
|
използвани видове и родове животни,
|
|
—
|
брой, възраст и пол на животните,
|
|
—
|
произход, условия на обитаване, хранителен режим и т.н.,
|
|
—
|
индивидуално тегло на животните при започването на изследването.
|
2.2.3 Условията, при които се извършва изследването:
|
—
|
рационален избор на нивото доза,
|
|
—
|
подробности за образуването/подготовката на хранителния режим, постигнатата концентрация, стабилност и хомогенност на разтвора,
|
|
—
|
подробности за приемането на тестваното вещество,
|
|
—
|
действителната доза (mg/kg дневно телесно тегло) и фактора на конверсия от концентрация на тестваното вещество в хранителния режим/питейната вода (ррm) към действителната доза, ако е приложимо,
|
|
—
|
подробности за качеството на храната и водата.
|
2.2.4. Резултати:
|
—
|
телесно тегло и промените в него,
|
|
—
|
консумацията на храна и вода, ако е приложимо,
|
|
—
|
съответните данни за токсичността според пола и нивото доза, включително проявените признаци на токсичност,
|
|
—
|
същност, острота и продължителност на клиничните наблюдения (обратими или не),
|
|
—
|
резултатите от офтолмологичните наблюдения,
|
|
—
|
оценка на сетивната активност, силата при хващане и двигателната активност (когато са налични),
|
|
—
|
хематологични тестове със съответните основни стойности,
|
|
—
|
клинични биохимични тестове със съответните основни стойности,
|
|
—
|
телесно тегло при завършване на експеримента, тегло на органите и съотношението между телесното тегло и теглото на органите,
|
|
—
|
подробно описание на всички хистопатологични сведения,
|
|
—
|
данни от абсорбцията, ако са на разположение,
|
|
—
|
статистически обработените резултати, където е приложимо.
|
Обсъждане на резултатите
Заключения
3. ПРЕПРАТКИ
|
(1)
|
IPCS (1986). Principles and Methods for the Assessment of Neurotoxicity Associated with Exposure to Chemicals. Environmental Health Criteria Document No 60.
|
|
(2)
|
Tupper, D. E., Wallace, R.B. (1980). Utility of the Neurologic Examination in Rats. Acta Neurobiol. Exp., 40, pp. 999—1003.
|
|
(3)
|
Gad, S. C. (1982). A Neuromuscular Screen for Use in Industrial Toxicology. J. Toxicol. Environ. Health, 9, pp. 691—704.
|
|
(4)
|
Moser, V. C, Mc Daniel, K. M., Phillips, P. M. (1991). Rat Strain and Stock Comparisons Using a Functional Observational Battery: Baseline Values and Effects of Amitraz. Toxicol. Appl. Pharmacol., 108, pp. 267—283.
|
|
(5)
|
Meyer O. A., Tilson H. A., Byrd W. C, Riley M. T. (1979). A Method for the Routine Assesment of Fore- and Hind- limb grip Strength of Rats and Mice. Neurobehav. Toxivol., 1, pp. 233—236.
|
|
(6)
|
Crofton K. M., Howard J. L., Moser V. C, Gill M. W., Reiter L. W., Tilson H. A., MacPhail R. C. (1991). Interlaboratory Comparison of Motor Activity Experiments: Implication for Neurotoxicological Assessments. Neurotoxicol. Teratol., 13, pp. 599—609.
|
|
(7)
|
Weingand K., Brown G., Hall R. et al. (1996). „Harmonisation of Animal Clinic Pathology Testing in Toxicity and Safety Studies“, Fundam. & Appl. Toxicol., 29, pp. 198—201.
|
Б.27. ИЗСЛЕДВАНЕ НА СУБХРОНИЧНА ОРАЛНА ТОКСИЧНОСТ — 90-ДНЕВНО ИЗСЛЕДВАНЕ НА ТОКСИЧНОСТТА ПРИ НЕ-ГРИЗАЧИ С ПОВТАРЯЩА СЕ ДОЗА
1. МЕТОД
Този метод за изследване на субхроничната орална токсичност е точно копие на ОECD TG 409 (1998).
1.1. ВЪВЕДЕНИЕ
След получаване на предварителна информация върху токсичността при извършване на 28-дневни тестове за акутна и повторна доза, при извършването на оценка и изчисляване на токсичните характеристики на химикала може да се определи субхроничната токсичност, използваща повторна дози. 90-дневното изследване предоставя информация за възможните рискове за здравето, произтичащи по всяка вероятност от повтарящото се излагане за периода на бързо порастване и от младост към зрелост. Това изследване предоставя информация за основните токсични въздействия, посочва засегнатия орган и възможността за акумулиране, като може да предостави и оценка на нивото на ненаблюдаваните неблагоприятни въздействия при излагане, която може да се използва при определена доза за хронично изследване и за създаване на критерии за защита при излагане на хората.
Този метод на тестване позволява идентификация на вредните въздействия от химичното излагане върху видовете не-гризачи и следва да се използва само:
|
—
|
когато наблюдаваните въздействия при други проучвания показват нуждата от изясняване/характеризиране при втори видове не-гризачи, или
|
|
—
|
когато токсикокинетичните изследвания показват, че употребата на определени видове не-гризачи е по-подходящият избор за лабораторно животно, или
|
|
—
|
когато други специфични причини оправдават използването на не-гризачи.
|
Вж. също Основно въведение, част Б.
1.2. ОПРЕДЕЛЕНИЯ
Доза: е определено количество извлечено вещество, дадено за тестване. Дозата се изразява като тегло (g, mg) или като тегло на тестваното вещество върху определена единица тегло от тестваното животно (т.е. mg/kg), или като постоянни диетични концентрации (ррm).
Дозировка: е обобщен термин, който включва отделните дози, тяхната честота и продължителност.
NOAEL: е абревиатура за ниво на ненаблюдавано вредно въздействие и е най-дозираното ниво, където не се наблюдават вредни резултати от съответната обработка.
1.3. ПРИНЦИПИ НА МЕТОДА ЗА ТЕСТВАНЕ
Веществото за тестване се приема всекидневно през устата в последователни дози за няколко групи от експериментални животни, по една доза за група за период от 90 дни. По време на периода на предписването животните се наблюдават отблизо за поява на някакви признаци на токсичност. В края на изследването се прави аутопсия на животните, които умират или са убити по време на извършването на тестването, а оцелелите животни също се умъртвяват и се извършва аутопсия.
1.4. ОПИСАНИЕ НА МЕТОДА ЗА ТЕСТВАНЕ
1.4.1. Избор на видове животни
Обикновено от не-гризачите се използват кучета, които се отглеждат при определени условия; най-често се използват дребните породи. Други видове, като свине, минипрасета, също могат да се използват. Не се препоръчва използването на примати и тяхното използване следва да е обосновано. Използват се млади и здрави животни, а когато се използват кучета, дозата следва да се дава на 4—6-месечни животни и не по-късно от деветия месец на първата година. Когато изследването се провежда като предварително по отношение на следващо дългосрочно хронично изследване на токсичността, и за двете изследвания следва да се използват животни от същия вид и род.
1.4.2. Подготовка на животните
Използват се млади здрави животни, които са адаптирани към лабораторните условия и не са били обект на предишни експериментални процедури. Продължителността на аклиматизацията ще зависи от определените за тестване видове и техния произход. Препоръчват се поне пет дни за кучетата и специално отгледаните за целта свине от постоянна колония и поне две седмици за другите животни, ако са с друг произход. Животните, използвани за извършване на теста, се определят според вида, рода, произхода, пола, теглото и/или възрастта. Животните се разпределят на случаен принцип в контролни групи и групи за обработване. Животните се разпределят на случаен принцип в контролни групи и групи за обработване. Клетките се подреждат така, че да се сведат до минимум възможните влияния, получени в резултат от разположението на клетките. За всяко животно се определя уникален идентификационен номер.
1.4.3. Подготовка на дозите
Веществото за тестване се приема през тръбичка или чрез храната или питейната вода. Методът на приемане на веществото през устата се определя в зависимост от целите на изследването и физичните/химичните свойства на тествания материал.
При необходимост изследваното вещество се разтваря или суспендира в подходящ разтворител. Където е възможно, се препоръчва първо употребата на воден разтвор/суспензия, последвана от петролен разтвор/емулсия, след това е възможен разтвор с друг разтворител. За разтворители, различни от вода, следва да се познават токсичните характеристики. Определя се и устойчивостта на тестваното вещество по време на процеса на извличане.
1.5. ПРОЦЕДУРА
1.5.1. Брой и пол на животните
Поне 8 животни (4 женски и 4 мъжки) следва да се използват при всяко ниво на доза. Ако междувременно се планира убиване на животни преди завършването на изследването, броят се увеличава в зависимост от броя на животните, които е планирано да бъдат убити. Броят на животните при завършване на проучването следва да бъде достатъчен за даване на съдържателна оценка на токсичните въздействия. Въз основа на предишни познания върху химикала или върху близък до него аналог се разглежда въпросът относно включването на допълнителна придружаваща група от 8 животни (по четири от всеки пол), поставени в контролната група и в групата с най-висока доза за наблюдаване, след периода на третиране, на способността за реверсиране и устойчивостта на всякакви токсични въздействия. Продължителността на периода след обработката се определя с оглед наблюдаваните резултати.
1.5.2. Дозиране
Използват се поне три нива на доза и се осъществява едновременен контрол, с изключение на случаите, когато се извършва ограничен тест (вж. 1.5.3.). Нивата на дози може да са основани на резултати от повтаряща се доза или обем от сведения, получени от проучвания, и следва да се вземат предвид всички съществуващи токсикологични и токсикокинетични данни, които са на разположение, за тестваното вещество или съответните материали. Освен ограничението от физикохимичната природа или биологичните въздействия на тестваното вещество, най-високото ниво на дозата се избира с цел да се индуцира токсичност, но не и смърт или силно страдание. Избира се намаляваща последователност на нивата на дозата с оглед да се покаже всяка ответна на дозата реакция и ненаблюдаваното неблагоприятно въздействие (NOAEL) на най-ниското ниво на дозата. Два до четири затворени интервала са най-често оптимални за поставяне на намаляващите нива на дозата и често се предпочита допълнение от четвърта група за тестване, за да се използват големи интервали (например повече от един фактор от около 6—10) между дозирането.
Контролната група е група, която не е третирана или група, която контролира разтворителя, при условие че разтворителят се използва при приемане на веществото, което се изследва. С изключение на самата обработка с веществото, което се изследва, животните в контролната група се третират по същия начин като тези от групите за тестване. Ако се използва разтворител, контролната група получава най-високото използвано количество от разтвора. Ако тестваното вещество се приема чрез хранителен режим и причини намалено приемане на храна, тогава една група, която е на същия хранителен режим, при сверяване може да бъде полезна, за да се направи разлика между намаляването, дължащо се на липсата на вкус или вследствие на токсикологични изменения при модела за изследване.
Когато е целесъобразно, се разглеждат следните характеристики на разтвора или други адитивни свойства: въздействия върху абсорбцията, разпределението, метаболизма или задържане на веществото, което се изследва; въздействия върху химичните свойства на веществото, което се изследва, което може да измени неговите токсикологични характеристики; и въздействия върху консумацията на храна и вода или хранителния статус на животните.
1.5.3. Ограничен тест
Ако тестът при едно ниво на доза, равно на поне 1 000 mg/kg телесно тегло на ден, и при използване на процедурите, описани за това изследване, води до ненаблюдавани неблагоприятни въздействия и ако въз основа на данни от вещества, отнасящи се до структурата, не се очаква токсичност, то пълното проучване с използване на трите нива дози не може да се счита за необходимо. Прилага се ограниченият тест, с изключение на случая, когато излагането на човека подсказва нуждата от използване на по-високо ниво на доза.
1.5.4. Приемане на дозите
Животните приемат дозата от тестваното вещество всеки ден в продължение на седем дни, всяка седмица за периода от 90 дни. Посочват се причините за използването на всеки друг режим на приемане на дозата, например 5 дни. Когато вещество се приема при хранене с тръбичка, това става, като една доза се дава на животното през стомашна тръба или подходяща интубационна канюла. Максималното количество течност, което може да бъде прието наведнъж, зависи от размера на тестваното животно. Обикновено количеството се задържа възможно най-ниско. С цел да се осигури постоянно количество на нивото доза, променливостта на количеството се намалява до минимум чрез регулиране на концентрацията, освен в случаите на дразнещи и корозивни вещества, които нормално ще показват засилени въздействия с висока концентрация.
За вещества, които се приемат чрез хранителен режим или вода за пиене, е важно да се гарантира, че количеството използвано за изследване вещество не въздейства върху нормалното хранене и водния баланс. Когато тестваното вещество се приема чрез хранителен режим, може да се използва или постоянна хранителна концентрация (ррm), или постоянно ниво на доза от гледна точка на телесното тегло на животното; следва да се определи и алтернативен вариант на употреба. За вещество, което се приема при хранене с тръбичка, дозата се дава по едно и също време всеки ден и е съобразена в случаи на необходимост да се поддържа постоянно ниво доза с оглед телесното тегло на животното. Когато 90-дневното изследване се използва като предварително по отношение на дългосрочно изследване на хроничната токсичност, и при двете изследвания следва да се използва един и същ хранителен режим.
1.5.5. Наблюдения
Периодът на наблюдение е 90 дни. Животните от придружаващата група, които са разпределени за следващи наблюдения, се запазват за подходящ период, без да бъдат третирани с цел да се уточни устойчивостта има или възстановяването от токсичността.
Поне един път на ден се правят основни клинични наблюдения, за предпочитане по едно и също време, като се взема предвид максималният период на предвидените въздействия след получаване на дозата. Клиничните условия, при които живеят животните, се описват. Поне два пъти на ден, обикновено в началото и в края на деня, всички животни се оглеждат за проявени признаци на заболеваемост или смъртност.
Поне един път преди първото излагане (с цел да е възможно сравнение в рамките на обекта) и след това поне веднъж в седмицата на всички животни следва да се правят подробни клинични изследвания. Тези изследвания следва да се правят извън клетката, която обитава животното, за предпочитане в стандартна обстановка и във всички случаи по едно и също време. Тези изследвания се описват внимателно, за предпочитане се използват изчислителни системи, изрично определени от лабораторията, която извършва теста. Полагат се необходимите усилия, за да се гарантира, че променливостта в условията за наблюдаване е минимална. Забелязаните признаци следва да включват, но не се ограничават само със: изменения в кожата, козината, очите, лигавиците, появяване на секреция и екскреция и органична независима активност (например лакримация, пилоерекция, размер на зеницата, необикновена респираторна схема). Записват се също и изменения в походката, стойката и чувствителността при маневриране, както и наличието на спазми или свивания на мускулите, стереотипа (например остатъчно дращене, повтарящо се обикаляне в кръг) или странно държание (например самоосакатяване, вървене назад).
Преди приемането на изследваното веществото и при приключването на изследването се прави офталмологичен преглед чрез използване на офталмоскоп или равнозначно подходящо оборудване, за предпочитане на всички животни, но поне при групата с най-високо ниво на доза и контролната група. Ако се открият изменения, очевидно свързани с третирането, всички животни се подлагат на преглед.
1.5.5.1. Телесно тегло и консумация на храна/вода
Теглото на всички животни се измерва поне един път в седмицата. Консумацията на храна също се измерва един път седмично. Ако тестваното вещество се приема чрез водата за пиене, един път в седмицата се измерва и консумацията на вода. Консумацията на вода може също да се вземе предвид за проучвания на хранителния режим или при хранене с тръбичка, когато питейната активност може да се измени.
1.5.5.2. Хематология и клинична биохимия
Ако е приложимо, при определени условия се вземат и се запазват кръвни проби от избран обект. В края на изследването пробите се събират точно преди или като част от процедурата по умъртвяването на животните.
В началото на изследването и след това или на интервали от един месец, или в средата на периода на извършване на теста и последно в края на този период се правят и следните хематологични изследвания: хематокрит, концентрация на хемоглобин, брой на еритроцити, общ и отделен брой на левкоцитите, брой на тромбоцитите и измерване на възможността на съсирване, като време на съсирване или протромбиново време, или тромбопластиново време.
За да се изследват основните токсични въздействия върху тъканите, и по специално въздействията върху бъбреците и черния дроб, върху кръвните проби, взети от всяко животно в началото и след това или на интервали от един месец, или в средата на периода на извършване на теста и последно в края на този период, се извършват клинични биохимични изследвания. Зоните, които се изследват, са електролитният баланс, карбохидратният метаболизъм и функциите на черния дроб и бъбреците. Изборът на специфичните тестове ще се повлияе от вида на действие на тестваното вещество. Препоръчва се в нощта преди вземането на кръвните проби да не се дава на животните месо за консумиране. Предложените изчисления включват калций, фосфор, хлор, натрий, калий, глюкоза, аланин аминотрансфераза, аспарат аминотрансфераза, орнитин декарбоксилаза, гама глутамил траспептидаза, карбамиден азот, албумин, кръвен креатинин, общ билирубин и общи изчисления на серумен протеин.
Поне в началото на изследването и след това в средата на периода на извършване на теста и последно в края на този период време на последната седмица от изследването може да се направят изследвания на урината, като се използва синхронно събраното количество урина. Тези изследвания включват: външен вид, количество, осмотичност и относително тегло, pH, протеини, глюкоза и кръв/кръвни клетки. Когато е необходимо, с оглед разширяване на проучването върху наблюдаваните въздействия, могат да се използват и допълнителни параметри.
Като допълнение следва да се предвиди проучване на знаците за увреждане на основните тъкани. Други изследвания, които могат да са полезни за адекватна оценка на токсичността, включват анализ на липиди, хормони, киселинно-основен баланс, метамоглобин и холинестеразна инхибиция. Може да се извърши допълнителна биохимия, когато е необходимо да се разширят проучванията върху наблюдаваните въздействия. Тези нужди се определят за химикалите от определени класове или въз основа на всеки отделен случай.
Накрая има нужда от гъвкав подход, в зависимост от видовете и от наблюдаваното и/или очакваното въздействие от всяко дадено вещество.
1.5.5.3. Обща аутопсия
Всички животни, подложени на експеримент, са обект на пълна, подробна аутопсия, която включва внимателен преглед на външната повърхност на тялото, всички отвори и мозъчната, гръдната и коремната кухина и тяхното съдържание. Черният дроб с жлъчния мехур, бъбреците, надбъбречните жлези, тестисите, епидидимидите, матката, яйчниците, щитовидната жлеза (с паратироидите), тимусът, далакът, мозъкът и сърцето на всички животни (без тези, които са намерени умиращи и/или са междувременно умъртвени) се почистват от полепналите по тях тъкани, когато е приложимо, и след дисекцията колкото е възможно по-скоро се измерва тяхното мокро тегло, за да се избегне изсушаването.
Следните тъкани следва да бъдат запазвани при най-подходящата консервираща среда за вида тъкан и за очакваните последващи хистопатологични изследвания: общи наранявания, мозък (представени области, включващи главен, малък и костен мозък, гръбначен мозък (на три нива: шиен, среден и лумбален), хипофизна жлеза, очи, щитовидна жлеза, паратироид, тимус, хранопровод, слюнчени лимфни жлези, стомах, дебели и тънки черва (включително Пайерови плочки), черен дроб, жлъчен мехур, панкреас, бъбреци, надбъбречни жлези, далак, сърце, трахея и бял дроб, аорта, полови жлези, матка, вторични полови органи, женски яйчни жлези, простата, пикочен мехур, лимфни възли (за предпочитане един лимфен възел, по пътя на приемането, и друг по-далече от него, за да се покрият и систематичните въздействия), периферни нерви (седалище и пищял), за предпочитане близо до мускул, разрез на кост с костен мозък (и/или кост с изваден костен мозък), кожа и очи (ако са наблюдавани изменения по време на офталмологичните изследвания). Клиничните и другите сведения могат да посочат необходимостта от допълнителни изследвания на тъканите. Всички други органи, които на основата на познатите свойства на тестваното вещество се считат за вероятни обекти, също следва да бъдат запазвани.
1.5.5.4. Хистопатология
Пълна хистопатология следва да се извършва на запазените органи и тъкани на всички животни от контролните групи и групите с висока доза. Тези прегледи следва да се приложат и за животните от всички други групи, получили доза, ако се наблюдават изменения в резултат от третирането на групата с най-висока доза.
Изследват се всички общи наранявания.
Когато се използва придружаваща група, хистопатология се извършва на тъкани и органи с показан ефект при третираните групи.
2. ДАННИ И ДОКЛАДВАНЕ
2.1. ДАННИ
Предоставят се индивидуални данни. Допълнително се синтезират данни в таблична форма, показваща за всяка тествана група броя на животните при започване на теста, броя на животните, които са открити мъртви по време на изследването или са били умъртвени, и времето на смъртта или умъртвяването, броя на проявените признаци на токсичност, описание на признаците на наблюдаваната токсичност, включително времето на започването, продължителността и остротата на всички токсични въздействия, броя на животните с наранявания, вида на нараняванията и процента на животните за всеки отделен вид нараняване.
Когато е необходимо, числовите резултати следва да се оценяват чрез използване на подходящ и общоприемлив статистически метод. Статистическите методи и данни, които следва да се анализират, се избират по време на проектирането на изследването.
2.2. ОТЧИТАНЕ
Докладът от проведеното изследване следва да включва следната информация:
2.2.1. Вещество за тестване
|
—
|
физична същност, чистота и физикохимични свойства,
|
|
—
|
идентификационни данни,
|
|
—
|
разтвор (ако е приложимо): посочване на причините за избор на разтвор, различен от водата.
|
2.2.2. Видове животни, с които се извършва тестването
|
—
|
използвани видове и родове животни,
|
|
—
|
брой, възраст и пол на животните,
|
|
—
|
произход, условия на обитаване, хранителен режим и т.н.,
|
|
—
|
индивидуално тегло на животните при започването на изследването.
|
2.2.3. Условията, при които се извършва изследването
|
—
|
рационален избор на нивото доза,
|
|
—
|
подробности за образуването/подготовката на хранителния режим, постигнатата концентрация, стабилност и хомогенност на разтвора,
|
|
—
|
подробности за приемането на тестваното вещество,
|
|
—
|
действителната доза (mg/kg телесно тегло дневно) и коефициент на пропорционалност от хранителния режим/питейната вода на концентрация на тестваното вещество (ррт) към действителната доза, ако е приложимо,
|
|
—
|
подробности за качеството на храната и водата.
|
2.2.4. Резултати:
|
—
|
телесно тегло и промените в него,
|
|
—
|
консумацията на храна и вода, ако е приложимо,
|
|
—
|
съответните данни за токсичността според пола и нивото доза, включително проявените признаци на токсичност,
|
|
—
|
същност, острота и продължителност на клиничните наблюдения (обратими или не),
|
|
—
|
резултатите от офталмологичните наблюдения,
|
|
—
|
хематологични тестове със съответните основни стойности,
|
|
—
|
клинични биохимични тестове със съответните основни стойности,
|
|
—
|
телесно тегло при завършване на експеримента, тегло на органите и съотношението между телесното тегло и теглото на органите,
|
|
—
|
подробно описание на всички хистопатологични сведения,
|
|
—
|
данни от абсорбцията, ако са на разположение,
|
|
—
|
статистически обработените резултати, където е приложимо.
|
Обсъждане на резултатите.
Заключения.
Б.28. ИЗПИТВАНЕ ЗА СУБХРОНИЧНА ДЕРМАЛНА ТОКСИЧНОСТ. 90-ДНЕВНИ МНОГОКРАТНИ ДЕРМАЛНИ ДОЗИ ПРИ ГРИЗАЧИ
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Вижте Общо въведение, част Б.
1.2. ОПРЕДЕЛЕНИЯ
Вижте Общо въведение, част Б.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Няма.
1.4. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Изпитваното вещество се прилага ежедневно върху кожата, в нарастващи дози, върху няколко групи експериментални животни, по една доза за група, в продължение на 90 дни. По време на прилагането животните се наблюдават ежедневно, за да се открият признаци на токсичност. Животните, които умират по време на изпитването, се подлагат на аутопсия, а преживелите животни се подлагат на аутопсия при приключване на изпитването.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Няма.
1.6. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
Подготовка
Животните се държат при експериментални условия на живот и хранене в продължение поне на пет дни преди изпитването. Преди изпитването здрави млади животни се избират по случаен признак и се разпределят в третирана и контролна група. Малко преди изпитването кожата в дорзалната област на туловището на експерименталните животни се подстригва. Може да се използва бръснене, но то следва да се извършва приблизително 24 часа преди изпитването. Повторно подстригване или бръснене е необходимо обикновено през интервали от една седмица. Когато козината се подстригва или бръсне, следва да се внимава да се избягва ожулване на кожата. Не по-малко от 10 % от повърхността на тялото следва да бъде подготвена за прилагане на изпитваното вещество. Когато се решава каква повърхност следва да бъде подготвена и какви да бъдат размерите на превръзката, следва да се вземе предвид теглото на животното. Когато се изпитват твърди вещества, които при нужда могат да бъдат стрити на прах, изпитваното вещество следва да бъде достатъчно намокрено с вода или с подходящ носител, когато е необходимо, за да се осигури добър контакт с кожата. Течните изпитвани вещества обикновено се използват неразредени. Прилагането е ежедневно, пет до седем дни седмично.
Условия на изпитване
Експериментални животни
Могат да се използват възрастни плъхове, зайци или морски свинчета. Могат да се използват други видове, но употребата им трябва да бъде обоснована. При започване на изпитването диапазонът на колебание на теглото трябва да бъде ± 20 % от средното тегло. Когато изпитването за субхронична дермална токсичност се провежда като предварително проучване преди продължително изпитване, и при двете изпитвания трябва да се използват същият вид и порода.
Брой и пол
За всяко ниво на дозиране трябва да се използват поне 20 животни (10 женски и 10 мъжки) със здрава кожа. Женските трябва да са нераждали и да не са бременни. Ако се планират междинни жертви, броят трябва да бъде увеличен с броя животни, които са планирани за пожертване преди завършване на изпитването. Допълнително една сателитна група от 20 животни (по 10 животни от пол) може да бъде третирана при високо ниво на дозиране в продължение на 90 дни и да бъде наблюдавана в продължение на 28 дни след третирането за обратимост, запазване или забавена проява на токсични ефекти.
Нива на дозиране
Необходими са поне три нива на дозиране с контрол или контрол за носителя, ако се използва носител. Експозицията трябва да продължава поне по шест часа дневно. Прилагането на изпитваното вещество трябва да се извършва по едно и също време всеки ден и количеството на прилаганото вещество трябва да бъде коригирано през определени интервали (от една или две седмици), за да се поддържа постоянно ниво на дозиране по отношение на телесното тегло на животното. Освен третирането с изпитваното вещество, животните от контролната група трябва да бъдат третирани по идентичен начин с животните от изпитваните групи. Когато за подпомагане на дозирането се използва помощно вещество, дозирането на контролната група с носител трябва да бъде същото, както при третираните групи, и контролната група трябва да получава същото количество носител, като това, което получава групата на най-висока доза. Най-високото ниво на дозиране трябва да води до токсични ефекти, но да не предизвиква или да предизвиква малък брой фатални изходи. Най-ниското ниво на дозиране не трябва да предизвиква никакви признаци на токсичност. Когато съществува оценка на експозицията при хора, която може да се използва, най-ниското ниво на дозиране трябва да е по-високо. В идеалния случай, междинното ниво на дозиране трябва да предизвиква минимални видими токсични ефекти. Ако се използва повече от една междинна доза, нивата на дозиране трябва да бъдат разделени едно от друго, така че да се получи градиране на токсичните ефекти. При групите на ниска и междинни дози и при контролните групи, честотата на фаталните изходи трябва да бъде ниска, така че да позволи значима оценка на резултатите.
Ако прилагането на изпитваното вещество води до силно кожно дразнене, концентрациите трябва да бъдат намалени и това може да доведе до намаляване или липса на други токсични ефекти при високото ниво на дозиране. Ако кожата е силно увредена, може да се наложи прекратяване на изпитването и предприемане на ново изпитване при по-ниска концентрация.
Гранично изпитване
Може да се приеме, че допълнително изпитване не е необходимо, ако е известно, че предварително проучване при доза 1 000 мг/кг или по-висока, която е свързана с възможна експозиция при хора, не предизвиква токсични ефекти.
Период на наблюдение
Експерименталните животни трябва ежедневно да бъдат наблюдавани за признаци на токсичност. Трябва да се регистрират времето на смъртта и времето, по което се появяват и изчезват признаците на токсичност.
Процедура
Животните трябва да бъдат настанени в индивидуални клетки. В идеалния случай животните се третират с изпитваното вещество седем дни в седмицата в продължение на 90 дни.
Животните от всяка сателитна група, планирана за контролни наблюдения, трябва да бъдат гледана в продължение на допълнителни 28 дни без третиране, за да бъдат открити възстановяването от токсичните ефекти или запазването им. Експозицията трябва да продължава шест часа на ден.
Изпитваното вещество трябва да бъде прилагано по еднакъв начин върху площ, която представлява приблизително 10 % от общата площ на телесната повърхност. При силно токсични вещества покритата повърхностна площ може да бъде по-малка, но колкото е възможно по-голяма площ трябва да бъде покрита с тънък и еднакъв филм.
При експозицията изпитваното вещество се поддържа в контакт с кожата с помощта на пореста марлена превръзка и недразнеща лента. Изпитваното място трябва да бъде допълнително покрито по подходящ начин, така че марлената превръзка и изпитваното вещество да се запазят и животните да не могат да погълнат изпитваното вещество. За да бъде предотвратено поглъщането на изпитваното вещество, могат да се използват ограничаващи средства, но пълно обездвижване не се препоръчва.
В края на експозицията останалото изпитвано вещество трябва да бъде отстранено, когато е възможно, с помощта на вода или друг подходящ метод за почистване на кожата.
Всички животни трябва да бъдат наблюдавани ежедневно и признаците на токсичност да бъдат регистрирани, включително времето им на настъпване, силата и продължителността им. Наблюденията в клетките трябва да включват измененията на кожата и козината, очите и лигавиците, а също дихателната, сърдечно-съдовата, автономната и централната нервна система, соматомоторната активност и начина на поведение. Трябва да се извършват ежеседмични измервания на консумираната храна и животните да се претеглят всяка седмица. Редовните наблюдения на животните са необходими, за да не се губят животни при изпитването поради причини като канибализъм, тъканна автолиза или преместване. В края на периода на изпитването всички оживели животни от несателитните третирани групи се подлагат на аутопсия. Умиращите животни трябва да бъдат отстранени и подложени на аутопсия, когато бъдат забелязани.
На всички животни, включително контролните, обичайно се правят следните прегледи:
|
а)
|
Преди експозицията на изпитваното вещество и при преустановяване на изпитването трябва да се проведе офталмологичен преглед с помощта на офталмоскоп или еквивалентно подходящо оборудване, за предпочитане при всички животни, но поне в групите на висока доза и контролните групи. Ако бъдат доловени очни изменения, трябва да бъдат прегледани всички животни.
|
|
б)
|
В края на изпитването трябва да бъде направено хематологично изследване, включващо хематокрита, концентрацията на хемоглобина, броя на еритроцитите, общия брой на левкоцитите и диференциалното им броене и измерване на потенциала за съсирване, например време на съсирване, протромбиново време, тромбопластиново време или брой на тромбоцитите.
|
|
в)
|
В края на изпитването трябва да се определят клиничните биохимични параметри на кръвта. изследвания, които се смятат за целесъобразни при всички изпитвания, са електролитният баланс, въглехидратният метаболизъм и чернодробната и бъбречната функция. Изборът на конкретни изследвания ще се повлияе от наблюденията върху механизма на действие на веществото. Предложени са параметрите калций, фосфор, хлориди, натрий, калий, глюкоза на гладно (с период на гладуване, подходящ за вида), серумна глутамат пируват трансаминаза (4), серумна глутамат оксалоацетат трансаминаза (5), орнитин декарбоксилаза, гама глутамил транспептидаза, уреен азот, албумин, креатинин в кръвта, общ билирубин и общ серумен белтък. Други параметри, които може да са необходими за адекватна токсикологична оценка, включват анализ на липиди, хормони, киселинно/алкално равновесие, метхемоглобин и холинестеразна активност. Когато е необходимо да бъде разширено изпитването на наблюдаваните ефекти, може да се използват допълнителни клинични биохимични параметри.
|
|
г)
|
Изследване на урина рутинно не е необходимо, а само когато съществуват показания поради очаквана или наблюдавана токсичност.
|
Ако историческите изходни данни не са адекватни, трябва да се има предвид определяне на хематологичните параметри и на параметрите на клиничната биохимия преди да започне дозирането.
Макроскопска аутопсия
Всички животни трябва да бъдат подложени на пълна макроскопска аутопсия, която включва преглед на външната повърхност на тялото, всички отвори, и на черепната, гръдната и коремната кухина и съдържанието им. Черният дроб, бъбреците, надбъбречните жлези и тестисите трябва да бъдат претеглени във влажно състояние колкото е възможно по-бързо след дисекцията, за да се избегне изсъхването им. Следните органи и тъкани трябва да бъдат съхранени в подходяща среда за възможно бъдещо хистопатологично изследване: всички макроскопски лезии, мозъкът — включително срези на продълговатия мозък/моста, кората на малкия мозък и главния мозък, хипофизата, щитовидната/паращитовидните жлези, пялата тимусна тъкан (трахеята), белите дробове, сърцето, аортата, слюнчените жлези, черният дроб, слезката, бъбреците, надбъбречните жлези, панкреасът, гонадите, матката, допълнителните полови органи, жлъчният мехур (ако е налице), хранопроводът, стомахът, дванадесетопръстникът, празното черво, хълбочното черво, сляпото черво, ободното черво, правото черво, пикочният мехур, представителен лимфен възел, (женската млечна жлеза), (бедрена мускулатура), периферен нерв, (очи), (гръдна кост с костен мозък), (бедрена кост, включително ставна повърхност), (гръбначен мозък на три нива — шийно, гръдно и поясно) и (извънорбитните слъзни жлези). Тъканите, посочени в скоби, трябва да се изследват само, ако въз основа на признаци на токсичност или ангажиране на целевите органи са налице показания за това.
Хистопатологично изследване
|
а)
|
Пълно хистопатологично изследване трябва да се извършва на нормалната и третираната кожа и на органи и тъкани на животни от контролната група и групата на висока доза.
|
|
б)
|
Всички макроскопски лезии трябва да бъдат изследвани.
|
|
в)
|
Целевите органи трябва да бъдат изследвани и в групите на други дози.
|
|
г)
|
Когато се използват плъхове, белите дробове на животните от групите на ниска и междинна доза трябва да бъдат подложени на хистопатологично изследване за признаци на инфекция, тъй като това дава възможност за лесно оценяване на здравословното състояние на животните. При животни от тези групи допълнително хистопатологично изследване може рутинно да не е необходимо, но в групата на висока доза то винаги трябва да се извършва върху органите, при които са налице данни за лезии.
|
|
д)
|
Когато се използва сателитна група, трябва да се прави хистопатологично изследване на тъканите и органите, при които се наблюдават ефекти в другите третирани групи.
|
2. ДАННИ
Данните трябва да бъдат обобщени в табличен вид, като за всяка изпитвана група са показани броят на животните в началото на изпитването, броят на животните, при които са налице лезии, типът на лезиите и процентът на животните, които демонстрират всеки тип лезия. Резултатите трябва да бъдат оценени с помощта на подходящ статистически метод. Може да се използва всеки признат статистически метод.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
—
|
вид, порода, източник, условия на околната среда, диета,
|
|
—
|
условия на изпитването,
|
|
—
|
нива на дозиране (включително носител ,ако е използван) и концентрации,
|
|
—
|
данни за токсичния отговор по пол и доза,
|
|
—
|
ниво без ефект, където е възможно,
|
|
—
|
време на смъртта по време на изпитването или дали животните са оживели до прекратяването му,
|
|
—
|
описание на токсичните или други ефекти,
|
|
—
|
времето на наблюдение на всеки абнормен признак и неговото последващо развитие,
|
|
—
|
данни за храната и телесното тегло,
|
|
—
|
резултати от офталмологичното изследване,
|
|
—
|
използвани хематологични изследвания и всички резултати,
|
|
—
|
използвани клинични биохимични изследвания и всички резултати (включително резултати от всички изследвания на урина).
|
|
—
|
резултати от аутопсията,
|
|
—
|
подробно описание на всички резултати от хистопатологичните изследвания,
|
|
—
|
статистическа обработка на резултатите, където е възможно,
|
|
—
|
обсъждане на резултатите,
|
|
—
|
интерпретиране на резултатите,
|
3.2. ОЦЕНКА И ИНТЕРПРЕТИРАНЕ
Вижте Общо въведение част Б.
4. Препратки
Вижте Общо въведение част Б.
Б.29. ИЗПИТВАНЕ ЗА СУБХРОНИЧНА ИНХАЛАЦИОННА ТОКСИЧНОСТ — 90-ДНЕВНИ МНОГОКРАТНИ ИНХАЛАЦИОННИ ДОЗИ ПРИ ГРИЗАЧИ
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Вижте Общо въведение част Б.
1.2. ОПРЕДЕЛЕНИЯ
Вижте Общо въведение част Б.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Няма.
1.4. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Няколко групи експериментални животни се осъществява ежедневна експозиция с определена продължителност на изпитваното вещество в нарастващи концентрации, като се използва по една концентрация за група, в продължение на 90 дни. Когато се използва носител, за да подпомогне създаването на подходяща концентрация на изпитваното вещество в атмосферата, трябва да се използва контролна група за носителя. По време на прилагането на изпитваното вещество животните се наблюдават ежедневно, за да се открият признаци на токсичност. Животните, които умират по време на изпитването, се подлагат на аутопсия, а преживелите животни се подлагат на аутопсия при приключване на изпитването.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Няма.
1.6. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
Подготовка
Животните се държат при експериментални условия на живот и хранене в продължение поне на пет дни преди експеримента. Преди изпитването здрави млади животни се избират по случаен признак и се разпределят в третирана и контролна група. Когато е необходимо, към изпитваното вещество може да се добави подходящ носител, за да подпомогне създаването на съответна концентрация на веществото в атмосферата. Ако за улесняване на дозирането се използват неактивно вещество или други добавки, трябва да е известно, че те не водят до токсични ефекти. Ако е необходимо, могат да се използват исторически данни.
Условия на изпитване
Експериментални животни
Предпочитан вид е плъхът, ако няма противопоказания. Трябва да се използват млади здрави животни от обичайно употребявани лабораторни породи. При започване на изпитването колебанието в теглото на използваните животни не трябва да превишава ± 20 % от съответната средна стойност. Когато инхалационното субхронично изпитване се провежда като предварително проучване преди продължително изпитване, и при двете изпитвания трябва да се използват същият вид и порода.
Брой и пол
За всяка експозиционна концентрация трябва да се използват поне по 20 животни (10 женски и 10 мъжки). Женските трябва да са нераждали и да не са бременни. Ако се планират междинни жертви, броят трябва да бъде увеличен с броя животни, които са планирани за пожертване преди завършване на изпитването. Допълнително една сателитна група от 20 животни (по 10 животни от пол) може да бъде третирана при високо ниво на дозиране в продължение на 90 дни и да бъде наблюдавана в продължение на 28 дни след третирането за обратимост, запазване или забавена проява на токсични ефекти.
Експозиционни концентрации
Необходими са поне три концентрации, с контрола и, ако се използва носител, контрола за носителя (съответстваща на концентрацията на носителя при най-високото ниво на дозиране). Освен третирането с изпитваното вещество, животните от контролната група трябва да бъдат третирани по идентичен начин с животните от изпитваните групи. Най-високата концентрация трябва да води до токсични ефекти, но да не предизвиква или да предизвиква малък брой фатални изходи. Когато съществува оценка на експозицията при хора, която може да се използва, най-ниското ниво на дозиране трябва да е по-високо. В идеалния случай, междинната концентрация трябва да предизвиква минимални видими токсични ефекти. Ако се използва повече от една междинна концентрация, концентрациите трябва да бъдат разделени една от друга, така че да се получи градиране на токсичните ефекти. В групата на ниска и междинна доза и в контролната група, честотата на фаталните изходи трябва да бъде ниска, така че да позволи значима оценка на резултатите.
Продължителност на експозицията
Продължителността на ежедневната експозиция трябва да бъде шест часа след изравняване на концентрациите в камерата. За да се изпълнят конкретни изисквания, може да се използва и друга продължителност.
Оборудване
Животните трябва да бъдат изследвани с инхалационно оборудване, предназначено за поддържане на динамичен въздушен поток при поне 12-кратно обменяне на въздуха за час, за да се осигурят адекватно кислородно съдържание и равномерно разпределена експозиционна атмосфера Когато се използва камера, тя трябва да бъде проектирана така, че струпването на експерименталните животни да бъде намалено до минимум и да се постигне максимална инхалационна експозиция на изпитваното вещество. Като правило, за да се постигне стабилност на атмосферата в камерата, общият обем на експерименталните животни не трябва да надвишава 5 % от обема на експерименталната камера. Може да се използват индивидуални камери за оро-назална експозиция, изолирана експозиция на главата, или за експозиция на пялото тяло, като първите две намаляват до минимум приема на изпитваното вещество по други пътища.
Период на наблюдение
Експерименталните животни трябва да бъдат наблюдавани ежедневно за признаци на токсичност по време на пялото третиране и възстановяване. Трябва да се регистрират времето на смъртта и времето, по което се появяват и изчезват признаците на токсичност.
Процедура
Животните се подлагат на експозиция на изпитваното вещество ежедневно, пет до седем дни в седмицата в продължение на 90 дни. Животните от всяка сателитна група, планирана за контролни наблюдения, трябва да бъдат държани в продължение на допълнителни 28 дни без третиране, за да бъдат открити възстановяването от токсичните ефекти или запазването им. Изпитването трябва да се провежда при температура 22 + 3 oС. В идеалния случай, относителната влажност трябва да се поддържа между 30 % и 70 %, но в определени случай (например изпитвания на аерозоли), това може да е невъзможно. По време на експозицията не трябва да се дават храна и вода.
Трябва да се използва динамична инхалационна система с подходяща аналитична система за контрол на концентрация. За установяване на подходящите експозиционни концентрации се препоръчва пробно изпитване. Въздушният поток трябва да бъде нагласен така, че да осигури хомогенни условия в пялата експозиционна камера. Системата трябва да осигури възможно най-бързо постигане на стабилни условия на експозиция.
Измерванията или мониторингът трябва включват:
|
а)
|
скоростта на въздушния поток (непрекъснато);
|
|
б)
|
действителната концентрация на изпитваното вещество, измерена в зоната на дишане. По време на ежедневната експозиция концентрацията не трябва да се колебае с повече от ± 15 % от средната стойност. При прахове и аерозоли, обаче, това ниво на контрол не може да се постигне и тогава може да се приеме по-широк диапазон. По време на пялото изпитване, концентрациите през отделните дни трябва да бъдат поддържани колкото е възможно по-постоянни. При разработване на генериращата система, трябва да се анализира размерът на частиците, за да се установи стабилността на концентрациите им в аерозолите. По време на експозицията анализите трябва да се провеждат толкова често, колкото е необходимо за определяне устойчивостта на разпределението на размерите на частиците.
|
|
в)
|
температура и влажност;
|
|
г)
|
по време на експозиция и след нея се провеждат наблюдения, които се регистрират системно, като за всяко животно се съхраняват отделни записи. Всички животни трябва да бъдат наблюдавани ежедневно и признаците на токсичност да бъдат регистрирани, включително времето им на настъпване, силата и продължителността им. Наблюденията в клетките трябва да включват: измененията на кожата и козината, очите, лигавиците, дихателната, сърдечно-съдовата, автономната и централната нервна система, соматомоторната активност и начина на поведение. Консумацията на храна трябва да се измерва и животните трябва да се претеглят всяка седмица Необходимо е редовно наблюдаване на животните, за да се осигури животните да не се губят от изпитването поради причини като канибализъм, тъканна автолиза или преместване. В края на експозицията всички оживели животни се подлагат на аутопсия. Умиращите животни трябва да бъдат отстранени и подложени на аутопсия, когато бъдат забелязани.
|
На всички животни, включително контролните, обичайно се правят следните прегледи:
|
а)
|
преди експозицията на изпитваното вещество и при прекратяване на изпитването трябва да се проведе офталмологичен преглед с помощта на офталмоскоп или еквивалентно подходящо оборудване, за предпочитане при всички животни, но поне в групите на висока доза и контролните групи. Ако бъдат открити очни изменения, трябва да бъдат прегледани всички животни.
|
|
б)
|
в края на изпитването трябва да бъде направено хематологично изследване, включващо хематокрита, концентрацията на хемоглобина, броя на еритроцитите, общия брой на левкоцитите и диференциалното им броене, и измерване на потенциала за съсирване, например време на съсирване, протромбиново време, тромбопластиново време или брой на тромбоцитите.
|
|
в)
|
в края на изпитването трябва да се определят клиничните биохимични параметри на кръвта. Изследвания, които се смятат за целесъобразни при всички изпитвания, са електролитният баланс, въглехидратният метаболизъм и чернодробната и бъбречната функция. Изборът на конкретни изследвания ще се повлияе от наблюденията върху механизма на действие на веществото. Предложени са параметрите: калций, фосфор, хлориди, натрий, калий, глюкоза на гладно (с период на гладуване, подходящ за вида), серумна глутамат пируват трансаминаза (4), серумна глутамат оксалоацетат трансаминаза (5), орнитин декарбоксилаза, гама глутамил транспептидаза, уреен азот, албумин, креатинин в кръвта, общ билирубин и общ серумен белтък. Други параметри, които може да са необходими за адекватна токсикологична оценка, включват анализ на липиди, хормони, киселинно/алкално равновесие, метхемоглобин и холинестеразна активност. Когато е необходимо да бъде разширено изпитването на наблюдаваните ефекти, може да се използват допълнителни клинични биохимични параметри.
|
|
г)
|
изследване на урина рутинно не е необходимо, а само когато съществуват показания поради очаквана или наблюдавана токсичност.
|
Ако историческите изходни данни не са адекватни, трябва да се има предвид определяне на хематологичните параметрите и на параметрите на клиничната биохимия преди да започне дозирането.
Макроскопска аутопсия
Всички животни трябва да бъдат подложени на пълна макроскопска аутопсия, която включва преглед на външната повърхност на тялото, всички отвори, и на черепната, гръдната и коремната кухина и съдържанието им. Черният дроб, бъбреците, надбъбречните жлези и тестисите трябва да бъдат претеглени във влажно състояние колкото е възможно по-бързо след дисекцията, за да се избегне изсъхването им. Следните органи и тъкани трябва да бъдат съхранени в подходяща среда за възможно бъдещо хистопатологично изследване: всички макроскопски лезии, белите дробове — които трябва да бъдат извадени интактни, претеглени и третирани с подходящ фиксатор, за да се обезпечи съхраняване на белодробната структура (префузията с фиксатор се смята за ефективна процедура), назо-фарингеални тъкани, мозък — включително срези на продълговатия мозък/моста, кората на малкия мозък и главния мозък, хипофизата, щитовидната/паращитовидните жлези, пялата тимусна тъкан, трахеята, белите дробове, сърцето, аортата, слюнчените жлези, черният дроб, слезката, бъбреците, надбъбречните жлези, панкреасът, гонадите, матката (допълнителните полови органи), (кожата), жлъчният мехур (ако е налице), хранопроводът, стомахът, дванадесетопръстникът, празното черво, хълбочното черво, сляпото черво, ободното черво, правото черво, пикочният мехур, представителен лимфен възел, (женската млечна жлеза), (бедрена мускулатура), периферен нерв, (очи), (гръдната кост с костен мозък), (бедрена кост, включително ставна повърхност) и (гръбначен мозък на три нива — шийно, средно гръдно и поясно) Тъканите, посочени в скоби, трябва да се изследват само, ако въз основа на признаци на токсичност или ангажиране на целевите органи са налице показания за това.
Хистопатологично изследване
|
а)
|
Пълно хистопатологично изследване трябва да се извършва върху дихателната система и други органи и тъкани на всички животни от контролната група и групата на висока доза.
|
|
б)
|
Всички макроскопски лезии трябва да бъдат изследвани.
|
|
в)
|
Целевите органи трябва да бъдат изследвани и в групите на други дози.
|
|
г)
|
Белите дробове на животните от групите на ниска и междинна доза също трябва да бъдат подложени на хистопатологично изследване, тъй като това дава възможност за лесно оценяване на здравословното състояние на животните. Допълнително хистопатологично изследване може рутинно да не е необходимо при животни от тези групи, но в групата на висока доза винаги трябва да се извършва върху органите, при които са налице данни за лезии.
|
|
д)
|
Когато се използва сателитна група, трябва да се прави хистопатологично изследване на тъканите и органите, при които се наблюдават дефекти в другите третирани групи.
|
2. ДАННИ
Данните трябва да бъдат обобщени в табличен вид, като за всяка изпитвана група са показани броят на животните в началото на теста, броят на животните, при които са налице лезии, типовете лезии и процентът на животните, които демонстрират всеки тип лезия. Резултатите трябва да бъдат оценени с помощта на подходящ статистически метод. Може да се използва всеки признат статистически метод.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
—
|
вид, порода, източник, условия на околната среда, диета,
|
|
—
|
условия на изпитването,
Описание на експозиционната апаратура: включително проектиране, тип, размери, източник на въздух, система за генериране на частици и аерозоли, метод за климатизиране, пречистване на използвания въздух и метод за настаняване на животните в експериментална камера, когато такава се използва. Трябва да бъде описано оборудването за измерване на температурата, влажността и, където е необходимо, стабилността на концентрациите на частиците в аерозолите или на размера на частиците.
Данни за експозицията: те трябва да бъдат представени в табличен вид със средни стойности и мярка за вариабилността (например стандартно отклонение) и трябва да включват:
|
а)
|
скорости на въздушните потоци през инхалационното оборудване;
|
|
б)
|
температура и влажност на въздуха;
|
|
в)
|
номинални концентрации (общо количество на изпитваното вещество, заредено в инхалационното оборудване, разделено на обема въздух);
|
|
г)
|
естество на носителя, ако е използван;
|
|
д)
|
действителни концентрации в изпитвателната зона на дишане;
|
|
е)
|
стойност на медианата на размерите на частиците (когато е необходимо);
|
|
|
—
|
данни за токсичния отговор по пол и концентрация,
|
|
—
|
ниво без ефект, където е възможно,
|
|
—
|
време на смъртта по време на изпитването или дали животните са оживели до прекратяването му,
|
|
—
|
описание на токсичните или други ефекти,
|
|
—
|
времето на наблюдение на всеки абнормен признак и неговото последващо развитие,
|
|
—
|
данни за храната и телесното тегло,
|
|
—
|
резултати от офталмологичното изследване,
|
|
—
|
използвани хематологични изследвания и всички резултати,
|
|
—
|
използвани клинични биохимични изследвания и всички резултати (включително резултати от всички изследвания на урина),
|
|
—
|
резултати от аутопсията,
|
|
—
|
подробно описание на всички резултати от хистопатологичните изследвания,
|
|
—
|
статистическа обработка на резултатите, където е необходимо,
|
|
—
|
обсъждане на резултатите,
|
|
—
|
интерпретиране на резултатите.
|
3.2. ОЦЕНКА И ИНТЕРПРЕТИРАНЕ
Вижте Общо въведение част Б.
4. ПРЕПРАТКИ
Вижте Общо въведение част Б.
Б.30. ИЗПИТВАНЕ ЗА ХРОНИЧНА ТОКСИЧНОСТ
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Вижте Общо въведение част Б.
1.2. ОПРЕДЕЛЕНИЯ
Вижте Общо въведение част Б.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Няма.
1.4. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Нормално изпитваното вещество се прилага седем дни седмично, по подходящ начин, върху няколко групи експериментални животни, по една доза за група, през голяма част от живота им. По време на експозицията на изпитваното вещество и след нея експерименталните животни се наблюдават ежедневно, за да се открият някакви признаци на токсичност.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Няма.
1.6. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
Подготовка
Животните се държат при експериментални условия на настаняване и хранене в продължение поне на пет дни преди изпитването. Преди изпитването здрави млади животни се избират по случаен признак и се разпределят в третирана и контролна група.
Условия на изпитване
Експериментални животни
Предпочитаният вид е плъх.
Въз основа на резултатите от изпитвания, проведени в миналото, могат да се използват други видове (гризачи и различни от гризачи). Трябва да се използват млади здрави животни от обичайно употребявани лабораторни породи и дозирането трябва да започне колкото е възможно по-скоро след отбиването.
При започване на изпитването колебанията в теглото на животните не трябва да превишават ± 20 % от средната стойност. Когато изпитването за субхронична орална токсичност се провежда като предварително проучване преди продължително изпитване, и при двете изпитвания трябва да се използват същият вид/порода.
Брой и пол
За гризачи за всяко ниво на дозиране и паралелната контролна група трябва да се използват най-малко по 40 животни (20 женски и 20 мъжки). Женските животни трябва да са нераждали и да не са бременни. Ако се планират междинни жертви, броят трябва да бъде увеличен съответно с броя животни, които са планирани за пожертване преди завършване на изпитването.
За видове, различни от гризачи, е приемлив по-малък брой животни, но най-малко по четири от пол за всяка група.
Нива на дозиране нива и честота на експозицията
В допълнение към паралелната контролна група трябва да се използват поне три нива на дозиране. Най-високото ниво на дозиране трябва да предизвиква явни признаци на токсичност без да причинява излишна смъртност.
Най-ниското ниво на дозиране не трябва да предизвиква никакви признаци на токсичност.
Междинната доза(и) трябва да се намират по средата на диапазона между високите и ниските дози.
При избиране на нива на дозиране трябва да се вземат предвид данните от предшестващи проучвания и изпитвания за токсичност.
Нормално експозицията е ежедневна. Ако дадено химическо вещество се прилага с питейната вода или се смесва с храната, то трябва да е непрекъснато в наличност.
Контроли
Трябва да се използва една паралелна контролна група, която е идентична с третираната група във всяко отношение, освен експозицията на изпитваното вещество.
При особени обстоятелства, например инхалационни изпитвания, с аерозоли или емулгиращо средство с нехарактеризирана при орални изпитвания биологична активност, трябва да се използва и паралелна отрицателна контролна група. Отрицателната контролна група се третира по същия начин, както експерименталните групи, с изключение на това, че животните не са подложени на експозиция на изпитваното вещество или някакъв носител.
Начин на прилагане
Двата основни начина на прилагане са орален и инхалационен. Изборът на начин на прилагане зависи от физичните и химичните характеристики на изпитваното вещество и вероятния начин на експозиция при хора.
Използването на дермалния път създава значителни практически проблеми. За хроничната системна токсичност, дължаща се на перкутанна абсорбция, нормално може да се съди по резултатите от друго орално изпитване и по информацията за степента на перкутанна абсорбция, получена от предишни изпитвания за перкутанна абсорбция.
Орални изпитвания
Когато изпитваното вещество се абсорбира от стомашно-чревния тракт и ако храносмилателният път е един от тези, чрез които хората могат да бъдат подложени на експозиция, предпочита се оралният начин на прилагане, освен ако няма противопоказания. Животните могат да получават изпитваното вещество с храната, разтворено в питейната вода или дадено с капсула. В идеалния случай дозирането трябва да бъде ежедневно, седем дни в седмицата, тъй като дозирането пет дни в седмицата може да даде възможност за възстановяване или за поява на токсичност при отнемане през периода, когато няма дозиране, и по този начин да повлияе върху резултата и последващата оценка. Обаче, въз основа главно на практически съображения, дозирането пет дни в седмицата се смята за приемливо.
Инхалационни изпитвания
Тъй като инхалационните изпитвания създават по-сложни технически проблеми в сравнение с другите начини на прилагане, тук са дадени по-подробни указания за този начин на прилагане. Трябва да се отбележи и че в особени ситуации интратрахеалното накапване може да представлява валидна алтернатива.
Продължителната експозиция обикновено наподобява предполаганата експозиция при хора, като животните са подложени на ежедневна експозиция в продължение на шест часа след изравняване на концентрациите в камерата, по пет дни в седмицата (интермитентна експозиция), или, съответно на възможна експозиция от околната среда, на 22- до 24-часова експозиция през деня по седем дни седмично (непрекъсната експозиция) с около един час дневно по едно и също време за хранене на животните и за поддържане на камерата.
И в двата случая животните обикновено са подложени на експозиция на фиксирани концентрации на изпитваното вещество Основна разлика между интермитентната и непрекъснатата експозиция е, че при първата съществува период от 17 до 18 часа, през който животните могат да се възстановят от ефектите на ежедневната експозиция, като в края на седмицата има дори още по-дълъг период за възстановяване.
Изборът на интермитентна или непрекъсната експозиция зависи от целите на изпитването и от експозицията при хора, която трябва да се симулира. Трябва, обаче, да се имат предвид определени технически трудности. Например предимствата на непрекъсната експозиция при симулиране на условията в околната среда могат да бъдат изместени от нуждата от поене и хранене по време на експозицията и от необходимостта от по-сложно (и сигурно) генериране на аерозол и пара и от мониторингови техники.
Експозиционни камери
Животните трябва да бъдат изследвани в инхалационни камери, предназначени да поддържат динамичен въздушен поток при поне 12-кратно обменяне на въздуха за час, за да се осигурят адекватно кислородно съдържание и равномерно разпределена експозицонна атмосфера. Контролните и експозиционните камери трябва да бъдат идентични и да бъдат проектирани така, че да осигурят условия на експозиция, които са сравними във всички отношения, освен експозицията на изпитваните вещества. Обикновено в камерите се поддържа леко отрицателно налягане, за да се предотврати изтичането на изпитваното вещество в заобикалящата зона. Камерите трябва да намалят до минимум струпването на експериментални животни. Като правило, за да се постигне стабилност на атмосферата в камерата, общият обем на експерименталните животни не трябва да надвишава 5 % от обема на камерата.
Измерванията или мониторингът трябва да включват:
|
i)
|
въздушен поток: за предпочитане е скоростта на въздушния поток през камерата да се мониторира непрекъснато;
|
|
ii)
|
концентрация: по време на ежедневната експозиция концентрацията на изпитваното вещество не трябва да варира с повече от ± 15 % от средната стойност;
|
|
iii)
|
температура и влажност: за гризачи, изпитването трябва да се провежда при температура 22 ± 2 oС, а влажността в камерата между 30 и 70 %, освен когато за суспендиране на изпитваното вещество в атмосферата на камерата се използва вода. За предпочитане е и двата показателя да се мониторират непрекъснато;
|
|
iv)
|
измерване размера на частиците: разпределението на размерите на частиците се определя в атмосферата на камери, които включват течни или твърди аерозоли. Частиците на аерозола трябва да бъдат с размери, позволяващи вдишването им от използваните експериментални животни. Проби от атмосферата в камерите трябва да се вземат в зоната на дишане на животните. Пробата въздух трябва да бъде представителна за разпределението на частиците, с които животните са в контакт, и трябва гравиметрично да се вземе предвид целият суспендиран аерозол, дори когато голяма част от него не се вдишва. При разработване на генериращата система трябва често да се анализират размерите на частиците, за да се осигури стабилността на аерозола, и впоследствие толкова често, колкото е необходимо по време на експозицията, за да се определи адекватно устойчивостта на разпределението на частиците, с които животните са в контакт.
|
Продължителност на изпитването
Продължителността на прилагането трябва да бъде най-малко 12 месеца.
Процедура
Наблюдения
Внимателен клиничен преглед трябва да се провежда поне един път дневно. Допълнителни наблюдения трябва да се извършват ежедневно, като се предприемат необходимите действия, за да се избегне загуба на животни при изпитването, например аутопсия или съхраняване в хладилник на животните, които са намерени мъртви, и изолиране или пожертване на слабите или умиращи животни. Трябва да се провеждат внимателни наблюдения, за да се долови началото и прогресирането на всички токсични ефекти, а също и за намаляване до минимум на загубите поради заболявания, автолиза или канибализъм.
Клиничните признаци, включително неврологични и очни изменения, а също смъртността, трябва да се регистрират за всички животни. Трябва да се регистрира времето на поява и прогресирането на токсичните състояния, включително съмнителните тумори.
Телесното тегло трябва да се регистрира индивидуално за всички животни един път седмично през първите 13 седмици на изпитването и поне един път на всеки четири седмици след това. Приемът на храна трябва да се определя всяка седмица през първите 13 седмици от изпитването, а после на интервали от приблизително три месеца, освен ако измененията на телесното тегло не изискват друго.
Хематологично изследване
Хематологично изпитване (т.е. съдържание на хемоглобин, хематокрит, общ брой на еритроцитите, общ брой на левкоцитите, тромбоцити и други показатели на потенциала за съсирване) трябва да се извършва на трети месец, шести месец и след това на интервали от приблизително шест месеца и при приключването върху кръвни проби, взети от всички видове, които са различни от гризачи, и от по 10 плъха/пол от всички групи. Ако е възможно, пробите трябва да се вземат от едни и същи плъхове при всеки интервал. Освен това, от всички видове, различни от гризачи, трябва да се вземе изходна проба преди изпитването.
Ако въз основа на клиничните наблюдения може да се предположи влошаване на здравословното състояние на животните по време на изпитването, на засегнатите животни трябва да се направи диференциално броене на кръвните клетки.
Диференциално броене на кръвните клетки се извършва върху проби от животни в групата на най-висока доза и контролната група. Диференциалното броене на кръвни клетки се извършва при групата на следваща по-ниска доза само ако е налице голямо несъответствие между групата на най-висока доза и контролната група или ако това е показано въз основа на патологични резултати.
Изследване на урина
За анализ трябва да се вземат проби урина от всички видове, различни от гризачи, и от 10 плъха/пол от всички групи, и, ако е възможно, от едни и същи плъхове през същите интервали, както за хематологичните изследвания. При гризачи трябва да се изследват следните параметри за отделни животни или за пул от проби от същия пол/група:
|
—
|
външен вид: обем и плътност при отделните животни,
|
|
—
|
белтък, глюкоза, кетони, скрита кръв (полуколичествено изследване).
|
|
—
|
микроскопско изследване на седимент (полуколичествено).
|
Клинична биохимия
Приблизително на шестмесечни интервали и при прекратяване на изпитването се вземат кръвни проби за клинични биохимични параметри от всички видове, различни от гризачи, и от 10 плъха/пол от всички групи, и, ако е възможно, от същите плъхове при всеки интервал. Освен това, от всички видове, различни от гризачи, преди изпитването трябва да се вземе изходна проба. От тези проби се приготвя плазма и се изследват следните параметри:
|
—
|
концентрация на общия белтък,
|
|
—
|
концентрация на албумина,
|
|
—
|
функционални чернодробни изследвания (като активност на алкалната фосфатаза, активност на глугамат пируват трансаминазата (4), активност на глутамат оксалоацетат трансаминазата (5), гама глутамил транспептидаза, орнитин декарбоксилаза,
|
|
—
|
въглехидратен метаболизъм, например кръвна захар на гладно,
|
|
—
|
бъбречни функционални изследвания, като уреен азот в кръвта.
|
Макроскопска аутопсия
Всички животни, включително тези, които са умрели по време на експеримента или са били убити, защото са намерени в умиращо състояние, трябва да бъдат подложени на пълна макроскопска аутопсия. Преди пожертването, от всички животни трябва да бъдат взети кръвни проби за диференциално броене на кръвни клетки. Всички макроскопски видими лезии, тумори или лезии, които са съмнителни за тумори, трябва да бъдат съхранени. Трябва да се направи опит за съпоставяне на резултатите от макроскопското и микроскопското изследване.
Всички органи и тъкани трябва да бъдат съхранени за хистопатологично изследване. Обикновено това се отнася до следните органи и тъкани: мозъка (6) (продълговат мозък/мост, кора на малкия мозък, кора на главния мозък), хипофизата, щитовидната жлеза (включително паращитовидните жлези), тимуса, белите дробове (включително трахеята), сърцето, аортата, слюнчените жлези, черния дроб (6), слезката, бъбреците (6), надбъбречните жлези (6), хранопровода, стомаха, дванадесетопръстника, празното черво, хълбочното черво, сляпото черво, ободното черво, правото черво, матката, пикочния мехур, лимфните възли, панкреаса, гонадите (6), допълнителните полови органи, женската млечна жлеза, кожата, мускулите, периферен нерв, гръбначния мозък (шиен, гръден и поясен), гръдната кост с костен мозък, бедрената кост (включително става) и очите. Раздуването на белите дробове и пикочния мехур с фиксатор представлява оптимален начин за съхраняване на тези тъкани. Раздуването на белите дробове при инхалационни изпитвания е много важно за правилното хистопатологично изследване. При специални изпитвания като инхалационните изпитвания, трябва да бъде изследван целият респираторен тракт, включително носа, фаринкса и ларинкса.
Ако се провеждат други клинични изследвания, информацията, получена при тези процедури, трябва да бъде налице преди микроскопското изследване, тъй като тя може да даде важни насоки на патолога.
Хистопатологично изследване
Всички видими изменения, особено туморите, и други лезии, възникващи в който и да е орган, трябва да бъдат изследвани микроскопски. Допълнително се препоръчват следните процедури:
|
а)
|
Микроскопско изследване на всички съхранени органи и тъкани с пълно описание на всички лезии, открити при:
|
1.
|
всички животни, които са умрели или са били убити по време на изпитването;
|
|
2.
|
всички животни от групата на висока доза и контролната група.
|
|
|
б)
|
Органите или тъканите, показващи аномалии, които са причинени или е възможно да са причинени от изпитваното вещество, също се изследват при групите на по-ниски дози.
|
|
в)
|
Когато резултатът от изпитването показва данни за значително съкращаване на нормалната продължителност на живота или за предизвикване на ефекти, които могат да окажат влияние върху токсичния отговор, следващата по-ниска доза трябва да бъде изследвана по начина, описан по-горе.
|
|
г)
|
Информацията за честотата на лезиите, които нормално възникват при използваните вид/порода животни, при същите лабораторни условия, т.е. исторически контролни данни, е незаменима за правилната оценка на значимостта на измененията, наблюдавани при третираните животни.
|
2. ДАННИ
Данните трябва да бъдат обобщени в табличен вид, като за всяка изпитвана група са показани броят на животните в началото на изпитването, броят на животните, при които са налице лезии, и процентът на животните, които демонстрират всеки тип лезия. Резултатите трябва да бъдат оценени с помощта на подходящ статистически метод. Може да се използва всеки признат статистически метод.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
—
|
вид, порода, източник, условия на околната среда, диета,
|
|
—
|
условия на изпитването:
Описание на експозиционната апаратура:
Включително проектиране, тип, размери, източник на въздух, система за генериране на частици и аерозоли, метод за климатизиране, пречистване на използвания въздух и метод за настаняване на животните в експериментална камера, когато такава се използва. Трябва да бъде описано оборудването за измерване н температурата, влажността и, където е необходимо, стабилността на концентрациите на частиците в аерозолите или на размера на частиците.
Данни за експозицията:
Те трябва да бъдат представени в табличен вид със средни стойности и мярка за вариабилността (например стандартно отклонение) и трябва да включват:
|
а)
|
скорости на въздушните потоци през инхалационното оборудване;
|
|
б)
|
температура и влажност на въздуха;
|
|
в)
|
номинални концентрации (общо количество на изпитваното вещество, заредено в инхалационното оборудване, разделено на обема въздух);
|
|
г)
|
естество на носителя, ако е използван;
|
|
д)
|
действителни концентрации в изпитвателната зона на дишане;
|
|
е)
|
стойност на медианата на размерите на частиците (когато е необходимо);
|
|
|
—
|
нива на дозиране (включително носител, ако е използван) и концентрации,
|
|
—
|
данни за токсичния отговор по пол и доза,
|
|
—
|
време на смъртта по време на изпитването или дали животните са оживели до прекратяването му,
|
|
—
|
описание на токсичните и други ефекти,
|
|
—
|
времето на наблюдение на всеки абнормен признак и неговото последващо развитие,
|
|
—
|
данни за храната и телесното тегло,
|
|
—
|
резултати от офталмологичното изследване,
|
|
—
|
използвани хематологични изследвания и всички резултати,
|
|
—
|
използвани клинични биохимични изследвания и всички резултати (включително резултати от всички изследвания на урина),
|
|
—
|
резултати от аутопсията,
|
|
—
|
подробно описание на всички резултати от изследвания,
|
|
—
|
статистическа обработка на резултатите, където е възможно,
|
|
—
|
обсъждане на резултатите,
|
|
—
|
интерпретиране на резултатите.
|
3.2. ОЦЕНКА И ИНТЕРПРЕТИРАНЕ
Вижте Общо въведение част Б.
4. ПРЕПРАТКИ
Вижте Общо въведение част Б.
Б.31. ИЗПИТВАНЕ ЗА ОЦЕНКА НА ТОКСИЧНОСТТА ЗА ПРЕНАТАЛНОТО РАЗВИТИЕ
1. МЕТОД
Този метод е еквивалентен на метод ОИСР ТG 414 (2001).
1.1. ВЪВЕДЕНИЕ
Този метод за оценка на токсичността за развитието е разработен с цел да се проучат ефектите на пренаталната експозиция върху бременните опитни животни и върху развиващите се организми in utero. Това включва оценка на ефектите върху майките, както и на смъртността, структурните аномалии и отклоненията в растежа на плода. Въпреки че функционалните нарушения представляват съществена проява на токсичността за развитието, тяхната оценка не е предмет на настоящия метод за изпитване. Тя може да се извърши отделно или като допълнение към това изпитване, като се приложи методът за оценка на невротоксичността за развитието. За информация във връзка с изпитването за функционални нарушения и други постнатални ефекти могат да се ползват методите за оценка на репродуктивната токсичност в две поколения и на невротоксичността за развитието.
В отделни случаи може да се наложи този метод да се адаптира въз основа на познанията за специфичните особености на изпитваното химично вещество, например за неговите физикохимични или токсикологични свойства. Внасянето на изменения в метода е допустимо, когато съществуват убедителни научни данни за това, че прилагането на адаптирания метод ще доведе до по-информативни резултати. Научните данни в подкрепа на необходимостта от адаптиране на метода трябва внимателно да се документират в отчета на проучването.
1.2. ОПРЕДЕЛЕНИЯ
Токсикология на развитието: дял от токсикологията, който изучава неблагоприятните ефекти върху развиващия се организъм в резултат от експозиция преди зачеването, по време на пренаталното развитие или постнатално до настъпването на полова зрялост. Основните прояви на токсичността за развитието включват: 1) смърт на организма; 2) структурни аномалии; 3) промени в растежа; 4) функционални нарушения. В миналото вместо „токсикология на развитието“ често се е използвало названието „тератология“.
Неблагоприятен ефект: всяка промяна спрямо изходното състояние на организма, свързана с прилагането на изпитваното вещество, която води до понижаване жизнеспособността на организма, способността му да се размножава или да се адаптира към околната среда. Неблагоприятните ефекти за развитието в най-широк смисъл обхващат всеки ефект, който нарушава нормалното развитие на организма преди или след раждането.
Нарушение на растежа: промени в масата или размерите на тялото или органите на развиващия се организъм.
Изменения (аномалии): нарушения в развитието на анатомичната структура, които включват малформации и вариации (28).
Малформация/тежка аномалия: структурна промяна, която оказва значителен неблагоприятен ефект върху състоянието на животното (може да бъде и летална) и обикновено настъпва рядко.
Вариация/незначителна аномалия: структурна промяна, която оказва незначителен неблагоприятен ефект или не оказва неблагоприятен ефект върху състоянието на животното; тя може да бъде преходна и може да се среща сравнително често в контролната популация.
Заченат организъм: термин, с който се обозначава развиващият се организъм през всички етапи от развитието на оплодената яйцеклетка от оплождането до раждането, включително ембрионалния и феталния период; към него се отнасят и екстраембрионалните структури.
Имплантация (нидация): прикрепването на бластоциста към епителния слой, покриващ маточната кухина, включително проникването на бластоциста през епитела и навлизането му в ендометриума.
Ембрион: организмът в ранния стадий на развитие след оплождането, по-специално времето от появата на дългата ос до момента, в който са налице всички основни анатомични структури (до края на периода на органогенезата).
Ембриотоксичност: токсичност, свързана с нарушаване на нормалната анатомична структура, развитието, растежа и/или жизнеспособността на ембриона.
Фетус: организмът в стадия на развитие между края на ембрионалния период и раждането.
Фетотоксичност: токсичност, свързана с нарушаване на нормалната анатомична структура, развитието, растежа и/или жизнеспособността на фетуса.
Аборт: преждевременното изхвърляне на ембриона или нежизнеспособния фетус от матката.
Резорбция: състояние, при което имплантираният в матката плод е загинал и в момента на наблюдението е в процес на резорбция или вече се е резорбирал.
Ранна резорбция: състояние, при което се наблюдават признаци на имплантация, без да се открива ембрион/фетус.
Късна резорбция: състояние, при което ембрионът или фетусът е загинал и при огледа му се наблюдават външни дегенеративни промени.
NOAEL: съкращение на термина „no-observed-adverse-effect level“ (ниво, при което не се наблюдава неблагоприятен ефект); означава най-високата доза/ниво на експозиция, при които не се наблюдават неблагоприятни ефекти вследствие третирането на организма с дадено химично вещество.
1.3. РЕФЕРЕНТНО ВЕЩЕСТВО
Не се използва.
1.4. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Обикновено бременните животни се третират с изпитваното вещество най-късно от момента на имплантацията до деня преди датата, за която е планирано убиването им. Тази дата следва да се избере така, че да бъде колкото е възможно по-близо до датата на термина, като в същото време се избегне рискът от загуба на данни в резултат от настъпване на преждевременно раждане. Методът не е предназначен за изследване само на периода на органогенезата (ден 5—15 при гризачи и ден 6—18 при зайци). Проследяват се ефектите през цялата бременност до деня преди извършването на цезарово сечение. Когато е възможно, се обхваща и предимплантационният период. Непосредствено преди извършването на цезарово сечение женските животни се убиват, съдържанието на матката се преглежда и фетусите се изследват за наличие на видими външни аномалии и аномалии на меките тъкани и скелета.
1.5. ОПИСАНИЕ НА МЕТОДА НА ИЗПИТВАНЕ
1.5.1. Избор на вида опитни животни
Препоръчва се изпитването да се извърши върху най-подходящия вид животни и да се изберат видове и породи лабораторни животни, които обичайно се използват при изпитвания за оценка на пренаталната токсичност за развитието. Предпочитаният вид гризачи е плъх, а предпочитаният вид опитни животни, който не се отнася към гризачите, е заек. Използването на други животински видове следва да се обоснове.
1.5.2. Условия на отглеждане и хранене
Температурата на помещението, в което се извършва изпитването, следва да бъде 22 oС (± 3o) за гризачите и 18 oС (± 3o) за зайците. Стойностите на относителната влажност не следва да бъдат по-ниски от 30 % и е желателно да не превишават 70 %, освен при почистване на помещението. Целта следва да бъде относителната влажност да се поддържа в интервала 50—60 %. Осветлението следва да бъде изкуствено, като се редуват 12 часа светлина и 12 часа тъмнина. При храненето се използват обичайните лабораторни диети с неограничен достъп до питейна вода.
Чифтосването следва да се извърши в клетки, подходящи за целта. За предпочитане е чифтосаните животни да се поставят в индивидуални клетки, но се допуска да се разпределят на малки групи в общи клетки.
1.5.3. Подготовка на опитните животни
Следва да се използват здрави животни, които предварително са се аклиматизирали към лабораторните условия в продължение най-малко на 5 дни и не са подлагани на други изпитвания. Опитните животни следва да се опишат по отношение на вид, порода, източник за доставка, пол, телесна маса и/или възраст. Стойностите на телесната маса и възрастта на животните във всички опитни групи следва да бъдат възможно най-близки. Във всяка опитна група следва да се включат млади, полово зрели, нераждали женски животни. Женските животни следва да се чифтосат с мъжки животни от същия вид и порода, като се избягва чифтосването между животни от едно и също котило. При гризачите за ден 0 на гестацията се приема денят, в който се наблюдава вагинална запушалка и/или сперматозоиди; при зайците за ден 0 се счита най-често денят на коитуса или изкуственото осеменяване в случаите, когато се прилага тази техника. Чифтосаните женски животни следва да бъдат разпределени на принципа на случайния подбор към експонираните групи и контролната група. Клетките следва да бъдат подредени по такъв начин, че да се намалят до минимум възможните ефекти в резултат от разположението им. Всяко животно следва да получи индивидуален идентификационен номер. Чифтосаните женски животни следва да бъдат разпределени чрез случаен подбор към контролната и опитните групи. Когато женските са чифтосани последователно по групи, животните от всяка група следва да се разпределят равномерно между отделните експонирани групи и контролната група. Също така женските, осеменени от едно и също мъжко животно, следва да се разпределят равномерно в отделните групи.
1.6. ПРОЦЕДУРА
1.6.1. Брой и пол на животните
Експонираните групи и контролната група следва да обхващат достатъчен брой женски животни, така че при аутопсията всяка група да включва приблизително 20 женски животни с места на имплантация. По правило групите не би следвало да наброяват по-малко от 16 животни с места на имплантация. При появата на смътни случаи сред майките проучването се приема за валидно, когато смъртността не превишава приблизителната граница от 10 %.
1.6.2. Подготовка на дозите
Когато за улесняване на въвеждането се използва носител или друга добавка към изпитваното вещество, следва да се вземат предвид следните възможни ефекти на носителя/добавката: ефекти върху резорбцията, разпределението, метаболизма и ретенцията или екскрецията на изпитваното вещество; ефекти върху химичните свойства на веществото, които могат да повлияят върху токсикологичните му свойства; ефекти върху консумацията на храна и вода или върху хранителния статус на животните. Веществото носител не следва да предизвиква токсични ефекти върху развиващия се организъм или възпроизводителната функция.
1.6.3. Дози
Най-често изпитваното вещество се въвежда всеки ден от момента на имплантацията (напр. от ден 5 след чифтосването) до деня преди датата, за която е определено извършването на цезарово сечение. Когато предварителните проучвания, ако такива са налице, показват, че вероятността от настъпване на предимплантационна смърт не е висока, периодът на третиране може да се разшири и да обхване целия гестационен период от момента на чифтосването до деня преди датата, за която е определено убиването. Известно е, че неправилното отглеждане и провеждане на манипулациите, както и стресът по време на бременността могат да доведат до преждевременна загуба на плода. За да се предотврати загубата на плода в резултат от фактори, които не са свързани с експозицията на изпитваното вещество, следва да се избягват ненужни манипулации върху бременните животни, както и стресът от външни фактори, например шум.
Следва да се приложат най-малко три дози. Успоредно с експонираните групи се наблюдава и нетретирана контролна група. Опитните животни следва да са здрави. Те се разпределят между отделните експонирани групи и контролната група чрез случаен подбор. Дозите следва да бъдат избрани в такова съотношение, че с нарастването им да се наблюдава ясно изразено засилване на токсичните ефекти. С изключение на случаите, когато се налагат ограничения във връзка с физични, химични или биологични свойства на изпитваното вещество, най-високата доза следва да бъде подбрана така, че да води до прояви на токсичност за майката и/или за развиващия се организъм (клинични симптоми или понижение на телесната маса), но не и до смърт или тежко страдание. Най-малко една междинна доза следва да предизвиква минимални наблюдавани токсични ефекти. Най-ниската доза не следва да предизвиква никакви прояви на токсичност за майката или развиващия се организъм. Дозите следва да се подберат в намаляваща последователност по такъв начин, че да се характеризира зависимостта „доза-отговор“ и да се установи нивото, при което не се наблюдава неблагоприятен ефект (NOAEL). В повечето случаи най-подходящо е да се използва двукратно до четирикратно намаление на всяка доза спрямо най-близката по-висока доза. Включването на допълнителна четвърта експонирана група често е за предпочитане пред използването на твърде големи интервали между дозите (напр. намаление повече от 10 пъти). Въпреки че целта на изпитването е определяне на NOAEL за майката, се допускат и случаи, когато това ниво не може да се установи (1).
Нивата на дозите следва да се подберат, като се вземат под внимание всички съществуващи токсикологични данни, както и информацията за метаболизма и токсикокинетиката на изпитваното вещество или на подобни вещества. Тази информация се използва също и при обосновката на схемата на третиране.
Заедно с експонираните групи следва да се използва и контролна група. На животните от тази група се въвежда вода или носител, когато се използва такъв. Изпитваното вещество или носителят се въвеждат в един и същи обем при всички групи. Животните в контролната група/групи следва да се поставят при същите условия и да се подлагат на същите манипулации както тези от експонираните групи. Носителят следва да се въвежда на животните от контролната група в най-голямото количество, което се въвежда на експонираните животни (количеството, с което се въвежда най-ниската доза от изпитваното вещество).
1.6.4. Лимитиращо изпитване
Когато изпитването върху една експонирана група с орална дневна доза, равна или по-висока от 1 000 mg/kg т.м., извършено съгласно процедурите, описани в настоящия метод, не предизвика наблюдавани признаци на токсичност както при бременните животни, така и при тяхното поколение, или когато при тази или по-високи дози не се очаква поява на токсичен ефект въз основа на съществуващи данни (напр. за структурни аналози или за вещества с подобен метаболизъм), тогава извършването на изпитването в пълен обем с три различни дози може да се прецени като ненужно. Във връзка с очакваните нива на експозиция за населението може да се наложи необходимостта от използване на по-високи орални дози в лимитиращото изпитване. При други пътища на въвеждане, напр. инхалаторно или дермално, физикохимичните свойства на изпитваното вещество често могат да повлияят и да ограничат максимално възможното ниво на експозиция (например дермалната апликация не следва да предизвиква силно изразена локална токсичност).
1.6.5. Въвеждане на дозите
Изпитваното вещество или носителят обикновено се въвеждат орално чрез гаваж. Когато се използва друг път на въвеждане, изборът следва да се обоснове. В този случай може да се наложи въвеждането на модификации в представения метод (2)(3)(4). Изпитваното вещество следва да се въвежда приблизително по едно и също време всеки ден.
Количеството от веществото, което се въвежда на всяко животно, се изчислява спрямо последното измерване на телесната маса. Въпреки това, когато третирането се извършва през последната третина на бременността, следва да се подхожда предпазливо при изчисляване на количеството. За да се избегне силно изразен токсичен ефект върху майките, при избора на дозите следва да се използват съществуващите данни за веществото. Когато при бременните животни се наблюдават симптоми на тежка интоксикация, те следва да бъдат умъртвени по хуманен начин. Ако няколко бременни животни показват симптоми на тежка интоксикация, следва да се прецени дали е необходимо всички животни от тази опитна група да бъдат умъртвени по хуманен начин. Когато веществото се въвежда чрез гаваж, се препоръчва въвеждането да се извършва веднъж дневно посредством стомашна сонда или подходяща интубационна канюла. Максималният обем течност, който може да бъде въведен еднократно, зависи от телесната маса на опитното животно. Обемът не следва да превишава 1 ml/100 g т.м., освен в случаите, когато се прилагат водни разтвори. Тогава обемът може да достигне 2 ml/100 g т.м. Когато се използва царевично олио като носител, обемът не следва да превишава 0,4 ml/100 g т.м. За да се осигури въвеждането на веществото в постоянен обем при всички използвани дози, промените в обема следва да бъдат сведени до минимум, като вместо него се променят концентрациите.
1.6.6. Наблюдения върху бременните животни
Клиничните наблюдения следва да се извършват и да се отразяват в документацията на изпитването най-малко един път дневно, за предпочитане всеки ден по едно и също време, като се вземе под внимание периодът след третирането, когато се очаква появата на най-силно изразени ефекти. Състоянието на животните следва да се описва, като се отразяват смъртността, наличието на животни в терминално състояние, промените в поведението и всички прояви на ясно изразено токсично действие.
1.6.7. Телесна маса и консумация на храна
Животните следва да се претеглят в ден 0 от гестационния период (в случаите когато осеменените животни са доставени от външен снабдител — не по-късно от ден 3 от гестацията), както и в деня, когато започва третирането, най-малко на всеки 3 дни по време на експозицията и в деня, за който е насрочено убиването.
Количеството на консумираната храна следва да се отчита и записва на всеки три дни, в същите дни, когато се измерва телесната маса.
1.6.8. Макроскопски оглед при аутопсиране
Женските животни следва да се убият един ден преди очакваната дата на раждането. Женските животни, показващи признаци на аборт или преждевременно раждане преди деня, за който е насрочено убиването, следва да бъдат убити и подложени на цялостен макроскопски оглед.
В момента на убиването или при настъпването на смърт по време на изпитването следва да се извърши макроскопски оглед на женските животни, за да се установи наличието на структурни аномалии или други патологични промени. Препоръчва се огледът на бременните животни по време на цезаровото сечение и огледът на фетусите да се извършат, без да се знае към коя група се отнасят майките и фетусите, за да не се отрази това върху наблюденията и оценките.
1.6.9. Оглед на съдържанието на матката
Веднага след убиването или възможно най-скоро след настъпване на смъртта матките следва да бъдат извадени и да се потвърди наличието на бременност. Когато видът на матката показва отсъствие на бременност, тя следва да се изследва по-подробно (напр. чрез оцветяване с амониев сулфид при гризачи и оцветяване по Salewski или друг подходящ метод при зайци), за да се потвърди, че животното не е бременно (5).
Матките на бременните животни, включително цервиксът, следва да бъдат претеглени. Не е необходимо да се измерва масата на матките на бременни животни, умрели по време на проучването.
За всяко бременно животно следва да се определи броят на жълтите тела.
Съдържанието на матката следва да се прегледа, за да се установи броят на мъртвите ембриони/фетуси и на живите фетуси. Следва да се опише степента на резорбция, за да се установи приблизителното време на смъртта на умрелите ембриони/фетуси (вж. точка 1.2).
1.6.10. Оглед на фетусите
При огледа на всеки фетус следва да се определи полът и да се измери телесната маса.
Всеки фетус следва да се прегледа за наличие на външни аномалии (6).
Фетусите следва да се огледат за наличие на изменения в скелета и меките тъкани (напр. вариации и малформации или аномалии) (7) (8) (9) (10) (11) (12) (13) (14) (15) (16) (17) (18) (19) (20) (21) (22) (23) (24). Препоръчва се да се извърши категоризиране на наблюдаваните изменения, но това не се изисква задължително. Когато се извършва категоризиране, следва ясно да се посочат критериите, отнасящи се за всяка категория. Особено внимание при огледа следва да се обърне на състоянието на половата система и да се търсят признаци за нарушение в развитието ѝ.
Когато изпитването се извършва върху гризачи, приблизително половината от фетусите във всяко котило следва да бъдат обработени и изследвани за наличие на скелетни аномалии. Останалите фетуси следва да се обработят и изследват за наличие на изменения в меките тъкани посредством утвърдени или подходящи методи за серийно сециране или прецизни секционни техники за макроскопски оглед.
Когато изпитването се извършва върху животни, които не са гризачи, например върху зайци, всички фетуси следва да се прегледат за наличие на изменения както в меките тъкани, така и в скелета. Огледът на тези фетуси се извършва чрез внимателна дисекция, при която се търсят изменения в меките тъкани. Дисекцията може да включва и процедури, чрез които се изследва по-подробно устройството на сърцето (25). При огледа главите на половината от фетусите следва да се отделят, обработят и изследват за наличие на изменения в меките тъкани (включително очи, мозък, носни кухини и език) посредством стандартни методи за серийно сециране (26) или други методи с подобна чувствителност. Телата на всички фетуси следва да се обработят и огледат за наличие на скелетни аномалии посредством същите методи както тези, които се прилагат при гризачите.
2. ДАННИ
2.1. ПРЕДСТАВЯНЕ И ОБРАБОТКА НА РЕЗУЛТАТИТЕ
Данните следва да се представят индивидуално както за бременните животни, така и за тяхното поколение, и да се обобщят в табличен вид, като за всяка опитна група и за всяко поколение се посочат броят на животните в началото на изпитването, броят на животните, умрели по време на изпитването или умъртвени по хуманни съображения, и времето на настъпване на смъртта или на умъртвяването, броят на бременните женски животни, броят на животните със симптоми на токсично действие, характеристиката на наблюдаваните симптоми, включително време на поява, продължителност и степен на изразеност, наблюдения върху ембрионите и фетусите, както и всички необходими данни за котилата.
Количествените резултати следва да се оценят чрез подходящи статистически методи, като котилото се използва като единица за наблюдение при анализа на данните. Следва да се приложат общоприети статистически методи. Подборът на статистическите методи следва да се направи в зависимост от дизайна на проучването и да се обоснове. Данните за животни, които не са преживели до датата на убиването, също следва да се представят в отчета за изпитването. Тези данни могат да се включат при изчислението на средногруповите стойности на изследваните показатели, когато това е възможно. Информативността на данните за тези животни и съответно включването или изключването им при изчислението на средногрупови стойности следва да се прецени за всеки отделен случай и да се обоснове.
2.2. ОЦЕНКА НА РЕЗУЛТАТИТЕ
Оценката на резултатите от проучването на пренаталната токсичност за развитието се извършва въз основа на наблюдаваните ефекти. Оценката включва следните данни:
|
—
|
резултати от изпитването по отношение на майките и ембрионите/фетусите, включително оценка на зависимостта (или отсъствието на такава) между експозицията на изпитваното вещество и честотата и тежестта на всяка от наблюдаваните промени;
|
|
—
|
критерии за категоризиране на измененията във външния вид, скелета и меките тъкани на фетусит, в случаите, когато е извършено категоризиране;
|
|
—
|
когато е необходимо, следва да се представят данни за контролни групи от предишни изпитвания (историческа контрола), за да се подпомогне интерпретацията на резултатите от настоящото изпитване;
|
|
—
|
стойностите, използвани при изчислението на индекси или на относителни дялове (в проценти);
|
|
—
|
адекватен статистически анализ на резултатите от изпитването, където това е необходимо; следва да се даде достатъчно информация за използваните методи, така че анализът да може да се възпроизведе и оцени от независим рецензент/статистик.
|
Във всяко проучване, при което се установява отсъствие на каквито и да е токсични ефекти, е необходимо да се прецени необходимостта от допълнителни изследвания за определяне степента на резорбция и съдържанието на изпитваното вещество в организма на третираните животни.
2.3. ИНТЕРПРЕТАЦИЯ НА РЕЗУЛТАТИТЕ
Изпитването за оценка на пренаталната токсичност за развитието следва да даде информация за ефектите върху бременните животни и върху вътреутробното развитие на тяхното потомство при многократно постъпване на дадено химично вещество по време на бременността. Резултатите от него следва да се интерпретират във връзка с данните от изпитванията за оценка на субхроничната токсичност, репродуктивната токсичност, токсикокинетиката и др. Тъй като при изпитването се оценява както системната токсичност за майката, така и токсичността за развиващия се организъм, резултатите позволяват до известна степен да се разграничат ефектите върху развиващия се организъм, които се явяват при отсъствие на прояви на системна токсичност, от ефектите, които се предизвикват само при нива, токсични и за майката (27).
3. ДОКЛАДВАНЕ НА РЕЗУЛТАТИТЕ
3.1. ОТЧЕТ ЗА ИЗПИТВАНЕТО
Отчетът за изпитването следва да включва следната информация:
|
|
Изпитвано вещество:
|
—
|
физична природа и, където е необходимо, физикохимични свойства;
|
|
—
|
данни за идентифициране на химичното вещество, включително CAS номер, ако такъв е известен/определен;
|
|
—
|
степен на чистота на веществото.
|
|
|
|
Носител (когато се използва такъв):
|
—
|
обосновка за използването на носител, когато носителят не е вода.
|
|
|
|
Опитни животни:
|
—
|
вид и порода на използваните опитните животни;
|
|
—
|
брой и възраст на опитните животни;
|
|
—
|
източник за доставка на животните, условия на отглеждане, диета и т.н.;
|
|
—
|
телесна маса на всяко животно в началото на изпитването.
|
|
|
|
Условия на провеждане на изпитването:
|
—
|
обосновка за избора на дозите;
|
|
—
|
описание на подготовката на изпитваното вещество за въвеждане (приготвяне на формулация или включване в диетата), използвани концентрации, стабилност и хомогенност на формулацията;
|
|
—
|
описание на въвеждането на изпитваното вещество;
|
|
—
|
преизчисляване на концентрациите на изпитваното вещество в диетата/питейната вода (ррт) в дневни дози (mg/kg т.м.), където това е приложимо;
|
|
—
|
условия на средата, в която се провежда изпитването;
|
|
—
|
критерии за качество, на които отговарят храната и водата за пиене.
|
|
|
|
Данни за отговора във връзка с токсичността за майката в зависимост от приложената доза — данните включват, но не се ограничават само до:
|
—
|
брой на животните в началото на изпитването, брой на животните, преживели до края на изпитването, брой на бременните животни, брой на животните с аборт и преждевременно раждане;
|
|
—
|
за всяко животно се отбелязва дали е преживяло до деня на убиването; за тези, които не са преживели, се отбелязва денят на смъртта;
|
|
—
|
данните за животните, които не са преживели до деня на планираното убиване, следва да се представят, но не следва да се използват при статистическия анализ за сравнение между групите;
|
|
—
|
дата на появата на всеки клиничен симптом; проследяване на по-нататъшното му развитие;
|
|
—
|
телесна маса, прираст на телесната маса и маса на бременната матка, включително, по желание, коригиране на прираста на телесната маса спрямо масата на бременната матка;
|
|
—
|
данни за консумацията на храна; представят се и данните за консумацията на вода, ако тя е измерена;
|
|
—
|
данни от аутопсията, включително маса на матката;
|
|
—
|
следва да се посочат стойностите на NOAEL за ефектите върху майката и развиващия се организъм.
|
|
|
|
Ефекти върху развиващия се организъм при всяка доза за котилата, при които се установява наличие на имплантации, включително:
|
—
|
брой на имплантациите, брой и относителен дял (като %) на живите и мъртвите фетуси и на резорбциите;
|
|
—
|
брой и относителен дял на пред- и постимплантационните загуби.
|
|
|
|
Ефекти върху развиващия се организъм при всяка доза за котилата с живи фетуси, включително:
|
—
|
брой и относителен дял на живите новородени;
|
|
—
|
съотношение между броя на фетусите от всеки пол;
|
|
—
|
фетална телесна маса, за предпочитане както поотделно за всеки пол, така и общо за двата пола;
|
|
—
|
малформации, засягащи външния вид, скелета и меките тъкани, и други изменения;
|
|
—
|
критерии за категоризиране, когато това е необходимо;
|
|
—
|
общ брой и относителен дял на фетусите и котилата с видими външни аномалии и аномалии на скелета и меките тъкани; характеристика на наблюдаваните аномалии и други изменения по вид и честота.
|
|
|
|
Обсъждане на резултатите.
|
4. ПРЕПРАТКИ
|
(1)
|
Kavlock R. J. et al. (1996) A Simulation Study of the Influence of Study Design on the Estimation of Benchmark Doses for Developmental Toxicity. Risk Analysis 16; 399—410.
|
|
(2)
|
Kimmel, C. A. and Francis, E.Z. (1990) Proceedings of the Workshop on the Acceptability and Interpretation of Dermal Developmental Toxicity Studies. Fundamental and Applied Toxicology 14; 386—398.
|
|
(3)
|
Wong, B. A., et al. (1997) Developing Specialized Inhalation Exposure Systems to Address Toxicological Problems. CUT Activities 17; 1—8.
|
|
(4)
|
US Environmental Protection Agency (1985) Subpart E-Specific Organ/Tissue Toxicity, 40 CFR 798.4350: Inhalation Developmental Toxicity Study.
|
|
(5)
|
Salewski, E. (1964) Faerbermethode zum Makroskopischen Nachweis von Implantations Stellen am Uterusder Ratte. Naunyn.Schmeidebergs Archiv fur Pharmakologie und Experimentelle Pathologie 247:367.
|
|
(6)
|
Edwards, J. A. (1968) The external Development of the Rabbit and Rat Embryo. In Advances in Teratology. D. H. M. Woolam (ed.) Vol. 3. Academic Press, NY.
|
|
(7)
|
Inouye, M. (1976) Differential Staining of Cartilage and Bone in Fetal Mouse Skeleton by Alcian Blue and Alizarin Red S. Congenital Anomalies 16; 171—173.
|
|
(8)
|
Igarashi, E. et al. (1992) Frequency Of Spontaneous Axial Skeletal Variations Detected by the Double Staining Techniquefor Ossified and Cartilaginous Skeleton in Rat Foetuses. Congenital Anomalies 32;: 381—391.
|
|
(9)
|
Kimmel, C.A. et al. (1993) Skeletal Development Following Heat Exposure in the Rat. Teratology 47: 229—242.
|
|
(10)
|
Marr, M.C. et al. (1988) Comparison of Single and Double Staining for Evaluation of Skeletal Development: The Effects of Ethylene Glycol (EG) in CD Rats. Teratology 37; 476.
|
|
(11)
|
Barrow, M.V. and Taylor, W.J. (1969) A Rapid Method for Detecting Malformations in Rat Foetuses. Journal of Morphology 127:291—306.
|
|
(12)
|
Fritz, H. (1974) Prenatal Ossification in Rabbits ss Indicative of Foetal Maturity. Teratology 11; 313—320.
|
|
(13)
|
Gibson, J.P. et al. (1966) Use of the Rabbit in Teratogenicity Studies. Toxicology and Applied Pharmacology 9; :398—408.
|
|
(14)
|
Kimmel, C.A. and Wilson, J.G. (1973) Skeletal Deviation in Rats: Malformations or Variations? Teratology 8; 309—316.
|
|
(15)
|
Marr, M.C. et al. (1992) Developmental Stages of the CD (Sprague-Dawley) Rat Skeleton after Maternal Exposure to Ethylene Glycol. Teratology 46; 169—181.
|
|
(16)
|
Monie, I.W. et al. (1965) Dissection Procedures for Rat Foetuses Permitting Alizarin Red Staining of Skeleton and Histological Study of Viscera. Supplement to Teratology Workshop Manual, pp. 163—173.
|
|
(17)
|
Spark, C. and Dawson, A.B. (1928) The Order and Time of appearance of Centers of Ossification in the Fore and Hind Limbs of the Albino Rat, with Special Reference to the Possible Influence of the Sex Factor. American Journal of Anatomy 41; 411—445.
|
|
(18)
|
Staples, R.E. and Schnell, V.L. (1964) Refinements in Rapid Clearing Technique in the KOH-Alizarin Red S Method for Fetal Bone. Stain Technology 39; 61—63.
|
|
(19)
|
Strong, R.M. (1928) The Order Time and Rate of Ossification of the Albino Rat (Mus Norvegicus Albinus) Skeleton. American Journal of Anatomy 36; 313—355.
|
|
(20)
|
Stuckhardt, J.L. and Poppe, S.M. (1984) Fresh Visceral Examination of Rat and Rabbit Foetuses Used in Teratogenicity Testing. Teratogenesis, Carcinogenesis, and Mutagenesis 4; 181—188.
|
|
(21)
|
Walker, D.G. and Wirtschafter, Z.T. (1957) The Genesis of the Rat Skeleton. Thomas, Springfield, IL.
|
|
(22)
|
Wilson, J.G. (1965) Embryological Considerations in Teratology. In Teratology: Principles and Techniques, Wilson J.G. and Warkany J. (eds). University of Chicago, Chicago, IL, pp 251—277.
|
|
(23)
|
Wilson, J.G. and Fraser, F.C. (eds). (1977) Handbook of Teratology, Vol. 4. Plenum, NY.
|
|
(24)
|
Varnagy, L. (1980) Use of Recent Fetal Bone Staining Techniques in the Evaluation of Pesticide Teratogenicity. Acta Vet. Acad. Sci. Hung. 28; 233—239.
|
|
(25)
|
Staples, R.E. (1974) Detection of visceral Alterations in Mammalian Foetuses. Teratology 9; 37—38.
|
|
(26)
|
Van Julsingha, E.B. and C.G. Bennett (1977) A Dissecting Procedure for the Detection of Anomalies in the Rabbit Foetal Head. In: Methods in Prenatal Toxicology Neubert, D., Merker, H.J. and Kwasigroch, T.E. (eds.). University of Chicago, Chicago, IL, pp. 126—144.
|
|
(27)
|
US Environmental Protection Agency (1991) Guidelines for Developmental Toxicity Risk Assessment. Federal Register 56; 63798—63826.
|
|
(28)
|
Wise, D.L. et al. (1997) Terminology of Developmental Abnormalities in Common Laboratory Mammals (Version 1) Teratology 55; 249—292.
|
Б.32. ИЗПИТВАНЕ ЗА КАНЦЕРОГЕННОСТ
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Вижте Общо въведение част Б.
1.2. ОПРЕДЕЛЕНИЯ
Вижте Общо въведение част Б.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Няма.
1.4. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Нормално изпитваното вещество се прилага седем дни седмично, по подходящ начин, върху няколко групи експериментални животни, по една доза за група, през голяма част от живота им. По време на експозицията на изпитваното вещество и след нея, експерименталните животни се наблюдават ежедневно, за да се открият признаци на токсичност, и, по-конкретно, развитие на тумори.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Няма.
1.6. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
Животните се държат при експериментални условия на настаняване и хранене в продължение поне на пет дни преди изпитването. Преди изпитването здрави млади животни се избират по случаен признак и се разпределят в третирана и контролна група.
Експериментални животни
Въз основа на резултатите от изпитвания, проведени в миналото, могат да се използват други видове (гризачи или различни от гризачи). Трябва да се използват млади здрави животни от обичайно употребявани лабораторни породи и дозирането трябва да започне колкото е възможно по-скоро след отбиването.
При започване на изпитването колебанията в теглото на използваните животни не трябва да превишават ± 20 % от средната стойност. Когато оралното субхронично изпитване се провежда като предварително проучване преди продължително изпитване, и при двете изпитвания трябва да се използва същият вид/порода.
Брой и пол
За гризачи за всяко ниво на дозиране за паралелната контролна група трябва да се използват най-малко по 100 животни (50 женски и 50 мъжки). Женските животни трябва да са нераждали и да не са бременни. Ако се планират междинни жертви, броят трябва да бъде увеличен с броя животни, които са планирани за пожертване преди завършване на изпитването.
Нива на дозиране и честота на експозицията
В допълнение към паралелната контролна група трябва да се използват поне три нива на дозиране. Най-високото ниво на дозиране трябва да предизвиква признаци на минимална токсичност, като леко потискане наддаването на тегло (под 10 %), без значително изменение на нормалната продължителност на живота поради ефекти, които са различни от тумори.
Най-ниското ниво на дозиране не трябва да влияе върху нормалния растеж, развитие и дълголетие на животното или да предизвиква някакъв признак на токсичност. Обикновено то не трябва да бъде по-ниско от 10 % от високата доза.
Междинната доза(и) трябва да се намират по средата на диапазона между високите и ниските дози.
При избиране на нива на дозиране трябва да вземат предвид данните от предшестващи проучвания и изпитвания за токсичност.
Нормално експозицията е ежедневна. Ако дадено химическо вещество се прилага с питейната вода или се смесва с храната, то трябва да е непрекъснато в наличност.
Контроли
Трябва да се използва една паралелна контролна група, която е идентична с третираната група във всяко отношение, освен експозицията на изпитваното вещество.
При особени обстоятелства, например инхалационни изпитвания с аерозоли или емулгиращо средство с нехарактеризирана при орални изпитвания биологична активност, трябва да се използва допълнителна контролна група, която не е в контакт с използвания носител.
Начин на прилагане
Трите основни начина на прилагане са орален, дермален и инхалационен. Изборът на начин на прилагане зависи от физичните и химичните характеристики на изпитваното вещество и вероятния начин на експозиция при хора.
1.6.5.1. Орални изпитвания
Когато изпитваното вещество се абсорбира от стомашно-чревния тракт и ако храносмилателният път е един от тези, чрез които хората могат да бъдат подложени на експозиция, предпочита се оралният начин на прилагане, освен ако няма противопоказания. Животните могат да получават изпитваното вещество с храната, разтворено в питейната вода или дадено с капсула.
В идеалния случай, дозирането трябва да бъде ежедневно, седем дни в седмицата, тъй като дозирането пет дни в седмицата може да даде възможност за възстановяване или за поява на токсичност при отнемане през периода без дозиране, и по този начин да окаже влияние върху резултата и последващата оценка. Обаче, въз основа главно на практически съображения, дозирането пет дни в седмицата се смята за приемливо.
1.6.5.2. Дермални изпитвания
Дермалната експозиция чрез боядисване на кожата може да бъде избрана за симулиране на основния път за експозиция при хора и като система-модел за предизвикване на кожни лезии.
1.6.5.3. Инхалационни изпитвания
Тъй като инхалационните изпитвания създават по-сложни технически проблеми в сравнение с другите начини на прилагане, тук се дават по-подробни указания за този начин на прилагане. Трябва да се отбележи, че в особени ситуации интратрахеалното накапване може да бъде валидна алтернатива
Продължителната експозиция обикновено наподобява предполаганата експозиция при хора, като животните са подложени на ежедневна експозиция в продължение на шест часа след изравняване на концентрациите в камерата, по пет дни в седмицата (интермитентна експозиция), или, съответно на възможна експозиция от околната среда, на 22- до 24-часова експозиция през деня по седем дни седмично (непрекъсната експозиция) с около един час дневно по едно и също време за хранене на животните и за поддържане на камерата. И в двата случая животните обикновено са подложени на експозиция с фиксирани концентрации на изпитваното вещество. Основна разлика между интермитентната и непрекъснатата експозиция е, че при първата съществува период от 17 до 18 часа, през който животните могат да се възстановят от ефектите на ежедневната експозиция, като в края на седмицата има дори още по-дълъг период за възстановяване.
Изборът на интермитентна или непрекъсната експозиция зависи от целите на изпитването и от експозицията при хора, която трябва да се симулира. Трябва обаче да се имат предвид определени технически трудности. Например предимствата на непрекъснатата експозиция при симулиране на условията в околната среда могат да бъдат изместени от нуждата от поене и хранене по време на експозицията и от необходимостта от по-сложно (и сигурно) генериране на аерозол и пара и от мониторингови техники.
Експозиционни камери
Животните трябва да бъдат изследвани в инхалационни камери, предназначени за поддържане на динамичен въздушен поток при поне 12-кратно обменяне на въздуха за час, за да се обезпечат адекватно кислородно съдържание и равномерно разпределена експозиционна атмосфера. Контролните и експозиционните камери трябва да бъдат идентични по конструкция и проект, така че да осигурят сравними във всички отношения условия, освен експозицията на изпитваните вещества. Обикновено в камерата се поддържа леко отрицателно налягане, за да се предотврати изтичането на изпитвано вещество в заобикалящата среда. Камерите трябва да намалят до минимум струпването на експериментални животни. Като правило, за да се постигне стабилност на атмосферата в камерата, общият обем на експерименталните животни не трябва да надвишава 5 % от обема на камерата.
Измерванията или мониторингът трябва да включват:
|
i)
|
Въздушен поток: за предпочитане е скоростта на въздушния поток през камерата да се мониторира непрекъснато;
|
|
ii)
|
Концентрация: По време на ежедневната експозиция концентрацията на изпитваното вещество не трябва да варира с повече от ± 15 % от средната стойност; По време на пялото изпитване, концентрациите през отделните дни трябва да бъдат поддържани колкото е възможно по-постоянни.
|
|
iii)
|
Температура и влажност: за гризачи, температурата трябва да се поддържа на 22 ± 2 oС, а влажността в камерата на 30 до 70 %, освен когато за суспендиране на изследваното вещество в атмосферата на камерата се използва вода. За предпочитане е и двата показателя да се мониторират непрекъснато;
|
|
(iv)
|
Измерване размера на частиците: разпределението на размерите на частиците се определя в атмосферата на камери, които включват течни или твърди аерозоли. Частиците на аерозола трябва да бъдат с размери, позволяващи вдишването им от използваните експериментални животни. Проби от атмосферата в камерите трябва да се вземат в зоната на дишане на животните. Пробата въздух трябва да бъде представителна за разпределението на частиците, с които животните са в контакт, и трябва гравиметрично да се вземе предвид целият суспендиран аерозол, дори когато голяма част от него не се вдишва. При разработване на генериращата система трябва често да се анализират размерите на частиците, за да се осигури стабилността на аерозола, и впоследствие толкова често, колкото е необходимо по време на експозицията, за да се определи адекватно устойчивостта на разпределението на частиците, с които животните са в контакт.
|
Продължителност на изпитването
Продължителността на изпитването за канцерогенност ангажира голяма част от нормалната продължителност на живота на експерименталните животни. Прекратяването на изпитването трябва да бъде след 18 месеца за мишки и хамстери и след 24 месеца за плъхове. За някои породи животни с по-голямо дълголетие и/или ниска спонтанна честота на туморите, обаче, прекратяването трябва да стане след 24 месеца за мишки и хамстери и след 30 месеца за плъхове. Алтернативно, прекратяването на такова разширено изпитване е приемливо, когато броят на оживелите животни в групата на най-ниска доза и контролната група достигне 25 %. При прекратяване на изпитване, при което се наблюдава явна разлика в отговора между половете, всеки пол трябва да се разглежда отделно. Когато само групата на висока доза умира преждевременно поради явна токсична причина, това не изисква прекратяване, при условие, че токсичните прояви не създават проблеми в другите групи. За да бъде приемлив един отрицателен резултат, не повече от 10 % от която и да е група може да бъде загубена от експеримента поради автолиза, канибализъм или проблеми с управлението, и преживяемостта във всички групи е не по-ниска от 50 % на 18-тия месец за мишки и хамстери и на 24-ия месец за плъхове.
Процедура
Наблюдения
Ежедневните наблюдения в клетките трябва да включват измененията на кожата и козината, очите и лигавиците, а също дихателната, сърдечно-съдовата, автономната и централната нервна система, соматомоторната активност и начина на поведение.
Редовното наблюдение на животните е необходимо, за да се обезпечи, доколкото е възможно, животните да не се губят от изпитването поради причини като канибализъм, тъканна автолиза или преместване. Умиращите животни трябва да бъдат отстранени и подложени на аутопсия, когато бъдат забелязани.
За всички животни трябва да бъдат регистрирани клиничните признаци и смъртността. Специално внимание трябва да се обърне на развитието на тумори: трябва да се регистрират времето на настъпване, локализацията, размерите, външният вид и прогресирането на всички макроскопски видими или напипващи се тумори.
Консумацията на храна (и на консумацията на вода, когато изпитваното вещество се прилага с питейната вода) трябва да се измерват всяка седмица по време на първите 13 седмици от изпитването и след това на интервали от приблизително три месеца, освен ако здравословното състояние или измененията на телесното тегло не изискват друго.
Телесното тегло трябва да се регистрира индивидуално за всички животни един път седмично през първите 13 седмици на изпитването и поне един път на всеки четири седмици след това.
Клинични изследвания
Хематологично изследване
Ако въз основа на клиничните наблюдения може да се предположи влошаване на здравословното състояние на животните по време на изпитването, на засегнатите животни трябва да се направи диференциално броене на кръвните клетки.
На 12-тия месец, 18-тия месец и преди умъртвяването на животните се правят кръвни натривки. Диференциално броене не кръвните клетки се извършва на проби от животни в групата на висока доза и контролните групи. Ако въз основа на тези данни, и, по-конкретно, данните, получени преди пожертването, или данните от патологичното изследване, съществува необходимост, диференциално броене на кръвните клетки трябва да се направи и на групата(ите) на следваща по-ниска доза.
Макроскопска аутопсия
Всички животни, включително тези, които са умрели по време на експеримента или са били пожертвани, защото са намерени умиращи, трябва да бъдат подложени на пълна макроскопска аутопсия. Всички макроскопски видими тумори или лезии, или лезии, които са съмнителни за тумори, трябва да бъдат съхранени.
Следните органи и тъкани трябва да бъдат съхранени в подходяща среда за възможно бъдещо хистопатологично изследване: мозъка (включително срези на продълговатия мозък/моста, кората на малкия мозък и главния мозък), хипофизата, щитовидната/паращитовидните жлези, пялата тимусна тъкан, трахеята и белите дробове, сърцето, аортата, слюнчените жлези, черния дроб, слезката, бъбреците, надбъбречните жлези, панкреаса, гонадите, матката, допълнителните полови органи, кожата, хранопровода, стомаха, дванадесетопръстника, празното черво, хълбочното черво, сляпото черво, ободното черво, правото черво, пикочния мехур, представителен лимфен възел, женската млечна жлеза, бедрената мускулатура, периферен нерв, гръдната кост с костен мозък, бедрена кост (включително става), (гръбначния мозък на три нива — шийно, средно гръдно и поясно) и очите.
Раздуването на белите дробове и пикочния мехур с фиксатор представлява оптимален начин за съхраняване на тези тъкани. Раздуването на белите дробове при инхалационни изпитвания е много важно за правилното хистопатологично изследване. При инхалационни изпитвания трябва да бъде съхранен целият респираторен тракт, включително носната кухина, фаринкса и ларинкса.
Хистопатологично изследване
|
а)
|
Пълно хистопатологично изследване трябва да се направи на органите и тъканите на всички животни, които са умрели или са били пожертвани по време на изпитването, и на всички животни от групата на висока доза и контролната група.
|
|
б)
|
Всички макроскопски видими тумори или лезии, съмнителни за тумори, трябва да бъдат изследвани микроскопски във всички групи.
|
|
в)
|
Ако е налице значима разлика в честотата на неопластичните лезии между групата на висока доза и контролната група, трябва да се извърши хистопатологично изследване на този конкретен орган или тъкан и в другите групи.
|
|
г)
|
Ако преживяемостта в групата на висока доза е значително по-ниска в сравнение с контролната група, тогава на групата на следващата по-ниска доза трябва да бъде направено пълно изследване.
|
|
д)
|
Ако при групата на висока доза за налице данни за предизвикване на токсични или други ефекти, които биха могли да окажат влияние върху неопластичния отговор, на групата на следващата по-ниска доза трябва да бъде направено пълно изследване.
|
2. ДАННИ
Данните трябва да бъдат обобщени в табличен вид, като за всяка изпитвана група са показани броят на животните в началото на изпитването, броят на животните, при които са налице тумори, доловени по време на изпитването, и броят на животните, които при пожертването имат тумори. Резултатите трябва да бъдат оценени с помощта на подходящ статистически метод. Може да се използва всеки признат статистически метод.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
—
|
вид, порода, източник, условия на околната среда, диета,
|
|
—
|
условия на изпитването,
Описание на експозиционната апаратура:
включително проектиране, тип, размери, източник на въздух, система за генериране на частици и аерозоли, метод за климатизиране, пречистване на използвания въздух и метод за настаняване на животните в експериментална камера, когато такава се използва. Трябва да бъде описано оборудването за измерване на температурата, влажността и, където е необходимо, стабилността на концентрациите на частиците в аерозолите или на размера на частиците.
Данни за експозицията:
те трябва да бъдат представени в табличен вид със средни стойности и мярка за вариабилността (например стандартно отклонение) и трябва да включват:
|
а)
|
скорости на въздушните потоци през инхалационното оборудване;
|
|
б)
|
температура и влажност на въздуха;
|
|
в)
|
номинални концентрации (общо количество на изпитваното вещество, заредено в инхалационното оборудване, разделено на обема въздух);
|
|
г)
|
естество на носителя, ако е използван;
|
|
д)
|
действителни концентрации в изпитвателната зона на дишане;
|
|
е)
|
стойност на медианата на размерите на частиците (когато е необходимо);
|
|
|
—
|
нива на дозиране (включително носител, ако е използван) и концентрации,
|
|
—
|
данни за честотата на туморите по пол, доза и вид на тумора,
|
|
—
|
време на смъртта по време на изпитването или дали животните са оживели до прекратяването му,
|
|
—
|
данни за токсичния отговор по пол и доза,
|
|
—
|
описание на токсичните или други ефекти,
|
|
—
|
времето на наблюдение на всеки абнормен признак и неговото последващо развитие,
|
|
—
|
данни за храната и телесното тегло,
|
|
—
|
използвани хематологични изследвания и всички резултати,
|
|
—
|
резултати от аутопсията,
|
|
—
|
подробно описание на всички резултати от хистопатологичните изследвания,
|
|
—
|
статистическа обработка на резултатите и описание на използваните методи,
|
|
—
|
обсъждане на резултатите,
|
|
—
|
интерпретиране на резултата.
|
3.2. ОЦЕНКА И ИНТЕРПРЕТИРАНЕ
Вижте Общо въведение част Б.
4. Препратки
Вижте Общо въведение част Б.
Б.33 КОМБИНИРАНО ИЗПИТВАНЕ ЗА ХРОНИЧНА ТОКСИЧНОСТ/КАНЦЕРОГЕННОСТ
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Вижте Общо въведение част Б.
1.2. ОПРЕДЕЛЕНИЯ
Вижте Общо въведение част Б.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Няма.
1.4. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Целта на комбинираното изпитване за хронична токсичност/канцерогенност е да определи хроничните токсични и канцерогенни ефекти на дадено вещество върху видове бозайници след продължителна експозиция.
За тази цел изпитването за канцерогенност се допълва с поне една третирана и една контролна сателитна група. Дозата, използвана за сателитната група на висока доза, може да бъде по-висока от дозата, използвана за групата на висока доза при изпитването за канцерогенност. При изпитването за канцерогенност животните се изследват за обща токсичност, а също и за канцерогенен отговор. Животните от третираната сателитна група се изследват за обща токсичност.
Нормално изпитваното вещество се прилага седем дни седмично, по подходящ начин, върху няколко групи експериментални животни, по една доза за група, в продължение на голяма част от живота им. По време на експозиция на изпитваното вещество и след нея, експерименталните животни се наблюдават ежедневно, за да се открият някакви признаци на токсичност и развитие на тумори.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Няма.
1.6. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
Животните се държат при експериментални условия на настаняване и хранене в продължение поне на пет дни преди изпитването. Преди изпитването здрави млади животни се избират по случаен признак и се разпределят в третирана и контролна група.
Експериментални животни
Предпочитаният вид е плъх. Въз основа на резултатите от изпитвания, проведени в миналото, могат да се използват други видове (гризачи и различни от гризачи). Трябва да се използват млади здрави животни от обичайно употребявани лабораторни породи и дозирането трябва да започне колкото е възможно по-скоро след отбиването.
При започване на изпитването колебанията в теглото на използваните животни не трябва да превишават ± 20 % от средната стойност. Когато оралното субхронично изпитване се провежда като предварително проучване преди продължително изпитване, и при двете изпитвания трябва да се използват същите вид/порода.
Брой и пол
За гризачи за всяко ниво на дозиране за и паралелната контролна група трябва да се използват най-малко по 100 животни (50 женски и 50 мъжки). Женските животни трябва да са нераждали и да не са бременни. Ако се планират междинни жертви, броят трябва да бъде увеличен съответно с броя животни, които са планирани за пожертване преди завършване на изпитването.
Третираната сателитна група(и) за оценка на патология, различна от тумори, трябва да съдържат по 20 животни от всеки пол, докато сателитната контролна група трябва да съдържа по 10 животни от всеки пол.
Нива на дозиране и честота на експозицията
За целите на изпитването за канцерогенност, в допълнение към паралелната контролна група трябва да се използват поне три нива на дозиране. Най-високото ниво на дозиране трябва да предизвиква признаци на минимална токсичност, като леко потискане наддаването на тегло (под 10 %), без значително изменение на нормалната продължителност на живота поради ефекти, които са различни от тумори.
Най-ниското ниво на дозиране не трябва да влияе върху нормалния растеж, развитие и дълголетие на животното или да предизвиква някакъв признак на токсичност. Обикновено то не трябва да бъде по-ниско от 10 % от високата доза.
Междинната(ите) доза(и) трябва да се намират по средата на диапазона между високата и ниската доза.
При избиране на нива на дозиране трябва да вземат предвид данните от предшестващи проучвания и изпитвания за токсичност.
За целите на изпитването за хронична токсичност, в изпитването трябва да бъдат включени допълнителни третирани групи и паралелна контролна сателитна група. Високата доза за третираните сателитни животни трябва да предизвиква ясни признаци на токсичност.
Нормално експозицията е ежедневна.
Ако в питейната вода се прилага химическо вещество или то се смесва с храната, то трябва да е непрекъснато в наличност.
Контроли
Трябва да се използва една паралелна група, която е идентична с третираната група във всяко отношение, освен експозицията на изпитваното вещество.
При особени обстоятелства, например инхалационни изпитвания с аерозоли или емулгиращо средство с нехарактеризирана при орални изпитвания биологична активност, трябва да се използва допълнителна контролна група, която не е подложена на експозиция на носителя.
Начин на прилагане
Трите основни начина на прилагане са орален, дермален и инхалационен.. Изборът на начин на прилагане зависи от физичните и химичните характеристики на изпитваното вещество и вероятния начин на експозиция при хора.
Орални изпитвания
Когато изпитваното вещество се абсорбира от стомашно-чревния тракт и ако храносмилателният път е един от тези, чрез които хората могат да бъдат подложени на експозиция, предпочита се оралният начин на прилагане, освен ако няма противопоказания. Животните могат да получават изпитваното вещество с храната, разтворено в питейната вода или дадено с капсула.
В идеалния случай дозирането трябва да бъде ежедневно, седем дни в седмицата, тъй като дозирането пет дни в седмицата може да даде възможност за възстановяване или за поява на токсичност при отнемане през периода, когато няма дозиране, и по този начин да се повлияят резултатът и последващата оценка. Обаче, въз основа главно на практически съображения, дозирането пет дни в седмицата се смята за приемливо.
Дермални изпитвания
Дермалната експозиция чрез боядисване на кожата може да бъде избрана за симулиране на основния път за експозиция при хора и като система-модел за предизвикване на кожни лезии.
Инхалационни изпитвания
Тъй като инхалационните изпитвания създават по-сложни технически проблеми в сравнение с другите начини на прилагане, тук се дават по-подробни указания за този начин на прилагане. Трябва да се отбележи и че в особени ситуации интратрахеалното накапване може да представлява валидна алтернатива.
Продължителната експозиция обикновено наподобява предполаганата експозиция при хора, като животните са подложени на ежедневна експозиция в продължение на шест часа след изравняване на концентрациите в камерата, по пет дни в седмицата (интермитентна експозиция), или, съответно на възможна експозиция от околната среда, на 22- до 24-часова експозиция през деня по седем дни седмично (непрекъсната експозиция) с около един час дневно по едно и също време за хранене на животните и за поддържане на камерата. И в двата случая, животните обикновено са подложени на експозиция с фиксирани концентрации на изпитваното вещество. Основна разлика между интермитентната и непрекъснатата експозиция е, че при първата съществува период от 17 до 18 часа, през който животните могат да се възстановят от ефектите на ежедневната експозиция, като в края на седмицата има дори още по-дълъг период за възстановяване.
Изборът на интермитентна или непрекъсната експозиция зависи от целите на изпитването и от експозицията при хора, която трябва да се симулира. Трябва, обаче, да се имат предвид определени технически трудности. Например, предимствата на непрекъснатата експозиция при симулиране на условията в околната среда могат да бъдат изместени от нуждата от поене и хранене по време на експозицията и от необходимостта от по-сложно (и сигурно) генериране на аерозол и пара и от мониторингови техники.
Експозиционни камери
Животните трябва да бъдат изследвани в инхалационни камери, предназначени за поддържане на динамичен въздушен поток при поне 12-кратно обменяне на въздуха за час, за да се обезпечат адекватно кислородно съдържание и равномерно разпределена експозиционна атмосфера. Контролните и експозиционните камери трябва да бъдат идентични по конструкция и проект, така че да осигурят сравними във всички отношения условия, освен експозицията на изпитваните вещества. Обикновено в камерата се поддържа леко отрицателно налягане, за да се предотврати изтичането на изпитваното вещество в заобикалящата среда. Камерите трябва да намалят до минимум струпването на експериментални животни. Като правило, за да се постигне стабилност на атмосферата в камерата, общият обем на експерименталните животни не трябва да надвишава 5 % от обема на камерата.
Измерванията или мониторингът трябва да включват:
|
i)
|
Въздушен поток: за предпочитане е скоростта на въздушния поток през камерата да се мониторира непрекъснато;
|
|
ii)
|
Концентрация: по време на ежедневната експозиция концентрацията не трябва да се колебае с повече от ± 15 % от средната стойност. През цялото изпитване концентрациите през отделните дни трябва да бъдат поддържани колкото е възможно по-постоянни.
|
|
iii)
|
Температура и влажност: за гризачи, температурата трябва да се поддържа на 22 ± 2 oС, а влажността в камерата на 30 до 70 %, освен когато за суспендиране на изпитваното вещество в атмосферата на камерата се използва вода. За предпочитане е и двата показателя да се мониторират непрекъснато;
|
|
(iv)
|
Измерване размера на частиците: разпределението на размерите на частиците се определя в атмосферата на камери, които включват течни или твърди аерозоли. Частиците на аерозола трябва да бъдат с размери, позволяващи вдишването им от използваните експериментални животни. Проби от атмосферата в камерите трябва да се вземат в зоната на дишане на животните. Пробата въздух трябва да бъде представителна за разпределението на частиците, с които животните са в контакт, и трябва гравиметрично да се вземе предвид целият суспендиран аерозол, дори когато голяма част от него не се вдишва. При разработване на генериращата система трябва често да се анализират размерите на частиците, за да се осигури стабилността на аерозола, и впоследствие толкова често, колкото е необходимо по време на експозицията, за да се определи адекватно устойчивостта на разпределението на частиците, с които животните са в контакт.
|
Продължителност на изпитването
Изпитването за канцерогенност ангажира голяма част от нормалната продължителност на живота на експерименталните животни. Прекратяването на изпитването трябва да бъде след 18 месеца за мишки и хамстери и след 24 месеца за плъхове. За някои породи животни с по-голямо дълголетие и/или ниска спонтанна честота на туморите, обаче, прекратяването трябва да стане след 24 месеца за мишки и хамстери и след 30 месеца за плъхове. Алтернативно, прекратяването на такова разширено изпитване е приемливо, когато броят на оживелите животни в групата на най-ниска доза и контролната група достигне 25 %. При прекратяване на изпитване, при което се наблюдава явна разлика в отговора между половете, всеки пол трябва да се разглежда отделно. Когато само групата на висока доза умира преждевременно поради явни токсични причини, това не налага прекратяване, при условие че токсичните прояви не създават проблеми в другите групи. За да бъде приемлив един отрицателен резултат, не повече от 10 % от която и да е група може да бъде загубена от експеримента поради автолиза, канибализъм или проблеми с управлението, и преживяемостта във всички групи е не по-ниска от 50 % на 18-тия месец за мишки и хамстери и на 24-ия месец за плъхове.
Сателитните групи от 20 дозирани животни от пол и 10 асоциирани контролни животни от пол, използвани за изпитване за хронична токсичност, трябва да бъдат задържани в експеримента в продължение поне на 12 месеца. Тези животни трябва да бъдат планирани за пожертване за изследване на патология, свързана с изпитваното вещество, която не е усложнена с геронтологични изменения.
Процедура
Наблюдения
Трябва да се извършват ежедневни наблюдения в клетките, като те трябва да включват измененията на кожата и козината, очите и лигавиците, а също дихателната, сърдечно-съдовата, автономната и централната нервна система, соматомоторната активност и начина на поведение.
През подходящи интервали трябва да се извършва клиничен преглед на животните от третираната(ите) сателитна(и) група(и).
Редовното наблюдение на животните е необходимо, за да се обезпечи, доколкото е възможно, животните да не се губят от изпитването поради причини като канибализъм, тъканна автолиза или преместване. Умиращите животни трябва да бъдат отстранени и подложени на аутопсия, когато бъдат забелязани.
Клиничните признаци, включително неврологични и очни изменения, а също смъртността, трябва да се регистрират за всички животни. Специално внимание трябва да се обърне на развитието на тумори: трябва да се регистрират времето на поява, локализацията, размерите, външният вид и прогресирането на всички макроскопски видими или опипващи се тумори; трябва да се регистрират времето на настъпване и прогресирането на токсичните състояния.
Консумацията на храна (и консумацията на вода, когато изпитваното вещество се прилага с питейната вода) трябва да се измерват всяка седмица по време на първите 13 седмици от изпитването и след това на интервали от приблизително три месеца, освен ако здравословното състояние или измененията на телесното тегло не изискват друго.
Телесното тегло трябва да се регистрира индивидуално за всички животни един път седмично през първите 13 седмици на изпитването и поне един път на всеки четири седмици след това.
Клинични изследвания
Хематологично изследване
Хематологично изследване (т.е. съдържание на хемоглобин, хематокрит, общ брой на еритроцитите, общ брой на левкоцитите, тромбоцити и други показатели на потенциала за съсирване трябва да се извършва на трети месец, шести месец и след това на интервали от приблизително шест месеца и при приключването върху кръвни проби, взети от по 10 плъха/пол от всички групи. Ако е възможно, пробите трябва да бъдат от едни и същи плъхове при всеки интервал.
Ако въз основа на наблюденията в клетките може да се предположи влошаване на здравословното състояние на животните по време на изпитването, на засегнатите животни трябва да се направи диференциално броене на кръвните клетки. Диференциално броене не кръвните клетки се прави на проби от такива животни от групата на най-висока доза и контролните групи. Диференциалното броене на кръвни клетки се извършва при групата(ите) със следваща по-ниска доза само, ако е налице голямо несъответствие между групата на най-висока доза и контролите или ако съществуват показания въз основа на патологични резултати.
Изследване на урина
За анализ трябва да се вземат проби урина от 10 плъха/пол от всички групи, и, ако е възможно, от едни и същи плъхове през същите интервали, както хематологичните изследвания. При гризачи трябва да се изследват следните параметри при отделни животни, или при пул от проби от същия пол/група:
|
—
|
външен вид: обем и плътност при отделните животни,
|
|
—
|
белтък, глюкоза, кетони, скрита кръв (полуколичествено изследване),
|
|
—
|
микроскопско изследване на седимент (полуколичествено).
|
Клинична биохимия
Приблизително на шестмесечни интервали и при прекратяване на изпитването се вземат кръвни проби за клинични биохимични параметри от всички видове, различни от гризачи, и от 10 плъха/пол от всички групи, и, ако е възможно, от същите плъхове при всеки интервал. Освен това от всички видове, различни от гризачи, преди изпитването трябва да се вземе изходна проба. От тези проби се приготвя плазма и се изследват следните параметри:
|
—
|
концентрация на общия белтък,
|
|
—
|
концентрация на албумина,
|
|
—
|
функционални чернодробни изследвания (като активност на алкалната фосфатаза, активност на глутамат пируват трансаминазата (4), активност на глутамат оксалоацетат трансаминазата (5), гама глутамил транспептидаза, орнитин декарбоксилаза,
|
|
—
|
въглехидратен метаболизъм, например кръвна захар на гладно,
|
|
—
|
бъбречни функционални изследвания, като уреен азот в кръвта.
|
Макроскопска аутопсия
Всички животни, включително тези, които са умрели по време на експеримента или са били пожертвани, защото са намерени умиращи, трябва да бъдат подложени на пълна макроскопска аутопсия. Преди пожертването, от всички животни трябва да бъдат взети кръвни проби за диференциално броене на кръвни клетки. Всички макроскопски видими тумори или лезии, които са съмнителни за тумори, трябва да бъдат съхранени. Трябва да се направи опит за съпоставяне на резултатите от макроскопското и микроскопското изследване.
Всички органи и тъкани трябва да бъдат съхранени за хистопатологично изследване. Обикновено това се отнася до следните органи и тъкани: мозъка (7) (продълговат мозък/мост, кора на малкия мозък, кора на главния мозък), хипофиза, щитовидна жлеза (включително паращитовидните жлези), тимуса, белите дробове (включително трахеята), сърцето, аортата, слюнчените жлези, черния дроб (7), слезката, бъбреците (7), надбъбречните жлези (7), хранопровода, стомаха, дванадесетопръстника, празното черво, хълбочното черво, сляпото черво, ободното черво, правото черво, пикочния мехур, лимфните възли, панкреаса, гонадите (7), допълнителните полови органи, женската млечна жлеза, кожата, мускулите, периферен нерв, гръбначния мозък (шиен, гръден и поясен), гръдната кост с костен мозък, бедрената кост (включително става) и очите.
Въпреки че раздуването на белите дробове и пикочния мехур с фиксатор представлява оптимален начин за съхраняване на тези тъкани, раздуването на белите дробове при инхалационни изпитвания представлява необходимо изискване за правилно хистопатологично изследване. При специални изпитвания като инхалационните изпитвания, трябва да бъде изследван целият респираторен тракт, включително носа, фаринкса и ларинкса.
Ако се провеждат други клинични изследвания, информацията, получена при тези процедури, трябва да бъде налице преди микроскопското изследване, тъй като тя може да даде важни насоки на патолога.
Хистопатологично изследване
За изпитването за хронична токсичност:
Всички съхранени органи от всички животни от сателитната група на висока доза и контролната група трябва да бъдат подложени на подробно изследване. Когато свързана с изпитваното вещество патология се открива в сателитната група на висока доза, целевите органи на всички други животни от всички други третирани сателитни групи, а също и тези от третираните групи от изпитването за канцерогенност, трябва да бъдат подложени на пълно и подробно хистологично изследване при прекратяване на изпитването.
За изпитването за канцерогенност:
|
а)
|
Трябва да се направи пълно хистопатологично изследване на органите и тъканите на всички животни, които са умрели или са били пожертвани по време на изпитването и на всички животни от контролната група и групата на висока доза.
|
|
б)
|
Всички макроскопски видими тумори или лезии, съмнителни за тумори, възникващи в който и да е орган, трябва да бъдат изследвани микроскопски във всички групи.
|
|
в)
|
Ако е налице значима разлика в честотата на неопластичните лезии между групата на висока доза и контролната група, трябва да се извърши хистопатологично изследване на този конкретен орган или тъкан и в другите групи.
|
|
г)
|
Ако преживяемостта в групата на висока доза е значително по-ниска в сравнение с контролната група, тогава трябва да се направи пълно изследване на групата на следващата по-ниска доза.
|
|
д)
|
Ако при групата на висока доза са налице данни за предизвикване на токсични или други ефекти, които биха могли да окажат влияние върху неопластичния отговор, на групата на следващата по-ниска доза трябва да бъде направено пълно изследване.
|
2. ДАННИ
Данните трябва да бъдат обобщени в табличен вид, като за всяка изпитвана група са показани броят на животните в началото на изпитването, броят на животните, при които са налице тумори или токсични ефекти, доловени по време на изпитването, времето на долавяне и броят на животните, които при пожертването имат тумори. Резултатите трябва да бъдат оценени с помощта на подходящ статистически метод. Може да се използва всеки признат статистически метод.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
—
|
вид, порода, източник, условия на околната среда, диета,
|
|
—
|
условия на изпитването,
Описание на експозиционната апаратура:
включително проектиране, тип, размери, източник на въздух, система за генериране на частици и аерозоли, метод за климатизиране, пречистване на използвания въздух и метод за настаняване на животните в експериментална камера, когато такава се използва. Трябва да бъде описано оборудването за измерване на температурата, влажността и, където е необходимо, стабилността на концентрациите на частиците в аерозолите или на размера на частиците.
Данни за експозицията:
Те трябва да бъдат представени в табличен вид със средни стойности и мярка за вариабилността (например стандартно отклонение) и трябва да включват:
|
а)
|
скорости на въздушните потоци през инхалационното оборудване;
|
|
б)
|
температура и влажност на въздуха;
|
|
в)
|
номинални концентрации (общо количество на изпитваното вещество, заредено в инхалационното оборудване, разделено на обема въздух);
|
|
г)
|
естество на носителя, ако е използван;
|
|
д)
|
действителни концентрации в изпитвателната зона на дишане;
|
|
е)
|
стойност на медианата на размерите на частиците (когато е необходимо);
|
|
|
—
|
нива на дозиране (включително носител, ако е използван) и концентрации,
|
|
—
|
данни за честотата на туморите по пол, доза и вид на тумора,
|
|
—
|
време на смъртта по време на изпитването или дали животните са оживели до прекратяването му, включително и от сателитната група,
|
|
—
|
данни за токсичния отговор по пол и доза,
|
|
—
|
описание на токсичните или други ефекти,
|
|
—
|
времето на наблюдение на всеки абнормен признак и неговото последващо развитие,
|
|
—
|
резултати от офталмологичното изследване,
|
|
—
|
данни за храната и телесното тегло,
|
|
—
|
използвани хематологични изследвания и всички резултати,
|
|
—
|
използвани клинични биохимични изследвания и всички резултати (включително резултати от всички изследвания на урина).
|
|
—
|
резултати от аутопсията,
|
|
—
|
подробно описание на всички резултати от хистопатологичните изследвания,
|
|
—
|
статистическа обработка на резултатите и описание на използваните методи,
|
|
—
|
обсъждане на резултатите,
|
|
—
|
интерпретиране на резултатите,
|
3.2. ОЦЕНКА И ИНТЕРПРЕТИРАНЕ
Вижте Общо въведение част Б.
4. Препратки
Вижте Общо въведение част Б.
Б.34. ИЗПИТВАНЕ ЗА ТОКСИЧНОСТ ЗА РАЗМНОЖАВАНЕТО В ЕДНО ПОКОЛЕНИЕ
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Вижте Общо въведение част Б.
1.2. ОПРЕДЕЛЕНИЯ
Вижте Общо въведение част Б.
1.3. Вещества за сравнение
Няма.
1.4. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Изпитваното вещество се прилага в нарастващи дози върху няколко групи мъжки и женски животни. Мъжките животни трябва да бъдат дозирани по време на растежа и в продължение на поне един пълен цикъл на сперматогенеза (приблизително 56 дни при мишки и 70 дни при плъхове), за да бъдат предизвикани евентуални нежелани ефекти на изпитваното вещество върху сперматогенезата.
Женските животни от родителското поколение (Р) трябва да бъдат дозирани с изпитваното вещество в продължение на поне два пълни цикъла на разгонване. След това животните се чифтосват. Изпитваното вещество се прилага и при двата пола по време на чифтосването и след това само при женските животни през бременността и по време на кърменето. Този метод ще изисква модифициране за прилагане чрез инхалиране.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Няма.
1.6. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
Подготовка
Преди изпитването здрави млади животни се избират по случаен признак и се разпределят в третирана и контролна група. Животните се държат при експериментални условия на настаняване и хранене в продължение поне на пет дни преди изпитването. Препоръчва се изпитваното вещество да се прилага с храната или в питейната вода. Приемливи са и други начини на прилагане Дозирането при всички животни трябва да се извършва по един и същ метод по време на съответния експеримент. Ако за улесняване на дозирането се използват помощно вещество или други добавки, трябва да е известно, че те не водят до токсични ефекти. Дозирането трябва да бъде седем дни в седмицата.
Експериментални животни
Избор на вид
Предпочитаните видове са плъх или мишка. Трябва да се използват здрави животни, които в миналото не са били подлагани на експериментални процедури. Не трябва да се използват породи с ниска плодовитост. Експерименталните животни трябва да бъдат характеризирани по отношение на вида, породата, пола, теглото и/или възрастта.
За адекватна оценка на плодовитостта трябва да бъдат изследвани както мъжки, така и женски животни. Всички експериментални и контролни животни трябва да бъдат отбити преди започването на дозирането.
Брой и пол
Всяка третирана контролна група трябва да се състои от достатъчен брой животни, за да се получат 20 бременни женски животни на или около термин.
Целта е да се получат достатъчно на брой бременности и потомство, за да се осигури значима оценка на потенциала на веществото да влияе върху плодовитостта, бременността и майчиното поведение при животните от поколение Р, както и сученето, растежа и развитието на поколението F1 от зачеването до отбиването.
Условия на изпитването
Храна и вода трябва да се предоставят ad libitum. Около раждането бременните женски трябва да бъдат настанени в индивидуални клетки за родилки и майки и могат да им бъдат предоставени материали за гнездо.
Нива на дозиране
Трябва да се използват поне три третирани групи и контролни групи. Ако за прилагане на изпитваното вещество се използва носител, контролната група трябва да получава най-голямото използвано количество носител. Ако изпитваното вещество предизвиква намаляване на приема или усвояването на храната, тогава може да се сметне за необходимо използването на втора контролна група за храненето. В идеалния случай, освен ако няма ограничение поради физичното/химичното естество или биологичните ефекти на изпитваното вещество, най-високото ниво на дозиране трябва да предизвика токсичност, но не и смъртност при животните от родителското (Р) поколение. Междинната доза(и) трябва да предизвиква минимални токсични ефекти, дължащи се на изпитваното вещество, а ниската доза не трябва да предизвиква никакви видими нежелани ефекти върху родителите или поколението. Когато е прилагана със сонда или капсули, даваната на всяко животно доза трябва да се базира на индивидуалното телесно тегло на всяко животно и да се коригира ежеседмично към измененията на телесното тегло. По желание, за женските животни по време на бременността дозите могат да се базират на телесното тегло на ден 0 или 6 от бременността.
Гранично изпитване
При вещества с ниска токсичност, ако доза, която е поне 1 000 mg/kg, не води до поява на признаци на повлияване на репродуктивната функция, изпитвания с други дози може да не се смятат за необходими. Ако предварителното изпитване при високо ниво на дозиране ниво с явни данни за майчина токсичност, не показва нежелани ефекти върху плодовитостта, изпитвания при други нива на дозиране може да не се смятат за необходими.
Провеждане на изпитването
Експериментални схеми
Ежедневното дозиране на мъжките животни от родителското поколение (Р) трябва да започне, когато те са на около пет до девет седмична възраст, след като са отбити и са аклиматизирани в продължение на поне пет дни. При плъхове дозирането продължава 10 седмици преди периода на чифтосване (за мишки периодът е осем седмици). Мъжките животни трябва да бъдат убити и изследвани в края на чифтосването, или, алтернативно, мъжките могат да бъдат задържани на експерименталната диета за евентуално получаване на второ котило и трябва да бъдат убити и изследвани преди края на изпитването. За женските животни от родителското поколение (Р) дозирането трябва д а започне след най-малко пет дни аклиматизиране в продължение на поне две седмици преди чифтосването. Ежедневното дозиране при женските животни от поколението Р трябва да продължи през целия триседмичен период на чифтосване, бременност и до отбиването на поколението F1. Трябва да се има предвид модифициране на схемата за дозиране на базата на друга съществуваща информация за изпитваното вещество, като стимулиране на метаболизма или биоакумулиране.
Процедура за чифтосване
При изпитвания за токсичност за размножаването може да се използва чифтосване в съотношение 1:1 (едно мъжко за едно женска животно), или 1:2 (едно мъжко за две женски животни).
При чифтосване 1:1 едно женско животно трябва да се оставя с едно и също мъжко животно до настъпване на бременност или до изтичането на три седмици. Всяка сутрин женските животни трябва да бъдат преглеждани за наличие на сперма или вагинални запушалки. Ден 0 на бременността се определя като деня, в който са открити вагинална запушалка или сперма.
Двойките, които не успеят да се чифтосат, трябва да бъдат оценени за определяне на причината за предполагаемото безплодие.
Това може да включва процедури като предоставяне на допълнителни възможности за чифтосване с други мъжки и женски животни с доказана оплодителна способност, микроскопско изследване на репродуктивните органи и изследване на цикъла на разгонване или сперматогенезата.
Големина на котилото
На животните, дозирани при изпитване за плодовитост, се дава възможност да родят потомството си нормално и да го отгледат до етапа на отбиване без стандартизиране на котилото.
Когато се извършва стандартизиране, се препоръчва следната процедура. Между ден 1 и 4 след раждането големината на всяко котило може да бъде коригирана посредством елиминиране на излишните новородени животни чрез селекция, за да се получат, колкото е възможно по-точно, четири мъжки и четири женски животни за котило.
Когато броят на мъжките или женските новородени животни не дава възможност да се получат по четири животни от пол за котило, приемлива е частична корекция (например, пет мъжки и три женски). Корекция не се прави при котила, състоящи се от по-малко от осем новородени животни.
Наблюдения
По време на изпитването всяко животно трябва да се наблюдава поне един път дневно. Трябва да се регистрират съответните изменения в поведението, признаците за затруднено или продължително раждане и всички признаци на токсичност, включително и смъртност. През времето преди чифтосването и по време на чифтосването, консумацията на храна трябва ежедневно да се измерва. След раждането и по време на лактацията измерванията на консумацията на храна (и на консумацията на вода, когато изпитваното вещество се прилага в питейната вода) трябва да се извършват в същия ден като претеглянето на котилото. Мъжките и женските животни от поколението Р трябва да бъдат претеглени през първия ден на дозирането и след това един път седмично. Тези наблюдения трябва да се провеждат за всяко възрастно животно поотделно.
Продължителността на бременността трябва да се изчислява от ден 0 на бременността. Всяко котило трябва да бъде прегледано възможно най скоро след раждането, за да се установят броят и полът на новородените животни, мъртвородените, живородените и наличието на макроскопски аномалии.
Мъртвите новородени и новородените, които са умъртвени на ден 4, трябва да бъдат съхранени и изследвани за възможни дефекти. Живите новородени животни трябва да бъдат преброени и котилата да бъдат претеглени на сутринта след раждането и на 4-ти и 7-и ден и след това всяка седмица до прекратяване на изпитването, когато животните трябва да бъдат претеглени индивидуално.
Трябва да се регистрират физическите и поведенческите аномалии, наблюдавани при майките и потомството.
Патологично изследване
Аутопсия
При умъртвяването или смъртта по време на изпитването, животните от поколение Р трябва да бъдат изследвани макроскопски за структурни аномалии или патологични изменения, като се обръща специално внимание на органите от размножителната система. Мъртвите или умиращи новородени животни трябва да бъдат изследвани за дефекти.
Хистопатологично изследване
Яйчниците, матката, шийката, влагалището, тестисите, надсеменниците, семенните мехурчета, простатната жлеза, коагулиращата жлеза, хипофизната жлеза и целевите орган(и) на всички животни от поколение Р трябва да бъдат съхранени за микроскопско изследване. В случай че тези органи не са изследвани при други изпитвания с многократни дози, те трябва да бъдат изследвани микроскопски при всички животни на висока доза, при контролните животни и при животните, които умират по време на изпитването, ако е възможно.
Органите, в които при тези животни се наблюдават аномалии, трябва след това да бъдат изследвани при всички други животни от поколение Р. В тези случаи трябва да се направи микроскопско изследване на всички тъкани, при които се наблюдават макроскопски патологични изменения. Както е предложено в процедурите за чифтосване, размножителните органи на животните, при които има съмнение за безплодие, могат да бъдат подложени на микроскопско изследване.
2. ДАННИ
Данните могат да бъдат обобщени в табличен вид, като за всяка изпитвана група са показани броят на животните в началото на изпитването, броят на фертилните мъжки животни, броят на бременните женски животни, типовете промени и процентът на животните, които демонстрират всеки тип промяна.
Когато е възможно, числовите резултати трябва да бъдат оценени с помощта на подходящ статистически метод. Може да се използва всеки признат статистически метод.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
—
|
данни за токсичния отговор по пол и доза, включително плодовитост, бременност и жизнеспособност,
|
|
—
|
време на смъртта по време на изпитването или дали животните оживяват до времето на планираното пожертване или до прекратяване на изпитването,
|
|
—
|
таблица, представяща теглото на всяко котило, средното тегло на новородените животни и индивидуалните тегла на новородените животни при прекратяване на изпитването,
|
|
—
|
токсичните или други ефекти върху размножаването, потомството и постнаталния растеж,
|
|
—
|
деня на наблюдение на всеки абнормен признак и неговото последващо развитие,
|
|
—
|
данни за телесното тегло за животните от поколение Р,
|
|
—
|
резултати от аутопсията,
|
|
—
|
подробно описание на всички резултати от микроскопските изследвания,
|
|
—
|
статистическа обработка на резултатите, където е необходимо,
|
|
—
|
обсъждане на резултатите,
|
|
—
|
интерпретиране на резултатите.
|
3.2. ОЦЕНКА И ИНТЕРПРЕТИРАН
Вижте Общо въведение част Б.
4. ПОЗОВАВАНИЯ
Вижте Общо въведение част Б.
Б.35. ИЗПИТВАНЕ ЗА РЕПРОДУКТИВНА ТОКСИЧНОСТ В ДВЕ ПОКОЛЕНИЯ
1. МЕТОД
Този метод е еквивалентен на метод ОИСР ТG 416 (2001).
1.1. ВЪВЕДЕНИЕ
Този метод за оценка на репродуктивната токсичност в две поколения е разработен с цел да се проучат ефектите на изпитваното вещество върху състоянието и функцията на женската и мъжката полова система, включително функцията на гонадите, естралния цикъл, поведението при чифтосване, зачеването, бременността, раждането, лактацията и отбиването, както и върху растежа и развитието на потомството. Също така чрез това изпитване се получава информация за ефектите на изпитваното вещество върху неонаталната болестност и смъртност, както и предварителни данни за пренаталната и постнаталната токсичност за развитието. Данните, получени от това изпитване, дават насока за провеждането на по-нататъшни изпитвания. Освен растежа и развитието на поколение F1 посредством този метод се оценяват състоянието и функцията на женската и мъжката полова система, както и растежът и развитието на поколение F2. По-нататъшна информация за токсичността за развитието и функционалните нарушения може да се получи, като към протокола на този метод се включат допълнителни процедури, взаимствани от методите за оценка на токсичността за развитието и/или невротоксичността за развитието, когато това е необходимо. Тези ефекти могат да се изследват и в отделни проучвания, като се приложат съответните методи.
1.2. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Изпитваното вещество се въвежда в различни дози на няколко групи мъжки и женски животни. Мъжките животни от родителското поколение (поколение Р) трябва да се третират по време на растежа и в продължение на най-малко един пълен цикъл на сперматогенеза (приблизително 56 дни при мишки и 70 дни при плъхове), за да се установят неблагоприятните ефекти върху сперматогенезата. Ефектите върху сперматозоидите се откриват чрез изследване на редица параметри (напр. морфология и подвижност на сперматозоидите), както и чрез подробно хистопатологично изследване на тъканни препарати. Ефектите върху мъжките животни от поколение Р не е необходимо да се оценяват, когато съществуват данни за сперматогенезата от предишни проучвания при многократно постъпване на изпитваното вещество за достатъчно продължителен период, например данни от 90-дневно изпитване. Въпреки това се препоръчва да се съхранят проби от сперматозоидите от поколение Р или техните дигитални образи, за да може по-късно да се извърши оценка, ако е необходимо. Женските животни от поколение Р трябва да се третират по време на растежа, както и в продължение на няколко пълни естрални цикъла, за да се установят неблагоприятните ефекти на изпитваното вещество върху нормалното протичане на естралния цикъл. Изпитваното вещество се въвежда на животните от родителското (Р) поколение по време на чифтосването и настъпилата в резултат от това бременност, както и след раждането до отбиването на потомството им (поколение F1). След отбиването веществото започва да се въвежда на животните от поколение F1 по време на техния растеж до достигане на полова зрялост, чифтосването и възпроизводството им до отбиването на потомството им (поколение F2).
При всички животни се провежда клинично наблюдение и патологоанатомично изследване за установяване на токсични ефекти, като особено внимание се обръща върху състоянието и функцията на мъжката и женска полова система и върху растежа и развитието на потомството.
1.3. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
1.3.1. Избор на вида опитни животни
Предпочитаният вид опитни животни е плъх. Използването на други животински видове трябва да се обоснове. В тези случаи се налага да се внесат съответни модификации в метода за изпитване. Не трябва да се използват породи с ниска плодовитост или породи, за които е характерна висока честота на вродените аномалии. Различията в индивидуалните стойности на телесната маса на животните в началото на проучването трябва да бъдат минимални и да не превишават 20 % от средната телесната маса за всяка група по пол.
1.3.2. Условия на отглеждане и хранене
Температурата във вивариума трябва да бъде 22 oС (± 3o). Стойностите на относителната влажност не трябва да бъдат по-ниски от 30 % и е желателно да не превишават 70 % освен при почистване на помещението. Целта трябва да бъде относителната влажност да се поддържа в интервала 50—60 %. Осветлението трябва да бъде изкуствено, като се редуват 12 часа светлина и 12 часа тъмнина. За храненето се използват обичайните лабораторни диети при неограничен достъп до вода за пиене. В определени случаи изборът на диетата може да зависи от това, че е необходимо веществото да се смеси по подходящ начин и да се въведе с храната.
Животните могат да се поставят в индивидуални клетки или да се разпределят на малки групи от един и същи пол в общи клетки. Чифтосването трябва да се извърши в клетки, подходящи за тази цел. След като се открият признаците на копулация, чифтосаните женски животни трябва да се поставят в индивидуални клетки, подходящи за раждане или отглеждане на малките. Друга възможност е чифтосаните плъхове да се разпределят в малки групи и да се отделят в самостоятелни клетки един или два дни преди раждането. Когато наближи раждането, в клетките на бременните животни трябва да бъдат поставени подходящи материали за гнездо.
1.3.3. Подготовка на опитните животни
Трябва да се използват здрави млади животни, които предварително са се аклиматизирали към лабораторните условия в продължение най-малко на 5 дни и не са подлагани на други изпитвания. Опитните животни трябва да се опишат по отношение на вид, порода, източник за доставка, пол, телесна маса и/или възраст. Трябва да се знае кои животни са от едно и също котило, за да се избегне чифтосването между тях. Животните трябва да бъдат разпределени на принципа на случайния подбор към контролната или експонираните групи (препоръчва се да се извърши стратифициране по телесна маса). Клетките трябва да бъдат подредени по такъв начин, че да се намалят до минимум ефектите, които биха могли да възникнат в резултат от разположението им. Всяко животно трябва да бъде обозначено с индивидуален идентификационен номер. Животните от поколение Р се номерират, преди да започне третирането с изпитваното вещество. Животните от поколение F1, които са избрани за чифтосване, се номерират при отбиването им. В документацията на изпитването трябва да се обозначи от кое котило произлиза всяко от избраните за чифтосване F1 животни. Освен това във връзка с измерването на индивидуалната телесна маса или провеждането на функционални изследвания се препоръчва новородените да получат индивидуална идентификация възможно най-скоро след раждането.
Животните от родителското (Р) поколение трябва да бъдат на възраст 5—9 седмици в началото на третирането. Стойностите на телесната маса и възрастта на всички животните в опитните групи трябва да бъдат възможно най-близки.
1.4. ПРОЦЕДУРА
1.4.1. Брой и пол на животните
Контролната група и всички експонирани групи трябва да включват достатъчно голям брой животни, тъй като е желателно по време на раждането или близо до термина броят на бременните животни във всяка група да бъде не по-малко от 20. За вещества, които предизвикват нежелани ефекти (например стерилитет, изразена токсичност при най-високата доза), това може да не бъде възможно. Целта е да се предизвикат достатъчно на брой бременности, за да може да се извърши адекватна оценка на потенциала на веществото да въздейства върху фертилитета, бременността, поведението на майките, кърменето, растежа и развитието на животните от поколение F1 от зачеването до достигането на полова зрялост, и развитието на тяхното потомство (F2) до отбиването му. Затова когато не се достигне желаният брой на бременните животни (т.е. 20), не във всички случаи проучването се приема за невалидно. Преценката трябва да се направи за всяко проучване поотделно в зависимост от конкретния случай.
1.4.2. Подготовка на дозите
Препоръчва се изпитваното вещество да се въвежда по орален път (с диетата, водата за пиене или чрез гаваж), освен когато се прецени, че е по-подходящо да се използва друг път на въвеждане (напр. дермален или инхалаторен).
Когато е необходимо, изпитваното вещество се разтваря или суспендира в подходящ носител. Препоръчва се първо да се прецени дали може се използва воден разтвор или суспензия. Когато това не е приложимо, като втора възможност трябва да се обсъди използването на разтвор или емулсия в олио (напр. царевично олио) и след това използването на други носители. Когато се използват други носители освен водата, трябва да се познават токсикологичните свойства на носителя. Трябва да бъде определена стабилността на изпитваното вещество в носителя.
1.4.3. Дози
Трябва да се приложат най-малко три дози. Успоредно с експонираните групи трябва да се наблюдава и нетретирана контролна група. С изключение на случаите, когато се налагат ограничения във връзка с физичните, химичните или биологичните свойства на изпитваното вещество, най-високата доза трябва да бъде подбрана така, че да предизвиква прояви на токсичност, но не и смърт или тежко страдание. Когато въпреки очакванията настъпят смъртни случаи, приблизителната граница, под която смъртността в родителското поколение (Р) се приема за допустима, е 10 %. Дозите трябва да се подберат в намаляваща последователност по такъв начин, че да се проявят всички ефекти, свързани с прилагането на изпитваното вещество, и да се установят нива, при които не се наблюдава неблагоприятен ефект (NOAEL). За определяне на последователно намаляващите дози в повечето случаи е най-подходящо всяка доза да намалява два до четири пъти спрямо най-близката по-висока доза. Включването на допълнителна четвърта експонирана група често е за предпочитане пред използването на твърде големи интервали между дозите (напр. намаление повече от 10 пъти). За проучвания, при които веществото се въвежда с диетата, намалението спрямо най-близката доза не трябва да бъде повече от 3 пъти. Дозите трябва да се изберат след преценка на всички съществуващи данни за токсичността, особено на резултатите от изпитвания при многократно постъпване. Всички налични данни за метаболизма и кинетиката на изпитваното химично съединение или подобни химични вещества също трябва да се вземат под внимание. В допълнение тази информация се използва също и при обосновката на схемата за третиране.
Контролната група не се третира или се третира с носителя в случаите, когато при въвеждането на изпитваното вещество се използва носител. С изключение на третирането с изпитваното вещество животните в контролната група трябва да се поставят при същите условия и да се подлагат на същите манипулации, както животните от експонираните групи. Когато се използва носител, той се въвежда на животните от контролната група в най-голямото количество, което се въвежда на експонираните животни. Когато изпитваното вещество се въвежда с диетата и предизвиква намален прием на храна или понижено усвояване на храната, може да се прецени като необходимо използването на контролна група от животни, които да приемат същото количество храна, както експонираните животни. Друг възможен подход вместо включването на такава контролна група е използването на данни от контролирани проучвания на ефекта от понижената консумация на храна върху параметрите на репродукцията.
Трябва да се отчетат следните характеристики на носителя или други добавки, ако се прилагат такива: ефекти върху резорбцията, разпределението, метаболизма или ретенцията на изпитваното вещество в организма; ефекти върху химичните свойства на изпитваното вещество, които могат да повлияят върху токсикологичните му характеристики; ефекти върху консумацията на храна или вода или върху хранителния статус на животните.
1.4.4. Лимитиращо изпитване
Може да се прецени, че извършването на изпитването в пълен обем с няколко дози не е необходимо, когато при орално изпитване по описаната в този метод процедура с едно ниво на експозиция (орална дневна доза равна или по-висока от 1 000 mg/kg т.м. или еквивалентно процентно съдържание в диетата или питейната вода) не се наблюдават токсични ефекти при родителските животни или потомството им и когато не се очакват прояви на токсичност въз основа на данните за вещества с подобна химична структура и/или метаболизъм. При лимитиращото изпитване може да се приложи и по-висока орална доза, когато това се налага във връзка с нивото на експозиция за населението. При другите пътища на въвеждане – инхалаторен или дермален, физикохимичните свойства на изпитваното вещество, като например разтворимостта, често могат да повлияят и да ограничат максимално достижимото ниво на експозиция.
1.4.5. Въвеждане на дозите
Третирането на животните с изпитваното вещество трябва да се извършва всеки ден (7 дни в седмицата). Желателно е въвеждането да става по орален път (чрез диетата, питейната вода или гаваж). Когато се използва друг път на въвеждане, изборът трябва да се обоснове. В този случай може да се наложи въвеждането на модификации в представения метод. Въвеждането трябва да се извършва по един и същи начин на всички животни през посочения в метода период на изпитването. Когато изпитваното вещество се въвежда чрез гаваж, гаважът трябва да се извърши посредством стомашна сонда. Максималният обем на течностите, който може да се въведе еднократно, е 1 ml/100 g т.м. (0,4 ml/100 g т.м. при носител царевично олио), освен в случаите, когато се прилагат водни разтвори. Тогава обемът може да достигне 2 ml/100 g т.м. Целта е веществото да се въвежда в постоянен обем при всички използвани дози. Промените в обема трябва да бъдат сведени до минимум, като вместо него се променят концентрациите. Това правило не се прилага само при дразнещи и корозивни вещества, тъй ефектът им се засилва при по-високи концентрации. При изпитвания чрез гаваж новородените обикновено са експонирани индиректно чрез майчиното мляко до отбиването им, когато започва директното въвеждане на веществото. При въвеждане чрез храната или питейната вода малките получават изпитваното вещество и директно, когато започнат да се хранят самостоятелно през последната седмица от периода на лактация.
Когато веществото се въвежда чрез храната или питейната вода, то трябва да се прилага в дози, които не влияят върху нормалното хранене и водния баланс. Когато изпитваното вещество се прилага с диетата, нивото на експозиция за дадена група може да се изрази като определена фиксирана концентрация в храната (ррm) или като фиксирана дневна доза спрямо телесната маса на животното. Трябва да се посочи кой от двата начина е приложен. Въвеждането чрез гаваж се извършва всеки ден приблизително по едно и също време, като количеството от веществото, което се въвежда на всяко животно, се определя поне веднъж седмично спрямо телесната му маса, за да се поддържа постоянно нивото на експозиция, съответстващо на избраната доза. При определяне на количеството, което се въвежда чрез гаваж, спрямо телесната маса, трябва да се вземат под внимание и данните за влиянието на плацентата върху разпределението на веществото.
1.4.6. Експериментални схеми
Мъжките и женските животни от родителското (Р) поколение трябва да започнат да се третират всеки ден на възраст между 5 и 9 седмици. Ежедневното третиране на мъжките и женските животни от поколение F1 започва при отбиването им. Когато изпитваното вещество се прилага чрез храната или питейната вода, трябва да се има предвид, че животните от поколение F1 може да са били експонирани директно още през периода на лактация. За Р и F1 животните от двата пола третирането трябва да продължи най-малко 10 седмици преди периода на чифтосване. Третирането продължава и при двата пола по време на двуседмичния период на чифтосване. Мъжките животни трябва да бъдат убити по хуманен начин и аутопсирани, когато се прецени, че с оглед оценката на репродуктивните ефекти не е необходимо изпитването върху тях да продължава по-дълго. За женските животни от родителското (Р) поколение третирането продължава по време на бременността и се прекратява при отбиването на потомството F1. Въз основа на наличната информация за изпитваното вещество, включително съществуващите данни за токсичността, метаболизма или биологичната кумулация, се преценява дали са необходими промени в схемата на третиране. Дозата за всяко животно се определя най-често въз основа на последното измерване на индивидуалната телесна маса. Въпреки това трябва да се подхожда предпазливо, когато се определят дозите през последната третина от бременността.
Третирането на мъжките и женски животни от поколение Р и F1 трябва да продължи до убиването им. Всички полово зрели мъжки и женски Р и F1 животни трябва да бъдат умъртвени по хуманен начин, когато се прецени, че с оглед оценката на репродуктивните ефекти не е необходимо изпитването върху тях да продължава по-дълго. Животните от поколение F1, които не са избрани за чифтосване, и всички животни от поколение F2 трябва да бъдат умъртвени по хуманен начин след отбиването им.
1.4.7. Процедура на чифтосването
1.4.7.1. Чифтосване на животните от родителското (Р) поколение
Всяко женско животно, определено за чифтосване, се поставя заедно с едно мъжко животно, третирано със същата доза (чифтосване 1:1), докато се осъществи копулация или до изтичането на 2 седмици. Всеки ден женските животни трябва да се преглеждат за наличие на сперма или вагинална запушалка. Денят, в който се установи наличие на сперматозоиди или вагинална запушалка, се определя като ден 0 от бременността. Когато чифтосването е неуспешно, може да се извърши повторно чифтосване на женските животни с мъжки животни с доказан фертилитет от същата опитна група. Животните от всяка двойка, определена за чифтосване, трябва да бъдат ясно идентифицирани в данните от изпитването. Чифтосването между животни от едно и също котило трябва да се избягва.
1.4.7.2. Чифтосване на животните от поколение F1
За чифтосването на F1 животните и получаването на поколение F2 веднага след отбиването се избират най-малко по едно мъжко и едно женско животно от всяко котило, които ще се чифтосат с по едно животно от друго котило, третирано със същата доза. Когато не се откриват значителни различия в телесната маса или вида между животните от дадено котило, животните за чифтосването трябва да се определят на принципа на случайния подбор. Когато се наблюдават такива различия, се подбират представителите от всяко котило, които са в най-добро състояние. На практика се препоръчва този подбор да се извърши въз основа на стойностите на телесната маса, но в някои случаи може да бъде по-подходящо животните да се изберат според външния им вид. F1 животните не трябва да се чифтосват, преди да достигнат напълно полова зрялост.
Двойките, при които не е настъпило оплождане и бременност, трябва да се изследват, за да се определи възможната причина за безплодието. Оценката на състоянието им може да включва процедури като повторно чифтосване с други мъжки или женски животни с доказан фертилитет, микроскопско изследване на репродуктивните органи и изследване на естралния цикъл или сперматогенезата.
1.4.7.3. Второ чифтосване
В някои случаи, като например при промени в броя на животните в котилото, свързани с експозицията на изпитваното вещество, или при появата на недостатъчно ясно изразени ефекти при първото чифтосване, се препоръчва двойките полово зрели животни от поколение Р или F1 да се чифтосат повторно, за да заченат второ котило. Препоръчва се женските или мъжки животни, които не са дали потомство, да се чифтосат повторно с животни от противоположния пол с доказан фертилитет. Когато се прецени, че е необходимо да се получи второ котило от Р и/или F1 животните, повторното чифтосване се извършва приблизително една седмица след отбиването на последното котило.
1.4.7.4. Брой на животните в котилото
На животните трябва да се даде възможност да родят нормално и да отгледат потомството си до отбиването. Може да се извърши стандартизиране на броя на животните във всяко котило, но това не е задължителна процедура. Когато се извършва стандартизиране, използваният метод за това трябва да се опише подробно.
1.5. НАБЛЮДЕНИЯ
1.5.1. Клинични наблюдения
Клиничното наблюдение на животните се извършва всеки ден. Когато въвеждането става чрез гаваж, при наблюдението трябва да се обърне особено внимание на периода след третирането, през който се очаква появата на най-силно изразени ефекти. Трябва да се опишат промените в поведението, признаците на трудно или удължено раждане, както и всички симптоми на токсично действие. Освен това най-малко веднъж седмично трябва да се извърши по-подробен преглед на всяко животно. Подходящо е прегледът да се провежда, когато животните се претеглят. Огледът на всички животни за наличие на патологични клинични симптоми и смъртни случаи се провежда два пъти дневно, а през двата неработни дни в края на седмицата — веднъж дневно, когато се прецени, че това е достатъчно.
1.5.2. Родителски животни — телесна маса и консумация на храна/вода
Р животните и F1 животните, определени за чифтосване, трябва да се претеглят на първия ден от началото на третирането, а след това най-малко веднъж седмично. Женските Р животни и женските F1 животни, определени за чифтосване, трябва да се претеглят като минимум в ден 0, 7, 14, и 20 или 21 от гестацията, по време на лактацията в същите дни, когато се претеглят котилата, както и в дните, когато животните се убиват. Тези наблюдения трябва да се описват индивидуално за всяко полово зряло животно. По време на периода преди чифтосването и на бременността количеството на консумираната храна трябва да се измерва най-малко веднъж седмично. Консумацията на вода трябва да се измерва най-малко веднъж седмично, когато изпитваното вещество се въвежда чрез питейната вода.
1.5.3. Eстрален цикъл
Продължителността и протичането на естралния цикъл се оценяват при женските животни от поколение Р и F1 чрез изследване на вагинални цитонамазки преди чифтосването и по желание през периода на чифтосването до момента, когато се установят признаците за извършено чифтосване. Материалът за цитонамазката се взима внимателно от вагината/цервикса, за да не се допусне увреждане на лигавицата и последващо индуциране на псевдобременност (1).
1.5.4. Параметри за оценка на състоянието на сперматозоидите
След убиването масата на тестисите и епидидимите на всички мъжки Р и F1 животни се измерва и записва. Единият тестис и епидидим от всяко животно се запазват за хистопатологично изследване (виж точки 1.5.7 и 1.5.8.1). Вторият тестис и епидидим на най-малко 10 мъжки животни от всяка опитна група от поколение Р and F1 се използват за изброяване съответно на сперматидите, резистентни на хомогенизация, и на сперматозоидите в опашката на епидидима. От същите животни се вземат сперматозоиди от опашката на епидидима или vas deferens и се изследват подвижността и морфологията им. Когато се наблюдават ефекти, свързани с третирането, или когато са налице данни от други проучвания за възможни ефекти върху сперматогенезата, оценката на състоянието на сперматозоидите трябва да се извърши при всички мъжки животни от всяка експонирана група. Когато липсват такива наблюдения или данни, може да се изследват проби само от мъжките Р и F1 животни от контролната група и най-силно експонираната група.
Трябва да се определи общият брой на тестикуларните сперматиди, резистентни на хомогенизиране, и на сперматозоидите в опашката на епидидима (2)(3). Броят на сперматозоидите в опашката на епидидима може да се изчисли въз основа на концентрацията и обема на сперматозоидите в суспензията, използвана за извършване на качествените наблюдения, както и на броя на сперматозоидите, отделени чрез раздробяване и/или хомогенизиране на останалите тъкани от опашката на епидидима. Изброяването на сперматозоидите в пробите от избраните мъжки животни от всички опитни групи се извършва веднага след убиването им. Това не е необходимо, когато пробите се заснемат на видеозапис или дигитално, или когато се замразяват и анализират по-късно. Когато пробите са съхранени или заснети, анализът им може да започне с контролната група и най-силно експонираната група. Ако не се установяват ефекти, свързани с третирането (например ефекти върху броя, подвижността или морфологията на сперматозоидите), не е необходимо да се анализират пробите от останалите експонирани групи. Когато при най-силно експонираната група се откриват ефекти, свързани с третирането, се анализират и пробите от групите с по-ниски дози.
Веднага след убиването на животните подвижността на сперматозоидите от епидидима (или ductus deferens) трябва да се оцени или да се направи видеозапис на пробата. Сперматозоидите трябва да се отделят с минимални увреждания и пробата да се разреди за анализ на подвижността, който се извършва чрез подходящи методи (4). Относителният дял (в проценти) на прогресивно подвижните сперматозоиди трябва да се определи субективно или обективно. Когато се извършва компютърен анализ на движението на сперматозоидите (5)(6)(7)(8)(9)(10), изчислението на прогресивната подвижност зависи от определените от потребителя прагове за скорост по средния път и праволинейност на движението или линеен индекс. По време на аутопсията пробите могат да бъдат заснети на видеозапис (11) или по друг начин. По-късно те се анализират, като първоначално се изследват само контролните групи и групите с най-високата доза от Р и F1 поколение. При наличие на ефекти, свързани с третирането, се изследват и групите, експонирани на по-ниски дози. Когато не са заснети на видеозапис или дигитално, всички проби от всички опитни групи се анализират по време на аутопсията.
Извършва се морфологично изследване на сперматозоиди от епидидима (или vas deferens). Сперматозоидите (най-малко 200 в една проба) се изследват във фиксирани влажни препарати (12) и се класифицират като нормални или абнормни. Примери за морфологични отклонения са: слепване, наличие на глави, отделени от тялото и опашката, промени във формата на главите и/или опашките. Оценката на пробите от избраните мъжки животни от всички експонирани групи трябва да се извърши веднага след убиване на животните, или по-късно, чрез използването на видео- или дигитални записи. Намазките също могат да се анализират по-късно, след като се фиксират. В тези случаи първо може да се извърши оценка на пробите от контролната група и най-силно експонираната група. Когато не се откриват ефекти, свързани с третирането (например ефекти върху морфологията на сперматозоидите), не е необходимо да се изследват останалите групи. Когато при най-високата доза се откриват ефекти, свързани с третирането, пробите от групите, третирани с по-ниски дози, също се анализират.
Когато някои от посочените по-горе параметри за оценка на състоянието на сперматозоидите вече са били изследвани по време на проучване на системната токсичност с продължителност най-малко 90 дни, не е задължително те да се изследват повторно в проучването в две поколения. Препоръчва се, обаче, пробите от сперматозоидите на Р мъжките животни или дигиталните им образи да бъдат съхранени, за да може по-нататък да се извърши оценка, ако това е необходимо.
1.5.5. Потомство
Всяко котило трябва да бъде прегледано възможно най-скоро след раждането (ден 0 от периода на лактация), за да се установи броят и полът на новородените, броят на мъртвородените и на живите, както и наличието на външни аномалии. Когато в ден 0 сред новородените има мъртви животни и труповете им не са мацерирани, желателно е те да се прегледат за установяване причината за смъртта и за наличие на дефекти и да се запазят. Живите новородени трябва да се преброят и всяко от тях да се претегли в деня на раждането (ден 0 от периода на лактация) или в ден 1. По-нататък телесната им маса трябва да се измерва редовно в определени дни, например в ден 4, 7, 14, и 21 от периода на лактация. Физическите аномалии или отклоненията в поведението, установени при майките или в потомството, трябва да се опишат.
Основният показател за физическото развитие на потомството, който се проследява и регистрира, е прирастът на телесната маса. Други параметри на физическото развитие (например отлепване на ушната мида, отваряне на очите, пробиване на зъбите, израстване на козина) могат да дадат допълнителна информация, но е желателно тези данни да се оценяват в контекста на данните за половото съзряване (например възраст и телесна маса при отварянето на вагината или отделянето на препуциума) (13). Препоръчва се извършването на функционални изследвания (например за моторна активност, сензорна функция, рефлексна дейност) върху поколение F1 преди и/или след отбиването, по-специално на изследвания, свързани с половото съзряване, когато такива изследвания не са включени в отделни проучвания. Възрастта, при която настъпва отварянето на вагината или отделянето на препуциума, трябва да се определи за F1 животните, избрани за чифтосване. Когато са установени данни за промяна в съотношението между двата пола или във времето за настъпване на полова зрялост при животните от поколение F1, на постнатален ден 0 трябва да се измери разстоянието между ануса и половите органи при новородените от поколение F2.
Функционалните изследвания могат да не се извършват в групите, при които се откриват ясно изразени признаци на неблагоприятни ефекти (например значително понижение в телесната маса и т.н.). Когато се провеждат функционални изследвания, те не трябва да се извършват върху малките, избрани за чифтосване.
1.5.6. Макроскопски оглед при аутопсиране
При убиването или смъртта по време на изпитването се извършва макроскопски оглед за наличие на структурни аномалии или патологични промени, като се обхващат всички родителски животни (Р и F1), всички малки с външни аномалии или клинични симптоми, както и по едно случайно подбрано малко от всеки пол и всяко котило на поколение F1 и F2. Особено внимание при огледа трябва да се обърне на органите на половата система. Малките от поколение F1 и F2, които са били в терминално състояние и са убити по хуманен начин, или са умрели, но труповете им не са мацерирани, трябва да се изследват за възможни дефекти и/или причини за смъртта. Труповете им трябва да се запазят.
Матките на всички женски животни, родили за първи път, трябва да се изследват за наличие и брой на места на имплантация. Изследването трябва да се проведе така, че да не се попречи на извършването на хистопатологично изследване.
1.5.7. Органна маса
При всички родителски Р и F1 животни в момента на убиването трябва да се измери телесната маса и масата на следните органи (всеки от чифтните органи трябва да се претегли отделно):
|
—
|
тестиси, епидидими (целият епидидим и отделно опашката на епидидима);
|
|
—
|
семенни мехурчета с коагулиращите жлези, течното им съдържимо и простатата жлеза (измерват се заедно);
|
|
—
|
мозък, черен дроб, бъбреци, слезка, хипофизна, щитовидна и надбъбречни жлези, познати критични органи.
|
Телесната маса при настъпване на смъртта трябва да бъде измерена за малките от поколение F1 и F2, които са избрани за аутопсиране. Трябва да бъдат претеглени следните органи от едно случайно подбрано малко от всеки пол и от всяко котило (виж точка 1.5.6): мозък, слезка и тимус.
Резултатите от макроскопския оглед и измерването на органната маса трябва да се оценяват в контекста на наблюденията, проведени по време на други изпитвания при многократно постъпване на веществото, когато това е възможно.
1.5.8. Хистопатологично изследване
1.5.8.1. Родителски животни
Следните органи и тъкани от родителските Р и F1 животни или репрезентативни проби от тях трябва да се фиксират и съхранят в подходяща среда за провеждане на хистопатологично изследване:
|
—
|
вагина, матка (заедно с цервикса) и яйчници (съхранени в подходящ фиксатор);
|
|
—
|
един тестис (съхранен във фиксатор на Воuin или друг подобен фиксатор), един епидидим, семенни мехурчета, простатна и коагулираща жлеза;
|
|
—
|
критичен орган/органи, установени при предишни проучвания, от всички Р и F1 животни, избрани за чифтосване.
|
Пълно хистопатологично изследване на съхранените органи и тъкани, изброени по-горе, трябва да бъде направено за всички Р и F1 животни от контролната и най-силно експонираната група, избрани за чифтосване. По желание може да се извърши изследване на яйчниците на животните от Р поколение. Органите, при които се установяват промени, свързани с третирането, трябва да бъдат изследвани също така и при животните от групите с най-ниската и междинната доза/дози, за да може да се установи NOAEL. Освен това на хистопатологично изследване трябва да бъдат подложени репродуктивните органи на животните от групите с най-ниската доза и междинната доза/дози, при които има съмнение за понижен фертилитет, например тези, при които чифтосването, оплождането или зачеването са били неуспешни, тези, които не са родили здраво потомство, както и тези, при които е нарушен естралният цикъл или се установяват промени в броя, подвижността или морфологията на сперматозоидите. Всички макроскопски лезии, като например атрофия или тумори, трябва да се изследват и хистопатологично.
Трябва да се извърши подробно хистопатологично изследване на тестисите (напр. чрез използване на фиксатора на Воuin, заливане с течен парафин и изготвяне на напречни срезове с дебелина 4—5 μm), за да се открият ефекти, свързани с третирането, например наличие на мултинуклеарни гигантски клетки, задържани сперматиди, излющване на сперматогенни клетки в лумена на извитите семенни каналчета или липсващи слоеве или видове герминативни клетки (14). Пълното изследване на епидидима трябва да обхваща главата, тялото и опашката, което може да се извърши, като се използва надлъжен срез. Епидидимът трябва да се изследва за наличие на левкоцитна инфилтрация, промени в броя на отделните видове клетки, аберантни видове клетки и фагоцитоза на сперматозоидите. При изследването на мъжките полови органи може да се използва оцветяване с хематоксилин и ПАС-реакция.
След прекратяване на лактацията яйчникът трябва да съдържа примордиални и зреещи фоликули, както и големи жълти тела. Чрез хистопатологичното изследване може качествено да се установи намаляване в броя на примордиалните фоликули. Количествената оценка на популацията от примордиални фоликули се извършва при женските животни от поколение F1. Броят на животните, изборът на срезове и броят на срезовете, включени в изследваната извадка, трябва да бъдат обосновани от статистическа гледна точка във връзка с използваната процедура за количествена оценка. Изследването включва определяне на броя на примордиалните фоликули, които могат да се изброят заедно с малките зреещи фоликули. След това броят на фоликулите се сравнява между контролните и експонираните животни (15) (16) (17) (18) (19).
1.5.8.2. Животни след отбиването
Тъкани с видими аномалии и критични органи от всички малки с външни аномалии или клинични симптоми, както и от едно случайно подбрано малко от всяко котило и пол в поколение F1 и F2, което не е било избрано за чифтосване, трябва да бъдат фиксирани и съхранени в подходяща среда за хистопатологично изследване. Трябва да се извърши пълно хистопатологично изследване на съхранените тъкани, като специално внимание се обърне на органите на половата система.
2. ДАННИ
2.1. ПРЕДСТАВЯНЕ И ОБРАБОТКА НА РЕЗУЛТАТИТЕ
Данните трябва да се представят, както индивидуално за всяко животно, така и обобщено в табличен вид, като за всяка опитна група и поколение се посочи броят на животните в началото на изпитването, броят на животните, умрели по време на изпитването или умъртвени по хуманни съображения, времето на настъпване на смъртта или умъртвяването по хуманни съображения, броят на фертилните животни, броят на бременните женски животни, броят на животните със симптоми на токсично действие, характеристиката на наблюдаваните симптоми, включително време на поява, продължителност и степен на изразеност, наблюденията при родителските животните и при потомството, хистопатологичните промени, както и всички необходими данни за котилата.
Резултатите, изразени количествено, трябва да се оценят чрез подходящи общоприети статистически методи. Статистическите методи трябва да се определят във връзка с дизайна на проучването и да се обосноват. При анализа на данните могат да се използват статистически модели на връзката „доза—отговор“. Отчетът трябва да включва достатъчно информация за използваните методи и компютърните програми, с които е извършен анализът, така че той да може да се възпроизведе и оцени от независим рецензент/статистик.
2.2. ОЦЕНКА НА РЕЗУЛТАТИТЕ
Оценката на резултатите от изпитването за репродуктивна токсичност в две поколения се извършва въз основа на наблюдаваните ефекти, включително данните от макроскопския оглед и хистопатологичното изследване. Оценката включва характеристика на връзката или установяване на отсъствие на връзка между дозата на изпитваното вещество и наличието или отсъствието, честотата и степента на изразеност на наблюдаваните промени, включително макроскопски лезии, ефекти върху критични органи, нарушения във фертилитета, клинични симптоми, нарушения в протичането на бременността, раждането и състоянието на потомството, промени в телесната маса, ефекти върху смъртността и всички други токсични ефекти. Физикохимичните свойства на изпитваното вещество и токсикокинетичните данни, когато такива са налице, трябва да се вземат под внимание при оценката на резултатите от изпитването.
При правилно провеждане на изпитването за репродуктивна токсичност трябва достатъчно обосновано да се определи недействащо ниво и да се характеризират неблагоприятните ефекти върху възпроизводството, раждането, лактацията, постнаталното развитие, включително растежа и половото развитие.
2.3. ИНТЕРПРЕТАЦИЯ НА РЕЗУЛТАТИТЕ
Чрез изпитването за оценка на репродуктивната токсичност в две поколения се осигурява информация за ефектите на изпитваното вещество при многократно постъпване през всички фази на репродуктивния цикъл. По-специално изпитването дава информация за параметрите на възпроизводителната функция, както и на развитието, растежа, съзряването и преживяемостта на потомството. Резултатите от изпитването трябва да бъдат интерпретирани във връзка с наблюденията от проучванията на субхроничната токсичност, пренаталната токсичност за развитието, токсикокинетиката и други достъпни проучвания. Резултатите от това изпитване трябва да бъдат използвани при оценката на необходимостта от по-нататъшно изследване на химичното вещество. Екстраполацията на резултатите от това изпитване за хора е валидна в ограничена степен. Най-голямо приложение намират резултатите, получени за недействащите нива, които се използват при определяне на допустимите нива на експозиция за хора (20) (21) (22) (23).
3. ДОКЛАДВАНЕ НА РЕЗУЛТАТИТЕ
3.1. ОТЧЕТ ЗА ИЗПИТВАНЕТО
Отчетът за изпитването трябва да включва следната информация:
|
|
Изпитвано вещество:
|
—
|
физична природа и, където е необходимо, физикохимични свойства;
|
|
—
|
данни за идентифициране на химичното вещество;
|
|
—
|
степен на чистота на веществото.
|
|
|
|
Носител (когато се използва такъв):
|
—
|
обосновка за избора на носителя, когато той е различен от водата.
|
|
|
|
Опитни животни:
|
—
|
брой, възраст и пол на животните;
|
|
—
|
източник за доставка на животните, условия на отглеждане във вивариума, диета, материали за приготвяне на гнездо и др.;
|
|
—
|
индивидуална телесна маса на животните в началото на изпитването.
|
|
|
|
Условия на провеждане на изпитването:
|
—
|
обосновка за избора на дозите;
|
|
—
|
описание на подготовката на изпитваното вещество за въвеждане (приготвяне на формулация/включване в храната), използвани концентрации;
|
|
—
|
стабилност и хомогенност на формулацията;
|
|
—
|
описание на въвеждането на изпитваното вещество;
|
|
—
|
изчисляване на достигнатите дневни дози (mg/kg т.м.) въз основа на концентрациите на изпитваното вещество в диетата/питейната вода (ррm), когато това е приложимо;
|
|
—
|
критерии за качество, на които отговарят храната и водата за пиене.
|
|
|
|
Резултати:
|
—
|
данни за консумацията на храна; данни за консумацията на вода, когато такива са налице; усвояване на храната (прираст на телесната маса на грам консумирана храна); прием на изпитваното вещество от Р и F1 животни с изключение на времето, през което женските и мъжките животни са съжителствали заедно, както и на периода на лактация (като минимум последната третина от този период);
|
|
—
|
данни за резорбцията на веществото (когато такива са налице);
|
|
—
|
данни за телесната маса на Р и F1 животните, избрани за чифтосване;
|
|
—
|
данни за телесната маса на малките (индивидуално и за всяко котило);
|
|
—
|
телесна маса в деня на убиването и абсолютна и относителна органна маса за родителските животни;
|
|
—
|
природа, степен на изразеност, продължителност и обратимост на клиничните симптоми;
|
|
—
|
време на настъпване на смъртта по време на проучването, като се отбелязва кои животни са преживели до деня на убиването;
|
|
—
|
данни за токсичния отговор в групите по пол и ниво на експозиция, включително индекси на чифтосване, фертилитет, гестация, раждане, преживяемост и лактация; в отчета трябва да се посочат конкретните стойности, въз основа на които са изчислени тези индекси;
|
|
—
|
токсични или други ефекти върху възпроизводството, потомството, постнаталния растеж и т.н.;
|
|
—
|
наблюдения при макроскопския оглед;
|
|
—
|
подробно описание на всички хистопатологични промени;
|
|
—
|
брой на женските животни от поколение Р и F1 с нормален естрален цикъл; продължителност на цикъла;
|
|
—
|
общ брой на сперматозоидите в опашката на епидидима, процент на прогресивно подвижните сперматозоиди, процент на сперматозоидите с нормална морфология; процент на сперматозоидите с всеки вид аномалия, който е установен;
|
|
—
|
време до чифтосването (брой на дните до извършване на чифтосването);
|
|
—
|
продължителност на бременността;
|
|
—
|
брой на имплантациите и жълтите тела; брой на животните във всяко котило;
|
|
—
|
брой на живородените и постимплантационните загуби;
|
|
—
|
брой на малките, родени с видими външни аномалии; когато е определен броят на животните с ниска телесна маса при раждането, той трябва да се посочи;
|
|
—
|
данни за характерните физически особености на потомството и други данни за постнаталното развитие; трябва да се обоснове подборът на разгледаните характерни физически особености;
|
|
—
|
данни за функционалните наблюдения при малките и при полово зрелите животни, когато това е приложимо;
|
|
—
|
статистическа обработка на резултатите, когато това е необходимо.
|
|
|
|
Обсъждане на резултатите.
|
|
|
Заключения, включително стойности на NOAEL, за ефектите върху майките и потомството.
|
4. ПРЕПРАТКИ
|
(1)
|
Sadleir, R.M.F.S. (1979). Cycles and Seasons, In: Reproduction in Mammals: I. Germ Cells and Fertilization, C.R. Auston and R.V. Short (eds.), Cambridge, New York.
|
|
(2)
|
Gray, L.E. et al., (1989). A DoseResponse Analysis of MethoxychlorInduced Alterations of Reproductive Development and Function in the Rat. Fundamental and Applied Toxicology 12:92—108.
|
|
(3)
|
Robb, G.W. et al., (1978). Daily Sperm Production and Epididymal Sperm Reserves of Pubertal and Adult Rats. Journal of Reproduction and Fertility 54:103—107.
|
|
(4)
|
Klinefelter, G.R. et al., (1991). The Method of Sperm Collection Significantly Influences Sperm Motion Parameters Following Ethane Dimethanesulfonate Administration in the Rat. Reproductive Toxicology 5:39 44
|
|
(5)
|
Seed, J. et al. (1996). Methods for Assessing Sperm Motility, Morphology, and Counts in the Rat, Rabbit, and Dog: a Consensus Report. Reproductive Toxicology 10(3):237—244.
|
|
(6)
|
Chapin, R.E. et al., (1992).Methods for Assessing Rat Sperm Motility. Reproductive Toxicology 6:267—273.
|
|
(7)
|
Klinefelter, G.R. et al., (1992). Direct Effects of Ethane Dimethanesulphonate on Epididymal Function in Adult Rats: an In Vitro Demonstration. Journal of Andrology 13:409—421.
|
|
(8)
|
Slott, V.L. et al., (1991). Rat Sperm Motility Analysis: Methodologic Considerations. Reproductive Toxicology 5:449—458.
|
|
(9)
|
Slott, V.L. and Perreault, S.D., (1993). ComputerAssisted Sperm Analysis of Rodent Epididymal Sperm Motility Using the HamiltonThorn Motility Analyzer. In: Methods in Toxicology, Part A., Academic, Orlando, Florida. pp. 319—333.
|
|
(10)
|
Toth, G.P. et al. (1989). The Automated Analysis of Rat Sperm Motility Following Subchronic Epichlorhydrin Administration: Methodologic and Statistical Considerations. Journal of Andrology 10: 401—415.
|
|
(11)
|
Working, P.K. and M. Hurtt, (1987). Computerized Videomicrographic Analysis of Rat Sperm Motility. Journal of Andrology 8:330—337.
|
|
(12)
|
Linder, R.E. et al., (1992). Endpoints of Spermatoxicity in the Rat After Short Duration Exposures to Fourteen Reproductive Toxicants. Reproductive Toxicology 6:491—505.
|
|
(13)
|
Korenbrot, C.C. et al., (1977). Preputial Separation as an External Sign of Pubertal Development in the Male Rat. Biological Reproduction 17:298—303.
|
|
(14)
|
Russell, L.D. et al., (1990). Histological and Histopathological Evaluation of the Testis, Cache River Press, Clearwater, Florida.
|
|
(15)
|
Heindel, JJ. and R.E. Chapin, (eds.) (1993). Part B. Female Reproductive Systems, Methods in Toxicology, Academic, Orlando, Florida.
|
|
(16)
|
Heindel, JJ. et al., (1989) Histological Assessment of Ovarian Follicle Number in Mice As a Screen of Ovarian Toxicity. In: Growth Factors and the Ovary, A.N. Hirshfield (ed.), Plenum, New York, pp. 421—426.
|
|
(17)
|
Manson, J.M. and Y.J. Kang, (1989). Test Methods for Assessing Female Reproductive and Developmental Toxicology. In: Principles and Methods of Toxicology, A.W. Hayes (ed.), Raven, New York.
|
|
(18)
|
Smith, B.J. et al,. (1991). Comparison of Random and Serial Sections in Assessment of Ovarian Toxicity. Reproductive Toxicology 5:379—383.
|
|
(19)
|
Heindel, JJ. (1999). Oocyte Quantitation and Ovarian Histology. In: An Evaluation and Interpretation of Reproductive Endpoints for Human Health Risk Assessment, G. Daston,. And C.A. Kimmel, (eds.), ILSI Press, Washington, DC.
|
|
(20)
|
Thomas, J. A. (1991). Toxic Responses of the Reproductive System. In: Casarett and Doull's Toxicology, M.O. Amdur, J. Doull, and CD. Klaassen (eds.), Pergamon, New York.
|
|
(21)
|
Zenick, H. and E.D. Clegg, (1989). Assessment of Male Reproductive Toxicity: A Risk Assessment Approach. In: Principles and Methods of Toxicology, A.W. Hayes (ed.), Raven Press, New York.
|
|
(22)
|
Palmer, A.K. (1981). In: Developmental Toxicology, Kimmel, C.A. and J. Buelke-Sam (eds.), Raven Press, New York.
|
|
(23)
|
Palmer, A.K. (1978). In Handbook of Teratology, Vol. 4, J.G. Wilson and F.C. Fraser (eds.), Plenum Press, New York.
|
Б.36. ТОКСИКОКИНЕТИКА
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Вижте Общо въведение част Б.
1.2. ОПРЕДЕЛЕНИЯ
Вижте Общо въведение част Б.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Няма.
1.4. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Изпитваното вещество се прилага по подходящ начин. В зависимост от целта на изпитването веществото може да бъде прилагано като еднократни или многократни дози за определени периоди върху една или няколко групи експериментални животни. Впоследствие, в зависимост от типа на изпитването се определят веществото и/или метаболитите в течностите, тъканите и/или екскретите на организма.
Могат да се провеждат изпитвания с „маркирани“ или „немаркирани“ форми на изпитваното вещество. Когато се използва маркер, той трябва да бъде поставен във веществото по такъв начин, че да предоставя възможно най-много информация за съдбата на съединението.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Няма.
1.6. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
Подготовка
Здрави млади възрастни животни се аклиматизират към лабораторните условия в продължение на поне пет дни преди изпитването. Преди изпитването животните се избират по случаен признак и се разпределят в третирани групи. В особени случаи могат да се използват много млади, бременни или предварително третирани животни.
Условия на изпитването
Експериментални животни
Токсикокинетични изпитвания могат да се провеждат върху един или повече подходящи животински видове и трябва да вземат предвид използваните или планираните за използване видове при други токсикологични изследвания със същото изпитвано вещество. Когато за изпитване се използват гризачи, колебанията в теглото не трябва да превишават ± 20 % от средното тегло.
Брой и пол
За изпитване на абсорбцията и екскрецията първоначално във всяка дозирана група следва да има по четири животни. Не е задължително да се предпочита определен пол, но при определени обстоятелства може да се наложи да бъдат изследвани и двата пола. Ако съществуват разлики между половете при отговора, тогава следва да се изследват по четири животни от всеки пол. При изпитвания с видове, различни от гризачи, могат да се използват по-малко животни.
Когато се изследва разпределението в тъканите, първоначалната големина на групата следва да отчита както броя на животните, които следва да бъдат пожертвани във всяка точка във времето, така и броя на точките във времето, които да се изследват. Когато се изследва метаболизмът, големината на групата е свързана с нуждите на изпитването. За изпитвания с многократни дози и много точки във времето големината на групата следва да взема предвид броя на точките във времето и планираното(ите) умъртвяване(ия), но в групата не може да има по-малко от две животни. Големината на групата следва да бъде достатъчна, за да обезпечи приемливо характеризиране на приема, платото и изчерпването (ако е необходимо) на изпитваното вещество и/или метаболитите.
Нива на дозиране
При прилагане на еднократна доза следва да се използват поне две нива на дозиране. Следва да има ниска доза, при която не се наблюдават токсични ефекти, и висока доза, при която може да има изменения в токсикокинетичните параметри или при която възникват токсични ефекти.
При прилагане на многократни дози ниската доза обикновено е достатъчна, но при определени обстоятелства може да е необходима и висока доза.
Начин на прилагане
Токсикокинетичните изпитвания следва да се провеждат, като се използват същият начин на прилагане и, когато е целесъобразно, същият носител като този, който е използван или е планиран за използване при другите токсикологични изпитвания. Изпитваното вещество обикновено се прилага по орален път със сонда или в храната, поставя се върху кожата или се прилага инхалационно за определени периоди на групи експериментални животни. Интравенозното прилагане на изпитваното вещество може да е полезно при определяне на относителната абсорбция при други начини на прилагане. Допълнително може да се получи полезна информация за начина на разпределение малко след интравенозно прилагане на веществото.
Следва да се има предвид възможността за влияние на носителя върху изпитваното вещество. Следва да се обърне внимание на разликите в абсорбцията при прилагане на изпитваното вещество със сонда и с храната и на необходимостта от точно определяне на дозата, особено когато изпитваното вещество се дава с храната.
Период на наблюдение
Всички животни следва да бъдат наблюдавани ежедневно и признаците на токсичност и други значими клинични признаци следва да бъдат регистрирани, включително времето им на настъпване, силата и продължителността им.
Процедура
След претегляне на експерименталните животни изпитваното вещество се прилага по съответен начин. Ако се сметне за целесъобразно, експерименталните животни могат да бъдат оставени гладни, преди да бъде приложено изпитваното вещество.
Абсорбция
Скоростта и степента на абсорбцията на прилаганото вещество могат да бъдат оценени с помощта на различни методи, със или без групи за сравнение (8), например:
|
—
|
определяне на количеството изпитвано вещество и/или метаболитите в екскрети, като урина, жлъчка, изпражнения, издишан въздух и това, което остава в тялото,
|
|
—
|
сравняване на биологичния отговор (например при изпитвания за остра токсичност) между изследваните и контролните групи и/или групите за сравнение,
|
|
—
|
сравняване на количеството вещество, екскретирано през бъбреците, и/или метаболитите в експерименталната и контролната група,
|
|
—
|
определяне на площта под кривата плазмено ниво/време за изпитваното вещество и/или метаболитите и сравняване с данните от група за сравнение.
|
Разпределение
В момента съществуват два подхода, като единият от тях или и двата могат да бъдат използвани за анализ на начините на разпределение:
|
—
|
полезна качествена информация се получава, като се използват авторадиографски техники за цялото тяло,
|
|
—
|
количествена информация се получава чрез пожертване на животни по различно време след експозицията и определяне на концентрацията и количеството на изпитваното вещество и/или метаболит в тъканите и органите.
|
Екскреция
При изследване на екскрецията се събират урина, изпражнения, издишан въздух и, при определени обстоятелства, жлъчка. Количеството на изпитваното вещество и/или метаболитите в тези екскрети следва да бъде измерено неколкократно след експозицията или докато приблизително 95 % от приложената доза бъде екскретирана, или в продължение на седем дни, в зависимост от това кое от тези събития настъпи най-напред.
В особени случаи може да е необходимо да се вземе предвид екскрецията на изпитваното вещество в млякото на кърмещи експериментални животни.
Метаболизъм
За да се определят степента и начинът на метаболизъм, следва с помощта на подходящи техники да се анализират биологични проби. Следва да се изясни структурата на метаболитите и да се предложат подходящи метаболитни пътища, при което да не се налага да се отговаря на въпроси, възникнали от предшестващи токсикологични изпитвания. За да се получи информация за метаболитните пътища, може да е полезно провеждането на изпитвания in vitro.
Допълнителна информация за връзката на метаболизма с токсичността може да се получи от биохимични изпитвания, например определяне на ефектите върху метаболитни ензимни системи, изчерпване на ендогенните небелтъчни сулфхидрилни съединения и свързване на веществото с макромолекули.
2. ДАННИ
В зависимост от типа проведено изпитване данните следва да бъдат обобщени в табличен вид и навсякъде, където е целесъобразно, да бъдат подкрепени с графично представяне. За всяка експериментална група следва да бъдат показани, когато е необходимо, средната стойност и статистическите колебания на измерванията по отношение на времето, дозите, тъканите и органите. Степента на абсорбция и количеството и скоростите на екскрецията следва да бъдат определени с помощта на подходящи методи. Когато се провеждат метаболитни изследвания, следва да бъде дадена структурата на идентифицираните метаболити и да бъдат представени възможните метаболитни пътища.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Според типа на проведеното изпитване, ако е възможно, протоколът от изпитването съдържа следната информация:
|
—
|
вид, порода, източник, условия на околната среда, диета,
|
|
—
|
характеризиране на маркираните материали, ако са използвани,
|
|
—
|
използваните нива и интервали на дозиране,
|
|
—
|
начинът(ите) на прилагане и всички използвани носители,
|
|
—
|
наблюдаваните токсични и други ефекти,
|
|
—
|
методите за определяне на изпитваното вещество и/или метаболитите в биологични проби, включително издишан въздух,
|
|
—
|
представяне на измерванията в табличен вид по пол, доза, режим, време, тъкани и органи,
|
|
—
|
представяне на степента на абсорбция и екскреция с времето,
|
|
—
|
методи за характеризиране и идентифициране на метаболитите в биологични проби,
|
|
—
|
методи за определяне на биохимични параметри, свързани с метаболизма,
|
|
—
|
предложени метаболитни пътища,
|
|
—
|
обсъждане на резултатите,
|
|
—
|
интерпретиране на резултатите.
|
3.2. ОЦЕНКА И ИНТЕРПРЕТИРАНЕ
Вижте Общо въведение, част Б.
4. ПРЕПРАТКИ
Вижте Общо въведение, част Б.
Б.37. ЗАБАВЕНА НЕВРОТОКСИЧНОСТ КЪМ ОРГАНИЧНИ ФОСФОР-СЪДЪРЖАЩИ ВЕЩЕСТВА СЛЕД ОСТРО ИЗЛАГАНЕ
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
При оценка на токсичните ефекти на веществата е необходимо да се има предвид способността на определени класове вещества да предизвикват специфичен вид невротоксичност, неоткрита в други проучвания. Установено е, че определени органични фосфор-съдържащи вещества предизвикват забавен тип невротоксичност и следва да се считат за потенциални кандидати за оценка.
Могат да се използват скриниращи тестове in vitro c цел идентифициране на веществата, които предизвикват късна полиневропатия; отрицателните находки обаче от изследванията in vitro не изключват възможността проучваното вещество да притежава невротоксичен потенциал.
Вж. Общо въведение, част Б.
1.2. ДЕФИНИЦИИ
Органичните фосфор-съдържащи вещества включват ненатоварени фосфор-органични естери, тиоестери или анхидриди на органичните фосфорни, органичните фосфони или органичните фосфорамидни киселини или свързаните с тях фосфоротични, фосфонотични или фосфортиоамидни киселини, или други вещества, които могат да предизвикат забавена невротоксичност, понякога наблюдавана в този клас вещества.
Забавената невротоксичност е синдром, свързан с късно проявена атаксия, дистална аксонопатия на гръбначния мозък и периферните нерви, както и инхибиране и остаряване на таргетната за невропатия естераза (NTE — neuropathy target esterase), намираща се в нервната тъкан.
1.3. РЕФЕРЕНТНИ ВЕЩЕСТВА
Референтно вещество може да бъде тествано с положителна контролна група с цел потвърждаване, че при лабораторни условия реакцията на опитните породи не се променя значително.
Пример за широко използвано невротоксично вещество е три-о-толил фосфат (CAS 78-30-8, EINECS 201-103-5, CAS номенклатура: фосфориста киселина, три(2-метилфенилов)естер), познато и под името три-о-крезилфосфат.
1.4. ПРИНЦИП НА МЕТОДА НА ИЗПИТВАНЕ
Проучваното вещество се прилага орално, в единична доза, на домашни кокошки, при необходимост протектирани от остри холинергични ефекти. Животните се наблюдават в продължение на 21 дни за поведенчески отклонения, атаксия и парализи. Биохимичните измервания, в частност инхибиране на таргетната за невропатия естераза (NTE), се извършват върху случайно подбрани от всяка група кокошки, обикновено 24 и 48 часа след дозирането. Двадесет и един дни след излагането останалите кокошки се убиват, след което се извършват хистопатологични изследвания на определени нервни тъкани.
1.5. ОПИСАНИЕ НА МЕТОДА НА ИЗПИТВАНЕ
1.5.1. Подготовка
Здрави, млади, пораснали кокошки, неболедуващи от вирусни заболявания, неполучаващи лекарства и без нарушения в походката, се подбират по случаен признак и се разпределят в третираните или контролните групи, като в продължение на поне 5 дни преди началото на проучването се аклиматизират към лабораторните условия.
Използват се достатъчно големи клетки или ограждения, позволяващи свободното движение на кокошките и незатрудняващи наблюдението върху походката им.
Дозирането с проучваното вещество обикновено се извършва орално, като се използва сонда, желатинови капсули или друг сравним метод. Течностите се дават неразредени или разредени в съответна среда, като например царевично олио; при възможност твърдите вещества се разтварят, тъй като големи дози твърди вещества в желатинови капсули не се абсорбират достатъчно ефективно. За нетечните среди следва предварително да се знаят токсичните свойства на средата, а ако не се познават — да се определят преди началото на теста.
1.5.2. Условия за провеждане на теста
1.5.2.1. Опитни животни
Препоръчва се използването на млади пораснали носещи кокошки (Gallus gallus domesticus), на възраст 8—12 месеца. Участват стандартни видове и породи, кокошките се отглеждат при условия, позволяващи свободно движение.
1.5.2.2. Брой и пол
В допълнение към третираната група следва да се използват и други две групи — контролна за действието на средата и положителна контролна. Контролната група за средата се третира по същия начин както и третираната група, с изключение на това, че проучваното вещество не се прилага.
Следва да участват достатъчно голям брой кокошки във всяка група, така че поне шест птици да бъдат убити с цел биохимични проучвания (по три във всяка от двете времеви точки) и шест да преживеят 21-дневния период на наблюдение с цел хистопатологично изследване.
Положителната контролна група може да участва едновременно в проучването или да се използват най-новите литературни данни за контролна група. В нея следва да участват поне шест кокошки, третирани с познато невротоксично вещество със забавено начало, от които три за биохимични и три за патологични изследвания. Препоръчва се периодичното обновяване на данните. Необходимо е събиране на нови данни за положителна контролна група, в случай че изследващата лаборатория промени някой основен елемент на провежданото проучване (напр. порода, хранене, условия на отглеждане).
1.5.2.3. Нива на доза
Провежда се предварително проучване, използващо съответен брой кокошки и групи с различни нива на доза, с цел определяне на нивото, което ще бъде използвано в основното проучване. За да се определи възможно най-подходящата доза за основното проучване, е необходимо е да има известен леталитет в това предварително проучване. За да се предотврати смърт, дължаща се на остри холинергични ефекти, може да се използва атропин или друго протективно вещество, за което се знае, че не си взаимодейства с реакциите на забавена невротоксичност. Могат да се използват различни тест-методи за определяне на максималната нелетална доза за проучваното вещество (вж. метод Б.1а). При избора на доза могат да се окажат полезни както литературните данни за кокошките, така и всяка друга токсикологична информация.
Нивото на доза на проучваното вещество в основното изследване следва да бъде възможно най-високото, имайки предвид резултатите от предварителното проучване за избор на доза, както и горната граница на дозата — 2 000 mg/kg телесно тегло. Всеки един смъртен случай, който може да настъпи, не бива да пречи на преживяването на достатъчен брой животни, необходими за биохимичните (шест) и хистологичните (шест) изследвания на 21-вия ден. За да се предотврати смърт, дължаща се на остри холинергични ефекти, може да се използва атропин или друго протективно вещество, за което се знае, че не си взаимодейства с реакциите на забавена невротоксичност.
1.5.2.4. Тест за определяне на граница
Ако тест при ниво на доза от поне 2 000 mg/kg телесно тегло/ден, използвайки процедурите, описани в това проучване, не предизвиква видими токсични ефекти и ако не се очаква токсичност, изхождайки от данните за структурно свързани вещества, то тогава не е необходимо да се извършва проучване, използващо по-висока доза. Прилага се тестът за определяне на граници, освен ако излагането на хора показва необходимост от използване на по-високо ниво на доза.
1.5.2.5. Период на наблюдение
Периодът на наблюдение следва да продължи 21 дни.
1.5.3. Процедура
След прилагане на протективно вещество, което да предотврати смърт, дължаща се на остър холинергичен еефект, се прилага и проучваното вещество в единична доза.
1.5.3.1. Общо наблюдение
Наблюденията започват веднага след излагането. Всички кокошки се наблюдават внимателно няколко пъти на ден през първите 2 дни, след което — поне един път дневно за период от 21 дни или до момента на убиване. Записват се всички симптоми на токсичност, включително начално време, вид, тежест и продължителност на поведенческите отклонения. Атаксията се измерва според обикновена скала за степени, състояща се от поне четири нива, парализите следва да се отбелязват. Поне два пъти седмично кокошките, определени за хистопатологично изследване, се извеждат извън клетките и се подлагат за период от време на форсирана двигателна активност, например изкачване на стълба, с цел улесняване откриването на минимални токсични ефекти. Морибундните животни и тези, изпитващи тежък дистрес или болка, се отстраняват, хуманно се убиват и дисецират.
1.5.3.2. Телесно тегло
Всички животни се претеглят точно преди прилагане на проучваното вещество, след което — поне един път седмично.
1.5.3.3. Биохимия
Шест случайно подбрани кокошки от всяка една третирана група и контролната на средата група, както и три кокошки от положителната контролна група (в случай че и тя участва едновременно), следва да бъдат убити в рамките на няколко дни след дозирането, приготвят се хистологични препарати от главния мозък и поясната част на гръбначния мозък, които се изследват за инхибираща активност на таргетната за невротоксичност естераза. В допълнение би било полезно да се запази и изследва тъкан от нервус ишиадикус за инхибираща активност на таргетната за невропатия естераза. Обикновено след 24 и 48 часа се убиват по три птици от контролната и всяка една от третираните групи, докато трите кокошки от групата на положителните контроли следва да се убият на 24-ия час. Ако наблюдението на клиничните симптоми на интоксикация (това често се преценява чрез наблюдение на времето на поява на холинергични белези) показва, че токсичното вещество може да бъде отстранено много бавно, тогава се предпочита вземане на проби от три птици във всяко от двете времена между 24 и най-късно 72 часа след дозирането.
Върху тези препарати може да се изследва и активността на ацетилхолинестеразата (AChE), ако се прецени, че е уместно. Спонтанна реактивация на AChE може да настъпи in vivo и така да доведе до подценяване на способността на веществото като AChE инхибитор.
1.5.3.4. Макроскопска дисекция
Извършва се макроскопска дисекция на всички животни (определени за убиване и убити в морибундно състояние), която включва описание на изгледа на главния и гръбначния мозък.
1.5.3.5. Хистопатологично изследване
Нервната тъкан на животните, преживели периода на наблюдение и неизползвани за биохимични проучвания, се подлага на микроскопско изследване. Тъканите се фиксират in situ, като се използват перфузионни техники. Препаратите следва да включват малкия мозък (срединен надлъжен срез), продълговатия мозък, гръбначния мозък и периферни нерви. Материал от гръбначния мозък се взема на ниво горен шиен отдел, средногръден и лумбо-сакрален. Взема се и материал от дисталния отдел на тибиалния нерв и неговите клонове към мускулус гастрокнемиус и нервус ишиадикус. Препаратите се оцветяват съответно и специфично за миелин и аксон.
2. ДАННИ
Отрицателните резултати за крайните цели, избрани за този метод (биохимия, хистопатология и наблюдение на поведението), обикновено не изискват по-нататъшно тестуване за забавена невротоксичност. Еднозначните или неинформативните резултати по отношение на тези крайни цели може да наложат по-нататъшно уточняване.
Предоставят се индивидуалните данни. В допълнение, всички данни са обобщават в таблична форма, показваща за всяка опитна група: броя на животни в началото на теста, броя на животните, показали увреждания, поведенчески или биохимични отклонения, вид и тежест на тези увреждания или ефекти, както и процент на животните, показали определен тип и тежест на уврежданията или ефекта.
Находките от това проучване се оценяват от гледна точка на честота, тежест и взаимна връзка между поведенческите, биохимичните и хистопатологичните ефекти, както и всеки друг наблюдаван ефект в третираните и контролните групи.
Числовите резултати следва да бъдат оценени чрез съответни и общоприети статистически методи. Статистическите методи се подбират по време на проектиране на проучването.
3. ДОКЛАДВАНЕ
ДОКЛАД ЗА ТЕСТА
Докладът за теста следва да съдържа по възможност следната информация:
|
|
Опитни животни:
|
—
|
брой и възраст на животните;
|
|
—
|
източник, условия на отглеждане, хранене и т.н.;
|
|
—
|
индивидуално тегло на животните в началото на теста.
|
|
|
|
Условия на теста:
|
—
|
подробности относно приготвяне на проучваното вещество, стабилност и хомогенност, където е възможно;
|
|
—
|
обосновка за избор на средата;
|
|
—
|
подробности относно прилагане на проучваното вещество;
|
|
—
|
подробности относно качество на храната и водата;
|
|
—
|
обосновка на избора на доза;
|
|
—
|
спецификация на приложените дози, включително подробности за средата, обема и физичната форма на прилаганото вещество;
|
|
—
|
същност и подробности за прилагането на каквито и да са протективни вещества.
|
|
|
|
Резултати:
|
—
|
данни за телесното тегло;
|
|
—
|
данни за отговора към токсичност според групата, включително и смъртност;
|
|
—
|
същност, тежест и продължителност на клиничните наблюдения (обратимост на наблюдаваното или не);
|
|
—
|
подробно описание на биохимичните методи и находки;
|
|
—
|
находки при дисекцията;
|
|
—
|
подробно описание на всички хистопатологични данни;
|
|
—
|
статистическа обработка на резултатите, където е уместно.
|
|
|
|
Обсъждане на резултатите.
|
4. ПРЕПРАТКИ
Този метод е еднакъв с ОECD TG 418.
Б.38. ЗАБАВЕНА НЕВРОТОКСИЧНОСТ КЪМ ОРГАНИЧНИ ФОСФОР-СЪДЪРЖАЩИ ВЕЩЕСТВА НА 28-ИЯ ДЕН В ПРОУЧВАНЕ ЗА ПОВТАРЯЩА СЕ ДОЗА
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
При оценка на токсичните ефекти на веществата е необходимо да се има предвид способността на определени класове вещества да предизвикват специфичен вид невротоксичност, неоткрита в други проучвания. Установено е, че определени органични фосфор-съдържащи вещества предизвикват забавен тип невротоксичност и следва да се смятат за потенциални кандидати за оценка.
Могат да използват скриниращи тестове in vitro c цел идентифициране на веществата, които могат да предизвикат късна полиневропатия; отрицателните находки, обаче, от изследванията in vitro не изключват възможността проучваното вещество да притежава невротоксичен потенциал.
Настоящият 28-дневен тест за забавена невротоксичност дава информация за възможните здравни рискове, които могат да се появят в резултат на повтарящи се излагания в ограничен период от време. Той дава информация за отговор на доза и предлага оценка на ненаблюдаваните странични ефекти, която е полезна за установяване на критерии за безопасно излагане.
Вж. също Общо въведение, част Б.
1.2. ДЕФИНИЦИИ
Органичните фосфор-съдържащи вещества включват ненатоварени фосфор-органични естери, тиоестери или анхидриди на органичните фосфорни, органичните фосфони или органичните фосфорамидни киселини или свързаните с тях фосфоротични, фосфонотични или фосфортиоамидни киселини, или други вещества, които могат да предизвикат забавена невротоксичност, понякога наблюдавана в този клас вещества.
Забавената невротоксичност е синдром, свързан с късно проявена атаксия, дистална аксонопатия на гръбначния мозък и периферните нерви, както и инхибиране и остаряване на таргетната за невропатия естераза (NTE — neuropathy target esterase), намираща се в нервната тъкан.
1.3. ПРИНЦИП НА МЕТОДА НА ИЗПИТВАНЕ
Проучваното вещество се прилага ежедневно орално на домашни кокошки в продължение на 28 дни. Животните се наблюдават поне един път дневно за поведенчески отклонения, атаксия и парализи до 14-ия ден след последната доза. Биохимичните измервания, в частност инхибиране на таргетната за невропатия естераза (NTE), се извършват върху случайно подбрани от всяка група кокошки, обикновено 24 и 48 часа след дозирането. Две седмици след последната доза се убиват и останалите кокошки, след което се извършват хистопатологични изследвания на определени нервни тъкани.
1.4. ОПИСАНИЕ НА МЕТОДА НА ИЗПИТВАНЕ
1.4.1. Подготовка
Здрави млади, пораснали кокошки, неболедуващи от вирусни заболявания, неполучаващи лекарства и без нарушения в походката се подбират по случаен признак и се разпределят в третираните или контролна групи, като в продължение на поне 5 дни преди началото на проучването се аклиматизират към лабораторните условия.
Използват се достатъчно големи клетки или ограждения, позволяващи свободното движение на кокошките и незатрудняващи наблюдението върху походката им.
Дозирането се извършва всеки ден, 7 дни седмично, за предпочитане чрез сонда или желатинови капсули. Течностите се дават неразредени или разредени в съответна среда, като например царевично олио; при възможност твърдите вещества се разтварят, тъй като големи дози твърди вещества в желатинови капсули не се абсорбират достатъчно ефективно. За нетечните среди следва предварително да се знаят токсичните свойства на средата, а ако не се познават — да се определят преди началото на теста.
1.4.2. Условия за провеждане на теста
1.4.2.1. Опитни животни
Препоръчва се използването на млади пораснали носещи кокошки (Gallus gallus domesticus) на възраст 8—12 месеца. Участват стандартни видове и породи, кокошките се отглеждат при условия, позволяващи свободно движение.
1.4.2.2. Брой и пол
Обикновено се използват поне три третирани групи и една контролна за действието на средата. Контролната група за средата се третира по същия начин, както и третираната група, с изключение на това, че проучваното вещество не се прилага.
Следва да участват достатъчно голям брой кокошки във всяка група, така че поне шест птици да бъдат убити с цел биохимични проучвания (по три във всяка от двете времеви точки) и шест да преживеят 14-дневния период на наблюдение с цел хистопатологично изследване.
1.4.2.3. Нива на доза
Нивата на доза се избират в зависимост от трите резултата от острия тест за забавена невротоксичност, както и от всички други налични данни за токсичност и кинетика на проучваното вещество. Избира се най-високата доза с цел индуциране на токсични ефекти, за предпочитане — забавена невротоксичност, без обаче да се стига до смъртен изход или видимо страдание. След това се избира постепенно намаляващ ред на дозовите нива с цел установяване на всеки един ефект, свързан с дозата, както и най-ниското ниво на доза, при което не се наблюдават странични ефекти.
1.4.2.4. Тест за определяне на граница
Ако тест при ниво на доза от поне 1 000 mg/kg телесно тегло дневно, използвайки процедурите, описани в това проучване, не предизвиква видими токсични ефекти и ако не се очаква токсичност, изхождайки от данните за структурно свързани вещества, то тогава не е необходимо да се извършва проучване, използващо по-висока доза. Прилага се тестът за определяне на граници, освен ако излагането на хора показва необходимост от използване на по-високо ниво на доза.
1.4.2.5. Период на наблюдение
Всички животни се наблюдават поне един път дневно по време на периода на излагане, както и 14 дни след това, освен ако не са определени за дисекция.
1.4.3. Процедура
Животните се дозират с проучваното вещество седем дни седмично за период от 28 дни.
1.4.3.1. Общо наблюдение
Наблюденията започват веднага след излагането. Всички кокошки се наблюдават внимателно поне един път дневно, всеки ден от 28-дневния период на третиране, и в продължение на 14 дни след дозирането или до момента на убиване. Записват се всички симптоми на токсичност, включително начално време, вид, тежест и продължителност на поведенческите отклонения. Атаксията се измерва според обикновена скала за степени, състояща се от поне четири нива, парализите следва да се отбелязват. Поне два пъти седмично кокошките, определени за хистопатологично изследване, се извеждат извън клетките и се подлагат за период от време на форсирана двигателна активност, например изкачване на стълба, с цел улесняване откриването на минимални токсични ефекти. Морибундните животни и тези, изпитващи тежък дистрес или болка, се отстраняват, хуманно се убиват и се дисецират.
1.4.3.2. Телесно тегло
Всички животни се претеглят точно преди прилагане на проучваното вещество, след което — поне един път седмично.
1.4.3.3. Биохимия
Шест кокошки, случайно подбрани от всяка една третирана група и контролната на средата група, следва да бъдат убити в рамките на няколко дни след последната доза; приготвят се хистологични препарати от главния мозък и поясната част на гръбначния мозък, които се изследват за инхибираща активност на таргетната за невропатия естераза (NТЕ). В допълнение би било полезно да се запази и изследва тъкан от нервус ишиадикус за инхибираща активност на таргетната за невропатия естераза (NТЕ). Обикновено на 24-ия и 48-ия час след прилагане на последната доза се убиват по три птици от контролната и всяка една от третираните групи. Ако данните от проучването за остра токсичност или други проучвания (напр. токсикокинетични) установяват, че по-подходящи за убиване след последната доза, са други времена, то тогава се следват тези времена и причините за промяната се документират.
Върху тези препарати може да се изследва и активността на ацетилхолинестеразата (АСhЕ), ако се прецени, че е уместно. Спонтанна реактивация на АСhЕ може да настъпи in vivo И така да доведе до подценяване на способността на веществото като АСhЕ инхибитор.
1.4.3.4. Макроскопска дисекция
Извършва се макроскопска дисекция на всички животни (определени за убиване и убити в морибундно състояние), която включва описание на изгледа на главния и гръбначния мозък.
1.4.3.5. Хистопатологично изследване
Нервната тъкан на животните, преживели периода на наблюдение и неизползвани за биохимични проучвания, се подлагат на микроскопско изследване. Тъканите се фиксират in situ, като се използват перфузионни техники. Препаратите следва да включват малкия мозък (срединен надлъжен срез), продълговатия мозък, гръбначния мозък и периферни нерви. Материал от гръбначния мозък се взема на ниво горен шиен отдел, средногръден и лумбо-сакрален. Взема се и материал от дисталния отдел на тибиалния нерв и неговите клонове към мускулус гастрокнемиус и нервус ишиадикус. Препаратите се оцветяват съответно и специфично за миелин и аксон. Първоначално се извършва микроскопско изследване на препаратите от тъкани на всички животни от контролната и групата, получила висока доза. Ако се намерят доказателства за ефекти в групата с висока доза, следва да се извърши микроскопско изследване и при кокошките от групите, получили средна и ниска доза.
2. ДАННИ
Отрицателните резултати за крайните цели, избрани за този метод (биохимия, хистопатология и наблюдение на поведението), обикновено не изискват по-нататъшно тестуване за забавена невротоксичност. Еднозначните или неинформативните резултати по отношение на тези крайни цели могат да наложат по-нататъшно уточняване.
Предоставят се индивидуалните данни. В допълнение, всички данни са обобщават в таблична форма, показваща за всяка опитна група: броя на животните в началото на теста, броя на животните, показали увреждания, поведенчески или биохимични отклонения, вид и тежест на тези увреждания или ефекти, както и процент на животните, показали определен тип и тежест на уврежданията или ефекта.
Находките от това проучване се оценяват от гледна точка на честота, тежест и взаимна връзка между поведенческите, биохимичните и хистопатологичните ефекти, както и всеки друг наблюдаван ефект в третираните и контролната групи.
Числовите резултати следва да бъдат оценени чрез съответни и общоприети статистически методи. Статистическите методи се подбират по време на проектирането на проучването.
3. ДОКЛАДВАНЕ
ДОКЛАД ЗА ТЕСТА
Докладът за теста следва да съдържа, по възможност, следната информация:
|
|
Опитни животни:
|
—
|
брой и възраст на животните;
|
|
—
|
източник, условия на отглеждане, хранене, и т.н.;
|
|
—
|
индивидуално тегло на животните в началото на теста.
|
|
|
|
Условия на теста:
|
—
|
подробности относно приготвяне на проучваното вещество, стабилност и хомогенност, където е възможно;
|
|
—
|
обосновка за избор на средата;
|
|
—
|
подробности относно прилагане на проучваното вещество;
|
|
—
|
подробности относно качество на храната и водата;
|
|
—
|
обосновка за избора на доза;
|
|
—
|
спецификация на приложените дози, включително подробности за средата, обема и физичната форма на прилаганото вещество;
|
|
—
|
обосновка за избора на друго време, различно от 24-и и 48-и час, за извършване на биохимични изследвания.
|
|
|
|
Резултати:
|
—
|
данни за телесното тегло;
|
|
—
|
данни за отговора към токсичност според групата, включително и смъртност;
|
|
—
|
липса на наблюдавани странични ефекти;
|
|
—
|
същност, тежест и продължителност на клиничните наблюдения (обратимост на наблюдаваното или не);
|
|
—
|
подробно описание на биохимичните методи и находки;
|
|
—
|
находки при дисекцията;
|
|
—
|
подробно описание на всички хистопатологични данни;
|
|
—
|
статистическа обработка на резултатите, където е уместно.
|
|
|
|
Обсъждане на резултатите.
|
4. ПРЕПРАТКИ
Този метод е еднакъв с ОECD ТG 419.
Б.39. ИЗПИТВАНЕ ЗА НЕРЕПАРАТИВЕН СИНТЕЗ НА ДНК (НСД) С ЧЕРНОДРОБНИ КЛЕТКИ ОТ БОЗАЙНИЦИ IN VIVO
1. МЕТОД
Настоящият метод е изцяло подобен на теста за нерепаративен синтез на ДНК (НСД) с чернодробни клетки от бозайници in vivo на ОECD ТG 486 от 1997 г.
1.1. ВЪВЕДЕНИЕ
Целта на теста за нерепаративен синтез на ДНК (НСД) с чернодробни клетки от бозайници in vivo е да се идентифицират тествани вещества, които индуцират репарация на ДНК в чернодробните клетки на третираните животни (вж. 1, 2, 3, 4).
Настоящият in vivo тест осигурява метод за изследване на генотоксичните ефекти на химикали в черния дроб. Измерената крайна точка показва увреждане на ДНК и последваща репарация в чернодробни клетки. По принцип черният дроб е главната площадка на метаболизма на абсорбираните съединения. Ето защо той е подходящото място за измерване на увреждане на ДНК in vivo.
Ако има доказателства, че тестваното вещество няма да достигне тъкан, която е обект на изследването, не е уместно да се използва настоящият тест.
Крайната точка на нерепаративния синтез на ДНК (НСД) се измерва чрез определяне на поглъщането на радиоактивно маркирани нуклеозиди в клетки, които не претърпяват репаративен синтез на ДНК (S-фаза). Най-широко използваният способ е определянето на поглъщането на маркирания с тритий тимидин 3Н-ТdR) чрез авторадиография. За НСД тестове in vivo се предпочита черен дроб на плъхове. Освен черен дроб могат да се използват други тъкани, но те не са обект на настоящия метод.
Откриването на НСД реакция зависи от ДНК базите, изрязани и заместени от страната на увреждането. Следователно тест НСД е особено ценен за откриване на „репарация с дълги парчета“ (20 до 30 бази), индуцирана от вещество. И обратното, „репарация с къси парчета“ (една до три бази) се открива с много по-ниска чувствителност. Освен това мутагенните събития могат да се случат поради липса на репарация, погрешна репарация или погрешна репликация на ДНК поражения. Степента на НСД реакция изобщо не показва надеждността на процеса на репарация. В допълнение на това възможно е мутаген да реагира с ДНК, но увреждането на ДНК не се коригира чрез процеса на ексцизионна репарация. Липсата на конкретна информация за мутагенната активност от НСД теста се компенсира от потенциалната чувствителност на тази крайна точка, тъй като се измерва в целия геном.
Вижте също Общо въведение, част Б.
1.2. ДЕФИНИЦИИ
Клетки в репарация: нето ядрено зрънце (НЯЗ), по-голямо от предварително определена стойност, която се доказва в лабораторията, провеждаща теста.
Нето ядрени зрънца (НЯЗ): количествена мярка за НСД активност на клетки в авторадиографни НСД тестове, изчислявана чрез изваждане на средния брой цитоплазмени зрънца на цитоплазмени зони, еквивалентни на ядрото (ЦЗ), от броя на ядрени зрънца (ЯЗ): НЯЗ = ЯЗ – ЦЗ. НЯЗ количества се изчисляват за отделните клетки и след това се групират за клетките в култура, паралелни култури и др.
Нерепаративен синтез на ДНК (НСД): ДНК репаративен синтез след ексцизията и отстраняването на участък от ДНК, съдържащ област на увреждане, индуцирано от химични вещества или физически агенти.
1.3. ПРИНЦИП НА МЕТОДА НА ИЗПИТВАНЕТО
НСД тестът in vivo с чернодробни клетки от бозайници показва ДНК репаративен синтез след ексцизията и отстраняването на участък от ДНК, съдържащ област на увреждане, индуцирано от химични вещества или физически агенти. Обикновено тестът се базира на включването на 3Н-ТdR в ДНК на чернодробни клетки, които имат ниска честота на клетки в S-фазата на клетъчния цикъл. Поглъщането на 3Н-ТdR обикновено се определя чрез авторадиография, тъй като този способ не е чувствителен към интерференция от страна на клетки в S-фаза, както например течното сцинтилационно броене.
1.4. ОПИСАНИЕ НА МЕТОДА
1.4.1. Подготовка
1.4.1.1. Избор на животински вид
Най-често се използват плъхове, въпреки че всеки подходящ вид от бозайници може да се използва. Следва да се вземат общо използваните лабораторни щамове на млади, здрави, пораснали животни. В началото на изследването вариациите в теглото на животните следва да е минимално и да не превишават ± 20 % от средното тегло на всеки пол.
1.4.1.2. Условия на отглеждане и хранене
Прилагат се общите условия в Общото въведение към част Б, въпреки че целта е влажността на въздуха да е от 50 до 60 %.
1.4.1.3. Подготовка на животните
Здрави, млади, пораснали животни се определят на произволен принцип за контролните и опитните групи. Клетките следва да се подредят така, че да се намалят до минимум евентуалните ефекти от разполагането им. На животните се дава уникална идентифакация и се държат в клетките поне пет дни преди началото на изследването, за да се аклиматизират към лабораторните условия.
1.4.1.4. Тествано вещество/приготвяне
Твърдите вещества за теста следва да се разтворят или суспендират в подходящи разтворители или носители и, ако е необходимо, да се разредят преди даване на дозата на животните. Течните вещества за теста могат да се дават директно или да се разредят преди дозиране. Следва да се използват пресни препарати на тестваното вещество, освен ако данните за стабилността му не показват, че може да се съхранява.
1.4.2. Условия за провеждане на теста
1.4.2.1. Разтворител/носител
Разтворителят/носителят не следва да има токсично въздействие с използваните нива на дозиране, а също така не следва да има съмнения за химическа реакция между него и тестваното вещество. Ако се използват различни от добре познатите разтворители/носители, включването им в теста следва да се подкрепи от данни за съвместимостта им. Препоръчва се, винаги когато е възможно, първо да се разглежда възможността за прилагането на воден разтворител/носител.
1.4.2.2. Контроли
Паралелни положителни и отрицателни контроли (разтворител/носител) следва да се включат във всяка отделно провеждана част от експеримента. С изключение на третирането с тестваното вещество, с животните в контролните групи следва да се борави по същия начин както с животните от опитните групи.
Положителните контроли следва да са вещества, за които се знае, че генерират НСД, когато се администрират на нива на експозиция, от които се очаква да се получи забележимо увеличение спрямо общия фон. Положителните контроли, които имат нужда от метаболична активация, следва да се използват с дози, предизвикващи умерена реакция (4). Дозите могат да са така избрани, че ефектите да са ясни, но да не разкриват непосредствено на четеца идентичността на кодираните предметни стъкла. Примерите за положителни контролни вещества включват:
|
Времетраене на вземането на проби
|
Вещество
|
САS №
|
ЕINECS №
|
|
Ранни (от 2 до 4 часа)
|
N-нитрозодиметиламин
|
62-75-9
|
200-249-8
|
|
Късни (от 12 до 16 часа)
|
N-2-флуоренилацетамид (2-AAF)
|
53-96-3
|
200-188-6
|
Могат да се използват други подходящи положителни контролни вещества. Приемливо е положителните контроли да се администрират по начин, различен от тестваното вещество.
1.5. ПРОЦЕДУРА
1.5.1. Брой и пол на животните
Следва да се използва адекватен брой животни, за да се вземе предвид естественото биологично вариране на реакцията към теста. Броят на животните следва да е минимум три анализируеми животни на група. Когато има натрупана значителна база данни от предишни изследвания, за паралелните отрицателни и положителни контролни групи се изисква само едно или две животни.
Ако в момента на изследването има налични данни от изследвания, проведени със същия вид и със същия начин на експозиция, показващи, че няма съществени разлики по отношение токсичността между половете, тогава тестването на един пол, за предпочитане мъжки, е достатъчно. Когато експозицията на хора към химикали може да е специфична в зависимост от пола, като например към някои фармацевтични агенти, тестът следва да се проведе с животни от подходящия пол.
1.5.2. График на третиране
Тестваните вещества по принцип се администрират като еднократно третиране.
1.5.3. Нива на дозиране
Нормално се използват две нива на дозиране. Най-високата доза се дефинира като доза, създаваща признаци на такава токсичност, че от по-високи нива на дозиране, базирани на същия режим, би могло да се очаква да доведат до леталност. По принцип по-ниската доза следва да бъде от 50 % до 25 % от високата доза.
Вещества със специфични биологични активности при ниски, нетоксични дози (като хормони и митогени) могат да бъдат изключения от критериите за определяне на дозата и следва да се оценяват за всеки конкретен случай. Ако се извършва изследване за обхват поради това, че няма подходящи данни в наличност, то следва да е в същата лаборатория, като се използват същият вид, щам, пол и режим на третиране както в главното изследване.
Най-високата доза може също да се дефинира като доза, показваща известни признаци на токсичност в черния дроб (напр. пикнотични ядра).
1.5.4. Граничен тест
Ако тест с едно ниво на дозиране от минимум 2 000 mg/kg телесно тегло при еднократно третиране или две третирания в един и същи ден не дава забележими токсични ефекти, а не би могла да се очаква генотоксичност на базата на данни от структурно свързани вещества, то тогава пълно изследване може да не се счита за необходимо. Очакваната експозиция на хора може да покаже необходимост в граничния тест да се използва по-високо ниво на дозиране.
1.5.5. Администриране на дозите
Тестваното вещество обикновено се дава със стомашна сонда, като се използва тръба или подходяща интубационна канюла. Други начини на експозиция са приемливи, ако могат да бъдат обосновани. Все пак интраперитонеалният път не се препоръчва, тъй като той би изложил черния дроб директно на въздействието на тестваното вещество, а не през системата на кръвообращението. Максималният обем течност, който може да се вкара еднократно със стомашна сонда или инжекция, зависи от големината на опитното животно. Обемът не следва да превишава 2m1/100g телесно тегло. Обеми, по-високите от тези, следва да се обосноват. С изключение на дразнещи или корозивни вещества, които нормално дават изострящи ефекти при по-високи концентрации, променливостта на тестовия обем следва да се сведе до минимум чрез регулиране на концентрацията с цел осигуряване на постоянен обем на всички нива на дозиране.
1.5.6. Подготовка на чернодробните клетки
Чернодробните клетки се подготвят от третирани животни нормално от 12 до 16 часа след дозиране. По принцип е необходимо по-ранно вземане на проба (нормално от два до четири часа след третиране), освен ако няма ясна положителна реакция на 12-ия до 16-ия час. Все пак може да се практикува вземане на проби и по друго време, когато това е обосновано на базата на токсикокинетични данни.
Краткосрочни култури на чернодробни клетки от бозайници обикновено се създават чрез обливане на черния дроб in situ с колагеназа, като прясно дисоциираните клетки се оставят да се прикрепят към подходяща повърхност. Чернодробните клетки от отрицателни контролни животни следва да имат жизнеспособност (5) минимум 50 %.
1.5.7. Определяне на НСД
Прясно изолираните чернодробни клетки от бозайници се инкубират обикновено със среда, съдържаща 3Н-ТdR, за подходящ период от време, напр. от три до осем часа. В края на инкубационното време средата следва да се отстрани от клетките, които след това се инкубират със среда, съдържаща голямо количество немаркиран тимидин, за да се намали неабсорбираната радиоактивност („студено отстраняване“). След това клетките се изплакват, фиксират и изсушават. При по-продължително инкубационно време студеното отстраняване може и да не е необходимо. Предметните стъкла се потопяват в авторадиографична емулсия, експонират се на тъмно (напр. държат се в хладилник от 7 до 14 дни, проявяват се, оцветяват се и експонираните сребърни зрънца се преброяват. От всяко животно се подготвят две до три предметни стъкла.
1.5.8. Анализ
Препаратът на предметното стъкло следва да съдържа достатъчно клетки с нормална морфология, за да може да се направи пълноценна оценка на НСД. Препаратите се изследват под микроскоп за признаци на явно изразена цитотоксичност (напр. пикноза, намалени нива на радиоактивно маркиране).
Предметните стъкла се кодират преди преброяването на зрънцата. Нормално 100 клетки се изследват от всяко животно от най-малко две предметни стъкла; база за отчитане на резултатите от по-малко от 100 клетки на животно следва да бъде обоснована.
Не се отчитат количествата зрънца за ядра в S-фаза, но пропорцията клетки в S- фаза може да се регистрира.
Количеството на 3Н-ТdR, въведено в ядрата и цитоплазмата на морфологично нормални клетки, по начина, по който се проявява чрез отлагането на сребърни зрънца, следва да се определи чрез подходящи методи.
2. ДАННИ
2.1. ОБРАБОТКА НА РЕЗУЛТАТИ
Следва да се представят индивидуални данни за всяко предметно стъкло и животно. В допълнение на това всички данни следва да се резюмират в таблица. Следва да се изчислят количествата на нето ядрените зрънца (НЯЗ) за всяка клетка, за всяко животно и всяка доза и време чрез изваждане на ЦЗ бройки от ЯЗ бройки. Ако се броят „клетки в репарация“, критериите за дефиниране на „клетки в репарация“ следва да се обосноват и да се базират на паралелни отрицателни контролни данни или на такива от предишни изследвания. Цифровите резултати могат да се оценяват чрез статистически методи. Ако се използват, статистическите тестове следва да се подберат и обосноват преди провежедане на изследването.
2.2. ОЦЕНКА И ТЪЛКУВАНЕ НА РЕЗУЛТАТИТЕ
Примерите на критерии за положителни/отрицателни реакции включват :
|
положителни
|
i)
|
НЯЗ стойности над зададен праг, обоснован на базата на лабораторни данни от предишни изследвания; или
|
|
|
ii)
|
НЯЗ стойности, значително по-високи от паралелни контроли;
|
|
отрицателни
|
i)
|
НЯЗ стойности в границите на/под контролен праг от предишни изследвания; или
|
|
|
ii)
|
НЯЗ стойности, незначително по-високи от паралелни контроли.
|
Следва да се разгледа биологическата значимост на данните: т.е. параметри като изменчивост между животните, взаимодействие между съотношението доза-реакция и цитотоксичност следва да се вземат под внимание. При оценката на резултатите от теста като помощно средство биха могли да се използват статистически методи. Статистическата значимост не следва да е единственият решаващ фактор за положителна реакция.
Въпреки че повечето експерименти дават ясно положителни или отрицателни резултати, в редки случаи наборът данни изключва правенето на категорична преценка за активността на тестваното вещество. Резултатите могат да останат двузначни или под въпрос, независимо от това колко пъти е повторен опитът.
Положителен резултат от теста за нерепаративен синтез на ДНК (НСД) с чернодробни клетки от бозайници in vivo показва, че увреждането на ДНК с чернодробни клетки от бозайници in vivo може да се репарира чрез нерепаративен синтез на ДНК in vivo. Отрицателният резултат показва, че при условията за провеждане на теста тестваното вещество не индуцира ДНК увреждане, което се открива с настоящия тест.
Следва да се обсъди вероятността тестуваното вещество да достигне общото кръвообращение или конкретно прицелната тъкан (напр. системна токсичност).
3. ДОКЛАДВАНЕ
ДОКЛАД ЗА ТЕСТА
Докладът за теста трябва да включва следната информация:
|
|
Разтворител/носител:
|
—
|
обосновка за избора на носител,
|
|
—
|
разтворимост и стабилност на тестваното вещество в разтворител/носител, ако са известни.
|
|
|
|
Опитни животни:
|
—
|
брой, възраст и пол на животните,
|
|
—
|
източник, условия на отглеждане, начин на хранене и др.,
|
|
—
|
индивидуално тегло на животните в началото на теста, в т.ч. обхват на телесното тегло, средно и стандартно отклонение за всяка група.
|
|
|
|
Условия за провеждане на теста:
|
—
|
положителни и отрицателни носител/разтворител контроли,
|
|
—
|
данни от изследването за установяване на обхват, ако е проведено,
|
|
—
|
основна причина за избора на нивото на дозата,
|
|
—
|
подробности за приготвянето на тестваното вещество,
|
|
—
|
подробности за администрирането тестваното вещество,
|
|
—
|
основна причина за начина на администриране,
|
|
—
|
методи за проверка дали тестваният агент е достигнал общото кръвообращение или тъканта, която е обект на изследването, ако са приложими,
|
|
—
|
преминаване от концентрация (ррm) на тестваното вещество в храната/питейната вода към действителната доза (mg/kg телесно тегло), ако е приложимо,
|
|
—
|
подробности за качеството на храната и водата,
|
|
—
|
подробно описание на графиците на третиране и вземане на проби,
|
|
—
|
методи на измерване на токсичността,
|
|
—
|
метод на подготовка на чренодробни клетки и култура,
|
|
—
|
използван авторадиографичен способ,
|
|
—
|
брой на подготвените предметни стъкла и брой на отчетените клетки,
|
|
—
|
критерии за считане на изследванията положителни, отрицателни или двузначни.
|
|
|
|
Резултати:
|
—
|
средни стойности на индивиудално предметно стъкло, животно и група за ядрени зрънца, цитоплазмени зрънца и нето ядрени зрънца,
|
|
—
|
взаимоотношение доза-реакция, където е възможно,
|
|
—
|
статистическа оценка, ако има такава,
|
|
—
|
признаци на токсичност,
|
|
—
|
паралелни отрицателни (разтворител/носител) и положителни контролни данни,
|
|
—
|
отрицателни (разтворител/носител) от предишни изследвания и положителни контролни данни с обхват, средни стойности и стандартни отклонения,
|
|
—
|
брой на „клетки в репарация“, ако е определен,
|
|
—
|
брой клетки в S-фаза, ако е определен,
|
|
—
|
жизнеспособност на клетките.
|
|
|
|
Обсъждане на резултатите.
|
4. Препратки
|
(1)
|
Ashby, J., Lefevre, P. A., Burlinson, B. and Penman, M. G. (1985), An Assessment of the In Vivo Rat Hepatocyte DNA Repair Assay, Mutation Res., 156, pp. 1—18.
|
|
(2)
|
Butterworth, B. E., Ashby, J., Bermudez, E., Casciano, D., Mirsalis, J., Probst G. and Williams, G. (1987), A Protocol and Guide for the In Vivo Rat Hepatocyte DNA-Repair Assay, Mutation Res., 189, pp. 123—133.
|
|
(3)
|
Kennelly, J. C, Waters, R., Ashby, J., Lefevre, P. A., Burlinson B., Benford, D. J., Dean, S. W. and Mitchell I. de G. (1993), In Vivo Rat Liver UDS Assay, in: Kirkland D. J. and Fox M., (eds.), Supplementary Mutagenicity Tests: UKEM Recommended Procedures. UKEMS Subcommittee on Guidelines for Mutagenicity Testing Report. Part II revised, Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, pp. 52—77.
|
|
(4)
|
Madle, S., Dean, S. W., Andrae, U., Brambilla, G., Burlinson, B., Doolittle, D. J., Furihata, C, Hertner, T., McQueen, C. A. and Mori, H. (1993), Recommendations for the Performance of UDS Tests In Vitro and In Vivo, Mutations Res., 312, pp. 263—285.
|
|
(5)
|
Fautz, R., Hussain, B., Efstathiou, E. and Hechenberger-Freudl, C. (1993), Assessment of the Relation Between the Initital Viability and the Attachment of Freshly Isolated Rat Hepatocytes Used for the In Vivo/In Vitro DNA Repair Assay (UDS), Mutation Res., 291, pp. 21—27.
|
|
(6)
|
Mirsalis, J. C, Tyson, C. K. and Butterworth, В. Е. (1982), Detection of Genotoxic Carcinogens in the In Vivo/In Vitro Hepatocyte DNA Repair Assay, Environ Mutagen, 4, pp. 553—562.
|
Б. 40. IN VITRO КОЖНА КОРОЗИЯ: ТРАНСКУТАННО ИЗМЕРВАНЕ НА ЕЛЕКТРИЧЕСКОТО СЪПРОТИВЛЕНИЕ НА КОЖАТА (TER)
1. МЕТОД
Този метод за измерване е еквивалентен на OECD TG 430 (2004).
1.1. ВЪВЕДЕНИЕ
Кожната корозия се отнася до причиняването на необратими тъканни увреждания на кожата вследствие на прилагането на материал на изпитване (както е дефинирано от Глобалната хармонизирана система за класификация и етикетиране на химични вещества и смеси (GHS) (1). Този метод осигурява процедура, при която оценката на корозивността не се извършва върху живи животни.
Оценката на кожната корозивност обикновено включва използване на лабораторни животни (2). Загрижеността за болката и страданието на животните, подложени на тази процедура, се разглежда в ревизирания метод на изпитване Б.4, позволяващ определянето на корозията чрез използването на алтернативни, in vitro методи, избягващи болката и страданието.
Първата стъпка към дефинирането на алтернативните изпитвания, които биха могли да се използват за изпитване за кожна корозивност за законодателни цели, бе провеждането на предварителни валидиращи изследвания (3). След това бе проведено официалното валидиращо изследване на in vitro методите за оценка на кожната корозия (4)(5) (6)(7)(8). Резултатът от тези изследвания и друга публикувана литература доведе до препоръката да бъдат използвани следните изпитвания при оценката in vivo на кожната корозивност (9)(10)(11): изпитване върху модел на човешка кожа (виж също метод на изпитване Б.40A и транскутанното изпитване за електрическо съпротивление (този метод).
Валидиращото изследване и други публикувани изследвания сочат, че на транскутанното изпитване за електрическо съпротивление (TER) при плъхове (12)(13) може надеждно да разграничи познати кожни корозиви и некорозиви (5)(9).
Изпитването, описано в този метод, позволява идентифицирането на корозивни химични вещества и смеси. Освен това, то дава възможност за идентифициране на некорозивните вещества и смеси, когато това се подкрепя от доказателствено определяне с помощта на друга съществуваща информация (например рН, структурно-активни взаимовръзки, човешки и/или животински данни) (1)(2)(11)(14). То не осигурява информация за кожните дразнения, нито пък ни позволява да направим подкатегоризация на корозивните вещества, както ни разрешава Глобалната хармонизирана система за класификация (GHS) (1).
За пълната оценка на локалните кожни ефекти се препоръчва, след еднократно дермално излагане да се следва последователна стратегия на изпитване, както е посочено в приложението към метод на изпитване Б.4 (2) и както се изисква от Глобалната хармонизирана система (1). Тази стратегия на изпитване включва провеждането на изпитване in vitro за корозия на кожата (както е описано в този метод) и кожно раздразнение преди да се обмисля изпитване върху живи животни.
1.2. ОПРЕДЕЛЕНИЕ
Кожна корозия
in vivo
е причиняването на необратимо увреждане на кожата, а именно, видима некроза през епидермиса и вътре в дермиса, вследствие прилагането на вещество за изпитване за период до четири часа. Типични корозивни реакции са язви, кървене, кървящи струпеи и до края на наблюдението, продължаващо 14 дена, обезцветяване, дължащо се на избледняване на кожата, цялостни повърхности на алопеция и белези. Хистопатологията също трябва да се вземе под внимание при оценката на спорните лезии.
Транскутанното електрическо съпротивление (TER) е мярка за електрическия импеданс на кожата, измерен като съпротивление в кОм (kilo Ohms). Един прост и сигурен метод за оценка на бариерната функцията чрез регистриране на преминаването на йони през кожата с помощта на измервателния мост на Уитстоун.
1.3. РЕФЕРЕНТНИ ВЕЩЕСТВА
Таблица 1
Референтни химически вещества
|
Име
|
EINECS No
|
CAS No
|
|
|
1,2-Диаминопропан
|
201-155-9
|
78-90-0
|
Силно корозивен
|
|
Акрилна киселина
|
201-177-9
|
79-10-7
|
Силно корозивен
|
|
2-терт. бутилфенол
|
201-807-2
|
88-18-6
|
Корозивен
|
|
Калиев хидроксид (10 %)
|
215-181-3
|
1310-58-3
|
Корозивен
|
|
Сярна киселина (10 %)
|
231-639-5
|
7664-93-9
|
Корозивен
|
|
Октанова киселина (каприлна киселина)
|
204-677-5
|
124-07-02
|
Корозивен
|
|
4-амино-1,2,4-триазол
|
209-533-5
|
584-13-4
|
Некорозивен
|
|
Еугенол
|
202-589-1
|
97-53-0
|
Некорозивен
|
|
Фенетил бромид
|
203-130-8
|
103-63-9
|
Некорозивен
|
|
Тетрахлоретилен
|
204-825-9
|
27-18-4
|
Некорозивен
|
|
Изостеаринова киселина
|
250-178-0
|
30399-84-9
|
Некорозивен
|
|
4-(метилдио)-бензалдехид
|
222-365-7
|
3446-89-7
|
Некорозивен
|
Повечето от химическите вещества, изброени по-горе, са взети от списъка на химикали, избрани за международното валидиращо изследване на ECVAM (4). Техният избор е въз основа на следните критерии:
|
i)
|
равен брой корозивни и некорозивни вещества;
|
|
ii)
|
търговско налични вещества, обхващащи повече от съответните химични класове;
|
|
iii)
|
включване на силно корозивни, както и на по-малко корозивни вещества, за да се позволи разделяне, въз основа на корозивната сила;
|
|
iv)
|
избор на химически вещества, с които да може да се работи в лабораторни условия, без да има излагане на други сериозни рискове, освен на корозивност.
|
1.4. ПРИНЦИП НА МЕТОДА НА ИЗПИТВАНЕ
Материалът на изпитването се прилага за период до 24 часа върху епидермалните повърхности на кожните дискове в опитната постановка с две отделения, при която кожните дискове функционират като преграда между двете отделения. Кожните дискове се вземат от хуманно убити плъхове на възраст 28—30 дни. Корозивните материали се идентифицират по способността си да предизвикват загуба на нормалната цялост на stratum corneum и бариерната функция, която се изразява като намаление на TER под нивото на прага (12). За плъховете за гранична TER се избира стойност от 5 kΏ, като това се основава на голям брой данни за широк кръг химически вещества, при които по-голямата част от стойностите са или определено над (често > 10 kΩ), или доста под (често < 3 kΩ) тази стойност (12). Като цяло, материалите, които не са корозивни, но са дразнещи или недразнещи при животните, не намаляват TER под тази референтна стойност. Нещо повече, използването на кожни препарати или друга апаратура може да промени граничната стойност, като изисква допълнително валидиране.
Етап за фиксиране на оцветител е включен в процедурата за изпитване за потвърждение на положителните резултати от TER, включващи стойности около 5 kΩ. Етапът с фиксиране на оцветител определя дали увеличаването на йонната проницаемост се дължи на физическо разрушаване на stratum corneum. Методът TER, използващ кожа от плъхове, показва, че с него могат да се правят предвиждания за in vivo корозивността при зайци, оценявана с помощта на метода за изпитване Б.4 (2). Трябва да се отбележи, че изпитването in vivo при зайци е високо консервативен по отношение на кожната корозивност и дразненето на кожата, когато се сравни с изпитването върху модел на човешка кожа (15).
1.5. ОПИСАНИЕ НА МЕТОДА НА ИЗПИТВАНЕ
1.5.1. Животни
Плъховете са избраният биологичен вид, тъй като чувствителността на кожата им към химическите вещества в това изпитване е била демонстрирана преди това (10). Възрастта (когато се взема кожата) и породата на плъха са особено важни, за да е сигурно, че фоликулите на козината им са в латентна фаза преди да започне растежа на козината.
Дорзалната и странична козина от млади, на възраст около 22 дни, мъжки и женски плъхове (от породата Wistar или друга сравнима), внимателно се отстранява с малки пинцети. После животните се измиват с бавно бърсане, като захваната повърхност се потапя в антибиотичен разтвор (съдържащ например стрептомицин, пеницилин, хлорамфеникол и амфотерицин, при концентрации, ефективни за инхибирането на бактериалния растеж). Животните се измиват с антибиотици отново на третия или четвъртия ден след първото измиване и се използват до три дни след второто миене, когато stratum corneum е възстановен от отстраняването на козината.
1.5.2. Подготовка на кожните дискове
Животните са убити по хуманен начин на възраст 28—30 дена; тази възраст е критична. Дорзо-латералната кожа на всяко едно животно се отстранява и от нея се премахва излишната подкожна мазнина чрез внимателно обелване и отделяне от кожата. Кожните дискове, всеки от които с диаметър от приблизително 20 mm, се отстраняват. Кожата може да се съхрани, преди да се използват дисковете, когато е показано, че положителните и отрицателни контролни данни са еквивалентни на тези, получени от прясна кожа.
Всеки кожен диск се поставя над единия от краищата на PTFE (политетрафлуороетиленова) тръба, като се внимава епидермалната повърхност да бъде в контакт с тръбата. Гумен О-пръстен се прикрепва с натиск в края на тръбата, за да държи кожата, без тя да мърда, а излишната тъкан се изрязва. Размерите на тръбата и О-пръстена са показани на фигура 2. Гуменият О-пръстен внимателно се запечатва в края на PTFE тръбата с петролно желе. Тръбата се поддържа от пружинена щипка вътре в рецепторната камера, съдържаща разтвор MgSO4(154 mM) (фигура 1). КОЖНИЯТ ДИСК трябва да бъде напълно потопен в разтвора MgSO4. От един единствен плъх могат да се получат 10—15 кожни диска.
Преди да започне изпитването, електрическото съпротивление на двата кожни диска се измерва като процедура за качествен контрол за всяка животинска кожа. И двата диска трябва да показват стойности на съпротивление по-високи от 10 KΩ, за да могат останалите дискове да се използват за изпитването. Ако стойността на съпротивлението е по-ниска от 10 KΩ, останалите дискове от тази кожа, не могат да се използват.
1.5.3. Прилагане на изпитването и контролни вещества
За всяко изследване трябва да се използват едновременно положителни и отрицателни контроли, за да се осигурят адекватни резултати от експерименталния модел. Трябва да се използват кожни дискове от едно единствено животно. Предлаганите положителни и отрицателни контролни вещества са съответно 10 М солна киселина и дестилирана вода.
Течните вещества на изпитване (150 μL) се прилагат равномерно върху епидермалната повърхност вътре в тръбата. Когато се изпитват твърди материали, достатъчно количество от него се разпределя равномерно по диска, за да се гарантира, че е покрита пялата повърхност на епидермиса. Добавя се дейонизирана вода (150 μL) върху твърдото вещество и тръбата леко се разклаща. За да се постигне максимален контакт с кожата, може да се наложи твърдото вещество да се нагрее до 30 oС, за се разтопи или омекне изпитваното вещество, или пък да се разтроши и да стане на гранули или на прах.
За всяко изпитване се използват три кожни диска и контролно вещество. Изпитваните вещества се прилагат за период от 24 часа при температура 20—23 oС. Изпитваното вещество се отстранява чрез измиване със струя течаща вода до 30 oС, докато повече не може да се отстранява никакъв материал.
1.5.4. Измервания на TER
Кожният импеданс се измерва, като се измерва TER с помощта на променлив ток с ниско напрежение чрез измервателния мост на Уитстоун (13). Общите спецификации на измервателния мост са 1—3 Volt работно напрежение, синусоидално или правоъгълно променливо напрежение от 50—1 000 Hz и измервателен обхват от поне 0,1—30 KΩ. Измервателният мост се използва за валидиране на измерени индуктивност, капацитет, съпротивление до стойности от 2 000 Н, 2 000 μF, и 2 MΩ, съответно при честоти от 100 Hz или 1 kHz, като се използват серии от паралелни стойности. За целите на изпитването TER за корозивност, измерванията се записват като съпротивление, при честота от 100 Hz и като се използват серийни стойности. Преди измерването на електрическото съпротивление се намалява повърхностното напрежение на кожата, като се добавя достатъчен обем 70 % етанол, за да се покрие епидермиса. След няколко секунди етанолът се отстранява от тръбата и след това тъканта се хидратира чрез добавяне на 3 ml разтвор на MgSO4 (154 mM). Електродите на измервателния мост се поставят от двете страни на кожните дискове, за да може да се измери съпротивлението в kΩ/кожен диск (фигура 1). Измеренията и дължината на електродите под крокодилските щипки са показани на фигура 2. Щипката, прикрепена към вътрешния електрод, се поставя върху горния край на тръбата от PTFE по време на измерването на съпротивлението, за да може достатъчна дължина на електрода да бъде потопена в разтвора на MgSO4. Външният електрод се позиционира вътре в рецепторната камера, така че да се опре на дъното на камерата. Разстоянието между пружинената щипка и дъното на PTFE тръбата се поддържа постоянно (фигура 2), тъй като това разстояние оказва влияние върху получената стойност на съпротивлението. Следователно, разстоянието между вътрешния електрод и кожния диск трябва да бъде постоянно и минимално (1—2 mm).
Ако измерваната стойност на съпротивлението е по-висока от 20 kΩ, това може да се дължи на отлагането на остатъци от веществото на изпитване по епидермалната повърхност на кожния диск. Може да се предприеме опит за по-нататъшното отстраняване на отлагането, например като се запечата PTFE тръбата с палец в ръкавица и като се разклати за около 10 секунди; разтворът на MgSO4 се изхвърля и измерването на резистентността се повтаря с пресен разтвор.
Свойствата и размерите опитната постановка и опитната процедура могат да повлияят на получените стойности на TER . Корозивният праг от 5 kΩ е определен въз основа на данни, получени от специфичната опитна постановка и процедура, описани в този метод. Различни прагове и контролни стойности могат да бъдат прилагани, ако условията на изпитване се променят или се използва друга опитна постановка. Ето защо, е необходимо да се калибрира методологията и праговите стойности на съпротивлението, като се изпитат серии референтни стандарти, избрани от използваните химически вещества при валидиращото изследване (4)(5), или химични класове, подобни на изследваните. Набор от подходящи референтни химически вещества е показан в таблица 1.
1.5.5. Методи за фиксиране на оцветител
Излагането на определени некорозивни материали може да доведе до намаляване на съпротивлението под границата от 5 kΩ, като това позволява преминаването на йоните през stratum corneum, като по този начин се намалява електрическото съпротивление (5). Например, неутралните неорганични вещества и веществата, които имат повърхностно-активни свойства (включително детергенти, емулсификатори и други повърхностноактивни вещества) могат да отстранят кожните мазнини, като по този начин направят бариерата по-лесно проницаема за йоните. Така, ако стойностите TER на изпитваните вещества са по-ниски или около 5 kΩ при липса на видимо увреждане, трябва да се направи оценка на проникването на оцветяващото вещество върху контролните и третираните тъкани, за да се определи дали получените TER стойности са в резултат на повишена кожна проницаемост или на кожна корозия (3)(5). Във втория случай, когато stratum corneum е разкъсан, когато се приложи към кожната повърхност бързо, оцветителят сулфорходамин В (sulforhodamine В) прониква и оцветява подлежащата тъкан. Този конкретен оцветител е устойчив на широк обхват от химически вещества и не се влияе от процедурата на екстракция, описана по-долу.
1.5.5.1. Приложение и отстраняване на оцветителя сулфорходамин В (sulforhodamine B)
След провеждане на измерването на TER магнезиевият сулфат се отстранява от тръбата и кожата се изследва внимателно за видими увреждания. Ако няма голямо очевидно увреждане оцветителят сулфорходамин В (Кисело червено 52; C.I. 45100; EINECS номер 222-529-8; CAS номер 3520-42-1), 150 μL от 10 % (w/v) разтвор в дестилирана вода, се нанася върху епидермалната повърхност на всеки кожен диск за период от 2 часа. Тези кожни дискове след това се измиват в течаща вода при стайна температура, приблизително за 10 секунди, за да се премахне излишния/несвързан оцветител. Всеки кожен диск внимателно се отстранява от PTFE тръбата и се поставя в контейнер (например 20 mL стъклен прозрачен контейнер), съдържащ дейонизирана вода (8 mL). Контейнерите леко се разклащат за 5 минути, за да се отстрани всякакъв допълнителен несвързан оцветител. Тази процедура на изплакване се повтаря, след което кожните дискове се отстраняват и се поставят в контейнери, съдържащи 5 ml от 30 % (w/v) натриев додецил сулфат (SDS) в дестилирана вода и се инкубират за една нощ при температура 60 oС.
След инкубирането веки кожен диск се отстранява и изхвърля, а останалата част от разтвора се центрофугира около 8 минути при 21 oС (относителна центробежна сила ~175 х g). Проба от 1 ml от супернатанта се разтваря в 1 от 5 (v/v) (т.е 1 mL + 4 mL) c 30 % (w/v) SDS в дестилирана вода. Оптичната плътност (OD) на разтвора се измерва при 565 nm.
1.5.5.2. Изчисляване на съдържанието на оцветител
Съдържанието на оцветителя сулфорходамин В се изчислява от стойностите OD (5) (моларен коефициент на поглъщане на оцветителя сулфорходамин В при 565 nm = 8,7 х 104; молекулно тегло = 580). Съдържанието на оцветителя се определя за всеки кожен диск с помощта на калибрираща крива и тогава се изчислява средното съдържание на оцветител при тези потвърдителни експерименти.
2. ДАННИ
Стойностите на съпротивлението (kΩ) и средните стойности на съдържанието на оцветител (μg/диск), където има такъв, за изпитвания материал, както за положителните, така и за отрицателните контроли, трябва да се докладват в таблична форма (данни от индивидуалното изпитание и средните стойности ± S.D.), включително данни за потвърдителни/повторни експерименти, средни и индивидуални стойности.
2.1. ИНТЕРПРЕТИРАНЕ НА РЕЗУЛТАТИТЕ
Средните резултати за TER се приемат, ако едновременните положителни и отрицателни контролни стойности попадат в допустимите граници за метода в лаборатория за изпитване. Допустимите граници на съпротивлението за методологията и опитната постановка, описани по-горе, са дадени в следната таблица:
|
Контрола
|
Вещество
|
Съпротивление (к)
|
|
Положителна
|
10М Солна киселина
|
0,5—1,0
|
|
Отрицателна
|
Дестилирана вода
|
10—25
|
Средните резултати при оцветяване се приемат, при условие че едновременните контролни стойности попадат в допустимите граници за метода. Предлаганите приемливи обхвати на съдържанието на оцветител за контролните вещества за методологията и опитната постановка, описани по-горе, са дадени в следната таблица:
|
Контрола
|
Вещество
|
Съдържание на оцветител (μg/диск)
|
|
Положителна
|
10М Солна киселина
|
40—100
|
|
Отрицателна
|
Дестилирана вода
|
15—35
|
Изпитваното вещество се счита за некорозивно спрямо кожата:
|
i)
|
ако средната стойност на TER, получена за изпитваното вещество, е по-голяма от 5 kΩ, или
|
|
ii)
|
средната стойност на TER е по-малка или равна на 5 kΩ, и
|
—
|
кожният диск не показва никакви видими увреждания, и
|
|
—
|
средното съдържание на оцветител в диска е доста под средното съдържание на оцветител в 10М НСl положителна контрола, получена едновременно.
|
|
Изпитваното вещество се счита за корозивно спрямо кожата:
|
i)
|
ако средната стойност на TER е по-ниска или равна на 5 kΩ и кожният диск е очевидно увреден, или
|
|
ii)
|
средната стойност на TER е по-малка или равна на 5 kΩ, и
|
—
|
кожният диск не показва никакви видими увреждания, но
|
|
—
|
средното съдържание на оцветител в диска е по-голямо или равно на средното съдържание на оцветител в 10М НСl положителна контрола, получена едновременно.
|
|
3. ДОКЛАДВАНЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Протоколът от изпитването трябва да включва следната информация:
|
|
Изпитвани и контролни вещества:
|
—
|
химичното наименование (наименования) като тези по IUPAC или CAS, CAS номер, ако е известен;
|
|
—
|
чистота и състав на веществото или препарата (в процент от теглото) и физична природа;
|
|
—
|
физико-химични свойства като физично състояние, рН, стабилност, разтворимост във вода, имащи отношение за провеждане на изследването;
|
|
—
|
обработване на изпитваните/контролните вещества преди изпитването, ако има такова (например загряване, смилане);
|
|
—
|
стабилност, ако е известна.
|
|
|
|
Лабораторни животни:
|
—
|
възраст на животните, когато са използвани като донори;
|
|
—
|
източник, условия на отглеждане, хранене и др.;
|
|
—
|
подробности по подготовката на кожата.
|
|
|
|
Условия на изпитване:
|
—
|
калибриращи криви за опитната постановка;
|
|
—
|
калибриращи криви за изпитването на оцветяване;
|
|
—
|
подробности по използваната процедура на изпитване за измервания на TER ;
|
|
—
|
подробности по използваната процедура на изпитване за определяне на оцветяването, ако случаят е такъв;
|
|
—
|
описание на всяко изменение на процедурата на изпитване;
|
|
—
|
описание на използваните критерии за оценка.
|
|
|
|
Резултати:
|
—
|
представяне в табличен вид на данните от изпитването за TER и за фиксиране на оцветител (ако случая е такъв) за отделните животни и отделните кожни проби;
|
|
—
|
описание на всички наблюдавани ефекти.
|
|
|
|
Обсъждане на резултатите.
|
4. ПРЕПРАТКИ
|
1.
|
OECD (2001) Harmonised Integrated Classification System for Human Health and Environmental Hazards of Chemical Substances and Mixtures. OECD Series on Testing and Assessment Number 33. ENV/JM/MONO(2001)6, Paris. http://www.olis.oecd.org/olis/2001doc.nsf/LinkTo/env-jm-mono(2001)6.
|
|
2.
|
Testing Method B.4. Acute Toxicity: Dermal Irritation/Corrosion.
|
|
3.
|
Botham, P.A., Chamberlain, M., Barratt, M.D., Curren, R.D., Esdaile, D.J., Gardner, J.R., Gordon, V.C., Hildebrand, B., Lewis, R.W., Liebsch, M., Logemann, P., Osborne, R., Ponec, M., Regnier, J.F., Steiling, W., Walker, A.P., and Balls, M. (1995). A prevalidation study on in vitro skin corrosivity testing. The report and recommendations of ECVAM Workshop 6. ATLA 23, 219—255.
|
|
4.
|
Barratt, M.D., Brantom, P.G., Fentem, J.H., Gerner, I., Walker, A.P., and Worth, A.P. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 1. Selection and distribution of the test chemicals. Toxic. in Vitro 12, 471—482.
|
|
5.
|
Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhütter, H.-G., and Liebsch, M. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxic. in Vitro 12, 483— 524.
|
|
6.
|
OECD (1996). Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods, 62pp.
|
|
7.
|
Balls, M., Blaauboer, B.J., Fentem. J.H., Bruner. L., Combes, R.D., Ekwall, B., Fielder. R.J., Guillouzo, A., Lewis, R.W., Lovell, D.P., Reinhardt, C.A., Repetto, G., Sladowski. D., Spielmann, H., and Zucco, F. (1995). Practical aspects of the validation of toxicity test procedures. The report and recommendations of ECVAM workshops. ATLA 23, 129—147.
|
|
8.
|
ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (1997). Validation and Regulatory Acceptance of Toxicological Test Methods. NIH Publication No. 97-3981. National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/docs/guidelines/validate.pdf
|
|
9.
|
ECVAM (1998). ECVAM News & Views. ATLA 26, 275—280.
|
|
10.
|
ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (2002). ICCVAM evaluation of EpiDermTM, EPISKINTM (EPI-200), and the Rat Skin Transcutaneous Electrical Resistance (TER) assay: In Vitro test methods for assessing dermal corrosivity potential of chemicals. NIH Publication No. 02-4502. National Toxicology Program Interagency Center for the Evaluation of Alternative Toxicological Methods, National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/methods/epiddocs/epis_brd.pdf.
|
|
11.
|
OECD (2002) Extended Expert Consultation Meeting on The In Vitro Skin Corrosion Test Guideline Proposal, Berlin, 1st - 2nd November 2001, Secretariat's Final Summary Report, 27th March 2002, OECD ENV/EHS, available upon request from the Secretariat
|
|
12.
|
Oliver, G.J.A., Pemberton, M.A., and Rhodes, C. (1986). An in vitro skin corrosivity test -modificationsand validation. Fd. Chem. Toxicol. 24, 507—512.
|
|
13.
|
Botham, P.A., Hall, T.J., Dennett, R., McCall, J.C., Basketter, D.A., Whittle, E., Cheeseman, M., Esdaile, D.J., and Gardner, J. (1992). The skin corrosivity test in vitro: results of an interlaboratory trial. Toxic. in vitro 6, 191—194.
|
|
14.
|
Worth AP, Fentem JH, Balls M, Botham PA, Curren RD, Earl LK, Esdaile DJ, Liebsch M (1998). An Evaluation of the Proposed OECD Testing Strategy for Skin Corrosion. ATLA 26: 709—720.
|
|
15.
|
Basketter, D.A., Chamberlain, M., Griffiths, H.A., Rowson, M., Whittle, E., York, M. (1997). The classification of skin irritants by human patch test. Fd. Chem. Toxicol. 35, 845—852.
|
|
16.
|
Oliver G.J.A, Pemberton M.A and Rhodes C. (1988). An In Vitro model for identifying skin-corrosive chemicals. I. Initial Validation. Toxic. in Vitro. 2, 7—17.
|
Фигура 1
Опитна постановка за изпитване на ТЕR върху кожа от плъхове

Фигура 2
Размери на използваните политетрафлуороетиленова (РTFЕ) и рецепторни тръби и електроди
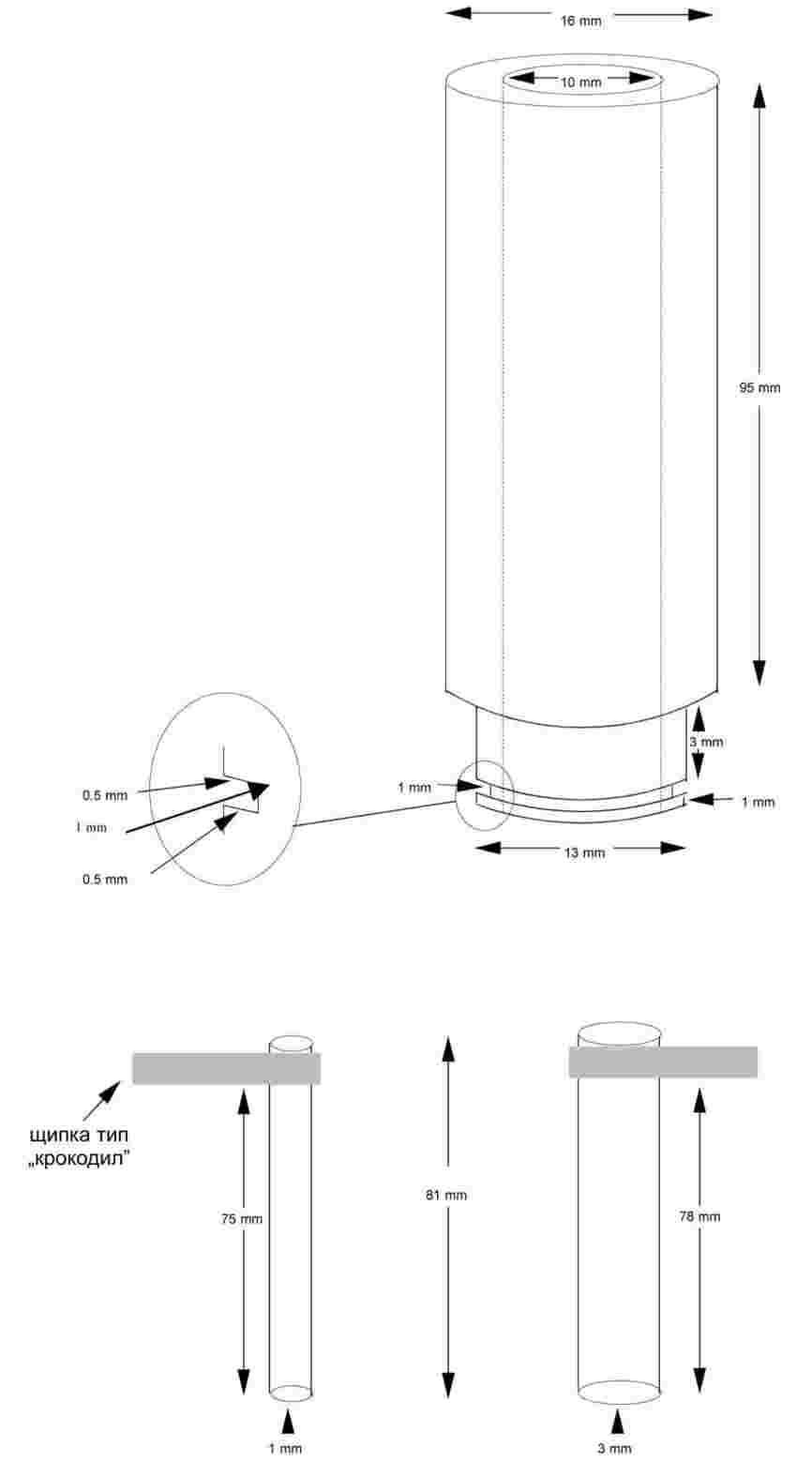
Критични точки на опитната постановка, показана по-горе:
|
—
|
вътрешният диаметър на тръбата РТFЕ,
|
|
—
|
дължина на електродите, подходяща за РТFЕ тръбата и рецепторната тръба, такава, че кожният диск да не се докосва от електродите и такава, че електрод със стандартна дължина да е в контакт с разтвора на МgSО4;
|
|
—
|
количеството разтвор на МgSО4 в рецепторната тръба трябва да образува такава дълбочина, че да съответства на нивото в РТFЕ тръбата, както е показано на фигура 1;
|
|
—
|
кожният диск трябва да бъде достатъчно добре закрепен за РТFЕ тръбата, така че електрическото съпротивление вярно да съответства на свойствата на кожата.
|
Б. 40А. IN VITRO КОЖНА КОРОЗИЯ: ИЗПИТВАНЕ ВЪРХУ МОДЕЛ НА ЧОВЕШКА КОЖА
1. МЕТОД
Този метод на изпитване е еквивалентен на ОЕСD ТG 431 (2004).
1.1. ВЪВЕДЕНИЕ
Кожната корозия се отнася до причиняването на необратими увреждания на тъканта на кожата вследствие прилагането на материал за изпитване (както се дефинира от Глобалната хармонизирана система за класификация и етикетиране на химични вещества и смеси (GHS) (1). Този метод на изпитване не изисква използването на живи животни или животински тъкани за оценката на корозивността на кожата.
Оценката на корозивността на кожата обикновено включва използването на лабораторни животни (2). Загрижеността за болката и страданието при прилагането на тази процедура е разгледана в ревизирания метод на изпитване Б.4, който позволява определянето на кожната корозия с помощта на алтернативни in vitro методи, с които се избягва болката и страданието на животните.
Първата стъпка към определянето на алтернативните тестове, които биха могли да се приложат за изпитване на кожната корозивност за регулаторни цели, беше да се проведат предварителни валидиращи изследвания (3). След това се направи официално проучване на методите in vitro за оценката на кожната корозия (4)(5) (6)(7)(8). Резултатът от тези изследвания и от други публикувана литература (9) доведе до препоръката да се използват следните изпитвания за оценката in vitro на кожната корозивност (10)(11)(12)(13): изпитването върху модел на човешка кожа (този метод) и транскутанното изпитване за електрическо съпротивление (виж метод на изпитване Б.40).
Валидиращите изследвания сочат, че изпитванията, включващи модели на човешка кожа (3)(4)(5)(9), са в състояние надеждно да разграничат между познати корозиви на кожата и некорозиви. Протокола от изпитването може да даде също индикация за разграничение между тежки и по-леки корозиви за кожата.
Изпитването, което се описва в този метод, позволява да се идентифицират корозивните химични вещества и смеси. Той позволява също и понататъшното идентифициране на некорозивните вещества и смеси, когато това се подкрепи от доказано определяне с помощта на съществуващата информация (например рН, структурно-активни връзки, човешки и/или животински данни) (1)(2)(13)(14). Изпитването обикновено не осигурява адекватна информация за кожните раздразнения, нито пък позволява подкатегоризацията на корозивните вещества, както е позволено в Глобалната хармонизирана система за класификация и етикетиране на химични вещества и смеси (GНS) (1).
За пълната оценка на локалните кожни ефекти след еднократно излагане на кожата се препоръчва да се спазва стратегията за последователно изпитване, която е приложена към тестови метод Б.4 (2) и която е описана в Глобалната хармонизирана система (GНS) (1). Тази стратегия на изпитване включва провеждането на in vitro тестове за кожна корозия (както са описани в този метод) и кожно раздразнение преди да се обсъжда изпитване при живи животни.
1.2. ОПРЕДЕЛЕНИЯ
Кожна корозия in vitro
: е причиняването на необратимо увреждане на кожата, а именно видима некроза през епидермиса и вътре в дермиса, вследствие прилагането на изпитвано вещество за период до 4 часа. Типичните корозивни реакции са язви, кървене, кървящи струпеи, и до края на наблюдението, продължаващо 14 дни, обезцветяване поради избеляване на кожата, цели участъци с алопеция и белези. Хистопатологията трябва да се вземе под внимание при оценката на спорните лезии.
Клетъчна жизнеспособност: параметър, измерващ общата активност на клетъчната популация (например способността на клетъчната митохондриална дехидрогеназа да намалява жизнения оцветител МТТ), която, в зависимост от измерената крайна точка и използваната процедура на изпитване, корелира с общия брой и/или виталност на клетките.
1.3. РЕФЕРЕНТНИ ВЕЩЕСТВА
Таблица 1
Референтни химикали
|
Име
|
№ ЕINECS
|
№ САS
|
|
|
1,2-Диаминопропан
|
201-155-9
|
78-90-0
|
Силно корозивен
|
|
Акрилна киселина
|
201-177-9
|
79-10-7
|
Силно корозивен
|
|
2-терт. бутилфенол
|
201-807-2
|
88-18-6
|
Корозивен
|
|
Калиев хидроксид (10 %)
|
215-181-3
|
1310-58-3
|
Корозивен
|
|
Сярна киселина (10 %)
|
231-639-5
|
7664-93-9
|
Корозивен
|
|
Октанова киселина (каприлна киселина)
|
204-677-5
|
124-07-02
|
Корозивен
|
|
4-амино-1,2,4-триазол
|
209-533-5
|
584-13-4
|
Некорозивен
|
|
Еугенол
|
202-589-1
|
97-53-0
|
Некорозивен
|
|
Фенетил бромид
|
203-130-8
|
103-63-9
|
Некорозивен
|
|
Тетрахлороетилен
|
204-825-9
|
27-18-4
|
Некорозивен
|
|
Изостеаринова киселина
|
250-178-0
|
30399-84-9
|
Некорозивен
|
|
4-(метилдио)-бензалдехид
|
222-365-7
|
3446-89-7
|
Некорозивен
|
Повечето от изброените химикали са взети от списъка на химичните вещества, селектиран за международното валидиращо изследване на ЕСVАМ (4). изборът им се основава на следните критерии:
|
i)
|
равен брой корозивни и некорозивни вещества;
|
|
ii)
|
търговски налични вещества, обхващащи по-голямата част от съответните химични класове;
|
|
iii)
|
включване както на силно корозивни, така и на по-малко корозивни вещества, за да се постигне разграничаване, основаващо се на корозивна сила;
|
|
iv)
|
избор на химични вещества, с които да може да се работи в лабораторни условия, без да има излагане на друг риск, освен корозивност.
|
1.4. ПРИНЦИП НА МЕТОДА НА ИЗПИТВАНЕ
Методът на изпитване се прилага конкретно към триизмерния модел на човешка кожа, който се състои поне от реконструиран епидермис с функционален stratum соrпеит. Корозивните материали се идентифицират по способността им да предизвикват намаляване на клетъчната жизнеспособност (която се определя, например, като се прави изпитване за намаляване на МТТ (15) под определени прагови нива на определени периоди от време на въздействие. Принципът на изпитанието на модела на човешка кожа се основава върху хипотезата, че корозивните химикали могат да проникват в stratum соrпеит чрез дифузия или ерозия и са цитотоксични за лежащите отдолу слоеве клетки.
1.4.1. Процедура
1.4.1.1. Модели на човешка кожа
Моделите на човешка кожа могат да се създадат или закупят от търговски фирми (например моделите ЕрiDerm™ и ЕРISKIN™) (16)(17)(18)(19), или пък да бъдат разработени или конструирани в лабораторията за изпитване (20)(21). Признава се, че използването на човешка кожа е предмет на национални и международни етични съображения и условия. Всеки нов модел трябва да се валидира (поне до степента, описана в 1.4.1.1.2). Моделите на човешка кожа, използвани при това изпитване трябва да отговарят на следното:
1.4.1.1.1. Общи условия за модела:
Да се използват човешки кератиноцити за конструирането на епитела. Трябва да са налични множество слоеве от жизнеспособни епителни клетки под функционалния stratum соrпеит. Кожният модел може да има също и стромален компонентен слой. Stratum соrпеит трябва да бъде многослоен с необходимия липиден профил, за да образува функционална бариера със здравина, за да може да устоява на бързото проникване на цитотоксични маркери. Свойствата на задържане на модела трябва да възпрепятстват преминаването на материала около stratum соrпеит към жизнената тъкан. Преминаването на изпитваните химични вещества около stratum соrпеит би довело до лошо моделиране на излагането на кожата. Моделът на кожа трябва да не е заразен с бактерии (включително микоплазма) и фунги.
1.4.1.1.2. Условия на функционалния модел:
Силата на жизнеспособност обикновено се измерва количествено с помощта на МТТ или други метаболитно преобразувани жизнени оцветители. В тези случаи оптичната плътност (ОD), извлеченият (разредим) оцветител от отрицателната контролна тъкан трябва да бъде поне 20-кратно по-голяма от ОD на извличащия разтворител (за преглед вижте (22). Отрицателната контролна тъкан трябва да бъде стабилна в култура (да осигурява измервания с подобна надеждност) за цялата продължителност на периода на излагане по време на изпитването. Stratum соrпеит трябва да бъде достатъчно здрав, за да устои на бързото проникване на цитотоксични маркерни химикали (например 1 % Тriton Х-100). Това свойство може да се прецени чрез времето на излагане, което се изисква за намаляване на клетъчната жизнеспособност с 50 % (ЕТ50) (т.е. за моделите EpiDerm™ и EPISKIN™ то е > 2 часа). Тъканта трябва да показва възпроизводимост във времето и за предпочитане е и в различни лаборатории. Освен това тя трябва да може да предвижда корозивния потенциал на референтните вещества (вижте таблица 1), когато се използва в избрания протокол за изпитване.
1.4.1.2. Прилагане на изпитваните и контролните вещества
Използват се два тъканни репликата за всяко обработване (време на излагане), включително и контроли. За течните материали трябва да се нанесе достатъчно изпитвано вещество, за да се разпредели равномерно по кожна повърхност: трябва да се използва минимум 25 μL/cm2. За твърдите материали, трябва да се нанесе достатъчно изпитвано вещество, което да покрие равномерно кожата, и то трябва да се овлажни с дейонизирана или дестилирана вода, за да направи добър контакт с кожата. Когато е необходимо, твърдите вещества трябва да бъдат смлени на прах преди използване. Методът на нанасяне трябва да бъде подходящ за изпитваното вещество (вижте справка 5). В края на периода на излагане изпитваният материал трябва внимателно да се измие от повърхността на кожата с подходящ буфер или 0,9 % NаСl.
За всяко проучване трябва едновременно да се използват положителни и отрицателни контроли, за да осигурят адекватни резултати на експерименталния модел. Препоръчваните вещества за положителни контроли са чиста оцетна киселина или 8N КОН. Препоръчваните вещества за отрицателни контроли са 0,9 % NaСl или вода.
1.4.1.3. Измервания на клетъчната жизнеспособност
За измерването на клетъчната жизнеспособност трябва да се използват само валидирани количествени методи. Освен това, измерването на жизнеспособността трябва да бъде съвместимо с използването на триизмерна тъканна конструкция. Фиксирането на неспецифичен оцветител не трябва да пречи на измерването на клетъчната жизнеспособност. Следователно, протеиносвързващи оцветители и онези, които не претърпяват метаболитно преобразуване (т.е. неутрално червено), не са подходящи. Най-често използваното изпитване е за намаляване на МТТ [3-(4,5-диметилтиазол-2у1)-2,5-дифенилтетразолиев бромид, Тиазолил син: номер ЕINEСS 206-069-5, СА8-номер 298-93-1)], което е доказало, че дава точни и възпроизводими резултати (5), но могат да се използват и други. Кожната проба се поставя в разтвор на МТТ със съответната концентрация (т.е. 0,3 — 1 mg/mL) при подходяща инкубационна температура за период от 3 часа. След това утаеният син продукт формазан се извлича с помощта на разтворител (изопропанол), а концентрацията на формазан се измерва, като се определели ОD при дължина на вълната между 540 и 595 nm.
Химичното действие на изпитвания материал върху жизнения оцветител прилича това на клетъчния метаболизъм, което води до невярна оценка на жизнеспособността. Това се случва, когато такъв изпитван материал не се отстрани напълно от кожата чрез изплакване (9). Ако изпитваният материал действа пряко на жизнения оцветител, трябва да се използват допълнителни контроли, за да се открие и коригира влиянието на изпитваните вещества върху измерването на жизнеспособността (9)(23).
2. ДАННИ
За всяка тъкан в таблична форма трябва да се докладват стойностите на ОD и изчисленият процент клетъчна жизнеспособност на изпитвания материал, положителните и отрицателни контроли, включително данните от повторните експерименти, там където са направени, както и средните и индивидуални стойности.
2.1. ТЪЛКУВАНЕ НА РЕЗУЛТАТИТЕ
Получените стойности на ОD за всяка изпитвана проба могат да се използват за изчисляването на процентната жизнеспособност в сравнение с отрицателната контрола, която произволно е определена на 100 %. Граничната процентна стойност на клетъчната жизнеспособност, разграничаваща корозивните от некорозивните изпитвани материали (или разграничаваща между различните корозивни класове), или статистически процедури, използвани при оценката на резултатите и идентифицирането на корозивните материали, трябва ясно да бъдат дефинирани и документирани, както и да бъде обосновано, че са подходящи. Общо взето, тези гранични стойности са установени по време на оптимизирането на изпитването, изпитване по време на предварителната валидация и потвърдени по време на валидиращото изследване. Един пример, предвиждането на корозивността, свързвана с модела ЕpiDerm™ е (9):
Изпитваното вещество се счита за корозивно за човешката кожа:
|
i)
|
ако жизнеспособността му след 3 минути на излагане е по-малка от 50 %, или
|
|
ii)
|
ако жизнеспособността след 3 минути на излагане е по-голяма или равна на 50 %, а жизнеспособността след 1 час на излагане е по-малка от 15 %.
|
Изпитваното вещество се счита за некорозивно за човешката кожа:
|
i)
|
ако жизнеспособността след 3 минути на излагане е по-голяма или равна на 50 %, а жизнеспособността след 1 час на излагане е по-голяма или равна на 15 %.
|
3. ДОКЛАДВАНЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Протоколът от изпитването трябва да съдържа следната информация:
|
|
Изпитвано и контролно вещество :
|
—
|
химично наименование (наименования) като по IUPАС или по САS и САS номер, ако е известен;
|
|
—
|
чистота и състав на веществото или препарата (в проценти от теглото);
|
|
—
|
физико-химични свойства като физично състояние, рН, стабилност, разтворимост във вода, които имат отношение за провеждането на изследването;
|
|
—
|
обработка на изпитваните/контролните вещества преди изпитването, ако има такава (като нагряване, смилане);
|
|
—
|
стабилност, ако е известна.
|
|
|
|
Обосновка на използвания кожен модел и протокол.
|
|
|
Условия на изпитване:
|
—
|
използвана клетъчна система;
|
|
—
|
информация за калибрирането на уреда, използван за измерване на клетъчната жизнеспособност (например спектрофотометър);
|
|
—
|
пълна придружаваща информация за конкретния използван модел на кожа, включително и валидността му;
|
|
—
|
подробности за използваната процедура на изпитване;
|
|
—
|
използвани дози на изпитване;
|
|
—
|
описание на всякакви модификации на процедурата на изпитване;
|
|
—
|
препратка към историческите данни за модела;
|
|
—
|
описание на използваните критерии за оценка.
|
|
|
|
Резултати:
|
—
|
таблично представяне на данните от индивидуалните проби на изпитване;
|
|
—
|
описание на други наблюдавани ефекти.
|
|
|
|
Обсъждане на резултатите.
|
4. ПРЕПРАТКИ
|
1.
|
OECD (2001) Harmonised Integrated Classification System for Human Health and Environmental Hazards of Chemical Substances and Mixtures. OECD Series on Testing and Assessment Number 33. ENV/JM/MONO(2001)6, Paris. http://www.olis.oecd.org/olis/2001doc.nsf/LinkTo/env-jm-mono(2001)6.
|
|
2.
|
Testing Method B.4. Acute Toxicity: Dermal Irritation/Corrosion.
|
|
3.
|
Botham, P.A., Chamberlain, M., Barratt, M.D., Curren, R.D., Esdaile, D.J., Gardner, J.R., Gordon, V.C., Hildebrand, B., Lewis, R.W., Liebsch, M., Logemann, P., Osborne, R., Ponec, M., Regnier, J.F., Steiling, W., Walker, A.P., and Balls, M. (1995). A prevalidation study on in vitro skin corrosivity testing. The report recommendations of ECVAM Workshop 6 ATLA 23,219-255.
|
|
4.
|
Barratt, M.D., Brantom, P.G., Fentem, J.H., Gerner, I., Walker, A.P., and Worth, A.P. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 1. Selection and distribution of the test chemicals. Toxic. In Vitro 12, 471—482.
|
|
5.
|
Fentem, J. H., Archer, G. E. B., Balls, M., Botham, P. A., Curren, R. D., Earl, L. K., Esdaile, D. J., Holzhutter, H. G. and Liebsch, M. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxic. In Vitro 12, 483—524.
|
|
6.
|
OECD (1996). Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods, 62pp.
|
|
7.
|
Balls, M., Blaauboer, B. J., Fentem, J. H., Bruner, L., Combes, R. D., Ekwall, B., Fielder, R. J., Guillouzo, A., Lewis, R. W., Lovell, D. P., Reinhardt, C. A., Repetto, G., Sladowski, D., Spielmann, H., and Zucco, F. (1995). Practical aspects of the validation of toxicity test procedures. Test report and recommendations of ECVAM workshops. ATLA 23, 129—147.
|
|
8.
|
ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (1997). Validation and Regulatory Acceptance of Toxicological Test Methods. NIH Publication No. 97-3981. National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/docs/guidelines/validate.pdf.
|
|
9.
|
Liebsch, M., Traue, D., Barrabas, C, Spielmann, H., Uphill, P., Wilkins, S., McPherson, J. P., Wiemann, C, Kaufmann, T., Remmele, M. and Holzhutter, H. G. (2000). The ECVAM prevalidation study on the use of EpiDerm for skin Corrosivity testing. ATLA 28, pp.371—401.
|
|
10.
|
ECVAM (1998). ECVAM News & Views. ATLA 26, 275—280.
|
|
11.
|
ECVAM (2000). ECVAM News & Views. ATLA 28, 365—67.
|
|
12.
|
ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods). (2002). ICCVAM evaluation of EpiDermTM, EPISKINTM (EPI-200), and the Rat Skin Transcutaneous Electrical Resistance (TER) assay: In Vitro test methods for assessing dermal corrosivity potential of chemicals. NIH Publication No. 02-4502. National Toxicology Program Interagency Center for the Evaluation of Alternative Toxicological Methods, National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. httpV/iccvam.niehs.nih.gov/methods/epiddocs/episjDrd.pdf.
|
|
13.
|
OECD (2002) Extended Expert Consultation Meeting on The In Vitro Skin Corrosion Test Guideline Proposal, Berlin, 1st—2nd November 2001, Secretariat's Final Summary Report, 27th March 2002, OECD ENV/EHS, available upon request from the Secretariat
|
|
14.
|
Worth A. P., Fentem J. H., Balls M., Botham P. A., Curren R. D., Earl L. K., Esdaile D. J., Liebsch M. (1998). An Evaluation of the Proposed OECD Testing Strategy for Skin Corrosion. ATLA 26: 709—720.
|
|
15.
|
Mosmann, T. (1983). Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity asssays. J.Immunol. Meth. 65, 55—63.
|
|
16.
|
Cannon, C. L., Neal, P. J., Southee, J. A., Kubilus, J., and Klausner, M., 1994. New epidermal model for dermal irritancy testing. Toxic. In Vitro 8, 889—891.
|
|
17.
|
Ponec, M., Boelsma, E., Weerheim, A., Mulder, A., Boutwstra, J., and Mommaas, M., 2000. Lipid and ultrastructural characterization of reconstructed skin models. International Journal of Pharmaceutics. 203, 211—225.
|
|
18.
|
Tinois E., Gaetani Q., Gayraud B., Dupont D., Rougier A., Pouradier D. X. (1994). The Episkin model: Successful reconstruction of human epidermis in vitro. In In vitro Skin Toxicology. Edited by A Rougier, AM Goldberg and HI Maibach: 133—140
|
|
19.
|
Tinois E., Tiollier J., Gaucherand M., Dumas H., Tardy M., Thivolet J. (1991). In vitro and post - transplantation differentiation of human keratinocytes grown on the human type IV collagen film of a bilayered dermal substitute. Experimental Cell Research 193: 310—319
|
|
20.
|
Parentau, N. L., Bilbo, P., Molte, C. J., Mason, V. S., and Rosenberg, H. (1992). The organotypic culture of human skin keratinocytes and fibroblasts to achieve form and function. Cytotechnology 9, 163—171.
|
|
21.
|
Wilkins, L. M., Watson, S. R., Prosky, S. J., Meunier, S. F., Parentau, N. L. (1994). Development of a bilayered living skin construct for clinical applications. Biotechnology and Bioengineering 43/8, 747—756.
|
|
22.
|
Marshall, N. J., Goodwin, C. J., Holt, S. J. (1995). A critical assessment of the use of microculture tetrazolium assays to measure cell growth and function. Growth Regulation 5, 69—84.
|
|
23.
|
Fentem, J. H., Briggs, D., Chesne', C, Elliot, G. R., Harbell, J. W., Heylings, J. R., Portes, P., Rouget, R., and van de Sandt, J. J. M., and Botham, P. A. (2001). A prevalidation study on in vitro tests for acute skin irritation: results and evaluation by the Management Team. Toxic. In VItro 15, 57—93.
|
Б.41. IN VITRO 3T3 NRU ИЗПИТВАНЕ ЗА ФОТОТОКСИЧНОСТ
1. МЕТОД
Този метод е еквивалентен на OECD TG 432 (2004).
1.1. ВЪВЕДЕНИЕ
Фототоксичността се определя като токсичната реакция от приложено върху тялото вещество, която се проявява или увеличава (и е забележима при ниски дози) след последващо излагане на светлина или се предизвиква от облъчване на кожата след систематично прилагане на дадено вещество.
Изпитването за фототоксичност in vitro 3Т3 NRU се използва за идентифициране на фототоксичния потенциал на изпитваното вещество, индуциран от веществото, активирано след излагане на светлина. Изпитването прави оценка на фотоцитотоксичността, като сравнява намаляването на жизнеспособността на клетките, изложени на веществото в присъствие и отсъствие на светлина. Веществата, които се идентифицират с помощта на настоящото изпитване, има вероятност да са фототоксични in vivo вследствие на систематично прилагане и разпределение по кожата или след локално приложение.
Известно е, че много видове химични вещества предизвикват фототоксични ефекти (1)(2)(3)(4). Общият признак между тях е способността им да абсорбират светлинна енергия в границите на спектъра на слънчевата светлина. Според първия закон на фотохимията (Закон на Grotthaus-Draper), фотореакцията изисква достатъчна абсорбция на светлинни кванти. По този начин, преди да се предприеме биологично изпитване, следва да се определи абсорбционният спектър UV/vis на изпитваното вещество според насоките за изпитване на OECD 101. Предполага се, че ако коефициентът на моларно поглъщане/абсорбция е по-нисък от 10 литра × mol-1 × cm-1, не е вероятно химичното вещество да е фотореактивно. Такова вещество не е необходимо да се изпитва с in vitro 3Т3 NRU за фототоксичност или с други биологични изпитвания за неблагоприятни фотохимични реакции (1)(5). Вж. също приложение 1.
Надеждността и приложимостта на изпитването in vitro 3Т3 NRU за фототоксичност бяха наскоро оценени (6)(7)(8) (9). Изпитването in vitro 3Т3 NRU за фототоксичност показа, че с него може да се предвижда остра фототоксичност при животни и хора in vivo. Той не е замислен да предвижда други неблагоприятни ефекти, които могат да се породят от комбинираното действие на веществото и светлината, напр. той не се отнася за фотогенотоксичност, фотоалергии или фотоканцерогенност, нито пък позволява да се направи оценка на фототоксичната сила. Освен това изпитването не е проектирано да се занимава с индиректните механизми на фототоксичността, ефектите от метаболитите на изпитваното вещество или ефектите от смесите.
Докато използването на метаболизиращи системи е общо изискване за всички изпитвания in vitro за предвиждане на генотоксичен и канцерогенен потенциал, досега във фототоксикологията съществуват много редки примери, в които е необходима метаболитна трансформация, за да може определено вещество да действа като фототоксин in vivo или in vitro. Поради това се счита, че нито е необходимо, нито е научно оправдано настоящото изпитване да се провежда при система на метаболитно активиране.
1.2. ОПРЕДЕЛЕНИЯ
Облъчване: интензитет на ултравиолетовата (UV) или видимата светлина, която попада върху дадена повърхност, измерен в W/m2 или mW/cm2.
Светлинна доза: количество (=интензитет × време) на ултравиолетовото (UV) или видимото лъчение, което попада върху дадена повърхност, изразено в джаули (= W × s) на повърхностна площ, напр. J/m2 или J/cm2.
Диапазони на UV светлината: препоръчваните от СIE (Commission Internationale de L'Eclairage) обозначения са UVA (315—400 nm), UVB (280—315 nm) и UVC (100—280 nm). Използват се и други обозначения; границата между UVB и UVA често се поставя на 320 nm, a UVA може да се раздели на UV-A1 и UV-A2, като границата се поставя на около 340 nm.
Клетъчна жизнеспособност: параметър, измерващ общата активност на клетъчната популация (напр. поглъщането на жизнения оцветител неутрално червено в клетъчните лизозоми), който в зависимост от измерваната крайна точка и използваната процедура на изпитване корелира с общия брой и/или жизнеността на клетките.
Относителна клетъчна жизнеспособност: клетъчната жизнеспособност, изразена спрямо разтворител (отрицателни) контроли, взети по време на пялата процедура на изпитване (+Irr или –Irr), но нетретирани с веществото на изпитване.
PIF (Photo-Irritation-Factor — фактор на фотодразнене): фактор, получен при сравняването на две еднакво ефективни цитотоксични концентрации (IC50) от изпитваното вещество, получен в отсъствието (–Irr) или присъствието (+Irr) на нецитотоксично облъчване с UVA/vis светлина.
IC
50
: концентрацията на изпитваното вещество, при която клетъчната жизнеспособност намалява с 50 %.
МРЕ (среден фотоефект): измерване, получено с помощта на математически анализ на кривите на реакция на концентрация, получени в отсъствието (–Irr) или присъствието (+Irr) на нетоксично облъчване с UVA/vis светлина.
Фототоксичност: остра токсична реакция, която се предизвиква след първото излагане на кожата на определени химични вещества и последващо излагане на светлина или предизвикана по подобен начин от облъчване на кожата след систематично прилагане на химично вещество.
1.3. ПРИНЦИП НА МЕТОДА НА ИЗПИТВАНЕ
Изпитването in vitro 3Т3 NRU за фототоксичност се основава на сравняването на цитотоксичността на едно вещество, когато се изпитва в присъствието или отсъствието на излагане на цитотоксична доза симулирана слънчева светлина. Цитотоксичността в това изпитване се изразява като намаляване, зависещо от концентрацията, на поглъщането на жизнения оцветител неутрално червено (НЧ), когато се измерва 24 часа след третирането с изпитваното вещество и облъчване (10). НЧ е слаб катионен оцветител, който лесно прониква през клетъчната мембрана чрез недифузия, като се акумулира вътрешноклетъчно в лизозомите. Промените по повърхността на чувствителната лизозомна мембрана водят до лизозомна крехкост и други промени, които постепенно стават необратими. Подобни промени, предизвикани от действието на ксенобиотици, водят до намалено поглъщане и свързване на НЧ. По този начин е възможно да се направи разграничение между жизнеспособни, увредени и мъртви клетки, което е смисълът на настоящото изпитване.
Balb/c 3T3 клетките се поддържат в култура в продължение на 24 часа, за да се образуват монослоеве. По две 96-гнездни плочки на изпитвано вещество предварително са инкубирани с осем различни концентрации на изпитваното вещество за период от 1 час. След това една от тези две плочки се излага на най-високата доза цитоксично облъчване, докато другата плочка се съхранява на тъмно. После в двете плочки средата на третиране се сменя с културна среда и след още 24 часа инкубиране клетъчната жизнеспособност се определя чрез поглъщането на НЧ. Клетъчната жизнеспособност се изразява като процент от нетретираните контроли от разтворители и се изчислява за всяка концентрация на изпитване. За да се предскаже цитотоксичният потенциал, се сравняват получените реакции на концентрация в присъствието или отсъствието на облъчване, обикновено на ниво IC50 , т.е. концентрация, намаляваща клетъчната жизнеспособност с 50 % в сравнение с нетретираните контроли.
1.4. ОПИСАНИЕ НА МЕТОДА НА ИЗПИТВАНЕ
1.4.1. Подготовка
1.4.1.1. Клетки
За валидиращото проучване са използвани постоянна линия от фибробластни клетки на мишки, Balb/c 3T3, клон 31, или от Американската банка за типови култури (АТСС), Манасас, Вирджиния, САЩ, или от Европейската банка на клетъчни култури (ЕСАСС), Салисбъри, Уилтшир, Обединеното кралство, и затова се препоръчва клетъчните култури да се получават от добре квалифицирани клетъчни банки. Други клетки или клетъчни линии могат да се използват за същата процедура на изпитване, ако условията на отглеждане на културите са адаптирани към специфичните нужди на клетките, но еквивалентността следва да се докаже.
Клетките следва да се проверяват редовно за отсъствие на микоплазмено заразяване и да се използват само ако не се открива такова (11).
Важно е UV чувствителността на клетките да се проверява редовно съгласно качествения контрол, описан в настоящия метод. Тъй като UV чувствителността на клетките може да се увеличи с броя на преминаванията, следва да се използват Balb/c 3Т3 клетки с най-нисък брой на преминавания, който може да се получи, за предпочитане по-нисък от 100 (Вж. точка 1.4.2.2.2 и приложение 2).
1.4.1.2. Условия за средата и отглеждането на културите
Следва да бъдат осигурени подходящи условия за средата и инкубация за рутинното преминаването на клетки и по време на процедурата на изпитване, напр. за Balb/c 3T3 това са DMEM (Dulbecco's modified Eagle's medium), в съчетание с 10 % серум от новородено теле, 4 mМ глутамин, пеницилин (100 IU) и стрептомицин (100 (μg/ml), както и влажна инкубация при 37 oС, 5 — 7,5 % СО2 в зависимост от буфера (вж. точка 1.4.1.4, втори параграф). Особено важно е условията за отглеждане на клетъчните култури да осигуряват време за клетъчния цикъл в нормалния исторически обхват на използваните клетки и клетъчни линии.
1.4.1.3 Изготвяне на културите
Клетките от замразения запас от култури се посяват в хранителна среда с подходяща плътност и се субкултивират поне веднъж, преди да бъдат използвани при изпитването in vitro 3Т3 NRU за фототоксичност.
Клетките, използвани за изпитването за фототоксичност, се посяват в хранителна среда с подходяща плътност, така че културите да не достигат сливане до края на изпитването, т.е. когато клетъчната жизнеспособност се определя 48 часа след посяването на клетките. За клетките Balb/c 3Т3, отгледани в 96-гнездни плочки, препоръчителната гъстота на клетките е 1 × 104 клетки на гнездо.
За всяко изпитвано вещество клетките се посяват еднакво в две отделни 96-гнездни плочки, които преминават едновременно през пялата процедура на изпитване при еднакви условия за културите, с изключение на периода време, през който едната от плочките се подлага на облъчване (+Irr), a другата се съхранява на тъмно (–Irr).
1.4.1.4. Подготовка на изпитваното вещество
Изпитваните вещества следва да са прясно приготвени непосредствено преди употреба, освен ако няма данни, които доказват тяхната стабилност при съхранение. Препоръчва се боравенето с веществото и първоначалната обработка на клетките да се извършват изцяло при светлинни условия, при които да се избегне фотоактивирането или разрушаването на изпитваното вещество преди облъчването.
Изпитваните вещества могат да се разтворят в буферни солни разтвори, например балансирания солен разтвор на Ърл (Earl's Balanced Salt Solution — EBSS) или други физиологично балансирани буферни разтвори, които да са свободни от протеинови компоненти, светлинно поглъщащи компоненти (като например цветни pH-индикатори и витамини), за да се избегне интерференцията по време на облъчването. Тъй като по време на облъчване клетките се държат около 50 минути извън СО2 инкубатора, следва да се вземат мерки да се избегне алкализирането. Ако се използват слаби буфери като EBSS, това може да се постигне чрез инкубиране на клетките при 7,5 % СО2. Ако клетките се инкубират при 5 % СО2, следва да се избере по-силен буфер.
Изпитваните химични вещества с ограничена водоразтворимост следва да се разтворят в подходящ разтворител. Ако се използва разтворител, той следва да присъства в постоянен обем във всички култури, т.е. в отрицателните (разтворител) контроли, както и във всички концентрации на изпитваното вещество, и да бъде нетоксичен за тази концентрация. Концентрациите на изпитваните вещества следва да се избират така, че да се избягва образуването на утайки или мътни разтвори.
За разтворители се препоръчват диметилсулфоксид (DMSO) и етанол (ЕТОН). Други разтворители с ниска токсичност също могат да бъдат подходящи. Преди употреба следва да се направи оценка на всички разтворители по отношение на техните специфични свойства, напр. реагиране с изпитваното вещество, потискане на фототоксичния ефект, свойства за отстраняване на примеси чрез свързването им с радикали и/или химическа стабилност в разтворителя.
Центробежно смесване и/или разбъркване с ултразвук, и/или загряване до подходяща температура също могат да бъдат използвани, за да се подпомогне разтворимостта, освен ако това не влияе върху стабилността на изпитваното вещество.
1.4.1.5. Условия на облъчване
1.4.1.5.1. Светлинен източник
Изборът на подходящ източник на светлина и на филтри е решаващ фактор при изпитването за фототоксичност. Светлината в UVA диапазона и видимата област обикновено се свързва с фототоксичните реакции in vivo (3)(12), докато, общо взето, UVB е с по-малко значение, но е високо цитотоксична; цитотоксичността се увеличава 1 000-кратно при промяна на дължината на вълната от 313 nm на 280 nm (13). Критериите за избор на подходящ светлинен източник следва да включват изискването светлинният източник да излъчва в дължини на вълните, които се поглъщат от изпитваното вещество (спектър на абсорбция), и светлинната доза (достижима в приемливо време на излагане) следва да бъде достатъчна за откриването на познати фототоксични химични вещества. Освен това използваните дължини на вълните и дози следва да не бъдат ненужно вредни за системата на изпитване, напр. излъчване на топлина (инфрачервен диапазон).
Симулирането на слънчева светлина със слънчеви симулатори се смята за оптималния изкуствен светлинен източник. Разпределението на силата на облъчване от филтрирания слънчев симулатор следва да бъде близко до това на излъчването на дневна светлина на открито, посочено в (14). Като слънчеви симулатори се използват както ксенонова дъга, така и (подобрени) живачно-метал халогенни дъги (15). Последните имат предимството да излъчват по-малко топлина и да са по-евтини, но по-малко наподобяват слънчевата светлина, отколкото ксеноновите дъги. Тъй като всички слънчеви симулатори излъчват значителни количества UVB, те следва да бъдат подходящо филтрирани, за да се намали присъствието на високотоксичните UVB дължини. Понеже пластмасовите материали за клетъчни култури съдържат UV стабилизатори, спектърът следва да се измерва през същия тип капак на 96-гнездната плочка, който ще се използва при изпитването. Независимо от мерките, предприети за смекчаване на части от спектъра чрез филтриране, или от неизбежните филтърни ефекти на оборудването, спектърът, записан след тези филтри, не бива да се отклонява от стандартната дневна светлина (14). Пример за спектралното разпределение на облъчването от филтрирания слънчев симулатор, използвано при валидиращото изпитване на изпитването in vitro 3Т3 NRU за фототоксичност, е даден в (8)(16). Вж. също приложение 2, фигура 1.
1.4.1.5.2. Дозиметрия
Интензитетът на светлината (облъчването) следва да се проверява редовно преди всяко изпитване за фототоксичност, като се използва подходящ широколентов UV-метър. Интензитетът следва да се измерва през същия тип капак на 96-гнездната плочка, който ще се използва при изпитването. UV-метърът следва да бъде калибриран според източника. Показателите на UV-метъра следва да се проверят и за тази цел се препоръчва използването на втори референтен UV-метър от същия вид и със същото калибриране. В идеалния случай на по-големи интервали следва да се използва спектрорадиометър за измерване на спектралното облъчване от филтрирания светлинен източник и за проверка на калибрирането на широколентовия UV-метър.
Дозата от 5 J/cm2 (както е измерена в UVA диапазона) е определена за нетоксична за Balb/c 3Т3 клетки и за достатъчно силна, за да възбуди химичните вещества да предизвикат фототоксични реакции (6) (17), напр. за да се постигнат 5 J/cm2 в период от време 50 минути, облъчването е настроено на 1,7 mW/cm2. Вижте приложение 2, фигура 2. Ако се използва друга клетъчна линия или светлинен източник, дозата на облъчване може да се наложи да се калибрира, така че да може да се избере такъв режим на дозиране, който да не е вреден за клетките, но да е достатъчен, за да възбуди стандартните фототоксини. Времето за излагане на светлина се изчислява по следния начин:
|

|
(1 J = 1 Wsec)
|
1.4.2. Условия на изпитване
1.4.2.1. Концентрации на изпитваните вещества
Обхватите на концентрациите на веществата, изпитвани в присъствието (+Irr) или отсъствието (–Irr) на светлина, следва да бъдат адекватно определени чрез провеждането на опити за определяне на обхвата на дозите. Може да е полезно да се направи оценка на разтворимостта в началото и на 60-ата минута (или каквото време за третиране се използва), тъй като разтворимостта може да се промени с течение на времето или по време на излагането. За да се избегне токсичност, предизвикана от неправилни условия на културата или от високо киселинни или алкални химични вещества, pH на клетъчните култури с добавеното изпитвано вещество следва да бъде в обхвата 6,5—7,8.
Най-високата концентрация на изпитваното вещество следва да бъде в границите на условията за физиологично изпитване, напр. осмотичният и pH стресът следва да се избегнат. В зависимост от изпитваното вещество може да се наложи да се вземат под внимание други физикохимични свойства като фактори, ограничаващи най-високата концентрация на изпитване. Сравнително неразтворимите вещества, които не са токсични при концентрации до точката на насищане, следва да се изпитат на най-високата достижима концентрация. Като цяло, утаяване на изпитваното вещество при която и да е от концентрациите на изпитване следва да се избягва. Максималната концентрация на изпитваното вещество не бива да превишава 1000 μg/ml; осмоларността не следва да превишава 10 mmolar. Следва да се използва разреждане в геометрична прогресия на 8 концентрации на изпитваното вещество с постоянен коефициент (вж. точка 2.1, втори параграф).
Ако съществува информация (от експериментите за определяне на обхвата), че изпитваното вещество не е цитотоксично до граничната концентрация при опита на тъмно (–Irr), но е високотоксично, когато е облъчено (+Irr), обхватите на концентрации, които следва да се изберат за опита (+Irr), могат да се различават от тези, които се избират за опита (–Irr), за да се изпълни изискването за адекватно качество на данните.
1.4.2.2. Контроли
1.4.2.2.1. Чувствителност на клетките на облъчване, установяване на исторически данни:
Клетките следва да се проверяват редовно (приблизително на всяко пето преминаване) за чувствителност спрямо светлинния източник, като се прави оценка на тяхната жизнеспособност след излагането им на увеличаващи се дози облъчване. Няколко дози облъчване, включително на нива, значително по-високи от тези, използвани при изпитването 3Т3 NRU за фоточувствителност, следва да се използват при тази оценка. Тези дози се измерват най-лесно количествено чрез измерване на частта UV на светлинния източник. Клетките се посяват при гъстотата, използвана при изпитването in vitro 3Т3 NRU за фоточувствителност, и се облъчват на другия ден. После, един ден по-късно, се определя клетъчната жизненост, като се използва поглъщането на неутрално червено. Следва да се покаже, че получената най-висока нетоксична доза (напр. при валидиращото изследване: 5 J/cm2 [UVА]) е била достатъчна да се класифицират правилно референтните вещества (таблица 1).
1.4.2.2.2. Чувствителност на облъчване, проверка на настоящото изпитване:
Изпитването отговаря на критериите за качество, ако облъчените отрицателни/разтворител контроли показват жизнеспособност над 80 % в сравнение с необлъчените.
1.4.2.2.3. Жизнеспособност на разтворителите контроли:
Абсолютната оптична плътност (OD540 NRU) на неутралното червено, извлечено от разтворителите контроли, показва дали 1 × 104 клетки, посети на гнездо, са се увеличили с нормално време на делене през двата дни на изпитването. Изпитването отговаря на критериите за приемане, ако средната OD540 NRU на нетретираните контроли е ≥ 0,4 (т.е. приблизително двадесет пъти фоновата абсорбция от разтворителя).
1.4.2.2.4. Положителни контроли
Познати фототоксични вещества се изпитват едновременно всеки с изпитване in vitro3Т3 NRU за фототоксичност. Препоръчва се хлорпромазин (CPZ). За да се изпита CPZ по стандартния протокол за изпитване in vitro 3Т3 NRU за фототоксичност, са определени следните критерии за приемане: CPZ облъчен (+Irr): 1С50 = 0,1 до 2,0 μg/ml, CPZ необлъчен (-Irr): IC50= 7,0 до 90,0 μg/ml. Факторът на фотодразнене (PIF) следва да бъде > 6. Следва да се наблюдават историческите показатели на положителната контрола.
Други фототоксични вещества, подходящи за химичния клас или характеристиките на разтворимост на веществото, на което се прави оценка, могат също да бъдат използвани като паралелни положителни контроли вместо хлорпромазина.
1.4.3. Процедура на изпитване (6)(7)(8)(16)(17):
1.4.3.1. Първи ден:
Отмерете по 100 μl· хранителна среда в периферните гнезда на 96-гнездната микротитърна плочка за тъканни култури (= празни). В останалите гнезда отмерете по 100 μl·от клетъчна суспензия от 1 × 105 клетки/ml в хранителна среда (= 1 × 104 клетки/гнездо). Следва да се подготвят по две плочки за всяка от сериите концентрации на изпитваното вещество, както и за контролата разтворител и положителната контрола.
Клетките се инкубират в продължение на 24 часа (вж. точка 1.4.1.2), докато образуват полуслят монослой. Този инкубационен период позволява възстановяване на клетките, прикрепване и експоненциален растеж.
1.4.3.2. Втори ден:
След инкубацията отдекантирайте хранителната среда от клетките и измийте внимателно със 150 μl·от буферния разтвор, използван за инкубацията. Добавете 100 μl·от буфера, съдържащ необходимата концентрация от изпитваното вещество или разтворител (разтворител контрола). Приложете 8 различни концентрации на изпитваното вещество. Инкубирайте клетките с изпитваното вещество на тъмно в продължение на 60 минути (вж. също точка 1.4.1.2 и точка 1.4.1.4, втори параграф).
От двете плочки, приготвени за всяка серия от концентрации на изпитваното вещество и контролите, изберете една, обикновено случайно, за определяне на цитотоксичността (-Irr) (т.е. контролната плочка) и една (третираната плочка) — за определяне на фототоксичността (+Irr).
За да направите +Irr излагане, облъчете клетките при стайна температура за период от 50 минути през капака на 96-гнездната плочка с най-високата доза облъчване, която е нетоксична (вж. също приложение 2). Поставете необлъчените плочки при стайна температура в тъмна кутия в продължение на 50 минути (= времето за излагане на светлина).
Отдекантирайте изпитвания разтвор и внимателно измийте два пъти с 150 μl от буферния разтвор, използван за инкубация, който обаче не съдържа от изпитвания материал. Сменете буфера с хранителна среда и инкубирайте (виж точка 1.4.1.2) до другия ден (18—22 часа).
1.4.3.3 Трети ден:
1.4.3.3.1 Микроскопска оценка
Клетките трябва да се изследват за растеж, морфология и цялост на монослоя с помощта на микроскоп фазов контраст. Трябва да се водят бележки за клетъчната морфология и въздействието върху клетъчния растеж.
1.4.3.3.2 Изпитване за поглъщане на Неутрално червено
Измийте клетките със 150 μl от предварително затоплен буфер. Отстранете измиващия разтвор с леко потупване. Добавете 100 μl от 50 μg/mL Неутрално червено (NR) (3-амин-7-диметиламино-2-метилфеназин хидрохлорид, номер EINECS 209-035-8; САS номер 553-24-2; С.I. 50040) в среда без серум (16) и инкубирайте, както е описано в параграф 1.4.1.2., в продължение на 3 часа. След инкубацията отстранете средата от NR и измийте клетките със 150 μl от буфера. Отдекантирайте и отстранете останалия буфер чрез попиване или центрофугиране.
Добавете точно 150 μl дезорбция за разтвор на НЧ (прясно приготвен от 49 части вода + 50 части етанол + 1 част оцетна киселина).
Разклатете леко микротитърната плочка на шейкър за микротитърни плочки за около 10 минути, докато НЧ не се извлече от клетките и не образува хомогенен разтвор.
Измерете оптичната плътност на екстракта НЧ при 540 nm в спектрофотометъра, като използвате празните места за референтни. Запишете данните във формата на електронен файл за последващ анализ.
2. ДАННИ
2.1. КОЛИЧЕСТВО И КАЧЕСТВО НА ДАННИТЕ
Данните от изпитването трябва да позволяват значим анализ на реакцията на концентрация, получена при наличието или отсъствието на облъчване и ако е възможно, концентрацията на изпитваното вещество, при която се намалява клетъчната жизнеспособност до 50 % (IС50). Ако се открие цитотоксичност, трябва така да се определят обхватът на концентрациите и интервала между отделните концентрации, за да може кривата добре да опише експерименталните данни.
Както за чисто положителните, така и за чисто отрицателните резултати (виж точка 2.3, първия параграф), първоначалният експеримент, подкрепен от един или повече предварителни експеримента за определяне на обхвата, може да бъде достатъчен.
Двусмислените, гранични или неясни резултати трябва да се изяснят чрез допълнителни изпитвания (виж също точка 2.4, втори параграф). В такива случаи трябва да се обмисли промяна на експерименталните условия. Експериментални условия, които могат да се променят, включват обхвата на концентрациите или интервала, времето преди инкубацията и времето за излагане на облъчване. За веществата, неустойчиви във вода, може да бъде подходящо по-кратко време на излагане.
2.2. ОЦЕНКА НА РЕЗУЛТАТИТЕ
За да могат резултатите да се оценят, може да се изчислят фактора на фотодразнене (PIF) или средния фотоефект (МРЕ).
За изчисляване на мерките фототоксичност (виж по-долу), наборът от дискретни стойности на реакция на концентрация трябва да се опише от подходяща крива на непрекъснати стойности на реакция на концентрация (модел). Налагането на кривата върху данните обикновено се прави с помощта на нелинеен регресивен метод (18). За да се оцени влиянието на променливостта на данните върху описващата крива, се препоръчва да се използва процедура bootstrap.
Факторът на фотодразнене (PIF) се изчислява по следната формула:
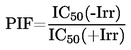
Ако IC50 в присъствието или отсъствието на светлина не може да се изчисли, то PIF не може да се определи за изпитвания материал. Средният фотоефект (МРЕ) се основава на сравняването на пълните криви на реакция на концентрация (19). Той се определя като среднотежестна стойност на представителен набор от стойности на фотоефекта

Фотоефектът РЕС, за която и да било концентрация С, е произведението от ефекта на реакция REC и ефекта на дозата DEC т.е. РЕС = REC x DEC. Ефектът на реакция REC представлява разликата от реакциите, наблюдавани в присъствието и отсъствието на светлина, т.е. REC = Rc (-Irr) – Rc (+Irr). Ефектът на дозата се определя c:
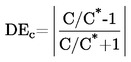
където С* представлява еквивалентната концентрация, т.е. концентрацията, при която реакцията при +Irr се изравнява с реакцията при -Irr при концентрация С. Ако С* не може да се определи, понеже стойностите на реакция от кривата +Irr систематично са по-високи или по-ниски от Rc(-Irr), ефектът на дозата се взима като 1. Тегловните коефициенти wi; представляват най-голямата стойност на реакция, т.е. wi = MAX {Ri (+Irr), Ri (-Irr)}. Решетката на концентрациите Ci се избира така, че един и същи брой точки да попадат във всеки един от интервалите на концентрация, получени от стойностите на концентрацията в експеримента. Изчисляването на МРЕ се ограничава до максималната стойност на концентрацията, при която поне едната от двете криви все още съдържа стойност на реакция от поне 10 %. Ако тази максимална концентрация е по-висока от концентрацията, използвана в експеримента +Irr, остатъчната част от кривата +Irr се взима като стойност на реакцията „0“. В зависимост от това дали стойността МРЕ е по-голяма от правилно избрана прагова стойност, (МРЕс = 0,15) или не, химичното вещество се класифицира като фототоксично.
Съществува софтуерен пакет за изчисляване на PIF и МРЕ от (20).
2.3. ТЪЛКУВАНЕ НА РЕЗУЛТАТИТЕ
Въз основа на валидиращото изследване (8), изпитвано вещество с PIF < 2 или МРЕ < 0,1 се очаква да e с: „отсъствие на фототоксичност“. При PIF > 2 и < 5 или МРЕ > 0,1 и < 0,15 очаква да е с: „вероятна фототоксичност“; а при PIF > 5 или МРЕ > 0,15 се очаква да е с: „фототоксичност“.
За всяка лаборатория, която за първи път провежда това изпитване, референтните материали, изброени в таблица 1, трябва да бъдат предварително изпитани, преди да се предприеме изпитване на веществата на изпитване за оценка на фототоксичността. Стойностите PIF или МРЕ трябва да са близки до тези, споменати в таблица 1.
Таблица 1
|
Химично наименование
|
№ ЕINECS
|
№ САS
|
РIF
|
МРЕ
|
Абсорбция Връх
|
Разтворител (9)
|
|
Амиодарон НСL
|
243-293-2
|
[19774-82-4]
|
>3,25
|
0,27—0,54
|
242 nm
300 nm
(рамо)
|
етанол
|
|
Хлоропромазин НСL
|
200-701-3
|
[69-09-0]
|
>14,4
|
0,33—0,63
|
309 nm
|
етанол
|
|
Норфлоксацин
|
274-614-4
|
[70458-96-7]
|
>71,6
|
0,34—0,90
|
316 nm
|
ацетонитрил
|
|
Антрацен
|
204-371-1
|
[120-12-7]
|
>18,5
|
0,19—0,81
|
356 nm
|
ацетонитрил
|
|
Протопорфирин IX, Динатрий
|
256-815-9
|
[50865-01-5]
|
>45,3
|
0,54—0,74
|
402 nm
|
етанол
|
|
L-Хистидин
|
|
[7006-35-1]
|
№ РIF
|
0,05—0,10
|
211 nm
|
вода
|
|
Хексахлорофен
|
200-733-8
|
[70-30-4]
|
1,1-1,7
|
0,00—0,05
|
299 nm
317 nm
(рамо)
|
етанол
|
|
Натриев лаурил сулфат
|
205-788-1
|
[151-21-3]
|
1,0-1,9
|
0,00—0,05
|
няма абсорбция
|
вода
|
2.4. ТЪЛКУВАНЕ НА ДАННИТЕ
Ако фототоксичните ефекти се наблюдават само при най-високата концентрация на изпитване (особено при водоразтворимите изпитвани вещества), може да се наложи разглеждане на допълнителни фактори за оценка на риска. Те могат да включват данни за кожната абсорбция и акумулирането на веществото в кожата и/или данни от други изпитвания, напр. изпитването на веществото in vitro върху животинска или човешка кожа или върху модели на кожа.
Ако не се проявява никаква токсичност (+Irr и -Irr) и ако малката разтворимост е ограничила концентрациите, които могат да се изпитат, може да се постави под съмнение съвместимостта на изпитваното вещество с това изпитване и да трябва да се проведе потвърдително изпитване, напр. с друг модел.
4. ДОКЛАДВАНЕ
ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Протоколът от изпитването трябва да включва поне следната информация:
|
|
Изпитвано вещество:
|
—
|
идентификационни данни, приети генерични наименования и номер по ICAS и САS номер, ако са известни;
|
|
—
|
физическа природа и чистота;
|
|
—
|
физикохимични свойства с отношение към провеждане изследването;
|
|
—
|
абсорбционен спектър на UV/vis;
|
|
—
|
стабилност и фотостабилност, ако са известни.
|
|
|
|
Разтворител:
|
—
|
обосновка на избора на разтворител;
|
|
—
|
разтворимост на изпитваното вещество в разтворителя;
|
|
—
|
процентно съдържание на разтворителя в средата на третиране.
|
|
|
|
Клетки:
|
—
|
тип и източник на клетките;
|
|
—
|
брой на преминаващите клетки, ако е известен;
|
|
—
|
чувствителност на клетките на облъчване, определена с апаратурата за облъчване, използвана при изпитването in vitro ЗТЗ NRUза фототоксичност.
|
|
|
|
Условия на изпитване (1); инкубиране преди и след третиране:
|
—
|
тип и състав на хранителната среда;
|
|
—
|
инкубационни условия (концентрация на CO2; температура; влажност);
|
|
—
|
продължителност на нкубацията (предварително и последващо обработване).
|
|
|
|
Условия на изпитване (2); третиране с веществото:
|
—
|
обяснение за реда на избор на концентрациите на изпитваното вещество при присъствието и отсъствието на облъчване;
|
|
—
|
в случай на ограничена разтворимост на изпитваното вещество и отсъствие на цитотоксичност: обяснение на реда за изпитване на най-висока концентрация;
|
|
—
|
тип и състав на средата на третиране (буферен солен разтвор);
|
|
—
|
продължителност на химичното третиране.
|
|
|
|
Условия на изпитване (3); облъчване:
|
—
|
описание на реда за избор на използвания източник на светлина;
|
|
—
|
производител и тип на светлинния източник и на радиометъра;
|
|
—
|
характеристики на спектралното облъчване от светлинния източник;
|
|
—
|
характеристики на пропускане и поглъщане на използвания филтър(ри);
|
|
—
|
характеристики на радиометъра и подробности за калибрирането му;
|
|
—
|
разстояние между светлинния източник и системата за изпитване;
|
|
—
|
UVA облъчване на това разстояние, изразено в mW/cm2;
|
|
—
|
продължителност на излагането на UV/vis светлина;
|
|
—
|
UVА доза (облъчване × време), изразена в J/cm2;
|
|
—
|
температура на клетъчните култури по време на облъчване и клетъчните култури, съхранявани в това време на тъмно.
|
|
|
|
Условия на изпитване (4); изпитване за жизнеспособност с Неутрално червено:
|
—
|
състав на средата за третиране с Неутрално червено;
|
|
—
|
продължителност на инкубацията при Неутрално червена;
|
|
—
|
инкубационни условия (концентрация на СО2; температура; влажност);
|
|
—
|
условия за екстракция на Неутрално червено (агент на екстракцията, продължителност);
|
|
—
|
дължина на вълната, използвана за спектрометричното отчитане за оптичната плътност на Неутралното червено;
|
|
—
|
втора дължина на вълната (за сравнение), ако е използвана;
|
|
—
|
съдържание на пробата използвана за „празно“ измерване със спектрофотометъра, ако е използвана такава.
|
|
|
|
Резултати:
|
—
|
клетъчната жизнеспособност, получена при всяка концентрация на изпитваното вещество, изразена в процент жизнеспособност от средната едновременна жизнеспособност на контролите разтворител;
|
|
—
|
кривите на реакция на концентрация (химична концентрация на изпитване спрямо сравнителна клетъчна жизнеспособност), получени при едновременни +Irr и -Irr експерименти;
|
|
—
|
анализ на кривите на реакция на концентрация: ако е възможно, изчисляване/пресмятане на IС50 (+Irr) и IС50 (-Irr);
|
|
—
|
сравнение на двете криви на реакция на концентрация, получени в присъствието или отсъствието на облъчване, или чрез калкулиране на фактора на фото дразнене (РIF), или чрез изчисляване на средния фотоефект (MPE);
|
|
—
|
критерии за приемане на изпитването; едновременен контрол с разтворител;
|
|
—
|
абсолютна жизнеспособност (оптична плътност екстракта на Неутрално червено) на облъчените или необлъчени клетки;
|
|
—
|
исторически отрицателни данни и данни за разтворителя контрола; средни и стандартни отклонения;
|
|
—
|
критерии за приемане на изпитването; едновременен положителен контрол;
|
|
—
|
IС50(+Irr) и IС50(-Irr) и РIFМРЕ на веществото положителна контрола;
|
|
—
|
исторически данни за веществото положителна контрола: IС50(+Irr) и IС50(-Irr) и РIFМРЕ; средни и стандартни отклонения.
|
|
|
|
Обсъждане на резултатите на резултатите.
|
4. ПРЕПРАТКИ
|
1.
|
Lovell W.W. (1993). A scheme for in vitro screening of substances for photoallergenic potential. Toxic. In Vitro 7: 95—102.
|
|
2.
|
Santamaria, L. and Prino, G. (1972). List of the photodynamic substances. In „Research Progress in Organic, Biological and Medicinal Chemistry“ Vol. 3 part 1. North Holland Publishing Co. Amsterdam. p XI—XXXV.
|
|
3.
|
Spielmann, H., Lovell, W.W., Hölzle, E., Johnson, B.E., Maurer, T., Miranda, M.A., Pape, W.J.W., Sapora, O., and Sladowski, D. (1994). In vitro phototoxicity testing: The report and recommendations of ECVAM Workshop 2. ATLA, 22, 314—348.
|
|
4.
|
Spikes, J.D. (1989). Photosensitization. In „The science of Photobiology“ Edited by K.C. Smith. Plenum Press, New York. 2nd edition, p 79—110.
|
|
5.
|
OECD (1997) Environmental Health and Safety Publications, Series on Testing and Assessment No.7 „Guidance Document On Direct Phototransformation Of Chemicals In Water“ Environment Directorate, OECD, Paris.
|
|
6.
|
Spielmann, H., Balls, M., Döring, B., Holzhütter, H.G., Kalweit, S., Klecak, G., L'Eplattenier, H., Liebsch, M., Lovell, W.W., Maurer, T., Moldenhauer. F. Moore. L., Pape, W., Pfannbecker, U., Potthast, J., De Silva, O., Steiling, W., and Willshaw, A. (1994). EEC/COLIPA project on in vitro phototoxicity testing: First results obtained with a Balb/c 3T3 cell phototoxicity assay. Toxic. In Vitro 8, 793—796.
|
|
7.
|
Anon (1998). Statement on the scientific validity of the 3T3 NRU PT test (an in vitro test for phototoxicity), European Commission, Joint Research Centre: ECVAM and DGXI/E/2, 3 November 1997, ATLA, 26, 7—8.
|
|
8.
|
Spielmann, H., Balls, M., Dupuis, J., Pape, W.J.W., Pechovitch, G. De Silva, O., Holzhütter, H.G., Clothier, R., Desolle, P., Gerberick, F., Liebsch, M., Lovell, W.W., Maurer, T., Pfannenbecker, U., Potthast, J. M., Csato, M., Sladowski, D., Steiling, W., and Brantom, P. (1998). The international EU/COLIPA In vitro phototoxicity validation study: results of phase II (blind trial), part 1: the 3T3 NRU phototoxicity test. Toxic. In Vitro 12, 305—327.
|
|
9.
|
OECD (2002) Extended Expert Consultation Meeting on The In Vitro 3T3 NRU Phototoxicity Test Guideline Proposal, Berlin, 30th-3 1th October 2001, Secretariat's Final Summary Report, 15th March 2002, OECD ENV/EHS, available upon request from the Secretariat.
|
|
10.
|
Borenfreund, E., and Puerner, J.A. (1985). Toxicity determination in vitro by morphological alterations and neutral red absorption. Toxicology Lett., 24, 119—124.
|
|
11.
|
Hay, R.J. (1988) The seed stock concept and quality control for cell lines. Analytical Biochemistry 171, 225—237.
|
|
12.
|
Lambert L.A, Warner W.G., and Kornhauser A. (1996) Animal models for phototoxicity testing. In „Dermatotoxicology“, edited by F.N. Marzulli and H.I. Maibach. Taylor & Francis, Washington DC. 5th Edition, p 515—530.
|
|
13.
|
Tyrrell R.M., Pidoux M (1987) Action spectra for human skin cells: estimates of the relative cytotoxicity of the middle ultraviolet, near ultraviolet and violet regions of sunlight on epidermal keratinocytes. Cancer Res., 47, 1825—1829.
|
|
14.
|
ISO 10977. (1993). Photography — Processed photographic colour films and paper prints — Methods for measuring image stability.
|
|
15.
|
Sunscreen Testing (UV.B) TECHNICALREPORT, CIE, International Commission on Illumnation, Publication No. 90, Vienna, 1993, ISBN 3 900 734 275
|
|
16.
|
ZEBET/ECVAM/COLIPA — Standard Operating Procedure: In Vitro 3T3 NRU Phototoxicity Test. Final Version, 7 September, 1998. 18 pgs.
|
|
17.
|
Spielmann, H., Balls, M., Dupuis, J., Pape, W.J.W., De Silva, O., Holzhütter, H.G., Gerberick, F., Liebsch, M., Lovell, W.W., and Pfannenbecker, U. (1998) A study on UV filter chemicals from Annex VII of the European Union Directive 76/768/EEC, in the in vitro 3T3 NRU phototoxicity test. ATLA 26, 679—708.
|
|
18.
|
Holzhütter, H.G., and Quedenau, J. (1995) Mathematical modeling of cellular responses to external signals. J. Biol. Systems 3, 127—138.
|
|
19.
|
Holzhütter, H.G. (1997). A general measure of in vitro phototoxicity derived from pairs of dose-response curves and its use for predicting the in vivo phototoxicity of chemicals. ATLA, 25, 445—462.
|
|
20.
|
http://www.oecd.org/document/55/0,2340,en_2649_34377_2349687_1_1_1_1,00.html
|
ПРИЛОЖЕНИЕ 1
Роля на изпитването ЗТЗ NRU за фототоксичност в последователния подход към изпитването за фототоксичност на веществата
ПРИЛОЖЕНИЕ 2
Фигура 1
Спектрално разпределение на мощността на филтриран слънчев симулатор

(виж секция 1.4.1.5, втори параграф)
Фигура 1 дава пример за приемливо спектрално разпределение на облъчването от слънчев симулатор с филтър. Той е от подобрен метал халогенен източник, използван за валидиращото изпитване на изпитването ЗТЗ NRU за фототоксичност (6)(8)(17). Показани са ефектът от двата различни филтъра и допълнителният филтриращ ефект на капака на 96-гнездната плочка за клетъчни култури. Филтърът Н2 беше използван само със системи на изпитване, които могат да толерират по-високи количества UVB (изпитване върху модел на кожа и изпитване на червени кръвни тела за фото-хемолиза). При изпитването ЗТЗ NRU за фототоксичност е използван филтърът HI. Фигурата показва, че допълнителният филтриращ ефект на капака на плочката се наблюдава главно в обхвата UVB, като все пак оставя достатъчно UVB в спектъра на облъчване, за да възбуди веществата, които типично поглъщат в UVB обхвата като Амиодарон (виж таблица 1).
Фигура 2
Чувствителност на облъчване на клетките Balb/c 3T3 (както е измерена в UVA обхвата)
Клетъчна жизнеспособност ( % поглъщане на Неутрално червено от контроли на тъмно)

(вижте секция 1.4.1.5.2, втори параграф; 1.4.2.2.1, 1.4.2.2.2)
Чувствителността на клетките Balb/c 3T3 на облъчване със слънчев симулатор, използван във валидиращото изпитване на изпитването 3T3NRU за фототоксичност, както е измерена в UVA обхвата. Фигурата показва резултатите, измерени в 7 различни лаборатории в предварителното валидиращо изследване (1). Докато двете криви с незапълнени символи са получени от остарели клетки (висок брой на преминавания), които е трябвало да бъдат заменени с нови клетки, кривите с плътни символи показват клетки с приемлив толеранс на облъчване.
От тези данни беше получена най-високата нецитотоксична доза на облъчване 5 J/cm2 (вертикалната пунктирана линия). Хоризонталната пунктирана линия допълнително показва максимално допустимия ефект на облъчване, посочен в параграф 1.4.2.2.
Б.42. КОЖНА СЕНСИБИЛИЗАЦИЯ: ИЗСЛЕДВАНЕ НА ЛОКАЛНИТЕ ЛИМФНИ ВЪЗЛИ
1. МЕТОД
Този метод е еквивалентен на ОИСР TG 429 (2002).
1.1. ВЪВЕДЕНИЕ
Изследването на локалните лимфни възли (LLNA) е подходящо валидиран и приет, за да се обсъди неговото одобрение като нов метод (1)(2)(3). Той е вторият метод за оценка на потенциалната кожна сенсибилизация от химикалите при животни. Другият метод (Б.6) използува изследвания върху морско свинче, особено максимизираното изследване с морско свинче и изследването на Buehler (4).
LLNA осигурява алтернативен метод за определяне на кожната сенсибилизация от химикалите и се прилага за потвърждение при неспособност (когато липсва значитена възможност) химикала да причини кожната сенсибилизация. Това не значи непременно, че при всички случаи трябва да бъде прилагано LLNA c морски свинчета, а по- скоро изпитването е равностойно и може да бъде приложено като алтернатива, при която обикновено не е необходим дълъг период от време за потвърждаване на позитивните и негативните резултати.
LLNA поставя някои предизвикателства едновременно пред научния прогрес и благополучието на животните. То проучва фазата на въвеждане (индукция) при кожна сенсибилизация и осигурява количествени данни, подходящи за оценяване на зависимостта доза- отговор. Описват се подробностите за валидирането на LLNA и се прави преглед на свързаната с него работа (5)(6)(7)(8). В допълнение, трябва да бъде отбелязано, че леките/средните сенсибилизатори, които се препоръчват като подходящи вещества за контрол при методите за изследване на морско свинче, също са подходящи за употреба при LLNA (6)(8)(9).
LLNA е in vivo метод и в следствие на това, използуването на животни при оценяването на контактната сенсибилизираща активност не може да се преустанови. Въпреки това, има възможност да се редуцира броя на животните, изисквани за тази цел. Освен това, LLNA предлага съществено усъвършенстване (подобряване) на начина, по който животните се използуват за изпитване на контактната сенсибилизация. LLNA се основава на разбирането за имунологичните ефекти, стимулирани от химикала по време на индукционната фаза на сенсибилизирането. За разлика от изследванията с морско свинче, при LLNA не изисква да бъдат провеждани реакции, предизвикващи след индукция дермална хиперчувствителност. Освен това, LLNA не изисква употребата на адювант, както в случаите на максимизираното изследване с морско свинче. По такъв начин LLNA намалява страданието на животните. Освен това трябва да се признае, че сред предимствата на LLNA пред традиционните изследвания с морско свинче, са наличието на определени ограничения, които могат да направят належаща употребата на традиционните изследвания с морски свинчета (напр. неверни отрицателни заключения при LLNA c определени метали, неверни положителни заключения — при определени кожни дразнители)(10).
Вижте също Въведението на част Б.
1.2 ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Основният принцип, залегнал в LLNA е, че сенсибилизаторите предизвикват първоначална пролиферация на лимфните възли, дренираща мястото на прилагане на химикала. Тази пролиферация е пропорционална на приложената доза (и на потенциала за възникване на алергия) и осигурява лесен начин за получаване на количествено измерване на сенсибилизацията. LLNA оценява тази пролиферация като зависимост доза- отговор, в която се сравнява пролиферацията на изпитваните групи с тази, на третираните с разтворител, контроли. Съотношението на пролиферацията в третираните групи спрямо тази в контролите на разтворителя, наречена Стимулационен индекс (SI), е определена и трябва да бъде поне три, за да може едно изпитвано вещество да бъде по- нататък оценено като потенциален кожен сенсибилизатор. Тук описаните методи се основават на използуването на радиоактивно маркиране за измерване на клетъчната пролиферация. Въпреки това обаче за оценка на пролиферацията могат да бъдат приложени други подходи, които се обосновават и имат подходящата научна подкрепа, включително пълно цитиране и описание на методологията.
1.3 ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
1.3.1 Подготовка
1.3.1.1 Условия за отглеждане и хранене
Животните трябва да бъдат индивидуално настанени. Температурата в стаята на опитните животни трябва да бъде 22oС (± 3oС). Въпреки че относителната влажност трябва да бъде поне 30 % и е препоръчително тя да не надвишава 70 % в друг момент, освен при почистване на стаята, трябва да се цели да се постигне 50—60 % относителна влажност. Светлината трябва да бъде изкуствена, с последващи 12 часа светъл период, 12 часа тъмен период. За хранене могат да бъдат използвани конвенционалните лабораторни диети с неограничен достъп до питейна вода.
1.3.1.2 Подготовка на животните
Животните са произволно избрани, маркирани, за да е възможно индивидуалното им идентифициране (но не и чрез маркиране на ушите им) и оставени в клетките си поне 5 дни преди започване на дозирането, за да се аклиматизират към лабораторните условия. Преди да започне третирането, всички животни се изследват, за да се потвърди отсъствието на видими кожни увреждания.
1.3.2 Условия на изследването
1.3.2.1 Експериментални животни
Видът животни, избрани за това изследване, е мишка. Използуват се млади възрастни мишки от женски пол от порода СВА/Са или CBA/J, които не са раждали и не са бременни. В началото на изследването, животните трябва да бъдат на възраст между 8—12 седмици и отклоненията в теглото им трябва да бъдат минимални и да не превишават 20 % от средното тегло. Животни от друг пол и други породи могат да бъдат използувани, когато има събрани достатъчно данни, които показват, че не съществува отговор при LLNA, който да показва съществени различия, обусловени от пола или породата.
1.3.2.2 Проверка за достоверност
Положителни контроли се използуват за демонстриране на подходящо провеждане на експеримента и на компетентността на лабораторията относно успешното провеждане на експеримента. Положителната контрола трябва да предизвика положителен LLNA отговор, при ниво на експозиция, при което се очаква нарастване на стимулационния индекс (SI) >3 спрямо отрицателната контролна група. Дозата за положителните контроли трябва да бъде избрана така, че да може свободно, но не окончателно (крайно) да предизвика отговор. Предпочитани вещества са хексилканелен алдехид (CAS № 101-86-0, EINECS № 202-983-3) и меркаптобензотиазол (CAS № 149-30-4, EINECS № 205-736-8). Може да има обстоятелства, при които след направено подходящо обосноваване, могат да бъдат използувани други контролни вещества, отговарящи на горепосочените критерии. Докато (обикновено) при всеки експеримент може да бъде изискана положителна контролна група, може да има ситуации, при които изпитвателните лаборатории да разполагат с налични исторически данни за позитивен контрол, които показват последователни задоволителни отговори в шестмесечен или по-широк период от време. При тези ситуации, може да бъде подходящо изследване с положителни контроли да бъде провеждано по-рядко, на интервали, не по-големи от 6 месеца. Въпреки че положителното контролно вещество трябва да бъде изпитвано в разтворител, за когото е известно, че при прилагането му се получава окончателен отговор (напр. ацетон: зехтин), може да има определени регулаторни (установени) ситуации, при които ще бъде необходимо също провеждането на изпитване с нестандартен разтворител (клинично/химично отговаряща формулация). При такава ситуация, трябва да бъде изследвано възможното взаимодействие на положителната контрола с този нетрадиционно използван разтворител.
1.3.2.3 Брой на животните, нива на дозата и избор на разтворител.
Използва се група от максимум четири животни за доза, при минимум три концентрации на изпитваното вещество, плюс отрицателна контролна група, третирана само с разтворителя на изпитваното вещество, и, където е подходящо, положителен контрол. В случаите, при които трябва да бъдат събрани индивидуални данни за всяко животно, се използуват групи от минимум пет животни за доза. Освен че липсва третиране с изпитваното вещество, животните от контролните групи трябва да бъдат отглеждани и третирани по начин, идентичен с този, на животните от третираните групи.
Изборът на доза и разтворител трябва да бъде основан на препоръките, посочени в позоваване (1). Дозите се избират от концентрационните серии 100 %, 50 %, 25 %, 10 %, 5 %, 2,5 %, 1 %, 0,5 % и др. При избора на трите последователни концентрации, трябва да бъдат отчетени съществуващата остра токсичност и кожно дразнене, където е удачно, така че най-високата концентрация да увеличава в максимална степен експозицията, така че да се избегне систематичната токсичност и крайното локално кожно дразнене (2)(11).
Разтворителят трябва да бъде избран въз основа на максимално повишените концентрации за изпитване и разтворимостта, при които се приготвя подходящ разтвор/суспензия за прилагане на изпитваното вещество. За предпочитане е да се използуват следните препоръчвани разтворители: ацетон/зехтин (4:1 об/об), диметилформамид, метилетилкетон, пропилей гликол и диметилсулфоксид (2)(10), но могат да бъдат използувани и други, при условие че те са достатъчно добре научно подкрепени. При определени ситуации може да бъде необходимо да се използват клинично обусловени разтворители или търговска формулация, в която изпитваното вещество се маркира като допълнителна контрола. Особено внимание трябва да бъде обърнато за уверение, че хидрофилните материали се инкорпорират в система от разтворители, която навлажнява кожата и не се разпада веднага. Ето защо разтворители на изцяло водна основа трябва да бъдат избягвани.
1.3.3 Процедура на изследване
1.3.3.1 Експериментален график
Експерименталният график на опита е, както следва:
|
|
Ден1:
Индивидуално идентифициране и записване на теглото на всяко животно. Пряко апликиране на 25μ1 от разтвор на изпитваното вещество с подходяща концентрация, самостоятелно на разтворителя или положителната контрола (както е подходящо), в горната част на всяко ухо.
|
|
|
Ден 2 и 3:
Повтаряне на апликационната процедура, проведена през ден 1.
|
|
|
Ден 6
Записва се теглото на всяко животно. Инжектира се 250μl phosphate-buffered saline (PBS), съдържащ 20 μCi (7.4е + 8 Bq) 3Η-метил тимитидин на всичките изследвани и контролни мишки през опашната вена. Алтернативно, се инжектира 250 μL PBS, съдържащ 2 μCi (7.4е + 7 Bq) 1251-йододеоксиуридин и 10-5 Μ флуородеоксиуридин на всички мишки през опашната вена.
Пет часа по-късно животните се убиват. Дренираните аурикуларни (ушни) лимфни възли от всяко ухо се отрязват и събират в PBS при всяка експериментална група (обединен подход за третиране на групата); алтернативно, двойките лимфни възли от отделните животни могат да бъдат отрязани и събирани в PBS при всяко животно (индивидуален подход към животните). Подробности и диаграми за идентифицирането и дисекцията на възлите могат да бъдат намерени в приложение I на позоваване 10.
|
1.3.3.2 Подготовка на клетъчни суспензии
Приготвя се еднократна клетъчна суспензия от клетки от лимфни възли (LNC) от всяка от общо третираните групи или двустранно от животинските индивиди чрез леко механично разпръсване през 200 μm-вите отвори на мрежа от неръждаема стомана. Клетките от лимфните възли се измиват двукратно с голямо количество PBS и преципитират с 5 % трихлороцетна киселина (ТСА) при 4 oС в продължение на 18h (2). Малките сферични топчета или повторно се суспендират в 1 ml ТСА и се пренасят до сцинтилационните стъкленици, съдържащи 10 ml сцинтилационна течност за 3Н-брояч, или се пренасят директно към гамма броящите епруветки за 125I-датчика.
1.3.3.3 Определяне на клетъчната пролиферация (инкорпориранарадиоактивност)
Инкорпорирането на 3Н-метил тимидин се измерва чрез ß-сцинтилационен датчик като разпадане (дезинтегриране) за минута (DPM). Инкорпорирането на 125I-йододеоксиуридин се измерва чрез 125I- брояч и също се изразява като DPM. В зависимост от използвания подход, инкорпорирането ще бъде изразено като DPM/третирана група (обединен подход) или DPM/животно (индивидуален подход).
1.3.3.4 Наблюдения
1.3.3.4.1 Клинични наблюдения
Животните трябва внимателно да бъдат наблюдавани веднъж дневно за някакви клинични белези, за локално дразнене около мястото на въвеждане или за систематична токсичност. Всички наблюдения систематично се записват с индивидуални архиви, които се поддържат за всяко животно.
1.3.3.4.2 Телесни тегла
Както и посочено в точка 1.3.3.1, индивидуалните телесни тегла на животните трябва да бъдат измерени в началото на изследването и при планираното убиване на животните.
1.3.4 Изчисляване на резултатите
Резултатите се изразяват като стимулационен индекс (SI). Когато се използува обединеният подход, SI се получава чрез разделяне на общото радиоактивно смесване (инкорпориране) при всяка третирана група на инкорпорирането на обединената с разтворителя контролна група. Така се получава средният SI. Когато се използува индивидуалният подход, SI се получава чрез разделяне на средната DPM/животно от всяка група, изследвана с изпитваното вещество и от положителната контролна група, на средната DPM/животно от контролната група с разтворителя/носителя. Средната стойност на SI за контролите, третирани с разтворител/носител, тогава е 1.
Използуването на индивидуален подход за изчисляване на SI ще позволи извършването на статистически анализ на данните. При избора на подходящ метод за статистически анализ, изследователят трябва да обърне внимание на възможни различия или променливост (вариране) и други, свързани с тях проблеми, които могат да наложат трансформация на данните или провеждане на статистически анализ без параметри. Подходящ подход за интерпрениране на данните е оценяването на всички индинидуални данни от третирането и контролите с разтворителя и получаване от тях на най-добрата свързваща крива доза — отговор, съобразена с доверителния интервал (8)(12)(13). Въпреки това изследователят трябва да внимава за възможни рязко отличаващи се от останалите отговори при животинските индивиди в група, което може да доведе до необходимост от използване на алтернативно оценяване на отговора (напр. по-скоро относителен, отколкото среден) или елиминиране на рязко отличаващите се отговори.
Процесът за вземане на решение, свързан с положителен отговор, включва стимулационен индекс ≥ 3, както и взема под внимание зависимостта доза — отговор и, където е подходящо, статистическата значимост (3)(6)(8)(12)(14).
Ако е необходимо за изясняване на получените резултати, трябва да бъде обърнато внимание на различните свойства на изпитваното вещество, включително на това, дали то има структурна връзка с познати кожни сенсибилизатори, дали то причинява изключително кожно дразнене и дали е ясна природата на зависимостта доза-отговор. Тези и други съображения подробно се обсъждат на друго място (7).
2. ДАННИ
Данните трябва да бъдат резюмирани в таблична форма, показваща средните и индивидуалните стойности на DPM и стимулационните индекси за всяка група от дози (включително контрол върху разтворителя/носителя).
3. ОТЧИТАНЕ
3.1 ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Протоколът от изпитването трябва да включва следната информация:
|
|
Изпитвано вещество:
|
—
|
данни за идентичността (напр. CAS номер, ако има, произход, чистота, известните примеси, пореден (lot) номер)
|
|
—
|
физична форма и физикохимични свойства (напр. летливост, стабилност, разтворимост);
|
|
—
|
ако е смес, състав и относително съотношение (в %) на компонентите;
|
|
|
|
Разтворител:
|
—
|
данни за идентичността (чистота, концентрация (където е подходящо), използван обем);
|
|
—
|
обосноваване на избора на разтворител.
|
|
|
|
Изследвани животни:
|
—
|
вид на използваните мишки;
|
|
—
|
микробиологично състояние на животните, когато е известно;
|
|
—
|
брой, възраст и пол на животните.
|
|
—
|
произход на животните, условия за отглеждане, диета и т.н.;
|
|
|
|
Условия на експеримента:
|
—
|
подробности за формулирането на изпитваното вещество и за прилагането му;
|
|
—
|
обосноваване на избора на доза, включително резултати от изследване на обхвата на откриване, ако е проведено; използувани концентрации на изпитваното вещество и разтворителя и общо количество на приложеното вещество
|
|
—
|
подробности във връзка с качеството на храната и водата (включително вид/източник на диетата, водоизточник);
|
|
|
|
Проверка на достоверността/надеждността:
|
—
|
резюме на резултатите от най-последната достоверна проверка, включително информация за веществото, концентрация и използван разтворител/носител.
|
|
—
|
съвпадащи и/или исторически позитивни и негативни контролни данни за лабораторията, провеждаща изследването.
|
|
|
|
Резултати:
|
—
|
индивидуални тегла на животните в началото на дозирането и в планираното им (по график) убиване;
|
|
—
|
таблица на средните (обединен подход) и индивидуалните (индивидуален подход) стойности на DPM, както и обхватът от стойности при двата подхода и стимулирането, индексирано за всяка група от дози (включително контрол върху разтворителя/носителя).
|
|
—
|
статистически анализи, където е подходящо;
|
|
—
|
време на поява на признаци на токсичност, включително кожно дразнене около мястото на администриране, ако има, за всяко животно.
|
|
|
|
Обсъждане на резултатите:
|
—
|
кратък коментар на резултатите, анализ доза — отговор и статистически анализ, където е подходящо, със заключение, дали веществото трябва да бъде разглеждано като кожен сенсибилизатор.
|
|
4. ПРЕПРАТКИ
|
1.
|
Kimber, I. and Basketter, D.A. (1992). The murine local lymph node assay; collaborative studies and new directions: A commentary. Food and Chemical Toxicology 30, 165—169.
|
|
2.
|
Kimber, I, Derman, R.J., Scholes E.W, and Basketter, D.A. (1994). The local lymph node assay: developments and applications. Toxicology, 93, 13—31.
|
|
3.
|
Kimber, I., Hilton, J., Dearman, R.J., Gerberick, G.F., Ryan, CA., Basketter, D.A., Lea, L., House, R.V., Ladies, G.S., Loveless, S.E., Hastings, K.L. (1998). Assessment of the skin sensitisation potential of topical medicaments using the local lymph node assay: An interlaboratory exercise. Journal of Toxicology and Environmental Health, 53, 563—79.
|
|
5.
|
Chamberlain, M. and Basketter, D.A. (1996). The local lymph node assay: status of validation. Food and Chemical Toxicology, 34, 999—1002.
|
|
6.
|
Basketter, D.A., Gerberick, G.F., Kimber, I. and Loveless, S.E (1996). The local lymph node assay- A viable alternative to currently accepted skin sensitisation tests. Food and Chemical Toxicology, 34, 985—997.
|
|
7.
|
Basketter, D.A., Gerberick, G.F. and Kimber, I. (1998). Strategies for identifying false positive responses in predictive sensitisation tests. Food and Chemical Toxicology. 36, 327—33.
|
|
8.
|
Van Och, F.M.M, Slob, W., De Jong, W.H., Vandebriel, R.J., Van Loveren, H. (2000). A quantitative method for assessing the sensitising potency of low molecular weight chemicals using a local lymph node assay: employement of a regression method that includes determination of uncertainty margins. Toxicology, 146, 49—59.
|
|
9.
|
Dearman, R.J., Hilton, J., Evans, P., Harvey, P., Basketter, D.A. and Kimber, I. (1998). Temporal stability of local lymph node assay responses to hexyl cinnamic aldehyde. Journal of Applied Toxicology, 18, 281—4.
|
|
10.
|
National Institute of Environmental Health Sciences (1999). The Murine Local Lymph Node Assay: A Test Method for Assessing the Allergic Contact Dermatitis Potential of Chemicals/Compounds: The Results of an Independent Peer Review Evaluation Coordinated by the Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program Center for the Evaluation of Alternative Toxicological Methods (NICETAM). NIH Publication №: 99- 4494, Research Triangle Park, N.C. (http://iccvam.niehs.nih.gov).
|
|
12.
|
Basketter, D.A., Selbie, E., Scholes, E.W. Lees, D. Kimber, I. and Botham, P.A. (1993) Results with OECD recommended positive control sensitisers in the maximisation, Buehler and local lymph node assays. Food and Chemical Toxicology, 31, 63—67.
|
|
13.
|
Basketter D.A., Lea L.J., Dickens A., Briggs D., Pate I., Dearman R.J., Kimber I. (1999). A comparison of statistical approaches to the derivation of EC3 values from local lymph node assay dose responses. J. Appl. Toxicology, 19, 261—266.
|
|
14.
|
Basketter DA, Blaikie L, Derman RJ, Kimber I, Ryan CA, Gerberick GF, Harvey P, Evans P, White IR and Rycroft RTG (2000). Use of local lymph node assay for the estimation of relative contact allergenic potency. Contact Dermatitis 42, 344—348.
|
Б.43. НЕВРОТОКСИКОЛОГИЧНО ИЗСЛЕДВАНЕ ПРИ ГРИЗАЧИ
1. МЕТОД
Този метод е еквивалентен на ОИСР ТG 424 (1997).
Този метод е предназначен да предостави информацията, необходима за потвърждаване или допълнително охарактеризиране на потенциалната невротоксичност на химикали при възрастни животни. Той може да бъде комбиниран със съществуващи методи за изпитване, чрез токсикологични изследвания с повтаряща се доза или проведен като самостоятелно изследване. Препоръчва се да бъдат направени консултации с Ръководството на ОИСР със стратегии и методи за изследване на невротоксичността (1), за да се подпомогне определянето на изследванията, основани на този метод. Това е особено важно, когато се разглеждат модификациите на наблюденията и процедурите за изпитване, както се препоръчва при рутинно прилагане на този метод. Ръководството е изготвено, за да подпомогне избора на други процедури за изследване, които се използват при определени обстоятелства.
Оценката на развитието на невротоксичността не е обект на този метод.
1.1. ВЪВЕДЕНИЕ
При извършването на междинна и окончателна оценка на токсикологичните характеристики на химикала, е важно да се разгледа потенциалната възможност за невротоксични ефекти. Методът за систематични изследвания при повтарящи се дози вече включва наблюдения, които прикриват потенциалната невротоксичност. Този метод за изпитване може да се използва за определяне на изследване за получаване на допълнителна информация за или която потвърждава невротоксичните ефекти, наблюдавани при систематичните токсикологичните изследвания с повтаряща се доза. Въпреки това, разглеждането на потенциалната невротоксичност в определени класове химикали може да предложи за по-подходящо оценяването чрез използването на метод, без предварителни индикации за потенциална невротоксичност от токсикологичните изследвания при повтаряща се доза. Такова разглеждане включва, например:
|
—
|
наблюдение на неврологичните признаци или невропатологичните увреждания от токсикологични изследвания, различни от систематичните изследвания с повтаряща се доза, или
|
|
—
|
структурна връзка или друга информация, която ги свързва с известни невротоксични вещества.
|
В допълнение, може да има други случаи, при които използването на този метод да е подходящо; за повече подробности вижте (1).
Този метод е разработен, така че да може да бъде приспособен да посрещне особените нужди от потвърждаване на специфичната хистопатологична и мотивационна невропатология на химикала, както и да осигури охарактеризиране и окачествяване на невротоксичните отговори.
В миналото невротоксикологията е била приравнявана с невропатията, включваща невропатологични увреждания или неврологични дисфункции, такива като припадъци, парализи или треперене. Освен това невропатията е важен израз на невротоксикологията. Сега е ясно, че има много други признаци за токсичност на нервната система (напр. загуба на двигателна координация, сензорен дефицит, дисфункции при заучаване и запаметяване), които не биха могли да се отразят на невропатията или други видове изследвания.
Този невротоксикологичен метод за изследване е предназначен за откриване на големи (основни) невроповеденчески и невропатологични ефекти при възрастни гризачи. Докато поведенческите ефекти, дори при отсъствие на морфологични изменения, могат да окажат вредно въздействие върху организма, не всички промени в поведението са характерни за нервната система. Поради това, всички наблюдавани изменения трябва да бъдат оценявани във връзка с корелативните хистопатологични, хематологични или биохимични данни, както и данни от други видове токсичност, засягаща целия организъм. Изследването, за което се говори в този метод, целящ да осигури възможност за охарактеризиране и количествено определяне на невротоксичните отговори, включва специфични хистопатологичнии и поведенчески процедури, които биха могли допълнително да бъдат подпомогнати чрез електрофизиологични и/или биохимични изследвания (1)(2)(3)(4).
Невротоксикантите могат да въздействат върху броя на елементите в рамките на нервната система и чрез разнообразни механизми. Тъй като невротоксичният потенциал на всички вещества може да бъде оценен чрез провеждането на неголям брой изследвания, може да се наложи да се използват други in vivo или in vitro изследвания, които се специфични за вида наблюдавана или очаквана невротоксичност.
Този метод за изследване може също да бъде използван във връзка с насоката, посочена в Ръководството на ОИСР за стратегии и методи за изследване на невротоксичността (1) за планиране на изследванията, които се провеждат, за да се охарактеризира в бъдещето или да се повиши чувствителността при последователното количествено определяне доза—отговор, или за по-доброто оценяване на нивото, при което не се наблюдава вреден ефект, или за потвърждаване на известните или допусканите опасни свойства на химикала. Например изследванията може да имат за цел идентифицирането и оценяването на невротоксичния(ите) механизъм(и) или допълването на вече известна данни, получени при използването на основните невроповеденчески и невропатологични процедури за наблюдения. Не е нужно да се повтарят такива изследвания, данните от които могат да бъдат събрани при прилагане на стандартните процедури, препоръчвани в този метод, ако тези данни са вече налични и ако това не се счита за необходимо при интерпретиране на резултатите от изследването.
Това невротоксикологично изследване, когато се използва самостоятелно или в комбинация, осигурява информация, която:
|
—
|
позволява да се определи, дали нервната система е постоянно или обратимо повлияна от изпитвания химикал;
|
|
—
|
допринася за охарактеризирането на измененията в нервната система, свързани с експозицията на химикала и за разбиране на основния механизъм;
|
|
—
|
позволява да се определи връзката между дозата, времето и отговора, за да се оцени нивото, при което не се наблюдават вредни ефекти (което може да бъде използвано за установяване на критериите за безопасност за химикала).
|
При този метод за изследване изпитваното вещество се въвежда перорално. Възможно е други пътища на постъпване (напр. дермален или инхалаторен) да бъдат по-подходящи, и е възможно да бъде изискано модифициране на препоръчваните процедури. Изборът на път на постъпване се съобразява, в зависимост от профила на експозицията на човека и наличната токсикологична или кинетична информация.
1.2. ОПРЕДЕЛЕНИЯ
Вреден ефект: е всяко свързано с третирането изменение спрямо първоначалното състояние, в резултат на което се повлиява на жизнеспособността на организма, неговата репродуктивност или способността му да се адаптира към условията на околната среда.
Доза: е количеството прието изпитвано вещество. Дозата се изразява като маса (g, mg) или като маса на изпитваното вещество за единица тегло на изследваното животно (напр. mg/kg), или като постоянни хранителни концентрации (ррm).
Дозиране: е общия период, свързан с дозата, честотата на прием и продължителността на дозиране.
Невротоксичност: е вредно изменение в структурата или функционирането на нервната система, в резултат от експозиция с химичен, биологичен или физичен агент.
Невротоксикант: е химичен, биологичен или физичен агент, способен да причини невротоксичност.
NOAEL: е абревиатурата на ниво, при което не се наблюдава вреден (неблагоприятен) ефект и представлява най-високото ниво на дозата, при която не се наблюдават находки (неблагоприятни промени), свързани с вредно въздействие.
1.3. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Изпитваният химикал се приема по орален път на постъпване в обхвата на дози, приемани от няколко групи лабораторни гризачи. Нормално се прилагат повтарящи се дози и режимът на дозиране може да бъде 28 дни, субхроничен (90 дни) или хроничен (1 година или по-дълъг период). Процедурата, представена в този метод, също може да бъде използвана за изследване на остра невротоксичност. Животните се изследват, за да се открият или да се охарактеризират поведенческите и/или неврологичните аномалии. Обхватът, в който може да бъде предизвикана реакция при въздействие от страна на невротоксикантите, се оценява през всеки един период на наблюдение. В края на експеримента подгрупа от животните от всеки пол, във всяка група, се перфузират in situ и секторите на главния мозък, гръбначния мозък и периферните нерви се подготвят и изпитват.
Когато изследването се провежда като самостоятелно изследване за проучване на невротоксичността или за охарактеризиране на невротоксичните ефекти, животните във всяка група, която не се използва за перфузия и последваща хистопатология (вижте таблица 1), могат да бъдат използвани за провеждане на определени невроповеденчески, невропатологични, неврохимични или електрофизиологични процедури, които могат да допълнят данните, получени при стандартните експерименти, чието провеждане се изисква от този метод (1). Тези допълнителни процедури могат да бъдат особено полезни, когато има емпирични наблюдения или се очакват ефекти, индикиращи за специфичен вид или група невротоксичност, предизвикана от химикала. Алтернативно, останалите животни могат да бъдат използвани за други оценки, такива като тези, посочени в методите за изпитване чрез токсикологични изследвания с повтарящи се дози при плъхове.
Когато процедурите на този метод за изследване се комбинират с тези на други методи за изследване, е необходимо да има достатъчен брой животни, за да се удовлетворят изискванията за наблюдения и на двете изследвания.
1.4. ОПИСАНИЕ НА МЕТОДА ЗА ИЗСЛЕДВАНЕ
1.4.1. Избор на животински видове
Предпочитаният вид от групата на гризачите е плъх, въпреки че след обосноваване, и други видове гризачи могат да бъдат използвани. Обикновено при лабораторните опити се използват млади възрастни здрави животни. Женските индивиди трябва да не са раждали и да не са бременни. Дозирането нормално трябва да започне, колкото е възможно по-скоро след отбиването им, но за предпочитане, не по-късно от периода, когато животните са на шест седмици, и преди животните да станат на възраст девет седмици. Обаче, когато това изследване се комбинира с други изследвания, това възрастово изискване се нуждае от обосноваване. В началото на изследването вариациите в теглото на използваните животни трябва да не надвишават ± 20 % от средното тегло за всеки пол. Когато се провежда, за кратък период от време, изследване с повтаряща се доза като предшестващо дългосрочно изследване, и при двете изследвания трябва да бъдат използвани животни от една и съща порода и от един и същ вид.
1.4.2. Условия за отглеждане и хранене
Температурата в стаята на опитните животни трябва да бъде 22 oС (± 3 oС). Въпреки че относителната влажност трябва да бъде поне 30 % и е препоръчително тя да не надвишава 70 % в друг момент, освен при почистване на стаята, трябва да се цели да се постигне 50—60 % относителна влажност. Светлината трябва да бъде изкуствена, с последващи 12 часа светъл период, 12 часа тъмен период. Като минимум трябва да се не се вдига рязък и силен шум. За хранене могат да бъдат използвани конвенционалните лабораторни диети с неограничен достъп до питейна вода. Изборът на диета може да бъде повлиян от нуждата да се осигури подходящо смесване на изпитваното вещество след приемането му по този метод. Животните могат да бъдат настанени в клетките индивидуално или на малки групи от един и същ пол.
1.4.3. Подготовка на животните
Здрави, млади животни са произволно отделени в контролни групи и групи, на които ще се въздейства. Клетките трябва да бъдат подредени по такъв начин, че възможните ефекти, в резултат на местоположението на клетката, да бъдат сведени до минимум. Животните индивидуално се идентифицират и се оставят в клетките си поне (5) пет дни преди започване на изследването, за да се аклиматизират към лабораторните условия.
1.4.4. Път на администриране и подготовка на дозите
При този метод за изследване конкретно се използва орален път на постъпване на изпитваното вещество. Оралният прием може да бъде осъществен чрез принудително хранене, посредством диета, чрез питейната вода или чрез капсули. Други пътища на администриране (напр. кожен или инхалаторен път на постъпване) също могат да бъдат използвани, но може да се изиска модифициране на препоръчваните процедури. Изборът на подходящия път на постъпване се съобразява в зависимост от профила на експозицията на човека и наличната токсикологична или кинетична информация. Трябва да се посочат съображенията за избора на съответния път на постъпване, както и резултатите от модификациите на процедурите на този метод за изпитване.
Когато е необходимо, изпитваното вещество може да бъде разтворено в подходящ разтворител. Препоръчва се да бъде обмислена първо възможността за използване на воден разтвор/суспензия, после — възможността за използване на разтвор/суспензия в масло (напр. царевично масло) и едва след това — възможността за използване на разтвор/суспензия в други разтворители. Трябва да бъдат известни токсичните характеристики на разтворителя. В допълнение, трябва да бъдат дадени следните характеристики на разтворителя: влияние на разтворителя върху абсорбцията, разпределението, метаболизма или задържането на изпитваното вещество, което може да промени токсичните си характеристики; и ефектите върху консумирането на храна или вода, или хранителното/питателното състояние на животните.
1.5. ПРОЦЕДУРИ
1.5.1. Брой и пол на животните
Когато изследването се провежда като самостоятелно изследване, трябва да бъдат използвани поне 20 животни (10 от женски пол и 10 от мъжки пол) за всяка доза и контролна група при оценяването на подробните клинични и функционални наблюдения. Най- малко пет животни от мъжки пол и пет животни от женски пол трябва да бъдат подложени на перфузия in situ и използвани за снемане на подробна неврохистопатология в края на изследването. В случаите, при които се наблюдава за признаци на невротоксични ефекти само група от ограничен брой животни, при дадена доза, трябва да бъде обърнато внимание на включването на тези животни в онези групи, избрани за перфузия. Когато изследването се провежда в комбинация с изследване за токсичност с повтарящи се дози, трябва да бъдат използвани подходящ брой животни, за да се постигнат целите и на двете изследвания. Минималният брой животни в група при различните комбинации от изследвания са представени в таблица 1. Ако се планира убиване или наблюдение на обратимостта, продължаването или забавеното появяване на токсични ефекти след третирането при възстановяващи се групи или когато се отчитат допълнителни наблюдения, тогава броят на животните трябва да бъде увеличен, за да бъде сигурно, че необходимият брой животни за наблюдения и хистопатология е в наличност.
1.5.2. Третирани и контролни групи
Обикновено се използват групи, третирани с най-малко три дози и контролна група, но ако от оценката на други данни се установи, че не трябва да се очакват ефекти при повтаряща се доза от 1 000 mg/kg телесно тегло/ден, може да бъде проведено ограничено изследване. Ако няма подходящи налични данни, може да бъде проведено изследване за намиране на обхвата, с което да се подпомогне определянето на дозите, които ще бъдат използвани. С изключение на третиране с изпитваното вещество, животните в контролната група трябва да бъдат отглеждани по идентичен начин на този, при животните от третираната група. Ако се използва разтворител при администриране на изпитваното вещество, контролната група трябва да приеме количество, равняващо се на най-високия използван обем на разтворителя.
1.5.3. Проверка за достоверност
Лабораторията, провеждаща изследването, трябва да представи данни, удостоверяващи способността ѝ да извърши изследването и чувствителността на използваната процедура. Тези данни трябва да осигуряват доказателство за способността за откриване и количествено определяне, където е подходящо, на промените в различните крайни точки, препоръчвани за наблюдение, такива като автономни признаци, сензорни реакции, силно схващане на крайниците и двигателна активност. Информация за химикалите, които причиняват различни видове невротоксични отговори и които могат да бъдат използвани като вещества за позитивен контрол, може да бъде намерена в препратки от 2 до 9. Могат да бъдат използвани исторически данни, ако съществените аспекти на експерименталните процедури остават едни и същи. Препоръчва се периодично актуализиране на историческите данни. Трябва да бъдат получени нови данни, демонстриращи непрекъснатата/непроменената чувствителност на процедурите, когато някои важни елементи при провеждането на изследването или процедурите, са били променени от изпитващата лаборатория.
1.5.4. Избор на доза
Нивата на дозите трябва да бъдат избрани като се вземат предвид всякакви предварително налични данни за наблюдаваните токсичност и кинетика при изпитваното съединение или свързани с него материали. Нивото на най-високата доза трябва да бъде избрано с цел да се предизвикат невротоксични ефекти или ясни системни токсични ефекти. Следователно намаляващата поредица от нива на дозите трябва да бъде избирана с оглед на получаване на някакъв, предизвикан от дозата, отговор и липсата на наблюдаван вреден ефект (NOAEL) при най-ниското ниво на дозата. По принцип нивата на дозите трябва да бъдат определени така, че началните токсични ефекти върху нервната система да могат да бъдат разграничени от ефектите, свързани със засягащата целия организъм токсичност. Два до три интервала често са достатъчни (оптимум) и добавянето на четвърта група за изпитване често е за предпочитане при използването на много големи интервали (напр. повече от фактор 10) между дозите. Където е възможно, трябва да се има предвид, че трябва да се направи разумна (приемлива) оценка на експозицията върху хората.
1.5.5. Гранично изследване
Ако изследването при еднократно ниво на доза от най-малко 1 000 mg/kg телесно тегло/ден, което използва описаната процедура, не предизвиква видими невротоксични ефекти и ако не би трябвало да се очаква токсичност, въз основа на данни от структурно свързани (структурноподобни) съединения, тогава може да не е необходимо провеждането на пълното изследване, използващо три нива на дозите. Очакваната експозиция върху хората може да индикира необходимостта при ограниченото изследване да бъде използвано по-високо ниво на дозиране чрез орален прием. При други пътища на администриране, такива като инхалация или дермално прилагане, често физико-химичните свойства на изпитваното вещество може да наложат максималното достижимо ниво на експозицията. За провеждането на изследване за остра орална токсичност дозата за ограничено изследване трябва да бъде поне 2 000 mg/kg.
1.5.6. Прием на дозите
Животните се дозират с изпитваното вещество ежедневно, в продължение на седем дни, всяка седмица, за период най-малко от 28 дни; използването на петдневен режим на дозиране или на по-кратък период на експозиция, е необходимо да бъде обосновано. Когато изпитваното вещество се приема чрез принудително хранене, това трябва да се прави с еднократна доза, посредством стомашна тръба или подходяща интубационна канюла. Максималният обем течност, който може да бъде администриран на един прием, зависи от размера на изследваното животно. Обемът не трябва да надвишава 1 ml/100 g телесно тегло. В случай на водни разтвори, обаче, може да бъде обмислена евентуалното използване на количество до 2 ml/100 g телесно тегло. С изключение на дразнещи или корозивни вещества, които обикновено показват изострени дразнещи ефекти при по-високи концентрации, варирането (променливостта) в изпитвания обем трябва да бъде минимизирано чрез регулиране на концентрацията, за осигуряване на постоянен обем при всички нива на дозите.
За вещества, приемани чрез диетата или питейната вода, е важно да се удостовери, че включените в тях количества на изпитваното вещество, не оказват влияние върху нормалното хранене или водния баланс. Когато изпитваното вещество се приема в диетата, могат да бъдат използвани постоянната диетична концентрация (ррm) или постоянно ниво на дозата спрямо телесното тегло на животното; трябва да бъде определена и алтернатива за използване. За вещество, администрирано чрез принудително хранене, дозата трябва да бъде давана по подобни начини ежедневно, и регулирана при необходимост за поддържане или постоянно ниво на дозата спрямо телесното тегло на животното. Когато се използва изследване с повтаряща се доза като предшестващо (предварително) дългосрочно изследване, и при двете изследвания трябва да бъде използвана подобна диета. При изследване за остра токсичност, ако не е възможно еднократно дозиране, дозата може да бъда давана на малки порции (фракции, части) в продължение на период, който не надвишава 24 часа.
1.6. НАБЛЮДЕНИЯ
1.6.1. Честота на наблюденията и изследванията
При изследвания с повтарящи се дози, периодът на наблюдения трябва да покрива периода на дозиране. При изследване за остра токсичност трябва да се извършат наблюдения в 14-дневния период след третирането. При животни от сателитните (съпътстващите) групи, които не са подложени на експозиция през периода след третирането, наблюденията трябва да покриват същия този период.
Наблюденията трябва да бъдат правени достатъчно често, за да се увеличи в максимална степен вероятността за откриване на някакви поведенчески и/или неврологични аномалии. За предпочитане е наблюденията да бъдат правени по едно и също време всеки ден, като се обърне внимание на максималния период за очаквани ефекти след дозирането. Честотата на клиничните наблюдения и функционалните изследвания е резюмирана в таблица 2. Ако кинетични или други данни, събрани от предишни изследвания, показват необходимост от използване на различни времеви моменти за наблюдения, изследвания или периодите след наблюдение, трябва да бъде приет алтернативен график, за да се получи в максимална степен информация. Трябва да се обмисли и обосновка на промените в графика.
1.6.1.1. Наблюдения върху общото здравословно състояние и смъртност/заболеваемост
Всички животни трябва да бъдат внимателно наблюдавани най-малко веднъж на ден, във връзка с тяхното здравословно състояние, както и най-малко два пъти дневно, в случай на заболяване или смърт.
1.6.1.2. Подробни клинични наблюдения
Подробни клинични наблюдения трябва да бъдат правени върху всички, избрани за тази цел, животни (вижте таблица 1), веднъж преди първата експозиция (за да са възможни сравнения в тази връзка) и на различни интервали от време след това, в зависимост от продължителността на изследването (вижте таблица 2). Подробни клинични наблюдения върху сателитни (съпътстващи) възстановяващи се групи трябва да бъдат направени в края на възстановителния период. Подробните клинични наблюдения трябва да бъдат направени извън домашната клетка на стандартна арена. Те трябва внимателно да бъдат записани чрез използване на голям брой системи, които включват критерии или голям брой мащаби за всяко измерване при наблюденията. Използваните критерии или мащаби трябва да бъдат ясно (категорично) определени от изпитвателната лаборатория. Трябва да бъде направено усилие да се осигури минимално вариране в условията за изследване (несистематично свързани с третирането) и тези наблюдения да се провеждат от обучени наблюдатели, които не са запознати с действителното третиране.
Препоръчва се наблюденията да бъдат провеждани по структуриран начин, в който систематично се прилагат добре дефинирани критерии (включително определението на понятието „обхват“) при всяко животно за всяко време на наблюдение. „Нормалният обхват“ трябва да бъда адекватно документиран. Всички наблюдавани признаци трябва да бъдат записани. Когато е възможно, големината (размерът) на наблюдаваните признаци също трябва да бъде записана. Клиничните наблюдения трябва да включват, но без да се ограничават до, изменения в кожа, козина, очи, лигавици, поява на секреция и екскреция и автономна дейност (напр. лакримация, пилоерекция, размер на зениците, необичайни респираторни модели и/или дишане през устата, някакви необичайни признаци на уриниране и дефекация, и обезцветена урина).
Всякакви необичайни отговори, свързани с положение на тялото, ниво на активност (напр. понижено или повишено проучване на стандартна арена) и координация на движенията трябва да бъдат отбелязани. Промените в походката (напр. клатушкаща се „патешка“ походка, атаксия), позата (напр., претърбване) и реактивността при отглеждане, поведение или други стимули на околната среда, както и наличието на клонични или тонични (ободряващи) движения, конвулсии или тремори, стереотипи (напр. прекомерено чесане, необичайни движения на главата, серийни (стандартни) цикли) или странно поведение (напр. хапане или прекомерено облизване, самоосакатяване, вървеж в обратна посока (на заден ход), издаване на двуци) или агресивност трябва да бъдат записани.
1.6.1.3. Функционални изследвания
По подобие на подробните клинични наблюдения, функционалните изследвания също трябва да бъдат проведени веднъж преди експозицията и често след това при всички, избрани за тази цел, животни (вижте таблица 1). Честотата на функционалното изследване също зависи от продължителността на експеримента (вижте таблица 2). В допълнение към периодите на наблюдение, посочени в таблица 2, трябва да бъдат направени функционални наблюдения върху сателитните възстановяващи се групи, колкото е възможно по-близо, до момента на убиването при завършване на изследването. Функционалните изследвания трябва да включват сензорна реактивност към стимули от различен вид (модалност) [напр. слухови, визуални и рецепторни стимули (5)(6)(7)], оценка на силата на схващане на крайниците (8) и оценка на двигателната активност (9). Двигателната активност трябва да бъде измерена с автоматичен уред, способен да улови и пониженията, и повишенията в активността. Ако се използва друга определена система, тя трябва да бъде количествено определена и нейната чувствителност и надеждност трябва да бъде демонстрирана. Всеки уред трябва да бъда проверен, за да се осигури надеждност през време на и при съвместимост между уредите. Повече подробности за процедурите, които трябва да бъдат следвани, са дадени в съответните препратки. Ако няма данни (напр. структура — активност, епидемиологични данни, други токсикологични изследвания), които да индикират потенциалните невротоксични ефекти, трябва да бъде обмислено включването на по-специализирани изследвания на сензорната и двигателната функция или научаване и запаметяване, за по-подробно изследване на тези възможни ефекти. Повече информация за по-специализираните изследвания и тяхното използване е представена в (1).
По изключение, животните, които проявяват признаци на токсичност в степен, която значително би повлияла на функционалното изследване, могат да бъдат извадени от това изследване. Трябва да бъда представено обяснение (да се обоснове) елиминирането на животните от функционалното изследване.
1.6.2. Телесно тегло и консумация на храна/вода
При изследвания с продължителност до 90 дни, всички животни трябва да бъдат претегляни поне веднъж на седмица и трябва да бъдат правени най-малко ежеседмични измервания на консумацията на храна (консумацията на вода, когато изпитваното вещество се администрира чрез такава среда). При дългосрочни изследвания, всички животни трябва да бъдат претегляни поне веднъж седмично, в продължение на първите 13 седмици и най-малко веднъж на всеки четири седмици след това. Трябва да бъдат правени измервания и на консумацията на храна (консумацията на вода, когато изпитваното вещество се администрира чрез такава среда) поне веднъж седмично, в продължение на първите 13 седмици и след това на приблизителни тримесечни интервали, освен ако промени в здравословното състояние или в телесното тегло не налагат нещо друго.
1.6.3. Офталмология
При изследвания, по-дълги от 28 дни, офталмологичното изследване, използващо офталмоскоп или подходящ еквивалентен инструмент, следва да бъде проведено преди администрирането на изпитваното вещество и при завършване на изследването, за предпочитане при всички животни или поне при животните, при които се прилага високата доза, и при тези от контролните групи. Ако се открият изменения в очите или ако клинични признаци покажат такава необходимост, всички животни следва да бъдат изследвани. При дългосрочни (продължителни) изследвания офталмологичното изследване следва също да бъде провеждано в продължение на 13 седмици. Не е необходимо провеждането на офталмологични изследвания, ако вече има такива данни от други изследвания с подобна продължителност и при подобни нива на дозите.
1.6.4. Хематология и клинична биохимия
Когато невротоксичното изследване се провежда в комбинация със систематично токсикологично изследване с повтарящи се дози, следва да бъдат проведени хематологични изследвания и клиничните биохимични определяния, както е посочено в съответния метод за систематично токсикологично изследване. Изборът на образци следва да бъде направен по такъв начин, че всякакви потенциални ефекти за неврологичното поведение да са минимизирани.
1.6.5. Хистопатология
Невропатологичното изследване е предназначено за допълване и разширяване на наблюденията, правени по време на in vivo фазата на изследването. Тъкани от поне 5 животни/пол/група (вж. таблица 1 и следващия параграф) следва да бъдат фиксирани in situ, чрез използване на общопознати перфузионни и фиксиращи техники (вж. препратка 3, глава 5 и препратка 4, глава 50). Всички наблюдавани цялостни промени следва да бъдат записани. Когато изследването се провежда като самостоятелно изследване за скрининг за невротоксичност или за охарактеризиране на невротоксичните ефекти, останалите части от животните могат да бъдат използвани и за специфични невроповеденчески (10)(11), невропатологични (10)(11)(12)(13), неврохимични (10)(11)(14)(15) или електрофизиологични (10)(11)(16)(17) процедури, които могат да подпомогнат процедурите и изследванията, описани тук, или да повишат броя на изследваните обекти от хистопатологията. Тези спомагателни процедури са от особено значение, когато емпирични наблюдения или очаквани ефекти индикират за специфичен вид или група невротоксичност (2)(3). Алтернативно, останалите части от животните могат също да бъде използвани за рутинни патологични оценки, както е описано в метода за изследвания с повтаряща се доза.
Следва да бъде изпълнена цялостно оцветяваща процедура, такава като хематоксилин и еозин (Н&Е), върху всички тъканни екземпляри (проби), поставени в парафин, и следва да бъде проведено микроскопско изследване. Ако се допускат или се наблюдават признаци на периферна невропатия, следва да бъдат изследвани пластично поставени проби от периферна нервна тъкан. Клиничните признаци също могат да предложат допълнителни места за изследване или използване на специални оцветяващи процедури. Насока за определянето на допълнителни места, които да бъдат изследвани, може да бъде намерена в (3)(4). Специални подходящи оцветители за демонстриране на определени видове патологични промени могат също да бъдат от полза (18).
Хистологично следва да бъдат изследвани представителни сектори (части) от централната и периферната нервна система (вж. препратка 3, глава 5 и препратка 4, глава 50). Изследваните зони обикновено включват: предния мозък, центъра на главния мозък, включително сектора през хипокампуса, средния мозък, малкия мозък, продълговатия мозък, окото с оптичния нерв и ретината, лимфния възел при цервикален и лумбарен оток (подутина), гръбначните коренови ганглии, гръбначните и коремните коренови влакна (нишки), разположения близо до средата на тялото седалищен нерв, разположения близо до средата на тялото тибиален нерв (при коляното) и мускулните разклонения при тибиалния нерв на прасеца. Секторите от лимфния възел и периферните нерви следва да включват едновременно кръстосани или напречни и надлъжни сектори. Следва да бъде обърнато внимание на васкулатурата на нервната система. Проба от скелетен мускул, особено мускула на прасеца, следва също да бъде изследвана. Специално внимание следва да бъда отделено на местата с клетъчна и нишковидна структура и известните модели в CNS и PNS, които ще бъдат особено повлияни от невротоксикантите.
Насока за невропатологичните алтернативи, които обикновено произтичат от експозиция на токсичен агент, може да бъде намерена в препратки (3)(4). Препоръчва се да се проведе поетапно изследване на тъканни проби, при което сектори от групата, дозирана с висока доза, първо се сравняват с тези от контролната група. Ако не се наблюдават невропатологични изменения в пробите от тези групи, не се изискват следващи анализи. Ако се наблюдават невропатологични изменения в групата с по-висока доза, следва да бъде взета проба от всяка от потенциално повлияните тъкани от групите със средна и ниска доза и впоследствие да бъдат кодирани и изследвани.
Ако бъде открито някакво доказателство за невропатологични изменения при количественото определяне, тогава следва да бъде проведено второ изследване за всички области от нервната система, показващи такива изменения. Сектори от всички дозирани групи от всяка от потенциално повлияните области следва да бъдат кодирани и изследвани произволно, без да е известен кодът. Честотата и тежестта на всяко поражение следва да бъдат записани. След като бъдат оценени всички области от всички дозирани групи, кодът може да бъде разкрит и да бъде проведен статистически анализ за оценяване на зависимостта доза—отговор. Следва да бъдат описани примери за различните степени на тежест при всяко поражение.
Невропатологичните находки следва да бъдат оценени в контекста на наблюденията и измерванията върху поведението, както и от други данни от предишни и паралелни изследвания за токсичността за целия организъм от изпитваното вещество.
2. ДАННИ
2.1. ОБРАБОТВАНЕ НА РЕЗУЛТАТИТЕ
Следва да бъдат осигурени индивидуални данни. В допълнение, всички данни следва да бъдат резюмирани в таблична форма, която да показва при всяко изследване или контролна група броя на животните в началото на изследването, броя на животните, намерени мъртви по време на изследването или убити по хуманни съображения, броя на появилите се признаци на токсичност, описание на наблюдаваните признаци на токсичност, включително време на появата им, продължителност, вид и тежест на всеки от токсичните ефекти, броя на животните, показващи поражения, включително вид и тежест на поражението(ята).
2.2. ОЦЕНКА И ИНТЕРПРЕТИРАНЕ НА РЕЗУЛТАТИТЕ
Находките от изследването следва да бъдат оценени по отношение на разпространение, тежест и корелация на невроповеденчески и невропатологични ефекти (неврохимични или електрофизиологични ефекти, както и ако са били включени допълнителни изследвания) и на всички други наблюдавани вредни ефекти. Когато е възможно, следва да се оценят получените числени резултати чрез използване на подходящ и общоприет статистически метод. Статистическите методи следва да бъдат избрани при планирането (проектирането) на изследването.
3. ОТЧИТАНЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Протоколът от изпитването следва да включва следната информация:
|
|
Изпитвано вещество:
|
—
|
физична природа (включително изомеризация, чистота и физикохимични свойства);
|
|
—
|
данни за идентичността.
|
|
|
|
Разтворител (ако има такъв):
|
—
|
обосноваване на избора на разтворител, ако е различен от вода.
|
|
|
|
Изследвани животни:
|
—
|
използвани видове/породи;
|
|
—
|
брой, възраст и пол на животните;
|
|
—
|
водоизточник, условия за отглеждане, аклиматизация, диета и т.н.;
|
|
—
|
индивидуално тегло на животните в началото на изследването.
|
|
|
|
Условия на изследването:
|
—
|
подробности за формулирането на изпитваното вещество/приготвянето на диетата, постигната концентрация, стабилност и хомогенност на препарата;
|
|
—
|
определяне на администрираните дози, включително подробности за разтворителя, обема и физичната форма на приемания материал;
|
|
—
|
подробности за администрирането на изпитваното вещество;
|
|
—
|
обосноваване на избраните нива на дозата;
|
|
—
|
обосноваване на пътя на постъпване и продължителността на експозицията;
|
|
—
|
конверсия от диета/питейна вода с концентрация на изпитваното вещество (ррm) към активна доза (mg/kg телесно тегло/ден), ако е приложимо;
|
|
—
|
подробности за качеството на храната и водата.
|
|
|
|
Наблюдения и процедури за изследване:
|
—
|
подробности за отнасянето на животните от всяка група към перфузионните подгрупи;
|
|
—
|
подробности за точковите системи за оценяване, включително критерии и точкови мащаби за всяко измерване при подробните клинични наблюдения;
|
|
—
|
подробности за функционалните изследвания на сензорната реактивност за стимулиране на различни модалности (напр. слухови, визуални и рецепторни); за оценка на издръжливостта при контролиране на крайниците; за оценка на двигателната активност (включително подробности за автоматизираните устройства за определяне на активността); и други използвани процедури;
|
|
—
|
подробности от офталмологичните изследвания и, където е подходящо, хематологичните изследвания и клиничните биохимични изследвания със съответните стойности на базовата линия;
|
|
—
|
подробности за специфичните невроповеденчески, невропатологични, неврохимични или електрофизиологични процедури.
|
|
|
|
Резултати:
|
—
|
телесно тегло/промени в телесното тегло, включително на телесното тегло при убиването;
|
|
—
|
консумация на храна и консумация на вода, където е подходящо;
|
|
—
|
данни за токсичен отговор по пол и ниво на дозата, включително признаци на токсичност или смърт;
|
|
—
|
вид, острота и продължителност (начално време и следващ курс) на подробните клинични наблюдения (дали са обратими или не);
|
|
—
|
подробно описание на всички функционални резултати от изследването;
|
|
—
|
находки при аутопсията;
|
|
—
|
подробно описание на всички невроповеденчески, невропатологични и неврохимични или електрофизиологични находки, ако има такива;
|
|
—
|
данни за абсорбцията и метаболизма, ако има такива;
|
|
—
|
статистическа обработка на резултатите, ако е подходящо.
|
|
|
|
Обсъждане на резултатите;
|
—
|
информация за дозата, при която има отговор;
|
|
—
|
връзка на някои други токсични ефекти със заключението за невротоксичния потенциал на изпитваното вещество;
|
|
—
|
ниво, при което не се наблюдава вреден ефект.
|
|
|
|
Заключения:
|
—
|
препоръчва се да се представи специфично изявление относно цялостната невротоксикология на изпитваното вещество.
|
|
4. ПРЕПРАТКИ
|
(1)
|
OECD Giudance Document on Neurotoxicity Testing Strategies and Test Methods. OECD, Paris, In Preparation.
|
|
(2)
|
Test Guideline for a Developmental Neurotoxicity Study, OECD Guidelines for the Testing of Chemicals. In preparation.
|
|
(3)
|
World Health Organization (WHO) (1986). Environmental Health Criteria document 60: Principles and Methods for the Assessment of Neurotoxicity associated with Exposure to Chemicals.
|
|
(4)
|
Spencer, P. S. and Schaumburg, H. H. (1980). Experimental and Clinical Neurotoxicology. Eds. Spencer, P. S. and Schaumburg, H. H. eds. Williams and Wilkins, Baltimore/London.
|
|
(5)
|
Tupper, D.E. and Wallace, R. B. (1980). Utility of the Neurological Examination in Rats. Acta Neurobiol. Exp., 40, 999—1003.
|
|
(6)
|
Gad, S. C. (1982). A Neuromuscular Screen for Use in Industrial Toxicology. J. Toxicol. Environ. Health, 9, 691—704.
|
|
(7)
|
Moser, V. C., McDaniel, K. M. and Phillips, P. M. (1991). Rat Strain and Stock Comparisons Using a Functional Observational Battery: Baseline Values and Effects of amitraz. Toxic. Appl. Pharmacol., 108, 267—283.
|
|
(8)
|
Meyer, O. A., Tilson, H. A., Byrd, W. C. and Riley, M. T. (1979). A Method for the Routine Assessment of Fore and Hind-limb Grip Strength of Rats and Mice. Neurobehav. Toxicol., 1, 233—236.
|
|
(9)
|
Crofton, K. M., Haward, J. L., Moser, V. C., Gill, M. W., Reirer, L. W., Tilson, H. A. and MacPhail, R. C. (1991) Interlaboratory Comparison of Motor Activity Experiments: Implication for Neurotoxicological Assessments. Neurotoxicol. Teratol., 13, 599—609.
|
|
(10)
|
Tilson, H. A., and Mitchell, C. L. eds. (1992). Neurotoxicology Target Organ Toxicology Series. Raven Press, New York.
|
|
(11)
|
Chang, L. W., ed. (1995). Principles of Neurotoxicology. Marcel Dekker, New York.
|
|
(12)
|
Broxup, B. (1991). Neuopathology as a screen for Neurotoxicity Assessment. J. Amer. Coll. Toxicol, 10, 689—695.
|
|
(13)
|
Moser, V. C., Anthony, D. C., Sette, W. F. and MacPhail, R. C. (1992). Comparison of Subchronic Neurotoxicity of 2-Hydroxyethyl Acrylate and Acrylamide in Rats. Fund. Appl.Toxicol, 18, 343—352.
|
|
(14)
|
O'Callaghan, J. P. (1988). Neurotypic and Gliotypic Proteins as Biochemical Markers of Neurotoxicity. Eurotoxicol. Teratol., 10, 445—452.
|
|
(15)
|
O'Callaghan J.P. and Miller, D. B. (1988). Acute Exposure of the Neonatal Rat to Triethyltin Results in Persistent Changes in Neurotypic and Gliotypic Proteins. J. Pharmacol. Exp. Ther., 244, 368—378.
|
|
(16)
|
Fox. D. A., Lowndes, H. E. and Birkamper, G. G. (1982). Electrophysiological Techniques in Neurotoxicology. In: Nervous System Toxicology. Mitchell, C. L. ed. Raven Press, New York, pp 299—335.
|
|
(17)
|
Johnson, B. L. (1980). Electrophysiological Methods in neurotoxicity Testing. In: Experimental and Clinical Neurotoxicology. Spencer, P. S. and Schaumburg, H. H. eds., Williams and Wilkins Co., Baltimore/London, pp. 726—742.
|
|
(18)
|
Bancroft, J. D. and Steven A. (1990). Theory and Pratice of Histological Techniques. Chapter 17, Neuropathological Techniques. Lowe, James and Cox, Gordon eds. Churchill Livingstone.
|
Таблица 1
Минимален брой животни в група, когато невротоксикологично изследване се провежда отделно или комбинирано с други изследвания
|
|
НЕВРОТОКСИКОЛОГИЧНО ИЗСЛЕДВАНЕ, ПРОВЕДЕНО КАТО:
|
|
отделно изследване
|
комбинирано изследване с 28-дневно изследване
|
комбинирано изследване с 90-дневно изследване
|
комбинирано изследване с изследване за хронична токсичност
|
|
Общ брой животни в група
|
10 мъжки и 10 женски
|
10 мъжки и 10 женски
|
15 мъжки и 15 женски
|
25 мъжки и 25 женски
|
|
Брой на животните, избрани за функционално изследване, включващо подробни клинични наблюдения
|
10 мъжки и 10 женски
|
10 мъжки и 10 женски
|
10 мъжки и 10 женски
|
10 мъжки и 10 женски
|
|
Брой на животните, избрани за перфузия in situ и за неврохистопатология
|
5 мъжки и 5 женски
|
5 мъжки и 5 женски
|
5 мъжки и 5 женски
|
5 мъжки и 5 женски
|
|
Брой на животните, избрани за наблюдения при повтарящи се дози/субхронична/хронична токсичност, хематология, клинична биохимия, хистопатология и други, както е указано в съответните ръководства
|
|
5 мъжки и 5 женски
|
10 мъжки (10) и 10 женски (10)
|
20 мъжки (10) и 20 женски (10)
|
|
Допълнителни наблюдения, където е подходящо
|
5 мъжки и 5 женски
|
|
|
|
Таблица 2
Честота на клиничните наблюдения и функционалните изследвания
|
Вид наблюдения
|
Продължителност на изследването
|
|
остро
|
28-дневно
|
90-дневно
|
хронично
|
|
При всички животни
|
Общо здравословно състояние
|
Ежедневно
|
Ежедневно
|
Ежедневно
|
Ежедневно
|
|
Смъртност/заболеваемост
|
Два пъти дневно
|
Два пъти дневно
|
Два пъти дневно
|
Два пъти дневно
|
|
При животни, избрани за функционални наблюдения
|
Подробни клинични наблюдения
|
|
—
|
преди първата експозиция
|
|
—
|
през 8 часа от дозиране при оценяваното време за слаб ефект
|
|
—
|
на 7-ия и 14-ия ден след дозирането
|
|
|
—
|
преди първата експозиция
|
|
—
|
след това веднъж седмично
|
|
|
—
|
преди първата експозиция
|
|
—
|
веднъж по време на първата или втората седмица от експозицията
|
|
|
—
|
преди първата експозиция
|
|
—
|
веднъж в края на първия месец от експозицията
|
|
—
|
на всеки три месеца след това
|
|
|
Функционални изследвания
|
|
—
|
преди първата експозиция
|
|
—
|
през 8 часа от дозиране при оценяваното време за слаб ефект
|
|
—
|
на 7-ия и 14-ия ден след дозирането
|
|
|
—
|
преди първата експозиция
|
|
—
|
през четвъртата седмица на третиране, колкото се може по-близо до края на периода на експозицията
|
|
|
—
|
преди първата експозиция
|
|
—
|
веднъж по време на първата или втората седмица от експозицията
|
|
|
—
|
преди първата експозиция
|
|
—
|
в края на първия месец от експозицията
|
|
—
|
на всеки три месеца след това
|
|
Б.44. КОЖНА АБСОРБЦИЯ: IN VIVO МЕТОД
1. МЕТОД
Този метод на изпитване е еквивалентен на OECD TG 427 (2004).
1.1. ВЪВЕДЕНИЕ
Излагането на много от химичните вещества става предимно през кожата, докато по-голямата част от токсикологичните изследвания, направени върху лабораторни животни, използват оралния път на прилагане. Изследването за перкутанна абсорбция in vivo, описано в тези насоки, осигурява връзката, необходима за екстраполиране на орални изследвания, при правенето на оценки за безопасност след кожно излагане.
Едно вещество следва да премине през голям брой слоеве на кожата, преди да достигне до обращението. Слоят, който определя степента на преминаване за повечето вещества, е stratum corneum, състоящ се от мъртви клетки. Проницаемостта през кожата зависи както от липофилността на веществото, така и от дебелината на външния слой на епидермиса, наред с фактори като молекулно тегло и концентрация на веществото. Като цяло, кожата на плъховете и зайците е по-проницаема, отколкото тази на хората, докато проницаемостта на кожата на морските свинчета и маймуните е по-сходна с човешката.
Методите на измерване на перкутанна абсорбция могат да се разделят на две категории: in vivo и in vitro. Методът in vivo може да осигурява добра информация в различни видове лабораторни животни за кожната абсорбция. Неотдавна бяха разработени методите in vitro. Те използват транспорта през напълно или частично дебела животинска или човешка кожа до резервоар с флуид. Методът in vitro e описан като отделен метод на изпитване (1). Препоръчва се да се направи консултация с документа за насоки на OECD за провеждане на изследвания за кожна абсорбция (2), за да се подпомогне изборът на най-подходящ метод при всеки отделен случай, тъй като той дава повече подробности за това, кога е подходящ методът in vivo и кога — методът in vitro.
Методът in vivo, който се описва в този метод, позволява определянето на проникването на изпитваното вещество през кожата във вътрешните органи. Техниката е широко използвана от много години насам (3)(4)(5)(6)(7). Въпреки че изследванията in vitro на перкутанна абсорбция могат в много случаи да са подходящи, може да има случаи, в които единствено изследване in vivo може да осигури необходимите данни.
Предимствата на метода in vivo са, че той използва физиологично и метаболитно незасегната система, използва видове, които се използват за много от изследванията за токсичност, и може да се модифицира за прилагане при други видове. Недостатъците са използването на живи животни, нуждата от радиоактивно белязан материал, за да се подпомогне получаването на надеждни резултати, трудности при определяне на ранната фаза на абсорбция и разликите в проницаемостта на предпочетения вид (плъх) и човешката кожа. Животинската кожа като цяло е по-проницаема и поради това човешката перкутанна абсорбция може да се надцени (6)(8)(9). Каустици/корозивни вещества не бива да се тестват върху живи животни.
1.2. ОПРЕДЕЛЕНИЯ
Неабсорбирана доза: представлява дозата, измита от кожната повърхност след излагане, и всяка доза, която е налице върху неоклузивната превръзка, включително всяка доза, за която бъде доказано, че се е изпарила от кожата по време на излагане.
Абсорбирана доза (in vivo
): състои се от дозата, налична в урината, от измиване на клетката, изпражненията, издишания въздух (ако е измерен), кръвта, тъканите (ако са събирани) и останалия труп след отстраняване на кожата от мястото на прилагане.
Абсорбируема доза: представлява дозата, която е останала по или в кожата след измиване.
1.3. ПРИНЦИП НА МЕТОДА НА ИЗПИТВАНЕ
Изпитваното вещество, за предпочитане е то да е радиоактивно белязано, се нанася върху остриганата кожа на животните при едно или повече подходящи нива на дозиране, под формата на представителен препарат за употреба. Изпитваният препарат се оставя в контакт с кожата за определен период от време под подходяща превръзка (неоклузивна, полуоклузивна или оклузивна), за да се предотврати поглъщането на изпитвания препарат от животното. В края на времето за излагане превръзката се отстранява, кожата се почиства с подходящ измиващ агент, като превръзката и измиващите материали се запазват за анализ, и се поставя нова превръзка. Животните се отглеждат преди, по време и след периода на излагане в индивидуални метаболитни клетки, като екскретите и издишаният въздух през тези периоди се събират за анализ. Събирането на издишания въздух може да се пропусне, когато има достатъчно информация, че не се образува почти никакъв или никакъв летлив радиоактивен метаболит. Всяко изследване обикновено включва няколко групи животни, които се излагат на препарата за изпитване. Една група ще бъде убита в края на периода на излагане. Другите групи ще бъдат убити след това на определени интервали от време (2). В края на периода, определен за взимане на проби, се убиват останалите животни, взима се кръв за анализ, мястото на прилагане се отстранява за анализ, а трупът се анализира за неекскретиран материал. Пробите се изпитват със съответните методи и се установява степента на перкутанна абсорбция (6) (8) (9).
1.4. ОПИСАНИЕ НА МЕТОДА
1.4.1. Избор на животинския вид
Плъхът е най-често използваният вид, но могат да се използват и породите без козина или тези, които имат степен на кожна абсорбция, сходна с тази при хората (3) (6) (7) (8) (9). Следва да се използват млади, зрели и здрави животни от един и същи пол (като по подразбиране се използва мъжкият пол) на широко използвани лабораторни породи. В началото на изследването разликите в теглото на използваните животни не трябва да надвишават ± 20 % от средното тегло. За пример, подходящи са мъжки плъхове с тегло 200—250 g, особено в горната част на тези граници.
1.4.2. Брой и пол на животните
За всеки препарат на изпитване и за всяка предварително определена продължителност следва да се използва група от поне четири животни от един и същи пол. Всяка група животни ще бъде убита след различен интервал от време, например в края на периода на експониране (обикновено от 6 до 24 часа) и последващи случаи (например 48 и 72 часа). Ако има данни, показващи съществени разлики в дермалната токсичност между женски и мъжки, следва да се избере по-чувствителният пол. Ако няма такива данни, може да се използва който и да е пол.
1.4.3. Условия на отглеждане и хранене
Температурата в експерименталното помещение с животните трябва да бъде 22 oС (± 3 oС). Въпреки че относителната влажност трябва да е поне 30 % и за предпочитане да не превишава 70 %, освен по време на почистване на помещението, целта следва да е 50—60 %. Осветлението трябва да бъде изкуствено, като последователността е 12 часа светлина, 12 часа тъмнина. За хранене могат да се използват конвенционалните лабораторни храни, които да бъдат напълно достъпни заедно с неограничено количество питейна вода. По време на изследването и за предпочитане също по време на аклиматизацията животните трябва да се държат поединично в метаболитни клетки. Тъй като разпръсването на храна и вода би компроментирало резултатите, възможността това да се случи трябва да бъде сведена до минимум.
1.4.4. Подготовка на животните
Животните се бележат, за могат да бъдат индивидуално идентифицирани, и се държат в клетките си за период поне от пет дни преди началото на изследването, за да могат да се аклиматизират към лабораторните условия.
След периода на аклиматизация и приблизително 24 часа преди прилагането на изпитваното вещество, участък от гърба в областта на раменете на всяко животно се остригва до кожа. Свойствата на проникване на увредена кожа са различни от тези на неувредена кожа и трябва да се положат грижи да се избегне нараняване на кожата. След остригването и приблизително 24 часа преди изпитваното вещество да се нанесе върху кожата (вж. също точка 1.4.7), кожната повърхност трябва да се избърше с ацетон, за да се отстрани себумът. Не се препоръчва допълнително измиване със сапун и вода, тъй като останалият сапун може да насърчи абсорбцията на изпитваното вещество. Площта трябва да бъде достатъчно голяма, за да позволи надеждно изчисляване на абсорбираното количество изпитвано вещество на квадратен сантиметър кожа, за предпочитане поне 10 cm2. Тази площ се постига при плъхове с телесно тегло 200—250 g. След подготовката животните се връщат в метаболитните клетки.
1.4.5. Изпитвано вещество
Изпитваното вещество е продуктът, чиито свойства на проникване трябва да се изследват. В идеалния случай изпитваното вещество трябва да бъде радиоактивно белязано.
1.4.6. Препарат за изпитване
Препаратът с изпитваното вещество (напр. чист, разтворен или приготвен по формула материал, съдържащ изпитваното вещество, който се прилага върху кожата) трябва да бъде същият (или реалистичен заместител) като този, на който могат да бъдат изложени хора или други прицелни видове. Всякакво отклонение от препарата за употреба трябва да бъде оправдано. Когато е необходимо, изпитваното вещество е в разтвор или в суспензия в подходяща среда. За среди, различни от водата, трябва да са познати характеристиките на абсорбция и потенциалното взаимодействие с изпитваното вещество.
1.4.7. Прилагане върху кожата
Определя се мястото на прилагане с определена площ върху кожната повърхност. Върху мястото равномерно се нанася предварително определено количество от изпитвания препарат. Това количество би трябвало да отговаря на потенциално човешко излагане, обикновено 1—5 mg/cm2 за твърди вещества или до 10 μl/cm2 за течности. Всякакви други количества трябва да бъдат оправдани с очакваните условия на използване, целите на изследването или физичните характеристики на изпитвания препарат. След прилагането третираното място трябва да се предпази от търкане. Пример за такова типично приспособление е показан на фигура 1. Обикновено мястото на прилагане се предпазва чрез неоклузивна превръзка (например пропусклив компрес от найлонова марля). Обаче при безкрайно дълго прилагане мястото на прилагане трябва да бъде направено оклузивно. В случай че изпаряването на полулетливи изпитвани вещества намалява степента на събиране на изпитваното вещество до неприемливи стойности (вж. също точка 1.4.10, първа алинея), е необходимо изпареното вещество да се улови във въглен филтър, който покрива приспособлението на прилагане (вж. фигура 1). Важно е никое приспособление да не уврежда кожата, нито пък да реагира със или да абсорбира изпитвания препарат. Животните се връщат в единични метаболитни клетки, за да се събере екскретът им.
1.4.8. Продължителност на експозиция и вземане на проби
Продължителността на излагане е интервалът от време между прилагането и отстраняването на изпитвания препарат от кожата чрез измиване. Трябва да се използва подходящ период на излагане (обикновено от 6 до 24 часа), който да се основава на очакваната продължителност на излагане на хора. След периода на експозиция животните се гледат в метаболитните клетки до планирания край. Животните следва редовно да се наблюдават за признаци на токсичност/анормални реакции на равни интервали през цялото време на изследването. В края на излагането третираната кожа трябва да се прегледа за видими признаци на раздразнение.
Метаболитните клетки трябва да позволяват отделното събиране на урина и изпражнения по време на цялото изследване. Те трябва да позволяват също и събирането на 14С-въглероден двуокис и летливите 14С-въглеродни съединения, които следва да се анализират, ако се произвеждат в големи количества (> 5 %). Урината, изпражненията и уловените флуиди (като 14С-въглероден двуокис и 14С-въглеродни съединения) трябва да бъдат събирани индивидуално от всяка група във времето за взимане на проби. Ако има достатъчно информация, че се е образувало слабо летливо или нелетливо радиоактивно метаболитно вещество, може да се използват отворени клетки.
Екскретите се събират по време на периода на експозиция, до 24 часа след първоначалния контакт с кожата и след това ежедневно до края на експеримента. Обикновено е достатъчно събирането на екскрети на три интервала, но предвижданото предназначение на изпитвания препарат или съществуващи данни за кинетиката може да изискват по-подходящи или допълнителни точки във времето, които да бъдат изследвани.
В края на периода на излагане защитното приспособление се отстранява от всяко животно и се запазва поотделно за анализ. Третираната кожа на всички животни трябва да се измие поне 3 пъти с измиващ агент, като се използват подходящи тампони. Трябва да се внимава да не се замърсят други части на тялото. Измиващият агент трябва да е представител на нормалната хигиенна практика, напр. сапунена вода. Накрая кожата трябва да се подсуши. Всички тампони и други средства за почистване трябва да се запазят за анализ. Трябва да се сложи нова превръзка, за да се защити третираното място на онези животни, които образуват по-късни групи, преди да се завърнат в индивидуалните клетки.
1.4.9. Крайни процедури
За всяка група индивидуалните животни се убиват в определеното време и се взима кръв за изследване. Защитното приспособление или превръзка се сваля за анализ. От всяко животно кожата от мястото на прилагане и подобна площ нетретирана остригана кожа се отстраняват за отделен анализ. Мястото на прилагане може да се фрагментира, за да се отдели stratum corneum от лежащия под него епидермис и да се осигури повече информация за разположението на изпитваното вещество. Определянето на това разположение за даден период след периода на излагане трябва да даде някаква индикация за съдбата в stratum corneum на което и да е вещество на изпитване. За да се улесни разделянето на фракции (след окончателното измиване на кожата и убиването на животното), се сваля всяко защитно средство. Кожата на мястото на прилагане, заедно с пръстен кожа около него, се изрязва от плъх и се забожда върху равна повърхност. Върху кожата с леко натискане се прилага парче лепенка и след това се отстранява заедно с част от stratum corneum. Това се повтаря с още парчета лепенка, докато лепенката престане да се залепва върху повърхността на кожата и stratum corneum е отстранен напълно. За всяко животно всички парчета лепенка могат да се поставят в един контейнер, в който се добавя разтворител на тъкани, за да разтвори stratum corneum. Всяка потенциална целева тъкан може да бъде отстранена за отделно измерване, преди остатъчният труп да се анализира за абсорбираната доза в трупа. Труповете на отделните животни трябва да се запазят за анализ. Обикновено е достатъчен анализът на общото съдържание. Органите обект на внимание могат да се отстранят за отделен анализ (ако това е показано от други изследвания). Урината, която се намира в пикочния мехур в момента на планираното убиване, трябва да се добави към събраната преди това урина. След събирането на екскрети от метаболитните клетки в момента на убиването, клетките и вратичките им трябва да се измият с подходящ разтворител. Друго евентуално замърсено оборудване също трябва да се анализира.
1.4.10. Анализ
При всички изследвания трябва да се постигне адекватно събиране (т.е. средно 100 ± 10 % от радиоактивността). Събирането извън този обхват трябва да бъде обосновано. Количеството на приложената доза за всяка проба трябва да се анализира с помощта на подходящи валидирани процедури.
Статистическият анализ трябва да включва измерване на отклонението на повторните изпитвания за всяко прилагане.
2. ДАННИ
Следните измервания трябва да бъдат направени за всяко животно в момента на всяко вземане на проба за изпитваното вещество и/или метаболити. В допълнение към индивидуалните данни, данните, групирани според времето на вземане на проби, трябва да се докладват като средни стойности.
|
—
|
количество, свързано със защитните средства;
|
|
—
|
количество, което може да се събере от кожата;
|
|
—
|
количество във/по кожата, което не може да се измие от нея;
|
|
—
|
количество в кръвната проба;
|
|
—
|
количество в екскрета и издишания въздух (ако има такива);
|
|
—
|
количество, оставащо в трупа и в органите, отстранени за отделен анализ.
|
Количеството изпитвано вещество и/или метаболити в екскрета, издишания въздух, кръвта и трупа ще позволят да бъде определено общото количество, абсорбирано във всяка точка от времето. Може да се направи и изчисление на количеството изпитвано вещество, абсорбирано на квадратен сантиметър кожа, изложена на изпитваното вещество по време на периода на излагане.
3. ДОКЛАДВАНЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Докладът от изпитването трябва да съдържа изискванията, определени в протокола, включително обосновка за използваната система на изпитване, и трябва да се включва следното:
|
|
Изпитвано вещество:
|
—
|
идентификационни данни (например CAS-номер, ако има; източник; чистота (радиохимична чистота); известни примеси; номер на партида),
|
|
—
|
физична природа, физикохимични свойства (например рН, летливост, разтворимост, стабилност, молекулно тегло и log Pow).
|
|
|
|
Препарат за изпитване:
|
—
|
формула и обосновка на употребата;
|
|
—
|
подробности за препарата за изпитване, приложено количество, достигната концентрация, транспортна среда, стабилност и хомогенност.
|
|
|
|
Лабораторно животно:
|
—
|
брой, възраст и пол на животните,
|
|
—
|
източник на животните, условия на живот, хранене и т.н.,
|
|
—
|
индивидуално тегло на животните в началото на теста.
|
|
|
|
Условия на теста:
|
—
|
подробности на администрирането на препарата на изпитване (място на прилагане, методи на изпитване, оклузия/без оклузия, обем, екстракция, откриване);
|
|
—
|
подробности за качеството на храната и водата.
|
|
|
|
Резултати:
|
—
|
всякакви признаци на токсичност,
|
|
—
|
таблично представени данни за абсорбцията (изразени като степен, количество или процент),
|
|
—
|
всичко обратно събрано от експеримента,
|
|
—
|
тълкуване на резултатите, сравнение с други налични данни за перкутанна абсорбция на изпитваното съединение.
|
|
|
|
Обсъждане на резултатите.
|
4. ПРЕПРАТКИ
|
(1)
|
Testing Method B.45. Skin Absorption: In vitro Method.
|
|
(2)
|
(2) ОИСР, 2002. Guidance Document for the Conduct of Skin Absorption Studies. OECD, Paris.
|
|
(3)
|
ECETOC, 1993. Percutaneous Absorption. European Centre for Ecotoxicology and Toxicology of Chemicals, Monograph No. 20.
|
|
(4)
|
Zendzian R. P., 1989. Skin Penetration Method suggested for Environmental Protection Agency Requirements. J. Am. Coll. Toxicol. 8(5), 829—835.
|
|
(5)
|
Kemppainen B. W., Reifenrath W. G., 1990. Methods for skin absorption. CRC Press Boca Raton, FL, USA.
|
|
(6)
|
EPA, 1992. Dermal Exposure Assessment: Principles and Applications. Exposure Assessment Group, Office of Health and Environmental Assessment.
|
|
(7)
|
EPA, 1998. Health Effects Test Guidelines, OPPTS 870-7600, Dermal Penetration. Office of Prevention, Pedsticides and Toxic Substances.
|
|
(8)
|
Bronaugh R. L., Wester R. C., Bucks D., Maibach H. I. and Sarason R. (1990) In vivo percutaneous absorption of fragrance ingredients in reshus monkeys and humans. Fd. Chem. Toxic. 28, 369—373.
|
|
(9)
|
Feldman R. J. and Maibach H. I., 1970. Absorption of some organic compounds through the skin in man. J. Invest Dermatol. 54, 399—404.
|
Фигура 1
Пример за класическо средство, използвано за отделяне и предпазване на мястото на кожно прилагане при изследвания in vivo на перкутанната абсорбция

Б.45. КОЖНА АБСОРБЦИЯ: IN VITRO МЕТОД
1. МЕТОД
Този метод на изпитване е еквивалентен на ОИСР TG 428 (2004).
1.1. ВЪВЕДЕНИЕ
Този метод е разработен, за да се получи информация за абсорбцията на изпитваното вещество, приложено върху изрязана кожа. Той може или да се комбинира с метода за кожна абсорбция: метод in vivo (1), или да се прилага самостоятелно. Препоръчва се да се направи консултация с Ръководството за провеждане на изследвания за кожна абсорбция на ОИСР (2), за да може да се подпомогне създаването на изследвания, основани на този метод. Ръководството е изготвено, за да се улесни изборът на подходящия метод in vitro за използване при конкретните обстоятелства и да се обезпечи надеждност на резултатите, получени с помощта на този метод.
Методите за измерване на кожната абсорбция и преминаването през кожата могат да се разделят на две категории: in vivo и in vitro. Методите in vivo за кожна абсорбция са добре установени и осигуряват фармакокинетична информация за голям брой животински видове. Методът in vivo е описан отделно в друг метод на изпитване (1). Методите in vitro също се използват отдавна за измерване на кожната абсорбция. Въпреки че не са правени официални валидиращи изследвания на методите in vitro, обхванати от този метод на изпитване, експертите от ОИСР се съгласиха през 1999 г., че има достатъчно данни, на които е направена оценка и които са в подкрепа на метода in vitro (3). Повече подробности, които подкрепят това, включително значителен брой преки сравнения на методи in vivo и in vitro, са дадени в ръководството (2). Съществуват голям брой монографии, които разглеждат тази тема и дават подробна информация за използването на in vitro метод (4) (5) (6) (7) (8) (9) (10) (11) (12). Методите in vitro измерват дифузията на химикалите вътре и през кожата към резервоар с флуид и могат да използват нежизнеспособна кожа за измерване само на дифузията, или свежа, метаболитно активна кожа за едновременното измерване на дифузията и кожния метаболизъм. Подобни методи имат приложение особено като средство за сравнение на усвояването на веществата при различни формули на приготвяне, във и през кожата, и също могат да осигурят полезни модели за оценка на перкутанната абсорбция при хората.
Методът in vitro не може да се прилага за всички ситуации и химични класове. Може да се използва методът за изпитване in vitro за първоначална качествена оценка на кожно проникване. В някои случаи може да се наложи то да бъде последвано от данни, получени in vivo. Трябва да се направи справка с ръководството (2) за по-нататъшно разработване на случаи, при които in vitro методът би бил подходящ. Допълнителна подробна информация, за да се подпомогне вземането на решение, е дадена в препратка (3).
Този метод показва общите принципи за измерване на дермалната абсорбция и преминаване на изпитваното вещество, като се използва изрязана кожа. Може да се използва кожа на различни видове бозайници, включително и хора. Свойствата на проницаемост на кожата се запазват и след изрязването от тялото, тъй като основната бариера пред дифузията е неживият stratum corneum; активен транспорт на химични вещества през кожата не е наблюдаван. Доказано е, че кожата има способността да метаболизира някои химикали по време на перкутанна абсорбция (6), но този процес не ограничава степента по отношение на действително абсорбираната доза, макар да може да повлияе на природата на материала, който прониква в кръвообращението.
1.2. ОПРЕДЕЛЕНИЯ
Неабсорбирана доза: представлява дозата, измита от повърхността на кожата след излагане, и всяка друга доза, която е налице върху неоклузивната превръзка, включително всяка доза, за която може да се покаже, че се е изпарила от кожата по време на излагането.
Абсорбирана доза (in vitro
): количеството изпитвано вещество, достигнало до рецепторния флуид или до циркулацията в системата в рамките на определен период от време.
Абсорбируема доза (in vitro
): представлява дозата, която е налице върху или в кожата след измиване.
1.3. ПРИНЦИП НА МЕТОДА НА ИЗПИТВАНЕ
Изпитваното вещество, което може да бъде радиоактивно белязано, се прилага върху повърхността на кожната проба, която разделя двете камери на дифузионната клетка. Веществото остава върху кожата за определено време при определени условия, преди да бъде отстранено с помощта на подходяща процедура за измиване. От рецепторния флуид се взимат проби в определени моменти по време на експеримента и се анализират за изпитваното вещество и/или метаболити.
Когато се използват метаболитноактивни системи, метаболитите на изпитваното вещество могат да се анализират с помощта на подходящи методи. В края на експеримента се правят количествени измервания на разпределението на изпитваното вещество и метаболитите, когато това е необходимо.
Като се използват подходящи условия, които са описани в този метод и в ръководството (2), абсорбцията на изпитваното вещество по време на определен период се измерва чрез анализ на рецепторния флуид и третираната кожа. Изпитваното вещество, останало в кожата, трябва да се счита за абсорбирано, освен ако може да бъде показано, че абсорбцията може да се определя само със стойностите в рецепторния флуид. Анализът на другите компоненти (материала, измит от кожата, и останалия вътре в кожните слоеве) позволява по-нататъшна оценка на данните, включително общото отлагане на изпитваното вещество и процента на събиране.
За да се покаже функционирането и надеждността на системата за изпитване, лабораторията, в която се провежда изпитването, трябва да разполага с резултати за съответните референтни вещества, които да съответстват на публикуваната литература за използвания метод. Това изискване може да се изпълни, като се изпита подходящо референтно вещество (за предпочитане такова с липофилност, близка до тази на изпитваното вещество) едновременно с изпитваното вещество или като се осигурят подходящи исторически данни за ред референтни вещества с различна липофилност (например кафеин, бензоена киселина, тестостерон).
1.4. ОПИСАНИЕ НА МЕТОДА НА ИЗПИТВАНЕ
1.4.1. Дифузна клетка
Дифузната клетка се състои от донорна камера и рецепторна камера, между които е разположена кожата (пример на типична концепция е даден на фигура 1). Клетката трябва да осигурява добро „запечатване“ около кожата, да дава възможност за лесно вземане на проби и добро смесване на рецепторния разтвор в контакт с долната страна на кожата, както и добър температурен контрол на клетката и нейното съдържание. Може да се използват както статични, така и проточни дифузни клетки. Обикновено донорните камери се оставят неоклузивни по време на излагане на определена крайна доза от изпитвания препарат. Обаче при безкрайни прилагания и някои сценарии с крайни дози донорните камери може да бъдат оклузивни.
1.4.2. Рецепторен флуид
За предпочитане е да се използва физиологично съвместим рецепторен флуид, въпреки че могат да се използват и други, при условие че това се обоснове. Трябва да има описание на точния състав на рецепторния флуид. Трябва да се покаже необходимата разтворимост на изпитваното вещество в рецепторния флуид, така че той да не действа като бариера за абсорбцията. Освен това рецепторният флуид не бива да уврежда целостта на изпитваната кожа. При проточна система стойността на потока не трябва да препятства дифузията на изпитваното вещество в рецепторния флуид. При система със статична клетка флуидът трябва непрекъснато да се разбърква и редовно да се взимат проби. Ако се изследва метаболизмът, рецепторният флуид трябва да поддържа кожната жизнеспособност по време на целия експеримент.
1.4.3. Подготвяне на кожата
Може да се използва кожа от човешки и животински източници. Отчита се фактът, че употребата на човешка кожа е предмет на национални и международни етични съображения и условия. Макар да се предпочита жизнеспособна кожа, нежизнеспособна също може да се използва, при условие че може да се покаже ненарушеността на кожата. Приемливо е използването както на епидермални мембрани (отделени ензимно, чрез нагряване или по химичен начин), така и на кожа с разцепена дебелина (типично с дебелина 200—400 μm), приготвени с дерматом. Може да бъде използвана кожа с цялата си дебелина, но следва да се избягва прекомерната дебелина (са. > 1 mm), освен ако нарочно не се изисква за определяне на изпитваното вещество в кожните слоеве. Избирането на животинския вид, анатомичното място и техниките за подготовка на препаратите следва да бъде аргументирано. Изискват се приемливи данни от минимум четири репликата на изпитвано вещество.
1.4.4. Ненарушеност на подготвената кожа
От съществена важност е кожата да бъде правилно подготвена. Неправилното боравене може да доведе до увреждане на stratum corneum и затова следва да се провери ненарушеността на подготвената кожа. Когато се изследва кожният метаболизъм, прясно изрязаната кожа следва да се използва възможно най-скоро и при условия, за които е известно, че поддържат метаболитната активност. Като обща насока, прясно изрязаната кожа следва да се използва до 24 часа, но приемливият период на съхранение може да варира в зависимост от ензимната система, която участва в метаболизма, и от температурите на съхранение (13). Когато кожните препарати са били съхранявани преди употребата им, следва да се покаже, че бариерната им функция не е нарушена.
1.4.5. Изпитвано вещество
Изпитвано вещество е веществото, чиито характеристики на проникване следва да се изучат. В идеалния случай изпитваното вещество следва да бъде радиационно маркирано.
1.4.6. Изпитван препарат
Препаратът с изпитваното вещество (напр. чист, разтворен или приготвен по формула материал, съдържащ изпитваното вещество, който се прилага върху кожата) следва да бъде същият (или реалистичен заместител) като този, на който хора или други прицелни видове могат да бъдат изложени. Всякакво отклонение от препарата за употреба следва да бъде оправдано.
1.4.7. Концентрации на изпитваните вещества и формули с тяхно участие
Нормално се използва повече от една концентрация на изпитваното вещество, като се достигат горните граници на потенциалното излагане на човека. Също така следва да се предвиди изпитване на разпространени формули.
1.4.8. Прилагане върху кожата
При нормални условия излагането на човека на химични вещества обикновено е при крайни дози. Поради това следва да се използва прилагане, което копира човешко излагане, обикновено 1—5 mg/cm2 от кожата за твърдите вещества и до 10 μl/cm2 за течностите. Количеството следва да бъде обосновано с очакваните условия на употреба, целите на изследването или физичните характеристики на изпитвания препарат. Например прилаганията към кожната повърхност могат да бъдат непрекъснати, когато се прилагат големи количества на единица площ.
1.4.9. Температура
Пасивната дифузия на химичните вещества (и поради това тяхната абсорбция от кожата) се влияе от температурата. Дифузната камера и кожата следва да се поддържат с постоянна температура, близо до нормалната кожна температура от 32 ± 1 oС. Различните концепции клетки изискват различни температури, постигнати във водна баня или с нагревателен блок, за да се гарантира, че рецепторът/кожата е във физиологичната си норма. Препоръчителната влажност е между 30 и 70 %.
1.4.10. Продължителност на излагането и вземане на проби
Излагането на кожата на изпитвания препарат може да продължи през целия експеримент или за по-кратки периоди от време (т.е. да копира конкретен тип човешко излагане). Кожата следва да се измие от излишния изпитван препарат с подходящ измиващ агент и течността от изплакването следва да се събере за анализ. Процедурата по отстраняване на изпитвания препарат зависи от очакваните условия на употреба и следва да бъде обоснована. Обикновено се изисква период от 24 часа за вземане на проби, за да се позволи адекватното характеризиране на абсорбционния профил. Тъй като кожната цялост може да започне да се влошава след 24-ия час, периодите на вземане на проби обикновено не следва да превишават 24 часа. За изпитвани вещества, които проникват бързо в кожата, може да не е необходимо, но за онези вещества, които проникват бавно, може да се изискват по-дълги периоди. Честотата на вземане на проби от рецепторния флуид би следвало да позволи абсорбционният профил на изпитваното вещество да се представи графично.
1.4.11. Крайни процедури
Всички компоненти на системата за изпитване следва да се анализират и да се определи събираемостта. Това включва донорната камера, течността от изплакването на кожната повърхност, кожата за изпитване и рецепторния флуид/камера. В някои случаи за отделно анализиране кожата може да се раздели на изложена кожна област, кожна област под фланеца на клетката и на фракциите на stratum corneum — епидермис и дермис.
1.4.12. Анализ
Във всички проучвания следва да се постигне адекватно събиране (целта следва да бъде средно 100 ± 10 % от радиоактивността и всяко отклонение следва да се обоснове). Количеството изпитвано вещество в рецепторния флуид, кожата на изпитване, отпадъците при измиване на кожната повърхност и течността от изплакването на апарата следва да се анализират с помощта на подходящи техники.
2. ДАННИ
Трябва да бъде направи анализ на рецепторния флуид, разпределението на изпитваното вещество в системата за изпитване и абсорбционния профил във времето. Когато се прилагат условия с крайна доза на излагане, следва да се изчислят количеството, измито от кожата, количеството, свързано с кожата (и в различните слоеве на кожата, ако е анализирано), и наличното количество в рецепторния флуид (степен и количество или процент от приложената доза). Кожната абсорбция понякога може да се опише само с данните от рецепторния флуид. Въпреки това, когато остане изпитвано вещество в кожата в края на проучването, то може да се наложи да се включи в общото абсорбирано количество (вж. параграф 66 в препратка 3). Когато се използват условия с безкрайна доза на излагане, данните могат да позволят да се изчисли константата на проницаемост (Кр). При такива условия процентът на абсорбиране не е приложим.
3. ДОКЛАДВАНЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Протоколът от изпитването следва да съдържа изискванията, описани в протокола, включително и обосновка за използваната система на изпитване, и следва да се състои от следното:
|
|
Изпитвано вещество:
|
—
|
физична природа, физикохимични свойства (поне молекулно тегло и log Pow), чистота (радиохимична чистота);
|
|
—
|
идентификационна информация (например номер на партида);
|
|
—
|
разтворимост в рецепторния флуид.
|
|
|
|
Изпитван препарат:
|
—
|
формула и основание за използване;
|
|
|
|
Условия на изпитване:
|
—
|
източници и място на кожата, метод на подготовка, условия на съхранение преди употреба, някаква предварителна обработка (почистване, третиране с антибиотици и др.), измервания на ненарушеността на кожата, метаболитен статус, основание за употреба;
|
|
—
|
вид клетка, състав на рецепторния флуид, количество на потока на рецепторния флуид или времена и процедури за вземане на пробите;
|
|
—
|
подробности за прилагането на изпитвания препарат и количеството използвана доза;
|
|
—
|
продължителност на експозиция;
|
|
—
|
подробности за отстраняването на изпитвания препарат от кожата, напр. изплакване на кожата;
|
|
—
|
подробности за анализа на кожата и техниките на раздробяване, използвани за показване на разпределението в кожата;
|
|
—
|
процедури за миене на клетката и оборудването;
|
|
—
|
методи на изпитание, техники на екстракция, граници на откриване и на валидиране на метода за анализ.
|
|
|
|
Резултати:
|
—
|
цялостна събираемост от експеримента (приложена доза = материали от измиването на кожата + кожа + рецепторен флуид + материали от измиването на клетката);
|
|
—
|
таблично представяне на събираното във всяко отделение на отделната клетка;
|
|
—
|
представяне в табличен вид на абсорбционните данни (изразени като съотношение, количество или процент).
|
|
|
|
Обсъждане на резултатите.
|
4. ПРЕПРАТКИ
|
(1)
|
Testing Method B.44. Skin Absorption: In vivo Method.
|
|
(2)
|
OECD (2002). Guidance Document for the Conduct of Skin Absorption Studies. OECD, Paris.
|
|
(3)
|
OECD (2000). Report of the Meeting of the OECD Extended Steering Committee for Percutaneous Absorption Testing, Annex 1 to ENV/JM/TG(2000)5. OECD, Paris.
|
|
(4)
|
Kemppainen B. W. and Reifenrath W. G. (1990). Methods for skin absorption. CRC
|
|
(5)
|
Bronaugh R. L. and Collier, S. W. (1991). Protocol for In vitro Percutaneous Absorption Studies, in In vitro Percutaneous Absorption: Principles, Fundamentals and Applications, R. L. Bronaugh and HI Maibach, Eds., CRC Press, Boca Raton, pp. 237—241.
|
|
(6)
|
Bronaugh R. L. and Maibach H. I. (1991). In vitro Percutaneous Absorption: Principles, Fundamentals and Applications. CRC Press, Boca Raton.
|
|
(7)
|
European Centre for Ecotoxicology and Toxicology of Chemicals (1993). Monograph No. 20, Percutaneous Absorption, ECETOC, Brussels.
|
|
(8)
|
Diembeck W., Beck H., Benech-Kieffer F., Courtellemont P., Dupuis J., Lovell W., Paye M., Spengler J., Steiling W. (1999). Test Guidelines for In Vitro Assessment of Dermal Absorption and Percutaneous Penetration of Cosmetic Ingredients, Fd Chem Tox, 37, 191—205.
|
|
(9)
|
Recommended Protocol for In vitro Percutaneous Absorption Rate Studies (1996). US Federal Register, Vol. 61, No. 65.
|
|
(10)
|
Howes D., Guy R., Hadgraft J, Heylings J. R. et al. (1996). Methods for assessing Percutaneous absorption. ECVAM Workshop Report ATLA 24, 81 R10.
|
|
(11)
|
Schaefer H. and Redelmeier T. E. (1996). Skin barrier: principles of percutaneous absorption. Karger, Basel.
|
|
(12)
|
Roberts M. S. and Walters K. A. (1998). Dermal absorption and toxicity assessment. Marcel Dekker, New York.
|
|
(13)
|
Jewell, C., Heylings, J. R., Clowes, H. M. and Williams, F. M. (2000). Percutaneous absorption and metabolism of dinitrochlorobenzene in vitro. Arch Toxicol 74: 356—365.
|
Фигура 1
Пример за типична конструкция на статична дифузна клетка за изследване in vitro на перкутанна абсорбция
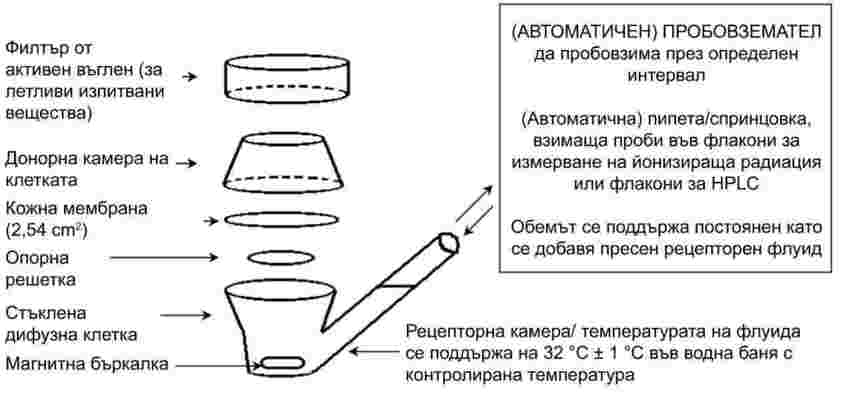
(1) Зоната на помътняване на роговицата следва да бъде отбелязана.
(2) За голям брой изследвания на серум и плазма, най-вече кръвна захар, се препоръчва гладуване през нощта. Основната причина за тази препоръка е, че увеличената вариабилност, която неизбежно произтича при негладуващите, би маскирала по-слабите ефекти и би затруднила интерпретацията. От друга страна обаче нощното гладуване може да си взаимодейства с метаболизма на животните и, особено при хранителните проучвания, може да наруши ежедневното излагане на проучваното вещество. Ако се възприеме нощно гладуване, клинико-биохимичните изследвания следва да се извършат след провеждането на функционално наблюдение през седмица 4 на проучването.
(3) За измерванията на серума и плазмата, и най-вече за глюкозата, се препоръчва през нощта да не се консумира месо. Основната причина за това е нарасналата променливост, която в резултат от храненето с месо би могла непредвидимо да доведе до лъжливи ефекти и до проблеми при тълкуването. От друга страна обаче, липсата на месо през нощта въздейства върху метаболизма на животните, и по-специално при изследване на храненето може да наруши дневното излагане на веществото, което се изследва. Ако се възприеме животното да не се храни с месо през нощта преди изследването, то клиничните биохимични изследвания се извършват след провеждането на функционалните наблюдения по изследването
(4) Сега известна като серумна аланин аминотрансфераза.
(5) Сега известна като серумна аспартат аминотрансфераза.
(6) Тези органи, от десет животни от пол за група за гризачи и всички животни от видове, различни от гризачи, плюс щитовидна жлеза (с паращитовидни жлези) за всички видове, различни от гризачи, трябва да бъдат претеглени.
(7) Тези органи, от 10 животни от пол за група за гризачите, трябва да бъдат претеглени.
(8) При този метод група за сравнение е такава група, в която изпитваното вещество се прилага по друг начин, обезпечаващ пълна биологична наличност на дозата.
(9) Разтворител, използван за измерване на абсорбцията.
(10)
|
†
|
Включва пет животни, избрани за функционални изследвания и подробни клинични наблюдения като част от невротоксичното изследване.
|
Част В: МЕТОДИ ЗА ОПРЕДЕЛЯНЕТО НА ЕКОЛОГИЧНА ТОКСИЧНОСТ
СЪДЪРЖАНИЕ
|
В.1.
|
ОСТРА ТОКСИЧНОСТ ЗА РИБА |
|
В.2.
|
DAPHNIA SP. ИЗПИТВАНЕ ЗА ОСТРА ИМОБИЛИЗАЦИЯ |
|
В.3.
|
ИЗПИТВАНЕ ЗА ПОТИСКАНЕ РАСТЕЖА НА ВОДОРАСЛИ |
|
В.4.
|
ОПРЕДЕЛЯНЕ НА ПРЯКАТА БИОЛОГИЧНА РАЗГРАДИМОСТ |
|
ЧАСТ II.
|
ОПРЕДЕЛЯНЕ НА DOC ЧРЕЗ СКОРОСТТА НА ОТМИРАНЕ (МЕТОД В.4-А) |
|
ЧАСТ III.
|
МОДИФИЦИРАН СКРИНИНГ НА ОИСР (МЕТОД В.4-Б) |
|
ЧАСТ IV.
|
МЕТОД ЗА ОТДЕЛЯНЕ НА СО2 (МЕТОД В.4-В) |
|
ЧАСТ V.
|
ИЗПИТВАНЕ ЧРЕЗ МАНОМЕТРИЧНА РЕСПИРОМЕТРИЯ (МЕТОД В.4-Г) |
|
ЧАСТ VI.
|
ИЗПИТВАНЕ ПО МЕТОДА НА ИЗОЛИРАНИТЕ ПРОБИ (МЕТОД В.4-Д) |
|
ЧАСТ VII.
|
ИЗПИТВАНЕ ПО M.I.T.I. (МЕТОД В.4-Е) |
|
В.5.
|
РАЗГРАЖДАНЕ – БИОХИМИЧНА ПОТРЕБНОСТ ОТ КИСЛОРОД |
|
В.6.
|
РАЗГРАЖДАНЕ – ХИМИЧНА ПОТРЕБНОСТ ОТ КИСЛОРОД |
|
В.7.
|
РАЗГРАЖДАНЕ – АБИОТИЧНО РАЗГРАЖДАНЕ: ХИДРОЛИЗА КАТО ФУНКЦИЯ ОТ PH |
|
В.8.
|
ТОКСИЧНОСТ ЗА ЗЕМНИ ЧЕРВЕИ. |
|
В.9.
|
БИОЛОГИЧНО РАЗГРАЖДАНЕ – ИЗПИТВАНЕ С ИЗКУСТВЕНА ПОЧВА |
|
В.10.
|
БИОЛОГИЧНО РАЗГРАЖДАНЕ – ИЗПИТВАНИЯ ЗА СИМУЛИРАНЕ НА АКТИВИРАНА УТАЙКА |
|
В.11.
|
БИОЛОГИЧНО РАЗГРАЖДАНЕ – ИЗПИТВАНЕ ЗА ПОТИСКАНЕ ДИШАНЕТО НА АКТИВИРАНА УТАЙКА |
|
В.12.
|
БИОЛОГИЧНО РАЗГРАЖДАНЕ – МОДИФИЦИРАНО SCAS ИЗПИТВАНЕ |
|
В.13
|
БИОКОНЦЕНТРАЦИЯ: ПРОТОЧЕН ТЕСТ ВЪРХУ РИБИ |
|
В.14.
|
ТЕСТВАНЕ РАСТЕЖА НА МЛАДИТЕ РИБИ |
|
В.15.
|
РИБИ, КРАТКОСРОЧЕН ТЕСТ ЗА ТОКСИЧНОСТ ПРИ ЕМБРИОНИТЕ И ИНДИВИДИТЕ В СТАДИЙ НА ХРАНЕНЕ ОТ ЖЪЛТЪЧНАТА ТОРБИЧКА |
|
В.16.
|
МЕДОНОСНА ПЧЕЛА – ТЕСТ ЗА ОСТРА ОРАЛНА ТОКСИЧНОСТ |
|
В.17.
|
МЕДОНОСНА ПЧЕЛА – ТЕСТ ЗА ОСТРА КОНТАКТНА ТОКСИЧНОСТ |
|
В.18.
|
АДСОРБЦИЯ/ДЕСОРБЦИЯ ЧРЕЗ ИЗПОЛЗВАНЕ МЕТОДА ЗА РАВНОВЕСИЕ В ГРУПАТА |
|
В.19.
|
ИЗЧИСЛЯВАНЕ КОЕФИЦИЕНТА НА АДСОРБЦИЯ (КOC) НА ПОЧВАТА И НА УТАЙКАТА ОТ ОТПАДНИ ВОДИ, ИЗПОЛЗВАЩИ ВИСОКОЕФЕКТИВНА ТЕЧНА ХРОМАТОГРАФИЯ (HPLC) |
|
В.20.
|
ТЕСТ ЗА ВЪЗПРОИЗВЕЖДАНЕ НА ГИГАНТСКА ВОДНА БЪЛХА |
|
В.21.
|
ПОЧВЕНИ МИКРООРГАНИЗМИ: ИЗПИТВАНЕ НА АЗОТНАТА ТРАНСФОРМАЦИЯ |
|
В.22.
|
ПОЧВЕНИ МИКРООРГАНИЗМИ: ИЗПИТВАНЕ НА ВЪГЛЕРОДНАТА ТРАНСФОРМАЦИЯ |
|
В.23.
|
АЕРОБНА И АНАЕРОБНА ТРАНСФОРМАЦИЯ В ПОЧВИ |
|
В.24.
|
АЕРОБНА И АНАЕРОБНА ТРАНСФОРМАЦИЯ ВЪВ ВОДНИ СЕДИМЕНТНИ СИСТЕМИ |
B.1. ОСТРА ТОКСИЧНОСТ ЗА РИБА
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Целта на този тест е да определи острата летална токсичност на вещество за риба в прясна вода. Желателно е да се разполага, доколкото е възможно, с данни за разтворимостта във вода, парното налягане, химическата устойчивост, дисоциационните константи и биологичното разграждане на веществото, за да се улесни изборът на най-подходящия метод за тестване (статичен, полустатичен или с постоянно водоподаване) с оглед осигуряването на достатъчно постоянни концентрации на изследваното вещество при провеждане на теста.
Допълнителната информация (например структурна формула, степен на пречистеност, естество и процентно съдържание на значими примеси, наличие и количества на добавки и разделителен коефициент n-octanol/вода) следва да се взема предвид както при подготовката на теста, така при интерпретацията на резултатите.
1.2. ОПРЕДЕЛЕНИЯ И МЕРНИ ЕДИНИЦИ
Остра токсичност е видимото вредно въздействие, причинено в организъм при излагане за кратко време (дни) на въздействие на вещество. В настоящия тест острата токсичност е изразена като средна летална концентрация (LC50), това е концентрацията във вода, която умъртвява 50 % от опитното количество риба при непрекъснато излагане и която следва да бъде посочена.
Всички концентрации на тестваното вещество са посочени в тегло за обем (милиграми на литър). Те могат да бъдат изразени също и в тегло за тегло (mg.kg-1).
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Референтното вещество може да се тества като средство за доказване, че в условията на лабораторен опит реакциите на изследваните видове не се променят съществено.
За този тест не се посочват вещества за сравнение.
1.4. ПРИНЦИП НА МЕТОДА
Може да се извърши ограничен тест със 100 mg/l, за да се докаже, че LC50 е по-голяма от тази концентрация.
Рибите се излагат на тестваното вещество, добавяно във водата в определен обхват от концентрации в продължение на 96 часа. Умъртвените бройки се отчитат на интервали от поне 24 часа и на всеки наблюдаван интервал, където е възможно, се изчисляват концентрациите, умъртвили 50 % от рибите (LC50).
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Критериите за качество се прилагат както към ограничения тест, така и към пълния метод на изследване.
Смъртността при контролните риби не следва да надвишава 10 % (или не повече от 1 риба, ако са използвани по-малко от 10 бройки) до края на експеримента.
Концентрацията на разтворения кислород следва да бъде над 60 % от стойността на въздухонаситеността на водата по време на теста.
Концентрациите на тестваното вещество следва да се поддържат в рамките до 80 % от първоначалните концентрации в продължение на целия експеримент.
За вещества, които лесно се разтварят в опитната среда, получавайки по този начин стабилни разтвори, т.е. такива, които няма, в известен значителен размер, да се изпарят, разложат, хидролизират или адсорбират, първоначалната концентрация може да бъде приета за равна на номиналната концентрация. Следва да се представят доказателства, че през периода на теста концентрациите са били поддържани постоянни и че критериите за качество са били спазени.
За вещества, които са:
|
i)
|
слабо разтворими в опитната среда, или
|
|
ii)
|
способни да образуват стабилни емулсии или дисперсии, или
|
|
iii)
|
нестабилни във водни разтвори,
|
като първоначална концентрация се приема измерената концентрация в разтвора (или, ако е технически невъзможно, във водна колона) в началото на теста. Концентрацията се определя след период на равновесие, но преди въвеждането на опитната риба.
Във всеки от тези случаи следва да се извършва последващо измерване, за да се потвърдят конкретните концентрации на излагане или изпълнението на качествените критерии.
рН не следва да варира с повече от 1 единица.
1.6. ОПИСАНИЕ НА МЕТОДА
Могат да се използват 3 вида процедури:
Статичен тест:
Това е тест за токсичност, при който не се добавя от опитния разтвор. (Разтворите остават непроменени през целия период на теста.)
Полустатичен тест:
Това е тест без добавяне от опитния разтвор, но при равномерно подновяване на целия опитен разтвор след продължителни периоди от време (например 24 часа).
Постоянно водоподаване:
Това е тест за токсичност, при който водата се обновява постоянно в опитните камери, а химическото вещество, което се изследва, се пренася с използваната вода за подновяване на опитната среда.
1.6.1. Химически реактиви
1.6.1.1. Разтвори на опитните вещества
Стандартни разтвори с необходимата сила се приготвят чрез разтваряне на веществото в дейонизирана вода или във вода съгласно описанието в т. 1.6.1.2.
Избраните опитни концентрации се приготвят чрез разреждане на стандартния разтвор. Ако се тестват високи концентрации, веществото може да бъде разтворено директно във водата.
Обикновено веществата се изследват само до границата на разтворимост. За някои вещества (например вещества с ниска разтворимост във вода, или висок Pow, или тези, които образуват по-скоро стабилна дисперсия, отколкото истински разтвор във вода) се допуска опитната концентрация да бъде над границата на разтворимост за веществото, за да се гарантира, че е получено максималното съотношение между разтворимост и стабилна концентрация. Важно е обаче тази концентрация по никакъв начин да не нарушава опитната система (например появата на филм на водната повърхност, пречейки за окисляването на водата, и т.н.).
Ултразвукова дисперсия, органични разтворители, емулгатори или дисперсанти могат да се използват като помощни съединения за приготвяне на стандартни разтвори на вещества с ниска водоразтворимост или да спомагат за разпръскването на тези вещества в опитната среда. Когато се използват такива спомагателни вещества, всички опитни концентрации следва да съдържат еднакво количество от спомагателните вещества и допълнителните бройки контролна риба да бъдат изложени на същата концентрация от спомагателното вещество, каквато се използва в опитните серии. Концентрацията на такива помощни съединения следва да бъде сведена до минимум, но в никакъв случай не следва да надвишава 100 mg/l в опитната среда.
Тестът се провежда без регулиране на рН. Ако се появят симптоми за настъпили промени в рН, препоръчва се тестът да бъде повторен с регулиране на рН и резултатите да се отбележат. В този случай стойността на рН на стандартния разтвор следва да се нагласи към стойността на рН на водата за разреждане, освен ако няма специфични причини това да не се направи. Предпочитани за целта са HCl и NaOH. Това регулиране на рН следва да се извърши така, че концентрацията на опитното вещество в стандартния разтвор да не се промени в значителна степен. Ако в резултат от регулацията на рН настъпи някаква химическа реакция или при опитното вещество протече физическо утаяване, това също следва да се отбележи.
1.6.1.2. Съхранение и разреждане на водата
Може да се използва питейна вода от водопровода (незамърсена от потенциално вредните концентрации на хлор, тежки метали или други вещества), доброкачествена природна вода или пречистена/дестилирана вода (вж. допълнение 1). Предпочитат се води с обща твърдост между 10 и 250 mg/l (като СаСО3) и с рН от 6,0 до 8,5.
1.6.2. Апаратура
Всички уреди следва да бъдат изработени от химически инертен материал.
|
—
|
автоматична система за разреждане (за теста с постоянно водоподаване);
|
|
—
|
измервател на кислород;
|
|
—
|
уред за определяне твърдостта на водата;
|
|
—
|
подходяща апаратура за температурен контрол;
|
1.6.3. Опитна риба
Рибите следва да са в добро здраве и да нямат никакви малформации.
Използаните видове следва да се подбират въз основа на практически критерии, каквито са постоянно наличие в течение на годината, лесно отглеждане, подходящи (удобни) за тестване, относителна чувствителност към химикали, както и към всякакви икономически, биологически или екологични фактори, които съществуват. Необходимостта от сравняемост на получените данни и съществуващата международна хармонизация (препратка 1) следва също да бъдат взети предвид при избора на вида риба.
Списък на видовете риба, които са препоръчителни за изпълнението на този тест, е представен в допълнение 2; най-предпочитаните видове са рибка-зебра и дъгова пъстърва.
1.6.3.1. Отглеждане
За предпочитане е опитните риби да бъдат от една доставка, с еднаква големина и възраст. Те следва да се отглеждат най-малко 12 дни при следните условия:
натоварване:
подходящо за системата (рециркулация или постоянно водоподаване) и за видовете риба;
вода:
вж. 1.6.1.2.;
светлина:
осветление в продължение на 12 — 16 часа/дневно;
концентрация на разтворения кислород:
най-малко 80 % от стойността на въздухонаситеността на водата;
хранене:
3 пъти седмично или дневно, преустановява се 24 часа преди стартиране на теста.
1.6.3.2. Смъртност
След 48 часа от началото на периода, смъртността се отчита както следва:
|
—
|
над 10 % от популацията след 7 дни:
отстранява се цялата партида;
|
|
—
|
между 5 и 10 % от популацията:
периодът на отглеждане се продължава с още 7 дни.
Ако повече умъртвени индивиди не се намерят, партидата се одобрява (приема), в противен случай следва да бъде отстранена;
|
|
—
|
под 5 % от популацията:
цялата партида се одобрява.
|
1.6.4. Адаптация
Рибите следва да бъдат поставени във вода с качеството и температурата, които ще се използват за теста, най-малко 7 дни преди да бъдат използвани.
1.6.5. Процедура на теста
Дефинитивният тест се предхожда от тест за определяне на обхвата, от който да се получи информация за диапазона на концентрациите, които ще се използват в основния експеримент.
Извършва се един контролен тест без опитното вещество и, ако е уместно, се провежда и един контролен тест със спомагателното вещество, в допълнение към опитните серии.
В зависимост от физическите и химическите свойства на опитното вещество следва да се избере подходящата за теста процедура: статичен тест, полустатичен тест или с постоянно водоподаване, за да бъдат спазени критериите за качество.
Рибите се излагат на въздействие на веществото, както е описано по-долу:
|
—
|
продължителност: 96 часа;
|
|
—
|
брой на животните: поне 7 на концентрация;
|
|
—
|
съдове: с подходящ капацитет в зависимост от препоръчителното натоварване;
|
|
—
|
натоварване: препоръчва се максимално натоварване от 1 g/l за статичните и полустатичните тестове, а за тези с постоянно водоподаване се допуска по-голямо натоварване;
|
|
—
|
опитна концентрация: най-малко 5 концентрации, различаващи се една от друга чрез постоянен фактор, ненадвишаващ 2,2, и доколкото е възможно, разширяване на обхвата от 0 до 100 % смъртност;
|
|
—
|
светлина: осветление в продължение на 12 — 16 часа/дневно;
|
|
—
|
температура: подходяща за вида на рибата (допълнение 2), но с допустимото отклонение от ± 1 oС за всеки отделен тест;
|
|
—
|
концентрация на разтворения кислород: не по-малко от 60 % от стойността на въздухонаситеността на водата при избраната температура;
|
Рибите се наблюдават след първите 2 до 4 часа и поне на интервали от 24 часа. Рибите се смятат за умрели, ако при допир на опашатите крачета няма никаква реакция и никакви признаци на дишане не са видими. Мъртвите риби се отстраняват след оглед и смъртните случаи се записват. Записват се и видимото ненормално поведение (например загуба на равновесие, промени в начина на плуване, дихателната функция, пигментацията и др.).
Ежедневно се извършват измервания на рН, разтворения кислород и температурата.
Ограничен тест
Използвайки описаните за този метод процедури, може да бъде извършен ограничен тест с натоварване 100 mg/l, за да се докаже, че LC50 е по-висока от тази концентрация.
Ако естеството на веществото е такова, че концентрация от 100 mg/l в опитната вода не може да бъде постигната, следва да се извърши ограничен тест при концентрация, равна на разтворимостта на веществото (или максималната концентрация, формираща стабилна дисперсия) в използваната среда (вж. също 1.6.1.1).
Ограниченият тест следва да се извърши със 7 до 10 риби, със същия брой на контролните риби. (Според биномната теория, когато са използвани 10 риби и е регистрирана нулева смъртност, това е 99,9-процентово доказателство, че LC50 е по-голяма от използваната концентрация в ограничения тест. При 7, 8 или 9 риби липсата на смъртност е поне 99-процентово доказателство, че LC50 е по-голяма в сравнение с използваната концентрация.)
В случай на смъртност следва да се извърши пълно проучване. Ако се наблюдават почти смъртоносни въздействия, те следва да бъдат отбелязани.
2. ДАННИ И ОЦЕНКА
За всеки отчетен интервал (24, 48, 72 и 96 часа) се построява зависимост на процентната смъртност за всеки препоръчителен период на излагане спрямо стойностите на концентрация върху логаритмична хартия.
При възможност за всеки отчетен интервал LC50 и границите на точност (р = 0,05) следва да бъдат отчетени при използване на стандартните процедури; тези стойности следва да се закръгляват до един или най-много два знака (ето примери за закръгляване: 173,5 на 170; 0,127 на 0,13; 1,21 на 1,2).
В случаи, когато наклонът на кривата от съотношението концентрация/процентна смъртност е прекалено стръмен и изчисляването на LC50 е затруднено, достатъчна е само оценката на стойността по графиката.
Когато две концентрации при съотношение 2,2 дават показания за смъртност само 0 и 100 %, тези две стойности са достатъчни за отчитане на обхвата, в който попада LC50.
Ако е забелязано, че стабилността или хомогенността на опитното вещество не може да се поддържа, това следва да бъде записано в доклада и да се внимава при интерпретацията на резултатите.
3. ДОКЛАДВАНЕ
Протоколът от изпитването следва, при възможност, да включва следната информация:
|
—
|
данни за опитната риба (научно наименование, вид (род), доставчик, някакво предварително третиране, размери и брой на използваните индивиди за всяка опитна концентрация);
|
|
—
|
източник на водата за разреждане и нейните основни химически характеристики (рН, твърдост, температура);
|
|
—
|
в случаи, когато веществото е с ниска разтворимост във вода, да се посочват методите за приготвяне на стандартните и тестовите разтвори;
|
|
—
|
концентрация на използваните спомагателни съединения;
|
|
—
|
списък на използваните концентрации и всяка налична информация за стабилността в концентрациите на опитния химикал и тестовия разтвор;
|
|
—
|
ако са извършени химически анализи, да се посочат използваните методи и получените резултати;
|
|
—
|
резултати от ограничения тест, ако е извършен;
|
|
—
|
обосновка за избора и подробности за използваната опитна процедура (например статичен или полустатичен метод, норма на дозите, скорост на водоподаване и аериране на водата, ако е приложено такова, натоварване на рибата и др.);
|
|
—
|
описание на опитната апаратура;
|
|
—
|
концентрации на разтворения кислород, стойности на рН и температурите на тестовите разтвори на всеки 24 часа;
|
|
—
|
доказателства, че критериите за качество са спазени;
|
|
—
|
таблица, показваща натрупаната смъртност при всяка концентрация и контролните риби (и контролни риби със спомагателни вещества, ако се налага) на всеки от препоръчителните интервали за наблюдение;
|
|
—
|
графика на съотношението концентрация/процентна смъртност в края на теста;
|
|
—
|
при възможност, стойностите на LC50 на всеки от препоръчителните интервали за наблюдение (при 95 % допустима точност);
|
|
—
|
използвани статистически процедури при определяне стойностите на LC50;
|
|
—
|
ако е използвано референтно вещество, посочват се получените резултати;
|
|
—
|
най-високата опитна концентрация, при която не е настъпила смъртност през периода на теста;
|
|
—
|
най-ниската опитна концентрация, при която е отчетена 100-процентова смъртност по време на теста.
|
4. ПРЕПРАТКИ
|
(1)
|
ОECD, Paris, 1981, Test Guideline 203, Decision of the Council C(81) 30 final and updates.
|
|
(2)
|
AFNOR – Determination of the acute toxicity of a substance to Brachydanio rerio - Static and Flow Through methods -NFT 90-303 June 1985.
|
|
(3)
|
AFNOR- Determination of the acute toxicity of a substance to Salmo gairdneri - Static and Flow – Through methods -NFT 90-305 June 1985.
|
|
(4)
|
ISO 7346/1,/2 and/3 – Water Quality – Determination of the acute lethal toxicity of substances to a fresh water fish (Brachydanio rerio Hamilton-Buchanan – Teleostei, Cyprinidae). Part 1: Static method. Part 2: Semi-static method. Part 3: Flow-through method.
|
|
(5)
|
Eidgenössisches Department des Innern, Schweiz: Richtlinien fur Probenahme und Normung von Wasseruntersuchungsmethoden – Part II 1974.
|
|
(6)
|
DIN Testverfahren mit Wasserorganismen, 38 412 (11) und 1 (15).
|
|
(7)
|
JIS K 0102, Acute toxicity test for fish.
|
|
(8)
|
NEN 6506 – Water – Bepaling van de akute toxiciteit met behulp van Poecilia reticulata, 1980.
|
|
(9)
|
Environmental Protection Agency, Methods for the acute toxicity tests with fish, macroinvertebrates and amphibians. The Committee on Methods for Toxicity Tests with Aquatic Organisms, Ecological Research Series EPA-660-75-009, 1975.
|
|
(10)
|
Environmental Protection Agency, Environmental monitoring and support laboratory, Office of Research and Development, EPA-600/4 -78-012, January 1978.
|
|
(11)
|
Environmental Protection Agency, Toxic Substance Control, Part IV, 16 March 1979.
|
|
(12)
|
Standard methods for the examination of water and wastewater, fourteen edition, APHA-AWWA-WPCF, 1975.
|
|
(13)
|
Commission of the European Communities, Inter-laboratory test programme concerning the study of the ecotoxicity of a chemical substance with respect to the fish. EEC Study D.8368, 22 March 1979.
|
|
(14)
|
Verfahrensvorschlag des Umweltbundesamtes zum akuten Fisch-Test. Rudolph, P. und Boje, R., Ökotoxikologie, Grundlagen fur die ökotoxikologische Bewertung von Umweltchemikalien nach dem Chemikaliengesetz, ecomed 1986.
|
|
(15)
|
Litchfield, J. T. and Wilcoxon, F., A simplified method for evaluating dose effects experiments, J. Pharm, tExp. Therap., 1949, vol. 96, 99.
|
|
(16)
|
Finney, D. J. Statistical Methods in Biological Assay. Griffin, Weycombe, U. K., 1978.
|
|
(17)
|
Sprague, J. B. Measurement of pollutant toxicity to fish. Bioassay methods for acute toxicity. Water Res., 1969, vol. 3, 793-821.
|
|
(18)
|
Sprague, J. B. Measurement of pollutant toxicity to fish. II Utilising and applying bioassay results. Water Res. 1970, vol. 4, 3-32.
|
|
(19)
|
Stephan, C. E. Methods for calculating an LC50. In Aquatic Toxicology and Hazard Evaluation (edited by F.I. Mayer and J.L. Hamelink). American Society for Testing and Materials, ASTM STP 634, 1977, 65-84.
|
|
(20)
|
Stephan, C. E., Busch, K. A., Smith, R., Burke, J. and Andrews, R. W. A computer program for calculating an LC50. US EPA.
|
Допълнение 1
Пречистена вода
Пример за подходяща вода за разреждане
Всички химикали следва да са с качество „чист за анализ“.
Използва се дестилирана вода с добро качество или дейонизирана вода с проводимост под 5 μScm-1.
Апаратурата за дестилиране на вода не следва да съдържа части, изработени от мед.
Стандартни разтвори
|
СаСl2.2Н2О (калциев хлорид дихидрат)
Разтваря се във вода и се долива до 1 литър.
|
11,76 g
|
|
MgSO4.7H2O (магнезиев сулфат хептахидрат)
Разтваря се във вода и се долива до 1 литър.
|
4,93 g
|
|
NaHCO3 (натриев бикарбонат)
Разтваря се във вода и се долива до 1 литър.
|
2,59 g
|
|
KCl (калиев хлорид)
Разтваря се във вода и се долива до 1 литър.
|
0,23 g
|
Пречистена вода за разреждане
Смесват се по 25 ml от всеки от 4-те стандартни разтвора и се долива до 1 литър.
Аерира се, докато концентрацията на разтворения кислород се изравни със стойността на въздухонаситеността на водата.
рН следва да бъде 7,8±0,2.
При необходимост рН се нагласява към това на NaOH (натриев хидроксид) или на HCL (солна киселина).
Така приготвената вода за разреждане се оставя да престои 12 часа и не следва повече да се аерира.
Сумата от калциевите и магнезиевите йони в този разтвор е 2,5 mmol/l. Съотношението на Ca:Mg йони е 4:1, а на Na:K йони — 10:1. Общата алкалност на разтвора е 0,8 mmol/l.
Евентуалните отклонения при приготвяне на водата за разреждане не следва да водят до промени в състава или свойствата на водата.
Допълнение 2
Препоръчителни видове риба за провеждане на изпитванията
|
Препоръчани видове
|
Препоръчан обхват на температурата за изпитване (oС)
|
Препоръчана обща дължина на експерименталното животно (cm)
|
|
Brachydanio rerio (Teleostei, Cyprinidae) (Hamilton-Buchanan) Рибка-зебра
|
От 20 до 24
|
3,0 ± 0,5
|
|
Pimephales promelas (Teleostei, Cyprinidae) (Rafinesque) Бодливка
|
От 20 до 24
|
5,0 ± 2,5
|
|
Cyprinus carpio (Teleostei, Cyprinidae) (Linneaus 1758) Обикновен шаран
|
От 20 до 24
|
6,0 ± 2,0
|
|
Oryzias latipes (Teleostei, Poeciliidae) Cyprinodontidae (Tomminck and Schlege 1850) Оризиа
|
От 20 до 24
|
3,0 ± 1,0
|
|
Poecilia reticulata (Teleostei, Poeciliidae) (Peters 1859) Гупи
|
От 20 до 24
|
3,0 ± 1,0
|
|
Lepomis macrochirus (Teleostei, Centrarchidae) (Rafinesque Linneaus 1758) Дребна сладководна риба
|
От 20 до 24
|
5,0 ± 2,0
|
|
Onchorhynchus mykiss (Teleostei, Salmonidae) (Walbaum 1988) Дъгова пъстърва
|
От 12 до 17
|
6,0 ± 2,0
|
|
Leuciscus idus (Teleostei, Cyprinidae) (Linneaus 1758) Златна рибка
|
От 20 до 24
|
6,0 ± 2,0
|
Събиране
Изброените по-горе риби са лесни за отглеждане и/или лесни за намиране през цялата година. Те могат да се развъждат и култивират в рибни ферми или в лаборатория, при условия на контрол за болести и паразити, така че експерименталните животни да бъдат здрави и с известен произход. Тези риби се намират в много части на света.
Допълнение 3
Пример за зависимостта концентрация : процент смъртност
Пример за определяне на LC50, използвайки логаритмични координати.

В.2. DAPHNIA SP. ИЗПИТВАНЕ ЗА ОСТРА ИМОБИЛИЗАЦИЯ
1. МЕТОД
Този метод за остра имобилизация е еквивалентен на OECD TG 202 (2004).
1.1. ВЪВЕДЕНИЕ
Този метод описва изпитване за остра токсичност за оценка на въздействието на химични вещества върху дафнии. Използвани са, доколкото е възможно, съществуващи методи на изпитване (1)(2)(3).
1.2. ОПРЕДЕЛЕНИЯ
В контекста на този метод са използвани следните определения:
|
|
ЕС
50
: е концентрацията, която имобилизира 50 % от дафниите в рамките на определен период на излагане. Ако се използва друго определение, то следва да е цитирано заедно с препратка.
|
|
|
Имобилизация: Животните, които не са в състояние да плуват до 15 секунди след лекото разклащане на съда на изпитване, се смятат за имобилизирани (дори ако все още да могат да движат антените си).
|
1.3. ПРИНЦИП НА МЕТОДА НА ИЗПИТВАНЕ
Млади дафнии, на възраст по-малка от 24 часа в началото на изпитването, се излагат на изпитваното вещество при редица концентрации за период от 48 часа. Имобилизацията се записва на 24-ия и 48-ия час и се сравнява с контролните стойности. Резултатите се анализират, за да се изчисли ЕС50 на 48-ия час (вж. точка 1.2 за определенията). Определянето на ЕС50 на 24-ия час е по избор.
1.4. ИНФОРМАЦИЯ ЗА ИЗПИТВАНОТО ВЕЩЕСТВО
Разтворимостта във вода и налягането на парите на изпитваното вещество следва да са известни и следва да има надежден аналитичен метод за количествено определяне на веществото в разтворите на изпитване, като ефикасността на събиране е известна, както и границата на определяне. Полезна е информацията за структурната формула, чистотата на веществото, стабилността му във вода или на светлина, Pow и резултатите от изпитването за лесна биоразградимост (вж. метод В.4).
Забележка: Насоки за изпитване на вещества с физикохимични свойства, които ги правят трудни за изпитване, са дадени в (4).
1.5. РЕФЕРЕНТНИ ВЕЩЕСТВА
Референтно вещество може да се изпита за ЕС50 като средство за потвърждение, че условията на изпитване са надеждни. Токсикантите, които са използвани в международен ринг-тест (1)(5), са препоръчителни за тази цел (1). Препоръчва се изпитването или изпитванията с референтни вещества да се правят всеки месец или поне два пъти в годината.
1.6. КРИТЕРИИ ЗА КАЧЕСТВО
За да бъде едно изпитване валидно, показателите му следва да отговарят на следните критерии:
|
—
|
при контролите, включително контролите, съдържащи разтварящия агент, не бива да се имобилизарат повече от 10 % от дафниите;
|
|
—
|
концентрацията на разтворения кислород в края на изпитването следва да бъде ≥ 3 mg/l в контролите съдове и съдовете за провеждане на изпитването.
|
Забележка: За първия критерий не повече от 10 % от контролните дафнии следва да показват имобилизация или други признаци на заболяване или стрес, например: обезцветяване, необичайно поведение, примерно невъзможност да се откъсне от водна повърхност.
1.7. ОПИСАНИЕ НА МЕТОДА НА ИЗПИТВАНЕ
1.7.1. Оборудване
Съдовете за изпитване и другото оборудване, което ще влезе в контакт с изпитваните разтвори, следва да бъдат изцяло стъклени или от друг химически инертен материал. Съдовете за изпитване обикновено са стъклени епруветки или колби; те следва да бъдат почистени преди всяка употреба по стандартни лабораторни процедури. Съдовете за изпитване следва да бъдат свободно покрити, за да се намали загубата на вода поради изпаряване и за да се избегне попадането на прах в разтворите. Летливите вещества следва да се изпитват при изцяло пълни затворени съдове, които да са достатъчно големи, за да може да се попречи на кислорода да стане лимитиращ фактор или съдържанието му да стане твърде ниско (вж. точка 1.6 и първи параграф от точка 1.8.3).
Освен това се използва напълно или отчасти следното оборудване: кислородометър (с микроелектрод или друго подходящо оборудване за измерване на разтворения кислород в проби с малък обем); рН-метър; подходящ прибор за контрол на температурата; оборудване за определяне на общата концентрация на органичен въглерод (ТОС); оборудване за определяне на химично потребния кислород (COD); апарат за определяне на твърдостта на вода и т.н.
1.7.2. Организъм на изпитване
Daphnia magna Straus е предпочитаният вид, макар че други видове Daphnia също могат да бъдат използвани за това изпитване (например Daphnia pulex). В началото на изпитването животните следва да бъдат на възраст не по-голяма от 24 часа и за да се намали вариабилността, силно се препоръчва те да не са от едно и също първо потомство. Те следва да са от една здрава популация (т.е. такава, която не проявява признаци на стрес, като висока смъртност, наличие на мъжки и ефипии, забавяне в създаването на първото поколение, обезцветени животни и т.н.). Всички организми, които се използват за дадено изпитване, следва да са произлезли от култури, създадени от дафнии от една и съща популация. Популацията животни следва да се държи в култура с условия (светлина, температура, среда), сходни с тези, които ще се използват по време на изпитването. Ако средата на културата дафнии, която ще се използва по време на изпитването, се различава от средата, която се използва при рутинни култури дафнии, добра практика е да се предвиди предварителен период за аклиматизация преди изпитването. Затова младите дафнии следва да се държат във вода за разреждане при температурата на изпитване поне 48 часа преди началото на изпитването.
1.7.3. Вода за аклиматизиране и вода за разреждане
Природни води (повърхностни или подпочвени), реконституирана вода или дехлорирана чешмяна вода могат да се използват за аклиматизиране и за разреждане, ако дафниите оцеляват в нея за времето на отглеждане на културата, аклиматизацията и изпитването, без да показват признаци на стрес. Всяка вода, която отговаря на химичните характеристики на вода, приемлива за разреждане, както са изброени в приложение 1, е подходяща да се използва като вода за изпитването. Тя следва да е с постоянно качество през пялото време на изпитването. Реконституирана вода може да се получи, като се добавят специфични количества реагенти от категория, призната за провеждане на опити, към дейонизирана или дестилирана вода. Примери за реконституирана вода са дадени в (1), (6) и в приложение 2. Забележете, че средите, съдържащи познати агенти, образуващи челати, като средите М4 и М7 в приложение 2, следва да се избягват при вещества на изпитване, съдържащи метал. рН следва да бъде в границите от 6 до 9. Твърдост между 40 и 250 mg/l (изразена като СаСО3) е препоръчителна за Daphnia Magna, докато по-ниска твърдост може също да бъде подходяща за други видове Daphnia. Водата за разреждане може да се аерира преди употреба за изпитването, така че концентрацията на разтворения кислород да достигне насищане.
Ако се използва природна вода, качествените ѝ параметри следва да се измерват поне два пъти годишно или всеки път когато има подозрение, че тези характеристики може да са се променили значително (вж. предишната точка и приложение 1). Следва да се измери и съдържанието на тежките метали (например Cu, Pb, Zn, Hg, Cd, Ni). Ако се използва дехлрорирана чешмяна вода, желателно е ежедневно да се прави хлорен анализ. Ако водата за разреждане е от повърхностен или подпочвен водоизточник, следва да се измерят проводимостта и общият органичен въглерод (ТОС) или химично потребният кислород (COD).
1.7.4. Разтвори на изпитване
Разтворите на изпитване с избраните концентрации обикновено се приготвят чрез разреждане на изходен разтвор. За предпочитане е изходните разтвори да се приготвят, като се разтвори изпитваното вещество във водата за разреждане. Доколкото е възможно, следва да се избягва използването на разтворители, емулгатори или дисперсанти. Въпреки това, в някои случаи може да се налага използването на подобни съединения, за да се получи подходящо концентриран изходен разтвор. Насоки за подходящи разтворители, емулгатори и дисперсанти са дадени в (4). Във всички случаи обаче изпитваните вещества в разтворите на изпитване не следва да превишават границата на разтворимост във водата за разреждане.
Изпитването следва да се проведе без коригиране на рН. Ако рН не остане в границите 6—9, може да се наложи провеждането на второ изпитване, при което рН на изходния разтвор се коригира, за да стане еднакъв с този на водата за разреждане преди добавянето на изпитваното вещество. Корекцията на рН следва да се направи по такъв начин, че концентрацията на изходния разтвор да не се промени в значителна степен и да не се предизвика никаква химична реакция или утаяване на изпитваното вещество. За предпочитане са НСl и NaOH.
1.8. ПРОЦЕДУРА
1.8.1. Условия на излагане
1.8.1.1. Групи на изпитване и контроли
Съдовете за изпитването се пълнят с подходящи обеми вода за разреждане и разтвори на изпитваното вещество. Съотношението въздух/вода в съда следва да бъде еднакво за изпитваната и контролната група. Тогава в съдовете за изпитване се поставят дафниите. Поне 20 животни, за предпочитане разделени на четири групи по пет животни всяка, следва да се използват за всяка изпитвана концентрация и за контролите. Поне 2 ml от разтвора на изпитване следва да се осигури за всяко животно (т.е. обем от 10 ml за пет дафнии на съд за изпитване). Изпитването може да се осъществи, като се прави полустатично обновяване или се използва проточна система, когато концентрацията на изпитваното вещество не е стабилна.
Една контролна серия с вода за разреждане и също, ако е необходимо, една контролна серия, съдържаща разтварящия агент, следва да се изпитат в допълнение към обработените серии.
1.8.1.2. Концентрации на изпитване
Може да се направи изпитване за определяне на обхвата, за да се определят концентрациите за същинските изпитвания, освен ако няма налична информация за токсичността на изпитваното вещество. За тази цел дафниите се излагат на серия от много раздалечени концентрации на изпитваното вещество. Пет дафнии следва да се изложат на всяка една концентрация на изпитване за период от 48 часа или по-малко, като не са необходими репликати. Периодът на излагане може да бъде скъсен (например 24 часа и по-малко), ако данните, подходящи за целта на изпитването за определяне на обхвата, могат да се получат за по-кратко време.
Необходимо е да се използват поне пет концентрации на изпитване. Те следва да образуват геометрична прогресия с частно, за предпочитане не превишаващо 2,2. Следва да се направи обосновка, ако се използват по-малко от пет концентрации. Най-високата изпитана концентрация е добре да води до 100-процентна имобилизация, а най-ниската изпитана концентрация да не предизвиква никакъв видим ефект.
1.8.1.3. Инкубационни условия
Температурата следва да бъде в обхвата от 18 до 22 oС, а за всяко единично изпитване тя следва да бъде постоянна в границите ± 1 oС. Препоръчва се цикъл от 16 часа на светло и 8 часа на тъмно. Приема се също и пълна тъмнина, особено за изпитвани вещества, които са нестабилни на светлина.
Съдовете за изпитванията не следва да се аерират по време на изпитването. Изпитването следва да се проведе без коригиране на рН. Дафниите не бива да се хранят по време на изпитването.
1.8.1.4. Продължителност
Изпитването продължава 48 часа.
1.8.2. Наблюдения
Всеки съд за изпитване следва да бъде проверяван за имобилизирани дафнии на 24-ия и 48-ия час след началото на изпитването (вж. точка 1.2 за дефинициите). Освен неподвижността следва да се докладва всяко анормално поведение или такъв външен вид.
1.8.3. Аналитични измервания
Разтвореният кислород и рН се измерват в началото и в края на изпитването в контролата/контролите и при най-високата концентрация на изпитваното вещество. Концентрацията на разтворения кислород при контролите следва да съответства на критериите за валидност (вж. точка 1.6). рН нормално не следва да варира с повече от 1,5 единици за което и да е изпитване. Температурата обикновено се измерва в контролните съдове или в околния въздух и следва да се регистрира, препоръчително е непрекъснато, през пялото време на изпитването или като минимум — в началото и в края на изпитването.
Концентрацията на изпитваното вещество следва да се измерва като минимум в най-високата и най-ниската концентрация на изпитване, в началото и в края на изпитването (4). Препоръчително е резултатите да се основават върху измерените концентрации. Въпреки това, ако има данни, които показват, че концентрацията на изпитваното вещество се поддържа достатъчно добре в рамките на ± 20 % от номиналната или първоначалната измерена концентрация през пялата продължителност на изпитването, то резултатите могат да се основат на номиналната или измерената първоначални стойност.
1.9. ИЗПИТВАНЕ ЗА ГРАНИЦИТЕ
Използвайки процедурата, описана в този метод, може да се направи гранично изпитване при 100 mg/l от изпитваното вещество или при неговата граница на разтворимост в средата за изпитване (тази която е по-ниска), за да се покаже, че ЕС50 е по-голяма от тази концентрация. Изпитването за границите следва да се проведе с 20 дафнии (за предпочитане е в четири групи по пет), със същия брой в контролата/контролите. Ако настъпи някаква имобилизация, следва да се направи цялостно изследване. Всякакво анормално поведение следва да бъде отбелязано.
2. ДАННИ
Данните следва да бъдат обобщени в таблична форма, като показват за всяка третирана група и контролите, броя на използваните дафнии и регистрираната имобилизация при всяко наблюдение. Процентът на имобилизираните на 24-ия и 48-ия час се представя графично срещу концентрациите на изпитване. Данните се анализират с помощта на подходящи статистически методи (например пробит-анализ и др.), за да се изчислят наклоните на кривите и ЕС50 c 95 % граница на вероятност (p = 0,05) (7) (8).
Когато стандартните методи за изчисляване на ЕС50 не са приложими за получените данни, следва да се използват най-високата концентрация, непричиняваща имобилизация, и най-ниската концентрация, предизвикваща 100 % имобилизация, като приближения на ЕС50 (това се смята за средно геометрично на тези две концентрации).
3. ДОКЛАДВАНЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Протоколът от изпитването следва да съдържа следното:
Изпитвано вещество:
|
—
|
физична природа и имащи отношение физикохимични свойства;
|
|
—
|
химични идентификационни данни, включително чистота.
|
Животински вид за изпитването:
|
—
|
източник и вид Daphnia, доставчик на източника (ако е известен), и използвани условия за културата (включително източник, вид и количество храна, честота на хранене).
|
Условия на изпитване:
|
—
|
описание на съдовете за изпитване: тип съдове, обем на разтвора, брой дафнии на съд за изпитване, брой на съдовете за изпитване (репликати) на концентрация;
|
|
—
|
методи на подготовка на изходните разтвори и на изпитване, включително използването на каквито и да било разтворители или дисперсанти, използвани концентрации;
|
|
—
|
подробности за водата за разреждане: източник и качествени характеристики на водата (рН, твърдост, съотношение Ca/Mg, съотношение Na/K, алкалност, проводимост и др.); състав на реконституираната вода, ако е използвана такава;
|
|
—
|
инкубационни условия: температура, светлинен интензитет и периодичност, разтворен кислород, рН и др.
|
Резултати:
|
—
|
броят и процентът на дафниите, които са имобилизирани или проявяват някакви неблагоприятни ефекти (включително анормално поведение) в контролите и във всяка третирана група, при всяко наблюдение, описание на природата на наблюдаваните ефекти;
|
|
—
|
резултати и дата на извършеното изпитване с референтно вещество, ако има такива;
|
|
—
|
следва да бъдат докладвани също и номиналните концентрации на изпитване, и резултатът от всички анализи за определяне на концентрацията на изпитваното вещество в съдовете за изпитване; ефикасността на събиране на метода и границите на определяне;
|
|
—
|
всички физикохимични измервания на температура, рН и разтворен кислород, направени по време на изпитването;
|
|
—
|
ЕС50 на 48-ия час за имобилизация с интервалите на надеждност и графики от модела, използван за тяхното изчисляване, наклона на кривите на реакция на дозата и тяхната стандартна грешка; статистически процедури, използвани при определяне на ЕС50 (тези данни за имобилизация на 24-ия час също следва да се докладват, когато са измерени);
|
|
—
|
обяснение на всякакви отклонения от метода на изпитване и дали тези отклонения влияят върху резултатите от изпитването.
|
4. ПРЕПРАТКИ
|
(1)
|
ISO 6341. (1996). Water quality — Determination of the inhibition of the mobility of
Daphnia magna
Straus (Cladocera, Crustacea) — Acute toxicity test. Third edition, 1996.
|
|
(2)
|
EPA OPPTS 850.1010. (1996). Ecological Effects Test Guidelines — Aquatic Invertebrate Acute Toxicity Test, Freshwater Daphnids.
|
|
(3)
|
Environment Canada. (1996) Biological test method. Acute Lethality Test Using
Daphnia
spp. EPS 1/RM/11. Environment Canada, Ottawa, Ontario, Canada.
|
|
(4)
|
Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environmental Health and Safety Publication. Series on Testing and Assessment. No. 23. Paris 2000.
|
|
(5)
|
Commission of the European Communities. Study D8369. (1979). Inter-laboratory Test Programme concerning the study of the ecotoxicity of a chemical substance with respect to
Daphnia.
|
|
(6)
|
OECD Guidelines for the Testing of Chemicals. Guideline 211:
Daphnia magna
Reproduction Test, adopted September 1998.
|
|
(7)
|
Stephan C.E. (1977). Methods for calculating an LC50. In Aquatic Toxicology and Hazard Evaluation (edited by F. I. Mayer and J. L. Hamelink). ASTM STP 634 — American Society for Testing and Materials. Pp 65—84
|
|
8.
|
Finney D. J. (1978). Statistical Methods in Biological Assay. 3rd ed. London. Griffin, Weycombe, UK.
|
Приложение 1
НЯКОИ ХИМИЧНИ ХАРАКТЕРИСТИКИ НА ПРИЕМЛИВАТА ВОДА ЗА РАЗРЕЖДАНЕ
|
Вещество
|
Концентрация
|
|
Суспендирани вещества
|
< 20 mg/l
|
|
Общ органичен въглерод
|
< 2mg/l
|
|
Свързани амониеви йони
|
< 1 μg/l
|
|
Остатъчен хлор
|
< 10 μg/l
|
|
Общи органофосфорни пестициди
|
< 50 ng/l
|
|
Общи органохлорни пестициди плюс полихлорирани бифенили
|
< 50 ng/l
|
|
Общ органичен хлор
|
< 25 ng/l
|
Приложение 2
ПРИМЕРИ ЗА ПОДХОДЯЩА РЕКОНСТИТУИРАНА ВОДА ЗА ИЗПИТВАНЕ
ISO Вода за изпитване (1)
|
Изходни разтвори (едно вещество)
|
За приготвянето на реконституирана вода се добавят следните обеми от изходните разтвори към 1 литър вода (2)
|
|
вещество
|
количество, добавено към 1 литър вода (2)
|
|
Калциев хлорид
CaCl2, 2H2O
|
11,76 g
|
25 ml
|
|
Магнезиев сулфат
MgSO4, 7H2O
|
4,93 g
|
25 ml
|
|
Натриев бикарбонат
NaHCO3
|
2,59 g
|
25 ml
|
|
Калиев хлорид
КСl
|
0,23 g
|
25 ml
|
Аклиматизация към среди Elendt М4 и М7
Някои лаборатории са изпитали затруднения при прекия пренос на Daphnia в среди М4 и М7 . Въпреки това е постигнат известен успех при постепенната аклиматизация, т.е. преместването от собствената среда в 30 % Elendt, после в 60 % Elendt и след това в 100 % Elendt. Периодите на аклиматизация могат да продължат до месец.
Подготовка
Остатъчен елемент
Отделните изходни разтвори (I) на индивидуални остатъчни елементи първо се подготвят във вода с подходяща чистота, напр. дейонизирана, дестилирана или чрез обратна осмоза. От тези различни изходни разтвори (I) се подготвя (II) втори еднократен изходен разтвор, който съдържа всичките остатъчни елементи (комбиниран разтвор), т.е.:
|
Изходен(и) разтвор(и) I (едно вещество)
|
Количество, добавено към вода (mg/l)
|
Концентрация (по отношение на средата М4)
|
За подготовката на комбинирания изходен разтвор II се добавя следното количество от изходен разтвор I към водата (ml/1)
|
|
M4
|
M7
|
|
Н3ВО3
|
57 190
|
20 000 пъти
|
1,0
|
0,25
|
|
MnCl2.4H2O
|
7 210
|
20 000 пъти
|
1,0
|
0,25
|
|
LiCl
|
6 120
|
20 000 пъти
|
1,0
|
0,25
|
|
RbCl
|
1 420
|
20 000 пъти
|
1,0
|
0,25
|
|
SrCl2.6H2O
|
3 040
|
20 000 пъти
|
1,0
|
0,25
|
|
NaBr
|
320
|
20 000 пъти
|
1,0
|
0,25
|
|
Na2 MoO4.2H2O
|
1 230
|
20 000 пъти
|
1,0
|
0,25
|
|
CuCl2.2H2O
|
335
|
20 000 пъти
|
1,0
|
0,25
|
|
ZnCl2
|
260
|
20 000 пъти
|
1,0
|
1,0
|
|
CoCl2.6H2O
|
200
|
20 000 пъти
|
1,0
|
1,0
|
|
KI
|
65
|
20 000 пъти
|
1,0
|
1,0
|
|
Na2 SeO3
|
43,8
|
20 000 пъти
|
1,0
|
1,0
|
|
NH4 VO3
|
11,5
|
20 000 пъти
|
1,0
|
1,0
|
|
Na2 EDTA.2H2O
|
5 000
|
2 000 пъти
|
—
|
—
|
|
FeSO4.7H2O
|
1 991
|
2 000 пъти
|
—
|
—
|
|
КактКакто Na 2 EDTA, така и FeSO4 разтворите се приготвят поединично, събират се аедно и веднага се поставят в автоклав.
|
|
Това дава:
|
|
2 1 Fe-EDTA разтвор
|
|
1 000 пъти
|
20,0
|
5,0
|
М4 и М7 среда
М4 и М7 среда се приготвят, като се използва изходен разтвор II, макронутриенти и витамини, както следва:
|
|
Количество, добавено към водата (mg/l)
|
Концентрация (по отношение на средата М4)
|
Количество от изходния разтвор II, добавено, за да се приготви средата (ml/l)
|
|
М4
|
М7
|
|
Изходен разтвор II (комбинирани остатъчни елементи)
|
|
20 пъти
|
50
|
511
|
|
Макронутриентни изходни разтвори (едно веществo)
|
|
|
|
|
|
СаСl2.2Н20
|
293 800
|
1 000 пъти
|
1,0
|
1,0
|
|
МgSО4.7Н2О
|
246 600
|
2 000 пъти
|
0,5
|
0,5
|
|
КСl
|
58 000
|
10 000 пъти
|
0,1
|
0,1
|
|
NаНСО3
|
64 800
|
1 000 пъти
|
1,0
|
1,0
|
|
Nа2SiO3.9Н2О
|
50 000
|
5 000 пъти
|
0,2
|
0,2
|
|
NaNO3
|
2 740
|
10 000 пъти
|
0,1
|
0,1
|
|
КН2РО4
|
1 430
|
10 000 пъти
|
0,1
|
0,1
|
|
KН2 РО4
|
1 840
|
10 000 пъти
|
0,1
|
0,1
|
|
Изходни комбинирани витамини
|
—
|
10 000 пъти
|
0,1
|
0,1
|
|
Изходният разтвор комбинирани витамини е изготвен чрез добавяне на 3 витамина към 1 литър вода, както е показано по-долу:
|
|
Тиамин хидрохлорид
|
750
|
10 000 пъти
|
|
|
|
Цианокобаламин (В12)
|
10
|
10 000 пъти
|
|
|
|
Биотин
|
7,5
|
10 000 пъти
|
|
|
Изходните комбиниран витамин се съхраняват замразени на малки равни части. Витамините се добавят към средата малко преди употреба.
|
Забележка
|
:
|
За да се избегне утаяването на солите, когато се приготвя пълната среда, добавете съхранените малки количества на изходните разтвори към около 500—800 ml дейонизирана вода и после допълнете до 1 литър.
|
|
Забележка
|
:
|
Първата публикация за М4 средата е на Elendt, В. Р. (1990). Selenium deficiency in crustacea; an ultrastructual approach to antennal damage in Daphnia magna Straus. Protoplasma, 154, 25—33.
|
B.3. ИЗПИТВАНЕ ЗА ПОТИСКАНЕ РАСТЕЖА НА ВОДОРАСЛИ
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Целта на това изпитване е да се определи ефектът на дадено вещество върху растежа на видове едноклетъчни зелени водорасли. Относително кратки (72 часа) изпитвания могат да покажат ефекти върху няколко поколения. Този метод може да се адаптира за използване с много видове едноклетъчни водорасли, като в такива случаи към протокола от изпитването следва да се приложи и описание на метода за изпитване.
Този метод е най-лесно приложим за разтворими във вода вещества, които при условията на изпитването остават във водата.
Методът може да се използва за вещества, които не възпрепятстват директно измерването на растежа на водораслите.
Преди да започне изпитването, желателно е да се разполага, доколкото е възможно, с информация за разтворимостта във вода, парното налягане, химичната стабилност, дисоциационните константи и биологичната разградимост на веществото.
Както при планирането на теста, така и при тълкуването на резултатите следва да се вземе под внимание допълнителната информация (например структурна формула, степен на чистота, природата и процентното съдържание на значимите примеси, присъствие и количество на добавки, както и коефициентът на съотношението n-октанол/вода).
1.2. ОПРЕДЕЛЕНИЯ И МЕРНИ ЕДИНИЦИ
Плътност: брой клетки в милилитър.
Растеж: увеличаване на плътността за периода на изпитването.
Скорост на растеж: увеличение на плътността за единица време.
ЕС50: при този метод това е концентрацията на изпитваното вещество, която причинява 50 % намаляване на растежа (EbC50) или на скоростта на растеж (ErC50), сравнено с контролата.
NOEC (КБНЕ — концентрация без наблюдаван ефект): при този метод това е най-високата изпитвана концентрация, при която не се наблюдава значимо потискане на растежа в сравнение с контролата.
Всички концентрации на изпитваното вещество се дават като маса за единица обем (mg.l). Те също биха могли да се изразяват и в тегловни единици (mg.kg-1).
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Веществото за сравнение може да се изпита, за да се покаже, че при условията на лабораторния тест чувствителността на изпитваните видове не се е променила значително.
Ако се използва вещество за сравнение, резултатите следва да се дадат в протокола от изпитването. Като вещество за сравнение може да се използва калиев дихромат, но неговият цвят може да се отрази на качеството и интензивността на светлината, достигаща до клетките, както и ако се използват спектрофотометрични определяния. Калиевият дихромат е използван в международен междулабораторен тест (вж. препратка 3 и допълнение 2).
1.4. ПРИНЦИП НА МЕТОДА
Може да се проведе гранично изпитване със 100 mg на литър, за да се покаже, че ЕС50 е по-висока от тази концентрация.
Експоненциално растящите култури от избрани зелени водорасли се експонират на различни концентрации от изпитваното вещество за няколко поколения при определени условия.
Изпитвателните разтвори се инкубират за период от 72 часа, по време на който се измерва плътността на клетките на всеки 24 часа. Определя се потискането на растежа спрямо контролна култура.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Критериите за качество следва да се прилагат както при граничното изпитване, така и при пълното изпитване.
Плътността на клетките в контролните култури би следвало да се увеличава не по-малко от 16 пъти за три дни.
Концентрациите на изпитваното вещество следва да се поддържат в границите над 80 % от началните концентрации през цялото време на изпитването.
За вещества, които се разтварят лесно в тестваната среда, давайки стабилни разтвори, т.е. такива, които не се изпаряват, деградират, хидролизират или адсорбират в значителна степен, началната концентрация може да бъде приета като еквивалент на номиналната концентрация. Следва да се представят доказателства, че концентрациите са били поддържани през цялото време на теста и че критериите за качество са били изпълнени задоволително.
За вещества, които:
|
i)
|
са слабо разтворими в изпитваната среда, или
|
|
ii)
|
са способни да формират стабилни емулсии или дисперсии, или
|
|
iii)
|
са нестабилни във водни разтвори,
|
началните концентрации следва да се приемат като концентрациите, измерени в началото на изпитването. Концентрацията се определя след период на установяване на равновесие.
Във всички такива случаи по време изпитването следва да се правят по-нататъшни измервания, за да се докажат истинските концентрации, на които са изложени водораслите, или че критериите за качество са изпълнени.
Известно е, в биомасата на водораслите по време на изпитването могат да се включат значителни количества от изпитваното вещество. Следователно, с цел спазване на горепосочените критерии, следва да се вземат предвид и двете количества — това на веществото, включено в биомасата на водораслите, и количеството в разтвора (или, ако не е технически възможно, измерено във водния стълб). Ако обаче определянето на концентрацията на веществото в биомасата на водораслите представлява значителен технически проблем, спазването на критериите за качество може да се покаже и чрез зареждане на съд за изпитване с най-високата концентрация на веществото, но без водорасли и измерване на концентрацията в разтвора (или, ако не е технически възможно, във водния стълб) в началото и в края на периода на изпитването.
1.6. ОПИСАНИЕ НА МЕТОДА
1.6.1. Реагенти
1.6.1.1. Разтвори на изпитваните вещества
Основни разтвори с необходимата концентрация се приготвят чрез разтваряне на веществото в дейонизирана вода или във вода съгласно 1.6.1.2.
Избраните концентрации на разтворите за изпитването се приготвят чрез прибавяне на подходящи аликвотни части към предкултури от водорасли (виж допълнение 1).
Веществата нормално следва да се изпитват само до границата им на разтворимост. За някои вещества (напр. вещества, имащи слаба разтворимост във вода или високо Pow (коефициент на съотношението n-октанол/вода), или такива, формиращи по-скоро стабилни дисперсии, отколкото истински водни разтвори), е приемливо да се прилагат концентрации над нивото на разтворимост, за да се гарантира получаването на максималната разтворена/стабилна концентрация. Важно е обаче тази концентрация да не пречи по друг начин на системата на изпитване (например чрез образуване на филм от веществото върху водната повърхност, който да пречи на достъпа на кислород във водата, и т.н.).
При приготвяне на изходни разтвори на вещества със слаба разтворимост във вода или за подпомагане на диспергирането на тези вещества в изпитваната среда може да се използват ултразвуково диспергиране, органични разтворители, емулгатори или диспергиращи агенти. Когато се използват такива спомагателни вещества, всички изпитвани концентрации би следвало да съдържат еднакво количество от спомагателното вещество и една допълнителна контрола да бъде експонирана при същата концентрация на допълнителното вещество като тази, използвана в тестовите серии. Концентрацията на такива допълнителни вещества следва да се свежда до минимум и в никакъв случай да не превишава 100 mg на литър в тестовата среда.
Изпитването се провежда без регулиране на рН. Ако има доказателство за значителна промяна в рН, се препоръчва изпитването да се повтори с регулиране на рН и резултатите да се отразят в протокола. В този случай стойността на рН на изходния разтвор се регулира към стойността на рН на водата за разтваряне, освен ако има специфични причини това да не се прави. НСl и NaOH са предпочитани за тази цел. Това регулиране на рН се прави по такъв начин, че концентрацията на изпитваното вещество в изходния разтвор да не се променя значително. Ако регулирането доведе до някаква химична реакция или физическо утаяване на изпитваното вещество, това следва да се отрази в протокола.
1.6.1.2. Среда за провеждане на изпитването
Водата следва да е дестилирана, с добро качество или дейонизирана с проводимост не по-висока от 5 μS.cm-1. Апаратурата за дестилиране на водата не следва да съдържа никакви части, направени от мед.
Препоръчва се следната среда:
Приготвят се четири изходни разтвора според таблицата по-долу. Изходните разтвори се стерилизират чрез мембранно филтриране или чрез автоклавиране и се съхраняват на тъмно при 4 oС. Изходен разтвор номер 4 се стерилизира само чрез мембранно филтриране. Тези изходни разтвори се разреждат до получаване на крайните хранителни концентрации в разтворите за изпитване.
|
Хранителна среда
|
Концентрация в изходния разтвор
|
Крайна концентрация в разтвора за изпитване
|
|
Изходен разтвор 1: макрохранителни съставки
|
|
NH4Cl
|
1,5 g/l
|
15 mg/l
|
|
MgCl2.6H2O
|
1,2 g/l
|
12mg/l
|
|
CaCl2.2H2O
|
1,8 g/l
|
18 mg/l
|
|
MgSO4.7H2O
|
1,5 g/l
|
15 mg/l
|
|
KH2PO4
|
0,16 g/l
|
1,6 mg/l
|
|
Изходен разтвор 2: Fe-EDTA
|
|
FeCl3.6H2O
|
80 mg/l
|
0,08 mg/l
|
|
Na2EDTA.2H2O
|
100 mg/l
|
0,1 mg/l
|
|
Изходен разтвор З: микроелементи
|
|
Н3ВО3
|
185 mg/l
|
0,185 mg/l
|
|
MnCl2.4H2O
|
415 mg/l
|
0,415 mg/l
|
|
ZnCl2
|
3 mg/l
|
3 × 10-3 mg/l
|
|
CoCl2.6H2O
|
1,5 mg/l
|
1,5 × 10-3 mg/1
|
|
CuCl2.2H2O
|
0,01 mg/l
|
105 mg/l
|
|
Na2MoO4.2H2O
|
7 mg/l
|
7 × 10-3 mg/l
|
|
Изходен разтвор 4: NaHCO
3
|
|
NaHCO3
|
50 g/l
|
50 mg/l
|
Активната реакция (рН) на средата след достигане на равновесие с въздуха е приблизително 8.
1.6.2. Апаратура
|
—
|
Нормални лабораторни технически средства.
|
|
—
|
Колби със съответен обем (например, подходящи са конични колби от 250 ml, когато обемът на изпитвания разтвор е 100 ml). Всички колби следва да са изработени от еднакъв материал и да имат еднакви размери.
|
|
—
|
Апаратура за култивиране: шкаф или бокс, в който може да се поддържа температура от 21 oС до 25 oС с точност ± 2oС и непрекъснато еднакво осветление в спектралния обхват от 400 до 700 nm. Ако водораслите в контролните култури са достигнали препоръчаната скорост на растеж, може да се смята, че условията за растеж, включително интензитетът на светлината, са подходящи.
При средно ниво на концентрациите на изпитваните разтвори се препоръчва използването на светлина с интензитет от 60 до 120 μE.m-2.s-1 (35 до 70 × 1018 фотони.m-2.s-1), когато се измерва в обхвата от 400 до 700 nm, използвайки подходящ светломер. Ако инструментите за измерване на светлината са калибрирани в луксове, приемлив е обхватът от 6000 до 10 000 lх.
Интензитетът на светлината може да се постигне с четири до седем флуоресцентни лампи от 30 W с универсална бяла светлина (цветна температура около 4300 К), на разстояние 0,35 m от водорасловата култура.
|
|
—
|
Измерването на плътността на клетките се прави по метода на директно броене на живите клетки, например микроскоп с камери за броене. Могат да се използват обаче и други процедури (фотометрия, турбидиметрия, ...), ако са достатъчно чувствителни и се покаже, че дават добра корелация с плътността на клетките.
|
1.6.3. Организми за изпитване
Предполага се, че използваните видове зелени водорасли са бързо растящи видове и са подходящи за култивиране и изпитване. Предпочитат се следните видове:
|
—
|
Selenastrum capricornutum, например щам АТСС 22662 или щам ССАР 278/4,
|
|
—
|
Scenedesmus subspicatus, например щам 86.81 SAG.
|
Забележка:
|
АТСС
|
=
|
Американска колекция от типови култури (САЩ)
|
|
ССАР
|
=
|
Център за култури от водорасли и протозоа (Великобритания)
|
|
SAG
|
=
|
Колекция от водораслови култури (Гьотинген, Германия)
|
Ако са използвани други видове, щамът следва да се отрази в протокола от изпитването.
1.6.4. Процедура на изпитването
Обхватът от концентрации, при които се очаква да се получи ефект, се определя на базата на резултатите от изпитването за намиране на обхвата.
Двете мерки за растежа (биомаса и скорост на растеж) могат да дадат коренно различни измерения за потискането на растежа. И двете обаче следва да се използват в изпитването за намиране на обхвата, за да се осигури геометричната прогресия от концентрации, която да позволи да се оценят както EbC50, така и ErC50.
Начална плътност на клетките
Препоръчва се началната плътност на клетките да бъде приблизително 104 клетки/ml за Selenastrum capricornutum и Scenedesmus subspicatus. Когато се използват други видове, тяхната биомаса следва да е сравнима.
Концентрации на изпитваното вещество
За изпитването се приготвят най-малко пет концентрации в геометрична серия с отношение на концентрациите, ненадвишаващо 2,2 пъти. При най-ниската изпитвана концентрация не следва да се наблюдава ефект върху растежа на водораслите. Най-високата изпитвана концентрация следва да потисне растежа най-малко с 50 % в сравнение с контролата или, за предпочитане, да спре напълно растежа.
Повторения и контрол
Планът на изпитването следва да включва три повторения за всяка изпитвана концентрация. Залагат се и три контроли без изпитваното вещество и, ако е подходящо, три контроли, съдържащи допълнително вещество. Ако е оправдано, планът на изпитването може да се промени, като се увеличава броят на концентрациите и се намалява броят на повторенията за дадена концентрация.
Изпълнение на изпитването
Тестовите култури, съдържащи желаните концентрации от изпитваното вещество и желаното количество водораслова култура, се приготвят чрез прибавяне на аликвотни части от основните разтвори на изпитваното вещество към съответните количества предкултури от водорасли (вж. допълнение 1).
Култивационните колби се разклащат и се поставят в апаратурата за култивиране. Водораслите се поддържат в суспензия чрез разклащане, разбъркване или продухване с въздух, за да се подобри газовият обмен и да се намалят промените в рН на изпитваните разтвори. Културите следва да се поддържат при температура от 21 до 25 oС с регулиране в границите на ± 2 oС.
Плътността на клетките във всяка колба се определя най-малко на 24, 48 и 72 часа след започване на изпитването. Когато плътността на клетките се измерва по метод, различен от директното броене, за определяне на фоновите стойности се използва филтрирана среда от водорасли, съдържаща съответна концентрация на изпитваното химично вещество.
Активната реакция (рН) се измерва в началото на теста и на 72-рия час.
Активната реакция (рН) на проверките нормално не би следвало да се отклонява с повече от 1,5 единици по време на изпитването.
Изпитване на летливи вещества
До момента няма общоприет начин за изпитване на летливи вещества. Когато дадено вещество показва тенденция за изпаряване, могат да се използват затворени стъкленици с по-голямо пространство над разтвора. Когато се изчислява пространството над разтвора в затворени стъкленици, следва да се вземе предвид възможността за недостиг на СО2. Предлагани са различни варианти на този метод (вж. препратка 4).
Следва да се направят опити за определяне количеството на веществото, което остава в разтвора, като се препоръчва изключително внимание при тълкуването на резултатите от изпитвания в затворени системи с летливи химични вещества.
Гранично изпитване
Като се използват процедурите, описани в настоящия метод, се прави едно гранично изпитване със 100 mg на литър, за да се покаже, че LC50 е по-висока от тази концентрация.
Ако природата на веществото е такава, че във водата за изпитването не могат да бъдат достигнати 100 mg на литър, граничният тест следва да се проведе с концентрации, равни на разтворимостта на веществото (или с максималната концентрация, която образува стабилна дисперсия) в използваната среда (вж. също точка 1.6.1.1).
Граничното изпитване следва да се направи най-малко в три повторения, със същия брой контроли. И двете измерения на растежа (биомаса и скорост на растеж) следва да се използват при граничното изпитване.
Ако при граничното изпитване се намери средно намаление от 25 % или повече в биомасата или в скоростта на растеж между граничното изпитване и контролите, следва да се направи пълно изпитване.
2. ДАННИ И ОЦЕНКА
Измерената плътност на изпитваните култури и на контролите се подрежда в таблици заедно с концентрациите на изпитваното вещество и времената на измерване. Средната стойност на плътността на клетките за всяка изпитвана концентрация на веществото и тази на контролите се нанася на графика срещу времето (0—72 часа), за да се получат кривите на растеж.
За да се определи отношението концентрация/ефект, могат да се използват следните два подхода. Някои вещества могат да стимулират растежа при ниски концентрации. Вземат се предвид само данни, показващи потискане на растежа между 0 и 100 %.
2.1. СРАВНЕНИЕ НА ПЛОЩИТЕ ПОД КРИВИТЕ НА РАСТЕЖА
Площта между кривите на растежа и хоризонталната линия N = N0 може да се изчисли по формулата:

където
|
A
|
=
|
площ,
|
|
N0
|
=
|
брой клетки/ml при време t0 (началото на изпитването),
|
|
N1
|
=
|
измерен брой клетки/ml при t1,
|
|
Nn
|
=
|
измерен брой клетки/ml при време tn,
|
|
t1
|
=
|
време на първото измерване при започване на изпитването,
|
|
tn
|
=
|
време на n-то измерване след започването на изпитването,
|
|
n
|
=
|
брой измервания, направени след започването на изпитването.
|
Процентът на потискане на клетъчния растеж за всяка изпитвана концентрация (IA) се изчислява по следната формула:

където
|
Ас
|
= площта между кривата на растежа на контролата и хоризонталната линия N = No.
|
|
At
|
= площта между кривата на растежа при концентрация t и хоризонталната линия N = No.
|
Стойностите на IA се нанасят на графика върху полулогаритмични или логаритмични координати срещу съответните концентрации. Ако са нанесени на графиката, точките се съединяват с права линия, прекарана на око или изчислена чрез регресионен анализ.
ЕС50 се оценява от линията на регресия чрез отчитане на концентрацията, която отговаря на 50 % потискане (IA = 50 %). За да се обозначи, че тази стойност е недвусмислено свързана с този метод на изчисление, се препоръчва да се използва символът ЕbС50. Важно е ЕbС50 да се цитира заедно със съответния период на експозиция, например ЕbС50 (0—72 часа).
2.2. СРАВНЕНИЕ НА СКОРОСТИТЕ НА РАСТЕЖ
Средната специфична скорост на растеж (μ) за експоненциално растящи култури може да бъде изчислена като

μ = (ln Nn – ln N0)/(t n – t0) където t0 е времето на започване на изпитването.
Друга възможност е да се намери средната специфична скорост на растеж от наклона на регресионната права в графиката ln N срещу време.
Процентът на потискане на специфичната скорост на растеж за всяка концентрация на изпитваното вещество (Iμt) се изчислява по формулата:

където
|
μc
|
=
|
средната специфична скорост на растеж при контролата,
|
|
μt
|
=
|
средната специфична скорост на растеж при изпитвана концентрация t.
|
Процентното намаляване на средната специфична скорост на растеж за всяка изпитвана концентрация, сравнена със стойността на контролата, се нанася на графика срещу логаритъма на концентрацията. ЕС50 може да се отчете от получената графика. За да се обозначи недвусмислено, че тази стойност е получена по този метод на изчисление, се препоръчва да се използва символът ErC50. Времето на измерването следва да се означи, например стойността, която се отнася за времена 0 и 72 часа. Важно е да се цитира съответният период на експозиция, ако стойността се отнася за време от 0 до 72 часа, символът става ErC50 (0—72 часа).
Забележка: специфичната скорост на растеж е логаритмична величина и малки промени в скоростта на растеж могат да доведат до големи промени в биомасата. Поради това стойностите EbC и ErC не могат да се сравняват числено.
2.3. ИЗЧИСЛЯВАНЕ НА NOEC (КОНЦЕНТРАЦИЯ БЕЗ НАБЛЮДАВАН ЕФЕКТ)
NOEC, т.е. концентрацията без наблюдаван ефект, се определя чрез подходяща статистическа процедура за сравнение на множество проби (напр. анализ на дисперсията или тест на Dunett), като се използват индивидуалните стойности на площите А под кривите на растеж (вж. точка 2.1) или специфичните скорости на растеж μ (вж. точка 2.2).
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
Протоколът с резултатите от изпитването следва по възможност да съдържа следната информация:
|
—
|
изпитвано вещество: данни за неговата химична идентификация;
|
|
—
|
тестови организми: произход, лабораторна култура, номер на щама, метод на култивиране;
|
|
—
|
условия на изпитването:
|
—
|
дата на започване и край на изпитването и неговата продължителност,
|
|
—
|
апаратура за култивиране,
|
|
—
|
pH на разтворите при започване и в края на теста (следва да се даде обяснение, ако са наблюдавани промени в pH, по-големи от 1,5 единици),
|
|
—
|
използвани средство и метод за разтваряне на изпитваното вещество и концентрацията му в разтворите за изпитването,
|
|
—
|
интензитет и качество на светлината,
|
|
—
|
концентрации при изпитването (измерени или номинални);
|
|
|
—
|
резултати:
|
—
|
клетъчна плътност за всяка стъкленица при всяко време на измерване и метод на измерване на клетъчната плътност,
|
|
—
|
средни стойности на клетъчната плътност,
|
|
—
|
графично представяне на връзката между концентрация и ефект,
|
|
—
|
стойности на ЕС и метод за изчисляване;
|
|
—
|
NOEC (концентрация без забележим ефект),
|
|
—
|
други наблюдавани ефекти.
|
|
4. ПРЕПРАТКИ
|
(1)
|
ОECD, Paris, 1981, Test Guideline 201, Decision of the Council C(81) 30 Final.
|
|
(2)
|
Umweltbundesamt, Berlin, 1984, Verfahrensvorschlag ’Hemmung der Zellvermehrung bei der Grünalge Scenedesmus subspicatus’, in: Rudolph/Boje: Ökotoxikologie, ecomed, Landsberg, 1986.
|
|
(3)
|
ISO 8692 — Water quality —Fresh water algal growth inhibition test with Scenedesmus subspicatus and Selenastrum capricornutum.
|
|
(4)
|
S. Galassi and M. Vighi — Chemosphere, 1981, vol.10, 1123-1126.
|
Допълнение 1
Пример на процедура за култивиране на водорасли
Общи наблюдения
Целта на култивирането по описаната процедура е получаване на водораслови култури за провеждане на изпитвания за токсичност.
Следва да се използват подходящи методи, които да гарантират, че водорасловите култури не са заразени с бактерии (ISO 4833). Желателно е културите да са чисти от чужди организми, но съществено важно е те да са и едновидови.
Всички операции следва да се извършват при стерилни условия, за да се избегне замърсяване с бактерии или с други водорасли. Замърсените култури се изхвърлят.
Процедури за получаване на водораслови култури
Приготвяне на хранителните разтвори (среди):
Средата може да се приготви чрез разреждане на концентрирани изходни разтвори на хранителни вещества. За приготвяне на твърда среда се прибавя 0,8 % агар. Използваната среда следва да е стерилна. Стерилизация чрез автоклавиране може да доведе до загуба на NH3.
Изходна култура:
Изходните култури са малки култури от водорасли, които редовно се прехвърлят в свежа среда, за да послужат като начален материал за изпитването. Ако културите не се използват постоянно, те се разстилат в наклонени епруветки с агар. Прехвърлят се в свежа среда (пресяват се) най-малко веднъж на два месеца.
Изходните култури се отглеждат в конични колби, съдържащи съответна среда (обем около 100 ml). Когато водораслите се инкубират при 20 oС с непрекъснато осветяване, е необходимо пресяване всяка седмица.
По време на пресяването дадено количество от „старата“ култура се прехвърля със стерилни пипети в колба със свежа среда, така че при бързорастящите видове началната концентрация да е 100 пъти по-малка от тази в старата култура.
Скоростта на растеж на видовете може да се определи от кривата на растеж. Ако тя е известна, може да се оцени плътността, с която културата следва да се прехвърли в нова среда. Това следва да стане, преди културата да достигне фазата на смърт.
Предкултура:
Предкултурата служи да даде определено количество водорасли, подходящо за отглеждане на тестови култури . Предкултурата се инкубира при условията на изпитването и се използва, когато е вече във фаза на експоненциален растеж, обикновено след инкубационен период от около три дни. Когато културите от водорасли съдържат деформирани или ненормални клетки, те следва да се изхвърлят.
Допълнение 2
ISO 8692 — Качество на водата — Изпитване потискането на растежа на водораслите Scenedesmus subspicatus и Selenastrum capricornutum в прясна вода. При този стандарт са докладвани следните резултати от междулабораторно изпитване с калиев дихромат, в което са участвали 16 лаборатории:
|
|
Средна стойност (mg/l)
|
Обхват (mg/l)
|
|
ЕгС50 (0—72ч)
|
0,84
|
От 0,60 до 1,03
|
|
ЕьС50(0—72ч)
|
0,53
|
От 0,20 до 0,75
|
В.4. ОПРЕДЕЛЯНЕ НА ПРЯКАТА БИОЛОГИЧНА РАЗГРАДИМОСТ
ЧАСТ I. ОБЩИ СЪОБРАЖЕНИЯ
I.1. ВЪВЕДЕНИЕ
Описани са шест метода, които позволяват скрининг на химични вещества за пряка биологична разградимост в аеробна водна среда:
|
а)
|
Метод за определяне на разтворен органичен въглерод (DOC) чрез скоростта на отмиране (метод В.4-А)
|
|
б)
|
Модифициран скрининг метод на OECD за определяне на DOC чрез скоростта на отмиране (метод В.4-Б)
|
|
в)
|
Метод за отделяне на въглероден диоксид (СО2) (модифициран метод на Щурм) (метод В.4-В)
|
|
г)
|
Манометрична респирометрия (метод В.4-Г)
|
|
д)
|
Метод на изолираните проби (метод В.4-Д)
|
|
е)
|
MITI (Министерство на международната търговия и индустрията — Япония) (метод В.4-Е)
|
Общите положения за всичките шест изпитвания са дадени в част I на метода. Специфичните детайли за отделните методи са дадени в части II—VII. Приложенията съдържат определения, формули и указателен материал.
Едно междулабораторно сравнително изпитване, проведено от OECD през 1988 г., показва, че методите дават съвместими резултати. Един или друг от методите обаче може да бъде предпочетен в зависимост от физичните характеристики на изпитваното вещество.
I.2. ИЗБОР НА ПОДХОДЯЩИЯ МЕТОД
За да се избере най-подходящият метод, е необходима информация за разтворимостта, парното налягане и адсорбционните характеристики на химичното вещество. Следва да са известни химичната структура и формулата, за да се изчисляват теоретичните стойности и/или да се проверяват измерените стойности на параметрите, например ThOD, ThCO2, DOC, TOC, COD (вж. приложения I и II).
Изпитваните химични вещества, които са разтворими във вода до не по-малко от 100 mg/l, могат да бъдат оценявани чрез всички методи, при положение че не са летливи и не се адсорбират. За онези химични вещества, които са трудно разтворими във вода, летливи или адсорбиращи се, подходящите методи са показани в таблица 1. Начинът, по който се работи с трудно разтворими във вода и летливи химични вещества, е описан в приложение III. Умерено летливите химични вещества могат да се изпитват по метода за определяне на органичен въглерод (DOC) чрез скоростта на отмиране, ако има достатъчно въздушно пространство в съдовете (които следва да са подходящо затворени). В този случай следва да се постави и абиотична контрола, за да се вземат под внимание всички физични загуби.
Таблица 1
Приложимост на методите за изпитване
|
Изпитване
|
Аналитичен метод
|
Подходящ за вещества, които са:
|
|
трудно разтворими
|
летливи
|
адсорбиращи се
|
|
Определяне на разтворен органичен въглерод чрез скоростта на отмиране
|
Разтворен органичен въглерод
|
—
|
—
|
+/–
|
|
Модифициран метод на OECD за определяне чрез скоростта на отмиране
|
Разтворен органичен въглерод
|
—
|
—
|
+/–
|
|
Метод с отделяне на CO2
|
Респирометрия: отделяне на СО2
|
+
|
—
|
+
|
|
Манометрична респирометрия
|
Манометрична респирометрия: потребление на кислород
|
+
|
+/–
|
+
|
|
Метод на изолираните проби
|
Респирометрия: разтворен кислород
|
+/–
|
+
|
+
|
|
MITI
|
Респирометрия: потребление на кислород
|
+
|
+/–
|
+
|
При тълкуването на получените резултати е необходима информация за чистотата или относителните дялове на основните компоненти на изпитвания материал, особено когато резултатите са ниски или гранични.
Информацията за токсичността на химичното вещество спрямо бактерии (приложение IV) може да бъде особено полезна при избирането на подходящи концентрации за изпитване и може да бъде особено важна за правилното тълкуване при ниски стойности на биологичното разграждане.
I.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
За да се провери процедурата, веществата за сравнение, които изпълняват критериите за биоразградимост, се изпитват чрез поставяне в съответна колба, успоредно на хода на нормалното изпитване.
Подходящи химични вещества са анилин (прясно дестилиран), натриев ацетат и натриев бензоат. Всички тези сравнителни вещества се разграждат по изброените методи, дори когато нарочно не е добавен инокулант.
Смята се, че следва да се търси сравнително вещество, което е лесно биоразградимо, но изисква прибавяне на инокулант. Предлаган е калиев хидрогенфталат, но са необходими повече доказателства за това вещество, за да може да бъде прието като сравнително.
При респирометричните изпитвания азот-съдържащите съединения могат да повлияват върху потреблението на кислород поради нитрификацията (виж приложения II и IV).
I.4. ПРИНЦИПИ НА МЕТОДИТЕ ЗА ИЗПИТВАНЕ
Разтвор или суспензия на изпитваното вещество в минерална среда се инокулира и се инкубира при аеробни условия на тъмно или при дифузна светлина. Количеството на DOC в изпитвания разтвор, дължащо се на инокуланта, следва да се поддържа колкото може по-ниско в сравнение с количеството на DOC, дължащо се на изпитваното вещество. Ендогенната активност на инокуланта се отчита чрез залагане на контролна проба с инокулант, но без изпитваното вещество, въпреки че ендогенната активност на клетките в присъствие на веществото няма да съвпадне точно с ендогенната контрола. Успоредно се залага и вещество за сравнение, за да се провери протичането на процедурите.
Най-общо разграждането се проследява чрез определяне на параметри, като DOC, продукция на СО2 и потребление на кислород, като измерванията се правят на достатъчно чести интервали, за да може да се отчетат началото и краят на биоразграждането. С автоматични респирометри измерванията са непрекъснати. DOC понякога се измерва като допълнение на други параметри, но това обикновено се прави само в началото и в края на изпитването. Може да се използва и специфичен химичен анализ, за да се оцени първоначалното разграждане на изпитваното вещество и да се определи концентрацията на всички образувани междинни вещества (задължително при изпитването по МITI).
Нормално изпитването продължава 28 дни. Изпитванията могат да завършат и преди 28 дни, т.е. тогава, когато кривата на биологичното разграждане е достигнала плато при поне 3 определяния. Изпитванията могат да продължат и повече от 28 дни, когато кривата показва, че биоразграждането е започнало, но платото не е достигнато за 28 дни.
I.5. КРИТЕРИИ ЗА КАЧЕСТВО
I.5.1. Възпроизводимост
Поради природата на биоразграждането и смесените бактериални популации, използвани като инокулант, определянето следва да се прави най-малко в две повторения.
От опит се знае, че колкото по-високи концентрации микроорганизми се прибавят първоначално към изпитваната среда, толкова по-малки са разликите между повторенията. Кръгови (междулабораторни) изпитвания са показали също така, че може да има големи различия в резултатите, получени от различни лаборатории, но нормално се получава добро съвпадение при лесно биоразградими съединения.
I.5.2. Валидност на изпитването
Едно изпитване се смята за валидно, ако при повторенията разликата между най-ниската и най-високата стойност при отстраняване на изпитваното химично вещество на платото в края на теста или в края на 10-дневен период е по-малка от 20 % и ако процентното разграждане на сравнителното вещество е достигнало равнището на биоразграждане за 14 дни. Ако което и да е от тези условия не е изпълнено, изпитването следва да бъде повторено. Поради строгостта на методите ниските стойности не винаги означават, че изпитваното вещество не се разгражда в естествени условия, но показват, че е необходима повече работа, за да се установи биоразграждането.
Ако при едно изпитване за токсичност, съдържащо както изпитваното вещество, така и веществото за сравнение, се получи по-малко от 35 % разграждане (на основата на DOC) или по-малко от 25 % (на основата на ThOD или ТhСО2) за 14 дни, изпитваното вещество може да се приеме като инхибитор (вж. приложение IV). Тестовите серии следва да бъдат повторени, използвайки по възможност по-ниски концентрации на изпитваното вещество при по-висока концентрация на инокуланта, но не повече от 30 mg частици/литър.
I.6. ОБЩИ ПРОЦЕДУРИ И ПОДГОТОВКА
Общите условия, приложими към изпитванията, са обобщени в таблица 2. Апаратурата и другите експериментални условия, приложими специфично за всеки индивидуален тест, са описани по-долу под заглавието на съответния тест.
Таблица 2
Условия на изпитването
|
Изпитване
|
Определяне на DOC чрез скоростта на отмиране
|
Метод за отделяне на СО2
|
Манометрична респирометрия
|
Модифициран скрининг метод на OECD
|
Метод на изолирани те проби
|
MITI (I)
|
|
Концентрация на изпитваното вещество като
|
|
|
|
|
|
|
|
mg/l
|
|
|
100
|
|
2—10
|
100
|
|
mg DOC/l
|
10—40
|
10—20
|
|
10—40
|
|
|
|
mg ThOD/l
|
|
|
50—100
|
|
5—10
|
|
|
Концентрация на инокуланта (в броя клетки/1, приблизително)
|
≤ 30 mg/l суспендирани частици
или ≤ 100 ml отток (изходяща вторична вода)/1
(107—108)
|
0,5 ml вторичен отток/l
(105)
|
≤5ml отток/l
(104—106)
|
30 mg/l суспендиран и частици
(107—108)
|
|
Концентрация на елементите в минералната среда (в mg/l)
|
|
|
|
|
|
|
|
Р
|
116
|
11,6
|
29
|
|
N
|
1,3
|
0,13
|
1,3
|
|
Na
|
86
|
8,6
|
17,2
|
|
K
|
122
|
12,2
|
36,5
|
|
Mg
|
2,2
|
2,2
|
6,6
|
|
Са
|
9,9
|
9,9
|
29,7
|
|
Fe
|
0,05—0,1
|
0,05—0,1
|
0,15
|
|
pH
|
7,4 + 0,2
|
За предпочитане 7.0
|
|
Температура
|
22 + 2 oС
|
25 + 1 oС
|
|
DOC
|
=
|
разтворен органичен въглерод
|
|
|
ThOD
|
=
|
теоретично потребление на кислород
|
|
|
SS
|
=
|
суспендирани частици
|
|
I.6.1. Вода за разреждане
Използва се дестилирана или дейонизирана вода, несъдържаща инхибиращи концентрации на токсични вещества (например Си++ йони). Водата трябва да съдържа не повече от 10 % от органичния въглерод, внесен с изпитвания материал. Високата чистота на водата за изпитването е необходима, за да се елиминират високи стойности на контролната проба. Замърсяването може да се дължи на присъщи онечиствания, а също така на йонообменните смоли и разграден материал от бактерии или водорасли. За всяка серия изпитвания се използва само една партида вода, предварително проверена чрез анализ за DOC. Такава проверка не е необходима при изпитването по метода на изолираните проби, но потреблението на кислород на водата трябва да е ниско.
I.6.2. Изходни разтвори на минерални компоненти
За да се направят разтворите за изпитване, се приготвят изходни разтвори с определени концентрации на минералните компоненти. За методите: определяне на DOC чрез скоростта на отмиране, модифициран скрининг на ОИСР, отделяне на СО2, манометрична респирометрия и този на изолираните проби могат да бъдат използвани описаните по-долу изходни разтвори (с различни фактори на разреждане).
Факторите на разреждане, а за изпитването по МIТI — и специфичното приготвяне на минералната среда, са дадени под заглавията на специфичните методи за изпитване.
Изходни разтвори:
Приготвят се следните изходни разтвори, като се използват химични вещества със степен ЧЗА („чист за анализ“).
|
а)
|
Монокалиев дихидрогенортофосфат, КН2РО4
|
8,50 g
|
|
Дикалиев монохидрогенортофосфат, K2НРО4
|
21,75 g
|
|
Динатриев монохидрогенортофосфат дихидрат, Nа2НРО4.Н2О
|
33,40 g
|
|
Амониев хлорид, NН4Сl
|
0,50 g
|
|
Разтварят се във вода и се долива до 1 литър. Стойността на рН на разтвора следва да бъде 7,4.
|
|
|
б)
|
Калциев хлорид, безводен, СаСl2
|
27,50 g
|
|
или калциев хлорид дихидрат, СаСl2, 2Н2О
|
36,40 g
|
|
Разтварят се във вода и се долива до 1 литър.
|
|
|
в)
|
Магнезиев сулфат хептахидрат, МgSО4.7Н2О
|
22,50 g
|
|
Разтваря се във вода и се долива до 1 литър.
|
|
|
г)
|
железен(Ш) хлорид хексахидрат, FеСl3.6Н2О
|
0,25g
|
|
Разтваря се във вода и се долива до 1 литър.
|
|
Забележка: За да се избегне приготвянето на този разтвор непосредствено преди употреба, прибавя се една капка концентрирана НС1 или 0,4 g динатриева сол на етилендиаминотетраоцетна киселина (EDTA) на литър.
I.6.3. Изходни разтвори на химични вещества
Например, разтварят се 1—10 g, както е подходящо, от изпитваното или сравнителното вещество в дейонизирана вода и се доливат до 1 l, ако разтворимостта превишава 1 g/1. В противен случай се приготвят изходните разтвори в минерална среда или веществото се добавя направо към минералната среда. При работа с по-малко разтворими химични вещества вижте приложение III, но при метода на MITI (метод В.4-Е) не могат да се използват нито разтворители, нито емулгатори.
I.6.4. Инокулант (култура от микроорганизми)
Инокулантът може да произхожда от различни източници: активна утайка, пречистена отпадъчна вода (нехлорирана), повърхностни води и почви или смес от всичко това. Ако при методите за изпитване за определяне на DOC чрез скоростта на отмиране и при методите за отделяне на СО2 и манометрична респирометрия се използва активна утайка, тя трябва да е взета от пречиствателна станция или от лабораторно звено, които получават предимно битови отпадъчни води. Опитът показва, че инокуланти от други източници дават по-голямо разсейване в резултатите. За изпитванията по модифицирания метод на ОИСР и метода на изолираните проби са необходими по-разредени инокуланти без утаечни флокули и като източник се предпочита оттокът от градска станция за пречистване на отпадъчни води (ГСПОВ) или от лабораторно звено. За изпитването по метода на МIТI инокулантът се извлича от смесени източници, както е описано под заглавието на настоящото специфично изпитване.
I.6.4.1. Инокулант от активна утайка
Взема се свежа проба от активната утайка от басейна за аериране на една ГСПОВ или от лабораторно звено, които преработват предимно битови отпадъчни води. Ако е необходимо, се отстраняват твърдите частици чрез филтруване през фино сито и след това утайката се съхранява при аеробни условия.
Друга възможност е утайката да се остави да се утаи или да се центрофугира (например при 1100 g в продължение на 10 min) след премахване на по-грубите частици. Отдекантира се супернатантата. Утайката може да се промива с минерална среда. Концентрираната утайка се разрежда с минерална среда до концентрация 3—5 g суспендирани вещества на литър и се аерира, колкото се изисква.
Утайката трябва да се вземе от обикновена добре работеща пречиствателна станция. Ако утайката трябва да бъде взета от пречиствателна станция, работеща при висока скорост на обработка, или има съмнение, че съдържа инхибитори, тя трябва да се промие. Ресуспендираната утайка се утаява или центрофугира след разбъркване, отлива се супернатантата и промитата с нова минерална среда утайка отново се ресуспендира. Тази процедура се повтаря, докато се прецени, че утайката е свободна от странични вещества или инхибитор.
След достигане на пълно суспендиране или при необработена утайка, преди употреба се отделя проба за определяне на сухото тегло на суспендираните частици.
Друга възможност е да се хомогенизира активната утайка (3—5 g суспендирани частици/l). Утайката се обработва в механичен хомогенизатор в продължение на 2 min при средна скорост. Хомогенизираната утайка се утаява за 30 min или по-дълго, ако е необходимо, и течността се отлива, а утайката се използва като посявка (инокулант) след 10-кратно разреждане в минерална среда.
I.6.4.2. Други източници на инокуланти
Инокулантите могат да произхождат от оттока на ГСПОВ или от лабораторно звено, получаващи предимно битови отпадъчни води. Взема се прясна проба и се съхранява при аеробни условия по време на транспортирането. Оставя се да се утаи за 1 час или се филтрува през груб хартиен филтър, а отлятата течност или филтратът се запазват при аеробни условия, докогато се изисква. От този тип култура могат да се използват до 100 ml на литър среда.
Друг един източник на инокулант са повърхностните води. В този случай се взема проба от подходяща повърхностна вода, например речна, езерна, и се съхранява при аеробни условия, докато се изисква. Ако е необходимо, инокулантът се концентрира чрез филтруване или центрофугиране.
I.6.5. Предварителна подготовка на микроорганизмите
Микроорганизмите могат да се адаптират предварително към условията на експеримента, но не и към изпитваното вещество. Предварителната подготовка се състои от аериране на активната утайка в минерална среда или в оттока в продължение на 5—7 дни при температурата на изпитването. Предварителната подготовка понякога подобрява точността на методите за изпитване чрез намаляване стойностите на контролната проба. Смята се, че е излишно посевките за метода на МITI да се подготвят предварително.
I.6.6. Абиотични контроли
Когато се налага, се прави проверка за възможно абиотично разграждане на изпитваното вещество чрез определяне изразходването на DOC, потреблението на кислород или отделянето на въглероден диоксид в стерилни контроли, несъдържащи инокуланта. Пробата се стерилизира чрез филтруване през мембранен филтър (0,2—0,45 μm) или чрез добавяне на подходящо токсично вещество в съответна концентрация. Ако се използва мембранна филтрация, пробите се взимат асептично, за да се поддържа стерилността. Ако не е предварително определена адсорбцията на изпитваното вещество, методите за изпитване, които измерват биоразграждането като изразходване на DOC, по-специално при инокуланти от активна утайка, следва да включват и абиотична контрола, която е посята с инокулант и отровена.
I.6.7. Брой на колбите
Броят на колбите при един типичен опит е описан под заглавието на всеки от методите за изпитване.
Могат да се използват следните видове колби:
|
—
|
Суспензия за изпитване: съдържа изпитваното вещество и инокуланта.
|
|
—
|
Контролна проба за инокуланта: съдържа само инокулант.
|
|
—
|
Проба за контрол на процедурата: съдържа сравнителното вещество и инокуланта.
|
|
—
|
Проба за абиотичен стерилен контрол: стерилна, съдържа изпитвано вещество (вж. I.6.6).
|
|
—
|
Проба за контрол на адсорбцията: съдържа изпитвано вещество, инокулант и стерилизиращ агент.
|
|
—
|
Контрола за токсичност: съдържа изпитвано вещество, сравнително вещество и инокулант.
|
Задължително е определянето в изпитваната суспензия и в контролната проба за инокуланта да се правят успоредно. Препоръчително е определянията и в другите колби да се изпълняват също така успоредно.
Това обаче не винаги е възможно. Трябва да се осигури вземане на достатъчно проби или отчитания, за да може да се позволи оценяването на процента на разграждане през 10-дневния период.
I.7. ДАННИ И ИЗЧИСЛЯВАНЕ
При изчисляването на процентното разграждане Dt ce използват средните стойности от измерване на две повторения на параметъра в съдовете за изпитване и в контролата за инокуланта. Формулите са разяснени по-долу в разделите за специфичните методи за изпитване. Ходът на разграждането се изрязява графично, като се отбелязва 10-дневният период. Изчислява се и се нанася в протокола достигнатият процент на разграждане в края на 10-дневния период и стойността при платото или в края на изпитването, което от двете е по-подходящо.
При респирометрични изпитвания азот-съдържащи съединения могат да повлияват потреблението на кислород поради нитрификацията (вж. приложения II и V).
I.7.1. Разграждане, измервано чрез определяне на разтворения органичен въглерод (DOC)
Процентът на разграждане Dt за всяко време, в което е взета една проба, трябва да се изчислява поотделно за колбите, съдържащи изпитваното вещество, като се използват средните стойности от две повторни измервания на DOC c оглед да може да се оцени валидността на изпитването (вж. 1.5.2). За изчислението се използва следното уравнение:

където:
|
Dt
|
=
|
% разграждане за време I,
|
|
Со
|
=
|
средна начална концентрация на DОС в среда с инокулант, съдържаща изпитваното вещество (mg DОС/l),
|
|
Сt
|
=
|
средна концентрация на DОС в среда с инокулант, съдържаща изпитваното вещество към времето t (mg DОС/l),
|
|
Сbo
|
=
|
средна начална концентрация на DОС в контролна проба с инокулант в минерална среда (mg DОС/1),
|
|
Сbt
|
=
|
средна концентрация на DОС в контролна проба с култура в минерална среда към времето t (mg DОС/1).
|
Всички концентрации се измерват експериментално.
I.7.2. Разграждане, измервано чрез специфичен анализ
Когато са достъпни специфични аналитични данни, първоначалното биоразграждане се изчислява по формулата:

където:
|
Dt
|
=
|
% на разграждане за времето I, нормално 28 дни,
|
|
Sа
|
=
|
остатъчно количество от изпитваното вещество в среда с инокулант към края на изпитването (mg),
|
|
Sb
|
=
|
остатъчно количество от изпитваното вещество в контролната проба с вода/среда, към която е прибавено само изпитваното вещество (mg).
|
I.7.3. Абиотично разграждане
Когато се използва стерилна абиотична контрола, за изчисляване на процента на абиотичното разграждане се използва:

където
|
CS(0)
|
=
|
концентрацията на DOC в стерилната контрола към деня 0;
|
|
CS(t)
|
=
|
концентрацията на DOC в стерилната контрола към деня t.
|
I.8. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
По възможност протоколът от изпитването трябва да съдържа следното:
|
—
|
изпитвани и сравнителни химични вещества и тяхната чистота;
|
|
—
|
условия на изпитването;
|
|
—
|
инокулант: естество и място на вземане и всякакво предварително третиране;
|
|
—
|
съотношение и естество на индустриалните отпадъци в канализацията, ако са известни;
|
|
—
|
продължителност на изпитването и температура;
|
|
—
|
начин на обработка в случай на трудно разтворими химични вещества;
|
|
—
|
приложен метод за изпитване; следва да бъдат представени научно обосновани причини и обяснения за всяка промяна в процедурата;
|
|
—
|
всякакви наблюдавани явления на инхибиране;
|
|
—
|
всяко наблюдавано абиотично разграждане;
|
|
—
|
специфични данни от химичен анализ, ако са достъпни;
|
|
—
|
аналитични данни от междинните продукти, ако са достъпни;
|
|
—
|
следва ясно да са обозначени кривата/диаграмата на процента на разграждане във времето за изпитваните и за сравнителните вещества; латентната фаза (лаг-фазата), фазата на разграждане, 10-дневният период от време и наклонът (вж. приложение I). Ако изпитването се съгласува с критериите за валидност, за графиката може да се използва средният процент на разграждане в колбите, съдържащи изпитваното вещество;
|
|
—
|
процентът на усвояване след 10-дневен период и при платото или в края на изпитването.
|
ЧАСТ II. ОПРЕДЕЛЯНЕ НА DOC ЧРЕЗ СКОРОСТТА НА ОТМИРАНЕ (МЕТОД В.4-А)
II.1. ПРИНЦИП НА МЕТОДА
Един измерен обем от бактериална култура в минерална среда, съдържаща позната концентрация на изпитваното вещество (10—40 mg DOC/l) като единствен номинален източник на органичен въглерод, се аерира на тъмно или при дифузна светлина при 22 ± 2oС.
Разграждането се следи чрез анализ на DOC на чести интервали през един 28-дневен период от време. Степента на биоразграждане се изчислява чрез изразяване на концентрацията на изразходвания DOC (коригирана с тази на контролната проба с инокулант като процент от първоначалната концентрация. Степента на първичното биоразграждане може също да се изчисли от допълнителния химичнен анализ, направен в началото и в края на инкубацията.
II.2. ОПИСАНИЕ НА МЕТОДА
II.2.1. Апаратура
|
а)
|
Конични колби, напр. от 250 ml до 2 l, в зависимост от необходимия обем за анализ на DOC.
|
|
б)
|
Клатачна машина за разполагане на коничните колби или с автоматично регулиране на температурата, или използвана в пространство с постоянна температура и с достатъчна мощност, за да се поддържат аеробни условия във всички колби.
|
|
в)
|
Апарат за филтруване, с подходящи мембрани.
|
|
д)
|
Апарат за определяне на разтворен кислород.
|
II.2.2. Приготвяне на минерална среда
За приготвянето на изходните разтвори вж. I.6.2.
Смесват се 10 ml от разтвор а) с 800 ml вода за разреждане, добавят се по 1 ml от разтвори от б) до г) и се долива до 1 l.
II.2.3. Предварителна подготовка и приготвяне на инокуланта
Инокулантът може да произхожда от различни източници: активна утайка, отток от канализация, повърхностни води, почви или смес от всички тях.
Вижте I.6.4., I.6.4.1., I.6.4.2. и I.6.5.
II.2.4. Подготовка на колбите
Като пример: наливат се порции от по 800 ml минерална среда в конични колби от 2 1 и се добавят достатъчни обеми от изходните разтвори на изпитваните и сравнителните вещества в отделни колби до достигане на концентрация на вещества еквивалентна на 10—40 mg DOC/l. Проверяват се стойностите на рН и се коригират, ако е необходимо, до 7,4. В колбите се добавя инокулантът от активна утайка или друг източник (вж. I.6.4) до достигане на крайна концентрация не по-голяма от 30 mg суспендирани частици на литър. Приготвят се също така контролни проби с инокулант в минерална среда, но без изпитваното или сравнителното вещество.
Ако е необходимо, използва се един съд, за да се провери възможният ефект на инхибиране на изпитваното вещество чрез посявка на разтвор, съдържащ в минерална среда съпоставими концентрации от изпитваното и сравнителното вещество.
Също така, ако се налага, се зарежда допълнителна стерилна колба, за да се провери дали изпитваното вещество се разгражда абиотично, като се използва разтвор на веществото без инокулант (вж. I.6.6).
Допълнително, ако се подозира, че изпитваното вещество се адсорбира значително върху стъклото, утайката и т.н., се прави предварителна оценка на степента на адсорбция, а с това и на пригодността на метода за изпитване на веществото (вж. таблица 1). Зарежда се колба, съдържаща изпитваното вещество, инокуланта и стерилизиращ агент.
Във всички колби се долива минерална среда до 1 l и след размесване се взема проба от всяка колба за определяне на началната концентрация на DOC (вж. приложение II.4). Отворите на колбите се покриват например с алуминиево фолио, така че да се позволи свободен обмен на въздух между колбата и околната атмосфера. След това съдовете се поставят в клатачната машина за започване на изпитването.
II.2.5. Брой на колбите при един типичен експеримент
Колби 1 и 2: изпитвана суспензия
Колби 3 и 4: контролна проба с инокулант
Колба 5: проба за контрол на процедурата
За предпочитане, когато е необходимо:
Колба 6: абиотична стерилна контрола
Колба 7: проба за контрол на адсорбцията
Колба 8: контрола за токсичност
Вижте също I.6.7.
II.2.6. Изпълнение на изпитването
По време на цялото изпитване се определя концентрацията на DOC двукратно във всяка колба през известни интервали от време, достатъчно често, за да може да се определят началото на 10-дневния период и процентът на изразходване в края на 10-дневния период. Взема се само минималният обем от изпитваната суспензия, необходим за всяко определяне.
Ако е необходимо, преди вземането на пробите се възстановяват загубите от изпарение в колбите чрез прибавяне на достатъчно количество вода за разреждане (I.6.1). При вземането на проба средата с инокуланта се разклаща добре и се проверява дали материалът, прилепнал по стените на съдовете, е разтворен или суспендиран, преди да се вземе пробата. Веднага след вземането пробата се филтрира през мембранен филтър или центрофугира (приложение II.4). В същия ден се прави анализ на филтрираните или центрофугираните проби, в противен случай те се съхраняват при 2—4 oС за максимум 48 часа или под –18oС за по-дълги периоди.
II.3. ДАННИ И ОТЧИТАНЕ
II.3.1. Обработка на резултатите
Пресмята се процентът на разграждане за времето t, както е дадено в I.7.1 (определяне на DOC) или, по избор, в I.7.2 (специфичен анализ).
Всички резултати се записват в предоставените таблици с данни
II.3.2. Валидност на резултатите
Вж. I.5.2.
II.3.3. Протокол от изпитването
Вж. I.8.
II.4. ПРОТОКОЛ ЗА ДАННИ
По-долу е даден примерен протокол за данни.
ИЗПИТВАНЕ ЗА ОПРЕДЕЛЯНЕ НА DOC ЧРЕЗ СКОРОСТТТА НА ОТМИРАНЕ
|
2.
|
ДАТА НА ЗАПОЧВАНЕ НА ИЗПИТВАНЕТО
|
3. ИЗПИТВАНО ВЕЩЕСТВО
Име:
Концентрация на изходния разтвор: … mg/l като химично вещество
Начална концентрация в средата: … mg/l като химично вещество
4. ИНОКУЛАНТ
Източник:
Извършена обработка:
Предварителна подготовка, ако има такова:
Концентрация на суспендирани вещества в реакционната смес: mg/1
5. ОПРЕДЕЛЯНИЯ НА ВЪГЛЕРОД
Анализатор на въглерод:
|
|
Колба номер
|
|
DOC след n дни (mg/l)
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
Изпитвано вещество плюс инокулант
|
1
|
a1
|
|
|
|
|
|
|
a2
|
|
|
|
|
|
|
а, средно
Ca(t)
|
|
|
|
|
|
|
2
|
b1
|
|
|
|
|
|
|
b2
|
|
|
|
|
|
|
b, средно
cb(t)
|
|
|
|
|
|
|
Контролна проба с инокулант без изпитваното вещество
|
3
|
c1
|
|
|
|
|
|
|
c2
|
|
|
|
|
|
|
c, средно Cc(t)
|
|
|
|
|
|
|
4
|
d1
|
|
|
|
|
|
|
d2
|
|
|
|
|
|
|
d,средно
Cd(t)
|
|
|
|
|
|
|

|
|
|
|
|
|
6. ОЦЕНЯВАНЕ НА ПЪРВИЧНИ ДАННИ ОПРЕДЕЛЯНИЯ НА ВЪГЛЕРОД
|
Колба №
|
|
% на разграждане след n дни
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
1
|

|
0
|
|
|
|
|
|
2
|
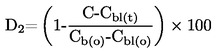
|
0
|
|
|
|
|
|
Средно (3)
|

|
0
|
|
|
|
|
Забележка: подобни протоколи могат да се използват за сравнителното вещество и за контролата за токсичност.
7. АБИОТИЧНА КОНТРОЛНА ПРОБА (по избор)
|
|
Време (дни)
|
|
0
|
t
|
|
Концентрация на DOC (mg/l) в стерилната контрола
|
Cs(o)
|
Cs(t)
|

8. СПЕЦИФИЧЕН ХИМИЧЕН АНАЛИЗ
|
|
Остатъчно количество от изпитваното вещество в края на изпитването (mg/l)
|
% на първично разграждане
|
|
Стерилна контрола
|
Sb
|
|
|
Среда за изпитване с инокулант
|
Sa
|

|
ЧАСТ III. МОДИФИЦИРАН СКРИНИНГ НА ОИСР (метод В.4-Б)
III. I. ПРИНЦИП НА МЕТОДА
В едно измерено количество минерална среда, съдържаща позната концентрация на изпитваното вещество (10—40 mg DOC на литър) като единствен номинален източник на органичен въглерод, се инокулират с 0,5 ml отток на литър среда. Сместа се аерира на тъмно или на дифузна светлина при 22 ± 2oС.
Разграждането се следи чрез анализ на DOC на чести интервали за 28-дневен период. Степента на биоразграждане се изчислява чрез изразяване на концентрацията на изразходвания DOC (коригирана с тази на контролата с инокуланта) като процент от първоначалната концентрация. Степента на първичното биоразграждане може също да се изчисли от допълнителен химичен анализ, направен в началото и в края на инкубацията.
III.2. ОПИСАНИЕ НА МЕТОДА
III.2.1. Апаратура
|
а)
|
Конични колби, от 250 ml до 2 l, в зависимост от необходимия обем за анализ на DOC.
|
|
б)
|
Клатачна машина за разполагане на коничните колби или с автоматично регулиране на температурата или използвана в пространство с постоянна температура и с достатъчна мощност, за да се поддържат аеробни условия във всички колби.
|
|
в)
|
Апарат за филтруване с подходящи мембрани.
|
|
д)
|
Апарат за определяне на разтворен кислород.
|
Ш.2.2. Приготвяне на минерална среда
За приготвянето на изходните разтвори вижте 1.6.2.
Смесват се 10 ml от разтвор а) с 80 ml вода, прибавят се по 1 ml от разтвори от б) до г) и се долива до 1 l.
Този метод използва само 0,5 ml отток на литър като инокулант и поради това средата трябва да се подсили с микроелементи и растежни фактори. Това се прави чрез добавяне на 1 ml от всеки от следните разтвори на литър от крайната среда:
Разтвор на микроелементи:
|
Манганов сулфат тетрахидрат, MnSO4.4H2O
|
39,9 mg
|
|
Борна киселина, Н3ВО3
|
57,2 mg
|
|
Цинков сулфат хептахидрат, ZnSO4.7H2O
|
42,8 mg
|
|
Амониев хептамолибдат, (NH4)6 MO7O24
|
34,7 mg
|
|
Fe-хелат (FeCl3 етилендиаминтетраоцетна киселина)
|
100 mg
|
|
Разтварят се във вода и се доливат с разреждаща вода до 1 литър.
|
|
|
Разтвор на витамини:
|
|
|
Екстракт от дрожди
|
15,0 mg
|
Разтваря се екстракт от дрожди в 100 ml вода. Стерилизира се чрез филтруване през мембранен филтър 0,2 μm или се приготвя пресен.
III.2.3. Приготвяне и предварителна подготовка на инокулант
Инокулантът се взема от оттока на ГСПОВ или лабораторно звено, приемащо предимно битови отпадъчни води. Вж. I.6.4.2 и I.6.5.
Използва се 0,5 ml на литър минерална среда.
III.2.4. Подготовка на колбите
Като пример: наливат се порции от по 800 ml минерална среда в конични колби от 2 1 и се добавят достатъчни обеми от изходните разтвори на изпитваните и сравнителните вещества в отделни колби до достигане на концентрация на химичното вещество, еквивалентна на 10 — 40 mg DOC/l. Проверяват се стойностите на рН и се коригират, ако е необходимо до 7,4. В колбите се добавя инокулант от оттока на ГСПОВ в количество 0,5 ml/l (вж. I.6.4.2). Приготвят се също така контролни проби с инокулант в минерална среда, но без изпитваното или сравнителното вещество.
Ако е необходимо, използва се един съд, за да се провери възможният ефект на инхибиране на изпитваното вещество чрез посявка на разтвор, съдържащ в минерална среда съпоставими концентрации от изпитваното и сравнителното вещество.
Също така, ако се налага, се зарежда допълнителна стерилна колба, за да се провери дали изпитваното вещество се разгражда абиотично, като се използва разтвор на веществото без инокулант (вж. I.6.6).
Допълнително, ако се подозира, че изпитваното вещество се адсорбира значително върху стъкло, утайка и т.н., се прави предварителна оценка на степента на адсорбция, а с това и на пригодността на метода за изпитване на химичното вещество (вж. таблица 1). Зарежда се колба, съдържаща изпитваното вещество, инокуланта и стерилизиращ агент.
Във всички колби се долива минерална среда до 1 l и след размесване се взема проба от всяка колба за определяне на началната концентрация на DOC (вж. приложение II.4). Отворите на колбите се покриват например с алуминиево фолио, така че да се позволи свободен обмен на въздух между колбата и околната атмосфера. След това съдовете се поставят в клатачната машина за започване на изпитването.
III.2.5. Брой на колбите при типичен експеримент
Колби 1 и 2: изпитвана суспензия
Колби 3 и 4: контролна проба с инокулант
Колба 5: проба за контрол на процедурата
За предпочитане, когато е необходимо:
Колба 6: абиотична стерилна контрола
Колба 7: проба за контрол на адсорбцията
Колба 8: контрола за токсичност
Вж. също I.6.7.
III.2.6. Изпълнение на изпитването
По време на цялото изпитване се определя концентрацията на DOC двукратно във всяка колба през известни интервали от време, достатъчно често, за да може да се определи началото на 10-дневния период и процента на изразходване в края на 10-дневния период. Взема се само минималният обем от изпитваната суспензия, необходим за всяко определяне.
Ако е необходимо, преди вземането на пробите се възстановяват загубите от изпарение в колбите чрез прибавяне на достатъчно количество вода за разреждане (I.6.1). При вземането на проба средата с инокуланта се разклаща добре и се проверява дали материалът, полепнал по стените на съдовете, е разтворен или суспендиран, преди да се вземе пробата. Веднага след вземането пробата се филтрира през мембранен филтър или центрофугира (приложение II.4). В същия ден се прави анализ на филтрираните или центрофугираните проби, в противен случай те се съхраняват при 2—4 oС за максимум 48 часа или под –18oС за по-дълги периоди.
III.3. ДАННИ И ОТЧИТАНЕ
III.3.1. Обработка на резултатите
Пресмята се процентът на разграждане за времето t, както е дадено в I.7.1 (определяне на DOC) или, по избор, в I.7.2 (специфичен анализ).
Всички резултати се записват в предоставените таблици с данни
III.3.2. Валидност на резултатите
Вж. I.5.2.
Ш.3.3. Протокол от изпитването
Вж. I.8.
III.4. ПРОТОКОЛ ЗА ДАННИ
По-долу е даден примерен протокол за данни.
МОДИФИЦИРАНО ИЗПИТВАНЕ НА ОИСР
|
2.
|
ДАТА НА ЗАПОЧВАНЕ НА ИЗПИТВАНЕТО
|
3. ИЗПИТВАНО ВЕЩЕСТВО
Име:
Концентрация на изходния разтвор: … mg/l като химично вещество
Начална концентрация на средата: … mg/l като химично вещество
4. ИНОКУЛАНТ
Източник:
Извършена обработка:
Предварителна подготовка, ако има такова:
Концентрация на суспендирани частици в реакционната смес: mg/l
5. ОПРЕДЕЛЯНЕ НА ВЪГЛЕРОДА
Анализатор на въглерод
|
|
Колба №
|
|
DOC след n дни (mg/l)
|
|
0
|
n1
|
n2
|
n3
|
nх
|
|
Изпитвано вещество плюс инокулант
|
1
|
a1
|
|
|
|
|
|
|
a2
|
|
|
|
|
|
|
а, средно
Ca(t)
|
|
|
|
|
|
|
2
|
b1
|
|
|
|
|
|
|
b2
|
|
|
|
|
|
|
В, средно
Cb(t)
|
|
|
|
|
|
|
Контролен инокулант без изпитваното вещество
|
3
|
c1
|
|
|
|
|
|
|
c2
|
|
|
|
|
|
|
С, средно Cc(t)
|
|
|
|
|
|
|
4
|
d1
|
|
|
|
|
|
|
d2
|
|
|
|
|
|
|
d, средно
Cd(t)
|
|
|
|
|
|
|

|
|
|
|
|
|
6. ОЦЕНЯВАНЕ НА ПЪРВИЧНИТЕ ДАННИ
|
Колба №
|
|
% на разграждане след n дни
|
|
0
|
n1
|
n2
|
n3
|
nх
|
|
1
|
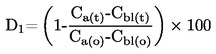
|
0
|
|
|
|
|
|
2
|

|
0
|
|
|
|
|
|
Средна стойност (4)
|
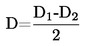
|
0
|
|
|
|
|
Забележка: подобни протоколи могат да се използват за сравнителното химично вещество и за контролата за токсичност.
7. АБИОТИЧНА КОНТРОЛА (по избор)
|
|
Време (дни)
|
|
0
|
t
|
|
Концентрация на DOC (mg/l) в стерилната контрола
|
Cs(o)
|
Cs(t)
|
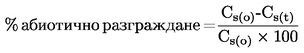
8. СПЕЦИФИЧЕН ХИМИЧЕН АНАЛИЗ (по избор)
|
|
Остатъчно количество от изпитваното вещество в края на изпитването (mg/l)
|
% на първично разграждане
|
|
Стерилна контрола
|
Sb
|
|
|
Среда за изпитване с инокуланта
|
Sa
|
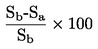
|
ЧАСТ IV. МЕТОД ЗА ОТДЕЛЯНЕ НА СО2 (МЕТОД В.4-В)
IV.1. ПРИНЦИП НА МЕТОДА
Един измерен обем на инокулант в минерална среда, съдържаща позната концентрация от изпитваното химично вещество (10—20 mg DOC или ТОС/l) като единствен номинален източник на органичен въглерод, се аерира чрез преминаване на контролиран дебит на чист от въглероден диоксид въздух на тъмно или при дифузна светлина. Разграждането се проследява повече от 28 дни чрез определяне на произведения въглероден диоксид, който се улавя в бариев или натриев хидроксид и се измерва чрез титруване на остатъчния хидроксид или като неорганичен въглерод. Количеството въглероден диоксид, произведено от изпитваното вещество (коригирано с това, което произхожда от контролния инокулант) се изразява като процент от ТhСО2. Степента на биоразграждане може също да бъде изчислена чрез допълнителен анализ на DOC, който се прави в началото и в края на инкубацията.
IV.2. ОПИСАНИЕ НА МЕТОДА
IV.2.1. Апаратура
|
а)
|
Колби, 2—5 l, всяка снабдена с тръба за аериране, достигаща почти до дъното на съда, и отдушник.
|
|
б)
|
Магнитни бъркалки, при оценяване на трудноразтворими химични вещества.
|
|
в)
|
Колби за абсорбция на газа.
|
|
г)
|
Уред за контролиране и измерване на въздушния поток.
|
|
д)
|
Апарат за поглъщане на въглероден диоксид, за подготовка на въздух, несъдържащ въглероден диоксид; съответно може да се използва смес от несъдържащ СО2 кислород и несъдържащ СО2 азот от газови колби в правилно съотношение (20 % О2 : 80 % N2).
|
|
е)
|
Уред за определяне на въглероден диоксид или чрез титруване, или чрез някаква друга форма на анализатор на неорганичен въглерод.
|
|
ж)
|
Уред за мембранно филтруване (по избор).
|
|
з)
|
Анализатор на DOC (по избор)
|
IV.2.2. Приготвяне на минерална среда
За приготвянето на изходните разтвори вж. I.6.2.
Смесват ce 10 ml от разтвор а) с 800 ml разреждаща вода, прибавят се по 1 ml от разтворите от б) до г) и се долива до 1 l.
IV.2.3. Приготвяне и предварителна подготовка на инокуланта
Инокулантът може да произлиза от различни източници: активна утайка, отточни канални води, повърхностни води, почви или смес от всички тях.
Вж. I.6.4, I.6.4.1, I.6.4.2 и I.6.5.
IV.2.4. Приготвяне на колбите
Като пример са дадени обемите и теглата, необходими за 5-литрови колби, съдържащи 3 1 от суспензията. Ако се използват по-малки обеми, стойностите се променят съответно, но трябва да се осигури точно измерване на образувания въглероден диоксид.
Във всяка 5-литрова колба се прибавят 2 400 ml минерална среда. Прибавя се подходящ обем от приготвената активна утайка (вж. I.6.4.1 и I.6.5), за да се получи концентрация на суспендираните частици не по-висока от 30 mg/l в крайните 3 1 смес на инокуланта. Друга възможност е първо да се разреди приготвената утайка до суспензия от 500—1 000 mg/l в минералната среда, преди аликвотна част от нея да се прибави към съдържанието на колба от 5 1 с оглед да се получи концентрация от 30 mg/l. Това осигурява по-голяма точност. Могат да се използват и други източници на инокулант (вж. I.6.4.2.).
Тези смеси с инокулант се аерират с несъдържащ СО2 въздух в продължение на 12 часа, за да се изчисти системата от въглероден диоксид.
Прибавят се поотделно известни обеми от изходните разтвори на изпитваното и сравнителното вещество към две колби до получаване на концентрации на дадените химични вещества от 10 до 20 mg DOC или ТОС/l. Оставят се няколко колби без добавка на вещества като контролен инокулант. Трудноразтворимите вещества за изпитване се прибавят директно в колбите на базата на обем или на тегло и с тях се процедира, както е описано в приложение III.
Ако се изисква, една колба се използва за проверка на възможен инхибиторен ефект на изпитваното химично вещество чрез прибавяне на изпитваното и сравнителното вещества при същата концентрация както в другите колби.
Също така, ако се изисква, една стерилна колба се използва за проверка дали изпитваното вещество се разгражда абиотично, използвайки разтвор на веществото без инокулант (вж. I.6.6). Стерилизира се чрез прибавяне на токсично вещество с подходяща концентрация.
Обемите на суспензиите във всички колби се доливат до 3 1 чрез прибавяне на минерална среда, предварително аерирана с въздух, свободен от СО2. По избор могат да се отделят проби за анализ на DOC (вж. приложение II.4) и/или за друг специфичен анализ. Абсорбционните колби се свързват с отдушниците на колбите.
Ако се използва бариев хидроксид, се присъединяват три абсорбционни колби, като всяка съдържа по 100 ml от 0,0125 M [mol/l] разтвор на бариев хидроксид, последователно към всяка 5-литрова колба. Разтворът не трябва да съдържа утаен сулфат и карбонат и неговата концентрация трябва да се определя непосредствено преди употреба. Ако се използва натриев хидроксид, се присъединяват два абсорбционни съда, като вторият действа като контрола на първия, за да се покаже, че цялото количество въглероден диоксид е абсорбирано в първия съд. За абсорбция са подходящи колби, които се затварят с капачки от серумни колби. Прибавят се 200 ml 0,05 M [mol/l] натриев хидроксид към всяка колба, което е достатъчно да абсорбира цялото количество въглероден диоксид, отделен, когато изпитваното вещество се разгради напълно. Натриевият хидроксид, даже прясно приготвен, съдържа следи от карбонати. Това се коригира чрез намаляване със стойността на карбоната, съдържащ се в контролната проба.
IV.2.5. Брой на колбите при типичен експеримент
Колби 1 и 2: изпитвана суспензия
Колби 3 и 4: контролна проба с инокуланта
Колба 5: проба за контрол на процедурата
и за предпочитане, когато е необходимо:
Колба 6: абиотична стерилна контрола
Колба 7: контрола за токсичност
Вж. също I.6.7.
IV.2.6. Изпълнение на изпитването
Изпитването се започва с барботиране на суспензиите с въздух без СО2 при дебит 30—100 ml/min. Периодично се вземат проби от абсорбента на въглероден диоксид за анализ на съдържанието на СО2. По време на първите десет дни се препоръчва анализът да се прави всеки втори или трети ден и след това всеки пети ден до 28-ия ден, така че да бъде определен 10-дневният период.
На 28-ия ден се вземат проби (по избор) за DOC и/или специфичен анализ, измерва се рН на суспензиите и се добавя 1 ml концентрирана солна киселина към всяка колба. Колбите се аерират 12 часа, за да се изчисти въглеродният диоксид от изпитваните суспензии. На 29-ия ден се прави последен анализ за отделения въглероден диоксид.
В дните на измерване на СО2 се откача абсорберът с бариев хидроксид, който е най-близо до колбата, и разтворът на хидроксид се титрува с 0,05 M [mol/l] HCl, като ce използва фенолфталеин като индикатор. Преместват се останалите абсорбери с едно място по-близо до колбата и се поставя нов абсорбер, съдържащ 100 ml пресен 0,0125 M [mol/l] бариев хидроксид най-накрая на редицата. Необходимото титруване се прави, например, когато се вижда значителна утайка в първия абсорбер и преди да има видима във втория, или най-малко веднъж на седмица. При избран абсорбент NaOH ce взема малка проба със спринцовка (в зависимост от характеристиките на използвания апарат за анализ на въглерод) от разтвора на натриевия хидроксид от абсорбера най-близо до колбата. Пробата се инжектира в частта за неорганичен въглерод на анализатора на въглерод за директен анализ на отделения въглероден диоксид.
Съдържанието на втория абсорбер се анализира едва в края на изпитването, за да се коригира за някакъв евентуален пренос на въглероден диоксид.
IV.3. ДАННИ И ОТЧИТАНЕ
IV.3.1. Обработка на резултатите
Количеството уловен в абсорбера СО2 след титруване се дава като:
mg CO2 = (100 × CB – 0,5 × V × CA) × 44
където:
|
V
|
=
|
обема M [mol/l] на НСl, използван за титруване на 100 ml от абсорбера (ml),
|
|
СB
|
=
|
концентрация на разтвора на бариевия хидроксид (mol/l),
|
|
СA
|
=
|
концентрация на разтвора на солна киселина (mol/l).
|
Ако СB е 0,0125 mol/l и СA е 0,05 mol/l, титрирането за 100 ml бариев хидроксид е 50 ml и теглото на СО2 ce дава от:

Така в този случай факторът за изчисляване на отделеното количество mg СО2 по обема на НСl, изразходвана за титруване, е 1,1.
Изчисляват се поотделно теглата на отделения СО2, произведен само от инокуланта и от инокуланта плюс изпитваното вещество, като се използват съответните стойности от титруването; а разликата е теглото на СО2, отделен само от разграждането на изпитваното вещество.
Например, ако само при инокуланта е титрувано с 48 ml, a при инокуланта плюс изпитваното вещество — с 45 ml, тогава
СО2 от инокуланта = 1,1 × (50 - 48) = 2,2 mg
СО2 от инокуланта плюс изпитваното вещество = 1,1 × (50 - 45) = 5,5 mg
и така теглото на произведения СО2 от изпитваното вещество е 3,3 mg.
Процентът на биоразграждане се изчислява от:

или

където 3,67 е фактор на преобразуване (44/12) на въглерода във въглероден диоксид.
Процентът разграждане се получава след всеки интервал от време чрез прибавяне на процентните стойности за ТhСО2 изчислени за всеки от дните до времето, до което е измервано.
При абсорберите с натриев хидроксид количеството произведен въглероден диоксид се изчислява, изразено като неорганичен въглерод (IC) (mg), чрез умножаване на концентрацията на IC в абсорбента по обема на абсорбента.
Процентът на разграждане се изчислява от:
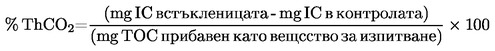
Изчислява се намалението на DOC (по избор), както е описано в I.7. Тези и всички останали резултати се записват във формуляра за данни.
IV.3.2. Валидност на резултатите
Съдържанието на неорганичен въглерод (IC) в суспензията с изпитваното вещество в минерална среда в началото на изпитването следва да бъде по-малко от 5 % от общия въглерод (ТС) и общото отделяне на СО2 от контролния инокулант в края на изпитването нормално не следва да надвишава 40 mg/l средно. Ако получените стойности са по-високи от 70 mg СО2/литър, резултатите и експерименталната техника следва критично да се проверят.
Вж. също I.5.2.
IV.3.3. Протокол от изпитването
Вж. I.8.
IV. 4. ПРОТОКОЛ ЗА ДАННИ
Тук е даден примерен протокол за данни.
ИЗПИТВАНЕ ЗА ОТДЕЛЯНЕ НА ВЪГЛЕРОДЕН ДИОКСИД
|
2.
|
ДАТА НА ЗАПОЧВАНЕ НА ИЗПИТВАНЕТО
|
3. ИЗПИТВАНО ВЕЩЕСТВО
Име:
Концентрация на изходния разтвор: … mg/l като химично вещество
Начална концентрация в средата: … mg/l като химично вещество
Общ въглерод, добавен към колбата: … mg C
ThCO2: mg CO2
4. ИНОКУЛАНТ
Източник:
Извършена обработка:
Предварителна подготовка, ако има такава:
Концентрация на суспендирани вещества в реакционната смес: mg/l
|
5.
|
ОТДЕЛЯНЕ НА ВЪГЛЕРОДЕН ДИОКСИД И РАЗГРАЖДАНЕ
Метод: Ba(OH)2 NaOH или друг
|
|
Време
(ден)
|
Образуван СО2
от изпитването (mg)
|
Образуван СО2
от контролната проба (mg)
|
Кумулиран СО2 (mg)
(изпитв. минус средна от контролата)
|
ThCO2

|
|
1
2
|
средно
|
3
4
|
средно
|
1
|
2
|
1
|
2
|
средно
|
|
0
|
|
|
|
|
|
|
|
|
|
|
n1
|
|
|
|
|
|
|
|
|
|
|
n2
|
|
|
|
|
|
|
|
|
|
|
n3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
28
|
|
|
|
|
|
|
|
|
|
Забележка: подобни форми могат да се използват за сравнителното вещество и за контролата за токсичност.
6. АНАЛИЗ НА ВЪГЛЕРОД (не е задължителен)
Анализатор на въглерод:
|
Време(ден)
|
Контрола mg/l
|
Изпитвано вещество mg/l
|
|
0
|
Cb(o)
|
Co
|
|
28 (5)
|
Cb(t)
|
Ct
|

7. АБИОТИЧНО РАЗГРАЖДАНЕ (по избор)

ЧАСТ V. ИЗПИТВАНЕ ЧРЕЗ МАНОМЕТРИЧНА РЕСПИРОМЕТРИЯ (МЕТОД В.4-Г)
V.1. ПРИНЦИП НА МЕТОДА
Измерено количество от инокуланта в минерална среда, съдържаща известна концентрация от изпитваното вещество (100 mg/l от изпитваното вещество, така че да даде 50 — 100 mg ThOD/литър) като единствен номинален източник на органичен въглерод, се разбърква в затворена колба при постоянна температура (± 1 oС или още по-точно) за 28 дни. Консумацията на кислород се определя или чрез измерване на количеството кислород (проведен електролитно), необходим да поддържа постоянен газов обем в респирометричната колба, или от изменението на обема или налягането (или комбинация от двете) в апаратурата. Отделеният въглероден диоксид се абсорбира от разтвор на калиев хидроксид или друг подходящ абсорбент. Количеството кислород, погълнат от изпитваното вещество (коригирано с това на контролния инокулант, изпитван успоредно), се изразява като процент от ThOD или ХПК (COD). По избор първичното биоразграждане може да се изчислява чрез допълнителен специфичен анализ, изпълнен в началото и в края на инкубацията, а пълното биоразграждане – чрез анализ на DOC.
V.2. ОПИСАНИЕ НА МЕТОДА
V.2.1. Апаратура
|
а)
|
подходящ респирометър;
|
|
б)
|
устройство за регулиране на температурата, поддържащо ± 1 oС, или по-добро;
|
|
в)
|
уред за мембранно филтруване (по избор);
|
|
г)
|
уред за анализ на въглерод (по избор).
|
V.2.2. Приготвяне на минерална среда
За приготвянето на изходните разтвори вж. I.6.2.
Смесват се 10 ml от разтвор а) с 800 ml вода за разреждане, прибавя се по 1 ml от разтвори от б) до г) и се долива до 1 l.
V.2.3. Приготвяне и предварителна подготовка на инокуланта
Инокулантът може да произхожда от различни източници: активна утайка, отток на канални води, повърхностни води, почви или смес от всички.
Вж. I.6.4, I.6.4.1, I.6.4.2 и I.6.5.
V.2.4. Приготвяне на колбите
Приготвят се разтвори от изпитваното и сравнителното вещество, на отделни партиди, еквивалентни на минерална среда с концентрация обикновено 100 mg вещество/литър (даваща най-малко 50—100 mg ThOD/l), като се използват изходните разтвори.
Изчислява се ThOD на базата на образуване на амониеви соли, освен ако не се очаква нитрификация, когато изчисляването следва да се базира върху образуването на нитрат (вж. приложение II.2)
Определят се стойностите на рН и ако е необходимо, се коригират до 7,4±0,2.
Трудноразтворими вещества се прибавят на по-късни етапи (вж. по-долу).
Ако следва да се определя токсичността на изпитваното вещество, се приготвя допълнително разтвор в минерална среда, съдържащ изпитваното и сравнителното вещество в същите концентрации както в индивидуалните разтвори.
Ако се изисква измерване на физикохимичното усвояване на кислорода, се приготвя разтвор на изпитваното вещество, обикновено 100 mg ThOD/l, който се стерилизира чрез прибавяне на подходящо токсично вещество (вж. I.6.6).
Необходимите обеми от разтворите на изпитваното и сравнителното вещество се дублират най-малко в по две колби. Към други колби се налива само минерална среда (за контролния инокулант) и, ако се изисква, смесен разтвор от изпитваното и сравнителното вещества и стерилен разтвор.
Ако изпитваното вещество е трудно разтворимо, се прибавя директно на този етап, на базата на обем или на тегло, или се процедира, както е описано в приложение III. Прибавя се калиев хидроксид, гранули натриева вар (смес от натриев хидроксид и калциев оксид) или друг абсорбент в клетките за абсорбция на СО2.
V.2.5. Брой на колбите при типичен експеримент
Колби 1 и 2: изпитвана суспензия
Колби 3 и 4: контролна проба с инокулант
Колба 5: проба за контрол на процедурата
За предпочитане, когато е необходимо:
Колба 6: стерилна контрола
Колба 7: контрола за токсичност
Вж. също I.6.7.
V.2.6. Изпълнение на изпитването
Съдовете се оставят да достигнат желаната температура и подходящите съдове се посяват с приготвена активна утайка или друг източник на инокулант, така че да се получи концентрация на суспендирани частици не по-висока от 30 mg/l. Апаратурата се сглобява, включва се разбъркването, проверява се за херметичност по отношение на въздуха и започва измерването на поемането на кислород. Обикновено не са необходими повече грижи освен отчитането на необходимите данни и ежедневни проверки дали се поддържат точната температура и съответното разбъркване.
Усвояването на кислород се изчислява по редовно правени отчитания, на чести интервали, като се използват методите, дадени от производителя на апаратурата. В края на инкубацията, нормално 28 дни, се измерва рН на съдържанието на колбите, по-специално ако поемането на кислород е ниско или по-високо от ThODNH4 (за азот-съдържащи съединения).
Ако е необходимо, в началото и в края се вземат проби от респирометричните колби за анализ на DOC или на друго специфично вещество (вж. приложение II.4). При първото вземане на проба следва да е сигурно, че е известен обемът на оставащата в колбата суспензия. Когато кислородът се консумира от N-съдържащо съединение, се определя увеличението на концентрацията на нитрит и нитрат за 28 дни и се изчислява корекцията за кислорода, консумиран чрез нитрификацията (приложение V).
V.3. ДАННИ И ОТЧИТАНЕ
V.3.1. Обработка на резултатите
Усвоеното количество кислород (mg) от изпитваното вещество след дадено време (коригирано с това на контролния инокулант за същото време) се разделя на теглото на използваното за изпитването вещество. Това дава биохимичната потребност от кислород (BOD), изразена като mg кислород/mg изпитвано вещество, което е

= mg O2 за mg изпитвано вещество
Определя се процентът на биологичното разграждане или като:

или като

Следва да се отбележи, че тези два метода не дават непременно същата стойност; препоръчително е да се използва последният метод.
За изпитвани вещества, съдържащи азот, се използва подходяща ThOD (NH4 или NO3) според това, което се знае или се очаква да стане при наличие на нитрификация (приложение II.2). Ако има нитрификация, но тя още не е завършила, корекцията за консумиран кислород чрез нитрификацията се изчислява от промените в концентрацията на нитрита и нитрата (приложение V).
Когато по избор се правят определяния на органичен въглерод и/или на специфично вещество, процентът на разграждане се изчислява, както е описано в I.7.
Всички резултати се записват в приложения протокол за данни.
V.3.2. Валидност на резултатите
Кислородът, усвоен от контролния инокулант, е нормално 20—30 mg О2/литър и не следва да е по-висок от 60 mg/l за 28 дни. Стойности, по-високи от 60 mg/l, изискват критична проверка на данните и експерименталните техники. Ако стойностите на рН са извън областта 6—8,5 и кислородната консумация от изпитваното вещество е по-малка от 60 %, изпитването следва да се повтори с по-ниска концентрация на изпитваното вещество.
Вж. също I.5.2.
V.3.3. Протокол от изпитването
Вж. I.8.
V. 4. ПРОТОКОЛ ЗА ДАННИ
Тук е даден примерен протокол за данни.
ИЗПИТВАНЕ ЧРЕЗ МАНОМЕТРИЧНА РЕСПИРОМЕТРИЯ
|
2.
|
ДАТА НА ЗАПОЧВАНЕ НА ИЗПИТВАНЕТО
|
3. ИЗПИТВАНО ВЕЩЕСТВО
Име:
Концентрация на изходния разтвор: … mg/l
Начална концентрация в средата, Со: … mg/l
Обем на колбата за изпитване (V): … ml
ThOD или COD: … mg О2/mg изпитвано вещество (NH4 или NO3)
4. ИНОКУЛАНТ
Източник:
Извършена обработка:
Предварителна подготовка, ако има такова:
Концентрация на суспендирани частици в реакционната смес: … mg/l
5. УСВОЯВАНЕ НА КИСЛОРОД: БИОРАЗГРАДИМОСТ
|
|
Време (ден)
|
|
0
|
|
7
|
|
14
|
|
|
21
|
|
|
28
|
|
|
Усвоен О2 (mg) от изпитваното вещество
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
а, средно
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Усвоен О2 (mg) от контролен инокулант
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
b, средно
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Коригирано BOD (mg)
|
(a1 – bm)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(a2 – bm)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
BOD за mg изпитваното вещество
|

|
|
|
|
|
|
|
|
|
|
|
|
|
|

|
|
|
|
|
|
|
|
|
|
|
|
|
|
% на разграждане

|
D1 (a1)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
D2(a2)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Средно (6)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V=обем на средата в колбата за изпитване
|
Забележка: Подобни протоколи може да се използват за сравнителното вещество и за контролата за токсичност.
6. КОРЕКЦИЯ ЗА НИТРИФИКАЦИЯ (вж. приложение V)
|
Ден
|
0
|
28
|
Разлика
|
|
i)
|
Концентрация на нитрат (mg N [азот]/l)
|
|
|
|
(N)
|
|
ii)
|
Кислороден еквивалент(4,57 × N [азот] × V) (mg)
|
|
—
|
—
|
|
|
iii)
|
Концентрация на нитрит (mg N [азот]/l)
|
|
|
|
(N)
|
|
iv)
|
Кислороден еквивалент(3,43 × N [азот] × V) (mg)
|
|
—
|
—
|
|
|
ii) + iv)
|
Общ кислороден еквивалент
|
|
—
|
—
|
|
7. АНАЛИЗ НА ВЪГЛЕРОД (по избор)
Анализатор на въглерод:
|
Време (ден)
|
Контрола mg/l
|
Изпитвано вещество mg/l
|
|
0
|
(Cblo)
|
(Co)
|
|
28 (7)
|
(Cblt)
|
(Ct)
|
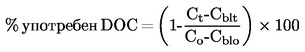
8. СПЕЦИФИЧНО ВЕЩЕСТВО (по избор)
|
Sb
|
=
|
концентрация на физикохимичната (стерилна) контрола на 28-ия ден
|
|
Sa
|
=
|
концентрация в колбата с инокулата на 28-ия ден
|

9. АБИОТИЧНО РАЗГРАЖДАНЕ (по избор)
|
а
|
=
|
консумация на кислород в стерилната колба след 28 дни, mg
|

(вж. точки 1 и 3)

ЧАСТ VI. ИЗПИТВАНЕ ПО МЕТОДА НА ИЗОЛИРАНИТЕ ПРОБИ (МЕТОД В.4-Д)
VI.1. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Разтвор на изпитваното вещество в минерална среда, обикновено 2—5 mg/l, се инокулира със сравнително малък брой микроорганизми от смесена популация и се държи в пълни догоре, затворени колби на тъмно при постоянна температура. Разграждането се следи чрез анализ на разтворения кислород през 28-дневен период. Количеството на усвоения от изпитваното вещество кислород се коригира с това на успоредно заложения контролен инокулант и се изразява като процент от ThOD или COD.
VI.2. ОПИСАНИЕ НА МЕТОДА
VI.2.1. Апаратура
|
а)
|
Колби за BOD със стъклени запушалки, 250—300 ml.
|
|
б)
|
Водна баня или инкубатор, за съхранение на колбите при постоянна температура (±1 oС или по-добър), без светлина.
|
|
в)
|
Големи стъклени колби (2—5 литра) за приготвяне на среда и пълнене на колбите за BOD.
|
|
г)
|
Кислороден електрод или оксиметър, или уреди и реагенти за титруване по Winkler.
|
VI.2.2. Приготвяне на минерална среда
За приготвянето на изходните разтвори вж. I.6.2.
Смесват се по 1 ml от разтвори от а) до г) и се долива с вода за разреждане до 1 литър.
VI.2.3. Приготвяне на инокулант
Инокулант обикновено се взема от оттока на пречиствателна станция или лабораторно звено, приемащи предимно битови отпадъчни води. Алтернативен източник на инокулант са повърхностните води. Нормално се използва от една капка (0,05 ml) до 5 ml от филтрата за 1 литър среда. Може да са необходими допълнителни опити, за да се открие оптималният обем за даден отток (вж. I.6.4.2 и I.6.5).
VI.2.4. Приготвяне на колбите
Минералната среда се аерира силно в продължение на най-малко 20 min. Всяка серия се провежда с минерална среда от една партида. Обикновено средата е готова за използване след престой от 20 часа при температурата на изпитването. Определя се концентрацията на разтворения кислород с контролна цел, като стойността би следвало да бъде около 9 mg/l при 20 oС. Всички операции на прехвърляне и пълнене с наситената с въздух среда се извършват без отделяне на мехурчета, например като се използват сифони.
Приготвят се успоредни групи от колби за BOD за определяне на изпитваното и сравнителното вещество в едновременни експериментални серии. Събират се достатъчен брой колби за BOD, включително контролен инокулант, за да е възможно измерването на потреблението на кислород да се прави най-малко в две повторения на определени интервали от време, например след 0, 7, 14, 21 и 28 дни. Може да са необходими и повече колби, за да се идентифицира надеждно 10-дневният период.
Прибавя се напълно аерирана минерална среда към големи колби, така че да се напълнят до една трета. Тогава се добавя достатъчно количество от изходните разтвори на изпитваното вещество и на сравнителното вещество към отделни големи колби, така че крайната концентрация на веществата да не е по-висока от 10 mg/l. В друга голяма колба, която е контрола на минералната среда, не се прибавят вещества.
За да не се ограничава активността на инокуланта, концентрацията на разтворения кислород не следва да спада под 0,5 mg/l в колбите за BOD. Това ограничава концентрацията на изпитваното вещество до около 2 mg/l. За трудноразграждащи се вещества и за такива с ниска ThOD, обаче, могат да използват 5—10 mg/l. В някои случаи е препоръчително да се пуснат успоредни серии от изпитваното вещества в две различни концентрации, например 2 и 5 mg/l. Нормално BOD се изчислява на базата на образуване на амониеви соли, но ако се очаква или се знае, че има нитрификация, изчислява се на базата на образуване на нитрат (ТhODNO3, вж. приложение II.2). Ако, обаче, има нитрификация, но тя не е завършила, промените в концентрацията на нитрита или нитрата се коригират след определяне чрез анализ (вж. приложение V).
Ако ще се изследва токсичността на веществото (в случай, например, че при предишно изпитване е намерена ниска стойност на биоразградимост), е необходима друга серия от колби.
Приготвя се друга голяма колба с аерирана минерална среда (до около една трета от обема) плюс изпитваното вещество и сравнителното вещество с крайни концентрации, които обикновено са същите както в другите големи колби.
Към разтворите в големите колби се прибавя инокулант от оттока (една капка или около 0,05 ml до 5 ml/l) или от друг източник, като например речна вода (вж. I.6.4.2). Накрая разтворите се довеждат до обема с аерирана минерална среда, като се използва маркуч, който достига до дъното на колбата, за да се осигури подходящо смесване.
VI.2.5. Брой на колбите при един типичен експеримент
В типичен експеримент се използват следните колби:
|
—
|
най-малко 10, съдържащи изпитвано вещество и инокулант (суспензии за изпитване),
|
|
—
|
най-малко 10, съдържащи само инокулант (контролен инокулант),
|
|
—
|
най-малко 10, съдържащи сравнително вещество и инокулант (проба за контрол на процедурата),
|
|
—
|
и, когато е необходимо, 6 колби, съдържащи изпитвано вещество, сравнително вещество и инокулант (контрола за токсичност). За да се идентифицира със сигурност 10-дневният период, са необходими около два пъти повече колби.
|
VI.2.6. Изпълнение на изпитването
Всеки приготвен разтвор се разпределя веднага в съответната група от колби за BOD с маркуч, започвайки от долната четвърт (не от дъното) на съответната голяма колба, до напълването на всички колби за BOD. Потупва се леко, за да се освободят всички въздушни мехурчета. Анализира се разтвореният кислород в колбите в нулевия момент по Winkler или с електрод. Съдържанието на колбите може да се консервира за по-късен анализ по метода на Winkler чрез прибавяне на манганов (II) сулфат и натриев хидроксид (първи реагент по Winkler). Внимателно запушените колби, съдържащи кислород, фиксиран като кафяв манганов (III) хидратиран оксид, се съхраняват на тъмно при 10—20 oС за не повече от 24 часа, преди да се продължат следващите етапи на метода на Winkler. Затварят се останалите повторения на колбите, като се внимава да не се включат въздушни мехурчета, и се инкубират при 20 oС на тъмно. Всяка серия трябва да се придружава от пълна успоредна серия за определяне на контролния инокулант. Отделят се най-малко по две колби от всяка серия за анализ на разтворения кислород на определени интервали от време (най-малко веднъж на седмица) по време на 28-дневната инкубация.
Ежеседмичното вземане на проби позволява оценка на процента на усвояване при 14-дневен период, докато вземането на проби на всеки 3—4 дни позволява да се идентифицира 10-дневният период, което ще изисква още двойно повече колби.
За азот-съдържащи изпитвани вещества трябва да се направят корекции за усвояването на кислород чрез нитрификацията. За да се направи това, се определя разтвореният кислород по метода с кислороден електрод и след това се вземат проби от колба за БПК за анализ за нитрит и нитрат. От увеличението на концентрацията на нитрита и нитрата се изчислява използваният кислород (вж. приложение V).
VI.3. ДАННИ И ОТЧИТАНЕ
VI.3.1. Обработка на резултатите
Първо се изчислява BOD след всеки период от време чрез изваждане на намалението на кислорода (mg О2/литър) при контролния инокулант от това, показано от изпитваното вещество. Разделя се коригираната стойност с концентрацията (mg/l) на изпитваното вещество, за да се получи специфичната БПК като mg кислород на mg изпитвано вещество. Изчислява се процентът на биоразградимост, като се разделя специфичната BOD със специфичната ThOD (изчислена според приложение II.2) или COD (определена чрез анализ, вж. приложение II.3), така:

или


Трябва да се отбележи, че тези два метода не дават непременно еднаква стойност; препоръчва се използването на последния.
За изпитвани вещества, които съдържат азот, се използва подходяща ThOD (NH4 или NO3) според това, което се знае или се очаква да стане при наличие на нитрификация (приложение II.2). Ако има нитрификацията, но тя още не е завършила, корекцията за консумиран кислород чрез нитрификацията се изчислява от промените в концентрацията на нитрит и нитрат (приложение V).
VI.3.2. Валидност на резултатите
Намалението на кислорода в контролния инокулант трябва да надвишава 1,5 mg/l разтворен кислород след 28 дни. Стойности, по-високи от тази, изискват проверка на експерименталните техники. Остатъчната концентрация на кислород в изпитвателните колби не трябва да спада под 0,5 mg/l през цялото време. Такива ниски кислородни нива са валидни само ако методът за определяне на разтворения кислород позволява точното измерване на такива равнища.
Вж. също I.5.2.
VI.3.3. Протокол от изпитването
Вж. I.8.
VI. 4. ПРОТОКОЛ ЗА ДАННИ
Тук е даден примерен протокол за данни.
ИЗПИТВАНЕ ПО МЕТОДА НА ИЗОЛИРАНИТЕ ПРОБИ
|
2.
|
ДАТА НА ЗАПОЧВАНЕ НА ИЗПИТВАНЕТО
|
3. ИЗПИТВАНО ВЕЩЕСТВО
Име:
Концентрация на изходния разтвор: … mg/l
Начална концентрация в колбата: … mg/l
ThOD или COD: … mg О2/mg изпитвано вещество
4. ИНОКУЛАНТ
Източник:
Извършена обработка:
Предварителна подготовка, ако има такова:
Концентрация в реакционната смес: … mg/l
5. ОПРЕДЕЛЯНЕ НА РАЗТВОРЕНИЯ КИСЛОРОД
Метод: по Winkler/c електрод
Анализи на съдържанието в колбите
|
Време на инкубация (дни)
|
Разтворен кислород (mg/l)
|
|
0
|
n1
|
n2
|
|
|
Инокулант без вещество
|
1
|
C1
|
|
|
|
|
|
2
|
C2
|
|
|
|
|
|
Средно
|

|
|
|
|
|
|
Изпитвано вещество
|
1
|
a
1
|
|
|
|
|
|
|
2
|
а2
|
|
|
|
|
|
Средно
|

|
|
|
|
|
Забележка: Подобни формуляри могат да се използват за сравнителното съединение и за контролата за токсичност.
6. КОРЕКЦИЯ ЗА НИТРИФИКАЦИЯ (вж. приложение V)
|
Време на инкубация (дни)
|
0
|
n1
|
n2
|
n3
|
|
i)
|
Концентрация на нитрат (mg N [азот]/l)
|
|
|
|
|
|
|
ii)
|
Промяна в концентрацията на нитрат (mg N [азот]/l)
|
|
—
|
|
|
|
|
iii)
|
Кислороден еквивалент (mg/l)
|
|
—
|
|
|
|
|
iv)
|
Концентрация на нитрит (mg N [азот]/l)
|
|
|
|
|
|
|
v)
|
Промяна в концентрацията на нитрит (mg N [азот]/l)
|
|
—
|
|
|
|
|
vi)
|
Кислороден еквивалент (mg/l)
|
|
—
|
|
|
|
|
(iii)
|
+ vi) Общ кислороден еквивалент (mg/l)
|
|
—
|
|
|
|
7. НАМАЛЯВАНЕ НА РАЗТВОРЕНИЯ КИСЛОРОД: % НА РАЗГРАЖДАНЕ
|
|
Намаляване след n дни (mg/l)
|
|
n1
|
n2
|
n3
|
|
|
КОЛБА 1: (mto – mtx) – (mbo – mbx)
|
|
|
|
|
|
КОЛБА 2: (mto – mtx) – (mbo – mbx)
|
|
|
|
|
|
КОЛБА 1:

|
|
|
|
|
|
КОЛБА 2:

|
|
|
|
|
| % Dсредно (8) =
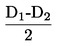
|
|
|
|
|
|
mto
|
=
|
стойност в колбата към време 0
|
|
mtx
|
=
|
стойност в колбата към време х
|
|
mbо
|
=
|
средна стойност в контролата към време 0
|
|
mbх
|
=
|
средна стойност в контролата към време х
|
Прилага се също корекция за нитрификация от iii + vi в точка 6.
8. НАМАЛЯВАНЕ НА РАЗТВОРЕНИЯ КИСЛОРОД В КОНТРОЛНИЯ ИНОКУЛАНТ
Потреблението на кислород от контролния инокулант е: (mbo – mb28) mg/l. Това потребление е важно за валидността на изпитването. То трябва да бъде по-малко от 1,5 mg/l.
ЧАСТ VII. ИЗПИТВАНЕ ПО M.I.T.I (МЕТОД В.4-Е)
VII.1. ПРИНЦИП НА МЕТОДА
Усвояването на кислород от разтвори при разбъркване или от суспензии на изпитваното вещество в минерална среда, с инокуланта от специално отгледани, неадаптирани микроорганизми, се измерва автоматично за период от 28 дни в затъмнен, затворен респирометър при 25 ± 1 oС. Отделеният въглероден диоксид се абсорбира в натриева вар. Биоразградимостта се изразява като процент на усвоения кислород (коригиран с усвояването от контролния инокулант) от теоретичната потребност (ThOD). Процентът на първичната биоразградимост може да се изчисли също от допълнителен специфичен химичен анализ, правен в началото и в края на инкубацията или, по избор, чрез анализ на разтворения органичен въглерод (DOC).
VII.2. ОПИСАНИЕ НА МЕТОДА
VII.2.1. Апаратура
|
а)
|
Автоматичен електролитен BOD-метър или респирометър, нормално съоръжен с 6 колби, по 300 ml всяка, и с чаши, съдържащи абсорбент на СО2.
|
|
б)
|
Пространство с постоянна температура и/или водна баня при 25 ± 1 oС или по-добра.
|
|
в)
|
Устройство за мембранно филтруване (по избор).
|
|
г)
|
Анализатор на въглерод (по избор).
|
VII.2.2. Приготвяне на минерална среда
Приготвят се следните изходни разтвори, като се използват реагенти и вода със степен „чист за анализи“ (I.6.1.):
|
а)
|
Монокалиев дихидрогенортофосфат, КН2РО4
|
8,50 g
|
|
Дикалиев монохидрогенортофосфат, К2НРО4
|
21,75 g
|
|
Динатриев монохидрогенортофосфат додекахидрат, Na2HPO4 12H2O
|
44,60 g
|
|
Амониев хлорид, NH4Cl
|
1,70 g
|
|
Разтварят ce във вода и се доливат до 1 литър
|
|
|
Стойността на рН на разтвора трябва да е 7,2
|
|
|
б)
|
Магнезиев сулфат хептахидрат, MgSO4 7H2O
|
22,50 g
|
|
Разтваря се във вода и се долива до 1 литър
|
|
|
в)
|
Калциев хлорид безводен, СаСl2
|
27,50 g
|
|
Разтваря се във вода и се долива до 1 литър
|
|
|
г)
|
Железен (III) хлорид хексахидрат, FeCl3 6H2O
|
0,25 g
|
|
Разтваря се във вода и се долива до 1 литър
|
|
Вземат се по 3 ml от всеки разтвор а), б), в) и г) и се долива вода до 1 литър.
VII.2.3. Приготвяне на инокулант
Събират се свежи проби от не по-малко от десет места, главно от области, където се използват и изхвърлят различни химични вещества. От места като пречиствателни станции на канални и промишлени отпадъчни води, от реки, езера, морета, събират се еднолитрови проби от утайка, повърхностна почва, вода и т.н. и се смесват добре. След премахване на плуващите материали и успокояване се регулира рН на супернатантата до стойност 7 ± 1 с натриев хидроксид или фосфорна киселина.
Използва се подходящ обем от филтрираната супернатанта, за да се напълни утаителен съд за промиване на активната утайка, и течността се аерира в продължение на 23 1/2 часа. Тридесет минути след спиране на аерацията се отлива около една трета от целия обем на супернатантата, като към утаения материал се добавя равен обем от разтвор (рН 7), съдържащ по 0,1 % от глюкоза, пептон и монокалиев ортофосфат, и се възобновява аерацията. Тази процедура се повтаря по веднъж на ден. Утаителят трябва да работи по правилата на добрата практика: оттокът трябва да е бистър, температурата трябва да се поддържа 25 ± 2 oС, рН трябва да е 7 ± 1, утайката трябва да е добре утаена, трябва да има добра аерация, която да поддържа сместа аеробна през цялото време, трябва да присъстват първаци и активността на утайката трябва да се изпитва спрямо сравнително вещество най-малко на всеки три месеца. Утайката не се използва като инокулант, ако станцията не е работила поне един месец, но след не повече от четири месеца. След това се вземат проби от най-малко 10 места през нееднакви интервали от време, веднъж на всеки три месеца.
За да се поддържат свежата и старата утайки с еднаква активност, филтруваната супернатанта от използваната активна утайка се смесва с равен обем филтрувана супернатанта от прясно събрана смес от десет източника и комбинираната течност се култивира, както е описано по-горе. Утайка за инокуланта се взема 18—24 часа след като апаратурата е била захранена.
VII.2.4. Приготвяне на колбите
Приготвят се следните шест колби:
№ 1: изпитваното вещество във вода за разреждане с концентрация 100 mg/l
№ 2, 3 и 4: изпитваното вещество в минерална среда с концентрация 100 mg/l
№ 5: сравнително вещество (напр. анилин) в минерална среда с концентрация 100 mg/l
№ 6: само минерална среда
Трудноразтворимите изпитвани вещества се добавят директно, на базата на обем или тегло, или се постъпва, както е описано в приложение III, с изключение на това, че не могат да се използват нито разтворители, нито емулгатори. Абсорбентите на СО2 ce прибавят към всички колби в специалните чашки. Регулира се рН до 7,0 в колби с номера 2, 3 и 4.
VII.2.5. Изпълнение на изпитването
Поставя се малък обем инокулант в колби с номера 2, 3 и 4 (изпитвани суспензии), номер 5 (контрола на активността) и номер 6 (контролен инокулант), така че да се получи концентрация на суспендираните частици 30 mg/l. Инокулантът не се прибавя към колба номер 1, която служи като абиотична контрола. Апаратурата се сглобява, проверява се за пропуски на въздух и се включват бъркалките. Започва измерване на усвояването на кислород на тъмно. Всеки ден се проверяват температурата, разбъркването и кулометричният записващ уред за потреблението на кислород, като се отбелязва всяка промяна в цвета на съдържимото в колбите. Потреблението на кислород се отчита директно от шест колби по съответен метод, например с шестканален записващ уред, който дава кривата на BOD. В края на инкубацията, обикновено 28 дни, се измерва рН на съдържимото в колбите и се определя концентрацията на остатъчното изпитвано вещество и разградните му продукти и, в случай на разтворими във вода вещества, концентрацията на DOC (приложение II.4). Обръща се специално внимание на летливите вещества. Ако се очаква нитрификация, се определят концентрациите на нитрат и нитрит, ако е възможно.
VII.3. ДАННИ И ОТЧИТАНЕ
VII.3.1. Обработка на резултатите
Разделя се потреблението на кислород (mg) от изпитваното вещество след дадено време, коригирано с това на контролния инокулант за същото време, на теглото на използваното за изпитването вещество. Това дава BOD, изразена като mg кислород/mg изпитвано вещество, което е:

= mg O2 / mg изпитвано вещество
Тогава процентът на биоразграждането се получава от:

За смеси ThOD ce изчислява от елементния анализ, както за просто съединение. Използва се подходяща ThOD (ThODNH4 или ТhODNO3) според това, дали нитрификацията липсва или е пълна (приложение II.2). Ако обаче има нитрификация, но тя не е напълно завършена, тогава корекцията за усвоения кислород се изчислява от промените в концентрациите на нитрит и нитрат (приложение V).
Процентът на първоначалното биоразграждане се изчислява от загубата на специфично (родителско) химично вещество (вж. 1.7.2.)
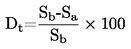
Ако е имало загуба на изпитваното вещество в колба номер 1, измерваща физикохимичното потребление, това се отразява в протокола и се използва концентрацията на изпитваното вещество (Sb) след 28 дни в тази колба, за да се изчисли процентът на биоразграждането.
Когато е направено определяне на DOC (незадължително), се изчислява процентът на пълното биоразграждане от:
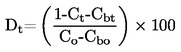
както е описано в I.7.1. Ако е имало загуба на DOC в колба номер 1, измерваща физикохимичното изразходване, концентрацията на DOC в тази колба се използва, за да се изчисли процентът на биоразграждането.
Всички резултати се записват в приложените формуляри за данни.
VII.3.2. Валидност на резултатите
Потреблението на кислород в контролния инокулант е нормално 20—30 mg O2/l и не трябва да е по-високо от 60 mg/l за 28 дни. Стойности, по-високи от 60 mg/l, изискват критична проверка на данните и експерименталните техники. Ако стойността на рН е извън областта 6—8,5 и потреблението на кислород от изпитваното вещество е по-малко от 60 %, изпитването трябва да се повтори с по-ниска концентрация на изпитваното вещество.
Вж. също I.5.2.
Ако процентът на разграждане на анилин, изчислен от консумацията на кислород, не надвишава 40 % след 7 дни и 65 % след 14 дни, изпитването се счита за невалидно.
VII.3.3. Протокол от изпитването
Вж. I.8.
VII.4. ПРОТОКОЛ ЗА ДАННИ
По-долу е даден примерен протокол за данни.
ИЗПИТВАНЕ ПО MITI (I)
|
2.
|
ДАТА НА ЗАПОЧВАНЕ НА ИЗПИТВАНЕТО
|
3. ИЗПИТВАНО ВЕЩЕСТВО
Име:
Концентрация на изходния разтвор: … mg/l като химично вещество
Начална концентрация в средата, Со: … mg/l като химично вещество
Обем на реакционната смес, V: ml
ThOD: … mg O2/l
4. ИНОКУЛАНТ
Места на вземане на проби от утайка:
Концентрация на суспендираните частици в активната утайка след аклиматизация със синтетична отпадъчна вода = mg/l
Обем на активната утайка за литър от крайната среда = ....ml
Концентрация на утайката в крайната среда = .. .mg/l
5. ПОТРЕБЛЕНИЕ НА КИСЛОРОД: БИОРАЗГРАЖДАНЕ
Вид на използвания респирометър:
|
|
Време (дни)
|
|
0
|
7
|
14
|
21
|
28
|
|
О2 потребление, (mg) от изпитваното вещество
|
a1
|
|
|
|
|
|
|
a2
|
|
|
|
|
|
|
a3
|
|
|
|
|
|
|
О2 потребление, (mg) от контролата
|
b
|
|
|
|
|
|
|
Коригирано потребление на О2 (mg)
|
(a1 – b)
(a2 – b)
(а3 – b)
|
|
|
|
|
|
|
БПК на mg изпитвано вещество
|

|
Колба 1
|
|
|
|
|
|
|
Колба 2
|
|
|
|
|
|
|
Колба 3
|
|
|
|
|
|
|
% на разграждане

|
|
1
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
Средно (9)
|
|
|
|
|
|
Забележка: Подобни протоколи могат да се използват за сравнителното съединение.
6. АНАЛИЗ НА ВЪГЛЕРОД (по избор)
Анализатор на въглерод:
|
Колба
|
DOC
|
% DOC изразходван
|
Средно
|
|
измерен
|
коригиран
|
|
Вода + изпитвано вещество
|
а
|
|
|
|
—
|
—
|
|
Утайка + изпитвано вещество
|
b1
|
|
b1-с
|
|
|
|
|
Утайка + изпитвано вещество
|
b2
|
|
b2 – с
|
|
|
|
|
Утайка + изпитвано вещество
|
b3
|
|
b3 – с
|
|
|
|
|
Контрола
|
с
|
|
—
|
|
—
|
—
|

7. ДАННИ ОТ СПЕЦИФИЧЕН ХИМИЧЕН АНАЛИЗ
|
|
Остатъчно количество от изпитвано вещество в края на изпитването
|
% на разграждане
|
|
Контролна проба с вода
|
Sb
|
|
|
Среда с инокулант
|
Sal
|
|
|
Sa2
|
|
|
Sa3
|
|

Изчислява се процент разграждане съответно за колби al и а3.
8. 3АБЕЛЕЖКИ
Следва да се приложи крива за BOD във времето, ако има такава.
Приложение I
СЪКРАЩЕНИЯ И ОПРЕДЕЛЕНИЯ
|
DO
|
:
|
Разтворен кислород (mg/l) е концентрацията на разтворения кислород в една водна проба.
|
|
BOD
|
:
|
Биохимична потребност от кислород (g) е количеството кислород, консумирано от микроорганизмите при метаболизиране на едно изпитвано съединение, изразявано също така като g усвоен кислород за g от изпитваното съединение (Виж метод С.5)
|
|
COD
|
:
|
Химична потребност от кислород (g) е количеството кислород, използвано при на окисляването на едно изпитвано съединение с горещ, кисел бихромат; представлява мярка за количеството на наличната окислима материя. Изразява се също така като g кислород, усвоен за g от изпитваното съединение (Виж метод С.6).
|
|
DOC
|
:
|
Разтворен органичен въглерод е органичният въглерод, присъстващ в разтвора или който преминава през филтър 0,45 μm, или остава в супернатанта след центрофугиране при 40 000 m.s-2(±4 000 g) за 15 min.
|
|
ThOD
|
:
|
Теоретична потребност от кислород (mg) е общото количество кислород, необходимо за пълното окисляване на едно химично вещество. То се изчислява от молекулната формула (вж. приложение II. 2) и се изразява също като mg кислород, необходим за mg от изпитваното съединение.
|
|
ThCO2
|
:
|
Теоретичен въглероден диоксид (mg) е изчисленото количество въглероден диоксид, което ще се получи от известно или измерено съдържание на въглерод в изпитваното съединение, когато то бъде напълно минерализирано. Изразява се също като mg въглероден диоксид, отделян от mg от изпитваното съединение.
|
|
TOC:
|
:
|
Общ органичен въглерод в пробата е сумата от органичния въглерод в разтвора и в суспензията.
|
|
IC
|
:
|
Неорганичен въглерод
|
|
ТС
|
:
|
Общ въглерод е сумата от органичния и неорганичния въглерод в една проба.
|
Първично биологично разграждане:
е изменение на химичната структура на едно вещество, причинено от биологично действие, и имащо за резултат загуба на специфично свойство на това вещество.
Пълно биологично разграждане (аеробно):
е равнището на постигнато разграждане, когато изпитваното съединение е напълно усвоено от микроорганизмите и в резултат на това са произведени въглероден диоксид, вода, минерални соли и нови микробни клетъчни съставки (биомаса).
Лесно биоразградими:
Условна класификация на химичните вещества, които са преминали през определени изпитвания за пълна биоразградимост. Тези изпитвания са толкова неоспорими, че се счита, че такива съединения бързо и напълно се разграждат биологично във водна среда при аеробни условия.
Присъщо биоразградими:
Класификация на химични вещества, за които има неоспорими доказателства за биологично разграждане (първично или пълно) от което и да е признато изпитване за биоразградимост.
Склонност към третиране:
Способността на съединенията да бъдат отстранявани при биологичната преработка на отпадъчни води, без да повлияват вредно нормалното протичане на процесите на третиране. Най-общо бързо разградимите съединения подлежат на третиране, но това не важи за всички присъщо биоразградими съединения. Абиотични процеси могат също да действат.
Латентно време (лаг-фаза):
Времето от посяването на инокуланта (при изследване чрез скоростта на отмиране), докато процентът на разграждане се увеличи най-малко до 10. Латентното време често е много променливо и слабо възпроизводимо.
Време на разграждане:
Времето от края на латентното време до времето, при което са достигнати 90 % от максималното равнище на разграждане.
10-дневен период:
10-те дни, които непосредствено следват достигане на 10 % разграждане.
Приложение II
ИЗЧИСЛЯВАНЕ И ОПРЕДЕЛЯНЕ НА ПОДХОДЯЩИ ОБОБЩЕНИ ПАРАМЕТРИ
В зависимост от избрания метод ще се изискват определени обобщени параметри. Следващата част описва получаването на тези стойности. Използването на тези параметри е описано при отделните методи.
1. Съдържание на въглерод
Съдържанието на въглерод се изчислява, когато елементният състав е известен, или от данните от елементния анализ на изпитваното вещество.
2. Теоретична потребност от кислород (ThOD)
Теоретичната потребност от кислород (ThOD) може да бъде изчислена, ако елементният състав е известен или е определен чрез елементен анализ. Така за съединението:
CcHhClclNnNanaOoPpSs
без нитрификация,
 mg/mg
mg/mg
или с нитрификация
 mg/mg
mg/mg
3. Химична потребност от кислород (COD)
Химичната потребност от кислород (COD) се определя според метод В.6.
4. Разтворен органичен въглерод (DOC)
Разтвореният органичен въглерод (DOC) е по определение разтвореният органичен въглерод на всяко химично вещество или смес във вода, преминаващи през филтър 0,45 μm.
Пробите се вземат от съдовете за изпитване и веднага се филтрират с апаратура за филтриране, използвайки подходящ мембранен филтър. Първите 20 ml (количеството може да се намали, когато се използват малки филтри) от филтрата се изхвърлят. Обеми от по 10—20 ml или по-малки, ако ще се инжектират (обемът зависи от количеството, необходимо за анализатора на въглерод), се оставят за анализ на въглерод. Концентрацията на DOC ce определя с апарат за анализ на органичен въглерод, който е способен да измерва точно концентрации на въглерод, равни или по-ниски от 10 % от началната концентрация на DOC, използвана при изпитването.
Филтрираните проби, които не могат да бъдат анализирани същия работен ден, се оставят в хладилник при 2—4 oС за 48 часа или под — 18oС за по-дълги периоди.
Забележки:
Мембранните филтри често са импрегнирани с повърхностноактивни вещества, които им осигуряват хидрофилност. В такъв случай филтърът може да съдържа до няколко mg разтворим органичен въглерод, който да пречи на определянето на биологичната разградимост. Повърхностноактивни вещества и други разтворими органични съединения се премахват от филтрите чрез варене в дейонизирана вода 3 пъти по 1 час. Филтрите след това се съхраняват във вода за 1 седмица. Ако се използват филтърни патрони за еднократна употреба, всяка партида следва да се проверява дали отделя разтворим органичен въглерод.
В зависимост от типа на мембранния филтър изпитваното вещество може да се задържи чрез адсорбция. Тогава следва да се получи сигурност, че изпитваното вещество не се задържа върху филтъра.
Вместо филтриране, за отделяне на TOC от DOC може да се използва центрофугиране при 40 000 m. s-2 (4 000 g) за 15 min. Методът не е надежден при начални концентрации < 10 mg DOC/l, ако или не са премахнати всички бактерии, или въглеродът като част от бактериалната плазма се е разтворил повторно.
ПРЕПРАТКИ
|
(1)
|
Standard Methods for the Examination of Water and Wastewater, 12th ed, Am. Pub. Hlth. Ass., Am. Wat. Poll. Control Fed., Oxygen Demand, 1965, P. 65;
|
|
(2)
|
Wagner, R., Von Wasser, 1976, vol. 46, 139;
|
|
(3)
|
DIN-Entwurf 38409 Teil 41 Deutsche Einheitsverfahren zur Wasser-, Abwasser-und Schlammuntersuchung, Summarische Wirkungs- und Stoffkenngrosen (Gruppe H). Bestimmung des Chemischen Sauerstoffbedarfs (CSB) (H 41), Normenausschus (NAW) in DIN Deutsches Institut fur Normung e. V.;
|
|
(4)
|
Gerike, P., The biodegradability testing of poorly watersoluble compounds. Chemosphere, 1984, vol 13(1), 169;
|
Приложение III
ОЦЕНКА НА БИОЛОГИЧНАТА РАЗГРАДИМОСТ НА ТРУДНОРАЗТВОРИМИ ВЕЩЕСТВА
При изпитванията за биологична разградимост на трудноразтворими вещества следва да се обърне внимание на следните аспекти.
Докато хомогенните течности рядко биха създали проблем при вземането на проба, препоръчва се твърдите материали да се хомогенизират по съответен начин, за да се избегнат грешки, дължащи се на липсата на хомогенност. Следва особено да се внимава, когато се вземат представителни проби от по няколко mg от смеси на химични вещества или от вещества, съдържащи големи количества примеси.
По време на изпитването могат да се използват различни форми на разбъркване. Следва да се използва само разбъркване дотолкова, че да се поддържа химичното вещество диспергирано, без да се стига до претопляне, образуване на много пяна или излишни сили на разкъсване.
Може да се използва емулгатор, даващ стабилна дисперсия на химичното вещество. Той следва да не е токсичен за бактериите, не следва да е биоразградим и да причинява образуване на пяна при условията на изпитването.
Същите критерии се прилагат за разтворителите, както и за емулгаторите.
Не се препоръчва използване на твърди носители при изпитване на твърди вещества, но те могат да са подходящи сами за себе си.
Когато се използват допълнителни вещества, като емулгатори, разтворитери и носители, следва да се пусне контролна проба с тях.
Всеки от трите респирометрични метода за СО2, BOD, MITI може да се използва за проучване на биоразградимостта на трудноразтворими съединения.
ПРЕПРАТКИ
|
—
|
(1) de Morsier, A. et al., Biodegradation of poorly soluble compounds. Chemosphere, 1987, vol. 16, 833.
|
|
—
|
(2) Gerike, P., The Biodegradability testing of poorly water soluble compounds. Chemosphere, 1984, vol. 13, 169.
|
Приложение IV
ОЦЕНКА НА БИОЛОГИЧНОТО РАЗГРАЖДАНЕ НА ВЕЩЕСТВИ, ЗА КОИТО СЕ ПРЕДПОЛАГА/ПОДОЗИРА, ЧЕ СА ТОКСИЧНИ КЪМ ИНОКУЛАНТА
Когато дадено химично вещество е подложено на изпитване за лесна биоразградимост и се оказва, че не е биоразградимо, се препоръчва следната процедура, ако е желателно да се разбере дали инхибира или е инертено (Reynolds et al., 1987).
Подобни или идентичени посявки следва да се използват при изпитванията за токсичност и биологично разграждане.
За да се оцени токсичността на химичното вещество, изпитвано в изпитванията за лесна биоразградимост, изглеждат подходящи един или комбинация от следните методи: за инхибиране скоростта на дишане на активната утайка (изпитване за инхибиране респирацията на активната утайка), за BOD и/или за инхибиране на растежа.
Ако следва да се избегне инхибиране, дължащо се на токсичност, се препоръчва концентрациите на изпитваното вещество при изпитването за лесна биоразградимост да са по-ниски от 1/10 от стойностите на ЕС50 (или по-ниски от стойностите на ЕС20) получени при изпитването на токсичността. Съединения със стойности на ЕС50, по-високи от 300 mg/l, не е вероятно да имат токсични ефекти при изпитването за лесна биоразградимост.
Стойности на ЕС50, по-ниски от 20 mg/l, биха поставили сериозни проблеми при последващото изпитване. Следва да се използват ниски концентрации, които се нуждаят от използване на строгия и чувствителен метод на изолираните проби или на материал, белязан с 14С. Друга възможност е, че един аклиматизиран инокулант би позволил да се използват по-високи концентрации при изпитването. В последния случай обаче се загубва критерият за лесна биоразградимост.
ПРЕПРАТКИ
Reynolds, L. et al., Evaluation of the toxicity of substances to be assessed for biodegradability. Chemosphere, 1987, vol. 16, 2259
Приложение V
КОРЕКЦИЯ НА ПОТРЕБЛЕНИЕТО НА КИСЛОРОД ПРИ ПОВЛИЯВАНЕ ЧРЕЗ НИТРИФИКАЦИЯ
Грешките, дължащи се на факта, че не е взета предвид нитрификацията при оценката на потреблението на кислород при изпитването за биоразградимост на несъдържащи азот вещества, са незначителни (не по-големи от 5 %), даже ако окисляването на амониевия азот в средата е непостоянно както в опитните съдове, така и в съдовете с контролния инокулант. При азот-съдържащи изпитвани вещества обаче могат да възникнат сериозни грешки.
Ако е налице нитрификация, но тя не е завършена, наблюдаваното потребление на кислород в реакционната среда може да се коригира с количеството кислород, използвано за окисляване на амоняка до нитрит или нитрат. Това има място, ако промените в концентрацията на нитрити и нитрати по време на инкубацията са определени, като се отчитат следните уравнения:
|
2 NH4Cl + 3O2 = 2 HNO2 + 2 HCl + 2H2O
|
(1)
|
|
2HNO2 +O2 = 2HNO3
|
(2)
|
|
Или обобщено:
|
|
|
2 NH4Cl + 4O2 = 2 HNO3 + 2 HCl + 2 H2O
|
(3)
|
От уравнение (1) потреблението на кислород от 28 g азот, съдържащ се в амониевия хлорид (NH4Cl), който се окислява до нитрит, е 96 g, т.е. фактор 3,43 (96/28). По същият начин от уравнение (3) потреблението на кислород от 28 g азот, окислен до нитрат, е 128 g, т.е. коефициент 4,57 (128/28).
Тъй като реакциите са последователни, извършвани от отделни и различни бактериални видове, е възможно концентрацията на нитрита да се увеличава или намалява, като в последния случай може да се получи еквивалентна концентрация на нитрат. Така кислородът, консумиран за образуване на нитрат, е 4,57, умножено по увеличението на концентрацията на нитрата, докато кислородът, консумиран за образуването на нитрит, е 3,43, умножено по увеличението на концентрацията на нитрита, или с намаляването на неговата концентрация загубата на кислород е -3,43, умножено с намаляването на концентрацията.
Това означава:
|
О2, консумиран при образуване на нитрат = 4,57 × увеличението на концентрацията на нитрат
|
(4)
|
|
и
|
|
|
О2, консумиран при образуване на нитрит = 3,43 × увеличението на концентрацията на нитрит
|
(5)
|
|
и
|
|
|
О2, изгубен при преобразуването на нитрит = -3,43 × намалението на концентрацията на нитрит
|
(6)
|
|
Така че:
|
|
|
Потреблението на О2, дължащо се на нитрификация = ±3,43 × изменението на концентрацията на нитрит +4,57 × увеличението на концентрацията на нитрат
|
(7)
|
|
И така:
|
|
|
Потреблението на О2, дължащо се на окисление на въглерода = общото наблюдавано потребление – потреблението, дължащо се на нитрификация
|
(8)
|
Алтернативно, когато е определен само общият окислен N, потреблението на кислород, дължащо се на нитрификация, може да се вземе на първо приближение като 4,57 × увеличението на окисления N.
Тогава коригираната стойност на консумацията на кислород, дължаща се на окисление на въглерода, след това се сравнява с ТhOD NH3, както е изчислено в приложение II.
В.5. РАЗГРАЖДАНЕ — БИОХИМИЧНА ПОТРЕБНОСТ ОТ КИСЛОРОД
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Целта на метода е измерване на биохимичната потребност от кислород (BOD) на твърди или течни органични вещества.
Данните, получени при това изпитване, се отнасят за разтворими във вода съединения. Летливи съединения и такива с ниска разтворимост във вода могат също да се изпитват, най-малко по принцип.
Методът е приложим за изпитване на онези органични материали, които не са инхибиращи за бактерии при концентрациите, използвани при изпитването. Ако изпитваният материал не е разтворим при изпитваните концентрации, се прилагат специални мерки, като използване на ултразвук, за да се получи добро диспергиране на изпитвания материал.
При избора на подходящи концентрации на изпитване и при интерпретирането на ниски резултати може да бъде полезна информацията за токсичността на химичното вещество.
1.2. ОПРЕДЕЛЕНИЯ И МЕРНИ ЕДИНИЦИ
BOD ce определя като масата на разтворения кислород, необходима за определен обем от разтвора на веществото, за да извърши биохимично окисление при зададени условия.
Резултатите се изразяват като грамове BOD на грам от изпитваното вещество.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Желателно е използването на вещество за сравнение, за да се провери активността на културата.
1.4. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
В предварително определено количество от веществото, разтворено или диспергирано в добре аерирана подходяща среда, се поставя култура от микроорганизми и се инкубира при определена постоянна околна температура на тъмно.
BOD се определя от разликата в съдържанието на разтворен кислород в началото и в края на изпитването. Продължителността на изпитването следва да бъде най-малко пет дни и не повече от 28 дни.
Определя се и една празна проба, пусната успоредно, но несъдържаща изпитваното вещество.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Определянето на BOD не може да се счита като валидно за определяне на биоразградимостта на дадено вещество. Това изпитване може да се разглежда само като изпитване за скрининг.
1.6. ОПИСАНИЕ НА МЕТОДА
Приготвят се предварителни разтвори или дисперсии на веществото, за да се получи концентрация на БПК, подходяща за използвания метод. BOD тогава се определя, като се следва подходящ национален или международен стандартизиран метод.
2. ДАННИ И ИЗЧИСЛЕНИЯ
БПК, съдържаща се в предварителния разтвор, се изчислява по избран стандартизиран метод и се превръща в грамове BOD на грам от изпитваното вещество.
3. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Следва да се цитира използваният метод.
Биохимичната потребност от кислород следва да е средна стойност от най-малко три валидни измервания.
Цялата информация и забележките с отношение към интерпретирането на резултатите следва да се отразят в протокола, по-специално от гледище на примесите, физическото състояние, токсичните ефекти и присъщия състав на веществото, които биха повлияли на резултатите.
Използването на добавки за инхибиране на биологичната нитрификация следва да се отрази в протокола.
4. ПРЕПРАТКИ
Списък на стандартизираните методи, например:
|
|
NF T 90 -103: Determination of the biochemical oxygen demand.
|
|
|
NBN 407: Biochemical oxygen demand.
|
|
|
NEN 32355.4: Bepaling van het biochemish zuurstofverbruik (BZV).
|
|
|
The determination of biochemical oxygen demand, Methods for the examination of water and associated materials, HMSO, London.
|
|
|
ISO 5815: Determination of biochemical oxygen demand after n days.
|
В.6. РАЗГРАЖДАНЕ — ХИМИЧНА ПОТРЕБНОСТ ОТ КИСЛОРОД
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Целта на метода е измерване на химичната потребност от кислород (COD) на твърди или течни органични вещества по произволно избран стандартен начин при фиксирани лабораторни условия.
Информация за формулата на веществото ще бъде полезна при провеждането на настоящото изпитване и при интерпретиране на получения резултат (например соли на халогени, железни соли на органични съединения, хлорсъдържащи органични съединения).
1.2. ОПРЕДЕЛЕНИЯ И МЕРНИ ЕДИНИЦИ
Химичната потребност от кислород е мярка за окисляемостта на веществото, изразена като еквивалентното количество кислород на един оксидиращ агент, усвоено от веществото при фиксирани лабораторни условия.
Резултатът се изразява като грамове COD на грам от изпитваното вещество.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Не винаги, когато се изпитва ново вещество, има нужда от използване на вещества за сравнение. Те следва да служат най-вече за калибриране на метода от време на време и да позволят сравнение на резултатите, когато е приложен друг метод.
1.4. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Предварително определено количество от веществото, разтворено или диспергирано във вода, се окислява на обратен хладник с калиев дихромат в силна сернокисела среда със сребърен сулфат като катализатор в продължение на два часа. Остатъчният дихромат се определя чрез титруване със стандартизиран фероамониев сулфат.
В случай на хлорсъдържащи вещества се прибавя живачен сулфат (10), за да се намали пречещото влияние на хлора.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Поради произволния начин на определяне COD е „индикатор за окисляемост“ и като такъв се използва като практически метод за измерване на органична материя.
Хлоридите могат да пречат на това изпитване. Неорганични редуциращи или оксидиращи агенти също могат да пречат на определянето на COD.
Някои циклични съединения и много летливи вещества (напр. нискомолекулни мастни киселини) не се окисляват напълно при това изпитване.
1.6. ОПИСАНИЕ НА МЕТОДА
Предварителният разтвор или дисперсия на веществото се приготвя така, че да се получи ХПК между 250 и 600 mg/l.
Забележки:
В случай на трудноразтворими или недиспергиращи се вещества се претегля фина пудра от веществото или течно вещество в количество, отговарящо на 5 mg COD и се поставя в експерименталната апаратура с вода.
Химичната потребност от кислород (COD) често и специално в случай на трудно разтворими вещества се определя успешно в един вариант на метода, т.е. в затворена система с изравнител на налягането (Н. Kelkenberg, 1975). При тази модификация съединения, които трудно се определят по конвенционалния метод, например оцетна киселина, могат често да бъдат успешно определени количествено. Методът, обаче не работи в случай на пиридин. Ако концентрацията на калиев дихромат, както е предписано в позоваване 1 се повиши до 0,25 N (0,0416 mol/l), директното претегляне на 5—10 mg от веществото се улеснява, което е много важно за определянето на COD на вещества, трудно разтворими във вода (позоваване 2).
От друга страна COD се определя, като се следва който и да е подходящ национален или международен стандартизиран метод.
2. ДАННИ И ОТЧИТАНЕ
COD, съдържаща се в експерименталната колба, се изчислява като се следва избран стандартизиран метод и се превръща в грамове COD на грам от изпитваното вещество.
3. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
В протокола се отразява използвания метод за сравнение.
Химичната потребност от кислород трябва да е средна стойност от най-малко три измервания. Цялата информация и забележки, отнасящи се до интерпретирането на резултатите, трябва да се запишат в протокола, особено отнасящите се до примесите, физично състояние, токсични ефекти и присъщи свойства на веществото (ако са известни), които биха повлияли на резултатите.
Трябва да се отрази и използването на живачен сулфат, за да се намали пречещото влияние на хлоридите.
4. ПРЕПРАТКИ
|
(1)
|
Kelkenberg, H., Z. von Wasser und Abwasserforschung, 1975, vol. 8, 146.
|
|
(2)
|
Gerike, P. The biodegradability testing of poorly water soluble compounds. Chemosphere, 1984, vol. 13,169.
Списък на стандартизирани методи, например:
|
|
NBN T 91-201 Determination of the chemical oxygen demand.
|
|
|
ISBN O 11 7512494 Chemical oxygen demand (dichromate value) of polluted and waste waters.
|
|
|
NF T 90-101 Determination of the chemical oxygen demand.
|
|
|
DS 217 = water analysis Determination of the chemical oxygen demand.
|
|
|
DIN 38409-H-41 Determination of the chemical oxygen demand (COD) within the range above 15 mg per litre.
|
|
|
NEN 3235 5.3 Bepaling van het chemisch zuurstofverbruik.
|
|
|
ISO 6060 Water quality: chemical oxygen demand dichromate methods.
|
|
В.7. РАЗГРАЖДАНЕ — АБИОТИЧНО РАЗГРАЖДАНЕ: ХИДРОЛИЗА КАТО ФУНКЦИЯ ОТ РН
1. МЕТОД
Настоящият метод на изпитване е еквивалентен на метода TG 111 (2004) на ОИСР.
1.1. ВЪВЕДЕНИЕ
Химичните вещества могат да проникнат в повърхностните води по такива начини като директното прилагане, отнасяне на спрей при пръскане, повърхностен отток, дренажни води, депониране на отпадъци, промишлени, битови или селскостопански отпадъчни води и отлагания от атмосферата и могат да се преобразуват в тези води от химични (напр. хидролиза, окисление), фотохимични и/или микробиологични процеси. Тези насоки описват лабораторен изпитателен метод за оценка на абиотично хидролитично преобразуване на химичните вещества във водни системи при стойности на рН, които се срещат обикновено в околната среда (рН 4—9) и е на основата на съществуващи ръководства (1)(2)(3)(4)(5)(6)(7).
Опитите са проведени, за да се определи i) степента на хидролиза на изпитваното вещество като функция на рН и ii) същността или природата и степента на образуване и разпадане на продукти на хидролиза, на които могат да бъдат изложени организмите. Такива проучвания може да се изискват за химични вещества, които се прилагат директно към водата или за които има вероятност да стигнат до околната среда по другите пътища, описани по-горе.
1.2 ОПРЕДЕЛЕНИЯ И ЕДИНИЦИ
Вж. приложение 2.
1.3 ПРИЛОЖИМОСТ НА МЕТОДА
Изпитването е общоприложимо за химични вещества (маркирани или немаркирани), за които съществува достатъчно точен и чувствителен аналитичен метод. Приложим е за слабо летливи и нелетливи съединения, достатъчно разтворими във вода. Изпитването не трябва да се прилага при химични вещества, които са силно летливи във вода (напр. фумиганти, органични разтворители) и по тази причина не могат да бъдат запазени в разтвор съгласно условията на изпитване за настоящото изпитване. Провеждането на изпитването с вещества, които са много слабо разтворими във вода е възможно да бъде трудно (8).
1.4. ПРИНЦИП НА МЕТОДА НА ИЗПИТВАНЕ
Стерилни водни буферни разтвори с различни рН стойности (рН 4, 7 и 9) се обработват с веществото на изпитване и се инкубират на тъмно при контролирани лабораторни условия (при постоянна температура). След подходящи интервали време буферните разтвори се изследват за изпитваното вещество и за продукти на хидролиза. С маркирано вещество на изпитване (напр. с 14С) масовият баланс може да се извърши по-лесно.
Настоящият метод на изпитване е замислен като стъпален подход, който е показан и обяснен в приложение 1. Всяка стъпало резултати е предизвикано от резултатите от предходното стъпало.
1.5. ИНФОРМАЦИЯ ЗА ИЗПИТВАНОТО ВЕЩЕСТВО
За измерване на степента на хидролиза може да бъде използвано немаркирано или маркирано вещество на изпитване. Като цяло за изучаване на пътя, по който протича хидролизата и за извършване на масовия баланс се предпочита маркиран материал; все пак в специални случаи маркирането може да не е абсолютно необходимо. Маркирането с 14С е препоръчително, но използването на други изотопи като 13С, 15N, 3H също може да бъде полезно. Доколкото е възможно, маркирането трябва да стане в най-стабилната(ите) част(и) на молекулата. Например, ако веществото на изпитване съдържа един пръстен, необходимо е да се маркира този пръстен; ако веществото на изпитване съдържа два или повече пръстена, може да се наложат отделни изследвания, за да се определи участта на всички маркирани пръстени и да се получи подходяща информация за формирането на хидролизни продукти. Чистотата на изпитваното вещество трябва да е най-малко 95 %.
Преди извършване на изпитването на хидролиза, трябва да е налична следната информация за изпитваното вещество:
|
а)
|
разтворимост във вода [Метод на изпитване А.6];
|
|
б)
|
разтворимост в органични разтворители;
|
|
в)
|
налягане на парите [Метод на изпитване А.4] и/или константа от закона на Хенри;
|
|
г)
|
коефициент на разпределение n-октанол/вода [Метод на изпитване А.8];
|
|
д)
|
константа на дисоциация (рKа) [Ръководство на ОИСР 112] (9);
|
|
е)
|
там където е необходимо, степен на пряка и непряка фототрансформация във вода.
|
Трябва да са налични аналитични методи за количествено определяне на изпитваното вещество и, ако е необходимо за откриване и количествено определяне на хидролизни продукти във водни разтвори (вж. също точка 1.7.2).
1.6. ВЕЩЕСТВА ЕТАЛОНИ
Там където е възможно, трябва да се използват еталонни вещества за откриване и количествено определяне на хидролизни продукти чрез спектроскопски и хроматографски методи или други методи с подходяща чувствителност.
1.7. КРИТЕРИИ ЗА КАЧЕСТВО
1.7.1. Аналитичен добив
Анализ на поне два буферни разтвора или на екстрактите им веднага след добавянето на изпитваното вещество дава първите показания за повторяемостта на аналитичния метод и за еднородността на процедурата на прилагане за изпитваното вещество. Аналитичните добиви на химичните вещества на по-късни етапи от експериментите се получават от съответните масови баланси (когато е използван маркиран материал). Аналитичните добиви трябва да са в границите 90 %—110 % за маркирани и немаркирани химични вещества (7). В случай, че е технически трудно да се постигне този порядък, за немаркирани материали може да се приеме аналитичен добив от 70 %, но трябва да се придружи с обяснение.
1.7.2. Повторяемост и чувствителност на аналитичния метод
Повторяемостта на аналитичния(ите) метод(и), използван(и) за количествено определяне на изпитваното вещество и хидролизни продукти по-късно може да бъде проверена чрез повторен анализ на същите буферни разтвори (или на техните екстракти), след като са се формирали достатъчни количества хидролизни продукти за количествено определяне.
Аналитичният метод трябва да е достатъчно чувствителен, за да бъдат определени количествено концентрациите на изпитваното вещество до 10 % или по-малко от първоначалната концентрация. Ако е необходимо, аналитичните методи също трябва да са достатъчно чувствителни за количествено определяне на хидролизни продукти, които представляват 10 % или повече от приложеното вещество (по всяко време на изследването) и до 25 % или по-малко от максимално достигнатата концентрация
1.7.3. Интервали на доверие на кинетичните данни на хидролизата
Интервалите на доверие следва да бъдат изчислени и представени за всички коефициенти на регресия, скоростни константи, времена на полуразпад и други кинетични параметри (напр. DT50).
1.8. ОПИСАНИЕ НА МЕТОДА НА ИЗПИТВАНЕ
1.8.1. Оборудване и прибори
Изследването следва да се проведе в стъклени съдове (напр. епруветки, малки колби), ако е необходимо на тъмно и при условия на стерилност, освен ако предварителна информация (като коефициентът на разпределение n-октанол-вода) не показва, че изпитваното вещество може да се полепи по стъклото. В такива случаи могат да се използват алтернативни материали (като тефлон). Може да е възможно и намаляване на проблема от полепването по стъкло, като се използва един от следните методи:
|
—
|
определяне на теглото на изпитваното вещество и на хидролизните продукти, получени чрез сорбция в съда на провеждане на изпитването;
|
|
—
|
използване на ултразвукова вана;
|
|
—
|
измиване с разтворител на цялата стъклария при всеки интервал на взимане на проби;
|
|
—
|
използване на формулирани продукти;
|
|
—
|
използване на увеличено количество съразтворител при добавянето на изпитвано вещество в системата, ако се използва съразтворител, той трябва да е такъв, който не хидролизира изпитваното вещество.
|
За процеса на инкубиране на различни разтвори на изпитване обикновено са необходими шейкъри с контролирана температура на водната баня или инкубатори с термостат.
Необходимо е стандартно лабораторно оборудване, особено, следното:
|
—
|
аналитични инструменти като GC, HPLC и TLC, включително подходящи системи за откриване за анализиране на радиоактивно маркирани и немаркирани вещества или метод за обратно изотопно разреждане;
|
|
—
|
инструменти за целите на определяне (напр. MS, GC-MS, HPLC-MS, NMR и др.);
|
|
—
|
течен сцинтилационен брояч;
|
|
—
|
разделителни фунии за екстракция течност—течност;
|
|
—
|
апарати за концентриране на разтвори и екстракти (напр. ротационен изпарител);
|
|
—
|
уред за контролиране на температурата (напр. водна баня).
|
Химичните реагенти включват например:
|
—
|
органични разтоворители, аналитично чисти, напр. хексан, дихлорметан и др.;
|
|
—
|
сцинтилационна течност;
|
|
—
|
буферни разтвори (за подробности вж. точка 1.8.3).
|
Цялата стъклария и отговарящите на стандартите за реагенти вода и буферни разтвори, които ще се използват в хидролизните опити, трябва да бъдат стерилизирани.
1.8.2. Прилагане на изпитваното вещество
Изпитваното вещество се прилага като воден разтвор към различни буферни разтвори (вж. приложение 3). Ако е необходимо, за подходящо разтваряне е разрешено използването на малки количества на добре разтворими във вода разтворители (като ацетонитрил, ацетон, етилов алкохол) за прилагане или разпределение на изпитваното вещество, но това обикновено не трябва да надхвърля 1 % v/v. В случай на предвидена по-висока концентрация на разтворителите (напр. в случая на слабо разтворими вещества на изпитване), това може да се разреши единствено когато е възможно да се покаже, че разтворителят не оказва ефект върху хидролизата на изпитваните вещества.
Използването на приготвени по формула продукти не е препоръчвано рутинно, тъй като не може да се изключи, че съставките, участващи във формулата на приготвяне, могат да повлияят процеса на хидролиза. Все пак, използването на материал, приготвен по формула може да е подходяща алтернатива за лошо разтворими във вода вещества или за вещества, които полепват по стъкло (виж точка 1.8.1).
Трябва да се използва концентрация на изпитваното вещество, която не превишава 0,01 М или половината от концентрацията на насищане (вж. приложение 1).
1.8.3. Буферни разтвори
Изпитването на хидролиза следва да се провежда при стойности на рН от 4, 7 и 9. За целта буферният разтвор следва да се приготви, като се използват химически вещества и вода, отговарящи на стандартите реагенти. Някои полезни буферни системи са представени в приложение 3. Следва да се отбележи, че използваната буферна система може да повлияе на степента на хидролиза и където това се наблюдава, трябва да се използва друга буферна система (11).
рН на всеки буферен разтвор следва да се провери с калибриран рН-метър с точност до 0,1 при изискваната температура.
1.8.4. Условия на изпитване
1.8.4.1. Температура на изпитване
Опитите за хидролиза следва да се провеждат при постоянна температура. За целите на екстраполиране е важно температурата да съответства най-малко до ±0,5oС.
Ако хидролитичното поведение на изпитваното веществото е неизвестно, следва да се проведе предварително изпитване (стъпало 1) при температура 50 oС. Кинетични изпитвания на по-високо стъпало следва да се провеждат при минимален брой от три температури (включително изпитването при 50 oС), освен ако изпитваното вещество е стабилно на хидролиза, определено при изпитването на стъпало 1. Предложения температурен диапазон е 10—70 oС (като за предпочитане е да се използва поне една температура под 25 oС), което ще обхване температурата от 25 oС, използвана в доклада от изпитването, и повечето температури, срещани на терена.
1.8.4.2. Светлина и кислород
Всички хидролизни изпитвания следва да се проведат, като се използва подходящ метод, за да се избегне фотолиза. Следва да се вземат всички подходящи мерки, за да се избегне кислорода (напр. барботиране на хелий, азот или аргон в продължение на 5 минути преди приготвянето на разтвора).
1.8.4.3. Продължение на изпитването
Предварителното изпитване следва да се проведе в продължение на 5 дни, а изпитванията на по-високо стъпало следва да се продължават, докато изпитваното вещество се хидролизира до 90 % или в продължение на 30 дни, в зависимост от това кое събитие ще настъпи първо.
1.8.5. Провеждане на изпитването
1.8.5.1. Предварително изпитване (стъпало 1)
Предварителното изпитване се провежда при 50 ±0,5oС и рН 4,0, 7,0 и 9,0. Ако след 5 дни се наблюдава хидролиза, по-малка от 10 процента (t0,5 25oС > 1 година), изпитваното вещество се счита хидролитично стабилно и обикновено не се изискват допълнителни изпитвания. Ако за веществото се знае, че е нестабилно при температури, срещани в околната среда (12)
3, тогава не се изисква предварително изпитване. Аналитичният метод трябва да е достатъчно точен и чувствителен, за да може да открие намаление от 10 процента на първоначалната концентрация.
1.8.5.2. Хидролиза на нестабилни вещества (стъпало 2)
Изпитване на по-високо стъпало (напреднало) следва да се проведе при стойностите на рН, при които изпитваното вещество се е показало нестабилно, както е определено от предварителното изпитване по-горе. Температурата на буферните разтвори на изпитваното вещество следва да се поддържа термостатно на избраните стойности. За да се провери дали реакцията е от първи порядък, всеки разтвор следва да се анализира през интервали време, които образуват минимум шест раздалечени точки, обикновено между 10 % и 90 % хидролизиране на изпитваното вещество. Следва да се вземат проби за повторно изпитване (минимум две еднакви проби, държани в отделни съдове на реакция) и съдържанието им да се анализира при всеки от поне шестте интервала за взимане на проби (за получаване на поне дванадесет точки с данни от повторно изпитване). Използването на еднообемна проба, от която да се взимат отделните аликвотни части от изпитваното вещество при всеки интервал на изпитване, се счита за неподходящо, тъй като не позволява анализ на варирането на данните и може да доведе до проблеми от замърсяване на изпитваното вещество. Изпитване за потвърждаване на стерилността следва да се проведат на края на изпитването от по-високо стъпало (т.е. при 90 % хидролиза или 30 дни). Все пак, ако не наблюдава разпадане (т.е. трансформиране), изпитването за стерилност не се счита за необходимо.
1.8.5.3. Определяне на продуктите от хидролизата (стъпало 3)
Всеки основен продукт от хидролиза, поне тези представляващи > 10 % от приложената доза, следва да бъде определен с подходящи аналитични методи.
1.8.5.4. Изпитвания по избор
Може да са необходими допълнителни изпитвания при стойности на рН, различни от 4, 7 и 9 за хидролитично неустойчиви изпитвани вещества. Например за физиологични цели може да е необходимо изпитване при условия с по-висока киселинност (напр. рН 1,2), като се използва една физиологично подходяща температура (37 oС).
2. ДАННИ
Ако е възможно, количествата на изпитваното вещество и на продуктите от хидролизата, следва да се представят като процент от приложената първоначална концентрация и когато е подходящо, като mg/L за всеки интервал на взимане на проби и за всяко рН и температура на изпитване. В допълнение, масовият баланс следва да се представи в проценти от първоначално приложената концентрация, когато е използвано маркирано вещество на изпитване.
Следва да се покаже графично представяне на превърнатите в логаритмична форма данни за концентрациите на изпитваното вещество по посока на времето. Всички основни хидролизни продукти или поне тези представляващи ≥ 10 % от приложената доза следва да се определят и техните логаритмични концентрации да се нанесат графично по същия начин както на главното вещество, с цел да се покаже тяхната степен на формиране и намаляване.
2.1. ОБРАБОТКА НА РЕЗУЛТАТИТЕ
По-точно определяне на времената на полуразпад или стойностите на DT50 следва да се получи чрез изчисляване подходящия кинетичен модел. Времето на полуразпад и/или стойностите на DT50 (включително интервала на доверие) следва да се докладват за всяко рН и температура, заедно с описание на използвания модел, порядъка на кинетиката и коефициента на определяне (r2). Ако е подходящо, изчисленията следва да се приложат и към хидролизните продукти.
В случая на изследвания за скорост на реакцията, проведени при различни температури, константите за скорост на хидролизата от псевдо първи порядък (kobs), следва да бъдат описани като функция от температурата. Изчисляването следва да е въз основа както на разделянето на kobs на скоростни константи за киселинно катализирани, неутрални и основно катализирани процеси на хидролиза (kН, кнеутрален, и kOН), така и на уравнението на Арениус:

където Ai и Bi са константите на регресия в мястото на пресичане на координатната ос и на наклона съответно на най-добре съответстващите линии, образувани от линейно намаляващия ln ki за реципрочната стойност на абсолютната температура по Келвин (Т). Чрез използването на уравненията на Арениус за киселинно, неутрални и основно катализирани процеси на хидролиза скоростните константи на реакции от псевдо първи порядък, и по този начин времената на полуразпад, могат да се изчислят за други температури, за които прякото опитно определяне на скоростна константа не е практически осъществимо (10).
2.2 ОЦЕНКА И ТЪЛКУВАНЕ НА РЕЗУЛТАТИТЕ
Повечето реакции на хидролиза следват видимо скорости на реакции от първи порядък, поради което времената на полуразпад са независими от концентрацията (вж. уравнение 4 в приложение 2). Това обикновено позволява прилагането на лабораторни резултати, получени в рамките на 10-2 до 10-3 М, към природни условия (≤ 10-6 М) (10). Няколко примера за добро съвпадение на скорости на хидролиза, измерени в чиста вода и в природни води за различни химични вещества, са докладвани от Мабей и Мил (11), при условие правилно са измерени рН и температурата.
3. ДОКЛАДВАНЕ
3.1 ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Протоколът от изпитването трябва да включва най-малко следната информация:
Изпитвано вещество:
|
—
|
тривиално наименование, химично наименование, номер по CAS, структурна формула (включително място на маркера, когато се използва радиоактивно маркиран материал) и съответните физико-химични свойства (вж. точка 1.5);
|
|
—
|
чистота (примеси) на изпитваното вещество;
|
|
—
|
чистота на маркера на маркираното химично вещество и моларна активност (където е необходимо).
|
|
—
|
дати и подробности на приготвяне;
|
|
—
|
използвани буфери и води;
|
|
—
|
моларност и рН на буферните разтвори.
|
Условия на изпитване:
|
—
|
дати на провеждане на изследванията;
|
|
—
|
количество приложено изпитвано вещество;
|
|
—
|
метод и разтворители (тип и количество), използвани за прилагането на изпитваното вещество;
|
|
—
|
обем на разтворите на изпитваното вещество с буфер, подложени на инкубиране;
|
|
—
|
описание на използваната система за инкубиране;
|
|
—
|
рН и температура по време на изследването;
|
|
—
|
времена на взимане на проби;
|
|
—
|
метод(и) на екстракция;
|
|
—
|
методи на количествено определяне и идентифициране на изпитваното вещество и хидролизните му продукти в буферните разтвори;
|
|
—
|
брой повторни изследвания.
|
Резултати:
|
—
|
повторяемост и чувствителност на използваните аналитични методи;
|
|
—
|
аналитични добиви (процентните стойности за валидно проучване са посочени в точка 1.7.1);
|
|
—
|
данни от повторните изпитвания и средни стойности, показани във вид на таблица;
|
|
—
|
масов баланс по време и в края на изследванията (когато са използвани маркирани вещества на изпитване);
|
|
—
|
резултати от предварителното изпитване;
|
|
—
|
обсъждане и тълкуване на резултатите;
|
|
—
|
всички изходни данни и цифри.
|
Следната информация е необходима само ако се определя скоростта на хидролиза:
|
—
|
графично отбелязване на концентрациите по отношение на времето за веществата на изпитване и, където е необходимо, за хидролизните продукти при всяка стойност на рН и температурата;
|
|
—
|
таблици с резултати от уравнението на Арениус за температура 20 oС/25 oС с рН, скоростна константа [час-1 или ден-1], време на полуразпад или DT50, температура [oС], включително интервала на доверие и коефициетните на корелация (r2) или подобна информация;
|
|
—
|
предложен път на хидролиза.
|
4. ПРЕПРАТКИ
|
1.
|
ОИСР (1981 г.). Хидролиза като функция от Ph. Насоки на ОИСР за изпитването на химически вещества № 111, приети на 12 май 1981 г.
|
|
2.
|
US-Environmental Protection Agency (1982). 40 CFR 796.3500, Hydrolysis as a Function of pH at 25 oC. Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate.
|
|
3.
|
Agriculture Canada (1987). Environmental Chemistry and Fate Guidelines for registration of pesticides in Canada.
|
|
4.
|
Европейски Съюз (EC) (1995 г.). Директива 95/36/ЕО на Комисията за изменение на Директива 91/414/ЕИО на Съвета относно пускането на пазара на продукти за растителна защита. Приложение V: Съдба и поведение в околната среда.
|
|
5.
|
Нидерландска комисия за регистрация на пестициди (1991 г.). Кандидатстване за регистриране на пестицид. Раздел G: Поведение на продукта и метаболитите му в почва, вода и въздух.
|
|
6.
|
BBA (1980). Merkblatt Nr. 55, Teil I und II: Prüfung des Verhaltens von Pflanzenbehandlungsmitteln im Wasser (октомври 1980 г.).
|
|
7.
|
SETAC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed.
|
|
8.
|
ОИСР (2000 г.). Guidance document on aquatic toxicity testing of difficult substances and mixtures, OECD Environmental Health and Safety Publications Series on Testing and Assessment Nr. 23.
|
|
9.
|
ОИСР (1993 г.). Насоки за изпитването на химични вещества, Париж, ОИСР (1994—2000 г.): Допълнение 6-11 към Насоки за изпитването на химични вещества.
|
|
10.
|
Nelson, H, Laskowski D, Thermes S, and Hendley P. (1997) Recommended changes in pesticide fate study guidelines for improving input to computer models. (Text version of oral presentation at the 14th Annual Meeting of the Society of Environmental Toxicology and Chemistry, Dallas TX, November 1993).
|
|
11.
|
Mabey, W. and Mill, T. (1978). Critical review of hydrolysis of organic compounds in water under environmental conditions. J. Phys. Chem. Ref. Data 7, 383-415.
|
Приложение 1
Схема на изпитване за стъпална хидролиза

Приложение 2
Дефиниции и единици
Следва да се използват единиците от Международната система единици (SI).
Изпитвано вещество: всяко вещество, независимо дали е основното вещество или съответните продукти на преобразуване.
Продукти на трансформация: всички вещества, получени в резултат на биотична или абиотична реакции на преобразуване на изпитваното вещество.
Хидролизни продукти: всички вещества, получени в резултат на хидролитично преобразуване на изпитваното вещество.
Хидролиза се отнася за реакция на вещество на изпитване RX с вода при чиста замяна на групата X с ОН, съгласно реакцията:
Скоростта с която концентрацията на RX намалява в този опростен процес се дава чрез:
|
скорост = k [H2O] [RX]
|
реакция от втори порядък
|
|
или
|
|
скорост = k [RX]
|
реакция от първи порядък
|
в зависимост от стъпката за определяне на скоростта. Поради присъствието на вода в много по-големи количества, отколкото изпитваното вещество, този тип реакция обикновено се описва като реакция от псевдо първи порядък, в която наблюдаваната скоростна константа е дадена със следната формула:
и може да бъде определена от израза (13)
|

ln

|
[3]
|
където
t= време
и Со, Ct= концентрации на RX във време 0 и t.
Единиците на тази константа имат дименсия от (време)-1 и времето на полуразпад на реакцията (времето за което 50 % от RX ще реагира) се дава с:
|

|
[4]
|
Време на полуразпад: (t0,5) е времето, за което 50 % от изпитваното вещество е претърпяло хидролиза, когато реакцията може да се опише като кинетика от първи порядък; то е независимо от концентрацията.
DT
50
(Време на изчезване 50): е времето, за което концентрацията на изпитваното вещество е намаляла с 50 %; то е различно от времето на полуразпад t0,5, когато реакцията не протича при кинетика от първи порядък.
Оценка на k при различна температура
Когато скоростните константи са известни за две температури, скоростните константи при други температури могат да се изчислят, като се използва уравнението на Арениус:
 или
или 
Нанасянето на In k спрямо на 1/Т образува права линия с наклон -E/R
където:
|
k
|
=
|
скоростна константа, измерена при различни температури
|
|
Е
|
=
|
енергия на активация [kJ/mol]
|
|
Т
|
=
|
абсолютна температура [К]
|
|
R
|
=
|
газова константа [8,314 J/mol.K]
|
Енергията на активация е изчислена чрез регресивен анализ или чрез следното уравнение:

където: T2 > T1
Приложение 3
Буферни системи
A. CLARK и LUBS:
Буферни смеси на CLARK и LUBS
(14)
|
Състав
|
pH
|
|
0,2 N HCl и 0,2 N KCl при 20 oC
|
|
47,5 ml HCl + 25 ml KCl разреден до 100 ml
|
1,0
|
|
32,25 ml HCl + 25 ml KCl разреден до 100 ml
|
1,2
|
|
20,75 ml HCl + 25 ml KCl разреден до 100 ml
|
1,4
|
|
13,15 ml HCl + 25 ml KCl разреден до 100 ml
|
1,6
|
|
8,3 ml HCl + 25 ml KCl разреден до 100 ml
|
1,8
|
|
5,3 ml HCl + 25 ml KCl разреден до 100 ml
|
2,0
|
|
3,35 ml HCl + 25 ml KCl разреден до 100 ml
|
2,2
|
|
0,1 M калиев бифталат +0,1 N HCl при 20 oC
|
|
46,70 ml 0,1 N HCl + 50 ml бифталат до 100 ml
|
2,2
|
|
39,60 ml 0,1 N HCl + 50 ml бифталат до 100 ml
|
2,4
|
|
32,95 ml 0,1 N HCl + 50 ml бифталат до 100 ml
|
2,6
|
|
26,42 ml 0,1 N HCl + 50 ml бифталат до 100 ml
|
2,8
|
|
20,32 ml 0,1 N HCl + 50 ml бифталат до 100 ml
|
3,0
|
|
14,70 ml 0,1 N HCl + 50 ml бифталат до 100 ml
|
3,2
|
|
9,90 ml 0,1 N HCl + 50 ml бифталат до 100 ml
|
3,4
|
|
5,97 ml 0,1 N HCl + 50 ml бифталат до 100 ml
|
3,6
|
|
2,63 ml 0,1 N HCl + 50 ml бифталат до 100 ml
|
3,8
|
|
0,1 M калиев бифталат +0,1 N NaOH при 20 oC
|
|
0,40 ml 0,1 N NaOH + 50 ml бифталат до 100 ml
|
4,0
|
|
3,70 ml 0,1 N NaOH + 50 ml бифталат до 100 ml
|
4,2
|
|
7,50 ml 0,1 N NaOH + 50 ml бифталат до 100 ml
|
4,4
|
|
12,15 ml 0,1 N NaOH + 50 ml бифталат до 100 ml
|
4,6
|
|
17,70 ml 0,1 N NaOH + 50 ml бифталат до 100 ml
|
4,8
|
|
23,85 ml 0,1 N NaOH + 50 ml бифталат до 100 ml
|
5,0
|
|
29,95 ml 0,1 N NaOH + 50 ml бифталат до 100 ml
|
5,2
|
|
35,45 ml 0,1 N NaOH + 50 ml бифталат до 100 ml
|
5,4
|
|
39,85 ml 0,1 N NaOH + 50 ml бифталат до 100 ml
|
5,6
|
|
43,00 ml 0,1 N NaOH + 50 ml бифталат до 100 ml
|
5,8
|
|
45,45 ml 0,1 N NaOH + 50 ml бифталат до 100 ml
|
6,0
|
Буферни смеси на CLARK и LUBS (продължение)
|
0,1 М монокалиев фосфат +0,1 N NaOH при 20 oС
|
|
5,70 ml 0,1 N NaOH + 50 ml фосфат до 100 ml
|
6,0
|
|
8,60 ml 0,1 N NaOH + 50 ml фосфат до 100 ml
|
6,2
|
|
12,60 ml 0,1 N NaOH + 50 ml фосфат до 100 ml
|
6,4
|
|
17,80 ml 0,1 N NaOH + 50 ml фосфат до 100 ml
|
6,6
|
|
23,45 ml 0,1 N NaOH + 50 ml фосфат до 100 ml
|
6,8
|
|
29,63 ml 0,1 N NaOH + 50 ml фосфат до 100 ml
|
7,0
|
|
35,00 ml 0,1 N NaOH + 50 ml фосфат до 100 ml
|
7,2
|
|
39,50 ml 0,1 N NaOH + 50 ml фосфат до 100 ml
|
7,4
|
|
42,80 ml 0,1 N NaOH + 50 ml фосфат до 100 ml
|
7,6
|
|
45,20 ml 0,1 N NaOH + 50 ml фосфат до 100 ml
|
7,8
|
|
46,80 ml 0,1 N NaOH + 50 ml фосфат до 100 ml
|
8,0
|
|
0,1 M H 3B03 в 0,1 M KCl +0,1 N NaOH при 20 oC
|
|
2,61 ml 0,1 N NaOH + 50 ml борна киселина до 100 ml
|
7,8
|
|
3,97 ml 0,1 N NaOH + 50 ml борна киселина до 100 ml
|
8,0
|
|
5,90 ml 0,1 N NaOH + 50 ml борна киселина до 100 ml
|
8,2
|
|
8,50 ml 0,1 N NaOH + 50 ml борна киселина до 100 ml
|
8,4
|
|
12,00 ml 0,1 N NaOH + 50 ml борна киселина до 100 ml
|
8,6
|
|
16,30 ml 0,1 N NaOH + 50 ml борна киселина до 100 ml
|
8,8
|
|
21,30 ml 0,1 N NaOH + 50 ml борна киселина до 100 ml
|
9,0
|
|
26,70 ml 0,1 N NaOH + 50 ml борна киселина до 100 ml
|
9,2
|
|
32,00 ml 0,1 N NaOH + 50 ml борна киселина до 100 ml
|
9,4
|
|
36,85 ml 0,1 N NaOH + 50 ml борна киселина до 100 ml
|
9,6
|
|
40,80 ml 0,1 N NaOH + 50 ml борна киселина до 100 ml
|
9,8
|
|
43,90 ml 0,1 N NaOH + 50 ml борна киселина до 100 ml
|
10,0
|
Б. KOLTHOFF и VLEESCHHOUWER:
Цитратни буфери на KOLTHOFF и VLEESCHHOUWER
|
Състав
|
рН
|
|
0,1 М монокалиев нитрат и 0,1 N НСl при 18
oС (15)
|
|
49,7 ml 0,1 N HCl + 50 ml нитрат до 100 ml
|
2,2
|
|
43,4 ml 0,1 N HCl + 50 ml нитрат до 100 ml
|
2,4
|
|
36,8 ml 0,1 N HCl + 50 ml нитрат до 100 ml
|
2,6
|
|
30,2 ml 0,1 N HCl + 50 ml нитрат до 100 ml
|
2,8
|
|
23,6 ml 0,1 N HCl + 50 ml нитрат до 100 ml
|
3,0
|
|
17,2 ml 0,1 N HCl + 50 ml нитрат до 100 ml
|
3,2
|
|
10,7 ml 0,1 N HCl + 50 ml нитрат до 100 ml
|
3,4
|
|
4,2 ml 0,1 N HCl + 50 ml нитрат до 100 ml
|
3,6
|
|
0,1 M монокалиев цитрат и 0,1 N NaOH при 18 oC
(15)
|
|
2,0 ml 0,1 N NaOH + 50 ml цитрат до 100 ml
|
3,8
|
|
9,0 ml 0,1 N NaOH + 50 ml цитрат до 100 ml
|
4,0
|
|
16,3 ml 0,1 N NaOH + 50 ml цитрат до 100 ml
|
4,2
|
|
23,7 ml 0,1 N NaOH + 50 ml цитрат до 100 ml
|
4,4
|
|
31,5 ml 0,1 N NaOH + 50 ml цитрат до 100 ml
|
4,6
|
|
39,2 ml 0,1 N NaOH + 50 ml цитрат до 100 ml
|
4,8
|
|
46,7 ml 0,1 N NaOH + 50 ml цитрат до 100 ml
|
5,0
|
|
54,2 ml 0,1 N NaOH + 50 ml цитрат до 100 ml
|
5,2
|
|
61,0 ml 0,1 N NaOH + 50 ml цитрат до 100 ml
|
5,4
|
|
68,0 ml 0,1 N NaOH + 50 ml цитрат до 100 ml
|
5,6
|
|
74,4 ml 0,1 N NaOH + 50 ml цитрат до 100 ml
|
5,8
|
|
81,2 ml 0,1 N NaOH + 50 ml цитрат до 100 ml
|
6,0
|
В. SÖRENSEN:
Боратни смеси на SORENSEN
|
Състав
|
Sörensen
18 oC
|
Walbum, pH при
|
|
ml боракс
|
ml HCl/N аОН
|
10 oC
|
40 oC
|
70 oC
|
|
0,05 М боракс +0,1 N HCl
|
|
5,25
|
4,75
|
7,62
|
7,64
|
7,55
|
7,47
|
|
5,50
|
4,50
|
7,94
|
7,98
|
7,86
|
7,76
|
|
5,75
|
4,25
|
8,14
|
8,17
|
8,06
|
7,95
|
|
6,00
|
4,00
|
8,29
|
8,32
|
8,19
|
8,08
|
|
6,50
|
3,50
|
8,51
|
8,54
|
8,40
|
8,28
|
|
7,00
|
3,00
|
8,08
|
8,72
|
8,56
|
8,40
|
|
7,50
|
2,50
|
8,80
|
8,84
|
8,67
|
8,50
|
|
8,00
|
2,00
|
8,91
|
8,96
|
8,77
|
8,59
|
|
8,50
|
1,50
|
9,01
|
9,06
|
8,86
|
8,67
|
|
9,00
|
1,00
|
9,09
|
9,14
|
8,94
|
8,74
|
|
9,50
|
0,50
|
9,17
|
9,22
|
9,01
|
8,80
|
|
10,0
|
0,00
|
9,24
|
9,30
|
9,08
|
8,86
|
|
0,05 М боракс +0,1 N NaOH
|
|
10,0
|
0,0
|
9,24
|
9,30
|
9,08
|
8,86
|
|
9,0
|
1,0
|
9,36
|
9,42
|
9,18
|
8,94
|
|
8,0
|
2,0
|
9,50
|
9,57
|
9,30
|
9,02
|
|
7,0
|
3,0
|
9,68
|
9,76
|
9,44
|
9,12
|
|
6,0
|
4,0
|
9,97
|
10,06
|
9,67
|
9,28
|
Фосфатни смеси на SÖRENSEN
|
Състав
|
рН
|
|
0,0667 М монокалиев фосфат + 0,0667 М двунатриев фосфат при 20 oС
|
|
99,2 ml KH2PO4 + 0,8 ml Na2HPO4
|
5,0
|
|
98,4 ml KH2PO4 + 1,6 ml Na2HPO4
|
5,2
|
|
97,3 ml KH2PO4 + 2,7 ml Na2HPO4
|
5,4
|
|
95,5 ml KH2PO4 + 4,5 ml Na2HPO4
|
5,6
|
|
92,8 ml KH2PO4 + 7,2 ml Na2HPO4
|
5,8
|
|
88,9 ml KH2PO4 + 11,1 ml Na2HPO4
|
6,0
|
|
83,0 ml KH2PO4 + 17,0 ml Na2HPO4
|
6,2
|
|
75,4 ml KH2PO4 + 24,6 ml Na2HPO4
|
6,4
|
|
65,3 ml KH2PO4 + 34,7 ml Na2HPO4
|
6,6
|
|
53,4 ml KH2PO4 + 46,6 ml Na2HPO4
|
6,8
|
|
41,3 ml KH2PO4 + 58,7 ml Na2HPO4
|
7,0
|
|
29,6 ml KH2PO4 + 70,4 ml Na2HPO4
|
7,2
|
|
19,7 ml KH2PO4 + 80,3 ml Na2HPO4
|
7,4
|
|
12,8 ml KH2PO4 + 87,2 ml Na2HPO4
|
7,6
|
|
7,4 ml KH2PO4 + 92,6 ml Na2HPO4
|
7,8
|
|
3,7 ml KH2PO4 + 96,3 ml Na2HPO4
|
8,0
|
В.8. ТОКСИЧНОСТ ЗА ЗЕМНИ ЧЕРВЕИ.
ИЗПИТВАНЕ С ИЗКУСТВЕНА ПОЧВА
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
При това лабораторно изпитване изпитваното вещество се добавя към изкуствена почва, в която за 14 дни се поставят земни червеи. След този период (и, по желание, след 7 дни) се изпитва леталният ефект на веществото върху земните червеи. Изпитването осигурява метод за относително краткотрайно пресяващо изпитване за ефекта на химическите вещества върху земните червеи, чрез постъпване по кожен и стомашно-чревен път.
1.2. ОПРЕДЕЛЕНИЕ И ЕДИНИЦА
LC50: Концентрацията на дадено вещество, за която е преценено, че убива 50 % от експерименталните животни през периода на изпитването.
1.3. ВЕЩЕСТВО ЗА СРАВНЕНИЕ
Периодично се използва вещество за сравнение се използва периодично за да се демонстрира, че чувствителността на експерименталната система не е значително променена.
Като вещество за сравнение се препоръчва хлороацетамид „чист за анализ“.
1.4. ПРИНЦИП НА ИЗПИТВАНЕТО
Почвата е непостоянна среда, така че за това изпитване се използва точно определена изкуствена глинеста почва. Възрастните земни червеи от вида Eisenia foetida (вижте забележката в приложението) се държат в определена изкуствена почва, третирана с различни концентрации на изпитваното вещество. Съдържанието на контейнерите се разстила на табла 14 дни (и, по желание, 7 дни) след началото на изпитването и се преброяват преживелите при всяка концентрация земни червеи.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Изпитването е проектирано така, че да бъде възможно най-добре възпроизводимо по отношение на изпитвания субстрат и организъм. В края на изпитването смъртността при контролите не трябва да превишава 10 %, в противен случай изпитването е невалидно.
1.6. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
1.6.1. Материали
1.6.1.1. Експериментален субстрат
Като основен експериментален субстрат се използва определена изкуствена почва.
|
а)
|
Основен субстрат (процентите са по отношение на сухото тегло)
|
—
|
10 % торфен мъх (с рН възможно най-близо до 5,5—6,0 без видими остатъци от растения и фино смлян),
|
|
—
|
20 % каолин, за предпочитане с повече от 50 % каолинит,
|
|
—
|
около 69 % промишлен кварцов пясък (преобладава финият пясък с над 50 % частици с размер 0,05 до 0,2 mm). Ако веществото не се диспергира достатъчно във вода, трябва да се подържат по 10 g за експериментален контейнер за по-късно смесване с изпитваното вещество.
|
|
—
|
около 1 % калциев карбонат (СаСО3), пулверизиран, химически чист, добавен за постигане на рН 6,0+0,5.
|
|
|
б)
|
Експериментален субстрат
Експерименталният субстрат съдържа основния субстрат, изпитваното вещество и дейонизирана вода.
Водното съдържание е около 25 до 42 % от сухото тегло на основния субстрат. Водното съдържание на субстрата се определя чрез изсушаване на проба до постоянно тегло до около 25 до 42 % от сухото тегло на основния субстрат при 105 oС. Най-важният критерий е, че изкуствената почва трябва да бъде навлажнена до степен, при която няма остатъчна вода. Трябва да се внимава при смесването да се получи равномерно разпределяне на изпитваното вещество и на субстрата. Трябва да се отбележи начинът на въвеждане на изпитваното вещество в субстрата.
|
|
в)
|
Контролен субстрат
Контролният субстрат съдържа основния субстрат и вода. Ако се използва добавка, една допълнителна контрола трябва да съдържа същото количество от добавката.
|
1.6.1.2. Експериментални контейнери
Стъклени контейнери с обем около един литър (адекватно затворени с пластмасови капаци, панички или пластмасов филм с вентилационни отвори), напълнени с определено количество влажен експериментален или контролен субстрат, еквивалентен на 500 g сухо тегло на субстрата.
1.6.2. Условия на изпитване
Контейнерите трябва да се държат в климатични камери при температура 20 ± 2 oС с непрекъснато осветяване. Интензивността на светлината трябва да бъде 400 до 800 лукса.
Изпитването трае 14 дни, но, по желание, смъртността може да бъде отчетена седем дни след началото на изпитването.
1.6.3. Експериментална процедура
Експериментални концентрации
Концентрациите на изпитваното вещество се изразяват като тегло на веществото за единица сухо тегло на основния субстрат (mg/kg).
Изпитване за определяне на диапазон
Диапазонът на концентрациите, които предизвикват смъртност в 0 до 100 % може да бъде определен с помощта на изпитване за определяне на диапазон, което да даде информация за диапазона на концентрациите, които да се използват в дефинитивното изпитване.
Веществото трябва да бъде изпитвано при следните концентрации: 1 000; 100; 10; 1; 0,1 mg вещество/килограм експериментален субстрат (сухо тегло).
Когато трябва да се проведе пълно дефинитивно изпитване, за изпитването за определяне на диапазон може да са достатъчни по една експериментална партида за концентрация и по една за нетретираната контрола, всяка с по 10 червея.
Дефинитивно изпитване
Резултатите от изпитването за определяне на диапазон се използват за избиране на поне пет концентрации в геометрична серия, които покриват диапазона от 0 до 100 % смъртност и които се различават с постоянен фактор, непревишаващ 1,8.
Изпитванията, при които се използват тези серии от концентрации, трябва да дават възможно най-точна оценка на стойността LC50 и нейните граници на доверителност.
При дефинитивното изпитване се използват най-малко по четири експериментални партиди за концентрация и четири нетретирани контроли, всяка с по 10 червея. Резултатите от тези повторения се представят като средна стойност и стандартно отклонение.
Когато две последователни концентрации в съотношение 1,8 дават само 0 % и 100 % смъртност, тези две стойности са достатъчни, за да покажат диапазона, в рамките на който попада LC50.
Смес от основния експериментален субстрат и изпитваното вещество
Винаги когато е възможно, експерименталният субстрат трябва да бъде приготвен без никакви допълнителни средства, освен вода. Непосредствено преди началото на изпитването изпитваното вещество се емулгира или диспергира в дейонизирана вода или друг разтворител и се смесва с основния експериментален субстрат или се разпръсква равномерно върху него с фин хроматографски или друг подобен спрей.
Ако е неразтворимо във вода, изпитваното вещество може да бъде разтворено във възможно най-малък обем подходящ органичен разтворител (например хексан, ацетон или хлороформ).
За разтваряне, диспергиране или емулгиране на изпитваното вещество могат да се използват само средства, които лесно се изпаряват. Преди употреба експерименталният субстрат трябва да бъде вентилиран. Количеството изпарена вода трябва да бъде възстановено. Контролата трябва да съдържа същото количество от всяка добавка.
Ако изпитваното вещество е неразтворимо и не може да се диспергира или емулгира в органични разтворители, 10 g смес от фино смлян кварцов пясък и определено количество изпитвано вещество, което е необходимо за третиране на 500 g сухо тегло от изкуствената почва, се смесват с 490 g сухо тегло от експерименталния субстрат.
За всяка експериментална партида във всеки стъклен контейнер се поставя определено количество влажен експериментален субстрат, еквивалентен на 500 g сухо тегло, заедно с 10 земни червея, които са аклиматизирани за 24 часа с сходен влажен основен субстрат и после са измити бързо, като излишната вода е абсорбирана с филтърна хартия преди използването им, и след това са поставени на повърхността на експерименталния субстрат.
Контейнерите се покриват с перфорирани пластмасови капаци, панички или филм, за да се предотврати изсъхването на субстрата, и се държат при експериментални условия в продължение на 14 дни.
Отчитането трябва да се направи 14 дни (и, по желание, седем дни) след започване на изпитването. Субстратът се разстила върху плочка, направена от стъкло или неръждаема стомана. Земните червеи се изследват и се определя броят на преживелите червеи. Земните червеи се смятат за мъртви, ако не реагират на лек механичен стимул в предния край.
Когато на седмия ден се прави изследване, контейнерът отново се напълва със субстрат и преживелите червеи отново се поставят върху повърхността на същия експериментален субстрат.
1.6.4. Експериментални организми
Експерименталните организми трябва да бъдат възрастни индивиди от вида Eiseniafoetida (виж забележката в допълнението) (на възраст поне два месеца с „поясче“) с влажно тегло 300 до 600 mg. (За метода на отглеждане виж допълнението).
2. ДАННИ
2.1. ТРЕТИРАНЕ И ОЦЕНКА НА РЕЗУЛТАТИТЕ
Концентрациите на изпитваното вещество се отчитат чрез препратка към съответните проценти на умрели земни червеи.
Когато данните са адекватни, стойността LC50 и границите на доверителност (р = 0,05) трябва да се определят с помощта на стандартни методи (Litchfield и Wilcoxon, 1949, за еквивалентен метод). Стойността LC50 трябва да бъде представена като mg изпитвано вещество за килограм от експерименталния субстрат (сухо тегло).
Когато наклонът на кривата на концентрацията е прекалено стръмен, за да позволи изчисляване на LC50, достатъчна е графична оценка на тази стойност.
Когато две последователни концентрации в съотношение 1,8 дават само 0 % и 100 % смъртност, тези две стойности са достатъчни, за да покажат диапазона, в рамките на който попада LC50.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Ако е възможно, протоколът от изпитването съдържа следното:
|
—
|
твърдение, че изпитването е проведено в съответствие с критериите за качество, посочени по-горе,
|
|
—
|
проведеното изпитване (изпитване за определяне на диапазон и/или дефинитивно изпитване),
|
|
—
|
точно описание на експерименталните условия или твърдение, че изпитването е проведено в съответствие с метода, като всички отклонения трябва да бъдат съобщени,
|
|
—
|
точно описание на начина, по който изпитваното вещество е смесено в основния експериментален субстрат,
|
|
—
|
информация за експерименталните организми (вид, възраст, средна стойност и диапазон на теглото, условия на отглеждане и размножаване, доставчик),
|
|
—
|
метод, използван за определяне на LC50,
|
|
—
|
резултати от изпитването, включително всички използвани данни,
|
|
—
|
описание на наблюдаваните симптоми или на измененията в поведението на експерименталните организми,
|
|
—
|
смъртност при контролите,
|
|
—
|
LC50 или най-високата изпитвана концентрация без смъртност и най-ниската изпитвана концентрация със смъртност 100 %, 14 дни (и, по желание, седем дни) след началото на изпитването,
|
|
—
|
построяване на кривата концентрация/отговор,
|
|
—
|
резултати, получени с веществото за сравнение, независимо дали във връзка с настоящото изпитване или от предишни задачи за контрол на качеството.
|
4. ПРЕПРАТКИ
|
1.
|
ОИСР, Париж, 1981, Test Guideline 207, Решение на Съвета C(81) 30 final.
|
|
2.
|
Edwards, C. A. and Lofty, J, R., 1977, Biology of Earthworms, Chapman and Hall, London, 331 pp.
|
|
3.
|
Bouche, M. B., 1972, Lombriciens de France, Ecologie et Systematique, Institut National de la Recherche Agronomique, 671 pp.
|
|
4.
|
Litchfield, J. T. and Wilcoxon, F., A simplified method of evaluation dose effect experiments. J. Pharm. Exp. Therap., vol. 96, 1949, p. 99.
|
|
5.
|
Комисия на Европейските общности, Development of a standardized laboratory method for assessing the toxicity of chemical substances to earthworms, Report EUR 8714 EN, 1983.
|
|
6.
|
Umweltbundesamt/Biologische Bundesanstalt für Land- und Forstwirtschaft, Berlin, 1984, Verfahrensvorschlag „Toxizitatstest am Regenwurm Eisenia foetida in kiinstlichem Boden“, in: Rudolph/Boje, Ökotoxikologie, ecomed, Landsberg, 1986.
|
Допълнение
Размножаване и отглеждане на червеите преди изпитването
За размножаване на животните, 30 до 50 възрастни червея се поставят в кутия за размножаване с пресен субстрат и се изваждат след 14 дни. Тези животни могат да се използват за получаване на допълнителни партиди за размножаване. Излюпените от какавидите земни червеи се използват за изпитване, когато съзреят (след два до три месеца при предписаните условия).
Условия на отглеждане и размножаване
|
Климатична камера
|
:
|
температура 20 + 2 oС, за предпочитане с непрекъснато осветяване (интензивност на светлината 400 до 800 лукса).
|
|
Кутии за размножаване
|
:
|
подходящи плитки контейнери с обем 10 до 20 l.
|
|
Субстрат
|
:
|
Eisenia foetida може да се отглежда в екскрементите на различни животни. Като среда за отглеждане се препоръчва да се използва смес в обем от 50 % торф и 50 % кравешка или конска тор. Средата трябва да има стойност на рН около 6 до 7 (регулирана с калциев карбонат) и ниска йонна проводимост (под 6 mmol или 0,5 % концентрация на сол).
Субстратът трябва да бъде влажен, но не прекалено мокър.
Освен посочения по-горе метод, могат успешно да се използват и други процедури.
|
Забележка: Съществуват две разновидности Eisenia foetida, които някои таксономи разделят като видове (Bouche, 1972). Те са морфологично сходни, но единият, Eisenia foetida foetida, обичайно има напречни черти или ленти върху сегментите, а при другия, Eisenia foetida andrei, това липсва, освен това той има пъстър червеникав цвят. Когато е възможно, трябва да се използва Eisenia foetida andrei. Ако съществува необходимата методика, могат да се използват други видове.
В.9. БИОЛОГИЧНО РАЗГРАЖДАНЕ
ИЗПИТВАНЕ ПО ZAHN — WELLENS
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Целта на метода е да оцени потенциалната крайна биологична разградимост на неразтворими във вода нелетливи органични вещества, когато са подложени на експозиция на относително високи концентрации на микроорганизми в условията на статично изпитване.
Възможно е да настъпи физико-химична адсорбция на суспендираните твърди вещества и това трябва да се вземе предвид при интерпретиране на резултатите (вижте 3.2).
Изпитваните вещества се използват в концентрации, съответстващи на стойностите на РОВ в диапазона 50 до 400 mg/l или стойностите на ХПК в диапазона 100 до 1 000 mg/l (РОВ = разтворен органичен въглерод; ХПК = химична потребност от кислород). Предимството на тези относително високи концентрации е аналитичната сигурност. Съединенията с токсични свойства могат да забавят или да потиснат процеса на разграждане.
При този метод измерването на концентрацията на разтворения органичен въглерод или на химичната потребност от кислород се използва за определяне на крайната биологична разградимост на изпитваното вещество.
Едновременното използване на специфичен аналитичен метод може да даде възможност за определяне на първичното биологично разграждане на веществото (изчезване на родителската химична структура).
Методът е приложим само за тези изпитвани органични вещества, които, при използваната за изпитването концентрация:
|
—
|
са разтворими във вода при експерименталните условия,
|
|
—
|
имат пренебрежимо ниско парно налягане при експерименталните условия,
|
|
—
|
не потискат развитието на бактериите,
|
|
—
|
се адсорбират в ограничена степен в рамките на експерименталната система,
|
|
—
|
не се губят при образуване на пяна в експерименталния разтвор,
|
Информацията за относителните пропорции на основните компоненти на изпитвания материал ще бъдат полезни за интерпретиране на получените резултати, по-конкретно в случаите, когато резултатите са ниски или гранични.
За интерпретиране на ниските резултати и за избор на подходящи експериментални концентрации е желателно да има информация за токсичността на веществото за микроорганизмите.
1.2. ОПРЕДЕЛЕНИЯ И ЕДИНИЦИ
Величината на разграждането, постигната в края на изпитването, се отчита като „Биологично разграждане при изпитване по Zahn — Wellens“:

където:
|
DT
|
=
|
биологично разграждане ( %) във времето Т,
|
|
СA
|
=
|
стойности на РОВ (или на ХПК) в експерименталната смес, измерени три часа след началото на изпитването (mg/l) (РОВ = разтворен органичен въглерод, ХПК = химична потребност от кислород),
|
|
СT
|
=
|
стойности на РОВ (или на ХПК) в експерименталната смес по време на вземането на проби (mg/l),
|
|
СB
|
=
|
стойности на РОВ (или на ХПК) в празната проба по време на вземането на проби (mg/l),
|
|
СBA
|
=
|
стойности на РОВ или ХПК в празната проба, измерени три часа след началото на изпитването (mg/l).
|
Степента на разграждане се закръглява до най-близкия цял процент.
Процентното разграждане се представя като процент от отнемането на РОВ (или на ХПК)от изпитваното вещество.
Разликата между измерената стойност след три часа и изчислената или, за предпочитане, измерената първоначална стойност, може да даде полезна информация за елиминирането на веществото (вижте 3.2. Интерпретиране на резултатите).
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
В някои случаи при изпитване на нови вещества, може да са полезни вещества за сравнение. Все още, обаче, не могат да бъдат препоръчани конкретни вещества за сравнение.
1.4. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
В стъклен съд с обем от един до четири литра с бъркачка и аератор се поставят заедно активирана утайка, минерални хранителни вещества и изпитваният материал като единствен източник на въглерод във воден разтвор. Сместа се разбърква и аерира при температура 20 до 25 oС и дифузно осветление или в тъмна стая за период до 28 дни. Процесът на разграждане се мониторира за определяне стойностите на РОВ (или на ХПК) във филтриран разтвор ежедневно или през други подходящи равни интервали от време. Съотношението на елиминирания РОВ (или ХПК) след всеки интервал и стойността, получена три часа след началото, се изразява като процент на биологично разграждане и служи като мярка за степента на разграждане в този момент. Построява се крива на биологичното разграждане като резултатът се нанася на графика срещу времето.
Когато се използва специфичен аналитичен метод, могат да се измерят промените в концентрацията на родителската молекула поради биологично разграждане (първична биологична разградимост).
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
С помощта на кръгово изпитване е доказано, че възпроизводимостта на този метод е задоволителна.
Чувствителността на метода в голяма степен се определя от вариабилността на празната проба и, в по-малка степен, от точността на определянето на разтворения органичен въглерод и от нивото на изпитваното съединение в течността.
1.6. ОПИСАНИЕ НА ЕКСПЕРИМЕНТАЛНАТА ПРОЦЕДУРА
1.6.1. Подготовка
1.6.1.1. Реактиви
Експериментална вода: питейна вода със съдържание на органичен въглерод < 5 mg/l. Общата концентрация на калциевите и магнезиевите йони не трябва да надвишава 2,7 mmol/l, в противен случай е необходимо адекватно разреждане с дейонизирана или дестилирана вода.
|
Сярна киселина, аналитичен реактив:
|
50 g/l.
|
|
Разтвор на натриев хидроксид, аналитичен реактив:
|
40 g/l.
|
|
Разтвор на минерални хранителни вещества: разтворете в един литър дейонизирана вода:
|
|
|
амониев хлорид, NH4Cl, аналитичен реактив:
|
38,5 g,
|
|
натриев дихидрогенфосфат, NaH2PO4.2H2O, аналитичен реактив:
|
33,4 g,
|
|
калиев дихидрогенфосфат, КН2РО4, аналитичен реактив:
|
8,5 g,
|
|
ди-калиев монохидрогенфосфат, К2НРО4, аналитичен реактив:
|
21,75 g.
|
Сместа служи както като хранително вещество, така и като буферна система.
1.6.1.2. Апаратура
Стъклени съдове с обем един до четири литра (например цилиндрични съдове).
Бъркачка със стъклена или метална бъркалка, монтирана на подходящ вал (бъркалката трябва да се върти приблизително 5 до 10 cm над дъното на съда). Вместо това може да се използва магнитна бъркалка с прът, дълъг 7 до 10 cm.
Стъклена тръбичка с вътрешен диаметър 2 до 4 mm за вкарване на въздух. Отворът на тръбичката трябва да се намира на около 1 cm над дъното на съда.
Центрофуга (около 3 550 g).
Уред за измерване на рН.
Уред за измерване на разтворения кислород.
Хартиени филтри
Апарат за мембранно филтриране.
Мембранни филтри, размер на порите 0,45 μm. Мембранните филтри са подходящи, ако е сигурно, че те нито освобождават въглерод, нито абсорбират веществото по време на филтрирането.
Аналитично оборудване за определяне съдържанието на органичен въглерод и химичната потребност от кислород.
1.6.1.3. Приготвяне на проба за инокулиране
Активирана утайка от станция за биологично пречистване се промива с експериментална вода чрез (многократно) центрофугиране или утаяване (горе).
Активираната утайка трябва да бъде в подходящо състояние. Такава утайка може да се получи от правилно функционираща пречиствателна станция за отпадъчни води. За да се получат колкото е възможно повече различни видове или щамове бактерии, може да се предпочете да се смесят проби за инокулиране от различни източници (например различни пречиствателни станции, почвени екстракти, речни води и др.). Сместа трябва да се третира, както е описано по-горе.
За проверка на активността на активираната утайка, вижте „Контрол на функционирането“ по-долу.
1.6.1.4. Приготвяне на експериментални разтвори
Към експерименталния съд добавете 500 ml експериментална вода, 2,5 ml/l разтвор на минерални хранителни вещества и активирана утайка в количество, което съответства на 0,2 до 1,0 g/l сухо вещество в крайната смес. Добавете достатъчно изходен разтвор на изпитваното вещество, така че в крайната смес да се получи концентрация на РОВ 50 до 400 mg/l. Съответните стойности на химичната потребност от кислород са 100 до 1 000 mg/l. Добавете експериментална вода, за да получите общ обем един до четири литра. Избраният общ обем зависи от броя на пробите, които трябва да се вземат за всяко определяне на РОВ и ХПК, и от обемите, които са необходими за аналитичната процедура.
Обикновено обем от два литра се смята за задоволителен. Приготвя се и поне един контролен съд (празна проба), който се наблюдава паралелно с всяка експериментална серия. Той съдържа само активирана утайка и разтвор на минерални хранителни вещества, приготвен с експериментална вода до същия общ обем, както в експерименталните съдове.
1.6.2. Провеждане на изпитването
Експерименталните съдове се разбъркват с магнитни бъркачки или винтови пропелери при дифузно осветление или в тъмна стая при температура 20 до 25 oС. Аерирането се постига с помощта на сгъстен въздух, пречистен с филтър от памучна вата и, ако е необходимо, бутилка за отмиване. Утайката не трябва да се утаява и кислородната концентрация не трябва да спада под 2 mg/l.
Стойността на рН трябва да се проверява на редовни интервали (например ежедневно) и ако е необходимо, да се коригира на рН 7 до 8.
Загубите от изпаряване се компенсират непосредствено преди всяко вземане на проба с дейонизирана или дестилирана вода в необходимите количества. Полезно е да се отбележи нивото на течността върху съда преди започване на изпитването. След всяко вземане на проби нивото се отбелязва отново (без аериране и разбъркване). Първите проби се вземат винаги три часа след започване на изпитването, за да се открие адеорбирането на изпитвания материал от активираната утайка.
Елиминирането на изпитвания материал се последва от определяне на РОВ и ХПК, което се извършва ежедневно или на други редовни интервали. Пробите от експерименталния съд и празната проба се филтрират през внимателно промит хартиен филтър. Първите 5 ml от филтрата на експерименталния разтвор се изхвърлят. Трудните за филтриране утайки могат да бъдат отстранени предварително чрез центрофугиране в продължение на 10 минути. Измерването на РОВ и ХПК се повтаря най-малко два пъти. Изпитването продължава до 28 дни.
Забележка: Пробите, които остават мътни, се филтрират през мембранни филтри. Мембранните филтри не трябва да освобождават или да адеорбират никакъв органичен материал.
Контрол на функционирането на активираната утайка
Паралелно с всяка експериментална серия трябва да се наблюдава съд, съдържащ познато вещество, за да се провери функционалния капацитет на активираната утайка. За тази цел е полезен диетиленгликолът.
Адаптиране
Ако анализите се провеждат на относително кратки интервали (например ежедневно), адаптирането може да бъде лесно разпознато по кривата на разграждане (вижте фигура 2). Следователно изпитването не трябва да започва непосредствено преди края на седмицата.
Ако адаптирането възникне в края на изпитването, изпитването може да бъде удължено до завършване на разграждането.
Забележка: Ако е необходимо по-широко познаване на поведението на адаптираната утайка, същата активирана утайка се подлага още един път на експозиция на същия изпитван материал в съответствие със следната процедура:
Изключете бъркачката и аератора и оставете активираната утайка да се утаи. Изтеглете над стояща течност, допълнете до два литра с експериментална вода, разбъркайте за 15 минути и оставете да се утаи отново. След като отново се изтегли надстояща течност, използвайте оставащата утайка, за да повторите изпитването със същия материал в съответствие с 1.6.1.4 и 1.6.2 по-горе. Активираната утайка може да бъде изолирана и чрез центрофугиране вместо утаяване.
Адаптираната утайка може да бъде смесена с прясна утайка до концентрация 0,2 до 1 g/l сухо тегло.
Аналитични средства
Нормално пробите се филтрират през внимателно измит хартиен филтър (за измиване използвайте дейонизирана вода).
Пробите, които остават мътни, се филтрират през мембранни филтри (0,45 μm).
Определянето на концентрацията на РОВ се повтаря два пъти в проби от филтратите (първите 5 ml се изхвърлят) с помощта на уред за определяне на общия органичен въглерод (общия окисляем въглерод). Ако филтратът не може да бъде анализиран същия ден, той трябва да се съхранява в хладилник до следващия ден. Не се препоръчва по-продължително съхранение.
Концентрацията на ХПК се определя в проби от филтратите с аналитична апаратура за определяне на ХКП по процедурата, описана в позоваване 2 по-долу.
2. ДАННИ И ОЦЕНКА
Определянето на концентрациите на РОВ и ХПК в пробите се повтаря поне два пъти в съответствие с 1.6.2 по-горе. Разграждането в момента Т се изчислява по формула (с определения), дадена в 1.2 по-горе.
Степента на разграждане се закръглява до най-близкия цял процент. Величината на разграждането, постигната в края на изпитването, се отчита като „Биологично разграждане при изпитване по Zahn — Wellens“.
Забележка: Ако се постигне пълно разграждане преди изтичане на експерименталното време и този резултат се потвърди чрез втори анализ на следващия ден, изпитването може да бъде приключено.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Ако е възможно, протоколът от изпитването съдържа следното:
|
—
|
първоначалната концентрация на веществото,
|
|
—
|
цялата друга информация и експерименталните резултати, отнасящи се до веществото за сравнение, ако е използвано, и до празната проба,
|
|
—
|
концентрацията след три часа,
|
|
—
|
кривата на биологично разграждане с описание,
|
|
—
|
датата и мястото, където са взети проби от експерименталните организми, състоянието на адаптиране, използваната концентрация и др.,
|
|
—
|
научните мотиви за всички изменения в експерименталната процедура.
|
3.2. ИНТЕРПРЕТИРАНЕ НА РЕЗУЛТАТИТЕ
Отнемането на РОВ (ХПК), което постепенно настъпва в продължение на дни или седмици, показва, че изпитваното вещество се разгражда биологично.
В някои случаи, обаче, физико-химичната адсорбция може да играе роля, и това се демонстрира с присъствието на пълно или частично отнемане в началото, в рамките на първите три часа, а разликата между контролната и експерименталната надстояща течност остава на неочаквано по-ниско ниво.
Ако трябва да се направи разграничаване между биологичното разграждане (или частично разграждане) и адсорбцията, са необходими допълнителни изпитвания.
Това може да се направи по много начини, но най-убедително е използването на надстояща течност или утайка като проба за инокулиране в основно изпитване (за предпочитане респирометричен тест).
Изпитваните вещества, при които се наблюдава голямо неадсорбтивно отнемане на РОВ (ХПК) при това изпитване, трябва да се считат за потенциално биологично разградими. Частичното неадсорбтивно отнемане показва, че химическото вещество е подложено поне на известно биологично разграждане. Ниското или близкото до нула отнемане на РОВ (ХПК) може да се дължи на потискане на микроорганизмите от изпитваното вещество и това може да се докаже и чрез лизиране или загуба на утайка, водещи до образуване на мътна надстояща течност. Изпитването трябва да бъде повторено, като се използва по-ниска концентрация на изпитваното вещество.
Използването на специфичен за съединението аналитичен метод или маркирано с 14С-изпитвано вещество могат да позволят по-висока чувствителност. При изпитвано съединение, маркирано с 14С, възстановяването на 14СО2 ще потвърди, че е настъпило биологично разграждане.
Когато резултатите са представени по отношение на първичното биологично разграждане, ако е възможно, трябва да бъде дадено обяснение за изменението в химичната структура, което води до загуба на отговор при родителското изпитвано вещество.
Валидирането на аналитичния метод трябва да бъде представено заедно с отговора, получен при празната експериментална среда.
4. ПРЕПРАТКИ
|
(1)
|
ОИСР, Париж, 1981, Test Guideline 302 B, Решение на Съвета C(81) 30 final.
|
Допълнение
ПРИМЕР ЗА ОЦЕНКА
|
Органично съединение:
|
4-етоксибензоева киселина
|
|
Теоретична експериментална концентрация:
|
600 mg/l
|
|
Теоретичен РОВ:
|
390 mg/l
|
|
Проба за инокулиране
|
Пречиствателна станция за отпадъчни води в …
|
|
Концентрация
|
1 грам сух материал/литър
|
|
Състояние на адаптиране:
|
неадаптиран
|
|
Анализ:
|
определяне на РОВ
|
|
Количество на пробата:
|
3 ml
|
|
Контролно вещество:
|
диетиленгликол
|
|
Токсичност на съединението:
|
Няма токсични ефекти под 1 000 mg/l
Използвано изпитване: Изпитване с ферментационни епруветки
|
|
Време на изпитванет0
|
Контролно вещество:
|
Изпитвано вещество
|
|
Празна проба за РОВ (16)
mg/l
|
РOB (16)
mg/l
|
Нетна стойност на РОВ
mg/l
|
Разграждане
%
|
РОВ (16)
mg/l
|
Нетна стойност на РОВ
mg/l
|
Разгражда не
%
|
|
0
|
—
|
—
|
300,0
|
—
|
—
|
390,0
|
—
|
|
3 часа
|
4,0
|
298,0
|
294,0
|
2
|
371,6
|
367,6
|
6
|
|
1 ден
|
6,1
|
288,3
|
282,2
|
6
|
373,3
|
367,2
|
6
|
|
2 дни
|
5,0
|
281,2
|
276,2
|
8
|
360,0
|
355,0
|
9
|
|
5 дни
|
6,3
|
270,5
|
264,2
|
12
|
193,8
|
187,5
|
52
|
|
6 дни
|
7,4
|
253,3
|
245,9
|
18
|
143,9
|
136,5
|
65
|
|
7 дни
|
11,3
|
212,5
|
201,2
|
33
|
104,5
|
93,2
|
76
|
|
8 дни
|
7,8
|
142,5
|
134,7
|
55
|
58,9
|
51,1
|
87
|
|
9 дни
|
7,0
|
35,0
|
28,0
|
91
|
18,1
|
11,1
|
97
|
|
10 дни
|
18,0
|
37,0
|
19,0
|
94
|
20,0
|
2,0
|
99
|
Фигура 1
Примери за криви на биологично разградимост
Фигура 2
Примери за адаптиране на утайка
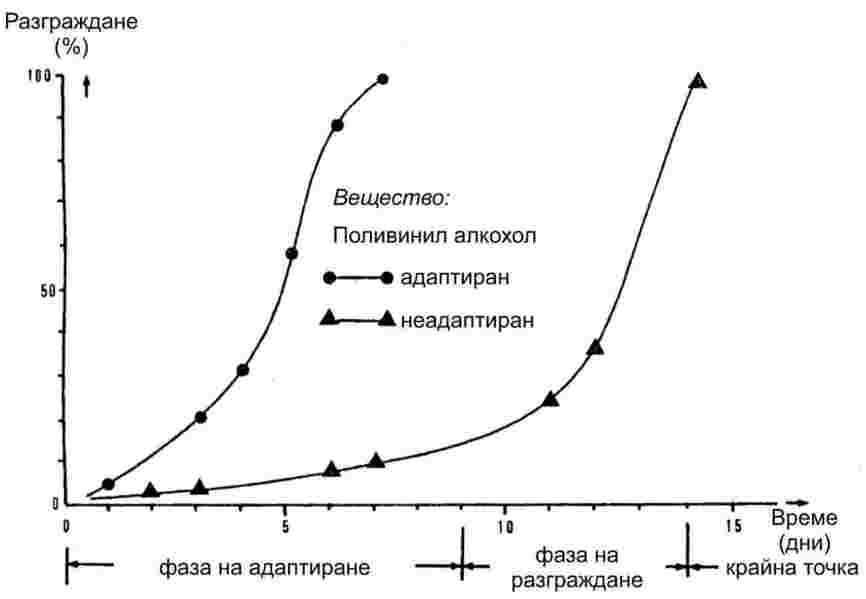
В.10. БИОЛОГИЧНО РАЗГРАЖДАНЕ
ИЗПИТВАНИЯ ЗА СИМУЛИРАНЕ НА АКТИВИРАНА УТАЙКА
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
1.1.1. Общи бележки
Методът е приложим само за тези органични вещества, които, в използваната експериментална концентрация:
|
—
|
са разтворими във вода до степента, необходима за приготвяне на експерименталните разтвори,
|
|
—
|
имат пренебрежимо ниско парно налягане при експерименталните условия
|
|
—
|
не потискат бактериите.
|
Информацията за относителните пропорции на основните компоненти на изпитвания материал ще бъде полезна за интерпретиране на получените резултати, по-конкретно, в случаите, когато резултатите са ниски или гранични.
За интерпретиране на ниските резултати и за избор на подходящи експериментални концентрации е желателно да има информация за токсичността на веществото за микроорганизмите.
1.1.2. Определяне на крайната биологична разградимост (анализ на РОВ/ХПК)
Целта на метода е определяне на крайната биологична разградимост чрез измерване на отнемането на веществото и всички метаболити в модел на станция за активирана утайка, при концентрация, съответстваща на > 12 mg/l РОВ (или приблизително 40 mg/l ХПК. Изглежда, че 20 mg/l е оптимален РОВ. (РОВ = разтворен органичен въглерод, ХПК = химична потребност от кислород).
Трябва да се установи съдържанието на органичен въглерод (или химичната потребност от кислород) на изпитвания материал.
1.1.3. Определяне на първичната биологична разградимост (специфичен анализ)
Целта на метода е да се определи първичната биологична разградимост на дадено вещество в модел на станция за активирана утайка, при концентрация около 20 mg/l, като се използва специфичен аналитичен метод (ако аналитичният модел и токсичността позволяват, могат да се използват по-високи или по-ниски концентрации). Това дава възможност за оценяване на първичната биологична разградимост на веществото (изчезване на родителската химична структура).
Целта на този метод не е определяне на минерализацията на изпитваното вещество.
Трябва да съществува адекватен аналитичен метод за определяне на изпитваното вещество.
1.2. ОПРЕДЕЛЕНИЯ И ЕДИНИЦИ
1.2.1. Анализ на РОВ/ХПК
Степента на отнемане на веществото се дава с:
|

|
[1 (a)]
|
където:
|
DR
|
=
|
степен на отнемане на РОВ (или ХПК) в проценти в рамките на дадено средно време на задържане по отношение на изпитвания материал,
|
|
Т
|
=
|
концентрация на изпитвания материал в постъпващата течност в mg/l РОВ (или mg/l ХКП),
|
|
Е
|
=
|
концентрация на РОВ (или ХПК) в изходящата течност на експерименталния модул в mg/l РОВ (или ХПК),
|
|
Ео
|
=
|
концентрация на РОВ (или ХПК) в изходящата течност на празния модул в mg/l РОВ (или mg/l ХПК),
|
Разграждането е представено като процент на отнемането на РОВ (или ХПК) в рамките на дадено време на задържане по отношение на изпитвания материал.
1.2.2. Специфичен анализ
Процентът на елиминиране на изпитваното вещество от водната фaзa (Rw) в рамките на дадено време на задържане се дава с
|
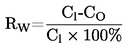
|
[1(6)]
|
където:
|
CI
|
=
|
концентрация на веществото в постъпващата течност на експерименталния модул (mg/l вещество, определено с помощта на специфичен анализ),
|
|
Со
|
=
|
концентрация на веществото в изходящата течност на експерименталния модул (mg/l вещество, определено с помощта на специфичен анализ).
|
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
В някои случаи при изпитване на ново вещество, може да са полезни вещества за сравнение; все още, обаче, не могат да бъдат препоръчани конкретни вещества за сравнение.
1.4. ПРИНЦИП НА МЕТОДИТЕ ЗА ИЗПИТВАНЕ
За определяне на крайната биологична разградимост се наблюдават паралелно два пилотни модула с активирана утайка (потвърдително изпитване или изпитване с метална пореста решетка на Организацията за икономическо сътрудничество и развитие, ОИСР). Изпитваното вещество се добавя към постъпващата течност (синтетични или битови отпадъчни води) на единия модул, докато в другия модул постъпват само отпадъчни води. За определяне на първичната биологична разградимост чрез специфичен анализ на постъпващата и изходящата течност, се използва само един модул.
Концентрациите на РОВ (или на ХПК) се измерват в изходящата течност или концентрациите на веществото се определят с помощта на специфичен анализ.
РОВ, дължащ се на изпитвания материал, не се измерва, а само се съобщава.
Когато се правят измервания на РОВ (или на ХПК), се приема, че разликата между средните стойности на концентрациите в експерименталната и контролната изходяща течност се дължат на неразграден изпитван материал.
Когато се правят специфични анализи, може да се определи изменението в концентрацията на родителската молекула (първично биологично разграждане.
Модулите могат да функционират в „режим на свързани модули“ по процедура за трансинокулиране.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Стартовата концентрация на веществото зависи от типа на проведения анализ и неговите ограничения.
1.6. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
1.6.1. Подготовка
1.6.1.1. Апаратура
Необходима е двойка модули от един и същ тип, освен когато се провеждат специфични анализи. Могат да се използват два типа устройства:
Потвърдително изпитване на Организацията за икономическо сътрудничество и развитие (ОИСР).
Оборудването (допълнение 1) се състои от съд (А) за съхраняване на синтетичните отпадъчни води, дозираща помпа (Б), съд (В) за аериране, сепаратор (Г), въздушна повдигаща помпа (Д) за рециклиране на активираната утайка и съд (Е) за събиране на третираната изходяща течност.
Съдовете (А) и (Е) трябва да бъдат изработени от стъкло или подходяща пластмаса и да имат вместимост поне 24 литра. Помпата (Б) трябва да осигурява постоянен поток на синтетични отпадъчни води към съда за аериране, като може да се използва всяка подходяща система, при условие че входящият поток и концентрацията са гарантирани. При нормално функциониране височината на сепаратора (Г) е фиксирана спрямо обема, съдържащ се в съда за аериране, така че в него да има три литра смесена течност. В съда (В) на върха на конуса е закрепен куб (Ж) от синтерирано стъкло. Количеството на въздуха, продухван през аератора, може да бъде мониторирано с дебитомер.
Въздушната повдигаща помпа (Д) е настроена така, че активираната утайка от сепаратора се рециклира редовно и непрекъснато в съда (В) за аериране.
„Метална пореста решетка“
Металната пореста решетка е изработено от листове порест полиетилен (дебелина 2 mm, максимален размер на порите 95 μm), от които са направени цилиндри с диаметър 14 cm с конична основа под ъгъл 45o (фигури 1 и 2 от допълнение 2). Металната пореста решетка се намира в непроницаем съд, изработен от подходяща пластмаса, с диаметър 15 cm, с отвор на височина 17,2 cm в цилиндричната част, което определя обема (3 литра) на решетката. Около горната част на вътрешния съд има твърд поддържащ пръстен, изработен от подходяща пластмаса, така че между вътрешния и външния съд има пространство за изходяща течност с ширина 0,5 cm.
Металните порести решетки могат да бъдат монтирани в основата на контролирана термостатично водна баня. Към основата на вътрешния съд постъпва въздух и отгоре са поставен подходящи дифузори.
Съдовете (А) и (Д) трябва да бъдат изработени от стъкло или подходяща пластмаса и да имат вместимост поне 24 литра. Помпата (Б) трябва да осигурява постоянен поток на синтетични отпадъчни води към съда за аериране, като може да се използва всяка подходяща система, при условие че входящият поток и концентрацията са гарантирани.
Необходими са резервни вътрешни метални порести решетки, за да заменят тези, които могат да блокират по време на употреба. Блокираните решетки се почистват чрез 24-часово потапяне в разтвор на хипохлорит, последвано от щателно отмиване с чешмяна вода.
1.6.1.2. Филтриране
Апарат за мембранно филтриране и мембранни филтри с размер на порите 0,45 μm. Мембранните филтри са подходящи, ако е сигурно, че те нито освобождават въглерод, нито адсорбират веществото по време на филтрирането.
1.6.1.3. Отпадъчни води
Може да се използва подхранване както със синтетични, така и с битови отпадъчни води.
Пример за синтетично подхранване
Във всеки литър чешмяна вода разтворете:
|
Пептон:
|
160 mg,
|
|
Месен екстракт:
|
10 mg,
|
|
Урея:
|
30 mg,
|
|
NaCl:
|
7 mg,
|
|
CaCl2.2H2O:
|
4 mg,
|
|
MgSO4.7H2O:
|
2 mg,
|
|
K2HPO4:
|
28 mg.
|
Битови отпадъчни води
Те трябва да се вземат пресни всеки ден от преливащата вода в танка за първично утаяване на пречиствателна станция главно за битови отпадъчни води.
1.6.1.4. Изходен разтвор на експериментален материал
За добавяне към експерименталния модул трябва да бъде приготвен разтвор на експериментален материал, например 1 %. Трябва да се определи концентрацията на материала, така че той да се добави към отпадъчните води пряко в експерименталния модул или чрез втора помпа, за да се получи необходимата експериментална концентрация.
1.6.1.5. Проба за инокулиране
Забележка: Когато се употребяват битови отпадъчни води, няма да има смисъл да се използва проба за инокулиране с ниска бактериална концентрация, но може да се използва активирана утайка.
Могат да се използват разнообразни проби за инокулиране.
Дадени са три примера за подходящи проби за инокулиране:
|
а)
|
Проба за инокулиране от вторична изходяща течност
Пробата за инокулиране трябва да бъде получена от вторична изходяща течност с добро качество, взета от пречиствателна станция, която обработва главно битови отпадъчни води. Между вземането на пробата и използването ѝ изходящата течност трябва да бъде съхранявана при аеробни условия. За да се приготви проба за инокулиране, пробата се филтрира през груб филтър, като първите 200 ml се изхвърлят. До използването му филтратът се съхранява в аеробни условия. Пробата за инокулиране трябва да се използва в деня на вземането ѝ. За инокулиране трябва да се използват най-малко 3 ml.
|
|
б)
|
Комбинирана проба за инокулиране
Проба за инокулиране от вторична изходяща течност:
Вижте описанието по-горе.
Проба за инокулиране от почва:
100 g градинска почва (плодородна, нестерилна) се суспендират в 1 000 ml питейна вода без хлор. (Почвите с изключително високо съдържание на глина, пясък или хумус не са подходящи.) След разбъркване суспензията се оставя да се утаи за 30 минути. Надстоящата течност се филтрира през груба филтърна хартия, като първите 200 ml се изхвърлят. Филтратът незабавно започва да се аерира, което продължава до използването му. Пробата за инокулиране трябва да се използва в деня на вземането ѝ.
Проба за инокулиране от повърхностни води:
Допълнителна частична проба за инокулиране се взема от мезосапробни повърхностни води. Пробата се филтрира през груба хартия, като първите 200 ml се изхвърлят. До използването му филтратът се съхранява в аеробни условия. Пробата за инокулиране трябва да се използва в деня на вземането ѝ.
Събират се равни обеми от трите частични проби за инокулиране, смесват се добре и от тази смес се взема крайната проба за инокулиране. За инокулиране трябва да се използват най-малко 3 ml.
|
|
в)
|
Проба за инокулиране от активирана утайка
Като проба за инокулиране може да се използва определен обем (не повече от 3 литра) активирана утайка (със съдържание на суспендирани твърди вещества не повече от 2,5 g/l), взета от танк за аериране на пречиствателна станция, третираща главно битови отпадъчни води.
|
1.6.2. Процедура
Изпитването се провежда при стайна температура, която трябва да се поддържа между 18 и 25 oC.
Ако е целесъобразно, изпитването може да се проведе при по-ниска температура (до 10 oС). Ако веществото се разгражда нормално, не е необходимо допълнително изпитване. Обаче ако веществото не се разгражда, изпитването трябва да се проведе при постоянна температура между 18 и 25 oС.
1.6.2.1. Период на отмиване: Образуване на утайка/стабилизиране на модулите
Периодът на растеж/стабилизиране на утайката представлява период, през който концентрацията на суспендираните твърди вещества от активираната утайка и функционирането на модулите прогресира до стабилно състояние при използваните функционални условия.
Периодът на отмиване е период, който трае от момента, в който изпитваното вещество е добавено за първи път, до момента, в който неговото отнемане достига плато (относително постоянна стойност). Този период не трябва да превишава шест седмици.
Периодът на оценяване е триседмичен период от момента, в който отнемането на изпитваното вещество достигне относително постоянна и обикновено висока стойност. За веществата, които през първите шест седмици показват слабо или липсващо разграждане, оценяването става през следващите три седмици.
Първоначално напълнете небходимата(ите) за едно изпитване модул(и) с проба за инокулиране, смесена с постъпваща течност.
След това се включват аераторът (и въздушната повдигаща помпа (Д) при модулите за потвърдително изпитване на Организацията за икономическо сътрудничество и развитие (ОИСР) и дозиращото устройство (Б).
Постъпващата течност без изпитвано вещество трябва да премине през съда за аериране (В) със скорост един литър за час или половин литър за час. Това дава средно време на задържане три или шест часа.
Степента на аериране трябва да бъде регулирана по такъв начин, че съдържанието на съда (В) да бъде поддържано постоянно като суспензия, а съдържанието на разтворен кислород да бъде най-малко 2 mg/l.
Образуването на пяна трябва да бъде предотвратено с помощта на подходящи средства. Не трябва да се използват противопенни средства, които потискат активираната утайка.
Утайката, която се е събрала около горната част на съда за аериране (В) (и при модулите за потвърдително изпитване на Организацията за икономическо сътрудничество и развитие (ОИСР) в основата на съда за утаяване (Г), и в кръга за циркулация) трябва да бъде връщана обратно в смесената течност поне един път дневно с помощта на четка или друго подходящо средство.
Когато утайката не се утаява, нейната плътност може да се увеличи чрез добавяне на порции от 2 ml 5 % разтвор на трижелезен хлорид, което при необходимост се повтаря.
Изходящата течност се събира в съда (Д или Е) в продължение на 20 до 24 часа и след щателно смесване се взема проба. Съдът (Д или Е) трябва да бъде внимателно почистен.
За да се мониторира и контролира ефективността на процеса, се измерват химичната потребност от кислород (ХПК) или разтвореният органичен въглерод (РОВ) на филтрата от акумулираната изходяща течност поне два пъти седмично, както и на филтрираната постъпваща течност (като се използва мембрана с размер на порите 0,45 μm, като първите 20 ml (приблизително) от филтрата се изхвърлят).
Намаляването на ХПК и РОВ достига равновесие, когато се получи приблизително еднакво дневно разграждане.
Съдържанието на сухо вещество в активираната утайка в танка за аериране трябва да се определя два пъти седмично (в g/l). Модулите трябва да функционират по един от двата начина: съдържанието на сухо вещество в активираната утайка трябва да се определя два пъти седмично и, ако е над 2,5 g/l, излишната активирана утайка трябва да бъде изхвърлена, или ежедневно от всяка решетка да се изхвърлят по 500 ml смесена течност, за да се получи средно време на задържане на утайката шест дни.
Когато измерваните и оценяваните параметри (ефективността на процеса (в отнемане на ХПК или РОВ), утаимостта на утайката, мътността на изходящите течности и др.) на двата модула са достатъчно стабилни, изпитваното вещество трябва да бъде въведено в постъпващата течност на единия от модулите, както е дадено в 1.6.2.2.
Алтернативно, изпитваното вещество може да бъде добавено в началото на растежа на утайката (1.6.2.1), особено когато утайката се добавя като проба за инокулиране.
1.6.2.2. Експериментална процедура
Функционалните условия на периода на отмиване се поддържат и към постъпващата течност в експерименталния модул се добавя достатъчно изходен разтвор (приблизително 1 %) от изпитвания материал, така че да се получи желаната концентрация на изпитвания материал (приблизително 10 до 20 mg/l РОВ или 40 mg/l ХПК) в отпадъчните води. Това може да се направи чрез ежедневно смесване на изходния разтвор с отпадъчните води или посредством отделна помпена система. Тази концентрация може да се постига прогресивно. Ако изпитваното вещество няма токсични ефекти върху активираната утайка, могат да се изпитват и по-високи концентрации.
Празният модул се захранва само с постъпваща течност без добавени вещества. За анализ се вземат адекватни обеми изходящи течности и се филтрират през мембранни филтри (0,45 μm), като първите 20 ml (приблизително) от филтрата се изхвърлят.
Филтрираните проби трябва да се анализират в същия ден, в противен случай трябва да се съхраняват по подходящ начин, например чрез използване на 0,05 ml 1 % разтвор на живачен хлорид (HgCl2) за всеки 10 ml филтрат или чрез съхраняването им при температура 2 до 4 oС за срок до 24 часа или под – 18 oС за по-дълги периоди.
Времето на отмиване с добавяне на изпитвано вещество не трябва да превишава шест седмици и периодът на оценка не трябва да бъде по-кратък от три седмици, т.е. за изчисляване на крайния резултат трябва да са налице около 14 до 20 определяния за изчисляване на крайния резултат.
Режим на свързани модули
Свързването на модулите се постига чрез взаимен обмен между двата модула един път дневно на 1,5 литра смесена течност (включително утайка) от съдовете за аериране на активирана утайка. При силно адсорбиращи експериментални материали, от съдовете за утаяване се вземат 1,5 литра надстояща течност и се изливат в съда за активирана утайка на другия модул.
1.6.2.3. Анализ
За да се проследи поведението на веществото, могат да се направят два вида анализи:
РОВ и ХПК
Определят се двукратно концентрациите на РОВ с анализатор за въглерод и/или стойностите на ХКП в съответствие с позоваване (2).
Специфичен анализ
Концентрациите на изпитваното вещество се определят посредством подходящ аналитичен метод. Когато е възможно, трябва да се провежда специфично определяне на веществото, абсорбирано в утайката.
2. ДАННИ И ОЦЕНКА
2.1. РЕЖИМ НА СВЪРЗАНИ МОДУЛИ
Когато се използва „режимът на свързани модули“, дневната степен на отнемане, DR, се изчислява в съответствие с 1.2.1.
Дневните степени на отнемане DR се коригират до DRc за трансфера на материал по време на процедурата по трансинокулация с уравнение [2] за тричасово или уравнение [3] за шестчасово средно време на задържане.
|
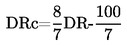
|
[2]
|
|
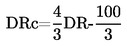
|
[3]
|
В допълнение към стандартното отклонение се изчислява средната стойност на серията стойности DRc в съответствие с уравнение [4]
|
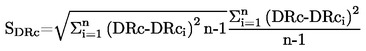
|
[4]
|
където:
|
SDRc
|
=
|
стандартно отклонение на серията стойности DRc,
|
|

c |
=
|
средна стойност на DRc,
|
|
n
|
=
|
брой на определянията.
|
Стойностите, попадащи извън серията на стойностите DRc, се елиминират в съответствие с подходяща статистическа процедура, например Nalimov (6), при ниво на вероятност 95 % и се преизчисляват средната стойност и стандартното отклонение на серията данни за DRc без стойностите, попадащи извън нея.
Крайният резултат след това се изчислява по уравнение [5] като
|

|
[5]
|
където:
|
tn
-1; α
|
=
|
таблична стойност на t за n броя двойки Е и Ео и статистическа доверителност Р (Р = 1-α), където Р е на 95 % (1).
|
Резултатът се дава като средна стойност с граници на толеранс при ниво на вероятност 95 %, съответното стандартно отклонение и броят на данните от серията данни за стойностите DRc без стойности, попадащи извън серията, и броя на стойностите, попадащи извън серията, т.е.
|
DRc
|
=
|
98,6±2,3 % отнемане на РОВ,
|
|
s
|
=
|
4,65 % отнемане на РОВ,
|
|
п
|
=
|
18,
|
|
х
|
=
|
брой на стойностите, попадащи извън серията.
|
2.2. РЕЖИМ НА НЕСВЪРЗАНИ МОДУЛИ
Функционирането на модулите може да бъде проверено както следва:

От тези ежедневни отнемания може да се построи графика, за да се проявят всички тенденции, например към аклиматизиране.
2.2.1. Използване на определянията на РОВ/ХПК
Ежедневната степен на отнемане DR се изчислява в съответствие с 1.2.1.
Изчислява се средната стойност на серията стойности DR; допълнително се изчислява нейното стандартно отклонение в съответствие с:
|

|
[6]
|
където:
|
DR
|
=
|
стандартно отклонение на серията стойности DRi,
|
|

|
=
|
средна стойност на стойностите DRi,
|
|
п
|
=
|
брой на определянията.
|
Стойностите, попадащи извън серията на стойностите DR, се елиминират в съответствие с подходяща статистическа процедура, например Nalimov (6), при ниво на вероятност 95 % и се преизчисляват средната стойност и стандартното отклонение на серията данни за DR без стойностите, попадащи извън нея.
Крайният резултат след това се изчислява по уравнение [7] като
|

|
[7]
|
където:
|
tn
-1; α
|
=
|
таблична стойност на t за n броя двойки Е и Ео и статистическа доверителност Р (Р = 1-α), където Р е 95 % (1).
|
Резултатът се дава като средна стойност с граници на толеранс при ниво на вероятност 95 %, съответното стандартно отклонение и броят на данните от серията данни за стойностите DR без стойностите, попадащи извън серията, и броя на стойностите, попадащи извън серията, т.е.
|
DR
|
=
|
(98,6±2,3) % отнемане на РОВ,
|
|
s
|
=
|
4,65 % отнемане на РОВ,
|
|
n
|
=
|
18,
|
|
х
|
=
|
брой на стойностите, попадащи извън серията.
|
2.2.2. Използване на специфичен анализ
Процентът на елиминиране на изпитваното вещество от водната фаза (Rw) се изчислява в съответствие с 1.2.2.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Ако е възможно, протоколът от изпитването съдържа следното:
|
—
|
формуляра, посочен в допълнение 3, показващ функционалните условия за изпитването,
|
|
—
|
кой апарат е избран (потвърдително изпитване на ОИСР или „метална пореста решетка“),
|
|
—
|
кой функционален режим е избран: дали режим на свързани модули или не,
|
|
—
|
какви отпадъчни води: синтетични или битови — ако са битови — датата и мястото на вземане на пробата,
|
|
—
|
каква проба за инокулиране, с дата и място на вземане на пробата,
|
|
—
|
изречение с описание на аналитичния метод, ако са провеждани специфични анализи,
|
|
—
|
графика на отнемането на ХПК или РОВ срещу времето, включително периодите на отмиване и оценка,
|
|
—
|
аналитично възстановяване на изпитваното вещество като ХПК или РОВ в изходния разтвор,
|
|
—
|
ако се провеждат специфични анализи, постройте графика на процентното отнемане на изпитваното вещество то водната фаза срещу времето (периоди на отмиване и оценка),
|
|
—
|
средното отнемане на РОВ или ХПК на изпитваното вещество и стандартното отклонение се изчисляват от резултатите за периода на оценка, т.е. когато е налице стабилно отнемане на изпитване материал или за периода на стабилно функциониране,
|
|
—
|
постройте графика на концентрацията на активираната утайка срещу времето,
|
|
—
|
всички забележки, отнасящи се до активираната утайка (изхвърляне на излишната утайка, наличие на натрупване, FeCl3, и т.н.),
|
|
—
|
концентрация на веществото, използвано при изпитването,
|
|
—
|
всички резултати, отнасящи се до анализите, направени на утайката,
|
|
—
|
цялата информация и резултатите, отнасящи се до изпитваното вещество и веществото за сравнение, ако е използвано,
|
|
—
|
научните мотиви за всички изменения в процедурата.
|
3.2. ИНТЕРПРЕТИРАНЕ НА РЕЗУЛТАТИТЕ
Слабото отнемане на изпитваното вещество от водната фаза може да се дължи на потискане на микроорганизмите от изпитваното вещество. Това може да бъде доказано и чрез лизиране или загуба на утайка, водещо до помътняване на надстоящата течност, и чрез намаляване на ефективността на отнемането на ХПК (или РОВ) в пилотната станция.
Понякога роля може да играе физико-химичното адаптиране. Разликите между биологичното действие върху молекулата и физико-химичната адсорбция могат да бъдат доказани чрез анализ на утайката след адекватна десорбция.
Ако трябва да се разграничат биологичното разграждане (или частично разграждане) и адсорбцията, са необходими допълнителни изпитвания.
Това може да се направи по много начини, но най-убедително е използването на надстояща течност като проба за инокулиране в основно изпитване (за предпочитане респирометричен тест).
Ако се наблюдава голямо отнемане на РОВ или ХПК, тогава се касае за биологично разграждане, докато, при слабо отнемане, биологичното разграждане не може да се разграничи от елиминирането. Например, ако едно разтворимо съединение показва висока константа на адсорбция 98 % и степента на допълнителното изразходване на утайката е 10 % на ден, възможно е елиминиране до 40 %. При степен на допълнително изразходване на утайка 30 %, елиминирането поради адсорбция върху или отнемане с излишната утайка може да възлезе на 65 % (4).
Когато се използва специфичен анализ, трябва да се обръща внимание на връзката между структурата на веществото и използвания специфичен анализ. В този случай наблюдаваното явление не може да бъде интерпретирано като минерализиране на веществото
4. ПРЕПРАТКИ
|
1.
|
ОИСР, Париж, 1981, Test Guideline 303 A, Решение на Съвета C(81) 30 final.
|
|
3.
|
Painter, H. A., King, E. F., WRC Porous-Pot method for assessing biodegradability, Technical Report TR70, June 1978, Water Research Centre, United Kingdom.
|
|
4.
|
Wierich, P., Gerike, P., The fate of soluble, recalcitrant, and adsorbing compounds in activated sludge plants, Ecotoxicology and Environmental Safety, vol. 5, No 2, June 1981, стр. 161 до 171.
|
|
6.
|
Streuli, H., Fehlerhafte Interpretation und Anwendung von Ausreißertests, insbesondere bei Ringversuchen zur Überprüfung analytisch-chemischer Untersuchungsmethoden, Fresenius-Zeitschrift fur Analytische Chemie, 303 (1980), стр. 406 до 408,
|
Допълнение 1
Фигура 1
Фигура 2
Допълнение 2
Фигура 1
Оборудване, използвано за оценка на биологичната разградимост

Фигура 2
Подробности за трилитровия съд за аериране „метална пореста решетка“

Допълнение 3
Функционални условия за изпитвания за симулиране на активирана утайка
Проверка във всяка група
Апаратура
|
Потвърдително изпитване на ОИСР
|
|
|
Метална пореста решетка
|
|
Функционален режим
|
Единичен модул
|
|
|
Свързани модули
|
|
|
Несвързани модули
|
|
Трансинокулиране
|
Липсва
|
|
|
Активирана утайка
|
|
|
Надстояща течност
|
|
Средно време на задържане
Основен нутриент
|
Битови отпадъчни води
|
|
|
Синтетични отпадъчни води
|
|
Проба за инокулиране
|
Вторична изходяща течност
|
|
|
Комбинирана
|
|
|
Активирана утайка
|
|
Допълнителен изпитван материал
|
От началото
|
|
|
Поетапно увеличаване
|
|
|
След образуването на утайка
|
|
Анализ
В. 11. БИОЛОГИЧНО РАЗГРАЖДАНЕ.
ИЗПИТВАНЕ ЗА ПОТИСКАНЕ ДИШАНЕТО НА АКТИВИРАНА УТАЙКА
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Описаният метод оценява ефекта на изпитваното вещество върху микроорганизмите посредством измерване на степента на дишане при дефинирани условия в присъствие на различни концентрации на изпитваното вещество.
Целта на този метод е да предостави бързо средство за пресяващо изпитване, при което веществата, можещи да окажат нежелано влияние върху станциите за биологично пречистване с аеробни микроорганизми, да бъдат идентифицирани, и да демонстрира подходящи непотискащи концентрации на изпитваните вещества, които да се използват при изпитванията за биологична разградимост.
Дефинитивното изпитване може да бъде предшествано от изпитване за определяне на диапазон. То дава информация за диапазона на концентрациите, които да се използват при основното изпитване.
В проекта за изпитването трябва да бъдат включени две контроли без изпитвано вещество, едната в началото и другата в края на експерименталната серия. Всяка партида активирана утайка трябва също да бъде проверена с помощта на вещество за сравнение.
Този метод най-лесно се използва с вещества, които поради своята разтворимост във вода и ниска летливост вероятно остават във водата.
За вещества с ограничена разтворимост в изпитваните среди може да не е възможно да се определи EC50.
Резултатите, базирани на постъпването на кислород, могат да доведат до погрешни изводи, когато изпитваното вещество притежава склонност да разединява окислителното фосфорилиране.
За провеждането на изпитването е полезно да е налице следната информация:
|
—
|
чистота на изпитваното вещество.
|
Препоръка
Активираната утайка може да съдържа потенциално патогенни организми и с нея трябва да се работи внимателно.
1.2. ОПРЕДЕЛЕНИЯ И ЕДИНИЦИ
Степента на дишане представлява кислородната консумация на микроорганизмите в аеробната утайка на отпадъчните води, изразена обичайно като mg О2 за mg утайка за час.
За да се изчисли потискащият ефект на дадено изпитвано вещество при конкретна концентрация, степента на дишане се изразява като процент от средната стойност на двете контролни степени на дишане:

където:
|
Rs
|
=
|
степен на кислородна консумация при изпитваната концентрация на веществото,
|
|
RC1
|
=
|
степен на кислородна консумация, контрола 1,
|
|
RC2
|
=
|
степен на кислородна консумация, контрола 2,
|
ЕС50 при този метод представлява концентрацията на изпитваното вещество, при която дихателната степен е 50 % от тази, която е демонстрирана от контролата при условията, описани за този метод.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Препоръчва се като вещество за сравнение да се използва 3,5-дихлорофенол, който е познат инхибитор на дишането, и да се изпитва за ЕС50 при всяка партида активирана утайка като средство за проверка дали чувствителността на утайката не е абнормна.
1.4. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Дихателната степен на активираната утайка, захранена със стандартно количество синтетични отпадъчни води, се измерва след време на експозиция 30 минути или три часа, или и двете. Измерва се също и дихателната степен на същата активирана утайка в присъствие на различни концентрации на изпитваното вещество при иначе идентични условия. Потискащият ефект на изпитваното вещество при конкретна концентрация се изразява като процент от средните дихателни степени на двете контроли. Стойност ЕС50 се изчислява от измерванията при различни концентрации.
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Резултатите от изпитването са валидни, ако:
|
—
|
дихателните степени на двете контроли не се различават помежду си с повече от 15 %,
|
|
—
|
стойността ЕС50 (30 минути и/или три часа) за 3,5-дихлорофенол е в рамките на приетия диапазон 5 до 30 mg/l.
|
1.6. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
1.6.1. Реактиви
1.6.1.1. Разтвори на изпитваното вещество,
Разтворите на изпитваното вещество са прясно приготвени в началото на изпитването, като се използва изходен разтвор. Подходящ е изходен разтвор с концентрация 0,5 g/l, ако се спазва препоръчаната по-долу процедура.
1.6.1.2. Разтвор на контролно вещество
Например, разтвор на 3,5-дихлорофенол може да бъде приготвен чрез разтваряне на 0,5 g 3,5-дихлорофенол в 10 ml lMNaOH, разреждане до приблизително 30 ml с дестилирана вода, добавяне при едновременно разбъркване на 0,5 M H2SO4 до започване на преципитация — ще бъдат необходими приблизително 8 ml 0,5 М H2SO4 — и накрая разреждане на сместа до един литър с дестилирана вода. pH трябва да бъде в диапазона от 7 до 8.
1.6.1.3. Синтетични отпадъчни води
Захранване със синтетични отпадъчни води се прави чрез разтваряне на следните количества вещества в един литър вода:
Забележка 1: Синтетичната отпадъчна вода представлява 100-кратен концентрат на този, който е посочен в Техническия доклад на ОИСР от 11 юни 1976 г.„Предложение за метод за определяне на биологичната разградимост на сърфактанти, използвани в синтетичните детергенти“, с добавка на дикалиев хидроген фосфат.
Забележка 2: Ако приготвената среда не се използва веднага, тя се съхранява на тъмно при температура от 0 до 4 oС за не по-дълго от една седмица при условия, които не водят до никаква промяна в нейния състав. Преди съхранението средата може да бъде и стерилизирана или пептонът и месният екстракт могат да бъдат добавени малко преди провеждането на изпитването. Преди употреба тя трябва да бъде щателно смесена и pH да бъде коригирано.
1.6.2. Апаратура
Апаратура за измерване: Точното проектиране не е от голямо значение. Трябва обаче да има пространство между капака на съда и водното ниво и сондата трябва да се поставя плътно в шийката на измервателната колба.
Необходимо е обичайно лабораторно оборудване, и по-конкретно следното:
|
—
|
апаратура за измерване,
|
|
—
|
устройство за аериране,
|
|
—
|
pH-електрод и устройство за измерване,
|
1.6.3. Приготвяне на проба за инокулиране
Като микробна проба за инокулиране за изпитването се използва активирана утайка от пречиствателна станция, третираща главно битови отпадъчни води.
Ако е необходимо, при връщане в лабораторията едрите частици могат да бъдат отстранени чрез краткотрайно утаяване, например за 15 минути, и отливане на горния слой по-фини твърди частици, който ще се използва. Алтернативно, утайката може да бъде смесена с помощта на миксер за няколко секунди.
Ако се смята, че съществува потискащ материал, утайката допълнително трябва да бъде измита с чешмяна вода или изотоничен разтвор. След центрофугиране надстоящата течност се отлива (тази процедура се повтаря три пъти).
Малко количество утайка се претегля и се изсушава. От този резултат може да се изчисли количеството на влажната утайка, която трябва да бъде суспендирана във водата, за да се получи активирана утайка със суспендирани в смесената течност твърди частици в рамките на диапазона между 2 и 4 g/l. Това ниво дава концентрация в експерименталната среда между 0,8 и 1,6 g/l, ако се спазва процедурата, препоръчана по-долу.
Ако утайката не може да се използва в деня на вземането, към всеки литър активирана утайка, приготвена, както е посочено по-горе, се добавят по 50 ml синтетична отпадъчна вода. След това тя се аерира една цяла нощ при температура 20 ± 2 oС. След това се аерира за използване през деня. Ако е необходимо, преди използване pH се проверява и коригира на pH от 6 до 8. Суспендираните твърди частици в смесената течност трябва да бъдат определени, както е описано в предишния абзац.
Ако през следващи дни трябва да се използва същата партида активирана утайка (максимум четири дни), в края на всеки работен ден се добавят допълнително по 50 ml синтетични отпадъчни води на литър утайка.
1.6.4. Провеждане на изпитването
|
Продължителност/време на експозиция:
|
30 минути и/или три часа, по време на които се провежда аериране
|
|
Вода:
|
Питейна вода (ако е необходимо, дехлорирана)
|
|
Снабдяване с въздух:
|
Чист, обезмаслен въздух. Въздушен дебит 0,5 до 1 l/min
|
|
Апаратура за измерване:
|
Колба с плоско дъно, например колба за определяне на БПК (биологична потребност от кислород)
|
|
О2-метър:
|
Подходящ кислороден електрод със записващо устройство
|
|
Хранителен разтвор:
|
Синтетични отпадъчни води (вж. по-горе)
|
|
Изпитвано вещество:
|
Експерименталният разтвор е прясно приготвен в началото на изпитването.
|
|
Вещество за сравнение:
|
Например 3,5-дихлорофенол (най-малко три концентрации)
|
|
Контроли:
|
Инокулирана проба без изпитвано вещество
|
|
Температура:
|
20 ± 2 oC.
|
По-долу е дадено предложение за експериментална процедура, която може да бъде следвана както за изпитваното, така и за веществото за сравнение по време на тричасовия период на експозиция:
Използват се няколко съда (например няколко еднолитрови мерителни чаши).
Трябва да се използват най-малко пет концентрации, различаващи се помежду си с постоянен фактор, за предпочитане непревишаващ 3,2.
Във времето ’0’ 16 ml синтетична отпадъчна вода се допълват с вода до 300 ml. Добавят се 200 ml микробна проба за инокулиране и цялата смес (500 ml) се излива в първия съд (първа контрола C1).
Експерименталните съдове трябва да се аерират непрекъснато, така че разтвореният О2 да не спада под 2,5 mg/l и непосредствено преди измерването на дихателната степен концентрацията на О2 да бъде около 6,5 mg/l.
Във времето ’15 минути’ (15 минути е произволен, но удобен интервал) горната процедура се повтаря с изключение на това, че 100 ml от изходния разтвор на изпитваното вещество се добавят към 16 ml синтетична отпадъчна вода преди добавяне на вода до 300 ml и микробната проба за инокулиране, така че да се получи обем от 500 ml. Тази смес после се излива във втори съд и се аерира както по-горе. Този процес се повтаря през 15-минутни интервали с различни обеми от изходния разтвор на изпитваното вещество, за да се получи серия от съдове, съдържащи различни концентрации от изпитваното вещество. Накрая се приготвя втора контрола (С2).
След три часа се регистрира pH и добре размесена проба от съдържанието на първия съд се излива в апаратурата за измерване и се измерва дихателната степен за период с продължителност до 10 минути.
Това определяне се повтаря със съдържанието на всеки съд на 15-минутни интервали по такъв начин, че времето на експозиция за всеки съд да е три часа.
Веществото за сравнение се изпитва за всяка партида микробни проби за инокулиране по същия начин.
Когато измерванията се правят след 30-минутна експозиция, е необходим различен режим (т.е. повече от един О2-метър).
Ако е необходимо измерване на химичната консумация на кислород, приготвят се допълнителни съдове, съдържащи изпитваното вещество, подхранване със синтетични отпадъчни води и вода, но не и активирана утайка. Кислородната консумация се измерва и се регистрира след аериране в продължение на 30 минути и/или три часа (време на експозиция).
2. ДАННИ И ОЦЕНКА
Дихателната степен се изчислява от записа между приблизително 6,5 mg/l О2 и 2,5 mg/l О2, или за 10-минутен период, когато дихателната степен е ниска. Частта на дихателната крива, върху която се измерва дихателната степен, трябва да бъде линейна.
Ако дихателните степени на двете контроли не се различават с повече от 15 % една от друга или ако ЕС50 (30 минути и/или три часа) на веществото за сравнение не е в приетия диапазон (от 5 до 30 mg/l за 3,5-дихлорофенол), изпитването е невалидно и трябва да бъде повторено.
Процентът на потискане се изчислява за всяка изпитвана концентрация (вижте 1.2). Построява се крива на процента на потискане срещу концентрацията на нормална логаритмична хартия (или логаритъма на вероятността) и се извежда стойността на ЕС50.
Като се използват стандартни процедури, могат да се определят 95 % граници на доверителност за стойностите на ЕС50.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Ако е възможно, протоколът от изпитването съдържа следното:
|
—
|
изпитвано вещество: данни за химическо идентифициране,
|
|
—
|
експериментална система: източник, концентрация и всяко предварително третиране на активираната утайка,
|
|
—
|
условия на изпитване,
|
—
|
pH на реакционната смес преди измерване на дишането,
|
|
—
|
експериментална температура,
|
|
—
|
продължителност на изпитването,
|
|
—
|
вещество за сравнение и неговата измерена ЕС50,
|
|
—
|
абиотично постъпване на кислород (ако има).
|
|
|
—
|
резултати:
|
—
|
крива на потискане и метод за изчисляване на ЕС50,
|
|
—
|
ЕС50 и, ако е възможно, граници на доверителност 95 %, ЕС20 и ЕС80
|
|
—
|
всички наблюдения и всички отклонения от този метод за изпитване, които може да са оказали влияние върху резултата.
|
|
3.2. ТЪЛКУВАНЕ НА ДАННИТЕ
Стойността ЕС50 трябва да се възприема просто като едно ръководство за вероятната токсичност на изпитваното вещество при пречистване на активирана отпадъчна утайка или за микроорганизмите в отпадъчните води, тъй като сложните взаимодействия, възникващи в околната среда, не могат да бъдат точно симулирани при лабораторно изпитване. Допълнително, при изпитваните вещества, които могат да имат потискащ ефект върху окислението на амония, също могат да се получат атипични криви на потискане. Съответно, такива криви трябва да бъдат интерпретирани внимателно.
4. ПОЗОВАВАНИЯ
|
(1)
|
Международен стандарт ISO 8192-1986.
|
|
(2)
|
Broecker, B., Zahn, R., Water Research 11, 1977, стр. 165.
|
|
(3)
|
Brown, D., Hitz, H. R., Schaefer, L., Chemosphere 10, 1981, стр. 245.
|
|
(4)
|
ETAD (Ecological and Toxicological Association of Dyestuffs Manufacturing Industries), Recommended Method No 103, also described by:
|
|
(5)
|
Robra, B., Wasser/Abwasser 117, 1976, стр. 80.
|
|
(6)
|
Schefer, W., Textilveredlung 6, 1977, стр. 247.
|
|
(7)
|
ОИСР, Париж, 1981, Test Guideline 209, Решение на Съвета C(84) 30 final.
|
В.12. БИОЛОГИЧНО РАЗГРАЖДАНЕ.
МОДИФИЦИРАНО SCAS ИЗПИТВАНЕ
1. МЕТОД
1.1. ВЪВЕДЕНИЕ
Целта на метода е да оцени потенциалната крайна биологична разградимост на разтворими във вода нелетливи органични вещества, когато са подложени на експозиция на относително високи концентрации на микроорганизми за продължителен период от време. През този период жизнеспособността на микроорганизмите се поддържа чрез ежедневно подхранване с утаени отпадъчни води. (За нуждите в края на седмицата, отпадъчните води могат да бъдат съхранявани при температура 4 oС. Алтернативно, може да се използват синтетичните отпадъчни води от потвърдителното изпитване на ОИСР.
Възможно е да настъпи физико-химична адсорбция на суспендираните твърди вещества и това трябва да се вземе предвид при интерпретирането на резултатите (вижте 3.2).
Поради дългия период на задържане на течната фаза (36 часа) и периодичното добавяне на хранителни вещества, изпитването не симулира условията, възникващи в пречиствателната станция за отпадъчни води. Резултатите, получени с различни изпитвани вещества, показват, че методът притежава висок потенциал за биологично разграждане.
Условията на изпитването са много благоприятни за селекция и/или адаптиране на микроорганизми, които са способни да разграждат изпитваното съединение. (Процедурата може да се използва и за получаване на аклиматизирани проби за инокулиране за използване при други изпитвания.)
При този метод концентрацията на разтворения органичен въглерод се използва за оценяване на крайната биологична разградимост на изпитваните вещества. Предпочита се РОВ да се определя след подкиселяване и продухване, а не като разликата Сoбщ – Снеорганичен.
Едновременното използване на специфичен аналитичен метод може да даде възможност за оценка на първичното биологично разграждане на веществото (изчезването на родителската химична структура).
Методът е приложим само за тези изпитвани органични вещества, които в използваната за изпитването концентрация:
|
—
|
са разтворими във вода (най-малко 20 mg разтворен органичен въглерод/l),
|
|
—
|
имат пренебрежимо ниско парно налягане,
|
|
—
|
не потискат развитието на бактериите,
|
|
—
|
не се абсорбират в значителна степен в експерименталната система,
|
|
—
|
не се губят при образуване на пяна в изпитвания разтвор=
|
Трябва да се определи съдържанието на органичен въглерод в изпитвания материал.
Информацията за относителните пропорции на основните компоненти на изпитвания материал ще бъдат полезни за интерпретиране на получените резултати, по-конкретно в случаите, когато резултатите са ниски или гранични.
Информацията за токсичността на веществото за микроорганизмите може да бъде полезна за интерпретиране на ниски резултати и за избор на подходяща експериментална концентрация.
1.2. ОПРЕДЕЛЕНИЯ И ЕДИНИЦИ
|
СT
|
=
|
концентрация на изпитваното вещество като органичен въглерод, намиращ се или добавян към утаена отпадъчна вода в началото на аерирането (mg/l),
|
|
Ct
|
=
|
концентрация на разтворения органичен въглерод, намиращ се в надстоящата течност от изпитването в края на аерирането (mg/l),
|
|
Сс
|
=
|
концентрация на разтворения органичен въглерод, намиращ се в надстоящата течност от контролата в края на аерирането (mg/l).
|
При този метод биологичното разграждане се определя като изчезване на органичния въглерод. Биологичното разграждане може да бъде изразено като:
|
1.
|
Процент на отнемане Dda на количеството ежедневно добавяно вещество.
|

|
[1]
|
където
|
Dda
|
=
|
разграждане/ежедневно добавяне.
|
|
|
2.
|
Процентното отнемане Dssd на количеството вещество, в наличност в началото на всеки ден:
|

|
2(a)]
|
|
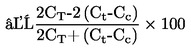
|
[2(б)]
|
където
|
Dssd
|
=
|
разграждане/вещество в началото на деня;
|
индексите i и (i + 1) се отнасят до деня на измерването.
Уравнението 2(а) се препоръчва, ако РОВ в изходящата течност варира от ден на ден, докато уравнение 2(б) може да се използва, когато РОВ в изходящата течност остава относително постоянен от ден на ден.
|
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
В някои случаи при изследване на нови вещества може да са полезни вещества за сравнение. Все още обаче не могат да бъдат препоръчани конкретни вещества за сравнение.
Представени са данните за няколко съединения, оценени с кръгови тестове (вижте допълнение 1), главно за да може се провежда от време на време калибриране на метода и да позволи сравняване на резултатите, когато се използва друг метод.
1.4. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Активираната утайка от станцията за пречистване на отпадъчни води се поставя в модул за полунепрекъснато изпитване с активирана утайка (SCAS). Добавят се изпитваното съединение и утаената битова отпадъчна вода и сместа се аерира в продължение на 23 часа. След това аерирането спира, утайката се оставя да се утаи и надстоящата течност се отстранява.
След това утайката, оставаща в камерата за аериране, се смесва с допълнителна порция изпитвано съединение и отпадъчна вода и цикълът се повтаря.
Биологичното разграждане се установява посредством определяне съдържанието на разтворения органичен въглерод в настоящата течност. Тази стойност се сравнява със стойността, определена за течността, която е получена от контролна епруветка, дозирана само с утаена отпадъчна вода.
Когато се използва специфичен аналитичен метод, могат да се измерят промените в концентрацията на родителската молекула поради биологично разграждане (първична биологична разградимост).
1.5. КРИТЕРИИ ЗА КАЧЕСТВО
Все още не е установена възпроизводимостта на този метод въз основа на отнемането на разтворения органичен въглерод. (Когато се взема предвид първичното биологично разграждане, се получават много точни данни за материали, които се разграждат във висока степен.)
Чувствителността на метода в голяма степен се определя от вариабилността на празната проба и, в по-малка степен, от точността на определянето на разтворения органичен въглерод и от нивото на изпитваното съединение в течността в началото на всеки цикъл.
1.6. ОПИСАНИЕ НА ЕКСПЕРИМЕНТАЛНАТА ПРОЦЕДУРА
1.6.1. Подготовка
Могат да се използват достатъчен брой чисти модули за аериране, алтернативно може да се използва оригиналният модул за SCAS изпитване от 1,5 l, като се поставят тръбички за аериране (фигура 1) за всяко изпитвано вещество и контролите. Сгъстеният въздух, захранващ експерименталните модули, е пречистен през филтър от памучна вата и не трябва да съдържа органичен въглерод, както и трябва да бъде предварително наситен с вода за намаляване на загубите от изпарение.
От активирана утайка от станция за пречистване главно на битови отпадъчни води се получава проба смесена течност, съдържаща 1 до 4 g/l суспендирани твърди вещества. За всека модул за аериране са необходими приблизително 150 ml смесена течност.
Изходните разтвори на изпитваното вещество се приготвят с дестилирана вода. Нормално необходимата концентрация е 400 mg/l, като органичният въглерод дава концентрация 20 mg/l въглерод за изпитваното съединение в началото на всеки цикъл на аериране, ако не настъпва биологично разграждане.
Ако токсичността за микроорганизмите разрешава, позволени са и по-високи концентрации.
Измерва се съдържанието на органичен въглерод в изходните разтвори.
1.6.2. Условия на изпитване
Изпитването трябва да се провежда при температура от 20 до 25 oС.
Използва се по-висока концентрация на аеробни микроорганизми (от 1 до 4 g/l суспендирани твърди вещества) и ефективният период на задържане е 36 часа. Съдържащият въглерод материал в захранващите отпадъчни води се окислява екстензивно, нормално в рамките на осем часа след началото на всеки цикъл на аериране. Впоследствие утайката има само ендогенно дишане през остатъка от аерирането, като през това време единственият съществуващ субстрат е изпитваното съединение, освен ако то също не се метаболизира лесно. Тези характеристики, комбинирани с ежедневно повторно инокулиране с използване на битови отпадъчни води като среда, създават много благоприятни условия както за аклиматизиране, така и за високи степени на биологично разграждане.
1.6.3. Провеждане на изпитването
Получава се проба смесена течност от подходяща станция за предимно битова активирана утайка или от лабораторен модул, като тя се съхранява при аеробни условия, докато се използва в лабораторията. Всеки модул за аериране, а също всеки контролен модул се напълват със 150 ml смесена течност (ако се използва оригиналният модул за SCAS изпитване, умножете дадените обеми по 10) и се започва аериране. След 23 часа аерирането се спира и утайката се оставя да се утаи за 45 минути. Кранът на всеки съд се отваря и се изтеглят 100 ml порции от надстоящата течност. Непосредствено преди използването се получава проба от утаена битова отпадъчна вода и към утайката, оставаща във всеки модул за аериране, се добавят по 100 ml от нея. Аерирането започва отново. На този етап не се добавят материали за изпитване и модулите се захранват ежедневно с битова отпадъчна вода само докато при утаяването се получи бистра надстояща течност. Това обикновено отнема две седмици, до което време разтвореният органичен въглерод в надстоящата течност в края на всеки цикъл на аериране достига постоянна стойност.
В края на този период индивидуалните утаени утайки се смесват и към всеки модул се добавят по 50 ml от получената смесена утайка.
Към контролните модули се добавят по 95 ml от утаената отпадъчна вода и 5 ml от водата, а към експерименталните модули се добавят 95 ml от утаената отпадъчна вода плюс 5 ml от изходния разтвор на съответното изпитвано съединение (400 mg/l). Аерирането започва отново и продължава 23 часа. След това утайката се оставя да се утаи в продължение на 45 минути, изтегля се надстояща течност и се анализира за съдържание на разтворен органичен въглерод.
Горната процедура на напълване и изтегляне се повтаря ежедневно по време на цялото изпитване.
Преди утаяването може да се наложи почистване на стените на модулите за предотвратяване акумулирането на твърди вещества над нивото на течността. За всеки модул се използват отделна стъргалка и четка за предотвратяване на кръстосано замърсяване.
В идеалния случай разтвореният органичен въглерод в надстоящата течност се определя ежедневно, въпреки че е разрешено и по-рядко анализиране. Преди анализите течността се филтрира през промити мембранни филтри с размер на порите 0,45 μm или се центрофугира. Мембранните филтри са подходящи, ако е сигурно, че те нито освобождават въглерод, нито абсорбират веществото по време на филтрирането. Докато се намира в центрофугата, температурата на пробата не трябва да надвишава 40 oС.
Продължителността на изпитването за съединения, демонстриращи слабо или липсващо биологично разграждане, е неопределена, но въз основа на опита може да се предположи, че тя трябва да бъде обикновено не по-малка от 12 седмици, но не по-голяма от 26 седмици.
2. ДАННИ И ОЦЕНКА
От стойностите на разтворения органичен въглерод в надстоящата течност от експерименталните и контролните модули се построява графика срещу времето.
При постигане на биологично разграждане нивото, достигнато при изпитването, се доближава до нивото, достигнато при контролите. След като се установи, че разликата между двете нива е постоянна в продължение на три последователни измервания, правят се такъв брой допълнителни измервания, че да бъдат достатъчни за статистическа обработка на данните. и се изчислява процентът на биологично разграждане на изпитваното съединение (Dda или Dssd, вижте 1.2).
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Ако е възможно, протоколът от изпитването съдържа следното:
|
—
|
цялата информация за типа отпадъчна вода, типа използвани модули и експерименталните резултати, отнасящи се до изпитваното вещество, веществото за сравнение, ако се използва, и празната проба,
|
|
—
|
кривата на отнемане с описание, начина на изчисляване (вижте 1.2),
|
|
—
|
дата и място на вземане на проби от активирана утайка и отпадъчни води, състояние на адаптиране, концентрация и т.н.,
|
|
—
|
научните мотиви за всички изменения в експерименталната процедура,
|
3.2. ИНТЕРПРЕТИРАНЕ НА РЕЗУЛТАТИТЕ
Тъй като веществото, което се изпитва по този метод, няма да подлежи на лесно биологично разграждане, отстраняването на РОВ, дължащо се единствено на биологично разграждане, нормално ще бъде постепенно в продължение на дни или седмици, освен в случаи, когато аклиматизирането е внезапно, както се вижда от рязкото изчезване, възникващо след няколко седмици.
Физикохимичната адсорбция, обаче, понякога може да играе важна роля. Това се вижда, когато е налице пълно или частично отнемане на добавения в началото РОВ. Какво ще се случи впоследствие, зависи от фактори, като степента на адсорбция и концентрацията на суспендираните твърди вещества в изхвърлената изходяща течност. Обикновено разликата между концентрациите на РОВ в контрола и експерименталните надстоящи течности постепенно нараства в сравнение с първоначалната ниска стойност и, освен ако не настъпи аклиматизиране, тази разлика после остава при новата стойност за останалата част от експеримента.
Ако трябва да се направи разграничение между биологичното разграждане (или частично разграждане) и адсорбцията, са необходими допълнителни изпитвания. Това може да се направи по много начини, но най-убедително е използването на надстоящата течност или утайката като проба за инокулиране в основно изпитване (за предпочитане респирометричен тест).
Изпитваните вещества с високо неадсорбтивно отнемане на РОВ при това изпитване трябва да се приемат за потенциално биологично разградими. Частичното неадсорбтивно отнемане показва, че химическото вещество е подложено на най-малко частично биологично разграждане.
Ниското или близкото до нула отнемане на РОВ може да се дължи на потискане на микроорганизмите от изпитваното вещество и това може да се докаже и чрез лизиране или загуба на утайка, водещо до образуване на мътна надстояща течност. Изпитването трябва да бъде повторено, като се използва по-ниска концентрация на изпитваното вещество.
Използването на специфичен аналитичен метод или маркирано с 14С изпитвано вещество могат да дадат възможност за по-голяма чувствителност. При маркирано с 14С изпитвано съединение възстановяването на 14СО2 ще потвърди, че е настъпило биологично разграждане.
Когато резултатите са дадени и за първичното биологично разграждане, ако е възможно, трябва да бъде дадено обяснение за изменението в химичната структура, която води до загуба на отговор при родителското изпитвано вещество.
Потвърждаването на аналитичния метод трябва да бъде представено заедно с отговора, получен при празната експериментална среда.
4. ПОЗОВАВАНИЯ
|
(1)
|
ОИСР, Париж, 1981, Test Guideline 302 А, Решение на Съвета С(81) 30 окончателен.
|
Допълнение 1
SCAS изпитване: примерни резултати
|
Вещество
|
СT
(mg/l)
|
сt—сc
(mg/l)
|
Процент на биологично разграждане
Dda
|
Продължителност на изпитването,
(дни)
|
|
4-ацетрил-аминобензен
|
17,2
|
2,0
|
85
|
40
|
|
Тетра-пропилен бензен
|
17,3
|
8,4
|
51,4
|
40
|
|
4-нитрофенол
|
16,9
|
0,8
|
95,3
|
40
|
|
Диетилен гликол
|
16,5
|
0,2
|
98,8
|
40
|
|
Анилин
|
16,9
|
1,7
|
95,9
|
40
|
|
Циклопентан тетра карбоксилат
|
17,9
|
3,2
|
81,1
|
120
|
Допълнение 2
Примерна експериментална апаратура
Фигура 1

В.13. БИОКОНЦЕНТРАЦИЯ: ПРОТОЧЕН ТЕСТ ВЪРХУ РИБИ
1. МЕТОД
Настоящият метод на биоконцентрация е точно копие на ОECD TG 305 (1996 г.).
1.1. УВОД
Настоящият метод описва процедура за охарактеризиране на биоконцентрационния потенциал на вещества в риба при проточни условия. Въпреки че проточните тестови режими са за предпочитане, полустатичните режими също са допустими, при условие че са удовлетворени критериите за валидност.
Методът дава достатъчно подробности за извършване на теста, като същевременно допуска задоволителна свобода за адаптиране на експерименталния проект към условията в отделните лаборатории и по отношение на променящите се характеристики на тестовите вещества. Той се прилага най-успешно при стабилни органични химикали със стойности log Pow между 1,5 и 6,0 (1), но може да се прилага към суперлипофилни вещества (с log Pow > 6,0). Предварителната оценка на коефициента на биоконцентрация (BCF), понякога отбелязван като KB, за такива суперлипофилни вещества вероятно ще бъде по-голяма от стойността на коефициента на биоконцентрация в устойчиво състояние (BCFSS), която се очаква при лабораторни експерименти. Предварителните оценки на коефициента на биоконцентрация за органични химикали с log РОW-стойности до около 9,0 могат да се получат чрез използване на уравнението на Bintein аt al (2). Параметрите, които характеризират биоконцентрационния потенциал, включват константата на скорост на поглъщане (k1), константата на скорост на очистване (k2) и BCFSS.
Радиомаркираните тестови вещества могат да улеснят анализа на водата и на пробите риба и могат да се използват за определяне на това, дали да се прави идентификация за израждане и количествена оценка. Ако се измерят общите радиоактивни отпадъци (например чрез изгаряне или разтваряне на тъкани), то BCF се базира на основното съединение, на всички задържани метаболити, а също и на асимилирания въглерод. Коефициентите BCF, базирани на общите радиоактивни отпадъци, могат следователно да се сравняват директно с BCF, получен при специфичен химически анализ само на основното съединение.
При радиомаркирани изследвания може да се използват процедури за очистване, за да се определи BCF, базиран на основното съединение, а главните метаболити се охарактеризират, ако се сметне за необходимо. Възможно е също да се комбинира изследване на метаболизма при рибите с изследване на биоконцентрацията, чрез анализ и идентификация на отпадъците в тъканите.
1.2. ОПРЕДЕЛЕНИЯ И ЕДИНИЦИ
Биоконцентрация/биоакумулиране е увеличението в концентрацията на тестовото вещество във или върху организъм (определени негови тъкани), отнесено към концентрацията на тестовото вещество в заобикалящата среда.
Коефициентът на биоконцентрация (BCF или KB) по всяко време на фазата на поглъщане в този акумулиращ тест е концентрацията на тестовото вещество във/върху рибата или определени нейни тъкани (Cf като μg/g (ррm), разделено на концентрацията на химикала в окръжаващата среда (Cw като μg/ml (ррm).
Коефициент на биоконцентрация в устойчиво състояние (BCFSS или KB) не се променя съществено за дълъг период от време, като концентрацията на тестовото вещество в окръжаващата среда през този период е константа.
Равна линия (плато), или устойчиво състояние на графиката на тестовото вещество в рибата (Cf) спрямо времето, се достига, когато кривата стане успоредна на времевата ос и са направени три успешни анализа на Cf на проби, взети на интервали от поне два дни, които три анализа не се отличават с повече от ± 20 % един от друг, и няма никакви съществени разлики между трите периода на вземане на проба. Когато се анализират обединени проби, са необходими поне четири успешни анализа. За тестови вещества, които са взети бавно, е по-подходящо интервалите да бъдат по седем дни.
Коефициентите на биоконцентрация, изчислени директно от константите на кинетичната скорост (k1/k2), се определят като кинетичен коефициент на концентрация, BCFk.
Коефициентът на разпределение октанол-вода (Pow) е съотношението на химичната разтворимост в n-октанол и водата при равновесно състояние (метод А.8), изразяван също като Kow. Логаритъмът от Pow се използва като индикация на химичния потенциал за биоконцентрация при водни организми.
Фазата на излагане или поглъщане е времето, през което рибата е изложена на въздействието на тестовия химикал.
Константата на скорост на поглъщане (k1) е цифровата стойност, определяща скоростта на нарастване на концентрацията на тестовото вещество във/върху рибата, подложена на теста (или определени нейни тъкани), когато рибата е изложена на въздействието на този химикал (k1 се изразява в ден-1).
Фазата след излагането или очистването (загуба) е времето, което следва след прехвърлянето на тестовата риба от среда, съдържаща тестово вещество, към среда, несъдържаща такова вещество, през което време се изследва очистването (или нетната загуба) на веществото от тестовата риба (или определени нейни тъкани).
Константа за скорост на очистването (загуба) (k2) е цифровата стойност, определяща скоростта на намаляване на концентрацията на тестовото вещество в тестовата риба (или определени нейни тъкани), следваща прехвърлянето на тестовата риба от среда, съдържаща тестово вещество, към среда, несъдържаща такова вещество (k2 се изразява в ден-1).
1.3. ПРИНЦИП НА ТЕСТОВИЯ МЕТОД
Тестът се състои от две фази: фаза на излагане на въздействие (поглъщане) и фаза след излагане (очистване). По време на фазата на поглъщането отделни групи риба от един вид се излагат на поне две концентрации на тестовото вещество. След това те се прехвърлят в среда, несъдържаща тестово вещество. Фазата на очистването е необходима винаги, освен ако поглъщането на веществото по време на тази фаза е незначително (например BCF е по-малко от 10). Концентрацията на тестовото вещество във/върху рибата (или определени нейни тъкани) се проследява по време на двете фази на теста. Освен двете тестови концентрации, една контролна група риби се държи при идентични условия с изключение на отсъствието на тестово вещество, за да се отнесат възможните странични ефекти, наблюдавани при теста за биоконцентрация, към съответната контролна група и да се получат концентрации за тестовото вещество.
Фазата на поглъщането протича 28 дни, освен ако не се установи, че равновесието е достигнато по-рано. Предвиждане за дължината на фазата на поглъщането и времето за достигане на устойчиво състояние може да се направи на база уравнението от приложение 3. След това започва периодът за очистване, като рибата се прехвърля към същата среда, но без тестово вещество, в друг чист съд. Когато е възможно, коефициентът на биоконцентрация се изчислява, за предпочитане както чрез съотношението (BCFSS) на концентрацията на рибата (Cf) и във водата (Cw) при видимо устойчиво състояние, така и като коефициент за кинетична биоконцентрация (BCFk), като съотношение на константите на скоростта на поглъщането (k1) и очистването (k2), приемайки кинетика от първи ред. Ако не се получава с кинетика от първи ред, се използват по-сложни модели (приложение 5).
Ако устойчивото състояние не се постигне за 28 дни, фазата на поглъщането се удължава, докато се постигне устойчиво състояние, или за още 60 дни, в зависимост от това кое ще се случи по-напред; след това започва фазата на очистването.
Константите на скоростта на поглъщането, на очистването (загуба) (или константите, при които се използват по-сложни модели), коефициентът на биоконцентрация и, когато е възможно, доверителните граници на всеки един от тези параметри се изчисляват от модела, който най-добре описва измерените концентрации на тестовото вещество в рибата и водата.
BCF се изразява като функция на общото мокро тегло на рибата. За специални цели обаче определени тъкани или органи (например мускули, черен дроб) могат да се използват, ако рибата е достатъчно голяма или може да се раздели на ядивна част (филе) и неядивна част (вътрешности). Тъй като при много органични вещества има ясна връзка между потенциала за биоконцентрация и липофилността, то има също и съответна връзка между липидното съдържание на тестовата риба и наблюдаваната биоконцентрация на такива вещества. Следователно, за да се намали този източник на променливост в тестовите резултати за веществата с висока липофилност (т.е. с log Pow > 3), биоконцентрацията се изразява по отношение на липидно съдържание като допълнение към цялото телесно тегло.
Липидното съдържание се определя върху същия биологичен материал, който се използва за определяне на концентрацията на тестовото вещество, когато това е възможно.
1.4. ИНФОРМАЦИЯ ЗА ТЕСТОВОТО ВЕЩЕСТВО
Преди провеждането на теста за биоконцентрация трябва да се знае следната информация за тестовото вещество:
|
—
|
коефициент на разпределение октанол-вода Pow (обозначаван също като Kow, определен чрез HPLC метода в А.8);
|
|
—
|
фототрансформация във вода, определена при слънчево лъчене или при условия, симулиращи слънчево лъчене, и при условия на лъчене на теста за биоконцентрация (3);
|
|
—
|
повърхностно напрежение (т.е. за вещества, при които log Pow не може да се определи);
|
|
—
|
готово биологично разграждане (когато е уместно).
|
Друга необходима информация е токсичността към рибните видове, която се използва в теста, за предпочитане асимптотичен LC50 (т.е. независим по време). Необходими са подходящ аналитичен метод, с позната точност, прецизност и чувствителност, за количественото определяне на тестовото вещество в тестовите разтвори и биологичен материал, заедно с подробности за подготовката на пробата и нейното съхранение. Аналитичната граница за детекция на тестовото вещество както във вода, така и в рибните тъкани, трябва също да се познават. Когато се използва 14С маркирано тестово вещество, трябва да се знае процентът радиоактивност, свързан с примесите.
1.5. ВАЛИДНОСТ НА ТЕСТА
За да бъде валиден един тест, трябва да се прилагат следните условия:
|
—
|
температурното колебание да е по-малко от ± 2oС,
|
|
—
|
концентрацията на разтворения кислород да не пада под 60 % насищане,
|
|
—
|
концентрацията на тестовото вещество в камерите да се поддържа в рамките на ±20 % от усреднените величини на измерените стойности по време на фазата на поглъщане,
|
|
—
|
смъртността или други странични ефекти/болести както в контролната, така и в обработваната риба да е по-малка от 10 % в края на теста; когато тестът продължи повече от няколко седмици или месеци, смъртността или други странични ефекти в двата комплекта риба да е по-малка от 5 % за месец и да не превишава общо 30 %.
|
1.6. ЕТАЛОННИ СЪЕДИНЕНИЯ
Използването на еталонни съединения с познат биоконцентрационен потенциал би било полезно при проверката на експерименталната процедура, когато е необходимо. Специфични вещества обаче все още не могат да се препоръчат.
1.7 ОПИСАНИЕ НА ТЕСТОВИЯ МЕТОД
1.7.1. Апаратура
Трябва внимателно да се избягва използването на материали за всички части от оборудването, които могат да разтворят, абсорбират или разтопят и да окажат страничен ефект върху рибата. Могат да се използват стандартни правоъгълни или цилиндрични резервоари, изработени от химически инертен материал, с подходящ обем спрямо скоростта на зареждане. За предпочитане е да се използва Teflon (R), неръждаема стомана и/или стъклени тръби, а използването на тръби от мека пластмаса да се ограничи до минимум. Опитът показва, че за вещества с високи коефициенти на абсорбция, като синтетични пиретроиди например, може да се изисква използването на силикатни стъкла. В такива ситуации оборудването трябва да се изхвърли след употреба.
1.7.2. Вода
Обикновено в теста се използва натурална вода, която се взема от незамърсен източник с постоянно качество на водата. Водата за разреждане трябва да има качество, което да позволява оцеляването на избраните видове риба за периодите на аклиматизация и тест, без те да показват необичаен външен вид или поведение. В идеалния случай трябва да се демонстрира, че тестовите видове могат да оцеляват, да растат и да се възпроизвеждат в разреждащата вода (например в лабораторна култура или тест за токсичност при жизнен цикъл). Водата трябва да се характеризира поне чрез рН, твърдост, общо съдържание на твърди частици, общо съдържание на органичен въглерод и, за предпочитане, амониеви йони, нитрит и алкалност, а за морските видове — и соленост. Параметрите, които са важни за оптималното физическо състояние, са напълно известни, но приложение 1 дава препоръчителните максимални концентрации за определен брой параметри за тест при сладководни басейни и морски води.
Водата трябва да има постоянно качество по време на целия период на теста. Нейната рН трябва да е в границите от 6,0 до 8,5, но по време на даден тест тя трябва да е в границите на ±0,5 рН единици. С цел да се обезпечи, че разреждащата вода няма да повлияе прекомерно върху резултата от теста (например чрез образуване на комплексни съединения с тестовото вещество) или да окаже странично въздействие върху качествата на семейството риби, на определени интервали трябва да се вземат проби за анализ. Определянето на тежки метали (например Cu, Pb, Zn, Hg, Cd, Ni), главни аниони и катиони, (например Са, Mg, Na, K, Cl, SO4), пестициди (например общо органофосфорни и общо органохлорни пестициди), общо органичен въглерод и суспендирали твърди частици трябва да се прави, например, на всеки три месеца, когато се знае, че разреждащата вода има относително постоянно качество. Ако се установи, че качеството на водата е постоянно за период от поне една година, тези определяния могат да се правят по-рядко и интервалите да се удължат (примерно на всеки шест месеца).
Съдържанието на природни частици, а също и общото съдържание на органичен въглерод (ТОС) на разредената вода трябва да е възможно най-ниско, за да се избегне абсорбция на органична материя от тестовото вещество, която може да намали неговата биологична степен на абсорбция (4). Максимално допустимата стойност е 5 mg/l за определено конкретно вещество (сухо вещество, непреминаващо през 0,45 μm филтър) и 2 mg/1 за общото количество органичен въглерод (вж. приложение 1). Ако е необходимо, водата се филтрира преди употреба. Приносът на органичния въглерод във водата от тестовата риба (екскрети) и от хранителните остатъци трябва да е възможно най-нисък. По време на теста концентрацията на органичен въглерод в тестовия съд не трябва да превишава концентрацията на органичен въглерод, получаван от тестовото вещество, и на разтварящия агент, ако се използва такъв, с повече от 10 mg/1 (± 20 %).
1.7.3. Тестови разтвори
Приготвя се основен разтвор от тестовото вещество в подходяща концентрация. Той се приготвя чрез просто смесване или разбъркване на тестовото вещество в разреждаща вода. Не се препоръчва употребата на разтворители или диспергиращи агенти (разтварящи агенти); това обаче може да се получи в някои случаи с цел да се направи подходящо концентриран основен разтвор. Могат да се използват следните разтворители: етанол, метанол, етиленгликол монометилетер, етиленгликол диметилетер, диметилформамид и триетиленгликол. Като диспергиращи агенти могат да се използват Cremophor RH40, Tween 80, метилцелулоза 0,01 % и НСО-40. Трябва да се внимава, когато се използват агенти с лесно биоразграждане, тъй като те могат да причинят проблеми при бактериалния растеж в проточните тестове. Тестовото вещество може да бъде радиомаркирано и трябва да има най-голямата чистота (например за предпочитане > 98 %).
За проточни тестове се изисква система, която непрекъснато дозира и разрежда основен разтвор от тестовото вещество (например дозираща помпа, пропорционален разредител, система за насищане) и го изпраща към тестовите камери. Допускат се поне пет замествания на обема на ден през всяка тестова камера. Проточният метод е за предпочитане, но където това не е възможно (например когато тестовите организми са подложени на неблагоприятно въздействие), може да се използва полустатичната техника, при условие че са удовлетворени критериите за валидност. Дебитите на основните разтвори и разреждащата вода се проверяват 48 часа преди теста и след това поне веднъж на ден по време на теста. Тази проверка включва определянето на дебита през всяка камера и следенето да не варира с повече от 20 % както във, така и извън камерите.
1.7.4. Избор на видове
Важни критерии при избора на видове са те да са достъпни, да могат да се получат с необходимите размери и да могат да се гледат в лабораторни условия. Другите критерии при избора на видове риба включват развлекателното, търговското и екологичното значение, а също и сравнима чувствителност, успешна употреба в миналото и т.н.
Препоръчваните видове риба са дадени в приложение 2. Могат да се използват и други видове, но може да се наложи адаптиране на тестовата процедура за постигане на подходящи тестови условия. В този случай се докладват обосновката за избора на видовете и експерименталният метод.
1.7.5. Хващане на рибата
Аклиматизирайте основната популация риба за поне две седмици във вода при тестова температура и я хранете достатъчно добре, на същия хранителен режим, на който ще бъде и по време на теста.
След 48-часов период се отчита смъртността и се прилагат следните критерии:
|
—
|
при смъртност, по-голяма от 10 % за седем дни: откажете цялата партида,
|
|
—
|
при смъртност между 5 и 10 % за седем дни: аклиматизирайте още седем дни,
|
|
—
|
при смъртност, по-малка от 5 % за седем дни: приемете партидата; ако смъртността през втората седмица надвиши 5 %, откажете цялата партида.
|
Уверете се, че рибата, която използвате при тестовете, не страда от видими болести и отклонения. Изхвърлете болната риба. Рибата не трябва да бъде лекувана от болести две седмици преди теста или по време на теста.
1.8. ИЗВЪРШВАНЕ НА ТЕСТА
1.8.1. Предварителен тест
Би било полезно да се извърши един предварителен експеримент с цел да се оптимизират тестовите условия на окончателния тест, например изборът на концентрация(и) на тестовото вещество, продължителност на фазите на поглъщане и очистване.
1.8.2. Условия на експозиция
1.8.2.1. Продължителност на фазата на поглъщане
Предвиждане за продължителността на фазата на поглъщане може да се направи на база практически опит (например от предишно изследване или химикал, свързан с акумулиране) или от определени емпирични взаимовръзки, използващи познания относно водоразтворимостта или коефициента на разпределение на октанол/вода на тестовото вещество (вж. приложение 3).
Фазата на поглъщане трае 28 дни, освен ако не се установи, че равновесието е постигнато по-рано. Ако устойчивото състояние не се постигне за 28 дни, фазата на поглъщане трябва да се удължи, докато се постигне устойчиво състояние или с още 60 дни, в зависимост от това кое ще се случи по-напред.
1.8.2.2. Продължителност на фазата на очистването
Обикновено, за да се получи подходящо (например 95 %) намаляване на веществото в тялото на рибата (вижте приложение 3 за обяснение на оценката), е необходим период от време на половината от периода на поглъщане. Ако времето, необходимо за да се постигне 95 % загуба, е прекалено дълго, превишаващо два пъти нормалната продължителност на фазата на поглъщане (т.е. повече от 56 дни), може да се използва по-къс период (т.е. докато концентрацията на тестовото вещество стане по-малко от 10 % от концентрацията в устойчиво състояние). Обаче за вещества, които имат по-сложни схеми на поглъщане и очистване, отколкото са тези, представени чрез модел риба от една категория, даващи кинетика от първи ред, трябва да се оставят по-дълги фази на очистване за да се определят константите за загуба на скорост. Периодът може да се регулира чрез периода, през който концентрацията на тестовото вещество в рибата остава над аналитичния лимит на детекция.
1.8.2.3. Брой на тестовите риби
Подберете такъв брой риби за теста, че да има минимум по 4 риби за проба при всяко вземане на проба. Ако са необходими повече статистически данни, ще трябват и повече риби за проба.
Ако се използват възрастни риби, отчетете какви се използват в експеримента — мъжки, женски или смесени. Ако се използват риби и от двата пола, разликите в липидното съдържание между половете се документира като незначително преди началото на излагането; може би ще е необходимо събирането на мъжките и женските риби.
За всеки един тест се избират риби с близко тегло, така че най-малките да не са по-малки от две трети теглото на най-големите. Рибите трябва да са от един и същи годишен клас и от един и същи източник. Понеже теглото и възрастта на една риба понякога оказва значително влияние върху BCF-стойностите (1), тези подробности се записват акуратно. Препоръчва се по-малка проба риби да се измери преди теста, за да се прецени средното тегло.
1.8.2.4. Зареждане
Използват се високи съотношения вода към риба, за да се намали до минимум намаляването на Cw, причинено от прибавянето на риба в началото на теста, а също за да се избегне намаляване на концентрацията на разтворения кислород. Важно е скоростта на зареждане да е подходяща спрямо използваните видове за теста. При всички случаи скорост на зареждане от 0,1 до 1,0 g риба (мокро тегло) за литър вода на ден е нормално препоръчваната скорост. По-високи скорости могат да се използват, ако се установи, че желаната концентрация на тестовото вещество може да се поддържа в рамките на ± 20 % и че концентрацията на разтворения кислород не пада под 60 % насищане.
При подбора на подходящи режими на зареждане се отчита нормалният хабитат на рибите. Например дънните риби може да изискват повече място на дъното на аквариума за същия обем вода в сравнение с пелагичните видове.
1.8.2.5. Хранене
По време на аклиматизационния и тестовия период хранителният режим на рибата е на база познато съдържание на липиди и протеини при количество, достатъчно да я поддържа здрава и да запазва теглото ѝ. През тези периоди рибата дневно се храни с количества от 1 до 2 % от телесеното ѝ тегло; това поддържа липидната концентрация на постоянно ниво по време на теста при повечето видове риби. Количеството храна се преизчислява, например веднъж седмично, за да може да се поддържа постоянно телесно тегло и липидно съдържание. За целите на това изчисление теглото на рибата във всяка тестова камера се пресмята на база теглото на рибата, тествана напоследък в тази камера. Не претегляйте теглото на рибата, останала в камерата.
Неконсумираната храна и изпражненията се източват ежедневно от камерите малко след храненето (30 минути до 1 час). Камерите се поддържат колкото е възможно най-чисти по време на теста, така че концентрацията на органично вещество да е възможно най-ниска, тъй като присъствието на органичен въглерод може да ограничи биологичната годност на тестовото вещество (1).
Понеже много от храненията са получени от рибно месо, то те се анализират за тестовото вещество. Желателно е също да се анализират за пестициди и тежки метали.
1.8.2.6. Светлина и температура
Фотопериодът обикновено е от 12 до 16 часа, а температурата (± 2oС) трябва да е подходяща за тестовите видове (вж. приложение 2). Типът и характеристиките на осветлението трябва да са познати. Трябва да се внимава относно възможната фототрансформация на тестовото вещество при условията на лъчението на изследването. Използва се подходящо осветление, за да се избегне излагане на рибата на неестествени фотопродукти. В някои случаи може да е подходяща употребата на екран, ограничаващ ултравиолетовите излъчвания под 290 nm.
1.8.2.7. Тестови концентрации
Рибата се излага на проточни условия при поне две концентрации на тестовото вещество във водата. Обикновено по-високата (или най-високата) концентрация се избира да бъде около 1 % от нейната силна асимптотична LC50 и поне 10 пъти по-висока от нейния лимит на детекция във вода чрез използвания аналитичен метод.
Най-високата тестова концентрация може също да бъде определена чрез разделяне на силната 96 h LC50 при подходящото съотношение силна/продължителна (подходящи съотношения за някои химикали могат да бъдат от 3 до 100). Ако е възможно, изберете друга концентрация(и), така че тя да се различава от горната с коефициент 10. Ако това не е възможно поради критерия 1 % от LC50 и аналитичния лимит, може да се използва коефициент или да се разглежда използването на 14С маркирано тестово вещество. Нито една от използваните концентрации не трябва да е над разтворимостта на тестовото вещество.
Когато се използва разтварящ агент, неговата концентрация не трябва да е по-голяма от 0,1 ml/l и трябва да бъде една и съща във всички тестови съдове. Неговият принос, заедно с тестовото вещество, към общото съдържание на органичен въглерод в тестовата вода трябва да е познат. Необходимо е обаче да се положат максимални усилия за избягване употребата на такива материали.
1.8.2.8. Контролни проверки
Една контролна проверка на разреждащата вода или, ако е уместно, на разтварящия агент се извършва допълнително към тестовите серии, при условие че е установено, че агентът няма въздействия върху рибата. Ако не е така, се залагат и двете контролни проверки.
1.8.3. Честота на измерванията на чистотата на водата
По време на теста разтвореният кислород, ТОС, рН и температурата се измерват във всички съдове. Общата твърдост и соленост, ако е уместно, се измерват при контролните проверки и един съд с по-висока (или най-високата) концентрация. Като минимум разтвореният кислород и солеността, ако е уместно, се измерват 3 пъти — в началото, около средата и в края на периода на поглъщане — и веднъж седмично в периода на очистване. ТОС се измерва в началото на теста (24 часа и 48 часа преди началото на теста във фазата на поглъщане). Температурата се измерва ежедневно, рН — в началото и края на всеки период, а твърдостта — веднъж за всеки тест. Желателно е температурата да се контролира непрекъснато поне в един съд.
1.8.4. Вземане на проба и анализ на рибата и водата
1.8.4.1. Програма за вземане на проба на вода и риба
Проба от водата от тестовите камери за определяне на концентрацията на тестовото вещество се взема преди слагането на рибата и по време както на фазата на поглъщане, така и на фазата на очистване. Като минимум проба от водата се взема по същото време, когато се взема от рибата, и преди хранене. По време на фазата на поглъщане се определят концентрациите на тестовото вещество, за да се провери съответствието с критериите за валидност.
Проба от рибата се взема поне при пет случая през фазата на поглъщане и поне при четири през фазата на очистване. Тъй като при някои случаи ще бъде трудно да се пресметне една сравнително точна преценка на стойността на BCF на база броя на пробите, особено когато се използва друга кинетика освен простата кинетика за очистване от първи ред, то може би е препоръчително да се вземат проби по-често и в двата периода (вж. приложение 4). По-голямото количество взети проби се съхранява и анализира само ако резултатите от първия кръг анализи докажат, че не се адекватни за изчислението на BCF c желаната точност.
Пример за приемлива програма за вземане на проби е даден в приложение 4. Могат да се изчислят и други програми, с помощта на други приети стойности на Pow, за да се изчисли времето за излагане при 95 % поглъщане.
Вземането на проби продължава през фазата на поглъщането до установяване на устойчивото състояние или 28 дни, в зависимост от това кое се случва по-напред. Ако устойчивото състояние не се постигне за 28 дни, вземането на проби продължава, докато се постигне или още 60 дни, в зависимост от това кое се случва по-напред. Преди началото на фазата на очистването рибата се прехвърля в чисти резервоари.
1.8.4.2. Вземане на проба и подготовка на пробата
Анализите на водните проби се получават, например, чрез източване през инертни тръби от централната точка в тестовата камера. Понеже нито филтрирането, нито центрофугирането могат винаги да отделят фракцията от тестовото вещество, която не е биологично годна, от тази, която е (особено за суперлипофилни химикали, т.е. онези химикали с log Pow > 5) (1) (5), пробите може да не са обекти на такова третиране.
Вместо това се правят измервания, за да се поддържат резервоарите колкото е възможно най-чисти и общото съдържание на органичен въглерод се контролира и през двете фази — на поглъщане и на очистване.
Подходящ брой риби (нормално минимум четири) се изваждат от тестовите камери при всяко вземане на проби. Тези риби се изплакват бързо с вода, изсушават се и се убиват моментално чрез най-подходящия и хуманен метод, след което се претеглят.
Желателно е рибата и водата да се анализират веднага след вземането на проба с цел да се избегне разлагането или други загуби и да се изчислят приблизителните скорости на поглъщане и очистване, докато тестът продължава. Незабавните анализи избягват закъснението, когато се достига равната част (платото) на кривата.
Ако не се извършат незабавни анализи, пробите се съхраняват по подходящ метод. Преди началото на изследването се проучва информацията относно подходящи методи за съхранение на конкретното тестово вещество — например дълбоко замразяване, съхранение при 4 oС, продължителност на съхранението, екстракция и др.
1.8.4.3. Качество на аналитичния метод
Понеже цялата процедура се обуславя по същество от точността, прецизността и чувствителността на аналитичния метод, използван за тестовото вещество, проверете експериментално дали прецизността и възпроизводимостта на химичния анализ, а също и възстановяването на тестовото вещество от водата и рибата са задоволителни за конкретния метод. Проверете също тестовото вещество да не е забележимо в използваната разреждаща вода.
Ако е необходимо, стойностите на Cw и Cf, получени при теста, се коригират за стойностите на възстановяване и подготовка от контролните проверки. С пробите вода и риба се борави по начин, който намалява до минимум замърсяването и загубите (които, например, могат да се получат при абсорбция от устройството за вземане на проба).
1.8.4.4. Анализ на пробата риба
Ако при теста се използват радиомаркирани материали, може да се анализира общата радиомаркировка (т.е. източник и метаболити) или пробите може да се почистят така, че основното съединение да се анализира отделно. Също така основните метаболити може да се охарактеризират при устойчиво състояние или в края на фазата на поглъщането, в зависимост от това кое се случва по-напред. Ако BCF по отношение на общите радиомаркирани остатъци е ≥ 1 000 %, може би е желателно, а за някои категории химикали, като пестициди — силно препоръчително, да се идентифицират и определят количествено продуктите на разпадането, представляващи ≥ 10 % от общите остатъци в рибните тъкани при устойчиво състояние. Ако продуктите на разпадането, представляващи ≥ 10 % от общите радиомаркирани остатъци в рибните тъкани, са идентифицирани и определени количествено, тогава се препоръчва да се направи същото и за продуктите на разпадането в тестовата вода.
Концентрация на тестовото вещество обикновено се определя за всяка отделна претеглена риба. Ако това не е възможно, се прави събиране на пробите при всяко вземане на проба, но това ограничава статистическите процедури, които могат да се приложат към данните. Ако една статистическа процедура представлява важен фактор, тогава в теста се включват достатъчен брой риби, за да се пригоди желаната процедура на събиране (6) (7).
BCF се изразява едновременно като функция на общото мокро тегло, а за високолипофилни вещества — като функция на липидното съдържание. Липидното съдържание при рибата се определя при всяко вземане на проба, когато е възможно. За определянето му се използват подходящи методи (препратки 8 и 2 от приложение 3). Екстракционната техника за хлороформ/метанол може да се препоръча като стандартен метод (9). Различните методи не дават идентични стойности (10), така че е важно да се дадат подробности за използвания метод. Когато е възможно, анализът за липиди се прави върху същия екстракт като този, произведен за анализа за тестовото вещество, понеже липидите често трябва да се отстраняват от екстракта, преди той да бъде анализиран хроматографски. Липидното съдържание на рибата (в mg/kg мокро тегло) в края на експеримента не трябва да се различава от това в началото с повече от ± 25 %. Отчита се също и процентното съдържание на твърди частици в тъканите, за да се позволи превръщане на липидната концентрация от мокра на суха база.
2. ДАННИ
2.1. ОБРАБОТКА НА РЕЗУЛТАТИТЕ
Кривата на поглъщането на тестовото вещество се получава чрез изчертаване на нейната концентрация във/върху рибата (или определени тъкани) във фазата на поглъщането спрямо времето в аритметични скали. Ако кривата достигне стабилно равнище, това означава да бъде приблизително асимптотична към времевата ос, устойчивото състояние BCFSS се изчислява от:

Когато не се достига устойчиво състояние, може би е възможно да се изчисли BCFSS c достатъчна точност за оценка на риска от „устойчиво състояние“ при 80 % (1,6/k2) или 95 % (3,0/k2) на равновесието.
Определя се също и коефициентът на концентрация (BCFk) като съотношение k1/k2, двете кинетични константи от първи ред. Константата за скорост на очистване (kg) обикновено се определя от кривата на очистването (т.е. графиката на намалението на концентрацията на тестовото вещество в рибата спрямо времето). След това константата за скорост на поглъщане (k1) се изчислява при дадена k2 и стойност на Cf, която се получава от кривата на поглъщането (вж. също приложение 5). Предпочитаният метод за получаване на BCFk и константите за скорост k1 и k2 е да се използват нелинейни параметрични изчислителни методи на компютър (11). В противен случай за изчисление на k1 и k2 могат да се използват графичните методи. Ако кривата на очистването очевидно не е от първи ред, се прилагат по-сложни модели (вж. позоваванията в приложение 3) и се търси консултация от статистик в областта на биологията.
2.2. ТЪЛКУВАНЕ НА РЕЗУЛТАТИТЕ
Резултатите трябва да се тълкуват с внимание, когато измерените концентрации на тестовите разтвори са на нива, близки до лимита на детекция на аналитичния метод.
Ясно определените криви на поглъщане и загуби са показател за биоконцентрационни данни с добро качество. Вариациите в константите поглъщане/очистване между двете тестови концентрации трябва да бъдат по-малки от 20 %. Наблюдаваните значителни разлики в скоростите при поглъщане/очистване между двете приложени тестови концентрации трябва да се отчетат и да получат възможно обяснение. Обикновено границата на достоверност на BCF при добре направени изследвания доближава ± 20 %.
3. ОТЧИТАНЕ
Протоколът от теста трябва да включва следната информация:
3.1. ТЕСТОВО ВЕЩЕСТВО
|
—
|
физическо естество и където е уместно, физикохимични свойства,
|
|
—
|
химическа идентификация (включително съдържание на органичен въглерод, ако е уместно),
|
|
—
|
ако е радиомаркирано, точно положение на маркирания(те) атом(и) и процент на радиоактивността, свързана с примесите.
|
3.2. ТЕСТОВИ ВИДОВЕ
|
—
|
научно име, род, източник, всякаква предварителна обработка, аклиматизация, възраст, размер и т.н.
|
3.3. ТЕСТОВИ УСЛОВИЯ
|
—
|
използвана тестова процедура (например проточна или полустатична),
|
|
—
|
тип и характеристики на използваното осветление и фотопериода(ите),
|
|
—
|
тестов дизайн (например брой и размер на тестовите камери, скорост на подмяна на обема вода, брой на възпроизвежданията, брой на тестовите концентрации, време на поглъщане и време на очистване, честота на вземане на проби от риба и вода),
|
|
—
|
метод на подготовка на наличните разтвори и честота на подновяването им (разтварящият агент, неговата концентрация и приносът му към съдържанието на органичен въглерод в тестовата вода трябва да се посочат, когато се използват),
|
|
—
|
номинални тестови концентрации, средни величини на измерваните стойности и техните стандартни отклонения в тестовите съдове и метод, по който са получени,
|
|
—
|
източник на разреждаща вода, описание на всякаква предварителна обработка, резултати от всякакви демонстрации на способността на рибата да живее във водата и характеристики на водата: рН, твърдост, температура, концентрация на разтворен кислород, остатъчни нива на хлор (ако се измерват), общо съдържание на органичен въглерод, суспензирали твърди частици, соленост на тестовата среда (ако е уместно) и всякакви други направени измервания,
|
|
—
|
качество на водата в тестовите съдове, рН, твърдост, ТОС, температура и концентрация на разтворен кислород,
|
|
—
|
подробна информация за храненето (например тип на храната, източник, състав — поне липидното и протеиновото съдържание, ако е възможно, количеството, което се дава, и на какви интервали),
|
|
—
|
информация за обработката на пробите риба и вода, включително подробности от подготовката, съхранението, екстракцията и аналитичните процедури (и прецизност) за тестовото вещество и липидното съдържание (ако се измерва).
|
3.4. РЕЗУЛТАТИ
|
—
|
резултати от всякакви извършени предишни изследвания,
|
|
—
|
смъртност на контролната риба и рибата във всяка камера за излагане и всякакво наблюдавано необичайно поведение,
|
|
—
|
липидно съдържание на рибата (ако е определено при този тест),
|
|
—
|
криви (включително всички измерени данни), показващи поглъщането и очистването на тестовия химикал в рибата, времето на устойчиво състояние,
|
|
—
|
Cf и Cw (със стандартно отклонение и гама, ако е уместно) за всички времена на вземане на проба (Cf изразено в μg/g мокро тегло (ррm) от цялото тяло или определени негови тъкани, например липиди, и Cw в μg/ml (ррm). Стойностите не Cw за контролните серии (произходът също се отчита),
|
|
—
|
биоконцентрационен коефициент в устойчиво състояние (BCFSS) и/или кинетичен коефициент на концентрация (BCFk) и, ако е приложимо, 95 % граници на достоверност за константите на скорост на поглъщане и очистване (загуба) (всички изразени по отношение на цялото тяло и общото липидно съдържание, ако се измерва, на животното или определени негови тъкани), граници на достоверност и стандартно отклонение (ако има) и методи на анализ на изчисления/данни за концентрация на използваното тестово вещество,
|
|
—
|
когато се използват радиомаркирани вещества и ако се изисква, може да се даде натрупването на всички открити метаболити,
|
|
—
|
всичко необичайно относно теста, всяко отклонение от тестовите процедури и всякаква друга уместна информация.
|
Намалете до минимум резултати като „неоткрито за времето на детекция“, като разработите предварителен тестов метод и експериментален дизайн, защото такива резултати не могат да се използват за изчисления на константите за скорост.
4. ПРЕПРАТКИ
|
(1)
|
Connell D. W. (1988). Bioaccumulation behaviour of persistent chemicals with aquatic organisms. Rev. Environ. Contam. Toxicol. 102, pp. 117—156.
|
|
(2)
|
Bintein S., Devillers J. and Karcher W. (1993). Non-linear dependence of fish bioconcentration on n-octanol/water partition coefficient. SAR and QSAR in Environmental Research, 1, pp. 29—390.
|
|
(3)
|
OECD, Paris (1996). Direct phototransformation of chemicals in water. Environmental Health and Safety Guidance Document Series on Testing and Assessment of Chemicals. No 3.
|
|
(4)
|
Kristensen P. (1991). Bioconcentration in fish: comparison of bioconcentration factors derived from OECD and ASTM testing methods; influence of particulate organic matter to the bioavailability of chemicals. Water Quality Institute, Denmark.
|
|
(5)
|
US EPA 822-R-94-002 (1994) Great Lake Water Quality Initiative Technical Support Document for the Procedure to Determine Bioaccumulation Factors. uly 1994.
|
|
(6)
|
US FDA (Food and Drug Administration) Revision. Pesticide analytical manual, 1, 5600 Fisher's Lane, Rockville, MD 20852, July 1975.
|
|
(7)
|
US EPA (1974). Section 5, A(1). Analysis of Human or animal Adipose Tissue, in Analysis of Pesticide Residues in Human and Evironmental Samples, Thompson J. F. (ed.) Research Triangle Park, N.C. 27711.
|
|
(8)
|
Compaan H. (1980) in `The determination of the possible effects of chemicals and wastes on the aquatic environment: degradation, toxicity, bioaccumulation©, Ch. 2.3, Part II. Government Publishing Office, the Hague, Netherlands.
|
|
(9)
|
Gardner et al, (1995). Limn. & Oceanogr. 30, pp. 1099—1105.
|
|
(10)
|
Randall R. C, Lee H., Ozretich R. J., Lake J. L. and Pruell R. J. (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Envir. Toxicol. Chem. 10, pp 1431—1436.
|
|
(11)
|
CEC, Bioconcentration of chemical substances in fish: the flow-through method- Ring Test Programme, 1984 to 1985. Final report March 1987. Authors: P. Kristensen and N. Nyholm.
|
|
(12)
|
ASTM E-1022-84 (Reapproved 1988). Standard Practice for conducting Bioconcentration Tests with Fishes and Saltwater Bivalve Molluscs.
|
Приложение 1
Химически характеристики на приемлива разреждаща вода
|
|
Вещество
|
Гранична концентрация
|
|
1
|
Специфично вещество
|
5 mg/l
|
|
2
|
Общо органичен въглерод
|
2 mg/l
|
|
3
|
Нейонизиран амоняк
|
1 μg/l
|
|
4
|
Остатъчен хлор
|
10 μg/l
|
|
5
|
Общо органофосфорни пестициди
|
50 ng/l
|
|
6
|
Общо органохлорни пестициди плюс полихлорирани бифенили
|
50 ng/l
|
|
7
|
Общо органичен хлор
|
25 ng/l
|
|
8
|
Алуминий
|
1 μg/l
|
|
9
|
Арсен
|
1 μg/l
|
|
10
|
Хром
|
1 μg/l
|
|
11
|
Кобалт
|
1 μg/l
|
|
12
|
Мед
|
1 μg/l
|
|
13
|
Желязо
|
1 μg/l
|
|
14
|
Олово
|
1 μg/l
|
|
15
|
Никел
|
1 μg/l
|
|
16
|
Цинк
|
1 μg/l
|
|
17
|
Кадмий
|
100 ng/l
|
|
18
|
Живак
|
100 ng/l
|
|
19
|
Сребро
|
100 ng/l
|
Приложение 2
Видове риба, препоръчвани за тест
|
|
Препоръчвани видове
|
Препоръчвана гама за тестова температура (°C)
|
Препоръчвана обща дължина на тестовото животно (cm)
|
|
1
|
Danio rerio (17) (Teleostei, Cyprinidae) (Hamilton- Buchanan) — аквариумна рибка Данио
|
20—25
|
3,0±0,5
|
|
2
|
Pimephales promelas (Teleostei, Cyprinidae) (Rafinesque) — вид лещанка
|
20—25
|
5,0±2,0
|
|
3
|
Cyprinus carpio (Teleostei, Cyprinidae) (Linnaeus) — шаран
|
20—25
|
5,0±3,0
|
|
4
|
Oryzias latipes (Teleostei, Poeciliidae) (Temminck and Schlegel) — японска оризова рибка
|
20—25
|
4,0±1,0
|
|
5
|
Poccilia reticulata (Teleostei, Poeciliidae) (Peters) — гупa
|
20—25
|
3,0±1,0
|
|
6
|
Lepomis macrochirus (Teleostei, Centrarchidae) (Rafinesque) — вид слънчева рибка
|
20—25
|
5,0±2,0
|
|
7
|
Oncorhynchus mykiss (Teleostei, Salmonidae) (Walbaum) — дъгова пъстърва (американска пъстърва)
|
13—17
|
8,0±4,0
|
|
8
|
Gasterosteus aculeatus (Teleostei, Gasterosteidae) (Linnaeus) — триглава бодливка
|
18—20
|
3,0±1,0
|
В различните страни се използват различни речни и морски видове, например:
|
Leiostomus xanthurus
|
|
|
Cyprinodon variegatus
|
|
|
Menidia beryllina
|
|
|
Cymatogaster aggregata
|
|
|
Parophrys vertulus
|
|
|
Leptocottus armatus
|
|
|
Gasterosteus aculeatus
|
Триглава бодливка
|
|
Dicentracus labrax
|
Лаврак
|
|
Alburnus alburnus
|
Уклей
|
Събиране
Пресноводната риба, дадена в таблицата, е лесна за развъждане и/или се среща през цялата година, като се има предвид, че наличността на морските и речните риби е частично ограничена до съответните страни. Тези риби могат да бъдат развъждани и култивирани било в рибни ферми или лабораторно, при условия на контрол върху болести и паразити, така че тестовите животни да са здрави и с познат произход. Тези риби се срещат в много части на света.
Приложение 3
Предвиждане на продължителността на фазите на поглъщане и очистване
1. Предвиждане на продължителността на фазата на поглъщане
Преди извършването на теста се прави пресмятане на k2 и следователно някакъв процент време, необходим за достигане на устойчиво състояние, може да се получи от емпиричната връзка между k2 и коефициент на разделяне октанол/вода (Pow) или kg и водоразтворимостта (s).
Пресмятане на k2 (ден-1) се получава например от следната емпирична връзка (1):
|
log10k2 = -0,414 log10(Pow) +1,47 (r2 = 0,95)
|
(уравнение 1)
|
За другите връзки вижте препратка 2.
Ако коефициентът на разделяне (Pow) не е известен, пресмятане може да се направи (3) от информацията за водоразтворимост (s) на веществото, като се използва:
|
log10(Pow) = 0,862 log10(s) +0,710 (r2 = 0,994)
|
(уравнение 2)
|
където
s = разтворимост (mol/l) : (n = 36).
Тези връзки се прилагат само за химикали със стойности на log Pow между 2 и 6,5 (4).
Времето, необходимо за достигане на процент устойчиво състояние, може да се получи чрез прилагане на пресмятането за k2 от общото кинетично уравнение, описващо поглъщане и очистване (кинетика от първи ред):

Или ако Cw е константа:
|
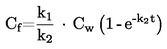
|
(уравнение 3)
|
Когато се достигне устойчиво състояние (t → ∞), уравнение 3 може да се редуцира (5) (6) до:
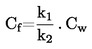 or Cf/Cw = k1/k2
= BCF
or Cf/Cw = k1/k2
= BCF
Тогава k1/k2 . Cw е едно приближение към концентрацията в рибата при устойчиво състояние (Cf, s).
Уравнение 3 може да се напише така:
|

or
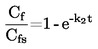
|
(уравнение 4)
|
Като приложим уравнение 4, времето за достигане на някакъв процент устойчиво състояние може да се предвиди, когато k2 е преизчислено с помощта на уравнение 1 или 2.
Като насока, статистически оптималната продължителност на фазата на поглъщане за производство на статистически приемливи данни (BCFk) е онзи период, който се изисква за логаритмичната крива на концентрация на тестовото вещество в рибата спрямо линейното време за достигане на средната му точка, или 1,6/k2, или 80 % от устойчивото състояние, но не повече от 3,0/k2 или 95 % устойчивото състояние (7).
Времето за достигане на 80 % от устойчивото състояние е (уравнение 4):
|
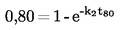
or
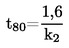
|
(уравнение 5)
|
По подобен начин 95 % от устойчивото състояние е:
|

|
(уравнение 6)
|
Например продължителността на фазата на поглъщане (up) за тестово вещество с log Pow = 4 ще бъде (използвайки уравнения 1, 5 и 6):
|
log10k2 = -0,414.(4) + 1,47
|
k2 = 0,652 дни-1
|
up (80 %) = 1,6/0,652, т.е. 2,45 дни (59 часа)
или up (95 %) = 3,0/0,652, т.е. 4,60 дни (110 часа)
По подобен начин за тестово вещество с s = 10-5 mol/1 (log(s) = 5,0), продължителността на up ще бъде (използвайки уравнения 1, 2, 5 и 6):
log10 (Pow) = 0,862 (– 5,0) +0,710 = 5,02
log10k2 = 0,414 (5,02)+1,47
k2 = 0,246 дни-1
up (80 %) = 1,6/0,246, т.е. 6,5 дни (156 часа)
или up (95 %) = 3,0/0,246, т.е. 12,2 дни (293 часа)
Алтернативно изразът:
teq = 6,54 × 103 Pow+55,31 (часа)
може да се използва за изчисляване на времето за достигане на ефективно устойчиво състояние (4).
2. Предвиждане на продължителността на фазата на очистване
Предвиждане на времето, необходимо за намаляване на товара на теглото до някакъв процент на начална концентрация, може също да се получи от общото уравнение, описващо поглъщането и очистването (кинетика от първи ред) (1) (8).
За фазата на очистването Cw се приема за нула. Уравнението може да се редуцира до:
 or
or 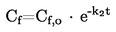
където Cf, o е концентрацията при старта на периода на очистването. Тогава 50 % очистване ще се достигне за времето (t50):
 or
or 
По подобен начин 95 % очистване ще се достигне при:
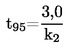
Ако 80 % поглъщане се използва за първия период (1,6/k2) и 95 % загуба при фазата на очистването (3,0/k2), тогава фазата на очистването е приблизително два пъти продължителността на фазата на поглъщането.
Важно е да се отбележи обаче, че пресмятанията са базирани на допускането, че кривите на поглъщане и очистване ще следват кинетика от първи ред. Ако такава кинетика не се получи, трябва да се използват по-сложни модели (например препратка 1).
ПРЕПРАТКИ (в приложение 3)
|
(1)
|
Spacie A. and Hamelink J. L. (1982). Alternative models for describing the bioconcentration of organics in fish. Environ. Toxicol. and Chem. 1, pp. 309—320.
|
|
(2)
|
Kristensen P. (1991). Bioconcentration in fish: comparison of BCFs derived from OECD and ASTM testing methods; influence of particulate matter to the bioavailability of chemicals. Danish Water Quality Institute.
|
|
(3)
|
Chiou C. T. and Schmedding D. W. (1982). Partitioning of organic compounds in octanol-water systems. Environ. Sci. Technol. 16 (1), pp. 4—10.
|
|
(4)
|
Hawker D. W. and Connell D. W. (1988). Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Res. 22 (6), pp. 701—707.
|
|
(5)
|
Branson D. R., Blau G. E., Alexander H. C. and Neely W. B. (1975). Transactions of the American Fisheries Society, 104 (4), pp. 785—792.
|
|
(6)
|
Ernst W. (1985). Accumulation in Aquatic organisms. In: Appraisal of tests to predict the environmental behaviour of chemicals. Ed. by Sheehman P., Korte F., Klein W. and Bourdeau P. H. Part 4.4, pp. 243—255. SCOPE, 1985, John Wiley & Sons Ltd N.Y.
|
|
(7)
|
Reilly P. M., Bajramovic R., Blau G. E., Branson D. R. and Sauerhoff M. W. (1977). Guidelines for the optimal design of experiments to estimate parameters in first order kenetic models, Can. J. Chem. Eng. 55, pp. 614—622.
|
|
(8)
|
Könemann H. and Van Leeuwen K. (1980). Toxicokinetics in fish: Accumulation and Elimination of six Chlorobenzenes by Guppies. Chemosphere, 9, pp. 3—19.
|
Приложение 4
Теоретичен пример за програма за вземане на проби за биоконцентрационни тестове на вещества с log Pow = 4
|
Вземане на проба от риба
|
Програма за вземане на проби
|
Брой на пробите вода
|
Брой на рибите за проба
|
|
минимална изисквана честота (дни)
|
допълнително вземане на проби
|
|
Фаза на поглъщане
|
-1
0
|
|
2 (18)
2
|
Прибавете 45 до 80 риби
|
|
1-ва
|
0,3
|
0,4
|
2
(2)
|
4
(4)
|
|
2-ра
|
0,6
|
0,9
|
2
(2)
|
4
(4)
|
|
3-та
|
1,2
|
1,7
|
2
(2)
|
4
(4)
|
|
4-та
|
2,4
|
3,3
|
2
(2)
|
4
(4)
|
|
5-та
|
4,7
|
|
2
|
6
|
|
Фаза на очистване
|
|
|
|
Прехвърлете рибата към вода без тестови химикали
|
|
6-та
|
5,0
|
5,3
|
|
4
(4)
|
|
7-ма
|
5,9
|
7,0
|
|
4
(4)
|
|
8-ма
|
9,3
|
11,2
|
|
4
(4)
|
|
9-та
|
14,0
|
17,5
|
|
6
(4)
|
|
Стойностите в скобите са броят на пробите (вода, риба), които трябва да се вземат, ако се прави допълнително вземане на проби.
|
Забележка
|
:
|
Предварително пресмятане на k2 за log Pow от 4,0 е 0,652 дни-1. Общата продължителност на експеримента е за 3 × up = 3 × 4,6 дни, т.е. 14 дни. За пресмятането на „up“ се обърнете към приложение 3.
|
|
Приложение 5
Оценка на модела
Повечето данни за биоконцентрация се считат за сравнително добре описани чрез прост модел на две прегради/два параметъра, както е показано чрез правата линия на графиката, която се доближава до точките на концентрация в рибата, по време на фазата на очистване, когато са изчертани върху полулогаритмична хартия. (Когато тези точки не могат да се опишат с такава права линия, тогава трябва да се използват по-сложни модели, например този на Spacie and Hamelink, препратка 1 в приложение 3).
Графичен метод за определяне на константата на очистване (загуба) k2
Изчертайте концентрацията на тестовото вещество, отчетена във всяка проба от риба спрямо времето за вземане на проба, върху полулогаритмична хартия. Наклонът на тази линия е k2.
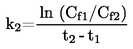

Забележете, че отклоненията от правата линия може да означават по-сложна графика на очистването от такава в кинетика първи ред. Може да се приложи графичен метод за анализиране на видове очистване, което се отклонява от кинетика първи ред.
Графичен метод за определяне на константата на поглъщане k1
При дадена k2 изчислете k1 както следва:
|
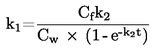
|
(уравнение 1)
|
Стойността на Cf се отчита от средната точка на гладката крива на поглъщането, получена от данните, когато log концентрация се изчертава спрямо времето (върху аритметична скала).
Компютърен модел за изчисление на константите на скоростта на поглъщане и очистване
Предпочитан начин за получаване на коефициента на биоконцентрация и на константите за скорост k1 и k2 е използването на нелинейни параметрични изчислителни методи на компютър. Такъв софтуер намира стойностите на k1 и k2 при наличие на данни за време и концентрация и модела:
|

0 < t < tc
|
(уравнение 2)
|
|
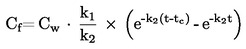
t < tc
|
(уравнение 3)
|
където tc = време в края на фазата на поглъщане.
Този подход осигурява изчисление на k1 и k2 със стандартно отклонение.
Понеже k2 в повечето случаи може да се пресметне от кривата на очистването с относително висока точност и тъй като съществува силна корелация между двата параметъра k1 и kg, ако се пресмятат едновременно, препоръчително е първо да се изчисли k2 само от кривата на очистването, а след това да се изчисли k1 от данните за поглъщане, като се използва нелинейна регресия.
В.14. ТЕСТВАНЕ РАСТЕЖА НА МЛАДИТЕ РИБИ
1. МЕТОД
Този метод за изследване на токсичността при растежа е точно копие на ОECD TG 215 (2000).
1.1. ВЪВЕДЕНИЕ
Това тестване се планира с цел да се направи оценка на въздействията при продължително излагане на химикали при растежа на младите риби. Базира се на метода, развит и кръгово тестван (1) (2) в Европейския съюз, за оценка на въздействията от химикали върху растежа на младата дъгова пъстърва (Oncorhynchus mykiss) в потокови условия. Могат да се използват и други добре документирани видове. Например е постигнат опит от тестове върху растежа с риба зебра (Danio rerio)
(19) (3) (4) и оризова риба (медака, Oryzias latipes) (5) (6) (7).
Вижте също Основно въведение, част В.
1.2. ОПРЕДЕЛЕНИЯ
Най-ниска концентрация на наблюдавано въздействие (LOEC): е най-ниската тествана концентрация от тестваното вещество, при която се наблюдава значително въздействие на веществото (при р < 0,05), при сравнение с контрола. Обаче всички тествани концентрации над LOEC трябва да имат вредно въздействие, равно или по-голямо от това, наблюдавано при LOEC.
Концентрация на ненаблюдавано въздействие (NOEC): това е тестваната концентрация непосредствено под концентрацията LOEC.
ЕС
Х
: в този метод на извършване на теста представлява концентрацията тествано вещество, която причинява х % променливост при величината на растеж на рибите в сравнение с контролите.
Скорост на концентрация: е мокрото тегло на рибата на количество вода.
Плътност на биомасата: е броят на рибата на количество вода.
Индивидуална скорост на специфичния растеж на рибата: изразява скоростта на растежа на един индивид, основана на първоначалното тегло.
Основна за резервоара специфична скорост на растеж: изразява основната скорост на растеж за резервоара при една концентрация.
Псевдоспецифична скорост на растеж: изразява индивидуалната скорост на растежа в сравнение с основното първоначално тегло на резервоара.
1.3. ПРИНЦИП НА МЕТОДА НА ТЕСТВАНЕ
След измерване на теглото, младата риба при фаза на експоненциален растеж се поставя в помещенията за тестване и се излага на серия сублетални концентрации от тестваното вещество, разтворено за предпочитане във вода при течение, или ако не е възможно при подходящи полустатични (статично-сменяеми) условия. Продължителността на теста е 28 дни. Рибите се хранят всекидневно. Съотношението на храната се основава на първоначалното тегло на рибата и може да се преизчисли след 14 дни. На края на теста теглото на рибата се измерва отново. Въздействието върху скоростта на растежа се анализира като се използват регресивни модели с цел да се изчисли концентрацията, която би довела до х % променливост в скоростта на растежа, т.е. ЕСХ (например ЕС 10, ЕС 20 или ЕС 30). Като алтернатива данните могат да се сравняват с контролните стойности с цел да се определи най-ниската концентрация на наблюдавано въздействие (LOEC) и следователно концентрацията на ненаблюдаваното въздействие (NOEC).
1.4. ИНФОРМАЦИЯ ЗА ТЕСТВАНОТО ВЕЩЕСТВО
Резултатите от теста за остра токсичност (виж метода на тест В.1), за предпочитане извършен с избрани за този тест видове, следва да са на разположение. Това предполага, че водната разтворимост и парното налягане на тестваното вещество са известни и е налице надежден аналитичен метод за количествено определяне на веществото в тествания разтвор с позната и отчетена точност и е налице ограничаване на откриването.
Полезната информация включва формула на структурата, чистота на веществото, устойчивост на вода и светлина, рКа, Pow и резултати от изследване на готово биохимично разлагане (вж. метод на теста В.4).
1.5. ВАЛИДНОСТ НА ТЕСТА
За да е валиден тестът, се прилагат следните условия:
|
—
|
в края на теста контролираната смъртност не трябва да превишава 10 %,
|
|
—
|
основното контролирано тегло на рибата трябва да се повишава, така че да позволява установяване на минималната променливост на скоростта на растеж, отбелязана като значителна. Кръгов тест (3) е показал, че за дъговата пъстърва основното тегло на контролираната риба се е повишило с поне половината (т.е. 50 %) от тяхното средно първоначално тегло за 28 дни; например първоначално тегло: 1g/риба (= 100 %), крайно тегло след 28 дни: = 1,5 g/pибa (= 150 %),
|
|
—
|
концентрацията на разтворен кислород трябва да бъде поне 60 % от стойността на насищане на въздуха с влага по време на теста,
|
|
—
|
температурата на водата трябва да не по-висока от ± 1oС между помещенията, в които се провежда теста, по всяко едно време по време на провеждането на теста, и се поддържа стойност от 2 oС със специфичните за тестваните видове стойности на температурата (приложение 1).
|
1.6. ОПИСАНИЕ НА МЕТОДА НА ТЕСТВАНЕ
1.6.1. Апаратура
Обикновено лабораторно оборудване, и по-специално следното:
|
—
|
оборудване за определяне твърдост и алкалност на водата;
|
|
—
|
подходяща апаратура за контрол на температурата и за предпочитане продължителен мониторинг;
|
|
—
|
аквариуми, направени от химични инертни материали и с подходящ капацитет по отношение на препоръчителната плътност на зареждане и биомаса (вж. точка 1.8.5 и приложение I);
|
|
—
|
подходящ прецизен баланс (т.е. прецизност от ±0,5 %).
|
1.6.2. Вода
Всяка вода, в която тестваният вид показва съответните признаци за дългосрочен живот и растеж, може да се използва като вода за тестване. Тя следва да е с постоянно качество през целия период на провеждане на теста. Стойността на рН на водата е от 6,5 до 8,5, но по време на тестване е ±0,5 рН единици. Препоръчва се твърдост над 140 mg/l (като СаСО3). С цел да се гарантира, че разредената вода не влияе прекалено на резултатите от теста (например чрез образуване на координационно съединение на тестваното вещество), следва да се взимат проби за анализ на равни интервали от време. Правят се измервания на твърди метали (например Cu, Pb, Zn, Hg, Cd и Ni), основните аниони и катиони (например Са, Mg, Na, K, Cl и SO4), пестициди (например органофосфорни и органохлоридни пестициди), органичен въглерод и твърди частици, например на всеки три месеца, когато се знае, че водата за разреждане има съответното постоянно качество. Ако се вижда, че качеството на водата е постоянно за поне повече от една година, то изследванията могат да са по-редки и да се увеличат интервалите (например на всеки шест месеца). Някои от химичните характеристики на разредената водата за разреждане са изброени в допълнение 2.
1.6.3. Разтвори за извършване на изследването
Разтвори за теста при избрана концентрация се приготвят чрез разреждане на основния разтвор.
Основният разтвор се приготвя за предпочитане чрез просто смесване и разбъркване на тестваното вещество в разредена вода, като се използват механични средства (например разклащане или с помощта на ултразвук). За постигане на подходящо концентриран основен разтвор могат да се използват колони на насищане (колони на разтваряне).
Използването на разтворители и диспергиращи устройства (разтварящи фактори) може да се наложи в някои случаи с цел да се получи подходящ концентриран основен разтвор. Подходящи разтворители са например ацетонът, етанолът, метанолът, диметилсулфооксидът, диметилформамидът и триетиленгликолът. Примери за подходящи диспергиращи устройства са Cremophor RH 40, Tween 80, Метилцелулоза 0,01 % и НСО-40. При употребата на готови биоразграждащи вещества (например ацетон) и/или високолетливи съединения се взема предвид, че те могат да причинят проблеми с бактериалното натрупване при потоковите тестове. Когато се използва разтворима добавка, тя не трябва да оказва нито значително въздействие върху растежа на рибите, нито невидими вредни ефекти върху младия екземпляр, проявени при контрол само чрез разтвора.
За потоковите тестове се изисква система, която постоянно дозира и разрежда основния разтвор на тестваното вещество (например измерваща помпа, пропорционален разредител, напоителни системи) за да се прехвърлят серии от концентрации към помещенията за тестване. Параметрите на изтичането на основния разтвор и водата за разреждане се проверяват на интервали, за предпочитане всеки ден, по време на извършването на теста и през това време не следва да се променят с повече от 10 %. Кръговите тестове (3) показват, че при дъговата пъстърва честотата на отстраняване на водата по време теста от 6 l/g на риба/ден е приемлива.
За полустатичните (подновяемите) тестове честотата на средното подновяване ще зависи от устойчивостта на тестваното вещество, но се препоръчва всекидневна смяна на водата. Ако от първоначалните тестове за устойчивост (вж. точка 1.4), се вижда, че концентрацията на тестваното вещество не е стабилна (т.е. извън номиналните стойности от 80—120 % или падне под 80 % от измерената първоначална концентрация) по време на периода на смяна, се взема предвид употребата на потокови тестове.
1.6.4. Избор на видове
Дъговата пъстърва (Oncorhynchus mykiss) е видът, които се препоръчва за тези тестове, тъй като най-много опити са били сполучливи с този вид (1) (2). Обаче други добре документирани видове могат да се използват, но процедурата, по която се извършва тестът, може да се адаптира, за да се постигнат подходящи условия за провеждане на теста. Например има наличен опит с риба зебра (Danio rerio) (3) (4) и оризова риба (медака, Oryzias latipes) (5) (6) (7). В тези случаи се посочват причините за рационалното избиране на видовете и методът, по които ще се проведе експериментът.
1.6.5. Отглеждане на рибата
Рибата, която се използва за извършването на теста, се избира от популация на едно стадо, за предпочитане от едно и също изхвърляне на хайвера, който е бил отглеждан в продължение на поне две седмици преди теста, при условия, подобни на тези, използвани при теста, като качеството на водата и осветление. Те се хранят с минимум количество от 2 % от телесното тегло на ден и за предпочитане 4 % от телесното тегло на ден през време на периода на отглеждане и по време на теста.
В следващият 48-часов период се записват всички случаи на смъртност и се прилагат следните критерии:
|
—
|
при смъртност, по-висока от 10 % от популацията за седем дни, се изхвърля цялата партида,
|
|
—
|
при смъртност между 5 % и 10 % от популацията се изчаква аклиматизация за нови седем дни; ако смъртността е повече от 5 % през вторите седем дни, се изхвърля цялата партида,
|
|
—
|
при смъртност, по-малко от 5 % от популацията за седем дни, партидата се приема.
|
При заболяване на рибите през последните две седмици, предхождащи теста, или по време на теста те не се третират с лекарства.
1.7. ПЛАНИРАНЕ НА ИЗВЪРШВАНЕТО НА ТЕСТА
Планирането на теста се изразява в избор на броя и разстоянието на тестваната концентрация, броя на аквариумите за всяко ниво концентрация и броя на рибите в аквариум. В идеални условия планирането на теста се извършва по отношение на:
|
—
|
метода на статистическия анализ, които ще се използва;
|
|
—
|
наличност и цена на източниците на експеримента.
|
При излагането на целите, ако е възможно, се определят статистическите показатели, при които се изисква да се определи определен вид разлика (например при размера на растежа) или алтернативно се изисква точността, с която да се оцени ЕСХ (например с х = 10, 20 или 30, и за предпочитане не по-малко от 10). Без да бъде извършено това, не може да се даде установено предписание за обхвата на изследването.
Важно е да се отбележи, че планирането, което е оптимално (с най-добра употреба на ресурсите) чрез използване на един метод на статистически анализ, не е непременно оптимално чрез използване на друг. Препоръчаното планиране за оценка на LOEC/NOEC следователно няма да бъде същото като това, което е препоръчано за регресионен анализ.
В повечето случаи регресионният анализ се предпочита пред дисперсионния анализ поради причини, дискутирани от Стефан и Роджърс (9). Обаче, когато не се намери подходящ регресен модел (г2 < 0,9), следва да се използва LOEC/NOEC.
1.7.1. Проектиране на регресионния анализ
При проектирането на теста, който трябва да се анализира чрез регресия, е важно да се има предвид:
|
—
|
концентрацията на въздействие (например ЕС10, 20, 30) и стойността на концентрация, над която въздействието на тестваното вещество е от значение, е необходимо да се измерват чрез концентрацията, включена в теста. Точността, с която може да се направи оценка на концентрацията на въздействието, ще бъде най-голяма, когато концентрацията на въздействието е в средата на стойността на тестваната концентрация. Предварителни тестове за определяне на обхвата могат да бъдат полезни за правилното избиране на тестваната концентрация;
|
|
—
|
за да е възможно задоволително статистическо моделиране, тестът следва да включва поне един контролен аквариум и пет допълнителни с различни концентрации. Когато е приложимо и когато се използва разтворимо вещество, се извършва контрол с разтворимото вещество на най-високата тествана концентрация като допълнение на тестовите серии (вж. точки 1.8.3 и 1.8.4);
|
|
—
|
използват се подходящи геометрични и логаритмични серии (9) (вж. приложение 3). Трябва да се предпочете логаритмичното разпределяне на тестваната концентрация;
|
|
—
|
ако повече от шест аквариума са на разположение, допълнителните аквариуми следва или да се използват за дубликати, или да се разпределят сред обхвата на концентрацията, за да се позволи по-близко разполагане на нивата. Всяка една от тези мерки е желателна в еднаква степен.
|
1.7.2. Проектиране оценката на LOEC/NOEC чрез използване на дисперсионния анализ (ANOVA)
За всяка концентрация се препоръчва дублиране на аквариума и статистическият анализ следва да се извършва на ниво аквариум (10). Без дублиращи аквариуми не може да се позволи разлика между аквариумите, извън тази, която се дължи на отделните риби. Обаче опитът показва, че в този случай (11) променливостта между аквариумите може в много малка степен да се сравнява с тази в аквариума (т.е. между рибите). Следователно сравнително приемлива алтернатива е да се извърши статистически анализ на ниво отделна риба.
Условно се използват поне пет концентрации в геометрична прогресия за предпочитане с коефициент, който не надвишава 3,2.
Обикновено, когато се извършват тестове с дублиращи аквариуми, броят на дублиращия контрол и следователно броят на рибите следва да е два пъти повече от броя в тестваните концентрации, които следва да са с еднакъв размер (12), (13), (14). Обратно, при липсата на дублиращ аквариум броят на рибите в контролната група е същият като броя във всяка тествана концентрация.
Ако ANOVA се основава по скоро на аквариума, отколкото на отделната риба (която би имала за последица индивидуално маркиране на рибата или употребата на „псевдо“ специфична скорост на растежа (вж. точка 2.1.2), има нужда от достатъчно дублиране на аквариумите, за да се даде възможност да се определи стандартното отклонение в „концентрацията на аквариума“. Това означава, че степента за свободна грешка при анализа на променливостта е поне 5 (10). Ако само контролните аквариуми се дублират, има опасност сгрешената променливост да бъде повлияна, защото може да се увеличи със средната стойност за съответната скорост на растеж. Тъй като е много вероятно скоростта на растежа да се намали с увеличаването на концентрацията, това ще доведе до надценяване на променливостта.
1.8. ПРОЦЕДУРА
1.8.1. Избор и измерване теглото на тестваните риби
Важно е променливостта в теглото на рибата в началото на теста да се сведе до минимум. Подходящият размер за различните видове, който се препоръчва при използване в теста, е даден в приложение 1. За цялата партида от риби, използвани в теста, стойностите на индивидуалните тегла в началото на теста теоретически се запазват в ± 10 % от средното аритметическо тегло и при всички случаи не надвишава 25 %. Препоръчва се да се измерва и теглото на подобразец риба преди теста с цел да се изчисли средното тегло.
24 часа преди началото на теста не се дава храна на основната популация. Рибите след това се избират произволно. Като се използва основно упойващо средство (например воден разтвор от 100 mg/l трикаин метан сулфонат (MS 222), неутрализиран допълнително от две части сода бикарбонат за една част MS 222), рибата следва да се измерва индивидуално като мокрото тегло (изсушаване до сухо) с точността, посочена в приложение 1. Тези риби с тегло в рамките на очакваното се съхраняват и след това се разпределят произволно между съдовете за теста. Общото мокро тегло на рибата във всеки съд се записва. Използването на упойващо средство, също както и отглеждането на рибите (включително изсушаването и измерването) може да причини стрес и наранявания на младата риба, и по-специално за видовете с малки размери. Следователно отглеждането на млади риби трябва да се извършва с най-голяма грижа, за да се избегне подлагането на стрес и нараняването на тестваните животни.
Теглото на рибите се измерва отново на двадесет и осмия ден от теста (вж. точка 1.8.6). Обаче, ако се намери за необходимо да се преизчисли порцията храна, теглото на рибата може да се измери отново на четиринадесетия ден от теста (вж. точка 1.8.2.3). Друг метод, като фотографския, може да се използва за определяне измененията при размера на рибата на основата, на която се определя порцията храна.
1.8.2. Условия на излагане
1.8.2.1. Продължителност
Продължителността на теста е ≥ 28 дни.
1.8.2.2. Скорост на зареждане и плътност на биомасата
Важно е скоростта на концентрация и плътността на биомасата да са подходящи за използваните за теста видове (вж. приложение I). Ако плътността на биомасата е прекалено висока, в резултат от препълването ще се появи стрес, което ще доведе до намаляване скоростта на растежа, а е възможно да доведе и до заболяване. Ако е прекалено ниска може да се предизвика намаляване на териториалното поведение, което също ще рефлектира върху растежа. Във всички случаи, скоростта на концентрация следва да е достатъчно ниска, за да може да се поддържа концентрация на разтворен кислород от поне 60 % ASV без вентилиране. Кръговите тестове (2) показват, че за дъговата пъстърва, се приема скорост на концентрация от 16 пъстърви от 3—5 g в 40-литров обем. Препоръчителната честота на смяна на водата по време на теста е 6 l/g за риба/ден.
1.8.2.3. Хранене
Рибите следва да бъдат хранени с подходяща храна (приложение 1) в достатъчно количество за да се предизвика приемлива скорост на растежа. Следва да се полагат грижи за избягване появата на микроби и мътност на водата. За дъговата пъстърва стойност от 4 % от теглото ѝ на ден вероятно отговаря на тези условия (3), (15), (16), (17). Дневната порция може да бъде разделена на две равни части и да се дава на рибите на два пъти на ден, в период от поне пет часа. Порцията се основава на първоначалното общо тегло на рибата за всеки съд. Ако теглото на рибата се измери на четиринадесетия ден, порцията се преизчислява. Даването на храна се прекратява 24 часа преди измерването на теглото на рибата.
Неизядената храна и фекалните отпадъци следва да се изхвърлят от съда за тестване всеки ден чрез внимателно почистване на дъното на всеки аквариум, с използване на вакуум.
1.8.2.4. Светлина и температура
Продължителността на излагане на светлина и водната температура следва да са подходящи за тестваните видове (приложение I).
1.8.3. Тествана концентрация
Обикновено се изискват пет концентрации на тестваното вещество, без оглед на планирането на теста (вж. точка 1.7.2). Предишните познания за токсичността на тестваното вещество (например от акутен тест и/или сведения от проучвания за обхвата) помагат при избора на подходящ тест за концентрацията. Обосновава се използването на по-малко от пет концентрации. Най-високата тествана концентрация не следва да надвишава границата на разтворимост на веществото във вода.
Когато разтворимият фактор се използва, за да участва при подготовката на основния разтвор, неговата последна концентрация не следва да е по-висока от 0,1 ml/l и е за предпочитане да бъде еднаква при всички съдове за тестване (вж. точка 1.6.3). Независимо от това, всички усилия следва да са насочени към избягване употребата на подобни материали.
1.8.4. Контроли
Броят на контролите за разреждане във вода зависи от планирането на теста (вж. точки 1.7-1.7.2). Ако се използва разтворим фактор, тогава се включват същия брой контроли, както при контроли за разреждане във вода.
1.8.5. Честота на аналитичните установявания и измервания
По време на теста концентрациите на тестваното вещество се определят на равни интервали от време (вж. по-долу).
При потокови тестове, величината на течението на разтворителя и основния токсичен разтвор се проверяват на интервали, за предпочитане всеки ден, и следва да не варират с повече от 10 % по време на теста. Когато се очаква концентрациите тествано вещество да бъдат в ± 20 % от номиналната стойност (т.е. в стойности 80—120 %; вж.точки 1.6.2 и 1.6.3), се препоръчва като минимум да се анализират най-високата и най-ниската концентрация на теста при започването на теста и след това на интервали всяка седмица. За тестове, където концентрацията на тестваното вещество не се очаква да остане в номиналната стойност от ± 20 % (на основата на данни за стабилността на тестваното вещество), е необходимо да се анализират всички тествани концентрации, но като се следва същия режим.
При полустатичните (обновяеми) тестове, където концентрацията на тестваното вещество се очаква да остане в номиналната стойност от ± 20 %, се препоръчва като минимум да се анализират най-високата и най-ниската концентрация на теста, скоро след подготовката им и веднага преди възстановяването им в началото на проучването и след това всяка седмица. За тестове, където концентрацията на тестваното вещество не се очаква да остане в номиналната стойност от ± 20 %, трябва да се анализират всички тествани концентрации, следвайки същия режим като при повечето стабилни вещества.
Препоръчва се резултатите да се базират на измерените концентрации. Обаче ако съществува доказателство, което показва, че концентрацията на тестваното вещество при разтваряне е поддържана на задоволително ниво в номиналната стойност от ± 20 % или по време на теста е измервана първоначалната концентрация, тогава резултатите могат да се основават на номиналната и на измерената стойности.
Възможно е да се наложи филтриране (т.е. използване на отвори с размер 0,45 (μm) или центрофугиране. Центрофугирането се препоръчва като процедура. Обаче в случай че тестваният материал не се адсорбира чрез филтрите, филтрирането също е приемливо.
По време на теста, разтворения кислород, рН и температурата от всеки съд за тестване следва да бъдат измервани. Общата твърдост, алкалност и соленост (ако се взема предвид) се измерват при контролните органи и съда с най-висока концентрация. Разтвореният кислород и солеността (ако се взема предвид) се измерват най-малко три пъти (в началото, средата и края на теста). При полустатичните тестове се препоръчва разтвореният кислород да се измерва по-често, за предпочитане преди и след всяка смяна на водата или поне веднъж на седмица. РН се измерва в началото и след всяка смяна на водата при статичните възстановими тестове и поне веднъж в седмицата при потоковите тестове. Твърдостта и алкалността се измерват поне веднъж по време на теста. За предпочитане е температурата да се наблюдава продължително по време на теста поне при един от съдовете.
1.8.6. Наблюдения
Тегло: в края на изследването трябва да се измери теглото на всички останали живи риби като мокро тегло (чрез пълно изсушаване) или в група от тествания съд, или поотделно Измерването на теглото на животните от съда, използван при теста, се предпочита пред измерването на индивидуалното тегло, което изисква рибите да бъдат маркирани поотделно. При индивидуалното измерване за определяне на индивидуалната скорост на растеж на рибите, техниката за маркиране следва да бъде подбрана така, че да се избегне подлагането на стрес на животните (може да е подходящо използването на алтернативен на студеното маркиране метод, т.е. използването на тънка цветна линия).
Рибите се преглеждат всеки ден през периода на извършване на теста и всички външни аномалии (като кръвоизлив, промяна на цвета) и ненормално поведение следва да бъдат отбелязвани. Всеки случай на смърт се описва и мъртвата риба се отстранява, колкото е възможно по-скоро. Мъртвата риба не се заменя, ако скоростта на концентрация и плътност на биомасата са достатъчни, за да се избегне въздействие върху растежа чрез изменения в броя на рибите в аквариума. Въпреки това, порцията храна е необходимо да бъде регулирана.
2. ДАННИ И ОТЧИТАНЕ
2.1. ОБРАБОТКА НА РЕЗУЛТАТИТЕ
Препоръчва се включването на статистик, както при планирането, така и при анализа на теста, доколкото методът за извършване на теста позволява значителни изменения при планирането, като например при броя на аквариумите за тестване, броя на тестваните концентрации, броя на рибите, и т.н. С оглед на наличните възможности при планирането на теста, тук не се дават специфични насоки върху статистическата процедура.
Скоростта на растежа не следва да се изчислява за съдове за тестване, когато смъртността надвишава 10 %. Обаче нивото на смъртност се определя за всички тествани концентрации.
Който и метод да се използва за анализ на данните, основната формула е специфичната скорост на растеж r за периода между t1 и t2. Това може да се определи по няколко начина, в зависимост от това, дали рибата е отделно маркирана или не, и от това, дали се изисква обикновен аквариум.



където,
|
ri
|
=
|
е индивидуалната специфична скорост на растежа
|
|
r2
|
=
|
е средната за аквариума специфична скорост на растеж
|
|
r3
|
=
|
е „псевдо“ специфичната скорост на растеж
|
|
Wi, W2
|
=
|
са теглото на отделната риба при време съответно t1 и t2
|
|
loge wi
|
=
|
е логаритъм на теглото на отделната риба при започване на изследователския период
|
|
loge W2
|
=
|
е логаритъм на теглото на отделната риба при завършване на периода на изследване
|
|
loge W1
|
=
|
е средната стойност на логаритмите на показателя wi за рибите в аквариума в началото на изследователския период
|
|
loge W2
|
=
|
е средната стойност на логаритмите на показателя W2 за рибите в аквариума в края на изследователския период
|
|
ti и t2
|
=
|
е времето (дните) в началото и в края на периода на изследване
|
ri, r2, r3 могат да се изчисляват за период от 0—28 дни и когато е подходящо (т.е. когато се прави измерване на четиринадесетия ден) за периоди от 0—14 и 14—28 дни.
2.1.1. Анализ на резултатите, получени чрез регресия (моделиране на концентрация—реакция)
Този метод на анализ отговаря на подходящи математически съотношения между специфичната скорост на растеж и концентрация и следователно позволява изчисляване на ЕСX т.е. всички необходими стойности на ЕС. Използването на този метод на изчисляване на r за отделната риба (ri) не е необходимо и вместо това анализът може да се основава на средната стойност за аквариум r (r2). Последният метод се предпочита. Подходящ е и в случаите, когато се използват най-малките видове.
Средната за аквариума специфична скорост на растеж (r2) се чертае графично спрямо концентрацията с цел да се провери отношението концентрация—реакция.
За да се изрази отношението между r2 и концентрацията, следва да се използва подходящ модел и неговият избор трябва да се подкрепи със съответните аргументи.
Ако броят на оцелелите във всеки аквариум риби не е еднакъв, тогава, за да се пригоди моделът, се натоварва, независимо дали е прост или не линеален, с цел да се обхванат групи с различни размер.
Методът за подбиране на модела трябва да дава възможност да се направи оценка например на ЕС20 и на дисперсията (или стандартна грешка или доверителен интервал). Графиката на изобразения модел следва да бъде показана във връзка с данните, така че да може да се види в каква степен е пригоден моделът (8) (18) (19) (20).
2.1.2. Анализ на резултатите от оценката на LOEC
Ако текстът включва дублиране на аквариума на всички нива на концентрация, оценката на LOEC може да се основава на анализа за променливост (ANOVA) на средната за аквариума специфична скорост на растеж (вж. точка 2.1), последван от подходящ метод (т.е. тестът на Дънет и Уилям (12) (13) (14) (21) за сравняване на средното г за всяка концентрация със средното г за контрола с цел да се определи най-ниската концентрация, за която тази разлика е значителна при възможно ниво от 0,05. Ако не се намери изискваната предпоставка за параметричен метод, с цел да се преобразуват данните към хомогенна променливост преди извършването на ANOVA или по време на извършване на ANOVA за теглото, се обръща внимание на ненормалното разпределение (например теста на Шапиро—Уилк) или хетерогенната променливост (тест на Бартлет).
Ако тестът не включва дублиращ аквариум за всяка концентрация, ANOVA, основана на аквариума, ще бъде невъзможна или слабочувствителна. В такава ситуация, се прави допустим компромис на основата на ANOVA върху „псевдо“ специфичната скоростна растеж r3 за отделната риба.
Средната r3 за всяка тествана концентрация може тогава да се сравни с средната r3 за контролите. LOEC тогава може да бъде определено, както преди това. Трябва да се признае, че този метод не дава възможност нито за допустимост, нито за защита срещу разликите между аквариумите, извън тази, която се отчита за разликите между отделните риби. Обаче практиката показва (8), че променливостта между аквариумите е много малка в сравнение с тази в аквариумите (т.е. между рибите). Ако отделната риба не е включвана в анализа, се посочват метода за определяне на рязко отличаваща се стойност и причините за неговата употреба.
2.2. ТЪЛКУВАНЕ НА РЕЗУЛТАТИТЕ
Резултатите се тълкуват внимателно, когато измерените токсични концентрации на тестваното вещество се появят на ниво, близко до определената от аналитичния метод граница, или при полустатичните тестове, когато концентрацията на тестваното вещество се увеличава за времето между току-що приготвения разтвор и преди подновяването.
2.3. ДОКЛАДВАНЕ НА ТЕСТА
Докладването на теста трябва да включва следната информация:
2.3.1. Тествано вещество:
|
—
|
физична природа и съответните физико-химични свойства;
|
|
—
|
данни за химична определеност включително чистота и аналитичен метод за проверка на тестваното вещество, когато е приложимо.
|
2.3.2. Тествани видове:
|
—
|
научно наименование, по възможност;
|
|
—
|
род, размер, доставчик и предварителна обработка, и т.н.
|
2.3.3. Условия за извършване на теста:
|
—
|
използвана процедура на тестване (например полустатична/възобновима, при течение, скорост на концентрацията, плътност на биомасата и т.н.);
|
|
—
|
проектиране на теста (например брой на съдовете за теста, тестваната и дублираща концентрация, брой на рибите в отделен съд);
|
|
—
|
метод на подготовка на основния разтвор и честотата на сменяне (трябва да се посочени разтварящия фактор и неговата концентрация, когато се използват);
|
|
—
|
номиналната тествана концентрация, средствата за изчисляване на стойностите и техните отклонения при съдовете за теста и метода, чрез който те са постигнат и доказателство, че тези мерки се отнасят за концентрацията на тестваното вещество в истинския разтвор;
|
|
—
|
характеристика — разтворимост във вода: рН, твърдост, алкалност, температура, концентрация на разтворен кислород, нива на остатъци от хлор (ако се измерени), общо количество органичен въглерод, разтворени частици, соленост на тестваната среда (ако се измерва) е всички други направени измервания;
|
|
—
|
качество на водата в съда за тестване: рН, твърдост, температура и концентрация на разтворен кислород;
|
|
—
|
подробна информация за храненето (например вида на храната, даденото количество и честота).
|
2.3.4. Резултати:
|
—
|
доказателство, че контролната група изпълнява валидния критерий за оцеляване, както и данни за смъртността при всички нива на тестваната концентрация;
|
|
—
|
използваните статистически техники за анализ, статистика, основана на дублирането или на рибите, обработване на данните и обосноваване използването на тези техники;
|
|
—
|
таблични данни за индивидуалното и средното тегло на рибата за дните 0, 14 (ако са изчислени) и 28 стойности от средната за аквариума или „псевдо“ специфичната скорост на растеж (при необходимост) за периодите 0—28 дни или по възможност 0—14 и 14—28 дни,
|
|
—
|
резултати от статистическите анализи (т.е. регресионен анализ или ANOVA) за предпочитане в таблична и графична форма и съответно LOEC (р = 0,05) и NOEC и ЕСХ по възможност със стандартна грешка,
|
|
—
|
разпространяване на необичайни реакции на рибите и всички видими ефекти, появили се в резултат от тестваното вещество.
|
3. ПРЕПРАТКИ
|
(1)
|
Solbe J. F. de LG (1987). Environmental Effects of Chemicals (CFM 9350 SLD). Report on a UK Ring Test of a Method for Studying the Effects of Chemicals on the Growth Rate of Fish. WRc Report No PRD 1388-M/2.
|
|
(2)
|
Ashley S., Mallett M. J. and Grandy N. J. (1990). EEC Ring Test of a Method for Determining the Effects of Chemicals on the Growth Rate of Fish. Final Report to the Commission of the European Communities. WRc Report No EEC 2600-M.
|
|
(3)
|
Crossland N. O. (1985). A method to evaluate effects of toxic chemicals on fish growth. Chemosphere, 14, pp. 1855—1870.
|
|
(4)
|
Nagel R., Bresh H., Caspers N., Hansen P. D., Market M., Munk R., Scholz N. and Höfte B. B. (1991). Effect of 3,4-dichloroaniline on the early life stages of the Zebrafish (Brachydanio rerio): results of a comparative laboratory study. Ecotox. Environ. Safety, 21, pp. 157—164.
|
|
(5)
|
Yamamoto, Tokio. (1975). Series of stock cultures in biological field. Medaka (killifish) biology and strains. Keigaku Publish. Tokio, Japan.
|
|
(6)
|
Holcombe, G. W., Benoit D. A., Hammermeister, D. E., Leonard, E. N. and Johnson, R. D. (1995). Acute and long-term effects of nine chemicals on the Japanese medaka (Oryzias latipes). Arch. Environ. Conta. Toxicol. 28, pp. 287—297.
|
|
(7)
|
Benoit, D. A., Holcombe, G. W. and Spehar, R. L. (1991). Guidelines for conducting early life toxicity tests with Japanese medaka (Oryzias latipes). Ecological Research Seriese PA-600/3-91-063. USE nvironmental Protection Agency, Duluth, Minnesota.
|
|
(8)
|
Stephan C. E. and Rogers J. W. (1985). Advantages of using regression analysis to calculate results of chronic toxicity tests. Aquatic Toxicology and Hazard Assessment: Eighth Symposium, ASTM STP 891, R. C. Bahner and D. J. Hansen, eds., American Society for Testing and Materials, Philadelphia, pp. 328—338.
|
|
(9)
|
Environment Canada (1992). Biological test method: toxicity tests using early life stages of salmonid fish (rainbow trout, coho salmon, or atlantic salmon). Conservation and Protection, Ontario, Report EPS 1/RM/28, 81 pp.
|
|
(10)
|
Cox D. R. (1958). Planning of experiments. Wiley Edt.
|
|
(11)
|
Pack S. (1991). Statistical issues concerning the design of tests for determining the effects of chemicals on the growth rate of fish. Room Document 4, OECD Ad Hoc Meeting of Experts on Aquatic Toxicology, WRc Medmenham, UK, 10—12 December 1991.
|
|
(12)
|
Dunnett C. W. (1955). A Multiple Comparisons Procedure for Comparing Several Treatments with a Control, J. Amer. Statist. Assoc, 50, pp. 1096—1121.
|
|
(13)
|
Dunnett C. W. (1964). New tables for multiple comparisons with a control. Biometrics, 20, pp. 482—491.
|
|
(14)
|
Williams D. A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, pp. 103—117.
|
|
(15)
|
Johnston, W. L., Atkinson, J. L., Glanville N. T. (1994). A technique using sequential feedings of different coloured food to determine food intake by individual rainbow trout, Oncorhynchus mykiss: effect of feeding level. Aquaculture 120, pp. 123—133.
|
|
(16)
|
Quinton, J. C. and Blake, R. W. (1990). The effect of feed cycling and ration level on the compensatory growth response in rainbow trout, Oncorhynchus mykiss. Journal of Fish Biology, 37, pp. 33—41.
|
|
(17)
|
Post, G. (1987). Nutrition and Nutritional Diseases of Fish. Chapter IX in Testbook of Fish Health. T.F.H. Publications, Inc. Neptune City, New Jersey, USA. 288 pp.
|
|
(18)
|
Bruce, R. D. and Versteeg D. J. (1992). A statistical procedure for modelling continuous toxicity data. Environ. Toxicol. Chem. 11, pp. 1485—1494.
|
|
(19)
|
DeGraeve, G. M., Cooney, J. M., Pollock, T. L., Reichenbach, J. H., Dean, Marcus, M. D. and McIntyre, D. O. (1989). Precision of EPA seven-day fathead minnow larval survival and growth test; intra and interlaboratory study. Report EA-6189 (American Petroleum Institute Publication, No 4468). Electric Power Research Institute, Palo Alto, CA.
|
|
(20)
|
Norbert-King T. J. (1988). An interpolation estimate for chronic toxicity: the Icp approach. USE nvironmental Protection Agency. Environmental Research Lab., Duluth, Minnesota. Tech. Rep. No 05-88 of National Effluent Toxicity Assesment Center. Sept. 1988. 12 pp.
|
|
(21)
|
Williams D. A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, pp. 510—531.
|
Приложение 1
ВИДОВЕ РИБИ, ПРЕПОРЪЧАНИ ЗА ТЕСТВАНЕ И ПОДХОДЯЩИ УСЛОВИЯ ЗА ИЗВЪРШВАНЕ НА ТЕСТА
|
Видове
|
Препоръчител на температура
(oC)
|
Излагане на светлина
(в часове)
|
Препоръчително първоначално тегло на рибата
(g)
|
Изисквана прецизност на измерването
|
Скорост на концентрацията
(g/l)
|
Плътност на биомасата
(за литър)
|
Храна
|
Продължителност на теста
(дни)
|
|
Препоръчани видове:
|
|
|
|
|
|
|
|
|
|
Oncorhynchus mykiss
дъгова пъстърва
|
12,5—16,0
|
12—16
|
1—5
|
Най-близо до 100 mg
|
1,2—2,0
|
4
|
Патентовани пържени храни от сушени сьомги
|
≥ 28
|
|
Други добре документирани видове:species:
|
|
|
|
|
|
|
|
|
|
Danio rerio
риба зебра
|
21—25
|
12—16
|
0,050—0,100
|
Най-близо до 1 mg
|
0,2—1,0
|
5—10
|
Сурова храна (Brachionus Artemia)
|
≥ 28
|
|
Oryzias latipes
оризова риба (Медака)
|
21—25
|
12—16
|
0,050—0,100
|
Най-близо до 1 mg
|
0,2—1,0
|
5—0
|
Сурова храна (Brachionus Artemia)
|
≥ 28
|
Приложение 2
НЯКОИ ХИМИЧНИ ХАРАКТЕРИСТИКИ НА ДОПУСТИМАТА РАЗТВОРИМОСТ ВЪВ ВОДА
|
Вещество
|
Концентрация
|
|
Твърди частици
|
< 20 mg/l
|
|
Общ органичен въглерод
|
< 2 mg/l
|
|
Нейонизиран амоняк
|
< 1 μg/l
|
|
Утайка от хлор
|
< 10 μg/l
|
|
Общи органофосфорни пестициди
|
< 50 ng/l
|
|
Общи органохлоридни пестициди плюс полихлоринатен бифенил
|
< 50ng/l
|
|
Общ органичен хлор
|
< 25 ng/l
|
Приложение 3
логаритмични серии на концентрации, подходящи за извършвоне на токсичен тест (9)
|
Колона (номер на концентрация между 100 и 10, или между 10 и 1) (20)
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
|
32
|
46
|
56
|
65
|
68
|
72
|
75
|
|
10
|
22
|
32
|
40
|
46
|
52
|
56
|
|
3,2
|
10
|
18
|
25
|
32
|
37
|
42
|
|
1,0
|
4,6
|
10
|
16
|
22
|
27
|
32
|
|
|
2,2
|
5,6
|
10
|
15
|
19
|
24
|
|
|
1,0
|
3,2
|
6,3
|
10
|
14
|
18
|
|
|
|
1,8
|
4,0
|
6,8
|
10
|
13
|
|
|
|
1,0
|
2,5
|
4,6
|
7,2
|
10
|
|
|
|
|
1,6
|
3,2
|
5,2
|
7,5
|
|
|
|
|
1,0
|
2,2
|
3,7
|
5,6
|
|
|
|
|
|
1,5
|
2,7
|
4,2
|
|
|
|
|
|
1,0
|
1,9
|
3,2
|
|
|
|
|
|
|
1,4
|
2,4
|
|
|
|
|
|
|
1,0
|
1,8
|
|
|
|
|
|
|
|
1,3
|
|
|
|
|
|
|
|
1,0
|
В.15. РИБИ, КРАТКОСРОЧЕН ТЕСТ ЗА ТОКСИЧНОСТ ПРИ ЕМБРИОНИТЕ И ИНДИВИДИТЕ В СТАДИЙ НА ХРАНЕНЕ ОТ ЖЪЛТЪЧНАТА ТОРБИЧКА
1. МЕТОД
Този метод за изследване на субхроничната орална токсичност е точно копие на ОИСР TG 212 (1998).
1.1. ВЪВЕДЕНИЕ
Този краткосрочен метод за тестване токсичността върху рибните ембриони и индивидите в стадий на хранене от жълтъчната торбичка е краткосрочен тест, при който се излагат етапите на живот от новоизлюпеното яйце до края на стадия на хранене от жълтъчната торбичка. Не се извършва хранене при тестовете върху ембрионите и индивидите в стадий на хранене от жълтъчната торбичка и следователно тестът трябва да бъде приключен, докато новоизлюпените все още се хранят от жълтъчната торбичка.
Очаква се тестът да определи леталните и, в ограничена степен, сублеталните въздействия на химикалите върху определени стадии и тествани видове. Този тест дава полезна информация, че може: а) да се образува мост между леталните и сублетални тестове, б) да се използва като екранен тест или за тест на целия ранен стадий на живот или за тест на хроничната токсичност, и в) да се използва като тестване на видове, при които техниките на отглеждане не са достатъчно добре развити за да покрият периода на промените от ендогенно до екзогенно хранене.
Следва да се има предвид, че само тестовете, които инкорпорират в себе си всички стадии от цикъла на живот на рибите, обикновено са надеждни при даване на точна преценка за хроничната токсичност на химикалите при рибите, и че всякакво редуциране на излагането с оглед на жизнените стадии може да намали чувствителността и така да се подцени хроничната токсичност. Следователно се очаква тестът върху ембриона и новоизлюпените да е по-малко чувствителен от теста за целия ранен стадий на живот, по-специално по отношение на химикалите с висока липофилност (log Pow > 4) и химикали със специфичен начин на действие на токсичността. Обаче по-малките разлики в чувствителността между двата теста може да се очакват при химикали с неспецифичен, наркотичен начин на действие (1).
Преди публикуването на този тест, по-голямата част от опита с ембриони и новоизлюпени е придобит със сладководните риби Danio rerio (риба зебра) Hamilton-Buchanan (telepstei, cyprinidae — общо наименование на риба зебра). По-подробни насоки по извършването на този тест за тези видове е следователно даден в приложение 1. Това не ограничава употребата на други видове, с които също има натрупан опит (таблици IA и IБ).
1.2. ОПРЕДЕЛЕНИЯ
Най-ниска концентрация на въздействие (LOEC): е най-ниската тествана концентрация от тестваното вещество, при която се наблюдава значително въздействие от страна на веществото (при р < 0,05), при сравнение с контролата. Въпреки това, всички тествани концентрации над LOEC трябва да имат вредно въздействие равно на или по-голямо от това, наблюдавано при LOEC.
Концентрация на ненаблюдавано въздействие (NOEC): това е тестваната концентрация непосредствено под LOEC.
1.3. ПРИНЦИП НА ПРОВЕЖДАНЕ НА ТЕСТА
Ембрионът и новоизлюпените при рибите се излагат на различна степен на концентрация на тестваното вещество, разтворено във вода. По протокол е възможен избор между полустатичната и потоковата процедурата. Изборът зависи от вида на тестваното вещество. Тестът започва чрез поставяне на оплоденото яйце в тестовите камери изследване и се определя точно преди жълтъчните торбички на всички ларви във всички помещения за тестване да са напълно абсорбирани и преди да започне измиране в резултат на пълен глад при контролите. Леталните и сублетални ефекти се оценяват и се сравняват с контролния параметър с цел да се определи най-ниското наблюдавано въздействие на концентрация и следователно ненаблюдаваното въздействие на концентрацията. Друга възможност е те да се анализират чрез използване на метод на регресия с цел да се извърши оценка на концентрацията, която би причинила дадения процент въздействие (т.е. LC/EСx, където х е определено въздействие в проценти).
1.4. ИНФОРМАЦИЯ ЗА ТЕСТВАНОТО ВЕЩЕСТВО
Следва да са на разположение и резултатите от теста за акутната токсичност (виж метод В.1), за предпочитане извършен с избраните за този тест видове. Резултатите могат да са полезни при избора на подходяща степен на тествана концентрация при теста в ранните стадии на живот. Следва да са известни разтворимостта във вода (включително разтворимост във тестваната вода) и парното налягане на тестваното вещество. Следва да е на разположение и надежден аналитичен метод за характеризиране на веществото в тествания разтвор, чрез известна и отчетена точност и чрез ограничение на разпространението.
Информацията, която е необходима за създаването на условията на провеждане на теста, включва структурната формула, чистота на веществото, устойчивост на светлина, устойчивост при условията на теста, рКа, Pow и резултатите от теста за готовност за биоразграждане (вж. метод В.4).
1.5. ВАЛИДНОСТ НА ТЕСТА
Тестът е валиден, ако са налице следните условия:
|
—
|
цялостно оцеляване на оплодените яйца в контролните групи и по отношение на съдовете само с разтвор, то трябва да бъде по-голямо или равно на ограниченията, определени в приложения 2 и 3;
|
|
—
|
концентрацията на разтворен кислород трябва да бъде между 60 и 100 % от степента на въздушно насищане по време на извършването на теста;
|
|
—
|
температурата на водата не трябва да се различава с повече от ±1,5oС между тестовите камери или през последователни дни по време на теста, и следва да е в температурния обхват, определен за тестваните видове (приложения 2 и 3).
|
1.6. ОПИСАНИЕ НА МЕТОДА ЗА ИЗВЪРШВАНЕ НА ТЕСТА
1.6.1. Тестови камери
Може да се използват всякакъв вид стъклени или химически неутрални съдове. Размерите на съдовете следва да са достатъчно широки, за да съответстват на плътността на биомасата (вж. точка 1.7.1.2). Препоръчва се помещенията, в които се извършва тестът, да са разположени на случаен принцип в зоната на извършване на теста. Когато има систематични въздействия в лабораторията, които могат да се контролират чрез блокиране, се предпочита подреждане на случаен принцип на стендовете за изпитване, като във всеки стенд са представени всички извършващи се обработки, преди напълно хаотичното подреждане. Ако се използва блокиране, то се взима предвид при последващи анализи на данните. Тестовите камери следва да са защитени от нежелани смущения по време на работата.
1.6.2. Избор на видове риби
Видовете риби, които се препоръчват, са посочени в таблица 1А. Това не ограничава използването на други видове (например посочените в таблица 1Б), но се налага приспособяване на процедурата за извършване на теста, за да се получат подходящите условия. В този случай следва да се отчита основанието за избор на отделните видове и на експерименталния метод.
1.6.3. Съхраняване на стадо риби за размножаване
Подробности относно съхраняването на стадо при задоволителни условия могат да се намерят в ОИСР TG 210 (21) и в препратки към използваната литература (2) (3) (4) (5) (6).
1.6.4. Третиране на ембрионите и ларвите
Ембрионите и ларвите могат да се излагат, вътре в основния съд за извършване на теста, в по-малки съдове, имащи странични и дънни отвори, за да се позволи оттичане на тествания разтвор през съда. Може да се предизвика слабо течение през тези малки съдове чрез спирането им с ръчка, монтирана да премества съда нагоре и надолу, но запазвайки винаги организмите потопени под вода; може да се използва система за промиване чрез сифон. Оплодените яйца на риби от семейството на сьомгата могат да се запазват с решетки и сито с достатъчно широки отвори, които да позволяват на ларвите да преминават през тях след излюпването. Целесъобразна е употребата на пипетка за цялостно всекидневно възстановяване на ембрионите и ларвите при полустатичните тестове (вж. параграф 1.6.6).
Когато контейнерите с яйца, решетките и ситата са били използвани, за да се задържат яйцата в основния съд за извършване на теста, тези ограничители се премахват след излюпването на ларвата (21), c изключение на ситата, които следва да се задържат, за да се предотврати изпускането на рибите. Ако има нужда от прехвърляне на ларвите, те следва да не се излагат на въздух и не следва да се използват мрежи, да за се освободи рибата от контейнерите с яйцата (такава предпазливост може да не е наложителна при някои не толкова чувствителни видове, например при шарана). Времетраенето на това преместване се променя в зависимост от видовете и това преместване не винаги е необходимо. За полустатичните техники могат да се използват чаши от химическо устойчиво стъкло и плитки съдове и ако е необходимо, оборудвани със сито, което е леко повдигнато над ръба на чашата. Ако обемът на тези съдове е достатъчен за условията за плътност, (вж. 1.7.1.2) не е необходимо преместване на ембрионите и ларвите.
1.6.5. Вода
Всички води, които отговарят на химичните характеристики за приемливо разреждане с вода, както са изброени в приложение 4 и в които тестваните видове показват контролирана жизнена способност най-малко толкова добра, колкото описаната в приложения 2 и 3, са води, подходящи за използване при изследването. Необходимо е постоянно качество на водата по време на изследването. РН следва да остане в границите от ±0,5 рН на единица. За да се гарантира, че водата, която служи за разтвор, няма да повлияе прекомерно на резултатите от изследването (например чрез образуване на комплексни съединения на тестваното вещество) или да навреди на стадото риби, анализите се правят на интервали. Следва да се измерват тежките метали (например Сu, Pb, Zn, Hg, Cd и Ni), основните аниони и катиони (например Сa, Mg, Na, K, Cl и SO4), пестициди (например органофосфор, и общо съдържание на органохлорни пестициди), общо съдържание на органичен въглерод и разтворими частици, например на всеки три месеца, в случаите, когато водата, която се използва като разтвор, е известно, че има относително постоянни качества. Ако качеството на водата е постоянно поне за период, по-голям от една година, изчисленията могат да се правят по-рядко и да се увеличат интервалите (например на всеки шест месеца).
1.6.6. Разтвори за теста
Разтворите за теста при избрана концентрация се приготвят чрез разреждане на основния разтвор.
Основният разтвор се приготвя за предпочитане чрез просто смесване и разбъркване на тестваното вещество във водата, която се използва като разтвор, като се използват механични средства (например разклащане или с помощта на ултразвук). За постигане на подходящо концентриран основен разтвор, могат да се използват колоните на насищане/разтворимост. Доколкото е възможно следва да се избегне употребата на разтворители и диспергиращи (разтварящи) агенти; Обаче може в някои случаи да наложи употребата на такива съединения с цел да се получи подходящ концентриран основен разтворител. Примери за подходящи разтворители са ацетон, етанол, метанол, диметилсулфооксид, диметилформамид и триетиленгликол. Примери за подходящи диспергиращи агенти са Cremophor RH40, Tween 80, метилцелулоза 0,01 % и НСО-40. Внимава се при употребата на готови биоразграждащи вещества (например ацетон) и/или високо летливи съединения, тъй като могат да причинят проблеми с бактериалното натрупване при потоковите тестове. Когато се използва разтварящ агент, не трябва да оказва значително въздействие върху жизнената способност, нито да има видими вредни ефекти върху ранните стадии от жизнения цикъл, проявени при контролите само с разтвор. Въпреки това, следва да се положат всички усилия, за да се избегне употребата на такива материали.
При полустатичните техники могат да се следват две различни процедури за възстановяване: или i) се приготвят нови разтвори за изследване в чисти съдове или жизненоспособните яйца и ларви внимателно се пренасят в нови съдове с малко количество от стария разтвор, избягвайки излагането на въздух, или И) тестваните организми се запазват в съдовете, докато поне три четвърти от водата за теста не се смени. Честотата на средното подновяване ще зависи от устойчивостта на тестваното вещество, но се препоръчва всекидневна смяна на водата. Ако от първоначалните тестове за устойчивост (вж. точка 1.4), е видно, че концентрацията на тестваното вещество не е стабилна (т.е. извън номиналните стойностите от 80—120 % или пада под 80 % от измерената първоначална концентрация) по време на периода на смяна, то трябва да се предвиди използването на потоков тест. Във всеки случай следва да се полагат грижи за избягване на стрес при ларвите по време на действията по смяна на водата.
За потоковите тестове се изисква система, която постоянно дозира и разрежда основния разтвор на тестваното вещество (например измерваща помпа, пропорционален разредител, напоителни системи), за да се прехвърлят серии от концентрации към тестовите камери. Параметрите на изтичането на основния разтвор и разредената вода се проверяват на интервали, за предпочитане всеки ден, по време на извършването на теста и през това време не се променя с повече от 10 %. Счита се, че скорост на течението равна на поне пет обема на помещението за тестване за 24 часа е подходяща.
1.7. ПРОЦЕДУРА
Публикуваните научни изследвания дават полезна информация за извършване на теста при рибния ембрион и новоизлюпеното, като някои примери са включени в раздела за използвана литература към настоящия текст (7) (8) (9).
1.7.1. Условия на експозиция
1.7.1.1. Продължителност
За предпочитане е изследването да започне до 30 минути след като яйцето е било оплодено. Ембрионите се потапят предварително в разтвора или колкото е възможно по-скоро след започване стадия на делене на бластодиск и при всички случаи преди началото на стадия на гаструлата. За яйца, получени от търговски доставчик, може да не е възможно тестът да започне веднага след оплождането. Тъй като чувствителността на теста може да бъде сериозно засегната чрез забавяне началото на изследването, самото тестване следва да започне в период от осем часа след оплождането. Тъй като ларвите не се хранят по време на експозиционния период, тестът следва да завърши точно преди жълтъчните торбички на всички ларви във всички камери за извършване на изследването да са се абсорбирали напълно, или преди да се появи смъртност в резултат на глад при контролните групи. Продължителността зависи от видовете, които се използват при изследването. Някои препоръки относно продължителността са дадени в приложения 2 и 3.
1.7.1.2. Зареждане
Броят на оплодените яйца в началото на изследването следва да е достатъчен, за да отговаря на статистическите изисквания. През време на третирането те следва да са разпределени на случаен принцип и поне 30 оплодени яйца,разделени по равно (или на колкото е възможно по-равно, като се има предвид, че може да е трудно да се постигне еднаквост при стадата риби, когато се използват някои видове), следва да бъдат използвани за всяка концентрация между поне три дублиращи камери за тестване. Скоростта на зареждане (биомаса на обем тестван разтвор) следва да е достатъчно ниска с цел да се поддържа без вентилация концентрация на разтворения кислород от поне 60 % от степента на въздушно насищане. За потоковия тест се препоръчва скорост на дозиране не по-голяма от 0,5 g/1 за 24 часа и не повече от 5 g/1 от разтвора по всяко време (2).
1.7.1.3. Светлина и температура
Продължителността на излагане на светлина и водната температура следва да са подходящи за тестваните видове (приложения 2 и 3). За наблюдение на температурата може да се окаже подходящо използването на допълнителни съдове за тестване.
1.7.2. Тествани концентрации
Обикновено се изискват пет концентрации на тестваното вещество разпределени с постоянен коефициент, който не превишава 3,2. Кривата относно LC50 за периода на излагане при акутното проучване следва да се има предвид, когато се избира обхвата на тестваната концентрация. Употребата на по-малко от пет концентрации, например при тест за определяне на граници, както и по-тесни интервали на концентрация, може да са подходящи при определени обстоятелства. Представят се причините, довели до използването на по-малко от пет концентрации. Не е нужно да се изследват концентрации на тестваното вещество по-високи от LC50 или 100 mg/1 за 96 часа, независимо кое от двете е по-ниско. Веществата не трябва да се тестват над техния лимит на разтворимост на веществото във водата за изследване.
Когато коефициентът на разтворимост се използва при подготовката на основния разтвор (вж. точка 1.6.6), неговата последна концентрация в съда за тестване следва да не бъде по-висока от 0,1 ml/1 и следва да бъде същата при всички съдове за тестване.
1.7.3. Контроли
Една контролна серия с водата, която се използва като разтвор (дублирана при необходимост) и, ако е уместно, една контролна серия, съдържаща разтворител, следва да бъдат включени допълнително към тестваните серии.
1.7.4. Честота на аналитичните установявания и измервания
По време на теста концентрациите на тестваното вещество се определят на равни интервали от време.
При полустатичните тестове, където концентрацията на тестваното вещество се очаква да остане в номиналната стойност от ± 20 %, (т.е. в стойности 80—120 %; виж точки 1.4 и 1.6.6), се препоръчва като минимум да се анализират най-високата и най-ниската концентрация на теста, когато след като са приготвени и незабавно преди възстановяването в поне три момента, разположени равномерно по време на теста (т.е. анализи се правят върху образец от същия разтвор — когато е току-що приготвен и възстановен).
За тестове, където концентрацията на тестваното вещество не се очаква да остане в номиналната стойност от ± 20 % (на основата на данни за стабилността на тестваното вещество), е необходимо да се анализират всички тествани концентрации, след като са приготвени и при подновяването, но като се следва същия режим (т.е. в поне три момента, разположени равномерно по време на теста). Определянето на концентрацията на веществото, което се изследва, преди подновяването, е необходимо да се извърши само при един от дублиращите съдове за всяка концентрация. Определянето на концентрациите се прави с разлика от не повече от седем дни. Обаче ако е налице доказателство, което показва, че концентрацията на тестваното вещество в разтвора е била задоволително постигната при ± 20 % от номиналната стойност или е измерена първоначална концентрация на тестваното вещество по време на извършването на изследването, тогава резултатите могат да се основават на номинала или на измерените първоначални стойности.
За потокови тестовете, подобен режим на взимане на проби е подходящ като този, описан за полустатичните тестове, (но измерване на „стари“ разтвори не се прилага в този случай). Обаче ако продължителността на теста е повече от седем дни, може да се препоръча увеличаване броя на вземането на пробите през първата седмица (например три измервания) за да се гарантира, че концентрациите от тестваното вещество са останали устойчиви.
Може да се появи нужда от центрофугиране или филтриране на пробите (например използвайки 0,45 μm размер на порите). Обаче, тъй като нито центрофугирането ,нито филтрирането разделят винаги небиологичните частици от биологичните, пробите може да не подлагат на тези третирания.
По време на теста следва да бъдат измервани разтвореният кислород, рН и температурата от всеки съд за тестване. Общата твърдост и соленост (ако е подходящо) се измерват при контролните органи и съда с най-висока концентрация. Като минимум разтвореният кислород и солеността (ако е подходящо) се измерват три пъти (в началото, средата и края на теста). При полустатичните тестове се препоръчва разтвореният кислород да се измерва по-често, за предпочитане преди и след всяка смяна на водата или поне веднъж на седмица. Измерването на рН става в началото и след всяка смяна на водата при полустатичните тестове и поне веднъж в седмицата при потоковите тестове. Твърдостта и алкалността се измерват поне веднъж по време на теста. Температурата следва да се измерва всекидневно и за предпочитане се наблюдава продължително поне при един съд по време на теста.
1.7.5. Наблюдения
1.7.5.1. Стадий на развитие на ембриона
Стадият на развитие на ембриона (т.н. гаструла) се проверява колкото може по-прецизно в началото на излагането на тестваното вещество. Това може да се направи като се използват представителни проби на яйца, запазени и изчистени по подходящ начин. Използваната литература също съдържа данни за описанието и илюстрирането на стадиите на развитие на ембриона.
1.7.5.2. Излюпване u жизнена способност
Наблюденията върху излюпването и жизнената способност се правят поне веднъж на ден и се записва броя на излюпените индивиди. Желателно е да се правят по-чести наблюдения в началото на теста (на всеки 30 минути по време на първите три часа), тъй като в някои случаи времето за оцеляване може да бъде от по-голямо значение, отколкото броят на мъртвите екземпляри (например при остри токсични въздействия). Мъртвите ембриони и ларви се отстраняват веднага след като са забелязани, тъй като могат да се разложат бързо. При отстраняването на мъртвите индивиди се полага изключителна грижа да не се ударят и да не се наранят физически близкостоящите яйца/ларви, които са изключително деликатни и чувствителни. Критериите за смърт варират в зависимост от стадия на съществуване:
|
—
|
при яйцата: по специално в ранните стадии това са: забелязана загуба на прозрачност и изменение в оцветяването, причинени от сгъстяване и/или утаяване на протеини, водещи до бял непрозрачен вид,
|
|
—
|
при ембрионите: липса на движенията на тялото и/или липса на сърдечен ритъм и/или непрозрачно обезцветяване при вид, чиито ембриони са нормално прозрачни,
|
|
—
|
при ларвите: неподвижност и/или липса на дихателни движения и/или липса на сърдечен ритъм и/или бял непрозрачно оцветяване на централната нервна система и/или липса на реакции при механични стимуланти.
|
1.7.5.3. Аномалия във външния вид
Броя на ларвите, които показват аномалии във формата на тялото и/или пигментацията и стадия на абсорбция на жълтъчната торбичка се записват на подходящи интервали, зависещи от продължителността на теста и вида на описаната аномалия. Следва да се отбележи, че анормалните ембриони и ларви се появяват по нормален начин и могат да бъдат от порядъка на няколко процента от контролните серии при някои видове. Анормалните животни следва да се отстраняват от съда за тестване само при смърт.
1.7.5.4. Анормално държание
Анормалните състояния, като хипервентилация, некоординирано плуване и нетипично състояние на покой, се записват на адекватни интервали в зависимост от продължителността на теста. Тези ефекти, въпреки трудността да се определи тяхното количество, когато се наблюдават, могат да помогнат при тълкуването на данните за смъртността т.е. да дадат информация за начина, по който се проявява токсичното действие на веществото.
1.7.5.5. Дължина
В края на теста, се препоръчва измерване дължината на индивидите; може да се използва стандартна, разклонена и обща дължина. Ако обаче се появят гниене на опашния плавник и разяждане на перката, се използва стандартната дължина. В повечето случаи при добре извършените тестове, коефициентът на променливост на дължината между дублиращите серии и контролните е ≤ 20 %.
1.7.5.6. Тегло
В края на теста може да се измери индивидуалното тегло; тегло в сухо състояние (24 часа при 60 oС) е за предпочитане пред мокро тегло (пълно изсушаване). В повечето случаи при добре извършените тестове, коефициентът на променливост на теглото между дублиращите серии и контролните е ≤ 20 %.
Тези наблюдения ще повлияят на някои или всички на следните данни, които са на разположение за статистическия анализ:
|
—
|
брой на здравите ларви на края на теста;
|
|
—
|
време на започване на излюпването и края му (т.е. 90 % излюпване във всяка репликация),
|
|
—
|
брой на ларвите, които се излюпват всеки ден;
|
|
—
|
дължина (и тегло) на оцелелите животни в края на теста;
|
|
—
|
брой на ларвите, които са деформирани или са с анормален вид;
|
|
—
|
брой на ларвите, проявили анормално държание.
|
2. ДАННИ И ОТЧИТАНЕ
2.1. ОБРАБОТКА НА РЕЗУЛТАТИТЕ
Препоръчва се да бъде включен и статистик и при проектирането и при анализа на теста, тъй като методът позволява значителна променливост при проектирането на експеримента като например брой на тестовите камери, брой на тестваните концентрации, начален брой на оплодените яйца и измерените параметри. От гледна точка на наличните възможности при проектирането на теста тук не се дават специфични насоки по статистическите процедури.
Ако LOEC/NOECs трябва да се измерват, необходимо е да се анализира променливостта във всяка дублираща серия, като се използва анализ на средното отклонение (ANOVA) или процедури за създаване на таблици за непредвидените случаи. С цел да се направи многократно сравнение между резултатите на индивидуалните концентрации и тези за контролните органи, метода на Дънет може да бъде полезен (12) (13). Други полезни примери също са на разположение (14) (15). Размерът на въздействието, който може да се установи като се използва ANOVA или други процедури (т.е. показател на теста), се измерва и отчита. Следва да се отбележи, че не всички наблюдения, изброени в точка 1.7.5.6, са подходящи за статистическия анализ, използващ ANOVA. Например общата смъртност и броят на здравите ларви в края на теста се анализират, като се използват безпогрешни методи.
Ако трябва да се измерват LС/ЕСх,подходяща крива(и), например логистична крива следва да се нагоди, така че да съответства точно на данните, които са от интерес за изследването, чрез използване на статистически метод като последните квадрати или нелинейни последни квадрати. Кривата(ите) се измерва така, че съотношението LC/ECX и неговите стандартни грешки да могат да се изчислят директно. Това много ще улесни изчисляването на границите на сигурност около LC/ECX. Освен ако няма основателни причини да се предпочетат различни граници на сигурност, позоваването става при двустранна сигурност от 95 %. Процедурите по съответствие следва преди всичко да предоставят средството за оценяване значението на липсата на съответствие. Могат да се използват графичните методи на съответстващи си криви. Регресионният анализ е подходящ за всички наблюдения, изброени в точка 1.7.5.6
2.2. ТЪЛКУВАНЕ НА РЕЗУЛТАТИТЕ
Резултатите следва да се тълкуват внимателно, когато измерените токсични концентрации в тестваните разтвори са на ниво, което е близко до границата на разпространение на аналитичния метод. Тълкуването на резултатите за концентрациите над водната разтворимост на веществата също се прави внимателно.
2.3. ОТЧИТАНЕ НА ТЕСТА
Резултатите от теста трябва да включват следната информация:
2.3.1. Тествано вещество
|
—
|
физична природа и съответните физико-химични свойства;
|
|
—
|
данни за химична определеност, включително чистота на състава и аналитичен метод за проверка на тестваното вещество, при необходимост.
|
2.3.2. Тествани видове:
|
—
|
научно наименование, род, брой на родителски риби (т.е. колко женски са използвани, за да се осигури необходимия брой яйца за теста), източник и метод на събиране на оплодените яйца, и последващите излюпвания.
|
2.3.3. Условия за извършване на теста:
|
—
|
използваната процедура на тестване (например полустатична или потокова, времето от оплождането до започването на теста, зареждането и т.н.);
|
|
—
|
планиране на теста (например брой на тестовите камери и дублиращите серии, брой на ембрионите в една дублираща серия);
|
|
—
|
метод на подготовка на основния разтвор и честотата на сменяне (трябва да се посочени разтворителя и неговата концентрация, когато се използват);
|
|
—
|
номиналната тествана концентрация, измерените стойности средствата за изчисляване на стойностите и техните отклонения в съдовете за теста и методът, чрез който те са постигнати и ако тестваното вещество се разтваря във вода при концентрация по-ниска от тестваната, следва да се представи доказателство, че тези мерки се отнасят за концентрацията на тестваното вещество в разтвора;
|
|
—
|
характеристика разтворимост във вода: рН, твърдост, температура, концентрация на разтворен кислород, нива на остатъци от хлор (ако се измерени), общо органичен въглерод, разтворени частици, соленост на тестваната среда (ако се измерва) и всички други направени измервания;
|
|
—
|
качество на водата в съда за тестване: рН, твърдост, температура и концентрация разтворен кислород.
|
2.3.4. Резултати:
|
—
|
резултати от предварителните проучвания за устойчивостта на тестваното вещество;
|
|
—
|
доказателство, че контролните серии отговарят на стандартите всички допустими критерии за оцеляване на тестваните видове (приложения 2 и 3);
|
|
—
|
данни за смъртността/оцеляването в стадиите на ембриони и ларви и общата смъртност/оцеляване;
|
|
—
|
данни за излюпването и броя на излюпените;
|
|
—
|
данни за дължината (и теглото);
|
|
—
|
разпространение и описание на морфологични отклонение, ако има такива;
|
|
—
|
разпространение и описание на въздействието върху държанието, ако има такова;
|
|
—
|
статистически анализ и обработка на данните,
|
|
—
|
за тестове анализирани чрез ANOVA, най-ниската концентрация с наблюдаван ефект (LOEC) като р = 0,05 и концентрация с ненаблюдавано въздействие (NOEC) за всяка оценена реакция, включително описание на използваните статистически процедури и индикация за размера на въздействието, която може да се определи;
|
|
—
|
за тестове, анализирани чрез регресионни техники, LC/ECX и интервалите на сигурност, и диаграма за използваните модели за тяхното изчисляване;
|
|
—
|
обяснение на всички отклонения от този метод на тестване.
|
3. ПРЕПРАТКИ
|
(1)
|
Kristensen P. (1990). Evaluation of the Sensitivity of Short Term Fish Early Life Stage Tests in Relation to other FELS Test Methods. Final report to the Commission of the European Communities, 60 pp. June 1990.
|
|
(2)
|
ASTM (1988). Standard Guide for Conducting Early Life-Stage Toxicity Tests with Fishes. American Society for Testing and Materials. E 1241-88. 26 pp.
|
|
(3)
|
Brauhn J. L. and Schoettger R. A. (1975). Acquisition and Culture of Research Fish: Rainbow trout, Fathead minnows, Channel Catfish and Bluegills. p. 54, Ecological Research Series, EPA-660/3-75-011, Duluth, Minnesota.
|
|
(4)
|
Brungs W. A. and Jones B. R. (1977). Temperature Criteria for Freshwater Fish: Protocol and Procedures. p. 128, Ecological Research Series EPA-600/3-77-061, Duluth, Minnesota.
|
|
(5)
|
Laale H. W. (1977). The Biology and Use of the Zebrafish (Brachydanio rerio) in Fisheries Research. A Literature Review. J. Biol. 10, pp. 121—173.
|
|
(6)
|
Legault R. (1958). A Technique for Controlling the Time of Daily Spawning and Collecting Eggs of the Zebrafish, Brachydanio rerio (Hamilton-Buchanan) Copeia, 4, pp. 328—330.
|
|
(7)
|
Dave G., Damgaard B., Grande M., Martelin J. E., Rosander B. and Viktor T. (1987). Ring Test of an Embryo-larval Toxicity Test with Zebrafish (Brachydanio rerio) Using Chromium and Zinc as Toxicants. Environmental Toxicology and Chemistry, 6, pp. 61—71.
|
|
(8)
|
Birge J. W., Black J. A. and Westerman A. G. (1985). Short-term Fish and Amphibian Embryo-larval Tests for Determining the Effects of Toxicant Stress on Early Life Stages and Estimating Chronic Values for Single Compounds and Complex Effluents. Environmental Toxicology and Chemistry 4, pp. 807—821.
|
|
(9)
|
Van Leeuwen C. J., Espeldoorn A. and Mol F. (1986). Aquatic Toxicological Aspects of Dithiocarbamates and Related Compounds. III. Embryolarval Studies with Rainbow Trout (Salmo gairdneri). J. Aquatic Toxicology, 9, pp. 129—145.
|
|
(10)
|
Kirchen R. V. and W. R. West (1969). Teleostean Development. Carolina Tips 32(4): 1-4. Carolina Biological Supply Company.
|
|
(11)
|
Kirchen R. V. and W. R. West (1976). The Japanese Medaka. Its care and Development. Carolina Biological Supply Company, North Carolina. 36 pp.
|
|
(12)
|
Dunnett C. W. (1955). A Multiple Comparisons Procedure for Comparing Several Treatments with Control. J. Amer. Statist. Assoc, 50, pp. 1096—1121.
|
|
(13)
|
Dunnett C. W. (1964). New Tables for Multiple Comparisons with a Control. Biometrics, 20, pp. 482—491.
|
|
(14)
|
Mc Clave J. T., Sullivan J. H. and Pearson J.G. (1980). Statistical Analysis of Fish Chronic Toxicity Test Data. Proceedings of 4th Aquatic Toxicology Symposium, ASTM, Philadelphia.
|
|
(15)
|
Van Leeuwen C. J., Adema D. M. M. and Hermes J. (1990). Quantitative Structure-Activity Relationships for Fish Early Life Stage Toxicity. Aquatic Toxicology, 16, pp. 321—334.
|
|
(16)
|
Environment Canada. (1992). Toxicity Tests Using Early Life Stages of Salmonid Fish (Rainbow Trout, Coho Salmon or Atlantic Salmon). Biological Test Method Series. Report EPS 1/RM/28, December 1992, 81 pp.
|
|
(17)
|
Dave G. and Xiu R. (1991). Toxicity of Mercury, Nickel, Lead and Cobalt to Embryos and Larvae of Zebrafish, Brachydanio rerio. Arch. Of Environmental Contamination and Toxicology, 21, pp. 126—134.
|
|
(18)
|
Meyer A., Bierman C. H. and Orti G. (1993). The phylogenetic position of the Zebrafish (Danio rerio), a model system in developmental biology — an invitation to the comperative methods. Proc. Royal Society of London, Series B, 252: pp. 231—236.
|
|
(19)
|
Ghillebaert F., Chaillou C, Deschamps F. and Roubaud P. (1995). Toxic Effects, at Three pH Levels, of Two Reference Molecules on Common Carp Embryo. Ecotoxicology and Environmental Safety 32, pp. 19—28.
|
|
(20)
|
US EPA, (1991). Guidelines for Culturing the Japanese Medaka, Oryzias latipes. EPA report EPA/600/3-91/064, Dec. 1991, EPA, Duluth.
|
|
(21)
|
US EPA, (1991). Guidelines for Conducting Early Life Stage Toxicity Tests with Japanese Medaka, (Oryzias latipes). EPA report EPA/600/3-91/063, Dec. 1991, EPA, Duluth.
|
|
(22)
|
De Graeve G. M., Cooney J. D., McIntyre D. O., Poccocic T. L., Reichenbach N. G., Dean J. H. and Marcus M. D. (1991). Validity in the performance of the seven-day Fathead minnow (Pimephales promelas) larval survival and growth test: an intra- and interlaboratory study. Environ. Tox. Chem. 10, pp. 1189—1203.
|
|
(23)
|
Calow P. (1993). Handbook of Ecotoxicology, Blackwells, Oxford. Vol. 1, Chapter 10: Methods for spawning, culturing and conducting toxicity tests with Early Life stages of Estuarine and Marine fish.
|
|
(24)
|
Balon E. K. (1985). Early life history of fishes: New developmental, ecological and evolutionary perspectives, Junk Publ., Dordrecht, 280 pp.
|
|
(25)
|
Blaxter J. H. S. (1988). Pattern and variety in development, in: W. S. Hoar and D. J. Randall eds., Fish Physiology, Vol. XIA, Academic press, pp. 1—58.
|
Таблица 1А
Видове риби, които се препоръчват за използване при тестове
|
СЛАДКОВОДНИ
|
|
Oncorhynchus mykiss
дъгова пъстърва (9) (16)
|
|
Danio rerio
риба зебра(7) (17) (18)
|
|
Cyprinus caprio
шаран (8) (19)
|
|
Oryzias latipes
японска оризова риба (медака)(20) (21)
|
|
Pimephales promelas
рибка бодливка (8) (22)
|
Таблица 1Б
Примери за други добре документирани видове, които също могат да се използват
|
СЛАДКОВОДНИ
|
СОЛЕНОВОДНИ
|
|
Carassius auratus
Златна рибка (8)
|
Menidia peninsualae
Крайбрежна дребна риба (23) (24) (25)
|
|
Lepomis macrochirus
Риба луна (8)
|
Clupea harengus
Херинга (24) (25)
|
|
Gadus morhua
Риба треска (24) (25)
|
|
Cyprinodon variegatus
Рибка бодливка (23) (24) (25)
|
Приложение 1
РЪКОВОДСТВО ЗА ИЗВЪРШВАНЕ НА ТЕСТОВЕ ЗА ТОКСИЧНОСТ ВЪРХУ ЕМБРИОНИТЕ И ИНДИВИДИТЕ В СТАДИЯ НА ХРАНЕНЕ ОТ ЖЪЛТЪЧНАТА ТОРБИЧКА НА РИБА ЗЕБРА (BRACHYDANIO RERIO)
ВЪВЕДЕНИЕ
Рибата зебра произлиза от Короманделския бряг на Индия, където обитава бързотечащи потоци. Това е обикновена аквариумна риба от семейство „Шарани“ и информация за начините на нейното отглеждане и развъждане може да се намери в съответните книги за тропическите риби. Нейните биологически особености и използването ѝ в проучвания за рибарството се разглеждат от Лаале (1).
Рибата рядко надвишава 45 mm дължина. Тялото е цилиндрично със 7—9 тъмносини хоризонтални сребристи ивици. Тези ивици достигат до опашния плавник и перките. Гърбът е маслиненозелен. Мъжките индивиди са по-тънки от женските. Женските индивиди са по-сребристи и коремната област е разширена, преди всичко заради хвърлянето на хайвера.
Възрастните риби са способни да устоят на големи колебания в температурата, рН и твърдостта. Обаче, за да има здрави риби, които снасят яйца от добро качество, следва да се осигурят оптимални условия.
По време на изхвърлянето на хайвера мъжките преследват и блъскат женските и, тъй като яйцата са изхвърлени, те се оплождат. Яйцата, които са прозрачни и не са лепкави, падат на дъното, където могат да бъдат изядени от родителите. Изхвърлянето на хайвера се влияе от светлината. Ако сутрешната светлина е подходяща, обикновено рибите изхвърлят хайвера си в ранните часове на следващото разсъмване.
Женският индивид може да произведе групи от по няколко стотина яйца на седмични интервали.
УСЛОВИЯ ЗА РИБИТЕ РОДИТЕЛИ, ВЪЗПРОИЗВЕЖДАНЕ И РАННИ СТАДИИ НА СЪЩЕСТВУВАНЕ
Избират се подходящ брой здрави риби и се запазват в подходяща вода (т.е. приложение 4) в продължение на поне две седмици преди очакваното изхвърляне на хайвера. Групата от риби се храни поне веднъж преди произвеждането на групата яйца, използвани при теста. Гъстотата на рибите по време на този период не следва да надвишава 1 g риба на литър. Редовната смяна на водата или използването на почистващи системи дава възможност да се увеличи гъстотата. Температурата на аквариума се поддържа на нивото от 25 + 2 oС. Рибата се подлага на различни хранителни режими, които могат да съдържат например подходяща суха храна от търговската мрежа, живи току-що уловени солнични раци, Chronomids, Daphnia, бели червеи (Enchytraeids).
По-долу са описани две процедури, които на практика водят до достатъчен брой здрави, оплодени яйца, за да се извърши теста:
|
i)
|
Осем женски и 16 мъжки индивида се поставят в аквариум, съдържащ 50 литра вода с разтвор, защитени от директна светлина и се оставят необезпокоявани колкото е възможно повече, в продължение на най-малко 48 часа. Ваната за събиране на хайвера се поставя на дъното на аквариума следобед в деня, предшестващ началото на теста. Ваната съдържа прегради (плексиглас или други подходящи материали), с 5—7 cm височина с 2—5 mm груба мрежа, прикрепена отгоре, както и 10—30 μm фина мрежа на дъното. Няколко „дървета от хайвер“, които се състоят от разплетено найлоново въже, са прикрепени към грубата мрежа на рамката. След като рибите са били оставени 12 часа на тъмнина, се пуска слаба светлина, която предизвиква изхвърлянето на хайвера. От два до четири часа след изхвърлянето на хайвера, ваната се отстранява и се събират яйцата. Ваната не позволява рибите да изядат яйцата и в същото време дава възможност за лесното им събиране. Групата от риби следва да е хвърляла хайвер поне веднъж преди изхвърлянето на хайвера, от който се използват яйца за тестване.
|
|
ii)
|
От 5 до 10 мъжки и женски индивида се настаняват поотделно поне две седмици преди очакваното изхвърляне на хайвер. След 5—10 дни коремната област на женските индивиди се разширява и техните генитални папили стават видими. Мъжките риби нямат папили. Изхвърлянето на хайвера става в съответен аквариум, оборудван с лъжливо дъно с решетка отгоре (като е посочено по-горе). Аквариумът се пълни с вода с разтвор, така че дълбочината на водата над решетката да е 5—10 cm. Един женски и два мъжки индивида се поставят в този аквариум един ден преди очакваното изхвърляне на хайвера. Температурата на водата се повишава постепенно до един градус над температурата за аклиматизация. Светлината се изгасва и аквариумът се оставя колкото е възможно без външно въздействие. На сутринта се пуска лека светлина, която предизвиква изхвърляне на хайвера. След 2—4 часа рибите се отстраняват и яйцата се събират. Ако има нужда от по-голям брой яйца, отколкото може да се получи от една женска, може паралелно да се подготвят достатъчен брой аквариуми за хайвер. Чрез записване на постигнатата репродуктивност на женския индивид преди теста (размера на групата и качеството), тези женски, които са с най-висока репродуктивностq могат да се изберат за отглеждане.
|
Яйцата се пренасят в съда за изследване чрез използване на стъклени тръби (вътрешен диаметър не по-малък от 4 mm), снабдени с еластично мехурче за изсмукване. Количеството вода, което се пренася заедно с яйцата, е колкото е възможно по-малко. Яйцата са по-тежки от водата и потъват извън тръбата. Полагат се грижи, за да се предпазят яйцата (ларвите) от контакт с въздуха. Следва да се извърши микроскопско изследване на пробите от групата, за да се гарантира, че няма неточности в първите стадии на развитие. Не се разрешава дезинфекция на яйцата.
Скоростта на смъртност при яйцата е най-висока през първите 24 часа след оплождането. Смъртност от 5—40 % е често наблюдавана през този период. Яйцата се израждат в резултат от неуспешно оплождане или развитие. Качеството на групата яйца зависи от женския индивид, тъй като някои женски постоянно произвеждат яйца с добро качество, а други никога не произвеждат доброкачествени яйца. Скоростта на развитие и на излюпване също зависи от различните групи. Обикновено над 90 % от успешно оплодените яйца и ларвите в жълтъчната торбичка оцеляват. При 25o С яйцата се излюпват 3—5 дни след оплождането и жълтъчната торбичка се абсорбира приблизително 13 дни след оплождането.
Развитието на ембриона е добре описано от Хизаока и Батъл (2). Благодарение на прозрачността на яйцата и ларвите след излюпването, може да се следи развитието на рибата и да се наблюдава наличието на дефекти. Приблизително четири часа след изхвърлянето на хайвера, неоплодените яйца могат да се различат от оплодените (3). При това изследване яйцата и ларвите се поставят в съдове за тестване с малък обем и се изучават под микроскоп.
Условията за извършване на теста, които се прилагат в ранния стадий, са изброени в приложение 2. Оптималните стойности за рН и за твърдост на водата, съдържаща разтвора, са 7, 8 и съответно 250 mg СаСО3/l.
ИЗЧИСЛЕНИЯ И СТАТИСТИКА
Предлага се двустепенен подход. Първо се анализират статистически данните за смъртността, анормалното развитие и времето на изхвърляне на хайвера. След това за тези концентрации, при които не са били определен вредни ефекти по никой от тези параметри, статистически се изчислява дължината на тялото. Този подход се препоръчва, тъй като токсикантите могат селективно да убият по-малките риби, да забавят времето за изхвърляне на хайвера и да предизвикат основни дефекти, което води до измервания на наклонената дължина. Освен това ще е налице приблизително същият брой риби, който трябва да бъде измерен за една обработка при гарантиране на валидността на тестваното вещество.
LC50 И ЕС50 ФОРМУЛИ
Процентът на оцелелите яйца и ларви се изчислява и се коригира за смъртността при контролите съгласно формулата на Абот (4):
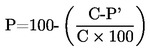
където,
|
Ρ
|
=
|
коригиран процент оцелели
|
|
Р'
|
=
|
процент на оцелели, наблюдавани в тестваната концентрация
|
|
С
|
=
|
процент оцелели в контролната серия
|
Ако е възможно, LC50 се определя чрез подходящ метод в края на теста.
Ако е желателно включването на морфологичните аномалии в статистическите данни за ЕС50, могат да се намерят насоки при Стефан (5).
ОЦЕНКА НА LOEC И NOEC
Една от целите на изследването на яйцата и индивидите в стадия на изхранване от жълтъчната торбичка, е да се направи сравнение на нулевите концентрации с контролата, т.е. да определи LOEC. Следователно могат да се използват процедури за многократно сравняване (6) (7) (8) (9) (10).
ПOЗOBABAHИЯ
|
(1)
|
Laale H. W. (1977). The Biology and Use of the Zebrafish (Brachydanio rerio) in Fisheries Research. A Literature Review. J. Fish Biol. 10, pp. 121—173.
|
|
(2)
|
Hisaoka K. K. and Battle H. I. (1958). The Normal Development Stages of the Zebrafish Brachydanio rerio (Hamilton-Buchanan) J. Morph., 102, 311 pp.
|
|
(3)
|
Nagel R. (1986). Untersuchungen zur Eiproduktion beim Zebrabärbling (Brachydanio rerio Hamilton-Buchanan). Journal of Applied Ichthyology, 2, pp. 173—181.
|
|
(4)
|
Finney D. J. (1971). Probit Analysis, 3rd ed., Cambridge University Press, Great Britain, pp. 1—333.
|
|
(5)
|
Stephan C. E. (1982). Increasing the Usefulness of Acute Toxicity Tests. Aquatic Toxicology and Hazard Assessment: Fifth Conference, ASTM STP 766, J. G. Pearson, R. B. Foster and W. E. Bishop, Eds., American Society for Testing and Materials, pp. 69—81.
|
|
(6)
|
Dunnett C. W. (1955). A Multiple Comparisons Procedure for Comparing Several Treatments with a Control. J. Amer. Statist. Assoc, 50, pp. 1096—1121.
|
|
(7)
|
Dunnett C. W. (1964). New Tables for Multiple Comparisons with a Control. Biometrics, 20, pp. 482—491.
|
|
(8)
|
Williams D. A. (1971). A Test for Differences Between Treatment Means when Several Dose Levels are Compared with a Zero Dose Control. Biometrics, 27, pp. 103—117.
|
|
(9)
|
Williams D. A. (1972). The Comparison of Several Dose Levels with a Zero Dose Control. Biometrics 28, pp. 519—531.
|
|
(10)
|
Sokal R. R. and Rohlf F. J. (1981). Biometry, the Principles and Practice of Statistics in Biological Research, W. H. Freeman and Co., San Francisco.
|
Приложение 2
УСЛОВИЯ ЗА ИЗВЪРШВАНЕ НА ТЕСТА, ПРОДЪЛЖИТЕЛНОСТ И КРИТЕРИИ ЗА СПОСОБНОСТТА ЗА ОЦЕЛЯВАНЕ ПРИ ПРЕПОРЪЧАНИТЕ ВИДОВЕ
|
ВИДОВЕ
|
Температура
(°С)
|
Соленост
(0/00)
|
Период на излагане на светлина
(часове)
|
Продължителност на периода
(дни)
|
Типична продължителност на теста
|
Оцеляване на контролите
(минимум %)
|
|
ембриони
|
торбичка
|
успешно изхвърляне на хайвер
|
след изхвърлянето на хайвера
|
|
СЛАДКОВОДНИ
|
|
Brachydanio rerio
риба зебра DANIORERIO
|
25±1
|
—
|
12–16
|
3–5
|
8–10
|
Колкото е възможно по-скоро след оплождането (ранен стадий на гаструла) до 5 дни след изхвърлянето на хайвера (8—10 дни)
|
80
|
90
|
|
ONCORHYNCHUS MYKISS
дъгова пъстърва
|
10±1 (22)
12±1 (23)
|
—
|
0 (24)
|
30–35
|
25–30
|
Колкото е възможно по-скоро след оплождането (ранен стадий на гаструла) до 20 дни след изхвърлянето на хайвера (50—55 дни)
|
66
|
70
|
|
CYPRINUS CAPRIO
шаран
|
21–25
|
—
|
12–16
|
5
|
>4
|
Колкото е възможно по-скоро след оплождането (ранен стадий на гаструла) до 4 дни след изхвърлянето на хайвера (8—9 дни)
|
80
|
75
|
|
ORYZIAS LATIPES
японска оризова риба
|
24±1 (22)
23±1 (23)
|
—
|
12–16
|
8–11
|
4–8
|
Колкото е възможно по-скоро след оплождането (ранен стадий на гаструла) до 5 дни след изхвърлянето на хайвера (13—16 дни)
|
80
|
80
|
|
PIMEPHALES ROMELAS
рибка бодливка
|
25±2
|
—
|
16
|
4–5
|
5
|
Колкото е възможно по-скоро след оплождането (ранен стадий на гаструла) до 4 дни след изхвърлянето на хайвера (8—9 дни)
|
60
|
70
|
Приложение 3
Условия за извършване на теста, продължителност и критерии за способността за оцеляване при препоръчаните видове
|
Видове
|
Температура (oС)
|
Соленост (0/00)
|
Период на излагане на светлина (часове)
|
Продължителност на периода (дни)
|
Типична продължителност на теста
|
Оцеляване на контролите (минимум %)
|
|
|
|
|
|
ембриони
|
торбичка
|
успешно изхвърляне на хайвер
|
след изхвърлянето на хайвера
|
|
СЛАДКОВОДНИ
|
|
Carassius auratus
златна рибка
|
24 ± 1
|
—
|
—
|
3—4
|
>4
|
Колкото е възможно по-скоро след оплождането (ранен стадий на гаструла) до 4 дни след изхвърлянето на хайвера (7 дни)
|
—
|
80
|
|
Lepomis macrochirus
риба луна
|
21 ± 1
|
—
|
16
|
3
|
>4
|
Колкото е възможно по-скоро след оплождането (ранен стадий на гаструла) до 4 дни след изхвърлянето на хайвера (7 дни)
|
—
|
75
|
|
СОЛЕНОВОДНИ
|
|
Menidia peninsualae
крайбрежна дребна риба
|
|
15—22
|
12
|
1,5
|
10
|
Колкото е възможно по скоро след оплождането (ранен стадий гаструла) до 5 дни след изхвърлянето на хайвера (6—7 дни)
|
80
|
60
|
|
Clupea harengus
херинга
|
10±1
|
8—15
|
|
20—25
|
3—5
|
Колкото е възможно по-скоро след оплождането (ранен стадий на гаструла) до 3 дни след изхвърлянето на хайвера (23—27 дни)
|
60
|
80
|
|
Gadus morhua
риба треска
|
5 ± 1
|
5—30
|
12
|
14—16
|
3—5
|
Колкото е възможно по-скоро след оплождането (ранен стадий на гаструла) до 3 дни след изхвърлянето на хайвера (18 дни)
|
60
|
80
|
|
Cyprinodon variegates
рибка бодливка
|
25 ± 1
|
15—30
|
12
|
—
|
—
|
Колкото е възможно по-скоро след оплождането (ранен стадий на гаструла) до 4/7 дни след изхвърлянето на хайвера (28 дни)
|
>75
|
80
|
Допълhение 4
НЯКОИ ХИМИЧНИ ХАРАКТЕРИСТИКИ НА ДОПУСТИМ РАЗТВОР ВвВ ВОДАТА
|
ВЕЩЕСТВО
|
КОНЦЕНТРАЦИИ
|
|
ПРАХОВИ ЧАСТИЦИ
|
< 20 mg/1
|
|
ОБЩ ОРГАНИЧЕН ВЪГЛЕРОД
|
< 2 mg/1
|
|
НЕЙОНИЗИРАН АМОНЯК
|
< 1 μg/l
|
|
ОСТАТЪЦИ ОТ ХЛОР
|
< 10 μg/l
|
|
ОБЩИ ОРГАНОФОСФОРНИ ПЕСТИЦИДИ
|
< 50 ng/1
|
|
ОБЩИ ОРГАНОХЛОРНИ ПЕСТИЦИДИ ПЛЮС ПОЛИХЛОРЕН БИФЕНИЛ
|
< 50 ng/1
|
|
ОБЩ ОРГАНИЧЕН ХЛОРИН
|
< 25 ng/1
|
В.16. МЕДОНОСНА ПЧЕЛА — ТЕСТ ЗА ОСТРА ОРАЛНА ТОКСИЧНОСТ
1. МЕТОД
Този метод за изследване на острата токсичност е точно копие на ОИСР TG 213 (1998).
1.1. ВЪВЕДЕНИЕ
Този тест за токсичност при медоносните пчели-работнички е лабораторен метод, планиран с цел да се оцени оралната остра токсичност на продуктите за защита на растенията и други химикали.
При оценката и изчисляването на токсичните характеристики на веществата може да се изисква определяне на острата орална токсичност при медоносните пчели, т.е. когато е възможно излагане на пчелите на даден химикал. Тестът за острата орална токсичност при пчелите се извършва, за да се определи присъщата токсичност на пестицидите и други химикали по отношение на пчелите. Резултатите от този тест следва да се използват за определяне необходимостта от по-нататъшна оценка. По-специално този метод може да се използва при програмите за оценка на риска от пестициди при пчелите, основана на последваща прогресия от лабораторни тестове за токсичност до експерименти в полуполеви и полеви условия (1). Пестицидите могат да се изследват като активни вещества или като образувани продукти.
Използва се стандарт за токсичност, за да се провери чувствителността на пчелите и прецизността на процедурата по извършване на теста.
1.2. ОПРЕДЕЛЕНИЯ
Остра орална токсичност: представлява вредните ефекти, които се появяват при максимална продължителност от 96 часа (h) на орално приемане на отделна доза от тестваното вещество.
Доза: е сборът от консумираното тествано вещество. Дозата се изразява като съотношение на масата (μg) на тестваното вещество към тестваното животно (μg/пчeлa). Истинската доза за всяка пчела поотделно не може да се изчисли, тъй като пчелите се хранят колективно, но може да се изчисли една средна доза (общото консумирано тествано вещество/броя на тестваните пчели в една клетка).
LD
50
(средната летална доза) орална: това е статистически получената единична доза от веществото, която може да причини смърт при 50 % от животните, когато се приема през устата. Стойността на LD50 се изразява в μg от тестваното вещество на пчела. За пестицидите тестваното вещество може да е или активно вещество, или образуван продукт, съдържащ едно или повече от едно активни вещества.
Смъртност: животното се записва като мъртво, когато е напълно неподвижно.
1.3. ПРИНЦИП НА МЕТОД НА ТЕСТВАНЕ
Възрастните медоносни пчели работнички (Apis mellifera) се излагат на серия дози от тестваното вещество, разпръснато в захаросан разтвор. След това пчелите се подлагат на същия хранителен режим, който не включва тестваното вещество. Смъртността се записва всеки ден по време на период от 48 часа и се сравнява с контролните стойности. Ако степента на смъртност се увеличи за период от 24 до 48 часа, докато контролната смъртност остава на приемливо ниво, т.е. < 10 %, е подходящо да се удължи продължителността на теста до максимум 96 часа. Резултатите се анализират, за да се изчисли LD50 на двадесет и четвъртия и на четиридесет и осмия час, а в случаи на продължително изследване, на седемдесети втория и на деветдесет и шестия час.
1.4. ВАЛИДНОСТ НА ТЕСТА
За да бъде тестът валиден, прилагат се следните условия:
|
—
|
средна смъртност за общия брой контроли не трябва да надвишава 10 % към края на теста;
|
|
—
|
LD50 на токсичните стандарти отговаря на специален обхват.
|
1.5. ОПИСАНИЕ НА МЕТОДА НА ТЕСТВАНЕ
1.5.1. Избор на пчели
Използват се младите възрастни пчели работници от един и същ род, т.е. пчели с една и съща възраст, начин на хранене, т.н. Пчелите се взимат от подходящо хранени, здрави и, доколкото е възможно, неболедували колонии с пчела царица, чието минало и физиологически статус са добре познати. Те могат да се съберат сутринта или вечерта преди теста и да се държат при условията на тестване до следващия ден. Подходящи са пчели, събрани от пита без пилило. Събирането в ранна пролет или късна есен се избягва, тъй като пчелите изменят физиологията си през това време. Ако тестовете трябва да се проведат през ранна пролет или късна есен, пчелите могат да се сложат в инкубатор и да се развъждат за една седмица с „пчелен хляб“ (тичинков прашец, събран от медената пита) и захаросан разтвор. Пчелите, които са третирани с химични вещества като антибиотици, антивароа продукти и т.н., не се използват при тест за токсичност в продължение на четири седмици след края на последното третиране.
1.5.2. Условия на настаняване и хранене
Използват се клетки, които се почистват лесно и се проветряват добре. Могат да се използват всички подходящи материали, т.е. неръждаема стомана, телена решетка, пластмасови и дървени клетки за еднократна употреба, т.н. Предпочитат се групи от 10 пчели в клетка. Размерът на клетките за теста следва да съответства на броя на пчелите, т.е. да осигурява достатъчно пространство.
Пчелите се държат в тъмнина в експерименталната стая при температура от 25 ± 2oС. По време на теста следва да се записва относителната влажност, която нормално е около 50—70 %. Процедурите по задържането, включително обработката и наблюденията могат да се провеждат при (дневна) светлина. За храна се използва захаросан разтвор във вода с крайна концентрация от 500 g/1 (50 % w/v). По желание храната се дава след даването на тествана доза. Системата на хранене позволява записване на приеманата храна за всяка клетка (вж. точка 1.6.3.1). Може да се използва стъклена тръба (приблизително 50 mm дълга и 10 mm широка с тесен отвор от едната страна около 2 mm диаметър).
1.5.3. Подготовка на пчелите
Събраните пчели се разпределят произволно в клетките за теста, разположени произволно в помещението, където се извършва тестът.
Пчелите могат да се оставят гладни до два часа преди началото на теста. Препоръчва се на пчелите да не дава храна преди обработването, за да може пчелите да са в еднакво положение относно съдържанието в червата им при започването на теста.Умиращите пчели се изхвърлят и се заместват със здрави преди началото на теста.
1.5.4. Подготовка на дозите
Тестваното вещество е водна смес и може да бъде разсеяно пряко в 50 % захаросан разтвор. За техническите продукти и вещества с ниска водна разтворимост, могат да се използват разтворители като например органичен разтвор, емулгатор и диспергиращо вещество с ниска токсичност към пчелите(т.е. ацетон, диметилформамид, диметилсулфоксид). Концентрациятта на разтворителя зависи от разтворимостта на тестваното вещество и следва да е еднаква при всички тествани концентрации. Обаче концентрацията на разтворителя от 1 % е в повечето случаи подходяща и не следва да бъде надвишавана.
Следва да се приготви подходящ контролен разтвор, т.е. където един разтвор или разтворител се използват за разтваряне на тестваното вещество, използват се и две отделни контролни групи: разтвор във вода и захаросан разтвор с разтворител/носител на концентрацията при дозиране на разтворите.
1.6. ПРОЦЕДУРА
1.6.1. Тествани и контролни групи
Броят на тестваните дози и дублиращите дози следва да отговаря на статистическите изисквания за определяне на LD50 c 95 % граници на сигурност Обикновено за теста се изискват пет дози в геометрична серия с коефициент, който не превишава 2,2 и покрива стойността за LD50. Обаче факторът на разтворителя броят на концентрациите за дозиране трябва да се определи спрямо наклона на токсичната крива (доза в сравнение със смъртност) и като се вземе предвид статистическия метод, който е избран за анализиране на резултатите. Сведенията, събрани от тестовете, позволяват избор на подходящи концентрации на дозиране.
Минимум три дублиращи тестови групи, всяка с 10 пчели, се дозират с всяка от тестваните концентрации. Минимум три контролни тестови групи, всяка с 10 пчели, се добавят към сериите за тестване. Контролните групи следва също да бъдат включени във връзка с използването на разтворител/носител (вж. точка 1.5.4).
1.6.2. Стандарти за токсичност
Стандартът за токсичност се включва в сериите за тестове. Поне три дози се избират, за да се покрие очакваната стойност на LD50. C всяка доза се използват минимум три дублиращи клетки, всяка съдържаща 10 пчели. Предпочитаният токсичен стандарт е диметоат, за който докладваната орална LC50 - 24 часа е в обхвата от 0,10—0,35 μg активно вещество/пчела (2). Обаче други токсични стандарти биха били приемливи, когато достатъчни данни могат да бъдат предоставени, за да се провери очаквания ефект от дозата (например паратион).
1.6.3. Експозиция
1.6.3.1. Приемане на дозата
Всяка тестова група от пчели трябва да има 100—200 μg от 50 % захаросан разтвор във вода, съдържащ тестваното вещество при подходящо концентрация. Големият обем изисква за всички продукти с ниска разтворимост, ниска токсичност или ниска концентрация на образуването, тъй като захаросания разтвор трябва да бъде използван. Трябва да се наблюдава приетата от всяка група обработена храна. Веднъж консумирана (обикновено за 3—4 часа), храната се отстранява от клетката и се замества с друга, която съдържа само захаросан разтвор. След това получават захаросаните разтвори по желание. За някои съединения при по-висока концентрация отхвърлянето на тестваната доза може да има за резултат по-малко или липса на консумирана храна. След максимум 6 часа неконсумираната третирана храна се замества само със захаросан разтвор. Сумата на третираната консумирана храна се изчислява (например измерване на обема/количество на оставащата третирана храна).
1.6.3.2. Продължителност
Продължителността на теста за предпочитане е 48 часа след като тестваният разтвор е заменен само от захаросан разтвор. Ако смъртността продължи да се увеличава с повече от 10 % след първите 24 часа, продължителността на теста следва да се увеличи на максимума от 96 часа, при условие че контролната смъртност не превиши 10 %.
1.6.4. Наблюдения
Смъртността се записва на четвъртия час след началото на теста и след това на 24 и 48 часа (т.е. след даване на дозата). Ако се налага удължен период за наблюдения, се правят по-нататъшни оценки за интервал от 24 часа, до максимум от 96 часа, при условие че контролната смъртност не превиши 10 %.
Количеството консумирана храна на група се изчислява. Сравняването на количеството консумация на третираната и нетретирана храна за дадени 6 часа може да предостави информация за вкуса на третираната храна.
Всяко наблюдавано въздействие на анормално държание по време на теста се записва.
1.6.5. Тест с ограничение
В някои случаи (например, когато се очаква тестваното вещество да е с ниска токсичност) се извършват ограничени тестове, с използване на 100 μg активно вещество/пчела с цел да се демонстрира, че стойността на LC50 е по-висока от тази стойност. Същата процедура се използва, като се включат три дублиращи тестови групи за тествана доза, съответните контролни групи, оценка на количеството консумирана храна, подложена на обработване и използването на токсичния стандарт. Ако се появи смъртност, следва да се извърши цялостно проучване. Ако се наблюдава сублетално въздействие, то се записва (вж. точка 1.6.4).
2. ДАННИ И ОТЧИТАНЕ
2.1. ДАННИ
Данните се сумират в таблична форма, показвайки за всяка третирана група, както и за контролните и за групите със стандартна токсичност, броя на използваните пчели, смъртността за всеки наблюдаван период от време и броя на пчелите с анормално поведение. Анализирайте данните за смъртността чрез подходящи статистически методи (например точен анализ, изменяща се средна стойност и вероятност за биномно разпределение (3) (4)). Изобразете графично кривите, които отговарят на дозите по всяко препоръчано време за наблюдение и изчислете наклона на кривите и медианата на летални дози LD50 c 95 % граници на сигурност. Коригирането на контролната смъртност може да се направи като се използва поправката на Абот (4) (5). Когато третираната храна не е изцяло консумирана, се определя дозата консумирано тествано вещество на група. LD50 се изразява в μg от тестваното вещество за пчела.
2.2. ОТЧИТАНЕ НА ТЕСТА
Отчетът за теста трябва да съдържа следната информация:
2.2.1. Тествано вещество:
|
—
|
физична природа и съответните физико-химични свойства (устойчивост във водата, парно налягане);
|
|
—
|
данни за химична определеност включително структурната формула, чистота (т.е. за пестицидите определяне и концентрация на активното вещество(а).
|
2.2.2. Тествани видове:
|
—
|
научно наименование, род, приблизителна възраст (в седмици), метод на събиране, дата на събиране,
|
|
—
|
информация за използваните колонии, от които се събират пчелите за теста, включително здравословно състояние, болести при възрастни индивиди, всякаква предварителна обработка и т.н.
|
2.2.3. Условия на теста:
|
—
|
температура и съответната влажност на стаята за експеримента,
|
|
—
|
условия на настаняване включително вид, размер и материал, от които са направени клетките,
|
|
—
|
методи за подготовка на основния и тествания разтвор (разтворителят и неговата концентрация трябва да са дадени, когато се използват);
|
|
—
|
методи за подготовка на основните разтвори и честота на подновяване (разтворителят и неговата концентрация трябва да са дадени, когато се използват);
|
|
—
|
проектиране на метода, т.е. брой и използвани тествани концентрации, брой на контролите; за всяка тествана концентрация и контрола, брой на дублиращите клетки и брой на пчелите в клетка;
|
|
—
|
дата на извършване на теста.
|
2.2.4. Резултати:
|
—
|
резултати от предварителното изследване за откриване на обхвата, ако е извършвано;
|
|
—
|
груби данни: смъртност за всяка тествана доза за всяко наблюдавано време,
|
|
—
|
диаграма на кривите за реакция спрямо дозите в края на теста;
|
|
—
|
стойности на LD50 c 95 % граници на сигурност за всяко време, препоръчано за наблюдение, за тестваното вещество и токсичния стандарт;
|
|
—
|
статистически процедури, използвани за определяне на LD50;
|
|
—
|
смъртност при контролите;
|
|
—
|
други биологически ефекти, наблюдавани или измерени т.е. анормално поведение на пчелите (включително изхвърляне на тестваната доза), количеството консумирана храна при третираните и нетретирани групи;
|
|
—
|
всички отклонения от описаната процедура на теста и всяка друга, отнасяща се до това информация.
|
3. ПРЕПРАТКИ
|
(1)
|
EPPO/Council of Europe (1993). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Products ó Honeybees. EPPO Bulletin, Vol. 23, N.1, pp. 151—165. March 1993.
|
|
(2)
|
Gough, H. J., McIndoe, E.C., Lewis, G.B. (1994). The use of dimethoate as a reference compound in laboratory acute toxicity tests on honeybees (Apis mellifera L.) 1981—1992. Journal of Apicultural Research, 22, pp. 119—125.
|
|
(3)
|
Litchfield, J.T. and Wilcoxon, F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, pp. 99—113.
|
|
(4)
|
Finney, D. J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New York.
|
|
(5)
|
Abbott, W. S. (1925). A method for computing the effectiveness of an insecticide. Jour. Econ. Entomol., 18, pp. 265—267.
|
В.17. МЕДОНОСНА ПЧЕЛА — ТЕСТ ЗА ОСТРА КОНТАКТНА ТОКСИЧНОСТ
1. МЕТОД
Този метод за изследване на острата токсичност е точно копие на ОИСР TG 214 (1998).
1.1. ВЪВЕДЕНИЕ
Този текст за токсичност при медоносните пчели работнички е лабораторен метод, създаден за оценяване на острата контактна токсичност на продукти за растителна защита и други химикали.
При оценката и оценяването на токсичните характеристики на веществата, може да се изисква определяне на острата контактна токсичност при медоносните пчели, т.е. когато е възможно излагане на пчелите на даден химикал. Тестът за острата контактна токсичност се извършва за да се определи присъщата токсичност на пестицидите и други химикали за пчелите. Резултатите от този тест се използват за да се определи нуждата от по-нататъшна оценка. По-специално този метод може да се използва програмите за оценка на риска от пестициди при пчелите, основани на последваща прогресия от лабораторни тестове за токсичност до експерименти в полуполеви и полеви условия (1). Пестицидите могат да се изследват като активни вещества или като образувани продукти.
Токсичният стандарт се използва за да се провери чувствителността на пчелите и прецизността на процедурата по извършване на теста.
1.2. ОПРЕДЕЛЕНИЯ
Острата орална токсичност: представлява вредните ефекти, които се появяват за минимален период от 96 часа (h) при локално прилагане на отделна доза от веществото.
Доза: е сбора от прилаганото тествано вещество. Дозата се изразява като масата на тестваното вещество към тестваното животно (μg/пчела).
LD
50
(средната летална доза) контактна: това е статистически извлечената единична доза от веществото, която може да причини смърт при 50 % от животните, когато се приема чрез контакт. LD50 стойност се изразява в μg от тестваното вещество на пчела. За пестицидите тестваното вещество може да е или активно вещество или образуван продукт, съдържащ едно или повече от едно активни вещества.
Смъртност: животното се записва като мъртво, когато е напълно неподвижно.
1.3. ПРИНЦИП НА МЕТОД НА ТЕСТВАНЕ
Възрастните медоносни пчели работнички (Apis mellifera) се излагат на серия дози от тестваното вещество, разтворено в подходящ носител чрез директно прилагане върху гръдния кош (капчици). Тестът продължава 48 часа. Ако нивото на смъртност се увеличи за период от 24 до 48 часа, докато контролната смътност остава на приемливо ниво, т.е. ≤ 10 %, подходящо е да се удължи продължителността на теста до максимум 96 часа. Смъртността се записва всеки ден и се сравнява с контролните стойности Резултатите се анализират с цел да се изчисли LD50 от 24 часа и 48 часа, а в случаи на продължено изследване на 72 часа и 96 часа.
1.4. ВАЛИДНОСТ НА ТЕСТА
За да бъде тестът валиден, се прилагат следните условия:
|
—
|
средната смъртност за общия брой контроли не трябва да надвишава 10 % в края на теста;
|
|
—
|
LD50 на токсичните стандарти отговаря на специалния обхват.
|
1.5. ОПИСАНИЕ НА МЕТОДА НА ТЕСТВАНЕ
1.5.1. Избор на пчели
Използват се млади възрастни пчели работници, т.е. пчели с една и съща възраст, начин на хранене, род и т.н. Пчелите се взимат от подходящо хранени, здрави и, доколкото е възможно, неболедували колонии с пчела царица, чието минало и физиологически статус са добре познати. Те могат да се съберат сутринта или вечерта преди теста и да се държат при условията на тестване до следващия ден. Подходящи са пчели събрани от пита без пипило.Събирането в ранна пролет или късна есен се избягва, тъй като пчелите изменят физиологията си през това време. Ако тестовете трябва да се проведат през ранна пролет или късна есен, пчелите могат да се сложат в инкубатор и да се развъждат за една седмица с „пчелен хляб“ (тичинков прашец, събран от медената пита) и захаросан разтвор. Пчелите, които са третирани с химични вещества като антибиотици, антивароа продукти и т.н., не се използват за тест за токсичност в продължение на четири седмици от края на последното третиране.
1.5.2. Условия на настаняване и хранене
Използват се клетки, които се почистват лесно и се проветряват добре. Могат да се използват всички подходящи материали, т.е. неръждаема стомана, телена решетка, пластмасови и дървени клетки за еднократна употреба, т.н. Размерът на клетките за теста следва да съответства на броя на пчелите, т.е. да осигурява достатъчно пространство. Предпочитат се групи от 10 пчели в клетка.
Пчелите се държат на тъмно в експерименталното помещение при температура от 25 ± 2 oС. По време на теста следва да се записва относителната влажност, която нормално е около 50—70 %. Процедурите по провеждането, включително обработката и наблюденията, могат да се провеждат при (дневна) светлина. За храна се използва захаросан разтвор във вода с крайна концентрация от 500 g/l (50 % w/v) и след тестваната доза храната се дава по преценка, като се използва хранилка за пчели. Това може да е стъклена тръба (приблизително 50 mm дълга и 10 mm широка с тесен отвор от едната страна с размер около 2 mm диаметър).
1.5.3. Подготовка на пчелите
Събраните пчели произволно се упояват с въглероден диоксид или амоняк за да се приложи тестваното вещество. Количеството използвано упойващо вещество и времето на излагане са минимални. Умиращите пчели се изхвърлят и се заместват със здрави преди започването на теста.
1.5.4. Подготовка на дозите
Когато тестваното вещество се прилага като разтвор на носителя, т.е. органичен разтвор или воден разтвор с мокрещо вещество. За органичен разтворител се предпочита ацетон, но могат да се използват и други органични разтворители с ниска токсичност (например диметилформамид, диметилсулфоксид). За продукти, получени при разтваряне във вода и за високополярни органични вещества, които не се разтварят в органични разтвори преносители, разтварянето може да се улесни, ако се приготви в слаб разтвор на промишлено мокрещо вещество (например Agral, Cittowett, Lubrol, Triton, Tween).
Следва да се приготви подходящ контролен разтвор, т.е. където един разтвор или разтворител се използват за разтваряне на тестваното вещество, се използват и две отделни контролни групи: една третирана с вода и една с разтвор/дисперсант.
1.6. ПРОЦЕДУРА
1.6.1. Тествани и контролни групи
Броят на тестваните дози и броят на дублиращите дози следва да отговарят на статистическите изисквания за определяне на LD50 c 95 % граници на сигурност. Обикновено за теста се изискват пет дози в геометрична прогресия с коефициент, който не превишава 2,2 и покрива стойността за LD50. Обаче броят на дозите трябва да бъде определен по отношение на наклона на токсичната крива (доза спрямо смъртност) и като се взимат под внимание статистическия метод, който е избран за анализиране на резултатите. Тестовете за намиране на обхвата позволяват избор на подходящи концентрации на дозата.
Минимум три дублиращи тестови групи, всяка с 10 пчели, се дозират с всяка тествана концентрация.
Минимум три контролни групи, всяка от 10 пчели, действат допълнително и се включват към сериите за тестване. Ако се използват органичен разтворител или мокрещо вещество, се включват и три допълнителни контролни групи, всяка от 10 пчели за разтворителя или мокрещото вещество.
1.6.2. Стандарти на токсичност
Токсичният стандартът на токсичност трябва да се включи в тестовите серии. Избират се най-малко три дози, за да се обхване очакваната LD50 стойност. С всяка доза следва да се използват минимум три дублиращи клетки, всяка съдържаща 10 пчели. Предпочитаният токсичен стандарт е диметоат, за който докладваната контактна LC50 - 24 часа е в 0,10—0,35 μg активно вещество/пчела (2). Обаче други токсични стандарти биха били приемливи, когато достатъчно данни могат да бъдат предоставени, за да се провери очаквания ефект от дозата (например паратион).
1.6.3. Експозиция
1.6.3.1. Приемане на дозите
Упоените пчели поотделно се третират чрез локално прилагане на тестваното вещество. Пчелите получават на случаен принцип различни тествани и контролни дози. Количество от 1 μg разтвор, съдържащ тестваното вещество при подходяща концентрация, се прилага с микроапликатор към гръбната част на торакса на всяка пчела. Ако са оправдани, се използват и други количества. След прилагането пчелите се разпределят по клетките и се захранват със захаросан разтвор.
1.6.3.2. Продължителност
За предпочитане е продължителност на теста от 48 часа. Ако смъртността продължи да се увеличава с повече от 10 % между първите 24 и 48 часа, продължителността на теста се увеличава на максимума от 96 часа, при условие че контролната смъртност не превиши 10 %.
1.6.4. Наблюдения
Смъртността се записва на четвъртия час след започване на теста и след това на 24 и 48 часа (т.е. след даване на дозата). Ако се налага удължен период за наблюдения, се правят по-нататъшни оценки за интервал от 24 часа, до максимум от 96 часа, при условие че контролната смъртност не превиши 10 %.
Всяко наблюдавано въздействие на анормално държание по време на теста се записва.
1.6.5. Ограничен тест
В някои случаи (например когато се очаква тестваното вещество да е с ниска токсичност) се извършват ограничени тестове, като се използва 100 μg активно вещество/пчела с цел да се демонстрира, че стойността на LD50 е по-голяма от тази стойност. Следва да се използва същата процедура чрез включване на три дублиращи тестови групи за тествана доза, съответните контролни групи и използването на токсичния стандарт. Ако се появи смъртност, следва да се извърши цялостно изследване. Ако се наблюдава сублетално въздействие, то се записва (вж. точка 1.6.4).
2. ДАННИ И ОТЧИТАНЕ
2.1. ДАННИ
Данните се сумират в таблична форма, като се посочва за всяка третирана група контролните и стандартно токсичните групи със стандартна токсичност, броят на използваните пчели, смъртността за всеки наблюдаван период от време и броят на пчелите с анормално поведение. Анализирайте се данните за смъртността чрез подходящи статистически методи (например точен анализ, подвижна средна стойност и вероятност за биномно разпределение) (3) (4). Изобразете графично кривите, които отговарят на дозите за всяко препоръчано време за наблюдение изчислява (т.е. 24, 48 и, ако е от значение, на 72 и 96 часа), и изчислете наклона на кривите и медианата на леталните дози (LD50) c 95 % граници на сигурност. Коригирането на контролната смъртност може да се направи като се използва поправката на Абот (4) (5). LD50 се изразява в μg от тестваното вещество за пчела.
2.2 ОТЧИТАНЕ НА ТЕСТА
Отчетът за теста трябва да съдържа следната информация:
2.2.1. Тествано вещество:
|
—
|
физична природа и съответните физико-химични свойства (например устойчивост на водата, парно налягане);
|
|
—
|
данни за химичната характеристика определеност включително структурната формула, чистота (т.е. при пестицидите определяне и концентрация на активното вещество(а).
|
2.2.2. Тествани видове:
|
—
|
научно наименование, род, приблизителна възраст (в седмици), метод на събиране, дата на събиране,
|
|
—
|
информация за използваните колонии, използване за събиране на пчелите за теста, включително здраве и заболяване при възрастни индивиди, всякаква предварителна обработка и т.н.
|
2.2.3. Условия на теста:
|
—
|
температура и съответната влажност на експерименталното помещение;
|
|
—
|
условия на настаняване включително вид, размер и материал, от който е направена клетката;
|
|
—
|
методи за приемане на тестваното вещество, т.е. използваният носещ разтвор, количеството приложено тествано вещество, използваното упойващо вещество;
|
|
—
|
проектиране на метода, т.е. броя и използваните тествани концентрации, броя на контролите; за всяка тествана концентрация и контрола, броя на дублиращите клетки и броя на пчелите в клетка;
|
|
—
|
дата на извършване на теста.
|
2.2.4. Резултати:
|
—
|
резултати от предварителното изследване за откриване на обхвата, ако е извършвано;
|
|
—
|
груби данни: смъртност за всяка тествана доза при всяко наблюдавано време,
|
|
—
|
диаграма на кривите на реакция към дозите в края на теста;
|
|
—
|
стойности на LD50 c 95 % граници на сигурност за всяко време, препоръчано за наблюдение, за тестваното вещество и стандарта на токсичност;
|
|
—
|
статистически процедури, използвани за определяне на LC50;
|
|
—
|
смъртност при контролите;
|
|
—
|
други биологически ефекти, наблюдавани или измерени, и анормално поведение на пчелите;
|
|
—
|
всички отклонения от описаната процедура на метода на теста и всяка друга, отнасяща се до това информация.
|
3. ПРЕПРАТКИ
|
(1)
|
EPPO/Council of Europe (1993). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Products ó Honeybees. EPPO bulletin, Vol. 23, N.1, pp. 151—165. March 1993.
|
|
(2)
|
Gough, H. J., McIndoe, E. C, Lewis, G. B. (1994). The use of dimethoate as a reference compound in laboratory acute toxicity tests on honeybees (Apis mellifera L.), 1981-1992. Journal of Apicultural Research 22, pp. 119—125.
|
|
(3)
|
Litchfield, J. T. and Wilcoxon, F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, pp. 99—113.
|
|
(4)
|
Finney, D. J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New York.
|
|
(5)
|
Abbott, W. S. (1925). A method for computing the effectiveness of an insecticide. Jour. Econ. Entomol. 18, pp. 265—267.
|
В.18. АДСОРБЦИЯ/ДЕСОРБЦИЯ ЧРЕЗ ИЗПОЛЗВАНЕ МЕТОДА ЗА РАВНОВЕСИЕ В ГРУПАТА
1. МЕТОД
Този метод е точно копие на ОИСР TG 106 за определяне на адсорбцията/десорбцията на почвата с използване на метода за равновесие в групата (2000).
1.1. ВЪВЕДЕНИЕ
Методът взима под внимание кръговите тестове и помещението за избор на почвата за извършване на теста за адсорбция (1) (2) (3) (4) и освен това съществуващите насоки на национално ниво (5) (6) (7) (8) (9) (10) (11).
Проучванията на адсорбцията/десорбцията са полезни за генериране на основната информация за подвижността на химикалите и тяхното разпространение в почвата, водата и въздуха (12) (13) (14) (15) (16) (17) (18) (19) (20) (21). Информацията може да се използва при предвиждане и изчисляване например наличността на химикали при разграждане, преобразуване и поглъщане от организмите (24); просмукване през повърхността на почвата (16) (18) (19) (21) (25) (26) (27) (28); изпаряемост от почвата (21) (29) (30); оттичане от повърхността на земята в естествените води (18) (31) (32). Могат да се използват данни за адсорбцията за сравнителни цели и моделиране (19) (33) (34) (35).
Разпространението на химикали между земната и водната фаза е сложен процес, който зависи от броя на различните фактори: химична природа на веществото (12) (36) (37) (38) (39) (40), характеристиките на почвата (4) (12) (13) (14) (41) (42) 43) (44) (45) (46) (47) (48) (49) и климатичните фактори като валежи, температура, слънчева светлина и вятър. Следователно многобройните явления и механизми, които са включени в процеса на адсорбция на химикалите от почвата, не могат напълно да се определят чрез обикновен лабораторен модел, какъвто е представения метод. Обаче, дори ако този опит не може да обхване всички възможни екологични случаи, той предоставя разнообразна информация за екологичната значение на адсорбцията на дадено химично вещество.
Вижте също общия предговор.
1.2. ОБХВАТ
Методът цели изчисляване на адсорбцията/десорбцията на веществата в почвата. Целта е да се постигне стойност на сорбция, която може да бъде използвана при предвиждане разделянето при различни екологични условия; за тази цел коефициентите на равновесие на адсорбцията за химикали при различни видове почви, се определя като функция на характеристиките на почвата (т.е. съдържание на органичен въглерод, съдържание на глина и строеж на почвата и рН). Трябва да се използват различни видове почви, за да се обхване колкото е възможно по-широко взаимодействието на даденото вещество с естествено появилите се почви.
В този метод адсорбция представлява процесът на съединяване на химикала с повърхността на почвата; той не прави разлика между различните процеси на адсорбция (физична и химична адсорбция) и тези процеси като катализирано разлагане на повърхността, адсорбция на основната маса и химична реакция. Не се взима предвид адсорбцията, която се появява при колоидалните частици (диаметър < 0,2 μm), генерирани от почвите.
Характеристиките на почвата, които са считат за най-важни за адсорбцията са: съдържание на органичен въглерод (3) (4) (12) (13) (14) (41) (43) (44) (45) (46) (47) (48); съдържание на глина и механична структура на почвата (3) (4) (41) (42) (43) (44) (45) (46) (47) (48) и рН за съединенията, които могат да се йонизират (3) (4) (42). Другите характеристики на почвата, които могат да имат въздействие върху адсорбцията/десорбцията на определено вещество са капацитетът на действителния катионен обмен (ЕСЕС), съдържанието на аморфно желязо и алуминиеви оксиди, по-специално за вулканичните и тропически почви (4), както и за специфичните повърхности (49).
Проучването се планира, за да се извърши оценка на адсорбцията на химикалите върху различни видове почви с различно съдържание на органичен въглерод, глина и механична структура на почвата, и рН. Той обхваща три редици:
|
Фаза 1:
|
Първоначално проучване с цел да се определи:
|
—
|
отношението почва/разтвор;
|
|
—
|
равновесно време на адсорбция и количеството тествано вещество, задържано на повърхността при равновесие;
|
|
—
|
адсорбцията на тестваното вещество върху почвата в съдовете за тестване и устойчивостта на тестваното вещество по време на периода на проучване.
|
|
|
Фаза 2:
|
Екранен анализ: адсорбцията се изучава при пет различни видове почви чрез адсорбна кинетика при една концентрация и определяне коефициента на разпространение Kd и Кос.
|
|
Фаза З:
|
Определяне на адсорбните изотерми на Фройндлих, за да се определи въздействието на концентрацията върху обхвата на адсорбцията върху почвата.
Проучвания на десорбция чрез десорбна кинетика/десорбционни изотерми на Фройндлих (приложение 1).
|
1.3. ОПРЕДЕЛЕНИЯ И ЕДИНИЦИ
|
Символи
|
Определения
|
Единици
|
|

|
Процент адсорбция при време ti
|
%
|
|
Aeq
|
Процент адсорбция при адсорбционно равновесие
|
%
|
|

|
Маса на тестваното вещество, адсорбирано върху почвата при време ti
|
μg
|
|

|
Маса на тестваното вещество, адсорбирано върху почвата при интервал от време Δ ti
|
μg
|
|
|
Маса на тестваното вещество, адсорбирано върху почвата при адсорбно равновесие
|
μg
|
|
m0
|
Маса на тестваното вещество в тръбата за тестване в началото на теста за адсорбция
|
μg
|
|

|
Маса на тестваното вещество измерено в аликвотна част при определено време ti
|
μg
|
|

|
Маса на тестваното вещество в разтвор при адсорбционно равновесие
|
μg
|
|
msol
|
Количество почвена фаза, изразена чрез сухата маса на почвата
|
g
|
|
Csm
|
Концентрация на масата на основния разтвор на веществото
|
μg cm-3
|
|
C0
|
Първоначална концентрация на масата на тествания разтвор при контакт с почвата
|
μg cm-3
|
|

|
Концентрация на масата веществото във водната фаза при адсорбционно равновесие
|
μg cm-3
|
|

|
Първоначално количество на водната фаза при контакта с почвата по време на теста за адсорбция
|
μg g-1
|
|
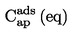
|
Концентрация на масата на веществото във водната фаза при време ti и извършен анализ
|
μg cm-3
|
|
V0
|
Съдържание на веществото, задържано върху почвата при адсорбно равновесие
|
cm3
|
|

|
Количество аликвотна част, в която се измерва тестваното вещество
|
cm3
|
|
Kd
|
Коефициент на разпространение на адсорбцията
|
cm3 g-1
|
|
Kco
|
Коефициент на нормализирана адсорбция на органичен въглерод
|
cm3 g-1
|
|
Kso
|
Коефициент на нормализирано разпространение на органични частици
|
cm3 g-1
|
|

|
Коефициент на адсорбция на Фройндлих
|
μg 1-1/n (cm3) 1/n g-1
|
|
1/n
|
Степенен показател на Фройндлих
|
|
|
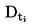
|
Процент на десорбция при определено време ti
|
%
|
|

|
Процент на десорбция, съответстващ на интервала от време Δ ti
|
%
|
|
Kdes
|
Коефициент на явна десорбция
|
cm3 g-1
|
|

|
Коефициент на десорбция на Фройндлих
|
μg 1-1/n (cm3) 1/n g-1
|
|

|
Маса на тестваното вещество, десорбирано от почвата при време ti
|
μg
|
|
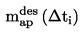
|
Маса на тестваното вещество, десорбирано от почвата при интервал от време Δ ti
|
μg
|
|

|
Маса на веществото, определена аналитично във водната фаза при десорбно равновесие
|
μg
|
|

|
Обща маса на веществото при десорбно равновесие
|
μg
|
|

|
Маса на веществото, което остава адсорбирано върху почвата след интервал от време Δ ti
|
μg
|
|

|
Маса на веществото, което остава отгоре от адсорбното равновесие заради непълен обем заместване
|
μg
|
|

|
Съдържание на веществото, задържано върху почвата при десорбно равновесие
|
μg g-1
|
|

|
Концентрация на масата тестваното вещество във водната фаза при десорбно равновесие
|
μg cm-3
|
|
VT
|
Общ обем на водната фаза в контакт с почвата по време на извършване на експеримента на десорбната кинетика с последователен метод
|
cm3
|
|
VR
|
Обем на плаващите отгоре частици, отстранени от тръбата след постигане на адсорбното равновесие и заместване със същия обем от 0,01 Μ СаСl2 разтвор
|
cm3
|
|
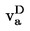
|
Обем на аликвотната част, изпробвана за аналитични цели за време (i), през извършване на експеримента на десорбната кинетика с последователен метод
|
cm3
|
|

|
Обем на разтвора, взет от тръбата (i) за изчисляване на тестваното вещество в експеримента на десорбционната кинетика (с паралелен метод)
|
cm3
|
|

|
Обем на разтвора, взет от тръбата (i) за изчисляване на тестваното вещество при десорбно равновесие
|
cm3
|
|
BM
|
Обемен баланс
|
%
|
|
mE
|
Обща маса на тестваното вещество, извлечено от почвата и стените на съда за тестване в два етапа
|
μg
|
|
Vrec
|
Обем на откритите плаващи отгоре частици след адсорбционното равновесие
|
cm3
|
|
Poa
|
Коефициент на разделението октанол/вода
|
|
|
pKa
|
Константа на разпадане Водоразтворимост
|
|
|
Sa
|
Водоразтворимост
|
g l-1
|
1.4 ПРИНЦИП НА МЕТОДА НА ИЗПИТВАНЕ
Към пробите от почва с познато сухо тегло, което и било предварително блансирано от 0,01 М СаСl2, се прибавят известни количества разтвор от тестваното вещество, не-етикетирани или радиоетикетирани при известна концентрация от 0,01 М СаСl2. Сместа се разклаща за подходящо време. След това частиците почва се отделят чрез центрофуга и ако се нуждае се филтрират и се анализира водната фаза. Количеството адсорбирано тествано вещество върху пробите от почва се изчислява като разликата между количеството тествано вещество първоначално представено в разтвора и количеството, оставащо вещество в края на експеримента (индиректен метод).
Като вариант, количеството от адсорбирано тествано вещество може също директно да се определи чрез анализиране на почвата (директен метод). Тази процедура, която включва извличане на етапи на почвата с подходящ разтвор, се препоръчва в случаите, когато не може да се определи точно разликата в концентрацията на разтвора на веществото. Примери за такива случаи са: адсорбция на тестваното вещество върху повърхността на съдовете за тестване, неустойчивостта на тестваното вещество за времето на експеримента, слаба адсорбция, даваща само малко изменение в концентрацията на разтвора; и силна адсорбция произвеждаща ниска концентрация, която не може да бъде точно определена. Ако се използва радиоетикетирано вещество, може да се избегне извличане на почва чрез анализ на почвената фаза от изгаряне и сцинтилираща течност. Обаче сцинтилиращата течност е неспецифична техника, която не може да направи разлика между изходния и преобразуван продукт; следователно се използва, само ако тествания химикал е стабилен за периода на проучването.
1.5. ИНФОРМАЦИЯ ЗА ТЕСТВАНОТО ВЕЩЕСТВО
Химичните реактиви следва да са в аналитичен порядък. Препоръчва се използването на неетикетирани тествани вещества с известен анализ и за предпочитане поне 95 % чистота или използването на радиоетикетирани тествани вещества с известен състав и радиочистота. В случаи на индикатори за кратки периоди на полуразпадане се прилагат корекции на разпадане.
Преди извършването на теста за адсорбция—десорбция, следва да е налице следната информация:
|
а)
|
водоразтворимост (А.6);
|
|
б)
|
парно налягане (А.4) и/или константа на закона на Хенри;
|
|
в)
|
абиотично разлагане: хидролиза като функция на рН (В.7);
|
|
г)
|
коефициент на разделянето (А.8);
|
|
д)
|
готова биоразложимост (В.4) или аеробни и анаеробни трансформации в почвата;
|
|
е)
|
рКа на веществата, които могат да се йонизират;
|
|
ж)
|
директна фотолиза във водата (т.е. UV-Vis спектър на поглъщане във вода, квантов добив) и разпадане на светлината върху почвата.
|
1.6. ПРИЛОЖИМОСТ НА ТЕСТА
Тестът се прилага за химични вещества, за които с достатъчна точност се прилага аналитичния метод. Един от важните параметри, който може да повлияе на надеждността на резултатите, особено когато се следва индиректния метод, е устойчивостта на тестваното вещество по време на извършването на теста. Така необходимо условие е устойчивостта да се провери при предварителното изследване; ако се наблюдава изменение в скалата за време през периода на извършване на теста, се препоръчва основното изследване да се извърши чрез анализиране и на почвената и на водната фази.
Могат да се появят трудности при извършването на това изследване за тестваното вещество с ниска водоразтворимост (Sw < 10-4 g l-1), както и за високозаредените вещества, заради факта, че концентрацията при водната фаза не може да бъде измерена аналитично с достатъчна точност. В тези случаи следва да се предприемат допълнителни стъпки. Насоки за това как да се справим с тези проблеми са дадени в съответния раздел за този метод.
Когато се изпитват летливи вещества, се полагат грижи да се избегнат загубите по време на проучването.
1.7. ОПИСАНИЕ НА МЕТОДА
1.7.1 Апаратура и химични реактиви
Стандартно лабораторно оборудване, и по-специално следното:
|
а)
|
Тръби и съдове за извършване на експеримента. Важно е тези тръби и съдове да:
|
—
|
пасват директно на апарата за центрофуга, за да се сведат до минимум грешки при управлението и прехвърлянето;
|
|
—
|
са направени от инертни материали, които намаляват до минимум адсорбцията на тестваното вещество върху неговата повърхност.
|
|
|
б)
|
Разклащащо устройство: горен вибратор или еквивалентно оборудване; разклащащото устройство запазва почвата в разтвора по време на разбъркването.
|
|
в)
|
Центрофуга: за предпочитане високоскоростна, т.е. сила на центрофугиране > 3 000 g, контролирана температура, възможност да се отстраняват частиците с диаметър по-голям от 0,2 μm от водния разтвор. Контейнерите следва да са затворени по време на разклащането и центрофугата, за да се избегне изпаряване и загуби на вода; за да се избегне адсорбция, се използват дезактивирани капачки като тефлонова капачка с права резба.
|
|
г)
|
По избор: филтриращо устройство; филтри от 0,2 μm порьозност, стерилни, за еднократна употреба. Специално внимание са обръща на избора на филтриращ материал, за да се избегнат всякакви загуби от тестваното вещество; за ниско разтворимите тествани вещества, не се препоръчва органичен филтриращ материал.
|
|
д)
|
Аналитична контролно-измервателна апаратура, подходяща за измерване концентрацията на тестваните химикали.
|
|
е)
|
Лабораторна пещ, способна да поддържа температура от 103 oС до 110 oС.
|
1.7.2. Характеристика и избор на почви
Почвите се характеризират по три параметри, за които се счита, че от тях до голяма степен зависи капацитетът за адсорбция: органичен въглерод, съдържание на глина и структура на почвата, и рН. Както вече се спомена (вж. Обхват) и други физико-химични свойства могат да окажат влияние върху адсорбцията/десорбцията но отделните вещества и следва да се вземат предвид в такива случаи.
Методите, които се използват за характеризиране на почвите, са много важни и могат да имат значително въздействие върху резултатите. Следователно се препоръчва рН на почвата да бъде измерено в разтвор от 0,01 Μ СаСl2 (това е разтворът, използван при тестване на адсорбцията/десорбция) съгласно съответстващия ISO метод (ISO-10390-1). Също се препоръчва да се определят и други съответни свойства на почвата, съгласно стандартните методи (например ISO Наръчник на анализа на почвата); той разрешава анализа на данните за сорбция да са базирани на световните стандартизирани параметри на почвата. Някои ръководства за съществуващите стандартни методи за анализ на почвата и нейните характеристики са дадени в раздела използвана литература (50-52). За тарирането на методите за изпитване на почвата се препоръчва употребата на почва за сравнение.
В таблица 1 е дадено ръководство за избор на почви при изследване на адсорбцията/дисорбцията. Седемте избрани вида почви покриват видовете почва, които се срещат в умерените географски пояси. За тестваните вещества, които могат да се йонизират, избраните почви покриват широк интервал от рН с цел да е възможно изчисляване на адсорбция на веществото в неговите йонизирана и нейонизирана форми. Ръководство за това колко различни видове почви трябва да се използват при различните стадии от теста е дадено под 1.9 „Извършване на теста“.
Ако се предпочетат други видове почви, те се характеризират със същите параметри и следва да имат подобна променливост на свойствата, с тези, които са описани в таблица 1, дори и да не съответстват точно на критериите.
Таблица 1
Ръководство за избор на почви при изследване на адсорбцията/десорбцията
|
Вид на почвата
|
Обхват на рН (в 0,01M CaCl2)
|
Съдържание на органичен въглерод ( %)
|
Съдържание на глина ( %)
|
Структура на почвата (25)
|
|
1
|
4,5—5,5
|
1,0—2,0
|
65—80
|
глина
|
|
2
|
>7,5
|
3,5—5,0
|
20—40
|
песъчлива глина
|
|
3
|
5,5—7,0
|
1,5—3,0
|
15—25
|
утаечна глина
|
|
4
|
4,0—5,5
|
3,0—4,0
|
15—30
|
глинест льос
|
|
5
|
< 4,0—6,0 (26)
|
<0,5—1,5 (26), (27)
|
<10—15 (26)
|
глинест пясък
|
|
6
|
>7,0
|
<0,5—1,0 (26), (27)
|
40—65
|
песъчлива глина/глина
|
|
7
|
<4,5
|
>10
|
<10
|
пясък/глинест пясък
|
1.7.3. Събиране и съхраняване на проби от почва
1.7.3.1. Събиране
Не се препоръчват никакви специални техники или средства за събиране на пробите; техниките за събиране на проби зависят от целта на проучването (53) (54) (55) (56) (57) (58).
Следва да се вземе предвид:
|
а)
|
необходима ли е подробна информация за историята на площадката; това включва разположение, растителна покривка, обработка с пестициди и/или торове, биологични добавки и случайни замърсявания. Следват се препоръките на ISO стандарта за взимане проби от почвата (ISO 10381-6) по отношение на описанието на мястото, откъдето са взети пробите;
|
|
б)
|
мястото, откъдето са взети пробите, трябва да се определи чрез UTM или географските координати; това позволява повторно събиране на отделните почви за в бъдеще и може да помогне при определяне на почвите при различните класификационни системи, които се използват в различните страни. Освен това, следва да се събира само хоризонт А до максимум 20 cm дълбочина. Особено за вид почва n. 7, ако Oh хоризонтът е представен като част от почвата, той следва да се включи във взимането на проби.
|
Пробите от почва се транспортират като се използват контейнери и при определени температурни условия, които гарантират, че първоначалните свойства на почвата няма да се изменят значително.
1.7.3.2. Съхраняване
Предпочита се използването на току-що взети от площадката почви. Само ако това не е възможно, почвите могат да се съхраняват при температура на околната среда и се пазят изсушени на въздух. Не се препоръчва ограничаване на времето за съхраняване, но почви, които се съхраняват повече от три години се анализират отново преди употребата с оглед на тяхното съдържание на органичен въглерод, рН и СЕС (капацитета на действителния катионен обмен).
1.7.3.3 Обслужване и подготовка на проби от почва за теста
Почвите се изсушават при въздух с температура на околната среда (за предпочитане между 20—25 oС). Отделянето на частиците се извършва с минимална сила, така че оригиналната структура на почвата да се измени колкото е възможно по-малко. Почвите се пресяват за частици с размер ≤ 2mm; следват се препоръките на ISO стандарта за взимане проби от почвата (ISO 10381-6) по отношение на процеса на пресяване. Препоръчва се внимателно хомогенизиране, тъй като това повишава възпроизводимостта на резултатите. Съдържанието на влага за всяка почва се определя на три съизмерими части с нагряване от 105 oС, докато няма значително изменение в теглото (приблизително 12 часа). За всички изчисления масата на почвата се отнася до масата след изсушаване в пещ, т.е.от теглото на почвата се отстранява съдържанието на влага.
1.7.4. Подготовка на тестваното вещество за прилагане върху почвата
Тестваното вещество се разтваря в разтвор от 0,01 Μ СаСl2 в дестилирана или дейонизирана вода; разтворът на СаСl2 се използва като фаза на воден разтвор за да се подобри центрофугата и да се минимизира обмяната на катиони. Концентрацията на основния разтвор е за предпочитане да бъде три степени по-висока от границата на откриване при използване на аналитичния метод. Този праг запазва точни измерванията по отношение на методологията, следвана от този метод; в допълнение, концентрацията на основният разтвор следва да бъде под нивото на разтворимост на водата на тестваното вещество.
Основният разтвор за предпочитане се приготвя точно преди прилагането върху пробите от почва и се запазва затворен на тъмно при 4 oС. Времето на съхраняване зависи от устойчивостта на тестваното вещество и неговата концентрация в разтвора.
Само при слабо разтворимите вещества (Sw < 10-4 g l-1) може да има нужда от подходящ разтварящ фактор, когато е трудно да се разтвори тестваното вещество. Това разтварящо вещество: а) се смесва с вода, както и с метанол и ацетонитрил; б) неговата концентрация не надвишава 1 % от общото количество на основния разтвор и е по-малка от тази в разтвора на тестваното вещество, което ще бъде в контакт с почвата (за предпочитане по-малко от 0,1 %); и в) да не е повърхностно активно вещество или да не влиза в солволизни реакции с тестваното вещество. Употребата на разтварящ агент се уговаря и обяснява при отчитането на данните.
Друга възможност за слабо разтварящите се вещества е да се добави тестваното вещество към системата на тестване чрез прибавяне: тестваното вещество е разтворено в органичен разтворител, аликвотната част на който се прибавя към почвената система и 0,01 Μ разтвор от СаСl2 в дестилирана или дейонинизирана вода. Съдържанието на органичния разтворител във водната фаза се запазва колкото е възможно по-ниско, обикновено не превишава 0,1 %. Прибавянето от органичен разтвор може да пострада от обема на неповторимост. Така може да се допуснат допълнителни грешки, тъй като тестваното вещество и концентрацията на коразтворителя няма да бъдат същите при всички изпитвания.
1.8. НЕОБХОДИМИ УСЛОВИЯ ЗА ИЗВЪРШВАНЕ НА ТЕСТА ЗА АДСОРБЦИЯ/ДЕСОРБЦИЯ
1.8.1. Аналитичен метод
Основните параметри, които могат да повлияят върху точността за измерване на сорбцията, включват точност на аналитичния метод при анализ на разтвора и адсорбционната фаза, величината на изменение на концентрацията на разтвора, отношението почва/разтвор и измененията в структурата на почвата през време на равновесния процес (35) (59-62). Някои примери за точността са дадени в приложение 2.
Надеждността на използвания аналитичен метод трябва да се провери при стойност на концентрация, която е много вероятно да се получи по време на теста. Извършващият експеримента следва да се чувства свободен да използва подходящия метод с подходящата точност, прецизност, възпроизводимост, границата на откриваемост и възстановяване. Ръководство как се извършва такъв тест е дадено при експеримента по-долу.
Подходящо количество от 0,01 М СаСl2, т.е. 100 cm3 се разбъркват 4 часа с почва, т.е. с тегло 20 g, на висока поглъщателна способност, т.е. с високо съдържание на органичен въглерод и глина; тези тежести и количества могат да варират в зависимост от аналитичните нужди, но отношението почва/разтвор от 1:5 е подходяща опорна точка. Сместа се центрофугира и водната фаза може да се филтрира. Определено количество тествано вещество основен разтвор се прибавя по-късно към първото, за да се постигне номинална концентрация със стойност, която е вероятно да се получи по време на теста. Това количество не превишава 10 % от крайното количество на водната фаза, с цел да се измени колкото е възможно по-малко вида на пред-равновесния разтвор. Разтворът се анализира.
С цел да се проверят доказателствата в аналитичния метод и матричните ефекти, причинени от почвата, трябва да се включи изпитване на празен ход, съдържащо системата почва + СаСl2 разтвор (без тестваното вещество).
Аналитичните методи, които могат да се използват за измерване на разтворимостта, включва газово-течна хроматография (GLC), високоефективна течна хроматография (HPLC), спектрометрия (т.е. GC/тегло спектрометрия, HPLC/тегло спектрометрия) и броене на течна сцинтилация (за радиоетикетирани вещества). Независимо от използвания аналитичен метод, се счита за подходящо, ако коефициентите на усвояване са между 90 % и 110 % от номиналните стойности. С цел да се позволи определяне и оценка след разделянето, границите на откриваемост на аналитичния метод са поне две степени под номиналната концентрация.
Характеристиките и границите на откриваемост на аналитичния метод, които са на разположение за извършване на проучвания на адсорбцията, играят важна роля при определяне условията на тестване и цялостното извършване на експеримента. Този метод следва основната пътека за извършване на експеримента и осигурява препоръки и ръководство при избор на алтернативни разтвори, където аналитичният метод и лабораторните съоръжения могат да поставят ограничения.
1.8.2. Избор на оптимално отношение почва/разтвор
Изборът на подходящо съотношение почва към разтвор за извършване на проучване на разтворимостта, зависи от коефициента на разпространение Кd и съответната степен желана адсорбция. Изменението на концентрацията на веществото в разтвора определя статистическата точност на измерването, което се основава на образуването на адсорбционното уравнение и границите на аналитичната методология, определяйки концентрацията на химикала в разтвора. Следователно е полезно общата практика да се установи върху малки фиксирани съотношения, за които процентът на адсорбция е над 20 % и за предпочитане е > 50 % (62), докато се полагат грижи, за да се запази концентрацията на тестваното вещество във водната фаза, достатъчно висока, за да се измери точно. Това е особено важно в случаи на високи проценти адсорбция.
Правилният подход за избор на подходящо съотношение почва/вода се основава на изчисляването на стойността на Кd или чрез първоначално проучване или чрез създаване техника на изчисляването (приложение 3). След това може да се направи избор на подходящо отношение, което се основава на схемата на съотношението почва/разтвор противоположно на Кd за определения процент на адсорбция (фигура 1). На тази схема е изчислено, че уравнението на адсорбция е линейно (28). Отношенията, които се прилагат се постигат чрез предварително постигнато уравнение (4) на Kd във формата на уравнение(1):
|

|
(1)
|
или в неговата логаритмична форма, изчисляваща, че R = m
пръст/V
0 и 
|
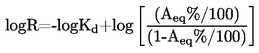
|
(2)
|

Фигура 1 показва съотношенията почва/разтвор, които се изискват като функция на Кd за различните нива на адсорбция. Например при отношение почва/разтвор 1:5 и Кd равно на 20, получава се приблизително 80 %. За да се постигнат 50 % адсорбция за същото Кd, трябва да се използва отношение 1:25. Този подход за избиране на подходящото съотношение почва/разтвор дава на изследователите гъвкавост при посрещане нуждите на експеримента.
По-трудните области са тези, където химикалите са високо или много слабо адсорбирани. Където има ниска адсорбция, се препоръчва съотношение 1:1, въпреки че за някои видове органични соли по-малкото съотношение може де е необходимо за получаване на смеси. Трябва да се полагат грижи с аналитичната методика, за да се измерят малките изменения в концентрацията на разтвора; иначе измерването на адсорбцията ще е неточно. От друга страна при много високи коефициенти на разпространение Кd, единият може се увеличи при отношение почва/разтвор 1:100 с цел да се остави значително количество от химикала в разтвора. Обаче трябва да се полагат грижи за да се гарантира доброто смесване и адекватното време трябва да е позволено от системата за уравновесяване. Алтернативен подход при тези изключения, когато аналитичната методология липса, е да се предвиди стойността на Кd,основана на приложимите техники за оценка, например Pow стойности (приложение 3). Това ще е полезно особено за химикали с ниско адсорбни/полярни химикали с Pow < 20 и за липофилни/високо сорбни химикали с Pow > 104.
1.9. ИЗВЪРШВАНЕ НА ТЕСТА
1.9.1. Условия на извършване на теста
Всички експерименти са правят при температура на околната среда и, ако е възможно, при постоянна температура между 20 oС и 25 oС.
Условията на центрофугиране позволяват премахването от разтвора на частици по-големи от 0,2 μm. Тези стойности пускат частиците с най-малък размер, които се считат за твърди частици и това е ограничението между твърдите и колоидните частици. Насоки как да се определят условията на центрофугиране са дадени в приложение 4.
Ако съоръженията за центрофуга не могат да гарантират отстраняването на частици по-големи от 0,2 μm, може да се използва комбинация от центрофуга и филтрация. Тези филтри следва да са направени от подходящ инертен материал, за да се избегнат всякакви загуби на тестваното вещество. При всички случаи трябва да се докаже, че няма никакви загуби от тестваното вещество по време на филтрацията.
1.9.2. Фаза 1 — Първоначално проучване
Целта на извършването на първоначално проучване беше вече дадена в раздела „Обхват“. Ръководство за регулирането на такъв тест е дадено в дадените по-долу предложения.
1.9.2.1. Избор на оптимално съотношение почва/разтвор
Използват се два вида почви и три съотношения почва/разтвор (шест експеримента). Единият вид почва има високо съдържание на органичен въглерод и ниско съдържание на глина, а другия има ниско съдържание на органичен въглерод и високо съдържание на глина. Използват се следните отношения почва/разтвор:
|
—
|
50 g почва и 50 cm3 воден разтвор на тестваното вещество (съотношение 1:1);
|
|
—
|
10 g почва и 50 cm3 воден разтвор на тестваното вещество (съотношение 1:5);
|
|
—
|
2 g почва и 50 cm3 воден разтвор на тестваното вещество (съотношение 1:25).
|
Минималното количество почва, с което може да се извърши експеримента зависи от лабораторните съоръжения и изпълнението на използвания аналитичен метод. Въпреки това се препоръчва да се използва поне 1 g и за предпочитане 2 g c цел да се постигнат надеждни резултати от теста.
С цел да се провери устойчивостта на тестваното вещество в СаСl2 разтвор и неговата възможна адсорбция върху повърхността на съдовете за тестване, една контролна проба само с тестваното вещество при разтвор 0,01 М СаСl2 (без почва) е насочена към точно същите стъпки от системата, използвана при теста.
Изпитването на празен ход със същото количество почва и обща маса от 50 cm3 на 0,01 М СаСl2 (без тестваното вещество) е обект на същата процедура. То служи като основен контрол по време на анализа, за да се определят интерфериращите вещества и замърсените почви.
Всички експерименти, включително контролните и на празен ход, се извършват поне два пъти. Общият брой проби, които се приготвят за проучването, може да се изчислят по отношение на методологията, която ще се следва.
Методите за първоначалните проучвания и основното проучване са основно еднакви, изключенията са споменати, където се отнасят.
Пробите почва, изсушени на въздух се уравновесяват чрез разбъркване с минимум обем от 45 cm3 на 0,01 М СаСl2 през цялата нощ (12 часа) преди деня на експеримента. След това се прибавя определено количество от основния разтвор с цел да се приспособи крайния обем към 50 cm3. Това добавено количество основен разтвор: а) не надвишава 10 % от крайното количество от 50 cm3 на водната фаза с цел да се измени колкото е възможно по-малко природата на разтвора преди равновесие; и б) за предпочитане завършва с първоначална концентрация на тестваното вещество, което е в контакт с почвата (C0) поне две степени по-високо от границите на откриваемост на аналитичния метод; тези прагове запазват възможността да се извършват точни изчисления дори когато има силна адсорбция (> 90 %) и по-късно да се определят адсорбните изотерми. Също се препоръчва, ако е възможно, първоначалната концентрация на веществото (C0) да не надвишава половината от неговата граница на разтворимост.
По-долу е даден пример за това как да се изчислява концентрацията на основния разтвор (Cst). Приема се че границата на откриваемост е 0,01 μg cm-3 и има 90 % адсорбция; така първоначалната концентрация на тестваното вещество в контакт с почвата за предпочитане е 1 μg cm-3 (две степени по-високо от границата на откриваемост). Като се предположи, че се прибавя препоръчаното максимално количество основен разтвор, т.е. от 5 до 45 cm3 на 0,01 М СаСl2 равновесен разтвор (= 10 % от основния разтвор на 50 cm3 обща маса на водната фаза), концентрацията на основния разтвор е 10 μg cm-3; това са трите степени по-високо от границата на откриваемост на аналитичния метод.
РН на водната фаза се измерва преди и след контакта с почвата, тъй като играе важна роля в целия процес на адсорбция и по специално за веществата, които се йонизират.
Сместа се разбърква, докато не се постигне адсорбционно равновесие. Времето на равновесие в почвата е по-високо променливо в зависимост от химикала и почвата; период от 24 часа обикновено е достатъчен (77). В предварителното проучване може да се събират проби, резултат от 48-часов период на смесване (например на 4, 8, 24, 48 часа). Обаче трябва да се вземе предвид времето на анализа, заедно с гъвкавостта по отношение на работния график на лабораторията.
Има два варианта за анализ на тестваното вещество във воден разтвор: а) паралелен метод и б) сериен метод. Следва да се наблегне на това, че въпреки паралелния метод изисква много повече време, математическата обработка на резултатите е много по-лесна (приложение 5). Обаче изборът на методологията, която трябва да се следва е оставен на тези, които извършват експеримента и които имат нужда да разгледат наличната лабораторна техника и ресурси.
|
а)
|
паралелен метод: приготвят се проби в съотношение почва/разтвор, с такова количество, каквото е нужно за изследване на адсорбните кинетика през отделните интервали от време. След центрофугата и ако се налага филтрацията, водната фаза на първата тръба се възстановява колкото е възможно повече и след това се измерва, например след 4 часа, втората тръба след 8 часа, третата тръба след 24 и т.н.
|
|
б)
|
сериен метод: приготвя се само двойна проба за всяко съотношение почва/разтвор. При определени интервали от време сместа се центрофугира за да се разделят фазите. Малка аликвотна част от водната фаза незабавно се анализира за тестваното вещество; след това експериментът продължава с оригиналната смес. Ако след центрофугата се прилага филтрация, то лабораторията следва да улесни извършването на филтрация на малката водна аликвотна част. Препоръчва се общата маса на взетата аликвотна част да не надвишава 1 % от общото количество разтвор с цел да не се промени значително отношението почва/разтвор и да се намали масата на разтвореното вещество, подготвено за адсорбция по време на теста.
|
Процента адсорбция  се изчислява за всяко определено време (ti) на основата на номиналната първоначална концентрация и измерената концентрация за времето на взимане на пробите (ti), коригирано със стойността при празен ход. Схемата на
се изчислява за всяко определено време (ti) на основата на номиналната първоначална концентрация и измерената концентрация за времето на взимане на пробите (ti), коригирано със стойността при празен ход. Схемата на  противоположно на времето (фигура 1, приложение 5) се генерира с цел да се изчисли постигането на равновесно плато (29). Кd стойността при равновесие също се изчислява. Основано на тази Кd стойност, от фигура 1 се избира подходящо съотношение почва/разтвор, така че процентът на адсорбция да достигне над 20 % и за предпочитане > 50 % (61). Всички приложими уравнения и принципи на схемата са дадени в раздела за данни и отчитане в приложение 5.
противоположно на времето (фигура 1, приложение 5) се генерира с цел да се изчисли постигането на равновесно плато (29). Кd стойността при равновесие също се изчислява. Основано на тази Кd стойност, от фигура 1 се избира подходящо съотношение почва/разтвор, така че процентът на адсорбция да достигне над 20 % и за предпочитане > 50 % (61). Всички приложими уравнения и принципи на схемата са дадени в раздела за данни и отчитане в приложение 5.
1.9.2.2. Определяне на времето на адсорбното равновесие и на количеството адсорбирано вещество по време на равновесие
Както вече се спомена, схемите на 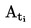 или
или  противоположно на времето, разрешава изчисляване на постигането на адсорбно равновесие и количеството адсорбирано тествано вещество по време на равновесие. Фигури 1 и 2 в приложение 5 показват примери за такива схеми. Времето на равновесие е това, което е необходимо на системата, за да достигне плато.
противоположно на времето, разрешава изчисляване на постигането на адсорбно равновесие и количеството адсорбирано тествано вещество по време на равновесие. Фигури 1 и 2 в приложение 5 показват примери за такива схеми. Времето на равновесие е това, което е необходимо на системата, за да достигне плато.
Ако с определен вид почва не се постигне плато, а се открие стабилно увеличаване, това може да е в резултат от усложнени фактори като биоразлагане или слаба дифузия. Биоразлагането може да се покаже чрез повтаряне на експеримента със стерилизирана проба от почвата. Ако не се постигне плато дори и в този случай, тези, които извършват експеримента трябва да се опитат да открият друго явление, което би могло да бъде включено в тяхното специфично изследване; това може да се направи с подходящо изменение на условията, при които се извършва експериментът (температура, време на разбъркване, съотношение почва/разтвор). Оставено е на преценката, на тези които извършват експеримента да решат дали да продължат процедурата, въпреки възможния неуспех при постигане на равновесие.
1.9.2.3. Адсорбция върху повърхността на съда за тестване и устойчивост на тестваното вещество
От анализа на контролните проби може да се извлече информация за адсорбцията на тестваното вещество върху повърхността на съда за тестване, така също и за неговата устойчивост. Ако се наблюдава отклонение по-голямо от стандартната грешка на аналитичния метод, може да се включи и абиотично разграждане и/или адсорбция върху повърхността на съда за тестване. Разграничаването между тези две явления може да се постигне чрез цялостно почистване на стените на съда с познато количество подходящ разтворител и подлагайки почистващия разтвор на анализ за тестваното вещество. Ако не се наблюдава адсорбция на повърхността на съдовете за тестване, то разграждането показва абиотичната нестабилност на тестваното вещество. Ако се открие адсорбция е необходимо да се сменят материалите, от които са направени съдовете за тестване. Обаче данните за адсорбцията върху повърхността на съдовете за тестване, които се получат от този експеримент, не могат директно да се екстраполират към експеримента почва/разтвор. Присъствието на почва ще повлияе върху тази адсорбция.
Допълнителна информация за устойчивостта на тестваното вещество може да се извлече чрез определяне на първоначалния баланс на масата през времето. Това означава, че водната фаза, екстрактите от почвата и стените на съдовете за тестване са равни на влошената и/или изпарена и/или не извлечена маса. С цел да се определи балансът на масата трябва да е постигнато адсорбно равновесие за периода на експеримента.
Балансът на масата се извършва върху двете почви и за съотношението почва/разтвор за почвата, което дава отклонение от 20 % и за предпочитане от > 50 % при равновесие. Когато експеримента за откриване на отношението завърши с анализ на последната проба на водната фаза след 48 часа, фазите се разделят чрез центрофуга и ако се е наложило чрез филтрация. Водната фаза се възстановява колкото е възможно повече и към почвата се прибавя подходящ екстрактен разтворител (коефициент на екстракция поне 95 %) за да се извлече тестваното вещество. Препоръчват се поне две успешни извличания на веществото. Определя се количеството тествано вещество в почвата и се изчислява балансът на масата (уравнение 10, данни и отчитане). Ако е по-малко от 90 %, се счита, че тестваното вещество не е устойчиво по време на извършване на теста. Обаче проучванията могат да продължат, като се вземе предвид неустойчивостта на тестваното вещество; в този случай се препоръчва да се анализират двете фази при основното изследване.
1.9.2.4. Фаза 2 — Адсорбна кинетика при една концентрация на тестваното вещество
Използват пет вида почви, избрани от таблица1. Предимство е измежду тези пет вида почви, ако е подходящо, да се включат няколко или всички, използвани почви по време на предварителното проучване. В този случай фаза 2 не се повтаря за почвите, които са използвани при предварителното проучване.
Времето за достигане на равновесно състояние, съотношението почва/разтвор, теглото на пробата от почва, обемът на водната фаза в контакт с почвата и концентрацията на тестваното вещество в разтвора се избират на основата на резултатите от предварителното проучване. За предпочитане анализът се прави приблизително след 2, 4, 6, 8, (възможно и при 10) и 24 часа от времето на контакт; времето на разбъркване може да се удължи на максимум 48 часа в случаите, когато химикала изисква по-дълго време за постигане на равновесно състояние с оглед на резултатите за намиране на съотношението. Обаче времето за анализ може да се разглежда гъвкаво.
Всеки експеримент (един вид почва и един разтвор) се прави поне два пъти за да стане възможно изчисляването променливостта на резултатите. При всеки експеримент се прави едно пускане на празен ход. Той се състои от почва и 0,01 М СаСl2 без тестваното вещество и теглото и съответно обема идентични на тези от експеримента. На същата процедура се подлага и контролната проба само с тестваното вещество в 0,01 М СаСl2 разтвор (без почва), служеща за това да предпази от неочакваното.
Процентът адсорбция се изчислява при определено време  и/или интервал от време
и/или интервал от време  (в съответствие с нуждата) и се изобразява графично противоположно на времето. Коефициента на разпределение Кd при равновесие, както и коефициента на нормализирана адсорбция на органичен въглерод Кос (за не полярните органични химикали), също си изчисляват.
(в съответствие с нуждата) и се изобразява графично противоположно на времето. Коефициента на разпределение Кd при равновесие, както и коефициента на нормализирана адсорбция на органичен въглерод Кос (за не полярните органични химикали), също си изчисляват.
Резултати от теста за адсорбна кинетика
Стойността на линейния Кd обикновено е точна за да опише поведението при сорбция в почвата (35) (78) и представлява израз на собствената мобилност на химикалите в почвата. Например главно химикали с Кd ≤ 1 cm3 g -1 се считат за качествено мобилни. Подобна класификационна схема на мобилността, основана на Коc стойността се развива чрез Маккол (16). Допълнително съществува схема за класификация на извличането, основана на отношенията между Кос и DT-50 (30) (32) (79).
Също така, в съответствие с проучването на допускането на грешки при анализ (61), стойност под 0,3 cm3 g -1 не може да се изчисли точно от намаляването при концентрацията във водната фаза, дори когато се прилага най-благоприятното (от гледна точка на точността) съотношение почва/разтвор, т.е. 1:1. В този случай се препоръчва анализ и на двете фази — почва и разтвор.
С оглед на посочените по-горе бележки, се препоръчва да се продължи изследването на поведението на химикала при адсорбция в почвата и неговата потенциална мобилност, чрез определяне на Фройндлих изотерми на адсорбция за тези системи, за които е възможно точното определяне на Кd с протокол за експеримента, воден според метода на този тест. Точното определяне е възможно, ако стойността, която чрез умножаване на Кdc отношението почва/разтвор ще е > 0,3, когато измерванията са основани на намаляване на концентрацията във водната фаза (индиректен метод) или ще е > 0,1, когато и двете фази са анализирани (директен метод) (61).
1.9.2.5. Фаза 3 — Изотерми на адсорбция и кинетика/изотерми на десорбция
1.9.2.5.1 Изотерми на адсорбция
Използват се пет концентрации от тестваното вещество, които покриват за предпочитане две степени от скалата; когато се избират тези концентрации, се вземат предвид разтворимостта във вода и концентрациите в резултат на водното равновесие. Същото съотношение почва/разтвор за почвата се запазва по време на проучването. Тестът за адсорбция се извършва както е описано по-долу с една разлика, че водната фаза се анализира само веднъж по време, когато е необходимо да се постигне равновесие, както е определено по-горе във фаза 2. Концентрациите при постигнато равновесие се определят и адсорбираното количество се изчислява от обедняването на тестваното вещество в разтвора или чрез директния метод. Адсорбираната маса за единица маса почва се представя графично като функция на концентрацията при постигнато равновесие на тестваното вещество (вж. данни и отчитане).
Резултати от експеримента за изотерми на адсорбция
Измежду досега предложените математически модели за адсорбция, изотермите на Фройндлих са най-често използваните за да се опишат процесите на адсорбция. По-подробна информация за прилагането и важността на модела на адсорбция се намира в раздел „Препратки“ (41) (45) (80) (82).
Забележка: Трябва да се отбележи, че сравняването на KF (коефициента на адсорбция на Фройндлих) стойността за различните вещества е възможна само ако тези KF стойности се изразяват в същата единица (83).
1.9.2.5.2. Кинетика на десорбцията
Целта на експеримента е да се открие дали химикалът е реверсивно или нереверсивно адсорбиран върху почвата. Този информация е важна, тъй като процеса на десорбциа също играе важна роля за поведението на химикала в почвата. Нещо повече, данните от десорбцията са полезни при компютърното моделиране на стимулирането на извличането и разтворения отток — ако е необходимо изследване на десорбцията, се препоръчва да се извърши описаното по-долу изследване върху същата система, за която е бил възможно точно определяне на Кd при предишния експеримент за кинетика на адсорбцията.
Подобно на проучването на кинетиката на адсорбция има две възможности за действие при проучването на кинетиката на десорбция: а) паралелен метод и б) сериен метод. Изборът на методология, която ще се следва се оставя на тези, които извършват експеримента и ще е нужно да вземат предвид и наличната лабораторна техника и ресурси.
|
а)
|
Паралелен метод: за всеки вид почва, който е избран за изследването за десорбция се приготвят проби със същото съотношение почва/разтвор, в такова количество каквото е нужно за изследване на десорбната кинетика през отделните интервали от време. За предпочитане се използват същите интервали от време като при експеримента за кинетика на адсорбцията; обаче, с цел системата да достигне равновесие на десорбция, когато е подходящо, може да се увеличи общото време. При всеки експеримент (един вид почва и един разтвор) се извършва пускане на празен ход. Той се състои от почва и 0,01 М СаСl2 разтвор без тестваното вещество и тегло и съответно обем, идентични на тези от експеримента. Като контролна проба тестваното вещество в разтвор 0,01 М СаСl2 се подлага на същата процедура на тестване. Всички смеси на почвата с разтвора се разбъркват, докато не се постигне равновесие на адсорбцията (както е определено по-горе във фаза 2). Тогава фазите се разделят чрез центрофуга и, ако е възможно, се отстранява водната фаза. Обемът на отстранения разтвор се замества с равно количество 0,01 М СаСl2 без тестваното вещество и новата смес се разбърква отново. Водната фаза от първата тръба се възстановява, колкото е възможно и се изчислява след например 2 часа, втората тръба — след 4 часа, третата тръба — след 6 часа и т.н., докато се постигне равновесие на десорбцията.
|
|
б)
|
Сериен метод: след експеримента за кинетика на адсорбцията, сместа се центрофугира и водната фаза се отстранява доколкото е възможно. Обемът на отстранения разтвор се замества с равно количество 0,01 М СаСl2 без тестваното вещество. Новата смес се разбърква отново докато се получи равновесие на десорбцият. През това време на определени интервали от време сместа се центрофугира за да се разделят фазите. Малка аликвотна част на водната фаза незабавно се анализира за тестваното вещество; след това експеримента продължава с оригиналната смес. Препоръчва се общата маса на взетата аликвотна част да не надвишава 1 % от общото количество. Същото количество пресен разтвор 0,01 М СаСl2 се прибавя към сместа за да се поддържа отношението почва/разтвор и разбъркването продължава до следващия интервал от време.
|
Процентът десорбция се изчислява за всяко определено време ( ) и/или за интервал от време (
) и/или за интервал от време (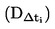 ) (В съответствие с нуждите на изследването) и се изобразява графично противоположно на времето. Коефициентът на десорбция Кdes при равновесие също се изчислява. Всички приложими уравнения и принципи на схемата са дадени в раздела за данни и отчитане и приложение 5.
) (В съответствие с нуждите на изследването) и се изобразява графично противоположно на времето. Коефициентът на десорбция Кdes при равновесие също се изчислява. Всички приложими уравнения и принципи на схемата са дадени в раздела за данни и отчитане и приложение 5.
Резултати от експеримента за кинетика на десорбция
Общи схеми на процентите на десорбция  и адсорбция
и адсорбция 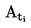 противоположно на времето позволяват изчисляването на обратимостта на процеса на адсорбция. Ако равновесието на десорбция се постигне дори при двойно време от постигане равновесието на адсорбция и общата десорбция е повече от 75 % от адсорбираното количество, се счита, че адсорбцията е обратима.
противоположно на времето позволяват изчисляването на обратимостта на процеса на адсорбция. Ако равновесието на десорбция се постигне дори при двойно време от постигане равновесието на адсорбция и общата десорбция е повече от 75 % от адсорбираното количество, се счита, че адсорбцията е обратима.
1.9.2.5.3. Изотерми на десорбцията
Изотермите на десорбция на Фройндлих се определят върху почвите, използвани при експериментите за определяне на изотермите на адсорбция. Тестът се извършва, както е описано в раздел кинетика на десорбцията, с единствената разлика, че водната фаза се анализира веднъж при постигната равновесие на десорбция. Количеството десорбирано тествано вещество се изчислява. Съдържанието тествано вещество, останало адсорбирано върху почвата при равновесие на десорбция, се представя графично като функция на концентрацията на постигнато равновесие на тестваното вещество в разтвора (вж. „Данни и отчитане“ и приложение 5).
2. ДАННИ И ОТЧИТАНЕ
Аналитичните данни се представят в таблична форма (вж. приложение 6). Отделните измервания и изчислените средни стойности се дадени. Графичното представяне на изотермите на адсорбция са доказани. Изчисленията се правят, както е описано по-долу.
За целите на теста се счита, че тегло от 1 cm3 от водния разтвор е 1 g. Съотношението почва/разтвор може да се изразява в единици от w/w или w/vol със същите цифри.
2.1. АДСОРБЦИЯ
Адсорбцията 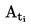 се определя като процент от адсорбираното вещество върху почвата по отношение на представеното количество в началото на теста, при условията за извършване на теста. Ако тестваното вещество е устойчиво и не се адсорбира значително върху стените на контейнера,
се определя като процент от адсорбираното вещество върху почвата по отношение на представеното количество в началото на теста, при условията за извършване на теста. Ако тестваното вещество е устойчиво и не се адсорбира значително върху стените на контейнера, 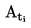 се изчислява при определено време ti съгласно уравнението:
се изчислява при определено време ti съгласно уравнението:
|

|
(3)
|
където:
|

|
=
|
процентът на адсорбция при определено време ti ( %);
|
|

|
=
|
масата тествано вещество, адсорбирано върху почвата при време ti (μg);
|
|
m0
|
=
|
масата тествано вещество в тръбата при началото на теста (μg).
|
Подробна информация за това как да се изчислява процента адсорбция 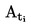 за паралелния и серийния метод е дадена в приложение 5.
за паралелния и серийния метод е дадена в приложение 5.
Коефициентът на разпределяне Кd е съотношение между съдържанието на вещество във почвата и концентрацията на масата на веществото във водния разтвор, при условията на извършване на теста, когато е постигнато равновесие на адсорбция.
|

(cm3 · g-1) |
(4)
|
където:
|

|
=
|
съдържание на адсробираното вещество върху почвата при равновесие на адсорбция (μg g-1);
|
|
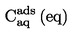
|
=
|
концентрация на масата на веществото във водна фаза при равновесие на адсорбция (μg g-3). Тази концентрация се определя аналитично като се вземат предвид получените по време на пускането на празен ход стойности;
|
|
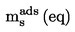
|
=
|
маса на веществото адсорбирано върху почвата при равновесие на адсорбция (μg);
|
|

|
=
|
маса на веществото в разтвора при равновесие на адсорбция (μg);
|
|
mSOil
|
=
|
количество почва, изразено като суха маса почва (g);
|
|
V0
|
=
|
първоначален обем на водната фаза в контакт с почвата (cm3).
|
Отношението между Aeq и Кd е дадено чрез:
|

(cm3 · g-1) |
(5)
|
където:
|
Aeq
|
=
|
процентът адсорбция при равновесие на адсорбция %.
|
Коефициентът на нормализирана адсорбция на органичния въглерод Кос свързва коефициента на разпределение Кd към съдържанието на органичен въглерод на пробата от почва:
|

(cm3 · g-1) |
(6)
|
където:
|
%ОС
|
=
|
процентът на органичен въглерод в пробата от почва (g g-1).
|
KOc коефициентът представлява отделна стойност, която характеризира разделянето главно на неполярните химикали между органичния въглерод в почвата или седименти и вода. Адсорбцията на тези химикали се намира в съотношение с органичното съдържание на сорбиращи частици (7); така KOc стойност зависи от специфичните характеристики на влажните частици, които значително се отличават със сорбционна способност заради разликите при произхода, генезиса и т.н.
2.1.1. Изотерми на адсорбция
Уравненията на Фройндлих изотермите на адсорбция на свързват адсорбираното тествано вещество върху почвата с концентрацията тествано вещество в разтвора при равновесие на адсорбция (уравнение 8).
Данните се обработват като при раздела „Адсорбция“ и, за всяка епруветка, се изчислява съдържанието на адсорбирано тествано вещество върху почвата след теста за адсорбция ( , другаде обозначени като х/m). Приема се, че равновесието е постигнато и че
, другаде обозначени като х/m). Приема се, че равновесието е постигнато и че 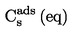 представлява стойността на равновесие:
представлява стойността на равновесие:
|

(μg · g-1) |
(7)
|
Уравненията на Фройндлих изотермите на адсорбция са показани в:
|
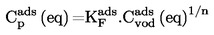
(μg · g-1) |
(8)
|
или в линейна форма:
|

|
(9)
|
където:
|

|
=
|
коефициент на адсорбция на Фройнндлих; неговата геометрична характеристика е cm3 g-1' само ако 1/n = 1; във всички други случаи наклонената 1/n се въвежда в геометричната характеристика на  (μg1-1/n (cm3)1/n · g-1); (μg1-1/n (cm3)1/n · g-1);
|
|
n
|
=
|
константа на регресията; 1/n основно между 0,7 – 1,0, което показва, че данните за сорбцията са често по-скоро нелинейни.
|
Уравнения (8) и(9) се изобразени в графика и стойностите 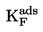 и 1/n се изчисляват чрез регресионен анализ, като се използва уравнение 9. Коефициентът на корелация r2 на логаритмичното уравнение също се изчислява. Пример на такова графично изображение е дадено във фигура 2.
и 1/n се изчисляват чрез регресионен анализ, като се използва уравнение 9. Коефициентът на корелация r2 на логаритмичното уравнение също се изчислява. Пример на такова графично изображение е дадено във фигура 2.

2.1.2. Баланс на масата
Балансът на масата (БМ) се определя като процент вещество, което може да бъде аналитично възстановено след теста за адсорбция противоположно на номиналното количество вещество в началото на теста.
Обработването на данните ще е различно, ако разтворът напълно се смеси с водата. В този случай обработката на данните, описана в „десорбция“ може да се прилага, за да се определи количеството вещество възстановено чрез извличане на разтворителя. Ако разтворителят е по-малко смесим с водата, трябва да се направят изчисления на възстановеното количество.
Балансът на масата (МБ) за адсорбция се изчислява, както следва: приема се, че периодът (mЕ) отговаря на сумата от масите на тестваното вещество, извлечено от почвата и повърхността на съда за тестване с органичен разтворител:
|
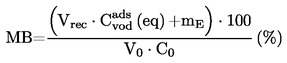
|
(10)
|
където:
|
MB
|
=
|
балансът на масата ( %)
|
|
mЕ
|
=
|
общата маса тестваното вещество, извлечено от почвата и повърхността на съда за тестване в два хода (μg);
|
|
C0
|
=
|
концентрацията първоначална маса на тестваното вещество в контакт с почвата (μg cm-3);
|
|
Vrec
|
=
|
обем на плаващите отгоре частици, възстановени след постигнато равновесие на адсорбция (cm-3).
|
2.2. ДЕСОРБЦИЯ
Десорбцията (Д) се определя като процент тествано вещество, което е десорбирано, отнасящо се към количеството вещество предварително адсорбирано при условията на извършване на теста:
|

|
(11)
|
където:
|

|
=
|
процент десорбция при определено време ti ( %);
|
|

|
=
|
маса на десорбирано вещество от почвата при определено време ti (μg);
|
|

|
=
|
маса на веществото, адсорбирано върху почвата при равновесие на адсорбция (μg).
|
Подробна информация за това как да се изчислява процентcj десорбция  за паралелния и серийния метод е дадена в приложение 5.
за паралелния и серийния метод е дадена в приложение 5.
Коефициентът на очевидната десорбция Kdes е, при условията за извършване на теста, съотношение между съдържанието на вещество оставащо в почвата и концентрацията на масата на десорбираното вещество във водния разтвор, когато е постигнато равновесие на десорбция:
|

(cm3 · g-1) |
(12)
|
където:
|
Kdes
|
=
|
коефициент на десорбция (cm3 g-1);
|
|
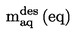
|
=
|
маса на десорбирано от почвата при равновесие на десорбция (μg);
|
|
VT
|
=
|
общ обем на водната фаза в контакт с почната по време на изпитване кинетиката на десорбция (cm3).
|
Ръководство за изчисляване на  е дадено в допълнение 5 в раздел „Десорбция“.
е дадено в допълнение 5 в раздел „Десорбция“.
Забележка:
Ако изпитването на адсорбцията, което е предшествало, е било извършено с паралелен метод, се счита, че VT В уравнение 12 е равно на V0.
2.2.1. Изотерми на десорбция
Уравненията на Фройндлих за изотермите на десорбция свързват съдържанието на тестваното вещество, адсорбирано върху почвата с концентрацията тествано вещество в разтвора при равновесие на десорбция (уравнение 16).
За всяка епруветка съдържанието на тестваното вещество адсорбирано върху почвата при равновесие на десорбция се изчислява, както следва:
|

(µg · g-1) |
(13)
|
 се определя като
се определя като
|

(μg) |
(14)
|
където:
|
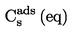
|
=
|
съдържание на адсорбираното вещество върху почвата при равновесие на десорбция (μg g-1);
|
|

|
=
|
масата вещество определено аналитично във водната фаза при равновесие на десорбция (μg);
|
|

|
=
|
масата тествано вещество останало от равновесието на адсорбция заради непълно количествено заместване (μg);
|
|

|
=
|
масата вещество в разтвора при равновесие на адсорбция (μg);
|
|
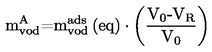
|
(15)
|
|
|
=
|
обем на количеството разтвор, взето от епруветката за измерване на тестваното вещество при равновесие на десорбция (cm3);
|
|
VR
|
=
|
количеството плаващи частици, отстранени от епруветката след постигане на равновесие на адсорбция и са заместени със същия обем от 0,01 M СаСl2 (cm3).
|
Уравненията на Фройндлих за изотермите на адсорбция са показани в 16:
|

(μg · g-1) |
(16)
|
или в линейна форма
|

|
(17)
|
където:
|

|
=
|
коефициент на десорбция на Фройндлих;
|
|
n
|
=
|
константа на регресията;
|
|
|
=
|
концентрация на масата на веществото във водна фаза при равновесие на десорбция (μg g-3).
|
Уравнения 16 и 17 са изобразени графично и стойностите  и 1/n се изчисляват чрез регресионен анализ, използвайки уравнение 17.
и 1/n се изчисляват чрез регресионен анализ, използвайки уравнение 17.
Забележка:
Ако Фройндлих показатели за адсорбция и десорбция 1/n са равни на 1, Фройндлих закрепващи константи за адсорбция и десорбция ( и
и  ) ще бъдат равни съответно на константите на равновесие на адсорбция и десорбция (Кd и Kdes) и графичното изображение на Cs vs Caq ще е линейно. Ако показателите не са равни на 1, то графичното изображение Cs vs Caq няма да бъде линейно и константите за адсорбция и десорбция ще варират през изотермите.
) ще бъдат равни съответно на константите на равновесие на адсорбция и десорбция (Кd и Kdes) и графичното изображение на Cs vs Caq ще е линейно. Ако показателите не са равни на 1, то графичното изображение Cs vs Caq няма да бъде линейно и константите за адсорбция и десорбция ще варират през изотермите.
2.2.2. Отчитане на теста
Отчитането на теста включва следната информация:
|
—
|
пълна идентификация на използваните проби от почва включва:
|
|
—
|
географско положение на площадката, от където са взети (географска ширина и дължина);
|
|
—
|
дата на взимането на пробите;
|
|
—
|
използвани образци (т.е. земеделски почви, гори и т.н.);
|
|
—
|
дълбочина на взимането на пробите;
|
|
—
|
съдържание на пясък, утайка, глина;
|
|
—
|
стойности на рН (в 0,01 M СаСl2);
|
|
—
|
съдържание на органичен въглерод;
|
|
—
|
съдържание на органични частици;
|
|
—
|
капацитет на обмяната на катиони (mmol/kg);
|
|
—
|
всякаква информация, която се отнася до събирането и съхраняването на пробите от почви;
|
|
—
|
където е уместно, всякаква информация за тълкуването на адсорбцията/десорбцията на тестваното вещество;
|
|
—
|
указания за методите, използвани при определяне на всеки параметър;
|
|
—
|
информация за тестваното вещество, ако е уместно;
|
|
—
|
температура на експеримента;
|
|
—
|
условия на центрофугиране;
|
|
—
|
аналитична процедура, използвана за анализ на тестваното вещество;
|
|
—
|
оправдаване използването на разтварящ фактор за подготовка на основния разтвор на тестваното вещество;
|
|
—
|
обяснения за направени поправки при изчисленията, ако са релевантни;
|
|
—
|
данни съгласно формуляра (приложение 6) и графично представяне;
|
|
—
|
цялата информация и полезни наблюдения за тълкуване на резултатите от теста.
|
3. ПРЕПРАТКИ
|
(1)
|
Kukowski H. and Brümmer G., (1987). Investigations on the Adsorption and Desorption of Selected Chemicals in Soils. UBA Report 106 02045. Part II.
|
|
(2)
|
Fränzle O., Kuhnt G. and Vetter L., (1987) Selection of Representative Soils in the EC-Territory. UBA Report 106 02 045. Part I.
|
|
(3)
|
Kuhnt G. and Muntau H. (Eds.) EURO-Soils: Identification, Collection, Treatment, Characterisation. Special Publication No 1.94.60, Joint Research Centre. European Commission, ISPRA, December 1994.
|
|
(4)
|
OECD Test Guidelines Programme, Final Report of the OECD Workshop on Selection of Soils/Sediments, Belgirate, Italy, 18—20 January 1995 (June 1995).
|
|
(5)
|
US Environment Protection Agency: Pesticide Assessment Guidelines, Subdivision N, Chemistry: Environmental Fate, Series 163-1, Leaching and Adsorption/Desorption Studies, Addendum 6 on Data Reporting, 540/09-88-096, Date: 1/1988.
|
|
(6)
|
US Environment Protection Agency: Prevention, Pesticides and Toxic Substances, OPPTS Harmonized Test Guidelines Series 835-Fate, Transport and Transformation Test Guidelines OPPTS No: 835.1220 Sediment and Soil Adsorption/Desorption Isotherm. EPA No: 712-C-96-048, April 1996.
|
|
(7)
|
ASTM Standards, E 1195-85, Standard Test Method for Determining a Sorption Constant (Koc) for an Organic Chemical in Soil and Sediments.
|
|
(8)
|
Agriculture Canada: Environmental Chemistry and Fate. Guidelines for registration of pesticides in Canada, 15 July 1987.
|
|
(9)
|
Netherlands Commission Registration Pesticides (1995): Application for registration of a pesticide. Section G. Behaviour of the product and its metabolites in soil, water and air.
|
|
(10)
|
Danish National Agency of Environmental Protection (October 1988): Criteria for registration of pesticides as especially dangerous to health or especially harmful to the environment.
|
|
(11)
|
BB A (1990), Guidelines for the Official Testing of Plant Protection Products, Biological Research Centre for Agriculture and Forestry, Braunschweig, Germany.
|
|
(12)
|
Calvet R., (1989), „Evaluation of adsorption coefficients and the prediction of the mobilities of pesticides in soils“, in Methodological Aspects of the Study of Pesticide Behaviour in Soil (ed. P. Jamet), INRA, Paris, (Review).
|
|
(13)
|
Calvet R., (1980), „Adsorption-Desorption Phenomena“ in Interactions between herbicides and the soil. (R. J. Hance ed.), Academic Press, London, pp. 83—122.
|
|
(14)
|
Hasset J. J., and Banwart W.L., (1989), „The sorption of nonpolar organics by soils and sediments“ in Reactions and Movement of Organic Chemicals in Soils. Soil Science Society of America (S.S.S.A), Special Publication no. 22, pp. 31—44.
|
|
(15)
|
van Genuchten M. Th., Davidson J. M., and Wierenga P. J., (1974), „An evaluation of kinetic and equilibrium equations for the prediction of pesticide movement through porous media“. Soil Sci. Soc. Am. Proa, Vol. 38(1), pp. 29—35.
|
|
(16)
|
McCall P. J., Laskowski D. A., Swann R. L., and Dishburger H. J., (1981), „Measurement of sorption coefficients of organic chemicals and their use, in environmental fate analysis“, in Test Protocols for Environmental Fate and Movement of Toxicants. Proceedings of AOAC Symposium, AOAC, Washington DC.
|
|
(17)
|
Lambert S. M., Porter P. E., and Schieferrstein R. H., (1965), „Movement and sorption of chemicals applied to the soil“. Weeds, 13, pp. 185—190.
|
|
(18)
|
Rhodes R. C, Belasco I. J., and Pease H. L., (1970) „Determination of mobility and adsorption of agrochemicals in soils“. J.Agric.Food Chem., 18, pp. 524—528.
|
|
(19)
|
Russell M. H., (1995), „Recommended approaches to assess pesticide mobility in soil“ in Environmental Behavior of Agrochemicals (ed. T. R. Roberts and P. C. Kearney). John Wiley & Sons Ltd.
|
|
(20)
|
Esser H. O., Hemingway R. J., Klein W., Sharp D. B., Vonk J. W. and Holland P. T., (1988), „Recommended approach to the evaluation of the environmental behavior of pesticides“, IUPAC Reports on Pesticides (24). Pure Appl. Chem., 60, pp. 901—932.
|
|
(21)
|
Guth J. A., Burkhard N., and D. O. Eberle, (1976), „Experimental models for studying the persistence of pesticides in soils“. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides, pp. 137—157, BCPC, Surrey, UK.
|
|
(22)
|
Furminge C. G. L., and Osgerby J. M., (1967), „Persistence of herbicides in soil“. J. Sci. Fd Agric, 18, pp. 269—273.
|
|
(23)
|
Burkhard N., and Guth J. A., (1981), „Chemical hydrolysis of 2-Chloro-4,6-bis(alkylamino)-1,3,5-triazine herbicides and their breakdown in soil under the influence of adsorption“. Pestic. Sci. 12, pp. 45—52.
|
|
(24)
|
Guth J. A., Gerber H. R., and Schlaepfer T., (1977), „Effect of adsorption, movement and persistence on the biological availability of soil-applied pesticides“. Proc. Br. Crop Prot. Conf., 3, pp. 961—971.
|
|
(25)
|
Osgerby J. M., (1973), „Process affecting herbicide action in soil“. Pestic. Sci., 4, pp. 247—258.
|
|
(26)
|
Guth J. A., (1972), „Adsorptions- und Einwascheverhalten von Pflanzenschutzmitteln in Böden“. Schr. Reihe Ver. Wass. -Boden-Lufthyg. Berlin-Dahlem, Heft 37, pp. 143—154.
|
|
(27)
|
Hamaker J. W., (1975), „The interpretation of soil leaching experiments“, in Environmental Dynamics of Pesticides (eds R. Haque and V.H. freed), pp. 135—172, Plenum Press, NY.
|
|
(28)
|
Helling C. S., (1971), „Pesticide mobility in soils“. Soil Sci. Soc. Amer. Proc. 35, pp. 732—210.
|
|
(29)
|
Hamaker J. W., (1972), „Diffusion and volatilization“ in Organic chemicals in the soil environment (C.A.I. Goring and J. W. Hamaker eds), Vol. I, pp. 49—143.
|
|
(30)
|
Burkhard N. and Guth J. A., (1981), „Rate of volatilisation of pesticides from soil surfaces; Comparison of calculated results with those determined in a laboratory model system“. Pestic. Sci. 12, pp. 37—44.
|
|
(31)
|
Cohen S. Z., Creeger S. M., Carsel R.F., and Enfield C.G., (1984), „Potential pesticide contamination of groundwater from agricultural uses“, in Treatment and Disposal of Pesticide Wastes, pp. 297—325, Acs Symp. Ser. 259, American Chemical Society, Washington, DC.
|
|
(32)
|
Gustafson D. I., (1989), „Groundwater ubiquity score: a simple method for assessing pesticide leachability“. J. Environ. Toxic. Chem., 8(4), pp. 339—357.
|
|
(33)
|
Leistra M., and Dekkers W. A., (1976). „Computed effects of adsorption kinetics on pesticide movement in soils“. J. of Soil Sci., 28, pp. 340—350.
|
|
(34)
|
Bromilov R. H., and Leistra M., (1980), „Measured and simulated behavior of aldicarb and its oxydation products in fallow soils“. Pest. Sci., 11, pp. 389—395.
|
|
(35)
|
Green R. E., and Karickoff S. W., (1990), „Sorption estimates for modeling“, in Pesticides in the Soil Environment: Process, Impacts and Modeling (ed. H.H. Cheng). Soil Sci. Soc. Am., Book Series no. 2, pp. 80—101,
|
|
(36)
|
Lambert S. M., (1967), „Functional relationship between sorption in soil and chemical structure“. J. Agri. Food Chem., 15, pp. 572—576.
|
|
(37)
|
Hance R. J., (1969), „An empirical relationship between chemical structure and the sorption of some herbicides by soils“. J. Agri. Food Chem., 17, pp. 667—668.
|
|
(38)
|
Briggs G. G. (1969), „Molecular structure of herbicides and their sorption by soils“. Nature, 223, 1288.
|
|
(39)
|
Briggs G. G. (1981). „Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficients, water solubilities, bioconcentration factors, and the parachor“. J. Agric. Food Chem., 29, pp. 1050—1059.
|
|
(40)
|
Sabljic A., (1984), „Predictions of the nature and strength of soil sorption of organic polutance by molecular topology“. J. Agric. Food Chem., 32, pp. 243—246.
|
|
(41)
|
Bailey G. W., and White J. L., (1970), „Factors influencing the adsorption, desorption, and movement of pesticides in soil“. Residue Rev., 32, pp. 29—92.
|
|
(42)
|
Bailey G. W., J. L. White and Y. Rothberg., (1968), „Adsorption of organic herbicides by montomorillonite: Role of pH and chemical character of adsorbate“. Soil Sci. Soc. Amer. Proc. 32: pp. 222—234.
|
|
(43)
|
Karickhoff S. W., (1981), „Semi-empirical estimation of sorption of hydrophobic pollutants on natural sediments and soils“. Chemosphere 10, pp. 833—846.
|
|
(44)
|
Paya-Perez A., Riaz M. and Larsen B., (1989), „Soil Sorption of 6 Chlorobenzenes and 20 PCB Congeners“. Environ. Toxicol. Safety 21, pp. 1—17.
|
|
(45)
|
Hamaker J. W., and Thompson J. M., (1972), „Adsorption in organic chemicals“ in Organic Chemicals in the Soil Environment (Goring C.A.I. and Hamaker J.W., eds), Vol I and II, Marcel Dekker, Inc., New York, NY, 1972, pp. 49—143.
|
|
(46)
|
Deli J., and Warren G. F., 1971, „Adsorption, desorption and leaching of diphenamid in soils“. Weed Sci. 19: pp. 67—69.
|
|
(47)
|
Chu-Huang Wu, Buehring N., Davinson J. M. and Santelmann, (1975), „Napropamide Adsorption, desorption and Movement in soils“. Weed Science, Vol. 23, pp. 454—57.
|
|
(48)
|
Haues M. H. B., Stacey M., and Thompson J. M., (1968), „Adsorption of s-triazine herbicides by soil organic preparations“ in Isotopes and Radiation in Soil Organic Studies, p.75, International. Atomic Energy Agency, Vienna.
|
|
(49)
|
Pionke H. B., and Deangelis R. J., (1980), „Methods for distributing pesticide loss in field run-off between the solution and adsorbed phase“, CREAMS, in A Field Scale Model for Chemicals, Run-off and Erosion from Agricultural Management Systems, Chapter 19, Vol. III: Supporting Documentation, USDA Conservation Research report.
|
|
(50)
|
ISO Standard Compendium Environment: Soil Quality — General aspects; chemical and physical methods of analysis; biological methods of analysis. First Edition (1994).
|
|
(51)
|
Scheffer F., and Schachtschabel, Lehrbuch der Bodenkunde, F. Enke Verlag, Stuttgart (1982), 11th edition.
|
|
(52)
|
Black, Evans D. D., White J. L., Ensminger L. E., and Clark F. E., eds. „Methods of Soil Analysis“, Vol 1 and 2, American Society of Agronomy, Madison, WI, 1982.
|
|
(53)
|
ISO/DIS 10381-1 Soil Quality — Sampling — Part 1: Guidance on the design of sampling programmes.
|
|
(54)
|
ISO/DIS 10381-2 Soil Quality — Sampling — Part 2: Guidance on sampling techniques.
|
|
(55)
|
ISO/DIS 10381-3 Soil Quality — Sampling — Part 3: Guidance on safety of sampling.
|
|
(56)
|
ISO/DIS 10381-4 Soil Quality — Sampling — Part 4: Guidance on the investigation of natural and cultivated soils.
|
|
(57)
|
ISO/DIS 10381-5 Soil Quality — Sampling — Part 5: Guidance on the investigation of soil contamination of urban and industrial sites.
|
|
(58)
|
ISO 10381-6, 1993: Soil Quality — Sampling — Part 6: Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory.
|
|
(59)
|
Green R. E., and Yamane V. K., (1970), „Precision in pesticide adsorption measurements“. Soil Sci. Am. Proa, 34, pp. 353—354.
|
|
(60)
|
Grover R., and Hance R. J. (1970), „Effect of ratio of soil to water on adsorption of linuron and atrazine“. Soil Sci., pp. 109—138.
|
|
(61)
|
Boesten, J. J. T. I, „Influence of soil/liquid ratio on the experimental error of sorption coefficients in pesticide/soil system“. Pest. Sci. 1990, 30, pp. 31—41.
|
|
(62)
|
Boesten, J. J. T. I. „Influence of soil/liquid ratio on the experimental error of sorption coefficients in relation to OECD guideline 106“. Proceedings of 5th international workshop on environmental behaviour of pesticides and regulatory aspects, Brussels, 26—29 April 1994.
|
|
(63)
|
(63) Bastide J., Cantier J. M., et Coste C, (1980), „Comportement de substances herbicides dans le sol en fonction de leur structure chimique“. Weed Res. 21, pp. 227—231.
|
|
(64)
|
Brown D. S., and Flagg E. W., (1981), „Empirical prediction of organic pollutants sorption in natural sediments“. J. Environ.Qual., 10(3), pp. 382—386.
|
|
(65)
|
Chiou C. T., Porter P. E., and Schmedding D. W., (1983), „Partition equilibria of non-ionic organic compounds between soil organic matter and water“. Environ. Sci. Technol, 17(4), pp. 227—231.
|
|
(66)
|
Gerstl Z., and Mingelgrin U., (1984), „Sorption of organic substances by soils and sediments“. J. Environm. Sci. Health, B19 (3), pp. 297—312.
|
|
(67)
|
Vowles P. D., and Mantoura R. F. C, (1987), „Sediment-water partition coefficient and CLIP retention factors of aromatic hydrocarbons“. Chemosphere, 16(1), pp. 109—116.
|
|
(68)
|
Lyman W. J., Reehl W. F. and Rosenblatt D. H. (1990). Handbook of Chemical Property Estimation Methods. Environmental Behaviour of Organic Compounds. American Chemical Society, Washington DC.
|
|
(69)
|
Keniga E. E., and Goring, C. A. I. (1980). „Relationship between water solubility, soil sorption, octanol-water partitioning and concentration of chemicals in the biota“ in Aquatic Toxicology (eds J.G. Eaton, et al.), pp.78—115, ASTM STP 707, Philadelphia.
|
|
(70)
|
Chiou C. T., Peters L. J., and Freed V. H., (1979), „A physical concept of soil-water equilibria for non-ionic organic compounds“. Science, Vol. 206, pp. 831—832.
|
|
(71)
|
Hassett J. J., Banwart W. I., Wood S. G., and Means J. C, (1981), „Sorption of/-Naphtol: implications concerning the limits of hydrophobic sorption“. Soil Sci. Soc. Am. J. 45, pp. 38—42.
|
|
(72)
|
Karickhoff S. W., (1981), „Semi-empirical estimation of sorption of hydrophobic pollutants on natural sediments and soils“. Chemosphere, Vol. 10(8), pp. 833—846.
|
|
(73)
|
Moreale A., van Bladel R., (1981), „Adsorption de 13 herbicides et insecticides par le sol. Relation solubilité-reactivité“. Revue de l'Agric., 34 (4), pp. 319—322.
|
|
(74)
|
Müller M., Kördel W. (1996), „Comparison of screening methods for the determination/estimation of adsorption coefficients on soil“. Chemosphere, 32(12), pp. 2493—2504.
|
|
(75)
|
Kördel W., Kotthoff G., Müller M. (1995), „HPLC — screening method for the determination of the adsorption coefficient on soil – results of a ring test“. Chemosphere 30 (7), pp. 1373—1384.
|
|
(76)
|
Kördel W., Stutte J., Kotthoff G. (1993), „HPLC – screening method for the determination of the adsorption coefficient on soil – comparison of different stationary phases“. Chemosphere 27 (12), pp. 2341—2352.
|
|
(77)
|
Hance, R. J., (1967), „The Speed of Attainment of Sorption Equilibria in Some Systems Involving Herbicides“. Weed Research, Vol. 7, pp. 29—36.
|
|
(78)
|
Koskinen W. C, and Harper S. S., (1990), „The retention processes: mechanisms“ in Pesticides in the Soil Environment: Processes, Impacts and Modelling (ed. H.H. Cheng). Soil Sci. Soc. Am. Book Series, No. 2, Madison, Wisconsin.
|
|
(79)
|
Cohen S. Z., Creeger S. M., Carsel R. F., and Enfield C. G. (1984), „Potential pesticide contamination of groundwater from agricultural uses“, in Treatment and Disposal of Pesticide Wastes, pp. 297—325, ACS Symp. Ser. 259, American Chemical Society, Washington, DC.
|
|
(80)
|
Giles C. H., (1970), „Interpretation and use of sorption isotherms“ in Sorption and Transport Processes in Soils. S.C.I. Monograph No. 37, pp. 14—32.
|
|
(81)
|
Giles, C. H.; McEwan J. H.; Nakhwa, S.N. and Smith, D, (1960), „Studies in adsorption: XI. A system of classification of solution adsorption isotherms and its use in the diagnosis of adsorption mechanisms and in measurements of pesticides surface areas of soils“. J. Chem. Soc, pp. 3973—93.
|
|
(82)
|
Calvet R., Terce M., and Arvien J. C, (1980), „Adsorption des pesticides par les sols et leurs constituants: 3. Caractéristiques générales de l'adsorption“. Ann. Agron. 31: pp. 239—251.
|
|
(83)
|
Bedbur E., (1996), „Anomalies in the Freundlich equation“, Proc. COST 66 Workshop, Pesticides in soil and the environment, 13—15 May 1996, Stratford-upon-Avon, UK.
|
|
(84)
|
Guth, J. A., (1985), „Adsorption/desorption“, in Joint International Symposium, Physicochemical Properties and their Role in Environmental Hazard Assessment, July 1—3, Canterbury, UK.
|
|
(85)
|
Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26:305 (1962).
|
Приложение 1
Cxema ha tectbahe
Приложение 2
ВЪЗДЕЙСТВИЕ НА ТОЧНОСТТА НА АНАЛИТИЧНИЯ МЕТОД И ИЗМЕНЕНИЕТО ВЪРХУ ТОЧНОСТТА НА АДСОРБНИТЕ РЕЗУЛТАТИ
От следващата таблица (84) става ясно, че когато разликата между първоначалната маса ( = 110 μg) и маса на равновесието (
= 110 μg) и маса на равновесието ( = 100 μg) от тестваното вещество в разтвора е много малка, грешка от 5 % в изчисляването на концентрацията на равновесие ще доведе до грешка от 50 % при изчисляване на масата на веществото, адсорбирано в почвата (ms
ads(eq)) и 52,4 % в изчисляването на Kd.
= 100 μg) от тестваното вещество в разтвора е много малка, грешка от 5 % в изчисляването на концентрацията на равновесие ще доведе до грешка от 50 % при изчисляване на масата на веществото, адсорбирано в почвата (ms
ads(eq)) и 52,4 % в изчисляването на Kd.
|
Количество почва
|
msoil
|
= 10 g
|
|
Обем на разтвора
|
v0
|
= 100 cm3
|
|
|
FOR-L_2008142BG.01044401.notes.0186.xml.jpg (μg)
|
FOR-L_2008142BG.01044401.notes.0187.xml.jpg (μg cm-3)
|
R
|
FOR-L_2008142BG.01044401.notes.0188.xml.jpg (μg)
|
FOR-L_2008142BG.01044401.notes.0189.xml.jpg (μg g-1)
|
R‡
|
Kd*
|
R‡
|
|
|
З А А = 9 %
|
|
т0= 100 μg иди С0 = 1.100 μg.cm-3
|
100
|
1,000
|
Действи телна стойност
|
10
|
1,00
|
Действи телна стойност
|
1
|
|
|
101
|
1,010
|
1 %
|
9
|
0,90
|
10 %
|
0,891
|
10,9 %
|
|
105
|
1,050
|
5 %
|
5
|
0,50
|
50 %
|
0,476
|
52,4 %
|
|
109
|
1,090
|
9 %
|
1
|
0,10
|
90 %
|
0,092
|
90,8 %
|
|
|
ЗА А = 55 %
|
|
т0= 100 μg иди С0 = 1.100 μg.cm-3
|
50,0
|
0,500
|
Действи телна стойност
|
60,0
|
6,00
|
Действи телна стойност
|
12,00
|
|
|
50,5
|
0,505
|
1 %
|
59,5
|
5,95
|
0,8 %
|
11,78
|
1,8 %
|
|
52,5
|
0,525
|
5 %
|
57,5
|
5,75
|
4,0 %
|
10,95
|
8,8 %
|
|
55,0
|
0,550
|
10 %
|
55,0
|
5,50
|
8,3 %
|
10,00
|
16,7 %
|
|
|
ЗА А =99 %
|
|
т0= 100 μg иди С0 = 1.100 μg.cm-3
|
1,100
|
0,011
|
Действи телна стойност
|
108,9
|
10,89
|
Действи телна стойност
|
990
|
|
|
1,111
|
0,01111
|
1 %
|
108,889
|
10,8889
|
0,01 %
|
980
|
1,0 %
|
|
1,155
|
0,01155
|
5 %
|
108,845
|
10,8845
|
0,05 %
|
942
|
4,8 %
|
|
1,21
|
0,0121
|
10 %
|
108,790
|
10,8790
|
0,10 %
|
899
|
9,2 %
|
където:
|
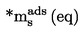
|
=
|
следва формула
|
|

|
=
|
маса на тестваното вещество в почвата при равновесие μg
|
|

|
=
|
маса на тестваното вещество във водната фаза при равновесие μg
|
|

|
=
|
съдържанието на тестваното вещество в почвата при равновесие μg g-1
|
|
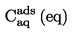
|
=
|
съдържанието на тестваното вещество във водната фаза при равновесие μg cm-3
|
|
R
|
=
|
аналитична грешка при определяне на 
|
|

|
=
|
грешка, получена заради аналитичната грешка R.
|
Приложение 3
ТЕХНИКА НА ИЗЧИСЛЯВАНЕ НА KD
|
1.
|
Техниките на изчисляване позволяват предвиждане на KD, основана на корелацията с например Pow стойности (12) (39) (63-68), данни за разтворимост във вода (12) (19) (21) (39) (68-73) или данни за полярността, получени от HPLC при противоположната фаза (74-76). Както е показано в таблици 1 и 2, Кoc и Кom се изчисляват чрез тези уравнения и след това индиректно Кd:
|
|
2.
|
Принципът на тези корелации се основава на две предположения: 1. органичното вещество е това, което основно въздейства върху адсорбцията на веществото и 2. включените взаимодействия са главно не-полярни. Като резултат тези корелации: 1. не са или са само в определена степен приложими за полярните вещества и 2. не се прилагат в случаите, когато съдържанието на органични частици на почвата е много малко (12). Като допълнение, въпреки че се намират задоволителни корелации между Pow и адсорбцията(19), същото не може да се каже за отношенията между водната разтворимост и степента на адсорбция (19) (21); засега проучванията са много противоречиви.
|
|
3.
|
Някои примери на корелации между разпространяването на адсорбция и коефициент на разделяне на коефициент на октанола, разтворим във вода, както и разтворимост във вода са дадени в таблици 1 и 2, съответно.
Таблица 1
Примери на корелации между коефициента на разпространяване на адсорбция и коефициент на октанола, разтворим във вода; за повече примери (12) (68)
|
Вещества
|
Корелации
|
Автори
|
|
Заместена урея
|
log Kom = 0,69 + 0,52 log Pow
|
Briggs (1981) (39)
|
|
Ароматично хлорирана
|
log Koс = -0,779 + 0,904 log Pow
|
Chiou и аl. (1983) (65)
|
|
Различни пестициди
|
log Kom= 4,4 + 0,72 log Pow
|
Gerstl и Mingelgrin (1984) (66)
|
|
Ароматни въглеводороди
|
log Koс= -2,53 + 1,15 log Pow
|
Vowles и Mantoura (1987) (67)
|
Таблица 2
Примери за корелации между коефициента на разпространяване на адсорбция и разтворимостта във вода; за повече примери (68) (69)
|
Съединения
|
Корелации
|
Автори
|
|
Различни пестициди
|
log Коm = 3,8 - 0,561 log Sw
|
Gerstl a Mingelgrin (1984) (66)
|
|
Алифатни, ароматично хлорирани вещества
|
log Kom= (4,040 +/- 0,038) -(0,557 ± 0,012) log Sw
|
Chiou и al. (1979) (70)
|
|
α-нафтол
|
log Koc = 4,273 - 0,686 log Sw
|
Hasset et al. (1981) (71)
|
|
Циклични, алифатни ароматични вещества
|
log Koc= -1,405 - 0,921 log Sw-0,00953 (mp-25)
|
Karickhoff (1981) (72)
|
|
Различни съединения
|
log Kom= 2,75 - 0,45 log Sw
|
Moreale van Blade(1982) (73)
|
|
Приложение 4
ИЗЧИСЛЕНИЯ ЗА ОПРЕДЕЛЯНЕ НА УСЛОВИЯТА, ПРИ КОИТО СЕ ИЗВЪРШВА ЦЕНТРОФУГА
|
1.
|
Времето за центрофуга е дадено чрез следната формула, вземайки за дадено
|
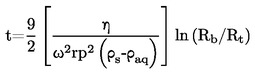
|
(1)
|
За рационалните цели всички параметри са описани в не-SI единици (g, cm).
Където:
|
ώ
|
=
|
скоростта на ротация (= 2 π rpm/60), rad s-1;
|
|
rpm
|
=
|
обороти на минута;
|
|
η
|
=
|
вискозитет на разтвора, g s-1 cm-1;
|
|
rp
|
=
|
радиус на частицата, cm;
|
|
ps
|
=
|
плътност на почвата, g cm-3;
|
|
paq
|
=
|
плътност на разтвора, g cm-3;
|
|
Rt
|
=
|
разстоянието от центъра на ротора на центрофугата до повърхността на разтвора в тръбата за центрофуга, cm;
|
|
Rb
|
=
|
разстоянието от центъра на ротора на центрофугата до дъното на разтвора в тръбата за центрофуга, cm;
|
|
Rb-Rt
|
=
|
дължината на сместа почва/разтвор в тръбата за центрофуга, cm.
|
В общата практика се удвоява времето за изчисляване, за да се гарантира пълното разделяне.
|
|
2.
|
Уравнение 1 може да се опрости по-нататък, ако се приеме, че вискозитета (η) и плътността ρaq на разтвора са равни на вискозитета и плътността на водата при 25 oС; така η = 8,95 × 10-3 g-1 cm-1 и ρaq = 1,0 g cm-3.
След това времето за центрофуга е дадено в уравнение (2):
|

|
(2)
|
|
|
3.
|
От уравнение 2 става ясно, че двата параметъра са важни при определянето на условията, при които трябва да се извърши центрофугата, т.е. времето (t) и скоростта (rpm), за да се постигне разделяне на частиците с определен размер (в нашия случай 0,1 μm радиус): 1. плътността на почвата и 2. дължината на сместа в тръбата за центрофуга (Rb-Rt), т.е. разстоянието, което частиците почва покриват от повърхността на разтвора до дъното на тръбата; очевидно определен обем дължина на сместа в тръбата ще зависи от радиуса на тръбата, повдигнат на втора степен.
|
|
4.
|
Фигура 1 представя променливостта във времето на центрофугиране (t) спрямо скоростта на центрофугиране (rpm) за различната плътност на почвите (ρs) (фигура 1а) и различните дължини на сместа в тръбите за центрофуга (фигура 1a). От фигура 1а се вижда въздействието на плътността на почвата; например за класическата центрофуга с 3 000 rpm, времето за центрофуга е приблизително 240 min за 1,2 g cm плътност на почвата, докато само 50 min за 2,0 g cm3. По подобен начин от фигура 1б за класическата центрофуга с 3 000 rpm, времето за центрофуга е приблизително 50 min при дължина на сместа от 10 cm и само 7 min при дължина от 1cm. Обаче е важно да се намери и оптималното отношение между центрофугата, което изисква възможно по-малка дължина и лесно боравене за тези, които извършват теста при разделянето на фазите след центрофугата.
|
|
5.
|
Нещо повече, когато се определят условията за извършване на експеримента за разделяне на фазите почва/разтвор, е важно да се разгледа възможното съществуване на трета „псевдофаза“ колоиди. Тези частици с големина по-малка от 0,2 μm могат да окажат важно въздействие върху целия механизъм на адсорбция на веществото в почвена суспензия. Когато центрофугата се извършва, както е описано по-горе, колоидите остават във водната фаза и се подлагат на анализ заедно с водната фаза. Така се губи информация за тяхното въздействие.
Ако извършващата лаборатория има техника за ултрацентрофуга или ултрафилтрация, адсорбцията/десорбция на веществото в почвата може да се изследва в по-голяма дълбочина, включително информация за адсорбцията на веществото върху колоидите. В този случай, за да се разделят трите фази почва, колоиди и разтвор, се използва апаратура за ултрацентрофуга от 60 000 rpm/min или ултрафилтрация с пропускливост на филтъра от 100 000 далтона. Протоколът, който се води по време на теста, също съответно се изменя с цел всичките три фази да се подложат на анализ на веществата.
|
Фигура 1а

Фигура 1б

Приложение 5
ИЗЧИСЛЯВАНЕ НА АДСОРБЦИЯТА А (%) И ДЕСОРБЦИЯ D (%)
Графиката на времето за извършване на процедурата е:

За всички изчисления се приема, че тестваното вещество е устойчиво и не се адсорбира значително върху стените на контейнера.
АДСОРБЦИЯ А (А %)
а) Паралелен метод
Процентът адсорбция се изчислява за всяка използвана епруветка (i) за определено време (ti), в съответствие с уравнението: (1)
|
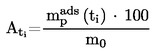
(%) |
(1)1
|
Периодът може да се изчисли, както следва:
|
m0 = C0 · V0 (μg)
|
(2)
|
|

(μg) |
(3)
|
където:
|
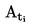
|
=
|
процента адсорбция (%) при определено време ti;
|
|

|
=
|
маса на тестваното вещество върху почвата при определено време ti на извършване на теста (μg);
|
|
m0
|
=
|
маса на тестваното вещество в епруветката в началото на теста (μg);
|
|
Со
|
=
|
първоначалната маса на тествания разтвор в контакт с почвата (μg cm-3);
|
|

|
=
|
съдържанието на тестваното вещество във водната фаза при определено време ti на извършване на теста (μg сm-3); така концентрацията се определя аналитично, като се взимат предвид стойностите, дадени по време на пускането на празен ход.
|
|
V0
|
=
|
първоначално количество на тествания разтвор в контакт с почвата (сm3).
|
Стойностите на процента адсорбция  или
или 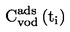 се представят графично противоположно на времето и времето, след което се определя времето за постигане на равновесие на сорбция. Примери за такива графики са дадени респективно във фигури 1 и 2.
се представят графично противоположно на времето и времето, след което се определя времето за постигане на равновесие на сорбция. Примери за такива графики са дадени респективно във фигури 1 и 2.


б) Сериен метод
При следните уравнения се взема предвид, че процедурата на адсорбция се извършва чрез измерване на тестваното вещество в малки аликвотни части на водната фаза, при определени интервали от време.
|
—
|
По време на всеки интервал от време се изчислява количеството адсорбирано вещество върху почвата, както следва:
|
—
|
за първия часови интервал Δt1 = t1 – t0
|

|
(4)
|
|
|
—
|
за втория часови интервал Δt2 = t2-t1
|
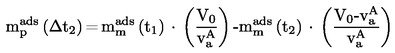
|
(5)
|
|
|
—
|
за третия часови интервал Δt3 =t3-t2
|

|
(6)
|
|
|
—
|
за n-ти часови интервал Δtn = tп- tп-1
|

|
(7)
|
|
|
|
—
|
Процентът на адсорбция при всеки интервал от време  се изчислява, като се използва следното уравнение: се изчислява, като се използва следното уравнение:
|

|
(8)1
|
докато процента на адсорбция  за време ti е дадено с уравнението: за време ti е дадено с уравнението:
|
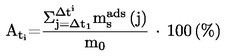
|
(9)1
|
Стойностите на адсорбция  и и  (по отношение на нуждите на проучването) се изобразяват графично противоположно на времето и времето, след което се определя времето за постигане на равновесие на сорбция. (по отношение на нуждите на проучването) се изобразяват графично противоположно на времето и времето, след което се определя времето за постигане на равновесие на сорбция.
|
|
—
|
При време на постигане на равновесие teq:
|
—
|
масата на адсорбираното тествано вещество върху почвата е:
|

|
(10)1
|
|
|
—
|
масата на тестваното вещество в разтвора е:
|

|
(11)1
|
|
|
—
|
и процентът на адсорбция при постигане на равновесие е:
|
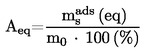
|
(12)1
|
|
|
Използваните по-горе параметри се определят като:
|
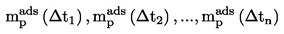
|
=
|
масата вещество, адсорбирано върху почвата за интервали от време Δt1, Δt2,..., Δtn (μg);
|
|

|
=
|
масата вещество, измерено в аликвотна част  за определено време t1, t2,..., tn съответно (μg); за определено време t1, t2,..., tn съответно (μg);
|
|

|
=
|
маса на адсорбираното вещество върху почвата при равновесие на адсорбция μg;
|
|
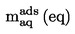
|
=
|
маса на веществото в разтвора при равновесие на адсорбция μg;
|
|

|
=
|
обем на аликвотната част, при която тестваното вещество се измерва (сm3);
|
|

|
=
|
процент адсорбция, съответстващ на интервала от време Δt1 (%)
|
|

|
=
|
процент на адсорбция при равновесие на адсорбция (%).
|
ДЕСОРБЦИЯ (%)
Времето t0, когато започва експериментът на кинетиката на дезорбция, се счита като момента, когато максимално възстановения обем тествано вещество в разтвора (след като е постигнато равновесие на адсорбция) се замества със същия обем 0,01 М СаСl2 разтвор.
а) Паралелен метод
При определено време ti масата на тествано вещество се измерва във водната фаза, взето от епруветка i (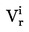 ) и масата на десорбция се изчислява съгласно уравнението:
) и масата на десорбция се изчислява съгласно уравнението:
|

|
(13)
|
При равновесие на десорбция ti = teq и следователно 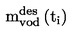 =
= 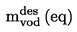 .
.
Масата на десорбираното вещество при интервал от време Δti е даден в уравнението:
|

|
(14)
|
Процентът на десорбция се изчислява:
при определено време ti с уравнението:
|
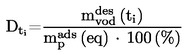
|
(15)
|
и при интервал (Δti) с уравнението:
|

|
(16)
|
където:
|

|
=
|
процент на десорбция при определено време ti (%);
|
|

|
=
|
процент на десорбция, съответстващ на интервал от време Δti (%);
|
|

|
=
|
масата на тестваното вещество, десорбирано при интервал от време ti (μg);
|
|
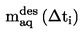
|
=
|
масата на тестваното вещество, десорбирано при интервал от време Δti (μg);
|
|

|
=
|
масата на тестваното вещество, измерено аналитично при време ti в количество 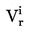 , който е взет за анализа (μg); , който е взет за анализа (μg);
|
|
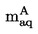
|
=
|
масата на тестваното вещество, останало от равновесието на адсорбация заради непълното заместване на количеството (μg);
|
|
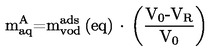
|
(17)
|
|
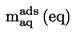
|
=
|
масата на тествано вещество в разтвор при равновесие на адсорбция (μg);
|
|
VR
|
=
|
обем на плаващите върху повърхността частици, отстранени от епруветката след постигане на равновесие на адсорбция и заместени със същото количество 0,01 М СаСl2 разтвор (сm3);
|
|

|
=
|
количеството почва, взето от епруветката (i) за измерване на тестваното вещество, в измерване на кинетиката на десорбция (сm3).
|
Стойностите на десорбция  и
и  (съгласно нуждите на проучването) се изобразяват графично противоположно на времето и времето, след което се определя постигане на равновесието на десорбция.
(съгласно нуждите на проучването) се изобразяват графично противоположно на времето и времето, след което се определя постигане на равновесието на десорбция.
б) Сериен метод
При следното уравнение се взима предвид, че процедурата на адсорбция, която е предшествала, се е извършила чрез изчисляване на тестваното вещество в малка аликвотна част 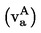 от водната фаза (сериен метод в 1.9 „Извършване на теста“). Приема се че: а) количеството плаващи частици, отстранени от епруветката след експеримент за кинетиката на адсорбция, се заместват със същото количество 0,01 М СаСl2 разтвор (VR) ,и б) и общото количество на водната фаза в контакт с почвата (Vт) по време на експеримент за кинетиката на десорбция остава постоянно и е дадено в уравнението:
от водната фаза (сериен метод в 1.9 „Извършване на теста“). Приема се че: а) количеството плаващи частици, отстранени от епруветката след експеримент за кинетиката на адсорбция, се заместват със същото количество 0,01 М СаСl2 разтвор (VR) ,и б) и общото количество на водната фаза в контакт с почвата (Vт) по време на експеримент за кинетиката на десорбция остава постоянно и е дадено в уравнението:
|
|
(18)
|
При време ti:
|
—
|
масата на тестваното вещество се измерва в малка аликвотна част  и десорбната маса се изчислява съгласно уравнението: и десорбната маса се изчислява съгласно уравнението:
|

-

|
(19)
|
|
|
—
|
при равновесие на десорбция ti = teq и следователно  = =  . .
|
|
—
|
Процентът на десорбция  се изчислява чрез следното уравнение: се изчислява чрез следното уравнение:
|

|
(20)
|
|
При интервал от време Δti:
По време на всеки интервал от време количеството десорбирано вещество се изчислява, както следва:
|
—
|
за първия часови интервал Δti = t1 – t0
|

a
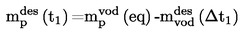
|
(21)
|
|
|
—
|
за втория часови интервал Δt2 = t2 -t1
|
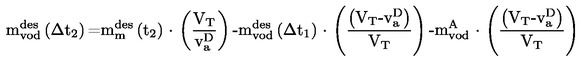

|
(22)
|
|
|
—
|
за n-ти часови интервал Δtn = tn -tn-1
|
 и и

|
(23)
|
|
Накрая при всеки интервал от време  ce изчислява със следното уравнение:
ce изчислява със следното уравнение:
|

|
(24)
|
докато процентът на десорбция  при време ti е даден чрез следното уравнение:
при време ti е даден чрез следното уравнение:
|

|
(25)
|
където гореспоменатите параметри се определят, както следва:
|
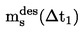
,

,... ,
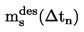
|
=
|
масата вещество, останало адсорбирано върху почвата след интервали от време Δt1,Δt2,..., Δtn респективно (μg);
|
|

,
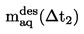
,... ,

|
=
|
масата вещество, останало адсорбирано върху почвата след интервали от време Δt1, Δt2,..., Δtn респективно (μg);
|
|

,
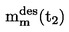
,... ,

|
=
|
масата вещество, измерено в аликвотна част  за определено време t1, t2,..., tn съответно (μg); за определено време t1, t2,..., tn съответно (μg);
|
|
Vт
|
=
|
общо количество на водната фаза в контакт с почвата през време на експеримента на кинетика на десорбция, извършен със сериен метод (сm3);
|
|
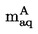
|
=
|
масата на тестваното вещество, останало от равновесието на адсорбция заради непълното заместване на количеството (μg);
|

|
(26)
|
|
|
VR
|
=
|
обем на плаващите върху повърхността частици, отстранени от епруветката след постигане на равновесие на адсорбция и заместени със същото количество 0,01 М СаСl2 разтвор (сm3);
|
|
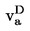
|
=
|
количество аликвотна част, изпробвана за аналитични цели от епруветката (i) по време на експеримент на кинетиката на десорбция, извършен със сериен метод (cm3);
|

|
(27)
|
|
Приложение 6
АДСОРБЦИЯ-ДЕСОРБЦИЯ В ПОЧВАТА: ФОРМУЛЯР ЗА ОТЧИТАНЕ
Изследвано вещество:
Изследвана почва:
Съдържание на суха маса в почвата (105 oС, 12 h): %
Температура: oС
Приложимост на аналитичния метод
|
Претеглена почва
|
g
|
|
|
Почва: суха маса
|
g
|
|
|
Обем на разтвор на СаСl2
|
сm3
|
|
|
Нормална концентрация на крайния разтвор
|
μg cm-1
|
|
|
Аналитична концентрация на крайния разтвор
|
μg cm-1
|
|
Принцип на използвания аналитичен метод:
Калибрация на аналитичния метод:
Изследвано вещество:
Изследвана почва
Съдържание на суха маса в почвата (105 oС, 12 h): … %
Температура: … oС
|
Използван аналитичен метод:
|
Непряк
|
|
Паралелен
|
|
Сериен
|
|
|
|
Пряк
|
|
|
|
|
|
Тест за сорбция: тестови проби
|
|
Знак
|
Единици
|
Време на равновесиет 0
|
Време на равновесиет 0
|
Време на равновесиет 0
|
Време на равновесиет 0
|
|
Епруветка №
|
|
|
|
|
|
|
|
|
|
|
|
Претеглена почва
|
—
|
g
|
|
|
|
|
|
|
|
|
|
Почва: суха маса
|
mпочва
|
g
|
|
|
|
|
|
|
|
|
|
Обем вода в претеглената почва (изчислено)
|
Vws
|
сm3
|
|
|
|
|
|
|
|
|
|
Обем на разтвор 0,01M на CaCl2 за изравняване на почвата
|
|
сm3
|
|
|
|
|
|
|
|
|
|
Обем на основния разтвор
|
|
сm3
|
|
|
|
|
|
|
|
|
|
Пълен обем на водната фаза при контакт с почвата
|
V0
|
сm3
|
|
|
|
|
|
|
|
|
|
Начална концентрация на тестовия разтвор
|
C0
|
μg cm-3
|
|
|
|
|
|
|
|
|
|
Маса на тестваното вещество в началото на теста
|
m
0
|
|
|
|
|
|
|
|
|
|
|
След разбъркване и центрофугиране
|
|
НЕПРЯК МЕТОД
|
|
Паралелен метод
|
|
Концентрация на тестваното вещество при водната фаза, включително и корекция на празна проба
|
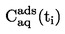
|
μg cm-3
|
|
|
|
|
|
|
|
|
|
Сериен метод
|
|
Измерена маса на тестваното вещество в аликвотна част
|

|
μg
|
|
|
|
|
|
|
|
|
|
ПРЯК МЕТОД
|
|
Маса на тестваното вещество, адсорбирано от почвата
|

|
μg
|
|
|
|
|
|
|
|
|
|
Изчисление на адсорбцията
|
|
Адсорбция
|

|
%
|
|
|
|
|
|
|
|
|
|
|

|
%
|
|
|
|
|
|
|
|
|
|
Средства
|
|
|
|
|
|
|
|
Коефициент на адсорбция
|
Kd
|
cm3.g-1
|
|
|
|
|
|
|
|
|
|
Средства
|
|
|
|
|
|
|
|
Коефициент на адсорбция
|
Koc
|
cm3.g-1
|
|
|
|
|
|
|
|
|
|
Средства
|
|
|
|
|
|
|
Тествано вегцество:
Тествана почва:
Съдържание на суха маса в почвата (105 oС, 12 h): … %
Температура: … oС
Адсорбционен тест: празни проби и контроли
|
|
Знак
|
Единици
|
Празни проби
|
Празни проби
|
Контроли
|
|
Епруветка №
|
|
|
|
|
|
|
|
|
|
Претеглена почва
|
|
g
|
|
|
|
|
0
|
0
|
|
Количество вода в претеглената почва (изчислено)
|
|
cm3
|
|
|
|
|
|
|
|
Добавено количество от 0,01 М разтвор на СаСl2
|
|
cm
|
|
|
|
|
|
|
|
Добавено количество от основен разтвор на тестваното вещество
|
|
cm3
|
0
|
0
|
|
|
|
|
|
Пълен обем на водната фаза (изчислено)
|
|
cm3
|
|
|
|
|
—
|
—
|
|
Начална концентрация на тестваното вещество във водната фаза
|
|
μg cm-3
|
|
|
|
|
|
|
|
След разбъркване и центрофугиране
|
|
Концентрация във водната фаза
|
|
μg cm-3
|
|
|
|
|
|
|
Забележка: Добавете колони, ако е необходимо.
Тествано вещество:
Тествана почва:
Съдьржапие па суха маса в почвата (105 oС. 12 Ь): … %
Температура: … oС
Баланс на масата
|
|
Знак
|
Единици
|
|
|
|
|
|
Епруветка №
|
|
|
|
|
|
|
|
Претеглена почва
|
—
|
g
|
|
|
|
|
|
Почва: суха маса
|
mпочва
|
g
|
|
|
|
|
|
Обем на водата в претеглената почва (изчислено)
|
V
ws
|
ml
|
|
|
|
|
|
Обем на 0,01 М разтвор на СаСl2 за изравняване на почвата
|
|
ml
|
|
|
|
|
|
Обем на основния разтвор
|
|
cm3
|
|
|
|
|
|
Пълен обем на водната фаза при контакт с почвата
|
V0
|
cm3
|
|
|
|
|
|
Начална концентрация на тестовия разтвор
|
C0
|
μg.cm-3
|
|
|
|
|
|
Време на равновесието
|
—
|
h
|
|
|
|
|
|
След разбъркване и центрофугиране
|
|
Концентрация на тестваното вещество при водната фаза, включително и корекция на празна проба
|
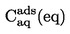
|
|μg.cm-3
|
|
|
|
|
|
Равновесие на адсорбцията
|
teq
|
h
|
|
|
|
|
|
Първо разреждане с разтворител
|
|
Отстранен обем на водната фаза
|
Vrec
|
cm3
|
|
|
|
|
|
Добавен обем разтворител
|
Δv
|
cm
|
|
|
|
|
|
Първа екстракция с разтворител
|
|
Сигнал при анализ на разтворител
|
SE1
|
различни
|
|
|
|
|
|
Концентрация на тестваното вещество в разтворител
|
СE1
|
μg.cm-3
|
|
|
|
|
|
Маса на веществото, екстрахирано от почвата и от стените на съда
|
mE1
|
μg
|
|
|
|
|
|
Второ разреждане с разтворител
|
|
Отстранен обем разтворител
|
Δ vS
|
cm3
|
|
|
|
|
|
Добавен обем разтворител
|
Δv
|
cm
|
|
|
|
|
|
Втора eкстракция с разтворител
|
|
Сигнал при анализ на разтворимата фаза
|
SE2
|
различни
|
|
|
|
|
|
Концентрация на тестваното вещество в разтворител
|
CE2
|
μg.cm-3
|
|
|
|
|
|
Маса на веществото, екстрахирано от почвата и от стените на съда
|
тЕ2
|
μg
|
|
|
|
|
|
Пълна маса на тестваното вещество, екстрахирано на два етапа
|
mE
|
μg
|
|
|
|
|
|
Баланс на масата
|
MB
|
%
|
|
|
|
|
Тествано вещество:
Тествана почва:
Съдържание на суха маса в почвата (105 oС, 12 h): … %
Температура: … oС
Адсорбни изотерми
|
|
Символ
|
Единицa
|
|
|
|
|
|
|
|
|
|
Епруветка №
|
|
|
|
|
|
|
|
|
|
|
|
Претеглена почва
|
—
|
g
|
|
|
|
|
|
|
|
|
|
Почва: суха маса
|
Е
|
g
|
|
|
|
|
|
|
|
|
|
Обем на водата в претеглената почва (изчислено)
|
|
cm3
|
|
|
|
|
|
|
|
|
|
Обем на 0,01 М разтвор на СаСl2 за изравняване на почвата
|
|
cm
|
|
|
|
|
|
|
|
|
|
Обем на основния разтвор
|
|
cm3
|
|
|
|
|
|
|
|
|
|
Пълен обем на водната фаза при контакт с почвата (изчислено)
|
V0
|
cm
|
|
|
|
|
|
|
|
|
|
Концентиран разтвор
|
|
μg.cm-3
|
|
|
|
|
|
|
|
|
|
Равновесие на адсорбцията
|
—
|
h
|
|
|
|
|
|
|
|
|
|
След разбъркване и центрофугиране
|
|
Концентрация на тестваното вещество при водната фаза, включително и корекция на празна проба
|
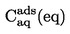
|
μg cm-
|
|
|
|
|
|
|
|
|
|
Температура
|
|
oC
|
|
|
|
|
|
|
|
|
|
Маса на адсорбцията за единица почва
|

|
μg-g-1
|
|
|
|
|
|
|
|
|
Регресен анализ:
стойност KF
аds :
стойност на l/n:
регресен коефициент r
2:
Тествано вещество:
Тествана почва:
Съдържание на суха маса в почвата (105 oС, 12 п): … %
Температура: … oС
|
Използва се аналитичният метод:
|
Непряк
Пряк
|
|
Паралелен
|
|
Сериен
|
|
Тест за десорбция
|
|
Символ
|
Единица
|
Времеви интервал
|
Времеви интервал
|
Времеви интервал
|
Времеви интервал
|
|
Епруветка № от етап на адсорбция
|
|
|
|
|
|
|
|
Маса на веществото адсорбирано в почвата при равновесие на адсорбция
|
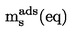
|
μg
|
|
|
|
|
|
Отстранен обем при водна фаза, заменена от 0,01 М СаСl2
|
VR
|
cm3
|
|
|
|
|
|
Пълен обем на водната фаза при контакт с почва
|
РМ
|
V0
|
cm3
|
|
|
|
|
|
SМ
|
VT
|
cm3
|
|
|
|
|
|
Маса на тестваното вещество, останало след равновесие на адсорбцията в резултат на непълно възстановяване на обема
|

|
μg
|
|
|
|
|
|
Киветика на десорбцията
|
|
Претеглена маса на веществото, отделено от почвата за време li
|
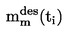
|
μg
|
|
|
|
|
|
Обем на разтвора взет от епруветка 0) за измерване на тестваното вещество
|
РМ
|
V
i
r
|
cm3
|
|
|
|
|
|
SМ
|
VD
a
|
cm3
|
|
|
|
|
|
Маса на веществото отделено от почвата във време 1, (изчислено)
|
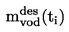
|
μg
|
|
|
|
|
|
Маса на веществото отделено от почвата във времеви интервал Delta
li
(изчислено)
|

|
μg
|
|
|
|
|
|
Процент на десорбцня
|
|
Десорбция във време li
|
Dti
|
%
|
|
|
|
|
|
Десорбция във времеви интервал Ат,
|
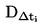
|
%
|
|
|
|
|
|
Видим коефициент на десорбция
|
Kdes
|
|
|
|
|
|
РМ: паралелен метод
SM: сериен метод
В.19. ИЗЧИСЛЯВАНЕ КОЕФИЦИЕНТА НА АДСОРБЦИЯ (Кос) НА ПОЧВАТА И НА УТАЙКАТА ОТ ОТПАДНИ ВОДИ, ИЗПОЛЗВАЩИ ВИСОКОЕФЕКТИВНА ТЕЧНА ХРОМАТОГРАФИЯ (HPLC)
1. МЕТОД
Този метод е точно копие на ОECD TG 121 (2001).
1.1. ВЪВЕДЕНИЕ
Поведението на веществата при сорбция в почвите или в утайките от отпадни води може да се опише чрез параметрите, които са определени със средствата на метода В.18. Важен параметър е коефициентът на адсорбция, който се определя като съотношение между концентрацията на веществото в почвата/утайката и концентрацията на веществото във водната фаза при равновесие на адсорбция. Коефициентът на адсорбция, нормализиран към съдържанието на органичен въглерод в почвата КOС, е полезен индикатор на свързващата способност на химикала с органичните частици на почвата и утайката от отпадни води и позволява да се направи сравнение между различните химикали. Този параметър може да се изчисли чрез корелация с водоразтворимостта и коефициента на разделяне n-октанол/вода (1) (2) (3) (4) (5) (6) (7).
Методът на извършване на експеримента, който е описан при този тест, използва HPLC за изчисляване на коефициента на адсорбция Кос в почвите или в утайките от отпадни води (8). Изчисленията са по-надеждни от тези на QSAR (9). Като метод на изчисляване не може напълно да замести експериментите за равновесие на подбора, използван при метод на тестване В.18. Обаче изчисленият Кос може да е полезен при избиране на подходящи параметри за проучванията на адсорбция/десорбция, съгласно метод В.18 чрез изчисляване на Kd (коефициент на разпределяне) или Kf (коефициент на адсорбция на Фройндлих) съгласно уравнение 3 (вж. точка 1.2).
1.2. ОПРЕДЕЛЕНИЯ
K
d
: коефициентът на разпределяне се определя като съотношение на концентрацията при равновесие С на разтвореното тествано вещество в двете системи фази, съдържащ сорбиращо вещество (почва или утайка) и водната фаза; той е с много малка стойност, когато концентрациите при двете фази се изразяват на основата на тегло/тегло. В случаите, когато е дадена концентрацията във водната фаза на основата на тегло/обем, тогава единиците са ml g-1. Kd може да варира със свойството сорбция и може да зависи от концентрацията.
|
|
(1)
|
където:
|
Спочва
|
=
|
концентрация тествано вещество в почвата при равновесие (μg g-1)
|
|
Сутайка
|
=
|
концентрация тествано вещество в утайките при равновесие (μg g-1)
|
|
Свода
|
=
|
концентрация тествано вещество във водната фаза при равновесие (μg g-1, μg ml-1.
|
K
f
: коефициент на адсорбция на Фройндлих се определя като концентрация на тестваното вещество в почвата или утайките (х/m), когато концентрацията на равновесие Cвода във водната фаза е равна на едно; единиците са μg g-1 сорбиращо вещество. Стойността може да варира със свойствата на сорбиращото вещество.
|

|
(2)
|
където:
|
х/m
|
=
|
количеството тествано вещество х (μg), адсорбирано върху количеството сорбиращо вещество m (g) при равновесие
|
|
1/n
|
=
|
наклон на изотерма на адсорбция на Фройндлих
|
|
Свода
|
=
|
концентрация тествано вещество във водната фаза при равновесие (μg ml-1)
|
ПРИ 
К
ос
: коефициент на разпределяне (Kd) или коефициент на адсорбция на Фройндлих (Kf), нормализирани към съдържанието на органичен въглерод (foc) на сорбиращото вещество; по-специално за нейонизираните химикали той е приблизителен индикатор за степента на адсорбция между веществото и сорбиращото вещество и позволява да се направи сравнение между различните химикали. В зависимост от размера на Kd и Kf, Кос може да е с много малка стойност или има единици ml g-1 или μg g-1 органични частици.
|
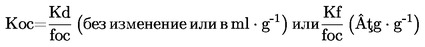
|
(3)
|
Отношението между Кd и KOС не е винаги линейно и тогава Кос стойностите могат да варират от почва до почва, но тяхната променливост е много намалена в сравнение с Kd и Kf стойностите.
Коефициентът на адсорбция (KOС) ce извлича от коефициента на използване на мощността (k'') в зависимост от кривата за калибриране на log k' като функция на log Кос от избраните съединения еталони.
|

|
(4)
|
където:
|
tR
|
=
|
HPLC време на запазване на теста и вещество еталон (минути)
|
|
to
|
=
|
HPLC време на престой (минути) (вж. точка 1.8.2).
|
P
ow
: коефициент на разделяне октанол-вода се определя като съотношение на концентрациите на разтворено вещество в n-октанол и вода; той е с много малка стойност.
|
|
(5)
|
1.3. ВЕЩЕСТВА ЕТАЛОНИ
Структурната формула, чистотата и константната на разпадане (ако е целесъобразно) трябва да се знаят преди използването на метода. Използва се информацията за разтворимост във вода и органични разтвори, върху коефициент на разделяне октанол-вода и характеристиките на хидролизата.
За да се съпоставят измерените HPLC данни за запазване на тестваното вещество с неговия коефициент на адсорбция Коc трябва да се състави графика на калибриране с log KOC в съответствие с log k. Използват се минимум шест точки еталони, поне една отгоре и една отдолу на очакваната стойност на тестваното вещество. Точността на метода ще бъде значително подобрена, ако се използват веществата еталони, които структурно се отнасят към тестваното вещество. Ако не са налице такива данни, тогава ползвателят избира подходящите вещества на калибриране. В този случай се избира по-основна мрежа от структурно хомогенни вещества. Веществата и Кос-стойности, които могат да се използват, са изброени в приложението в таблица 1 за утайките и в таблица 3 за почвата. Посочват се причините за избор на други вещества на калибриране.
1.4. ПРИНЦИП НА МЕТОДА НА ТЕСТА
HPLC се извършва с аналитични колони, свързани с цианопропил твърда фаза, съдържащи липофилна и полярна половина. Използва се умерено стационарна фаза, основана на кварцова матрица:
|
-O -Si
|
— CH2 — CH2 — CH2
|
— CN
|
|
силициев двуокис
|
неполярна част
|
полярна половина
|
Принципът на метода на теста е подобен на метода на тестване А.8 (коефициент на разпределяне, HPLC метод). Докато преминава през колоните заедно с мобилната фаза, тестваното вещество взаимодейства със стационарната фаза. Като резултат от разпределянето между мобилната и стационарната фаза, тестваното вещество се забавя. Двойният състав на стационарната фаза, имащ полярна и неполярна страна, позволява взаимодействие с полярните и неполярните групи от молекули по начин, подобен на случая за органичните частици в матриците почва или утайка. Това позволява да се създаде отношение между времето за задържане в колоната и коефициента на адсорбция на органичните частици.
PH има значително въздействие върху поведението при сорбция, и по-специално за полярните вещества. За земеделските почви или утайници на станциите за преработване на утайките от отпадни води pH обикновено варира между 5,5 и 7,5. За веществата, които се йонизират, трябва да се извършат два теста с йонизирана и нейонизирана форма при подходящ буферен разтвор, но само в случаи, когато поне 10 % от тестваното съединение ще се дисоциират в pH от 5,5 до 7,5.
Тъй като отношението между задържането на HPLC колона и коефициента на адсорбция се използват за изчисление, не се изисква количествен аналитичен метод и са необходими само изчисленията на времето за задържане. Ако е на разположение подходяща мрежа от вещества еталони и могат да се използват стандартните условия за извършване на експериментите, методът осигурява бърз и ефикасен метод за оценяване на коефициента на адсорбция KOC.
1.5. ПРИЛОЖИМОСТ НА ТЕСТА
HPLC метод се прилага за химичните вещества (не-етикетирани или етикетирани), за които е налице подходяща система за откриване (например спектрометър, радиоактивен детектор) и които са достатъчно устойчиви по време на експеримента. Може по-специално да бъде полезен за химикали, които е трудно да се изследват в други експериментални системи (т.е. летливи вещество; вещества, които не са разтворими във вода при концентрация, която може да се измери аналитично; веществата с високо сродство към повърхността на инкубационната система). Методът може да се използва за смеси, които дават неразделни отмити ивици. В такъв случай се формулират горните и долни ограничения на log Koc стойности на съединенията на тестваната смес.
Примесите могат понякога да причинят проблеми при тълкуването на резултатите от HPLC, но те не са от голямо значение, когато тестваното вещество може да бъде аналитично ясно определено и разделено от примесите.
Методът е валиден за веществата, които са изброени в таблица 1 на приложението и също са приложими за различните видове химикали, принадлежащи на следните класове:
|
—
|
ароматни амини (например: трифлуралин, 4-хлороанилин, 3,5-динитроанилин, 4- метиламин, N-метиламин, 1-нафтиламин),
|
|
—
|
ароматни естери на карбоксилните киселинни (например: метилестер на бензонената киселина, 3,5- естер динитробензонената киселина),
|
|
—
|
ароматни хидрокарбони (например толуол, ксилол, етилбензол, нитробензол),
|
|
—
|
естери на арилоксифеноксипропиоловите киселинни (например диклофоп-метил, феноксапроп-етил, феноксапроп-Р-етил)
|
|
—
|
бензимидазол и имидазол фунгициди (например карбендазим, фуберидазол, триазоксид),
|
|
—
|
амиди на карбоксилните киселини (например 2-хролбензамид, N, N-диметилбензамид, 3,5-динитробензамид, N-метилбензамид, 2-нитробензамид, 3-нитробензамид),
|
|
—
|
хлорирани въглеводороди (например ендосулфан, дихлордифенил-трихлоретан, хексахлорбензен, квинтозен, 1,2,3-трихлорбензен),
|
|
—
|
органофосфор инсектициди (например азинфос-метил, дизулфотон, фенамифос, изофенфос, пиразофос, сулпрофос, тризофос),
|
|
—
|
феноли (например фенол, 2-нитрофенол, 4-нитрофенол, пентахлорфенол, 2,4,6-трихлорфенол, 1-нафтол),
|
|
—
|
фенилурея производни съединения (например изопротурон, монолинурон, пенсикурон),
|
|
—
|
багрилни вещества (например Acid Yellow 219, Basic Blue 41, Direct Red 81),
|
|
—
|
полиароматни хидрокарбони (например аценафтен, нафталин),
|
|
—
|
1,3,5-триазин хербициди (например прометрин, пропазин, симазин, тербутрин),
|
|
—
|
триазол производни съединения (например тебуконазол, тридимефон, традименол, трипенфенол),
|
Методът не се прилага за вещества, които реагират или с отмиващ агент или със стационарната фаза. Също не се прилагат за вещества, които взаидействат по специфичен начин с неорганични съединения (например образуване на група от комплекси с глинени минерали). Методът може да не работи за повърхностните активни вещества, неорганичните съединения и умерените и силни органични киселини и основи. Могат да се определят log Koc стойности с обхват от 1,5 до 5,0. Веществата, които се йонизират трябва да се измерят като се използва буферна мобилна фаза, но се вземат грижи за да се избегне утаяване на буферни съединения или тестваното вещество.
1.6. КРИТЕРИИ ЗА КАЧЕСТВО
1.6.1. Точност
Обикновено коефициента на адсорбция на тестваното вещество може да се изчисли с ±0,5 log единици на стойността, определена чрез метода за равновесие на Фройндлих (виж таблица 1 в допълнението). По-висока точност може да се постигне, ако използваните вещества-еталони структурно се отнасят към тестваното вещество.
1.6.2. Повтарясмост
Изчисленията следва да се правят поне два пъти. Стойностите на log KOC, получени от индивидуалните изследвания са в обхват от 0,25 log единици.
1.6.3. Възпроизводимост
Полученият досега опит при прилагането на този метод се поддържа от неговата валидност. Проучванията на HPLC метод, който използва 48 вещества (повечето пестициди), за които има данни, отнасящи се до KOС върху почвата, дават коефициента на корелация R = 0,95 (10) (11).
Направено е сравнение на теста между 11 участващи лаборатории, за да се подобри и валидира методът (12). Резултатите са дадени в таблица 2 от приложението.
1.7. ОПИСАНИЕ НА МЕТОДА
1.7.1. Предварителна оценка на коефициента на адсорбция
Коефициентът на разделение на октанол-вода Роw = (Коw), и до някаква степен разтворимостта във вода може да се използват като индикатори за степента на адсорбция, по-специално за нейонизираните вещества, и по този начин може да се използват за предварителни сведения. Разнообразието от полезни корелации е било публикувано за няколко групи химикали (1) (2) (3) (4) (5) (6) (7).
1.7.2. Апаратура
Изисква се течен хроматограф, оборудван с пулсационна помпа и подходящ уред за откриване. Препоръчва се използването на инжекционен клапан с отвор за впръскване. Използват се химично свързани с цианопропил смоли на основата на силициев двуокис (например Хайперсил и Зорбакс CN). Колоната на безопасност от същия материал може да бъде поставена между системата за впръскване и аналитичната колона. Колоните от различните доставчици могат да варират значително в тяхната отделна ефективност. Като ръководство, се постигат следните фактори за капацитет k': log k' > 0,0 за log KOc = 3,0 И log k' > – 0,4 за log KOc = 2,0, когато се използва метанол/вода 55/45 % като мобилна фаза.
1.7.3. Мобилни фази
Проучени са няколко мобилни фази и се препоръчват следните две:
|
—
|
метанол/вода (55/45 % v/v),
|
|
—
|
метанол/0,01 М цитрат-буфер рН 6,0 (55/45 % v/v).
|
За приготвянето на цитрат-буферен разтвор се използват HPLC степен на метанола и дестилираната вода или отмиващ разтвор. Преди употреба сместа се дегазира. Използват се изократни отмиващи агенти. Ако метанолът/водната смес не са подходящи, могат да се опитат други органични разтворители/водни смеси, например етанол/водна смес или ацетонитрил/водна смес. За съединенията, които се йонизират, за да стабилизират рН, се препоръчва употребата на отмиващ разтвор. Трябва да се полагат грижи, за да се избегне утаяването на солта и влошаване/разваляне на колоните, което може да се случи с някои органични фази/буферни смеси.
Не могат да се използват никакви добавки като йон реактив, защото те могат да повлияят на свойството на сорбция на стационарната фаза. Такива изменения на стационарната фаза може да са необратими. Поради тази причина е задължително тези експерименти, за които се използват добавки, да се извършват в отделна колона.
1.7.4. Разтворими вещества
Тестваните вещества и веществата еталони следва да се разтварят през мобилната фаза.
1.8. ИЗВЪРШВАНЕ НА ТЕСТА
1.8.1. Условия на извършване на теста
Температурата по време на измерването следва да се записва. Използването на отделна колона за контролиране на температурата се препоръчва силно, за да се гарантират постоянните условия по време на калибриране и извършването на оценка и измерване на тестваното вещество.
1.8.2. Определяне на времето на престой t0
За определяне на времето на престой t0 могат да се използват два различни метода (вж. точка 1.2).
1.8.2.1. Определяне на времето на престой t0 чрез хомологусни серии
За тази процедура е доказано, че дава надеждни резултати и стандартизирани стойности t0. За подробности вижте метод А.8: коефициент на разделяне (n-октанол/вода), HPLC метод.
1.8.2.2. Определяне на времето на престой t0 чрез инертни вещества, които не се задържат чрез колона
Тази техника се основава на впръскването на разтворите от формамид, урея и содни нитрати. Извършват се измервания поне два пъти.
1.8.3. Определяне на времето на задържане tR
Веществата еталони се избират, както е описано в точка 1.3. Те могат да се впръскат като смесен стандарт, за да се определи тяхното време на задържане, при условие че е било потвърдено, че времето на задържане на всяко вещество еталон не е повлияно от присъствието на други стандарти еталони. Калибрирането се извършва на равни интервали поне два пъти на ден с цел да се изчислят неочакваните промени в колоната за изпълнение. За да се потвърди, че времето на задържане не се е натрупало и за да се постигне най-добър опит, калибрираното впръскване се извършва преди и след впръскването на тестваното вещество. Веществата се впръскват поотделно в колкото е възможно по-малко количество (за да се избегне претрупване на колоната) и се определя тяхното време на задържане.
С цел да се повиши коефициентът в измерването, следва да се извършват поне две измервания. Стойностите на log Koc, получени от индивидуалните измервания, попадат в обхвата на 0,25 log единици.
1.8.4. Оценка
Факторите на капацитета k' се изчисляват от времето на престой to и времето на задържане tR на избраните вещества еталони в съответствие с уравнение 4 (вж. точка 1.2). Данните за log k' на веществата еталони след това са изобразени графично срещу техните log Koc стойности от експеримента за изравняване на партидата, даден в таблици 1 и 3 от приложението. Следователно, използвайки тази схема, log k' стойността на тестваното вещество се използва, за да се определи неговата log Koc стойност. Ако фактическите резултати показват, че log Кос на тестваното вещество е извън обхвата на калибриране, тестът следва да се извърши отново, като се използват различни, по-подходящи вещества еталони.
2. ДАННИ И ОТЧИТАНЕ
Отчетът трябва да включва следната информация:
|
—
|
идентификация на тестваното вещество и веществата еталони и тяхната чистота, и рКа, ако е необходимо,
|
|
—
|
описание на оборудването и условията на работа, например вида и размера на аналитичната (и за безопасност) колона, средствата за установяване, мобилната фаза (съотношение на компонентите и рН), температура по време на измерванията,
|
|
—
|
времето на престой и използваният за неговото определяне метод,
|
|
—
|
количествата тествано вещество и веществата еталони, въведени в колоната,
|
|
—
|
време на задържане на съединенията еталони, използвани за калибриране,
|
|
—
|
подробности за съответстващата линия на регресия (log k' в съотношение с log Кос и графиката на линията на регресия,
|
|
—
|
средните данни за задържането и изчислената стойност d log Koc за тестваните химически съединения,
|
3. ПРЕПРАТКИ
|
(1)
|
W. J. Lyman, W. F. Reehl, D. H. Rosenblatt (ed). (1990). Handbook of chemical property estimation methods, Chap. 4, McGraw-Hill, New York.
|
|
(2)
|
J. Hodson, N. A. Williams (1988). The estimation of the adsorption coefficient (Koc) for soils by CLIP. Chemosphere, 17, 1—67.
|
|
(3)
|
G. G. Briggs (1981). Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficients, water solubilities, bioconcentration factors, and the parachor. J. Agric. Food Chem., 29, pp. 1050—1059.
|
|
(4)
|
C. T. Chiou, P. E. Porter, D.W. Schmedding (1983). Partition equilibria of nonionic organic compounds between soil organic matter and water. Environ. Sci. Technol., 17, pp. 227—231.
|
|
(5)
|
Z. Gerstl, U. Mingelgrin (1984). Sorption of organic substances by soils and sediment. J. Environm. Sci. Health, B19, pp. 297—312.
|
|
(6)
|
C. T. Chiou, L. J. Peters, V. H. Freed (1979). A physical concept of soil water equilibria for nonionic organic compounds, Science, 106, pp. 831—832.
|
|
(7)
|
S. W. Karickhoff (1981). Semi-empirical estimation of sorption of hydrophobic pollutants on natural sediments and soils. Chemosphere, 10, pp. 833—846.
|
|
(8)
|
W. Kördel, D. Hennecke, M. Herrmann (1997). Application of the HPLC-screening method for the determination of the adsorption coefficient on sewage sludges. Chemosphere, 35(1/2), pp. 121—128.
|
|
(9)
|
M. Mueller, W. Kördel (1996). Comparison of screening methods for the estimation of adsorption coefficients on soil. Chemosphere, 32(12), pp. 2493—2504.
|
|
(10)
|
W. Kördel, J. Stutte, G. Kotthoff (1993). HPLC-screening method for the determination of the adsorption coefficient in soil-comparison of different stationary phases, Chemosphere, 27(12), pp. 2341—2352.
|
|
(11)
|
B. von Oepen, W. Kördel, W. Klein (1991). Sorption of nonpolar and polar compounds to soils: Processes, measurements and experience with the applicability of the modified OECD Guideline 106, Chemosphere, 22, pp. 285—304.
|
|
(12)
|
W. Kördel, G. Kotthoff, J. Müller (1995). HPLC-screening method for the determination of the adsorption coefficient on soil-results of a ring test. Chemosphere, 30(7), pp. 1373—1384.
|
Приложение
Таблица 1
Сравнение на стойностите на Кос за почвите и утайките и изчислените стойности чрез HPLC скрининг метод (31), (32)
|
Вещество
|
CAS номер
|
log Koc на утайки от отпадни води
|
log Koс на HPLC
|
Δ
|
log Koс на почвата
|
log Koс на HPLC
|
Δ
|
|
Атразин
|
1912-24-9
|
1,66
|
2,14
|
0,48
|
1,81
|
2,20
|
0,39
|
|
Линурон
|
330-55-2
|
2,43
|
2,96
|
0,53
|
2,59
|
2,89
|
0,30
|
|
Фентион
|
55-38-9
|
3,75
|
3,58
|
0,17
|
3,31
|
3,40
|
0,09
|
|
Монурон
|
150-68-5
|
1,46
|
2,21
|
0,75
|
1,99
|
2,26
|
0,27
|
|
Фенантрен
|
85-01-8
|
4,35
|
3,72
|
0,63
|
4,09
|
3,52
|
0,57
|
|
Фенилбензоат
|
93-99-2
|
3,26
|
3,03
|
0,23
|
2,87
|
2,94
|
0,07
|
|
Бензамид
|
55-21-0
|
1,60
|
1,00
|
0,60
|
1,26
|
1,25
|
0,01
|
|
4-нитробензамид
|
619-80-7
|
1,52
|
1,49
|
0,03
|
1,93
|
1,66
|
0,27
|
|
Ацетанилид
|
103-84-4
|
1,52
|
1,53
|
0,01
|
1,26
|
1,69
|
0,08
|
|
Анилин
|
62-53-3
|
1,74
|
1,47
|
0,27
|
2,07
|
1,64
|
0,43
|
|
2,5-дихлоранилин
|
95-82-9
|
2,45
|
2,59
|
0,14
|
2,55
|
2,58
|
0,03
|
Таблица 2
Резултати от междулабораторния тест (11 участващи лаборатории), извършен, за да подобри и валидира HPLC метода (33)
|
Вещество
|
CAS номер
|
log Koс
|
Koс
|
log Koс
|
|
(OECD 106)
|
HPLC
|
|
Атразин
|
1912-24-9
|
1,81
|
78+16
|
1,89
|
|
Монурон
|
150-68-5
|
1,99
|
100+8
|
2,00
|
|
Трипентенол
|
77608-88-3
|
2,37
|
292 ±58
|
2,47
|
|
Линурон
|
330-55-2
|
2,59
|
465 ±62
|
2,67
|
|
Фентион
|
55-38-9
|
3,31
|
2062 ±648
|
3,31
|
Таблица 3
Препоръчани вещества еталони за HPLC екранен метод, основан на данните за адсорбция на почвата
|
Вещество еталон
|
CAS номер
|
Log Koс е стойност на равновесието
|
Номер на данни
|
Log S.D.
|
Източник
|
|
Ацетанилид
|
03-84-4
|
1,25
|
4
|
0,48
|
(34)
|
|
Фенол
|
108-95-2
|
1,32
|
4
|
0,70
|
(34)
|
|
2-нитробензамид
|
610-15-1
|
1,45
|
3
|
0,90
|
(35)
|
|
N, N-диметилбензамид
|
611-74-5
|
1,52
|
2
|
0,45
|
(34)
|
|
4-метилбензамид
|
619-55-6
|
1,78
|
3
|
1,76
|
(34)
|
|
Метилбензоат
|
93-58-3
|
1,80
|
4
|
1,08
|
(34)
|
|
Атразин
|
1912-24-9
|
1,81
|
3
|
1,08
|
(36)
|
|
Изопротурон
|
34123-59-6
|
1,86
|
5
|
1,53
|
(36)
|
|
3-Нитробензами д
|
645-09-0
|
1,95
|
3
|
1,31
|
(35)
|
|
Анилин
|
62-53-3
|
2,07
|
4
|
1,73
|
(34)
|
|
3,5-Динитробензамид
|
121-81-3
|
2,31
|
3
|
1,27
|
(35)
|
|
Карбендазим
|
10605-21-7
|
2,35
|
3
|
1,37
|
(36)
|
|
Триадименол
|
55219-65-3
|
2,40
|
3
|
1,85
|
(36)
|
|
Триазоксид
|
72459-58-6
|
2,44
|
3
|
1,66
|
(36)
|
|
Триазофос
|
24017-47-8
|
2,55
|
3
|
1,78
|
(36)
|
|
Линурон
|
330-55-2
|
2,59
|
3
|
1,97
|
(36)
|
|
Нафтален
|
91-20-3
|
2,75
|
4
|
2,20
|
(34)
|
|
Ендосулфан-диол
|
2157-19-9
|
3,02
|
5
|
2,29
|
(36)
|
|
Метиокарб
|
2032-65-7
|
3,10
|
4
|
2,39
|
(36)
|
|
Киселина жълто 219
|
63405-85-6
|
3,16
|
4
|
2,83
|
(34)
|
|
1,2,3-Трихлорбензол
|
87-61-6
|
3,16
|
4
|
1,40
|
(34)
|
|
γ-НСН (линдан)
|
58-89-9
|
3,23
|
5
|
2,94
|
(34)
|
|
Фентион
|
55-38-9
|
3,31
|
3
|
2,49
|
(36)
|
|
Директно червено 81
|
2610-11-9
|
3,43
|
4
|
2,68
|
(34)
|
|
Пиразофос
|
13457-18-6
|
3,65
|
3
|
2,70
|
(36)
|
|
Алфа- ендосулфан
|
959-98-8
|
4,09
|
5
|
3,74
|
(36)
|
|
диклофопметил
|
51338-27-3
|
4,20
|
3
|
3,77
|
(36)
|
|
Фенантрен
|
85-01-8
|
4,09
|
4
|
3,83
|
(34)
|
|
Основно синьо 41 (смес)
|
26850-47-5
12270-13-2
|
4,89
|
4
|
4,46
|
(34)
|
|
ддт
|
50-29-3
|
5,63
|
1
|
—
|
(35)
|
В.20. ТЕСТ ЗА ВЪЗПРОИЗВЕЖДАНЕ НА ГИГАНТСКА ВОДНА БЪЛХА
1. МЕТОД
Този метод е точно копие на ОECD TG 211 (1998).
1.1. ВЪВЕДЕНИЕ
Първоначалната цел на теста е оценяване въздействието на химикалите върху репродуктивната способност на Daphnia magna (гигантска водна бълха).
1.2. ОПРЕДЕЛЕНИЯ И ЕДИНИЦИ
Родителско животно: са тези женски животни от Daphnia magna, които са представени в началото на експеримента и чиято репродуктивна способност е обект на проучването.
Поколение: са младите Daphnia magna, произлезли от родителското животно по време на теста.
Концентрация на най-ниско наблюдаваното въздействие (LOEC): е най-ниската тествана концентрация, при която се наблюдава, че веществото статистически определено има значително въздействие върху репродуктивната способност и смъртността на родителското животно (при р < 0,05) в сравнение с контролната по време на определено излагане. Обаче всички тествани концентрации над LOEC трябва да имат вредно въздействие, равно или по-голямо от това, което се наблюдава при LOEC. Когато тези две условия не могат да се изпълнят, трябва да се даде пълно обяснение за това как LOEC (и следователно NOEC) са били избрани.
Концентрация на ненаблюдавано въздействие (NOEC): това е тестваната концентрация непосредствено преди LOEC, която в сравнение с контролната статистически няма значително въздействие (при р < 0,05) по време на определено излагане.
ЕС
Х
: е концентрацията на тестваното вещество, разтворено във вода, което има за резултат х % намаляване в репродуктивността на Daphnia magna по време на определено излагане.
Вътрешна скорост на увеличаване: е мярка за растеж на популацията, която интегрира репродуктивната способност и смъртността (20) (21) (22). При постоянно състояние на популацията тя е нула. При нарастваща популация е положителна, а при намаляваща популация е отрицателна. Последната не е устойчива и накрая води до прекратяване.
Граница на откриваемост: е най-ниската концентрация, която може да се открие, но не може да се определи количествено.
Граница на определяне: е най-ниската концентрация, която може да се измери количествено.
Смъртност: животно, което е записано като мъртво, когато е неподвижно, т.е. когато не е способно да плува или ако не се наблюдава движение на външните органи и корема след 15-секундно леко разтърсване на съда за тестване. (Ако се използва друга дефиниция, това трябва да се отчете заедно с нейната референция.)
1.3. ПРИНЦИП НА МЕТОДА НА ТЕСТВАНЕ
Млади женски животни Daphnia magna (родителски животни) на възраст по-малко от 24 часа при започването на теста се излагат на тестваното вещество, прибавено към водата при поредица от концентрации. Продължителността на теста е 21 дни. В края на теста се оценява общият брой живо поколение, произлязло от живо родителско животно в края на теста. Това означава, че младите индивиди, произлезли от възрастните индивиди, които са умрели по време на теста, се изключват от изчисленията. Репродуктивната способност на родителските животни може да се изрази по друг начин (например броя на живото поколение, произлязло от животно за един ден от първия ден, когато се е наблюдавало поколение), но тези начини трябва да се отчетат като допълнение към общия брой от млади индивиди, произлезли от родител, който е жив в края на теста. С цел да се определи концентрация на най-ниското наблюдавано въздействие (LOEC) и следователно концентрация на ненаблюдавано въздействие (NOEC), репродуктивната способност на животните, изложени на тестваното вещество, се сравнява с тази на контролните животни. С цел да се оцени концентрацията, която би причинила х % намаляване в репродуктивността (т.е. ЕС50, ЕС20 или ЕС10), като допълнение данните се анализират колкото е възможно по скоро чрез използване на модела на регресия.
Оцелелите от родителските животни и времето на появяване на първото поколение трябва да се запише. Други въздействия върху параметрите, свързани с веществото, като растеж (например дължина) и възможна вътрешна скорост на увеличаване, също могат да се изследват.
1.4. ИНФОРМАЦИЯ ЗА ТЕСТВАНОТО ВЕЩЕСТВО
Резултатите от теста за остра токсичност (вж. метод В.2, част 1), извършен с Daphnia magna, следва да са на разположение. Резултатът може да е полезен при избиране на подходящ обхват на тестваните концентрации при репродуктивния тест. Разтворимостта във вода и парното налягане при тестваното вещество следва да са известни и да е на разположение сигурен аналитичен метод за класифициране на веществото в тествания разтвор, с отчетена ефективност при възстановяване и граница на откриваемост.
Информацията за тестваното вещество, която може да е полезна при създаване на условията за провеждане на теста, включва формула на структурата, чистота на веществото, устойчивост при светлина, устойчивост при условията на теста, рКа, Pow и резултатите от теста за готовата биоразложимост (вж. метод В.4).
1.5. ВАЛИДНОСТ НА ТЕСТА
За да бъде тестът валиден, при контролите следва да се изпълнят следните критерии:
|
—
|
смъртността на родителските животни (женските Daphnia magna) да не превишава 20 % в края на теста,
|
|
—
|
основният брой живо поколение, произлязло от оцеляло в края на теста родителско животно, да е ≥ 60.
|
1.6. ОПИСАНИЕ НА МЕТОДА НА ТЕСТА
1.6.1. Апаратура
Съдовете за теста и другата апаратура, които ще влизат в контакт с тествания разтвор, следва да са направени изцяло от стъкло или други инертни материали. Съдовете за тестване нормално ще са от устойчиво стъкло.
Допълнително се изисква част или цялото оборудване, както следва:
|
—
|
О2 метър (с микроелектрод или друго подобно оборудване за измерване на разтворения кислород в проби с ниско количество),
|
|
—
|
адекватна апаратура за контрол на температурата,
|
|
—
|
оборудване за определяне на твърдостта на водата,
|
|
—
|
оборудване за определяне на концентрацията на органичен въглерод (ТОС) във водата или оборудване за определяне на необходимостта от химичен кислород (COD),
|
|
—
|
адекватно оборудване за контрол на режима на светлина и измерването на интензитета на светлината.
|
1.6.2. Тествани организми
Видовете, които ще се използват при теста, са видовете Daphnia magna Щраус. Другите видове Daphnia могат да се използват, при условие че съответно отговарят на критериите за валидност (критериите за валидност по отношение на репродуктивната способност при контролите са релевантни за Daphnia видовете). Ако се използват други видове Daphnia, те трябва ясно да се идентифицират и да се посочат причините за тяхната употреба.
За предпочитане е клонингът да се идентифицира чрез генотипа. Проучване (1) показва, че характеристиката за репродуктивността от клонинг А (която произлиза от IRCHA във Франция) (3) постоянно отговаря на критериите за валидност посредством ≥ 60 животни поколение на родителско животно, оцеляло при условията, описани в този метод. Обаче други клонинги се допустими, при условие че Daphnia е показала, че отговаря на критериите за валидност на теста.
В началото на теста животните следва да са на възраст по-малко от 24 часа и не трябва да са първо поколение. Те следва да са произлезли от здраво стадо (т.е. такова, което не показва признаци на стрес, като висока смъртност, присъствие на мъжки и ефипия, закъснение при създаване на първото поколение, безцветни животни и т.н.). Стадото животни трябва да се отглежда в условия (светлина, температура, среда, хранене и животни на единица обем), подобни на тези, които ще се използват при теста. Ако средата на отглеждане на Daphnia, която се използва при теста е различна от тази, която е използвана за обикновеното отглеждане на Daphnia, добре е да се включи преди теста един период на аклиматизация от обикновено три седмици (т.е. едно поколение), за да се избегне подлагането на стрес на родителските животни.
1.6.3. Среда на извършване на теста
Препоръчва се при този тест да се използва изцяло определена среда. Това може да предотврати употребата на добавки (например водорасли, екстракти от почвата и т.н.), които са трудни за характеризиране и следователно подобряват възможността за стандартизиране между лабораториите. Създадени са подходящи за тази цел среди на Elendt М4 (4) и М7 (вж. приложение 1). Обаче са допустими и други среди (например (5) (6), при условие че отглеждането на Daphnia показва, че отговаря на критериите за валидност на теста.
Ако се използват среди, които включват неопределени добавки, тези добавки следва да се определят ясно и при отчитането на теста следва да се предостави информация за състава, по-специално с оглед на съдържанието на въглерод, тъй като това може да съдейства при определяне на хранителния режим. Препоръчва се общият органичен въглерод (ТОС) и/или необходимият химичен кислород (COD) на основната подготовка на органичните добавки да са опредени и да е направена оценка на въздействието на ТОС и COD върху средата, която се използва при теста. При този способ се препоръчва ТОС нивото (т.е. преди добавянето на морски водорасли) да бъде под 2 mg/l (7).
Когато се тестват вещества, съдържащи метали, е важно да се знае, че свойствата на тестваната среда (например твърдост, способност за образуване на хелатен пръстен) могат да издържат токсичността на тестваното вещество. Поради тази причина е желателно средата да бъде напълно определена. Обаче до момента единствените напълно определени среди, за които се знае, че са подходящи за дългосрочно отглеждане на Daphnia magna, са средите на Elendt М4 и М7. И двете среди съдържат хелатообразуващ фактор EDTA (етилендиаминтетраоцетна киселина, комплексон III). Изследванията са показали, че (2) очевидната токсичност на кадмия е най-общо по-ниска, когато тестовете на репродуктивността се извършват при М4 и М7 среди, в сравнение със среди, които не съдържат EDTA. Следователно М4 иМ7 не се препоръчват за тестване на веществата, които съдържат метали, и други способи, съдържащи известни хелагообразуващи фактори, също трябва да се избягват. За веществата, които съдържат метали, е препоръчително да се използва алтернативна среда, като например ASTM (Американско сдружение за изпитване и изследване на материалите) възстанови твърдата прясна вода (7), която не съдържа EDTA и е с прибавени екстракти от водорасли (8). Тази комбинация от ASTM, която възстановява твърдата прясна вода и добавени екстракти от водорасли, също е подходяща за продължително отглеждане и тестване на Daphnia magna (2), въпреки че тя все още проявява слабо хелатообразуващо действие заради органичната съставка на добавените екстракти от водорасли.
В началото и по време на теста концентрацията на разтворен кислород е над 3 mg/l. РН е в границата от 6 до 9 и обикновено не варира повече от 1,5 единици при всеки един тест. Препоръчва се твърдост над 140 mg/1 (като СаСО3). Тестове при и над тези нива са показвали, че репродуктивността е в съответствие с критериите за валидност (9) (10).
1.6.4. Тествани разтвори
Тестваните разтвори на избраните концентрации обикновено се приготвят чрез разреждане на основния разтвор. Основният разтвор за предпочитане се приготвя чрез разреждане на веществото в средата за тестване.
С цел да се приготви устойчив концентриран основен разтвор, може в някои случаи да се наложи употребата на органични разтворители или диспергиращи вещества, но трябва да се положат всички усилия, за да се избегне употребата на такива материали. Примери на подходящи разтворители са ацетон, етанол, метанол, диметилформамид и триетилен гликол. Примери на подходящи разпръскващи вещества са Cremophor RH40, метилцелулоза 0,01 % и НСО-40. Във всички случаи тестваното вещество в тествания разтвор следва да не превишава границата на разтворимост в тестваната среда.
Разтворителите се използват, за да се получи основният разтвор, който може да се дозира точно във водата. С препоръчаната концентрация разтвор и при финалната среда на тестване (т.е. ≤ 0,1 ml/1), изброените по-горе разтвори не са токсични и не повишават разтворимостта във вода на веществото.
Разпръскващите вещества могат да подпомогнат при точното дозиране и разпръскване. При препоръчаната концентрация в условията на последния тест (т.е. ≤ 0,1 ml/1) разпръскващите вещества, изброени по-горе, не са токсични и не повишават разтворимостта във вода на веществото.
1.7. ПЛАНИРАНЕ НА ТЕСТА
Следва да се определят съдовете за теста и да бъдат направени на случаен принцип всички последващи манипулации. Неизпълнението на тези действия може да доведе до отклонение, което може да се изтълкува погрешно като въздействие от концентрацията. По-специално, ако експерименталните единици се управляват по реда на обработката и концентрацията, тогава някои ефекти, относими към времето, като умората на оператора или други грешки, могат да доведат до по-големи въздействия при по-високите концентрации. Нещо повече, ако е вероятно резултатите от теста да са повлияни от първоначалните условия или условията на околната среда по време на теста, такива като местонахождение на лабораторията, следва да се помисли за спиране на теста.
1.8 ПРОЦЕДУРА
1.8.1. Условия на експозиция
1.8.1.1. Продължителност
Тестът продължава 21 дни.
1.8.1.2. Зареждане
Родителските животни се обслужват индивидуално, едно за един съд за тестване, с 50 — 100 ml от средата на всеки съд.
За да се постигнат изискванията на аналитичната процедура, използвана при определяне на концентрацията тествано вещество, понякога може да са необходими по-големи обеми, въпреки че е допустимо и обединяването на дублиращите съдове за химически анализи. Ако се използва количество, по-голямо от 100 ml, може да се наложи да се повиши съотношението, дадено за Daphnia, за да се гарантира достатъчен достъп на храна и съответствие с критериите за валидност. За потоковите тестове може да се помисли за алтернативно планиране, по технически причини, (например четири групи от 10 животни в по-голям обем), но следва да бъдат отчитани всякакви промени в планирането на теста.
1.8.1.3. Брой животни
За полустатичните тестове се използват най-малко 10 животни, разделени поотделно за всяка тествана концентрация, и най-малко 10 животни, разделени поотделно в контролните серии.
За потоковите тестове се установява за уместно да се използват 40 животни, разделени на четири групи от 10 животни за всяка тествана концентрация (1). По-малък брой от тествани организми може да се използва и се препоръчва минимум 20 животни за концентрация, разделени на две или повече контролни групи с равен брой животни (например четири контролни групи, като всяка съдържа пет водни бълхи). За отбелязване е, че за тестове, където животните са държани в групи, ако родителското животно умре, няма да е възможно да се отчете репродуктивната способност като общ брой оцеляло поколение, произлязло от родителско животно, което е живо в края на теста. В тези случаи репродуктивната способност се изразява като общ брой живо поколение, произлязло от родителите, които са били живи в началото на теста.
1.8.1.4. Хранене
За полустатичните тестове храненето за предпочитане се прави дневно, но поне три пъти на седмица (т.е. съответстващи на измененията в средата). Отклоненията от това (например за потоковите тестове) следва да бъдат отчитани.
По време на теста хранителният режим на родителските животни за предпочитане са живи клетки от морски водорасли или едно или повече от следните: Chorella sp, Selenastrum capricornutum (сега Pseudokichneriella subcapitata (11) и Scenedesmus subspicatus. Хранителният режим, който се прилага, следва да се основава на количеството органичен въглерод (С), осигурен за всяко родителско животно. Проучванията (12) показват, че за Daphnia magna нива на съотношение между 0,1 и 0,2 mg C/Daphnia/ден са достатъчни за получаването на изисквания брой поколение, за да се покрият критериите за валидност на теста. Съотношението може да се получи или при постоянна пропорция по време на теста, или, ако е желателно, може да се използва по-ниска пропорция в началото на теста, която да се повиши по време на извършването на теста, като се вземе предвид растежът на родителските животни. В този случай съотношението все още остава в препоръчания обхват от 0,1 — 0,2 mg C/Daphnia/ден по всяко време.
Ако за да се поддържа изискваното ниво на съотношение (т.е. за удобство, тъй като измерването на органичния въглерод изисква време) трябва да се използват заместващи мерки, такива като брой на клетките от морски водорасли или слаба адсорбция, всяка лаборатория трябва да има собствена номограма, която се отнася до заместващия начин на измерване на органичния въглерод на морските водорасли (вж. приложение 2 за съвети при създаването на номограма). Номограмите се проверяват поне веднъж годишно и по-често, ако условията за отглеждане на морските водорасли са се променили. Установено е, че слаба адсорбция е по-добър заместител на съдържанието на въглерод, отколкото броят на клетките (13).
За да се минимизира количеството отглеждани морски водорасли, прехвърлени в съдовете за тестване, за Daphnia се поддържа концентрирана суспензия на морските водорасли. Концентрацията на морските водорасли може да се постигне чрез центрофуга, последвана от ресуспензия на дестилирана вода, дейонизирана вода или среда на Daphnia културата.
1.8.1.5. Светлина
16 часа светлина при интензитет, непревишаващ 15 — 20 μΕ m-2 s-1
1.8.1.6. Температура
Температурата на средата, при която се извършва тестът, е в граници от 18 — 20 oС. Обаче за всеки един тест температурата не следва да се изменя, ако е възможно, с повече от 2 oС извън тези ограничения (например 18 — 20, 19 — 21 или 20 — 22 oС). Може да е подходящо използването на допълнителни съдове за теста за целите на мониторинга на температурата.
1.8.1.7. Проветряване
По време на теста съдовете не се проветряват.
1.8.2. Тествана концентрация
Обикновено следва да са налични поне пет тествани концентрации, подредени в геометрични серии с фактор на разделяне, за предпочитане не превишаващ 3,2, и се използва подходящият брой контроли за всяка тествана концентрация (вж. точка 1.8.1.3). Посочват се причините за използването на по-малко от пет концентрации. Не се тестват вещества над тяхната граница на разтворимост в тестваната среда.
При определяне границите на концентрация се взема предвид следното:
|
i)
|
ако целта е постигане на LOEC/NOEC, най-ниската концентрация трябва да е достатъчно ниска, така че плодовитостта при тази концентрация да не е значително по-ниска от тази при контролната. Ако случаят не е такъв, тестът трябва да се повтори с намалена най-ниска концентрация;
|
|
ii)
|
ако целта е постигане на LOEC/NOEC, най-високата концентрация трябва да е достатъчно висока, така че плодовитостта при тази концентрация да е значително по-ниска от тази при контролната. Ако случаят не е такъв, тестът трябва да се повтори с повишена най-висока концентрация;
|
|
iii)
|
ако е изчислено ЕСХ за въздействието върху репродуктивността, се препоръчва да се използват достатъчни концентрации, за да се определи ЕСХ с подходящо ниво на увереност. Ако е изчислено ЕС50 за въздействието върху репродуктивността, се препоръчва най-високата концентрация да е по-висока от тази ЕС50. Иначе, въпреки че все пак е възможно да се изчисли ЕС50, интервалът на увереност по отношение на ЕС50 е много широк и няма да е възможно да се оцени задоволително приложимостта на съответния модел;
|
|
iv)
|
границите на тестваната концентрация е за предпочитане да не включват никакви концентрации, които статистически имат значително въздействие върху оцеляването на възрастните индивиди, тъй като това би променило природата на теста от обикновен тест за репродуктивност до сложен тест за репродуктивност и смъртност, изискващ много повече сложни статистически анализи.
|
Предварителните познания за токсичността на тестваното вещество (например от акутен тест и/или от сведения от проучвания на обхвата) ще помогнат при избора на подходящи концентрации за изследване.
Където се използва разтвор или разпръскващо вещество, за да се подпомогне разтворът за тестване (вж. точка 1.6.4), неговата последна концентрация в съда за тестване не следва да е по-висока от 0,1 ml/1 и следва да е една и съща във всички съдове за тестване.
1.8.3. Контроли
Допълнително към сериите от теста, по средата на теста се използва една контролна серия и също, ако е уместно, една контролна серия, съдържаща разтвор или разпръскващо вещество. Когато се използва такава серия, концентрацията на разтворителя или на разпръскващото вещество следва да е същата като използваната в съда, съдържащ тестваното вещество. Използват се подходящ брой дублиращи серии (вж. точка 1.8.1.3).
Най-общо, при добре проведените тестове коефициентът на променливост спрямо основния брой живо поколение, произлязло от едно родителско животно в контролната(ите) серия(и), следва да бъде ≤ 25 и това се отчита, при планирането на теста чрез използване на самостоятелно отглеждани животни.
1.8.4. Възстановяване на средата за тестване
Честотата на възстановяването на средата зависи от устойчивостта на тестваното вещество, но това следва да бъде поне три пъти на седмица. Ако от предварителните тестове за устойчивост (вж. точка 1.4), концентрацията тествано вещество не е стабилна (т.е. е извън обхвата от 80 — 120 % от номинала или пада под 80 % от измерената първоначална концентрация) за по-дълго време от максималния период на възстановяване (т.е. три дни), се вземат мерки за по-често възстановяване на средата или за използване на потоков тест.
Когато средата се е възстановила при полустатичните тестове, се подготвя втора серия от съдове за тестване и родителските животни се прехвърлят в тях чрез например стъклена пипета с подходящ диаметър. Количеството прехвърлена среда с Daphnia се минимизира.
1.8.5. Наблюдения
Резултатите от наблюденията, направени по време на теста, се записват върху таблици (вж. примерите в приложения 3 и 4). Ако се изискват други измервания (вж. 1.3 и 1.8.8), се правят допълнителни наблюдения.
1.8.6. Поколение
За да не се консумира храната, предназначена за възрастния индивид, поколението, произлязло от едно родителско животно, е за предпочитане да се отстранява и всекидневно да се преброява след появяването на първото потомство. За целите на този метод се преброява само живото поколение, но наличието на недоразвити яйца или мъртво поколение също следва да бъде отчитано.
1.8.7. Смъртност
За предпочитане е смъртността между родителските животни да се записва всеки ден поне по едно и също време с времето, когато се преброява поколението.
1.8.8. Други параметри
Въпреки че този метод принципно е планиран да оценява въздействието върху репродуктивността, е възможно задоволително да се определят и други въздействия, за да се позволи статистически анализ. Желателно е измерване на растежа, тъй като се набира информация за възможните сублетални въздействия, които може да са по-полезни, отколкото измерването само на репродуктивността; препоръчва се в края на теста да се измери дължината на родителските животни (т.е. дължината на тялото, като се изключи краят на гръбнака). Други параметри, които могат да се измерват или изчисляват, са времето за произвеждане на първото поколение (и следващите), броят и размерът на поколението по животни, броят на неразвитото поколение, наличието на мъжки или ефипии и присъщата скорост на повишаване на популацията.
1.8.9. Честота на аналитичните определяния и измервания
Поне веднъж в седмицата се измерват стойностите на концентрацията на кислород, температурата, твърдостта и рН, в прясна и стара среда, в контролите и при най-високата концентрация на тестваното вещество.
По време на теста концентрацията на тестваното вещество се определя на равни интервали.
При полустатичните тестове, където концентрацията на тестваното вещество се очаква да остане в рамките на ± 20 % от номинала (т.е. в обхвата 80 — 120 % — вж. 1.4 и 1.8.4), се препоръчва да се анализират като минимум най-високата и най-ниската концентрация на тестване, когато са току-що приготвени и по време на възстановяването през първата седмица на теста (т.е. прави се анализ на пробите от същия разтвор — когато са току-що приготвени и при възстановяването). След това се повтарят на интервали от поне една седмица.
За тестове, където концентрацията на тестваното вещество не се очаква да остане под ± 20 % от номинала, е необходимо да се анализират всички концентрации на тестване, когато са току-що приготвени и при възстановяване. Обаче за тези тестове, където измерената първоначална концентрация на тестваното вещество не е ± 20 % от номинала, но има достатъчно доказателства, които показват, че първоначалните концентрации са повторяеми и устойчиви (т.е. в обхвата от 80 — 120 % от първоначалната концентрация), се намалява определянето на химикалите от втората и третата седмица на теста до най-високата и най-ниската тествана концентрация. Във всички случаи определянето на концентрацията тествано вещество се извършва само при дублиращия съд за всяка тествана концентрация, преди възстановяването.
Ако е ползван потоков тест, е подходящ режим на пробите, подобен на този, описан за полустатичните тестове (но измерването на стари разтвори не се прилага в този случай). Обаче е препоръчително да се увеличи броят на вземането на проби по време на първата седмица (например три измервания), за да се гарантира, че тестваните концентрации остават устойчиви. При тези видове тестове дебитът на разтворителя и тестваното вещество се проверяват всеки ден.
Ако има доказателство, че концентрацията тествано вещество, която се изследва, е била задоволително поддържана в ± 20 % от номинала или измерената първоначална концентрация по време на теста, то резултатите могат да се основават на номинала или на измерените първоначални стойности. Ако отклонението от номинала или измерената първоначална концентрация е по-голямо от ± 20 %, резултатите се изразяват с оглед на натовареното средно време (вж. приложение 5).
2. ДАННИ И ОТЧИТАНЕ
2.1. ОБРАБОТКА НА РЕЗУЛТАТИТЕ
Целта на този тест е да се определи въздействието на тестваното вещество върху общия брой живо поколение за едно родителско животно, което е останало живо до края на теста. Общият брой живо поколение за едно родителско животно се изчислява за всеки съд за тестване (т.е. дублиращ). Ако при някои от дублиращите съдове по време на теста родителското животно умре или се окаже мъжки индивид, то дублиращото животно се изключва от анализа. Анализът тогава ще се основава на намаления брой дублиращи животни.
За оценяването на LOEC и следователно NOEC за въздействието на химикала върху репродуктивната способност е необходимо да се изчисли основната репродуктивна способност между дублиращите за всяка концентрация и свързаните остатъчни стандартни отклонения и това може да бъде направено, като се използва анализът на променливостта (ANOVA). Средната стойност на всяка тествана концентрация трябва следователно да се сравни с контролната средна стойност, като се използва подходящ метод за многократно сравняване. Тестовете на Дънет и Уилям могат да се използват (14) (15) (16) (17). Необходимо е да се провери дали ANOVA предположение за хомогенност на променливостта се запазва. Препоръчва се това да се направи по-скоро графично, отколкото чрез тест за формална значимост (18); подходяща алтернатива е тестът на Барлет. Ако това предположение не издържи, тогава се предпочита преобразуването на данните за променливост на хомогенността пред извършването на ANOVA или утежнена ANOVA. Размерът на въздействието, което се определя чрез използването на ANOVA (т.е. последната значителна разлика), се изчислява и отчита.
За оценка на концентрацията, която причинява 50 % намаляване на репродуктивната способност (т.е. ЕС50), подходяща крива, например логистична крива, следва да е съобразена с данните чрез използване на статистическия метод, като например последните квадрати. Параметрите на кривата се определят, така че ЕС50 и неговите статистически грешки да могат да се оценят директно. Това много ще улесни изчисляването на границата на сигурност за ЕС50. Освен ако няма основание да бъдат предпочетени различни граници на сигурност, позоваването следва да се прави при двустранни 95 % граници на сигурност. Съответстващата процедура преди всичко предоставя средството за оценка на значимостта на липсата на съответствие. Това може да се направи графично или чрез разделяне на остатъчната сума от квадрата в „липсата на съответствие“ и „компоненти на чиста грешка“ и извършване на специален тест за липса на съответствие. Тъй като за обработките, които дават висока плодовитост, е възможно да има голяма променливост в броя на произлезлите млади индивиди, отколкото обработките, които дават ниска плодовитост, за да се отрази на различната променливост при различните третирани групи, се предпочита компенсиране на наблюдаваните стойности (вж. за основна информация използвана литература (18)).
При анализа на данни от последния кръгов тест (2) логистичната крива се пригодява, като се използва следният модел, въпреки че може да се използват и други подходящи модели:

където:
|
Y
|
=
|
общият брой млади индивиди за родителско животно, което е живо в края на теста (изчислени за всеки съд)
|
|
х
|
=
|
концентрация на веществото
|
|
с
|
=
|
очакван брой млади организми, когато х = 0
|
|
хо
|
=
|
ЕС50 в популацията
|
|
b
|
=
|
параметри на наклона
|
Този модел е вероятно да бъде адекватен на голям брой ситуации, но все пак ще има тестове, за които няма да е подходящ. Следва да се прави проверка на валидността на модела, както бе предложено по-горе. В някои случаи може да е подходящ хормезен модел, при който ниските концентрации дават засилени ефекти (19).
Други концентрации, които оказват въздействие, като ЕС10 и ЕС20, също могат да се изчисляват, въпреки че може да се предпочете използването на различни параметри на модела от тези, които са използвани за изчисляване на ЕС50.
2.2. ОТЧИТАНЕ НА ТЕСТА
При отчитане на теста се включва следното:
2.2.1. Тествано вещество
|
—
|
физическа природа и съответните физикохимични свойства,
|
|
—
|
данни за химическата идентификация, включително чистота.
|
2.2.2. Тествани видове
|
—
|
клонинг (независимо от това дали е генетичен вид), доставчик и източник (ако е известен) и използваните условия за отглеждане. Ако се използват видове, различни от Daphnia magna, това се отчита и се посочват причините за това.
|
2.2.3. Условия, при които се извършва теста
|
—
|
използваната при теста процедура (т.е. полустатична или потокова, количество, зареждане на брой Daphnia за литър),
|
|
—
|
период на излагане и интензитет на светлината,
|
|
—
|
планиране на теста (т.е. брой на дубликатите, брой на родителите спрямо дубликатите),
|
|
—
|
подробности за използваната среда за отглеждане,
|
|
—
|
ако са използвани, добавки от органични материали, включително структура, източник, метод на приготвяне, TOC/COD на основния разтвор, оценка на резултатите на TOC/COD в тестваната среда,
|
|
—
|
подробна информация за храненето, включително количеството (в mg C/Dapnia/ден) и разписанието (например вида на храната, включително характерното название на морските водорасли и, ако се знае, рода, условията на отглеждане),
|
|
—
|
метода на подготовка на основните разтвори и честотата на подновяване (ако се използват разтвор и разпръскващо вещество, те трябва да са дадени, както и тяхната концентрация).
|
2.2.4. Резултати:
|
—
|
резултатите от всички предварителни проучвания върху устойчивостта на тестваното вещество,
|
|
—
|
номиналните тествани концентрации и резултатите от всички анализи, за да се определи концентрацията на тестваното вещество в съд за тестване (вж. пример на таблица с данни в приложение 4); отчитат се също ефикасността на метода за възстановяване и границата на определеност,
|
|
—
|
качество на водата в съда за тестване (т.е. рН, температура и концентрация на разтворения кислород и ТОС и/или COD и твърдост, където е необходимо) (вж. пример на таблица в приложение 3),
|
|
—
|
целият записан брой живо поколение спрямо всяко родителско животно (вж. таблицата в приложение 3),
|
|
—
|
брой на мъртвите сред родителските животни и денят, в който това се е случило (вж. таблицата в приложение 3),
|
|
—
|
коефициент на променливост за контрол на плодовитостта (основан на общия брой живо поколение за родителско животно, което е останало живо в края на теста),
|
|
—
|
графика на общия брой живо поколение на родителско животно (за всяка дублираща група), което е останало живо в края на теста, по отношение на концентрацията на тестваното вещество,
|
|
—
|
най-ниско наблюдавано въздействие на концентрация LOEC за репродуктивността, включително описание на използваните статистически процедури и индикация за това, каква големина на въздействие може да се определи и ненаблюдавано въздействие на концентрация NOEC за репродуктивността; където това е подходящо; отчита се и LOEC/NOEC за смъртността на родителските животни,
|
|
—
|
където е подходящо, ЕСХ за репродуктивността и интервалите на сигурност и графика за съответния модел, използван за изчисляване, наклон на кривата за реакция спрямо дозата и стандартната грешка,
|
|
—
|
други наблюдавани биологически ефекти или измервания: отчитане на всички други биологични ефекти, които са били наблюдавани или измервани (например растеж на родителското животно), включително и съответното обосноваване,
|
|
—
|
обяснение за всички отклонения от метода на теста.
|
3. ПРЕПРАТКИ
|
(1)
|
OECD Test Guideline Programme, Report of the Workshop on the Daphnia magna Pilot Ring Test, Sheffield University, UK, 20—21 March 1993.
|
|
(2)
|
OECD Environmental Health and Safety Publications. Series on Testing and Assessment No. 6. Report of the Final Ring Test of the Daphnia magna Reproduction Test Paris. 1997.
|
|
(3)
|
Baird D. J., Barber J., Bradley M. C, Soares A. M. V. M. and Calow P. (1991). A comparative study of genotype sensitivity to acute toxic stress using clones of Daphnia magna Strauss. Ecotoxicology and Environmental Safety, 21, pp. 257—265.
|
|
(4)
|
Elendt B. P., (1990). Selenium deficiency in Crustacea; An ultrastructural approach to antennal damage in Daphnia magna Straus. Protoplasma, 154, pp. 25—33.
|
|
(5)
|
EPA (1993). Methods for Measuring the Acute Toxicity of Effluents and Receiving Waters to Freshwater and Marine Organisms. (Fourth ed.). EPA/600/4-90/027F. C. I. Weber (ed), USEPA, Cincinnati, Ohio.
|
|
(6)
|
Vigano L., (1991) Suitability of commercially available spring waters as standard medium for culturing Daphnia magna. Bull. Environ. Contam. Toxicol., 47, pp. 775—782.
|
|
(7)
|
ASTM (1988). Standard Guide for Conducting Acute Toxicity Tests with Fishes, Macroinvertebrates and Amphibians. E729-88a. American Society for Testing and Materials, Philadelphia P.A. 20 pp.
|
|
(8)
|
Baird D. J., Soares A. M. V. M., Girling A., Barber J., Bradley M. C. and Calow P. (1989). The long term maintenance of Daphnia magna Straus for use in ecotoxicological tests; problems and prospects. In: Proceedings of the 1st European Conference on Ecotoxicology. Copenhagen 1988 (H. Løkke, H. Tyle & F. Bro-Rasmussen. Eds.), pp. 144—148.
|
|
(9)
|
Parkhurst B. R., Forte J. L. and Wright G. P. (1981). Reproducibility of a life-cycle toxicity test with Daphnia magna. Bull. Environ. Contam. and Toxicol., 26, pp. 1—8.
|
|
(10)
|
Cowgill U. M. and Milazzo D. P. (1990) The sensitivity of two cladocerans to water quality variables: salinity and hardness. Arch. Hydrobiol., 120(2), pp. 185—196.
|
|
(11)
|
Korshikov (1990). Pseudokirchneriella subcapitata Hindak, F-1990. Biologice Prace, 36, 209.
|
|
(12)
|
Sims I. R., Watson S. and Holmes D. (1993). Toward a standard Daphnia juvenile production test. Environmental Toxicology and Chemistry, 12, pp. 2053—2058.
|
|
(13)
|
Sims I. (1993). Measuring the growth of phytoplankton: the relationship between total organic carbon with three commonly used parameters of algal growth. Arch. Hydrobiol., 128, pp. 459—466.
|
|
(14)
|
Dunnett C. W., (1955). A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc, 50, pp. 1096—1121.
|
|
(15)
|
Dunnett C. W., (1964). New tables for multiple comparisons with a control. Biometrics, 20, pp. 482—491.
|
|
(16)
|
Williams D. A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, pp. 103—117.
|
|
(17)
|
Williams D. A. (1972). The comparison of several dose levels with a zero dose control. Biometrics, 28, pp. 510—531.
|
|
(18)
|
Draper N. R. and Smith H. (1981). Applied Regression Analysis, second edition, Wiley, N.Y.
|
|
(19)
|
Brain P. and Cousens R. (1989). An equation to describe dose responses where there is stimulation of growth at low doses. Weed Research, 29, pp. 93—96.
|
|
(20)
|
Wilson E. O. and Bossert, W. H. (1971). A Primer of Population Biology. Sinauer Associates Inc. Publishers.
|
|
(21)
|
Poole R. W. (1974). An Introduction to quantitative Ecology. McGraw-Hill Series in Population Biology, New York, pp. 532.
|
|
(22)
|
Meyer J. S., Ingersoll C. G., McDonald L. L. and Boyce M. S. (1986). Estimating uncertainty in population growth rates: Jackknife vs bootstrap techniques. Ecology, 67, pp. 1156—1166.
|
Приложение 1
ПОДГОТОВКА HA НАПЪЛНО ОПРЕДЕЛЕНАТА СРЕДА HA ELENDT М7 И M4
Аклиматизация към средите на Elendt M7 и M4
Някои лаборатории срещат трудности при директното прехвърляне на Daphnia към среди М4 (1) и М7. Обаче са постигнати някои успехи при постепенната аклиматизация, т.е. преместване от една среда от 30 % Elendt към 60 % Elendt и след това към 100 % Elendt. Може да се наложи периодите на аклиматизация да бъдат дълги по един месец.
ПОДГОТОВКА
Елементи с микроконцентрация
Първо във вода със съответната чистота, т.е. дейонизирана, дестилирана и обратна осмоза, се приготвят отделени основни разтвори (I) от индивидуални елементи с микроконцентрация. От тези различни основни разтвори (I) се приготвя втори отделен основен разтвор, който съдържа всички елементи с микроконцентрация (комбиниран разтвор), т.е.:
|
Основни разтвори I
(единично вещество)
|
Количество, прибавено към водата
(mg/l)
|
Концентрация (взависимост от средата М4)
(на част)
|
За приготвяне на комбиниран основен разтвор II добавете следното количество основен разтвор I към водата
(ml/l)
|
|
М4
|
М7
|
|
H3BO3
|
57 190
|
20 000
|
1,0
|
0,25
|
|
MnCl2 4H2O
|
7 210
|
20 000
|
1,0
|
0,25
|
|
LiCl
|
6 120
|
20 000
|
1,0
|
0,25
|
|
RbCl
|
1 420
|
20 000
|
1,0
|
0,25
|
|
SrCl2 6H2O
|
3 040
|
20 000
|
1,0
|
0,25
|
|
NaBr
|
320
|
20 000
|
1,0
|
0,25
|
|
Na2MoO4 2H2O
|
1 260
|
20 000
|
1,0
|
0,25
|
|
CuCl2 2H2O
|
335
|
20 000
|
1,0
|
0,25
|
|
ZnCl2
|
260
|
20 000
|
1,0
|
1,0
|
|
CoCl2 6H2O
|
200
|
20 000
|
1,0
|
1,0
|
|
KI
|
65
|
20 000
|
1,0
|
1,0
|
|
Na2SeO3
|
43,8
|
20 000
|
1,0
|
1,0
|
|
NH4VO3
|
11,5
|
20 000
|
1,0
|
1,0
|
|
Na2EDTA 2H2O
|
5 000
|
2 000
|
—
|
—
|
|
FeSO4VH2O
|
1 991
|
2 000
|
—
|
—
|
|
И при разтвор на Na2EDTA, и при разтвор на FeSO4 разтворите се приготвят отделно, изливат се заедно и незабавно се автоклавират. Това дава:
|
|
2l разтвор на Fe-EDTA
|
|
1 000 на част
|
20,0
|
5,0
|
Среди М4 и М7
Средите М4 и М7 се приготвят чрез използване на основен разтвор II, макронутриенти и витамини, както следва:
|
|
Количество, прибавено към водата
(mg/l)
|
Концентрация (взависимост от средата М4)
(на част)
|
Количество основен разтвор, прибавено към средата
(ml/l)
|
|
М4
|
М7
|
|
Съчетани микроелементи основен разтвор II
|
|
20
|
50
|
50
|
|
Основен разтвор с макронутриенти (единично вещество)
|
|
CaCl2 2H2O
|
293 800
|
1 000
|
1,0
|
1,0
|
|
MgSO4 7H2O
|
246 600
|
2 000
|
0,5
|
0,5
|
|
KCl
|
58 000
|
10 000
|
0,1
|
0,1
|
|
NaHCO3
|
64 800
|
1 000
|
1,0
|
1,0
|
|
Na2SiO3 9H2O
|
50 000
|
5 000
|
0,2
|
0,2
|
|
NaNO3
|
2 740
|
10 000
|
0,1
|
0,1
|
|
KH2PO4
|
1 430
|
10 000
|
0,1
|
0,1
|
|
K2HPO4
|
1 840
|
10 000
|
0,1
|
0,1
|
|
Комбиниран разтвор на витамини
|
—
|
10 000
|
0,1
|
0,1
|
|
Комбинираният разтвор на витамини се приготвя чрез прибавяне на 3 витамина към 1 l вода, както е показано по-долу:
|
|
Тиамин хидрохлорид
|
750
|
10 000
|
—
|
—
|
|
Цианокобаламин (B12)
|
10
|
10 000
|
—
|
—
|
|
Биотин
|
7,5
|
10 000
|
—
|
—
|
|
Комбинираният разтвор на витамини се съхранява замразен на малки, съразмерни части. Малко преди употреба се добавят витамините към средата.
|
Бележки:
|
За да се избегне утаяването на соли, когато се приготвя цялата среда, се прибавя съразмерна част от основния разтвор от около 500 — 800 ml дейонизирана вода и след това се допълва до 1 l.
|
|
|
Първото публикуване на среда М4 може да се намери при Elendt (1990). Selenium deficiency in crustacea; an ultrastructural approach to antennal damage in Daphnia magna Straus. 154, 25—33.
|
|
Приложение 2
АНАЛИЗ HA ОБЩИЯ ОРГАНИЧЕН ВЪГЛЕРОД (TOC) И СЪЗДАВАНЕ HA НОМОГРАМА ЗА TOC СЪДЪРЖАНИЕ HA ХРАНАТА OT МОРСКИ ВОДОРАСЛИ
Приема се, че съдържанието на въглерод в храната от морски водорасли обикновено не се измерва директно, а от корелациите (т.е. номограмите) със заместващи мерки, такива като броя на клетките морски водорасли или адсорбцияТА на светлина.
TOC се измерва по-скоро чрез високотемпературно окисляване, отколкото чрез UV или персулфатни методи (вж. Инструментално определяне на общия органичен въглерод, общия нужен кислород и съответните детерминанти 1979, The Instrumental Determination of Total Organic Carbon, Total Oxygen Demand and Related Determinands 1979, HMSO 1980; 49 High Holborn, London WC1V 6HB).
За създаване на номограмата водораслите следва да се отделят от средата на растеж чрез центрофуга, след което следва ресуспензия в дестилирана вода. Измерват се параметрите заместители и TOC концентрацияТА във всички проби по три екземпляра. Празните проби с дестилираната вода се анализират и TOC концентрацията се изважда от TOC концентрацията на пробите от морски водорасли.
Номографията е линеаРна при изисквания обхват на концентрацията от въглерод. Примерите са показани по-долу.
NB: Te следва да не се използват за конверсия; необходимо е лабораториите да приготвят техни собствени номограми.


Приложение 3
ПРИМЕРНА ТАБЛИЦА ЗА ЗАПИСВАНЕ ВЪЗСТАНОВЕНАТА СРЕДА, ДАННИ OT ФИЗИКОХИМИЧЕН МОНИТОРИНГ, ХРАНЕНЕ, РЕПРОДУКТИВНОСТ HA DAPHNIA И СМЪРТНОСТ ПРИ ВЪЗРАСТНИТЕ ИНДИВИДИ
|
Експеримент №:
|
Начална дата:
|
Клонинг:
|
Среда:
|
Вид храна
|
Тестващо вещество:
|
Номинална концентрация:
|
|
Ден
|
O
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
13
|
14
|
15
|
16
|
17
|
18
|
19
|
20
|
21
|
|
|
|
Възстановяване на средата (водна бълха)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
РН (37)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
нова
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
стара
|
|
|
O2 mg/l (37)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
нова
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
стара
|
|
|
температура ( oC) (37)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
нова
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
стара
|
|
|
Предоставена храна (водна бълха)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Няма живо поколение (38)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Общо
|
|
Съд 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Общо
|
|
|
Кумулативна смъртност при възрастните индивиди (39)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Приложение 4
ПРИМЕРНА ТАБЛИЦА ЗА ЗАПИСВАНЕ РЕЗУЛТАТИТЕ OT ХИМИЧНИЯАНАЛИЗ
а) Измерени концентрации
|
Номинална концентрация
|
Проба от I седмица
|
Проба от II седмица
|
Проба от III седмица
|
|
прясна среда
|
стара среда
|
прясна среда
|
стара среда
|
прясна среда
|
стара среда
|
|
|
|
|
|
|
|
|
б) Измерени концентрации като процент от номинала
|
Номинална концентрация
|
Проба от I седмица
|
Проба от II седмица
|
Проба от III седмица
|
|
прясна среда
|
стара среда
|
прясна среда
|
стара среда
|
прясна среда
|
стара среда
|
|
|
|
|
|
|
|
|
Приложение 5
ИЗЧИСЛЯВАНЕ HA НАТОВАРЕНА СРЕДНА СТОЙНОСТ
Натоварена средна стойност
Когато е дадено, че концентрацията тествано вещество може да се намали за периода между възстановяването на средата, е необходимо да се прецени коя концентрация от обхвата на изпробваните концентрации върху родител Daphnia да се избере като представителна. Изборът се основава на биологически и статистически преценки. Например ако репродуктивността е повлияна най-вече от изпробваната върхова концентрация, тогава се използва максималната концентрация. Обаче ако се смята, че акумулираните и по-дългосрочни въздействия на токсичното вещество са по-важни, то средната концентрация е по уместна. B този случай подходящата средна величина, която се използва, е концентрацията на натоварена средна стойност, тъй като се взима под внимание променливостта на моментната концентрация през времето.
Фигура 1
Пример за натоварена средна стойност
Фигура 1 показва пример за опростен тест, който продължава седем дни с възстановяване на средата в дни 0, 2 и 4.
|
|
Тънката зигзагообразна линия показва концентрацията по всяко време. Предполага се, че падането на концентрацията следва експоненциалния процес на разлагане.
|
|
|
Шестте изобразени точки представят наблюдаваните концентрации, които са измерени в началото и в края на всеки период на възстановяване.
|
|
|
Дебелата линия показва позицията на натоварената средна стойност.
|
Натоварена средна стойност се изчислява така, че зоната под натоварената средна стойност да е равна на зоната под кривата на концентрация. Изчисляването за по-горе посочения пример е посочено в таблица 1.
Таблица 1
Изчисляване на натоварената средна стойност
|
№ на възстановяване
|
Дни
|
Конц 0
|
Конц 1
|
Ln (Конц 0)
|
Ln (Koнц 1)
|
Площ
|
|
1
|
2
|
10,000
|
4,493
|
2,303
|
1,503
|
13,767
|
|
2
|
2
|
11,000
|
6,037
|
2,398
|
1,798
|
16,544
|
|
3
|
3
|
10,000
|
4,066
|
2,303
|
1,403
|
19,781
|
|
Общ брой дни: 7
|
Обща площ
|
50,091
|
|
Натоварена средна стойност
|
7,156
|
|
„Дни“ е броят на дните в периода на възстановяване.
„Конц0“ е измерената концентрация в началото на всеки период на възстановяване.
„Конц1“ e измерената концентрация в края на всеки период на възстановяване.
„Ln (Koнц0)“ е естествен логаритъм на Конц0.
„Ln (Koнц1)“ е естествен логаритъм на Конц1.
„Площ“ е площта под експоненциалната крива за всеки период на възстановяване. Изчислява се с уравнението:

|
Натоварената средна стойност и общата зона са разделени на общия брой дни.
Разбира се, за теста за репродуктивност на Daphnia таблицата би трябвало да се разшири до 21 дни.
Ясно е, че когато се извършват наблюдения само в началото и в края на периода на възстановяване, е невъзможно да се потвърди, че процесът на спадане е всъщност експотенциален. Различна крива би довела до различно изчисление за графата „Площ“. Обаче експоненциалният процес на разлагане не е неприемлив и вероятно е най-добрата крива, която при отсъствието на друга информация следва да се използва.
Изисква се обаче внимателно боравене, ако химическият анализ не доведе до намиране на някакво вещество в края на периода на възстановяване. Ако не е възможно да се оцени колко бързо веществото изчезва от разтвора, е невъзможно да се получи реалистична площ под кривата и следователно е невъзможно да се постигне разумна натоварена средна стойност.
В.21. ПОЧВЕНИ МИКРООРГАНИЗМИ: ИЗПИТВАНЕ НА АЗОТНАТА ТРАНСФОРМАЦИЯ
1. METOД
Този метод е идентичен с ОECD TG 216 (2000).
1.1. ВЪВЕДЕНИЕ
Методът за изпитване представлява предназначен за лабораторни анализи метод за обследване на дългосрочните ефекти върху азотната трансформация на почвените микроорганизми при еднократна експозиция с химикали. Изпитването принципно се основава на Препоръките на Европейската и Средиземноморската организация за защита на растенията (1). Други насоки обаче, включително тези на Немския биологичен институт (2), Американската агенция за защита на околната среда (3), SETAC (4) и Международната организация за стандартизация (5), също може да бъдат взети предвид. Семинарът на ОИСР за избор на почви/седименти, проведен в Belgirate, Италия, през 1995 г. (6), приема броя и вида на почвите, използвани при това изпитване. Препоръките за събиране, обработване и съхранение на почвената проба се основават на Ръководството на ISO (7) и препоръките от семинара в Belgirate. За междинните и окончателната оценка на токсичните характеристики на изпитваните вещества може да бъде изискано определянето на ефектите върху микробната активност на почвата, напр. когато се изискват данни за потенциалната големина на ефектите върху почвената микрофлора от продуктите за защита на зърнените култури или когато се очаква експозиция на почвените микроорганизми от химикали, които не са продукти за защита на зърнени култури. Изпитването за азотна трансформация се провежда, за да се определят ефектите от такива химикали върху почвената микрофлора. Ако се изпитват агрохимикали (напр. продуктите за защита на зърнените култури, торове, химикали за защита на горите), се провеждат едновременно азотна и въглеродна трансформация. Ако не се изпитват агрохимикали, достатъчно е изпитването за азотна трансформация. Ако обаче стойностите на ЕС50 на такива химикали при изпитването на азотната трансформация са в обхвата на наличните в естествено състояние (натурални) нитрификационни инхибитори (напр. нитрапирин), трябва да бъде проведено и изпитване на въглеродната трансформация, за да се събере повече информация.
Почвите се състоят от живи и неживи компоненти, които съществуват в комплексни хетерогенни смеси. Микроорганизмите играят важна роля в разграждането и трансформирането на органичната материя в наторените почви, като различните видове способстват по различен начин за почвеното плодородие. Всяко дългосрочно влияние при тези биохимични процеси по всяка вероятност може да окаже влияние на цикъла на хранене, а това би могло да измени плодородието на почвата. Във всички наторени почви се извършват трансформации на азота и въглерода. Въпреки че микробните общества в различните почви отговарят различно на тези процеси, начините на трансформация в основата си са едни и същи.
Описаният метод за изпитване е предназначен за откриване на дългосрочните вредни ефекти от вещество, в хода на азотната трансформация, при почви с аеробна повърхност. Методът за изпитване позволява също да се оценят ефектите от веществото при въглеродна трансформация, извършвана от почвената микрофлора. Образуването на нитрат се провежда последователно при разграждане на въглерод-азотните връзки. Следователно ако в третираните и контролните проби са установени равни стойности на образувания нитрат, много вероятно е постигането в най-висока степен на цялостното и пълно разграждане на въглерода. Избраният за изпитването субстрат (люцерна в прахообразна форма) е в предпочетено въглерод-азотно съотношение (обикновено между 12/1 и 16/1). Поради това по време на изпитването се ограничава въглеродното „гладуване“ и ако микробните общества се изменят вследствие на прилагането на химикал, те могат да се самовъзстановят в рамките на 100-дневен период от време.
Изпитванията, въз основа на които е разработен този метод, са предназначени предимно за вещества, за които може да се предположи количеството, до което почвата достига. Такъв е случаят например с продуктите за защита на зърнените култури, за които апликационното ниво е известно. За агрохимикали е достатъчно изпитване с две дози, съответстващо на очакваното или предполаганото апликационно ниво. Агрохимикалите могат да бъдат изпитвани като активни съставки (a.i.) или като получени продукти. Обаче изпитването не се ограничава до агрохимикали. Чрез промяна едновременно на количествата на изпитваното вещество, прилагано върху почвата, и на начина, по който се оценяват данните, изпитването може също да бъде приложено при химикали, за които е известно количеството, което се очаква почвата да достигне. По такъв начин се определят ефектите при азотна трансформация от сериите концентрации на химикали, които не са агрохимикали. Данните от тези изследвания се използват за изготвянето на кривата доза-отговор и за изчисляване на стойностите на ЕСх, където х е определеният в проценти ефект.
1.2. ОПРЕДЕЛЕНИЯ
Азотна трансформация: е пълното разграждане от микроорганизми на азот-съдържаща органична материя, през етапи на амонификация и нитрификация до образуване на съответния неорганичен краен продукт — нитрат.
ЕС
х
(ефективна концентрация): е концентрацията на изпитваното вещество в почвата, която води до х % задържане на трансформацията на азота до нитрат.
ЕС
50
(средна ефективна концентрация): е концентрацията на изпитваното вещество в почвата, която води до 50 процента (50 %) задържане на преобразуването на азота до нитрат.
1.3. РЕФЕРЕНТНИ ВЕЩЕСТВА
Няма.
1.4. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Пресятата почва се подправя с растителна храна в прахообразна форма и всяка проба се третира с изпитваното вещество или остава необработена с него (контрола). Ако се изпитва агрохимикал, се препоръчват минимум две концентрации за изпитване и те трябва да бъдат избрани във връзка с най-високата очаквана концентрация в тази област. След 0, 7, 14 и 28 дни от инкубирането пробите с третираните и контролните почви се екстрахират с подходящ разтворител и се определят количествата нитрат в екстрактите. Нивото на образувания нитрат в третираните проби се сравнява с нивото в контролите и се изчислява процентното отклонение в стойностите на третираните проби и контролите. Всички изпитвания траят поне 28 дни. Ако на 28-ия ден разликите между третираните и нетретираните почви са по-големи или равни на 25 %, измерванията продължават, но не по-дълго от 100 дни. Ако се изпитват агрохимикали, в почвените проби се добавят серия от концентрации на изпитваното вещество и след 28 инкубационни дни се измерват количествата на образувания нитрат в третираните и контролните проби. Резултатите от изпитванията с множество концентрации се анализират с използването на регресионен модел и се изчисляват стойностите на ЕСх (т.е. ЕС50, EC25 и/или ЕС10). Вж. определенията.
1.5. ВАЛИДИРАНЕ НА ИЗПИТВАНЕТО
Оценяването на резултатите от изпитването с агрохимикали се основава на относително малки разлики (т.е. средна стойност ± 25 %) между нитратните концентрации в контролните и третираните почвени проби, така че големи отклонения в контролите могат да доведат до погрешни резултати. Следователно отклонението между еднаквите контролни образци трябва да бъде по-малко от ± 15 %.
1.6. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
1.6.1. Апаратура
Използват се контейнери за изпитване, направени от химически инертен материал. Те трябва да бъдат с подходящ капацитет, в съответствие с използваната процедура за инкубиране на почви, т.е. инкубиране в насипно състояние или в серии от индивидуални почвени проби (вж. точка 1.7.1.2). Трябва да бъде обърнато внимание едновременно на минимизирането на водните загуби и на невъзпрепятстването на обмена на газове по време на изпитването (напр. изпитваните контейнери могат да бъдат покрити с перфорирано полиетиленово фолио). Когато се изпитват летливи вещества, трябва да бъдат използвани запечатващи се и газонепропускливи контейнери. Те трябва да бъдат с такъв размер, че приблизително една четвърт от техния обем да е пълна с почвената проба.
Използва се стандартно лабораторно оборудване, както следва:
|
—
|
разбъркващо/клатачно устройство: механична клатачка или еквивалентно оборудване;
|
|
—
|
центруфуга (3 000 g) или филтриращо устройство (използва се несъдържаща нитрати филтърна хартия);
|
|
—
|
инструмент с подходяща чувствителност и способност за възпроизводимост на нитратния анализ.
|
1.6.2. Избор и брой на почвените проби
Използва се една-единствена почвена проба. Препоръчва се почвата да има характеристики, както следва:
|
—
|
съдържание на пясък: не по-малко от 50 % и не повече от 75 %;
|
|
—
|
съдържание на органичен въглерод: 0,5—1,5 %;
|
|
—
|
микробната биомаса трябва да бъде измерена (8)(9) и нейното въглеродно съдържание трябва да бъде най-малко 1 % от общия органичен въглерод в почвата.
|
В повечето случаи почва с такива характеристики представлява случай на по-лоша ситуация и адсорбцията на изпитвания химикал е минимална, а наличността му в микрофлората е максимална. Следователно като цяло не е необходимо провеждането на изпитвания с други почви. Въпреки това при определени обстоятелства, напр. когато се очаква основно употребата на изпитваното вещество да е в определени почви, такива като кисели горски почви, или при електростатично заредени химикали, може да бъде необходимо да се използва допълнителна почвена проба.
1.6.3. Събиране и съхранение на почвени проби
1.6.3.1. Събиране
Трябва да има налична подробна историческа информация за мястото в полето, откъдето е взета почва за изпитване. Подробностите включват: точно местоположение, растителна покривка, дати на третиране с продукти за защита на зърнени култури, обработване с органични и неорганични торове, прибавяне на биологични материали или аварийни замърсявания. Избраното място за вземане на почва трябва да позволява дългосрочна употреба. Постоянни пасища, поля с годишно зърнени култури (с изключение на царевицата) или гъсто засети зелени торища са подходящи за вземане на проби. Избраните места за вземане на проби не трябва да са били третирани с продукти за защита на зърнените култури поне една година преди вземането на пробите. Също никакви органични торове не трябва да бъдат прилагани поне шест месеца преди това. Употребата на минерални торове е приемлива само когато, в съответствие с изискванията за зърнени култури, почвени проби не трябва да бъдат вземани поне три месеца след използването на такива торове. Използването на почва, третирана с торове с известна биолигична ефективност (напр. калциев цианамид), трябва да бъде избягвано.
Вземането на проби се избягва през или веднага след дълги (по-дълги от 30 дни) периоди на засушаване или валежи. Проби от разорани почви трябва да бъдат вземани на дълбочина от 0 до 20 cm. При зелени площи (пасища) или други почви, които не са били разоравани дълги периоди от време (поне един растежен сезон), максималната дълбочина за вземане на проби може да бъде малко повече от 20 cm (напр. до 25 cm).
Почвените проби трябва да се транспортират в контейнери при определена температура. Тези условия гарантират, че първоначалните свойства на почвата не са значително изменени.
1.6.3.2. Съхранение
Препоръчва се използването на прясно събрани почвени проби. Ако съхраняване в лабораторни условия не може да бъде избегнато, почвите могат да бъдат съхранявани на тъмно при 4 ± 2 oС в продължение максимум на три месеца. По време на съхраняването на почвите трябва да бъдат осигурени аеробни условия. Ако почвите са събрани от области, където са замръзнали през поне три месеца в годината, те могат да бъдат съхранени за шест месеца при температура от минус 18 oС до минус 22 oС. Микробната биомаса на съхраняваната почва се измерва преди всеки експеримент и съдържанието на въглерод в биомасата трябва да бъде поне 1 % от общото съдържание на органичен въглерод в почвата (вж. точка 1.6.2).
1.6.4. Обработване и подготовка на почвата преди изпитването
1.6.4.1. Предварителна инкубация
Ако почвата ще бъде съхранявана (вж. точки 1.6.3.2), се препоръчва предварителна инкубация през периода от 2-рия до 28-ия ден. Температурата и съдържанието на влага в почвата при предварителната инкубация трябва да бъдат подобни на използваните при изпитването (вж. точки 1.6.4.2 и 1.7.1.3).
1.6.4.2. Физикохимични характеристики
Почвата ръчно се почиства от големи предмети (напр. камъни, части от растения и др.) и тогава влагата се филтрира, без допълнително сушене, при размер на частиците, по-малък или равен на 2 mm. Съдържанието на влага в почвената проба трябва да бъде регулирано с дестилирана или дейонизирана вода до стойност между 40 % и 60 % от максималната способност за задържане на вода.
1.6.4.3. Изменение с органичен субстрат
Почвата трябва да бъде изменена (подобрена/захранена) с подходящ органичен субстрат, напр. люцерна-зелена трева (основен компонент: Medicago sativa) със съотношение C/N между 12/1 и 16/1. Препоръчваното съотношение люцерна : почва е 5 g люцерна за 1 kg почва (сухо тегло).
1.6.5. Подготовка на изпитваното вещество за прилагане в почвата
Изпитваното вещество обикновено се прилага чрез използване на носител. Носителят може да бъде вода (за водоразтворими вещества) или инертно твърдо вещество, като ситен кварцов пясък (размер на частиците: 0,1—0,5 mm). Употребата на течни носители, различни от вода (напр. органични разтворители, такива като ацетон, хлороформ), трябва да бъде избягвана, тъй като те могат да увредят микрофлората. Ако като носител се използва пясък, той може да бъде покрит с разтвореното или суспендирано в подходящ разтворител изпитвано вещество. В такива случаи разтворителят трябва чрез изпаряване да бъде отстранен преди смесването с почва. За оптимално разпространение на изпитваното вещество в почвата се препоръчва да се използва съотношение 10 g пясък на килограм почва (сухо тегло). Контролните проби се третират само с еквивалентни количества вода и/или кварцов пясък.
Когато се изпитват летливи химикали, трябва, доколкото е възможно, да бъдат избегнати загубите и експериментът трябва да бъде проведен при осигурено хомогенно разпределение в почвата (напр. изпитваното вещество трябва да бъде впръскано/вкарано в почвата на няколко места).
1.6.6. Изпитвани концентрации
Ако се изпитват агрохимикали, трябва да се използват поне две концентрации. По-ниската концентрация може да се отрази най-малко на максималното количество, което се очаква да достигне почвата при условията на експеримента, като се има предвид, че по-високата концентрация трябва да бъде кратна на по-ниската концентрация. Концентрациите на изпитваното вещество, добавяно към почвата, се изчисляват, като се приема, че има еднакво смесване в дълбочина от 5 cm и плътност на насипната почва 1,5. За агрохимикали, които се прилагат директно в почвата, или за химикали, за които може да бъде предвидено достигнатото количество в почвата, се препоръчва като изпитвани концентрации да се използват максимално предвижданите концентрации в околната среда (РЕС) и пет времена за концентрация. Веществата, които се очаква да бъдат прилагани в почвата неколкократно за един сезон, трябва да бъдат изпитвани при концентрации, получени от умножението на РЕС и очаквания максимален брой апликации. По-високата концентрация обаче не трябва да превишава с повече от десет пъти стойността на максималното еднократно прилагано ниво. Ако не се изпитват агрохимикали, се прилага геометрична серия от поне пет концентрации. Изпитваните концентрации трябва да покриват обхвата, нужен за определяне стойностите на ЕСх.
1.7. ПРЕДСТАВЯНЕ НА ИЗПИТВАНЕТО
1.7.1. Условия на експозиция
1.7.1.1. Третиране и контрол
Ако се изпитват агрохимикали, почвата се разделя на три части с еднаква маса. Двете части се смесват с носителя, съдържащ продукта, а другата част се смесва с носителя, който не съдържа продукта (контрола). Препоръчва се използването на минимум три реплики на двете третирани и нетретираната почвена проба. Ако не се изпитват агрохимикали, почвата се разделя на шест части с еднаква маса. Пет от пробите се смесват с носителя, съдържащ изпитваното вещество, а шестата проба се изпитва с носителя, несъдържащ химикала. Препоръчва се използването на минимум три реплики на двете третирани проби и контролата. Трябва да се обърне внимание на осигуряването на хомогенно разпределение на изпитваното вещество в третираните почвени проби. По време на смесването трябва да бъде избягвано сбиването или кълбообразното натрупване на почвата.
1.7.1.2. Инкубация на почвени проби
Инкубация на почвените проби може да бъде извършена по два начина: като насипни проби от всяка третирана и нетретирана почва или като серия от индивидуални и с еднаква маса подпроби от всяка третирана и нетретирана почва. Когато обаче се изпитват летливи вещества, се извършва изпитване само със серия от индивидуални подпроби. Когато се инкубират почви в насипно количество, се приготвят големи количества от всички третирани и нетретирани почви и за подпробите, които ще се анализират, се взема такова количество, каквото е необходимо за провеждане на изпитването. Първоначално приготвеното количество за всяко третиране и контрола зависи от големината на подпробите, броя на използваните при анализа реплики и максималния очакван брой на времената за изпитване. Почвите, които се инкубират в насипно количество, трябва да бъдат напълно смесени (хомогенизирани) преди отделянето на подпробите. Когато почвите се инкубират като серия от индивидуални почвени проби, всяка третирана или нетретирана почвена проба в насипно количество се разделя на необходимия брой подпроби и те се използват, както е необходимо. При експериментите, при които се очакват повече от две времена на изпитване, трябва да бъдат приготвени достатъчно подпроби, за да бъдат отчетени всички реплики и всички времена на изпитване. Поне три повтарящи се проби (реплики) трябва да бъдат инкубирани при аеробни условия (вж. точка 1.7.1.1). По време на всички изпитвания трябва да бъдат използвани подходящи контейнери с достатъчно пространство в горния си край, за да се избегне възникването на анаеробни условия. Когато се изпитват летливи вещества, изпитването трябва да бъде проведено само при серия индивидуални подпроби.
1.7.1.3. Условия и продължителност на изпитването
Изпитването се провежда на тъмно при стайна температура 20 ± 2 oС. Съдържанието на влага в почвените образци трябва да бъде поддържано по време на изпитването между 40 % и 60 % от максималната способност на почвата да задържа вода (вж. точка 1.6.4.2) в обхвата ± 5 %. Добавя се дестилирана, дейонизирана вода, ако е необходимо.
Минималната продължителност на изпитванията е 28 дни. Ако се изпитват агрохимикали, стойностите на образувания нитрат в третираните и контролните проби се сравняват. Ако те се различават с повече от 25 % на 28-ия ден, изпитването продължава, докато се получи разлика, равна или по-малка от 25 %, или за максимум 100 дни, която е по-малка. Ако не се изпитват агрохимикали, изпитването завършва след 28 дни. На 28-ия ден се определят количествата на нитрата в третираните и контролните почвени проби и се изчисляват стойностите на ЕСх.
1.7.2. Вземане на проби и анализ на почви
1.7.2.1. Схема за вземане на почвени проби
Ако се изпитват агрохимикали, почвените проби се анализират за нитрат в ден 0 и през 7-ия, 14-ия и 28-ия ден. Ако е необходимо удължаване на изпитването, трябва да бъдат направени допълнителни измервания през 14-дневни интервали след 28-ия ден.
Ако не се изпитват агрохимикали, се използват поне пет изпитвани концентрации и почвените проби се анализират за нитрати в началото (ден 0) и в края на периода на експозиция (28 дни). Може да бъде направено внезапно измерване, напр. през 7-ия ден, ако изглежда необходимо. Данните, получени на 28-ия ден, се използват за определяне стойността на ЕСх за химикала. При желание данните от ден 0 на контролните проби също могат да бъдат използвани за оценяване на първоначалното количество на нитрата в почвата.
1.7.2.2. Анализ на почвените проби
Количеството на образувания нитрат се определя за всяка третирана и контролна реплика за времето на всяка проба. Нитратът се екстрахира от почвата чрез разклащане на пробите и подходящия екстрахиращ разтворител, напр. 0,1 Μ разтвор на калиев хлорид. Препоръчва се количество от 5 ml разтвор на КСl на грам сухо тегло почвен еквивалент. За оптимално екстрахиране контейнерите, в които се намират почвата и екстрахиращият разтвор, трябва да не бъдат по-пълни от половината им обем. Смесите се разклащат при 150 rpm в продължение на 60 минути. После смесите се центрофугират или филтрират и течните фази се анализират за нитрат. Течните екстракти, освободени от твърди частици, могат да бъдат съхранявани преди анализ при минус 20 ± 5 oС за период до шест месеца.
2. ДАННИ
2.1. ОБРАБОТВАНЕ НА РЕЗУЛТАТИТЕ
Ако се изпитват агрохимикали, образуваният нитрат трябва да бъде записан за всяка повтаряща се почвена проба (реплика), а средните стойности от всички реплики трябва да бъдат представени в таблична форма. Стойностите на азотната трансформация трябва да бъдат оценявани чрез подходящи и общоприети статистически методи (напр. F-метод, 5 % ниво на значимост). Количествата на образувания нитрат се изразяват в mg нитрат/kg сухо тегло почва/ден. Стойността на получения нитрат при всяко третиране се сравнява с това на контролата и се изчислява процентното отклонение от контролата.
Ако изпитванията не са проведени с агрохимикали, количеството на образувания нитрат се определя за всяка реплика и се изготвя крива доза-отговор за оценка на стойностите на ЕСх. Количествата на нитрата (т.е. mg нитрат/kg сухо тегло почва), открити в третираните проби след 28 дни, се сравняват с тези в контролите. От тези данни се изчисляват процентните стойности на задържане за всяка изпитана концентрация. Тези проценти се разпределят спрямо концентрацията и се използват статистически процедури за изчисляване на стойностите на ЕСх. Доверителните интервали (р = 0,95) за изчислените ЕСх също се определят чрез използване на стандартни процедури (10) (11) (12).
Изпитвани вещества, които съдържат големи количества азот, могат да подпомогнат получаването на количествата нитрат по време на изпитването. Ако тези вещества се изпитват при висока концентрация (напр. химикали, които се очаква да бъдат използвани при повтарящи се апликации), в изпитването трябва да бъдат включени и подходящи контроли (т.е. почва плюс изпитвано вещество, но без растителна храна). Данните от тези контроли трябва да бъдат използвани при изчисленията на ЕСх.
2.2. ИНТЕРПРЕТИРАНЕ НА РЕЗУЛТАТИТЕ
При оценяване на резултатите от изпитванията с агрохимикали, когато разликата в стойностите на образувания нитрат при по-слабото третиране (т.е. максималната предвиждана концентрация) и контрола е по-малка или равна на 25 % по всяко време на проби след 28-ия ден, продуктът може да бъде оценен като такъв, който няма дълготрайно влияние върху азотната трансформация в почвите. Когато се оценяват резултати от изпитвания с химикали, различни от агрохимикалите, се използват стойностите на ЕС50, EC25 и/или ЕС10.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
Протоколът от изпитването трябва да съдържа следната информация:
|
|
Пълно идентифициране на използваната почва, което включва:
|
—
|
географско положение на мястото (географска ширина, географска дължина);
|
|
—
|
историческа информация за мястото (т.е. покриваща растителност, третиране с продукти за защита на зърнените култури, третиране с торове, аварийно замърсяване и др.);
|
|
—
|
използвани образци (напр. земеделска почва, гора и др.);
|
|
—
|
дълбочина на вземане на пробата (cm);
|
|
—
|
съдържание на пясък/тиня/глина ( % сухо тегло);
|
|
—
|
съдържание на органичен въглерод ( % сухо тегло);
|
|
—
|
съдържание на азот ( % сухо тегло);
|
|
—
|
начална нитратна концентрация (mg нитрат/kg сухо тегло);
|
|
—
|
способност за катионен обмен (mmol/kg);
|
|
—
|
—микробиална биомаса в процентно съотношение с общия органичен въглерод;
|
|
—
|
референции на използваните методи за определянето на всеки параметър;
|
|
—
|
цялата информация, свързана със събирането и съхранението на почвени проби;
|
|
—
|
подробности за предварителната инкубация на почвата, ако има.
|
|
|
|
Изпитвано вещество:
|
—
|
физична природа и, където е подходящо, физикохимични свойства;
|
|
—
|
данни за идентичността на химикала, където е подходящо, включително структурна формула, чистота (т.е. за продукти за защита на зърнени култури – процентът на активната съставка), съдържание на азот.
|
|
|
|
Субстрат:
|
—
|
състав (т.е. люцерна, люцерна-зелена трева);
|
|
—
|
съдържание на азот и въглерод ( % сухо тегло);
|
|
|
|
Условия на изпитването:
|
—
|
подробности за изменението на почвата с органичен субстрат;
|
|
—
|
брой на използваните концентрации на изпитваното вещество и, където е подходящо, обосноваване на избраните концентрации;
|
|
—
|
подробности около апликирането на изпитваното вещество в почвата;
|
|
—
|
инкубационна температура;
|
|
—
|
съдържание на влага в почвата при започване и по време на изпитването;
|
|
—
|
метод на инкубация на използваната почва (т.е. в насипно количество или като серия от индивидуални почвени подпроби);
|
|
—
|
брой на репликите (повтарящи се почвени проби);
|
|
—
|
времена при вземане на пробите;
|
|
—
|
използван метод за екстрахиране на нитрата от почвата.
|
|
|
|
Резултати:
|
—
|
аналитична процедура и оборудване, използвани при анализа на нитрата;
|
|
—
|
таблични данни, включващи индивидуални и средни стойности от измерванията на нитрата;
|
|
—
|
отклонения между репликите в третираните и контролните проби;
|
|
—
|
обяснения на направените корекции в изчисленията, ако е подходящо;
|
|
—
|
процентни отклонения в стойностите на образувания нитрат за времето на всяка проби или, ако е подходящо, ЕС50 с 95 % потвърдено ограничение, други ЕСх (т.е. ЕС25 или ЕС10) с доверителни интервали, и графика на кривата доза-отговор;
|
|
—
|
статистическо обработване на резултатите;
|
|
—
|
пялата информация и наблюдения, подпомагащи интерпретирането на резултатите.
|
|
4. ПРЕПРАТКИ
|
(1)
|
EPPO (1994). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Chemicals. Chapter 7: Soil Microflora. EPPO Bulletin 24: 1—16, 1994.
|
|
(2)
|
BBA (1990). Effects on the Activity of the Soil Microflora. BBA Guidelines for the Official Testing of Plant Protection Products, VI, 1—1 (2nd eds., 1990).
|
|
(3)
|
EPA (1987). Soil Microbial Community Toxicity Test. EPA 40 CFR Part 797.3700. Toxic Substances Control Act Test Guidelines; Proposed rule. September 28, 1987.
|
|
(4)
|
SETAC-Europe (1995). Procedures for assessing the environmental fate and ecotoxicity of pesticides, Ed. M. R. Lynch, Pub. SETAC-Europe, Bruxelles.
|
|
(5)
|
ISO/DIS 14238 (1995). Soil Quality — Determination of Nitrogen Mineralisation and Nitrification in Soils and the Influence of Chemicals on these Processes. Technical Committee ISO/TC 190/SC 4: Soil Quality — Biological Methods.
|
|
(6)
|
OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments, Belgirate, Italie, 18-20 janvier 1995.
|
|
(7)
|
ISO 10381-6 (1993). Soil quality — Sampling. Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory.
|
|
(8)
|
ISO 14240-1 (1997). Soil quality — Determination of soil microbial biomass — Part 1: Substrateinduced respiration method.
|
|
(9)
|
ISO 14240-2 (1997). Soil quality — Determination of soil microbial biomass — Part 2: Fumigationextraction method.
|
|
(10)
|
Litchfield, J. T. and Wilcoxon F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, 99-113.
|
|
(11)
|
Finney, D. J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New-York.
|
|
(12)
|
Finney, D. J. (1978). Statistical Methods in biological Assay.Griffin, Weycombe, UK.
|
В.22. ПОЧВЕНИ МИКРООРГАНИЗМИ: ИЗПИТВАНЕ НА ВЪГЛЕРОДНАТА ТРАНСФОРМАЦИЯ
1. МЕТОД
Този метод е идентичен с ОECD TG 217 (2000).
1.1. ВЪВЕДЕНИЕ
Методът за изпитване представлява предназначен за лабораторни анализи метод за обследване на дългосрочните потенциални ефекти от еднократна експозиция на продуктите за защита на зърнените култури и други възможни химикали при преобразуването на въглерода от почвените микроорганизми. Изпитването принципно се основава на Препоръките на Европейската и Средиземноморската организация за защита на растенията (1). Други насоки обаче, включително тези на Немският национален биологичен институт (2), Американската агенция за защита на околната среда (3) и SETAC (4), също може да бъдат взети предвид. Семинарът на ОИСР за избор на почви/седименти, проведен в Belgirate, Италия, през 1995 г. (5), приема броя и вида на почвите, използвани при това изпитване. Препоръките за събиране, обработване и съхранение на почвената проба се основават на Ръководството на ISO (6) и препоръките от семинара в Belgirate.
За междинните и окончателната оценка на токсичните характеристики на изпитваните вещества може да бъде изискано определянето на ефектите върху микробната активност на почвата, напр. когато се изискват данни за потенциалната големина на ефектите върху почвената микрофлора от продуктите за защита на зърнените култури или когато се очаква експозиция на почвените микроорганизми от химикали, които не са продукти за защита на зърнени култури. Изпитването за въглеродна трансформация се провежда, за да се определят ефектите от такива химикали върху почвената микрофлора. Ако се изпитват агрохимикали (напр. продукти за защита на зърнените култури, торове, химикали за защита на горите), се провеждат едновременно азотна и въглеродна трансформация. Ако не се изпитват агрохимикали, достатъчно е изпитването за азотна трансформация. Ако обаче стойностите на ЕС50 на такива химикали при изпитването на азотната трансформация са в обхвата на наличните в естествено състояние (натуралните) нитрификационни инхибитори (напр. нитрапирин), трябва да бъде проведено и изпитване на въглеродната трансформация, за да се събере повече информация.
Почвите се състоят от живи и неживи компоненти, които съществуват в комплексни хетерогенни смеси. Микроорганизмите играят важна роля в разграждането и трансформирането на органичната материя в наторените почви, като различните видове способстват по различен начин за почвеното плодородие. Всяко дългосрочно влияние при тези биохимични процеси по всяка вероятност може да окаже влияние на цикъла на хранене, а това би могло да измени плодородието на почвата. Във всички плодородни почви се извършват трансформации на азота и въглерода. Въпреки че микробните съобщества в различните почви отговарят различно на тези процеси, начините на трансформация в основата си са едни и същи.
Този метод за изпитване е предназначен за откриване на дългосрочните вредни ефекти от вещество в хода на въглеродна трансформация при почви с аеробна повърхност. Методът е чувствителен към промени в размера и активността на микробните съобщества, отговорни за въглеродната трансформация, тъй като тези съобщества са зависими едновременно от въздействието на химикала и от въглеродно „гладуване“. Използва се пясъчна почва с ниско съдържание на органична материя. Тази почва се третира с изпитваното вещество и се инкубира при условия, позволяващи бърз микробен метаболизъм. При тези условия източниците на леснодостъпен въглерод в почвата бързо се изчерпват. Това причинява въглеродното „гладуване“, което едновременно убива микробните клетки и предизвиква латентност (летаргия) и/или спорообразуване. Ако изпитването продължи повече от 28 дни, сумата от тези реакции може да бъде измерена в (нетретирана почва) контроли като прогресивна загуба на метаболично активната микробна биомаса (7). Ако биомасата във въглеродно трансформираните почви, при условията на провеждане на експеримента, се влияе от присъствието на химикал, тя не може да бъде върната за използване на същото ниво като контрола. Следователно смущенията, причинени от изпитваното вещество във всеки един момент от време през периода на провеждане на експеримента, често продължават до края на изпитването.
Изпитванията, въз основа на които е разработен този метод, са били предназначени предимно за вещества, за които може да се предположи количеството, до което почвата достига.Такъв е случаят, например, с продуктите за защита на зърнените култури, за които е известно апликационното ниво. За агрохимикали е достатъчно изпитване с две дози, съответстващо на очакваното или предполаганото апликационно ниво. Агрохимикалите могат да бъдат изпитвани като активни съставки (a.i.) или като получени (крайни) продукти. Обаче изпитването не се ограничава до химикали с предвидими концентрации в околната среда. Чрез промяна едновременно на количествата на изпитваното вещество, прилагано върху почвата, и на начина, по който се оценяват данните, изпитването може също да бъде приложено при химикали, за които не е известно количеството, което се очаква почвата да достигне. По такъв начин се определят ефектите от въглеродна трансформация при серия концентрации на химикали, които не са агрохимикали. Данните от тези изследвания се използват за изготвянето на кривата доза-отговор и за изчисляване на стойностите на ЕСх, където х е определения в проценти ефект.
1.2. ОПРЕДЕЛЕНИЯ
Въглеродна трансформация: е микроорганичното разграждане на органична материя до образуване на неорганичния краен продукт въглероден диоксид.
ЕС
х
(ефективна концентрация): е концентрацията на изпитваното вещество в почвата, която води до х % задържане на преобразуването на въглерода във въглероден диоксид.
ЕС
50
(средна ефективна концентрация): е концентрацията на изпитваното вещество в почвата, която води до 50 % задържане на преобразуването на въглерода във въглероден диоксид.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
Няма.
1.4. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Пресятата почва или се третира с изпитваното вещество, или остава нетретирана (контрола). Ако се изпитват агрохимикали, се препоръчват минимум две концентрации за изпитване и те трябва да бъдат избрани във връзка с най-високата очаквана концентрация в тази област. След 0, 7, 14 и 28 дни от инкубирането пробите с третираните и контролните почви се смесват с глюкоза и се измерват нивата на глюкозно предизвиканата респирация за 12-часов непрекъснат интервал от време. Респираторните нива се изразяват като отделен въглероден диоксид (mg въглероден диоксид/kg суха почва/h) или погълнат кислород (mg кислород/kg почва/h). Средното респираторно ниво в третираните почвени проби се сравнява с това в контролите и се изчислява процентното отклонение в нивото на третираните проби и контролите. Всички изпитвания траят поне 28 дни. Ако на 28-ия ден разликите между третираните и нетретираните почви са по-големи или равни на 25 %, измерванията продължават на 14-дневни интервали в продължение на максимум 100 дни. Ако се изпитват химикали, които не са агрохимикали, в почвените проби се добавят серия от концентрации на изпитваното вещество и след 28 инкубационни дни се измерват нивата на глюкозно предизвиканата респирация (т.е. средно количествата на образувания въглероден диоксид или погълнатия кислород). Резултатите от изпитванията със сериите от концентрации се анализират чрез използване на регресионен модел и се изчисляват стойностите на ЕСх (т.е. ЕС50, ЕС25 и/или ЕС10). Вж. определенията.
1.5 .ВАЛИДИРАНЕ НА ИЗПИТВАНЕТО
Оценяването на резултатите от изпитването с агрохимикали се основава на относително малки разлики (т.е. средна стойност ± 25 %) между отделяния въглероден диоксид или погълнатия кислород във (или чрез) контролните и третираните почвени проби, така че големи отклонения в контролите могат да доведат до погрешни резултати. Следователно отклонението между еднаквите контролни образци трябва да бъде по-малко от ± 15 %.
1.6. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
1.6.1. Апаратура
Използват се контейнери за изпитване, направени от химически инертен материал. Те трябва да бъдат с подходящ капацитет, в съответствие с използваната процедура за инкубиране на почви, т.е. инкубиране в насипно състояние или в серии от индивидуални почвени проби (вж. точка 1.7.1.2). Трябва да бъде обърнато внимание едновременно на минимизирането на водните загуби и на невъзпрепятствания обмен на газове по време на изпитването (напр. изпитваните контейнери могат да бъдат покрити с перфорирано полиетиленово фолио). Когато се изпитват летливи вещества, трябва да бъдат използвани запечатващи се и газонепропускливи контейнери. Те трябва да бъдат с такъв размер, че приблизително една четвърт от техния обем да е пълна с почвената проба.
За определяне на глюкозно предизвиканата респирация са необходими инкубационна система и инструменти за измерване производството на въглероден диоксид или консумацията на кислород. Примери за такива системи и инструменти могат да бъдат намерени в препратки (8) (9) (10) (11).
1.6.2. Избор и брой на почвените проби
Използва се една-единствена почвена проба. Препоръчва се почвата да има характеристики, както следва:
|
—
|
съдържание на пясък: не по-малко от 50 % и не повече от 75 %;
|
|
—
|
съдържание на органичен въглерод: 0,5—1,5 %;
|
|
—
|
микробната биомаса трябва да бъде измерена (12) (13) и нейното въглеродно съдържание трябва да бъде поне 1 % от общия органичен въглерод в почвата.
|
В повечето случаи почва с такива характеристики представлява по-лоша ситуация и адсорбцията на изпитвания химикал е минимална, а наличността му в микрофлората е максимално. Следователно като цяло не е необходимо провеждането на изпитвания с други почви. Въпреки това при определени обстоятелства, напр. когато се очаква основно употребата на изпитваното вещество да е в определени почви, такива като кисели горски почви или при електростатично заредени химикали, може да бъде необходимо да се замени с допълнителна почвена проба.
1.6.3. Събиране и съхранение на почвени проби
1.6.3.1. Събиране
Трябва да има налична подробна историческа информация за мястото в полето, откъдето е взета почва за изпитване. Подробностите включват: точно местоположение, растителна покривка, дати на третиране с продукти за защита на зърнени култури, обработване с органични и неорганични торове, прибавяне на биологични материали или аварийни замурсявания. Избраното място за вземане на почва трябва да позволява дългосрочна употреба. Постоянни пасища, поля с годишни зърнени култури (с изключение на царевицата) или гъсто засети зелени торища са подходящи за вземане на проби. Избраните места за вземане на проби не трябва да са били третирани с продукти за защита на зърнените култури поне една година преди вземането на пробите. Също така никакви органични торове не трябва да бъдат прилагани поне шест месеца преди това. Употребата на минерални торове е приемлива само когато, в съответствие с изискванията за зърнени култури, почвени проби не трябва да бъдат вземани поне три месеца след използването на такива торове. Използването на почва, третирана с торове с известна биологична ефективност (напр. калциев цианамид), трябва да бъде избягвано.
Вземането на проби се избягва през или веднага след дълги (по-дълги от 30 дни) периоди на засушаване или валежи. Проби от разорани почви трябва да бъдат вземани на дълбочина от 0 до 20 cm. При зелени площи (пасища) или други почви, които не са били разоравани дълги периоди от време (поне един растежен сезон), максималната дълбочина за вземане на проби може да бъде малко повече от 20 cm (напр. до 25 cm). Почвените проби трябва да се транспортират в контейнери при определена температура. Тези условия гарантират, че първоначалните свойства на почвата не са значително изменени.
1.6.3.2. Съхранение
Препоръчва се използването на прясно събрани почвени проби. Ако съхраняване в лабораторни условия не може да бъде избегнато, почвите могат да бъдат съхранявани на тъмно при 4 ± 2 oС в продължение максимум на три месеца. По време на съхраняването на почвите, трябва да бъдат осигурени аеробни условия. Ако почвите са събрани от области, където са замръзнали през поне три месеца в годината, те могат да бъдат съхранени за шест месеца при минус 18 oС. Микробната биомаса на съхраняваната почва се измерва, преди всеки експеримент и съдържанието на въглерод в биомасата трябва да бъде поне 1 % от общото съдържание на органичен въглерод в почвата (вж. точка 1.6.2).
1.6.4. Обработване и подготовка на почвата преди изпитването
1.6.4.1. Предварителна инкубация
Ако почвата ще бъде съхранявана (вж. точки 1.6.4.2 и 1.7.1.3), се препоръчва предварителна инкубация през периода от 2-рия до 28-ия ден. Температурата и съдържанието на влага в почвата при предварителната инкубация трябва да бъдат подобни на използваните при изпитването (вж. точки 1.6.4.2 и 1.7.1.3).
1.6.4.2. Физикохимични характеристики
Почвата ръчно се почиства от големи предмети (напр. камъни, части от растения и др.) и тогава влагата се филтрира, без допълнително сушене, при размер на частиците, по-малък или равен на 2 mm. Съдържанието на влага в почвената проба трябва да бъде регулирано с дестилирана или дейонизирана вода до стойност между 40 % и 60 % от максималната способност за задържане на вода.
1.6.5. Подготовка на изпитваното вещество за прилагане в почвата
Изпитваното вещество обикновено се прилага чрез използване на носител. Носителят може да бъде вода (за водоразтворими вещества) или инертно твърдо вещество, като фин кварцов пясък (размер на частиците: 0,1—0,5 mm). Употребата на течни носители, различни от вода (напр. органични разтворители, такива като ацетон, хлороформ), трябва да бъде избягвана, тъй като те могат да увредят микрофлората. Ако като носител са използва пясък, той може да бъде покрит с разтвореното или суспендирано в подходящ разтворител изпитвано вещество. В такива случаи разтворителят трябва да бъде отстранен чрез изпаряване преди смесването с почва. За оптимално разпределение на изпитваното вещество в почвата се препоръчва да се използва съотношение 10 g пясък на килограм почва (сухо тегло). Контролните проби се третират само с еквивалентни количества вода и/или кварцов пясък.
Когато се изпитват летливи химикали, при провеждането на експеримента трябва да бъдат избегнати загубите и експериментът трябва да бъде проведен при осигурено хомогенно разпределение в почвата (напр. изпитваното вещество трябва да бъде впръскано/вкарано в почвата на няколко места).
1.6.6. Изпитвани концентрации
Ако се изпитват агрохимикали или други химикали с предвидими концентрации в околната среда, трябва да се използват поне две концентрации. Трябва да се въздейства с по-ниската концентрация. По-ниската концентрация рефлектира най-малко на максималното количество, което се очаква да достигне почвата при условията на експеримента, като се има предвид, че по-високата концентрация трябва да бъде кратна на по-ниската концентрация. Концентрациите на изпитваното вещество, добавяно към почвата, се изчисляват, като се приема, че има еднакво смесване в дълбочина от 5 cm и плътност на насипната почва 1,5. За агрохимикали, които се прилагат директно в почвата, или за химикали, за които може да бъде предвидено достигнатото количество в почвата, се препоръчва като изпитвани концентрации да се използват максимално предвижданите концентрации в околната среда (РЕС) и пет времена за концентрация. Веществата, които се очаква да бъдат прилагани в почвата неколкократно за един сезон, трябва да бъдат изпитвани при концентрации, получени от умножението на РЕС и очаквания максимален брой апликации. По-високата концентрация обаче не трябва да превишава с повече от десет пъти стойността на максималното еднократно прилагано ниво.
Ако не се изпитват агрохимикали, се използват геометрични серии от поне пет концентрации. Изпитваните концентрации трябва да покриват обхвата, необходим за определянето на стойностите на ЕСх.
1.7. ПРОВЕЖДАНЕ НА ИЗПИТВАНЕТО
1.7.1. Условия на експозиция
1.7.1.1. Третиране и контрол
Ако се изпитват агрохимикали, почвата се разделя на три части с еднаква маса. Двете части се смесват с носителя, съдържащ продукта, а другата част се смесва с носителя, който не съдържа продукта (контрола). Препоръчва се използването на минимум три реплики на двете третирани и нетретираната почвена проба. Ако не се изпитват агрохимикали, почвата се разделя на шест части с еднаква маса. Пет от пробите се смесват с носителя, съдържащ изпитваното вещество, а шестата проба се изпитва с носителя, не съдържащ химикала. Препоръчва се използването на минимум три реплики на двете третирани проби и контролата. Трябва да се обърне внимание на осигуряването на хомогенно разпределение на изпитваното вещество в третираните почвени проби. По време на смесването трябва да бъде избягвано сбиването или кълбообразното натрупване на почвата.
1.7.1.2. Инкубация на почвени проби
Инкубация на почвените проби може да бъде извършена по два начина: като насипни проби от всяка третирана и нетретирана почва или като серия от индивидуални и с еднаква маса подпроби от всяка третирана и нетретирана почва. Когато обаче се изпитват летливи вещества, се извършва изпитване само със серия от индивидуални подпроби. Когато се инкубират почви в насипно количество, се приготвят големи количества от всички третирани и нетретирани почви и за подпробите, които ще се анализират, се взема такова количество, каквото е необходимо за провеждане на изпитването. Първоначално приготвеното количество за всяко третиране и контрола зависи от големината на подпробите, броя на използваните при анализа реплики и максималния очакван брой на времената за изпитване. Почвите, които се инкубират в насипно количество, трябва да бъдат напълно смесени (хомогенизирани) преди отделянето на подпробите. Когато почвите се инкубират като серия от индивидуални почвени проби, всяка третирана или нетретирана почвена проба в насипно количество се разделя на необходимия брой подпроби и те се използват, както е необходимо. При експериментите, при които се очакват повече от две времена на изпитване, трябва да бъдат приготвени достатъчно подпроби, за да бъдат отчетени всички реплики и всички времена на изпитване. Поне три повтарящи се проби (реплики) трябва да бъдат инкубирани при аеробни условия (вж. точка 1.7.1.1). По време на всички изпитвания трябва да бъдат използвани подходящи контейнери с достатъчно пространство в горния си край, за да се избегне възникването на анаеробни условия. Когато се изпитват летливи вещества, изпитването трябва да бъде проведено само при серия индивидуални подпроби.
1.7.1.3. Условия и продължителност на изпитването
Изпитването се провежда на тъмно при стайна температура 20 + 2 oС. Съдържанието на влага в почвените образци трябва да бъде поддържано по време на изпитването между 40 % и 60 % от максималната способност на почвата да задържа вода (вж. точка 1.6.4.2) в обхвата ± 5 %. Добавя се дестилирана дейонизирана вода, ако е необходимо. Минималната продължителност на изпитванията е 28 дни.
Ако се изпитват агрохимикали, количествата на отделения въглероден диоксид или на погълнатия кислород в третираните и контролните проби се сравняват. Ако те се различават с повече от 25 % на 28-ия ден, изпитването продължава, докато се получи разлика, равна или по-малка от 25 %, или за максимум 100 дни, която е по-малка. Ако не се изпитват агрохимикали, изпитването завършва след 28-ия ден. На 28-ия ден се определя количеството на отделения въглероден диоксид или на погълнатия кислород в третираните и контролните почвени проби и се изчисляват стойностите на ЕСх.
1.7.2. Вземане на проби и анализ на почви
1.7.2.1. Схема за вземане на почвени проби
Ако се изпитват агрохимикали, почвените проби се анализират за нива на глюкозно предизвиканата респирация през деня 0, 7-ия, 14-ия и 28-ия ден. Ако е необходимо удължаване на изпитването, трябва да бъдат направени допълнителни измервания през 14-дневни интервали след 28-ия ден.
Ако не се изпитват агрохимикали, се използват поне пет изпитвани концентрации и почвените проби се анализират за глюкозно предизвикана респирация в началото (ден 0) и в края на периода на експозиция (28 дни). Може да бъде направено внезапно измерване, напр. през 7-ия ден, ако изглежда необходимо. Данните, получени на 28-ия ден, се използват за определяне стойността на ЕСх за химикала. Ако желаете, данните от ден 0 на контролните проби също могат да бъдат използвани за оценяване на първоначалното количество на метаболично-активната микробиална биомаса в почвата (12).
1.7.2.2. Измерване на нивата на глюкозно- предизвиканата респирация
Ниво на глюкозно предизвиканата респирация се определя за всяка третирана и контролна реплика за всяко време на всяка проба. Почвените проби се смесват с допълнително количество глюкоза, за да се предизвика незабавен максимален респираторен отговор. Количеството глюкоза, необходимо за предизвикването на максимален респираторен отговор от дадена почва, може да бъде определено при предварителни изпитвания чрез използването на серия глюкозни концентрации (14). Въпреки това при пясъчни почви с 0,5—1,5 % органичен въглерод, от 2 000 mg до 4 000 mg глюкоза за kg сухо тегло почва, определено са достатъчни. Глюкозата може да бъде стрита на пудра с чист кварцов пясък (10 g пясък/kg сухо тегло почва) и хомогенно смесена с почва.
Изменените с глюкозата почвени проби са инкубирани в подходяща апаратура за продължително измерване на респираторните нива на всеки час или на всеки два часа (вж. точка 1.6.1) при 20 ± 2 oС. Отделянето на въглероден диоксид или поглъщането на кислород се измерва в продължение на 12 поредни часа и измерванията трябва да започнат колкото е възможно по-рано, т.е. в рамките на 1 до 2 часа след прибавянето на глюкозата. Общото количество на отделения въглероден диоксид или погълнатият кислород през тези 12 часа се измерва и се определят средните респираторни нива.
2. ДАННИ
2.1. ОБРАБОТВАНЕ НА РЕЗУЛТАТИТЕ
Ако се изпитват агрохимикали, отделяният въглероден диоксид или поглъщаният кислород се записват за всяка повтаряща се почвена проба (реплика), а средните стойности на всички реплики трябва да бъдат представени в таблична форма. Резултатите трябва да бъдат оценявани чрез подходящи и общоприемливи статистически методи (напр. F-тест, 5 % ниво на значимост). Нивата на глюкозно предизвиканата респирация се изразяват в mg въглероден диоксид/kg сухо тегло почва/h или mg кислород/сухо тегло почва/h. Средното ниво на образувания въглероден диоксид или средното ниво на погълнатия кислород при всяко третиране се сравнява с това на контролата и се изчислява процентното отклонение от контролата.
Ако изпитванията не са проведени с агрохимикали, количеството на отделения въглероден диоксид или на погълнатия кислород се определя за всяка реплика и се изготвя крива доза-отговор за оценка на стойностите на ЕСх. Нивата на глюкозно предизвиканата респирация (т.е. mg въглероден диоксид/kg сухо тегло почва/h или mg кислород/сухо тегло почва/h), открити в третираните проби след 28 дни, се сравняват с тези, открити в контролите. От тези данни се изчисляват процентните стойности на задържане за всяка изпитана концентрация. Тези проценти се разпределят спрямо концентрацията и се използват статистически процедури за изчисляване на стойностите на ЕСх. Доверителните интервали (р = 0,95) за изчислените ЕСх също се определят чрез използване на стандартни процедури (15) (16) (17).
2.2. ИНТЕРПРЕТИРАНЕ НА РЕЗУЛТАТИТЕ
При оценяване на резултатите от изпитванията с агрохимикали, когато разликата в респираторните нива между по-слабото третиране (т.е. максималната предвиждана концентрация) и контролата е по-малка или равна на 25 % по всяко време за вземане на проби след 28-ия ден, продуктът може да бъде оценен като такъв, който няма дълготрайно влияние върху преобразуването на въглерода в почвите. Когато се оценяват резултати от изпитвания с химикали, различни от агрохимикалите, се използват стойностите на ЕС50, EC25 и/или ЕС10.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Протоколът от изпитването трябва да съдържа следната информация:
|
|
Пълно идентифициране на използваната почва, което включва:
|
—
|
географско положение на мястото (географска ширина, географска дължина);
|
|
—
|
историческа информация за мястото (т.е. покриваща растителност, третиране с продукти за защита на зърнените култури, третиране с торове, аварийно замърсяване и др.);
|
|
—
|
употреба на образци (напр. земеделска почва, гора и др.);
|
|
—
|
дълбочина на вземане на пробата (cm);
|
|
—
|
съдържание на пясък/тиня/глина ( % сухо тегло);
|
|
—
|
съдържание на органичен въглерод ( % сухо тегло);
|
|
—
|
съдържание на азот ( % сухо тегло);
|
|
—
|
способност за катионен обмен (mmol/kg);
|
|
—
|
начална микробна биомаса в процентно съотношение с общия органичен въглерод;
|
|
—
|
референции на използваните методи за определянето на всеки параметър;
|
|
—
|
цялата информация, свързана със събирането и съхранението на почвени проби;
|
|
—
|
подробности за предварителната инкубация на почвата, ако има.
|
|
|
|
Изпитвано вещество:
|
—
|
физична природа и, където е подходящо, физикохимични свойства;
|
|
—
|
данни за идентичността на химикала, където е подходящо, включително структурна формула, чистота (т.е. за продукти за защита на зърнени култури – процент на активната съставка), съдържание на азот.
|
|
|
|
Условия на изпитването:
|
—
|
подробности за замяната на почвата с органичен субстрат;
|
|
—
|
брой на използваните концентрации на изпитваното вещество и, където е подходящо, обосноваване на избраните концентрации;
|
|
—
|
подробности около апликирането на изпитваното вещество в почвата;
|
|
—
|
инкубационна температура;
|
|
—
|
съдържание на влага в почвата при започване и по време на изпитването;
|
|
—
|
метод на инкубация на използваната почва (т.е. в насипно количество или като серия от индивидуални почвени подпроби);
|
|
—
|
брой на репликите (повтарящи се почвени проби);
|
|
—
|
времена при вземане на пробите.
|
|
|
|
Резултати:
|
—
|
използвани метод и оборудване за измерване на респираторните нива;
|
|
—
|
таблични данни, включващи индивидуални и средни стойности за количествата на въглеродния диоксид или кислорода;
|
|
—
|
отклонения между репликите в третираните и контролните проби;
|
|
—
|
обяснения на направените корекции в изчисленията, ако е подходящо;
|
|
—
|
процентни отклонения в нивата на глюкозно предизвиканата респирация за всяко време на вземане на проби или, ако е подходящо, ЕС50 c 95 % потвърдено ограничение, други ЕСх (т.е. ЕС25 или ЕС10) с доверителни интервали, и графика на кривата доза-отговор;
|
|
—
|
статистическо обработване на резултатите, където е подходящо;
|
|
—
|
цялата информация и наблюдения, подпомагащи интерпретирането на резултатите.
|
|
4. ПРЕПРАТКИ
|
(1)
|
EPPO (1994). Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Chemicals. Chapter 7: Soil Microflora. EPPO Bulletin 24: 1—16, 1994.
|
|
(2)
|
BBA (1990). Effects on the Activity of the Soil Microflora. BBA Guidelines for the Official Testing of Plant Protection Products, VI, 1—1 (2nd eds., 1990).
|
|
(3)
|
EPA (1987). Soil Microbial Community Toxicity Test. EPA 40 CFR Part 797.3700. Toxic Substances Control Act Test Guidelines; Proposed rule. September 28, 1987.
|
|
(4)
|
SETAC-Europe (1995). Procedures for assessing the environmental fate and ecotoxicity of pesticides, Ed. M.R. Lynch, Pub. SET AC-Europe, Brussels.
|
|
(5)
|
OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments, Belgirate, Italy, 18—20 January 1995.
|
|
(6)
|
ISO 10381-6 (1993). Soil quality — Sampling. Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory.
|
|
(7)
|
Anderson, J.P.E. (1987). Handling and Storage of Soils for Pesticide Experiments, in „Pesticide Effects on Soil Microflora“. Eds. L. Somerville and M.P. Greaves, Chap. 3: 45—60.
|
|
(8)
|
Anderson, J.P.E. (1982). Soil Respiration, in „Methods of Soil Analysis — Part 2: Chemical and Microbiological Properties“. Agronomy Monograph № 9. Eds. A.L. Page, R.H. Miller and D.R.Keeney. 41: 831—871.
|
|
(9)
|
ISO 11266-1. (1993). Soil Quality — Guidance on Laboratory Tests for Biodegradation in Soil: Part 1.Aerobic Conditions.
|
|
(10)
|
ISO 14239 (1997E). Soil Quality — Laboratory incubation systems for measuring the mineralization of organic chemicals in soil under aerobic conditions.
|
|
(11)
|
Heinemeye, r O., Insam, H., Kaiser, E. A, and Walenzik, G. (1989). Soil microbial biomass and respiration measurements; an automated technique based on infrared gas analyses. Plant and Soil, 116: 77—81.
|
|
(12)
|
ISO 14240-1 (1997). Soil quality — Determination of soil microbial biomass — Part 1: Substrateinduced respiration method.
|
|
(13)
|
ISO 14240-2 (1997). Soil quality — Determination of soil microbial biomass — Part 2: Fumigationextraction method.
|
|
(14)
|
Malkomes, H.- P. (1986). Einfluu von Glukosemenge auf die Reaktion der Kurzzeit-Atmung im Boden Gegenbber Pflanzenschutzmitteln, Dargestellt am Beispiel eines Herbizide. (Influence of the Amount of Glucose Added to the Soil on the Effect of Pesticides in Short-Term Respiration, using a Herbicide as an Example). Nachrichtenbl. Deut. Pflanzenschutzd., Braunschweig, 38: 113—120.
|
|
(15)
|
Litchfield, J. T. and Wilcoxon, F. (1949). A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, 99—113.
|
|
(16)
|
Finney, D. J. (1971). Probit Analysis. 3rd ed., Cambridge, London and New-York.
|
|
(17)
|
Finney D. J. (1978). Statistical Methods in biological Assay. Griffin, Weycombe, UK.
|
В.23. АЕРОБНА И АНАЕРОБНА ТРАНСФОРМАЦИЯ В ПОЧВИ
1. METOД
Този метод е идентичен с ОECD TG 307 (2002)
1.1. ВЪВЕДЕНИЕ
Този метод за изпитване се основава на съществуващите ръководства (1) (2) (3) (4) (5) (6) (7) (8) (9). Методът, описан в настоящия метод за изпитване, е предназначен за оценяване на аеробната и анаеробната трансформация на химикали в почви. Провеждането на експериментите има за цел да се определят: i) степента на трансформация на изпитваното вещество, и ii) видът и нивата на образуване и намаляване на продуктите от трансформацията, на които растителните и почвените организми могат да бъдат изложени. Такива изпитвания се изискват за химикали, които директно се прилагат в почвата или които е вероятно да достигнат до почвата при условията на околната среда. При разработване на пробите могат също да бъдат използвани резултатите от тези лабораторни изпитвания и аналитичните протоколи от подобни изпитвания в тази област.
Аеробни и анаеробни изпитвания с един вид почва като цяло са достатъчни за оценяване на пътищата на трансформация (8) (10) (11). Нивата на трансформация трябва да бъдат определени при поне три допълнителни почви (8) (10).
Семинарът на ОИСР за избор на почви и седименти, проведен в Belgirate, Италия, през 1995 г. (10), приема по-специално броя и вида на почвите, използвани при настоящото изпитване. Видовете изпитвани почви трябва да бъдат представителни за условията на околната среда, при които ще се използват или ще бъдат изхвърлени. Например химикали, които могат да бъдат изпуснати (отделени) при условията на субтропичен до тропичен климат, трябва да бъдат изпитвани с Ferrasols или Nitosols (FAO система). На семинара също са представени препоръки, основани на Ръководството на ISO (15) за събиране, обработване и съхранение на почвените проби. В този метод се приема също използването на почви от оризища.
1.2. ОПРЕДЕЛЕНИЯ
Изпитвано вещество: всяко вещество, независимо от това, дали е изходно съединение или съответен продукт от трансформацията.
Продукти от трансформацията: всички вещества, получени в резултат на реакциите при биотични и абиотични трансформации на изпитваното вещество, включително СО2 и продуктите, които са в крайните остатъци.
Крайни остатъци: представляват съединения в почвата, растенията или животните, които остават в матрицата под формата на изходно вещество или негов(и) метаболит(и)/продукт, получен при трансформацията след екстрахиране. Методът за екстрахиране не трябва съществено да изменя самите съединения или структурата на матрицата. Би могло донякъде (частично) да се изясни природата на връзката чрез прилагане на екстракционни методи с промяна на матрицата и на сложни аналитични техники. Например по този начин се идентифицират ковалентни йонни и сорбционни връзки, а така също и включванията (примеси). Най-общо, образуването на крайни остатъци намалява значително биологичния достъп и биологичната наличност (12) [изменено от IUPAC 1984 (13)].
Аеробна трансформация: реакциите протичат в присъствието на молекулен кислород (14).
Анаеробна трансформация: реакциите протичат в отсъствието на молекулен кислород (14).
Почва: е смес от минерални и органични химични съставки\компоненти, които съдържат съединения с високо съдържание на въглерод и азот в тях и с високи молекулни маси, състоящи се от живи малки (предимно микро-) организми. Почвата може да бъде третирана в две състояния:
|
а)
|
необработено, като тя се разработва с времето, в определени пластове на различните типове почви;
|
|
б)
|
обработено, като тя се намира обикновено в разораните площи или когато пробите са взети чрез разкопаване и се използват в този метод за изпитване (14).
|
Минерализация: е пълното разграждане на органично съединение до СО2 и Н2О при аеробни условия и до СН4, СО2 и Н2О при анаеробни условия. В контекста на този метод за изпитване, когато се използва съединение, което е маркирано с 14С, минерализация означава пълното разграждане, по време на което маркиран въглероден атом се окислява, при което се отделя съответното количество 14СО2 (14).
Време на полуразпад: t0,5, е времето, при което е достигната 50 % трансформация на изпитвано вещество, когато трансформацията може да бъде описана чрез кинетика от първи ред; той не зависи от концентрацията.
DT
50
(време на изчезване 50): е времето, за което концентрацията на изпитваното вещество намалява с 50 %; То е различно от времето на полуразпад t0,5, тъй като трансформацията не следва кинетика от първи ред.
DT
75
(време на изчезване 75): е времето, за което концентрацията на изпитваното вещество намалява със 75 %.
DT
90
(време на изчезване 90): е времето, за което концентрацията на изпитваното вещество намалява с 90 %.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
За охарактеризиране и/или идентифициране на продуктите от трансформацията трябва да бъдат използвани вещества за сравнение в съответните спектроскопски и хроматографски методи.
1.4. ПРИЛОЖИМОСТ НА ИЗПИТВАНЕТО
Този метод е приложим за всички химични вещества (немаркирани или с маркиран радиоактивен изотоп), за които има аналитичен метод с достатъчна точност и чувствителност. Той е приложим за слабо летливи, нелетливи, водоразтворими или водонеразтворими съединения. Изпитването не трябва да бъде прилагано за химикали, които са силно летливи при прилагане върху почви (напр. дезинфекционни средства, органични разтворители), и поради това не биха могли да бъдат запазени в почвата при експерименталните условия на настоящото изпитване.
1.5. ИНФОРМАЦИЯ ЗА ИЗПИТВАНОТО ВЕЩЕСТВО
За измерване на степента на трансформация могат да бъдат използвани немаркирани или маркирани изпитвани вещества. Необходимо е използването на маркиран материал за проследяване на пътя на трансформация и за установяване на масовия баланс. Препоръчва се маркиране 14С, но употребата на други изотопи, такива като 13С, 15N, 3H, 32Р, също може да бъде от полза. Доколкото е възможно, етикетът трябва да бъде поставен върху най-стабилната(ите) част(и) на молекулата (40). Изпитваното вещество трябва да бъде със степен на чистота минимум 95 %.
Преди извършване на изпитването за аеробна и анаеробна трансформация в почви трябва да бъде осигурена следната информация за изпитваното вещество:
|
а)
|
разтворимост във вода (метод А. 6);
|
|
б)
|
разтворимост в органични разтворители;
|
|
в)
|
парно налягане (метод А.4) и константата на Хенри;
|
|
г)
|
коефициент на съотношението n-октанол/вода (метод А.8);
|
|
д)
|
химична стабилност на тъмно (хидролиза) (метод В.7);
|
|
е)
|
рКа, ако молекула е подложена на реакция, свързана с приемане или отнемане на протон [Ръководство на ОИСР 112] (16).
|
Друга полезна информация може да включва данни за токсичността на изпитваното вещество при почвените микроорганизми (Методи за изпитване В.21 и В.22) (16).
Трябва да има налични аналитични методи (включително методи за екстракция и почистване) за количествено определяне и идентифициране на изпитваното вещество и неговите продукти от трансформацията.
1.6. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Почвените проби се третират с изпитваното вещество и се инкубират на тъмно в колби биометричен вид или в проточни системи при контролирани лабораторни условия (като постоянна температура и влажност на почвата). След подходящи интервали от време почвените проби се екстрахират и анализират за изходното вещество и за продукти от трансформацията. Летливите продукти също се събират за анализ чрез използване на подходящи абсорбционни уреди. Когато се използва материал, маркиран с 14С, могат да бъдат измерени различни степени на минерализация на изпитваното вещество чрез улавяне на отделяния 14СО2 и чрез масовия баланс, включително може да бъде установено образуването на остатъчни количества в почвата.
1.7. КРИТЕРИИ ЗА КАЧЕСТВО
1.7.1. Възстановяване
Екстрахиране и анализиране на най-малко две почвени проби веднага след добавяне на изпитваното вещество дава първоначална индикация за повторяемостта на аналитичния метод и за еднаквото прилагане на апликационната процедура при изпитваното вещество. Възстановяванията на по-късните етапи на експеримента се представят чрез съответните масови баланси. Възстановяванията трябва да бъдат в обхвата от 90 % до 110 % за маркирани химикали (8) и от 70 % до 110 % за немаркирани химикали (3).
1.7.2. Повторяемост и чувствителност на аналитичния метод
Повторяемостта на аналитичния метод (с изключение на първоначалната екстракционна ефективност) за количествено определяне на изпитваното вещество и продуктите от трансформацията може да бъде проверена чрез дублиращи се анализи на един и същ почвен екстракт, инкубиран достатъчно дълъг период от време, за да се образуват продукти от трансформацията.
Границата на аналитичния метод за откриване (LOD) на изпитваното вещество и на продуктите от трансформацията трябва да бъде по-ниската стойност от поне 0,01 mg.kg-l почва (като изпитвано вещество) или от 1 % от приложената доза. Трябва да бъде определена също и границата за количествено определяне на метода (LOQ).
1.7.3. Прецизност на данните от трансформацията
Регресионният анализ на концентрациите на изпитваното вещество като функция от времето дава подходяща информация за надеждността на кривата на трансформация и позволява да се изчислят доверителните интервали на полуразпада (в случай на псевдокинетика от първи ред) или стойностите на DT50 и, ако е подходящо, стойностите на DT75 и DT90.
1.8. ОПИСАНИЕ НА МЕТОДА ЗА ИЗПИТВАНЕ
1.8.1. Оборудване и химични реагенти
Инкубационните системи са статични затворени системи или подходящи проточни системи (7) (17). На фигури 1 и 2 са показани примери на проточна апаратура, подходяща за инкубиране на почви, и съответно биометричен тип колба. И двата вида инкубационни системи имат предимства и недостатъци (7) (17).
Изисква се стандартно лабораторно оборудване, и по-специално:
|
—
|
аналитични инструменти, като GLC, HPLC, TLC оборудване, включително подходяща система за откриване на анализирани с маркиран радиоактивен изотоп или немаркирани вещества или противоположен метод с разреждане на изотопи;
|
|
—
|
инструменти, използвани за целите на идентификацията (напр. MS, GC-MS, HPLC-MS, NMR и др.);
|
|
—
|
течен сцинтилационен брояч (детектор);
|
|
—
|
окислител за изгаряне на радиоактивни материали;
|
|
—
|
екстракционна апаратура (например центрофужни епруветки за студена екстракция и Soxhlet апаратура за продължително екстрахиране при нагряване с обратен хладник);
|
|
—
|
инструментариум за концентриране на разтвори и екстракти (напр. ротационен изпарител);
|
|
—
|
механично смесващо устройство (напр. месилна (разбъркваща) машина, ротационен миксер).
|
Като химични реагенти се използват например:
|
—
|
NaOH, аналитически чиста за анализ, 2 mol.dm-3 или друга подходяща основа (напр. КОН, етаноламин);
|
|
—
|
H2SO4, аналитически чиста за анализ, 0,05 mol.dm-3;
|
|
—
|
етилен гликол, аналитически чист за анализ;
|
|
—
|
твърди абсорбционни материали, такива като натронкалк (смес от натриев хидроксид и вар) и полиуретанови тапи;
|
|
—
|
органични разтворители, аналитически чисти за анализ, такива като ацетон, метанол и др.;
|
|
—
|
сцинтилационна течност.
|
1.8.2. Прилагане на веществото за изпитване
За прибавяне и разпространение в почвата изпитваното вещество може да бъде разтворено във вода (дейонизирана или дестилирана) или, когато е необходимо, в минимални количества ацетон или други органични разтворители (6), в които изпитваното вещество е достатъчно разтворимо и стабилно. Въпреки това количеството на избрания разтворител не трябва да оказва значително влияние върху микробната активност в почвата (вж. точки 1.5, 1.9.2 и 1.9.3). Трябва да се избягва употребата на такива разтворители, като хлороформ, дихлорметан и други халогенирани разтворители, които възпрепятстват (инхибират) микробната активност.
Изпитваното вещество може също да бъде добавено в твърд вид (агрегатно състояние), напр. смесено с кварцов пясък (6) или в малка подпроба от изпитваната почва, която се суши на въздух и се стерилизира. Ако изпитваното вещество се добавя, като се използва разтворител, разтворителят трябва да може да бъде изпарен, преди отделената подпроба да бъде добавена към първоначалната нестерилна почвена проба.
За обикновените химикали, чийто основен път на постъпване в почвата е чрез канализационните утайки/селскостопанска употреба, изпитваното вещество първо трябва да бъде добавено към утайката, която след това се въвежда в почвената проба (вж. точки 1.9.2 и 1.9.3).
Употребата на образуваните продукти обикновено не се препоръчва. Въпреки това обаче, напр. при слаборазтворими изпитвани вещества, използването на новообразуван материал може да бъде подходяща алтернатива.
1.8.3. Почви
1.8.3.1. Избор на почва
За определяне пътя (начина) на трансформацията може да бъде използвана „представителна“ почва; Препоръчва се да се използва пясъчна почва или наносна почва, или глина, или глинест пясък [съгласно класификацията на FAO и USD A (18)] с рН = 5,5—8,0, със съдържание на органичен въглерод 0,5—2,5 % и с микробна биомаса най-малко 1 % от общия органичен въглерод (10).
За установяване степента на трансформация трябва да бъдат използвани поне три допълнителни почви, представляващи обхват от съответните почви. Почвите трябва да са с различно (вариращо) съдържание на техния органичен въглерод, рН, съдържание на глина и микробна биомаса (10).
Всички почви трябва да бъдат охарактеризирани, поне по отношение на състава им ( % пясък, % нанос, % глина) [съгласно класификацията на FAO и USD A (18)], рН, способност за катионен обмен, органичен въглерод, насипна плътност, способност за задържане на вода (41) и микробна биомаса (само за аеробни изпитвания). Допълнителната информация за свойствата на почвата може да бъде от полза при интерпретирането на резултатите. За определянето на характеристиките на почвата, могат да бъдат използвани методите, препоръчани в препратки (19) (20) (21) (22) (23). Микробната биомаса трябва да бъде определена чрез прилагане на метода на субстратно индуцираната респирация (SIR) (25) (26) или алтернативни методи (20).
1.8.3.2. Събиране, обработване и съхранение на почви
Трябва да има подробна информация за историята (миналото) на мястото в полето, откъдето е била събрана почвата за изпитване. Подробностите включват точно местоположение, растителна покривка, обработване с химикали, третиране с органични и неорганични торове, добавки към биологични материали или друго замърсяване. Ако почвите са третирани с изпитваното вещество или с негов структурен аналог през предходните четири години, те не трябва да бъдат използвани за изследвания на трансформацията (10) (15).
Почвата трябва да бъде прясно събрана от полето (от хоризонт А или от горния 20 cm слой) с такова водно съдържание в нея, което да улеснява пресяването. За почви, различни от тези при наводнени повърхности, вземането на проби трябва да бъде избягвано през или веднага след дълги периоди (> 30 дни) на засушаване, замръзване или наводнение (14). Почвите трябва да бъдат транспортирани по начин, който свежда до минимум загубите на водно съдържание в почвата, и трябва да бъдат държани на тъмно, при свободен достъп до въздух, толкова дълго, колкото е възможно. Обикновено хлабаво завързан полиетиленов плик (чувал) е подходящ за тази цел.
Почвата трябва да бъде използвана възможно най-бързо след вземането ѝ за проби. Растителността, по-големите растителни части и камъни трябва да бъдат отстранени преди пресяването на почвата през 2 mm сито, чрез което се отстраняват малки камъни, растения и растителни части. Трябва да бъде избягвано продължителното сушене и стриване на почвата преди пресяването (15).
Когато вземането на почвени проби от повърхността е трудно през зимата (замръзнала почва или покрита от пластове сняг), проба може да бъде взета от почвена партида, съхранявана в оранжерия под растителна покривка (напр. трева или смесени туфи трева-детелина). Силно се препоръчва провеждането на изпитвания с прясно събрани от полето почви, но ако събраните и обработени почви трябва да бъдат съхранявани преди започване на изпитването, условията на съхранение трябва да бъдат адекватно подбрани и съхранението да продължи само определен период от време (4 ± 2 oС за максимум три месеца) за поддържане на микробната активност (42). Подробни инструкции за събирането, обработването и съхранението на почви, които ще бъдат използвани при биотрансформационни експерименти, могат да бъдат намерени в (8) (10) (15) (26) (27).
Преди преработената почва да се използва в това изпитване, трябва да бъде извършена предварителна инкубация, която ще позволи поникване и отстраняване на семената, и възстановяване на равновесието в микробния метаболизъм, изменено от вземането на пробата или условията на съхранение или инкубация. Общоприето е прединкубационният период да трае между 2 и 28 дни при приблизително поддържане на условията — температура и влажност — като тези при реалното изпитване (15). Периодът на съхранение и прединкубационният период заедно не трябва да превишават три месеца.
1.9. ПРОВЕЖДАНЕ НА ИЗПИТВАНЕТО
1.9.1. Условия на изпитването
1.9.1.1. Температура на изпитването
През целия период от време за провеждане на изпитването почвите трябва да бъдат инкубирани на тъмно при постоянна температура, представителна за климатичните условия, при които ще се използва или освобождава веществото. Препоръчва се температурата да е 20 ± 2 oС за всички изпитвани вещества, които може да поеме почвата при климатичните температури. Температурата трябва да бъде наблюдавана.
За химикали, прилагани или освобождавани при по-студен климат (напр. в северните страни, през есенно-зимните периоди), трябва да бъдат инкубирани допълнителни почвени проби, но при по-ниска температура (напр. 10 ± 2 oС).
1.9.1.2. Съдържание на влага
При изпитвания на трансформацията при аеробни условия трябва да бъде установено съдържанието на влага в почвата (43) и влажността да бъде поддържана при pF между 2,0 и 2,5 (3). Съдържанието на влага в почвата се изразява като маса на водата към маса на сухата почва и трябва регулярно да бъде контролирано (напр. на двуседмични интервали от време) чрез претегляне на инкубационните колби и компенсиране на водните загуби чрез добавянето на вода (за предпочитане стерилно филтрирана чешмяна вода). Трябва да бъде отделено внимание на предотвратяването или минимизирането на загубите от изпитваното вещество и/или продуктите от трансформацията чрез изпаряване и/или фотолиза (фоторазграждане) (ако има) по време на допълнителното овлажняване.
За изпитвания на трансформацията при анаеробни и наводнени условия почвата е напоена с вода чрез наводняване.
1.9.1.3. Условия за аеробно инкубиране
При проточни системи аеробни условия ще бъдат поддържани чрез прекъсвания за продухвания или чрез продължително (непрекъснато) проветряване с влажен въздух. В биометричните колби обменът на въздух се поддържа чрез дифузия.
1.9.1.4. Стерилни аеробни условия
За да се получи информация за съответствието на абиотичната трансформация на изпитвано вещество, почвените проби могат да бъдат стерилизирани (за методи за стерилизация вж. препратки 16 и 29), третирани със стерилизираното изпитвано вещество (напр. добавяне на разтвор през стерилен филтър) и аерирани с овлажнен стерилен въздух, както е описано в точка 1.9.1.3. За наводнени почви почвата и водата трябва да бъдат стерилизирани и инкубацията трябва да бъде проведена, както е описано в точка 1.9.1.6.
1.9.1.5. Условия за анаеробно инкубиране
За създаване и поддържане на анаеробни условия почвата, третирана с изпитваното вещество и инкубирана при аеробни условия в продължение на 30 дни или едно време на полуразпад, или DT50 (което е по-кратко), е в 1 — 3 cm воден слой и инкубационната система се продухва с инертен газ (напр. азот или аргон) (44). Системата за изпитване трябва да позволява измервания на pH, концентрацията на кислород и редоксипотенциала, както и да включва улавящо устройство за летливите продукти. Биометричният вид система трябва да е затворена, за да се избегне проникването на въздух чрез дифузия.
1.9.1.6. Условия за инкубиране при наводняване
За проучване на трансформацията в наводнени оризови почви почвата се наводнява с воден слой, който е с дебелина около 1 — 5 cm, и изпитваното вещество се прилага във водната фаза (9). Препоръчва се почвата да е с дълбочина поне 5 cm. Системата се проветрява с въздух както при аеробните условия. pH, концентрацията на кислород и редоксипотенциалът на водния слой трябва да бъдат наблюдавани и отчитани. Необходимо е да има поне две седмици прединкубационен период преди започването на трансформационните изпитвания (вж. точка 1.8.3.2).
1.9.1.7. Продължителност на изпитването
Продължителността (степента и пътят на протичане) на изпитването обикновено не трябва да превишава 120 дни (45) (3) (6) (8), тъй като след това трябва да се очаква понижаване във времето на почвената микробна активност в изкуствено създадената лабораторна система, която е изолирана от естествено допълване. Когато е необходимо за охарактеризиране намаляването на изпитваното вещество и образуването и намаляването на основните продукти от трансформацията, изпитванията могат да бъдат продължени за по-дълъг период от време (напр. 6 или 12 месеца) (8). По-дългите инкубационни периоди трябва да бъдат обосновани в протокола от изпитването и придружени от измервания на биомасата по време и в края на тези периоди.
1.9.2. Провеждане на изпитването
Около 50 до 200 g почва (на база сухо тегло) се поставят във всяка инкубационна колба (вж. фигури 1 и 2 от приложение 3) и почвата се третира с изпитваното вещество по един от методите, описани в точка 1.8.2. Когато за апликиране на изпитваното вещество се използват органични разтворители, те трябва да бъдат отстранени от почвата чрез изпаряване. Тогава почвата се смесва напълно, като за това се използва шпатула и/или се разклаща колбата. Ако изпитването са провежда при наводнени повърхностни условия, почвата и водата трябва да бъдат напълно смесени след прилагането на изпитваното вещество. За да се провери за хомогенното разпределение на изпитваното вещество, трябва да бъдат анализирани малки аликвоти (напр. 1 g) от третираните почви за изпитваното вещество. За алтернативен метод вижте по-долу.
Нивото на третиране трябва да съответства на най-високото апликационно ниво на продукт за защита на зърнените култури, препоръчвано в инструкциите за употреба, и по един и същ начин инкорпорирано на подходяща дълбочина в полето (напр. най-горния 10 cm почвен слой (46). Например за химикали, прилагани върху листата или в почвата без инкорпориране (смесване), подходящата дълбочина за изчисляване количеството химикал, което трябва да бъде добавено във всяка колба, е 2,5 cm. За инкорпорирани в почвата химикали подходящата дълбочина е определената в инструкциите за употреба дълбочина за инкорпориране. За обикновени химикали апликационното ниво трябва да бъде оценено въз основа на най- подходящия път за въвеждане; например когато основният път на постъпване в почвата е чрез канализационните утайки, химикалът трябва да бъде дозиран в утайката с такава концентрация, която да рефлектира върху очакваната концентрация на утайката, и количеството на утайката, добавено към почвата, трябва да се отрази (да повлияе) нормално на земеделските почви. Ако тази концентрация не е достатъчно висока за идентифицирането на основните продукти от трансформацията, може да бъде от полза инкубирането на отделни почвени проби, съдържащи по-високи нива, като крайните нива, влияещи на микробните функции на почвата, трябва да бъдат избягвани (вж. точки 1.5 и 1.8.2).
Алтернативно, по-големи партиди почва (т.е. от 1 до 2 kg) могат да бъдат третирани с изпитваното вещество след внимателно смесване в подходящо смесително устройство и впоследствие прехвърляни на малки порции от 50 до 200 g в инкубационните колби (например с използването на разделител на пробите). Малки аликвотни части (напр. 1 g) от третираната почвена партида трябва да се анализират за изпитваното вещество, за да се провери еднородното му разпределение. Предпочита се тази процедура, тъй като позволява по-равномерно разпределение на изпитваното вещество в почвата.
Така също нетретираните почвени проби се инкубират при същите условия (аеробни) както пробите, третирани с изпитваното вещество. Тези проби се използват за измерване на биомасата по време и в края на изпитванията.
Когато изпитваното вещество се прилага в почвата, разтворено в органичен(и) разтворител(и), почвените проби, третирани със същото количество разтворител(и), се инкубират при същите условия (аеробни) както пробите, третирани с изпитваното вещество. Тези проби се използват за измерване на биомасата в началото, по време и в края на изпитванията, за да се провери влиянието на разтворителя(ите) върху микробната биомаса.
Колбите, съдържащи третирани почви, се прикрепят към проточната система, описана във фигура 1, или се затварят в абсорбционната колона, показана на фигура 2 (вж. приложение 3).
1.9.3. Вземане на проби и измервания
Колби с дублираща се инкубация се изваждат на подходящи интервали от време и почвените проби се екстрахират с подходящи разтворители с различен поляритет и се анализират за изпитваното вещество и/или продуктите от трансформацията. Добре подготвеното (проектираното) изпитване включва достатъчно колби, така че две колби да бъдат „пожертвани“ при експеримента с всяка проба. Така също абсорбционните разтвори или твърдите абсорбционни материали се отстраняват на различни интервали от време (7-дневни интервали през първия месец и след един месец на 17-дневни интервали) по времето и в края на инкубацията на всяка почвена проба и анализиране за летливи продукти. Освен почвена проба, взета директно (проба от ден 0), трябва да бъдат включени поне 5 допълнителни пробоотборни точки. Времевите интервали трябва да бъдат такива, че да могат да бъдат определени моделите на запазване на изпитваното вещество и моделите на образуване и запазване на продуктите от трансформацията (напр. 0, 1, 3, 7 дни; 2, 3 седмици; 1, 2, 3 месеца и т.н.).
Когато се използва изпитвано вещество, маркирано с 14С, неекстрахируемата радиоактивност ще бъде количествено определена чрез изгаряне и за всеки интервал за проба ще бъде изчислен масов баланс.
В случай на анаеробна и инкубация при наводнение почвената и водната фаза се анализират заедно за изпитваното вещество и продукти от трансформацията или поотделно чрез филтриране или центрофугиране преди екстрахиране и анализиране.
1.9.4. Възможни (незадължителни) изпитвания
За оценка на влиянието на температурата и влагата на почвата върху степените на трансформация на изпитвано вещество и/или негови продукти от трансформация в почвата може да бъде от полза провеждането на аеробни нестерилни изпитвания при допълнителни температури и влажности на почвата.
За по-нататъшно охарактеризиране на неекстрахируемата радиоактивност например може да бъде използвана свръхкритична течна екстракция.
2. ДАННИ
2.1. ОБРАБОТВАНЕ НА РЕЗУЛТАТИТЕ
Количествата на изпитваното вещество, продуктите от трансформацията, летливите вещества (само в проценти) и неекстрахираните остатъци трябва да бъдат представени като процент от приложената начална концентрация и, където е подходящо, като mg.kg-l почва (основана на сухо претеглена почва) за всеки интервал на проба. Трябва да бъде представен масов баланс като процент на приложената начална концентрация за всеки интервал на проба. Графичното представяне на концентрациите на изпитваното вещество спрямо времето ще позволи да се направи оценка на времето за достигане на неговия полуразпад при трансформацията или на DT50. Основните продукти от трансформацията трябва да бъдат идентифицирани и техните концентрации също трябва да бъдат графично нанесени спрямо времето, за да се установят техните степени на образуване и задържане. Основен продукт от трансформацията е всеки продукт, представляващ ≥ 10 % от приложената доза във всеки момент по време на изпитването.
Уловените летливи продукти дават някои индикации за потенциалната летливост на изпитваното вещество и неговите продукти от трансформацията в почвата.
По-точно определяне на стойностите на времето за полуразпад или стойностите на,DT50 и, ако е подходящо, DT75 и DT90 трябва да бъдат включени чрез прилагане на подходящ кинетичен модел при изчисленията. Стойностите на времето за полуразпад или DT50 трябва да бъдат отчетени при едновременно описание на използвания модел, кинетиката от първи ред и определящия коефициент (r2). Предпочита се кинетиката от първи ред, освен ако r2 < 0,7. Ако е подходящо, изчисления трябва да се направят и за основните продукти от трансформацията. Примери на подходящи модели са описани в препратки от 31 до 35.
В случай на изпитвания, проведени при различни температури, степените на трансформация трябва да бъдат описани като функция на температурата в експерименталния температурен обхват с използването на Арениусовата зависимост по формулата:
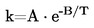 или
или 
където ln А и В са регресионни константи на пресичане и наклон, респективно, на най-добра свързваща линия, произхождаща от линейната регресия ln k спрямо 1/T, k е скоростна константа при температура Т и Т е температура по Келвин. Трябва да бъде обърнато внимание на граничния температурен интервал, в който ще бъде валидна Арениусовата зависимост при случаите на трансформация, управлявана от микробната дейност.
2.2. ОЦЕНЯВАНЕ И ИНТЕРПРЕТИРАНЕ НА РЕЗУЛТАТИТЕ
Въпреки че изпитванията се провеждат в изкуствена лабораторна система, резултатите ще позволят да се оцени степента на трансформация на изпитваното вещество, а така също и степента на образуване и устойчивост на продуктите от трансформацията при условията на експеримента (36) (37).
Проучването на пътя на трансформацията осигурява информация за начина, по който чрез химични и микробни реакции приложеното вещество структурно се изменя в почвата
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Протоколът от изпитването трябва да включва:
|
|
Изпитвано вещество:
|
—
|
търговско наименование, химично наименование, CAS номер, структурна формула (показваща положението на етикета(ите), когато се използва материал с маркиран радиоактивен изотоп) и съответните физикохимични свойства (вж. точка 1.5);
|
|
—
|
степен на чистота (примеси) на изпитваното вещество;
|
|
—
|
радиохимична степен на чистота на маркирания химикал и специфична активност (където е подходящо).
|
|
|
|
Вещества за сравнение:
|
—
|
химично наименование и структура на веществата за сравнение, използвани за охарактеризиране и/или идентифициране на продукт от трансформацията.
|
|
|
|
Изпитвани почви:
|
—
|
подробности за местата, от които са събирани;
|
|
—
|
дата и процедура за вземане на почвени проби;
|
|
—
|
свойства на почвите, такива като pH, съдържание на органичен въглерод, състав ( % пясък, % наноси, % глина), способност за катионен обмен, насипна плътност, способност за задържане на вода и микробна биомаса;
|
|
—
|
продължителност на периода на съхраняване на почвата и условия на съхранение (ако се съхранява).
|
|
|
|
Условия на изпитването:
|
—
|
дати на провеждане на експериментите;
|
|
—
|
приложено количество на изпитваното вещество;
|
|
—
|
използвани разтворители и метод за апликиране на изпитваното вещество;
|
|
—
|
тегло на първоначално третираната почва и на почвените проби при всеки интервал за анализ;
|
|
—
|
описание на използваната инкубационна система;
|
|
—
|
нива на въздушния поток (само за проточни системи);
|
|
—
|
температура на експерименталната постановка;
|
|
—
|
съдържание на влага в почвата през периода на инкубиране;
|
|
—
|
микробна биомаса в началото, по време и в края на аеробните изпитвания;
|
|
—
|
pH, концентрация на кислорода и редоксипотенциал в началото, по време и в края на анаеробните и изпитванията при наводняване;
|
|
—
|
метод(и) на екстрахиране;
|
|
—
|
методи за количествено определяне и идентифициране на изпитваното вещество и основните продукти от трансформацията в почва и абсорбционни материали;
|
|
—
|
брой на репликите и брой на контролите.
|
|
|
|
Резултати:
|
—
|
резултати от определянето на микробната активност;
|
|
—
|
повторяемост и чувствителност на използваните аналитични методи;
|
|
—
|
степени на възстановяване ( % стойности за валиден експеримент са посочени в точка 1.7.1);
|
|
—
|
таблици с резултати, изразени като процент от приложената първоначална доза и, където е подходящо, като mg.kg-l почва (въз основа на сухо тегло);
|
|
—
|
масов баланс по време и в края на изпитванията;
|
|
—
|
охарактеризиране на неекстрахируемата (граничната) радиоактивност или остатъци в почвата;
|
|
—
|
количествено определяне на отделения СО2 и на други летливи съединения;
|
|
—
|
диаграми на концентрациите в почвата спрямо времето за изпитваното вещество и, където е подходящо, за основните продукти от трансформацията;
|
|
—
|
време на полуразпад или DT50, DT75 и DT90 за изпитваното вещество и, където е подходящо, за основните продукти от трансформацията, включително доверителни интервали;
|
|
—
|
оценка на степента на абиотично разграждане при стерилни условия;
|
|
—
|
оценка на кинетиката на трансформацията на изпитваното вещество и, където е подходящо, на основните продукти от трансформацията;
|
|
—
|
предлагани пътища на трансформация, където е подходящо;
|
|
—
|
обсъждане и интерпретиране на резултатите;
|
|
—
|
„сурови“ (необработени) данни (напр. хроматограми на пробите, примерни изчисления на степените на трансформация и използваните средства за идентифициране на продуктите от трансформацията.
|
|
4. ПРЕПРАТКИ
|
(1)
|
US Environmental Protection Agency (1982). Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate.
|
|
(2)
|
Agriculture Canada (1987). Environmental Chemistry and Fate. Guidelines for registration of pesticides in Canada.
|
|
(3)
|
European Union (EU) (1995). Commission Directive 95/36/EC of 14 July 1995 amending Council Directive 91/414/EEC concerning the placing of plant protection products on the market. Annex II, Part A and Annex III, Part A: Fate and Behaviour in the Environment.
|
|
(4)
|
Dutch Commission for Registration of Pesticides (1995). Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air.
|
|
(5)
|
BBA (1986). Richtlinie fer die amtliche Prъfung von Pflanzenschutzmitteln, Teil IV, 4—1. Verbleib von Pflanzenschutzmitteln im Boden — Abbau, Umwandlung und Metabolismus.
|
|
(6)
|
ISO/DIS 11266-1 (1994). Soil Quality -Guidance on laboratory tests for biodegradation of organic chemicals in soil — Part 1: Aerobic conditions.
|
|
(7)
|
ISO 14239 (1997). Soil Quality — Laboratory incubation systems for measuring the mineralization of organic chemicals in soil under aerobic conditions.
|
|
(8)
|
SETAC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed.
|
|
(9)
|
MAFF — Japan 2000 — Draft Guidelines for трaнсformation studies of pesticides in soil — Aerobic metabolism study in soil under paddy field conditions (flooded).
|
|
(10)
|
OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments. Belgirate, Italy, 18—20 January 1995.
|
|
(11)
|
Guth, J. A. (1980). The study of трaнсformations. In Interactions between Herbicides and the Soil (R. J. Hance, Ed.), Academic Press, 123—157.
|
|
(12)
|
DFG: Pesticide Bound Residues in Soil. Wiley — VCH (1998).
|
|
(13)
|
T. R. Roberts: Non-extractable pesticide residue in soils and plants. Pure Appl. Chem. 56, 945—956 (IUPAC 1984).
|
|
(14)
|
OECD Test Guideline 304 A: Inherent Biodegradability in Soil (adopted 12 May 1981).
|
|
(15)
|
ISO 10381-6 (1993). Soil Quality — Sampling — Part 6: Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory.
|
|
(16)
|
приложение V to Dir. 67/548/EEC.
|
|
(17)
|
Guth, J.A. (1981). Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry. D.H. Hutson, T.R. Roberts, Eds. J. Wiley & Sons. Vol 1, 85—114.
|
|
(18)
|
Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26:305 (1962).
|
|
(19)
|
Methods of Soil Analysis (1986). Part 1, Physical and Mineralogical Methods. A. Klute, Ed.) Agronomy Series № 9, 2nd Edition.
|
|
(20)
|
Methods of Soil Analysis (1982). Part 2, Chemical and Microbiological Properties. A. L. Page, R. H. Miller and D. R. Kelney, Eds. Agronomy Series № 9, 2nd Edition.
|
|
(21)
|
ISO Standard Compendium Environment (1994). Soil Quality — General aspects; chemical and physical methods of analysis; biological methods of analysis. First Edition.
|
|
(22)
|
Mъckenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt, Main.
|
|
(23)
|
Scheffer, F., Schachtschabel, P. (1975). Lehrbuch der Bodenkunde. F. Enke Verlag, Stuttgart.
|
|
(24)
|
Anderson, J. P. E., Domsch, K. H. (1978) A physiological method for the quantitative measurement of microbial biomass in soils. Soil Biol. Biochem. 10, 215—221.
|
|
(25)
|
ISO 14240-1 and 2 (1997). Soil Quality — Determination of soil microbial biomass — Part 1: Substrate-induced respiration method. Part 2: fumigation-extraction method.
|
|
(26)
|
Anderson, J. P. E. (1987). Handling and storage of soils for pesticide experiments. In Pesticide Effects on Soil Microflora. L. Somerville, M. P. Greaves, Eds. Taylor & Francis, 45-60.
|
|
(27)
|
Kato, Yasuhiro. (1998). Mechanism of pesticide трaнсformation in the environment: Aerobic and bioтрaнсformation of pesticides in aqueous environment. Proceedings of the 16th Symposium on Environmental Science of Pesticide, 105—120.
|
|
(28)
|
Keuken O., Anderson J. P. E. (1996). Influence of storage on biochemical processes in soil. In Pesticides, Soil Microbiology and Soil Quality, 59—63 (SETAC-Europe).
|
|
(29)
|
Stenberg B., Johansson M., Pell M., Sjцdahl-Svensson K., Stenstrцm J., Torstensson L. (1996). Effect of freeze and cold storage of soil on microbial activities and biomass. In Pesticides, Soil Microbiology and Soil Quality, 68—69 (SETAC-Europe).
|
|
(30)
|
Gennari, M., Negre, M., Ambrosoli, R. (1987). Effects of ethylene oxide on soil microbial content and some chemical characteristics. Plant and Soil 102, 197—200.
|
|
(31)
|
Anderson, J. P. E. (1975). Einfluss von Temperatur und Feuchte auf Verdampfung, Abbau und Festlegung von Diallat im Boden. Z. PflKrankh Pflschutz, Sonderheft VII, 141—146.
|
|
(32)
|
Hamaker, J. W. (1976). The application of mathematical modelling to the soil persistence and accumulation of pesticides. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides, 181—199.
|
|
(33)
|
Goring, C. A. I., Laskowski, D. A., Hamaker, J. W., Meikle, R. W. (1975). Principles of pesticide degradation in soil. In „Environmental Dynamics of Pesticides“. R. Haque and V. H. Freed, Eds., 135—172.
|
|
(34)
|
Timme, G., Frehse, H., Laska, V. (1986). Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues. II. Pflanzenschutz — Nachrichten Bayer 39, 188—204.
|
|
(35)
|
Timme, G., Frehse, H. (1980). Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues. I. Pflanzenschutz — Nachrichten Bayer 33, 47—60.
|
|
(36)
|
Gustafson D.I., Holden L.R. (1990). Non-linear pesticide dissipation in soil; a new model based on spatial variability. Environm. Sci. Technol. 24, 1032—1041.
|
|
(37)
|
Hurle K., Walker A. (1980). Persistence and its prediction. In Interactions between Herbicides and the Soil (R.J. Hance, Ed.), Academic Press, 83—122.
|
Приложение 1
ВОДНО НАЛЯГАНЕ, ПОВЪРХНОСТЕН КАПАЦИТЕТ (FC) И СПОСОБНОСТ ЗА ЗАДЪРЖАНЕ НА ВОДА (WHC) (47)
|
Височина на водния стълб
[cm]
|
pF (48)
|
bar (49)
|
Забележки
|
|
107
|
7
|
104
|
Суха почва
|
|
1,6 . 104
|
4,2
|
16
|
Точка на сушене
|
|
104
|
4
|
10
|
|
|
103
|
3
|
1
|
|
|
6.102
|
2,8
|
0,6
|
|
|
3,3 . 102
|
2,5
|
0,33 (50)
|
Обхват на
повърхностния капацитет (51)
|
|
102
|
2
|
0,1
|
|
60
|
1,8
|
0,06
|
|
33
|
1,5
|
0,033
|
|
10
|
1
|
0,01
|
WHC (приближение)
|
|
1
|
0
|
0,001
|
Водооросявана почва
|
Водното налягане се измерва в cm воден стълб или в bar. Във връзка с по-големия обхват на налягането на всмукване то се изразява просто като стойност на pF, която е еквивалентна на логаритъма от cm на водния стълб.
Повърхностният капацитет (FC) се определя като количеството вода, което може да бъде запазено 2 дни след по-дълъг дъждовен период или достатъчно напояване, спрямо притеглянето от естествената почва (в природата). Той се определя за необработена почва in situ на повърхността. Измерването е неприложимо за обработени лабораторно почвени проби. Стойностите на FC, определени при обработени почви, могат да покажат големи систематични отклонения.
Способността за задържане на вода (WHC) се определя в лабораторни условия с необработени и обработени почви чрез насищане на почвата в колоната с вода, пренасяна по капилярен път. Тя е особено важна при обработени почви и може да бъде до 30 % по-голяма от повърхностния капацитет (1). А така също експериментално по-лесно е да се определят такива достоверни стойности на FC.
Приложение 2
СЪДЪРЖАНИЕ НА ВЛАГА В ПОЧВАТА (g вода за 100 g суха почва) ПРИ РАЗЛИЧНИТЕ ВИДОВЕ ПОЧВА ОТ РАЗЛИЧНИ СТРАНИ
|
|
|
Съдържание на влага в почвата
|
|
Тип почва
|
Страна
|
|
|
|
WHC (52)
|
pF = 1,8
|
pF = 2,5
|
|
Пясък
|
Германия
|
28,7
|
8,8
|
3,9
|
|
Глинест пясък
|
Германия
|
50,4
|
17,9
|
12,1
|
|
Глинест пясък
|
Швейцария
|
44,0
|
35,3
|
9,2
|
|
Наносна почва
|
Швейцария
|
72,8
|
56,6
|
28,4
|
|
Глинеста почва
|
Бразилия
|
69,7
|
38,4
|
27,3
|
|
Глинеста почва
|
Япония
|
74,4
|
57,8
|
31,4
|
|
Пясъчна почва
|
Япония
|
82,4
|
59,2
|
36,0
|
|
Наносна почва
|
САЩ
|
47,2
|
33,2
|
18,8
|
|
Пясъчна почва
|
САЩ
|
40,4
|
25,2
|
13,3
|
Приложение 3
Фигура 1
Пример за проточна апаратура за изследване на трансформацията на химикали в почва
(53)
(54)
Фигура 2
Пример за биометричен вид колба за изследване на трансформацията на химикали в почва
(55)

B.24. АЕРОБНА И АНАЕРОБНА ТРАНСФОРМАЦИЯ ВЪВ ВОДНИ СЕДИМЕНТНИ СИСТЕМИ
1. METOД
Този метод е идентичен с ОECD TG 308 (2002).
1.1. ВЪВЕДЕНИЕ
Химикалите могат да попаднат в плитчините или дълбоко под водната повърхност по такива пътища на постъпване, като директно прилагане, впръскване, изливане, дренаж, депониране на отпадъци, промишлени, битови или земеделски отпадъчни води и атмосферно отлагане. Този метод за изпитване описва лабораторен метод за оценка на аеробната и анаеробната трансформация на органични химикали във водни седиментни системи. Той се основава на съществуващите ръководства (1) (2) (3) (4) (5) (6). Семинарът на ОИСР за избор на почви и седименти, проведен в Belgirate, Италия, през 1995 г. (7), приема конкретно броя и вида на седиментите, използвани при това изпитване. Той също дава препоръки, свързани със събирането, обработването и съхранението на седиментните проби, основани на Ръководството на ISO (8). Такива изпитвания се изисква да бъдат проведени за химикали, които директно се прилагат във водата или които има вероятност да достигнат водната среда по някой от описаните по-горе пътища.
Често условията в естествената водна седиментна система са аеробни в по-горната водна фаза. Повърхностният слой на седимента може да бъде или аеробен, или анаеробен, докато по-дълбокият седимент обикновено е анаеробен. За да се обхванат всички тези възможности, в този метод са описани и аеробни, и анаеробни изпитвания. Аеробното изпитване симулира аеробна водна колона над аеробен седиментен слой, който е с анаеробен градиент. Анаеробното изпитване симулира затворена анаеробна водноседиментна система. Ако обстоятелствата показват, че е необходимо значително отклонение от тези препоръки, например поради използване на цели седименти или седименти, които могат да бъдат експозирани с изпитваното вещество, за целта се използват други налични методи (9).
1.2. ОПРЕДЕЛЕНИЯ
При всички случаи трябва да бъдат използвани международните стандартни единици (SI).
Изпитвано вещество: всяко вещество, независимо от това дали е изходно съединение или съответен продукт от трансформацията.
Продукти от трансформацията: всички вещества, получени в резултат на реакциите при биотични и абиотични трансформации на изпитваното вещество, включително СО2 и крайните остатъци.
Крайни остатъци: представляват съединения в почвата, растенията или животните, които остават в матрицата под формата на изходно вещество или негов(и) метаболит(и) след екстракциите. Методът за екстрахиране не трябва съществено да изменя самите съединения или структурата на матрицата. Би могло донякъде да се изясни природата на връзката чрез прилагане на екстракционни методи с промяна на матрицата и на сложни аналитични техники. Например по този начин се идентифицират ковалентни йонни и сорбционни връзки, а така също и включванията (примеси). Най-общо образуването на крайни остатъци намалява значително биологичния достъп и биологичната наличност (10) [изменено от IUPАС 1984(11)].
Аеробна трансформация: (окисление): реакциите протичат в присъствието на молекулен кислород (12).
Анаеробна трансформация: (редукция) реакциите протичат в отсъствието на молекулен кислород (12).
Природни води: са повърхностните води от езера, реки, потоци и др.
Седимент: е смес от минерални и органични химични инградиенти, които съдържат съединения с високо съдържание на въглерод и азот в тях и са с високи молекулни маси. Той се отлага от природните води и формира граница с тях.
Минерализация: е пълното разграждане на органично съединение до СО2 и Н2О при аеробни условия и до СН4, СО2 и Н2О при анаеробни условия. В контекста на този метод за изпитване, когато се използва съединение с маркиран радиоактивен изотоп, минерализация означава пълното разграждане на молекулата, по време на което маркиран въглероден атом се окислява или редуцира количествено, вследствие на което се отделя съответното количество 14СО2 или съответно 14СН4.
Време на полуразпад: t0,5 е времето, при което е достигната 50 % трансформация на изпитвано вещество, когато трансформацията може да бъде описана чрез кинетика от първи клас; то не зависи от началната концентрация.
DT
50
(време на изчезване 50): е времето, за което началната концентрация на изпитваното вещество намалява с 50 %;
DT
75
(време на изчезване 75): е времето, за което началната концентрация на изпитваното вещество намалява със 75 %.
DT
90
(време на изчезване 90): е времето, за което началната концентрация на изпитваното вещество намалява с 90 %.
1.3. ВЕЩЕСТВА ЗА СРАВНЕНИЕ
За количествено определяне и идентифициране на продуктите от трансформацията трябва да бъдат използвани вещества за сравнение в съответните спектроскопски и хроматографски методи.
1.4. ИНФОРМАЦИЯ ЗА ИЗПИТВАНОТО ВЕЩЕСТВО
За измерване на степента на трансформация могат да бъдат използвани немаркирани изпитвани вещества или такива с маркирани изотопи, въпреки че се предпочита маркиран материал. Необходимо е използването на маркиран материал за проследяване на пътя на трансформация и за установяване на масовия баланс. Препоръчва се маркиране 14С, но употребата на други изотопи, такива като 13С, 15N, 3Н, 32Р, също може да бъде от полза. Доколкото е възможно, етикетът трябва да бъде поставен върху най-стабилната(ите) част(и) на молекулата (56). Изпитваното вещество трябва да бъде с химична и/или радиохимична степен на чистота минимум 95 %.
Преди провеждане на изпитване трябва да бъде осигурена следната информация за изпитваното вещество:
|
а)
|
разтворимост във вода (метод А.6)
|
|
б)
|
разтворимост в органични разтворители;
|
|
в)
|
парно налягане (метод А.4) и константата на Хенри;
|
|
г)
|
коефициент на съотношението n-октанол/вода (метод А.8);
|
|
д)
|
адсорбционен коефициент (Kd, Kf или Kос, където е възможно) (метод В.18);
|
|
е)
|
хидролиза (метод В.7);
|
|
ж)
|
дисоциационна константа (рKа) [Насоки на ОИСР 112] (13);
|
|
з)
|
химична структура на изпитваното вещество и положение на етикетирания(те) изотоп(и), ако има.
|
Забележка: Трябва да бъде отчетена температурата, при която са направени тези измервания.
Друга полезна информация може да включва данни за токсичността на изпитваното вещество към микроорганизмите, данни за действителната и/или наследствената способност за биоразграждане и данни за аеробната и анаеробната трансформация в почвата.
Трябва да има налични аналитични методи (включително методи за екстракция и почистване) за количествено определяне и идентифициране на изпитваното вещество и неговите продукти от трансформацията във вода и в седимент (вж. точка 1.7.2).
1.5. ПРИНЦИП НА МЕТОДА ЗА ИЗПИТВАНЕ
Методът, описан в настоящото изпитване, използва аеробна и анаеробна водна седиментна система (вж. приложение 1), която позволява:
|
i)
|
измерването на нивото на трансформация на изпитваното вещество във водноседиментна система,
|
|
ii)
|
измерването на нивото на трансформация на изпитваното вещество в седимента,
|
|
iii)
|
измерването на степента на минерализация на изпитваното вещество и/или неговите продукти от трансформацията (когато се използва изпитвано вещество, маркирано с14С),
|
|
iv)
|
идентифициране и количествено определяне на продуктите от трансформацията във водната и седиментната фаза, в това число масов баланс (когато се използва маркирано вещество),
|
|
v)
|
измерването на разпределението на изпитваното вещество и неговите продукти от трансформацията между двете фази през периода на инкубиране на тъмно (да се избягват, например, цветове от морски водорасли) при постоянна температура. Стойностите на времената на полуразпадите, DT50, DT75 и DT90 ce определят, когато данните се потвърждават, но не трябва да бъдат екстраполирани дълго след експерименталния период (вж. точка 1.2).
|
Най-малко два седимента и свързаните с тях води са необходими за аеробните и респективно за анаеробните изпитвания (7). Въпреки това може да има случаи, при които да бъдат използвани повече от два водни седимента, например при химикал, който може да присъства в сладководни води и/или в морска среда.
1.6. ПРИЛОЖИМОСТ НА ИЗПИТВАНЕТО
Този метод е общоприложим за химичните вещества (немаркирани или маркирани), за които има аналитичен метод с достатъчна точност и чувствителност. Той е приложим за слаболетливи, нелетливи, водоразтворими или слаборазтворими във вода съединения. Изпитването не трябва да бъде прилагано за химикали, които при контакт с вода стават силно летливи (напр. опушващи средства, органични разтворители) и поради това не биха могли до бъдат запазени във водата и/или седимента при експерименталните условия на настоящото изпитване.
Методът се прилага и за проучване на трансформацията на химикалите в сладководни води и седименти, но по принцип също може да бъде приложен за естуарни/морски системи. Той не е подходящ за симулиране условията в течащи води (напр. реки) или открито море.
1.7. КРИТЕРИИ ЗА КАЧЕСТВО
1.7.1. Възстановяване
Екстрахиране и анализиране на най-малко две водни и седиментни проби веднага след добавяне на изпитваното вещество дават първоначална индикация за повторяемостта на аналитичния метод и за еднаквото прилагане на апликационната процедура при изпитваното вещество. Възстановяванията на по-късните етапи на експеримента се представят чрез съответните масови баланси (когато се използва маркиран материал). Възстановяванията трябва да бъдат в обхвата от 90 % до 110 % за маркирани химикали (6) и от 70 % до 110 % за немаркирани химикали.
1.7.2. Повторяемост и чувствителност на аналитичния метод
Повторяемостта на аналитичния метод (с изключение на първоначалната екстракционна ефективност) за количествено определяне на изпитваното вещество и продуктите от трансформацията може да бъде проверена чрез дублиращи се анализи на едни и същи водни или седиментни проби, които са били инкубирани достатъчно дълго време, за да се образуват продуктите от трансформацията.
Границата на аналитичния метод за откриване (LOD) на изпитваното вещество и на продуктите от трансформацията трябва да бъде поне 0,01 mg.kg-l във вода или в седимент (като изпитвано вещество) или 1 % от началното количество, приложено на системата за изпитване; разглежда се стойността, която е по ниска. Трябва да бъде определена също и границата за количествено определяне на метода (LOQ).
1.7.3. Прецизност на данните от трансформацията
Регресионният анализ на концентрациите на изпитваното вещество като функция от времето дава подходяща информация за надеждността (прецизността) на кривата на трансформация и позволява да се изчислят доверителните интервали на полуразпада (ако се прилага псевдокинетика от първи клас или стойностите на DT50 и, ако е подходящо, стойностите на DT75 и DT90.
1.8. ОПИСАНИЕ НА МЕТОДА
1.8.1. Система и апаратура за изпитването
Изпитването трябва да бъде провеждано в стъклени контейнери (напр. бутилки, центрофужни епруветки), освен ако предварително известната информация (такава като коефициента на съотношението n-октанол-вода, сорбционните данни и др.) показва, че изпитваното вещество може да се прилепи към стъклото, като в този случай трябва да се помисли за използване на алтернативен материал (като тефлон). Когато е известно, че изпитваното вещество прилепва към стъклото, може да е възможно за разрешаването на този проблем да се използват един или повече от следните методи:
|
—
|
определяне на сорбираната от стъклото маса на изпитваното вещество и продуктите от трансформацията;
|
|
—
|
осигуряване на разтворител за почистване на цялата стъклария в края на експеримента;
|
|
—
|
използване на образуваните продукти (вж. също точка 1.9.2);
|
|
—
|
използване на по-голямо количество съразтворител за добавяне на изпитвано вещество към системата; ако се използва съразтворител, той не трябва да солволизира изпитваното вещество.
|
Примери за типичната апаратура за изпитване, т.е. газопроточна и биометричен тип системи, са представени съответно в приложения 2 и 3 (14). Други инкулационни системи, които биха били от полза, са описани в позоваване 15. Дизайнът на експерименталната апаратура трябва да позволява обмена на въздух или азот и улавянето на летливите продукти. Размерите на апаратурата трябва да бъдат такива, че да отговарят на изискванията на изпитването (вж. точка 1.9.1). Вентилацията може да бъде осигурена или чрез лек барботаж (леко кипене), или чрез продухване с въздух или азот над водната повърхност. В друг случай леко разбъркване на водата може да бъде препоръчано за по-добро разпределение на кислорода или азота във водата. Свободният от СО2 въздух не трябва да се използва, тъй като той може да причини като резултат нарастване на pH на водата. От друга страна, трябва да бъде избягвано въздействието върху седимента, доколкото е възможно. Слабо летливите химикали трябва също да бъдат изпитвани в биометричен тип система с леко разбъркване на водната повърхност. Може да се използват също затворени съдове, пространството в горната част на които е заето от атмосферен въздух или азот и от вътрешни ампули за улавяне на летливи продукти (16). При аеробно изпитване се изисква редовен обмен на газа в горното пространство, за да се компенсира консумацията на кислород от биомасата.
Подходящи уловители за събиране на летливите продукти от трансформацията включват, без да се ограничават до 1 mol.dm-3, разтвори на калиев хидроксид или натриев хидроксид за въглероден диоксид (57) и етилен гликол, етаноламин или 2 % парафин в ксилен за органични съединения. Летливите съединения, образувани при анаеробни условия, като метан, могат да бъдат събрани, например чрез молекулни отсявания. Такива летливи съединения могат да бъдат изгаряни, например до СО2, чрез преминаване на газа през кварцова тръба, напълнена с CuO при температура 900 oС и улавяне на образувания СО2 в абсорбер с алкали (17).
Изисква се използването на лабораторен инструментариум за химичните анализи на изпитваното вещество (напр. газотечна хроматография (GLC), високоефективна течна хроматография (HPLC), тънкослойна хроматография (TLC), масспектрометрия (MS), газ-хроматография-масспектрометрия (GC-MS), течна хроматография-масспектрометрия (LC-MS), ядрено-магнитен резонанс (NMR) и други), включително системи за откриване на химикали с маркиран радиоактивен изотоп и немаркирани химикали, ако е подходящо. Когато се използва материал с маркиран радиоактивен изотоп, се изисква да има също течен сцинтилационен брояч (детектор) и окислител за горенето (за изгарянето на седиментни проби преди анализиране за радиоактивност).
Изисква се и друго подходящо стандартно лабораторно оборудване, стъклария, химикали и реагенти за физикохимични и биологични определяния (вж. таблица 1, точка 1.8.2.2).
1.8.2. Избор и брой на водните седименти
Местата за вземане на проби трябва да бъдат избрани в съответствие с целта на изпитването за всяка ситуация. За избраните места за вземане на проби трябва да бъде обстойно разгледана историята на възможните земеделски, промишлени или битови влияния (намеси) и на насрещните води (водите срещу течението). Седиментите не трябва да бъдат използвани, ако са замърсени с изпитваното вещество или негови структурни аналози през предходните 4 години.
1.8.2.1. Избор на седимент
Обикновено за аеробни изпитвания се използват два седимента (7). Двата избрани седимента трябва да се различават по съдържание на органичен въглерод и структура. Единият седимент трябва да има високо съдържание на органичен въглерод (2,5—7,5 %) и дребнозърнеста (фина) структура, а другият седимент трябва да има ниско съдържание на органичен въглерод (0,5—2,5 %) и едрозърнеста структура. Обикновено разликата в съдържанието на органичен въглерод в седиментите трябва да бъде поне 2 %. „Дребнозърнеста (фина) структура“ се дефинира като съдържание на [глина + нанос] (58) > 50 %, а „едрозърнеста структура“ се дефинира като съдържание на [глина + нанос] < 50 %. Разликата в съдържанието на [глина + нанос] при двата седимента обикновено трябва да бъде поне 20 %. В случаите, при които химикал може да бъде открит също в морски води, поне една от водноседиментните системи трябва да бъде от морски произход.
За стриктното провеждане на анаеробно изпитване трябва да бъдат взети като проби два седимента (включително асоциираните им води) от анаеробните зони на повърхностен водоизточник (7). И седиментната, и водната фаза трябва внимателно да бъдат обработвани и транспортирани в отсъствие на кислород.
Може да има други параметри, които да са важни при избора на седименти, като те се разглеждат за всеки отделен случай. Например pH обхватът на седиментите е важен за изпитвани химикали, за които трансформацията и/или сорбцията могат да бъдат зависими от pH. Върху pH зависимостта на сорбцията може да се въздейства чрез рKа на изпитваното вещество.
1.8.2.2. Охарактеризиране на водноседиментните проби
Ключовите параметри, които трябва да бъдат измерени и отчетени (с препратка към избрания метод) и при водата, и при седимента, и етапът от изпитването, при който тези параметри са били определени, се резюмират в таблицата по-долу. За информация, в препратки (18) (19) (20) (21) са представени методи за определяне на тези параметри.
В допълнение, може да е необходимо да бъдат измерени и отчетени други параметри, определяни за всеки отделен случай (напр. за сладки води: частици, алкалност, твърдост, проводимост, NO3/PO4 (съотношение и индивидуални стойности); за седименти: способност за катионен обмен, способност за задържане на вода, карбонат, общи азот и фосфор; и за морски системи: соленост. Анализиране на седиментите и водите за нитрати, сулфонати, бионалично (биологично годно) желязо и други възможни електронни аксептори също може да бъде от полза при оценяването на окислително-редукционните условия, особено във връзка с анаеробната трансформация.
Измервания на параметрите за охарактеризиране на водноседиментните проби (7)(22)(23)
|
Параметър
|
Етап от процедурата за изпитване
|
|
място за вземане на пробите
|
последваща обработка
|
начало на аклиматизацията
|
начало на изпитването
|
по време на изпитването
|
край на изпитването
|
|
Вода
|
|
Произход/източник
|
X
|
|
|
|
|
|
|
Температура
|
X
|
|
|
|
|
|
|
pH
|
X
|
|
X
|
X
|
X
|
X
|
|
TOC
|
|
|
X
|
X
|
|
X
|
|
Концентрация на 02*
|
X
|
|
X
|
X
|
X
|
X
|
|
Редоксипотенциал*
|
|
|
X
|
X
|
X
|
X
|
|
Седимент
|
|
Произход/източник
|
X
|
|
|
|
|
|
|
Дебелина на слоя
|
X
|
|
|
|
|
|
|
pH
|
|
X
|
X
|
X
|
X
|
X
|
|
Разпределение на частиците по размер
|
|
X
|
|
|
|
|
|
TOC
|
|
X
|
X
|
X
|
|
X
|
|
Микробна биомаса (59)
|
|
X
|
|
X
|
|
X
|
|
Редоксипотенциал (60)
|
Наблюдения (цвят/мирис)
|
|
X
|
X
|
X
|
X
|
1.8.3. Събиране, обработване и съхранение
1.8.3.1. Събиране
При вземането на проби от седимент трябва да бъде използвано Проекторъководството на ISO за вземане на проби от основата на седимента (8). Седиментните проби трябва да бъдат взети от целия по-горен слой на седимента на дълбочина от 5 до 10 cm. Асоциираната с него вода трябва да бъде събрана от същото място или местоположение и по същото време, както при седимента. За анаеробно изпитване пробите от седимент и асоциирана вода трябва да бъдат взети и транспортирани в отсъствие на кислород (28) (вж. точка 1.8.2.1). В позовавания (8) (23) са описани някои устройства за вземане на проби.
1.8.3.2. Обработване
Седиментът се отделя от водата чрез филтруване и във влажен вид се пресява през 2 mm сито чрез използване на допълнително добавена вода, която след това се отделя. Тогава определените количества седименти и вода се смесват в желаното съотношение (вж. точка 1.9.1) в инкубационните колби и се подготвят за аклиматизационния период (вж. точка 1.8.4). За анаеробно изпитване всички етапи на обработване трябва да бъдат провеждани в отсъствие на кислород (29) (30) (31) (32) (33).
1.8.3.3. Съхранение
Силно се препоръчва употребата на пресни проби седимент и вода, но ако е необходимо съхранение, седиментът и водата трябва да бъдат пресети, както е описано по-нагоре, и съхранявани заедно (6 — 10 cm воден слой), на тъмно, при 4 ± 2 oС в продължение на максимум 4 седмици (7) (8) (23). Пробите, които ще бъдат използвани за аеробни изпитвания, трябва да бъдат съхранявани при свободен достъп на въздух (напр. в отворени контейнери), докато тези за анаеробно изпитване – в отсъствие на кислород. Не трябва да се допуска замръзване на седимента и водата и изсъхване на седимента по време на транспортирането и съхранението.
1.8.4. Подготовка на седиментните/водните проби за изпитването
Подготовката трябва да премине през период на аклиматизация, преди да се добави изпитваното вещество към всяка седиментна/водна проба, която е била поставена в инкубационен съд, да бъде използвана в основното изпитване и аклиматизацията да бъде проведена при точно спазване на същите условия, както при инкубирането за изпитването (вж. точка 1.9.1). Аклиматизационният период е времето, необходимо за достигане на приемлива стабилност на системата, което се отразява на pH, концентрацията на кислород във водата, редоксипотенциалите на седимента и водата и макроскопското разделяне на фазите. Периодът за аклиматизация обикновено трябва да продължи между една и две седмици и не трябва да превишава четири седмици. Резултатите от направените през този период определяния трябва да бъдат отчетени.
1.9. ПРОВЕЖДАНЕ НА ИЗПИТВАНЕТО
1.9.1. Условия на изпитването
Изпитването трябва да се провежда в инкубационна апаратура (вж. точка 1.8.1) при обемно съотношение вода-седимент между 3:1 и 4:1, и седиментен слой 2,5 cm (±0,5 cm) (61). Препоръчва се минималното количество на седимента да е 50 g (сухо тегло) за инкубационен съд.
Изпитването трябва да се провежда на тъмно, при постоянна температура, в обхвата от 10 до 30 oС. Подходящата температура е (20 ± 2) oС. Когато е подходящо, при отделни случаи може да бъде приложена допълнителна по-ниска температура (напр. 10 oС), в зависимост от информацията, която следва да бъде осигурена от изпитването. Инкубационната температура трябва да бъде наблюдавана и отчитана.
1.9.2. Обработване и прилагате на изпитваното вещество
Използва се една концентрация за изпитване на химикала (62). При препаратите за защита на зърнените култури химикалите се прилагат директно чрез напоителните съоръжения, като се вземе предвид максималната доза, указана на етикета като максимално апликационно ниво, което е изчислено въз основа на повърхността (площта) на водата в съда за изпитване. При всички други случаи използваната концентрация трябва да се базира на предположенията за емисиите в околната среда. Трябва да се обърне внимание на осигуряването на подходящата концентрация на изпитваното вещество, която ще се приложи за охарактеризиране на пътя на трансформацията, и образуването и намаляването на продуктите от трансформацията. Може да се наложи да се приложат по-високи дози (напр. 10 пъти) в ситуации, при които концентрациите на изпитваното вещество са близки до границите на откриване в началото на експеримента и/или основните продукти от трансформацията не могат лесно да бъдат открити, при наличие на 10 % апликационно ниво на изпитваното вещество. Въпреки това, ако се използват по-високи концентрации, те не трябва да оказват значително вредно въздействие върху микробната активност на водноседиментната система. За да се постигне постоянна концентрация на изпитваното вещество в съдове с различни размери, може да бъде представено съответното уточнение за количеството приложен материал въз основа на дълбочината на водната колона в съда, във връзка с дълбочината на водата на повърхността (която се приема, че е 100 cm, но могат да се използват и други дълбочини). Вж. приложение 4 за примерно изчисление.
В идеалния случай изпитваното вещество трябва да бъде приложено като воден разтвор във водната фаза на изпитваната система. Ако е невъзможно да се избегне, се приема употребата в малки количества на водосмесими разтворители (такива, като ацетон, етанол) за апликиране и разпределение на изпитваното вещество, но те трябва да не надвишават 1 % об/об и не трябва да оказват вредно въздействие върху микробната активност на изпитваната система. Трябва да се внимава при приготвянето на водните разтвори на изпитваното вещество, за да се осигури пълно хомогенизиране, може да бъде подходящо използването на генериращи колони и предварително смесване. При следващо добавяне на водния разтвор в изпитваната система се препоръчва леко смесване на водната фаза, което, доколкото е възможно, да не засегне седимента.
Обикновено не се препоръчва употребата на образуваните продукти, тъй като образуваните съставки могат да повлияят на разпределението на изпитваното вещество и/или продуктите от трансформацията между водната и седиментната фаза. Въпреки това, при слаборазтворими във вода изпитвани вещества, употребата на образувания материал може да бъде подходяща алтернатива.
Броят на инкубационните съдове зависи от броя на пробните времена (вж. точка 1.9.3). В изпитването трябва да бъдат включени достатъчно на брой системи за изпитване, така че при всяко пробно време по две системи да могат да бъдат „пожертвани“. Когато се оставят контролни сектори във всяка водноседиментна система, те не трябва да бъдат третирани с изпитваното вещество. Контролните сектори могат да бъдат използвани за определяне на микробната биомаса на седимента и на общия органичен въглерод на водата и седимента при завършване на изпитването. Два от контролните сектори (т.е. един контролен сектор от всеки воден седимент) могат да бъдат използвани за наблюдение на изискваните параметри в седимента и водата по време на аклиматизационния период (вж. таблицата в точка 1.8.2.2). Трябва да бъдат включени два допълнителни контролни сектора за измерване на вредните въздействия върху микробната активност на изпитваната система, в случай че изпитваното вещество се прилага чрез разтворител.
1.9.3. Продължителност на изпитването и вземане на проби
Обикновено продължителността на експеримента не трябва да превишава 100 дни (6) и трябва да продължи до установяване на пътя на разграждане и модела на разпределение вода/седимент или когато 90 % от изпитваното вещество е разпръснато поради трансформация и/или летливост. Броят на пробните времена трябва да бъде най-малко шест (включително нулево време), като се провежда незадължително предварително изпитване (вж. точка 1.9.4), за да се установят подходящият режим на пробите и продължителността на изпитването, освен ако има достатъчно налични данни за изпитваното вещество от предишни изпитвания. За хидрофобни изпитвани вещества може да бъдат необходими допълнителни пробоотборни точки в началния период на изпитването, за да се определи степента на разпределение между водната и седиментната фаза.
При съответните пробни времена всички инкубационни съдове (с репликите) се изваждат за анализ. Седиментът и покриващата го вода се анализират поотделно (63). Повърхностната вода трябва внимателно да бъде отстранена при минимално въздействие върху седимента. Екстрахирането и охарактеризирането на изпитваното вещество и на продуктите от трансформацията трябва да следват подходящата аналитична процедура. Трябва да бъде обърнато внимание на отделянето на материала, който може да бъде адсорбиран от инкубационния съд, или на използваните свързващи тръби за улавяне на летливи съединения.
1.9.4. Възможно (незадължително) предварително изпитване
Ако продължителността и режимът за вземане на проби не могат да бъдат оценени по други съответстващи изследвания на изпитващото вещество, може да бъде счетено за подходящо провеждането на незадължително предварително изпитване, което трябва да бъде проведено при същите условия на изпитване както прилаганите в окончателното изпитване. Съответните експериментални условия и резултатите от предварителното изпитване, ако е проведено такова, трябва кратко да бъдат отчетени.
1.9.5. Измервания и анализи
Концентрацията на изпитваното вещество и на продуктите от трансформацията за всяко пробно време във водата и в седимента трябва да бъде измерена и отчетена (като концентрация и като процент на приложената). Най-общо, продуктите от трансформацията, открити при ≥ 10 % приложена радиоактивност върху цялата водноседиментна система, при всяко пробно време, трябва да бъдат идентифицирани, освен ако не е посочено разумно обяснение. Продуктите от трансформацията, чиито концентрации непрекъснато нарастват по време на изпитването, също трябва да бъдат отчетени за идентифициране, дори ако техните концентрации не надвишават посочените по-горе граници, тъй като това може да индикира за устойчивост. Последните трябва да бъдат отчитани за всеки отделен случай и да се посочат в протокола заедно със съответните обяснения.
Резултатите от системите за улавяне на газове/летливи съединения (СО2 и други, т.е. летливи органични съединения) трябва да бъдат отчетени за всяко пробно време. Трябва да бъдат отчетени и степените на минерализация. Неекстрахируемите (крайните) остатъци в седимента също трябва да бъдат отчетени за всяка пробоотборна точка.
2. ДАННИ
2.1. ОБРАБОТВАНЕ НА РЕЗУЛТАТИТЕ
Общият масов баланс или възстановяването (вж. точка 1.7.1) на допълнителната радиоактивност се изчислява за всяко пробно време. Резултатите трябва да бъдат отчетени като резултат от допълнителната радиоактивност. Разпределението на радиоактивността между водата и седимента трябва да бъда отчетено като концентрации и като проценти за всяко пробно време.
Времето за полуразпад, DT50 и, ако е подходящо, DT75 и DT90 на изпитваното вещество трябва самостоятелно да бъдат изчислени с техните доверителни интервали (вж. точка 1.7.3). Информация за степента на разсейване на изпитваното вещество във водата и в седимента може да бъде получена чрез използването на подходящи инструменти за оценка. Те могат да обхващат: прилагане на псевдокинетика от първи порядък, техники, свързани с емпиричната крива, които прилагат графични или цифрови решения, и използване на по-комплексни оценки, например едно- или многостъпални модели. Повече подробности могат да бъдат получени от съответната публикувана литература (35) (36) (37).
Всички подходи имат своите силни и слаби страни и са разнообразни по отношение сложността им. Основно положение (предпоставка за избор) на кинетиката от първи порядък може да бъде свръхрационализирането (прекомерното опростяване) на процесите на разграждане и разпределение, а когато е възможно, тя предоставя показател (степенна константа или на полуразпад), който е лесно разбираем и стойността му се получава чрез използването на симулационен модел и изчисления при предвидими концентрации в околната среда. Емпиричните подходи или линейните трансформации могат да доведат до по-добра връзка между кривите и данните, и следователно да позволят по-точно определяне на стойностите на времето за полуразпад, DT50 и, ако е подходящо, DT75 и DT90. Използването на диференцирани константи обаче е ограничено. Степенните модели могат да създадат определени константни величини, които да са от полза при оценката на риска, описват степента на разграждане при различните степени и разпределението на химикала. Те трябва да бъдат използвани също при оценяване на степенните константи на образуване и разграждане на основните продукти от трансформацията. При всички случаи изборът на конкретния метод трябва да бъде обоснован и експериментаторът трябва графично и/или статистически да демонстрира преимуществата му.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. ПРОТОКОЛ ОТ ИЗПИТВАНЕТО
Протоколът от изпитването трябва да включва следната информация:
|
|
Изпитвано вещество:
|
—
|
търговско наименование, химично наименование, CAS номер, структурна формула (показваща положението на етикета(ите), когато се използва материал с маркиран радиоактивен изотоп) и съответните физикохимични свойства;
|
|
—
|
степен на чистота (примеси) на изпитваното вещество;
|
|
—
|
радиохимична степен на чистота на маркиран химикал и моларна активност (където е подходящо).
|
|
|
|
Вещества за сравнение:
|
—
|
химично наименование и структура на веществата за сравнение, използвани за охарактеризиране и/или идентифициране на продуктите от трансформацията.
|
|
|
|
Изпитвани седименти и води:
|
—
|
местоположение и описание на местата за вземане на водни седиментни проби, включително, ако е възможно, история на замърсяването;
|
|
—
|
цялата информация, свързана със събирането, съхранението (ако има) и аклиматизирането на водноседиментните системи;
|
|
—
|
характеристики на водноседиментните проби, както е посочено в таблицата от точка 1.8.2.2.
|
|
|
|
Условия на изпитването:
|
—
|
използвана система за изпитване (напр. проточна, биометрична, начин на вентилация, метод за разбъркване, обем на водата, маса на седимента, дебелина на двата слоя – воден и седиментен, размери на съдовете за изпитване и др.);
|
|
—
|
прилагане на изпитваното вещество в системата за изпитване: използвана концентрация за изпитване, брой на репликите и контролите, начин на прилагане на изпитваното вещество (напр. употреба на разтворител, ако има) и др.;
|
|
—
|
инкубационна температура;
|
|
—
|
екстракционни методи и тяхната ефективност, както и аналитични методи и граници на откриване;
|
|
—
|
методи за охарактеризиране/идентифициране на продуктите от трансформацията;
|
|
—
|
отклонения от протокола за изпитването или условията на изпитването по време на експеримента.
|
|
|
|
Резултати:
|
—
|
фигури със „сурови“ (необработени) данни от представителни анализи (всички „сурови“ данни трябва да бъдат съхранени в GLP-архив);
|
|
—
|
повторяемост и чувствителност на използваните аналитични методи;
|
|
—
|
степени на възстановяване ( % стойности за валиден експеримент са посочени в точка 1.7.1);
|
|
—
|
таблици с резултати, изразени като процент на приложената доза и в mg.kg-l във вода, седимент и цялата система (само в проценти), на изпитваното вещество и, ако е подходящо, на продуктите от трансформацията и неекстрахируемата радиоактивност;
|
|
—
|
масов баланс по време и в края на изпитванията;
|
|
—
|
графично представяне на трансформацията във водната и седиментната фракция и в цялата система (включително минерализация);
|
|
—
|
степени на минерализация;
|
|
—
|
стойности на времето на полуразпад, DT50 и, ако е подходящо, на DT75 и DT90 за изпитваното вещество и, където е подходящо, за основните продукти от трансформацията, включително доверителни интервали във вода, седимент и в цялата система;
|
|
—
|
оценка на кинетиката на трансформацията на изпитваното вещество и, където е подходящо, на основните продукти от трансформацията;
|
|
—
|
предлагани пътища на трансформация, където е подходящо;
|
|
—
|
обсъждане на резултатите.
|
|
4. ПРЕПРАТКИ
|
(1)
|
BBA-Guidelines for the examination of plant protectors in the registration process. (1990). Part IV, Section 5—1: Degradability and fate of plant protectors in the water/sediment system. Germany.
|
|
(2)
|
Commission for registration of pesticides: Application for registration of a pesticide. (1991). Part G. Behaviour of the product and its metabolites in soil, water and air, Section G.2.1 (a). The Netherlands.
|
|
(3)
|
MAFF Pesticides Safety Directorate. (1992). Preliminary guideline for the conduct of biodegradability tests on pesticides in natural sediment/water systems. Ref № SC 9046. United-Kingdom.
|
|
(4)
|
Agriculture Canada: Environmental chemistry and fate. (1987). Guidelines for registration of pesticides in Canada. Aquatic (Laboratory) — Anaerobic and aerobic. Canada, pp 35—37.
|
|
(5)
|
US-EPA: Pesticide assessment guidelines, Subdivision N. Chemistry: Environmental fate (1982). Section 162—3, Anaerobic aquatic metabolism.
|
|
(6)
|
SETAC-Europe publication. (1995). Procedures for assessing the environmental fate and ecotoxicity of pesticides. Ed. Dr Mark R. Lynch. SETAC-Europe, Brussels.
|
|
(7)
|
OECD Test Guidelines Programme. (1995). Final Report of the OECD Workshop on Selection of Soils/sediments, Belgirate, Italy, 18—20 January 1995.
|
|
(8)
|
ISO/DIS 5667—12. (1994). Water quality — Sampling — Part 12: Guidance on sampling of bottom sediments.
|
|
(9)
|
US-EPA (1998a). Sediment/water microcosm biodegradation test. Harmonised Test Guidelines (OPPTS 835.3180). EPA 712-C-98-080.
|
|
(10)
|
DFG: Pesticide Bound Residues in Soil. Wiley-VCH (1998).
|
|
(11)
|
T.R. Roberts: Non-extractable pesticide residues in soils and plants. Pure Appl. Chem. 56, 945—956 (IUPAC 1984).
|
|
(12)
|
OECD Test Guideline 304A: Inherent Biodegradability in Soil (adopted 12 May 1981).
|
|
(13)
|
OECD (1993): Guidelines for Testing of Chemicals. Paris. OECD (1994-2000): Addenda 6-11 to Guidelines for the Testing of Chemicals.
|
|
(14)
|
Scholz, K., Fritz R., Anderson C. and Spiteller M. (1988) Degradation of pesticides in an aquatic model ecosystem. BCPC — Pests and Diseases, 3B-4, 149—158.
|
|
(15)
|
Guth, J. A. (1981). Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry (D.H. Hutson, T.R. Roberts, Eds.), Vol. 1, 85-114. J. Wiley & Sons.
|
|
(16)
|
Madsen, T., Kristensen, P. (1997). Effects of bacterial inoculation and non-ionic surfactants on degradation of polycyclic aromatic hydrocarbons in soil. Environ. Toxicol. Chem. 16, 631—637.
|
|
(17)
|
Steber, J., Wierich, P. (1987). The anaerobic degradation of detergent range fatty alcohol ethoxylates. Studies with 14C-labelled model surfactants. Water Research 21, 661—667.
|
|
(18)
|
Black, C. A. (1965). Methods of Soil Analysis. Agronomy Monograph №. 9. American Society of Agronomy, Madison.
|
|
(19)
|
APHA (1989). Standard Methods for Examination of Water and Wastewater (17th edition). American Public Health Association, American Water Works Association and Water Pollution Control Federation, Washington D.C.
|
|
(20)
|
Rowell, D. L. (1994). Soil Science Methods and Applications. Longman.
|
|
(21)
|
Light, T. S. (1972). Standard solution for redox potential measurements. Anal. Chemistry 44, 1038—1039.
|
|
(22)
|
SETAC-Europe publication (1991). Guidance document on testing procedures for pesticides in freshwater mesocosms. From the Workshop ’A Meeting of Experts on Guidelines for Static Field Mesocosms Tests’, 3—4 July 1991.
|
|
(23)
|
SETAC-Europe publication. (1993). Guidance document on sediment toxicity tests and bioassays for freshwater and marine environments. From the Workshop On Sediment Toxicity Assessment (WOSTA), 8—10 November 1993. Eds.: I. R. Hill, P. Matthiessen and F. Heimbach.
|
|
(24)
|
Vink, J. P. M., van der Zee, S. E. A. T. M. (1997). Pesticide bioтрaнсformation in surface waters: multivariate analyses of environmental factors at field sites. Water Research 31, 2858—2868.
|
|
(25)
|
Vink, J. P. M., Schraa, G., van der Zee, S. E. A. T. M. (1999). Nutrient effects on microbial трaнсformation of pesticides in nitrifying waters. Environ. Toxicol, 329—338.
|
|
(26)
|
Anderson, T. H., Domsch, K. H. (1985). Maintenance carbon requirements of actively-metabolising microbial populations under in-situ conditions. Soil Biol. Biochem. 17, 197—203.
|
|
(27)
|
ISO-14240-2. (1997). Soil quality — Determination of soil microbial biomass — Part 2: Fumigationextraction method.
|
|
(28)
|
Beelen, P. Van and F. Van Keulen. (1990), The Kinetics of the Degradation of Chloroform and Benzene in Anaerobic Sediment from the River Rhine. Hydrobiol. Bull. 24 (1), 13—21.
|
|
(29)
|
Shelton, D. R. and Tiedje, J. M. (1984). General method for determining anaerobic biodegradation potential. App. Environ. Microbiol. 47, 850—857.
|
|
(30)
|
Birch, R. R., Biver, C, Campagna, R., Gledhill, W. E., Pagga, U., Steber, J., Reust, H. and Bontinck, W. J. (1989). Screening of chemicals for anaerobic biodegradation. Chemosphere 19, 1527—1550.
|
|
(31)
|
Pagga, U. and Beimborn, D. B. (1993). Anaerobic biodegradation tests for organic compounds. Chemoshpere 27, 1499—1509.
|
|
(32)
|
Nuck, B. A. and Federle, T. W. (1986). A batch test for assessing the mineralisation of 14C-radiolabelled compounds under realistic anaerobic conditions. Environ. Sci. Technol. 30, 3597—3603.
|
|
(33)
|
US-EPA (1998b). Anaerobic biodegradability of organic chemicals. Harmonised Test Guidelines (OPPTS 835.3400). EPA 712-C-98-090.
|
|
(34)
|
Sijm, Haller and Schrap (1997). Influence of storage on sediment characteristics and drying sediment on sorption coefficients of organic contaminants. Bulletin Environ. Contam. Toxicol. 58, 961—968.
|
|
(35)
|
Timme, G., Frehse H. and Laska V. (1986) Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues II. Pflanzenschutz — Nachrichten Bayer, 39, 187—203.
|
|
(36)
|
Timme, G., Frehse, H. (1980) Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues I. Pflanzenschutz — Nachrichten Bayer, 33, 47—60.
|
|
(37)
|
Carlton, R. R. and Allen, R. (1994). The use of a compartment model for evaluating the fate of pesticides in sediment/water systems. Brighton Crop Protection Conference — Pest and Diseases, pp 1349—1354.
|
Приложение 1
РЪКОВОДСТВО ЗА АЕРОБНИ И АНАЕРОБНИ СИСТЕМИ ЗА ИЗПИТВАНЕ
Аеробна система за изпитване
Аеробната система за изпитване, описана в настоящия метод, се състои от аеробен воден слой (обикновено концентрациите на кислород са в обхвата от 7 до 10 mg.l-l) и седиментен слой, аеробен на повърхността и анаеробен под повърхността (обикновено средната стойност на редоксипотенциала (Eh) в анаеробната зона на седимента е в обхвата от – 80 до – 190 mV). Над повърхността на водата във всяка инкубационна единица преминава влажен въздух, за да се поддържа достатъчно количество кислород в горното пространство.
Анаеробна система за изпитване
При анаеробната система за изпитване процедурата за изпитване основно е същата както тази, изложена за аеробната система за изпитване, с изключение на това, че над повърхността на водата във всяка инкубационна единица преминава влажен азот, за да се поддържа достатъчно количество азот в горното пространство. Седиментът и водата се разглеждат като анаеробни, щом редоксипотенциалът (Eh) е по-нисък от – 100 mV.
При анаеробно изпитване оценката на минерализацията включва измерване на отделените въглероден диоксид и метан.
Приложение 2
ПРИМЕР ЗА ГАЗОПРОТОЧНА АПАРАТУРА

Приложение 3
ПРИМЕР ЗА БИОМЕТРИЧНА АПАРАТУРА

Приложение 4
ПРИМЕРНО ИЗЧИСЛЕНИЕ НА АПЛИКАЦИОННАТА ДОЗА ЗА СЪДОВЕТЕ ЗА ИЗПИТВАНЕ
|
Вътрешен диаметър на цилиндъра:
|
= 8 cm
|
|
Дълбочина на водната колона, несъдържаща седимент:
|
= 12 cm
|
|
Повърхностна площ: 3,142 × 42
|
50,3 cm2
|
|
Апликационно ниво: 500 g изпитвано вещество/ha съответстват на 5 μg/cm2
|
|
|
Общо μg: 5 × 50,3
|
= 251,5 μg
|
|
Пригодено количество към дълбочина 100 cm: 12 × 251,5 ÷ 100
|
= 30,18 μg
|
|
Обем на водната колона: 50,3 × 12
|
= 603 ml
|
|
Концентрация във вода: 30,18 ÷ 603
|
= 0,050 (μg/ml или 50 μg/l
|
(1) Резултатите от тези междулабораторни изпитвания и техническата поправка към ISO 6341 определят EC50 — 24 h на калиев дихромат (K2Сr2О7) в границите от 0,6 mg/1 до 1,7 mg/1.
(2) Вода с подходяща чистота, например дейонизирана, дестилирана или преминала обратна осмоза, като проводимостта ѝ за предпочитане не превишава 10 μS.cm-1. Среди Elendt M7 и M4
(3) D1 и D2 не следва да се осредняват, ако има значителна разлика помежду им.
(4) D1 и D2 не трябва да се осредняват, ако имат значителна разлика.
(5) Или в края на инкубацията.
(6) D1 и D2 не се осредняват, ако имат значителна разлика.
(7) или в края на инкубацията
(8) Не се изчислява средна стойност, ако има значителна разлика между повторенията.
(9) Не се изчислява средна стойност, ако има значителна разлика между повторенията.
(10) След използване разтворите, съдържащи живачни соли, следва да се обработят, за да се избегне разнасяне на живак в околната среда
(11) Мабей и Мил препоръчват използването на боратен или ацетатен буфер вместо фосфатен (11).
(12) Такава информация може да се получи от други източници като данни за хидролизата на съединения с подобен строеж от литературни източници или други предварителни, полуколичествени изпитвания за хидролиза на изпитваното вещество на по-ранен етап на развитие.
(13) Ако нанасянето на логаритмичните данни спрямо времето не показва линейна функция (равна на реакция от първи порядък), то използването на уравнение [3] не е подходящо за определяне на скоростната константа на хидролиза на изпитваното съединение.
(14) Стойностите на рН, докладвани в таблиците, са изчислени от измерване на потенциала, като са използвани стандартните уравнения на Sörensen (1909 г.). Съответните стойности на рН са с 0,04 единици по-високи, отколкото табличните стойности.
(15) Добавете малки кристали тимол или сходно вещество, за да предотвратите появата на мухъл.
(16) Средни стойности от трикратно отчитане.
(17) Meyer A., Orti G. (1993) Proc. Royal Society of London, Series B., Vol. 252, p. 231.
(18) Пробата вода след минимум три прехвърляния на обема на камерата.
Стойностите в скобите са броят на пробите (вода, риба), които трябва да се вземат, ако се прави допълнително вземане на проби.
|
Забележка
|
:
|
Предварително пресмятане на k2 за log Pow от 4,0 е 0,652 дни-1. Общата продължителност на експеримента е за 3 × up = 3 × 4,6 дни, т.е. 14 дни. За пресмятането на „up“ се обърнете към приложение 3.
|
(19) Meyer, A., Bierman, C. H. and Orti, G. (1993). The phytogenetic position of the zebrafish (Danio Rerio), a model system in developmental biology: an invitation to the comparative method. Proc. R. Soc. Lond. B. 252, 231—236.
(20) Серия от пет (и повече) успешни концентрации може да бъде избрана от една колона. Средните точки между концентрациите в колона (х) се намират в колона (2х + 1). Изброените стойности могат да представят концентрации, изразени като процент на количество или като тегло (mg/1 или μg/l). Стойностите могат да се умножават или делят на всички степени на 10, както е подходящо. Колона 1 може да се използва, ако е имало значителна несигурност за нивото на токсичност.
(21) ОИСР, Париж, 1992 г., Ръководство за извършване на изследвания 210, „Риби, изследване на токсичността в началните стадии“.
(22) За ембриони.
(23) За ларви.
(24) Тъмнина за ембриони и ларви до една седмица след изхвърлянето на хайвера, с изключение на времето, когато се наблюдават. По-късно по време на теста намалена светлина.
(25) Според ФАО и американската система (85).
(26) Съответните променливи следва да показват предимно стойности в дадения обхват. В случай обаче, че се появят трудности при намирането на подходящ почвен материал, приемат се стойности и под посочения минимум.
(27) Почви с наличие на по-малко от 0,3 % органичен въглерод могат да нарушат корелацията между органичното съдържание и адсорбцията. Следователно се препоръчва използването на почвите с минимално съдържание на органичен въглерод от 0,3 %.
(28) 
(29) Схемите на концентрацията на тестваното вещество във водната фаза  противоположно на времето също може да се използва за да изчисли постигането на равновесно плато (вж. фигура 2 в приложение 5).
противоположно на времето също може да се използва за да изчисли постигането на равновесно плато (вж. фигура 2 в приложение 5).
(30) DT-50: времето за разграждане на 50 % от тестваното вещество.
(31) W. Kördel, D. Hennecke, M. Herrmann (1997). Application of the HPLC-screening method for the determination of the adsorption coefficient on sewage sludges. Chemosphere, 35(1/2), 121—128.
(32) W. Kördel, D. Hennecke, C. Franke (1997). Determination of the adsorption-coefficients of organic substances on sewage sludges. Chemosphere, 35 (1/2), 107—119.
(33) W. Kördel, G. Kotthoff, J. Müller (1995). HPLC-screening method for the determination of the adsorption coefficient on soil-results of a ring test. Chemosphere, 30(7), 1373-1384.
(34) W. Kördel, J. Müller (1994). Bestimmung des Adsorptionskoeffizienten organischer Chemikalien mit der HPLC. UBA R & D Report No. 106 01 044 (1994).
(35) B.V. Oepen, W. Kördel, W. Klein. (1991). Chemosphere, 22, 285—304
(36) Údaje poskytnuté prumyslem.
(37) Посочва се кой съд е използван за експеримента.
(38) Записва се неразвитото поколение като „AB“ в съответната клетка.
(39) Записва се смъртността на всяко възрастно животно като „M“ в съответната клетка.
(40) Например, ако изпитваното вещество съдържа един пръстен, се изисква маркиране на този пръстен; ако изпитваното вещество съдържа два или повече пръстена, може да са необходими отделни изследвания за оценяване „жизнения цикъл“ на всеки маркиран пръстен, за да се придобие подходяща информация за образуването на продуктите от трансформацията.
(41) Способността на почвата да задържа вода може да бъде измерена като повърхностен капацитет или като водно налягане на всмукване (pF). За обяснение вж. приложение 1. В протоколите от изпитването трябва да бъде отчетено дали характеристиките на почвата, свързани със способността ѝ да задържа вода, и насипната ѝ плътност са определени в необработвани повърхностни проби или в обработвани (преработени) проби.
(42) Последните резултати от изследванията показват, че почвите от температурните зони могат също да бъдат съхранявани при - 20 oС за повече от три месеца (28)(29) без значителни загуби на микробната активност.
(43) Почвата не трябва да бъде нито твърде влажна, нито прекалено суха, за да се поддържат подходящи аерация и хранене на почвената микрофлора. Препоръчва се съдържанието на влага в почвата за оптимален микробиален растеж да е в обхват 40 — 60 % за способността за задържане на вода (WHC) и от 0,1 до 0,33 bar (6). Последният (от двата) обхват е еквивалентен на pF обхвата от 2,0 до 2,5. Характерните стойности на влажността на различните видове почви са посочени в приложение 2.
(44) Аеробните условия са доминиращи при повърхностни почви и дори при почви под повърхността, както е показано в един изследователски проект, финансиран от EU [К. Takagi et al. (1992). Microbial diversity and activity in subsoils: Methods, field site, seasonal variation in subsoil temperatures and oxygen contents. Proc. Internat. Symp. Environm. Aspects Pesticides Microbiol., 270-277, 17—21 August 1992, Sigtuna, Sweden]. Анаеробни условия могат да възникнат само от време на време (случайно) при наводнение на почвите след тежки проливни валежи от дъжд или когато се създадат наводнени условия в оризовите полета.
(45) Аеробните изпитвания могат да бъдат приключени в този момент (много преди осигурения 120-дневен период), при който ясно се констатира, че са достигнати крайният път на трансформиране и окончателната минерализация. Приключване на изпитването е възможно след 120 дни или при най-малко 90-процентна трансформация на изпитваното вещество, но само когато се е образувал най-малко 5 % CO2.
(46) Началната концентрация се изчислява въз основа на следното уравнение:

|
Csoil
|
=
|
начална концентрация в почвата[mg.kg-1]
|
|
A
|
=
|
апликационно ниво [kg.ha-1]; 1 = дебелина на почвения слой на полето [m]; d = насипна плътност на суха почва [kg.m3].
|
Практическо правило за получаване на резултати е прилагане на апликационно ниво от 1 kg.ha-1 при концентрации в почвата приблизително 1 mg.kg-1 в 10 cm слой (приема се насипна плътност от 1 g.cm3).
(47) Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt, Main.
(48) pF = log на cm воден стълб.
(49) 1 bar = 105 Pa.
(50) Съответства на приблизително водно съдържание от 10 % в пясък, 35 % в почва и 45 % в глина.
(51) Повърхностният капацитет не е константа, а варира с различните типове почва между pF 1,5 и 2,5.
(52) Способност за задържане на вода.
(53) Guth, J.A. (1980). The study of transformations. In Interactions between Herbicides and the Soil (R. J. Hance, Ed.), Academic Press, 123—157.
(54) Guth, J. A. (1981). Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry. D. H. Hutson, T. R. Roberts, Eds. J. Wiley & Sons. Vol 1,85—114.
(55) Anderson, J. P. E. (1975). Einfluss von Temperatur und Feuchte auf Verdampfung, Abbau und Festlegung von Diallat im Boden. Z. PflKrankh Pflschutz, Sonderheft VII, 141—146.
(56) Например ако веществото съдържа един пръстен, се изисква маркиране на този пръстен; ако изпитваното вещество съдържа два или повече пръстена, за оценяване на „жизнения цикъл“ на всеки маркиран пръстен може да бъде необходимо провеждане на отделни изпитвания, за да се получи подходяща информация за образуването на продуктите от трансформацията.
(57) Тъй като тези алкални абсорбционни разтвори също абсорбират въглероден диоксид от вентилиралия въздух и правят това чрез респирация при аеробни експерименти, на равни интервали от време те трябва да бъдат сменяни, за да се избегне тяхното насищане и поради това да се загуби тяхната абсорбционна способност.
(58) [Глина + нанос] е минералната фракция на седимента с размер на частиците < 50 μm.
(59) Метод на микробиалното респираторно ниво (26), метод за опушване (27) или измервания чрез преброяване върху плочка (напр. бактерии, актиномицети, фунги и общо колонии) при аеробни изпитвания; степен на метаногенеза при анаеробни изпитвания.
(60) Последните резултати от научните изследвания показват, че измерванията на концентрациите на кислорода във вода и на редоксипотенциалите не са нито механистични, нито предвидими стойности, доколкото зависят от растежа и развитието на микробните популации в повърхностните води (24) (25). Определянето на биохимичната потребност от кислород (BOD, при вземането на повърхностни проби, в началото и края на изпитването) и на концентрациите на микро/макрохрани Са, Mg и Мn (в началото и края на изпитването) във води и измерванията на общия N и общия Р в седименти (при вземането на повърхностни проби и в края на изпитването) могат да бъдат по-добри инструменти за интерпретиране и оценка на нивата и пътищата на аеробна биотрансформация.
(61) Последните изследвания показват, че съхранението при 4 oС може да доведе до намаляване на съдържанието на органичен въглерод в седимента, което има вероятност да доведе до понижаване на микробната активност (34).
(62) Провеждането на изпитване с втора концентрация може да бъде от полза при химикали, които попадат в повърхностните води чрез различни пътища на въвеждане, водещи до напълно различни концентрации, докато по-ниските концентрации могат да бъдат анализирани с достатъчна точност.
(63) В случаите, при които е възможно да се получи бързото преокисляване на продуктите от анаеробната трансформация, при вземането на проби и при анализирането трябва да бъдат поддържани анаеробни условия.





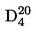 трябва да се съобщава по начина, определен в 1.2, заедно с физичното състояние на измерваните вещества.
трябва да се съобщава по начина, определен в 1.2, заедно с физичното състояние на измерваните вещества.
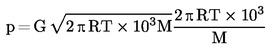

![]()
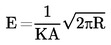 и представлява ефузионната константа на клетката.
и представлява ефузионната константа на клетката.

![]()

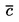 “ се дава с:
“ се дава с:
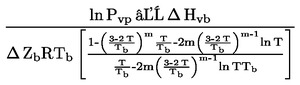












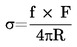








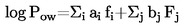











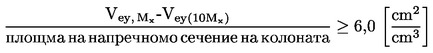










 (mN/m)
(mN/m)

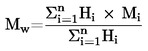



























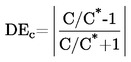















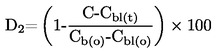




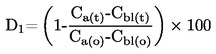

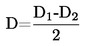
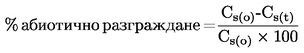
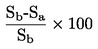


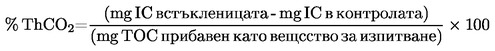








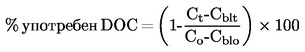










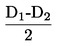


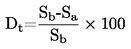
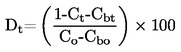




 mg/mg
mg/mg mg/mg
mg/mg










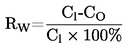
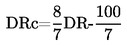
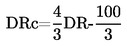
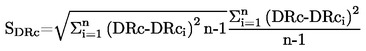















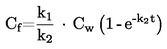
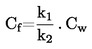 or
or 
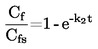
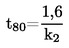

 or
or 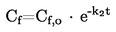
 or
or 
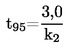
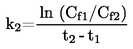

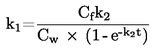

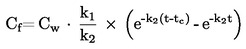



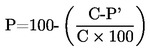



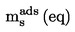




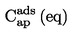

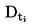



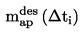










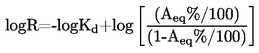

 се изчислява за всяко определено време (t
се изчислява за всяко определено време (t противоположно на времето (фигура 1, приложение 5) се генерира с цел да се изчисли постигането на равновесно плато
противоположно на времето (фигура 1, приложение 5) се генерира с цел да се изчисли постигането на равновесно плато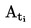 или
или  противоположно на времето, разрешава изчисляване на постигането на адсорбно равновесие и количеството адсорбирано тествано вещество по време на равновесие. Фигури 1 и 2 в приложение 5 показват примери за такива схеми. Времето на равновесие е това, което е необходимо на системата, за да достигне плато.
противоположно на времето, разрешава изчисляване на постигането на адсорбно равновесие и количеството адсорбирано тествано вещество по време на равновесие. Фигури 1 и 2 в приложение 5 показват примери за такива схеми. Времето на равновесие е това, което е необходимо на системата, за да достигне плато. и/или интервал от време
и/или интервал от време  (в съответствие с нуждата) и се изобразява графично противоположно на времето. Коефициента на разпределение К
(в съответствие с нуждата) и се изобразява графично противоположно на времето. Коефициента на разпределение К ) и/или за интервал от време (
) и/или за интервал от време (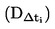 ) (В съответствие с нуждите на изследването) и се изобразява графично противоположно на времето. Коефициентът на десорбция К
) (В съответствие с нуждите на изследването) и се изобразява графично противоположно на времето. Коефициентът на десорбция К и адсорбция
и адсорбция  противоположно на времето позволяват изчисляването на обратимостта на процеса на адсорбция. Ако равновесието на десорбция се постигне дори при двойно време от постигане равновесието на адсорбция и общата десорбция е повече от 75 % от адсорбираното количество, се счита, че адсорбцията е обратима.
противоположно на времето позволяват изчисляването на обратимостта на процеса на адсорбция. Ако равновесието на десорбция се постигне дори при двойно време от постигане равновесието на адсорбция и общата десорбция е повече от 75 % от адсорбираното количество, се счита, че адсорбцията е обратима. се определя като процент от адсорбираното вещество върху почвата по отношение на представеното количество в началото на теста, при условията за извършване на теста. Ако тестваното вещество е устойчиво и не се адсорбира значително върху стените на контейнера,
се определя като процент от адсорбираното вещество върху почвата по отношение на представеното количество в началото на теста, при условията за извършване на теста. Ако тестваното вещество е устойчиво и не се адсорбира значително върху стените на контейнера,  се изчислява при определено време t
се изчислява при определено време t


 за паралелния и серийния метод е дадена в приложение 5.
за паралелния и серийния метод е дадена в приложение 5.

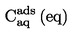
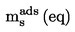



 , другаде обозначени като х/m). Приема се, че равновесието е постигнато и че
, другаде обозначени като х/m). Приема се, че равновесието е постигнато и че 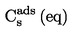 представлява стойността на равновесие:
представлява стойността на равновесие:
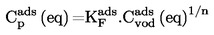


 (μg
(μg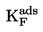 и 1/n се изчисляват чрез регресионен анализ, като се използва уравнение 9. Коефициентът на корелация r
и 1/n се изчисляват чрез регресионен анализ, като се използва уравнение 9. Коефициентът на корелация r
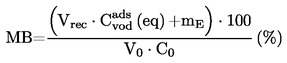




 за паралелния и серийния метод е дадена в приложение 5.
за паралелния и серийния метод е дадена в приложение 5.
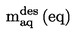
 е дадено в допълнение 5 в раздел „Десорбция“.
е дадено в допълнение 5 в раздел „Десорбция“.
 се определя като
се определя като
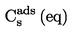



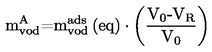
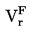



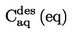
 и 1/n се изчисляват чрез регресионен анализ, използвайки уравнение 17.
и 1/n се изчисляват чрез регресионен анализ, използвайки уравнение 17. и
и 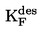 ) ще бъдат равни съответно на константите на равновесие на адсорбция и десорбция (К
) ще бъдат равни съответно на константите на равновесие на адсорбция и десорбция (К
 = 110 μg) и маса на равновесието (
= 110 μg) и маса на равновесието ( = 100 μg) от тестваното вещество в разтвора е много малка, грешка от 5 % в изчисляването на концентрацията на равновесие ще доведе до грешка от 50 % при изчисляване на масата на веществото, адсорбирано в почвата (m
= 100 μg) от тестваното вещество в разтвора е много малка, грешка от 5 % в изчисляването на концентрацията на равновесие ще доведе до грешка от 50 % при изчисляване на масата на веществото, адсорбирано в почвата (m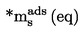



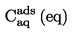



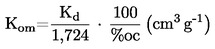
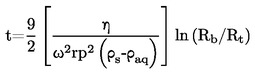




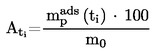

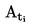


 или
или 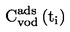 се представят графично противоположно на времето и времето, след което се определя времето за постигане на равновесие на сорбция. Примери за такива графики са дадени респективно във фигури 1 и 2.
се представят графично противоположно на времето и времето, след което се определя времето за постигане на равновесие на сорбция. Примери за такива графики са дадени респективно във фигури 1 и 2.


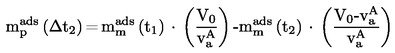


 се изчислява, като се използва следното уравнение:
се изчислява, като се използва следното уравнение:
 за време t
за време t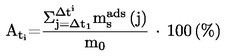
 и
и  (по отношение на нуждите на проучването) се изобразяват графично противоположно на времето и времето, след което се определя времето за постигане на равновесие на сорбция.
(по отношение на нуждите на проучването) се изобразяват графично противоположно на времето и времето, след което се определя времето за постигане на равновесие на сорбция.

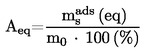




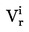 ) и масата на десорбция се изчислява съгласно уравнението:
) и масата на десорбция се изчислява съгласно уравнението:
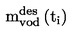 =
= 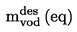 .
.
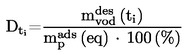




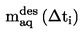

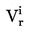 , който е взет за анализа (μg);
, който е взет за анализа (μg);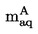
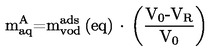
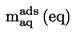

 и
и  (съгласно нуждите на проучването) се изобразяват графично противоположно на времето и времето, след което се определя постигане на равновесието на десорбция.
(съгласно нуждите на проучването) се изобразяват графично противоположно на времето и времето, след което се определя постигане на равновесието на десорбция.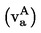 от водната фаза (сериен метод в 1.9 „Извършване на теста“). Приема се че: а) количеството плаващи частици, отстранени от епруветката след експеримент за кинетиката на адсорбция, се заместват със същото количество 0,01 М СаСl
от водната фаза (сериен метод в 1.9 „Извършване на теста“). Приема се че: а) количеството плаващи частици, отстранени от епруветката след експеримент за кинетиката на адсорбция, се заместват със същото количество 0,01 М СаСl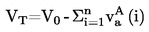
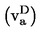 и десорбната маса се изчислява съгласно уравнението:
и десорбната маса се изчислява съгласно уравнението:

 =
=  .
.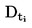 се изчислява чрез следното уравнение:
се изчислява чрез следното уравнение:

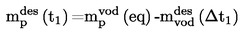
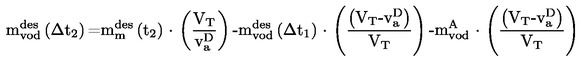

 и
и
 ce изчислява със следното уравнение:
ce изчислява със следното уравнение:
 при време t
при време t
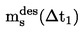

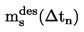

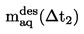


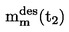

 за определено време t
за определено време t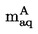


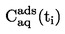




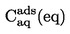
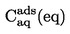

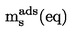

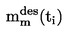
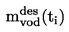

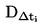

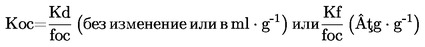







 или
или 





 противоположно на времето също може да се използва за да изчисли постигането на равновесно плато (вж. фигура 2 в приложение 5).
противоположно на времето също може да се използва за да изчисли постигането на равновесно плато (вж. фигура 2 в приложение 5).