|
03/ 14 |
BG |
Официален вестник на Европейския съюз |
19 |
31993L0085
|
L 259/1 |
ОФИЦИАЛЕН ВЕСТНИК НА ЕВРОПЕЙСКИЯ СЪЮЗ |
ДИРЕКТИВА 93/85/ЕИО НА СЪВЕТА
от 4 октомври 1993 година
относно борбата с пръстеновидното гниене по картофите
СЪВЕТЪТ НА ЕВРОПЕЙСКИТЕ ОБЩНОСТИ,
като взе предвид Договора за създаване на Европейската икономическа общност и по-специално член 43 от него,
като взе предвид предложението на Комисията (1),
като взе предвид становището на Европейския парламент (2),
като взе предвид становището на Икономическия и социален комитет (3);
като има предвид, че производството на картофи заема важно място в селското стопанство на Общността; като има предвид, че добивът на картофи е постоянно застрашен от вредни организми;
като има предвид, че чрез защитата на отглеждането на картофи от такива вредни организми не само ще се поддържа добивът, но също ще се увеличи производителността на селското стопанство;
като има предвид, че защитните мерки за предотвратяване внасянето на вредни организми на територията на държавите-членки биха имали само ограничен ефект, ако срещу тях не се води едновременна и методична борба в цялата Общност и не се предотвратява разпространението им;
като има предвид, че един от вредните организми по картофите е Clavibacter michiganensis (Smith) Davis et al. ssp. sepedonicus (Spieckermann et Kotthoff) Davis et al., патогенният агент на пръстеновидното гниене; като има предвид, че болестта се е появила в някои части на Общността и че все още съществуват ограничени източници на заразяване;
като има предвид, че съществува значителен риск от отглеждането на картофи в цялата Общност, ако не се предприемат ефективни мерки за локализиране на болестта и определяне разпространението ѝ, с цел да се предотврати появата и пренасянето ѝ, а в случай, че бъде открита, да се предотврати разпространението ѝ и да се води борба за изкореняването ѝ;
като има предвид, че за да се постигне това, следва да се вземат определени мерки в Общността; като има предвид, че, освен това, държавите-членки трябва да могат да вземат допълнителни или по-строги мерки при необходимост, при условие че няма пречки за движението на картофите в на Общността, с изключение на посоченото в Директива 77/93/ЕИО на Съвета от 21 декември 1976 г. за защитните мерки срещу внасяне в Общността на организми, вредни за растенията или продуктите от растителен произход (4); като има предвид, че тези мерки следва да се съобщават на останалите държави-членки и Комисията;
като има предвид, че Директива 80/665/ЕИО на Съвета от 24 юни 1980 г. за борба срещу пръстеновидното гниене по картофите (5) предвижда приемането от държавите-членки на минимални мерки срещу пръстеновидното гниене;
като има предвид, че оттогава значително са се развили познанията за болестта пръстеновидно гниене и за откриване на патогена на тази болест;
като има предвид, че прилагането на режима на Общността за здравето на растенията спрямо Общността като пространство без вътрешни граници налага преразглеждането и ревизията на някои разпоредби на Директива 80/665/ЕИО на Съвета;
като има предвид, че в резултат на такова преразглеждане разпоредбите на Директива 80/665/ЕИО на Съвета се считат за недостатъчни и че е необходимо по-подробно уточняване на мерките;
като има предвид, че при това положение Директива 80/665/ЕИО на Съвета следва да бъде отменена и да се предприемат необходимите мерки;
като има предвид, че тези мерки следва да вземат под внимание, на първо място, че болестта може да остане скрита и незабелязана както в клубените по време на вегетация, така и в съхраняваните на склад клубени, и че тя може да бъде ефективно предотвратена само чрез производство и използване на незаразени картофи за семе и, на второ място, че са необходими системни официални проучвания за локализирането ѝ; като има предвид, че разпространението на патогена в клубени по време на вегетация не е най-важният фактор, но като има предвид, че патогенът може да просъществува през зимата в картофени самосевки (саморасляци) и че те са основният източник на зараза, която се разпространява от един сезон в следващия; като има предвид, че патогенът се разпространява главно чрез заразяване на картофи посредством контакт със заразени картофи и чрез контакт с техника за засаждане, манипулация и прибиране на реколтата и с контейнери, използвани за транспортиране и съхраняване, които са били заразени с вредителя при предишен контакт със заразени картофи; като има предвид, че такива заразени предмети могат да бъдат причинители на зараза известно време след настъпване на такова заразяване; като има предвид, че разпространението на патогена може да се предотврати или спре чрез дезинфекция на такива предмети; като има предвид, че заразяването на картофи за семе представлява основен риск от разпространяване на патогена;
като има предвид, че за определянето на подробностите на такива общи мерки, както и на по-строги или допълнителни мерки, взети от държавите-членки за предотвратяване внасянето на патогена на тяхна територия, е желателно държавите-членки да бъдат в тясно сътрудничество с Комисията в рамките на Постоянния фитосанитарен комитет (наричан по-нататък „Комитета“),
ПРИЕ НАСТОЯЩАТА ДИРЕКТИВА:
Член 1
Настоящата директива се отнася до мерките, които държавите-членки следва да вземат срещу Clavibacter michiganensis (Smith) Davis et al. ssp. sepedonicus (Spieckermann et Kotthoff) Davis et al., причинител на пръстеновидното гниене по картофите (по-долу наричан „вредител“), с цел:
|
а) |
да локализират и определят разпространението на болестта; |
|
б) |
да предотвратят появата и разпространението ѝ; и |
|
в) |
да предотвратят разпространението ѝ и да водят борба с нея с цел изкореняването ѝ, в случай че бъде открита. |
Член 2
1. Държавите-членки провеждат системни официални проучвания за наличие на вредителя по картофените клубени и, при необходимост, по картофените растения (Solanum tuberosum L.), произхождащи от тяхната територия, за да потвърдят отсъствието на вредителя.
За целите на такива проучвания, в случая на клубени, се вземат проби както от картофите за семе, така и от други картофи, за предпочитане от партиди на склад, и се подлагат на официално лабораторно изпитване или официално контролирано лабораторно изпитване, като се прилага методът, посочен в приложение I, за откриване и диагностициране на вредителя. Освен това, при необходимост, може да се извършва официална визуална проверка или официално контролирана проверка на други проби чрез нарязване на клубени.
В случая на растения проучванията се извършват чрез подходящи методи, а пробите се подлагат на официално изпитване или официално контролирано изпитване.
Броят, произходът, стратификацията и графикът на събиране на пробите се решават от компетентните официални органи по смисъла на Директива 77/93/ЕИО, въз основа на обосновани научни и статистически принципи и на биологията на вредителя, като се вземат под внимание конкретните системи за производство на картофи в съответните държави-членки. Подробностите от тези изследвания се представят ежегодно на останалите държави-членки и на Комисията, за да се осигури сравнима степен на гаранция между държавите-членки за потвърждаване отсъствието на вредителя.
2. Резултатите от официалните изследвания, предвидени в параграф 1, се съобщават на останалите държави-членки и на Комисията най-малко веднъж годишно. Подробностите по това уведомяване са поверителни. Те могат да се представят на Комитета в съответствие с процедурата, определена в член 16а от Директива 77/93/ЕИО.
3. В съответствие с процедурата, посочена в член 16а от Директива 77/93/ЕИО, могат да се приемат следните разпоредби:
|
— |
подробностите на изследванията, предвидени в параграф 1 по-горе, които да бъдат проведени в съответствие с обосновани научни и статистически принципи, |
|
— |
подробностите по уведомяването, предвидени в параграф 2 по-горе. |
4. В съответствие с процедурата, посочена в член 16а от Директива 77/93/ЕИО, се приемат следните разпоредби:
|
— |
за подходящия метод за извършване на проучванията и изпитвания, предвидени в третата алинея от параграф 1 по-горе. |
Член 3
Държавите-членки гарантират, че при всяко съмнение за поява или потвърдено наличие на вредителя в картофените растения в процес на вегетация или в прибраните, съхраняваните на склад или продавани на тяхна територия клубени се докладва на техните компетентни официални органи.
Член 4
1. В случаи на съмнение за поява компетентните официални органи на държавите-членки, в които са докладвани такива случаи, осигуряват извършването на официални или официално наблюдавани лабораторни изпитвания, като прилагат метода, описан в приложение I, и в съответствие с условията, посочени в точка 1 от приложение II, с оглед потвърждаване или опровергаване на съмненията за поява на болестта. В горните случаи се прилагат изискванията, определени в точка 2 от приложение II.
2. До потвърждаване или опровергаване на съмненията за поява по параграф 1, в случаите на съмнения за поява, когато:
|
i) |
са установени визуални диагностични симптоми, които пораждат съмнение за наличието на болестта; или |
|
ii) |
е установена положителна реакция при имунофлуоресцентно изпитване, както е посочено в приложение I, или при друго подходящо изпитване, |
компетентните органи на държавите-членки:
|
а) |
забранят движението на всички партиди или пратки, от които са взети проби, с изключение под техен контрол и при условие че е установено, че няма определен риск от разпространение на вредителя; |
|
б) |
предприемат стъпки за откриване на източника на поява, за която има съмнение; |
|
в) |
да въведат подходящи допълнителни предпазни мерки, основаващи се на нивото на оценения риска, с оглед да се предотврати разпространението на вредителя. Тези мерки могат да включват официален контрол на движението на всички други клубени или растения в или извън помещенията, свързани с появата на болестта, за която има съмнения. |
3. В съответствие с процедурата, предвидена в член 16а от Директива 77/93/ЕИО, могат да се приемат следните мерки:
|
— |
мерките, посочени в параграф 2, буква в) по-горе. |
4. В съответствие с процедурата, предвидена в член 16а от Директива 77/93/ЕИО, се приемат следните мерки:
|
— |
други подходящи изпитвания, предвидени в параграф 2, ii) по-горе; |
Член 5
1. Ако при официално изпитване или официално контролирано лабораторно изпитване, при което се използва методът, описан в приложение I, се потвърди наличието на вредителя в проба от клубени, растения или части от растения, компетентните официални органи на държавата-членка, като взема под внимание обосновани научни принципи, биологията на вредителя и конкретните системи за производството, пускане на пазара и преработка в съответната държава-членка:
|
а) |
определят като заразени клубените или растенията, пратката и/или партидата, машините, транспортните средства, съдовете, складовете или техните части, и всякакви други предмети, включително опаковъчен материал, от които е била взета пробата и, при необходимост, мястото/местата на производство и полето/полята, от които са прибрани клубените или растенията; |
|
б) |
като вземат под внимание разпоредбите на точка 1 от приложение III, определят степента на вероятното заразяване чрез контакт преди или след прибиране на реколтата, или чрез производствената връзка с посоченото заразяване; |
|
в) |
определят границите на зона въз основа на посоченото в буква а) заразяване, степента на вероятното заразяване по буква б) и вероятното разпространяване на вредителя, като вземат под внимание разпоредбите на точка 2 от приложение III. |
2. Държавите-членки незабавно уведомяват останалите държави-членки и Комисията в съответствие с разпоредбите на точка 3 от приложение III за всяко заразяване, определено по параграф 1, буква а), и за подробности по определяне на зоната по параграф 1, буква в).
Подробностите по това уведомяване са поверителни. Те се представят на Комитета в съответствие с процедурата, предвидена в член 16а от Директива 77/93ЕИО.
3. В резултат на уведомяването по параграф 2 и елементите посочени в него, останалите държави-членки, изброени в уведомлението, посочват, при необходимост, наличието на заразяване, определят степента на вероятното заразяване и зоната, в съответствие с параграф 1, букви а), б) и в).
Член 6
В случай че клубените или растенията са били обявени за заразени съгласно член 5, параграф 1, буква а), държавите-членки предписват да се проведе изпитване, в съответствие с член 4, параграф 1, на наличностите от картофи, свързани клоново с картофите, обявени за заразени. Изследват се толкова клубени или растения, колкото е необходимо, за определяне на вероятния първичен източник на заразяване и степента на вероятно замърсяване, за предпочитане по степен на риска.
В резултат на изпитванията при необходимост се извършва допълнително определяне на заразяването, на степента на вероятното замърсяване и на зоната, съгласно член 5, параграф 1, букви а), б) и в).
Член 7
1. Държавите-членки предписват, че клубени или растения, обявени за заразени по член 5, параграф 1, буква а), не могат да бъдат засаждани, и че под контрола на компетентните официални органи те следва да бъдат:
|
— |
унищожени или |
|
— |
по някакъв друг начин премахнати, при спазване на официално контролираните мерки, в съответствие с разпоредбите на точка 1 от приложение IV, при условие че е установено, че няма определен риск от разпространяване на вредителя. |
2. Държавите-членки предписват, че клубени или растения, обявени за вероятно заразени по член 5, параграф 1, буква в), не могат да бъдат засаждани и че без да се засягат резултатите от посоченото в член 6 изпитване за клоново свързани запаси, следва да бъдат пуснати за подходяща употреба или премахване под контрола на съответните компетентни официални органи, както се посочва в точка 2 от приложение IV, по такъв начин, че да се гарантира отсъствието на определен риск от т разпространяване на вредителя.
3. Държавите-членки предписват всяко оборудване, транспортно средство, съд, склад или техни части и всякакви други предмети, включително опаковъчният материал, обявени за заразени по член 5, параграф 1, буква а) или обявени за вероятно заразени по член 5, параграф 1, буква б), да бъдат унищожени или почистени и дезинфектирани чрез прилагане на подходящи методи, както се посочва в точка 3 от Приложение IV. След дезинфектирането всички тези обекти не се считат повече за заразени.
4. Без да се засягат мерките, приложени по параграф 1, 2 и 3, държавите-членки предписват, че в определената по член 5, параграф 1, буква в) зона се прилагат серия от мерки, както се посочва в точка 4 от приложение IV.
Член 8
1. Държавите-членки постановяват, че картофите за семе трябва да отговарят на изискванията на Директива 77/93ЕИО и да произхождат по права линия от материал, получен по официално одобрена програма, за който е установено, че няма вредител чрез официално изпитване или официално контролирано изпитване, като се използват методите, описани в приложение I.
Горепосоченото изпитване се извършва:
|
— |
в случаи, когато заразяването засяга производството на картофи за семе, на растения от началната клонова селекция |
|
— |
в други случаи, на растения от началната клонова селекция или на представителни проби от базови картофи за семе, или от предишно размножаване. |
2. Могат да бъдат приети следните разпоредби в съответствие с процедурата, предвидена в член 16а от Директива 77/93/ЕИО:
|
— |
подробни правила за прилагане на първото тире на втората алинея на параграф 1 на настоящия член, |
|
— |
правилата, отнасящи се до представителните проби, предвидени във второто тире на втората алинея на параграф 1 на настоящия член. |
Член 9
Държавите-членки забраняват притежаването на вредителя и манипулации с него.
Член 10
Без да се засягат разпоредбите на Директива 77/93/ЕИО, държавите-членки могат да разрешат изключения от мерките, посочени в членове 6, 7 и 9 от настоящата директива, за експериментални или научни цели и за работа по сортова селекция, при условие че тези изключения не вредят на мерките за борба с вредителя и не създават риск от разпространяването му.
Член 11
Държавите-членки могат да приемат допълнителни или по-строги мерки, каквито може да са необходими за борба с вредителя или за предотвратяване на разпространяването му, доколкото те са в съответствие с разпоредбите на Директива 77/93/ЕИО.
Допълнителните мерки, посочени в първата алинея, трябва да включват предписанието, че могат да се засаждат само картофи за семе, които са официално сертифицирани или официално проверени, с цел да отговарят на необходимите фитосанитарни норми. Последното може да се прилага по-специално в случаи, когато на земеделските производители се разрешава да използват в собственото си стопанство картофи за семе, получени от собствената им реколта и в други случаи на засаждане на картофи за семе, произведени от земеделския стопанин.
Подробностите по тези мерки се съобщават на останалите държави-членки и на Комисията.
Член 12
Измененията на приложенията към настоящата директива, които следва да се внесат в светлината на развитието на научнотехническите знания, се приемат в съответствие с процедурата, предвидена в член 16а от Директива 77/93/ЕИО.
Член 13
1. Държавите-членки приемат и публикуват преди 15 ноември 1993 г. разпоредбите, необходими за да се съобразят с настоящата директива. Те незабавно информират Комисията за това.
Когато държавите-членки приемат тези разпоредби, в тях се съдържа позоваване на настоящата директива или то се извършва при официалното им публикуване. Условията и редът на позоваване се определят от държавите-членки.
Държавите-членки прилагат тези разпоредби от 16 ноември 1993 г.
2. Държавите-членки съобщават незабавно на Комисията всички разпоредби от националното законодателство, които те приемат в областта, уредена с настоящата директива. Комисията информира останалите държави-членки за тези разпоредби.
Член 14
Директива 80/665/ЕИО се отменя считано от 16 ноември 1993 г.
Член 15
Адресати на настоящата директива са държавите-членки.
Съставено в Люксембург на 4 октомври 1993 година.
За Съвета
Председател
W. CLAES
(1) ОВ С 93, 2.4.1993 г., стр. 12.
(2) ОВ С 176, 28.6.1993 г., стр. 210.
(3) ОВ С 161, 14.6.1993 г., стр. 18.
(4) ОВ L 26, 31.1.1977 г., стр. 20. Последно изменена с Директива 92/103/ЕИО на Комисията (ОВ L 363, 11.12.1992 г., стр. 1).
(5) ОВ L 180, 14.7.1980 г., стр. 30.
ПРИЛОЖЕНИЕ I
МЕТОД ЗА ОТКРИВАНЕ И ДИАГНОСТИКА НА ПРЪСТЕНОВИДНО ГНИЕНЕ ПО КАРТОФИТЕ, CLAVIBACTER MICHIGANENSIS (Smith) Davis et al. ssp. SEPEDONICUS (Spieckermann et Kotthof) Davis et al. В ПАРТИДИ КАРТОФЕНИ КЛУБЕНИ
1. Вземане на проба от сърцевината от долния край
1.1. Измиват се 200 клубена на течаща вода и се отстранява епидермиса около долната част на всеки клубен, като се използва обикновено дезинфектиран скалпел или картофобелачка; дезинфекция може да се постигне чрез потапяне на белачката в 70 % етилов спирт и обгаряне.
1.2. Внимателно се отстранява коничната тъкан на сърцевината от долния край с нож или картофобелачка. Взема се колкото се може по-малко количество неваскуларна тъкан. Отстранените долни краища се обработват в продължение на 24 часа (виж параграф 3) или се съхраняват за не повече от две седмици при температура – 20 °С.
2. Визуален преглед за симптоми на пръстеновидно гниене
След отстраняване на долните краища се срязва напречно всеки клубен и се наблюдава за симптоми на пръстеновидно гниене.
Изстискват се клубените и се проверява дали има мацерирани части от васкуларната тъкан.
Най-ранните симптоми са лек стъклен или полупрозрачен вид на тъканта без омекване около васкуларната система, и по-специално при долния край. Васкуларният пръстен в долния край може да бъде малко по-тъмен на цвят от нормално. Първият лесно установим симптом е наличието на жълтеникаво оцветяване на васкуларния пръстен, а когато се стисне клубена, от съдовете излизат стълбчета от приличен на сирене материал. Този ексудат съдържа милиони бактерии. На този етап може да се появи кафеникаво оцветяване на васкуларната тъкан. Първоначално симптомите може да са ограничени в една част на пръстена, не непременно близо до долния край, и може постепенно оцветяването да се разширят до целия пръстен. С напредването на инфекцията се разрушава васкуларната тъкан. Външната кора може да се отдели от вътрешната. В напредналите стадии на инфекция по повърхността на клубена се появяват цепнатини, които често са червеникаво-кафяви по края. Вторична гъбична или бактериална инвазия може да прикрие симптомите и тогава ще бъде трудно, ако не и невъзможно, да се различат симптомите на напреднал стадий на пръстеновидно гниене от други видове гниене на картофените клубени.
3. Подготовка на проби за оцветяване по метода на Грам, изпитване за имунофлуоресцентно оцветяване (IF) и изпитване на сини домати
3.1. Хомогенизират се долните краища до пълна мацерация в разредител, за който е известно, че не е токсичен за Corynebacterium sepedonicum (например 0,05 М фосфатно-буферен солен разтвор (ФБР) с рН 7,0) при температура, по-ниска от 30 °С. Препоръчва се добавяне на нетоксичен дефлокулиращ агент, а може да се добави и нетоксичен антипенител (приложения 1 и 2). Трябва да се избягва прекомерна мацерация.
3.2. Извличат се бактериите от хомогенизираната течност чрез един от следните методи (1):
|
А. |
|
|
Б. |
|
3.3. Оставя се утайката (концентриран екстракт) в стерилен 0,01 М фосфатен буферен разтвор с рН 7,2 (допълнение 2), за да се постигне общ обем от приблизително 1 мл. Разделя се на две равни части и се запазва едната част за сравнение, като се замразява при –20 °С (2) или чрез лиофилизация. Разделя се другата част на две половини и се използва едната половина за изпитване на реакция на имунофлуоресценция и за Грам оцветяване, а другата за изпитване на син домат.
3.4. Абсолютно задължително да се третират поотделно всички положителни контролни образци и проби на C. sepedonicum, за да се избегне заразяване. Това се отнася както за имунофлуоресцентното изпитване, така и за изпитването на син домат.
4. Реакция на Грам
4.1. Приготвят се оцветители на Грам за всички разтвори на концентрирания екстрат (точка 5.2.1) и за всички отрязани клубени (точка 2), при които се наблюдава прозрачност, загниване или други подозрителни симптоми. Пробите се взимат от края на болните тъкани.
4.2. Приготвя се Грам оцветители за познати култури C. sepedonicum и, ако е възможно, за естествено заразена тъкан (точка 5.1).
4.3. Определя се кои проби съдържат типични Грам положителни клетки на Corynebacterium. Най-общо клетките на C. sepedonicum са с дължина 0,8—1,2 mm и с широчина 0,4—0,60 mm.
Подходящ начин за оцветяване на Грам е посочен в допълнение 3.
В препаратите от естествени инфекции или от наскоро изолирани култури често преобладават кокоидни пръчици, които обикновено са малко по-малки от клетките на по-стари култури върху агар-агар. В повечето среди на култура клетките на C. sepedonicum са плеоморфни пръчици от вида бактерии coryneform и могат да дадат променлива Грам реакция. Клетките са единични, по двойки, с характерни „извивки“, типични за огънато делене, а понякога са в несиметрични групи, често наричани палисади и китайски букви.
5. Имунофлуоресцентни изпитвания
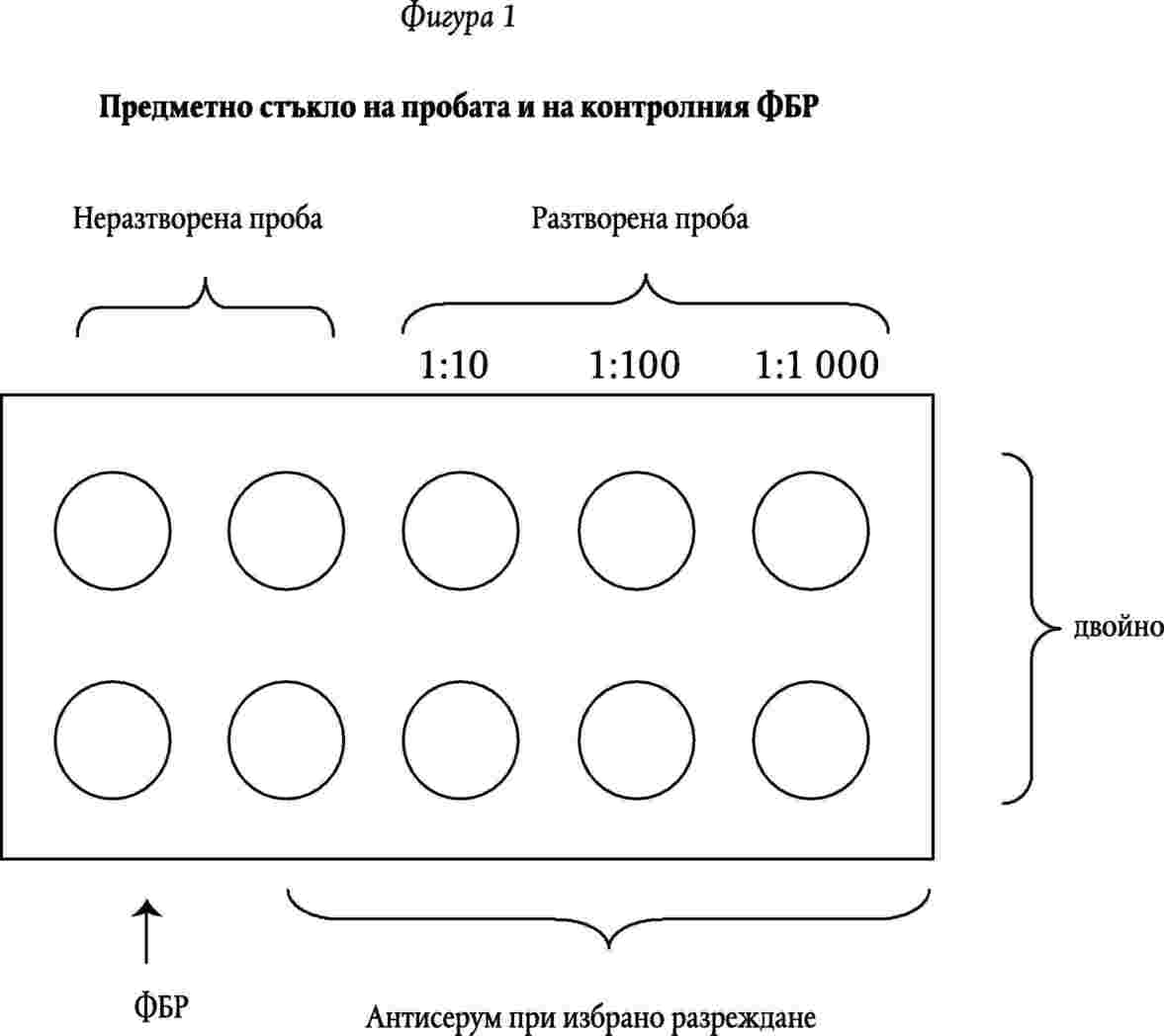
5.1. Използва се антисерум за познат щам на C. sepedonicum - ATCC 33113 (NCPPB 2137) или NCPPB 2140. Той трябва да има титър на имунофлуоресценция по-голям от 1:600. Включва се една контролна проба на ФБР върху предметното стъкло, за да се определи дали антитялото флуоресцеин изотиоцианат заешки имуноглобулинов конюгат (ФИИК) се съчетава неспецифично с бактериалните клетки. Corynebacterium sepedonicum (ATCC 33113 (NCPPB 2137), NCPPB 2140) следва да се използва като контролни проби на хомоложен антиген върху отделно предметно стъкло. При възможност тъкан, заразена по естествен път (поддържана чрез лиофилизация или замразяване при – 20 °С), трябва да се използва като подобна контрола на същото предметно стъкло (Фигура 2).
5.2. Процедура
5.2.1. Приготвят се три поредни десеторни разреждания (101, 102, 103) на окончателния концентрират екстрат в дестилирана вода (Фигура 1).
5.2.2 Поставя се с пипета измерен стандартен обем, достатъчен да покрие гнездото (приблизително 25 ml), от всеки разтвор на концентрирания екстрат или суспензия на C. sepedonicum (приблизително 106 клетки/µl) в гнездата на многоклетъчно предметно стъкло, както е показано на фигура 1.


5.2.3. Оставя се да изсъхне при температура приблизително 37 °С и се фиксира с 95 % етанол или на пламък.
5.2.4. Покриват се съответните гнезда с антисерум на C. sepedonicum при препоръчаните разреждания, 0,01 М ФБР с рН 7,2, (допълнение 2), както е показано на фигура 1. (Използва се ФБР за контролата ФИИК). Работният разтвор на антисерума трябва да бъде приблизително наполовина от този на титъра на имунофлуоресценцията. Ако бъдат включени други антисерумни разтвори, ще трябва да се приготвят отделни предметни стъкла за всеки разтвор, който ще се използва.
5.2.5. Инкубира се във влажна камера при температура на околната среда в продължение на 30 минути.
5.2.6. Изплаква се внимателно с 0,01 М ФБР с рН 7,2. Мие се в продължение на пет минути във фосфатно-буферен разтвор 0,01 М с рН 7,2, като се сменя разтворът три пъти.
5.2.7. Отстранява се внимателно излишната влага.
5.2.8. Покрива се всяко гнездо с конюгат ФИИК при същото разреждане, използвано за определяне на титъра, и се инкубира в тъмна влажна камера при температура на околната среда в продължение на 30 минути.
5.2.9. Изплаква се и се измива като преди.
5.2.10. Използва се приблизително 5 до 10 мл 0,1 М фосфатен буферен разтвор на глицерин с рН 7,6 (или подобен препарат с рН не по-малко от 7,6) за всяко гнездо и се покрива с предпазно стъкло (допълнение 2).
5.2.11. Изследва се под микроскоп, снабден с епифлуоресцентен светлинен източник и с филтри, подходящи за работа с ФИИК. Подходящо е увеличение от 400 до 1 000 пъти. Сканират се получените еднакви гнезда през средата на два диаметъра под прави ъгли и около периметрите на гнездото.
Следят се флуоресциращи клетки в положителните контроли и се определят титъра. Следят се флуоресциращи клетки в контролното гнездото на ФИИК/ФБР и ако няма такива, се преминава към тестовите гнезда. Определят се в минимум 10 микроскопски полета средният брой на флуоресциращи клетки с типична морфология на поле и се изчислява техният брой на мл от неразтворения концентриран екстрат (допълнение 4).
Съществуват няколко проблема, присъщи на имунофлуоресцентното изпитване:
|
— |
В картофените концентрирани екстракти съществува вероятност да се появят фонови популации на флуоресциращи клетки с нетипична морфология и противоположно реагиращи сапрофитни бактерии, с големина и морфология подобни на Clavibacter michiganensis ssp. sepedonicus. Вземат се под внимание само флуоресциращите клетки с типична големина и морфология. Поради възможността от противоположни реакции, проби с положителна реакция при имунофлуоресцентно изпитване трябва да се тестват отново, но с различен антисерум. |
|
— |
Техническата граница на откриване при този метод е между 103 и 104 клетки на мл неразреден концентриран екстрат. Проби за които броят на типичните флуоресциращи клетки е на границата на откриване обикновено са отрицателни за C. m. ssp. sepedonicus, но могат да бъдат подложени на изпитване на син домат. |
За всички проби, в които не са открити флуоресциращи клетки с типична морфология, се определя проба за реакция при имунофлуоресцентно изпитване. Пробите следва да се считат за „незаразени“ с Clavibacter michiganensis ssp. sepedonicus.
Изпитването на син домат не е задължителю.
За всички проби, в които се установява наличие на флуоресциращи клетки с типична морфология, се определя проба за положителна реакция при имунофлуоресцентно изпитване.
Проби, за които е била определена проба за положителна реакция на имунофлуоресцентно изпитване с двата антисерума, се считат за „потенциално заразени“ с Clavibacter michiganensis ssp. sepedonicus.
Изпитване на син домат се изисква за всички проби, считани за потенциално заразени.
6. Изпитване на син домат
За подробности за културите виж допълнение 5.
6.1. Разпределя се концентрираният екстрат от точка 3.3. между най-малко 25 сини домата във фаза на разлистване 3 (допълнение 5), като се прилага един от посочените по-долу методи (точка 6.2, 6.3 или 6.4).
6.2. Инокулация чрез разрез I
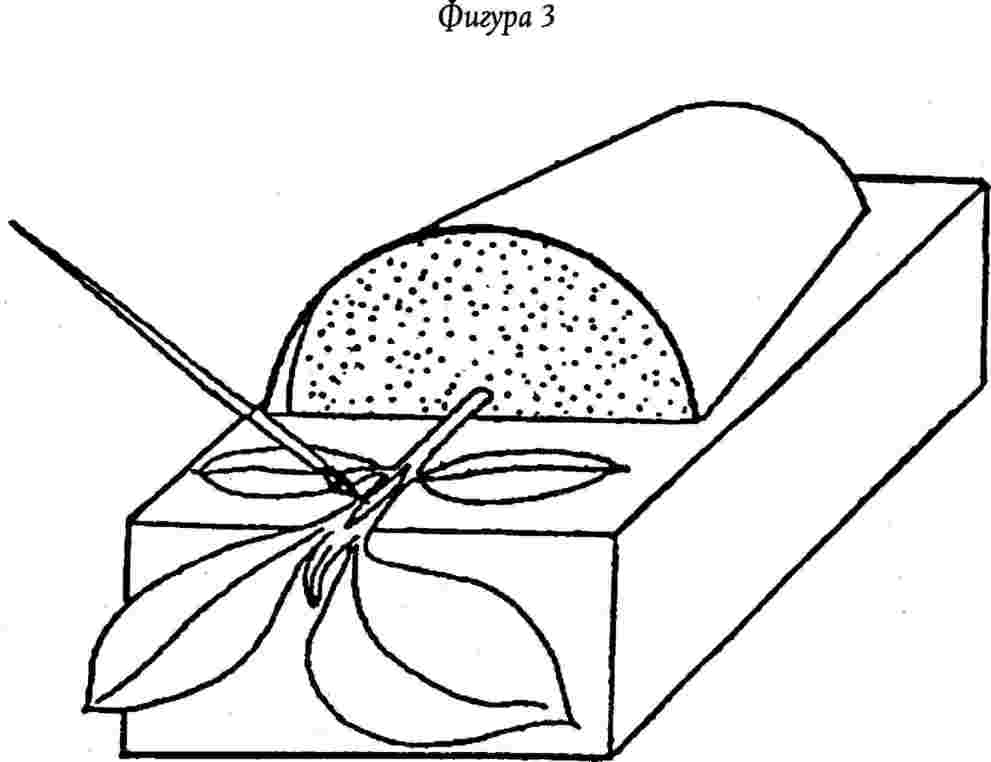
6.2.1. Поставя се всяка саксия в хоризонтално положение (за 10 сантиметрова саксия е подходящ блок от пенополистирол, от който е смахнато от едната повърхност парче с дълбочина 5 см, широчина 10 см и дължина 15 см (Фигура 3). За всяка тествана проба се поставя лента от стерилно алуминиево фолио между стъблото и пенополистиролния блок. Растението може да бъде поддържано с ластик около блока.
6.2.2. Прави се със скалпел надлъжен или леко диагонален разрез с дължина от 0,5 до 1,0 см и с дълбочина приблизително три четвърти от диаметъра на стъблото между, семеделния лист и първия лист.
6.2.3. Задържа се разреза отворен с острието на скалпела и се оцветява инокулата вътре с помощта на очна линия или фина четка за рисуванепотопена в концентрирания екстракт.. Разпределя се останалата част от концентрирания екстракт между другите сини домати.
6.2.4. Затваря се разрезът със стерилен вазелин, като се използва спринцовка с вместимост 2 мм.
6.3. Инокулация чрез разрез II
6.3.1. Държи се растението между два пръста и се капват (приблизително от 5 до 10 мл) от суспендирания концентриран екстракт върху стъблото, между семеделния лист и първия лист.
6.3.2. Прави се със стерилен скалпел диагонален разрез (под ъгъл приблизително 5о) с дължина 1,0 см и с дълбочина около 2/3 от дебелината на стъблото, като разрезът се започва капката от концентрирания екстракт.
6.3.3. Запечатва се разрезът със стерилен вазелин, като се използва спринцовка.
6.4. Инокулация със спринцовка
6.4.1. Не се поливат сините домати един ден преди вкарването на материала, за да се намали тургурното налягане.
6.4.2. Прави се инокулация на стъблото на синия домат, точно над семеделния лист, използвайки спринцовка с игла за подкожна инжекция (не по-малко от 23 G). Разпределя се концентрираният екстракт между сините домати.
6.5. Инокулират се 25 растения с известна култура на C. sepedonicum и при възможност, заразена по естествен път тъкан от клубен (точка 5.1.), като се прилага същият метод на инокулация (точка 6.2, 6.3 или 6.4).
6.6. Инокулират се 25 растения със стерилен 0,05 М ФБР по същия метод на инокулация (точка 6.2, 6.3 или 6.4).
6.7. Инкубират се растенията при подходящи условия (допълнение 5) в продължение на 40 дни. Проверяват се редовно за симптоми след осем дни. Преброяват се растенията с проявени симптоми. C. sepedonicum причинява увяхване на листата при сините домати, което може да започне като отпуснатост на краищата на листата или между жилките. Повяхналата тъкан може първоначално да бъде тъмнозелена или на петна, но преди да загние избледнява. При увяхване между жилките, повърхността често изглежда мазна и много водна. Мъртвата тъкан е често ярко жълта по края. Растенията не умират непременно. Колкото по-дълъг е периодът преди да се развият симптомите, толкова по-голям е шансът за оцеляване. Растенията могат да превъзмогнат инфекцията. Податливите млади сини домати са много по-чувствителни към ниски популации на C. sepedonicum, отколкото по-старите растения, и оттам следва необходимостта да се използват растения в третата фаза на разлистване или точно преди нея.
Повяхване може да се предизвика и от популации на други бактерии или гъбички, намиращи се в концентрирания екстракт от тъкан на картофен клубен. В тях са включени Erwinia carotovora, subsp. carotovora и E. carotovora subsp. atroseptica, Phoma exigua var. foveata, както и големи популации на сапрофитни бактерии. Такъв вид повяхване може да бъде разграничено от повяхването, причинено от C. sepedonicum, тъй като при него цели листа или цели растения бързо увяхват.
6.8. Приготвя се Грам оцветител (точка 4) за всички партиди сини домати с проявени симптоми, като се използват части от тъкан на увехнал лист и тъкан от стъбло от растения, и се изолират в подходящи хранителни среди (точка 7). Дезинфекцира се повърхността на листата и стъблата на сините домати чрез изтриване със 70 % етанол.
При определени условия, и по-специално когато условията за растеж не са оптимални, съществува възможност C. sepedonicum да присъства като латентна инфекция в сините домати дори след 40 дневна инкубация. Такива инфекции могат да доведат до спиране на растежа и липса на жизненост в инокулираните растения. Ако имунофлуоресцентното изпитване се приеме за положително, може да се счете за необходимо да се продължи с тестването. Поради това, от съществено значение е да се сравнят темповете на растеж на всички тествани сини домати с помощта на инокулирани контролни проби на стерилен 0,05 М ФБР и да се наблюдава екологичната обстановка в оранжерията.
Правят се следните препоръки за допълнително изпитване:
6.9.1. изрязват се стъблата над мястото на инокулацията и се махат листата;
6.9.2. накисват се стъблата в 0,05 М ФБР с рН 7,0, както е посочено в точка 3.1 и точка 3.2;
6.9.3. използва се половината от концентрирания екстракт, за да се извърши Грам оцветяване (точка 4) и имунофлуоресцентното изпитване (точка 5);
6.9.4. използва се другата половина, за да се проведе допълнителео изпитване на син домат (точка 6), ако са положителни резултатите от изпитването на Грам оцветяване и имунофлуоресцентното изпитване. Използва се известна култура на C. sepedonicum и стерилни контроли с 0,05 М ФБР. Ако в последващото изпитване не се наблюдават симптоми, пробата следва да се счита за отрицателна.
7. Изолиране на C. sepedonicum
Диагнозата може да се потвърди само ако C. sepedonicum бъде изолирана и идентифицирана (точка 8). Въпреки че C. sepedonicum е труден за изолиране вредител, това може да се направи от симптоматична тъкан. Въпреки това бързо растящи сапрофитни бактерии могат да я надживеят, поради което не се препоръчва директно изолиране от концентрирания екстракт от тъкан на клубен (точка 3.3.). Сините домати предоставят отлична селективно обогатителна среда за растежа на C. sepedonicum, както и възможности за отличен тест за потвърждаване на гостоприемник.
Изолиране следва да се направи от всички симптоматични картофени клубени и сини домати (точка 4 и точка 6). При необходимост трябва да се извърши мацерация на стъблата на сини домати, както е посочено в точка 3. и точка 6.9.
Прочиства се с нова посявка на ивици със суспензии една от следните среди: (формулите са дадени в допълнение точка 6):
|
|
хранителен агар с декстроза (само за субкултура), |
|
|
дрождов-пептонов агар с глюкоза, |
|
|
хранителен дрождов агар с декстроза, |
|
|
агар с екстракт от дрожди и минерални соли. |
Инкубира се до 20 дни при температура 21 °C.
C. sepedonicum расте бавно и обикновено за 10 дни произвежда съвсем малки, кремави, куполовидни колонии.
Прави отново посявка на ивици, за да се постигнат чисти култури.
Темповете на растеж се подобряват при субкултурата. Типичните колонии са кремаво-бели или с цвят на слонова кост, заоблени, гладки, надигнати, издути и куполовидни, слизесто-течни, с цели краища, и са обикновено от 1 до 3 мм в диаметър.
Идентифициране
Много Грам положителни бактерии coryneform, с характеристики на колониите подобни на тези на C. sepedonicum, могат да бъдат изолирани от здрави или заболели картофи и сини домати. В тази връзка, C. sepedonicum следва да се идентифицира чрез едно от посочените по-долу изпитвания:
|
|
имунофлуоресцентното изпитване (точка 5.1), |
|
|
изпитване на син домат, |
|
|
хранителни и физиологични изпитвания (допълнение 7),
|
Всички проби следва да включват известна контрола на C. sepedonicum. Хранителните и физиологичните изпитвания трябва да се правят с инокулати от субкултури на хранителен агар. Трябва да се правят морфологични сравнения на култури на агар с хранителна декстроза.
За имунофлуоресцентното изпитване, клетъчните популации трябва да се поставят до 106 клетки/мл. Титърът на имунофлуоресценцията трябва да прилича на титъра на познатата култура на C. sepedonicum.
За изпитването на синия домат клетъчни популациити трябва да се поставят до 107 клетки/мл. Изпитванията със син домат се правят с 10 растения за всеки от тестваните вредители, и отново се използва позната култура на C. sepedonicum и стерилни водни контроли. При чисти култури за 20 дни трябва да се получи типично увяхване, а растенията, които след този период не проявяват симптоми, трябва да се инкубират в продължение на 30 дни при температури, благоприятни за растежа на синия домат, но не по-високи от 30 °С (допълнение 5). Ако след 30 дни симптомите не се проявят, не може да се потвърди, че културата е патогенна форма на Corynebacterium sepedonicum.
|
Проба |
C. sepedonicum |
||
|
O/F |
Инертна или леко окислителна |
||
|
Оксидаза |
– |
||
|
Каталаза |
+ |
||
|
Намаляване на нитратите |
– |
||
|
Активност на уреаза |
– |
||
|
Произвеждане на Н2S |
– |
||
|
Произвеждане на индол |
– |
||
|
Използване на цитрат |
– |
||
|
Скорбялна хидролиза |
или слаба |
||
|
Растеж при 37 °С |
– |
||
|
Растеж в 7 % разтвор на натриев хлорид |
– |
||
|
Желатинова хидролиза |
– |
||
|
Ескулинова хидролиза |
+ |
||
|
Проба за кисела реакция от |
|
||
|
– |
||
|
или слаба |
||
|
– |
||
|
– |
(1) Алтернативен метод за извличане е даден от Динсен, 1984 г.
(2) Доказано е (Янсен и Ван Веренберг, 1987 г.), че замразяването може да намали жизнеспособността на Corynebacterium sepedonicum.
Допълнение 1
ФОРМУЛАЦИЯ НА МАЦЕРИРАЩАТА ТЕЧНОСТ, ПРЕПОРЪЧВАНА ОТ ЛЕЛИОТ И СЕЛАР, 1976 Г.
|
D C силиконова антипенова смес MS A (Hopkins & Williams Ltd, Cat. № 9964-25, Chadwell Heath, Essex, England) |
10 мл |
|
Люспици луброл W (ICI Ltd) |
0,5 г |
|
Тетра-натриев пирофосфат |
1 г |
|
0,05 М фосфатно-буферен солен разтвор с рН 7,0 (допълнение 2) |
1 л |
Допълнение 2
БУФЕРНИ РАЗТВОРИ
Фосфатно-буферен солен разтвор 0,05 М с рН 7,0
Този буферен разтвор се използва за мацерация на тъкан от клубени (2.1.)
|
Na2HPO4 |
4,26 г |
|
KH2PO4 |
2,72 г |
|
NaCl |
8,0 г |
|
Дестилирана вода |
1 литър |
Фосфатно-буферен солен разтвор 0,01 M с pH 7,2
Този буферен разтвор се използва за разреждащи антисеруми и за измиване на предметни стъкла при проби за имунофлуоресцентното изпитване
|
Na2HPO4 12 H2O |
2,7 г |
|
NaH2PO4 2 H2O |
0,4 г |
|
NaCl |
8,0 г |
|
Дестилирана вода до 1 л |
1 литър |
Фосфатно-буферен глицеринов разтвор М с рН 7,6
Този буферен разтвор се използва като препарат за засилване на флуоресценцията при имунофлуоресцентното изпитване
|
Na2HPO4 12 H2O |
3,2 г |
|
NaH2PO4 2 H2O |
0,15 г |
|
Глицерин |
50 мл |
|
Дестилирана вода |
100 мл |
Допълнение 3
НАЧИН НА ОЦВЕТЯВАНЕ ПО МЕТОДА НА ГРАМ (МОДИФИКАЦИЯ НА HUCKER) (DOETSCH, 1981)
Кристален виолетов разтвор
Разтварят се 2 г виолетов кристал в 20 мл 95 % етанол.
Разтварят се 0,8 г амониев оксалат в 80 мл дестилирана вода.
Смесват се двата разтвора.
Йод на Лугол
|
Йод |
1 г |
|
Калиев йодид |
2 г |
|
Дестилирана вода |
300 мл |
Стриват се всички твърди частици заедно в хаван с чукало. Добавя се получената смес към водата и се разбърква, докато се разтвори, в затворен съд.
Сафранов разтвор за оцветяване
Основен разтвор:
|
Сафран |
2,5 г |
|
95 % етанол |
100 мл. |
Разбърква се и се съхранява.
Разрежда се в съотношение 1:10, за да се получи работен разтвор.
Процедура на оцветяване
|
1. |
Приготвят се намазките, изсушават се на въздуха и се установява точно топлината. |
|
2. |
Потапя се предметното стъкло в кристално-виолетов разтвор в продължение на една минута. |
|
3. |
Измива се за кратко на течаща вода |
|
4. |
Потапя се в йод на Лугол в продължение на една минута. |
|
5. |
Измива се на течаща вода и изсушете с попивателна хартия. |
|
6. |
Обезцветява се с 95 % етанол, който се добавя на капки, докато обезцветяването не престане, или го потопете, като се разклаща леко в продължение на 30 секунди. |
|
7. |
Измива се на течаща вода и се изсушава с попивателна хартия. |
|
8. |
Потапя се в сафранов разтвор в продължение на 10 секунди. |
|
9. |
Измива се на течаща вода и се подсушава с попивателна хартия. |
Грам положителните бактерии се оцветяват във виолетовосиньо. Грам отрицателните бактерии се оцветяват в розово-червено.
Допълнение 4
ОПРЕДЕЛЯНЕ НА ПОПУЛАЦИЯ ОТ ПОЛОЖИТЕЛНИ КЛЕТКИ С ИМУНОФЛУОРЕСЦЕНТНОТО ИЗПИТВАНЕ
Повърхността (S) на гнездото на многоклетъчно предметно стъкло
|
|
(1) |
| където D= диаметъра на гнездото. |
|
|
Повърхност(и) на полето на обектива |
|
|
|
(2) |
| където d= диаметъра на полето. |
|
|
Изчислява се d чрез пряко измерване, или по следната формула: |
|
|
|
(3) |
| където i= коефициент на полето (зависи от вида на обектива и варира между 8 и 24), K= коефициент на тубуса (1 или 1,25), G= увеличение (100 ×, 40 × и т.н.) на обектива |
|
|
|
|
|
|
(4) |
Преброява се броят на типичните флуоресцентни клетки на поле (с).
Изчислява се броят на типичните флуоресцентни клетки на гнездо (С).

Изчислява се броят на типичните флуоресцентни клетки на мл концентриран екстракт (N)

където
y= обем на концентрирания екстракт в гнездо,
F= коефициент на разреждане на концентрирания екстракт.
Допълнение 5
КУЛТУРА ОТ СИН ДОМАТ
Посяват се семена от син домат (Solanum melongena cv. Black Beauty Черна красота) в пастьоризиран компост за семена. Разсаждат се младите растения с напълно развити семеделни листа (10—14 дни) в пастьоризиран компост за саксиен разсад.
Използват се сини домати в трета вегетационна фаза, но с не повече от три напълно разтворени листа.
Сините домати трябва да се отглеждат в оранжерия при следните условия на околната среда:
|
продължителност на деня: |
14 часа или естествената продължителност на деня, ако е по-дълъг; |
|
|
температура: |
дневна |
21—24 °С |
|
нощна: |
15 °С |
|
NB: C. sepedonicum не вирее при температури, по-високи от 30 °С. Ако нощните температури не паднат до 15 °С, може да настъпи хромофорно увреждане (сребриста некроза).
Прилагането на подходящ инсектицид позволява да се предотврати увреждане на корена, причинено от ларви.
Син домат от сорта Black Beauty може да се получи от:
|
1. |
|
|
2. |
|
|
3. |
|
|
4. |
|
Допълнение 6
СРЕДИ ЗА РАСТЕЖ И ИЗОЛИРАНЕ НА C. SEPEDONICUM
Хранителен агар (ХA)
Хранителен агар difco bacto в дестилирана вода при концентрация, посочена от производителя. Стерилизира се чрез обработване в автоклав при 121 °С в продължение на 15 минути.
Хранителен агар с декстроза (ХАД)
Хранителен агар difco bacto, съдържащ 1 % D(+) глюкоза (монохидрат). Стерилизира се чрез автоклав при температура 115 °С в продължение на 20 минути.
Дрождов пептон-глюкозен агар (ДПГА)
|
Екстракт от дрожди difco bacto (№ 0127) |
5 г |
|
Пептон difco bacto (№ 0118) |
5 г |
|
D(+)-глюкоза (монохидрат) |
10 г |
|
Пречистен агар difco bacto (№ 0560) |
15 г |
|
Дестилирана вода |
1 литър |
Стерилизира се 0,5 литра обеми от среда чрез автоклав при 115 °С в продължение на 20 минути.
Среда с екстракт от дрожди и минерални соли (СДМ)
|
Екстракт от дрожди bacto difco |
2,0 г |
|
D(+)-глюкоза (монохидрат) |
2,5 г |
|
K2HPO4 |
0,25 г |
|
KH2PO4 |
0,25 г |
|
MgSO4 · 7H2O |
0,1 г |
|
MnSO4 · H2O |
0,015 г |
|
NaCl |
0,05 г. |
|
FeSO4 · 7H2O |
0,005 г |
|
Очистен агар bacto difco |
18 г |
|
Дестилирана вода |
1 литър |
Стерилизира се 0,5 литра обеми от средата чрез автоклав при 115 °С в продължение на 20 минути.
Допълнение 7
ХРАНИТЕЛНИ И ФИЗИОЛОГИЧНИ ИЗПИТВАНИЯ ЗА ИДЕНТИФИКАЦИЯ НА C. SEPEDONICUM
Всички среди трябва да се инкубират при 21 °С и да се изследват след 6 дни. Ако няма растеж, се инкубират до 20 дни.
|
— |
Окислително и ферментационно изпитване (Hugh и Leifson), 1953) - O/F проба. Среда на култура:
Смесва се и се регулира рН на 7,0 до 7,2 с 1N KOH. Разпределя се в пирекс епруветки за култури 16 мм х 100 мм (капацитет 12 мл) в обеми 5 мл и 10 мл. Стерилизира се чрез автоклав при 115 °С в продължение на 10 минути. Инокулира се всяка култура като се дълбока инжекция в 5 мл и 10 мл в епруветки. Добавя се асептично 1 до 2 мл стерилен течен парафин в епруветка от 10 мл. Инкубира се. Положителна реакция
|
||||||||||||||||||||||||||||||||||||||
|
— |
Изпитване за оксидаза (проба на Ковакс, 1956 г.) Реактив за оксидаза на Ковакс:
Този реактив трябва да е прясно приготвен в обеми от 1 мл или може да се съхранява в кафява стъклена бутилка при 5 °С в продължение на 1 до 4 седмици. Капва се капка от реактива върху филтърна хартия в чиста чашка Петри. Незабавно натрийте малко от тестваната култура от хранителния агар, като се използва платинена гребалка. Положителна реакция: за 10 секунди се появява пурпурно оцветяване. Културите, при които тази реакция се появява след 10 до 30 секунди, са слабо положителни. NB: Важно е да се използва платинена гребалка и култури ХA, тъй като следи от желязо или високо съдържание на захар в растежната среда могат да дадат фалшиви положителни резултати. |
|
— |
Произвеждане на киселина от лактоза, рамноза, салицин, глицерин. Приготвя се окислително-ферментационната среда на Hugh и Leifson, без глюкозата. Разпределя се на обеми от по 5 мл в епруветки. Стерилизира се чрез автоклав при 115 °С в продължение на 10 минути. Към разтопената при 45 °С основа се прибавя асептично 0,5 мл от 10 % воден разтвор на глицерин, лактоза, рамноза, или на салицин, стерилизиран през филтър. Разбърква се внимателно. Положителна реакция: промяната на цвета от синьозелен в жълт е индикация за произвеждане на киселина. |
|
— |
Изпитване за каталаза Капва се капка от водороден прекис (обем 30) върху чисто предметно стъкло и се емулгира с пълна платинена гребалка от културата. Положителна реакция: произведените кислородни мехурчета в капката показват наличие на каталаза. |
|
— |
Нитроредуктазна активност и денитрификация (Брадбъри, 1970) Среда на култура:
Разпределя се на обеми по 10 мл в 20 милилитрови шишенца. Стерилизира се чрез автоклав при 121 °С в продължение на 15 минути. Реактив А:
Реактив В:
Инокулира се нитратната среда двойно. Тества се след 10 и 20 дни, чрез добавяне на една капка йод на Лугол, 0,5 мл реактив А и 0,5 мл реактив В. Ако средата не стане червеникава, се добавя приблизително 50 мг цинкова прах. Следи се цветовата реакция.
|
||||||||||||||||||||||||||||||
|
— |
Произвеждане на уреаза (Lelliott, 1966) Среда на култура:
Стерилизира се чрез автоклав при 115 °С в продължение на 20 минути. Охлажда се разтопената основа до 50 °С и се добавя асептично 5 мл от стерилизирания с филтър 40 % воден разтвор на урея (оксоид SR20). Смесва се добре. Разпределя се в обеми по 6 мл в стерилни епруветки (16 × 100 мм) и се оставя да се втвърди в наклонени епруветки. Положителна реакция: в случай на активност на уреаза, жълто-оранжевата среда развива черешово червено или пурпурно оцветяване. Използване на цитрат (Christensen) (Skerman, 1967)
Разбърква се и се разтваря чрез загряване. Разпределя се в обеми по 6 мл както за среда с урея. Стерилизира се чрез автоклав при 121 °С в продължение на 15 минути и се оставя да се втвърди в наклонени епруветки. Положителна реакция: използването на цитрат се вижда от промяна в цвета на средата от оранжев в червен. |
|
— |
Произвеждане на сероводород (Рамамурти, 1959) Среда:
Разтворя се и се разпределя в обеми по 6 мл в епруветки 16 х 100 мм. Стерилизира се чрез автоклав при 115 °С в продължение на 10 минути. Инокулира се и се закача асептично оловна ацетатна хартия от края на епруветката. Задържа се на място със запушалката. Инкубира се до 20 дни. Положителна реакция: произвеждането на H2S от триптона се вижда от появяването на черно-кафяво оцветяване на индикаторната хартия. |
|
— |
Произвеждане на индол (Рамамурти, 1959) Среда:
Отстранява се оловно ацетатната хартия и се добавя 1 до 2 мл диетилов етер, и леко се разклаща. Оставя се (пет минути) пластовете да се разделят. Добавя се внимателно 0,5 мл реактив на Ковакс (Merck 9293) във вътрешността на наклонената епруветка. Положителна реакция: наличието на индол се вижда от появата на червен цвят в жълтия слой между етера и водните фракции. |
|
— |
Растеж при 37 °С (Рамамурти, 1959) Среда:
Смесва се, разтваря се и се разпределя в обеми по 6 мл в епруветките. Стерилизира се чрез автоклав при 121 °С в продължение на 15 минути. Инокулира се и се инкубира при 37 °С. Положителна реакция: следете за растеж. |
|
— |
Растеж в 7 % разтвор на натриев хлорид (Рамамурти, 1959) Среда:
Смесва се, разтваря се и се разпределя в обеми по 6 мл в епруветки. Стерилизира се чрез обработване в автоклав при 121 °С в продължение на 15 минути. Положителна реакция: следи се за растеж. |
|
— |
Желатинова хидролиза (Лелиот, Билинг и Хейуърд, 1966) Среда:
Смесва се, разтваря се чрез нагряване и се разпределя в обеми по 6 мл в епруветки. Стерилизира се чрез автоклав при 121 °С в продължение на 15 минути. Положителна реакция: втечняване на желатина, дори когато се държи при 5 °С в продължение на 30 минути. |
|
— |
Скорбялна хидролиза Среда:
Смесва се, стерилизира се в автоклав при 115 °С в продължение на 10 минути. Сипва се върху пластинките. Инокулира се точково пластинките. След настъпване на добър растеж (10 до 20 дни), се премахва част от бактериалната култура и се залива с йод на Лугол. Положителна реакция: наличието на скорбялна хидролиза се вижда от ясните зони под и около бактериалната култура. Останалата част от средата е на пурпурни петна. |
|
— |
Ескулин хидролазна активност (Снийт и Колинс, 1974) Среда:
Разбърква се, за да се разтвори и се разпределя в обеми от 6 мл в епруветки. Стерилизира се чрез автоклав при 115 °С в продължение на 10 минути. Средата е бистра, но има синкава флуоресценция. Положителна реакция: хидролизата на ескулин се вижда от появата на кафяв цвят, заедно с изчезване на флуоресценцията. Това може да се провери с ултравиолетова лампа. |
СПРАВОЧНА ЛИТЕРАТУРА
Bradbury, J. F., 1970. Isolation and preliminary study of bacteria from plants. (Изолиране и предварително изследване на бактерии от растения.) Rev. Pl. Path. 49, 213—218.
Dinesen, I. G., 1984. The extraction and diagnosis of Corynebacterium sepedonicum from diseased potato tubers. (Извличане и диагноза на Corynebacterium sepedonicum от заболели картофени клубени) EPPO Bull. 14 (2), 147—152.
Doetsch, R. N., 1981. Determinative methods of light microscopy. In: Manual of methods for general bacteriology, (Определящи методи на светлинна микроскопия. В: Наръчник с методи за обща бактериология) American Society for Microbiology, Washington, 21—23.
Hugh, R. and Leifson, F., 1953. The taxonomic significance of fermentative versus oxidative metabolism of carbohydrates by various gram-negative bacteria. (Таксономично значение на ферментационната срещу окислителната обмяна на въглехидрати чрез различни грам-отрицателни бактерии J. Bact.), 66, 24—26
Janse, J. D. and J. Van Vaerenbergh. The interpretation of the EC method for the detection of latent ring rot infections (Corynebacterium sepedonicum) in potato. (Тълкуване на метода на ЕО за откриване на латентна зараза с пръстеновидна бактериоза (Corynebacterium sepedonicum) по картофите) EPPO Bull., № 17, 1987, pp. 1—10.
Kovacs, N., 1956. Identification of Pseudomonas pyocyanea by the oxidase reaction. (Установяване на Pseudomonas pyocyanea чрез реакция на оксидаза) Nature, Lond., 178, 703.
Lelliott, R. A., 1966. The plant pathogenic coryneform bacteria. (Патогенни бактерии coryneform по растенията) J. appl. Bact., 29, 114—118.
Lelliott, R. A., E. Billing and A. C. Hayward, 1966. A determinative scheme for the fluorescent plant pathogenic pseudomonads J. appl. Bact. (Определяща схема за растителните патогенни псевдомонади), 29, 470—489.
Lelliott, R. A. and P. W., Sellar, 1976. The detection of latent ring rot (Corynebacterium sepedonicum (Spiek. et Kotth.) Skapt. et Burkh.) in potato stocks (Определяне на латентна пръстеновидно гниене(Corynebacterium sepedonicum (Spiek. et Kotth.) Skapt. et Burkh.) в запаси от картофи) EPPO Bull., 6 (2), 101—106.
Ramamurthi, C. S., 1959. Comparative studies on some Gram-positive phytopathogenic bacteria and their relationship to the Corynebacteria. (Сравнителни изследвания на някои грам-положителни фитопатогенни бактерии и връзката им с коринебактериите) Mem. Cornell agric. Exp. Sta., 366, 52 pp.
Skerman, V. B. D., 1967. A guide to the identification of the genera of bacteria. (Ръководство за определяне на видовете бактерии) 2nd ed., William and Wilkins Company, Baltimore.
Sneath, P. H. A. and V. G. Collins, 1974. A study in test reproductibility between laboratories: report of Pseudomonas working party. (Изследване за възпроизводимост на тестове между лабораториите: доклад на работна група по псевдомоните) Antonie van Leeuwenhoek, 40, 481—527.
ПРИЛОЖЕНИЕ II
1. За всяка поява, за която има съмнения и е констатирана положителна реакцияпри имунофлуоресцентното изпитване по метода, описан в приложение I, и за която се очаква потвърждаване или опровергаване чрез прилагане на посочения метод, следва да се запазят и съхранят по подходящ начин:
|
— |
всички клубени или растения, от които е взета проба, ако е възможно, и |
|
— |
всеки останал екстракт или допълнително приготвени предметни стъкла за имунофлуоресцентното изпитване, |
до завършване на изпитването по посочения метод.
2. В случай че се потвърди наличието на вредител, следва да се запази и съхрани по подходящ начин:
|
— |
материалът, посочен в параграф 1, и |
|
— |
проба от заразения материал от син домат, инокулиран с екстракт от клубени или растения, и |
|
— |
изолираната култура на вредителя, |
най-малко до един месец след процедурата по уведомяване по член 5, параграф 2.
ПРИЛОЖЕНИЕ III
1. Елементите, които следва да се вземат под внимание при определяне на степента на вероятно заразяване по член 5, параграф 1, буква б), включват:
|
— |
клубени или растения, отгледани на място на производство, обявено за заразно по член 5, параграф 1, буква а), |
|
— |
място/места на производство или помещения, които са в някаква производствена връзка с клубените или растенията, обявени за заразени по член 5, параграф 1, буква а), включително места, на които се ползва общо производствено оборудване и съоръжения, директно или чрез общ доставчик, |
|
— |
клубени или растения, произведени на мястото/местата на производство посочени в предишното тире, или които се намират на такова/и място/места а на производство по време, когато клубените или растенията, обявени за заразени по член 5, параграф 1, буква а), са били в помещенията или на местата на производство, посочени в първото тире, |
|
— |
централни складове, в които се товарят и разтоварват картофи от горепосочените места на производство, |
|
— |
всички машини, транспортни средства, съдове, складове или техни части, и всякакви предмети, включително опаковъчен материал, които вероятно са били в контакт с клубените или растенията, обявени за заразени по член 5, параграф 1, буква а) през предходните 12 месеца, или на каквито и да е други места, |
|
— |
всички клубени или растения, намиращи се на склад в, или са били в контакт с някой от елементите или предметите, изброени в предходното тире, преди прочистването и обеззаразяването им, и |
|
— |
включва, в резултат от извършените изпитвания по член 6, клубени или растения със същия клонален произход като клубените или растенията, обявени за заразени по член 5, параграф 1, буква а), и за които направените проучвания показват вероятно заразяване. |
2. Елементите, които следва да се вземат под внимание при определяне на вероятното разпространяване на заразата по член 5, параграф 1, буква в), включват:
|
— |
близостта на други места на производствено, където се отглеждат картофи или други гостоприемници, |
|
— |
общият произход на наличностите от картофи за семе. |
3. Подробностите по уведомяването, посочено в първата алинея на член 5, параграф 2, включват:
|
— |
за всяка пратка или партида картофи, обявени за заразени, сертификатите, определени в членове 7 или 8 от Директива 77/93/ЕИО, паспортът или регистрационният номер, според случая, |
|
— |
за наличностите от картофи за семе, името на сорта, и, при възможност, във всички останали случаи, |
|
— |
описание на елементите на обявената зараза и границите на зоната, |
|
— |
наличието на екстракт, приготвени предметни стъкла с оглед на имунофлуоресцентното изпитване, материал от заразени сини домати и изолирана култура на вредителя от изпитването, чрез която се потвърждава наличието на вредителя. |
ПРИЛОЖЕНИЕ IV
1. Посочените в член 7, параграф 1 официално контролирани мерки за унищожаване на клубени или растения, обявени за заразени по член 5, параграф 1, буква а), са:
|
— |
употреба с цел промишлено преработване чрез пряка и незабавна доставка до преработващото предприятие със съответни съоръжения за депониране на отпадъци, за които е установено, че не представляват риск от разпространяване на вредителя, и със система за обеззаразяване на складовите площи и превозните средства, напускащи предприятието, или |
|
— |
други мерки, при условие че не е установен определен риск от разпространяване на вредителя. за тези мерки трябва да се съобщават на Комисията и останалите държави-членки. |
2. Подходящата употреба или унищожаване на клубените или растенията, обявени за вероятно заразени по член 5, параграф 1, буква б) и посочени в член 7, параграф 2, извършвано под контрола на отговорните официални органи, съдържа:
|
— |
употребата има като картофи за съхранение на склад, предназначени за консумация, в пакетирани за директна доставка и употреба без повторно пакетиране, и предназначени за такава пряка доставка и употреба, или |
|
— |
употребата като картофи за съхранение на склад, предназначени за промишлено преработване и предназначени за незабавна доставка до преработващото предприятие, снабдено със съответни съоръжения за депониране на отпадъци и дезинфекция, или |
|
— |
някакъв друг вид употреба или унищожаване, за които е установено, че не съществува определен риск от разпространяване на вредителя. |
3. Подходящите методи за почистване и дезинфекция на предметите, посочени в член 7, параграф 3, са онези, за които е установено, че не крият определен риск от разпространяване на вредителя и че се прилагат под надзора на отговорните официални органи на държавите-членки.
4. Сериите мерки, които държавите-членки следва да приложат в границите на зоната, установена по член 5, параграф 1, буква в) и посочена в член 7, параграф 4, включват:
4.1. на места на производство, обявени за заразени по член 5, параграф 1, буква а):
|
а) |
в поле, обявено за заразено по член 5, параграф 1, буква а), или
|
|
б) |
в други полета:
|
|
в) |
незабавно след обявяване на заразяването по член 5, параграф 1, буква а) и през всяка последваща вегетационна година, до и включително първия разрешен сезон за отглеждане на картофи на полето (полята), обявени за заразени, както е описано подробно в буква а), всички машини и складови съоръжения на мястото на производството и участващи в производството на картофи се почистват и дезинфекцират, при необходимост, чрез прилагане на подходящи методи, както е посочено в точка 3; |
|
г) |
в производствени системи, където е възможна пълна подмяна на средата за отглеждане на растенията,
|
4.2. в границите на определената зона, без да се засягат мерките, описани подробно в точка 4.1, държавите- членки:
|
а) |
незабавно и в продължение най-малко на три вегетационни сезона след обявяване на заразата:
|
|
б) |
при необходимост, разработват програма за подмяна на всички наличности от картофи за семе за подходящ период от време. |
Комисията и останалите държави-членки следва да бъдат информирани всяка година за мерките, прилагани по точка 4.2, заедно с регистрационните номера на производителите, общите складове и центрове за експедиция на територията на определената зона.