EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document L:2023:071:FULL
Official Journal of the European Union, L 071, 9 March 2023
Официален вестник на Европейския съюз, L 071, 9 март 2023 г.
Официален вестник на Европейския съюз, L 071, 9 март 2023 г.
Display all documents published in this Official Journal
|
ISSN 1977-0618 |
||
|
Официален вестник на Европейския съюз |
L 71 |
|

|
||
|
Издание на български език |
Законодателство |
Година 66 |
|
|
|
Поправки |
|
|
|
* |
||
|
|
* |
||
|
|
* |
|
|
|
|
|
(1) Текст от значение за ЕИП. |
|
BG |
Актовете, чиито заглавия се отпечатват с нормален шрифт, са актове по текущо управление на селскостопанската политика и имат кратък срок на действие. Заглавията на всички останали актове се отпечатват с удебелен шрифт и се предшестват от звезда. |
II Незаконодателни актове
РЕГЛАМЕНТИ
|
9.3.2023 |
BG |
Официален вестник на Европейския съюз |
L 71/1 |
ДЕЛЕГИРАН РЕГЛАМЕНТ (ЕС) 2023/511 НА КОМИСИЯТА
от 24 ноември 2022 година
за допълнение на Регламент (ЕС) № 575/2013 на Европейския парламент и на Съвета с регулаторни технически стандарти за изчисляване по мандатния подход на рисково претеглените експозиции на предприятията за колективно инвестиране
(текст от значение за ЕИП)
ЕВРОПЕЙСКАТА КОМИСИЯ,
като взе предвид Договора за функционирането на Европейския съюз,
като взе предвид Регламент (ЕС) № 575/2013 на Европейския парламент и на Съвета от 26 юни 2013 г. относно пруденциалните изисквания за кредитните институции и за изменение на Регламент (ЕС) № 648/2012 (1), и по-специално член 132а, параграф 4, трета алинея от него,
като има предвид, че:
|
(1) |
С цел да се избегне ненужното вариране на капиталовите изисквания сред институциите и за да може мандатният подход да функционира в случаите, когато информацията е недостатъчна, е необходимо да се уточни методът за определяне по мандатния подход на рисково претеглените експозиции на дадено предприятие за колективно инвестиране (ПКИ) тогава, когато липсващи данни не позволяват да се изчислят рисково претеглените експозиции. |
|
(2) |
Когато ПКИ сключва сделки с деривати и базисните инструменти на дериватите или базисният риск на позициите в деривати са неопределими, заместителната стойност на позициите не може да бъде определена от институциите, поради което не може да бъде определена и стойността на тяхната експозиция. В такива случаи институциите следва да взимат за основа на изчисленията си условната стойност на дериватната позиция, която обикновено е известна и е най-добрият показател за размера на позицията; така те могат приблизително да оценят стойността на експозицията. |
|
(3) |
Когато мандатът на ПКИ допуска сключването на сделки с деривати, но не предоставя достатъчно информация, за да се прецени дали даден базисен инструмент представлява балансова или задбалансова експозиция, не може да се изключи, че такава експозиция е създадена. Поради това, тази експозиция трябва да бъде включена в изчисляването на рисково претеглените експозиции на ПКИ. |
|
(4) |
Когато мандатът не предоставя достатъчно информация за стойността на експозицията на такава позиция, не може да се изключи, че стойността на експозицията е пълната условна стойност на дериватната позиция. |
|
(5) |
Когато мандатът не посочва условната стойност на дериватната позиция, тази стойност следва да се извлича от максималната позволена от мандата условна стойност на дериватите, за да се осигури достатъчно предпазлив подход. |
|
(6) |
Когато при изчисляването на експозицията към кредитен риск от контрагента не могат да се определят необходимите за това изчисляване заместителна стойност или потенциална бъдеща експозиция, мандатният подход може да се използва, ако институциите взимат за основа на изчисленията си сбора на условните стойности на сделките в нетиращата съвкупност, който е най-добрата налична консервативна оценка. |
|
(7) |
Понякога институциите не могат да установят съответните нетиращи съвкупности за определен вид дериват в ПКИ, тъй като няма налична информация за контрагентите или за това дали сделките са предмет на посоченото в член 272, точка 4 от Регламент (ЕС) № 575/2013 правно изпълнимо двустранно споразумение за нетиране. В тези случаи институциите следва да приемат, че за този вид деривати няма нито ефект на нетиране, нито диверсификация на контрагентите. Поради това институциите следва да приемат, че ПКИ е сключило сделка с един дериват, чиято стойност е максималната позволена от мандата за този вид дериват условна стойност. |
|
(8) |
Настоящият регламент е изготвен въз основа на проектите на регулаторни технически стандарти, представени на Комисията от Европейския банков орган. |
|
(9) |
Европейският банков орган проведе открити обществени консултации по проекта на регулаторни технически стандарти, въз основа на който е изготвен настоящият регламент, като анализира потенциалните разходи и ползи и поиска становището на създадената с член 37 от Регламент (ЕС) № 1093/2010 на Европейския парламент и на Съвета (2) Група на участниците от банковия сектор, |
ПРИЕ НАСТОЯЩИЯ РЕГЛАМЕНТ:
Член 1
Определяне на стойността на експозицията на дериватните позиции на ПКИ при неопределим за целите на член 132а, параграф 2 от Регламент (ЕС) № 575/2013 базисен инструмент
1. Когато по силата на член 132а, параграф 2 от Регламент (ЕС) № 575/2013 институциите изчисляват рисково претеглените експозиции по мандатния подход в случаите, когато мандатът на ПКИ допуска базисният инструмент на дериватната му позиция да представлява балансова или задбалансова експозиция, но стойността на експозицията, а при задбалансова експозиция – приложимият процент по член 111 от Регламент (ЕС) № 575/2013, са неопределими, те взимат за стойност на експозицията пълната условна стойност на дериватната позиция.
2. Когато, при определянето съгласно параграф 1 на стойността на експозицията, необходимата за това условна стойност на дериватните позиции е неопределима, институциите взимат за стойност на експозицията консервативна оценка, основана на максималната позволена от мандата на ПКИ условна стойност на дериватите.
Член 2
Изчисляване на стойността на експозицията към кредитен риск от контрагента на нетираща съвкупност от дериватни позиции на ПКИ
1. Когато изчисляват стойността на експозицията към кредитен риск от контрагента на нетираща съвкупност в съответствие с подходите в част 3, дял II, глава 6, раздели съответно 3, 4 или 5 от Регламент (ЕС) № 575/2013, институциите прилагат следното:
|
а) |
когато липсващи входящи данни не им позволяват да изчислят по съответния подход заместителната стойност на нетиращата съвкупност, те взимат за заместителна стойност сбора от условните стойности на всички деривати в нетиращата съвкупност; |
|
б) |
когато липсващи входящи данни не им позволяват да изчислят по съответния подход потенциална бъдеща експозиция на нетиращата съвкупност, те я заменят със сбора на условните стойности на всички деривати в нетиращата съвкупност, умножен по 0,15. |
2. Когато, при определянето съгласно параграф 1 на стойността на експозицията към кредитен риск от контрагента, необходимата за това условна стойност на дериватите в нетиращата съвкупност е неопределима, институциите определят стойността на експозицията на тази нетираща съвкупност, като използват консервативна оценка, основана на максималната позволена от мандата на ПКИ условна стойност на дериватите.
3. За целите на параграфи 1 и 2, когато не могат да установят съответните нетиращи съвкупности за определен вид дериват в ПКИ, институциите приемат, че ПКИ е сключило сделка с един дериват, чиято стойност е максималната позволена от мандата за този вид дериват условна стойност.
Член 3
Влизане в сила
Настоящият регламент влиза в сила на двадесетия ден след деня на публикуването му в Официален вестник на Европейския съюз.
Настоящият регламент е задължителен в своята цялост и се прилага пряко във всички държави членки.
Съставено в Брюксел на 24 ноември 2022 година.
За Комисията
Председател
Ursula VON DER LEYEN
(1) ОВ L 176, 27.6.2013 г., стр. 1.
(2) Регламент (ЕС) № 1093/2010 на Европейския парламент и на Съвета от 24 ноември 2010 г. за създаване на Европейски надзорен орган (Европейски банков орган), за изменение на Решение № 716/2009/ЕО и за отмяна на Решение 2009/78/ЕО на Комисията (ОВ L 331, 15.12.2010 г., стр. 12).
|
9.3.2023 |
BG |
Официален вестник на Европейския съюз |
L 71/4 |
РЕГЛАМЕНТ ЗА ИЗПЪЛНЕНИЕ (ЕС) 2023/512 НА КОМИСИЯТА
от 2 март 2023 година
за одобрение на изменение, което не е несъществено, в продуктовата спецификация на наименование, вписано в регистъра на защитените наименования за произход и защитените географски указания („Aceto Balsamico di Modena“ (ЗГУ))
ЕВРОПЕЙСКАТА КОМИСИЯ,
като взе предвид Договора за функционирането на Европейския съюз,
като взе предвид Регламент (ЕС) № 1151/2012 на Европейския парламент и на Съвета от 21 ноември 2012 г. относно схемите за качество на селскостопанските продукти и храни (1), и по-специално член 52, параграф 3, буква б) от него,
като има предвид, че:
|
(1) |
В съответствие с член 50, параграф 2, буква а) от Регламент (ЕС) № 1151/2012 заявлението на Италия за одобрение на изменение, което не е несъществено, в продуктовата спецификация на защитеното географско указание „Aceto Balsamico di Modena“ беше публикувано в Официален вестник на Европейския съюз (2). |
|
(2) |
На 31 август 2021 г. Комисията получи от Германия три уведомления за възражение и едно мотивирано възражение. На 11 октомври 2021 г. бяха представени две допълнителни мотивирани възражения от Германия. На 16 септември 2021 г. Комисията получи четвърто уведомление за възражение от възразяваща страна със седалище в Турция. Съответното мотивирано възражение беше подадено на 16 ноември 2021 г. |
|
(3) |
След като разгледа мотивираните възражения и ги счете за допустими в съответствие с член 51, параграф 3 от Регламент (ЕС) № 1151/2012, с писмо от 10 декември 2021 г. Комисията прикани Италия и Германия, от една страна, и Италия и възразяващата страна от Турция — от друга, да проведат подходящи консултации с оглед на постигането на съгласие. |
|
(4) |
На 4 март 2021 г. Германия уведоми Комисията, че едно от възраженията е било оттеглено, но другите две възразяващи страни от Германия продължават да поддържат своите възражения. |
|
(5) |
Консултациите между Италия и Германия, от една страна, и Италия и възразяващата страна от Турция — от друга, приключиха, без да бъде постигнато съгласие. Поради това Комисията следва, в съответствие с процедурата, посочена в член 52, параграф 3, буква б) от Регламент (ЕС) № 1151/2012, да приеме решение относно измененията, като вземе предвид резултатите от тези консултации. |
|
(6) |
Възразяващите страни считат, че измененията в продуктовата спецификация ще доведат до неспазване на условията, определени в член 5, параграф 2 от Регламент (ЕС) № 1151/2012, по-специално по отношение на прекъсването на връзката между продукта и географския район. Поради тази причина бяха поставени под въпрос предполагаемите промени в органолептичните характеристики на „Aceto Balsamico di Modena“, промяната в минималното общо киселинно съдържание на отлежалия продукт и процедурата за коригиране на евентуални отклонения от параметрите. Тези изменения бяха също така оспорени като понижаващи качеството на „Aceto Balsamico di Modena“ и водещи до неспазване на изискванията за винения оцет, определени в част II, точка 17 от приложение VII към Регламент (ЕС) № 1308/2013 на Европейския парламент и на Съвета (3) за установяване на обща организация на пазарите на селскостопански продукти (киселинно съдържание не по-ниско от 60 грама на литър = най-малко 6 %). |
|
(7) |
Освен това възразяващите страни твърдят, че премахването на обозначението за контролен орган за „Aceto Balsamico di Modena“ води до неспазване на минималните изисквания за съдържанието на продуктовата спецификация, съгласно член 7, параграф 1, буква ж) от Регламент (ЕС) № 1151/2012. |
|
(8) |
Възразяващите страни също така твърдят, че съществуващият обхват на закрила на наименованието е бил неправомерно разширен и по този начин регистрацията на измененията би застрашила съществуването на други наименования, търговски марки или продукти, включително балсамови оцети с различен произход. Това твърдение се отнася по-специално за предполагаемото включване на задължението за бутилиране в определения район, за допълнителното правило относно формата на контейнерите, както и за въвеждането на параметри на изотопното съотношение. Възразяващите страни твърдят, че планираните изменения накърняват интересите на бутилиращите предприятия на „Aceto Balsamico di Modena“ и на германските производители на други видове оцет. |
|
(9) |
Накрая, възразяващите страни заявиха, че нововъведеното понижение на минималното киселинно съдържание би могло да породи объркване между „Aceto Balsamico di Modena“ (ЗГУ) и „Aceto Balsamico Tradizionale di Modena“ (ЗНП). |
|
(10) |
Комисията оцени аргументите, изложени от Германия и Турция в мотивираните възражения, с оглед на разпоредбите на Регламент (ЕС) № 1151/2012, взе предвид резултатите от съответните консултации, проведени между заявителя и възразяващите страни, и стигна до заключението, че изменението в продуктовата спецификация на защитеното географско указание „Aceto Balsamico di Modena“ следва да бъде одобрено. |
|
(11) |
Италия заяви, че възразяващите страни не са доказали законния си интерес за внасяне на възражения, в съответствие с член 51, параграф 1 от Регламент (ЕС) № 1151/2012, тъй като те оспорват изменения, за които или не са били подадени заявления, или които не са довели до търговски и/или пазарни пречки. В рамките на процедурата, приложима за заявления за изменения в продуктовата спецификация, които не са незначителни, всяко физическо или юридическо лице, което има законен интерес, може да подаде възражение по подаденото заявление за изменение. В настоящия случай рискът от увреждане на интересите на възразяващите страни не беше счетен за напълно невероятен или хипотетичен, което доведе до заключението, че възразяващите страни са доказали законен интерес за подаване на възражения. |
|
(12) |
Анализът на представените възражения показа, че в действителност някои от твърденията са отправени към такива елементи в продуктовата спецификация, които на практика не са се променили в резултат на настоящите изменения, а се състоят само от редакционни промени. Тези редакционни промени имат за цел да приведат единния документ в съответствие с член 8, параграф 1, буква в) от Регламент (ЕС) № 1151/2012 и да отразят по-добре условията, установени в продуктовата спецификация на „Aceto Balsamico di Modena“ (ЗГУ). Това се отнася по-специално за предполагаемите промени в органолептичните характеристики, предполагаемите промени във връзка с използването на добавки и на пластмасови бутилки, както и предполагаемото задължение за бутилиране в определения район. Тези правила не са се променили, а новата формулировка, която се съдържа в единния документ и може да бъде възприета като изменения в продуктовата спецификация, всъщност произтича от коригирането на несъответствията между продуктовата спецификация и резюмето на спецификацията на продукта, публикувано в Официален вестник на Европейския съюз (4). Оценката на Комисията на заявлението за изменение на „Aceto Balsamico di Modena“ (ЗГУ) е съсредоточена върху заявените съществени изменения. |
|
(13) |
Не може да се счита, че промените, които се свеждат до намаляване на минималния процент киселинно съдържание за вида „invecchiato“ (отлежал) от 6 % на 5,5 % и до въвеждане на процедура за корекции на евентуалните отклонения, оказват отрицателно въздействие върху връзката между продукта и неговия географски произход. Причините за тези изменения са обяснени и надлежно обосновани при публикуването на заявлението, като е очевидно, че естеството и мащабът на тези изменения не променят основните характеристики на „Aceto Balsamico di Modena“ (ЗГУ) и следователно не могат да доведат до изчезване на връзката. |
|
(14) |
Освен това сходството в степените на киселинност не е толкова значимо и не може да породи объркване между „Aceto Balsamico di Modena“ (ЗГУ) и „Aceto Balsamico Tradizionale di Modena“ (ЗНП), нито да доведе до имитация на последното. Независимо че продуктите с двете наименования имат определени общи характеристики, като например степента на киселинност, те са направени от различни суровини и следват различен метод на производство и поради това остават различни. |
|
(15) |
Накрая, защитеното географско указание „Aceto Balsamico di Modena“ не е определено като винен оцет и следователно не подлежи на правилата, приложими за винения оцет, по-специално по отношение на минималното киселинно съдържание. |
|
(16) |
Що се отнася до възраженията относно разширяването на обхвата от размери на бутилките, не може да се счита, че изменението налага ограничения на операторите, включени в опаковането на „Aceto Balsamico di Modena“. Напротив, допускането на допълнителни бутилки с вместимост съответно 0,100 l, 0,150 l, 0,200 l и 1,5 l може да се разглежда като либерализиране на условията за бутилиране. Евентуалното засилване на конкуренцията, което би могло да произтече в резултат на предлагането на пазара на „Aceto Balsamico di Modena“ в по-широк обхват от размери на бутилките, би било в съответствие с основополагащите принципи на политиката на ЕС в областта на конкуренцията и не следва да се счита за вредно за репутацията на „Aceto Balsamico di Modena“ (ЗГУ). |
|
(17) |
Характеристиките на бутилките с вместимост под 0,250 литра, включени в раздел 3.5 от единния документ, имат за цел да осигурят минимален стандарт за еднородност на бутилките, в които ще се продава продуктът. Това правило за опаковането не е включено в продуктовото описание, нито е разработено по отношение на специфичния характер на продукта, посочен в раздела на единния документ, посветен на връзката, и поради това не може да се счита за съществен елемент от представянето на продукта. Тъй като тези изисквания са определени само за нови бутилки с вместимост под 0,250 литра, които не са били разрешени преди настоящото изменение, оспорваната промяна няма да окаже отрицателно въздействие върху разходите за бутилки, които вече са закупени от бутилиращите предприятия на „Aceto Balsamico di Modena“, и следователно няма да доведе до финансови загуби за тях. |
|
(18) |
В единния документ не е предоставена директно информация относно контролния орган, тъй като такава информация не се изисква там, съгласно приложение I към Регламент за изпълнение (ЕС) № 668/2014 на Комисията (5). Тази информация обаче е включена в продуктовата спецификация, както е предвидено в член 7, параграф 1, буква ж) от Регламент (ЕС) № 1151/2012. |
|
(19) |
Що се отнася до подадените от страните възражения срещу изискваното спазване на параметрите на изотопното съотношение, тези параметри са въведени, за да се установи по-добре възможното подправяне на винения оцет и да се подобри системата за контрол на „Aceto Balsamico di Modena“. Проверката на изотопното съотношение във всички случаи се извършва на етапа на производство и следователно засяга само производителите на „Aceto Balsamico di Modena“. |
|
(20) |
Следователно публикуваните в Официален вестник на Европейския съюз изменения в продуктовата спецификация на наименованието „Aceto Balsamico di Modena“ (ЗГУ) следва да бъдат одобрени. |
|
(21) |
Мерките, предвидени в настоящия регламент, са в съответствие със становището на Комитета по политиката за качество на селскостопанските продукти, |
ПРИЕ НАСТОЯЩИЯ РЕГЛАМЕНТ:
Член 1
Одобряват се публикуваните в Официален вестник на Европейския съюз изменения в продуктовата спецификация на наименованието „Aceto Balsamico di Modena“ (ЗГУ).
Член 2
Настоящият регламент влиза в сила на двадесетия ден след деня на публикуването му в Официален вестник на Европейския съюз.
Настоящият регламент е задължителен в своята цялост и се прилага пряко във всички държави членки.
Съставено в Брюксел на 2 март 2023 година.
За Комисията
Председател
Ursula VON DER LEYEN
(1) OВ L 343, 14.12.2012 г., стр. 1.
(2) ОВ C 231, 16.6.2021 г., стр. 11.
(3) Регламент (ЕС) № 1308/2013 на Европейския парламент и на Съвета от 17 декември 2013 г. за установяване на обща организация на пазарите на селскостопански продукти и за отмяна на регламенти (ЕИО) № 922/72, (ЕИО) № 234/79, (ЕО) № 1037/2001 и (ЕО) № 1234/2007 (OВ L 347, 20.12.2013 г., стр. 671).
(4) ОВ C 152, 6.7.2007 г., стр. 18 и Регламент (ЕО) № 583/2009 на Комисията от 3 юли 2009 г. за вписване на наименование в Регистъра на защитените наименования за произход и защитените географски указания (Aceto Balsamico di Modena (ЗГУ)) (OВ L 175, 4.7.2009 г., стр. 7).
(5) Регламент за изпълнение (ЕС) № 668/2014 на Комисията от 13 юни 2014 г. за определяне на правила за прилагането на Регламент (ЕС) № 1151/2012 на Европейския парламент и на Съвета относно схемите за качество на селскостопанските продукти и храни (OВ L 179, 19.6.2014 г., стр. 36).
|
9.3.2023 |
BG |
Официален вестник на Европейския съюз |
L 71/8 |
РЕГЛАМЕНТ ЗА ИЗПЪЛНЕНИЕ (ЕС) 2023/513 НА КОМИСИЯТА
от 8 март 2023 година
за изменение на приложения XV и XIX към Регламент за изпълнение (ЕС) 2021/404 по отношение на списъка на трети държави, територии или зони от тях, от които е разрешено въвеждането в Съюза на месни продукти от копитни животни, домашни птици и пернат дивеч и на яйца и яйчни продукти
(текст от значение за ЕИП)
ЕВРОПЕЙСКАТА КОМИСИЯ,
като взе предвид Договора за функционирането на Европейския съюз,
като взе предвид Регламент (ЕС) 2016/429 на Европейския парламент и на Съвета от 9 март 2016 г. за заразните болести по животните и за изменение и отмяна на определени актове в областта на здравеопазването на животните (Законодателство за здравеопазването на животните) (1), и по-специално член 230, параграф 1 от него,
като има предвид, че:
|
(1) |
С Регламент (ЕС) 2016/429 се определят, inter alia, ветеринарно-здравните изисквания във връзка с въвеждането в Съюза на пратки с животни, зародишни продукти и продукти от животински произход и той се прилага от 21 април 2021 г. Съгласно едно от посочените ветеринарно-здравни изисквания пратките трябва да идват от трета държава или територия, или зона или компартмент от нея, включени в списък в съответствие с член 230, параграф 1 от посочения регламент. |
|
(2) |
С Делегиран регламент (ЕС) 2020/692 на Комисията (2) се допълва Регламент (ЕС) 2016/429 по отношение на ветеринарно-здравните изисквания във връзка с въвеждането в Съюза на пратки с определени видове и категории животни, със зародишни продукти и с продукти от животински произход от трети държави или територии, или зони, или компартменти от тях. В Делегиран регламент (ЕС) 2020/692 се предвижда, че въвеждането в Съюза на пратки с животни, със зародишни продукти и с продукти от животински произход, попадащи в приложното поле на регламента, се разрешава само ако те идват от трета държава или територия, или зона или компартмент от нея, включени в списък за конкретните видове и категории животни, зародишни продукти и продукти от животински произход, в съответствие с ветеринарно-здравните изисквания, предвидени в посочения делегиран регламент. |
|
(3) |
С Регламент за изпълнение (ЕС) 2021/404 на Комисията (3) се установяват списъците на трети държави или територии, или зони, или компартменти от тях, от които е разрешено въвеждането в Съюза на видовете и категориите животни, зародишни продукти и продукти от животински произход, които попадат в приложното поле на Делегиран регламент (ЕС) 2020/692. Списъците и някои общи правила относно списъците са посочени в приложения I—XXII към посочения регламент за изпълнение. |
|
(4) |
В част 1 от приложение XV към Регламент за изпълнение (ЕС) 2021/404 е установен списъкът на трети държави или територии, или зони от тях, от които е разрешено въвеждането в Съюза на месни продукти от копитни животни, домашни птици и пернат дивеч. В част 1 от приложение XIX към Регламент за изпълнение (ЕС) 2021/404 е установен списъкът на трети държави или територии, или зони от тях, от които е разрешено въвеждането в Съюза на пратки с яйца и яйчни продукти. |
|
(5) |
Молдова подаде заявление до Комисията да бъде разрешено въвеждането в Съюза от нея на пратки с месни продукти от домашни птици, различни от щраусови птици, и яйца и предостави гаранции по отношение на спазването от тази трета държава на изискванията за уведомяване и докладване за болестите от списъка, посочени в приложение I към Делегиран регламент (ЕС) 2020/692, които са от значение за домашните птици, както и гаранции по отношение на спазването от тази трета държава на съответните ветеринарно-здравни изисквания на Съюза или на еквивалентни изисквания. Поради това и предвид здравната обстановка с домашните птици в Молдова е целесъобразно тази трета държава да бъде включена в списъците в част 1 от приложение XV и в част 1 от приложение XIX към Регламент за изпълнение (ЕС) 2021/404 по отношение на месните продукти от домашни птици, различни от щраусови птици и на яйцата. |
|
(6) |
Поради това приложения XV и XIX към Регламент за изпълнение (ЕС) 2021/404 следва да бъдат съответно изменени. |
|
(7) |
Мерките, предвидени в настоящия регламент, са в съответствие със становището на Постоянния комитет по растенията, животните, храните и фуражите, |
ПРИЕ НАСТОЯЩИЯ РЕГЛАМЕНТ:
Член 1
Приложения XV и XIX към Регламент за изпълнение (ЕС) 2021/404 се изменят в съответствие с приложението към настоящия регламент.
Член 2
Настоящият регламент влиза в сила на двадесетия ден след деня на публикуването му в Официален вестник на Европейския съюз.
Настоящият регламент е задължителен в своята цялост и се прилага пряко във всички държави членки.
Съставено в Брюксел на 8 март 2023 година.
За Комисията
Председател
Ursula VON DER LEYEN
(1) ОВ L 84, 31.3.2016 г., стр. 1.
(2) Делегиран регламент (ЕС) 2020/692 на Комисията от 30 януари 2020 г. за допълнение на Регламент (ЕС) 2016/429 на Европейския парламент и на Съвета по отношение на правилата за въвеждането в Съюза на пратки с някои животни, зародишни продукти и продукти от животински произход и за движението им и боравенето с тях след въвеждане (ОВ L 174, 3.6.2020 г., стр. 379).
(3) Регламент за изпълнение (ЕС) 2021/404 на Комисията от 24 март 2021 г. за установяване на списъци на трети държави, територии или зони от тях, от които е разрешено въвеждането в Съюза на животни, зародишни продукти и продукти от животински произход, в съответствие с Регламент (ЕС) 2016/429 на Европейския парламент и на Съвета (ОВ L 114, 31.3.2021 г., стр. 1).
ПРИЛОЖЕНИЕ
Приложения XV и XIX към Регламент за изпълнение (ЕС) 2021/404 се изменят, както следва:
|
1) |
в приложение XV, част 1, между вписванията за Мароко и Черна гора се добавя следното вписване за Молдова:
|
|
2) |
В приложение XIX, част 1, вписването за Молдова се заменя със следното:
|
|
9.3.2023 |
BG |
Официален вестник на Европейския съюз |
L 71/11 |
РЕГЛАМЕНТ ЗА ИЗПЪЛНЕНИЕ (ЕС) 2023/514 НА КОМИСИЯТА
от 8 март 2023 година
за изменение на Регламент за изпълнение (ЕС) 2021/405 по отношение на силно рафинираните продукти, на списъка на трети държави с одобрен план за контрол и на включването на Молдова в списъка на третите държави, от които е разрешено въвеждането в Съюза на пратки с яйца, предназначени за пускане на пазара като яйца от клас А
(текст от значение за ЕИП)
ЕВРОПЕЙСКАТА КОМИСИЯ,
като взе предвид Договора за функционирането на Европейския съюз,
като взе предвид Регламент (ЕС) 2017/625 на Европейския парламент и на Съвета от 15 март 2017 г. относно официалния контрол и другите официални дейности, извършвани с цел да се гарантира прилагането на законодателството в областта на храните и фуражите, правилата относно здравеопазването на животните и хуманното отношение към тях, здравето на растенията и продуктите за растителна защита, за изменение на регламенти (ЕО) № 999/2001, (ЕО) № 396/2005, (ЕО) № 1069/2009, (ЕО) № 1107/2009, (ЕС) № 1151/2012, (ЕС) № 652/2014, (ЕС) 2016/429 и (ЕС) 2016/2031 на Европейския парламент и на Съвета, регламенти (ЕО) № 1/2005 и (ЕО) № 1099/2009 на Съвета и директиви 98/58/ЕО, 1999/74/ЕО, 2007/43/ЕО, 2008/119/ЕО и 2008/120/ЕО на Съвета, и за отмяна на регламенти (ЕО) № 854/2004 и (ЕО) № 882/2004 на Европейския парламент и на Съвета, директиви 89/608/ЕИО, 89/662/ЕИО, 90/425/ЕИО, 91/496/ЕИО, 96/23/ЕО, 96/93/ЕО и 97/78/ЕО на Съвета и Решение 92/438/ЕИО на Съвета (Регламент относно официалния контрол) (1), и по-специално член 127, параграф 2 от него,
като има предвид, че:
|
(1) |
С Делегиран регламент (ЕС) 2022/2292 на Комисията (2) се допълва Регламент (ЕС) 2017/625 и се цели да се гарантира, че пратките с животни за производство на храни и определени стоки, предназначени за консумация от човека, от трети държави или региони от тях отговарят на определени изисквания на Съюза за безопасност на храните или на такива, които са признати за поне еквивалентни на тях. По-специално в посочения регламент се идентифицират животните и стоките, предназначени за консумация от човека, по отношение на които се прилага изискването да идват от трета държава или регион от нея, които са включени в списъка, посочен в член 126, параграф 2, буква а) от Регламент (ЕС) 2017/625. |
|
(2) |
В член 7 от Делегиран регламент (ЕС) 2022/2292 се предвижда, че определени пратки с животни за производство на храни, продукти от животински произход и съставни продукти се въвеждат в Съюза само от трета държава, включена в списъка на трети държави, одобрени за въвеждане на такива пратки в Съюза с цел консумация от човека. |
|
(3) |
С Регламент за изпълнение (ЕС) 2021/405 на Комисията (3) се установява списък на трети държави или региони от тях, от които е разрешено въвеждането в Съюза на пратки с някои силно рафинирани продукти, предназначени за консумация от човека. |
|
(4) |
Съгласно неотдавнашно изменение (4) на Регламент (ЕО) № 853/2004 на Европейския парламент и на Съвета (5) силно рафинираните продукти обхващат също така мастните производни и ароматизантите в храните, разрешени в съответствие с Регламент (ЕО) № 1334/2008 на Европейския парламент и на Съвета (6), при условие че бъдат подложени на обработка, изключваща риск за общественото здраве или за здравето на животните. Регламент за изпълнение (ЕС) 2021/405 следва да бъде изменен, за да бъде в съответствие с тази промяна. |
|
(5) |
Азербайджан представи план за контрол, който обхваща хайвера и черния хайвер. Планът дава достатъчно гаранции и поради това следва да бъде одобрен. |
|
(6) |
Ливан представи план за контрол, който обхваща пчелния мед. Планът дава достатъчно гаранции и поради това следва да бъде одобрен. |
|
(7) |
Остров Ман е включен в таблицата в приложение -I към Регламент за изпълнение (ЕС) 2021/405 за износа му за Съюза на месо от овце и кози. Остров Ман обаче уведоми Комисията, че вече не проявява интерес към износ на месо от кози за Съюза. Поради това вписването за остров Ман за месо от овце и кози в посочената таблица в приложение -I към Регламент за изпълнение (ЕС) 2021/405 следва да обхваща само овче месо. |
|
(8) |
Япония е включена в таблицата в приложение -I към Регламент за изпълнение (ЕС) 2021/405 за износа ѝ за Съюза на свинско месо. Япония обаче уведоми Комисията, че вече няма интерес да предоставя план за контрол за свинското месо, а възнамерява да използва само свинско месо с произход от държави членки или от трети държави, от които въвеждането на такива продукти в Съюза е разрешено. Поради това вписването за Япония за свинско месо следва да бъде съответно адаптирано в приложение -I към Регламент за изпълнение (ЕС) 2021/405. |
|
(9) |
Обединеното кралство е включено в таблицата в приложение -I към Регламент за изпълнение (ЕС) 2021/405 за износа му за Съюза на заешко месо. Обединеното кралство обаче уведоми Комисията, че вече няма интерес да предоставя план за контрол за заешкото месо, а възнамерява да използва само заешко месо с произход от държави членки или от трети държави, от които въвеждането на такива продукти в Съюза е разрешено. Поради това вписването за Обединеното кралство за заешко месо следва да бъде съответно адаптирано в приложение -I към Регламент за изпълнение (ЕС) 2021/405. |
|
(10) |
Тайланд не е представил на Комисията план за контрол за млякото. Той обаче е предоставил гаранции, че ще използва само мляко с произход от държави членки или от трети държави, от които е разрешено въвеждането на мляко в Съюза. Той също така уведоми Комисията, че такова мляко, предназначено за износ за Съюза, няма да бъде ограничено до съставни продукти, съдържащи преработени млечни продукти. Поради това вписването за Тайланд за мляко следва да бъде съответно адаптирано в приложение -I към Регламент за изпълнение (ЕС) 2021/405. |
|
(11) |
Съединените американски щати представиха план за контрол, който обхваща естествените обвивки. Планът дава достатъчно гаранции и поради това следва да бъде одобрен. |
|
(12) |
Понастоящем Руанда е включена в таблицата в приложение -I към Регламент за изпълнение (ЕС) 2021/405 по отношение на пчелния мед, а Колумбия и Сирия са включени в таблицата по отношение на естествените обвивки. Тъй като тези трети държави не са представили на Комисията планове за съответните продукти, тези вписвания следва да бъдат заличени от таблицата в посоченото приложение. |
|
(13) |
Молдова представи програма за контрол на Salmonella при стада кокошки носачки, за да получи разрешение за въвеждането в Съюза на яйца от клас А в съответствие с член 7 от Регламент за изпълнение (ЕС) 2021/405. Тази програма за контрол е оценена като задоволителна от Комисията. Спазването на изискванията за контрол на Salmonella в съответствие с член 10, параграф 6 от Регламент (ЕО) № 2160/2003 на Европейския парламент и на Съвета (7), беше повторно проверено по време на одита, проведен от Комисията през април 2022 г. (8). Поради това следва да бъде разрешено въвеждането в Съюза на яйца от клас A от Молдова. |
|
(14) |
Поради това Регламент за изпълнение (ЕС) 2021/405 следва да бъде съответно изменен. |
|
(15) |
Мерките, предвидени в настоящия регламент, са в съответствие със становището на Постоянния комитет по растенията, животните, храните и фуражите, |
ПРИЕ НАСТОЯЩИЯ РЕГЛАМЕНТ:
Член 1
Изменения в Регламент за изпълнение (ЕС) 2021/405
Регламент за изпълнение (ЕС) 2021/405 се изменя, както следва:
|
1) |
В член 22 уводното изречение се заменя със следното: „Въвеждането в Съюза на силно рафинирани продукти, както са описани в раздел XVI от приложение III към Регламент (ЕО) № 853/2004, предназначени за консумация от човека, се разрешава само ако те идват от следните трети държави или региони от тях:“; |
|
2) |
Приложение -I се заменя с текста, съдържащ се в приложение I към настоящия регламент; |
|
3) |
Приложение IV се заменя с текста, съдържащ се в приложение II към настоящия регламент. |
Член 2
Влизане в сила и прилагане
Настоящият регламент влиза в сила на двадесетия ден след деня на публикуването му в Официален вестник на Европейския съюз.
Настоящият регламент е задължителен в своята цялост и се прилага пряко във всички държави членки.
Съставено в Брюксел на 8 март 2023 година.
За Комисията
Председател
Ursula VON DER LEYEN
(1) ОВ L 95, 7.4.2017 г., стр. 1.
(2) Делегиран регламент (ЕС) 2022/2292 на Комисията от 6 септември 2022 г. за допълнение на Регламент (ЕС) 2017/625 на Европейския парламент и на Съвета по отношение на изискванията за въвеждане в Съюза на пратки с животни за производство на храни и определени стоки, предназначени за консумация от човека (ОВ L 304, 24.11.2022 г., стр. 1).
(3) Регламент за изпълнение (ЕС) 2021/405 на Комисията от 24 март 2021 г. за установяване на списъци на трети държави или региони от тях, от които е разрешено въвеждането в Съюза на определени животни и стоки, предназначени за консумация от човека, в съответствие с Регламент (ЕС) 2017/625 на Европейския парламент и на Съвета (ОВ L 114, 31.3.2021 г., стр. 118).
(4) Делегиран регламент (ЕС) 2022/2258 на Комисията от 9 септември 2022 г. за изменение и коригиране на приложение III към Регламент (ЕО) № 853/2004 на Европейския парламент и на Съвета относно специфичните хигиенни изисквания за храните от животински произход по отношение на рибни продукти, яйца и някои силно рафинирани продукти, и за изменение на Делегиран регламент (ЕС) 2019/624 на Комисията по отношение на някои двучерупчести мекотели (ОВ L 299, 18.11.2022 г., стр. 5).
(5) Регламент (ЕО) № 853/2004 на Европейския парламент и на Съвета от 29 април 2004 г. относно определяне на специфични хигиенни правила за храните от животински произход (ОВ L 139, 30.4.2004 г., стр. 55).
(6) Регламент (ЕО) № 1334/2008 на Европейския парламент и на Съвета от 16 декември 2008 г. относно ароматизантите и определени хранителни съставки с ароматични свойства за влагане във или върху храни и за изменение на Регламент (ЕИО) № 1601/91 на Съвета, регламенти (ЕО) № 2232/96 и (ЕО) № 110/2008 и Директива 2000/13/ЕО (ОВ L 354, 31.12.2008 г., стр. 34).
(7) Регламент (ЕО) № 2160/2003 на Европейския парламент и на Съвета от 17 ноември 2003 г. относно контрола на салмонела и други специфични агенти, причиняващи зоонози, които присъстват в хранителната верига (ОВ L 325, 12.12.2003 г., стр. 1).
(8) DG (SANTE) 2021—7268 — окончателният доклад е на разположение на адрес: https://ec.europa.eu/food/audits-analysis/audit-report/details/4533
ПРИЛОЖЕНИЕ I
Приложение -I към Регламент за изпълнение (ЕС) 2021/405 се заменя със следното:
„ПРИЛОЖЕНИЕ -I
Списък на третите държави или региони от тях с одобрени планове за контрол за някои животни за производство на храни и продукти от животински произход, предназначени за консумация от човека, както е посочено в член 2а, член 3, член 6, първа алинея, член 7, първа алинея, член 10, втора алинея, членове 11, 15, 16, 21 и член 25, букви а) и в)
|
Код на държавата по ISO |
Трета държава (1) или региони от нея |
Говеда |
Овце/кози |
Свине |
Еднокопитни |
Домашни птици |
Аквакултури (17) |
Мляко |
Яйца |
Зайци |
Дивеч |
Дивеч, отглеждан в стопанства |
Мед |
Естествени обвивки |
|
AD |
Андора |
X |
X |
Δ |
X |
|
P |
|
|
|
|
|
X |
|
|
AE |
Обединени арабски емирства |
|
|
|
|
|
Δ P |
X (2) O |
O |
|
|
|
X (3) |
|
|
AL |
Албания |
|
X |
|
|
|
X (14) P |
O |
X |
|
|
|
|
X |
|
AM |
Армения |
|
|
|
|
|
X (14) P |
O |
O |
|
|
|
X |
|
|
AR |
Аржентина |
X |
X |
|
X |
X |
X (14) P |
X |
X |
X |
X |
X |
X |
X |
|
AU |
Австралия |
X |
X |
|
X |
|
X M |
X |
X |
|
X |
X |
X |
X |
|
AZE |
Азербайджан |
|
|
|
|
|
X (16) P |
|
|
|
|
|
|
|
|
BA |
Босна и Херцеговина |
X |
X |
X |
|
X |
X (14) P |
X |
X |
|
|
|
X |
|
|
BD |
Бангладеш |
|
|
|
|
|
X P |
O |
O |
|
|
|
|
|
|
BF |
Буркина Фасо |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
BJ |
Бенин |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
BN |
Бруней |
|
|
|
|
|
X (15) P |
O |
O |
|
|
|
|
|
|
BR |
Бразилия |
X |
|
|
X |
X |
X P |
O |
O |
|
|
|
X |
X |
|
BW |
Ботсуана |
X |
|
|
|
|
P |
|
|
|
|
|
|
|
|
BY |
Беларус |
|
|
|
X (8) |
|
X (14) P |
X |
X |
|
|
|
X |
X |
|
BZ |
Белиз |
|
|
|
|
|
X (15) P |
O |
O |
|
|
|
|
|
|
CA |
Канада |
X |
X |
X |
X |
X |
X M |
X |
X |
X |
X |
X |
X |
|
|
CH |
Швейцария (7) |
X |
X |
X |
X |
X |
X (14) M |
X |
X |
X |
X |
X |
X |
X |
|
CL |
Чили |
X |
X5 |
X |
|
X |
X (14) M |
X |
O |
|
X |
|
X |
X |
|
CM |
Камерун |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
CN |
Китай |
|
|
|
|
X |
X P |
O |
X |
X |
|
|
X |
X |
|
CO |
Колумбия |
|
|
|
|
|
X P |
X |
Δ |
|
|
|
|
|
|
CR |
Коста Рика |
|
|
|
|
|
X P |
O |
O |
|
|
|
|
|
|
CU |
Куба |
|
|
|
|
|
X (15) P |
O |
O |
|
|
|
X |
|
|
DO |
Доминиканска република |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
EC |
Еквадор |
|
|
|
|
|
X P |
O |
O |
|
|
|
|
|
|
EG |
Египет |
|
|
|
|
|
|
|
|
|
|
|
|
X |
|
ЕТ |
Етиопия |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
FK |
Фолкландски острови |
X |
X (5) |
|
|
|
X (14) P |
O |
O |
|
|
|
|
|
|
FO |
Фарьорски острови |
|
|
|
|
|
X (14) P |
O |
O |
|
|
|
|
|
|
GB |
Обединеното кралство (6) |
X |
X |
X |
X |
X |
X (14) Δ M |
X |
X |
Δ |
X |
X |
X |
X |
|
GE |
Грузия |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
GG |
Гърнзи |
|
|
|
|
|
O M |
X |
O |
|
|
|
|
|
|
GL |
Гренландия |
|
X (5) |
|
|
|
M |
|
|
|
|
X |
|
|
|
GT |
Гватемала |
|
|
|
|
|
X (15) P |
O |
O |
|
|
|
X |
|
|
HK |
Хонконг |
|
|
|
|
|
Δ P |
|
Δ |
|
|
|
|
|
|
HN |
Хондурас |
|
|
|
|
|
X P |
O |
O |
|
|
|
|
|
|
ID |
Индонезия |
|
|
|
|
|
X P |
O |
O |
|
|
|
|
|
|
IL |
Израел (4) |
|
|
|
|
X |
X (14) P |
X |
X |
|
|
|
X |
|
|
IM |
Остров Ман |
X |
X (5) |
X |
|
|
X (14) M |
X |
O |
|
|
|
X |
|
|
IN |
Индия |
|
|
|
|
O |
X P |
O |
X |
|
|
|
X |
X |
|
IR |
Иран |
|
|
|
|
|
X (15) X (16) P |
O |
O |
|
|
|
|
X |
|
JE |
Джърси |
X |
|
|
|
|
M |
X |
O |
|
|
|
|
|
|
JM |
Ямайка |
|
|
|
|
|
M |
|
|
|
|
|
X |
|
|
JP |
Япония |
X |
|
Δ |
|
X |
X (14) M |
X |
X |
|
|
|
Δ |
X |
|
KE |
Кения |
|
|
|
|
|
X (14) P |
O |
O |
|
|
|
|
|
|
KR |
Южна Корея |
|
|
|
|
X |
X M |
O |
O |
|
|
|
Δ |
|
|
LB |
Ливан |
|
|
|
|
|
|
|
|
|
|
|
X |
X |
|
LK |
Шри Ланка |
|
|
|
|
|
X P |
O |
O |
|
|
|
|
|
|
MA |
Мароко |
|
|
|
|
X |
X (14) Δ M |
O |
O |
|
|
|
|
X |
|
MD |
Молдова |
|
|
|
|
X |
X (14) P |
X |
X |
|
|
|
X |
|
|
ME |
Черна гора |
X |
X (5) |
X |
|
X |
X (14) P |
X |
X |
|
|
|
X |
|
|
MG |
Мадагаскар |
|
|
|
|
|
X P |
O |
O |
|
|
|
X |
|
|
MK |
Северна Македония |
X |
X |
X |
|
X |
X (14) P |
X |
X |
|
X |
|
X |
|
|
MM |
Мианмар |
|
|
|
|
|
X P |
O |
O |
|
|
|
X |
|
|
MN |
Монголия |
|
|
|
|
|
|
|
|
|
|
|
|
X |
|
MU |
Мавриций |
|
|
|
|
|
X (14) P |
O |
O |
|
|
|
Δ |
|
|
MX |
Мексико |
|
|
Δ |
|
|
X P |
O |
X |
|
|
|
X |
|
|
MY |
Малайзия |
|
|
|
|
Δ |
X P |
O |
O |
|
|
|
|
|
|
MZ |
Мозамбик |
|
|
|
|
|
X (15) P |
O |
O |
|
|
|
|
|
|
NA |
Намибия |
X |
X (5) |
|
|
|
P |
|
|
|
X |
|
|
|
|
NC |
Нова Каледония |
|
|
|
|
|
X (15) P |
O |
O |
|
|
X |
X |
|
|
NG |
Нигерия |
|
|
|
|
|
X (15) P |
O |
O |
|
|
|
|
|
|
NI |
Никарагуа |
|
|
|
|
|
X (15) P |
O |
O |
|
|
|
X |
|
|
NZ |
Нова Зеландия |
X |
X |
O |
X |
O |
X (14) M |
X |
O |
O |
X |
X |
X |
X |
|
PA |
Панама |
|
|
|
|
|
X P |
O |
O |
|
|
|
|
|
|
PE |
Перу |
|
|
|
|
|
X M |
O |
O |
|
|
|
|
|
|
РН |
Филипини |
|
|
|
|
|
X P |
O |
O |
|
|
|
|
|
|
PK |
Пакистан |
|
|
|
|
|
|
|
|
|
|
|
|
X |
|
PM |
Сен Пиер и Микелон |
|
|
|
|
X |
P |
|
|
|
|
|
|
|
|
PN |
Острови Питкерн |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
PY |
Парагвай |
X |
|
|
|
|
P |
|
|
|
|
|
|
X |
|
RS |
Сърбия |
X |
X |
X |
X (8) |
X |
X (14) P |
X |
X |
X |
X |
|
X |
X |
|
RU |
Русия |
X |
X |
X |
|
X |
O P |
X |
X |
|
|
X (9) |
X |
X |
|
RW |
Руанда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SA |
Саудитска Арабия |
|
|
|
|
|
X P |
O |
O |
|
|
|
|
|
|
SG |
Сингапур |
Δ |
Δ |
Δ |
X (10) |
Δ |
X (14) P |
Δ |
Δ |
|
X (10) |
X (10) |
|
|
|
SM |
Сан Марино |
X |
|
Δ |
|
|
O P |
X |
O |
|
|
|
X |
|
|
SV |
Ел Салвадор |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
SY |
Сирия |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SZ |
Есватини |
X |
|
|
|
|
P |
|
|
|
|
|
|
|
|
TG |
Того |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
TH |
Тайланд |
O |
|
O |
|
X |
X M |
Δ |
Δ |
|
|
|
X |
|
|
TN |
Тунис |
|
|
|
|
|
X (14) M |
O |
O |
|
|
|
|
X |
|
TR |
Турция |
|
|
|
|
X |
X (14) M |
X |
X |
|
|
|
X |
X |
|
TW |
Тайван |
|
|
|
|
|
X P |
O |
X |
|
|
|
X |
|
|
TZ |
Танзания |
|
|
|
|
|
X (15) P |
O |
O |
|
|
|
X |
|
|
UA |
Украйна |
X |
|
X |
|
X |
X (14) M |
X |
X |
X |
|
|
X |
X |
|
UG |
Уганда |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
US |
Съединени щати |
X |
X (11) |
X |
|
X |
X M |
X |
X |
X |
X |
X |
X |
X |
|
UY |
Уругвай |
X |
X |
|
X |
|
X (14) M |
X |
O |
|
X |
|
X |
X |
|
UZ |
Узбекистан |
|
|
|
|
|
|
|
|
|
|
|
|
X |
|
VE |
Венесуела |
|
|
|
|
|
X (15) P |
O |
O |
|
|
|
|
|
|
VN |
Виетнам |
|
|
|
|
|
X M |
O |
O |
|
|
|
X |
|
|
WF |
Уолис и Футуна |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
XK |
Косово (12) |
|
|
|
|
Δ |
|
|
|
|
|
|
|
|
|
ZA |
Южна Африка |
|
|
|
|
|
P |
|
|
|
X |
X (13) |
|
|
|
ZM |
Замбия |
|
|
|
|
|
|
|
|
|
|
|
X |
|
(1) Списък на третите държави и териториите (не е ограничен до третите държави, признати от Съюза).
(2) Само камилско мляко.
(3) Само областта Ras al Khaimah.
(4) Под Израел по-долу се разбира Държавата Израел, като се изключват териториите, които са под управлението на Държавата Израел след 5 юни 1967 г., а именно Голанските възвишения, ивицата Газа, Източен Йерусалим и останалата част от Западния бряг.
(5) Само овце.
(6) В съответствие със Споразумението за оттеглянето на Обединеното кралство Великобритания и Северна Ирландия от Европейския съюз и Европейската общност за атомна енергия, и по-специално член 5, параграф 4 от Протокола за Ирландия/Северна Ирландия във връзка с приложение 2 към посочения протокол, за целите на настоящото приложение позоваванията на Обединеното кралство не включват Северна Ирландия.
(7) В съответствие със Споразумението от 21 юни 1999 г. между Европейската общност и Конфедерация Швейцария относно търговията със селскостопански продукти (ОВ L 114, 30.4.2002 г., стр. 132).
(8) Износ за ЕС на живи еднокопитни, предназначени за клане (само животни за производство на храни).
(9) Само северни елени.
(10) Само за пратки с прясно месо с произход от Нова Зеландия, предназначени за Съюза и разтоварени, със или без съхранение, в Сингапур и повторно натоварени в одобрено предприятие по време на транзитно преминаване през Сингапур.
(11) Само кози.
(12) Това название не засяга позициите по отношение на статута и е съобразено с Резолюция 1244/1999 за сигурност на ООН и становището на Международния съд относно обявяването на независимост от страна на Косово.
(13) Само щраусови птици.
(14) Само перкови риби.
(15) Само ракообразни.
(16) Само хайвер и черен хайвер.
(17) Аквакултурите обхващат перковите риби, включително змиорките, и продуктите от перкови риби (например хайвер и черен хайвер) и ракообразните. Третите държави или региони от тях, включени в списъка на живи, охладени, замразени или преработени двучерупчести мекотели, бодлокожи, мантийни и морски коремоноги в приложение VIII, се отбелязват с „М“ в тази колона.“
ПРИЛОЖЕНИЕ II
Приложение IV към Регламент за изпълнение (ЕС) 2021/405 се заменя със следното:
„ПРИЛОЖЕНИЕ IV
Списък на третите държави, от които е разрешено въвеждането в Съюза на пратки с яйца, предназначени за пускане на пазара като яйца от клас А, както е посочено в член 7, втора алинея
|
КОД НА ДЪРЖАВАТА ПО ISO |
ТРЕТА ДЪРЖАВА |
ЗАБЕЛЕЖКИ |
|
CH |
Швейцария (1) |
|
|
GB |
Обединено кралство (2) |
|
|
JP |
Япония |
|
|
MD |
Молдова |
|
|
MK |
Северна Македония |
|
|
UA |
Украйна |
|
(1) В съответствие със Споразумението от 21 юни 1999 г. между Европейската общност и Конфедерация Швейцария относно търговията със селскостопански продукти (ОВ L 114, 30.4.2002 г., стр. 132).
(2) В съответствие със Споразумението за оттеглянето на Обединеното кралство Великобритания и Северна Ирландия от Европейския съюз и Европейската общност за атомна енергия, и по-специално член 5, параграф 4 от Протокола за Ирландия/Северна Ирландия във връзка с приложение 2 към посочения протокол, за целите на настоящото приложение позоваванията на Обединеното кралство не включват Северна Ирландия.“
|
9.3.2023 |
BG |
Официален вестник на Европейския съюз |
L 71/22 |
РЕГЛАМЕНТ ЗА ИЗПЪЛНЕНИЕ (ЕС) 2023/515 НА КОМИСИЯТА
от 8 март 2023 година
за подновяване на одобрението на активното вещество абамектин в съответствие с Регламент (ЕО) № 1107/2009 на Европейския парламент и на Съвета и за изменение на регламент за изпълнение (ЕС) № 540/2011 на Комисията
(текст от значение за ЕИП)
ЕВРОПЕЙСКАТА КОМИСИЯ,
като взе предвид Договора за функционирането на Европейския съюз,
като взе предвид Регламент (ЕО) № 1107/2009 на Европейския парламент и на Съвета от 21 октомври 2009 г. относно пускането на пазара на продукти за растителна защита и за отмяна на директиви 79/117/ЕИО и 91/414/ЕИО на Съвета (1), и по-специално член 20, параграф 1 от него,
като има предвид, че:
|
(1) |
С Директива 2008/107/ЕО на Комисията (2) абамектин е включен като активно вещество в приложение I към Директива 91/414/ЕИО на Съвета (3). |
|
(2) |
Активните вещества, включени в приложение I към Директива 91/414/ЕИО, се считат за одобрени съгласно Регламент (ЕО) № 1107/2009 и са включени в списъка в част А от приложението към Регламент за изпълнение (ЕС) № 540/2011 на Комисията (4). |
|
(3) |
Срокът на одобрението на активното вещество абамектин, определен в част А от приложението към Регламент за изпълнение (ЕС) № 540/2011, изтича на 30 април 2023 г. |
|
(4) |
В съответствие с член 1 от Регламент за изпълнение (ЕС) № 844/2012 на Комисията (5) в предвидения в същия член срок до докладващата държава членка — Австрия и до съдокладващата държава членка — Малта, бе подадено заявление за подновяване на одобрението на активното вещество абамектин. |
|
(5) |
Заявителят представи допълнителните досиета на докладващата държава членка, съдокладващата държава членка, Комисията и Европейския орган за безопасност на храните („Органа“), съгласно член 6 от Регламент за изпълнение (ЕС) № 844/2012. Докладващата държава членка установи, че заявлението е пълно. |
|
(6) |
Като се консултира със съдокладващата държава членка, докладващата държава членка изготви проект на доклад за оценка във връзка с подновяването и на 17 април 2019 г. го представи на Органа и на Комисията. В своя проект на доклад за оценка във връзка с подновяването докладващата държава членка предложи да се поднови одобрението на абамектин. |
|
(7) |
Органът изпрати проекта на доклада за оценка във връзка с подновяването на одобрението до заявителя и до държавите членки за коментар и препрати получените коментари на Комисията. Органът също така направи обществено достъпно допълнителното обобщено досие. |
|
(8) |
На 15 юли 2020 г. Органът предаде на Комисията заключението си (6) за това дали може да се очаква веществото абамектин да отговаря на критериите за одобряване, предвидени в член 4 от Регламент (ЕО) № 1107/2009. Органът установи редица въпроси, които не можаха да бъдат приключени. По-специално той установи рискове по отношение на птиците и бозайниците, водните организми и почвените макроорганизми. |
|
(9) |
На 1 февруари 2022 г. Комисията изпрати на Органа мандат с искане за преглед на оценките на експозицията и риска по отношение на птиците и бозайниците, водните организми и почвените макроорганизми. На 27 юли 2022 г. Органът изпрати на Комисията актуализираното си заключение (7). В актуализираното си заключение Органът потвърди рисковете, установени в предходната оценка. |
|
(10) |
На 25 март 2021 г. Комисията представи на Постоянния комитет по растенията, животните, храните и фуражите доклад във връзка с подновяването на одобрението и проект на регламент относно абамектин, а на 8 декември 2022 г. — преработени версии на двата документа, за да се вземат предвид резултатите от актуализираното заключение на Органа. |
|
(11) |
Комисията прикани заявителя да представи своите коментари относно заключението на Органа, а в съответствие с член 14, параграф 1, трета алинея от Регламент за изпълнение (ЕС) № 844/2012 — и относно доклада във връзка с подновяването. Заявителят представи своите коментари по двете версии на доклада и те бяха разгледани внимателно. |
|
(12) |
Бе установено, че критериите за одобряване, предвидени в член 4 от Регламент (ЕО) № 1107/2009, са изпълнени по отношение на един или повече представителни видове употреба на най-малко един продукт за растителна защита, съдържащ абамектин. |
|
(13) |
Оценката на риска във връзка с подновяването на одобрението на активното вещество абамектин се основава на представителни видове употреба като инсектицид и акарицид при защитени култури. Въпреки че с оглед на резултатите от оценката на риска не е необходимо запазването на ограничението за употреба само като инсектицид и акарицид, е необходимо, в съответствие с член 14, параграф 1 от Регламент (ЕО) № 1107/2009 във връзка с член 6 от него и с оглед на съвременните научно-технически познания, да бъдат предвидени определени условия и ограничения. По-специално е целесъобразно да се ограничи употребата на продукти за растителна защита, съдържащи абамектин, до видове употреба, които позволяват контролиран обмен на материя и енергия със заобикалящата среда, за да се предотврати освобождаването на продукти за растителна защита в околната среда и да се намали установеният висок риск за водните организми и дивите сухоземни нецелеви организми. Съответно може да бъде разрешена употребата в постоянни култивационни съоръжения. |
|
(14) |
Поради това Регламент за изпълнение (ЕС) № 540/2011 следва да бъде съответно изменен. |
|
(15) |
С Регламент за изпълнение (ЕС) 2022/378 на Комисията (8) срокът на одобрението на абамектин бе удължен до 30 април 2023 г., за да се даде възможност процедурата по подновяването да приключи, преди срокът на одобрението на посоченото вещество да изтече. Като се има предвид, че решението за подновяване на одобрението беше взето преди удължаването на този срок и като се има предвид, че срокът на настоящото одобрение на абамектин изтича на 30 април 2023 г., настоящият регламент следва да влезе в сила възможно най-скоро и да започне да се прилага по-рано от тази дата. |
|
(16) |
Мерките, предвидени в настоящия регламент, са в съответствие със становището на Постоянния комитет по растенията, животните, храните и фуражите, |
ПРИЕ НАСТОЯЩИЯ РЕГЛАМЕНТ:
Член 1
Подновяване на одобрението на активното вещество
Одобрението на активното вещество абамектин, посочено в приложение I, се подновява при предвидените в същото приложение условия.
Член 2
Изменения в Регламент за изпълнение (ЕС) № 540/2011
Приложението към Регламент за изпълнение (ЕС) № 540/2011 се изменя в съответствие с приложение II към настоящия регламент.
Член 3
Влизане в сила и начална дата на прилагане
Настоящият регламент влиза в сила на третия ден след деня на публикуването му в Официален вестник на Европейския съюз.
Той се прилага от 1 април 2023 г.
Настоящият регламент е задължителен в своята цялост и се прилага пряко във всички държави членки.
Съставено в Брюксел на 8 март 2023 година.
За Комисията
Председател
Ursula VON DER LEYEN
(1) ОВ L 309, 24.11.2009 г., стр. 1.
(2) Директива 2008/107/ЕО на Комисията от 25 ноември 2008 г. за изменение на Директива 91/414/ЕИО на Съвета с цел включване на абамектин, епоксиконазол, фенпропиморф, фенпироксимат и тралкоксидим като активни вещества (ОВ L 316, 26.11.2008 г., стр. 4).
(3) Директива 91/414/ЕИО на Съвета oт 15 юли 1991 г. относно пускането на пазара на продукти за растителна защита (ОВ L 230, 19.8.1991 г., стр. 1).
(4) Регламент за изпълнение (ЕС) № 540/2011 на Комисията от 25 май 2011 г. за прилагане на Регламент (ЕО) № 1107/2009 на Европейския парламент и на Съвета по отношение на списъка на одобрените активни вещества (ОВ L 153, 11.6.2011 г., стр. 1).
(5) Регламент за изпълнение (ЕС) № 844/2012 на Комисията от 18 септември 2012 г. за определяне на разпоредбите, необходими за изпълнението на процедурата по подновяване по отношение на активните вещества в съответствие с Регламент (ЕО) № 1107/2009 на Европейския парламент и на Съвета относно пускането на пазара на продукти за растителна защита (ОВ L 252, 19.9.2012 г., стр. 26).
(6) EFSA Journal (Бюлетин на ЕОБХ) 2020 г.; 18(8):6227. Достъпен на следния интернет адрес: www.efsa.europa.eu.
(7) EFSA Journal (Бюлетин на ЕОБХ) 2022 г.; 20(8):7544. Достъпен на следния интернет адрес: www.efsa.europa.eu.
(8) Регламент за изпълнение (ЕС) 2022/378 на Комисията от 4 март 2022 г. за изменение на Регламент за изпълнение (ЕС) № 540/2011 по отношение на удължаването на срока на одобренията на активните вещества абамектин, Bacillus subtilis (Cohn 1872), щам QST 713, Bacillus thuringiensis подвид Aizawai, щамове ABTS-1857 и GC-91, Bacillus thuringiensis подвид Israeliensis (серотип H-14), щам AM65-52, Bacillus thuringiensis подвид Kurstaki, щамове ABTS 351, PB 54, SA 11, SA12 и EG 2348, Beauveria bassiana, щамове ATCC 74040 и GHA, клодинафоп, Cydia pomonella Granulovirus (CpGV), ципродинил, дихлорпроп-P, фенпироксимат, фосетил, малатион, мепанипирим, метконазол, метрафенон, пиримикарб, Pseudomonas chlororaphis, щам MA342, пириметанил, Pythium oligandrum M1, римсулфурон, спинозад, Trichoderma asperellum (известен по-рано като „T. harzianum“), щамове ICC012, T25 и TV1, Trichoderma atroviride (известен по-рано като „T. harzianum“), щам T11, Trichoderma gamsii (известен по-рано като „T. viride“), щам ICC080, Trichoderma harzianum, щамове T-22 и ITEM 908, триклопир, тринексапак, тритиконазол и цирам (ОВ L 72, 7.3.2022 г., стр. 2).
ПРИЛОЖЕНИЕ I
|
Популярно наименование, идентификационни номера |
Наименование по IUPAC |
Чистота (1) |
Дата на одобрението |
Изтичане срока на одобрението |
Специфични разпоредби |
||||
|
Абамектин CAS № 71751-41-2 Авермектин В1а CAS № 65195-55-3 Авермектин В1b CAS № 65195-56-4 Абамектин CIPAC № 495 |
Авермектин В1а (10E,14E,16E)-(1R,4S,5′S,6S,6′R,8R,12S,13S,20R,21R,24S)-6′-[(S)-втор-бутил]-5′,11,13,22-тетраметил-21,24-дихидрокси-2-оксо-(3,7,19-триоксатетрацикло[15.6.1.14,8.020,24]пентакоза-10,14,16,22-тетраен)-6-спиро-2′-(5′,6′-дихидро-2′H-пиран)-12-илов 2,6-дидеокси-4-O-(2,6-дидеокси-3-O-метил-α-L-арабино-хексопиранозил)-3-O-метил-α-L-арабино-хексопиранозид Авермектин В1b (10E,14E,16E)-(1R,4S,5′S,6S,6′R,8R,12S,13S,20R,21R,24S)-21,24-дихидрокси-6′-изопропил-5′,11,13,22-тетраметил-2-оксо-(3,7,19-триоксатетрацикло [15.6.1.14,8.020,24]пентакоза-10,14,16,22-тетраен)-6-спиро-2′-(5′,6′-дихидро-2′H-пиран)-12-илов 2,6-дидеокси-4-O-(2,6-дидеокси-3-O-метил-α-L-арабино-хексопиранозил)-3-O-метил-α-L-арабино-хексопиранозид |
≥ 850 g/kg абамектин (сума от авермектин B1a и авермектин B1b), минимум 800 g/kg авермектин B1a и максимум 200 g/kg авермектин B1b |
1 април 2023 г. |
31 март 2038 г. |
Могат да бъдат разрешени само видове употреба, които позволяват контролиран обмен на материали и енергия със заобикалящата среда и предотвратяват изпускането на продукти за растителна защита в околната среда, по-специално употреба в постоянни култивационни съоръжения. За прилагането на единните принципи, посочени в член 29, параграф 6 от Регламент (ЕО) № 1107/2009, се вземат под внимание заключенията от доклада във връзка с подновяването на одобрението на абамектин, и по-специално допълнения I и II към него. При тази цялостна оценка държавите членки обръщат особено внимание на:
|
(1) Допълнителна подробна информация за идентичността и спецификацията на активното вещество е предоставена в доклада във връзка с подновяването на одобрението.
ПРИЛОЖЕНИЕ II
Приложението към Регламент за изпълнение (ЕС) № 540/2011 се изменя, както следва:
|
(1) |
в част А вписване 210 за абамектин се заличава; |
|
(2) |
в част Б се добавя следното вписване:
|
(1) Допълнителна подробна информация за идентичността и спецификацията на активното вещество е предоставена в доклада във връзка с подновяването на одобрението.
|
9.3.2023 |
BG |
Официален вестник на Европейския съюз |
L 71/27 |
РЕГЛАМЕНТ ЗА ИЗПЪЛНЕНИЕ (ЕС) 2023/516 НА КОМИСИЯТА
от 8 март 2023 година
за изменение на Регламент за изпълнение (ЕС) 2020/2236 по отношение на образеца на ветеринарен здравен сертификат за въвеждане в Съюза на пратки с водни животни, предназначени за определени животновъдни обекти за аквакултура, за пускане в дивата природа или за други цели, с изключение на директна консумация от човека
(текст от значение за ЕИП)
ЕВРОПЕЙСКАТА КОМИСИЯ,
като взе предвид Договора за функционирането на Европейския съюз,
като взе предвид Регламент (ЕС) 2016/429 на Европейския парламент и на Съвета от 9 март 2016 г. за заразните болести по животните и за изменение и отмяна на определени актове в областта на здравеопазването на животните (Законодателство за здравеопазването на животните) (1), и по-специално член 238, параграф 3, букви а) и в) от него,
като взе предвид Регламент (EС) 2017/625 на Европейския парламент и на Съвета от 15 март 2017 г. относно официалния контрол и другите официални дейности, извършвани с цел да се гарантира прилагането на законодателството в областта на храните и фуражите, правилата относно здравеопазването на животните и хуманното отношение към тях, здравето на растенията и продуктите за растителна защита, за изменение на регламенти (ЕО) № 999/2001, (EО) № 396/2005, (EО) № 1069/2009, (EО) № 1107/2009, (EС) № 1151/2012, (ЕС) № 652/2014, (EС) 2016/429 и (EС) 2016/2031 на Европейския парламент и на Съвета, регламенти (EО) № 1/2005 и (EО) № 1099/2009 на Съвета и директиви 98/58/EО, 1999/74/EО, 2007/43/EО, 2008/119/EО и 2008/120/EО на Съвета, и за отмяна на регламенти (EО) № 854/2004 и (EО) № 882/2004 на Европейския парламент и на Съвета, директиви 89/608/ЕИО, 89/662/ЕИО, 90/425/ЕИО, 91/496/ЕИО, 96/23/EО, 96/93/EО и 97/78/EО на Съвета и Решение 92/438/EИО на Съвета (Регламент относно официалния контрол) (2), и по-специално член 90 от него,
като има предвид, че:
|
(1) |
В Регламент за изпълнение (ЕС) 2020/2236 на Комисията (3) са установени образците на ветеринарни здравни сертификати за въвеждане в Съюза и за движение в рамките на Съюза на пратки с водни животни и с определени продукти от животински произход от водни животни. |
|
(2) |
По-специално в приложение II към Регламент за изпълнение (ЕС) 2020/2236 е установен образецът на ветеринарен здравен сертификат за въвеждане в Съюза на водни животни, предназначени за определени животновъдни обекти за аквакултура, за пускане в дивата природа или за други цели, с изключение на директна консумация от човека (образец AQUA-ENTRY-ESTAB/RELEASE/OTHER). Член 166 от Делегиран регламент (ЕС) 2020/692 на Комисията (4) наскоро бе изменен с Делегиран регламент (ЕС) 2023/119 (5), за да се разреши на специалистите в областта на здравеопазването на водните животни да извършват клиничните прегледи на пратките с водни животни преди износ за Съюза, при условие че са оправомощени за целта в съответствие с правото на извършващата износа трета държава или територия. Тези нови изисквания за въвеждане в Съюза на посочените видове пратки следва да бъдат отразени в точка II.3.2. от съответния образец на ветеринарен здравен сертификат. Поради това приложение II към Регламент за изпълнение (ЕС) 2020/2236 следва да бъде съответно изменено. |
|
(3) |
С цел да се избегнат смущения в търговията във връзка с въвеждането в Съюза на пратки с водни животни, предназначени за определени животновъдни обекти за аквакултура, за пускане в дивата природа или за други цели, с изключение на директна консумация от човека, използването на ветеринарен здравен сертификат, издаден в съответствие с Регламент за изпълнение (ЕС) 2020/2236 във вида му преди измененията, внесени с настоящия регламент за изпълнение, следва да продължи да бъде разрешено за преходен период при определени условия. |
|
(4) |
Тъй като Регламент за изпълнение (ЕС) 2020/2236 се прилага от 21 април 2021 г., в интерес на правната сигурност и за улесняване на търговията измененията, които трябва да бъдат направени в Регламент за изпълнение (ЕС) 2020/2236 с настоящия регламент, следва да породят действие по спешност. |
|
(5) |
Мерките, предвидени в настоящия регламент, са в съответствие със становището на Постоянния комитет по растенията, животните, храните и фуражите, |
ПРИЕ НАСТОЯЩИЯ РЕГЛАМЕНТ:
Член 1
Приложение II към Регламент за изпълнение (ЕС) 2020/2236 се изменя в съответствие с приложението към настоящия регламент.
Член 2
За преходен период до 15 декември 2023 г. въвеждането в Съюза на пратки с водни животни, предназначени за определени животновъдни обекти за аквакултура, за пускане в дивата природа или за други цели, с изключение на директна консумация от човека, придружени от ветеринарен здравен сертификат, издаден в съответствие с образеца, установен в приложение II към Регламент за изпълнение (ЕС) 2020/2236 във вида му преди измененията, внесени в посочения регламент за изпълнение с настоящия регламент за изпълнение, продължава да бъде разрешено, при условие че сертификатът е издаден не по-късно от 15 септември 2023 г.
Член 3
Настоящият регламент влиза в сила в деня след деня на публикуването му в Официален вестник на Европейския съюз.
Настоящият регламент е задължителен в своята цялост и се прилага пряко във всички държави членки.
Съставено в Брюксел на 8 март 2023 година.
За Комисията
Председател
Ursula VON DER LEYEN
(1) ОВ L 84, 31.3.2016 г., стр. 1.
(2) ОВ L 95, 7.4.2017 г., стр. 1.
(3) Регламент за изпълнение (ЕС) 2020/2236 на Комисията от 16 декември 2020 г. за определяне на правила за прилагането на регламенти (ЕС) 2016/429 и 2017/625 на Европейския парламент и на Съвета по отношение на образците на ветеринарни здравни сертификати за въвеждане в Съюза и за движение в рамките на Съюза на пратки с водни животни и с определени продукти от животински произход от водни животни и по отношение на официалното сертифициране във връзка с тези сертификати и за отмяна на Регламент (ЕО) № 1251/2008 (ОВ L 442, 30.12.2020 г, стр. 410).
(4) Делегиран регламент (ЕС) 2020/692 на Комисията от 30 януари 2020 г. за допълнение на Регламент (ЕС) 2016/429 на Европейския парламент и на Съвета по отношение на правилата за въвеждането в Съюза на пратки с някои животни, зародишни продукти и продукти от животински произход и за движението им и боравенето с тях след въвеждане (ОВ L 174, 3.6.2020 г., стр. 379).
(5) Делегиран регламент (ЕС) 2023/119 на Комисията от 9 ноември 2022 г. за изменение на Делегиран регламент (ЕС) 2020/692 за допълнение на Регламент (ЕС) 2016/429 на Европейския парламент и на Съвета по отношение на правилата за въвеждането в Съюза на пратки с някои животни, зародишни продукти и продукти от животински произход и за движението им и боравенето с тях след въвеждане (ОВ L 16, 18.1.2023 г., стр. 5).
ПРИЛОЖЕНИЕ
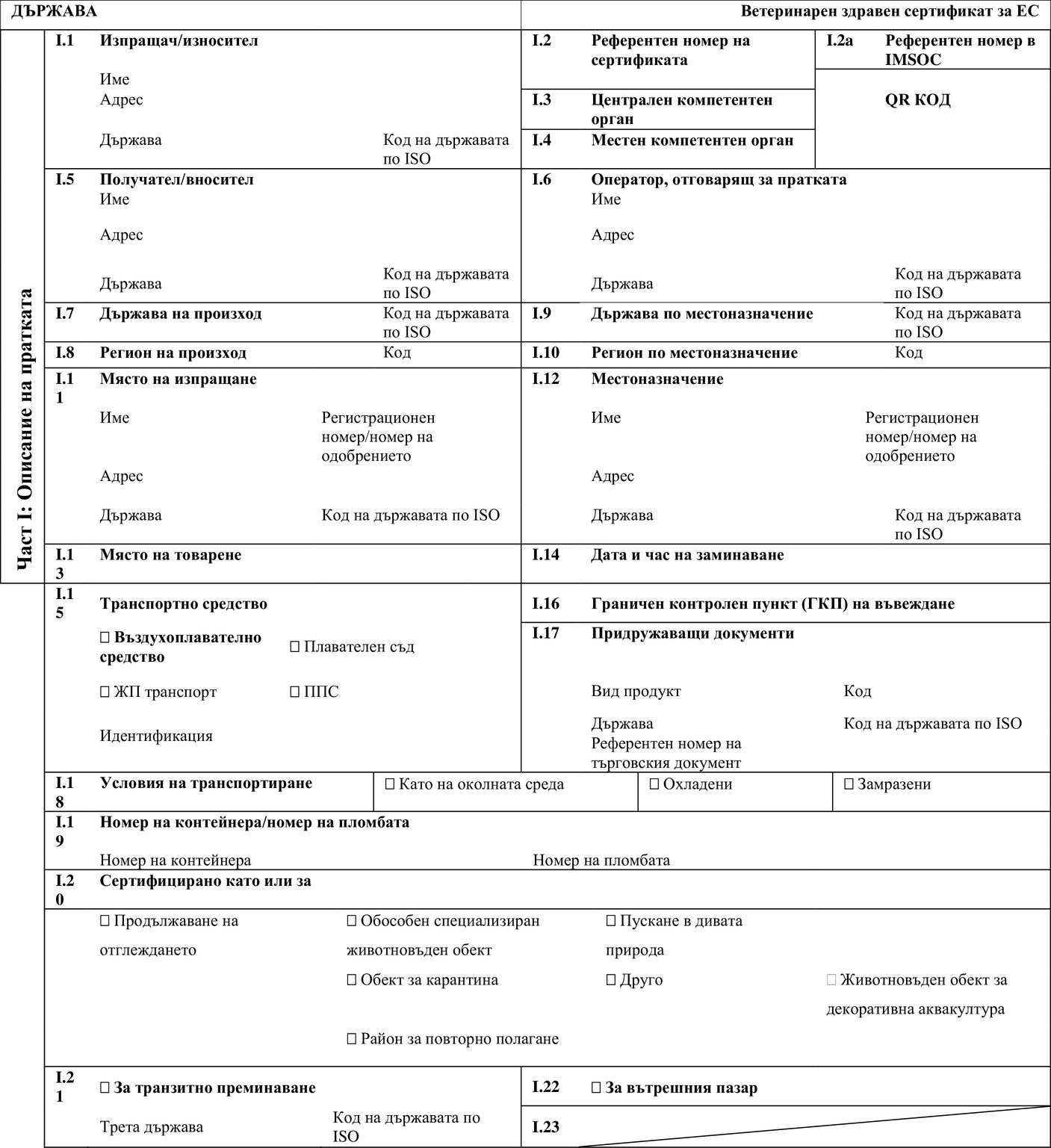
Приложение II към Регламент за изпълнение (ЕС) 2020/2236 се заменя със следното:
„ПРИЛОЖЕНИЕ II
Приложение II съдържа следния образец на ветеринарен здравен сертификат:
Образец
|
AQUA-ENTRY-ESTAB/RELEASE/OTHER |
Образец на ветеринарен здравен сертификат за въвеждане в Съюза на водни животни, предназначени за определени животновъдни обекти за аквакултура, за пускане в дивата природа или за други цели, с изключение на директна консумация от човека |
ОБРАЗЕЦ НА ВЕТЕРИНАРЕН ЗДРАВЕН СЕРТИФИКАТ ЗА ВЪВЕЖДАНЕ В СЪЮЗА НА ВОДНИ ЖИВОТНИ, ПРЕДНАЗНАЧЕНИ ЗА ОПРЕДЕЛЕНИ ЖИВОТНОВЪДНИ ОБЕКТИ ЗА АКВАКУЛТУРА, ЗА ПУСКАНЕ В ДИВАТА ПРИРОДА ИЛИ ЗА ДРУГИ ЦЕЛИ, С ИЗКЛЮЧЕНИЕ НА ДИРЕКТНА КОНСУМАЦИЯ ОТ ЧОВЕКА (ОБРАЗЕЦ AQUA-ENTRY-ESTAB/RELEASE/OTHER)






Поправки
|
9.3.2023 |
BG |
Официален вестник на Европейския съюз |
L 71/37 |
Поправка на Регламент (ЕС) 2022/123 на Европейския парламент и на Съвета от 25 януари 2022 година относно засилена роля на Европейската агенция по лекарствата в готовността за действия при кризи и управлението на кризи по отношение на лекарствените продукти и медицинските изделия
( Официален вестник на Европейския съюз L 20 от 31 януари 2022 г. )
|
1. |
На страница 11, член 1, буква а) |
вместо:
|
„а) |
подготовка по отношение на въздействието на извънредни ситуации в областта на общественото здраве върху лекарствените продукти и медицинските изделия и въздействието на събития с голям мащаб върху лекарствените продукти и медицинските изделия, както и предотвратяване, координиране и управление на това въздействие на равнището на Съюза;“ |
да се чете:
|
„а) |
подготовка по отношение на въздействието на извънредни ситуации в областта на общественото здраве върху лекарствените продукти и медицинските изделия и въздействието на събития с голям мащаб върху лекарствените продукти, както и предотвратяване, координиране и управление на това въздействие на равнището на Съюза;“. |
|
2. |
На страница 14, член 4, параграф 2 |
вместо:
„2. За да се улесни осъществяването на мониторинга, посочен в параграф 1, националните компетентни органи за лекарствени продукти докладват своевременно на Агенцията посредством единните звена за контакт, посочени в член 3, параграф 6, или платформата, посочена в член 13 (Европейската платформа за мониторинг на недостига), след като тя започне да функционира пълноценно, […].“
да се чете:
„2. За да се улесни осъществяването на мониторинга, посочен в параграф 1, националните компетентни органи за лекарствени продукти докладват своевременно на Агенцията посредством единните звена за контакт, посочени в член 3, параграф 6, втора алинея или платформата, посочена в член 13 (Европейската платформа за мониторинг на недостига), след като тя започне да функционира пълноценно, […].“.
|
3. |
На страница 16, член 8, параграф 1 |
вместо:
„1. През цялата продължителност на дадена извънредна ситуация в областта на общественото здраве или след признаването на събитие с голям мащаб, както е посочено в член 4, параграф 3, докато се потвърди, че са били предприети достатъчни мерки за справяне със събитието с голям мащаб съгласно член 4, параграф 4, Ръководната група за недостига на лекарства докладва редовно на Комисията и на единните звена за контакт, посочени в член 3, параграф 6, за резултатите от мониторинга, посочен в член 7, и по-специално сигнализира за всеки действителен или потенциален недостиг на лекарствени продукти, включени в списъците на критично важните лекарства, или за всяко събитие, което има вероятност да доведе до събитие с голям мащаб.“
да се чете:
„1. През цялата продължителност на дадена извънредна ситуация в областта на общественото здраве или след признаването на събитие с голям мащаб, както е посочено в член 4, параграф 3, докато се потвърди, че са били предприети достатъчни мерки за справяне със събитието с голям мащаб съгласно член 4, параграф 4, Ръководната група за недостига на лекарства докладва редовно на Комисията и на единните звена за контакт, посочени в член 3, параграф 6, втора алинея, за резултатите от мониторинга, посочен в член 7, и по-специално сигнализира за всеки действителен или потенциален недостиг на лекарствени продукти, включени в списъците на критично важните лекарства, или за всяко събитие, което има вероятност да доведе до събитие с голям мащаб.“.
|
4. |
На страница 16, член 8, параграф 2, въвеждащо изречение |
вместо:
„По искане на Комисията или на едно или повече звена за контакт, посочени в член 3, параграф 6, Ръководната група за недостига на лекарства предоставя обобщени данни и прогнози относно търсенето, за да подкрепи констатациите и заключенията си. В това отношение Ръководната група за недостига на лекарства:“
да се чете:
„По искане на Комисията или на едно или повече звена за контакт, посочени в член 3, параграф 6, втора алинея, Ръководната група за недостига на лекарства предоставя обобщени данни и прогнози относно търсенето, за да подкрепи констатациите и заключенията си. В това отношение Ръководната група за недостига на лекарства:“.
|
5. |
На страница 18, член 9, параграф 2, буква г) |
вместо:
|
„г) |
изисква информация от единните звена за контакт, посочени в член 3, параграф 6, относно лекарствените продукти в списъците на критично важните лекарства въз основа на пакета от информация, посочен в член 6, параграф 4, и определя краен срок за представянето на посочената информация, ако тази информация не е налична на Европейската платформа за мониторинг на недостига.“ |
да се чете:
|
„г) |
изисква информация от единните звена за контакт, посочени в член 3, параграф 6, втора алинея, относно лекарствените продукти в списъците на критично важните лекарства въз основа на пакета от информация, посочен в член 6, параграф 4, и определя краен срок за представянето на посочената информация, ако тази информация не е налична на Европейската платформа за мониторинг на недостига.“. |
|
6. |
На страница 18, член 10, параграф 2, втора алинея |
вместо:
„Титулярите на разрешения за търговия, посочени в първа алинея на настоящия параграф, подават поисканата информацията в определения от Агенцията срок посредством единните звена за контакт, посочени в член 9, параграф 2, буква б), като използват методите за мониторинг и докладване и системите, установени съответно съгласно член 9, параграф 1, букви б) и в). При необходимост титулярите на разрешения за търговия предоставят актуализации.“
да се чете:
„Титулярите на разрешения за търговия, посочени в първа алинея на настоящия параграф, подават поисканата информацията в определения от Агенцията срок посредством единните звена за контакт, посочени в член 9, параграф 2, буква а), като използват методите за мониторинг и докладване и системите, установени съответно съгласно член 9, параграф 1, букви б) и в). При необходимост титулярите на разрешения за търговия предоставят актуализации.“.
|
7. |
На страница 19, член 11, параграф 1, буква а) |
вместо:
|
„а) |
подаде набора от информация, посочен в член 6, параграф 4, включително наличните и прогнозните данни относно обема на търсенето и прогнозата за търсенето, посредством единните звена за контакт, определени в член 3, параграф 6, и като използват методите и системите за докладване, установени, съответно, съгласно член 9, параграф 1, букви б) и в);“ |
да се чете:
|
„а) |
подаде набора от информация, посочен в член 9, параграф 2, буква г), включително наличните и прогнозните данни относно обема на търсенето и прогнозата за търсенето, посредством единното звено за контакт, посочено в член 3, параграф 6, втора алинея, като използва методите и системите за докладване, установени, съответно, съгласно член 9, параграф 1, букви б) и в);“. |
|
8. |
На страница 20, член 11, параграф 3 |
вместо:
„3. Ако държавите членки разполагат, в допълнение към информацията, която трябва да се предостави в съответствие с параграфи 1 и 2 от настоящия член, с информация относно обема на продажбите и обема на рецептите за лекарствените продукти, в които се съдържат доказателства за действителен или потенциален недостиг на даден лекарствен продукт, включен в списъците на критично важните лекарства, включително данни, посочени в член 23а, трета алинея от Директива 2001/83/ЕО, те предоставят незабавно тази информация на Ръководната група за недостига на лекарства посредством съответните си единни звена за контакт, посочени в член 3, параграф 6 от настоящия регламент.“
да се чете:
„3. Ако държавите членки разполагат, в допълнение към информацията, която трябва да се предостави в съответствие с параграфи 1 и 2 от настоящия член, с информация относно обема на продажбите и обема на рецептите за лекарствените продукти, в които се съдържат доказателства за действителен или потенциален недостиг на даден лекарствен продукт, включен в списъците на критично важните лекарства, включително данни, посочени в член 23а, трета алинея от Директива 2001/83/ЕО, те предоставят незабавно тази информация на Ръководната група за недостига на лекарства посредством съответните си единни звена за контакт, посочени в член 3, параграф 6, втора алинея от настоящия регламент.“.
|
9. |
На страница 21, член 13, параграф 3, буква б) |
вместо:
|
„б) |
Държавите членки използват ЕПМН за да докладват на Агенцията чрез единните звена за контакт, посочени в член 9, параграф 1, буква г, информация, отнасяща се до лекарствени продукти, включени в списъците на критично важните лекарства, в съответствие с членове 9 и 11.“ |
да се чете:
|
„б) |
Държавите членки използват ЕПМН за да докладват на Агенцията чрез единните звена за контакт, посочени в член 3, параграф 6, втора алинея, информация, отнасяща се до лекарствени продукти, включени в списъците на критично важните лекарства, в съответствие с членове 9 и 11.“. |
|
10. |
На страница 21, член 13, параграф 4, буква б) |
вместо:
|
„б) |
държавите членки използват ЕПМН, за да докладват на Агенцията относно недостиг на лекарствени продукти, който има вероятност да доведе до извънредна ситуация в областта на общественото здраве или събитие с голям мащаб, в съответствие с член 4, параграф 2, чрез единните звена за контакт, посочени в член 9, параграф 1, буква д).“ |
да се чете:
|
„б) |
държавите членки използват ЕПМН, за да докладват на Агенцията относно недостиг на лекарствени продукти, който има вероятност да доведе до извънредна ситуация в областта на общественото здраве или събитие с голям мащаб, в съответствие с член 4, параграф 2, чрез единните звена за контакт, посочени в член 3, параграф 6, втора алинея.“. |
|
11. |
На страница 28, член 22, параграф 2 |
вместо:
„2. За целите на член 25, параграф 2, Ръководната група за недостига на медицински изделия приема и оповестява публично набора от информация, посочена в член 25, параграф 2, букви б) и в), която е необходима, за да се следи предлагането и търсенето на медицинските изделия, включени в списъка на критично важните изделия при извънредна ситуация в областта на общественото здраве, и информира работната група, посочена в член 21, параграф 5, за посочения набор от информация.“
да се чете:
„2. За целите на член 25, параграф 2, Ръководната група за недостига на медицински изделия приема и оповестява публично набора от информация, посочена в член 25, параграф 2, букви в) и г), която е необходима, за да се следи предлагането и търсенето на медицинските изделия, включени в списъка на критично важните изделия при извънредна ситуация в областта на общественото здраве, и информира работната група, посочена в член 21, параграф 5, за посочения набор от информация.“.
|
12. |
На страница 28, член 24, параграф 1 |
вместо:
„1. За цялата продължителност на дадена извънредна ситуация в областта на общественото здраве Ръководната група за недостига на медицински изделия редовно докладва на Комисията и единните звена за контакт, посочени в член 25, параграф 2, буква а), резултатите от мониторинга, посочен в член 23, и по-специално сигнализира за всеки действителен или потенциален недостиг на медицински изделия, включени в списъка на критично важните изделия при извънредна ситуация в областта на общественото здраве.“
да се чете:
„1. За цялата продължителност на дадена извънредна ситуация в областта на общественото здраве Ръководната група за недостига на медицински изделия редовно докладва на Комисията и единните звена за контакт, посочени в член 21, параграф 5, втора алинея, резултатите от мониторинга, посочен в член 23, и по-специално сигнализира за всеки действителен или потенциален недостиг на медицински изделия, включени в списъка на критично важните изделия при извънредна ситуация в областта на общественото здраве.“.
|
13. |
На страница 29, член 24, параграф 5 |
вместо:
„5. По искане на Комисията, Ръководната група за недостига на медицински изделия може да координира мерките, предприети от националните компетентни органи за медицински изделия, производителите на медицински изделия, нотифицираните органи и други субекти, когато е целесъобразно, за да се предотврати или смекчи действителният или потенциалният недостиг на медицински изделия в контекста на извънредна ситуация в областта на общественото здраве или събитие с голям мащаб.“
да се чете:
„5. По искане на Комисията, Ръководната група за недостига на медицински изделия може да координира мерките, предприети от националните компетентни органи за медицински изделия, производителите на медицински изделия, нотифицираните органи и други субекти, когато е целесъобразно, за да се предотврати или смекчи действителният или потенциалният недостиг на медицински изделия в контекста на извънредна ситуация в областта на общественото здраве.“.
|
14. |
На страница 31, член 27, параграф 1, буква а) |
вместо:
|
„а) |
подаде набораот информация, посочен в член 22, параграф 2, включително наличната информация относно нуждите, свързани с медицинските изделия, включени в списъка на критично важните изделия при извънредна ситуация в областта на общественото здраве, както и наличните и прогнозните данни относно обема на търсенето и прогнозата за търсенето на тези медицински изделия, чрез съответните единни звена за контакт, посочени в член 25, параграф 2, буква а), и като използват методите за мониторинг и докладване и системите, установени съгласно член 25, параграф 1, буква б);“ |
да се чете:
|
„а) |
подаде набора от информация, посочен в член 25, параграф 2, буква г), включително наличната информация относно нуждите, свързани с медицинските изделия, включени в списъка на критично важните изделия при извънредна ситуация в областта на общественото здраве, както и наличните и прогнозните данни относно обема на търсенето и прогнозата за търсенето на тези медицински изделия, чрез съответното единно звено за контакт, посочено в член 21, параграф 5, втора алинея, като използва методите за мониторинг и докладване и системите, установени съгласно член 25, параграф 1, буква б);“. |
|
15. |
На страница 32, член 27, параграф 3 |
вместо:
„3. Ако държавите членки разполагат, в допълнение към информацията, която трябва да се представи в съответствие с параграфи 1 и 2 от настоящия член, в която се съдържат доказателства за действителен или потенциален недостиг на медицински изделия, те предоставят незабавно тази информация на Ръководната група за недостига на медицински изделия чрез съответните си единни звена за контакт, посочени в член 25, параграф 2, буква а).“
да се чете:
„3. Ако държавите членки разполагат с информация, в допълнение към информацията, която трябва да се представи в съответствие с параграфи 1 и 2 от настоящия член, в която се съдържат доказателства за действителен или потенциален недостиг на медицински изделия, те предоставят незабавно тази информация на Ръководната група за недостига на медицински изделия чрез съответните си единни звена за контакт, посочени в член 21, параграф 5, втора алинея.“.
|
16. |
На страница 32, член 27, параграф 4, буква б) |
вместо:
|
„б) |
вземат предвид евентуалните препоръки, посочени в член 24, параграф 3, и евентуалните насоки, посочени в член 28, буква б), и съгласуват своите действия във връзка с всякакви действия, предприети на равнището на Съюза съгласно член 12, буква а);“ |
да се чете:
|
„б) |
вземат предвид евентуалните препоръки, посочени в член 24, параграф 3, и евентуалните насоки, посочени в член 28, буква б), и съгласуват своите действия във връзка с всякакви действия, предприети на равнището на Съюза съгласно член 28, буква а);“. |
|
9.3.2023 |
BG |
Официален вестник на Европейския съюз |
L 71/42 |
Поправка на Регламент за изпълнение (ЕС) 2021/620 на Комисията от 15 април 2021 година за установяване на правила за прилагането на Регламент (ЕС) 2016/429 на Европейския парламент и на Съвета във връзка с одобряването на статута „свободен от болест“ и на липсата на имунизационен статут на някои държави членки или зони или компартменти от тях по отношение на определени болести от списъка и одобряването на програми за ликвидиране на тези болести от списъка
( Официален вестник на Европейския съюз L 131 от 16 април 2021 г. )
|
1. |
На страница 78 в заглавието |
вместо:
„и на липсата на имунизационен статут на някои държави членки или зони или компартменти от тях“
да се чете:
„и на статута „без ваксинация“ на някои държави членки или зони или компартменти от тях“.
|
2. |
На страница 78 в съображение 1, четвъртото изречение |
вместо:
„Освен това в регламента се предвижда одобряване от Комисията на статута „свободен от болест“ или на липсата на имунизационен статут на държавите членки или зони или компартменти от тях във връзка с определени болести от списъка, посочени в член 9, параграф 1, букви а), б) и в) от Регламент (ЕС) 2016/429.“
да се чете:
„Освен това в регламента се предвижда одобряване от Комисията на статута „свободен от болест“ или на статута „без ваксинация“ на държавите членки или зони или компартменти от тях във връзка с определени болести от списъка, посочени в член 9, параграф 1, букви а), б) и в) от Регламент (ЕС) 2016/429.“
|
3. |
На страница 82 в член 1, параграф 1 |
вместо:
„1. С настоящия регламент се установяват правила за прилагане по отношение на посочените в член 9, параграф 1, букви а), б) и в) от Регламент (ЕС) 2016/429 болести от списъка при животните във връзка със статута „свободен от болест“ и липсата на имунизационен статут на някои държави членки (20) или зони или компартменти от тях и одобряването на програми за ликвидиране на тези болести от списъка.“
да се чете:
„1. С настоящия регламент се установяват правила за прилагане по отношение на посочените в член 9, параграф 1, букви а), б) и в) от Регламент (ЕС) 2016/429 болести от списъка при животните във връзка със статута „свободен от болест“ и статута „без ваксинация“ на някои държави членки (20) или зони или компартменти от тях и одобряването на програми за ликвидиране на тези болести от списъка.“
|
4. |
На страница 82 в член 1, параграф 3, буква б) |
вместо:
|
„б) |
държавите членки или зони от тях с одобрен статут „свободнa от болест“ и без имунизационен статут;“ |
да се чете:
|
„б) |
държавите членки или зони от тях с одобрен статут „свободнa от болест“ и „без ваксинация“;“. |
|
5. |
На страница 84 в член 11 |
вместо:
„Държавите членки или зони от тях със статут „свободнa от болест“ по отношение на инфекция с вируса на нюкасълската болест и без имунизационен статут се вписват в приложение X.“
да се чете:
„Държавите членки или зони от тях със статут „свободнa от болест“ по отношение на инфекция с вируса на нюкасълската болест без ваксинация се вписват в приложение X.“
|
6. |
На страница 110 в приложение Х, заглавието на таблицата |
вместо:
„Държави членки или зони от тях със статут „свободна от болест“ по отношение на инфекция с вируса на нюкасълската болест и без имунизационен статут“
да се чете:
„Държави членки или зони от тях със статут „свободна от болест“ по отношение на инфекция с вируса на нюкасълската болест без ваксинация“.
|
9.3.2023 |
BG |
Официален вестник на Европейския съюз |
L 71/44 |
Поправка на Регламент за изпълнение (ЕС) 2023/419 на Съвета от 24 февруари 2023 година за прилагане на член 8а от Регламент (ЕО) № 765/2006 на Съвета относно ограничителни мерки с оглед на положението в Беларус и участието на Беларус в руската агресия срещу Украйна
( Официален вестник на Европейския съюз L 61 от 27 февруари 2023 г. )
На страница 22 в приложението, в уводната част
вместо:
„Приложение I към Регламент (ЕО) 765/2006 се изменя, както следва:
|
1) |
В таблица „А. Физически лица, посочени в член 2, параграф 1“ вписвания 10, 17, 20, 22, 35, 39, 41, 42, 64, 65, 71, 73, 75, 78, 85, 87, 89, 90, 123, 125 и 179 се заменят със следното:“ |
да се чете:
„Приложение I към Регламент (ЕО) 765/2006 се изменя, както следва:
|
1) |
В таблица „А. Физически лица, посочени в член 2, параграф 1“ вписвания 10, 17, 20, 22, 35, 39, 41, 42, 64, 65, 71, 73, 75, 78, 85, 87, 89, 90, 104, 123, 125, 129, 131, 179 и 195 се заменят със следното:“. |

