EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 02006L0086-20150429
Commission Directive 2006/86/EC of 24 October 2006 implementing Directive 2004/23/EC of the European Parliament and of the Council as regards traceability requirements, notification of serious adverse reactions and events and certain technical requirements for the coding, processing, preservation, storage and distribution of human tissues and cells (Text with EEA relevance)
Consolidated text: Директива 2006/86/ЕО на Комисията от 24 октомври 2006 година за прилагане на Директива 2004/23/ЕО на Европейския парламент и на Съвета относно установяването на изисквания за проследимост, съобщаване на сериозни нежелани реакции и събития и определени технически изисквания по отношение на кодиране, преработване, съхраняване, съхранение и предоставяне на човешки тъкани и клетки (текст от значение за ЕИП)
Директива 2006/86/ЕО на Комисията от 24 октомври 2006 година за прилагане на Директива 2004/23/ЕО на Европейския парламент и на Съвета относно установяването на изисквания за проследимост, съобщаване на сериозни нежелани реакции и събития и определени технически изисквания по отношение на кодиране, преработване, съхраняване, съхранение и предоставяне на човешки тъкани и клетки (текст от значение за ЕИП)
2006L0086 — BG — 29.04.2015 — 001.001
Този документ е средство за документиране и не обвързва институциите
|
ДИРЕКТИВА 2006/86/ЕО НА КОМИСИЯТА от 24 октомври 2006 година за прилагане на Директива 2004/23/ЕО на Европейския парламент и на Съвета относно установяването на изисквания за проследимост, съобщаване на сериозни нежелани реакции и събития и определени технически изисквания по отношение на кодиране, преработване, съхраняване, съхранение и предоставяне на човешки тъкани и клетки (ОВ L 294, 25.10.2006, p.32) |
Изменен с
|
|
|
Официален вестник |
||
|
No |
page |
date |
||
|
ДИРЕКТИВА (ЕС) 2015/565 НА КОМИСИЯТА текст от значение за ЕИП от 8 април 2015 година |
L 93 |
43 |
9.4.2015 |
|
ДИРЕКТИВА 2006/86/ЕО НА КОМИСИЯТА
от 24 октомври 2006 година
за прилагане на Директива 2004/23/ЕО на Европейския парламент и на Съвета относно установяването на изисквания за проследимост, съобщаване на сериозни нежелани реакции и събития и определени технически изисквания по отношение на кодиране, преработване, съхраняване, съхранение и предоставяне на човешки тъкани и клетки
(текст от значение за ЕИП)
КОМИСИЯТА НА ЕВРОПЕЙСКИТЕ ОБЩНОСТИ
като взе предвид Договора за създаване на Европейската общност,
като взе предвид Директива 2004/23/ЕО на Европейския парламент и на Съвета от 31 март 2004 г. относно установяването на стандарти за качество и безопасност при даряването, доставянето, контрола, преработването, съхраняването, съхранението и разпределянето на човешки тъкани и клетки ( 1 ), и по-специално член 8, членове 11, параграф 4 и 28, букви а), в), ж) и з) от нея,
като има предвид, че:|
(1) |
Директива 2004/23/ЕО определя стандарти за качество и безопасност при даряването, доставянето, контрола, преработването, съхраняването, съхранението и разпределянето на човешки тъкани и клетки, предназначени за прилагане при хора и на продукти, произведени от човешки тъкани и клетки, предназначени за прилагане при хора, чрез което да се осигури високо ниво на опазване на човешкото здраве. |
|
(2) |
За да се предотврати предаване на болести чрез човешки тъкани и клетки за прилагане при хора, и за да се осигури единно ниво на качество и безопасност, Директива 2004/23/ЕО изисква определяне на специфични технически изисквания за всяка отделна стъпка при процеса на прилагане на човешки тъкани и клетки, в това число стандарти и спецификации по отношение на система за качество на заведенията работещи с тъкани. |
|
(3) |
В съответствие с Директива 2004/23/ЕО, във всяка държава-членка се изгражда система за акредитиране, определяне, оторизиране или лицензиране на заведенията работещи с тъкани с цел осигуряване на високо ниво на опазване на човешкото здраве. Необходимо е да се установят техническите изисквания за такава система. |
|
(4) |
Изискванията за акредитиране, определяне, оторизиране или лицензиране на заведенията работещи с тъкани следва да покриват тяхната организация и управление, персонал, оборудване и материали, съоръжения/офиси, документация и регистри и контрол на качеството. Заведенията за работа с тъкани, получили акредитиране, определяне, оторизиране или лицензиране следва да отговарят на допълнителни изисквания, свързани със специфичните дейности, които извършват. |
|
(5) |
Стандартът за качество на въздуха при обработване на тъкани и клетки е ключов фактор, който може да окаже влияние върху риска от замърсяване на тъканите или клетките. Изисква се качество на въздуха с концентрация на частици и праг на микробно замърсяване, приравнено към качество от категория А, съгласно определението в Европейските насоки за добрата производствена практика, приложение 1 и Директива 2003/94/ЕО на Комисията ( 2 ). При определени обстоятелства следва да не се посочва изискване за качество на въздуха с концентрация на частици и праг на микробно замърсяване, приравнени към категория А. При такива обстоятелства е необходимо да се докаже и документира, че подбраната среда отговаря на изискванията за качество и безопасност, необходими за съответния вид тъкани и клетки, преработване и прилагане при хора. |
|
(6) |
Обхватът на настоящата директива следва да се разпростира за качеството и безопасността на човешки тъкани и клетки при кодиране, преработване, съхраняване, съхранение и предоставяне на лечебното заведение, където ще се трансплантират в човешкото тяло. Въпреки това, тя следва да не обхваща прилагане на тъкани и клетки при хора (като например имплантационна хирургия, перфузия, оплождане или пренос на ембриони). Разпоредбите на настоящата директива относно проследимостта и съобщаването на сериозни нежелани реакции и събития се прилагат и при даряването, доставянето и контрола на човешки тъкани и клетки, уредени в Директива 2006/17/ЕО на Комисията ( 3 ). |
|
(7) |
Използването на тъкани и клетки за прилагане при хора носи риск от предаване на заболявания и други потенциални неблагоприятни въздействия за реципиентите на тъкани или клетки. С цел мониторинг и намаляване на подобни неблагоприятни въздействия е необходимо изработване на точно определени изисквания за проследимост и процедура на Общността за съобщаване на сериозни нежелани реакции и събития. |
|
(8) |
Необходимо е компетентните органи да бъдат незабавно нотифицирани при съмнения за сериозни нежелани реакции при донор или реципиент, както и за сериозни нежелани събития по цялата верига: от даряване до разпределяне на тъкани и клетки, които могат да окажат влияние върху качеството и безопасността на тъканите и клетките, и които могат да се дължат на доставяне (в това число оценка и подбор на донори), контрол, преработване, съхраняване, съхранение и разпределяне на човешки тъкани и клетки. |
|
(9) |
Сериозни неблагоприятни реакции могат да бъдат открити по време и след процеса на предоставяне от живи донори, както и по време или след прилагане при хора. Такива случаи следва да се съобщават на свързаното заведение работещо с тъкани за последващо изследване и нотифициране на компетентния орган. Това следва да не пречи на организацията за доставяне или организацията, отговорна за прилагане при хора, също директно да нотифицират компетентния орган, ако такова е желанието ѝ. Настоящата директива определя минималния набор от данни, необходим за уведомяване на компетентния орган, без това да засяга способността на държавите-членки да въвеждат или поддържат на териториите си по-строги защитни мерки, които са в съответствие с изискванията на Договора. |
|
(10) |
С цел да сведе до минимум разходите по пренос, избягване на припокриване на дейности и подобряване на административната ефективност е необходимо да се използват съвременни технологии и схеми за електронно управление при изпълнение на дейностите, свързани с пренос и обработка на информация. Технологиите следва да са основани на стандартен обменен формат, като се използва подходяща система за управление на референтни данни. |
|
(11) |
С цел осигуряване на проследимост и информация относно главните характеристики и свойства на тъканите и клетките е необходимо да се определят основните данни, които следва да бъдат включени в единния Европейски код. |
|
(12) |
Настоящата директива зачита основните права на човека и спазва принципите, които са изрично описани в Хартата за основните права на Европейския съюз. |
|
(13) |
Мерките, предвидени в настоящата директива са в съответствие със становището на Комитета, установен с член 29 от Директива 2004/23/ЕО, |
ПРИЕ НАСТОЯЩАТА ДИРЕКТИВА:
Член 1
Обхват
1. Настоящата директива се прилага по отношение на кодирането, преработването, съхраняването, съхранението и предоставянето на:
а) човешки тъкани и клетки, предназначени за трансплантация при човека;
б) произведени продукти, получени от човешки тъкани и клетки, предназначени за трансплантиране при хора, когато такива продукти не са в обхвата на други директиви.
2. Разпоредбите на членове 5—9 от настоящата директива, отнасящи се до проследимостта и съобщаването на сериозни нежелани реакции и събития, се отнасят и до даряването, доставянето и контрола на човешки тъкани и клетки.
Член 2
Определения
По смисъла на настоящата директива се прилагат следните определения:
а) „репродуктивни клетки“
означава всички тъкани и клетки, предназначени да се използват за целите на асистираната репродукция;
б) „донорство от партньор“
означава донорство на репродуктивни клетки между мъж и жена, които са декларирали, че имат интимна физическа връзка;
в) „система за качество“
означава организационна структура, определени отговорности, процедури, процеси и ресурси за въвеждане и осъществяване на управление на качеството и включва всички дейности, които пряко или непряко допринасят за качеството;
г) „управление на качеството“ означава координирани дейности по управление и контрол на дадена организация по отношение на качеството;
д) „Стандартни оперативни процедури“ (СОП) означава писмени инструкции, които описват отделните стъпки в определен процес, включително използваните материали и методи и очаквания краен продукт;
е) „утвърждаване“ (или „оценка“ когато става въпрос за оборудване или среда) означава установяване на документирано доказателство, което дава висока степен на сигурност, че определен процес, дадено оборудване или среда неизменно произвежда продукт, който отговаря на предварително определените за него спецификации и качествени характеристики; един процес подлежи на утвърждаване с цел оценка на качеството на работата на дадена система по отношение на нейната ефективност въз основа на предназначението;
ж) „проследимост“ означава способността да се локализира и идентифицира тъкан/клетка във всеки етап от доставянето, през преработването, контрола и съхранението до разпределянето на реципиента или изваждането им от употреба, което също така означава и способност да се идентифицира донора и заведението работещо с тъкани или производственото съоръжение, което получава, преработва или съхрънява тъкани/клетки, както и способността да се идентифицира реципиента/ите в лечебното заведение/я, където се извършва трансплантацията на тъканите/клетките в реципиента/ите; понятието проследимост включва и способността за локализиране и идентифициране на всички съотносими данни, свързани с продукти и материали, които влизат в контакт с такива тъкани/клетки;
з) „критично“ обозначава потенциална способност за въздействие върху качеството и/или безопасността или наличие на контакт с клетките и тъканите;
и) „организация за доставяне“ означава лечебно заведение или отделение на болница или друга организация, която се ангажира с осигуряване на човешки тъкани и клетки; и която може да не е акредитирана, определена, оторизирана или лицензирана като заведение за работа с тъкани;
й) „организация, отговорна за прилагане при хора“ означава лечебно заведение или отделение на болница или друга организация, която прилага човешки тъкани и клетки при хора;
к) „единен европейски код“ — или SEC, е уникален идентификатор, прилаган за тъкани и клетки, разпределяни в Съюза. Единният европейски код се състои от идентификационни данни на дарението и идентификационни данни на продукта, както е уточнено в приложение VII към настоящата директива;
л) „идентификационни данни на дарението“ е първата част от единния европейски код, състояща се от кода на ЕС на лечебното заведение за работа с тъкани и уникалния номер на дарението;
м) „код на ЕС на лечебното заведение за работа с тъкани“ е уникален идентификатор за акредитирани, определени, упълномощени или получили разрешение лечебни заведения за работа с тъкани в Съюза. Кодът на лечебното заведение за работа с тъкани се състои от ISO кода на държавата и номер на лечебното заведение за работа с тъкани, посочен в указателя на ЕС на лечебните заведения за работа с тъкани, както е уточнено в приложение VII към настоящата директива;
н) „уникален номер на дарението“ е уникалният номер, зададен на конкретно дарение на тъкани и клетки в съответствие със системата, която се прилага във всяка държава членка за задаване на тези номера, както е уточнено в приложение VII към настоящата директива;
о) „идентификационни данни на продукта“ е втората част от единния европейски код, съставен от кода на продукта, единичния номер и срока на годност;
п) „код на продукта“ е идентификаторът за конкретния вид тъкани и клетки. Кодът на продукта се състои от идентификатора на системата за кодиране на продукта, указващ системата за кодиране, използвана от лечебното заведение за работа с тъкани („E“ за EUTC, „A“ за ISBT128, „B“ за Eurocode), както и на продуктовите номера на тъканите и клетките, предвидени в съответната система за кодиране на типа продукт, както е определено в приложение VII към настоящата директива;
р) „единичен номер“ е номерът, който разграничава и еднозначно идентифицира тъканите и клетките с един и същ уникален номер на дарението, един и същ продуктов код и произход от едно и също лечебно заведение за работа с тъкани, както е определено в приложение VII към настоящата директива;
с) „срок на годност“ е датата, до която тъканите и клетките могат да се използват, както е определено в приложение VII към настоящата директива;
т) „платформа на ЕС за кодиране“ е информационна платформа в интернет, която се поддържа от Комисията и съдържа указателя на ЕС на лечебните заведения за работа с тъкани и указателя на ЕС за продуктите от клетките и тъканите;
у) „указател на ЕС на лечебните заведения за работа с тъкани“ е регистър на всички лечебни заведения за работа с тъкани, които са упълномощени, с издадено разрешение, определени или акредитирани от компетентния орган или органи на държавите членки, който съдържа информация за тези лечебни заведения за работа с тъкани, както е посочено в приложение VIII към настоящата директива;
ф) „указател на ЕС на продукти от тъкани и клетки“ е регистър на всички видове тъкани и клетки, които са в обращение в Съюза, и съответните кодове на продуктите в рамките на трите разрешени системи за кодиране (EUTC, ISBT128 и Eurocode);
х) „EUTC“ е система за кодиране на продукти от тъкани и клетки, разработена от Съюза и състояща се от регистър на всички видове тъкани и клетки, които са в обращение в Съюза, и съответните им продуктови кодове;
ц) „пуснати в обращение“ е разпределяне за употреба при човека или прехвърляне към друг оператор, напр. за допълнително преработване, със или без връщане;
ч) „в рамките на един и същ център“ означава, че всеки етап от доставянето до употребата при човека се извършва при едно и също отговорно лице, система за управление на качеството и система за проследяване, в рамките на едно лечебно заведение, което на едно и също място включва поне акредитирано, определено, упълномощено или с издадено разрешение лечебно заведение за работа с тъкани и организация, отговорна за употребата при човека;
ш) „обединяване“ е физически контакт или смесване в един контейнер на тъкани или клетки от повече от едно доставяне от един и същ донор или от два или повече донори.
Член 3
Изисквания за акредитиране, определяне, оторизиране или лицензиране на заведения за работа с тъкани
Всяко заведение за работа с тъкани трябва да отговаря на изискванията, определени в приложение I.
Член 4
Изисквания за акредитиране, определяне, оторизиране, лицензиране на процесите по подготовка на тъкани и клетки
Процесите по подготовка в заведенията за работа с тъкани следва да отговарят на изискванията, определени в приложение II.
Член 5
Нотифициране на сериозни нежелани реакции
1. Държавите-членки гарантират, че:
а) организациите за доставяне имат въведени процедури за съхраняване на всички регистрирани данни по отношение на взетите тъкани и клетки и за незабавно нотифициране на заведенията работещи с тъкани за възникнали сериозни неблагоприятни реакции в живия донор, които биха могли да окажат влияние върху качеството и безопасността на тъканите и клетките;
б) организациите, отговорни за прилагане на тъкани и клетки при хора имат въведени процедури за съхраняване на регистрираните данни по отношение на присадените тъкани и клетки и за незабавно нотифициране на заведенията, работещи с тъкани за наблюдавани сериозни нежелани реакции, които са възникнали след клиничното им приложение и които могат да са свързани с качеството и безопасността на тъканите и клетките;
в) заведенията за работа с тъкани, които разпределят тъкани и клетки за прилагане при хора осигуряват информация за организациите, отговорни за прилагане на тъкани и клетки при хора относно процедурата, съгласно която те трябва да съобщават за сериозни нежелани реакции, както е упоменато в буква б).
2. Държавите-членки гарантират, че заведенията за работа с тъкани:
а) са въвели процедури, съгласно които незабавно предоставят на компетентните органи цялата необходима информация относно предполагаеми сериозни нежелани реакции, както е упоменато в параграф 1, букви а) и б);
б) са въвели процедури, съгласно които незабавно предоставят на компетентните органи заключението от извършено разследване за анализ на причината и последвалия изход.
3. Държавите-членки гарантират, че:
а) отговорното лице, упоменато в член 17 от Директива 2004/23/ЕО нотифицира компетентните органи за информацията, включена в съобщението, посочена в част А на приложение III;
б) заведенията за работа с тъкани нотифицират компетентните органи за предприетите действия, по отношение на други въвлечени тъкани и клетки, които са били предоставени за употреба при хора;
в) заведенията за работа с тъкани нотифицират компетентните органи за резултата от разследването, предоставяйки най- малко информация, както е посочена в част Б на приложение III.
Член 6
Нотифициране на сериозни нежелани събития
1. Държавите-членки гарантират, че:
а) организациите за доставяне и заведенията за работа с тъкани имат въведени процедури за съхраняване на регистрираните данни и за незабавно нотифициране на заведенията за работа с тъкани за всички сериозни нежелани събития, които са възникнали по време на предоставянето, и които могат да окажат влияние върху качеството и/или безопасността на тъканите и клетките с човешки произход;
б) организациите, отговорни за прилагане на тъкани и клетки при хора са въвели процедури за незабавно нотифициране на заведенията работещи с тъкани за всички сериозни нежелани събития, които могат да окажат влияние върху качеството и безопасността на тъканите и клетките;
в) заведенията за работа с тъкани предоставят информация на организациите, отговорни за прилагане при хора, относно начините за съобщаване на сериозните нежелани събития, които могат да окажат влияние върху качеството и безопасността на тъканите и клетките.
2. В случаите на асистирана репродукция, неправилната идентификация или подмяна на гамети или ембриони се счита за сериозно нежелано събитие. Всички лица, организации за доставяне или организации, отговорни за прилагане при хора, които извършват асистираната репродукция са длъжни да съобщават такива случаи на заведението за работа с тъкани, което ги е доставило, с цел разследване и нотифициране на компетентните органи.
3. Държавите-членки гарантират, че заведенията за работа с тъкани:
а) са въвели процедури, съгласно които незабавно предоставят на компетентните органи цялата необходима информация относно подозирани сериозни нежелани събития, както е упоменато в параграф 1, букви а) и б);
б) са въвели процедури, съгласно които незабавно предоставят на компетентните органи резултата от разследването за анализ на причината и последвалия изход.
4. Държавите-членки гарантират, че:
а) отговорното лице, посочено в член 17 от Директива 2004/23/ЕО незабавно предоставя на компетентните органи информацията, включена в част А на приложение IV;
б) заведенията за работа с тъкани извършват оценка на възникнали сериозни нежелани събития, посредством което да идентифицират причини, които могат за бъдат предотвратени в рамките на процеса;
в) заведенията за работа с тъкани нотифицират компетентните органи относно резултата от разследването, като осигуряват минимума от информация, посочен в част Б на приложение IV.
Член 7
Годишни доклади
1. Държавите-членки представят на Комисията годишни доклади до 30 юни на следващата година, в които представят всички получени съобщения от компетентните органи за сериозни нежелани реакции и събития. Комисията предоставя на компетентните органи в държавите-членки обобщен доклад за получените доклади. Компетентните органи са длъжни да предоставят обобщения доклад на заведенията за работа с тъкани.
2. Предаването на данни трябва да е в съответствие със спецификациите за формата на обмен на данни, както е определен в приложение V, части А и Б и следва да съдържа цялата информация, необходима за идентифицирането на изпращащата страна и поддържане на референтните данни.
Член 8
Обмен на информация между компетентни органи и към Комисията
Държавите-членки гарантират, че техните компетентни органи обменят помежду си и предоставят на Комисията подходяща информация относно сериозни нежелани реакции и събития, чрез което да осигурят предприемането на адекватни действия.
Член 9
Проследимост
1. Държавите членки гарантират, че тъканите и клетките са проследими, по-специално чрез документация и чрез използването на единния европейски код, от доставянето им до тяхната употреба при човек или унищожаване и обратно. Тъканите и клетките, предназначени за лекарствени продукти за модерна терапия, се проследяват съгласно настоящата директива поне до предаването им на производителя на лекарствени продукти за модерна терапия.
2. Държавите членки гарантират, че лечебните заведения за работа с тъкани и организациите, отговорни за употребата при човек, съхраняват данните, описани в приложение VI, най-малко 30 години в подходяща и лесна за работа архивираща система.
3. За тъкани и клетки, получени от починал донор от екипи по доставка, които работят към две или повече лечебни заведения за работа с тъкани, държавите членки осигуряват подходяща система за проследяване при доставките.
Член 10
Европейска система за кодиране
1. Без да се засягат разпоредбите на параграф 2 или 3 от настоящия член, единният европейски код се прилага за всички тъкани и клетки, разпределени за употреба при човек. За други ситуации, при които тъканите и клетките са пуснати в обращение, като минимум идентификационните данни на дарението се прилагат поне в придружаващата документация.
2. Параграф 1 не се прилага за:
а) донорство на репродуктивни клетки между партньори;
б) тъканите и клетките, разпределени за незабавна трансплантация пряко към реципиента, както е посочено в член 6, параграф 5 от Директива 2004/23/ЕО;
в) тъканите и клетките, внесени в Съюза при неотложна необходимост и разрешени пряко от компетентните органи, както е посочено в член 9, параграф 3, буква б) от Директива 2004/23/ЕО.
3. Държавите членки могат също така да позволят освобождаване от изискването, предвидено в параграф 1, за:
а) тъкани и клетки, различни от репродуктивни клетки, дарени от партньор, когато тези тъкани и клетки остават в рамките на един и същ център;
б) тъкани и клетки, които са внесени в Съюза, когато тези тъкани и клетки останат в рамките на един и същ център от внасянето до употребата, при условие че центърът включва лечебно заведение за работа с тъкани, упълномощено, определено, акредитирано или с издадено разрешение за извършване на дейности по внос.
Член 10а
Формат на единния европейски код
1. Единният европейски код, посочен в член 10, параграф 1, отговаря на спецификациите, посочени в настоящия член и в приложение VII.
2. Единният европейски код е във формат, който може да се разчете от невъоръжено око, и се предшества от съкращението „SEC“. Възможно е паралелното използване на други системи за етикетиране и проследяване.
3. Единният европейски код се отпечатва с идентификационните данни на дарението и идентификационните данни на продукта, разделени от интервал или в два последователни реда.
Член 10б
Изисквания, свързани с прилагането на единния европейски код
1. Държавите членки гарантират, че следните минимални изисквания са спазени от лечебните заведения за работа с тъкани, включително извършващите внос лечебни заведения за работа с тъкани, както е определено с Директива (ЕС) 2015/566 на Комисията ( 4 ):
а) задаване на единен европейски код за всички тъкани и клетки, за които се изисква прилагането на такъв код, най-късно преди тяхното разпределяне за употреба при човека;
б) задаване на идентификационни данни на даряването след доставянето на тъкани и клетки, при получаването им от организация за доставяне на тъкани и клетки или при вноса на тъкани и клетки от доставчик от трета държава. Идентификационните данни на дарението включват:
(1) техния код на ЕС на лечебното заведение за работа с тъкани, определен в указателя на ЕС на лечебните заведения за работа с тъкани;
(2) уникален номер на дарението, зададен им от лечебното заведение за работа с тъкани, освен ако такъв номер не е разпределен централно на национално равнище или е уникален номер в световен мащаб, използван от системата за кодиране ISBT128. Когато това се допуска, в случай на обединяване на тъкани и клетки, се задава нов идентификационен номер на дарението на крайния продукт; проследимостта на индивидуалните дарения се гарантира от лечебното заведение за работа с тъкани, в което се извършва обединяването;
в) идентификационните данни на дарението не се променят, след като вече е зададен номерът на тъкани и клетки, пуснати за обращение, освен ако не се налага корекция на грешка при кодирането; всяка корекция изисква надлежно документиране;
г) използва се една от разрешените системи за кодиране на продуктите и съответстващите продуктови номера на тъканите и клетките, включени в указателя на ЕС за продуктите от клетки и тъкани най-късно преди тяхното разпределяне за употреба при човека;
д) използва се подходящ единичен номер и срок на годност. За тъкани и клетки, за които не е определен срок на годност, датата на изтичане на годността е 00000000 най-късно преди разпределението им за употреба при човека;
е) единният европейски код се прилага на етикета на съответния продукт по незаличим и траен начин и се споменава в съответните придружаващи документи най-късно преди разпределението за употреба при човека. Лечебното заведение за работа с тъкани може да възложи тази задача на трета страна или страни, при условие че лечебното заведение за работа с тъкани гарантира съответствие с изискванията на настоящата директива, по-специално по отношение на уникалността на кода. Когато размерът на етикета допуска прилагането на единния европейски код върху етикета, кодът ясно се свързва с тъканите и клетките, опаковани с такъв етикет, посредством придружаващата документация;
ж) компетентният орган или органи се уведомяват, когато:
(1) е необходима актуализация или поправка на информацията в указателя на ЕС на лечебните заведения за работа с тъкани;
(2) е необходима актуализация на указателят на ЕС за продуктите от клетки и тъкани;
(3) лечебното заведение за работа с тъкани забележи случай на сериозно несъответствие с изискванията, свързани с единния европейски код по отношение на тъканите и клетките, получени от други лечебни заведения за работа с тъкани в ЕС;
з) вземат се необходимите мерки в случай на неправилно прилагане на единния европейски код върху етикета.
2. Държавите членки гарантират, че всички компетентни органи прилагат следните минимални изисквания:
а) обезпечават задаването на уникален номер на лечебно заведение за работа с тъкани за всички лечебни заведения за работа с тъкани, които са упълномощени, акредитирани, определени или получили разрешение в съответната държава членка. Ако дадено лечебно заведение за работа с тъкани е разположено на различни места, но има една система за задаване на уникални номера на дарението, то може да се счита за едно лечебно заведение за работа с тъкани. Ако дадено лечебно заведение за работа с тъкани използва две или повече системи за задаване на уникални номера на дарението, на това заведение се задават отделни номера на лечебни заведения за работа с тъкани, съответстващи на броя на използваните системи за задаване на номера;
б) решават коя система или системи се използват за задаване на уникални номера на дарението в тяхната държава членка. Разрешените системи за задаване на номера са: национални системи за централизирано задаване на национален уникален номер на дарението, системи, изискващи всяко лечебно заведение за работа с тъкани да зададе уникални номера на даренията, или международни системи, които задават уникални в световен план номера на даренията, които са съвместими с единния европейски код;
в) наблюдават и прилагат цялостното прилагане на единния европейски код в съответната държава членка;
г) осигуряват потвърждаване на данните за лечебните заведения за работа с тъкани, които се съдържат в указателя на ЕС на лечебните заведения за работа с тъкани за тяхната държава членка, и своевременно актуализират указателя, по-специално в следните ситуации:
(1) когато се упълномощава, определя, акредитира или издава разрешение на ново лечебно заведение за работа с тъкани;
(2) когато има промяна в информацията за лечебно заведение за работа с тъкани или тя не е записана правилно в указателя на ЕС на лечебните заведения за работа с тъкани;
(3) когато има промяна в данните за акредитацията, определянето, упълномощаването или разрешението на лечебно заведение за работа с тъкани, както са посочени в приложение VIII към настоящата директива, включително:
— акредитация, определяне, упълномощаване или издаване на разрешение за нов тип тъкани или клетки,
— акредитация, определяне, упълномощаване или издаване на разрешение за нова предписана дейност,
— данни за евентуални условия и/или изключения, добавени към разрешението,
— временно преустановяване, частично или изцяло, на конкретна акредитация, определяне, упълномощаване или издадено разрешение за определена дейност или вид тъкани или клетки,
— оттегляне, изцяло или отчасти, на акредитация, определяне, упълномощаване или издадено разрешение за лечебно заведение за работа с тъкани,
— случаи, при които лечебно заведение за работа с тъкани доброволно преустановява, частично или изцяло, дейността или дейностите, за които е упълномощено, акредитирано, определено или с издадено разрешение.
Своевременно означава не по-късно от десет работни дни за всяка промяна, съществено засягаща упълномощаването, акредитирането, определянето или издаването на разрешение на съответните лечебни заведения за работа с тъкани.
Когато дадено лечебно заведение за работа с тъкани е упълномощено от два или повече компетентни органа за различни видове тъкани и клетки или различни дейности, всеки компетентен орган актуализира информацията, свързана с дейностите, за които е отговорен;
д) предупреждават компетентните органи на друга държава членка, когато забележат погрешна информация в указателя на ЕС на лечебните заведения за работа с тъкани, отнасяща се до друга държава членка, или когато забележат съществено неспазване на разпоредбите относно единния европейски код, свързани с друга държава членка;
е) предупреждават Комисията и другите компетентни органи, когато при провеждането на оценка стане ясно, че е необходима актуализация на указателя на ЕС за продуктите от клетки и тъкани.
3. Прилагането на единния европейски код не изключва допълнителното прилагане на други кодове в съответствие с националните изисквания на държавите членки.
Член 10в
Достъпност и водене на европейската система за кодиране
1. Комисията поддържа и води информационна платформа в интернет („платформа на ЕС за кодиране“), която съдържа:
а) указателя на ЕС на лечебните заведения за работа с тъкани;
б) указателя на ЕС за продуктите от клетки и тъкани.
2. Комисията гарантира, че информацията, която се съдържа в платформата на ЕС за кодиране, е публично достъпна преди 29 октомври 2016 г.
3. При необходимост Комисията актуализира EUTC и гарантира цялостната актуализация на указателя на ЕС за продуктите от клетки и тъкани. Комисията счита, че е необходимо да се установят споразумения с организациите, които отговарят за управлението на системите ISBT128 и Eurocode, за да се гарантира, че на Комисията редовно се предоставят актуализираните кодове на продуктите за включване в указателя на ЕС за продуктите от клетки и тъкани. Ако тези организации не спазват условията в меморандумите за разбирателство, Комисията може да преустанови, частично или изцяло, бъдещото използване на съответните кодове на продукти, като вземе предвид наличието на необходимите доставки на съответните видове продукти в държавите членки, като се включи преходен период, и след консултации с експерти от държавите членки чрез експертната група на компетентните органи по веществата с човешки произход.
Член 10г
Преходен период
Тъканите и клетките, които вече са на съхранение на 29 октомври 2016 г., се освобождават от задълженията, свързани с единния европейски код, при условие че тъканите и клетките са пуснати в обращение в Съюза в срок до пет години след тази дата и при условие че е гарантирано пълно проследяване чрез алтернативни средства. За тъкани и клетки, които са на съхранение и които са пуснати в обращение след изтичането на този петгодишен срок и за които прилагането на единния европейски код не е възможно, по-специално защото тъканите и клетките се съхраняват с дълбоко замразяване, лечебните заведения за работа с тъкани използват процедурите, приложими за продукти с малки етикети, както е определено в член 10б, параграф 1, буква е).
Член 11
Транспониране
1. Държавите-членки въвеждат в сила законови, подзаконови и административни разпоредби, необходими за да се съобразят с настоящата директива преди 1 септември 2007 г. Държавите-членки незабавно предоставят на Комисията текстовете на съответните разпоредби и таблица на съответствието между тези разпоредби и настоящата директива.
Държавите-членки въвеждат в сила законови, подзаконови и административните разпоредби, необходими, за да се съобразят с член 10 от настоящата директива преди 1 септември 2008 г.
Когато държавите-членки приемат тези разпоредби, в тях се съдържа позоваване на настоящата директива или то се извършва при официалното им публикуване. Условията и редът на позоваване се определят от държавите-членки.
2. Държавите-членки съобщават на Комисията текста на основните разпоредби от националното законодателство, които те приемат в областта, уредена с настоящата директива.
Член 12
Влизане в сила
Настоящата директива влиза в сила на 20-я ден след публикуването ѝ в Официален вестник на Европейския съюз.
Член 13
Адресати
Адресати на настоящата директива са държавите-членки.
ПРИЛОЖЕНИЕ I
Изисквания за акредитиране, определяне, оторизиране или лицензиране на заведенията, работещи с тъкани, както е посочено в член 3
А. ОРГАНИЗАЦИЯ И УПРАВЛЕНИЕ
1. Трябва да бъде определено отговорно лице, което има необходимата квалификация и отговорности, както е посочено в член 17 от Директива 2004/23/ЕО.
2. Всяко заведение за работа с тъкани трябва да има организационна структура и оперативни процедури, подходящи за дейностите, за които иска акредитиране/определяне/оторизиране/лицензиране; заведенията следва да имат организационна схема, която ясно да определя отчетността и взаимоотношенията при докладване.
3. Всяко заведение за работа с тъкани трябва да има достъп до правоспособен лекар, който да консултира и контролира медицинските му дейности, например, подбор на донори, преглед на клиничните резултати от приложените тъкани и клетки или взаимоотношенията с потребители на тези клинични услуги.
4. Задължително е прилагането на документална система за управление на качеството по отношение на дейностите, за които заведението за работа с тъкани иска акредитиране/определяне/оторизиране/лицензиране в съответствие със стандартите, определени в настоящата директива.
5. Трябва да се гарантира идентифициране и свеждане до минимум на рисковете, произтичащи от използване и обработка на биологичен материал, в съответствие с поддържане на адекватно качество и безопасност за планираното предназначение на тъканите и клетките. Рисковете включват тези, които се отнасят до процедурите, средата, здравословното състояние на персонала и са специфични за заведенията за работа с тъкани.
6. Споразумения между заведенията за работа с тъкани и трети страни се сключват в съответствие с член 24 от Директива 2004/23/ЕО. Споразуменията с трети страни трябва да специфицират условията и сроковете на взаимоотношенията и отговорностите, както и протоколите, които ще бъдат спазвани с цел постигане на заложените спецификации за качество на изпълнението.
7. Задължително се въвежда документална система под контрола на отговорното лице, чрез която да се потвърждава, че тъканите и/или клетките отговарят на необходимите спецификации за безопасност и качество и са годни за използване и дистрибуция.
8. В случай на прекратяване на дейността, сключените споразумения и процедури, приети в съответствие с член 21, параграф 5 от Директива 2004/23/ЕО трябва да включват данни за проследимост и информация по отношение на качеството и безопасността на клетките и тъканите.
9. Задължително се въвежда документална система, която да гарантира идентифициране на всяка отделна единица от тъкани или клетки във всеки отделен етап от дейността, за която се иска акредитиране/определяне) оторизиране/лицензиране.
Б. ПЕРСОНАЛ
1. Заведенията за работа с тъкани следва да разполагат с достатъчен на брой персонал, добре квалифициран за дейностите, които извършва. Компетентността на персонала подлежи на оценяване през подходящи интервали, определени в системата за качество.
2. Всеки член на персонала следва да има ясна, документирана и актуализирана длъжностна характеристика. Задачите, отговорностите и отчетността трябва да са ясно документирани, а персоналът добре запознат с тях.
3. На персонала се осигурява първоначално/основно обучение, допълнително квалифициране при промяна в процедурите или при новости в научните познания и адекватни възможности за професионално развитие. Програмите по обучение гарантират и документират, че всеки отделен член на персонала:
а) е доказал компетентност при изпълнение на поверените му дейности;
б) притежава адекватни познания и разбиране на научните/техническите процеси и принципи, отнасящи се до поверените му дейности;
в) разбира организационна структура, системата за качество и правилата за здраве и безопасност в заведението за работа с тъкани, в което работи
г) е добре информиран за по-общия етичен, законов и регулаторен контекст на работата си.
В. ОБОРУДВАНЕ И МАТЕРИАЛИ
1. Оборудването и материалите трябва да бъдат проектирани и поддържани в състояние, отговарящо на предназначението им и да свеждат до минимум всяка опасност за реципиентите и/или персонала.
2. Цялото критично оборудване и всички технически уреди от критично значение подлежат на идентифициране и утвърждаване, редовни инспекции и превантивна поддръжка в съответствие с предписанията на производителя. В случаи, при които оборудване или материали оказват влияние при параметрите на обработване или съхранение с критично значение (напр. температура, налягане, концентрация на частици във въздуха, нива на микробно замърсяване), те следва да бъдат точно определени и да подлежат на подобаващ контрол, постоянно наблюдение, мерки за подаване на тревога и коригиращи действия, в зависимост от изискванията, с цел откриване на неправилно функциониране и неизправности и гарантиране, че критичните параметри се поддържат в приемливи граници във всеки момент. Цялото оборудване, чрез което се измерват критични параметри трябва да бъде калибрирано спрямо проследим стандарт, ако има такъв.
3. Ново и ремонтирано оборудване подлежи на изпитвания при инсталиране и трябва да бъде утвърдено преди въвеждането му в употреба. Резултатите от изпитванията се документират.
4. Поддръжката, сервизното обслужване, почистване, дезинфекция и хигиенизиране на цялото оборудване от критично значение трябва да се извършва редовно и подлежи на документиране.
5. Изработват се процедури за експлоатация на всяка единица от оборудването с критично значение, които подробно описват действията в случай на неизправности или повреда.
6. Процедурите по дейностите, за които се иска акредитиране/определяне/ оторизиране/лицензиране трябва да включват подробни спецификации за всички критични материали и реагенти. И по-специално трябва да се определят спецификации за използваните добавки (напр. разтвори) и опаковъчни материали. Критичните реагенти и материали трябва да отговарят на документираните изисквания и спецификации, а когато това е приложимо, на изискванията на Директива 93/42/ЕИО на Съвета от 14 юни 1993 г. относно медицинските уреди ( 5 ) и Директива 98/79/ЕО на Европейския парламент и на Съвета от 27 октомври 1998 г. относно диагностичните медицински изделия in vitro ( 6 ).
Г. СЪОРЪЖЕНИЯ/ПОМЕЩЕНИЯ
1. Заведенията за работа с тъкани трябва да разполагат с подобаващи съоръжения за извършване на дейностите, за които искат акредитиране/определяне/оторизиране или лицензиране, в съответствие със стандартите, определени в настоящата директива.
2. Когато тези дейности включват обработване на тъкани и клетки при излагането им на въздействието на околната среда, това трябва да се извършва в среда с определено качество и чистота на въздуха с цел свеждане до минимум на риска от заразяване, в това число предаване на зараза от една тъкан на друга. Ефективността на тези мерки подлежи на утвърждаване и постоянен контрол.
3. Освен ако не е специфицирано друго в точка 4, когато тъканите и клетките са изложени на въздействието на средата при процесите на обработка без последващ процес на микробиологично деактивиране, се изисква качество на въздуха с концентрация на частици и микробни колонии, еквивалентно на качеството на въздух от категория А, съгласно определението във валидния към момента Европейския кодекс на добрата производствена практика (ДПР), приложение 1 и Директива 2003/94/ЕО, с основна среда, подходяща за обработката на съответните тъкани/клетки, но най-малко с качество, еквивалентно на категория Г от ДПР, що се отнася до съдържанието на частици и микроби.
4. Не толкова строги изисквания към околната среда, определени в точка 3 са приемливи, където:
а) е приложена утвърдена система за микробна инактивация или утвърден процес на пълно стерилизиране;
б) е доказано, че излагане на среда от категория А оказва пагубно въздействие върху необходимите свойства на съответните тъкан или клетки;
в) е доказано, че начинът на прилагане на тъканта или клетката в реципиента предполага значително по-нисък риск от предаване на бактериална или гъбична инфекция отколкото при другият начин за присаждане на клетка или тъкан;
г) когато е технически невъзможно да се извърши необходимия процес в условията на среда от Категория А (например, поради изискване за специфично оборудване на мястото на обработка, което не е напълно съвместимо със среда от категория А).
5. В случаите на точка 4, букви а), б), в) и г) се извършва точно описание на необходимата среда. Лечебното заведение трябва да разполага с доказателства и документи, че избраната среда е подходяща за постигане на изискванията за качество и безопасност, предвид планираното предназначение, начин на присаждане и имунния статус на реципиента. За всеки отдел на заведението за работа с тъкани, занимаващ се с тези дейности, се осигуряват подходящи облекла и оборудване с цел лична безопасност и хигиена, заедно с писмени правила за хигиена и носене на облеклото.
6. Когато дейностите, изискващи акредитиране/определяне/оторизиране или лицензиране, са свързани със съхранение на тъкани и клетки е необходимо точно определяне на условия за съхранение, посредством които да се поддържа състоянието на тъканите и клетките, например температура, влажност или качество на въздуха.
7. Параметрите от критично значение (напр. температура, влажност, качество на въздуха) подлежат на строг контрол, мониторинг и вписване в регистрите, с цел доказване на съответствие и изпълнение на определените условия за съхранение.
8. Трябва да бъдат осигурени съоръжения за съхранение, които ясно разделят и разграничават тъкани и клетки, които трябва да бъдат предоставени за употреба, от тези, които са под карантина от тези, които вече са подготвени за употреба, както и от тези, които са били изтеглени от употреба, чрез което да се гарантира предотвратяване на подмяна или пренасяне на зарази между тъканите. За складирането на определени тъкани и клетки, взети в съответствие със специални критерии, са необходими отделени помещения или уреди за съхранение или сигурно разделение в рамките на уреда за съхранение, както в отделението за тъкани под карантина, така и в мястото, където се съхраняват вече одобрените за употреба тъкани.
9. Заведенията за работа с тъкани са длъжни да имат писмени инструкции и процедури за контролиран достъп, почистване и поддръжка, изхвърляне на отпадъци и за повторно предоставяне на услуги при спешни ситуации.
Д. ДОКУМЕНТАЦИЯ И РЕГИСТРИ
1. Заведенията за работа с тъкани трябва да разполагат със система, посредством която да поддържат ясно определена и точна документация, правилни записи и регистри, както и утвърдени Стандартни оперативни процедури (СОП) по отношение на дейностите, изискващи акредитиране/определяне/оторизиране или лицензиране. Документацията подлежи на редовни инспекции и трябва да отговаря на стандартите, определени в настоящата директива. Системата трябва да гарантира, че извършваната дейност е стандартизирана и да дава възможност за проследяване на всички етапи: т.е., кодиране, критерии за подбор на донори, доставяне, преработване, съхраняване, съхранение, транспортиране, разпределяне или изваждане от употреба на тъкани/клетки, в това число аспекти, свързани с контрола на качеството и неговото гарантиране.
2. Материалите, оборудването и персоналът за всяка критична дейност трябва да бъдат идентифицирани и документирани.
3. Всички промени в документацията на заведенията за работа с тъкани трябва да бъдат надлежно преглеждани, датирани, одобрени, документирани и въведени в изпълнение от оторизиран персонал.
4. Трябва да се въведе процедура за контрол на документацията, която осигурява прегледи на историята на документите и промените по тях, и която да гарантира, че се използват само актуализирани документи.
5. Записаните данни трябва да са доказано надеждни и правилно да представят резултатите.
6. Записаната информация трябва да бъде четлива и да не подлежи на изтриване. Данните могат да се вписват на ръка или да се пренесат на друга валидирана система, например компютър или микрофилм.
7. Без да се засяга член 9, параграф 2, се съхраняват всички данни, в това число първоначални данни, които са критични за безопасността и качеството на тъканите и клетките, по начин, който позволява достъп до тях за минимум от 10 години след срока на годност, клинично използване или извеждане от употреба на тъканите/клетките.
8. Регистрите следва да отговарят на изискванията за конфиденциалност, определени в член 14 от Директива 2004/23/ЕО. Достъпът до регистрите и данните се ограничава до лица, оторизирани от отговорното лице и до компетентния орган по смисъла на инспекцията и мерките за контрол.
Е. КОНТРОЛ НА КАЧЕСТВОТО
1. Заведенията за работа с тъкани въвеждат система за инспекция на дейностите, изискващи акредитиране/определяне/оторизиране/лицензиране. Инспекцията е независима и се извършва от добре обучени и компетентни лица поне веднъж на всеки две години, като целта е потвърждение, че всички одобрени процедури и регулаторни изисквания се спазват. Всички заключения и корективни действия от инспекцията трябва да бъдат документирани.
2. Отклоненията от установените стандарти за качество и безопасност трябва да водят до документирано разследване, което включва решение за възможни коригиращи и превантивни действия. Как да се процедира с тъкани и клетки, които не отговарят на изискванията се решава в съответствие с писмени процедури, които се контролират от отговорното лице и се вписват в регистрите. Всички засегнати тъкани и клетки трябва да бъдат идентифицирани и отчетени.
3. Коригиращите действия трябва да се документират, започват и приключват навременно и ефективно. Ефективността на превантивните и коригиращи действия следва да бъде оценена след тяхното изпълнение.
4. Заведенията за работа с тъкани следва да разполагат с действащи процедури, посредством които да извършват прегледи на ефективността на системата за управление на качеството, като по този начин гарантират непрекъснато и систематично подобряване на работата си.
ПРИЛОЖЕНИЕ II
Изисквания за утвърждаване на процесите по подготовка на тъкани и клетки в заведенията за работа с тъкани, както е посочено в член 4
Компетентният орган утвърждава всяка процедура по подготовка на тъкани и клетки след като извърши оценка на критериите за подбор на донори и процедурите по осигуряване на тъкани и клетки, протоколите за всяка стъпка от процеса, критериите за управление на качеството и крайните количествени и качествени критерии за клетки и тъкани. Оценката трябва да отговаря най-малко на изискванията, определени в настоящото приложение.
А. ПРИЕМАНЕ В ЗАВЕДЕНИЕТО ЗА РАБОТА С ТЪКАНИ
При приемане на експлантирани тъкани и клетки в заведенията за работа с тъкани, същите трябва да отговарят на изискванията, определени в Директива 2006/17/ЕО.
Б. ПРЕРАБОТВАНЕ
Когато дейностите, за които е необходимо акредитиране/определяне/оторизиране/лицензиране включват обработване на тъкани и клетки, процедурите на заведението за работа с тъкани трябва да отговарят на следните критерии:
1. Процедурите по критичните етапи от преработването на тъкани и клетки трябва да бъдат утвърдени и трябва да са в състояние да предотвратят присаждане на клинично неефективни или вредни тъкани и клетки на реципиента. Подобно утвърждаване може да се базира на проучвания, извършвани от самото лечебно заведение или на данни от публикувани изследвания, а когато става въпрос за добре отработени процедури, чрез ретроспективна оценка на клиничните резултати от присаждане на тъкани, които са доставени от лечебното заведение.
2. Необходимо е да се демонстрира, че персоналът на заведението за работа с тъкани е в състояние да осъществява утвърдения процес постоянно и ефективно.
3. Процедурите трябва да бъдат отразени в СОП, които следва да отговарят на утвърдения метод и на стандартите, изложени в настоящата директива съгласно приложение I Е, точки 1-4.
4. Необходимо е да се гарантира че управлението на всички процеси е в съответствие с утвърдените СОП.
5. Когато е приложена процедура за микробиологично инактивиране на тъкани или клетки, тя трябва да се опише, документира и утвърди.
6. Преди въвеждане на значителна промяна в преработването, промененият процес трябва да се утвърди и документира.
7. Процедурите по преработване подлежат на редовна критична оценка, чрез която да се гарантира, че те продължават ефективно да постигат търсените резултати.
8. Процедурите по изваждане от употреба на тъкани и клетки трябва да предотвратят заразяване на други дарени тъкани и продукти, средата на тяхната преработка или персонала. Тези процедури следва да са в съответствие с националните регламенти.
В. СЪХРАНЕНИЕ И ОСВОБОЖДАВАНЕ НА ПРОДУКТИ
Когато дейностите, за които е необходимо акредитиране/определяне/оторизиране/лицензиране включват съхранение и освобождаване на тъкани и клетки за употреба, утвърдените процедури на заведението за работа с тъкани трябва да отговарят на следните критерии:
1. За всеки тип условие на съхранение трябва да се определи максимално време за съхранение. Избраният период трябва да отразява, освен всичко друго, възможното влошаване на необходимите свойства на тъканите и клетките.
2. Трябва да има система за инвентаризация на наличните тъкани и/или клетки, чрез която да се гарантира, че същите няма да бъдат освобождавани за употреба докато не бъдат удовлетворени всички изисквания, изложени в настоящата директива. Трябва да има стандартна оперативна процедура, която подробно описва обстоятелствата, отговорностите и процедурите по освобождаване на тъканите и клетките и предоставянето им за присаждане.
3. Система за идентифициране на тъканите и клетките през всеки етап от тяхната обработка в заведението за работа с тъкани трябва да осигурява ясно разграничение между продукти, одобрени за употреба и такива, които не са одобрени (под карантина) и продукти изтеглени от употреба.
4. Отразените данни трябва да доказват, че преди тъканите и клетките да бъдат освободени за употреба, те отговарят на всички необходими спецификации, и по-специално, че всички приложими декларативни формуляри, медицинските данни и резултати от изпитвания са утвърдени съгласно писмена процедура от лице, оторизирано за тази цел от отговорното лице, както е определено в член 17 от Директива 2004/23/ЕО. Ако се използва компютърна система за подаване на данните от лабораторните изследвания, трябва да е налице процедура, която определя кой е отговорен за подаването на тези данни.
5. Предприема се документирана оценка на риска, утвърдена от отговорното лице, съгласно определенията на член 17 от Директива 2004/23/ЕО, за да се вземе решение как да се процедира с вече налични тъкани и клетки след въвеждане на нови критерии за подбор на донори и изпитвания или значително променени етапи на обработка, подобряващи безопасността или качеството.
Г. РАЗПРЕДЕЛЯНЕ И ИЗТЕГЛЯНЕ ОТ УПОТРЕБА
Когато дейностите, за които е необходимо акредитиране/определяне/оторизиране/лицензиране включват разпределяне на тъкани и клетки, утвърдените процедури на заведението за работа с тъкани трябва да отговарят на следните критерии:
1. Трябва да се определят критичните състояния при транспортиране, като температура и време за доставка, с цел запазване на необходимите свойства на тъканите и клетките.
2. Контейнерът/опаковката трябва да бъде надеждна и да гарантира съхранение на тъканите и клетките при определените условия. Всички контейнери и опаковки, трябва да бъдат утвърдени, че са подходящи за целта.
3. Когато доставката се извършва от трета страна контрагентът е необходимо да има подписано споразумение, което гарантира осигуряване на необходимите условия.
4. Заведението за работа с тъкани трябва да разполага с оторизиран персонал, който преценява необходимостта за изтегляне от употреба на наличните тъкани/клетки, инициира и координира необходимите действия.
5. Трябва да има ефективна процедура за изтегляне от употреба, като тази процедура включва описание на отговорностите и предприеманите действия. Това включва и нотифициране на компетентния орган.
6. Трябва да се предприемат действия в рамките на предварително определени срокове и трябва да включват проследяване на всички тъкани и клетки, а когато това е приложимо, да включват и обратно проследяване. Целта на разследването е да се идентифицира всеки донор, който може да е допринесъл за възникнала реакция в даден реципиент и да се изтеглят от употреба всички налични тъкани и клетки, получени от такъв донор, както и да се нотифицират съответните лечебни заведения и реципиенти на тъкани и клетки от същия донор, в случай, че са били изложени на риск.
7. Трябва да има действащи процедури за обработка на заявки за тъкани и клетки. Правилата за предоставяне на тъкани и клетки на определени пациенти или лечебни заведения трябва да бъдат документирани и предоставени на тези лица при поискване.
8. Трябва да има система за документиране на предприетите действия в случаи на връщане на доставени продукти, в това число изработени критерии за тяхното обратно приемане, ако е приложимо.
Д. КРАЙНО ЕТИКЕТИРАНЕ ЗА РАЗПРЕДЕЛЯНЕ
1. Етикета на първичният контейнер, съдържащ тъкан/клетки, трябва да осигури информация за:
а) вид тъкан и клетки, идентификационен номер или код на тъканта/клетките, а когато е приложимо, сериен или партиден номер;
б) идентификация на заведението за работа с тъкани;
в) срок на годност;
г) в случаите на автотрансплантация, това трябва да бъде посочено (само за автотрансплантация) и да се идентифицира донора/реципиента;
д) в случай насочено дарение — етикетът идентифицира реципиента за когото е предназначено;
е) когато е известно, че тъкани и клетки имат позитивни маркери за инфекциозна болест, те следва да бъдат маркирани с надпис БИОЛОГИЧЕСКА ОПАСНОСТ;
ж) Единния европейски код, приложим за тъкани и клетки, които са разпределени за употреба при човека, или идентификационните данни на даряването, приложими за тъканите и клетките, пуснати в обращение, различни от разпределените за употреба при човека.
Ако информацията от букви г), д) и ж) по-горе не може да бъде включена върху етикета на първичния контейнер, то тя се представя на отделен лист, придружаващ първичния контейнер. Листът следва да се пакетира заедно с първичния контейнер по начин, осигуряващ тяхната неразделност.
2. Следната информация следва да бъде предоставена върху етикета или чрез придружаващата документация:
а) описание (определение) и ако е необходимо, размери на продукта;
б) морфология и функционални данни, когато е необходимо;
в) дата на разпределяне на тъканта/клетките;
г) биологични изследвания, извършени на донора и резултатите от тях;
д) препоръки за съхранение;
е) инструкции за отваряне на контейнера, опаковката и всички необходими манипулации/възстановяване;
ж) срок на годност след отваряне/манипулация;
з) инструкции за докладване на сериозни нежелани реакции и/или събития съгласно членове 5 и 6;
е) наличие на потенциални вредни остатъци (напр. антибиотици, етиленов оксид и др.);
й) по отношение на внесените тъкани и клетки — държавата на доставянето и държавата износител (ако е различна от държавата на доставянето).
Е. ВЪНШНИ ЕТИКЕТИ НА ТРАНСПОРТНИЯ КОНТЕЙНЕР
При транспортиране, първичният контейнер се поставя в транспортен контейнер, чиито етикет трябва да съдържа следния минимум от информация:
а) наименование на заведението за работа с тъкани, което ги предоставя, адрес и телефонен номер;
б) наименование на организацията, която ще извърши присаждането, получател на пратката, адрес и телефонен номер;
в) информация, че контейнерът съдържа човешки тъкани/клетки и надпис: ДА СЕ ПРЕНАСЯ С ПОВИШЕНО ВНИМАНИЕ;
г) когато за физиологичната функция на графта са необходими живи клетки, например, стволови клетки, гамети и ембриони, следва да се добави надпис: „ДА НЕ СЕ ОБЛЪЧВА С ЙОНИЗИРАЩО ЛЪЧЕНИЕ“;
д) препоръки за условия по време на транспортиране (напр. да се държи на хладно място, в изправено положение и т.н.)
е) инструкции за безопасност/метод на охлаждане (когато е приложимо).
ПРИЛОЖЕНИЕ III
НОТИФИКАЦИИ НА СЕРИОЗНИ НЕЖЕЛАНИ РЕАКЦИИ
ЧАСТ А
Бързо нотифициране при съмнение за сериозни нежелани реакции
Лечебно заведение за работа с тъкани
Код на ЕС на лечебното заведение за работа с тъкани (ако е приложимо)
Идентификация на доклада
Дата на доклада (година/месец/ден)
Засегнато лице (реципиент или донор)
Дата и място на доставяне или употреба при човека (година/месец/ден)
Уникален идентификационен номер на дарението
Дата на предполагаемата сериозна нежелана реакция (година/месец/ден)
Вид на използваните тъкани и клетки, свързани със съмнението за сериозна нежелана реакция
Единен европейски код на тъканите или клетките, свързани със съмнението за сериозни нежелани реакции (ако е приложимо)
Вид на предполагаемата(ите) сериозна(и) нежелана(и) реакция(и)
ЧАСТ Б
Заключения от разследване на сериозни нежелани реакции
Лечебно заведение за работа с тъкани
Код на ЕС на лечебното заведение за работа с тъкани (ако е приложимо)
Идентификация на доклада
Дата на потвърждение (година/месец/ден)
Дата на сериозна нежелана реакция (година/месец/ден)
Уникален идентификационен номер на дарението
Потвърждение на сериозна нежелана реакция (да/не)
Единен европейски код на тъканите или клетките, свързани с потвърдените сериозни нежелани реакции (ако е приложимо)
Промяна на вида на сериозната нежелана реакция (да/не). Ако отговорът е „да“, посочете
Клиничен резултат (ако е известен)
— Пълно възстановяване
— Незначителни последствия
— Сериозни последствия
— Смърт
Резултат от разследването и окончателни заключения
Препоръки за превантивни и коригиращи действия
ПРИЛОЖЕНИЕ IV
НОТИФИКАЦИЯ НА СЕРИОЗНИ НЕЖЕЛАНИ СЪБИТИЯ
ЧАСТ А
Бързо нотифициране при съмнение за сериозни нежелани събития
|
Лечебно заведение за работа с тъкани |
||||
|
Код на ЕС на лечебното заведение за работа с тъкани (ако е приложимо) |
||||
|
Идентификация на доклада |
||||
|
Дата на доклада (година/месец/ден) |
||||
|
Дата на сериозен нежелан инцидент (година/месец/ден) |
||||
|
Сериозно нежелано събитие, което би могло да окаже влияние върху качеството и безопасността на тъканите и клетките поради отклонения във: |
Описание |
|||
|
дефектни тъкани и клетки |
повреда в оборудването |
човешка грешка |
други (опишете) |
|
|
Доставяне |
||||
|
Контрол |
||||
|
Транспортиране |
||||
|
Преработване |
||||
|
Съхранение |
||||
|
Разпределяне |
||||
|
Материали |
||||
|
Друго (посочете) |
||||
ЧАСТ Б
Заключения от разследването за сериозни нежелани събития
Лечебно заведение за работа с тъкани
Код на ЕС на лечебното заведение за работа с тъкани (ако е приложимо)
Идентификация на доклада
Дата на потвърждение (година/месец/ден)
Дата на сериозен нежелан инцидент (година/месец/ден)
Анализ на причините (подробности)
Предприети коригиращи мерки (подробности)
ПРИЛОЖЕНИЕ V
ФОРМАТ НА ГОДИШНАТА НОТИФИКАЦИЯ
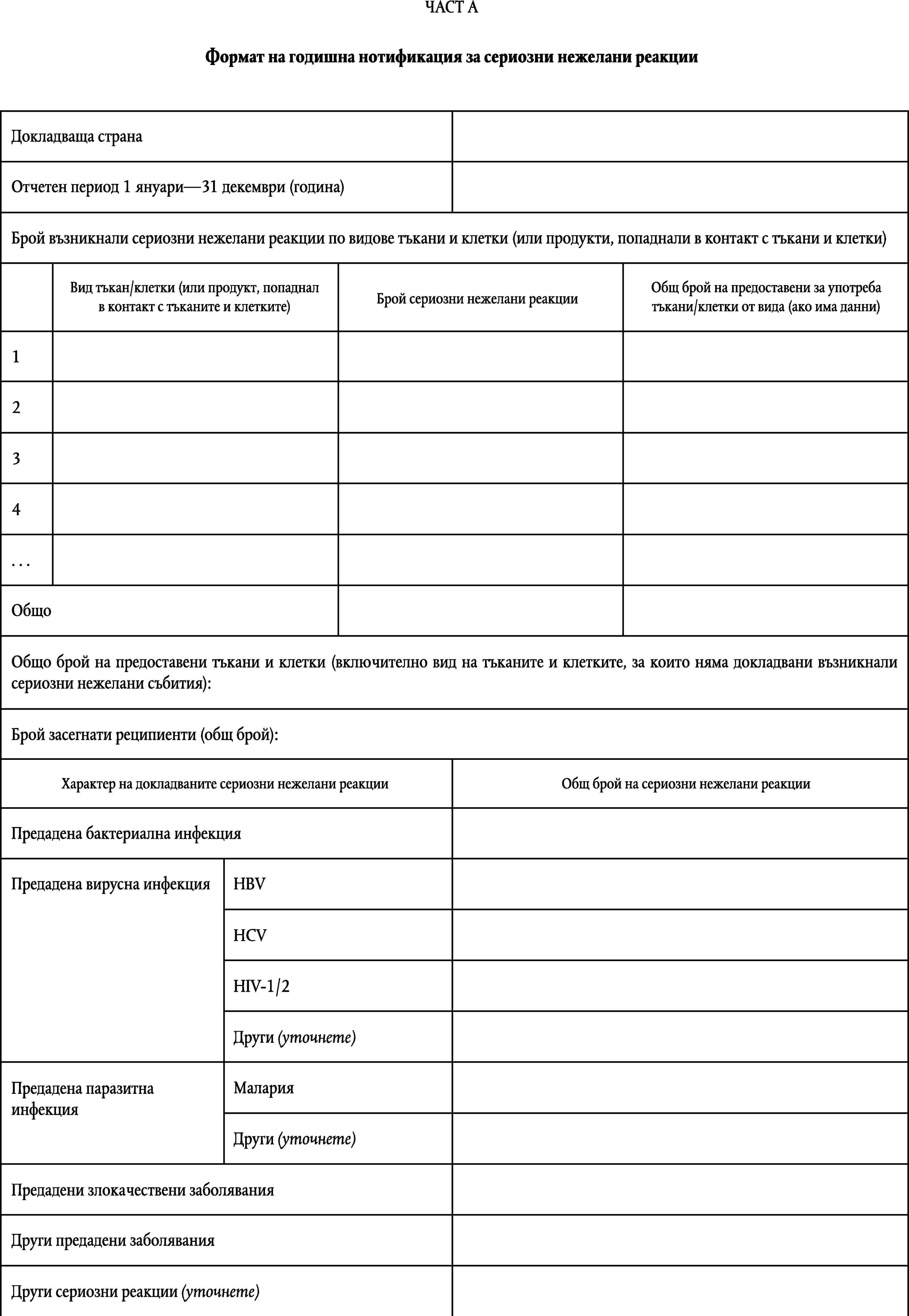
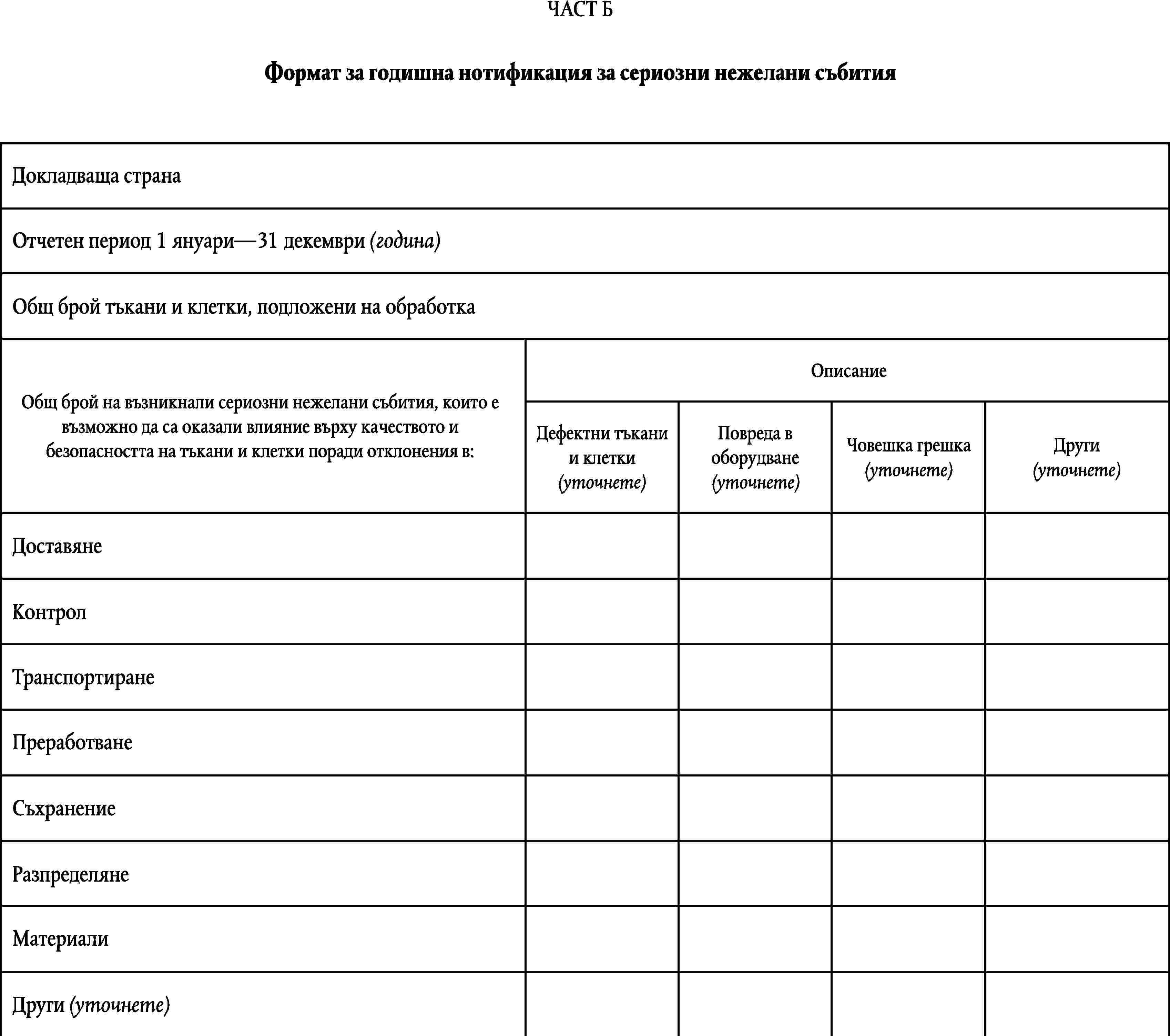
ПРИЛОЖЕНИЕ VI
Информация за минимума от данни, които се съхраняват в съответствие с член 9, параграф 2
А. ОТ ЛЕЧЕБНИ ЗАВЕДЕНИЯ ЗА РАБОТА С ТЪКАНИ
(1) Идентификационни данни на донора
(2) Идентификационните данни на даряването включват най-малко:
— идентификационни данни на организацията за доставяне (включително информация за контакт) или лечебното заведение за работа с тъкани
— уникален идентификационен номер на даряването
— дата на доставянето
— място на доставянето
— вид донорство (напр. единично или мултитъканно; автоложно или алогенно; жив или мъртъв донор)
(3) Идентификационните данни на продукта включват най-малко:
— идентификационни данни на лечебното заведение за работа с тъкани
— вид тъкан и клетки/продукт (основна номенклатура)
— групов номер (ако има обединяване)
— единичен номер (ако е приложимо)
— срок на годност (ако е приложимо)
— състояние на тъканта/клетките (напр. под карантина, подходяща/и за употреба и т.н.)
— описание и произход на продуктите, приложени стъпки на преработване, материали и добавки, влезли в съприкосновение с тъканите и клетките и които оказват влияние върху тяхното качество и/или безопасност
— идентификационни данни за организацията, издала крайните етикети
(4) Единен европейски код (ако е приложимо)
(5) Идентификационните данни за употребата при човека включват най-малко:
— дата на разпределяне/унищожаване
— идентификационни данни на лекаря или крайния потребител/организация
Б. ОТ ОРГАНИЗАЦИИ, ОТГОВОРНИ ЗА УПОТРЕБАТА ПРИ ЧОВЕКА
(1) Идентификационни данни на лечебното заведение за работа с тъкани, извършило доставката
(2) Идентификационни данни на лекаря или крайния потребител/организация
(3) Вид тъкани и клетки
(4) Идентификационни данни на продукта
(5) Идентификационни данни на реципиента
(6) Дата на прилагане
(7) Единен европейски код (ако е приложимо)
ПРИЛОЖЕНИЕ VII
СТРУКТУРА НА ЕДИННИЯ ЕВРОПЕЙСКИ КОД
|
ИДЕНТИФИКАЦИОННИ ДАННИ НА ДАРЯВАНЕТО |
ИДЕНТИФИКАЦИОННИ ДАННИ НА ПРОДУКТА ПОСЛЕДОВАТЕЛНОСТ |
|||||
|
КОД НА ЕС НА ЛЕЧЕБНОТО ЗАВЕДЕНИЕ ЗА РАБОТА С ТЪКАНИ |
УНИКАЛЕН НОМЕР НА ДАРЕНИЕТО |
КОД НА ПРОДУКТА |
ЕДИНИЧЕН НОМЕР |
СРОК НА ГОДНОСТ (ГГГГММДД) |
||
|
Код по ISO на страната |
Номер на лечебното заведение за работа с тъкани |
Идентификатор на системата за кодиране на продукта |
Номер на продукта |
|||
|
2 букви |
6 буквено-цифрови символа |
13 буквено-цифрови символа |
1 буква |
7 буквено-цифрови символа |
3 буквено-цифрови символа |
8 цифри |
ПРИЛОЖЕНИЕ VIII
Данни, които се записват в указателя на ЕС на лечебните заведения за работа с тъкани
A. Информация за лечебното заведение за работа с тъкани
1. Наименование на лечебното заведение за работа с тъкани
2. Национален или международен код на лечебното заведение за работа с тъкани
3. Наименование на организацията, в която се намира лечебното заведение за работа с тъкани (ако е приложимо)
4. Адрес на лечебното заведение за работа с тъкани
5. Данни за контакт на издателя, които може да се публикуват: функционална ел. поща, телефон и факс
Б. Данни за упълномощаването, акредитирането, определянето или издаването на разрешение на лечебното заведение за работа с тъкани
1. Наименование на упълномощаващия, акредитиращия, определящия или издаващия разрешение компетентен орган или органи
2. Наименование на националния компетентен орган или органи, отговорни за воденето на указателя на ЕС на лечебните заведения за работа с тъкани
3. Наименование на титуляря на пълномощното, акредитирането, определянето или на издаденото разрешение (ако е приложимо)
4. Тъканите и клетките, за които е предоставено упълномощаването, акредитирането, определянето или разрешението
5. Действително извършените дейности, за които е предоставено упълномощаването, акредитирането, определянето или разрешението
6. Статут на разрешението, акредитирането, определянето или издаването на разрешението (разрешено, преустановено, оттеглено отчасти или изцяло, доброволно прекратяване на дейностите)
7. Данни за евентуални условия и изключения, добавени към упълномощаването (ако е приложимо).
( 1 ) ОВ L 102, 7.4.2004 г., стр. 48.
( 2 ) http://pharmacos.eudra.org/F2/eudralex/vol-4/home.htm и ОВ L 262, 14.10.2003 г., стр. 22.
( 3 ) ОВ L 38, 9.2.2006 г., стр. 40.
( 4 ) Директива (ЕС) 2015/566 на Комисията от 8 април 2015 г. за прилагане на Директива 2004/23/ЕО по отношение на процедурите за контрол на спазването на еквивалентните стандарти за качество и безопасност на внасяните тъкани и клетки (ОВ L 93, 9.4.2015 г., стp. 56).
( 5 ) ОВ L 169, 12.7.1993 г., стр. 1. Директива, последно изменена с Регламент (ЕО) № 1882/2003 на Европейския парламент и на Съвета (ОВ L 284, 31.10.2003 г., стр. 1).
( 6 ) ОВ L 331, 7.12.1998 г., стр. 1. Директива, последно изменена от Регламент (ЕО) № 1882/2003.


