EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 32006L0056
Commission Directive 2006/56/EC of 12 June 2006 amending the Annexes to Council Directive 93/85/EEC on the control of potato ring rot
Директива 2006/56/EО на Комисията от 12 юни 2006 година за изменение на приложенията към Директива 93/85/ЕИО на Съвета относно борбата с пръстеновидното гниене по картофите
Директива 2006/56/EО на Комисията от 12 юни 2006 година за изменение на приложенията към Директива 93/85/ЕИО на Съвета относно борбата с пръстеновидното гниене по картофите
OJ L 182, 4.7.2006, p. 1–43
(ES, CS, DA, DE, ET, EL, EN, FR, IT, LV, LT, HU, NL, PL, PT, SK, SL, FI, SV)
OJ L 314M, 1.12.2007, p. 63–105
(MT)
Special edition in Bulgarian: Chapter 03 Volume 073 P. 174 - 216
Special edition in Romanian: Chapter 03 Volume 073 P. 174 - 216
Special edition in Croatian: Chapter 03 Volume 064 P. 115 - 157
 No longer in force, Date of end of validity: 31/12/2021; заключение отменено от 32016R2031
No longer in force, Date of end of validity: 31/12/2021; заключение отменено от 32016R2031
|
03/ 73 |
BG |
Официален вестник на Европейския съюз |
174 |
32006L0056
|
L 182/1 |
ОФИЦИАЛЕН ВЕСТНИК НА ЕВРОПЕЙСКИЯ СЪЮЗ |
ДИРЕКТИВА 2006/56/EО НА КОМИСИЯТА
от 12 юни 2006 година
за изменение на приложенията към Директива 93/85/ЕИО на Съвета относно борбата с пръстеновидното гниене по картофите
КОМИСИЯТА НА ЕВРОПЕЙСКИТЕ ОБЩНОСТИ,
като взе предвид Договора за създаване на Европейската общност,
като взе предвид Директива 93/85/ЕИО на Съвета от 4 октомври 1993 г. (1) относно борбата с пръстеновидното гниене по картофите, и по-специално член 12 от нея,
като има предвид, че:
|
(1) |
Един от важните организми, вредни за картофите, е Clavibacter michiganensis (Smith) Davis et al. ssp. sepedonicus (Spieckermann et Kotthoff) Davis et al. — патогенният причинител на болестта пръстеновидно гниене по картофите (наричан по-нататък „организмът“). |
|
(2) |
Организмът все още се среща в някои части на Общността. |
|
(3) |
Директива 93/85/ЕИО на Съвета установява подробните мерки, които трябва да се вземат в държавите-членки срещу организма, с цел да се локализира и спре разпространението му; да се предотврати появата и разпространяването му; а ако се открие, да се предотврати разпространението му и да се води борба с него с цел унищожаване. |
|
(4) |
Оттогава насам има значително развитие в разбирането за биологията, процедурите за откриване и определяне на организма, още повече практическият опит, натрупан в борбата с организма, предполага преглед на някои технически разпоредби, свързани с мерките за борба. |
|
(5) |
Като резултат от това развитие изглежда необходимо да се преразгледат и актуализират мерките, включени в приложенията към Директива 93/85/ЕИО. |
|
(6) |
Що се касае до процедурите за откриване и определяне, са включени и наскоро разработени процедури като флуоресцентна хибридизация на място (FISH) и полимеразна верижна реакция (PCR), също както и подобрения на различни технически елементи на актуалната процедура за откриване и определяне. |
|
(7) |
Що се касае до техническите елементи на контролните мерки, подобрени разпоредби са направени за: начина на съхранение на тествани проби с оглед да са гарантира проследяването на организма, елементите, необходими за да се определи степента на възможното заразяване, подробностите за нотифициране на всяка потвърдена поява на организма и на съответната заразена зона, мерките, които да са предприемат на местата за производство, обозначени като заразени и в демаркираните зони. |
|
(8) |
Мерките, предвидени в настоящата директива, са в съответствие със становището на Постоянния фитосанитарен комитет, |
ПРИЕ НАСТОЯЩАТА ДИРЕКТИВА:
Член 1
Приложенията към Директива 93/85/ЕИО се заменят със съответните текстове в приложението към настоящата директива.
Член 2
1. Държавите-членки приемат и публикуват не по-късно от 31 март 2007 г. законовите, подзаконовите и административните разпоредби, необходими, за да се съобразят с настоящата директива. Те незабавно съобщават на Комисията текста на тези разпоредби, както и таблица на съответствието между разпоредбите и настоящата директива.
Те прилагат тези разпоредби от 1 април 2007 г.
Когато държавите-членки приемат тези разпоредби, в тях се съдържа позоваване на настоящата директива или то се извършва при официалното им публикуване. Условията и редът на позоваване се определят от държавите-членки.
2. Държавите-членки съобщават незабавно на Комисията текста на основните разпоредби от националното законодателство, които те приемат в областта, уредена с настоящата директива.
Член 3
Настоящата директива влиза в сила на третия ден след публикуването ѝ в Официален вестник на Европейския съюз.
Член 4
Адресати на настоящата директива са държавите-членки.
Съставено в Брюксел на 12 юни 2006 година.
За Комисията
Markos KYPRIANOU
Член на Комисията
(1) ОВ L 259, 18.10.1993 г., стр. 2.
ПРИЛОЖЕНИЕ I
ТЕСТОВА СХЕМА ЗА ДИАГНОСТИКА, ОТКРИВАНЕ И ОПРЕДЕЛЯНЕ НА БАКТЕРИЯТА НА ПРЪСТЕНОВИДНОТО ГНИЕНЕ ПО КАРТОФИТЕ CLAVIBACTER MICHIGANENSIS (Smith) Davis et al. ssp. SEPEDONICUS (Spieckermann Et Kotthoff) Davis et al.
ОБХВАТ НА ТЕСТОВАТА СХЕМА
Настоящата схема описва различните процедури, включени във:
|
i) |
диагностика на пръстеновидното гниене в картофени клубени и растения; |
|
ii) |
откриване на Clavibacter michiganensis ssp. sepedonicus в проби от картофени клубени и растения; |
|
iii) |
определяне на Clavibacter michiganensis ssp. sepedonicus (C. m. subsp. sepedonicus). |
ОБЩИ ПРИНЦИПИ
Оптимизирани протоколи за различните методи, валидирани реактиви и подробности за приготвянето на тестовите и контролни материали са изложени в допълненията. Списък с лаборатории, които са били включени в оптимизирането и валидирането на протоколи, е изложен в допълнение 1.
Тъй като протоколите включват откриване на карантинен организъм и ще включват използване на живи култури от C. m. subsp. sepedonicus като контролни материали, ще бъде необходимо да се изпълняват процедурите при подходящи карантинни условия с адекватни съоръжения за унищожаване на отпадъците и при условията за подходящи разрешителни, издадени от официалните власти по растителна карантина.
Тестовите параметри трябва да осигурят последователно и възпроизводимо откриване на нива от C. m. subsp. sepedonicus в набора от прагове на избрани методи.
Прецизната подготовка на положителни контроли е задължителна.
Тестването съгласно необходимите прагове също предполага правилни настройки, поддръжка и калибриране на оборудването, внимателно боравене и предпазване от реактивите и всички мерки за предотвратяване на заразяване между пробите, например разделяне на положителните контроли от тестовите проби. Стандартите за контрол на качеството трябва да се прилагат за да се избегнат административни и други грешки, особено що се отнася до етикетирането и документацията.
Предполагано наличие, описано в член 4, параграф 2 от Директива 93/85/ЕИО, предполага положителен резултат на диагностичните или скринингови тестове, извършени на една проба както е описано в диаграмите.
Ако първият скринингов тест (имунофлуоресцентен (IF) или PCR/FISH) е положитетелен, тогава се предполага заразяване с Cms и трябва да се направи втори скринингов тест. Ако вторият скринингов тест е положителен, тогава предположението е потвърдено (предполагано наличие) и тестването трябва да продължи по схемата. Ако вторият скринингов тест е отрицателен, тогава пробата се счита за незаразена с Cms.
Следователно положителният имунофлуоресцентен тест, упоменат в член 4, параграф 2, се определя от положителен имунофлуоресцентен (IF) резултат, потвърден от втори скринингов тест (PCR/FISH).
Потвърдено наличие, упоменато в член 5, параграф 1 от Директива 93/85/ЕИО, предполага изолиране и определяне на чиста култура от C. m. subsp. sepedonicus с потвърждение за патогенност
1. ПРЕДСТАВЯНЕ НА ДИАГРАМАТА ЗА ПОСЛЕДОВАТЕЛНОСТ
1.1. Схема за откриване за диагностика на пръстеновидно гниене в картофени клубени и растения със симптоми на пръстеновидно гниене
Тестовата процедура е предназначена за картофени клубени и растения със симптоми типични или подозирани за пръстеновидно гниене. Тя включва бърз скрининг тест, изолиране на патогена от проводящата тъкан върху диагностична среда и, в случай на положителен резултат, определяне на културата като C. m. subsp. sepedonicus.

1.2. Схема за откриване и определяне на Clavibacter michiganensis ssp. sepedonicus в проби от асимптоматични картофени клубени
Принцип
Тестовата процедура е предназначена за откриване на латентна инфекция на картофени клубени. Положителен резултат от поне два скринингови теста, базирани на различни биологични принципи, трябва да бъде допълнен от изолиране на патогена; mоследвана от, в случай на изолиране на типични колонии, потвърждаване на чиста култура от C. m. subsp. sepedonicus. Положителният резултат от само един от скрининговите тестове не е достатъчен, за да се предполага пробата за евентуална зараза.
Скрининговите тестове и изолационните тестове трябва да позволят праг за откриване от 103 до 104 клетки/ml ресуспендирана утайка, включени като положителни контроли във всяка серия от тестове.


1.3. Схема за откриване и определяне на Clavibacter michiganensis ssp. sepedonicus в проби от асимптоматични картофени растения


2. ВИЗУАЛЕН ПРЕГЛЕД ЗА СИМПТОМИ НА ПРЪСТЕНОВИДНО ГНИЕНЕ
2.1. Картофени растения
При европейските климатични условия симптомите рядко се откриват на полето и често само в края на сезона. Още повече симптомите са често маскирани или повлияниот/объркани с/ други болести, остаряване или други механични повреди. Следователно може лесно да се пропуснат симптомите при инспекции на полето. Симтпомите на спаружването са много различни от тези при кафявото гниене, спаружването обикновено е бавно и първоначално е ограничено до периферията на листата. Младите заразени листа често продължават да нарастват макар и по-бавно в заразените зони. Това създава листа със странни форми. Листата, засегнати от блокирането на проводящите тъкани по-надолу по стъблото, често развиват хлоротични, жълти до оранжеви интеркостални зони. Заразените листчета, листа и дори стъбла могат най-накря да загинат. Често листата и клубените са просто с намален размер. Рядко растенията са недоразвити. Цветни снимки на обхвата от симптоми могат да бъдат намерени на интернет страницата http://forum.europa.eu.int/Public/irc/sanco/Home/main
2.2. Картофени клубени
Най-ранните симптоми са лека стъкловидност или полупрозрачност на тъканта без омекване около проводящата система, особено близо до столона. Проводящият пръстен на столоните може да е малко по-тъмен на цвят от обикновено. Първият лесно определим симптом е този, при който проводящият пръстен има жълтеникаво оцветяване и когато клубенът е изтискан нежно, струйки от подобна на сирене материя излизат от съдовете. Този ексудат съдържа милиони бактерии. Покафеняването на проводящата тъкан може да се развие и симптомите на клубените на този етап са подобни на тези на кафявото гниене, причинявано от Ralstonia solanacearum. Първоначално тези симптоми може да са ограничени до една част от пръстена, не задължително близо до столоните и могат постепенно да се разпрострат по целият пръстен. С напредването на инфекцията става разрушаване на проводящата тъкан; външната кора може да се отдели от вътрешната. При напредналите стадии на инфекция се появяват пукнатини по повърхността на клубена, често те са червеникаво-кафяви по краищата. В последно време в Европа се появиха няколко случая, при които централната кора гние в същото време като проводящият пръстен, причиняващо вторична инвазия с вътрешно изкуфяване и некроза. Вторичната гъбна или бактериална инвазия може да маскира симптомите и да може да е трудно, и дори невъзможно да се различат симптомите на напреднало пръстеновидно гниене от друго гниене на клубените. Възможни са атипични симптоми. Цветни снимки на обхвата от симптоми могат да бъдат намерени на интернет страницата http://forum.europa.eu.int/Public/irc/sanco/Home/main
3. ПРИГОТВЯНЕ НА ПРОБАТА
3.1. Картофени клубени
Бележка:
|
— |
Стандартният размер на пробата е 200 клубена на тест. По-интензивно пробовземане изисква повече тестове на проби с този размер. По-големият брой клубени в пробата ще доведе до потискане или трудно разбиране на резултатите. Въпреки това процедурата може за удобство да бъде приложена за проби с по-малко от 200 клубена, когато са налични по-малко клубени. |
|
— |
Валидирането на всички методи за откриване, описани по-долу, е базирано на тестването на проби от по 200 клубена. |
|
— |
Картофеният извлек, описан по-долу, може също да бъде използван за откриване на бактерията на кафявото гниене по картофите — Ralstonia solanacearum. |
Незадължителна предварителна обработка преди приготвянето на пробата:
Измийте клубените. Използвайте подходящ дезинфектант (хлорна съставка, когато ще се използва PCR-тест, с оглед да се премахне ДНК на евентуален патоген и прахове за пране между всяка проба. Изсушете с въздух клубените. Тази процедура за измиване е особено полезна (но не е задължителна) за проби с много почва и ако ще се прави PCR-тест или директно изолиране.
3.1.1. Премахнете с чист и дезинфектиран скалпел или нож за зеленчуци кожата при столоните от всеки клубен, така че проводящата тъкан да стане видима. Внимателно изрежете малко сърцевина от проводящата тъкан при столоните и поддържайте количеството непроводяща тъкан минимално (виж интернет страницата: http://forum.europa.eu.int/Public/irc/sanco/Home/main)
Бележка:
Отделете настрани всички клубени с предполагаеми симптоми на пръстеновидно гниене и ги тествайте отделно.
Ако по време на премахването на столоните се наблюдават симптоми на пръстеновидно гниене по сърцевината на столоните, клубенът трябва да се прегледа визуално след разрез близо до столона. Всеки клубен с предполагаеми симтоми трябва да бъде суберизиран при стайна температура за два дни и съхранен под карантина (при температура от 4 до 10 °C), докато не завършат всички изпитвания. Всички клубени в пробата (включително тези с предполагаеми симтоми) трябва да се съхраняват съгласно приложение II.
3.1.2. Събирайте сърцевината на столоните в неупотребявани контейнери, които могат да се изхвърлят и които могат да бъдат затворени и/или запечатани (в случай че контейнерите се използват повторно, те трябва да бъдат щателно почистени и дезинфекцирани като се използват хлорни съединения). Препоръчително е сърцевината на столоните да се обработи незабавно. Ако това не е възможно, ги съхранете в контейнер, без да добавяте буфер, замразени за не по-дълго от 72 часа или не по дълго от 24 часа при стайна температура. Изсушаването и суберизацията на сърцевините и развитието на сапрофити по време на съхранението могат да възпрепятстват откриването на бактерията на пръстеновидното гниене.
3.1.3. Обработете сърцевината на столоните по една от следните процедури:
|
а) |
покрийте сърцевините с достатъчно обем (приблизително 40 ml) екстракционен буфер (допълнение 3) и разклатете на ротационен шейкър (50—100 rpm) за четири часа при под 24 °C или от 16 до 24 часа замразени, или |
|
б) |
хомогенизирайте сърцевините с достатъчен обем (приблизително 40 ml) екстракционен буфер (допълнение 3) или в блендер (например Waring или Ultra Thurax), или чрез разбиване в запечатана торбичка за мацерация за еднократна употреба (например Stomacher или Вioreba здрав полиетилен, 150 mm × 250 mm; стерилизиран с облъчване), като използвате гумено чукче или подходящ апарат за счукване (например Homex). |
Бележка:
Рискът от кръстосана инфекция на проби е висок, когато се хомогенизират пробите с блендер. Вземете предпазни мерки, за да избегнете аерозолно пораждане или разпиляване по време на процеса на екстракция. Уверете се, че се използват прясно стерилизирани остриета на блендера и съдове за всяка проба. Ако ще се използва PCR тест, избягвайте остатъците от ДНК по контейнерите или апарата за смачкване. Разбиването в торбички за еднократна употреба и използването на туби за еднократна употреба се препоръчва, където ще се използва PCR.
3.1.4. Прелейте супернатантата. Ако е твърде мътна, я избистрете с центрофугиране на ниска скорост (при не повече от 180 g за 10 min при температура между 4 и 10 °C) или чрез вакуумна филтрация (40 до 100 µm), като измивате филтъра с допълнителен (10 ml) екстракционен буфер (допълнение 3).
3.1.5. Концентрирайте бактериалната фракция чрез центрофугиране при 7 000 g за 15 min (или 10 000 g за 10 min) при температура между 4 и 10 °C и изхвърлете супернатантата ,без да разклащате утайката.
3.1.6. Ресуспендирайте утайката в 1,5 ml буфер за утайка (допълнение 3). Използвайте 500 µl за тестване за C. m. subsp. sepedonicus, 500 µl за Ralstonia solanacearum и 500 µl за референтни цели. Добавете стерилен глицерол до крайна концентрация от 10 до 25 % (v/v) към 500-те µl референтна аликвота и към оставащата тест аликвота, разбийте и съхранете при – 16 до – 24 °C (седмици) или – 68 до – 86 °C (месеци). Пазете тест аликвотите при 4—10 °C по време на тестването.
Не е желателно повторно замразяване и топене.
Ако се налага транспортиране на екстракта, осигурете доставяне в хладилна кутия в рамките на 24—48 часа.
3.1.7. Задължително е всички положителни контроли и проби от C. m. subsp. sepedonicus да се третират отделно, за да се избегне заразяване. Това се отнася за слайдовете за имунофлуоресценция и за всички тестове.
3.2. Картофени растения
Бележка:
За откриване на латентни популации от C. m. subsp. sepedonicus е препоръчително да се тестват смесени проби. Процедурата може да бъде подходящо приложена за смесени проби до 200 части от стъбла. (Там където се извършват наблюдения, те трябва да се основават на статистически представителна проба от растителната популация под проучване.)
3.2.1. С чист дезинфекциран нож или лозарски ножици премахнете участък от 1 до 2 cm от основата на всяко стъбло, над нивото на почвата.
Дезинфекцирайте стъблените части за кратко в етанол 70 % и незабавно ги подсушете на филтърна хартия.
Съхранявайте ги в затворен стерилен контейнер съгласно следните процедури за обработване на пробата:
3.2.2. Обработете частите по една от следните процедури:
|
a) |
покрийте частите със достатъчен обем (приблизително 40 ml) екстракционен буфер (допълнение 3) и разклатете в ротационна клатачка (50—100 rpm) за 4 часа под 24 °C или за 16—24 часа замразени, или |
|
б) |
обработете незабавно. Като ги разбиете в здрава торбичка за мацерация (например Stomacher or Bioreba) с подходящ обем екстракционен буфер (допълнение 3) като използвате гумено чукче или подходящ апарат за счукване (например Homex). Ако това не е възможно, съхранявайте частите от стъблата замразени за не по-дълго от 72 часа или за не по-дълго от 24 часа при стайна температура. |
3.2.3. Прелейте супернатантата след утаяване от 15 минути.
3.2.4. По-нататъшно избистряне на екстраката или концентрата на бактериалната фракция обикновено не се изискват, но могат да бъдат постигнати чрез филтрация и/или центрофугиране, както е описано в раздели 3.1.4—3.1.6.
3.2.5. Разделете чистия или концентриран екстракт от пробата на 2 равни части. Поддържайте едната половина при 4—10 °C по време на тестването и съхранявайте другата половина с 10—25 % (v/v) сктерилен глицерол при – 16 до – 24 °C (седмици) или при – 68 до – 86 °C (месеци), в случай че се налага по-нататъшно тестване.
4. ИМУНОФЛУОРЕСЦЕНТЕН ТЕСТ
Принцип
Използването на имунофлуоресцентен тест като основен скринигов тест се препоръчва поради доказаната му яснота да постига изискваните нива.
Когато се използва имунофлуоресцентен тест като основен скринигов тест и резултатите от имунофлуоресценцията са положителни, то PCR тест или FISH тест трябва да бъдат извършени като втори скринингов тест. Когато имунофлуоресцентен тест се използва като втори скринингов тест и резултатите от имунофлуоресценцията са положителни, за да се завършат анализите, се изисква по-нататъшно тестване съгласно диаграмата.
Бележка:
Винаги използвайте поликлонални антитела, когато се използва имунофлуоресцентен тест като основен скринигов тест. В случай на положигелни резултати от имунофлуоресценцията с поликлонални антитела по-нататъшен скрининг на пробата с моноклонални антитела може да предостави повече специфичност, но може да е по-слабо чуствителен.
Използвайте антителата за реферетен щам на C. m. subsp. sepedonicus. Препоръчително е титърът да се определя за всяка нова серия антитела. Титърът се определя като най-високото разреждане, при което настъпва оптимална реакция, когато при тестване на суспензия, съдържаща от 105 до 106 клетки/ml от хомоложен щам на C. m. subsp. sepedonicus, и като се използва флуоросцентен изоцианат (FITC), се свързват съгласно препоръките на производителя. Суровите поликлонални или моноклонални антитела трябва да имат титър от поне 1:2 000. По време на тестването антителата трябва да бъдат използвани при работни дози (WD) близки до или равни на титъра. Използвайте валидирани антитела. (виж интернет страницата http://forum.europa.eu.int/Public/irc/sanco/Home/main).
Тестът трябва да се провежда на прясно приготвени екстракти от пробата. Ако е необходимо, може да бъде успешно проведен на екстракти съхранявани при – 68 до – 86 °C в глицерол. Глицеролът може да бъде премахнат от пробата чрез добавяне на 1 ml утаечен буфер (допълнение 4), повторно центрофугиране за 15 мин при 7 000 g и ресуспензиране в еднакъв обем от утаечен буфер. Това често не е необходимо, особено ако пробите от слайдовете са фиксирани към слайдовете от опламеняването. (виж 2.2).
Изгответе отделни положителни контролни слайдове от хомоложния щам или друг референтен щам на C. m. subsp. sepedonicus, суспендирани в картофен извлек, както е описано в допълнение 2 и по избор в буфер.
Естествено заразената тъкан (поддържана чрез лиофилизация или замразяване при – 16 до – 24 °C) трябва да бъде използвана, където е възможно, като подобна контрола на същия слайд.
Като отрицателни контроли използвайте аликвоти от извлек от пробата, които са показали отрицателни проби при тестването преди това.
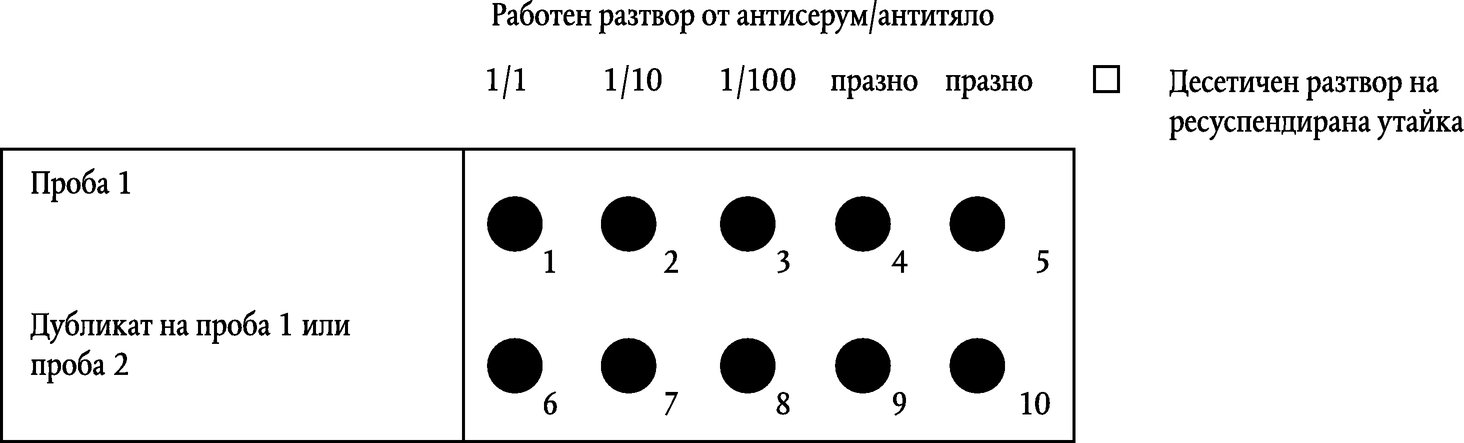
Използвайте предметни стъкла с много гнезда с препоръчително 10 прозорчета от поне 6 mm в диаметър.
Тествайте контролния материал по еднакъв начин, както пробата/ите.
4.1. Пригответе слайдовете за тестване по една от следните процедури:
|
i) |
За утайки с относително малко утайка от скорбяла: Пипетирайте един измерен стандартен обем (15 µl е подходящ за прозорче с диаметър 6 mm, увеличете обема за по-големи прозорчета) от разтвор 1/100 от ресуспендираната картофена утайка върху първото прозорче. След това пипетирайте подобен обем от неразтворената утайка (1/1) върху останалите прозорчета на редицата. Вторият ред може да се използва за дубликат или за втора проба, така както е представено на фигура 1. |
|
ii) |
За други утайки: Пригответе десетични разтвори (1/10 и 1/100) от ресуспендираната утайка в буфер за утайки. Пипетирайте един измерен стандартен обем (15 µl е подходящ за прозорче с диаметър 6 mm, увеличете обема за по-големи прозорчета) от ресуспендираната утайка и всеки разтвор на един ред от прозорчета. Вторият ред може да се използва за дубликат или за втора проба, така както е представено на фигура 2. |
4.2. Изсушете капчиците на стайна температура или чрез затопляне при температура от 40 до 45 °C. Фиксирайте бактериалните клетки на стъклото или чрез загряване (15 минути при 60 °C), опламеняване с 95 % етанол, или съгласно специфичните инструкции на доставчиците на антителата.
Ако е нееобходимо, фиксираните стъкла могат след това да бъдат съхранявани в изсушена кутия за известно време, колкото е необходимо (максимум до 3 месеца), преди по-нататъшно тестване.
4.3. Имунофлуоресцентна процедура:
|
i) |
Съгласно изготвянето на препарати за тестване в 4.1, i): Изгответе серия от двупластови разтвори на антитялото в имунофлуоресцентен буфер. Първата колба трябва да има 1/2 от титъра (T/2), останалите — 1/4 от титъра (T/4), 1/2 от титъра (T/2), титъра (T) и двойно на титъра (2T). |
|
ii) |
Съгласно изготвянето на препарати за тестване 4.1, ii): Изгответе работен разтвор (WD) на антитялото в имунофлуоресцентен буфер. Работният разтвор влияе на специфичността. 
|
4.3.1. Подредете препаратите върху влажна хартия. Покрийте всяко тестово прозорче напълно с разтвор на антитялото. Обемът на антитялото, нанасян върху всяко прозорче, трябва да е поне обемът на прилаганият извлек.
Следната процедура трябва да бъде извършвана при отсъствие на специфични инструкции от доставчиците на антитела:
4.3.2. Инкубирайте препаратите върху влажна хартия под похлупак за 30 минути на стайна температура (18-25 °C).
4.3.3. Изтръскайте капчиците от всеки препарат и изплакнете внимателно с имунофлуоресцентен буфер. Измийте чрез потапяне за 5 минути в имунофлуоресцентен буфер Tween (допълнение 3) и след това за 5 минути в имунофлуоресцентен буфер. Избягвайте получаване на аерозол или преминаване на капчици, които могат да причинят кръстосано заразяване. Внимателно премахнете излишната влага чрез нежно подсушаване.
4.3.4. Подредете препаратите на влажна хартия. Покрийте тестовите прозорчета с разтвор на FITC конюгат, използван, за да се определи титърът. Обемът на конюгата, нанасян върху прозорчетата, трябва да е идентичен с обема на нанасяното антитяло.
4.3.5. Инкубирайте препаратите на влажна хартия под похлупак за 30 минути на стайна температура (18-25 °C).
4.3.6. Изтръскайте капчиците от конюгат от препарата. Изплакнете и измийте, както преди (4.3.3).
Внимателно отстранете излишната влага.
4.3.7. Пипетирайте 5-10 µl от 0,1M буфериран с фосфат глицерол (допълнение 3) или търговски увеличител против избледняване върху всяко прозорче и поставете покривното стъкло.
4.4. Тълкуване на имунофлуоресцентния тест:
4.4.1. Прегледайте тестовите препарати на епифлуоресцентен микроскоп с филтри подходящи за възбуждането на багрилото FITC, под водна или маслена имерсия при увеличение от 500 до 1 000. Сканирайте прозорчетата напречно на двата диаметъра при десните ъгли и по периметъра. За проби, показващи липса или нисък брой на клетки, наблюдавайте поне 40 микроскопски полета.
Проверете препарата с положителната контрола първо. Клетките трябва да са ярко флуоресцентни и напълно обагрени при определения титър на антитялото или работния разтвор. Имунофлуоресцентният тест (раздел 4) трябва да бъде повторен, ако обагрянето е анормално.
4.4.2. Наблюдавайте за ярко флуоресциращи клетки с характерната морфология за C. m. subsp. sepedonicus в тестовите прозорчета на тестовите препарати (виж интернет страницата http://forum.europa.eu.int/Public/irc/sanco/Home/main). Интензитетът на флуоресценцията трябва да бъде еквивалентен или по-добър от щама на положителната контрола при същия разтвор на антитялото. Клетки с непълно оцветяване или със слаба флуоресценция трябва да бъдат игнорирани.
Ако се предполага някакво заразяване, тестът трябва да бъде повторен. Това може да бъде случай, при който всички препарати от една серия показват положителни клетки поради замърсяване на буфера или ако положителните клетки се откриват (извън прозорчето на препарата) по покривния слой на предметното стъкло.
4.4.3. Има няколко проблема, присъщи на специфичността на имунофлуоресцентния тест. Има вероятност съпътстващи популации от флуоресциращи клетки с атипична морфология и противоположно реагиращите сапрофитни бактерии с размер и морфология, подобни на C. m. sepedonicus, да се намерят в сърцевината на столоните на картофите и утайки с части от стъбла.
4.4.4. Отчитайте само флуоресциращи клетки с характерен размер и морфология при титъра или работния разтвор на антителата като в 4.3.
4.4.5. Тълкуване на резултатите от имунофлуоресценцията:
|
i) |
Ако се открият ярко флуоресциращи клетки с характерна морфология, преценете средния брой типични клетки на микроскопско поле и изсчислете броя на типични клетки/ml от ресуспендираната утайка (допълнение 4). Резултатите от имунофлуоресценцията са положителни за проби с поне 5 × 103 типични клетки/ml от от ресуспендираната утайка. Пробата се счита за потенциално заразена и се изисква по-нататъшно тестване. |
|
ii) |
Резултатите от имунофлуоресценцията са отрицателни за проби с по-малко от 5 × 103 клетки/ml от ресуспендираната утайка и пробата се счита за отрицателна. Не се изисква по-нататъшно тестване. |
5. FISH ТЕСТ
Принцип
Когато се използва FISH тест като първи скринингов тест и той даде положителен резултат, то трябва да се извърши имунофлуоресцентния тест като втори задължителен скринингов тест. Когато се използва FISH тест като втори скринингов тест и той даде положителен резултат, се изисква по-нататъшно тестване съгласно диаграмата за да се зъвърши диагностиката.
Бележка:
Използвайте валидирани специфични олигопроби от C. m. subsp. sepedonicus (допълнение 7). Предварително тестване с този метод би трябвало да позволи възпроизводимо откриване на поне 103 до 104 клетки C. m. subsp. sepedonicus на ml, добавен към екстракт от пробата, която преди това е била отрицателна.
Следната процедура трябва с предимство да бъде изпълнявана на прясно приготвен екстракт от пробата, но може също да бъде изпълнена и на екстракт от пробата, който е бил съхраняван в глицерол при – 16 до – 24 °C или – 68 до – 86 °C.
Като отрицателни контроли използвайте аликвоти от екстракт от пробата, които преди това са дали отрицателни резултати за C. m. subsp. sepedonicus.
Като положителни контроли пригответе суспензии съдържащи 105 до 106 клетки/ml от C. m. subsp. sepedonicus (например щам NCPPB 4053 или PD 406) в 0,01M фосфатен буфер (PB) от три до пет дневна култура (за приготвяне виж допълнение 2). Изгответе отделни препарати за положителни контроли от хомоложен щам или от някой друг референтен щам на C. m. subsp. sepedonicus, суспендиран в картофен екстракт, както е описано в допълнение 2.
Използването на етикетирана с FITC еубактериална олигопроба предлага контрола за хибридизационния процес, тъй като ще оцвети всички еубактери които са налични в пробата.
Тествайте контролния материал по същия начин като пробата/ите.
5.1. Фиксиране на картофения екстракт
Следният протокол се базира на Wullings et al., (1998):
5.1.1. Изгответе фиксационен разтвор (виж допълнение 7).
5.1.2. Пипетирайте 100 µl от всеки екстракт от проба в епруветка на Епендорф и центрофугирайте 8 минути при 7 000 g.
5.1.3. Отстранете супернатантата и разтворете пелетата в 500 µl от фиксационния разтвор, приготвен преди по-малко от 24 часа. Разбъркайте и инкубирайте една нощ при 4 °C.
Алтернативен фиксатор е 96 % етанол. За да го използвате, разтворете утайката от стъпка 5.1.2 в 50 µl 0,01M PB и 50 µl 96 % етанол. Разбъркайте сместа и инкубирайте при 4 °C 30—60 минути.
5.1.4. Центрофугирайте 8 минути при 7 000 g, отсранете супернатантата и ресуспендирайте утайката в 75 µl 0,01M PB (виж допълнение 3).
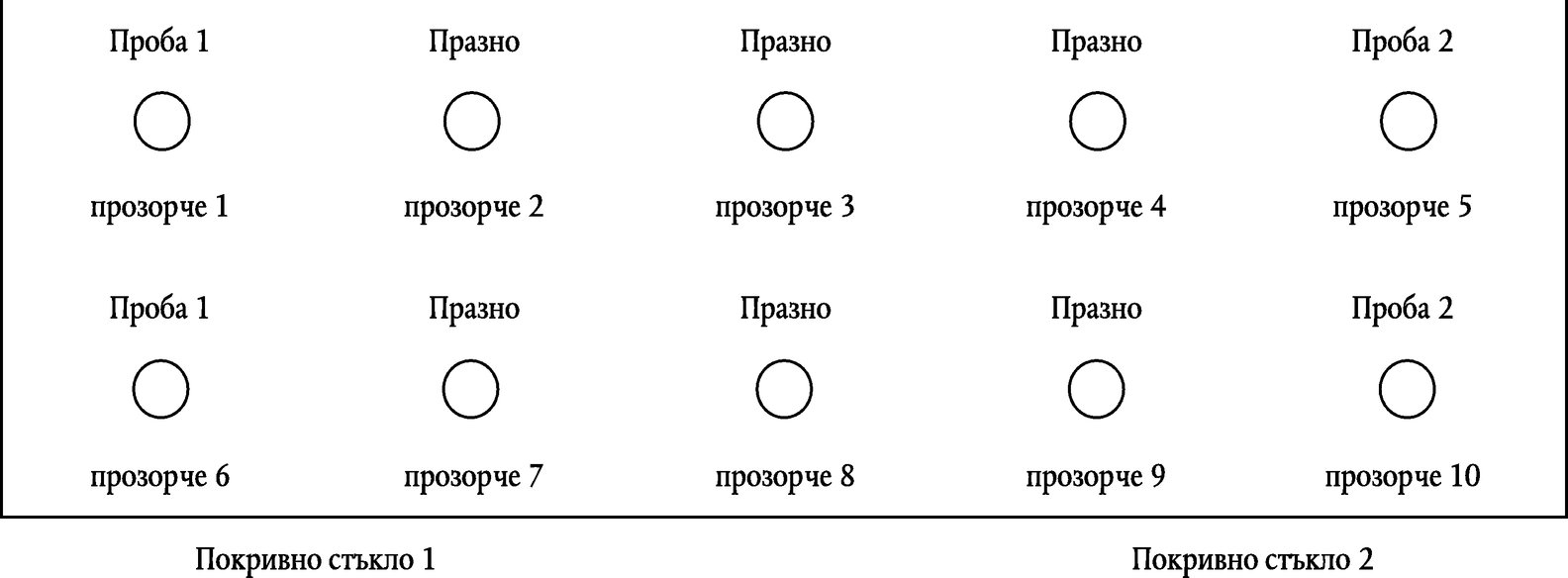
5.1.5. Капнете 16 µl от фиксираната суспензия на чисто предметно стъкло за многократно тестване, както е показано на фигура 3. Нанесете 2 различин проби на препарата, неразтворени, и използвайте 10 µl, за да направите разтвор 1:100 (в 0,01M PB). Оставащият разтвор от пробата (49 µl) може да бъде съхранен при – 20 °C след прибавяне на 1 обем от 96 % етанол. В случай че FISH тестът изисква повторение, отстранете етанола чрез центрофугиране и добавете равен обем 0,01M PB (смесете чрез разбъркване).
5.1.6. Изсушете на въздух препаратите (или на сушилня за препарати при 37 °C) и ги фиксирайте чрез опламеняване.
На този стадий процедурата може да бъде прекъсната и хибридизацията продължена на следващият ден. Препаратите трябва да бъдат съхранявани далеч от прах и сухи при стайна температура.
5.2. Прехибридизация и хибридизация
5.2.1. Пригответе лизозимен разтвор, съдържащ 10 mg лизозим (Sigma L–6876), в 10 ml буфер (100 mM Tris-HCl, 50 mM EDTA, pH 8.0). Този разтвор може да се съхранява, но трябва само замразяван и размразяван само веднъж. Покрийте всяка проба добре с приблизително 50 µl лизозимен разтвор и инкубирайте 10 минута на стайна температура. След това топнете препаратите в деминерализирана вода само веднъж и изсушете с филтърна хартия.
Алтернативно вместо лизозим прибавете 50 µl от 40 до 400µg ml–1 протеиназа K в буфер (20 mM Tris-HCl, 2 mM CaCl2, pH 7,4) във всяко кладенче и инкубирайте при 37 °C за 30 минути.
5.2.2. Дехидратирайте клетките в степенувани серии етанол от 50 %, 80 % и 96 % за една минута всяка. Изсушете на въздух препаратите в поставка за препарати.
5.2.3. Пригответе влажна инкубационна камерка чрез покриване на дъното на херметична кутия с тъкан от филтърна хартия, накисната в 1x хибмикс (допълнение 7). Предварително инкубирайте кутията в хибридизационна пещ при 55 °C за поне 10 минути.
5.2.4. Пригответе хибридизационен разтвор (допълнение 7), позволяващо 45 µl на предметно стъкло, и предварително инкубирайте за 5 минути при 55 °C.
5.2.5. Поставете препаратите на котлон при 45 °C и сложете 10 µl от хибридизационния разтвор във всеки от четирите кладенчета на препарата/ите).
5.2.6. Поставете 2 покривни стъкла (24 × 24 mm) на всеки препарат, без да допускате въздух. Поставете препаратите в предварително затоплена влажна камерка и хибридизирайте за една нощ в пещ при 55 °C на тъмно.
5.2.7. Пригответе три стъкленици, съдържащи 1 литър ултрачиста вода (UPW), 1 литър от 1x хибмикс (334 ml 3x хибмикс и 666 ml UPW) и 1 литър от 1/2x хибмикс (167 ml 3x хибмикс и 833 ml UPW). Предварително инкубирайте всяка на водна баня при 55 °C.
5.2.8. Махнете покривните стъкла от препаратите и поставете препаратите в кутия за препарати.
5.2.9. Отмийте излишната проба чрез инкубация за 15 минути в стъкленица с 1x хибмикс при 55 °C.
5.2.10. Преместете кутията за препарати в 1/2 хибмикс разтвор за измиване и инкубирайте за още 15 минути.
5.2.11. Потопете препаратите за кратко в УЧВ (UPW) и ги поставете върху филтърна хартия. Отстранете излишната влага чрез внимателно покриване на повърхността с филтърна хартия. Пипетирайте 5—10 μl от разтвора на увеличителя против избледняване (например Vectashield, Vecta Laboratories, CA, USA или еквивалентен) върху всяко прозорче и поставете голямо покривно стъкло (24 × 60 mm) върху целия препарат.
5.3. Тълкуване на FISH теста
5.3.1. Наблюдавайте препаратите веднага с микроскоп, пригоден за епифлуоресцентна микроскопия при 630 до 1 000 x увеличение, под имерсионни масла. С филтър, подходящ за флуоресцентен изотиоцианат (FITC), еубактериалните клетки (включително повечето грамотрицателни клетки) в пробата се оцветяват във флуоресцентно зелено. Като се използва филтър за тетраметилродамин-5-изотиоцианат, Cy3-оцветените клетки на C. m. subsp. sepedonicus се наблюдават като флуоресцентно червени. Сравнете морфологията на клетките с тази на положителните контроли. Клетките трябва да са ярко флуоресциращи и напълно оцветени. FISH тестът (раздел 9.4) трябва да бъде повторен, ако оцветяването е анормално. Сканирайте прозорчетата напречно през двата диаметъра при десните ъгли и по периметъра. За проби без или с нисък брой клетки наблюдавайте поне 40 микроскопски полета.
5.3.2. Наблюдавайте за ярко флуоресциращи клетки с характерна морфология за C. m. subsp. sepedonicus в тестовото прозорче на тестовите препарати (виж интернет страницата http://forum.europa.eu.int/Public/irc/sanco/Home/main). Интензивността на флуоресценцията трябва да бъде еквивалентна или по-добра от тази на щама на положителната контрола. Клетки с непълно оцветяване или слаба флуоресценция не трябва да бъдат отчитани.
5.3.3. Ако се предполага някакво заразяване, тестът трябва да бъде повторен. Това може да бъде случай, при който всички препарати от една серия показват положителни клетки поради замърсяване на буфера или ако се намират положителни клетки (извън прозорчетата на препарата) по покривния слой на предметното стъкло.
5.3.4. Има няколко проблема, присъщи на специфичността на FISH теста. Има вероятност съпътстващи популации от флуоресциращи клетки с атипична морфология и противоположно реагиращите сапрофитни бактерии с размер и морфология, подобни на C. m. subsp. sepedonicus, да се намерят в сърцевината на столоните на картофите и утайките с части от стъбла макар и по-рядко, отколкото при имунофлуоресцентния тест.
5.3.5. Отчитайте само флуоресциращи клетки с типичен размер и морфология, вижте 5.3.2.
5.3.6. Тълкуване на резултатите от FISH теста:
|
i) |
Валидни резултати от FISH теста се получават, ако се наблюдават яркозелени флуоресциращи клетки с размер и морфология, типични за C. m. subsp. sepedonicus, като се използва FITC филтър, и ярко оцветени флуоресциращи клетки, като се използва родаминов филтър във всички положителни контроли и в нито една от отрицателните контроли. Ако се открият ярко флуоресциращи клетки с типична морфология, пресметнете средния брой типични клетки на микроскопско поле и изчислете броя на типични клетки на мл от ресуспендирана утайка (допълнение 4). Проби с поне 5 × 103 типични клетки/ml от ресуспендирана утайка се считат за потенциално заразени. Изисква се по-нататъшно тестване. Пробите с по-малко от 5 × 103 типични клетки/ml от ресуспендирана утайка се считат за отрицателни. |
|
ii) |
FISH тестът е открицателен, ако не се наблюдават ярко оцветени флуоресциращи клетки с размер и морфология, типични за C. m. subsp. sepedonicus, като се използва родаминов филтър, при условие че типични ярко оцветени флуоресциращи клетки се наблюдават във всички препарати с положителни контроли, като се използва родаминов филтър |
6. PCR ТЕСТ
Принципи
Когато се използва PCR тест като основен скринингов тест и той даде положителни резултати, трябва да се извърши имунофлуоресцентен тест като втори задължителен скринингов тест. Когато се използва PCR тест като втори скринингов тест и той даде положителни резултати, се изисква по-нататъшно тестване според диаграмата за да се завърши диагностикага.
Пълно използване на този метод като основен скринингов тест се препоръчва само когато е била получена специална експертиза.
Бележка:
Предварително тестване с този метод би трябвало да позволи възпроизводимо откриване на 103 до 104 клетки от C. m. subsp. sepedonicus на ml, прибавени към екстрактите от пробата, които преди това са дали отрицателни резултати. Може да се наложат опити за оптимизиране, за да се постигнат максималните нива на чуствителност и специфичност във всички лаборатории.
Използвайте валидирани реактиви и протоколи за PCR. Препоръчително е да изберете метод с вътрешен контрол.
Използвайте подходящи предпазни мерки за да избегнете замърсяване на пробата с целева ДНК. PCR тестът трябва да се извършва от опитни лаборанти в специализирани лаборатории по молекулярна биология с оглед да се минимизира възможността от заразяване с целева ДНК.
Отрицателните контроли (за ДНК екстракция и PCR процедури) трябва винаги да бъдат третирани като крайни проби в процедурата, за да стане ясно дали е станало някакво пренасяне на ДНК.
В PCR теста трябва да бъдат включени следните отрицателни контроли:
|
— |
екстракт от пробата, която преди това е показала отрицателни резултати за C. m. subsp. sepedonicus, |
|
— |
буферни контроли използвани за екстракция на бактерията и ДНК от пробата, |
|
— |
реакционна смес за PCR. |
Трябва да бъдат включени следните положителни контроли:
|
— |
аликвоти от ресуспендирани утайки, към които е бил прибавен C. m. subsp. sepedonicus (за подготовка виж допълнение 2), |
|
— |
суспензия от C. m. subsp. sepedonicus на 106 клетки/ml във вода от вирулентен изолат (например NCPPB 2140 или NCPPB 4053), |
|
— |
ако е възможно, използвайте също ДНК, извлечена от проби на положителни контроли при PCR тест. |
За да избегнете потенциално заразяване пригответе положителни контроли в отделна среда от пробите, които ще се тестват.
Екстрактите от проби трябва да бъдат колкото е възможно по-чисти от почва. Следователно в определени случай може да е препоръчително да се приготвят извлеци от измити картофи, ако трябва да се използват протоколите от PCR.
6.1. Методи за пречистване на ДНК
Използвайте положителни и отрицателни контролни проби, както е описано по-горе.
Използвайте контролния материал по същия начин както за пробата/ите.
На разположение има разнообразие от методи за пречистване на целева ДНК от сложните субстрати на пробата, като по този начин се премахват инхибиторите на PCR и други ензимни реакции и концентриращи целевата ДНК в екстракта от пробата.
Следните методи са били оптимизирани за изпозване с валидирания PCR метод, показан в допълнение 6.
6.1. a) Метод на Пастрик (2000)
|
1. |
Пипетирайте 220 µl лизисен буфер (100 mM NaCl, 10 mM Tris-HCl [pH 8,0], 1 mM EDTA [pH 8,0]) в 1,5 ml епендорфова епруветка. |
|
2. |
Добавете 100 µl екстракт от пробата и поставете в термостат или на водна баня при 95 °C за 10 митути. |
|
3. |
Сложете епруветката върху лед за пет минути. |
|
4. |
Добавете 80 µl разтвор на лизозим за съхраняване (50 mg лизозим на ml в 10 mM Tris HCl, pH 8,0) и инкубирайте при 37 °C за 30 минути. |
|
5. |
Добавете 220 µl Easy DNA® разтвор A (Invitrogen), разбъркайте добре чрез разбъркване и инкубирайте при 65 °C 30 минути. |
|
6. |
Добавете 100 µl Еasy DNA® разтвор B (Invitrogen), разбъркайте енергично, докато преципитатът потече свободно в епруветката и пробата стане еднообразно вискозна. |
|
7. |
Добавете 500 µl хлороформ и разбъркайте, докато вискозитетът намалее и сместта стане хомогенна. |
|
8. |
Центрофугирайте при 15 000 g 20 минути при 4 °C, за да отделите фазите и да образувате интерфазите. |
|
9. |
Прехвърлете горната фаза в нова епендорфова епруветка. |
|
10. |
Добавете 1 ml 100 % етанол (– 20 °C), разбъркайкте за кратко и инкубирайте върху лед 10 минути. |
|
11. |
Центрофугирайте при 15 000 g 20 минути при 4 °C и махнете етанола от пелетата. |
|
12. |
Добавете 500 µl 80 % етанол (– 20 °C) и разбъркайте чрез обръщане на епруветката. |
|
13. |
Центрофугирайте при 15 000 g за 10 минути при 4 °C, запазете пелетата и отстранете етанола. |
|
14. |
Оставете пелетата да изсъхне на въздух или в скоростна камера за ДНК. |
|
15. |
Ресуспендирайте утайката в 100 µl стерилна УЧВ (UPW) и оставете на стайна температура поне 20 минути. |
|
16. |
Съхранете при – 20 °C до необходимото за PCR. |
|
17. |
Утайте всички бели преципитати чрез центрофугиране и изполване на 5 µl от супернатантата, съдържаща ДНК за PCR. |
6.1. б) Други методи
Други методи за екстракция на ДНК (например Qiagen DNeasy Plant Kit) могат да бъдът прилагани, при условие че за тях е доказано, че са толкова ефективни в пречистването на ДНК от контролни проби, съдържащи 103 до 104 патогенни клетки/ml.
6.2. PCR
6.2.1. Пригответе тестови и контролни модели за PCR според валидираните протоколи (допълнение 6). Пригответе едно десетично разреждане на ДНК екстракт от пробата. (1:10 в УЧВ (UPW/).
6.2.2. Пригответе подходящата реакционна смес за PCR в среда, свободна от зараза според публикувания протокол (допълнение 6). Валидираният PCR протокол е многостранна реакция, която също включва вътрешен PCR контрол.
6.2.3. Добавете 5 µl ДНК екстракт на 25 µl PCR реакция в стерилни PCR епруветки.
6.2.4. Включете отрицателна контролна проба, съдържаща само реакционна смес за PCR, и добавете същия източник на УЧВ (UPW), така както е използван в сместа за PCR на място на пробата.
6.2.5. Поставете епруветките в същия термоцикльор, който е бил използван при предварителното тестване и включете оптимизирана PCR програма (допълнение 6).
6.3. Анализ на продукта от PCR
6.3.1. Разтворете наново PCR ампликоните чрез електрофореза с агарозен гел. Излейте поне 12 µl амплифицирана ДНК реакционна смес от всяка проба с 3 µl пълнещ буфер (допълнение 6) в 2,0 % (w/v) агарозни гелове в три-ацетат-EDTA (TAE) буфер (допълнение 6) при 5—8 V/cm. Използвайте подходящ ДНК маркер, например 100 bp стълбица.
6.3.2. Разкрийте ДНК поясите чрез обагряне в етидиум бромид (0,5 mg/l) за 30—45 min, като вземете подходящи предпазни мерки за боравене с този мутаген.
6.3.3. Наблюдавайте обагрения гел при къса UV трансилюминация (например λ = 302 nm) за амплифицирани PCR продукти от очаквания размер (допълнение 6) и документирайте.
6.3.4. За всички нови заключения/случаи проверявайте автентичността на PCR ампликона чрез извършване на рестрикционен ензимен анализ на проба от оставащата амплифицирана ДНК чрез инкубиране при оптимална температура и време с подходящ ензим и буфер (виж допълнение 6). Разтворете наново разтворените фрагменти чрез електрофореза с агарозен гел, както преди, и наблюдавайте характерния фрагмент на ограничаване под UV трансилюминация след обагряне с етидиум бромид и сравнете с разтворените и неразтворени положителни контроли.
Тълкуване на резултата от PCR теста:
PCR тестът е отрицателен, ако специфичният за C. m. subsp. sepedonicus PCR ампликон с очаквания размер не се намира в съответната проба, но се намира във всички положителни контролни проби (в случай на многостранна PCR със специфични за растението вътрешни контролни праймери: втори PCR продукт от очаквания размер трябва да бъде намножен със съответната проба).
PCR тестът е положителен, ако специфичният за C. m. subsp. sepedonicus PCR ампликон с очаквания размер и ограничителен модел се открива, при условие че не се увеличава от никоя от отрицателните контролни проби. Достоверно потвърждение на положителен резултат може също да се получи чрез повтаряне на теста с втора серия от PCR праймери (раздел 9.3).
Бележка:
Може де се предполага инхибиране на PCR, ако очакваното намножаване е получено от проба с положителна контрола, съдържаща C. m. subsp. sepedonicus във вода, но отрицателните резултати са били получени от положителни контроли с C. m. subsp. sepedonicus в картофен извлек. В многостранни PCR протоколи с външни PCR контроли има индикации за инхибирането, когато не е получен нито един от двата ампликона.
Може да се предполага заразяване, ако очакваният ампликон се получава от една или повече отрицателни контроли.
7. БИОЛОГИЧЕН ТЕСТ
Бележка:
Предварителното тестване с този тест трябва да позволи възпроизводимо откриване 103 до 104 единици от C. m. subsp. sepedonicus, формиращи колония на ml, прибавен към екстракта от пробата, която преди това е дала отрицателен резултат. (за приготвянето виж допълнение 2).
Най-голяма чуствителност на откриването може да се очаква, когато се използват прясно приготвен екстракт и оптимални условия на растеж. Въпреки това методът може успешно да се приложи и за екстракти, които са били съхраняване в глицерол при – 68 до – 86 °C.
Някои сортове патладжан предлагат отлична селективна обогатена среда за растежа на C. m. subsp. sepedonicus дори при отсъствие на симптоми и също предоставят отличен тест за потвърждаване на гостоприемника.
Условията на растеж трябва да са оптимални за да се намали риска от фалшиви отрицателни резултати от теста.
За подробности за културата виж допълнение 8.
7.1. Разпределете цялата оставаща тест аликвота от ресуспендираната утайка от раздел 3.1.6 или 3.2.5 между патладжани по един от методите, дадени по-долу (7.3 или 7.4). Използвайте само растения на листен стадий две до три до пълно разгъване на третият същински лист. За да се гарантира пълно оползотворяване на ресуспендираната утайка, както и ефективна инокулация, подчертаните по-долу процедури ще изискват 15—25 растения от патладжан на проба.
7.2. Не поливайте патладжаните един или два дни преди инокулацията, за да намалите тургорното налягане.
7.3. Инокулация чрез срязване
7.3.1. Като придържате растението между два пръста, пипетирайте една капка (приблизително 5—10 µl) от суспендираната утайка върху стъблото между котиледоните (семеделни листа) и първия лист.
7.3.2. Като използвате стерилен скалпел, направете диагонален разраз, дълъг около 1,0 cm и дълбок приблизително до 2/3 от дебелината на стъблото, като започвате разреза от капката утайка от концентрирания екстракт.
7.3.3. Запечататйте разреза със стерилен вазелин от спринцовка.
7.4. Инокулация със спринцовка
Инжектира се стъблото на патладжана точно над котиледоните, като използвате спринцовка с игла за подкожно инжекция (не по-малка от 23 G). Разпределете пробата между патладжаните.
7.5. Като положителни контроли инокулирайте 5 растения с водна суспензия на 105 до 106 клетки/ml позната култура на C. m. subsp. sepedonicus и, където е възможно, с естествено заразена тъкан от клубени (виж раздел 4) по същия инокулационен метод (7.3 или 7.4).
7.6. Като отрицателни контроли инокулирайте 5 растения със стерилен буфер от утайката по същият инокулационен метод (7.3 или 7.4).
7.7. Инкубирайте растенията в карантинни съоръжения до четири седмици при 18—24 °C. Инкубирайте растенията при достатъчно светлина и висока влажност (70—80 %) и вода, за да предотвратите напукване или спаружване поради недостиг на вода. Клетките на C. m. sepedonicus загиват при температура 30 °C и оптималната температура е 21 °C. За да избегнете заразяване, инкубирайте растенията от положителната и отрицателната контрола на ясно разделени маси в оранжерия или парник за развъждане или, в случай че мястото е ограничено, оскигурете строго разделяне между третиранията. Ако растенията за различни проби трябва да бъдат инкубирани близо едно до друго, отделете ги с подходящи прегради. Когато наторявате, поливате, инспектирате или извършвате някакви други манипулации, внимавайте изключително много, за да избегнете кръстосано заразяване. Важно е да се пазят оранжериите и парниците за развъждане свободни от всички насекомни вредители, тъй като те могат да пренесат бактерията от проба на проба.
7.8. Преглеждайте редовно за симптоми, като започвате след една седмица. Преброявайте растениятка, показващи симптоми. C. m. subsp. sepedonicus причинява повяхване на листата при патладжаните, което може да започне като омекване на тъканите по периферията на листата или между нерватурата. Засегнатата тъкан може първоначално да бъде тъмнозелена или на петна, но в последствие избледнява преди да некротизира. При увяхване между жилките повърхността често изглежда мазна и много водна. Мъртвата тъкан е често яркожълта по края. Растенията не умират непременно. Колкото по-дълъг е периодът, преди да се развият симптомите, толкова по-голям е шансът за оцеляване. Растенията могат да превъзмогнат инфекцията. Младите патладжани са много по-чувствителни към ниски популации на C. m. subsp. sepedonicus, отколкото по-старите растения, и оттам следва необходимостта да се използват растения в третата фаза на разлистване или точно преди нея.
Увяхването може също да се предизвика и от популации на други бактерии или гъби, намиращи се в концентрирания екстракт от картофените клубени. В тях са включени Ralstonia solanacearum, Erwinia carotovora subsp. carotovora и E. carotovora subsp. atroseptica, Erwinia chrysanthemi, Phoma exigua var. foveata, както и големи популации на сапрофитни бактерии. В частност Erwinia chrysanthemi може да предизвика симптоми по листата и увяхване, които са много сходни с тези на C. m. sepedonicus. Единствената разлика е почерняването на на стъблата в случай на инфекции с Erwinia chrysanthemi. Другото повяхване може да бъде разграничено от повяхването, причинено от C. m. subsp. sepedonicus, тъй като при него цели листа или цели растения бързо увяхват. Също може да се приготви и Грам оцветяване: така тестът ще различи C. m. subsp. sepedonicus от Erwinia spp.
7.9. Веднага щом се наблюдават симптомите при патладжаните, трябва да се направи реизолиране, като се използват участъци от тъкан на повехнали листа или тъкан от стъбла на растения (виж 3.1.3 за тъканна мацерация). Дезинфекцира се повърхността на листата и стъблата на патладжаните със 70 % етанол. Направете имунофлуоресцентен тест или PCR тест на патладжанен сок и изолирайте на подходяща (серлективна) среда (виж раздел 8). Може също да се приготви и Грам оцветяване (допълнение 9). Идентифицирайте пречистени култури от предполагаем C. m. subsp. sepedonicus и потвърдете патогенността (виж раздели 9 и 10).
7.10. При определени обстоятелства, особено където условията на растеж не са оптимални, е възможно C. m. subsp. sepedonicus да присъства като латентна инфекция в патладжаните дори след инкубационен период до 4 седмици. Ако не се наблюдават симптоми след 4 седмици, извършете IF/PCR тест на смесена проба от 1 cm части от стъбла от всяко тестово растение, взети от участъка над инокулацията. Ако тестът е положителен, трябва да се извърши наново изолация върху подходяща (селективна) среда, като се следва процедурата от раздел 8. Идентифицирайте пречистени култури от предполагаем C. m. subsp. sepedonicus и потвърдете патогенността (виж раздели 9 и 10).
Тълкуване на резултатите от биологичния тест.
Валидни резултати от биологичния тест се получават, когато растенията от положителните контроли показват типични симптоми, бактериите могат да бъдат повторно изолирани от тези растения и не са открити симптоми по отрицателните контроли.
Биологичният тест е отрицателен, ако тестовите растения не са заразени с C. m. subsp. sepedonicus и при условие че C. m. subsp. sepedonicus не се открива в положителните контроли.
Биологичният тест е положителен, ако тестовите растения са заразени с C. m. subsp. sepedonicus.
8. ИЗОЛИРАНЕ НА C. M. SUBSP. SEPEDONICUS
Бележка:
Диагностицирането може да се потвърди, само ако C. m. subsp. sepedonicus бъде изолиран и впоследствие идентифициран (виж раздел 9). Въпреки че C. m. subsp. sepedonicus е труден за изолиране вредител, той може да се изолира от тъкани с характерни симптоми.
Въпреки това той може да бъде изпреварен от други бързорастящи сапрофитни бактерии и поради това директното му изолиране от клубена или утайка от стъблена тъкан (мацерат) (раздел 3.1.6 или 3.2.5.) е трудно. Със селективна среда и подходящо разреждане на ресуспендираната утайка (мацерат) от конусите или от стъблата на картофите директното изолиране на C. m. subsp. sepedonicus може да е възможно.
Изолирането трябва да се прави от всички картофени клубени или части от стъбла със симптоми и от растенията на патладжана, при които не се наблюдават симптоми, IF/PCR теста от смесената проба е бил положителен (виж раздел 7.10). Където е необходимо мацерацията на стъблата на патладжаните може да бъде извършена, както е описано в раздел 3.1.3.
Като положителни контроли пригответе десетични разреждания от суспензия от 106 cfu/ml от C. m. subsp. sepedonicus (например NCPPB 4053 или PD 406). За да избегнете каквато и да е вероятност от заразяване, пригответе положителни контроли напълно отделно от пробите, които ще се тестват.
За всяка новоприготвена серия от селективна среда трябва да се тества нейната пригодност за растеж на патогена, преди тя да се използва за тестване на рутинни проби.
Тествайте контролния мателиал по идентичен начин като пробата/ите
8.1. Селективна посявка
8.1.1. От 100 µl аликвота от проба от ресуспендираната картофена утайка (мацерат) или сок от патладжан направете 10-кратни разреждания в буфер за утайка (допълнение 3).
8.1.2. Изолирането от неразредена картофен екстракт обикновено се проваля поради трудният растеж на Cms и конкуренция от сапрофитите. Тъй като бактерията обикновено присъства в големи популации в заразените тъкани, сапрофитите обикновено могат да бъдат отмити, докато патогенът остава. Поради това се препъръчва да се разпредели 100 µl от всяка от пробите, от 1/100 до 1/10 000 разреждания върху MTNA среда или NCP-88 среда (допълнение 5) (ако се използват петриеви блюда с диаметър 90 mm пригодете обема за алтернативен размер на блюдата), като се използва инструмент за мазане (като стикове за хокей) и техниката за намазване на плоча.
Бележка:
Алтернативно стратегия е да се размаже първоначалната аликвота от 100 µl картофен извлек върху първата агарна плоча с инструмент за мазане и след това да се премахне инструмента към втората агарна плоча, като се размазва целият остатък, останал на инструмента, най-накрая повторете това с третата плоча, като по този начин произвеждате ефект на разреждане на плочите чрез инструмента за мазане.
8.1.3. Инкубирайте плочите на тъмно при 21—23 °C.
8.1.4. Първоначални прегледи на плочите, включително по референция на контролните плочи, преброявания на някакви подобни на колониите на C. m. subsp. sepedonicus се правят след 3 дни с последващи преброявания след 5, 7 и накрая 10 дни.
8.2. Пречистване на предполагаеми колонии
Бележка:
Подкултивирането на подобни на C. m. subsp. sepedonicus колонии трябва да бъде извършвано върху YGM среда за инокулация на патладжан и/или последваща идентификация; това трябва да бъде изършвано преди платата да се разраснат твърде много т.е. за предпочитане след три до пет дни.
8.2.1. Прави се натривка отподобни на C. m. subsp. sepedonicus колонии върху една от следните хранителни среди: (формулите са дадени в допълнение 5):
хранителен декстрозен агар (за употреба само при субкултура),
дрожден пептонен глюкозен агар,
дрожден екстракт с минерални соли.
Инкубирайте при 21—24 °C до 10 дни.
C. m. subsp. sepedonicus расте бавно, обикновено дава точковидни кремави куполообразни колонии за 10 дни. За снимки на типични колонии на C. m. subsp. sepedonicus виж интернет страницата http://forum.europa.eu.int/Public/irc/sanco/Home/main).
8.2.2. Натрийте отново за да установите чистота.
Темповете на растеж се подобряват в субкултурата. Типичните колонии са кремавобели или с цвят на слонова кост, рядко жълти, заоблени, гладки, издигнати, с изпъкнал купол, мукоидно-течни, с ясни краища и диаметър обикновено от 1 до 3 mm.
Прост щам (допълнение 9) може да помогне да се подберат колонии за по-нататъшно тестване.
8.2.3. Идентифицирайте предполагаемите култури (виж раздел 9) и направете тест за патогенност (виж раздел 10).
9. ИДЕНТИФИКАЦИЯ
Определяйте чисти култури от предполагаеми изолати на C. m. subsp. sepedonicus, като използвате един от следните тестове, базирани на различни биологични принципи.
Включете познати референтни щамове, където е уместно за всеки провеждан тест.
9.1. Хранителни и ензимни тестове за идентификация
Определете следните фенотипни възможности, които са универсално застъпени или отсъстващи при C. m. subsp. sepedonicus, съгласно методите на Лелио и Стед (Lelliott and Stead) (1987), Клемен и кол. (Klement et al.) (1990), Шаад (Schaad) (2001), Анонимен (Anonymous) (1987).
Всички среди трябва да бъдат инкубирани при 21 °C и прегледани след шест дни. Ако не е настъпил растеж, инкубирайте 20 дни.
Всички тестове трябва да включват позната контрола на C. m. subsp. sepedonicus. Хранителните и физиологичне тестове трябва да се правят, като се използва инокулат от субкулткури от хранителен агар. Морфологичните сравнения трябва да се правят от култури от хранителен декстрозен агар.
|
Тестове |
Очакван резултат |
|
Окислително-ферментационен тест (O/F) |
инертен или слабо окислителен |
|
Окислителна активност |
– |
|
Растеж при 37 °C |
– |
|
Уреазна активност |
– |
|
Хидролиза на ескулина |
+ |
|
Хидролиза на скорбялата |
– или слаба |
|
Толеранс от 7 % разтвор на NaCl |
– |
|
Произвеждане на индол |
– |
|
Каталазна активност |
+ |
|
Произвеждане на H2S |
– |
|
Използване на цитрат |
– |
|
Втечняване на желатин |
– |
|
Кисела реакция от глицерин |
– |
|
Кисела реакция от лактоза |
– или слаба |
|
Кисела реакция от рамноза |
– |
|
Кисела реакция от салицин |
– |
|
Грам оцветяване (допълнение 9) |
+ |
9.2. Имунофлуоресцентен тест
|
a) |
Пригответе суспензия от приблизително 106 клетки/ml в имунофлуоресцентен буфер (допълнение 3). |
|
б) |
Пригответе серия от двукратни разреждания на подходящ антисерум. |
|
в) |
Приложете процедурата за имунофлуоресценция (раздел 4). |
|
г) |
Положителен имунофлуоресцентен тест се постига, ако имунофлуоресцентният титър на културата е еквивалентен на този от положителната контрола. |
9.3. PCR тест
|
a) |
Пригответе суспензия от приблизително 106 клетки/ml в ултрачиста вода (UPW). |
|
б) |
Загрейте 100 µl от клетъчната суспензия в затворени епруветки в термостат или на водна баня при 100 °C за 4 минути. Ако е необходимо, добавянето на прясно приготвена NaOH към крайната концентрация от 0,05M може да спомогне за разграждането на клетките. След това пробите могат да бъдат съхранявани при – 16 до – 24 °C, докато е необходимо. |
|
в) |
Приложете подходящи PCR процедури, за да увеличите специфичните ампликони от C. m. subsp. sepedonicus (например Pastrik, 2000; виж допълнение 4; Li and de Boer, 1995; Mills et al., 1997; Pastrik and Rainey, 1999; Schaad et al., 1999). |
|
г) |
Положителна идентификация на C. m. subsp. sepedonicus се постига, ако PCR ампликоните са същият размер и имат същият полиморфизъм по отношение ограничение участък от дължината катко щамът от положителната контрола. |
9.4. FISH тест
|
a) |
Пригответе суспензия от приблизително 106 клетки/ml в UPW. |
|
б) |
Приложете FISH процедурата (раздел 5). |
|
в) |
Положителен FISH тест се постига, ако се получат едни и същи реаккции от културата и от положителната контрола. |
9.5. Профилиране на мастните киселини (FAP)
|
a) |
Отгледайте културата на трипитказен соев агар (Oxoid) 72 часа при 21 °C (+/– 1°). |
|
б) |
Приложете подходяща FAP процедура (Janse, 1991; Stead, 1992). |
|
в) |
Положителен FAP тест се получава, когато профилът на предполагаемата контрола е идентичен с този на положителната контрола. Наличието на характерните мастни киселини 15:1 Anteiso A, 15:0 Iso, 15:0 Anteiso, 16:0 Iso, 16:0 и 17:0 Anteiso е много индикативно за C. m. sepedonicus. Други родове като Curtobacterium, Arthrobacter и Micrococcus също имат такива киселини, но някои от тези киселини, но 15:1 Anteiso A е рядка киселина в тези бактерии, но се среща във всички видове Clavibacter spp. между 1 и 5 %. При C. m. sepedonicus стойността обикновено е около 5 %. |
9.6. BOX-PCR
|
a) |
Пригответе суспензия от приблизително 106 клетки/ml в UPW. |
|
б) |
Приложете теста съгласно процедурата. (Smith et al., 2001). |
10. ТЕСТ ЗА ПОТВЪРЖДАВАНЕ
Тестът за патогенност трябва да се извърши като крайно потвърждаване на диагностиката на C. m. subsp. sepedonicus и за оценка на вирулентността на културите идентифицирани C. m. subsp. sepedonicus:
10.1. Пригответе инокулум от приблизително 106 клетки/ml от култури на 3 дни от изолати, които да бъдат тествани и подходящи щамове от положителни контроли на C. m. subsp. sepedonicus.
10.2. Инокулирайте 5—10 стъбла от патладжан от млади прорастъци на листен стадий 3 (раздел 7.3 или 7.4).
10.3. Инкубирайте при 18—24 °C с достатъчно светлина и висока относителна влажност, за да избегнете напукване или стрес от засушаване (раздел 7.7). С чисти култури типичното повяхване ще се получи за две седмици, но растенията, които не показват симптоми (виж раздел 7.8) след този период трябва да бъдат инкубирани до три седмици при температури, които водят до растеж на патладжанените растения, но ненадхвърлящи 25 °C (допълнение 8). Ако няма симптоми след 3 седмици, културата не може да бъде потвърдена като патогенна форма на C. m. subsp. sepedonicus.
10.4. Изолирайте участък от стъблото 2 cm над точката на инокулация на растение със симптоми. Стрийте и суспендирайте в малък обем от стерилна дестилирана вода или 50 mM фосфатен буфер (допълнение 3). Изолирайте от утайката чрез намазване на разтвор или натриване върху MTNA и YPGA (допълнение 5), инкубирайте три до пет дни при 21—23 °C и наблюдавайте образуването на типични за C. m. subsp. sepedonicus колонии.
Допълнение 1
Лаборатории, включени в оптимизирането и валидиране на протоколи
|
Лаборатория (1) |
Място |
Държава |
|
Agentur fur Gesundheit und Ernahrungssicherheit |
Viena și Linz |
Австрия |
|
Departement Gewasbescherming |
Merelbeke |
Белгия |
|
Plantedirektoratet |
Lyngby |
Дания |
|
Central Science Laboratory |
York |
Англия |
|
Scottish Agricultural Science Agency |
Edinburgh |
Шотландия |
|
Laboratoire National de la Protection des Végétaux, Unité de Bactériologie |
Angers |
Франция |
|
Laboratoire National de la Protection des Végétaux, Station de Quarantaine de la Pomme de Terre |
Le Rheu |
Франция |
|
Biologische Bundesanstalt |
Kleinmachnow |
Германия |
|
Pflanzenschutzamt Hannover |
Hanover |
Германия |
|
State Laboratory |
Dublin |
Ирландия |
|
Plantenziektenkundige Dienst |
Wageningen |
Нидерландия |
|
Norwegian Crop Research Institute, Plant Protection Centre |
Aas |
Норвегия |
|
Direcção-Geral de Protecção das Culturas |
Lisabona |
Португалия |
|
Nacionalni institut za biologijo |
Ljubljana |
Словения |
|
Centro de Diagnostico de Aldearrubia |
Salamanca |
Испания |
Допълнение 2
Изготвяне на положителни и отрицателни контроли за скрининг тестове PCR/IF и FISH на сърцевината
Изгответе 72-часова култура от вирулентен щам на C. m. subsp. sepedonicus (NCPPB 4053 или PD 406) върху MTNA базална среда и суспендирайте 10 mM фосфатен буфер, за да получите клетъчна плътност от приблизително 1 до 2 × 108 cfu/ml. Това обикновено се постига чрез слабо мътна суспензия, еквивалентна на оптична плътност от 0,20 при 600 nm.
Отстранете конусчетата от 200 клубена, взети от сорт с бяла кора, за които се знае, че са свободни от C. m. subsp. sepedonicus.
Обработете връхчетатаq както обикновеноq и ресуспендирайте утайката в 10 ml.
Пригответе 10 стерилни 1,5-милилитрови микроепруветки с 900 µl ресуспендирана утайка.
Прехвърлете 100 ml от суспензията от C. m. subsp. sepedonicus в първата микроепруветка. Разбъркайте.
Установете десетични нива на заразяване чрез по-нататъшно разреждане в следващите 5 микрофиали.
Шестте заразени микрофиали ще бъдатк използвани като положителни контроли. Четирите незаразени микрофиали ще бъдат използвани като отрицателни контроли. Надпишете микрофиалите.
Пригответе аликвоти от 100 µl в стерилни микрофиали от 1,5 ml, като по този начин получите девет повторения на всяка контролна проба. Съхранявайте при – 16 до – 24 °C до употребата.
Присъствието и количественото определяне на C. m. subsp. sepedonicus в контролните проби трябва първо да се потвърди от имунофлуоресценцията.
За PCR теста извършете ДНК екстракция от положителни и отрицателни контролни проби с всяка серия от тестови проби.
За имунофлуоресценцията и FISH теста извършете опити върху положителни и отрицателни контролни проби с всяка серия от тестови проби.
За имунофлуоресценцията, FISH и PCR опитите C. m. subsp. sepedonicus трябва да бъде открит в поне 106 и 104 клетки/ml от положителните контроли и в нито една от отрицателните контроли.
Допълнение 3
Буфери за тестовите процедури
ОБЩО: Неотворените стерилизирани буфери могат да бъдат съхранявани до една година.
1. Буфери за екстракционна процедура
1.1. Екстракционен буфер (50 mM фосфатен буфер, pH 7,0)
Този буфер се използва за екстракция на бактерията от растителни тъкани чрез хомогенизиране или разклащане.
|
Na2HPO4 (anhydrous) |
4,26 g |
|
KH2PO4 |
2,72 g |
|
Дестилирана вода |
1.00 L |
Разтворете съставките, проверете pH и стерилизирайте в автоклав при 121 °C за 15 минути.
Допълнителни компоненти могат да бъдат полезни, както следва:
|
|
Цел |
Количество (за L) |
|
Lubrol flakes |
Deflocculant (*) |
0,5 g |
|
DC silicone antifoam |
Anti-foam agent (*) |
1,0 ml |
|
Tetrasodium pyrophosphate |
Anti-oxidant |
1,0 g |
|
Polyvinylpyrrolidone-40 000 (PVP-40) |
Спойка за инхибитори за PCR |
50 g |
1.2. Буфер за утайката (10 mM фосфатен буфер, pH 7,2)
Този буфер се използва за ресуспендиране и разреждане на екстракт от конусчета на картофени клубени следващи концентрирането до утайка чрез центрофугиране.
|
Na2HPO4 · 12H2O |
2,7 g |
|
NaH2PO4 · 2H2O |
0,4 g |
|
Дестилирана вода |
1,00 L |
Разтворете съставките, проверете pH и стерилизирайте в автоклав при 121 °C за 15 минути.
2. Буфери за имунофлуоресцентен тест
2.1. IF-буфер (10 mM фосфатен буфер солен (физиологичен р-р) (PBS), pH 7,2)
Този буфер се използва за разреждане на антитела.
|
Na2HPO4 · 12H2O |
2,7 g |
|
NaH2PO4 · 2H2O |
0,4 g |
|
NaCl |
8,0 g |
|
Дестилирана вода |
1.0 L |
Разтворете съставките, проверете pH и стерилизирайте в автоклав при 121 °C за 15 минути.
2.2. Буфер за имунофлуоресценция Tween
Този буфер се използва за измиване на предметните стъкла.
Прибавете 0,1 % Tween 20 към буфера за имунофлуоресценция.
2.3. Глицерол буфериран с фосфат, pH 7,6
Този буфер се използва като течен увеличител върху гнездата на предметните стъкла за имунофлуоресценция за да се ускорява флуоресценцията.
|
Na2HPO4 · 12H2O |
3,2 g |
|
NaH2PO4 · 2H2O |
0,15 g |
|
Глицерол |
50 ml |
|
Дестилирана вода |
100 ml |
Разтвори на увеличител против избледняване са търговски достъпни, напр. Vectashield® (Vector Laboratories) or Citifluor® (Leica).
Допълнение 4
Определяне на нивото на зараза в имунофлуоресцентни и FISH тестове
|
1. |
Избройте средния брой типични флуоресцентни клетки на зрително поле (c) |
|
2. |
Изчислете броя на типични флуоресцентни клетки на гнездо от микроскопски препарат (C) 
|
|
3. |
Изчислете броя броя на типични флуоресцентни клетки на мл ресуспендирана утайка. (N) 
|
Допълнение 5
Среда за изолиране и култура на C. m. subsp. sepedonicus
|
a) |
Обща среда за растеж Хранителен агар (NA)
Разтворете съставките и стерилизирайте в автоклав при 121 °C за 15 минути. Хранителен декстрозен агар (NDA) Difco bacto хранителен агар, съдържащ 1 % D(+) глюкоза (монохидрат). Стерилизирайте в автоклав при 115 °C за 20 минути. Пептонен глюкозен агар с дрожди (YPGA)
Разтворете съставките и стерилизирайте в автоклав при 121 °C за 15 минути. Среда с минерални соли и екстракт от дрожди (YGM)
Разтворете съставките и стерилизирайте 0,5 литър обеми от средата в автоклав при 115 °C за 20 минути. |
|
б) |
Валидирани селективни хранителни среди среда MTNA В случай че не е упоменато друго, всички компоненти са от BDH.
Разтворете съставките, нагласете pH на 7,2. След загряването в автоклав (при 121 °C за 15 мин) и охлаждане до 50 °C, добавете антибиотици: trimethoprim 0,06 g, nalidixic acid 0,002 g, amphotericin B 0,01 g. Съхранявайте разтворите на антибиотиците: trimethoprim (Sigma) и nalidixic acid (Sigma) (и двете 5 mg/ml), in 96 % methanol, amphotericin B (Sigma) (1 mg/ml) в диметилов серен оксид. Разтворите на склад са филтърно стерилизирани. Бележка: Годността на основната среда е три месеца. След като се добавят антибиотици, трайността е един месец, ако се съхранява замразена. NCP-88 среда
Разтворете съставките, нагласете pH на 7,2. След загряването в автоклав (при 121 °C за 15 минути) и охлаждане до 50 °C, добавете следните антибиотици: Polymyxin B sulphate (Sigma) 0,003 g, nalidixic acid (Sigma) 0,008 g, Cycloheximide (Sigma) 0,2 g. Разтворете антибиотиците в разтвор за складиране, както следва: nalidixic acid в 0,01 M NaOH, cycloheximide в 50 % етанол, polymyxin B sulphate в дестилирана вода. Разтворите за складиране са филтърно стерилизирани. Бележка: Годността на основната среда е три месеца. След като се добавят антибиотици, трайността е един месец, ако се съхранява замразена. |
Допълнение 6
Валидирани PCR протоколи и реактиви
Бележка:
Предварителното тестване трябва да позволи възпроизводимо откриване на поне 103 до 104 клетки на C. m. sepedonicus на ml екстракт от проба.
Предварителото тестване трябва също да не показва положителни резултати с панел от селектирани щамове.
1. Многостранни протоколи с вътрешен PCR контрол. (Pastrik, 2000)
1.1. Олигонуклеотидни праймери
|
Начален праймер PSA-1 |
5′ – ctc ctt gtg ggg tgg gaa aa – 3′ |
|
Краен праймер PSA-R |
5′ – tac tga gat gtt tca ctt ccc c – 3′ |
|
Начален праймер NS-7-F |
5′ – gag gca ata aca ggt ctg tga tgc – 3′ |
|
Краен праймер NS-8-R |
5′ – tcc gca ggt tca cct acg ga – 3′ |
Очакваният размер на ампликона от модел на ДНК от C. m. subsp. sepedonicus = 502 bp (PSA-primer set).
Очакваният размер на ампликона от 18S rРНК при вътрешен контрол PCR = 377 bp (NS-primer set).
1.2. PCR реакционна смес
|
Реактив |
Количество реактиви на реакция |
Крайна концентрация |
|
Стерилна UPW |
15,725 µl |
|
|
10x PCR (2) буфер (15 mM MgCl2) |
2,5 µl |
1 × (1,5 mM MgCl2) |
|
BSA (фракция V) (10 %) |
0,25 µl |
0,1 % |
|
d-nTP mix (20 mM) |
0,125 µl |
0,1 mM |
|
Праймер PSA-1 (10 µM) |
0,5 µl |
0,2 µM |
|
Праймер PSA-R (10 µM) |
0,5 µl |
0,2 µM |
|
Праймер NS-7-F (10 µM) (3) |
0,1 µl |
0,04 µM |
|
Праймер NS-8-R (10 µM) (3) |
0,1 µl |
0,04 µM |
|
Taq polymerase (5 U/µl) (2) |
0,2 µl |
1,0 U |
|
Обем на пробата |
5,0 µl |
|
|
Общ обем |
25,0 µl |
|
1.3. Условия на реакцията PCR
Включете следната програма:
|
1 цикъл: |
i) |
3 минути при 95 °C (денатурация на матрична ДНК) |
|
10 цикъла: |
ii) |
1 минута при 95 °C (денатурация на матрична ДНК) |
|
iii) |
1 минута при 64 °C (хибридизаия на праймерите) |
|
|
iv) |
1 минута при 72 °C (удължаване на копието) |
|
|
25 цикъла: |
v) |
30 секунди при 95 °C (денатурация на матрична ДНК) |
|
vi) |
30 секунди при 62 °C (хибридизаия на праймерите) |
|
|
vii) |
1 минута at 72 °C (удължаване на копието) |
|
|
1 цикъл: |
viii) |
5 минути при 72 °C (крайно удължаване на копието) |
|
ix) |
дръжте при 4 °C. |
Бележка:
Тази програма е оптимизирана за използване с MJ Research PTC 200 термоцикльор. Може да се наложи модифициране на стъпките продължителност на циклите ii), iii) iv), v), vi) и vii) при използване на други модели.
1.4. Анализ на ампликона за ограничителен ензим
PCR продуктите, получени от ДНК на C. m. subsp. sepedonicus, дават ясно разграничим полиморфизъм на дължината на фрагмента с ензима Bgl II след инкубиране при 37 °C за 30 минути. Ограничителните фрагменти, получени от специфичен за C. m. subsp. sepedonicus фрагмент, са 282 bp и 220 bp по размер.
2. Приготвяне на буфер за електрофореза
2.1. Бромфенолово синьо (10 % готов разтвор)
|
Бромфенолово синьо |
5 g |
|
Дестилирана вода (bidest) |
50 ml |
2.2. Буфер за електрофореза
|
Глицерол (86 %) |
3,5 ml |
|
Бромфенолово синьо (5.1) |
300 µl |
|
Дестилирана вода (bidest) |
6,2 ml |
3. 10x Триацетат EDTA (TAE) буфер, pH 8,0
|
Tris буфер |
48,4 g |
|
Ледена оцетна киселина |
11,42 ml |
|
EDTA (дикалиева сол) |
3,72 g |
|
Дестилирана вода |
1,00 L |
Разтворете до 1x преди употреба.
Налични и в търговски вид (например Invitrogen or equivalent).
Допълнение 7
Валидирани реактиви за FISH тест
1. Олигосонди
|
Cms-специфична проба CMS-CY3-01: |
5′ –ttg cgg ggc gca cat ctc tgc acg–3′ |
|
Неспецифична еубактериална проба EUB-338-FITC: |
5′–gct gcc tcc cgt agg agt–3′ |
2. Фиксиращ разтвор
[ВНИМАНИЕ! ФИКСАТОРЪТ СЪДЪРЖА ПАРАФОРМАЛДЕХИД, КОЙТО Е ТОКСИЧЕН, НОСЕТЕ РЪКАВИЦИ И НЕ ВДИШВАЙТЕ. ПРЕПОРЪЧИТЕЛНО Е ДА СЕ РАБОТИ В ИЗОЛАЦИОННА КАМЕРА]
|
i) |
Загрейте 9 ml вода за молекулярен анализ (например ултрачиста вода (UPW)) до около 60 °C и прибавете 0,4 g параформалдехид. Параформалдехидът се разтваря след прибавяне на пет капки 1N NaOH и разбъркване с магнитна бъркалка. |
|
ii) |
Нагласете pH до 7,0 чрез прибавяне на 1ml 0,1 M фосфатен буфер (PB; pH 7,0) и пет капки 1 N HCl. Проверете pH с индикаторна лентичка и го нагласете ако е необходимо с HCl or NaOH. [ВНИМАНИЕ! НЕ ИЗПОЛЗВАЙТЕ PH-МЕТЪР В РАЗТВОРИ С ПАРАФОРМАЛДЕХИД] |
|
iii) |
Филтрирайте разтвора през 0,22 µm мембранен филтър и го пазете от прах при 4 °C преди следваща употреба. |
|
iv) |
Бележка: Алтернативни фиксиращи разтвори: 96 % етанол. |
3. 3x Хибмикс
|
NaCl |
2,7 M |
|
Tris-HCl |
60 mM (pH 7,4) |
|
EDTA (филтърно стерилизирана или на автоклав) |
15 mM |
Разредете до 1x, както се изисква.
4. Хибридизационен разтвор
1x Хибмикс
|
Калиев додецил сулфат (SDS) |
0,01 % |
|
проба EUB 338 |
5 ng/μl |
|
проба CMSCY301 |
5 ng/μl |
Пригответе количествата от разтвора за хибридизация според изчисленията в таблицата. За всяко предметно стъкло (съдържащо две различни проби в дубликат) се изисква 90 μl хибридизационен разтвор.
Таблица: Примерни количества за приготвяне на хибридизационна смес.
|
|
2 препарата |
8 препарата |
|
Стерилна UPW |
50,1 |
200,4 |
|
3x хибмикс |
30,0 |
120,0 |
|
1 % SDS |
0,9 |
3,6 |
|
Сонда EUB 338 (100 ng/μl) |
4,5 |
18,0 |
|
Сонда CMSCY301 (100 ng/μl) |
4,5 |
18,0 |
|
Общ обем (μl) |
90,0 |
360,0 |
NB: Съхранявайте всички разтвори съдържащи чуствителни на светлина олигосонди на тъмно при – 20 °C. Пазете ги от пряка слънчева светлина или електрическа светлина по време на използване.
5. 0,1M Фосфатен буфер, pH 7,0
|
Na2HPO4a |
8,52 g |
|
KH2PO4 |
5,44 g |
|
Дестилирана вода |
1,00 L |
Разтворете съставките, проверете pH и стерилизирайте в автоклав при 121 °C за 15 минути.
Допълнение 8
Култура от патладжан
Посейте семена от патладжан (Solanum melongena) в пастьоризиран компост за семан. Пресадете покълнеците с напълно развити семедели (10—14 дни) в пастьоризиран компост за засаждане.
Патладжанените растения трябва да са развъждат в оранжерия със следните условия на средата:
|
Продължителност на деня: |
|
14 часа или естествена дневна продължителност, ако тя е по-голяма; |
|
Температура: |
дневна |
21—24 °C, |
|
нощна: |
15 °C. |
|
Чуствителни сортове патладжан: |
„Black Beauty“, |
|
„Long Tom“, |
|
|
„Rima“, |
|
|
„Balsas“ |
Доставчик: виж интернет страницата http://forum.europa.eu.int/Public/irc/sanco/Home/main
Допълнение 9
Грам щам процедура (поправка на Hucker's) (Doetsch, 1981) (4)
Разтвор на кристално виолетово
Разтворете 2 g кристално виолетово в 20 ml 95 % етанол.
Разтворете 0,8 g амониев оксалат в 80 ml дестилирана вода.
Смесете двата разтвора.
Луголов йодин
|
Йодин |
1 g |
|
Калиев йодид |
2 g |
|
Дестилирана вода |
300 ml |
Смелете твърдите части заедно в хаванче с чукало. Добавете към водата и разбъркайте за да разтворите в затворен съд.
Шафранинов разтвор за обагряне
Готов разтвор:
|
Шафранин O |
2,5 g |
|
95 % етанол |
100 ml |
Разбъркайте и съхранете.
Разредете 1:10 за да получите работен разтвор.
Багрилна процедура
|
1. |
Пригответе натривки, изсушете на въздух и фиксирайте с топлина. |
|
2. |
Залейте предметното стъкло с разтвор на кристално виолетово за 1 минута. |
|
3. |
Изплакнете бързо на чешмяна вода. |
|
4. |
Залейте с луголов йодин за 1 минута. |
|
5. |
Изплакнете на чешмяна вода и попийте. |
|
6. |
Обезцветете с 95 % етанол, като добавяте внимателноq докато не се извлича повече цвят или имерсирайте с леко разклащане за 30 секунди. |
|
7. |
Изплакнете на чешмяна вода и попийте. |
|
8. |
Залейте с шафранинов разтвор до 10 секунди. |
|
9. |
Изплакнете на чешмяна вода и попийте. |
Грам положителните бактерии се оцветяват във виолетово-синьо; грам отрицателните бактерии се оцветяват в розово-червено.
ЛИТЕРАТУРА
|
1. |
Anonymous, 1987. Scheme of the detection and diagnosis of the ring rot bacterium Corynebacterium sepedonicum in batches of potato tubers. Commission of the European Communities, Luxembourg. Publ EUR 11288 EN, 21 pp. |
|
2. |
Bradbury, J. F., 1970. Isolation and preliminary study of bacteria from plants. Rev. Pl. Path., 49, 213-218. |
|
3. |
Dinesen, I. G., 1984. The extraction and diagnosis of Corynebacterium sepedonicum from diseased potato tubers. EPPO Bull. 14 (2), 147-152. |
|
4. |
Doetsch, R. N., 1981. Determinative methods of light microscopy. In: Manual of methods for general bacteriology, American Society for Microbiology, Washington, 21-23. |
|
5. |
Hugh, R. and Leifson, F., 1953. The taxonomic significance of fermentative versus oxidative metabolism of carbohydrates by various gram-negative bacteria. J. Bact., 66, 24-26. |
|
6. |
Janse, J. D., 1991. Infra- and intra-specific classification of Pseudomonas solanacearum strains using whole cell fattyacid analysis. Systematic and Applied Microbiology 14; 335-345. |
|
7. |
Janse, J. D. and J. Van Vaerenbergh. The interpretation of the EC method for the detection of latent ring rot infections (Corynebacterium sepedonicum) in potato. EPPO Bull., No 17, 1987, pp. 1-10. |
|
8. |
Jansing, H. and K. Rudolph, 1998. Physiological capabilities of Clavibacter michiganensis ssp. sepedonicus and development of a semi-selective medium. Journal of Plant Diseases and Protection, 105, 590-601. |
|
9. |
Kovacs, N., 1956. Identification of Pseudomonas pyocyanea by the oxidase reaction. Nature, Lond., 178, 703. |
|
10. |
Klement Z.; Rudolph, K and D. C. Sands, 1990. Methods in Phytobacteriology. Akademiai Kiado, Budapest, 568 pp. |
|
11. |
Lelliott, R. A., 1966. The plant pathogenic coryneform bacteria. J. appl. Bact., 29, 114-118. |
|
12. |
Lelliott, R. A., E. Billing and A. C. Hayward, 1966. A determinative scheme for the fluorescent plant pathogenic pseudomonads J. appl. Bact., 29, 470-489. |
|
13. |
Lelliott, R. A. and P. W., Sellar, 1976. The detection of latent ring rot (Corynebacterium sepedonicum (Spiek. et Kotth.) Skapt. et Burkh.) in potato stocks. EPPO Bull., 6 (2), 101-106. |
|
14. |
Li, X. and S.H. de Boer, 1995. Selection of Polymerase Chain Reaction primers from RNA intergenic spacer region for specific detection of Clavibacter michiganensis ssp sepedonicus. Phytopathology, 85, 837-842. |
|
15. |
Mills, D., Russell, B., W. and J., W. Hanus, 1997. Specific detection of Clavibacter michiganensis ssp. sepedonicusby amplification of three unique DNA sequences isolated by subtraction hybridization. Phytopathology, 87, 8, 853-861. |
|
16. |
Pastrik, K.-H. and R.A. Rainey. 1999. Identification and differentiation of Clavibacter michiganensis subspecies by polymerase chain reaction-based techniques. J. Phytopathology 147; 687-693. |
|
17. |
Pastrik, K.-H., 2000. Detection of Clavibacter michiganensis ssp. sepedonicus in potato tubers by multiplex PCR with coamplification of host DNA. European Journal of Plant Pathology, 106, 155-165. |
|
18. |
Ramamurthi, C. S., 1959. Comparative studies on some Gram-positive phytopathogenic bacteria and their relationship to the Corynebacteria. Mem. Cornell agric. Exp. Sta., 366, 52 pp. |
|
19. |
Schaad, W., Berthier-Schaad, Y., Sechler, A. and Knorr, D. (1999) Detection of Clavibacter michiganensis subsp. sepedonicusin potato tubers by BIO-PCR and an automated real-time fluorescence detection system. Plant Disease 83; 1095.1100. |
|
20. |
Schaad, W. 2001. Laboratory guide for identification of plant pathogenic bacteria. Schaad [Hrsg.]. . 3. ed.; St. Paul, Minnesota:, 373 pp. |
|
21. |
Skerman, V. B. D., 1967. A guide to the identification of the genera of bacteria. 2nd ed., William and Wilkins Company, Baltimore. |
|
22. |
Smith, N. C.; Hennesy, J; Stead, D.E., 2001. Repetetive sequence-derived PCR profiling using the BOX-A1 Ralstonia solanacearum primer for rapid identification of plant pathogen Clavibacter michiganensis ssp. sepedonicus. European Journal of Plant Pathology, 107 (7), 739-748. |
|
23. |
Sneath, P. H. A. and V. G. Collins, 1974. A study in test reproductibility between laboratories: report of Pseudomonas working party. Antonie van Leeuwenhoek, 40, 481-527. |
|
24. |
Stead, D.E. 1992. Grouping of plant pathogenic and some other Pseudomonas spp. using cellular fatty-acid profiles. International Journal of Systematic Bacteriology 42; 281-295. |
|
25. |
Wullings, B. A.; van Beuningen, A. R.; Janse, J. D. and A. D. L. Akkermans, 1998. Detection of Ralstonia solanacearum, which causes brown rot of potato, by fluorescent in situ hybridization with 23s rRNA-targeted probes. Appl. Environ. Microbiol. 64, 4546-4554. |
(1) Учени за контакт: виж интернет страницата http://forum.europa.eu.int/Public/irc/sanco/Home/main
(*) За употреба при хомогенизиращия метод за екстракция.
(2) Методите са били валидирани чрез използване на Taq полимераза от Perkin Elmer (AmpliTaq или Gold) и Gibco BRL.
(3) Концентрацията на праймерите NS-7 F и NS-8-R е била оптимизирана за екстракцията на конусчетата, като се използва метода на хомогенизиране и пречистване на ДНК според Pastrik (2000) (виж раздел 6.1, буква a) и 6.2). Реоптимизиране на концентрациите от реактивите ще се изисква ако са използвани екстракция чрез разклащане или други методи за изолиране.
(4) Могат да се използват и търговски разтвори и комплекти за оцветяване.
ПРИЛОЖЕНИЕ II
|
1. |
За всяко предполагаемо наличие, за което е бил определен положителен резултат от скрининг теста/овете според методите, описани в приложение I, и за което се очаква потвърждение или опровержение чрез упоменатите методи, трябва да има задържане и подходящо съхраняване на:
до зъвършването на упоменатите методи. Задържането на клубените ще позволи да се извърши сортоизпитване, ако е необходимо. |
|
2. |
В случай на положително потвърждение на организма, трябва да има задържане и подходящо съхраняване на
изолираната култура от организма, най-малко до един месец след процедурата по нотификация съгласно член 5, параграф 2. |
ПРИЛОЖЕНИЕ III
|
1. |
Елементите, които трябва да вземат предвид при определянето на степента на възможното заразяване съгласно член 5, параграф 1, буква б) трябва да включват:
|
|
2. |
Елементите, които трябва да бъдат взети предвид при определянето на възможното разпространение съгласно член 5, параграф 1, буква в), трябва да включват:
|
|
3. |
Нотификацията, посочена в 5, параграф 2, първа алинея, трябва да бъде изпратена, както следва:
Комисията трябва да бъде уведомявана незабавно, след като тази информация е била предоставена.
|
ПРИЛОЖЕНИЕ IV
|
1. |
Официално съблюдаваните мерки, цитирани в член 7, параграф 1, трябва да са:
Всички оставащи отпадъци, свързани или произлизащи от горните, трябва да бъдат съхранявени по официално одобрените методи в съответствие с приложение V към настоящата директива. |
|
2. |
Правилната употреба или изхвърляне на клубени или растения, определени като вероятно заразени съгласно член 5, параграф 1, буква б) и назовани в член 7, параграф 2, под контрола на официално отговорните органи на заинтересованите държави-членки, с правилната комуникация между официално отговорните органи да гарантира такъв контрол през цялото време и одобрение от официално отговорните органи на държавата-членка, където ще се опаковат или преработват картофите по отношение на съоръжения за съхранение на отпадъците, цитирани в първо и второ тире, трябва да са:
|
|
3. |
Правилните методи за почистване и дезинфекциране на предметите, цитирани в член 7, параграф 3, трябва да бъдат тези, за които е било установено, че няма идентифицируем риск от разпространение на организма и ще бъдат използвани съгласно надзора на официално отговорни органи на държавите-членки. |
|
4. |
Серията от мерки, които да бъдат изпълнявани от държавите-членки в рамките на демаркираната зона, установена съгласно член 5, параграф 1, буква в) и цитирани в член 7, параграф 4, трябва да включват:
|
ПРИЛОЖЕНИЕ V
Официално одобрените методи за отлагане на отпадъците, посочени в приложение IV, точка 1, трябва да отговарят на следните разпоредби, така че да се избегне всякакаъв идентифицируем риск от разпространение на организма:
|
i) |
отпадъци от картофи (включително изхвърлените картофи и обелки) и всякакви други твърди отпадъци, свързвани с картофите (включително почва, камъни и други остатъци), трябва да бъдат изхвърляни чрез,
|
|
ii) |
течни отпадъци: преди отлагането им течните отпъдъци, съдържащи утаени твърди частици, трябва да бъдат подложени на филтрация или разделителен процес, за да се отстранят тези твърди частици. Тези твърди частици трябва да бъдат отложени така, както е определено в i). Течните отпадъци трябва следователно да бъдат:
|
Възможностите, описани в настоящото приложение, също се прилагат за отпадъците, свързани с боравенето, преработката и отлагането на замърсените пратки.