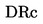EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 31988L0302
Commission Directive 88/302/EEC of 18 November 1987 adapting to technical progress for the ninth time Council Directive 67/548/EEC on the approximation of laws, regulations and administrative provisions relating to the classification, packaging and labelling of dangerous substances
Директива на Комисията от 18 ноември 1987 година относно девето адаптиране към техническия прогрес на Директива 67/548/EИО на Съвета за сближаване на законовите, подзаконовите и административните разпоредби относно класификацията, опаковането и етикетирането на опасни вещества
Директива на Комисията от 18 ноември 1987 година относно девето адаптиране към техническия прогрес на Директива 67/548/EИО на Съвета за сближаване на законовите, подзаконовите и административните разпоредби относно класификацията, опаковането и етикетирането на опасни вещества
OJ L 133, 30.5.1988, p. 1–127
(ES, DA, DE, EL, EN, FR, IT, NL, PT)
Special edition in Finnish: Chapter 15 Volume 014 P. 3 - 129
Special edition in Swedish: Chapter 15 Volume 014 P. 3 - 129
Special edition in Czech: Chapter 13 Volume 009 P. 90 - 216
Special edition in Estonian: Chapter 13 Volume 009 P. 90 - 216
Special edition in Latvian: Chapter 13 Volume 009 P. 90 - 216
Special edition in Lithuanian: Chapter 13 Volume 009 P. 90 - 216
Special edition in Hungarian Chapter 13 Volume 009 P. 90 - 216
Special edition in Maltese: Chapter 13 Volume 009 P. 90 - 216
Special edition in Polish: Chapter 13 Volume 009 P. 90 - 216
Special edition in Slovak: Chapter 13 Volume 009 P. 90 - 216
Special edition in Slovene: Chapter 13 Volume 009 P. 90 - 216
Special edition in Bulgarian: Chapter 13 Volume 008 P. 80 - 206
Special edition in Romanian: Chapter 13 Volume 008 P. 80 - 206
Special edition in Croatian: Chapter 13 Volume 021 P. 29 - 30
 No longer in force, Date of end of validity: 31/05/2015; заключение отменено от 32008R1272
No longer in force, Date of end of validity: 31/05/2015; заключение отменено от 32008R1272
- Date of document:
- 18/11/1987
- Date of effect:
- 24/11/1987; влизане в сила дата на оповестяване
- Date of notification:
- 24/11/1987
- Date of transposition:
- 31/12/1988; най - късно виж чл. 2
- Date of end of validity:
- 31/05/2015; заключение отменено от 32008R1272
- Author:
- Европейска комисия
- Form:
- Директива
- Addressee:
- Дванадесетте държави-членки: Белгия, Дания, Германия, Ирландия, Гърция, Испания, Франция, Италия, Люксембург, Нидерландия, Португалия, Обединеното кралство
- Additional information:
- разширяване на ЕИП от 21994A0103(01), изменяща директива
- Authentic language:
- испански, датски, немски, гръцки, английски, френски, италиански, нидерландски, португалски, исландски, норвежки
- Treaty:
- Договор за създаване на Европейската икономическа общност
- Legal basis:
-
- 31967L0548 - A19
- Link
- Link
- Link
- Select all documents mentioning this document No data available in the table
- Modifies:
-
Relation Act Comment Subdivision concerned From To Modifies 31967L0548 изпълнение приложение 5 24/11/1987
No data available in the table
- Modified by:
-
Relation Act Comment Subdivision concerned From To Corrected by 31988L0302R(01) (DA, DE, EL, EN, ES, FR, IT, NL, PT) Modified by 31992L0069 поправка приложение Implicitly repealed by 32008R1272 01/06/2015 - Instruments cited:
- Link
- EUROVOC descriptor:
- Subject matter:
- Directory code:
|
13/ 08 |
BG |
Официален вестник на Европейския съюз |
80 |
31988L0302
|
L 133/1 |
ОФИЦИАЛЕН ВЕСТНИК НА ЕВРОПЕЙСКИЯ СЪЮЗ |
ДИРЕКТИВА НА КОМИСИЯТА
от 18 ноември 1987 година
относно девето адаптиране към техническия прогрес на Директива 67/548/EИО на Съвета за сближаване на законовите, подзаконовите и административните разпоредби относно класификацията, опаковането и етикетирането на опасни вещества
(88/302/EИО)
КОМИСИЯТА НА ЕВРОПЕЙСКИТЕ ОБЩНОСТИ,
като взе предвид Договора за създаване на Европейската икономическа общност,
като взе предвид Директива 67/548/EИО на Съвета от 27 юни 1967 г. за сближаване на законовите, подзаконовите и административните разпоредби относно класификацията, опаковането и етикетирането на опасни вещества (1), изменена за шести път с Директива 79/831/EИО (2), и по-специално член 19 от нея,
като има предвид, че член 3, параграф 1 от Директива 67/548/EИО предвижда, че физико-химичните свойства, токсичността и екотоксичността на веществата и препаратите се определят в съответствие с методите, посочени в приложение V;
като има предвид, че член 3, параграф 2 от Директива 67/548/EИО предвижда, че действителната или потенциална опасност на дадено вещество или препарат за околната среда се преценява в съответствие с характеристиките, посочени в приложения VII и VIII;
като има предвид, че приложение V към версията, въведена с Директива 84/449/EИО на Комисията (3), понастоящем описва само тези методи за изпитване, които съответстват на характеристиките, изброени в приложение VII, и че е необходимо освен това да бъдат описани методи за изпитване, съответстващи на характеристиките, изброени в приложение VIII;
като има предвид, че разпоредбите в настоящата директива са в съответствие със становището на Комитета по адаптиране към техническия прогрес на директивите за премахване на техническите пречки при търговията с опасни вещества и препарати,
ПРИЕ НАСТОЯЩАТА ДИРЕКТИВА:
Член 1
Текстът на приложението към настоящата директива допълва текста на приложение V към Директива 67/548/EИО.
Член 2
Държавите-членки приемат и публикуват разпоредбите, необходими за да се съобразят с настоящата директива, преди 31 декември 1988 г. и незабавно информират Комисията за това. Те прилагат тези разпоредби най-късно до 30 юни 1989 г.
Член 3
Адресати на настоящата директива са държавите-членки.
Съставено в Брюксел на 18 ноември 1987 година.
За Комисията
Stanley CLINTON DAVIS
Член на Комисията
(1) ОВ 196, 16.8.1967 г., стр. 1/67.
(2) ОВ L 259, 15.10.1979 г., стр. 10.
(3) ОВ L 251, 19.9.1984 г., стр. 1.
ПРИЛОЖЕНИЕ
Методите за изпитване, описани в настоящото приложение, са предназначени за определяне на някои токсикологични и екотоксикологични свойства, изброени в приложение VIII към Директива 79/831/EИО на Съвета. Описани са методите за изпитване, подходящи за ниво 1 и ниво 2 от приложение VIII, но изпитванията не са подразделени като функция на различните нива.
СЪДЪРЖАНИЕ
ЧАСТ Б: Методи за определяне на токсичността …
Общо въведение: Част Б…
Изпитване за субхронична орална токсичност: 90-дневни многократни орални дози при гризачи …
Изпитване за субхронична орална токсичност: 90-дневни многократни орални дози при видове, различни от гризачи …
Изпитване за субхронична дермална токсичност: 90-дневни многократни дермални дози при гризачи…
Изпитване за субхронична инхалационна токсичност: 90-дневни многократни инхалационни дози при гризачи …
Изпитване за тератогенност – гризачи и видове, различни от гризачи …
Изпитване за хронична токсичност …
Изпитване за канцерогенност …
Комбинирано изпитване за хронична токсичност/канцерогенност …
Изпитване за репродуктивна токсичност върху едно поколение…
Изпитване за репродуктивна токсичност върху две поколения …
Токсикокинетика …
Изпитване за мутагенност и пресяващо изпитване за канцерогенност…
|
— |
Генна мутация — Saccharomyces cerevisiae … |
|
— |
Митотична рекомбинация — Saccharomyces cerevisiae … |
|
— |
Изпитване in vitro за генни мутации в клетки от бозайници … |
|
— |
Увреждане и репарация на ДНК — непланиран синтез на ДНК — клетки от бозайници in vitro … |
|
— |
Изпитване in vitro за обмени на сестрински хроматиди… |
|
— |
Изпитване за полово свързана рецесивна леталност при Drosophila melanogaster… |
|
— |
Изпитвания in vitro за трансформации в клетки от бозайници … |
|
— |
Изпитване за доминантна леталност при гризачи … |
|
— |
Цитогенетични изпитвания in vivo на зародишни клетки от бозайници … |
|
— |
Изпитване за петна по козината при мишки … |
|
— |
Наследствени транслокации при мишки… |
ЧАСТ В: Методи за определяне на токсичността за околната среда …
Общо въведение: Част В…
Изпитване за потискане растежа на водорасли…
Токсичност за земни червеи: Изпитване в изкуствена почва …
Биологично разграждане: Изпитване по Zahn — Wellens …
Биологично разграждане: Изпитвания за симулиране на активирана утайка …
Биологично разграждане: Изпитване за потискане дишането на активирана утайка …
Биологично разграждане: Модифицирано SCAS изпитване…
ЧАСТ Б: МЕТОДИ ЗА ОПРЕДЕЛЯНЕ НА ТОКСИЧНОСТТА
ОБЩО ВЪВЕДЕНИЕ: ЧАСТ Б
ПРОДЪЛЖИТЕЛНИ ИЗПИТВАНИЯ
Изпитвания за субхронична и хронична токсичност и канцерогенност
Характеризиране на изпитваното вещество и на сместа за третиране
Преди започване на всяко изпитване за токсичност трябва да бъдат известни съставът на изпитваното вещество, включително основните примеси, и съответните му физико-химични свойства, включително стабилността му.
Физико-химичните свойства на изпитваното вещество предоставят важна информация за избор на начина на прилагане, проекта на изпитванията за субхронична, хронична токсичност и канцерогенност и за съхраняването и работата с изпитваното вещество.
Информацията за химичната структура и физико-химичните свойства може да представлява и показател за абсорбционните характеристики на планирания начин на прилагане и за възможното метаболитно и тъканно разпределение. Информация за токсикокинетичните параметри може да има и от предшестващи изпитвания за токсичност и токсикокинетика.
Началото на изпитването трябва да бъде предшествано от разработване на аналитичен метод за качествено и количествено определяне на изпитваното вещество (включително основните примеси, когато това е възможно) в средата за дозиране и в биологичния материал.
Експериментални животни: избор на вид и порода
Налице е тенденция изпитванията да бъдат ограничени до експериментални видове, които се отглеждат лесно и имат сравнително кратък живот, тъй като е необходимо животните да бъдат третирани през голямата част от живота им. Желателно е да бъде известна честотата на спонтанните заболявания и туморите при използваната порода животни, когато се отглеждат при сходни условия.
Породите трябва да бъдат добре характеризирани и да нямат вродени дефекти, които да оказват влияние. Употребата на близкородствено кръстосани породи от Fl –хибриди в това отношение има някои предимства, но когато са налице достатъчно минали данни за близкородствено кръстосаните породи при животни, получени от затворени стада, такива са приемливи.
Грижи за животните, хранене и поене
Изпитванията и проучванията върху животни се провеждат в съответствие с националните разпоредби и се вземат предвид принципите на хуманността и международните разработки в областта на хуманното отношение към животните.
За получаване на значими резултати са задължителни строг контрол върху условията на околната среда и правилните техники за грижи за животните. Фактори като условия на настаняване, съпътстващи интеркурентни заболявания, медикаментозно лечение, примеси в храната, водата и мястото за спане, както и общите съоръжения за грижи за животните, могат да повлияят в значителна степен на изхода от изпитванията с многократни дози. Обикновено трябва да бъде известен ефектът на химичните стерилизиращи средства върху изпитването.
Диетата трябва да отговаря на всички хранителни нужди за изследвания вид и не трябва да съдържа примеси, които могат да окажат влияние върху изхода от изпитването. Гризачите трябва да се хранят и поят ad libitum, като храната трябва да се сменя поне един път седмично. В момента се използват три типа диети: конвенционална, синтетична, както и различни диети с отворени формули.
Независимо каква диета е избрана доставчиците трябва да проверяват хранителната стойност и нивото на замърсителите в основната диета посредством периодичен мониторинг и да предоставят тази информация на лабораторията заедно с всяка партида храна. Много е желателно да са известни ефектите на хранителния режим върху метаболизма, а също и върху развитието на тумори и дълголетието на животните
Допълнително в изследователската лаборатория може да се провеждат анализи за проверка на основната диета както за хранителните компоненти, така и за случайни замърсители, включително канцерогени. Ако това се прави, резултатите от анализите трябва да бъдат съхранени и включени в заключителния протокол за всяко изпитвано вещество.
Обичайните хранителни съставки, за които е известно, че оказват влияние върху канцерогенезата (например антиоксиданти, ненаситени мастни киселини, селен), не трябва да присъстват в пречещи концентрации. Потенциалното влияние на някои обичайни хранителни замърсители върху оценката на канцерогенезата изисква да се обръща специално внимание върху наличието на остатъци от пестициди, хлорорганични съединения, полициклични ароматни въглеводороди, естрогени, тежки метали, нитрозамини и микотоксини в храната.
Изпитванията за стабилност са изключително важни, когато изпитваното вещество се прилага във водата или храната. За установяване честотата на приготвяне на храната и необходимия мониторинг се използват правилно проведени изпитвания за стабилност и хомогенност преди изпитванията за многократни дози.
Когато храната се стерилизира, ефектите от тази процедура върху изпитваното вещество и хранителните съставки трябва да бъдат известни. Трябва да бъдат направени всички необходими промени.
По време на изпитвания за канцерогенност изследователите трябва да са наясно с потенциалните замърсители в използваната вода. Обикновено водата, която е одобрена за консумация от хора, е на задоволително равнище и трябва да има информация за нейния състав.
Може да се наложи концентрацията на дадено изпитвано вещество в диетата да бъде променена, тъй като животните растат така, че да се поддържа сравнително постоянен прием на изпитваното вещество по отношение на телесното тегло.
Хранителната стойност на контролните и изпитваните диети трябва да бъде колкото е възможно по-сходна. Трябва да се има предвид хранителната стойност на изпитваното вещество, което е смесено с храната. Въз основа на опита може да се предполага, че съдържание на нехранителни вещества в диетата до 5 % е малко вероятно да окаже значимо влияние върху нейната хранителна стойност.
1. Инхалационни изпитвания
Не е посочено гранично изпитване, тъй като се оказва невъзможно определянето на една-единствена гранична стойност за инхалационна експозиция.
2. Изпитване за тератогенност
Изпитването е насочено главно към прилагане по орален път. Алтернативно могат да се използват други пътища на прилагане в зависимост от физичните свойства на изпитваното вещество или вероятния начин на експозиция при хора. В такива случаи методът за изпитване трябва да бъде адаптиран по подходящ начин, като се вземат предвид съответните елементи на 28-дневните методи за изпитване.
3. Токсикокинетика
Токсикокинетичните изпитвания подпомагат интерпретирането и оценката на данните за токсичността. Предназначението на тези изпитвания е да изяснят конкретни аспекти на токсичността на изпитваното химическо вещество и резултатите могат да подпомогнат проектирането на допълнителни изпитвания за токсичност. Не се предвижда необходимостта да бъдат определяни всички параметри за всеки един случай. Пълната серия токсикокинетични изпитвания (абсорбция, екскреция, разпределение и метаболизъм) ще бъде необходима само в редки случаи. За определени съединения може да се препоръчат промени в тази серия или да е достатъчно изпитване с единична доза.
Определения
|
Токсикокинетика: |
изучаване на абсорбцията, разпределението, метаболизма и екскрецията на изпитваните вещества; |
|
Абсорбция: |
процесът(ите), чрез който (които) приложеното вещество попада в организма; |
|
Екскреция: |
процесът(ите), чрез който (които) приложеното вещество и/или неговите метаболити се отстраняват от организма; |
|
Разпределение: |
процесът(ите), чрез който (които) приложеното вещество и/или неговите метаболити се разделят в организма; |
|
Метаболизъм: |
процесът(ите), чрез който (които) структурата на приложените вещества се изменя в организма посредством ензимни или неензимни реакции. |
4. Изпитване на остра и подостра токсичност при втори вид
Целта на изпитването при втори вид е да допълни изводите, направени при първия вид.
По време на изпитване при втори вид може да се използва методът за изпитване, който вече е описан, или той може да бъде адаптиран за по-малък брой животни.
5. Изпитвания за плодовитост
Когато е необходимо изпитване за размножаването в три поколения, описаният метод за изпитване на размножаване в две поколения може да бъде разширен така, че да покрие трето поколение.
6. Изпитвания за мутагенност
Допълнителни изпитвания за мутагенност, включително пресяващи изпитвания за канцерогенност
В приложение VIII към директивата са споменати допълнителни изпитвания за по-нататъшно проучване на мутагенността или за предварително пресяващо изпитване за канцерогенност. Изпитванията, които са изложени схематично в този раздел, обикновено могат да се използват за проучване и на двата аспекта.
Въведение
Първоначалната оценка на мутагенната активност на едно вещество се състои от изпитвания за генни (точкови) мутации при бактерии и за цитогенетични увреждания в клетки на бозайници (in vitro или in vivo). По-горе бяха описани методи, подходящи за този „основен набор“ изпитвания. Настоящият раздел се отнася до допълнителни изпитвания, които са подходящи за потвърждаване и/или разширяване на резултатите, получени при основния набор, и които могат да се използват за голям брой цели:
|
1. |
за потвърждаване на резултатите, получени при основния набор; |
|
2. |
за изпитване на крайните точки, които не са проучвани при основния набор; |
|
3. |
за започване или разширяване на проучвания in vivo. |
За тези цели диапазонът на описаните тестове включва еукариотни системи, както in vitro, така и in vivo, а също разширен диапазон биологични крайни точки. Тестовете предоставят информация за точковите мутации в организми, които са по-сложни от бактериите, използвани в основния набор, и разширяват информацията за способността на веществото да предизвиква хромозомни аберации.
Описани са и изпитвания за крайни точки, които са различни от точкови мутации и хромозомни аберации. Те предоставят допълнителна информация и при необходимост могат да бъдат използвани в схемите за изпитване.
Като общ принцип, когато се има предвид програма за допълнителни изпитвания за мутагенност, тя трябва да бъде проектирана така, че да предоставя съответна допълнителна информация за мутагенния и/или канцерогенния потенциал на веществото.
Действителните изпитвания, които може да са подходящи в конкретен случай, ще зависят от многобройни фактори, включително химичните и физичните характеристики на веществото, резултатите от първоначалните бактериални и цитогенетични изпитвания, метаболитния профил на веществото, резултатите от други изпитвания за токсичност и известните приложения на веществото. Следователно, като се има предвид разнообразието на факторите, които може да се наложи да се вземат под внимание, строгата програма за избор на изпитвания не е целесъобразна. Някои общи принципи обаче могат да послужат като ръководство. Ако изпитване от основния набор се окаже положително, допълнителните изпитвания трябва да включват поне един метод, който може да открие същата генетична крайна точка. Ако и двете изпитвания от основния набор са отрицателни, обикновено като допълнителни проучвания трябва да се проведат изпитване за генни мутации и изпитване за хромозомни аберации. Може да е целесъобразно да се получат и допълнителни данни от индикаторните изпитвания (както са изброени по-долу).
Методите за такива изпитвания са групирани по-долу въз основа на тяхната първостепенна генетична крайна точка.
Изпитвания за генни (точкови) мутации
За допълнително изпитване на потенциала на веществото да предизвиква генни (точкови) мутации, може да са целесъобразни един или повече от следните методи:
|
a) |
Изпитвания за прави или обратни мутации с еукариотни микроорганизми (Saccharomyces cerevisiae). |
|
б) |
Изпитвания in vitro за прави мутации в клетки на бозайници. |
|
в) |
Изпитване за полово свързана леталност при Drosophila melanogaster. |
|
г) |
Изпитване in vivo за мутации в соматични клетки: изпитване за петна по козината при мишки. |
Изпитвания за хромозомни аберации
За допълнително изпитване на потенциала на веществото да предизвиква хромозомни аберации, може да е целесъобразен един от следните два метода:
|
a) |
Цитогенетични изпитвания in vivo при бозайници; Ако не е бил включен в първоначалната оценка („основен набор“ изпитвания), трябва да се предвиди метафазен анализ на костномозъчни клетки in vivo. Допълнително може да се направят и цитогенетични изпитвания in vivo на зародишни клетки. |
|
б) |
Цитогенетични изпитвания in vitro на клетки на бозайници, ако не са включени в първоначалната оценка; |
|
в) |
Изпитвания за доминантна леталност при гризачи; |
|
г) |
Изпитване за наследствени транслокации при мишки. |
Индикаторни изпитвания за ефекти върху ДНК
Съществуват методи, които представляват индикатор за някои ефекти върху ДНК, но които нямат за „крайна точка“ мутагенно явление. Тези изпитвания могат да предоставят информация, която допълва информацията, получена от изпитванията за мутагенност, и която може да бъде полезна за интерпретирането на такива изпитвания. Когато съществува необходимост от тези изпитвания, може да бъде подходящ един или друг от следните методи с използване на еукариотни микроорганизми или клетки на бозайници:
|
a) |
Митотична рекомбинация при Saccharomyces cerevisiae; |
|
б) |
Увреждане и репарация на ДНК — непланиран синтез на ДНК — клетки от бозайници (in vitro); |
|
в) |
Обмен на сестрински хроматиди в клетки от бозайници (in vitro). |
Други индикаторни изпитвания за канцерогенен потенциал
Съществуват трансформационни изпитвания на клетки от бозайници, с помощта на които се определя способността за предизвикване на морфологични и поведенчески изменения в клетъчна култура, за които се смята, че са свързани със злокачествено трансформиране in vivo. Могат да се използват голям брой различни типове клетки и критерии за трансформиране.
Оценка на риска от наследствени ефекти при бозайници
Съществуват методи за определяне като цяло на наследствените ефекти при бозайници, които са предизвикани от генни (точкови) мутации (изпитване за специфичен локус при мишки (1) или от хромозомни аберации (изпитване за наследствени транслокации при мишки). Такива методи може да се използват при оценяване на възможния генетичен риск на дадено вещество за човека. Като се имат предвид сложността на тези методи и големият брой необходими животни обаче, особено за изпитването за специфичен локус, е необходимо добро обосноваване преди провеждане на тези изпитвания.
ИЗПИТВАНЕ ЗА СУБХРОНИЧНА ОРАЛНА ТОКСИЧНОСТ
90-ДНЕВНИ МНОГОКРАТНИ ОРАЛНИ ДОЗИ ПРИ ГРИЗАЧИ
1. МЕТОД
1.1. Въведение
Виж общо въведение, част Б.
1.2. Определения
Виж общо въведение, част Б.
1.3. Вещества за сравнение
Няма.
1.4. Принцип на метода за изпитване
Изпитваното вещество се прилага ежедневно, по орален път, в нарастващи дози, върху няколко групи експериментални животни, по една доза за група, в продължение на 90 дни. По време на прилагането животните се наблюдават ежедневно, за да се открият признаци на токсичност. Животните, които умират по време на изпитването, се подлагат на аутопсия, а преживелите животни се подлагат на аутопсия при приключване на изпитването.
1.5. Критерии за качество
Няма.
1.6. Описание на метода за изпитване
Подготовка
Животните се държат при експериментални условия на настаняване и хранене в продължение поне на пет дни преди изпитването. Преди изпитването здрави млади животни се избират на случаен принцип и се разпределят в третирани и контролни групи.
Изпитваното вещество може да се прилага с храната, чрез сонда, в капсули или в питейната вода. Определянето на дозите при всички животни трябва да се извършва по един и същ метод по време на целия експеримент. Ако за подпомагане на дозирането се използват неактивно вещество или други добавки, трябва да е известно, че те не водят до токсични ефекти. Ако е необходимо, могат да се използват исторически данни.
Условия на изпитване
Експериментални животни
Предпочитаният вид е плъх, ако няма противопоказания. Трябва да се използват млади здрави животни от широко използвани лабораторни породи, като в идеалния случай дозирането трябва да започне преди плъховете да достигнат шестседмична възраст, но във всички случаи, преди да навършат осем седмици. При започване на изпитването колебанията в теглото на животните не трябва да превишават ± 20 % от средната му стойност. Когато изпитването за субхронична орална токсичност се провежда като предварително проучване преди продължително изпитване, и при двете изпитвания трябва да се използват същият вид и порода.
Брой и пол
За всяко ниво на дозиране трябва да се използват поне 20 животни (10 женски и 10 мъжки). Женските животни трябва да са нераждали и да не са бременни. Ако се планират междинни жертви, броят трябва да бъде увеличен съответно с броя животни, които са планирани за пожертване преди завършване на изпитването. Освен това една сателитна група от 20 животни (по 10 животни от пол) може да бъде третирана с високо ниво на дозиране в продължение на 90 дни и да бъде наблюдавана в продължение на 28 дни след третирането за обратимост, запазване или забавена проява на токсичните ефекти.
Нива на дозиране
Трябва да се използват поне три нива на дозиране и една контрола. С изключение на третирането с изпитваното вещество, животните от контролната група трябва да бъдат третирани по идентичен начин с животните от изпитваните групи. Когато за подпомагане на дозирането трябва да се използва помощно вещество, дозирането на носителя при контролните животни трябва да бъде същото, както при третираните групи, а контролните животни трябва да получават същото количество носител като това, което получава групата, третирана с най-високата доза. Най-високото ниво на дозиране трябва да води до токсични ефекти, но да не предизвиква или да предизвиква малък брой фатални изходи. Най-ниското ниво на дозиране не трябва да предизвиква никакви признаци на токсичност. Когато съществува оценка на нивото на експозиция при хора, която може да се използва, най-ниското ниво на дозиране трябва да е по-високо от него. В идеалния случай междинното ниво на дозиране трябва да предизвиква минимални наблюдаеми токсични ефекти. Ако се използва повече от една междинна доза, нивата на дозиране трябва да бъдат разделени едно от друго така, че да се получи градиране на токсичните ефекти.
При групите, третирани с ниска и междинна доза, и при контролите честотата на фаталните изходи трябва да бъде ниска така, че да позволи значима оценка на резултатите.
Когато изпитваното вещество се прилага с храната, може да се използва постоянна концентрация (ppm или мг/кг храна) или постоянно ниво на дозиране по отношение телесното тегло на животното, като използваната алтернатива трябва да бъде посочена. За вещество, прилагано през сонда, дозата трябва да се дава по едно и също време всеки ден. Нивата на дозиране трябва да бъдат коригирани на интервали (на една или две седмици), за да се поддържа постоянно ниво на дозиране по отношение на телесното тегло на животното.
Гранично изпитване
Ако 90-дневното изпитване, проведено в съответствие с метода, разгледан подробно по-долу, при ниво на дозиране 1 000 мг/кг телесно тегло/ден или при по-високо ниво на дозиране, свързано с възможна експозиция при хора, когато такава е известна, не показва данни за токсични ефекти, допълнително изпитване може да не се сметне за необходимо. За вещества с ниска токсичност, прилагани с храната, е важно да се обезпечи количеството и другите свойства на съответното изпитвано вещество да не повлияват нормалните хранителни нужди.
Период на наблюдение
Всички животни трябва да бъдат наблюдавани ежедневно и признаците на токсичност да бъдат регистрирани, включително времето им на настъпване, силата и продължителността им. Трябва да се регистрират времето на смъртта и времето, по което се появяват и изчезват признаците на токсичност.
Процедура
В идеалния случай животните се дозират с изпитваното вещество седем дни в седмицата в продължение на 90 дни. Животните от всички сателитни групи, планирани за контролни наблюдения трябва да бъдат гледани в продължение на допълнителни 28 дни без третиране, за да бъдат доловени възстановяването от токсичните ефекти или запазването им.
Наблюденията в клетките трябва да включват най-вече измененията на кожата и козината, очите и лигавиците, а също дихателната, сърдечно-съдовата, автономната и централната нервна система, соматомоторната активност и начина на поведение. Ежеседмично трябва да се извършва измерване на консумацията на храна (и на консумацията на вода, когато изпитваното вещество се прилага с питейната вода) и животните трябва да се претеглят.
Редовното наблюдение на животните е необходимо, за да не се губят, доколкото е възможно, животни при изпитването поради причини като канибализъм, тъканна автолиза или преместване. В края на изпитването всички оживели животни от несателитните третирани групи се подлагат на аутопсия. Умиращите животни трябва да бъдат отстранени и подложени на аутопсия, когато бъдат забелязани.
На всички животни, включително контролните, обичайно се правят следните прегледи:
|
a) |
Преди прилагане на изпитваното вещество и при преустановяване на изпитването трябва да се проведе офталмологичен преглед с помощта на офталмоскоп или еквивалентно подходящо оборудване, за предпочитане при всички животни, но поне в групата, третирана с висока доза, и в контролната група. Ако бъдат доловени очни изменения, трябва да бъдат прегледани всички животни. |
|
б) |
В края на изпитването трябва да бъде направено хематологично изследване, включващо хематокрита, концентрацията на хемоглобина, броя на еритроцитите, общия брой на левкоцитите и диференциалното им броене и измерване на потенциала за съсирване, например време на съсирване, протромбиново време, тромбопластиново време или брой на тромбоцитите. |
|
в) |
В края на изпитването трябва да се определят клиничните биохимични параметри на кръвта. Изследвания, които се смятат за целесъобразни при всички изпитвания, са електролитният баланс, въглехидратният метаболизъм, чернодробната и бъбречната функция. Изборът на конкретни изследвания ще се повлияе от наблюденията върху механизма надействие на веществото. Препоръчва се определянето на: калций, фосфор, хлориди, натрий, калий, глюкоза на гладно (с период на гладуване, подходящ за вида), серумна глутамат-пируват трансаминаза (2), серумна глутамат-оксалоацетат трансаминаза (3), орнитин декарбоксилаза, гама-глутамил транспептидаза, уреен азот, албумин, креатинин в кръвта, общ билирубин и общ серумен белтък. Други определяния, които може да са необходими за адекватна токсикологична оценка, включват анализ на липиди, хормони, киселинно-алкално равновесие, метхемоглобин и холинестеразна активност. Когато е необходимо да бъде разширено изпитването на наблюдаваните ефекти, може да се използват допълнителни биохимични параметри. |
|
г) |
Рутинно изследване на урина не е необходимо, освен когато съществуват показания въз основа на очаквана или наблюдавана токсичност. |
Ако историческите изходни данни не са адекватни, трябва да се предвиди определяне на параметрите на кръвната картина и клиничната биохимия преди да започне дозирането.
Макроскопска аутопсия
Всички животни трябва да бъдат подложени на пълна макроскопска аутопсия, която включва преглед на външната повърхност на тялото, на всички отвори, както и на черепната, гръдната и коремната кухина и на съдържанието им. Черният дроб, бъбреците, надбъбречните жлези и тестисите трябва да бъдат претеглени във влажно състояние колкото е възможно по-бързо след дисекцията, за да се избегне изсъхването им.
Следните органи и тъкани трябва да бъдат съхранени в подходяща среда за възможно бъдещо хистопатологично изследване: всички макроскопски лезии, мозъкът — включително срези на продълговатия мозък/варолиевият мост, кората на малкия мозък и кората на главния мозък, хипофизата, щитовидната/паращитовидните жлези, цялата тимусна тъкан, трахеята и белите дробове, сърцето, аортата (слюнчените жлези), черният дроб, слезката, бъбреците, надбъбречните жлези, панкреасът, гонадите, матката (допълнителните полови органи), (кожата), хранопроводът, стомахът, дванадесетопръстникът, празното черво, хълбочното черво, сляпото черво, ободното черво, правото черво, пикочния мехур, представителен лимфен възел, (женската млечна жлеза), (бедрената мускулатура), периферен нерв, гръдната кост с костен мозък, (очи), (бедрената кост, включително ставна повърхност), (гръбначният мозък на три нива — шийно, гръдно и поясно) и (извънорбитните слъзни жлези). Тъканите, посочени в скоби, трябва да се изследват, само ако въз основа на признаци на токсичност или ангажиране на целевите органи са налице показания за това.
Хистопатологично изследване
|
a) |
Пълно хистопатологично изследване трябва да се провежда само върху органи и тъкани на животни от контролната група и групата, третирана с висока доза. |
|
б) |
Всички макроскопски лезии трябва да бъдат изследвани. |
|
в) |
Целевите органи трябва да бъдат изследвани и в другите дозирани групи. |
|
г) |
Белите дробове на животните от групите, третирани с ниска и междинна доза, трябва да бъдат подложени на хистопатологично изследване за данни за инфекция, тъй като това дава възможност за лесно оценяване на здравословното състояние на животните. При тези групи трябва да се предвиди и хистопатологично изследване на черния дроб и бъбреците. При животни от тези групи допълнително рутинно хистопатологично изследване може да не е необходимо, но в групата, третирана с висока доза, то винаги трябва да се провежда на органите, при които са налице данни за лезии. |
|
д) |
Когато се използва сателитна група, хистопатологично изследване трябва да се провежда на тъканите и органите, които в третираните групи показват аномалии. |
2. ДАННИ
Данните трябва да бъдат обобщени в табличен вид, като за всяка изпитвана група се дават броят на животните в началото на изпитването, броят на животните, при които са налице лезии, и процентът на животните, които демонстрират всеки тип лезия. Резултатите трябва да бъдат оценени с помощта на подходящ статистически метод. Може да се използва всеки признат статистически метод.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. Протокол от изпитването
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
— |
вид, порода, източник, условия на околната среда, диета, |
|
— |
условия на изпитването, |
|
— |
нива на дозиране (включително носител, ако е използван) и концентрации, |
|
— |
данни за токсичния отговор по пол и доза, |
|
— |
ниво без ефект, където е възможно, |
|
— |
време на смъртта по време на изпитването или дали животните са оживели до прекратяването му, |
|
— |
описание на токсичните или други ефекти, |
|
— |
време на наблюдение на всеки абнормен признак и неговото последващо развитие, |
|
— |
данни за храната и телесното тегло, |
|
— |
данни от офталмологичния преглед, |
|
— |
използвани хематологични изследвания и всички резултати, |
|
— |
използвани клинични биохимични изследвания и всички резултати (включително резултати от всички изследвания на урина), |
|
— |
резултати от аутопсията, |
|
— |
подробно описание на всички резултати от хистопатологичните изследвания, |
|
— |
статистическа обработка на резултатите, където е възможно, |
|
— |
обсъждане на резултатите, |
|
— |
интерпретиране на резултатите. |
3.2. Оценка и интерпретиране
Виж общо въведение, част Б.
4. ПОЗОВАВАНИЯ
Виж общо въведение, част Б.
ИЗПИТВАНЕ ЗА СУБХРОНИЧНА ОРАЛНА ТОКСИЧНОСТ
90-ДНЕВНИ МНОГОКРАТНИ ОРАЛНИ ДОЗИ ПРИ ВИДОВЕ, РАЗЛИЧНИ ОТ ГРИЗАЧИ
1. МЕТОД
1.1. Въведение
Виж общо въведение, част Б.
1.2. Определения
Виж общо въведение, част Б.
1.3. Вещества за сравнение
Няма.
1.4. Принцип на метода за изпитване
Изпитваното вещество се прилага ежедневно, по орален път, в нарастващи дози, върху няколко групи експериментални животни (различни от гризачи), по една доза за група, в продължение на 90 дни. По време на периода на прилагане животните се наблюдават ежедневно, за да се открият признаци на токсичност. Животните, които умират по време на изпитването, се подлагат на аутопсия, а преживелите животни се подлагат на аутопсия при приключване на изпитването.
1.5. Критерии за качество
Няма.
1.6. Описание на метода за изпитване
Подготовка
Животните се държат при експерименталните условия на настаняване и хранене в продължение поне на пет дни преди изпитването. Преди изпитването здрави млади животни се избират по случаен признак и се разпределят в третирани и контролни групи.
Изпитваното вещество може да се прилага с храната или да се окаже по-удобно прилагането му в капсули. Могат да се използват други начини за прилагане по орален път. Дозирането при всички животни трябва да се извършва по един и същ метод по време на целия експериментален период. Ако за подпомагане на дозирането се използва неактивно вещество или други добавки, трябва да е известно, че те не водят до токсични ефекти. Ако е необходимо, могат да се използват исторически данни.
Условия на изпитване
Експериментални животни
Често използваният вид, различен от гризачи, е кучето, за предпочитане от определена порода. Могат да се използват други видове, различни от гризачи. Трябва да се използват млади здрави животни, като при кучетата дозирането трябва да започне за предпочитане на четири- до шестмесечна възраст и не по-късно от деветмесечна възраст. Когато изпитването за субхронична орална токсичност се провежда като предварително проучване преди продължително изпитване, и при двете изпитвания трябва да се използват същият вид и порода.
Брой и пол
За всяко ниво на дозиране трябва да се използват най-малко по осем животни (четири женски и четири мъжки животни). При прекратяване на изпитването броят на животните трябва да бъде адекватен за значима оценка на токсичните ефекти.
Нива на дозиране
Трябва да се използват поне три нива на дозиране и една контрола. С изключение на третирането с изпитваното вещество, животните от контролната група трябва да бъдат третирани по идентичен начин с животните от изпитваните групи. Най-високото ниво на дозиране трябва да води до токсични ефекти, но да не предизвиква фатални изходи. Най-ниското ниво на дозиране не трябва да предизвиква никакви признаци на токсичност. Когато съществува оценка на нивото на експозиция при хора, която може да се използва, най-ниското ниво на дозиране трябва да е по-високо от него.
В идеалния случай междинното ниво на дозиране трябва да предизвиква минимални наблюдаеми токсични ефекти. Ако се използва повече от една междинна доза, нивата на дозиране трябва да бъдат разделени едно от друго така, че да се получи градиране на токсичните ефекти.
В групата, третирана с ниска и междинна доза, и в контролните групи също не трябва да има фатални изходи.
За вещества с ниска токсичност, когато се прилагат с храната, е важно да се обезпечи количеството и други свойства на изпитваното вещество да не повлияват нормалното хранене.
Когато изпитваното вещество се прилага с храната, може да се използва постоянна концентрация в диетата (ppm или мг/кг храна) или постоянно ниво на дозиране по отношение на телесното тегло на животното, като използваната алтернатива трябва да бъде посочена. Когато дозата се прилага пряко, например в капсула, тя трябва да се дава по едно и също време всеки ден и да бъде коригирана, ако е необходимо, през интервали от една седмица, за да се поддържа постоянно ниво на дозиране по отношение на телесното тегло на животното. Когато изпитването за субхронична токсичност се използва като предварително проучване преди продължително изпитване, обикновено и при двете изпитвания трябва да се използва сходна диета.
Гранично изпитване
Ако 90-дневното изпитване, проведено в съответствие с метода, разгледан подробно по-долу, при едно ниво на дозиране 1 000 мг/кг телесно тегло/ден или при по-високо ниво на дозиране, свързано с възможна експозиция при хора, когато такава е известна, не показва данни за токсични ефекти, допълнителното изпитване може да не се смята за необходимо. За вещества с ниска токсичност, когато се прилагат с храната, е важно да се обезпечи количеството и други свойства на изпитваното вещество да не повлияват нормалните хранителни нужди.
Период на наблюдение
Всички животни трябва да бъдат наблюдавани ежедневно и признаците на токсичност да бъдат регистрирани, включително времето им на настъпване, силата и продължителността им. Трябва да се регистрират времето на смъртта и времето, по което се появяват и изчезват признаците на токсичност.
Процедура
В идеалния случай животните се дозират с изпитваното вещество седем дни в седмицата в продължение на 90 дни. Обаче въз основа главно на практически съображения, когато веществото се прилага по друг начин освен с храната, дозирането пет дни в седмицата се смята за приемливо.
Наблюденията в клетките трябва да включват, без да се ограничават до това, измененията на кожата и козината, очите и лигавиците, а също дихателната, сърдечно съдовата, автономната и централната нервна система, соматомоторната активност и начина на поведение. Ежеседмично трябва да се извършва измерване на консумацията на храна (и на консумацията на вода, когато изпитваното вещество се прилага с питейната вода) и животните трябва да се претеглят.
Ежедневно трябва да се провежда внимателен клиничен преглед на животните, като се предприемат съответни действия, за да се намали до минимум загубата на животни от изпитването. В края на експозицията всички оживели животни се подлагат на аутопсия. Умиращите животни трябва да бъдат отстранени и подложени на аутопсия, когато бъдат забелязани.
На всички животни, включително контролните, обичайно се правят следните прегледи:
|
a) |
Преди прилагане на изпитваното вещество и при преустановяване на изпитването трябва да се проведе офталмологичен преглед с помощта на офталмоскоп или еквивалентно подходящо оборудване, за предпочитане при всички животни, но поне в групата, третирана с висока доза, и в контролната група. Ако бъдат открити очни изменения, трябва да бъдат прегледани всички животни. |
|
б) |
В началото и в края на изпитването трябва да бъде направено хематологично изследване, включващо хематокрита, концентрацията на хемоглобина, броя на еритроцитите, общия брой на левкоцитите и диференциалното им броене и измерване на потенциала за съсирване, например време на съсирване, протромбиново време, тромбопластиново време или брой на тромбоцитите. |
|
в) |
В началото на изпитването, а след това или на едномесечни интервали, или по средата на изпитването и накрая при прекратяването му, трябва да се определят клиничните биохимични параметри на кръвта. Изследвания, които се смятат за целесъобразни при всички изпитвания, са електролитният баланс, въглехидратният метаболизъм и чернодробната и бъбречната функция. Изборът на конкретни изследвания ще се повлияе от наблюденията върху механизма на действие на веществото. Препоръчва се определянето на калций, фосфор, хлориди, натрий, калий, глюкоза на гладно (с период на гладуване, подходящ за вида/породата), серумна глутамат пируват трансаминаза (2), серумна глутамат оксалоацетат трансаминаза (3), орнитин декарбоксилаза, гама-глутамил транспептидаза, уреен азот, албумин, креатинин в кръвта, общ билирубин и общ серумен белтък. Други определяния, които може да са необходими за адекватна токсикологична оценка, включват анализ на липиди, хормони, киселинно/алкално равновесие, метхемоглобин и холинестеразна активност. Когато е необходимо да бъде разширено изпитването на наблюдаваните ефекти, може да се използват допълнителни клинични биохимични параметри. Видовете, различни от гризачи, трябва да гладуват известно време (за период не по-дълъг от 24 часа) преди вземане на кръвните проби. |
|
г) |
Рутинно изследване на урина не е необходимо, освен когато съществуват показания поради очаквана или наблюдавана токсичност. |
Макроскопска аутопсия
Всички животни трябва да бъдат подложени на пълна макроскопска аутопсия, която включва преглед на външната повърхност на тялото, на всички отвори, както и на черепната, гръдната и коремната кухина и на съдържанието им. Черният дроб, бъбреците, надбъбречните жлези, щитовидната жлеза (с паращитовидните жлези) и тестисите трябва да бъдат претеглени във влажно състояние колкото е възможно по-бързо след дисекцията, за да се избегне изсъхването им.
Следните органи и тъкани трябва да бъдат съхранени в подходяща среда за възможно бъдещо хистопатологично изследване: всички макроскопски лезии, мозъкът — включително срези на продълговатия мозък/варолиевият мост, кората на малкия мозък и кората на главния мозък, хипофизата, щитовидната/паращитовидните жлези, цялата тимусна тъкан, (трахеята), белите дробове, сърцето, аортата, слюнчените жлези, черният дроб, слезката, бъбреците, надбъбречните жлези, панкреасът, гонадите, матката (допълнителните полови органи), (кожата), жлъчният мехур, хранопроводът, стомахът, дванадесетопръстникът, празното черво, хълбочното черво, сляпото черво, ободното черво, правото черво, пикочният мехур, представителен лимфен възел, (женската млечна жлеза), (бедрената мускулатура), периферен нерв, (очи), гръдната кост с костен мозък, (бедрената кост, включително ставна повърхност) и (гръбначният мозък на три нива — шийно, гръдно и поясно). Тъканите, посочени в скоби, трябва да се изследват, само ако въз основа на признаци на токсичност или ангажиране на целевите органи са налице показания за това.
Хистопатологично изследване
Пълно хистопатологично изследване трябва да се извършва само върху органи и тъкани на животни от контролната група и групата, третирана с висока доза. Допълнително хистопатологично изследване при групи, третирани с други дози, трябва да се извършва само върху органи, които демонстрират лезии в групата, третирана с висока доза, или за които клиничните наблюдения показват такава необходимост.
2. ДАННИ
Данните трябва да бъдат обобщени в табличен вид, като за всяка изпитвана група са показани броят на животните в началото на изпитването, броят на животните, при които са налице лезии, типовете лезии и процентът на животните, които демонстрират всеки тип лезия. Резултатите трябва да бъдат оценени с помощта на подходящ статистически метод. Може да се използва всеки признат статистически метод.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. Протокол от изпитването
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
— |
вид или порода, източник, условия на околната среда, диета, |
|
— |
условия на изпитването, |
|
— |
нива на дозиране (включително носител, ако е използван) и концентрации, |
|
— |
данни за токсичния отговор по пол и доза, |
|
— |
ниво без ефект, където е възможно, |
|
— |
време на смъртта по време на изпитването или дали животните са оживели до прекратяването му, |
|
— |
описание на токсичните или други ефекти (с особено внимание към резултатите от клиничните изследвания), |
|
— |
време на наблюдение на всеки абнормен признак и неговото последващо развитие, |
|
— |
данни за храната и телесното тегло, |
|
— |
резултати от офталмологичното изследване, |
|
— |
използвани хематологични изследвания и всички резултати, |
|
— |
използвани биохимични изследвания и всички резултати (включително резултати от всички изследвания на урина), |
|
— |
резултати от аутопсията, |
|
— |
подробно описание на всички резултати от хистопатологичните изследвания, |
|
— |
статистическа обработка на резултатите, където е целесъобразно, |
|
— |
обсъждане на резултатите, |
|
— |
интерпретиране на резултатите. |
3.2. Оценка и интерпретиране
Виж общо въведение, част B.
4. ПОЗОВАВАНИЯ
Виж общо въведение, част Б.
ИЗПИТВАНЕ ЗА СУБХРОНИЧНА ДЕРМАЛНА ТОКСИЧНОСТ
90-ДНЕВНИ МНОГОКРАТНИ ДЕРМАЛНИ ДОЗИ ПРИ ГРИЗАЧИ
1. МЕТОД
1.1. Въведение
Виж общо въведение, част B.
1.2. Определения
Виж общо въведение, част B.
1.3. Вещества за сравнение
Няма.
1.4. Принцип на метода за изпитване
Изпитваното вещество се прилага ежедневно, върху кожата, в нарастващи дози, върху няколко групи експериментални животни, по една доза за група, в продължение на 90 дни. По време на прилагането животните се наблюдават ежедневно, за да се открият признаци на токсичност. Животните, които умират по време на изпитването, се подлагат на аутопсия, а преживелите животни се подлагат на аутопсия при приключване на изпитването.
1.5. Критерии за качество
Няма.
1.6. Описание на метода за изпитване
Подготовка
Животните се държат при експериментални условия на живот и хранене в продължение поне на пет дни преди изпитването. Преди изпитването здрави млади животни се избират по случаен признак и се разпределят в третирана и контролна групи. Малко преди изпитването кожата в дорзалната област на туловището на експерименталните животни се остригва. Може да се използва бръснене, но то трябва да се извършва приблизително 24 часа преди изпитването. Повторно остригване или бръснене е необходимо обикновено през интервали от една седмица. Когато козината се остригва или бръсне, трябва да се внимава да се избягва нараняване на кожата. Не по-малко от 10 % от повърхността на тялото трябва да бъде подготвена за прилагане на изпитваното вещество. Когато се решава каква повърхност трябва да бъде подготвена и какви да бъдат размерите на превръзката, трябва да се вземе предвид теглото на животното. Когато се изпитват твърди вещества, които при нужда могат да бъдат стрити на прах, изпитваното вещество трябва да бъде достатъчно намокрено с вода или с подходящ носител, когато е необходимо, за да се осигури добър контакт с кожата. Течните изпитвани вещества обикновено се използват неразредени. Прилагането е ежедневно, от пет до седем дни седмично.
Условия на изпитване
Експериментални животни
Могат да се използват възрастни плъхове, зайци или морски свинчета. Могат да се използват други видове, но употребата им трябва да бъде обоснована. При започване на изпитването диапазонът на колебание на теглото трябва да бъде ± 20 % от средното тегло. Когато изпитването за субхронична дермална токсичност се провежда като предварително проучване преди продължително изпитване, и при двете изпитвания трябва да се използват същият вид и порода.
Брой и пол
За всяко ниво на дозиране трябва да се използват поне 20 животни (10 женски и 10 мъжки) със здрава кожа. Женските трябва да са нераждали и да не са бременни. Ако се планират междинни жертви, броят трябва да бъде увеличен с броя животни, които са планирани за пожертване преди завършване на изпитването. Освен това една сателитна група от 20 животни (по 10 животни от пол) може да бъде третирана при високо ниво на дозиране в продължение на 90 дни и да бъде наблюдавана в продължение на 28 дни след третирането за обратимост, запазване или забавена проява на токсичните ефекти.
Нива на дозиране
Необходими са поне три нива на дозиране с контрол или контрол за носителя, ако се използва носител. Експозицията трябва да продължава поне по шест часа дневно. Прилагането на изпитваното вещество трябва да се извършва по едно и също време всеки ден и количеството на прилаганото вещество трябва да бъде коригирано през определени интервали (от една или две седмици), за да се поддържа постоянно ниво на дозиране по отношение на телесното тегло на животното. С изключение на третирането с изпитваното вещество, животните от контролната група трябва да бъдат третирани по идентичен начин с животните от изпитваните групи. Когато за подпомагане на дозирането се използва помощно вещество, дозирането на контролната група с носител трябва да бъде същото, както при третираните групи, а контролната група трябва да получава същото количество носител като това, което получава групата, третирана с най-високата доза. Най-високото ниво на дозиране трябва да води до токсични ефекти, но да не предизвиква или да предизвиква малък брой фатални изходи. Най-ниското ниво на дозиране не трябва да предизвиква никакви признаци на токсичност. Когато съществува оценка на нивото на експозиция при хора, която може да се използва, най-ниското ниво на дозиране трябва да е по-високо от него. В идеалния случай междинното ниво на дозиране трябва да предизвиква минимални наблюдаеми токсични ефекти. Ако се използва повече от една междинна доза, нивата на дозиране трябва да бъдат разделени едно от друго така, че да се получи градиране на токсичните ефекти. При групите, третирани с ниска и междинни дози, и при контролните групи честотата на фаталните изходи трябва да бъде ниска така, че да позволи значима оценка на резултатите.
Ако прилагането на изпитваното вещество води до силно кожно дразнене, концентрациите трябва да бъдат намалени и това може да доведе до намаляване или липса на други токсични ефекти при високото ниво на дозиране. Ако кожата е силно увредена, може да се наложи прекратяване на изпитването и предприемане на ново изпитване при по-ниска концентрация.
Гранично изпитване
Може да се приеме, че допълнително изпитване не е необходимо, ако е известно, че предварително проучване при доза 1 000 мг/кг или по-висока, която е свързана с възможна експозиция при хора, когато такава е известна, не предизвиква токсични ефекти.
Период на наблюдение
Експерименталните животни трябва ежедневно да бъдат наблюдавани за признаци на токсичност. Трябва да се регистрират времето на смъртта и времето, през което се появяват и изчезват признаците на токсичност.
Процедура
Животните трябва да бъдат настанени в индивидуални клетки. В идеалния случай животните се третират с изпитваното вещество седем дни в седмицата в продължение на 90 дни.
Животните от всяка сателитна група, планирана за контролни наблюдения, трябва да бъдат гледани в продължение на допълнителни 28 дни без третиране, за да бъдат открити възстановяването от токсичните ефекти или запазването им. Експозицията трябва да продължава шест часа на ден.
Изпитваното вещество трябва да бъде прилагано по еднакъв начин върху площ, която представлява приблизително 10 % от общата площ на телесната повърхност. При силно токсични вещества покритата повърхностна площ може да бъде по-малка, но колкото е възможно по-голяма площ трябва да бъде покрита с тънък и еднакъв филм.
При експозицията изпитваното вещество се поддържа в контакт с кожата с помощта на пореста марлена превръзка и недразнеща лента. Изпитваното място трябва да бъде допълнително покрито по подходящ начин така, че марлената превръзка и изпитваното вещество да се запазят и животните да не могат да погълнат изпитваното вещество. За да бъде предотвратено поглъщането на изпитваното вещество, могат да се използват ограничаващи средства, но пълно обездвижване не се препоръчва.
В края на експозицията останалото изпитвано вещество трябва да бъде отстранено, когато е възможно, с помощта на вода или друг подходящ метод за почистване на кожата.
Всички животни трябва да бъдат наблюдавани ежедневно и признаците на токсичност да бъдат регистрирани, включително времето им на настъпване, силата и продължителността им. Наблюденията в клетките трябва да включват измененията на кожата и козината, очите и лигавиците, а също дихателната, сърдечно съдовата, автономната и централната нервна система, соматомоторната активност и начина на поведение. Трябва да се извършват ежеседмични измервания на консумираната храна и на теглото на животните. Редовните наблюдения на животните са необходими, за да не се губят животни при изпитването поради причини като канибализъм, тъканна автолиза или преместване. В края на периода на изпитването всички оживели животни от несателитните третирани групи се подлагат на аутопсия. Умиращите животни трябва да бъдат отстранени и подложени на аутопсия, когато бъдат забелязани.
На всички животни, включително контролните, обичайно се правят следните прегледи:
|
а) |
Преди експозицията на изпитваното вещество и при преустановяване на изпитването трябва да се проведе офталмологичен преглед с помощта на офталмоскоп или еквивалентно подходящо оборудване, за предпочитане при всички животни, но поне в групите, третирани с висока доза, и в контролните групи. Ако бъдат доловени очни изменения, трябва да бъдат прегледани всички животни. |
|
б) |
В края на изпитването трябва да бъде направено хематологично изследване, включващо хематокрита, концентрацията на хемоглобина, броя на еритроцитите, общия брой на левкоцитите и диференциалното им броене и измерване на потенциала за съсирване, например време на съсирване, протромбиново време, тромбопластиново време или брой на тромбоцитите. |
|
в) |
В края на изпитването трябва да се определят клиничните биохимични параметри на кръвта. изследвания, които се смятат за целесъобразни при всички изпитвания, са електролитният баланс, въглехидратният метаболизъм и чернодробната и бъбречната функция. Изборът на конкретни изследвания ще се повлияе от наблюденията върху механизма на действие на веществото. Препоръчва се определянето на калций, фосфор, хлориди, натрий, калий, глюкоза на гладно (с период на гладуване, подходящ за вида), серумна глутамат пируват трансаминаза (2), серумна глутамат оксалоацетат трансаминаза (3), орнитин декарбоксилаза, гама-глутамил транспептидаза, уреен азот, албумин, креатинин в кръвта, общ билирубин и общ серумен белтък. Други определяния, които може да са необходими за адекватна токсикологична оценка, включват анализ на липиди, хормони, киселинно/алкално равновесие, метхемоглобин и холинестеразна активност. Когато е необходимо да бъде разширено изпитването на наблюдаваните ефекти, може да се използват допълнителни клинични биохимични параметри. |
|
г) |
Рутинно изследване на урина не е необходимо, освен когато съществуват показания въз основа на очаквана или наблюдавана токсичност. |
Ако историческите изходни данни не са адекватни, трябва да се предвиди определяне на хематологичните параметри и на параметрите на клиничната биохимия преди да започне дозирането.
Макроскопска аутопсия
Всички животни трябва да бъдат подложени на пълна макроскопска аутопсия, която включва преглед на външната повърхност на тялото, на всички отвори, както и на черепната, гръдната и коремната кухина и на съдържанието им. Черният дроб, бъбреците, надбъбречните жлези и тестисите трябва да бъдат претеглени във влажно състояние колкото е възможно по-бързо след дисекцията, за да се избегне изсъхването им. Следните органи и тъкани трябва да бъдат съхранени в подходяща среда за възможно бъдещо хистопатологично изследване: всички макроскопски лезии, мозъкът — включително срези на продълговатия мозък/варолевият мост, кората на малкия мозък и кората на главния мозък, хипофизата, щитовидната/паращитовидните жлези, цялата тимусна тъкан (трахеята), белите дробове, сърцето, аортата, слюнчените жлези, черният дроб, слезката, бъбреците, надбъбречните жлези, панкреасът, гонадите, матката, допълнителните полови органи, жлъчният мехур (ако е налице), хранопроводът, стомахът, дванадесетопръстникът, празното черво, хълбочното черво, сляпото черво, ободното черво, правото черво, пикочният мехур, представителен лимфен възел, (женската млечна жлеза), (бедрената мускулатура), периферен нерв, (очи), (гръдната кост с костен мозък), (бедрената кост, включително ставна повърхност), (гръбначният мозък на три нива – шийно, гръдно и поясно) и (извънорбитните слъзни жлези). Тъканите, посочени в скоби, трябва да се изследват, само ако въз основа на признаци на токсичност или ангажиране на целевите органи са налице показания за това.
Хистопатологично изследване
|
a) |
Пълно хистопатологично изследване трябва да се извършва на нормалната и третираната кожа и на органи и тъкани на животни от контролната група и групата, третирана с висока доза. |
|
б) |
Всички макроскопски лезии трябва да бъдат изследвани. |
|
в) |
Целевите органи трябва да бъдат изследвани и в групите, третирани с други дози. |
|
г) |
Когато се използват плъхове, белите дробове на животните от групите, третирани с ниска и междинна доза, трябва да бъдат подложени на хистопатологично изследване за признаци на инфекция, тъй като това дава възможност за лесно оценяване на здравословното състояние на животните. При животни от тези групи допълнително рутинно хистопатологично изследване може да не е необходимо, но в групата, третирана с висока доза, то винаги трябва да се извършва върху органите, при които са налице данни за лезии. |
|
д) |
Когато се използва сателитна група, трябва да се прави хистопатологично изследване на тъканите и органите, при които се наблюдават ефекти в другите третирани групи. |
2. ДАННИ
Данните трябва да бъдат обобщени в табличен вид, като за всяка изпитвана група са показани броят на животните в началото на изпитването, броят на животните, при които са налице лезии, типът на лезиите и процентът на животните, които демонстрират всеки тип лезия. Резултатите трябва да бъдат оценени с помощта на подходящ статистически метод. Може да се използва всеки признат статистически метод.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. Протокол от изпитването
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
— |
вид, порода, източник, условия на околната среда, диета, |
|
— |
условия на изпитването, |
|
— |
нива на дозиране (включително носител,ако е използван) и концентрации, |
|
— |
данни за токсичния отговор по пол и доза, |
|
— |
ниво без ефект, където е възможно, |
|
— |
време на смъртта по време на изпитването или дали животните са оживели до прекратяването му, |
|
— |
описание на токсичните или други ефекти, |
|
— |
време на наблюдение на всеки абнормен признак и неговото последващо развитие, |
|
— |
данни за храната и телесното тегло, |
|
— |
резултати от офталмологичното изследване, |
|
— |
използвани хематологични изследвания и всички резултати, |
|
— |
използвани клинични биохимични изследвания и всички резултати (включително резултати от всички изследвания на урина), |
|
— |
резултати от аутопсията, |
|
— |
подробно описание на всички резултати от хистопатологичните изследвания, |
|
— |
статистическа обработка на резултатите, където е възможно, |
|
— |
обсъждане на резултатите, |
|
— |
интерпретиране на резултатите. |
3.2. Оценка и интерпретиране
Виж общо въведение, част Б.
4. ПОЗОВАВАНИЯ
Виж общо въведение, част Б.
ИЗПИТВАНЕ ЗА СУБХРОНИЧНА ИНХАЛАЦИОННА ТОКСИЧНОСТ
90-ДНЕВНИ МНОГОКРАТНИ ИНХАЛАЦИОННИ ДОЗИ ПРИ ГРИЗАЧИ
1. МЕТОД
1.1. Въведение
Виж общо въведение, част Б.
1.2. Определения
Виж общо въведение, част Б.
1.3. Вещества за сравнение
Няма.
1.4. Принцип на метода за изпитване
При няколко групи експериментални животни се осъществява ежедневна експозиция с определена продължителност на изпитваното вещество в нарастващи концентрации, като се използва по една концентрация за група, в продължение на 90 дни. Когато се използва носител, за да подпомогне създаването на подходяща концентрация на изпитваното вещество в атмосферата, трябва да се използва контролна група за носителя. По време на прилагането на изпитваното вещество животните се наблюдават ежедневно, за да се открият признаци на токсичност. Животните, които умират по време на изпитването, се подлагат на аутопсия, а преживелите животни се подлагат на аутопсия при приключване на изпитването.
1.5. Критерии за качество
Няма.
1.6. Описание на метода за изпитване
Подготовка
Животните се държат при експериментални условия на живот и хранене в продължение поне на пет дни преди експеримента. Преди изпитването здрави млади животни се избират по случаен признак и се разпределят в третирана и контролна група. Когато е необходимо, към изпитваното вещество може да се добави подходящ носител, за да подпомогне създаването на съответна концентрация на веществото в атмосферата. Ако за улесняване на дозирането се използват неактивно вещество или други добавки, трябва да е известно, че те не водят до токсични ефекти. Ако е необходимо, могат да се използват исторически данни.
Условия на изпитване
Експериментални животни
Предпочитан вид е плъхът, освен ако няма противопоказания. Трябва да се използват млади здрави животни от обичайно употребявани лабораторни породи. При започване на изпитването колебанието в теглото на използваните животни не трябва да превишава с ± 20 % съответната средна стойност. Когато инхалационното субхронично изпитване се провежда като предварително проучване преди продължително изпитване, и при двете изпитвания трябва да се използват същият вид и порода.
Брой и пол
За всяка експозиционна концентрация трябва да се използват поне по 20 животни (10 женски и 10 мъжки). Женските трябва да са нераждали и да не са бременни. Ако се планират междинни жертви, броят трябва да бъде увеличен с броя животни, които са планирани за пожертване преди завършване на изпитването. Допълнително една сателитна група от 20 животни (по 10 животни от пол) може да бъде третирана при високо ниво на дозиране в продължение на 90 дни и да бъде наблюдавана в продължение на 28 дни след третирането за обратимост, запазване или забавена проява на токсичните ефекти.
Експозиционни концентрации
Необходими са поне три концентрации, с контрола и, ако се използва носител, контрола за носителя (съответстваща на концентрацията на носителя при най-високото ниво на дозиране). С изключение на третирането с изпитваното вещество, животните от контролната група трябва да бъдат третирани по идентичен начин с животните от изпитваните групи. Най-високата концентрация трябва да води до токсични ефекти, но да не предизвиква или да предизвиква малък брой фатални изходи. Когато съществува оценка на нивото на експозиция при хора, която може да се използва, най-ниското ниво на дозиране трябва да е по-високо от него. В идеалния случай междинната концентрация трябва да предизвиква минимални наблюдаеми токсични ефекти. Ако се използва повече от една междинна концентрация, концентрациите трябва да бъдат разделени една от друга така, че да се получи градиране на токсичните ефекти. В групите, третирани с ниска и междинна доза, и в контролната група честотата на фаталните изходи трябва да бъде ниска така, че да позволи значима оценка на резултатите.
Продължителност на експозицията
Продължителността на ежедневната експозиция трябва да бъде шест часа след изравняване на концентрациите в камерата. За да се изпълнят конкретни изисквания, може да се използва и друга продължителност.
Оборудване
Животните трябва да бъдат изследвани с инхалационно оборудване, предназначено за поддържане на динамичен въздушен поток при поне 12-кратно обменяне на въздуха за час, за да се осигурят адекватно кислородно съдържание и равномерно разпределена експозиционна атмосфера. Когато се използва камера, тя трябва да бъде проектирана така, че струпването на експерименталните животни да бъде намалено до минимум и да се постигне максимална инхалационна експозиция на изпитваното вещество. Като правило, за да се постигне стабилност на атмосферата в камерата, общият обем на експерименталните животни не трябва да надвишава 5 % от обема на експерименталната камера. Може да се използват индивидуални камери за ороназална експозиция, изолирана експозиция на главата или за експозиция на цялото тяло, като първите две намаляват до минимум приема на изпитваното вещество по други пътища.
Период на наблюдение
Експерименталните животни трябва да бъдат наблюдавани ежедневно за признаци на токсичност по време на цялото третиране и възстановяване. Трябва да се регистрират времето на смъртта и времето, през което се появяват и изчезват признаците на токсичност.
Процедура
Животните се подлагат на експозиция на изпитваното вещество ежедневно, от пет до седем дни в седмицата в продължение на 90 дни. Животните от всяка сателитна група, планирана за контролни наблюдения, трябва да бъдат държани в продължение на допълнителни 28 дни без третиране, за да бъдат открити възстановяването от токсичните ефекти или запазването им. Изпитването трябва да се провежда при температура 22 ± 3 °C. В идеалния случай относителната влажност трябва да се поддържа между 30 % и 70 %, но в определени случаи (например изпитвания на аерозоли) това може да е невъзможно. По време на експозицията на животните не трябва да се дават храна и вода.
Трябва да се използва динамична инхалационна система с подходяща аналитична система за контрол на концентрация. За установяване на подходящите експозиционни концентрации се препоръчва пробно изпитване. Въздушният поток трябва да бъде нагласен така, че да осигури хомогенни условия в цялата експозиционна камера. Системата трябва да осигури възможно най-бързо постигане на стабилни условия на експозиция.
Измерванията или мониторингът трябва да включват:
|
a) |
дебита на въздушния поток (непрекъснато); |
|
б) |
действителната концентрация на изпитваното вещество, измерена в зоната на дишане. По време на ежедневната експозиция концентрацията не трябва да се колебае с повече от ± 15 % от средната стойност. При прахове и аерозоли обаче това ниво на контрол не може да се постигне и тогава може да се приеме по-широк диапазон. По време на цялото изпитване дневните концентрации трябва да бъдат поддържани колкото е възможно по-постоянни. При разработване на генериращата система трябва да се анализира размерът на частиците, за да се установи стабилността на концентрациите им в аерозолите. По време на експозицията анализите трябва да се провеждат толкова често, колкото е необходимо за определяне устойчивостта на разпределението на размерите на частиците. |
|
в) |
температурата и влажността; |
|
г) |
по време на експозицията и след нея се провеждат наблюдения, които се регистрират системно, като за всяко животно се съхраняват отделни записи. Всички животни трябва да бъдат наблюдавани ежедневно и признаците на токсичност да бъдат регистрирани, включително времето им на настъпване, силата и продължителността им. Наблюденията в клетките трябва да включват: измененията на кожата и козината, очите, лигавиците, дихателната, сърдечно съдовата, автономната и централната нервна система, соматомоторната активност и начина на поведение. Консумацията на храна трябва да се измерва и животните трябва да се претеглят всяка седмица Необходимо е редовно наблюдаване на животните, за да се осигури животните да не се губят от изпитването поради причини като канибализъм, тъканна автолиза или преместване. В края на експозицията всички оживели животни се подлагат на аутопсия. Умиращите животни трябва да бъдат отстранени и подложени на аутопсия, когато бъдат забелязани. |
На всички животни, включително контролните, обичайно се правят следните прегледи:
|
a) |
преди експозицията на изпитваното вещество и при прекратяване на изпитването трябва да се проведе офталмологичен преглед с помощта на офталмоскоп или еквивалентно подходящо оборудване, за предпочитане при всички животни, но поне в групите, третирани с висока доза, и в контролните групи. Ако бъдат открити очни изменения, трябва да бъдат прегледани всички животни; |
|
б) |
в края на изпитването трябва да бъде направено хематологично изследване, включващо хематокрита, концентрацията на хемоглобина, броя на еритроцитите, общия брой на левкоцитите и диференциалното им броене и измерване на потенциала за съсирване, например време на съсирване, протромбиново време, тромбопластиново време или брой на тромбоцитите; |
|
в) |
в края на изпитването трябва да се определят клиничните биохимични параметри на кръвта. Изследвания, които се смятат за целесъобразни при всички изпитвания, са електролитният баланс, въглехидратният метаболизъм и чернодробната и бъбречната функция. Изборът на конкретни изследвания ще се повлияе от наблюденията върху механизма на действие на веществото. Предложени са параметрите: калций, фосфор, хлориди, натрий, калий, глюкоза на гладно (с период на гладуване, подходящ за вида), серумна глутамат пируват трансаминаза (2), серумна глутамат оксалоацетат трансаминаза (2), орнитин декарбоксилаза, гама-глутамил транспептидаза, уреен азот, албумин, креатинин в кръвта, общ билирубин и общ серумен белтък. Други параметри, които може да са необходими за адекватна токсикологична оценка, включват анализ на липиди, хормони, киселинно/алкално равновесие, метхемоглобин и холинестеразна активност. Когато е необходимо да бъде разширено изпитването на наблюдаваните ефекти, може да се използват допълнителни клинични биохимични параметри; |
|
г) |
Рутинно изследване на урина не е необходимо, освен когато съществуват показания въз основа на очаквана или наблюдавана токсичност. |
Ако историческите изходни данни не са адекватни, трябва да се предвиди определяне на хематологичните параметрите и на параметрите на клиничната биохимия преди да започне дозирането.
Макроскопска аутопсия
Всички животни трябва да бъдат подложени на пълна макроскопска аутопсия, която включва преглед на външната повърхност на тялото, на всички отвори, както и на черепната, гръдната и коремната кухина и на съдържанието им. Черният дроб, бъбреците, надбъбречните жлези и тестисите трябва да бъдат претеглени във влажно състояние колкото е възможно по-бързо след дисекцията, за да се избегне изсъхването им. Следните органи и тъкани трябва да бъдат съхранени в подходяща среда за възможно бъдещо хистопатологично изследване: всички макроскопски лезии, белите дробове, които трябва да бъдат извадени интактни, претеглени и третирани с подходящ фиксатор, за да се обезпечи съхраняване на белодробната структура (префузията с фиксатор се смята за ефективна процедура), назо-фарингеални тъкани, мозък — включително срези на продълговатия мозък/варолиевият мост, кората на малкия мозък и кората на главния мозък, хипофизата, щитовидната/паращитовидните жлези, цялата тимусна тъкан, трахеята, белите дробове, сърцето, аортата, слюнчените жлези, черният дроб, слезката, бъбреците, надбъбречните жлези, панкреасът, гонадите, матката (допълнителните полови органи), (кожата), жлъчният мехур (ако е налице), хранопроводът, стомахът, дванадесетопръстникът, празното черво, хълбочното черво, сляпото черво, ободното черво, правото черво, пикочният мехур, представителен лимфен възел, (женската млечна жлеза), (бедрената мускулатура), периферен нерв, (очи), (гръдната кост с костен мозък), (бедрената кост, включително ставна повърхност) и (гръбначният мозък на три нива – шийно, средно гръдно и поясно) Тъканите, посочени в скоби, трябва да се изследват, само ако въз основа на признаци на токсичност или ангажиране на целевите органи са налице показания за това.
Хистопатологично изследване
|
a) |
Пълно хистопатологично изследване трябва да се извършва върху дихателната система и други органи и тъкани на всички животни от контролната група и групата, третирана с висока доза. |
|
б) |
Всички макроскопски лезии трябва да бъдат изследвани. |
|
в) |
Целевите органи трябва да бъдат изследвани и в групите, третирани с други дози. |
|
г) |
Белите дробове на животните от групите, третирани с ниска и междинна доза, също трябва да бъдат подложени на хистопатологично изследване, тъй като това дава възможност за лесно оценяване на здравословното състояние на животните. Допълнително рутинно хистопатологично изследване може да не е необходимо при животни от тези групи, но в групата, третирана с висока доза, винаги трябва да се извършва върху органите, при които са налице данни за лезии. |
|
д) |
Когато се използва сателитна група, трябва да се прави хистопатологично изследване на тъканите и органите, при които се наблюдават дефекти в другите третирани групи. |
2. ДАННИ
Данните трябва да бъдат обобщени в табличен вид, като за всяка изпитвана група са показани броят на животните в началото на теста, броят на животните, при които са налице лезии, типовете лезии и процентът на животните, които демонстрират всеки тип лезия. Резултатите трябва да бъдат оценени с помощта на подходящ статистически метод. Може да се използва всеки признат статистически метод.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. Протокол от изпитването
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
— |
вид, порода, източник, условия на околната среда, диета, |
|
— |
условия на изпитването: Описание на експозиционната апаратура: включително проектиране, тип, размери, източник на въздух, система за генериране на частици и аерозоли, метод за климатизиране, пречистване на използвания въздух и метод за настаняване на животните в експериментална камера, когато се използва такава. Трябва да бъде описано оборудването за измерване на температурата, влажността и, където е необходимо, стабилността на концентрациите на частиците в аерозолите или на размера на частиците. Данни за експозицията: те трябва да бъдат представени в табличен вид със средни стойности и мярка за вариабилността (например стандартно отклонение) и трябва да включват:
|
|
— |
данни за токсичния отговор по пол и концентрация, |
|
— |
ниво без ефект, където е възможно, |
|
— |
време на смъртта по време на изпитването или дали животните са оживели до прекратяването му, |
|
— |
описание на токсичните или други ефекти, |
|
— |
време на наблюдение на всеки абнормен признак и неговото последващо развитие, |
|
— |
данни за храната и телесното тегло, |
|
— |
резултати от офталмологичното изследване, |
|
— |
използвани хематологични изследвания и всички резултати, |
|
— |
използвани клинични биохимични изследвания и всички резултати (включително резултати от всички изследвания на урина), |
|
— |
резултати от аутопсията, |
|
— |
подробно описание на всички резултати от хистопатологичните изследвания, |
|
— |
статистическа обработка на резултатите, където е необходимо, |
|
— |
обсъждане на резултатите, |
|
— |
интерпретиране на резултатите. |
3.2. Оценка и интерпретиране
Виж общо въведение, част Б.
4. ПОЗОВАВАНИЯ
Виж общо въведение, част Б.
ИЗПИТВАНЕ ЗА ТЕРАТОГЕННОСТ – ГРИЗАЧИ И ВИДОВЕ, РАЗЛИЧНИ ОТ ГРИЗАЧИ
1. МЕТОД
1.1. Въведение
Виж общо въведение, част Б.
1.2. Определения
Виж общо въведение, част Б.
1.3. Вещества за сравнение
Няма.
1.4. Принцип на метода за изпитване
Изпитваното вещество се прилага в нарастващи дози или концентрации в продължение поне на тази част от бременността, която съвпада с периода на органогенезата, върху няколко групи бременни експериментални животни, като се използва по една доза за група. Малко преди очакваната дата на раждане майката се пожертва, матката се отстранява и съдържанието се изследва. Този метод изследва токсичността за зародиша и плода (ембрио- и фетотоксичността).
1.5. Критерии за качество
Няма.
1.6. Описание на метода за изпитване
Подготовка
Здрави млади възрастни девствени женски животни със сходна възраст и размери се аклиматизират към лабораторните условия в продължение на поне пет дни преди изпитването и след това се чифтосват с мъжки животни с доказана плодовитост. Оплодените женски животни се избират по случаен признак и се разпределят в третираните групи.
Чифтосването може да бъде осъществено по естествен път или чрез изкуствено оплождане. Изпитваното вещество се прилага ежедневно върху женските животни, като се започва веднага след имплантирането и се продължава през целия период на органогенеза. Един ден преди термина фетусите се раждат чрез хистеректомия и се изследват за висцерални или скелетни аномалии, включително забавяне на растежа, забавено вкостяване (осификация) и вътрешни кръвоизливи.
Условия на изпитване
Експериментални животни
Обичайно се използват видовете плъх, мишка, хамстер и заек. Предпочитаните видове са плъх и заек. Трябва да се използват обичайно употребявани лабораторни породи. Породата не трябва да бъде с ниска плодовитост и трябва да бъде характеризирана по отношение на отговора към тератогени. Животните трябва да бъдат настанени в индивидуални клетки.
Брой и пол
За всяко ниво на дозиране са необходими поне 20 бременни плъха, мишки или хамстера или 12 бременни заека. Целта е да се осигурят достатъчно котила и новородени животни, за да дадат възможност за оценка на тератогенния потенциал на веществото.
Нива на дозиране
Трябва да се използват поне три нива на дозиране и едно контролно. Когато изпитваното вещество се прилага в носител, трябва да се използва и контролна група за носителя. Ако се използва носител, неговите токсикологични свойства трябва да са ясни, той не трябва да бъде тератогенен или да оказва влияние върху размножаването. Освен третирането с изпитваното вещество, животните от контролната(ите) група(и) трябва да бъдат третирани по идентичен начин с животните от изпитваните групи. Освен ако не са ограничени от физичното/химичното естество или биологичните свойства на веществото най-високата доза трябва в идеалния случай да предизвиква известна видима токсичност за майката, например лека загуба на тегло, но не повече от 10 % майчина смъртност. Ниското ниво на дозиране не трябва да предизвиква видими ефекти, които могат да се дължат на изпитваното вещество. Междинната(ите) доза(и) трябва да е (са) разделена(и) геометрично между ниското и високото ниво на дозиране.
Гранично изпитване
При вещества с ниска токсичност ако доза, която е поне 1000 мг/кг, не води до поява на признаци на ембриотоксичност или тератогенност, изпитвания с други дози може да не се смятат за необходими.
Продължителност на експозицията
Ден 0 на изпитването е денят, в който се наблюдават вагинална запушалка и/или сперма (когато е възможно). Периодът на дозиране трябва да съвпада с периода на основната органогенеза. Това може да стане през ден от 6 до 15 за плъхове и мишки, ден от 6 до 14 за хамстери или ден от 6 до 18 за зайци. Ако ден 0 се базира на наблюдаваното чифтосване или изкуствено оплождане, споменатите времена трябва да бъдат коригирани чрез добавяне на един ден. Алтернативно дозирането можа да бъде удължено до приблизително един ден преди датата на очакваното раждане.
Период на наблюдение
Внимателен клиничен преглед трябва да се провежда поне един път дневно. Ежедневно трябва да се извършват допълнителни наблюдения, като се предприемат подходящи действия за намаляване до минимум на загубата на животни от изпитването.
Процедура
Изпитваното вещество се прилага по орален път със сонда. Изпитваното вещество трябва да се прилага всеки ден по приблизително едно и също време.
Женските експериментални животни се третират с изпитваното вещество ежедневно през целия подходящ период на третиране. Дозата може да се базира на теглото на женските животни при започване прилагането на веществото. Като се има предвид бързото наддаване на тегло по време на бременност, животните може да се претеглят периодично и дозата да се базира на най-скорошното измерване на телесното тегло. Признаците на токсичност трябва да бъдат регистрирани при наблюдението, включително времето им на настъпване, силата и продължителността им. Женските животни, показващи признаци на аборт или преждевременно раждане, трябва да бъдат пожертвани и подложени на подробно макроскопско изследване. Наблюдението след третирането трябва да продължи приблизително до един ден преди термина, като целта е да съвпадне с по-голямата част от бременността, но да се избегне усложняването при интерпретирането на резултатите, което може да възникне след раждане по естествен път. Наблюденията в клетките трябва да включват, но не се ограничават до измененията на кожата и козината, очите и лигавиците, а също дихателната, сърдечно съдовата, автономната и централната нервна система, соматомоторната активност и начина на поведение. Консумацията на храна трябва да се измерва всяка седмица. Животните трябва да се претеглят всяка седмица.
Аутопсия
В случай на смърт по време на или в края на изпитването, майката трябва да бъде изследвана макроскопски за структурни аномалии или патологични изменения, които може да са оказали влияние върху бременността. Веднага след смъртта матката трябва да бъде отстранена и съдържанието да бъде изследвано за ембрионална или фетална смърт и за определяне броя на живите фетуси. Обикновено е възможно да се прецени момента на смъртта in utero, когато това е станало. При плъхове и зайци може да се определи броят на corpora lutea (жълтите тела). Трябва да се определи полът на фетусите и те трябва да бъдат претеглени поотделно, теглата да бъдат регистрирани и да бъде получено средното фетално тегло. След отстраняването всеки фетус трябва да бъде прегледан отвън. За плъхове, мишки и хамстери една трета до една втора от всяко котило трябва да бъде подготвено и изследвано за скелетни аномалии, а оставащата част от всяко котило трябва да бъде подготвена и изследвана за аномалии на меките тъкани, като се използват подходящи методи. За зайци всеки фетус трябва да бъде изследван посредством внимателна дисекция за висцерални аномалии и след това да бъде изследван за скелетни аномалии.
2. ДАННИ
Данните трябва да бъдат обобщени в табличен вид, като представят за всяка експериментална група броя на животните в началото на изпитването, броя забременели животни, броя и процентите на живите фетуси и на фетусите със скелетни аномалии и тяхната връзка с конкретни котила. Резултатите трябва да бъдат оценени с помощта на подходящ статистически метод. Може да се използва всеки признат статистически метод.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. Протокол от изпитването
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
— |
вид, порода, източник, условия на околната среда, диета, |
|
— |
условия на изпитването, |
|
— |
нива на дозиране (включително носител,ако е използван) и концентрации, |
|
— |
данни за токсичния отговор по дози, |
|
— |
ниво без ефект (където е възможно), |
|
— |
време на смъртта по време на изпитването или дали животните са оживели до прекратяването му, |
|
— |
описание на токсичните или други ефекти, |
|
— |
време на наблюдение на всеки абнормен признак и неговото последващо развитие, |
|
— |
данни за храната и телесното тегло, |
|
— |
продължителност на бременността и данни за котилото (включително исторически данни), |
|
— |
данни за фетусите (жив/мъртъв, пол, мекотъканни и скелетни дефекти), |
|
— |
данни за котилото (живо/мъртво, пол, мекотъканни и скелетни дефекти за всяко котило), |
|
— |
статистическа обработка на резултатите, |
|
— |
обсъждане на резултатите, |
|
— |
интерпретиране на резултатите. |
3.2. Оценка и интерпретиране
Виж общо въведение, част Б.
4. ПОЗОВАВАНИЯ
Виж общо въведение, част Б.
ИЗПИТВАНЕ ЗА ХРОНИЧНА ТОКСИЧНОСТ
1. МЕТОД
1.1. Въведение
Виж общо въведение, част Б.
1.2. Определения
Виж общо въведение, част Б.
1.3. Вещества за сравнение
Няма.
1.4. Принцип на метода за изпитване
Обикновено изпитваното вещество се прилага седем дни седмично, по подходящ начин, върху няколко групи експериментални животни, по една доза за група, през голяма част от живота им. По време на експозицията на изпитваното вещество и след нея, експерименталните животни се наблюдават ежедневно, за да се открият някакви признаци на токсичност.
1.5. Критерии за качество
Няма.
1.6. Описание на метода за изпитване
Подготовка
Животните се държат при експериментални условия на настаняване и хранене в продължение поне на пет дни преди изпитването. Преди изпитването здрави млади животни се избират на случаен принцип и се разпределят в третирана и контролна група.
Условия на изпитване
Експериментални животни
Предпочитаният вид е плъх. Въз основа на резултатите от изпитвания, проведени в миналото, могат да се използват други видове (гризачи и различни от гризачи). Трябва да се използват млади здрави животни от обичайно употребявани лабораторни породи и дозирането трябва да започне колкото е възможно по-скоро след отбиването.
При започване на изпитването колебанията в теглото на животните не трябва да превишават ± 20 % от средната стойност. Когато изпитването за субхронична орална токсичност се провежда като предварително проучване преди продължително изпитване, и при двете изпитвания трябва да се използват същият вид и порода.
Брой и пол
За гризачи за всяко ниво на дозиране и паралелната контролна група трябва да се използват най-малко по 40 животни (20 женски и 20 мъжки). Женските животни трябва да са нераждали и да не са бременни. Ако се планират междинни жертви, броят трябва да бъде увеличен съответно с броя животни, които са планирани за пожертване преди завършване на изпитването.
За видове, различни от гризачи, е приемлив по-малък брой животни, но най-малко по четири от пол за всяка група.
Нива на дозиране нива и честота на експозицията
В допълнение към паралелната контролна група трябва да се използват поне три нива на дозиране. Най-високото ниво на дозиране трябва да предизвиква явни признаци на токсичност без да причинява излишна смъртност. Най-ниското ниво на дозиране не трябва да предизвиква никакви признаци на токсичност.
Междинната(ите) доза(и) трябва да се намира(т) по средата на диапазона между високите и ниските дози.
При избиране на нива на дозиране трябва да се вземат предвид данните от предшестващи проучвания и изпитвания за токсичност.
Обикновено експозицията е ежедневна. Ако дадено химическо вещество се прилага с питейната вода или се смесва с храната, то трябва да е непрекъснато в наличност.
Контроли
Трябва да се използва една паралелна контролна група, която е идентична с третираната група във всяко отношение, освен експозицията на изпитваното вещество.
При особени обстоятелства, например инхалационни изпитвания с аерозоли или емулгиращо средство с нехарактеризирана при орални изпитвания биологична активност, трябва да се използва и паралелна отрицателна контролна група. Отрицателната контролна група се третира по същия начин както експерименталните групи, с изключение на това, че животните не са подложени на експозиция на изпитваното вещество или някакъв носител.
Начин на прилагане
Двата основни начина на прилагане са орален и инхалационен. Изборът на начин на прилагане зависи от физичните и химичните характеристики на изпитваното вещество и вероятния начин на експозиция при хора.
Използването на дермалния път създава значителни практически проблеми. За хроничната системна токсичност, дължаща се на перкутанна абсорбция, нормално може да се съди по резултатите от друго орално изпитване и по информацията за степента на перкутанна абсорбция, получена от предишни изпитвания за перкутанна абсорбция.
Орални изпитвания
Когато изпитваното вещество се абсорбира от стомашно-чревния тракт и ако храносмилателният път е един от тези, чрез които хората могат да бъдат подложени на експозиция, се предпочита оралният начин на прилагане, освен ако няма противопоказания.
Животните могат да получават изпитваното вещество с храната, разтворено в питейната вода или дадено с капсула.
В идеалния случай дозирането трябва да бъде ежедневно, седем дни в седмицата, тъй като дозирането пет дни в седмицата може да даде възможност за възстановяване или намаляване на токсичността през периода, през който дозирането е прекъснато, и по този начин да повлияе върху резултата и последващата оценка. Обаче въз основа главно на практически съображения дозирането пет дни в седмицата се смята за приемливо.
Инхалационни изпитвания
Тъй като инхалационните изпитвания създават по-сложни технически проблеми в сравнение с другите начини на прилагане, тук са дадени по-подробни указания за този начин на прилагане. Трябва да се отбележи и че в особени ситуации интратрахеалното накапване може да представлява валидна алтернатива.
Продължителната експозиция обикновено наподобява предполаганата експозиция при хора, като животните са подложени на ежедневна експозиция в продължение на шест часа след изравняване на концентрациите в камерата, по пет дни в седмицата (интермитентна експозиция) или на 22- до 24-часова експозиция през деня по седем дни седмично (непрекъсната експозиция), съответстваща на възможна експозиция от околната среда, като около един час дневно по едно и също време се отделя за хранене на животните и за поддържане на камерата. И в двата случая животните обикновено са подложени на експозиция на фиксирани концентрации на изпитваното вещество. Основна разлика между интермитентната и непрекъснатата експозиция е, че при първата съществува период от 17 до 18 часа, през който животните могат да се възстановят от ефектите на ежедневната експозиция, като в края на седмицата има дори още по-дълъг период за възстановяване.
Изборът на интермитентна или непрекъсната експозиция зависи от целите на изпитването и от експозицията при хора, която трябва да се симулира. Трябва обаче да се имат предвид определени технически трудности. Например, предимствата на непрекъсната експозиция при симулиране на условията в околната среда могат да бъдат изместени от нуждата от поене и хранене по време на експозицията и от необходимостта от по-сложно (и сигурно) генериране на аерозол и пара и от мониторингови техники.
Експозиционни камери
Животните трябва да бъдат изследвани в инхалационни камери, предназначени да поддържат динамичен въздушен поток при поне 12-кратно обменяне на въздуха за час, за да се осигурят адекватно кислородно съдържание и равномерно разпределена експозиционна атмосфера. Контролните и експозиционните камери трябва да бъдат идентични и да бъдат проектирани така, че да осигурят условия на експозиция, които са сравними във всички отношения, освен експозицията на изпитваните вещества. Обикновено в камерите се поддържа леко отрицателно налягане, за да се предотврати изтичането на изпитваното вещество в заобикалящата зона. Камерите трябва да намалят до минимум струпването на експериментални животни. Като правило, за да се постигне стабилност на атмосферата в камерата, общият обем на експерименталните животни не трябва да надвишава 5 % от обема на камерата.
Измерванията или мониторингът трябва да включват:
|
i) |
въздушен поток: за предпочитане е дебитът на въздушния поток през камерата да се мониторира непрекъснато; |
|
ii) |
концентрация: по време на ежедневната експозиция концентрацията на изпитваното вещество не трябва да варира с повече от ± 15 % от средната стойност; |
|
iii) |
температура и влажност: за гризачи изпитването трябва да се провежда при температура от 22 ± 2 °C, а влажността в камерата трябва да е между 30 и 70 %, освен когато за суспендиране на изпитваното вещество в атмосферата на камерата се използва вода. За предпочитане е и двата показателя да се мониторират непрекъснато; |
|
iv) |
измерване размера на частиците: разпределението на размерите на частиците се определя в атмосферата на камери, които включват течни или твърди аерозоли. Частиците на аерозола трябва да бъдат с размери, позволяващи вдишването им от използваните експериментални животни. Проби от атмосферата в камерите трябва да се вземат в зоната на дишане на животните. Пробата въздух трябва да бъде представителна за разпределението на частиците, с които животните са в контакт, и трябва гравиметрично да се вземе предвид целият суспендиран аерозол, дори когато голяма част от него не се вдишва. При разработване на генериращата система трябва често да се анализират размерите на частиците, за да се осигури стабилността на аерозола, а впоследствие толкова често, колкото е необходимо по време на експозицията, за да се определи адекватно устойчивостта на разпределението на частиците, с които животните са в контакт. |
Продължителност на изпитването
Продължителността на прилагането трябва да бъде най-малко 12 месеца.
Процедура
Наблюдения
Внимателен клиничен преглед трябва да се провежда поне един път дневно. Допълнителни наблюдения трябва да се извършват ежедневно, като се предприемат необходимите действия, за да се избегне загуба на животни при изпитването, например аутопсия или съхраняване в хладилник на животните, които са намерени мъртви, и изолиране или пожертване на слабите или умиращи животни. Трябва да се провеждат внимателни наблюдения, за да се долови началото и прогресирането на всички токсични ефекти, а също и за намаляване до минимум на загубите поради заболявания, автолиза или канибализъм.
Клиничните признаци, включително неврологични и очни изменения, а също смъртността, трябва да се регистрират за всички животни. Трябва да се регистрира времето на поява и прогресирането на токсичните състояния, включително съмнителните тумори.
Телесното тегло трябва да се регистрира индивидуално за всички животни един път седмично през първите 13 седмици на изпитването и поне един път на всеки четири седмици след това. Приемът на храна трябва да се определя всяка седмица през първите 13 седмици от изпитването, а после на интервали от приблизително три месеца, освен ако измененията на телесното тегло не изискват друго.
Хематологично изследване
Хематологично изпитване (т.е. съдържание на хемоглобин, хематокрит, общ брой на еритроцитите, общ брой на левкоцитите, тромбоцити и други показатели на потенциала за съсирване) трябва да се извършва на третия и шестия месец, след това на интервали от приблизително шест месеца, както и в края на изпитването върху кръвни проби, взети от всички видове, които са различни от гризачи, и от по 10 плъха/пол от всички групи. Ако е възможно, пробите трябва да се вземат от едни и същи плъхове при всеки интервал. Освен това от всички видове, различни от гризачи, трябва да се вземе изходна проба преди изпитването.
Ако въз основа на клиничните наблюдения може да се предположи влошаване на здравословното състояние на животните по време на изпитването, на засегнатите животни трябва да се направи диференциално броене на кръвните клетки.
Диференциално броене на кръвните клетки се извършва върху проби от животни в групата , третирана с най-високата доза, и в контролната група. Диференциалното броене на кръвни клетки се извършва при групата, третирана със следващата по-ниска доза, само ако е налице голямо несъответствие между групата, третирана с най-високата доза, и контролната група или ако това е показано въз основа на патологични резултати.
Изследване на урина
За анализ трябва да се вземат проби урина от всички видове, различни от гризачи, и от 10 плъха/пол от всички групи и, ако е възможно, от едни и същи плъхове през същите интервали, както за хематологичните изследвания. При гризачи трябва да се изследват следните параметри за отделни животни или за пул от проби от същия пол/група.
|
— |
външен вид: обем и плътност при отделните животни, |
|
— |
белтък, глюкоза, кетони, скрита кръв (полуколичествено изследване), |
|
— |
микроскопско изследване на седимент (полуколичествено). |
Клинична биохимия
Приблизително на шестмесечни интервали и при прекратяване на изпитването се вземат кръвни проби за клинични биохимични параметри от всички видове, различни от гризачи, и от 10 плъха/пол от всички групи и, ако е възможно, от същите плъхове при всеки интервал. Освен това от всички видове, различни от гризачи, преди изпитването трябва да се вземе изходна проба. От тези проби се приготвя плазма и се изследват следните параметри:
|
— |
концентрация на общия белтък, |
|
— |
концентрация на албумина, |
|
— |
функционални чернодробни изследвания (като активност на алкалната фосфатаза, активност на глутамат пируват трансаминазата (2), активност на глутамат оксалоацетат трансаминазата (3), гама-глутамил транспептидаза, орнитин декарбоксилаза, |
|
— |
въглехидратен метаболизъм, например кръвна захар на гладно, |
|
— |
бъбречни функционални изследвания като уреен азот в кръвта. |
Макроскопска аутопсия
Всички животни, включително тези, които са умрели по време на експеримента или са били убити, защото са намерени в умиращо състояние, трябва да бъдат подложени на пълна макроскопска аутопсия. Преди пожертването от всички животни трябва да бъдат взети кръвни проби за диференциално броене на кръвни клетки. Всички макроскопски видими лезии, тумори или лезии, които са съмнителни за тумори, трябва да бъдат съхранени. Трябва да се направи опит за съпоставяне на резултатите от макроскопското и микроскопското изследване.
Всички органи и тъкани трябва да бъдат съхранени за хистопатологично изследване. Обикновено това се отнася до следните органи и тъкани: мозъка (4) (продълговатия мозък/варолиевия мост, кората на малкия мозък, кората на главния мозък), хипофизата, щитовидната жлеза (включително паращитовидните жлези), тимуса, белите дробове (включително трахеята), сърцето, аортата, слюнчените жлези, черния дроб (4), слезката, бъбреците (4), надбъбречните жлези (4), хранопровода, стомаха, дванадесетопръстника, празното черво, хълбочното черво, сляпото черво, ободното черво, правото черво, матката, пикочния мехур, лимфните възли, панкреаса, гонадите (4), допълнителните полови органи, женската млечна жлеза, кожата, мускулите, периферния нерв, гръбначния мозък (шиен, гръден и поясен), гръдната кост с костен мозък, бедрената кост (включително става) и очите. Раздуването на белите дробове и пикочния мехур с фиксатор представлява оптимален начин за съхраняване на тези тъкани. Раздуването на белите дробове при инхалационни изпитвания е много важно за правилното хистопатологично изследване. При специални изпитвания като инхалационните изпитвания трябва да бъде изследван целият респираторен тракт, включително носа, фаринкса и ларинкса.
Ако се провеждат други клинични изследвания, информацията, получена при тези процедури, трябва да бъде налице преди микроскопското изследване, тъй като тя може да даде важни насоки на патолога.
Хистопатологично изследване
Всички видими изменения, особено туморите и други лезии, възникващи в който и да е орган, трябва да бъдат изследвани микроскопски. Допълнително се препоръчват следните процедури:
|
a) |
Микроскопско изследване на всички съхранени органи и тъкани с пълно описание на всички лезии, открити при:
|
|
б) |
Органите или тъканите, показващи аномалии, които са причинени или е възможно да са причинени от изпитваното вещество, също се изследват при групите, третирани с по-ниски дози; |
|
в) |
Когато резултатът от изпитването показва данни за значително съкращаване на нормалната продължителност на живота или за предизвикване на ефекти, които могат да окажат влияние върху токсичния отговор, следващата по-ниска доза трябва да бъде изследвана по начина, описан по-горе. |
|
г) |
Информацията за честотата на лезиите, които нормално възникват при използваната порода животни, при същите лабораторни условия, т.е. исторически контролни данни, е незаменима за правилната оценка на значимостта на измененията, наблюдавани при третираните животни. |
2. ДАННИ
Данните трябва да бъдат обобщени в табличен вид, като за всяка изпитвана група са показани броят на животните в началото на изпитването, броят на животните, при които са налице лезии, и процентът на животните, които демонстрират всеки тип лезия. Резултатите трябва да бъдат оценени с помощта на подходящ статистически метод. Може да се използва всеки признат статистически метод.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. Протокол от изпитването
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
— |
вид, порода, източник, условия на околната среда, диета, |
|
— |
условия на изпитването: Описание на експозиционната апаратура: включително проектиране, тип, размери, източник на въздух, система за генериране на частици и аерозоли, метод за климатизиране, пречистване на използвания въздух и метод за настаняване на животните в експериментална камера, когато такава се използва. Трябва да бъде описано оборудването за измерване на температурата, влажността и, където е необходимо, стабилността на концентрациите на частиците в аерозолите или на размера на частиците. Данни за експозицията: те трябва да бъдат представени в табличен вид със средни стойности и мярка за вариабилността (например стандартно отклонение) и трябва да включват:
|
|
— |
нива на дозиране (включително носител, ако е използван) и концентрации, |
|
— |
данни за токсичния отговор по пол и доза, |
|
— |
ниво без ефект, |
|
— |
време на смъртта по време на изпитването или дали животните са оживели до прекратяването му, |
|
— |
описание на токсичните и други ефекти, |
|
— |
време на наблюдение на всеки абнормен признак и неговото последващо развитие, |
|
— |
данни за храната и телесното тегло, |
|
— |
резултати от офталмологичното изследване, |
|
— |
използвани хематологични изследвания и всички резултати, |
|
— |
използвани клинични биохимични изследвания и всички резултати (включително резултати от всички изследвания на урина), |
|
— |
резултати от аутопсията, |
|
— |
подробно описание на всички резултати от хистопатологичните изследвания, |
|
— |
статистическа обработка на резултатите, където е възможно, |
|
— |
обсъждане на резултатите, |
|
— |
интерпретиране на резултатите. |
3.2. Оценка и интерпретиране
Виж общо въведение, част Б.
4. ПОЗОВАВАНИЯ
Виж общо въведение, част Б.
ИЗПИТВАНЕ ЗА КАНЦЕРОГЕННОСТ
1. МЕТОД
1.1. Въведение
Виж общо въведение, част Б.
1.2. Определения
Виж общо въведение, част Б.
1.3. Вещества за сравнение
Няма.
1.4. Принцип на метода за изпитване
Нормално изпитваното вещество се прилага седем дни седмично, по подходящ начин, върху няколко групи експериментални животни, по една доза за група, през голяма част от живота им. По време на експозицията на изпитваното вещество и след нея експерименталните животни се наблюдават ежедневно, за да се открият признаци на токсичност и по-конкретно, развитие на тумори.
1.5. Критерии за качество
Няма.
1.6. Описание на метода за изпитване
Животните се държат при експериментални условия на настаняване и хранене в продължение поне на пет дни преди изпитването. Преди изпитването здрави млади животни се избират по случаен признак и се разпределят в третирана и контролна група.
Експериментални животни
Предпочитан вид е плъхът. Въз основа на резултатите от изпитвания, проведени в миналото, могат да се използват други видове (гризачи или различни от гризачи). Трябва да се използват млади здрави животни от обичайно употребявани лабораторни породи и дозирането трябва да започне колкото е възможно по-скоро след отбиването.
При започване на изпитването колебанията в теглото на използваните животни не трябва да превишават ± 20 % от средната стойност. Когато оралното субхронично изпитване се провежда като предварително проучване преди продължително изпитване, и при двете изпитвания трябва да се използва същият вид/порода.
Брой и пол
За гризачи за всяко ниво на дозиране за паралелната контролна група трябва да се използват най-малко по 100 животни (50 женски и 50 мъжки). Женските животни трябва да са нераждали и да не са бременни. Ако се планират междинни жертви, броят трябва да бъде увеличен с броя животни, които са планирани за пожертване преди завършване на изпитването.
Нива на дозиране и честота на експозицията
В допълнение към паралелната контролна група трябва да се използват поне три нива на дозиране. Най-високото ниво на дозиране трябва да предизвиква признаци на минимална токсичност като леко потискане наддаването на тегло (под 10 %), без значително изменение на нормалната продължителност на живота поради ефекти, които са различни от тумори.
Най-ниското ниво на дозиране не трябва да влияе върху нормалния растеж, развитие и дълголетие на животното или да предизвиква някакъв признак на токсичност. Обикновено то не трябва да бъде по-ниско от 10 % от високата доза.
Междинната(ите) доза(и) трябва да се намира(т) по средата на диапазона между високите и ниските дози.
При избиране на нива на дозиране трябва да вземат предвид данните от предшестващи проучвания и изпитвания за токсичност.
Нормално експозицията е ежедневна. Ако дадено химическо вещество се прилага с питейната вода или се смесва с храната, то трябва да е непрекъснато в наличност.
Контроли
Трябва да се използва една паралелна контролна група, която е идентична с третираната група във всяко отношение, освен експозицията на изпитваното вещество.
При особени обстоятелства, например инхалационни изпитвания с аерозоли или емулгиращо средство с нехарактеризирана при орални изпитвания биологична активност, трябва да се използва допълнителна контролна група, която не е в контакт с използвания носител.
Начин на прилагане
Трите основни начина на прилагане са орален, дермален и инхалационен. Изборът на начин на прилагане зависи от физичните и химичните характеристики на изпитваното вещество и вероятния начин на експозиция при хора.
Орални изпитвания
Когато изпитваното вещество се абсорбира от стомашно-чревния тракт и ако храносмилателният път е един от тези, чрез които хората могат да бъдат подложени на експозиция, се предпочита оралният начин на прилагане, освен ако няма противопоказания. Животните могат да получават изпитваното вещество с храната, разтворено в питейната вода или дадено с капсула.
В идеалния случай дозирането трябва да бъде ежедневно, седем дни в седмицата, тъй като дозирането пет дни в седмицата може да даде възможност за възстановяване или за намаляване на токсичността през периода, през който дозирането е прекъснато, и по този начин да окаже влияние върху резултата и последващата оценка. Обаче въз основа главно на практически съображения, дозирането пет дни в седмицата се смята за приемливо.
Дермални изпитвания
Дермалната експозиция чрез боядисване на кожата може да бъде избрана за симулиране на основния път за експозиция при хора и като система модел за предизвикване на кожни лезии.
Инхалационни изпитвания
Тъй като инхалационните изпитвания създават по-сложни технически проблеми в сравнение с другите начини на прилагане, тук се дават по-подробни указания за този начин на прилагане. Трябва да се отбележи, че в особени ситуации интратрахеалното накапване може да бъде валидна алтернатива.
Продължителната експозиция обикновено наподобява предполаганата експозиция при хора, като животните са подложени на ежедневна експозиция в продължение на шест часа след изравняване на концентрациите в камерата, по пет дни в седмицата (интермитентна експозиция) или на 22- до 24-часова експозиция през деня по седем дни седмично (непрекъсната експозиция), съответстваща на възможна експозиция от околната среда, като около един час дневно по едно и също време се отделя за хранене на животните и за поддържане на камерата. И в двата случая животните обикновено са подложени на експозиция с фиксирани концентрации на изпитваното вещество.
Основна разлика между интермитентната и непрекъснатата експозиция е, че при първата съществува период от 17 до 18 часа, през който животните могат да се възстановят от ефектите на ежедневната експозиция, като в края на седмицата има дори още по-дълъг период за възстановяване.
Изборът на интермитентна или непрекъсната експозиция зависи от целите на изпитването и от експозицията при хора, която трябва да се симулира. Трябва обаче да се имат предвид определени технически трудности. Например, предимствата на непрекъснатата експозиция при симулиране на условията в околната среда могат да бъдат изместени от нуждата от поене и хранене по време на експозицията и от необходимостта от по-сложно (и сигурно) генериране на аерозол и пара и от мониторингови техники.
Експозиционни камери
Животните трябва да бъдат изследвани в инхалационни камери, предназначени за поддържане на динамичен въздушен поток при поне 12-кратно обменяне на въздуха за час, за да се обезпечат адекватно кислородно съдържание и равномерно разпределена експозиционна атмосфера. Контролните и експозиционните камери трябва да бъдат идентични по конструкция и проект така, че да осигурят сравними във всички отношения условия, освен експозицията на изпитваните вещества. Обикновено в камерата се поддържа леко отрицателно налягане, за да се предотврати изтичането на изпитвано вещество в заобикалящата среда. Камерите трябва да намалят до минимум струпването на експериментални животни. Като правило, за да се постигне стабилност на атмосферата в камерата, общият обем на експерименталните животни не трябва да надвишава 5 % от обема на камерата.
Измерванията или мониторингът трябва да включват:
|
i) |
въздушен поток: за предпочитане е дебитът на въздушния поток през камерата да се мониторира непрекъснато; |
|
ii) |
концентрация: По време на ежедневната експозиция концентрацията на изпитваното вещество не трябва да варира с повече от ± 15 % от средната стойност; По време на цялото изпитване, концентрациите през отделните дни трябва да бъдат поддържани колкото е възможно по-постоянни. |
|
iii) |
температура и влажност: за гризачи температурата трябва да се поддържа на 22 ± 2 °C, а влажността в камерата на 30 до 70 %, освен когато за суспендиране на изследваното вещество в атмосферата на камерата се използва вода. За предпочитане е и двата показателя да се мониторират непрекъснато; |
|
iv) |
измерване размера на частиците: разпределението на размерите на частиците се определя в атмосферата на камери, които включват течни или твърди аерозоли. Частиците на аерозола трябва да бъдат с размери, позволяващи вдишването им от използваните експериментални животни. Проби от атмосферата в камерите трябва да се вземат в зоната на дишане на животните. Пробата въздух трябва да бъде представителна за разпределението на частиците, с които животните са в контакт, и трябва гравиметрично да се вземе предвид целият суспендиран аерозол, дори когато голяма част от него не се вдишва. При разработване на генериращата система трябва често да се анализират размерите на частиците, за да се осигури стабилността на аерозола, а впоследствие толкова често, колкото е необходимо по време на експозицията, за да се определи адекватно устойчивостта на разпределението на частиците, с които животните са в контакт. |
Продължителност на изпитването
Продължителността на изпитването за канцерогенност ангажира голяма част от нормалната продължителност на живота на експерименталните животни. Прекратяването на изпитването трябва да бъде след 18 месеца за мишки и хамстери и след 24 месеца за плъхове. За някои породи животни с по-голямо дълголетие и/или ниска спонтанна честота на туморите обаче прекратяването трябва да стане след 24 месеца за мишки и хамстери и след 30 месеца за плъхове. Алтернативно прекратяването на такова разширено изпитване е приемливо, когато броят на оживелите животни в групата, третирана с най-ниската доза, и в контролната група достигне 25 %. При прекратяване на изпитване, при което се наблюдава явна разлика в отговора между половете, всеки пол трябва да се разглежда отделно. Когато само животните от групата, третирана с висока доза, умират преждевременно поради явна токсична причина, това не изисква прекратяване, при условие че токсичните прояви не създават проблеми в другите групи. За да бъде приемлив един отрицателен резултат, не повече от 10 % от която и да е група може да бъде загубена от експеримента поради автолиза, канибализъм или проблеми с управлението, а преживяемостта във всички групи е не по-ниска от 50 % на 18-ия месец за мишки и хамстери и на 24-ия месец за плъхове.
Процедура
Наблюдения
Ежедневните наблюдения в клетките трябва да включват измененията на кожата и козината, очите и лигавиците, а също дихателната, сърдечно съдовата, автономната и централната нервна система, соматомоторната активност и начина на поведение.
Редовното наблюдение на животните е необходимо, за да се обезпечи, доколкото е възможно, животните да не се губят от изпитването поради причини като канибализъм, тъканна автолиза или преместване. Умиращите животни трябва да бъдат отстранени и подложени на аутопсия, когато бъдат забелязани.
За всички животни трябва да бъдат регистрирани клиничните признаци и смъртността. Специално внимание трябва да се обърне на развитието на тумори: трябва да се регистрират времето на настъпване, локализацията, размерите, външният вид и прогресирането на всички макроскопски видими или напипващи се тумори.
Консумацията на храна (и консумацията на вода, когато изпитваното вещество се прилага с питейната вода) трябва да се измерват всяка седмица по време на първите 13 седмици от изпитването и след това на интервали от приблизително три месеца, освен ако здравословното състояние или измененията на телесното тегло не изискват друго.
Телесното тегло трябва да се регистрира индивидуално за всички животни един път седмично през първите 13 седмици на изпитването и поне един път на всеки четири седмици след това.
Клинични изследвания
Хематологично изследване
Ако въз основа на клиничните наблюдения може да се предположи влошаване на здравословното състояние на животните по време на изпитването, на засегнатите животни трябва да се направи диференциално броене на кръвните клетки.
На 12-ия месец, 18-ия месец и преди умъртвяването на животните се правят кръвни натривки. Диференциално броене на кръвните клетки се извършва на проби от животни в групата, третирана с висока доза, и в контролните групи. Ако въз основа на тези данни и по-конкретно данните, получени преди пожертването, или данните от патологичното изследване, съществува необходимост, диференциално броене на кръвните клетки трябва да се направи и на групата(ите), третирана(и) със следващата по-ниска доза.
Макроскопска аутопсия
Всички животни, включително тези, които са умрели по време на експеримента или са били пожертвани, защото са намерени умиращи, трябва да бъдат подложени на пълна макроскопска аутопсия. Всички макроскопски видими тумори или лезии или лезии, които са съмнителни за тумори, трябва да бъдат съхранени.
Следните органи и тъкани трябва да бъдат съхранени в подходяща среда за възможно бъдещо хистопатологично изследване: мозъкът (включително срези на продълговатия мозък/варолиевият мост, кората на малкия мозък и кората на главния мозък), хипофизата, щитовидната/паращитовидните жлези, цялата тимусна тъкан, трахеята и белите дробове, сърцето, аортата, слюнчените жлези, черният дроб, слезката, бъбреците, надбъбречните жлези, панкреасът, гонадите, матката, допълнителните полови органи, кожата, хранопроводът, стомахът, дванадесетопръстникът, празното черво, хълбочното черво, сляпото черво, ободното черво, правото черво, пикочният мехур, представителен лимфен възел, женската млечна жлеза, бедрената мускулатура, периферен нерв, гръдната кост с костен мозък, бедрената кост (включително става), (гръбначният мозък на три нива – шийно, средно гръдно и поясно) и очите.
Раздуването на белите дробове и пикочния мехур с фиксатор представлява оптимален начин за съхраняване на тези тъкани. Раздуването на белите дробове при инхалационни изпитвания е много важно за правилното хистопатологично изследване. При инхалационни изпитвания трябва да бъде съхранен целият респираторен тракт, включително носната кухина, фаринкса и ларинкса.
Хистопатологично изследване
|
a) |
Пълно хистопатологично изследване трябва да се направи на органите и тъканите на всички животни, които са умрели или са били пожертвани по време на изпитването, и на всички животни от групата, третирана с висока доза, и контролната група. |
|
б) |
Всички макроскопски видими тумори или лезии, съмнителни за тумори, трябва да бъдат изследвани микроскопски във всички групи. |
|
в) |
Ако е налице значима разлика в честотата на неопластичните лезии между групата, третирана с висока доза, и контролната група трябва да се извърши хистопатологично изследване на този конкретен орган или тъкан и в другите групи. |
|
г) |
Ако преживяемостта в групата, третирана с висока доза, е значително по-ниска в сравнение с контролната група, тогава на групата, третирана със следващата по-ниска доза, трябва да бъде направено пълно изследване. |
|
д) |
Ако в групата, третирана с висока доза, са налице данни за предизвикване на токсични или други ефекти, които биха могли да окажат влияние върху неопластичния отговор, на групата, третирана със следващата по-ниска доза, трябва да бъде направено пълно изследване. |
2. ДАННИ
Данните трябва да бъдат обобщени в табличен вид, като за всяка изпитвана група са показани броят на животните в началото на изпитването, броят на животните, при които са налице тумори, открити по време на изпитването, моментът, в който тези тумори са открити, и броят на животните, които при пожертването имат тумори. Резултатите трябва да бъдат оценени с помощта на подходящ статистически метод. Може да се използва всеки признат статистически метод.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. Протокол от изпитването
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
— |
вид, порода, източник, условия на околната среда, диета, |
|
— |
условия на изпитването, Описание на експозиционната апаратура: включително проектиране, тип, размери, източник на въздух, система за генериране на частици и аерозоли, метод за климатизиране, пречистване на използвания въздух и метод за настаняване на животните в експериментална камера, когато се използва такава. Трябва да бъде описано оборудването за измерване на температурата, влажността и, където е необходимо, стабилността на концентрациите на частиците в аерозолите или на размера на частиците. Данни за експозицията: те трябва да бъдат представени в табличен вид със средни стойности и мярка за вариабилността (например стандартно отклонение) и трябва да включват:
|
|
— |
нива на дозиране (включително носител, ако е използван) и концентрации, |
|
— |
данни за честотата на туморите по пол, доза и вид на тумора, |
|
— |
време на смъртта по време на изпитването или дали животните са оживели до прекратяването му, |
|
— |
данни за токсичния отговор по пол и доза, |
|
— |
описание на токсичните или други ефекти, |
|
— |
време на наблюдение на всеки абнормен признак и неговото последващо развитие, |
|
— |
данни за храната и телесното тегло, |
|
— |
използвани хематологични изследвания и всички резултати, |
|
— |
резултати от аутопсията, |
|
— |
подробно описание на всички резултати от хистопатологичните изследвания, |
|
— |
статистическа обработка на резултатите и описание на използваните методи, |
|
— |
обсъждане на резултатите, |
|
— |
интерпретиране на резултата. |
3.2. Оценка и интерпретиране
Виж общо въведение, част Б.
4. ПОЗОВАВАНИЯ
Виж общо въведение, част Б.
КОМБИНИРАНО ИЗПИТВАНЕ ЗА ХРОНИЧНА ТОКСИЧНОСТ/КАНЦЕРОГЕННОСТ
1. МЕТОД
1.1. Въведение
Виж общо въведение, част Б.
1.2. Определения
Виж общо въведение, част Б.
1.3. Вещества за сравнение
Няма.
1.4. Принцип на метода за изпитване
Целта на комбинираното изпитване за хронична токсичност/канцерогенност е да определи хроничните токсични и канцерогенни ефекти на дадено вещество върху видове бозайници след продължителна експозиция.
За тази цел изпитването за канцерогенност се допълва с поне една третирана и една контролна сателитна група. Дозата, използвана за сателитната група, подложена на висока доза, може да бъде по-висока от дозата, използвана за групата, подложена на висока доза при изпитването за канцерогенност. При изпитването за канцерогенност животните се изследват за обща токсичност, а също и за канцерогенен отговор. Животните от третираната сателитна група се изследват за обща токсичност.
Нормално изпитваното вещество се прилага седем дни седмично, по подходящ начин, върху няколко групи експериментални животни, по една доза за група, в продължение на голяма част от живота им. По време на експозицията на изпитваното вещество и след нея, експерименталните животни се наблюдават ежедневно, за да се открият някакви признаци на токсичност и развитие на тумори.
1.5. Критерии за качество
Няма.
1.6. Описание на метода за изпитване
Животните се държат при експериментални условия на настаняване и хранене в продължение поне на пет дни преди изпитването. Преди изпитването здрави млади животни се избират по случаен признак и се разпределят в третирана и контролна група.
Експериментални животни
Предпочитаният вид е плъх. Въз основа на резултатите от изпитвания, проведени в миналото, могат да се използват други видове (гризачи и различни от гризачи). Трябва да се използват млади здрави животни от обичайно употребявани лабораторни породи и дозирането трябва да започне колкото е възможно по-скоро след отбиването.
При започване на изпитването колебанията в теглото на използваните животни не трябва да превишават ± 20 % от средната стойност. Когато оралното субхронично изпитване се провежда като предварително проучване преди продължително изпитване, и при двете изпитвания трябва да се използват същите вид и порода.
Брой и пол
За гризачи за всяко ниво на дозиране и за паралелната контролна група трябва да се използват най-малко по 100 животни (50 женски и 50 мъжки). Женските животни трябва да са нераждали и да не са бременни. Ако се планират междинни жертви, броят трябва да бъде увеличен съответно с броя животни, които са планирани за пожертване преди завършване на изпитването.
Третираната(ите) сателитна(и) група(и) за оценка на патология, различна от тумори, трябва да съдържа(т) по 20 животни от всеки пол, докато сателитната контролна група трябва да съдържа по 10 животни от всеки пол.
Нива на дозиране и честота на експозицията
За целите на изпитването за канцерогенност в допълнение към паралелната контролна група трябва да се използват поне три нива на дозиране. Най-високото ниво на дозиране трябва да предизвиква признаци на минимална токсичност като леко потискане наддаването на тегло (под 10 %), без значително изменение на нормалната продължителност на живота поради ефекти, които са различни от тумори.
Най-ниското ниво на дозиране не трябва да влияе върху нормалния растеж, развитие и дълголетие на животното или да предизвиква някакъв признак на токсичност. Обикновено то не трябва да бъде по-ниско от 10 % от високата доза.
Междинната(ите) доза(и) трябва да се намира(т) по средата на диапазона между високата и ниската доза.
При избиране на нива на дозиране трябва да вземат предвид данните от предшестващи проучвания и изпитвания за токсичност.
За целите на изпитването за хронична токсичност в изпитването трябва да бъдат включени допълнителни третирани групи и паралелна контролна сателитна група. Високата доза за третираните сателитни животни трябва да предизвиква ясни признаци на токсичност.
Нормално експозицията е ежедневна. Ако дадено химическо вещество се прилага в питейната вода или се смесва с храната, то трябва да е непрекъснато в наличност.
Контроли
Трябва да се използва една паралелна група, която е идентична с третираната група във всяко отношение, освен експозицията на изпитваното вещество.
При особени обстоятелства, например инхалационни изпитвания с аерозоли или емулгиращо средство с нехарактеризирана при орални изпитвания биологична активност, трябва да се използва допълнителна контролна група, която не е подложена на експозиция на носителя.
Начин на прилагане
Трите основни начина на прилагане са орален, дермален и инхалационен. Изборът на начин на прилагане зависи от физичните и химичните характеристики на изпитваното вещество и вероятния начин на експозиция при хора.
Орални изпитвания
Когато изпитваното вещество се абсорбира от стомашно-чревния тракт и ако храносмилателният път е един от тези, чрез които хората могат да бъдат подложени на експозиция, се предпочита оралният начин на прилагане, освен ако няма противопоказания. Животните могат да получават изпитваното вещество с храната, разтворено в питейната вода или дадено с капсула. В идеалния случай дозирането трябва да бъде ежедневно, седем дни в седмицата, тъй като дозирането пет дни в седмицата може да даде възможност за възстановяване или за намаляване на токсичността през периода, през който дозирането е прекъснато, и по този начин да се повлияят резултатът и последващата оценка. Обаче въз основа главно на практически съображения, дозирането пет дни в седмицата се смята за приемливо.
Дермални изпитвания
Дермалната експозиция чрез боядисване на кожата може да бъде избрана за симулиране на основния път за експозиция при хора и като система модел за предизвикване на кожни лезии.
Инхалационни изпитвания
Тъй като инхалационните изпитвания създават по-сложни технически проблеми в сравнение с другите начини на прилагане, тук се дават по-подробни указания за този начин на прилагане. Трябва да се отбележи и че в особени ситуации интратрахеалното накапване може да представлява валидна алтернатива.
Продължителната експозиция обикновено наподобява предполаганата експозиция при хора, като животните са подложени на ежедневна експозиция в продължение на шест часа след изравняване на концентрациите в камерата, по пет дни в седмицата (интермитентна експозиция) или на 22- до 24-часова експозиция през деня по седем дни седмично (непрекъсната експозиция), съответстваща на възможна експозиция от околната среда, като около един час дневно по едно и също време се отделя за хранене на животните и за поддържане на камерата. И в двата случая животните обикновено са подложени на експозиция с фиксирани концентрации на изпитваното вещество. Основна разлика между интермитентната и непрекъснатата експозиция е, че при първата съществува период от 17 до 18 часа, през който животните могат да се възстановят от ефектите на ежедневната експозиция, като в края на седмицата има дори още по-дълъг период за възстановяване.
Изборът на интермитентна или непрекъсната експозиция зависи от целите на изпитването и от експозицията при хора, която трябва да се симулира. Трябва обаче да се имат предвид определени технически трудности. Например, предимствата на непрекъснатата експозиция при симулиране на условията в околната среда могат да бъдат изместени от нуждата от поене и хранене по време на експозицията и от необходимостта от по-сложно (и сигурно) генериране на аерозол и пара и от мониторингови техники.
Експозиционни камери
Животните трябва да бъдат изследвани в инхалационни камери, предназначени за поддържане на динамичен въздушен поток при поне 12-кратно обменяне на въздуха за час, за да се обезпечат адекватно кислородно съдържание и равномерно разпределена експозиционна атмосфера. Контролните и експозиционните камери трябва да бъдат идентични по конструкция и проект така, че да осигурят сравними във всички отношения условия, освен експозицията на изпитваните вещества. Обикновено в камерата се поддържа леко отрицателно налягане, за да се предотврати изтичането на изпитваното вещество в заобикалящата среда. Камерите трябва да намалят до минимум струпването на експериментални животни. Като правило, за да се постигне стабилност на атмосферата в камерата, общият обем на експерименталните животни не трябва да надвишава 5 % от обема на камерата.
Измерванията или мониторингът трябва да включват:
|
i) |
въздушен поток: за предпочитане е дебитът на въздушния поток през камерата да се мониторира непрекъснато; |
|
ii) |
концентрация: по време на ежедневната експозиция концентрацията не трябва да се колебае с повече от ± 15 % от средната стойност. През цялото изпитване, концентрациите през отделните дни трябва да бъдат поддържани колкото е възможно по-постоянни. |
|
iii) |
температура и влажност: за гризачи, температурата трябва да се поддържа на 22 ± 2 °C, а влажността в камерата на 30 до 70 %, освен когато за суспендиране на изпитваното вещество в атмосферата на камерата се използва вода. За предпочитане е и двата показателя да се мониторират непрекъснато; |
|
iv) |
измерване размера на частиците: разпределението на размерите на частиците се определя в атмосферата на камери, които включват течни или твърди аерозоли. Частиците на аерозола трябва да бъдат с размери, позволяващи вдишването им от използваните експериментални животни. Проби от атмосферата в камерите трябва да се вземат в зоната на дишане на животните. Пробата въздух трябва да бъде представителна за разпределението на частиците, с които животните са в контакт, и трябва гравиметрично да се вземе предвид целият суспендиран аерозол, дори когато голяма част от него не се вдишва. При разработване на генериращата система трябва често да се анализират размерите на частиците, за да се осигури стабилността на аерозола, а впоследствие толкова често, колкото е необходимо по време на експозицията, за да се определи адекватно устойчивостта на разпределението на частиците, с които животните са в контакт. |
Продължителност на изпитването
Изпитването за канцерогенност ангажира голяма част от нормалната продължителност на живота на експерименталните животни. Прекратяването на изпитването трябва да бъде след 18 месеца за мишки и хамстери и след 24 месеца за плъхове. За някои породи животни с по-голямо дълголетие и/или ниска спонтанна честота на туморите обаче прекратяването трябва да стане след 24 месеца за мишки и хамстери и след 30 месеца за плъхове. Алтернативно прекратяването на такова разширено изпитване е приемливо, когато броят на оживелите животни в групата, третирана с най-ниската доза, и в контролната група достигне 25 %. При прекратяване на изпитване, при което се наблюдава явна разлика в отговора между половете, всеки пол трябва да се разглежда отделно. Когато само животните в групата, третирана с висока доза, умират преждевременно поради явни токсични причини, това не налага прекратяване, при условие че токсичните прояви не създават проблеми в другите групи. За да бъде приемлив един отрицателен резултат, не повече от 10 % от която и да е група може да бъде загубена от експеримента поради автолиза, канибализъм или проблеми с управлението, а преживяемостта във всички групи е не по-ниска от 50 % на 18-ия месец за мишки и хамстери и на 24-ия месец за плъхове.
Сателитните групи от 20 дозирани животни от пол и 10 асоциирани контролни животни от пол, използвани за изпитване за хронична токсичност, трябва да бъдат задържани в експеримента в продължение поне на 12 месеца. Тези животни трябва да бъдат планирани за пожертване за изследване на патология, свързана с изпитваното вещество, която не е усложнена с геронтологични изменения.
Процедура
Наблюдения
Трябва да се извършват ежедневни наблюдения в клетките, като те трябва да включват измененията на кожата и козината, очите и лигавиците, а също дихателната, сърдечно съдовата, автономната и централната нервна система, соматомоторната активност и начина на поведение.
През подходящи интервали трябва да се извършва клиничен преглед на животните от третираната(ите) сателитна(и) група(и).
Редовното наблюдение на животните е необходимо, за да се обезпечи, доколкото е възможно, животните да не се губят от изпитването поради причини като канибализъм, тъканна автолиза или преместване. Умиращите животни трябва да бъдат отстранени и подложени на аутопсия, когато бъдат забелязани.
Клиничните признаци, включително неврологични и очни изменения, а също смъртността, трябва да се регистрират за всички животни. Специално внимание трябва да се обърне на развитието на тумори: трябва да се регистрират времето на поява, локализацията, размерите, външният вид и прогресирането на всички макроскопски видими или опипващи се тумори; трябва да се регистрират времето на настъпване и прогресирането на токсичните състояния.
Консумацията на храна (и консумацията на вода, когато изпитваното вещество се прилага с питейната вода) трябва да се измерват всяка седмица по време на първите 13 седмици от изпитването и след това на интервали от приблизително три месеца, освен ако здравословното състояние или измененията на телесното тегло не изискват друго.
Телесното тегло трябва да се регистрира индивидуално за всички животни един път седмично през първите 13 седмици на изпитването и поне един път на всеки четири седмици след това.
Клинични изследвания
Хематологично изследване
Хематологично изследване (т.е. съдържание на хемоглобин, хематокрит, общ брой на еритроцитите, общ брой на левкоцитите, тромбоцити и други показатели на потенциала за съсирване) трябва да се извършва на третия и шестия месец, след това на интервали от приблизително шест месеца, както и в края на идпитването върху кръвни проби, взети от по 10 плъха/пол от всички групи. Ако е възможно, пробите трябва да бъдат от едни и същи плъхове при всеки интервал.
Ако въз основа на наблюденията в клетките може да се предположи влошаване на здравословното състояние на животните по време на изпитването, на засегнатите животни трябва да се направи диференциално броене на кръвните клетки.
Диференциално броене на кръвните клетки се прави на проби от такива животни от групата, третирана с най-висока доза, и от контролните групи. Диференциалното броене на кръвни клетки се извършва при групата(ите), третирана(и) със следващата по-ниска доза, само ако е налице голямо несъответствие между групата, третирана с най-високата доза, и контролите или ако съществуват показания въз основа на патологични резултати.
Изследване на урина
За анализ трябва да се вземат проби урина от 10 плъха/пол от всички групи и, ако е възможно, от едни и същи плъхове през същите интервали, както хематологичните изследвания. При гризачи трябва да се изследват следните параметри при отделни животни или при пул от проби от същия пол и група.
|
— |
външен вид: обем и плътност при отделните животни, |
|
— |
белтък, глюкоза, кетони, скрита кръв (полуколичествено изследване), |
|
— |
микроскопско изследване на седимент (полуколичествено). |
Клинична биохимия
Приблизително на шестмесечни интервали и при прекратяване на изпитването се вземат кръвни проби за клинични биохимични параметри от всички видове, различни от гризачи, и от 10 плъха/пол от всички групи и, ако е възможно, от същите плъхове при всеки интервал. Освен това от всички видове, различни от гризачи, преди изпитването трябва да се вземе изходна проба. От тези проби се приготвя плазма и се изследват следните параметри:
|
— |
концентрация на общия белтък, |
|
— |
концентрация на албумина, |
|
— |
функционални чернодробни изследвания (като активност на алкалната фосфатаза, активност на глутамат пируват трансаминазата (2), активност на глутамат оксалоацетат трансаминазата (3), гама-глутамил транспептидаза, орнитин декарбоксилаза, |
|
— |
въглехидратен метаболизъм, например кръвна захар на гладно, |
|
— |
бъбречни функционални изследвания като уреен азот в кръвта. |
Макроскопска аутопсия
Всички животни, включително тези, които са умрели по време на експеримента или са били пожертвани, защото са намерени умиращи, трябва да бъдат подложени на пълна макроскопска аутопсия. Преди пожертването от всички животни трябва да бъдат взети кръвни проби за диференциално броене на кръвни клетки. Всички макроскопски видими тумори или лезии, които са съмнителни за тумори, трябва да бъдат съхранени. Трябва да се направи опит за съпоставяне на резултатите от макроскопското и микроскопското изследване.
Всички органи и тъкани трябва да бъдат съхранени за хистопатологично изследване. Обикновено това се отнася до следните органи и тъкани: мозъка (5) (продълговатия мозък/варолиевия мост, кората на малкия мозък, кората на главния мозък), хипофизата, щитовидната жлеза (включително паращитовидните жлези), тимуса, белите дробове (включително трахеята), сърцето, аортата, слюнчените жлези, черния дроб (5), слезката, бъбреците (5), надбъбречните жлези (5), хранопровода, стомаха, дванадесетопръстника, празното черво, хълбочното черво, сляпото черво, ободното черво, правото черво, пикочния мехур, лимфните възли, панкреаса, гонадите (5), допълнителните полови органи, женската млечна жлеза, кожата, мускулите, периферен нерв, гръбначния мозък (шиен, гръден и поясен), гръдната кост с костен мозък, бедрената кост (включително става) и очите.
Въпреки че раздуването на белите дробове и пикочния мехур с фиксатор представлява оптимален начин за съхраняване на тези тъкани, раздуването на белите дробове при инхалационни изпитвания представлява необходимо изискване за правилно хистопатологично изследване. При специални изпитвания като инхалационните трябва да бъде изследван целият респираторен тракт, включително носа, фаринкса и ларинкса.
Ако се провеждат други клинични изследвания, информацията, получена при тези процедури, трябва да бъде налице преди микроскопското изследване, тъй като тя може да даде важни насоки на патолога.
Хистопатологично изследване
За изпитването за хронична токсичност:
Всички съхранени органи от всички животни от сателитната група, третирана с висока доза, и от контролната група трябва да бъдат подложени на подробно изследване. Когато свързана с изпитваното вещество патология се открива в сателитната група,третирана с висока доза, целевите органи на всички други животни от всички други третирани сателитни групи, а също и тези от третираните групи от изпитването за канцерогенност, трябва да бъдат подложени на пълно и подробно хистологично изследване при прекратяване на изпитването.
За изпитването за канцерогенност:
|
a) |
Трябва да се направи пълно хистопатологично изследване на органите и тъканите на всички животни, които са умрели или са били пожертвани по време на изпитването и на всички животни от контролната група и групата, третирана с висока доза. |
|
б) |
Всички макроскопски видими тумори или лезии, съмнителни за тумори, възникващи в който и да е орган, трябва да бъдат изследвани микроскопски във всички групи. |
|
в) |
Ако е налице значима разлика в честотата на неопластичните лезии между групата, третирана с висока доза, и контролната група трябва да се извърши хистопатологично изследване на този конкретен орган или тъкан и в другите групи. |
|
г) |
Ако преживяемостта в групата, третирана с висока доза, е значително по-ниска в сравнение с контролната група, тогава трябва да се направи пълно изследване на групата, третирана със следващата по-ниска доза. |
|
д) |
Ако при групата, третирана с висока доза, са налице данни за предизвикване на токсични или други ефекти, които биха могли да окажат влияние върху неопластичния отговор, на групата, третирана със следващата по-ниска доза, трябва да бъде направено пълно изследване. |
2. ДАННИ
Данните трябва да бъдат обобщени в табличен вид, като за всяка изпитвана група са показани броят на животните в началото на изпитването, броят на животните, при които са налице тумори или токсични ефекти, открити по време на изпитването, времето на откриване и броят на животните, които при пожертването имат тумори. Резултатите трябва да бъдат оценени с помощта на подходящ статистически метод. Може да се използва всеки признат статистически метод.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. Протокол от изпитването
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
— |
вид, порода, източник, условия на околната среда, диета, |
|
— |
условия на изпитването, Описание на експозиционната апаратура: включително проектиране, тип, размери, източник на въздух, система за генериране на частици и аерозоли, метод за климатизиране, пречистване на използвания въздух и метод за настаняване на животните в експериментална камера, когато се използва такава. Трябва да бъде описано оборудването за измерване на температурата, влажността и, където е необходимо, стабилността на концентрациите на частиците в аерозолите или на размера на частиците. Данни за експозицията: Те трябва да бъдат представени в табличен вид със средни стойности и мярка за вариабилността (например стандартно отклонение) и трябва да включват:
|
|
— |
нива на дозиране (включително носител, ако е използван) и концентрации, |
|
— |
данни за честотата на туморите по пол, доза и вид на тумора, |
|
— |
време на смъртта по време на изпитването или дали животните са оживели до прекратяването му, включително и от сателитната група, |
|
— |
данни за токсичния отговор по пол и доза, |
|
— |
описание на токсичните или други ефекти, |
|
— |
време на наблюдение на всеки абнормен признак и неговото последващо развитие, |
|
— |
резултати от офталмологичното изследване, |
|
— |
данни за храната и телесното тегло, |
|
— |
използвани хематологични изследвания и всички резултати, |
|
— |
използвани клинични биохимични изследвания и всички резултати (включително резултати от всички изследвания на урина), |
|
— |
резултати от аутопсията, |
|
— |
подробно описание на всички резултати от хистопатологичните изследвания, |
|
— |
статистическа обработка на резултатите и описание на използваните методи, |
|
— |
обсъждане на резултатите, |
|
— |
интерпретиране на резултатите. |
3.2. Оценка и интерпретиране
Виж общо въведение, част Б.
4. ПОЗОВАВАНИЯ
Виж общо въведение, част Б.
ИЗПИТВАНЕ ЗА ТОКСИЧНОСТ ЗА РАЗМНОЖАВАНЕТО В ЕДНО ПОКОЛЕНИЕ
1. МЕТОД
1.1. Въведение
Виж общо въведение, част Б.
1.2. Определения
Виж общо въведение, част Б.
1.3. Вещества за сравнение
Няма.
1.4. Принцип на метода за изпитване
Изпитваното вещество се прилага в нарастващи дози върху няколко групи мъжки и женски животни. Мъжките животни трябва да бъдат дозирани по време на растежа и в продължение на поне един пълен цикъл на сперматогенеза (приблизително 56 дни при мишки и 70 дни при плъхове), за да бъдат предизвикани евентуални нежелани ефекти на изпитваното вещество върху сперматогенезата.
Женските животни от родителското поколение (P) трябва да бъдат дозирани с изпитваното вещество в продължение на поне два пълни цикъла на разгонване. След това животните се чифтосват. Изпитваното вещество се прилага и при двата пола по време на чифтосването , а след това само при женските животни през бременността и по време на кърменето.
Този метод ще изисква модифициране при прилагане чрез инхалиране.
1.5. Критерии за качество
Няма.
1.6. Описание на метода за изпитване
Подготовка
Преди изпитването здрави млади животни се избират по случаен признак и се разпределят в третирана и контролна група. Животните се държат при експериментални условия на настаняване и хранене в продължение поне на пет дни преди изпитването.
Препоръчва се изпитваното вещество да се прилага с храната или в питейната вода. Приемливи са и други начини на прилагане Дозирането при всички животни трябва да се извършва по един и същ метод по време на съответния експеримент. Ако за улесняване на дозирането се използват помощно вещество или други добавки, трябва да е известно, че те не водят до токсични ефекти.
Дозирането трябва да бъде седем дни в седмицата.
Експериментални животни
Избор на вид
Предпочитаните видове са плъх или мишка. Трябва да се използват здрави животни, които в миналото не са били подлагани на експериментални процедури. Не трябва да се използват породи с ниска плодовитост. Експерименталните животни трябва да бъдат характеризирани по отношение на вида, породата, пола, теглото и/или възрастта.
За адекватна оценка на плодовитостта трябва да бъдат изследвани както мъжки, така и женски животни. Всички експериментални и контролни животни трябва да бъдат отбити преди започване на дозирането.
Брой и пол
Всяка третирана и контролна група трябва да се състои от достатъчен брой животни, за да се получат около 20 бременни женски животни достигнали или наближаващи термина.
Целта е да се получат достатъчно на брой бременности и потомства, за да се осигури значима оценка на потенциала на веществото да влияе върху плодовитостта, бременността и майчиното поведение при животните от поколение P, както и сученето, растежа и развитието на поколението F1 от зачеването до отбиването.
Условия на изпитването
Храна и вода трябва да се предоставят ad libitum. Около раждането бременните женски трябва да бъдат настанени в индивидуални клетки за родилки и майки и могат да им бъдат предоставени материали за гнездо.
Нива на дозиране
Трябва да се използват поне три третирани групи и контролна група. Ако за прилагане на изпитваното вещество се използва носител, контролната група трябва да получава най-голямото използвано количество носител. Ако изпитваното вещество предизвиква намаляване на приема или усвояването на храната, тогава може да се сметне за необходимо използването на втора контролна група за храненето. В идеалния случай, освен ако няма ограничение поради физичното/химичното естество или биологичните ефекти на изпитваното вещество, най-високото ниво на дозиране трябва да предизвиква токсичност, но не и смъртност при животните от родителското (P) поколение. Междинната(ите) доза(и) трябва да предизвиква(т) минимални токсични ефекти, дължащи се на изпитваното вещество, а ниската доза не трябва да предизвиква никакви видими нежелани ефекти върху родителите или поколението. Когато се прилага със сонда или капсули, даваната на всяко животно доза трябва да се базира на индивидуалното телесно тегло на всяко животно и да се коригира ежеседмично към измененията на телесното тегло. По желание за женските животни по време на бременността дозите могат да се базират на телесното тегло от ден 0 или 6 от бременността.
Гранично изпитване
При вещества с ниска токсичност ако доза, която е поне 1 000 мг/кг, не води до поява на признаци на повлияване на репродуктивната функция, изпитвания с други дози може да не се смятат за необходими. Ако предварителното изпитване при високо ниво на дозиране с явни данни за майчина токсичност, не показва нежелани ефекти върху плодовитостта, изпитвания при други нива на дозиране може да не се смятат за необходими.
Провеждане на изпитването
Експериментални схеми
Ежедневното дозиране на мъжките животни от родителското поколение (P) трябва да започне, когато те са на около пет- до деветседмична възраст, след като са отбити и са аклиматизирани в продължение на поне пет дни. При плъхове дозирането продължава 10 седмици преди периода на чифтосване (за мишки периодът е осем седмици). Мъжките животни трябва да бъдат убити и изследвани в края на чифтосването или, алтернативно, те могат да бъдат задържани на експерименталната диета за евентуално получаване на второ котило и трябва да бъдат убити и изследвани преди края на изпитването. За женските животни от родителското поколение (P) дозирането трябва да започне след най-малко пет дни аклиматизиране в продължение на поне две седмици преди чифтосването Ежедневното дозиране при женските животни от поколението P трябва да продължи през целия триседмичен период на чифтосване, бременност и до отбиването на поколението F1. Трябва да се има предвид модифициране на схемата за дозиране на базата на друга съществуваща информация за изпитваното вещество като стимулиране на метаболизма или биоакумулиране.
Процедура за чифтосване
При изпитвания за токсичност за размножаването може да се използва чифтосване в съотношение 1:1 (едно мъжко за едно женски животно) или 1:2 (едно мъжко за две женски животни),
При чифтосване 1:1 едно женско животно трябва да се оставя с едно и също мъжко животно до настъпване на бременност или до изтичането на три седмици. Всяка сутрин женските животни трябва да бъдат преглеждани за наличие на сперма или вагинални запушалки. Ден 0 на бременността се определя като деня, в който е открита вагинална запушалка или сперма.
Двойките, които не успеят да се чифтосат, трябва да бъдат оценени за определяне на причината за предполагаемото безплодие. Това може да включва процедури като предоставяне на допълнителни възможности за чифтосване с други мъжки и женски животни с доказана оплодителна способност, микроскопско изследване на репродуктивните органи и изследване на цикъла на разгонване или сперматогенезата.
Големина на котилото
На животните, дозирани при изпитване за плодовитост, се дава възможност да родят потомството си нормално и да го отгледат до етапа на отбиване без стандартизиране на котилото.
Когато се извършва стандартизиране, се препоръчва следната процедура. Между ден 1 и 4 след раждането големината на всяко котило може да бъде коригирана посредством елиминиране на излишните новородени животни чрез селекция, за да се получат, доколкото това е възможно, четири мъжки и четири женски животни за котило. Когато броят на мъжките или женските новородени животни не дава възможност да се получат по четири животни от пол за котило, приемлива е частична корекция (например, пет мъжки и три женски). Корекция не се прави при котила, състоящи се от по-малко от осем новородени животни.
Наблюдения
По време на изпитването всяко животно трябва да се наблюдава поне един път дневно. Трябва да се регистрират съответните изменения в поведението, признаците за затруднено или продължително раждане и всички признаци на токсичност, включително и смъртността. В периода преди и по време на чифтосването консумацията на храна трябва ежедневно да се измерва. След раждането и по време на лактацията измерванията на консумацията на храна (и на консумацията на вода, когато изпитваното вещество се прилага в питейната вода) трябва да се извършват в същия ден, в който се претегля котилото. Мъжките и женските животни от поколението P трябва да бъдат претеглени през първия ден на дозирането и след това един път седмично. Тези наблюдения трябва да се провеждат за всяко възрастно животно поотделно.
Продължителността на бременността трябва да се изчислява от ден 0 на бременността. Всяко котило трябва да бъде прегледано възможно най скоро след раждането, за да се установят броят и полът на новородените животни, мъртвородените, живородените и наличието на макроскопски аномалии.
Мъртвите новородени и новородените, които са умъртвени на ден 4, трябва да бъдат съхранени и изследвани за възможни дефекти. Живите новородени животни трябва да бъдат преброени и котилата да бъдат претеглени на сутринта след раждането и на 4-ти и 7-ми ден, а след това всяка седмица до прекратяване на изпитването, когато животните трябва да бъдат претеглени индивидуално. Трябва да се регистрират физическите и поведенческите аномалии, наблюдавани при майките и потомството.
Патологично изследване
Аутопсия
При умъртвяването или смъртта по време на изпитването животните от поколение P трябва да бъдат изследвани макроскопски за структурни аномалии или патологични изменения, като се обръща специално внимание на органите от размножителната система. Мъртвите или умиращи новородени животни трябва да бъдат изследвани за дефекти.
Хистопатологично изследване
Яйчниците, матката, шийката, влагалището, тестисите, надсеменниците, семенните мехурчета, простатната жлеза, коагулиращата жлеза, хипофизната жлеза и целевият(ите) орган(и) на всички животни от поколение P трябва да бъдат съхранени за микроскопско изследване. В случай, че тези органи не са изследвани при други изпитвания с многократни дози, те трябва да бъдат изследвани микроскопски при всички животни, третирани с висока доза, при контролните животни и при животните, които умират по време на изпитването, ако е възможно.
Органите, в които при тези животни се наблюдават аномалии, трябва след това да бъдат изследвани при всички други животни от поколение P. В тези случаи трябва да се направи микроскопско изследване на всички тъкани, при които се наблюдават макроскопски патологични изменения. Както е предложено в процедурите за чифтосване, размножителните органи на животните, при които има съмнение за безплодие, могат да бъдат подложени на микроскопско изследване.
2. ДАННИ
Данните могат да бъдат обобщени в табличен вид, като за всяка изпитвана група са показани броят на животните в началото на изпитването, броят на фертилните мъжки животни, броят на бременните женски животни, типовете промени и процентът на животните, които демонстрират всеки тип промяна.
Когато е възможно, числовите резултати трябва да бъдат оценени с помощта на подходящ статистически метод. Може да се използва всеки признат статистически метод.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. Протокол от изпитването
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
— |
използван вид/порода, |
|
— |
данни за токсичния отговор по пол и доза, включително плодовитост, бременност и жизнеспособност, |
|
— |
време на смъртта по време на изпитването или дали животните оживяват до времето на планираното пожертване или до прекратяване на изпитването, |
|
— |
таблица, представяща теглото на всяко котило, средното тегло на новородените животни и индивидуалните тегла на новородените животни при прекратяване на изпитването, |
|
— |
токсични или други ефекти върху размножаването, потомството и постнаталния растеж, |
|
— |
ден на наблюдение на всеки абнормен признак и неговото последващо развитие, |
|
— |
данни за телесното тегло за животните от поколение P, |
|
— |
резултати от аутопсията, |
|
— |
подробно описание на всички резултати от микроскопските изследвания, |
|
— |
статистическа обработка на резултатите, където е необходимо, |
|
— |
обсъждане на резултатите, |
|
— |
интерпретиране на резултатите. |
3.2. Оценка и интерпретиране
Виж общо въведение, част Б.
4. ПОЗОВАВАНИЯ
Виж общо въведение, част Б.
ИЗПИТВАНЕ ЗА ТОКСИЧНОСТ ЗА РАЗМНОЖАВАНЕТО В ДВЕ ПОКОЛЕНИЯ
1. МЕТОД
1.1. Въведение
Виж общо въведение, част Б.
1.2. Определения
Виж общо въведение, част Б.
1.3. Вещества за сравнение
Няма.
1.4. Принцип на метода за изпитване
Изпитваното вещество се прилага в нарастващи дози върху няколко групи мъжки и женски животни. Мъжките животни от родителското поколение (P) трябва да бъдат дозирани по време на растежа и в продължение на поне един пълен цикъл на сперматогенеза (приблизително 56 дни при мишки и 70 дни при плъхове), за да бъдат предизвикани евентуални нежелани ефекти на изпитваното вещество върху сперматогенезата.
Женските животни от родителското поколение (P) трябва да бъдат дозирани с изпитваното вещество в продължение на поне два пълни цикъла на разгонване, за да бъдат предизвикани евентуални нежелани ефекти на изпитваното вещество върху разгонването. След това животните се чифтосват. Изпитваното вещество се прилага и при двата пола по време на чифтосването, а след това само при женските животни през бременността и по време на кърменето. При отбиване прилагането на веществото продължава върху поколението F1 по време на растежа му до възрастни индивиди, чифтосването и създаването на поколение F2, докато поколението F2 бъде отбито. За да се прилага чрез инхалиране, този метод ще трябва да се модифицира.
1.5. Критерии за качество
Няма.
1.6. Описание на метода за изпитване
Подготовка
Преди изпитването здрави млади животни се избират по случаен признак и се разпределят в третирана и контролна група. Животните от родителското поколение (P) се държат при експериментални условия на настаняване и хранене в продължение поне на пет дни преди изпитването. Препоръчва се изпитваното вещество да се прилага с храната или в питейната вода. Приемливи са и други начини на прилагане. Дозирането при всички животни трябва да се извършва по един и същ метод по време на целия експеримент. Ако за улесняване на дозирането се използват помощно вещество или други добавки, трябва да е известно, че те не водят до токсични ефекти. Дозирането трябва да бъде седем дни в седмицата.
Експериментални животни: избор на видове
Предпочитаните видове са мишка или плъх.
Трябва да се използват здрави животни от поколение P, които в миналото не са били подлагани на експериментални процедури. Не трябва да се използват породи с ниска плодовитост. Експерименталните животни трябва да бъдат характеризирани по отношение на вида, породата, пола, теглото и/или възрастта.
За адекватна оценка на плодовитостта трябва да бъдат изследвани както мъжки, така и женски животни. Всички експериментални и контролни животни трябва да бъдат отбити преди започване на дозирането.
Брой и пол
Всяка третирана и контролна група трябва да се състои от достатъчен брой животни, за да се получат около 20 бременни женски животни, достигнали или наближаващи термина. Целта е да се получат достатъчен брой бременности и потомства, за да се осигури значима оценка на потенциала на веществото да влияе върху плодовитостта, бременността и майчиното поведение, както и върху сученето, растежа и развитието на поколението F1 от зачеването до съзряването и развитието на тяхното потомство (F2) до отбиването.
Условия на изпитването
Храна и вода трябва да се предоставят ad libitum. Около раждането бременните женски животни трябва да бъдат настанени в индивидуални клетки за родилки и майки и могат да им бъдат предоставени материали за гнездо.
Нива на дозиране
Трябва да се използват поне три третирани групи и контролна група. Ако за прилагане на изпитваното вещество се използва носител, контролната група трябва да получава най-голямото използвано количество носител. Ако изпитваното вещество предизвиква намаляване на приема или усвояването на храната, тогава може да се сметне за необходимо използването на втора контролна група за храненето. В идеалния случай, освен ако няма ограничение поради физичното/химичното естество или биологичните ефекти на изпитваното вещество, най-високото ниво на дозиране трябва да предизвиква токсичност, но не и смъртност при животните от родителското (P) поколение. Междинната(ите) доза(и) трябва да предизвиква(т) минимални токсични ефекти, дължащи се на изпитваното вещество, а ниската доза не трябва да предизвиква никакви видими нежелани ефекти върху родителите или потомството. Когато се прилага със сонда или капсули, дозата, давана на всяко животно, трябва да се базира на индивидуалното телесно тегло на всяко животно и да се коригира ежеседмично. По желание за женските животни по време на бременността дозите могат да се базират на телесното тегло от ден 0 или 6 от бременността.
Гранично изпитване
При вещества с ниска токсичност ако доза, която е поне 1 000 мг/кг, не води до поява на признаци на повлияване на размножителната функция, изпитвания с други дози може да не се смятат за необходими. Ако предварителното изпитване при високо ниво на дозиране с явни данни за майчина токсичност, не показва нежелани ефекти върху плодовитостта, изпитвания при други нива на дозиране може да не се смятат за необходими.
Провеждане на изпитването
Експериментални схеми
Ежедневното дозиране на мъжките животни от родителското поколение (P) трябва да започне, когато те са на около пет- до деветседмична възраст, след като са отбити и са аклиматизирани в продължение на поне пет дни. При плъхове дозирането продължава 10 седмици преди чифтосването (за мишки периодът е осем седмици). Мъжките животни трябва да бъдат убити и изследвани в края на периода на чифтосването или, алтернативно, те могат да бъдат задържани на експерименталната диета за евентуално получаване на второ котило, и трябва да бъдат убити и изследвани преди края на експеримента.
За женските животни от родителското поколение (P) дозирането трябва да започне след най-малко пет дни аклиматизиране и да продължи поне две седмици преди чифтосването. Ежедневното дозиране при женските животни от поколението P трябва да продължи през целия триседмичен период на чифтосване, бременността и до отбиването на поколението F1. Трябва да се има предвид модифициране на схемата за дозиране на базата на друга съществуваща информация за изпитваното вещество като стимулиране на метаболизма или биологично натрупване.
Дозирането при животните от поколението F1 започва при отбиването и приключва, когато те бъдат пожертвани.
Процедура за чифтосване
При изпитвания за токсичност за размножаването може да се използва чифтосване в съотношение 1:1 (едно мъжко за едно женско животно) или 1:2 (едно мъжко за две женски животни),
При чифтосване 1:1 едно женско животно трябва да се оставя с едно и също мъжко животно до настъпване на бременност или до изтичането на три седмици. Всяка сутрин женските животни трябва да бъдат преглеждани за наличие на сперма или вагинални запушалки. Ден 0 от бременността се определя като деня, в който е открита вагинална запушалка или сперма. Като се има предвид сперматогенезата, поколението F1 не бива да се чифтосва докато не достигне възраст поне 11 седмици за мишките и 13 седмици за плъховете. За чифтосване на поколението F1 от всяко котило се избират на случаен принцип по едно мъжко и едно женско животно за кръстосване с новородено животно от друго котило от групата, третирана с една и съща доза, за да се получи поколение F2. Мъжките и женските животни от поколение F1, които не са избрани за чифтосване, се убиват при отбиването.
Двойките, които не успеят да се чифтосат, трябва да бъдат оценени за определяне на причината за предполагаемото безплодие. Това може да включва процедури като предоставяне на допълнителни възможности за чифтосване с други мъжки и женски животни с доказана оплодителна способност, микроскопско изследване на репродуктивните органи и изследване на цикъла на разгонване или сперматогенезата.
Големина на котилото
На животните, дозирани при изпитване за плодовитост, се дава възможност да родят потомството си нормално и да го отгледат до етапа на отбиване без стандартизиране на котилото.
Когато се извършва стандартизиране, се препоръчва следната процедура. Между ден 1 и 4 след раждането големината на всяко котило може да бъде коригирана посредством елиминиране на излишните новородени животни чрез селекция, за да се получат, доколкото това е възможно, четири мъжки и четири женски животни за котило. Когато броят на мъжките или женските новородени животни не дава възможност да се получат по четири животни от пол за котило, приемлива е частична корекция (например, пет мъжки и три женски). Корекция не се прави при котила, състоящи се от по-малко от осем новородени животни. Корекцията на котилата от поколение F2 се провежда по същия начин.
Наблюдения
По време на изпитването всяко животно трябва да се наблюдава поне един път дневно. Трябва да се регистрират съответните изменения в поведението, признаците за затруднено или продължително раждане и всички признаци на токсичност, включително и смъртността. В периода преди и по време на чифтосването консумацията на храна може да се измерва ежеседмично. По желание през бременността консумацията на храна може да се измерва ежедневно. След раждането и по време на кърменето измерванията на консумацията на храна трябва да се извършва в същия, в който се претегля котилото. Животните от поколенията на родителите (P и F1) трябва да бъдат претеглени през първия ден на дозирането и след това всяка седмица. Резултатите от тези наблюдения трябва да се отбелязват поотделно за всяко възрастно животно.
Продължителността на бременността трябва да се изчислява от ден 0 на бременността. Всяко котило трябва да бъде прегледано възможно най скоро след раждането, за да се установят броят и полът на новородените животни, мъртвородените, живородените и наличието на макроскопски аномалии.
Мъртвите новородени животни и новородените животни, които са пожертвани на ден 4, трябва да бъдат съхранени и изследвани за възможни дефекти. Живите новородени животни трябва да бъдат преброени и котилата да бъдат претеглени на сутринта след раждането, на 4-ти и 7-ми ден и след това всяка седмица до приключване на изпитването, когато животните трябва да бъдат претеглени поотделно. Трябва да се регистрират физическите и поведенческите аномалии, наблюдавани при майките или потомството.
Патологично изследване
Аутопсия
Всички възрастни животни от поколенията P и F1 трябва да бъдат убити, когато повече не са необходими за оценка на ефектите върху размножаването. Потомството F1, което не е избрано за чифтосване, и цялото потомство F2 трябва да бъде убито при отбиването.
При пожертването или смъртта по време на изпитването животните от родителските поколения (P и F1) трябва да бъдат изследвани микроскопски за структурни аномалии или патологични изменения, като се обръща специално внимание на органите от размножителната система. Мъртвите или умиращи новородени животни трябва да бъдат изследвани за дефекти.
Хистопатологично изследване
Яйчниците, матката, шийката, влагалището, тестисите, надсеменниците, семенните мехурчета, простатната жлеза, коагулиращата жлеза, хипофизната жлеза и целевият(ите) орган(и) на всички животни от поколение P и F1 трябва да бъдат съхранени за микроскопско изследване. В случай, че тези органи не са изследвани при други изпитвания с многократни дози, те трябва да бъдат изследвани микроскопски при всички животни, третирани с висока доза, при контролните животни от поколенията P и F1, които са избрани за чифтосване, и при животните, които умират по време на изпитването, ако е възможно. Органите, в които при тези животни се наблюдават аномалии, трябва след това да бъдат изследвани при животните от другите дозирани групи. В тези случаи микроскопско изследване трябва да бъде направено на всички тъкани, при които се наблюдават макроскопски патологични изменения. Както е предложено при процедурите за чифтосване, репродуктивните органи на животните, съмнителни за безплодие, могат да бъдат подложени на микроскопско изследване.
2. ДАННИ
Обработка на резултатите
Данните могат да бъдат обобщени в табличен вид, като за всяка изпитвана група са показани броят на животните в началото на изпитването, броят на бременните животни, типът на измененията и процентът на животните, които демонстрират всеки тип изменение.
Когато е възможно, числовите резултати трябва да бъдат оценени с помощта на подходящ статистически метод. Може да се използва всеки признат статистически метод.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. Протокол от изпитването
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
— |
използван вид/порода, |
|
— |
данни за токсичния отговор по пол и доза, включително показатели за плодовитост, бременност и жизнеспособност, |
|
— |
време на смъртта по време на изпитването или дали животните са оживели до прекратяването на изпитването, |
|
— |
таблица, представяща теглото на всяко котило, средното тегло на новородените животни и индивидуалните тегла на новородените животни при прекратяване на изпитването, |
|
— |
токсични или други ефекти върху размножаването, потомството и постнаталния растеж, |
|
— |
ден на наблюдение на всеки абнормен признак и неговото последващо развитие, |
|
— |
данни за телесното тегло на животните от поколения P и F1, които са избрани за чифтосване, |
|
— |
резултати от аутопсията, |
|
— |
подробно описание на всички резултати от микроскопските изследвания, |
|
— |
статистическа обработка на резултатите, когато е необходимо, |
|
— |
обсъждане на резултатите, |
|
— |
интерпретиране на резултатите. |
3.2. Оценка и интерпретиране
Виж общо въведение, част Б.
4. ПОЗОВАВАНИЯ
Виж общо въведение, част Б.
ТОКСИКОКИНЕТИКА
1. МЕТОД
1.1. Въведение
Виж общо въведение, част Б.
1.2. Определения
Виж общо въведение, част Б.
1.3. Вещества за сравнение
Няма.
1.4. Принцип на метода за изпитване
Изпитваното вещество се прилага по подходящ начин. В зависимост от целта на изпитването веществото може да бъде прилагано като еднократни или многократни дози за определени периоди върху една или няколко групи експериментални животни. Впоследствие в зависимост от типа на изпитването се определят веществото и/или метаболитите в течностите, тъканите и/или екскретите на организма.
Могат да се провеждат изпитвания с „маркирани“ или „немаркирани“ форми на изпитваното вещество. Когато се използва маркер, той трябва да бъде поставен във веществото по такъв начин, че да предоставя възможно най-много информация за съдбата на съединението.
1.5. Критерии за качество
Няма.
1.6. Описание на метода за изпитване
Подготовка
Здрави млади възрастни животни се аклиматизират към лабораторните условия в продължение на поне пет дни преди изпитването. Преди изпитването животните се избират по случаен признак и се разпределят в третирани групи. В особени случаи могат да се използват много млади, бременни или предварително третирани животни.
Условия на изпитването
Експериментални животни
Токсикокинетични изпитвания могат да се провеждат върху един или повече подходящи животински видове и трябва да вземат предвид използваните или планираните за използване видове при други токсикологични изследвания със същото изпитвано вещество. Когато за изпитване се използват гризачи, колебанията в теглото не трябва да превишават ± 20 % от средното тегло.
Брой и пол
За изпитване на абсорбцията и екскрецията първоначално във всяка дозирана група трябва да има по четири животни. Не е задължително да се предпочита определен пол, но при определени обстоятелства може да се наложи да бъдат изследвани и двата пола. Ако съществуват разлики между половете при отговора, тогава трябва да се изследват по четири животни от всеки пол. При изпитвания с видове, различни от гризачи, могат да се използват по-малко животни.
Когато се изследва разпределението в тъканите, първоначалната големина на групата трябва да отчита както броя на животните, които трябва да бъдат пожертвани във всяка точка във времето, така и броя на точките във времето, които да се изследват.
Когато се изследва метаболизмът, големината на групата е свързана с нуждите на изпитването.
За изпитвания с многократни дози и много точки във времето, големината на групата трябва да е съобразена с броя на точките във времето и планираното(ите) умъртвяване(ния), но в групата не може да има по-малко от две животни. Големината на групата трябва да бъде достатъчна, за да обезпечи приемливо характеризиране на приема, платото и изчерпването (ако е необходимо) на изпитваното вещество и/или метаболитите.
Нива на дозиране
При прилагане на еднократна доза трябва да се използват поне две нива на дозиране. Трябва да има ниска доза, при която не се наблюдават токсични ефекти, и висока доза, при която може да има изменения в токсикокинетичните параметри или при която възникват токсични ефекти.
При прилагане на многократни дози ниската доза обикновено е достатъчна, но при определени обстоятелства може да е необходима и висока доза.
Начин на прилагане
Токсикокинетичните изпитвания трябва да се провеждат, като се използва същият начин на прилагане и, когато е целесъобразно, същият носител като този, който е използван или е планиран за използване при другите токсикологични изпитвания. Изпитваното вещество обикновено се прилага по орален път със сонда или смесено с храната, поставя се върху кожата или се прилага инхалационно за определени периоди на групи експериментални животни. Интравенозното прилагане на изпитваното вещество може да е полезно при определяне на относителната абсорбция при други начини на прилагане. Освен това може да се получи полезна информация за начина на разпределение малко след интравенозно прилагане на веществото.
Трябва да се има предвид възможността за влияние на носителя върху изпитваното вещество. Трябва да се обърне внимание на разликите в абсорбцията при прилагане на изпитваното вещество със сонда и с храната, и необходимостта от точно определяне на дозата, особено когато изпитваното вещество се дава с храната.
Период на наблюдение
Всички животни трябва да бъдат наблюдавани ежедневно и признаците на токсичност и други значими клинични признаци трябва да бъдат регистрирани, включително времето им на настъпване, силата и продължителността им.
Процедура
След претегляне на експерименталните животни изпитваното вещество се прилага по съответен начин. Ако се сметне за целесъобразно, експерименталните животни могат да бъдат оставени гладни преди да бъде приложено изпитваното вещество.
Абсорбция
Скоростта и степента на абсорбцията на прилаганото вещество могат да бъдат оценени с помощта на различни методи, със или без групи за сравнение (6), например:
|
— |
определяне на количеството изпитвано вещество и/или метаболитите в екскрети като урина, жлъчка, изпражнения, издишан въздух и това, което остава в тялото, |
|
— |
сравняване на биологичния отговор (например при изпитвания за остра токсичност) между изследваните и контролните групи и/или групите за сравнение, |
|
— |
сравняване на количеството вещество, екскретирано през бъбреците и/или метаболитите в експерименталната и контролната група, |
|
— |
определяне на площта под кривата плазмено ниво/време за изпитваното вещество и/или метаболитите и сравняване с данните от група за сравнение. |
Разпределение
В момента съществуват два подхода, като единият от тях или и двата могат да бъдат използвани за анализ на начините на разпределение:
|
— |
полезна качествена информация се получава, като се използват авторадиографски техники за цялото тяло, |
|
— |
количествена информация се получава чрез пожертване на животни по различно време след експозицията и определяне на концентрацията и количеството на изпитваното вещество и/или метаболит в тъканите и органите. |
Екскреция
При изследване на екскрецията се събират урина, изпражнения, издишан въздух и, при определени обстоятелства, жлъчка. Количеството на изпитваното вещество и/или метаболитите в тези екскрети трябва да бъде измерено неколкократно след експозицията или докато приблизително 95 % от приложената доза бъде екскретирана или в продължение на седем дни, в зависимост от това кое от тези събития настъпи най-напред.
В особени случаи може да е необходимо да се вземе предвид екскрецията на изпитваното вещество в млякото на кърмещи експериментални животни.
Метаболизъм
За да се определи степента и начина на метаболизъм, трябва с помощта на подходящи техники да се анализират биологични проби. Трябва да се изясни структурата на метаболитите и да се предложат подходящи метаболитни пътища, при което да не се налага да се отговаря на въпроси, възникнали от предшестващи токсикологични изпитвания. За да се получи информация за метаболитните пътища, може да е полезно провеждането на изпитвания in vitro.
Допълнителна информация за връзката на метаболизма с токсичността може да се получи от биохимични изпитвания, например определяне на ефектите върху метаболитни ензимни системи, изчерпване на ендогенните небелтъчни сулфхидрилни съединения и свързване на веществото с макромолекули.
2. ДАННИ
В зависимост от типа проведено изпитване данните трябва да бъдат обобщени в табличен вид и навсякъде, където е целесъобразно, да бъдат подкрепени с графично представяне. За всяка експериментална група трябва да бъдат показани, когато е необходимо, средната стойност и статистическите колебания на измерванията по отношение на времето, дозите, тъканите и органите. Степента на абсорбция и количеството и скоростите на екскрецията трябва да бъдат определени с помощта на подходящи методи. Когато се провеждат метаболитни изследвания, трябва да бъде дадена структурата на идентифицираните метаболити и да бъдат представени възможните метаболитни пътища.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. Протокол от изпитването
Според типа на проведеното изпитване, ако е възможно, протоколът от изпитването съдържа следната информация:
|
— |
вид, порода, източник, условия на околната среда, диета, |
|
— |
характеризиране на маркираните материали, ако са използвани, |
|
— |
използвани нива и интервали на дозиране, |
|
— |
начин(и) на прилагане и всички използвани носители, |
|
— |
наблюдавани токсични и други ефекти, |
|
— |
методи за определяне на изпитваното вещество и/или метаболитите в биологични проби, включително издишан въздух, |
|
— |
представяне на измерванията в табличен вид по пол, доза, режим, време, тъкани и органи, |
|
— |
представяне на степента на абсорбция и екскреция с времето, |
|
— |
методи за характеризиране и идентифициране на метаболитите в биологични проби, |
|
— |
методи за определяне на биохимични параметри, свързани с метаболизма, |
|
— |
предложени метаболитни пътища, |
|
— |
обсъждане на резултатите, |
|
— |
интерпретиране на резултатите. |
3.2. Оценка и интерпретиране
Виж общо въведение, част Б.
4. ПОЗОВАВАНИЯ
Виж общо въведение, част Б.
ИЗПИТВАНЕ ЗА МУТАГЕННОСТ И ПРЕСЯВАЩО ИЗПИТВАНЕ ЗА КАНЦЕРОГЕННОСТ
ГЕННИ МУТАЦИИ — SACCHAROMYCES CEREVISIAE
1. МЕТОД
1.1. Въведение
Виж общо въведение, част Б.
1.2. Определение
Виж общо въведение, част Б.
1.3. Вещества за сравнение
Няма.
1.4. Принцип на метода за изпитване
За измерване продукцията на генни мутации, предизвикани от химични агенти със или без метаболитно активиране, могат да се използват разнообразни хаплоидни и диплоидни щамове на дрождите Saccharomyces cerevisiae.
Използват се системите за прави мутации в хаплоидни щамове, например измерване на мутацията от червени, аденин-зависими мутанти (ade-1, ade-2) към двойно аденин-зависими бели мутанти и селективни системи, например предизвикване на резистентност към канавнаин и циклохексимид.
Най-широко утвърдената система за обратни мутации включва използването на хаплоидния щам XV 185-14C, който е носител на охра „безсмислени“ мутации ade 2-1, arg 4-17, lys 1-1 и trp 5-48, които са обратими от мутагени за заместване на бази, които предизвикват специфични по място мутации или охра потискащи мутации. XV 185-14C е носител и на маркера his 1-7, „променяща смисъла“ мутация, която е обратима главно от мутации на друго място, и маркера hom 3-10, който е обратим от мутагени, свързани с изместване на рамката.
При диплоидните щамове на S. cerevisiae единственият широко използван щам е D7, който е хомозиготен по ilv 1-92.
1.5. Критерии за качество
Няма.
1.6. Описание на метода за изпитване
Подготовка
Разтворите на изпитваните химически вещества трябва да бъдат приготвени непосредствено преди изпитването, като се използва подходящ носител. При органични съединения, които не са разтворими във вода, трябва да се използва не по-концентриран от 2 % об/об разтвор на органични разтворители като етанол, ацетон или диметилсулфоксид. Крайната концентрация на носителя не трябва да оказва значимо влияние върху клетъчната жизнеспособност и растежните характеристики.
Метаболитно активиране
Клетките трябва да бъдат подложени на експозиция на изпитваните химически вещества както в присъствие, така и в отсъствие на подходяща екзогенна система за метаболитно активиране.
Най-често използваната система е допълнена с ко-фактор пост митохондриална фракция от черни дробове на гризачи, предварително обработени със средства за ензимна индукция. За метаболитно активиране може да бъде подходящо и използването на други видове, тъкани, пост митоходриални фракции или процедури.
Условия на изпитване
Експериментални щамове
При изпитвания за генни мутации най-широко се използват хаплоидният щам XV 185-14C и диплоидният щам D7. Други щамове също могат да бъдат подходящи.
Среди
За определяне броя на преживелите микроорганизми и на мутантите се използват подходящи среди за култивиране.
Използване на положителни и отрицателни контроли
Паралелно трябва да се използват положителни и отрицателни контроли и контроли за разтворителите. За всяка конкретна мутационна крайна точка трябва да се използват подходящи химически вещества за положителни контроли.
Експозиционна концентрация
Трябва да се използват поне пет концентрации, които са адекватно разделени една от друга. За токсичните вещества най-високата изпитвана концентрация не трябва да понижава преживяемостта под 5 до 10 %. Относително неразтворимите във вода вещества трябва да се изпитват до границата на разтворимостта им, като се използват подходящи процедури. За лесно разтворимите във вода нетоксични вещества високата концентрация трябва да се определя за всеки конкретен случай.
Условия за инкубиране
Петриевите панички се инкубират в продължение на четири до седем дни при 28 до 30 °C на тъмно.
Честоти на спонтанните мутации
Трябва да се използват субкултури с честоти на спонтанните мутации в рамките на приетия нормален диапазон.
Брой на повторенията
За изследване на прототрофи, получени посредством генна мутация, и за изследване на клетъчната жизнеспособност трябва да се използват поне по три Петриеви панички за всяка концентрация. При експерименти с маркери като hom 3-10 с ниска честота на мутациите броят на използваните Петриеви панички трябва да бъде увеличен, за да се обезпечат статистически значими данни.
Процедура
Третирането на щамовете S. cerevisiae обикновено се извършва в течна среда с клетки в стационарна фаза или фаза на растеж. Първоначалните експерименти трябва да се провеждат върху растящи клетки. На експозиция на изпитваното химическо вещество се подлагат 1 — 5 × 107 клетки/мл в продължение на не повече от 18 часа при 28 до 37 °C, като се разклащат. Когато е необходимо, по време на третирането се добавя адекватно количество система за метаболитно активиране. В края на третирането клетките се центрофугират, промиват се и се посяват върху подходяща среда за култивиране. След инкубиране на Петриевите панички се отчитат преживяемостта и предизвикването на генни мутации.
Ако първият експеримент е отрицателен, тогава трябва да се проведе втори експеримент, като се използват клетки в стационарна фаза. Ако първият експеримент е положителен, това се потвърждава с помощта на подходящ независим експеримент.
2. ДАННИ
Данните трябва да бъдат представени в табличен вид, като се отбелязва броят на преброените колонии, броят на мутантите, преживяемостта и честотата на мутациите. Всички резултати трябва да бъдат потвърдени в независим експеримент. Данните трябва да бъдат оценени с помощта на подходящи статистически методи.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. Протокол от изпитването
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
— |
използван щам, |
|
— |
условия на изпитването: клетки в стационарна фаза или фаза на растеж, състав на средите, температура и продължителност на инкубирането, система за метаболитно активиране, |
|
— |
условия на третиране: нива на експозиция, процедура и продължителност на третирането, температура на третиране, положителни и отрицателни контроли, |
|
— |
брой на преброените колонии: брой на мутантите, преживяемост и честота на мутантите, връзка между доза и отговор, ако е приложимо, статистическа оценка на данните, |
|
— |
обсъждане на резултатите, |
|
— |
интерпретиране на резултатите. |
3.2. Оценка и интерпретиране
Виж общо въведение, част Б.
4. ПОЗОВАВАНИЯ
Виж общо въведение, част Б.
МИТОТИЧНИ РЕКОМБИНАЦИИ — SACCHAROMYCES CEREVISIAE
1. МЕТОД
1.1. Въведение
Виж общо въведение, част Б.
1.2. Определение
Виж общо въведение, част Б.
1.3. Вещества за сравнение
Няма.
1.4. Принцип на метода за изпитване
Митотичната рекомбинация при Saccharomyces cerevisiae може да бъде открита между гените (или по-общо между гена и неговия центромер) и в рамките на отделните гени. Първото явление се нарича кросинговър и води до получаване на реципрочни продукти, докато второто най-често не е реципрочно и се нарича генна конверсия. Кросинговърът обикновено се изследва посредством получаване на рецесивни хомозиготни колонии или сектори в хетерозиготен щам, докато генната конверсия се изследва посредством получаване на прототрофни ревертанти, получени в ауксотрофен хетероалелен щам и носещи два различни дефектни алела на един и същ ген. Най-широко използваните за откриване на митотична генна конверсия щамове са D4 (хетероалелен по ade 2 и trp 5) D7 (хетероалелен по trp 5) BZ34 (хетероалелен по arg 4) и JD1 (хетероалелен по his 4 и trp 5). Митотичният кросинговър, от който се получават червени и розови хомозиготни сектори, може да се изследва при D5 или при D7 (като се измерва и митотичната генна конверсия и обратната мутация при ilv 1-92), като и двата щама са хетероалелни за комплементните алели на ade 2.
1.5. Критерии за качество
Няма.
1.6. Описание на метода за изпитване
Подготовка
Разтворите на изпитваните химически вещества и съединенията за сравнение трябва да бъдат приготвени непосредствено преди изпитването, като се използва подходящ носител. При органични съединения, които не са разтворими във вода, трябва да се използва не по-концентриран от 2 % об/об разтвор на органични разтворители като етанол, ацетон или диметилсулфоксид. Крайната концентрация на носителя не трябва да оказва значимо влияние върху клетъчната жизнеспособност и растежните характеристики.
Метаболитно активиране
Клетките трябва да бъдат подложени на експозиция на изпитваните химически вещества както в присъствие, така и в отсъствие на подходяща система за метаболитно активиране. Най-често използваната система е допълнена с ко-фактор пост митохондриална фракция от черни дробове на гризачи, предварително обработени със средства за ензимна индукция. За метаболитно активиране може да бъде подходящо и използването на други видове, тъкани, пост митоходриални фракции или процедури.
Условия на изпитване
Експериментални щамове
Най-често използвани са диплоидните щамове D4, D5, D7 и JD1. Може да е целесъобразно използването на други щамове.
Среди
За определяне на преживяемостта и честотата на митотичните рекомбинации се използват подходящи среди за култивиране.
Използване на положителни и отрицателни контроли
Паралелно трябва да се използват положителни и отрицателни контроли и контроли за разтворителите. За всяка конкретна рекомбинантна крайна точка трябва да се използват подходящи химически вещества за положителни контроли.
Експозиционни концентрации
Трябва да се използват поне пет концентрации на изпитваното вещество, които са адекватно разделени една от друга. Сред факторите, които трябва да се вземат предвид, са клетъчната токсичност и разтворимостта. Най-ниската концентрация не трябва да оказва влияние върху клетъчната жизнеспособност. За токсичните химически вещества най-високата изпитвана концентрация не трябва да понижава преживяемостта под 5 до 10 %. Относително неразтворимите във вода химически вещества трябва да се изпитват до границата на разтворимостта им, като се използват подходящи процедури. За лесно разтворимите във вода нетоксични вещества високата концентрация трябва да се определя за всеки конкретен случай.
Клетките могат да бъдат подложени на експозиция на изпитваните химически вещества в стационарна или растежна фаза за периоди с продължителност до 18 часа. При продължителни периоди на третиране обаче културите трябва да бъдат огледани микроскопски за образуване на спори, чието присъствие прави изпитването невалидно.
Условия за инкубиране
Петриевите панички се инкубират на тъмно за четири до седем дни при 28 дo 30 °C. Петриевите панички, използвани за изследване на червени и розови хомозиготни сектори, получени посредством митотичен кросинговър, трябва да бъдат съхранявани в хладилник (при около 4 °C) за допълнителни един до два дни преди отчитането, за да се даде възможност за развитие на съответните пигментирани колонии.
Спонтанни честоти на митотичните рекомбинации
Трябва да се използват субкултури с честоти на спонтанните митотични рекомбинантни мутации в рамките на приетия нормален диапазон.
Брой на повторенията
За изследване на прототрофи, получени посредством генна мутация, и за изследване на клетъчната жизнеспособност трябва да се използват поне по три Петриеви панички за всяка концентрация. При изпитване на рецесивни хомозиготи, получени посредством митотичен кросинговър, броят на Петриевите панички трябва да бъде увеличен, за да се осигури адекватен брой колонии.
Процедури
Третирането на щамовете S. cerevisiae обикновено се извършва в течна среда с клетки в стационарна фаза или фаза на растеж. Първоначалните експерименти трябва да се провеждат върху растящи клетки. На експозиция на изпитваното химическо вещество се подлагат 1 — 5 x 107 клетки/мл в продължение на не повече от 18 часа при 28 до 37 °C, като се разклащат. Когато е необходимо, по време на третирането се добавя адекватно количество система за метаболитно активиране.
В края на третирането клетките се центрофугират, промиват се и се посяват върху подходяща среда за култивиране. След инкубиране Петриевите панички се отчитат за преживяемост и предизвикване на митотична рекомбинация.
Ако първият експеримент е отрицателен, трябва да се проведе втори експеримент, като се използват клетки в стационарна фаза. Ако първият експеримент е положителен, това се потвърждава с помощта на независим експеримент.
2. ДАННИ
Данните трябва да бъдат представени в табличен вид, като се отбелязва броят на преброените колонии, броят на рекомбинантите, преживяемостта и честотата на рекомбинантите.
Резултатите трябва да бъдат потвърдени в независим експеримент.
Данните трябва да бъдат оценени с помощта на подходящи статистически методи.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. Протокол от изпитването
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
— |
използван щам, |
|
— |
условия на изпитването: клетки в стационарна фаза или фаза на растеж, състав на средите, температура и продължителност на инкубирането, система за метаболитно активиране, |
|
— |
условия на третиране: експозиционна концентрация, процедура и продължителност на третирането, температура на третиране, положителни и отрицателни контролни групи, |
|
— |
брой на преброените колонии: брой на рекомбинантите, преживяемост и честота на рекомбинациите, ако е приложимо, връзка между доза и отговор, статистическа оценка на данните, |
|
— |
обсъждане на резултатите, |
|
— |
интерпретиране на резултатите. |
3.2. Оценка и интерпретиране
Виж общо въведение, част Б.
4. ПОЗОВАВАНИЯ
Виж общо въведение, част Б.
ИЗПИТВАНЕ IN VITRO ЗА ГЕННИ МУТАЦИИ В КЛЕТКИ ОТ БОЗАЙНИЦИ
1. МЕТОД
1.1. Въведение
Виж общо въведение, част Б.
1.2. Определение
Виж общо въведение, част Б.
1.3. Вещества за сравнение
Няма.
1.4. Принцип на метода за изпитване
За откриване на мутации, предизвикани от химически вещества, могат да се използват системи за култивиране на клетки на бозайници. Широко използваните клетъчни линии включват лимфомни клетки L5178Y от мишки и клетъчните линии CHO и V-79 от китайски хамстер. В тези клетъчни линии най-често използваните системи измерват мутациите в локусите на тимидин киназата (TK), хипоксантин гуанин фосфорибозил трансферазата (HPRT) (7) и на Na+/K+ АТФазата. Мутационните системи за TK и HPRT откриват мутациите в двойките бази, мутациите с изместване на рамката и малките делеции, а системата Na+/K+ открива само мутации в двойките бази.
Клетките с дефицит на тимидин киназа (TK) са устойчиви на бромодезоксиуридин (BrdU), флуородеоксиуридин (FdU) или трифлуоротимидин (TFT), поради правата мутация TK+ — TK–, тъй като тези антиметаболити не се включват в клетъчните нуклеотиди от „спасителната“ ензимна система тимидин киназа, а нуклеотидите, необходими за клетъчния метаболизъм, са получават изключително посредством синтезиране de novo. В присъствието на тимидин киназа обаче BrdU, FdU или TFT се включват в нуклеотидите, което води до потискане на клетъчния метаболизъм и до клетъчна токсичност. Така мутантните клетки могат да пролиферират в присъствието на BrdU, FdU или TFT, докато нормалните клетки, които съдържат тимидин киназа, не могат. По подобен начин клетките с дефицит на HPRT се избират на базата на устойчивост към 8-азагуанин или 6-тиогуанин. Клетките с променена Na+/K+ АТФаза се избират на базата на устойчивост към убаин.
Клетъчната токсичност се определя чрез измерване ефекта на изпитвания материал върху способностите за образуване на колонии (ефективност на клониране) или скоростта на растеж на културите. Честотата на мутантите се определя посредством посяване на известен брой клетки в среда, съдържаща селективно средство за определяне на мутантните клетки, и в среда без селективно средство за определяне на оживелите клетки. След подходящ инкубационен период се преброяват колониите. Честотите на мутантите се изчисляват от броя на мутантните колонии, коригиран за клетъчната преживяемост.
1.5. Критерии за качество
Няма.
1.6. Описание на метода за изпитване
Подготовка
Клетки
Съществуват разнообразни клетъчни линии, които се използват при това изпитване. Те включват подклонове на клетките L5178Y, CHO или V-79 клетки с доказана чувствителност към химически мутагени, висока ефективност на клониране и ниска честота на спонтанните мутации. Клетките могат да бъдат проверявани периодично за кариотипна стабилност и за заразяване с Mycoplasma. Могат да се използват други типове клетки, при условие че са валидността им като метод за изследване за химически предизвикани генни мутации може да бъде напълно документирана.
Среда
Трябва да се използват подходящи среди за култивиране и условия за инкубиране (т.е. температура, използвани съдове за култивиране, концентрации на CO2 и влажност). Средите и серумите трябва да бъдат избрани според селективните системи и типовете клетки, използвани при изпитването.
Изпитвано вещество
Изпитваните вещества могат да бъдат приготвени в средите за култивиране или да бъдат разтворени или суспендирани в подходящи носители преди третирането на клетките. Крайната концентрация на носителя в системата за култивиране не трябва да оказва влияние върху жизнеспособността и скоростта на растеж на клетките.
Метаболитно активиране
Клетките трябва да бъдат подложени на експозиция на изпитваното вещество както в присъствие, така и в отсъствие на подходяща екзогенна система за метаболитно активиране при бозайници. Алтернативно, когато се използват клетки с вътрешна метаболитна активност, трябва да бъде известно, че скоростта и естеството на активността са подходящи за изпитвания клас химически вещества.
Условия на изпитване
Използване на положителни и отрицателни контроли
Във всеки експеримент трябва да бъдат включени положителни контроли, като се използва както пряко действащо съединение, така и съединение, което изисква метаболитно активиране. Трябва да се използват и отрицателни контроли (за носителя).
Следват примери за вещества, които могат да бъдат използвани като положителни контроли:
|
— |
съединения с пряко действие:
|
|
— |
съединения с непряко действие:
|
Когато е целесъобразно, може да се включи допълнителна положителна контрола със същия химически клас, към който би могло да спада изпитваното химическо вещество.
Експозиционни концентрации
Трябва да се използват няколко концентрации на изпитваното вещество. Тези концентрации трябва да предизвикат токсичен ефект, свързан с концентрацията, като най-високата концентрация води до ниско ниво на преживяемост, а преживяемостта при най-ниската концентрация е приблизително същата, както при отрицателната контрола.
Относително неразтворимите във вода вещества трябва да се изпитват до границата им на разтворимост, като се използват подходящи процедури. За лесно разтворимите във вода нетоксични вещества високата изпитвана концентрация трябва да се определя за всеки конкретен случай.
Процедура
Броят клетки, използвани за една култура, трябва да е свързан с честотата на спонтанните мутации, като общото правило е броят жизнеспособни клетки, който се използва, да бъде равен на 10 пъти обратно пропорционалната стойност на честотата на спонтанните мутации.
Клетките трябва да бъдат подложени на експозиция за подходящ период от време, като в повечето случаи два до пет часа са достатъчни. Клетките без достатъчна вътрешна метаболитна активност трябва да бъдат подложени на експозиция на изпитваното вещество както в присъствие, така и в отсъствие на подходяща система за метаболитно активиране. В края на експозицията клетките се измиват напълно от изпитваното вещество и се култивират, за да се определи жизнеспособността им и да се даде възможност за експресия на мутантния фенотип.
В края на експресията, която трябва да бъде достатъчно продължителна, за да даде възможност за близка до оптималната експресия на предизвиканите мутанти, клетките се култивират в среда със и без селективни средства за определяне на броя на мутантите и жизнеспособността.
Всички резултати се потвърждават в независим експеримент.
2. ДАННИ
Данните трябва да бъдат представени в табличен вид. Броят в отделните Петриеви панички за изпитваното вещество и контролите трябва да бъде представен както за предизвиканите мутации, така и за преживяемостта. Трябва да бъде даден и средният брой колонии за Петриева паничка и стандартното отклонение. Честотата на мутациите трябва да бъде изразена като брой мутанти за брой преживели клетки. Преживяемостта и ефективността на клониране се изразяват като процент от контролното ниво.
Данните трябва да бъдат оценени с помощта на подходящи статистически методи.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. Протокол от изпитването
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
— |
използвана клетъчна линия, брой на клетъчните култури, методи за поддържане на клетъчните култури, |
|
— |
условия на изпитване: състав на средите, концентрация на CO2, концентрация на изпитваното вещество, използван носител, температура на инкубиране, време на инкубиране, продължителност на експресията (включително брой на посетите клетки и субкултури и схеми за подхранване, ако е необходимо), продължителност на третирането, клетъчна плътност по време на третирането, тип на използваната система за метаболитно активиране при бозайници, положителни и отрицателни контроли, използвано селективно средство. |
|
— |
обосновка за избора на доза, |
|
— |
използван метод за пресмятане на броя на жизнеспособните и мутантните клетки, |
|
— |
статистическа оценка, |
|
— |
обсъждане на резултатите, |
|
— |
интерпретиране на резултатите. |
3.2. Оценка и интерпретиране
Виж общо въведение, част Б.
4. ПОЗОВАВАНИЯ
Виж общо въведение, част Б.
УВРЕЖДАНЕ И РЕПАРАЦИЯ НА ДНК — НЕПЛАНИРАН СИНТЕЗ НА ДНК — КЛЕТКИ ОТ БОЗАЙНИЦИ (IN VITRO)
1. МЕТОД
1.1. Въведение
Виж общо въведение, част Б.
1.2. Определение
Виж общо въведение, част Б.
1.3. Вещества за сравнение
Няма.
1.4. Принцип на метода за изпитване
Изпитването за непланиран синтез на ДНК (UDS) измерва синтеза за репарация на ДНК след изрязване и отстраняване на последователност от ДНК, която съдържа участъка с повреда, предизвикана от химични или физични агенти. Изпитването се базира на включването на маркиран с тритий тимидин (3H-TdR) в ДНК на клетки от бозайници, които не са във фаза S на клетъчния цикъл. Навлизането на 3H-TdR може да бъде определено с помощта на авторадиография или посредством течно сцинтилационно броене (LSC) на ДНК от третираните клетки. Културата на клетките от бозайници, освен ако не се използват първични хепатоцити от плъх, се третират с изпитвания агент със и без екзогенна система за метаболитно активиране. UDS може да се измерва и в in vivo системи.
1.5. Критерии за качество
Няма.
1.6. Описание на метода за изпитване
Подготовка
Изпитваните химически вещества и веществата за сравнение трябва да бъдат приготвени в средата за растеж или разтворени или суспендирани в подходящи носители и после да бъдат разредени допълнително в средата за растеж, която се използва при изпитването. Крайната концентрация на носителя не трябва да оказва влияние върху жизнеспособността на клетките.
При изпитването могат да се използват първични култури от хепатоцити на плъх, човешки лимфоцити или постоянни клетъчни линии (например човешки диплоидни фибробласти).
Клетките трябва да бъдат подложени на експозиция на изпитваното химическо вещество както в присъствие, така и в отсъствие на подходяща система за метаболитно активиране.
Условия на изпитване
Брой на културите
За всяка експериментална точка са необходими поне две клетъчни култури за авторадиография и шест култури (или по-малко, ако е научно оправдано) за LSC UDS изпитвания.
Използване на положителни и отрицателни контроли
Във всеки експеримент трябва да бъдат включени паралелни положителни и отрицателни (нетретирани и/или с носител) контроли със и без метаболитно активиране.
Примери за положителни контроли за изследване на хепатоцити от плъх са 7,12-диметилбензантрацен (7,12-DMBA) или 2-ацетиламинофлуорен (2-AAF). При постоянни клетъчни линии пример за положителна контрола е 4-нитроквинолин-N-оксид (4-NQO) както за авторадиографски, така и за LSC изследвания, проведени без метаболитно активиране. N-диметилнитрозаминът представлява пример за положително контролно съединение, когато се използват системи за метаболитно активиране.
Експозиционни концентрации
Трябва да се използват множество концентрации на изпитваното вещество в диапазон, който е адекватен за определяне на отговора. Най-високата концентрация трябва да предизвиква известни токсични за клетката ефекти. Относително неразтворимите във вода съединения трябва да се изпитват до границата на разтворимостта им. За лесно разтворимите във вода нетоксични химически вещества високата концентрация на изпитваните химически вещества трябва да се определя за всеки конкретен случай.
Клетки
При поддържане на културите трябва да се използват подходящи среди за растеж, концентрация на CO2, температура и влажност. Постоянните клетъчни линии трябва да се проверяват периодично за заразяване с Mycoplasma.
Метаболитно активиране
При първични култури от хепатоцити не се използват системи за метаболитно активиране. Постоянните клетъчни линии и лимфоцитите се подлагат на експозиция на изпитваното вещество както в присъствие, така и при липса на подходяща система за метаболитно активиране.
Процедура
Приготвяне на културите
Постоянните клетъчни култури се получават от изходни култури (например чрез трипсинизация или отделяне), посети в съдове за култивиране при подходяща плътност и инкубирани при 37 °C.
Краткотрайните култури от хепатоцити на плъх се създават чрез даване възможност на прясно дисоциирани в подходяща среда хепатоцити да се закрепят към растежната повърхност.
Култури от човешки лимфоцити се създават с помощта на подходящи техники.
Третиране на културите с изпитваното вещество
Първични хепатоцити от плъх
Прясно изолирани хепатоцити от плъх се третират с изпитваното вещество в среда, съдържаща 3H-TdR, в продължение на подходящ по продължителност период от време. В края на третирането от средата се отстраняват клетките, които след това се измиват, фиксират и изсушават. Предметните стъкла се потопяват в авторадиографска емулсия (алтернативено може да се използва филм с отлепващ се слой (stripping film), експонират се, проявяват се, оцветяват се и се преброяват.
Постоянни клетъчни линии и лимфоцити
Авторадиографски техники: Клетъчните култури се подлагат на експозиция на изпитваното вещество за периоди с подходяща продължителност, последвани от третиране с 3H-TdR. Времената зависят от естеството на веществото, активността на метаболизиращите системи и типа клетки. За да се открият пиковете на UDS, 3H-TdR трябва да бъде добавен едновременно с изпитваното вещество или в рамките на няколко минути след експозицията на изпитваното вещество. Изборът между тези две процедури ще зависи от възможните взаимодействия между изпитваното вещество и 3H-TdR. За да се направи разлика между UDS и полуконсервативната репликация на ДНК, последната трябва да бъде потисната, например чрез използване на среда с дефицит на аргинин, ниско съдържание на серум или чрез добавяне на хидроксиурея към средата за култивиране.
LSC измервания на UDS: Преди третиране с изпитваното вещество навлизането на клетки в S- фазата трябва да бъде блокирано, както е описано по-горе. След това клетките трябва да бъдат подложени на експозиция на изпитваното химическо вещество, както е описано при авторадиографията. В края на инкубирането ДНК трябва да бъде извлечена от клетките и трябва да се определят общото съдържание на ДНК и степента на включване на 3H-TdR.
Трябва да се отбележи, че когато при горепосочените техники се използват човешки лимфоцити, потискането на полуконсервативната репликация на ДНК в нестимулирани култури не е необходимо.
Анализ
Авторадиографски изследвания
При определяне на UDS в клетки от култура не се броят ядрата във фаза S. Трябва да се преброят поне по 50 клетки от всяка концентрация. Преди преброяването предметните стъкла трябва да бъдат кодирани. На всяко предметно стъкло трябва да се преброят по няколко разделени на голямо разстояние едно от друго случайни полета. Количеството на включения в цитоплазмата 3H-TdR трябва да бъде определено посредством преброяване на три цитоплазмени полета с размер колкото ядро от всяка преброена клетка.
Измервания с LSC
При всяка концентрация и при контролите за изследване на непланирания синтез на ДНК чрез измервания с LSC трябва да се използва адекватен брой култури.
Всички резултати трябва да бъдат потвърдени в независим експеримент.
2. ДАННИ
Данните трябва да бъдат представени в табличен вид.
2.1. Авторадиографски изследвания
Степента на включване на 3H-TdR в цитоплазмата и броят на гранулите, открити в клетъчното ядро, трябва да бъдат регистрирани поотделно.
За да се опишат разпределението на степента на включване на 3H-TdR в цитоплазмата и броят на гранулите за ядро, може да се използват средната стойност и стойностите на медианата и модата.
2.2. Измервания с LSC
За измерванията с LSC включването на 3H-TdR трябва да се отчита като dpm/μg ДНК. Средната стойност на dpm/μg ДНК със стандартното отклонение може да се използва за описване на разпределението на включването.
Данните трябва да бъдат оценени с помощта на подходящи статистически методи.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. Протокол от изпитването
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
— |
използвани клетки, плътност и брой на пасажите при третирането, брй на клетъчните култури, |
|
— |
методи, използвани за поддържане на клетъчните култури, включително средата, температурата и концентрациите на CO2. |
|
— |
изпитванот вещество, носител, концентрации и обосновка за избор на концентрации, използвани при изпитването, |
|
— |
подробности за системите за метаболитно активиране, |
|
— |
схема на третирането, |
|
— |
положителни и отрицателни контроли, |
|
— |
използвана авторадиографска техника, |
|
— |
процедури, използвани за блокиране влизането на клетките в S-фаза, |
|
— |
процедури, използвани за извличане на ДНК и за определяне на общото съдържание на ДНК при измерването с LSC, |
|
— |
когато е възможно, връзка доза/отговор, |
|
— |
статистическа оценка, |
|
— |
обсъждане на резултатите, |
|
— |
интерпретиране на резултатите. |
3.2. Оценка и интерпретиране
Виж общо въведение, част Б.
4. ПОЗОВАВАНИЯ
Виж общо въведение, част Б.
ИЗПИТВАНЕ IN VITRO ЗА ОБМЕНИ НА СЕСТРИНСКИ ХРОМАТИДИ
1. МЕТОД
1.1. Въведение
Виж общо въведение, част Б.
1.2. Определение
Виж общо въведение, част Б.
1.3. Вещества за сравнение
Няма.
1.4. Принцип на метода за изпитване
Изпитването за обмени на сестрински хроматиди (SCE) представлява краткотрайно изпитване за откриване на реципрочни обмени на ДНК между две сестрински хроматиди в удвояваща се хромозома. SCE представляват обмен на продукти от репликацията на ДНК в предполагаеми хомоложни локуси. Предполага се, че процесът на обмен включва разкъсване и след това повторно съединяване на ДНК, въпреки че е известно малко за молекулната му основа. Откриването на SCE изисква средство за диференциално маркиране на сестринските хроматиди и това може да бъде постигнато посредством включване на бромодезоксиуридин (BrdU) за два клетъчни цикъла в хромозомната ДНК.
Клетките на бозайниците се подлагат in vitro на експозиция на изпитваното химическо вещество със и без екзогенна система за метаболитно активиране при бозайници, ако е необходимо, и се култивират в продължение на два цикъла на репликация в среда, съдържаща BrdU. След третиране на клетките със средство, потискащо делителното вретено (например колхицин), за да се натрупат клетки в подобен на метафаза етап от митозата (c-метафаза), те се отлепват и от хромозомите се приготвят препарати.
1.5. Критерии за качество
Няма.
1.6. Описание на метода за изпитване
Подготовка
|
— |
При изпитването могат да се използват първични култури (човешки лимфоцити) или постоянни клетъчни линии (например яйчникови клетки от китайски хамстер). Клетъчните линии трябва да се проверяват за заразяване с Mycoplasma, |
|
— |
Трябва да се използват подходящи среди за култивиране и условия за инкубиране (т.е. температура, съдове за култивиране, концентрации на CO2 и влажност), |
|
— |
Изпитваните вещества могат да бъдат приготвени в средите за култивиране или да бъдат разтворени или суспендирани в подходящи носители преди третирането на клетките. Крайната концентрация на носителя в системата за култивиране не трябва да оказва значително влияние върху жизнеспособността или скоростта на растеж на клетките и ефектите върху честотата на обмена на сестрински хроматиди трябва да бъдат мониторирани посредством контрол за разтворителя, |
|
— |
Клетките трябва да бъдат подложени на експозиция на изпитваното вещество както в присъствие, така и в отсъствие на екзогенна система за метаболитно активиране при бозайници. Алтернативно, когато се използват клетки с вътрешна метаболитна активност, скоростта и естеството на активността трябва да бъдат подходящи за изпитвания клас химически вещества. |
Условия на изпитване
Брой на културите
За всяка експериментална точка трябва да се използват най-малко по две култури.
Използване на положителни и отрицателни контроли
Във всеки експеримент трябва да бъдат включени положителни контроли, като се използва както пряко действащо съединение, така и съединение, което изисква метаболитно активиране. Трябва да се използват и контроли за носителя.
Следват примери за вещества, които могат да бъдат използвани като положителни контроли:
|
— |
съединение с пряко действие:
|
|
— |
съединение с непряко действие:
|
Когато е целесъобразно, може да се включи допълнителна положителна контрола със същия клас химически вещества, както изпитваното.
Експозиционни концентрации
Трябва да се използват поне три концентрации, които са адекватно разделени една от друга. Най-високата концентрация трябва да предизвиква значителен токсичен ефект, но все пак трябва да дава възможност за осъществяването на адекватна клетъчна репликация. Относително неразтворимите във вода вещества трябва да се изследват до границата на разтворимостта им, като се използват подходящи процедури. За лесно разтворимите във вода нетоксични вещества високата изпитвана концентрация трябва да се определя за всеки конкретен случай.
Процедура
Приготвяне на култури
Постоянните клетъчни култури се получават от изходни култури (например чрез трипсинизиране или отделяне), посети в съдове за култивиране при подходяща плътност и инкубирани при 37 °C. За еднослойните култури броят на клетките за съд за култивиране трябва да бъде коригиран така, че културите да не се сливат над 50 % в момента на отлепването. Алтернативно клетките могат да бъдат използвани в суспензионна култура. Културите от човешки лимфоцити се получават от хепаринизирана кръв, като се използват подходящи техники и се инкубират при 37 °C.
Третиране
Клетките в експоненциален стадий на растеж се подлагат на експозиция на изпитваното вещество за период с подходяща продължителност. В повечето случаи един до два часа могат да бъдат достатъчни, но в определени случаи продължителността на третирането може да бъде удължена до два пълни клетъчни цикъла. Клетките без достатъчна вътрешна метаболитна активност трябва да бъдат подложени на експозиция на изпитваното химическо вещество както в присъствие, така и в отсъствие на подходяща система за метаболитно активиране. В края на експозицията клетките се измиват напълно от изпитваното вещество и се култивират в продължение на два цикъла на репликация в присъствието на BrdU. Като алтернативна процедура, клетките могат да бъдат подложени на експозиция едновременно на изпитваното химическо вещество и на BrdU в продължение на пълното време на култивиране на два клетъчни цикъла.
Културите от човешки лимфоцити се третират, когато се намират в полусинхронно състояние
Клетките се анализират при второто им деление след третирането, като най-чувствителните етапи от клетъчния цикъл трябва да бъдат подложени на експозиция на химическото вещество. С всички култури, към които се добавя BrdU, трябва да се работи на тъмно или при матова светлина от лампи с нажежаеми жички до отлепването на клетките, за да се намали до минимум фотолизата на съдържащата BrdU ДНК.
Отлепване на клетки
Клетъчните култури се третират с инхибитори на делителното вретено (например колхицин) един до четири часа преди отлепването. Всяка култура се отлепва и обработва поотделно за приготвяне на хромозоми.
Приготвяне и оцветяване на хромозоми
Хромозомните препарати се приготвят с помощта на стандартни цитогенетични техники. Оцветяването на предметните стъкла, за да се демонстрират SCE, може да се направи с помощта на няколко техники (например метод с флуоресценция плюс Giemsa).
Анализ
Броят на анализираните клетки трябва да се базира на спонтанната честота на SCE в контролата. Обикновено за SCE се анализират най-малко 25 добре разгърнати метафази за култура. Преди анализа предметните стъкла се кодират. При човешки лимфоцити се анализират само метафази, които съдържат 46 центромера. При постоянни клетъчни линии се анализират само метафази, които съдържат ± 2 от модалния брой. Трябва да се посочи дали центромерното превключване на маркера се брои за SCE или не. Резултатите трябва да бъдат потвърдени в независим експеримент.
2. ДАННИ
Данните трябва да бъдат представени в табличен вид. За всички третирани и контролни култури поотделно трябва да се дадат броят на обмените на сестрински хроматиди във всяка метафаза и броят на обмените на сестрински хроматиди за хромозома във всяка метафаза.
Данните трябва да бъдат оценени с помощта на подходящи статистически методи.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. Протокол от изпитването
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
— |
използвани клетки, методи за поддържане на клетъчната култура, |
|
— |
условия на изпитване: състав на средите, концентрация на CO2, концентрация на изпитваното вещество, използван носител, температура на инкубиране, продължителност на третирането, използван инхибитор на делителното вретено, неговата концентрация и продължителността на третирането с него, тип на използваната система за метаболитно активиране, положителни и отрицателни контроли, |
|
— |
брой на клетъчните култури за една експериментална точка, |
|
— |
подробности за техниката, използвана за приготвяне на предметните стъкла, |
|
— |
брой на анализираните метафази (данните се дават поотделно за всяка култура), |
|
— |
среден брой SCE за клетка и за хромозома (данните се дават поотделно за всяка култура), |
|
— |
критерии за отчитане на SCE, |
|
— |
обосновка за избора на доза, |
|
— |
когато е необходимо, връзка доза/отговор, |
|
— |
статистическа оценка, |
|
— |
обсъждане на резултатите, |
|
— |
интерпретиране на резултатите. |
3.2. Оценка и интерпретиране
Виж общо въведение, част Б.
4. ПОЗОВАВАНИЯ
Виж общо въведение, част Б.
ИЗПИТВАНЕ ЗА ПОЛОВО СВЪРЗАНА РЕЦЕСИВНА ЛЕТАЛНОСТ ПРИ DROSOPHILA MELANOGASTER
1. МЕТОД
1.1. Въведение
Виж общо въведение, част Б.
1.2. Определение
Виж общо въведение, част Б.
1.3. Вещества за сравнение
Няма.
1.4. Принципи на метода за изпитване
Изпитването за полово свързана леталност (SLRL) при Drosophila melanogaster открива появата на мутации, точкови мутации и малки делеции в зародишната линия на насекомото. Това изпитване представлява метод за изследване за прави мутации, с който може да се направи пресяващо изпитване за мутации при около 800 локуса в Х-хромозомата, като това представлява около 80 % от всички локуси в Х-хромозомата. Х-хромозомата представлява около една пета от целия хаплоиден геном.
Мутациите в Х-хромозомата на Drosophila melanogaster са фенотипно изявени при мъжките индивиди, които са носители на мутантния ген. Когато мутацията е летална в хомозиготно състояние, за присъствието ѝ се съди по липсата на единия от двата класа мъжко потомство, които нормално се получават от хетерозиготно женско насекомо. При изпитването SLRL се използват тези факти с помощта на специално маркирани и подредени хромозоми.
1.5. Критерии за качество
Няма.
1.6. Описание на метода за изпитване
Подготовка
Източници
Могат да се използват мъжки насекоми от добре дефинирани източници на насекоми от див тип и женски от източник на вида Muller-5. Могат да се използват и други подходящо маркирани източници на женски насекоми с множество инвертирани Х-хромозоми.
Изпитвано вещество
Изпитваните вещества трябва да бъдат разтворени във вода. Веществата, които са неразтворими във вода, могат да бъдат разтворени или суспендирани в подходящи носители (например смес от етанол и Tween-60 или 80), а след това да бъдат разтворени във вода или физиологичен разтвор преди прилагането. Трябва да се избягва използването на диметилсулфоксид като носител.
Брой на животните
Изпитването трябва да бъде проектирано с предварително определена чувствителност и възможности. Наблюдаваната честота на спонтанните мутации при съответната контрола ще окаже силно влияние върху броя на третираните хромозоми, които трябва да бъдат анализирани.
Начин на прилагане
Експозицията може да бъде орална, чрез инжектиране или чрез експозиция на газове или пари. Подхранване с изпитваното вещество може да се направи със захарен разтвор. Когато е необходимо, веществата могат да бъдат разтворени в 0,7 % разтвор на NaCl и да бъдат инжектирани в гръдния кош или корема.
Използване на отрицателни и положителни контроли
Трябва да бъдат включени отрицателни (за носителя) и положителни контроли. Обаче ако съществуват подходящи исторически контролни данни, паралелни контроли не са необходими.
Нива на експозиция
Трябва да се използват три нива на експозиция. За предварителна оценка може да се използва едно ниво на експозиция на изпитваното вещество, като това ниво представлява максималната поносима концентрация или нивото, което води до някакви признаци на токсичност. За нетоксичните вещества, трябва да се използва експозиция на максималната възможна концентрация.
Мъжките насекоми див тип (на възраст три до пет дни) се третират с изпитваното вещество и се чифтосват поотделно с по-голям брой девствени женски насекоми от вида Muller-5 или от друг подходящо маркиран (с множество инвертирани Х-хромозоми) вид. Женските се заместват с нови девствени женски насекоми на всеки два до три дни, за да се покрие целият цикъл на зародишните клетки. Потомството на тези женски се оценява за леталност, съответстваща на ефектите върху зрялата сперма, сперматидите от средна или късна фаза, ранните сперматиди, сперматоцитите и сперматогониите по време на третирането.
Хетерозиготните женски насекоми от поколението F1 от кръстосвания, споменати по-горе, се чифтосват поотделно (т.е. една женска за флакон) със своите братя. В поколението F2 всяка култура се отчита за липса на мъжки насекоми от див тип. Ако изглежда, че една култура е възникнала от женско насекомо от поколение F1, което носи летален признак в родителската Х-хромозома (т.е. не се наблюдават мъжки насекоми с третираната хромозома), дъщерите на тази женска със същия генотип трябва да бъдат изследвани, за да се провери, че леталният признак се повтаря в следващото поколение.
2. ДАННИ
Данните трябва да бъдат представени в табличен вид, за да бъде показан броят на изследваните Х-хромозоми, броят на безплодните мъжки насекоми и броят на хромозомите с летален признак при всяка експозиционна концентрация и за всяко чифтосване на всяко третирано мъжко насекомо. Трябва да бъде даден броят на клъстерите. Тези резултати трябва да бъдат потвърдени в отделен експеримент.
За оценка на изпитванията за полово свързана леталност трябва да се използват подходящи статистически методи. Образуването на клъстери от рецесивни летални признаци, произхождащи от едно мъжко насекомо, трябва да се вземат предвид и да се оценят с подходящ статистически метод.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. Протокол от изпитването
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
— |
източник: използвани източници/видове и породи Drosophila, възраст на насекомите, брой на третираните мъжки насекоми, брой на стерилните мъжки насекоми, брой на постоянните култури от поколение F2, брой на културите F2 без потомство, брой на хромозомите, носещи летален признак, открити на всеки стадий от развитието на зародишните клетки, |
|
— |
критерии за определяне размера на третираните групи, |
|
— |
условия на изпитване: подробно описание на схемата за третиране и вземане на проби, нива на експозиция, данни за токсичността, ако е необходимо, отрицателни (за разтворителя) и положителни контроли, |
|
— |
критерии за отчитане на леталните мутации, |
|
— |
връзка контакт/ефект, когато е възможно, |
|
— |
оценка на данните, |
|
— |
обсъждане на резултатите, |
|
— |
интерпретиране на резултатите. |
3.2. Оценка и интерпретиране
Виж общо въведение, част Б.
4. ПОЗОВАВАНИЯ
Виж общо въведение, част Б.
ИЗПИТВАНИЯ IN VITRO ЗА ТРАНСФОРМАЦИИ В КЛЕТКИ ОТ БОЗАЙНИЦИ
1. МЕТОД
1.1. Въведение
Виж общо въведение, част Б.
1.2. Определение
Виж общо въведение, част Б.
1.3. Вещества за сравнение
Няма.
1.4. Принцип на метода за изпитване
За откриване на фенотипни изменения in vitro, предизвикани от химични вещества, свързани с in vivo злокачествена трансформация, могат да бъдат използвани системи за култивиране на клетки от бозайници. Често използваните клетки са C3H10T½, 3T3, SHE, плъх на Fischer и при изпитванията се разчита на измененията в клетъчната морфология, образуването на огнища и закрепването в полутвърд агар. Съществуват по-рядко използвани системи, които откриват други физиологични и морфологични изменения в клетките след експозиция на канцерогенни химически вещества. Никоя от изпитваните in vitro крайни точки няма установена механистична връзка с рака. Някои от изпитваните системи могат да долавят туморни промотори. Клетъчната токсичност може да се определя чрез измерване на ефекта на изпитвания материал върху способността за образуване на колонии (ефективност на клониране) или скоростта на растеж на културите. За да се измери клетъчната токсичност, трябва да се установи дали експозицията на изпитваното химическо вещество е свързано с токсикологични ефекти, но не може да се използва за изчисляване на честотата на трансформациите при всички изпитвания, защото някои могат да включват продължително инкубиране и/или повторно посяване/пресяване.
1.5. Критерии за качество
Няма.
1.6. Описание на метода за изпитване
Подготовка
Клетки
В зависимост от използваното трансформационно изпитване съществуват разнообразни клетъчни линии или първични клетки. Изследователят трябва да бъде сигурен, че всички клетки при провежданото изпитване демонстрират подходящи фенотипни изменения след експозиция на известни канцерогени и че изпитването в лабораторията на изследователя е с доказана и документирана валидност и надеждност.
Среда
Трябва да е използват среди и експериментални условия, които са подходящи за използваното трансформационно изпитване.
Изпитвано вещество
Изпитваните вещества могат да бъдат приготвени в средите за култивиране или да бъдат разтворени или суспендирани в подходящи носители преди третирането на клетките. Крайната концентрация на носителя в системата за култивиране не трябва да оказва влияние върху жизнеспособността, скоростта на растеж на клетките или честотата на трансформациите.
Метаболитно активиране
Клетките трябва да бъдат подложени на експозиция на изпитваното вещество както в присъствие, така и в отсъствие на подходяща система за метаболитно активиране. Алтернативно, когато се използват клетки, които притежават вътрешна метаболитна активност, трябва да бъде известно, че естеството на активността е подходящо за изпитвания клас химически вещества.
Условия на изпитване
Използване на отрицателни и положителни контроли
Във всеки експеримент трябва да бъдат включени положителни контроли, като се използва както пряко действащо съединение, така и съединение, което изисква метаболитно активиране. Трябва да се използват и отрицателни контроли (за носителя).
Следват примери за вещества, които могат да бъдат използвани като положителни контроли:
|
— |
Пряко действащи химически вещества:
|
|
— |
Съединения, изискващи метаболитно активиране:
|
Когато е целесъобразно, трябва да се включи допълнителна положителна контрола със същия химически клас, както изпитваното съединение.
Експозиционни концентрации
Трябва да се използват няколко концентрации на изпитваното вещество. Тези концентрации трябва да предизвикат токсичен ефект, свързан с концентрацията, като най-високата концентрация води до ниско ниво на преживяемост, а преживяемостта при най-ниската концентрация е приблизително същата, както при отрицателната контрола. Относително неразтворимите във вода вещества трябва да се изпитват до границата на разтворимостта им, като се използват подходящи процедури. За лесно разтворимите във вода нетоксични вещества високата изпитвана концентрация трябва да се определя за всеки конкретен случай.
Процедура
Клетките трябва да бъдат подложени на експозиция с подходяща продължителност в зависимост от използваната експериментална система, а това може да включва повторно дозиране, придружено с промяна на средата (и, ако е необходимо, прясна смес за метаболитно активиране), ако експозицията е продължителна. Клетките без достатъчна вътрешна метаболитна активност трябва да бъдат подложени на експозиция на изпитваното вещество както в присъствие, така и в отсъствие на подходяща система за метаболитно активиране. В края на експозицията, клетките се промиват напълно от изпитваното вещество и се култивират при условия, които са подходящи за появата на трансформирания фенотип, който се мониторира и се определя честотата на трансформацията. Всички резултати се потвърждават в независим експеримент.
2. ДАННИ
Данните трябва да бъдат представени в табличен вид и могат да бъдат в различна форма според използваното изпитване, например брой на Петриевите панички, положителни Петриеви панички или брой на трансформираните клетки. Когато е целесъобразно, преживяемостта трябва да се изрази като процент от контролните нива, а честотата на трансформациите да се изрази за брой преживели клетки. Данните трябва да бъдат оценени с помощта на подходящи статистически методи.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. Протокол от изпитването
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
— |
използван тип клетки, брой на клетъчните култури, методи за поддържане на клетъчните култури, |
|
— |
условия на изпитване: концентрация на изпитваното вещество, използван носител, време на инкубиране, продължителност и честота на третирането, плътност на клетките по време на третирането, тип на използваната екзогенна система за метаболитно активиране, положителни и отрицателни контролни групи, спецификация на мониторирания фенотип, използвана селективна система (ако е необходимо), обосновка за избор на дозата, |
|
— |
използван метод за пресмятане броя на жизнеспособните и трансформираните клетки, |
|
— |
статистическа оценка, |
|
— |
обсъждане на резултатите, |
|
— |
интерпретиране на резултатите. |
3.2. Оценка и интерпретиране
Виж общо въведение, част Б.
4. ПОЗОВАВАНИЯ
Виж общо въведение, част Б.
ИЗПИТВАНЕ ЗА ДОМИНАНТНА ЛЕТАЛНОСТ ПРИ ГРИЗАЧИ
1. МЕТОД
1.1. Въведение
Виж общо въведение, част Б.
1.2. Определение
Виж общо въведение, част Б.
1.3. Вещества за сравнение
Няма.
1.4. Принцип на метода за изпитване
Доминантната леталност предизвиква ембрионална или фетална смърт. Предизвикването на доминантна леталност чрез контакт с химично вещество показва, че веществото е оказало влияние върху зародишната тъкан на изпитвания вид. Общоприето е, че доминантната леталност се дължи на увреждане на хромозомите (структурни или бройни аномалии). Ембрионалната смърт, ако женските индивиди са третирани, също може да бъде в резултат на токсични ефекти.
Обикновено мъжките животни се подлагат на експозиция на изпитваното съединение и се чифтосват с нетретирани девствени женски индивиди. Различните стадии на развитието на зародишните клетки могат да бъдат изпитвани поотделно с помощта на последователни чифтосвания. Нарастването на броя на мъртвите имплантирани зародиши за женски индивид в третираната група в сравнение с броя на мъртвите имплантирани зародиши за женски индивид в контролната група отразява постимплантационната загуба. Предимплантационната загуба може да бъде оценена въз основа на броя на жълтите тела или чрез сравняване на общия брой имплантирани зародиши за женски индивид в третираната и контролната група. Общата доминантна леталност представлява сумата от пред- и постимплантационната загуба. Изчисляването на общата доминантна леталност става чрез сравняване на броя живи имплантирани зародиши за женски индивид в експерименталната група и броя на живите имплантирани зародиши за женски индивид в контролната група. Намаляването на броя на имплантираните зародиши през определени интервали може да се дължи на убиване на клетки (т.е. на сперматоцити и/или сперматогонии).
1.5. Критерии за качество
Няма.
1.6. Описание на метода за изпитване
Подготовка
Когато е възможно, изпитваните вещества трябва да бъдат разтворени или суспендирани в изотоничен физиологичен разтвор. Неразтворимите във вода химически вещества могат да бъдат разтворени или суспендирани в подходящи носители. Използваният носител не трябва да оказва влияние върху изпитваното химическо вещество нито да предизвиква токсични ефекти. Трябва да се използват прясно приготвени препарати от изпитваните химически вещества.
Условия на изпитване
Начин на прилагане
Обикновено изпитваното съединение трябва да се приложи еднократно Въз основа на токсикологичната информация може да се използва схема за многократно третиране. Обичайните начини на прилагане са чрез орално интубиране или интраперитонеално инжектиране. Може да са целесъобразни други начини на прилагане.
Експериментални животни
Като експериментални видове се препоръчват плъхове или мишки. Здрави, напълно полово съзрели животни се избират по случаен признак и се разпределят в третирана и контролна група.
Брой и пол
Трябва да се използват адекватен брой третирани мъжки индивиди, като се вземат предвид спонтанните колебания в оценяваната биологична характеристика. Избраният брой трябва да се базира на предварително определената чувствителност на откриването и възможностите. Например при типично изпитване броят на мъжките индивиди във всяка дозирана група трябва да бъде достатъчен, за да се осигурят между 30 и 50 бременни женски индивиди за чифтосване.
Използване на отрицателни и положителни контроли
Обикновено във всеки експеримент трябва да се включат паралелни положителни и отрицателни (за носителя) контроли. Когато съществуват приемливи положителни контролни резултати от наскоро проведени в същата лаборатория експерименти, тези резултати могат да бъдат използвани вместо паралелна положителна контрола. Положителните контролни вещества трябва да се използват при подходяща ниска доза (например метил метансулфонат (MMS) интраперитонеално в доза 10 мг/кг), за да се демонстрира чувствителността на изпитването.
Нива на дозиране
Обикновено трябва да се използват три нива на дозиране. Високата доза трябва да предизвиква признаци на токсичност или намалена плодовитост при третираните животни. В определени случаи може да е достатъчно едно единствено ниво на дозиране.
Гранично изпитване
Нетоксичните вещества трябва да бъдат изпитвани при 5 г/кг при еднократно прилагане и при 1 г/кг на ден при многократно прилагане.
Процедура
Съществуват няколко схеми за третиране. Най-широко се прилага еднократното прилагане на изпитваното вещество. Могат да се използват други схеми за третиране.
Отделните мъжки индивиди се чифтосват последователно с една или две нетретирани девствени женски животни на подходящи интервали след третирането. Женските индивиди трябва да бъдат оставени с мъжките животни в продължение поне на един пълен цикъл на разгонване или докато се осъществи чифтосване, което се определя по наличието на сперма във влагалището или на вагинална запушалка.
Броят на чифтосванията след третирането зависи от схемата на третиране и трябва да осигури вземане на проби от всички стадии на развитие на зародишните клетки.
Женските индивиди се пожертват през втората половина на бременността и съдържанието на матката се изследва, за да се определи броят на мъртвите и живите имплантирани зародиши. Могат да се изследват яйчниците, за да се определи броят на жълтите тела.
2. ДАННИ
Данните трябва да бъдат представени в табличен вид, за да покажат броя на мъжките индивиди, броя на бременните женски и броя на женските животни, които не са бременни. Поотделно трябва да се отчетат резултатите от всяко чифтосване, включително идентичността на всеки мъжки и женски индивид. За всеки женски индивид трябва да се регистрират седмицата на чифтосването, нивото на дозиране, получено от мъжките, честотата на живите имплантирани зародиши и на мъртвите имплантирани зародиши.
Изчисляването на общата доминантна леталност се базира на сравняване на броя живи имплантирани зародиши за женски индивид в експерименталната група с броя на живите имплантирани зародиши за женски индивид в контролната група. Анализира се съотношението на живите към мъртвите имплантирани зародиши от третираната група, сравнено със същото съотношение от контролната група, за да се отбележи постимплантационната загуба.
Ако данните се регистрират като ранни и късни смъртни случаи, като в таблиците тази разлика трябва да е ясно изразена. Ако се оценява предимплантационната загуба, резултатите от нея трябва да бъдат представени. Предимплантационната загуба може да бъде изчислена като несъответствие между броя на жълтите тела и броя на имплантираните зародиши или като намаляване на средния брой имплантирани зародиши за матка в сравнение с контролните чифтосвания.
Данните се оценяват с помощта на подходящи статистически методи.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. Протокол от изпитването
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
— |
вид, порода, възраст и тегло на използваните животни, брой на животните от всеки пол в експерименталната и контролната група, |
|
— |
изпитвано вещество, носител, изследванит нива на дозиране и обосновка за избор на доза, отрицателни и положителни контроли, данни за токсичността, |
|
— |
начин и схема на третиране, |
|
— |
схема на чифтосване, |
|
— |
използван метод за определяне дали е осъществено чифтосване, |
|
— |
време на пожертване, |
|
— |
критерии за отчитане на доминантната леталност, |
|
— |
когато е необходимо, връзка доза/отговор, |
|
— |
статистическа оценка, |
|
— |
обсъждане на резултатите, |
|
— |
интерпретиране на резултатите. |
3.2. Оценка и интерпретиране
Виж общо въведение, част Б.
4. ПОЗОВАВАНИЯ
Виж общо въведение, част Б.
ЦИТОГЕНЕТИЧНО ИЗПИТВАНЕ IN VIVO НА ЗАРОДИШНИ КЛЕТКИ OT БОЗАЙНИЦИ
1. МЕТОД
1.1. Въведение
Виж общо въведение, част Б.
1.2. Определение
Виж общо въведение, част Б.
1.3. Вещества за сравнение
Няма.
1.4. Принцип на метода за изпитване
Това цитогенетично изпитване in vivo открива структурните хромозомни аберации в сперматогониите. Състои се от анализ на митозите на сперматогониите за аберации от хромозомен и хроматиден тип.
При този метод се използват препарати от тестиси на бозайници, които са подложени на експозиция на изпитваните химически вещества по подходящи начини и са умъртвени през различни интервали от време. Преди умъртвяването животните са третирани допълнително с инхибитори на делителното вретено като колхицин, за да натрупат клетки в подобен на метафаза стадий на митозата (c-метафаза). Приготвят се изсушени на въздух препарати от хромозоми, които се оцветяват и анализират микроскопски.
Допълнителна полезна информация може да се получи от анализа на сперматоцитите в метафаза I на диакинезата за мултивалентни транслокации след третиране на стволови клетки на сперматогонии.
1.5. Критерии за качество
Няма.
1.6. Описание на метода за изпитване
Подготовка
Изпитваните химически вещества се разтварят в изотоничен физиологичен разтвор. Ако са неразтворими, те се разтварят или суспендират в подходящ носител. Използват се прясно приготвени разтвори на изпитваното съединение. Ако за улесняване на дозирането се използва носител, той не трябва да влияе върху изпитваното химическо вещество нито да предизвиква токсични ефекти.
Начин на прилагане
Изпитваните съединения обикновено трябва да се приложат само един път. Въз основа на токсикологичната информация може да се използва схема за многократно третиране. Многократно третиране обаче може да се използва, само ако изпитваното съединение не проявява сериозни цитотоксични ефекти върху диференциращите се сперматогонии.
Обичайните начини на прилагане са оралният и чрез интраперитонеално инжектиране. Може да са целесъобразни други начини на прилагане.
Експериментални животни
Най-често се използват мишки и китайски хамстери. Могат да се използват всички други видове бозайници.
Използват се полово съзрели мъжки индивиди и те се разпределят на случаен принцип в третирана и контролна група.
Брой на животните
Използват се най-малко по пет мъжки животни за експерименталната и контролната група.
Използване на отрицателни и положителни контроли
Във всеки експеримент трябва да бъдат включени паралелни положителни и отрицателни (за носителя) контроли.
Положителните контролни вещества трябва да се използват при подходяща ниска доза (например митомицин C интраперитонеално в доза 0,3 мг/кг), за да се демонстрира чувствителността на изпитването.
Нива на дозиране
Използва се една доза от изпитваното съединение, като това е максималната поносима доза или доза, която предизвиква известни признаци на клетъчна токсичност. Ако тази доза убива голям брой клетки, тогава трябва да се използва допълнителна по-ниска доза, предизвикваща клетъчната токсичност. Когато е необходимо да се определи връзката доза/отговор, са необходими поне три дози (например, за да се потвърди слаб положителен отговор). Нетоксичните вещества трябва да се изпитват с най-високата възможна доза при еднократно и при многократно прилагане.
Процедура
Обикновено животните се третират с изпитваното съединение само един път. В групата, третирана с най-високата доза, се използват три интервала за вземане на проби след третирането. Основният интервал за вземане на проби е 24 часа. Тъй като изпитваното съединение може да окаже влияние върху кинетиката на клетъчния цикъл, се използват един по-ранен и един по-късен интервал за вземане на проби, които са разделени адекватно в рамките на 6 до 48 часа. За допълнителни нива на дозиране могат да се вземат проби през най-чувствителния интервал или, ако той не е известен, 24 часа след третирането.
Като алтернатива, може да се използва многократно третиране и животните трябва да бъдат пожертвани 24 часа след последното третиране. Могат да се използват допълнителни срокове за вземане на проби в диапазона от 6 до 24 часа.
Препарати от тестиси
За анализиране на митозите на сперматогониите на животните се инжектира интраперитонеално адекватна доза инхибитор на делителното вретено, например колхицин. Впоследствие животните се умъртвяват след подходящ интервал от време. За мишките този интервал се колебае от три до пет часа, а за китайските хамстери може да са необходими повече от пет часа.
Използва се техника за изсушаване с въздух. Различните видове може да изискват модифициране на стандартната процедура. Получават се клетъчни суспензии, които се третират с хипотоничен разтвор и се фиксират. Клетките се разстилат върху предметни стъкла и се оцветяват. Преди микроскопския анализ предметните стъкла се кодират.
Анализ
Поне 100 добре размазани митотични метафази с пълен брой центромери се анализират за структурни хромозомни аберации. Допълнително може да се определи съотношението на митозите в сперматогониите към първата и втората мейотична метафаза в обща проба от 100 делящи се клетки за животно, за да се установи евентуален цитотоксичен ефект.
2. ДАННИ
Данните трябва да бъдат представени в табличен вид. Всички типове аберации трябва да бъдат изброени поотделно за всички контролни и третирани животни. Включват се общият брой анализирани клетки и общият брой аберантни клетки за група. За всички параметри се дават средни стойности и стандартно отклонение. Ако се определя средното съотношение на митозите в сперматогониите към първата и втората мейотична метафаза, то се представя в табличен вид за всяка експериментална и контролна група.
Данните се оценяват с помощта на подходящи статистически методи.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. Протокол от изпитването
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
— |
вид и порода на мъжките индивиди, възраст и тегло на мъжките индивиди, |
|
— |
брой на животните във всяка експериментална и контролна група, |
|
— |
условия на изпитването, подробно описание на третирането, нива на дозиране, разтворители, използван инхибитор на делителното вретено, |
|
— |
брой на анализираните клетки за животно във всяка група, |
|
— |
за всяко третирано и контролно животно: типове и брой на аберациите, |
|
— |
статистическа оценка, |
|
— |
обсъждане на резултатите, |
|
— |
интерпретиране на резултатите. |
3.2. Оценка и интерпретиране
Виж общо въведение, част Б.
4. ПОЗОВАВАНИЯ
Виж общо въведение, част Б.
ИЗПИТВАНЕ ЗА ПЕТНА ПО КОЗИНАТА ПРИ МИШКИ
1. МЕТОД
1.1. Въведение
Виж общо въведение, част Б.
1.2. Определение
Виж общо въведение, част Б.
1.3. Вещества за сравнение
Няма.
1.4. Принцип на метода за изпитване
Това е изпитване in vivo върху мишки, при които развиващите се зародиши се подлагат на експозиция на химически вещества. Целевите клетки в развиващите се зародиши са меланобластите, а целевите гени са тези, които контролират пигментирането на космите на козината. Развиващите се зародиши са хетерозиготни по много от тези гени за цвета на козината. Една мутация в доминантния алел или загуба на доминантния алел на такъв ген в меланобластна клетка (причинени от разнообразни генетични събития) водят до изява на рецесивния фенотип в клетките-потомци, което се изразява в петно с променен цвят върху козината на получената мишка. Оценява се броят на потомството с такива петна (т.е. мутации) и честотата им се сравнява с тази сред поколението, получено от зародиши, които са третирани само с разтворител. Изпитването за петна по козината при мишки открива предполагаеми соматични мутации във феталните клетки.
1.5. Критерии за качество
Няма.
1.6. Описание на метода за изпитване
Подготовка
Когато е възможно, изпитваните вещества трябва да бъдат разтворени или суспендирани в изотоничен физиологичен разтвор. Неразтворимите във вода химически вещества могат да бъдат разтворени или суспендирани в подходящи носители. Използваният носител не трябва да оказва влияние върху изпитваното химическо вещество нито да предизвиква токсични ефекти. Трябва да се използват прясно приготвени препарати от изпитваните химически вещества.
Експериментални животни
Мишки от породата T (nonagouti, a/a; chinchilla, pink eye, cch p/cchp; brown, b/b; dilute, short ear, d se/d se; piebald spotting, s/s) са чифтосани с породата HT (pallid, nonagouti, brachypody, pa a bp/pa a bp; leaden fuzzy, ln fz/ln fz; pearl pe/pe) или C57 BL (nonagouti, a/a). Могат да се използват други подходящи кръстоски, например между NMRI (nonagouti, a/a; albino, c/c) и DBA (nonagouti, a/a; brown, b/b; dilute d/d), при условие че от тях се получава потомство неагути.
Брой и пол
Третират се достатъчно на брой бременни женски индивиди, за да се получи подходящ брой преживяващо поколение за всяко използвано ниво на дозиране. Подходящата големина на извадката зависи от броя на наблюдаваните петна при третираните мишки и от количеството контролни данни. Отрицателният резултат е приемлив, само ако се оценяват най-малко 300 индивида от потомството на женските животни, третирани с най-високата доза.
Използване на отрицателни и положителни контроли
Трябва да има паралелни контролни данни от мишки, третирани само с носител (отрицателни контроли). От историческите контролни данни от същата лаборатория може да се направи пул, за да се повиши чувствителността на изпитването, при условие че тези данни са хомогенни. Ако не бъде открита мутагенност на изпитваното химическо вещество, трябва да съществуват получени наскоро от същата лаборатория положителни контролни данни за третиране с химическо вещество, за което е известно, че при това изпитване демонстрира мутагенност.
Начин на прилагане
Обичайните начини на прилагане са чрез орално интубиране или интраперитонеално инжектиране при бременните женски индивиди. Когато е целесъобразно, се използват третиране чрез инхалиране или други начини на прилагане.
Нива на дозиране
Използват се най-малко две нива на дозиране, включително едно, при което се наблюдават признаци на токсичност или намалена големина на котилото. За нетоксичните вещества, трябва да се използва експозиция на максималната възможна доза.
Процедура
Нормално се провежда единично третиране в ден 8, 9 или 10 от бременността, като за ден 1 се брои денят, в който за първи път се наблюдава вагинална запушалка. Тези дни съответстват на дни 7,25, 8,25 и 9,25 след зачеването. През тези дни може да се използва последователно третиране.
Анализ
Потомството се кодира и изследва за петна между три и четири седмици след раждането. Различават се три класа петна:
|
a) |
бели петна на разстояние до 5 мм от средната коремна линия (WMVS), за които се смята, че се дължат на убийство на клетки; |
|
б) |
жълти, подобни на агути петна, асоциирани с гръдните жлези, гениталиите, гърлото, аксиларните и ингвиналните области и по средата на челото, за които се смята, че се дължат на нарушена диференциация (MDS) и |
|
в) |
пигментирани и бели петна, случайно разпръснати по козината, за които се смята, че се дължат на соматични мутации (RS). |
Отчитат се всичките три класа, но само, последният (RS) има генетично значение. Проблемите с разграничаването на MDS от RS могат да бъдат разрешени с помощта на флуоресцентна микроскопия на проби от косми.
Трябва да се отбележат очевидните макроскопски аномалии при потомството.
2. ДАННИ
Данните се представят като общ брой на проследяваното потомство и брой на индивидите с едно или повече петна, за които се предполага, че се дължат на соматични мутации. Данните от третираните групи и отрицателните контроли се сравняват с помощта на подходящи методи. Данните се представят и за отделно котило.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. Протокол от изпитването
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
— |
породи, използвани при кръстосването, |
|
— |
брой бременни женски животни в експерименталната и контролната група, |
|
— |
средна големина на котилото в експерименталната и контролната група при раждането и при отбиването, |
|
— |
ниво(а) на дозиране на изпитваното химическо вещество, |
|
— |
използван разтворител, |
|
— |
ден от бременността, в който е извършено третирането, |
|
— |
начин на третиране, |
|
— |
общ брой проследявано потомство и брой на животните с WMVS, MDS и RS в експерименталните и контролните групи, |
|
— |
микроскопски морфологични аномалии, |
|
— |
когато е възможно, връзката доза/отговор за RS, |
|
— |
статистическа оценка, |
|
— |
обсъждане на резултатите, |
|
— |
интерпретиране на резултатите. |
3.2. Оценка и интерпретиране
Виж общо въведение, част Б.
4. ПОЗОВАВАНИЯ
Виж общо въведение, част Б.
НАСЛЕДСТВЕНИ ТРАНСЛОКАЦИИ ПРИ МИШКИ
1. МЕТОД
1.1. Въведение
Виж общо въведение, част Б.
1.2. Определение
Виж общо въведение, част Б.
1.3. Вещества за сравнение
Няма.
1.4. Принцип на метода за изпитване
Изпитването за наследствени транслокации при мишки открива структурните и бройните изменения в хромозомите в зародишни клетки от бозайници, както се проявяват при потомството от първо поколение. Откриваните хромозомни изменения са от типа на реципрочните транслокации и, ако се включи женското потомство, загуба на Х-хромозоми. Носителите на транслокации и женските индивиди с XO-генотип демонстрират намалена плодовитост, която се използва за селекция на потомство от поколение F1 за цитогенетичен анализ. Пълно безплодие се причинява от определени типове транслокации (Х-автозомни и c-t-тип). Транслокациите се наблюдават цитогенетично в мейотичните клетки в метафаза I на диакинезата при мъжките индивиди от поколение F1 или мъжкото потомство на женските от поколение F1. Женските с XO-генотип се идентифицират генетично по наличието само на 39 хромозоми при митозите в костния мозък.
1.5. Критерии за качество
Няма.
1.6. Описание на метода за изпитване
Подготовка
Изпитваните химически вещества се разтварят в изотоничен физиологичен разтвор. Ако са неразтворими, те се разтварят или суспендират в подходящи носители. Използват се прясно приготвени разтвори на изпитваното съединение. Ако за улесняване на дозирането се използва носител, той не трябва да влияе на изпитваното съединение нито да предизвиква токсични ефекти.
Начин на прилагане
Обикновено начините на прилагане са орална интубация или интраперитонеално инжектиране. Може да са целесъобразни други начини на прилагане.
Експериментални животни
За улесняване на отглеждането и цитологичното потвърждаване тези експерименти се правят с мишки. Не е необходима конкретна порода мишки. Средната големина на котилото на породата обаче трябва да е по-голяма от осем и да бъде относително постоянна. Използват се здрави полово зрели животни.
Брой на животните
Броят на необходимите животни зависи от честотата на спонтанните транслокации и от минималната честота на предизвикването, необходима за положителен резултат.
Изпитването обикновено се провежда посредством анализиране на мъжкото потомство F1. Трябва да се изследват най-малко по 500 мъжки индивида от поколението F1 за дозирана група. Ако се включват женските животни от поколение F1, са необходими 300 мъжки и 300 женски индивида.
Използване на отрицателни и положителни контроли
Трябва да съществуват адекватни данни, получени от паралелни и исторически контроли. Когато съществуват приемливи положителни контролни резултати от наскоро проведени в същата лаборатория експерименти, тези резултати могат да бъдат използвани вместо паралелна положителна контрола.
Нива на дозиране
Изпитва се едно ниво на дозиране, обикновено най-високата доза, свързана с предизвикване на минимални токсични ефекти, но без засягане на размножителното поведение или преживяването. За да се установи връзката доза/отговор, са необходими две допълнителни по-ниски дози. За нетоксичните вещества трябва да се използва експозиция на максималната възможна доза.
Процедура
Третиране и чифтосване
Съществуват две схеми за третиране. Най-широко се използва еднократното прилагане на изпитваното вещество. Може да се използва и прилагане на изпитваното вещество седем дни в седмицата в продължение на 35 дни. Броят на чифтосванията след третирането зависи от схемата на третиране и трябва да осигури вземане на проби от всички третирани стадии на развитие на зародишните клетки. В края на чифтосването женските животни се настаняват в индивидуални клетки. Когато женските родят, се регистрират датата, големината на котилото и полът на потомството. Цялото мъжко потомство се отбива и цялото женско потомство се отстранява, освен ако не е включено в експеримента.
Изпитване за хетерозиготност на транслокациите
Използва се единият от двата възможни метода:
|
— |
Изпитване за плодовитост на потомството F1 и последващо потвърждаване на възможните носители на транслокация чрез цитогенетичен анализ, |
|
— |
Цитогенетичен анализ на всички мъжки индивиди от поколението F1 без предварителна селекция чрез изпитване за плодовитост. |
a) Изпитване за плодовитост
Намалената плодовитост на даден индивид от поколение F1 може да се установи чрез наблюдение на големината на котилото и/или анализ на съдържанието на матката при женските индивиди.
За използваната порода мишки трябва да бъдат установени критериите за определяне на нормална и намалена плодовитост.
Наблюдение на големината на котилото: Експерименталните мъжки индивиди от поколение F1 трябва да се настанят в индивидуални клетки с женски от същия експеримент или от колонията. Клетките се проверяват ежедневно от 18-тия ден след чифтосването. Големината на котилото и полът на потомството F2 се регистрират при раждането и след това котилата се елиминират. Ако се изследва женското потомство от поколение F1, потомството от поколение F2 от малките котила се запазва за допълнително изпитване. Женските носители на транслокации се потвърждават посредством цитогенетичен анализ на транслокациите в цялото им мъжко потомство. Женските животни с XO-генотип се разпознават по измененото съотношение между половете в тяхното потомство от 1:1 на 1:2 мъжки към женски индивиди. При следваща процедура нормалните животни от поколение F1 се елиминират от допълнителното изпитване, ако първото котило от поколение F2 достигне или превиши предварително определена нормална големина. В противен случай се наблюдават второ или трето котило от поколение F2.
Животните от поколение F1, които не могат да бъдат класифицирани като нормални след наблюдение на до три котила от поколение F2, се изследват допълнително чрез анализ на съдържанието на матката на женските партньори или направо се подлагат на цитогенетичен анализ.
Анализ на съдържанието на матката: Намаляването на големината на котилото при носителите на транслокация се дължи на смърт на зародиши, така че големият брой мъртви имплантирани зародиши е показателен за наличието на транслокация при експерименталното животно. Всеки от експерименталните мъжки индивиди от поколение F1 се чифтосва с по две до три женски животни. Зачеването се установява чрез ежедневна сутрешна проверка за вагинални запушалки. Женските се пожертват 14 до 16 дни по-късно и се регистрират живите и мъртвите имплантирани зародиши в матките им.
б) Цитогенетичен анализ
Препарати от тестиси се приготвят по техниката за изсушаване с въздух. Носителите на транслокации се идентифицират по наличието на мултивалентни конфигурации в метафаза I на диакинезата на първичните сперматоцити. За да се докаже, че едно животно е носител на транслокация, трябва да се наблюдават поне две клетки с мултивалентно асоцииране.
Ако не е извършвана селекция чрез кръстосване, всички мъжки индивиди от поколение F1 се анализират цитогенетично. Трябва да се направи микроскопски анализ на най-малко 25 клетки в метафаза I на диакинезата за мъжки индивид. При мъжките индивиди от поколение F1, които имат малки тестиси и мейотично разкъсване преди диакинезата, или при женски индивиди от поколение F1, за които се подозира, че имат XO-генотип, трябва да се изследват митотичните метафази в сперматогонии или костен мозък. Наличието на необичайно дълга и/или къса хромозома във всяка една от 10 клетки свидетелства за особена транслокация, причиняваща безплодие при мъжките индивиди (c-t-тип). Някои X-автозомни транслокации, които причиняват безплодие при мъжките индивиди, могат да бъдат идентифицирани само посредством анализ на ивиците на митотичните хромозоми. Наличието на 39 хромозоми при всички 10 митози свидетелства за наличие на XO-генотип в женски индивид.
2. ДАННИ
Данните се представят в табличен вид.
За всяко чифтосване средната големина на котилото и съотношението между половете от чифтосванията на родителите се отразяват при раждането и при отбиването.
За оценка на плодовитостта на животните от поколение F1 се представят средната големина на котилото от всички нормални чифтосвания и големината на отделните котила на носителите на транслокации от поколение F1. За анализиране на съдържанието на матката се отчитат средният брой на живите и мъртвите имплантирани зародиши от нормалните чифтосвания и броят на живите и мъртвите имплантирани зародиши за всяко чифтосване поотделно за носителите на транслокации от поколение F1.
За цитогенетичен анализ на метафаза I на диакинезата се отбелязват броят на типовете мултивалентни конфигурации и общият брой на клетките за всеки носител на транслокация.
За стерилните индивиди от поколение F1 се съобщават общият брой чифтосвания и продължителността на чифтосването. Дават се теглата на тестисите и подробности от цитогенетичния анализ.
За женските с XO-генотип се съобщават средната големина на котилото, съотношението между половете в потомството F2 и резултатите от цитогенетичния анализ.
Когато евентуалните носители на транслокации от поколението F1 се селекционират предварително с помощта на изпитвания за плодовитост, таблиците трябва да включват информация за това колко от индивидите са потвърдени хетерозиготи по отношение на транслокацията.
Съобщават се данните от отрицателните контроли и положителните контролни експерименти.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. Протокол от изпитването
Ако е възможно, протоколът от изпитването съдържа следната информация:
|
— |
порода мишки, възраст на животните, тегла на третираните животни, |
|
— |
брой на животните от родителското поколение от всеки пол в експерименталните и контролните групи, |
|
— |
условия на изпитването, подробно описание на третирането, нива на дозиране, разтворители, схема на чифтосването, |
|
— |
брой и пол на потомството за един женски индивид, брой и пол на потомството, отгледано за анализ на транслокациите, |
|
— |
време и критерии за анализ на транслокациите, |
|
— |
брой и подробно описание на носителите на транслокации, включително данни за кръстосването и данни за съдържанието на матката, ако е необходимо, |
|
— |
цитогенетични процедури и подробности за микроскопския анализ, за предпочитане със снимки, |
|
— |
статистическа оценка, |
|
— |
обсъждане на резултатите, |
|
— |
интерпретиране на резултатите. |
3.2. Оценка и интерпретиране
Виж общо въведение, част Б.
4. ПОЗОВАВАНИЯ
Виж общо въведение, част Б.
ЧАСТ В: МЕТОДИ ЗА ОПРЕДЕЛЯНЕ НА ТОКСИЧНОСТТА ЗА ОКОЛНАТА СРЕДА
ОБЩО ВЪВЕДЕНИЕ: ЧАСТ В
Методите за изпитване, описани по-долу, са предназначени за определяне на някои екотоксикологични свойства, изброени в приложение VIII към Директива 79/831/EИО. Уведомяващите органи трябва да бъдат наясно, че методите за определяне на следните свойства, предвидени в ниво 1 от приложение VIII, не са включени в текста:
|
— |
Продължително изпитване за токсичност с Daphnia magna, |
|
— |
Изпитвания с висши растения, |
|
— |
Продължително изпитване за токсичност с риби, |
|
— |
Изпитване за натрупване във вида. |
Когато съответните методи за изпитване за определяне на тези свойства бъдат уточнени, те ще бъдат публикувани под формата на допълнително адаптиране към техническия прогрес. Междувременно уведомяващите органи трябва да използват подходящи международно признати методи, които да бъдат представени пред съответните компетентни органи.
ИЗПИТВАНЕ ЗА ПОТИСКАНЕ НА РАСТЕЖА НА ВОДОРАСЛИ
1. МЕТОД
1.1. Въведение
Целта на това изпитване е да се определят ефектите на дадено вещество върху растежа на едноклетъчни зелени водорасли. С помощта на относително краткотрайни изпитвания могат да се оценят ефектите върху няколко поколения. Методът може да бъде адаптиран за използване с няколко вида едноклетъчни зелени водорасли, като в протокола от изпитването трябва да бъде описан използваният метод.
Този метод най-лесно се прилага за водноразтворими вещества, които при експерименталните условия е вероятно да останат във водата.
За вещества с ограничена разтворимост в изпитваната среда може да не е възможно да се определи количествено EC50 (виж определенията, по-долу).
Методът може да се използва за вещества, които не влияят пряко върху измерването на растежа на водораслите.
При провеждане на това изпитване може да се окаже полезна следната информация:
|
— |
Разтворимост във вода, |
|
— |
Парно налягане, |
|
— |
Структурна формула, |
|
— |
Чистота на веществото, |
|
— |
Химическа стабилност във вода и при осветяване, |
|
— |
Методи за анализ за количествено определяне на веществото във водата, |
|
— |
Стойност на pKa, |
|
— |
Коефициент на разделяне на n-октанол/вода, |
|
— |
Резултати от „лесно“ изпитване за биологична разградимост. |
1.2. Определения и единици
„Концентрация на клетки“: брой на клетките на милилитър;
„Растеж“: нарастване концентрацията на клетки по време на изпитването;
„Скорост на растеж“: повишаване концентрацията на клетки за единица време,
„EC50“: при този метод концентрацията на изпитваното вещество, която води до 50 % намаляване на растежа или на скоростта на растеж в сравнение с контролата;
„Концентрация без видим ефект (NOEC)“: при този метод най-високата концентрация, при която измерваният(те) параметър(ри) не показват значително потискане на растежа в сравнение с контролните стойности.
1.3. Вещества за сравнение
За да се открият незадоволителни експериментални условия, може да се изпитва вещество за сравнение. Ако се използва вещество за сравнение, резултатите трябва да бъдат представени в протокола от изпитването. Като вещество за сравнение може да се използва калиев дихромат.
1.4. Принцип на метода за изпитване
Култури от селекционирани зелени водорасли в експоненциална фаза на растеж се подлагат на експозиция на различни концентрации на изпитваното вещество в продължение на няколко поколения при определени условия. Потискането на растежа в сравнение с контролната култура се определя за фиксиран период от време.
1.5. Критерии за качество
1.5.1. Условия за валидност на изпитването
Концентрацията на клетки в контролните култури трябва да нарасне поне 16 пъти в рамките на три дни.
Преминаването на изпитваното вещество от водата в биологичната маса не прави изпитването непременно невалидно.
1.6. Описание на експерименталната процедура
1.6.1. Подготовка
1.6.1.1. Оборудване и материали
|
— |
Обичайно лабораторно оборудване, |
|
— |
Експериментални колби с подходящ обем (например коничните колби от 250 мл са подходящи, когато обемът на експерименталния разтвор е 100 мл), |
|
— |
Апаратура за култивиране: шкаф или камера, в които може да се поддържа температура в диапазона от 21 до 25 ± 2 °C и да се осигури непрекъснато еднакво осветление в спектралния диапазон от 400 до 700 нм. (Препоръчва се квантов поток от 0,72 × 1020 фотона/m2s с колебание в рамките на ± 20 %. Този квантов поток е равен на 120 µE/m2s и може да се получи с универсални флуоресцентни лампи с бяла светлина (температура на светлината приблизително 4 200 K), като се получават приблизително 8 000 лукса, (измерени със сферичен колектор) |
|
— |
Апарат за определяне на концентрацията на клетките, например електронен брояч на частици, микроскоп с броителна камера, флуориметър, спектрофотометър, колориметър (Забележка: за да се осигурят значими измервания при ниски концентрации на клетки, когато се използва спектрофотометър, може да се наложи да се употребяват кювети с път на светлината най-малко 4 см). |
1.6.1.2. Среда за водорасли
Препоръчва се следната среда:
|
NH4C1: |
15 |
мг/л, |
|
MgCl2.6H2O: |
12 |
мг/л, |
|
CaCl2.2H2O: |
18 |
мг/л, |
|
MgSO4.7H2O: |
15 |
мг/л, |
|
KH2PO4: |
1,6 |
мг/л, |
|
FeCl3.6H2O: |
0,08 |
мг/л, |
|
Na2EDTA.2H2O: |
0,1 |
мг/л, |
|
H3BO3: |
0,185 |
мг/л, |
|
MnCl2.4H2O: |
0,415 |
мг/л, |
|
ZnCl2: |
3 × 10-3 |
мг/л, |
|
CoCl2.6H2O: |
1,5 × 10-3 |
мг/л, |
|
CuCl2.2H2O: |
10-5 |
мг/л, |
|
Na2MoO4.2H2O: |
7 × 10-3 |
мг/л, |
|
NaHCO3: |
50 |
мг/л. |
След уравновесяване с въздух pH на тази среда е приблизително 8.
Горната препоръка не изключва използването на други среди, при условие, обаче, че се спазват следните граници за най-важните съставки:
|
P: |
≤ 0,7 мг/л, |
|
N: |
≤ 10 мг/л, |
|
хелатори: |
≤ 10-3 ммол/л, |
|
твърдост (Ca + Mg): |
≤ 0,6 ммол/л. |
Препоръчваната среда и средата, дадена в позоваване (1), отговарят на това изискване.
1.6.1.3. Експериментални организми
Избор на видове
Предлага се видовете зелени водорасли, които се използват, да имат бърз растеж, тъй като това ги прави удобни за култивиране и изпитване. За подходящи се смятат следните видове:
|
— |
Selenastrum capricornutum ATCC 22662, |
|
— |
Scenedesmus subspicatus 86.81 SAG, |
|
— |
Chlorella vulgaris CCAP 211/11b. |
Ако се използват други видове, трябва да се съобщи породата.
1.6.1.4. Проект на изпитването
Първоначална концентрация на клетки
Препоръчва се първоначалната концентрация на клетки в експерименталните култури да бъде приблизително 104 клетки/мл за Selenastrum capricornutum и Scenedesmus subspicatus. Когато се използват други видове, биологичната маса трябва да бъде сравнима.
Концентрации на изпитваното вещество
Диапазонът на концентрации, в който вероятно ще възникнат ефекти, се определя въз основа на резултатите от изпитвания за определяне на диапазона. За изпитването трябва да бъдат избрани поне пет концентрации, подредени в геометрична серия. Най-ниската изпитвана концентрация не трябва да има видим ефект върху растежа на водораслите. Най-високата изпитвана концентрация трябва да потиска растежа с поне 50 % в сравнение с контролата и се предпочита тя напълно да спира растежа.
Повторения и контроли
За предпочитане е проектът за изпитването да включва три повторения за всяка експериментална концентрация и в идеалния случай два пъти по-голям брой контроли. Ако е оправдано, проектът за изпитването може да бъде променен, за да се увеличи броят на концентрациите и да се намали броят на повторенията за концентрация.
Когато за разтваряне на изпитваното вещество се използва носител, в проекта за изпитването трябва да бъдат включени допълнителни контроли, които съдържат носител в най-високите концентрации, използвани при експерименталните култури.
1.6.2. Провеждане на изпитването
Този раздел съдържа указания за изпитване на лесно разтворими, на трудно разтворими вещества и на летливи вещества.
1.6.2.1. Изпитване на вещества, които са лесно разтворими във вода
Експерименталните култури, съдържащи изпитвано вещество в желаните концентрации, и желаното количество култура от водорасли се приготвят чрез разреждане с филтрирана среда за култивиране на водорасли на порции от изходните разтвори на изпитваното вещество и на суспензия от водорасли.
Колбите за култивиране се разклащат и се поставят в апаратурата за култивиране. По време на изпитването водораслите трябва да се поддържат в суспензия и да се подпомага трансферът на CO2. За тази цел може да се използват разклащане, разбъркване или аериране. Културите трябва да се поддържат при температура от 21 до 25 °C, контролирана в рамките на ± 2 °C.
Концентрацията на клетките във всяка колба се определя най-малко на 24-тия, 48-мия и 72-рия час след началото на изпитването. Филтрираната среда за култивиране на водорасли се използва за определяне на фонова стойност при използване на броячи за частици или като контрола, когато се използват спектрофотометри.
pH се измерва в началото на изпитването и на 72-ия час.
Нормално по време на изпитването pH на разтворите не трябва да се колебае с повече от една единица.
1.6.2.2. Изпитване на вещества с ограничена разтворимост във вода
Когато разтворимостта на изпитваното вещество е от порядъка на най-високата концентрация, използвана в изпитването, за приготвяне на експериментални разтвори е необходимо леко отклоняване от горната процедура. Като изходен разтвор на изпитваното вещество може да служи наситен разтвор. Друг подход може да бъде разтварянето на изпитваното вещество при желаната концентрация в среда за водорасли преди въвеждането на суспензията от водорасли.
Изходните разтвори на веществата с ниска разтворимост във вода могат да бъдат приготвени чрез механична дисперсия или като се използват носители с ниска токсичност за водораслите, например органични разтворители, емулгатори или диспергиращи агенти. Когато се използва носител, концентрацията не трябва да превишава 100 мг/л, а в проекта за изпитването трябва да бъдат включени допълнителни контроли, в които се включва носител в най-високата концентрация, присъстваща в експерименталните разтвори.
1.6.2.3. Изпитване на летливи вещества
Засега не съществува общоприет начин за изпитване на летливи вещества. Когато е известно, че едно вещество показва тенденция към изпаряване, могат да се използват затворени експериментални колби с увеличен обем над нивото на течността. Предложени са варианти на този метод (виж позоваване (1).
Трябва да се направят опити за определяне на количеството вещество, което остава в разтвора, и се препоръчва изключително внимание при интерпретиране резултатите от изпитванията на летливи химически вещества, когато се използват затворени системи.
2. ДАННИ И ОЦЕНКА
Измерваните концентрации на клетките в експерименталните култури и контролите се представят в табличен вид заедно с концентрациите на изпитваното вещество и времената на измерванията. Средната стойност за концентрацията на клетките за всяка концентрация на изпитваното вещество и за контролите се представят като графика срещу времето, за да се получат криви на растежа.
За да се определи връзката концентрация/ефект, трябва да се използват следните два подхода.
2.1. Сравняване на площите под кривите на растежа
Площта под кривите на растежа може да бъде изчислена по формулата:

където:
|
A |
= |
площта, |
|
N0 |
= |
номиналния брой клетки/мл във времето t0, |
|
N1 |
= |
измерения брой клетки/мл във времето t1, |
|
Nn |
= |
измерения брой клетки/мл във времето tn, |
|
t1 |
= |
времето на първото измерване след започване на изпитването, |
|
tn |
= |
времето на n-тото измерване след започване на изпитването. |
Процентът на потискане на клетъчния растеж за всяка концентрация на изпитваното вещество (IA) се изчислява като разлика между площта под контролната крива на растеж (Ac) и площта под кривата на растеж за всяка концентрация на изпитваното вещество (Аt) по формулата:

Стойностите на IA се нанасят на графика за съответните концентрации на полулогаритмична или логаритмична хартия. Ако графиките се построяват на логаритмична хартия, точките се доближават до правата линия на око или когато се приема нормално логаритмично разпределение на стойностите, може да се начертае изчислена регресионна линия.
Стойността на EC50 се получава от отсечката от (регресионната) линия, като се начертае успоредна линия към абсцисата при стойност на IA = 50 %. За да се отбележи недвусмислено тази точка по отношение на метода на изчисляване, е предложен символът EbC50. По отношение на този метод, който изисква измервания на 24-тия, 48-мия и 72-рия час, символът става EbC50 (0—72 h).
Други стойности на EC, например EbC10, могат също да бъдат получени чрез построяване на графика на IA срещу логаритъма на концентрацията.
2.2. Сравняване на скоростите на растеж
Средната специфична скорост на растеж (μ) за експоненциално растящи култури може да бъде изчислена по следния начин:

Средната специфична скорост на растеж може също така да бъде получена от наклона на регресионната линия при нанасяне на In N на графика срещу времето.
Процентното намаляване на средната специфична скорост на растеж за всяка концентрация на изпитваното вещество, сравнена с контролната стойност, се нанася на графика срещу логаритъма на концентрацията. От получената графика могат да се определят техните EC50. За да бъде недвусмислено обозначена EC50, получена по този метод, се предлага символът ErC50. Времената на измерванията трябва да бъдат отбелязани, т.е. ако стойността се отнася за 24-тия и 48-мия час, символът става ErC50 (24—48 h).
Забележка: специфичната скорост на растеж е логаритмичен термин и малките изменения в скоростта на растеж могат да доведат до големи изменения в биологичната маса. Следователно стойностите EbC и ErC не са сравними като цифри.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
Ако е възможно, протоколът от изпитването съдържа следното:
|
— |
Изпитвано вещество: данни за химическото идентифициране, |
|
— |
Експериментални организми: произход, лабораторна култура, номер на породата, метод на култивиране, |
|
— |
Условия на изпитване:
|
|
— |
Резултати:
|
4. ПОЗОВАВАНИЯ
(1) ОИСР, Париж, 1981, Test Guideline 201, Решение на Съвета C(81) 30 окончателен.
(2) Umweltbundesamt, Berlin, 1984, Verfahrensvorschlag „Hemmung der Zellvermehrung bei der Grünalge Scenedesmus subspicatus“, в: Rudolph/Boje: Ökotoxikologie, ecomed, Landsberg, 1986.
Допълнение
ПРИМЕР ЗА ПРОЦЕДУРА ЗА КУЛТИВИРАНЕ НА ВОДОРАСЛИ
Общи наблюдения
Целта на култивирането по следващата процедура е да се получат култури от водорасли за изпитвания за токсичност.
Трябва да се използват подходящи методи, за да се осигури културите от водорасли да не са инфектирани с бактерии (ISO 4833). Може да е желателно културите да са съставени само от един вид организми, но най-важни са културите, съставени от един вид водорасли.
Всички операции трябва да се извършват в стерилни условия, за да се избегне заразяването с бактерии и други водорасли.
Оборудване и материали
Виж 1.6.1: Подготовка и експериментални организми.
Процедури за получаване на култури от водорасли
Приготвяне на хранителни разтвори (среди)
Всички хранителни соли за средата се приготвят като концентрирани изходни разтвори и се съхраняват на тъмно и студено. Тези разтвори се стерилизират чрез филтриране или в автоклав.
Средата се приготвя чрез добавяне на съответни количества изходни разтвори към стерилна дестилирана вода, като се внимава да не възникнат инфекции. За твърда среда се добавя 0,8 % агар.
Изходна култура
Изходните култури представляват малки култури от водорасли, които се прехвърлят редовно в прясна среда, за да служат като първоначален експериментален материал. Ако културите не се използват редовно, те се посяват върху епруветки с наклонен агар. Изходните култури се прехвърлят в прясна среда поне един път на всеки два месеца.
Изходните култури се отглеждат в конични колби, съдържащи подходяща среда (с обем около 100 мл). Когато водораслите се инкубират при 20 °C с непрекъснато осветяване, необходимо е ежеседмично прехвърляне.
По време на прехвърлянето определено количество от „старата“ култура се прехвърля с помощта на стерилна пипета в колба с прясна среда така, че при бързо растящите видове първоначалната концентрация да бъде около 100 пъти по-ниска от тази в старата култура.
Скоростта на растеж на даден вид може да се определи от кривата на растежа. Ако това е известно, може да се оцени плътността, при която културата трябва да бъде прехвърлена в нова среда. Това трябва да се направи преди културата да достигне фазата на смърт.
Предкултура
Целта на предкултурата е да осигури определено количество водорасли, които са подходящи за отглеждане в експериментални култури. Предкултурата се инкубира в експериментални условия и се използва, докато е все още във фаза на експоненциален растеж, обикновено след инкубационен период от около три дни. Културите от водорасли трябва да бъдат изхвърлени, ако съдържат деформирани или абнормални клетки.
ТОКСИЧНОСТ ЗА ЗЕМНИ ЧЕРВЕИ
ИЗПИТВАНЕ С ИЗКУСТВЕНА ПОЧВА
1. МЕТОД
1.1. Въведение
При това лабораторно изпитване изпитваното вещество се добавя към изкуствена почва, в която за 14 дни се поставят земни червеи. След този период (или по избор след 7 дни) се изпитва леталният ефект на веществото върху земните червеи. Изпитването осигурява метод за относително краткотрайно пресяващо изпитване за ефекта на химическите вещества върху земните червеи чрез постъпване по кожен и стомашно-чревен път.
1.2. Определение и единица
LC50: Концентрацията на дадено вещество, за която е преценено, че убива 50 % от експерименталните животни през периода на изпитването.
1.3. Вещество за сравнениe
Периодично се използва вещество за сравнение, за да се демонстрира, че чувствителността на експерименталната система не е значително променена.
Като вещество за сравнение се препоръчва хлороацетамид „чист за анализ“.
1.4. Принцип на изпитването
Почвата е непостоянна среда, така че за това изпитване се използва точно определена изкуствена глинеста почва. Възрастните земни червеи от вида Eisenia foetida (виж забележката в допълнението) се държат в определена изкуствена почва, третирана с различни концентрации на изпитваното вещество. Съдържанието на контейнерите се разстила на табла 14 дни (или по избор 7 дни) след началото на изпитването и се преброяват преживелите при всяка концентрация земни червеи.
1.5. Критерии за качество
Изпитването е проектирано така, че да бъде възможно най-добре възпроизводимо по отношение на изпитвания субстрат и организъм. В края на изпитването смъртността при контролите не трябва да превишава 10 %, в противен случай изпитването е невалидно.
1.6. Описание на метода за изпитване
1.6.1. Материали
1.6.1.1. Експериментален субстрат
Като основен експериментален субстрат се използва определена изкуствена почва.
a) Основен субстрат (процентите са по отношение на сухото тегло)
|
— |
10 % торфен мъх (с pH възможно най-близо до 5,5—6,0 без видими остатъци от растения и фино смлян), |
|
— |
20 % каолин, за предпочитане с повече от 50 % каолинит, |
|
— |
Около 69 % промишлен кварцов пясък (преобладава финият пясък с над 50 % частици с размер от 0,05 до 0,2 мм). Ако веществото не се диспергира достатъчно във вода, трябва да се отделят по 10 г на експериментален контейнер за по-късно смесване с изпитваното вещество, |
|
— |
Около 1 % калциев карбонат (CaCO3), пулверизиран, химически чист, добавен за постигане на стойност на pH от 6,0 ± 0,5. |
б) Експериментален субстрат
Експерименталният субстрат съдържа основния субстрат, изпитваното вещество и дейонизирана вода.
Водното съдържание е около 25 до 42 % от сухото тегло на основния субстрат. Водното съдържание на субстрата се определя чрез изсушаване на проба до постоянно тегло при 105 °C. Най-важният критерий е, че изкуствената почва трябва да бъде навлажнена до степен, при която няма остатъчна вода. Трябва да се внимава при смесването да се получи равномерно разпределяне на изпитваното вещество и на субстрата. Трябва да се отбележи начинът на въвеждане на изпитваното вещество в субстрата.
в) Контролен субстрат
Контролният субстрат съдържа основния субстрат и вода. Ако се използва добавка, една допълнителна контрола трябва да съдържа същото количество от добавката.
1.6.1.2. Експериментални контейнери
Стъклени контейнери с обем около един литър (адекватно затворени с пластмасови капаци, панички или пластмасово фолио с вентилационни отвори), напълнени с определено количество влажен експериментален или контролен субстрат, еквивалентен на 500 г сухо тегло на субстрата.
1.6.2. Условия на изпитване
Контейнерите трябва да се държат в климатични камери при температура 20 ± 2 °C с непрекъснато осветяване. Интензивността на светлината трябва да бъде 400 до 800 лукса.
Изпитването трае 14 дни, но по желание смъртността може да бъде отчетена седем дни след началото на изпитването.
1.6.3. Експериментална процедура
Експериментални концентрации
Концентрациите на изпитваното вещество се изразяват като тегло на веществото за единица сухо тегло на основния субстрат (мг/кг).
Изпитване за определяне на диапазон
Диапазонът на концентрациите, които предизвикват смъртност от 0 до 100 % може да бъде определен с помощта на изпитване за определяне на диапазон, което да даде информация за диапазона на концентрациите, които да се използват в дефинитивното изпитване.
Веществото трябва да бъде изпитвано при следните концентрации: 1 000; 100; 10; 1; 0,1 мг вещество/килограм експериментален субстрат (сухо тегло).
Когато трябва да се проведе пълно дефинитивно изпитване, за изпитването за определяне на диапазон може да са достатъчни по една експериментална партида за концентрация и по една за нетретираната контрола, всяка с по 10 червея.
Дефинитивно изпитване
Резултатите от изпитването за определяне на диапазон се използват за избиране на поне пет концентрации в геометрична серия, които покриват диапазона от 0 до 100 % смъртност и които се различават с постоянен фактор, непревишаващ 1,8.
Изпитванията, при които се използват тези серии от концентрации, трябва да дават възможно най-точна оценка на стойността LC50 и нейните граници на доверителност.
При дефинитивното изпитване се използват най-малко по четири експериментални партиди за концентрация и четири нетретирани контроли, всяка с по 10 червея. Резултатите от тези повторения се представят като средна стойност и стандартно отклонение.
Когато две последователни концентрации в съотношение 1,8 дават само 0 % и 100 % смъртност, тези две стойности са достатъчни, за да покажат диапазона, в рамките на който попада LC50.
Смес от основния експериментален субстрат и изпитваното вещество
Винаги, когато е възможно, експерименталният субстрат трябва да бъде приготвен без никакви допълнителни средства, освен вода. Непосредствено преди началото на изпитването изпитваното вещество се емулгира или диспергира в дейонизирана вода или друг разтворител и се смесва с основния експериментален субстрат или се разпръсква равномерно върху него с фин хроматографски или друг подобен спрей.
Ако е неразтворимо във вода, изпитваното вещество може да бъде разтворено във възможно най-малък обем подходящ органичен разтворител (например хексан, ацетон или хлороформ).
За разтваряне, диспергиране или емулгиране на изпитваното вещество могат да се използват само средства, които лесно се изпаряват. Преди употреба експерименталният субстрат трябва да бъде вентилиран. Количеството изпарена вода трябва да бъде възстановено. Контролата трябва да съдържа същото количество от всяка добавка.
Ако изпитваното вещество е неразтворимо и не може да се диспергира или емулгира в органични разтворители, 10 г смес от фино смлян кварцов пясък и определено количество изпитвано вещество, което е необходимо за третиране на 500 г сухо тегло от изкуствената почва, се смесват с 490 г сухо тегло от експерименталния субстрат.
За всяка експериментална партида във всеки стъклен контейнер се поставя определено количество влажен експериментален субстрат, еквивалентен на 500 г сухо тегло, заедно с 10 земни червея, които са аклиматизирани за 24 часа в сходен влажен основен субстрат и после бързо измити, като излишната вода е абсорбирана с филтърна хартия, и след това са поставени на повърхността на експерименталния субстрат.
Контейнерите се покриват с перфорирани пластмасови капаци, панички или фолио, за да се предотврати изсъхването на субстрата, и се държат при експериментални условия в продължение на 14 дни.
Отчитането трябва да се направи 14 дни (или по избор седем дни) след започване на изпитването. Субстратът се разстила върху плочка, направена от стъкло или неръждаема стомана. Земните червеи се изследват и се определя броят на преживелите червеи. Земните червеи се смятат за мъртви, ако не реагират на лек механичен стимул в предния край.
Когато изследването се прави на седмия ден, контейнерът отново се напълва със субстрат и преживелите червеи отново се поставят върху повърхността на същия експериментален субстрат.
1.6.4. Експериментални организми
Експерименталните организми трябва да бъдат възрастни индивиди от вида Eisenia foetida (виж забележката в допълнението) (на възраст поне два месеца с „поясче“) с влажно тегло 300 до 600 мг. (За метода на отглеждане виж допълнението).
2. ДАННИ
2.1. Третиране и оценка на резултатите
Концентрациите на изпитваното вещество се отчитат чрез препратка към съответните проценти на умрели земни червеи.
Когато данните са адекватни, стойността LC50 и границите на доверителност (p = 0,05) трябва да се определят с помощта на стандартни методи (Litchfield и Wilcoxon, 1949, за еквивалентен метод). Стойността LC50 трябва да бъде представена като мг изпитвано вещество за килограм от експерименталния субстрат (сухо тегло).
Когато наклонът на кривата на концентрацията е прекалено стръмен, за да позволи изчисляване на LC50, достатъчна е графична оценка на тази стойност.
Когато две последователни концентрации в съотношение 1,8 дават само 0 % и 100 % смъртност, тези две стойности са достатъчни, за да покажат диапазона, в рамките на който попада LC50.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. Протокол от изпитването
Ако е възможно, протоколът от изпитването съдържа следното:
|
— |
удостоверение, че изпитването е проведено в съответствие с критериите за качество, посочени по-горе, |
|
— |
проведеното изпитване (изпитване за определяне на диапазон и/или дефинитивно изпитване), |
|
— |
точно описание на експерименталните условия или удостоверение, че изпитването е проведено в съответствие с метода, като всички отклонения трябва да бъдат отразени, |
|
— |
точно описание на начина, по който изпитваното вещество е смесено в основния експериментален субстрат, |
|
— |
информация за експерименталните организми (вид, възраст, средна стойност и диапазон на теглото, условия на отглеждане и размножаване, доставчик), |
|
— |
метод, използван за определяне на LC50, |
|
— |
резултати от изпитването, включително всички използвани данни, |
|
— |
описание на наблюдаваните симптоми или на измененията в поведението на експерименталните организми, |
|
— |
смъртност при контролите, |
|
— |
LC50 или най-високата изпитвана концентрация без смъртност и най-ниската изпитвана концентрация със смъртност 100 %, 14 дни (или по избор седем дни) след началото на изпитването, |
|
— |
графика на кривата концентрация/отговор, |
|
— |
резултати, получени с веществото за сравнение, независимо дали във връзка с настоящото изпитване или от предишни задачи за контрол на качеството, |
4. ПОЗОВАВАНИЯ
(1) ОИСР, Париж, 1981, Test Guideline 207, Решение на Съвета C(81) 30 окончателен.
(2) Edwards, C. A. and Lofty, J, R., 1977, Biology of Earthworms, Chapman and Hall, London, 331 рp.
(3) Bouche, M. B., 1972, Lombriciens de France, Écologie et Systématique, Institut National de la Recherche Agronomique, 671 pp.
(4) Litchfield, J. T. and Wilcoxon, F., A simplified method of evaluation dose effect experiments. J. Pharm. Exp. Therap., vol. 96, 1949, p. 99.
(5) Комисия на Европейските общности, Development of a standardized laboratory method for assessing the toxicity of chemical substances to earthworms, Report EUR 8714 EN, 1983.
(6) Umweltbundesamt/Biologische Bundesanstalt für Land- und Forstwirtschaft, Berlin, 1984, Verfahrensvorschlag „Toxizitätstest am Regenwurm Eisenia foetida in künstlichem Boden“, B: Rudolph/Boje, Ökotoxikologie, ecomed, Landsberg, 1986.
Допълнение
Размножаване и отглеждане на червеите преди изпитването
За размножаване на животните от 30 до 50 възрастни червея се поставят в кутия за размножаване с пресен субстрат и се изваждат след 14 дни. Тези животни могат да се използват за получаване на допълнителни партиди за размножаване. Излюпените от какавидите земни червеи се използват за изпитване, когато съзреят (след два до три месеца при предписаните условия).
Условия на отглеждане и размножаване
|
Климатична камера: |
температура 20 ± 2 °C, за предпочитане с непрекъснато осветяване (интензивност на светлината от 400 до 800 лукса). |
|
Кутии за размножаване: |
подходящи плитки контейнери с обем 10 до 20 л. |
|
Субстрат: |
Eisenia foetida може да се отглежда в екскрементите на различни животни. Като среда за отглеждане се препоръчва да се използва смес в обем от 50 % торф и 50 % кравешка или конска тор. Средата трябва да има стойност на pH около 6 до 7 (регулирана с калциев карбонат) и ниска йонна проводимост (под 6 mmhos или 0,5 % концентрация на сол). |
|
Субстратът трябва да бъде влажен, но не прекалено мокър. |
|
|
Освен посочения по-горе метод, могат успешно да се използват и други процедури. |
Забележка: Съществуват две разновидности Eisenia foetida, които някои таксономи разделят като видове (Bouche, 1972). Те са морфологично сходни, но единият, Eisenia foetida foetida, обичайно има напречни черти или ленти върху сегментите, а при другия, Eisenia foetida andrei, теа липсват, като освен това той има пъстър червеникав цвят. Когато е възможно, трябва да се използва Eisenia foetida andrei. Ако съществува необходимата методика, могат да се използват други видове.
БИОЛОГИЧНО РАЗГРАЖДАНЕ
ИЗПИТВАНЕ ПО ZAHN — WELLENS
1. МЕТОД
1.1. Въведение
Целта на метода е да оцени потенциалната крайна биологична разградимост на неразтворими във вода нелетливи органични вещества, когато са подложени на експозиция на относително високи концентрации на микроорганизми в условията на статично изпитване.
Възможно е да настъпи физико-химична адсорбция на суспендираните твърди вещества и това трябва да се вземе предвид при интерпретиране на резултатите (виж 3.2).
Изпитваните вещества се използват в концентрации, съответстващи на стойностите на РОВ в диапазона от 50 до 400 мг/л или стойностите на ХПК в диапазона от 100 до 1 000 мг/л (РОВ = разтворен органичен въглерод; ХПК = химична потребност от кислород). Предимството на тези относително високи концентрации е аналитичната сигурност. Съединенията с токсични свойства могат да забавят или да потиснат процеса на разграждане.
При този метод измерването на концентрацията на разтворения органичен въглерод или на химичната потребност от кислород се използва за определяне на крайната биологична разградимост на изпитваното вещество.
Едновременното използване на специфичен аналитичен метод може да даде възможност за определяне на първичното биологично разграждане на веществото (изчезване на родителската химична структура).
Методът е приложим само за тези изпитвани органични вещества, които при използваната за изпитването концентрация:
|
— |
са разтворими във вода при условията на изпитването, |
|
— |
имат пренебрежимо ниско парно налягане при условията на изпитването, |
|
— |
не потискат развитието на бактериите, |
|
— |
се адсорбират в ограничена степен в рамките на експерименталната система, |
|
— |
не се губят при образуване на пяна в експерименталния разтвор. |
Информацията за относителните пропорции на основните компоненти на изпитвания материал ще бъдат полезни за интерпретиране на получените резултати, по-конкретно в случаите, когато резултатите са ниски или гранични.
За интерпретиране на ниските резултати и за избор на подходящи експериментални концентрации е желателно да има информация за токсичността на веществото за микроорганизмите.
1.2. Определения и единици
Величината на разграждането, постигната в края на изпитването, се отчита като „Биологично разграждане при изпитване по Zahn — Wellens“:

където:
|
DT |
= |
биологичното разграждане (%) във времето T, |
|
CA |
= |
стойностите на РОВ (или на ХПК) в експерименталната смес, измерени три часа след началото на изпитването (мг/л) (РОВ = разтворен органичен въглерод, ХПК = химична потребност от кислород), |
|
CT |
= |
стойностите на РОВ (или на ХПК) в експерименталната смес по време на вземането на проби (мг/л), |
|
CВ |
= |
стойностите на РОВ (или на ХПК) в празната проба по време на вземането на проби (мг/л), |
|
CBA |
= |
стойностите на РОВ или ХПК в празната проба, измерени три часа след началото на изпитването (мг/л). |
Степента на разграждане се закръглява до най-близкия цял процент.
Процентното разграждане се представя като процент от отнемането на РОВ (или на ХПК) от изпитваното вещество.
Разликата между измерената стойност след три часа и изчислената или за предпочитане измерената първоначална стойност може да даде полезна информация за елиминирането на веществото (виж 3.2. Интерпретиране на резултатите).
1.3. Вещества за сравнение
В някои случаи при изпитване на нови вещества, може да са полезни вещества за сравнение. Все още обаче не могат да бъдат препоръчани конкретни вещества за сравнение.
1.4. Принцип на метода за изпитване
В стъклен съд с обем от един до четири литра с бъркачка и аератор се поставят заедно активирана утайка, минерални хранителни вещества и изпитваният материал като единствен източник на въглерод във воден разтвор. Сместа се разбърква и аерира при температура от 20 до 25 °C и дифузно осветление или в тъмна стая за период до 28 дни. Процесът на разграждане се мониторира чрез определяне стойностите на РОВ (или на ХПК) във филтриран разтвор ежедневно или през други подходящи равни интервали от време. Съотношението на елиминирания РОВ (или ХПК) след всеки интервал и стойността, получена три часа след началото, се изразява като процент на биологично разграждане и служи като мярка за степента на разграждане в този момент. Построява се крива на биологичното разграждане, като резултатът се нанася на графика срещу времето.
Когато се използва специфичен аналитичен метод, могат да се измерят промените в концентрацията на родителската молекула, дължащи се на биологично разграждане (първична биологична разградимост).
1.5. Критерии за качество
С помощта на кръгово изпитване е доказано, че възпроизводимостта на този метод е задоволителна.
Чувствителността на метода до голяма степен се определя от вариабилността на празната проба и в по-малка степен от точността на определянето на разтворения органичен въглерод и от нивото на изпитваното съединение в течността.
1.6. Описание на експерименталната процедура
1.6.1. Подготовка
1.6.1.1. Реактиви
Вода за изпитването: питейна вода със съдържание на органичен въглерод < 5 мг/л. Общата концентрация на калциевите и магнезиевите йони не трябва да надвишава 2,7 ммол/л, в противен случай е необходимо адекватно разреждане с дейонизирана или дестилирана вода.
|
Сярна киселина, аналитичен реактив: |
50 г/л. |
|
Разтвор на натриев хидроксид, аналитичен реактив: |
40 г/л. |
|
Разтвор на минерални хранителни вещества: в един литър дейонизирана вода се разтварят: |
|
|
амониев хлорид, NH4Cl, аналитичен реактив: |
38,5 г, |
|
натриев дихидрогенфосфат, NaH2PO4.2H2O, аналитичен реактив: |
33,4 г, |
|
калиев дихидрогенфосфат, KH2PO4, аналитичен реактив: |
8,5 г, |
|
дикалиев монохидрогенфосфат, K2HPO4, аналитичен реактив: |
21,75 г. |
Сместа служи както като хранително вещество, така и като буферна система.
1.6.1.2. Апаратура
Стъклени съдове с обем от един до четири литра (например цилиндрични съдове).
Бъркачка със стъклена или метална бъркалка, монтирана на подходящ вал (бъркалката трябва да се върти на приблизително 5 до 10 см над дъното на съда). Вместо това може да се използва магнитна бъркалка с прът, дълъг от 7 до 10 см.
Стъклена тръбичка с вътрешен диаметър от 2 до 4 мм за вкарване на въздух. Отворът на тръбичката трябва да се намира на около 1 см над дъното на съда.
Центрофуга (около 3 550 г).
Уред за измерване на pH.
Уред за измерване на разтворения кислород.
Хартиени филтри
Апарат за мембранно филтриране.
Мембранни филтри с размер на порите 0,45 мкм. Мембранните филтри са подходящи, ако е сигурно, че те нито освобождават въглерод, нито абсорбират веществото по време на филтрирането.
Аналитично оборудване за определяне съдържанието на органичен въглерод и химичната потребност от кислород.
1.6.1.3. Приготвяне на проба за инокулиране
Активирана утайка от станция за биологично пречистване се промива с вода за изпитване чрез (многократно) центрофугиране или утаяване (виж по-горе).
Активираната утайка трябва да бъде в подходящо състояние. Такава утайка може да се получи от правилно функционираща пречиствателна станция за отпадъчни води. За да се получат колкото е възможно повече различни видове или щамове бактерии, може да се предпочете да се смесят проби за инокулиране от различни източници (например различни пречиствателни станции, почвени екстракти, речни води и др.). Сместа трябва да се третира, както е описано по-горе.
За проверка на активността на активираната утайка, виж „Контрол на функционирането“ по-долу.
1.6.1.4. Приготвяне на експериментални разтвори
В експерименталния съд се наливат 500 мл вода за изпитване, 2,5 мл/л разтвор на минерални хранителни вещества и активирана утайка в количество, което съответства на 0,2 до 1,0 г/л сухо вещество в крайната смес. Добавя се достатъчно изходен разтвор на изпитваното вещество така, че в крайната смес да се получи концентрация на РОВ от 50 до 400 мг/л. Съответните стойности на химичната потребност от кислород са от 100 до 1 000 мг/л. Долива се вода за изпитване, за да се получи общ обем от един до четири литра. Избраният общ обем зависи от броя на пробите, които трябва да се вземат за всяко определяне на РОВ и ХПК, и от обемите, които са необходими за аналитичната процедура.
Обикновено обем от два литра се смята за задоволителен. Приготвя се и поне един контролен съд (празна проба), който се наблюдава паралелно с всяка експериментална серия. Той съдържа само активирана утайка и разтвор на минерални хранителни вещества, приготвен с водата за изпитване до същия общ обем, както в експерименталните съдове.
1.6.2. Провеждане на изпитването
Експерименталните съдове се разбъркват с магнитни бъркачки или винтови пропелери при дифузно осветление или в тъмна стая при температура от 20 до 25 °C. Аерирането се постига с помощта на сгъстен въздух, пречистен през филтър от памучна вата и, ако е необходимо, бутилка за отмиване. Утайката не трябва да се утаява и кислородната концентрация не трябва да спада под 2 мг/л.
Стойността на pH трябва да се проверява на редовни интервали (например ежедневно) и ако е необходимо, да се коригира на pH от 7 до 8.
Загубите от изпаряване се компенсират непосредствено преди всяко вземане на проба с дейонизирана или дестилирана вода в необходимите количества. Полезно е да се отбележи нивото на течността върху съда преди започване на изпитването. След всяко вземане на проби нивото се отбелязва отново (без аериране и разбъркване). Първите проби се вземат винаги три часа след започване на изпитването, за да се открие адсорбирането на изпитвания материал от активираната утайка.
Елиминирането на изпитвания материал се проследява чрез определяне на РОВ и ХПК, което се извършва ежедневно или на други редовни интервали. Пробите от експерименталния съд и празната проба се филтрират през внимателно промит хартиен филтър. Първите 5 мл от филтрата на експерименталния разтвор се изхвърлят. Трудните за филтриране утайки могат да бъдат отстранени предварително чрез центрофугиране в продължение на 10 минути. Измерването на РОВ и ХПК се повтаря най-малко два пъти. Изпитването продължава до 28 дни.
Забележка: Пробите, които остават мътни, се филтрират през мембранни филтри. Мембранните филтри не трябва да освобождават или да адсорбират никакъв органичен материал.
Контрол на функционирането на активираната утайка
Паралелно с всяка експериментална серия трябва да се наблюдава съд, съдържащ познато вещество, за да се провери функционалния капацитет на активираната утайка. За тази цел е полезен диетиленгликолът.
Адаптиране
Ако анализите се провеждат на относително кратки интервали (например ежедневно), адаптирането може да бъде лесно разпознато по кривата на разграждане (виж фигура 2). Следователно изпитването не трябва да започва непосредствено преди края на седмицата.
Ако адаптирането възникне в края на изпитването, изпитването може да бъде удължено до завършване на разграждането.
Забележка: Ако е необходимо по-широко познаване на поведението на адаптираната утайка, същата активирана утайка се подлага още един път на експозиция на същия изпитван материал в съответствие със следната процедура:
Изключват се бъркачката и аераторът и активираната утайка се оставя да се утаи. Изтегля се надстоящата течност, допълва се до два литра с вода за изпитване, разбърква се за 15 минути и се оставя да се утаи отново. След като отново се изтегли надстоящата течност, оставащата утайка се използва, за да се повтори изпитването със същия материал в съответствие с 1.6.1.4 и 1.6.2 по-горе. Активираната утайка може да бъде изолирана и чрез центрофугиране вместо утаяване.
Адаптираната утайка може да бъде смесена с прясна утайка до концентрация 0,2 до 1 г/л сухо тегло.
Аналитични средства
Нормално пробите се филтрират през внимателно измит хартиен филтър (за измиване се използва дейонизирана вода).
Пробите, които остават мътни, се филтрират през мембранни филтри (0,45 мкм).
Определянето на концентрацията на РОВ се повтаря два пъти в проби от филтратите (първите 5 мл се изхвърлят) с помощта на уред за определяне на общия органичен въглерод. Ако филтратът не може да бъде анализиран същия ден, той трябва да се съхранява в хладилник до следващия ден. Не се препоръчва по-продължително съхранение.
Концентрацията на ХПК се определя във филтратите от пробите с аналитична апаратура за определяне на ХКП по процедурата, описана в позоваване (2) по-долу.
2. ДАННИ И ОЦЕНКА
Определянето на концентрациите на РОВ и ХПК в пробите се повтаря поне два пъти в съответствие с 1.6.2. по-горе. Разграждането в момента T се изчислява по формула (с определенията), дадена в 1.2. по-горе.
Степента на разграждане се закръглява до най-близкия цял процент. Величината на разграждането, постигната в края на изпитването, се отчита като „Биологично разграждане при изпитване по Zahn — Wellens“.
Забележка: Ако се постигне пълно разграждане преди изтичане на експерименталното време и този резултат се потвърди чрез втори анализ на следващия ден, изпитването може да бъде приключено.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. Протокол от изпитването
Ако е възможно, протоколът от изпитването съдържа следното:
|
— |
първоначалната концентрация на веществото, |
|
— |
цялата друга информация и експерименталните резултати, отнасящи се до веществото за сравнение, ако е използвано, и до празната проба, |
|
— |
концентрацията след три часа, |
|
— |
кривата на биологично разграждане с описание, |
|
— |
датата и мястото, където са взети проби от експерименталните организми, състоянието на адаптиране, използваната концентрация и др., |
|
— |
научните мотиви за всички изменения в експерименталната процедура. |
3.2. Интерпретиране на резултатите
Отнемането на РОВ (ХПК), което настъпва постепенно в продължение на дни или седмици, показва, че изпитваното вещество се разгражда биологично.
В някои случаи обаче физико-химичната адсорбция може да изиграе роля и това проличава от наличието на пълно или частично отнемане в началото, в рамките на първите три часа, а разликата между контролната и експерименталната надстояща течност остава на неочаквано по-ниско ниво.
Ако трябва да се направи разграничаване между биологичното разграждане (или частично разграждане) и адсорбцията, са необходими допълнителни изпитвания.
Това може да се направи по много начини, но най-убедително е използването на надстояща течност или утайка като проба за инокулиране в основно изпитване (за предпочитане респирометричен тест).
Изпитваните вещества, при които се наблюдава високо, неадсорбционно отнемане на РОВ (ХПК) при това изпитване, трябва да се считат за потенциално биологично разградими. Частичното неадсорбционно отнемане показва, че химическото вещество е подложено поне на известно биологично разграждане. Ниското или близкото до нула отнемане на РОВ (ХПК) може да се дължи на потискане на микроорганизмите от изпитваното вещество и това може да се докаже и чрез лизиране или загуба на утайка, водещи до образуване на мътна надстояща течност. Изпитването трябва да бъде повторено, като се използва по-ниска концентрация на изпитваното вещество.
Използването на специфичен за съединението аналитичен метод или маркирано с 14C изпитвано вещество могат да позволят по-висока чувствителност. При изпитвано съединение, маркирано с 14C, възстановяването на 14CO2 ще потвърди, че е настъпило биологично разграждане.
Когато резултатите са представени като първичното биологично разграждане, ако е възможно, трябва да бъде дадено обяснение за изменението в химичната структура, което води до загуба на отговор при родителското изпитвано вещество.
Валидирането на аналитичния метод трябва да бъде представено заедно с отговора, получен при празната експериментална среда.
4. ПОЗОВАВАНИЯ
(1) ОИСР, Париж, 1981, Test Guideline 302 B, Решение на Съвета C(81) 30 окончателен.
(2) Приложение V В.9 Разграждане: Химична потребност от кислород, Директива 84/449/ЕИО на Комисията, Официален вестник на Европейските общности, L 251, 19.9.1984 г.
Допълнение
ПРИМЕР ЗА ОЦЕНКА
|
Органично съединение: |
4-етоксибензоева киселина |
|
Теоретична експериментална концентрация: |
600 мг/л |
|
Теоретичен РОВ: |
390 мг/л. |
|
Проба за инокулиране |
Пречиствателна станция за отпадъчни води в… |
|
Концентрация: |
1 грам сух материал/литър, |
|
Състояние на адаптиране: |
неадаптиран |
|
Анализ: |
определяне на РОВ |
|
Количество на пробата: |
3 мл |
|
Контролно вещество: |
диетиленгликол |
|
Токсичност на съединението: |
Няма токсични ефекти под 1 000 мг/l Използвано изпитване: Изпитване с ферментационни епруветки |
|
Време на изпитването |
Контролно вещество |
Изпитвано вещество |
|||||
|
Празна проба за РОВ (8) мг/л |
РОВ (8) мг/л |
Нетна стойност на РОВ мг/л |
Разграждане % |
РОВ (8) мг/л |
Нетна стойност на РОВ мг/л |
Разграждане % |
|
|
0 |
— |
— |
300,0 |
— |
— |
390,0 |
— |
|
3 часа |
4,0 |
298,0 |
294,0 |
2 |
371,6 |
367,6 |
6 |
|
1 ден |
6,1 |
288,3 |
282,2 |
6 |
373,3 |
367,2 |
6 |
|
2 дни |
5,0 |
281,2 |
276,2 |
8 |
360,0 |
355,0 |
9 |
|
5 дни |
6,3 |
270,5 |
264,2 |
12 |
193,8 |
187,5 |
52 |
|
6 дни |
7,4 |
253,3 |
245,9 |
18 |
143,9 |
136,5 |
65 |
|
7 дни |
11,3 |
212,5 |
201,2 |
33 |
104,5 |
93,2 |
76 |
|
8 дни |
7,8 |
142,5 |
134,7 |
55 |
58,9 |
51,1 |
87 |
|
9 дни |
7,0 |
35,0 |
28,0 |
91 |
18,1 |
11,1 |
97 |
|
10 дни |
18,0 |
37,0 |
19,0 |
94 |
20,0 |
2,0 |
99 |
Фигура 1
Примери за криви на биологично разграждане

БИОЛОГИЧНО РАЗГРАЖДАНЕ
ИЗПИТВАНИЯ ЗА СИМУЛИРАНЕ НА АКТИВИРАНА УТАЙКА
1. МЕТОД
1.1. Въведение
1.1.1. Общи бележки
Методът е приложим само за тези органични вещества, които в използваната експериментална концентрация:
|
— |
са разтворими във вода до степента, необходима за приготвяне на експерименталните разтвори, |
|
— |
имат пренебрежимо ниско парно налягане при експерименталните условия, |
|
— |
не потискат бактериите. |
Информацията за относителните пропорции на основните компоненти на изпитвания материал ще бъде полезна за интерпретиране на получените резултати, по-конкретно в случаите, когато резултатите са ниски или гранични.
За интерпретиране на ниските резултати и за избор на подходящи експериментални концентрации е желателно да има информация за токсичността на веществото за микроорганизмите.
1.1.2. Определяне на крайната биологична разградимост (анализ на РОВ/ХПК)
Целта на метода е определяне на крайната биологична разградимост чрез измерване на отнемането на веществото и всички метаболити в модел на станция за активирана утайка при концентрация, съответстваща на > 12 мг РОВ /л (или приблизително 40 мг ХПК/л. Изглежда, че 20 мг РОВ/л е оптимална стойност. (РОВ = разтворен органичен въглерод, ХПК = химична потребност от кислород)
Трябва да се установи съдържанието на органичен въглерод (или химичната потребност от кислород) на изпитвания материал.
1.1.3. Определяне на първичната биологична разградимост (специфичен анализ)
Целта на метода е да се определи първичната биологична разградимост на дадено вещество в модел на станция за активирана утайка при концентрация около 20 мг/л, като се използва специфичен аналитичен метод (ако аналитичният модел и токсичността позволяват, могат да се използват по-високи или по-ниски концентрации). Това дава възможност за оценяване на първичната биологична разградимост на веществото (изчезване на родителската химична структура).
Целта на този метод не е определяне на минерализацията на изпитваното вещество.
Трябва да съществува адекватен аналитичен метод за определяне на изпитваното вещество.
1.2. Определения и единици
1.2.1. Анализ на РОВ/ХПК
Степента на отнемане на веществото се дава с:
|
[1 (a)] |
|
където:
|
DR |
= |
степента на отнемане на РОВ (или ХПК) в проценти в рамките на дадено средно време на задържане по отношение на изпитвания материал, |
|
T |
= |
концентрацията на изпитвания материал в постъпващата течност в мг РОВ/л (или мг ХКП/л), |
|
E |
= |
концентрацията на РОВ (или ХПК) в изходящата течност на експерименталния модул в мг РОВ/л (или в мг ХПК/л), |
|
Eo |
= |
концентрацията на РОВ (или ХПК) в изходящата течност на празния модул в мг РОВ/л (или мг ХПК/л), |
Разграждането е представено като процент на отнемането на РОВ (или ХПК) в рамките на дадено време на задържане по отношение на изпитвания материал.
1.2.2. Специфичен анализ
Процентът на елиминиране на изпитваното вещество от водната фаза (Rw) в рамките на дадено време на задържане се дава с
|
[1 (б)] |
|
където:
|
CI |
= |
концентрацията на веществото в постъпващата течност на експерименталния модул (мг вещество /л, определена с помощта на специфичен анализ), |
|
CO |
= |
концентрацията на веществото в изходящата течност на експерименталния модул (мг вещество /л, определена с помощта на специфичен анализ), |
1.3. Вещества за сравнение
В някои случаи при изпитване на ново вещество може да са полезни вещества за сравнение. Все още обаче не могат да бъдат препоръчани конкретни вещества за сравнение.
1.4. Принцип на методите за изпитване
За определяне на крайната биологична разградимост се наблюдават паралелно два пилотни модула с активирана утайка (потвърдително изпитване или изпитване с „метална пореста решетка“ на Организацията за икономическо сътрудничество и развитие, ОИСР). Изпитваното вещество се добавя към постъпващата течност (синтетични или битови отпадъчни води) на единия модул, докато в другия модул постъпват само отпадъчни води. За определяне на първичната биологична разградимост чрез специфичен анализ на постъпващата и изходящата течност се използва само един модул.
Концентрациите на РОВ (или на ХПК) се измерват в изходящата течност или концентрациите на веществото се определят с помощта на специфичен анализ.
РОВ, дължащ се на изпитвания материал, не се измерва, а само се отбелязва.
Когато се правят измервания на РОВ (или на ХПК), се приема, че разликата между средните стойности на концентрациите в експерименталната и контролната изходяща течност се дължат на неразграден изпитван материал.
Когато се правят специфични анализи, може да се определи изменението в концентрацията на родителската молекула (първично биологично разграждане).
Модулите могат да функционират в „режим на свързани модули“ по процедура за трансинокулиране.
1.5. Критерии за качество
Стартовата концентрация на веществото зависи от типа на проведения анализ и неговите ограничения.
1.6. Описание на метода за изпитване
1.6.1. Подготовка
1.6.1.1. Апаратура
Необходима е двойка модули от един и същ тип, освен когато се провеждат специфични анализи. Могат да се използват два типа устройства:
Потвърдително изпитване на Организацията за икономическо сътрудничество и развитие (ОИСР).
Оборудването (допълнение 1) се състои от съд (A) за съхраняване на синтетичните отпадъчни води, дозираща помпа (Б), съд за аериране (В), сепаратор (Г), въздушна повдигаща помпа (Д) за рециклиране на активираната утайка и съд (Е) за събиране на третираната изходяща течност.
Съдовете (A) и (Е) трябва да бъдат изработени от стъкло или подходяща пластмаса и да имат вместимост поне 24 литра. Помпата (Б) трябва да осигурява постоянен поток на синтетични отпадъчни води към съда за аериране, като може да се използва всяка подходяща система, при условие че входящият поток и концентрацията са гарантирани. При нормално функциониране височината на сепаратора (Г) е фиксирана спрямо обема, съдържащ се в съда за аериране така, че в него да има три литра смесена течност. В съда (В) на върха на конуса е закрепен куб (Ж) от синтерирано стъкло. Количеството на въздуха, продухван през аератора, може да бъде мониторирано с дебитомер.
Въздушната повдигаща помпа (Д) е настроена така че активираната утайка от сепаратора се рециклира редовно и непрекъснато в съда (В) за аериране.
„Метална пореста решетка“
Металната пореста решетка е изработена от листове порест полиетилен (дебелина 2 мм, максимален размер на порите 95 мкм), от които са направени цилиндри с диаметър 14 см с конична основа под ъгъл 45° (фигури 1 и 2 от допълнение 2). Металната пореста решетка се намира в непроницаем съд, изработен от подходяща пластмаса, с диаметър 15 см, с отвор на височина 17,2 см в цилиндричната част, което определя обема (3 литра) на решетката. Около горната част на вътрешния съд има твърд поддържащ пръстен, изработен от подходяща пластмаса така, че между вътрешния и външния съд има пространство за изходяща течност с ширина 0,5 см.
Металните порести решетки могат да бъдат монтирани в основата на контролирана термостатично водна баня. Към основата на вътрешния съд постъпва въздух и отгоре са поставени подходящи дифузори.
Съдовете (A) и (Д) трябва да бъдат изработени от стъкло или подходяща пластмаса и да имат вместимост поне 24 литра. Помпата (Б) трябва да осигурява постоянен поток на синтетични отпадъчни води към съда за аериране, като може да се използва всяка подходяща система, при условие че входящият поток и концентрацията са гарантирани.
Необходими са резервни вътрешни метални порести решетки, за да заменят тези, които могат да се запушат по време на употреба. Запушените решетки се почистват чрез 24-часово потапяне в разтвор на хипохлорит, последвано от щателно отмиване с чешмяна вода.
1.6.1.2. Филтриране
Апарат за мембранно филтриране и мембранни филтри с размер на порите 0,45 мкм. Мембранните филтри са подходящи, ако е сигурно, че те нито освобождават въглерод, нито адсорбират веществото по време на филтрирането.
1.6.1.3. Отпадъчни води
Може да се използва подхранване както с подходящи синтетични, така и с битови отпадъчни води.
Пример за синтетично подхранване
Във всеки литър чешмяна вода се разтварят:
|
Пептон: |
160 мг, |
|
Месен екстракт: |
110 мг, |
|
Урея: |
30 мг, |
|
NaCl: |
7 мг, |
|
CaCl2.2H2O: |
4 мг, |
|
MgSO4.7H2O: |
2 мг, |
|
K2HPO4: |
28 мг. |
Битови отпадъчни води
Те трябва да се вземат пресни всеки ден от преливащата вода в танка за първично утаяване на пречиствателна станция главно за битови отпадъчни води.
1.6.1.4. Изходен разтвор на експериментален материал
За добавяне към експерименталния модул трябва да бъде приготвен разтвор на експериментален материал, например 1 %. Трябва да се определи концентрацията на материала така, че той да се добави към отпадъчните води пряко в експерименталния модул или чрез втора помпа, за да се получи необходимата експериментална концентрация.
1.6.1.5. Проба за инокулиране
Забележка: Когато се употребяват битови отпадъчни води, няма да има смисъл да се използва проба за инокулиране с ниска бактериална концентрация, но може да се използва активирана утайка.
Могат да се използват разнообразни проби за инокулиране.
Дадени са три примера за подходящи проби за инокулиране:
a) Проба за инокулиране от вторична изходяща течност
Пробата за инокулиране трябва да бъде получена от вторична изходяща течност с добро качество, взета от пречиствателна станция, която обработва главно битови отпадъчни води. В периода между вземането на пробата и използването ѝ изходящата течност трябва да бъде съхранявана при аеробни условия. За да се приготви проба за инокулиране, пробата се филтрира през груб филтър, като първите 200 мл се изхвърлят. До използването му филтратът се съхранява в аеробни условия. Пробата за инокулиране трябва да се използва в деня на вземането ѝ. За инокулиране трябва да се използват най-малко 3 мл.
б) Комбинирана проба за инокулиране
Проба за инокулиране от вторична изходяща течност;
Виж описанието по-горе.
Проба за инокулиране от почва:
100 г градинска почва (плодородна, нестерилна) се суспендират в 1 000 мл питейна вода, несъдържаща хлор. (Почвите с изключително високо съдържание на глина, пясък или хумус не са подходящи.) След разбъркване суспензията се оставя да се утаи за 30 минути. Надстоящата течност се филтрира през груба филтърна хартия, като първите 200 мл се изхвърлят. Филтратът незабавно започва да се аерира, което продължава до използването му. Пробата за инокулиране трябва да се използва в деня на вземането ѝ.
Проба за инокулиране от повърхностни води:
Допълнителна частична проба за инокулиране се взема от мезосапробни повърхностни води. Пробата се филтрира през груба хартия, като първите 200 мл се изхвърлят. До използването му филтратът се съхранява в аеробни условия. Пробата за инокулиране трябва да се използва в деня на вземането ѝ.
Събират се равни обеми от трите частични проби за инокулиране, смесват се добре и от тази смес се взема крайната проба за инокулиране. За инокулиране трябва да се използват най-малко 3 мл.
в) Проба за инокулиране от активирана утайка
Като проба за инокулиране може да се използва определен обем (не повече от 3 литра) активирана утайка (със съдържание на суспендирани твърди вещества не повече от 2,5 г/л), взета от танк за аериране на пречиствателна станция, третираща главно битови отпадъчни води.
1.6.2. Процедура
Изпитването се провежда при стайна температура, която трябва да се поддържа между 18 и 25 °C.
Ако е целесъобразно, изпитването може да се проведе при по-ниска температура (до 10 °C). Ако веществото се разгражда нормално, не е необходимо допълнително изпитване. Обаче ако веществото не се разгражда, изпитването трябва да се проведе при постоянна температура между 18 и 25 °C.
1.6.2.1. Период на отмиване: образуване на утайка/стабилизиране на модулите
Периодът на растеж/стабилизиране на утайката представлява период, през който концентрацията на суспендираните твърди вещества от активираната утайка и функционирането на модулите прогресира до стабилно състояние при използваните функционални условия.
Периодът на отмиване е период, който трае от момента, в който изпитваното вещество е добавено за първи път, до момента, в който неговото отнемане достига плато (относително постоянна стойност). Този период не трябва да превишава шест седмици.
Периодът на оценяване е триседмичен период от момента, в който отнемането на изпитваното вещество достигне относително постоянна и обикновено висока стойност. За веществата, които през първите шест седмици показват слабо или липсващо разграждане, оценяването става през следващите три седмици.
Първоначално небходимият(ите) за едно изпитване модул(и) се напълва(т) с проба за инокулиране, смесена с постъпваща течност.
След това се включват аераторът (и въздушната повдигаща помпа (Д) при модулите за потвърдително изпитване на ОИСР).
Постъпващата течност без изпитваното вещество трябва да премине през съда за аериране (В) със скорост един литър за час или половин литър за час. Това дава средно време на задържане три или шест часа.
Степента на аериране трябва да бъде регулирана по такъв начин, че съдържанието на съда (В) да бъде поддържано постоянно като суспензия, а съдържанието на разтворен кислород да бъде най-малко 2 мг/л.
Образуването на пяна трябва да бъде предотвратено с помощта на подходящи средства. Не трябва обаче да се използват противопенни средства, които потискат активираната утайка.
Утайката, която се е събрала около горната част на съда за аериране (В) (а при модулите за потвърдително изпитване на ОИСР — в основата на съда за утаяване (Г) и в кръга за циркулация) трябва да бъде връщана обратно в смесената течност поне един път дневно с помощта на четка или друго подходящо средство.
Когато утайката не се утаява, нейната плътност може да се увеличи чрез добавяне на порции от 2 мл 5 % разтвор на трижелезен хлорид, което при необходимост се повтаря.
Изходящата течност се събира в съда (Д или Е) в продължение на 20 до 24 часа и след щателно смесване се взема проба. Съдът (Д или Е) трябва да бъде внимателно почистен.
За да се мониторира и контролира ефективността на процеса, се измерват химичната потребност от кислород (ХПК) или разтвореният органичен въглерод (РОВ) на филтрата от акумулираната изходяща течност поне два пъти седмично, както и на филтрираната постъпваща течност (като се използва мембрана с размер на порите 0,45 мкм, като първите 20 мл (приблизително) от филтрата се изхвърлят).
Намаляването на ХПК и РОВ достига равновесие, когато се получи приблизително еднакво дневно разграждане.
Съдържанието на сухо вещество в активираната утайка в танка за аериране трябва да се определя два пъти седмично (в г/л). Модулите трябва да функционират по един от двата начина: съдържанието на сухо вещество в активираната утайка трябва да се определя два пъти седмично и, ако е над 2,5 г/л, излишната активирана утайка трябва да бъде изхвърленаили ежедневно от всяка решетка да се изхвърлят по 500 мл смесена течност, за да се получи средно време на задържане на утайката шест дни.
Когато измерваните и оценяваните параметри (ефективността на процеса (в отнемане на ХПК или РОВ), утаимостта на утайката, мътността на изходящите течности и др.) на двата модула са достатъчно стабилни, изпитваното вещество трябва да бъде въведено в постъпващата течност на единия от модулите, както е дадено в 1.6.2.2.
Друго решение е изпитваното вещество да бъде добавено в началото на растежа на утайката (1.6.2.1), особено когато утайката се добавя като проба за инокулиране.
1.6.2.2. Експериментална процедура
Функционалните условия на периода на отмиване се поддържат и към постъпващата течност в експерименталния модул се добавя достатъчно изходен разтвор (приблизително 1 %) от изпитвания материал така, че да се получи желаната концентрация на изпитвания материал (приблизително 10 до 20 мг РОВ/л или 40 мг/л ХПК) в отпадъчните води. Това може да се направи чрез ежедневно смесване на изходния разтвор с отпадъчните води или посредством отделна помпена система. Тази концентрация може да се постига прогресивно. Ако изпитваното вещество няма токсични ефекти върху активираната утайка, могат да се изпитват и по-високи концентрации.
Празният модул се захранва само с постъпваща течност без добавени вещества. За анализ се вземат адекватни обеми изходящи течности и се филтрират през мембранни филтри (0,45 мкм), като първите 20 мл (приблизително) от филтрата се изхвърлят.
Филтрираните проби трябва да се анализират в същия ден. В противен случай трябва да се съхраняват по подходящ начин, например чрез използване на 0,05 мл 1 % разтвор на живачен хлорид (HgCl2) за всеки 10 мл филтрат или чрез съхраняването им при температура от 2 до 4 °C за срок до 24 часа или под – 18 °C за по-дълги периоди.
Времето на отмиване с добавяне на изпитвано вещество не трябва да превишава шест седмици и периодът на оценка не трябва да бъде по-кратък от три седмици, т.е. за изчисляване на крайния резултат трябва да се направят около 14 до 20 определяния.
Режим на свързани модули
Свързването на модулите се постига чрез взаимен обмен между двата модула един път дневно на 1,5 литра смесена течност (включително утайка) от съдовете за аериране на активираната утайка. При силно адсорбиращи експериментални материали от съдовете за утаяване се вземат 1,5 литра надстояща течност и се изливат в съда за активирана утайка на другия модул.
1.6.2.3. Анализ
За да се проследи поведението на веществото могат да се направят два вида анализи:
РОВ и ХПК
Определят се двукратно концентрациите на РОВ с анализатор за въглерод и/или стойностите на ХКП в съответствие с позоваване (2).
Специфичен анализ
Концентрациите на изпитваното вещество се определят посредством подходящ аналитичен метод. Когато е възможно, трябва да се провежда специфично определяне на веществото, абсорбирано в утайката.
2. ДАННИ И ОЦЕНКА
2.1. Режим на свързани модули
Когато се използва „режимът на свързани модули“, дневната степен на отнемане DR се изчислява в съответствие с 1.2.1.
Дневните степени на отнемане DR се коригират до DRc за трансфера на материал по време на процедурата по трансинокулация с уравнение [2] за тричасово или уравнение [3] за шестчасово средно време на задържане.
|
[2] |
|
|
[3] |
|
В допълнение към стандартното отклонение се изчислява средната стойност на серията стойности DRc в съответствие с уравнение [4]
|
[4] |
|
където:
|
SDRc |
= |
стандартното отклонение на серията стойности DRc, |
|
|
= |
средната стойност на DRc, |
|
n |
= |
броя на определянията. |
Стойностите, попадащи извън серията на стойностите DRc, се елиминират в съответствие с подходяща статистическа процедура, например Nalimov (6), при ниво на вероятност 95 % и се преизчисляват средната стойност и стандартното отклонение на серията данни за DRc без стойностите, попадащи извън нея.
Крайният резултат след това се изчислява по уравнение [5]
|
[5] |
|
където:
tn– 1;α= табличната стойност на t за n броя двойки E и EO и статистическа доверителност P (P = 1 - α), където P е на 95 % (1).
Резултатът се дава като средна стойност с граници на толеранс при ниво на вероятност 95 %, съответното стандартно отклонение и броят на данните от серията данни за стойностите DRc без стойностите, попадащи извън серията, и броя на стойностите, попадащи извън серията, например:
|
DRc |
= |
98,6 ± 2,3 % отнемане на РОВ, |
|
s |
= |
4,65 % отнемане на РОВ, |
|
n |
= |
18, |
|
x |
= |
брой на стойностите, попадащи извън серията. |
2.2. Режим на несвързани модули
Функционирането на модулите може да бъде проверено както следва:
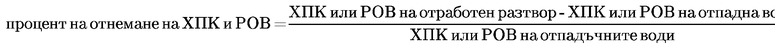
От тези ежедневни отнемания може да се построи графика, за да се проявят всички тенденции, например към аклиматизиране.
2.2.1. Използване на определянията на РОВ/ХПК
Ежедневната степен на отнемане DR се изчислява в съответствие с 1.2.1.
Изислява се средната стойност на серията стойности DRc. Допълнително се изчислява нейното стандартно отклонение в съответствие с:
|
[6] |
|
където:
|
SDR |
= |
стандартното отклонение на серията стойности DRi, |
|
|
= |
средната стойност на стойностите DRi, |
|
n |
= |
броя на определянията. |
Стойностите, попадащи извън серията на стойностите DR, се елиминират в съответствие с подходяща статистическа процедура, например Nalimov (6), при ниво на вероятност 95 % и се преизчисляват средната стойност и стандартното отклонение на серията данни за DR без стойностите, попадащи извън нея.
Крайният резултат след това се изчислява по уравнение [7]
|
[7] |
|
където:
|
tn – 1;α |
= |
таблична стойност на t за n броя двойки E и EО и статистическа доверителност P (P = 1 - α), където P е 95 % (1). |
Резултатът се дава като средна стойност с граници на толеранс при ниво на вероятност 95 %, съответното стандартно отклонение и броят на данните от серията данни за стойностите DR без стойностите, попадащи извън серията, и броя на стойностите, попадащи извън серията, например:
|
DR |
= |
(98,6 ± 2,3 %) отнемане на РОВ, |
|
s |
= |
4,65 % отнемане на РОВ, |
|
n |
= |
18, |
|
x |
= |
брой на стойностите, попадащи извън серията. |
2.2.2. Използване на специфичен анализ
Процентът на елиминиране на изпитваното вещество от водната фаза (RW) се изчислява в съответствие с 1.2.2.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. Протокол от изпитването
Ако е възможно, протоколът от изпитването съдържа следното:
|
— |
формуляра, посочен в допълнение 3, показващ функционалните условия за изпитването, |
|
— |
кой апарат е избран (потвърдително изпитване на ОИСР или „метална пореста решетка“), |
|
— |
кой функционален режим е избран: режим на свързани модули или не, |
|
— |
какви отпадъчни води: синтетични или битови. Ако са битови — датата и мястото на вземане на пробата, |
|
— |
каква проба за инокулиране, с дата и място на вземане на пробата, |
|
— |
описание на аналитичния метод, ако са провеждани специфични анализи, |
|
— |
графика на отнемането на ХПК или РОВ срещу времето, включително периодите на отмиване и оценка, |
|
— |
аналитичното възстановяване на изпитваното вещество като ХПК или РОВ в изходния разтвор, |
|
— |
ако се провеждат специфични анализи, да се построи графика на процентното отнемане на изпитваното вещество от водната фаза срещу времето (периоди на отмиване и оценка), |
|
— |
средното отнемане на РОВ или ХПК на изпитваното вещество и стандартното отклонение се изчисляват от резултатите за периода на оценка, т.е. когато е налице стабилно отнемане на изпитвания материал или за периода на стабилно функциониране, |
|
— |
да се построи графика на концентрацията на активираната утайка срещу времето, |
|
— |
всички забележки, отнасящи се до активираната утайка (изхвърляне на излишната утайка, наличие на натрупване, FeCl3, и т.н.), |
|
— |
концентрацията на веществото, използвано при изпитването, |
|
— |
всички резултати, отнасящи се до анализите, направени на утайката, |
|
— |
цялата информация и резултатите, отнасящи се до изпитваното вещество и веществото за сравнение, ако е използвано, |
|
— |
научните мотиви за всички изменения в процедурата. |
3.2. Интерпретиране на резултатите
Слабото отнемане на изпитваното вещество от водната фаза може да се дължи на потискане на микроорганизмите от изпитваното вещество. Това може да бъде доказано и чрез лизиране или загуба на утайка, водещо до помътняване на надстоящата течност, и чрез намаляване на ефективността на отнемането на ХПК (или РОВ) в пилотната станция.
Понякога роля може да играе физико-химичната адсорбция. Разликите между биологичното действие върху молекулата и физико-химичната адсорбция могат да бъдат доказани чрез анализ на утайката след адекватна десорбция.
Ако трябва да се разграничат биологичното разграждане (или частично разграждане) и адсорбцията, са необходими допълнителни изпитвания.
Това може да се направи по много начини, но най-убедително е използването на надстояща течност като проба за инокулиране в основно изпитване (за предпочитане респирометричен тест).
Ако се наблюдава голямо отнемане на РОВ или ХПК, тогава се касае за биологично разграждане, докато при слабо отнемане биологичното разграждане не може да се разграничи от елиминирането. Например ако едно разтворимо съединение показва висока константа на адсорбция от 98 % и степента на допълнителното изразходване на утайката е 10 % на ден, възможно е елиминиране до 40 %. При степен на допълнително изразходване на утайка от 30 % елиминирането поради адсорбция или отнемане с излишната утайка може да възлезе на 65 % (4).
Когато се използва специфичен анализ, трябва да се обръща внимание на връзката между структурата на веществото и използвания специфичен анализ. В този случай наблюдаваното явление не може да бъде интерпретирано като минерализиране на веществото.
4. ПОЗОВАВАНИЯ
(1) ОИСР, Париж, 1981, Test Guideline 303 A, Решение на Съвета C(81) 30 окончателен.
(2) Приложение V В.9 Разграждане: Химична потребност от кислород, Директива 84/449/ЕИО на Комисията, Официален вестник на Европейските общности, L 251, 19.9.1984 г.
(3) Painter, H. A., King, E. F., WRC Porous-Pot method for assessing biodegradability, Technical Report TR70, June 1978, Water Research Centre, United Kingdom.
(4) Wierich, P., Gerike, P., The fate of soluble, recalcitrant, and adsorbing compounds in activated sludge plants, Ecotoxicology and Environmental Safety, vol. 5, № 2, June 1981, стp. 161 дo 171.
(5) Директиви 82/242/ЕИО и 82/243/ЕИО на Съвета, Официален вестник на Европейските общности, L 109, 22.4.1982 г., за изменение на Директиви 73/404 (ЕИО) и 73/ 405 (ЕИО) на Съвета относно биологична разградимост на детергенти, Официален вестник на Европейските общности, L 347, 17.12.1973 г.
(6) Streuli, H., Fehlerhafte Interpretation und Anwendung von Ausreißertests, insbesondere bei Ringversuchen zur Überprüfung analytisch-chemischer Untersuchungsmethoden, Fresenius-Zeitschrift fur Analytische Chemie, 303 (1980), стp. 406 дo 408,
Допълнение 1
Фигура 1
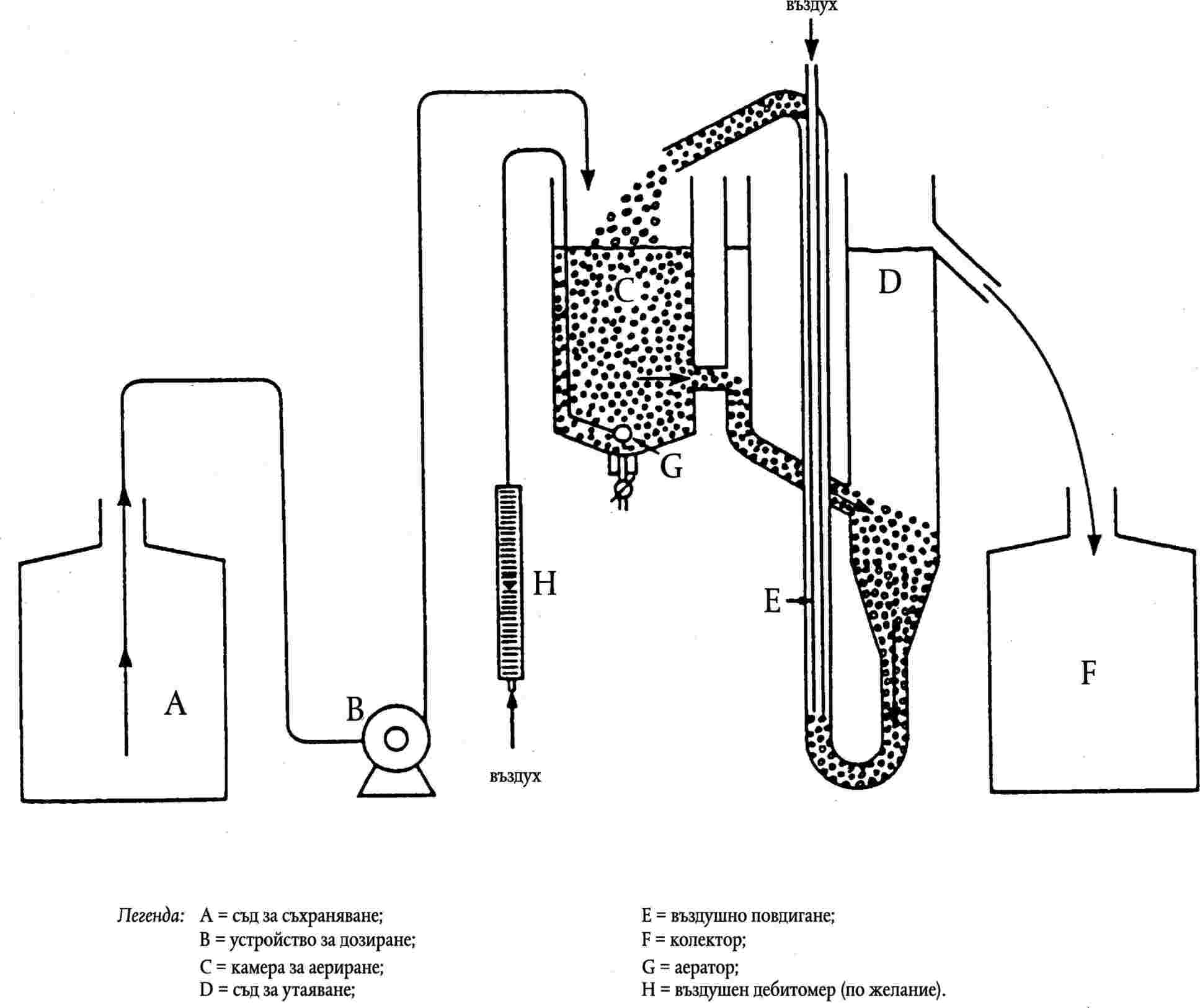
Фигура 2

Допълнение 2
Фигура 1
Оборудване, използвано за оценка на биологичната разградимост

Фигура 2
Подробности за трилитровия съд за аериране „метална пореста решетка“

Допълнение 3
Функционални условия за изпитването за симулиране на активирана утайка
Във всяка група да се провери
|
Апаратура |
|
|
Потвърдително изпитване на ОИСР |
|
|
Метална пореста решетка |
|
|
Режим на функциониране |
|
|
Единичен модул |
|
|
Свързани модули |
|
|
Несвързани модули |
|
|
Трансинокулиране |
|
|
Няма |
|
|
Активирана утайка |
|
|
Надстояща течност |
|
|
Средно време на задържане |
|
|
Три часа |
|
|
Шест часа |
|
|
Основно хранително вещество |
|
|
Битови отпадъчни води |
|
|
Синтетични отпадъчни води |
|
|
Проба за инокулиране |
|
|
Вторична изходяща течност |
|
|
Композит |
|
|
Активирана утайка |
|
|
Добавяне на изпитван материал |
|
|
От началото |
|
|
Стъпаловидно повишаване |
|
|
След образуването на утайка |
|
|
Анализ |
|
|
Специфичен |
|
|
ХПК |
|
|
РОВ |
|
БИОЛОГИЧНО РАЗГРАЖДАНЕ
ИЗПИТВАНЕ ЗА ПОТИСКАНЕ НА ДИШАНЕТО НА АКТИВИРАНА УТАЙКА
1. МЕТОД
1.1. Въведение
Описаният метод оценява ефекта на изпитваното вещество върху микроорганизмите посредством измерване на степента на дишане при дефинирани условия в присъствие на различни концентрации на изпитваното вещество.
Целта на този метод е да предостави бързо средство за пресяващо изпитване, което да позволи веществата, можещи да окажат нежелано влияние върху станциите за биологично пречистване с аеробни микроорганизми, да бъдат идентифицирани и да демонстрира подходящи непотискащи концентрации на изпитваните вещества, които да се използват при изпитванията за биологична разградимост.
Дефинитивното изпитване може да бъде предшествано от изпитване за определяне на диапазон. То дава информация за диапазона на концентрациите, които да се използват при основното изпитване.
В проекта за изпитването трябва да бъдат включени две контроли без изпитвано вещество, едната в началото и другата в края на експерименталната серия. Всяка партида активирана утайка трябва също да бъде проверена с помощта на вещество за сравнение.
Този метод най-лесно се използва с вещества, които поради своята разтворимост във вода и ниска летливост вероятно остават във водата.
За вещества с ограничена разтворимост в изпитваните среди може да не е възможно да се определи EC50.
Резултатите, базирани на постъпването на кислород, могат да доведат до погрешни изводи, когато изпитваното вещество притежава склонност да разединява окислителното фосфорилиране.
За провеждането на изпитването е полезно да е налице следната информация:
|
— |
разтворимост във вода, |
|
— |
парно налягане, |
|
— |
структурна формула, |
|
— |
чистота на изпитваното вещество. |
Препоръка
Активираната утайка може да съдържа потенциално патогенни организми и с нея трябва да се работи внимателно.
1.2. Определения и единици
Степента на дишане представлява кислородната консумация на микроорганизмите в аеробната утайка на отпадъчните води, изразена обичайно в мг O2 за мг утайка за час.
За да се изчисли потискащият ефект на дадено изпитвано вещество при конкретна концентрация, степента на дишане се изразява като процент от средната стойност на двете контролни степени на дишане:

където:
|
Rs |
= |
степента на кислородна консумация при изпитваната концентрация на веществото, |
|
Rc1 |
= |
степента на кислородна консумация на контрола 1, |
|
Rc2 |
= |
степента на кислородна консумация на контрола 2. |
EC50 при този метод представлява концентрацията на изпитваното вещество, при която дихателната степен е 50 % от тази, която е демонстрирана от контролата при условията, описани за този метод.
1.3. Вещества за сравнение
Препоръчва се като вещество за сравнение да се използва 3,5-дихлорофенол, който е познат инхибитор на дишането, и да се изпитва за EC50 при всяка партида активирана утайка като средство за проверка дали чувствителността на утайката не е абнормна.
1.4. Принцип на метода за изпитване
Дихателната степен на активираната утайка, захранена със стандартно количество синтетични отпадъчни води, се измерва след време на експозиция 30 минути или три часа или и двете. Измерва се също и дихателната степен на същата активирана утайка в присъствие на различни концентрации на изпитваното вещество при иначе идентични условия. Потискащият ефект на изпитваното вещество при конкретна концентрация се изразява като процент от средните дихателни степени на двете контроли. Стойността EC50 се изчислява от измерванията при различни концентрации.
1.5. Критерии за качество
Резултатите от изпитването са валидни, ако:
|
— |
дихателните степени на двете контроли не се различават помежду си с повече от 15 %, |
|
— |
стойността EC50 (30 минути и/или три часа) за 3,5-дихлорофенол е в рамките на приетия диапазон 5 до 30 мг/л. |
1.6. Описание на метода за изпитване
1.6.1. Реактиви
1.6.1.1. Разтвори на изпитваното вещество
Разтворите на изпитваното вещество са прясно приготвени в началото на изпитването, като се използва изходен разтвор. Подходящ е изходен разтвор с концентрация 0,5 г/л, ако се спазва препоръчаната по-долу процедура.
1.6.1.2. Разтвор на контролно вещество
Например разтвор на 3,5-дихлорофенол може да бъде приготвен чрез разтваряне на 0,5 г 3,5-дихлорофенол в 10 мл 1МNaOH, като се разрежда до приблизително 30 мл с дестилирана вода, след това се добавя 0,5MH2SO4 и едновременно с това се разбърква до започване на преципитация — необходими са приблизително 8 мл 0,5MH2SO4 — и накрая сместа се разрежда до един литър с дестилирана вода. pH трябва да бъде в диапазона от 7 до 8.
1.6.1.3. Синтетични отпадъчни води
Захранване със синтетични отпадъчни води се прави чрез разтваряне на следните количества вещества в един литър вода:
|
— |
16 г. пептон, |
|
— |
11 г. месен екстракт, |
|
— |
3 г урея, |
|
— |
0,7 г NaCl, |
|
— |
0,4 г CaCl2.2H2O, |
|
— |
0,2 г MgSO4.7H2O, |
|
— |
2,8 г K2HPO4. |
Забележка 1: Синтетичната отпадъчна вода представлява 100-кратен концентрат на този, който е посочен в Техническия доклад на ОИСР от 11 юни 1976 г.„Предложение за метод за определяне на биологичната разградимост на сърфактанти, използвани в синтетичните детергенти“, с добавка на дикалиев хидроген фосфат.
Забележка 2: Ако приготвената среда не се използва веднага, тя се съхранява на тъмно при температура от 0 до 4 °C за не по-дълго от една седмица при условия, които не водят до никаква промяна в нейния състав. Преди съхранението средата може да бъде и стерилизирана или пептонът и месният екстракт да бъдат добавени малко преди провеждането на изпитването. Преди употреба тя трябва да бъде щателно смесена и pH да бъде коригирано.
1.6.2. Апаратура
Апаратура за измерване: точното проектиране не е от голямо значение. Трябва обаче да има пространство между капака на съда и водното ниво и сондата трябва да се поставя плътно в шийката на измервателната колба.
Необходимо е обичайно лабораторно оборудване и по-конкретно следното:
|
— |
апаратура за измерване, |
|
— |
устройство за аериране, |
|
— |
pH-електрод и устройство за измерване на pH, |
|
— |
O2-електрод. |
1.6.3. Приготвяне на проба за инокулиране
Като микробна проба за инокулиране за изпитването се използва активирана утайка от пречиствателна станция, третираща главно битови отпадъчни води.
Ако е необходимо, при връщане в лабораторията едрите частици могат да бъдат отстранени чрез краткотрайно утаяване, например за 15 минути, и отливане на горния слой по-фини твърди частици, който ще се използва. Като алтернативно решение, утайката може да бъде смесена с помощта на миксер за няколко секунди.
Ако се смята, че съществува потискащ материал, утайката допълнително трябва да бъде измита с чешмяна вода или изотоничен разтвор. След центрофугиране надстоящата течност се отлива (тази процедура се повтаря три пъти).
Малко количество утайка се претегля и се изсушава. От този резултат може да се изчисли количеството на влажната утайка, която трябва да бъде суспендирана във водата, за да се получи активирана утайка със суспендирани в смесената течност твърди частици в рамките на диапазона между 2 и 4 г/л. Това ниво дава концентрация в експерименталната среда между 0,8 и 1,6 г/л, ако се спазва процедурата, препоръчана по-долу.
Ако утайката не може да се използва в деня на вземането, към всеки литър активирана утайка, приготвена както е посочено по-горе, се добавят по 50 мл синтетична отпадъчна вода. След това тя се аерира една цяла нощ при температура 20 ± 2 °C. След това се аерира, за използване през деня. Ако е необходимо, преди използване pH се проверява и коригира на pH от 6 до 8. Суспендираните твърди частици в смесената течност трябва да бъдат определени както е описано в предишния абзац.
Ако през следващи дни трябва да се използва същата партида активирана утайка (максимум четири дни), в края на всеки работен ден се добавят допълнително по 50 мл синтетични отпадъчни води на литър утайка.
1.6.4. Провеждане на изпитването
|
Продължителност/време на експозиция: |
30 минути и/или три часа, по време на които се провежда аериране |
|
Вода: |
Питейна вода (ако е необходимо, дехлорирана) |
|
Снабдяване с въздух: |
Чист, обезмаслен въздух. Въздушен дебит 0,5 до 1 литър/минута |
|
Апаратура за измерване: |
Колба с плоско дъно, например колба за определяне на БПК (биологична потребност от кислород) |
|
O2-метър: |
Подходящ кислороден електрод със записващо устройство |
|
Хранителен разтвор: |
Синтетични отпадъчни води (виж по-горе) |
|
Изпитвано вещество: |
Експерименталният разтвор е прясно приготвен в началото на изпитването. |
|
Вещество за сравнение: |
Например 3,5-дихлорофенол (най-малко три концентрации) |
|
Контроли: |
Инокулирана проба без изпитвано вещество |
|
Температура: |
20 ± 2 °C. |
По-долу е дадено предложение за експериментална процедура, която може да бъде следвана както за изпитваното, така и за веществото за сравнение по време на тричасовия период на експозиция:
Използват се няколко съда (например няколко еднолитрови мерителни чаши).
Трябва да се използват най-малко пет концентрации, различаващи се помежду си с постоянен фактор, за предпочитане непревишаващ 3,2.
Във времето „0“ 16 мл синтетична отпадъчна вода се допълват с вода до 300 мл. Добавят се 200 мл микробна проба за инокулиране и цялата смес (500 мл) се излива в първия съд (първа контрола C1).
Експерименталните съдове трябва да се аерират непрекъснато така, че разтвореният O2 да не спада под 2,5 мг/л и непосредствено преди измерването на дихателната степен концентрацията на O2 да бъде около 6,5 мг/л.
Във времето „15 минути“ (15 минути е произволен, но удобен, интервал) горната процедура се повтаря, с изключение на това, че 100 мл от изходния разтвор на изпитваното вещество се добавят към 16 мл синтетична отпадъчна вода преди добавяне на вода до 300 мл и микробната проба за инокулиране така, че да се получи обем от 500 мл. Тази смес после се излива във втори съд и се аерира както по-горе. Този процес се повтаря през 15-минутни интервали с различни обеми от изходния разтвор на изпитваното вещество, за да се получи серия от съдове, съдържащи различни концентрации от изпитваното вещество. Накрая се приготвя втора контрола (C2).
След три часа се регистрира pH и добре размесена проба от съдържанието на първия съд се излива в апаратурата за измерване и се измерва дихателната степен за период с продължителност до 10 минути.
Това определяне се повтаря със съдържанието на всеки съд на 15-минутни интервали по такъв начин, че времето на експозиция за всеки съд да е три часа.
Веществото за сравнение се изпитва за всяка партида микробни проби за инокулиране по същия начин.
Когато измерванията се правят след 30-минутна експозиция, е необходим различен режим (т.е. повече от един O2-метър).
Ако е необходимо измерване на химичната консумация на кислород, се добавят допълнителни съдове, съдържащи изпитваното вещество, синтетични отпадъчни води и вода, но не и активирана утайка. Кислородната консумация се измерва и се регистрира след аериране в продължение на 30 минути и/или три часа (време на експозиция).
2. ДАННИ И ОЦЕНКА
Дихателната степен се изчислява от записа между приблизително 6,5 мг O2/л и 2,5 мг O2/л или за 10-минутен период, когато дихателната степен е ниска. Частта на дихателната крива върху която се измерва дихателната степен, трябва да бъде линейна.
Ако дихателните степени на двете контроли не се различават с повече от 15 % една от друга или ако EC50 (30 минути и/или три часа) на веществото за сравнение не е в приетия диапазон (5 до 30 мг/л за 3,5-дихлорофенол), изпитването е невалидно и трябва да бъде повторено.
Процентът на потискане се изчислява за всяка изпитвана концентрация (виж 1.2). Построява се крива на процента на потискане срещу концентрацията на нормална логаритмична хартия (или логаритъма на вероятността) и се извежда стойността на EC50.
Като се използват стандартни процедури, могат да се определят граници на доверителност до 95 % за стойностите на EC50.
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. Протокол от изпитването
Ако е възможно, протоколът от изпитването съдържа следното:
|
— |
изпитвано вещество: данни за химическо идентифициране, |
|
— |
експериментална система: източник, концентрация и всяко предварително третиране на активираната утайка, |
|
— |
условия на изпитване:
|
|
— |
резултати:
|
3.2. Тълкуване на данните
Стойността EC50 трябва да се възприема просто като едно ръководство за вероятната токсичност на изпитваното вещество при пречистване на активирана отпадъчна утайка или за микроорганизмите в отпадъчните води, тъй като сложните взаимодействия, възникващи в околната среда, не могат да бъдат точно симулирани при лабораторно изпитване. Освен това при изпитваните вещества, които могат да имат потискащ ефект върху окислението на амония, също могат да се получат атипични криви на потискане. Следователно такива криви трябва да бъдат интерпретирани внимателно.
4. ПОЗОВАВАНИЯ
(1) Международен стандарт ISO 8192-1986.
(2) Broecker, B., Zahn, R., Water Research 11, 1977, стp. 165.
(3) Brown, D., Hitz, H. R., Schaefer, L., Chemosphere 10, 1981, стp. 245.
(4) ETAD (Ecological and Toxicological Association of Dyestuffs Manufacturing Industries), Recommended Method № 103, also described by:
(5) Robra, B., Wasser/Abwasser 117, 1976, стp. 80.
(6) Schefer, W., Textilveredlung 6, 1977, стp. 247.
(7) ОИСР, Париж, 1981, Test Guideline 209, Решение на Съвета C(81) 30 окончaтелен.
БИОЛОГИЧНО РАЗГРАЖДАНЕ
МОДИФИЦИРАНО SCAS ИЗПИТВАНЕ
1. МЕТОД
1.1. Въведение
Целта на метода е да оцени потенциалната крайна биологична разградимост на разтворими във вода нелетливи органични вещества, когато са подложени на експозиция на относително високи концентрации на микроорганизми за продължителен период от време. През този период жизнеспособността на микроорганизмите се поддържа чрез ежедневно подхранване с утаени отпадъчни води. (През почивните дни отпадъчните води могат да бъдат съхранявани при температура 4 °C. Може също така да се използват синтетичните отпадъчни води от потвърдителното изпитване на ОИСР).
Възможно е да настъпи физико-химична адсорбция на суспендираните твърди вещества и това трябва да се вземе предвид при интерпретирането на резултатите (виж 3.2).
Поради дългия период на задържане на течната фаза (36 часа) и периодичното добавяне на хранителни вещества изпитването не симулира условията, възникващи в пречиствателната станция за отпадъчни води. Резултатите, получени с различни изпитвани вещества, показват, че методът притежава висок потенциал за биологично разграждане.
Условията на изпитването са много благоприятни за селекция и/или адаптиране на микроорганизми, които са способни да разграждат изпитваното съединение. (Процедурата може да се използва и за получаване на аклиматизирани проби за инокулиране за използване при други изпитвания.)
При този метод концентрацията на разтворения органичен въглерод се използва за оценяване на крайната биологична разградимост на изпитваните вещества. Предпочита се РОВ да се определя след подкиселяване и продухване, а не като разликата Cобщ — Cнеорганичен.
Едновременното използване на специфичен аналитичен метод може да даде възможност за оценка на първичното биологично разграждане на веществото (изчезването на родителската химична структура).
Методът е приложим само за тези изпитвани органични вещества, които в използваната за изпитването концентрация:
|
— |
са разтворими във вода (най-малко 20 мг разтворен органичен въглерод/литър), |
|
— |
имат пренебрежимо ниско парно налягане, |
|
— |
не потискат развитието на бактериите, |
|
— |
не се абсорбират в значителна степен в експерименталната система, |
|
— |
не се губят при образуване на пяна в изпитвания разтвор. |
Трябва да се определи съдържанието на органичен въглерод в изпитвания материал.
Информацията за относителните пропорции на основните компоненти на изпитвания материал ще бъдат полезни за интерпретиране на получените резултати, по-конкретно в случаите, когато резултатите са ниски или гранични.
Информацията за токсичността на веществото за микроорганизмите може да бъде полезна за интерпретиране на ниски резултати и за избор на подходяща експериментална концентрация.
1.2. Определения и единици
|
CT |
= |
концентрацията на изпитваното вещество като органичен въглерод, намиращ се или добавян към утаена отпадъчна вода в началото на аерирането (мг/л), |
|
Ct |
= |
концентрацията на разтворения органичен въглерод, намиращ се в надстоящата течност от изпитването в края на аерирането (мг/л), |
|
Cc |
= |
концентрацията на разтворения органичен въглерод, намиращ се в надстоящата течност от контролата в края на аерирането (мг/л). |
При този метод биологичното разграждане се определя като изчезване на органичния въглерод. Биологичното разграждане може да бъде изразено като:
|
1. |
Процент на отнемане Dda на количеството ежедневно добавяно вещество:
където Dda = разграждане/ежедневно добавяне |
|
2. |
Процентното отнемане Dssd на количеството вещество, в наличност в началото на всеки ден:
където Dssd = разграждане/вещество в началото на деня; индексите i и (i + 1) се отнасят до деня на измерването. Уравнението 2(a) се препоръчва, ако РОВ в изходящата течност варира от ден на ден, докато уравнение 2(б) може да се използва, когато РОВ в изходящата течност остава относително постоянен от ден на ден. |
1.3. Вещества за сравнение
В някои случаи, при изследване на нови вещества, може да са полезни вещества за сравнение. Все още обаче не могат да бъдат препоръчани конкретни вещества за сравнение.
Представени са данните за няколко съединения, оценени с кръгови тестове (виж допълнение 1), главно за да може да се провежда периодично калибриране на метода и да позволи сравняване на резултатите, когато се използва друг метод.
1.4. Принцип на метода за изпитване
Активираната утайка от станцията за пречистване на отпадъчни води се поставя в модул за полунепрекъснато изпитване с активирана утайка (SCAS). Добавят се изпитваното съединение и утаената битова отпадъчна вода и сместа се аерира в продължение на 23 часа. След това аерирането се прекратява, утайката се оставя да се утаи и надстоящата течност се отстранява.
След това утайката, оставаща в камерата за аериране, се смесва с допълнителна порция изпитвано съединение и отпадъчна вода и цикълът се повтаря.
Биологичното разграждане се установява посредством определяне съдържанието на разтворения органичен въглерод в настоящата течност. Тази стойност се сравнява със стойността, определена за течността, която е получена от контролна епруветка, дозирана само с утаена отпадъчна вода.
Когато се използва специфичен аналитичен метод, могат да се измерят промените в концентрацията на родителската молекула поради биологично разграждане (първична биологична разградимост).
1.5. Критерии за качество
Все още не е установена възпроизводимостта на този метод въз основа на отнемането на разтворения органичен въглерод. (Когато се взема предвид първичното биологично разграждане, се получават много точни данни за материали, които се разграждат във висока степен.)
Чувствителността на метода до голяма степен се определя от вариабилността на празната проба и в по-малка степен от точността на определянето на разтворения органичен въглерод и от нивото на изпитваното съединение в течността в началото на всеки цикъл.
1.6. Описание на експерименталната процедура
1.6.1. Подготовка
Могат да се използват достатъчен брой чисти модули за аериране (може да се използва и оригиналният модул за SCAS изпитване от 1,5 литра), като се поставят тръбички за аериране (фигура 1) за всяко изпитвано вещество и контролите. Сгъстеният въздух, захранващ експерименталните модули, е пречистен през филтър от памучна вата и не трябва да съдържа органичен въглерод, както и трябва да бъде предварително наситен с вода за намаляване на загубите от изпарение.
От активирана утайка от станция за пречистване главно на битови отпадъчни води се получава проба смесена течност, съдържаща от 1 до 4 г/л суспендирани твърди вещества. За всека модул за аериране са необходими приблизително 150 мл смесена течност.
Изходните разтвори на изпитваното вещество се приготвят с дестилирана вода. Нормално необходимата концентрация е 400 мг/л органичен въглерод, което прави концентрация на органичен въглерод от 20 мг/л въглерод за изпитваното съединение в началото на всеки цикъл на аериране, ако не настъпва биологично разграждане.
Ако токсичността за микроорганизмите разрешава, могат да се използват и по-високи концентрации.
Измерва се съдържанието на органичен въглерод в изходните разтвори.
1.6.2. Условия на изпитване
Изпитването трябва да се провежда при температура от 20 до 25 °C.
Използва се по-висока концентрация на аеробни микроорганизми (от 1 до 4 г/л суспендирани твърди вещества) и ефективният период на задържане е 36 часа. Съдържащият въглерод материал в захранващите отпадъчни води се окислява екстензивно, нормално в рамките на осем часа след началото на всеки цикъл на аериране. Впоследствие утайката има само ендогенно дишане през остатъка от аерирането, като през това време единственият съществуващ субстрат е изпитваното съединение, освен ако то също не се метаболизира лесно. Тези характеристики, комбинирани с ежедневно повторно инокулиране с използване на битови отпадъчни води като среда, създава много благоприятни условия както за аклиматизиране, така и за високи степени на биологично разграждане.
1.6.3. Провеждане на изпитването
Получава се проба смесена течност от подходяща станция за предимно битова активирана утайка или от лабораторен модул, като тя се съхранява при аеробни условия докато се използва в лабораторията. Всеки модул за аериране, а също и всеки контролен модул се напълват със 150 мл смесена течност (ако се използва оригиналният модул за SCAS изпитване, дадените обеми трябва да се умножат по 10) и се започва аериране. След 23 часа аерирането се спира и утайката се оставя да се утаи за 45 минути. Кранът на всеки съд се отваря и се изтеглят 100 мл порции от надстоящата течност. Непосредствено преди използването се получава проба от утаена битова отпадъчна вода и към утайката, оставаща във всяка модул за аериране, се добавят по 100 мл от нея. Аерирането се подновява. На този етап не се добавят материали за изпитване и модулите се захранват ежедневно с битова отпадъчна вода, само докато при утаяването се получи бистра надстояща течност. Това обикновено отнема две седмици, до което време разтвореният органичен въглерод в надстоящата течност в края на всеки цикъл на аериране достига постоянна стойност.
В края на този период индивидуалните утаени утайки се смесват и към всеки модул се добавят по 50 мл от получената смесена утайка.
Към контролните модули се добавят по 95 мл от утаената отпадъчна вода и 5 мл вода, a към експерименталните модули се добавят 95 мл от утаената отпадъчна вода плюс 5 мл от изходния разтвор на съответното изпитвано съединение (400 мг/л). Аерирането започва отново и продължава 23 часа. След това утайката се оставя да се утаи в продължение на 45 минути, изтегля се надстояща течност и се анализира за съдържание на разтворен органичен въглерод.
Горната процедура на напълване и изтегляне се повтаря ежедневно по време на цялото изпитване.
Преди утаяването може да се наложи почистване на стените на модулите за предотвратяване акумулирането на твърди вещества над нивото на течността. За всеки модул се използват отделна стъргалка и четка за предотвратяване на кръстосано замърсяване.
В идеалния случай разтвореният органичен въглерод в надстоящата течност се определя ежедневно, въпреки че е разрешено и по-рядко анализиране. Преди анализите течността се филтрира през промити мембранни филтри с размер на порите 0,45 мкм или се центрофугира. Мембранните филтри са подходящи, ако е сигурно, че те нито освобождават въглерод, нито абсорбират веществото по време на филтрирането. Докато се намира в центрофугата, температурата на пробата не трябва да надвишава 40 °C.
Продължителността на изпитването за съединения, демонстриращи слабо или липсващо биологично разграждане, е неопределена, но въз основа на опита може да се предположи, че тя трябва да бъде обикновено не по-малка от 12 седмици, но не по-голяма от 26 седмици.
2. ДАННИ И ОЦЕНКА
От стойностите на разтворения органичен въглерод в надстоящата течност от експерименталните и контролните модули се построява графика срещу времето.
При постигане на биологично разграждане нивото, достигнато при изпитването, се доближава до нивото, достигнато при контролите. След като се установи, че разликата между двете нива е постоянна в продължение на три последователни измервания, се правят такъв брой допълнителни измервания, че да бъдат достатъчни за статистическа обработка на данните и се изчислява процентът на биологично разграждане на изпитваното съединение (Dda или Dssd, виж 1.2).
3. ОТЧИТАНЕ НА РЕЗУЛТАТИТЕ
3.1. Протокол от изпитването
Ако е възможно, протоколът от изпитването съдържа следното:
|
— |
цялата информация за типа отпадъчна вода, типа използвани модули и експерименталните резултати, отнасящи се до изпитваното вещество, веществото за сравнение, ако се използва, и празната проба, |
|
— |
температурата, |
|
— |
кривата на отнемане с описание, начинът на изчисляване (виж 1.2), |
|
— |
датата и мястото на вземане на проби от активирана утайка и отпадъчни води, състоянието на адаптиране, концентрация и т.н., |
|
— |
научните мотиви за всички изменения в експерименталната процедура, |
|
— |
подпис и дата. |
3.2. Интерпретиране на резултатите
Тъй като веществото, което се изпитва по този метод, няма да подлежи на лесно биологично разграждане, отстраняването на РОВ, дължащо се единствено на биологично разграждане, нормално ще бъде постепенно в продължение на дни или седмици, освен в случаи, когато аклиматизирането е внезапно, както се вижда от рязкото изчезване, възникващо след няколко седмици.
Физико-химичната адсорбция обаче понякога може да играе важна роля. Това се вижда, когато е налице пълно или частично отнемане на добавения в началото РОВ. Какво ще се случи впоследствие зависи от фактори като степента на адсорбция и концентрацията на суспендираните твърди вещества в изхвърлената изходяща течност. Обикновено разликата между концентрациите на РОВ в контролата и експерименталните надстоящи течности постепенно нараства в сравнение с първоначалната ниска стойност и, освен ако не настъпи аклиматизиране, тази разлика после остава при новата стойност за останалата част от експеримента.
Ако трябва да се разграничи биологичното разграждане (или частично разграждане) от адсорбцията, са необходими допълнителни изпитвания. Това може да се направи по много начини, но най-убедително е използването на надстоящата течност или утайката като проба за инокулиране в основно изпитване (за предпочитане респирометричен тест).
Изпитваните вещества с високо неадсорбционно отнемане на РОВ при това изпитване трябва да се приемат за потенциално биологично разградими. Частичното неадсорбционно отнемане показва, че химическото вещество е подложено на най-малко частично биологично разграждане.
Ниското или близкото до нула отнемане на РОВ може да се дължи на потискане на микроорганизмите от изпитваното вещество и това може да се докаже и чрез лизиране или загуба на утайка, водещо до образуване на мътна надстояща течност. Изпитването трябва да бъде повторено, като се използва по-ниска концентрация на изпитваното вещество.
Използването на специфичен аналитичен метод или маркирано с 14C изпитвано вещество могат да дадат възможност за по-голяма чувствителност. При маркирано с 14C изпитвано съединение възстановяването на 14CO2 ще потвърди, че е настъпило биологично разграждане.
Когато резултатите са дадени и за първичното биологично разграждане, ако е възможно, трябва да бъде дадено обяснение за изменението в химичната структура, която води до загуба на отговор при родителското изпитвано вещество.
Потвърждаването на аналитичния метод трябва да бъде представено заедно с отговора, получен при празната експериментална среда.
4. ПОЗОВАВАНИЯ
(1) ОИСР, Париж, 1981, Test Guideline 302 A, Решение на Съвета C(81) 30 окончaтелен.
Допълнение 1
SCAS изпитване: примерни резултати
|
Вещество |
CT (мг/л) |
Ct – Cc (мг/л) |
Процент на биологично разграждане Dda |
Продължителност на изпитването, (дни) |
|
4-ацетрил-аминобензен сулфонат |
17,2 |
2,0 |
85 |
40 |
|
Тетра-пропилен бензен сулфонат |
17,3 |
8,4 |
51,4 |
40 |
|
4-нитрофенол |
16,9 |
0,8 |
95,3 |
40 |
|
Диетилен гликол |
16,5 |
0,2 |
98,8 |
40 |
|
Анилин |
16,9 |
1,7 |
95,9 |
40 |
|
Циклопентан тетра карбоксилат |
17,9 |
3,2 |
81,1 |
120 |
Допълнение 2
Примерна експериментална апаратура
Фигура 1

(1) Изпитването за специфичен локус при мишки (което не е описано в настоящия документ) може да се използва за измерване на мутациите в зародишните клетки в първото поколение след експозиция на мутагенно вещество. Могат да се открият и определят количествено генетични изменения, които водят до изменения в генните продукти, предизвикващи видими фенотипни характеристики.
(2) Сега известна като серумна аланин аминотрансфераза.
(3) Сега известна като серумна аспартат аминотрансфераза.
(4) Тези органи, от десет животни от пол за група за гризачи и всички животни от видове, различни от гризачи, плюс щитовидна жлеза (с паращитовидни жлези) за всички видове, различни от гризачи, трябва да бъдат претеглени.
(5) Тези органи, от 10 животни от пол за група за гризачите, трябва да бъдат претеглени.
(6) При този метод група за сравнение е такава група, в която изпитваното вещество се прилага по друг начин, обезпечаващ пълна биологична наличност на дозата.
(7) Предишно HGPRT.
(8) Средни стойности от трикратно отчитане.