EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 32011D0214
2011/214/EU: Commission Decision of 1 April 2011 amending Annexes II to IV to Council Directive 2009/158/EC on animal health conditions governing intra-Community trade in, and imports from third countries of, poultry and hatching eggs (notified under document C(2011) 2068) Text with EEA relevance
2011/214/UE: Décision de la Commission du 1 er avril 2011 modifiant les annexes II à IV de la directive 2009/158/CE du Conseil relative aux conditions de police sanitaire régissant les échanges intracommunautaires et les importations en provenance des pays tiers de volailles et d’œufs à couver [notifiée sous le numéro C(2011) 2068] Texte présentant de l'intérêt pour l'EEE
2011/214/UE: Décision de la Commission du 1 er avril 2011 modifiant les annexes II à IV de la directive 2009/158/CE du Conseil relative aux conditions de police sanitaire régissant les échanges intracommunautaires et les importations en provenance des pays tiers de volailles et d’œufs à couver [notifiée sous le numéro C(2011) 2068] Texte présentant de l'intérêt pour l'EEE
OJ L 90, 6.4.2011, p. 27–49
(BG, ES, CS, DA, DE, ET, EL, EN, FR, IT, LV, LT, HU, MT, NL, PL, PT, RO, SK, SL, FI, SV)
Special edition in Croatian: Chapter 03 Volume 020 P. 288 - 310
 No longer in force, Date of end of validity: 20/04/2021; abrog. implic. par 32016R0429
No longer in force, Date of end of validity: 20/04/2021; abrog. implic. par 32016R0429
- Date of document:
- 01/04/2011
- Date of effect:
- 04/04/2011; prise d'effet date de notification
- Date of notification:
- 04/04/2011
- Date of end of validity:
- 20/04/2021; abrog. implic. par 32016R0429
- Author:
- Commission européenne
- Form:
- Décision
- Addressee:
- Les vingt-sept États membres: Belgique, Bulgarie, République tchèque, Danemark, Allemagne, Estonie, Irlande, Grèce, Espagne, France, Italie, Chypre, Lettonie, Lituanie, Luxembourg, Hongrie, Malte, Pays-Bas, Autriche, Pologne, Portugal, Roumanie, Slovénie, Slovaquie, Finlande, Suède, Royaume-Uni
- Additional information:
- intérêt pour l'EEE
- Treaty:
- Traité sur le fonctionnement de l’Union européenne
- Legal basis:
-
- 32009L0158 - A34
- Link
- Link
- Link
- Select all documents mentioning this document No data available in the table
- Modifies:
-
Relation Act Comment Subdivision concerned From To Modifies 32009L0158 modification annexe II Modifies 32009L0158 modification annexe III Modifies 32009L0158 modification annexe IV
No data available in the table
- Modified by:
-
Relation Act Comment Subdivision concerned From To Corrected by 32011D0214R(01) (HU) Implicitly repealed by 32016R0429 21/04/2021 - Instruments cited:
- Link
- EUROVOC descriptor:
- Subject matter:
- Directory code:
|
6.4.2011 |
FR |
Journal officiel de l'Union européenne |
L 90/27 |
DÉCISION DE LA COMMISSION
du 1er avril 2011
modifiant les annexes II à IV de la directive 2009/158/CE du Conseil relative aux conditions de police sanitaire régissant les échanges intracommunautaires et les importations en provenance des pays tiers de volailles et d’œufs à couver
[notifiée sous le numéro C(2011) 2068]
(Texte présentant de l'intérêt pour l'EEE)
(2011/214/UE)
LA COMMISSION EUROPÉENNE,
vu le traité sur le fonctionnement de l’Union européenne,
vu la directive 2009/158/CE du Conseil du 30 novembre 2009 relative aux conditions de police sanitaire régissant les échanges intracommunautaires et les importations en provenance des pays tiers de volailles et d’œufs à couver (1), et notamment son article 34,
considérant ce qui suit:
|
(1) |
La directive 2009/158/CE fixe les conditions de police sanitaire régissant les échanges dans l’Union et les importations en provenance des pays tiers de volailles et d’œufs à couver. Son annexe II établit les règles applicables à l’agrément des établissements aux fins de tels échanges. Les chapitres II, III et IV de cette annexe spécifient, respectivement, les conditions applicables aux installations et au fonctionnement des établissements, les programmes de contrôle sanitaire des maladies et les critères de suspension ou de retrait de l’agrément d’un établissement, qui prévoient notamment le dépistage obligatoire de certains micro-organismes (Salmonella et Mycoplasma) dans les établissements agréés pour les échanges dans l’Union. |
|
(2) |
L’expérience acquise dans l’application des conditions relatives aux installations et au fonctionnement des établissements, qui sont définies au chapitre II de l’annexe II de la directive 2009/158/CE, montre qu’il convient d’adapter celles-ci aux pratiques des entreprises, notamment pour ce qui est du comportement des différentes espèces de volaille en matière de ponte. |
|
(3) |
En outre, il y a lieu de modifier les chapitres III et IV de l’annexe II de la directive 2009/158/CE pour tenir compte des progrès scientifiques en matière de techniques de diagnostic pour Mycoplasma, conformément au chapitre 2.3.5. du manuel des tests de diagnostic et des vaccins pour les animaux terrestres de l’Organisation mondiale de la santé animale (OIE), ainsi que de la modification de la nomenclature de Salmonella suivant le schéma White-Kauffmann-Le Minor des formules antigéniques des sérovars de Salmonella, en 2007, par le Centre collaborateur OMS de référence et de recherche sur les Salmonella et conformément au chapitre 2.3.11 du manuel susmentionné. |
|
(4) |
L’annexe III de la directive 2009/158/CE fixe les conditions relatives aux vaccinations de volailles. Il convient de la modifier afin d’y inclure des conditions spécifiques pour la vaccination contre Salmonella. |
|
(5) |
Il est également nécessaire de modifier certaines références concernant la vaccination contre l’influenza aviaire dans les modèles de certificats sanitaires établis à l’annexe IV de la directive 2009/158/CE. |
|
(6) |
Le règlement (CE) no 2160/2003 du Parlement européen et du Conseil du 17 novembre 2003 sur le contrôle des salmonelles et d’autres agents zoonotiques spécifiques présents dans la chaîne alimentaire (2) établit des règles visant à garantir que des mesures adaptées et efficaces sont prises pour détecter les salmonelles et d’autres agents zoonotiques, et pour lutter contre ces agents. Il dispose que les cheptels de volailles et les troupeaux d’origine de certaines espèces recensées à l’annexe I sont soumis à des tests de recherche de zoonoses et agents zoonotiques spécifiques avant toute expédition d’animaux vivants ou d’œufs à couver à partir de l’entreprise agroalimentaire d’origine. La date et le résultat des tests sont indiqués dans les certificats sanitaires concernés prévus par la législation de l’Union, notamment la directive 2009/158/CE. |
|
(7) |
L’annexe IV de la directive 2009/158/CE établit des modèles de certificats sanitaires pour les échanges dans l’Union de volailles et d’œufs à couver. |
|
(8) |
Le règlement (CE) no 584/2008 de la Commission du 20 juin 2008 portant application du règlement (CE) no 2160/2003 du Parlement européen et du Conseil en ce qui concerne la fixation d’un objectif communautaire de réduction de la prévalence de Salmonella enteritidis et Salmonella typhimurium chez les dindes (3) dispose que les exigences applicables en matière de test s’appliquent également aux cheptels de dindes à compter du 1er janvier 2010; il convient donc d’adapter en conséquence les certificats vétérinaires correspondants établis à l’annexe IV de la directive 2009/158/CE. |
|
(9) |
Il y a donc lieu de modifier en conséquence les annexes II, III et IV de la directive 2009/158/CE. |
|
(10) |
Les mesures prévues à la présente décision sont conformes à l’avis du comité permanent de la chaîne alimentaire et de la santé animale, |
A ADOPTÉ LA PRÉSENTE DÉCISION:
Article premier
Les annexes II, III et IV de la directive 2009/158/CE sont modifiées conformément à l’annexe de la présente décision.
Article 2
Les États membres sont destinataires de la présente décision.
Fait à Bruxelles, le 1er avril 2011.
Par la Commission
John DALLI
Membre de la Commission
(1) JO L 343 du 22.12.2009, p. 74.
(2) JO L 325 du 12.12.2003, p. 1.
(3) JO L 162 du 21.6.2008, p. 3.
ANNEXE
Les annexes II, III, et IV de la directive 2009/158/CE sont modifiées comme suit:
|
1. |
L’annexe II est modifiée comme suit.
|
|
2. |
L’annexe III est modifiée comme suit:
|
|
3. |
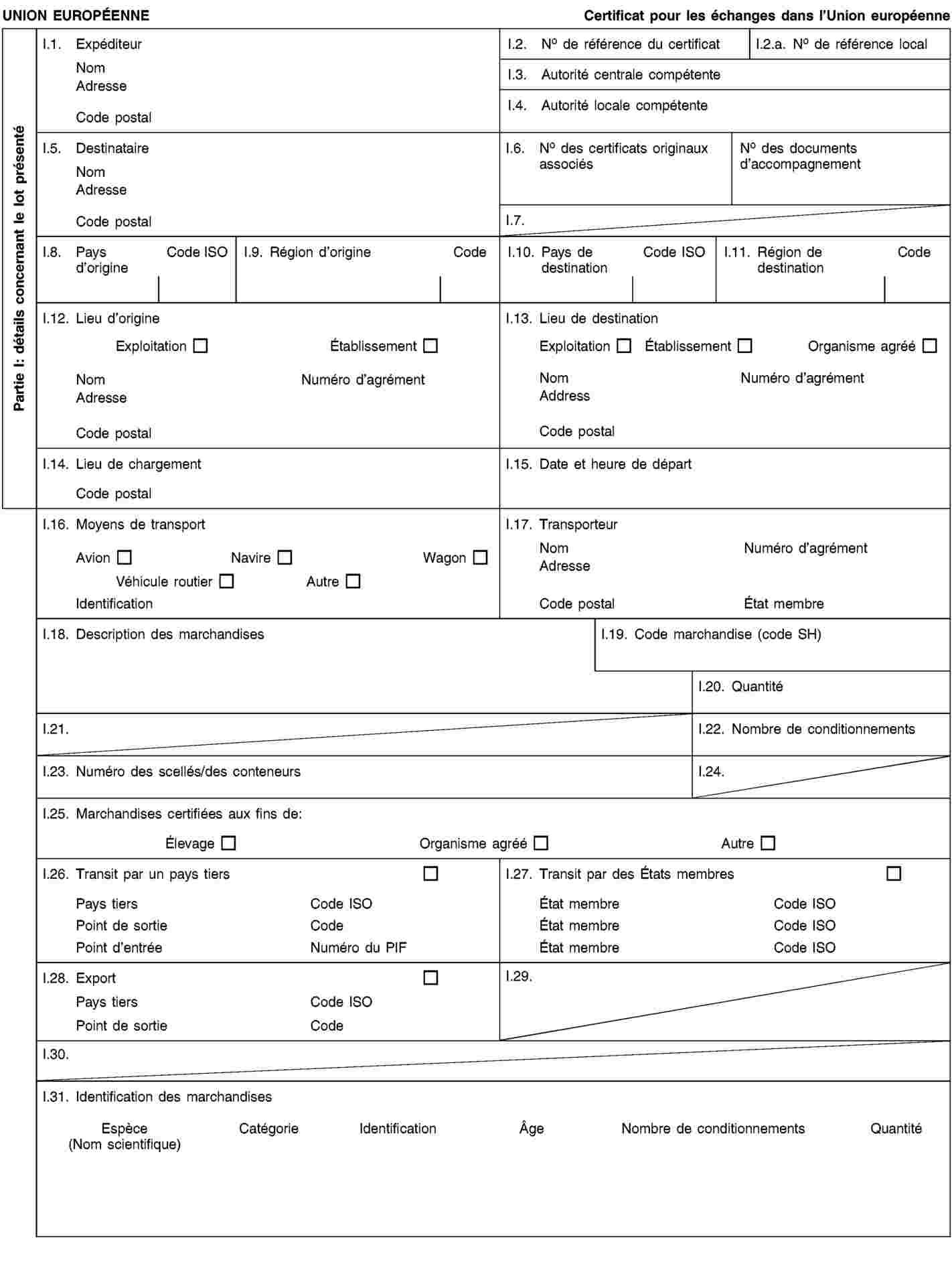
L’annexe IV est remplacée par le texte suivant: «ANNEXE IV CERTIFICATS VÉTÉRINAIRES POUR LES ÉCHANGES À L’INTÉRIEUR DE LUNION (Modèles 1 à 6) MODÈLE 1
MODÈLE 2
MODÈLE 3
MODÈLE 4
MODÈLE 5
MODÈLE 6
|
(1) On entend par Salmonella Pullorum, Salmonella enterica subsp. enterica sérovar Gallinarum biovar Pullorum
(2) On entend par Salmonella Gallinarum, Salmonella enterica subsp. enterica sérovar Gallinarum biovar Gallinarum
(3) On entend par Salmonella arizonae, Salmonella enterica subsp. arizonae sérogroupe K (O18) arizonae
(4) Il convient de noter que pour les espèces aviaires autres que les poules, les résultats de tests sérologiques peuvent comporter une proportion inacceptable de fausses réactions positives.
(5) Il convient de noter que les échantillons de l’environnement ne se prêtent pas à un dépistage fiable de Salmonella Pullorum et de Salmonella Gallinarum.
(6) Il convient de noter que l’étalement direct d’échantillons tissulaires aseptiques sur une gélose très peu sélective, comme la gélose MacConkey, peut également contribuer à établir un diagnostic.
(7) Salmonella Pullorum et Salmonella Gallinarum ne se développent pas facilement dans le milieu semi-solide modifié Rappaport-Vassiliadis (MRSV) utilisé dans l’Union pour la détection de Salmonella spp.
(8) Il convient de noter qu’il n’existe actuellement aucun test capable de distinguer les réactions à une infection par Salmonella Pullorum ou Salmonella Gallinarum et la réaction au vaccin pour ce sérotype.