|
21.7.2007
|
SV
|
Europeiska unionens officiella tidning
|
L 191/1
|
KOMMISSIONENS FÖRORDNING (EG) nr 829/2007
av den 28 juni 2007
om ändring av bilagorna I, II, VII, VIII, X och XI till Europaparlamentets och rådets förordning (EG) nr 1774/2002 beträffande utsläppande av animaliska biprodukter på marknaden
(Text av betydelse för EES)
EUROPEISKA GEMENSKAPERNAS KOMMISSION HAR ANTAGIT DENNA FÖRORDNING
med beaktande av fördraget om upprättandet av Europeiska gemenskapen,
med beaktande av Europaparlamentets och rådets förordning (EG) nr 1774/2002 av den 3 oktober 2002 om hälsobestämmelser för animaliska biprodukter som inte är avsedda att användas som livsmedel (1), särskilt artikel 28 andra stycket, artikel 29.3 första stycket och artikel 32.1, och
av följande skäl:
|
(1)
|
I förordning (EG) nr 1774/2002 fastställs folk- och djurhälsobestämmelser för import till och transitering genom gemenskapen av vissa animaliska biprodukter och produkter som framställts av dessa. I förordningen fastställs allmänna hygienkrav för bearbetning av kategori 1-, 2- och 3-material och krav för utsläppande på marknaden av dessa animaliska biprodukter och produkter av dessa inklusive förlagor till hälsointyg för import av dessa till gemenskapen.
|
|
(2)
|
På grund av risken för att skalbaggar av typen Aethina tumida förs in till gemenskapen, som för närvarande är fri från parasiten, är det nödvändigt att fastställa krav för import av bivax för tekniska ändamål och att ändra definitionen på biodlingsprodukter i bilaga I till förordning (EG) nr 1774/2002. Därför bör den relevanta definitionen i bilaga I till den förordningen, importkraven i kapitel IX i bilaga VIII och förlagan till hälsointyg i kapitel 13 i bilaga X till den förordningen ändras i enlighet med detta.
|
|
(3)
|
I kapitel X i bilaga II till förordning (EG) nr 1774/2002 fastställs en förlaga till handelsdokument som skall åtfölja animaliska biprodukter och bearbetade produkter under transport. För att kunna öka spårbarheten för hudar och skinn under transport bör denna förlaga ändras. Bilaga II till den förordningen bör därför ändras i enlighet med detta.
|
|
(4)
|
Europaparlamentets och rådets förordning (EG) nr 999/2001 av den 22 maj 2001 om fastställande av bestämmelser för förebyggande, kontroll och utrotning av vissa typer av transmissibel spongiform encefalopati (2) gäller för produktion och utsläppande på marknaden av levande djur och produkter av animaliskt ursprung. Det är förbjudet att med bearbetat animaliskt protein utfordra djur inom animalieproduktionen som hålls, göds eller föds upp för produktion av livsmedel.
|
|
(5)
|
Även om förbudet i förordning (EG) nr 999/2001 är i kraft bör mindre strikta bearbetningskrav enligt kapitel II i bilaga VII till förordning (EG) nr 1774/2002 än den gällande bearbetningsmetoden 1 gälla för bearbetat animaliskt protein från grisblod, eftersom det inte finns några vetenskapliga indikationer på att det föreligger risk för överföring av TSE från svin. Av folk- och djurhälsoskäl är det dock nödvändigt att införa ett krav på minimitemperatur för bearbetning av grisblod. Kapitel II i bilaga VII till förordning (EG) nr 1774/2002 bör därför ändras i enlighet med detta.
|
|
(6)
|
Enligt kapitel II A.1 i bilaga VIII till förordning (EG) nr 1774/2002 får delar från slaktade djur som är tjänliga som livsmedel men som av kommersiella skäl inte är avsedda som livsmedel användas för framställning av obehandlat sällskapsdjursfoder inom gemenskapen. Det verkar som om delar av de djur som förklaras otjänliga som livsmedel trots att de inte visar några tecken på sjukdomar som kan överföras till människor eller djur också är säkra att användas i sällskapsdjursfoder. Kapitel II A.1 och kapitel XI i bilaga VIII till den förordningen, där det i det senare fastställs bestämmelser för import till gemenskapen, bör därför ändras i enlighet med detta.
|
|
(7)
|
De nuvarande förlagorna till hälsointyg för import av hudar och skinn till gemenskapen bör ändras för att införa vissa tekniska ändringar. De särskilda kraven för dessa produkter i kapitel VI i bilaga VIII och förlagorna till hälsointyg i kapitlen 5 A, 5 B och 5 C i bilaga X till förordning (EG) nr 1774/2002 bör därför av klarhetsskäl ändras i enlighet med detta.
|
|
(8)
|
Europeiska myndigheten för livsmedelssäkerhet (EFSA) konstaterade i sitt vetenskapliga yttrande Scientific Opinion on Animal health and welfare aspects of avian influenza, som antogs den 13 och 14 september 2005, att fjädrar bör behandlas innan de saluförs för att minska risken för spridning av aviär influensa. I kapitel VIII i bilaga VIII till förordning (EG) nr 1774/2002 fastställs de permanenta gemenskapsåtgärderna avseende utsläppande på marknaden och import av fjädrar. Mot bakgrund av detta yttrande och den aktuella epidemiologiska situationen i världen i fråga om aviär influensa bör de relevanta gemenskapsåtgärderna för import och behandling av fjädrar före import ändras. Bilaga VIII till den förordningen bör därför ändras i enlighet med detta.
|
|
(9)
|
Det relevanta hälsointyget i kapitel 1 i bilaga X till förordning (EG) nr 1774/2002 för import av bearbetat animaliskt protein som inte är avsett som livsmedel och andra produkter än sällskapsdjursfoder som innehåller sådant protein till gemenskapen bör ändras i enlighet med detta för att fastställa likvärdiga bearbetningsmöjligheter för tredjeländer som för gemenskapen. Kapitel 1 i bilaga X till förordning (EG) nr 1774/2002 bör därför ändras i enlighet med detta.
|
|
(10)
|
I kapitel 3 B i bilaga X till förordning (EG) nr 1774/2002 fastställs förlagan till hälsointyg för import av annat bearbetat sällskapsdjursfoder än konserverat sällskapsdjursfoder till gemenskapen. Det verkar som om det är allt vanligare att bearbetat sällskapsdjursfoder i tredjeländer produceras genom att redan bearbetade ingredienser som var för sig har behandlats i enlighet med kraven i den förordningen blandas. Värmebehandling av sådana ingredienser skulle kunna påverka näringskvaliteten negativt. Import till gemenskapen av bearbetat sällskapsdjursfoder som består av sådana säkra ingredienser bör därför tillåtas och förlagan till hälsointyg i kapitel 3 B i bilaga X till förordning (EG) nr 1774/2002 bör ändras i enlighet med detta.
|
|
(11)
|
I förordning (EG) nr 1774/2002 föreskrivs att vissa animaliska biprodukter för framställning av sällskapsdjursfoder får importeras till gemenskapen även om de innehåller material som kommer från djur som har behandlats med vissa förbjudna ämnen. Det är dock för närvarande inte tillåtet att importera bearbetat sällskapsdjursfoder, tuggben och aromatiska inälvsprodukter som innehåller sådant material till gemenskapen. Eftersom hälsorisken inte verkar vara högre vid import av sådant material för framställning av sällskapsdjursfoder inom gemenskapen än då sådant material ingår i bearbetat sällskapsdjursfoder, tuggben eller aromatiska inälvsprodukter som importeras, bör import av dessa bearbetade produkter som innehåller sådant material till gemenskapen även tillåtas. Förlagorna till hälsointyg i kapitlen 3 A, 3 B, 3 C och 3 E i bilaga X till förordning (EG) nr 1774/2002 bör därför ändras i enlighet med detta.
|
|
(12)
|
I kapitel 3 B i bilaga X till förordning (EG) nr 1774/2002 fastställs att förlagan till hälsointyg för annat bearbetat sällskapsfoder än konserverat sällskapsdjursfoder skall innehålla en förklaring som säger att sällskapsdjursfodret har förpackats i nya förpackningar som märkts med texten ”inte avsett att användas som livsmedel”. Rådets direktiv 79/373/EEG av den 2 april 1979 om saluföring av foderblandningar (3) innehåller redan likvärdiga märkningskrav som förhindrar att produkterna oavsiktligen eller av försumlighet konsumeras som livsmedel. Kraven i förlagan till hälsointyg i kapitel 3 B i bilaga X till förordning (EG) nr 1774/2002 bör ta hänsyn till denna lagstiftning och bör därför ändras i enlighet med detta.
|
|
(13)
|
I bilaga VIII till förordning (EG) nr 1774/2002 fastställs krav för utsläppande på marknaden och import till gemenskapen av sällskapsdjursfoder, tuggben och tekniska produkter. Enligt kapitel II B.4 i den bilagan skall tuggben ha genomgått en värmebehandling som förstör patogena organismer. Flera medlemsstater har begärt att andra behandlingar som ger likvärdiga säkerhetsgarantier skall tillåtas under bearbetningen av tuggben. Kapitel II B.4 i bilaga VIII till förordning (EG) nr 1774/2002 bör därför ändras i enlighet med detta.
|
|
(14)
|
I kapitel 3 C i bilaga X till förordning (EG) nr 1774/2002 fastställs förlagan till hälsointyg för import av tuggben till gemenskapen. Eftersom andra behandlingar än värmebehandling skall tillåtas för bearbetning av tuggben inom gemenskapen, bör dessa andra behandlingar även tillåtas för importerade tuggben. Vissa tuggben framställs enligt traditionella metoder av fisk. Ur djurhälsoperspektiv krävs ingen värmebehandling i sådana fall. Förlagan till hälsointyg i kapitel 3 C i bilaga X till den förordningen bör därför ändras i enlighet med detta.
|
|
(15)
|
I kapitel II B.6 i bilaga VIII till förordning (EG) nr 1774/2002 fastställs mikrobiologiska krav på obehandlat sällskapsdjursfoder som producerats inom gemenskapen. Dessa krav bör även gälla för import till gemenskapen av obehandlat sällskapsdjursfoder som skall säljas direkt och av animaliska biprodukter som skall ges till farmade pälsdjur som skall importeras till gemenskapen. Kapitel 3 D i bilaga X till den förordningen bör därför ändras i enlighet med detta.
|
|
(16)
|
Bilaga XI till förordning (EG) nr 1774/2002 innehåller förteckningar över tredjeländer från vilka medlemsstaterna får tillåta import av animaliska biprodukter som inte är avsedda att användas som livsmedel. I del XIII i den bilagan förtecknas de tredjeländer från vilka medlemsstaterna får tillåta import av serum från hästdjur. Enligt denna del XIII omfattar förteckningen tredjeländer som anges i bilaga I till kommissionens beslut 2004/211/EG av den 6 januari 2004 om upprättande av en förteckning över tredje länder eller delar av tredje länder från vilka medlemsstaterna tillåter import av levande hästdjur och sperma, ägg och embryon från hästdjur samt om ändring av besluten 93/195/EEG och 94/63/EG (4), från vilka det är tillåtet att importera hästdjur för slakt.
|
|
(17)
|
Serum från hästdjur kan dock härröra från levande djur. Den djurhälsostatus som krävs för att ett tredjeland skall införas i den förteckning över tredjeländer från vilka det är tillåtet att importera hästdjur för avel och bruksändamål bör vara tillräcklig för att bestämma om serum från hästdjur skall få importeras från detta tredjeland. Detta skulle särskilt tillåta import av serum från hästdjur från Mexiko. Del XIII i bilaga XI till förordning (EG) nr 1774/2002 bör därför ändras i enlighet med detta.
|
|
(18)
|
Veterinärintyg skall utfärdas i det format som föreskrivs i kommissionens beslut 2007/240/EG (5) beträffande harmoniserade förlagor till veterinärintyg för import till Europeiska gemenskapen av levande djur och animaliska produkter. Handelsdokumentet i kapitel X i bilaga II till förordning (EG) nr 1774/2002 och förlagorna till hälsointyg i bilaga X till den förordningen bör ändras i enlighet med detta.
|
|
(19)
|
En övergångsperiod bör medges efter det att denna förordning träder i kraft för att importen till gemenskapen av animaliska biprodukter och produkter som framställts av dessa som omfattas av förordning (EG) nr 1774/2002 och åtföljs av hälsointyg som är i överensstämmelse med den förordningen skall kunna fortsätta.
|
|
(20)
|
De åtgärder som föreskrivs i denna förordning är förenliga med yttrandet från ständiga kommittén för livsmedelskedjan och djurhälsa.
|
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
Bilagorna I, II, VII, VIII, X och XI till förordning (EG) nr 1774/2002 skall ändras i enlighet med bilagan till den här förordningen.
Artikel 2
Under en övergångsperiod på sex månader efter den här förordningens ikraftträdande får handelsdokumentet i bilaga II till förordning (EG) nr 1774/2002 och förlagorna till hälsointyg i bilaga X till den förordningen, som ifylldes i enlighet med de bestämmelser som gällde före den här förordningens ikraftträdande, fortsätta att åtfölja de produkter som dokumenten eller intygen omfattar.
Artikel 3
Denna förordning träder i kraft den tredje dagen efter det att den har offentliggjorts i Europeiska unionens officiella tidning.
Denna förordning är till alla delar bindande och direkt tillämplig i alla medlemsstater.
Utfärdad i Bryssel den 28 juni 2007.
På kommissionens vägnar
Markos KYPRIANOU
Ledamot av kommissionen
(1) EGT L 273, 10.10.2002, s. 1. Förordningen senast ändrad genom kommissionens förordning (EG) nr 2007/2006 (EUT L 379, 28.12.2006, s. 98).
(2) EGT L 147, 31.5.2001, s. 1. Förordningen senast ändrad genom kommissionens förordning (EG) nr 1923/2006 (EUT L 404, 30.12.2006, s. 1).
(3) EGT L 86, 6.4.1979, s. 30. Direktivet senast ändrat genom förordning (EG) nr 807/2003 (EUT L 122, 16.5.2003, s. 36).
(4) EUT L 73, 11.3.2004, s. 1. Beslutet ändrat genom förordning (EG) nr 1792/2006 (EUT L 362, 20.12.2006, s. 1).
(5) EUT L 104, 21.4.2007, s. 37.
BILAGA
Bilagorna till förordning (EG) nr 1774/2002 skall ändras på följande sätt:
|
1.
|
Bilaga I skall ändras på följande sätt:
|
a)
|
Punkt 1 skall ersättas med följande:
|
”1.
|
biprodukter från biodling: honung, bivax, drottninggelé, propolis eller pollen, om dessa produkter inte är avsedda att användas som livsmedel.”
|
|
|
b)
|
Punkt 42 skall ersättas med följande:
|
”2.
|
bearbetat animaliskt protein: animaliskt protein som helt och hållet framställts av kategori 3-material som behandlats i enlighet med kapitel II i bilaga VII på ett sådant sätt att det lämpar sig för direkt användning som foderråvara eller för varje annan användning i djurfoder, inklusive sällskapsdjursfoder, eller för användning i organiska gödningsmedel eller jordförbättringsmedel. Hit räknas dock inte blodprodukter, mjölk, mjölkbaserade produkter, råmjölk, gelatin, hydrolyserat protein och dikalciumfosfat, ägg och äggprodukter, trikalciumfosfat och kollagen.”
|
|
|
|
2.
|
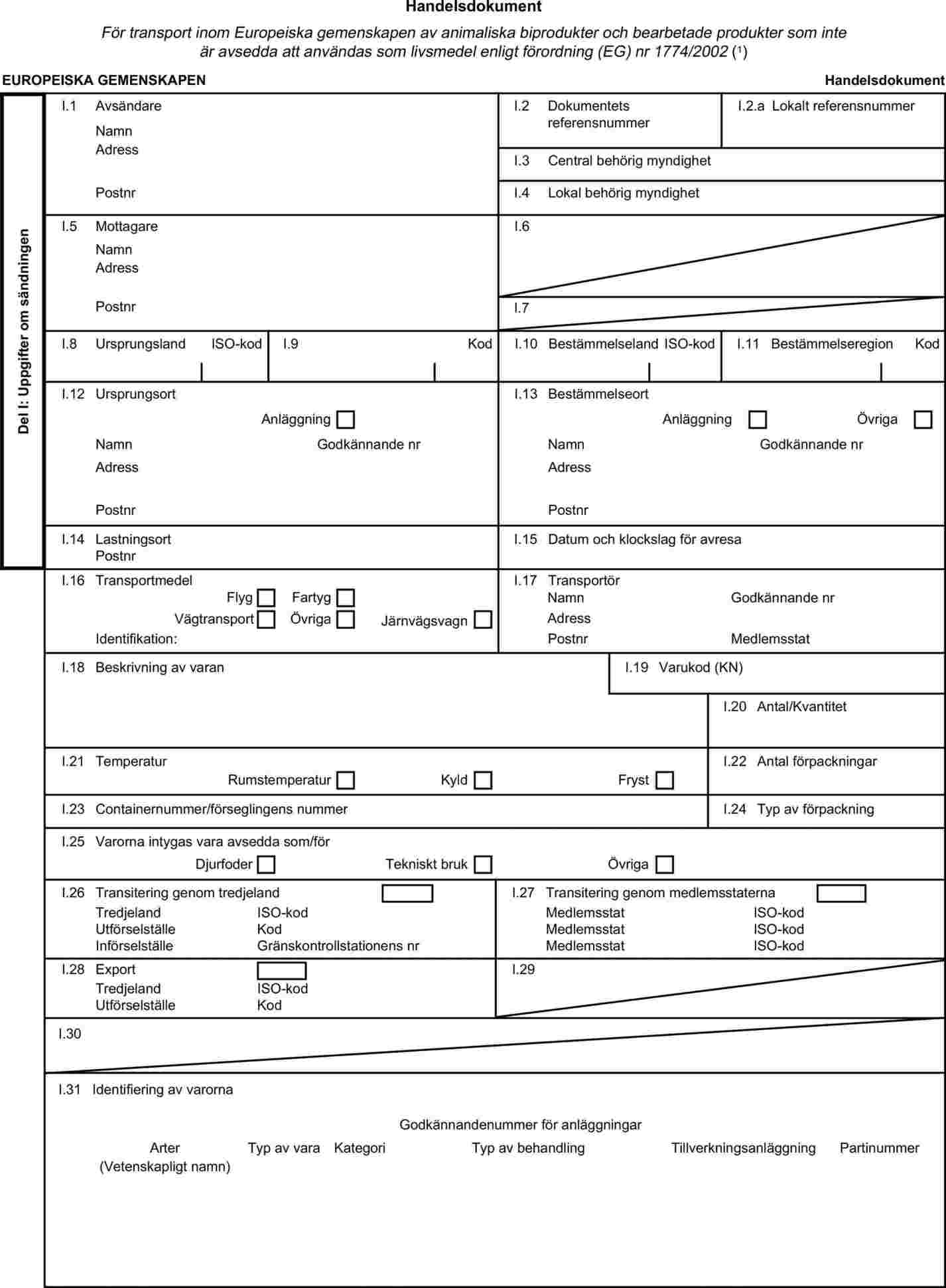
Kapitel X i bilaga II skall ersättas med följande:
”KAPITEL X
Handelsdokument
|
1.
|
Under transport skall följande handelsdokument åtfölja animaliska biprodukter och bearbetade produkter. Medlemsstaterna får dock använda ett annat handelsdokument, på papper eller i elektronisk form, för animaliska biprodukter och bearbetade produkter som transporteras inom medlemsstaten under förutsättning att detta handelsdokument uppfyller kraven i kapitel III.2.
|
|
2.
|
Om fler än en transportör är inblandade skall varje transportör fylla i en försäkran i enlighet med punkt 7 i handelsdokumentet som skall utgöra en del av dokumentet.
|
FÖRLAGA TILL HANDELSDOKUMENT FÖR TRANSPORT AV ANIMALISKA BIPRODUKTER OCH BEARBETADE PRODUKTER INOM EUROPEISKA GEMENSKAPEN
Anmärkningar
|
a)
|
Handelsdokument skall utfärdas i enlighet med förlagan i denna bilaga. Handelsdokumentet skall, i den nummerordning som framgår av förlagan, innehålla de intyganden som krävs för transport av animaliska biprodukter och bearbetade produkter som härrör från dessa.
|
|
b)
|
Det skall vara avfattat på ett av ursprungsmedlemsstatens eller bestämmelsemedlemsstatens officiella språk. Det får även vara avfattat på andra officiella gemenskapsspråk om det åtföljs av en officiell översättning eller om detta överenskommits med den behöriga myndigheten i bestämmelsemedlemsstaten.
|
|
c)
|
Handelsdokumentet skall utfärdas i minst tre exemplar (ett originaldokument och två kopior). Originaldokumentet skall åtfölja sändningen fram till slutdestinationen och sparas av mottagaren. Producenten skall behålla en kopia och transportföretaget skall behålla den andra.
|
|
d)
|
Originalet till varje handelsdokument skall bestå av ett enda blad med text på båda sidor eller, om mer text krävs, utformas på ett sådant sätt att alla blad som behövs utgör en odelbar enhet.
|
|
e)
|
Om det för identifieringen av enskilda beståndsdelar i sändningen bifogas ytterligare blad till handelsdokumentet, skall även dessa blad anses utgöra en del av originaldokumentet och på varje sida förses med underskrift av den person som ansvarar för sändningen.
|
|
f)
|
Om handelsdokumentet, inklusive sådana ytterligare blad som avses i e, omfattar mer än en sida, skall varje sida vara numrerad nedtill – (sidnummer) av (totalt antal sidor) – och det dokumentnummer som har tilldelats av den ansvariga personen skall stå upptill.
|
|
g)
|
Originalet till handelsdokumentet skall fyllas i och undertecknas av den ansvariga personen. Den ansvariga personen skall därvid se till att de principer för dokumentation som föreskrivs i kapitel III i bilaga II till förordning (EG) nr 1774/2002 följs. I handelsdokumentet skall anges
|
i)
|
datum då materialet transporterades bort från anläggningen,
|
|
ii)
|
en beskrivning av materialet, inklusive identifieringen av materialet, djurarten för kategori 3-material och bearbetade produkter som härrör från detta som är avsedda som foderråvara samt, i förekommande fall, numret på djurets öronmärke,
|
|
iv)
|
materialets ursprungsort,
|
|
v)
|
transportföretagets namn och adress,
|
|
vi)
|
mottagarens namn, adress och, i tillämpliga fall, godkännandenummer, och
|
|
vii)
|
i förekommande fall, ursprungsanläggningens godkännandenummer, samt typ av behandling och behandlingsmetoder.
|
|
|
h)
|
Den ansvariga personens namnteckning skall ha en annan färg än den tryckta texten.
|
|
i)
|
Handelsdokumentet skall arkiveras i minst två år så att det kan läggas fram för den behöriga myndigheten för att styrka de uppgifter som avses i artikel 9 i förordning (EG) nr 1774/2002.
|
|
j)
|
Om medlemsstaterna bestämmer sig för att använda ett handelsdokument i elektronisk form skall kraven i a–i uppfyllas enligt vad som är lämpligt för denna elektroniska form.
|


|
|
3.
|
I kapitel II punkt A.1 i bilaga VII skall första stycket ersättas med följande:
”Bearbetat däggdjursprotein skall ha bearbetats med metod 1. Grisblod får dock ha bearbetats med någon av metoderna 1–5 eller 7 förutsatt att man vid bearbetningsmetod 7 har genomfört en värmebehandling under vilken hela materialet upphettats till minst 80 °C.”
|
|
4.
|
Bilaga VIII skall ändras på följande sätt:
|
a)
|
Kapitel II skall ändras på följande sätt:
|
i)
|
Punkt A.1 skall ersättas med följande:
|
”1.
|
De enda animaliska biprodukter som får användas för att tillverka sällskapsdjursfoder och tuggben är de som avses i artikel 6.1 a–j. Obehandlat sällskapsdjursfoder får dock endast tillverkas av de animaliska biprodukter som avses i artikel 6.1 a eller 6.1 b.”
|
|
|
ii)
|
Punkt B.4 skall ersättas med följande:
|
”4.
|
Tuggben skall i samband med bearbetning genomgå en behandling som förstör patogena organismer (inklusive salmonella).
Efter denna behandling skall omfattande försiktighetsåtgärder vidtas för att förhindra att sådana tuggben kontamineras. Tuggbenen skall förpackas i nytt förpackningsmaterial.”
|
|
|
|
b)
|
Kapitel III skall ändras på följande sätt:
|
i)
|
Punkt I A.3 skall ersättas med följande:
|
”3.
|
Obearbetad naturgödsel från hästdjur som det handlas med får inte härröra från en anläggning som är föremål för djurhälsorestriktioner i fråga om rots, vesikulär stomatit, mjältbrand eller rabies i enlighet med artikel 4.5 i direktiv 90/426/EEG.”
|
|
|
ii)
|
Punkt I B.4 skall ersättas med följande:
|
”4.
|
Det är förbjudet att importera obehandlad naturgödsel.”
|
|
|
iii)
|
Punkt II B.6 d skall ersättas med följande:
|
”d)
|
åtföljs av ett hälsointyg som är förenligt med förlagan i kapitel 17 i bilaga X.”
|
|
|
|
c)
|
Kapitel VI skall ändras på följande sätt:
|
i)
|
Avsnitt A punkt 1 a skall ersättas med följande:
|
”a)
|
hudar och skinn från hovdjur som uppfyller kraven i Europaparlamentets och rådets förordning (EG) nr 853/2004 av den 29 april 2004 om fastställande av särskilda hygienregler för livsmedel av animaliskt ursprung (1),
|
|
|
ii)
|
Avsnitt B punkt 3 skall ersättas med följande:
|
”3.
|
Handel med färska och kylda hudar och skinn omfattas av samma hälsovillkor som de som gäller för färskt kött enligt rådets direktiv 2002/99/EG av den 16 december 2002 om fastställande av djurhälsoregler för produktion, bearbetning, distribution och införsel av produkter av animaliskt ursprung avsedda att användas som livsmedel (2).
|
|
|
iii)
|
I avsnitt C punkt 5 b skall den inledande meningen ersättas med följande:
|
”b)
|
De skall komma från ett tredjeland eller, vid regionalisering enligt gemenskapens lagstiftning, från ett område i ett tredjeland som har upptagits på förteckningen i del XIV A i bilaga XI och som beroende på djurarten ifråga”
|
|
|
iv)
|
Avsnitt C punkt 6 b–e skall ersättas med följande:
|
”b)
|
De skall antingen komma från
|
i)
|
ett tredjeland eller, vid regionalisering enligt gemenskapens lagstiftning, från ett område i ett tredjeland, som har upptagits på förteckningen i del XIV B i bilaga XI och från vilket import av färskt kött från de motsvarande arterna är tillåten, och de skall ha beretts i enlighet med avsnitt A punkt 2 a, b och c, eller
|
|
ii)
|
ett tredjeland som har upptagits på förteckningen i del XIV B i bilaga XI och de skall ha beretts i enlighet med avsnitt A punkt 2 c eller d, eller
|
|
iii)
|
hästdjur eller idisslare från ett tredjeland som har upptagits på förteckningen i del XIV C i bilaga XI och som har beretts i enlighet med avsnitt A punkt 2 a, b och c och efter beredning har hållits avskilda i minst 21 dagar.
|
|
|
c)
|
När det gäller saltade hudar och skinn som transporteras med fartyg skall de ha beretts i enlighet med avsnitt A punkt 2 b eller c och ha hållits åtskilda efter beredningen under transport i minst 14 dagar före import när det gäller b eller i minst sju dagar före import när det gäller c och det hälsointyg som åtföljer sändningen skall intyga en sådan beredning och hur lång tid transporten tog.
|
|
d)
|
De skall åtföljas av ett hälsointyg enligt förlagan i kapitel 5 B i bilaga X eller, när det gäller hudar och skinn som avses i avsnitt C punkt 6 b iii i den här bilagan, en officiell försäkran enligt förlagan i kapitel 5 C i bilaga X.”
|
|
|
|
d)
|
Kapitel VIII skall ändras på följande sätt:
|
i)
|
I avsnitt B punkt 4 skall den inledande meningen ersättas med följande:
”Medlemsstaterna måste tillåta import av obearbetad ull och obearbetat hår om dessa”
|
|
ii)
|
I avsnitt B skall följande punkt läggas till som punkt 5:
|
”5.
|
Det är förbjudet att importera obearbetade fjädrar och delar av fjädrar.
Medlemsstaterna måste tillåta import av bearbetade fjädrar och delar av fjädrar om
|
a)
|
det rör sig om bearbetade dekorationsfjädrar, bearbetade fjädrar som medförs av resande för privat bruk eller sändningar av bearbetade fjädrar som sänts till privatpersoner för icke-industriellt bruk, eller
|
|
b)
|
de åtföljs av ett handelsdokument, där det anges att fjädrarna eller delarna av fjädrar har behandlats med ånga eller med någon annan metod som säkerställer att patogenen har inaktiverats, och är säkert förpackade och torra.”
|
|
|
|
|
e)
|
Kapitel IX skall ändras på följande sätt:
|
i)
|
I avsnitt A punkt 1 skall den inledande meningen ersättas med följande:
|
”1.
|
Biprodukter från biodling som uteslutande är avsedda att användas inom biodling”
|
|
|
ii)
|
Avsnitt B punkt 3 skall ersättas med följande:
|
”3.
|
Medlemsstaterna skall tillåta import av andra biprodukter från biodling än bivax i form av bikaka som är avsedda att användas inom biodling om de
|
a)
|
kommer från tredjeländer som har upptagits på förteckningen i del XII i bilaga XI,
|
|
b)
|
antingen
|
i)
|
har utsatts för en temperatur på –12 °C eller lägre i minst 24 timmar, eller
|
|
ii)
|
när det gäller bivax, om materialet har förädlats eller utsmälts före importen, och
|
|
|
c)
|
åtföljs av ett hälsointyg som är förenligt med förlagan i kapitel 13 i bilaga X.”
|
|
|
|
iii)
|
I avsnitt B skall följande punkter läggas till som punkterna 4 och 5:
|
”4.
|
Medlemsstaterna skall tillåta import av annat bivax för tekniska ändamål än bivax i form av bikaka om det
|
a)
|
har förädlats eller utsmälts före import, och
|
|
b)
|
åtföljs av ett handelsdokument som intygar denna förädling eller utsmältning.
|
|
|
5.
|
Det är förbjudet att importera bivax i form av bikaka.”
|
|
|
|
f)
|
Kapitel XI skall ändras på följande sätt:
|
i)
|
I punkt 2 skall andra stycket ersättas med följande:
”Animaliska biprodukter som används i foder för farmade pälsdjur eller i obehandlat sällskapsdjursfoder får endast bestå av de animaliska biprodukter som avses i artikel 6.1 a och 6.1 b.”
|
|
ii)
|
Punkt 6 skall ersättas med följande:
|
”6.
|
De skall åtföljas av ett intyg som är förenligt med en av förlagorna i kapitel 3 D, kapitel 3 F eller kapitel 8 i bilaga X.”
|
|
|
|
|
5.
|
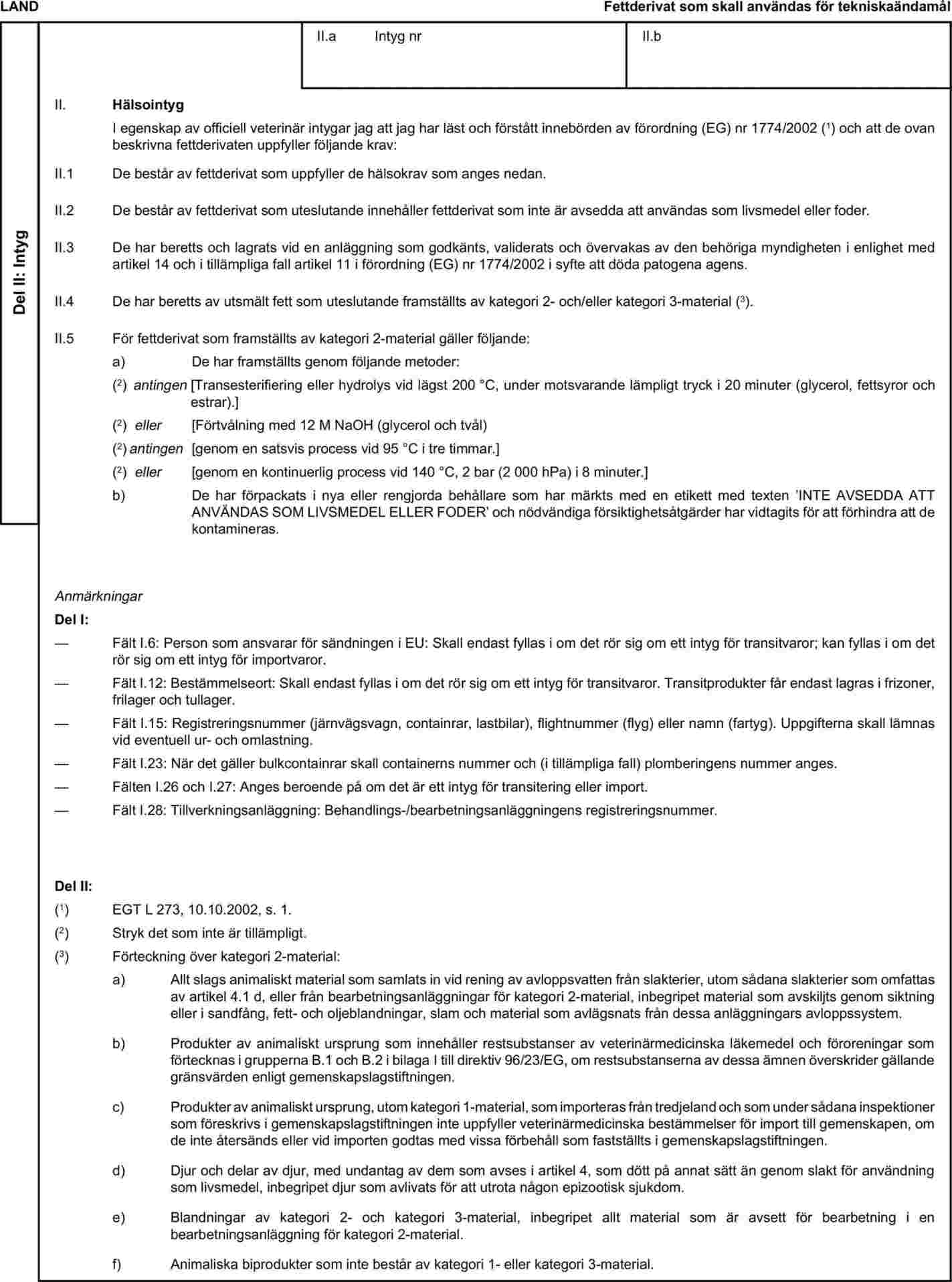
Bilaga X skall ersättas med följande:
”BILAGA X
FÖRLAGOR TILL HÄLSOINTYG FÖR IMPORT FRÅN TREDJELAND OCH TRANSITERING GENOM EUROPEISKA GEMENSKAPEN AV VISSA ANIMALISKA BIPRODUKTER OCH PRODUKTER SOM FRAMSTÄLLTS AV DESSA
Anmärkningar
|
a)
|
Veterinärintyg skall utfärdas av exportlandet på grundval av förlagorna i bilaga X, i enlighet med den förlaga som motsvarar de berörda animaliska biprodukterna. De skall innehålla, i den nummerordning som anges i förlagan, de intyganden som krävs för alla tredjeländer och, i tillämpliga fall, de tilläggsgarantier som krävs för det exporterande tredjelandet eller en del därav.
|
|
b)
|
Originalet till varje intyg skall bestå av ett enda blad med text på båda sidor eller, om mer text krävs, utformas på ett sådant sätt att alla blad som behövs utgör en odelbar enhet.
|
|
c)
|
Det skall vara avfattat på minst ett av de officiella språken i den medlemsstat där besiktningen vid gränskontrollstationen skall företas och på minst ett av de officiella språken i bestämmelsemedlemsstaten. Dessa medlemsstater får emellertid tillåta andra språk, vid behov åtföljda av en officiell översättning.
|
|
d)
|
Om det med tanke på identifiering av varorna i sändningen bifogas ytterligare sidor till intyget skall även dessa sidor betraktas som en del av originalintyget och den officiella veterinären skall underteckna och stämpla var och en av dessa sidor.
|
|
e)
|
Om intyget, med de ytterligare sidor som avses i d, består av mer än en sida skall varje sida numreras – (sidans nummer) av (det totala antalet sidor) – längst ned på sidan, medan intygets kodnummer, som fastställts av den behöriga myndigheten, skall anges högst upp på sidan.
|
|
f)
|
Originalintyget skall fyllas i och undertecknas av en officiell veterinär. De behöriga myndigheterna i exportlandet skall därvid se till att de principer för utfärdande av intyg som följs är likvärdiga med dem som anges i rådets direktiv 96/93/EG.
|
|
g)
|
Underskriften skall ha en annan färg än den tryckta texten. Detta gäller även för stämplar, med undantag för präglade stämplar och vattenstämplar.
|
|
h)
|
Originalintyget skall åtfölja sändningen till EU:s gränskontrollstation.
|
|
i)
|
Om hälsointyg används för transitsändningar skall fält I.5 (’Avsändare’) i det relevanta hälsointyget fyllas i med namn och adress på den gränskontrollstation genom vilken sändningen skall lämna Europeiska gemenskapen.
|





















































































|
|
6.
|
Bilaga XI skall ändras på följande sätt:
|
a)
|
Titeln till del VI skall ersättas med följande:
”DEL VI
Förteckning över tredjeländer från vilka medlemsstaterna får tillåta import av animaliska biprodukter och blodprodukter (utom blodprodukter från hästdjur) för tekniska ändamål inbegripet farmaceutiska produkter (hälsointygen i kapitlen 4 C och 8)”
|
|
b)
|
I del VII A skall titeln och punkt A ersättas med följande:
”DEL VII A
Förteckning över tredjeländer från vilka medlemsstaterna får tillåta import av animaliska biprodukter för framställning av bearbetat sällskapsdjursfoder (hälsointygen i kapitlen 3 B och 3 F)
|
A.
|
Animaliska biprodukter från nötkreatur, får, getter, svin och hästdjur, såväl produktionsdjur som vilda djur:
De tredjeländer eller delar av de tredjeländer som förtecknas i del 1 i bilaga II till rådets beslut 79/542/EEG, från vilka import av denna kategori av färskt kött från motsvarande arter är tillåten samt från följande länder vad gäller de angivna biprodukterna:
Länder eller delar av länder i Sydamerika eller södra Afrika, i vilka mognadslagrat och urbenat kött av de motsvarande arterna är tillåtet, vad gäller mognadslagrat och urbenat kött (inbegripet diafragma) eller mognadslagrade, putsade slaktbiprodukter från nötkreatur, får, getter och vilt (produktionsdjur eller vilda djur).”
|
|
|
c)
|
Del IX skall ersättas med följande:
”DEL IX
Förteckning över tredjeländer från vilka medlemsstaterna får tillåta import av bearbetad naturgödsel och bearbetade naturgödselprodukter för jordförbättring (hälsointyg i kapitel 17)
För bearbetad naturgödsel och bearbetade naturgödselprodukter de tredjeländer som förtecknas i
|
a)
|
del 1 i bilaga II till rådets beslut 79/542/EEG,
|
|
b)
|
bilaga I till kommissionens beslut 2004/211/EG, eller
|
|
|
d)
|
Del XIII skall ersättas med följande:
”DEL XIII
Förteckning över tredjeländer från vilka medlemsstaterna får tillåta import av serum från hästdjur (hälsointyg i kapitel 4 A)
De tredjeländer eller delar av de tredjeländer som förtecknas i bilaga I till kommissionens beslut 2004/211/EG (8), från vilka det är tillåtet att importera hästdjur för avel och bruksändamål.”
|
|
(1) EUT L 139, 30.4.2004, s. 55. Rättad i EUT L 226, 25.6.2004, s. 22.”
(2) EUT L 18, 23.1.2003, s. 11.”
























































































